Поліциклоалкілпурини як антагоністи аденозинових рецепторів
Номер патенту: 77391
Опубліковано: 15.12.2006
Автори: Енсінгер Керол Л., Петтер Расселл К., Чан Хе Сі, Кесман Уілльям Ф., Даулінг Джеймс Е., Лін Ко Чунг, Кумаравел Гнанасамбандам
Формула / Реферат
1. Сполука, що має формулу:
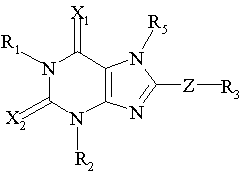 , (І)
, (І)
де R1 і R2 незалежно вибрані з групи, що складається з:
a) водню;
b) алкілу, алкенілу з не менш ніж 3 вуглецевими атомами або алкінілу з не менш ніж 3 вуглецевими атомами, причому вказаний алкіл, алкеніл або алкініл є незаміщеним або заміщеним одним або декількома замісниками, вибраними з гідрокси, алкокси, аміно, алкіламіно, діалкіламіно, гетероциклілу, ациламіно, алкілсульфоніламіно і гетероциклілкарбоніламіно; і
c) арилу або заміщеного арилу;
R3 вибраний з групи, що складається з:
(а) біциклічної, трициклічної або пентациклічної групи, вибраної з групи, що складається з:
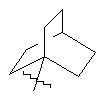 ,
, 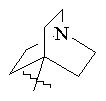 ,
, 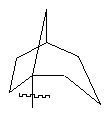 ,
,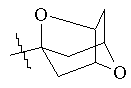 ,
,
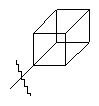 ,
,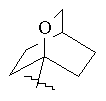 ,
,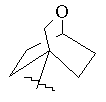 ,
, ,
,
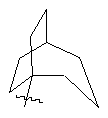 ,
,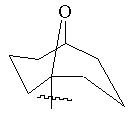 ,
,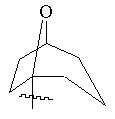 ,
,
де біциклічна або трициклічна група є незаміщеною або заміщеною одним або декількома замісниками, вибраними з групи, що складається з:
(а) алкілу, алкенілу і алкінілу, де кожна алкільна, алкенільна або алкінільна група є незаміщеною або заміщеною одним або декількома замісниками, вибраними з групи, що складається з (аміно)(R5)ацилгідразинілкарбонілу, (аміно)(R5)ацилоксикарбокси, (гідрокси)(карбоалкоксі)алкілкарбамоїлу, ацилокси, альдегідо, алкенілсульфоніламіно, алкокси, алкоксикарбонілу, алкіламіноалкіламіно, алкілфосфоно, алкілсульфоніламіно, карбамоїлу, R5,R5-алкокси, R5-алкіламіно, ціано, ціаноалкілкарбамоїлу, циклоалкіламіно, діалкіламіно, діалкіламіноалкіламіно, діалкілфосфоно, галогеналкілсульфоніламіно, гетероциклілалкіламіно, гетероциклілкарбамоїлу, гідрокси, гідроксіалкілсульфоніламіно, оксіміно, фосфоно, заміщеного аралкіламіно, заміщеного арилкарбоксіалкоксикарбонілу, заміщеного гетероарилсульфоніламіно, заміщеного гетероциклілу, тіокарбамоїлу і трифторметилу; і
(b) (алкоксикарбоніл)аралкілкарбамоїлу, альдегідо, алкенокси, алкенілсульфоніламіно, алкокси, алкоксикарбонілу, алкілкарбамоїлу, алкоксикарбоніламіно, алкілсульфоніламіно, алкілсульфонілокси, аміно, аміноалкіларалкілкарбамоїлу, аміноалкілкарбамоїлу, аміноалкілгетеро-циклілалкілкарбамоїлу, аміноциклоалкілалкілциклоалкілкарбамоїлу, аміноциклоалкілкарбамоїлу, аралкоксикарбоніламіно, арилгетероциклілу, арилокси, арилсульфоніламіно, арилсульфонілокси, карбамоїлу, карбонілу, -R5,R5-алкокси, R5-алкіл(алкіл)аміно, R5-алкілалкілкарбамоїлу, R5-алкіламіно, R5-алкілкарбамоїлу, R5-алкілсульфонілу, R5-алкілсульфоніламіно, R5-алкілтіо, R5-гетероциклілкарбонілу, ціано, циклоалкіламіно, діалкіламіноалкілкарбамоїлу, галогену, гетероциклілу, гетероциклілалкіламіно, гідрокси, оксіміно, фосфату, заміщеного аралкіламіно, заміщеного гетероциклілу, заміщеного гетероциклілсульфоніламіно, сульфоксіациламіно або тіокарбамоїлу; і
(b) трициклічної групи:
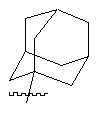 ,
,
де трициклічна група є заміщеною одним або декількома замісниками, вибраними з групи, що складається з:
(а) алкілу, алкенілу і алкінілу, де кожна алкільна, алкенільна або алкінільна група є незаміщеною або заміщеною одним або декількома замісниками, вибраними з групи, що складається з (аміно)(R5) ацилгідразинілкарбонілу, (аміно)(R5) ацилоксикарбокси, (гідрокси)(карбоалкоксі)алкілкарбамоїлу, ацилокси, альдегідо, алкенілсульфоніламіно, алкокси, алкоксикарбонілу, алкіламіноалкіламіно, алкілфосфоно, алкілсульфоніламіно, карбамоїлу, R5, R5-алкокси, R5-алкіламіно, ціано, ціаноалкілкарбамоїлу, циклоалкіламіно, діалкіламіно, діалкіламіноалкіламіно, діалкілфосфоно, галогеналкілсульфоніламіно, гетероциклілалкіламіно, гетероциклілкарбамоїлу, гідрокси, гідроксіалкілсульфоніламіно, оксіміно, фосфоно, заміщеного аралкіламіно, заміщеного арилкарбоксіалкоксикарбонілу, заміщеного гетероарилсульфоніламіно, заміщеного гетероциклілу, тіокарбамоїлу і трифторметилу; і
(b) (алкоксикарбоніл)аралкілкарбамоїлу, альдегідо, алкенокси, алкенілсульфоніламіно, алкокси, алкоксикарбонілу, алкілкарбамоїлу, алкоксикарбоніламіно, алкілсульфоніламіно, алкілсульфонілокси, аміно, аміноалкіларалкілкарбамоїлу, аміноалкілкарбамоїлу, аміно-алкілгетероциклілалкілкарбамоїлу, аміноциклоалкілалкілциклоалкілкарбамоїлу, аміноциклоалкілкарбамоїлу, аралкоксикарбоніламіно, арилгетероциклілу, арилокси, арилсульфоніламіно, арилсульфонілокси, карбамоїлу, карбонілу, -R5, R5-алкокси, R5-алкіл(алкіл)аміно, R5-алкілалкілкарбамоїлу, R5-алкіламіно, R5-алкілкарбамоїлу, R5-алкілсульфонілу, R5-алкілсульфоніламіно, R5-алкілтіо, R5-гетероциклілкарбонілу, ціано, циклоалкіламіно, діалкіламіноалкілкарбамоїлу, галогену, гетероциклілу, гетероциклілалкіламіно, оксіміно, фосфату, заміщеного аралкіламіно, заміщеного гетероциклілу, заміщеного гетероциклілсульфоніламіно, сульфоксіациламіно або тіокарбамоїлу;
R4 вибраний з групи, що складається з водню, С1-4алкілу, С1-4-алкіл-СО2Н або фенілу, де групи С1-4-алкільна, С1-4-алкіл-СО2Н і фенільна є незаміщеними або заміщеними від одного до трьох замісниками, вибраними з групи, що складається з галогену, -ОН, -ОМе, -NH2, NO2, бензилу і бензилу, заміщеного від одного до трьох замісниками, вибраними з групи, що складається з галогену, -ОН, -ОМе, -NH2 і –NO2;
R5 вибраний з групи, що складається з –СН2СООН, -С(СF3)2OН, -CONHNHSO2CF3, -CONHOR4, -CONHSO2R4, -CONHSO2NHR4, -С(ОН)R4РО3Н2, -NНСОСF3, -NHCONHSO2R4, -NHPO3H2, -NHSO2R4, -NHSO2NHCOR4, -ОРО3Н2, -OSO3Н, -PO(OH)R4, -РО3Н2, -SO3Н, -SO2NHR4, -SО3NНСОR4, -SO3NHCONHCO2R4 і наступних груп:
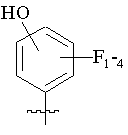 ,
, 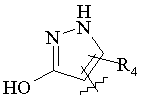 ,
, 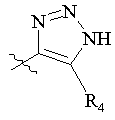 ,
, 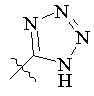 ,
, 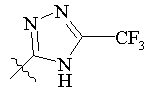 ,
,
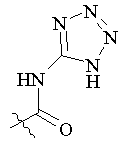 ,
,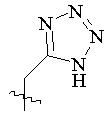 ,
, 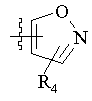 ,
, 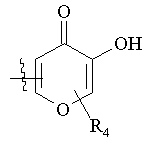 ,
,
Х1 і Х2 незалежно вибрані з групи, що складається з О і S;
Z вибраний з групи, що складається з простого зв'язку, -O-, -(СН2)1-3-, -O(СН2)1-2-, -CH2OCH2, -(CH2)1-2O-, -СН=СНСН2-, -СН=СН- і -СН2СН=СН-; і
R6 вибраний з групи, що складається з водню, алкілу, ацилу, алкілсульфонілу, аралкілу, заміщеного аралкілу і гетероциклілу.
2. Сполука за п. 1, яка знаходиться в формі, вибраній з групи, що складається з ахіральної сполуки, рацемату, оптично активної сполуки, чистого діастереомеру, суміші діастереомерів і фармакологічно прийнятної адитивної солі.
3. Сполука за п. 1, в якій R1 і R2 кожний представляє алкільну групу.
4. Сполука за п. 1, в якій R1 і R2 кожний представляє н-пропіл.
5. Сполука за п. 1, в якій R1 представляє н-пропіл і R3 вибраний з групи, що складається з аралкілу, заміщеного -ОН, -ОМе або галогену, метилу і 3-гідроксипропілу.
6. Сполука за п. 4, в якій Z представляє простий зв'язок.
7. Сполука за п. 6, в якій R3 представляє:
 ,
,
і в якій R3 є незаміщеним або заміщеним одним або декількома замісниками, вибраними з групи, що складається з гідрокси, R5- і R5-алкенілу.
8. Сполука за п. 7, яка являє собою
5-(2,6-діоксо-1,3-дипропіл-2,3,6,7-тетрагідро-1Н-пурин-8-іл)біцикло[3.2.1]октан-1-карбонову кислоту;
8-(4-гідроксибіцикло[3.2.1]окт-1-ил)-1,3-дипропіл-3,7-дигідропурин-2,6-діон;
5-(2,6-діоксо-1,3-дипропіл-2,3,6,7-тетрагідро-1Н-пурин-8-іл)біцикло[3.2.1]октан-2-карбонову кислоту.
9. Сполука за п. 6, в якій R3 представляє
 ,
,
і де R3 є незаміщеним або заміщеним одним або декількома замісниками, вибраними з групи, що складається з гідрокси, R5-алкілу, -R5, R5-алкенілу, алкоксикарбонілу, алкоксикарбонілалкілу, алкоксикарбонілалкенілу, гідроксіалкілу, альдегідо, алкоксіалкілу, R5-алкокси, фосфату, R5-алкілкарбамоїлу і R5-алкіл(алкіл)карбамоїлу.
10. Сполука за п. 9, яка являє собою
8-(4-гідроксибіцикло[2.2.2]окт-1-ил)-1,3-дипропіл-3,7-дигідропурин-2,6-діон;
4-(2,6-діоксо-1,3-дипропіл-2,3,6,7-тетрагідро-1Н-пурин-8-іл)біцикло[2.2.2]октан-1-карбонову кислоту;
4-(2,6-діоксо-1,3-дипропіл-2,3,6,7-тетрагідро-1Н-пурин-8-іл)біцикло[2.2.2]октан-1-карбальдегід;
метиловий ефір 4-(2,6-діоксо-1,3-дипропіл-2,3,6,7-тетрагідро-1Н-пурин-8-іл)біцикло[2.2.2]октан-1-карбонової кислоти;
метиловий ефір 3-[4-(2,6-діоксо-1,3-дипропіл-2,3,6,7-тетрагідро-1Н-пурин-8-іл)біцикло[2.2.2]окт-1-ил]акрилової кислоти;
метиловий ефір 3-[4-(2,6-діоксо-1,3-дипропіл-2,3,6,7-тетрагідро-1Н-пурин-8-іл)біцикло[2.2.2]окт-1-ил]пропіонової кислоти;
3-[4-(2,6-діоксо-1,3-дипропіл-2,3,6,7-тетрагідро-1Н-пурин-8-іл)біцикло[2.2.2]окт-1-ил]акрилову кислоту.
3-[4-(2,6-діоксо-1,3-дипропіл-2,3,6,7-тетрагідро-1Н-пурин-8-іл)біцикло[2.2.2]окт-1-ил]пропіонову кислоту;
4-[4-(2,6-діоксо-1,3-дипропіл-2,3,6,7-тетрагідро-1Н-пурин-8-іл)біцикло[2.2.2]окт-1-ил]масляну кислоту;
моно-[4-(2,6-діоксо-1,3-дипропіл-2,3,6,7-тетрагідро-1Н-пурин-8-іл)біцикло [2.2.2]окт-1-ил]ефір фосфорної кислоти;
{[4-(2,6-діоксо-1,3-дипропіл-2,3,6,7-тетрагідро-1Н-пурин-8-іл)біцикло[2.2.2]октан-1-карбоніл]метиламіно} оцтову кислоту;
{[4-(2,6-діоксо-1,3-дипропіл-2,3,6,7-тетрагідро-1Н-пурин-8-іл)біцикло[2.2.2]октан-1-карбоніл]аміно}оцтову кислоту;
3-[4-(2,6-діоксо-1,3-дипропіл-2,3,6,7-тетрагідро-1Н-пурин-8-іл)біцикло[2.2.2]окт-1-илокси] пропіонову кислоту;
метиловий ефір 3-[4-(2,6-діоксо-1,3-дипропіл-2,3,6,7-тетрагідро-1Н-пурин-8-іл)біцикло[2.2.2]окт-1-илокси]пропіонової кислоти;
трет-бутиловий ефір 3-[4-(2,6-діоксо-1,3-дипропіл-2,3,6,7-тетрагідро-1Н-пурин-8-іл)біцикло[2.2.2]окт-1-ілокси] пропіонової кислоти;
3-[4-(2,6-діоксо-1,3-дипротл-2,3,6,7-тетрагідро-1Н-пурин-8-іл)біцикло[2.2.2]окт-1-ил]-2-метилпропіонову кислоту.
11. Сполука за п. 6, де R3 представляє
 ,
,
і де R3 є незаміщеним або заміщеним одним або декількома замісниками, вибраними з групи, що складається з R5-алкілу, -R5, R5-алкенілу, алкоксикарбонілу, алкоксикарбонілалкенілу, гідроксіалкілу, альдегідо і гідрокси.
12. Сполука за п. 11, яка являє собою
6-(2,6-діоксо-1,3-дипропіл-2,3,6,7-тетрагідро-1Н-пурин-8-іл)кубан-3-карбонову кислоту;
8-(6-гідроксиметилкубан-3-іл)-1,3-дипропіл-3,7-дигідропурин-2,6-діон;
3-[6-(2,6-діоксо-1,3-дипропіл-2,3,6,7-тетрагідро-1Н-пурин-8-іл)кубан-3-іл]акрилову кислоту.
13. Сполука за п. 6, де R3 представляє
 ,
,
і де R3 є незаміщеним або заміщеним одним або декількома замісниками, вибраними з групи, що складається з R5-алкілу, -R5, R5-алкенілу, R5-алкокси, алкоксикарбонілу, алкоксикарбонілалкенілу, гідроксіалкілу, альдегідо і гідрокси.
14. Сполука за п. 13, яка являє собою
[5-(2,6-діоксо-1,3-дипропіл-2,3,6,7-тетрагідро-1Н-пурин-8-іл)біцикло[3.2.2]нон-1-ілоксі]оцтову кислоту;
8-(5-гідроксибіцикло[3.2.2]нон-1-іл)-1,3-дипропіл-3,7-дигідропурин-2,6-діон;
5-(2,6-діоксо-1,3-дипропіл-2,3,6,7-тетрагідро-1Н-пурин-8-іл)біцикло[3.2.2]нонан-1-карбонову кислоту.
15. Сполука за п. 6, де R3 представляє
 ,
,
і де R3 є незаміщеним або заміщеним одним або декількома замісниками, вибраними з групи, що складається з гідрокси, R5-алкокси, R5-алкенілу, алкоксикарбонілу і карбонілу.
16. Сполука за п. 15, яка являє собою
8-(4-гідрокси-7-метил-2,6-діоксабіцикло[3.3.1]нон-1-іл)-1,3-дипропіл-3,7-дигідропурин-2,6-діон;
[1-(2,6-діоксо-1,3-дипропіл-2,3,6,7-тетрагідро-1Н-пурин-8-іл)-7-метил-2,6-діоксабіцикло[3.3.1]нон-4-ілоксі]оцтову кислоту.
17. Лікарська композиція, що містить сполуку за п. 1 разом з придатним наповнювачем.
18. Спосіб лікування суб'єкта, страждаючого від стану, що характеризується підвищеною концентрацією аденозину і/або підвищеною чутливістю до аденозину, який включає введення суб'єкту ефективної для антагоністичної дії відносно аденозину кількості сполуки за п. 1.
19. Спосіб за п. 18, де стан вибраний з групи, що складається з розладів серцевої діяльності і кровообігу, дегенеративних розладів центральної нервової системи, респіраторних захворювань, захворювань, для яких показано лікування сечогінними засобами, хвороби Паркінсона, депресії, травматичного пошкодження головного мозку, післяшокового неврологічного дефіциту, пригнічення дихання, травми головного мозку новонародженого, дислексії, гіперактивності, кистозного фіброзу, циротичного асциту, апное новонародженого, ниркової недостатності, діабету, астми і набрякових станів.
20. Спосіб за п. 18, де вказаний стан являє собою застійну серцеву недостатність або ниркову дисфункцію.
21. Спосіб одержання 8-заміщених ксантинів, що включає стадії:
a) одержання N7, С8-дигідроксантину;
b) захисту положення N7 ксантину;
c) депротонування положення С8 сильною основою з одержанням аніона;
d) захоплення аніона карбоксильною сполукою, карбонільною сполукою, альдегідом або кетоном;
e) зняття захисту у захищеного положення N7 з одержанням 8-заміщеного ксантину.
Текст
1. Сполука, що має формулу: никами, вибраними з групи, що складається з: X1 (а) алкілу, алкенілу і алкінілу, де кожна алкільна, R5 R1 алкенільна або алкінільна група є незаміщеною N або заміщеною одним або декількома замісникаN ми, вибраними з групи, що складається з (аміZ R3 (І) но)(R5)ацилгідразинілкарбонілу, (аміN X2 N но)(R5)ацилоксикарбокси, (гідрокси)(карбоалкоксі)алкілкарбамоїлу, ацилокси, R2 альдегідо, алкенілсульфоніламіно, алкокси, алкок, сикарбонілу, алкіламіноалкіламіно, алкілфосфоно, де R1 і R2 незалежно вибрані з групи, що складаалкілсульфоніламіно, карбамоїлу, R5,R5-алкокси, ється з: R5-алкіламіно, ціано, ціаноалкілкарбамоїлу, циклоa) водню; алкіламіно, діалкіламіно, діалкіламіноалкіламіно, b) алкілу, алкенілу з не менш ніж 3 вуглецевими діалкілфосфоно, галогеналкілсульфоніламіно, атомами або алкінілу з не менш ніж 3 вуглецевими гетероциклілалкіламіно, гетероциклілкарбамоїлу, атомами, причому вказаний алкіл, алкеніл або гідрокси, гідроксіалкілсульфоніламіно, оксіміно, алкініл є незаміщеним або заміщеним одним або фосфоно, заміщеного аралкіламіно, заміщеного декількома замісниками, вибраними з гідрокси, арилкарбоксіалкоксикарбонілу, заміщеного гетеалкокси, аміно, алкіламіно, діалкіламіно, гетероцироарилсульфоніламіно, заміщеного гетероциклілу, клілу, ациламіно, алкілсульфоніламіно і гетероцитіокарбамоїлу і трифторметилу; і (b) (алкоксикарклілкарбоніламіно; і боніл)аралкілкарбамоїлу, альдегідо, алкенокси, c) арилу або заміщеного арилу; алкенілсульфоніламіно, алкокси, алкоксикарбоніR3 вибраний з групи, що складається з: лу, алкілкарбамоїлу, алкоксикарбоніламіно, алкіл(а) біциклічної, трициклічної або пентациклічної сульфоніламіно, алкілсульфонілокси, аміно, амігрупи, вибраної з групи, що складається з: ноалкіларалкілкарбамоїлу, аміноалкілкарбамоїлу, аміноалкілгетеро-циклілалкілкарбамоїлу, аміноциклоалкілалкілциклоалкілкарбамоїлу, аміноциклоаN лкілкарбамоїлу, аралкоксикарбоніламіно, арилгетероциклілу, арилокси, арилсульфоніламіно, арилсульфонілокси, карбамоїлу, карбонілу, -R5,R5, , алкокси, R5-алкіл(алкіл)аміно, R 5алкілалкілкарбамоїлу, R5-алкіламіно, R5алкілкарбамоїлу, R5-алкілсульфонілу, R5O алкілсульфоніламіно, R5-алкілтіо, R5 гетероциклілкарбонілу, ціано, циклоалкіламіно, діалкіламіноалкілкарбамоїлу, галогену, гетероцикO, , лілу, гетероциклілалкіламіно, гідрокси, оксіміно, фосфату, заміщеного аралкіламіно, заміщеного гетероциклілу, заміщеного гетероциклілсульфоніламіно, сульфоксіациламіно або тіокарбамоїлу; і O (b) трициклічної групи: , , O , , , де трициклічна група є заміщеною одним або декількома замісниками, вибраними з групи, що складається з: 5 77391 6 N (а) алкілу, алкенілу і алкінілу, де кожна алкільна, N N алкенільна або алкінільна група є незаміщеною NH N N або заміщеною одним або декількома замісниками, вибраними з групи, що складається з (аміN R4 но)(R5) ацилгідразинілкарбонілу, (аміно)(R5) ациH , , локсикарбокси, N (гідрокси)(карбоалкоксі)алкілкарбамоїлу, ацилокси, N N альдегідо, алкенілсульфоніламіно, алкокси, алкокN сикарбонілу, алкіламіноалкіламіно, алкілфосфоно, N N HN H CF3 алкілсульфоніламіно, карбамоїлу, R5, R5-алкокси, R5-алкіламіно, ціано, ціаноалкілкарбамоїлу, циклоN алкіламіно, діалкіламіно, діалкіламіноалкіламіно, H O , діалкілфосфоно, галогеналкілсульфоніламіно, N гетероциклілалкіламіно, гетероциклілкарбамоїлу, O N N гідрокси, гідроксіалкілсульфоніламіно, оксіміно, N фосфоно, заміщеного аралкіламіно, заміщеного N H арилкарбоксіалкоксикарбонілу, заміщеного гетеR4 роарилсульфоніламіно, заміщеного гетероциклілу, , , , тіокарбамоїлу і трифторметилу; і O (b) (алкоксикарбоніл)аралкілкарбамоїлу, альдегідо, алкенокси, алкенілсульфоніламіно, алкокси, OH алкоксикарбонілу, алкілкарбамоїлу, алкоксикарбоніламіно, алкілсульфоніламіно, алкілсульфонілокси, аміно, аміноалкіларалкілкарбамоїлу, аміноалO кілкарбамоїлу, аміноR4 алкілгетероциклілалкілкарбамоїлу, аміноциклоал, кілалкілциклоалкілкарбамоїлу, аміноциклоалкілкарбамоїлу, аралкоксикарбоніламіно, арилгетероциХ1 і Х2 незалежно вибрані з групи, що складається клілу, арилокси, арилсульфоніламіно, з О і S; арилсульфонілокси, карбамоїлу, карбонілу, -R5, Z вибраний з групи, що складається з простого R5-алкокси, R5-алкіл(алкіл)аміно, R 5зв'язку, -O-, -(СН2)1-3-, -O(СН2)1-2-, -CH2OCH2, алкілалкілкарбамоїлу, R5-алкіламіно, R5 (CH2)1-2O-, -СН=СНСН2-, -СН=СН- і -СН2СН=СН-; і алкілкарбамоїлу, R5-алкілсульфонілу, R 5R6 вибраний з групи, що складається з водню, алалкілсульфоніламіно, R5-алкілтіо, R 5кілу, ацилу, алкілсульфонілу, аралкілу, заміщеного гетероциклілкарбонілу, ціано, циклоалкіламіно, аралкілу і гетероциклілу. діалкіламіноалкілкарбамоїлу, галогену, гетероцик2. Сполука за п. 1, яка знаходиться в формі, виблілу, гетероциклілалкіламіно, оксіміно, фосфату, раній з групи, що складається з ахіральної сполузаміщеного аралкіламіно, заміщеного гетероцикліки, рацемату, оптично активної сполуки, чистого лу, заміщеного гетероциклілсульфоніламіно, судіастереомеру, суміші діастереомерів і фармакольфоксіациламіно або тіокарбамоїлу; логічно прийнятної адитивної солі. R4 вибраний з групи, що складається з водню, С13. Сполука за п. 1, в якій R1 і R2 кожний представляє алкільну групу. 4алкілу, С1-4-алкіл-СО2Н або фенілу, де групи С1-4алкільна, С1-4-алкіл-СО2Н і фенільна є незаміще4. Сполука за п. 1, в якій R1 і R2 кожний представними або заміщеними від одного до трьох замісниляє н-пропіл. ками, вибраними з групи, що складається з гало5. Сполука за п. 1, в якій R1 представляє н-пропіл і гену, -ОН, -ОМе, -NH2, NO2, бензилу і бензилу, R3 вибраний з групи, що складається з аралкілу, заміщеного від одного до трьох замісниками, вибзаміщеного -ОН, -ОМе або галогену, метилу і 3раними з групи, що складається з галогену, -ОН, гідроксипропілу. ОМе, -NH2 і –NO2; 6. Сполука за п. 4, в якій Z представляє простий R5 вибраний з групи, що складається з –СН2СООН, зв'язок. -С(СF3)2OН, -CONHNHSO2CF3, -CONHOR4, 7. Сполука за п. 6, в якій R3 представляє: CONHSO2R4, -CONHSO2NHR4, -С(ОН)R4РО3Н2, NНСОСF3, -NHCONHSO2R4, -NHPO3H2, -NHSO2R4, -NHSO2NHCOR4, -ОРО3Н2, -OSO3Н, -PO(OH)R4, РО3Н2, -SO3Н, -SO2NHR4, -SО3NНСОR4, SO3NHCONHCO2R4 і наступних груп: HO F1-4 N H N R4 , HO , , і в якій R3 є незаміщеним або заміщеним одним або декількома замісниками, вибраними з групи, що складається з гідрокси, R5- і R5-алкенілу. 8. Сполука за п. 7, яка являє собою 5-(2,6-діоксо-1,3-дипропіл-2,3,6,7-тетрагідро-1Нпурин-8-іл)біцикло[3.2.1]октан-1-карбонову кислоту; 7 77391 8-(4-гідроксибіцикло[3.2.1]окт-1-ил)-1,3-дипропіл3,7-дигідропурин-2,6-діон; 5-(2,6-діоксо-1,3-дипропіл-2,3,6,7-тетрагідро-1Нпурин-8-іл)біцикло[3.2.1]октан-2-карбонову кислоту. 9. Сполука за п. 6, в якій R3 представляє , і де R3 є незаміщеним або заміщеним одним або декількома замісниками, вибраними з групи, що складається з гідрокси, R5-алкілу, -R5, R5-алкенілу, алкоксикарбонілу, алкоксикарбонілалкілу, алкоксикарбонілалкенілу, гідроксіалкілу, альдегідо, алкоксіалкілу, R5-алкокси, фосфату, R5-алкілкарбамоїлу і R5-алкіл(алкіл)карбамоїлу. 10. Сполука за п. 9, яка являє собою 8-(4-гідроксибіцикло[2.2.2]окт-1-ил)-1,3-дипропіл3,7-дигідропурин-2,6-діон; 4-(2,6-діоксо-1,3-дипропіл-2,3,6,7-тетрагідро-1Нпурин-8-іл)біцикло[2.2.2]октан-1-карбонову кислоту; 4-(2,6-діоксо-1,3-дипропіл-2,3,6,7-тетрагідро-1Нпурин-8-іл)біцикло[2.2.2]октан-1-карбальдегід; метиловий ефір 4-(2,6-діоксо-1,3-дипропіл-2,3,6,7тетрагідро-1Н-пурин-8-іл)біцикло[2.2.2]октан-1карбонової кислоти; метиловий ефір 3-[4-(2,6-діоксо-1,3-дипропіл2,3,6,7-тетрагідро-1Н-пурин-8-іл)біцикло[2.2.2]окт1-ил]акрилової кислоти; метиловий ефір 3-[4-(2,6-діоксо-1,3-дипропіл2,3,6,7-тетрагідро-1Н-пурин-8-іл)біцикло[2.2.2]окт1-ил]пропіонової кислоти; 3-[4-(2,6-діоксо-1,3-дипропіл-2,3,6,7-тетрагідро-1Нпурин-8-іл)біцикло[2.2.2]окт-1-ил]акрилову кислоту. 3-[4-(2,6-діоксо-1,3-дипропіл-2,3,6,7-тетрагідро-1Нпурин-8-іл)біцикло[2.2.2]окт-1-ил]пропіонову кислоту; 4-[4-(2,6-діоксо-1,3-дипропіл-2,3,6,7-тетрагідро-1Нпурин-8-іл)біцикло[2.2.2]окт-1-ил]масляну кислоту; моно-[4-(2,6-діоксо-1,3-дипропіл-2,3,6,7-тетрагідро1Н-пурин-8-іл)біцикло [2.2.2]окт-1-ил]ефір фосфорної кислоти; {[4-(2,6-діоксо-1,3-дипропіл-2,3,6,7-тетрагідро-1Нпурин-8-іл)біцикло[2.2.2]октан-1карбоніл]метиламіно} оцтову кислоту; {[4-(2,6-діоксо-1,3-дипропіл-2,3,6,7-тетрагідро-1Нпурин-8-іл)біцикло[2.2.2]октан-1карбоніл]аміно}оцтову кислоту; 3-[4-(2,6-діоксо-1,3-дипропіл-2,3,6,7-тетрагідро-1Нпурин-8-іл)біцикло[2.2.2]окт-1-илокси] пропіонову кислоту; метиловий ефір 3-[4-(2,6-діоксо-1,3-дипропіл2,3,6,7-тетрагідро-1Н-пурин-8-іл)біцикло[2.2.2]окт1-илокси]пропіонової кислоти; трет-бутиловий ефір 3-[4-(2,6-діоксо-1,3-дипропіл2,3,6,7-тетрагідро-1Н-пурин-8-іл)біцикло[2.2.2]окт1-ілокси] пропіонової кислоти; 3-[4-(2,6-діоксо-1,3-дипротл-2,3,6,7-тетрагідро-1Нпурин-8-іл)біцикло[2.2.2]окт-1-ил]-2метилпропіонову кислоту. 11. Сполука за п. 6, де R3 представляє 8 , і де R3 є незаміщеним або заміщеним одним або декількома замісниками, вибраними з групи, що складається з R5-алкілу, -R5, R5-алкенілу, алкоксикарбонілу, алкоксикарбонілалкенілу, гідроксіалкілу, альдегідо і гідрокси. 12. Сполука за п. 11, яка являє собою 6-(2,6-діоксо-1,3-дипропіл-2,3,6,7-тетрагідро-1Нпурин-8-іл)кубан-3-карбонову кислоту; 8-(6-гідроксиметилкубан-3-іл)-1,3-дипропіл-3,7дигідропурин-2,6-діон; 3-[6-(2,6-діоксо-1,3-дипропіл-2,3,6,7-тетрагідро-1Нпурин-8-іл)кубан-3-іл]акрилову кислоту. 13. Сполука за п. 6, де R3 представляє , і де R3 є незаміщеним або заміщеним одним або декількома замісниками, вибраними з групи, що складається з R5-алкілу, -R5, R5-алкенілу, R5алкокси, алкоксикарбонілу, алкоксикарбонілалкенілу, гідроксіалкілу, альдегідо і гідрокси. 14. Сполука за п. 13, яка являє собою [5-(2,6-діоксо-1,3-дипропіл-2,3,6,7-тетрагідро-1Нпурин-8-іл)біцикло[3.2.2]нон-1-ілоксі]оцтову кислоту; 8-(5-гідроксибіцикло[3.2.2]нон-1-іл)-1,3-дипропіл3,7-дигідропурин-2,6-діон; 5-(2,6-діоксо-1,3-дипропіл-2,3,6,7-тетрагідро-1Нпурин-8-іл)біцикло[3.2.2]нонан-1-карбонову кислоту. 15. Сполука за п. 6, де R3 представляє O O , і де R3 є незаміщеним або заміщеним одним або декількома замісниками, вибраними з групи, що складається з гідрокси, R5-алкокси, R5-алкенілу, алкоксикарбонілу і карбонілу. 16. Сполука за п. 15, яка являє собою 8-(4-гідрокси-7-метил-2,6-діоксабіцикло[3.3.1]нон1-іл)-1,3-дипропіл-3,7-дигідропурин-2,6-діон; [1-(2,6-діоксо-1,3-дипропіл-2,3,6,7-тетрагідро-1Нпурин-8-іл)-7-метил-2,6-діоксабіцикло[3.3.1]нон-4ілоксі]оцтову кислоту. 17. Лікарська композиція, що містить сполуку за п. 1 разом з придатним наповнювачем. 18. Спосіб лікування суб'єкта, страждаючого від стану, що характеризується підвищеною концентрацією аденозину і/або підвищеною чутливістю до аденозину, який включає введення суб'єкту ефективної для антагоністичної дії відносно аденозину кількості сполуки за п. 1. 19. Спосіб за п. 18, де стан вибраний з групи, що складається з розладів серцевої діяльності і кровообігу, дегенеративних розладів центральної не 9 77391 10 рвової системи, респіраторних захворювань, за21. Спосіб одержання 8-заміщених ксантинів, що хворювань, для яких показано лікування сечогінвключає стадії: ними засобами, хвороби Паркінсона, депресії, a) одержання N7, С8-дигідроксантину; травматичного пошкодження головного мозку, пісb) захисту положення N7 ксантину; ляшокового неврологічного дефіциту, пригнічення c) депротонування положення С8 сильною оснодихання, травми головного мозку новонародженовою з одержанням аніона; го, дислексії, гіперактивності, кистозного фіброзу, d) захоплення аніона карбоксильною сполукою, циротичного асциту, апное новонародженого, ниркарбонільною сполукою, альдегідом або кетоном; кової недостатності, діабету, астми і набрякових e) зняття захисту у захищеного положення N7 з станів. одержанням 8-заміщеного ксантину. 20. Спосіб за п. 18, де вказаний стан являє собою застійну серцеву недостатність або ниркову дисфункцію. Дана заявка має пріоритет від 12 листопада 1999р. по попередній заявці №60/165191 на патент США. Даний винахід відноситься до антагоністів аденозинових рецепторів і до способів їх одержання і застосування для лікування захворювань. Аденозин є внутрішньоклітинним і позаклітинним месенджером, що виробляється всіма клітинами в організмі. Він виробляється також позаклітинно шляхом ферментативного перетворення. Аденозин зв'язується з сіма трансмембранними, пов'язаними з G-білком рецепторами і активує їх, викликаючи різноманітні фізіологічні реакції у відповідь. Сам аденозин, речовини, що імітують дію аденозина (агоністи), і речовини, що є його антагоністами, мають важливе клінічне застосування. Аденозинові рецептори діляться на чотири відомих підтипи (тобто А1, А2а, А2b і А3). Вказані підтипи володіють незвичайною і іноді протилежною дією. Активація аденозинового А1-рецептора, наприклад, спричиняє підвищення ниркового судинного опору, а активація аденозинового А2а-рецептора спричиняє зниження ниркового судинного опору. У більшості систем органів періоди метаболічного стресу приводять до значного зростання концентрації аденозину в тканинах. Наприклад, серце продукує і вивільняє аденозин для опосередкування адаптивних реакції у відповідь на стрес, такі як зменшення частоти серцевих скорочень і розширення коронарних судин серця. Аналогічним чином, у відповідь на гіпоксію, метаболічний стрес і багато які нефротоксичні речовини концентрація аденозину в нирках підвищується. Нирки також виробляють аденозин конститутивно. Нирки регулюють кількість конститутивно продукованого аденозину, щоб регулювати клубочкову фільтрацію і електролітну реабсорбцію. Що стосується клубочкової фільтрації, то активація А1-рецепторів приводить до звуження приносячих артеріол, тоді як активація А2а-рецепторів веде до розширення виносячих артеріол. Активація А2a-рецепторів може також надавати судинорозширювальну дію на приносячу артеріолу. Загалом, ефект активації вказаних клубочкових аденозинових рецепторів полягає в зниженні рівня клубочкової фільтрації. Крім того, аденозинові А1-рецептори локалізовані в областях проксимальних і дистальних канальців. Активація цих рецепторів стимулює реабсорбцію натрію з просвіту канальців. Отже, блокування дії аденозину на ці рецептори дасть підвищення рівня клубочкової фільтрації і збільшення екскреції натрію. Даний винахід заснований на тому, що, як було виявлено, сполуки формули І несподівано виявилися дуже могутніми і виборчими інгібіторами певних підтипів аденозинових рецепторів. Антагоністи аденозину можуть бути корисні для профілактики і/або лікування численних захворювань, що включають розлади серцевої діяльності і кровообігу, дегенеративні розлади центральної нервової системи, респіраторні захворювання і багато які захворювання, для яких показано лікування сечогінними засобами. В одному з варіантів здійснення даний винахід відноситься до сполуки формули І: У формулі І R1 і R2 можуть (незалежно) представляти: a) водень; b) алкіл, алкеніл з не менш ніж 3 вуглецевими атомами або алкініл з не менш ніж 3 вуглецевими атомами (наприклад, коли алкіл, алкеніл або алкініл може бути незаміщеним або заміщеним одним або декількома заступниками, вибраними з гідрокси, алкокси, аміно, алкіламіно, діалкіламіно, гетероциклілу, ациламіно, алкілсульфоніламіно і гетероциклілкарбоніламіно); або c) арил або заміщений арил; R3 вибраний з групи, що складається з: (а) біциклічної, трициклічної або пентациклічної групи, вибраної з: 11 де біциклічна або трициклічна група може бути незаміщеною або заміщеною одним або декількома заступниками, вибраними з: (a) алкілу, алкенілу і алкінілу, де кожна алкільна, алкенільна або алкінільна група може бути незаміщеною або заміщеною одним або декількома заступниками, вибраними з групи, що складається з (аміно) (R5)ацилгідразинілкарбонілу, (аміно) (R5) ацилоксикарбокси, (гідрокси) (карбоалкокси) алкілкарбамоїлу, ацилокси, альдегідо, алкенілсульфоніламіно, алкокси, алкоксикарбонілу, алкіламіноалкіламіно, алкілфосфоно, алкілсульфоніламіно, карбамоїлу, R5, R5-алкокси, R5алкіламіно, ціано, ціаноалкілкарбамоїлу, циклоалкіламіно, діалкіламіно, діалкіламіноалкіламіно, діалкілфосфоно, галогеналкілсульфоніламіно, гетероциклілалкіламіно, гетероциклілкарбамоїлу, гідрокси, гідроксіалкілсульфоніламіно, оксиміно, фосфоно, заміщеного аралкіламіно, заміщеного арилкарбоксіалкоксикарбонілу, заміщеного гетероарилсульфоніламіно, заміщеного гетероциклілу, тіокарбамоїлу і трифторметилу; або (b) (алкоксикарбоніл)аралкілкарбамоїлу, альдегідо, алкенокси, алкенілсульфоніламіно, алкокси, алкоксикарбонілу, алкілкарбамоїлу, алкоксикарбоніламіно, алкілсульфоніламіно, алкілсульфонілокси, аміно, аміноалкіларалкілкарбамоїлу, аміноалкілкарбамоїлу, аміноалкілгетероциклілалкілкарбамоїлу, аміноциклоалкілалкілциклоалкілкарбамоїлу, аміноциклоалкілкарбамоїлу, аралкоксикарбоніламіно, арилгетероциклілу, арилокси, арилсульфоніламіно, арилсульфонілокси, карбамоїлу, карбонілу, R5, R5-алкокси, R5алкіл(алкіл)аміно, R5-алкілалкілкарбамоїлу, R5алкіламіно, R5-алкілкарбамоїлу, R 5алкілсульфонілу, R5-алкілсульфоніламіно, R5алкілтіо, R5-гетероциклілкарбонілу, ціано, циклоалкіламіно, діалкіламіноалкілкарбамоїлу, галогену, гетероциклілу, гетероциклілалкіламіно, гідрокси, оксиміно, фосфату, заміщеного аралкіламіно, заміщеного гетероциклілу, заміщеного гетероциклілсульфоніламіно, сульфоксіациламіно або тіокарбамоїлу; і (b) трициклічної групи: де трициклічна група є заміщеною одним або декількома заступниками, вибраними з групи, що складається з: 77391 12 (a) алкілу, алкенілу і алкінілу, де кожна алкільна, алкенільна або алкінільна група є незаміщеною або заміщеною одним або декількома заступниками, вибраними з групи, що складається з (аміно) (R5)ацилгідразинілкарбонілу, (аміно)(R5)ацилоксикарбокси, (гідрокси)(карбоалкокси) алкілкарбамоїлу, ацилокси, альдегідо, алкенілсульфоніламіно, алкокси, алкоксикарбонілу, алкіламіноалкіламіно, алкілфосфоно, алкілсульфоніламіно, карбамоїлу, R5, R5-алкокси, R5-алкіламіно, ціано, ціаноалкілкарбамоїлу, циклоалкіламіно, діалкіламіно, діалкіламіноалкіламіно, діалкілфосфоно, галогеналкілсульфоніламіно, гетероциклілалкіламіно, гетероциклілкарбамоїлу, гідрокси, гідроксіалкілсульфоніламіно, оксиміно, фосфоно, заміщеного аралкіламіно, заміщеного арилкарбоксіалкоксикарбонілу, заміщеного гетероарилсульфоніламіно, заміщеного гетероциклілу, тіокарбамоїлу і трифторметилу; і (b) (алкоксикарбоніл)аралкілкарбамоїлу, альдегідо, алкенокси, алкенілсульфоніламіно, алкокси, алкоксикарбонілу, алкілкарбамоїлу, алкоксикарбоніламіно, алкілсульфоніламіно, алкілсульфонілокси, аміно, аміноалкіларалкілкарбамоїлу, аміноалкілкарбамоїлу, аміноалкілгетероцикліл-алкілкарбамоїлу, аміноциклоалкілалкілциклоалкілкарбамоїлу, аміноциклоалкілкарбамоїлу, аралкоксикарбоніламіно, арилгетероциклілу, арилокси, арилсульфоніламіно, арилсульфонілокси, карбамоїлу, карбонілу, R5, R5-алкокси, R5-алкiл (алкіл) аміно, R5-алкілалкілкарбамоїлу, R 5алкіламіно, R5-алкілкарбамоїлу, R 5алкілсульфонілу, R5-алкілсульфоніламіно, R5алкілтіо, R5-гетероциклілкарбонілу, ціано, циклоалкіламіно, діалкіламіноалкілкарбамоїлу, галогену, гетероциклілу, гетероциклілалкіламіно, оксиміно, фосфату, заміщеного аралкіламіно, заміщеного гетероциклілу, заміщеного гетероциклілсульфоніламіно, сульфоксіациламіно або тіокарбамоїлу; R4 може представляти водень, С1-4-алкіл, С1-4алкіл-СО2Н або феніл, де групи С1-4-алкільна, С1-4алкіл-СО2Н і фенільна можуть бути незаміщеними або заміщеними одним, двома, трьома або більш заступниками, такими як галоген, -ОН, - ОМе, NH2, -NO2 і бензил або бензил, заміщений одним, двома, трьома або більш заступниками, такими як галоген, -ОН, -ОМе, -NH2 і -NO2; R5 може представляти -СН2СООН, -C(CF3)2OH -CONHNHSO2CF3, -CONHOR4, -CONHSO2R4, CONHSO2NHR4, -C(OH) R4PO3H2, -NHCOCF3, NHCONHSO2R4, -NHPO3H2, -NHSO2R4, NHSO2NHCOR4, -OPO3H2, -OSO3H, -PO(OH)R4, PO3H2, -SO3H, -SO2NHR4, -SO3NHCOR4, SO3NHCONHCO2R4 або будь-яку з наступних груп: Χ1 і Х2 вибрані з кисню (О) і сірки (S); 13 77391 14 Ζ може представляти простий зв'язок, -О-, тетрагідро-1Н-пурин-8-іл)біцикло[2.2.2]окт-1(СН2)1-3-, -О(СН2)1-2-, -СН2ОСН2-, -(СН2)1-2О-, іл]пропіонову кислоту, 4-[4-(2,6-діоксо-1,3СН=СНСН2-, -СН=СН- або - СН2СН-СН-; і дипропіл-2,3,6,7-тетрагідро-1Н-пурин-8R6 може представляти водень, алкіл, ацил, аліл)біцикло[2.2.2]окт-1-іл]масляну кислоту, складний кілсульфоніл, аралкіл, заміщений аралкіл, заміщемоно-[4-(2,6-діоксо-1,3-дипропіл-2,3,6,7-тетрагідроний алкіл або гетероцикліл. 1Н-пурин-8-іл)біцикло[2.2.2]окт-1-іл]ефір фосфорПереважно R6 представляє водень. Однак, коної кислоти, {[4-{2,6-діоксо-1,3-дипропіл-2,3,6,7ли R6 представляє метил або інший неводневий тетрагідро-1Н-пурин-8-іл)біцикло[2.2.2]октан-1заступник, сполуки можуть виявляти високу вибіркарбоніл]метиламіно}оцтову кислоту, {[4-(2,6ковість до інгібування аденозинових А2адіоксо-1,3-дипропіл-2,3,6,7-тетрагідро-1Н-пурин-8рецепторів. іл)біцикло[2.2.2]октан-1-карбоніл]аміно}оцтову киУ деяких варіантах R1 і R2 можуть представляслоту, 3-[4-(2,6-діоксо-1,3-дипропіл-2,3,6,7ти однакові або різні алкільні групи (наприклад, тетрагідро-1Н-пурин-8-іл)біцикло[2.2.2]окт-1один або обидва можуть представляти н-пропіл). илокси]пропіонову кислоту, метиловий ефір 3-[4R3 може представляти аралкіл, заміщений (2,6-діоксо-1,3-дипропіл-2,3,6,7-тетрагідро-1НОН, -ОМе або галогеном, метил або 3пурин-8-іл)біцикло[2.2.2]окт-1-илокси]пропіонової гідроксипропіл, a Z може представляти простий кислоти, трет-бутиловий ефір 3-[4-(2,6-діоксо-1,3зв'язок. дипропіл-2,3,6,7-тетрагідро-1Н-пурин-8У деяких варіантах R3 може представляти: іл)біцикло[2.2.2]окт-1-ілокси]пропіонової кислоти або 3-[4-(2,6-діоксо-1,3-дипропіл-2,3,6,7тетрагідро-1Н-пурин-8-іл)біцикло[2.2.2]окт-1-іл]-2метилпропіонову кислоту. В іншому варіанті R3 може представляти: і може бути незаміщеним або заміщеним одним або декількома (тобто 1, 2, 3 або більш) заступниками, такими, як гідрокси, R5- або R5aлкeнiл. Таким чином, сполука може являти собою, наприклад, 5-(2,6-діоксо-1,3-дипропіл-2,3,6,7тетрагідро-1Н-пурин-8-іл)біцикло[3.2.1]октан-1карбонову кислоту, 8-(4-гідроксибіцикло[3.2.1]окт1-іл)-1,3-дипропіл-3,7-дигідропурин-2,6-діон або 5(2,6-діоксо -1,3-дипропіл-2,3,6,7-тетрагідро-1Нпурин-8-іл)біцикло[3.2.1]октан-2-карбонову кислоту. В інших варіантах R3 може представляти: і може бути незаміщеним або заміщеним одним або декількома заступниками, такими, як гідрокси, R5-aлкiл, -R5, R5-aлкeнiл, алкоксикарбоніл, алкоксикарбонілалкіл, алкоксикарбонілалкеніл, гідроксіалкіл, альдегідо, алкоксіалкіл, R5-алкокси, фосфат, R5-aлкiлкapбaмoїл і R 5алкіл(алкіл)карбамоїл. Таким чином, сполука може являти собою, наприклад, 8-(4гідроксибіцикло[2.2.2]окт-1-іл)-1,3-дипропіл-3,7дигідропурин-2,6-діон, 4-(2,6-діоксо-1,3-дипропіл2,3,6,7-тетрагідро-1Н-пурин-8іл)біцикло[2.2.2]октан-1-карбонову кислоту, 4-(2,6діоксо-1,3-дипропіл-2,3,6,7-тетрагідро-1Н-пурин-8іл)біцикло[2.2.2]октан-1-карбальдегід, метиловий ефір 4-(2,6-діоксо-1,3-дипропіл-2,3,6,7-тетрагідро1Н-пурин-8-іл)біцикло[2.2.2]октан-1-карбонової кислоти, метиловий ефір 3-[4-(2,6-діоксо-1,3дипропіл-2,3,6,7-тетрагідро-1Н-пурин-8-іл)біцикло[2.2.2]окт-1-іл]акрилової кислоти, метиловий ефір 3-[4-(2,6-діоксо-1,3-дипропіл-2,3,6,7-тетрагідро-1Нпурин-8-іл)біцикло[2.2.2]окт-1-іл]пропіонової кислоти, 3-[4-(2,6-діоксо-1,3-дипропіл-2,3,6,7-тетрагідро1Н-пурин-8-іл)біцикло[2.2.2]окт-1-іл]акрилову кислоту, 3-[4-(2,6-діоксо-1,3-дипропіл-2,3,6,7 і може бути незаміщеним або заміщеним одним або декількома заступниками, такими, як R5алкіл, -R5, R5-алкеніл, алкоксикарбоніл, алкоксикарбонілалкеніл, гідроксіалкіл, альдегідо і гідрокси. Таким чином, сполука може являти собою, наприклад, 6-(2,6-діоксо-1,3-дипропіл-2,3,6,7-тетрагідро1Н-пурин-8-іл)кубан-3-карбонову кислоту, 8-(6гідроксиметилкубан-3-іл)-1,3-дипропіл-3,7дигідропурин-2,6-діон або 3-[6-(2,6-діоксо-1,3дипропіл-2,3,6,7-тетрагідро-1Н-пурин-8-іл)кубан-3іл]акрилову кислоту. У ще одному варіанті R3 може представляти: і може бути незаміщеним або заміщеним одним або декількома заступниками, такими, як R5алкіл, -R5, R5-алкеніл, R5-aлкoкcи, алкоксикарбоніл, алкоксикарбонілалкеніл, гідроксиалкіл, альдегідо і гідрокси. Таким чином, сполука може являти собою, наприклад, [5-(2,6-діоксо-1,3-дипропіл2,3,6,7-тетрагідро-1Н-пурин-8-іл)біцикло[3.2.2]нон1-ілокси]оцтову кислоту, 8-(5гідроксибіцикло[3.2.2]нон-1-іл)-1,3-дипропіл-3,7дигідропурин-2,6-діон або 5-(2,6-діоксо-1,3дипропіл-2,3,6,7-тетрагідро-1Н-пурин-8іл)біцикло[3.2.2]нонан-1-карбонову кислоту. І в ще одному варіанті R3 може представляти: і може бути незаміщеним або заміщеним одним або декількома заступниками, такими як гідро 15 77391 16 кси, R5-алкокси, R5-алкены, алкоксикарбоніл і карня положення С8 сильною основою (такою як діібоніл. Таким чином, сполука може являти собою, зопропіламід літію або н-бутиллітій) з одержанням наприклад, 8-(4-гідрокси-7-метил-2,6аніону, захоплення аніону карбоксильною сполудіоксабщикло[3.3.1]нон-1-іл)-1,3-дипропіл-3,7кою, карбонільною сполукою, альдегідом або кедигідропурин-2,6-діон або[1-(2,6-діоксо-1,3тоном і зняття захисту в захищеному положенні N7 дипротл-2,3,6,7-тетрагідро-1Н-пурин-8-іл)-7-метилз одержанням 8-заміщеного ксантину. 2,6-діоксабіцикло [3.3.1]нон-4-ілокси]оцтову кисПри використанні в даному описі група «алкіл» лоту. означає насичену аліфатичну вуглеводневу групу. Сполука може бути, наприклад, в формі ахиАлкільна група може бути нерозгалуженою або ральної сполуки, рацемата, оптично активної спорозгалуженою і може мати, наприклад, від 1 до 6 луки, чистого діастереомеру, суміші діастереомевуглецевих атомів в ланцюгу. Приклади нерозгарів або фармакологічно прийнятної адитивної солі. лужених алкільних груп включають, але не обмеСполуки по даному винаходу можуть бути тажуються ними, етил і бутил. Приклади розгалужекож модифіковані шляхом приєднання відповідних них груп включають, але не обмежуються ними, функціональних груп для поліпшення виборчих ізопропіл і трет-бутил. біологічних властивостей. Такі модифікації відомі в «Алкеніл» означає аліфатичну вуглеводневу даній області і включають модифікації, які збільгрупу, яка має принаймні один подвійний зв'язок. шують біологічну проникність в задану біологічну Алкенільна група може бути нерозгалуженою або систему (наприклад, кров, лімфатичну систему, розгалуженою і може мати, наприклад, від 3 до 6 центральну нервову систему), підвищують перовуглецевих атомів в ланцюгу і 1 або 2 подвійні ральну доступність, підвищують розчинність, зазв'язки. Приклади алкенільної групи включають, безпечуючи тим самим можливість введення шляале не обмежуються ними, аліл і ізопреніл. хом ін'єкції, полегшують метаболізм і/або «Алкініл» означає аліфатичну вуглеводневу змінюють швидкість виведення. Приклади вказагрупу, яка має принаймні один потрійний зв'язок. них модифікацій включають, але не обмежуються Алкінільна група може бути нерозгалуженою або ними, етерифікацію поліетиленгліколями, одеррозгалуженою і може мати, наприклад, від 3 до 6 жання похідних пивалатами або заступниками вуглецевих атомів в ланцюгу і 1-2 потрійні зв'язки. жирними кислотами, перетворення в карбамати, Приклади алкінільної групи включають, але не гідроксилювання ароматичних кілець і гетероатообмежуються ними, пропаргіл і бутиніл. мне заміщення в ароматичних кільцях. «Арил» означає фенільну або нафтильну груВідповідно до даного винаходу пропонується пу або її похідні. «Заміщена арильна» група ознатакож лікарська композиція, що включає будь-яку з чає арильну групу, яка заміщена одним або декіописаних вище сполук, одну або в поєднанні, ралькома заступниками, такими як алкіл, алкокси, зом з відповідним наповнювачем. аміно, нітро, карбокси, карбоалкокси, ціано, алкіПропонується також спосіб лікування суб'єкта, ламіно, діалкіламіно, галоген, гідрокси, гідроксіалстраждаючого від стану, що характеризується підкіл, меркаптил, алкілмеркаптил, тригалогеналкіл, вищеною концентрацією аденозину і/або підвищекарбоксіалкіл, сульфокси або карбамоїл. ною чутливістю до аденозину і/або підвищеним «Аралкіл» означає алкільну групу, заміщену числом аденозинових рецепторів або їх підвищеарильною групою. Прикладом аралкільної групи є ною здібністю до скріплення. Спосіб включає стабензил. дію введення суб'єкту ефективної кількості будь«Циклоалкіл» означає аліфатичне кільце з, якої з вищеописаних сполук як антагоніста аденонаприклад, 3-8 вуглецевих атомів. Приклади цикзинових рецепторів. Вказаний стан може являти лоалкільних груп включають циклопропіл і циклособою, наприклад, розлад серцевої діяльності і гексил. кровообігу, дегенеративний розлад центральної «Ацил» означає нерозгалужену або розгалунервової системи, респіраторне захворювання, жену алкіл-С(=О)-групу або формільну групу. Призахворювання, для якого показано лікування сечоклади ацильних груп включають алканоїльні групи гінними засобами, гіпертензію, хворобу Паркінсо(наприклад, що мають від 1 до 6 вуглецевих атона, депресію, травматичне пошкодження головномів в алкільній групі). Прикладами ацильних груп є го мозку, післяшоковий неврологічний дефіцит, ацетил і пивалоїл. Ацильні групи можуть бути запридушення дихання, травму головного мозку номіщеними або незаміщеними. вонародженого, дислексію, гіперактивність, кисто«Карбамоїл» означає групу, що має формулу зний фіброз, циротичний асцит, апное новонароH2N-CO2-. «Алкілкарбамоїл» і «діалкілкарбамоїл» дженого, ниркову недостатність, діабет, астму, відносяться до карбамоїльних груп, в яких азот набряклий стан, застійну серцеву недостатність має одну або дві алкільні групи, приєднані замість або ниркову дисфункцію (наприклад, дисфункцію, атомів водню відповідно. Аналогічним чином, пов'язану із застосуванням сечогінних засобів при «арилкарбамоїл» і «арилалкілкарбамоїл» включазастійній серцевій недостатності, або ниркове отють арильну групу замість одного з атомів водню і руєння внаслідок лікування хіміотерапевтичними (в останньому випадку) алкільну групу замість друзасобами). гого атома водню. Відповідно до даного винаходу пропонується «Карбоксил» означає групу -СООН. також спосіб одержання 8-заміщених ксантинів. «Алкокси» означає алкіл-О-групу, в якій «алСпосіб включає стадії одержання N7, С8кіл» такий, як описаний вище. дигідроксантину (наприклад, сполуки 10 на Фіг.1), «Алкоксіалкіл» означає алкільну групу, як опизахисту положення N7 ксантину (наприклад, з висана вище, з атомом водню, заміщеним алкоксигкористанням ТНР або ВОМ ефіру), депротонуванрупою, як описана вище. 17 77391 18 «Галоген» означає фтор, хлор, бром або йод. для лікування худоби і домашніх тварин. «Гетероцикліл» означає 5-10-членну кільцеву Якщо не вказане інше, все технічні і наукові структуру, в якій один або декілька атомів в кільці терміни, що використовуються в даному описі, являють собою елемент, відмінний від вуглецю, мають те ж значення, яке звичайно знайоме фахінаприклад N,O, S. Гетероциклічна група може бути вцеві в області, до якої відноситься даний винахід. ароматичною або неароматичною, тобто може Хоч при практичному здійсненні даного винаходу бути насиченою або частково або повністю ненаабо при випробуваннях сполук по даному винахосиченою. Приклади гетероциклічних груп включаду можна використати способи і матеріали, аналоють піридил, імідазоліл, фураніл, тієніл, тіазоліл, гічні або рівноцінні тим, що описані в даному описі, тетрагідрофураніл, тетрагідропіраніл, морфолініл, відповідними способами і матеріалами є ті, які тіоморфолініл, індоліл, індолініл, ізоіндолініл, піпеописані нижче. Всі публікації, заявки на патент, ридиніл, піримідиніл, піперазиніл, ізоксазоліл, ізокпатенти і інші посилання, згадані в даному описі, сазолідиніл, тетразоліл і бензімідазоліл. повністю включені сюди як посилання. Крім того, «Заміщений гетероцикліл» означає гетероцикматеріали, способи і приклади є ілюстративними, лічну групу, в якій один або декілька атомів водню а не такими, що обмежують. заміщені заступниками, такими, як алкокси, алкіІнші ознаки і переваги даного винаходу очевиламіно, діалкіламіно, карбалкокси, карбамоїл, ціадні з наступного докладного опису і з формули но, галоген, тригалогенметил, гідрокси, карбоніл, винаходу. тіокарбоніл, гідроксиалкіл або нітро. Фіг.1 - серія ілюстративних прикладів сполук «Гідроксиалкіл» означає алкільну групу, заміпо даному винаходу. щену гідроксигрупою. Фіг.2 - схематичне зображення синтезу сполук «Сульфамоїл» означає групу формули по даному винаходу. S(O)2NH2. Фіг.3 - схематичне зображення альтернативно«Алкілсульфамоїл» і «діалкілсульфамоїл» відго шляху синтезу сполук по даному винаходу. носяться до сульфамоїльних груп, в яких азот має Фіг.4 - схематичне зображення перетворення одну або дві алкільні групи, приєднані замість атосполуки [VII] у відповідний олефін (XII) через мів водню відповідно. Аналогічним чином, «арилспирт (X). сульфамоїл» і «арилалкілсульфамоїл» містять Фіг.5 - схематичне зображення ще одногоарильну групу замість одного з атомів водню і (в шляху синтезу сполук по даному винаходу. останньому випадку) алкільну групу замість другоФіг.6 - схематичне зображення синтезу сполуго атома водню. ки (XXI), яка є початковим матеріалом, що викори«Антагоніст» означає молекулу, яка зв'язуєтьстовується в реакції, показаній на Фіг.3. ся з рецептором, не активуючи його. Антагоніст Фіг.7 - схематичне зображення альтернативноконкурує з ендогенним лігандом за вказаний сайт го шляху синтезу сполуки (XXI). скріплення і, таким чином, знижує здатність едоФіг.8 - схематичне зображення синтезу різних генного ліганду стимулювати рецептор. сполук по даному винаходу. У контексті даного винаходу «селективний анЗагалом, відповідно до даного винаходу протагоніст» означає антагоніст, який зв'язується з понуються дуже могутні і селективні антагоністи певним підтипом аденозинового рецептора з аденозинового А1 -рецептора. Описані також селебільш високою спорідненістю до скріплення, чим ктивні антагоністи аденозинового А2а-рецептора. до інших підтипів. Антагоністи по даному винаходу Синтез сполук-антагоністів аденозину можуть, наприклад, мати високу спорідненість до Сполуки по даному винаходу можуть бути скріплення А1-рецепторів або А2a-рецепторів і є одержані багатьма відомими способами. Тут описелективними, коли мають (а) наномолярну спорісані два основних способи. Як показано на двох дненість до скріплення одного з вказаних двох схемах, представлених нижче, в кожному з вказапідтипів і (b) принаймні в 10 разів, більш переважних способів використовують один і той же початно в 50 разів і найбільш переважно принаймні в ковий матеріал 1,3-дизаміщений-5,6100 разів більшу спорідненість до скріплення оддіаміноурацил (сполука (VI)). 1,3-Дизаміщені-5,6ного підтипу, чим інших. діаміноурацили можуть бути одержані обробкою Даний винахід дає багато переваг. Сполуки, відповідної симетрично або несиметрично заміщещо пропонуються легко одержують з легкодоступної сечовини ціанооцтовою кислотою з подальшиних початкових матеріалів у відносно мале число ми нітрозуванням і відновленням [дивись, напристадій. Сполуки мають ряд груп, здатних до утвоклад, J. Org. Chem. 16, 1879, 1951; Can. J. Chem. рення різних похідних, що забезпечує можливість 46, 3413, 1968, включене в даний опис як посисистематичної оптимізації. Як специфічні антагонілання]. Несиметрично заміщені ксантини можуть сти сполуки мають велику медичну корисність. бути одержані по методу Мюллера (Mueller) [J. Оскільки сполуки є дуже могутніми і специфічними Med. Chem. 36, 3341, 1993, включене в даний опис антагоністами, їх можна (1) застосовувати в низьяк посилання]. Згідно з цим методом 6ких дозах для зведення до мінімуму імовірності аміноурацил специфічно моноалкілують, по N3 побічних ефектів і (2) включати в різні лікарські урацилу в умовах по Ворбрюггену (Vorbruggen). форми, що включають, але не обмежені ними, Відповідно до іншого варіанту, незаміщене полопілюлі, таблетки, капсули, аерозолі, супозиторії, ження N1 або N3 може бути функціоналізоване рідкі препаративні форми для прийому всередину (наприклад, алкілуванням) на останній стадії синабо для ін'єкції, харчові добавки або препарати тезу. місцевого застосування. Крім медичного застосуУ першому загальному способі 1,3вання, сполуку-антагоніст можна застосовувати дизаміщений-5,6-діаміноурацил (сполука (VI)) мо 19 77391 20 же бути спочатку підданий реакції замикання кільчатковий 1,3-дизаміщений-5,6-діаміноурацил (тобця з одержанням проміжного похідного ксантину, то сполуку (VI)) спочатку зв'язують з незаміщеного в положенні 8. Вказана проміжна ди(карбоксил/складний ефір)заміщеним попередсполука, в свою чергу, може бути пов'язана з поником частини Z-R3, HOOC-Z-R3-COORa (тобто передником частини Z-R3 сполуки з одержанням сполукою (G), де Ra представляє Н, С1-5 алкіл або необхідних 8-заміщених ксантинів. Як показано на бензил, причому фенільне кільце є необов'язково представленій нижче схемі 1, початковий 1,3заміщеним 1-3 заступниками, вибраними з групи, дизаміщений-5,6-діаміноурацил (тобто сполуку що складається з галогену, гідроксилу або С1-3 (VI)) спочатку піддають взаємодії з НС(ОЕt)3 для алкокси) з одержанням 6-амідзаміщеного проміжпроведення реакції замикання кільця з одержанного похідного урацилу (тобто сполуки (Н)) шляням проміжного похідного ксантину, незаміщеного хом проведення реакцій, добре відомих фахівцеві в положенні 8 (тобто сполуки (А)). Вказану проміжв даній області техніки (наприклад, з використанну сполуку після захисту аміно захисною групою ням реагентів для скріплення, таких як бензотриа(наприклад, ТНРабо ВОМ в положенні N7) піддазол-1-ілокситрис(диметиламіно) фосфонію гексають реакції скріплення, взаємодії з попередником фторфосфат (ВОР), О-бензотриазол-1-ілчастини Z-R3 (наприклад, альдегідом або кетоном) N,N,N',N'-тетраметилуронійгексафторфосфат в присутності сильної основи (наприклад, н(HBTU) або О-(7-азабензотриазол-і-іл-N,N,N',N'бутиллітію (nBuLi) або діізопропіламіду літію тетраметилуронійгексафторфосфат (НАТО)). При(LDA)) з одержанням спирту (тобто сполуки (С)). клади сполук (G) включають монометиловий ефір Гідроксильна група спирту може бути потім піддабіцикло[3.2.1]октан-1,5-дикарбонової кислоти і мона реакції перетворення спирту в амін, меркаптан, ноетиловий ефір біцикло[2.2.2]октан-1,4простий ефір, лактон (наприклад, сполуку (Е)) або дикарбонової кислоти. Дивись, наприклад, прикіншу функціоналізовану сполуку способами, відолади 8 і 13. З проміжним похідним урацилу провомими фахівцям в даній області. Після цього може дять потім реакцію замикання кільця в основних бути видалена захисна група в положенні N7 з умовах (наприклад, з використанням КОН і ізопроодержанням продукту зі знятим захистом (тобто пілового спирту) з одержанням ксантину (тобто сполуки F)), який потім може бути функціоналізосполуки (J)), який потім може бути функціоналізований з одержанням сполук по даному винаходу. ваний з одержанням різних сполук по даному виДивись, наприклад, приклади 1-6, 51 і 52. находу. Згідно з другим загальним способом, сполуки по даному винаходу можуть бути одержані здійсненням взаємодії початкового 1,3-дизаміщеного5,6-діаміноурацилу з попередником частини Z-R3 (наприклад, альдегіди, карбонові кислоти або хлорангідриди карбонових кислот) з одержанням проміжного 6-амідзаміщеного похідного урацилу, яке, в свою чергу, може бути піддано реакції замикання кільця з одержанням необхідної сполуки ксантину. Як показано на представленій нижче схемі 2, по Необхідні альдегіди, кетони, карболові кислоти і хлорангідриди карбонових кислот комерційно доступні [наприклад, Aldrich Chemical Co., Inc., Milwaukee, Wise.] або можуть бути легко одержані з комерційно доступних матеріалів добре відомими методами синтезу. Такі методи синтезу включають, але не обмежуються ними, окислення, відновлення, гідроліз, алкілування і реакції гомологізації по Віттігу (Wittig). Як посилання, що стосуються одержання біциклоалканових карбонових кислот по даному винаходу (наприклад, сполуки (III), яка є прикладом сполуки (G) ), дивись, наприклад, [Aust. J. Cheiru 38, 1705, 1985; Aust. J. Chem. 39, 2061, 1986; J. Am. Chem, Soc. 75, 637, 1953; J. Am. Chem. Soc. 86, 5183, 1964; J. Am. Chem. Soc. 102,6862, 1980; J. Org. Chem. 46, 4795, 1981; and J. Org. Chem. 60, 6873, 1995]. В одному випадку, коли сполука (G) являє собою біцикло[2.2.2]октан-1,4-дикарбонову кислоту або відповідний її ефір (де Ζ представляє простий зв'язок і R3 представляє біцикло[2.2.2]октил), існує ряд способів їх одержання. Як показано на Фіг.2, початковий матеріал (тобто сполука (І)) являє со 21 77391 22 бою 1-COORa-4-COORb-циклогексан, де кожний з Що стосується шляху (3), де початкову сполуRa і Rb незалежно представляє Н, С1-5 алкіл або ку (І) перетворюють безпосередньо в сполуку (III), бензил, причому фенільне кільце є необов'язково то сполуку (І) спочатку обробляють приблизно 1заміщеним 1-3 заступниками, вибраними з групи, 1,5 еквівалентами сильної основи, такої як LDA що складається з галогену, гідроксилу або С1-3 або ізопропілциклогексиламід літію (LDA є переалкокси. Переважно Ra і Rb однакові і представляважною основою), у відповідному розчиннику, тають метил або етил. На Фіг.2 показані три різних кому як ТГФ, диметоксіетан, діоксан або третшляхи синтезу для перетворення сполуки (І) в бутилметиловий ефір (з них переважним розчинсполуку (III) (приклад сполуки (G)). Шлях (1) (тобто ником є ТГФ). Температура реакції повинна знахостадії (А) і (В)) включає перетворення сполуки (І) в дитися в межах від приблизно -100°С до приблизїї відповідну хлоретилвмісну сполуку (II), яке, в но -60°С. Одержану реакційну суміш потім свою чергу, піддають реакції замикання кільця з обробляють менш ніж одним еквівалентом бромходержанням відповідної 1,4лоретану в присутності принаймні чотирьох еквібіцикло[2.2.2]октанової кислоти або її ефіру (III). валентів НМРА при температурі в межах від прибДивись приклади 79 і 80. Шлях (2) також включає лизно -80°С до приблизно 25°С. Далі реакційну сполуку (II), яку перетворюють в сполуку (III) через суміш вводять в контакт з приблизно 1-1,5 еквіваіншу проміжну сполуку (XXV), йодетилвмісне похілентами сильної основи, такої як LDA або ізопродне сполуки (І). Дивись приклади 101 і 102. Шлях пілциклогексиламід літію (LDA є переважною ос(3) (тобто стадія (ТТ)) включає в себе перетворенновою), і принаймні чотирма еквівалентами НМРА ня сполуки (І) в 1,4-біцикло[2.2.2]октанову кислоту у відповідному розчиннику, такому як ТГФ, димеабо її ефір (III) без виділення проміжних сполук, токсіетан, діоксан або трет-бутилметиловий ефір тобто сполуки (II). Дивись приклад 110. (переважним розчинником є ТГФ). Дану реакцію Для одержання сполуки (II) початкову сполуку треба проводити при температурі в межах від при(І) обробляють приблизно 1-1,5 еквівалентами близно -100°С до приблизно -60°С. Слід зазначисильної основи. Сильні основи, які можуть бути ти, що шлях (3) не вимагає виділення проміжних використані в даній реакції, включають діізопропісполук. ламід літію (LDA) і ізопропілциклогексиламід літію, Існує багато способів додаткової функціоналіз яких переважною основою є LDA. Типові розчинзації сполуки (J), яка містить карбонову кислоту ники для цієї реакції включають тетрагідрофуран або її складний ефір, приєднані до групи R5. На(ТГФ, THF), диметоксіетан, діоксан і третприклад, сполука (J) може бути перетворена у відбутилметиловий ефір, з яких переважним розчинповідне похідне акрилової кислоти. Згідно з одним ником є ТГФ. Дану реакцію треба проводити в тез способів спочатку гідролізують складноефірну мпературному діапазоні від приблизно -100°С до групу сполуки (J) (при умові, що Ra представляє не приблизно -60°С. Далі реакційну суміш обробляН) з одержанням відповідної карбонової кислоти, ють приблизно 1-1,5 еквівалентами бромхлоретавідновлюють карбонову кислоту до відповідного ну в присутності, принаймні, чотирьох еквівалентів спирту, окисляють спирт до відповідного альдегіду реагенту, такого, як 1,1,3,3-тетраметилсечовина і потім здійснюють реакцію Уодсворта-Хорнера(TMU), 1,3-диметил-3,4,5,6-тетрагідро-2(1Н)Еммонса (Wadsworth-Horner-Emmons) або Віттіга піримідинон (DMPU), 15-краун-5 і 12-краун-4, з (Wittig) з одержанням відповідного похідного акрияких переважною є TMU. Дана реакція може бути лової кислоти. Дивись, наприклад, приклади 5, 6, проведена в розчинниках, таких як ТГФ, диметок15, 16 і 17. Сполука (J) може бути також перетвосіетан, діоксан або трет-бутилметиловий ефір (з рена безпосередньо у відповідний спирт (дивись, них переважним розчинником є ТГФ), і при темпенаприклад, приклад 4). Відповідно до іншого варіратурі в межах від приблизно -80°С до приблизно анту сполуку (J) перетворюють безпосередньо в її 0°С. Реакція замикання кільця може бути здійсневідповідний альдегід. Згідно з ще одним варіантом на спочатку обробкою сполуки (II) приблизно чотисполуку (J), що містить складноефірну групу, перерма еквівалентами гексилметилфосфораміду творюють у відповідну карбонову кислоту і потім (НМРА) з подальшою обробкою сильною основою, безпосередньо в альдегід. Альтернативно, можна такою як н-бутиллітій і діізопропіламін (DIEA). також функціоналізувати попередник частини Z-R3 Повертаючись до шляху (2), треба зазначити, перед скріпленням з 1,3-дизаміщеним-8що хлоретилвмісна проміжна сполука (II) може незаміщеним ксантином по схемі 1 або 1,3бути оброблена йодидом з одержанням необхіднодизаміщеним-5,6-диаміноурацилом по схемі 2. го йодетилвмісної проміжної сполуки (XXV). ПрикКрім того, сполуки по даному винаходу можуть лади йодиду, який може бути використаний в даній бути одержані на твердому носії (наприклад, смолі реакції, включають йодид натрію, йодид калію, Ванга (Wang)). Дивись приклад 36. йодид літію або йодид тетрабутиламонію, з яких На Фіг.3 показаний альтернативний спосіб переважним є Nal. Потім проводять реакцію замиодержання сполуки (XIV) із сполуки (IV). У способі, кання кільця в присутності відповідної сильної оспоказаному на Фіг.3, використовують хімію проценови, такої як LDA або ізопропілциклогексиламід су, аналогічну тій, що показана на Фіг.2, але сполітію (LDA є переважною основою) і реагентів, чатку одержують бічний ланцюг - пропіонову кистаких як TMU або DMPU. Типові розчинники для лоту у біцикло[2.2.2]октильної частини і потім використання в даній реакції включають ТГФ, диприєднують до 1,3-дизамещенной урацильної часметоксіетан, діоксан або трет-бутилметиловий тини з подальшою циклизацією, одержуючи в реефір (переважним є ТГФ). Дану реакцію треба зультаті необхідну сполуку (XIV). Що стосується проводити при температурі в межах від приблизно сполуки (XX), то R3 і R4 повинні бути хімічно різни-80°С до приблизно 25°С. ми по їх реакційній здатності (наприклад, метил і 23 77391 24 бензил). гідридом в присутності основи, такої як пірідин, На Фіг.4 показаний альтернативний спосіб педає сполуку XXXVI (Rg представляє OTf). Наступна ретворення сполуки (VII) у відповідний спирт (X) і стадія, тобто стадія (MM) полягає в обробці сполуподальшого перетворення спирту (X) у відповідний ки (XXXVI) (Rg представляє OTf) каталізатором, олефін (XII). На стадіях (F')-(H) здійснюють замипохідним від солі паладію (Pd(OAc)2, PdCl2, кання кільця і потім омилення складного ефіру Pd(O2CCF3)2 і т.д.) і фосфінового ліганду (PPh3, (VIII) до кислоти (IX) з подальшим відновленням Р(о-толіл)3 і т.д.), з подальшою обробкою олефідо спирту (X), дивись приклади 84, 85 і 86. Відпоном (метилакрилат, метилпропіолат і т.д.), внаслівідно до іншого варіанту сполуку (VII) можна піддок чого одержують сполуку (XXXVII) (де Μ преддати відновленню (стадія (Y), дивись приклад 103) ставляє -C С- або -СН=СН-). На стадії (ΝΝ) і реакціям циклізації з одержанням сполуки (X) сполуку (XXXVII) піддають гідруванню з паладієм (стадія (Z), дивись, наприклад, приклад 84а). Ще на вуглеці в атмосфері водню з одержанням споодин альтернативний спосіб включає омилення і луки (XXI)). циклізацію сполуки (VII) з одержанням сполуки (IX) Як показано на Фіг.1, сполука (X) може бути (стадії (Y) і (Z')). Дані реакції добре відомі фахівперетворена в сполуку (XL), що містить йдучу груцям в даній області. Дивись, наприклад, приклади пу (LG), таку, як, наприклад, галоген (СІ, Вr або І), 85а і 84а. Стадії (I)-(DD) показують альтернативні мезилат, нозилат, тозилат і трифторметансульфопроцеси перетворення спирту (X) у відповідний нат. Потім йдуча група (LG) може бути заміщена олефін (XII). Зокрема, стадії (J), (АА) і (СС) (дивись складним малоновим ефіром, таким як диметилприклади 89, 104 і 105) є альтернативними шлямалонат, в присутності основи, такої як, наприхами перетворення монокарбонового альдегіду клад, метоксид. Йдуча група (LG) може бути також сполуки (XI) в частину, що містить акрилову кислозаміщена кислотою Мелдрума (Meldrum) в присутту/складний ефір, відомими фахівцям в даній обності основи, такої як метоксид. Перетворення ласті способами. складного ефіру, або циклічного ангідриду у разі Як показано на Фіг.5, сполуки (XXIX) і (XXX) використання кислоти Мелдрума, у відповідні кисвже були описані в літературі [Grob, С.Α., Rich, R. лоти з подальшим декарбоксилюванням дає споHelv. Chim. Acta. 1979, 62, 2802; Ahmed, S.A., луку (XXXV). Hickmott, P.W. J. Chem. Soc. Perkin Trans. I, 1979, На Фіг.8 додатково показані способи синтезу, 2180] (тобто стадії (ЕЕ) and (FF)). Сполука (XXX) які можуть бути використані для одержання різних може бути перетворена в сполуку (XXXI) добре сполук по даному винаходу. На стадії 1 обробка відомими методами. Наприклад, сполуки (XXX) сполуки 7-1 (Z представляє Вr, І або OTf і R предможе бути безпосередньо відновлене по Вольфуставляє Н, тетрагідропіран-2-іл або 1Кижнеру (Wolff-Kishner) або по Клемменсону піролідинілметил) каталізатором, похідним від солі (Clemmenson). Відповідно до альтернативного паладію (Pd(OAc)2, PdCl2, Pd(O2CCF3)2 і т.д.) і фоваріанту функціональна кетогрупа сполуки (XXX) сфінового ліганду (PPh3, Р(о-толіл)3 і т.д.), з подаможе бути спочатку перетворена в дитіокетальне льшою обробкою сполукою 7-2 (X представляє Li, похідне, таке як, наприклад, 1,3-дитіан, 1,3ZnCl, MgBr, SnBu3, B(OH)2 і R' представляє СО2Н, дитіолан або 1,3-діалкілтіокеталь. Вказане похідСО2Ме, CO2Et, C CCO2Me, C CCO2Et, не, в свою чергу, може бути десульфурізоване CH=CHCO2Me, CH=CHCO2Et, CH2CH2CO2Me, нікелем Ренею. Такого роду маніпуляції з функціоCH2CH2CO2Et) дає сполуку 7-3 (R представляє Н, нальними групами звичайні і відомі рядовому фатетрагідропіран-2-іл або 1-піролідинілметил і R' хівцеві в даній області. Наступні дві стадії, тобто представляє СО2Н, СО2Ме, CO2Et, С ССО2Ме, стадії (GG) і (НН), є прикладами скріплення 1,3C CCO2Et, СН=СНСО2Ме, CH=CHCO2Et, дизаміщеного-5,6-диаміноурацилу з карбоновою CH2CH2CO2Me, CH2CH2CO2Et). Коли R представкислотою з подальшим замиканням кільця, що ляє тетрагідропіран-2-іл або 1-піролідинілметил, опосередковується основою. На стадії (II) третинобробка кислотою (TFA, PPTS, HCl і т.д.) дає споний гідроксил перетворюють в його відповідний луку 7-3, де R представляє Н. На стадії 2 обробка бромід, йодид або трифторметансульфонат вплисполуки 7-2 (Z представляє Вr, І або OTf і R' предвом РВr3, TMSBr, TMSI, ΚΘ and Н3РО4 або трифтоставляє СО2Н, СО2Ме, CO2Et, C CCO2Me, рметансульфонового ангідриду в присутності неC CCO2Et, CH=CHCO2Me, CH-CHCO2Et, нуклеофільної основи. Потім одержують сполуку СН2СН2СО2Ме, CH2CH2CO2Et) каталізатором, по(XXXV) обробкою сполуки (XXXIV) каталізатором, хідним від солі паладію (Pd(OAc)2, PdCl2, похідним від солі паладію (Pd(OAc)2, PdCl2, Pd(O2CCF3)2 і т.д.) і фосфінового ліганду (PPh3, Pd(O2CCF3) і т.д.) і фосфінового ліганду (PPh3, Р(о-толіл)3 і т.д.), з подальшою обробкою сполуР(про-толіл)3 і т.д.), з подальшою обробкою олекою 7-1 (X представляє Li, ZnCl, MgBr, SnBu3, фіном (таким, як метилакрилат, метилпропіолат і B(OH)2 і R представляє тетрагідропіран-2-іл або 1т.д.). Гідрування сполуки (XXXV) з подальшим пепіролідинілметил) дає сполуку 7-3 (R представляє ретворенням складного ефіру у відповідну кислоту тетрагідропіран-2-іл або 1-піролідинілметил і R' дає сполуку (XIV). Відповідно до іншого варіанту представляє СО2Н, СО2Ме, CO2Et, C CCO2Me, складний ефір може бути спочатку перетворений в C CCO2Et, СН=СНСО2Ме, CH=CHCO2Et, кислоту, після чого здійснюють гідрування також з СН2СН2СО2Ме, CH2CH2CO2Et). Коли R представодержанням сполуки (XIV). ляє тетрагідропіран-2-іл або 1-піролідинілметил, На Фіг.6 показаний процес одержання кислоти обробку кислотою (TFA, PPTS, HCI і т.д.) дає спо(сполука (XXI)), що є початковим матеріалом в луку 7-3, де R представляє Н. На стадії 3 провопроцесі, показаному на Фіг.3. На стадії (LL) обробдять HATU-опосередковану реакцію скріплення ка сполуки (XXXI) трифторметансульфоновим ан 25 77391 26 діаміноурацильної частини з біцикпентаоксациклопентадекан. ло[2.2.2]октановою кислотою (яка вже була описа12-краун-4 означає 1,4,7,10на вище). На стадії 4 обробка сполуки 7-4 (X предтетраоксациклододекан. ставляє СІ, Вr, І) каталізатором, похідним від солі DMPU означає 1,3-диметил-3,4,5,6-тетрагідропаладію (Pd(OAc)2, PdCl2, Pd(O2CCF3)2 і т.д.) і фо2(1Н)-піримідинон. сфінового ліганду (PPh3, Р(о-толіл)3 і т.д.), з подаTMU означає 1,1,3,3-тетраметилсечовину. льшою обробкою олефіном (метилакрилат, метиСольовий розчин означає насичений водний лпропіолат, аліловий спирт і т.д.) дає сполуку 7-5 розчин хлориду натрію. Хроматографія (колонкова і флеш(R1 представляє C ССO2Ме, C CCO2Et, хроматографія) означає очищення/розділення CH=CHCO2Me, CH=CHCO2Et, CH2CH2CHO і т.д.). сполук, що виражаються певними термінами (ноНа стадії 5 проводять промотовану основою циклісій, елюент). Зрозуміло, що відповідні фракції збизацію урацилу 7-5 до ксантину типу 7-3 (яка вже рають і концентрують з одержанням необхідної була описана вище). Аналогічним чином, вже була сполуки(к). описана вище проведена на стадії 6 промотована IR (ІЧ) означає інфрачервону спектроскопію. основою циклізація урацилу 7-4 до ксантину типу FTIR означає інфрачервону спектроскопію з 7-6. На стадії 7 обробка сполуки 7-6 (X представФур'є-перетворенням. ляє СІ, Вr, І, OTf) каталізатором, похідним від солі ATR означає ослаблену повну відбивну здатпаладію (Pd(OAc)2, PdCl2, Pd(O2CCF3)2 і т.д.) і фоність. сфінового ліганду (PPh3, Р(о-толіл)3 і т.д.), з подаUV (УФ) означає ультрафіолетову спектроскольшою обробкою олефіном (метилакрилат, метипію. лпропіолат, аліловий спирт і т.д.) дає сполуку 7-3 NMR (ЯМР) означає спектроскопію ядерного (R представляє Н, R' представляє С ССО2Ме, (протонного) магнітного резонансу, хімічні зсуви C CCO2Et, CH=CHCO2Me, CH=CHCO2Et, даються в ч/млн d) від поля, що одержується від CH2CH2CHO і т.д.). На стадії 8 проводять окислентетраметилсилану. ня кінцевої альдегідної групи в сполуці 7-3 (R рсі означає тиск в фунтах на квадратний представляє Н, R' представляє СН2СН2СНО) стадюйм. ндартними засобами (a. NaClO2, NaH2PO4, 2[а]D25 означає кут обертання плоскополярізометил-2-бутен; b. NaIO4; і т.д.). ваного світла (питоме оптичне обертання) при 25° Визначення з D-лінією натрію (589А). Всі температури показані в градусах Цельсію MS (MC) означає мас-спектрометрію, вираже(°С). ну як m/e, m/z або відношення маса/заряд. [М+Н]+ TLC (ТШХ) означає тонкошарову хроматограозначає позитивний іон джерела плюс атом водфію. ню. ЕІ означає електронний удар. СІ означає хіміHPLC (ВЕРХ) означає високоефективну рідинчну іонізацію. FAB означає бомбардування швидну хроматографію. кими атомами. НМРА означає гексилметилфосфорамід. Вираз «фармацевтично прийнятний» відноTHF (ТГФ) означає тетрагідрофуран. ситься до тих властивостей і/або речовин, які приТНР означає тетрагідропіраніл. йнятні для пацієнта з фармакологічDMSO (ДМСО) означає диметилсульфоксид. ної/токсикологічної точки зору і для DMF (ДМФ) означає диметилформамід. фармацевтичного хімічного виробництва з фізикоDDQ означає 2,3-дихлор-5,6-диціано-1,4хімічної точки зору відносно композиції, препарабензохінон. тивної форми, стабільності, прийнятності для паціDBU означає 1,8-діазабіцикло[5.4.0]ундецєнта і біодоступності. 7-ен. Фармацевтично прийнятні аніонні солі вклюDBN означає 1,5-діазабіцикло[4.3.0]нон-5-ен. чають солі наступних кислот: метансульфонової, DMAC означає диметилацетамід. хлористоводневої, бромистоводневої, сірчаної, LDA означає діізопропіламід літію. фосфорної, азотної, бензойної, лимонної, винної, p-TSA означає моногідрат пфумарової, малеїнової, СН3-(СН2)n-СОО, де n дотолуолсульфонової кислоти. рівнює 0-4, НООС-(СН2)n-СООН, де n - такий, як NBS означає N-бромсукцинімід. визначений вище. NCS означає N-хлорсукцинімід. При використанні пари розчинників відношенTEA означає триетиламін. ня розчинників, що використовуються виражене як ВОС означає трет-бутилкарбамат або третоб'єм/об'єм (об./об.). бутоксикарбоніл. При використанні розчинності твердої речовиОснова Хуніга (Hunig) означає діізопропілетини в розчиннику відношення твердої речовини до ламін, [(CH3)2CH]2-N-CH2CH3. розчинника виражене як маса/об'єм (мас./об.). DMAP означає диметиламінопіридин, (СН3)2NRa представляє Н, С1-5алкіл, бензил, де феніпірідин-1-іл. льне кільце є необов'язково заміщеним від одного TFA означає трифтороцтову кислоту, CF3до трьох атомами галогену, гідроксилами або С1-3 COOH. алкокси. GDI означає 1,1'-карбонілдіімідазол. Rb представляє Н, С1-5алкіл, бензил, де феніDIBAL означає діізобутилалюмінійгідрид. льне кільце є необов'язково заміщеним від одного ТНАМ означає до трьох атомами галогену, гідроксилами або С1-3 трис(гідроксиметил)амінометан. алкокси. Коли Ra і Rb обидва знаходяться в одній і TMS означає триметилсиліл. тій же молекулі, вони можуть бути однаковими або 15-краун-5 означає 1,4,7,10,13 27 77391 28 різними. може мати терапевтичну користь, включають циRc представляє Н, С1-5 алкіл, бензил, де феніротичний асцит, апное новонародженого, ниркову льне кільце є необов'язково заміщеним від одного недостатність, пов'язану з традиційним лікуванням до трьох атомами галогену, гідроксилами або С1-3 сечогінними засобами, діабет і астму. алкокси. Коли Ra і Rc обидва знаходяться в одній і Крім того, виявлено, що введення високоселетій же молекулі, вони можуть бути однаковими або ктивних і могутніх антагоністів, наприклад, аденорізними. зинових А1-рецепторів може викликати діуретичну Rd представляє Н, С1-5 алкіл, бензил, де феніреакцію у відповідь при введенні нарізно і може льне кільце є необов'язково заміщеним від одного посилювати діуретичну реакцію у відповідь на до трьох атомами галогену, гідроксилами або С1-3 традиційні діуретики. До того ж введення антагоніалкокси. Коли Rc і Rd знаходяться в одній і тій же стів аденозинових рецепторів з традиційними діумолекулі, такій, як сполука (XX), вони повинні бути ретиками зменшує зниження рівня клубкової фільрізними. Коли Ra і Rd обидва знаходяться в одній і трації, що викликається традиційними сечогінними тій же молекулі, вони повинні бути різними. засобами. Заявлені способи застосовні, наприRe представляє -Н, С1-5 алкіл, бензил, де феклад, при набряклих станах, таких як застійна сернільне кільце є необов'язково заміщеним від одноцева недостатність і асцит. го до трьох атомами галогену, гідроксилами або Введення сполук-антагоністів аденозину С1-3 алкокси. Коли R1 і R5 обидва знаходяться в Сполуки можуть бути введені тварині (наприодній і тій же молекулі, вони повинні бути різними. клад, ссавцеві, такому як людина, нелюдиноподібRf представляє -(CH2)n-CO-OR' і -CH=CH-COний примат, кінь, собака, корова, свиня, вівця, коOR, де n дорівнює 0, 1 або 2 і R представляє Η за, кішка, миша, пацюк, морська свинка, кролик, або С1-3 алкіл. хом'як, піщанка, тхір, ящірка, рептилія або птах). Rg представляє галоген або трифлат. Сполуки можуть бути введені будь-яким з відповіΜ представляє -СН2-СН2- або -СН=СН-. дних для введення фармацевтичних сполук споTf означає трифторметилсульфоніл, -SO2-CF3. собів, що включають, але що не обмежуються ниLG означає «йдучу групу» і являє собою -Оми, пілюлі, таблетки, капсули, аерозолі, SО2-феніл-NO2, -O-SO2-CH3, -О-SО2-феніл-СН3 супозиторії, рідкі склади для прийому всередину або -O-SO2-CF3. або ін'єкції або для застосування у вигляді очних Застосування антагоністів аденозину або вушних крапель, харчові добавки і препарати Активація аденозинових рецепторів викликає для місцевого застосування. Сполуки можуть бути багато фізіологічних реакції у відповідь, що вклювведені перорально, інтраназально, трансдермачають зниження ниркового кровотоку, зниження льно, інтрадермально, вагінально, інтраокулярно, рівня клубкової фільтрації і підвищення реабсорбтрансбукально, ректально, трансмукозально або ції натрію в нирці. Активація аденозинових рецепшляхом інгаляції, імплантації (тобто хірургічно) торів знижує частоту серцевих скорочень, швидабо внутрішньовенного введення. кість провідності і скоротність. Вказані і інші Сполуки, необов'язково, можуть бути введені в ефекти активації аденозинових рецепторів в інших поєднанні з фармацевтичною композицією, що не органах звичайно є регуляторними процесами. модифікує аденозин (наприклад, в поєднанні з Однак вказані ефекти стають патологічними при диуретиком, що не модифікує аденозин, як описабагатьох хворобливих станах. Тому антагоністи но, наприклад, в заявці, що одночасно розглядааденозину мають широке застосування як для ється PCT/US99/08879, поданій 23 квітня 1999p., профілактики, так і для лікування захворювань. включена повністю в даний опис як посилання). Захворювання, які можуть бути попереджені і/або Далі даний винахід описаний в приведених вилікувані за допомогою антагоністів аденозинонижче прикладах, які не обмежують об'єм винахових рецепторів, включають будь-які стани, (а) що ду, описаного в прикладеній формулі винаходу. відзначаються наявністю анормального рівня адеПриклади нозину і/або (b) що вимагають для лікування інгіПриклад 1 бування або стимуляції продукції і/або вивільнення 8-(3-Оксо-2-оксабіцикло[2.2.2]окт-1-іл)-1,3аденозину. Такі стани включають, але не обмежуДипропіл-3,7-дигідропурин-2,6-діон ються ними, застійну серцеву недостатність, від1,3-дипропіл-7-(тетрагідропіран-2-іл)-3,7новлення серцевої діяльності і дихання, геморагідигідропурин-2,6-діон (3,0г, 9,37ммоль) розчиняли чний шок і інші розлади серцевої діяльності і в 100мл безводного ТГФ і охолоджували до -78°С. кровообігу; дегенеративні розлади центральної Додавали nBuLi (2,5Μ в гексанах, 4,70мл), а потім нервової системи; респіраторні захворювання (наетиловий ефір 4-оксоциклогексанкарбонової кисприклад, бронхіальну астму, алергічні легеневі лоти (9,37ммоль, 1,5мл) і одержану реакційну сузахворювання) і багато які захворювання, для яких міш повільно нагрівали до кімнатної температури і показано лікування сечогінними засобами (наприперемішували при кімнатній температурі протягом клад, гостру і хронічну ниркову недостатність, нирночі. На наступний день реакцію зупиняли насичекову недостатність, гіпертензію). Дегенеративні ним водним розчином NH4CI. Реакційну суміш розахворювання, такі як хвороба Паркінсона, депрезбавляли водою і екстрагували ЕtOАс. Органічний сія, травматичне пошкодження головного мозку, шар сушили і концентрували при зниженому тиску. післяшоковий неврологічний дефіцит, травма гоОчищення хроматографією (2:1 гексани/EtAOc) ловного мозку новонародженого, дислексія, гіпедала 1,30г необхідного похідного спирту. рактивність і кистозний фіброз пов'язані з активніОдержаний продукт (290мг, 0,592ммоль) розстю аденозинових рецепторів. Інші стани, в яких чиняли в 3мл ТГФ і додавали водний розчин LiOH лікування антагоністами аденозинових рецепторів (2Μ, 0,60мл). Реакційну суміш перемішували при 29 77391 30 кімнатній температурі протягом 18 годин. Потім її гексани/EtAOc) дала проміжний діефір. зупиняли 10% водним розчином лимонної кислоти Одержаний діефір (8,0г, 29,4ммоль) розчиняли і екстрагували ЕtOАс. Органічний шар сушили в сухому Et2O (500мл) і охолоджували до 0°С. До(Na2SO4) і концентрували. давали LiAlH4 (2,2г, 2екв.) невеликими порціями Одержану кислоту розчиняли в оцтовому ангіпротягом 15хв. Реакційну суміш перемішували при дриді (3мл) і кип'ятили із зворотним холодильни0°С протягом 15хв. і потім нагрівали до кімнатної ком протягом 1 години. Потім її охолоджували до температури і перемішували 1год. Потім її охолокімнатної температури і концентрували. Одержаджували до 0°С і обережно гасили 5% водним роний залишок розчиняли в ЕtOАс і промивали насизчином NaOH (10мл). Суміш фільтрували і фільтченим водним розчином НаНСО3, насиченим сорат концентрували з одержанням 3,30г проміжного льовим розчином, сушили (Na2SO4) і діолу. концентрували. Очищення хроматографією (2:1 Одержаний діол (1,60г, 7,9ммоль) розчиняли в EtAOc/гексани) дало вказану в заголовку сполуку. пірідині (10мл) і додавали TsCl (3,3г, 2,2екв.). РеаМС (ES+) 361 кційну суміш перемішували при кімнатній темпераПриклад 2 турі 18год. Потім її розбавляли ЕtOАс і промивали 8-(2-Оксабіцикло[2.2.2]окт-1-іл)-1,3-дипропіл10% водним розчином лимонної кислоти. Органіч3,7-дигідропурин-2,6-діон ний шар сушили (Na2SO4) і концентрували з одерЕтиловий ефір 4-[2,6-діоксо-1,3-Дипропіл-7жанням похідного дитозилату. (тетрагідропіран-2-іл)-2,3,6,7-тетрагідро-1Н-пуринОдержаний матеріал розчиняли в ТГФ (60мл) і 8-іл]-4-гідроксициклогексанкарбонової кислоти 1н. НСI (30мл). Реакційну суміш перемішували при (приклад 1) (270мг, 0,551ммоль) розчиняли в 4мл кип'ятінні із зворотним холодильником протягом безводного ТГФ і додавали LiBH4 (2,0Μ розчин в 1год. Реакційну суміш охолоджували до кімнатної ТГФ, 0,55мл). Реакційну суміш перемішували при температури і екстрагували ЕtOАс. Органічний кімнатній температурі протягом ночі. На наступний шар сушили (Na2SO4) і концентрували при знижедень реакцію зупиняли 10% водним розчином линому тиску. Очищення хроматографією (1:1 гексамонної кислоти і екстрагували ЕtOАс. Органічний ни/EtAOc) дала 2,0г дитозилатного похідного 4,4шар концентрували при зниженому тиску і одербісгідроксиметилциклогексанону. жаний неочищений продукт очищали хроматогра1,3-дипропіл-7-(тетрагідропіран-2-іл)-3,7фією (1:1 гексани/EtAOc). дигідропурин-2,6-діон (5,30г, 16,5ммоль) розчиняЧистий діол (90мг, 0,21ммоль) розчиняли в ли в безводному ТГФ (250мл) і охолоджували до СН2СI2 (5мл) і додавали Et3N (1,2екв.). Потім до78°С. Додавали nBuLi (2,5Μ в гексанах, 6,60мл, давали MsCl (1,1екв.). Реакційну суміш перемішу1екв.), а потім дитозилатне похідне 4,4вали при кімнатній температурі протягом 1год. і бісгідроксиметилциклогексанону (7,7г, 1екв.) і одепотім зупиняли насиченим водним розчином NH4CI ржану реакційну суміш повільно нагрівали до кімі екстрагували СН2СІ2. Органічний шар сушили натної температури і перемішували при кімнатній (Na2SO4) і концентрували. температурі протягом ночі. На наступний день Одержаний залишок розчиняли в ТГФ (2мл) і реакцію зупиняли насиченим водним розчином 1н. НСI (1мл). Реакційну суміш перемішували при NH4CI. Реакційну суміш розбавляли водою і ексткімнатній температурі протягом 12год., розбавлярагували ЕtOАс. Органічний шар сушили і конценли Н2О і екстрагували ЕtOАс. Органічний шар сутрували при зниженому тиску. Очищення хроматошили (Na2SO4) і концентрували при зниженому графією (2:1 гексани/EtAOc) дала 10,4г похідного тиску. Очищення ВЕРХ з використанням водного дитозилатксантину. розчину CH3CN дало вказану в заголовку сполуку. Одержану проміжну сполуку (9,0г) розчиняли в МС (ES+) 347 сухому ТГФ (200мл) і до одержаного розчину доПриклад 3 давали порошкоподібний NaOH (9,0г). Реакційну 1-(2,6-діоксо-1,3-дипропіл-2,3,6,7-тетрагідросуміш перемішували при кип'ятінні із зворотним 1Н-пурин-8-іл)-2-оксабіцикло[2.2.2]окт-4холодильником протягом 24год. Потім її охолоілметиловий ефір оцтової кислоти джували до кімнатної температури і розбавляли Етиловий ефір 4-оксоциклогексанкарбонової Н2О і екстрагували ЕtOАс. Органічний шар сушили кислоти перетворювали у відповідне кетальне по(Na2SO4) і концентрували при зниженому тиску. хідне відповідно до встановленої методики [Green, Очищення хроматографією (2:1 гексани/EtAOc) Protective Groups in Organic Synthesis, Third дала 5,6г монотозилатного похідного. Edition]. Вказане кетальне похідне (1,0г, Одержане монотозилатне похідне (40г, 4,67ммоль) розчиняли в безводному ТГФ (15мл). D 6,5ммоль) розчиняли в ДМСО (70мл). Додавали окремій колбі розчиняли 2,2,6,6NaOAc (9г) і реакційну суміш перемешивели при тетраметилпіперидин (1,2мл, 1,5екв.) в ТГФ (30мл) 70-80°С протягом 2 днів. Реакційну суміш охолоі одержаний розчин охолоджували до -78°С, після джували до кімнатної температури і розбавляли чого додавали nBuLi (2,80мл, 2,5Μ розчин в гексаН2О і екстрагували EtOAc. Органічний шар сушили нах, 1,5екв.)· Через 15хв. додавали розчин кеталю (Na2SO4) і концентрували. Очищення хроматограі реакційну суміш перемішували при -78°С протяфією (2:1 гексани/EtAOc) дало 800мг вказаної в гом 1год. Додавали метилхлорформіат (0,72мл, заголовку сполуки. MC(ES+) 419. 2екв.) і реакційну суміш нагрівали до кімнатної Приклад 4 температури. Реакцію зупиняли насиченим вод8-(4-Гідроксиметил-2-оксабіцикло[2.2.2]окт-1ним розчином NH4CI і екстрагували ЕtOАс. Органііл)-1,3-дипропіл-3,7-дигідропурин-2,6-діон чний шар сушили (Na2SO4) і концентрували при 1-(2,6-діоксо-1,3-дипропіл-2,3,6,7-тетрагідрозниженому тиску. Очищення хроматографією (2:1 1Н-пурин-8-іл)-2-оксабіцикло [2.2.2]окт-4 31 77391 32 ілметиловий ефір оцтової кислоти, одержували тиску з одержанням проміжного альдегіду. так, як описано в прикладі 3. Одержаний ацетат Одержаний продукт відразу ж розчиняли в 4мл (120мг, 0,287ммоль) розчиняли в МеОН (5мл). безводного ТГФ. В окремій колбі розчиняли тримеДодавали К2СО3 (200мг, 5екв.) у вигляді розчину в тилфосфоноацетат (60мкл, 1,2екв.) в 3мл безвод5мл Н2О. Одержану реакційну суміш перемішуваного ТГФ, охолоджували до 0°С і додавали ли при кімнатній температурі протягом 2год. РеакKHDMS (0,5Μ в PhMe, 730мкл). Одержану суміш ційну суміш розбавляли Н2О і екстрагували EtOAc. перемішували при 0°С протягом 10хв. і потім доОрганічний шар сушили (Na2SO4) і концентрували давали до розчину альдегіду. Реакційну суміш при зниженому тиску. Одержаний залишок очищаперемішували при кімнатній температурі протягом ли препаративною ВЕРХ з використанням водного 3год. і потім гасили насиченим водним розчином розчину CH3CN, одержуючи вказану в заголовку NH4CI і екстрагували EtOAc. Органічний шар сусполуку. МС (ES+) 377. шили (Na2SO4) і концентрували. Приклад 5 Одержаний залишок розчиняли в 4мл ТГФ і 1-(2,6-діоксо-1,3-дипропіл-2,3,6,7-тетрагідро4мл Н2О, що містить LiOH (4екв.), і перемішували 1Н-пурин-8-іл)-2-оксабіцикло[2.2.2]октан-4при кімнатній температурі протягом 18год. Реаккарбонова кислота ційну суміш розбавляли водним розчином лимон1-(2,6-діоксо-1,3-дипропіл-2,3,6,7-тетрагідроної кислоти і екстрагували EtOAc. Органічний шар 1Н-пурин-8-іл)-2-оксабіцикло [2.2.2]окт-4сушили (Na2SO4) і концентрували. Очищення преілметиловий ефір оцтової кислоти, одержували паративною ВЕРХ з використанням водного розтак, як описано в прикладі 3. Одержаний ацетат чину CH3CN дало вказану в заголовку сполуку. МС (400мг) розчиняли в 3мл СН2СI2 і 3мл дигідропіра(ES+)417 ну. Додавали PPTS (10мг) і реакційну суміш переПриклад 7 мішували при кімнатній температурі протягом 3-[1-(2,6-діоксо-1,3-ДИпропіл-2,3,6,718год. Реакційну суміш розбавляли СН2СI2 і протетрагідро-1Н-пурин-8-іл)-2-оксабіцикло[2.2.2]октмивали NaHCO3, 10% водним розчином лимонної 4-іл]пропіонова кислота кислоти і насиченим сольовим розчином. Органіч3-[1-(2,6-діоксо-1,3-дипропіл-2,3,6,7ний шар сушили (Na2SO4) і концентрували при тетрагідро-1Н-пурин-8-іл)-2-оксабіцикло[2.2.2]октзниженому тиску. 4-іл]акрилову кислоту розчиняли в 50мл МеОН. Одержаний залишок розчиняли в 10мл МеОН і Додавали 10% Pd на С (10мг) і реакційну суміш додавали К2СО3 (450мг) у вигляді розчину в 10мл гідрували при кімнатній температурі при тиску Н2 Н2О. Одержану реакційну суміш перемішували при 55фунт/кв.дюйм (3,9кг/см2) протягом 30хв. Реаккімнатній температурі протягом 18год. Потім її роційну суміш фільтрували через шар Целіту і фільзбавляли Н2О і екстрагували EtOAc. Органічний трат концентрували при зниженому тиску з одершар сушили (Na2SO4) і концентрували з одержанжанням вказаної в заголовку сполуки. МС (ES+) ням 8-(4-гідроксиметил-2-оксабіцикло[2.2.2]окт-1419 іл)-1,3-Дипропіл-7-тетрагідропіран-2-іл)-3,7Приклад 8 дигідропурин-2,6-діону. 5-(2,6-діоксо-1,3-Дипропіл-2,3,6,7-теорагідроОдержаний продукт (320мг, 0,7ммоль) розчи1Н-пурин-8-іл)біцикло[3.2.1]октан-1-карбонова киняли в 8мл ДМФ. Додавали PDC (1,0г, 4екв.) і реаслота кційну суміш перемішували при кімнатній темпераДо розчину монометилового ефіру біциктурі протягом 18год. Реакційну суміш розбавляли ло[3.2.1]октан-1,5-дикарбонової кислоти [Delia, 3мл 10% водного розчину лимонної кислоти і 20мл E.W.; Tsanaktsidis, J. Aust. J. Chem. 1985, 38, 1705; Н2О і швидко екстрагували EtOAc. Органічний шар Delia, E.W.; Tsanaktsidis. J. Aust. J. Chem. 1986, 39, сушили (Na2SO4) і концентрували при зниженому 2061]; (5,94ммоль, 1,26г), HATU (5,94ммоль, 2,26г) тиску. Залишок розчиняли в 10мл Н2О і 20мл і 5,6-діаміно-1,3-дипропіл-1Н-піримідин-2,4CH3CN разом з 1мл TFA. Реакційну суміш перемідіонгідрохлориду [Daly, J.W. et al., J.Med.Chem., шували при кімнатній температурі протягом 18год. 1985, 28 (4), 487] (5,94ммоль, 1,56г) в ДМФ (25мл) Реакційну суміш концентрували. Одержаний задодавали iзoPr2Net (17,82ммоль, 3,1мл). Реакційну лишок очищали препаративною ВЕРХ з викориссуміш перемішували протягом ночі при кімнатній танням водного розчину CH3CN, одержуючи вкатемпературі. Потім її концентрували при відсмокзану в заголовку сполуку. МС (ES+) 391 туванні для видалення ДМФ. Залишок розчиняли в Приклад 6 EtOAc і промивали 1н. НСI, 5% NaHCO3 і насиче3-[1-(2,6-діоксо-1,3-дипропіл-2,3,6,7ним сольовим розчином і сушили (MgSO4). Фільттетрагідро-1Н-пурин-8-іл)-2-оксабіцикло[2.2.2]октрування і випаровування, а потім колонкова флеш4-іл]акрилова кислота хроматографія з використанням суміші (3:1) 8-(4-Гідроксиметил-2-оксабіцикло[2.2.2]окт-1ЕtOАс/гексани дали продукт (0,7г, 28%) у вигляді іл)-1,3-дипропіл-7-(тетрагідро-піран-2-іл)-3,7масла. MS (ES+) 443,1 (M+Na, 100%), 421,4 (М+Н, дигідропурин-2,6-діон синтезували по методиці 10%). прикладу 4. Одержане похідне спирту (140мг, Розчин етилового ефіру 5-(6-аміно-2,4-діоксо0,3ммоль) розчиняли в 5мл СН2СI2 разом з реак1,3-дипропіл-1,2,3,4-тетрагідропіримідин-5тивом Деса-Мартіна (Dess-Martin) (Lancaster, ілкарбамоїл)біцикло[3.2.1]октан-1-карбонової кис155мг, 1,2екв.). Реакційну суміш перемішували при лоти (0,238ммоль, 0,10г) в 20% NaOH (2,0мл) і кімнатній температурі протягом 1год. Реакційну МеОН (10,0мл) перемішували і кип'ятили із зворосуміш розбавляли водним розчином (1М) сульфіту тним холодильником протягом 5год. Реакційну натрію і екстрагували СН2СI2. Органічний шар сусуміш охолоджували до кімнатної температури і шили (Na2SO4) і концентрували при зниженому потім концентрували для видалення МеОН. Вод 33 77391 34 ний розчин підкисляли (рН 2-3) концентрованою 8-(5-Гідроксиметилбіцикло[3.2.1]окт-1-іл)-1,3НСI і потім екстрагували EtOAc. Об'єднані етиладипропіл-3,7-дигідропурин-2,6-діон цетатні екстракти промивали Н2О і насиченим соДо розчину метилового ефіру 5-(6-аміно-2,4льовим розчином і сушили (MgSO4). Фільтрування діоксо-1,3-дипропіл-1,2,3,4-тетрагідропіримідин-5і випаровування з подальшою зворотнофазовою ілкарбамоїл)біцикло[3.2.1]октан-1-карбонової кисВЕРХ дали продукт (0,039г, 42%) у вигляді твердої лоти (одержаного так, як описано в прикладі 8) речовини. MS (ES+) 389,12 (М+Н, 100%). (0,714ммоль, 0,30г) додавали LiBH4 (2Μ в ТГФ, Приклад 9 0,54мл). Після перемішування протягом ночі при 8-(4-Гідрокси-2,6-діоксатрицикло[3.3.1.03,7]нонкімнатній температурі з подальшим кип'ятінням із 1-іл)-1,3-дипропіл-3,7-дигідропурин-2,6-діон зворотним холодильником протягом 90хв., реакРозчин LDA одержували при -78°С шляхом ційну суміш зупиняли при кімнатній температурі додання n-BuLi (1,8Μ в гексанах, 1,7мл) до розчидоданням 1н. НСi, розбавляли Н2О і екстрагували ну iзoPr2NH (3,61ммоль, 0,506мл) в ТГФ (25мл). По EtOAc. Об'єднані органічні екстракти промивали закінченні додатки витримували LDA при -78°С насиченим NaHCO3, водою і насиченим сольовим протягом 45хв. До одержаного розчину повільно розчином і сушили (MgSO4). Фільтрування і випадодавали при -78°С розчин 1,3-дипропіл-7ровування дали продукт (0,20г, 71%) у вигляді ма(тетрагідропіран-2-іл)-3,7-дигідропурин-2,6-діону сла. МС (ES+) 415,15 (M+Na, 100%), 393,5 (М+Н, (приклад 52) (2,78ммоль, 0,89г) в ТГФ (35мл). Піс48%). ля перемішування протягом ще 1год. при -78°С, Розчин (6-аміно-2,4-діоксо-1,3-Дипропілдодавали розчин 8-оксабіцикло[3.2.1]окт-6-ен-31,2,3,4-тетрагідропіримідин-5-іл) аміду 5ону [Mann.J. et al., J. Chem. Soc. Parkin Trans I гідроксиметилбіцикло[3.2.1]октан-1-карбонової 1992, 787] (2,78ммоль, 0,345г) в ТГФ (5мл). Реаккислоти (0,51ммоль, 0,20г) в 20% NaOH (2мл) і ційну суміш перемішували протягом ночі при наМеОН (10,0мл) перемішували і кип'ятили із зворогріванні до кімнатної температури. Потім реакцію тним холодильником протягом ночі. Реакційну сузупиняли доданням насиченого NH4CI і суміш ексміш охолоджували до кімнатної температури і потрагували EtOAc. Об'єднані органічні екстракти тім концентрували для видалення МеОН. Водний промивали насиченим NH4CI, H2O і насиченим розчин підкисляли (рН 2-3) концентрованою НСl і сольовим розчином і сушили (MgSO4). Фільтрупотім екстрагували ЕtOАс. Об'єднані EtOAc екствання і випаровування і потім колонкова флешракти промивали насиченим NаНСО3, Н2О і насихроматографія з елююванням градієнтом суміші ченим сольовим розчином і сушили (MgSO4). ФільЕtOАс/СН2СI2 дали продукт скріплення (0,55г, трування і випаровування і потім флеш45%). МС (ESP+, 60V): 445,07 (М+Н, 35%), 361,06 хроматографія з елю.dfyyzv сумішшю (3:2) (48%), 343,05 (100%). ЕtOАс/СН2Сl2 дали вказану в заголовку сполуку До розчину 8-(3-гідрокси-8(0,077г, 40%) у вигляді масла. 13 оксабіцикло[3.2.1]окт-6-ен-3-іл)-1,3-дипропіл-7С ЯМР (100МГц, CDCI3): 11,53 (кв), 11,74 (тетрагідропіран-2-іл)-3,7-дигідропурин-2,6-діону (кв), 20,26 (кв), 21,71 (т), 31,62 (т), 34,15 (т), 37,29 (одержаного так, як описано вище) (0,225ммоль, (т), 43,49 (с), 45,54 (т), 45,67 (т), 46,14 (т), 46,90 (т), 0,10г) в ізоРrOН (2мл) і Н2О (1мл) додавали ММРР 70,51 (т), 71,11 (с), 107,03 (с), 149,25 (с), 151,54 (с), (80%, 0,45ммоль, 0,223г) однією порцією. Через 5 155,88 (с), 162,58 (с). днів витримування при кімнатній температурі, реаПриклад 11 кційну суміш гасили доданням насиченого водного [1-(2,6-діоксо-1,3-дипропіл-2,3,6,7-тетрагідророзчину Na2S2O3 і концентрували для видалення 1Н-пурин-8-іл)-2,6-діоксатрицикло[3.3.1.03,7]нон-4ізоРrOН. Водний залишок розподіляли між EtOAc і ілокси]оцтова кислота насиченим NaHCO3. Органічні екстракти промиваДо розчину 8-(4-гідрокси-2,6ли Н2О і насиченим сольовим розчином і сушили діоксатрицикло[3.3.1.03,7]нон-1-іл)-1,3-дипропіл-7(MgSO4). Фільтрування і випаровування дали про(тетрагідропіран-2-іл)-3,7-дигідропурин-2,6-діоне дукт (0,093г, 90%) у вигляді піноподібної речовини. (приклад 9) (0,065ммоль, 0,030г) в ТГФ (2мл) до13 С ЯМР (75МГц CDCI3): 11,50, 11,63, 21,55, давали NaH (60% дисперсія, 0,068ммоль, 0,0027г) 21,61, 21,72, 23,00, 25,01, 32,17, 37,96, 40,42, однією порцією. Реакційну суміш перемішували 43,52, 45,19, 54,46, 54,62, 70,46, 70,79, 71,51, при кімнатній температурі протягом 1год. і потім 71,64, 86,09, 107,18, 147,34, 151,21, 155,19, 157,82. додавали трет-бутилбромацетат (0,068ммоль, До розчину 8-(4-гідрокси-2,610мкл). Через 3 дні реакційну суміш гасили насидіоксатрицикло[3.3.1.03,7]нон-1-іл)-1,3-дипропіл-7ченим водним розчином NH4Cl і екстрагували (тетрагідропіран-2-іл)-3,7-дигідропурин-2,6-діону EtOAc (3 рази). Об'єднані органічні шари промива(0,065ммоль, 0,030г) в суміші (1:1) ТГФ/МеОН ли насиченим сольовим розчином і сушили (6мл) додавали 1н. НСI (3 краплі). Реакційну суміш (MgSO4). Фільтрування і випаровування дали проперемішували при кімнатній температурі протягом дукт (0,059г) з домішкою трет-бутилбромацетату. 4год. і потім концентрували досуху. Залишок очиМС (ES+) 575,15 (М+Н). щали ВЕРХ із зверненою фазою з одержанням Розчин трет-бутилового ефіру (1-[2,6-діоксопродукту (0,0094г, 38%). 1,3-дипропіл-7-(тетрагідропіран-2-іл)-2,3,6,71 H ЯМР (400МГц, (d6-ДМСО): 0,80-0,89 (м, 6Н), тетрагідро-1Н-пурин-8-іл]-2,6-Діоксатрицикло 1,48-1,56 (м, 2Н), 1,60-1,70 (м, 2Н), 1,9-2,09 (м, 2Н), [3.3.1.03,7]нон-4-ілокси}оцтової кислоти (0,10ммоль, 2,2-2,25 (м, 1Н), 3,78-3,82 (м, 2Н), 3,89-3,91 (м, 2Н), 0,059г) в СН2СI2 (1мл) обробляли TFA (1мл) і пе3,99 (с, 1Н), 4,21 (ш.с, 1Н), 4,51 (ш.с, 1Н), 4,80 (м, ремішували при кімнатній температурі протягом 1Н). ночі. Реакційну суміш концентрували досуху і заПриклад 10 лишок очищали ВЕРХ із зворотною фазою з одер 35 77391 36 жанням продукту (0,0036, 8%). МС (ES+) 435,13 4-(2,6-діоксо-1,3-дипропіл-2,3,6,7-тетрагідро(М+Н). 1Н-пурин-8-іл)-біцикло[2.2.2]октан-1-карбонова Приклад 12 кислота 3-[5-(2,6-діоксо-1,3-Дипропіл-2,3,6,7До суміші 2,00г (8,84ммоль) моноетилового тетрагідро-1Н-пурин-8-іл)біцикло[3.2.1]окт-1ефіру, що перемішується біцикло[2.2.2]октан-1іл]акрилова кислота карбонової кислоти, 2,60г (9,89ммоль) 5,6-діаміноДо розчину 5-(2,6-діоксо-1,3-дипропіл-2,3,6,71,3-дипропіл-1Н-піримідин-2,4-діонгідрохлориду, тетрагідро-1Н-пурин-8-іл) біцикло[3.2.1]октан-15,32мл (38,1ммоль) NEt3 і 30мл безводного ацетокарбонової кислоти (приклад 8) (1,29ммоль, 0,50г), нітрилу додавали 3,76г (9,89ммоль) HATU. РеакНАТО (1,29ммоль, 0,49г) і Ν,Οційний розчин перемішували при кімнатній темпедиметилгідроксиламінгідрохлориду (1,29ммоль, ратурі протягом 1год. Реакційну суміш 0,126г) в ДМФ (12мл) додавали iзoPR2NEt концентрували у вакуумі і об'єднували з 40мл (3,86ммоль, 0,67мл). Реакційну суміш перемішуЕtOАс і 40мл 10% лимонної кислоти. Водний шар вали при кімнатній температурі протягом ночі. Повідділяли і промивали двічі 40-мл порціями EtOAc. тім її концентрували при відсмоктування для виОб'єднані органічні фракції промивали 20-мл пордалення ДМФ. Залишок розчиняли в EtOAc, ціями насиченого NaHCO3 і насиченим сольовим промивали 1н. НСl, насиченим NaHCO3 і насичерозчином і концентрували у вакуумі. Одержану ним сольовим розчином і сушили (MgSO4). Фільттверду речовину об'єднували в 200-мл круглодонрування і випаровування дали продукт (0,791г) з ній колбі, забезпеченій холодильником, із сумішдомішкою ДМФ. МС (ES+) 432,13 (М+Н). шю 35мл ізоРrOН і 35мл 1н. КОН (35ммоль) і наДо розчину метоксиметиламіду 5-(2,6-діоксогрівали із зворотним холодильником. Після 1,3-дипропіл-2,3,6,7-тетрагідро-1Н-пурин-8нагрівання протягом 1год., реакційний розчин коніл)біцикло[3.2.1]октан-1-карбонової кислоти центрували у вакуумі, розчиняли в 40мл води і (0,232ммоль, 0,100г) в ТГФ (3мл) при -78°С додапромивали двічі 30-мл порціями СН2СI2. Водний вали розчин LiAlH4 (1M в ТГФ, 0,52мл). По закіншар підкисляли концентрованою НСI і одержаний ченні додання реакційну суміш перемішували при осадок збирали фільтруванням з відсмоктуванням 78°С 30хв. і при 0°С 30хв. Реакційну суміш оберез одержанням 3,00г (вихід 87%) не зовсім білої жно гасили послідовним доданням Н2О (20мкл), твердої речовини. (МН+=389, 25). 20% NaOH (20мкл) і Н2О (40мкл). Суспензію інтенАналогічним чином одержували наступні спосивно перемішували протягом ночі, потім фільтрулуки: вали через целіт, рясно промиваючи колбу і осаПриклад 13а: 8-(4-Гідроксибіцикло[2.2.2]окт-1док ТГФ. Випаровування і потім флешіл)-1,3-дипропіл-3,7-дигідропурин-2,6-діон, + хроматографія з елююванням сумішшю 5% (МН =361,15) ТГФ/СН2Сl2 дали продукт (0,048г, 56%) у вигляді Приклад 13b: 8-(4-Пентилбіцикло[2.2.2]окт-1масла. МС (ES+): 373,17 (М+Н). іл)-1,3-дипропіл-3,7-дигідропурин-2,6-діон, До розчину триметилфосфоноацетату (МН+=415,19) (0,310ммоль, 0,056г) в ТГФ (4мл) при 0°С додаваПриклад 13с: 5-(2,6-діоксо-1,3-дипропілли розчин KHMDS (0,5Μ в PhMe, 0,6мл). Після 2,3,6,7-тетрагідро-1Н-пурин-8перемішування протягом 45хв., повільно додавали іл)біцикло[3.2.2]нонан-1-карбонова кислота, розчин 5-(2,6-діоксо-1,3-дипропіл-2,3,6,7(МН+=403,30) тетрагідро-1Н-пурин-8-іл)біцикло[3.2.1]октан-1Приклад 13d: [4-(2,6-діоксо-1,3-Дипропілкарбальдегіду (0,129ммоль, 0,048г) в ТГФ (2мл). 2,3,6,7-тетрагідро-1Н-пурин-8-іл)біцикло[2.2.2]октПісля перемішування при кімнатній температурі 1-іл]карбамінової кислоти метиловий ефір, протягом ночі, реакційну суміш гасили насиченим (МН+=418,15) водним розчином NH4Cl і екстрагували ЕtOАс. Приклад 13e: 8-(4-Бромбіцикло[2.2.2]окт-1-іл)Об'єднані органічні шари промивали насиченим 1,3-дипропіл-3,7-дигідропурин-2,6-діон, NaHCO3, насиченим сольовим розчином і сушили (MNa+=425,22) (MgSO4). Фільтрування і випаровування дали проПриклад 13f: 8-(1-Азабіцикло[2.2.2]окт-4-іл)дукт (0,119г) з домішкою надмірного триметилфо1,3-дипропіл-3,7-дигідропурин-2,6-діон, (МН+=34 + сфоноацетату. МС (ES ) 429,16 (М+Н). 6,31) Розчин метилового ефіру 3-[5-(2,6-діоксо-1,3Здійснювали N-3 алкілування попередників дипропіл-2,3,6,7-тетрагідро-1Н-пурин-8монопропілурацилів по методиках, описаних в іл)біцикло[3.2.1]окт-1-іл]акрилової кислоти літературі [Muller, Gels, U.; Hipp, J.; Schobert, U.; (0,129ммоль, 0,055г) в ТГФ (4мл) обробляли при Frobenius, W.; Pawlowski, M.; Suzuki, F.; Sandovalкімнатній температурі 1н. LiOH (1,1мл). Реакційну Ramirez, J. J. Med. Chem. 1997, 40, 4396-4405] висуміш кип'ятили із зворотним холодильником прокористовуючи ВОС захищений 5,6-діаміно-1тягом ночі. Реакційну суміш охолоджували до кімпропілурацил з подальшим видаленням ВОС 4н. натної температури, розбавляли Н2О, підкисляли НСl в діоксані. Потім для одержання похідних ксаконцентрованою НСl (рН 2-3) і екстрагували нтину використали описану вище методику скріпEtOAc. Об'єднані органічні шари промивали насилення-циклізації. ченим сольовим розчином і сушили (MgSO4). ФільПриклад 13g: 3-(2-метоксіетіл)-8-(4трування і випаровування з подальшої ВЕРХ із пентилбіцикло[2.2.2]окт-1-іл)-1-пропіл-3,7зворотною фазою дали продукт (0,010г, 19%). МС дигідропурин-2,6-діон. (МН+=431,64) (ES+) 397,24 (М+Н-ОН' 100%); МС (ES-) 413,01 (МПриклад 13h: 4-[3-(2-метоксіетіл)-2,6-діоксо-1Н, 100%).) пропіл-2,3,6,7-тетрагідро-1Н-пурин-8-іл]біцикло Приклад 13 [2.2.2]октан-1-карбонова кислота (МН+=405,63) 37 77391 38 Приклад 13i: 3-[2-(4-метоксифеніл)етил]-8-(4(0,379г, 17,4ммоль), МеОН (0,141мл, 3,48ммоль) і пентилбіцикло-[2.2.2]окт-1-іл)-1-пропіл-3,7100мл ТГФ і одержану суміш кип'ятили із зворотдигідропурин-2,6-діон, (МН+=507,30) ним холодильником протягом 18год. Після охолоПриклад 13j: 4-{3-[2-(4-метоксифеніл)етил]-2,6джування до кімнатної температури додавали діоксо-1-пропіл-2,3,6,7-тетрагідро-1Н-пурин-850мл 1Μ НСl і суміш концентрували у вакуумі. Заіл}біцикло[2.2.2]октан-1-карбонова кислота, лишок розчиняли в EtOAc і промивали 1Μ НСl, (МН+=481,2) насиченим NaНСО3, насиченим сольовим розчиПриклад 13k: 3-метил-8-(4ном і сушили над Na2SO4. Етилацетатний розчин пентилбіцикло[2.2.2]окт-1-іл)-1-пропіл-3,7концентрували у вакуумі з одержанням 1,15г (вихід дигідропурин-2,6-діон, (МН+=387, 21) 88%) білої твердої речовини. (МН+=375,50) Приклад 13l: 4-[3-(4-метоксифеніл)-2,6-діоксоПриклад 16 1-пропіл-2,3,6,7-тетрагідро-1Н-пурин-84-(2,6-діоксо-1,3-дипропіл-2,3,6,7-тетрагідроіл]біцикло[2.2.2]октан-1-карбонова кислота, 1Н-пурин-8-іл)-біцикло[2.2.2]октан-1-карбальдегід (МН+=453,4) До розчину 0,092г (0,246ммоль) 8-(4Приклад 13m: 4-[2,6-діоксо-1,3-біс-(3,3,3гідроксиметилбіцикло[2.2.2]окт-1-іл)-1,3-дипропілтрифторпропіл)-2,3,6,7-тетрагідро-1Н-пурин-83,7-дигідропурин-2,6-діону (приклад 15) в 5мл іл]біцикло[2.2.2]октан-1-карбонова кислота, СН2Сl2 додавали 0,125г (0,295ммоль) перйодинану (МН+=496,98) Десса-Мартіна (Dess-Martin). Реакційну суміш пеПриклад 13n: 4-[2,6-діоксо-1,3-біс-(3,3,3ремішували при кімнатній температурі до завертрифторпропіл)-2,3,6,7-тетрагідро-1Н-пурин-8шення окислення. Реакційний розчин фільтрували іл]біциклоо[2.2.2]октан-1-карбонової кислоти метичерез шар основного оксиду алюмінію, промивали ловий ефір, (МН+=511,3) насиченим NaHCO3, насиченим сольовим розчиПриклад 13о: 3-[4-(6-Оксо-1,3-дипропіл-2ном і сушили над Na2SO44. Дихлорметановий розтіоксо-2,3,6,7-тетрагідро-1Н-пурин-8чин концентрували у вакуумі з одержанням 0,057г іл)біцикло[2.2.2]окт-1-іл]пропіонова кислота, (вихід 62%) не зовсім білої твердої речовини. (МН+=432,98) з 5,6-діаміно-1,3-дипротл-2-тіоксо(МН+=373,30) 2,3-дигідро-1Н-піримідин-4-ону, одержаного по Приклад 17 методиці, описаній в літературі [Jacobson, K.A.; 3-[4-(2,6-діоксо-1,3-Дипропіл-2,3,6,7Kiriasis, L.; Barone, S.; Bradbury, Kamraula, U.; тетрагідро-1Н-пурин-8-іл)біцикло[2.2.2]окт-1Campagne, M.; Secunda, S.; Daly, J.W.; Neumeyer, іл]акрилова кислота J.L.; Pfleiderer, W. J. Med. Chem. 1989,32, 1873Триметилфосфоноацетат (0,161г, 0,886ммоль) 1879]. розчиняли в 12мл толуолу і охолоджували до 0Приклад 13р: 4-(6-Оксо-1,3-дипропіл-2-тіоксо5°С. Протягом 5хв. додавали по краплях при пе2,3,6,7-тетрагідро-1Н-пурин-8ремішуванні KHMDS (0,5Μ в толуолі) (3,54мл). Ще іл)біцикло[2.2.2]октан-1-карбонова кислота, через 30хв. витримки при 0-5°С додавали 0,300г (MH+=405,04) з 5,6-діаміно-1,3-дипропіл-2-тіоксо(0,805ммоль) 4-(2,6-діоксо-1,3-дипропіл-2, 3,6,72,3-дигідро-1Н-піримідин-4-ону, одержаного по тетрагідро-1Н-пурин-8-іл)біцикло[2.2.2]октан-1методиці, описаній в літературі [Jacobson, Κ.Α.; карбальдегіду з прикладу 16 і реакційній суміші Kiriasis, L.; Barone, S.; Bradbury, B.A.; Kammula, U.; давали нагрітися до кімнатної температури і переCampagne, M.; Secunda, S.; Daly, J.W.; Neumeyer, мішували її 16год. Реакційну суміш концентрували J.L.; Pfleiderer, W. J. Med. Chem. 1989, 32, 1873у вакуумі. Неочищений матеріал розчиняли в 25мл 1879]. МеОН і 10мл води, додавали 0,150г LiOH і суміш Приклад 14 перемішували при кімнатній температурі протягом Метиловий ефір 4-(2,6-діоксо-1,3-Дипропілночі. Реакційну суміш концентрували у вакуумі і 2,3,6,7-тетрагідро-1Н-пурин-8знову розчиняли в 15мл води. Водний шар тричі іл)біцикло[2.2.2]октан-1-карбонової кислоти екстрагували 20-мл порціями EtOAc, підкисляли 4-(2,6-діоксо-1,3-дипропіл-2,3,6,7-тетрагідроконцентрованою НСl і збирали осадок шляхом 1Н-пурин-8-іл)біцикло[2.2.2]октан-1-карбонову кисвакуум-фільтрування з одержанням 0,190г (вихід лоту (приклад 13) (1,50г, 3,86ммоль) змішували з 57%) (транс)-акрилової кислоти. (МН+=415,08) 60мл МеОН і 10 краплями концентрованої H2SO4. Приклад 18 Реакційний розчин кип'ятили із зворотним холоди3-[4-(2,6-Діоксо-1,3-дипропіл-2,3,6,7льником, поки не витрачався початковий матеріал. тетрагідро-1Н-пурин-8-іл)біцикло[2.2.2]окт-1Потім додавали насичений NaНСО3 до одержання іл]пропіонова кислота нейтрального рН і реакційну суміш концентрували 3-[4-(2,6-діоксо-1,3-дипропіл-2,3,6,7у вакуумі. Залишок розчиняли в EtOAc і промивали тетрагідро-1Н-пурин-8-іл)біцикло [2.2.2]окт-1насиченим NaHCO3, насиченим сольовим розчиіл]акрилову кислоту (приклад 17) розчиняли в 5мл ном і сушили над Na2SO4. Етил ацетатний розчин МеОН і змішували з 0,005г 10% Pd/C. Реакційну концентрували у вакуумі з одержанням 1,51г (вихід судину продували три рази N2 і потім з'єднували з 97%) білої твердої речовини. (МН+=403,13) балоном з газоподібним Н2. Через 2год. реакційну Приклад 15 суміш фільтрували і концентрували з одержанням 8-(4-Гідроксиметилбіцикло[2.2.2]окт-1-іл)-1,30,037г (вихід 74%) білої твердої речовини. дипропіл-3,7-дигідропурин-2,6-діон (МН+=417,30) Метиловий ефір 4-(2,6-діоксо-1,3-дипропілАналогічним чином одержували наступну спо2,3,6,7-тетрагідро-1Н-пурин-8луку: іл)біцикло[2.2.2]октан-1-карбонової кислоти (прикПриклад 18а: 3-[4-(2,6-діоксо-1,3-дипропіллад 14) (1,40г, 3,48ммоль) змішували з LiBH4 2,3,6,7-тетрагідро-1Н-пурин-8-іл)біцикло[2.2.2]окт 39 77391 40 1-іл]-2-метилпропіонова кислота. (МН+=431,36) 3,7-дигідропурин-2,6-діон Приклад 19 Метиловий ефір [4-(2,6-діоксо-1,3-дипропіл{[4-(2,6-діоксо-1,3-Дипропіл-2,3,6,7-тетрагідро2,3,6,1-тетрагідро-1Н-пурин-8-іл)біцикло[2.2.2]окт1Н-пурин-8-іл)біцикло[2.2.2]октан-11-іл]карбамінової кислоти (приклад 13d) (8,3г, карбоніл]метиламіно}оцтова кислота 20ммоль) кип'ятили із зворотним холодильником в До суміші 0,100, що перемішується г 40мл концентрованої НСl протягом 3год. Реакційну (0,257ммоль) 4-(2,6-діоксо-1,3-дипропіл-2,3,6,7суміш концентрували у вакуумі до твердого залитетрагідро-1Н-пурин-8-іл)біцикло[2.2.2]октан-1шку, який розтирали в ацетонітрилі з одержанням карбонової кислоти, 0,039г (0,257ммоль) саркозин5,8г (77%) білої твердої речовини (МН+=360,02). гідрохлориду, 0,143мл (1,03ммоль) Net3 і 2мл безПриклад 21 водного ацетонітрилу додавали 0,103г 2-(R)-[4-(2,6-діоксо-1,3-дипропіл-2,3,6,7(0,270ммоль) HATU. Реакційний розчин перемішутетрагідро-1Н-пурин-8-іл)біцикло[2.2.2]окт-1вали при кімнатній температурі протягом 16год. ілокси]пропіонова кислота Реакційну суміш концентрували у вакуумі і змішу8-(4-Амінобіцикло[2.2.2]окт-1-іл)-1,3-дипропілвали з 10мл EtOAc і 10мл 10% лимонної кислоти. 3,7-дигідропурин-2,6-діон (приклад 20) (0,100г, Водний шар відділяли і промивали двічі 10-мл 0,279ммоль) змішували з 1,5мл (R)-метиллактату і порціями EtOAc. Об'єднані органічні фракції про0,075мл ізоамілнітриту. Суміш нагрівали до 60°С мивали 10-мл порціями насиченого NaHCO3 і напротягом 2год. і охолоджували до кімнатної темсиченого сольового розчину і концентрували у ператури. Реакційну суміш концентрували у вакувакуумі. Одержану тверду речовину розчиняли в умі і залишок перемішували з 8мл 50% МеОН розсуміші 5мл МеОН і 5мл 1н. NaOH і перемішували чину і 0,050г LiOH протягом ночі. Реакційну суміш 16год. Реакційний розчин концентрували у вакуумі, концентрували у вакуумі, розчиняли в 8мл води, розчиняли в 10мл води і промивали два рази 10доводили рН розчину до 10 і суміш екстрагували мл порціями СН2Сl2. Водний шар підкисляли кондва рази 6-мл порціями СН2Сl2. Водний шар підкицентрованою НСl і одержаний осадок збирали васляли концентрованою НСI і одержаний осадок куум-фільтруванням з одержанням 0,094г (вихід збирали вакуум-фільтруванням з одержанням 77%) не зовсім білої твердої речовини. 0,024г (вихід 20%) необхідного продукту. (МН+=460,18) (МН+=433,08). Аналогічним чином були одержані наступні Аналогічним чином були одержані наступні сполуки: сполуки: Приклад 19а: 4-(2,6-діоксо-1,3-дипропілПриклад 21а: 2-(S)-[4-(2,6-діоксо-1,3-дипропіл2,3,6,7-тетрагідро-1Н-пурин-82,3,6,7-тетрагідро-1Н-пурин-8-іл)біцикло[2.2.2]окт+: іл)біцикло[2.2.2]октан-1-карбонової кислоти (21-ілокси]пропіонова кислота, (МН =433,10) + диметиламіноетил)амід, (МН =459,17) Приклад 21b: 8-(4Приклад 19b: {[4-(2,6-діоксо-1,3-дипропілІзопропоксибіцикло[2.2.2]окт-1-іл)-1,3-дипропіл-3,72,3,6,7-тетрагідро-1Н-пурин-8дигідро-пурин-2,6-діон, (МН+=403,13) іл)біцикло[2.2.2]октан-1-карбоніл]аміно}оцтової Приклад 21с: 8-(4- Алілоксибіцикло[2.2.2]окт-1кислоти метиловий ефір, (МН+=460,3) іл)-1,3-дипропіл-3,7-дигідропурин-2,6-діон, Приклад 19с: 3-{[4-(2,6-діоксо-1,3-дипропіл(МН+=401,11) 2,3,6,7-тетрагідро-1Н-пурин-8Приклад 21d: [4-(2,6-діоксо-1,3-дипропіліл)біцикло[2.2.2]октан-1-карбоніл]аміно}пропіонової 2,3,6,7-тетрагідро-1Н-пурин-8-іл)біцикло[2.2.2]окткислоти метиловий ефір, (МН+=389,3) 1-ілокси]оцтова кислота, (МН+=419,08) Приклад 19d: {[4-(2,6-діоксо-1,3-дипропілПриклад 21е: 1,3-Дипропіл-8-[4-(2,2,2-трифтор2,3,6,7-тетрагідро-1Н-пурин-81-трифторметилетокси)біцикло[2.2.2]окт-1-іл]-3,7іл)біцикло[2.2.2]октан-1-карбоніл]аміно}оцтова дигідропурин-2,6-діон, (МН+=511,00) + кислота, (МН =446,06) Приклад 21f: 2-[4-(2,6-діоксо-1,3-дипропілПриклад 19е: 1-[4-(2,6-діоксо-1,3-дипропіл2,3,6,7-тетрагідро-1Н-пурин-8-іл) біцикло[2.2.2]окт2,3,6,7-тетрагідро-1Н-пурин-81-ілокси]-2-метилпропіонова кислота, іл)біцикло[2.2.2]октан-1-карбоніл]піперидин-4(МН+=447,17) карбонова кислота, 1Н ЯМР (400МГц, CDCl3): Приклад 21g: 3-[4-(2,6-діоксо-1,3-дипропіл2,3,6,7-тетрагідро-1Н-пурин-8-іл)біцикло[2.2.2]окт=0,84 (т, 3Н), 0,085 (т, 3Н), 1,50-1,68 (м, 6Н), 1,841-ілокси]пропіонова кислота, (МН+=433,6) 1,92 (м, 14Н), 2,44 (м, 1Н), 2,86 (м, 2Н), 3,78 (т, 2Н), Приклад 21h: 3-(R)-[4-(2,6-діоксо-1,3-дипропіл3,91 (т, 2Н), 4,15 (м, 2Н). 2,3,6,7-тетрагідро-1Н-пурин-8-іл)біцикло[2.2.2]октПриклад 19f: 8-(41-ілокси]масляна кислота, (МН+=447,34) Диметиламінометилбіцикло[2.2.2]окт-1-іл)-1,3+= Приклад 21і: 3-(8)-[4-(2,6-діоксо-1,3-дипропілдипропіл-3,7-дигідропурин-2,6-діон, (МН =402,08) 2,3,6,7-тетрагідро-1Н-пурин-8-іл)біцикло[2.2.2]октПриклад 19g: 8-{4-[(21-ілокси]масляна кислота, (МЕ+=447,33) Диметиламіноетиламіно)метил]біцикло[2.2.2]окт-1Приклад 21j: 3-[4-(2,6-діоксо-1,3-дипропіліл}-1,3-дипропіл-3,7-дигідропурин-2,6-діон, + 2,3,6,7-тетрагідро-1Н-пурин-8-іл)біцикло[2.2.2]окт(МН =445,24) 1-ілокси]-2(3)-метилпропіонова кислота, Приклад 19h: 4-(2,6-діоксо-1,3-дипропіл(МН+=447,32) 2,3,6,7-тетрагідро-1Н-пурин-8Приклад 21k: 3-[4-(2,6-діоксо-1,3-дипропіліл)біцикло[2.2.2]октан-1-карбонової кислоти (22,3,6,7-тетрагідро-1Н-пурин-8-іл)біцикло[2.2.2]октаміноетил)амід, (МН+=431,06) 1-ілокси]-2(R)-метилпропіонова кислота, Приклад 20 (МН+=447,33) 8-(4-Амінобіцикло[2.2.2]окт-1-іл)-1,3-дипропіл 41 77391 42 Приклад 211: 3-[4-(2,6-діоксо-1,3-дипропілбані з льодом. Додавали до неї 20мкл метансуль2,3,6,7-тетрагідро-1Н-пурин-8-іл)біцикло[2.2.2]октфонілхлориду (0,26ммоль) і реакційну суміш ви1-ілокси]-2,2-диметилпропіонова кислота, тримували при 10°С протягом ночі. Реакційну су(МН+=461,32) міш концентрували у вакуумі і залишок розчиняли Приклад 21m: [5-(2,6-діоксо-1,3-дипропілв EtOAc і промивали 2 рази розбавленою НСl 2,3,6,7-тетрагідро-1Н-пурин-8-іл)біцикло[3.2.2]нон(5мл). Органічний шар сушили над Na2SO4 і кон1-ілокси]оцтова кислота, (МН+=433,3) центрували. Залишок розтирали в ацетонітрилі з Приклад 21n: 3-[4-(2,6-діоксо-1,3-дипропілодержанням 36мг (59%) чистої білої твердої речо2,3,6,7-тетрагідро-1Н-пурин-8-іл)біцикло[2.2.2]октвини (МН+=439,4). 1 1-ілметокси]-2,2-диметилпропіонова кислота, Н Приклад 24 4-(2,6-діоксо-1,3-ДИпропіл-2,3,6,7-тетрагідроЯМР (400МГц, CDCl3): =0,86 (т, 6Η), 1,15 (м, 6Н), 1Н-пурин-8-іл)біцикло[2.2.2]окт-1-ільний ефір то1,45 (м, 6Н), 1,58 (тд, 2Н), 1,67 (тд, 2Н), 1,84 (м, луол-4-сульфонової кислоти 6Н), 3,32 (с, 2Н), 3,38 (с, 2Н), 3,90 (т, 2Η), 3,98 (т, До розчину 100мг 8-(42Η). гідроксибіцикло[2.2.2]окт-1-іл)-1,3-дипропіл-3,7Приклад 21о: 3-[5-(2,6-діоксо-1,3-дипропілдигідропурин-2,6-діону (приклад 13а) (0,28ммоль) 2,3,6,7-тетрагідро-1Н-пурин-8-іл)біцикло[3.2.2]нонв СН2Сl2 (10мл) додавали 40мкл Et3N і реакційну 1-ілокси]пропіонова кислота, (МН+=447,32) суміш охолоджували на бані з льодом. Додавали Приклад 21р: 2-(R)-[5-(2,6-діоксо-1,3-дипропілдо неї 100мг п-толуолсульфонілхлориду 2,3,6,7-тетрагідро-1Н-пурин-8-іл)біцикло[3.2.2]нон(0,52ммоль) і реакційну суміш витримували при 1-ілокси]пропіонова кислота, (МН+=447,26) 10°С протягом ночі. Реакційну суміш концентруваПриклад 22 ли у вакуумі і залишок розчиняли в EtOAc і проми8-(4-Феноксибіцикло[2.2.2]окт-1-іл)-1,3вали 2 рази розбавленою НСl (10мл). Органічний Дипропіл-3,7-дигідропурин-2,6-діон шар сушили над Na2SO4 і концентрували. Залишок До розчину 60мг 8-(4-гідроксибіцикло[2.2.2]октрозтирали в ацетонітрилі з одержанням 78мг 1-іл)-1,3-дипропіл-3,7-дигідропурин-2,6-діону (при(54%) чистої білої твердої речовини (МН+=515,10). клад 13а) (0,167ммоль) в СН2Сl2 (2мл) додавали Приклад 25 27мкл піридину і реакційну суміш охолоджували до N-[4-(2,6-діоксо-1,3-дипропіл-2,3,6,70°С. Додавали до неї 40мкл трифлікангідриду театрагідро-1Н-пурин-3-іл)біцикло[2.2.2]окт-1(0,24ммоль) в СН2Сl2 (1мл). Реакційну суміш виіл]метансульфонамід тримували при 10°С протягом ночі. Потім її розбаДо розчину 100мг 8-(4-амінобіцикло[2.2.2]октвляли СН2Сl2 (5мл) і промивали холодною 1н. НСI, 1-іл)-1,3-дипропіл-3,7-дигідропурин-2,6-діону (принасиченим NaHCO3 і насиченим сольовим розчиклад 20) (0,28ммоль) в 2мл піридину, що охолоном. Сушили над сульфатом натрію і концентруджується на водяній бані з льодом, додавали вали у вакуумі з одержанням жовтого масла. Не22мкл метансульфонілхлориду (0,28ммоль), при очищений трифлат розчиняли в 1,4-діоксані (3мл) і цьому через 24год. при 10°С реакція завершилася додавали 100мг фенолу (1,08ммоль) з подальшим на 30%. Для повного завершення реакції додавали нагріванням при 80°С протягом ночі. Реакційну ще дві аліквоти (22мкл і 50мкл) метансульфонілхсуміш випаровували і залишок розчиняли в етилалориду. Реакційну суміш концентрували у вакуумі цетаті (10мл), промивали 1н. КОН (5мл), насичез одержанням жовтого масла, яке розчиняли в ним NaHCO3 (5мл), 1н. НСI (5мл) і насиченим соEtOAc (10мл) і промивали двічі насиченим льовим розчином. Органічний шар сушили над NaНСО3 (5мл), один раз 0,5н. НСI і один раз насиNa2SO4 і концентрували у вакуумі до безбарвного ченим сольовим розчином. Органічний шар сушимасла, яке очищали колонковою хроматографією ли над Na2SO4 і концентрували до масла. Залишок (SiO2, 1:1 гексани/EtOAc) з одержанням 11мг вкакристалізували з ацетонітрилу з одержанням 27мг заної в заголовку сполуки у вигляді білої твердої (22%) у вигляді білої твердої речовини речовини (МН+=437,29). Аналогічним чином після (МН+=438,08). Аналогічним чином були одержані омилення складного метилового ефіру були одернаступні сполуки: жані наступні сполуки. Приклад 25а: 3-[4-(2,6-діоксо-1,3-дипропілПриклад 22а: [4-(2,6-діоксо-1,3-дипропіл2,3,6,7-тетрагідро-1Н-пурин-8-іл)біцикло[2.2.2]окт2,3,6,7-тетрагідро-1Н-пурин-8-іл)біцикло[2.2.2]окт1-ілсульфамоїл]бензолсульфонова кислота, 1-ілсульфаніл]оцтова кислота, (МН+:=435,35) (МН+=579,95) Приклад 22b: {[4-(2,6-діоксо-1,3-дипропілПриклад 25b: [4-(2,6-діоксо-1,3-дипропіл2,3,6,7-тетрагідро-1Н-пурин-8-іл)біцикло[2.2.2]окт2,3,6,7-тетрагідро-1Н-пурин-8-іл)біцикло[2.2.2]окт1-іл]метиламіно}оцтова кислота, (МН+=432,31) 1-ілсульфамоїл]оцтова кислота, (МН+=482,27) Приклад 22с: [4-(2,6-діоксо-1,3-дипропілПриклад 25с: 3-[4-(2,6-діоксо-1,3-дипропіл2,3,6,7-тетрагідро-1Н-пурин-82,3,6,7-тетрагідро-1Н-пурин-8-іл)біцикло[2.2.2]октіл)біцикло[2.2.2]октан-1-сульфоніл]оцтова кислота, 1-ілсульфамоїл]тіофен-2-карбонової кислоти ме(МН+=467,31). тиловий ефір, (МН+=564,19) Приклад 23 Приклад 25d: 3-[4-(2,6-діоксо-1,3-дипропіл4-(2,6-діоксо-1,3-Дипропіл-2,3,6,7-тетрагідро2,3,6,7-тетрагідро-1Н-пурин-8-іл)біцикло[2.2.2]окт1Н-пурин-8-іл)біцикло[2.2.2]окт-1-ільний ефір ме1-ілсульфамоїл]тіофен-2-карбонова кислота, тансульфонової кислоти (МН+=550,20) До розчину 50мг 8-(4-гідроксибіцикло[2.2.2]октПриклад 25е: N-[4-(2,6-діоксо-1,3-дипропіл1-іл)-1,3-дипропіл-3,7-дигідропурин-2,6-діону (при2,3,6,7-тетрагідро-1Н-пурин-8-іл)біцикло[2.2.2]октклад 13а) (0,14ммоль) в СН2Сl2 (5мл) додавали 1-ілметил]метансульфонамід, (МН+=388,32) 20мкл Et3N і реакційну суміш охолоджували на 43 77391 44 Приклад 25f: 3-{[4-(2,6-діоксо-1,3-дипропілдипропіл-3,7-ди-гідропурин-2,6-діон, (МН+=428,3 8) 2,3,6,7-тетрагідро-1Н-пурин-8-іл)біцикло[2.2.2]октПриклад 26m: 8-(41-ілметил]сульфамоїл}тіофен-2-карбонової кислоЦиклопентиламінометилбіцикло[2.2.2]окт-1-іл)-1,3ти метиловий ефір, (МН+=578,3) дипропіл-3,7-дигідропурин-2,6-діон, (МН+=442,56) Приклад 25g: 3-{[4-(2,6-діоксо-1,3-дипропілПриклад 26n: 8-{4-[(12,3,6,7-тетрагідро-1Н-пурин-8-іл)біцикло[2.2.2]октметилбутиламіно)метил]біцикло[2.2.2]окт-1-іл}-1,31-ілметил]сульфамоїл}тіофен-2-карбонова кислоди-пропіл-3,7-дигідропурин-2,6-діон, (МН+=444,60) + та, (МН =564,24) Приклад 27 Приклад 25h: [4-(2,6-діоксо-1,3-дипропіл4-[3-(4-Гідроксифеніл)-2,6-діоксо-1-пропіл2,3,6,7-тетрагідро-1Н-пурин-8-іл)біцикло[2.2.2]окт2,3?6,7-тетрагідро-1Н-пурин-81-ілкарбамоїл]метансульфонова кислота, іл]біцикло[2.2.2]октан-1-карбонова кислота (МН+=480,13). До розчину 10мг 4-[3-(4-Метоксифеніл)-2,6Приклад 26 діоксо-1-пропіл-2,3,6,7-тетрагідро-1Н-пурин-81,3-Діпропіл-8-{4-[(тіофен-2-ілмеотил) амііл]біцикло[2.2.2]октан-1-карбонової кислоти (прикно]біцикло[2.2.2]окт-1-іл}-3,7-дигідропурин-2,6-діон лад 131) (0,022ммоль) в СН2СІ2 (2мл), що охолоДо розчину 100мг 8-(4-амінобіцикло[2.2.2]октджується на бані зі сумішшю сухий лід/ацетон, 1-іл)-1,3-дипропіл-3,7-дигідро-пурин-2,6-діону (придодавали 1мл 1М розчину триброміду бору клад 20) (0,28ммоль) і 37мг тіофен-2(1ммоль) в СН2Сl2. Реакційній суміші давали нагрікарбоксальдегіду (0,33ммоль) в СН2Сl2 (5мл) дотися до кімнатної температури і витримували продавали 5 крапель крижаної оцтової кислоти і 100мг тягом 2год. Після закінчення вказаного часу реактриацетоксиборогідриду натрію (0,47ммоль). Повційну суміш охолоджували на сухому льоду і не перетворення відбувалося за 24год. при кімназупиняли МеОН. Неочищений продукт виділяли тній температурі. Реакційну суміш зупиняли 2мл після концентрування у вакуумі і перекристалізоетанолу і 2мл 2н. НСI і потім концентрували у вавували з ацетонітрилу з одержанням 10мг білої куумі з одержанням безбарвного масла, яке очитвердої речовини (МН+=439,09). Аналогічним чищали від безводного ацетонітрилу з одержанням ном були одержані наступні сполуки: 50,8мг (40%) необхідної сполуки у вигляді білої Приклад 27а: 4-{3-[2-(4-Гідроксифеніл)етил]твердої речовини (МН+=456,29). Аналогічним чи2,6-діоксо-1-пропіл-2,3,6,7-тетрагідро-1Н-пурин-8ном були одержані наступні сполуки: іл}біцикло[2.2.2]октан-1-карбонова кислота, Приклад 26а: {[4-(2,6-діоксо-1,3-дипропіл(МН+=467,4) 2,3,6,7-тетрагідро-1Н-пурин-8-іл)біцикло[2.2.2]октПриклад 27b: 4-[3-(2-Гідроксіетіл)-2,6-діоксо-11-ілметил]аміно}оцтова кислота, (МН+=432,32) пропіл-2,3,6,7-тетрагідро-1Н-пурин-8Приклад 26b: 8-{4-[(1Н-Імідазол-2іл]біцикло[2.2.2]октан-1-карбонова кислота, ілметил)аміно]біцикло[2.2.2]окт-1-іл}-1,3-дипропіл(МН+=391,12) 3,7-дигідропурин-2,6-діон, (МН+=440,09) Приклад 27с: 4-[3-(4-Гідроксифеніл)-2,6-діоксоПриклад 26с: [4-(2,6-діоксо-1,3-дипропіл1-пропіл-2,3,6,7-тетрагідро-1Н-пурин-82,3,6,7-тетрагідро-1Н-пурин-8-іл)біцикло[2.2.2]октіл]біцикло[2.2.2]октан-1-карбонова кислота, 1-іламіно]оцтова кислота, (МН+=418,15) (МН+=439,09) Приклад 26d: 8-{4-[(Фуран-2Приклад 27d: 3-(4-{3-[2-(4-Гідроксифеніл)етил]ілметил)аміно]біцикло[2.2.2]окт-1-іл}-1,3-дипропіл2,6-діоксо-1-пропіл-2,3,6,7-тетрагідро-1Н-пурин-83,7-дигідропурин-2,6-діон, (МН+=440,30) іл}біцикло[2.2.2]окт-1-іл)пропіонова кислота, Приклад 26е: 1,3-дипропіл-8-(4-{(тіофен-2(МН+=495,12) ілметил)[аміно]метил}біцикло[2.2.2]окт-1-іл)-3,7Приклад 27е: 8-(4-Гідроксибіцикло[2.2.2]окт-1дигідропурин-2,6-діон, (МН+=470,31) іл)-3-[2-(4-Гідроксифеніл)етил]-1-пропіл-3,7Приклад 26f: 8-(4-{[(ЗН-Імідазол-4дигідропурин-2,6-діон, (МН+=439,14) ілметил)аміно]метил}біцикло[2.2.2]окт-1-іл)-1,3Приклад 28 дипропіл-3,7-дигідропурин-2,6-діон, (МН+=454,35) 4-{3-[2-(4-Гідрокси-3-йодофеніл)етил]-2,6Приклад 26g: 4-{[4-(2,6-діоксо-1,3-дипропілдіоксо-1-пропіл-2,3,6,7-тетрагідро-1Н-пурин-82,3,6,7-тетрагідро-1Н-пурин-8-іл)біцикло[2.2.2]октіл}біцикло[2.2.2] октан-1-карбонова кислота 1-іламіно]метил}бензойна кислота, (МН+=494,34) До розчину 50мг 4-{3-[2-(4Приклад 26h: 4-({[4-(2,6-діоксо-1,3-дипропілгідроксифеніл)етил]-2,6-діоксо-1-пропіл-2,3,6,72,3,6,7-тетрагідро-1Н-пурин-8-іл)біцикло[2.2.2]окттетрагідро-1Н-пурин-8-іл}біцикло-[2.2.2]октан-11-ілметил]аміно}метил)бензойна кислота, карбонової кислоти (приклад 27а}(0,107ммоль) у (МН+=508,31) воді (10мл), що містить 1екв. 1н. NaOH (110мкл), Приклад 26і: 1,3-дипропіл-8-(4-{(пірідин-4додавали при кімнатній температурі розчин 30мг ілметил)[аміно]метил}біцикло[2.2.2]окт-1-іл)-3,7йоду (0,107ммоль) в етанолі (1мл). Реакційну судигідропурин-2,6-діон, (МН+:=465,33) міш концентрували у вакуумі і неочищений продукт Приклад 26j: 8-(4-{[(Фуран-2очищали препаративною хроматографією з одерілметил)аміно]метил}біцикло[2.2.2]окт-1-іл)-1,3жанням 12мг (20%) необхідного продукту + + дипропіл-3,7-дигідропурин-2,6-діон, (МН =454,33) (МН =592,89).) Приклад 26k: 5-{[4-(2,6-діоксо-1,3-дипропілАналогічним чином були одержані наступні 2,3,6,7-тетрагідро-1Н-пурин-8-іл)біцикло[2.2.2]октсполуки: 1-іламіно]метил}фуран-2-сульфонова кислота, Приклад 28а: 4-{3-[2-(4-Гідрокси-3,5(МН+=520,26) дійодофеніл)етил]-2,6-діоксо-1-пропіл-2,3,6,7Приклад 26l: 8-(4тетрагідро-1Н-ііурин-8-іл}біцикло[2.2.2]октан-1Циклопентиламінобіцикло[2.2.2]окт-1-іл)-1,3карбонова кислота, (МН+=718,50) 45 77391 46 Приклад 28b: 3-(4-{3-[2-(4Тідрокси-3кислоти (3,84ммоль, 0,86г) перетворювали в етийодофеніл)етил]-2,6-діоксо-1-пропіл-2,3,6,7ловий ефір 4-формілбіцикло[3.2.1]октан-1тетрагідро-1Н-пурин-8-іл}біцикло[2.2.2]окт-1карбонової кислоти (0,81г, 100%). ТШХ (діоксид іл)пропіонова кислота, (МН+=621,08). кремнію, 20% Еt2О/гексани, 20% PMA/EtOH візуаПриклад 29 лізація) Rf (вказана в заголовку сполука) = 0,29. Амід 4-(2,6-діоксо-1,3-дипропіл-2,3,6,7До розчину етилового ефіру, що охолоджуєтьтетрагідро-1Н-пурин-8-іл)біцикло[2.2.2]октан-1ся льодом 4-формілбіцикло[3.2.1]октан-1карбоновоїкислоти карбонової кислоти (3,85ммоль, 0,81г) повільно До розчину 200мг 4-(2,6-діоксо-1,3-дипропілдодавали реактив Джонса (2,7Μ, 1,43мл). Реакцій2,3,6,7-тетрагідро-1Н-пурин-8ну суміш перемішували при температурі льоду іл)біцикло[2.2.2]октан-1-карбонової кислоти (прик20хв., після чого зупиняли доданням ізоРrОН, розлад 13) (0,515ммоль) в 5мл ДМФ додавали 235мг бавляли Н2О і екстрагували Et2O (3 рази). Об'єдHATU (0,618ммоль) і 0,4мл Ν,Νнані органічні екстракти промивали Н2О (2 рази), діізопропілетиламіну. Одержану суміш залишали насиченим сольовим розчином (1 раз) і сушили перемішуватися при кімнатній температурі протя(MgSO4). Фільтрування і випаровування дали в'язгом 30хв. Додавали 2,1мл 0,5Μ розчину ΝΗ3 в діокий маслянистий 1-етиловий ефір біциклоксані (1,03ммоль) по краплях за 5хв. Залишали [3.2.1]октан-1,4-дикарбонової кислоти (0,76г, 87%) перемішуватися на ніч, додавали 0,5екв. 0,5Μ розу вигляді суміші аксіальної і екваторіальної кислот. 13 чину ΝΗ3 в діоксані (0,5мл). Додавали EtOAc і 1н. С ЯМР (100МГц, CDCl3): 14,16 (кв), 19,86 (т), NaOH до рН=9 і промивали 10% лимонною кисло21,07 (т), 25,98 (т), 29,20 (т), 31,52 (т), 31,87 (т), тою, насиченим NaНСО3 і насиченим сольовим 32,27 (т), 33,39 (т), 37,80 (д), 38,07 (т), 38,10 (д), розчином. Сушили над Na2SO4 і концентрували у 42,06 (т), 44,80 (д), 45,78 (д), 49,38 (із), 49,60 (з), вакуумі з одержанням 80,9мг (40%) чистого проду60,31 (т), 60,36 (т), 177,08 (с), 180,01 (с). кту (МН+=3 88,34). При 0°С додавали розчин DCC (0,5Μ в СН2Сl2, Приклад 30 5,5мл) до розчину 1-етилового ефіру біцик8-(4-Амінометилбіцикло[2.2.2]окт-1-іл)-1,3ло[3.2.1]октан-1,4-дикарбонової кислоти дипропіл-3,7-дигідропурин-2,6-діон (2,52ммоль, 0,57г), t-BuOH (7,56ммоль, 0,56г) і До розчину 50мг аміду 4-(2,6-діоксо-1,3ОМАР (2,02ммоль, 0,247г) в СН2Сl2 (15мл). Після дипропіл-2,3,6,7-тетрагідро-1Н-пурин-8перемішування протягом ночі при кімнатній темпеіл)біцикло[2.2.2]октан-1-карбонової кислоти (прикратурі, реакційну суміш фільтрували для видаленлад 29) (0,129ммоль) в ТГФ (10мл) додавали по ня твердих часток і фільтрат промивали 5% ликраплях при кімнатній температурі 0,28мл 1Μ коммонною кислотою, насиченим NaHCO3 і сушили плексу боран-ТГФ (0,284ммоль) і по закінченні (MgSO4). Фільтрування і випаровування дали прододання суміш повільно доводили до кипіння із дукт (0,71г, 100%) у вигляді масла. МС (ES+) зворотним холодильником. Кип'ятили із зворотним 225,24 (M+H-tBu). холодильником протягом 3,5год., після чого охоРозчин 1-етилового ефіру 4-трет-бутилового лоджували і гасили 10мл метанолу і доводили до ефіру біцикло[3.2.1]октан-1,4-дикарбонової кислокипіння. Концентрували у вакуумі і залишок розчити (2,52ммоль, 0,71г) в ТГФ (12мл) обробляли 1н. няли в 1н. НСl і промивали двічі СН2Сl2. Доводили LiOH (12,6мл) і перемішували при кімнатній темдо рН~8 і промивали два рази EtOAc, сушили над пературі протягом 3 днів. Реакційну суміш конценNa2SO4 і концентрували у вакуумі, одержуючи трували для видалення ТГФ і водний залишок екс30,2мг (63%) аміну (МН+=374,31). трагували Et2O для видалення нейтральних Приклад 31 домішок. Водну фазу підкисляли (рН 2-3) при 0°С 5-{2,6-діоксо-1,3-Дипропіл-2,3,6,7-тетрагідрододанням 1н. НСI і потім відразу ж екстрагували 1Н-пурин-8-мул)біцикло[3.2.1]октан-1-карбонова EtOAc. Об'єднані органічні фракції промивали Н2О, кислота насиченим сольовим розчином і сушили (MgSO4). Користуючись методикою, описаною в посиФільтрування і випаровування дали продукт (0,48г, ланнях [Kraus, W., et al. Liebigs Ann.Chem. 1981, 75%). 10, 1826, and Kraus, W., et al. Tetrahedron Lett. Користуючись методикою прикладу 8, 4-трет1978, 445; Filippini, M.-H. et al. J. Org. Chem. 1995, бутиловий ефір біцикло[3.2.1]октан-1,460, 6872], етиловий ефір 4-оксобіцикло[3.2.1 ]окдикарбонової кислоти (1,89ммоль, 0,48г) піддаватан-1-карбонової кислоти (6,17ммоль, 1,21г) перели взаємодії з 5,6-діаміно-1,3-дипрошл-1Нтворювали в етиловий ефір 4піримідин-2,4-діонгідрохлоридом (1,89ммоль, метоксиметиленбіцикло[3.2.1]октан-1-карбонової 0,597г) з одержанням продукту (0,81г, 93%). МС кислоти. Флеш-хроматографія з елююванням су(ES+) 463,14 (М+Н). мішшю 10% діетиловий ефір/гексани дала чистий Користуючись методикою прикладу 8, третпродукт (0,96г, 69%) у вигляді рідини (суміш E/Z бутиловий ефір 5-(6-аміно-2,4-діоксо-1,3-дипропілізомерів). 13С ЯМP (100МГц, CDCl3): 14,31 (кв), 1,2,3,4-тетрагідропіримідин-519,5 (т), 22,97 (т), 23,61 (т), 23,91 (т), 29,97 (т), ілкарбамоїл)біцикло[3.2.1]октан-2-карбонової кис31,13 (т), 32,04 (т), 32,36 (т), 34,61 (т), 34,85 (д), лоти (1,75ммоль, 0,81г) перетворювали в продукт 35,81 (т), 43,18 (т), 43,63 (т), 50,47 (із), 50,77 (з), (0,501г, 70%). 59,63 (кв), 59,69 (т), 121,04 (с), 121,44 (с), 137,18 Розчин трет-бутилового ефіру 5-(2,6-діоксо(д), 138,16 (д), 177,60 (с), 177,63 (с). 1,3-дипропіл-2,3,6,7-тетрагідро-1Н-пурин-8Користуючись методикою, описаною в приклаіл)біцикло[3.2.1]октан-2-карбонової кислоти ді 50, етиловий ефір 4(1,13ммоль, 0,501г) в СН2Сl2 (5мл) обробляли TFA метоксиметиленбіцикло[3.2.1]октан-1-карбонової (5мл). Після перемішування при кімнатній темпе 47 77391 48 ратурі протягом ночі, реакційну суміш концентруровування з подальшим очищенням зворотнофавали досуха. Зворотнофазовою ВЕРХ розділяли зовою ВЕРХ дали необхідний продукт (0,0055г, екваторіальний (перша смуга, 0,010г) і аксіальний 48%) у вигляді суміші діастереомерів. ВЕРХ (10%(друга смуга, 0,010г) ізомери кислоти. ВЕРХ (10%90% MeCN (0,1% TFA)/H2O (0,1% TFA), колонка 90% MeCN (0,1% TFA)/H2O (0,1% TFA), колонка YMC 120 A/S-5 ODS-AM, 100мм x 4,6мм, 1,5мл/хв.: YMC 120 A/S-5 CDS-AM, 100мм x 4,6мм, 1,5мл/хв: Rt=6,88хв. Rt(екваторіальний)=6,49хв.; Rt(аксіальний)=6,75. Аналогічним чином була одержана наступна Приклад 32 сполука: 3-[5-(2,6-діоксо-1,3-ДИпропіл-2,3,6,7Приклад 33а: (1RS, 2S, 5SR)-{[5-(2,6-діоксотетрагідро-1Н-пурин-8-іл)біцикло[3.2.1]окт-11,3-дипропіл-2,3,6,7-тетрагідро-1Н-пурин-8іл]пропіонова кислота іл)біцикло[3.2.1]октан-1-карбоніл]аміно} фенілоцСуспензію метилового ефіру 3-[5-(2,6-діоксотової кислоти. 1,3-дипропіл-2,3,6,7-тетрагідро-1Н-пурин-8Приклад 34 іл)біцикло[3.2.1]окт-1-іл]акрилової кислоти (прик8-(4-Гідроксибіцикло[3.2.1]окт-1-іл)-1,3лад 12) (0,58ммоль, 0,25г) і 10% Pd/C (50% H2O, дипропіл-3,7-дигідропурин-2,6-діон 0,029ммоль, 0,062г) в МеОН (20мл) гідрували при Користуючись методикою, описаною в прикла40 фунтах на кв. дюйм (2,8кг/см2) протягом ночі. ді 8, 4-гідроксибіцикло[3.2.1]октан-1-карбонову Відпрацьовану реакційну суміш фільтрували через кислоту [Kraus, W., et al. Liebigs Ann. Chem., 1981, целіт і промивали МеОН. Випаровування дало 10, 1826] (0,50ммоль, 0,085г) піддавали взаємодії з необхідний продукт (0,196г, 79%) у вигляді масла. 5,6-діаміно-1,3-дипропіл-1Н-піримідин-2,4МС (ES+) 431,18 (М+Н). діонгідрохлоридом (0,50ммоль, 0,132г) з одержанРозчин метилового ефіру 3-[5-(2,6-діоксо-1,3ням необхідного продукту (0,081г, 44%). дипропіл-2,3,6,7-тетрагідро-1Н-пурин-8Користуючись методикою, описаною в приклаіл)біцикло[3.2.1]окт-1-іл]пропіонової кислоти ді 8, (6-аміно-2,4-діоксо-1,3-дипропіл-1,2,3,4(0,456ммоль, 0,196г) в ТГФ (10мл) обробляли 20% тетрагідропіримідин-5-іл)амід 4NaOH (2мл) і перемішували протягом ночі при кімгідроксибіцикло[3.2.1]октан-1-карбонової кислоти натній температурі. Реакційну суміш концентрува(0,21ммоль, 0,081г) перетворювали в необхідний ли для видалення ТГФ. Водний залишок підкисляпродукт. МС (ES+) 361,36 (М+Н). ли (рН 2-3) концентрованою НСl і додавали Приклад 35 ізоРrОН для одержання гомогенної суміші. Розчин 3-[4-(2,6-Діоксо-1,3-дипропіл-2,3?6,7концентрували на роторному випарнику до початтетрагідро-1Н-пурин-8-іл)-2-оксабіцикло[2.2.2]октку відділення твердих часток. Після охолоджуван1-іл]пропіонова кислота ня на льоду протягом 1год., тверді частки, що виВінілмагнійбромід (1,0Μ в ТГФ, 100мл) охолопали в осадок, збирали вакуумним фільтруванням, джували до 0°С і дитозилатне похідне 4,4промивали невеликою кількістю Н2О і витісняли з бісгідрокси концентрували при зниженому тиску. допомогою Et2O. Тверді частки сушили на фільтрі Очищення хроматографією (1:1 гексани/EtOAc) з одержанням необхідного продукту (0,061г, 32%). дало 5,0г проміжного спирту. 13 СЯМР (100МГц, CDCl3): 11,11 (кв), 11,26 (кв), Одержаний продукт (5,0г) розчиняли в 200мл 20,04 (т), 21,25 (т), 21,31 (т), 29,51 (с), 33,97 (т), безводного ДМФ і додавали 730мг NaH (3екв.). 35,15 (с), 36,16 (т), 36,39 (т), 43,32 (т), 43,41 (т), Реакційну суміш перемішували при нагріванні із 45,38 (т), 49,18 (т), 106,01 (с), 149,40 (с), 150,90 (с), зворотним холодильником протягом 18год. Потім її 156,30 (с), 161,56 (с), 178,54 (с). охолоджували до кімнатної температури і зупиняПриклад 33 ли насиченим водним розчином NH4Cl і екстрагу(1RS, 2R, 5SR)-{[5-(2,6-Діоксо-1,3-дипропілвали EtOAc. Органічний шар сушили (Na2SO4) і 2,3,6,7-тетрагідро-1Н-пурин-8-іл) біцикконцентрували з одержанням 3,30г проміжного ло[3.2.1]октан-1-карбоніл]аміно}фенілоцтова кисмонотозилату. лота Одержаний монотозилат (4,40г, 13,7ммоль) Користуючись методикою, описаною в прикларозчиняли в 20мл ДМСО і додавали NaOAc·3Н2О ді 8, здійснювали взаємодію між 5-(2,6-діоксо-1,3(18,0г, 10екв.). Реакційну суміш перемішували при дипропіл-2,3,6,7-тетрагідро-1Н-пурин-860°С протягом 2 днів. Потім її розбавляли Н2О і іл)біцикло[3.2.1]октан-1-карбоновою кислотою екстрагували EtOAc. Органічний шар промивали (приклад 8) (0,052ммоль, 0,020г) і гідрохлоридом Н2О, сушили (Na2SO4) і концентрували з одержанскладного метилового ефіру (R)-фенілгліцину ням 2,60г ацетату, 1-вініл-2-оксабіцикло[2,2.2]окт(0,064ммоль, 0,013г) з одержанням вказаної в за4-ілметилового ефіру оцтової кислоти. головку сполуки (0,0134г, 48%) у вигляді суміші Одержаний ацетат (2,60г, 12,4ммоль) розчидіастереомерів. МС (ES+) 536,36 (М+Н). няли в 40мл МеОН і додавали К2СО3 (8,5г, 5екв.) у Розчин метилового ефіру (1RS, 2R, 5SR)-{[5вигляді розчину в 50мл Н2О. Реакційну суміш пе(2,6-діоксо-1,3-дипропіл-2,3,6,7-тетрагідро-1Нремішували при кімнатній температурі протягом пурин-8-іл)біцикло[3.2.1]октан-13год. Потім її концентрували і екстрагували EtOAc. карбоніл]аміно}фенілоцтової кислоти (0,022ммоль, Органічний шар сушили (Na2SO4) і концентрували. 0,012г) в ТГФ (2мл) обробляли 1н. LiOH (0,22мл) Очищення хроматографією (2:1 EtOAc/гексани) протягом 3 днів. Видаляли на роторному випарнидала 1,20г спирту, (1-вініл-2-оксабіцикло[2.2.2]октку ТГФ, водний залишок підкисляли (рН 2) додан4-іл)метанолу. ням 1н. НСI і екстрагували EtOAc. Об'єднані оргаОдержаний продукт (1,20г, 7,14ммоль) розчинічні фракції промивали Н2О, насиченим сольовим няли в 20мл ацетону і охолоджували до 10°С. Дорозчином і сушили (MgSO4). Фільтрування і випадавали СrО3 (2,1г, 3екв.) у вигляді розчину в 10мл 49 77391 50 1,5н. H2SO4 (водний розчин). Реакційну суміш пе(3,5г) розчиняли в ДМФ (20мл), додавали DIC ремішували при 10°С протягом 15хв., нагрівали до (1,36мл) і перемішували протягом 1год. Одержакімнатної температури і перемішували 45хв. Потім ний ангідрид додавали до смоли зі стадії 2. Смолу її розбавляли Н2О і екстрагували EtOAc. Об'єднані струшували протягом ночі. На наступний день органічні шари промивали Н2О і потім екстрагувасмолу фільтрували, промивали ДМФ (3x25мл), ли розбавленим водним розчином КОН. Водний СН2Сl2 (3x25мл) і МеОН (3x25мл) і сушили. шар підкисляли до рН 1 концентрованою НСl і ексСтадія 4: 1,3-дипропіл-5,6-діаміноурацил·НСl трагували EtOAc. Органічний шар сушили зв'язували зі смолою зі стадії 3, використовуючи (Na2SO4) і концентрували з одержанням 920мг РуВОР, N-метилморфолін в ДМФ, протягом ночі. похідного карбонової кислоти, 1-вініл-2Смолу промивали ДМФ (3x25мл), СН2Сl2 (3x25мл) оксабіцикло[2.2.2]октан-4-карбонової кислоти. і МеОН (3x25мл) і сушили. Одержаний продукт обробляли 5,6-діаміноСтадія 5: До смоли зі стадії 4 додавали 2мл 1,3-дипропіл-1Н-піримідин-2,4-діоном так само, як розчину КОН (7,5г КОН в 200мл суміші воописано вище, з одержанням відповідного похіднода:МеОН:ТГФ=10:90:100, 10екв.) і суміш нагрівали го ксантину, 1,3-дипропіл-8-(1-вініл-2при 60°С протягом ночі. На наступний день, після оксабіцикло[2.2.2]окт-4-іл)-3,7-дигідропурин-2,6охолоджування до кімнатної температури, смолу діону. промивали МеОН (3x2мл), ТГФ (3x2мл) і СН2Сl2 1,3-дипропіл-8-(1-вініл-2-оксабіцикло[2.2.2]окт(3x2мл) і сушили. Смолу розщеплювали, викорис4-іл)-3,7-дигідропурин-2,6-діон (400мг, 1,08ммоль) товуючи суміш (1:1) TFA:CH2Cl2 (2мл), протягом суспендували в 8мл діоксану і додавали 1мл 2,5% 1год. Смолу фільтрували і промивали СН2Сl2. розчину OsO4 в t-BuOH, а потім 3мл Н2О. Через Змішаний розчинник видаляли, користуючись ви10хв. додавали NaIO4 і реакційну суміш перемішупарником Speed Vac. Залишок розчиняли в суміші вали при кімнатній температурі протягом 3год. СН3Сn:вода=1:1 (2мл) і ліофілізували. Продукти Потім її розбавляли Н2О і екстрагували EtOAc. ідентифікували РХ-МС (LCMS). MC(ES+533). Органічний шар сушили (Na2SO4) і концентрували Приклад 37 з одержанням проміжного альдегіду, 4-(2,6-діоксо3-(2,6-діоксо-1,3-ДИпропіл-2,3,6,7-тетрагідро1,3-дипропіл-2,3,6,7-тетрагідро-1Н-пурин-8-іл)-21Н-пурин-8-іл)адамантан-1-карболової кислоти 3оксабіцикло[2.2.2]октан-1-карбальдегіду. амінометилбензиламід Одержаний продукт розчиняли в 8мл ТГФ і Слідували методиці з прикладу 36. На стадії 2 додавали метил(трифенілфосфоранілін)ацетат використали 3-амінометилбензиламін. МС (720мг, 2екв.). Реакційну суміш перемішували при (ES+533). кімнатній температурі протягом 18год. Додавали Приклад 38 LiOH (155мг, 6екв.) у вигляді розчину в 8мл Н2O і 3-(2,6-діоксо-1,3-дипропіл-2,3,6,7-тетрагідроодержану реакційну суміш перемішували при кім1Н-пурин-8-іл)адамантан-1-карбонової кислоти (3натній температурі протягом 4год. Потім реакційну амінопропіл)амід суміш екстрагували EtOAc. Органічний шар сушиСлідували методиці прикладу 36. На стадії 2 ли (Na2SO4) і концентрували з одержанням 250мг використали 1,3-діамінопропан. MC(ES+471). 3-[4-(2,6-діоксо-1,3-дипропіл-2,3,6,7-тетрагідро-1НПриклад 39 пурин-8-іл)-2-оксабіцикло[2.2.2]окт-1-іл]акрилової 3-(2,6-діоксо-1,3-дипропіл-2,3,6,7-тетрагідрокислоти. 1Н-пурин-8-іл)-адамантан-1-карбоновоїкислоти {3Одержаний продукт розчиняли в 25мл 95% [4-(3-амінопропіл)піперазин-1-іл]пропіл}амід ТГФ і 5% Н2О. Додавали 10% Pd/C (80мг) і реакСлідували методиці прикладу 36. На стадії 2 ційну суміш гідрували при тиску водню 50 фунтів використали 3-[4-(3-амінопропіл)піперазин-1на квадратний дюйм (3,5кг/см2) протягом 3год. іл]пропіламін. МС (ES+599). Реакційну суміш фільтрували через целіт і фільтПриклад 40 рат концентрували. Очищення препаративною 3-(2,6-діоксо-1,3-ДИпропіл-2,3,6,7-тетрагідроВЕРХ з використанням водного розчину CH3CN 1Н-пурин-8-іл)адамантан-1-карбонової кислоти [4дало вказану в заголовку сполуку. МС (ES+) 419. (4-аміноциклогексилметил)циклогексил]амід Приклад 36 Слідували методиці прикладу 36. На стадії 2 3-(2,6-діоксо-1,3-дипропіл-2,3,6,7-тетрагідровикористали 4,4'-метиленбіс(циклогексиламін). МС 1Н-пурин-8-іл)адамантан-1-карболової кислоти 4(ES+ 607). амінометилбензиламід Приклад 41 Стадія 1: До смоли Ванга (Wang) (10г, вироб3-(2,6-діоксо-1,3-дипропіл-2,3,6,7-тетрагідроництво Advanced ChemTech, заміщення 1Н-пурин-8-іл)адамантан-1-карбонової кислоти (40,7ммоль/г) в 100мл ТГФ додавали CDI (10г) і смоаміноциклогексил)амід лу струшували протягом ночі. На наступний день Слідували методиці з прикладу 36. На стадії 2 смолу фільтрували, промивали ТГФ (3x100мл) і використали циклогексил-1,4-диамін.МС(ЕS+ 511). сушили. Приклад 42 Стадія 2: Смолу 2,5г кожна, 1,75ммоль) зі ста8-[3-(Піперазін-1-карбоніл)адамантан-1-іл]-1,3дії 1 обробляли вісьма різними діамінами дипропіл-3,7-дигідропурин-2,6-діон (8,75ммоль, 5екв.) в ТГФ (25мл). Для даного прикСлідували методиці прикладу 36. На стадії 2 ладу використали 4-амінометилбензиламін. Після використали піперазин. МС (ES+ 483). струшування протягом ночі, смолу промивали ТГФ Приклад 43 (3x25мл), МеОН (3x25мл), СН2Сl2 (3x25мл) і МеОН 3-(2,6-Діоксо-1,3-дипропіл-2,3,6,7-тетрагідро(3x25мл) і сушили. 1Н-пурин-8-іл)адамантан-1-карбонової кислоти Стадія 3: Адамантан-1,3-дикарбонову кислоту амід 51 77391 52 Слідували методиці прикладу 36, стадія 3. Засольовим розчином і сушили над Na2SO4. Після мість смоли Ванга використали смолу Рінка. МС концентрування неочищений продукт використали (ES+414). на наступній стадії без очищення. Приклад 44 Стадія 2: 5-(2,6-діоксо-1,3-дипропіл-2,3,6,73-(2,6-діоксо-1,3-дипропіл-2,3,6,7-тетрагідротетрагідро-1Н-пурин-8-іл)біцикло[3.3.1]нонан-11Н-пурин-8-іл)адамантан-1-карбонова кислота карбальдегід (40мг) розчиняли в 5мл СН2СI2. ДоСиметричний ангідрид, одержаний з адамандавали N1,N1-диметилетан-1,2-діамін (40мг), тан-1,3-дикарбонової кислоти з використанням DIC Na(OAc)3BH (100мг), 2 краплі оцтової кислоти і в ДМФ, зв'язували з 1,3-дипропіл-5,6перемішували при кімнатній температурі протягом діаміноурацил-НСl. Продукт піддавали циклізації з ночі. На наступний день реакційну суміш розбаввикористанням КОН в суміші ізопропанол/вода. ляли етилацетатом, промивали насиченим MC(ES+415). NaHCO3, насиченим сольовим розчином і сушили Приклад 45 над MgSO4. Видаляли при зниженому тиску роз8-(3-Гідроксиметиладамантан-1-іл)-1,3чинник. Неочищений продукт очищали препаратиДипропіл-3,7-дигідропурин-2,6-діон вною ВЕРХ. МС (ES+ 459). + Слідували методиці прикладу 46. МС (ES 401). Приклад 49 Приклад 46 3-[5-(2,6-діоксо-1,3-дипропіл-2,3,6,75-(2,6-Діоксо-1,3-дипропіл-2,3,6,7-тетрагідротетрагідро-1Н-пурин-8-іл) біцикло[3.3.1]нон-11Н-пурин-8-іл)біцикло[3.3.1]нонан-1-карбонова іл]акрилова кислота кислота 5-(2,6-діоксо-1,3-дипропіл-2,3,6,7-тетрагідроМонометиловий ефір біцикло[3.3.1]нонан-1,51Н-пурин-8-іл)біцикло[3.3.1] нонан-1-карбальдегід дикарбонової кислоти (900мг) розчиняли в СН2СІ2 (355мг) розчиняли в ТГФ (25мл). Додавали мети(25мл), додавали оксалілхлорид (417мкл) і 2 крапловий ефір трифенілфосфаніліден)оцтової кислолі ДМФ і перемішували при кімнатній температурі ти (614мг) і кип'ятили із зворотним холодильником протягом 2год. Через дві години видаляли розчинпротягом ночі. На наступний день додавали ще ник на роторному випарнику. Залишок розчиняли в 460мг метилового ефіру трифенілфосфанілі20мл СН2СІ2· Додавали діаміноурацил·НСl (1,25г) і ден)оцтової кислоти і кип'ятили із зворотним холодіізопропілетиламін (1,7мл) і перемішували при дильником протягом 24год. Охолодивши суміш до кімнатній температурі протягом ночі. На наступний кімнатної температури, додавали LiOH (210мг), день реакційну суміш розбавляли водою, екстраводу (2мл), МеОН (5мл) і перемішували її при кімгували СН2Сl2, промивали насиченим сольовим натній температурі протягом ночі. Видаляли при розчином, сушили над Na2SO4 і концентрували. зниженому тиску розчинник. Розбавляли водою Неочищений продукт розчиняли в суміші ізопропа(25мл), екстрагували етилацетатом (3x25мл). Воднол:вода (2:1, 100мл) і, додавши КОН (890мг), киний шар підкисляли 1н. НСl і екстрагували етилап'ятили із зворотним холодильником протягом ноцетатом (3x50мл), сушили над Na2SO4 і концентчі. На наступний день, після охолоджування до рували. Вихід 254мг. МС (ES+ 429). кімнатної температури, видаляли розчинник на Приклад 50 роторному випарнику, розбавляли водою, підкис3-[5-(2,6-діоксо-1,3-дипропіл-2,3,6,7ляли 1н. НСl. Осадок, що утворився відфільтровутетрагідро-1Н-пурин-8-іл)біцикло[3.3.1]нон-1вали і сушили. Вихід 900мг. МС (ES+ 403). іл]пропіонова кислота Приклад 47 3-[5-(2,6-діоксо-1,3-дипропіл-2,3,6,78-(5-Гідроксиметилбіцикло[3.3.1]нон-1-іл)-1,3тетрагідро-1Н-пурин-8-іл)біцикло[3.3.1]нон-1дипропіл-3,7-дигідропурин-2,6-діон іл]акрилову кислоту (150мг) гідрували в присутнос5-(2,6-діоксо-1,3-дипропіл-2,3,6,7-тетрагідроті 10% Pd/C в суміші ТГФ:МеОН (2:1, 5мл) при 60 1Н-пурин-8-іл)біцикло[3.3.1]нонан-1-карбонову фунтах на квадратний дюйм (4,22кг/см ) протягом кислоту (700мг) розчиняли в ТГФ (25мл). Додавали ночі. Відфільтровували через целіт каталізатор і ВН3·ТГФ (1М, 3,5мл) і суміш перемішували при випаровували розчинник. Тверду речовину очикімнатній температурі протягом ночі. На наступний щали кристалізацією з ефіру. Вихід 105мг. МС день реакцію зупиняли доданням МеОН. На рото(ES+ 431) рному випарнику видаляли розчинник. Розбавляли Приклад 51 водою і екстрагували етилацетатом, промивали 5-(2,6-діоксо-1,3-дипропіл-2,3,6,7-тетразгідроводою, насиченим сольовим розчином, сушили 1Н-пурин-8-іл)-9-оксабіцикло[3.3.1]нонан-2над Na2SO4 і концентрували. Вихід 690мг. карбонова кислота MC(ES+389)· Стадія 1: 1,3-ДИпропіл-7-піролідин-1-ілметилПриклад 48 3,7-дигідропурин-2,6-діон (638мг) розчиняли в су8-{5-[(2хому ТГФ (10мл) при -78°С. Повільно додавали Диметиламіноетіламіно)метил]біцикло[3.3.1]нон-1nBuLi (0,88мл, 2,5Μ в гексані). Реакційна суміш іл}-1,3-дипропіл-3,7-дигідропурин-2,6-діон ставала оранжевою і її перемішували 30хв. при Стадія 1: 8-(5-Гідроксиметилбіцикло[3.3.1]нон78°С. Циклоокт-4-енон (298мг) розчиняли в 3мл 1-іл)-1,3-дипропіл-3,7-дигідропурин-2,6-діон сухого ТГФ і додавали до реакційної суміші. Пере(690мг) розчиняли в 50мл ДМСО. Додавали пірімішували при -78°С протягом 30хв., повільно надин·SО3 (844мг) і триетиламін (1,6мл) і перемішугрівали до кімнатної температури і перемішували вали протягом ночі. Додавали додаткову кількість 2год. Реакційну суміш гасили насиченим водним пірідин·SO3 (844мг) і перемішували протягом ночі. розчином NH4Cl і екстрагували етилацетатом Реакційну суміш розбавляли етилацетатом (3x50мл). Об'єднаний органічний шар промивали (100мл) і промивали 1н. НСI, водою, насиченим 1н. НСl, водою і насиченим сольовим розчином. 53 77391 54 Сушили над безводним Na2SO4 і концентрували. температурі протягом ночі. Розбавляли МеОН, Неочищений продукт очищали на колонці з силікаводою і осадок, що утворився відфільтровували гелем, елююючи сумішшю (1:1) етилацетаттексан. через целіт. Видаляли МеОН на роторному випарМС (ES+ 361). нику і залишок екстрагували етилацетатом. ЕтиСтадія 2: 8-(1-Гідроксициклоокт-4-еніл)-1,3лацетатний шар промивали водою, насиченим дипропіл-3,7-дигідропурин-2,6-діон (180мг, з рівня сольовим розчином і сушили над Na2SO4. Після 1) розчиняли в сухому МеОН (15мл) при кімнатній концентрування неочищений продукт розчиняли в температурі. Через розчин барботували моноксид МеОН (5мл) і воді (1мл). Додавали LiOH (25мг) і вуглецю. Додавали PdCl2 (9мг), а потім СuСl2 перемішували при кімнатній температурі протягом (201мг). CO барботували 4год. при кімнатній темночі. На наступний день видаляли на роторному пературі. Реакційна суміш ставала прозорою через випарнику МеОН, залишок розчиняли у воді (20мл) 3год. Через 4год. видаляли при зниженому тиску і екстрагували етилацетатом (2x25мл). Водний МеОН. Розбавляли водою, екстрагували етилацешар підкисляли 1н. НСl, екстрагували етилацетататом. Етилацетатний шар промивали водою, натом (2x50мл). Етилацетатний шар промивали насиченим сольовим розчином і сушили над Na2SO4. сиченим сольовим розчином і сушили. Після конПісля концентрування неочищений продукт очицентрування продукт розчиняли в ефірі і щали хроматографією на силікагелі з елююванням фільтрували через шар силікагелю. Концентрусумішшю (1:1) етилацетаттексан. Вихід 120мг. МС вання дало 30мг продукту. МС (ES+ 391). + (ES 419). Приклад 54 Стадія 3: Метиловий ефір 5-(2,6-діоксо-1,3Моно-[4-(2,6-діоксо-1,3-дипропіл-2,3,6,7дипропіл-2,3,6,7-тетрагідро-1Н-пурин-8-іл)-9тетрагідро-1Н-пурин-8-іл)біцикло[2.2.2]окт-1оксабіцикло[3.3.1]нонан-2-карбонової кислоти іл]ефір фосфорної кислоти (50мг, зі стадії 2) розчиняли в МеОН (5мл). Дода8-(4-Гідроксибіцикло[2.2.2]окт-1-іл)-1,3вали LiOH (15мг) і перемішували при кімнатній дипропіл-3,7-дигідропурин-2,6-діон (приклад 13а) температурі протягом ночі. На наступний день (180мг, 0,5ммоль) розчиняли в суміші 1Н-тетразол видаляли при зниженому тиску МеОН, розбавляли (350мг, 5ммоль) в 10мл сухого ацетонітрилу і 10мл водою і екстрагували етилацетатом. Водний шар сухого метиленхлориду. При кімнатній температурі підкисляли 1н. НСl, екстрагували етилацетатом додавали дибензилдіетилфосфорамідит (476мг, (3x25мл). Об'єднаний органічний шар промивали 1,5ммоль) в атмосфері азоту і суміш перемішуванасиченим сольовим розчином і сушили над ли 2год. Потім додавали 70% трет-бутиловий розNa2SO4. Випаровування розчинника дало білу твечин гідропероксиду (1мл) і суміш перемішували рду речовину, яку очищали кристалізацією з ефіру. 1год. При 0°С додавали 15мл 10% NaНСО3 і суміш + МС (ES 405). перемішували ще 15 хвилин. Потім суміш екстраПриклад 52 гували три рази СН2Сl2 і органічний шар промива8-(5-гідрокси-9-оксабіцикло[3.3.1]нон-1-іл)-1,3ли водою. Випаровування розчинника дало 4-(2,6дипропіл-3,7-дигідропурин-2,6-діон діоксо-1,3-дипропіл-2,3,6,7-тетрагідро-1Н-пурин-81,3-дипропіл-7-піролідин-1-ілметил-3,7іл)біцикло[2.2.2]-окт-1-иловий ефір складного дидигідропурин-2,6-діон (638мг) розчиняли в сухому бензилового ефіру фосфорної кислоти у вигляді ТГФ (10мл) при -78°С. Повільно додавали nBuLi жовтого масла, яке очищали колонковою хромато(0,88мл, 2,5Μ в гексані). Реакційна суміш ставала графією. Фракції, що містять 4-(2,6-діоксо-1,3оранжевою і її перемішували 30хв. при -78°С. Цикдипропіл-2,3,6,7-тетрагідро-1Н-пурин-8лооктан-1,5-діон (280мг) розчиняли в 3мл сухого іл)біцикло[2.2.2]окт-1-иловий ефір дибензилового ТГФ і додавали до реакційної суміші. Перемішуваефіру фосфорної кислоти об'єднували і концентли при -78°С протягом 30хв., повільно нагрівали рували у вакуумі з одержанням 280мг продукту. до кімнатної температури і перемішували протяМС (М+1) 621. гом ночі. Реакційну суміш зупиняли насиченим 4-(2,6-діоксо-1,3-дипропіл-2,3,6,7-тетрагідроводним розчином NH4C1 і екстрагували етилаце1Н-пурин-8-іл)біцикло[2.2.2]окт-1-иловий ефір дитатом (3x50мл). Об'єднаний органічний шар пробензилового ефіру фосфорної кислоти розчиняли мивали 1н. НСl, водою і насиченим сольовим розв суміші 15мл метанолу і 10мл ТГФ і до суміші дочином. Сушили над безводним Na2SO4 і давали Pd/C (10%, 50мг). Проводили гідрування концентрували. Неочищений продукт очищали на при 50 фунтах на квадратний дюйм (3,5кг/см2) колонці з силікагелем, елююючи сумішшю (1:1) протягом 8год. Відфільтровували Pd/C і випаровуетилацетат:гексан. МС (ES+ 377). вали розчинник. Залишок перекристалізовували з Приклад 53 суміші метанолу і етилацетату з одержанням 5-(2,6-діоксо-1,3-дипропіл-2,3,6,7-тетрагідро190мг вказаної в заголовку сполуки (вихід 86%). 1Н-пурин-8-іл)-8-оксабіцикло[3.2.1]октан-2МС (М+1) 441. карбонова кислота Приклад 55 Стадія 1: Слідували методиці прикладу 51, 3-[4-(2,6-Діоксо-1,3-дипропіл-2,3,6,7стадія 1. Замість циклоокт-4-енону використали тетрагідро-1Н-пурин-8-іл)біцикло[2.2.2]окт-1+ циклогепт-4-енон. МС (ES 347). іл]пропіонілоксиметиловий ефір 4-хлор-2-[(фуранСтадія 2: 8-(1Тідроксициклогепт-4-еніл)-1,32-ілметил)аміно]-5-сульфамоїлбензойної кислоти дипропіл-3,7-дигідропурин-2,6-діон (50мг) розчиСуміш 3-[5-(2,6-діоксо-1,3-дипропіл-2,3,6,7няли в 10мл МеОН при кімнатній температурі. Чететрагідро-1Н-пурин-8-іл)біцикло[2.2.2]окт-1рез МеОН барботували моноксид вуглецю протяіл]пропіононової кислоти (208мг, 0,5ммоль), бікаргом 10хв. Додавали PdCl2 (25мг), СuСl2 (58мг) і CO бонату натрію (168мг, 2ммоль) і тетра-нбарботували 3год. Перемішували при кімнатній бутиламонійгідросульфату (17мг, 0,05ммоль) у 55 77391 56 воді (5мл) і дихлорметані (5мл) інтенсивно перевідповідно. ТГФ видаляли у вакуумі і залишок мішували при 0°С. Через 10хв. до реакційної суміочищали колонковою хроматографією з подальші додавали розчин хлорметилхлорсульфату в шим зняттям захисту в (CH2CI2/TFA), одержуючи дихлорметані (1мл), давали їй можливість досяггідразид 3-[4-(2,6-діоксо-1,3-дипропіл-2,3,6,7нути температури навколишнього середовища і тетрагідро-1Н-пурин-8-іл)біцикло[2.2.2]окт-1-іл] продовжували інтенсивно перемішувати. Через 2 пропіонової кислоти у вигляді солі TFA. МС (М+1) години органічний шар відділяли і промивали на431. сиченим сольовим розчином. Органічні екстракти Одержану сіль TFA підлужували триетиламісушили над сульфатом натрію. Потім видаляли у ном, використовуючи таку ж методику зі змішаним вакуумі розчинник і залишок очищали колонковою ангідридом, як при описаній вище взаємодії з 1хроматографією на SiO2 з використанням суміші трет-бутиловим ефіром 2-трет(1:5) етил/гексан як елюенту, одержуючи (200мг, бутоксикарбоніламінопентандіової кислоти, з повихід 86%) хлорметиловий ефір 3-[4-(2,6-діоксодальшими колонковою хроматографією, зняттям 1,3-дипропіл-2,3,6,7-тетрагідро-1Н-пурин-8захисту в СН2Сl2/TFA, препаративною ВЕРХ з іл)біцикло[2.2.2]окт-1-іл]пропіонової кислоти. МС одержанням вказаної в заголовку сполуки у вигля(М+1) 465. ді солі TFA. МС (М+1) 599. До розчину 4-хлор-2-[(фуран-2-ілметил)аміно]Приклад 58 5-сульфамоїлбензойної кислоти (142,5мг, [3-(2,6-Діоксо-1,3-дипропіл-2,3,6,7-тетрагідро0,43ммоль) в ДМФ (3мл) додавали триетиламін 1Н-пурин-8-ілметил)адамантан-1-іл]оцтова кисло(10мг, 0,95ммоль) і суміш перемішували 1год. До та реакційної суміші додавали одержаний хлорметиСлідували методиці прикладу 45 з викорисловий ефір (200мг, 0,43ммоль) і Nal (130мг, танням (3-метоксикарбонілметиладамантан-10,86ммоль). Реакцію залишали протікати при кіміл)оцтової кислоти замість монометилового ефіру натній температурі протягом ночі. Реакційну суміш біцикло[3.3.1]нонан-1,5-дикарбонової кислоти. МС концентрували у вакуумі. Залишок розподіляли (ES+ 443). між етилацетатом і водою. Органічний шар концеПриклад 59 нтрували і очищали колонковою хроматографією з 4-(2,6-Діоксо-1,3-дипропіл-2,3,6,7-тетрагідроодержанням вказаної в заголовку сполуки (190мг, 1Н-пурин-8-іл)кубан-1-карбонова кислота вихід 58%) у вигляді твердої білої речовини. МС До розчину метилового ефіру 4-(6-аміно-2,4(М+1) 759. діоксо-1,3-дипропіл-1,2,3,4-тетрагідропіримідин-5Приклад 56 ілкарбамоїл)кубан-1-карбонової кислоти (400мг, Трифторацетат 1-карбокси-3-{3-[4-(2,6-діоксо0,966ммоль) в МеОН (20мл) додавали 4мл 20% 1,3-дипропіл-2,3,6,7-тетрагідро-1Н-пурин-8-іл) біводного розчину NaOH і одержану каламутну суцикло[2.2.2] окт-1міш кип'ятили із зворотним холодильником протяіл]пропіонілоксиметоксикарбоніл}пропіламонію гом ночі (12год.). Холодну реакційну суміш конценСлідуючи методиці прикладу 54, одержували трували у вакуумі, розбавляли декількома 5-{3-[4-(2,6-діоксо-1,3-дипропіл-2,3,6,7-тетрагідродрібними шматочками льоду і підкисляли додан1Н-пурин-8-іл)біцикло-[2.2.2]окт-1ням по краплях концентрованої НСI. Одержаний іл]пропіонілоксиметил}ефір 1-трет-бутилового білий осадок збирали, сушили і промивали ефіром ефіру 2-трет-бутоксикарбоніламінопентандіової з одержанням білої твердої речовини (280мг, кислоти, використовуючи 1-трет-бутиловий ефір 276%). 1Н ЯМР (400МГц, ДМСО-d6) 1,05 (співпатрет-бутоксикарбоніламінопентандіової кислоти, даючий т, 6Н), 1,70 (м, 2Н), 1,83 (м, 2Н), 3,99 (м, хлорметиловий ефір 3-[4-(2,6-діоксо-1,3-дипропіл2Н), 4,08 (м, 2Н), 4,27 (м, 3Н), 4,38 (м, 3Н). МС: 383 2,3,6,7-тетрагідро-1Н-пурин-8-іл)біцикло[2.2.2]окт(МН+). 1-іл] пропіонової кислоти, триетиламін і Nal в ДМФ. Приклад 60 Знявши захист в СН2Сl2/TFA (50/50) при кімна8-(1-Гідроксиметилкубан-4-іл)-1,3-дипропілтній температурі протягом 8 год., очищали препа3,7-дигідропурин-2,6-діон ративною ВЕРХ з одержанням вказаної в заголовДо суспензії, що перемішується 4-(2,6-діоксоку сполуки у вигляді солі TFA (вихід 20%). МС 1,3-дипропіл-2,3,6,7-тетрагідро-1Н-пурин-8(М+1) 576. іл)кубан-1-карбонової кислоти (100мг, 0,261ммоль) Приклад 57 і HATU (1,1екв., 0,288ммоль, 110мг) в 6мл MeCN Трифторацетат 1-карбокси-3-(N'-{3-[4-(2,6додавали акуратно за допомогою шприца основу діоксо-1,3-дипропіл-2,3,6,7-тетрагідро-1Н-пурин-6Х'юніга (Hunig) (1,1екв., 0,288ммоль, 37мг). Одеріл) біцикло[2.2.2]окт-1жану гетерогенну суміш перемішували 3год. і доіл]пропіонил}гідразинокарбоніл)пропіламонію давали однією порцією NaBH4 (2екв., 0,522ммоль, До суміші 3-[4-(2,6-діоксо-1,3-дипропіл-2,3,6,720мг). Суміш перемішували ще 2год., охолоджуватетрагідро-1Н-пурин-8-іл)біцикло[2.2.2]окт-1ли за допомогою бані з льодом і підкисляли доіл]пропіонової кислоти (приклад 18) (208мг, данням по краплях концентрованої НСl. Одержа0,5ммоль) в ТГФ (15мл) додавали Nний блідо-жовтий осадок збирали, сушили і знову метилморфолін (56мг, 0,55ммоль) і ізобутилхлорсуспендували в MeCN. Після перемішування проформіат (75мг, 0,55ммоль) і суміш перемішували тягом ночі, продукт збирали і сушили з одержан1год. Додавали до реакційної суміші третням не зовсім білого порошку (50мг, 52%). МС: 369 бутиловий ефір гідразинкарбонової кислоти (МН+). (100мг, 0,75ммоль). Реакцію залишали протікати Приклад 61 протягом 2год. Реакційну суміш промивали 4-(7-Бензил-2,6-діоксо-1,3-дипропіл-2,3,6,7NaHSO3, NaHCO4 і насиченим сольовим розчином, тетрагідро-1Н-пурин-8-іл)біцикло[2.2.2]октан-1 57 77391 58 карбонова кислота іл]пропіонітрил До розчину метилового ефіру, що перемішуРозчин 3-[4-(2,6-діоксо-1,3-дипропіл-2,3,6,7ється 4-[(6-аміно-2,4-діоксо-1,3-дипропіл-1,2,3,4тетрагідро-1Н-пурин-8-іл)біцикло[2.2.2]окт-1тетрагідропіримідин-5іл]акрилонітрилу (110мг, 0,278ммоль) в МеОН іл)бензилкарбамоїл]біцикло[2.2.2]октан-1(20мл) і СН2Сl2 (5мл) гідрували з використанням карбонової кислоти (430мг, 0,843ммоль) в ізоРrOН Pd на вуглеці (10мол.%) і до перехідника з матово(20мл) додавали 2н. КОН (4,0екв., 3,37ммоль, го скла з 3-ходовим запірним краном приєднували 1,7мл) і одержану суміш кип'ятили із зворотним балон з воднем. Після перемішування протягом холодильником протягом 26год. Холодну реакційночі, суміш дегазували, фільтрували через целіт і ну суміш концентрували у вакуумі з одержанням концентрували у вакуумі з одержанням крихкої напівтвердого залишку, який розбавляли водою і піноподібної речовини (100мг, 90%). 1Н ЯМР екстрагували СНСІ3. Водну фазу підкисляли кон(400МГц, CDCl3) 0,93 (суміщені триплети, 6Н), центрованою НСI з одержанням білого осадка, 1,53 (м, 6Н), 1,57 (т, 2Η), 1,67 (м, 2Н), 1,77 (м, 2Η), який збирали і сушили (381мг, 91%). МС: 479 2,00 (м, 6Н), 2,24 (т, 2Η), 3,99 (т, 2Η), 4,05 (т, 2Η), (МН+). 12,17 (с, 1Н). Приклад 62 Аналогічним чином були одержані наступні 4-(2,6-діоксо-1,3-дипропіл-2,3,6,7-теотрагідросполуки: 1Н-пурин-8-іл)біцикло[2.2.2]октан-1Приклад 64а: 4-[4-(2,6-діоксо-1,3-дипропілкарбальдегідоксим 2,3,6,7-тетрагідро-1Н-пурин-8-іл)біцикло[2.2.2]октДо розчину, що перемішується 4-(2,6-діоксо1-іл]масляної кислоти метиловий ефір, МС: 445 1,3-дипропіл-2,3,6,7-тетрагідро-1Н-пурин-8(МН+); іл)біцикло[2.2.2]октан-1-карбальдегіду (1,6г, Приклад 64b: {2-[4-(2,6-діоксо-1,3-дипропіл4,3ммоль) в МеОН (30мл) додавали гідроксиламін2,3,6,7-тетрагідро-1Н-пурин-8-іл)біцикло[2.2.2]октгідрохлорид (1,2екв., 5,16ммоль, 356мг) і розчин 1-іл]етил}фосфонової кислоти діетиловий ефір, NaOAc (тригідрат, 1,5екв., 6,45ммоль, 890мг) у МС: 509 (МН+). воді (10мл). Одержану суміш перемішували при Приклад 65 кімнатній температурі протягом ночі. Суміш конце4-(2,6-діоксо-1,3-дипропіл-2,3,6,9-тетрагідронтрували у вакуумі і твердий залишок суспендува1Н-пурин-8-іл)біцикло[2.2.2]октан-1-карбонітрил ли у воді (15мл), збирали, промивали водою і суДо суспензії, що перемішується 4-(2,6-діоксошили з одержанням білого порошку (1,4г, 84%). 1,3-дипропіл-2,3,6,9-тетрагідро-1Н-пурин-8Даний спосіб використали також, щоб одержати: іл)біцикло[2.2.2]октан-1-карбальдегідоксиму Приклад 62а: [4-(2,6-діоксо-1,3-дипропіл(400мг, 1,03ммоль) в CDCl3 (20мл), що охолоджу2,3,6,9-тетрагідро-1Н-пурин-8-іл)біцикло[2.2.2]октється за допомогою бані з льодом, додавали РО1-іл]ацетальдегідоксим. МС: 404 (МН+). СІ3 (нерозбавлений, 1,5екв., 237мг) і одержаній Приклад 63 суміші давали досягнути температури навколиш3-[4-(2,6-Діоксо-1,3-дипропіл-2,3,6,7нього середовища протягом ночі (17год.). Реакційтетрагідро-1Н-пурин-8-іл)біцикло[2.2.2]окт-1ну суміш вливали у воду, розділяли фази і органііл]акрилонітрил чну фазу промивали насиченим водним розчином До суспензії, що перемішується 4-(2,6-діоксоNaHCO3, сушили над Na2SO4, фільтрували і кон1,3-дипротл-2,3,6,7-тетрагідро-1Н-пурин-8центрували у вакуумі з одержанням білої крихкої іл)біцикло[2.2.2]октан-1-карбальдегіду (535мг, піноподібної речовини (360мг, 95%). МС: 370 1,44ммоль) і (ціанме(МН+). тил)трифенілфосфонійхлориду (1,2екв., Приклад 66 1,73ммоль, 582мг) в ТГФ (30мл) при 0°С додавали [4-(2,6-діоксо-1,3-дилропіл-2,3,6,9-тетрагідроKHMDS (0,5Μ в толуолі, 2,2екв., 3,16ммоль, 1Н-пурин-8-іл) біцикло[2.2.2]окт-1-іл]ацетальдегід 6,3мл). Одержану суміш перемішували 1,5год. при До суспензії, що перемішується метоксиметивказаній температурі, після чого нагрівали при лтрифенілфосфонійхлориду (1,1г, 3,2ммоль) в 55°С протягом 5год. Холодну реакційну суміш розТГФ (60мл) при -78°С додавали розчин KHMDS поділяли між EtOAc (10мл) і насиченим водним (0,5Μ в толуолі, 10мл, 5ммоль). Одержану жовту розчином NH4CI (20мл) і водну фазу екстрагували суміш перемішували при вказаній температурі EtOAc (20мл). Об'єднані органічні шари промивали 1,5год. і додавали за 20 хвилин розчин 4-(2,6насиченим водним розчином NaCl (2x20мл), сушидіоксо-1,3-дипропіл-2,3,6,9-тетрагідро-1Н-пурин-8ли (MgSO4), фільтрували і випаровували з одеріл)біцикло[2.2.2]октан-1-карбальдегіду (372мг, жанням твердого залишку, який очищали радіаль1,0ммоль) в ТГФ (12мл). Суміш витримували при ною хроматографією (2мм пластинка) з 78°С 6год. і давали їй досягнути температури навикористанням 5% МеОН в СН2Сl2 як елюенту, вколишнього середовища протягом ночі (12год.). одержуючи 425мг (75%) крихкої піноподібної речоРеакційну суміш розподіляли між насиченим водвини (суміш цис/транс ізомерів). МС: 396 (МЕ+). ним розчином NH4Cl (100мл) і EtOAc (100мл) і воДаний спосіб використали, щоб синтезувати: дну фазу екстрагували EtOAc (50мл). Об'єднані Приклад 63а: {2-[4-(2,6-діоксо-1,3-дипропілорганічні фази промивали насиченим водним роз2,3,6,7-тетрагідро-1Н-пурин-8-іл)біцикло[2.2.2]октчином NaCl (100мл), концентрували у вакуумі, зно1-іл]вініл}фосфонової кислоти діетиловий ефір. ву розчиняли в ТГФ і концентрували до об'єму МС: 507 (МН+). приблизно 20мл. До розчину додавали рівний Приклад 64 об'єм 1н. НСl і суміш перемішували протягом ночі. 3-[4-(2,6-діоксо-1,3-дипропіл-2,3,6,7Суміш розбавляли EtOAc (20мл), водну фазу відтетрагідро-1Н-пурин-8-іл)біцикло[2.2.2]окт-1діляли і екстрагували EtOAc (10мл). Об'єднані ор 59 77391 60 ганічні фази промивали насиченим водним розчиПриклад 69а: 8-[4-(2ном NaCl (2x25мл), сушили (MgSO4), фільтрували і Гідроксіетіл)біцикло[2.2.2]окт-1-іл]-1,3-дипропілконцентрували у вакуумі. Одержане оранжеве ма3,9-дигідропурин-2,6-діон. МС: 389 (МН+). сло очищали порціями радіально, хроматографією Приклад 70 (2мм пластинка) з використанням 3% МеОН і 3% 3-[4-(2,6-Діоксо-1,3-дипропіл-2,3,6,7ТГФ в СН2Сl2 як елюенту. Фракції, що містили протетрагідро-1Н-пурин-8-іл)біцикло[2.2.2]окт-1дукт, об'єднували і концентрували, одержуючи іл]пропіонамід 290мг (75%) білої твердої речовини. МС: 387 До розчину 3-[4-(2,6-діоксо-1,3-дипропіл(МН+). 2,3,6,7-тетрагідро-1Н-пурин-8-іл)біцикло[2.2.2]октПриклад 67 1-іл]пропіонової кислоти (510мг, 1,22ммоль) і [4-(2,6-діоксо-1,3-дипропіл-2,3,6,9-тетрагідроHATU (1,1екв., 1,34ммоль, 511мг) в ДМФ (10мл) 1Н-пурин-8-іл) біцикло[2.2.2]окт-1-іл]оцтова кисдодавали основу Хюніга (1,3екв., 1,60ммоль, лота 205мг). Після перемішування одержаної суспензії До розчину [4-(2,6-діоксо-1,3-дипропіл-2,3,6,9протягом 1год., додавали надмірний аміак (0,5Μ в тетрагідро-1Н-пурин-8-іл)біцикло[2.2.2]окт-1діоксані, 4,0мл) і суміш перемішували протягом іл]ацетальдегіду (170мг, 0,440ммоль) в трет-ВuОН ночі (14год.), видаляли у вакуумі розчинник і оде(10мл) і 2-метил-2-бутену (10екв., 4,4ммоль, ржаний залишок розподіляли між СН2Сl2 (10мл) і 470мкл), що охолоджується за допомогою бані з 1н. НСl (10мл) з допомогою 2мл МеОН для сприльодом, додавали NaClO2 (1,5екв., 0,66ммоль). яння перенесенню речовини і поліпшення розчинОдержаному жовтому розчину давали досягнути ності. Водну фазу екстрагували СН2Сl2 (2x10мл), температури навколишнього середовища за об'єднані органічні фази промивали 1н. НСl 14год., після чого концентрували його у вакуумі. (2x10мл), сушили (MgSO4), фільтрували і випароОдержаний маслянистий залишок розподіляли між вували у вакуумі з одержанням не зовсім білої водою (10мл) і СН2Сl2 (10мл). Водну фазу підкиствердої речовини (455мг, 90%). МС: 416 (МН+). ляли доданням по краплях концентрованої НСl і Даний спосіб використали, щоб синтезувати одержаний осадок збирали, промивали водою і наступні сполуки: сушили з одержанням 105мг (59%) білого порошку. Приклад 70а: 3-[4-(2,6-діоксо-1,3-дипропіл1 2,3,6,7-тетрагідро-1Н-пурин-8-іл)біцикло[2.2.2]октН ЯМР (400МГц, CDCl3) 0,91 (т, 3Н), 0,93 (т, 3Н), 1-іл]-N-(1Н-тетразол-5-іл)пропіонамід, МС: 484 1,63 (м, 2Н), 1,77 (м, 2Н, не повністю ясний), 1,82 (МН+); (м, 6Н), 2,01 (м, 6Н), 2,32 (с, 2Н), 3,95 (м, 2HJ, 4,07 Приклад 70b: N-(2-Ціанетил)-3-[4-(2,6-діоксо(м, 2Н), 12,74 (с, 1Н).) 1,3-дипропіл-253,6,7-тетрагідро-1Н-пурин-8Приклад 68 іл)біцикло[2.2.2]окт-1-іл]пропіонамід, МС: 469 Моноетиловий ефір {2-[4-(2,6-діоксо-1,3(МН+); дипропіл-2,3,6,7-тетрагідро-1Н-пурин--8Приклад 70с: 2-{[4-(2,6-діоксо-1,3-дипропіліл)біцикло[2.2.2]окт-1-іл]етил}фосфонової кислоти 2,3,6,7-тетрагідро-1Н-пурин-8Розчиняли діетиловий ефір {2-[4-(2,6-діоксоіл)біцикло[2.2.2]октан-1-карбоніл]аміно}-31,3-дипропіл-2,3,6,7-тетрагідро-1Н-пурин-8гідроксимасляної кислоти метиловий ефір, МС: іл)біцикло[2.2.2]окт-1-іл] етил}фосфонової кислоти 504 (МН+); (30мг, 59мкмоль) в 1н. NaOH (4мл) і розчин нагріПриклад 70d: 2-{[4-(2,6-діоксо-1,3-дипропілвали при 80°С протягом 3год. Суміші давали вихо2,3,6,7-тетрагідро-1Н-пурин-8лонути до кімнатної температури і повільно підкиіл)біцикло[2.2.2]октан-1-карбоніл]аміно}-3сляли її концентрованою НСl. Одержаний осадок гідроксипропіонової кислоти метиловий ефір, МС: збирали і сушили (22мг, 79%). 1Н ЯМР (400МГц, 480 (МН+). CDCl3) 0,93 (суміщені триплети, 6Н), 1,31 (т, 3Н), Приклад 71 1,48 (м, 8Н), 1,70 (ш.м, 6Н), 1,95 (м, 6Н), 3,95 (т, {2-[4-(2,6-діоксо-1,3-дипропіл-2,3,6,72Н), 4,07 (т, 2Н), 12,2 (ш.с, 1Н). тетрагідро-1Н-пурин-8-іл)біцикло[2.2.2]окт-1Приклад 69 іл]етил}фосфонова кислота 8-[4-(3-Гідроксипропіл)біцикло[2.2.2]окт-1-іл]До розчину діетилового ефіру {2-[4-(2,6-діоксо1,3-дипропіл-3,7-дигідропурин-2,6-діон 1,3-дипропіл-2,3,6,7-тетрагідро-1Н-пурин-8До розчину 3-[4-(2,6-діоксо-1,3-дипропіліл)біцикло[2.2.2]окт-1-іл]етил}фосфонової кислоти 2,3,6,7-тетрагідро-1Н-пурин-8-іл)біцикло[2.2.2]окт(30мг, 59мкмоль) в СН2СI2 (8мл) додавали TMSBr 1-іл]пропіонової кислоти (417мг, 1,0ммоль) в ТГФ (надмірний) і одержану суміш перемішували при (25мл), охолодженому до 0°С за допомогою бані з кімнатній температурі протягом ночі. Додавали льодом, додавали ВН3 (1,0Μ в ТГФ, 3,0ммоль). додатковий TMSBr і реакційну суміш нагрівали при Одержаній суміші давали досягнути температури 55°С протягом 6год. Розчинник видаляли у вакуумі навколишнього середовища і перемішували протяз одержанням оранжевої твердої речовини, яка гом 60год. Після додання МеОН (10мл) суміш конзнебарвлювалася при розтиранні з водою. Процентрували у вакуумі з одержанням білої твердої дукт збирали, промивали водою і сушили (20мг, речовини, яку розчиняли в МеОН (20мл), перемі+ 77%). МС: 453 (МН ). шували при кімнатній температурі протягом 2год. і Приклад 72 випаровували досуху у вакуумі. Одержану білу 3-(5-{2-[4-(2,6-діоксо-1,3-дипропіл-2,3,6,7тверду речовину перекристалізовували з EtOAc з тетрагідро-1Н-пурин-8-іл)біцикло[2.2.2]окт-1одержанням 345мг (86%) білого порошку. МС: 403 іл]етил}тетразол-1-іл)-пропіонітрил (МН+). Розчин N-(2-ціанетил)-3-[4-(2,6-діоксо-1,3Даний спосіб також використали, щоб одердипропіл-2,3,6,7-тетрагідро-1Н-пурин-8жати:
ДивитисяДодаткова інформація
Назва патенту англійськоюPolycycloalkylpurines as antagonists of adenosine receptors
Автори англійськоюKumaravel, Gnanasambandam, Petter Russell C.
Назва патенту російськоюПолициклоалкилпурины в качестве антагонистов аденозиновых рецепторов
Автори російськоюПеттер Расселл К.
МПК / Мітки
МПК: A61K 31/522, A61P 3/10, A61P 25/24, A61P 9/04, A61P 9/10, A61P 25/16, C07D 473/06, A61K 31/662, A61P 11/00, A61P 13/12, A61P 7/10, C07D 473/22, A61P 1/16, A61P 11/06, A61P 9/02, A61P 11/16, A61P 17/02, A61P 9/00, C07D 519/00, A61K 31/661, A61P 25/28, A61P 3/00
Мітки: поліциклоалкілпурини, антагоністи, рецепторів, аденозинових
Код посилання
<a href="https://ua.patents.su/48-77391-policikloalkilpurini-yak-antagonisti-adenozinovikh-receptoriv.html" target="_blank" rel="follow" title="База патентів України">Поліциклоалкілпурини як антагоністи аденозинових рецепторів</a>
Попередній патент: Розчин для очищення офсетних друкарських форм
Наступний патент: Вхідний пристрій схеми порівняння струмів
Випадковий патент: Пристрій для очищення рідини в електричному полі












