N-ацильні похідні амінокислот, спосіб їх одержання, фармацевтична композиція і їх застосування як протиалергічних, протизапальних і гіполіпідемічних засобів
Номер патенту: 94586
Опубліковано: 25.05.2011
Автори: Нєбольсін Владімір Євгєньєвіч, Желтухіна Галіна Алєксандровна, Ковальова Віолєтта Лєонідовна, Кромова Татьяна Алєксандровна
Формула / Реферат
1. N-ацильні похідні амінокислот загальної формули (І)
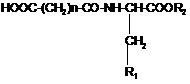 , (І)
, (І)
де n дорівнює 2 або 3; і
R1 являє собою
 або
або 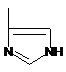 ,
,
R2=Н, -СН3, -С2Н5,
і їх фармацевтично прийнятні солі,
за умови, що сполука загальної формули (І) не є N![]() -сукциніл-L-гістидином, сукциніл-L-триптофаном, сукциніл-D-триптофаном і сукциніл-D,L-триптофаном і його дикалієвою сіллю, N
-сукциніл-L-гістидином, сукциніл-L-триптофаном, сукциніл-D-триптофаном і сукциніл-D,L-триптофаном і його дикалієвою сіллю, N![]() -сукциніл-L-триптофану метиловим ефіром, N
-сукциніл-L-триптофану метиловим ефіром, N![]() -глутарил-L-гістидину метиловим ефіром, N
-глутарил-L-гістидину метиловим ефіром, N![]() -глутарил-L-триптофану метиловим ефіром, N
-глутарил-L-триптофану метиловим ефіром, N![]() -глутарил-D-триптофану метиловим ефіром.
-глутарил-D-триптофану метиловим ефіром.
2. Сполука за п. 1, де фармацевтично прийнятна сіль являє собою моно- або динатрієву сіль.
3. Спосіб одержання N-ацильних похідних амінокислот загальної формули (І)
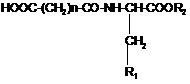 , (І)
, (І)
де n дорівнює 2 або 3; і
R1 являє собою
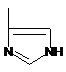 ,
,
R2=H,
або їх фармацевтично прийнятних солей, що включає додавання ангідриду глутарової або бурштинової кислоти у вигляді твердої речовини до водного розчину амінокислоти загальної формули:
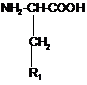
або її солі, де R1 являє собою
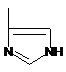 ,
,
і, необов'язково, перетворення цільового продукту в його сіль.
4. Спосіб одержання N-ацильних похідних амінокислот загальної формули (І)
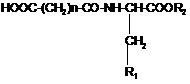 , (І)
, (І)
де n дорівнює 2 або 3; і
R1 являє собою
 або
або 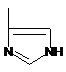 ,
,
або їх солей, що включає проведення реакції у двофазовій системі ангідриду глутарової або бурштинової кислоти в органічному розчиннику, що не змішується з водою, з водним або водно-органічним розчином амінокислоти загальної формули:
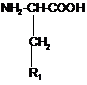
або її солі, або
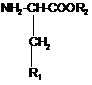 ,
,
де R2 являє собою -СН3, -С2Н5,
a R1 являє собою
 або
або 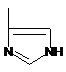 ,
,
і, необов'язково, перетворення цільового продукту в його сіль.
5. Фармацевтична композиція, яка має протиалергічну, антианафілактичну, протизапальну і гіполіпідемічну активність, що включає N-ацильні похідні амінокислот загальної формули (І) за пунктом 1 або їх фармацевтично прийнятні солі в ефективній кількості і фармацевтично прийнятні домішки.
6. Фармацевтична композиція, яка має здатність регулювати вміст еозинофілів, нейтрофілів і лімфоцитів, яка включає N-ацильні похідні амінокислот загальної формули (І) за пунктом 1 або їх фармацевтично прийнятні солі в ефективній кількості і фармацевтично прийнятні добавки.
7. Застосування N-ацильних похідних амінокислот загальної формули (І), визначених в пункті 1, або їх фармацевтично прийнятних солей для одержання лікарського засобу, що має протиалергічну, антианафілактичну, протизапальну і гіполіпідемічну активність.
8. Застосування N-ацильних похідних амінокислот, визначених в п. 1, для одержання лікарського засобу для зниження антигензалежної секреції гістаміну, дегрануляції базофілів, а також регулювання вмісту еозинофілів, нейтрофілів і лімфоцитів.
9. Застосування N-ацильних похідних амінокислот, визначених в п. 1, для одержання лікарського засобу для полегшення симптомів бронхіальної астми, псоріазу, атеросклерозу, ожиріння, ішемічної хвороби серця і головного мозку, інфаркту міокарда, інсульту.
10. Застосування N-ацильних похідних амінокислот загальної формули (І)
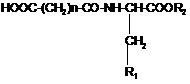 , (І)
, (І)
де n дорівнює 2 або 3;
і R1 являє собою
 або
або 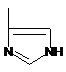 ,
,
R2=Н, -СН3, -С2Н5,
або їх фармацевтично прийнятних солей для одержання лікарського засобу для полегшення симптомів алергічного риніту, полінозів, сезонного і цілорічного риніту, алергічного запалення легень, атопічного дерматиту, кропивниці, алергічних (у тому числі анафілактичних) реакцій на укуси комах і лікарські препарати, холодової алергії, алергічного кон'юнктивіту.
11. Лікарський засіб, який має протиалергічну, антианафілактичну, протизапальну і гіполіпідемічну активність, що містить N-ацильні похідні амінокислот загальної формули (І) за пунктом 1 або їх фармацевтично прийнятні солі.
12. Спосіб лікування алергічних, анафілактичних захворювань, у тому числі захворювань, які супроводжуються запаленням, гіперліпідемією, гіперхолестеринемією, що включає введення ссавцю ефективної кількості сполуки загальної формули (І) за пунктом 1 або її фармацевтично прийнятної солі.
13. Спосіб за п. 12 лікування бронхіальної астми, атеросклерозу, ожиріння, ішемічної хвороби серця і головного мозку, інфаркту міокарда, інсульту.
14. Спосіб лікування алергічного риніту, полінозів, сезонного і цілорічного риніту, алергічного запалення легень, атопічного дерматиту, кропивниці, алергічних (у тому числі анафілактичних) реакцій на укуси комах і лікарські препарати, холодової алергії, алергічного кон'юнктивіту, що включає введення ссавцю ефективної кількості сполуки загальної формули (І)
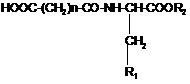 , (І)
, (І)
де n дорівнює 2 або 3;
і R1 являє собою
 або
або 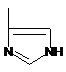 ,
,
R2=Н, -СН3, -С2Н5,
або її фармацевтично прийнятної солі.
Текст
1. N-ацильні похідні амінокислот загальної формули (І) HOOC-(CH2)n-CO-NH-CH-COOR2 R1 94586 CH2 , (І) N NH або , R2=Н, -СН3, -С2Н5, і їх фармацевтично прийнятні солі, за умови, що сполука загальної формули (І) не є N H N -сукциніл-L-гістидином, сукциніл-Lтриптофаном, сукциніл-D-триптофаном і сукцинілD,L-триптофаном і його дикалієвою сіллю, N сукциніл-L-триптофану метиловим ефіром, N глутарил-L-гістидину метиловим ефіром, N UA (11) де n дорівнює 2 або 3; і R1 являє собою (19) (21) a200800495 (22) 15.06.2006 (24) 25.05.2011 (86) PCT/RU2006/000311, 15.06.2006 (31) 2005118635 (32) 15.06.2005 (33) RU (46) 25.05.2011, Бюл.№ 10, 2011 р. (72) НЄБОЛЬСІН ВЛАДІМІР ЄВГЄНЬЄВІЧ, RU, КРОМОВА ТАТЬЯНА АЛЄКСАНДРОВНА, RU, ЖЕЛТУХІНА ГАЛІНА АЛЄКСАНДРОВНА, RU, КОВАЛЬОВА ВІОЛЄТТА ЛЄОНІДОВНА, RU (73) ОТКРИТОЄ АКЦИОНЄРНОЄ ОБЩЄСТВО "ОТЄЧЄСТВЄННИЄ ЛЄКАРСТВА", RU, НЄБОЛЬСІН ВЛАДІМІР ЄВГЄНЬЄВІЧ, RU (56) DATABASE CAPLUS [Online] RAIMONDI S. ET AL.: 'Glutaryl acylase: One reaction enzymes or versatile enantioselective biocatalysts', XP003005512 Retrieved from STN Database accession no. (2003:499950) & ADVANCED SYNTHESIS & CATALYSIS vol. 345, no. 6+7, 2003, pages 783 - 789 WO9901103 14.01.1999 ROSENKRANZ H.J. ET AL.: 'Synthese von Tuboflavin, 4-Athylcanthin-6-on und Canthin-6-on' JUSTUS LIEBIGS ANNALEN DER CHEMIE vol. 691, 1966, pages 159 - 164, XP008074615 GALENKO-YAROSHEVSKY P.A. ET AL.: 'Protivoaritmicheskaya aktivnost befola, sulfana, meksidola i T3-146 v sochetanii s nekotorymi antiaritmikami' BJULLETEN EXPERIMENTALNOI BIOLOGII I MEDITSINY vol. 125, no. 5, 1998, pages 544 - 547, XP008096952 -& GALENKOYAROSHEVSKII P.A. ET AL: 'Antiarrhythmic activity of befol, suphan, mexidol, and T3-146 in combination with some antiarrhythmics' BULLETIN OF EXPERIMENTAL BIOLOGY AND MEDICINE vol. 125, no. 5, 01 May 1998, pages 483 - 486, XP008096955 2 (13) 1 3 94586 глутарил-L-триптофану метиловим ефіром, N глутарил-D-триптофану метиловим ефіром. 2. Сполука за п. 1, де фармацевтично прийнятна сіль являє собою моно- або динатрієву сіль. 3. Спосіб одержання N-ацильних похідних амінокислот загальної формули (І) HOOC-(CH2)n-CO-NH-CH-COOR2 CH2 R1 , (І) , R2=H, або їх фармацевтично прийнятних солей, що включає додавання ангідриду глутарової або бурштинової кислоти у вигляді твердої речовини до водного розчину амінокислоти загальної формули: NH2-CH-COOH CH2 R1 або її солі, де R1 являє собою NH , і, необов'язково, перетворення цільового продукту в його сіль. 4. Спосіб одержання N-ацильних похідних амінокислот загальної формули (І) HOOC-(CH2)n-CO-NH-CH-COOR2 CH2 R1 , (І) де n дорівнює 2 або 3; і R1 являє собою N NH або , або їх солей, що включає проведення реакції у двофазовій системі ангідриду глутарової або бурштинової кислоти в органічному розчиннику, що не змішується з водою, з водним або водноорганічним розчином амінокислоти загальної формули: N H CH2 R1 або її солі, або NH2-CH-COOR2 R1 , де R2 являє собою -СН3, -С2Н5, a R1 являє собою NH N NH2-CH-COOH CH2 де n дорівнює 2 або 3; і R1 являє собою N 4 N NH або , і, необов'язково, перетворення цільового продукту в його сіль. 5. Фармацевтична композиція, яка має протиалергічну, антианафілактичну, протизапальну і гіполіпідемічну активність, що включає N-ацильні похідні амінокислот загальної формули (І) за пунктом 1 або їх фармацевтично прийнятні солі в ефективній кількості і фармацевтично прийнятні домішки. 6. Фармацевтична композиція, яка має здатність регулювати вміст еозинофілів, нейтрофілів і лімфоцитів, яка включає N-ацильні похідні амінокислот загальної формули (І) за пунктом 1 або їх фармацевтично прийнятні солі в ефективній кількості і фармацевтично прийнятні добавки. 7. Застосування N-ацильних похідних амінокислот загальної формули (І), визначених в пункті 1, або їх фармацевтично прийнятних солей для одержання лікарського засобу, що має протиалергічну, антианафілактичну, протизапальну і гіполіпідемічну активність. 8. Застосування N-ацильних похідних амінокислот, визначених в п. 1, для одержання лікарського засобу для зниження антигензалежної секреції гістаміну, дегрануляції базофілів, а також регулювання вмісту еозинофілів, нейтрофілів і лімфоцитів. 9. Застосування N-ацильних похідних амінокислот, визначених в п. 1, для одержання лікарського засобу для полегшення симптомів бронхіальної астми, псоріазу, атеросклерозу, ожиріння, ішемічної хвороби серця і головного мозку, інфаркту міокарда, інсульту. 10. Застосування N-ацильних похідних амінокислот загальної формули (І) HOOC-(CH2)n-CO-NH-CH-COOR2 N H CH2 R1 де n дорівнює 2 або 3; і R1 являє собою , (І) 5 N NH або , R2=Н, -СН3, -С2Н5, або їх фармацевтично прийнятних солей для одержання лікарського засобу для полегшення симптомів алергічного риніту, полінозів, сезонного і цілорічного риніту, алергічного запалення легень, атопічного дерматиту, кропивниці, алергічних (у тому числі анафілактичних) реакцій на укуси комах і лікарські препарати, холодової алергії, алергічного кон'юнктивіту. 11. Лікарський засіб, який має протиалергічну, антианафілактичну, протизапальну і гіполіпідемічну активність, що містить N-ацильні похідні амінокислот загальної формули (І) за пунктом 1 або їх фармацевтично прийнятні солі. 12. Спосіб лікування алергічних, анафілактичних захворювань, у тому числі захворювань, які супроводжуються запаленням, гіперліпідемією, гіперхолестеринемією, що включає введення ссавцю ефективної кількості сполуки загальної формули (І) за пунктом 1 або її фармацевтично прийнятної солі. N H Даний винахід стосується галузі біоорганічної хімії і стосується N-ацильних похідних амінокислот і їх фармацевтично прийнятних солей, нових способів синтезу зазначених сполук, а також фармацевтичних композицій на їх основі і застосування у медицині як протиалергічних, протизапальних і гіполіпідемічних засобів. Попередній рівень техніки Як відомо у наш час алергічні захворювання і порушення ліпідного обміну досить поширені, внаслідок поганої екологічної обстановки, зміни структури харчування і способу життя населення. Тому проблема створення лікарських засобів для боротьби з цими патологіями, а також з запальними процесами, які, як правило, супроводжують алергію, продовжує залишатися актуальною. Найпоширенішою групою протиалергічних препаратів є блокатори Н1-гістамінових рецепторів. У наш час виділяють 2 покоління антигістамінних препаратів [Машковський М. Д. Лікарські засоби./Москва: Нова хвиля. 2005. с.285]. Антигістамінні препарати 1-го покоління проникають через гематоенцефалічний бар'єр і здатні викликати блокаду Н1-рецепторів клітин центральної нервової системи, що обумовлює їх небажаний седативний ефект. Для досягнення вираженої антигістамінної дії необхідні високі концентрації цих препаратів у крові, що потребує призначення їх у більших дозах. Негативною характеристикою цих препаратів є досить частий розвиток тахіфілаксії, вплив на ЦНС, що проявляється у порушенні координації, запамороченні, почутті млявості, зниженні здатності концентрувати увагу. Незважаючи 94586 6 13. Спосіб за п. 12 лікування бронхіальної астми, атеросклерозу, ожиріння, ішемічної хвороби серця і головного мозку, інфаркту міокарда, інсульту. 14. Спосіб лікування алергічного риніту, полінозів, сезонного і цілорічного риніту, алергічного запалення легень, атопічного дерматиту, кропивниці, алергічних (у тому числі анафілактичних) реакцій на укуси комах і лікарські препарати, холодової алергії, алергічного кон'юнктивіту, що включає введення ссавцю ефективної кількості сполуки загальної формули (І) HOOC-(CH2)n-CO-NH-CH-COOR2 CH2 R1 , (І) де n дорівнює 2 або 3; і R1 являє собою N NH або , R2=Н, -СН3, -С2Н5, або її фармацевтично прийнятної солі. N H на вказане вище, антигістамінні засоби першого покоління як і раніше застосовуються, особливо у тих ситуаціях, коли необхідний дуже швидкий ефект від лікування, наприклад, при анафілаксії. До антигістамінних препаратів першого покоління належать димедрол (дифенгідрамін), супрастин (хлорпірамін), тавегіл (клемастин), фенкарол (хіфенадин). Антигістамінні препарати 2-го покоління одержали в останні роки широке застосування в алергологічній практиці, оскільки не мають побічних ефектів, властивих препаратам 1-го покоління. Зокрема, препарати 2-го покоління не проникають через гематоенцефалічний бар'єр, не мають седативного і снодійного ефектів. Для них характерна швидка і тривала антигістамінна дія. До антигістамінних засобів другого покоління належать: кларитин (лоратадин) зиртек (цетиризин), кестин (ебастин). Однак, проведені клінічні випробування виявили побічні дії і цих препаратів, обумовлені їх взаємодією з іншими лікарськими засобами або порушенням їх метаболізму цитохромом Ρ 450. Таким чином, були виявлені потенційно седативні (цетиризин, лоратадин) і потенційно кардіотоксичні (терфенадин, астемізол (ебастин)) ефекти в антигістамінних засобах 2-го покоління. У деяких випадках, наприклад, при бронхіальній астмі застосовують глюкокортикостероїди, які здійснюють потужну антиалергічну дію. Однак, їх застосування супроводжується системними проявами у вигляді синдрому Іценко-Кушинга, гіпертензії, гіперглікемії, остеопорозу та ін. [Машковський 7 М.Д. Лікарські засоби. /Медицина. Москва. 1993. т.1, с.565]. Особливе значення у розвитку алергічних захворювань має патохімічна стадія алергічних реакцій, яка у значній мірі визначається ступенем активації клітин-мішеней алергії 1-го порядку (базофілів і гладких клітин). Їх важливою особливістю є здатність до накопичення і вивільнення під дією стимулу (алергену) біологічно активних сполук, у першу чергу, гістаміну. При IgE- і/або IgGопосередкованій відповіді на антиген саме ці клітини визначають ступінь виразності клінічної картини негайної алергії [Паркер Ч.В./ Медіатори: вивільнення і функції.// У кн.: Імунологія. За редакцією У. Пола. М. Мир. 1989. т.З. с 170-247; Chakravarty N.K.// In: The mast cell: Its role in health and disease. ed. J. Pepys. 1979.p.38-46]. Існує група препаратів кромоглікат-натрію (динатрієва сіль кромогліцієвої кислоти), кетотифен, оксатомід, застосовуваних при бронхіальній астмі і бронхоспастичних станах, в основі дії яких лежить здатність гальмувати дегрануляцію гладких клітин і затримувати вивільнення з них медіатор них речовин, що сприяють розвитку бронхоспазму, алергії і запалення (брадикініну, гістаміну). Як побічні ефекти можуть спостерігатися подразнення слизових оболонок, головний біль, набряк гортані, кашель, ядуха [Машковський М.Д. Лікарські засоби. /Москва: Нова хвиля. 2005. с.297]. Відомо, що найбільш частим проявом атеросклерозу є ішемічна хвороба серця, яка знаходиться на першому місці у ряді причин смертності дорослого населення планети. Одним з переважних порушень при даному захворюванні визнане порушення ліпідного обміну, що виражається у підвищенні вмісту у плазмі крові холестерину, у тому числі у складі ліпопротеїнів низької (ЛПНЩ) і дуже низької щільності (ЛПДНЩ), що одержали назву "атерогенних", з одночасним зниженням кількості "антиатерогенних" ліпопротеїнів високої щільності (ЛПВЩ). Показано, що зміна вмісту і співвідношення ліпідів у плазмі відображає їх зміну у мембранних структурах паренхіматозних органів. Склад мембран клітини, наприклад, мікросомальних, прямо залежить від складу раціону експериментальних тварин [Wade Α., Harred W. // Feder. Proct. 1976. vol. 55. pp. 2475-2479]. Введення тваринам холестерину викликає накопичення його у мембранах клітин, зменшуючи його текучість, що, у свою чергу, приводить до зміни функціонального стану ферментів [Buters J.T.M., Zysset Т., Reichen J. //Biochem. Pharmacol. 1993. vol. 46. Iss 6. pp. 983991]. Гіполіпідемічні засоби, що знижують вміст холестерину і тригліцеридів у крові, можуть застосовуватися для лікування і профілактики захворювань, пов'язаних з порушеннями ліпідного обміну. Останні характеризуються підвищенням вмісту тригліцеридів, загального холестерину (ХС), холестерину у складі ліпопротеїнів низької і дуже низької щільності (ЛПНЩ і ЛПДНЩ) і зниженням вмісту холестерину у складі ліпопротеїнів високої щільності, при таких захворюваннях як атеросклероз, ожиріння, ішемічна хвороба серця і головного моз 94586 8 ку, інфаркт міокарда, інсульт, і які служать фактором ризику маніфестації цукрового діабету і тромбоутворення. Відомо клінічне застосування так званих статинів, інгібіторів біосинтезу холестерину, наприклад зокору (симвастатин). Препарати даної групи у дозах 80 мг/день досить ефективні, головним чином відносно зниження рівня загального холестерину у крові, при цьому малодоступні, дорогі і являють собою чужорідні для організму хімічні сполуки. Крім того, їх застосування може супроводжуватися побічними ефектами: зміною функцій печінки з підвищенням рівня трансаміназ у крові, диспепсією [Машковський М.Д. Лікарські засоби. /Медицина. Москва. 1993. т.1, с.463]. У зв'язку із зазначеним вище, актуальним є пошук нових ефективних протиалергічних і гіполіпідемічних засобів, з альтернативними механізмами дії, здатних проявляти активність у низьких концентраціях і позбавлених побічних ефектів. Щодо цього особливий інтерес представляють сполуки, які включають залишки речовин природного походження, оскільки для них можна прогнозувати більш низьку токсичність і частоту побічних ефектів. У публікації міжнародної заявки WO 99/01103 описана протиалергічна і гіполіпідемічна дія Nацильних похідних біогенних амінів, наприклад, глутамілгістаміну, і його найближчого аналога глутарилгістаміну, які найбільш близькі за структурою і дією до сполук, що заявляються. У статті Кржечковська В. В., Желтухіна Γ. Α., Небольсин В. Ε. та ін. Вивчення антианафілактичної активності і механізмів дії -L-глутамілгістаміну. //Патогенез. 2003. Т. 1. №2. с. 60-64 показано, що глутамілгістамін володіє вираженою антианафілактичною активністю при використанні різних видів тварин і способів введення. Одержані результати свідчать про те, що у гладких клітинах тварин під дією -глутамілгістаміну вірогідно знижується вміст гістаміну і його антиген-стимульована секреція. У тесті з дослідження впливу глутарилгістаміну на виразність індукованого бронхоспазму було показане зниження величини бронхоспазму більш ніж на 50% у порівнянні з контролем. Даний ефект проявлявся як при пероральному, так і інтратрахеальному способі його введення у низькій дозі - 50 мкг/кг. Глутарилгістамін має здатність знижувати прояви пасивної шкірної анафілаксії. У WO 99/01103 показано, що при введенні тваринам глутарилгістаміну у дозах 50 і 500 мкг/кг було продемонстровано вірогідне зниження інтенсивності гіперчутливості уповільненого типу. Крім того, глутарилгістамін у дозах 50 і 500 мкг/кг володів також деякою антихолестеринемімічною активністю, знижуючи вміст загального холестерину у порівнянні з тваринами з атерогенним навантаженням на 5-7%. Недоліком глутарилгістаміну є його порівняно висока вартість і мала доступність вихідної сировини для його одержання - гістаміну. Крім того, зазначена речовина недостатньо ефективна у перерахованих вище тестах. З метою розширення арсеналу технічних засобів і створення більш ефективного і доступного 9 протиалергічного, протизапального і гіполіпідемічного засобу, авторами винаходу були виявлені деякі специфічні N-ацильні похідні амінокислот загальної формули (І), розкритої у публікації міжнародної заявки WO 99/01133, але конкретно у ній не описані, не одержані і не охарактеризовані, за винятком глутарил-L-гістидину метилового ефіру (XII). Так, під загальну формулу (І) вказаної вище міжнародної заявки підпадають сполуки даного винаходу. Однак, у зазначеній публікації не наведені ні конкретні структурні формули даних сполук, ні які-небудь фізико-хімічні характеристики, а також не описані способи їх одержання. Сполуки даного винаходу підпадають під загальну структурну формулу сполук, розкритих у публікації міжнародної заявки WO 03/072124, що володіють дією, яка індукує диференціювання клітин. Однак, у даній публікації не описаний спосіб їх синтезу і не наведені які-небудь фізико-хімічні константи. Одна зі сполук глутарилгістидину згадується тільки у вигляді метилового ефіру по С-кінцю His [Glt-His(OMe) (XII)] у патенті США 3963691, як проміжна сполука у синтезі пептиду Glt-His-Trp-SerTyr-Gly-Leu-Arg-Pro-Gly-poly-Lys. Крім того, у публікації міжнародної заявки WO 99/01133 описаний синтез глутарил-L-гістидину метилового ефіру (XII) 1 і наведені фізико-хімічні характеристики: дані НЯМР-, мас-спектрометрії, ВЕРХ. Сполука сукцинілгістидин згадується у публікації міжнародної заявки WO 93/04690. У цій публікації зазначено, що додавання вільного імідазолу або сукцинілгістидину прискорює взаємодію карнозину з дигідроксіацетоном. Методики синтезу сукцинілгістидину і його фізико-хімічні константи не наведені. Структурна формула сукцинілтриптофану згадується у заявці США № 2005079515. У зазначеній публікації ні методики синтезу сукцинілтриптофану, ні його фізико-хімічні константи не наведені. У Бюлетені експериментальної біології і медицини, 1998, т.125. №5, стор.544-547 розкрита дикалієва сіль N-сукциніл-d,1-триптофану, що володіє протиаритмічною і протифібрилярною активністю, яка здійснює антиішемічну і антигіпоксичну дію, стабілізує показники гемодинаміки при гострій ішемії міокарда. В Justus liebigs annalen der chemie, 1966, Band 691. P. 159-164 описаний рацемічний сукцинілтриптофан. У Tetrahedron, 2005, v.61, №4, P.919-926 наведені фізико-хімічні характеристики сукциніл-Lтриптофану і сукциніл-D-триптофану. Які-небудь відомості про їх біологічну активність відсутні. У статті Joseph R.Votano et al Inhibition of deoxyhemoglobin S polymerization by biaromatic peptides found to associate with the hemoglobin molecule at a preferred site, Biochemistry, 1977, v.16, №25, pp.5484-5491 згадають сукциніл-L-триптофан і вивчена його здатність зв'язуватися з деоксигемоглобіном. У статті Dongmei Η., Chao W., Ming Ζ., Shiqi P. Synthesis and analgesic activity of Ν,Ν'dicarbonyltryptamines. Prep. Biochem. & Biotechnol., 2000, V.30(3), P.231-240 описаний синтез N 94586 10 сукциніл-L-триптофану метилового ефіру (XI), виходячи з метилового ефіру триптофану і бурштинового ангідриду у присутності диметиламінопіридину, з подальшим хроматографічним очищенням цільового продукту. N-сукциніл-L-триптофан метилового ефіру (XI) охарактеризований фізико1 хімічними даними: Н-ЯМР-, ІЧ-спектроскопії, масспектрометрії, температурою плавлення і даними елементного аналізу. Глутарил-L-триптофан метиловий ефір (XIII) згадується у статті Raimondi S., Monti D., Pagnoni U.M., Riva S. Glutaryl acylases: One-reaction enzymes or versatile enantioselective biocatalysts? Adv. Synth. Catal. 2003. V.345(6-7). P.783-789, де наведена тільки типова методика синтезу, а з фі1 зико-хімічних констант -дані H-ЯМР-спектроскопії. Сполука (Хlll) була синтезована з метою її дослідження як субстрату для глутарилацилази. Одержання N-глутарил-L-гістаміну описане у публікації міжнародної заявки WO 99/01103 і являє собою N-ацилювання біогенного аміну глутаровим ангідридом у середовищі безводного Ν,Νдиметилформаміду. Крім того, у публікації Гершкович A.A., Кібірєв В.К. //Хімічний синтез пептидів/Київ, Наукова думка, 1992, с.360 описаний спосіб ацилювання амінокислот у водно-органічному, сильно лужному середовищі. У Sorm F., Pravda Ζ. Proteins and amino acids. X. Synthesis of two peptide analogs. //Chemicke Listy pro Vedu a Prumysl. 1951. V.45. P.423-425 описаний спосіб синтезу сукцинілтирозину етилового ефіру у суміші води і етилацетату при співвідношенні (1:1), виходячи з хлоргідрату етилового ефіру тирозину і глутарового ангідриду у присутності NaHCO3 для підтримки слаболужного pH. Ацилювання ангідридами дикарбонових кислот вільного гістидину у літературі не описане. Метою даного винаходу є нові ефективні Nацильні похідні амінокислот і їх фармацевтично прийнятні солі, що володіють протиалергічною, протизапальною і гіполіпідемічною дією у низьких дозах і не проявляють побічних ефектів, фармацевтичні композиції на їх основі, їх застосування як більш ефективних протиалергічних, протизапальних і гіполіпідемічних засобів, а також нові способи синтезу N-ацильних похідних амінокислот. Авторами винаходу розроблений простий і ефективний спосіб синтезу сполук загальної формули (І), який полягає у тому, що ангідрид глутарової або бурштинової кислоти у вигляді твердої речовини додають до водного розчину амінокислоти за відсутності неорганічної і органічної основи з одержанням цільового продукту з досить високим виходом 55-60%. Авторами винаходу також розроблений ще один спосіб синтезу сполук загальної формули (І), у тому числі N-ацильних похідних гістидину і триптофану, що включає проведення реакції у двофазовій системі, яка складається з водного розчину гістидину або солі триптофану і розчину ацилюючого агента у придатному органічному розчиннику при використанні надлишку ацилюючого агента. Короткий опис винаходу Даний винахід стосується нових N-ацильних похідних амінокислот загальної формули І: 11 94586 де n дорівнює 2 або 3; R1 являє собою 12 де R1 являє собою , a R2 = Н, -СН3, -С2Н5 і їх фармацевтично прийнятних солей, що володіють протиалергічною, протизапальною і гіполіпідемічною дією. Даний винахід також стосується способу одержання N-ацильних похідних амінокислот загальної формули І і їх солей, що включає додавання ангідриду глутарової або бурштинової кислоти у вигляді твердої речовини до водного розчину амінокислоти загальної формули: де R1 являє собою і необов'язково, перетворення цільового продукту в його сіль. Даний винахід далі стосується способу одержання N-ацильних похідних амінокислот загальної формули І і їх солей, що включає проведення реакції у двофазовій системі з ангідридом глутарової або бурштинової кислоти в органічному розчиннику, що не змішується з водою, з водним розчином амінокислоти загальної формули: і, необов'язково, перетворення цільового продукту в його сіль. Даний винахід стосується також застосування сполук загальної формули І і їх фармацевтично прийнятних солей як протиалергічних, протизапальних і гіполіпідемічних засобів. Далі, даний винахід стосується фармацевтичної композиції і засобу, що володіє протиалергічною, антианафілактичною і протизапальною і гіполіпідемічною дією, що містить ефективну кількість сполуки загальної формули І або її фармацевтично прийнятної солі, а також, якщо потрібно, фармацевтично прийнятний носій. Ще одним об'єктом винаходу є спосіб лікування алергічних захворювань, що включають бронхіальну астму, алергічний риніт, полінози, сезонний риніт, цілорічний риніт, атопічний дерматит, псоріаз, кропивницю, алергічні (у тому числі анафілактичні) реакції на укуси комах і лікарські препарати, холодову алергію, алергічний кон'юктивіт, хронічних обструктивних захворювань легенів, а саме хронічного обструктивного бронхіту, емфіземи, облітеруючого бронхіту, муковісцидозу, а також захворювань, пов'язаних з порушеннями ліпідного обміну: атеросклероз, ожиріння, ішемічна хвороба серця і головного мозку, інфаркт міокарда, інсульт, що включає введення ефективної кількості сполуки загальної формули І або її фармацевтично прийнятної солі. Детальний опис винаходу Переважні сполуки загальної формули І представлені у таблиці 1. 13 Синтез сполук загальної формули І може бути здійснений двома способами. Перший спосіб полягає у поступовому додаванні до водного розчину амінокислоти загальної формули 94586 14 глутарової або бурштинової кислоти в органічному розчиннику, що не змішується з водою, до водного розчину амінокислоти загальної формули: де R1 являє собою де R1 являє собою глутарового або бурштинового ангідриду у вигляді твердої речовини, з подальшим виділенням цільового продукту іонообмінною хроматографією, переважно пропусканням реакційної суміші через колонку з катіонітом і подальшою кристалізацією з водного розчину. Одержані кристали цільового продукту промивають придатним розчинником, переважно метанолом. Головна перевага способу, що заявляється, полягає у відсутності лугу у водному розчині амінокислоти, що перешкоджає інактивації ангідриду дикарбонової кислоти у результаті гідролізу. Крім того, залишок імідазолу у складі молекули амінокислоти може здійснювати кислотно-основний аутокаталіз реакції ацилювання аміногрупи амінокислоти. Досить високих виходів (5560%) при використанні способу, що заявляється, досягають, зокрема, завдяки поступовому додаванню ангідриду дикарбонової кислоти, взятого у надлишку, та інтенсивному перемішуванню реакційної маси. Сполуки загальної формули І також можуть бути одержані альтернативним способом у двофазовій системі, що включає додавання ангідриду Даний спосіб дозволяє використовувати надлишок ацилюючого агента, досягати повного ацилювання -аміногрупи амінокислоти і виходу цільового продукту близько 70%. Для підтримки необхідного pH замість неорганічного лугу використовують органічну основу - піридин, який не гідролізує ангідрид, і, крім того, як відомо, є каталізатором ацилювання. Використання піридину дозволяє уникнути забруднення кінцевого продукту неорганічними солями, які разом з продуктом реакції залишаються у водному шарі. Використані підходи дозволяють спростити відділення цільового продукту від ангідриду і відповідної амінокислоти, які не прореагували, і виділяти цільовий продукт простою кристалізацією. Переважними органічними розчинниками, що не змішуються з водою, є бутанол, етилацетат, хлороформ. Переважними розчинниками, використовуваними для кристалізації цільового продукту, є водно-спиртові суміші, зокрема, вода-етанол. N-ациловані похідні ефірів амінокислот за винаходом (VI-XIII) можна одержати дією відповідних внутрішніх ангідридів дикарбонових кислот на амі 15 новільні ефіри гістидину або триптофану в органічному або водно-органічному середовищі. Переважним є одержання сполук VI-XIII у двофазовій системі, з використанням органічних розчинників, що не змішуються з водою: бутанол, етилацетат, хлороформ. Сполуки загальної формули І можуть бути також одержані у вигляді фармацевтично прийнятних солей шляхом взаємодії, наприклад, з гідроксидом натрію, гідроксидом калію, карбонатом магнію, гідроксидом літію, карбонатом кальцію рутинними способами, широко описаними у літературі. Сполуки загальної формули І володіють протиалергічною, протизапальною і гіполіпідемічною активністю і можуть бути використані для лікування алергічних, анафілактичних захворювань, у тому числі захворювань, які супроводжуються запаленням, а також порушеннями ліпідного обміну. Зокрема, сполуки даного винаходу можуть бути використані для лікування наступних алергічних захворювань: бронхіальної астми, алергічного риніту, полінозів, сезонного риніту, цілорічного риніту, атопічного дерматиту, псоріазу, кропивниці, алергічних (у тому числі анафілактичних) реакцій на укуси комах і лікарські препарати, холодової алергії, алергічного кон'юктивіту, хронічних обструктивних захворювань легенів, а саме хронічного обструктивного бронхіту, емфіземи, облітеруючого бронхіту, муковісцидозу, а також захворювань, пов'язаних с порушеннями ліпідного обміну, таких як атеросклероз, ожиріння, ішемічна хвороба серця і головного мозку, інфаркт міокарда, інсульт. Сполуки даного винаходу вводяться в ефективній кількості, що забезпечує бажаний терапевтичний результат. Для лікування алергічних захворювань, що включають бронхіальну астму, алергічний риніт, полінози, сезонний риніт, цілорічний риніт, атопічний дерматит, псоріаз, кропивницю, алергічні (у тому числі анафілактичні) реакції на укуси комах і лікарські препарати, холодову алергію, алергічний кон'юктивіт, хронічні обструктивні захворювання легенів, а саме хронічний обструктивний бронхіт, емфізему, облітеруючий бронхіт, муковісцидоз, а також захворювань, пов'язаних з порушеннями ліпідного обміну, таких як атеросклероз, ожиріння, ішемічна хвороба серця і головного мозку, інфаркт міокарда, інсульт, сполуки загальної формули І можуть бути введені перорально, місцево, парентерально, інтраназально, інгаляційно і ректально у вигляді стандартних лікарських форм, що містять нетоксичні фармацевтично прийнятні носії. Використовуваний у даному описі термін «парентеральне введення» означає підшкірні, внутрішньовенні, внутрішньом'язові або внутрішньогрудні ін'єкції або вливання. Сполуки даного винаходу можуть бути введені пацієнту у дозах, що складають від 0,01 до 10 мг/кг ваги тіла на день, переважно у дозах від 0,05 до 5 мг/кг один або більше разів на день. При цьому слід зазначити, що конкретна доза для кожного конкретного пацієнта буде залежати від багатьох факторів, включаючи активність даної використовуваної сполуки, вік, вагу тіла, стать, 94586 16 загальний стан здоров'я і режим харчування пацієнта, час і спосіб введення лікарського засобу, швидкість його виведення з організму, конкретно використовувану комбінацію лікарських засобів, а також тяжкість захворювання у даного індивіда, який піддається лікуванню. Фармацевтичні композиції за даним винаходом містять сполуку загальної формули (І) у кількості, ефективній для досягнення бажаного результату, і можуть бути введені у вигляді стандартних лікарських форм (наприклад, у твердій, напівтвердій або рідкій формах), що містять сполуки даного винаходу як активний інгредієнт у суміші з носієм або наповнювачем, придатним для внутрішньом'язового, внутрішньовенного, перорального, сублінгвального, інгаляційного, інтраназального та інтраректального введення. Активний інгредієнт може бути включений у композицію разом зі звичайно використовуваними нетоксичними фармацевтично прийнятними носіями, придатними для виготовлення розчинів, таблеток, пігулок, капсул, драже, супозиторіїв, емульсій, суспензій, мазей, гелів і будь-яких інших лікарських форм. Як наповнювачі можуть бути використані різні речовини, такі як сахариди, наприклад глюкоза, лактоза або сахароза, маніт або сорбіт, похідні целюлози і/або фосфати кальцію, наприклад, трикальцій фосфат або кислий фосфат кальцію, як зв'язувальний компонент можуть бути використані такі як крохмальна паста, наприклад, кукурудзяний, пшеничний, рисовий, картопляний крохмаль, желатин, трагакант, метилцелюлоза, гідроксипропілметилцелюлоза, натрій карбоксиметилцелюлоза і/або полівінілпіролідон. За необхідності можуть бути використані агенти, що розпушують, такі як згадані вище крохмалі і карбоксиметилкрохмаль, поперечно зшитий полівінілпіролідон, агар або альгінова кислота або її сіль, така як альгінат натрію. Можуть бути використані необов'язкові домішки, такі як агенти, що регулюють текучість, і змащувальні агенти, такі як діоксид кремнію, тальк, стеаринова кислота і її солі, такі як стеарат магнію або стеарат кальцію, і/або пропіленгліколь. Ядро драже звичайно покривають шаром, що стійкий до дії шлункового соку. Для цієї мети можуть бути використані концентровані розчини сахаридів, які можуть необов'язково містити аравійську камедь, тальк, полівінілпіролідон, поліетиленгліколь і/або діоксид титану, і придатні органічні розчинники або їх суміші. Як домішки можуть бути також використані стабілізатори, загусники, барвники і віддушки. Як мазева основа можуть бути використані вуглеводневі мазеві основи, такі як вазелін білий і жовтий (Vaselinum album, Vaselinum flavum), вазелінове масло (Oleum Vaselini), мазь біла і рідка (Unguentum album, Unguentum flavum), а як домішки для надання більш густої консистенції - твердий парафін і віск; абсорбтивні мазеві основи, такі як гідрофільний вазелін (Vaselinum hydrophylicum), ланолін (Lanolinum), кольдкрем (Unguentum leniens); мазеві основи, що змиваються водою, такі як гідрофільна мазь (Unguentum hydrophylum); водорозчинні мазеві основи, такі як поліетиленглі 17 колева мазь (Unguentum Glycolis Polyaethyleni), бентонітові основи та ін. Як основа для гелів можуть бути використані метилцелюлоза, натрієва сіль карбоксиметилцелюлози, оксипропілцелюлоза, поліетиленгліколь або поліетиленоксид, карбопол. Як основа для супозиторію можуть бути використані основи, не розчинні у воді, такі як олія какао; основи, розчинні у воді або ті, що змішуються з водою, такі як желатино-гліцеринові або поліетиленоксидні; комбіновані основи -мильногліцеринові. При приготуванні стандартної лікарської форми кількість активного інгредієнта, використовуваного у комбінації з носієм, може варіювати в залежності від реципієнта, який піддається лікуванню, від конкретного способу введення лікарського засобу. Так, наприклад, при використанні сполук даного винаходу у вигляді розчинів для ін'єкцій, вміст активного агента в них складає 0,01-5%. Як розріджувачі можуть бути використані 0,9% розчин хлориду натрію, дистильована вода, розчин новокаїну для ін'єкцій, розчин Рінгера, розчин глюкози, специфічні домішки для розчинення. При введенні в організм сполук даного винаходу у вигляді таблеток і супозиторіїв їх кількість становить 5,0-500 мг на стандартну лікарську форму. Лікарські форми даного винаходу одержують за стандартними методиками, такими як, наприклад, процеси змішування, гранулювання, формування драже, розчинення і ліофілізація. Слід зазначити, що сполуки даного винаходу проявляють біологічну активність у дозах на дватри порядки нижче у порівнянні з відомими препаратами, використовуваними для порівняння, при практично однаковій ефективності, і для них не виявлено негативних побічних дій і не виявлено протипоказань до застосування. При цьому, при дослідженні токсичності сполук даного винаходу у дозі 3000 мг/кг, перорально, не зареєстрували загибелі експериментальних тварин. Детальний опис сполук даного винаходу, їх одержання і дослідження фармакологічної активності представлені у наведених нижче прикладах, які призначені для ілюстрації переважних варіантів винаходу і не обмежують його об'єм. Приклади синтезу N-ацильних похідних амінокислот загальної формули (І) Індивідуальність одержаних сполук перевірялася методом ТШХ на пластинках "Kieselgel 60 F254" "Merck" (Німеччина) у системах: метанол (1), хлороформ-метанол-аміак (4:3:1) (2). Хроматограми проявляли хлортолідиновим реактивом, нінгідрином, йодом за світінням в УФсвітлі. Кути оптичного обертання вимірювали на поляриметрі "Perkin Elmer 341" (Швеція). 1 Н-ЯМР реєстрували на приладі "АМХ-400 Вruker" (Німеччина). Температуру плавлення визначали на приладі "Boetius" (Німеччина). Аналітичну ВЕРХ проводили на приладі "System Gold" ("Beckman", США): швидкість елюювання 0,25 мл/хв., детектування при 214 нм в умо 94586 18 вах: колонка Ultrasphere ODS "Beckman", 2250 мм, 5 мкм, елюювання 0,1% TFA, швидкість елюювання 0,25 мл/хв. (1); швидкість елюювання 1 мл/хв., детектування при 220 нм, колонка Luna-5 "Phenomenex", C18, 2504,6 мм, елюювання 25% ацетонітрилу в 0,05 Μ фосфатному буфері (pH 3,0) (2). Приклад 1 N-глутарил-L-гістидин (IV) Методика А До розчину 103,4 г (0,67 моль) гістидину в 400 мл води додають 83,7 г (0,73 моль) глутарового ангідриду. Суспензію перемішують 1 годину, утворений розчин упарюють до об'єму 150 мл, залишають у холодильнику на 16 годин. Осад, що випав, відфільтровують, промивають 150 мл метанолу і сушать. Очищення проводять іонооб+ мінною хроматографією на смолі П'юролайт у Н формі, елююючи водою. Фракції, що містять цільовий продукт, об'єднують, упарюють до початку випадання осаду і залишають на 16 годин при +4°С. Осад, що випав, відфільтровують, промивають 200 мл метанолу і сушать до постійної ваги. Вихід 98,8 г (55%). Rf 0,55 (1), 0,37 (2). Тпл=22220 + 224°С. []D +15,95° (С 0,53, вода). [М+Н] 270,1. 1 Н-ЯМР спектр (D2O), δ, м.ч.: 1,60-1,80 (м, 2Н, CH2-Glt), 2,10-2,25 (м, 4Н, ,-CH2-Glt), 2,90-3,25 (м, 2Н, -CH2-His), 4,40-4,50 (м, 1Н, -CH-His), 7,15 (с, 1Н, CH-4-Im), 8,50 (с, 1Н, CH-2-Im). Знайдено, %: С 49,18; Η 5,91; N 15,42. С11Н15N3O5. Обчислено, %: С 49,07; Η 5,62; Ν 15,61. Методика Б До суспензії 0,3 г (1,93 ммоль) гістидину у 5 мл води при інтенсивному перемішуванні додають 0,44 г (3,86 ммоль) глутарового ангідриду, розчиненого в 2,5 мл етилацетату. Перемішують 2 години, піридином доводять pH до 7 і перемішують ще 1 годину. Етил ацетатний і водний шари розділяють. Водний шар двічі промивають ефіром, ефірний шар відкидають. Воду видаляють у вакуумі, залишок розчиняють у мінімальній кількості води і додають етанол до початку випадання білого осаду, залишають при +4°С на 20 год. Осад відділяють фільтруванням, сушать у вакуумі. Вихід 0,36 г (70%). Rf 0,56 (1), 0,35 (2). Тпл=219-221 °С. 20 + 1 []D =+15,71° (С 0,56, вода). [М+Н] 270,1. Н-ЯМР спектр (D2O), δ, мл.: 1,40-1,55 (м, 2Н, -CH2-Glt), 1,90-2,0 (м, 4Н, ,-CH2-Glt), 2,7-3,0 (м, 2Н, -CH2His), 4,20-4,30 (м, 1Н, -CH-His), 6,95 (с, 1H, 4-CHIm), 8,30 (с, 1Н, 2-CH-Im). ВЕРХ в умовах: (1) - індивідуальний пік, час утримання 14,55 хв. Знайдено, %: С 49,07; Η 5,65; Ν 15,65. С11Н15N3O5. Обчислено, %: С 49,07; Η 5,62; N 15,61. Приклад 2 N-сукциніл-L-гістидин (V) Синтез проводили відповідно до методики А, наведеної для сполуки IV. Вихід 0,08 г (57%). Rf 0,44(l),0,25(2). Тпл=179-181°С. 20 []D =+30,71° (С 0,56, вода). + [М] 255,2. 1 Н-ЯМР спектр (D2O), δ, мл.: 2,15-2,30 (м, 4Н, (CH2)2-Suc), 2,75-2,95 (м, 2Н, -CH2-His), 4,25 19 (уш.с, 1Н, -CH-His), 6,95 (с, 1H, 4-CH-Jm), 8,25 (с, 1Н, 2-СН-Jm). Знайдено, %: С 47,09; Η 5,04; Ν 16,40. С10Н13N3О5. Обчислено, %: С 47,06; Η 5,13; Ν 16,46. Синтез проводили відповідно до методики Б, наведеної для сполуки IV. Вихід 0,101 г (67%). Rf 0,45(l),0,27(2). Тпл=178-180°С. 20 []D =+30,8° (С 0,57, вода). ВЕРХ в умовах (1) - індивідуальний пік, час утримання 7,54 хв. Знайдено %: С 47,15; Η 5,2; Ν 16,50. С10Н13N3О5. Обчислено %: С 47,06; Η 5,13; Ν 16,46. Приклад 3 N-глутарилтриптофан (III) До суспензії 1,0 г (4,9 ммоль) триптофану у 7 мл води додають по краплях розчин 1 N NaOH (4,9 ммоль). До одержаного розчину додають розчин 0,56 г (4,9 мммоль) глутарового ангідриду у 3 мл етилацетату. Реакційну суміш перемішують протягом 3 годин при кімнатній температурі в атмосфері аргону у темряві, залишають на 16 годин при +4°. Розчинник з реакційної суміші видаляють у вакуумі. Одержаний олієподібний залишок розчиняють у 30 мл води при перемішуванні, охолоджують до 0°, додають розчин 1 N НСl до pH 4. Продукт екстрагують етилацетатом (325 мл). Об'єднаний етилацетатний екстракт охолоджують до 0°, промивають водою (425 мл) до pH 7,розчином 5% HCl (5мл), водою (425 мл) до pH 7, сушать над безводним Na2SO4 протягом 1 години. Осад Na2SO4 відфільтровують, промивають етилацетатом, розчинник видаляють у вакуумі. Одержують сіруватий твердий залишок, який сушать у вакуумі. Вихід 1,0 г (70%). Rf 0,54 (1). Тпл=150-152°С. 20 []D =+8,20° (С 0,5, метанол). 1 Н-ЯМР спектр (CD3OD), δ, м.ч.: 1,75-1,84 (м, 2Н, -CH2-Glt), 2,15-2,30 (м, 4Н, ,-CH2-Glt), 3,303,40 (м, 2Н, -CH2-Trp), 3,80-3,90 (м, 1H, -CH-Trp), 6,97 (т, J=7 Гц, 1H, СН-6-Ind), 7,06 (т, J=7 Гц, 1H, СН-7-Ind), 7,15 (д, J=7 Гц, 1H, СН-2-Ind), 7,33 (д, J=7 Гц, 1Н, СН-5-Ind), 7,55 (д, J=7 Гц, 1H, СН-8Ind). ВЕРХ в умовах: (2) - індивідуальний пік, час утримання 6,77 хв. Знайдено, %: С 60,07; Η 5,65; Ν 8,75. C16H18N2O5. Обчислено, %: С 60,37; Η 5,7; Ν 8,8. Приклад 4 N-сукциніл-L-триптофан (II) Синтез проводили відповідно до методики, наведеної для сполуки III. Вихід 100,5 мг (67%). Rf 0,63(1). 20 []D =+21,05° (С 0,6, вода). 1 Н-ЯМР спектр (DMSO-d6), δ, м.ч.: 2,33-2,41 (м, 4Н, ,-CH2-Suc), 2,93-3,01 (м, 1H, -CH2-Trp), 3,10-3,16 (м, 1H, -CH2-Trp), 4,39-4,47 (м, 1H, CH-Trp), 6,93-7,06 (м, 2H, CH-6,7-Ind), 7,11 (д, 94586 20 J=2,2 Гц, 1H, СН-2-Ind), 7,30-7,32 (м, 1H, СН-5-Ind), + 7,44-7,47 (м, 1Н, СН-8-Ind). [М] 304,3. ВЕРХ в умовах: (2) - індивідуальний пік, час утримання 6,35 хв. Знайдено, %: С 59,07; Η 5,65; Ν 9,35. C16H18N2O5. Обчислено, %: С 59,21; Η 5,3; Ν 9,21. Приклад 5 Моно-натрієва сіль N-глутарил-L-гістидину (IV) До розчину 1,0 Г (3,7 ммоль) N-глутарил-Lгістидину у 15 мл води при перемішуванні і охолодженні до +5°С додають розчин 0,15 г (3,7 ммоль) NaOH у 20 мл води. Розчин перемішують 30 хв., розчинник видаляють у вакуумі. До олієподібного залишку порціями додають бензол, розчинник видаляють у вакуумі. Твердий залишок сушать над гранульованим лугом. Вихід 1,07 г (99,7%). Тпл=208-210°С. 20 []D -+16,27° (C 0,58, вода). Знайдено, %: С 45,25; Η 5,51; Ν 14,52. С11Н15N3O5Na. Обчислено, %: С 45,21; Η 5,17; Ν 14,38. Приклад 6 Мононатрієва сіль N-сукциніл-L-гістидину (V) Синтез проводили відповідно до методики, наведеної для моно-натрієвої солі N-сукциніл-Lгістидину (IV) (приклад 5). Вихід 1,06 г (97,0%). 20 []D =+40,21° (С 0,48, вода). Знайдено, %: С 43,25; Η 4,51; Ν 15,52. С10Н13N3О5Na. Обчислено, %: С 43,17; Н 4,71; N 15,10. Приклад 7 Мононатрієва сіль N-сукциніл-L-триптофану (II) Синтез проводили відповідно до методики, наведеної для моно-натрієвої солі N-глутарил-Lгістидину (IV) (приклад 5). Вихід 0,21 г (98,0%). Тпл=147-150°С. 20 []D =+22,02° (C 0,39, вода). Знайдено, %: С 55,25; Η 4,51; Ν 8,32. C15H16N2O5Na. Обчислено, %: С 55,05; Η 4,93; Ν 8,56. ВЕРХ в умовах: (2) - індивідуальний пік, час утримання 6,56 хв. Приклад 8 Мононатрієва сіль N-глутарил-L-триптофану (III) Синтез проводили відповідно до методики, наведеної для моно-натрієвої солі N-глутарил-Lгістидину (IV) (приклад 5). Вихід 0,11г (99,0%). Тпл=128-130°С. 20 []D =+22,06° (C 0,34, метанол). Знайдено, %: С 56,15; Η 5,21; Ν 8,22. C16H18N2O5Na. Обчислено, %: С 56,30; Η 5,32; Ν 8,21. ВЕРХ в умовах: (2) - індивідуальний пік, час утримання 6,96 хв. Приклад 9 Динатрієва сіль N-глутарил-L-гістидину (IV) 21 До розчину 1,0 г (3,7 ммоль) N-глутарил-Lгістидину в 15 мл води при перемішуванні і охолодженні до +5°С додають розчин 0,3 г (7,44 ммоль) NaOH в 15 мл води. Розчин перемішують 30 хв., розчинник видаляють у вакуумі. До олієподібного залишку порціями додають бензол, розчинник видаляють у вакуумі. Твердий залишок сушать над гранульованим лугом. Вихід 1,15 г (99,0%). 20 []D =+11,92° (С 0,57, вода). Знайдено, %: С 41,25; Η 4,51; Ν 13,52. C11H15N3O5Na2. Обчислено, %: С 41,91;H 4,80;N 13,3. Приклад 10 Динатрієва сіль N-сукциніл-L-гістидину (V) Синтез проводили відповідно до методики, наведеної для динатрієвої солі N-глутарил-Lгістидину (IV) (приклад 9). Вихід 1,16 г (99,0%). Тпл=124-128°С. 20 []D =+20,06° (C 0,67, вода). Знайдено, %: С 39,55; Η 4,31; Ν 13,52. C10H13N3O5Na2. Обчислено, %: С 39,88; Η 4,35; Ν 13,95. Приклад 11 Динатрієва сіль N-сукциніл-L-триптофану (II) Синтез проводили відповідно до методики, наведеної для динатрієвої солі N-глутарил-Lгістидину (IV) (приклад 9). Вихід 0,56 г (97,7%). Знайдено, %: С 51,35; Η 4,31; Ν 8,22. C15H16N2O5Na2. Обчислено, %: С 51,43; Η 4,60; Ν 8,0. 94586 22 Приклад 12 Динатрієва сіль N-глутарил-L-триптофану (III) Синтез проводили відповідно до методики, наведеної для динатрієвої солі N-глутарил-Lгістидину (IV) (приклад 9). Вихід 0,56 г (98,5%). Знайдено, %: С 52,55; Η 4,71; Ν 7,52. C16H18N2O5Na2. Обчислено, %: С 52,75; Η 4,98; Ν 7,69. Приклад 13 N-сукциніл-L-гістидину метиловий ефір До розчину 1,0 г (4,13 ммоль) гістидину метилового ефіру в 5 мл Ν,Ν-диметилформаміду при інтенсивному перемішуванні додають 5 мл води і розчин 0,41 г (4,13 ммоль) бурштинового ангідриду в 2,5 мл етилацетату. Перемішують 2 години при кімнатній температурі. Етилацетатний і водний шари розділяють. Водний шар двічі промивають ефіром, ефірний шар відкидають. Воду видаляють у вакуумі, залишок затирають з 10 мл гексану. Осад відфільтровують, сушать у вакуумі. Вихід 0,70 г (67%). Rf 0,38 (1). Тпл=171-173°С. 1 Н-ЯМР спектр (DMSO-d6), δ, м.ч.: 2,26-2,37 (м, 4Н, ,-CH2-Suc), 2,70 (с, 3Н, -О-СН3), 2,76-2,87 (м, 2Н, -CH2-His), 4,33-4,45 (м, 1H, -CH2-His), 6,78 (с, 1Н, 4-CH-Im), 7,93 (с, 1H, 2-CH-Im), 8,25 (д, J=7Гц, 20 NH-амід.). []D =+ 11,92° (С 0,57, вода). За аналогічними типовими методиками одержують також нові сполуки загальної формули (І), наведені у таблиці 2. 23 94586 24 25 Тести на біологічну активність Приклад 14 Вплив сполук загальної формули І на алергічні реакції негайного типу (тест індукованої овальбуміном (ОА) дегрануляції базофілів крові імунізованої морської свинки in vitro) Виділення лейкоцитів з крові морської свинки здійснювали за методом Фримеля [Імунологічні методи /Під ред. М.Фримеля/ М., Медицина, 1987, стор.222 у нашій модифікації]. Для постановки тесту використовували морських свинок обох статей масою 600-800 г. Тварин імунізували однократно сумішшю овальбуміну 10 мкг і 100 мг гідроокису алюмінію на тварину за Andersson [Anderson P. Antigen-induced bronchial anaphulaxis in actively sensitized geineapigs.//Allergy. 1980. Vol. 35. P.63-71]. Під ефірним наркозом з серця морської свинки відбирали 15 мл крові. Для виділення базофілів у складі лейкоцитарної суспензії використовували подвійне осадження клітин - за допомогою ЕДТА і за допомогою цитратвмісної осаджувальної рідини. Кров змішували з 5% розчином ЕДТАNa2 2Н2О ("Sigma") у співвідношенні 9:1 і через 30 хв. м'яко центрифугували (12 хв. при 80 g). Надосадову рідину збирали і центрифугували 15 хв. при 500 g. До клітин крові, що залишилися, додавали цитратвмісну осаджувальну рідину (3) у пропорції 3:10 (термостатується при 37°С протягом 30 хв.). Збагачену лейкоцитами надосадову фракцію центрифугували 7 хв. при 100 g. До осаду лейкоцитів додавали 0,85% розчин NaCl і концентрацію 3 клітин доводили др3010 /мкл. Постановка тесту дегрануляції базофілів in vitro [Довідник з клінічних лабораторних методів дослідження /Під ред. Е.А.Кост/ М., Медицина, 1975, стор. 130]. Для постановки тесту у центрифужну пробірку (використовується по 3 пробірки на кожну пробу) вміщували 300 мкл клітинної суспензії, потім додавали 300 мкл сольового розчину досліджуваної сполуки (або сольового розчину у контролі спонтанної і максимальної дегрануляції) і передінкубували при 37°С протягом 15 хв., потім додавали по 300 мкл 1% сольового розчину ОА у кожну пробірку (у контроль спонтанної дегрануляції додавали сольовий розчин у такій самій кількості) і ще раз передінкубували при 37°С протягом 10 хв. Робоча концентрація лейкоцитів складає при цьому 94586 26 4 10 /мкл. З кожної пробірки відбирали проби (100 мкл) в окремі пробірки для оцінки повної дегрануляції базофілів, а до клітин, що залишилися, додавали охолоджений сольовий розчин (по 5 мл у кожну пробірку) для зупинки реакції дегрануляції, потім центрифугували 7 хв. при 100 g, а з осаду готували препарати для мікроскопування. Фіксацію і забарвлювання препаратів проводили за методом Seder et al. [Seder R.A. et al. Mouse splenic and bone marrow cell populations that express high affinity Fc receptors and produce interleukin-4 are highly enriched in basophils. //Proc.Natl.Acad.USA, 1991, V.88, P.2835-2839]. Для виявлення специфічної зернистості базофілів використовували барвник 0,5% альціановий синій (pH 1,0), ядра дозабарвлювали сафраніном (0,1% розчин в 1% оцтовій кислоті). Препарати використовували для оцінки сумарного гальмування дегрануляції. Гальмування сумарної дегрануляції (ГГ) (%) розраховували за формулою: (max експер .) ГГ 100(%), (max спонт .) де max - % дегранульованих базофілів при максимальній дегрануляції (ОА) спонт. - % дегранульованих базофілів при спонтанній дегрануляції (контроль) експер. - % дегранульованих базофілів після впливу досліджуваної сполуки. Оцінка повної дегрануляції базофілів Відібрані після постановки тесту дегрануляції базофілів проби (по 100 мкл) поміщали у пробірки з барвником (0,5% альціановий синій, pH 1,0) у співвідношенні 1:1. Забарвлювання здійснювали при кімнатній температурі не менше 50 хв. Підрахунок кількості забарвлених базофілів проводили з використанням камери Фукса-Розенталя. Гальмування повної дегрануляції (ГПД) базофілів розраховували за формулою: ГПД (%) = 1 - [(М сер. (к) - Μ сер. (експ.)] / [М сер. (к) - Μ сер. (ОА)] 100, де Μ сер. (к) - середня (по 3-х пробах) кількість базофілів у тесті спонтанної дегрануляції; Μ сер. (ОА) - середня (по 3-х пробах) кількість базофілів у тесті максимальної антигеніндукованої дегрануляції; Μ сер. (експ.) - середня (по 3-х пробах) кількість базофілів у тесті дегрануляції після інкубації з досліджуваною сполукою. 27 94586 28 Таблиця 3 Гальмування ОА-індукованої дегрануляції базофілів крові імунізованих морських свинок in vitro під впливом сполук загальної формули І № досл. 1. 2. 3. 4. 5. 6. 7. 8. 9. 10. 11. 12. 13. 14. 15. 16. 17. 18. Гальмування повної де- Кількість повністю дегранульогрануляції (ГПД), (%) ваних базофілів, (%) Контроль 1 (спонтанна дегрануляція) 100 0 Овальбумін 1% (max дегрануляція) 0 35,2±0,8 -3 Сполука IV (10 М) 99,2±11,2 2,6±2,6* -4 Сполука IV (10 М) 99,5±12,0 2,9±1,6* -5 Сполука IV (10 М) 113,5±2,7 0 -6 Сполука IV (10 М) 90,0±1,8 3,9±0,6 -7 Сполука IV (10 М) 76,7±1,5 9,1±0,8 -3 Глутарилгістамін (10 М) 9,3±5,5 31,6±6,33 -4 Глутарилгістамін (10 Μ) 24,1±1,1 25,3±3,38 -5 Глутарилгістамін (10 Μ) 0 29,8±6,73 Контроль 2 100 0 Овальбумін 1% (max дегрануляція) 0 38,9±8,43 -3 Сполука V (10 М) 10,6±7,6 35,3±7,29 -4 Сполука V (10 М) 18,9±11,8 31,2±6,8 -5 Сполука V (10 М) 44,0±11,27 24,6±10,38 -3 Гідрокортизон (10 М) 71,0+1,6 10,0±0,7 -4 Гідрокортизон (10 М) 48,0±0,8 17,3±0,9 -5 Гідрокортизон (10 М) 40,0±0,6 20,0±1,3 Групи (*-P < 0,001) Дані таблиці 3 показують, що у порівнянні з глутарилгістаміном сполука (IV) здійснює виражену антианафілактичну дію, що проявляється у практично 100% гальмуванні дегрануляції у тесті повної ОА-індукованої дегрануляції базофілів крові активно імунізованих морських свинок (реакція анафілаксії in vitro у безкальцієвому середовищі). Значний антианафілактичний ефект сполуки IV проявляється і у зменшенні кількості дегранульованих клітин, особливо вираженому у концентрації -5 10 Μ (відсутність дегранульованих клітин). Приклад 15 Вивчення впливу сполук загальної формули І на системну анафілаксію in vivo Використовували модель бронхоспазму у ненаркотизованих активно сенсибілізованих морських свинок з аерозольним впливом овальбуміну як антигену [Ковальова В.Л. "Методичні вказівки з вивчення бронхолітичних, муколітичних і протизапальних засобів. //Посібник з експериментального (доклінічного) вивчення нових фармакологічних речовин. Москва. 2000. с.242-250]. Морських свинок сенсибілізували овальбуміном за методом Andersson [Anderson P. Antigeninduced bronchial anaphulaxis in actively sensitized geinea-pigs.//Allergy. 1980. Vol. 35. P. 63-71] і через 1-2 місяця після сенсибілізації індукували бронхоспазм аерозольним введенням розрізнювальної дози овальбуміну (3 мг/кг в 1 мл фіз. розчину). У дослідних групах морським свинкам протягом трьох днів внутрішньошлунково за допомогою зонду вводили досліджувані сполуки у дозах 10 мкг/кг, 50 мкг/кг і 150мкг/кг. В іншій серії експериментів, досліджувані сполуки у дозі 50 мкг/кг (в 1 мл фіз. розчину) вводили інгаляційно (за допомогою небулайзера) також протягом трьох днів 1 раз на добу. Контрольній групі вводили фіз. розчин. Через 1 годину після останнього введення речовин інгалювали за допомогою небулайзера овальбумін і оцінювали тривалість (у секундах) та інтенсивність бронхоспастичної реакції тварин. Таблиця 4 Гальмування системної анафілактичної реакції морських свинок при інгаляційному введенні сполуки IV у дозі 50 мкг/кг Групи Контроль 1 (фіз. розчин) Сполука IV 50 мкг/кг Тривалість гострої фази, сек. 180±6 0 Тривалість підгострої фази, сек. 650±34 400±25 29 94586 30 Таблиця 5 Гальмування системної анафілактичної реакції морських свинок при внутрішньошлунковому введенні сполуки IV у дозах 10 і 150 мкг/кг (М±m) Групи Контроль 2 (фіз. розчин) Сполука IV 10 мкг/кг Сполука IV 150 мкг/кг Тривалість гострої фази, сек. 296,7±104,6 68,0±54,7* 72,0±42,1* Загальний час реакції, сек. 628,3±80,6 428,0±75,0 337,0±78,5* * -Р < 0,001 Результати експериментів, представлені у таблицях 4 і 5, показують, що сполука IV при внутрішньошлунковому введенні у дозах 10 і 150 мкг/кг та інгаляційному введенні у дозі 50 мкг/кг проявила антианафілактичну активність. Інгаляційне введення речовини у дозі 50 мкг/кг блокувало розвиток гострої фази бронхоконстрикторної реакції, яка, викликаючи ядуху, є причиною загибелі тварин. При внутрішньошлунковому введенні сполуки IV у дозах 10 мкг/кг і 150мкг/кг був виявлений значний протективний ефект відносно антигеніндукованого бронхоспазму. Таким чином, сполука IV проявляє значний протективний ефект відносно системної анафілактичної реакції in vivo. Приклад 16 Протиалергічна дія сполук загальної формули І на моделі алергічного риніту у морських свинок Використано модель алергічного риніту у морських свинок. Морських свинок імунізували за ви значеною схемою протягом 1,5-2-х місяців (Hutson P.A., Church М.К. et al. 1988): спочатку тварин імунізували внутрішньоочеревинним введенням овальбуміну у дозі 10 мг/кг з 7-денним інтервалом (двічі), потім свинкам інгалювали за допомогою небулайзерної техніки (Pari) розчин овальбуміну у зростаючій концентрації, починаючи з 0,1% до 1% з інтервалом у 4 дні між інгаляціями. Останню дозу овальбуміну вводили у назальні ходи за допомогою мікропіпетки. Через 24 години після останнього введення овальбуміну виконували забір назального змиву (через систему спеціальних трубочок) і зміни у слизовій носа оцінювали за допомогою комплексу методів: гістологічних і цитологічних. Досліджувані сполуки (0,1% розчин) вводили щодня у вигляді інгаляцій за допомогою небулайзерної техніки протягом 6 днів, на 6-й день введення викликали провокацію антигеном (ОА). Назальний змив одержували через добу після провокації. Таблиця 6 Група N Цитоз Вплив сполуки IV на цитоз (абсолютна кількість клітин в 1 мкл) у назальному змиві Інтактн. Контроль Модель + провокац. (риніт) Сполука IV (0,1% р-р) 6 7 7 18,0±2,10 67,2±6,47** 43,7±6,65°* * - відмінність від інтактного контролю; ° - відмінність від моделі (°-Р
ДивитисяДодаткова інформація
Назва патенту англійськоюN-acyl amino acid derivatives, method for the preparation thereof, pharmaceutical composition and use thereof as antiallergic, anti-inflammatory and hypolipidemic agents
Автори англійськоюNebolsin Vladimir Yevhenievich, Kromova Tatiana Aleksandrovna, Zheltukhina Galina Aleksandrovna, Kovaliova Violietta Leonidovna
Назва патенту російськоюN-ацильные производные аминокислот, способ их получения, фармацевтическая композиция и их применение как противоаллергических, противовоспалительных и гиполипидемических средств
Автори російськоюНебольсин Владимир Евгеньевич, Кромова Татьяна Александровна, Желтухина Галина Александровна, Ковалёва Виолетта Леонидовна
МПК / Мітки
МПК: A61P 9/00, A61K 31/405, A61P 37/08, A61P 3/06, C07D 209/20, A61K 31/4172, A61P 11/00, C07D 233/64
Мітки: амінокислот, похідні, композиція, засобів, протизапальних, одержання, спосіб, застосування, фармацевтична, гіполіпідемічних, протиалергічних, n-ацильні
Код посилання
<a href="https://ua.patents.su/25-94586-n-acilni-pokhidni-aminokislot-sposib-kh-oderzhannya-farmacevtichna-kompoziciya-i-kh-zastosuvannya-yak-protialergichnikh-protizapalnikh-i-gipolipidemichnikh-zasobiv.html" target="_blank" rel="follow" title="База патентів України">N-ацильні похідні амінокислот, спосіб їх одержання, фармацевтична композиція і їх застосування як протиалергічних, протизапальних і гіполіпідемічних засобів</a>
Попередній патент: Спосіб виготовлення вугільного виробу, курильний виріб та вугільний виріб
Випадковий патент: Спосіб моделювання морфологічних типів пластів осадових порід












