Неконкурентні антагоністи нікотинових рецепторів
Номер патенту: 108500
Опубліковано: 12.05.2015
Автори: Йоханнес Деніел, Бхатті Балвіндер Сінгх, Акіредді Срініваса Рао, Мелвін Метт С., Хімстра Рональд Джозеф, Сяо Юньде, Спік Джейсон
Формула / Реферат
1. Сполука формули І:
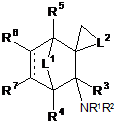 , Формула I
, Формула I
де
кожен з R1 і R2 окремо являє собою Н, С1-6алкіл або арилзаміщений С1-6алкіл, або R1 і R2 зв'язані з атом азоту, до якого вони приєднані, з утворенням 3-8-членного кільця, необов'язково заміщеного С1-6алкільними, арильними, С1-6алкокси- або арилоксизамісниками;
R3 являє собою Н, С1-6алкіл або С1-6алкоксизаміщений С1-6алкіл;
кожен з R4, R5, R6 і R7 окремо являє собою Н, С1-6алкіл або С1-6алкоксигрупу;
L1 являє собою лінкер, вибраний з групи, яка складається з CR8R9, CR8R9CR10R11 i O;
L2 являє собою лінкер, вибраний з групи, яка складається з СН2, СН2СН2, СН2СН2СН2 або СН2СН2СН2СН2;
кожен з R8, R9, R10 і R11 окремо являє собою водень або С1-6алкіл, і
пунктирна лінія означає необов'язковий подвійний зв'язок;
або її фармацевтично прийнятна сіль.
2. Сполука за п. 1, де R1 являє собою Н, і R2 являє собою С1-6алкіл.
3. Сполука за п. 1 або 2, де R3 являє собою С1-6алкіл.
4. Сполука за будь-яким з пп. 1-3, де кожен з R4, R5, R6 і R7 являє собою Н.
5. Сполука за будь-яким з пп. 1-4, де L1 являє собою CR8R9, і кожен з R8 і R9 являє собою водень.
6. Сполука за будь-яким з пп. 1-5, де La являє собою СН2СН2.
7. Сполука за будь-яким з пп. 1-6, де пунктирна лінія означає одинарний зв'язок.
8. Фармацевтична композиція, яка містить сполуку за будь-яким з пп. 1-7 і фармацевтично прийнятний носій.
9. Спосіб лікування або запобігання захворюванню або стану, опосередкованому нейрональним нікотиновим рецептором, який включає введення сполуки за будь-яким з пп. 1-7.
10.Спосіб за п. 9, де захворювання або стан являє собою IBS-D, ОАВ, нікотинову залежність, припинення паління, депресію, великий депресивний розлад або гіпертензію.
11. Застосування сполуки за будь-яким з пп. 1-7 для отримання лікарського засобу для лікування або запобігання захворюванню або стану, опосередкованому нейрональним нікотиновим рецептором.
12. Застосування за п. 11, де захворювання або стан являє собою IBS-D, ОАВ, нікотинову залежність, припинення паління, депресію, великий депресивний розлад або гіпертензію.
13. Сполука за будь-яким з пп. 1-7, призначена для застосування як активної терапевтичної речовини.
14. Сполука за будь-яким з пп. 1-7, призначена для застосування в лікуванні або запобіганні захворюванню або стану, опосередкованому нейрональним нікотиновим рецептором.
15. Сполука за п. 13 або 14, де захворювання або стан являє собою IBS-D, ОАВ, нікотинову залежність, припинення паління, депресію, великий депресивний розлад або гіпертензію.
Текст
Реферат: Даний винахід стосується сполук, що модулюють нікотинові рецептори, як неконкурентних антагоністів, способів їх синтезу, способів застосування та їх фармацевтичних композицій. UA 108500 C2 (12) UA 108500 C2 UA 108500 C2 5 10 15 20 25 30 35 40 45 50 55 60 Галузь техніки, до якої належить винахід Даний винахід стосується сполук, які модулюють нікотинові рецептори як неконкурентні модулятори (наприклад, неконкурентні антагоністи), способів їх синтезу, способів застосування і їх фармацевтичних композицій. Передумови створення винаходу Нікотинові рецептори є мішенню для великого числа екзогенних і ендогенних сполук, які алостерично модулюють їх функцію. Див. Arias H.R., Binding sites for exogenous and endogenous non-competitive inhibitors of the nicotinic acetylcholine receptor, Biochimica et Biophysica Acta Reviews on Biomembranes 1376:173-220 (1998) і Arias H.R., Bhumireddy Р., Anesthetics as chemical tools to study the structure and function of nicotinic acetylcholine receptors, Current Protein & Peptide Science 6: 451-472 (2005). Функція нікотинових рецепторів може бути знижена або блокована структурно різними сполуками, які називаються неконкурентними модуляторами, включаючи неконкурентні антагоністи (Arias H.R., Bhumireddy Р., Bouzat С., Molecular mechanisms and binding site locations for noncompetitive antagonists of nicotinic acetylcholine receptors. The international Journal of Biochemistry & Cell Biology 38; 1254-1276 (2006)). Неконкурентні модулятори включають широкий діапазон структурно різних сполук, які інгібують функцію рецептору, діючи на ділянку або ділянки, відмінні від ортостеричної ділянки зв’язування. Доведено, що модуляція рецептору є вкрай складною. Механізми дії і афінності зв’язування неконкурентних модуляторів відрізняються по підтипах нікотинових рецепторів (Arias et al., 2006). Неконкурентні модулятори можуть діяти за допомогою щонайменше двох різних механізмів: алостеричного і/або стеричного механізму. Механізм дії алостеричного антагоніста включає зв’язування неконкурентного антагоніста з рецептором і стабілізацію непровідного конформаційного стану, а саме стану спокою або десенсибілізації і/або підвищення в рецепторі ступеня десенсибілізації. На противагу цьому, безпосереднє представлення стеричного механізму полягає в тому, що молекула антагоніста фізично блокує іонний канал. Такі антагоністи можуть бути названі неконкурентними модуляторами каналу (NCM). Деякі з них інгібують рецептори за допомогою зв’язування в порі, коли рецептор знаходиться у відкритому стані, таким чином, фізично блокуючи проникність іонів. Крім того, деякі діють тільки як абсолютні блокатори каналу у відкритому стані, інші блокують відкриті і закриті канали. Такі антагоністи інгібують потік іонів за допомогою механізму, який не має на увазі зв’язування з ортостеричними ділянками. Показано, що барбітурати, дисоціативні анестетики, антидепресанти і певні стероїди інгібують нікотинові рецептори за допомогою алостеричних механізмів, включаючи блокаду каналів у відкритих і закритих станах. Дослідження барбітуратів підтримують модель, згідно з якою зв’язування відбувається при відкритих і закритих станах рецепторів, що призводить до блокади потоку іонів. Див. Dilger J.P., Boguslavsky R. Barann M., Kate Т., Vidal A.M., Mechanisms of barbiturate inhibition of acetylcholine receptor channels, Journal General Physiology 109: 401-414 (1997). Хоча інгібуюча дія місцевих анестетиків на нервову провідність є переважно опосередкованою блокуванням потенціалзалежних натрієвих каналів, нікотинові рецептори також є мішенями місцевих анестетиків. Див. Arias H.R., Role of local anesthetics on both cholinergic and serotonergic ionotropic receptors, Neuroscience and Biobehavioral Reviews 23: 817843 (1999) і Arias H.R. & Blanton M.P., Molecular and physicochemical aspects of local anesthetics acting on nicotinic acetylcholine receptor-containing membranes, Mini Reviews in Medicinal Chemistry 2: 385-410 (2002). Наприклад, тетракаїн зв'язується з каналами рецепторів переважно в стані спокою. Дисоціативні анестетики інгібують ряд нікотинових рецепторів нейронального типу в діапазонах клінічних концентрацій, наприклад, такі як фенциклідин (PCP) (Connolly J., Boulter J. & Heinemann S.F., Alpha 4-befa 2 and other nicotinic acetylcholine receptor subtypes as targets of psychoactive and addictive drugs, British Journal of Pharmacology 105: 657-666 (1992)), кетамін (Flood Р. & Krasowski M.D., Intravenous anesthetics differentially modulate ligand-gated ion channels, Anesthesiology 92: 1418-1425(2000) і Ho K.K. & Flood Р., Single amino acid residue in the extracellular portion of transmembrane segment 2 in the nicotinic α7 acetylcholine receptor modulates sensitivity to ketamine, Anesthesiology 100: 857-682 (2004)) і дизоцилпін (Krasowski M.D. & Harrison N.L., General anaesthetic actions on ligand-gated ion channels, Cellular and Molecular Life Sciences 55; 1278-1303 (1999)). Дослідження вказують, що дисоціативні анестетики зв'язуються з єдиними або перекривними ділянками в іонних каналах в стані спокою, і дозволяють передбачити, що локус кетамін/PCP частково перекриває ділянку зв’язування тетракаїну в каналі рецептору. Дизоцилпін, також відомий як MK-801, є дисоціативний анестетик і протисудомний засіб, який також діє як неконкурентний антагоніст для різних нікотинових рецепторів. Опубліковано, що дизоцилпін є блокатором каналу у відкритому стані нейрональних 1 UA 108500 C2 5 10 15 20 α4β2-нікотинових рецепторів. ДИВ. Buisson В. & Bertrand D., Open-channel blockers at the human α4β2 neuronal nicotinic acetylcholine receptor, Molecular Pharmacology 53: 555-563 (1998). У доповнення до їх добре відомих дій на системи зворотного захоплення моноамінів і серотоніну, також показано, що антидепресанти модулюють нікотинові рецептори. Перші дослідження показали, що трициклічні антидепресанти діють як неконкурентні антагоністи. Див. Gumilar F., Arias H.R., Spitzmaul G., Bouzat С., Molecular mechanisms of inhibition of nicotinic acetylcholine receptors by tricyclic antidepressants. Neuropharmacology 45: 984-76 (2003). В статті Garcia-Golunga et al. опубліковано, що флуоксетин, селективний інгібітор зворотного захоплення серотоніну (SSRI), інгібує мембранні струми, викликані активацією м’язових або нейрональних нікотинових рецепторів неконкурентним способом, а також збільшенням міри десенсибілізації і/або включенням блокади каналів. Див. Garcia-Colunga J., Awad J.N. & Miledi R., Blockage of muscle and neuronal nicotinic acetylcholine receptors by fluoxetine (Prozac), Proceedings of the National Academy of Sciences USA 94: 2041-2044 (1937) і Garcia-Colunga J., Vazquez-Gomez Е. &. Miledi R., Combined actions of zinc and fluoxetine on nicotinic acetylcholine receptors, The Phafmacogenomics Journal 4: 388-393 (2004). Мекаміламін, раніше схвалений для лікування гіпертензії, являє собою класичний неконкурентний антагоніст нікотинових рецепторів, а також добре відомо, що він інгібує функцію рецептору, блокуючи іонний канал. Див. Giniatuliin R.A., Sokolova E.M., Di Angelantonio S., Skorinkin А., Talantova M.V., Nistri А. Rapid relief of block by mecamyiarnine of neuronal nicotinic acetylcholine receptors of rat chromaffin cells in vitro: an electrophysiological and modeling study. Molecular Pharmacology 58: 778-787 (2000). Суть винаходу Даний винахід стосується сполук формули I: , 25 30 35 40 45 50 Формула I де 1 2 1 2 кожен з R і R окремо являють собою Н, C1-6алкіл або арилзаміщений C1-6алкіл, або R і R зв'язані з атом азоту, до якого вони приєднані, з утворенням 3-8-членного кільця, необов'язково заміщеного C1-6алкільними, арильними, C1-6алкокси або арилокси замісниками; 3 R являє собою Н, C1-6алкіл або C1-6алкоксизаміщений C1-6алкіл; 4 5 6 7 кожен з R , R , R і R окремо являє собою Н, C1-6алкіл або C1-6алкоксигрупу; 1 8 9 8 9 10 11 L являє собою лінкер, вибраний з групи, яка складається з CR R , CR R CR R і О; 2 L являє собою лінкер, вибраний з групи, яка складається з CH 2, CH2CH2, CH2CH2CH2 або CH2CH2CH2CH2; 8 9 10 11 кожен з R , R , R і R окремо являє собою водень або C1-6алкіл, і пунктирна лінія означає необов'язковий подвійний зв'язок; або їх фармацевтично прийнятної солі. Даний винахід стосується фармацевтичних композицій, які містять сполуки за даним винаходом або їх фармацевтично прийнятну сіль. Фармацевтичні композиції за даним винаходом можна використовувати для лікування або запобігання широкого спектру станів або порушень, і зокрема порушень, які характеризуються дисфункцією нікотинової холінергічної нейротрансмісії або дегенерацією нікотинових холінергічних нейронів. Даний винахід стосується способу лікування або запобіганню порушень і дисфункцій, таких як порушення і дисфункції ЦНС, а також лікування або запобігання певних станів, наприклад, полегшення болю, гіпертензії і запалення у ссавців, які потребують такого лікування. Способи включають введення індивідууму терапевтично ефективної кількості сполуки за даним винаходом, включаючи її солі, або фармацевтичної композиції, яка містить такі сполуки. Докладний опис винаходу I. Сполуки Один з варіантів здійснення даного винаходу стосується сполук формули I: 2 UA 108500 C2 , 5 10 15 20 25 30 35 40 45 50 Формула I де 1 2 1 2 кожен з R і R окремо являє собою Н, C1-6алкіл або арилзаміщений C1-6алкіл, або R і R зв'язані з атом азоту, до якого вони приєднані, з утворенням 3-8-членного кільця, необов'язково заміщеного C1-6алкільними, арильними, C1-6алкокси або арилокси замісниками; 3 R являє собою Н, C1-6алкіл або C1-6алкоксизаміщений C1-6алкіл; 4 5 6 7 кожен з R , R , R і R окремо являє собою Н, C1-6алкіл або C1-6алкоксигрупу; 1 8 9 8 9 10 11 L являє собою лінкер, вибраний з групи, яка складається з CR R , CR R CR R і О; 2 L являє собою лінкер, вибраний з групи, яка складається з CH 2, CH2CH2, CH2CH2CH2 або CH2CH2CH2CH2; 8 9 10 11 кожен з R , R , R і R окремо являє собою водень або C1-6алкіл, і пунктирна лінія означає необов'язковий подвійний зв'язок; або їх фармацевтично прийнятної солі. 1 2 У одному з варіантів здійснення R являє собою Н, і R являє собою C1-6алкіл. У одному з 3 4 5 варіантів здійснення R являє собою C1-6алкіл. У одному з варіантів здійснення кожен з R , R , 6 7 1 8 9 8 9 R і R являє собою H. У одному з варіантів здійснення L являє собою CR R , і кожен з R і R 2 являє собою водень. У одному з варіантів здійснення L являє собою CH2CH2, у одному з варіантів здійснення пунктирна лінія означає одинарний зв'язок. Один з аспектів даного винаходу стосується фармацевтичної композиції, яка містить сполуку за даним винаходом і фармацевтично прийнятний носій. Один з аспектів даного винаходу стосується способу платного лікування або запобігання захворюванню або стану, опосередкованого нейрональним нікотиновим рецептором, конкретно за допомогою застосування неконкурентних модуляторів (наприклад, неконкурентних антагоністів), включаючи, але, не обмежуючись ними, блокатори каналів, який включає введення сполуки за даним винаходом. У одному з варіантів здійснення захворювання або стан являє собою порушення ЦНС. У іншому варіанті здійснення захворювання або стан являє собою запалення або запальну відповідь. У іншому варіанті здійснення захворювання або стан являє собою біль. У іншому варіанті здійснення захворювання або стан являє собою неоваскуляризацію, в іншому варіанті здійснення захворювання або стан являє собою гіпертензію. У іншому варіанті здійснення захворювання або стан являє собою інше порушення, яке описується в даному описі. Один з аспектів даного винаходу стосується застосування сполуки за даним винаходом при отриманні лікарського засобу для лікування або запобігання захворюванню або стану, опосередкованого нейрональним нікотиновим рецептором, конкретно за допомогою застосування неконкурентних антагоністів, таких як блокатори каналів. У одному з варіантів здійснення захворювання або стан являє собою порушення ЦНС, в іншому варіанті здійснення захворювання або стан являє собою запалення або запальну відповідь. У іншому варіанті здійснення захворювання або стан являє собою біль. У іншому варіанті здійснення захворювання або стан являє собою неоваскуляризацію. У іншому варіанті здійснення захворювання або стан являє собою гіпертензію. У іншому варіанті здійснення захворювання або стан являє собою інше порушення, яке описується в даному описі. Один з аспектів даного винаходу стосується сполуки за даним винаходом, призначеної для застосування як активної терапевтичної речовини. Один аспект, таким чином, стосується сполуки за даним винаходом, призначеної для застосування в лікуванні або запобіганні захворюванню або стану, опосередкованого нейрональним нікотиновим рецептором, конкретно за допомогою застосування неконкурентних антагоністів, таких як блокатори каналів. У одному з варіантів здійснення захворювання або стан являє собою порушення ЦНС. У іншому варіанті здійснення захворювання або стан являє собою запалення або запальну відповідь. У іншому варіанті здійснення захворювання або стан являє собою біль. У іншому варіанті здійснення захворювання або стан являє собою неоваскуляризацію. У іншому варіанті здійснення 3 UA 108500 C2 5 10 15 20 25 30 35 40 45 50 55 60 захворювання або стан являє собою гіпертензію. У іншому варіанті здійснення захворювання або стан являє собою інше порушення, яке описується в даному описі. Конкретні захворювання або стани включають депресію, в тому числі великий депресивний розлад, гіпертензію, синдром подразненого кишечнику (IBS), в тому числі IBS-D (з переважанням діареї), надактивний сечовий міхур (GAB) і залежність, включаючи припинення паління. У об'єм даного винаходу включені всі комбінації аспектів і варіантів здійснення. Наступні визначення призначені для роз'яснення, а не для обмеження термінів, які визначаються, якщо конкретний термін, який використовується в даному описі, не визначений конкретно, такий термін потрібно вважати невизначеним. Переважно терміни використовують в їх прийнятих значеннях. Як використовується протягом всьому даного опису, переважна кількість атомів, таких як атоми вуглецю, представлені, наприклад, фразою "С х-уалкіл", яка означає алкільну групу, як визначено в даному описі, яка містить конкретну кількість атомів вуглецю. Подібну термінологію застосовують для інших переважних термінів, а також діапазонів. Таким чином, наприклад, алкіл являє собою вуглеводень з нерозгалуженим або розгалуженим ланцюгом, який містить від одного до шести атомів вуглецю. Як використовується в даному описі, термін "алкіл" стосується вуглеводню з нерозгалуженим або розгалуженим ланцюгом, який може бути необов'язково заміщеним, з багаторазовими ступенями допустимого заміщення. Приклади "алкілу", як використовується в даному описі, включають, але, не обмежуючись ними, метил, етил, пропіл, ізопропіл, ізобутил, н-бутил, трет-бутил, ізопентил і н-пентил. Як використовується в даному описі, термін "алкілен" стосується двовалентної групи, такої як "метилен", "етилен" і "ацетилен",які стосуються двовалентних форм -CH2-, -CH2-CH2- і CH=CH-, відповідно. Як використовується в даному описі, термін "арил" стосується одного бензольного кільця або системи конденсованих бензольних кілець, необов'язково заміщених з багаторазовими ступенями допустимого заміщення. Приклади "арильних" груп, включають, але, не обмежуючись ними, феніл, 2-нафтил, 1-нафтил, антраценом і фенантрен. Переважно арильні кільця містять від п'яти до десяти членів. Як використовується в даному описі, система конденсованих бензольних кілець, включена в термін "арил", містить конденсовані поліциклічні вуглеводні, а саме циклічний вуглеводень менше ніж з максимальною кількістю некумулятивних подвійних зв'язків, наприклад, де насичене вуглеводневе кільце (циклоалкільне, таке як циклопентильне кільце) конденсоване з ароматичним кільцем (арильним, таким як бензольне кільце) з утворенням, наприклад, груп, таких як інданіл і аценафталеніл, а також включає такі групи, як необмежуючих приклади, як дигідронафталін і тетрагідронафталін. a a Як використовується в даному описі, термін "алкокси" стосується групи -OR , де R являє собою алкіл, як визначено в даному описі. a a Як використовується в даному описі, термін "арилокси" стосується групи -OR , де R являє собою арил, як визначено в даному описі. a b a b Як використовується в даному описі, "аміно" стосується групи -NR R , де кожен з R і R a b a b являє собою водень. Додатково "заміщений аміно" стосується групи -NR R , де кожен з R і R a окремо являє собою алкіл, ариалкіл або арил. Як використовується в даному описі, коли R або b R відмінні від водню, така група може бути позначена як "заміщений аміно" або, наприклад, a b якщо R являє собою Н, і R являє собою алкіл, як "алкіламіно". Як використовується в даному описі, термін "фармацевтично прийнятний" стосується носія(носіїв), розріджувача(ів), ексципієнта(ів) або сольових форм сполук за даним винаходом, які сумісні з іншими інгредієнтами складу і не є шкідливими для реципієнта фармацевтичної композиції. Як використовується в даному описі, термін "фармацевтична композиція" стосується сполуки за даним винаходом необов'язково змішаної з одним або більше фармацевтично прийнятними носіями, розріджувачами або ексципієнтами. Фармацевтичні композиції переважно демонструють такий ступінь стабільності в умовах навколишнього середовища, що робить їх прийнятними для цілей отримання і комерції. Як використовується в даному описі, терміни "ефективна кількість", "терапевтична кількість" і "ефективна доза" стосуються кількості сполуки за даним винаходом, достатньої для отримання бажаних фармакологічних або терапевтичних ефектів, таким чином, які призводять до ефективного лікування порушення. Лікування порушення може виявлятися в затримці або запобіганні початку або прогресуванню порушення, а також початку або прогресування 4 UA 108500 C2 5 10 15 20 25 30 35 40 45 50 55 симптомів, асоційованих з порушенням. Лікування порушення може також виявлятися в зниженні або усуненні симптомів, купіруванні прогресування порушення, а також в будь-якому іншому внеску в самопочуття пацієнта. Ефективна доза може варіювати залежно від чинників, таких як стан пацієнта, тяжкість симптомів порушення і способу введення фармацевтичної композиції. Як правило, для введення в ефективній дозі сполуки можуть бути введені в кількості менше 5 мг/кг маси пацієнта. Сполуки можна вводити в кількості приблизно від менше 1 мг/кг маси пацієнта приблизно до менше 100 мкг/кг маси пацієнта, і додатково приблизно від 1 мкг/кг до менше 100 мкг/кг маси пацієнта. Вказані вище ефективні дози, як правило, представляють таку кількість, яку можна вводити у вигляді одноразової дози або у вигляді однієї або більше доз, які можна вводити протягом періоду 24 годин. Сполуки за даним винаходом можуть бути отримані різними способами, включаючи загальноприйняті синтетичні способи. Ілюстративні загальні синтетичні способи описані нижче, а також конкретні сполуки за винаходом отримані в робочих прикладах. У описаних нижче прикладах для чутливих або реакційноздатних груп при необхідності використовують захисні групи згідно із загальними принципами синтетичної хімії. Захисними групами маніпулюють стандартними способами органічного синтезу (T.W. Green and P.G.M. Wuts (1999) Protecting Groups in Organic Synthesis, 3rd Edition, John Wiley & Sons, включена в даний опис за допомогою посилання щодо захисних груп). Ці групи видаляють на відповідній стадії синтезу сполуки способами, очевидними фахівцям в даній галузі. Вибір способу, а також умов реакції і порядку їх виконання, знаходиться відносно отримання сполук за даним винаходом. Даний винахід також стосується способу синтезу сполук, придатних як проміжних сполук при отриманні сполук за даним винаходом, а також способів їх отримання. Сполуки можна отримувати описаними нижче способами з використанням легкодоступних вихідних речовин і реагентів. У таких реакціях можна застосовувати модифікації, відомі фахівцям в даній галузі, але не описані детально в даному описі. Якщо не вказане інше, також мають на увазі, що описані в даному описі структури включають сполуки, відмінні тільки наявністю одного або більше ізотопно збагачених атомів. Сполуки, які мають дану структуру, за винятком заміни атома водню дейтерієм або тритієм або 13 14 заміни атома вуглецю C- або C-збагаченим вуглецем, входять в об'єм винаходу. Наприклад, дейтерій широко використовується для дослідження фармакокінетики і метаболізму біологічно активних сполук. Хоча дейтерій поводиться аналогічно водню з хімічної точки зору, існують значні відмінності в енергії зв'язків і довжині зв'язків між зв'язком дейтерій-вуглець і зв'язком водень-вуглець. Таким чином, заміна водню дейтерієм в біологічно активній сполуці може призводити до сполуки, яка, як правило, зберігає свою біохімічну активність і вибірковість, але виявляє значно відмінні властивості (ADME) абсорбції, розподілу, метаболізму і/або екскреції в порівнянні з її аналогом, який не містить ізотопу. Таким чином, заміна дейтерієм може призводити до поліпшеної ефективності лікарського засобу, безпеки і/або переносимості для деяких біологічно активних сполук. Сполуки за даним винаходом можуть кристалізуватися більше ніж в одній формі, властивість відома як поліморфізм, і такі поліморфні форми ("поліморфи") входять в об'єм даного винаходу. Поліморфізм, як правило, виникає у відповідь на зміни температури, тиску або того і іншого. Поліморфізм може також бути результатом варіацій в способі кристалізації. Поліморфи можуть відрізнятися за різними відомими в даній галузі фізичними характеристиками, такими як дифракційна рентгенограма, розчинність і температура плавлення. Певні сполуки, з тих, які описуються в даному описі, містять один або більше хіральних центрів або, в інших випадках, можуть існувати у вигляді численних стереоізомерів. У об'єм даного винаходу включені суміші стереоізомерів, а також очищені енантіомери або енантіомерно/діастеріомерно збагачені суміші. У об'єм винаходу також включені окремі ізомери сполук, представлених формулами за даним винаходом, а також їх будь-які повністю або частково урівноважені суміші. Даний винахід також включає окремі ізомери сполук, представлених вказаними вище формулами, у вигляді сумішей з їх ізомерами, в яких один або більше хіральних центрів є інвертованими. Коли сполука бажана у вигляді одного енантіомеру, то вона може бути отримана стереоспецифічним синтезом, шляхом розділення кінцевого продукту або будь-якої відповідної проміжної сполуки або методами хіральної хроматографії, як відомо в даній галузі. Розділення кінцевого продукту, проміжної сполуки або вихідної речовини можна провести будь-яким 5 UA 108500 C2 5 10 15 20 25 30 35 40 45 50 55 60 відомим в даній галузі відповідним способом. Див., наприклад, Stereochemistry of organic compounds (Wiley-Interscience, 1994). Даний винахід включає сіль або сольват описаних в даному описі сполук, включаючи їх комбінації, такі як сольват солі. Сполуки за даним винаходом можуть існувати в сольватованих, наприклад, гітратованих, а також несольватованих формах, і даний винахід включає всі такі форми. Як правило, але не обов'язково, солі за даним винаходом являють собою фармацевтично прийнятні солі. Солі, включені в термін "фармацевтично прийнятні солі" стосуються нетоксичних солей сполук за даним винаходом. Приклади відповідних фармацевтично прийнятних солей включають адитивні солі неорганічних кислот, такі як хлорид, бромід, сульфат, фосфат і нітрат; адитивні солі органічних кислот, такі як ацетат, галактарат, пропіонат, сукцинат, лактат, гліколят, малат, тартрат, цитрат, малеат, фумарат, метансульфонат, п-толуолсульфонат і аскорбат; солі з кислою амінокислотою, такі як аспартат і глутамат; солі лужних металів, такі як натрієва сіль і калієва сіль; солі лужноземельних металів, такі як магнієва сіль і кальцієва сіль; амонійна сіль; солі органічних основ, такі як сіль триметиламіну, сіль триетиламіну, сіль піридину, сіль піколіну, сіль дициклогексиламіну і сіль N,N'-дибензилетилендиаміну, і солі з основною амінокислотою, такі як сіль лізину і сіль аргініну. У деяких випадках, солі можуть являти собою гідрати або сольвати етанолу. Фахівцям в галузі органічної хімії буде очевидно, що багатьом органічним сполукам може бути присвоєно більше однієї систематичної назви. Об'єм даного винаходу не треба розглядати як недостатність наочності, внаслідок декількох потенційних назв, можливих для сполук. II. Загальні синтетичні способи Фахівцям в галузі органічного синтезу буде зрозуміло, що існують численні способи отримання сполук за даним винаходом, а також способи отримання сполук за даним винаходом, які мічені радіоактивним ізотопом, відповідним для різних застосувань. Один з способів отримання сполук за даним винаходом представлений на схемі 1 (див. приклади синтезу). Таким чином, норкамфор (2-норборнанон) може бути алкілований по сусідній карбонільній функціональній групі способами, добре відомими фахівцям в галузі органічного синтезу. Як правило, для таких перетворень застосовують обробку кетон сильною основою (наприклад, гідридом натрію, алкоксидом натрію, амідом натрію) з утворенням проміжної сполуки еноляту, з подальшою обробкою алкілгалогенідом або алкілсульфонатом. У певних умовах алкілування можна проводити α,ω-дигалоалканом (таким як 1,3-дибромпропан) з утворенням спірозв’язку. Хоча на схемі 1 показано утворення спіроциклобутану (сполуки II), інші розміри кілець (наприклад, спіроциклопентани) також можна отримувати таким чином з використанням інших α,ω-дигалогеналканів. Карбонільна функціональна група може бути потім перетворена в екзоциклічний метилен (сполуки III) реакцією Віттіга (або еквівалентної). Обробкою сполук екзометилену ціанідом водню (або схожими реагентами, такими як тіоціанати) в присутності сильної кислоти можна отримати відповідні третинні формамідосполуки способом, відомим як реакція Ріттера. Відновлення формамідосполуки з використанням гідридного відновника, такого як алюмогідрид літію або біс(метоксіетокси)алюмогідрид натрію, дає відповідний вторинний амін, сполуки IV. Альтернативно, також можна використовувати заміщені 2-норборнанони як вихідні речовини при перетвореннях, представлених на схемі 2. Таким чином, кожен з D-камфора і L-камфора (обидва комерційно доступні) можна перетворити в стереоізомери сполуки V. Інші вихідні речовини на основі кетонів також можна використовувати. Наприклад, гомолог 2-норборнанону біцикло[2.2.2]октан-2-ону можна отримати гідруванням біцикло[2.2.2]октан-5-ен-2-ону, який в свою чергу може бути отриманий за методиками, аналогічно опублікованих Kozikowski and Schmiesing в J. Org. Chem. 48: 1000-1007 (1983), включеної в даний опис за допомогою посилання щодо такої реакції. Аналогічно, 7-оксабіцикло[2.2.1]гепт-5-ен-2-он, отриманий, як описано у Black and Vogel, в Helv. Chim. Acta 67: 1612 (1984), включеної в даний опис за допомогою посилання щодо такої реакції, може бути підданий гідруванню, з отриманням 7оксабіцикло[2.2.1]гептан-2-ону. Кожен з цих кетонів являє собою потенційну вихідну речовину для перетворення, подібно до представлених на схемах 1 і 2. Спіроциклопропанову функціональну групу можна встановити з використанням реакції Сімонса-Сміта і подібних реакцій. Таким чином, взаємодією 3-мителен-2-норборнанону з дийодметаном в присутності пари цинк-мідь отримують спіро[біцикло[2.2.1]гептан-2,1'циклопропанол]-3-он, який потім можна перетворити в сполуки за даним винаходом із застосуванням описаних вище реакцій. Певні сполуки, які містять спіроциклопропани, відомі в 6 UA 108500 C2 5 літературі, а також служать як вихідна точка синтезу сполук за даним винаходом. Див., наприклад, статтю Gream and Pincombe, Aust. J. Chem, 27: 543-585 (1974), включену в даний опис за допомогою посилання щодо такої реакції. Другорядні аміни, такі як сполуки IV і V, можна перетворити в третинні аміни з проміжним утворенням амідів і карбаматів. Таким чином, послідовною обробкою таких сполук ди-третбутилдикарбонатом і алюмогідридом літію отримують відповідний третинний N-метиламін. Схема I 10 Схема II 15 20 25 30 35 40 45 Також можливе введення конкретних радіоактивних ізотопів. Наприклад, відновленням амідів і карбаматів алюмодейтеридом літію або алюмітитридом літію як відновників можна отримати N-тридейтерометиламіни або N-тритритіометиламіни. Альтернативно, з генерації 11 13 14 аміду або карбамату, в якій карбонільний вуглець являє собою атом C, C або C, з 11 13 подальшим відновленням алюмогідридом літію отримують амін з вбудованим атомом C, C 14 або C, відповідно. При отриманні сполук, які необхідно використати в діагностиці (наприклад, як засоби візуалізації) або при дослідженнях функцій і метаболізму, часто бажане введення конкретних радіоактивних ізотопів. III. Фармацевтичні композиції Хоча можливо введення сполуки за даним винаходом в формі сукупної активної хімічної речовини, переважно вводити сполуки в формі фармацевтичної композиції або складу. Таким чином, один аспект даного винаходу стосується фармацевтичних композицій, які містять одну або більше сполук формули I і/або їх фармацевтично прийнятні солі і один або більше фармацевтично прийнятних носіїв, розріджувачів або ексципієнтів. Інший аспект винаходу стосується способу отримання фармацевтичної композиції, яка включає змішування однієї або більше сполук формули I і/або їх фармацевтично прийнятні солі з одним або більше фармацевтично прийнятними носіями, розріджувачами або ексципієнтами. Спосіб, яким вводиться сполука за даним винаходом, може бути різним. Сполуку за даним винаходом переважно вводять перорально. Переважні фармацевтичні композиції для перорального введення включають таблетки, капсули, каплети, сиропи, розчини і суспензії. Фармацевтичні композиції за даним винаходом можуть бути надані в дозованих формах з модифікованим вивільненням, таким як склади таблеток і капсул з уповільненим вивільненням. Фармацевтичні композиції також можна вводити за допомогою ін'єкції, а саме: внутрішньовенно, внутрішньом'язово, підшкірно, інтраперитонеально, внутрішньоартеріально, інтратекально і інтрацеребровентрикулярно. Внутрішньовенне введення є переважним способом ін'єкції. Відповідні носії для ін'єкції добре відомі фахівцям в даній галузі і включають 5 % розчини декстрози, фізіологічний розчин і забуферений фосфатом сольовий розчин. Склади також можна вводити іншими способами, наприклад, ректальним введенням. Придатні для ректального введення склади, такі як супозиторії, добре відомі фахівцям в даній галузі. Сполуки також можна вводити за допомогою інгаляції, наприклад, в формі аерозолю; місцево, наприклад, в формі лосьйону; трансдермально, наприклад, з використанням трансдермального пластиру (наприклад, із застосуванням комерційно доступної технології від Novartis and Alza Corporation), за допомогою порошкової ін'єкції або за допомогою букального, сублінгвального або інтраназального всмоктування. 7 UA 108500 C2 5 10 15 20 25 30 35 40 45 50 55 Фармацевтичні композиції можна формулювати в одиничній дозованій формі або в формі багаторазових або субодиничних доз. Введення фармацевтичних композицій, які описуються в даному описі може бути періодичним або поетапним, безперервним шляхом, постійним або, який контролюється. Фармацевтичні композиції можна вводити теплокровній тварині, наприклад, ссавцеві, такому як миша, щур, кішка, кролик, собака, свиня, корова або мавпа, але переважно вводити людині. Крім того, час доби і кількість разів на добу введення фармацевтичної композиції можна змінювати. Сполуки за даним винаходом можна використовувати при лікуванні ряду порушень і станів, і, по суті, їх можна використовувати в комбінації з рядом інших відповідних терапевтичних засобів, придатних для лікування або профілактики таких порушень або станів. Таким чином, один з варіантів здійснення даного винаходу стосується введення сполуки за даним винаходом в комбінації з іншими терапевтичними сполуками. Наприклад, сполуки за даним винаходом можна використовувати в комбінації з іншими лігандами NNR (такими як вареніклін), алостеричними модуляторами NNR, антиоксидантами (такими як засоби, які вловлюють вільні радикали), антибактеріальними засобами (такими як пеніцилінові антибіотики), противірусними засобами (такими як аналоги нуклеозидів, як зидовудин і ацикловір), антикоагулянтами (такими як варфарін), протизапальними засобами (такими як NSAID), антипіретиками, анальгетиками, анестетиками (такими як використовуються в хірургії), інгібіторами ацетилхолінестерази (такими як донепезил і галантамін), антипсихотичними засобами (такими як галоперидол, клозапін, оланзапін і кветіапін), імунодепресантами (такими як циклоспорин і метотрексат), нейропротективними засобами, стероїдами (такими як стероїдні гормони), кортикостероїдами (такими як дексаметазон, преднізон і гідрокортизон), вітамінами, мінералами, нутріцевтиками, антидепресантами (такими як іміпрамін, флуоксетин, пароксетин, екситалопрам, сертралін, венлафаксин і дулоксетин), анксіолітиками (такими як алпразолам і буспірон), протисудомними засобами (такими як фенітоїн і габапентин), судинорозширювальними засобами (такими як празозин і силденафіл), стабілізаторами настрою (такими як вальпроат і арипіпразол), протипухлинними засобами (такими як антипроліферативні), антигіпертензивними засобами (такими як атенолол, клонідин, амлопідин, верапаміл і олмесартан), проносним, пом’якшувачами випорожнення, діуретиками (такими як фуросемід), антиспазматичними засобами (такими як дицикломін), антидискінетичними засобами і противиразковими лікарськими засобами (такими як езомерпазол). Такі комбінації фармацевтично активних засобів можна вводити спільно або окремо, і введення можна провести одночасно або послідовно в будь-якому порядку при окремому введенні. Кількість сполук або засобів і відносні строки введення вибирають для отримання бажаного терапевтичного ефекту. Введення сполуки за даним винаходом з іншими лікарськими засобами можна провести в комбінації супутнім введенням (1) однієї фармацевтичної композиції, яка містить обидві сполуки або (2) окремих фармацевтичних композицій, де кожна містить одну сполуки. Альтернативно, комбінацію сполук можна вводити окремо послідовним способом, де один лікарський засіб вводять першим, а інший - другим. Таке послідовне введення може бути близьким за часом або віддаленим за часом. Інший аспект даного винаходу стосується комбінованого лікування, яке включає введення індивідууму терапевтично або профілактично ефективної кількості сполуки за даним винаходом і одну або більше інших терапій, включаючи хіміотерапію, променеву терапію, генотерапію або імунотерапію. IV. Спосіб застосування фармацевтичних композицій Сполуки за даним винаходом можна використовувати для запобігання або лікування різних станів або порушень, для яких запропоновані інші типи нікотинових сполук або показана їх придатність як терапевтичних засобів, таких як порушення ЦНС, запалення, запальна відповідь, асоційована з бактеріальною і/або вірусною інфекцією, біль, метаболічний синдром, аутоімунні порушення, залежність, ожиріння або інші порушення, описані більш детально в даному описі. Такі сполуки також можна використовувати як діагностичний засіб (in vitro і in vivo). Такі терапевтичні і інші способи описані, наприклад, в перерахованих вище в даному описі посиланнях, включаючи Williams et al., Drug News Perspec. 7(4): 205 (1994), Americ et al., CNS Drug Rev. 1(1): 1-26 (1995), Americ et al., Exp. Opin. Invest. Drugs 5(1): 79-100 (1996), Bencherif et al., J. Pharmacol. Exp. Ther. 279: 1413 (1998), Lippiello et al., J. Pharmacol. Exp. Ther. 279: 1422 (1996), Damaj et al., J. Pharmacol. Exp. Ther. 291: 390 (1999), Chiari et al., Anesthesiology 91: 1:447 (1999), Lavand'homme and Eisenbach, Anesthesiology 91: 1455 (1999), Holladay et al., J. Med. Chem. 40(28): 4189-94 (1997), Bannon et al., Science 279: 77 (1998), PCT WO 94/08992, PCT WO 8 UA 108500 C2 5 10 15 20 25 30 35 40 45 50 55 60 96/31475, PCT WO 98/40682 і патент США 5583140 на ім'я Bencherif et al., 5597919 на ім'я Dull et al., 5604231 на ім'я Smith et al. і 5852041 на ім'я Cosford et al. Порушення ЦНС Сполуки і їх фармацевтичні композиції придатні для лікування або запобігання ряду порушень ЦНС, включаючи нейродегенеративні порушення, психоневрологічні порушення, неврологічні порушення і залежність. Сполуки і їх фармацевтичні композиції можна застосовувати при лікуванні або запобіганні когнітивного дефіциту і когнітивних дисфункцій, пов'язаних з віком і інших; порушення уваги і деменції, включаючи викликані збудниками інфекцій або порушеннями обміну речовин; для забезпечення нейропротекції; при лікуванні судом і множинних церебральних інфарктів; при лікуванні порушень настрою, компульсивної поведінки і адиктивної поведінки; при знеболюванні; для регуляції запалення, такого як опосередкованого цитокінами і ядерним фактором каппа В; при лікуванні запальних порушень; для полегшення болю і при лікуванні інфекцій, як протиінфекційних засобів для лікування бактеріальних, грибкових і вірусних інфекцій. Серед порушень, захворювань і станів, для лікування або запобігання яких можна використовувати сполуки і фармацевтичні композиції за даним винаходом, виділяють: вікове порушення пам'яті (AAMI), помірне когнітивне порушення (MCI), пов'язане з віком зниження когнітивної функції (ARCD), пресенільну деменцію, хворобу Альцгеймера з раннім початком, сенільну деменцію, деменцію типу Альцгеймера, хворобу Альцгеймера, когнітивне порушення без деменції (CIND), деменцію з тільцями Леві, асоційовану з ВІЛ деменцію, комплекс СНІД-деменція, судинну деменцію, синдром Дауна, травму голови, травматичне пошкодження головного мозку (TBI), деменцію боксерів, хворобу КрейцфельдаЯкоба і пріонні хвороби, інсульт, центральну ішемію, периферичну ішемію, розлад дефіциту уваги, синдром дефіциту уваги з гіперактивністю, дислексію, шизофренію, шизофреноформний розлад, шизоафективний розлад, когнітивну дисфункцію при шизофренії, когнітивний дефіцит при шизофренії, паркінсонізм, включаючи хворобу Паркінсона, постенцефалітичний паркінсонізм, комплекс паркінсонізм-деменцію острова Гуам, лобово-скроневу деменцію за типом хвороби Паркінсона (FTDP), хворобу Піка, хворобу Німанна-Піка, хворобу Хантінгтона, хорею Хантінгтона, дискінезію, пізню дискінезію, спастичну дискінезію, гіперкінезію, прогресуючий супрануклеарний параліч, прогресуючий супрануклеарний парез, синдром втомлених ніг, хворобу Крейтцфельда-Якоба, розсіяний склероз, бічний аміотрофічний склероз (ALS), хворобу мотонейронів (MND), множинну системну атрофію (MSA), кортико-базальну дегенерацію, синдром Гійєна-Барре (GBS) і хронічну запальну демієлінізуючу полінейропатію (CIDP), епілепсію, аутосомно-домінантну нічну лобову епілепсію, манію, тривожність, депресію, включаючи великий депресивний розлад (MDD), передменструальну дисфорію, панічні розлади, булімію, анорексію, нарколепсію, надлишкову денну сонливість, біполярні розлади, генералізований тривожний розлад, обсесивно-компульсивний розлад, приступи агресії, розлад поведінки, викликаючий опозиційний розлад, синдром Туретта, аутизм, наркотичну і алкогольну залежність, тютюнозалежність і, таким чином, придатний як засіб для припинення паління, компульсивне переїдання і сексуальну дисфункцію. Когнітивні порушення або дисфункції можуть бути асоційовані з психіатричними розладами або станами, такими як шизофренія і інші психотичні розлади, включаючи, але, не обмежуючись ними, психотичний розлад, шизофреноформний розлад, шизоафективний розлад, маревний розлад, короткочасні психічні розлади, індукований психотичний розлад і психотичні розлади, зумовлені загальним медичним станом, деменції і інші когнітивні порушення, включаючи, але, не обмежуючись ними, помірне когнітивне порушення, пресенільну деменцію, хворобу Альцгеймера, сенільну деменцію, деменцію типу Альцгеймера, пов'язана з віком порушення пам'яті, деменцію з тільцями Леві, судинну деменцію, комплекс СНІД-деменція, дислексію, паркінсонізм, включаючи хворобу Паркінсона, когнітивне порушення і деменцію при хворобі Паркінсона, когнітивне порушення при неуважному склерозі, когнітивне порушення, викликане травматичним пошкодженням головного мозку, деменції, зумовлені загальним медичним станом, тривожні розлади, включаючи, але, не обмежуючись ними, панічний розлад без агорафобії, панічний розлад з агорафобією, агорафобію без панічного розладу в історії хвороби, специфічну фобію, соціофобію, обсесивно-компульсивний розлад, посттравматичний стрес, гострий стресовий розлад, генералізований тривожний розлад і генералізований тривожний розлад, зумовлений загальним медичним станом, порушення настрою, включаючи, але, не обмежуючись ними, великий депресивний розлад, дистимію, біполярну депресію, біполярну манію, біполярне порушення I, депресію, асоційовану з манією, депресивні і інші епізоди, біполярне порушення II, циклотимічний розлад і порушення настрою, зумовлені соматичними захворюваннями, розлади сну, включаючи, але, не обмежуючись ними, дисомнії, первинне безсоння, первинну гіперсомнію, нарколепсію, порушення сну, страхітливе 9 UA 108500 C2 5 10 15 20 25 30 35 40 45 50 55 сновидіння, порушення сну, пов'язане зі страхом, і лунатизм, затримку розумового розвитку, розладу навчання, порушення рухових навичок, комунікативні розлади, первазивні розлади розвитку, дизраптивні розлади поведінки і дефіцитарні розлади уваги, синдром дефіциту уваги, синдром дефіциту уваги з гіперактивністю, розлади харчування і харчової поведінки у дітей молодшого віку, дитячого віку або у дорослих, тікові розлади, порушення обміну речовин, залежність від речовин, включаючи, але, не обмежуючись ними, наркотичну залежність і токсикоманію, зловживання наркотиками, наркотичну інтоксикацію, абстинентний синдром, розлади, пов'язані зі зловживанням алкоголю, пов'язані зі зловживанням амфетаміну або подібних амфетаміну речовин, розлади, пов'язані зі зловживанням кофеїну, розлади, пов'язані зі зловживанням марихуани, розлади, пов'язані зі зловживанням кокаїну, розлади, пов'язані зі зловживанням галюциногенів, розлади, пов'язані зі зловживанням летючих препаратів, розлади, пов'язані зі зловживанням нікотину, розлади, пов'язані зі зловживанням опіоїдів, розлади, пов'язані зі зловживанням фенциклідину або подібних фенциклідину речовин, і розлади, пов’язані зі зловживанням седативних, снотворних засобів або анксіолітиків, розлади особистості, включаючи, але, не обмежуючись ними, обсесивно-компульсивний розлад особистості і розлади спонукань. Когнітивну функцію можна оцінювати по валідизованій шкалі оцінки когнітивних здібностей, такій як, наприклад, допоміжна шкала оцінки когнітивних здатностей шкали оцінки хвороби Альцгеймера (ADAS-cog). Одне з вимірювань ефективності сполук за даним винаходом в поліпшенні пізнавальної здатності може включати вимірювання величини зміни у пацієнта по такій шкалі. Відносно компульсивної і адиктивної поведінки сполуки за даним винаходом можна використовувати як терапію нікотинової залежності, включаючи як засоби для припинення паління, і інших порушень головного мозку, пов'язаних із задоволенням, таких як залежність від речовин, включаючи алкогольну залежність, залежність від незаконних і прописаних лікарських засобів, розлади харчової поведінки, включаючи ожиріння, і поведінкову залежність, таку як пристрасть до азартної гри або інші схожі поведінкові вияви залежності. Вказані вище стани і порушення детально описані, наприклад, в American Psychiatric Association: Diagnostic and Statistical Manual of Mental Disorders, Fourth Edition, Text Revision, Washington, DC, American Psychiatric Association, 2000. У цьому довіднику також можна знайти більш докладну інформацію про симптоми і діагностичні ознаки, асоційовані з використанням речовин, зловживанням і залежністю. Запалення Відомо, що нервова система, переважно блукаючий нерв, регулюють величину природної імунної відповіді, інгібуючи вивільнення фактора некрозу пухлини (TNF) макрофагами. Цей фізіологічний механізм відомий як "холінергічний протизапальний шлях" (див., наприклад, Tracey, "The-Inflammatory Reflex", Nature 420: 853-9 (2002)). Надмірне запалення і синтез фактора некрозу пухлини є причиною захворюваності і навіть смертності при ряді захворювань. Ці захворювання включають, але не обмежуються ними, ендотоксикоз, ревматоїдний артрит, остеоартрит, псоріаз, астму, атеросклероз, ідіопатичний легеневий фіброз і запальне захворювання кишечнику. Запальні стани, які можна лікувати або запобігати введенням сполуки, яка описується в даному описі, включають, але не обмежуються ними, хронічне і гостре запалення, псоріаз, ендотоксикоз, подагру, гостру псевдоподагру гострий подагричний артрит, артрит, ревматоїдний артрит, остеоартрит, відторгнення алотрансплантату, хронічне відторгнення трансплантату, астму, атеросклероз, пошкодження легень, зумовлені монуклеарними фагоцитами, ідиопатичний легеневий фіброз, атопічний дерматит, хронічне обструктивне захворювання легень, респіраторний дистрес-синдром дорослих, гострий грудний синдром, запальне захворювання кишечнику, синдром подразненого кишечнику, включаючи переважання діареї IBS, хворобу Крона, виразки, виразковий коліт, гострий холангіт, афтозний стоматит, кахексію, паучит, гломерулонефрит, вівчаковий нефрит, тромбоз і реакцію трансплантат проти хазяїна. Асоційована з бактеріальною і/або вірусною інфекцією запальна відповідь Багато які бактеріальні і/або вірусні інфекції асоційовані з побічними ефектами, викликаними утворенням токсинів і природною реакцією організму на бактерії або вірус і/або токсини. Як зазначено вище, реакція організму на інфекцію часто призводить до утворення істотної кількості TNF і/або інших цитокінів. Підвищена експресія цих цитокінів може спричиняти значне пошкодження, таке як септичний шок (коли бактерії викликають сепсис), ендотоксичний шок, уросепсис, вірусна пневмонія і синдром токсичного шоку. 10 UA 108500 C2 5 10 15 20 25 30 35 40 45 50 55 Ці сполуки також можна використовувати як допоміжну терапію в комбінації з існуючими препаратами для лікування бактеріальних, вірусних і грибкових інфекцій, такими як антибіотики, противірусні і протигрибкові засоби. Також можна використовувати антитоксини для зв’язування токсинів, утворених збудниками інфекції, і для забезпечення проходження зв'язаних токсинів через організм, не викликаючи запальної відповіді. Приклади антитоксинів описані, наприклад, в патенті США 6310043 на ім'я Bundle et al. Інші ефективні проти бактеріальних і інших токсинів засоби можуть бути ефективними, і їх терапевтичний ефект можна доповнити спільним введенням із сполуками, які описуються в даному описі. Біль Сполуки можна вводити для лікування і/або запобігання болю, включаючи гострий, невралгічний, запальний, нейропатичний і хронічний біль. Сполуки можна використовувати в поєднанні з опіатами для зниження ймовірності виникнення залежності від опіатів (наприклад, зберігаюча морфін терапія). Аналгетична дія сполук, яка описуються в даному описі може бути продемонстрована на моделях постійного запального болю і нейропатичного болю, проведених, як описано в опублікованій патентній заявці США № 20010056084 A1 (Allgeier et al.) (наприклад, механічна гіпералгезія на моделі запального болю у щура з повним ад’ювантом Фрейнда, і механічна гіпералгезія на моделі нейропатичного болю у миші з частковим лігуванням седативного нерва). Аналгетичний ефект підходить для лікування болю різного генезису або етіології, зокрема для лікування запального болю і асоційованої гіпералгезії, нейропатичного болю і асоційованої гіпералгезії, хронічного болю (наприклад, сильного хронічного болю, післяопераційного болю і болю, асоційованого з різними станами, включаючи рак, ангіну, ниркоподібну або печінкову коліку, менструацію, мігрень і подагру). Запальний біль може бути різного генезису, включаючи артрит і ревматоїдне захворювання, теносиновіт і васкуліт. Нейропатичний біль включає невралгію трійникового нерва або герпесну невралгію, нейропатії, такий як нейропатичний біль при діабеті, каузалгія, поперекова біль і синдроми деаферентації, такий як розрив плечового зчеплення. Неоваскуляризація Інгібуючі неоваскуляризації, наприклад, введенням антагоністів (або часткових агоністів при певних дозуваннях) нікотинових рецепторів можна лікувати або запобігати станам, які характеризуються небажаною неоваскуляризацією або ангіогенезом. Такі стани можуть включати стани, які характеризуються запальним ангіогенезом і/або викликаним ішемією ангіогенезом. Також можна інгібувати асоційовану із ростом пухлини неоваскуляризацію за допомогою введення таких сполук, які описуються в даному описі, які діють як антагоністи або часткові агоністи нікотинових рецепторів. Вибірковий антагонізм нікотинових рецепторів знижує ангіогенну відповідь при запаленні, ішемії і неоплазії. Посібник відносно відповідних систем тваринних моделей для оцінки сполук, які описуються в даному описі можна знайти, наприклад, у Heeschen C. et al., в "А novel angiogenic pathway mediated by non-neuronal nicotinic acetylcholine receptors", J. Clin. Invest. 110(4):527-36 (2002). Конкретні види пухлин, які можна лікувати застосуванням сполук, які описуються в даному описі, включають SCLC, NSCLC, рак яєчників, рак підшлункової залози, карциному молочної залози, карциному товстої кишки, карциному прямої кишки, карциному легень, карциному мезофаринксу, карциному гіпофаринксу, карциному стравоходу, карциному шлунка, карциному підшлункової залози, карциному печінки, карциному жовчного міхура, карциному жовчних протоків, карциному тонкого кишечнику, карциному сечовивідних шляхів, карциному нирки, карциному сечового міхура, карциному уротелію, карциному жіночих статевих шляхів, карциному шийки матки, карциному матки, карциному яєчників, хоріокарциному, гестаційне трофобластичне захворювання, карциному чоловічих статевих шляхів, карциному передміхурової залози, карциному сім’яних пухирців, карциному сім’яників, герміноми, карциному ендокринних залоз, карциному щитовидної залози, карциному надниркових залоз, карциному гіпофіза, карциному шкіри, гемангіоми, меланоми, саркоми, саркому кістки і м'яких тканин, саркому Капоші, пухлини головного мозку, пухлини нервів, пухлини очей, пухлини оболонок головного мозку, астроцитоми, гліоми, гліобластоми, ретинобластоми, невроми, нейробластоми, шваноми, менінгіоми, солідні пухлини, зумовлені гемопоетичними злоякісними новоутвореннями (такими як лейкоз, хлороми, плазмоцитоми і бляшки і пухлини грибоподібного мікозу і шкірна Т-клітинна лімфома/лейкоз) і солідні пухлини, зумовлені лімфомами. Сполуки також можна вводити в поєднанні з іншими формами лікування злоякісних пухлин, включаючи спільне введення з антибластомними протипухлинними засобами, такими як 11 UA 108500 C2 5 10 15 20 25 30 35 40 45 50 55 60 цисплатин, адріаміцин, дауноміцин і т.п., і/або засобами, які інгібують VEGF (фактор росту ендотелію судин), такими як відомі в даній галузі. Сполуки можуть бути введені таким способом, що вони націлені на ділянку локалізації пухлини. Наприклад, сполуки можна вводити в мікросферах, мікрочастинках або ліпосомах, кон’югованих з різними антитілами, які направляють мікрочастинки до пухлини. Додатково, сполуки можна вміщувати в мікросфери, мікрочастинки або ліпосоми, яким надають відповідний розмір для проходження через артерії і вени, але депонування в капілярних шарах, навколишніх пухлини, і локального введення сполуки в пухлину. Такі засоби доставки лікарських засобів відомі в даній галузі. Інші порушення У доповнення до лікування порушень ЦНС, запалення, неоваскуляризації і болі сполуки за даним винаходом також можна використовувати для запобігання і лікування інших певних станів, захворювань і порушень,в яких NNR відіграють деяку роль. Приклади включають аутоімунні порушення, такі як вівчак, асоційовані з вивільненням цитокінів порушення, кахексію на фоні інфекції (наприклад, яка виникає при СНІД, СНІД-асоційованому комплексі і неоплазіях), ожиріння, пемфігус, нетримання сечі, гіперактивність сечового міхура (OAB), діарею, запор, захворювання сітківки ока, інфекційні захворювання, міастенію, синдром Ітона-Ламберта, гіпертензію, прееклампсію, остеопороз, вазоконстрикцію, вазодилатацію, аритмії серця, діабет типу I, діабет типу II, булімію, анорексію і сексуальну дисфункцію, а також такі показання, як описано в опублікованій заявці PCT WO 98/25819. Сполуки за даним винаходом також можна вводити для лікування судом, таких, які є клінічним виявом епілепсії, і для лікування станів, таких як сифіліс і хвороба Крейтцфельдта-Якоба. Сполуки за даним винаходом можна використовувати для лікування бактеріальних інфекцій і шкіряних станів, таких як листоподібна пухирчатка, звичайна пухирчатка і інші порушення, такі як акантоліз, де присутня аутоімунна відповідь з високим титром антитіл NNR гангліозного підтипу. При цих порушеннях і при інших аутоімунних захворюваннях, таких як міастенія, фрагмент Fab антитіла зв'язується з рецептором NNR (зшиваючи 2 рецептори), який індукує інтерналізацію і руйнування. Застосування в діагностиці Сполуки можна застосовувати в діагностичних композиціях, таких як зонди, зокрема, коли їх модифікують для введення відповідних міток. Для цієї мети сполуки за даним винаходом 11 найбільш переважно мітити радіоактивним ізотопом C. Введені сполуки можна детектувати за допомогою позитронно-емісійної томографії (PET). Для візуалізації вибраного підтипу рецептору при ненасичених концентраціях бажана висока специфічна активність. Дози, які вводяться, як правило, нижчі межі токсичності і забезпечують висококонтрастні зображення. Приблизно можливо вводити сполуки на нетоксичних рівнях. Визначення дози проводять способом, відомим фахівцеві в галузі отримання зображень з радіоактивною міткою. Див., наприклад, патент США 5989144 на ім'я London et al. Сполуки можна вводити відомими способами. Див., наприклад, патент США 5969144 на ім'я London et al., як зазначено вище. Сполуки можна вводити до складу композицій, які містять інші інгредієнти, такі як типи інгредієнтів, які придатні для формулювання діагностичної композиції. Найбільш переважно, сполуки, придатні відносно здійснення даного винаходу, використовують в формах високого ступеня очищення. Див., патент США 5853696 на ім'я Elmalch et al. Після введення сполук індивідууму (наприклад, людині) наявність сполуки всередині індивідуума можна візуалізувати і кількісно визначити відповідними способами для реєстрації наявності, кількісного визначення і функціональних характеристик. У доповнення до введення людям сполуки також можна вводити тваринам, таким як миші, пацюки, собаки і мавпи. Отримання зображень SPECT і PET можна провести будь-яким відповідним способом і з використанням будь-якого відповідного приладу. Для інформації про конкретні способи отримання зображення див. Villemagne et al.,. в Arnerie et al. (Eds.) Neuronal Nicotinic Receptors: Pharmacology and Therapeutic Opportunities, 235-250 (1998) і в патенті США 5853696 на ім'я Elmalch et al., кожен включений в даний опис за допомогою посилання. V. Приклади синтезу Приклад 1. Екзо-N,3-диметилспіро[біцикло[2.2.1]гептан-2,1'-циклобутан]-3-амін До розчину 2-норборнанону (норкамфору) (16,0 г, 145 ммоль) і 1,3-дибромпропану (203 ммоль, 20,7 мл, 41,1 г) в простому діетиловому ефірі (450 мл) додавали амід натрію (363 ммоль, 14,8 г) і перемішували суміш при кип’ятінні зі зворотним холодильником протягом 24 годин. Суміш виливали в 200 мл крижаної води і відділяли органічний шар. Водяний шар екстрагували 200 мл простого ефіру. Об'єднані екстракти простого ефіру концентрували і переганяли рідкий залишок при 60-100 °C при 10-20 мм рт. ст. вакууму, з отриманням 14 г 12 UA 108500 C2 5 10 15 20 25 30 35 40 45 50 55 60 неочищеного продукту. Його розчиняли в 150 мл гексану і перемішували з розчином перманганату калію (12,0 г, 75,9 ммоль) у воді (150 мл) протягом 5 годин. Двофазну суміш фільтрували через шар діатомової землі, яку потім промивали гексаном (100 мл). Гексановий шар відділяли і екстрагували водний шар 600 мл гексану. Гексанові шари об'єднували, концентрували і очищали на колонці з силікагелем, елююючи 10-40 % простим ефіром в гексані, з отриманням спіро[біцикло[2.2.1]гептан-2,1'-циклобутан]-3-ону (сполука II на схемі 1) (6,1 г, 28 % виходу) у вигляді масла. 1 H ЯМР (CDCl3, 400 МГц): δ 2,55-2,49 (м, 2H), 2,18-2,08 (м, 2H), 2,00-1,58 (м, 7H), 1,49-1,38 (м, 3H); РХМС (m/z): 151 (M+1). До суспензії (метил)трифенілфосфонійброміду (49,9 ммоль, 18,2 г) в безводному тетрагідрофурані (ТГФ) (100 мл) при -78 °C додавали н-бутилітій (48,5 ммоль, 18,6 мл 2,5М розчину в гексані). Суміш перемішували протягом 30 хв при -78 °C. До отриманої суміші додавали спіро[біцикло[2.2.1]гептан-2,1'-циклобутан]-3-он (5,00 г, 33,3 ммоль). Отриману суміш перемішували при температурі навколишнього середовища протягом 20 годин. Додавали гексан (300 мл) і фільтрували суміш. Фільтрати концентрували і залишок очищали на колонці з 80 г силікагелю, елююючи гексаном, з отриманням 3-метиленспіро[біцикло[2.2.1]гептан-3-ону (сполука III на схемі 1) (3,7 г, 75 %) у вигляді масла. 1 H ЯМР (CDCl3, 400 МГц): δ 4,82 (с, 2H), 2,63 (ушир.с, 1H), 2,22 (ушир.с, 1H), 2,05-1,78 (м, 6H), 1,63-1,52 (м, 1H), 1,48-1,34 (м, 3H), 1,21-1,12 (м, 2H). До суспензії 3-метиленспіро[біцикло[2.2.1]гептан-2,1'-циклобутану] (2,10 г, 14,2 ммоль) і тіоціанату калію (14,2 ммоль, 1,39 г) повільно додавали розчин сірчаної кислоти (1,40 г, 14,3 ммоль) у воді (0,52 мл) протягом 15 хв при 50 °C, перемішували розчин при 85 °C протягом 5,5 годин. Розчин охолоджували до температури навколишнього середовища, розбавляли толуолом (20 мл) і послідовно промивали водою (20 мл) і насиченим водним бікарбонатом натрію (10 мл). Толуоловий шар збирали, сушили в надлишку безводного сульфату натрію і фільтрували. До фільтрату додавали натрийбіс(метоксіетокси)алюмінійгідрид (28 ммоль, 7,9 мл 65-70 % розчину в толуолі) і отриману суміш перемішували при 85 °C протягом 2 годин. Суміш охолоджували до 0 °C і суміш 3 н. водного гідроксиду натрію (3 мл) і 5 % гіпохлориту натрію (15 мл) повільно по краплях додавали через певні проміжки часу. Толуоловий шар відділяли і промивали водою (30 мл), потім екстрагували толуоловий шар 1 н. водною хлористоводневою кислотою (2×10 мл). Видаляли толуоловий шар, і об'єднані екстракти хлористоводневої кислоти робили основними додаванням 10 % водного гідроксиду натрію (до pH 10). Основну водну суміш екстрагували простим ефіром (2×30 мл). Екстракти простого ефіру збирали, концентрували і очищали колонковою хроматографією на силікагелі, елююючи 0-40 % CMA (хлороформ:метанол:30 % водний аміак, 9:1:0,1) в хлороформі, з отриманням екзо-N, 3диметилспіро[біцикло[2.2.1]гептан-2,1'-циклобутан]-3-аміну (0,38 г, 15 % вихід) (сполука IV на схемі 1) у вигляді масла. Масло розчиняли в 5 мл дихлорметану, охолоджували на крижаній бані і об'єднували з 2 мл 6M водної хлористоводневої кислоти. Суміш концентрували і сушили у вакуумі, з отриманням гідрохлоридної солі. 1 H ЯМР (D2O, 400 МГц): δ 2,41 (с, 3H), 2,24-2,18 (м, 2H), 1,98-1,90 (м, 1H), 1,82-1,74 (м, 1H), 1,67-1,58 (м, 2H), 1,52-1,11 (м, 8H), 0,95 (с, 3H); РХМС (m/z): 180 (M+1). Екзостереохімію визначали ЯМР. Приклад 2. Розділення хіральною хроматографією екзо-N,3диметилспіро[біцикло[2.2.1]гептан-2,1'-циклобутан]-3-аміну Екзо-N,3-диметилспіро[біцикло[2.2.1]гептан-2,1'-циклобутан]-3-амін (2,0 г) розчиняли в 20 мл ацетонітрилу і розділяли в 0,2 мл вприсків на хіральній колонці (Chiral Pak AD-H, 5 мікрометрів, 250×20 см) з використанням 0,2 % діетиламіну в суміші ацетонітрил/ізопропанол (95:5), з швидкістю потоку 10 мл/хв. Фракції, які містять пік 1 (початкове елюювання) і пік 2 (пізнє елюювання), окремо концентрували. Два залишки розчиняли окремо в 10 мл дихлорметану, обробляли 2 мл 6н. водної хлористоводневої кислоти і концентрували насухо. Маса продуктів гідрохлоридних солей становила 0,74 г (пік 1) і 0,48 г (пік 2), відповідно. Приклад 3. N,3-диметилспіро[біцикло[2.2.1]гептан-2,1'-циклопентан]-3-амін До розчину 2-норборнанону (25,0 г, 227 ммоль) і 1,4-дибромбутану (68,0 г, 317 ммоль) в простому діетиловому ефірі (700 мл) додавали амід натрію (23,1 г, 567 ммоль). Отримані суміші нагрівали при кип’ятінні зі зворотним холодильником протягом 24 годин, охолоджували і виливали в 200 мл крижаної води. Органічний шар збирали і екстрагували водний шар 200 мл простого діетилового ефіру. Об'єднані екстракти простого діетилового ефіру концентрували, і залишок переганяли при 65-80 °C при 7-15 мм рт. ст., з отриманням 19 г неочищеного продукту. Його розчиняли в гексані (500 мл) і перемішували з водним перманганатом калію (30 г, 0,19 моль, в 500 мл) протягом 5 годин. Суміш фільтрували і збирали гексановий шар. Водний шар 13 UA 108500 C2 5 10 15 20 25 30 35 40 45 50 55 60 екстрагували 600 мл гексану. Об'єднані гексанові шари концентрували і очищали залишок на колонці з силікагелем, елююючи 5-15 % етилацетатом в гексані, з отриманням спіро[біцикло[2.2.1]гептан-2,1'-циклопентан]-3-ону (12,6 г, 33,8 %) у вигляді масла. 1 H ЯМР (CDCl3, 400 МГц): δ 2,56 (д, J=5,1 Гц, 1H), 2,24 (ушир.с, 1H), 1,44-1,88 (м, 14H); РХМС (m/z): 165 (M+1). До суспензії (метил)трифенілфосфонійброміду (17,6 г, 48,4 ммоль) в ТГФ (100 мл) при 78 °C додавали н-бутилітій (18,1 мл 2,5М розчину в ТГФ, 45 ммоль) і перемішували суміш 30 хвилин. До отриманої суміші додавали спіро[біцикло[2.2.1]гептан-2,1'-циклопентан-3-он (5,30 г, 32,3 ммоль) і перемішували реакційну суміш при температурі навколишнього середовища протягом 18 годин. Гексан (200 мл) додавали і фільтрували суміш. Фільтрати концентрували і очищали залишок на колонці з 80 г силікагелю, елююючи гексаном, з отриманням 3метиленспіро[біцикло[2.2.1]гептан-2,1'-циклопентану] (4,80 г, 91 7 %) у вигляді масла. Сірчану кислоту (1,61 мл, 2,96 г, 30,2 ммоль) повільно додавали до суспензії 3метиленспіро[біцикло[2.2.1]гептан-2,1-циклопентану] (4,80 г, 29,6 ммоль) і тіоціанату калію (2,96 г, 30,2 ммоль) при 50 °C. Потім реакційну суміш перемішували при 85 °C протягом 5,5 годин, охолоджували до температури навколишнього середовища, розбавляли толуолом (30 мл) і промивали водою (20 мл) з подальшим промиванням насиченим водним бікарбонатом натрію (10 мл). Толуоловий шар сушили в надлишку безводного сульфату натрію і фільтрували. До фільтрату додавали натрійбіс(метоксіетокси)алюмінійгідрид (40 % розчин в толуолі, 2 еквіваленти) і перемішували реакційну суміш при 85 °C протягом 2 годин. Реакційну суміш охолоджували до 0 °C і повільно додавали (по краплях через певні проміжки часу) 3н. розчин водного гідроксиду натрію (20 мл) у 5 % водному гіпохлориті натрію (35 мл). Толуоловий шар відділяли і промивали водою (30 мл). Потім толуоловий шар екстрагували 1н. водною хлористоводневою кислотою (2×10 мл) і відкидали. Шар водної хлористоводневої кислоти робили основним (до pH 10) додаванням 10 % водного гідроксиду натрію і екстрагували простим діетиловим ефіром. Екстракти простого діетилового ефіру концентрували і очищали залишок колонковою хроматографією на силікагелі з використанням 0-40 % CMA (хлороформ:метанол:30 % водний аміак, 9:1:0,1) в хлороформі, з отриманням N,3диметилспіро[біцикло[2.2.1]гептан-2,1'-циклопентан]-3-аміну (1,2 г, 53 %) у вигляді масла. 1 H ЯМР (CDCl3, 400 МГц): δ 2,28 (с, 3H), 2,24 (ушир.с, 1H), 1,84-1,76 (м, 2H), 1,73-1,68 (м, 1H), 1,62-1,52 (м, 4H), 1,48-1,24 (м, 7H), 1,09-1,05 (м, 1H), 1,04 (с, 3H); РХМС (m/z): 194 (M+1). Приклад 4. Загальний спосіб отримання N-заміщеного спіро[біцикло[2.2.1]гептан-2,1'циклобутан]-3-амінів Визначені N-заміщені спіро[біцикло[2.2.1]гептан-2,1'-циклобутан]-3-аміни можуть бути отримані відновним амінуванням спіро[біцикло[2.2.1]гептан-2,1-циклобутан]-3-ону. Наступна методика, яка використовує метиламін, і отримання N-трифторацетату метилспіро[біцикло[2.2.1]гептан-2,1'-циклобутан]-3-аміну є ілюстративними. Відновне амінування з використанням диметиламіну, азетидину і піролідину проводили аналогічно. До розчину спіро[біцикло[2.2.1]гептан-2,1'-циклобутан]-3-ону (0,15 г, 1,0 ммоль) і метиламіну (4,0 мл 2,0М розчини в ТГФ, 8,0 ммоль) в 1,2-дихлоретані (10 мл) додавали оцтову кислоту (0,2 мл) і триацетоксиборогідрид натрію (0,85 г, 4,0 ммоль). Реакційну суміш перемішували при температурі навколишнього середовища протягом 48 годин, розбавляли дихлорметаном (10 мл), промивали насиченим водним розчином бікарбонату натрію (10 мл) і концентрували. Залишок очищали препаративною ВЕРХ, елююючи сумішшю 0,05 % мурашиної кислоти у воді і 0,05 % мурашиної кислоти в ацетонітрилі. Відібрані фракції концентрували і розчиняли залишок в метанолі (2 мл). Трифтороцтову кислоту (0,1 мл) додавали, і суміш концентрували і сушили у вакуумі, з отриманням трифторацетату N-метилспіро[біцикло[2.2.1]гептан-2,1'-циклобутан]-3аміну (0,088 г) у вигляді смоли. 1 H ЯМР (CD3OD, 400 МГц): ВЕРХ 3,06-3,02 (м, 1H), 2,568 (с, 3H), 2,54 (ушир.с, 1H), 2,34 (ушир.с, 1H), 2,02-1,83 (м, 6H), 1,56-1,42 (м, 5H), 1,26-1,32 (м, 1H); РХМС (m/z): 166 (M+1). Приклад 5. Гідрохлорид (1S,3R,4R)-N,4,7,7-тетраметилспіро[біцикло[2.2.1]гептан-2,1'циклобутан]-3-аміну і гідрохлорид (1S,3S,4R)-N,4,7,7-тетраметилспіро[біцикло[2.2.1]гептан-2,1'циклобутан]-3-аміну Наступну хімічну взаємодію з використанням D-камфори як вихідної речовини повторювали з використанням L-камфори як вихідної речовини, з отриманням продуктів, які є енантіомерами описаних в даному описі продуктів. Суміш D(+)-камфори (4,40 г, 28,9 ммоль) і аміду натрію (2,50 г, 61,5 ммоль) в толуолі (100 мл) перемішували при 100 °C протягом 30 хвилин. Додавали розчин 1,3-дибромпропану (31,8 ммоль, 3,24 мл, 6,42 г) в толуолі (20 мл) і нагрівали реакційну суміш при кип’ятінні зі зворотним холодильником протягом 3 годин. Реакційну суміш охолоджували до температури 14 UA 108500 C2 5 10 15 20 25 30 35 40 45 50 55 60 навколишнього середовища, промивали водою (100 мл), сушили в надлишку безводного сульфату натрію і концентрували, залишок розчиняли в 5 % метанолі в дихлорметані (80 мл) і охолоджували до -78 °C. Пропускали озон через розчин до встановлення блакитного забарвлення (~10 хвилин). Потім додавали диметилсульфід (2 мл) і реакційну суміш повільно нагрівали до температури навколишнього середовища. Реакційну суміш концентрували і очищали залишок на колонці з силікагелем (40 г), елюювали 0-20 % простим ефіром в гексані, з отриманням (1S,4R)-4,7,7-триметилспіро[біцикло[2.2.1]гептан-2,1'-циклобутан]-3-ону (1,66 г, 29,0 % виходу) у вигляді масла. 1 H ЯМР (CDCl3, 400 МГц): δ 2,26 (м, 1H), 2,10-1,97 (м, 5H), 1,85-1,66 (м, 2H), 1,82-1,53 (м, 1H), 1,47-1,40 (м, 1H), 1,28-1,19 (м, 1H), 0,94 (с, 3H), 0,88 (с, 3H), 0,75 (с, 3B); РХМС (m/z): 193 (M+1). Суміш (1S, 4R)-4,7,7-триметилспіро[біцикло[2.2.1]гептан-2,1'-циклобутан]-3-ону (1,60 г, 8,32 ммоль) і формаміду (10 мл) в мурашиній кислоті (7 мл) перемішували при 175 °C протягом 72 годин. Реакційну суміш охолоджували до температури навколишнього середовища, виливали в 200 мл крижаної води і екстрагували простої ефіром (2×50 мл). Об'єднані екстракти простого ефіру промивали водою (40 мл), сушили в надлишку безводного сульфату натрію і концентрували, з отриманням N-(4,7,7-триметилспіро[біцикло[2.2.1]гептан-2,1'-циклобутан]-3їл)формаміду (1,55 г, 84,2 % виходу) у вигляді смоли. До розчину N-(4,7,7-триметилспіро[біцикло[2.2.1]гептан-2,1'-циклобутан]-3-їл)формаміду (1,50 г, 8,78 ммоль) в ТГФ (40 мл) при 0 °C повільно додавали алюмогідрид літію (27,1 ммоль, 27,1 мл 1,0М розчини в ТГФ). Після додавання реакційну суміш кип'ятили зі зворотним холодильником протягом 48 годин. Реакційну суміш охолоджували до 0 °C і зупиняли додаванням частинами твердого декагідрату сульфату натрію (10 г). Після перемішування протягом 1 години отриману суміш фільтрували і концентрували фільтрат. Залишок очищали на колонці з 40 г силікагелю з використанням в якості елюенту 0-100 % CMA (хлороформ:метанол:30 % водний аміак; 9:1:0,1) в хлороформі, з отриманням екзоамінопродукту (1S,3R,4R)-N,4,7,7-тетраметилспіро[біцикло[2.2.1]гептан-2,1'-циклобутан]-3-аміну (0,49 г, 35 % виходу) і ендо-амінопродукту (1S,3S,4R)-N,4,7,7тетраметилспіро[біцикло[2.2.1]гептан-2,1'-циклобутан]-3-аміну (0,30 г, 21 % виходу), обидва у вигляді масла. Два продукти перетворювали в їх гідрохлоридні солі, розчиняючи кожен в 1 мл концентрованої хлористоводневої кислоти, концентруючи і піддаючи зразки сушці у вакуумі. 1 H ЯМР гідрохлориду екзо-(1S,3R,4R)-N,4,7,7-тетраметилспіро[біцикло[2.2.1]гептан-2,1'циклобутан]-3-аміну (D2O, 400 МГц): δ 2,80 (с, 3H), 2,72 (ушир.с, 1H), 2,22-1,91 (м, 4H), 1,84-1,72 (м, 3H), 1,54-1,45 (м, 2H), 1,38-1,31 (м, 1H). 1,10-1,01 (м, 1H), 0,87 (с, 3H), 0,75 (с, 3H), 0,72 (с, 3H); РХМС (m/z): 20:8 (M+1). 1 H ЯМР гідрохлориду ендо-(1S,3R,4R)-N,4,7,7-тетраметилспіро[біцикло[2.2.1]гептан-2,1'циклобутан]-3-аміну (D2O, 400 МГц): δ 3,12 (ушир.с, 1H), 2,79 (с, 3H), 2,26-2,16 (м, 1H), 2,01-1,85 (м, 3H), 1,78-1,69 (м, 3H), 1,60-1,51 (м, 1H), 1,36-1,24 (м, 2H), 1,08-1,00 (м, 1H), 0,85 (с, 3H), 0,78 (с, 3H), 0,75 (с, 3H); РХМС (m/z): 208 (M+1). Приклад 6. Загальний спосіб перетворення вторинних амінів в третинні N-метиламіни Визначені третинні N-метиламіни можуть бути отримані відновним амінуванням відповідних вторинних амінів. Наступна методика, яка використовує формальдегід, і отримання гідрохлориду екзо-(1S,3R,4R)-N,N,4,7,7-пентаметилспіро[біцикло[2.2.1]гептан-2,1'-циклобутан-3аміну є ілюстративними. Аналогічні реакції N-метилування проводили з рядом вторинних амінів. До розчину (1S,3R,4R)-N,N,4,7,7-тетраметилспіро[біцикло[2.2.1]гептан-2,1'-циклобутан-3аміну (0,10 г, 0,48 ммоль) і 30 % водного формальдегіду (1 мл) в метанолі (4 мл) додавали триацетоксиборогідрид натрію (0,31 г, 1,4 ммоль) і перемішували реакційну суміш при температурі навколишнього середовища протягом 18 годин. Реакцію гасили насиченим водним розчином бікарбонату натрію (30 мл) і екстрагували дихлорметаном (2×30 мл). Мурашину кислоту (0,2 мл) додавали до об'єднаних органічних екстрактів і концентрували їх на роторному випарнику. Залишок очищали препаративною РХМС з використанням суміші 0,05 % мурашиної кислоти у воді і 0,05 % мурашиної кислоти в ацетонітрилі. Відібрані фракції об'єднували, робили основними (pH 9) додаванням 10 % водного гідроксиду натрію і екстрагували дихлорметаном (2×30 мл). Об'єднані органічні екстракти обробляли 0,5 мл концентрованою хлористоводневою кислотою. Отриману суміш концентрували і сушили у вакуумі, з отриманням гідрохлориду (1S,3R,4R)-N,N,4,7,7-пентаметилспіро[біцикло[2.2.1]гептан-2,1'-циклобутан]-3-аміну (0,06 г) у вигляді білої твердої речовини. 1 H ЯМР (D2O, 400 МГц): δ 3,27 (с, 3H), 3,19 (с, 3H), 3,10 (с, 1H), 2,55-2,28 (м, 4H), 2,18-1,97 (м, 3H), 1,80-1,60 (м, 3H), 1,45-1,36 (м, 1H), 1,28 (с, 3H), 1,02 (с, 3H), 1,01 (с, 3H); РХМС (m/z): 222 (M+1). 15 UA 108500 C2 5 10 15 20 25 30 35 40 45 50 55 60 Приклад 7. Трифторацетат N-метилспіро[біцикло[2.2.1]гептан-2,1'-циклопропан]-3-аміну До завису пари цинк-мідь (9,1 г, 57 ммоль) в простому діетиловому ефірі (75 мл) додавали чистий 3-метилен-2-норборнанон (8,9 г, 73 ммоль), і потім чистий дийодметан (8,30 мл, 103 ммоль). Отриману суміш нагрівали при кип’ятінні зі зворотним холодильником протягом 6 годин. Додавали другу порцію пари цинк-мідь (10 г) і продовжували кип'ятіння зі зворотним холодильником додатково протягом 16 годин. Потім реакцію гасили водою (200 мл) і розбавляли простим діетиловим ефіром (200 мл). Двофазну суміш фільтрували через шар діатомової землі. Органічний шар розділяли, промивали 10 % водною хлористоводневою кислотою (2×50 мл), сушили в надлишку безводного сульфату магнію і концентрували. Залишок пропускали через колонку з силікагелем, елююючи дихлорметаном. Відібрані фракції концентрували і залишок піддавали перегонці в дистиляторі типу "з колби в колбу" у вакуумі при 3 мм рт. ст., з отриманням спіро[біцикло[2.2.1]гептан-2,1'-циклопропан]-3-ону (1,6 г) у вигляді масла. 1 H ЯМР (CDCl3, 400 МГц): δ 2,71-2,69 (м, 1H), 2,06 (ушир.с, 1H), 2,00-1,72 (м, 3H), 1,66-1,57 (м, 3H), 1,09-1,00 (м, 2H), 0,91-0,89 (м, 1H), 0,80-0,75 (м, 1H). До розчину спіро[біцикло[2.2.1]гептан-2,1'-циклопропан]-3-ону (0,13 г, 0,96 ммоль) і метиламіну (4,0 мл 2,0М розчини в ТГФ, 8,0 ммоль) в 1,2-дихлоретані (10 мл) додавали оцтову кислоту (0,2 мл) і триацетоксиборогідрид натрію (0,85 г 4,0 ммоль) і перемішували реакційну суміш при температурі навколишнього середовища протягом 48 годин. Реакційну суміш розбавляли дихлорметаном (10 мл), промивали насиченим водним розчином бікарбонату натрію (10 мл) і концентрували. Залишок очищали препаративною ВЕРХ, елююючи сумішами 0,05 % мурашиної кислоти у воді і 0,05 % мурашиної кислоти в ацетонітрилі. Відібрані фракції концентрували і розчиняли залишок в метанолі (2 мл). Додавали трифтороцтову кислоту (0,1 мл), і суміш концентрували і сушили у вакуумі, з отриманням трифторацетату Nметилспіро[біцикло[2.2.1]гептан-2,1'-циклобутан]-3-аміну (0,005 г) у вигляді смоли. 1 H ЯМР (CD3OD, 400 МГц): δ 2,76 (ушир.с, 1H), 2,59 (с, 3H), 1,85-1,82 (м, 1H), 1,69-1,55 (м, 6H), 1,34-1,28 (м, 1H), 0,83-0,78 (м, 1H), 0,67-0,62 (м, 1H), 0,58-0,50 (м, 2H); РХМС (m/z): 152 (M+1). Приклад 8. Гідрохлорид N,3-диметилспіро[біцикло[2.2.1]гептан-2,1'-циклопропан]-3-аміну До розчину (3-метилспіро[біцикло[2.2.1]гепт[5]ен-2,1'-циклопропан]-3-ил)метанолу (9,4 г, 57 ммоль), отриманому, як описано в статті Gream and Pincombe, Aust. J. Chem. 27: 543-565 (1974), включеної в даний опис за допомогою посилання щодо такого отримання, в метанолі (20 мл) додавали 0,8 г 10 % Pd/С (вологий) в атмосфері азоту. Атмосферу азоту замінювали воднем (50 2 фунт/дюйм ), і суміш перемішували протягом 4 годин при температурі навколишнього середовища. Потім реакційну суміш фільтрували через шар діатомової землі, яку потім промивали метанолом. Фільтрати концентрували, з отриманням 9,80 г (3метилспіро[біцикло[2.2.1]гептан-2,1'-циклопропан]-3-іл)метанолу у вигляді білої твердої речовини (99 %). До розчину триоксиду хрому (8,0 г, 76 ммоль), який перемішується у воді (30 мл), охолодженого на крижаній бані, обережно додавали 96 % сірчану кислоту (6,9 мл, 120 ммоль). Продовжуючи охолоджувати і перемішувати окисний розчин на крижаній бані, додавали розчин (3-метилспіро[біцикло[2.2.1]гептан-2,1'-циклопропан]-3-іл)метанолу (9,5 г, 57 ммоль) в ацетоні (115 мл) протягом періоду 20 хвилин. Після додавання, реакційну суміш перемішували протягом 3 годин при нагріванні до температури навколишнього середовища. Реакційну суміш розбавляли водою (45 мл) і етилацетатом (200 мл). Повільно додавали порошок бісульфіту натрію до зникнення коричневого забарвлення і становлення водного шару блакитним. Потім фази розділяли і промивали водний шар етилацетатом (2×100 мл). Органічні шари об'єднували і сушили в надлишку безводного сульфату магнію. Висушувальну речовину видаляли фільтруванням і концентрували фільтрати, з отриманням зеленого масла. Масло очищали колонковою хроматографією на силікагелі (200 г) з використанням градієнта 0-50 % етилацетату в гексані. Відібрані фракції об'єднували і концентрували, з отриманням 8,0 г 3метилспіро[біцикло[2.2.1]гептан-2,1'-циклопропан]-3-карбонової кислоти у вигляді білої твердої речовини (58 %). До розчину, який перемішується 3-метилспіро[біцикло[2.2.1]гептан-2,1'-циклопропан]-3карбонової кислоти (2,8 г, 15 ммоль) і триетиламіну (2,6 мл, 18 ммоль) в толуолі (70 мл), охолодженому на крижаній бані, додавали дифенілфосфонійазид (3,5 мл, 16 ммоль). Реакційну суміш нагрівали до 90 °C і перемішували протягом 2,5 годин. Потім до реакційної суміші додавали бензиловий спирт (1,7 мл, 16 ммоль) і перемішували суміш додатково протягом 16 годин при 90 °C. Реакційну суміш охолоджували і концентрували. Залишок очищали колонковою хроматографією на силікагелі (60 г) з використанням градієнта 0-15 % етилацетату в гексані. 16 UA 108500 C2 5 10 15 20 25 30 35 40 45 50 55 60 Відібрані фракції об'єднували і концентрували, з отриманням 1,6 г суміші речовин, яка містить 3ізоціанато-3-метилспіро[біцикло[2.2.1]гептан-2,1'-циклопропан] і відповідний бензилкарбамат, у вигляді білої твердої речовини. Отриману суміш розчиняли в безводному ТГФ (16 мл) і охолоджували на крижаній бані. Повільно додавали алюмогідрид літію (8,5 мл 2,0М в ТГФ, 17 ммоль). Реакційну суміш нагрівали до 55 °C протягом 3 годин. Потім реакційну суміш охолоджували на крижаній бані і розбавляли простим діетиловим ефіром (20 мл). Реакцію гасили, обережно додаючи воду до припинення виділення газу. Отриману білу в'язку суспензію перемішували при температурі навколишнього середовища протягом 1 години, протягом якої солі ставали гранульованими. Потім суспензію фільтрували через шар діатомової землі і промивали осад на фільтрі простим діетиловим ефіром (10 мл), і потім етилацетатом (10 мл). Об'єднані фільтрати екстрагували 8М хлористоводневою кислотою (3×4 мл). Водні екстракти об'єднували і концентрували на роторному випарнику, з отриманням гідрохлориду 1,6 г N,3диметилспіро[біцикло[2.2.1]гептан-2,1'-циклопропан]-3-аміну у вигляді білої твердої речовини (53 % виходу). 1 H ЯМР (400 МГц, D2O): δ 2,52 (с, 1H), 2,46 (с, 3H), 1,72 (д, J=11 Гц, 1H), 1,49-1,41 (м, 3H), 1,39-1,32 (м, 2H), 1,28 (д, J=11 Гц, 1H), 1,02 (с, 3H), 0,59-0,51 (м, 3H), 0,45-0,43 (м, 1H); РХМС (m/z): 166 (M+1). Приклад 9. Гідрохлорид N,3-диметилспіро[біцикло[2.2.2]окт[5]ен-2,1'-циклопентан]-3-аміну і гідрохлорид N,3-диметилспіро[біцикло[2.2.2]октан-2,1'-циклопентан]-3-аміну Проміжні сполуки біцикло[2.2.2]окт5-ен-2-он отримували способом, описаним в статті Kozikowski і Schmiesing, J. Org. Chem. 48: 1000-1007 (1983), включеної за допомогою посилання щодо такої реакції вище, і потім перетворювали в N,3-диметил[біцикло[2.2.2]окт[5]ен-2,1'циклопентан]-3-амін і N,3-диметилспіро[біцикло[2.2.2]октан-2,1'-циклопентан]-3-амін. Суміш акрилонітрилу (79,4 г, 1,49 моль), 1,3-циклогексадієну (60 г, 0,75 моль) і гідрохінону (1,1 г, 10 ммоль) герметизували в пробірці і нагрівали при 120 °C протягом 18 годин. Отриману суміш концентрували і очищали хроматографією на силікагелі, елююючи сумішшю етилацетату (від 0,5 % до 1 %) в петролейному ефірі, з отриманням роздільної суміші ізомерів (переважно ендо/екзо) 5-ціанобіцикло[2.2.2]окт-2-ену (84 г, 64 % виходу) у вигляді білої напівтвердої речовини. 1 H ЯМР (300 МГц, CDCl3) δ 1,32 (м, 2H), 1,75 (м, 3H), 2,04 (м, 1H), 2,43 (м, 1H), 2,62 (м, 1H), 2,78 (м, 1H), 6,23 (м, 1H), 6,30 (м, 1H); 1H ЯМР (300 МГц, CDCl 3) δ 128 (м, 2H), 1,50 (м, 3H), 1,94 (м, 1H), 2,68 (м, 2H), 2,87 (м, 1H), 6,29 (м, 1H), 6,44 (м, 1H); РХМС (m/z): 134 (M+1). До киплячої зі зворотним холодильником суміші піридину (14,2 г, 0,180 моль), пентахлориду фосфору (28,0 г, 0,135 моль) і хлороформу (100 мл) додавали по краплях розчин 5ціанобіцикло[2.2.2]окт-2-ену (12 г, 90 ммоль) в хлороформі (50 мл). Отриману суміш нагрівали при кип’ятінні зі зворотним холодильником протягом 15 годин, охолоджували і виливали на лід. Органічний шар концентрували і очищали залишок хроматографією на силікагелі, елююючи сумішами етилацетату (від 0,5 % до 1 %) в петролейному ефірі, з отриманням 5-хлор-5ціанобіцикло[2.2.2]окт-2-ену (14,3 г, 95 % виходу) у вигляді білої напівтвердої речовини. 1 H ЯМР (300 МГц, CDCl3) δ 1,3-1,5 (м, 3H), 2,02-2,18 (м, 2H), 2,51 (м, 1H), 2,72 (м, 1H), 3,12 (м, 1H), 6,22 (м, 1H), 6,41 (м, 1H); ГХМС (m/z): 167. До розчину, який перемішується 5-хлор-5-ціанобіцикло[2.2.2]окт-2-ену (65 г, 0,39 моль) (виконано декілька повторів вказаного вище способу) в диметилсульфоксиді (500 мл) додавали гідроксид калію (87,4 г, 1,56 моль) і воду (30 мл). Отриману суміш перемішували при кімнатній температурі протягом 15 годин, розбавляли водою (1000 мл) і екстрагували простим ефіром (4×500 мл). Об'єднані екстракти простого ефіру промивали насиченим розчином солі, сушили в надлишку безводного сульфату натрію і концентрували. Залишок очищали хроматографією на силікагелі, елююючи сумішами простого діетилового ефіру (від 1 % до 5 %) в петролейному ефірі, з отриманням біцикло[2.2.2]окт-5-ен-2-ону (23,8 г, 50 % виходу) у вигляді білої твердої речовини. 1 H ЯМР (300 МГц, CDCl3) δ 1,53-1,84 (м, 4H), 2,01-2,02 (м, 2H), 2,96-2,99 (м, 1H), 3,11-3,13 (м, 1H), 6,15-6,21 (м, 1H), 6,43-6,48 (м, 1H); ГХМС (m/z): 122. До розчину діізопропіламіну (11,2 мл, 8,05 г, 79,6 ммоль) в безводному ТГФ (108 мл) при 78 °C додавали н-бутилітій (56,5 мл 1,6М в гексані, 90,4 ммоль), суміш нагрівали до 90 °C і перемішували протягом 30 хв. Розчин знову охолоджували до -78 °C і додавали розчинений в ТГФ (10 мл) біцикло[2.2.2]окт-5-ен-2-он (5,00 г, 36,2 ммоль). Реакційну суміш перемішували протягом 30 хв при -78 °C, і потім додавали гексаметилфосфортриамід (13,9 мл, 14,3 г, 79,6 ммоль) з подальшим додаванням 1,4-дибромбутану (4,76 мл, 8,59 г, 39,8 ммоль). Реакційну суміш нагрівали до температури навколишнього середовища, перемішували протягом 16 годин, гасили насиченим водним хлоридом амонію (50 мл), розбавляли простим ефіром (100 мл) і 17 UA 108500 C2 5 10 15 20 25 30 35 40 45 50 55 60 промивали водою (3×50 мл). Органічний шар сушили в надлишку безводного сульфату натрію, фільтрували і концентрували. Залишок очищали на колонці з 12,0 г діоксиду кремнію, елюювали 100 % гексаном в об'ємі для 4 колонок, з подальшим ступеневим градієнтом 9:1 гексану/етилацетату. Відібрані фракції концентрували, з отриманням спіро[біцикло[2.2.2]окт[5]ен-2,1'-циклопентан]-3-ону (5,1 г, ≈90 % чистий ГХ/МС) у вигляді прозорого масла. Речовину надалі використали без додаткового очищення, розчиняючи в безводному ТГФ (20 мл) і охолоджуючи до 78 °C. Потім додавали метилмагнійбромід (28,6 мл 3,0М в простому діетиловому ефірі, 85,8 ммоль) і повільно нагрівали реакційну суміш до температури навколишнього середовища. Реакційну суміш перемішували при температурі навколишнього середовища протягом 18 годин і гасили, обережно додаючи насичений водний хлорид амонію. Реакційну суміш переносили в ділильну лійку і видаляли водний шар. Органічний шар двічі промивали водою (10 мл), сушили в надлишку безводного сульфату натрію, фільтрували і концентрували. Речовина (безбарвне масло), яка залишилася, являла собою суміш 3-метилспіро[біцикло[2.2.2]окт[5]ен-2,1'-циклопентан]-3-олу (4,9 г) і вихідної речовини. Без додаткового очищення щойно отриманий зразок об'єднували з ціанідом натрію (1,93 г, 37,8 ммоль) в оцтовій кислоті (20 мл). Отриману суміш охолоджували до 0 °C і перемішували при цій температурі, так як повільно додавали сірчану кислоту (20 мл). Реакційну суміш, яка стала темно-червоного кольору після всіх додавань реагентів, перемішували при температурі навколишнього середовища протягом 18 годин. Потім її гасили додаванням 100 мл води, робили основний (pH 9) додаванням 3М водного гідроксиду натрію і екстрагували дихлорметаном (4×50 мл). Об'єднані органічні шари сушили в надлишку безводного сульфату натрію і концентрували, з отриманням не зовсім білої твердої речовини. Тверду речовину розчиняли в безводному ТГФ (200 мл), охолоджували до 0 °C і витримували при цій температурі, так як повільно додавали розчин алюмогідриду літію (25,2 мл 2М в ТГФ, 50,4 ммоль). Реакційну суміш нагрівали при кип’ятінні зі зворотним холодильником протягом 18 годин, охолоджували на крижаній бані і гасили, обережно додаючи 5 г декагідрату сульфату натрію. Отриману суміш перемішували протягом 30 хвилин і фільтрували. Фільтрат концентрували і залишок очищали на колонці з 120 г силікагелю з використанням 0-70 % CMA в хлороформі, з отриманням N,3-диметилспіро[біцикло[2.2.2]окт[5]ен-2,1'-циклопентан]-3-аміну (0,20 г, 2,7 % виходу). Дану речовину отримували в дихлорметані (5 мл), перетворювали в сіль HCl обробкою 0,5 мл 4М хлористоводневої кислоти в диоксані і концентруванням отриманої суміші. Отриману аморфну тверду речовину розчиняли в метанолі (3 мл) і осаджували простим діетиловим ефіром (3 мл). Розчинник видаляли аспірацією і тричі розтирали осад з простим діетиловим ефіром (3 мл). Потім зразок гідрохлоридної солі сушили у вакуумі. 1 H ЯМР (300 МГц, CD3OD) δ 1,02 (с, 3H), 1,19-1,42 (м, 4H), 1,51-1,64 (м, 7H), 1,81 (м, 1H), 2,21 (м, 2H), 2,73 (с, 3H), 5,57 (дд, J1=9 Гц, J2=3 Гц, 1H), 6,01 (д, J=6 Гц, 1H); РХМС (m/z): 206 (M+1). N,3-диметилспіро[біцикло[2.2.2]окт[5]ен-2,1'-циклопентан]-3-амін (80 мг, 0,39 ммоль) розчиняли в метанолі (7,8 мл) і додавали 10 % Pd/С (вологий) (41 мг). Отриману суміш вміщували в атмосферу газоподібного водню з балона і перемішували при температурі навколишнього середовища протягом 18 годин. Потім реакційну суміш фільтрували через діатомову землю і концентрували фільтрат, з отриманням N,3-диметилспіро[біцикло[2.2.2]октан2,1'-циклопентан]-3-аміну (45 мг, 58 % виходи). Отриману речовину розчиняли в дихлорметані (3 мл), перетворювали в його сіль хлористоводневої кислоти обробкою 0,3 мл 4М хлористоводневої кислоти в діоксані і концентруванням отриманої суміші. Отриману аморфну тверду речовину розчиняли в метанолі (3 мл) і осаджували простим діетиловим ефіром (1 мл). Розчинник видаляли аспірацією і тричі розтирали осад з простим діетиловим ефіром (3 мл). Потім сушили у вакуумі зразок гідрохлоридної солі. 1 H ЯМР (300 МГц, CD3OD) δ 0,99 (с, 3H), 1,31 (м, 2H), 1,45-1,70 (м, 10H), 1,85 (м, 1H), 2,08 (м, 3H), 2,22-2,35 (м, 1H), 2,65 (с, 3H), 3,02 (м, 1H); РХМС (m/z): 208 (M+1). VI. Біологічні аналізи Характеристика взаємодії в нікотинових ацетилхолінових рецепторах Матеріали і способи Клітинні лінії. Клітинні лінії SH-EP1-α4β2 людини (Eaton et al., 2003), SH-EP1-α4β4 людини (Gentry et al., 2003) і SH-EP1-α6β3β4α5 (Grinevich et al., 2005) отримували від Dr. Ron Lukas (Barrow Neurological Institute). Клітинні лінії SH-EP1, клітини PC12, SH-SY5Y і TE671/RD підтримували в проліферативній фазі росту в модифікованому Дульбеко середовищі Ігла (Invitrogen, Carlsbad, California) з 10 % кінською сироваткою (Invitrogen), 5 % ембріональною телячою сироваткою (HyClone, Logan UT), 1 мМ пірувату натрію, 4 мМ L-глутаміну. Для 18 UA 108500 C2 5 10 15 20 25 30 35 40 45 50 55 60 підтримки стабільних трансфектантів в середовище до клітин α4β2 і α4β4 додатково додавали 0,25 мг/мл зеоцину і 0,13 мг/мл гігроміцину B. Селекцію підтримували для клітин α6β3β4α5 додаванням 0,25 мг/мл зеоцину, 0,13 мг/мл гігроміцину В, 0,4 мг/мл генетицину і 0,2 мг/мл бластицидину. Аналізи зв’язування з рецептором Отримання мембран з тканин щура. Кору головного мозку щура отримували від Analytical Biological Services Incorporated (ABS, Wilmington, Delaware). Тканини самиць щурів SpragueDawley в препарованому замороженому вигляді транспортували на сухому льоду. Тканини зберігали при -20 °C доти, поки не виникала необхідність в мембранних препаратах. Кору головного мозку 10 щурів об'єднували і гомогенізували гомогенізатором Polytron (Kinematica GmbH, Switzerland) в 10 об'ємах (маса:об'єм) крижаного препаративного буфера (11 мМ KCl, 6 мM KH2PO4, 137 мМ NaCl, 8 мМ Na2HPO4, 20 мМ HEPES (вільна кислота), 5 мМ йодацетамід, 1,5 мМ EDTA, 0,1 мМ PMSF pH 7,4). Отриманий гомогенат центрифугували при 40000 g протягом 20 хвилин при 4 °C і ресуспендували отриманий осад в 20 об'ємах крижаної води. Після 60 хвилин інкубації при 4 °C збирали новий осад центрифугуванням при 40000 g протягом 20 хвилин при 4 °C. Кінцевий осад ресуспендували в препаративному буфері і зберігали при 20 °C. В день аналізу тканину розморожували, центрифугували при 40000 g протягом 20 хвилин, і потім ресуспендували в забуференому фосфатному сольовому розчині Дульбекко pH 7,4 (PBS, Invitrogen) до кінцевої концентрації 2-3 мг білка/мл. Концентрації білків визначали з використанням набору Pierce BCA Protein Assay (Pierce Biotechnology, Rockford, IL), з бичачим сивороточним альбуміном як стандарт. Отримання мембран з клонованих клітинних ліній. Клітини збирали в крижаному PBS pH 7,4, потім гомогенізували гомогенізатором Polytron (Kinematica GmbH, Switzerland). Гомогенати центрифугували при 40000 g протягом 20 хвилин (4 °C), і ресуспендували осад в PBS, і вимірювали концентрацію білка з використанням набору Pierce BCA Protein Assay (Pierce Biotechnology, Rockford, IL). Конкурентне зв’язування з рецепторами в мембранних препаратах. Зв’язування з нікотиновими рецепторами оцінювали на мембранах стандартними способами на основі опублікованих методик (Lippiello and Fernandes 1986; Davies et al., 1999). Стисло, мембрани відновлювали із заморожених вихідних зразків і інкубували протягом 2 годин на льоду в 150 мкл буфери для аналізу (PBS) в присутності конкуруючої сполуки (від 0,001 нМ до 100 мкМ) і 3 радіоактивного ліганда. Для досліджень зв’язування з α4β2 людини використовували [ H]3 нікотин (L-(-)-[N-метил- H]нікотин, 69,5 Кі/моль, Perkin-Elmer Life Sciences, Waltham, MA). Для 3 досліджень зв’язування з іншим підтипом нікотинового рецептору використали [ H]-епібатидин (52 Кі/моль, Perkin-Elmer Life Sciences). Для дослідження зв’язування з мускариновим 3 3 рецептором використовували L-[бензиловий-4,4- H]хінуклідинілбензилат ([ H]QNB). Інкубацію зупиняли швидким фільтруванням на мультисистемі колектора тканини (Brandel, Gaithersburg, MD) з використанням фільтрів GF/В, які попередньо просочені 0,33 % поліетиленіміном (мас./об.) для зменшення неспецифічного зв’язування. Фільтри тричі промивали крижаним PBS і визначали залишкову радіоактивність за допомогою підрахунку імпульсів в рідкій фазі. Аналіз даних зв’язування. Дані зв’язування виражали у вигляді процента від загального контрольного зв’язування. Повторні дані для кожної точки усереднювали і наносили на графік проти log концентрації лікарського засобу. IC50 (концентрацію сполуки, яка забезпечує 50 % інгібування зв’язування) визначали середньоквадратичною нелінійною регресією із застосуванням програмного забезпечення GraphPad Prism (GraphPAD, San Diego, CA). Ki розраховували з використанням рівняння Ченга-Прусоффа (Cheng and Prusoff, 1973). Функціональні аналізи потоку кальцію За двадцять чотири і сорок вісім годин до кожного експерименту клітини висівали в 86ямкові планшети з темними стінками, прозорим дном (Corning, Corning, NY) з щільністю 60100000 клітин/ямку. У день експерименту середовище для вирощування обережно видаляли, в кожну ямку додавали 200 мкл реагенту для аналізу Calcium 4 (Molecular Devices, Sunnyvale, CA) в буфері для аналізу (2,0 мМ HEPES, 7 мМ основний Тріс-буфер, 4 мМ CaCl2, 5 мМ D-глюкози, 0,8 мМ MgSO4, 5 мМ KCl, 0,8 мМ MgCl2, 120 мМ N-метил D-глюкамін, 20 мМ NaCl pH 7,4 для клітин SH-EP1 α4β2 людини або 10 мМ HEPES, 2,5 мМ CaCl2, 5,6 мМ D-глюкози, 0,8 мМ MgSO4, 5,3 мМ KCl, 138 мМ NaCl pH 7,4 з основним Тріс-буфером для всіх інших клітинних ліній) і інкубували планшети при 37 °C протягом 1 години (29 °C для клітин SH-EP1-α4β2 людини оброблених при 29 °C). Для дослідження інгібування під час додавання барвника додавали конкуруючу сполуку (10 пМ-10 мкМ). Планшети витягували з інкубатора і давали врівноважитися до кімнатної температури. Для додавання сполуки і моніторингу флуоресценції (збудження 485 нм, емісія 525 нм) планшети переносили в планшет-рідер для візуалізації флуоресценції FLIPR 19 UA 108500 C2 5 10 15 20 25 30 35 40 45 50 55 60 (Molecular Devices). Кількість потоку кальцію порівнювали з позитивним (нікотин) і негативним контролем (один буфер). Позитивний контроль визначали як 100 % відповідь, і результати сполук, які тестуються виражали у вигляді процента від позитивного контролю. Для досліджень інгібування використовували агоніст нікотину при концентраціях 1 мкМ для клітин SH-EP1-α4β2 людини і SH-EP1-α4β4 людини, 10 мкМ для клітин PC12 і SH-SY5Y і 100 мкМ для клітин TE671/RD. Вивільнення нейротрансмітеру Дослідження вивільнення дофаміну проводили з використанням стріарних синаптосом, отриманих з головного мозку щура, як описано раніше (Bencherif et al., 1998). Тканину стріатуму від двох щурів (самиці Sprague-Dawley масою 150-250 г) об'єднували і гомогенізували в крижаній 0,32 M сахарозі (8 мл), яка містить 5 мМ HEPES, pH 7,4 з використанням гомогенізатора скло/скло. Потім тканину центрифугували при 1000×g протягом 10 хвилин. Осад видаляли і супернатант центрифугували при 12500×g протягом 20 хвилин. Отриманий осад ресуспендували в крижаному перфузійному буфері, який містить інгібітори моноаміноксидази (128 мМ NaCl, 1,2 мМ KH2PO4, 2,4 мМ KCl, 3,2 мМ CaCl2, 1,2 мМ MgSO4, 25 мМ HEPES, 1 мМ аскорбінової кислоти, 0,02 мМ паргілін HCl і 10 мМ глюкози pH 7,4), і центрифугували протягом 15 хвилин при 23000×g. Останній осад ресуспендували в перфузійному буфері (2 мл) для негайного використання. Суспензію синаптосом інкубували протягом 10 хвилин в інкубатор при перемішуванні при 3 3 37 °C для відновлення метаболічної активності. Додавали [ H]дофамін ([ H]DA, специфічна активність=28,0 Кі/моль, NEN Research Products) в кінцевій концентрації 0,1 пМ і інкубували суспензію при 37 °C ще протягом 10 хвилин. Аліквоти перфузійного буфера (100 мкл) і тканини (100 мкл) поміщали в супрафузійні камери Brandel Suprafusion System (Series 2500, Gaithersburg, MD). У камери прокачували перфузійний буфер (кімнатної температури) з швидкістю приблизно 0,6 мл/хв протягом періоду промивання, рівного 8 хвилинам. У перфузійний потік вводили конкуруючі сполуки (10 пМ-100 нМ) протягом 8 хвилин. Потім в перфузійний потік вводили нікотин (10 пМ) протягом 48 секунд. З кожної камери безперервно відбирали фракції (кожні 12 секунд) протягом всього експерименту для фіксації базового вивільнення і піка вивільнення, індукованого агоністом, і для повторної фіксації базового рівня після застосування агоністу. Перфузійну рідину збирали безпосередньо в сцинтиляційні 3 флакони, в які додавали сцинтиляційну рідину. Кількість вивільненого [ H]DA визначали підрахунком сцинтиляції. Для кожної камери нормалізували інтегровану ділянку піка відносно його базового рівня. Вивільнення виражали в процентах від вивільнення, отриманого з контрольним нікотином при відсутності конкуруючої сполуки. У кожному аналізі проводили повторний експеримент для кожної концентрації сполуки, яка тестується, використовуючи 2 камери; результати повторних експериментів усереднювали. Визначали концентрацію сполуки, яка приводила до половини максимального інгібування (IC50) потоку специфічних іонів. Електрофізіологія петч-кламп Маніпуляції з клітинами. Після видалення клітин GH4C1-T6'Sα7 пацюки видаляли середовище, трипсинізували клітини протягом 3 хвилин, обережно розтирали, щоб відділити їх від чашки, двічі промивали середовищем для реєстрації і ресуспендували в 2 мл зовнішнього розчину (див. нижче для композиції). Клітини вміщували в чіп для препарату системи Dynaflow на предметному столі інвертованого мікроскопа Zeiss (Carl Zeiss Inc., Thornwood, NY). У середньому необхідно 5 хвилин, перед тим як встановлювали конфігурацію реєстрації суцільної клітини. Для усунення зміни умов клітин одну клітину реєстрували при одному завантаженні. Для індукції швидких відповідей сполуки застосовували протягом 0,5 сек з використанням системи Dynaflow (Cellectricon, Inc., Gaithersburg, MD), де в кожен канал подавали розчини під 2 тиском або 50, або 150 фунт/дюйм . Електрофізіологія. Застосовували загальноприйняті способи реєстрації струмів суцільної клітини. Використовували скляні мікроелектроди (5-10 MΩ опір) для створення герметичних ділянок (>1 GΩ) на клітинну поверхню, перед тим як застосовували всмоктування для приведення до умов загальноприйнятої реєстрації суцільної клітини. Потім в клітинах фіксували напруження при вихідних потенціалах -60 мВ і вимірювали іонні струми у відповідь на застосування лігандів. Струми суцільної клітини, які реєструються підсилювачем Axon 700A, фільтрували при 1 кГц і відбирали при 5 кГц з використанням плати ADC 1440 (Molecular Devices). Вхідний опір суцільної клітини складав менше 20 MΩ. Реєстрацію даних струмів суцільної клітини проводили з використанням Clampex 10 (Molecular Devices, Sunnyvale, CA) і будували графік за результатами із застосуванням Prism 5,0 (GraphPad Software Inc., San Diego, CA). Експериментальні дані представлені як середнє значення±S.E.M., і порівняння різних умов 20 UA 108500 C2 5 10 15 20 25 30 проаналізовані відносно статистичної значущості з використанням t-тесту Ст’юдента і тесту Two Way ANOVA. Всі експерименти проводили при кімнатній температурі (22±1 °С). Профілі концентрація-відповідь приводили у відповідність з рівнянням Hill і аналізували з використанням Prism 5,0. Застосування розчинів і лікарських засобів. Стандартний внутрішній розчин містив 120 мМ NaCl, 3 мМ KCl, 2 мМ MgCl2, 2 мМ CaCl2, 25 мМ D-глюкози і 10 мМ HEPES, і pH доводили до 7,4 основним Тріс-буфером. Внутрішній розчин для реєстрацій цільної клітини складався з 110 мМ двоосновного фосфатного Тріс-буфера, 28 мМ основного Тріс-буфера, 11 мМ EGTA, 2 мМ MgCl2, 0,1 мМ CaCl2 і 4 мМ Mg-АТФ pH 7,3. (Liu et al., 2008). Для ініціації відповідей струмів суцільної клітини сполуки доставляли за допомогою переміщення клітин з контрольного розчину в розчин, який містить агоніст, і таким же чином назад, так що заміна розчинів здійснювалася протягом ≈50 мсек (основуючись на 10-90 % підвищенні часу струму піка). Проміжки часу між застосуванням сполук (0,5-1 хвилина) спеціально підбирали для забезпечення стабільності реакції у відповідь рецептору (без функціонального зниження), і з тією ж метою проводили вибір розчинів для піпетування, які використовуються в більшій частині описаних в даному описі досліджень. (-)-нікотин і ацетилхолін (ACh) придбали у Sigma-Aldrich, (St. Louis, MO). Всі лікарські засоби отримували щодня з вихідних розчинів. Для визначення інгібування індукованих ACh струмів сполуками за даним винаходом автори фіксували стабільний основний рівень реєстрації, використовуючи 70 мкМ ACh (як правило, стабільних при 5-10 послідовних застосуваннях). Потім спільно застосовували ACh (70 мкM) і тестовану сполуку в діапазоні концентрацій від 1 нМ до 10 мкM. Оскільки кінцева частина струму (струм, виміряний в кінці 0,5 сек застосування ACh) піддавалась найбільш сильним змінам, графіки інгібування і відновлення являють собою амплітуду струму кінцевої частини. Підсумовування результатів в таблицю Як показано в таблиці 1, репрезентативні сполуки за даним винаходом, як правило, демонструють константи інгібування (значення Ki) для α4β2 людини і гангліозного підтипу рецептору в діапазоні 1-100 мМ, вказуючих на низьку афінність відносно ортостеричних ділянок зв’язування (тобто ділянки зв’язування конкурентного агоністу) цих підтипів рецептору. Однак дані в таблиці 1 також ілюструють, що репрезентативні сполуки за даним винаходом ефективно інгібують потік іонів цих підтипів рецептору з конкретними значеннями IC 50 приблизно менше 2 мМ і конкретними значеннями Imax>95 %. Сукупно ці дані демонструють, що репрезентативні сполуки за даним винаходом ефективні при інгібуванні потоку іонів, опосередкованого цими підтипами рецептору за допомогою механізму, який не призводить до зв’язування з ортостеричними ділянками. 35 Таблиця 4 Структура IC50 Imax потоку IC50 Imax потоку IC50 Ki потоку Ca Ca в α4β2 потоку Ca Ca в α4β2 потоку Imax потоку Ki α4β2 ганглію в α4β2 людини в α4β2 людини Ca в Ca в ганглії людини людини людини [29 °C/HS] людини [37 °C/LS] ганглії людини (% (нМ) (нM) [29 °C/HS] (% [37 °C/LS] (% людини інгібування) (нМ) інгібування) (нМ) інгібування) (нМ) >10000 >10000 1000 99 500 97 160 97 3800 >10000 1400 99 59 96 190 79 10000 >10000 1400 96 740 98 190 89 21 UA 108500 C2 Таблиця 4 Структура IC50 Imax потоку IC50 Imax потоку IC50 Ki потоку Ca Ca в α4β2 потоку Ca Ca в α4β2 потоку Imax потоку Ki α4β2 ганглію в α4β2 людини в α4β2 людини Ca в Ca в ганглії людини людини людини [29 °C/HS] людини [37 °C/LS] ганглії людини (% (нМ) (нM) [29 °C/HS] (% [37 °C/LS] (% людини інгібування) (нМ) інгібування) (нМ) інгібування) (нМ) 2600 >10000 1800 98 620 98 230 98 540 >10000 2100 97 570 93 440 93 8700 >10000 610 98 230 95 98 93 >10000 >10000 210 98 97 96 23 100 >10000 >10000 260 98 65 94 40 98 >10000 >10000 1300 99 490 96 180 97 5600 >10000 710 98 430 96 74 99 >10000 >10000 1000 97 600 96 98 95 >10000 >10000 310 97 270 93 60 97 22 UA 108500 C2 Таблиця 4 Структура IC50 Imax потоку IC50 Imax потоку IC50 Ki потоку Ca Ca в α4β2 потоку Ca Ca в α4β2 потоку Imax потоку Ki α4β2 ганглію в α4β2 людини в α4β2 людини Ca в Ca в ганглії людини людини людини [29 °C/HS] людини [37 °C/LS] ганглії людини (% (нМ) (нM) [29 °C/HS] (% [37 °C/LS] (% людини інгібування) (нМ) інгібування) (нМ) інгібування) (нМ) >10000 >10000 540 96 520 97 100 98 >10000 >10000 140 96 350 95 66 97 3200 >10000 1100 96 280 95 65 95 2600 >10000 740 95 380 95 86 99 >10000 >10000 1100 99 120 100 35 96 >10000 >10000 380 97 120 93 170 98 400 95 240 92 3000 >10000 5 10 Специфічні фармакологічні відповіді, які спостерігаються можуть змінюватися відповідно і залежно від конкретної вибраної активної сполуки або фармацевтичних носіїв, які містяться, а також від типу складу і способу введення, який використовується, і такі очікувані зміни або відмінності в результатах розглядаються відносно застосування на практиці даного винаходу. Хоча конкретні варіанти здійснення даного винаходу в даному описі є ілюстративними і детально описані, винахід не обмежений тим або іншим способом. Вказані вище докладні описи приведені як приклади даного винаходу, і їх не треба розцінювати як такі, які обмежують винахід. Модифікації будуть очевидні фахівцям в даній галузі, і всі модифікації, які не відходять від суті даного винаходу, призначені для включення в об'єм прикладеної формули винаходу. ФОРМУЛА ВИНАХОДУ 1. Сполука формули І: 23 UA 108500 C2 R R 5 6 L2 L1 R 7 3 R 5 10 15 20 25 30 35 4 R NR1R2 , Формула I де 1 2 1 2 кожен з R і R окремо являє собою Н, С1-6алкіл або арилзаміщений С1-6алкіл, або R і R зв'язані з атомом азоту, до якого вони приєднані, з утворенням 3-8-членного кільця, необов'язково заміщеного С1-6алкільними, арильними, С1-6алкокси- або арилоксизамісниками; 3 R являє собою Н, С1-6алкіл або С1-6алкоксизаміщений С1-6алкіл; 4 5 6 7 кожен з R , R , R і R окремо являє собою Н, С1-6алкіл або С1-6алкоксигрупу; 1 8 9 8 9 10 11 L являє собою лінкер, вибраний з групи, яка складається з CR R , CR R CR R i O; 2 L являє собою лінкер, вибраний з групи, яка складається з СН 2, СН2СН2, СН2СН2СН2 або СН2СН2СН2СН2; 8 9 10 11 кожен з R , R , R і R окремо являє собою водень або С1-6алкіл, і пунктирна лінія означає необов'язковий подвійний зв'язок; або її фармацевтично прийнятна сіль. 1 2 2. Сполука за п. 1, де R являє собою Н, і R являє собою С1-6алкіл. 3 3. Сполука за п. 1 або 2, де R являє собою С1-6алкіл. 4 5 6 7 4. Сполука за будь-яким з пп. 1-3, де кожен з R , R , R і R являє собою Н. 1 8 9 8 9 5. Сполука за будь-яким з пп. 1-4, де L являє собою CR R , і кожен з R і R являє собою водень. a 6. Сполука за будь-яким з пп. 1-5, де L являє собою СН2СН2. 7. Сполука за будь-яким з пп. 1-6, де пунктирна лінія означає одинарний зв'язок. 8. Фармацевтична композиція, яка містить сполуку за будь-яким з пп. 1-7 і фармацевтично прийнятний носій. 9. Спосіб лікування або запобігання захворюванню або стану, опосередкованому нейрональним нікотиновим рецептором, який включає введення сполуки за будь-яким з пп. 1-7. 10. Спосіб за п. 9, де захворювання або стан являє собою IBS-D, ОАВ, нікотинову залежність, припинення паління, депресію, великий депресивний розлад або гіпертензію. 11. Застосування сполуки за будь-яким з пп. 1-7 для отримання лікарського засобу для лікування або запобігання захворюванню або стану, опосередкованому нейрональним нікотиновим рецептором. 12. Застосування за п. 11, де захворювання або стан являє собою IBS-D, ОАВ, нікотинову залежність, припинення паління, депресію, великий депресивний розлад або гіпертензію. 13. Сполука за будь-яким з пп. 1-7, призначена для застосування як активної терапевтичної речовини. 14. Сполука за будь-яким з пп. 1-7, призначена для застосування в лікуванні або запобіганні захворюванню або стану, опосередкованому нейрональним нікотиновим рецептором. 15. Сполука за п. 13 або 14, де захворювання або стан являє собою IBS-D, ОАВ, нікотинову залежність, припинення паління, депресію, великий депресивний розлад або гіпертензію. Комп’ютерна верстка М. Шамоніна Державна служба інтелектуальної власності України, вул. Василя Липківського, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут інтелектуальної власності”, вул. Глазунова, 1, м. Київ – 42, 01601 24
ДивитисяДодаткова інформація
Назва патенту англійськоюNicotinic receptor non-competitive antagonists
Автори англійськоюAkireddy, Srinivasa, Rao, Bhatti, Balwinder Singh, Heemstra, Ronald Joseph, Melvin, Matt S., Speake, Jason, Xiao, Yunde, Yohannes, Daniel
Автори російськоюАкиредди Сриниваса Рао, Бхатти Балвиндер Сингх, Химстра Рональд Джозеф, Мелвин Мэтт С., Спик Джэйсон, Сяо Юньде, Йоханнес Дэниел
МПК / Мітки
МПК: A61K 31/13, A61P 9/12, A61P 25/24, C07C 211/41
Мітки: рецепторів, нікотинових, антагоністи, неконкурентні
Код посилання
<a href="https://ua.patents.su/26-108500-nekonkurentni-antagonisti-nikotinovikh-receptoriv.html" target="_blank" rel="follow" title="База патентів України">Неконкурентні антагоністи нікотинових рецепторів</a>
Попередній патент: Спосіб розділення та подальшої реєстрації іонів у газових сумішах
Наступний патент: Синергетичні гербіцидні композиції, що містять пропізамід і амінопіралід
Випадковий патент: Пристрій для лазерної літотрипсії












