Тризаміщені 1,2,4-триазоли як модулятори нікотинових ацетилхолінових рецепторів
Номер патенту: 102681
Опубліковано: 12.08.2013
Автори: ван Росброеск Йвес Еміль Марія, Тюрінг Йоханес Уілхелмус Джон Ф., Зхуанг Вей, ван ден Кейбус Франс Альфонс Марія, МакДональд Грегор Джеймс, Станіславскі Пауліна Керол
Формула / Реферат
1. Сполука формули (І)
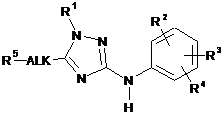
або її стереоізомерна форма, де
R1 є незаміщеним фенілом; незаміщеним бензодіоксан-6-ілом; незаміщеним піридинілом або фенілом, або піридинілом, заміщеним 1, 2 або 3 замісниками, вибраними з групи, що складається з галогену, трифторметилу, трифторметокси, С1-3алкілу, С1-3алкілокси, С1-3алкілоксіС1-3алкілу, С1-3алкіламіно, С3-6циклоалкілу, С3-6циклоалкілокси, С3-6циклоалкіламіно, (С3-6циклоалкіл)С1-3алкілу, (С3-6циклоалкіл)С1-3алкілокси і (С3-6циклоалкіл)С1-3алкіламіно;
R2 є воднем, галогеном, С1-3алкілом, С1-3алкілокси або трифторметокси;
R3 є воднем, галогеном або трифторметилом;
R4 є воднем або галогеном;
R2 і R3 можуть утворювати радикал -OCF2-O-;
Alk є лінійним або розгалуженим С1-6алкандіїлом або С2-6алкендіїлом;
R5 є воднем, гідрокси, С1-3алкілокси, галогеном, R6R7N-C(=O)- або R8-О-С(=О)-;
R6 є С1-3алкілом, С3-6циклоалкілом або (С3-6циклоалкіл)С1-3алкілом;
R7 є воднем або С1-3алкілом; або
R6 і R7 утворюють піролідиніл або піперидиніл, кожен необов'язково заміщений гідроксилом;
R8 є воднем або С1-4алкілом;
або її фармацевтично прийнятна адитивна сіль або гідрат, або сольват.
2. Сполука формули (І) за п. 1, яка відрізняється тим, що
R1 є незаміщеним фенілом; незаміщеним бензодіоксан-6-ілом; незаміщеним піридинілом або фенілом, або піридинілом, заміщеним 1, 2 або 3 замісниками, вибраними з групи, що складається з галогену, трифторметокси, С1-3алкілу, С1-3алкілокси, С1-3алкілоксіС1-3алкілу, С1-3алкіламіно, С3-6циклоалкілу, С3-6циклоалкілокси, С3-6циклоалкіламіно, (С3-6циклоалкіл)С1-3алкілу, (С3-6циклоалкіл)С1-3алкілокси і (С3-6циклоалкіл)С1-3алкіламіно;
R2 є галогеном, С1-3алкілом, С1-3алкілокси або трифторметокси;
R3 є воднем, галогеном або трифторметилом;
R4 є воднем або галогеном;
R2 і R3 можуть утворювати радикал -OCF2-O-;
Alk є лінійним або розгалуженим С1-6алкандіїлом або С2-6алкендіїлом;
R5 є воднем, гідрокси, С1-3алкілокси, галогеном, R6R7N-C(=O)- або R8-O-C(=O)-;
R6 є С1-3алкілом, С3-6циклоалкілом або (С3-6циклоалкіл)С1-3алкілом;
R7 є воднем або С1-3алкілом; або
R6 і R7 утворюють піролідиніл або піперидиніл, кожен необов'язково заміщений гідроксилом;
R8 є воднем або С1-4алкілом;
або її фармацевтично прийнятна адитивна сіль або гідрат, або сольват.
3. Сполука формули (І) за п. 1, яка відрізняється тим, що
R1 є незаміщеним фенілом; незаміщеним бензодіоксан-6-ілом; незаміщеним піридинілом або фенілом, або піридинілом, заміщеним 1 або 2 замісниками, вибраними з групи, що складається з галогену, трифторметокси, С1-3алкілу, С1-3алкілокси, С1-3алкілоксіС1-3алкілу і С1-3алкіламіно;
R2 є воднем, галогеном, метилом, метокси або трифторметокси;
R3 є воднем, галогеном або трифторметилом;
R4 є воднем або галогеном;
R2 і R3 можуть утворювати радикал -OCF2-O- у 3,4-положенні;
Alk є лінійним або розгалуженим С1-6алкандіїлом або С2-6алкендіїлом;
R5 є воднем, гідрокси, С1-3алкілокси, галогеном, R6R7N-C(=O)- або R8-О-С(=О)-;
R6 є С1-3алкілом, С3-6циклоалкілом або (С3-6циклоалкіл)С1-3алкілом;
R7 є воднем або С1-3алкілом; або
R6 і R7 утворюють піролідиніл, необов'язково заміщений гідроксилом;
R8 є воднем або С1-4алкілом;
або її фармацевтично прийнятна адитивна сіль або гідрат, або сольват.
4. Сполука формули (І) за п. 1, яка відрізняється тим, що
R1 є незаміщеним бензодіоксан-6-ілом; незаміщеним піридинілом або піридинілом, заміщеним 1 або 2 замісниками, вибраними з групи, що складається з хлору, метилу, етилу, метоксиметилу і етиламіно;
R2 є воднем, галогеном, метилом, метокси або трифторметокси;
R3 є воднем, галогеном або трифторметилом;
R4 є воднем або галогеном;
R2 і R3 можуть утворювати радикал -OCF2-O- у 3,4-положенні;
Alk є лінійним або розгалуженим С1-6алкандіїлом;
R5 є гідроксилом або R6R7N-C(=O)-;
R6 є метилом, етилом, циклопропілом, циклобутилом або (циклопропіл)метилом;
R7 є воднем або метилом;
або її фармацевтично прийнятна адитивна сіль або гідрат, або сольват.
5. Сполука за п. 1, вибрана з
(альфаS)-альфа-етил-3-[[3-метокси-5-(трифторметил)феніл]аміно]-1-(2-метил-4-піридиніл)-1Н-1,2,4-триазол-5-етанолу;
3-[(2,2-дифтор-1,3-бензодіоксол-5-іл)аміно]-1-(2,6-диметил-4-піридиніл)-N-етил-1Н-1,2,4-триазол-5-ацетаміду;
N-циклопропіл-3-[(2,2-дифтор-1,3-бензодіоксол-5-іл)аміно]-1-(2,6-диметил-4-піридиніл)-1H-1,2,4-триазол-5-ацетаміду;
(альфаS)-альфа-етил-1-(2-метил-4-піридиніл)-3-[(2,3,4-трифторфеніл)аміно]-1H-1,2,4-триазол-5-етанолу;
(альфаS)-1-(2,6-диметил-4-піридиніл)-альфа-етил-3-[(2,3,4-трифторфеніл)аміно]-1H-1,2,4-триазол-5-етанолу;
(альфаS)-1-(2,6-диметил-4-піридиніл)-альфа-метил-3-[(2,3,4-трифторфеніл)аміно]-1H-1,2,4-триазол-5-етанолу;
3-[(3,4-дифторфеніл)аміно]-1-(2,6-диметил-4-піридиніл)-N-етил-1H-1,2,4-триазол-5-ацетаміду;
N-циклопропіл-1-(2,6-диметил-4-піридиніл)-3-[[3-(трифторметокси)феніл]аміно]-1H-1,2,4-триазол-5-ацетаміду;
3-[(3-хлор-2-фторфеніл)аміно]-1-(2,6-диметил-4-піридиніл)-N-етил-1H-1,2,4-триазол-5-ацетаміду;
(альфаS)-1-(2,6-диметил-4-піридиніл)-альфа-етил-3-[(3,4,5-трифторфеніл)аміно]-1H-1,2,4-триазол-5-етанолу;
(альфаS)-альфа-етил-1-(2-метил-4-піридиніл)-3-[(3,4,5-трифторфеніл)аміно]-1H-1,2,4-триазол-5-етанолу;
(альфаS)-альфа-етил-3-[(3-фтор-5-метоксифеніл)аміно]-1-(2-метил-4-піридиніл)-1H-1,2,4-триазол-5-етанолу;
(альфаS)-1-(2,6-диметил-4-піридиніл)-альфа-етил-3-[(3-фтор-5-метоксифеніл)аміно]-1H-1,2,4-триазол-5-етанолу;
(альфаS)-3-[(3-хлор-5-метоксифеніл)аміно]-1-(2,6-диметил-4-піридиніл)-альфа-етил-1H-1,2,4-триазол-5-етанолу;
3-[(3,4-дифторфеніл)аміно]-1-(2,6-диметил-4-піридиніл)-N,N-диметил-1H-1,2,4-триазол-5-пропанаміду і
3-[(2,2-дифтор-1,3-бензодіоксол-5-іл)аміно]-1-(2,6-диметил-4-піридиніл)-N,N-диметил-1H-1,2,4-триазол-5-пропанаміду;
і їх кислих адитивних солей і сольватів.
6. Застосування сполуки для одержання лікарського засобу для запобігання або лікування психотичних порушень, порушень або захворювань, пов'язаних з розумовими розладами, або запальних захворювань або порушень, в якому сполука є сполукою за будь-яким з пп. 1-5.
7. Фармацевтична композиція, що містить фармацевтично прийнятний носій і як активний інгредієнт терапевтично ефективну кількість сполуки за будь-яким з пп. 1-5.
8. Спосіб одержання композиції за п. 7, який відрізняється тим, що фармацевтично прийнятний носій ретельно змішаний з терапевтично ефективною кількістю сполуки за будь-яким з пп. 1-5.
9. Продукт, що містить
(a) сполуку формули (І) і
(b) агоніст нікотинового ос7-рецептора, вибраний з:
моногідрохлориду 4-бромфенілового ефіру 1,4-діазабіцикло[3.2.2]нонан-4-карбонової кислоти (SSR180711 А);
(-)-спіро[1-азабіцикло[2.2.2]октан-3,5'-оксазолідин]-2'-ону;
дигідрохлориду 3-[(2,4-диметокси)бензиліден]анабазину (GTS-21);
PNU-282987 [гідрохлориду N-[(3R)-1-азабіцикло[2.2.2]окт-3-ил]-4-хлорбензаміду];
нікотину;
варенікліну;
МЕМ3454;
AZD-0328 і
МЕМ63908;
у вигляді комбінованого препарату для одночасного, роздільного або послідовного застосування для запобігання або лікування захворювань, що включають хворобу Альцгеймера, деменцію при хворобі тілець Леві, порушення, що характеризується дефіцитом уваги і гіперактивністю, тривогу, шизофренію, манію, біполярну депресію, хворобу Паркінсона, хворобу Хантінгтона, синдром Туретта, травму мозку або інші неврологічні, дегенеративні або психіатричні порушення, при яких є втрата холінергічних синапсів, включаючи порушення добового ритму, пристрасть до нікотину, біль.
Текст
Реферат: Даний винахід стосується похідних 1-арил-3-анілін-5-алкіл-1,2,4-триазолів формули (І) і їх аналогів або фармацевтично прийнятних солей, способів їх отримання, фармацевтичних композицій, що їх містять, і їх застосування в терапії. Винахід, зокрема, стосується сильних позитивних алостеричних модуляторів нікотинових ацетилхолінових рецепторів, причому такий позитивний алостеричний модулятор має здатність збільшувати ефективність агоністів нікотинових рецепторів. UA 102681 C2 (12) UA 102681 C2 UA 102681 C2 5 10 15 20 25 30 35 40 45 50 55 Даний винахід відноситься до похідних 1-арил-3-анілін-5-алкіл-1,2,4-триазолу та до їх фармацевтично прийнятних солей, до способів їх отримання, до фармацевтичних композицій, що їх містять і до їх застосування в терапії. Винахід, зокрема, відноситься до сильних позитивних аллостеричним модуляторам нікотинових ацетилхолінових рецепторів, причому такі позитивні аллостеричні модулятори мають здатність збільшеувати ефективність агоністів нікотинових рецепторів. Рівень техніки Європейський патент 1044970 описує 3-алкіламіно-1,2,4-триазоли як лігандів рецептора нейропептида Y. Стаття Makara G.M. із співавторами (Organic Letters (2002) Vol.4(10); 1751-1754) описує твердофазний синтез 3-алкіламіно-1,2,4-триазолів і дає приклад невдалого синтезу N-(4метоксифеніл)-1-метил-5-(4-метилфеніл)-1H-1,2,4-триазол-3-аміна [CAS № 433710-55-5] і нічого не згадує про потенційне терапевтичне застосування даної сполуки, зокрема про її застосування як позитивного аллостеричного модулятора нікотинового ацетилхолінового α7рецептора. Стаття Chen Chen із співавторами в Bioorganic & Medicinal Chemistry Letters 11 (2001) 31653168 описує синтез 1-алкіл-3-аміно-5-арил-1H-[1,2,4]триазолів, зокрема N-(2-метоксифеніл)-1метил-5-(2,4-дихлорфеніл)-1H-1,2,4-триазол-3-аміна, і їх застосування як антагоністів релізингфактора-1 кортикотропіну (CRF1). Публікація WO 2001/44207 розкриває схожі сполуки, що мають спорідненість до CRFрецепторів. Публікація WO 2007/118903 розкриває 3-анілін-5-арил-1,2,4-триазоли як позитивні модулятори нікотинових ацетилхолінових рецепторів, прийнятних для лікування неврологічних, дегенеративних і психіатричних порушень. Передумови створення винаходу Холінергічні рецептори зазвичай зв'язують ендогенний нейромедіатор ацетилхолін (ACh), запускаючи тим самим відкриття іонних каналів. Рецептори ACh у центральній нервовій системі ссавців можуть бути підрозділені на мускаринові (mAChR) і нікотинові (nAChR) підтипи, грунтуючись на агоністичній активності мускарину і нікотину, відповідно. Нікотинові ацетилхолінові рецептори є ліганд-залежними іонними каналами, що містять п'ять субодиниць. Члени генного сімейства nAChR-субодиниць були підрозділені на дві групи на основі їх амінокислотних послідовностей: одну групу, що містить так звані β-субодиниці, і другу групу, що містить α-субодиниці. Було показано, що три види α-субодиниць, α7, α8 і α9, утворюють функціональні рецептори, коли експресуються поодинці, і, таким чином, передбачається, що вони утворюють гомоолігомерні пентамерні рецептори. Була розроблена модель аллостеричного перехідного стану для nAChR, яка включає щонайменше стан спокою, активований стан і "десенсибілізований" стан із закритим каналом, тобто процес, за допомогою якого рецептори стають нечутливими до агоніста. Різні ліганди nAChR можуть стабілізувати конформаційний стан рецептора, з яким вони переважно зв'язуються. Наприклад, агоністи ACh і (-)-нікотин, відповідно, стабілізують активний і десенсибілізований стани. Зміни активності нікотинових рецепторів залучені в ряд захворювань. Деякі з них, наприклад, міастенія і аутосомно-домінантна нічна лобова епілепсія (ADNFLE) пов'язані зі зменшенням активності нікотинової передачі або внаслідок зменшення числа рецепторів, або внаслідок підвищеної десенсибілізації. Передбачають також, що зменшення числа нікотинових рецепторів слугує зв'язуючим звеном для дефіцитів пізнавальної здатності, які спостерігаються при захворюваннях, таких як хвороба Альцгеймера і шизофренія. Ефекти табачного нікотину також опосредковані нікотиновими рецепторами, і, оскільки ефект нікотина полягає в стабілізації рецепторів у десенсибілізованому стані, підвищена активність нікотинових рецепторів може зменшити бажання палити. Сполуки, що зв'язують nAChR, були запропоновані для лікування різних порушень, що включають знижену холінергічну функцію, таких як дефіцит виучуваності, дефіцит пізнавальної здатності, дефіцит уваги або втрата пам'яті. Передбачається, що модуляція активності нікотинового α7-рецептора дає позитивний ефект у випадку ряду захворювань, що включають хворобу Альцгеймера, деменцію при хворобі телець Леві, порушення, що характеризується дефіцитом уваги і гіперактивністю, тривогу, шизофренію, манію, біполярну депресію, хворобу Паркінсона, хворобу Хантінгтона, синдром Туретта, травму мозку або інші неврологічні, дегенеративні або психіатричні порушення, при яких є втрата холінергічних синапсів, включаючи порушення добового ритму, пристрасть до нікотину, біль. 1 UA 102681 C2 5 10 15 20 25 30 35 40 45 50 Проте лікування агоністами нікотинових рецепторів, які діють на ті ж ділянки, що і ACh, є проблематичним, оскільки ACh не лише активує, але також блокує активність рецепторів за допомогою процесів, які включають десенсибілізацію і неконкурентну блокаду. Більшее того, здається, що тривала активація індукує тривалу інактивацію. Отже, можна чекати, що агоністи ACh знижують активність так само, як збільшеують її. На нікотинових рецепторах загалом, і особливо на нікотиновому α7-рецепторе, десенсибілізація обмежує тривалість дії агоніста, що застосовується. Опис винаходу Автори даного винаходу несподівано виявили, що деякі нові похідні триазолу можуть збільшеувати ефективність агоністів нікотинових ацетилхолінових рецепторів (nAChR). Сполуки, що мають даним типом активності (тут далі названі "позитивними аллостеричними модуляторами"), ймовірно, можуть бути прийнятними для лікування станів, пов'язаних з погіршеннями нікотинової передачі. У ході терапії такі сполуки могли б відновити нормальний міжнейронний зв'язок, не впливаючи на тимгодиний профіль активації. Крім того, передбачається, що позитивні аллостеричні модулятори не викликатимуть тривалу інактивацію рецепторів, як це може відбуватись при довготривалому вживанні агоністів. Позитивні nAChR-модулятори даного винаходу прийнятні для лікування або профілактики психотичних порушень, порушень або захворювань, пов'язаних з розумовими розладами, запальних захворювань або станів, при яких модуляція нікотинового α7-рецептора дає корисний ефект. Даний винахід відноситься до похідних 1-(арил)-3-анілін-5-алкіл-1,2,4-триазола, що має властивості позитивних аллостеричних модуляторів, що зокрема збільшеують ефективність агоністів нікотинового α7-рецептора. Винахід додатково відноситься до способів їх отримання і до фармацевтичних композицій, що їх включають. Винахід також відноситься до застосування даних похідних для отримання лікарського засобу для лікування або профілактики психотичних порушень, порушень або захворювань, пов'язаних з розумовими розладами, або запальних захворювань або станів, при яких модуляція нікотинового α7-рецептора дає корисний ефект. Сполуки за даним винаходом відрізняються структурно від сполук відомого рівня техніки і фармакологічно своєю підвищеною активністю як позитивних аллостеричних модуляторів нікотинового ацетилхолінового α7-рецептора. Даний винахід відноситься до сполуки формули (I) або до її стереоізомерної форми, де 1 R є незаміщеним фенілом; незаміщеним бензодіоксан-6-ілом; незаміщеним піридинілом; або фенілом або піридинілом, заміщеним 1, 2 або 3 замісниками, вибраними з групи, що складається з галогену, трифторметила, трифторметокси, C1-3алкіла, C1-3алкілокси, C13алкілоксиC1-3алкіла, C1-3алкіламіно, C3-6циклоалкіла, C3-6циклоалкілокси, C3-6циклоалкіламіно, (C3-6циклоалкіл)C1-3алкіла, (C3-6циклоалкіл)C1-3алкілокси і (C3-6циклоалкіл)C1-3алкіламіно; 2 R є воднем, галогеном, C1-3алкілом, C1-3алкілокси або трифторметокси; 3 R є воднем, галогеном або трифторметилом; 4 R є воднем або галогеном; 2 3 R і R можуть утворювати радикал -OCF2-O-; Alk є лінійним або розгалуженим C1-6алкандіїлом або C2-6алкендіїлом; 5 6 7 8 R є воднем, гідрокси, C1-3алкілокси, галогеном, R R N-C(=O) - або R -O-C(=O) -; 6 R є C1-3алкілом, C3-6циклоалкілом або (C3-6циклоалкіл)C1-3алкілом; 7 R є воднем або C1-3алкілом; або 6 7 R і R утворюють пірролідиніл або піперидиніл, кожен необов'язково заміщений гідроксилом; 8 R є воднем або C1-4алкілом; або до її фармацевтично прийнятної аддитивної солі або гідрату, або сольвату. 2 UA 102681 C2 5 10 15 20 25 30 35 40 45 50 55 60 Даний винахід відноситься, зокрема, до сполуки формули (I) або до її стереоізомерної форми, в якій 1 R є незаміщеним фенілом; незаміщеним бензодіоксан-6-ілом; незаміщеним піридинілом; або фенілом або піридинілом, заміщеним 1, 2 або 3 замісниками, вибраними з групи, що складається з галогену, трифторметокси, C1-3алкіла, C1-3алкілокси, C1-3алкілоксиC1-3алкіла, C1C3-6циклоалкіла, C3-6циклоалкілокси, C3-6циклоалкіламіно, (C3-6циклоалкіл)C13алкіламіно, 3алкіла, (C3-6циклоалкіл)C1-3алкілокси і (C3-6циклоалкіл)C1-3алкіламіно; 2 R є галогеном, C1-3алкілом, C1-3алкілокси або трифторметокси; 3 R є воднем, галогеном або трифторметилом; 4 R є воднем або галогеном; 2 3 R і R можуть утворювати радикал -OCF2-O-; Alk є лінійним або розгалуженим C1-6алкандіїлом або C2-6алкендіїлом; 5 6 7 8 R є воднем, гідрокси, C1-3алкілокси, галогеном, R R N-C(=O) - або R -O-C(=O) -; 6 R є C1-3алкілом, C3-6циклоалкілом або (C3-6циклоалкіл)C1-3алкілом; 7 R є воднем або C1-3алкілом; або 6 7 R і R утворюють пірролідиніл або піперидиніл, кожен необов'язково заміщений гідроксилом; 8 R є воднем або C1-4алкілом або до її фармацевтично прийнятної аддитивної солі або гідрату, або сольвату. Даний винахід відноситься, зокрема, до сполуки формули (I) або до її стереоізомерної форми, в якій 1 R є незаміщеним фенілом; незаміщеним бензодіоксан-6-ілом; незаміщеним піридинілом; або фенілом або піридинілом, заміщеним 1 або 2 замісниками, вибраними з групи, що складається з галогену, трифторметокси, C1-3алкіла, C1-3алкілокси, C1-3алкілоксиC1-3алкіла і C13алкіламіно; 2 R є воднем, галогеном, метилом, метокси або трифторметокси; 3 R є воднем, галогеном або трифторметилом; 4 R є воднем або галогеном; 2 3 R і R можуть утворювати радикал -OCF2-O- у 3,4-положенні; Alk є лінійним або розгалуженим C1-6алкандіїлом або C2-6алкендіїлом; 5 6 7 8 R є воднем, гідрокси, C1-3алкілокси, галогеном, R R N-C(=O) - або R -O-C(=O) -; 6 R є C1-3алкілом, C3-6циклоалкілом або (C3-6циклоалкіл)C1-3алкілом; 7 R є воднем або C1-3алкілом; або 6 7 R і R утворюють пірролідиніл, необов'язково заміщений гідроксилом; 8 R є воднем або C1-4алкілом; або до її фармацевтично прийнятної аддитивної солі або гідрату, або сольвату. Даний винахід, конкретніше, відноситься до сполуки формули (I) або до її стереоізомерної форми, в якій 1 R є незаміщеним бензодіоксан-6-ілом; незаміщеним піридинілом; або піридинілом, заміщеним 1 або 2 замісниками, вибраними з групи, що складається з хлору, метила, етилу, метоксиметила і етиламіно; 2 R є воднем, галогеном, метил, метокси або трифторметокси; 3 R є воднем, галогеном або трифторметилом; 4 R є воднем або галогеном; 2 3 R і R можуть утворювати радикал -OCF2-O- у 3, 4 положенні; Alk є лінійним або розгалуженим C1-6алкандіїлом; 5 6 7 R є гідроксилом або R R N-C(=O) -; 6 R є метилом, етилом, циклопропілом, циклобутилом або (циклопропіл)метилом; 7 R є воднем або метилом; або до її фармацевтично прийнятної аддитивної солі або гідрату, або сольвату. Даний винахід, особливо, відноситься до сполуки формули (I) або до її стереоізомерної форми, в якій 1 R є незаміщеним бензодіоксан-6-ілом; піридинілом, заміщеним 1 метильною або етиламінною групою; або піридинілом, заміщеним 2 метильними групами; 2 R є воднем, фтором, хлором, бромом, метокси або трифторметокси; 3 R є воднем, фтором, трифторметилом, хлором; 4 R є воднем або фтором; 2 3 R і R можуть утворювати радикал -OCF2-O- у 3, 4 положенні; Alk є лінійним або розгалуженим C1-6алкандіїлом; 5 6 7 R є гідроксилом або R R N-C(=O) -; 3 UA 102681 C2 6 5 10 15 20 25 30 35 40 45 50 55 60 R є метилом, етилом, циклопропілом, циклобутилом або (циклопропіл)метилом; 7 R є воднем або метилом; або до її фармацевтично прийнятної аддитивної солі або гідрату, або сольвату. Даний винахід відноситься, зокрема, до сполуки формули (I) або до її стереоізомерної форми, в якій 1 R є незаміщеним фенілом; незаміщеним бензодіоксан-6-ілом; незаміщеним піридинілом; або фенілом або піридинілом, заміщеним 1 або 2 замісниками, вибраними з групи, що складається з галогену, трифторметокси, C1-3алкіла, C1-3алкілокси, C1-3алкілоксиC1-3алкіла і C13алкіламіно; 2 R є галогеном, метилом, метокси або трифторметокси; 3 R є воднем, галогеном або трифторметилом; 4 R є воднем або галогеном; 2 3 R і R можуть утворювати радикал -OCF2-O- у 3,4-положенні; Alk є лінійним або розгалуженим C1-5алкандіїлом або C2-5алкендіїлом; 5 6 7 8 R є воднем, гідрокси, C1-3алкілокси, галогеном, R R N-C(=O) - або R -O-C(=O) -; 6 R є C1-3алкіл, C3-6циклоалкіл або (C3-6циклоалкіл)C1-3алкілом; 7 R є воднем або C1-3алкілом; або 6 7 R і R утворюють пірролідиніл, необов'язково заміщений гідроксилом; 8 R є воднем або C1-3алкіл; або до її фармацевтично прийнятної аддитивної солі або гідрату, або сольвату. Даний винахід, конкретніше, відноситься до сполуки формули (I) або до її стереоізомерної форми, в якій 1 R є незаміщеним бензодіоксан-6-ілом; незаміщеним піридиніл; або піридинілом, заміщеним 1 або 2 замісниками, вибраними з групи, що складається з хлору, метила, етилу, метоксиметила і етиламіно; 2 R є галогеном, метилом, метокси або трифторметокси; 3 R є воднем, галогеном або трифторметилом; 4 R є воднем або галогеном; Alk є лінійним або розгалуженим C1-5алкандіїлом; 5 6 7 R є гідроксилом або R R N-C(=O) -; 6 R є метилом або етилом; 7 R є воднем або метилом, або до її фармацевтично прийнятної аддитивної солі або гідрату, або сольвату. Даний винахід, особливо, відноситься до сполуки формули (I) або до її стереоізомерної форми, в якій 1 R є незаміщеним бензодіоксан-6-ілом; піридинілом, заміщеним 1 метильною або етиламінною групою; або піридинілом, заміщеним 2 метильними групами; 2 R є фтором, хлором, метокси або трифторметокси; 3 R є воднем, фтором або трифторметилом; 4 R є воднем або фтором; Alk є лінійним або розгалужений C1-5алкандіїлом; 5 6 7 R є гідроксилом або R R N-C(=O) -; 6 R є метилом або етилом; 7 R є воднем або метилом; або до її фармацевтично прийнятної аддитивної солі або гідрату, або сольвату. Бажаними сполуками є сполуки: - (альфаS)-альфа-етил-3-[[3-метокси-5-(трифторметил)феніл]аміно]-1-(2-метил-4-піридиніл)1H-1,2,4-триазол-5-етанол – E137; 3-[(2,2-дифтор-1,3-бензодіоксол-5-іл)аміно]-1-(2,6-диметил-4-піридиніл)-N-етил-1H-1,2,4триазол-5-ацетамід – E200; - N-циклопропіл-3-[(2,2-дифтор-1,3-бензодіоксол-5-іл)аміно]-1-(2,6-диметил-4-піридиніл)-1H1,2,4-триазол-5-ацетамід – E180; (альфаS)-альфа-етил-1-(2-метил-4-піридиніл)-3-[(2,3,4-трифторфеніл)аміно]-1H-1,2,4триазол-5-етанол – E130; - (альфаS)-1-(2,6-диметил-4-піридиніл)-альфа-етил-3-[(2,3,4-трифторфеніл)аміно]-1H-1,2,4триазол-5-етанол – E127; - (альфаS)-1-(2,6-диметил-4-піридиніл)-альфа-метил-3-[(2,3,4-трифторфеніл)аміно]-1H-1,2,4триазол-5-етанол – E189; 3-[(3,4-дифторфеніл)аміно]-1-(2,6-диметил-4-піридиніл)-N-етил-1H-1,2,4-триазол-5ацетамід – E167; 4 UA 102681 C2 5 10 15 20 25 30 35 40 45 50 55 N-циклопропіл-1-(2,6-диметил-4-піридиніл)-3-[[3-(трифторметокси)феніл]аміно]-1H-1,2,4триазол-5-ацетамід – E182; 3-[(3-хлор-2-фторфеніл)аміно]-1-(2,6-диметил-4-піридиніл)-N-етил-1H-1,2,4-триазол-5ацетамід – E153; - (альфаS)-1-(2,6-диметил-4-піридиніл)-альфа-етил-3-[(3,4,5-трифторфеніл)аміно]-1H-1,2,4триазол-5-етанол – E188; (альфаS)-альфа-етил-1-(2-метил-4-піридиніл)-3-[(3,4,5-трифторфеніл)аміно]-1H-1,2,4триазол-5-етанол – E187; - (альфаS)-альфа-етил-3-[(3-фтор-5-метоксифеніл)аміно]-1-(2-метил-4-піридиніл)-1H-1,2,4триазол-5-етанол – E186; (альфаS)-1-(2,6-диметил-4-піридиніл)-альфа-етил-3-[(3-фтор-5-метоксифеніл)аміно]-1H1,2,4-триазол-5-етанол – E190; (альфаS)-3-[(3-хлор-5-метоксифеніл)аміно]-1-(2,6-диметил-4-піридиніл)-альфа-етил-1H1,2,4-триазол-5-етанол – E205; - 3-[(3,4-дифторфеніл)аміно]-1-(2,6-диметил-4-піридиніл)-N, N-диметил-1H-1,2,4-триазол-5пропанамід – E234; і - 3-[(2,2-дифтор-1,3-бензодіоксол-5-іл)аміно]-1-(2,6-диметил-4-піридиніл)-N, N-диметил-1H1,2,4-триазол-5-пропанамід – E235; і їх кислі аддитивні солі і сольвати. Використані в даній заявці C1-3алкіл, як група або частина групи, визначає насичені вуглеводневі радикали з лінійним або розгалуженим ланцюгом, що мають від 1 до 3 атомів вуглецю, такі як метил, етил, пропіл і 1-метилетил; C3-6циклоалкіл, як група або частина групи, визначає циклопропіл, циклобутил, циклопентил і циклогексил; C1-6алкандіїл визначає двовалентні насичені вуглеводневі радикали з лінійним і розгалуженим ланцюгом, що мають від 1 до 6 атомів вуглецю, такі як, наприклад, метилен, 1,2етандіїл, 1,3-пропандіїл, 1,4-бутандіїл, 1,5-пентандіїл і їх розгалужені ізомери; C2-6алкендіїл визначає двовалентні ненасичені вуглеводневі радикали з лінійним і розгалуженим ланцюгом, що мають від 2 до 6 атомів вуглецю, такі як, наприклад, 1,2-етендіїл, 1,3-проп-1-ендіїл і тому подібне; галоген є фтором, хлором, бромом або йодом. Слід прийняти до уваги, що деякі із сполук формули (I) і їх аддитивні солі, гідрати і сольвати можуть містити один або більшее центрів хіральності і можуть існувати у вигляді стереоізомерних форм. Термін "стереоізомерні форми", що використовується у даній заявці, визначає всі можливі стереоізомерні форми, які можуть мати сполуки формули (I) і їх аддитивні солі. Якщо інше не згадане або не вказано, хімічне найменування сполук означає суміш усіх стереохімічно можливих ізомерних форм, причому вказані суміші містять усі діастереомери и енантіомери базової молекулярної структури, а також кожну з індивідуальних ізомерних форм формули (I) і их солей, сольватів, по суті вільну від інших ізомерів, тобто таку, що містить менше 10 %, бажано менше 5 %, особливо менше 2 % і найбільше бажано менше 1 % інших ізомерів. Прийнятними для терапевтичного використання солями сполук формули (I) є солі, в яких протиіон є фармацевтично прийнятним. Проте солі кислот і основ, які не є фармацевтично прийнятними, також можуть знайти застосування, наприклад, при отриманні або очищенні фармацевтично прийнятної сполуки. Усі солі, фармацевтично прийнятні або неприйнятні, включені в обсяг даного винаходу. Мається на увазі, що фармацевтично прийнятні кислотно- і основно-аддитивні солі, згадані в даній заявці, включають терапевтично активні нетоксичні кислотно- і основно-аддитивні сольові форми, які здатні утворювати сполуки формули (I). Фармацевтично прийнятні кислотноаддитивні солі можуть бути легко отримані обробкою основної форми прийнятною фармацевтично прийнятною кислотою. Прийнятні кислоти включають, наприклад, неорганичні кислоти, такі як галогеноводневі кислоти, наприклад, хлористоводневу или бромистоводневу кислоту, сірчану, азотну, фосфорну и подібні кислоти; або органичні кислоти, такі як, наприклад, оцтову, пропанову, гідроксиоцтову, молочну, піровиноградну, щавлеву (тобто етандіову), малонову, янтарну (тобто бутандіову кислоту), малеїнову, фумарову, яблучну, винну, лимонну, метансульфонову, етансульфонову, бензолсульфонову, п-толуолсульфонову, цикламову, саліцилову, п-аміносаліцилову, памоїнову и подібні кислоти. Навпаки, вказані сольові форми можуть бути перетворені обробкою прийнятною основою в форму вільної основи. 5 UA 102681 C2 10 Термін сольвати відноситься до алкоголятів, які можуть утворювати сполуки формули (I), а також їх солі. Деякі із сполук формули (I) можуть також існувати у вигляді своїх таутомерних форм. Мається на увазі, що такі форми, хоча вони явно не вказані в наведеній вище формулі, включені в обсяг даного винаходу. Отримання сполук Сполука за винаходом може бути, загалом, отримана послідовністю стадій, кожна з яких відома фахівцеві в даній галузі. Зокрема, сполуки в даній патентній заявці можуть бути отримані згідно одному або більше з наступних способів отримання. У наступних схемах, і якщо інше не вказане, усі групи, що варіюються, використані, як визначено у формулі (I). Q представляє 15 де R , R і R є такими, як визначено у формулі (I). 5 У деяких з наступних проміжних структур визначення радикала R розширене, так що воно включає HO-CH2 (Ie), заміщений силілокси (If і IV-а) і (алкіл або арил) сульфонілокси (Ig). Схема 1 5 2 20 25 30 3 4 Сполуки даного винаходу можуть бути отримані згідно схемі 1 перетворенням метилового складноефірного похідного N-ацилкарбоімідотіокислоти загальної формули (II) у 1,2,4-триазоли формули (I), використовуючи прийнятне похідне (III) гідразину, в умовах відомого рівня техніки. Дане перетворення типово проводять в апротонному розчиннику, такому як DMF або тому подібне, і, найбажаніше, його проводять у присутності м'якої кислоти Льюіса, зокрема хлориду ртуті (II) (HgCl2), і воно вимагає температури в діапазоні від кімнатної температури до 150 °C. У конкретному варіанті здійснення температура реакції знаходиться між 70° і 120 °C і найбажаніше складає 80 °C. Інтермедіати формули (II) можуть бути присутніми в E- або Zконфігурації або у вигляді їх суміші, а також у таутомерній формі (II-а) також в E- або Zконфігурації або у вигляді їх суміші (схема 2). Схема 2 Загальний інтермедіат (II) у синтезі тризамещених триазолів даного винаходу типово отримують, використовуючи методику, яка складається з 3 синтетичних перетворень (схема 2), 6 UA 102681 C2 5 10 15 20 25 30 35 40 45 50 55 вихідячи з хлорангідрида карбонової кислоти загальної формули (IV). На першій стадії ацилхлорид (IV) вводять в реакцію з тіоціанатом моновалентного катіона (M-NCS на схемі 2), таким як, наприклад, тіоціанат калія або тіоціанат аммонія, отримуючи відповідний ацилізотіоціанат in situ. Дану реакцію зазвичай проводять, використовуючи ацетон як розчинник і при температурі в діапазоні від 0 °C до 70 °C, бажано при кімнатній температурі. Проміжний ацилізотіоціанат не виділяють, а обробляють у тому ж реакційному середовищі прийнятним ароматичним аміном (V), отримуючи N-ацилтіосечовину загальної формули (VI). Дане перетворення зазвичай проводять при температурі від 0 °C до 70 °C, бажано при кімнатній температурі. На кінцевій стадії S-метилювання N-ацилтіосечовини (VI) дає метилове складноефірне похідне N-ацилкарбоімідотіокислоти загальної формули (II). Дане перетворення здійснюють, використовуючи метилйодид, і воно вимагає присутності сильної основи, бажано сильної неорганічної основи, такої як NаH, і його проводять в апротонному розчиннику, такому як, наприклад, DMF, THF і тому подібне, при температурі в діапазоні від –70 °C до кімнатної температури, бажано при 0 °C. Бажаніше, вказане перетворення здійснюють у присутності карбонату калію як неорганічної основи в ацетоні як розчиннику при температурі від 0 °C до 60 °C, бажано при кімнатній температурі. Необов'язково, в тих випадках, коли ацилхлорид (IV) не є комерційно доступним, вказаний ацилхлорид (IV) може бути отриманий з відповідної карбонової кислоти (IX) в умовах відомого рівня техніки. Наприклад, ацилхлорид (IV) може бути отриманий обробкою карбонової кислоти (IX) надлишком оксалілхлорида, необов'язково у присутності DMF як каталізатора при температурі бажано в діапазоні від 0 °C до 50 °C. Вказане перетворення може бути також здійснене у присутності органічного розчинника, такого як дихлорметан або тому подібне. У конкретних прикладах сполук, описаних в даному винаході, ацилхлорид (IV) вимагає попередньої функціоналізації і захисту деяких функціональних груп, щоб бути сумісним з 5 умовами реакцій, наступними далі у всій синтетичній послідовності. Наприклад, коли R є гідроксилом, можна слідувати синтетичній послідовності, показаній на схемі 3, щоб отримати ацилхлорид загальної формули (IVa) із захищеним гідроксилом (схема 3). Схема 3 На першій стадії гідроксильний фрагмент у складному ефірі алканкарбонової кислоти загальної формули (VIIa) захищають прийнятною захисною групою силілу. Зокрема, може бути використана дифенілтретбутильна група, оскільки дана група інертна до умов реакцій, описаних у даній заявці. У бажаному варіанті здійснення складний ефір, що містить гідроксил (VIIa) обробляють трет-бутил(хлор)дифенілсиланом у присутності імідазолу як основи, необов'язково у присутності диметиламінопіридина (DMAP) як каталізатора. Бажаним розчинником є полярний апротонний розчинник, такий як DMF або тому подібне. Температура реакції бажано знаходиться в діапазоні від 0 °C до кімнатної температури. У подальшому перетворенні складний ефір алкілкарбонової кислоти гідролізують із отриманням відповідної карбонової кислоти загальної формули (VIIIa). Дане перетворення може бути здійснене, використовуючи гідроксид металу (M-ОН), такий як гідроксид калію або, бажаніше, гідроксид літію. Реакцію проводять у водному середовищі і, найбажаніше, здійснюють у присутності щонайменше одного або, бажаніше, двох органічних співрозчинників, що змішуються з водою, таких як THF і метанол або тому подібне. Хлорангідрид кислоти загальної формули (IVa) може бути отриманий обробкою карбонової кислоти (VIIIa) надлишком оксалілхлорида, необов'язково у присутності DMF як каталізатора, при температурі переважно в діапазоні від 0 °C до 50 °C. Вказане перетворення може бути також здійснене у присутності органічного розчинника, такого як дихлорметан або тому подібне. Декілька сполук загальної формули (I) можуть бути отримані за допомогою перетворень 5 функціональних груп, що включають замісник R . Схеми 4-8 представляють приклади вказаних перетворень функціональних груп. Схема 4 представляє отримання амідів карбонових кислот загальної формули (Ib) з відповідних складних ефірів карбонових кислот (Ic), що включає 6 7 обробку первинним або вторинним аліфатичним аміном HNR R . В одному варіанті здійснення вказане перетворення може бути здійснене безпосередньо вихідячи із складного ефіру (Ic). Бажаним розчинником є протонний розчинник, такий як нижчий алкіловий спирт, наприклад, 7 UA 102681 C2 метанол або тому подібне. Бажана температура реакції знаходиться між кімнатною температурою і 120 °C. Схема 4 5 10 15 20 25 30 Альтернативно, складний ефір карбонової кислоти (Ic) спочатку гідролізують з отриманням відповідної карбонової кислоти загальної формули (Ib). Дане перетворення може бути здійснене, використовуючи гідроксид металу (M-ОН), такий як гідроксид калію або, бажаніше, гідроксид літію. Реакцію проводять у водному середовищі і, найбажаніше, здійснюють у присутності щонайменше одного або, бажаніше, двох органічних співрозчинників, що змішуються з водою, таких як THF і метанол або тому подібне. Подальше перетворення карбонової кислоти (Id) на аміди формули (Ib) проводять, використовуючи відомі в даній області 6 7 методики, такі як, наприклад, обробку первинним або вторинним аміном HNR R , як визначено вище, у присутності звичайного поєднуючого реагенту для отримання амідів, такого як HBTU (гексафторфосфат O-бензотриазол-N, N,N',N'-тетраметилуронію), EDCI (моногідрохлорид N'(етилкарбонімідоїл)-N, N-диметил-1,3-пропандіаміна) або EDAC (N'-(етилкарбонімідоїл)-N, Nдиметил-1,3-пропандіамін), в апротонному розчиннику, такому як DCM, або бажаніше в полярному апротонному розчиннику, такому як THF або DMF, у присутності добавки амінної основи, такої як діізопропілетиламін. У деяких обставинах застосування HOBT (1-гідрокси-1Hбензотриазол) як добавки є бажаним. 5 Коли R у сполуці загальної формули (I) є первинною гідроксильною функцією, такою як у сполуках загальної формули (Ie), дані сполуки можуть бути отримані як показано на схемі 5, вихідячи із складного ефіру карбонової кислоти (Ic). Дане перетворення може бути успішно проведене, використовуючи боргідрид натрію у присутності хлориду кальцію в системі розчинника, що складається з нижчого алкілового спирту, такого як метанол, і апротонного розчинника, такого як THF. Бажана температура реакції знаходиться між 0 °C і кімнатною температурою. Альтернативно, коли реакційна здатність складноефірного фрагмента нижча, бажано може бути використаний сильніший відновник. Конкретніше, літійалюмогідрид в апротонному розчиннику, такому як діетиловий ефір або THF або тому подібне, може давати первинний спирт (Ie). Бажана температура реакції знаходиться між 0 °C і кімнатною температурою. Схема 5 5 35 У тих випадках, коли R є гідроксильною функцією у сполуці загальної формули (I) і коли вказана гідроксильна група приєднана до вторинного атома вуглецю, сполука загальної формули (Ie') може бути отримана видаленням захисної групи силілу, як показано на схемі 6. У конкретному варіанті здійснення дифенілтретбутильну групу у сполуці загальної формули (If) видаляють за допомогою джерела нуклеофільного фтору, такого як фторид тетрабутиламмонію (TBAF). Дане перетворення проводять бажано в апротонному розчиннику, такому як THF або 8 UA 102681 C2 тому подібне. Бажана температура реакції знаходиться між 0 °C і 50 °C, зокрема дорівнює кімнатній температурі. Схема 6 5 10 15 20 25 30 5 Сполуки загальної формули (I), в яких R є галогеном, можуть бути отримані як показано на схемі 7. На першій стадії гідроксильний фрагмент в (Ie') функціоналізують у метилсульфонатну групу, отримуючи (Ig). Дане перетворення здійснюють обробкою (Ie') метансульфонілхлоридом у присутності амінної основи, такої як триетиламін або тому подібне, у галогенованному розчиннику, такому як дихлорметан або тому подібне, необов'язково у присутності диметиламінопіридина (DMAP) як каталізатора. Бажана температура реакції знаходиться між 0 °C і кімнатною температурою. У даних умовах утворюється значна кількість хлорованої сполуки (Ih). Коли суміш (Ig) і (Ih) обробляють джерелом нуклеофільного фтору, таким як фторид тетрабутиламмонію, вказаний метансульфонат (Ig) перетворюється на фторалкан (Ii). Бажаним розчинником є апротонний розчинник, такий як THF або тому подібне. Бажана температура реакції знаходиться між 0 °C і 70 °C, бажаніше, між кімнатною температурою і 50 °C. Схема 7 В одному конкретному випадку даного винаходу 5-алкіліден-1,2,4-триазоли загальної формули (Ij) можуть бути отримані в умовах реакції Міцунобу, вихідячи з вторинного спирту загальної формули (Ie''). Вторинний спирт (Ie'') обробляють ароматичною карбоновою кислотою, такою як бензойна кислота або 4-нітробензойна кислота або тому подібне, у присутності фосфіна, такого як трифенілфосфін або тому подібне, і азодикарбоксилата, такого як діізопропілазодикарбоксилат (DIAD) або тому подібне, що дає алкіліден (Ij). Схема 8 В одному конкретному випадку даного винаходу, коли Alk у сполуці загальної формули (I) є фрагментом розгалуженого C3-5алкандіїла, вказане розгалуження може бути введене в інтермедіат загальної формули (VIa), даючи інтермедіат загальної формули (IIb) (схема 9). Сполуку (VIa), яка містить активовану метиленову функцію, обробляють галогеноC 1-4алканом, таким як йодметан, в апротонному розчиннику, такому як ацетон, у присутності неорганічної основи, такої як карбонат калія або тому подібне, що дає сполуку загальної формули (IIb). Бажана температура реакції знаходиться між 0 °C і 50 °C, зокрема дорівнює кімнатній 9 UA 102681 C2 температурі. Подібно до того, що було описане вище, сполука (IIb) може бути перетворена в сполуку загальної формули (I), як описано на схемі 1. Схема 9 5 10 15 В іншому варіанті здійснення даного винаходу сполуки загальної формули (I) можуть бути 1 отримані перетвореннями функціональних груп, що включають замісник R . Схеми 10-12 представляють приклади вказаних перетворень функціональних груп. 9 Алкокси-заміщений піридиніл-1,2,4-триазол загальної формули (Il), в якій R є воднем, галогеном, C1-3алкілом, C1-3алкілокси, C1-3алкіламіно, C3-6циклоалкілом, C3-6циклоалкілокси, C3(C3-6циклоалкіл)C1-3алкілом, (C3-6циклоалкіл)C1-3алкілокси або (C36циклоалкіламіно, 6циклоалкіл)C1-3алкіламіно, може бути отриманий обробкою хлорзаміщеного піридиніл-1,2,4триазола загальної формули (Ik) алкоксидом натрію, NaOC1-3алкілом, у відповідному спиртному розчиннику HOC1-3алкіл, наприклад у метанолі, коли як реагент використаний метоксид натрию, і при нагріванні при високих температурах, бажано при 100-130 °C у пробірці, що витримує високий тиск, або в мікрохвильовій печі (схема 10). Аналогічно можуть бути отримані C36циклоалкілокси- і (C3-6циклоалкіл)C1-3алкілокси-заміщені піридиніл-похідні. Схема 10 9 20 25 Аміно- або алкіламіно-заміщений піридиніл-1,2,4-триазол загальної формули (Im), в якій R є воднем, галогеном, C1-3алкілом, C1-3алкілокси, C1-3алкіламіно, C3-6циклоалкілом, C36циклоалкілокси, C3-6циклоалкіламіно, (C3-6циклоалкіл)C1-3алкілом, (C3-6циклоалкіл)C1-3алкілокси або (C3-6циклоалкіл)C1-3алкіламіно, може бути отриманий обробкою хлорзаміщеного піридиніл1,2,4-триазола загальної формули (Ik) C1-3алкіламіном у спиртовому розчиннику, такому як етанол або тому подібне, і при нагріванні при високих температурах, бажано при 100-200 °C у пробірці, що витримує високий тиск, або в мікрохвильовій печі (схема 11). Аналогічно можуть бути отримані C3-6циклоалкіламіно- і (C3-6циклоалкіл)C1-3алкіламіно-заміщені піридиніл-похідні. Схема 11 30 35 10 Моно- або ди-C1-3алкіл-заміщений піридиніл-1,2,4-триазол загальної формули (In), у якій R є воднем, галогеном, C1-3алкілом, C1-3алкілокси або C1-3алкіламіно, може бути отриманий обробкою хлор- або дихлор-заміщеного піридиніл-1,2,4-триазола загальної формули (Io) надлишком (3-15 еквівалентів) реактиву Гриньяра C1-3алкіл-MgBr у присутності каталітичної кількості Fe(acac)3 в системі розчинника, що складається з 85 % THF і 15 % NMP. Вказане перетворення може бути проведене в діапазоні температур від –10 °C до 50 °C, найбажаніше, від 0 °C до 25 °C (схема 12). Буде зрозуміло, що використовуючи дану методологію можуть бути отримані як 2-C1-3алкіл-, так і 2,6-ди-C1-3алкіл-піридинільні сполуки загальної формули (In), 10 UA 102681 C2 вихідячи з відповідних 2-хлор- або 2,6-дихлор- попередників (Io), відповідно. Пірідінільні похідні, заміщені C3-6циклоалкілом або (C3-6циклоалкіл) C1-3алкілом, можуть бути отримані аналогічно. Схема 12 5 10 15 20 25 30 35 40 45 50 Фармакологія Було виявлено, що сполуки за даним винаходом є позитивними аллостеричними модуляторами нікотинового α7-рецептора. Нікотиновий α7-рецептор (α7-nAChR) належить до суперсімейства іонотропних лігандзалежних іонних каналів, що мають cys-петлю, яке включає сімейства 5-HT3-, GABAA- і гліцинового рецепторів. Він активується ацетилхоліном і продуктом його розпаду холіном, і основною ознакою α7-nAChR є його швидка десенсибілізація в разі постійної присутності агоніста. Він є другим підтипом нікотинового рецептора, що найбільше зустрічається, в головному мозку і є важливим регулювальником вивільнення багатьох нейромедіаторів. Він має дискретний розподіл у декількох структурах головного мозку, що мають відношення до пов'язаних з увагою і пізнавальним процесам, у таких як гіпокамп і префронтальна кора головного мозку, і залучений у різні психіатричні і неврологічні порушення у людей. Він також залучений у холінергічний запальний шлях. Генетичний доказ його зв'язку з шизофренією помітний у формі сильного зчеплення між маркером шизофренії (порушення чутливості воротного механізму іонних каналів) і α7-локусом на 15q13-14 і поліморфізму в центральній промоторній області α7-гена. Патологічний доказ вказує на втрату α7-іммунореактивности і α-Btx-зв'язування у гіпокампі, фронтальній і поясній корі шизофренічного головного мозку, при хворобі Паркінсона і Альцгеймера і паравентрикулярному ядрі і в nucleus reuniens при аутизмі. Фармакологічний доказ, такий як виражена звичка до паління хворих шизофренією у порівнянні зі здоровими людьми, було інтерпретовано как спроба пацієнтів до самолікування, щоб компенсувати дефіцит α7-нікотинергічної передачі. Тимгодина нормалізація дефектів чутливості воротного механізма іонних каналів (преімпульсне інгібування PPI) як на тваринних моделях, так і у людини при введенні нікотина і тимгодине відновлення нормальноі чутливості воротного механізма іонних каналів у хворих шизофренією, коли холінергічна активність переднього мозку низька (наприклад, сон у 2 стадії), були інтерпретовані як результат тимгодиної активації нікотинового α7-рецептора, за якою наступала десенсібілізація. Таким чином, є достатня основа передбачити, що активація α7-nAChR даватиме терапевтично корисні ефекти в разі ряду порушень ЦНС (психіатричних і неврологічних). Як уже згадувалося, α7-nAChR швидко десенсибілізується у виадку постійної присутності природного медіатора ацетилхоліну, а також екзогенних лігандів, таких як нікотин. У десенсибілізованому стані рецептор залишається пов'язаним з лігандом, але є функціонально неактивним. Це не являє великої проблеми в разі природних медіаторів, таких як ацетилхолін і холін, оскільки вони є субстратами вельми потужних механізмів розщеплювання (ацетилхолінестераза) і очищення (переносчик холіну). Дані механізми розщеплювання/очищення від медіатора, ймовірно, підтримують баланс між тим, що активується і десенсибілізованим α7-nAChR у фізіологічно прийнятному діапазоні. Проте зрозуміло, що синтетичні агоністи, які не є субстратами механізмів природного розщеплювання і очищення, потенційно схильні як до надмірної стимуляції, а також до зсуву рівноваги в популяції α7-nAChR убік постійно десенсибілізованого стану, що небажано при порушеннях, в яких має значення недостатність в експресії або функції α7-nAChR. Агоністи за своєю природою мають бути націлені на карман зв'язування ACh, який висококонсервативний у різних підтипів нікотинового рецептора, приводячи до потенційної можливості несприятливих реакцій через неспецифічну активацію інших підтипів нікотинового рецептора. Отже, аби уникнути даних потенційних схильностей, альтернативна терапевтична стратегія для α7-агонізму полягає в тому, аби підвищити чутливість рецептора до природних агоністів, використовуючи позитивний аллостеричний модулятор (PAM). PAM визначають як агент, який зв'язується з ділянкою, відмінною від ділянки зв'язування агоніста, і, отже, очікується, що він не матиме агоністичних або десенсибілізуючих властивостей, але підвищуватиме чутливість α7-nAChR до природного 11 UA 102681 C2 5 10 15 20 25 30 35 40 45 50 55 60 медіатора. Перевага даної стратегії полягає в тому, що для даної кількості медіатора сила α7nAChR-відповіді збільшується у присутності PAM відносно рівня передачі, можливої при його відсутності. Отже, в разі порушень, при яких існує дефіцит α7-nAChR-білка, PAM-індуковане посилення α7-нікотиненергічної передачі може бути корисним. Оскільки PAM залежить від присутності природного медіатора, потенціал надстимуляції обмежений механізмами розщеплювання/очищення для природного медіатора. Сполуки за даним винаходом класифіковані на такі, що відносяться до типів 1-4, грунтуючись на якісних кінетичних властивостях, визначених реєстрацією даних, отриманих методом фіксації напруги в конфігурації цілої клітини. Дана класифікація заснована на дії α7PAM-сполуки, описаної в даній заявці, на сигнал, викликаний застосуванням агоніста. Зокрема, вказаний агоніст є холіном з концентрацією 1 мМ. У бажаному експериментальному виконанні вказаною α7-PAM-сполукою і холіном одночасно впливають на клітину, як описано в даному описі. Десенсибілізацію визначають як закриття рецептора після активації в ході застосування агоніста в електрофізіологічних вимірах методом фіксації напруги в конфігурації цілої клітини, що спостерігається як зменшення струму, що вихідить, після початкової активації агоністом. Визначення 1-4 типів PAM описане нижче: Тип 0: сполуки мінімально збільшують ефективну величину струму, викликаного 1 мМ холіну. Тип 1: сполуки збільшеують ефективну величину струму, викликаного 1 мМ холіну, але мінімально змінюють кінетику рецептора. Зокрема, швидкість і міра десенсибілізації, викликаної агоністом, не піддається дії. Модульована сполукою відповідь на 1 мМ холіну, отже, близька до лінійного масштабування відповіді на 1 мМ холіну у відсутності α7-PAM-сполуки. Тип 2: сполуки збільшують ефективну величину струму, викликаного 1 мМ холіну, зменшуючи в той же час швидкість та∕або міру десенсибілізації. Тип 3: сполуки збільшують ефективну величину струму, викликаного 1 мМ холіну. При тестуванні при більш високих концентраціях аж до 10 мкM вони повністю інгібують десенсибілізацію, зокрема викликану застосуванням 1 мМ холіну і таку, що становить 250 мілісекунд. Тип 4: сполуки допускають початкову десенсибілізацію рецептора, за якою йде повторне відкриття рецептора в ході застосування агоніста. При концентраціях α7-PAM-сполуки, що забезпечують малу активність, індукована агоністом активація, за якою йде десенсибілізація, все ще може бути відокремлена від індукованого сполукою повторного відкриття у вигляді початкового максимуму вхідного струму. При концентраціях α7-PAM-сполуки, що забезпечують більш високу активність, повторне відкриття відбувається швидше, ніж закриття внаслідок десенсибілізації, так що початковий максимум струму зникає. Відповідно, завдання даного винаходу полягає в тому, аби надати способи лікування, які включають або введення позитивного аллостеричного модулятора як єдиної активної речовини, таким чином модулюючи активність ендогенних агоністів нікотинових рецепторів, таких як ацетилхолін або холін, або введення позитивного аллостеричного модулятора разом з агоністом нікотинового рецептора. В окремому варіанті даного аспекту винаходу спосіб лікування включає терапію позитивним аллостеричним модулятором нікотинового α7рецептора, описаним тут, і агоністом або частковим агоністом нікотинового α7-рецептора. Приклади прийнятних сполук, що мають агоністичну активність відносно нікотинового α7рецептора, включають - моногідрохлорид 4-бромфенілового ефіру 1,4-діазабіцикло[3.2.2]нонан-4-карбонової кислоти (SSR180711A); -(-)-спіро[1-азабіцикло[2.2.2]октан-3,5'-оксазолідин]-2'-он; - дигідрохлорид 3-[(2,4-диметокси)бензиліден]-анабазина (GTS-21); - [гідрохлорид N-[(3R)-1-азабіцикло[2.2.2]окт-3-іл]-4-хлорбензаміда] PNU-282987; - нікотин; - вареніклин; - MEM3454; - AZD-0328; і - MEM63908. Позитивні nAChR-модулятори даного винаходу придатні для лікування або профілактики психотичних порушень, порушень або захворювань, пов'язаних з розумовими розладами, або станів, при яких модуляція нікотинового α7-рецептора дає корисний ефект. Конкретний аспект способу винаходу є способом лікування дефіциту виучуваності, дефіциту пізнавальної здатності, дефіциту уваги або втрати пам'яті; передбачається, що модуляція активності нікотинового α7-рецептора дає позитивний ефект у разі ряду захворювань, що включають 12 UA 102681 C2 5 10 15 20 25 30 35 40 45 50 55 хворобу Альцгеймера, деменцію при хворобі телець Леві, порушення, що характеризується дефіцитом уваги і гіперактивністю, тривогу, шизофренію, манію, біполярну депресію, хворобу Паркінсона, хворобу Хантінгтона, синдром Туретта, травму мозку або інші неврологічні, дегенеративні або психіатричні порушення, при яких є втрата холінергічних синапсів, включаючи порушення добового ритму, пристрасть до нікотину, біль. Сполуки можуть також знайти терапевтичне застосування як протизапальні лікарські засоби, оскільки α7-субодиниця нікотинового ацетилхолінового рецептора є істотною для інгібування синтезу цитокінів за допомогою холінергічного запального шляху. Прикладами показань, при яких може бути використана терапія даними сполуками, є ендотоксемія, ендотоксичний шок, сепсис, ревматоїдний артрит, астма, множинний склероз, псоріаз, кропив'янка, запальне захворювання кишковика, запальне захворювання жовчного міхура, хвороба Крону, неспецифічний виразковий коліт, післяопераційна непрохідність кишковика, панкреатит, серцева недостатність, гостре пошкодження легені і відторгнення аллотрансплантата. Сполуки за винаходом можуть знайти терапевтичне застосування при наступних показаннях, як наприклад порушення пізнавальної здатності при шизофренії, порушення пізнавальної здатності при хворобі Альцгеймера, м'яке порушення пізнавальної здатності, хвороба Паркінсона, порушення, що характеризується дефіцитом уваги і гіперактивністю, неспецифічний виразковий коліт, панкреатит, артрит, сепсис, післяопераційна непрохідність кишковика і гостре пошкодження легені. Приймаючи до уваги описані вище фармакологічні властивості, сполуки формули (I) або будь-яка їх підгрупа, їх фармацевтично прийнятні аддитивні солі, четвертинні аммонійні і стереохімічно ізомерні форми можуть бути використані як лікарський засіб. Зокрема, дані сполуки можуть бути використані для отримання лікарського засобу для лікування або профілактики психотичних порушень, порушень або захворювань, пов'язаних з розумовими розладами, або станів, при яких модуляція нікотинового α7-рецептора дає корисний ефект. Приймаючи до уваги корисність сполук формули (I), представлений спосіб лікування теплокровних тварин, включаючи людей, страждаючих на згадані далі захворювання, або спосіб запобігання розвитку у теплокровних тварин, включаючи людей, захворювань, при яких модуляція нікотинового α7-рецептора дає позитивний ефект, таких як шизофренія, манія і біполярна депресія, тривога, хвороба Альцгеймера, дефіцит виучуваності, дефіцит пізнавальної здатності, дефіцит уваги, втрата пам'яті, деменція при хворобі телець Леві, порушення, що характеризується дефіцитом уваги і гіперактивністю, хвороба Паркінсона, хвороба Хантінгтона, синдром Туретта, травма мозку, порушення добового ритму, пристрасть до нікотину і біль. Указані способи включають введення, тобто систематичне або місцеве введення, бажане пероральне введення, ефективної кількості сполуки формули (I), включаючи усі її стереохімічно ізомерні форми, її фармацевтично прийнятної аддитивної солі, сольвата або її четвертинної аммонійної форми, теплокровним тваринам, включаючи людей. Фахівцеві у даній галузі буде ясно, що терапевтично ефективна кількість PAM даного винаходу є кількістю, достатньою для того, щоб модулювати активність нікотинового α7рецептора, і що дана кількість варіюється серед іншого залежно від типа захворювання, концентрації сполуки в терапевтичній рецептурі і стану пацієнта. Звичайна кількість PAM, що підлягає введенню як терапевтичного агенту для лікування захворювань, при яких модуляція нікотинового α7-рецептора дає позитивний ефект, таких як шизофренія, манія і біполярна депресія, тривога, хвороба Альцгеймера, дефіцит виучуваності, дефіцит пізнавальної здатності, дефіцит уваги, втрата пам'яті, деменція при хворобі телець Леві, порушення, що характеризується дефіцитом уваги і гіперактивністю, хвороба Паркінсона, хвороба Хантінгтона, синдром Туретта, травма мозку, порушення добового ритму, пристрасть до нікотину і біль, визначатиметься лікарем у кожному окремому випадку. Зазвичай, прийнятна доза є такою, яка дає концентрацію PAM на ділянці, що піддається лікуванню, у діапазоні від 0,5 нМ до 200 мкМ і звичайніше від 5 нМ до 50 мкМ. Аби отримати дані терапевтичні концентрації, пацієнт, що потребує лікування, ймовірно отримає введення від 0,01 мг/кг до 2,50 мг/кг маси тіла, зокрема від 0,1 мг/кг до 0,50 мг/кг маси тіла. Кількість сполуки згідно даному винаходу, яка називається тут активним інгредієнтом, яка потрібна для досягнення терапевтичного ефекту, звичайно, змінюватиметься у кожному окремому випадку залежно від конкретної сполуки, шляху введення, віку і стану реципієнта і конкретного порушення або захворювання, що піддається лікуванню. Спосіб лікування може також включати введення активного інгредієнта в режимі від одного до чотирьох прийомів на добу. У даних способах лікування сполуки за даним винаходом складають у рецептури, бажано, перед надходженням до лікувальної установи. Як описано в даній заявці, прийнятні фармацевтичні 13 UA 102681 C2 5 10 15 20 25 30 35 40 45 50 55 60 рецептури отримують згідно відомим методикам, використовуючи добре відомі і легко доступні інгредієнти. Даний винахід також надає композиції для запобігання або лікування захворювань, при яких модуляція нікотинового α7-рецептора дає позитивний ефект, таких як шизофренія, манія і біполярна депресія, тривога, хвороба Альцгеймера, дефіцит виучуваності, дефіцит пізнавальної здатності, дефіцит уваги, втрата пам'яті, деменція при хворобі телець Леві, порушення, що характеризується дефіцитом уваги і гіперактивністю, хвороба Паркінсона, хвороба Хантінгтона, синдром Туретта, травма мозку, порушення добового ритму, пристрасть до нікотину і біль. Вказані композиції включають терапевтично ефективну кількість сполуки формули (I) і фармацевтично прийнятний носій або розчинник. Хоча можливим є введення одного активного інгредієнта, бажано надавати його у вигляді фармацевтичної композиції. Відповідно, даний винахід додатково представляє фармацевтичну композицію, що включає сполуку за даним винаходом разом з фармацевтично прийнятним носієм або розчинником. Носій або розчинник має бути "прийнятним" у сенсі своєї сумісності з іншими інгредієнтами композиції і не бути шкідливим для реципієнта. Фармацевтичні композиції за даним винаходом можуть бути отримані будь-якими способами, добре відомими в області фармації, наприклад, використовуючи такі способи, які описані в публікації Gennaro і ін. Remington's Pharmaceutical Sciences (18th ed., Mack Publishing Company, 1990, див. особливо частину 8: Pharmaceutical preparations and their Manufacture). Терапевтично ефективна кількість конкретної сполуки у формі основи або формі аддитивної солі як активного інгредієнта об'єднують у ретельно змішаній суміші з фармацевтично прийнятним носієм, який може приймати різні форми залежно від форми препарату, потрібного для введення. Дані фармацевтичні композиції за бажанням знаходяться у вигляді стандартної лікарської форми, прийнятної бажано для систематичного введення, такого як пероральне, черезшкірне або парентеральне введення; або для місцевого введення, такого як введення через інгаляції, носового спрея, очних крапель або за допомогою крему, гелю, шампуню або тому подібне. Наприклад, при отриманні композицій у вигляді пероральної стандартної лікарської форми може бути використане будь-яке із звичайних фармацевтичних середовищ, таке як, наприклад, вода, гліколі, олії, спирти і тому подібне в разі пероральних рідких препаратів, таких як суспензії, сиропи, еліксири і розчини; або ж у разі порошків, пігулок, капсул і таблеток можуть бути використані тверді носії, такі як крохмалі, цукри, каолін, змащуючі речовини, зв'язуючі, дезінтегруючі агенти і тому подібне. Унаслідок легкості їх введення таблетки і капсули є найбільш бажані пероральні стандартні лікарські форми, у разі яких застосування твердих фармацевтичних носіїв очевидне. У разі парентеральних композицій носій зазвичай включатиме стерильну воду, щонайменше у більшій частині, хоча можуть бути включені інші інгредієнти, наприклад для поліпшення розчинності. Можуть бути отримані, наприклад, розчини, що ін'єктуються, в яких носій включає фізіологічний розчин, розчин глюкозиабо суміш фізіологічного розчину і розчину глюкози. Можуть бути отримані суспензії, що також ін'єктуються, у разі яких можуть бути використані прийнятні рідкі носії, суспендуючі агенти, і тому подібне. У композиціях, прийнятних для черезшкірного введення, носій необов'язково включає агент, що збільшеує проникнення, та/або відповідний змочуючий агент, необов'язково об'єднаний з прийнятними добавками будь-якої природи в мінорних кількостях, де дані добавки не викликають яких-небудь шкідливих дій на шкіру. Вказані добавки можуть полегшувати введення в шкіру та/або можуть сприяти отриманню бажаних композицій. Дані композиції можуть бути введені різними шляхами, наприклад, як трансдермальний пластир, як засіб точкового нанесення або як мазь. Особливо бажано складати рецептури вищезгаданих фармацевтичних композицій у вигляді стандартної лікарської форми з метою легкості введения і одноманітності дозування. Термін стандартна лікарська форма, що використовується в даному описі і формулі винаходу, відноситься до фізично дискретних одиниць, прийнятним як стандартні дозировки, причому кожна одиниця містить задану кількість активного інгредієнта, розраховану таким чином, щоб давати бажаний терапевтичний ефект у поєднанні з обов'язковим фармацевтичним носієм. Прикладами таких стандартних лікарських форм є таблетки (включаючи таблетки з рискою або вкриті оболонкою), капсули, пігулки, пакети с порошком, облатки, ін'єковані розчини або суспензії, чайніі ложки, столові ложки і тому подібне, і окремі кратні їм кількості. Дані сполуки можуть бути використані для систематичного введення, такого як пероральне, черезшкірне або парентеральне введення, або місцевого введення, такого як введення за допомогою інгаляції, носового спрея, очних крапель або за допомогою крему, гелю, шампуню або тому подібне. Сполуки вводять бажано перорально. Точне дозування і частота введення залежать від конкретної використаної сполуки формули (I), конкретного стану, що піддається 14 UA 102681 C2 5 10 15 20 25 30 35 40 45 50 лікуванню, важкості стану, що піддається лікуванню, віку, маси, статі, міри поширення порушення і загального фізичного стану конкретного пацієнта, а також від інших лікарських засобів, які може приймати індивідуум, як це добре відомо фахівцям у даній галузі. Більше того, вочевидь, що вказана ефективна добова кількість може бути знижена або збільшена залежно від відповіді суб'єкта, який піддається лікуванню, та/або залежно від оцінки лікаря, що призначає сполуки за даним винаходом. Опис композицій з формоутворюючими (%). Залежно від способу введення фармацевтична композиція включатиме від 0,05 до 99 % по масі, бажано від 0,1 до 70 % по масі, бажаніше від 0,1 до 50 % по масі активного інгредієнта і від 1 до 99,95 % по масі, бажано від 30 до 99,9 % по масі, бажаніше від 50 до 99,9 % по масі фармацевтично прийнятного носія, причому усі процентні вмісти розраховані на сумарну масу композиції. Сполуки формули (I) можуть бути також використані у поєднанні з іншими традиційними агоністами нікотинового α7-рецептора, такими як, наприклад, моногідрохлорид 4бромфенілового ефіру 1,4-діазабіцикло[3.2.2]нонан-4-карбонової кислоти (SSR180711A); (-)спіро[1-азабіцикло[2.2.2]октан-3,5'-оксазолідин]-2'-он; дигідрохлорид 3-[(2,4диметокси)бензиліден]-анабазина (GTS-21); [гідрохлорид N-[(3R)-1-азабіцикло[2.2.2]окт-3-іл]-4хлорбензаміда] PNU-282987; нікотин; вареніклін; MEM3454; AZD-0328 і MEM63908. Таким чином, даний винахід також відноситься до поєднання сполуки формули (I) і агоніста нікотинового α7-рецептора. Вказане поєднання може бути використане як лікарський засіб. Даний винахід також відноситься до продукту, що включає (a) сполуки формули (I) і (b) агоніст нікотинового α7-рецептора, як комбінованому препарату для одночасного, роздільного або послідовного застосування в лікуванні захворювань, при яких модуляція нікотинового α7рецептора дає позитивний ефект. Різні лікарські засоби можуть бути об'єднані в єдиному препараті разом з фармацевтично прийнятними носіями. Експериментальна частина Декілька способів отримання сполук за даним винаходом проілюстровано в наступних прикладах. Якщо інше не вказане, всі вихідні матеріали отримували від комерційних постачальників і використовували без додаткового очищення. Тут і далі, "THF" означає тетрагідрофуран; "DMF" означає N, N-диметилформамід; "EtOAc" означає етилацетат; "DCM" означає дихлорметан; "DIPE" означає диізопропіловий ефір; "DMSO" означає диметилсульфоксид; "DMAP" означає 4-(диметиламіно) піридину; "хв" означає хвилини; "нас.” означає насичений; "MеOH" означає метанол; "EtOH" означає етанол; "Et2O" означає диетиловий ефір; "acac" означає ацетилацетонат; "TBAF" означає фторид тетрабутиламмонію; "DIAD" означає диізопропілдіазодикарбоксилат; "NH4OAc" означає ацетат аммонію і "к.т.” означає кімнатну температуру. Реакції за сприяння мікрохвильового випромінювання здійснювали в одномодовому реакторі: мікрохвильовий реактор Initiator™ Sixty EXP (Biotage AB) або в багатомодовому реакторі: MICRO-SYNTH Labstation (Milestone, Inc.). Наступні приклади призначені ілюструвати, але не обмежувати обсяг даного винаходу. Опис 1 Метиловий ефір (3S)-3-[[(1,1-диметилетил)дифенілсиліл]окси]-бутанової кислоти (D1) Трет-бутил(хлор)дифенілсилан (15,282 г, 55,6 ммоль) додавали по краплях до охолоджуваного льодом і перемішуваному розчину метилового ефіру (S)-3-гідроксибутанової кислоти (5,473 г, 46,3 ммоль), 1H-імідазола (6,939 г, 102 ммоль) і DMAP (0,566 г, 4,63 ммоль) в DMF (250 мл). Через 10 хв каламутній реакційній суміші дозволяли нагрітися до кімнатної температури і перемішували її протягом ночі. Реакційну суміш розчиняли в EtOAc, потім промивали послідовно H2O (3(х), 1 N HCl і насиченим розчином NaHCO 3. Органічну фазу висушували (Na2SO4), профільтровували і концентрували з отриманням в'язкого безбарвного масла. Вихід: 10,614 г інтермедіата D1 (64 %). Опис 2 (3S)-3-[[(1,1-Диметилетил)дифенілсиліл]окси]-бутанова кислота (D2) 15 UA 102681 C2 5 10 15 20 25 30 35 Розчин гідроксиду літію (2,1 г, 89,3 ммоль) в MeOH/H2O (80 мл/80 мл) додавали до перемішуваного розчину інтермедіата D1 (10,6 г, 29,8 ммоль) у THF (80 мл) при кімнатній температурі. Реакційну суміш перемішували протягом ночі. Потім розчинник видаляли при зниженому тиску і залишок розподіляли між H 2O/EtOAc. Шари розділяли і водну фазу екстрагували EtOAc ((3), потім підкислювали до pH 1 концентрованою HCl і знову екстрагували EtOAc ((3). Об'єднані органічні екстракти висушували (Na 2SO4), фільтрували і концентрували при зниженому тиску, з отриманням світло-жовтого в'язкого масла. Вихід: 11 г інтермедіата D2 (99,9 %). Опис 3 (3S)-3-[[(1,1-Диметилетил)дифенілсиліл]окси]-бутаноїлхлорид (D3) Оксалілхлорид (4,1 мл, 48 ммоль; щільність 1,5 г/мл) додавали по краплях до перемішуваного розчину інтермедіата D2 (11 г, 32 ммоль) і DMF (1 мл) у DCM (300 мл) при кімнатній температурі протягом 90 хв. Реакційну суміш упарювали при зниженому тиску спільно з толуолом (х3), з отриманням сирого інтермедіата D3 у вигляді жовтого масла. Даний матеріал був використаний на наступній стадії послідовності реакцій без якого-небудь додаткового очищення. Опис 4 (3S)-3-[[(1,1-Диметилетил)дифенілсиліл]окси]-N-[[[4-фтор-3-(трифторметил) феніл]аміно]тіоксометил]-бутанамід (D4) Інтермедіат D3 (5,4 г, 14,9 ммоль) додавали по краплях до перемішуваного розчину тіоціанату аммонія (1,1 г, 14,9 ммоль) в ацетоні (150 мл) при кімнатній температурі. Через 2 години додавали 4-фтор-(3-трифторметил)анілін (2,7 г, 14,9 ммоль) і реакційну суміш перемішували протягом ночі при кімнатній температурі. Розчинник видаляли при зниженому тиску і залишок розподіляли між H2O/DCM. Шари розділяли і водну фазу екстрагували DCM (х2). Об'єднані органічні екстракти промивали розсолом, висушували (Na 2SO4) і фільтрували. Потім розчинник упарювали, з отриманням сирого матеріалу у вигляді в'язкого темно-помаранчевого масла з вихідом 8,8 г (104,9 %). Даний матеріал очищали флеш-хроматографією (Biotage; колонка 40M; елюент: EtOAc/гептан, градієнтне елюювання від 0/100 до 40/60). Вихід 3,7 г інтермедіата D4 (44,4 %) у вигляді в'язкого, жовтого масла. Опис 5 Етиловий ефір 4-[[[(3,4-Дифторфеніл)аміно]тіоксометил]аміно]-4-оксо-бутанової кислоти (D5) 16 UA 102681 C2 5 10 Суміш аммонійної солі тіоціанової кислоти (5 г, 0,065 моль) у CH3CN (42 мл) перемішували протягом 15 хв при кімнатній температурі. Етиловий ефір 4-хлор-4-оксобутанової кислоти (0,061 моль) додавали по краплях і суміш перемішували протягом 30 хв при 60 °C. Суміш охолоджували до 0 °C і потім по краплях додавали 3,4-дифторанілін (6 мл, 0,061 моль). Реакційну суміш перемішували протягом 30 хв при кімнатній температурі. Потім суміш розбавляли льодяною водою і перемішували протягом 15 хв при 0 °C. Суміш фільтрували через фільтр з пористого скла, висушивали і азеотропною відгонкою з толуолом удаляли оставшуюся воду. Вихід: 16,40 г інтермедіата D5 (85 %, жовта тверда речовина). Так само отримували наступні інтермедіати: Опис 9 Метиловий ефір N-[(3S)-3-[[(1,1-Диметилетил)дифенілсиліл]окси]-1-оксобутил]-N'-[4-фтор-3(трифторметил)феніл]карбоімідотіокислоти (D9) 15 20 25 K2CO3 (1 г, 7,3 ммоль) додавали до перемішуваного розчину інтермедіата D4 (отриманий згідно опису 4) (3,7 г, 6,6 ммоль) в ацетоні (70 мл) при кімнатній температурі. Через 50 хв по краплях додавали CH3I (0,5 мл, 7,9 ммоль) і реакційну суміш перемішували при кімнатній температурі протягом 145 хв. Розчинник видаляли при зниженому тиску і отриманий залишокрозподіляли між H2O/DCM. Шари розділяли і водну фазу екстрагували DCM (х2). Об'єднані органічні екстракти промивали розсолом, висушували (Na2SO4), фільтрували, і розчинник упарювали, з отриманням сирого продукту у вигляді в'язкого жовтого масла. Вихід: 3,8 г інтермедіата D9 (99,4 %). Так само отримували наступні інтермедіати: Інтермедіат D10, 17 UA 102681 C2 Інтермедіат D11 Інтермедіат D12 Інтермедіат D13 5 10 15 20 Інтермедіат D17 Опис 14 5-[(2S)-2-[[(1,1-Диметилетил)дифенілсиліл]окси]пропіл]-N-[4-фтор-3-(трифторметил)феніл]1-(2-метил-4-піридиніл)-1H-1,2,4-триазол-3-амін (D14) Хлорид ртуті (II) (1,8 г, 6,5 ммоль) додавали до перемішуваного розчину інтермедіата D9 (отриманий згідно опису 9) (3,8 г, 6,5 ммоль) і 4-гідразин-2-метилпіридину (0,8 г, 6,5 ммоль) у DMF (65 мл) при кімнатній температурі. Реакційну суміш нагрівали при 80 °C протягом 140 хв. Охолоджену реакційну суміш виливали на кригу і осаджений продукт відділяли фільтруванням, з отриманням жовтої напівтвердої речовини. Вихід: 4,2 г інтермедіата D14 (101,2 %). Опис 15 Етиловий ефір 3-[[[[4-фтор-3-(трифторметил)феніл]аміно]тіоксометил]аміно]-3-оксопропанової кислоти (D15) Етиловий ефір 3-хлор-3-оксо-пропанової кислоти (5 г; 33,2 ммоль) повільно додавали до перемішуваного розчину амонійної солі тіоціанової кислоти (1:1) (2,781 г; 36,5 ммоль) у CH3CN (110 мл) при кімнатній температурі. Через 2 години додавали 4-фтор-3(трифторметил)бензоламін (4,27 мл; 33,2 ммоль). Розчинник видаляли при зниженому тиску. 18 UA 102681 C2 5 10 15 20 25 30 35 Отриманий залишок розподіляли між H2O/DCM і розділяли фази. Водну фазу екстрагували DCM (х2) і об'єднані органічні екстракти промивали розсолом, висушували і фільтрували. Вихід: 3,656 г інтермедіата D15. Опис 16 Етиловий ефір 3-[[(1Z)-[[4-фтор-3-(трифторметил)феніл]аміно](метилтіо) метилен]аміно]-2метил-3-оксо-пропанової кислоти (D16) K2CO3 (0,831 г; 6,01 ммоль) додавали до перемішуваного розчину інтермедіата D15 (1,765 г; 5,01 ммоль) в ацетоні (50 мл) при кімнатній температурі. Через 40 хв по краплях додавали CH3I (0,624 мл; 10,0 ммоль). Реакційну суміш перемішували при кімнатній температурі. Розчинник видаляли при зниженому тиску і залишок розподіляли між H2O/DCM. Водну фазу екстрагували DCM і об'єднані органічні екстракти промивали розсолом, висушували (Na2SO4) і фільтрували, з отриманням помаранчевого масла. LCMS показала 4 різних продукти, які розділяли флешхроматографією, використовуючи систему Biotage (колонка 40M), елюент: градієнтне елюювання від DCM до 10 % MeOH/DCM. Третя фракція містила бажану сполуку. Вихід: 401 мг інтермедіата D16. Опис D18 5-[(2S)-2-[[(1,1-Диметилетил)дифенілсиліл]окси]бутил]-N-[3-метокси-5(трифторметил)феніл]-1-(2-метил-4-піридиніл)-1H-1,2,4-триазол-3-амін (D18) Хлорид ртуті (II) (5,2 г; 19,1 ммоль) додавали до перемішуваного розчину інтермедіата D17 (отриманий згідно опису 9) (11,5 г, 19,1 ммоль) і 4-гідразин-2-метилпіридину (3,1 г, 19,1 ммоль) у DMF (180 мл) при кімнатній температурі. Через 5 хв реакційну суміш нагрівали при 80 °C протягом 120 хв. Реакційну суміш охолоджували до кімнатної температури і розчинник видаляли при зниженому тиску. Залишок розподіляли між H 2O/EtOAc. Водну фазу екстрагували EtOAc (х2) і об'єднані органічні екстракти промивали розсолом, висушували (Na 2SO4) і фільтрували, з отриманням жовтого масла. Вихід: інтермедіат D18 (41 %). Інтермедіат D18 (29 г; кілька об'єднаних порцій) розчиняли в 1,5 літрах EtOAc. Додавали розчин Na2S у воді (20 мл), і суміш енергійно перемішували протягом 2 годин. Утворювався чорний нерозчинний осад (HgS). Реакційну суміш фільтрували через дикаліт і знову обробляли розчином Na2S. Органічний шар відділяли і промивали розсолом. Органічний шар висушували над MgSO4, фільтрували і обробляли силікагель-S-тіолом (2 × 2 години при 50 °C). Суміш фільтрували через дикаліт і упарювали. Продукт викристалізовувався, коли упарювання було практично завершене. Додавали Et2O, і осад фільтрували. Продукт висушували у вакуумній печі при 50 °C. Вихід: 25,70 г інтермедіата D18. Опис D19 Метиловий ефір 3-[[[[2-фтор-3-(трифторметил)феніл]аміно]тіоксометил]аміно]-3-оксопропанової кислоти (D19) 19 UA 102681 C2 5 10 15 20 25 30 35 Метиловий ефір 3-хлор-3-оксо-пропанової кислоти (7,5 г) у MеCN (50 мл) повільно додавали до перемішуваного розчину тіоціанату аммонію (4,6 г) у MеCN (400 мл) при кімнатній температурі. Через 1,5 години реакційну суміш охолоджували до 0 °C і повільно додавали розчин 2-фтор-3-(трифторметил)аніліну (9,8 г) в MеCN (50 мл). Через 5-10 хв отриманій реакційній суміші дозволяли нагрітись до кімнатної температури і через 1 годину розчинник видаляли при зниженому тиску, і отриманий залишок розподіляли між H 2O/DCM і розділяли фази. Водну фазу екстрагували DCM (х2), і об'єднані органічні екстракти промивали розсолом, потім висушували (Na2SO4). Фільтрували і концентрували з отриманням сирого матеріалу у вигляді бурштинового масла. Вихід: 17,1 г інтермедіата D19 (60 %). Опис D20 Метиловий ефір 3-[[(1Z)-[[2-фтор-3-(трифторметил)феніл]аміно](метилтіо) метилен]аміно]-3оксо-пропанової кислоти Охолоджуваний льодом розчин інтермедіата D19 (17,1 г) у THF (450 мл) перемішували в атмосфері N2. Додавали NaOtBu (1 еквівалент), і через 30 хв додавали по краплях розчин йодметана (3,15 мл) у THF. Після додаткових 30 хв додавали додаткову кількість NaOtBu (1 еквівалент) і вміст перемішували при ~0 °C. Після 45 хв, коли реакція завершилася, додавали насичений розчин NH4Cl і реакційну суміш розбавляли EtOAc. Фази розділяли і водну фазу екстрагували EtOAc (х2). Об'єднані органічні екстракти промивали розсолом, потім висушували (Na2SO4). Фільтрували і концентрували при зниженому тиску з отриманням сирого матеріалу у вигляді бурштинового масла. Вихід: 17,2 г інтермедіата D20 (59 %). Опис D21 Метиловий ефір 1-(2,6-диметил-4-піридиніл)-3-[[2-фтор-3-(трифторметил) феніл]аміно]-1H1,2,4-триазол-5-оцтової кислоти (D21) Хлорид ртуті (II) (7 г) додавали до перемішуваного розчину інтермедіата D20 (9,1 г) і 2,6диметил-4-гідразинпіридина HCl (4,48 г) у DMF (200 мл) при кімнатній температурі. Після 5 хв при кімнатній температурі отриману реакційну суміш нагрівали до 70 °C і перемішували при цій температурі протягом ночі (реакція пройшла на 40 %). Вміст охолоджували до кімнатної температури і розчинник видаляли при зниженому тиску. Отриманий залишок розподіляли між H2O і EtOAc і фази розділяли. Водну фазу екстрагували EtOAc (х2) і об'єднані органічні екстракти промивали розсолом, потім висушували (Na2SO4). Фільтрували і концентрували з отриманням жовтого масла, яке розчиняли в EtOAc, і додавали розчин сульфіду натрию (4 г) в H2O (утворювався чорний осад). Отриману реакційну суміш енергійно перемішували при кімнатній температурі протягом декількох годин, потім фільтрували через дикаліт. Фази розділяли і водну фазу екстрагували EtOAc (х2), і об'єднані органічні екстракти промивали H2O, потім розсолом і висушували (Na2SO4). Вміст фільтрували і концентрували, і отримане масло 20 UA 102681 C2 5 10 15 20 25 30 розчиняли в DCM, і додавали Si-тіол (функціоналізований силікагель). Отриману суспензію енергійно перемішували при кімнатній температурі протягом декількох годин, потім фільтрували і упарювали, з отриманням бурштинового масла, яке очищали флеш-хроматографією, використовуючи систему Biotage, елюент: градієнтне елюювання від 20 % EtOAc: 80 % гептана до 100 % EtOAc (елюювання більшості домішок), потім 10 % MeOH/DCM, аби елюювати бажаний продукт у вигляді тягучого жовтого масла. Жовте масло перемішували в DIPE протягом ночі, потім вміст фільтрували, з отриманням блідо-жовтого порошку. Вихід: 814 мг інтермедіата D21 (6 %). Приклад 1 3-[(3,4-Дифторфеніл)аміно]-1-(2,3-дигідро-1,4-бензодіоксин-6-іл)-1H-1,2,4-триазол-5пропанова кислота (E1) LiOH·H2O (0,00277 моль) додавали до перемішуваного при кімнатній температурі розчину сполуки E114 (отримане згідно опису 14) (0,00158 моль) у THF (9 мл), MeOH (3 мл) і H2O (3 мл). Реакційну суміш перемішували протягом 1 години при кімнатній температурі. Розчинники упарювали при зниженому тиску. Додавали HCl (2 М, 20 мл) і отрманий осад відфільтровували і висушували. Вихід: 0,570 г сполуки E1 (90 %, сіра тверда речовина). Приклад 2 3-[(3,4-Дифторфеніл)аміно]-1-(2,3-дигідро-1,4-бензодіоксин-6-іл)-N-метил-1H-1,2,4-триазол5-пропанамід (E2) Сполуку E114 (отримана згідно опису 14) (0,00019 моль) розчиняли в CH3NH2, 2,0 М у THF (1,9 мл; 0,0038 моль), і розчин кип'ятили протягом 12 годин. Приблизно кожні 3 години додавали додаткову порцію CH3NH2, 2,0 М у MeOH (1,9 мл; 0,0038 моль) і THF (1 мл). Суміш охолоджували і розчинник упарювали при зниженому тиску. Коричневий твердий залишок очищали колонковою хроматографією на силікагелі (елюент: DCM/(MeOH/NH 3) від 100/0 до 90/10). Фракції продукту збирали і розчинник упарювали. Вихід: 0,013 г сполуки E2 (16 %). Приклад 3 3-[(3,4-Дифторфеніл)аміно]-1-(2,3-дигідро-1,4-бензодіоксин-6-іл)-N, N-диметил-1H-1,2,4триазол-5-пропанамід (E3) 21 UA 102681 C2 5 10 15 20 25 30 35 Сполуку E1 (отримана згідно прикладу 1) (0,00062 моль) розчиняли в DMF (5 мл). Додавали 1-гідрокси-1H-бензотриазол (0,00186 моль), гідрохлорид (3-диметиламінопропіл)-етилкарбодиіміда (1:1) (0,00186 моль) і N-етил-N-(1-метилетил)-2-пропанамін (0,00248 моль), потім додавали гідрохлорид диметиламіна (1:1) (0,00124 моль). Реакційну суміш перемішували протягом 3 годин при кімнатній температурі. Реакційну суміш виливали в воду. Суміш екстрагували CHCl3. Органічний шар відділяли, промивали 1 М розчином HCl, потім промивали розсолом і фільтрували через гідрофобну фритту. Розчинники упарювали при зниженому тиску, з отриманням жовтого твердого залишку, який додатково висушували протягом однієї години (у GeneVac®). Залишок затирали с диетиловим ефіром, відфільтровували і висушивали. Вихід: 0,245 г сполуки E3 (92 %). Приклад 4 1-(2-Метокси-3-піридиніл)-N, N-диметил-3-[[3-(трифторметокси)феніл]аміно]-1H-1,2,4триазол-5-пропанамід (E4) Суміш сполуки E76 (отримана згідно прикладу 3) (0,20 г; 0,0004 моль), NaOCH 3 у MeOH (1 мл) и MeOH (4 мл) перемішували протягом 30 хв при 100 °C у мікрохвильовій печі. Реакційну суміш упарювали і залишок очищали високоефективною рідинною хроматографією на оберненій фазі (Shandon Hyperprep® C18 BDS (дезактивований основою силікагель), 8 мкм, 250 г, I.D. 5 см). Використовували градієнт з 2 рухомими фазами. Фаза A: 0,25 % розчин NH4HCO3 у воді; фаза B: CH3CN. Бажані фракції збирали, упарювали і висушували. Вихід: 38 мг сполуки E4 (21 %). Приклад 5 N, N-Диметил-1-(2-метил-3-піридиніл)-3-[[3-(трифторметокси)феніл]аміно]-1H-1,2,4-триазол5-пропанамід (E5) Суміш сполуки E76 (отримана згідно прикладу 3) (0,20 г; 0,0004 моль), Fe(acac) 3 (0,031 г; 0,0001 моль), THF (5 мл) і 1-метил-2-пирролідинона (1,5 мл) перемішували при кімнатній температурі перед додаванням CH3MgBr у Et2O, 2 M (2 мл) і MeOH (5 мл). Реакційну суміш упарювали і розчиняли в DCM і H2O і фільтрували через дикаліт. Фільтрат висушивали над MgSO4 і фільтрували. Фільтрат упарювали. Продукт розчиняли в DIPE/H 2O. Органічний шар відділяли, висушивали (MgSO4) і фільтрували. Фільтрат упарювали і залишок очищали високоефективною рідинною хроматографією на оберненій фазе (Shandon Hyperprep® C18 BDS (дезактивований основою силікагель), 8 мкм, 250 г, I.D. 5 см). Використовували градієнт з 2 рухомими фазами. Фаза A: 0,25 % розчин NH4HCO3 у воді; фаза B: CH3CN. Бажані фракції збирали, упарювали і висушивали. Вихід: 81 мг сполуки E5 (47 %). 22 UA 102681 C2 Приклад 6 N, N-Диметил-1-[2-(метиламіно)-3-піридиніл]-3-[[3-(трифторметокси) феніл]аміно]-1H-1,2,4триазол-5-пропанамід (E6) 5 10 15 20 25 30 35 Суміш сполуки E76 (отримана згідно прикладу 3) (0,20 г, 0,00044 моль), CH3NH2 (2 г) и EtOH (20 мл) перемішували протягом 16 годин при 160 °C. Потім розчинник упарювали і залишок очищали високоефективною рідинною хроматографією на оберненій фазі (Shandon Hyperprep® C18 BDS (дезактивований основою силікагель), 8 мкм, 250 г, I.D. 5 см). Використовували градієнт з 3 рухомими фазами. Фаза A: 0,25 % розчин NH4HCO3 у воді; фаза B: MeOH; фаза C: CH3CN. Чисті фракції збирали і розчинник упарювали. Бажану сполуку висушивали. Вихід: 0,091 г сполуки E6 (46 %). Приклад 7 3-[[4-фтор-3-(трифторметил)феніл]аміно]-1-(2-метил-4-піридиніл)-1H-1,2,4-триазол-5пропанол (E7) LiAlH4 (10,5 ммоль) додавали частинами до охолоджуваного льодом і перемішуваному розчину сполуки E113 (отримана згідно опису D14) (6,98 ммоль) у Et2O (80 мл) в атмосфері N2. Через 5 хв суміші дозволяли нагрітися до кімнатної температури і потім перемішували протягом ночі. Потім реакційну суміш охолоджували до 0 °C і додавали додаткову кількість Et2O (20,9 ммоль). Через 5 хв реакційну суміш нагрівали до кімнатної температури. Додавали додаткову кількість LiAlH4 (3 еквіваленти; 21,0 ммоль) до охолодженої реакційної суміші, і суміш перемішували протягом 1 години. Реакційну суміш охолоджували і обережно гасили 10 % NаOH. Потім суміші дозволяли нагрітись до кімнатної температури і її фільтрували через подушку діатомової землі. Фільтрат екстрагували EtOAc. Об'єднані органічні екстракти промивали розсолом, висушували (Na2SO4), фільтрували і концентрували, з отриманням 0,634 г жовтої твердої речовини (вихід = 23 %). Продукт очищали високоефективною рідинною хроматографією на оберненій фазі (Shandon Hyperprep® C18 BDS (дезактивований основою силікагель), 8 мкм, 250 г, I.D. 5 см). Використовували градієнт з 3 рухомими фазами. Фаза A: 90 % 0,5 % розчину NH4OAc у воді + 10 % CH3CN; фаза B: MеOH; фаза C: CH3CN. Бажані фракції збирали, і розчинник упарювали, з отриманням білої твердої речовини. Додавали H2O, і суміш нейтралізували насиченим NaHCO3. Потім вміст екстрагували DCM. Об'єднані органічні екстракти промивали розсолом, висушували (Na2SO4), фільтрували і концентрували, з отриманням білої твердої речовини. Вихід: 0,084 г сполуки E7 (3 %). Приклади 8 і 9 5-(3-Фторпропіл)-N-[4-фтор-3-(трифторметил)феніл]-1-(2-метил-4-піридиніл)-1H-1,2,4триазол-3-амін (E8) і 5-(3-хлорпропіл)-N-[4-фтор-3-(трифторметил)феніл]-1-(2-метил-4піридиніл)-1H-1,2,4-триазол-3-амін (E9) 23 UA 102681 C2 5 10 15 20 25 30 35 40 Метансульфонілхлорид (0,986 моль) додавали по краплях до охолоджуємої льодом і перемішуваної суспензії сполуки E7 (отримана згідно прикладу 7) (0,493 ммоль), N-етил-N-(1метилетил)-2-пропанаміна (0,986 ммоль) і DMAP (0,049 ммоль) у DCM (5 мл). Через 5 хв реакційній суміші дозволяли нагрітись до кімнатної температури. До реакційної суміші додавали насичений розчин NН4Cl, потім додавали H2O. Фази розділяли. Водну фазу екстрагували DCM. Об'єднані органичні екстракти промивали розсолом, потім висушували (Na2SO4), фільтрували, і розчинник упарювали, з отриманням помаранчевого масла. Дане масло розчиняли в THF (5 мл) і охолоджували до 0 °C. Додавали TBAF (1,0 M у THF) (2,50 ммоль) і через 5-10 хв реакційній суміші дозволяли нагрітись до кімнатної температури. Потім суміш перемішували протягом ночі. Додавали додаткову кількість TBAF (1,0 M у THF) (2,50 ммоль) і реакційну суміш нагрівали при 50 °C протягом 2 годин. Розчинник видаляли при зниженому тиску і залишок розподіляли між H2O і DCM. Шари розділяли. Водну фазу екстрагували DCM і об'єднані органічні екстракти промивали, висушували (Na2SO4), фільтрували і концентрували, з отриманням помаранчевого масла. Дане масло спочатку очищали флеш-хроматографією (Biotage; колонка 40M; елюент: DCM/MeOH, градієнтне елюювання від 100/0 до 90/10). Отриманий матеріал додатково очищали високоефективною рідинною хроматографією на оберненій фазі (Shandon Hyperprep® C18 BDS (дезактивований основою силікагель), 8 мкм, 250 г, I.D. 5 см). Використовували градієнт з 2 рухомими фазами. Фаза A: 0,25 % розчин NH4HCO3 у воді; фаза B: CH3CN. Бажані фракції збирали і обробляли. Вихід: 13 мг сполуки E8 і 36 мг сполуки E9 (6,6 % и 17,7 % відповідно). Приклад 10 3-[[4-фтор-3-(трифторметил)феніл]аміно]-альфа-метил-1-(2-метил-4-піридиніл)-(альфаS)1H-1,2,4-триазол-5-етанол (E10) TBAF (16,3 мл; 16,3 ммоль; 1,0 М у THF) додавали до охолоджуваної льодом і перемішуваної суспензії інтермедіата D14 (отриманий згідно опису D14) (4,1 г; 6,5 ммоль) у THF (60 мл). Через 5 хв отриманій реакційній суміші дозволили нагрітися до кімнатної температури. Через 170 хв додавали насичений розчин NH4Cl, і суміш екстрагували EtOAc. Об'єднані органічні екстракти промивали розсолом, висушували (Na2SO4), фільтрували і концентрували, з отриманням помаранчевого масла. Даний матеріал спочатку очищали флеш-хроматографією (Biotage; колонка 40M; елюент: DCM/MeOH, градієнтне елюювання від 100/0 до 90/10). Бажані фракції збирали і розчинник упарювали, з отриманням жовтої маслянистої твердої речовини. Даний матеріал розчиняли в MeOH/DCM. Отриману суміш фільтрували і фільтрат концентрували при зниженому тиску, із отриманням 1,251 г жовтої маслянистої твердої речовини. Продукт додатково очищали високоефективною рідинною хроматографією на оберненій фазі (Shandon Hyperprep® C18 BDS (дезактивований основою силікагель), 8 мкм, 250 г, I.D. 5 см). Використовували градієнт з 2 рухомими фазами. Фаза A: 0,25 % розчин NH4HCO3 у воді; фаза B: CH3CN. Бажані фракції збирали, з отриманням (після упарювання розчинника) кремового порошку. Вихід: 357 мг сполуки E10 (13,9 %). Приклад 11 N-[4-фтор-3-(трифторметил)феніл]-1-(2-метил-4-піридиніл)-5-[(1E)-1-пропеніл]-1H-1,2,4триазол-3-амін (E11) 24 UA 102681 C2 5 10 15 20 25 30 35 DIAD (0,3 мл; 1,5 ммоль) додавали по краплях до охолоджуваного льодом і перемішуваному розчину сполуки E10 (отримана згідно прикладу 10) (121 мг; 0,3 ммоль), п-нітробензойної кислоти (230,2 мг; 1,4 ммоль) і трифенілфосфіна (401,4 мг; 1,5 ммоль) у THF (6 мл) (в атмосфері N2). Реакційній суміші дозволили нагрітись до кімнатної температури протягом 1 години, і потім її перемішували протягом ночі при кімнатній температурі. Розчинник видаляли при зниженому тиску, з отриманням жовтого масла. Даний матеріал очищали флешхроматографією (Biotage; колонка 40M; елюент: DCM/MeOH, градієнтне елюювання від 100/0 до 90/10). Бажані фракції об'єднували, з отриманням блідо-жовтої маслянистої твердої речовини. Даний матеріал перемішували в DIPE протягом декількох годин. Потім суміш фільтрували, і тверду речовину, що осіла, промивали DIPE і DCM, з отриманням дрібного кремового порошку. Вихід: 92 мг сполуки E11 (79,7 %). Приклад 12 1-(3-Хлор-4-піридиніл)-N-[4-фтор-3-(трифторметил)феніл]-5-(3-метоксипропіл)-1H-1,2,4триазол-3-амін (E12) Метансульфонілхлорид (0,050 мл; 0,646 ммоль) додавали по краплях до охолоджуваної льодом і перемішуваної суспензії сполуки E14 (отримана згідно прикладу 7) (0,111 г; 0,258 ммоль), N, N-диетилетанаміна (0,090 мл; 0,646 ммоль) і DMAP (0,003 г; 0,026 ммоль) у DCM (2,5 мл). Через 5-10 хв реакційній суміші дозволяли нагрітись до кімнатної температури. Через 2,5 години LCMS показала присутність мезилата і відсутність залишків вихідного матеріалу. До реакційної суміші додавали насичений розчин NН4Cl, потім додавали воду. Водну фазу екстрагували DCM і об'єднані органічні екстракти промивали розсолом, висушували (Na 2SO4), фільтрували і концентрували, з отриманням помаранчевого масла. Масло обробляли NaOMe (5 мл), і отриманий розчин перемішували протягом ночі при кімнатній температурі. Додавали додаткову кількість NaOMe (5 мл), і реакційну суміш нагрівали при 50 °C протягом 2 годин. Реакційну суміш охолоджували і додавали насичений розчин NH 4Cl, потім додавали воду і фази розділяли. Водну фазу екстрагували DCM і об'єднані органічні екстракти промивали розсолом, потім висушували (Na2SO4), фільтрували і концентрували, з отриманням блідо-жовтого масла. Даний залишок очищали хроматографією на системі Biotage, елюент: від DCM до 10 % MeOH/DCM. Об'єднані відповідні фракції давали жовте масло і були очищені RPхроматографією з отриманням кремової твердої речовини. Вихід: 22 мг сполуки E12 (100 %). Приклад 137 (альфаS)-альфа-етил-3-[[3-метокси-5-(трифторметил)феніл]аміно]-1-(2-метил-4-піридиніл)1H-1,2,4-триазол-5-етанол (E137) 25 UA 102681 C2 5 10 15 20 TBAF (57,4 мл; 57,4 ммоль; 1,0 М у THF) додавали до перемішуваного розчину інтермедіата D18 (отриманий згідно опису D18) (12,6 г; 19,1 ммоль) у THF (200 мл). Суміш перемішували протягом 24 годин. Додавали насичений розчин NH4Cl і суміш перемішували ще протягом 5-10 хв. Суміш екстрагували EtOAc (х3). Об'єднані органічні екстракти промивали водою (х5) до видалення більшої частини TBAF, потім промивали розсолом, висушували (Na2SO4), фільтрували і концентрували при зниженому тиску, з отриманням бурштинового масла. Даний матеріал очищали флеш-хроматографією, використовуючи системи Flashmaster і Biotage, елюент: від DCM до 5 % CH3OH/DCM, градієнтне елюювання від 100/0 до 90/10, прийнятні фракції об'єднували з отриманням з них кремового порошку. Вихід: 1,3 г сполуки E137 (16,1 %). Приклад 257 N-Циклопропіл-1-(2,6-диметил-4-піридиніл)-3-[[2-фтор-(трифторметил) феніл]аміно]-1H1,2,4-триазол-5-ацетамід (E257) Циклопропіламін (5 мл) додавали до перемішуваної суспензії інтермедіата D21 (отриманий згідно D21) (1,41 ммоль) у MеOH (5 мл), і отриману реакційну суміш перемішували при 40 °C протягом ночі. Реакційну суміш концентрували при зниженому тиску, з отриманням блідожовтого/кремового порошку. Даний матеріал кристалізували з MеCN (продукт розчиняється при 80 °C), потім вміст фільтрували і висушували, з отриманням рихлого білого порошку. Вихід: 527 мг сполуки E257 (83 %). У Таблицях 1 і 2 перераховані сполуки формули (I), що були отримані згідно одному з наведених вище прикладів. 26 UA 102681 C2 27 UA 102681 C2 28
ДивитисяДодаткова інформація
Назва патенту англійськоюTrisubstituted 1,2,4-triazoles as modulators of nicotinic acetylcholine receptors
Автори англійськоюMacdonald, Gregor, James, Thuring, Johannes, Wilhelmus, John F., Stanislawski, Pauline, Carol, Zhuang, Wei, van Roosbroeck, Yves, Emiel, Maria, Van Den Keybus Frans Alfons Ma
Назва патенту російськоюТризамещенные 1,2, 4-триазолы как модуляторы никотиновых ацетилхолиновых рецепторов
Автори російськоюМакдональд Грегор Джеймс, Тюринг Йоханес Уилхелмус Джон Ф., Станиславски Паулина Керол, Зхуанг Вей, ван Росброеск Йвес Эмиль Мария, ван ден Кейбус Франс Альфонс Мария
МПК / Мітки
МПК: C07D 405/04, C07D 401/14, C07D 401/04, A61P 25/00, A61K 31/4439, C07D 249/14, A61K 31/4196
Мітки: нікотинових, 1,2,4-триазоли, рецепторів, ацетилхолінових, тризаміщені, модулятори
Код посилання
<a href="https://ua.patents.su/82-102681-trizamishheni-124-triazoli-yak-modulyatori-nikotinovikh-acetilkholinovikh-receptoriv.html" target="_blank" rel="follow" title="База патентів України">Тризаміщені 1,2,4-триазоли як модулятори нікотинових ацетилхолінових рецепторів</a>
Попередній патент: Одинична дозована форма, що включає прищеплений співполімер полівінілового спирту-поліетиленгліколю і стероїдний естроген
Наступний патент: Датчик для зчитування банкнот, паперів, захищених від підробки, тощо, які мають щонайменше один елемент захисту
Випадковий патент: Спосіб перетворення тепла в гідравлічну енергію і пристрій для його здійснення