Отримання прегабанілу і споріднених сполук
Номер патенту: 83575
Опубліковано: 25.07.2008
Автори: Ху Шанхуй, Таллі Віл'ям Юджін, Мартінес Карлос Альберто, Тао Дзюньхуа, Дюмон Ів Рене, Келлгер Патрік Джерард Томас
Формула / Реферат
1. Спосіб отримання сполуки формули 1
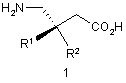
або її фармацевтично прийнятних комплексу, солі, сольвату або гідрату, в яких R1 і R2 є різними і кожна незалежно вибрана з групи, яку складають атом гідрогену, С1-12алкіл, С3-12циклоалкіл і заміщений С3-12циклоалкіл,
який включає:
(a) введення в реакцію сполуки формули 2
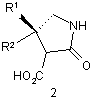
або її солі, з кислотою і водою з отриманням сполуки формули 1 або її солі; і
(b) як варіант, перетворення сполуки формули 1 або її солі у фармацевтично прийнятні комплекс, сіль, сольват або гідрат, в яких R1 і R2 у Формулі 2 є подібними до визначених у Формулі 1.
2. Спосіб за п. 1, який відрізняється тим, що додатково включає відновлення ціанокомпонента сполуки формули 3
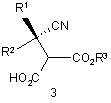
або її солі з отриманням сполуки формули 2 або її солі, де R1 і R2 у Формулі 3 є подібними до визначених у Формулі 1; і
R3 у Формулі 3 є С1-12алкілом, С3-12циклоалкілом або арил-С1-6алкілом.
3. Спосіб за п. 2, який відрізняється тим, що додатково включає
(а) введення сполуки формули 4
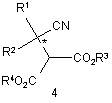
у контакт з ензимом з отриманням сполуки формули 3 або її солі, і сполуки формули 5
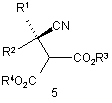 ,
,
де ензим адаптовано до енантіоселективного гідролізу сполуки формули 4 з отриманням сполуки формули 3 або її солі;
(b) відділення сполуки формули 3 або її солі; і
(c) як варіант, рацемізацію сполуки формули 5 з отриманням сполуки формули 4, де R1, R2 і R3 у Формулі 4 і Формулі 5 є подібними до визначених у Формулі 3; a R4 у Формулі 4 і Формулі 5 є такою ж або іншою, ніж R3, і є С1-12алкілм, С3-12циклоалкілом або арил-С1-6алкілом.
4. Спосіб отримання сполуки формули 1

або її фармацевтично прийнятних комплексу, солі, сольвату або гідрату, в яких R1 і R2 є різними і кожна незалежно вибрана з групи, яку складають атом гідрогену, С1-12алкіл, С3-12циклоалкіл і заміщений С3-12циклоалкіл,
який включає:
(а) відновлення ціанокомпонента сполуки формули 6
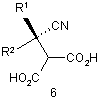
або її солі, з отриманням сполуки формули 7
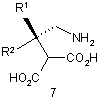
або її солі;
(b) декарбоксилування сполуки формули 7 або її солі з отриманням сполуки формули 1 або її солі; і
(c) як варіант, перетворення сполуки формули 1 або її солі у фармацевтично прийнятні комплекс, сіль, сольват або гідрат, де R1 і R2 у Формулі 6 і у Формулі 7 є подібними до визначених у Формулі 1.
5. Спосіб отримання сполуки формули 1

або її фармацевтично прийнятних комплексу, солі, сольвату або гідрату, в яких R1 і R2 є різними і кожна незалежно вибрана з групи, яку складають атом гідрогену, С1-12алкіл, С3-12циклоалкіл і заміщений С3-12циклоалкіл, який включає:
(a) відновлення ціанокомпонента сполуки формули 8
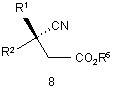
або її солі з отриманням сполуки формули 1 або її солі; і
(b) як варіант, перетворення сполуки формули 1 або її солі у фармацевтично прийнятні комплекс, сіль, сольват або гідрат, де R1 і R2 у Формулі 8 є подібними до визначених у Формула 1, a R5 у Формулі 8 є атомом гідрогену, С1-12алкілом, С3-12циклоалкілом або арил-С1-6алкілом.
6. Спосіб отримання сполуки формули 3
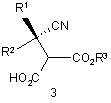
або її солі, в яких
R1 і R2 є різними і кожна незалежно вибрана з групи, яку складають атом гідрогену, С1-12алкіл, С3-12циклоалкіл і заміщений С3-12циклоалкіл, і
R3 є С1-12алкілом, С3-12циклоалкілом або арил-С1-6алкілом,
який включає:
(a) введення в реакцію сполуки формули 4
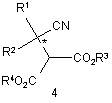
з ензимом з отриманням сполуки формули 3 і сполуки формули 5
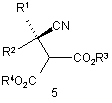 ,
,
де ензим адаптовано до енантіоселективного гідролізу сполуки формули 4 з утворенням сполуки формули 3 або її солі;
(b) відділення сполуки формули 3 або її солі; і
(c) як варіант, рацемізацію сполуки формули 5 з отриманням сполуки формули 4, де R1, R2, і R3 у Формулі 4 і Формулі 5 є подібними до визначених у Формулі 3; a R4 у Формулі 4 і Формулі 5 є такою ж або іншою, ніж R3, і є С1-12алкілом, С3-12циклоалкілом або арил-С1-6алкілом.
7. Сполука формули 2

включаючи її солі, де
R1 і R2 є різними і кожна незалежно вибрана з групи, яку складають атом гідрогену, С1-12алкіл, С3-12циклоалкіл і заміщений С3-12циклоалкіл, за умови, що коли один з замісників, репрезентований R1 або R2, є гідрогеном, інший замісник не є С1-3алкілом або С5алкілом.
8. Сполука формули 27
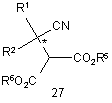
включаючи її солі, де
R1 і R2 є різними і кожна незалежно вибрана з групи, яку складають атом гідрогену, С1-12алкіл, С3-12циклоалкіл і заміщений С3-12циклоалкіл, за умови, що коли один з замісників, репрезентований R1 або R2, є атомом гідрогену, інший замісник не є метилом; і
R5 і R6 незалежно вибрані з групи, яку складають атом гідрогену, С1-12алкіл, С3-12циклоалкіл або арил-С-1-6алкіл, за умови, що R5 і R6 є різними, якщо вони обидві не є атомами гідрогену.
9. Спосіб отримання сполуки формули 9

або її фармацевтично прийнятних комплексу, солі, сольвату або гідрату, який включає:
(a) введення сполуки формули 10

або її солі у реакцію з кислотою і водою з отриманням сполуки формули 9 або її солі; і
(b) як варіант, перетворення сполуки формули 9 або її солі у фармацевтично прийнятні комплекс, сіль, сольват або гідрат.
10. Спосіб за п. 9, який відрізняється тим, що додатково включає відновлення ціанокомпонента сполуки формули 11
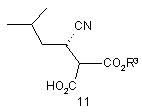
або її солі з отриманням сполуки формули 10 або її солі, де R3 є С1-12алкілом, С3-12циклоалкілом або арил-С1-6алкілом.
11. Спосіб за п. 10, який відрізняється тим, що додатково включає:
(a) введення сполуки формули 12
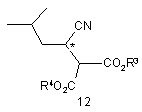
у контакт з ензимом з отриманням сполуки формули 11 або її солі, і сполуки формули 13
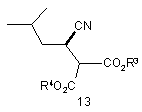 ,
,
де ензим адаптовано до енантіоселективного гідролізу сполуки формули 12 з утворенням сполуки формули 11 або її солі;
(b) відділення сполуки формули 11 або її солі; і
(c) як варіант, рацемізацію сполуки формули 13 з отриманням сполуки формули 12, де
R3 у Формулі 12 і Формулі 13 визначено вище у Формулі 11; а
R4 у Формулі 12 і Формулі 13 є такою ж або іншою, ніж R3, і є С1-12алкілом, С3-12циклоалкілом або арил-С1-6алкілом.
12. Спосіб отримання сполуки формули 9

або її фармацевтично прийнятних комплексу, солі, сольвату або гідрату,
який включає:
(a) відновлення ціанокомпонента сполуки формули 14

або її солі з отриманням сполуки формули 15

або її солі;
(b) декарбоксилування сполуки формули 15 або її солі з отриманням сполуки формули 9 або її солі; і
c) як варіант, перетворення сполуки формули 9 або її солі у фармацевтично прийнятні комплекс, сіль, сольват або гідрат.
13. Спосіб отримання сполуки формули 9

або її фармацевтично прийнятних комплексу, солі, сольвату або гідрату,
який включає:
(a) відновлення ціанокомпонента сполуки формули 16

або її солі з отриманням сполуки формули 9 або її солі; і
(b) як варіант, перетворення сполуки формули 9 або її солі у фармацевтично прийнятні комплекс, сіль, сольват або гідрат; причому сполуку формули 16, як варіант, отримують декарбоксилуванням сполуки формули 11

або її солі; a R3 у Формулі 11 є С1-12алкілом, С3-12циклоалкілом або арил-С1-6алкілом, і R5 у Формулі 16 є атомом гідрогену, С1-12алкілом, С3-12циклоалкілом або арил-С1-6алкілом.
14. Спосіб отримання сполуки формули 11

або її солі, де R3 є С1-12алкілом, С3-12циклоалкілом або арил-С1-6алкілом,
який включає:
(a) введення сполуки формули 12
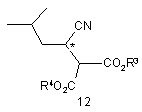
у контакт з ензимом з отриманням сполуки формули 11 і сполуки формули 13
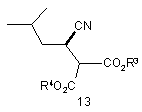 ,
,
де ензим адаптовано до енантіоселективного гідролізу сполуки формули 12 з утворенням сполуки формули 11 або її солі;
(b) відділення сполуки формули 11 або її солей; і
(c) як варіант, рацемізацію сполуки формули 13 з отриманням сполуки формули 12, де
R3 у Формулі 12 і Формулі 13 є подібною до визначеної у Формулі 11; і
R4 у Формулі 12 і Формулі 13 є такою ж або іншою, ніж R3, і є С1-12алкілом, С3-12циклоалкілом або арил-С1-6алкілом.
15. Сполука, вибрана з групи, яку складають:
3-ціано-2-етоксикарбоніл-5-метилгексанова кислота,
(3S)-3-ціано-2-етоксикарбоніл-5-метилгексанова кислота,
(2S,3S)-3-ціано-2-етоксикарбоніл-5-метилгексанова кислота,
(2R,3S)-3-ціано-2-етоксикарбоніл-5-метилгексанова кислота,
етиловий естер 3-ціано-2-етоксикарбоніл-5-метилгексанової кислоти,
етиловий естер (R)-3-ціано-2-етоксикарбоніл-5-метилгексанової кислоти,
4-ізобутил-2-оксопіролідин-3-карбонова кислота,
(S)-4-ізобутил-2-оксопіролідин-3-карбонова кислота,
3-ціано-2-карбокси-5-метилгексанова кислота,
(S)-3-ціано-2-карбокси-5-метилгексанова кислота,
3-амінометил-2-карбокси-5-метилгексанова кислота і
(S)-3-амінометил-2-карбокси-5-метил-гексанова кислота,
включаючи їх солі і протилежні енантіомери.
Текст
1. Спосіб отримання сполуки формули 1 H 2N CO 2H HO 2C O 2 або її солі, з кислотою і водою з отриманням сполуки формули 1 або її солі; і (b) як варіант, перетворення сполуки формули 1 або її солі у фармацевтично прийнятні комплекс, сіль, сольват або гідрат, в яких R1 і R2 у Формулі 2 є подібними до визначених у Формулі 1. 2. Спосіб за п. 1, який відрізняється тим, що додатково включає відновлення ціанокомпонента сполуки формули 3 (13) 83575 R2 (11) 1 або її фармацевтично прийнятних комплексу, солі, сольвату або гідрату, в яких R1 і R2 є різними і кожна незалежно вибрана з групи, яку складають атом гідрогену, С1-12алкіл, С3-12циклоалкіл і заміщений С3-12циклоалкіл, який включає: (a) введення в реакцію сполуки формули 2 R1 NH C2 R2 UA R1 (19) (21) a200612380 (22) 09.06.2005 (86) PCT/IB2005/001924, 09.06.2005 (31) 60/581,671 (32) 21.06.2004 (33) US (31) 60/629,034 (32) 18.11.2004 (33) US (46) 25.07.2008, Бюл.№ 14, 2008 р. (72) ХУ ШАН ХУЙ, МАРТІНЕС КАРЛОС АЛЬБЕРТО, ТАО ДЗЮНЬХУ А, ТАЛЛІ ВІЛ'Я М ЮДЖІН, КЕЛЛГЕР ПАТРІК ДЖЕРАРД ТОМАС, ДЮМОН ІВ РЕНЕ (73) ВОРНЕР-ЛАМБЕРТ КОМПАНІ ЛЛК (56) US 5 637 767 A 10.06.1997 DATABASE BEILSTEIN INSTITUT ZUR FORDERUNG DER CHEMISCHEN WISSENSCHAFTEN, FRANKFURT AM MAIN, DE; XP002356477 Database accession no. 120995 & KATO ET AL: NIPPON NOGEI KAGAKU KAISHI, vol. 27, 1953, page 500 US 2003212290 A1 13.11.2003 GLENN M.SAMMIS AND ERIC N. JACOBSEN: "Highly Enantioselective, Catalytic Conjugate Addition of Cyanide to alpha,beta-Unsaturated Imides" J.AM.CHEM.SOC., vol. 125, 2003, pages 4442-4443, XP002356467 MARK J.BURK ET AL: "An Enantioselective Synthesis of (S)-(+)-3-Aminomethyl-5-methylhexanoic Acid via Asymmetric Hydrogenation" J.ORG.CHEM., vol. 68, 2003, pages 5731-5734, XP002356468 DATABASE BEILSTEIN INSTITUT ZUR FORDERUNG DER CHEMISCHEN WISSENSCHAFTEN, FRANKFURT AM MAIN, DE; XP002356478 Database accession no. 2040983 & KNABE, J. ET AL: TETR AHEDRON LETT.; GE;, 1973, pages 745-746 DATABASE BEILSTEIN INSTITUT ZUR FORDERUNG DER CHEMISCHEN WISSENSCHAFTEN, FRANKFURT AM MAIN, DE; KNABE, J. ET AL: XP002356479 Database accession no. 5920356 & KNABE, J. ET AL: ARCH. PHARM. (WEINHEIM GER.); GE;, vol. 305, 1972, 2 3 83575 або її солі, з отриманням сполуки формули 7 R1 R1 CN R2 CO2 R3 HO 2C 3 або її солі з отриманням сполуки формули 2 або її солі, де R1 і R2 у Формулі 3 є подібними до визначених у Формулі 1; і R3 у Формулі 3 є С1-12алкілом, С3-12циклоалкілом або арил-С1-6алкілом. 3. Спосіб за п. 2, який відрізняється тим, що додатково включає (а) введення сполуки формули 4 R1 CN * R2 CO2R 3 4 R O2 C 4 у контакт з ензимом з отриманням сполуки формули 3 або її солі, і сполуки формули 5 R1 CN R2 CO2R 3 R 4O2 C 5 , де ензим адаптовано до енантіоселективного гідролізу сполуки формули 4 з отриманням сполуки формули 3 або її солі; (b) відділення сполуки формули 3 або її солі; і (c) як варіант, рацемізацію сполуки формули 5 з отриманням сполуки формули 4, де R1, R2 і R3 у Формулі 4 і Формулі 5 є подібними до визначених у Формулі 3; a R4 у Формулі 4 і Формулі 5 є такою ж або іншою, ніж R3, і є С1-12алкілм, С312циклоалкілом або арил-С 1-6алкілом. 4. Спосіб отримання сполуки формули 1 H 2N CO 2H R1 R2 1 або її фармацевтично прийнятних комплексу, солі, сольвату або гідрату, в яких R1 і R2 є різними і кожна незалежно вибрана з групи, яку складають атом гідрогену, С1-12алкіл, С3-12циклоалкіл і заміщений С3-12циклоалкіл, який включає: (а) відновлення ціанокомпонента сполуки формули 6 R1 CN R2 HO2C CO 2H 6 4 NH 2 R2 CO 2H HO2C 7 або її солі; (b) декарбоксилування сполуки формули 7 або її солі з отриманням сполуки формули 1 або її солі; і (c) як варіант, перетворення сполуки формули 1 або її солі у фармацевтично прийнятні комплекс, сіль, сольват або гідрат, де R1 і R2 у Формулі 6 і у Формулі 7 є подібними до визначених у Формулі 1. 5. Спосіб отримання сполуки формули 1 H 2N CO 2H R1 R2 1 або її фармацевтично прийнятних комплексу, солі, сольвату або гідрату, в яких R1 і R2 є різними і кожна незалежно вибрана з групи, яку складають атом гідрогену, С1-12алкіл, С3-12циклоалкіл і заміщений С3-12циклоалкіл, який включає: (a) відновлення ціанокомпонента сполуки формули 8 R1 CN R2 CO2 R5 8 або її солі з отриманням сполуки формули 1 або її солі; і (b) як варіант, перетворення сполуки формули 1 або її солі у фармацевтично прийнятні комплекс, сіль, сольват або гідрат, де R1 і R2 у Формулі 8 є подібними до визначених у Формула 1, a R5 у Формулі 8 є атомом гідрогену, С1-12алкілом, С3-12 циклоалкілом або арил-С 1-6алкілом. 6. Спосіб отримання сполуки формули 3 R1 CN R2 HO 2C CO2 R3 3 або її солі, в яких R1 і R2 є різними і кожна незалежно вибрана з групи, яку складають атом гідрогену, С1-12алкіл, С312циклоалкіл і заміщений С 3-12циклоалкіл, і R3 є С1-12алкілом, С3-12циклоалкілом або арил-С 16алкілом, який включає: (a) введення в реакцію сполуки формули 4 5 83575 6 R1 CN R2 NH2 * CO2R 3 R 4O2 C 4 з ензимом з отриманням сполуки формули 3 і сполуки формули 5 R1 CN R2 R 4O2 C 5 R2 O 2 включаючи її солі, де R1 і R2 є різними і кожна незалежно вибрана з групи, яку складають атом гідрогену, С1-12алкіл, С312циклоалкіл і заміщений С 3-12циклоалкіл, за умови, що коли один з замісників, репрезентований R1 або R2, є гідрогеном, інший замісник не є С13алкілом або С 5алкілом. 8. Сполука формули 27 R1 CN * R2 CO2 R5 R 6O 2C NH CO2R 3 , де ензим адаптовано до енантіоселективного гідролізу сполуки формули 4 з утворенням сполуки формули 3 або її солі; (b) відділення сполуки формули 3 або її солі; і (c) як варіант, рацемізацію сполуки формули 5 з отриманням сполуки формули 4, де R1, R2, і R3 у Формулі 4 і Формулі 5 є подібними до визначених у Формулі 3; a R4 у Формулі 4 і Формулі 5 є такою ж або іншою, ніж R3, і є С1-12алкілом, С312циклоалкілом або арил-С 1-6алкілом. 7. Сполука формули 2 R1 NH HO 2C CO 2H 9 або її фармацевтично прийнятних комплексу, солі, сольвату або гідрату, який включає: (a) введення сполуки формули 10 27 включаючи її солі, де R1 і R2 є різними і кожна незалежно вибрана з групи, яку складають атом гідрогену, С1-12алкіл, С312циклоалкіл і заміщений С 3-12циклоалкіл, за умови, що коли один з замісників, репрезентований R1 або R2, є атомом гідрогену, інший замісник не є метилом; і R5 і R6 незалежно вибрані з групи, яку складають атом гідрогену, С1-12алкіл, С3-12циклоалкіл або арил-С-1-6алкіл, за умови, що R5 і R6 є різними, якщо вони обидві не є атомами гідрогену. 9. Спосіб отримання сполуки формули 9 O HO 2C 10 або її солі у реакцію з кислотою і водою з отриманням сполуки формули 9 або її солі; і (b) як варіант, перетворення сполуки формули 9 або її солі у фармацевтично прийнятні комплекс, сіль, сольват або гідрат. 10. Спосіб за п. 9, який відрізняється тим, що додатково включає відновлення ціанокомпонента сполуки формули 11 CN CO2 R3 HO2C 11 або її солі з отриманням сполуки формули 10 або її солі, де R3 є С1- 12алкілом, С3-12циклоалкілом або арил-С 1-6алкілом. 11. Спосіб за п. 10, який відрізняється тим, що додатково включає: (a) введення сполуки формули 12 CN * CO2 R3 R4O 2C HO2 12 у контакт з ензимом з отриманням сполуки формули 11 або її солі, і сполуки формули 13 CN CO2 R3 R4O 2C HO2 13 , де ензим адаптовано до енантіоселективного гідролізу сполуки формули 12 з утворенням сполуки формули 11 або її солі; (b) відділення сполуки формули 11 або її солі; і (c) як варіант, рацемізацію сполуки формули 13 з отриманням сполуки формули 12, де R3 у Формулі 12 і Формулі 13 визначено вище у 7 83575 Формулі 11; а R4 у Формулі 12 і Формулі 13 є такою ж або іншою, ніж R3, і є С1-12алкілом, С3-12циклоалкілом або арил-С 1-6алкілом. 12. Спосіб отримання сполуки формули 9 NH2 CO 2H 9 або її фармацевтично прийнятних комплексу, солі, сольвату або гідрату, який включає: (a) відновлення ціанокомпонента сполуки формули 14 CN CO2 R3 HO2C 11 або її солі; a R3 у Формулі 11 є С1-12алкілом, С35 12циклоалкілом або арил-С 1-6алкілом, і R у Формулі 16 є атомом гідрогену, С1-12алкілом, С312циклоалкілом або арил-С 1-6алкілом. 14. Спосіб отримання сполуки формули 11 CN CO2 R3 CN HO2C CO 2H HO 2C 14 або її солі з отриманням сполуки формули 15 NH2 CO 2H HO 2C 8 15 або її солі; (b) декарбоксилування сполуки формули 15 або її солі з отриманням сполуки формули 9 або її солі; і c) як варіант, перетворення сполуки формули 9 або її солі у фармацевтично прийнятні комплекс, сіль, сольват або гідрат. 13. Спосіб отримання сполуки формули 9 11 або її солі, де R3 є С1-12алкілом, С3-12циклоалкілом або арил-С1-6алкілом, який включає: (a) введення сполуки формули 12 CN * CO2 R3 R4O 2C HO2 12 у контакт з ензимом з отриманням сполуки формули 11 і сполуки формули 13 CN CO2 R3 R4O 2C HO2 NH2 CO 2H 9 або її фармацевтично прийнятних комплексу, солі, сольвату або гідрату, який включає: (a) відновлення ціанокомпонента сполуки формули 16 CN CO2R 5 16 або її солі з отриманням сполуки формули 9 або її солі; і (b) як варіант, перетворення сполуки формули 9 або її солі у фармацевтично прийнятні комплекс, сіль, сольват або гідрат; причому сполуку формули 16, як варіант, отримують декарбоксилуванням сполуки формули 11 13 , де ензим адаптовано до енантіоселективного гідролізу сполуки формули 12 з утворенням сполуки формули 11 або її солі; (b) відділення сполуки формули 11 або її солей; і (c) як варіант, рацемізацію сполуки формули 13 з отриманням сполуки формули 12, де R3 у Формулі 12 і Формулі 13 є подібною до визначеної у Формулі 11; і R4 у Формулі 12 і Формулі 13 є такою ж або іншою, ніж R3, і є С1-12алкілом, С3-12циклоалкілом або арил-С 1-6алкілом. 15. Сполука, вибрана з групи, яку складають: 3-ціано-2-етоксикарбоніл-5-метилгексанова кислота, (3S)-3-ціано-2-етоксикарбоніл-5-метилгексанова кислота, (2S,3S)-3-ціано-2-етоксикарбоніл-5метилгексанова кислота, (2R,3S)-3-ціано-2-етоксикарбоніл-5метилгексанова кислота, етиловий естер 3-ціано-2-етоксикарбоніл-5 9 83575 10 метилгексанової кислоти, етиловий естер (R)-3-ціано-2-етоксикарбоніл-5метилгексанової кислоти, 4-ізобутил-2-оксопіролідин-3-карбонова кислота, (S)-4-ізобутил-2-оксопіролідин-3-карбонова кислота, 3-ціано-2-карбокси-5-метилгексанова кислота, (S)-3-ціано-2-карбокси-5-метилгексанова кислота, 3-амінометил-2-карбокси-5-метилгексанова кислота і (S)-3-амінометил-2-карбокси-5-метил-гексанова кислота, включаючи їх солі і протилежні енантіомери. Винахід стосується способів і матеріалів для приготування енантіомерно збагачених gамінокислот, які виявляють приєднувальну спорідненість до субодиниці каналу a 2d кальцію, включаючи прегабалін і споріднені сполуки. Прегабалін, (S)-(+)-3-амінометил-5-метилгексанова кислота споріднена з ендогенним інгібіторним нейротрансмітером - g-амінобутировою кислотою (GABA), яка бере участь у регулюванні нейронної активності мозку. Прегабалін виявляє антинападову активність [див. Патент США 5 563 175] і, як вважають, може бути використаний для лікування, серед інших станів, болю, фізіологічних станів, пов'язаних з психомоторними стимуляторами, запалення, шлунково-кишкових розладів, алкоголізму, безсоння і різних психічних розладів, включаючи маніакальний і біполярний розлади [див. Патенти США 6 242 488, 6 326 374, 6 001 876, 6 194 459, 6 329 429, 6 127 418, 6 426 368, 6 306 910 і 6 359 005, включені у даний документ посиланням]. Прегабалін приготовляють багатьма способами. Звичайно рацемічну суміш 3-амінометил-5метил-гексановою кислоти синтезують і потім розрізняють на R- і S-енантіомери. У таких способах можуть бути використані азидні і малонатні інтермедіати або синтез Гофмана [див. Патенти США 5 563 175, 6 046 353, 5 840 956, 5 637 767, 5 629 447 і 5 616 793, включені посиланням]. У кожному з таких методів рацемати реагують з хіральною кислотою (розрізнюючим агентом) з утворенням пари діастереоізомерних солей, які розділяють відомими методами, наприклад, фракційною кристалізацією і хроматографією. Ці методи пов'язані з великим об'ємом обробки, окрім приготування рацемату, і це разом з витратою розрізнюючого агента підвищує вартість виробництва. Крім того, небажаний R-енантіомер часто викидають, оскільки його неможливо ефективно рециклізувати, а це знижує ефективність процесу на 50%. Прегабалін синтезують також, використовуючи безпосередньо хіральний допоміжний агент (4R,5S)-4-метил-5-феніл-2-оксазолідинон [див. наприклад, Патенти США 6 359 169, 6 028 214, 5 847 151, 5 710 304, 5 684 189, 5 608 090 і 5 599 973, включені посиланням]. Хоча ці методи дають прегабалін високої енантіомерної чистоти, вони є менш бажаними для синтезу у великих об'ємах, оскільки в них використовуються порівняно дорогі (наприклад, хіральні допоміжні) агенти, з якими складно працювати, а також спеціальне кріогенне обладнання для отримання необхідних робочих температур (-78°С). У щойно опублікованій заявці на патент США описано спосіб виготовлення прегабаліну асимет ричним гідрогенуванням заміщеного ціано олефіну для отримання хірального ціано-прекурсора - (S)3-амінометил-5-метилгексанової кислоти [див. заявку на патент США 2003/0212290 від 13/11/2003, включену посиланням]. Ціанопрекурсор відновлюють і отримують прегабалін. При асиметричному гідрогенуванні використовується хіральний каталізатор, який містить перехідний метал, приєднаний до біфосфінового ліганду, наприклад, (R,R)-Me-DUPHOS. Метод дає суттєве збагачення прегабаліну (R)-3-(амінометил)-5метилгексановою кислотою. У заявці 2003/0212290 А1 запропоновано промисловий спосіб приготування прегабаліну, але з деяких причин бажаними є подальші удосконалення. Наприклад, біфосфінові ліганди, включаючи запропонований ліганд (R,R)-Me-DUPHOS часто важко приготувати, оскільки вони мають два хіральні центри, що здорожує їх. Крім того, асиметричне гідрогенування потребує спеціального обладнання для роботи з H2, що підвищує капітальні витрати. Винахід включає матеріали і способи приготування енантіомерно збагачених g-амінокислот (Формула 1), наприклад, прегабаліну (Формула 9). Спосіб згідно з винаходом включає кінетичне розрізнення рацемічного ціано-діестерового інтермедіату (Формула 4 або Формула 12) з використанням ензиму, адаптованого до естерного компонента інтермедіату енантіоселективного гідрогенування. Отриманий моноестер дикарбонової кислоти (Формула 3 або Формула 11), який є суттєво енантіочистим, вводять у подальшу реакцію для отримання бажаних енантіомерно збагачених g-амінокислот (Формула 1 або Формула 9). Енантіомер, що не прореагував (Формула 5 або Формула 13) у кінетичному розрізненні, може бути знову використаний в ензимному розрізненні після рацемізації для збільшення загального виходу. Спосіб згідно з винаходом має значні переваги порівняно з існуючими приготування енантіомерно збагачених g-амінокислот (Формула 1 і Формула 9). Наприклад, оптично активні g-амінокислоти можуть бути приготовлені без застосування хіральних допоміжних агентів або каталізаторів гідрогенування, тобто з меншими витратами. Оскільки ензимні процеси можна проводити при кімнатній температурі і при атмосферному тиску, способи винаходу допоможуть мінімізувати конфлікти розкладів, які виникають при роботі з спеціалізованим обладнанням високого тиску і при низьких температурах. Як показано у прикладах, винахід може бути використаний для приготування прегабаліну, починаючи з рацемічного заміщеного ціано діестеру (Формула 12), з високим виходом (26-31%) піс 11 83575 12 ля одноперіодичного рециклювання енантіомеру, що не прореагував (Формула 13). Це дає приблизно 50%-е зниження витрат порівняно з малонатним методом, описаним вище. Згідно з одним з аспектів, винахід включає спосіб отримання сполуки формули 1, або її фармацевтично прийнятні комплекс, сіль, сольват або гідрат, в яких R1 і R2 є різними і кожна незалежно вибрана з групи, яку складають атом гідрогену, С1-12алкіл, С3-12циклоалкіл і заміщений С3-12циклоалкіл, який включає: (a) введення сполуки формули 2 або її солі у реакцію з кислотою і водою для отримання сполуки формули 1 або її солі; і (b) як варіант, перетворення сполуки формули 1 або її солі у фармацевтично прийнятні комплекс, сіль, сольват або гідрат, де R1 і R2 у Формулі 2 є подібними до визначених у Формулі 1. Інший аспект винаходу включає спосіб отримання сполуки формули 1, який включає: (а)відновлення ціано-компонента сполуки формули 6 або її солі, де R1 і R2 у Формулі 3 є подібними до визначених у Формулі 1, a R3 є С1-12алкілом, С312циклоалкілом або арил-С 1-6алкілом. Ще один аспект винаходу включає спосіб отримання сполук формули 1, який містить: (a)відновлення ціано-компонента сполуки формули 8 або її солі для отримання сполук формули 1 або її солі; і (b) як варіант, перетворення сполуки формули 1 або її солі у фармацевтично прийнятні комплекс, сіль, сольват або гідрат, де R1 і R2 у Формулі 8 є подібними до визначених у Формулі 1, a R5 у Формула 8 є атомом гідрогену, С1-12алкілом, С312циклоалкілом або арил-С 1-6алкілом. Сполука формули 8 може бути приготовлена декарбоксилуванням сполуки формули або її солі, або гідролізацією і декарбоксилуванням сполука формули 3 або її солі для отримання сполуки формули 8 або її солі. Подальший аспект винаходу включає спосіб отримання сполуки формули 3 або її солі, який містить: (а) введення сполуки формули 4 або її солі для отримання сполуки формули 7 у контакт з ензимом для отримання сполуки формули 3 і сполуки формули 5 або її солі; (b) декарбоксилування сполуки формули 7 або її солі для отримання сполуки формули 1 або її солі; і (c) як варіант, перетворення сполуки формули 1 або її солі у фармацевтично прийнятні комплекс, сіль, сольват або гідрат, де R1 і R2 у Формулі 6 і у Формулі 7 є подібними визначеним у Формулі 1. Сполуку формули 6 можна приготувати гідролізом сполуки формули 3 де ензим адаптовано до енантіоселективного гідролізу сполуки формули 4 з отриманням сполуки формули 3 або її солі; (b) ізолювання сполуки формули 3 або її солі і (c) як варіант, рацемізацію сполуки формули 5 для отримання сполуки формули 4, де R1, R2 і R3 у Формулі 4 і Формулі 5 є подібними до визначених у 13 83575 Формулі 1 і Формулі 3; a R 4 у Формулі 4 і Формулі 5 є подібною до або відмінною від R3 і є С112алкілом, С 3-12циклоалкілом або арил-С 1-6алкілом. Для енантіоселективного гідролізу сполуки формули 4 до сполуки формули 3 або її солі може бути використана будь-яка кількість ензимів. Придатні для цього ензими включають ліпази, наприклад, отримані від Thermomyces lanuginosus. Інший аспект винаходу включає сполуки Формули 2 і їх комплекси, солі, сольвати або гідрати за умови, що одним з замісників, репрезентованих R1 або R2 у Формулі 2, є гідроген, а іншим замісником не є С 1-3алкіл або С5алкіл. Інший аспект винаходу включає сполуки формули 27 14 9 або її солі у фармацевтично прийнятні комплекс, сіль, сольват або гідрат. Інший аспект винаходу включає спосіб отримання сполуки формули 9 або її фармацевтично прийнятного комплексу, солі, сольвату або гідрату, який включає: (а) відновлення ціано-компонента сполуки формули 14, або її солі для отримання сполуки формули 15 і їх комплекси, солі, сольвати або гідрати, де R1 і R2 є різними і кожна незалежно вибрана з групи, яку складають атом гідрогену, С1-12алкіл, С312циклоалкіл і заміщений С 3-12 циклоалкіл, за умови, що, коли одним замісників, репрезентованих R1 або R2 є атом гідрогену, іншим замісником не є метил; а R5 і R6 незалежно вибрані з групи, яку складають атом гідрогену, С1-12алкіл, R6 незалежно вибрані з групи, яку складають атом гідрогену, С1-12алкіл, С3-12циклоалкіл, або арил-С1-6алкіл за умови, що R5 і R6 є різними і не є атомами гідрогену. Сполуки формули 27 включають репрезентовані Формулою 3, Формулою 4, Формулою 5, Формулою 6 і Формулою 7, включаючи їх комплекси, солі, сольвати або гідрати. Корисні сполуки формул 2-7 і 27 включають ті, в яких R 1 є атомом гідрогену, a R2 є ізобутил. Ще один аспект винаходу включає спосіб отримання сполуки формули 9 або її солі; (b) декарбоксилування сполуки формули 15 або її солі для отримання сполуки формули 9 або її солі; і (c) як варіант, перетворення сполуки формули 9 або її солі у фармацевтично прийнятні комплекс, сіль, сольват або гідрат. Сполука формули 14 може бути приготовлене гідролізом сполуки формули 11 або її солі, де R3 у Формула 11 є такою, що була визначена у Формулі 3. Інший аспект винаходу включає спосіб отримання сполук формули 9 або її фармацевтично прийнятних комплексу, солі, сольвату або гідрату, який включає: (a) відновлення ціано-компонента сполуки формули 16 або її фармацевтично прийнятних комплексу, солі, сольвату або гідрату, який включає: (a) введення сполуки формули 10, або її солі у реакцію з кислотою і водою для отримання сполуки формули 9 або її солі; і (b) як варіант, перетворення сполуки формули або її солі для отримання сполуки формули 9 або її солі; і (b) як варіант, перетворення сполуки формули 9 або її солі у фармацевтично прийнятні комплекс, сіль, сольват або гідрат, де R5 у Формулі 16 є подібною до визначеної у Формулі 8. Сполука формули 16 може бути приготовлена декарбоксилуванням (наприклад, нагріванням) сполуки формули 11 або її солі, або гідролізацією і декарбоксилуванням сполуки формули 11 або її 15 83575 солі. Ще один аспект винаходу включає спосіб отримання сполук формули 11 або її солі, який включає: (а) введення сполуки формули 12 у контакт з ензимом для отримання сполуки формули 11 і сполуки формули 13 де ензим адаптовано до енантіоселективного гідролізу сполуки формули 12 до сполуки формули 11 або її солі; (b) ізолювання сполуки формули 11 або її солі; і (c) як варіант, рацемізацію сполуки формули 13 для отримання сполуки формули 12, де R3 у Формулі 12 і Формулі 13 є подібною до визначеної у Формулі 3; і R4 у Формулі 12 і Формулі 13 є такою ж або відмінною від R3 і є С 1-12алкілом, С3-12циклоалкілом або арил-С1-6алкілом. У способі приготування сполуки формули 11 відповідні солі сполуки формули 11 включають вибрані з групи, яку складають солі лужних металів, наприклад, солі калію; первинні солі аміну, наприклад, сіль t-бутиламіну; і вторинні солі аміну. 16 Крім того, корисні ензими включають ліпази, наприклад, отримані від Thermomyces lanuginosus. Інший аспект винаходу включає сполуки, вибрані з групи, яку складають: 3-ціано-2-етоксикарбоніл-5-метил-гексанова кислота, (3S)-3-ціано-2-етоксикарбоніл-5-метилгексанова кислота, (2S,3S)-3-ціано-2-етоксикарбоніл-5-метилгексанова кислота, (2S,3S)-3-ціано-2-етоксикарбоніл-5-метилгексанова кислота, етиловий естер 3-ціано-2-етоксикарбоніл-5метил-гексанової кислоти, етил естер (R)-3-ціано-2-етоксикарбоніл-5метил-гексанової кислоти, 4-ізобутил-2-оксо-піролідин-3-карбонова кислота, (S)-4-ізобутил-2-оксо-піролідин-3-карбонова кислота, 3-ціано-2-карбокси-5-метил-гексанова кислота, (S)-3-ціано-2-карбокси-5-метил-гексанова кислота, 3-амінометил-2-карбокси-5-метил-гексанова кислота і (S)-3-амінометил-2-карбокси-5-метилгексанова кислота, включаючи їх комплекси, солі, сольвати і гідрати, і їх протилежні енантіомери. Винахід включає всі комплекси і солі, фармацевтично прийнятні або неприйнятні, сольвати, гідрати і поліморфні форми цих сполук. Деякі сполуки можуть містити алкенільну або циклічну групу, і тому можливими є цис/транс (або Z/E) стереоізомери, або ці сполуки можуть містити кетонну або оксимну груп у, що робить можливою таутомерію. У таких випадках винахід включає всі Z/E ізомери і таутомерні форми, чисті, суттєво чисті або суміші. Фіг.1 містить схему приготування енантіомерно-збагачених g-амінокислот (Формула 1). 17 83575 Фіг.2 містить схему приготування діестерів, заміщених ціано (Формула 4). 18 19 83575 Визначення і абревіатури Якщо не зазначено інше, у даному описі використані визначення, наведені нижче. Деякі визначення і формули можуть включати штри х ("-"), який вказує на зв'язок між атомами або точками приєднання найменованих або не найменованих атомів або груп атомів. Інші визначення і формули можуть включати знак рівняння ("=") або символ тотожності ("="), які вказують на подвійний або потрійний зв'язок, відповідно. Деякі формули можуть також включати одну або більше зірочок ("*"), які вказують на стереогенні (асиметричні або хіральні) центри, хоча відсутність зірочки не вказує на відсутність стереоцентру. Такі формули можуть стосува тись рацемату або індивідуальних енантіомерів або індивідуальних діастереомерів, які можуть бути або не бути чистими або суттєво чистими. "Заміщеними"групами є ті, в яких один або більше атомів гідрогену заміщені одним або більше негідрогенними групам за умови, що задовольняються вимоги валентності і результатом заміщення є стабільна сполука. "Приблизно" при використанні у зв'язку з виміряним числовим значенням означає зазначене числове значення і всі значення, що лежать у межах похибки експерименту (наприклад, у 95%-му довірчому інтервалі для значення) або у межах ±10% від зазначеного значення (береться ширша з цих меж). "Алкіл" є лінійною або розгалуженою насиченою гідрокарбоновою групою, з зазначеною кількістю атомів карбону (тобто С 1-6алкіл означає алкільну груп у з 1, 2, 3, 4, 5 або 6 атомами карбону, а С1-12алкіл означає алкільну груп у з 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11 або 12 атомами карбону). Прикладам алкільних груп є (без обмеження), метил, етил, nпропіл, i-пропіл, n-бутил, s-бутил, i-бутил, t-бутил, пент-1-іл, пент-2-іл, пент-3-іл, 3-метилбут-1-іл, Зметилбут-2-іл, 2-метилбут-2-іл, 2,2,2-триметилет1-іл, n-гексил тощо. "Алкеніл" стосується лінійно-ланцюгових і розгалужених гідрокарбонових гр уп з одним або більше ненасиченими карбон-карбоновими зв'язками і, взагалі, з певною кількістю атомів карбону. Приклади алкенільних груп включають (без обмеження) етеніл, 1-пропен-1-іл, 1-пропен-2-іл, 2-пропен1-іл, 1-бутен-1-іл, 1-бутен-2-іл, 3-бутен-1-іл, 3бутен-2-іл, 2-бутен-1-іл, 2-бутен-2-іл, 2-метил-1пропен-1-іл, 2-метил-2-пропен-1-іл, 1,3-бутадієн-1іл, 1,3-бутадієн-2-іл тощо. "Алкініл" стосується лінійно-ланцюгових або розгалужених гідрокарбонових груп з одним або більше потрійними карбон-карбоновими зв'язками і, взагалі, з певною кількістю атомів карбону. Приклади алкінільних груп включають (без обмеження) етиніл, 1-пропін-1-іл, 2-пропін-1-іл, 1-бутин-1-іл, 3-бутин-1-іл, 3-бутин-2-іл, 2-бутин-1-іл тощо. Алканоїл" і "алканоїламіно" стосуються, відповідно, алкіл-С(О)- і алкіл-С(О)-ІЧН-, де алкіл визначено вище, і взагалі включає певну кількість атомів карбону, включаючи кар-бонілкарбон. Приклади алканоїльних груп включають (без обмеження) форміл, ацетил, пропіоніл, бутурил, пентаноїл, гексаноїл тощо. 20 "Алкеноїл" і "алкіноїл" стосуються, відповідно, алкеніл-С(О)- і алкініл-С(О)-, де алкеніл і алкініл визначені вище. Алкеноїл і алкіноїл взагалі включають певну кількість атомів карбону, виключаючи карбонілкарбон. Приклади алкеноїльних груп включають (без обмеження) пропеноїл, 2метилпропеноїл, 2-бутеноїл, 3-бутеноїл, 2-метил2-бутеноїл, 2-метил-3-бутеноїл, 3-метил-3бутеноїл, 2-пентеноїл, 3-пентеноїл, 4-пентеноїл тощо. Приклади алкіноїльних гр уп включають (без обмеження) пропіноїл, 2-бутіноїл, 3-бутіноїл, 2пентіноїл, 3-пентіноїл, 4-пентіноїл тощо. "Алкокси," "алкоксикарбоніл" і "алкоксикарбоніламіно," стосуються, відповідно, алкіл-О-, алкеніл-O і алкініл-О; алкіл-О-С(О)-, алкеніл-О-С(О)-, алкініл-О-С(О)-; і алкіл-О-C(O)-NH-, алкеніл-ОС(О)-МН-, і алкініл-О-С(О)-МН-, де алкіл, алкеніл і алкініл визначені вище. Приклади алкоксигруп включають (без обмеження) метокси, етокси, nпропокси, i-пропокси, n-бутокси, s-бутокси, tбутокси, n-пентокси, s-пентокси тощо. Приклади алкоксикарбонільних груп включають (без обмеження) метоксикарбоніл, етоксикарбоніл, nпропоксикарбоніл, i-пропоксикарбоніл, n-бутоксикарбоніл, s-бутоксикарбоніл, t-бутоксикарбоніл, nпентоксикарбоніл, s-пентоксикарбоніл тощо. "Алкіламіно," "алкіламінокарбоніл," "діалкіламінокарбоніл," "алкілсульфоніл" "сульфоніламіноалкіл," і "алкілсульфоніламінокарбоніл" стосуються, відповідно, алкіл-NH-, алкіл-NH-С(О)-, алкіл2-NС(О)-, алкіл-S(О2)-, НS(О2)-МН-алкіл-, і алкіл-S(O)NH-C(O)-, де алкіл визначено вище. "Аміноалкіл" і "ціаноалкіл" стосуються, відповідно, NH2-aлкiлy і NºC-алкілу, де алкіл визначено вище. "Галоген" означає флуор, хлор, бром і йод. "Галогеналкіл", "галогеналкеніл", "галогеналкініл", "галогеналканоїл", "галогеналкеноїл", "галогеналкіноїл", "галогеналкокси" і "галогеналкоксикарбоніл" стосуються, відповідно, алкільних, алкенільних, алкінільних, алканоїльних, алкеноїльних, алкіноїльних, алкокси- і алкоксикарбонільних гр уп, заміщених одним або більше атомами галогену, де алкіл, алкеніл, алкініл, алканоїл, алкеноїл, алкіноїл, алкокси і алкоксикарбоніл визначені вище. Приклади галогеналкільних груп включають (без обмеження) трифлуорметил, трихлорметил, пентафлуоретил, пентахлоретил тощо. "Гідроксиалкіл" і "оксоалкіл" стосуються, відповідно, НО-алкілу і О=алкілу, де алкіл визначено вище. Приклад гідроксиалкільних і оксоалкільних груп включають (без обмеження) гідроксиметил, гідроксиетил, 3-гідроксипропіл, оксометил, оксоетил, 3-оксопропіл тощо. "Циклоалкіл" стосується насичених моноциклічних і біциклічних гідрокарбонових кілець з певною кількістю атомів карбону, що утворюють кільце (тобто С3-7циклоалкіл стосується циклоалкільних груп з 3, 4, 5, в або 7 атомам карбону як членів кільця). Циклоалкіл може бути приєднаний до основної групи або до субстрату на будь-якому атомі кільця, якщо таке приєднання не порушує вимог валентності. Подібним чином, циклоалкільні групи 21 83575 можуть включати один або більше негідрогенних замісників, якщо таке заміщення не порушує вимог валентності. Корисні замісники включають (без обмеження) алкіл, алкеніл, алкініл, галогеналкіл, галогеналкеніл, галогеналкініл, алкокси, алкоксикарбоніл, алканоїл і галоген, визначені вище, і гідрокси, меркапто, нітро і аміно. Приклади моноциклічних циклоалкільних груп включають (без обмеження) циклопропіл, циклобутил, циклопентил, циклогексил тощо. Приклади біциклічних циклоалкільних груп включають (без обмеження) біцикло[1,1,0]бутил, біцикло[1,1,1]пентил, біцикло[2,1,0]пентил, біцикло [2,1,1]гексил, біцикло[3,1,0]гексил, біцикло[2,2,1] гептил, біцикло[3,2,0]гептил, біцикло[3,1,1]гептил, біцикло[4,1,0]гептил, біцикло[2,2,2]октил, біцикло[3,2,1]октил, біцикло[4,1,1]октил, біцикло[3,3,0] октил, біцикло[4,2,0]октил, біцикло[3,3,1]ноніл, біцикло[4,2,1]ноніл, біцикло[4,3,0]ноніл, біцикло[3,3,2]децил, біцикло[4,2,2]децил, біцикло[4,3,1]децил, біцикло[4,4,0]децил, біцикло[3,3,3] ундецил, біцикло[4,3,2]ундецил, біцикло[4,3,3] додецил тощо, які можуть бути приєднані до основної групи або субстрату будь-якому атомі кільця, якщо таке приєднання не порушує вимог валентності. "Циклоалкеніл" стосується моноциклічних і біциклічних гідрокарбонових кілець з одним або більше ненасиченими карбон-карбоновими зв'язками і з певною кількістю атомів карбону що утворюють кільце (тобто С3-7циклоалкеніл стосується циклоалкенільної групи з 3, 4, 5, 6 або 7 атомами карбону як членами кільця). Циклоалкеніл може бути приєднаний до основної групи або субстрату на будь-якому атомі кільця, якщо таке приєднання не порушує вимог валентності. Подібним чином циклоалкенільні групи можуть включати один або більше негідрогенних замісників, якщо таке заміщення не порушує вимог валентності. Корисні замісники включають (без обмеження) алкіл, алкеніл, алкініл, галогеналкіл, галогеналкеніл, галогеналкініл, алкокси, алкоксикарбоніл, алканоїл і галоген, визначені вище, і гідрокси, меркапто, нітро і аміно. "Циклоалканоїл" і "циклоалкеноїл" означають циклоалкіл-С(О)- і циклоалкеніл-C(O)-, відповідно, де циклоалкіл і циклоалкеніл визначені вище. Циклоалканоїл і циклоалкеноїл взагалі включають певну кількість атомів карбону, виключаючи карбонілкарбон. Приклади циклоалканоїльних груп включають (без обмеження) циклопропаноїл, циклобутаноїл, циклопентаноїл, циклогексаноїл, циклогептаноїл, 1-циклобутеноїл, 2-цикпобутеноїл, 1циклопентеноїл, 2-циклопентеноїл, 3-циклопентеноїл, 1-циклогексеноїл, 2-циклогексеноїл, 3циклогексеноїл тощо. "Циклоалкокси" і "циклоалкоксикарбоніл" стосуються, відповідно, циклоалкіл-О- і циклоалкенілО і циклоалкіл-О-С(О)- і циклоалкеніл-О-С(О)-, де циклоалкіл і циклоалкеніл визначені вище. Циклоалкокси і циклоалкоксикарбоніл взагалі включають певну кількість атомів карбону, виключаючи карбонілкарбон. Приклади циклоалкоксигруп включають (без обмеження) циклопропокси, циклобутокси, циклопентокси, циклогексокси, 1 22 циклобутенокси, 2-циклобутенокси, 1циклопентенокси, 2-циклопентенокси, 3циклопентенокси, 1-циклогексенокси, 2циклогексенокси, 3-циклогексенокси тощо. Приклади циклоалкоксикарбонільних груп включають (без обмеження) циклопропоксикарбоніл, циклобутоксикарбоніл, циклопентоксикарбоніл, циклогексоксикарбоніл, 1-циклобутеноксикарбоніл, 2циклобутеноксикарбоніл, 1-циклопентеноксикарбоніл, 2-циклопентеноксикарбоніл, 3-циклопентеноксикарбоніл, 1-циклогексеноксикарбоніл, 2-циклогексеноксикарбоніл, 3-циклогексеноксикарбоніл тощо. "Арил" і "арилен" стосуються моновалентних і дивалентних ароматичних груп, відповідно, включаючи 5- і 6-членні моноциклічні ароматичні групи, які містять 0-4 гетероатоми, незалежно вибрані з групи, яку складають нітроген, оксиген і сульфур. Приклади моноциклічних арильних гр уп включають (без обмеження) феніл, піроліл, фураніл, тіофенеїл, тіазоліл, ізотіазоліл, імідазоліл, триазоліл, тетразоліл, піразоліл, оксазоліл, ізо-оксазоліл, піридиніл, піразиніл, піридазиніл, піримідиніл тощо. Арильні і ариленові групи також включають біциклічні групи, трициклічні групи тощо., включаючи злиті 5- і 6-членні кільця, описані вище. Приклади мультициклічних арильних груп включають (без обмеження) нафтил, біфеніл, антраценіл, піреніл, карбазоліл, бензоксазоліл, бензодіоксазоліл, бензотіазоліл,бензоімідазоліл, бензотіофенеїл, хінолініл, ізохінолініл, індоліл, бензофураніл, пуриніл, індолізиніл тощо. Ці арильні і ариленові групи можуть бути приєднані до основної групи або до субстрату на будь-якому атомі кільця, якщо таке приєднання не порушує вимог валентності. Подібним чином арильні і ариленові групи можуть включати один або більше негідрогенових замісників, якщо таке заміщення не порушує вимог валентності. Корисні замісники включають (без обмеження) алкіл, алкеніл, алкініл, галогеналкіл, галогеналкеніл, галогеналкініл, циклоалкіл, циклоалкеніл, алкокси, циклоалкокси, алканоїл, циклоалканоїл, циклоалкеноїл, алкоксикарбоніл, циклоалкоксикарбоніл і галоген, визначені вище, і гідрокси, меркапто, нітро, аміно і алкіламіно. "Гетероцикл" і "гетероцикліл" стосуються насичених, частково ненасичених або ненасичених моноциклічних або біциклічних кілець з 5-7 або 711 кільцевими членами, відповідно. Ці групи мають кільцеві члени, побудовані з атомів карбону і з 1-4 гетероатомів, якими незалежно є нітроген, оксиген або сульфур, і можуть включати будь-яку біциклічну груп у, в якій будь-які з вищезазначених моноциклічних гетероциклів злиті з бензольним кільцем. Нітрогенні і сульфурові гетероатоми можуть бути, як варіант, окисленими. Гетероциклічне кільце може бути приєднане до основної групи або до субстрату на будь-якому гетероатомі або атомі карбону, якщо таке приєднання не порушує вимог валентності. Подібним чином будь-який з карбонових або нітрогенних кільцевих членів може включати негідрогенні замісники, якщо таке заміщення не порушує вимог валентності. Корисні замісники включають (без обмеження) алкіл, алкеніл, алкініл, галогеналкіл, галогеналкеніл, галогеналкініл, цик 23 83575 лоалкіл, циклоалкеніл, алкокси, циклоалкокси, алканоїл, циклоалканоїл, циклоалкеноїл, алкоксикарбоніл, циклоалкоксикарбоніл і галоген, визначені вище, і гідрокси, меркапто, нітро, аміно і алкіламіно. Приклади гетероциклів включають (без обмеження) акридиніл, азоциніл, бензімідазоліл, бензофураніл, бензотіофураніл, бензотіофеніл, бензоксазоліл, бензтіазоліл, бензтриазоліл, бензтетразоліл, бензізоксазоліл, бензізотіазоліл, бензімідазолініл, карбазоліл, 4аН-карбазоліл, карболініл, хроманіл, хроменіл, цинолініл, декагідрохінолініл, 2Н, 6Н-1,5,2-дитіазиніл, дигідрофуро[2,3b]тетрагідрофуран, фураніл, фуразаніл, імідазолідиніл, імідазолініл, імідазоліл, 1Н-індазоліл, індоленіл, індолініл, індолізиніл, індоліл, 3Н-індоліл, ізобензофураніл, ізохроманіл, ізоіндазоліл, ізоіндолініл, ізоіндоліл, ізохінолініл, ізотіазоліл, ізохазоліл, морфолініл, нафтиридиніл, октагідроізохінолініл, оксадіазоліл, 1,2,3-оксадіазоліл, 1,2,4оксадіазоліл, 1,2,5-оксадіазоліл, 1,3,4оксадіазоліл, оксазолідиніл, оксазоліл, оксазолідиніл, піримідиніл, фенантридиніл, фенантролініл, феназиніл, фенотіазиніл, феноксатіїніл, феноксазиніл, фталазиніл, піперазиніл, піпери-диніл, птеридиніл, пуриніл, піраніл, піразиніл, піразолідиніл, піразолініл, піразоліл, піридазиніл, піридооксазол, піридоімідазол, піридотіазол, піридиніл, піридил, піримідиніл, піролідиніл, піролініл, 2H-піроліл, піроліл, хіназолініл, хінолініл, 4Н-хінолізиніл, хіноксалініл, хінуклідиніл, тетрагідрофураніл, тетрагідроізохінолініл, тетрагідрохінолініл, 6Н-1,2,5тіадіазиніл, 1,2,3-тіадіазоліл, 1,2,4-тіадіазоліл, 1,2,5-тіадіазоліл, 1,3,4-тіадіазоліл, тіантреніл, тіазоліл, тієніл, тієнотіазоліл, тієнооксазоліл, тієноімідазоліл, тіофеніл, три-азиніл, 1,2,3-триазоліл, 1,2,4-триазоліл, 1,2,5-триазоліл, 1,3,4-триазоліл і ксантеніл. "Гетероарил" і "гетероарилен" стосуються, відповідно, моновалентних і дивалентних гетероциклів або гетероциклільних гр уп, визначених вище, які є ароматичними. Гетероарильні і гетероариленові групи репрезентують підгрупу арильних і ариленових гр уп, відповідно. "Арилалкіл" і "гетероарилалкіл" стосуються, відповідно, арилалкілу і гетероарилалкілу, де арил, гетероарил і алкіл визначені вище. Приклади включають (без обмеження) бензил, флуоренілметил, імідазол-2-іл-метил тощо. "Арилалканоїл", "гетероарилалканоїл", "арилалкеноїл", "гетероарилалкеноїл", "арилалкіноїл" і "гетероарилалкіноїл" стосуються, відповідно, арилалканоїлу, гетероарил-алканоїлу, арилалкеноїлу, гетероарилалкеноїлу, арилалкіноїлу і гетероарилалкіноїлу, де арил, гетероарил, алканоїл, алкеноїл, і алкіноїл визначені вище. Приклади включають (без обмеження) бензоїл, бензилкарбоніл, флуореноїл, флуоренілметилкарбоніл, імідазол-2-оїл, імідазол-2-іл-метилкарбоніл, фенілетенкарбоніл, 1-фенілетенкарбоніл, 1-фенілпропенкарбоніл, 2фенілпропенкарбоніл,3-фенілпропенкарбоніл, імідазол-2-іл-етенкарбоніл, 1-(імідазол-2-іл)етенкарбоніл, 1-(імідазол-2-іл)-пропенкарбоніл, 2(імідазол-2-іл)-пропенкарбоніл, 3-(імідазол-2-іл)пропенкарбоніл, фенілетинекарбоніл, фенілпропі 24 нкарбоніл, (імідазол-2-іл)-етинкарбоніл, (імідазол2-іл)-пропінкарбоніл тощо. "Арилалкокси" і "гетероарилалкокси" стосуються, відповідно, арилалкокси і гетероарилалкокси, де арил, гетероарил і алкокси визначені вище. Приклади включають (без обмеження) бензилокси, флуоренілметилокси, імідазол-2-ілметилокси тощо. "Арилокси" і "гетероарилокси" стосуються, відповідно, арил-О- і гетероарил-О-, де арил і гетероарил визначені вище. Приклади включають (без обмеження) фенокси, імідазол-2-ілокси тощо. "Арилоксикарбоніл", "гетероарилоксикарбоніл", "арилалкоксикарбоніл" і "гетероарилалкоксикарбоніл" стосуються, відповідно, арилокси-С(О)-, гетероарилокси-С(О)-, арилалкокси-С(О)і гетероарилалкокси-С(О)-, де арилокси, гетероарилокси, арилалкокси, і гетероарилалкокси визначені вище. Приклади включають (без обмеження) феноксикарбоніл, імідазол-2-ілоксикарбоніл, бензилоксикарбоніл, флуоренілметилоксикарбоніл, імідазол-2-іл-метилоксикарбоніл тощо. "Відщеплювана група" стосується будь-якої групи, яка відщеплює молекулу під час процесу фрагментації, включаючи реакції заміщення, реакції елімінації і реакції адитивної елімінації. Відщеплювані групи можуть бути нуклеофугальними, тобто такими, в яких групи віддають пару електронів, які перед тим слугували зв'язком між відщеплюваною групою і молекулою, або може бути електрофугальною, в якій група відщеплюється без пари електронів. Здатність нуклефугальних відщеплюваних гр уп відщеплюватись залежить від сили її основності, причому найсильніші основи є найгіршими відщеплюваними групами. Звичайні нуклеофугальні відщеплювані групи включають нітроген (наприклад, з солі діазонію); сульфонати, включаючи алкілсульфонати (наприклад, мезилат), флуоралкілсульфонати (наприклад, трифлат, гексафлат, нонафлат і трезилат) і арилсульфонати (наприклад, тозилат, брозилат, клозилат і нозилат). Інші включають карбонати, галогенідні іони, карбоксилатні аніони, фенолатні іони і алкоксиди. Деякі сильніші основи, наприклад, NH2- і OH- можуть бути кращими відщеплюваними групами при обробці кислотою. Звичайні електрофугальні відщеплювані групи включають протон, CO2 і метали. "Енантіомерний надлишок" або "ен" є мірою для даного зразка надлишку одного енантіомеру відносно рацемічного зразка хіральної сполуки і дається у відсотках. Енантіомерний надлишок визначають як 100 х (еr - 1)/(еr + 1), де "еr" - відношення більш рясного енантіомеру до менш рясного. "Діастереомерний надлишок" або "дн" є для даного зразка мірою надлишку одного діастереомеру відносно зразка, що має однакові кількості діастереомерів, і дається як відсоток. Діастереомерний надлишок визначають як 100 x (dr - 1)/(dr + 1), де "dr" - відношення більш рясного діастереомеру до менш рясного. "Стереоселективний", "енантіоселективний", "діастереоселективний" і їх варіанти стосуються даного процесу (наприклад, естерного гідролізу, 25 83575 гідрогенування, гідроформілування, p-алілпаладієвого сполучення, гідрозилування, гідроціанування, олефінметатезису, гідроацилування, аліламінової ізомеризації тощо), який породжує більшу кількість одного стереоізомеру, енантіомеру або діастереоізомеру, ніж інших, відповідно. "Високий рівень стереоселективності", "високий рівень енантіоселективності", "високий рівень діастереоселективності" і їх варіанти, стосуються процесу, що дає продукти з надлишком одного стереоізомеру, енантіомеру або діастереоізомеру, який становить щонайменше приблизно 90% продуктів. Для пари енантіомерів або діастереомерів високий рівень енантіоселективності або діастереоселективності відповідає "ен" або "дн" щонайменше приблизно 80%. "Стереоізомерно збагачений", "енантіомерно збагачений", "діастереомерно збагачений" і їх варіанти стосуються, відповідно, зразків сполуки, яка має більше одного стереоізомера, енантіомера або діастереомера, ніж інших. Рівень збагачення може бути виміряний як % від усього продукту, або для пари енантіомерів або діастереомерів як "ен" або "дн". "Суттєво чистий стереоізомер", "суттєво чистий енантіомер", "суттєво чистий діастереомер" і їх варіанти стосуються, відповідно, зразка, що містить стереоізомер, енантіомер або діастереомер, який становить щонайменше приблизно 95% зразка. Для пар енантіомерів і діастереомерів, суттєво чистий енантіомер або діастереомер відповідають зразку, що має "ен" або "дн" приблизно 90% або більше. "Чистий стереоізомер", "чистий енантіомер", "чистий діастереомер" і їх варіанти стосуються, відповідно, зразка, що містить стереоізомер, енантіомер, або діастереомер, який становить щонайменше приблизно 99,5% зразка. Для пар енантіомерів і діастереомерів чистий енантіомер або чистий діастереомер відповідають зразку, в якому "ен" або "дн" становить приблизно 99% або більше. "Протилежний енантіомер" стосується молекули, що є несуперпозиційним дзеркальним відображенням даної молекули, яке може бути отримане інверсією всіх стерео-генних центрів даної молекули. Наприклад, якщо дана молекула має абсолютну стереохімічну S-конфігурацію, то протилежний енантіомер має абсолютну стереохімічну R-конфігурацію. Подібним чином, якщо дана молекула має абсолютну стереохімічну S,Sконфігурацію, то протилежний енантіомер має абсолютну стереохімічну R,R-конфігурацію і т. д. "Стереоізомери" конкретної сполуки включають протилежний енантіомер сполуки і будь-які діастереоізомери або геометричні ізомери (Z/E) сполуки. Наприклад, якщо певна сполука має стереохімічну S,R,Z-конфігурацію, її стереоізомери включають протилежний енантіомер з R,S,Zконфігурацією, її діастереомери з S,S,Zконфігурацією і R,R,Z-конфігурацією, і її геометричні ізомери з S,R,E-конфігурацією, R,S,Eконфігурацією, S,S,E-конфігурацією і R,R,E- конфігурацією. "Енантіоселективне значення" або "E" є від 26 ношенням констант специфічності для кожного енантіомеру сполуки, що бере участь у хімічній реакції або перетворенні і може бути обчислене (для S-енантіомеру) з співвідношення ln 1 - c (1 + ен р ) ln [1 - c (1 + ен S )] K /K E = S SM = = KR / K RM ln 1 - c (1 - ен р ) ln [1 - c (1 - енS )] [ [ ] ] де KS і KR є константами швидкості для конверсії- і R-енантіомерів, відповідно; KSM і KRM є константам Міхаеліса для S- і R-енантіомерів, відповідно; c - фракційна конверсія субстрату; ен р і ен s є енантіомерними надлишками продукту і субстрату (реагенту), відповідно. "Ліпазною Одиницею" або "ЛО" є кількість ензиму (у г), яка вивільняє 1мкМ здатної до титрування бутирової кислоти за хвил. при контакті з трибутирином і емульгатором (гуміарабіком) при 30°C і рН 7. "Сольватом" є молекулярний комплекс, який включає описану або заявлену сполуку і сте хіомерну або нестехіомерну кількість однієї більше молекул розчинника (наприклад, EtOH). "Гідратом" є сольват, який включає описану або заявлену сполуку і стехіомерну або нестехіомерну кількість води. "Фармацевтично прийнятними комплексами, солями, сольватами або гідратами" є комплекси, кислоти або солі приєднання основ, сольвати або гідрати описаних або заявлених сполук, що мають позитивну медичну оцінку і є придатними для використання у контакті з тканинами пацієнтів і не створюють токсичності, подразнення, алергічної реакції тощо з прийнятними відношенням корисність/ризик і ефективністю при призначеному застосуванні. "Прекаталізатором" або "прекурсором каталізатора" є сполука або група сполук, які перетворюються у каталізатор перед використанням. "Обробкою" є обернення, послаблення, уповільнення прогресу або відвернення розладу або стану, якого може стосуватись такий термін, або відвернення одного або більше симптомів таких розладу або стану. Таблиця 1 Абревіатури Абревіатура Ac ACN AcNH aq BES BICINE Bn Bu n-Buli Bu4NBr t-BuNH 2 t-BuOK t-BuOMe t-BuONa Опис ацетил ацетонітрил ацетиламіно водний N,N-біс(2-гідроксиетил)-2аміноетансульфонова кислота N,N-6іс(2-гідроксиетил)гліцин бензил бутил n-бутиллітій бромід тетрабутиламонію трет-бутиламін трет-бутилоксид калію трет-бутилметиловий етер трет-бутилоксид натрію 27 CBz c COD DABCO DBU DEAD DIPEA DMAP ДМФ ДМСО бензилоксикарбоніл фракційна конверсія 1,5-циклооктадієн 1,4-діазабіцикло[2,2,2]октан 1,8-діазабіцикло[5,4,0]ундек-7-ен діетилазодикарбоксилат діізопропілетиламін (основа Гюніга) 4-диметиламінопіридин диметилформамід диметилсульфоксид Енантіоселективне значення або відношення констант специфічності E для кожного енантіомеру сполуки, що реагує або перетворюється "eн" ("ен"р енантіомерний надлишок (продукту або "ен"s) або реагента) екв. еквівалентний, еквівалент "ев" енантіомерне відношення Et етил Et3N триетиламін Et2NH діетиламін EtOH етиловий спирт EtOAc етилацетат 4-(2-гідроксиетил)піперазин-1HEPES етансульфонова кислота HOAc оцтова кислота високоефективна рідинна хроматогВЕРХ рафія IAcOEt етилйодацетат IPA ізопропанол константа швидкості 1-го порядку KS, KS для S- або R-енантіомеру константа Мі хаеліса для S- або RKSM, KSM енантіомеру рідинна хроматографія/ масРХ/МС спектрометрія LDA діізопропіламід літію LiHMDS гексаметилдисалізид літію LTMP тетраметилпіперидид літію ЛО ліпазна одиниця Me метил MeCI2 метиленхлорид (R,R)-Me(-)-1,2-біс((2R,5R)-2,5DUPHOS диметилфосфолано)бензол MeI метил йодид MeONa метоксид натрію MeOH метиловий спирт 2-морфоліноетансульфонова кислоMES та 3-(N-морфоліно)пропансульфонова MOPS кислота Ms мезил або метилсульфоніл MTBE метил-трет-бутиловий етер NMP N-метилпіролідон трифлат-(аніон трифлуорметансуOTf льфонової кислоти) Ph феніл Ph3P трифенілфосфін Ph3As трифеніларсин піперазин-1,4-біс(2-етансульфонова PIPES кислота) 83575 28 RaNi Rl нікель Рейні коефіцієнт рефракції кімнатна температура (приблизно RT 20°С-25°С) молярне відношення субs/c страт/каталізатор N-[трис(гідроксиметил)метил]-3TAPS амінопропансульфонова кислота N-[трис(гідроксиметил)метил]-2TES аміноетансульфонова кислота Tf трифлуорметансульфоніл (трифліл) ТФК трифлуороцтова кислота ТГФ тетрагідрофуран ТШХ тонкошарова хроматографія N,N,N',N'-тетраметил-1,2TMED A етилендіамін TRICINE N-[трис(гідроксиметил)метил]гліцин трис(гідроксиметил)амінометановий Трис буфер буфер TRITON B гідроксид бензилтриметиламонію 2-аміно-2-(гідроксиметил)-1,3TRIZMA® пропандіол Ts тозил або р-толуолсульфоніл P-TSA пара-толуол-сульфонова кислота У деяких схемах реакцій певні сполуки можуть бути приготовлені з застосуванням захисних груп, які відвертають небажані хімічні реакції в інших реактивних сайтах. Захисні групи можуть також бути використані для підвищення розчинності або іншого модифікування фізичних властивостей сполук. Щодо стратегій захисних груп, опису матеріалів і методів встановлення і видалення захисних груп і компіляції корисних захисних груп для звичайних функціональних груп, включаючи аміни, карбонові кислоти, спирти, кетони, альдегіди тощо, див. T. W. Green і P.G. Wuts, Protecting Groups in Organic Chemistry (1999) і P. Kocienski, Protective Groups (2000), включені уданий опис посиланням. Крім того, у деяких з схем і прикладів можуть бути відсутні деталі звичайних реакцій, включаючи окислення, відновлення тощо, відомі фахівцям. Описи таких реакцій можна знайти, наприклад, у Richard Larock, Comprehensive Organic Transformations (1999) і багатотомну серію, під редакцією Michael B. Smith та інш., Compendium of Organic Synthetic Methods (1974-2003). Взагалі вихідні матеріали і реагенти можна отримати з комерційних джерел або приготувати згідно з літературою. Взагалі хімічні перетворення, описані тут, можуть бути проведені з застосуванням суттєво стехіомерних кількостей реагентів, хоча певні реакції можуть проходити краще при наявності надлишку одного або більше реагентів. Крім того, багато реакцій, описаних тут, включаючи енантіоселективний гідроліз рацемічного діестеру (Формула 4), детально описані нижче, можуть бути проведені при приблизно кімнатній температурі, але певні реакції можуть потребувати ви щої або нижчої температури залежно від кінетики реакції, виходу тощо. Більше того, багато хімічних перетворень можуть потребувати одного або більше сумісних розчинників, які можуть впливати на швидкість 29 83575 реакції і вихід. Залежно від природи реагентів, один або більше розчинників можуть бути полярними протонними розчинниками, полярними апротонними розчинниками, неполярними розчинниками або деякими їх комбінаціями. У будь-яких згадуваннях межі концентрації, температури, рН, кількості каталізатора тощо, незалежно від застосування слова "межі", включають граничні точки. Винахід включає матеріали і способи для приготування оптично активних g-амінокислот (Формула 1), включаючи їх фармацевтично прийнятні солі, естери, аміди або проліки. Сполуки формули 1 включають замісники R1 і R2, визначені вище. Корисні сполуки формули 1 включають ті, в яких R1 є атомом гідрогену, a R2 є С1-12алкілом, С312циклоалкілом або заміщеним С 3-12циклоалкілои, або ті, в яких R2 є атомом гідрогену, a R1 є С112алкілом, С 3-12циклоалкілом або заміщеним С 312циклоалкілом. Особливо корисні сполуки формули 1 включають ті, в яких R1 є атомом гідрогену, a R2 є С1-6алкілом або С3-7циклоалкілом, або ті, в яких R2 є атомом гідрогену, a R1 є C1-6 алкілом або С3-7циклоалкілом. Зокрема, корисними сполуками формули 1 є ті, в яких R1 є атомом гідрогену, a R2 є С1-4алкілом, наприклад, прегабалін (Формула 9). Фіг.1 ілюстр ує процес приготування оптично активних g-амінокислот (Формула 1). Цей процес включає операцію контактування або комбінування реакційної суміші, яка містить заміщений ціано діестер (Формула 4) і воду, з ензимом, для отримання суміші продуктів, яка включає оптично активний моноестер дикарбонової кислоти (Формула 3) і оптично активний діестер (Формула 5). Заміщений ціано діестер (Формула 4) має стереогенний центр, позначений "*", і, як описано нижче, може бути приготовлений згідно з схемою на Фіг.2. Перед контактом з ензимом заміщений ціано діестер (Формула 4) звичайно містить рацемічну (еквімолярну) суміш діестеру формули 5 і його протилежний енантіомер. Замісники R1, R2 і R3 у Формулі 3, Формулі 4 і Формулі 5 і замісник R4 у Формулі 4 і Формулі 5 є ідентичними визначеним вище для Формули 1. Взагалі, якщо не зазначено інше, коли певний замісник (R1, R2, R3 тощо) визначено вперше у зв'язку з деякою формулою, той же замісник, використаний у подальших формулах має те ж значення.. Ензим (або біокаталізатор) може бути будьяким протеїном, який, мало або зовсім не впливаючи на сполуку формули 5, каталізує гідроліз протилежного енантіомеру з отриманням моноестеру дикарбонової кислоти (Формула 3). Корисні ензими для енантіоселективного гідролізу сполуки формули 4 з отриманням сполуки Формули 3 можуть включати гідролази, включаючи ліпази, певні протеази і інші енантіоселективні естерази. Такі ензими можна отримати з різних природних джерел, включаючи органи тварин і мікроорганізми. Див. Табл. 2, що містить не обмежуючий перелік комерційних гідролаз. 30 Таблиця 2 Комерційні гідролази Ензим Ліпаза підшлункової залози свині CAL-A, ліофілізована Ліпаза Candida lipolytica CAL-B, ліофілізована Ліпаза Geotrichum candidum Ліпаза Pseudomonas aroginosa Ліпаза Aspergillus niger Ліпаза Pseudomonas cepacia Pseudomonas fluorescens Ліпаза Candida rugosa Ліпаза Rhizopus delemar Ліпаза Rhizopus oryzae Ліпаза Penicillium camembertii Ліпаза Mucor javanicus Ліпаза Pseudomonas cepacia Ліпаза Penicillium roqueforti Протеаза Aspergillus sp. Ліпаза Pseudomonas sp. Ліпаза грибкова Ліпаза мікробна, ліофілізована Ліпаза CAL-B, ліофілізована Candida sp., ліофілізована CAL-A, ліофілізована Ліпаза Thermomyces sp. Ліпаза Alcaligines sp., ліофілізована Ліпаза Chromobacterium viscosum CAL-B, L2 SoI Ліпаза Candida utilis Ліпаза Rhizopus niveus Ліпопротеїнова ліпаза Pseudomonas sp. Ліпаза Thermomuces lanuginosus Ліпаза Thermomuces lanuginosus Ліпаза Rhizomucor miehei Ліпаза Pseudomonas species Ліпаза проростка пшениці Ліпаза Rhizopus arrhizus Ліпаза підшлункової Комерційна назва Altus03 Altus11 Altus12 Altus13 Altus28 Altus50 Amano Lipase A Amano Lipase AH Amano Lipase AK Amano Lipase AY Amano Lipase D Amano Lipase F Amano Lipase G Amano Lipase M Amano Lipase PS Amano Lipase R BioCatalytics101 BioCatalytics103 BioCatalytics105 BioCatalytics108 BioCatalytics110 BioCatalytics111 BioCatalytics112 BioCatalytics115 BioCatalytics117 Altus 26 Chriazyme L2 Sol Fluka6 Sigma L8 Sigma L13 Sigma L9 Lipolase Sigma L10 Novo871 Sigma L6 Palatase Sigma L14 Type XIII Sigma L11 Sigma L7 Type Xl Valley Research V1 31 залози 250 Трипсинова протеаза Хімопапаїнова протеаза Бромеленова протеаза Протеаза Aspergillus niger Протеаза Aspergillus oryzae Протеаза Penicillium sp. Протеаза Aspergillus sp. Ренінова протеаза шлунку теляти Протеаза Subtilisin Carlsberg Протеаза Bacillus lentus Протеаза Aspergillus niger Протеаза Rhizopus niveus Протеаза Rhizopus niveus Протеаза Rhizopus oryzae Протеаза Bacillus subtilis Протеаза Aspergillus oryzae Протеаза Aspergillus oryzae Протеаза Bacillus subtilis Протеаза Aspergillus melleus Протеаза Bacillus stearinimophilus Естераза печінки свині, ліофілізована Естераза печінки свині, ліофілізована Протеаза Streptomyces sp. Протеаза Tritirachium album Протеаза бичачої підшлункової залози Протеаза Streptomyces griseus Протеаза бичачої підшлункової залози Протеаза Clostridium histolyticum Протеаза бичачого кишечника Протеаза кишечника свині Протеаза Bacillus sp. Протеаза Aspergillus oryzae Протеаза Bacillus amyloliquefaciens Протеаза Саrіса papaya Bacillus thermoproteolyticus rokko Протеаза Pyrococcus 83575 Altus33 Altus38 Altus40 Altus41 Altus42 Altus43 Altus45 Sigma P24 Altus10 Altus53 Amano Acid Protease A Amano Acid Protease Il Amano Newlase F Amano Peptidase R Amano Proleather FGF Amano Protease A Amano Protease M Amano Protease N Amano Protease P Amano Protease SG BioCat Chirazyme E1 BioCat Chirazyme E2 BioCatalytics118 Fluka P6 Proteinase K Sigma P18 alpha chymotrypsin I Sigma P16 Bacterial Sigma P21 Beta chymotrypsin Sigma P13 Clostripain Sigma P17 Enteropeptidase Sigma P25 Enteropeptidase Sigma P8 Esperase Sigma P1 Flavourzyme Sigma P5 Neutrase Sigma Р12 Papain Sigma P10 Protease Sigma P14 Protease S 32 furiosis Протеаза Bacillus sp. Протеаза бичачої підшлункової залози Протеаза Bacillus політуха Протеаза Bacillus licheniformis Протеаза Aspergillus saitoi Протеаза Aspergillus sojae Протеаза Aspergillus oryzae Бактеріальна протеаза Нью лаза Rhizopus sp. Вапідаза FP Сопc Bromelian Соnc Ацилаза від Aspergillus sp. Ацилаза нирки свині Ацилаза Penicillin G Естераза Mucor meihei Естераза Candida rugosa Ecrepase Еластаза підшлункової залози свині Холестерольна Естераза PLE-Ammonium Sulfate Естераза кролячої печінки Холестерольна естераза Pseudomonas sp. Sigma P9 Savinase Sigma P19 Type 1 (crude) Sigma P7 Type IX Sigma P6 Type VIII Sigma P3 Type XIII Sigma P4 Type XIX Sigma P2 Type XXIII Sigma P11 Type XXIV Sigma15 Newlase Valley05 Valley 10 Amano Am1 Sigma A-S2 Acylase I Altus06 Fluka Altus31 Altus35 BioCatalytics BioCatalytics 123 Sigma ES2 Sigma ES4 Як показано у Прикладах, корисні ензими для енантіоселективної конверсії заміщеного ціанодіестеру (Формула 4 і Формула 12) у бажаний оптично активний моноестер дикарбонової кислоти (Формула 3 і Формула 11) включають ліпази. Зокрема, корисні ліпази включають ензими, отримані від мікроорганізмів Thermomyces lanuginosus, наприклад, від Novo-Nordisk A/S (LIPOLASE® (CAS по. 9001-62-1)). Ензими LIPOLASE® ензими отримують ферментацією мікроорганізму Aspergillus oryzae, генетично модифікованого ДНК Thermomyces lanuginosus DSM 4109, яка кодує амінокислотну послідовність ліпази. LIPOLASE® 100L і LIPOLASE® 100T можна придбати у вигляді рідкого розчину і гранульованої твердої речовини, відповідно, з номінальною активністю 100кЛО/г. Інші форми LIPOLASE® включають LIPOLASE® 50L, яка має половину активності LIPOLASE® 100L, і LIPOZYME® 100L, з такою ж активністю, як і LIPOLASE® 100L, але харчової якості. Для ідентифікації придатних ензимів можуть бути використані різні методи скринінгу. Наприклад, велика кількість комерційних ензимів можуть бути піддані скринінгу високоефективним методом, описаним у Прикладах нижче. Інші ензими (або мікробні джерела ензимів) можуть бути піддані скринінгу методами ізольованого збагачення. Такі методи звичайно включають використання сере 33 83575 довища з обмеженням кількості карбону або нітрогену і з субстратом збагачення, яким може бути рацемічний субстрат (Формула 4) або структурно подібна сполука. Потенційно корисні мікроорганізми вибирають для подальших досліджень за їх здатністю рости у середовищі, що містить збагачений субстрат. Ці мікроорганізми потім оцінюють за їх здатністю до енантіоселективного каталізу гідролізу естеру, вводячи суспензії мікробних клітин у контакт з рацемічним субстратом і перевіряючи на присутність бажаного оптично активного моноестеру дикарбонової кислоти (Формула 3) аналітичними методами, наприклад, хіральною ВЕРХ, газорідинною хроматографією, РХ/МС тощо. Після ізолювання мікроорганізму з бажаною гідролітичною активністю можна застосувати ензимні технології для поліпшення якості ензиму, який він продукує. Наприклад, така техніка може бути застосована для підвищення виходу і енантіоселективності гідролізу естеру, для розширення робочих меж температури і рН для ензиму і для підвищення толерантності ензиму до органічних розчинників. Корисні методи ензимних технологій включають методи раціонального конструювання, наприклад, спрямований на сайт мутагенез і еволюційні методи in vitro з використанням послідовних циклів рандомізованого мутагенезу, експресії гену і скринінгу з високою пропускною здатністю для оптимізації бажаних властивостей [див., наприклад, K. M. Koeller & C-H. Wong, "Enzimes for chemical synthesis", Nature 409:232-240 (11 Jan. 2001) з зауваженнями, включені посиланням]. Ензими можуть мати форму цілих мікробних клітин, клітин з порушеною цілісністю мембрани, екстрактів мікробних клітин, частково очищених ензимів, очищених ензимів тощо. Ензим може бути дисперсією часток середнього розміру за об'ємом, або розміром менше приблизно 0,1мм (тонка дисперсія) або приблизно 0,1мм або більше (груба дисперсія). Грубі ензимні дисперсії мають переваги над тонкими дисперсіями при обробці. Наприклад, грубі ензимі частки можна використовувати багаторазово у періодичних процесах або у напівбезперервних або безперервних процесах і їх можна відділяти (наприклад, фільтрацією) від інших компонентів біоконверсії з більшої легкістю, ніж тонкі дисперсії ензимів. Корисні грубі ензимні дисперсії включають ензимні кристали з поперечними зв'язками (CLEC) і ензимні агрегати з поперечними зв'язками (CLEA), які включають, головним чином, ензими. Інші грубі дисперсії включають ензими іммобілізовані на або у нерозчинній підложці. Корисні тверді підложки включають полімерні матриці з альгінату кальцію, поліакриламіду, EUPERGIT® і інши х полімерних матеріалів, а також неорганічні матриці, наприклад, CELITE®. Загальний опис CLEC і інших методів іммобілізації ензиму можна знайти у Патенті США 5 618 710. Загальний огляд CLEA, включаючи їх приготування і застосування можна знайти у заявці на патент США. 2003/0149172. Див. також A. M. Anderson, Biocat. Biotransform, 16:181 (1998) і P. Lopez-Serrano et al., Biotechnol. Lett. 24:1379-83 (2002) стосовно застосування CLEC і CLEA техно 34 логій до ліпази. Зазначені матеріали включені у даний опис посиланням. Реакційна суміш може мати одну фазу або множинні фази (наприклад, бути дво- або трифазною системою). Наприклад, енантіоселективний гідроліз (Фіг.1) може відбуватись в єдиній водній фазі, яка містить ензим, початковий рацемічний субстрат (Формула 4), небажаний оптично активний діестер (Формула 5) і бажаний оптично активний моноестер дикарбонової кислоти (Формула 3). В іншому варіанті реакційна суміш може включати мультифазну систему, яка містить водну фазу у контакті з твердою фазою (наприклад, ензимом або продуктом), водну фазу у контакті з органічною фазою або водну фазу у контакті з органічної фазою і твердою фазою. Наприклад, енантіоселективний гідроліз може бути проведений у двофазній системі, яка має тверду фазу, що містить ензим, і водну фазу, що містить первісний рацемічний субстрат, небажаний оптично активний діестер і бажаний оптично активний моноестер дикарбонової кислоти. В іншому варіанті енантіоселективний гідроліз може бути здійснений у три фазній системі, яка включає тверду фазу, що містить ензим, органічну фазу, що спочатку містить рацемічний субстрат (Формула 4) і водну фазу, що спочатку містить невелику фракцію рацемічного субстрату. Оскільки бажаний оптично активний моноестер дикарбонової кислоти (Формула 3) має нижчий рКа, ніж оптично активний діестер, що не прореагував (Формула 5), і тому має більшу розчинність у воді, органічна фаза збагачується діестером, що не прореагував, а водна фаза збагачується бажаним моноестером дикарбонової кислоти у процесі реакції. Кількості рацемічного субстрату (Формула 4) і біокаталізатору, що використовуються у енантіоселективному гідролізі, залежать від, між іншим, від властивостей конкретного заміщеного ціано діестеру і ензиму. Взагалі, у реакції можна використовувати субстрат з початковою концентрацією приблизно 0,1-3,0M і у багатьох випадках з початковою концентрацією від приблизно 1,5М до приблизно 3,0M. Крім того, у реакції взагалі можна використовува ти ензим у кількості від приблизно 1% до приблизно 10% і у багатьох випадках від приблизно 3% до приблизно 4% (об'єм/об'єм). Енантіоселективний гідроліз може бути здійснений у широких межах температур і рН. Наприклад, реакцію можна проводити при температурі від приблизно 10°C до приблизно 50°C, але звичайно її проводять приблизно при кімнатній температурі. Такі температури взагалі забезпечують повну конверсію (наприклад, від приблизно 42% до приблизно 50%) від рацемату (Формула 4) протягом помірного часу (від приблизно 2 год. до приблизно 24 год.) без дезактивації ензиму. Крім того, енантіоселективний гідроліз може бути здійснений при рН від приблизно 5 до приблизно 10, звичайно при рН від приблизно 6 до приблизно 9, і часто при рН від приблизно 6,5 до приблизно 7,5. За відсутності контролю рН, рН реакційної суміші буде знижуватись у процесі гідролізу субстрату (Формула 4), внаслідок утворення моноестеру 35 83575 дикарбонової кислоти (Формула 3). Для компенсації цього явища реакцію гідролізу можна проводити з внутрішнім контролем рН (наприклад, у присутності придатного буфера) або з зовнішнім контролем рН з доданням основи. Придатні буфери включають фосфат калію, фосфат натрію, ацетат натрію, ацетат амонію, ацетат кальцію, BES, BICINE, HEPES, MES, MOPS, PIPES, TAPS, TES, триСINЕ, трис, триZMA®, або інші буфери з рКа від приблизно 6 до приблизно 9. Концентрація буфера взагалі становить від приблизно 5мМ до приблизно 1мМ і звичайно становить від приблизно 50мМ до приблизно 200мМ. Придатні основи включають водні розчини KOH, NaOH, NH 4OH тощо, у концентраціях від приблизно 0,5М до приблизно 15М або більше, звичайно від приблизно 5М до приблизно 10M. Можна використовувати інші неорганічні добавки, наприклад, ацетат кальцію. Після або під час ензимної конверсії рацемату (Формула 4) бажаний оптично активний моноестер дикарбонової кислоти (Формула 3) ізолюють з суміші стандартними методами. Наприклад, у випадку водно-однофазової періодичної реакції, суміш може бути екстрагована один або більше разів неполярним органічним розчинником, наприклад, гексаном або гептаном, який відділяє бажаний дикарбоновий моноестер (Формула 2) і діестер (Формула 5), що не прореагував, у водній і органічній фазах, відповідно. В іншому варіанті у випадку мультифазової реакції з застосуванням водної і органічної фаз, збагачених бажаним моноестером (Формула 3) і діестер, що не прореагував (Формула 5), відповідно, моноестер і діестер можуть бути відділені подальшою періодичною реакцією, напівбезперервно або безперервно у процесі енантіоселективного гідролізу. Діестер, що не прореагував (Фіг.1, Формула 5), може бути відділений від органічної фази і рацемізований для отримання рацемічного субстрату (Формула 4). Отриманий рацемат (Формула 4) може бути рецикльований або комбінований з неконвертованим рацемічним субстратом, який потім зазнає ензимної конверсії до Формули 3, як описано вище. Рециклювальний діестер, що не прореагував (Формула 5), підвищує загальний вихід енантіоселективного гідролізу до 50% і вище, збільшуючи економічність метода і знижуючи витрати на усунення небажаних енантіомерів. Обробка діестеру (Формула 5) основою, достатньо сильною, щоб витягти кислотний a-протон малонатного компонента, викликає інверсію стереогенного центру і створення рацемічного субстрату (Формула 4). Корисні основи включають органічні основи, наприклад, алкоксиди (зокрема, етоксид натрію), лінійні аліфатичні аміни і циклічні аміни, і неорганічні основи, наприклад, KOH, NaOH, NH4OH тощо. Реакцію здійснюють у сумісному розчиннику, включаючи полярні протонні розчинники, наприклад, EtOH або апротонні полярні розчинники, наприклад, MTBE. Реакційні температури вище кімнатної звичайно підвищують рацемізацію. Суттєво енантіочистий моноестер дикарбонової кислоти (Фіг.1, Формула 3) може бути перетво 36 рений в оптично активну g-амінокислоту (Формула 1) щонайменше трьома різними методами. В одному з них моноестер (Формула 3) гідролізують у присутності кислотного каталізатора або основного каталізатора і отримують оптично активну заміщену ціано дикарбонову кислоту (Формула 6) або відповідну сіль. Ціано-компонент отриманої дикарбонової кислоти (або її сіль) відновлюють, отримуючи оптично активну g-аміно-дикарбонову кислоту (Формула 7) або відповідну сіль, яку потім декарбоксилують обробкою кислотою, нагріванням або обома, отримуючи бажану оптично активну gамінокислоту (Формула 1). Ціано-компонент може бути відновлений реакцією з H2 у присутності каталітичної кількості нікелю Рейні, паладію, платини тощо, або реакцією з відновлювальним агентом, наприклад, LiAIH4, BH3-Me2S то що. Корисні кислоти для гідролізу і декарбоксилування включають неорганічні кислоти, наприклад, HCIO4, НІ, H2SO4, HBr, HCI тощо. Корисні основні каталізатори гідролізу включають гідроксиди і оксиди різних лужних і лужноземельних металів, включаючи LiOH, NaOH, KOH тощо. Згідно з іншим методом, моноестер дикарбонової кислоти (Формула 3) піддають відновлювальній циклізації з утворенням оптично активного циклічного 3-карбокси-піролідин-2-ону (Формула 2), який потім обробляють кислотою і отримують бажану енантіомерно збагачену g-амінокислоту (Формула 1). Відновлювальна циклізація може бути здійснена введенням моноестеру (Формула 3) у реакцію з H2 у присутності каталітичної кількості нікелю Рейні, паладію, платини тощо. Для гідролізу і декарбоксилування можна використати одну або більше кислот з отриманням лактамової кислоти (Формула 2), включаючи неорганічні кислоти, наприклад, HCIO4, НІ, H2SO4, HBr і HCI, і органічні кислоти, наприклад, HOAc, ТФК, p-TSA тощо. Концентрація кислоти може становити від приблизно 1N до приблизно 12N, а кількість кислоти може становити від приблизно 1 екв. до приблизно 7 екв. Реакції гідролізу і декарбоксилування можуть бути здійснені при приблизно кімнатній температурі або вище або при температурі приблизно 60°C або вище, або при температурі від приблизно 60°C до приблизно 130°C. Згідно з третім методом, естерний компонент моноестеру дикарбонової кислоти (Формула 3) спочатку гідролізують, отримуючи заміщену ціано дикарбонову кислоту (Формула 6 або її сіль), описану вище. Отриману дикарбонову кислоту (або її сіль) декарбоксилують, отримуючи оптично активну заміщену ціанокарбонову кислоту або її сіль (Формула 8, в якій R5 - атом гідрогену, хоча R5 може також бути C1-12 алкілом, С3-12 циклоалкілом, або арил-С1-6 алкіом, як це відзначено нижче). Такі ж умови застосовують для декарбоксилату лактамової кислоти (Формула 2) або g-амінодикарбонової кислоти (Формула 7). Замість гідролізу естерного компонента можна спочатку декарбоксилувати моноестер дикарбонової кислоти (Формула 3) з безпосереднім отриманням заміщеного ціано моноестеру (Формула 8) нагріванням водного розчину моноестеру дикарбонової кислоти (як солі) до температури від приблизно 50°C до 37 83575 температури флегми. Можуть бути використані також умови Крепчо (Krapcho) (ДМСО/NaCl/вода). У будь-якому випадку ціанокомпонент сполуки формули 8 відновлюється з отриманням оптично активної у-амінокислота (Формула 1). На додаток до нікелю Рейні можуть бути застосовані інші каталізатори для відновлення ціанокомпонента сполук формул 3, 6 і 8, а саме (без обмеження) гетерогенні каталізатори, що містять від приблизно 0,1% до приблизно 20%, і більш типово, від приблизно 1% до приблизно 5% (за масою) перехідних металів наприклад, Ni, Pd, Pt, Rh, Re, Ru і Ir, включаючи їх оксиди і комбінації, на різних утримуючих матеріалах, включаючи AI 2O 3, C, CaCO3, SrCO3, BaSO4 , MgO, SiO2, TiO2 , ZrO2 тощо. Деякі з цих металів, включаючи Pd, можуть бути леговані аміном, сульфідом або другим металом, наприклад, Pb, Cu, або Zn. Корисні каталізатори включають паладієві каталізатори, наприклад, Pd/C, Pd/SrCO3, Pd/AI 2O3 , Pd/MgO, Pd/CaCO3, Pd/BaSO4, PdO, Pd на вугіллі, PdCI2 тощо, які містять від приблизно 1% до приблизно 5% Pd (за масою). Інші корисні каталізатори включають Rh/C, Ru/C, Re/C, PtO2, Rh/C, RuO2 тощо. Каталітичне відновлення ціанокомпонента звичайно здійснюють у присутності одного або більше полярних розчинників, включаючи (без обмеження) воду, спирти, етери, естери і кислоти, наприклад, MeOH, EtOH , IPA, ТГФ, EtOAc, і HOAc. Реакцію можна проводити при температурах від приблизно 5°С до приблизно 100°C, звичайно при кімнатній температурі. Взагалі, відношення підложка/каталізаторможе становити від приблизно 1:1 до приблизно 1000:1 (за масою), а тиск H2 може становити від приблизно атмосферного до приблизно 1500 фунт/кв. дюйм (105 ат). Частіше відношення підложка/каталізатор становить від приблизно 4:1 до приблизно 20:1, а тиск H2 - від приблизно 25 фунт/кв. дюйм (1,9 ат) до приблизно 150 фунт/кв. дюйм (11 ат). Наведені вище методи можуть бути застосовані для перетворення суттєво енантіочистого моноестеру (Формула 3) в оптично активну gамінокислоту (Формула 1), але кожний з методів має певні переваги над іншими. Наприклад, після обробки кислоти відновлювальною циклізацією, лактамова кислота (Формула 2) може бути ізольована і очищена екстрагуванням органічним розчинникам, а заміщену ціано дикарбонову кислоту (Формула 6) важче ізолювати, оскільки вона має вищу розчинність у воді. Ізолювання лактамової кислоти (Формула 2) знижує перенесення розчинних у воді домішків у суміш кінцевих продуктів і припускає вищу концентрацію реагенту (наприклад, від приблизно 1М до приблизно 2M) під час гідролізу і декарбоксилування, і тому дає ви щий вихід. Крім того, пряме декарбоксилування нагріванням водного розчину моноестеру дикарбонової кислоти (Формула 3) дає ціаномоноестер (Формула 8) з високою енантіомерною чистотою. Цю сполук можна бути відділити від реакційного середовищ екстрагуванням органічним розчинником або прямим розділенням фаз, яке забезпечує ефективне видалення неорганічних забруднень водною фазою. Перевагами такого варіанту є високий ви 38 хід реакції і відсутність сильних кислот в умовах реакції. Фіг.2 ілюструє процес приготування заміщених ціано діестерів (Формула 4), які можуть слугува ти як субстрати для ензимного енантіоселективного гідролізу, показаного на Фіг.1. Цей процес включає перехресну альдольну конденсацію, яка включає введення несиметричного кетону або альдегіду (Формула 17) з діестером малонової кислоти (Формула 18) у присутності каталітичної кількості основу, з отриманням діестеру a,b-ненасиченої малонової кислоти (Формула 19), де R1, R 2, R 3 і R4 визначені вище у Формулі 1. Цей тип перехресної альдольної реакції відомий як конденсація Кновенагеля (Knoevenagel), описаний у ряді оглядів літератури [див., наприклад, В. K. WiIk, Теmpahedron 53:7097-7100 (1997)], включений посиланням. Взагалі може бути використана будь-яка основа, здатна отримувати енолатний іон з діестеру малонової кислоти (Формула 18), включаючи вторинні аміни, наприклад, ди-n-пропіламін, ди-iпропіламін, піролідин тощо і їх солі. Реакція може включати карбонову кислоту, наприклад, HOAc, для нейтралізації продукту і для мінімізації енолювання несиметричного кетону або альдегіду (Формула 17). У реакції з використанням несиметричних кетонів можуть бути використані кислоти Льюїса, наприклад, тетрахлорид титану, хлорид цинку, ацетат цинку то що, для сприяння реакції. Реакцію звичайно проводять у гідрокарбоновому розчиннику під зворотним холодильником. Корисні розчинники включають гексан, гептан, циклогексан, толуол, метил-і-бутиловий етер тощо, з азеотропним видаленням води. Подальшою операцією джерело ціаніду, наприклад, HCN, ціаногідрин ацетону, ціанід лужного металу (NaCN, KCN тощо), ціанід лужноземельного металу (ціанід магнію тощо), кон'юговано додають до b-карбону діестеру a,bненасиченої малонової кислоти (Формула 19). Реакцію звичайно проводять в одному або більше полярних протонних розчинниках, включаючи EtOH, MeOH, n-пропанол, ізопропанол, або полярних апротонних розчинниках, наприклад, ДМСО тощо. Подальша обробка кислотою дає заміщений ціано діестер (Формула 4). Застосування методу, ілюстрованого Фіг.2, для приготування прекурсора прегабаліну (Формула 12) описано у Патенті США 5 637 767, включеному посиланням. Бажані (S)- або (R)-енантіомери будь-яких описаних тут сполук можуть бути у подальшому збагачені звичайним розрізненням, хіральною хроматографією або рекристалізацією. Наприклад, оптично активні g-амінокислоти (Формула 1 або Формула 9) можуть бути введені у реакцію з енантіомерно чистою сполукою (наприклад, кислотою або основою) для отримання пари діастереоізомерів, кожний з яких складається з одного енантіомеру, які розділяють, наприклад, фракційною рекристалізацією або хроматографією. Бажаний енантіомер потім регенерують з належного діастереоізомеру. Крім того, бажаний енантіомер часто може бути додатково збагачений рекристалізацією у відповідному, розчиннику, коли він є у достатній кількості (наприклад, не менше, ніж приблизно з 39 83575 85%-м "не", і у деяких випадках не менше, як з 90%-м "не"). Багато з описаних сполук мають стереоізомери. Деякі з цих сполук можуть існувати як одиночні енантіомери (енантіочисті сполуки) або суміші таких енантіомерів (збагачених і рацемічних), які, залежно від відносного надлишку одного енантіомеру відносно інших у зразках, можуть виявляти оптичну активність. Такі стереоізомери, які є нездатними до накладання дзеркальними відображеннями, мають стереогенні осі або один або більше стереогенних центрів (наприклад, хіральність). Інші описані сполуки можуть бути стереоізомерами, що не є дзеркальними відображеннями. Такі стереоізомери, відомі як діастереоізомери, можуть бути хіральними або ахіральним (без стерео генних центрів). Вони включають молекули, які містять алкенільну або циклічну групу, що зумовлює існування цис/транс стереоізомерів, або молекули, що містять два або більше стереогенних центрів, в яких інверсія одного стереогенного центру дає відповідний діас-тереоізомер. Якщо не зазначено інше (наприклад, використання стереозв'язків, дескрипторів стереоцентрів тощо) винахід взагалі включає такі сполуки ї їх стереоізомери, чисті (наприклад, енантіочисті) або у сумішах (наприклад, енантіомерно збагачені або рацемічні). Деякі сполуки можуть також містити кетонну або оксимну груп у, і тому може виникати таутомерія. У таких випадках винахід взагалі включає таутомерні форми, як чисті, так і у суміша х. Деякі з описаних сполук, включаючи репрезентовані Формулами 1 і 9, здатні утворювати фармацевтично прийнятні солі. Ці солі включають (без обмеження) кислотоадитивні солі (включаючи дикислоти) і основні солі. Фармацевтично прийнятні кислотоадитивні солі включають нетоксичні солі неорганічних кислот, наприклад, гідрохлорної, нітро-, фосфорної, сульфурової, гідробромної, гідройодної, гідрофлуорової тощо, а також нетоксичні солі органічних кислот, наприклад, аліфатичних моно- і дикарбонових кислот, заміщених фенілом алканойних кислот, гідроксиалканойних кислот, алканойних кислот, ароматичних кислот, аліфатичних і ароматичних сульфонових кислот то що. Такі солі включають сульфати, піросульфати, бісульфати, сульфі ти, бісульфі ти, нітрати, фосфати, моногідрофосфати, дигідрофосфати, метафосфати, пірофосфати, хлориди, броміди, йодиди, ацетати, трифлуорацетати, пропіонати, каприлати, ізобутирати, оксалати, малонати, сукцинати, субеоати, себацати, фумарати, малеати, манделати, бензоати, хлорбензоати, метилбензоати, динітробензоати, фталати, бензолсульфонати, толуолсульфонати, фенілацетати, цитрати, лактати, малати, тартрати, метансульфонати то що. Фармацевтично прийнятні основні солі включають нетоксичні солі основ, що містять катіони металу, наприклад, катіон лужного або лужноземельного металу, а також аміни. Приклади придатних катіонів металу включають (без обмеження) катіони натрію (Na+), катіони калію (K+), катіони магнію (Mg2+), катіони кальцію (Ca2+) тощо. Приклади придатних амінів включають (без обмежен 40 ня) N,N'-дибензилетилендіамін, хлорпрокаїн, холін, діетаноламін, дициклогексиламін, етилендіамін, N-метилглюкамін, прокаїн і tбутиламін. Див. S. M. Berge et al., "Pharmaceutical Salts," 66 J. of Pharm. Sci., 1-19 (1977); а також Stahl і Wermuth, Handbook of Pharmaceutical Salts: Properties, Selection, and Use (2002). Фармацевтично прийнятну кислотоадитивну сіль (або основну сіль) можна отримати введенням вільної основи сполуки (або вільної кислоти) або цвітеріону у контакт з достатньою кількістю бажаної кислоти (або основи) для отримання нетоксичної солі. Якщо сіль осаджується з розчину, її можна ізолювати фільтрацією; в іншому варіанті сіль можна відділити випарюванням розчинника. Можна також регенерувати вільну основу (або вільну кислоту) введенням кислотоадитивної солі у контакт з основою (або основної солі з кислотою). Хоча певні фізичні властивості вільної основи (або вільної кислоти) і їх відповідних кислотоадитивних солей (або основної солі) можуть бути різними (наприклад, за розчинністю, кристалічною структурою, гігроскопічністю тощо), вільна основа і кислотоадитивна сіль (або відповідні вільна кислота і основна сіль) є зрештою придатними для застосування згідно з винаходом. Описані сполуки можуть існувати у несольватованій і сольватованій формах, а також у вигляді комплексів інших типів, відмінних від солей. Корисні комплекси включають решітчасті комплекси або комплекси, що включають основну сполуку, в яких дана сполука і основна сполука присутні у стехіомерній або нестехіомерній кількостях. Корисні комплекси можуть також містити два або більше органічних, неорганічних або органічних і неорганічних компонентів у сте хіомерній або нестехіомерній кількостях. Отримані комплекси можуть бути іонізовані, частково іонізовані або неіонізовані. Див. K. Haleblian, J. Pharm. Sci. 64(8): 1269-88 (1975). Фармацевтично прийнятні сольвати також включають гідрати і сольвати, в яких кристалізаційний розчинник може бути ізотопічно заміщений, наприклад, D2O, d6-ацетоном, d6-ДМСО тощо. Взагалі згідно з винаходом несольватовані форми сполуки також включають відповідні сольвати або гідрати сполуки. Описані сполуки також включають всі фармацевтично прийнятні ізотопні варіанти, в яких щонайменше один атом заміщений атомом з таким же атомним номером, але з іншою атомною масою, відмінною від тих, що зустрічаються у природі. Приклади ізотопів, приданих для описаних сполук, включають (без обмеження) ізотопи гідрогену, наприклад, 2H і 3H; ізотопи карбону, наприклад, 13C і 14C; ізотопи нітрогену, наприклад, 15N; ізотопи оксигену, наприклад, 17O і 18O; ізотопи фосфору, наприклад, 31P і 32P; ізотопи сульфуру, наприклад, 35 S; ізотопи флуору, наприклад, 18F; і ізотопи хлору, наприклад, 36CI. Використання ізотопів (наприклад, дейтерію, 2H) може дати певні терапевтичні переваги, зумовлені вищою метаболічною стабільністю, наприклад, підвищення на півжиття in vivo або знижені вимоги до доз. Крім того, певні ізотопні варіанти описаних сполук можуть містити радіоактивні ізотопи (наприклад, тритій, 3H, або 14C), які 41 83575 42 можуть бути корисними у ліках і/або в аналізах на розподілення у тканині субстрату. ПРИКЛАДИ Наведені далі приклади ілюструють певні втілення винаходу, не обмежуючи його. Загальні матеріали і методи Скринінг ензимів проводять у 96-коміркових планшетах, описаних у роботі D. Ya zbecketal., Synth. Catal. 345:524-32 (2003), включеній посиланням. Всі ензими, використані у скринінгу (табл..2) були отримані від комерційних постачальників, включаючи Amano (Nagoya, Japan), Roche (Basel, Switzerland), Novo Nordisk (Bagsvaerd, Denmark), Altus Biologies Inc. (Cambridge, MA), BioCatalytics (Pasadena, CA), Toyobo (Osaka, Japan), Sigma-Aldrich (St. Louis, MO) і Fluka (Buchs, Switzerland). Реакцію скринінгу проводили в Eppendorf Thermomixer-R (VWR). Подальше великомасштабне ензимне розрізнення виконували на LIPOLASE® 100L і LIPOLASE®100T від NovoNordisk A/S (CAS по. 9001-62-1). Ядерно-магнітний резонанс Спектри 1H ЯМР (300МГц) і 13C ЯМР (75МГц) були отримані на BRUKER 300 UltraShield™ з 5мм пробником PHQNP з автоперемиканням. Спектри взагалі отримують приблизно при кімнатній температурі з застосуванням стандартних автоблокування, автошимування і автоматичного регулювання коефіцієнта передачі. Зразки повертають при 20Гц для експериментів 1D. Спектри 1H ЯМР отримують з використанням імпульсів з кутом при вершині 30°, з затримкою повторення циклу 1,0 сек. і 16 скануваннями при розрізненні 0,25Гц/точка. Вікно читання становить при 8000Гц від +18 до -2 1/млн. (Еталон TMS при 0 1/млн.) і обробка з розширенням лінії 0,3Гц. Типовий час зчитування - 5-10 сек. Регулярні 13C ЯМР спектри отримують з використанням імпульсів з кутом при вершині 30°, з затримкою повторення циклу 2,0 сек. і 2048 скануваннями при розрізненні 1Гц/точка. Спектральна ширина при 25КГц - від +235 до -15 1/млн. (Еталон TMS при 0 1/млн.). Роз'єднання протонів - безперервне, обробка з розширенням лінії 1Гц. Типовий час зчитування 102 хвил. Мас-спектрометрія Mac-спектрометрію проводили на HEWLETT PACKARD 1100MSD з застосуванням програмного забезпечення HP Chemstation Plus. Рідинний хроматограф (PX) був обладнаний кватернарною PX системою Agilent 1100 і маніпулятором рідини Agilent як форматором зразків. Дані отримували при електронно-розпилювальній іонізації з ACN/водою (з 0,1% мурашиної кислоти) як розчинником (від 10% ACN до 90%, 7 хвил.). Температури: зразка - 350°C1 джерела - 150°C. Коронний розряд - при 3000В для позитивного і негативного іонів. Високоефективна рідинна хроматографія (ВЕРХ) ВЕРХ проводили на інструменті серії 1100 AGILENT TECHNOLOGIES, обладнаному авто форматором зразків Agilent 220, кватернарним насосом і УФ-детектором. PX - під керуванням ПК з програмним забезпеченням HP Chemstation Plus. Нормальнофазну хіральну ВЕРХ проводили на колонці Chiral HPLC від Chiral Technologies (Exton, PA) і Phenomenex (Torrance, CA). Газова хроматографія (ГХ) ГХ проводили на системі Agilent 6890N network GC 110 В, обладнаній детектором FID з електрометром/нерозщеплювальним капілярним інжектором 7683 Series, релейною карткою, що веде моніторинг чотирьох зовнішніх процесів і вбудованим принтером/плотером. Енантіомерний надлишок діестеру (Формула 13, R3=R4=Et) і моноестеру (Формула 11, R3=Et) отримували, використовуючи колонку CHIRALDEX G-TA (30m x 0,25мм) з гелієм (газ) як носієм, при 135°С. В таких умовах моноестер розкладається з утворенням етилового естеру (S)-3-ціано-5-метил-гексанової кислоти, а "не" визначають на основі продукту розкладання. Хіральні колонки ГХ для аналізу - від Astec, Іnс (Whippany, NJ). Приклад 1. Ензимний скринінг ензимним гідролізом етилового естеру (R/S)-3-ціано-2етоксикарбоніл-5-метил-гексанової кислоти (Формула 20) для отримання (3S)-3-ціано-2етоксикарбоніл-5-метил-гексанової кислоти (Формула 21). Ензимний скринінг проводять за допомогою скринінгового комплекту, який містить індивідуальні ензими, розміщені в окремих комірках 96коміркового планшету, приготовленого заздалегідь згідно з методом, описаним у D. Yazbeck et al., Synth. Catal. 345:524-32 (2003). Кожна комірка має об'єм 0,3мл. Одна комірка 96-коміркового планшету містить лише фосфатний буфер (10мкл, 0,1M, рН 7,2), інша комірка містить лише ACN (10мкл), а кожна з решти комірок містить один з 94 ензимів, перелічених у табл.2 (10мкл, 100мг/мл). Перед використанням скринінговий комплект беруть з схови ща зберігання (-80°C) і ензими залишають для відтаювання при кімнатній температурі на приблизно 5 хвил. Калійфосфатний буфер (85мл, 0,1M, рН 7,2) вносять у кожну з комірок за допомогою багатоканальної піпетки. Такою ж піпеткою у кожну комірку вносять концентрований субстрат (Формула 20, 5мл) і 96 реакційних сумішей інкубують при 30°C і 750об./хвил. Реакції гасять і через 43 83575 24 год. зразки реакційної суміші переносять в окремі комірки другого 96-коміркового планшету, кожна комірка якого має об'єм 2мл (глибококомірковий планшет) і містить EtOAc (1мл) і HCI (1N, 100мкл). Компоненти кожної з комірок змішують за допомогою піпетки. Другий планшет центрифугують і 100мкл органічної над осадової рідини від кожної комірки переносять в окрему комірку третього 96-коміркового планшету (мілкого планшету). Комірки третього планшету герметизують проникним матом. Після закриття комірок третій планшет вносять у ГХ систему для визначення оптичної чистоти ("не"). 44 Таблиця 3 містить ензим, комерційну назву, постачальника і значення E для деяких ензимів, що були піддані скринінгу. Для даного ензиму значення E можна інтерпретувати як відносну реактивність пари енантіомерів (субстратів). Значення E у табл.3 були обчислені з даних ВЕРХ (фракційна конверсія, c і "не") з застосуванням комп’ютерної програми з назвою Ее2 від University of Graz. Взагалі ензими з S-селективністю і значенням E приблизно 35 або більше можуть бути піддані збільшенню масштабу. Таблиця 3 Результати реакцій скринінгу Прикладу 1 Ензим Ліпаза Thermomyces lanuginosus Ліпаза Rhizopus delemar Ліпаза Rhizopus niveus Естераза Rhizomucor miehei Ліпаза Pseudomonas sp. Ліпаза Rhizomucor miehei Ліпаза Rhizopus oryzae Ліпаза -A Candida antarctica Ліпаза -В Candida antarctica Естераза печінки свині Ентеропептидаза Ациназа нирки свині Холестерольна естераза Комерційна назва S-селективність Lipolase Lipase D L-9406 46059 103 Palatase 20000 FAP15 CAL-A CAL-B, Chirazyme L-2 Маргінальна S-селективність PLE-AS Постачальник Значення E Novozymes Amano Sigma Fluka Biocatalitics Novozymes Amano Novozymes Novozymes >200 >200 66 52 51 41 35 5 3 Biocatalitics Sigma Sigma
ДивитисяДодаткова інформація
Назва патенту англійськоюPreparation of pregabalin and related compounds
Автори англійськоюHu Shanghui, Martinez Carlos Alberto, Tao Junhua, Tully William Eugene, Kelleher Patrick Gerard Thomas, Dumond Yves Rene
Назва патенту російськоюПолучение прегабалина и родственных соединений
Автори російськоюХу Шанхуй, Мартинес Карлос Альберто, Тао Дзюньхуа, Талли Вильям Юджин, Келлгер Патрик Джерард Томас, Дюмон Ив Рене
МПК / Мітки
МПК: C07C 227/00, C07C 253/30, C07C 255/03, C07D 207/04
Мітки: споріднених, сполук, прегабанілу, отримання
Код посилання
<a href="https://ua.patents.su/26-83575-otrimannya-pregabanilu-i-sporidnenikh-spoluk.html" target="_blank" rel="follow" title="База патентів України">Отримання прегабанілу і споріднених сполук</a>
Попередній патент: Барокомпенсований первинний вимірювальний перетворювач з твердотільним чутливим елементом
Наступний патент: Пристрій для автоматичного регулювання процесу підігрівання рідкого палива
Випадковий патент: Формувач одиночної пачки, яка містить чотири симетричних кодових серії імпульсів з програмованими часовими параметрами












