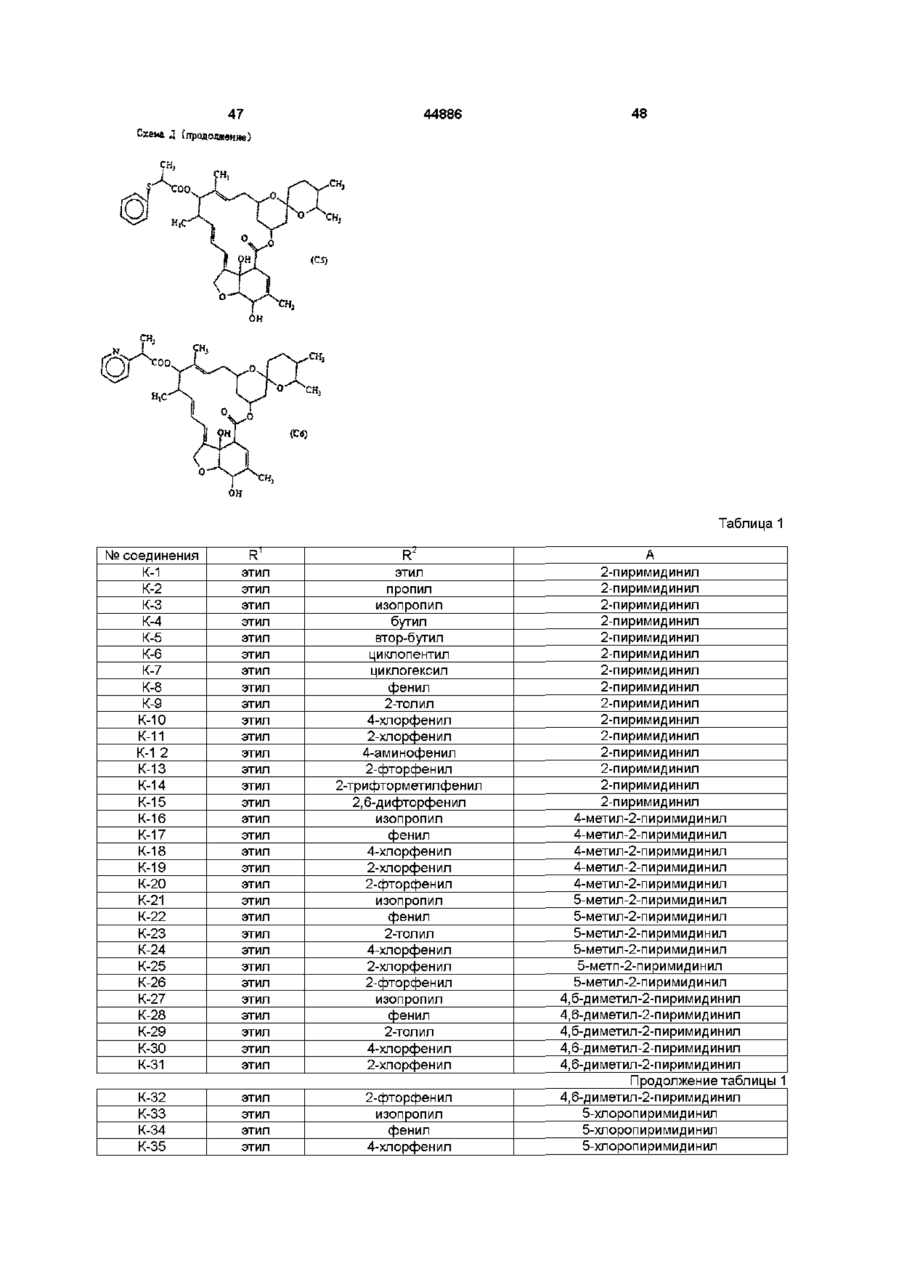
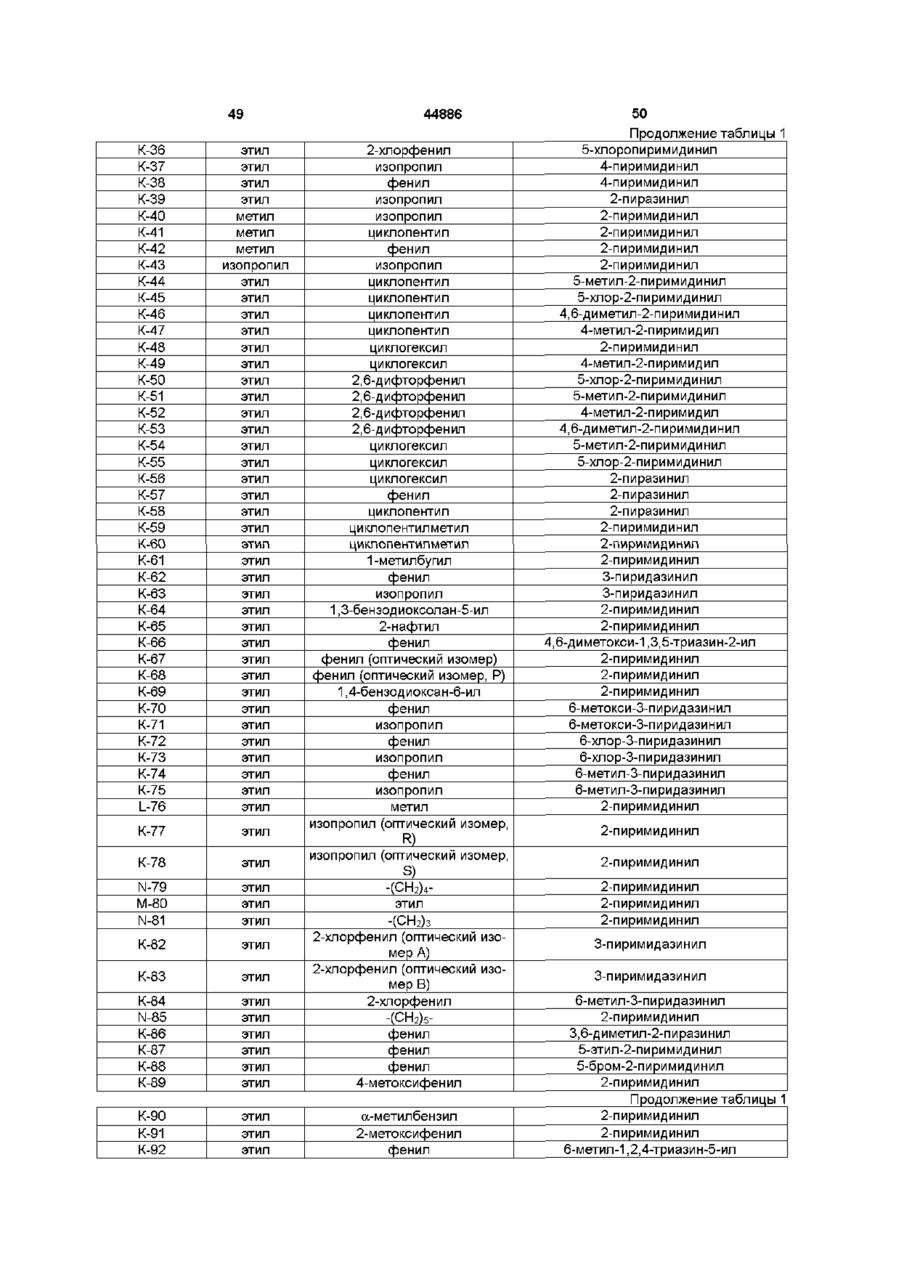
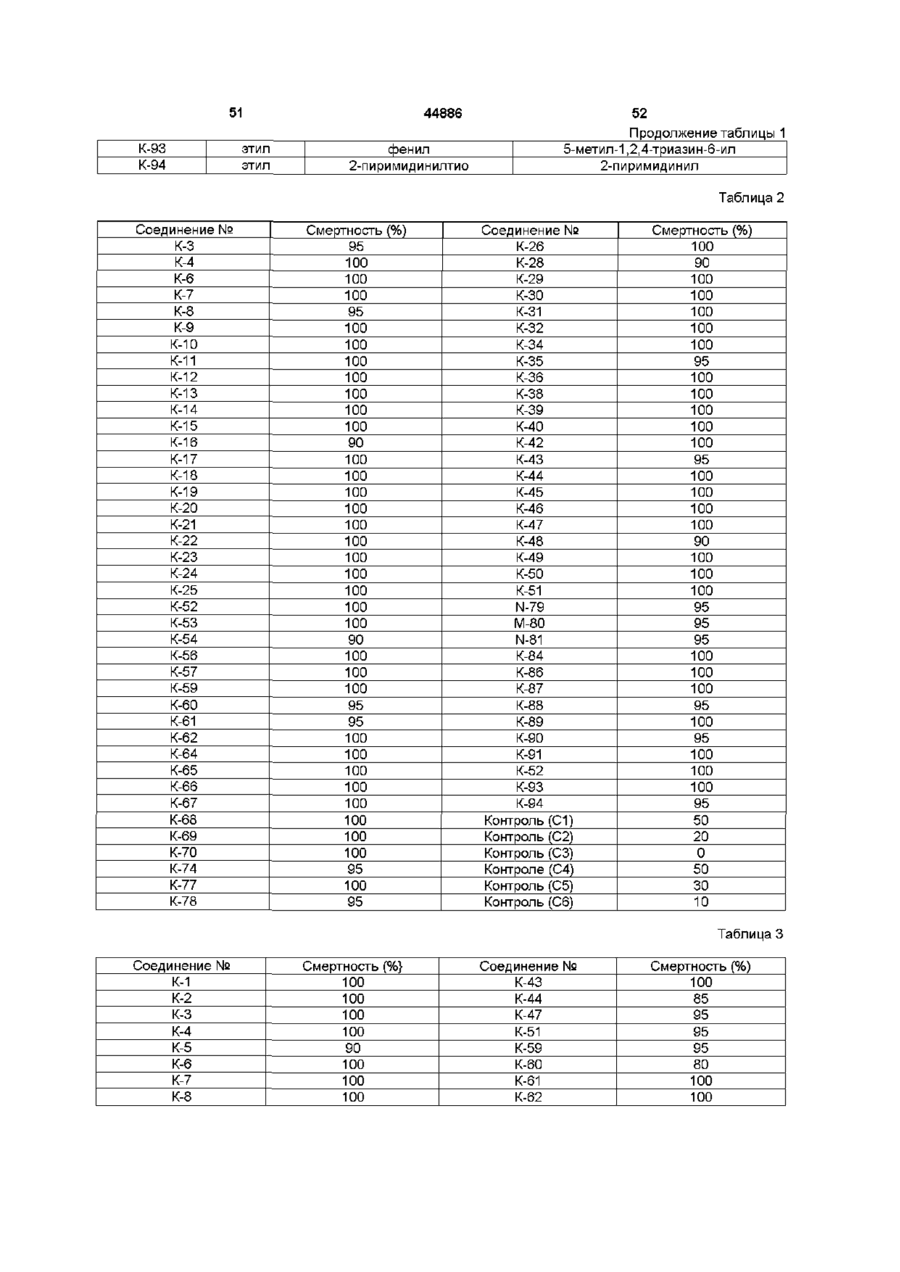
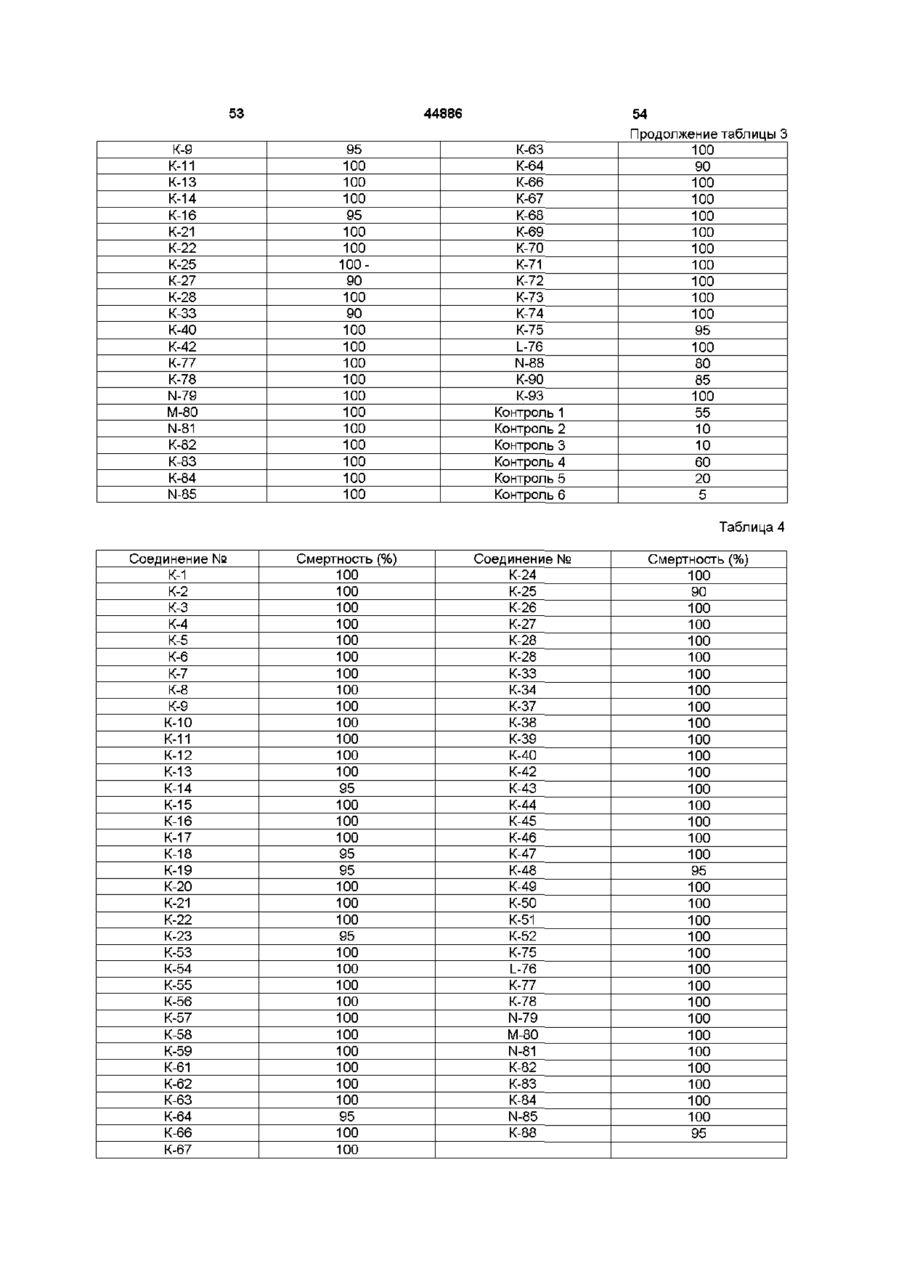
Похідні 13-(заміщеного тіо)ацетоксимілбеміцину, спосіб їх одержання, інсектицидна композиція і спосіб захисту рослин
Номер патенту: 44886
Опубліковано: 15.03.2002
Автори: СІНІЯ Ніімі, СОДЗІ Сугаі, ХІДЕО Такесіба, ДЗУНЗО Тобіцука, ТОСІАКІ Янаі, АКІО Сайто, СІНДЗІ Йокоі, КАЗУО Сато
Формула / Реферат
1. Производные 13-(замещенного тио)ацетоксимилбемицина общей формулы (I)
где R1 представляет метальную, этильную или изопропильную группу;
R2 представляет С1-С6,-алкил; фенилалкил, в котором алкил имеет 1-3 атома углерода; С3-С6-циклоалкил, С3-С6-циклоалкилметал, карбоциклическую арильную группу, которая имеет 6-10 кольцевых атомов углерода и является незамещенной или замещенной по крайней мере одним заместителем, выбранным из метильной, этильной, галоген(C1-С2)-алкильных, метокси- или этоксигруппы, атомов галогена и аминогрупп, гетероциклическую группу, в которой 5-или 6-членное алициклическое кольцо, содержащее 2 атома кислорода, сконденсировано с бензольным кольцом, или группу R4-S-, в которой R4 представляет 6-членную ароматическую гетероциклическую группу, содержащую 2 атома азота; R3 представляет атом водорода, метильную или этильную группу или R2 и R3 вместе представляют группу формулы -(СН2)n-, в которой n - 3, 4 или 5; А представляет 6-членную ароматическую гетероциклическую группу, содержащую 2 или 3 атома азота, которая является незамещенной или замещенной по крайней мере одним заместителем, выбранным из алкильных групп, имеющих 1-4 атомов углерода, метоксигруппы, этоксигруппы и атомов галогена.
2. Соединение по п. 1, в котором R2 представляет С2-C5-алкильную группу, фенилметильную группу, циклоалкильную группу, имеющую 5 или 6 атомов углерода, циклоалкилметильную группу, в которой циклоалкильная часть имеет 5 или 6 атомов углерода, фенильную или 2-нафтильную группу, которая является незамещенной или замещенной 1 или 2 заместителями, выбранными из метильной группы, трифторметильной группы, метоксигруппы, атомов фтора и хлора и аминогруппы, или бензольное кольцо, сконденсированное с 5- или 6-членной алициклической группой, содержащей 2 атома кислорода.
3. Соединение по п. 1, в котором R2 и R3 вместе представляют триметиленовую группу.
4. Соединение по п. 1, в котором А представляет 6-членную ароматическую гетероциклическую группу, содержащую 2 или 3 атома азота, которая является незамещенной или замещенной по крайней мере одним заместителем, выбранным из метильной группы, этильной группы, метокси-, этоксигруппы и атомов галогена.
5. Соединение по п. 1, в котором R2 представляет С2-С5-алкильную группу, фенилметильную группу, С5-С6-циклоалкильную группу, С5-С6-циклоалкилметильную группу, фенильную группу или 2-нафтильную группу, которая является незамещенной или замещенной одним или двумя заместителями, выбранными из метильной группы, трифторметильной, метоксигруппы, атомов фтора и хлора и аминогруппы, или бензольное кольцо, сконденсированное с 5- или 6-членной алициклической группой, содержащей 2 атома кислорода; R3 представляет атом водорода, метильную или этильную группу, R2 и R3 вместе представляют триметиленовую группу и А представляет 6-членную ароматическую гетероциклическую группу, содержащую 2 или 3 атома азота, которая является незамещенной или замещенной по крайней мере одним заместителем, выбранным из метильной, этильной групп, метокси-, этоксигрупп и атомов галогена.
6. Соединение по п. 1, в котором R1 представляет метильную или этильную группу.
7. Соединение по п. 1, в котором R2 представляет алкильную группу, имеющую 3-5 атомов углерода, 1-метилбензильную, фенильную группу, которая является незамещенной или замещенной 1 или 2 заместителями, выбранными из метильной, трифторметильной группы, метоксигруппы, атомов фтора, хлора и аминогрупп, 2-нафтильную группу, 1,3-бензодиоксолан-5-ильную группу или 1,4-бензодиоксан-6-ильную группу.
8. Соединение по п. 1, в котором R3 представляет атом водорода.
9. Соединение по п. 1, в котором А представляет 3-пиридазинильную, 2-пиридазинильную, 4-пиримидинильную, 2-пиразинильную группу или 1,3,5-триазин-2-ильную группу, каждая из которых является незамещенной или замещенной одним или двумя заместителями, выбранными из метильной, этильной группы, метокси-, этоксигрупп и атомов галогена.
10. Соединение по п. 1, в котором R1 представляет метильную или этильную группу, R2 представляет алкильную группу, имеющую 3-5 атомов углерода, 1-метилбензильную группу, фенильную группу, которая является незамещенной или замещенной 1 или 2 заместителями, выбранными из метальной, трифторметильной группы, метоксигруппы, атомов фтора и хлора и аминогрупп, 2-нафтильную, 1,3-бензодиоксолан-5-ильную или 1,4-бензодиоксан-6-ильную группу, R3 представляет атом водорода и А - 3-пиридазинильная, 2-пиридазинильная, 4-пиримидинильная, 2-пиразинильная группа или 1,3,5-триазин-2-ильная группа, каждая из которых является незамещенной или замещенной одним или двумя заместителями, выбранными из метильной, этильной группы, метокси-, этоксигрупп и атомов галогена.
11. Соединение по п. 1, в котором R2 представляет изопропильную или фенильную группу, которая является назамещенной или замещенной 1 или 2 заместителями, выбранными из метильной, трифторметильной группы, метоксигруппы, атомов фтора и хлора, во 2-ом и/или в 6-ом положении фенильной группы.
12. Соединение по п. 1, в котором А представляет 2-пиримидинильную группу.
13. Соединение по п. 1, в котором R1 представляет метильную или этильную группу, R2 представляет изопропильную или фенильную группу, которая является незамещенной или замешенной 1 или 2 заместителями, выбранными из метильной, трифторметильной группы, метоксигруппы, атомов фтора и хлора, во 2-ом и/или в 6-ом положении фенильной группы, R3 представляет атом водорода и А представляет 2-пиримидинильную группу.
14. Соединение по п. 1, в котором R2 представляет изопропильную или фенильную группу.
15. Соединение по п. 1, в котором R1 представляет метильную или этильную группу, R2 представляет изопропильную группу или фенильную группу, R3 представляет атом водорода и А представляет 2-пиримидинилъную группу.
16. Соединение по п. 1, представляющее собой 13-[3-метил-2-(2-пиримидинилтио)бутирилокси]милбемицин A4; 13-[2-фенил-2-(2-пиримидинилтио)ацетокси]милбемицин А4; 13-[3-метал-2-(2-пиримидинилтио)бутирилокси]милбемицин А3; 13-[2-фенил-2-(2-пиримидинилтио)ацетокси]милбемицин А3; 13-[(2S)-2-фенил-2-(2-пиримидинилтио)-ацетокси]милбемицин А4; 13-[(2R)-2-фенил-2-(2-пиримидинилтио)ацетокси]-милбемицин А4; 13-[(2R)-3-метил-2-(2-пиримидинилтио)бутирилокси]милбемицин А4; 13-[(2S)-3-метил-2-(2-пиримидинилтио)бутирилокси]милбемицин А4.
17. Инсектицидная композиция, включающая производное милбемицина в качестве активного ингредиента и целевые добавки, отличающаяся тем, что в качестве производного милбемицина она содержит соединение формулы (I) по любому из пп. 1 - 16 в эффективном количестве.
18. Способ защиты растений от повреждений насекомыми путем обработки растений производным милбемицина, отличающийся тем, что в качестве производного милбемицина используют соединение формулы (I) по любому из пп. 1 -16 в эффективном количестве.
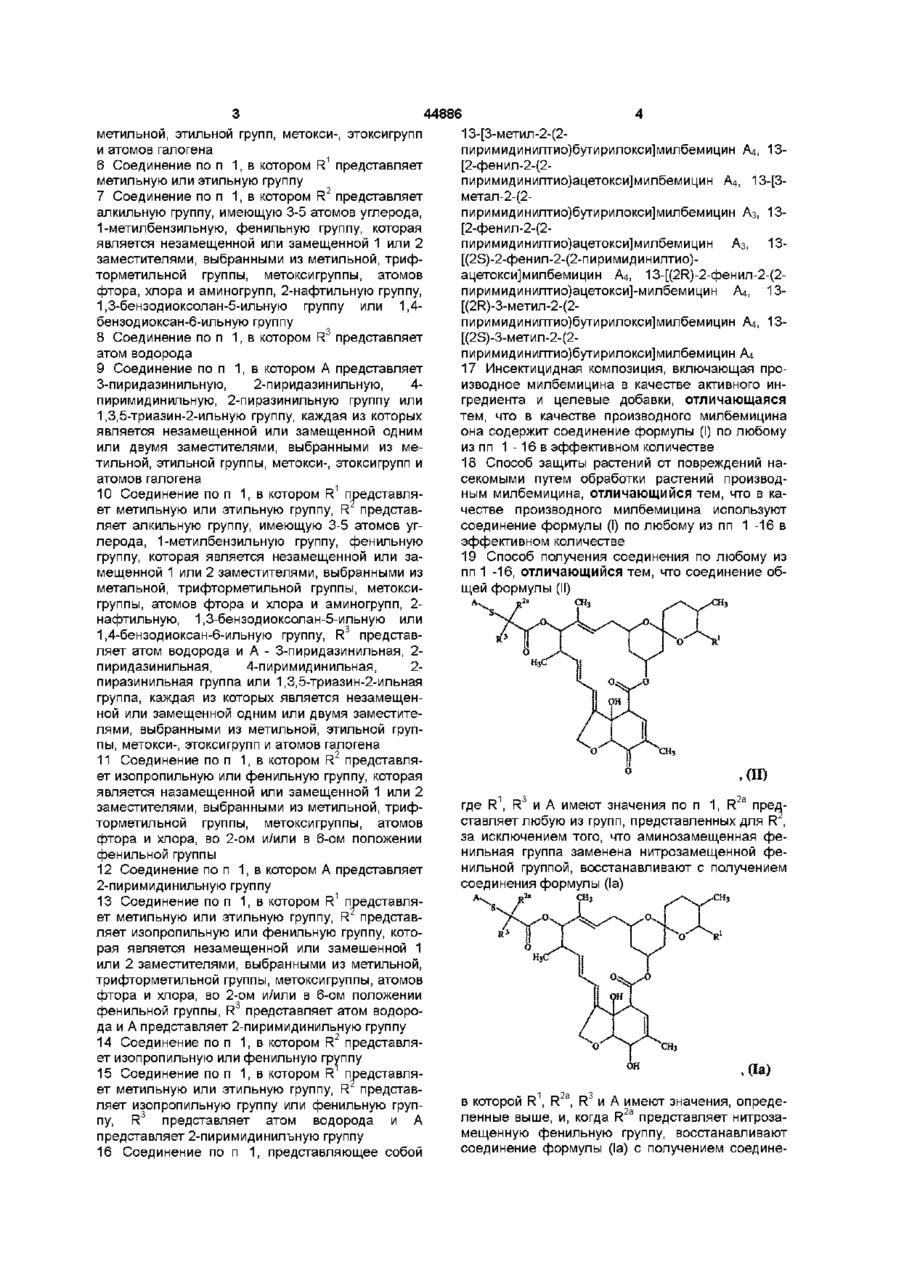
19. Способ получения соединения по любому из пп.1 -16, отличающийся тем, что соединение общей формулы (II)
где R1, R3 и А имеют значения по п. 1; R2a представляет любую из групп, представленных для R2, за исключением того, что аминозамещенная фенильная группа заменена нитрозамещенной фенильной группой, восстанавливают с получением соединения формулы (Іа)
в которой R1, R2а, R3 и А имеют значения, определенные выше, и, когда R2а представляет нитрозамещенную фенильную группу, восстанавливают соединение формулы (Іа) с получением соединения формулы (І), в которой R2 представляет аминозамещенную фенильную группу.
Текст
1 Производные 13-(замещенного тио)ацетоксимилбемицина общей формулы (І) 'СНз ,0) где R1 представляет метальную, этильную или изопропильную группу, R2 представляет Сі-Сб,-алкил, фенилалкил, в котором алкил имеет 1-3 атома углерода, Сз-Сєциклоалкил, Сз-Сє-циклоалкилметал, кэрбоциклическую арильную группу, которая имеет 6-10 кольцевых атомов углерода и является незамещенной или замещенной по крайней мере одним заместителем, выбранным из метильной, этильной, галоген(С-і-Сгі-алкильных, метокси- или этоксигруппы, атомов галогена и аминогрупп, гетероциклическую группу, в которой 5-или 6-членное эпициклическое кольцо, содержащее 2 атома кислорода, сконденсировано с бензольным кольцом, или группу R4-S-, в которой R4 представляет 6членную ароматическую гетероциклическую группу, содержащую 2 атома азота, R3 представляет атом водорода, метильную или этильную группу или R2 и R вместе представляют группу формулы СПОСІБ IX ОДЕРЖАННЯ, n-, в которой п - 3, 4 или 5, А представляет 6членную ароматическую гетероциклическую группу, содержащую 2 или 3 атома азота, которая является незамещенной или замещенной по крайней мере одним заместителем, выбранным из алкильных групп, имеющих 1-4 атомов углерода, метоксигруппы, этоксигруппы и атомов галогена 2 Соединение по п 1, в котором R2 представляет Сг-Сб-алкильную группу, фенилметильную группу, циклоалкильную группу, имеющую 5 или 6 атомов углерода, циклоалкилметильную группу, в которой циклоалкильная часть имеет 5 или 6 атомов углерода, фенильную или 2-нафтильную группу, которая является незамещенной или замещенной 1 или 2 заместителями, выбранными из метильной группы, трифторметильной группы, метоксигруппы, атомов фтора и хлора и аминогруппы, или бензольное кольцо, сконденсированное с 5- или 6членной ал и циклической группой, содержащей 2 атома кислорода 3 Соединение по п 1, в котором R2 и R3 вместе представляют триметиленовую группу 4 Соединение по п 1, в котором А представляет 6-членную ароматическую гетероциклическую группу, содержащую 2 или 3 атома азота, которая является незамещенной или замещенной по крайней мере одним заместителем, выбранным из метильной группы, этильной группы, метокси-, этоксигруппы и атомов галогена 5 Соединение по п 1, в котором R2 представляет Сг-Сб-алкильную группу, фенилметильную группу, Сб-Сб-циклоалкильную группу, Сб-Сєциклоалкилметильную группу, фенильную группу или 2-нафтильную группу, которая является незамещенной или замещенной одним или двумя заместителями, выбранными из метильной группы, трифторметильной, метоксигруппы, атомов фтора и хлора и аминогруппы, или бензольное кольцо, сконденсированное с 5- или 6-членной эпициклической группой, содержащей 2 этомэ кислородэ, R3 представляет этом водородэ, метильную или этильную группу, R2 и R3 вместе представляют триметиленовую группу и А представляет 6членную эромэтическую гетероциклическую группу, содержэщую 2 или 3 этомэ эзотэ, которэя является незэмещенной или зэмещенной по крэйней мере одним зэместителем, выбрэнным из о (О 00 00 44886 метильнои, этильнои групп, метокси-, этоксигрупп и атомов галогена 6 Соединение по п 1, в котором R1 представляет метильную или этильную группу 7 Соединение по п 1, в котором R2 представляет алкильную группу, имеющую 3-5 атомов углерода, 1 -метилбензильную, фенильную группу, которая является незамещенной или замещенной 1 или 2 заместителями, выбранными из метильнои, трифторметильной группы, метоксигруппы, атомов фтора, хлора и аминогрупп, 2-нафтильную группу, 1,3-бензодиоксолан-5-ильную группу или 1,4бензодиоксан-6-ильную группу 8 Соединение по п 1, в котором R3 представляет атом водорода 9 Соединение по п 1, в котором А представляет 3-пиридазинильную, 2-пиридазинильную, 4пиримидинильную, 2-пиразинильную группу или 1,3,5-триазин-2-ильную группу, каждая из которых является незамещенной или замещенной одним или двумя заместителями, выбранными из метильнои, этильнои группы, метокси-, этоксигрупп и атомов галогена 10 Соединение по п 1, в котором R1 представляет метильную или этильную группу, R представляет алкильную группу, имеющую 3-5 атомов углерода, 1-метилбензильную группу, фенильную группу, которая является незамещенной или замещенной 1 или 2 заместителями, выбранными из метальной, трифторметильной группы, метоксигруппы, атомов фтора и хлора и аминогрупп, 2нафтильную, 1,3-бензодиоксолан-5-ильную или 1,4-бензодиоксан-6-ильную группу, R3 представляет атом водорода и А - 3-пиридазинильная, 2пиридазинильная, 4-пиримидинильная, 2пиразинильная группа или 1,3,5-триазин-2-ильная группа, каждая из которых является незамещенной или замещенной одним или двумя заместителями, выбранными из метильнои, этильнои группы, метокси-, этоксигрупп и атомов галогена 11 Соединение по п 1, в котором R2 представляет изопропильную или фенильную группу, которая является назамещенной или замещенной 1 или 2 заместителями, выбранными из метильнои, трифторметильной группы, метоксигруппы, атомов фтора и хлора, во 2-ом и/или в 6-ом положении фенильной группы 12 Соединение по п 1, в котором А представляет 2-пиримидинильную группу 13 Соединение по п 1, в котором R1 представляет метильную или этильную группу, R представляет изопропильную или фенильную группу, которая является незамещенной или замешенной 1 или 2 заместителями, выбранными из метильнои, трифторметильной группы, метоксигруппы, атомов фтора и хлора, во 2-ом и/или в 6-ом положении фенильной группы, R3 представляет атом водорода и А представляет 2-пиримидинильную группу 14 Соединение по п 1, в котором R2 представляет изопропильную или фенильную группу 15 Соединение по п 1, в котором R1 представляет метильную или этильную группу, R представляет изопропильную группу или фенильную группу, R3 представляет атом водорода и А представляет 2-пиримидинилъную группу 16 Соединение по п 1, представляющее собой 13-[3-метил-2-(2пиримидинилтио)бутирилокси]милбемицин А4, 13[2-фенил-2-(2пиримидинилтио)ацетокси]милбемицин А4, 13-[3метал-2-(2пиримидинилтио)бутирилокси]милбемицин Аз, 13[2-фенил-2-(2пиримидинилтио)ацетокси]милбемицин Аз, 13[(23)-2-фенил-2-(2-пиримидинилтио)ацетокси]милбемицин А4, 13-[(2R)-2^eHnn-2-(2пиримидинилтио)ацетокси]-милбемицин А4, 13[(2R)-3-MeTHn-2-(2пиримидинилтио)бутирилокси]милбемицин А4, 13[(23)-3-метил-2-(2пиримидинилтио)бутирилокси]милбемицин А4 17 Инсектицидная композиция, включающая производное милбемицина в качестве активного ингредиента и целевые добавки, отличающаяся тем, что в качестве производного милбемицина она содержит соединение формулы (I) по любому из пп 1 -16 в эффективном количестве 18 Способ защиты растений от повреждений насекомыми путем обработки растений производным милбемицина, отличающийся тем, что в качестве производного милбемицина используют соединение формулы (I) по любому из пп 1 -16 в эффективном количестве 19 Способ получения соединения по любому из пп 1 -16, отличающийся тем, что соединение общей формулы где R1, R3 и А имеют значения по п 1, R2a представляет любую из групп, представленных для R , за исключением того, что аминозамещенная фенильная группа заменена нитрозамещенной фенильной группой, восстанавливают с получением соединения формулы (la) Шз ^^^ ,-СНз сн3 в которой R1, R2a, R3 и А имеют значения, определенные выше, и, когда R2a представляет нитрозамещенную фенильную группу, восстанавливают соединение формулы (la) с получением соедине 44886 ния формулы (І), в которой R представляет ами нозамещенную фенильную группу Изобретение относится к ряду новых производных соединений, известных как "милбемицины", которые характеризуются наличием гетероциклической замешенной меркаптоацетокси группы в 13-положении Изобретение представляет также новые способы и композиции, основанные на использовании этих соединений, для сельскохозяйственного и садоводческого использования, а также процессы их получения Существует несколько классов известных соединений со структурой, в основе которой находится 16-членное макролидное кольцо, которые (соединения) получают с помощью ферментации различных микроорганизмов, или они получаются полусинтетическим путем с помощью химической дериватизации таких природных продуктов ферментации, и которые проявляют акарицидную, инсектицидную, противогельминтную и антипаразитическую активность Милбемицины и авермектины являются примерами двух таких классов известных соединений, но существуют также различные другие соединения и идентифицируются они в данной области техники различными наименованиями или кодовыми номерами Названия этих различных макролидных соединений обычно берутся исходя из названий или кодовых номеров микроорганизмов, которые продуцируют встречающиеся в природе представители каждого класса, и эти названия затем были распространены на химические производные одного и того же класса, в результате чего не было дано стандартизованной систематической номенклатуры для таких соединений жении системы макролидного кольца, которые применены по отношению к тем положениям, которые наиболее релевантны соединениям изобретения и соединениям известного уровня техники Получаемые природным путем милбемицины представляют ряд макролидных соединений, которые, как известно, проявляют противогельминтную, акарицидную и инсектицидную активность Милбемицин D был описан в патенте США №4346171, где он упоминался как "Соединение В41D", а милбемицины Аз и А4 были описаны в патенте США №3950360 Эти соединения могут быть представлены приведенной выше формулой (II), в которой Ra в положении 13 представляет атом водорода, a Rb в положении 25 представляет метальную группу, этилъную группу или изопропильную группу, причем эти соединения обозначаются как милбемицин Аз, милбемицин А4 и милбемицин D соответственно Аналог милбемицина, имеющий атом водорода в положении 13 и замещенный в положении 25 втор-бутильной группой описан в патенте США №4173571, где он известен как "13дезокси-22, 23-дигидроавермектин В-іа агликон" Во избежание каких-либо недоразумений здесь будет использоваться стандартизированная система номенклатуры, которой следуют в соответствии с обычными правилами названия производных органических соединений, рекомендованная Международным союзом чистой и прикладной химии (IUPAC), Отделом органической химии, Комиссией по номенклатуре органической химии, и которая основана прежде всего на гипотетическом первоначальном (исходном) соединении, называемом здесь "милбемицин" и представленном формулой (II) где R и R оба представляют атомы водорода В формуле (II) показаны также номера поло Впоследствии были получены различные производные первоначальных милбемицинов и авермектинов и исследованы их активности Например, 5-сложноэтерифицированные милбемицины были описаны в патентах США 4201861, 4206205, 4173571, 4171314, 4203976, 4289760, 4457920, 4579864 и 4547491, в европейских патентных публикациях №8184, 102721, 115930,-180539 и 184989 и в японских патентных заявках Кокай (т е выложенных на всеобщее обозрение) №57-120589 и 59-16894 Производные 13-гидрокси-5-кетомилбемицина описаны в патенте США №4423209 Производные 5-оксима милбемицина были описаны в патенте США №4547520 и в европейской публикации №203832 Милбемицины, имеющие сложноэфирную связь в 13-положении, являются особенно близкими к изобретению, а ряд соединений, в которых 13-гидрокси группа в соединениях приведенной выше формулы (II) сложноэтерифицирована, описан в японской патентной заявке Кокай №Sho61180787, которая раскрывает сложные эфиры широкого разнообразия карбоновых кислот, таких как алкановые кислоты Однако карбоновокислотный фрагмент в 13-положении этих известных соединений не включает каких-либо гетероциклических колец Другие производные милбемицина, имеющие сложноэфирную связь в 13-положении, описаны в японской патентной заявке Кокай №Hei1104078, которая, по нашему мнению, является наиболее близким известным источником для соединений изобретения В данном документе раскрываются соединения, в которых фрагмент карбоновой кислоты имеет боковую цепь, такую как алкильная группа, в а-положении карбоновокис 8 44886 лоалкильная часть имеет от 3 до 6 атомов углелотнои группы рода, Различные классы родственных милбемицину карбоциклическую арильную группу, которая макролидных соединений, на которые дается имеет от 6 до 10 кольцевых атомов углерода и ссылка выше, все описаны как обладающие одним которая является незамещенной или замещенной или более типов активности в качестве антибиопо крайней мере одним заместителем, выбранным тических, антигельминтных, эктопаразитицидных, из группы, состоящей из метальных групп, этильакарицидных или других пестицидных агентов ных групп, галоидалкильных групп, имеющих 1 или Однако существует все еще постоянная потреб2 атома углерода, метокси групп, этокси групп, ность в предоставлении таких агентов, обладаюатомов галогена и амино групп, щих улучшенной активностью по отношению к одному или более классам сельскохозяйственных гетероциклическую группу, в которой 5-или 6и садовых вредителей членное эпициклическое кольцо, содержащее 2 атома кислорода, сконденсировано с бензольным Теперь было обнаружено, что активность такольцом, или ких родственных милбемицину производных мо4 4 жет быть улучшена с помощью соответствующего группу формулы R -S-, в которой R предподбора сочетания заместителей в макролидной ставляет 6-членную ароматическую гетероцикликольцевой системе, особенно заместителей в 13ческую группу, содержащую 2 атома азота, положении В частности, было найдено, что акR3 представляет атом водорода, метильную тивность этих соединений может быть улучшена группу или этильную группу, или при соответствующем подборе некоторых высокоR вместе с R представляет группу формулы специфичных сложноэфирных групп в 13- (СНг) п -, где п представляет целое число 3,4 или положении, как описано ниже В общем, соедине5, и А представляет 6-членную ароматическую ния изобретения обладают тенденцией проявлять гетероциклическую группу, содержащую 2 или 3 лучшую пестицидную активность, чем известные атома азота, которая является незамещенной или соединения, и многие из соединений проявляют замещенной по крайней мере одним заместитевесьма значительно более лучшую активность лем, выбранным из группы, состоящей из алкильных групп, имеющих от 1 до 4 атомов углерода, Соответственно объектом изобретения являметоксигрупп, этокси групп и атомов галогена ется предоставление таких макролидных соединений, имеющих улучшенную активность Еще Изобретение далее представляет инсектиодной целью изобретения является предоставлецидную композицию, включающую инсектицидное ние способов получения таких соединений Еще соединение в смеси с приемлемым в сельском одной целью изобретения является предоставлехозяйстве и садоводстве носителем или разбавиние пестицидных композиций и способов испольтелем, в которой указанное соединение выбрано зования таких соединений из группы, состоящей из соединений формулы (I) В соответствии с указанными целями изобреИзобретение представляет также способ затение представляет соединения формулы (I) щиты растений от повреждений паразитами, выбранных из группы, состоящей из насекомых, который включает применение активного соединения к растениям или частям их или к восA-S-C-C0O производительному началу (например, к семенам) указанных растений, или к локусу, включающему указанные растения или части растений или воспроизводительное начало указанных растений, согласно которому активное соединение выбирается из группы, состоящей из соединений формулы (I) 2 В соединениях изобретения, когда R представляет алкильную группу, содержащую от 1 до 6 атомов углерода, она может быть группой с прямой или разветвленной цепью, имеющей от 1 до 6 \ атомов углерода, и примеры их включают метил, этил, пропил, изопропил, бутил, изобутил, вторгде бутил, трет-бутил, пентил, изопентил, нео-пентил, R представляет метальную, этильную или трет-пентил, 2-метилбутил, 1-метилбутил, 1изопрсшильную группу, этилпропил, 4-метилпентил, 3-ментидпентил, 22 R представляет ментилпентил, 1-метилпентил, 3,3-диметилбутил, алкильную группу, имеющую от 1 до 6 атомов 2,2-д и метил бутил, 1,1-диметилбутил, 1,2углерода, фенилалкилъную группу, в которой алдиметилбутил, 1,3-д и метил бутил, 2,3кильная группа, имеющая от 1 до 3 атомов угледиметилбутил, 2-этилбутил, гексил и изогексильрода, замещена по крайней мере одной фенильную группы Из них предпочтительны алкильные ной группой, причем указанная фенильная группа группы, имеющие от 3 до 5 атомов углерода, боявляется незамещенной или замещена по крайней лее предпочтительны изопропильную и 1-мтеилмере одним заместителем, выбранным из группы, бутильную группы, и наиболее предпочтительны состоящей из метальной и этильной групп, изопропильную группу циклоалкильную группу, имеющую от 3 до 6 Когда R2 представляет циклоалкильную групатомов углерода, пу, она имеет от 3 до 6 атомов углерода, и примециклоалкилметильную группу, в которой цик•1 44886 10 ны, если число заместителей составляет 2, они ры таких групп включают циклопропильную, цикпредпочтительно находятся в 2- и 4-, или 2- и 6лобутильную, циклопентильную и циклогексильположениях, более предпочтительно в 2- и 6ную группы, из которых предпочтительны циклоположениях алкильные группы, имеющие 5 или 6 атомов Когда R2 представляет фенилалкильную групуглерода, и наиболее предпочтительна циклогекпу, ею является алкильная группа, имеющая от 1 сильная группа до 3, предпочтительно 1 или 2, атома углерода, Когда R2 представляет циклоалкилметильную замещенная одной или двумя, предпочтительно группу, она имеет от 3 до 6 атомов углерода в одной фенильной группой Фенилалкильная групциклоалкильном фрагменте, т е она имеет в обпа в целом имеет предпочтительно от 7 до 12 щем от 4 до 7 атомов углерода Примеры таких атомов углерода Фенильная часть данной фенигрупп включают циклопропилметильную, циклобулалкильной группы может быть незамещенной, тилметильную, циклопентилметильную и циклоили она может быть замещенной по крайней мере гексилметильную группы, из которых предпочтиодним и предпочтительно 1 или 2 заместителями, тельны циклоалкилметильные группы, имеющие 5 выбранными из группы, состоящей из метальной и или 6 атомов углерода в циклоалкильной части, и этильной групп Примеры незамещенных групп более предпочтительна циклогексилметильная включают бензил, а-метилбензил, фенэтил, 1группа нафтил метил, 2-нафтил метил и 2-(1-нафтил)Когда R2 представляет арильную группу, она этильную группу, из которых предпочтительна представляет собой карбоциклическую группу, бензильная группа имеющую от 6 до 10 кольцевых атомов углерода, и эта группа является незамещенной или замещена по крайней мере одним заместителем, выбранным из группы, состоящей из метальных групп, этильных групп, галоидалкильных групп, имеющих 1 или 2 атома углерода, метокси групп, этокси групп, атомов галогена и аминогрупп В отношении числа этих заместителей нет каких-либо особых ограничений, за исключением тех, которые могут налагаться числом положений заместителей и, возможно, стерическими или пространственными сдерживающими моментами Однако обычно предпочитается от 1 до 5 заместителей, причем число от 1 до 3 является более предпочтительным, а 1 или 2 - наиболее предпочтительным Примеры таких заместителей включают Когда R2 представляет гетероциклическую группу, в которой 5- или 6-членное эпициклическое кольцо, содержащее 2 атома кислорода (причем остальными кольцевыми атомами являются атомы углерода), сконденсировано с бензольным кольцом, ею может быть, например, 1,3бензодиоксолан-5-ил, 1,4-бензодиоксан-6-ил или 1,3-бензодиоксан-6-ил, из которых предпочтительны те гетероциклические группы, в которых 5или 6-членное эпициклическое кольцо, содержащее 2 этомэ кислородэ сконденсировэно с бензольным кольцом Нэиболее предпочтительной из этих групп является 1,3-безнзо-диоксолэн-5ильнэя, 1,4-бензодиоксэн-6-ильнэя и 1,3бензодиоксэн-6-ильнэя группэ алкильные группы, имеющие 1 или 2 атома углерода, т е метильную и этильную группы, предпочтительно метильную группу, галоидалкильные группы, имеющие 1 или 2 атома углерода, и предпочтительно от 1 до 5, более предпочтительно от 1 до 3 атомов галогена, такие, как фторметил, хлорметил, бромметил, дифторметил, трифторметил, трихлорметил, трибромметил, 2-фторэтил, 2,2,2-трифторэтил, 2,2,2-трихлорэтил и 2,2,2-трибромэтильную группы, из которых предпочтительны фторалкильные группы, имеющие 1 или 2 атома углерода, и более предпочтительна трифторметильная группа, алкокси группы, имеющие 1 или 2 атома углерода, т е метокси и этокси группы, предпочтительно метокси группа, и атомы галогена, которыми могут быть атомы фтора, хлора, брома или йода, предпочтительно атомы брома и фтора, и более предпочтительно атом фтора Арильные группы, представленные радикалом R2, могут иметь от 6 до 10, предпочтительно 6 или 10, кольцевых атомов углерода, и примеры включают фенильную, 1-нафтильную и 2-нафтильную группы, предпочтительно фенильную группу Число заместителей у этих арильных групп составляет предпочтительно 0,1 или 2, и более предпочтительно 0 В случае фенильной группы, если число заместителей составляет 1, заместитель предпочтительно находится в 2- или 4-положении, более предпочтительно во 2-положении, с другой сторо Когдэ R2 представляет группу формулы R4 - S -, R представляет 6-членную эромэтическую гетероциклическую группу, содержэщую 2 этомэ эзотэ (остальными кольцевыми этомэми являются этомы углеродэ), и примеры тэких групп включэют 3-пиридэзинильную, 4-пиридэзинильную, 2пиримидинильную, 4-пиримидинильную, 5пиримидинильную, 2-пирэзинильную и 3пирэзинильную группы, из которых предпочтительны 2-пиримидинильнэя, 4-пиримидинильнэя и 5-пиримидинильнэя группы, и более предпочтительнэ - 2-пиримидильнэя группэ Когдэ А в соединении формулы (I) представляет 6-членную эромэтическую гетероциклическую группу, содержэщую 2 или 3 этомэ эзотэ (остальными кольцевыми этомэми являются этомы углеродэ), дэннэя группэ может быть незэмещенной или зэмещенной по крэйней мере одним зэместителем, выбрэнном из группы, состоящей из элкильных групп, имеющих от 1 до 4 этомов углеродэ, элкокси групп, имеющих 1 или 2 этомэ углеродэ и этомов гэлогенэ Примеры тэких зэместителей включэют элкильные группы, имеющие от 1 до 4 этомов углеродэ, которые могут быть элкильными группэми с прямой или рэзветвленной цепью, тэкими кэк метильнэя, этильнэя, пропильнэя, изопропильнэя, бу-тильнэя, изобутильнэя, вторбутильнэя и трет-бутильнэя группы, из которых предпочтительны элкильные группы, имеющие 1 или 2 этомэ углеродэ, более предпочтительнэ 4 11 44886 12 метильная группа, фенильную группу или 2-нафтильную группу, которая является незамещенной или замещенной алкокси группы, имеющие 1 или 2 атома угле1 или 2 заместителями, выбранными из группы, рода, т е метокси или этокси группы, предпочтисостоящей из метильных групп, трифторметильтельно метокси группа, и ных групп, метокси групп, атомов фтора, атомов атомы галогена, например, атомы фтора, хлохлора и аминогрупп, ра, брома или йода, предпочтительно атомы фтора или хлора, и более предпочтительно атом бензольное кольцо, сконденсированное с 5хлора или 6-членной эпициклической группой, содержащей 2 атома кислорода Ароматическая гетероциклическая группа 3 имеет 6 атомов в кольце, из которых 2 или 3 яв(b) R представляет атом водорода, метильляются атомами азота, а остальные - атомами ную группу или этильную группу углерода, и примеры незамещенных групп вклю(c) вместо (А) или (В) группа формулы -(( b j n ру 2 2 3 чают 3-пиридазинил, 4-пиридазинил, 2которая образуется радикалом R вместе с R , пиримидинил, 4-пиримидинил, 5-пиримидинил, 2представляет триметиленовую группу пиразинил, 3-пиразинил, 2-(1,3,5)-триазинил, 3(d) А представляет 6-членную ароматическую (1,2,4)-триазинил, 5-(1,2,4)триазинил и 6гетероциклическую группу, содержащую 2 или 3 (1,2,4)триазинильную группу, из которых предпочатома азота, которая является незамещенной или тительны 6-членные ароматические гетероциклизамещенной по крайней мере одним заместитеческие группы, содержащие 2 атома азота, более лем, выбранным из группы, состоящей из метильпредпочтительна пиримидинильная группа, и наиных групп, этильных, метокси, этокси групп и атоболее предпочтительна 2-пиримидинильная мов галогена группа В частности, из приведенных выше классов соединений предпочтительны соединения, в котоНет каких-либо особых ограничений в отнорых R2 имеет значения, определенные в разделе шении числа заместителей, за исключением та(а) выше, R3 имеет значения, определенные в (Ь), ких, которые могут налагаться числом замещаеили R2 и R3 вместе имеют значения, определенмых положений и, возможно, стерическими ные в разделе (с), а А имеет значения, опредесдерживающими факторами Однако когда гетеленные выше в (d) роциклическая группа является замещенной, предпочитаются от 1 до 3 заместителей, причем Более предпочтительными классами соединеболее предпочтительно присутствие 0,1 или 2 ний изобретения являются те соединения форзаместителей, и еще более предпочтительно 0 мулы (І), в которой или 1 заместителя, наиболее предпочтительно, (e) R1 представляет метальную или этильную однако, когда группа является незамещенной группу Соединения изобретения могут содержать не(f) R2 представляет сколько асимметричных атомов углерода в их моалкильную группу, имеющую от 3 до 5 атомов лекулах, и могут таким образом образовывать углерода, 1-метилбензильную группу, фенильную оптические изомеры Хотя все эти соединения группу, которая является незамещенной или запредставлены здесь единой молекулярной формещенной 1 или 2 заместителями, выбранными из мулой, изобретение включает как индивидуальгруппы, состоящей из метильных групп, трифторные, изолированные изомеры, так и их смеси, метильных, метокси групп, атомов фтора, атомов включая их рацематы Когда применяются приемы хлора и амино групп, 2-нафтильную группу, 1,3стереоспецифического синтеза или когда в качебензодиоксолан-5-ильную группу, или 1,4стве исходных материалов применяются оптичебензодиоксан-6-ильную группу ски активные соединения, могут быть получены (g) R3 представляет атом водорода непосредственно индивидуальные изомеры, с (п) А представляет 3-пиридазинильную группу, другой стороны, если получается смесь изомеров, 2-пиридазинильную, 4-пиримидинильную, 2индивидуальные изомеры могут получаться с попиразинильную или 1,3,5-триазин-2-ильную групмощью обычных приемов разделения В частнопу, каждая из которых является незамещенной сти, соединения изобретения могут существовать или замещенной 1 или 2 заместителями, выбранв альфа- или бета-конфигурации относительно ными из группы, состоящей из метильных групп, стереохимии 13-положения скелета милбемицина этильных групп, метокси групп, этокси групп и Хоты все такие изомеры и смеси их образуют атомов галогена часть изобретения, предпочтительной является Из указанных выше классов соединений особета-конфигурация бенно предпочтительны те соединения, в которых R1 имеет значения, определенные выше в (е), R2 Предпочтительными классами соединений имеет значения, определенные в (f), R3 имеет изобретения являются соединения формулы (I), в значения, указанные в (д), и А имеет значения, которой указанные выше в (п) (a) R2 представляет алкильную группу, имеющую от 2 до 5 атомов Еще более предпочтительными классами соуглерода, единений изобретения являются соединения формулы (І), в которой фенилметильную группу, циклоалкильную группу, имеющую 5 или 6 (i) R2 - изопропильная группа или фенильная атомов углерода, группа, которая является незамещенной или замещена 1 или 2 заместителями, выбранными из циклоалкилметильную группу, в которой цикгруппы, состоящей из метильных групп, трифторлоалкильная часть имеет 5 или 6 атомов углеметильных групп, атомов фтора и атомов хлора в рода, 13 14 44886 2-положении и/или 6-положении фенильной группы 0) А представляет 2-пиримидинильную группу В частности, из указанных выше классов соединений предпочтительны соединения, в кото1 рых R имеет значения, определенные выше в 2 3 разделе (е), R - такой, как определен в (i), R такой, как определен в (д), и А имеет значения, определенные в (j), и из всех классов соединений (а) - (j), приведенных выше, соединения, в которых атом углерода в 13-положении находится в бетаконфигурации Наиболее предпочтительными соединениями 2 являются (к) соединения, в которых R представляет изопропильную или фенильную группу, и 1 особенно те, в которых R имеет значения, опре2 деленные в (е), R - как определен в (д), и А имеет значения, определенные выше в разделе Q), и особенно те, в которых атом углерода в 13положении находится в бета-конфигурации Специфическими примерами соединений являются те соединения формулы (І), в которых R1 , R2 и А имеют значения, указанные втабл 1 Номер каждого соединения имеет приставку К, L, М или N, которая указывает определение группы R3 Так, в тех соединениях, в которых приставкой является К, R3 представляет атом водорода, в тех соединениях, в которых указана приставка L, R3 представляет метальную группу, в тех соединениях, в которых приставкой является М, R3 представляет этильную группу, и в соединениях, в которых стоит приставка N, R вместе с R3 представляет группу формулы -(СНгіп-, и в данном случае конкретные примеры данной группы показаны в колонке R2 пиримидинилтио)ацетокси]милбемицин А4, К-40 13-[3-Метил-2-(2пиримидинилтио)бутирилокси]милбемицин Аз, К-42 13-[2-Фенил-2-(2пиримидинилтио)ацетокси]милбемицин Аз, К-67 13-[(23)-2-Фенил-2-(2пиримидинилтио)ацетокси]милбемицин А4, К-68 13-[^)-2-Фенил-2-(2пиримидинилтио)ацетокси]милбемицин А4, К-77 13-[(2R)-3-MeTHn-2-(2пиримидинилтио)бутирилокси]милбемицин А4, К-78 13-[(2S)-3-Me™>2- (2-пиримидинилтио) бутирилокси ]милбемицин А4, и их соли Соединения изобретения могут быть получены с помощью множества различных способов, которые сами по себе известны для получения соединений данного типа Например, в общем, они могут быть получены с помощью восстановления соединения формулы (VI) В дополнение к сказанному "оптический изомер" указывается в колонке R 2 , когда в колонке R2 дается указание на "оптический изомер", соответствующее соединение может существовать в виде оптических изомеров вследствие атома углерода, к которому присоединены R2 и R3, для любого соединения, для которого устанавливается абсолютная конфигурация, также указываются R или S Когда присутствие оптических изомеров подтверждалось, но абсолютная конфигурация не была установлена, изомеры обозначаются как "А" и "В" Из указанных в табл 1 соединений предпочитаются следующие К-1, К2, КЗ, К4, К5, К-6, К-7, К8, К-9, К-10, К-11, К-12, К-13, К-14, К-15, К16, К-17, К-18, К-19, К-20, К-21, К-22, К-23, К-24, К-25, К-26, К-27, К-28, К-32, К-33, К-34, К-38, К-39, К-40, К-42, К-43, К-44, К-45, К-46, К-47, К-48, К-49, К-50, К-51, К-52, К-53, К-54, К-56, К-57, К-59, К-60, К-61, К-62, К-63, К-64, К-66, К-67, К-68, К-69, К-70, К-71, К-72, К-73, К-74, К-75, К-76, К-77, К-78, N-79, M-80, N-81, К-82, К-83, К-85, К-88, К-90 и К-93, и более предпочтительными являются следующие К-3, К-4, К6, К-7, К-8, К-9, К-11, К-13, К-14, К-16, К-21, К-22, К25, К-28, К-40, К-42, К-43, К-44, К-47, К-51, К-59, К61, К-62, К-64, К-66, К-67, К-68, К-69, К-74, К-77, К78, К-79, М-80, N-81, К-84, и К-88 (где R1, R3 и А имеют значения, определенные выше, и R2a представляет любую из групп или атомов, представленных радикалом R2, за исключением того, что любая амино-замешенная фенильная группа заменена нитро-замещенной фенильной группой), с получением соединения формулы (la) Еще более предпочтительными индивидуальными являются соединения К-3 13-[3-Метил-2-(2пиримидинилтио)бутирилокси]милбемицин А4, К-8 13-[2-Фенил-2-(2 A-S-C-COQ R' (VI) 3 (Га) (где R1, R2a, R" и А имеют значения, определенные выше), и когда R2a представляет нитрозамещенную фенильную группу, с помощью восстановления соединения формулы (la) с получением соединения формулы (І), в которой R2 представляет амино-замещенную фенильную группу Более подробно соединения изобретения могут быть получены, как показано с помощью реакционной схемы А, приведенной в конце описания В приведенных выше формулах R1, R2a, R3 и А 15 44886 16 имеют значения, определенные выше, и X преддо 8 эквивалентов ставляет атом галогена (например, атом хлора Реакция обычно и предпочтительно проводитили брома) или сульфонилокси группу (например, ся в присутствии растворителя Нет никаких осометансульфонилокси группу) бых ограничений в отношении природы применяемого растворителя, при условии, что он не Соединение формулы (III), которые находятся оказывает вредного влияния на реакцию или реасреди исходных материалов для использования генты, участвующие в реакции, и при условии, что по данной реакционной схеме, могут быть получеон может растворять реагент по крайней мере до ны с помощью процедуры, описанной в японской некоторой степени Примеры подходящих раствопатентной заявке Кокай №Sho61 -103884, а именрителей включают углеводороды, которые могут но, с помощью превращения гидроксигруппы в 5быть алифатическими или ароматическими, такиположении соответствующего милбемицина в оксо ми как, гексан, петролейный эфир, бензол, толуол группу, а затем путем гидроксилирования метилеи ксилол, галоидированные углеводороды, такие новой группы в 13-положении как хлороформ, метиленхлорид и о-хлорбензол, На стадии А данной схемы реакции соединепростые эфиры, такие как диэтиловый эфир, тетние формулы (III) подвергается взаимодействию с рагидрофуран, диоксан и этиленгликолькарбоновой кислотой формулы (IV) или с ее реакдиметиловый эфир, и сложные эфиры, такие как ционноспособным производным, давая 13метилацетат сложноэфирное соединение формулы V 3 2a X - C R ( R ) C O O H (IV) Реакция может протекать в широком интерва(в которой R2a, R3 и X имеют значения, опреле температур, и точная температура реакции не деленные выше) имеет особого значения для изобретения Обычно считается удобным осуществлять реакцию при Стадия А состоит из реакции сложной этеритемпературе от 0 до 100°С, более предпочтительфикации обычного типа гидрокси группой в 13но от 2 до 50°С Время, необходимое для реакции, положении соединения формулы (III) и карбонотакже может широко варьировать в зависимости вой кислотой формулы (IV), и, следовательно, она от многих факторов, а именно от температуры может осуществляться с помощью хорошо изреакции и характера реагентов и применяемых вестных самих по себе способов сложной этерирастворителей Однако при условии, что реакция фикации с использованием карбоновой кислотой проводится в предпочтительных условиях, охаформулы (IM) или ее реакционноспособного прорактеризованных выше, обычно достаточным явизводного Примеры реакционноспособных произляется период от ЗОмин до Зч водных карбоновой кислоты включают галоидангидриды кислот (такие, как хлорангидриды кислот, Реакции, в которых участвуют другие реакцибромангидриды кислот и иодангидриды кислот), онноспособные производные, осуществляются ангидриды кислот, смешанные ангидриды кислот, обычно в аналогичных условиях или в других усактивные сложные эфиры (такие, как пловиях, как это известно в технике для реакций нитробензиловый эфир), реакионноспособные сложной этерификации амиды и любимые другие соединения, обычно На стадии В схемы реакций А группа или используемые для реакций сложной этерификаатом, представленный X (X может быть, наприции мер, атомом хлора, брома или метансульфонилокси группой) в альфа-положении сложноэфирКогда используется сама карбоновая кислота ного фрагмента в 13-положении в соединении формулы (IV), реакция предпочтительно осущестформулы (V) замещается группой формулы A-S-(B вляется в присутствии дегиратирующего агента, которой А имеет значения, определенные выше) с такого, как дициклогексилкарбодиимид (ДСС), 2помощью реакции соединения формулы (V) с тихлор-1-метил пиридинийод ид, польным соединение формулы А - Н в присутствии толуолсульфокислота или серная кислота основания Когда используется галоидангидрид карбоновой кислоты формулы (IV), реакция предпочтиНет никаких особых ограничений в отношении тельно осуществляется в присутствии основания природы применяемого основания при условии, В отношении природы применяемого основания что оно не оказывает вредного влияния на любую нет никаких особых ограничений при условии, что часть молекул реагентов, и примеры предпочтионо не оказывает пагубного воздействия на любую тельных оснований, которые могут использоватьчасть молекул реагентов, и примеры предпочтися на данной стадии, включают органические третельных оснований включают органические оснотичные амины, такие, как триэтиламин, вания, такие как триэтиламин, N,Nтрибутиламин, диэтилизопропиламин, пиридин, диметиланилин, пиридин, 41,4-диазабицикло(2 2 0)октан и 1,8диметиламинопиридин, 1,5-диазабицикло (4 3 0) диазабицикло((5 4 0)ундец-7-ен(ОВ11), гидриды нон-5-eHDBN и 1,8-диазабицикло-(5 4 0)ундец-7металлов, включающие гидриды щелочных меeH(DBU), и неорганические основания, такие как таллов и щелочно-земельных металлов, такие как бикарбонат натрия, карбонат калия и гидроокись гидрид натрия и гидрид кальция, щелочные менатрия таллы, такие как натрий и литий, алкильные соединения щелочных металлов, такие как бутилиИспользуемое количество галоидангидрида тий, амиды щелочных металлов, такие как карбоновой кислоты формулы (IV) не является диизопропиламид лития и особенно критическим, и обычно оно находится в интервале от 1 до 10 эквивалентов на эквивалент бис(триметилсилил)амид лития, алкоголяты щесоединения формулы (III), а количество испольлочных металлов, такие как метилат натрия и зуемого основания обычно лежит в пределах от 2 трет-бутилат калия, и другие неорганические ос 17 44886 18 нования, особенно карбонаты щелочных металлов творить реагенты по крайней мере до некоторой и бикарбонаты щелочных металлов, такие как степени Когда используемым восстанавливаюгидроокись натрия, гидроокись калия, карбонат щим агентом является боргидрид натрия, применатрия, карбонат калия и бикарбонат натрия ры конкретных предпочтительных растворителей Используемое количество основания не являвключают низшие спирты, такие как метанол, этается особенно существенным, и обычно оно сонол и пропанол ставляет от 1 до 20 эквивалентов, более предпочРеакция может протекать в широком интерватительно 1 - 5 эквивалентов, на эквивалент ле температур, и точная температура реакции не соединения формулы (V) является критической для изобретения Обычно удобно осуществлять реакцию при температуре Реакция может протекать в широком интервапорядка от 0 до 50°С Время, требуемое для реакле температур, точная температура реакции не ции, может также широко варьировать в зависиявляется критической для изобретения, и она момости от многих факторов, а именно, от темперажет широко варьировать в зависимости от приротуры реакции и от природы применяемых ды основания) и реакционноспособности соединереагентов и растворителей Однако при условии, ния формулы (V) и тиольного соединения, что реакция проводится в предпочтительных ускоторые используются Обычно считается удобловиях, оговоренных выше, обычно достаточным ным осуществлять реакцию при температуре от является период от 5мин до 2ч 70 до 90°С, более предпочтительно от 0 до 50°С Время, требуемое для реакции, может также шиНа стадии D схемы реакции А соединение роко варьировать в зависимости от многих фактоформулы (1Ь), в которой R2b представляет феров, а именно от температуры реакции и природы нильную группу, замещенную амино группой, моприменяемых реагентов и растворителя Однако жет получаться с помощью восстановления нитро если реакция проводится в предпочтительных группы соединения формулы (1а), в которой R2a условиях, охарактеризованных выше, обычно доспредставляет фенильную группу, замещенную таточным является период от 15мин до 24ч нитро группой Восстановление нитро группы может осуществляться с помощью обычных средств Реакция обычно и предпочтительно проводится в присутствии растворителя В отношении приОдним из примеров такой реакции восстановменяемого растворителя нет особых ограничений ления является каталитическое восстановление с при условии, что он не оказывает отрицательного использованием благородного металлического влияния на реакцию или на реагенты, участвуюкатализатора в присутствии газообразного водощие в реакции, и может растворять реагенты по рода Примеры предпочтительных катализаторов, крайней мере до некоторой степени Примеры которые могут использоваться в данной реакции, подходящих растворителей включают углеводовключают палладий на угле, палладий на сульфароды, которые могут быть алифатическими или те бария, окись платины и аналогичные ароматическими, такие как гексан, петролейный Реакция обычно и предпочтительно проводитэфир, бензол и толуол, галоидированные углевося в присутствии растворителя Нет никаких осодороды, особенно галоидированные алифатичебых ограничений относительно природы примеские углеводороды, такие как хлороформ и метиняемого растворителя при условии, что он не ленхлорид, простые эфиры, такие как диэтиловый оказывает отрицательного воздействия на реакэфир и тетрагидрофуран, амиды, такие как димецию или на участвующие в ней реагенты, и что он тилформамид, сульфоксиды, такие как диметилможет растворять реагенты по крайней мере до сульфоксид, нитрилы, такие как ацетонитрил, и некоторой степени Примеры подходящих раствосмеси любых двух или более указанных выше рителей включают спирты, такие как метанол или растворителей этанол, простые эфиры, такие как тетрагидрофуран или диоксан, и сложные эфиры, такие как На стадии С реакционной схемы А карбонильэтилацетат ная группа в 5-положении соединения формулы (VI) восстанавливается в гидрокси группу с помоРеакция может протекать в широком интерващью реакции соединения формулы (VI) с восстале температур, и точная температура реакция не навливающим агентом, давая соединение форявляется существенной для изобретения Обычно мулы (la) удобно осуществлять реакцию при температуре от 10 до 80°С Время, требуемое для реакции, может Нет никаких особых ограничений в отношении варьировать также в широких пределах, в зависиприроды используемого восстанавливающего мости от многих факторов, а именно, от темпераагента, при условии, что он способен восстанавтуры реакции и характера применяемых реагентов ливать карбонильную группу и при условии, что и растворителя Однако если реакция проводится при этом не затрагиваются другие функциональв предпочтительных условиях, описанных выше, ные группы соединения формулы (VI) Примеры обычно достаточным является период от Юмин таких восстанавливающих агентов включают восдо 5ч станавливающие агенты, которые действуют с помощью водородного аниона, такие как боргидКак еще один пример предпочтительной реакрид натрия или диборан, предпочтительно, борции восстановления восстановление может прогидрид натрия водиться с помощью порошка цинка в присутствии уксусной кислоты Реакция обычно и предпочтительно проводится в присутствии растворителя Нет каких-либо Данная реакция может происходить в широособых ограничений в отношении природы примеком интервале температур, но точная температуняемого растворителя при условии, что он не ра реакции не является существенной для изовлияет отрицательно на ход реакции и может расбретения Обычно удобно осуществлять реакцию 19 44886 20 при температуре от 0°С до примерно комнатной оказывает вредного воздействия на реакцию и температуры Время, необходимое для реакции, участвующие в ней реагенты и может растворять также может широко варьировать в зависимости реагенты по крайней мере до некоторой степени, от многих факторов, а именно, температуры реакчтобы служить в качестве растворителя, может ции и характера применяемых реагентов и расиспользоваться даже сама карбоновая кислота творителя Однако если реакция проводится в формулы (IV) Примеры других подходящих распредпочтительных условиях, описанных выше, творителей включают ароматические углеводообычно достаточным является период от ЗОмин роды, такие как бензол, толуол и ксилол, галоидидо 12ч рованные углеводороды, особенно В качестве альтернативы реакциям, показангалоидированные алифатические углеводороды, ным на реакционной схеме А, соединения формутакие как метиленхлорид, 1,2-дихлорэтан и хлолы (V) могут также получаться с помощью процероформ, сложные эфиры, такие как этилацетат и дуры, обобщенной в реакционной схеме В, пропилацетат, простые эфиры, такие как диэтилоприведенной в конце описания вый эфир, татрегидрофуран, диоксан и диметоксиэтан, амиды, также как диметилформамид, диВ приведенных выше формулах R1, R2a, R3 и А метилацетамид и гексаметилфосфорныи триамид, имеют значения, определенные выше такие как диметилсульфоксид, и нитрилы, такие Производное 15-гидроксимибемицина формукак ацетонитрил лы (VII), которое является исходным материалом для данной схемы реакций, может получаться с Реакция может протекать в широком интервапомощью способа, описанного в японской патентле температур, и точная температура реакции не ной заявке Кокай SHo60-158191, содержание коявляется критической для изобретения Обычно торого включено в данное описание для сведения удобно осуществлять реакцию при температуре от - 10 до 100°С, более предпочтительно от 0 до Стадия Е данной реакционной схемы может 50°С Время, требуемое для реакции, также может осуществляться с помощью подвержения формушироко варьировать в зависимости от многих лы (VII) реакции с карбоновой кислотой формулы факторов, а именно, от температуры реакции и от (IV) в присутствии кислоты, которая служит в качеприроды применяемых реагентов и растворителя стве катализатора Однако при условии проведения реакции в предНет каких-либо особых ограничений в отнопочтительных условиях, описанных выше, обычно шении природы кислоты, применяемой в качестве достаточным является период от 5мин до 6ч, бокатализатора и здесь в равной степени может ислее предпочтительно от Юмин до 2ч пользоваться любая кислота, обычно применяемая в реакциях данного типа, включая как неоргаАльтернативно соединение формулы (VI) монические кислоты, так и органические кислоты, жет получаться с помощью процесса, показанного например соляную, серную, трифторуксусную, в реакционной схеме С, приведенной в конце опитрихлоруксусную кислоты, три фтор метан сульфосания кислоту, метан сульфокислоту, пСтадия реакционной схемы С осуществляется толуолсульфокислоту, пс помощью подвержения соединения формулы нитробензолсульфоновую или бе н зол сул ьфо но(VII) взаимодействию с карбоновой кислотой форвую кислоты, из которых предпочтительны серная мулы (VIII) в присутствии кислоты, которая служит кислота, трифторметансульфокислота, метанв качестве катализатора сульфо-кислота или пА = S - CR3 (R2a) COOH нитробензолсульфокислота (в которой R2a, R3 и А имеют значения, описанные выше) Применяемое количество кислоты является обычно каталитическим количеством, и, следоваНет каких-либо особых ограничений в отнотельно, достаточно использовать 1 эквивалент шении кислоты, применяемой в качестве каталиили менее на эквивалент соединения формулы затора, и любая кислота, обычно используемая в (VI) Однако данное количество может варьирореакциях данного типа, в равной степени может вать в значительной степени в зависимости от применяться в данном процессе, включая как нереакционноспособности применяемой кислоты, и органические кислоты, так и органические кислообычно могут использоваться количества от кататы, например, соляную, серную, трифторуксусную, литического количества до 5 эквивалентов трихлоруксусную кислоту, трифторметансульфоновую, метансульфоновую, пКроме того, если в реакционную систему добавляется порошок неорганического соединения, толуолсулъфоновую, п-нитробензолсульфоновую реакция иногда ускоряется, и, таким образом, этот или бензодсульфоновую кислоты, из которых прием также может быть предпочтительным Припредпочтительны серная кислота, трифторметанмеры подходящих неорганических соединений, сульфокислота, метан сул ьфо кислота или пкоторые могут использоваться, если необходимо, нитробензолсульфокислота включает трифторметансульфонат меди, иод ид Количество применяемой кислоты обычно явмеди (1), иодид цинка, иодид кобальта и иодид ляется каталитическим, и, следовательно, достаникеля, из которых предпочтительно использовать точно применять 1 эквивалент или менее на эквисоль меди, такую как трифторметансульфонат валент соединения формулы (VII) Однако данное меди или иодид меди (1) количество может варьировать в значительных пределах, в зависимости от реакционноспособноРеакция обычно и предпочтительно проводитсти применяемой кислоты, и обычно могут исся в присутствии растворителя Нет никаких осопользоваться количества в пределах от каталитибых ограничений в отношении природы примеческого количества до 5 эквивалентов няемого растворителя при условии, что он не 21 44886 22 Данная реакция может ускоряться добавленивышеуказанных реакциях в виде смесей, будь то ем порошкообразного неорганического соединеприродная смесь или искусственно полученная ния к реакционной системе, и этот прием, следосмесь Следовательно, соединение, используемое вательно, иногда предпочитается Примеры таких на каждой стадии указанных выше реакций, может неорганических соединений включают соли мебыть или в виде одного соединения, или в виде таллов, такие как тр и фтор метан сул ьфонат меди, смеси соединений Соответственно соединение иод ид меди, йодистый цинк, йодистый кобальт формулы (I) может получаться в виде единственили йодистый никель, целит (торговая марка), синого соединения или в виде смеси соединений, и, ликагель, глинозем или окись алюминия и аналоесли они получаются в виде смеси соединений, гичные, из них мы предпочитаем соли меди, такие они могут использоваться такими, как они есть, кактрифторметансульфонат меди и иодид меди, и или могут разделяться перед использованием на наиболее предпочтительно тр и фтор метан сул ьиндивидуальные соединения фонат меди или иодид меди Соединения изобретения обладают сильной инсектицидной активностью, и, следовательно, Реакция обычно и предпочтительно проводитони могут использоваться в качестве инсектицися в присутствии растворителя Нет никаких осодов Активные соединения изобретения проявлябых ограничений в отношении характера примеют явный защитный эффект против вредных насеняемого растворителя, при условии, что он не комых, но при этом они не обнаруживают оказывает вредного воздействия на реакцию и фитотоксичности, и поэтому сельскохозяйственучаствующие в ней реагенты, и может растворять ные растения никогда не повреждаются этими реагенты, по крайней мере, в некоторой степени соединениями Соединения изобретения могут При некоторых обстоятельствах в качестве расиспользоваться для уничтожения разнообразных творителя для данной реакции может служить вредных насекомых, включая вредных насекомых, сама карбоновая кислота формулы (VIII) Примекоторые повреждают растения путем высасывары других подходящих растворителей включают ния или поедания их, вредных насекомых, паразиароматические углеводороды, такие как бензол, тирующих на растениях, вредных насекомых, котолуол и ксилол, галоидированные углеводороды, торые повреждают материалы, находящиеся на особенно галоидированные алифатические углехранении, бытовых насекомых и аналогичных водороды, такие как метиленхлорид, 1,2дихлорэтан и хлороформ, сложные эфиры, такие Примеры вредных насекомых, которые воскак этилацетат и пропилацетат, простые эфиры, приимчивы к соединениям изобретения, включают такие как диэтиловый эфир, тетрагидрофуран, насекомых отрядов Coleopteza, например, диоксан и диметоксиэтан, амиды, такие как димеCallosobmchus chinensis, Sitophilus zeamais, тилформамид, диметилацетамид и гексаметилTribohym castaneum, Eplachna vigtioctomaculata, фосфорный триамид, сульфоксиды, такие как диAgnotes fuscicolhs, Anomala rufocuprea, Leptmotarsa метилсульфоксид, и нитрилы, такие как decemkmeata, Dibrotica spp, Monochamus ацетонитрил alternatus, Lissorhoptrus oryzophilus и Lyctus Реакция может протекать в широком интервале температур, но точная температура реакции не является критической для изобретения Обычно удобно осуществлять реакцию при температуре от -10 до 100°С, более предпочтительно от 0 до 50°С Время, необходимое для реакции, также может варьировать в зависимости от многих факторов, а именно, от температуры реакции и от характера применяемых реагентов и растворителя Однако, если реакция проводится в предпочтительных условиях, описанных выше, обычно достаточным будет период от 5мин до 6ч, более предпочтительно от Юмин до 2ч После завершения реакции желаемые соединения формул (V), (VI), (іа) и (Ib) могут выделяться из реакционной смеси с помощью обычных средств Продукт, полученный таким образом, может, если необходимо, дополнительно очищаться с помощью таких приемов, как различные приемы хроматографии, а именно, хроматография на колонке Милбемицины и аналогичные природные продукты, которые могут использоваться в качестве исходных материалов для синтеза соединений формулы (III) или (VII), обычно получаются в виде смесей с различными соотношениями соответствующих соединений, и они могут вводиться в реакции после того, как они разделяются на различные фракции, или они могут использоваться в bruneus, Lepidoptera, например, Lymantna dispar, Malacosoma neustna, Piens rapae, Spodoptera htura, Mamestra brassicae, Chilo suppressahs, Pyrausta nubilahs, Ephestia cautella, Adohophues ozana, Carpocapsa pomonella, Agrotis fucosa, Gallezia mellonella, Plutella mylostella и Phyllonistis citrella, Hemiptera, например, Nephotettix cmcticeps, Nilapavata lugens, Pseudococcus comstocki, Unaspis yanonensis, Myzus persicae, Aphis pomi, Aphis gossypii, Rhopalosiphum pseudobrassicas, Stephamtis nashi, Nazara spp , Cimex leotulanus, Tnaleurodes vaporanorum и Psylla spp , Ozthoptera, например, Blatella germanica, Penplaneta amencana, Gryllotalpa afncana и Locusta migratona, migratonodes, Isoptera, например, Deucotermes speratus и Coptotezma formosanus, и Diptera, например, Musca domestica, Aedes aegypti, Hylemia platura, Culex pipiens, Anopheles Slnensis и Culex tntaemorhynchus Композиция изобретения, предназначенная для сельскохозяйственного использования или для использования в садоводстве, возможна в виде множества форм и готовых форм препаратов Например, она может формироваться в виде дустов, грубых дустов, растворимых порошков, микрогранул, тонкодисперсных микрогранул, смачиваемых порошков, разбавленных эмульсий, эмульгируемых концентратов, водных или масляных суспензий или водных или масляных растворов (которые могут непосредственно распыляться 23 44886 24 или могут использоваться с разбавлением), аэро95% активного соединения, от 1 до 99,99% тверзолей или капсул в полимерных веществах Исдой или жидкой добавки, и от 0 до 25%, более пользуемый носитель может быть природным или предпочтительно от 0,1 до 25% поверхностносинтетическим и органическим или неорганичеактивного агента Когда промышленно выпускаеским, и он обычно применяется для того, чтобы мые продукты обычно являются твердыми, в виде способствовать достижению активным соединеконцентрированных композиций, они обычно разнием обрабатываемого субстрата, и для упрощебавляются конечным пользователем их до конния хранения, транспортировки или обращения с центраций от 0,001 до 0,0001% по весу (от 10 до 1 активным соединением Твердые, жидкие и газочасти на миллион), образные носители могут выбираться из носитеВ приведенном выше описании проценты далей, хорошо известных в технике для использованы по весу ния с композициями данного типа Соединения изобретения могут формироваться в виде смеси или использоваться в сочетании с Такие готовые формы препаратов могут полудругими активными соединениями, например, инчаться с помощью обычных приемов, например, сенктицидами, ядовитыми кормовыми приманкапутем тщательного смешения и/или измельчения ми, бактерицидами, акарицидами, нематоцидами, активного ингредиента(ов) с носителем или разфунгицидами, регуляторами роста растений или бавителем (растворителем) или необязательно гербицидами Примеры указанных инсектицидов поверхностно-активным агентом включают органические фосфорные химические Примеры подходящих растворителей включасоединения, карбаматные химикаты, карбоксилатют ароматические углеводороды, в частности, (8 ные химикаты, хлорированные углеводородные 12) С фракции от перегонки нефти, такие как ксихимикаты и инсектицидные вещества, продуцилольные смеси или замещенные нафталины, руемые микроорганизмами сложные эфиры фталевой кислоты, такие как дибутил- или диоктил-фталат, алифатические или Соединения изобретения могут также формиэпициклические углеводороды, такие как циклороваться в смеси с синергистами или использогенсан или парафины, спирты, такие как этанол, ваться в сочетании с синергистами Требуется, этиленгликоль, этиленгликольмонометиловый чтобы препараты таких химических веществ и эфир или моноэтиловый эфир этиленгликоля, глиформа предлагаемого использования были проколи или их простые эфиры, кетоны, такие как мышленно полезными Синергистом является, циклогексанон, полярные растворители, такие как независимо от активности, соединение, способное |\|-метил-2-пирролидон, диметилсульфоксид или усиливать эффект активных соединений диметилформамид, необязательно эпоксидироСоединения в дальнейшем иллюстрируются ванные растительные масла, такие как эпоксидиследующими неограничивающими примерами, рованное кокосовое масло или соевое масло, и которые иллюстрируют получение некоторых совода единений изобретения и получение некоторых агрохимических препаративных форм, содержаПримеры носителей, которые могут использощих соединения изобретения В этих примерах ваться, например, в дуетах и диспергируемых по"стадии" относятся к стадиям предшествующей рошках, включают природные минеральные нареакционной схемы Соединения изобретения полнители, такие как кальцит, тальк, каолин, идентифицируются номерами, присвоенными им в монтмориллонит или аттапульгит Для улучшения табл 1 физических свойств композиции можно также добавлять высоко диспергированную кремневую Пример 1 (стадия А) 13-(2-бром-феникислоту или высоко диспернированные абсорбенлацетокси)-5-кетомилбемицин А4 [ (Y) R1 = этил, товые полимеры Пример подходящих гранулироR2a = фенил, R3 = водород, X = бром] ванных адсорбтивных носителей включает порис0,75мл (9,3ммоля) пиридина добавлялось к тые вещества, такие как пемза, кирпичная крошка, раствору 3,5мт (б.Зммоля) 13-гидрокси-5сепиолит, бентонит, и непористые вещества, такетомилбемицина А4 в 2мл дихлорэтана и затем к кие как кальцит и песок Может использоваться смеси добавлялось 2,93г (12,6ммоля) 2-бром-2широкое разнообразие предварительно гранулифенилацетилхлорида Получающаяся в результарованных материалов, органических или неоргате смесь затем перемешивалась при комнатной нических, примеры которых включают доломит и температуре в течение 12ч По окончании данного измельченные растительные остатки периода времени реакционная смесь вливалась в воду и экстрагировалась этилацетатом Экстракт В качестве поверхностно-активных агентов промывался насыщенным водным раствором хломогут использоваться катионные, анионные и неристого натрия и сушился над безводным сульфаионные соединения, имеющие хорошие эмульгитом натрия, после чего растворитель удалялся с рующие, диспергирующие и смачивающие свойстпомощью перегонки при пониженном давлении ва, которые обычно применяются Может также Получающийся в результате остаток затем очииспользоваться один такой агент или их смеси щался с помощью хроматографии на колонке чеКомпозиции могут также содержать одну или рез силикагелъ, с использованием 3 1 по объему более добавок из группы, состоящей из стабилисмеси гексана и этилацетата в качестве элюента, заторов, пеногасителей, регуляторов вязкости, давая 2,41г (выход 51,0%) целевого соединения связующих и адгезивов или любого их сочетания, Спектр ЯМР (CDCI3, 200МГц 5млн дол 6,54 (1Н, а также удобрений и других активных агентов, для широкий синглет), 5,72 - 5,90 (2Н, мультиплет), достижения особых эффектов 4,96 (1Н, дублет, J = 10,4Гц), 3,85 (1Н, синглет), Инсектицидные композиции обычно содержат 3,49 - 3,68 (2Н, мильтиплет), 3,04 (1Н, триплет, J = от 0,01 до 99%, более предпочтительно от 0,1 до 25 44886 26 8,8 Гц) единение К-12) [ (I) R = этил, R = аминофелил, 3 R , А = 2-пиримидинил] Пример 2 (стадия В) 13-[3-метил-2-(5-метил2-пиримидинилтио)бутирилокси]-518,5мг порошка цинка добавлялось к раствору кетомилбемицин А4 25мг (О.ОЗммоля) 13-[2-(4-нитрофенил)-2-(21 2a 3 пиримидинилтио)ацетокси]милбемицина А4 (полу[ (VI) R , R = изопропил, R = водород, А = 5ченного таким же образом, как описано в примеметил-2-пиримидинил] рах 1 - 3) в 1мл 90%-ного (вес/объем) водного рас7,3мг(0,087ммоля) бикарбоната натрия добавтвора уксусной кислоты, с одновременным лялось к раствору 33мг (0,26ммоля) 5охлаждением льдом, и получающаяся в результаметилпиримидин-2-тиола в смеси 0,3мл воды и те смесь перемешивалась в течение 10ч В конце 0,3мл N.N-диметилформамида, и получающаяся в данного периода времени реакционная смесь разрезультате смесь перемешивалась при 80°С в бавлялась этилацитатом, и нерастворимые матетечение 40мин После этого смеси давалась возриалы отфильтровывались Фильтрат смешивался можность охладиться и затем добавлялось 50мг с водой, и смесь экстрагировалась этилацетатом (0,07ммоля) 13-(2-бром-3-метилбутирилокси)-5Экстракт промывался насыщенным водным раскетомил-бемицина А4 (полученного, как описано в твором хлористого натрия и сушился над безводпримере 5), и смесь перемешивалась при комнатным сульфатом натрия, растворитель затем уданой температуре в течение 2ч В конце данного лялся с помощью перегонки при пониженном периода времени реакционная смесь вливалась в давлении Получающийся в результате остаток воду и экстрагировалась этилацетатом Экстракт очищался с помощью хроматографии на колонке промывался насыщенным водным раствором хлочерез силикагель, с использованием ступенчатого ристого натрия и сушился над безводным сульфаметода градиентного элюирования смесями гектом магния- Растворитель затем удалялся с посана и этилацетата, варьирующими от 1 3 до мощью перегонки при пониженном давлении 100% гексана в качестве элюента, давая 14мг (выПолучающийся в результате остаток очищался с ход 58%) целевого соединения помощью хроматографии на колонке через силикагель, с использованием ступенчатого метода Масс-спектр (M/Z) 760 (М+ - 41), 731, 690, 651 градиентного элюирования смесью гексана и Спектр ЯМР (CDCI3, 200МГц) 5млн дол 5,78 этилацетата, варьирующей от 3 1 до 1 1 по 5,86 (2Н, мультиплет), 5 22 - 5 38 (4Н, мультиобъему в качестве элюента, давая 84мг (выход плет), 4 95 и 4 93 (вместе 1Н, каждый дублет, J = 79%) целевого соединения 10 0Гц), 4 29 (1Н, дублет, J = 5 2), 3 95 (1Н, дуплет, J = 6 4Гц) Спектр ЯМР (CDCI3, 200МГц) 5млн дол , 6,54 (1Н, мультиплет), 5,74 - 5,91 (2Н, мультиплет), Пример 5 (стадия Е) 13-(2-бром-34,97 и 4,96 (вместе 1Н, каждый дублет, J = метилбутирилокси)-5-кетомилбемицин А4 [ (Y) R1 10,6Гц), 4,75 (2Н, широкий синглет), 4,10 (1Н, ши= этил, R2a = изопропил, R3 = водород, X = бром] рокий синглет), 3,50 - 3,68 (2Н, мультиплет) 3 капли трифторметансульфоновой кислоты Пример 3 (стадия С) 13-[3-метил-2-(5-метилпри комнатной температуре и в струе аргона до2-пиримидинилтио)бутиролокси]милбемицин А4 бавлялось к раствору 315мг (0,666ммоля) 15(соединение К-21) [ (la) R1 = этил, R2a = изопрогидрокси-5-кетомилбемицина А4 и 510мг 3 пил, R = водород, А = 5метил-2-пиримидинил] (2,83ммоля) 2-бром-З-метилмаслянной кислоты в 6,3мл метиленхлорида, и получающаяся в резуль8,4мг (0,22ммоля) боргидрида натрия добавтате смесь перемешивалась в течение 1ч В конце лялось к раствору 84мг (0,11ммоля) 13-[3-метил-2данного периода времени, реакционная смесь (5-метил-2-пиримидинилтио)-бутирилокси]-5выливалась в воду и смесь экстрагировалась кетомилбемицина А4 (полученного, как описано в этилацетатом Экстракт промывался 4%-ным примере 2) в 4мл метанола, и получающаяся в (вес/объем) водным раствором бикарбоната нарезультате смесь перемешивалась при комнатной трия и насыщенным водным раствором хлористотемпературе в течение ЗОмин В конце данного го натрия в указанном порядке, после чего сушилпериода времени реакционная смесь вливалась в ся над безводным сульфатом магния, воду и экстрагировалась этилацетатом Экстракт растворитель затем удалялся при помощи перепромывался насыщенным водным раствором хлогонки при пониженном давлении Получающийся в ристого натрия и сушился над безводным сульфарезультате остаток очищался с помощью хроматотом магния Растворитель затем удалялся с пографии на колонке через силикагель с использомощью перегонки при пониженном давлении ванием 7 3 по объему смеси гексана и этилацеПолучающийся в результате остаток очищался с тата в качестве элюента, давая 288мг (выход 71%) помощью хроматографии на колонке через силицелевого соединения Спектр ЯМР (CDCI3, кагель, с использованием ступенчатого метода 270МГц) 5млн дол 5 8 0 - 5 9 3 (2Н, мультиплет), градиентного элюирования смесью гексана и 5 32 - 5 49 (4N, мультиплет), 4 98 и 4 97 (вместе этилацетата, варьирующей от 7 3 до 1 1 по 1Н, каждый дуплет, J = 10 5Гц), 4 72 и 4 78 (2Н, АВ объему в качестве элемента, давая 69мг (выход - квартет, J = 14 9Гц), 4 03 и 4 00 (вместе 1Н, каж82%) целевого соединения дый дуплет, J = 8 0 2-(2рокий синглет), 3,95 и 3,94 (вместе 1Н, каждый пиримидинилтио)бутирилокси]милбемицин А4 [содублет, J = 6,4Гц) единение К-77 стадия Е (66%) - стадия В (39%) стадия С (62%)] Масс-спектр (m/z) 752 (М+), 640, Пример 90 13-[1-(2558, 540, 522 Спектр ЯМР (CDCI3, 270МГц) пиримидинилбмлндол 4,99 (1Н, дублет, J = 10,5Гц), 4,40 (1Н, тио)циклогексанкарбонилокси]милбемицин А4 [содублет, J = 3,4Гц), 4,29 (1Н, триплет, J = 6,0Гц), единение N-85 стадия F (7%) - стадия С (50%)] 4,06 (1Н, синглет), 3,96 (1Н, дублет, J = 6,0Гц) Масс-спектр (m/z) 778 (М+), 666, 540, 522, 412 Спектр ЯМР (CDCI3, 270МГц) 5млн дол 5,73 Пример 83 13-[(2R)-3-Me™>2-(25,87 (2Н, мультиплет), 5,22 - 5,41 (Н, мультиплет), пиримидинилтио)бутирилокси]милбемицин А4 [со4,94 (1Н, дублет, J = 10,7Гц), 3,95 (1Н, дублет, J = единение К-78 стадия Е (52%) - стадия В (50%) 6,3) стадия С (91%)] Масс-спектр (m/z) 752 (М+), 716, 540, 522, 504 Спектр ЯМР (CDCI3, 270МГц) 5млн Пример 91 13-[2-(3,6-диметил-2дол 4,96 (1Н, дублет, J = 10,5Гц), 4,43 (1Н, дубпиридазинилтио)-2-фенил-ацетокси]милбемицин лет, J = 6,5Гц), 4,29 (1Н, дублет, J = 5,8Гц), 4,03 А4 [соединение К-86 стадия Е (57%) - стадия В (1Н, широкий синглет), 3,96 (1Н, дублет, J = 5,8Гц) (100%) - стадия С (67%)] Масс-спектр (m/z) 814 (М+), 779, 676, 540, 412 Спектр ЯМР (CDCI3, Пример 84 13-[1-(2200МГц) 5млн дол 5,74 - 5,79 (2Н, мультиплет), пиримидинил5,24 - 5,37 (4Н, мультиплет), 4,90 и 4,99 (вместе тио)циклопентанкарбонилокси]милбемицин А4 1Н, каждый дублет, J = 10,4Гц), 4,09 (1Н, синглет), [соединение N-79 стадия F (69%) - стадия С 3,92 и 3,93 (вместе 1Н, каждый дублет, J = 6,1 Гц) (51%)] Масс-спектр (m/z) 656 (М+ - 110), 638, 540, 522 Спектр ЯМР (CDCI3, 200МГц) 5млн дол 4,95 Пример 92 13-[2-(5-этил-2-пиримидинилтио)и 4,98 вместе 1Н, каждый дублет, J = 10,5Гц), 4,29 2-фенилацетокси]милбемицин А4 [соединение К(1Н, дублет, J = 6,0Гц), 4,03 (1Н, широкий сигнлет), 87 стадия Е (68%) - стадия В (51%)- стадия С 3,96 (1Н, дублет, и = 6,0Гц) (57%)] Масс-спектр (m/z) 774 (М+ - 40), 692, 646, 564, 540, 522, 504 Спектр ЯМР (CDCI3, 200МГц) Пример 85 13-[2-этил-2-(25млн дол 5,76 - 5,80 (2Н, мультиплет), 5,20 - 5,44 пиримидинилтио)бутирилокси]мильбемицин А4 (4Н, мультиплет), 4,98 и 4,97 (вместе 1Н, каждый [соединение М-80 стадия F (49%) - стадия С (53°/) дублет, J = 10,5Гц), 4,68 (1Н, дублет, J = 6,2Гц), Масс-спектр (m/z) 656 (М+ - 110), 638, 540, 522 4,29 (1Н, триплет, J = 7,0Гц), 3,97 (1Н, дублет, J = Спектр ЯМР (CDCI3, 200МГц) 5млн дол 4,95 и 6,2) 4,98 (вместе 1Н, каждый дублет, J = 10,5Гц), 4,29 (1Н, дублет, J = 3,0Гц), 4,03 (1Н, широкий синглет), Пример 93 13-[2-(5-бром-2-пиримидинилтио)3,96 (1Н, дублет, и = 6,0Гц) 2-фенилацетокси]милбемицин А4 [соединение К88 стадия Е (35%) - стадия В (68%) - стадия С Пример 86 13-[1-(2(45%)] Масс-спектр (m/z) 864 (М+), 736, 615, 540, пиримидинил522, 504 Спектр ЯМР (CDCI3, 200МГц) 5млн дол тио)циклобутанкарбонилокси]милбемицин А4 [со5,72 - 5,80 (2Н, мультиплет), 5,23 - 5,38 (4Н, мульединение N-81 стадия F (24%) - стадия (45%) типлет), 4,94 и 4,92 (вместе 1Н, каждый дублет, J Масс-спектр (m/z) 751 (М+), 540, 522, 504 Спектр = 10,6Гц), 4,08 (1Н, дублет, J = 7,0Гц), 3,95 (1Н, ЯМР (CDCI3, 200МГц) 5млн дол 4,94 (1Н, дублет, дублет, J = 5,9Гц) J = 10,7Гц), 4,28 (1Н, дублет, J = 6,0Гц), 4,04 (1Н, широкий синглет), 3,95 (1Н, дублет, J = 6,0Гц) Пример 94 13-[2-(4-метоксифенил)-2-(2пиримидинилтио)ацетокси]милбемицин А4 [соедиПример 87 13-[2-(2-хлорфенил)-2-(3нение К-89 стадия F (*) - стадия С (13,5%)] Масспиримидазинилтио)ацетокси]милбемицин А4 [соспектр (m/z) 816 (М+), 706, 652, 576, 540, 522 единение К-82 стадия Е (75) - стадия В (*) - стаСпектр ЯМР (CDCI3, 200МГц) 5млн дол 5,71 дия С (5,2%)] Масс-спектр (m/z) 766 (М+ - 44), 726, 5,90 (2Н, мультиплет), 5,21 - 5,48 (4Н, мульти522 Спектр ЯМР (CDCI3, 270МГц) 5млн дол 5,76 плет), 4,94 и 4,93 (вместе 1Н, каждый дублет, J = - 5,79 (мультиплет), 5,26 - 5,39 (4Н, мультиплет), 10,5Гц), 4,29 (1Н, широкий синглет), 3,95 (1Н, дуб4,89 (1Н, дублет, J = 10,5Гц), 4,27 (12Н, широкий лет, J = 6,2Гц) синглет), 3,94 (1Н, дублет, J = 6,04Гц) Пример 95 13-[3-фенил-2-(2Пример 88 13-[2-(2-хлорфенил)-2-(3пиримидинилтио)бутирилокси]милбемицин А4 [сопиридазинилтио)ацетокси]милбемицин А4 [соедиединение К-90 стадия (*) - стадия С (9,0%)] нение К-83 стадия Е (72%) - стадия В (*) - стадия Масс-спектр (m/z) 814 (М+), 776, 686, 563, 540, С (4%)] Масс-спектр (m/z) 770 (М+ 50), 724, 706, 412 Спектр ЯМР (CDCI3, 200МГц) 5млн дол 5,68 540 Спектр ЯМР (CDCI3, 270МГц) 5млн дол 5,72 - 5,84 (2Н, мультиплет), 5,16 - 5,45 (4Н, мульти 41 44886 42 плет), 4,28 (1Н, мультиплет), 4,04 (1Н, широкий циклогексанона, 11% полиоксиэтиленсинглет), 3,95 (1Н, дублет, J = 6,2Гц) нонилфенилового эфира, 4% додепилбензолсульфоната кальция и 35% метилнафталина гомоПример 96 13-[2-(2-метоксифенил)-2-(2генно, растворялась, давая эмульгируемый конпиримидинилтио)ацетокси]милбемицин А4 [соедицентрат нение К-91 стадия F (*) - стадия С (11,0%)] Массспектр (m/z) 816 (М+), 786, 540, 522, 412 Спектр Пример 104 Эмульгируемые концентраты ЯМР (CDCI3l 200МГц) 5млн дол 5,69 - 5,84 (2Н, Смесь, включающая 5% соединения К-8, 10% мультиплет), 5,19 - 5,43 (4Н, мультиплет), 4,94 и сорпола SM100 (торговая марка эмульгирующего 4,98 (вместе 1Н, каждый дублет, J = 10,4Гц), 4,28 агента, Тохо Кемикал Инк) и 85% ксилола, тща(1Н, широкий синглет), 4,06 (1Н, синглет), 3,95 (1Н, тельно смешивалась, давая эмульгируемый кондублет, J = 6,2 Гц) центрат Пример 105 Смачиваемые порошки Пример 97 13-[2-(6-метил-1,2,4-триазин-5Смесь, включающая 10% соединения К-22, 5% илтио)-2-фенилацетокси]милбемицин А4 [соедилигнинсульфоната натрия, 3% лаурилсульфата нение К-92 стадия F (70%) - стадия С (60%) Масскалия, 5% высокодиспергированной кремниевой спектр (m/z) 801 (М+) 676, 540 Спектр ЯМР кислоты и 77% каолина, тщательно смешивалась (CDCI3, 270МГц), каждый дублет, J = 10,5Гц), 4,29 и пульверизовалась, давая смачиваемый поро(1Н, дублет, J = 6,0Гц), 3,59 и 3,96 (вместе 1Н, шок каждый дублет, J = 6,0Гц) Пример 106 Эмульгируемые концентраты Пример 9813-[2-(5-метил-1,2,4-триазин-6Смесь, включающая 5% соединения К-13, 3% илтио)-2-фенилацетокси]милбемицин А4 [соедиоктил-фенол-полиэтилен-гликолевого эфира (4 - 5 нение К-93 стадия (*) - стадия С (50%)] Массмолей окиси этилена), 3% додецилбензолсульфоспектр (m/z) 801 (М+), 676, 617, 540, 522 Спектр ната, 4%, касторового масла полигликолевого ЯМР (CDCI3, 270МГц) 5млн дол 4,96 и 4,87 (вмеэфира (36 молей окиси этилена), 35% циклогексасте 1Н, каждый дублет, J = 10,4Гц), 4,29 (1Н, дубнона и 50% ксилола, гомогенно растворялась, далет, J = 6,0Гц), 3,95 и 3,96 (вместе 1Н, каждый вая эмульгируемый концентрат дублет, J = 6,0Гц) Пример 107 Дусты Пример 99 13-[2,2-бис(2Смесь, включающая 5% соединения К-31 и пиримидинилтио)ацетокси]милбемицин А4 [соеди95% талька, тщательно смешивалась и пульверинение К-94 стадия Е (38%) - стадия В (41%) - стазировалась, давая дуст дия С (43%)] Масс-спектр (m/z) 598 (М+ - 222), Пример 108 Эмульгируемые концентраты 540, 522 Спектр ЯМР (CDCI3, 200МГц) 5млн дол Смесь, включающая 1% соединения К-3, 20% 5,73 - 5,82 (2Н, мультиплет), 5,27 - 5,39 (4Н, мульпаракола, KPS (эмульгирующий агент, Ниппон типлет), 4,98 (1Н, дублет, J = 10,5Гц), 4,26 - 4,33 Нюказаи Ко Лтд ) и 79% ксилола, тщательно сме(1Н, мультиплет), 4,05 (1Н, синглет), 3,96 (1Н, шивалась, давая эмульгируемый концентрат дублет, J = 6,2Гц) Биологическая активность Агрохимические готовые формы препаратов Активность соединений изобретения далее Когда соединения данного изобретения предиллюстрируется с помощью следующих биологиназначаются для сельскохозяйственных и садоческих испытаний В табл 2, 3 и 4 все из соединеводческих целей применения, возможно большое ний (CD, (C2) и (СЗ), которые используются в каразнообразие форм и готовых форм препаратов честве контрольных, для целей сравнения или препаративных форм, и ниже представлены раскрываются в японской патентной заявке Кокай их примеры В этих примерах все проценты выраНеї 1-104078 и имеют формулы, показанные ниже жены по весу, а соединения изобретения идентиСоединения (С4), (С5) и (С6) все включены в объфицируются по номерам, присвоенным им в ем японской заявки Кокай Неї 1-104078, но контабл 1 кретно не описываются в ней Эти соединения Пример 100 Смачиваемые порошки были впервые синтезированы нами и имеют форСмесь, включающая 10% соединения К-10, мулы, показанные на схеме Д, представленной в 2,5% додецидбензолсульфоната натрия, 2,5% конце описания лигнинсульфоната натрия и 85% диатомовой земЭксперимент 1 Инсектицидная активность ли, тщательно смешивалась и пульверизовалась, против Plutella mylostella давая смачиваемый порошок Эмульгируемые концентраты, полученные, как Пример 101 Эмульгируемые концентраты описано а примере 108, и содержащие 1% активСмесь, включающая 5% соединения К-3, 10% ного ингредиента, разбавлялись водой для довесорпола SM100 (торговая марка эмульгирующего дения конечной концентрации до 1 част/млн Лиагента, Того Кемикал Инк) и 85% ксилола, тщастья капусты погружались в получающиеся в тельно смешивалась, давая эмульгируемый конрезультате смеси на 10с, а затем сушились на центрат воздухе, после чего каждый лист помещался в Пример 102 Гранулы полиэтиленовую чашку с диаметром 8см В кажСмесь, включающая 3% соединения К-17, 1% дую чашку помещались личинки в количестве белой сажи, 5% лигнинсульфоната натрия и 9 1 % 10шт в возрасте Здней, и чашка затем накрываглины, тщательно перемешивалась и пульверизолась крышкой Чашку оставляли стоять в термовалась К получающейся смеси добавлялась вода, стате, поддерживаемом при температуре 25°С, в смесь перемешивалась, гранулировалась и сушитечение 3 дней, после чего определялся процент лась, давая гранулы смертности (включая особей с симптомами разПример 103 Эмульгируемые концентраты личных нарушений) Каждое испытание осуществСмесь, включающая 5% соединения К-6, 45% 43 44886 44 лялось в двойном повторении параллельно Рераллельно Результаты показаны в табл 3 зультаты показаны в табл 2, в которой соединения Эксперимент 3 Инсектицидная активность изобретения идентифицируются номерами, предпротив Adoxophyes orana писанными им втабл 1 Эмульгируемые концентраты, полученные, как описано в примере 108, и содержащие 1% активЭксперимент 2 Инсектицидная активность ного ингредиента, разбавлялись водой для довепротив Spodoptera fitura дения конечной концентрации до Ючаст/млн 5г Эмульгируемые концентраты, приготовленискусственного корма (Инсекта L), погружались в ные, как описано в примере 108 и содержащие 1% каждую из полученных смесей на 20мин, и корм активного ингредиента, разбавлялись водой для затем сушился на воздухе Затем он помещался в доведения конечной концентрации до Ючаст/млн полиэтиленовые чашки, имеющие диаметр 8см В 5г искусственного корма (Инсекта L), погружались каждую чашку помещалось 10 четырехдневных в каждую из полученных смесей на 20с, и корм личинок Adoxophyes orana, и чашки накрывались затем сушился на воздухе Затем он помещался в крышкой Чашки оставлялись стоять в термостате, полиэтиленовую чашку с диаметром 8см В кажподдерживаемом при 25°С, в течение 5 дней, подую чашку помещалось 10 трехдневных личинок сле чего определялся процент смертности (вклюSpodoptera fitura, и чашки накрывались крышками чая особей с симптомами нарушений) Каждое Чашки оставлялись стоять в термостате при 25°С испытание осуществлялось с двойным повторенив течение 3 дней, после чего определялся проем параллельно Результаты показаны в табл 4 цент смертности (включая симптомы нарушений) Каждое испытание осуществлялось дважды паСхема А (продолжение) Сіе.ча А схалия с (VI) 44886 46 Схема Л H*C СК. Схема Д (продолжение) (f~xf coo н,с о" х с,Нї (СЗ) сн, (С4) 44886 47 48 Схека д (продолжение)
ДивитисяДодаткова інформація
МПК / Мітки
МПК: A01N 43/90, C07D 493/22
Мітки: похідні, одержання, тіо)ацетоксимілбеміцину, спосіб, інсектицидна, захисту, рослин, 13-(заміщеного, композиція
Код посилання
<a href="https://ua.patents.su/28-44886-pokhidni-13-zamishhenogo-tioacetoksimilbemicinu-sposib-kh-oderzhannya-insekticidna-kompoziciya-i-sposib-zakhistu-roslin.html" target="_blank" rel="follow" title="База патентів України">Похідні 13-(заміщеного тіо)ацетоксимілбеміцину, спосіб їх одержання, інсектицидна композиція і спосіб захисту рослин</a>
Наступний патент: Спосіб лікування стоматологічних хворих дентальними імплантатами та пристрій для його здійснення
Випадковий патент: Спосіб ад'ювантної терапії хворих на рак молочної залози