Бензиларалкілові прості ефіри, спосіб їх отримання, застосування таких сполук та спосіб лікування і/або профілактики захворювань
Номер патенту: 108479
Опубліковано: 12.05.2015
Автори: Сакураі Серджіо Луіз, Заім Марсіо Енрікє, Тоузарім Карлос Едуардо да Коста, Кепплєр Артур Франц
Формула / Реферат
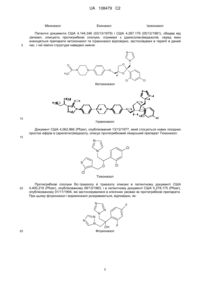
1. Бензиларалкілові прості ефіри сполук, які характеризуються Формулою (І):
 , (I)
, (I)
їх солі, енантіомери та/або фармацевтично прийнятні діастереоізомери, де:
Аr являє собою імідазоліл;
R1, R2, R4 і R5 незалежно являють собою водень;
R3 являє собою галоген;
R6 являє собою трифторметил;
n являє собою ціле число від 1 до 2; і
m являє собою 1.
2. Сполуки за п. 1, де вони додатково являють собою солі фармацевтично прийнятних кислот.
3. Сполука за п. 1, де сполука являє собою 1-[2-(2,4-дихлорфеніл)-2-{[4-(трифторметил)бензил]оксі}етил]-1H-імідазол; або її фармацевтично прийнятні солі.
4. Сполуки за будь-яким із пунктів 1-3, які мають антигрибкову, антибактеріальну та/або антипаразитичну активність.
5. Спосіб одержання сполук за будь-яким із пунктів 1-3, в якому здійснюють взаємодію сполуки формули (II) і сполуки формули (III):
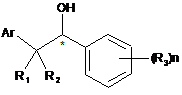 , (II)
, (II)
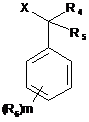 , (III)
, (III)
у придатному реакційному середовищі, де:
Аr являє собою імідазоліл;
R1, R2, R4 і R5 незалежно являють собою водень;
R3 являє собою галоген;
R6 являє собою трифторметил;
n являє собою ціле число від 1 до 2;
m являє собою 1; і
X являє собою елементи вибрані з групи, яка складається з Сl, Вr або І.
6. Спосіб одержання сполук за п. 5, який відрізняється тим, що викристовують реакційне середовище, що включає:
(a) полярний органічний розчинник,
(b) розчин сильної основи з концентрацією в інтервалі від 20 % до 70 % (маса/об'єм) і
(c) основну органічну сіль з концентрацією в інтервалі від 0,001 до 0,1 г/мл у загальному об'ємі реакційного середовища.
7. Спосіб за п. 6, який відрізняється тим, що використовують:
(a) полярний органічний розчинник, вибраний з групи, яка складається з ацетону, метилетилкетону та їх суміші;
(b) сильну основу, вибрану з групи, яка складається з гідроксиду натрію та гідроксиду калію, або
(c) основну органічну сіль, що являє собою бензилтриетиламонійхлорид.
8. Спосіб за п. 5, який відрізняється тим, що зазначені проміжні сполуки (II) і (III) мають захисну групу, необов'язково вибрану з групи, яка складається з тритилу, N,N-диметилсульфонаміду, п-метоксифенілсульфонаміду, бензенсульфонаміду, 2,2,2-трихлоретилкарбамату, t-бутилкарбамату, N-2-хлоретиламіну, N-триізопропілсиліламіну, N-2-нітробензиламіну та/або N-2-тетрагідропіраніламіну.
9. Застосування сполук за будь-яким із пунктів 1-3, або їх сумішей, для виготовлення лікарського препарату для лікування та/або попередження патологічних станів і/або захворювань в індивідуума, асоційованих із мікроорганізмами.
10. Застосування за п. 9, де мікроорганізми являють собою гриби, бактерії або найпростіші.
11. Спосіб лікування та/або попередження патологічних станів і/або захворювань, асоційованих із мікроорганізмами, який включає введення ефективної кількості щонайменше однієї сполуки за будь-яким із пунктів 1-3 або їх сумішей ссавцеві.
Текст
Реферат: Даний винахід описує нові протигрибкові сполуки, які являють собою аралкілбензилові прості ефіри Формули (І): n 1 2 * 4 5 m , (I) де Аr являє собою, арил, імідазоліл, 1,2,4-триазоліл, бензімідазоліл; R1, R2, R4 та R5 незалежно являють собою водень, галоген, С1-6алкіл; R3 представляє галоген, С1-6алкіл або O-R', де R' представляє водень або нижчий алкіл; R6 представляє арил, заміщений арил, трифторметил, трихлорметил або O-R', де R' представляє водень або нижчий алкіл; при цьому замісниками арилу є галоген або радикал тетразоліл; n і m незалежно один від одного представляють ціле число від 0 до 5; за умови, якщо Аr являє собою імідазоліл, R3 являє собою хлор, R6 являє собою n-феніл, і R1, R2, R4 та R5 являють собою водень, n повинно бути відмінним від 2; коли n і m не дорівнюють 0 і 1, R3 або R6 можуть бути представлені замісниками, які необов'язково є рівними. Даний винахід стосується також їхніх солей, сольватів, складних ефірів, енантіомерів і/або фармацевтично прийнятних діастереоізомерів або їхніх сумішей, способів одержання цих сполук, проміжних сполук, фармацевтичних композицій, що містять такі сполуки, і/або похідних, включаючи ці сполуки і/або похідні, а також застосування та способів застосування цих сполук і/або похідних для лікування і/або попередження патологічних станів і/або захворювань, викликаних мікроорганізмами, такими як гриби, бактерії і/або найпростіші, для інгібування проліферації і/або виживання зазначених мікроорганізмів, для лікування і/або попередження утворення колоній мікроорганізмів у індивідуума і для виготовлення лікарського препарату. UA 108479 C2 5 10 15 20 25 30 35 ОБЛАСТЬ ТЕХНІКИ Даний винахід відноситься до сполук, які являють собою аралкілбензилові прості ефіри, описані Формулою (I), їхні енантіомери, їхні діастереоізомери, їхні проліки, складні ефіри, їхні фармацевтично прийнятні солі, їхні фармацевтично прийнятні сольвати і/або їхні суміші в будьякому співвідношенні цих сполук і/або похідних, до способів одержання цих сполук, проміжних сполук, фармацевтичних композицій, які містять такі сполуки, і/або похідних, лікарських препаратів, які містять зазначені сполуки і/або похідні. Він відноситься також до застосування цих сполук і/або похідних для лікування і/або попередження патологічних станів і/або захворювань, викликаних мікроорганізмами, такими як гриби, бактерії і/або найпростіші, для інгібування проліферації і/або виживання зазначених мікроорганізмів, для лікування і/або попередження утворення колоній мікроорганізмів у індивідуума і для виготовлення лікарського препарату. Даний винахід відноситься також до способу лікування і/або попередження патологічних станів у ссавців, викликаних грибами і/або іншими мікроорганізмами, такими як бактерії й найпростіші, з застосуванням сполук аралкілбензилових простих ефірів, описаних у Формулі (I), і, зокрема, сполук 1-[2-(2,4-дихлорфеніл)-2-{[4-(трифторметил)бензил]окси}етил]-1Н-імідазолу і 1-[2-(2,4-дихлорфеніл)]-2-({4-[(2-феніл)-2H-тетразол]бензил}окси)-етил]-1Н-імідазолу. Даний винахід охоплює сполуки аралкілбензилового простого ефіру, описаного в Формулі (I), та їхні суміші в будь-якому співвідношенні, їхні фармацевтично прийнятні солі та фармацевтичні композиції, які їх містять. Зокрема, даний винахід відноситься до застосування сполук аралкілбензилового простого ефіру, описаного в Формулі (I), і, більш конкретно, сполук 1-[2-(2,4-дихлорфеніл)-2-{[4-(трифторметил)бензил]окси}етил]-1Н-імідазолу та 1-[2-(2,4дихлорфеніл)]-2-({4-[(2-феніл)-2H]бензил}окси)-етил]-1Н-імідазолу як фунгістатичних і/або фунгіцидних протигрибкових препаратів. РІВЕНЬ ТЕХНІКИ Азоли являють собою основні сполуки, застосовувані в клінічній медицині для лікування і/або попередження патологічних станів і/або захворювань, асоційованих із грибами. Протигрибкова дія азолів зазвичай відбувається за рахунок інгібування ергостерину (ergosta-5,7,22-трієн-3β-ол), за допомогою інгібування білків, залучених до його біосинтезу, таких як: (а) фермент ланостерин 14-альфа-деметилаза, який належить до сімейства 22 цитохрома Р-450 і кодується геном ERG11, і (b) дельта десатураза (кодується геном ERG5). Ергостерин є стериновим попередником вітаміну D і структурним компонентом клітинної мембрани грибів, який може бути знайдений також у інших мікроорганізмів, таких як найпростіші й бактерії. Документ США 3,705,172 (Bayer), опублікований 12/05/1972, відноситься до сполук Nтритил-імідазолу, серед яких сполуку клотримазол, структура якої представлена нижче, застосовували в медичній практиці для місцевого лікування захворювань, викликаних дерматофітами, дріжджами й диморфними та міцеліальними грибами. Cl N N 40 45 Клотримазол Документ США 3,717,655 (Janssen), опублікований 02/20/1973, відноситься до похідних амінів або арилетилімідазол простих ефірів, які введені в медичну практику протигрибкових препаратів, застосовуваних до сьогоднішнього дня, таких як міконазол, еконазол, і ізоконазол, які представлені наступними структурними формулами: N N N N Cl O Cl N N Cl O Cl Cl O Cl Cl 1 Cl Cl Cl Cl UA 108479 C2 Міконазол 5 Еконазол Ізоконазол Патентні документи США 4,144,346 (03/13/1979) і США 4,267,179 (05/12/1981), обидва від Janssen, описують протигрибкові сполуки, отримані з (диоксолан)імідазолів, серед яких знаходяться препарати кетоконазол та ітраконазол відповідно, застосовувані в терапії в даний час, і чиї хімічні структури наведені нижче: N N O O N N O H3C H O Cl Cl Кетоконазол N C H 3 H C 3 N N O O N N N N O N O H C l 10 C l Ітраконазол Документ США 4,062,966 (Pfizer), опублікований 13/12/1977, який стосується нових похідних простих ефірів із (арилетил)імідазолу, описує протигрибковий лікарський препарат Тіоконазол. 15 N Cl N S O Cl Cl Тіоконазол 20 Протигрибкові сполуки біс-триазолу й триазолу описані в патентному документі США 4,400,219 (Pfizer), опублікованому 09/13/1983, і в патентному документі США 5,278,175 (Pfizer), опублікованому 01/11/1994, які застосовувалися в клінічних умовах як протигрибкові препарати. При цьому флуконазол і вориконазол розкриваються, відповідно, як: N F N N N N 25 N F OH Флуконазол 2 UA 108479 C2 N N N N F N OH CH3 F F Вориконазол 5 10 15 20 25 30 Цікаво, що тривалий і багаторазовий вплив на грибкові штами протигрибковими препаратами може призвести до резистентності цих штамів до дії цих препаратів, знижуючи їхню ефективність. Це виражається у виді штаму конкретного генетичного варіанта мікроорганізму. Така резистентність може бути результатом різних механізмів, таких як, не обмежуючись ними: (а) модифікація на молекулярному рівні ERG11 гена, (b) підвищений рівень експресії ефлюксних насосів для певних лікарських препаратів, такий як CDR (резистентність, залежна від ступеня змикання моношару) і MDR (множинна лікарська резистентність), (с) модифікація стерольного біосинтезу, і (г) зниження внутрішньоклітинної концентрації цільових ферментів. Проблема резистентності стає все більш актуальною в поточній епідеміологічній ситуації захворювань, викликаних грибами. Було помічено, що в останні десятиліття в усьому світі спостерігається значне збільшення захворюваності людей у результаті грибкових інфекцій. Більша частина цього збільшення приписується пролонгованому виживанню пацієнтів з ослабленим імунітетом та частому і/або хронічному застосуванню протимікробних препаратів. Так, більшість пацієнтів, які піддані цим інфекціям, – це пацієнти з ослабленою імунною системою або в результаті прямої імуносупресії, викликаної застосуванням цитотоксичних лікарських препаратів чи ВІЛ-інфекцією, або вторинної, або через інші виснажливі хвороби, такі як рак, гострий лейкоз, інвазивні хірургічні процедури, або в результаті тривалого впливу антимікробних препаратів. Зокрема, широке поширення ВІЛ-інфекції сприяє збільшенню опортуністичних інфекцій, викликаних грибами, які нешкідливі для здорових людей, але стають патогенними через ослаблений імунний захист у ВІЛ-інфікованих пацієнтів. Тому, виходячи з поточної епідеміологічної ситуації інфікованості, викликаної цими мікроорганізмами, і появи патогенних штамів, стійких до застосовуваних в даний час протигрибкових препаратів, інтерес до розробки нових сполук стає очевидним. Бажаною є розробка сполуки з широким спектром протигрибкової активності, беручи до уваги штами і/або види грибів, не резистентних і/або резистентних до відомих лікарських препаратів. СУТНІСТЬ ВИНАХОДУ Метою даного винаходу є забезпечення нових сполук, корисних для лікування захворювань і/або станів, асоційованих із мікроорганізмами, такими як гриби, бактерії і/або найпростіші, які являють собою аралкілбензилові прості ефіри, хімічна структура яких показана в Формулі (I): 35 (R 3 )n R1 Ar R2 * O R4 R5 (I) (R 6 )m 3 UA 108479 C2 5 10 15 20 25 30 35 40 45 50 55 60 в якій: Ar являє собою арил, імідазоліл, 1,2,4-триазоліл і бензімідазоліл; R1, R2, R4 та R5 незалежно являють собою водень, галоген, C1-6 алкіл; R3 є замісником, який являє собою галоген, C1-6 алкіл або O-R', у якому R' являє собою водень або нижчий алкіл; R6 являє собою арил або заміщений арил, трифторметил, трихлорметил або O-R', у якому R' являє собою водень або нижчий алкіл; при цьому замісником арилу є галоген або радикал тетразолілу; n і m представляють незалежно ціле число від 0 до 5; За умови, що якщо Аг являє собою імідазоліл, R3 являє собою хлор, R6 являє собою пфеніл, і R1, R2, R4 та R5 являють собою водень, n повинно бути відмінним від 2; і Коли n і m не дорівнюють 0 і 1, R3 або R6 можуть бути представлені замісниками, які не обов'язково є рівними. Даний винахід також включає солі, сольвати, проліки й фармацевтично прийнятні складні ефіри сполук, описаних Формулою (I), а також їхні енантіомери і/або фармацевтично прийнятні солі, діастереоізомери та їхні суміші в будь-якому співвідношенні. Ще однією метою даного винаходу є забезпечення способу одержання сполук аралкілбензилових простих ефірів, описаних у Формулі (I), а також їхніх проміжних сполук, використовуваних у процесі синтезу. Крім того, метою даного винаходу є опис застосування аралкілбензилових простих ефірів за даним винаходом або їх солей, сольватів, проліків, складних ефірів, енантіомерів і/або фармацевтично прийнятних діастереоізомерів або їх сумішей, для лікування і/або попередження, і/або для виготовлення лікарського препарату для лікування і/або попередження патологічних станів і/або захворювань, викликаних мікроорганізмами, такими як гриби, бактерії і/або найпростіші, в еукаріотичних організмах. Крім того, сполуки за даним винаходом застосовуються для інгібування і/або вповільнення, і/або для виготовлення лікарського препарату для інгібування і/або вповільнення проліферації і/або виживання мікроорганізмів, таких як гриби, бактерії і/або найпростіші, особливо патогенних мікроорганізмів. Зокрема, метою даного винаходу є застосування аралкілбензилових простих ефірів, описаних у Формулі (I), як фунгістатичних і/або фунгіцидних протигрибкових препаратів. Додатковою метою даного винаходу є забезпечення способу лікування і/або попередження патологічних станів і/або захворювань, асоційованих із мікроорганізмами, такими як гриби, бактерії і/або найпростіші, у ссавця, який потребує такого лікування. При цьому спосіб містить введення ефективної кількості, щонайменше, однієї зі сполук аралкілбензилового простого ефіру, описаного Формулою (I), за даним винаходом або його солей, сольватів, проліків, складних ефірів, енантіомерів і/або фармацевтично прийнятних діастереоізомерів, або їхніх сумішей. Ще однією метою цього винаходу є забезпечення фармацевтичної композиції та лікарського препарату, які містять ефективну кількість щонайменше однієї зі сполук, описуваних Формулою (I), або її солей, сольватів, проліків, складних ефірів, енантіомерів і/або фармацевтично прийнятних діастереоізомерів, або їхніх сумішей, як активної речовини і одну або декілька фармацевтично прийнятних допоміжних речовин. КОРОТКИЙ ОПИС КРЕСЛЕНЬ І ТАБЛИЦЬ Фіг. 1: Характеристика сполуки, отриманої способом, описаним у Прикладах 1 і 2 (1-[2-(2,4дихлорфеніл)-2-{[4-(трифторметил)бензил]окси}етил]-1H-імідазол (BL-123)), згідно з методом ЯМР-спектроскопії на ядрах вуглецю (С13). Фіг. 2: Характеристика сполуки, отриманої способом, описаним у Прикладах 1 і 2 (1-[2-(2,4дихлорфеніл)-2-{[4-(трифторметил)бензил]окси}етил]-1H-імідазол (BL-123)), згідно з методом 1 ЯМР-спектроскопії на ядрах H. Фіг. 3: Характеристика сполуки, отриманої способом, описаним у Прикладі 3 (1-[2-(2,4дихлорфеніл)]-2-({4-[(2-феніл)-2H-тетразол]бензил}окси)етил]-1H-імідазол (BL-137)), згідно з 1 методом ЯМР-спектроскопії на ядрах H. Фіг. 4: Характеристика сполуки, отриманої способом, описаним у Прикладі 3 (1-[2-(2,4дихлорфеніл)]-2-({4-[(2-феніл)-2H-тетразол]бензил}окси)етил]-1H-імідазол (BL-137)), згідно з методом ЯМР-спектроскопії вуглецю (С13). Формула (I): Структурна формула, що описує базові сполуки, включені в даний винахід, у якій Ar представляє арил, імідазоліл, 1,2,4-триазоліл, бензімідазоліл; R1, R2, R4 та R5 незалежно представляють водень, галоген, C1-6 алкіл; R3 представляє галоген, C1-6 алкіл або O-R', у якому R' представляє водень або нижчий алкіл; n і m представляють незалежно ціле число від 0 до 5; R6 представляє арил або заміщений арил, трифторметил, трихлорметил або O-R', у якому R' 4 UA 108479 C2 5 10 15 20 25 30 35 40 45 представляє водень або нижчий алкіл; при цьому замісниками арилу є галоген або радикал тетразолілу. За умови, що якщо Аг являє собою імідазоліл, R3 являє собою хлор, R6 являє собою п-феніл, і R1, R2, R4 та R5 являють собою водень, n повинно бути відмінним від 2, і коли n і m не дорівнюють 0 і 1, R3 або R6 можуть бути представлені замісниками, які не обов'язково є рівними. Формули (Ia), (Ib) і (Ic): Базові структурні формули, що описують особливо переважні сполуки за даним винаходом, де R3 являє собою галоген, і R6 являє собою фенільний радикал, галогенфеніл, (тетразоліл)феніл, трифторметил, трихлорметил у будь-якій точці бензильного кільця; Спосіб 1: Загальна схема процесу синтезу сполук за даним винаходом, у яких Ar, R1-R6, n і m у Формулах (II) і (III) є такими, як описано вище, і в яких Х відноситься до елементів, обраних із групи, яка складається з Cl, Br, I, метансульфонату й толуенсульфонатів. Спосіб 2: Окрема схема процесу синтезу за даним винаходом для одержання сполуки BL123. Спосіб 3: Окрема схема процесу синтезу за даним винаходом для одержання сполуки BL137. Таблиця 1: Приклади проміжних сполук, описаних Формулами II і III, які застосовуються для одержання сполук за даним винаходом, залежно від замісників, представлених на позиціях Ar, R1, R2, R4, R5, (R3)n, R6 і m, і в яких термін "prot" представляє захисні групи за даним винаходом, і "X" представляє елементи, обрані з групи, яка складається з Cl, Br, I, MS (метансульфонати) і TS (толуенсульфонати). Таблиця 2: Ідентифікація штамів міцеліальних грибів, застосованих у тестах на чутливість до протигрибкових препаратів за даним винаходом. Таблиця 3: Середнє значення мінімальної інгібуючої концентрації (MІК), отриманої в чотирьох експериментах визначення чутливості штамів міцеліальних грибів, які описані в Таблиці 2, виконаних впродовж кількох діб, з показами результатів, виконаних на четверту й сьому добу. Таблиця 4: Середні значення MІК 50 (мінімальна інгібуюча концентрація, необхідна для інгібування 50 % штамів), MІК 90 (мінімальна інгібуюча концентрація для інгібування 90 % штамів) і ВМІК (варіанти мінімальної інгібуючої концентрації) для препаратів, використовуваних при тестуванні сприйнятливості міцеліальних грибів до протигрибкових препаратів за даним винаходом. Таблиця 5: Ідентифікація штамів бактерій і дріжджів, використовуваних при тестуванні на чутливість до протигрибкових препаратів за даним винаходом. Таблиця 6: Мінімальна інгібуюча концентрація протигрибкових препаратів, випробуваних стосовно штамів дріжджів і бактерій, описаних у Таблиці 5. Таблиця 7: Приклад композиції в формі крему, яка містить сполуку BL-123, описану в даному винаході. Таблиця 8: Приклад порошкоподібної композиції, яка містить сполуку BL-123, описану в даному винаході. Таблиця 9: Приклад композиції в формі лосьйону, яка містить сполуку BL-123, описану в даному винаході. ДОКЛАДНИЙ ОПИС ВИНАХОДУ Даний винахід розкриває нові сполуки, які є корисними для лікування патологічних станів, що викликаються грибами і/або іншими мікроорганізмами, такими як бактерії та найпростіші, які являють собою аралкілбензилові прості ефіри, описані Формулою (I), та їхні солі, сольвати, проліки й фармацевтично прийнятні складні ефіри: 5 UA 108479 C2 (R 3 )n R1 Ar R2 * O R4 R5 (I) (R 6 )m 5 10 15 в якій: Ar представляє арил, імідазоліл, 1,2, 4-триазоліл, бензімідазоліл; R1, R2, R4 та R5 незалежно представляють водень, галоген, C1-6 алкіл; R3 представляє замісник, який являє собою галоген, C1-6 алкіл або O-R', у якому R' представляє водень або нижчий алкіл; R6 представляє арил або заміщений арил, трифторметил, трихлорметил або O-R', у якому R' представляє водень або нижчий алкіл; при цьому замісником арилу є галоген або радикал тетразоліл; n і m представляють незалежно ціле число від 0 до 5; За умови, що якщо Аг являє собою імідазоліл, R 3 являє собою хлор, R6 являє собою пфеніл, і R1, R2, R4 та R5 представляють водень, n повинно бути відмінним від 2; і Коли n і m відмінні від 0 і 1, R3 або R6 можуть бути представлені замісниками, які не обов'язково є рівними; і Коли замісники R1, R2, R4 та R5 одночасно представляють водень і R6 являє собою трифторметил або трихлорметил, 1,2,4-триазоліл радикал повинен бути зв'язаний із основною структурою в конкретній позиції 2, як наведено нижче N N 20 25 30 35 40 N Зв'язок у позиції 2. Сполуки Формули (I) мають один або більше асиметричних центрів і, таким чином, можуть існувати енантіомерні і/або діастереоізомерні солі. Зокрема, хіральний центр показаний зірочкою в описі структури Формули (I). Таким чином, даний винахід також охоплює енантіомери сполук Формули (I) у їхніх індивідуальних роздільних способах дії і/або у формі рацемічних сумішей або не рацемічних сумішей з енантіомерним надлишком у будь-якому співвідношенні. Фармацевтично прийнятні солі сполуки Формули (I) утворюються шляхом додавання фармацевтично прийнятних кислот. Приклади солей включають, не обмежуючись такими, нітрати, хлориди, бромгідрати, сульфати, бісульфати, фосфати, гідрофосфати, ацетати, бензоати, сукцинати, фумарати, малеати, лактати, цитрати, тартрати, глюконати, метасульфонати, бензолсульфонати і п-толуолсульфонати. Загалом, у описі сполук Формули (I), термін "арил", описаний як Ar, представляє фенільну групу або фенільну групу, заміщену від 1 до 5 атомами галогену, від 1 до 5 (C1-6 алкіл) і/або від 1 дo 5 (C1-6 алкокси). Термін "алкіл" представляє головний алкільний ланцюг, або, якщо такий є, розгалужений алкільний ланцюг із груп, які він представляє. Приклади "алкільних" груп цього винаходу включають, не обмежуючись такими: метил, етил, н-пропіл, i-пропіл, н-бутил, s-бутил, t-бутил, нпентил, s-пентил, t-пентил, i-пентил, н-гексил, s-гексил або t-гексил. Термін "нижчий алкіл" відноситься до алкільних груп, як це визначено вище, які містять від 1 до 6 атомів вуглецю. Термін "галоген" представляє атоми фтору, хлору, брому або йоду. 6 UA 108479 C2 5 10 15 Коли R3 або R6 представляють групи "O-R'" або "арил", або "трифторметил", або "трихлорметил", то такі замісники можуть бути приєднані в будь-якій підходящій позиції фенільної групи на одній або більше позиціях. Певна група сполук за даним винаходом вибирається зі сполук, описаних Формулою (I), у якій R1, R2, R4 та R5 являють собою водень, R3 являє собою галоген, n є цілим числом від 0 до 2, так що, коли n дорівнює 0, ароматичне кільце, яке пов'язане з R3, не є заміщеним, m являє собою 1, R6 являє собою фенільний, галогенфенільний, тетразолілфенільний, трифторметильний або трихлорметильний радикал у будь-якій позиції бензильного кільця, і Аr являє собою імідазоліл або 1,2,4-триазоліл, у яких, коли n і m відмінні від 0 і 1, R3 або R6 можуть бути представлені замісниками, які не обов'язково є рівними, і/або коли R6 являє собою трифторметил або трихлорметил, радикал 1,2,4-триазоліл повинен бути пов'язаний із основною структурою в позиції, відмінній від 2. Ця конкретна група сполук за даним винаходом представлена Формулами (Ia), (Ib) і (Ic), які наведені нижче, у яких замісники R3 і R6 являють собою так, як зазначено в наступному абзаці: Більш конкретно, переважними сполуками даного винаходу є сполуки, обрані з групи, яка включає ( R3 ) 0- 2 H N N H H * O N H N N H H * O H R6 30 35 40 45 N H N * O H H ( I c) ( I b) R6 25 N H H ( I a) 20 ( R3 ) 0- 2 ( R3 ) 0- 2 R6 1-[2-(2,4-дихлорфеніл)-2-{[3-(трифторметил)бензил]окси}етил]-1Н-імідазол 1-[2-(2,4-дихлорфеніл)-2-{[3-(трихлорметил)бензил]окси}етил]-1Н-імідазол 1-[2-(2,4-дихлорфеніл)-2-{[4-(трифторметил)бензил]окси}етил]-1Н-імідазол 1-[2-(2,4-дихлорфеніл)-2-{[4-(трихлорметил)бензил]окси}етил]-1Н-імідазол 1-[2-(2,4-дихлорфеніл)-2-{[3-(трифторметил)бензил]окси}етил]-4Н-1,2,4-триазол 1-[2-(2,4-дихлорфеніл)-2-{[3-(трихлорметил)бензил]окси}етил]-4H-1,2,4-триазол 1-[2-(2,4-дихлорфеніл)-2-{[4-(трифторметил)бензил]окси}етил]-4H-1,2,4-триазол 1-[2-(2,4-дихлорфеніл)-2-{[4-(трихлорметил)бензил]окси}етил]-4Н-1,2,4-триазол 1-[2-(2,4-дихлорфеніл)]-2-({4-[(2-феніл)-2H-тетразол]бензил}окси)етил]-1Н-імідазол 1-{2-[(4'- хлордифеніл-4-іл)метокси]-2-(2,4-дихлорфеніл)етил}-1H-імідазол 1-[2-(дифеніл-4-ілметокси)-2-(2,4-дихлорфеніл)етил]-1Н-імідазол 1-[2-(2,4-дихлорфеніл)]-2-({4-[(2-феніл)-2H-тетразол]бензил}окси)етил]-1Н-1,2,4-триазол 1-{2-[(4'- хлордифеніл-4-іл)метокси]-2-(2,4-дихлорфеніл)етил}-1H-1,2,4-триазол 1-[2-(дифеніл-4-ілметокси)-2-(2,4-дихлорфеніл)етил]-1Н-1,2,4-триазол 1-[2-(2,4-дихлорфеніл)]-2-({4-[(2-феніл)-2H-тетразол]бензил}окси)етил]-4H-1,2,4-триазол 1-{2-[(4'- хлордифеніл-4-іл)метокси]-2-(2,4-дихлорфеніл)етил}-4H-1,2,4-триазол 1-[2-(дифеніл-4-iлметокси)-2-(2,4-дихлорфеніл)етил]-4H-1,2,4-триазол 1-[2-(4-хлорфеніл)-2-{[4-(трифторметил)бензил]окси}етил]-1Н-імідазол 1-[2-(4-хлорфеніл)-2-{[4-(трихлорметил)бензил]окси}етил]-1Н-імідазол 1-[2-(4-хлорфеніл)-2-{[4-(трифторметил)бензил]окси}етил]-4H-1,2,4-триазол 1-[2-(4-хлорфеніл)-2-{[4-(трихлорметил)бензил]окси}етил]-4H-1,2,4-триазол 1-[2-(2-хлорфеніл)-2-{[4-(трифторметил)бензил]окси}етил]-1Н-імідазол 1-[2-(2-хлорфеніл)-2-{[4-(трихлорметил)бензил]окси}етил]-1Н-імідазол 1-[2-(2-хлорфеніл)-2-{[4-(трифторметил)бензил]окси}етил]-4H-1,2,4-триазол 1-[2-(2-хлорфеніл)-2-{[4-(трихлорметил)бензил]окси}етил]-4H-1,2,4-триазол 1-[2-(4-фторфеніл)-2-{[2-(трифторметил)бензил]окси}етил]-1Н-імідазол 1-[2-(4-фторфеніл)-2-{[2-(трихлорметил)бензил]окси}етил]-1Н-імідазол 1-[2-(4-фторфеніл)-2-{[2- (трифторметил)бензил]окси}етил]-4H-1,2,4-триазол 1-[2-(4-фторфеніл)-2-{[2-(трихлорметил)бензил]окси}етил]-4H-1,2,4-триазол 1-[2-(2,4-дифторфеніл)-2-{[2-(трифторметил)бензил]окси}етил]-1Н-імідазол 1-[2-(2,4-дифторфеніл)-2-{[2-(трихлорметил)бензил]окси}етил]-1Н-імідазол 7 UA 108479 C2 5 10 15 20 25 1-[2-(2,4-дифторфеніл)-2-{[2-(трифторметил)бензил]окси}етил]-4Н-1,2,4-триазол 1-[2-(2,4-дифторфеніл)-2-{[2-(трихлорметил)бензил]окси}етил]-4H-1,2,4-триазол або їхні солі, сольвати, проліки, складні ефіри, енантіомери і/або фармацевтично прийнятні діастереоізомери. Переважно сполуки аралкілбензилових простих ефірів Формули (I) за даним винаходом можуть бути отримані за допомогою реакції О-алкілування спирту, відповідному сполуці, яка повинна бути отриманою. Проміжна сполука, використовувана для додавання алкільної групи, відповідно до реакції О-алкілування за даним винаходом, може бути, наприклад, отримана з бензилгалогеніду, бензилмезилату або бензилтозилату, заміщених групами, описаними нижче для R6, які відповідають сполукам, які повинні бути отриманими. Реакції можна виконати в реакційному середовищі, яке містить розчинник тетрагідрофуран (ТHF) і гідрид натрію, у діапазоні концентрацій від 40 % до 80 % (маса/об'єм) відносно загального об'єму реакційного середовища. У іншому аспекті, реакції можна виконати в реакційному середовищі, яке містить полярний розчинник, розчин сильної основи при концентраціях від 20 % до 70 % (маса/об'єм) і основної органічної солі при концентрації від 0,001 до 0,1 г/мл відносно загального об'єму реакційного середовища. Переважно, названий полярний органічний розчинник може являти собою ацетон або метилетилкетон або їхню суміш; названий розчин сильної основи може бути основою, яка містить елементи лужного металу та лужноземельного металу, переважно, вибраною з групи, яка складається з гідроксиду натрію та гідроксиду калію; названа основна органічна сіль, переважно, являє собою бензилтриетиламонію хлорид. Проміжні продукти реакції можуть, не обов'язково, мати захисні групи реакційно-здатних фрагментів, як, наприклад, пов'язаних із хімічно активним азотом із тетразольного кільця в проміжних сполуках, що його містять. Прикладами захисних груп можуть бути, не обмежуючись такими: тритильна група, N, Nдиметилсульфонамід, р-метоксифенілсульфонамід, бензенсульфонамід, 2,2,2трихлоретилкарбамат, t-бутилкарбамат, N-2-хлоретиламін, N-триізопропілсіліламін, N-2нітробензиламін і/або N-2-тетрагідропіраніламін. Названий спосіб одержання, загалом, може бути представлений наступною реакцією 1: 30 (Реакція 1) 35 40 у якій Ar, R1-R6, n і m із Формул (II) і (III) визначаються відповідно до докладного опису Формули (I), і в якій X відноситься до елементів, обраних із групи, яка складається з Cl, Br, I, MS (метансульфонатів) і TS (толуенсульфонатів). Переважно, похідна 1-[2-(2,4-дихлорфеніл)-2-{[4-(трифторметил)бензил]окси}етил]-1Німідазолу (BL-123) за даним винаходом може бути отримана з 1-(2,4-дихлорфеніл)-2-(1Німідазол-1-іл)етанолу й 1-(хлорметил)-4-(трифторметил)бензолу згідно з реакцією, представленою нижче (Реакція 2). 8 UA 108479 C2 (Реакція 2) 5 10 15 20 25 30 35 40 45 Наступні приклади ілюструють, але не обмежують такі, способи одержання сполуки 1-[2-(2,4дихлорфеніл)-2-{[4-(трифторметил)бензил]окси}етил]-1Н-імідазолу (BL-123) відповідно до реакцій 1 і 2, представлених вище. ПРИКЛАД 1 10,30 г сполуки 1-(2,4-дихлорфеніл)-2-(1Н-імідазол-1-іл)етанолу суспендували в 26 мл ацетону, потім додавали 31 мл 50 % розчину гідроксиду натрію у воді, потім більш, ніж 26 мл ацетону, підтримуючи всю реакційну суміш при інтенсивному перемішуванні. Потім додавали 45 г бензилтриетиламонію хлорид, витримуючи реакційну суміш зі зворотним холодильником протягом тридцяти хвилин. Продовжуючи витримувати суміш зі зворотним холодильником, додавали 8,2 г сполуки 1-(хлорметил)-4-(трифторметил)бензолу (розведеного в 13 мл ацетону), підтримуючи перемішування й рефлюкс протягом 6 годин. Наприкінці гетерогенну суміш фільтрували й фази розділяли. Органічну фазу випарювали за допомогою роторного випарника при 45 °C насухо. Отриманий залишок розчиняли в 100 мл холодного етилового ефіру. Потім додавали 2 мл азотної кислоти (65 %) при температурі 0 °C, підтримуючи перемішування протягом однієї години. Наприкінці продукт фільтрували й промивали холодним етанолом і сушили при температурі 65 °C протягом 12 годин. Отриманий продукт, у вигляді твердої речовини білого кольору (сполука BL-123), мав наступні характеристики: ЯMР 1H (300 MГцDMSO (диметилсульфоксид)): 9.05 (1H, s), 7.72-7.74 (1H, m), 7.65-7.66 (4H, m), 7.53-7.54 (1H, m), 7.38-7.45 (3H, m), 5.51-5.20 (1H, m) 4.45-4.64 (4H, m). ЯMР 13C (75MГц-DMSO): 142.1, 136.3, 134.1, 133.6, 133.3, 129.5, 129.2, 128.5, 128.1, 127.9, 125, 2, 125.1, 123,, 119.8, 75.4, 69.7, 51.8; Елементний аналіз розрах. для C19H16Cl2O4 F3N3: C=47.72 %, H=3.37 %, N=8.79 %; отримано: C=48.06 %, H=3.44 %, N=8.76 %. Температура плавлення: 173-176 °C. ПРИКЛАД 2 До більш, ніж 60 % суспензії NaН (2,0 г) у сухому тетрагідрофурані (ТHF) (18 мл) додавали розчин сполуки 1-(2,4-дихлорфеніл)-2-(1Н-імідазол-1-ілетанолу (5,14 г) у сухому ТHF (52 мл) при кімнатній температурі. Потім до реакційної суміші повільно додавали розчин, який містить сполуку 1-(хлорметил)-4-(трифторметил)бензолу (3,6 мл) у сухому ТHF (10 мл), підтримуючи отриману суміш зі зворотним холодильником протягом трьох годин. Наприкінці цього періоду часу додавали 50 мл води, і продукт екстрагували етилацетатом та сушили сульфатом магнію, і розчинник, що залишився, випарювали за допомогою роторного випарника. Залишок, отриманий після повного випарювання розчинника, розчиняли в діетиловому простому ефірі (20 мл) і охолоджували до 0 °C. До розчину залишку обережно додавали 65 % азотну кислоту (1,4 мл). Потім продукт фільтрували й сушили при температурі 65 °C. Чистий продукт одержували після перекристалізації в метанолі. Продукт, отриманий у вигляді твердої речовини білого кольору (сполука BL-123) мав наступні характеристики: 1H ЯMР (300 MГц-DMSO): 9.05 (1H, s), 7.72 to 7.74 (1H, m), 7.65 to 7.66 (4H, m), 7.53 to 7.54 (1H, m), 7.38 to 7.45 (3H, m), 5.51 to 5.20 (1H, m), 4.45 to 4.64 (4H, m). 13C ЯMР (75 MГц-DMSO): 13C ЯMР (75 MГц-DMSO): 142.1, 136.3, 134.1, 133.6, 133.3, 129.5, 129.2, 128.5, 128.1, 127.9, 125, 2, 125.1, 123,, 119.8, 75.4, 69.7, 51.8. Температура плавлення: від 173 дo 176 °C. Переважно, похідна 1-[2-(2,4-дихлорфеніл)]-2-({4-[(2-феніл)-2H-тетразол]бензил}окси)етил]1Н-імідазолу (BL-137) за даним винаходом може бути отримана з 1-(2,4-дихлорфеніл)-2-(1Німідазол1-іл)етанолу [1] і 5-(4'-(бромметил)дифеніл-3-а)-1-тритил-1Н-тетразолу [2] у відповідності зі схемою реакції, наведеною нижче (Реакція 3). 9 UA 108479 C2 N N N N N N N N N HO A N NaH + THF N O Cl N Br Cl Cl 1 N Cl 2 3 N N N N N NH N H2SO4/H2O B N O N O N Cl N Cl Cl Cl 3 4 BL - 137 (Реакція 3) 5 10 15 20 25 Наступний приклад ілюструє, але не обмежує, одержання азотнокислої солі сполуки 1-[2(2,4-дихлорфеніл)]-2-({4-[(2-феніл)-2Н-тетразол]бензил}окси)етил]-1Н-імідазолу (BL-137) згідно зі схемами реакцій 1 і 3, наведеними вище. ПРИКЛАД 3 У 3-горлу колбу, оснащену механічною мішалкою та зворотним холодильником, завантажували ТHF (120 мл) і NaН 60 % (24 г). До цієї суспензії повільно додавали розчин 1(2,4-дихлорфеніл)-2-(1Н-імідазол-1-іл)етанолу [1] (0,233 ммоль, 60 г в 600 мл ТHF), і отриманий розчин залишали при механічному перемішуванні протягом 30 хв. Після цього періоду часу реакційну суміш охолоджували на льодяній бані і до неї повільно додавали розчин 5-(4'(бромметил)дифеніл-3-а)-тритил-1Н-тетразолу [2] (0,223 ммоль; 129 г у 650 мл ТHF). Коли додатковий процес був завершений, льодяну баню видаляли і реакційну суміш залишали зі зворотним холодильником та витримували протягом 4 годин. Після цього періоду часу реакційну суміш охолоджували до кімнатної температури і до неї повільно додавали 560 мл води. Цю реакційну суміш екстрагували 600 мл етилацетату. Органічну фазу відокремлювали й екстрагували 5 % водним розчином лимонної кислоти (2 × 420 мл). Водні фази поєднували й екстрагували етилацетатом (2 × 300 мл). Органічні фази поєднували, сушили MgSO4. Розчинник випарювали за допомогою роторного випарника і виділяли масло жовтогарячого кольору. Сирий продукт реакції, отриманий на стадії А, розчиняли при 50 °C у 1650 мл ацетонітрилу. Після досягнення кімнатної температури додавали 1300 мл 1,5N водного розчину H2SO4. Цю суміш витримували при магнітному перемішуванні протягом 2 годин. Після цього додавали 2М водні розчини NaOH до досягнення рН, рівного 13. Реакційну суміш переганяли при температурі 65/70 °C з застосуванням вакууму для видалення ацетонітрилу. Матеріал, що залишився у початковій колбі, витримували при перемішуванні протягом 30 хв. при 30/35 °C. Осад, який 10 UA 108479 C2 5 10 15 20 утворився, фільтрували та промивали 600 мл суміші вода/ацетонітрил (80/20). Фільтрат екстрагували гарячим толуолом (4 × 450 мл). Водну фазу відбирали і, при нагріванні, додавали достатній об'єм оцтової кислоти до досягнення рН близько 7,0. При підтримці температури близько 55 °C додавали етилацетат. Цю суміш нагрівали й перемішували протягом 30 хв. Органічну фазу відбирали, і водну фазу екстрагували гарячим етилацетатом (3 × 500 мл). Органічні фази поєднували й сушили MgSO4. Розчинник видаляли за допомогою роторного випарника доти, поки не відбувалося формування щільної твердої речовини. Сирий продукт реакції охолоджували на льодяній бані при механічному перемішуванні протягом 2 годин. Осад відфільтровували та промивали 120 мл ацетонітрилу. Отриманий твердий продукт жовтувато1 білого кольору, сполука BL-137, мав наступні характеристики: ЯMР H (300 MГц-CDCl 3): 3.78 (1H, dd, J=9 і 15 Гц), 3.91 (1H, d, J=15 Гц), 4.08 (1H, dd, J=3 і 15 Гц), 4.67 (1H, d, J=15 Гц), 4.92 (1H, dd, J=3:09 Гц), 6.78 to 6.86 (2H, m), 6.96 to 7.04 (4H, m), 7.39 to 7.67 (8H, m), 7.98 to 8, 01 13 (1H, m). ЯMР C (125MГц-CDCl3): 52.2, 72.4, 76.8, 119.9, 124.8, 126.4, 128.0, 128.2, 128.6, 128.9; 129.6, 130.6, 130.7, 131.4, 133.1, 134.4, 135.1, 136.1, 136.9, 139.9, 140.7, 155.8.HRMS (масспектрометрія високої роздільності) розрах. для C25H20Cl2N6O (MH +) m/z 491.1154, отримано 491.1134; Температура плавлення: 93-96 °C. Таким чином, сполуки, що описані в даному винаході, можуть бути отримані на основі будьякої зі схем реакцій від 1 до 3 і будь-якого з описаних прикладів від 1 до 3 із застосуванням відповідних проміжних сполук. З метою ілюстрації, але не обмеження, деякі проміжні сполуки представлені в Таблиці 1: Таблиця 1 Ar R1 = R2 = R4 = R5 (R3)n R6 m Проміжна сполука I Проміжна сполука II N N N Pr ot N N N N N H N N N H 2.4(Cl)2 para N OH 1 Cl Cl X C l N Cl N OH N N H 2.4(Cl)2 1 para Cl Cl X CF N 3 N N N H H para 3 - CF 1 X 11 OH UA 108479 C2 Продовження таблиці 1 R1 = R2 = R4 = R5 Ar (R3)n R6 m Проміжна сполука I Проміжна сполука II N N N Pr ot N N N H N N N N H 2.4(Cl)2 para N N N N OH N OH 1 X C l N Cl N N N H N 2.4(Cl)2 1 para Cl Cl X CF N 3 N N N N N H H para 3 - CF OH 1 Cl X CF Cl 3 N N N N N H 2.4(Cl)2 N para 3 - CF OH 1 X 5 10 у якій термін "prot" представляє захисну групу, визначену в даному винаході, і "X" представляє елементи, обрані з групи, яка складається з Cl, Br, I, MS (метансульфонату) і TS (толуоленльфонатів). Сполуки за даним винаходом, а також їхні солі, сольвати, проліки, складні ефіри, енантіомери і/або фармацевтично прийнятні діастереоізомери, потенційно мають протимікробну активність, переважно протигрибкову активність. Зокрема, сполуки, описані в даному винаході, та їхні фармацевтично прийнятні солі, можуть застосовуватися як протигрибкові препарати, одночасно являючись фунгіцидами і/або фунгістатиками. Фунгіциди являють собою протигрибкові препарати, які руйнують цілісність і/або функціонування грибкової клітини, стимулюючи її смерть, у той час як фунгістатичні протигрибкові препарати являють собою засоби, що здатні запобігти росту і/або поділу грибкових клітин, роблячи їх статичними. Цікаво, що фунгіцидні препарати мають можливість 12 UA 108479 C2 5 10 15 20 25 30 35 40 45 очистити від грибкової інфекції хазяїна, а фунгістатичні препарати зазвичай не повністю виключають інфекцію. Крім того, сполуки, описані в даному винаході, застосовуються як інгібітори і/або сповільнювачі проліферації і/або виживання мікроорганізмів, таких як гриби, бактерії і/або найпростіші, особливо патогенні мікроорганізми. Гриби можуть паразитувати майже в кожній групі еукаріотичних організмів від одноклітинних організмів, таких як водорості й найпростіші, до складних рослин, тварин і самої людини. Мікроорганізми, такі як гриби, що викликають хвороби і/або розлади у рослин і/або тварин, називаються патогенними, більш точно патогенними мікроорганізмами. Зрозуміло, що при захворюванні, патологічному стані і/або розладі ненормальний стан організму, коли знижується одна або кілька функцій організму, пов'язаний із конкретними симптомами й ознаками, які можуть бути викликані зовнішніми факторами, такими як інвазивні організми, або внутрішніми факторами організму. Захворювання, клінічно виражені як патологічний стан у результаті проникнення в тіло патогенних мікроорганізмів, таких як віруси, бактерії, гриби, найпростіші, багатоклітинні паразити й білки, відомі як пріони, називаються інфекціями. Гриби, які є патогенними для ссавців, можна розділити на три морфологічні типи: (а) дріжджі, які є одноклітинними, розмножуються безстатевим шляхом і ростуть у вигляді колоній, (b) міцеліальні гриби, які є багатоклітинними, мають перегородку або асептичний гіф, можуть розмножуватися статевим шляхом, безстатевим або парасексуальним способом, і (iii) диморфні гриби, які можуть існувати в дріжджовій або міцеліальній формі в залежності від температури та умов навколишнього середовища. Міцеліальні гриби можна розділити на: (i), дерматофіти, і (ii) анемофіли. Зокрема, сполуки, що описані в даному винаході, їхні солі й сольвати, проліки, складні ефіри, енантіомери і/або фармацевтично прийнятні діастереоізомери можуть застосовуватися для лікування і/або попередження захворювань, викликаних первинними патогенними грибами, які можуть бути представлені, не обмежуючись такими, дерматофітами й диморфними грибами. Зрозуміло, що лікування набором засобів, таких як фармакологічні, хірургічні або фізичні, метою яких є лікування або полегшення захворювання або симптомів, здійснюється після постановки діагнозу. У той же час, попередження полягає в застосуванні засобів, щоб запобігти початку захворювання або появі симптомів і/або їхньому поширенню. Основними видами дерматофітів, що мають відношення до медицини, є Epidermophyton sp, Trycophyton sp і Microsporum sp, серед яких, можуть бути виділені наступні види: Trichophyton mentagrophytes, Trichophyton verrucosum, Trichophyton rubrum, Trichophyton shöenleinii, Trichophyton tonsurans, Trichophyton violaceum, Trichophyton concentricum, Microsporum gypseum, Microsporum canis, Microsporum audouinii і Epidermophyton floccosum. Серед диморфних грибів головними видами, важливими в медичному відношенні, є: Paracoccidioides brasiliensis, Histoplasma capsulatum, Blastomyces dermatiditis, Coccidioides immitis, Penicillium marneffei і Sporothrix schenckii. Протигрибкову дію сполук за даним винаходом оцінювали, використовуючи аналіз in vitro мінімальної інгібуючої концентрації (МІК) сполуки 1-[2-(2,4-хлорфеніл)-2-{[4(трифторметил)бензил]окси}етил]-1Н-імідазолу (BL-123). Протигрибкову активність сполуки BL-123 оцінювали для декількох штамів міцеліальних грибів дерматофітів, узятих із клінічних і лабораторних штамів, як показано в Прикладі 4. ПРИКЛАД 4 4.1 Культивування грибкових штамів. Для проведення експериментів за даним винаходом використовували штами грибів типу дерматофітів, які були отримані з клінічних і лабораторних штамів від інфікованих хворих, як зазначено в Таблиці 2. Таблиця 2 No. I II III IV Ідентифікація Найменування Клінічні штами 16404 Aspergillus Niger Trichophyton 2 mentagrophytes Microsporum 24 gypseum Trichophyton 381a verrucosum 13 UA 108479 C2 Продовження таблиці 2 No. V VI VII VIII IX X XI XII XIII 5 10 15 20 25 30 35 40 Ідентифікація 28188 373 Найменування Trichophyton rubrum Microsporum canis Trichophyton 381b verrucosum 455 Trichophyton rubrum Лабораторні штами 22019 Candida parapsilosis Trichophyton 40004 mentagrophytes 40005 Trichophyton rubrum Microsporum 40051 gypseum Trichophyton 9533 mentagrophytes Грибкові штами культивували на середовищі картопляного агару в похилому жолобі при температурі 30 °C протягом від 7 до 15 діб. 4.2 Установка для підготовки й тестування. Для експериментів застосовували сполуку 1-[2-(2,4-хлорфеніл)-2-{[4(трифторметил)бензил]окси}етил]-1Н-імідазолу (BL-123) в формі її солі азотної кислоти та нітрат міконазолу. Обидві сполуки розчиняли в диметилсульфоксиді (DMSO) так, щоб кінцева концентрація сполук відповідно була рівною або меншою, ніж 1 %. Методологія, використана для визначення чутливості мікроорганізму, заснована на мікророзведенні бульйонної культури згідно з методом, описаним у Standard М38-А (Референтний метод тестрозведень бульйонної культури для визначення чутливості міцеліальних грибів до протигрибкової терапії; NCCLS, volume 22 No. 16, USA, 2008), полягала в наступному. Гриб культивували відповідно до пункту 4.1. У пробірки, в яких вирощували гриби, додавали 5 мл фізіологічного розчину, щоб вилучити гриби з поверхні агару. Потім цю гомогенну суспензію переносили в нову пробірку і кількісно оцінювали колонієутворюючі одиниці (КУО) відповідно до методів підрахунку: (i) у чашках Петрі з агаром Сабуро з декстрозою та (ii) у камері Нейбауера. Потім штами грибів, наведених у Таблиці 2, інокулювали в двох паралельних дослідах у 963 лункові планшети. Був використаний інокулят від 2 до 6 × 10 КУО/мл грибів на лунку при загальному об'ємі 0,2 мл середовища RPMI-1640 (поживне середовище для імунобіологічної діагностики) (яке містить L-глутамін і при відсутності бікарбонату), забуференого при рН 7,0 MOPS (3-(N-морфолін)-15-пропансульфонова кислота). Процедуру здійснювали в ламінарному потоці. Сполуки, що підлягають тестуванню, в серійному розведенні в двох паралельних дослідах, при кінцевих концентраціях 16 мкг/мл; 8 мкг/мл, 4 мкг/мл, 2 мкг/мл, 1 мкг/мл, 0,5 мкг/мл; 0,25 мкг/мл; 0,125 мкг/мл; 0,0625 мкг/мл, або 0,03125 мкг/мл додавали в культуральне середовище, що знаходиться у кожній лунці. Інкубацію грибів із цими сполуками проводили протягом 4, 5, 6 і 7 днів при температурі від 30 до 35 °C. Кількісну оцінку росту грибів виконували для кожної лунки у порівнянні з ростом грибів, який відбувався в негативному контрольному експерименті, за допомогою дзеркального пристрою з інвертованою оптикою. Негативний контрольний експеримент представлений грибами, вирощеними в поживному середовищі без сполук, що підлягають тестуванню. Методологія цього порівняння полягає в кількісній оцінці росту грибів, для чого проводиться серія мікророзведень. При цьому методі значення 4 означає, що не спостерігається ніякого зниження росту. Значення 3 відповідає невеликому зниженню росту, який становить приблизно 75 % від росту грибів у негативному контрольному експерименті. Значення 2 відповідає значному скороченню росту грибів, або приблизно 50 % від їх росту в негативному контрольному досліді. Значення 1 означає, що спостерігається незначний ріст, який становить близько 25 % від росту в негативному контрольному досліді, а значення 0 відповідає оптично прозорому середовищу або відсутності росту грибів. 14 UA 108479 C2 5 10 У цьому експерименті, мінімальна інгібуюча концентрація (МІК) розглядається як найнижча концентрація агента, здатного інгібувати щонайменше 80 % росту колонієутворюючих одиниць (КУО). Результати, отримані в зазначеному експерименті, представлені в Таблиці 3, в якій наведене середнє значення MІК, отримане в чотирьох незалежних експериментах, які відносяться до 4 і 7 доби інкубації зі сполукою BL-123 або міконазолом. Сполука BL-123 за даним винаходом показала, що вона чинить інгібуючу дію на ріст 13 різних штамів грибів, які відповідають семи різним видам дерматофітів. Цікаво, що результати, представлені в Таблиці 3, показують, що деякі клінічні штами, стійкі до міконазолу (штами I, VII і VIII), у даному випадку чутливі до дії сполуки BL-123. Таблиця 3 Середні значення МІК, отримані протягом декількох діб, із показами на четверту й сьому добу Штами I II III IV V VI VII VIII IX X XI XII XIII 15 20 16404 2 24 381 28188 373 381 455 22019 40004 40005 40051 9533 Мікроорганізм Aspergillus Niger Trichophyton mentagrophytes Microsporum gypseum Trichophyton verrucosum Trichophyton rubrum Microsporum canis Trichophyton verrucosum Trichophyton rubrum Candida parapsilosis Trichophyton mentagrophytes Trichophyton rubrum Microsporum gypseum Trichophyton mentagrophytes Міконазол (мкг/мл) Доба 4 Доба 7 >16 >16 1 1 0.05 0.05 >16 >16 0.03 0.06 0.5 1 >16 >16 >16 >16 1 0.5 1 0.5 1 0.03 0.06 0.06 0.125 BL-123 (мкг/мл) Доба 4 Доба 7 8 8 4 4 0.25 0.25 >16 >16 0.03 0.03 0.125 0.5 4 >16 4 8 2 0.25 0.5 0.25 0.5 0.03 0.03 0.03 0.125 Інгібуюча дія сполуки BL-123 була підтверджена результатами, отриманими в експериментах, проведених для одержання значень мінімальної інгібуючої концентрації для інгібування 50 % тестованих штамів (MІК50), мінімальної інгібуючої концентрації для інгібування 90 % тестованих штамів (MІК90) і варіантів МІК (ВMІК), як описано в Таблиці 4. У цих експериментах ми виявили, що ефект інгібування BL-123 залишався тим же самим, коли ми використовували низькі концентрації сполуки для того, щоб інгібувати ріст 90 % популяції тестованих штамів. На відміну від цього, більша частина популяції тих же штамів при обробці міконазолом виявилася несприйнятливою до обробки у випадку, коли застосовували найнижчу концентрацію, при якій інгібується ріст 50 % популяції. Таблиця 4 Значення середніх MІК50 і MІК90 та варіантів MІК для тестованих протигрибкових препаратів n=13 MІК50 MІК90 ВМІК 25 Міконазол Середня MІК (мкг/мл) Доба 4 Доба 7 0.5 1 >16 >16 0.03→16 0.06→16 BL-123 Середня MІК (мкг/мл) Доба 4 Доба 7 0.25 0.5 4 8 0.03→16 0.03→16 Протимікробну активність сполук за даним винаходом вимірювали, використовуючи аналіз in vitro мінімальної інгібуючої концентрації (МІК) сполук 1-[2-(2,4-хлорфеніл)-2-{[4(трифторметил)бензил]окси}етил]-1H-імідазолу (BL-123) і 1-[2-(2,4-дихлорфеніл)]-2-({4-[(2феніл)-2H]бензил}окси)етил]-1H-імідазолу (BL-137). Протимікробну активність сполук BL-123 та BL-137 тестували на декількох штамах дріжджоподібних грибів і бактерій, як показано в Прикладі 5. 15 UA 108479 C2 5 ПРИКЛАД 5 5.1 Культивування дріжджових штамів і бактерій. Для експериментів за даним винаходом застосовували (i) штами дріжджів, отримані з клінічних штамів і лабораторних штамів, і (ii) бактеріальні штами, отримані з лабораторних штамів, як зазначено в Таблиці 5. Таблиця 5 Дріжджові й бактеріальні штами, використані для тестування Ідентифікація Найменування Лабораторні дріжджові штами XIV 10231 Candida albicans Клінічні дріжджові штами Candida XV 22019 parapsilosis XVI 2001 Candida glabrata Лабораторні бактеріальні штами Staphylococcus XVII 12228 epidermidis Staphylococcus XVIII 6538 aureus No. 10 15 20 25 30 35 40 5.1.a Культивування дріжджових штамів – приготування інокулюму. Штами дріжджів вирощували в поживному середовищі агар Сабуро з декстрозою, підтримуючи температуру 35 °C протягом 48 годин. 5.1.a Культивування бактеріальних штамів – приготування інокулюму. Бактеріальні штами вирощували в поживному середовищі триптон-соєвому агарі при температурі 35 °C протягом від двох до шести годин (або до одержання мутності розчину, яка відповідає стандарту мутності 0,5 за MакФарландом). 5.2 Порядок підготовки й тестування Для проведення експериментів використовували сполуку 1-[2-(2,4-хлорфеніл)-2-{[4(трифторметил)бензил]окси}етил]-1H-імідазолу (BL-123) в формі її азотнокислої солі, 1-[2-(2,4дихлорфеніл)]-2-({4-[(2-феніл)-2H-тетразол]бензил}окси)етил]-1H-імідазол (BL-137) і нітрат міконазолу. Сполуки розчиняли в диметилсульфоксиді (DMSO), підганяючи кінцеву концентрацію сполуки до рівної або меншої, ніж 1 %. 5.2.а Дріжджові штами Методологія, використовувана для тестування чутливості збудника, являла собою мікророзведення в бульйоні відповідно до методу, описаного в Standard M27-A2 (Референтний метод тестрозведень бульйонної культури для визначення чутливості дріжджів до протигрибкової терапії – друге видання, NCCLS, volume 22 number 15, USA, 2002), наступним чином. Штами дріжджів вирощували відповідно до пункту 5.1.а для одержання культури, яка містить 6 6 від 1 × 10 до 5 × 10 КУО/мл. Потім суспензії розбавляли в поживному середовищі RPMI-1640 (забуференому MOPS 0,165 моль/л) до кінцевої концентрації від 50 до 2500 КУО/мл. Розведені суспензії інокулювали в двох паралельних дослідах у 96-лункові планшети. Процедуру проводили в ламінарному потоці. Тестовані сполуки в серійному розведенні при кінцевих концентраціях 16 мкг/мл; 8 мкг/мл; 4 мкг/мл; 2 мкг/мл; 1 мкг/мл; 0,5 мкг/мл; 0,25 мкг/мл; 0,125 мкг/мл; 0,0625 мкг/мл; або 0,03125 мг/мл додавали в поживне середовище в кожній лунці. Інкубування грибів із цими сполуками виконували протягом 48 годин при температурі від 30 до 35 °C. 5.2.b Культивування бактеріальних штамів Методологія, використовувана для тестування чутливості збудника, являла собою мікророзведення в бульйоні згідно з методом, описаним у Standard M7-A6 (Методологія тестів на чутливість до антибактеріальних препаратів за допомогою розведення для бактерій, які ростуть у кисневій атмосфері - 6th Edition: NCCLS, volume 23, No. 2, USA, 2003), наступним чином. 16 UA 108479 C2 5 10 15 Бактеріальні штами вирощували відповідно до пункту 5.1.b для одержання культури, яка 7 7 містить від 1 × 10 до 5 × 10 КУО/мл. Потім суспензії розбавляли в поживному середовищі 4 Mueller Hinton до кінцевої концентрації 5 × 10 КУО/мл. Розведені суспензії інокулювали в 0,1 мл у 24-лункові планшети в двох паралельних експериментах. Процедуру проводили в ламінарному потоці. Сполуки, які підлягають тестуванню, в серійному розведенні, у двох паралельних експериментах, з кінцевими концентраціями 16 мкг/мл; 8 мкг/мл; 4 мкг/мл; 2 мкг/мл; 1 мкг/мл; 0,5 мкг/мл; 0,25 мкг/мл; 0,125 мкг/мл; 0,0625 мкг/мл; або 0,03125 мг/мл у 0,9 мл додавали в поживне середовище в кожній лунці. Інкубування грибів із цими сполуками виконували протягом 24 годин при температурі від 30 до 35 °C. Після інкубування спостерігали ріст мікроорганізмів неозброєним оком за наявністю мутності або присутністю осаду на дні жолоба. Ми встановили в цьому експерименті, що мутне середовище є результатом росту мікроорганізмів, а присутність осаду й прозоре середовище означають відсутність росту мікроорганізмів. Мінімальну інгібуючу концентрацію (МІК) визначали як найнижчу концентрацію випробовуваного препарату, яка запобігає будь-якому ступеню бактеріального росту. Було показано, що сполуки за даним винаходом BL-123 і BL-137 чинять інгібуючу дію на ріст трьох різних видів дріжджів і двох різних видів бактерій, як представлено в Таблиці 6 нижче. 20 Таблиця 6 Значення МІК для штамів дріжджів і бактерій Штами XIV XV XVI XVII XVIII 25 30 35 40 45 10231 22019 2001 12228 6538 Мікроорганізм Candida albicans Candida parapsilosis Candida glabrata Staphylococcus epidermidis Staphylococcus aureus Міконазол (мкг/мл) 4.0 2.0 0.125 2.0 2.0 BL-123 BL-137 8.0 4.0 0.125 4.0 4.0 512.0 512.0 512.0 128.0 128.0 Спостерігаючи результати цього експерименту, ми прийшли до висновку, що сполуки за даним винаходом чинять інгібуючу дію на ріст мікроорганізмів і тому можуть застосовуватися як протимікробні препарати, переважно, проти грибів і бактерій. Зрозуміло, що для того, щоб бути противомікробним, будь-який препарат повинен бути хімічною сполукою, яка руйнує або інгібує ріст мікроорганізмів, таких як гриби, бактерії і/або найпростіші, або яка здатна знищувати віруси. Сполуки за даним винаходом призначені для застосування проти грибів, приклади яких включають, не обмежуючись такими, роди: Aspergilus, Microsporum, Epidermophyton, Trichophyton, Candida, Phycomyces, Zygomyces, Rhizopus, Mucor, Absidia, Malassezia, Exophiala, Piedraia, Trichosporum, Sporothrix, Cladosporium, Phialophora, Fosecaea, Histoplasma, Coccidioides, Fusarium, Penicillium, Blastomyces, Cryptococcus, Paracoccidioides, Scedosporium, Sacharomyces, Piedraia, Actinomyces, Keratinomyces, Nannizia, Arthroderma, Ctenomyces, Olpidium, Physodema, Synchytrium, Phytophora, Verticillium, Gliocladium, Rhytisma, Sclerotinia, Ophiostoma, Lophiodermium, Elsinoe, Capnodium, Mycosphaerella, Venturia, Gaeumannomyces, Alternaria, Bipolaris, Botrytis, Cercospora, Diplodia, Dreschlera, Exerohilum, Phoma, Phomopsis, Rhisoctonia, Puccinia, Erysphe, Phyllactinia, Uncinula, Phragmidium, Melampsora, Eutypha, Hypоkсulon, Xylaria, Ceratobasidium, Heterobasidium, Thanatephorus, Armillaria та інші. Приклади бактерій, проти яких призначені сполуки за даним винаходом, можуть являти собою роди: Actinomyces, Corynebacterium, Mycobacterium, Nocardia, Bacillus, Bifidobacterium, Clostridium, Erysipelothrix, Listeria, Staphylococcus, Streptococcus, Pneumococcus, Anaplasma, Ehrlichia, Neorickettsia, Wolbachia, Bacterioides, Bartonella, Bordetella, Borrelia, Brucella, Burkholderia, Campylobacter, Chlamydia, Chlamydophila, Escherichia, Klebsiella, Proteus, Salmonella, Serratia, Yersinia, Fusobacterium, Helicobacter, Acinetobacter, Mycoplasma, Ureaplasma, Neisseria, Meningococcus, Actinobacillus, Haemophilus, Pasteurella, Pseudomonas, Rickettsia, Treponema та інші. Приклади найпростіших, проти яких призначені сполуки за даним винаходом, можуть являти собою роди: Plasmodium, Toxoplasma, Balantidium, Coccidia, Cryptosporidium, Cylospora, Isospora, Sarcocystis, Babesia, Theileria, Dientamoeba, Giárdia, Leishmania, Acanthamoeba, Blastocystis, Anaplasma, Ehrlichia, Trychomonas, Trypanosoma, Giardia, Entamoeba та інші. 17 UA 108479 C2 5 10 15 20 25 30 35 40 45 50 55 60 Сполуки, описані в даному винаході, а також їхні солі, сольвати, проліки, складні ефіри, енантіомери і/або їхні фармацевтично прийнятні діастереоізомери, можуть застосовуватися для виготовлення лікарського препарату для лікування і/або попередження патологічних станів і/або захворювань, асоційованих із мікроорганізмами, такими як гриби, бактерії і/або найпростіші. Крім того, сполуки, описані в даному винаході, а також їхні солі, сольвати, проліки, складні ефіри, енантіомери і/або їхні фармацевтично прийнятні діастереоізомери, можуть застосовуватися для виготовлення лікарського препарату для інгібування проліферації і/або виживання мікроорганізмів, таких як гриби, бактерії і/або найпростіші, особливо патогенні мікроорганізми. Таким чином, даний винахід забезпечує спосіб лікування і/або запобігання патологічних станів і/або захворювань, асоційованих із мікроорганізмами, такими як гриби, бактерії і/або найпростіші, наприклад, із дерматофітами, дріжджами, міцеліальними грибами не дерматофітами, грампозитивними та грамнегативними бактеріями й найпростішими, у ссавців шляхом введення щонайменше однієї сполуки, описаної Формулою (I) за даним винаходом, та її солей, сольватів, проліків, складних ефірів, енантіомерів і/або фармацевтично прийнятних діастереоізомерів. Даний винахід забезпечує також спосіб інгібування проліферації і/або виживання мікроорганізмів, таких як гриби, бактерії і/або найпростіші, особливо патогенні мікроорганізми. Таким чином, ми вважаємо, що забезпечені доведеною ефективністю сполуки Формули (I) та їхні фармацевтично прийнятні солі, становлять інтерес для терапії, особливо для лікування і/або попередження в індивідуума патологічних станів і/або захворювань, асоційованих із мікроорганізмами, такими як гриби, бактерії і/або найпростіші. Під індивідуумом мається на увазі організм, який являє собою як зовсім незалежну фізіологічну одиницю, так і окремий генотип. Хвороби, які уражають людей, викликані патогенними грибами, називають мікозами. Мікози можуть бути розділені на три групи в залежності від місця розташування й глибини, на яких вони проявляються в організмі, а саме: (i) поверхневі мікози: інфекції на поверхні шкіри, нігтів, волосся, слизової оболонки і/або волосся, (ii) підшкірні мікози, викликані грибами, здатними проникати в глибокі шари шкіри, такі як підшкірна тканина, сполучна тканина й кісткова тканина, і (iii) системні мікози (або глибокі): найбільш важкі грибкові інвазивні інфекції, якими можна заразитися при вдиханні спор патогенних грибів, які залишаються й ростуть у легенях, і досягають кровотоку, і можуть інфікувати інші внутрішні органи тіла. Основні поверхневі мікози викликаються дерматофітами (грибами, що уражають шкіру) і називаються дерматомікозом (дерматофітією). Прикладами найпоширеніших дерматомікозів можуть бути: (i) грибкове ураження волосистої частини (шкіри голови), викликане різними дерматофітами, такими як M. Canis (мікроспорія волосистої частини голови), T. tonsurans (оперезуючий лишай), T. mentagrophytes, E. floccosum, M. gypseum (керіон), T. violaceum, T. schoenleinii (грибкове захворювання ніг), T. verrucosum і T. schönleinii, (ii) дерматомікоз бороди й вусів, викликаний T. rubrum і T. Mentagrophytes, (iii) трихофітія гладкої шкіри тулуба, найбільш часто викликана T. rubrum, T. mentagrohytes і M. kennels, (iv) дермофітія ступнів (ніг і рук), часто викликана T. rubrum, T. mentagrohytes і E. Floccosum, (v) дерматомікоз промежини (паховий), викликаний T. rubrum, T. mentagrohytes і E. Floccosum, (vi) грибкове ураження вуха, викликане M. kennels, (vii) черепицеподібний лишай, викликаний T. Concentricum, (viii) дерматофітія нігтів (грибкова оніхія), викликана головним чином різними дерматофітами, родів Trichophyton, Epidermophyton, рідко Microsporum; Крім того, гриби, які, звісно, не є патогенними для людини, можуть розвити опортуністичні інфекції, вторинні стосовно інших, раніше існуючих патологічних станів і ослабленої імунної системи хазяїна. Основними прикладами грибів, які викликають опортуністичні інфекції, є: (i) міцеліальні гриби, які здебільшого належать до роду Aspergillus sp, Fusarium sp, Scedosporium sp, мукорові й темнозабарвлені пігментовані гриби та (ii) дріжджі, які здебільшого належать до родів Candida sp, Cryptococcus sp, Trichosporon sp, Rhodotorula SP, Malassezia sp і Saccharomyces sp. Прикладами клінічно значимих дерматозів, викликаних іншими умовно-патогенними міцеліальними грибами, можуть служити (i) різнокольоровий (висівкоподібний) лишай (шкіри), викликаний Malassezia furfur; (ii) пітироспорум-фолікуліт, викликаний грибами Malassezia furfur, інфекція волосся й сальної залози; (iii) чорний лишай (долонь і рук або боків пальців), викликаний Cladosporium werneckii; (iv) чорна п'єдра (волосся), викликана грибом Piedraia hortai. Крім того, можна також послатися на приклади захворювань, викликаних умовнопатогенними грибковими дріжджами, таких як (i) трихоспороноз, викликаний дріжджовим грибком Trichosporon beigelii, який підрозділяється на білу п'єдру (волосся) та трихоспороноз статевих органів і паху (сип на статевих органах і паховій області), (ii) кандидоз, викликаний 18 UA 108479 C2 5 10 15 20 25 30 35 40 45 50 55 60 Candida sp, найбільш часто представлений C. albicans, але, як було знайдено, також виявили види C. tropicalis, C. parapsilosis, C. Guilliermondii, і кандидоз може бути підрозділений на оральний кандидоз, вульвовагінальний кандидоз, кандидоз голівки статевого члена, інтертригінозний кандидоз, шкірно-слизовий кандидоз і фолікулярний кандидоз. Серед глибоких мікозів існують: (i) паракокцидіоїдомікоз, викликаний Paracoccicioides brasiliensis, який проявляється через форми зовнішніх покривів шкіри, форми слизових оболонок, форми лімфатичних вузлів, Vicere форми та в інших органах і змішаних формах, (ii) лобомікоз, викликаний Paracoccidioides loboi, (iii) хромобластомікоз або хромомікоз, викликається пігментованими грибами, такими як Fosecaea pedrosoi, Fosecaea compacta, Cladosporium cartionii, Phialophora verrucosa і Rhinocladiella aquaspersa; (iv) споротрихоз, викликаний Sporothrix schenckii, і проявляється в зовнішніх шкірних і поза-шкірних формах, (v) мадурська стопа, викликана деякими грибами, які включають Pietriellidium boydii, Cephalosporium sp, Madurella sp, Pyrenochaeta sp, Exophiala sp; (vi) гістоплазмоз, викликаний Histoplasma capsulatum, (vii) феогіфомікоз, викликаний грибами Exophiala jeanselmei, Wangiella dermatitis, Cladosporium bantiasenum, Alternaria alternada, Exophiala moniliae, Exophiala spinifera, Phialophora verrucosa, Phloma sp, Curvularia geniculata, Mycelia sterilia; (viii) ентомофторомікоз, викликаний грибами Basidiobolus haptosporus, Conidiobolus coranatus або Conidiobolus incongrus; (ix) мукормікоз, викликаний грибом Absidia corymbifera, Rhizomucor pussilus, ramossimus Mucor, Rhizopus microsporus, Rhizopus oryzae, Rhizopus rhizopodiformis, Cunninghamella Berthollet, Saksenae vasiformis; (x) криптококоз, викликаний Cryptococcus neoformans; (xi) кокцидіоїдомікоз, викликаний Coccidoides immitis; (xii) північноамериканський бластомікоз, викликаний Bastomyces dermatitis, (xiii) риноспоридіоз, викликаний Rhinosporidium seeberi. Зокрема, сполуки Формули (I) за даним винаходом можуть застосовуватися, не обмежуючись наступним, для лікування або попередження патологічних станів і/або захворювань, таких як мікроспоритія волосистої частини голови, оперізуючий лишай, глибока трихофітія (керіон), грибкове захворювання ніг, аліментарно-токсична алейкія, дерматомікоз бороди й вусів, трихофітія гладкої шкіри тулуба, дермофітія стопи, дерматомікоз промежини, грибкове ураження вуха, черепицеподібний лишай, дерматофітія нігтів, різнокольоровий пітиріаз, пітироспорум-фолікуліт, чорний лишай, чорна п'єдра, трихоспороноз, оральний кандидоз, вульвовагінальний кандидоз, кандидоз голівки статевого члена, інтертригінозний кандидоз, кандидоз мигдалин і/або кандидоз слизової оболонки. Захворювання, викликані грибами, які уражають рослини, мають велике значення, оскільки паразити є для них руйнівними. Вони зустрічаються в основному на культурних рослинах, що завдає значний збиток сільському господарству. Ці захворювання можуть являти собою іржу, цвіль, сажу або цвілевий гриб, залежно від збудника, а деякі гриби також можуть виробляти токсини - мікотоксини. Мікотоксини можуть викликати захворювання у людей, зокрема такий токсин, як афлатоксин, вироблюваний грибами Aspergillus flavus, який є потенційним канцерогеном для людини. Прикладами патологічних станів і/або захворювань, пов'язаних із бактеріями, які можна лікувати і/або попередити за допомогою введення сполук за даним винаходом, можуть бути, не обмежуючись такими: актиномікоз, хвороба Уіпла, дифтерія, еритразма, проказа, виразка Бурулі, паратуберкульоз, туберкульоз, туберкулома, перикардит, еритема, міцетома, сибірська виразка, ботулізм, ентероколіт, ентеротоксемія, газова гангрена, правець, бешихове запалення, менінгіт, пневмонія, фурункульоз, імпетиго, ендокардит, ревматоїдна лихоманка, анаплазмоз, ерліхіоз, ангіоматоз, бруцельоз, меліоїдоз, кон'юнктивіт, лімфогранулема венерична, трахома, орнітоз, дизентерія, гранулема, черевний тиф, паратифозна лихоманка, гінгівіт, легіонельоз, лептоспіроз, плевропневмонія, гонорея, тиф, плями на шкірі, сифіліс, рак, нейросифіліс, туляремія, холера та інші. Прикладами патологічних станів і/або захворювань, асоційованих із найпростішими, які можна лікувати і/або попередити за допомогою введення сполук за даним винаходом, можуть бути, не обмежуючись такими: малярія, токсоплазмоз, балантидіаз, кокцидіоїдоз, криптоспоридіоз, циклоспороз, ізоспороз, саркоцистоз, бабезіоз, дурина, тейлеріоз, трипаносомоз, дієнтамебіаз, амебіаз, лямбліоз, лейшманіоз, трихомоніаз, хвороба Шагаса, амебіаз, амебна дизентерія та інші. Сполуки, описані Формулою (I) за даним винаходом, та їхні солі, сольвати, проліки, складні ефіри, енантіомери і/або фармацевтично прийнятні діастереоізомери можна вводити за допомогою будь-яких підходящих способів, таких як місцево, орально, парентерально, внутрішньочеревинно і/або вагінально. Фармацевтичні композиції, що містять як активну речовину ефективну кількість похідних Формули (I) або їхніх солей, сольватів, проліків, складних ефірів, енантіомерів і/або 19 UA 108479 C2 5 10 15 20 25 30 фармацевтично прийнятних діастереоізомерів, окремо або в суміші, щонайменше двох сполук Формули (I) за даним винаходом, можуть бути представлені в формі рідини, напівтвердої або твердої речовини, такої як, не обмежуючись такими, (i) креми, гелі, гель-креми, гідрогелі, порошки, мазі, лосьйони або емульсії, (ii) капсули, не обов'язково покриті, жувальні, шипучі, багатошарові або розчинні, (iii) капсули будь-якого роду, такі як, тверда капсула, гелеподібна м'яка капсула і крохмальна; (iv) капсули, (v) пост-дисперсійні або шипучі, (vi) таблетки, (vii), гранули, не обов'язково у вигляді мікрочастинок чи мікрокапсул або у вигляді векторизованих препаратів, таких як ліпосоми, (viii) не обов'язково місцеві, оральні, назальні або офтальмологічні розчини; (ix), свічки, (х) сиропи, (xi) суспензії; (xii) ін'єкції, у тому числі для підшкірного, внутрішньошкірного, внутрішньом'язового й внутрішньовенного введення, та інші. Крім того, у даному винаході представлені фармацевтичні композиції контрольованої дії, швидкої дії, пролонгованої дії та уповільненої дії. Фармацевтичні композиції, а також лікарські препарати, які містять сполуки, описані в даному винаході, а також їхні солі, сольвати, проліки, складні ефіри, енантіомери і/або фармацевтично прийнятні діастереоізомери, застосовуються для лікування патологічних станів, викликаних грибами і/або іншими мікроорганізмами, такими як бактерії і/або найпростіші, у ссавців. Фармацевтичні композиції, що містять як активні речовини описані в даному винаході сполуки, а також їхні солі, сольвати, проліки, складні ефіри, енантіомери і/або фармацевтично прийнятні діастереоізомери, можуть містити ці сполуки окремо або у вигляді їхніх суміші та в сполученні з іншою активною речовиною. Для введення ссавцям під час профілактики або лікування патологічних станів, викликаних грибами і/або іншими мікроорганізмами, такими як бактерії і/або найпростіші, дозування сполук, описаних у Формулі (I), знаходиться у діапазоні від 0,001 до 1000 мг на добу для пацієнта, який цього потребує. На практиці лікар повинен визначити найбільш підходящу систему стандартних доз для кожного пацієнта, яка варіюється залежно від віку, ваги пацієнта й індивідуальної реакції. Приклади, які можуть проілюструвати кілька фармацевтичних композицій для місцевого застосування, що містять сполуки Формули (I) за даним винаходом, можуть бути, не обмежуючись цим, описані нижче. ПРИКЛАД 6 Tаблиця 7 Композиція у вигляді протигрибкового крему Опис BL-123 Цетиловий спирт Безводний ланолін Ізопропілмірістат Пропіленглікольмоностеарат Meтилпарабен Сорбітанмоностеарат Пропіленгліколь Пропілпарабен Полісорбат 60 Ароматизатор DMSO (диметилсульфоксид) Очищена вода QSP (достатня кількість) 35 40 Кількість на 100 г продукту 1.000 6,000 6,000 10,000 4.000 0.100 4.000 10,000 0.050 6,000 0.00 дo 0.50 0.00 до 5.00 100.000 Одиниці г г г г г г г г г г г г г Спосіб одержання: У першій ємності нагрівали воду при температурі 75 °C ± 5 °C й розчиняли метилпарабен і пропілпарабен. У другій ємності при температурі 75 °C ± 5 °C нагрівали безводний ланолін, полісорбат 60, сорбітанмоностеарат, цетиловий спирт, пропіленглікольмоностеарат і ізопропілмірістат до повного розплавлення. Вміст першої ємності додавали до вмісту другої ємності при перемішуванні і потім охолоджували до температури 45 °C ± 5 °C. До цієї суміші повільно додавали активну речовину BL-123, пропіленгліколь, і, не обов'язково, DMSO. Отриману суміш охолоджували до температури 30 °C (25-35 °C) і до неї, не обов'язково, могли додавати ароматизатор. До загальної маси додавали воду і суміш гомогенізували. 20 UA 108479 C2 ПРИКЛАД 7 Таблиця 8 Протигрибкова композиція в порошковій формі Опис BL-123 Колоїдний діоксид кремнію Оксид цинку Ароматизатор Тальк (Фарм. Рівень.) QSP 5 Кількість на 100 г продукту 1.000 1.00 5.00 0.00 до 0.50 100.00 Одиниці г г г г г Діоксид кремнію змішували з ароматизатором і потім пропускали через сито 60 меш. В окремій ємності змішували активну речовину BL-123, оксид цинку й фармацевтично прийнятний тальк і пропускали через сито 40 меш. Після цього процесу порошки змішували. ПРИКЛАД 8 Taблиця 9 Композиція в формі протигрибкового лосьйону Опис BL-123 Макрогол 300 Ароматизатор DMSO (диметилсульфоксид) Пропілен QSP 10 15 20 25 30 35 Кількість на 100 мл продукту 1.00 50.00 0.00 до 0.50 0.00 до 5.00 100.00 Одиниці г г г г мл У ємність із достатньою місткістю додавали Macrogol 300 і пропіленгліколь та нагрівали при температурі від 60 °C до 70 °C. Потім при перемішуванні додавали активну речовину BL-123 і, не обов'язково, DMSO при температурі 60 °C – 70 °C і перемішували до повного розчинення. Суміш охолоджували до температури 30 °C і, не обов'язково, могли додавати ароматизатор. Кінцевий об'єм доповнювали пропіленгліколем і перемішували до одержання лосьйону. Сполуки, що, як припускають, є протигрибковими, можуть бути асоційовані з мішенями, як описано, але не обмежуються такими: [Amaral, AC et al "Therapeutic targets in Paracoccdioides brasiliensis: post-transcriptome perspectives" Gent Mol Res 4 (2): 430-449. 2005] (i) синтазами, такими як (а) 1,3-глюкан синтаза, яка має відношення до вірулентності грибів, і (b) хітин-синтаза, залучена до синтезу хітину, який зустрічається винятково в грибах; а також (ii) ферментами, що реконструюються, такими як (а) манозилтрансфераза, що грає важливу роль у формуванні структури клітинної стінки, адгезії й вірулентності; (b) трансглюкозидази, залучені в кінцеву архітектуру гриба, і (с) гідролази, які мають кілька ролей у морфогенетичних подіях. (iii) плазматичними мембранними компонентами, такими як (а) стерол - ергостерол, який представляє істотний компонент у цитоплазматичній мембрані і таким же чином унікальне явище в грибах; (б) компоненти метаболічного шляху сфінголіпідів, таких як інозитолфосфорилцерамід, які представляють різні гриби; і (с) протонні АТФази, які є необхідними для підтримки клітинного гомеостазу за допомогою регулювання йонного обміну в клітині. (iv) молекулярними компонентами, такими як (а) топоізомерази, які являють собою ферменти, що впливають на реплікацію, транскрипцію, рекомбінацію й сегрегацію хромосом, і чиї відмінності між клітинами людини й дріжджовими клітинами можуть бути використані при молекулярному моделюванні; (b) фактори елонгації, які необхідні для синтезу білка, як, наприклад, фактор елонгації 3, присутній у грибів і відсутній у інших організмів, включаючи людину, (c) Hsp90 являє собою білок, високо консервативний серед різних організмів і, очевидно, асоціюється з патогенністю грибів; (d) N-мірістоїлтрансфераза, відповідальна за перенос мірістату на амінотермінальний залишок гліцину, ряду білків еукаріотичних клітин, необхідна для виживання грибів, і чиї відмінності між формами людини та грибів уже виявлені; і (е) пренілтрансферази, відповідальні за пренілювання білків, які беруть участь у різних 21 UA 108479 C2 5 10 15 клітинних функціях, таких як ріст клітин, диференціація, сигнальна трансдукція, поряд з іншими, які мають слабку подібність із людськими формами. (v) білками, що беруть участь у передачі клітинних сигналів, такими як (а) кальциневрин, специфічна серин-треонінова фосфатаза, збережена в еукаріот, яка відіграє вирішальну роль у підтримці клітинного гомеостазу через контроль внутрішньоклітинного кальцію в умовах стресу і пов'язана з вірулентністю гриба; і (b) ТOR, які представляють білки, пов'язані з фосфатидилінозитол кіназою, відомі своєю залученістю до клітинного росту у відповідь на мітогенні сигнали. (vi) компонентами клітинного метаболізму, такими як (а) гліоксилатний цикл, який є альтернативним способом, коли гриб одержує енергію, при цьому в процесі беруть участь ферменти ізоцитрат-ліаза й малат-синтаза; (b) уреазa, що являє собою металофермент, відповідальний за гідроліз сечовини до карбамату, який збільшує рН. Те ж саме представляє грибковий патогенний фактор, відсутній в організмі людини; і (с) уратоксидаза, фермент шляху пуринового розпаду, залучається до викрадення грибкових вільних радикалів, відіграючи істотну роль у їхньому виживанні і характеризуючись тим, що цей шлях відсутній у людей. (vii) істотними генами, такими як (а) CDC28 і (b) Civ1, які залучені до основного клітинного циклу грибів. ФОРМУЛА ВИНАХОДУ 20 1. Бензиларалкілові прості ефіри сполук, які характеризуються формулою (І): n 1 2 * 4 5 m 25 30 35 , (I) їх солі, енантіомери та/або фармацевтично прийнятні діастереоізомери, де: Аr являє собою імідазоліл; R1, R2, R4 і R5 незалежно являють собою водень; R3 являє собою галоген; R6 являє собою трифторметил; n являє собою ціле число від 1 до 2; і m являє собою 1. 2. Сполуки за п. 1, де вони додатково являють собою солі фармацевтично прийнятних кислот. 3. Сполука за п. 1, де сполука являє собою 1-[2-(2,4-дихлорфеніл)-2-{[4(трифторметил)бензил]оксі}етил]-1H-імідазол; або її фармацевтично прийнятні солі. 4. Сполуки за будь-яким із пунктів 1-3, які мають антигрибкову, антибактеріальну та/або антипаразитичну активність. 5. Спосіб одержання сполук за будь-яким із пунктів 1-3, в якому здійснюють взаємодію сполуки формули (II) і сполуки формули (III): OH Ar * R1 (R3)n R2 , (II) 22 UA 108479 C2 X R4 R5 (R6 )m 5 10 15 20 25 30 , (III) у придатному реакційному середовищі, де: Аr являє собою імідазоліл; R1, R2, R4 і R5 незалежно являють собою водень; R3 являє собою галоген; R6 являє собою трифторметил; n являє собою ціле число від 1 до 2; m являє собою 1; і X являє собою елементи вибрані з групи, яка складається з Сl, Вr або І. 6. Спосіб одержання сполук за п. 5, який відрізняється тим, що викристовують реакційне середовище, що включає: (a) полярний органічний розчинник, (b) розчин сильної основи з концентрацією в інтервалі від 20 до 70 % (маса/об'єм) і (c) основну органічну сіль з концентрацією в інтервалі від 0,001 до 0,1 г/мл у загальному об'ємі реакційного середовища. 7. Спосіб за п. 6, який відрізняється тим, що використовують: (a) полярний органічний розчинник, вибраний з групи, яка складається з ацетону, метилетилкетону та їх суміші; (b)сильну основу, вибрану з групи, яка складається з гідроксиду натрію та гідроксиду калію, або (c) основну органічну сіль, що являє собою бензилтриетиламонійхлорид. 8. Спосіб за п. 5, який відрізняється тим, що зазначені проміжні сполуки (II) і (III) мають захисну групу, необов'язково вибрану з групи, яка складається з тритилу, N,N-диметилсульфонаміду, пметоксифенілсульфонаміду, бензенсульфонаміду, 2,2,2-трихлоретилкарбамату, tбутилкарбамату, N-2-хлоретиламіну, N-триізопропілсиліламіну, N-2-нітробензиламіну та/або N2-тетрагідропіраніламіну. 9. Застосування сполук за будь-яким із пунктів 1-3, або їх сумішей, для виготовлення лікарського препарату для лікування та/або попередження патологічних станів і/або захворювань в індивідуума, асоційованих із мікроорганізмами. 10. Застосування за п. 9, де мікроорганізми являють собою гриби, бактерії або найпростіші. 11. Спосіб лікування та/або попередження патологічних станів і/або захворювань, асоційованих із мікроорганізмами, який включає введення ефективної кількості щонайменше однієї сполуки за будь-яким із пунктів 1-3 або їх сумішей ссавцеві. 23 UA 108479 C2 24 UA 108479 C2 25 UA 108479 C2 26 UA 108479 C2 Комп’ютерна верстка Л. Ціхановська Державна служба інтелектуальної власності України, вул. Василя Липківського, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут інтелектуальної власності”, вул. Глазунова, 1, м. Київ – 42, 01601 27
ДивитисяДодаткова інформація
Назва патенту англійськоюBenzyl aralkyl ether compounds, method for preparing same, intermediate compounds, use of said compounds, method for treatment and/or prevention, pharmaceutical composition and medicament containing same
Автори англійськоюKeppler, Artur Franz, Sacurai, Sergio Luiz, Zaim, Marcio Henrique, Touzarim, Carlos Eduardo da Costa
Автори російськоюКепплер Артур Франц, Сакураи Серджио Луиз, Заим Марсио Энрике, Тоузарим Карлос Эдуардо да Коста
МПК / Мітки
МПК: C07D 233/56, A61P 31/04, A61P 31/10, A61K 31/4196, C07D 257/06, C07C 15/14, A61K 31/4174, A61P 33/02
Мітки: спосіб, захворювань, отримання, сполук, профілактики, застосування, ефіри, прості, бензиларалкілові, таких, лікування
Код посилання
<a href="https://ua.patents.su/29-108479-benzilaralkilovi-prosti-efiri-sposib-kh-otrimannya-zastosuvannya-takikh-spoluk-ta-sposib-likuvannya-i-abo-profilaktiki-zakhvoryuvan.html" target="_blank" rel="follow" title="База патентів України">Бензиларалкілові прості ефіри, спосіб їх отримання, застосування таких сполук та спосіб лікування і/або профілактики захворювань</a>
Попередній патент: Фармацевтична композиція, що містить ефір дгк, для парентерального введення
Наступний патент: Склади у вигляді везикул для лікування запальних дерматозів
Випадковий патент: Фунгіцидна композиція