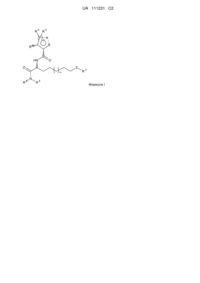
Тіопохідні лактамів як високоактивні інгібітори hdac та їх застосування як лікарського засобу
Номер патенту: 111231
Опубліковано: 11.04.2016
Автори: Пізано Клаудіо, Фанто' Нікола, Віньола Давіде, Кабрі Валтер, Баттістуцци Джанфранко, Веши Лоредана, Джанніні Джузеппе
Формула / Реферат
1. Сполука, що має загальну Формулу (І)
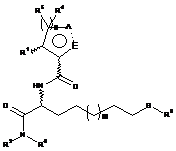 , Формула І
, Формула І
де
R1 являє собою Н, (С1-С6)-алкіл або арил; або альтернативно
R1 й один R4, кожний з яких зв'язаний з двома сусідніми атомами вуглецю, у випадку, якщо n дорівнює 2 або 3, об'єднані з утворенням циклопропанового кільця;
R2 являє собою феніл, можливо заміщений галогеном, бензилокси, (С1-С3)-алкілом або CF3; (С3-С6)-циклоалкіл; арил-(С1-С6)-алкіл, де арил можливо заміщений бензилокси, (С1-С3)-алкілом або CF3;
R3 являє собою Н, РО(ОН)2 або групу Формули (II)
![]() , Формула II
, Формула II
R7 являє собою (С1-С7)-алкіл, (С1-С6)-алкокси або -CH(NH2)R8;
R8 являє собою Н або бічний ланцюг природної a-амінокислоти;
R4 й R5 у кожному випадку незалежно являють собою Н, галоген, (С1-С6)-алкіл, або, як альтернатива,
якщо n дорівнює 2 або 3, то один R4 й один R5, кожний з яких зв'язаний з двома сусідніми атомами вуглецю, об'єднані з утворенням циклопропанового кільця;
R6 являє собою Н, або, як альтернатива,
R2 й R6 об'єднані з утворенням п'яти- або шестичленного гетероциклу, що може бути необов'язково конденсований з арильним фрагментом;
-А-Е- являє собою -(CO)-(NR9)- або -(NR9)-(CO)-;
R9 являє собою Н або (С1-С3)-алкіл;
m являє собою ціле число від 0 до 3;
n являє собою ціле число від 0 до 3, за умови, що, якщо n дорівнює 2 або 3, то R4 й R5 у кожному випадку можуть мати різні значення;
символ ![]() означає, що атом вуглецю, який відзначений зазначеним символом, може мати R- або S-конфігурацію;
означає, що атом вуглецю, який відзначений зазначеним символом, може мати R- або S-конфігурацію;
символ ![]() може бути відсутнім, але, якщо присутній, означає, що цикл може бути частково ненасиченим, за умови, що, якщо атом вуглецю, що містить R4, розташований при подвійному зв'язку, то R5 відсутній;
може бути відсутнім, але, якщо присутній, означає, що цикл може бути частково ненасиченим, за умови, що, якщо атом вуглецю, що містить R4, розташований при подвійному зв'язку, то R5 відсутній;
її таутомери, геометричні ізомери, оптично активні форми, такі як енантіомери, діастереомери і рацемічні форми, а також їх фармацевтично прийнятні солі.
2. Сполука за п. 1, яка відрізняється тим, що n дорівнює 1 або 2.
3. Сполука за п. 1, яка відрізняється тим, що m дорівнює 1 або 2.
4. Сполука за пп. 1-2, вибрана з групи, що складається з:
S-{(S)-6-[((S)-4-оксоазетидин-2-карбоніл)аміно]-6-фенілкарбамоїлгексилового} ефіру тіооцтової кислоти,
S-[(S)-6-[((S)-6-оксопіперидин-2-карбоніл)аміно]-6-(4-трифторметилбензилкарбамоїл)гексилового] ефіру тіооцтової кислоти,
S-{(S)-6-(3-бензилоксибензилкарбамоїл)-6-[((S)-6-оксопіперидин-2-карбоніл)аміно]гексилового} ефіру тіооцтової кислоти,
S-{(S)-7-(3,4-дигідро-1Н-ізохінолін-2-іл)-7-оксо-6-[((S)-6-оксопіперидин-2-карбоніл)аміно]гептилового} ефіру тіооцтової кислоти,
S-[(S)-6-[((S)-6-оксопіперидин-2-карбоніл)аміно]-6-(2-м-толуїлетилкарбамоїл)гексилового] ефіру тіооцтової кислоти,
S-{(S)-6-[((R)-6-оксопіперидин-2-карбоніл)аміно]-6-фенілкарбамоїлгексилового} ефіру тіооцтової кислоти,
S-{(S)-6-[((S)-6-оксопіперидин-2-карбоніл)аміно]-6-фенілкарбамоїлгексилового} ефіру тіооцтової кислоти,
S-{(S)-6-[((S)-6-оксопіперидин-2-карбоніл)аміно]-6-п-толуїлкарбамоїлгексилового} ефіру тіооцтової кислоти,
S-{(S)-6-[((S)-6-оксопіперидин-2-карбоніл)аміно]-6-м-толуїлкарбамоїлгексилового} ефіру тіооцтової кислоти,
S-{(S)-6-[((S)-6-оксопіперидин-2-карбоніл)аміно]-6-циклопентилкарбамоїлгексилового} ефіру тіооцтової кислоти,
S-{(S)-6-[((3R*,4S*)-2-оксо-4-фенілпіролідин-3-карбоніл)аміно]-6-фенілкарбамоїлгексилового} ефіру тіооцтової кислоти,
S-{(S)-6-[((3R*,4R*)-2-оксо-4-фенілпіролідин-3-карбоніл)аміно]-6-фенілкарбамоїлгексилового} ефіру тіооцтової кислоти,
S-{(S)-6-[((R)-5-оксопіролідин-2-карбоніл)аміно]-6-фенілкарбамоїлгексилового} ефіру тіооцтової кислоти,
S-{(S)-6-[(R*)-(2-оксопіперидин-3-карбоніл)аміно]-6-фенілкарбамоїлгексилового} ефіру тіооцтової кислоти,
((S)-6-меркапто-1-фенілкарбамоїлгексил)аміду (S)-6-оксопіперидин-2-карбонової кислоти,
((S)-1-циклопентилкарбамоїл-6-меркаптогексил)аміду (S)-6-оксопіперидин-2-карбонової кислоти,
[(S)-1-(3-бензилоксибензилкарбамоїл)-6-меркаптогексил]аміду (S)-6-оксопіперидин-2-карбонової кислоти,
[(S)-6-меркапто-1-(4-трифторметилбензилкарбамоїл)гексил]аміду (S)-6-оксопіперидин-2-карбонової кислоти,
((S)-6-меркапто-1-фенілкарбамоїлгексил)аміду (S)-4-oкcoaзeтидин-2-кapбoнової кислоти,
((S)-6-меркапто-1-фенілкарбамоїлгексил)аміду (3S,4S)-2-оксо-4-фенілпіролідин-3-карбонової кислоти,
((S)-6-меркапто-1-фенілкарбамоїлгексил)аміду (3R,4R)-2-oкco-4-фенілпіролідин-3-карбонової кислоти,
((S)-6-меркапто-1-фенілкарбамоїлгексил)аміду (3R,4S)-2-оксо-4-фенілпіролідин-3-карбонової кислоти,
((S)-6-меркапто-1-фенілкарбамоїлгексил)аміду (3S,4R)-2-оксо-4-фенілпіролідин-3-карбонової кислоти,
[(S)-1-(3,4-дигідро-1Н-ізохінолін-2-карбоніл)-6-меркаптогексил]аміду (S)-6-оксопіперидин-2-карбонової кислоти,
((S)-6-меркапто-1-фенілкарбамоїлгексил)аміду (R)-5-оксопіролідин-2-карбонової кислоти,
[(S)-6-меркапто-1-(2-м-толуїлетилкарбамоїл)гексил]аміду (S)-6-оксопіперидин-2-карбонової кислоти,
((S)-6-меркапто-1-фенілкарбамоїлгексил)аміду (R)-2-оксопіперидин-3-карбонової кислоти,
((S)-6-меркапто-1-фенілкарбамоїлгексил)аміду (S)-2-оксопіперидин-3-карбонової кислоти,
((S)-6-меркапто-1-фенілкарбамоїлгексил)аміду (R)-6-оксопіперидин-2-карбонової кислоти,
етилового ефіру {(S)-6-[((S)-6-оксопіперидин-2-карбоніл)аміно]-6-фенілкарбамоїлгексил}тіокарбонової кислоти,
S-{(S)-6-[((S)-6-оксопіперидин-2-карбоніл)аміно]-6-фенілкарбамоїлгексилового} ефіру тіоізомасляної кислоти,
S-{(S)-6-[((S)-5-оксопіролідин-2-карбоніл)аміно]-6-фенілкарбамоїлгексилового} ефіру тіооцтової кислоти,
S-{(S)-6-[((S)-5-оксопіролідин-2-карбоніл)аміно]-6-м-толуїлкарбамоїлгексилового} ефіру тіооцтової кислоти,
S-{(S)-6-[((R)-1-метил-5-оксопіролідин-2-карбоніл)аміно]-6-фенілкарбамоїлгексилового} ефіру тіооцтової кислоти,
етилового ефіру {(S)-6-[((R)-5-оксопіролідин-2-карбоніл)аміно]-6-фенілкарбамоїлгексил}-тіокарбонової кислоти,
S-{(S)-6-[((R)-5-оксопіролідин-2-карбоніл)аміно]-6-м-толуїлкарбамоїлгексилового} ефіру тіооцтової кислоти,
S-{(S)-6-[((R)-1-метил-5-оксопіролідин-2-карбоніл)аміно]-6-м-толуїлкарбамоїлгексилового} ефіру тіооцтової кислоти,
S-[(S)-6-[((R)-5-оксопіролідин-2-карбоніл)аміно]-6-(3-трифторметилфенілкарбамоїл)гексилового] ефіру тіооцтової кислоти,
S-{(S)-6-[((S)-1-метил-6-оксопіперидин-2-карбоніл)аміно]-6-фенілкарбамоїлгексилового} ефіру тіооцтової кислоти,
((S)-6-меркапто-1-фенілкарбамоїлгексил)аміду (S)-1-метил-6-оксопіперидин-2-карбонової кислоти,
((S)-6-меркапто-1-м-толуїлкарбамоїлгексил)аміду (S)-6-оксопіперидин-2-карбонової кислоти,
((S)-6-меркапто-1-п-толуїлкарбамоїлгексил)аміду (S)-6-оксопіперидин-2-карбонової кислоти й
S-{(S)-6-[((S)-6-оксо-1,2,3,6-тетрагідропіридин-2-карбоніл)аміно]-6-фенілкарбамоїлгексилового} ефіру тіооцтової кислоти.
5. Фармацевтична композиція, що містить щонайменше одну сполуку за пп. 1-4 як активний інгредієнт у суміші щонайменше з одним фармацевтично прийнятним носієм і/або наповнювачем.
6. Застосування сполуки за будь-яким із пп. 1-4 як лікарського засобу.
7. Застосування за п. 6 для лікування патологічного стану, при якому модуляція активності HDAC приводить до поліпшення стану здоров'я пацієнта.
8. Застосування за п. 7, яке відрізняється тим, що патологічний стан являє собою ракове захворювання, нейродегенеративне захворювання, запальне захворювання, інсульт, ішемію або інфекції Plasmodium.
9. Застосування за п. 8, яке відрізняється тим, що ракове захворювання являє собою рак грудей, підшлункової залози, легенів, товстої кишки, плеври, черевної порожнини, обличчя й шиї, нирки, сечового міхура, мозку, простати, яєчників або очей.
10. Застосування за п. 9, яке відрізняється тим, що ракове захворювання являє собою метастатичну форму раку.
11. Застосування за п. 8, яке відрізняється тим, що запальне захворювання являє собою ревматоїдний артрит.
12. Застосування за п. 8, яке відрізняється тим, що нейродегенеративне захворювання являє собою хворобу Хантінгтона, хворобу Паркінсона, аміотрофічний латеральний склероз.
13. Спосіб лікування пацієнта, ураженого раковим захворюванням, що включає введення сполуки за пп. 1-4.
14. Спосіб синтезу сполуки за п. 1 шляхом взаємодії сполуки Формули (III)
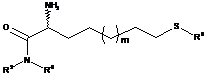 , Формула III
, Формула III
де R2, R3 й R6 й m такі, як описано у п. 1, зі сполукою Формули (IV) у формі солі або несольовій формі
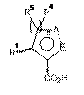 , Формула IV
, Формула IV
де R1, R4 й R5 й n такі, як описано у п. 1, у полярному апротонному розчиннику у присутності агента сполучення.
Текст
Реферат: Даний винахід стосується нових амідних сполук Формули (І) і їх застосування як протипухлинні і проапоптотичні агенти. Винахід включає застосування зазначених сполук у медицині відносно ракових захворювань, а також інших захворювань, чутливих до інгібування HDAC, і фармацевтичну композицію, що містить зазначені сполуки. UA 111231 C2 ДЕРЖАВНА СЛУЖБА ІНТЕЛЕКТУАЛЬНОЇ ВЛАСНОСТІ УКРАЇНИ UA 111231 C2 R 5 R n R 4 A E 1 HN O S O m R 2 N R R 3 6 Формула І UA 111231 C2 5 10 15 20 25 30 35 40 45 50 55 60 Галузь техніки Даний винахід відноситься до нових тіосполук й їхньому застосуванню як лікарськіх засобів. Винахід включає застосування зазначених сполук і фармацевтичної композиції, що містить зазначені сполуки, у медицині для лікування ракових захворювань, запальних захворювань, нейрональних захворювань, паразитарних інфекцій (наприклад, інфекції Plasmodium), а також інших захворювань, чутливих до інгібування HDAC. Рівень техніки Гістондеацетилази (HDAC) є сімейством ферментів, що містяться у ряді організмів, включаючи бактерії, грибки, рослини і тварини. Зазначені ферменти каталізують видалення ацетильних груп із залишків ε-N-ацетилованого лізину, що входять до складу різних білкових субстратів, включаючи гістони, фактори транскрипції, α-тубулін й імпортери білкових речовин у ядро. До теперішнього часу охарактеризовані вісімнадцять ізоформ HDAC. Вони розділені на чотири різних сімейства за подібністю послідовностей їх ДНК й їхньої біологічної ролі у клітинах. HDAC1, HDAC2, HDAC8 й HDAC3 є представниками класу I. Перші три ізоформи, головним чином, представлені в ядрі, тоді як HDAC3 також є присутньою у цитоплазмі або пов'язана з мембраною. HDAC4, HDAC5, HDAC6, HDAC7, HDAC9 й HDAC10 утворюють клас II. Цей клас додатково розділений на два підкласи - клас IIa (HDAC4, 5, 7 й 9) і клас IIb (HDAC6 й 10). Ферменти класу II експресуються в обмеженій кількості типів клітин й або переміщаються між ядром і цитоплазмою (тобто клас IIa), або присутні, головним чином, у цитоплазмі (тобто клас IIb) (Yang X.J., et al., Mol. Cell. Biol., 2005, 25, 2873). + Клас IV складається тільки з одного члена (HDAC11), при цьому клас III складається з НАД залежних ферментів, також називаних сиртуїнами. Загальною відмітною ознакою ферментів класів I, II й IV є їхня чутливість до цинку. Було показано, що інгібітори HDAC (HDACi) є високоактивними стимуляторами блокування росту, диференціювання й апоптотичної загибелі трансформованих клітин in vitro й in vivo. Також на моделях аутоімунних і запальних захворювань було показано, що інгібування HDAC призводить до зниження запалення (Leoni F., et al., Proc. Natl. Acad. Sci., 2002, 99, 2995). Однією з перших сполук, яка була підтверджена як HDACi, була добре відома вальпроєва кислота, використовувана проти епілепсії, яка інгібує всі ізоформи класів I, II й IV. Після виявлення важливої ролі цього сімейства ферментів у розвитку раку низкою наукових груп, а також фармацевтичних компаній вживали спроби, спрямовані на пошук високоактивних HDACi. Вориностат, спочатку відомий як SAHA (субероїланілід гідроксамової кислоти), був кращим HDACi у класі невеликих похідних гідроксаматів, схвалених FDA у 2006 році для лікування рідкого ракового захворювання - шкірної Т-клітинної лімфоми - у пацієнтів, яким раніше проводили щонайменше одну системну терапію (Grant S., et al., Nature Rev. Drug Discov., 2007, 6, 21). SAHA є високоактивним HDACi, інгібуючим класи I й II, при цьому в цей час переважна більшість HDACi перебуває на стадії клінічних досліджень (Paris M., et al., J. Med. Chem., 2008, 51, 1505). Фактично, залежно від структури різні сімейства інгібіторів можна розділити на чотири основні групи: а) коротколанцюгові жирні кислоти (наприклад, бутират натрію, фенілбутират, Pivanex (пивалоїлоксиметилбутират, AN-9) і вальпроєва кислота); b) гідроксамати (наприклад, SAHA, беліностат (PXD101), панобіностат (LBH589), дациностат (LAQ-824) і трихостатин); с) циклічні похідні (наприклад, ромідепсин або FK-228); d) бензамід (наприклад, ентиностат (MS-275), моцетиностат (MGCD-0103) і ацетилдиналін (CI-994)). Для визначення ефективності комбінації широкого спектра HDACi і стандартних хіміотерапевтичних агентів (наприклад, доцетакселу й вориностату) у пацієнтів з розповсюдженим і рецидивуючим раком легенів, сечового міхура або простати проводили низку клінічних досліджень із застосуванням комбінованої терапії (клінічне дослідження NCT00565227). Ще приблизно тринадцять років тому припустили, що HDAC є потенційною мішенню для лікування паразитарних інфекцій (наприклад, інфекції Plasmodium). З урахуванням того, що у науковому співтоваристві більшість спроб спрямована на виявлення селективних HDACi, у медицині зберігається більша потреба в універсальних інгібіторах, оскільки показано, що в різних ракових захворюваннях задіяні різні ізоформи HDAC. Крім того, у науковому співтоваристві також виділилися групи, що намагаються співвіднести конкретні ізоформи HDAC і конкретні ракові захворювання (Giannini G., et al., Future Medicinal Chemistry, 2012, 4, 11, 14391460). Дійсно, вміст HDAC1 підвищений при раку простати (Halkidou K., et al., Prostate, 2004, 59, 1 UA 111231 C2 5 10 15 20 25 30 35 40 177) і раку кишечнику (Choi J.H., et al., Jpn. J. Cancer Res., 2001, 92, 1300), HDAC2 - при раку кишечнику (Song J., et al., APMIS, 2005, 113, 264), HDAC3 - при раку легенів (Bartling B., et al., Lung Cancer, 2005, 49, 145), а при плоскоклітинній карциномі порожнини рота спостерігається підвищена експресія HDAC6 (Sakuma T., et al., J. Oncol., 2006, 29, 117). Також відзначена участь HDAC в інших захворюваннях, таких як нейродегенеративні захворювання (Chuang D.M., et al., Trends in Neuroscience, 2009, 32, 11, 591; Sleiman S.F., et al., Expert Opin. Investig. Drugs, 2009, 18, 5, 573), гіпертрофія серця (Hamamori Y., et al., J. Clin. Invest., 2003, 112, 6, 824). У недавньому огляді докладно розглянуті захворювання, новим підходом до лікування яких є інгібування HDAC (Dinarello C.A., et al., Mol. Med., 2011, 17, 333). Відомо, що бідентатний фрагмент гідроксамової кислоти є однією з кращих груп, що зв'язують цинк, і була розроблена множина інгібіторів HDAC, що містять зазначений фрагмент (Sampath-Kumar A., et al., Bioorg. Med. Chem. Lett., 2005, 15, 8, 1969). Проте, застосування зазначеної функціональної групи зв'язують з погіршенням фармакокінетичних властивостей (Colletti S., et al., Bioorg. Med. Chem. Lett., 2001, 11, 107), а також із тривалою токсичністю (Suzuki T., Cur. Med. Chem., 2005, 12, 24, 2867). Відповідно, вживалося багато спроб виявлення нових HDACi, які можуть мати високу афінність зв'язування з біологічною мішенню, а також високу активність у клітині. У недавно опублікованому огляді (Bertrand P., Eur. J. Med. Chem., 2010, 45, 2095), у якому визначали афінність зв'язування й біологічні властивості, серед негідроксаматних похідних були описані тіоадукти, що дозволяє припустити, що останні можуть мати орієнтацію в активній ділянці білка, зовсім відмінну від орієнтації гідроксаматних аналогів. Незважаючи на те, що проводилися дослідження HDACi, що містять лінійну тіозв’язувальну групу, проте, до цього часу не було клінічних випробувань жодної із зазначених похідних. П. Бертранд (Bertrand P.) також припустив, що біологічна активність FK228 була викликана відновленням дисульфідного зв'язку, що призводило до отримання тіоадукту 1, і активною речовиною був останній, що зображено нижче на схемі 1. Проте, цей механізм дії FK228 може бути оскаржений на підставі заявки на патент США №12/845658, у якій як активна сполука запропонований інший метаболіт. На жаль, тому що біологічна активність різних метаболітів, запропонованих у теорії, не показана, прямих висновків на підставі цієї роботи зробити не можна. Був синтезований лінійний тіоаналог SAHA (схема 2) (Suzuki T., et al., Bioorg. Med. Chem. Lett., 2004, 14, 3313), і обидві сполуки мали схожу афінність до HDAC. Т. Сузукі зі співавторами (Suzuki T., et al.) додатково запропонували більш активні HDACi з тіовмісними групами, що зв'язують метали (MBG), які містять більше стерично утруднений амідний фрагмент, такий як біфеніл, бензофуран, індол або хінолін замість фенільної групи SAHA (Suzuki T., et al., J. Med. Chem., 2005, 48, 1019). 2 UA 111231 C2 У заявці на патент Японії №2007238452 описані похідні Формули 2, де атом вуглецю в 2 положенні α відносно карбоніламіду заміщений карбаматним фрагментом (тобто R = CO2R). 5 10 15 20 Зазначені похідні також були описані пізніше, коли повідомлялося про оптимізацію групи САР (Suzuki T., et al., J. Med. Chem., 2006, 49, 4809) і/або проміжної групи-спейсера (Itoh Y., et al., J. Med. Chem., 2007, 50, 5425). Необхідно відзначити, що зазначені похідні описували як селективні до HDAC6. Зокрема, І. Іто (Itoh Y.) запропонував похідні, що містять амінозамісники середнього розміру у положенні α відносно карбоніламіду, які, як було показано, були селективними до HDAC6, імовірно внаслідок відсутності гідрофобної кишені, в яку входять зазначені групи інших ізоформ. Також загальновідомо, що тіопохідні на порядок менш активні у порівнянні з гідроксаматним аналогом (Wang D., et al., J. Org. Chem., 2007, 72, 5446). Була показана сприятлива дія SAHA на моделі фокальної церебральної ішемії (Faraco G., et al., Mol. Pharmacol., 2006, 70, 6,1876). Таким чином, зберігається більша потреба у забезпеченні нових інгібіторів HDAC, що мають афінність зв'язування з білками HDAC у діапазоні малих наномолярних значень, а також високу активність у клітині. Опис винаходу Було виявлено, що нові тіопохідні мають високу інгібуючу активність у відношенні HDAC. У винаході запропоновані сполуки Формули (I) або їх солі, гідрати або сольвати для отримання композиції для інгібування активності HDAC: 25 30 35 40 45 де 1 R являє собою Н, (С1-С6)-алкіл або арил; або як альтернатива 1 4 R й один R , кожний з яких пов'язаний з двома сусідніми атомами вуглецю, у випадку якщо n дорівнює 2 або 3, об'єднані з утворенням циклопропанового кільця; 2 R являє собою феніл, можливо заміщений галогеном, бензилокси, (C 1-C3)-алкілом або CF3; (C3-C6)-циклоалкіл; арил-(C1-C6)-алкіл, де арил можливо заміщений бензилокси, (C 1-C3)-алкілом або CF3; 3 R являє собою Н, РО(ОН)2 або групу Формули (II) 7 -(СО)-R Формула II 7 8 R являє собою (C1-C7)-алкіл, (C1-C6)-алкокси або -CH(NH2)R ; 8 R являє собою Н або бічний ланцюг природної α-амінокислоти; 4 6 R й R у кожному випадку незалежно являють собою Н, галоген, (С 1-С6)алкіл, або як альтернатива 4 5 якщо n дорівнює 2 або 3, то один R й один R , кожний з яких пов'язаний з двома сусідніми атомами вуглецю, об'єднані з утворенням циклопропанового кільця; 6 R являє собою Н, або як альтернатива 2 6 R й R об'єднані з утворенням п'яти- або шестичленного гетероциклу, що може бути необов'язково конденсований з арильним фрагментом; 9 9 -А-Е- являє собою -(CO)-(NR )- або -(NR )-(CO)-; 3 UA 111231 C2 9 5 10 15 R являє собою Н або (С1-С3)-алкіл; m являє собою ціле число від 0 до 3; 4 5 n являє собою ціле число від 0 до 3 за умови, що якщо дорівнює 2 або 3, то R й R у кожному випадку можуть мати різні значення; символ означає, що атом вуглецю, який відзначений зазначеним символом, може мати R або S конфігурацію; символ може бути відсутнім, але якщо є присутнім, означає, що цикл може бути 4 частково ненасиченим за умови, що якщо атом вуглецю, що містить R , розташований при 5 подвійному зв'язку, то R відсутній; їх таутомери, геометричні ізомери, оптично активні форми, такі як енантіомери, діастереомери і рацемічні форми, а також їх фармацевтично прийнятні солі. Один з варіантів реалізації даного винаходу являє собою сполуки Формули (I) для застосування як лікарські засоби. У додатковому варіанті реалізації зазначений лікарський засіб застосовують для лікування суб'єкта, ураженого раковими захворюваннями, запальними захворюваннями, нейрональними захворюваннями і паразитарними інфекціями (наприклад, інфекцією Plasmodium). У винаході додатково запропонований спосіб отримання сполук Формули (I), включаючи традиційні способи синтезу, описані нижче. Сполуки загальної Формули (I) можна отримувати шляхом взаємодії сполук Формули (III) 20 2 3 6 де R , R й R й m такі, як описано вище, зі сполуками Формули (IV) або їх органічними солями 25 1 30 35 2 40 4 5 де R , R й R , -А-Е- і n такі, як описано вище, у полярному апротонному розчиннику у присутності агента сполучення, добре відомого фахівцям в області сполучення пептидів. 3 Сполуки загальної Формули (I), де R являє собою Н, можна отримувати шляхом взаємодії Формула IV Formula IV 3 сполук Формули (I), де R являє собою групу Формули (II), таку як визначено вище, і всі інші замісники й параметри такі, як визначено вище, з гідроксидом натрію у полярному розчиннику. Як альтернатива зазначені сполуки можна отримувати після заміни у вищевказаній реакції гідроксиду натрію на тіометоксид натрію за допомогою описаного способу (Wallace O.B., et al., Tetrahedron Letters, 1998, 39, 2693). Сполуки загальної Формули (III) можна отримувати шляхом взаємодії сполук Формули (V) 6 де R й R й m такі, як описано вище, а PG відноситься до амінозахисної групи, такої як, наприклад, трет-бутоксикарбоніл, зі сполуками Формули (VI) 4 UA 111231 C2 3 R SH Формула VI де R такий, як описано вище, у присутності радикального ініціатора, такого як AIBN, у полярному розчиннику при температурі до 80 °C. У всіх зазначених перетвореннях можна захищати будь-які заважаючі реакційноздатні групи, а потім знімати захист відповідно до загальновизнаних способів, описаних в області органічної хімії (наприклад, Greene T. W. and P.G.M. Wuts “Protective Groups in Organic Synthesis”, J. Wiley & Sons, Inc., 3rd Ed., 1999), а також добре відомих фахівцям у даній галузі техніки. Всі зазначені перетворення є винятково прикладами загальновизнаних способів, описаних в області органічної хімії (наприклад, March J., “Advanced Organic Chemistry”, J. Wiley & Sons, Inc., 4th Ed., 1992), а також добре відомих фахівцям у даній галузі техніки. Терміни «(С1-Сх)-алкіл», «(С1-Сх)-алкокси» й «(С3-Сх)-циклоалкіл», де х являє собою ціле число від 2 до 7 (і ціле число від 4 до 7 у випадку циклоалкілу), використовувані окремо або у складі більше складної структури, відносяться до лінійного або розгалуженого алкілу, лінійного або розгалуженого алкокси, що містить від 1 до 7 атомів вуглецю, або до циклоалкільних груп, що містять від 3 до 7 атомів вуглецю. Терміни «гетероциклоалкіл» і «гетероцикл» відносяться до насиченого або ненасиченого (але не ароматичного) чотирьох-, п'яти-, шести- або семичленного кільця, що містить щонайменше один атом азоту й можливо один або більше інших гетероатомів, які можуть бути однаковими або різними і вибрані з групи, що складається з азоту, кисню й сірки, що може бути заміщене аміно- або алкільними фрагментами. Переважні гетероциклоалкіли включають азетидин, піролідин, піперидин, піперазин, кетопіперазин, 2,5- дикетопіперазин, морфолін і тіоморфолін. Шестичленний гетероциклоалкіл може бути необов'язково конденсований з арилом, таким як визначено нижче. Переважними зазначеними конденсованими гетероциклами є, наприклад, тетрагідрохінолін і тетрагідроізохінолін. Термін «арил» відноситься до ароматичної карбоциклічної групи, що містить від 6 до 14 атомів вуглецю, яка складається з одного кільця (наприклад, феніл) або декількох кілець, які можуть бути з'єднані за допомогою одинарного зв'язку або можуть бути конденсовані. Переважні арили включають феніл, нафтил, фенантреніл, біфеніл тощо. Зазначений «арил» може містити від 1 до 3 замісників, вибраних із гідроксилу, галогену, галогеналкілу, ціано, (С1Сх)-алкілу, (С1-Сх)-алкокси, бензилокси, аміно, аміноалкілу або алкіламіно. Термін «аміно» відноситься до групи -NH2. Термін «алкіламіно» відноситься до групи -NHR, де R являє собою «(С1-Сх)-алкіл», такий як визначено вище. Термін «аміноалкіл» відноситься до (С1-Сх)-алкілу, такому як визначено вище, заміщеному аміногрупою. Термін «галогеналкіл» відноситься до фрагментів CF 3 або CHF2 або до алкільних груп, таких як визначено раніше, що містять фрагменти CF3 або CHF2. Термін «арил-(С1-С6)-алкіл» відноситься до алкільних груп, таких як визначено вище, що містять один арильний замісник, такий як визначено вище. Переважні арил-(С1-С6)-алкіли включають бензил, фенетил, дифенілметил тощо. Вираження «природна α-амінокислота» відноситься до 20 природних амінокислот, включаючи гліцин, аланін, фенілаланін, валін, лейцин, ізолейцин, аспарагінову кислоту, аспарагін, глутамінову кислоту, глутамін, серин, лізин, гістидин, метіонін, пролін, цистеїн, треонін, триптофан, аргінін і тирозин у всіх можливих ізомерних формах. Термін «рак» означає злоякісне новоутворення, яке впроваджується й руйнує навколишні тканини і може давати метастази й, зрештою, призводити до смерті хазяїна. «Фармацевтично прийнятні солі» відносяться до солей визначених нижче сполук Формули (I), які зберігають бажану біологічну активність. Приклади зазначених солей включають, але не обмежуються ними, солі приєднання кислот, отримані із застосуванням неорганічних кислот (наприклад, хлороводневої кислоти, бромоводневої кислоти, сірчаної кислоти, фосфорної кислоти, азотної кислоти тощо), і солі органічних кислот, таких як оцтова кислота, щавлева кислота, винна кислота, бурштинова кислота, яблучна кислота, фумарова кислота, малеїнова кислота, аскорбінова кислота, бензойна кислота, танінова кислота, памова кислота, альгінова кислота, поліглутамінова кислота, нафталін сульфокислота, толуол сульфокислота, нафталін дисульфокислота, метан сульфокислота й полігалактуронова кислота. Ми виявили, що похідні (I) і їх фармацевтично прийнятні солі, отримані згідно з даним винаходом, підходять для лікування хворобливих станів, порушень і патологічних станів, опосередкованих HDAC; зокрема для лікування ракових захворювань, запальних захворювань, нейрональних захворювань і паразитарних інфекцій (наприклад, інфекції Plasmodium). Фармацевтичні композиції містять щонайменше одну сполуку Формули (I) як активний 3 5 10 15 20 25 30 35 40 45 50 55 60 5 UA 111231 C2 5 10 15 20 25 30 35 40 45 50 55 60 інгредієнт у кількості, достатній для забезпечення значної терапевтичної дії. Композиції, охоплені даним винаходом, повною мірою можна вважати традиційними, і їх отримують за допомогою способів, розповсюджених у фармацевтичній промисловості, наприклад, проілюстрованих в останньому виданні Remington's Pharmaceutical Science Handbook, Mack Pub. N.Y. Відповідно до вибраного способу введення композиції мають тверду або рідку форму, що підходить для перорального, парентерального або місцевого введення. Композиції згідно з даним винаходом разом із активним інгредієнтом містять щонайменше один фармацевтично прийнятний носій або наповнювач. Вони можуть являти собою допоміжні речовини, що особливо підходять для отримання складів, наприклад, агенти, що підвищують розчинність, диспергуючі агенти, суспендуючі агенти й емульгатори. У цілому, сполуки згідно з даним винаходом вводять у «терапевтично ефективній кількості». Фактично кількість сполуки, що вводять, як правило, визначає лікар з урахуванням важливих обставин, включаючи стан, що піддається лікуванню, вибраний спосіб введення, фактичну сполуку, яку вводять, комбінацію лікарських засобів, вік, масу тіла, індивідуальну відповідь пацієнта, тяжкість симптомів пацієнта тощо. Для будь-якої сполуки спочатку можна проводити оцінку терапевтично ефективної дози у дослідженнях клітинних культур або на тваринних моделях, зазвичай на мишах, пацюках, морських свинках, кроликах, собаках або свинях. Тваринні моделі також можна застосовувати для визначення відповідного діапазону концентрацій і способу введення. Зазначену інформацію потім можна використати для визначення придатних доз і способів введення людині. При розрахунку еквівалентної дози для людини (HED) рекомендується використовувати таблицю переведення, наведену у керівництві для галузі й в експертній документації (2002, U.S. Food and Drug Administration, Rockville, Maryland, USA). У цілому, ефективна доза становить від 0,01 мг/кг до 100 мг/кг, переважно від 0,05 мг/кг до 50 мг/кг. Для будь-якої сполуки спочатку можна проводити оцінку терапевтично ефективної дози у дослідженнях клітинних культур або на тваринних моделях, зазвичай на мишах, пацюках, морських свинках, кроликах, собаках або свинях. Точна ефективна доза для суб'єкта-людини залежить від тяжкості хворобливого стану, загального стану здоров'я суб'єкта, віку, маси тіла й статі суб'єкта, режиму харчування, часу й частоти введення, комбінації(й) лікарських засобів, чутливості реакції й переносимості/відповіді на терапію. Цю кількість можна визначати за допомогою традиційної експериментальної роботи, вибір знаходиться у рамках компетенції лікаря. Композиції можна вводити пацієнтові окремо або у комбінації з іншими агентами, лікарськими засобами або гормонами. Лікарський засіб також може містити фармацевтично прийнятний носій для введення терапевтичного агента. Зазначені носії включають антитіла й інші поліпептиди, гени й інші терапевтичні агенти, такі як ліпосоми, за умови, що застосування носія не призводить до отримання антитіл, шкідливих для індивідуума, що отримує композицію, і введення носія не викликає надмірну токсичність. Придатні носії можуть являти собою великі повільно метаболізуючі макромолекули, такі як білки, полісахариди, полімолочні кислоти, полігліколієві кислоти, полімерні амінокислоти, співполімери амінокислот й інактивні частки вірусів. Докладне обговорення фармацевтично прийнятних носіїв наведене у Remington's Pharmaceutical Sciences (Mack Pub. Co., N.J. 1991). Фармацевтично прийнятні носії у терапевтичних композиціях можуть додатково містити рідини, такі як вода, сольовий розчин, гліцерин й етанол. Крім того, до складу зазначених композицій можуть входити допоміжні речовини, такі як зволожувачі або емульгатори, буферні речовини тощо. Зазначені носії дозволяють вводити фармацевтичні композиції до складу таблеток, пігулок, драже, капсул, рідин, гелів, сиропів, еліксирів, суспензій, суспензій тощо для споживання пацієнтом. Після введення до складу лікарської форми композиції згідно з даним винаходом можна безпосередньо вводити суб'єктові. Суб'єкти, яких піддають лікуванню, можуть являти собою тварин; зокрема можна піддавати лікуванню людину. Лікарський засіб згідно з даним винаходом можна вводити за допомогою будь-яких способів, включаючи, але не обмежуючись ними, пероральне, внутрішньовенне, внутрішньом'язове, внутрішньоартеріальне, інтрамедулярне, інтратекальне, внутрішньошлуночкове, черезшкірне й транскутанне введення, за допомогою підшкірного, інтраперитонеального, інтраназального, ентерального, місцевого, під'язикового, внутрішньовагінального або ректального способів. Композиції для перорального введення можуть мати форму не розфасованих рідких розчинів або суспензій або не розфасованих порошків. Частіше, проте, композиції містяться у 6 UA 111231 C2 5 10 15 20 25 30 35 40 45 50 55 60 вигляді одиничних лікарських форм, що сприяє точності дозування. Термін «одиничні лікарські форми» відноситься до фізично роздільних часток, що підходять для введення стандартних дозувань людині й іншим ссавцям, де кожна частка містить попередньо визначену кількість активної речовини, розраховану для забезпечення бажаної терапевтичної дії, разом із придатним фармацевтичним наповнювачем. Типові одиничні лікарські форми включають ампули або шприци, попередньо заповнені дозованими кількостями рідких композицій, або пігулки, таблетки, капсули тощо у випадку твердих композицій. У зазначених композиціях сполука згідно з даним винаходом зазвичай є неосновним компонентом (вміст від приблизно 0,1 до приблизно 50% за масою або переважно від приблизно 1 до приблизно 40% за масою), а кількість, що залишилася, становлять різні наповнювачі або носії й технологічні добавки, що сприяють отриманню бажаної лікарської форми. Введення дозування можна проводити за один раз або у вигляді декількох доз. Як обговорювалося вище, сполуки згідно з даним винаходом за рахунок інгібуючих властивостей у відношенні HDAC є придатними лікарськими засобами для лікування порушень, при яких зазначене інгібування призводить до поліпшення стану здоров'я пацієнта, зокрема пацієнтів, що страждають від раку й запальних захворювань. Зазначені композиції можуть разом зі сполуками Формули (I) додатково містити відомі активні компоненти. Додатковим завданням винаходу є спосіб отримання фармацевтичних композицій, що характеризується змішуванням однієї або більше сполук Формули (I) з придатними наповнювачами, стабілізаторами й/або фармацевтично прийнятними розріджувачами. Одним із варіантів реалізації даного винаходу є сполуки Формули (I), описані раніше, де n дорівнює 1 або 2. Переважним варіантом реалізації даного винаходу є сполуки Формули (I), описані раніше, де 3 R являє собою групу Формули (II), описану вище. Відповідно до іншого варіанта реалізації даного винаходу раковим захворюванням, що піддається лікуванню, є первинна пухлина, вибрана з групи, що включає саркому, карциному, меланому, пухлину кістки, нейроендокринну пухлину, лімфоїдну лейкемію, мієлоїдну лейкемію, моноцитарну лейкемію, мегакаріоцитарну лейкемію, гостру промієлоцитарну лейкемію або хворобу Ходжкіна. Вищевказані саркома й карцинома складаються з групи, що включає: рак грудей, рак легенів, включаючи недрібноклітинний рак легенів (НДРЛ) і дрібноклітинний рак легенів (ДРЛ); рак шлунково-кишкового тракту, включаючи рак стравоходу, шлунка, тонкого кишечнику, товстого кишечнику, прямої кишки й товстої кишки; гліому, включаючи гліобластому; рак яєчників; рак шийки матки; рак ендометрію; мезотеліому; рак нирок; рак простати; рак черевної порожнини; рак плеври; рак області обличчя і шиї; рак сечового міхура; рак мозку; і рак шкіри або ока. Новоутворення також можуть відноситися до педіатричного раку. Педіатричні ракові захворювання, які можна лікувати або прогресування яких можна відкладати згідно з даним винаходом, наприклад, вибрані з групи, що складається з: гострої лімфобластної лейкемії, гострої мієлоїдної лейкемії, адренокортикальної карциноми, астроцитоми, раку сечового міхура, гліоми стовбура головного мозку, атипового тератоїдного/рабдоїдного раку центральної нервової системи, раку мозку, ембріонального раку центральної нервової системи, раку мозку, астроцитоми, краніофарингіоми, епендимобластоми, епендимоми, дитячої медулобластоми, медулоепітеліоми, раку паренхіми шишкоподібної залози з проміжним диференціюванням, супратенторіального примітивного нейроектодермального раку й пінеобластоми, раку грудей, бронхіального раку, карциноїдного раку, раку шийки матки, хордоми, колоректального раку, раку стравоходу, екстракраніального раку зародкових клітин, рака шлунка, гліоми, печінковоклітинного раку (раку печінки), лімфоми Ходжкіна, раку нирки, раку гортані, лейкемії, гострої лімфобластної/мієлоїдної лейкемії, раку печінки, неходжкінської лімфоми, медулобластоми, мезотеліоми, синдрому множинної ендокринної неоплазії, раку носоглотки, раку порожнини рота, раку яєчників, раку підшлункової залози, папіломатозу, нирковоклітинного раку, рабдоміосаркоми, раку слинних залоз, саркоми, раку шкіри, тимоми і тимусної саркоми, раку щитовидної залози й раку піхви. Інший варіант реалізації даного винаходу включає сполуки, вибрані з групи, що складається з: ((S)-6-меркапто-1-фенілкарбамоїлгексил)аміду (S)-6-оксопіперидин-2-карбонової кислоти, ((S)-1-циклопентилкарбамоїл-6-меркаптогексил)аміду (S)-6-оксопіперидин-2-карбонової кислоти, [(S)-1-(3-бензилоксибензилкарбамоїл)-6-меркаптогексил]аміду (S)-6-оксопіперидин-2карбонової кислоти, [(S)-6-меркапто-1-(4-трифторметилбензилкарбамоїл)гексил]аміду (S)-6оксопіперидин-2-карбонової кислоти, ((S)-6-меркапто-1-фенілкарбамоїлгексил)аміду (S)-4 7 UA 111231 C2 5 10 15 20 25 30 35 40 45 50 55 60 оксоазетидин-2-карбонової кислоти, ((S)-6-меркапто-1-фенілкарбамоїлгексил)аміду (3S,4S)-2оксо-4-фенілпіролідин-3-карбонової кислоти, ((S)-6-меркапто-1-фенілкарбамоїлгексил)аміду (3R,4R)-2-оксо-4-фенілпіролідин-3-карбонової кислоти, ((S)-6-меркапто-1фенілкарбамоїлгексил)аміду (3R,4S)-2-оксо-4-фенілпіролідин-3-карбонової кислоти, ((S)-6меркапто-1-фенілкарбамоїлгексил)аміду (3S,4R)-2-оксо-4-фенілпіролідин-3-карбонової кислоти, [(S)-1-(3,4-дигідро-1H-ізохінолін-2-карбоніл)-6-меркаптогексил]аміду (S)-6-оксопіперидин-2карбонової кислоти, ((S)-6-меркапто-1-фенілкарбамоїлгексил)аміду (R)-5-оксопіролідин-2карбонової кислоти, [(S)-6-меркапто-1-(2-м-толуїлетилкарбамоїл)-гексил]аміду (S)-6оксопіперидин-2-карбонової кислоти, ((S)-6-меркапто-1-фенілкарбамоїлгексил)аміду (R)-2оксопіперидин-3-карбонової кислоти, ((S)-6-меркапто-1-фенілкарбамоїлгексил)аміду (S)-2оксопіперидин-3-карбонової кислоти, ((S)-6-меркапто-1-фенілкарбамоїлгексил)аміду (R)-6оксопіперидин-2-карбонової кислоти, ((S)-6-меркапто-1-фенілкарбамоїлгексил)аміду (S)-6-оксо1,2,3,6-тетрагідропіридин-2-карбонової кислоти, ((S)-6-меркапто-1- фенілкарбамоїлгексил)аміду (S)-2-оксо-3-азабіцикло[4.1.0]гептан-4-карбонової кислоти, ((S)-6-меркапто-1фенілкарбамоїлгексил)аміду (S)-6-оксо-1,2,5,6-тетрагідропіридин-2-карбонової кислоти, ((S)-6меркапто-1-фенілкарбамоїлгексил)аміду (S)-4-оксо-3-азабіцикло[4.1.0]гептан-2-карбонової кислоти, ((S)-6-меркапто-1-фенілкарбамоїлгексил)аміду 6-оксо-1,6-дигідропіридин-2-карбонової кислоти, ((S)-5-меркапто-1-фенілкарбамоїлпентил)аміду (S)-6-оксопіперидин-2-карбонової кислоти, ((S)-7-меркапто-1-фенілкарбамоїлгептил)аміду (S)-6-оксопіперидин-2-карбонової кислоти, ((S)-6-меркапто-1-фенілкарбамоїлгексил)аміду (S)-1-метил-6-оксопіперидин-2карбонової кислоти, ((S)-6-меркапто-1-м-толуїлкарбамоїлгексил)аміду (S)-6-оксопіперидин-2карбонової кислоти й ((S)-6-меркапто-1-п-толуїлкарбамоїлгексил)аміду (S)-6-оксопіперидин-23 карбонової кислоти й відповідних проліків, де R такий, як описаний для сполук Формули (I), але не є Н. Інший варіант реалізації даного винаходу включає сполуки, вибрані з групи, що складається з S-{(S)-6-[((S)-4-оксоазетидин-2-карбоніл)аміно]-6-фенілкарбамоїлгексильного} ефіру тіооцтової кислоти, S-[(S)-6-[((S)-6-оксопіперидин-2-карбоніл)аміно]-6-(4трифторметилбензилкарбамоїл)гексильного] ефіру тіооцтової кислоти, S-{(S)-6-(3бензилоксибензилкарбамоїл)-6-[((S)-6-оксопіперидин-2-карбоніл)-аміно]гексильного} ефіру тіооцтової кислоти, S-{(S)-7-(3,4-дигідро-1H-ізохінолін-2-іл)-7-оксо-6-[((S)-6-оксопіперидин-2карбоніл)аміно]гептильного} ефіру тіооцтової кислоти, S-[(S)-6-[((S)-6-оксопіперидин-2карбоніл)аміно]-6-(2-м-толуїлетилкарбамоїл)-гексильного] ефіру тіооцтової кислоти, S-{(S)-6[((R)-6-оксопіперидин-2-карбоніл)-аміно]-6фенілкарбамоїлгексильного} ефіру тіооцтової кислоти, S-{(S)-6-[((S)-6-оксопіперидин-2-карбоніл)аміно]-6-фенілкарбамоїлгексильного} ефіру тіооцтової кислоти, S-{(S)-6-[((S)-6-оксопіперидин-2-карбоніл)аміно]-6-птолуїлкарбамоїлгексильного} ефіру тіооцтової кислоти, -{(S)-6-[((S)-6-оксопіперидин-2карбоніл)аміно]-6-м-толуїлкарбамоїлгексильного} ефіру тіооцтової кислоти, S-{(S)-6-[((S)-6оксопіперидин-2-карбоніл)аміно]-6-циклопентилкарбамоїлгексильного} ефіру тіооцтової кислоти, S-{(S)-6-[((3R*,4S*)-2-оксо-4-фенілпіролідин-3-карбоніл)аміно]-6-фенілкарбамоїлгексильного} ефіру тіооцтової кислоти, S-{(S)-6-[((3R*,4R*)-2-оксо-4-фенілпіролідин-3-карбоніл)аміно]- 6фенілкарбамоїлгексильного} ефіру тіооцтової кислоти, S-{(S)-6-[((R)-5-оксопіролідин-2карбоніл)аміно]-6-фенілкарбамоїлгексильного} ефіру тіооцтової кислоти, S-{(S)-6-[(R*)-(2оксопіперидин-3-карбоніл)аміно]-6-фенілкарбамоїлгексильного}ефіру тіооцтової кислоти, ((S)-6меркапто-1-фенілкарбамоїлгексил)аміду (S)-6-оксопіперидин-2-карбонової кислоти, ((S)-1циклопентилкарбамоїл-6-меркаптогексил)аміду (S)-6-оксопіперидин-2-карбонової кислоти, [(S)1-(3-бензилоксибензилкарбамоїл)-6-меркаптогексил]аміду (S)-6-оксопіперидин-2-карбонової кислоти, [(S)-6-меркапто-1-(4-трифторметилбензилкарбамоїл)гексил]аміду (S)-6-оксопіперидин2-карбонової кислоти, ((S)-6-меркапто-1-фенілкарбамоїлгексил)аміду (S)-4-оксоазетидин-2карбонової кислоти, ((S)-6-меркапто-1-фенілкарбамоїлгексил)аміду (3S,4S)-2-оксо-4фенілпіролідин-3-карбонової кислоти, ((S)-6-меркапто-1-фенілкарбамоїлгексил)аміду (3R,4R)-2оксо-4-фенілпіролідин-3-карбонової кислоти, ((S)-6-меркапто-1-фенілкарбамоїлгексил)аміду (3R,4S)-2-оксо-4-фенілпіролідин-3-карбонової кислоти, ((S)-6-меркапто-1фенілкарбамоїлгексил)аміду (3S,4R)-2-оксо-4-фенілпіролідин-3-карбонової кислоти, [(S)-1-(3,4дигідро-1H-ізохінолін-2-карбоніл)-6-меркаптогексил]аміду (S)-6-оксопіперидин-2-карбонової кислоти, ((S)-6-меркапто-1-фенілкарбамоїлгексил)аміду (R)-5-оксопіролідин-2-карбонової кислоти, [(S)-6-меркапто-1-(2-м-толуїлетилкарбамоїл)гексил]аміду (S)-6-оксопіперидин-2карбонової кислоти, ((S)-6-меркапто-1-фенілкарбамоїлгексил)аміду (R)-2-оксопіперидин-3карбонової кислоти, ((S)-6-меркапто-1-фенілкарбамоїлгексил)аміду (S)-2-оксопіперидин-3карбонової кислоти, ((S)-6-меркапто-1-фенілкарбамоїлгексил)аміду (R)-6-оксопіперидин-2карбонової кислоти, змішаного {(S)-6-[((S)-6-оксопіперидин-2карбоніл)аміно]-6 8 UA 111231 C2 5 10 15 20 25 30 35 40 45 50 55 60 фенілкарбамоїлгексилового}етилового ефіру тіокарбонової кислоти, S-{(S)-6-[((S)-6оксопіперидин-2-карбоніл)аміно]-6-фенілкарбамоїлгексильного} ефіру тіоізомасляної кислоти, S-{(S)-6-[((S)-5-оксопіролідин-2-карбоніл)аміно]-6-фенілкарбамоїлгексильного} ефіру тіооцтової кислоти, S-{(S)-6-[((S)-5-оксопіролідин-2-карбоніл)аміно]-6-м-толуїлкарбамоїлгексильного} ефіру тіооцтової кислоти, S-{(S)-6-[((R)-1-метил-5-оксопіролідин-2-карбоніл)аміно]-6фенілкарбамоїлгексильного} ефіру тіооцтової кислоти, змішаного {(S)-6-[((R)-5-оксопіролідин-2карбоніл)аміно]-6-фенілкарбамоїлгексилового}етилового ефіру тіокарбонової кислоти, S-{(S)-6[((R)-5-оксопіролідин-2-карбоніл)аміно]-6-м-толуїлкарбамоїлгексильного} ефіру тіооцтової кислоти, S-{(S)-6-[((R)-1-метил-5-оксопіролідин-2-карбоніл)аміно]-6-мтолуїлкарбамоїлгексильного} ефіру тіооцтової кислоти, S-[(S)-6-[((R)-5-оксопіролідин-2карбоніл)аміно]-6-(3-трифторметилфенілкарбамоїл)гексильного] ефіру тіооцтової кислоти, S{(S)-6-[((S)-1-метил-6-оксопіперидин-2-карбоніл)аміно]-6-фенілкарбамоїлгексильного} ефіру тіооцтової кислоти, ((S)-6-меркапто-1-фенілкарбамоїлгексил)аміду (S)-1-метил-6-оксопіперидин2-карбонової кислоти, ((S)-6- меркапто-1-м-толуїлкарбамоїлгексил)аміду (S)-6-оксопіперидин-2карбонової кислоти, ((S)-6-меркапто-1-п-толуїлкарбамоїлгексил)аміду (S)-6-оксопіперидин-2карбонової кислоти й S-{(S)-6-[((S)-6-оксо-1,2,3,6-тетрагідропіридин-2-карбоніл)аміно]-6фенілкарбамоїлгексильного} ефіру тіооцтової кислоти. Опис креслення Фігура 1: Вестерн-блот аналіз екстрактів цитоплазми і ядер клітин NCI-H460 після введення сполуки відповідно до Прикладу 14. У проілюстрованих нижче прикладах наведений не вичерпний перелік об'єктів, що перебувають під захистом даного винаходу. Приклади Скорочення: AcOEt: етилацетат AIBN: азобісизобутиронітрил ДХМ: дихлорметан DIPEA: діізопропілетиламін ДМФ: диметилформамід EDCI: 1-етил-3-(3-диметиламінопропіл)карбодіімід EtOH: етанол Et2O: діетиловий ефір ВЕРХ: високоефективна рідинна хроматографія IPA: ізопропіловий спирт МеОН: метанол NaHCO3: бікарбонат натрію Na2SO4: сульфат натрію NEt3: триетиламін PyBOP: (гексафторфосфат бензотриазол-1-ілокси-трис- (диметиламіно)фосфонію) КТ: кімнатна температура SAc: тіоацетил ТФО: трифтороцтова кислота ТШХ: тонкошарова хроматографія Загальні положення: Всі реакції у безводному середовищі проводили у висушеному полум'ям скляному посуді при позитивному тиску аргону без доступу вологи до реагентів і скляному посуді за допомогою традиційних способів обігу з чутливими до повітря сполуками. Безводний ТГФ, толуол, Et2O і ДХМ отримували шляхом фільтрування через колонки з осушувачем (Solvent Delivery System); інші розчинники перед застосуванням переганяли при позитивному тиску сухого аргону й сушили за допомогою традиційних способів. Реагенти, отримувані з комерційних джерел, використовували без додаткового очищення. Флешхроматографію проводили на силікагелі 230-400 меш із використанням зазначених систем розчинників. Тонкошарову хроматографію проводили на пластинах з попередньо нанесеним силікагелем і фольгованою зворотною стороною (Merck 60F254). Візуалізацію проводили у короткохвильовому ультрафіолеті й/або шляхом занурення пластин у розчин сульфату церію/молібдату амонію у водній H2SO4, перманганату калію або розчин анісальдегіду в етанолі й наступного обвуглювання з використанням фена. Як альтернатива фарбування пластин ТШХ можна проводити шляхом впливу пари йоду у проявляючій камері з йодом. Масовий аналіз із низьким і високим дозволом проводили на мас-спектрометрах AEI-MS 902 або MS-50 з використанням техніки електронного розпилення (ІЕР). Спектри ядерного магнітного резонансу отримували на спектрометрах Gemini (Varian) при 300 або 500 Мгц. Масовий аналіз проводили на спектрометрі Waters ZQ2000 з використанням техніки електронного розпилення (ІЕР). Аналіз 9 UA 111231 C2 5 10 15 20 25 30 35 40 45 РХМС проводили на пристрої LC-Waters (HPLC Waters Alliance 2695, ZQ2000 MS, детектор PDA-УФ 2996). Приклад 1 S-{(S)-6-[((S)-4-оксоазетидин-2-карбоніл)аміно]-6-фенілкарбамоїлгексиловий} складний ефір тіооцтової кислоти Стадія А: Трет-бутиловий ефір ((S)-1-фенілкарбамоїлгекс-5-еніл)карбамінової кислоти Розчин (S)-2-трет-бутоксикарбоніламіногепт-6-енової кислоти (5,24 ммоль), DIPEA (15,7 ммоль) і аніліну (5,76 ммоль) перемішували при КТ у ДХМ (70 мл) протягом 20 хвилин, після чого додавали PyBOP (5,24 ммоль) і безводний ДМФ (5 мл). Реакційну суміш перемішували протягом 2 годин при КТ. Розчинник видаляли при зниженому тиску й неочищену реакційну суміш розбавляли AcOEt, промивали 5% Na2CO3, водою, а потім 5% водною лимонною кислотою й, нарешті, сольовим розчином. Після видалення розчинника при зниженому тиску й очищення на силікагелі (н-гексан/ AcOEt: 9/1) отримували цільовий адукт. Вихід: 85%. 1 H ЯМР (300 МГц, ДМСО-d6) δ: 1,13 (m, 2H), 1,14 (s, 9H), 1,60 (m, 2H), 2,01 (m, 2H), 4,05 (m, 1H), 4,94 (m, 2H), 5,77 (m, 1H), 7,02 (m, 2H), 7,29 (t, 2H), 7,59 (d, 2H), 9,92 (s, 1H). + ІЕР-МС m/z 341,2 (M+Na) . Стадія В: S-((S)-6-трет-бутоксикарбоніламіно-6-фенілкарбамоїлгексиловий) ефір тіооцтової кислоти У перемішуваний розчин трет-бутилового ефіру ((S)-1-фенілкарбамоїлгекс-5еніл)карбамінової кислоти (250 мг, 0,78 ммоль), тіооцтової кислоти (564 мкл, 7,8 ммоль) у дегазованому діоксані при 75 °C додавали AIBN (129 мг, 0,78 ммоль). Реакційну суміш перемішували протягом 1 години. Реакційну суміш охолоджували до 0 °C і при перемішуванні додавали надлишок циклогексану, перемішували протягом 20 хвилин. Реакційну суміш концентрували при зниженому тиску, а отриманий неочищений продукт промивали декілька разів гексаном з отриманням цільового адукту. Вихід: 81%. 1 H ЯМР (300 МГц, ДМСО-d6) δ: 1,30 (m, 4H), 1,36 (s, 9H), 1,47 (m, 2H), 1,56 (m, 2H), 2,29 (s, 3H), 2,79 (t, 2H), 4,02 (m, 1H), 6,96 (d, 1H), 7,02 (t, 1H), 7,28 (t, 2H), 7,57 (d, 2H), 9,89 (s,1H). + ІЕР-МС m/z 417,2 (M+Na) . Стадія С: S-((S)-6-аміно-6-фенілкарбамоїлгексиловий) ефір тіооцтової кислоти У перемішуваний розчин S-((S)-6-трет-бутоксикарбоніламіно-6-фенілкарбамоїлгексилового) ефіру тіооцтової кислоти у ДХМ при 0 °C повільно додавали ТФО. Реакційну суміш потім залишали нагріватися до КТ і перемішували протягом ночі. Розчинник видаляли при зниженому тиску з отриманням цільового адукту у вигляді трифторацетатної солі, який використали без якого-небудь очищення на наступній стадії. Стадія D: S-{(S)-6-[((S)-4-оксоазетидин-2-карбоніл)аміно]-6-фенілкарбамоїлгексиловий} ефір тіооцтової кислоти У розчин трифторацетатної солі, отриманої на стадії С (305 мг, 0,75 ммоль), у ДХМ (10 мл) додавали NEt3 (312 мкл, 2,24 ммоль), (S)-4-оксоазетидин-2-карбонову кислоту (90 мг, 0,79 ммоль), PyBOP (408 мг, 0,79 ммоль) і ДМФ (1,7 мл). Реакційну суміш перемішували протягом ночі, а потім розбавляли AcOEt, промивали водою, 5% водн. Na2CO3, сольовим розчином, 5% розчином лимонної кислоти й знову сольовим розчином. Неочищену речовину очищали шляхом хроматографії на силікагелі з використанням AcOEt як елюент з отриманням цільового адукту у вигляді білої твердої речовини. 10 UA 111231 C2 5 10 15 20 25 30 35 40 45 50 55 60 Вихід: 42%. 1 H ЯМР (300 МГц, ДМСО-d6) δ: 1,31 (m, 4H), 1,48 (m, 2H), 1,64 (m, 2H), 2,29 (s, 3H), 2,67 (dt, 1H), 2,79 (t, 2H), 3,09 (dd, 1H), 4,06 (dd, 1H), 4,42 (m, 1H), 7,03 (t, 1H), 7,28 (t, 2H), 7,57 (d, 2H), 8,12 (s, 1H), 8,38 (d, 1H), 10,07 (s, 1H). + ІЕР-МС m/z 392,0 (M+H) ; ІЕР-МС m/z 504,2 (M+CF3COO) . Сполуки відповідно до Прикладів 2-12 синтезували відповідно до способу, зображеному на схемі 1, з використанням відповідного аміну на стадії А і придатної кислоти на стадії D. Приклад 2 S-[(S)-6-[((S)-6-оксопіперидин-2-карбоніл)аміно]-6-(4-трифторметилбензилкарбамоїл)гексиловий] ефір тіооцтової кислоти Вихід: 51%. 1 H ЯМР (500 МГц, CD2Cl2) δ: 1,39 (m, 4H), 1,56 (m, 2H), 1,64-1,94 (m, 5H), 2,05 (m, 1H), 2,24 (m, 2H), 2,32 (s, 3H), 2,84 (t, 2H), 4,00 (m, 1H), 4,46 (m, 3H), 7,21 (m, 1H), 7,32-7,47 (m, 4H), 7,60 (m, 2H). + ІЕР-МС m/z 502,09 (M+H) . Приклад 3 S-{(S)-6-(3-бензилоксибензилкарбамоїл)-6-[((S)-6-оксопіперидин-2-карбоніл)аміно]гексиловий} ефір тіооцтової кислоти Вихід: 44%. 1 H ЯМР (500 МГц, CD2Cl2) δ: 1,25-1,48 (m, 4H), 1,56 (m, 2H), 1,62-1,97 (m, 5H), 2,01 (m, 1H), 2,23 (m, 2H), 2,30 (s, 3H), 2,83 (t, 2H), 3,98 (m, 1H), 4,36 (m, 2H), 4,46 (m, 1H), 5,06 (m, 2H), 6,826,92 (m, 3H), 7,02 (m, 1H), 7,25 (t, 1H), 7,32-7,50 (m, 5H). + ІЕР-МС m/z 540,17 (M+H) . Приклад 4 S-{(S)-7-(3,4-дигідро-1H-ізохінолін-2-іл)-7-оксо-6-[((S)-6-оксопіперидин-2-карбоніл)аміно]гептиловий} ефір тіооцтової кислоти Вихід: 28%. 1 H ЯМР (500 МГц, ДМСО-d6) δ: 1,15-1,85 (m, 13H), 2,11 (m, 2H), 2,29 (s, 3H), 2,79 (m, 3H), 3,69 (m, 2H), 3,91 (m, 1H), 4,45-4,90 (m, 3H), 7,16 (s, 4H) 7,47 (m, 1H), 8,10 (m, 1H). +. ІЕР-МС m/z 460,14 (M+H) Приклад 5 S-[(S)-6-[((S)-6-оксопіперидин-2-карбоніл)аміно]-6-(2-м-толуїлетилкарбамоїл)гексиловий] ефір тіооцтової кислоти Вихід: 27%. 1 H ЯМР (500 МГц, ДМСО-d6) δ: 1,06-1,32 (m, 4H), 1,36-1,76 (m, 7H), 1,76-1,88 (m, 1H), 2,10 (t, 2H), 2,26 (s, 3H), 2,30 (s, 3H), 2,65 (t, 2H), 2,78 (t, 2H), 3,21 (m, 2H), 3,89 (m, 1H), 4,16 (m, 1H), 6,93-7,03 (m, 2H), 7,14 (m, 1H), 7,50 (d, 1H), 7,86-8,00 (m, 3H). + ІЕР-МС m/z 462,11 (M+H) . Приклад 6 S-{(S)-6-[((R)-1-метил-5-оксопіролідин-2-карбоніл)аміно]-6-м-толуїлкарбамоїлгексиловий} ефір тіооцтової кислоти Вихід: 37%. 1 H ЯМР (300 МГц, ДМСО-d6) δ: 1,31 (m, 4H), 1,48 (m, 2H), 1,63 (m, 2H), 1,80 (m, 1H), 2,17 (m, 3H), 2,25 (s, 3H), 2,28 (s, 3H), 2,58 (s, 3H), 2,80 (t, 2H), 4,13 (m, 1H), 4,37 (m, 1H), 6,85 (d, 1H), 7,16 (t, 1H), 7,36 (d, 1H), 7,40 (s, 1H), 8,47 (d, 1H), 9,99 (s, 1H). + ІЕР-МС m/z 433,4 (M+H) ; 546,5 (M+CF3COO) . Приклад 7 S-{(S)-6-[((S)-5-оксопіролідин-2-карбоніл)аміно]-6-м-толуїлкарбамоїлгексиловий} ефір тіооцтової кислоти Вихід: 53%. 1 H ЯМР (300 МГц, ДМСО-d6) δ: 1,33 (m, 4H), 1,50 (m, 2H), 1,65 (m, 2H), 1,88 (m, 1H), 2,11 (m, 2H), 2,25 (m, 1H), 2,27 (s, 3H), 2,31 (s, 3H), 2,81 (t, 2H), 4,10 (m, 1H), 4,38 (m, 1H), 6,87 (d, 1H), 7,18 (t, 1H), 7,37 (d, 1H), 7,42 (s, 1H), 7,79 (s, 1H), 8,19 (d, 1H), 9,96 (s, 1H). + ІЕР-МС m/z 420,3 (M+H) . Приклад 8 S-{(S)-6-[((R)-5-оксопіролідин-2-карбоніл)аміно]-6-м-толуїлкарбамоїлгексиловий} ефір тіооцтової кислоти Вихід: 43%. 1 H ЯМР (300 МГц, ДМСО-d6) δ: 1,30 (m, 4H), 1,48 (m, 2H), 1,64 (m, 2H), 1,84 (m, 1H), 2,10 (m, 2H), 2,25 (m, 1H), 2,25 (s, 3H), 2,28 (s, 3H), 2,79 (t, 2H), 4,09 (m, 1H), 4,39 (m, 1H), 6,85 (d, 1H), 11 UA 111231 C2 5 10 15 20 25 30 35 7,16 (t, 1H), 7,36 (d, 1H), 7,40 (s, 1H), 7,80 (s, 1H), 8,15 (d, 1H), 9,96 (s, 1H). + ІЕР-МС m/z 420,3 (M+H) . Приклад 9 S-{(S)-6-[((R)-1-метил-5-оксопіролідин-2-карбоніл)аміно]-6-фенілкарбамоїлгексиловий} ефір тіооцтової кислоти Вихід: 36%. 1H ЯМР (300 МГц, ДМСО-d6) δ: 1,34 (m, 4H), 1,51 (m, 2H), 1,66 (m, 2H), 1,82 (m, 1H), 2,22 (m, 3H), 2,31 (s, 3H), 2,61 (s, 3H), 2,82 (t, 2H), 4,14 (m, 1H), 4,42 (m, 1H), 7,07 (t, 1H), 7,32 (t, 2H), 7,60 (d, 2H), 8,47 (d, 1H), 10,10 (s, 1H). + ІЕР-МС m/z 420,3 (M+H) . Приклад 10 S-{(S)-6-[((S)-6-оксо-1,2,3,6-тетрагідропіридин-2-карбоніл)аміно]-6фенілкарбамоїлгексиловий} ефір тіооцтової кислоти Вихід: 64%. 1 H ЯМР (300 МГц, ДМСО-d6) δ: 1,28 (m, 4H), 1,45 (m, 2H), 1,65 (m, 2H), 2,28 (s, 3H), 2,55 (m, 2H), 2,78 (t, 2H), 4,08 (m, 1H), 4,38 (m, 1H), 5,66 (m, 1H), 6,50 (m, 1H), 7,03 (t, 1H), 7,28 (t, 2H), 7,47 (m, 1H), 7,56 (d, 2H), 8,02 (d, 1H), 10,10 (s, 1H). + ІЕР-МС m/z 440,1 (M+Na) . Приклад 11 S-{(S)-6-[((S)-5-оксопіролідин-2-карбоніл)аміно]-6-фенілкарбамоїлгексиловий} ефір тіооцтової кислоти Вихід: 25%. 1 H ЯМР (300 МГц, ДМСО-d6) δ: 1,32 (m, 4H), 1,48 (m, 2H), 1,63 (m, 2H), 1,87 (m, 1H), 2,08 (m, 2H), 2,22 (m, 2H), 2,30 (s, 3H), 2,79 (t, 2H), 4,09 (m, 1H), 4,38 (m, 1H), 7,03 (t, 1H), 7,28 (t, 2H), 7,58 (d, 1H), 7,78 (s, 1H), 8,20 (d, 1H), 10,03 (s, 1H). + ІЕР-МС m/z 406,4 (M+H) . Приклад 12 S-{(S)-6-[((S)-1-метил-6-оксопіперидин-2-карбоніл)аміно]-6-фенілкарбамоїлгексиловий} ефір тіооцтової кислоти Вихід: 68%. 1 H ЯМР (300 МГц, ДМСО-d6) δ: 1,32 (m, 4H), 1,48 (m, 2H), 1,58 (m, 2H), 1,68 (m, 2H), 1,86 (m, 2H), 2,17 (m, 2H), 2,29 (s, 3H), 2,68 (s, 3H), 2,79 (t, 2H), 4,07 (m, 1H), 4,43 (m, 1H), 7,03 (t, 1H), 7,28 (t, 2H), 7,58 (d, 2H), 8,35 (d, 1H), 10,07 (s, 1H). + ІЕР-МС m/z 433,9 (M+H) . Приклад 13 S-{(S)-6-[((R)-6-оксопіперидин-2-карбоніл)аміно]-6-фенілкарбамоїлгексиловий} ефір тіооцтової кислоти Scheme 2 40 45 Стадія А: трет-бутиловий ефір ((S)-1-фенілкарбамоїлгекс-5-еніл)карбамінової кислоти Сполуку отримували відповідно до Стадії А, описаної у Прикладі 1. Стадія В: феніламід (S)-2-аміногепт-6-енової кислоти У перемішуваний розчин трет-бутилового ефіру ((S)-1-фенілкарбамоїлгекс-5еніл)карбамінової кислоти (тобто сполуки, отриманої на стадії А у прикладі 1) при 0 °C повільно 12 UA 111231 C2 5 10 15 20 25 30 35 40 45 50 55 60 додавали ТФО. Реакційну суміш потім залишали нагріватися до КТ і перемішували протягом 2 годин. Розчинник видаляли при зниженому тиску з отриманням цільового адукту у вигляді трифторацетатної солі з кількісним виходом, який використали без якого-небудь очищення на наступній стадії. Стадія С: ((S)-1-фенілкарбамоїлгекс-5-еніл)амід (R)-6-оксопіперидин-2-карбонової кислоти Трифторацетатну сіль, отриману на Стадії А, розчинену у ДХМ/ДМФ (10 мл, 10/2), піддавали взаємодії з (R)-6-оксопіперидин-2-карбоновою кислотою (0,79 ммоль) і PyBOP (0,79 ммоль) у присутності NEt3 (2,25 ммоль) протягом 2 годин. Реакційну суміш розбавляли ДХМ і промивали 5% Na2CO3, сольовим розчином, 5% лимонною кислотою й сольовим розчином. Органічну фазу сушили над Na2SO4, фільтрували і концентрували при зниженому тиску. Неочищену реакційну суміш очищали шляхом хроматографії на силікагелі з використанням суміші AcOEt/МеОН (9/1) як елюент з отриманням цільового адукту у вигляді білої твердої речовини. Вихід: 85%. 1 H ЯМР (300 МГц, ДМСО-d6) δ: 1,38 (m, 2H), 1,65 (m, 5H), 1,86 (m, 1H), 2,03 (m, 2H), 2,11 (t, 2H), 3,96 (m, 1H), 4,44 (m, 1H), 4,96 (m, 2H), 5,77 (m, 1H), 7,04 (t, 1H), 7,29 (t, 2H), 7,47 (d, 1H), 7,57 (d, 2H), 8,13 (d, 1H), 10,03 (s, 1H). + ІЕР-МС m/z 366,3 (M+Na) ; 342,2 (M-H) . Стадія D: S-{(S)-6-[((R)-6-оксопіперидин-2-карбоніл)аміно]-6- фенілкарбамоїлгексиловий} ефір тіооцтової кислоти У перемішуваний розчин ((S)-1-фенілкарбамоїлгекс-5-еніл)аміду (R)-6-оксопіперидин-2карбонової кислоти (220 мг, 0,64 ммоль), тіооцтової кислоти (460 мкл, 6,4 ммоль) у дегазованому діоксані (7 мл) при 75 °C додавали AIBN (105 мг, 0,64 ммоль). Реакційну суміш перемішували до повної конверсії вихідної речовини, яку відслідковували за допомогою аналізу ТШХ. Реакційну суміш охолоджували до 0 °C і реакцію гасили надлишком циклогексану при перемішуванні протягом 20 хвилин. Концентрування при зниженому тиску й очищення шляхом хроматографії на силікагелі з використанням суміші гексан/ДХМ/IPA: 50/40/10 як елюент призводили до отримання цільового адукту. Вихід: 53%. 1 H ЯМР (300 МГц, ДМСО-d6) δ: 1,30 (m, 4H), 1,47 (m, 2H), 1,64 (m, 5H), 1,86 (m, 1H), 2,11 (t, 2H), 2,29 (s, 3H), 2,79 (t, 2H), 3,95 (m, 1H), 4,41 (m, 1H), 7,03 (t, 1H), 7,29 (t, 2H), 7,48 (d, 1H), 7,57 (d, 2H), 8,14 (d, 1H), 10,05 (s, 1H). + + ІЕР-МС m/z 420,1 (M+H) ; 532,2 (M+CF3COO) . Сполуки відповідно до Прикладів 14-18 синтезували відповідно до способу, зображеному на схемі 2, з використанням відповідного аміну на стадії А і придатної кислоти на стадії С. Приклад 14 S-{(S)-6-[((S)-6-оксопіперидин-2-карбоніл)аміно]-6-фенілкарбамоїлгексиловий} ефір тіооцтової кислоти Вихід: 87%. 1 H ЯМР (200 МГц, CDCl3) δ: 1,31 (m, 4H), 1,47 (m, 2H), 1,64 (m, 5H), 1,84 (m, 1H), 2,09 (t, 2H), 2,29 (s, 3H), 2,79 (t, 2H), 3,95 (m, 1H), 4,37 (m, 1H), 7,03 (t, 1H), 7,28 (t, 2H), 7,47 (d, 1H), 7,57 (d, 2H), 8,08 (d, 1H), 9,97 (s, 1H). + ІЕР-МС m/z 420,0 (M+H) ; 532,2 (M+CF3COO) . Приклад 15 S-{(S)-6-[((S)-6-оксопіперидин-2-карбоніл)аміно]-6-п-толуїлкарбамоїлгексиловий} ефір тіооцтової кислоти Вихід: 88%. 1 H ЯМР (300 МГц, ДМСО-d6) δ: 1,30 (m, 2H), 1,47 (m, 2H), 1,64 (m, 5H), 1,84 (m, 1H), 2,10 (t, 2H), 2,23 (s, 3H), 2,29 (s, 3H), 2,79 (t, 2H), 3,94 (m, 1H), 4,37 (m, 1H), 7,09 (d, 2H), 7,45 (d, 2H), 7,47 (d, 1H), 8,06 (d, 1H), 9,87 (s, 1H). + ІЕР-МС m/z 456,6 (M+H) . Приклад 16 S-{(S)-6-[((S)-6-оксопіперидин-2-карбоніл)аміно]-6-м-толуїлкарбамоїлгексиловий} ефір тіооцтової кислоти Вихід: 62%. 1 H ЯМР (300 МГц, ДМСО-d6) δ: 1,31 (m, 4H), 1,47 (m, 2H), 1,61 (m, 5H), 1,84 (m, 1H), 2,10 (t, 2H), 2,25 (s, 3H), 2,29 (s, 3H), 2,80 (t, 2H), 3,95 (m, 1H), 4,36 (m, 1H), 6,85 (d, 1H), 7,16 (t, 1H), 7,35 (d, 1H), 7,40 (s, 1H), 7,47 (d, 1H), 8,09 (d, 1H), 9,90 (s, 1H). + ІЕР-МС m/z 456,4 (M+H) . Приклад 17 S-{(S)-6-[((S)-6-оксопіперидин-2-карбоніл)аміно]-6-циклопентилкарбамоїлгексиловий} ефір тіооцтової кислоти Вихід: 51%. 13 UA 111231 C2 1 5 10 15 20 25 30 35 40 45 H ЯМР (500 МГц, ДМСО-d6) δ: 1,05-1,90 (m, 20H), 2,10 (t, 2H), 2,30 (s, 3H), 2,80 (t, 2H), 3,95(m, 2H), 4,20 (m, 1H), 7,50 (d, 1H), 7,80 (s, 1H), 7,82 (s,1H). + ІЕР-МС m/z 434,38 (M+Na) . Приклад 18 S-[(S)-6-[((R)-5-оксопіролідин-2-карбоніл)аміно]-6-(3-трифторметилфенілкарбамоїл)гексиловий] ефір тіооцтової кислоти Вихід: 84%. 1 H ЯМР (300 МГц, ДМСО-d6) δ: 1,31 (m, 4H), 1,48 (m, 2H), 1,66 (m, 2H), 1,84 (m, 1H), 2,28 (s, 3H), 2,25 (m, 1H), 2,10 (m, 2H), 2,79 (t, 2H), 4,09 (m, 1H), 4,37 (m, 1H), 7,39 (d, 1H), 7,54 (t, 1H), 7,77 (d, 1H), 7,80 (s, 1H), 8,08 (s, 1H), 8,26 (d, 1H), 10,43 (s, 1H). 19 F ЯМР (282 МГц, ДМСО-d6) δ: -62,97. + ІЕР-МС m/z 474,3 (M+H) ; 586,3 (M+CF3COO) . Приклад 19 S-{(S)-6-[((3R*,4S*)-2-оксо-4-фенілпіролідин-3-карбоніл)аміно]-6- фенілкарбамоїлгексиловий} ефір тіооцтової кислоти Стадія А: трет-бутиловий ефір ((S)-6-бром-1-фенілкарбамоїлгексил)карбамінової кислоти EDCI (2,10 г, 11,1 ммоль) і анілін (0,68 мл, 7,5 ммоль) додавали у розчин 7,4 ммоль (S)-7бром-2-трет-бутоксикарбоніламіногептанової кислоти (Gupta P.K., et al., Bioorg. Med. Chem. Lett., 2010, 20, 23, 7067) у ТГФ (70 мл) і реакційну суміш перемішували протягом ночі при КТ. Розчинник видаляли при зниженому тиску й неочищену реакційну суміш розбавляли AcOEt, промивали водою, а потім 10% водною лимонною кислотою й, нарешті, насиченим NaHCO3. Після видалення розчинника при зниженому тиску й очищення на силікагелі (нгексан/AcOEt: 1/9) отримували цільовий адукт. Вихід: 91%. 1 H ЯМР (500 МГц, CDCl3) δ: 1,38-1,48 (m, 14H), 1,75-2,00 (m, 3H), 3,48 (t, 2H), 4,30 (m, 1H), 5,40 (m, 1H), 6,50 (m, 1H), 7,12 (t, 1H), 7,33 (t, 2H), 7,60 (d, 2H). + + ІЕР-МС m/z 421,21 (M+Na) ; 423,21 (M+Na) . Стадія В: S-((S)-6-трет-бутоксикарбоніламіно-6-фенілкарбамоїлгексиловий) ефір тіооцтової кислоти Тіоацетат калію (9,7 ммоль) додавали у розчин трет-бутилового ефіру ((S)-6-бром-1фенілкарбамоїлгексил)карбамінової кислоти (6,5 ммоль) в EtOH (40 мл). Реакційну суміш перемішували при КТ протягом ночі. Розчинник видаляли при зниженому тиску й отриманий осад виливали у воду й двічі екстрагували AcOEt. Органічний шар промивали сольовим розчином і сушили над Na2SO4, після чого випарювали з отриманням цільового адукту. Вихід: 97%. 1 H ЯМР (300 МГц, CDCl3) δ: 1,45-1,50 (m, 13H) 1,65-1,55 (m, 3H), 2,10 (t, 3H), 2,74 (m, 1H), 2,84 (t, 2H), 4,17 (s, 1H), 5,04 (s, 1H), 7,10 (t, 1H), 7,30 (t, 1H), 7,52 (d, 2H). + ІЕР-МС m/z 417,41 (M+Na) . Стадія С: трифторацетат S-((S)-6-аміно-6-фенілкарбамоїлгексилового) ефіру тіооцтової кислоти Трифтороцтову кислоту (61 ммоль) додавали у розчин S-((S)-6-трет-бутоксикарбоніламіно6-фенілкарбамоїлгексилового) ефіру тіооцтової кислоти (6,10 ммоль) у ДХМ (30 мл). Реакційну суміш перемішували при КТ протягом п'яти годин, після чого концентрували при зниженому тиску. Отриману неочищену реакційну суміш двічі обробляли Et 2O для повного видалення надлишку трифтороцтової кислоти. Цільовий адукт отримували у вигляді червонуватої 14 UA 111231 C2 5 10 15 20 25 30 35 40 45 маслянистої рідини. Вихід: кількісний. 1 H ЯМР (500 МГц, ДМСО-d6) δ: 1,20-2,00 (m, 8H), 2,31 (s, 3H), 2,80 (t, 2H), 4,05 (m, 1H), 7,05 (t, 1H), 7,30 (t, 2H), 7,40 (m, 3H), 7,58 (d, 2H), 9,85 (s,1H). Стадія D: S-{(S)-6-[(2-оксо-4-фенілпіролідин-3-карбоніл)аміно]-6- фенілкарбамоїлгексиловий} ефір тіооцтової кислоти Трифторацетат S-((S)-6-аміно-6-фенілкарбамоїлгексилового) ефіру тіооцтової кислоти (1,03 ммоль), DIPEA (3,08 ммоль) і PyBOP (1,03 ммоль) додавали у розчин (3R*,4S*)-2-оксо-4фенілпіролідин-3-карбонової кислоти у ДХМ/ДМФ: 5/9. Отриману реакційну суміш перемішували при КТ протягом ночі. Після видалення розчинника при зниженому тиску отриману тверду речовину висипали у воду й двічі екстрагували AcOEt. Органічний шар потім промивали NaHCO3, водою й сольовим розчином, після чого сушили над Na 2SO4 і концентрували при зниженому тиску з отриманням маслянистої рідини, яку частково очищали шляхом хроматографії на силікагелі, а потім піддавали очищенню ВЕРХ. Вихід: 12%. 1 H ЯМР (500 МГц, ацетон-d6) δ: 1,30-1,80 (m, 8H), 2,28 (s, 3H), 2,81 (t, 2H), 3,51 (t, 1H), 3,75 (d, 1H), 3,87 (m, 1H), 4,31 (m, 1H), 4,54 (m, 1H), 7,00-7,40 (m, 8H), 7,53 (bs, 1H), 7,84 (m, 2H), 7,89 (d, 1H), 9,80 (bs, 1H). + ІЕР-МС m/z 482,06 (M+H) . Сполуки відповідно до Прикладів 20-22 синтезували відповідно до способу, зображеному на схемі 3, з використанням відповідного аміну на стадії А і придатної кислоти на стадії D. Приклад 20 S-{(S)-6-[((3R*,4R*)-2-оксо-4-фенілпіролідин-3-карбоніл)аміно]-6-фенілкарбамоїлгексиловий} ефір тіооцтової кислоти Кислота, яку використали у реакції на стадії D, являла собою цис-рацемічну (тобто «3R*,4R*») суміш 2-оксо-4-фенілпіролідин-3-карбонової кислоти. Вихід: 60%. 1 H ЯМР (300 МГц, ацетон-d6) δ: 1,35-2,00 (m, 8H), 2,28 (s, 3H), 2,84 (t, 2H), 3,40(t, 1H), 3,59 (d, 1H), 3,78 (m, 1H), 4,13 (m, 1H), 4,48 (m, 1H), 7,00-7,40 (m, 9H), 7,63 (m, 2H), 7,89 (d, 1H), 9,25 (bs, 1H). + ІЕР-МС m/z 482,06 (M+H) . Приклад 21 S-{(S)-6-[((R)-5-оксопіролідин-2-карбоніл)аміно]-6-фенілкарбамоїлгексиловий} ефір тіооцтової кислоти Вихід: 35%. 1 H ЯМР (500 МГц, CD3OD) δ: 1,20-2,00 (m, 10H), 2,18 (m, 2H), 2,29 (s, 3H), 2,80 (t, 2H), 4,07 (m, 1H), 4,40 (m, 1H), 7,04 (t, 2H), 7,29 (t, 2H), 7,57 (d, 1H), 7,58 (d, 2H), 8,10 (d, 1H), 9,90 (s, 1H). +. ІЕР-МС m/z 428,17 (M+Na) Приклад 22 S-{(S)-6-[(R*)-(2-оксопіперидин-3-карбоніл)аміно]-6-фенілкарбамоїлгексиловий} ефір тіооцтової кислоти Вихід: 60%. 1 H ЯМР (500 МГц, CD3OD) δ: 1,42-1,19 (m, 10H), 2,29 (s, 3H), 2,55 (t, 2H), 2,80 (t, 2H), 3,35 (m, 2H), 3,40 (m, 2H), 4,53 (m, 2H), 7,12 (t, 1H), 7,33 (t, 2H), 7,60 (d, 2H). + ІЕР-МС m/z 442,14 (M+Na) . Приклад 23 ((S)-6-меркапто-1-фенілкарбамоїлгексил)амід (S)-6-оксопіперидин-2-карбонової кислоти 50 2н. розчин NaOH (7,0 ммоль) додавали у розчин S-{(S)-6-[((S)-6-оксопіперидин-2 15 UA 111231 C2 5 10 15 20 25 30 35 40 45 50 55 60 карбоніл)аміно]-6-фенілкарбамоїлгексилового} ефіру тіооцтової кислоти (0,95 ммоль) в EtOH (13 мл). Реакційну суміш перемішували при КТ протягом ночі, а потім виливали у воду й екстрагували AcOEt, промивали водою, сольовим розчином й, нарешті, сушили над Na2SO4. Видалення розчинника при зниженому тиску призводило до отримання цільового адукту, який очищали шляхом ВЕРХ. Вихід: 20%. 1 H ЯМР (500 МГц, CD3OD) δ: 1,50 (m, 4H), 1,68 (m, 2H), 1,80 (m, 2H), 1,95 (m, 3H), 2,10 (m, 1H), 2,38 (m, 2H), 2,55 (t, 2H), 4,15 (t, 1H), 4,53 (m, 1H), 7,12 (t, 1H), 7,33 (t, 2H), 7,60 (d, 2H). + ІЕР-МС m/z 400,40 (M+Na) ; 376,34 (M-H) . Сполуки відповідно до Прикладів 24-40 синтезували відповідно до способу, зображеному на схемі 4, з використанням відповідної вихідної речовини. Приклад 24 ((S)-1-циклопентилкарбамоїл-6-меркаптогексил)амід (S)-6-оксопіперидин-2-карбонової кислоти Вихідною речовиною була сполука відповідно до Прикладу 17. Вихід: 44%. 1 H ЯМР (500 МГц, ДМСО-d6) δ: 1,05-1,90 (m, 20H), 2,12 (t, 2H), 2,21 (t, 1H), 2,45 (m, 2H), 3,92 (m, 1H), 3,97 (m, 1H), 4,21 (m, 1H), 7,55 (d, 1H), 7,80 (s, 1H), 7,82 (s,1H). + ІЕР-МС m/z 392,2 (M+Na) ; 368,1 (M-H) . Приклад 25 [(S)-1-(3-бензилоксибензилкарбамоїл)-6-меркаптогексил]амід (S)-6-оксопіперидин-2карбонової кислоти Вихідною речовиною була сполука відповідно до Прикладу 3. Вихід: 32%. 1 H ЯМР (500 МГц, CD2Cl2) δ: 1,20-1,48 (m, 4H), 1,48-2,02 (m, 8H), 2,21 (m, 2H), 2,49 (m, 2H), 3,20-3,42 (m, 2H), 4,51 (m, 1H), 5,04 (s, 2H), 6,80-6,95 (m, 3H), 7,23 (t, 1H), 7,28-7,50 (m, 5H), 7,64 (s, 1H), 7,75 (d, 1H). + ІЕР-МС m/z 498,35 (M+H) . Приклад 26 [(S)-6-меркапто-1-(4-трифторметилбензилкарбамоїл)гексил]амід (S)-6-оксопіперидин-2карбонової кислоти Вихідною речовиною була сполука відповідно до Прикладу 2. Вихід: 33%. 1 H ЯМР (500 МГц, CD2Cl2) δ: 1,38 (m, 4H), 1,52-2,12 (m, 9H), 2,23 (m, 2H), 2,50 (m, 2H), 3,98 (m, 1H), 4,45 (m, 3H), 7,20 (m, 1H), 7,28-7,72 (m, 6H). + ІЕР-МС m/z 460,14 (M+H) . Приклад 27 ((S)-6-меркапто-1-фенілкарбамоїлгексил)амід (S)-4-оксоазетидин-2-карбонової кислоти Вихідною речовиною була сполука відповідно до Прикладу 1. Вихід: 56%. 1 H ЯМР (300 МГц, ДМСО-d6) δ:1,34 (m, 4H), 1,57 (m, 4H), 2,22 (t, 1H), 2,47 (q, 1H), 2,66 (m, 2H), 3,10 (dd, 1H), 4,07 (m, 1H), 4,43 (m, 1H), 7,04 (t, 1H), 7,29 (t, 2H), 7,58 (d, 2H), 8,15 (s, 1H), 8,43 (d, 1H), 10,11 (s, 1H). + ІЕР-МС m/z 372,2 (M+Na) ; 348,2 (M-H) . Приклад 28 ((S)-6-меркапто-1-фенілкарбамоїлгексил)амід (3S,4S)-2-оксо-4-фенілпіролідин-3-карбонової кислоти Вихідною речовиною була сполука відповідно до Прикладу 20. Після гідролізу діастереомірну суміш двох тіолатних похідних очищали шляхом флеш-хроматографії на силікагелі, що забезпечувало виділення чистих ізомерів. Вихід: 44%. 1 H ЯМР (500 МГц, ацетон-d6) δ: 1,35-2,00 (m, 8H), 2,42 (t, 2H), 3,40 (t, 1H), 3,59 (d, 1H), 3,78 (m, 1H), 4,13 (m, 1H), 4,48 (m, 1H), 7,00-7,40 (m, 9H), 7,63 (m, 2H), 7,89 (d, 1H), 9,25 (bs, 1H). + ІЕР-МС m/z 462,27 (M+Na) . Приклад 29 ((S)-6-меркапто-1-фенілкарбамоїлгексил)амід (3R,4R)-2-оксо-4-фенілпіролідин-3-карбонової кислоти Сполуку відповідно до Прикладу 29 отримували після очищення відповідно до способу, наведеному у Прикладі 28. Вихід: 37%. 1 H ЯМР (500 МГц, ацетон-d6) δ: 1,35-2,00 (m, 8H), 2,42 (t, 2H), 3,51 (t, 1H), 3,75 (d, 1H), 3,87 16 UA 111231 C2 5 10 15 20 25 30 35 40 45 50 55 60 (m, 1H), 4,31 (m, 1H), 4,54 (m, 1H), 7,00-7,40 (m, 9H), 7,63 (m, 2H), 7,89 (d, 1H), 9,25 (bs, 1H). + ІЕР-МС m/z 462,27 (M+Na) . Приклад 30 ((S)-6-меркапто-1-фенілкарбамоїлгексил)амід (3R,4S)-2-оксо-4-фенілпіролідин-3-карбонової кислоти Вихідною речовиною була сполука відповідно до Прикладу 19. Після гідролізу діастереомірну суміш двох тіолатних похідних очищали шляхом флеш-хроматографії на силікагелі, що забезпечувало виділення чистого ізомеру. Вихід: 40%. 1 H ЯМР (500 МГц, ацетон-d6) δ: 1,30-1,80 (m, 8H), 2,42 (t, 2H), 3,51 (t, 1H), 3,75 (d, 1H), 3,87 (m, 1H), 4,31 (m, 1H), 4,54 (m, 1H), 7,00-7,40 (m, 8H), 7,53 (bs, 1H), 7,84 (m, 2H), 7,89 (d, 1H), 9,80 (bs, 1H). + ІЕР-МС m/z 462,81 (M+Na) . Приклад 31 ((S)-6-меркапто-1-фенілкарбамоїлгексил)амід (3S,4R)-2-оксо-4-фенілпіролідин-3-карбонової кислоти Сполуку відповідно до Прикладу 31 отримували після очищення відповідно до способу, наведеному у Прикладі 30. Вихід: 37%. 1 H ЯМР (500 МГц, CD3OD) δ: 1,35-2,40 (m, 8H), 2,43 (m, 2H), 3,48 (t, 1H), 3,80 (m, 2H), 4,22 (m, 1H), 4,53 (m, 1H), 7,09 (m, 2H), 7,30 (m, 4H), 7,36 (m, 4H), 7,68 (m, 2H). + ІЕР-МС m/z 462,27 (M+Na) . Приклад 32 [(S)-1-(3,4-дигідро-1H-ізохінолін-2-карбоніл)-6-меркаптогексил]амід (S)-6-оксопіперидин-2карбонової кислоти Вихідною речовиною була сполука відповідно до Прикладу 4. Вихід: 37%. 1 H ЯМР (500 МГц, ДМСО-d6) δ: 1,10-1,90 (m, 13H), 2,05-2,23 (m, 2H), 2,35-3,00 (m, 4H), 3,60-4,10 (m, 3H), 4,48-4,86 (m, 3H), 7,17 (s, 4H), 7,49 (m, 1H), 8,10 (m, 4H). + ІЕР-МС m/z 418,05 (M+H) . Приклад 33 ((S)-6-меркапто-1-фенілкарбамоїлгексил)амід (R)-5-оксопіролідин-2-карбонової кислоти Вихідною речовиною була сполука відповідно до Прикладу 21. Вихід: 42%. 1 H ЯМР (500 МГц, ДМСО-d6) δ: 1,20-2,00 (m, 10H), 2,18 (m, 2H), 2,21 (t, 1H), 2,45 (m, 1H), 4,05 (m, 1H), 4,40 (m, 1H), 7,04 (t, 1H), 7,29 (t, 2H), 7,55 (d, 1H), 7,58 (d, 2H), 8,08 (d, 1H), 9,98 (s, 1H). + ІЕР-МС m/z 364,28 (M+H) . Приклад 34 [(S)-6-меркапто-1-(2-м-толуїлетилкарбамоїл)гексил]амід (S)-6-оксопіперидин-2- карбонової кислоти Вихідною речовиною була сполука відповідно до Прикладу 5. Вихід: 41%. 1 H ЯМР (500 МГц, ДМСО-d6) δ: 1,10-1,34 (m, 4H), 1,42-1,76 (m, 7H), 1,83 (m, 1H), 2,11 (t, 2H), 2,21 (t, 1H), 2,27 (s, 3H), 2,44 (m, 2H), 2,66 (t, 2H), 3,23 (m, 2H), 3,91 (m, 1H), 4,19 (m, 1H), 6,907,08 (m, 2H), 7,16 (t, 1H), 7,51 (bs, 1H), 7,89 (d, 1H), 7,95 (t, 1H). + ІЕР-МС m/z 420,09 (M+H) . Приклад 35 ((S)-6-меркапто-1-фенілкарбамоїлгексил)амід (R)-2-оксопіперидин-3-карбонової кислоти Вихідною речовиною була сполука відповідно до Прикладу 22. Після гідролізу діастереомірну суміш двох тіолатних похідних очищали шляхом флеш-хроматографії на силікагелі, що забезпечувало виділення чистого ізомеру. Вихід: 39%. 1 H ЯМР (500 МГц, CD3OD) δ: 1,42-1,19 (m, 12H), 2,55 (t, 2H), 3,35 (m, 2H), 3,40 (m, 2H), 4,53 (m, 2H), 7,12 (t, 1H), 7,33 (t, 2H), 7,60 (d, 2H). + ІЕР-МС m/z 400,40 (M+Na) . Приклад 36 ((S)-6-меркапто-1-фенілкарбамоїлгексил)амід (S)-2-оксопіперидин-3-карбонової кислоти Сполуку відповідно до Прикладу 36 отримували після очищення відповідно до способу, наведеному у Прикладі 35. Вихід: 20%. 17 UA 111231 C2 1 5 10 15 20 25 30 35 40 45 50 55 60 H ЯМР (500 МГц, CD3OD) δ: 1,40-2,22 (m, 12H), 2,55 (t, 2H), 3,35 (m, 2H), 3,42 (m, 2H), 4,53 (m, 2H), 7,09 (t, 1H), 7,29 (t, 2H), 7,68 (d, 2H). + ІЕР-МС m/z 400,40 (M+Na) . Приклад 37 ((S)-6-меркапто-1-фенілкарбамоїлгексил)амід (R)-6-оксопіперидин-2-карбонової кислоти Вихідною речовиною була сполука відповідно до Прикладу 13. Вихід: 82%. 1 H ЯМР (300 МГц, ДМСО-d6) δ: 1,34 (m, 4H), 1,51 (m, 2H), 1,64 (m, 5H), 1,87 (m, 1H), 2,11 (t, 2H), 2,22 (t, 1H), 2,44 (m, 2H), 3,96 (m, 1H), 4,43 (m, 1H), 7,04 (t, 1H), 7,29 (t, 2H), 7,49 (d, 1H), 7,57 (d, 2H), 8,13 (d, 1H), 10,04 (s, 1H). + ІЕР-МС m/z 400,2 (M+Na) ; 376,2 (M-H) . Приклад 38 ((S)-6-меркапто-1-м-толуїлкарбамоїлгексил)амід (S)-6-оксопіперидин-2-карбонової кислоти Вихідною речовиною була сполука відповідно до Прикладу 16. Вихід: 25%. 1 H ЯМР (300 МГц, ДМСО-d6) δ: 1,34 (m, 4H), 1,51 (m, 2H), 1,64 (m, 5H), 1,85 (m, 1H), 2,10 (t, 2H), 2,20 (t, 1H) 2,25 (s, 3H), 2,44 (m, 2H), 3,95 (m, 1H), 4,38 (m, 1H), 6,85 (d, 1H), 7,16 (t, 1H), 7,36 (d, 1H), 7,41 (s, 1H), 7,48 (d, 1H), 8,06 (d, 1H), 9,89 (s, 1H). + ІЕР-МС m/z 414,3 (M+Na) ; 390,4 (M-H) . Приклад 39 ((S)-6-меркапто-1-п-толуїлкарбамоїлгексил)амід (S)-6-оксопіперидин-2-карбонової кислоти Вихідною речовиною була сполука відповідно до Прикладу 15. Вихід: 53%. 1 H ЯМР (300 МГц, ДМСО-d6) δ: 1,33 (m, 4H), 1,51 (m, 2H), 1,60 (m, 5H), 1,83 (m, 1H), 2,10 (t, 2H), 2,21 (t, 1H), 2,23 (s, 3H), 2,43 (m, 2H), 3,95 (m, 1H), 4,37 (m, 1H), 7,09 (d, 2H), 7,45 (d, 2H), 7,48 (d, 1H), 8,08 (d, 1H), 9,89 (s, 1H). + ІЕР-МС m/z 414,4 (M+Na) ; 390,3 (M-H) . Приклад 40 ((S)-6-меркапто-1-фенілкарбамоїлгексил)амід (S)-1-метил-6-оксопіперидин-2-карбонової кислоти Вихідною речовиною була сполука відповідно до Прикладу 12. Вихід: 28%. 1 H ЯМР (300 МГц, ДМСО-d6) δ: 1,34 (m, 4H), 1,49 (m, 2H), 1,57 (m, 3H), 1,66 (m, 2H), 1,88 (m, 2H), 2,17 (m, 2H), 2,67 (s, 3H), 2,80 (t, 2H), 4,08 (m, 1H), 4,42 (m, 1H), 7,02 (t, 1H), 7,26 (t, 2H), 7,56 (d, 2H), 8,33 (d, 1H), 10,05 (s, 1H). + ІЕР-МС m/z 392,0 (M+H) . Приклад 41 Змішаний {(S)-6-[((S)-6-оксопіперидин-2-карбоніл)аміно]-6-фенілкарбамоїлгексиловий}етиловий ефір тіокарбонової кислоти У розчин ((S)-6-меркапто-1-фенілкарбамоїлгексил)аміду (S)-6-оксопіперидин-2- карбонової кислоти (0,21 ммоль) у ДХМ (20 мл) додавали NEt3 (0,23 ммоль) і етилхлорформіат (0,23 ммоль). Реакційну суміш перемішували при КТ протягом 2 годин. Реакційну суміш концентрували при зниженому тиску й неочищений продукт очищали шляхом хроматографії на силікагелі з використанням суміші AcOEt/Меон: 80/20 як елюент. Вихід: 74%. 1 H ЯМР (500 МГц, ДМСО-d6) δ: 1,20 (t, 3H), 1,25-1,45 (m, 4H), 1,52-1,80 (m, 7H), 1,87 (m, 1H), 2,11 (t, 2H), 2,82 (t, 2H), 3,97 (m, 1H), 4,21 (m, 4H), 3,47 (q, 2H), 4,41 (m, 1H), 7,05 (t, 1H), 7,30 (t, 2H), 7,48 (bs, 1H), 7,58 (d, 2H), 8,10 (d, 1H), 9,99 (s, 1H). + ІЕР-МС m/z 450,15 (M+H) . Сполуку відповідно до Прикладу 42 синтезували відповідно до способу, наведеному у Прикладі 41, з використанням ((S)-6-меркапто-1-фенілкарбамоїлгексил)аміду (R)-5оксопіролідин-2-карбонової кислоти замість ((S)-6-меркапто-1-фенілкарбамоїлгексил)-аміду (S)6-оксопіперидин-2-карбонової кислоти. Приклад 42 Змішаний {(S)-6-[((R)-5-оксопіролідин-2-карбоніл)аміно]-6-фенілкарбамоїлгексиловий}етиловий ефір тіокарбонової кислоти Вихід: 82%. 1 H ЯМР (300 МГц, ДМСО-d6) δ: 1,18 (t, 3H), 1,33 (m, 4H), 1,6 (m, 4H), 1,85 (m, 1H), 2,10 (m, 2H), 2,25 (m, 1H), 2,79 (t, 2H), 4,09 (m, 1H), 4,20 (q, 2H), 4,42 (m, 1H), 7,03 (t, 1H), 7,28 (t, 2H), 7,57 (d, 2H), 7,82 (s, 1H), 8,20 (d, 1H), 10,05 (s, 1H). 18 UA 111231 C2 + 5 10 15 20 25 30 ІЕР-МС m/z 436,3 (M+H) . Приклад 43 S-{(S)-6-[((S)-6-оксопіперидин-2-карбоніл)аміно]-6-фенілкарбамоїлгексиловий} ефір тіоізомасляної кислоти Дану сполуку синтезували відповідно до способу, описаному у Прикладі 30, але з використанням ізобутирилхлориду замість етилхлорформіату. Вихід: 42%. 1 H ЯМР (500 МГц, ДМСО-d6) δ: 1,04 (t, 6H), 1,22-1,44 (m, 4H), 1,46-1,77 (m, 6H), 1,93 (m, 1H), 2,06 (m, 1H), 2,20 (m, 1H), 2,37 (m, 1H), 2,48 (m, 4H), 3,47 (m, 1H), 4,32 (m, 1H), 4,81 (m, 1H), 7,04 (t, 1H), 7,29 (t, 2H), 7,57 (d, 2H), 8,33 (d, 1H), 9,99 (s, 1H). + ІЕР-МС m/z 448,24 (M+H) . Сполука А S-(6-фенілкарбамоїлгексиловий) ефір тіооцтової кислоти Дану комерційно доступну похідну, яка не містить фрагмент лактамкарбоніламіногрупи у бічному ланцюзі при кістяку, досліджували як сполуку порівняння в експерименті in vivo, в якому тестували сполуку відповідно до Прикладу 14 (таблиця 8). Біологія Приклад 44 Ферментне дослідження HDAC Визначення профілю HDAC проводили у відношенні одинадцяти виділених ізоформ HDAC людини у присутності фторогенного тетрапептидного субстрату RHKKAc (від р53 залишки 379382) (10 мкМ). Виділені HDAC людини отримували шляхом стандартного очищення за винятком HDAC3, яка є рекомбінантним білком людини, тобто комплексом повнорозмірної HDAC3 людини з С-термінальним His-тегом й амінокислот 395-489 NCOR2 людини з N-термінальним GSTтегом, які спільно експресували у системі експресування бакуловірусу. Кожну сполуку розчиняли у ДМСО, і послідовно розведені розчини використовували для дослідження. TSA й SAHA використовували як сполуки порівняння. Після деацетилування вивільнявся фтороформ, що був джерелом флуоресцентного випромінювання, його детектували на флуорометрі, значення IC50 сполук визначали шляхом аналізу кривих залежності доза – інгібуючий ефект. TSA й SAHA використовували як сполуки порівняння. Таблиця 1 Приклади SAHA 23 24 25 26 27 28 29 30 31 32 33 34 35 36 37 38 39 40 1 + +++ + + + +++ +++ ++ ++ +++ + +++ ++ +++ +++ +++ +++ +++ +++ 2 + ++ + + + ++ + + + +++ +++ ++ + +++ +++ +++ +++ ++ ++ 3 + +++ ++ + + +++ +++ ++ ++ +++ + +++ + +++ +++ +++ +++ +++ +++ IC50, Ізоформи HDAC (нМ) 4 5 6 7 8 + + +++ + + +++ +++ +++ +++ + +++ + +++ +++ + + + ++ + +++ +++ + + + +++ + +++ +++ +++ ++ +++ ++ +++ + + +++ + +++ + + +++ + + + + +++ +++ +++ +++ +++ +++ + + + + ++ +++ +++ +++ + +++ + +++ + +++ +++ +++ +++ +++ ++ +++ +++ +++ ++ + +++ +++ +++ + + + +++ +++ +++ + + +++ +++ +++ + + +++ +++ +++ + 9 + +++ +++ + + +++ +++ ++ ++ +++ + +++ + +++ +++ +++ +++ +++ +++ 10 + +++ + + + +++ +++ +++ +++ +++ + +++ ++ +++ +++ +++ +++ +++ +++ 11 + +++ ++ + + +++ +++ +++ +++ +++ + +++ ++ +++ +++ +++ +++ +++ +++ IC50 < 50 нМ: +++; 50 нМ < IC50 < 100 нМ: ++; 100 нМ < IC50
ДивитисяДодаткова інформація
Назва патенту англійськоюLactam thioderivatives as potent hdac inhibitors and their uses as medicaments
Автори англійськоюGiannini, Ciuseppe, Cabri, Walter, Battistuzzi, Gianfranco, Vignola, Davide, Fanto', Nicola, Pisano, Claudio, Vesci, Loredana
Назва патенту російськоюТиопроизводные лактамов как высокоактивные ингибиторы hdac и их применение как лечебного средства
Автори російськоюДжаннини Джузэппэ, Кабри Вальтер, Баттистуцци Джанфранко, Винёла Давидэ, Фанто' Никола, Пизано Клаудио, Веши Лоредана
МПК / Мітки
МПК: A61P 25/00, C07D 205/08, A61K 31/4015, C07D 207/277, A61K 31/4709, A61P 35/00, C07D 211/78, A61P 29/00, A61P 33/00, A61K 31/397, A61K 31/45, C07D 401/04, C07D 207/28
Мітки: високоактивні, лактамів, тіопохідні, застосування, засобу, лікарського, інгібітори
Код посилання
<a href="https://ua.patents.su/29-111231-tiopokhidni-laktamiv-yak-visokoaktivni-ingibitori-hdac-ta-kh-zastosuvannya-yak-likarskogo-zasobu.html" target="_blank" rel="follow" title="База патентів України">Тіопохідні лактамів як високоактивні інгібітори hdac та їх застосування як лікарського засобу</a>
Попередній патент: Введення сухого сорбенту у скрубер сухої очистки під час роботи в умовах нестаціонарного режиму
Наступний патент: Спосіб нанесення гальванічного покриття сплавами заліза для зміцнення поверхні деталей зі сталі та чавуну
Випадковий патент: Спосіб керування процесом сушіння в мікрохвильовому полі