Застосування sarp-1 для лікування та/або попередження фіброзних захворювань
Номер патенту: 83790
Опубліковано: 26.08.2008
Автори: Пауер Крістін, Платер-Зіберк Крістін, Колінж Жак
Формула / Реферат
1. Застосування речовини, вибраної з групи, що складається з:
(a) зрілого SARP-1;
(b) фрагмента SARP-1, що містить багатий цистеїном “завитий” домен;
(с) поліпептиду, що містить SEQ ID NO: 2;
(d) поліпептиду, що містить амінокислоти з 21 по 295 SEQ ID NO: 2;
(е) поліпептиду, що містить амінокислоти з 24 по 295 SEQ ID NO: 2;
(f) поліпептиду, що містить амінокислоти з 25 по 295 SEQ ID NO: 2;
(g) поліпептиду, що містить амінокислоти з 26 по 295 SEQ ID NO: 2;
(h) поліпептиду, що містить амінокислоти з 27 по 295 SEQ ID NO: 2;
(і) поліпептиду, що містить амінокислоти з 28 по 295 SEQ ID NO: 2;
(j) поліпептиду, що містить амінокислоти з 37 по 295 SEQ ID NO: 2;
(k) мутеїну будь-якого з (а)-(j), в якому амінокислотна послідовність має принаймні 70 % або 80 %, або 90 % ідентичність принаймні з однією з послідовностей в (а)-(j);
(l) мутеїну будь-якого з (а)-(j), який кодується послідовністю ДНК, яка гібридизується з комплементом нативної послідовності ДНК, що кодує будь-який з (а)-(j), при помірно жорстких умовах або при надзвичайно жорстких умовах;
(m) мутеїну будь-якого з від (а) до (j), в якому будь-які зміни в амінокислотній послідовності є консервативними амінокислотними заміщеннями в амінокислотних послідовностях в (а)-(j); і
(n) солі або ізоформи, злитого білка, функціонального похідного або активної фракції будь-якого з (а)-(m),
для виробництва лікарського засобу для лікування і/або попередження фіброзного захворювання, вибраного з групи, яка складається зі склеродермії, цирозу печінки, інтерстиціального та ідіопатичного фіброзу легень, бронхопульмональної дисплазії, саркоїдозу, фібропроліферативного ARDS (РДСД), контактури Дюпюітрена, келоїду, рубців та реактивного фіброзу.
2. Застосування за п. 1, при якому речовина є глікозильованою по одній або більше ділянках.
3. Застосування за будь-яким з пп. 1-2, при якому злитий білок включає сполуку з імуноглобуліном (Іg).
4. Застосування за будь-яким з попередніх пунктів, при якому функціональне похідне містить щонайменше одну складову, приєднану до однієї або більше функціональних груп, які зустрічаються у вигляді одного або більше бічних ланцюгів на амінокислотних залишках.
5. Застосування за п. 4, при якому складова являє собою поліетиленову складову.
6. Застосування молекули нуклеїнової кислоти для виробництва лікарського засобу для лікування і/або попередження фіброзного захворювання, вибраного з групи, яка складається зі склеродермії, цирозу печінки, інтерстиціального та ідіопатичного фіброзу легень, бронхопульмональної дисплазії, саркоїдозу, фібропроліферативного ARDS (РДСД), контактури Дюпюітрена, келоїду, рубців та реактивного фіброзу, причому молекула нуклеїнової кислоти містить послідовність нуклеїнової кислоти, кодуючої поліпептид, який включає амінокислотну послідовність, вибрану з групи, що складається з:
(a) зрілого SARP-1;
(b) фрагмента SARP-1, що містить багатий цистеїном “завитий” домен;
(с) поліпептиду, що містить SEQ ID NO: 2;
(d) поліпептиду, що містить амінокислоти з 21 по 295 SEQ ID NO: 2;
(е) поліпептиду, що містить амінокислоти з 24 по 295 SEQ ID NO: 2;
(f) поліпептиду, що містить амінокислоти з 25 по 295 SEQ ID NO: 2;
(g) поліпептиду, що містить амінокислоти з 26 по 295 SEQ ID NO: 2;
(h) поліпептиду, що містить амінокислоти з 27 по 295 SEQ ID NO: 2;
(і) поліпептиду, що містить амінокислоти з 28 по 295 SEQ ID NO: 2;
(j) поліпептиду, що містить амінокислоти з 37 по 295 SEQ ID NO: 2;
(k) мутеїну будь-якого з (а)-(j), в якому амінокислотна послідовність має принаймні 70 % або 80 %, або 90 % ідентичність принаймні з однією з послідовностей в (а)-(j);
(l) мутеїну будь-якого з (а)-(j), який кодується послідовністю ДНК, яка гібридизується з комплементом нативної послідовності ДНК, що кодує будь-який з (а)-(j), при помірно жорстких умовах або при надзвичайно жорстких умовах;
(m) мутеїну будь-якого з від (а) до (j), в якому будь-які зміни в амінокислотній послідовності є консервативними амінокислотними заміщеннями в амінокислотних послідовностях в (а)-(j); і
(n) ізоформи, злитого білка або активної фракції будь-якого з (а)-(m).
7. Застосування вектора, що містить молекулу нуклеїнових кислот за п. 6, для виробництва лікарського засобу для лікування і/або попередження фіброзного захворювання, вибраного з групи, яка складається зі склеродермії, цирозу печінки, інтерстиціального та ідіопатичного фіброзу легень, бронхопульмональної дисплазії, саркоїдозу, фібропроліферативного ARDS (РДСД), контактури Дюпюітрена, келоїду, рубців та реактивного фіброзу.
8. Застосування за п. 7, при якому вектор є експресуючим вектором.
9. Застосування за п. 7 або 8, при якому вектор являє собою вектор генної терапії.
10. Застосування вектора для індукції і/або збільшення ендогенної продукції поліпептиду за п. 1 в клітині для одержання лікарського засобу для лікування і/або попередження фіброзного захворювання, вибраного з групи, яка складається зі склеродермії, цирозу печінки, інтерстиціального та ідіопатичного фіброзу легень, бронхопульмональної дисплазії, саркоїдозу, фібропроліферативного ARDS (РДСД), контактури Дюпюітрена, келоїду, рубців та реактивного фіброзу.
11. Застосування клітини, що містить вектор за будь-яким з пп. 7-10, для приготування лікарського засобу для лікування і/або попередження фіброзного захворювання, вибраного з групи, яка складається зі склеродермії, цирозу печінки, інтерстиціального та ідіопатичного фіброзу легень, бронхопульмональної дисплазії, саркоїдозу, фібропроліферативного ARDS (РДСД), контактури Дюпюітрена, келоїду, рубців та реактивного фіброзу.
12. Застосування клітини, яка експресує речовину за будь-яким з пп. 1-3, для виробництва лікарського засобу для лікування і/або попередження фіброзного захворювання, вибраного з групи, яка складається зі склеродермії, цирозу печінки, інтерстиціального та ідіопатичного фіброзу легень, бронхопульмональної дисплазії, саркоїдозу, фібропроліферативного ARDS (РДСД), контактури Дюпюітрена, келоїду, рубців та реактивного фіброзу.
13. Застосування клітини, яка була генетично модифікована, щоб продукувати поліпептид за пп. 1-3, для виробництва лікарського засобу для лікування і/або попередження фіброзного захворювання, вибраного з групи, яка складається зі склеродермії, цирозу печінки, інтерстиціального та ідіопатичного фіброзу легень, бронхопульмональної дисплазії, саркоїдозу, фібропроліферативного ARDS (РДСД), контактури Дюпюітрена, келоїду, рубців та реактивного фіброзу.
14. Застосування за будь-яким з попередніх пунктів, де речовину вводять системно.
15. Застосування за будь-яким з попередніх пунктів, де речовину вводять внутрішньом’язовою, підшкірною або внутрішньовенною ін’єкцією або інгаляцією.
16. Застосування за будь-яким з попередніх пунктів, при якому лікарський засіб, додатково, містить інтерферон для одночасного, послідовного або роздільного застосування.
17. Застосування за п. 16, при якому інтерферон є інтерфероном-β.
18. Застосування за будь-яким з попередніх пунктів, при якому лікарський засіб, додатково, містить антагоніст фактора некрозу пухлини (TNF) для одночасного, послідовного або роздільного застосування.
19. Застосування за п. 18, при якому антагоніст TNF являє собою TBPI і/або TBPII.
20. Застосування за будь-яким з попередніх пунктів, при якому захворюванням є склеродермія та лікарський засіб, додатково, містить антисклеродермічний агент для одночасного, послідовного або роздільного застосування.
21. Застосування за п. 20, при якому антисклеродермічний агент вибраний з групи, що складається з інгібіторів АСЕ (АПФ), блокаторів кальцієвих каналів, інгібіторів протонного насоса, NSAID, СОХ-інгібіторів, кортикостероїдів, тетрацикліну, пентоксифіліну, буциламіну, інгібіторів геранілгеранілтрансферази, ротерліну, інгібіторів проліл-4-гідроксилази, інгібіторів с-протеїнази, інгібіторів лізилоксидази, релаксину, галогенфугінону, простагландинів, простациклінів, ендотеліну-1, оксиду азоту, інгібіторів ангіотензину II і антиоксидантів.
22. Спосіб лікування і/або попередження фіброзного захворювання, вибраного з групи, яка складається зі склеродермії, цирозу печінки, інтерстиціального та ідіопатичного фіброзу легень, бронхопульмональної дисплазії, саркоїдозу, фібропроліферативного ARDS (РДСД), контактури Дюпюітрена, келоїду, рубців та реактивного фіброзу, що включає введення пацієнту ефективної кількості речовини за пп. 1-10, необов’язково, разом з фармацевтично прийнятним носієм.
23. Спосіб за п. 22, де речовину вводять системно.
24. Спосіб за п. 22, де речовину вводять внутрішньом’язовою, підшкірною або внутрішньовенною ін’єкцією або інгаляцією.
25. Фармацевтична композиція, що містить речовину, як описано в пп. 1-5, в комбінації з антисклеродермічним агентом, вибраним з групи, що складається з інгібіторів АСЕ, блокаторів кальцієвих каналів, інгібіторів протонного насоса, NSAID, СОХ-інгібіторів, кортикостероїдів, тетрацикліну, пентоксифіліну, буциламіну, інгібіторів геранілгеранілтрансферази, ротерліну, інгібіторів проліл-4-гідроксилази, інгібіторів с-протеїнази, інгібіторів лізилоксидази, релаксину, галогенфугінону, простагландинів, простациклінів, ендотеліну-1, оксиду азоту, інгібіторів ангіотензину II і антиоксидантів.
Текст
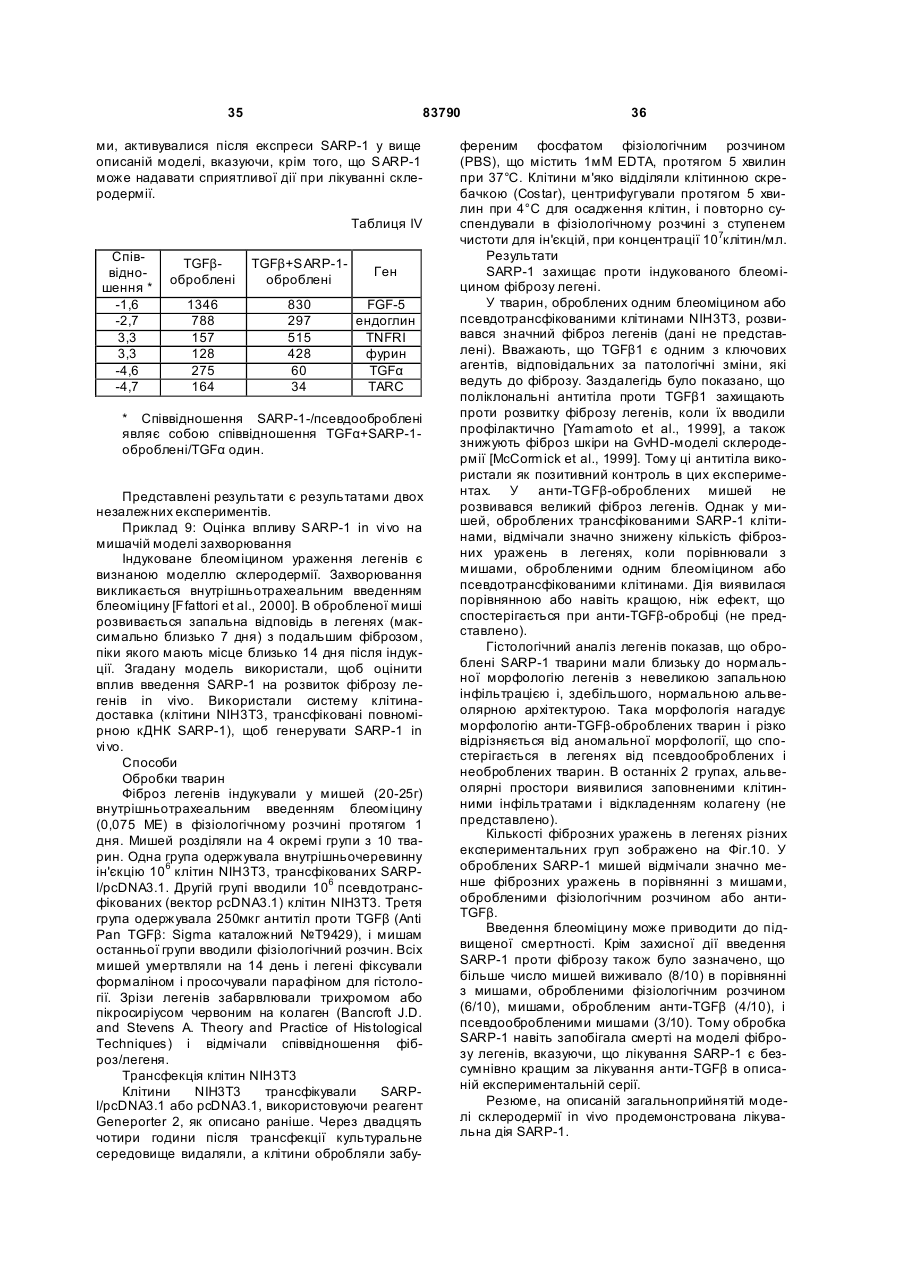
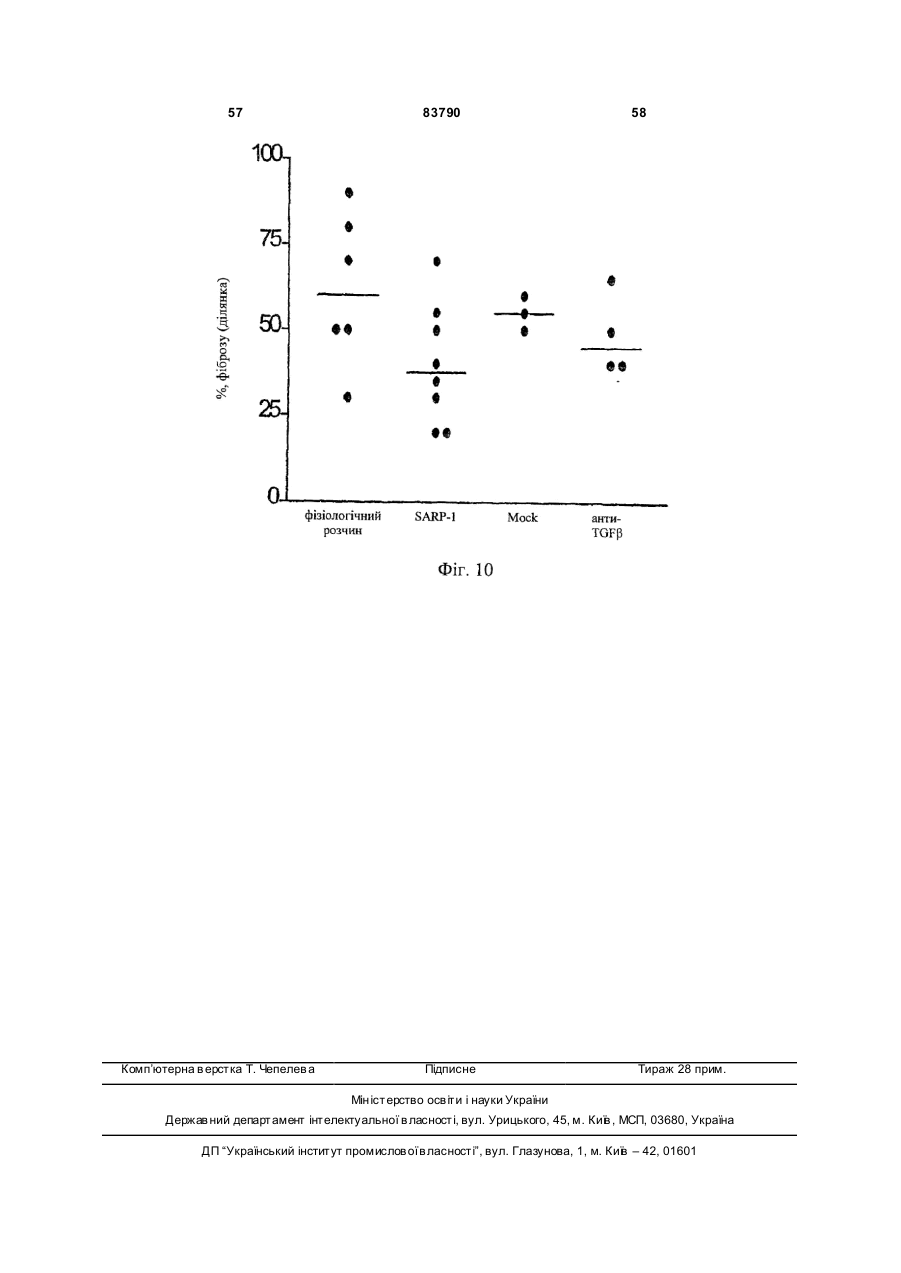
1. Застосування речовини, вибраної з групи, що складається з: a) зрілого SARP-1; b) фрагмента SARP-1, що містить багатий цистеїном “завитий” домен; (с) поліпептиду, що містить SEQ ID NO: 2; (d) поліпептиду, що містить амінокислоти з 21 по 295 SEQ ID NO: 2; (е) поліпептиду, що містить амінокислоти з 24 по 295 SEQ ID NO: 2; (f) поліпептиду, що містить амінокислоти з 25 по 2 (19) 1 3 83790 найменше одну складову, приєднану до однієї або більше функціональних гр уп, які зустрічаються у вигляді одного або більше бічних ланцюгів на амінокислотних залишках. 5. Застосування за п.4, при якому складова являє собою поліетиленову складову. 6. Застосування молекули нуклеїнової кислоти для виробництва лікарського засобу для лікування і/або попередження фіброзного захворювання, вибраного з групи, яка складається зі склеродермії, цирозу печінки, інтерстиціального та ідіопатичного фіброзу легень, бронхопульмональної дисплазії, саркоїдозу, фібропроліферативного ARDS (РДСД), контактури Дюпюітрена, келоїду, рубців та реактивного фіброзу, причому молекула нуклеїнової кислоти містить послідовність нуклеїнової кислоти, кодуючої поліпептид, який включає амінокислотну послідовність, вибрану з групи, що складається з: (a) зрілого SARP-1; (b) фрагмента SARP-1, що містить багатий цистеїном “завитий” домен; (с) поліпептиду, що містить SEQ ID NO: 2; (d) поліпептиду, що містить амінокислоти з 21 по 295 SEQ ID NO: 2; (е) поліпептиду, що містить амінокислоти з 24 по 295 SEQ ID NO: 2; (f) поліпептиду, що містить амінокислоти з 25 по 295 SEQ ID NO: 2; (g) поліпептиду, що містить амінокислоти з 26 по 295 SEQ ID NO: 2; (h) поліпептиду, що містить амінокислоти з 27 по 295 SEQ ID NO: 2; (і) поліпептиду, що містить амінокислоти з 28 по 295 SEQ ID NO: 2; (j) поліпептиду, що містить амінокислоти з 37 по 295 SEQ ID NO: 2; (k) мутеїн у будь-якого з (а)-(j), в якому амінокислотна послідовність має принаймні 70 % або 80 %, або 90 % ідентичність принаймні з однією з послідовностей в (а)-(j); (l) мутеїн у будь-якого з (а)-(j), який кодується послідовністю ДНК, яка гібридизується з комплементом нативної послідовності ДНК, що кодує будьякий з (а)-(j), при помірно жорстких умовах або при надзвичайно жорстких умовах; (m) мутеїн у будь-якого з від (а) до (j), в якому будь-які зміни в амінокислотній послідовності є консервативними амінокислотними заміщеннями в амінокислотних послідовностях в (а)-(j); і (n) ізоформи, злитого білка або активної фракції будь-якого з (а)-(m). 7. Застосування вектора, що містить молекулу нуклеїнових кислот за п.6, для виробництва лікарського засобу для лікування і/або попередження фіброзного захворювання, вибраного з групи, яка складається зі склеродермії, цирозу печінки, інтерстиціального та ідіопатичного фіброзу легень, бронхопульмональної дисплазії, саркоїдозу, фібропроліферативного ARDS (РДСД), контактури Дюпюітрена, келоїду, рубців та реактивного фіброзу. 8. Застосування за п.7, при якому вектор є експресуючим вектором. 9. Застосування за п.7 або 8, при якому вектор 4 являє собою вектор генної терапії. 10. Застосування вектора для індукції і/або збільшення ендогенної продукції поліпептиду за п.1 в клітині для одержання лікарського засобу для лікування і/або попередження фіброзного захворювання, вибраного з групи, яка складається зі склеродермії, цирозу печінки, інтерстиціального та ідіопатичного фіброзу легень, бронхопульмональної дисплазії, саркоїдозу, фібропроліферативного ARDS (РДСД), контактури Дюпюітрена, келоїду, рубців та реактивного фіброзу. 11. Застосування клітини, що містить вектор за будь-яким з пп.7-10, для приготування лікарського засобу для лікування і/або попередження фіброзного захворювання, вибраного з групи, яка складається зі склеродермії, цирозу печінки, інтерстиціального та ідіопатичного фіброзу легень, бронхопульмональної дисплазії, саркоїдозу, фібропроліферативного ARDS (РДСД), контактури Дюпюітрена, келоїду, рубців та реактивного фіброзу. 12. Застосування клітини, яка експресує речовину за будь-яким з пп.1-3, для виробництва лікарського засобу для лікування і/або попередження фіброзного захворювання, вибраного з групи, яка складається зі склеродермії, цирозу печінки, інтерстиціального та ідіопатичного фіброзу легень, бронхопульмональної дисплазії, саркоїдозу, фібропроліферативного ARDS (РДСД), контактури Дюпюітрена, келоїду, рубців та реактивного фіброзу. 13. Застосування клітини, яка була генетично модифікована, щоб продукувати поліпептид за пп.13, для виробництва лікарського засобу для лікування і/або попередження фіброзного захворювання, вибраного з групи, яка складається зі склеродермії, цирозу печінки, інтерстиціального та ідіопатичного фіброзу легень, бронхопульмональної дисплазії, саркоїдозу, фібропроліферативного ARDS (РДСД), контактури Дюпюітрена, келоїду, рубців та реактивного фіброзу. 14. Застосування за будь-яким з попередніх пунктів, де речовину вводять системно. 15. Застосування за будь-яким з попередніх пунктів, де речовину вводять внутрішньом’язовою, підшкірною або внутрішньовенною ін’єкцією або інгаляцією. 16. Застосування за будь-яким з попередніх пунктів, при якому лікарський засіб, додатково, містить інтерферон для одночасного, послідовного або роздільного застосування. 17. Застосування за п.16, при якому інтерферон є інтерфероном-β. 18. Застосування за будь-яким з попередніх пунктів, при якому лікарський засіб, додатково, містить антагоніст фактора некрозу пухлини (TNF) для одночасного, послідовного або роздільного застосування. 19. Застосування за п.18, при якому антагоніст TNF являє собою TBPI і/або TBPII. 20. Застосування за будь-яким з попередніх пунктів, при якому захворюванням є склеродермія та лікарський засіб, додатково, містить антисклеродермічний агент для одночасного, послідовного або роздільного застосування. 5 83790 6 21. Застосування за п.20, при якому антисклеродермічний агент вибраний з групи, що складається з інгібіторів АСЕ (АПФ), блокаторів кальцієвих каналів, інгібіторів протонного насоса, NSAID, СОХ-інгібіторів, кортикостероїдів, тетрацикліну, пентоксифіліну, буциламіну, інгібіторів геранілгеранілтрансферази, ротерліну, інгібіторів проліл-4гідроксилази, інгібіторів с-протеїнази, інгібіторів лізилоксидази, релаксину, галогенфугінону, простагландинів, простациклінів, ендотеліну-1, оксиду азоту, інгібіторів ангіотензину II і антиоксидантів. 22. Спосіб лікування і/або попередження фіброзного захворювання, вибраного з групи, яка складається зі склеродермії, цирозу печінки, інтерстиціального та ідіопатичного фіброзу легень, бронхопульмональної дисплазії, саркоїдозу, фібропроліферативного ARDS (РДСД), контактури Дюпюітрена, келоїду, рубців та реактивного фіброзу, що включає введення пацієнту е фективної кількості речовини за пп.1-10, необов’язково, разом з фармацевтично прийнятним носієм. 23. Спосіб за п.22, де речовину вводять системно. 24. Спосіб за п.22, де речовину вводять внутрішньом’язовою, підшкірною або внутрішньовенною ін’єкцією або інгаляцією. 25. Фармацевтична композиція, що містить речовину, як описано в пп.1-5, в комбінації з антисклеродермічним агентом, вибраним з групи, що складається з інгібіторів АСЕ, блокаторів кальцієвих каналів, інгібіторів протонного насоса, NSAID, СОХ-інгібіторів, кортикостероїдів, тетрацикліну, пентоксифіліну, буциламіну, інгібіторів геранілгеранілтрансферази, ротерліну, інгібіторів проліл-4гідроксилази, інгібіторів с-протеїнази, інгібіторів лізилоксидази, релаксину, галогенфугінону, простагландинів, простациклінів, ендотеліну-1, оксиду азоту, інгібіторів ангіотензину II і антиоксидантів. Даний винахід має відношення до склеродермії. Точніше, винахід стосується застосування SARP-1 для лікування і/або попередження склеродермії, особливо прогресуючого системного склерозу. Склеродермія є захворюванням з'єднувальної тканини, яке характеризується, фіброзом шкірні і внутрішніх органів, що приводить до поразки органів і смерті [Black et al, 1998; Clements and Furst, 1996]. Склеродермія характеризується спектром симптомів і цілим рядом терапевтичних аспектів. Вона включає в себе осередкову склеродермію, прогресуючий системний склероз, склеродерміяподібні І порушення і безсимптомну склеродермію [Smith, 2000]. У той час як осередкова і склеродермія є рідкісним шкірним захворюванням, пов'язаним з фіброзом і виявами, обмеженими шкірою, прогресуючий системний склероз являє собою мультисистемне захворювання з мінливим ступенем ризику відносно поразки внутрішніх органів і коливаннями тяжкості захворювання шкіри. Системний склероз може бути дифузним або обмеженим. Обмежений прогресуючий системний склероз також називають CREST (кальциноз, езофагальна дисфункція Рейно, склеродактилія, телеангіектазії). Вважають, що склеродермія-подібні порушення пов'язані з впливом чинників , навколишнього промислового середовища. У випадку безсимптомного захворювання, має місце ураження внутрішніх органів без шкірних змін. Основними виявами склеродермії і, зокрема, прогресуючого системного склерозу є невідповідні, надмірні синтез і відкладення колагену, ендотеліальна дисфункція, спазми, колапс і облітерація в результаті фіброзу. Склеродермія є рідкісним захворюванням зі стабільною частотою захворюваності приблизно 19 випадків на 1 мільйон осіб. Причини склеродермії невідомі. Однак генетична схильність є важливою. Розлади включають в себе аутоімунну реакцію і зміну функції ендотеліальних клітин і фібробластів. Дійсно, прогресуючий системний склероз ймовірно є найбільш тяжким аутоімунним захворюванням з 50% смертністю протягом 5 років після діагностики [Silman, 1991]. З точки зору діагностики важливим клінічним показником є шкірне ущільнення проксимально до п'ястково-фалангових суглобів. Феномен Рейно є частим, майже універсальним компонентом склеродермії. Феномен розпізнається по зміні кольору шкіри при впливі холоду. Ішемія і шкірне ущільнення є симптомами хвороби Рейно. Декілька біологічних процесів, що лежать в основі, залучені до ініціації, тяжкості і прогресування захворювання і включають в себе судинну дисфункцію, активацію і пошкодження ендотеліальних клітин, акумуляцію лейкоцитів, продукцію аутоантитіл і вирішальну неконтрольовану фіброзну відповідь, які можуть привести до смерті [Clement and Furst, 1996]. Фібробласти грають центральну роль в патогенезі захворювання. Первинні фібробласти, одержані від хворих склеродермією, виявляють безліч характерних особливостей захворювання, що спостерігаються in vivo, значно підвищені синтез і відкладення позаклітинного матриксу, особливо колагену і фібронектину, і змінену продукцію фактора росту і цитокінів, таких як TGFβ і CTGF [Strehlow and Korn, 1998 і LeRoy, 1974]. Не існує ефективної терапії склеродерми. У новітній, але високого ризику, терапії запропонована трансплантація аутогенних стовбурових клітин [Martini et al., 1999]. Зокрема, в цей час немає ніякого лікування склеродермії, направленого на фіброзний процес [Wigley and Boling, 2000]. Ідентифікація генів, асоційованих з ризиком захворювання і прогресією склеродермії, може привести до розробки ефективної стратегії для втр учання на різних стадіях за хворювання. SAEP-1 (пов'язаний з апоптозом білок 1, що секретується) є представником сімейства білків, що секретуються, відомих як секретовані родинні 7 83790 "завиті" білки, на основі їх гомології з багатим на цистеїн доменом (CRD-домен), виявленим у "завитого" сімейства з 7 трансмембранних рецепторів [Rattner et al., 1997]. "Завиті" гени спочатку були ідентифіковані у плодової мушки і в контрольній тканинній полярності [Adler et al., 1987]. "Завиті" білки є рецепторами для висококонсервативного Wnt-сімейства з, принаймні, 16 сигнальних молекул, що секретуються, які регулюють взаємодії клітина-клітина під час ембріогенезу [Smalley and Dale, 1999]. Розуміння механізмів дії Wnt складалося за даними декількох систем: генетики Drosophila і C.elegant, біохімічних досліджень клітинної культури, і експреси ектопічного гена у Xenopus embryos. Здійснені мутації багатьох генів Wnt у миші, що привели до різних специфічних дефектів розвитку. Wnt-шлях передачі сигналу, який запускається взаємодією Wnt з "завитими" білками, опосередкований декількома цитоплазматичними компонентами перемикання і функціонує, щоб подавити активність мультибілкового комплексу обміну β-катеніну, таким чином сприяючи створенню цитозольного β-катеніну, який потім проникає в ядро і утворює комплекс з TCF, щоб активувати транскрипцію генів-мішеней Wnt [Miller et al., 1999; Kuhl et al., 2000]. Взаємодії Wnt -"завиті" білки можна модулювати за допомогою обмеженої експресії окремих Wnt-зв'язуючих білків, секретованих родинних "завитих" білків (sFRP). SFRPs здатні зв'язувати Wnt по N-кінцевому CRD-домену. Тому вони можуть ізолювати Wnt від його рецепторів і, таким чином, протидіяти його ефектам [Bafico et al, 1999]. SARP-1 відомий під декількома альтернативними назвами, такими як SDF-5, PR0697, ATG1622, HLHDY31, SFRP-2. Часткові або повномірні білкові послідовності і/або послідовності нуклеїнових кислот SARP-1 миші або людини описані в декількох патентних заявках, [наприклад WO 98/35043, WO 98/13493, EP 0 879887, WO 99/46281]. З точки зору функції, секретовані родинні "завиті" білки (SFRPs), мабуть, діють як розчинні модулятори передачі сигналу Wnt за допомогою конкурування з мембранозв'язаними "завитими" рецепторами за скріплення секретованих Wntлігандів. Крім SARP-1, відомі в цей час людські білки згаданого сімейства включають в себе SARP-2 (SFRP-1) і SARP-3 (SFRP-5). Описано, що мишачий SARP-1 і SARP-2 і -3 людини володіють здатністю або підвищувати чутливість клітин до апоптозу, або інгібувати апоптозну відповідь [Melkonyan et al., 1997]. Коли SARP-1 миші і SARP2 людини експресували в клітинній лінії аденокарциноми молочної залози, вони надавали протилежних ефектів на клітинну чутливість до проапоптозного стимулу. Тоді як клітини з SARP-1 виявляли більш високу резистентність, клітини, що експресують SARP-2, виявилися чутливими до апоптозу, індукованому фактором некрозу пухлини і церамідом. Експресія SARP-1 або SARP-2 змінювала внутрішньоклітинні рівні β-катеніну, індикатора опосередкованої Wnt трансдукції сигналу, дозволяючи передбачити, що SARP є перешкодою для 8 Wnt - "завиті" білки шляхів передачі сигналу [Melkonyan et al., 1997]. Аналіз методом Нозерн-блотінгу показав, що гени SARP характеризуються індивідуальними особливостями експресії [Leimeister et al., 1998]. SARP-1 існує у ви гляді транскриптів розміром 2,2- і 1,3-т.п.н. в деяких тканинах людини з найбільш високими рівнями в прямій кишці і тонкому кишечнику. [Chang et al., 1999], повідомили, що SARP-1 або SFRP-2 високо і переважно експресуються в сітківці бика по всьому внутрішньому нуклеарному шару. У сітчастій оболонці SARP-3 або SFRP-5 експресуються, в основному, в сітківочному пігментованому епітелії. За допомогою аналізу соматичних клітинних гібридів, [Melkonyan et al., (1997)] картували ген SARP-1 в хромосомі 4 людини. [Chang et al., (1999)] уточнили положення місця до 4q31.3, використовуючи радіаційний аналіз гібридів. Також з'являються дані, які стосуються того, що змінена експресія SARP-1 пов'язана з раком [WO 98/13493]. Винахід базується на даних сприятливої дії SARP-1 на розробленій тваринній моделі склеродермії. Тому, першим аспектом винаходу є застосування SARP-1 для приготування лікарського засобу для лікування і/або попередження склеродермії і, зокрема, прогресуючого системного склерозу. Другий аспект винаходу полягає в застосуванні клітини, яка експресує SARP-1, або експресуючого вектора, що містить кодуючу послідовність SARP1, для одержання лікарського засобу для лікування і/або попередження склеродермії, особливо, прогресуючого системного склерозу. Також в рамках інтересів даного винаходу розглядаються фармацевтичні композиції, що містять SARP-1, і способи лікування, що включають в себе введення SARP-1 в організм людини. На Фіг.1 представлена експресія мРНК SARP1 в нормальних і патологічних фібробластах від 7 хворих склеродермією за даними аналізу фільтрів з іммобілізованими генами. Середній рівень експресії для кожного класу зразків (нормальних або патологічних) представлений в (А) і медіана представлена в (В). На Фіг.2 показане співвідношення експресії мРНК SAKP-1 в патологічних/нормальних фібробластах (низька кількість пасажів,
ДивитисяДодаткова інформація
Назва патенту англійськоюUse of sarp-1 for the treatment and/or prevention of fibrotic diseases
Автори англійськоюPlater Zyberk Christine, Power Christine, Colinge Jacques
Назва патенту російськоюПрименение sarp-1 для лечения и/или предупреждения фиброзных заболеваний
Автори російськоюПлатер-Зиберк Кристин, Пауэр Кристин, Колинж Жак
МПК / Мітки
МПК: A61K 38/21, A61K 48/00, A61P 43/00, C12N 15/19, C07K 14/52, A61P 17/02, A61K 38/17
Мітки: лікування, застосування, sarp-1, фіброзних, захворювань, попередження
Код посилання
<a href="https://ua.patents.su/29-83790-zastosuvannya-sarp-1-dlya-likuvannya-ta-abo-poperedzhennya-fibroznikh-zakhvoryuvan.html" target="_blank" rel="follow" title="База патентів України">Застосування sarp-1 для лікування та/або попередження фіброзних захворювань</a>
Попередній патент: Спосіб забезпечення гігієни рук
Наступний патент: Диференціальна оптопара та спосіб її виготовлення бобонича
Випадковий патент: Штекерний з'єднувач