Інгібітори бета-аміногетероциклічної дипептидилпептидази для лікування або попередження захворювань
Номер патенту: 78612
Опубліковано: 10.04.2007
Автори: Цянь Сяося, Фен Данцін Денніс, Лянг Гуй-Бай, Уебер Енн Е., Біфту Тесфайє
Формула / Реферат
1. Сполука формули І:
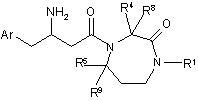 (I)
(I)
або її фармацевтично прийнятна сіль,
де кожний n незалежно дорівнює 0, 1 або 2;
Аr являє собою феніл, заміщений від одного до п'яти R3 замісниками;
R1 вибраний з групи, що складається з водню,
С1-10алкілу, де алкіл є незаміщеним або заміщеним від одного до п'яти замісниками, незалежно вибраними з галогену, гідрокси, С1-6алкокси, карбокси, С1-6алкілоксикарбонілу і феніл-С1-3алкокси, де алкокси є незаміщеним або заміщеним від одного до п'яти атомами галогену,
(СH2)n-арилу, де арил є незаміщеним або заміщеним від одного до п'яти замісниками, незалежно вибраними з галогену, CN, гідрокси, R2, OR2, NHSO2R2, NR2SO2R2, SO2R2, СО2Н і С1-6алкілоксикарбонілу,
(СH2)n-гетероарилу, де гетероарил є незаміщеним або заміщеним від одного до трьох замісниками, незалежно вибраними з гідрокси, галогену, С1-6алкілу і С1-6алкокси, де алкіл і алкокси є незаміщеними або заміщеними від одного до п'яти атомами галогену,
(СH2)n-гетероциклілу, де гетероцикліл є незаміщеним або заміщеним від одного до трьох замісниками, незалежно вибраними з оксо, гідрокси, галогену, С1-6алкілу і С1-6алкокси, де алкіл і алкокси є незаміщеними або заміщеними від одного до п'яти атомами галогену,
(СH2)n-С3-6циклоалкілу, де циклоалкіл є незаміщеним або заміщеним від одного до трьох замісниками, незалежно вибраними з галогену, гідрокси, С1-6алкілу і С1-6алкокси, де алкіл і алкокси є незаміщеними або заміщеними від одного до п'яти атомами галогену; і
де будь-який атом вуглецю метилену (СН2) в R1 є незаміщеним або заміщеним однією або двома групами, незалежно вибраними з галогену, гідрокси і С1-4алкілу, незаміщеного або заміщеного від одного до п'яти атомами галогену;
кожний R3 незалежно вибраний з групи, що складається з:
водню,
галогену,
ціано,
гідрокси,
С1-6алкілу, незаміщеного або заміщеного від одного до п'яти атомами галогену,
С1-6алкокси, незаміщеного або заміщеного від одного до п'яти атомами галогену,
карбокси,
алкоксикарбонілу,
аміно,
NHR2,
NR2R2,
NHSO2R2,
NR2SO2R2,
NHCOR2,
NR2COR2,
NHCO2R2,
NR2CO2R2,
SO2R2,
SO2NH2,
SO2NHR2 і
SO2NR2R2;
кожний R2 незалежно являє собою С1-6алкіл, незаміщений або заміщений від одного до п'яти замісниками, незалежно вибраними з галогену, СO2Н і С1-6алкілоксикарбонілу;
R4 і R5 незалежно вибрані з групи, що складається з:
водню,
ціано,
карбокси,
С1-6алкілоксикарбонілу,
С1-10алкілу, незаміщеного або заміщеного від одного до п'яти замісниками, незалежно вибраними з галогену, гідрокси, С1-6алкокси, карбокси, С1-6алкілоксикарбонілу і феніл-С1-3алкокси, де алкокси є незаміщеним або заміщеним від одного до п'яти атомами галогену,
(СH2)n-арилу, де арил є незаміщеним або заміщеним від одного до п'яти замісниками, незалежно вибраними з галогену, гідрокси, С1-6алкілу і С1-6алкокси, де алкіл і алкокси є незаміщеними або заміщеними від одного до п'яти атомами галогену,
(СH2)n-гетероарилу, де гетероарил є незаміщеним або заміщеним від одного до трьох замісниками, незалежно вибраними з гідрокси, галогену, С1-6алкілу і С1-6алкокси, де алкіл і алкокси є незаміщеними або заміщеними від одного до п'яти атомами галогену,
(СH2)n-гетероциклілу, де гетероцикліл є незаміщеним або заміщеним від одного до трьох замісниками, незалежно вибраними з оксо, гідрокси, галогену, С1-6алкілу і С1-6алкокси, де алкіл і алкокси є незаміщеними або заміщеними від одного до п'яти атомами галогену,
(СH2)n-С3-6циклоалкілу, де циклоалкіл є незаміщеним або заміщеним від одного до трьох замісниками, незалежно вибраними з галогену, гідроки, С1-6алкілу і С1-6алкокси, де алкіл і алкокси є незаміщеними або заміщеними від одного до п'яти атомами галогену,
(СH2)nCONR6R7, де R6 і R7 незалежно вибрані з групи, що складається з водню, тетразолілу, тіазолілу, (СH2)n-фенілу, (СH2)n-С3-6циклоалкілу і С1-6алкілу, де алкіл є незаміщеним або заміщеним від одного до п'яти атомами галогену, і де феніл і циклоалкіл є незаміщеними або заміщеними від одного до п'яти замісниками, незалежно вибраними з галогену, гідрокси, С1-6алкілу і С1-6алкокси, де алкіл і алкокси є незаміщеними або заміщеними від одного до п'яти атомами галогену;
або R6 і R7 разом з атомом азоту, до якого вони приєднані, утворюють гетероциклічне кільце, вибране з азетидину, піролідину, піперидину, піперазину і морфоліну; і де вказане гетероциклічне кільце є незаміщеним або заміщеним від одного до п'яти замісниками, незалежно вибраними з галогену, гідрокси, С1-6алкілу і С1-6алкокси, де алкіл і алкокси є незаміщеними або заміщеними від одного до п'яти атомами галогену; і де будь-який атом вуглецю метилену (СН2) в R4 або R5 є незаміщеним або заміщеним однією або двома групами, незалежно вибраними з галогену, гідрокси і С1-4алкілу, незаміщеного або заміщеного від одного до п'яти атомами галогену; і
R8 і R9 кожний, незалежно, являє собою водень або С1-6алкіл.
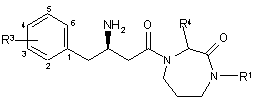
2. Сполука за п. 1 формули Іа:
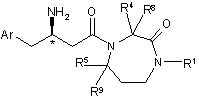 , (Ia)
, (Ia)
де атом вуглецю, помічений *, має R конфігурацію, і Аr, R1, R4, R5, R8 і R9 є такими, як визначено в п. 1.
3. Сполука за п. 1, де R3 вибраний з групи, що складається з:
водню,
галогену,
ціано,
гідрокси,
С1-6алкілу, незаміщеного або заміщеного від одного до п'яти атомами галогену, і
С1-6алкокси, незаміщеного або заміщеного від одного до п'яти атомами галогену.
4. Сполука за п. 3, де R3 вибраний з групи, що складається з водню, фтору, хлору, брому, трифторметилу і метилу.
5. Сполука за п. 4, де R3 являє собою водень, хлор або фтор.
6. Сполука за п. 1, де R1 вибраний з групи, що складається з:
водню,
С1-6алкілу, де алкіл є незаміщеним або заміщеним від одного до п'яти замісниками, вибраними з галогену, гідрокси, С1-6алкокси, карбокси, С1-6алкілоксикарбонілу і феніл-С1-3алкокси, де алкокси є незаміщеним або заміщеним від одного до п'яти атомами галогену,
(СH2)n-С3-6циклоалкілу, де циклоалкіл є незаміщеним або заміщеним від одного до трьох замісниками, незалежно вибраними з галогену, гідрокси, С1-6алкілу і С1-6алкокси, де алкіл і алкокси є незаміщеними або заміщеними від одного до п'яти атомами галогену; і
де будь-який атом вуглецю метилену (СН2) в R1 є незаміщеним або заміщеним однією або двома групами, незалежно вибраними з галогену, гідрокси і С1-4алкілу, незаміщеного або заміщеного від одного до п'яти атомами галогену.
7. Сполука за п. 6, де R1 вибраний з групи, що складається з:
водню,
С1-4алкілу,
2,2,2-трифторетилу,
метоксикарбонілметилу,
карбоксиметилу,
гідроксіетилу,
бензилоксиметилу,
бензилоксіетилу і
циклопропілу.
8. Сполука за п. 7, де R1 вибраний з групи, що складається з водню, метилу, трет-бутилу і циклопропілу.
9. Сполука за п. 1, де R4 і R5 незалежно вибрані з групи, що складається з:
водню,
С1-10алкілу, незаміщеного або заміщеного від одного до п'яти замісниками, незалежно вибраними з галогену, гідрокси, С1-6алкокси, карбокси, С1-6алкілоксикарбонілу і феніл-С1-3алкокси, де алкокси є незаміщеним або заміщеним від одного до п'яти атомами галогену,
(СH2)n-арилу, де арил є незаміщеним або заміщеним від одного до п'яти замісниками, незалежно вибраними з галогену, гідрокси, С1-6алкілу і С1-6алкокси, де алкіл і алкокси є незаміщеними або заміщеними від одного до п'яти атомами галогену,
(СH2)n-гетероарилу, де гетероарил є незаміщеним або заміщеним від одного до трьох замісниками, незалежно вибраними з гідрокси, галогену, С1-6алкілу і С1-6алкокси, де алкіл і алкокси є незаміщеними або заміщеними від одного до п'яти атомами галогену,
(СH2)n-гетероциклілу, де гетероцикліл є незаміщеним або заміщеним від одного до трьох замісниками, незалежно вибраними з оксо, гідрокси, галогену, С1-6алкілу і С1-6алкокси, де алкіл і алкокси є незаміщеними або заміщеними від одного до п'яти атомами галогену,
(СH2)n-С3-6циклоалкілу, де циклоалкіл є незаміщеним або заміщеним від одного до трьох замісниками, незалежно вибраними з галогену, гідрокси, С1-6алкілу і С1-6алкокси, де алкіл і алкокси є незаміщеними або заміщеними від одного до п'яти атомами галогену,
де будь-який атом вуглецю метилену (СН2) в R4 або R5 є незаміщеним або заміщеним однією або двома групами, незалежно вибраними з галогену, гідрокси і С1-4алкілу, незаміщеного або заміщеного від одного до п'яти атомами галогену.
10. Сполука за п. 9, де R4 і R5 незалежно вибрані з групи, що складається з:
водню,
С1-6алкілу, незаміщеного або заміщеного від одного до п'яти замісниками, незалежно вибраними з галогену, гідрокси, С1-6алкокси, карбокси, С1-6алкілоксикарбонілу і феніл-С1-3алкокси, де алкокси є незаміщеним або заміщеним від одного до п'яти атомами галогену,
(СH2)n-арилу, де арил є незаміщеним або заміщеним від одного до п'яти замісниками, незалежно вибраними з галогену, гідрокси, С1-6алкілу і С1-6алкокси, де алкіл і алкокси є незаміщеними або заміщеними від одного до п'яти атомами галогену,
(СH2)n-гетероарилу, де гетероарил є незаміщеним або заміщеним від одного до трьох замісниками, незалежно вибраними з гідрокси, галогену, С1-6алкілу і С1-6алкокси, де алкіл і алкокси є незаміщеними або заміщеними від одного до п'яти атомами галогену,
(СH2)n-С3-6циклоалкілу, де циклоалкіл є незаміщеним або заміщеним від одного до трьох замісниками, незалежно вибраними з галогену, гідрокси, С1-6алкілу і С1-6алкокси, де алкіл і алкокси є незаміщеними або заміщеними від одного до п'яти атомами галогену, і
де будь-який атом вуглецю метилену (СН2) в R4 або R5 є незаміщеним або заміщеним однією або двома групами, незалежно вибраними з галогену, гідрокси і С1-4алкілу, незаміщеного або заміщеного від одного до п'яти атомами галогену.
11. Сполука за п. 10, де R4 і R5 незалежно вибрані з групи, що складається з:
водню,
СН3,
СН2СН3,
СН2СН(СН3)2,
СН2-циклопропілу,
СН2-циклогексилу,
CH2OCH2Ph,
CH2OH,
CH2Ph,
СН2(3-ОСF3-Рh),
СН2(4-ОСF3-Рh),
СН2(3-СF3, 5-СF3-Рh),
СН2(2-СF3-Рh),
CH2(2-Cl-Ph),
CH2(2-Me-Ph),
CH2(2-Me, 5-Me-Ph),
CH2(2-Ph-Ph),
CH2(2-F, 5-F-Ph),
CH2(2-F-Ph),
CH2(2-F, 3-F-Ph),
СН2(2-піридиніл),
CH2(3-піридиніл),
СН2(4-піридиніл),
СН2(1-оксидопіридин-2-іл),
СН2(1-оксидопіридин-3-іл),
СH2(1Н-піразол-1-іл),
CH2(2-F, 6-F-Ph) і
CH2CF3.
12. Сполука за п.11, де R5 являє собою водень.
13. Сполука за п.1, де R8 i R9 незалежно вибрані з водню і метилу.
14. Сполука за п. 13, де R8 і R9 являють собою водень.
15. Сполука за п. 1, де R1 вибраний з групи, що складається з:
водню,
С1-4алкілу,
2,2,2-трифторетилу,
метоксикарбонілметилу,
карбоксиметилу,
гідроксіетилу,
бензилоксиметилу,
бензилоксіетилу і
циклопропілу;
R3 являє собою водень, хлор або фтор;
R4 вибраний з групи, що складається з:
водню,
СН3,
СH2СH3,
СН2СН(СН3)2,
СН2-циклопропілу,
СН2-циклогексилу,
CH2OCH2Ph,
СН2OН,
CH2Ph,
СН2(3-ОСF3-Рh),
СН2(4-ОСF3-Рh) і
СН2(3-СF3, 5-CF3-Ph),
СН2(2-СF3-Рh),
CH2(2-Cl-Ph),
CH2(2-Me-Ph),
СН2(2-Ме, 5-Me-Ph),
CH2(2-Ph-Ph),
CH2(2-F, 5-F-Ph),
CH2(2-F-Ph),
CH2(2-F, 3-F-Ph),
СН2(2-піридиніл),
CH2(3-піридиніл),
СН2(4-піридиніл),
СН2(1-оксидопіридин-2-іл),
СН2(1-оксидопіридин-3-іл),
СН2(1Н-піразол-1-іл),
CH2(2-F, 6-F-Ph) і
СН2СF3; і
R8 і R9 являють собою водень.
16. Сполука за п. 15, де R5 являє собою водень.
17. Сполука за п. 15, вибрана з групи, що включає:
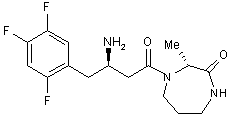 ,
,
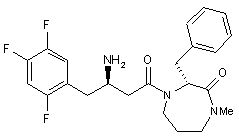 ,
,
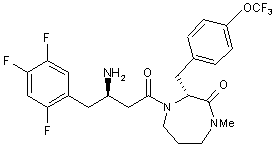 ,
,
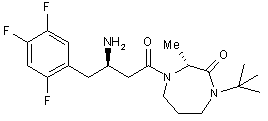 ,
,
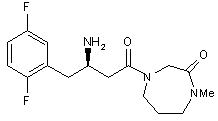 i
i
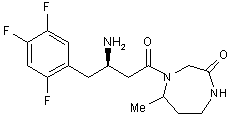
або їх фармацевтично прийнятні солі.
18. Сполука за п. 15 структурної формули 1b, вибрана з групи, що включає:
 Ib
Ib
R3
R4
R1
2-F, 5-F
Me
H
2-F, 4-F, 5-F
СН2-сРr
H
2-F, 4-F, 5-F
Me
Me
2-F, 5-F
Me
Et
2-F, 4-F, 5-F
Me
cPr
2-F, 5-F
Me
СН2СO2Мe
2-F, 4-F, 5-F
Me
СН2СН2ОН
2-F, 4-F, 5-F
Me
СН2СН2ОСН2
С6Н5
2-F, 4-F, 5-F
Et
Me
2-F, 5-F
Et
Me
2-F, 4-F, 5-F
СН2ОН
Me
2-F
СН2Рh
Me
3-F, 4-F
CH2Ph
Me
2-F, 4-F, 5-F
CH2OCH2Ph
Me
2-F, 4-F, 5-F
Et
H
2-F, 4-F, 5-F
CH2Ph
H
3-F, 4-F
CH2Ph
H
2-F, 5-F
СН2(4-ОСF3-Рh)
H
2-F, 4-F, 5-F
CH2(3-OCF3-Ph)
H
2-F, 4-F, 5-F
СН2СН(СН3)2
Me
2-F, 4-F, 5-F
CH2(3-CF3, 5-CF3-Ph)
H
2-F, 5-F
H
H
2-F, 4-F, 5-F
СН2(2-СF3-Рh)
H
2-F, 4-F, 5-F
CH2(2-Cl-Ph)
H
2-F, 4-F, 5-F
СН2(2-СН3-Рh)
H
2-F, 4-F, 5-F
СН2(2-СН3, 5-СН3-Рh)
H
2-F, 4-F, 5-F
Me
CHMe2
2-F, 4-F, 5-F
CH2(2-Ph-Ph)
H
2-F, 4-F, 5-F
CH2(2-F,5-F-Ph)
H
2-F, 4-F, 5-F
CH2(2-F-Ph)
H
2-F, 4-F, 5-F
Me
СН2СF3
2-F, 4-F, 5-F
CH2(2-F,3-F-Ph)
H
2-F, 4-F, 5-F
СН2(3 -піридил)
H
2-F, 4-F, 5-F
CH2(2-F-Ph)
СН2СН2СН3
2-F, 4-F, 5-F
СН2(4-піридил)
H
2-F, 4-F, 5-F
CH2(2-F-Ph)
Me
2-F, 4-F, 5-F
СН2(2-піридил)
H
2-F, 4-F, 5-F
CH2(2-F,6-F-Ph)
H
2-F, 4-F, 5-F
СН2СF3
H
або їх фармацевтично прийнятні солі.
19. Фармацевтична композиція, що містить сполуку за п. 1 і фармацевтично прийнятний носій.
20. Спосіб інгібування активності ферменту дипептидилпептидази-IV у ссавців, що потребують цього, який включає введення ссавцеві ефективної кількості сполуки за п. 1.
21. Спосіб лікування діабету у ссавців, що потребують цього, який включає введення ссавцеві терапевтично ефективної кількості сполуки за п. 1.
22. Спосіб лікування інсулінонезалежного (тип 2) діабету у ссавців, що потребують цього, який включає введення ссавцеві терапевтично ефективної кількості сполуки за п. 1.
23. Спосіб лікування гіперглікемії у ссавців, що потребують цього, який включає введення ссавцеві терапевтично ефективної кількості сполуки за п. 1.
24. Спосіб лікування ожиріння у ссавців, що потребують цього, який включає введення ссавцеві терапевтично ефективної кількості сполуки за п. 1.
25. Спосіб лікування одного або декількох ліпідних порушень, вибраних з групи, що включає дисліпідемію, гіперліпідемію, гіпертригліцеридемію, гіперхолестеролемію, низький рівень HDL (ліпопротеїнів високої щільності) і високий рівень LDL (ліпопротеїнів низької щільності) у ссавців, що потребують цього, який включає введення ссавцеві терапевтично ефективної кількості сполуки за п. 1.
26. Спосіб лікування у ссавців, що потребують цього, одного або декількох станів, вибраних з групи, що включає гіперглікемію, знижену толерантність до глюкози, резистентність до інсуліну, ожиріння, ліпідні порушення, дисліпідемію, гіперліпідемію, гіпертригліцеридемію, гіперхолестеролемію, низькі рівні HDL, високі рівні LDL, атеросклероз і його наслідки, судинний рестеноз, синдром подразненого кишечнику, запальне захворювання кишечнику, включаючи хворобу Крона і виразковий коліт, інші запальні стани, панкреатит, абдомінальне ожиріння, нейродегенеративне захворювання, ретинопатію, нефропатію, нейропатію, синдром X, синдром полікістозу яєчників і інші захворювання, при яких резистентність до інсуліну є складовою, що включає введення ссавцеві терапевтично ефективної кількості сполуки за п. 1.
27. Фармацевтична композиція за п. 19, що додатково містить один або декілька додаткових активних компонентів, вибраних з групи, що складається з:
(a) другого інгібітору дипептидилпептидази IV;
(b) інсулінового сенсибілізатора, вибраного з групи, що складається з агоніста PPARg, подвійного агоніста PPARa/g, агоніста PPARa, бігуаніду і інгібітора білка тирозин-фосфатази-1В;
(c) інсуліну або міметика інсуліну;
(d) сульфонілсечовини або іншого стимулятора інсуліну;
(e) інгібітора a-глюкозидази;
(f) антагоніста глюкагонового рецептора;
(g) GLP-1, міметика GLP-1 або агоніста GLP-1 рецептора;
(h) GIP, міметика GDP або агоніста GIP рецептора;
(і) РАСАР, міметика РАСАР або агоніста РАСАР рецептора;
(j) агента, що понижує рівень холестерину, такого як (і) інгібітор HMG-CoA редуктази, (іі) секвестрант, (ііі) нікотиніловий спирт, нікотинова кислота або її сіль, (iv) агоніст PPARa, (v) подвійний агоніст PPARa/g, (vi) інгібітор абсорбції холестерину, (vii) інгібітор ацил-СоА:холестерин ацилтрансферази і (viii) антиоксидант;
(k) агоніста PPARd;
(l) агента проти ожиріння;
(m) інгібітора ідеального транспортера для жовчних кислот;
(n) протизапального агента; і
(о) антигіпертензивного агента.
28. Фармацевтична композиція за п. 27, де подвійний агоніст PPARa/g являє собою KRP-297.
29. Спосіб лікування діабету у ссавців, які потребують цього, що включає введення ссавцеві терапевтично ефективної кількості сполуки за п. 1 в поєднанні з подвійним агоністом PPARa/g KRP-297.
Текст
Діабет відноситься до патологічного процесу, викликаного численними етіологічними факторами і характеризується підвищеними рівнями глюкози в плазмі або гіперглікемією натщесерце або після введення глюкози при проведенні тесту на толерантність до глюкози при пероральному прийомі. Стійка або неконтрольована гіперглікемія пов'язана з підвищеним числом захворювань і передчасною смертністю. Часто аномальний гомеостаз глюкози пов'язаний як з прямими, так і опосередкованими змінами метаболізму ліпідів, ліпопротеїнів і аполіпопротеїнів і інших метаболічних і гемодинамічних порушень. Отже, пацієнти, страждаючі цукровим діабетом типу 2, мають особливо підвищений ризик макросудинних і мікросудинних ускладнень, що включають коронарну хворобу серця, інсульт, захворювання периферичних судин, гіпертензію, нефропатію, нейропатію і ретинопатію. Тому терапевтичне регулювання гомеостазу глюкози, метаболізму ліпідів і гіпертензії є надто важливим в клінічній терапії і при лікуванні цукрового діабету. Існують дві форми діабету, що звичайно визначаються. При діабеті типу 1, або інсулінозалежному цукровому діабеті (ІЗЦД), у пацієнтів виробляється невелика кількість інсуліну, або не виробляється інсулін, гормон, який регулює утилізацію глюкози. При діабеті типу 2, або інсулінонезалежному цукровому діабеті (ІНЗЦД), вміст інсуліну в плазмі пацієнтів часто такий самий або навіть підвищений в порівнянні з таким у людей, які не страждають діабетом; однак у таких пацієнтів розвивається резистентність до інсуліностимулюючої дії на глюкозу і метаболізм ліпідів в основних тканинах, чутливи х до інсуліну, таких як м'язи, печінка і жирові тканини, і вміст інсуліну в плазмі, хоч і підвищений, є недостатнім для компенсації чітко вираженої резистентності до інсуліну. Резистентність до інсуліну по суті не є наслідком зменшеної кількості інсулінових рецепторів, а наслідком дефекту зв'язування пост-інсулінового рецептора, який ще не вивчений. Така резистентність до інсулінової сприйнятливості приводить в результаті до недостатньої активації інсуліну при накопиченні глюкози, окислення і збереження глюкози в м'язах, і недостатньому придушенню інсуліну при ліполізисі в жирових тканинах і продукуванню і секреції глюкози в печінці. Доступні способи лікування діабету типу 2, які не змінилися істотним чином за багато років, виявили ряд обмежень. Незважаючи на те, що фізичні вправи і зниження калорій в харчовому раціоні може ефективно поліпшити діабетичний стан, дотримання такого лікування є дуже складним внаслідок малорухомого способу життя, що зміцнився, і надлишку споживання їжі, особливо їжі, що містить високу кількість насичених жирів. Збільшення рівня інсуліну в плазмі шляхом введення сульфонілсечовини (наприклад, толбутаміду і гліпізиду) або меглітиніду, які стимулюють β-клітини підшлункової залози для секреції більшої кількості інсуліну, і/або шляхом ін'єкції інсуліну, якщо суль фонілсечовина або меглітинід стають неефективними, можуть привести до концентрацій інсуліну ви ще достатньої для стимуляції особливо інсулін-резистентних тканин. Однак небезпечно низькі рівні глюкози в плазмі можуть бути результатом введення інсуліну або стимуляторів секреції інсуліну (сульфонілсечовини або меглітиніду), і можуть привести до підвищеного рівня резистентності до інсуліну внаслідок навіть більш високих рівнів інсуліну в плазмі. Бігуаніди збільшують чутливість до інсуліну, що приводить до деякої корекції гіперглікемії. Однак, два бігуанідини, фенформін і метформін, можуть індукувати лактоцидоз і нудоту/діарею. Метформін має менше побічних ефектів, ніж фенформін, і часто призначається при лікуванні діабету типу 2. Глітазони (тобто 5-бензилтіазолідин-2,4-діони) являють собою недавно описаний клас сполук з потенціалом поліпшення багатьох симптомів діабету тип у 2. Такі агенти по суті збільшують чутливість до інсуліну в м'язах, печінці і жировій тканині в деяких моделях тварин діабету типу 2, що приводить в результаті до часткової або повної корекції підвищених рівнів глюкози в плазмі без випадків гіпоглікемії. Глітазони, які продаються в цей час, є агоністами рецептора, які активуються проліфераторами пероксисом (PPAR), головним чином підтипу PPAR-гамма. Звичайно передбачається, що PPAR-гамма агонізм є відповідальним за поліпшення сенсибілізації до інсуліну, яка виявлена за допомогою глітазонів. Більш нові агоністи PPAR, які почали тестувати для лікування діабету типу II, є агоністами підтипу альфа, гамма або дельта, або їх комбінацією, і в багатьох випадках хімічно відрізняються від глітазонів (тобто, вони не є тіазолідиндіонами). Серйозні побічні ефекти (наприклад, гепатотоксичність) виникали з деякими глітазонами, такими як троглітазон. Інші способи лікування захворювання все ще знаходяться на стадії дослідження. Нові біохімічні досягнення, які введені недавно, або все ще знаходяться на стадії розробки, включають в себе лікування інгібіторами альфа-глюкозидів (наприклад, акарбоз) і інгібіторами протешу тирозин-фосфатази-1В (РТР-1В). Сполуки, які є інгібіторами ферменту дипептидилпептидази-IV ("DP-IV" або "DPP-IV"), також знаходяться на стадії дослідження як лікарські засоби, які можуть бути придатними при лікуванні діабету, і, більш конкретно, діабету типу 2. [Див., наприклад WO97/40832, WO 98/19998, патент США №5939560, Bioorg. Med. Chem. Lett., 6: 1163-1166 (1996); і Bioorg. Med. Chem. Lett.. 6: 2745-2748 (1996)]. Застосовність інгібіторів DP-IV при лікуванні діабету типу 2 основана на тому факті, що DP-IV in vi vo легко інактивує глюкагон-подібний пептид-1 (GLP-1), і гастроінгібуючий кишковий пептид (GIP). GLP-1 і GDP є інкретинами і продукуються при споживанні їжі. Інкретини стимулюють продукування інсуліну. Інгібування DP-IV приводить до зниження інактивації інкретинів, і це, в свою чергу, приводить до збільшення ефективності інкретинів при стимуляції продукування інсуліну підшлунковою залозою. Таким чином, інгібування DP-IV приводить в результаті до підвищеного рівня інсуліну в сироватці. Переважно, оскільки інкретини продукуються тілом тільки при споживанні їжі, передбачається, що інгібування DP-IV не збільшує рівень інсуліну в невідповідні моменти часу, такі як між їдою, що може привести до занадто низького рівня цукру в крові (гіпоглікемії). Отже, передбачається, що інгібування DP-IV збільшує інсулін без збільшення ризику гіпоглікемії, яка являє собою небезпечний побічний ефект, пов'язаний з використанням стимуляторів секреції інсуліну. Інгібітори DP-IV також мають інші терапевтичні застосування, як викладено в даному описі. Інгібітори DPIV в цей час ще не вивчені в достатній мірі, особливо з точки зору їх застосовності відносно не тільки діабету, але і інших захворювань. Для того, щоб можна було виявити поліпшені DP-IV для лікування діабету і потенційно інших захворювань і станів, необхідні нові сполуки. Терапевтичний потенціал інгібіторів DP-IV для лікування діабету типу 2 обговорюється [D. J. Drucker в Ехр. Opin. Invest. Drugs, 12: 87-100 (2003) і K. Augustyns, і ін., в Exp. Opin. Ther. Patents. 13:499-510(2003)]. Даний винахід відноситься до сполук, які є інгібіторами ферменту дипептидилпептидази-IV ("DP-IV inhibitors") і можуть використовуватися при лікуванні або попередженні захворювань, в які залучений фермент дипептидилпептидаза-IV, таких як діабет і, більш конкретно, діабет типу 2. Даний винахід також відноситься до фармацевтичних композицій, що містять такі сполуки, і застосування таких сполук і композицій для попередження або лікування таких захворювань, в які залучений фермент дипептидилпептидаза-IV. Даний винахід відноситься до похідних гексагідродіазепінону, які можуть використовуватися як інгібітори дипептидилпептидази-IV. Сполуки згідно з даним винаходом описуються структурною формулою І: або її фармацевтично прийнятною сіллю; де кожний п, незалежно, дорівнює 0, 1, або 2; Аr являє собою феніл, заміщений від одного до п'я ти замісниками R3; R1 вибраний з групи, що складається з водню, С1-10алкілу, де алкіл є незаміщеним або заміщеним від одного до п'яти замісниками, незалежно вибраними з галогену, гідрокси, С1-6алкокси, карбокси, С1-6aлкілоксикарбонілу і феніл-С 1-3алкокси, де алкокси є незаміщеним або заміщеним від одного до п'яти атомами галогену, (СН2)nарилу, де арил є незаміщеним або заміщеним від одного до п'яти замісниками, незалежно вибраними з галогену, CN, гідрокси, R2, OR2 , NHSO2R2, NR2SO2R 2, SO2R2, CO2H, і С1-6алкілоксикарбонілу, (СН2)n-гетероарилу, де гетероарил є незаміщеним або заміщеним від одного до трьох замісниками, незалежно вибраними з гідрокси, галогену, С1-6алкілу і С1-6алкокси, де алкіл і алкокси є незаміщеними або заміщеними від одного до п'яти атомами галогену, (СН2)n-гетероциклілу, де гетероцикліл є незаміщеним або заміщеним від одного до трьох замісниками, незалежно вибраними з оксо, гідрокси, галогену, С1-6алкілу і С1-6алкокси, де алкіл і алкокси є незаміщеними або заміщеними від одного до п'яти атомами галогену, (СН2)n-С3-6циклоалкілу, де циклоалкіл є незаміщеним або заміщеним від одного до трьох замісниками, незалежно вибраними з галогену, гідрокси, С1-6алкілу і С1-6алкокси, де алкіл і алкокси є незаміщеними або заміщеними від одного до п'яти атомами галогену; і де будь-який атом вуглецю метилену (СН2) в R 1 є незаміщеним або заміщеним однією або двома групами, незалежно вибраними з галогену, гідрокси і С 1-4алкілу, незаміщеного або заміщеного від одного до п'яти атомами галогену; кожний R3 незалежно вибраний з групи, що складається з водню, галогену, ціано, гідрокси, С1-6алкілу, незаміщеного або заміщеного від одного до п'яти атомами галогену, С1-6алкокси, незаміщеного або заміщеного від одного до п'яти атомами галогену, карбокси, алкоксикарбонілу, аміно, NHR2, NR2R2, NHSO2R2, NR2SO2R2, NHCOR2, NR2COR2, NHCO2R2, NR2CO2R2, SO2R2, SO2NH2, SO2NHR2 і SO2NR2R2; кожний R2 незалежно являє собою С1-6алкіл, незаміщений або заміщений від одного до п'яти замісниками, незалежно вибраними з галогену, СО2Н і С1-6алкілоксикарбонілу; R4 і R5 незалежно вибрані з групи, що складається з: водню, ціано, карбокси, С1-6алкілоксикарбонілу, С1-6алкілу, незаміщеного або заміщеного від одного до п'яти замісниками, незалежно вибраними з галогену, гідрокси, С1-6алкокси, карбокси, С1-6алкілоксикарбонілу, і феніл-С 1-3алкокси, де алкокси є незаміщеним або заміщеним від одного до п'яти атомами галогену, (СН2)n-арилу, де арил є незаміщеним або заміщеним від одного до п'яти замісниками, незалежно вибраними з галогену, гідрокси, С1-6алкілу і С 1-6алкокси, де алкіл і алкокси є незаміщеними або заміщеними від одного до п'яти атомами галогену, (СН2)n-гетероарилу, де гетероарил є незаміщеним або заміщеним від одного до трьох замісниками, незалежно вибраними з гідрокси, галогену, С1-6алкілу і С1-6алкокси, де алкіл і алкокси є незаміщеними або заміщеними від одного до п'яти атомами галогену, (СН2)n-гетероциклілу, де гетероцикліл є незаміщеним або заміщеним від одного до трьох замісниками, незалежно вибраними з оксо, гідрокси, галогену, С1-6алкілу і С 16алкокси, де алкіл і алкокси є незаміщеними або заміщеними від одного до п'яти атомами галогену, , (СН2)n-С3-6циклоалкілу, де циклоалкіл є незаміщеним або заміщеним від одного до трьох замісниками, незалежно вибраними з галогену, гідрокси, С1-6алкілу і С1-6алкокси, де алкіл і алкокси є незаміщеними або заміщеними від одного до п'яти атомами галогену, (CH2)nCONR6R7, де R6 і R7 незалежно вибрані з групи, що складається з водню, тетразолілу, тіазолілу, (СН2)n-фенілу, (СН2)n-С3-6циклоалкілу і С 1-6алкілу, де алкіл є незаміщеним або заміщеним від одного до п'яти атомами галогену, і де феніл і циклоалкіл є незаміщеними або заміщеними від одного до п'яти замісниками, незалежно вибраними з галогену, гідрокси, С1-6алкілу і С1-6алкокси, де алкіл і алкокси є незаміщеними або заміщеними від одного до п'яти атомами галогену і; або де R6 і R7 разом з атомом азоту, до якого вони приєднані, утворюють гетероциклічне кільце, вибране з азетидину, піролідину, піперидину, піперазину і морфоліну; і де вказане гетероциклічне кільце є незаміщеним або заміщеним від одного до п'яти замісниками, незалежно вибраними з галогену, гідрокси, С1-6алкілу і С16алкокси, де алкіл і алкокси є незаміщеними або заміщеними від одного до п'я ти атомами галогену; і де будьякий атом вуглецю метилен (СН2) в R4 або R5 є незаміщеним або заміщеним однією або двома групами, незалежно вибраними з галогену, гідрокси і С 1-4алкілу, незаміщеного або заміщеного від одного до п'яти атомами галогену; і R8 і R9, кожний, незалежно, являють собою водень або С 1-6алкіл. В одному з варіантів здійснення сполук згідно з даним винаходом атом вуглецю, помічений *, має R конфігурацію, як зображено на формулі Іа: де Аr, R 1, R 4, R5 , R8 і R9 є такими, як визначено в даному описі. У другому варіанті здійснення сполук згідно з даним винаходом R3 вибраний з групи, що складається з водню, галогену, ціано, гідрокси, С1-6алкілу, незаміщеного або заміщеного від одного до п'яти атомами галогену, і С1-6алкокси, незаміщеного або заміщеного від одного до п'яти атомами галогену. У класі таких варіантів здійснення R3 вибраний з групи, що складається з водню, фтору, хлору, брому, трифторметилу і метилу. У підкласі вказаного класу R3 вибраний з групи, що складається з водню, фтору і хлору. У третьому варіанті здійснення сполук згідно з даним винаходом R1 вибраний з групи, що складається з: водню, С1-6алкілу, де є незаміщеним або заміщеним від одного до п'яти замісниками, вибраними з галогену, гідрокси, С1-6алкокси, карбокси, С1-6алкілоксикарбонілу і феніл-С 1-3алкокси, де алкокси є незаміщеним або заміщеним від одного до п'яти атомами галогену, (СН2)n-С3-6циклоалкілу, де циклоалкіл є незаміщеним або заміщеним від одного до трьох замісниками, незалежно вибраними з галогену, гідрокси, С1-6алкілу і С1-6алкокси, де алкіл і алкокси є незаміщеними або заміщеними від одного до п'яти атомами галогену; і де будь-який атом вуглецю метилену (СН2) в R 1 є незаміщеним або заміщеним однією або двома групами, незалежно вибраними з галогену, гідрокси і С 1-4алкілу, незаміщеного або заміщеного від одного до п'яти атомами галогену. У класі такого варіанту здійснення сполук згідно з даним винаходом R1 вибраний з групи, що складається з водню, С1-4алкілу, 2,2,2-трифторетилу, метоксикарбонілметилу, карбоксиметилу, гідроксіетилу, бензилоксиметилу, бензилоксіетилу і циклопропілу. У підкласі вказаного класу R1 вибраний з групи, що складається з водню, метилу, трет-бутилу і циклопропілу. У четвертому варіанті здійснення сполук згідно з даним винаходом R 4 і R5 незалежно вибрані з групи, що складається з: водню, С1-10алкілу, незаміщеного або заміщеного від одного до п'яти замісниками, незалежно вибраними з галогену, гідрокси, С1-6алкокси, карбокси, С1-6алкілоксикарбонілу і феніл-С 1-3алкокси, де алкокси є незаміщеним або заміщеним від одного до п'яти атомами галогену, (СН2)n-арилу, де арил є незаміщеним або заміщеним від одного до п'яти замісниками, незалежно вибраними з галогену, гідрокси, С1-6алкілу і С 1-6алкокси, де алкіл і алкокси є незаміщеними або заміщеними від одного до п'яти атомами галогену, (СН2)n-гетероарилу, де гетероарил є незаміщеним або заміщеним від одного до трьох замісниками, незалежно вибраними з гідрокси, галогену, С1-6алкілу і С1-6алкокси, де алкіл і алкокси є незаміщеними або заміщеними від одного до п'яти атомами галогену, (СН2)n-гетероциклілу, де гетероцикліл є незаміщеним або заміщеним від одного до трьох замісниками, незалежно вибраними з оксо, гідрокси, галогену, С1-6алкілу і С1-6алкокси, де алкіл і алкокси є незаміщеними або заміщеними від одного до п'яти атомами галогену, (СН2)n-С3-6циклоалкілу, де циклоалкіл є незаміщеним або заміщеним від одного до трьох замісниками, незалежно вибраними з галогену, гідрокси, С1-6алкілу і С1-6алкокси, де алкіл і алкокси є незаміщеними або заміщеними від одного до п'яти атомами галогену, де будь-який атом вуглецю метилену (СН2) в R4 або R5 є незаміщеним або заміщеним однією або двома групами, незалежно вибраними з галогену, гідрокси і С1-4алкілу, незаміщеного або заміщеного від одного до п'яти атомами галогену. У класі такого варіанту здійснення сполук згідно з даним винаходом R 4 і R5 незалежно вибрані з групи, що складається з: водню, С1-6алкілу, незаміщеного або заміщеного від одного до п'яти замісниками, незалежно вибраними з галогену, гідрокси, С1-6алкокси, карбокси, С1-6алкілоксикарбонілу і феліл-С 1-3алкокси, де алкокси є незаміщеним або заміщеним від одного до п'яти атомами галогену, (СН2)n-арилу, де арил є незаміщеним або заміщеним від одного до п'яти замісниками, незалежно вибраними з галогену, гідрокси, С1-6алкілу і С 1-6алкокси, де алкіл і алкокси є незаміщеними або заміщеними від одного до п'яти атомами галогену, (СН2)n-гетероарилу, де гетероарил є незаміщеним або заміщеним від одного до трьох замісниками, незалежно вибраними з гідрокси, галогену, С1-6алкілу і C1-6алкокси, де алкіл і алкокси є незаміщеними або заміщеними від одного до п'яти атомами галогену, (СН2)n-С3-6циклоалкілу, де циклоалкіл є незаміщеним або заміщеним від одного до трьох замісниками, незалежно вибраними з галогену, гідрокси, С1-6алкілу і С1-6алкокси, де алкіл і алкокси є незаміщеними або заміщеними від одного до п'яти атомами галогену, і де будь-який атом вуглецю метилену (СН2) в R4 або R5 є незаміщеним або заміщеним однією або двома групами, незалежно вибраними з галогену, гідрокси і С1-4алкілу, незаміщеного або заміщеного від одного до п'яти атомами галогену. У підкласі вказаного класу R4 і R5 незалежно вибрані з групи, що складається з: водню, СН3, СН2СН3, СН2СН(СН3)2, СН2-циклопропілу, СН2-циклогексилу, CH2OCH2Ph, СН2ОН, CH2Ph, CH2(3-OCF3-Ph), CH2(4-OCF3-Ph), CH2(3-CF3, 5-CF3-Ph), CH2(2-CF3-Ph), CH2(2-Cl-Ph), CH2(2-Me-Ph), CH2(2-Me, 5-Me-Ph), CH2(2-Ph-Ph), CH2(2-F, 5-F-Ph), CH2(2-F-Ph), CH2(2-F, 3-F-Ph), СН2(2-піридиніл), СН2(3-піридиніл), СН2(4-піридиніл), СН2(1-оксидопіридин-2-іл), СН2(1-оксидопіридин-3-іл), СН2(1Н-піразол-1-іл), CH2(2-F, 6-F-Ph) і CH2CF3. У додатковому підкласі вказаного класу R5 являє собою водень. У п'ятому варіанті здійснення сполук згідно з даним винаходом R 8 і R9 незалежно вибрані з водню і метилу. У класі такого варіанту здійснення R8 і R9 являють собою водень. У шостому варіанті здійснення згідно з даним винаходом представлені сполуки формули Іа, де R 1 вибраний з групи, що складається з водню, С1-4алкілу, 2,2,2-трифторетилу, метоксикарбонілметилу, карбоксиметилу, гідроксіетилу, бензилоксиметилу, бензилоксіетилу і циклопропілу; R3 являє собою водень, хлор або фтор; R4 вибраний з групи, що складається з: водню, СН3, СН2СН3, СН2СН(СН3)2, СН2-циклопропілу, СН2-циклогексилу, CH2OCH2Ph, CH2OH CH2Ph, CH2(3-OCF3-Ph), CH2(4-OCF3-Ph), і CH2(3-CF3, 5-CF3-Ph), CH2 (2-CF3-Ph), CH2(2-Cl-Ph), CH2(2-Me-Ph), CH2(2-Me, 5-Me-Ph), CH2(2-Ph-Ph), CH2(2-F, 5-F-Ph), CH2(2-F-Ph), CH2(2-F, 3-F-Ph), СН2(2-піридиніл), СН2(3-піридиніл), CH2 (4-піридиніл), СН2(1-оксидопіридин-2-іл), СН2(1-оксидопіридин-3-іл), СН2(1H-піразол-1-іл), CH2(2-F, 6-F-Ph) і CH2CF3; і R8 і R9 являють собою водень. У класі такого варіанту здійснення R5 являє собою водень. Ілюстративні, але не обмежуючі приклади сполук згідно з даним винаходом, які можуть бути використані як інгібітори дипептидилпиптедази-IV є наступними: або їх фармацевтично прийнятні солі. Як використовується в даному описі, застосовуються нижченаведені визначення. "Алкіл", а також інші групи, які мають префікс "алк", такі як алкокси і алканоїл, означають вуглецевий ланцюг, який може бути лінійним або розгалуженим, і їх поєднання, крім вуглецевого ланцюга визначеного іншим способом. Приклади алкільних груп включають в себе метил, етил, пропіл, ізопропіл, бутил, втор- і третбутил, пентил, гексил, гептил, октил, ноніл і т.п. Там, де допускається певна кількість атомів вуглецю, наприклад, з С3-10, термін алкіл також включає в себе циклоалкільні групи і поєднання лінійних або розгалужених алкільних ланцюгів, об'єднаних з циклоалкільними структурами. Якщо кількість атомів вуглецю не вказана, мається на увазі C1-6. "Циклоалкіл" являє собою підклас алкілу і означає насичене вуглеводневе кільце, що має певну кількість атомів вуглецю. Приклади циклоалкілу включають в себе циклопропіл, циклобутил, циклопентил, циклогексил, циклогептил, циклооктил і т.п. Звичайно циклоалкільна група являє собою моноциклічну, крім встановлених іншим способом. Групи циклоалкілу є насиченими, крім визначених іншим способом. Термін "алкокси" відноситься до алкоксидів лінійного або розгалуженого ланцюга з певною кількістю атомів вуглецю (наприклад, С1-6алкокси), або будь-якою кількістю всередині даного діапазону [тобто, метокси (МеО-), етокси, ізопропокси, і т.д.]. Термін "алкілтіо" відноситься до алкілсульфідів лінійного або розгалуженого ланцюга з певною кількістю атомів вуглецю (наприклад, С1-6алкілтіо), або будь-якою кількістю всередині даного діапазону [тобто, метилтіо (MeS-), е тилтіо, ізопропілтіо, і т.д.] Термін "алкіламіно" відноситься до лінійних або розгалужених алкіламінів з певною кількістю атомів вуглецю (наприклад, С1-6алкіламіно), або будь-якою кількістю всередині даного діапазону [тобто , метиламіно, етиламіно, ізопропіламіно, трет-бутиламіно, і т.д.]. Термін "алкілсульфоніл" відноситься до алкілсульфонілів лінійного або розгалуженого ланцюга з певною кількістю атомів вуглецю (наприклад, С1-6алкілсульфоніл), або будь-якою кількістю всередині даного діапазону [тобто, метилсуль фоніл (MeSO2-), етилсульфоніл, ізопропілсульфоніл, і т.д.]. Термін "алкілоксикарбоніл" відноситься до складних ефірів, лінійного або розгалуженого ланцюга, похідних карбонових кислот, згідно з даним винаходом з певною кількістю атомів вуглецю (наприклад, С16алкілоксикарбоніл), або будь-якою кількістю всередині даного діапазону [тобто, метилоксикарбоніл (МеОСО-), етилоксикарбоніл або бутилоксикарбоніл]. "Арил" означає моно- або систему поліциклічних ароматичних кілець, що містять атоми вуглецю. Переважними арилами є моноциклічні або системи біциклічних 6-10-ти членних ароматичних кілець. Феніл і нафтил є переважними арилами. Найбільш переважним арилом є феніл. "Гетероцикл" і "гетероцикліл" відноситься до насичених або ненасичених неароматичних кілець або систем кілець, що містять, щонайменше, один гетероатом, вибраний з О, S і N, що додатково включає в себе окислені форми сірки, а саме SO і SCV Приклади гетероциклів включають в себе тетрагідрофуран (THF), дигідрофуран, 1,4-діоксан, морфолін, 1,4-дитіан, піперазин, піперидин, 1,3-діоксолан, імідазолідин, імідазолін, піролін, піролідин, тетрагідропіран, дигідропіран, оксатіолан, дитіолан, 1,3-діоксан, 1,3-дитіан, оксатіан, тіоморфолін і т.п. "Гетероарил" означає ароматичний або частково ароматичний гетероцикл, який містить, щонайменше, один гетероатом в кільці, вибраний з О, S і N. Таким чином, гетероарили включають в себе гетероарили, злиті з іншими видами кілець, такими як арили, циклоалкіли і гетероцикли, які не є ароматичними. Приклади гетероарильних груп включають в себе: піроліл, ізоксазоліл, ізотіазоліл, піразоліл, піридил, оксазоліл, оксадіазоліл, тіадіазоліл, тіазоліл, імідазоліл, триазоліл, тетразоліл, фурил, триазиніл, тієніл, піримідил, бензізоксазоліл, бензоксазоліл, бензотіазоліл, бензотіадіазоліл, дигідробензофураніл, індолініл, піридазиніл, індазоліл, ізоіндоліл, дигідробензотієніл, індолізиніл, цинолініл, фталазиніл, хіназолініл, нафтиридиніл, карбазоліл, бензодіоксоліл, хіноксалініл, пуриніл, фуразаніл, ізобензилфураніл, бензімідазоліл, бензофураніл, бензотієніл, хіноліл, індоліл, ізохіноліл, дибензофураніл і т.п. Для гетероциклільних і гетероарильних груп, включаються кільця і системи кілець, що містять від 3-15 атомів, утворюючі 1-3 кільця. "Галоген" відноситься до фтору, хлор у, брому і йоду. У загальному випадку хлор і фтор є переважними. Фтор є найбільш переважним, якщо галогени є заміщеними на алкільній або алкокси групі (наприклад, CF3O і CF3CH2O). Сполуки згідно з даним винаходом можуть містити один або декілька асиметричних центрів, і таким чином можуть зустрічатися у вигляді рацематів і рацемічних сумішей, одних енантіомерів, сумішей діастереомерів і окремих діастереомерів. Сполуки згідно з даним винаходом мають один асиметричний центр на атомі вуглецю, поміченому * в формулі Іа. Додаткові асиметричні центри можуть бути присутніми в молекулі в залежності від природи різних замісників. Кожний такий асиметричний центр може незалежно створювати два оптичних ізомери, і передбачається, що всі можливі оптичні ізомери і діастереомери в сумішах і у вигляді чистих або частково обчищених сполук включені в об'єм згідно з даним винаходом. Мається на увазі, що даний винахід охоплює всі такі ізомерні форми вказаних сполук. Деякі сполуки, представлені в даному описі, містять олефінові подвійні зв'язки, і, якщо тільки не вказане протилежне, мається на увазі, що вони включають в себе як Е, так і Ζ геометричні ізомери. Деякі сполуки, представлені в даному описі, можуть існувати у вигляді таутомерів, які мають різні точки приєднання водню, що супроводжуються одним або декількома переміщеннями подвійних зв'язків. Наприклад, кетон і його енольна форма являють собою кето-енольний таутомер. Окремі таутомери, а також їх суміші охоплюються сполуками згідно з даним винаходом. Формула І показує структури класу сполук без переважної стереохімії. Формула Іа показує переважну стереохімію атома вуглецю, до якого приєднана аміногрупа бета-амінокислоти, з якої ці сполуки отримують. Незалежний синтез цих діастереомерів або їх хроматографічне розділення можуть бути здійснені як відомо в даній галузі техніки, за допомогою відповідної модифікації методів, описаних в даному описі. їх абсолютна стереохімія може бути визначена за допомогою рентгенівської кристалографії кристалічних продуктів або кристалічних проміжних продуктів, які перетворюють, якщо необхідно, за допомогою реагентів, які містять асиметричний центр відомої абсолютної конфігурації. При бажанні, рацемічні суміші сполук можуть бути розділені для того, щоб виділити окремі енантіомери. Розділення може бути здійснене способами, добре відомими в даній галузі техніки, такими як зв'язування рацемічної суміші сполук з енантіомерно чистою сполукою для утворення суміші діастереомерів, з подальшим розділенням окремих діастереомерів стандартними способами, такими як, фракційна кристалізація або хроматографія. Реакція приєднання часто являє собою утворення солей з використанням енантіомерно чистих кислоти або основи. Потім похідні діастереомерів можуть бути перетворені в чисті енантіомери розщепленням додаткових хіральних залишків. Рацемічні суміші таких сполук також можуть бути розділені безпосередньо хроматографічними способами, що використовують хіральні нерухомі фази, способами, які добре відомі в даній галузі техніки. Як альтернатива, будь-який енантіомер сполуки може бути отриманий стереоселективним синтезом, використовуючи оптично чисті вихідні речовини або реагенти відомої конфігурації, способами добре відомими в даній галузі техніки. Повинно бути зрозуміло, як використовується в даному описі, що посилання на сполуки структурної формули І також означають включення фармацевтично прийнятних солей, а також солей, які не є фармацевтично прийнятними, якщо вони використані як попередники для вільних сполук або їх фармацевтично прийнятних солей, або при інших синтетичних маніпуляціях. Сполуки згідно з даним винаходом можуть бути введені у вигляді фармацезтично прийнятної солі. Термін "фармацевтично прийнятна сіль" відноситься до солей, отриманих з фармацевтично прийнятних нетоксичних основ або кислот, включаючи неорганічні або органічні основи і неорганічні або органічні кислоти. Солі основних сполук, охоплені терміном "фармацевтично прийнятна сіль", відносяться до нетоксичних солей сполук згідно з даним винаходом, які звичайно отримують при взаємодії реакції вільної основи з відповідною органічною або неорганічною кислотою. Характерні солі основних сполук згідно з даним винаходом включають в себе, без обмеження, наступні: ацетат, бензолсульфонат, бензоат, бікарбонат, бісульфат, бітартрат, борат, бромід, камзилат, карбонат, хлорид, клавуланат, цитрат, дигідрохлорид, едетат, едисилат, естолат, езилат, фумарат, глюцептат, глюконат, глутамат, глюколіларсанілат, гексилрезорцинат, гідрабамін, гідробромід, гідрохлорид, гідроксинафтоат, йодид, ізотіонат, лактат, лактобіонат, лаурат, малат, малеат, манделат, мезилат, метилбромід, метилнітрат, метилсульфат, м укат, напсилат, нітрат, сіль N-метилглюкамін амонію, олеат, оксалат, памоат (ембонат), палмітат, пантотенат, фосфат/ди фосфа т, полігалактуронат, саліцилат, стеарат, сульфат, субацетат, сукцинат, танат, тартрат, теоклат, тозилат, триетйодид і валерат. Крім того, якщо сполуки згідно з даним винаходом несуть кислу складову, їх відповідні фармацевтично прийнятні солі включають в себе, без обмеження, солі, отримані з неорганічних основ, що включають в себе алюміній, амоній, кальцій, мідь, залізо (III), залізо (II), літій, магній, марганець (III), марганець (II), калій, натрій, цинк і т.п. Більш конкретно, переважними є солі амонію, кальцію, магнію, калію і натрію. Солі, отримані з фармацевтично прийнятних органічних нетоксичних основ, включають в себе солі первинних, вторинних і третинних амінів, циклічних амінів і основних неіонообмінних смол, таких як аргінін, бетаїн, кофеїн, холін, Ν,Νдибензилетилендіамін, діетиламін, 2-діетиламіноетанол, 2-диметиламіноетанол, етаноламін, етилендіамін, Nетилморфолін, N-етилпіперидин, глюкамін, глюкозамін, гістидин, гідрабамін, ізопропіламін, лізин, метилглюкамін, морфолін, піперазин, піперидин, поліамінові смоли, прокаїн, пурини, теобромін, триетиламін, триметиламін, трипропіламін, трометамін і т.п. Також, у випадку присутності в сполуках згідно з даним винаходом групи карбонової кислоти (-СООН) або спирту, може використовуватися фармацевтично прийнятні складні ефіри, похідні карбонових кислот, такі як метиловий, етиловий, або півалоїлоксиметиловий, або ацильні похідні спиртів, такі як ацетат або малеат. Включені ефіри і ацильні групи, відомі в даній галузі техніки для модифікації характеристик розчинності або гідролізу для використання як склади з уповільненим вивільненням або проліки. Сольвати, і більш конкретно, гідрати сполук структурної формули І також включені в даний винахід. Ілюстрацією згідно з даним винаходом є застосування сполук, приведене в прикладах і даному описі. Цільові сполуки придатні в способі інгібування ферменту дипептидилпептидази-IV у пацієнта, такого як ссавець, за необхідності такого інгібування, шляхом введення ефективної кількості сполуки. Даний винахід відноситься до застосування сполук, приведених в даному описі, як інгібіторів активності ферменту дипептидилпептидази-IV. Крім приматів, наприклад, людей, згідно з способом згідно з даним винаходом, може бути вилікувана множина інших ссавців. Наприклад, можуть бути вилікувані ссавці, що включають в себе, без обмеження, корів, овець, кіз, коней, собак, кішок, морських свинок, щурів або інші види великої рогатої худоби, дрібної рогатої худоби, кінських, псових, котячих, гризунів або мишоподібних. Однак спосіб також може бути застосований до інших видів, таких як види птиці (наприклад курчата). Даний винахід додатково відноситься до способу отримання лікарського засобу для інгібування активності ферменту дипептидилпептидази-IV у людей і тварин, який включає об'єднання сполуки згідно з даним винаходом з фармацевтично прийнятним носієм або розріджувачем. Об'єктом, що виліковується даними способами, звичайно є ссавець, переважно людина, чоловік або жінка, в якого бажано інгібувати активність ферменту дипептидилпептидази-IV. Термін "терапевтично ефективна кількість" означає кількість цільової сполуки, яка може викликати біологічну або медичну відповідь тканини, системи, тварини або людини, яка встановлена дослідником, ветеринаром, лікарем або іншим клініцистом. Термін "композиція", як використовується в даному описі, означає продукт, що містить певні інгредієнти в певних кількостях, а також будь-який продукт, який виходить, прямо або опосередковано, з комбінації певних інгредієнтів в певних кількостях. Такий термін відносно фармацевтичної композиції, призначений для охоплення продукту, що містить активний інгредієнт(інгредієнти), і інертний інгредієнт(інгредієнти), які складають носій, а також будь-який продукт, який, виходить, прямо або опосередковано, при поєднанні, комплексоутворенні або агрегації будь-яких дво х або декількох інгредієнтів, або дисоціації одного або декількох з інгредієнтів, або інших типів реакцій або взаємодії одного або декількох інгредієнтів. Таким чином, фармацевтичні композиції згідно з даним винаходом охоплюють будь-яку композицію, отриману змішуванням сполуки згідно з даним винаходом і фармацевтично прийнятного носія. Під "фармацевтично прийнятним" мається на увазі носій, розріджувач або наповнювач, який повинен бути сумісним з іншими інгредієнтами складу і не небезпечний для його реципієнта. Терміни "застосування" і або "введення" сполуки потрібно розуміти, як сполуки, що означають надання згідно з даним винаходом або проліків сполуки згідно з даним винаходом індивіду, потребуючому лікування. Корисність сполук згідно з даним винаходом як інгібіторів активності ферменту дипептидилпептидази-IV може бути продемонстрована за допомогою методів, відомих в даній галузі техніки. Константи інгібування визначають таким чином. Застосовують безперервний флуоресцентний аналіз з субстратом Gly-Pro-AMC, який очищають за допомогою DP-IV для звільнення флуоресцентної АМС групи, що виходить. Кінетичні параметри, які описують таку реакцію, є наступними: Km=50мкМ; kcat=75s -1; kcat/Km=1,5´106 Μ1-s -1. Звичайно реакція містить приблизно 50пМ ферменту, 50мкМ Gl y-Pro-AMC, і буфер (100мМ HEPES, рН7,5, 0,1мг/мл BSA) в загальному реакційному об'ємі 100мкл. Виділення АМС постійно контролюють в флуорометрі з 96-ямковим планшетом, з використанням довжини хвилі збудження 360нм і довжини хвилі випромінювання 460нм. У таких умовах, приблизно 0,8мкМ АМС продукується за 30 хвилин при 25°С. Фермент, використаний в таких дослідженнях, був розчинним (трансмембранний домен і цитоплазматичне розширення виключили) людським білком, продукованим в системі експресії бакуловірусу (Вас-То-Вас, Gibco BRL). Було встановлено, що кінетичні константи гідролізу Gly-Pro-AMC і GLP-1 відповідають літературним значенням нативного ферменту. Для вимірювання констант дисоціації сполук, розчини інгібітору в ДМСО додавали в реакційні суміші, що містять фермент і субстрат (кінцева концентрація ДМСО становила 1%). Всі експерименти проводили при кімнатній температурі, використовуючи стандартні реакційні умови, описані вище. Для визначення констант дисоціації (Ki, встановили швидкості реакції за допомогою нелінійної регресії по рівнянню Міхаеліса-Ментона для конкурентного інгібування. Помилки при відтворенні констант дисоціації звичайно не перевищували дво х. Зокрема, сполуки за наступними прикладами мали активність при інгібуванні ферменту дипептидилпептидази-IV у вищезгаданому аналізі, звичайно з ІС 50 менше, ніж приблизно 1мкМ. Такий результат служить ознакою природної активності сполук при використанні як інгібіторів активності ферменту дипептидилпептидази-IV. Фермент дипептидилпептидаза-IV (DP-IV) є білком клітинної поверхні, який залучений до широкого спектра біологічних функцій. Він має широке поширення в тканинах (кишечнику, нирок, печінки, підшлункової залози, плаценти, тимусу, селезінки, епітеліальних клітинах, ендотелії судин, лімфоїдних і мієлоїдних клітинах, сироватці), і рівні експресії в різних тканинах і типах клітин. DP-IV є ідентичним CD26 маркеру активації Τ клітин, і він може розщеплювати деяку кількість пептидів імунорегуляції, ендокринних і нейрологічних пептидів in vitro. Це підтверджує потенційну роль вказаної пептидази в ряді процесів захворювань у людини або інших видів. Отже, цільові сполуки можуть бути використані при попередженні або лікуванні наступних захворювань, порушень і станів. Діабет типу II і пов'язані захворювання: Дійсно встановлено, що інкретини GLP-1 і GIP легко інактивуються in vivo за допомогою DP-IV. Дослідження на мишах з дефіцитом DP-IV1(-/-) і попередні клінічні випробування показують, що інгібування DP-IV збільшує стійкі концентрації GLP-1 і GIF, що є результатом поліпшеної толерантності до глюкози. Аналогічно з GLP-1 і GIP, можливо, що інші пептиди сімейства глюкагонів, які залучені до регуляції глюкози, також інактивуються за допомогою DP-IV (наприклад, ΡАСАР). Інактивація таких пептидів за допомогою DP-IV також може грати роль в гомеостазі глюкози. Отже, інгібітори DP-IV згідно з даним винаходом можуть бути використані при лікуванні діабету типу II і для лікування і попередження численних станів, які часто супроводжують діабет типу II, включаючи синдром X (також відомий як метаболічний синдром), реактивну гіпоглікемію і діабетичну дисліпідемію. Ожиріння, що обговорюється нижче, є іншим станом, який часто виявляють при діабеті типу II, і воно може бути піддане лікуванню сполуками згідно з даним винаходом. Нижченаведені захворювання, порушення і стани пов'язані з діабетом типу 2, і, отже, можуть бути вилікувані, контрольовані, або в деяких випадках попереджені за допомогою лікування сполуками згідно з даним винаходом: (1) гіперглікемія, (2) низька толерантність до глюкози, (3) резистентність до інсуліну, (4) ожиріння, (5) ліпідні порушення, (6) дисліпідемія, (7) гиперліпідемія, (8) гіпертригліцеридемія, (9) гіперхолестеролемія, (10) низькі рівні HDL, (11) високі рівні LDL, (12) атеросклероз і його наслідки, (13) судинний рестеноз, (14) синдром подразненого кишечнику, (15) запальне захворювання кишечнику, включаючи хворобу Крона і виразковий коліт, (16) інші запальні стани, (17) панкреатит, (18) абдомінальне ожиріння, (19) нейродегенеративне захворювання, (20) ретинопатія, (21) нефропатія, (22) нейропатія, (23) синдром X, (24) оваріальний гіперандрогенізм (синдром полікістозу яєчників), і інші захворювання, при яких резистентність до інсуліну є складовою. При синдромі X, також відомому як метаболічний синдром, передбачається, що ожиріння сприяє резистентності до інсуліну, діабету, дисліпідемії, гіпертензії і до збільшеного ризику серцево-судинних захворювань. Отже, інгібітори DP-IV також можуть бути використані для лікування гіпертензії, пов'язаної з таким станом. Ожиріння: інгібітори DP-IV можуть бути використані для лікування ожиріння. Це припущення основане на спостережній інгібуючій дії GLP-1 і GLP-2 на прийняття їжі і випорожнення шлунка. Екзогенне введення GLP-1 людям істотно збільшує прийняття їжі і сповільнює випорожнення шлунка (Am. J. Physiol., 277: R910-R916 (1999)). Введення ICV (інтрацервікально) GLP-1 щурам і мишам також має виражену дію на прийняття їжі (Nature Medicine, 2: 1254-1258 (1996)). Це придушення прийняття їжі не спостерігається у GLP-1R('A) мишей, що вказує на те, що такі ефекти опосередковані рецепторами GLP-1 мозку. Аналогічно з GLP-1, можливо, що GLP-2 також регулюється за допомогою DP-IV. IC V введення GLP-2 також придушує прийняття їжі, аналогічно ефектам, що спостерігаються при GLP-1 (Nature Medicine, 6: 802-807 (2000)). Додатково, дослідження мишей з дефіцитом DP-IV підтвердило, що такі тварини є резистентними до ожиріння, що викликається харчуванням, і пов'язаної патології (наприклад, гіперінсулінонемії). Дефіцит гормону росту: Інгібування DP-IV може годитися для лікування дефіциту гормону росту, що базується на гіпотезі, що фактор (GRF), який вивільняє гормон росту, білок який стимулює вивільнення гормону росту з передньої частки гіпофіза, розщеплюється ферментом DP-IV in vivo [WO 00/56297]. Наступні дані надають доказ того, що GRF є ендогенним субстратом: (1) GRF ефективно розщеплюється in vitro, створюючи неактивний продукт GRF[3-44] (BBA 1122: 147-153 (1992)); (2) GRF легко руйнується в плазмі до GRF[3-44]; це попереджається дипротином А інгібітором DP-IV; і (3) GRF[3-44] виявлений в плазмі трансгенної свині з людським GRF (J. Сііп. Invest., 83: 1533-1540 (1989)). Такі інгібітори DP-IV можуть бути використані для такого ж спектра ознак, який був обговорений для засобів, що посилюють секрецію гормону росту. Пошкодження кишечнику: Можливість використання інгібіторів DP-IV для лікування пошкоджень кишечнику підтверджена результатами досліджень, які вказують на те, що глюкагон-подібні пептиди-2 (GLP-2), подібно до ендогенного субстрату для DP-IV, можуть виявляти трофічні ефекти на епітелій кишечнику (Regulatory Peptides, 90: 27-32 (2000)). Введення GLP-2 приводить до деякого збільшення маси кишечнику у гризунів і ослабляє внутрішнє пошкодження в моделях коліту і ентериту гризунів. Імуносупресія: Інгібування DP-IV може бути використане для моделювання імунної відповіді, основаної на дослідженнях що мають на увазі фермент DP-IV при активації Τ клітин і при обробці хемокіном, і ефективність інгібіторів DP-IV в моделях захворювань in vivo. Показано, що DP-IV є ідентичним CD26, маркером клітинної поверхні активованих імунних клітин. Експресія CD26 регулюється станом диференціації і активації імунних клітин. Загальновизнано, що CD26 функціонує як ко-стимуляторна молекула в моделях активації Τ клітин in vitro. Деякі хемокіни містять пролін в передостанньому положенні, мабуть для захисту від руйнування неспецифічними амінопептидазами. Показано, що багато які з них обробляються in vitro за допомогою DP-IV. У деяких випадках (RANTES, LD78-бета, MDC, еотаксин, SDF-1 альфа) розщеплення дає змінену активність в дослідженнях хемотаксису і передачі сигналів. Також показано, що селективність рецепторів в деяких випадках модифікується (RANTES). Множина N-термінально зрізаних форм деяких хемокінів ідентифікована в системах клітинних культур in vitro, що включають в себе передбачені продукти гідролізу DP-IV. Показано, що інгібітори DP-IV є е фективними імуносупресантами в тваринних моделях трансплантації і артриту. Продипін (Pro-Pro-дифеніл-фосфонат), незмінний інгібітор DP-IV, показав збільшення вдвічі виживання серцевого алотрансплантату у щурів з 7 дня по 14 день (Transplantation, 63:1495-1500 (1997)). Інгібітори DP-IV протестовані в колагені і при артритах, індукованих алкілдіаміном, у щурів, і показали статистично значуще пом'якшення задньої лапи, опухло ї в такій моделі [Int. J. Immunopharmacology, 19:15-24 (1997) і Immunopharmacology, 40: 21-26 (1998)]. DP-IV є зави щення регульованим в деяких аутоімунних захворюваннях, що включають в себе ревматоїдні артрити, розсіяний склероз, хворобу Грейвса, і тиреоїдит Хашімото (Immunology Today, 20: 367-375 (1999)). ВІЛ інфекція: Інгібування DP-IV може бути використане для лікування або попередження ВІЛ інфекції або СНІДу, оскільки деякі хемокіни, які інгібують проникнення ВІЛ клітин, є можливими субстратами для DP-IV (Immunology Today 20: 367-375 (1999)). У випадку SDF-Іальфа, розщеплення посилює антивірусну активність (PNAS, 95: 6331-6 (1998)). Таким чином, очікується, що стабілізація SDF-Іальфа шляхом інгібування DP-IV може збільшити ВІЛ інфективність. Гемопоез: Інгібування DP-IV може бути використане для лікування або попередження гемопоезу, оскільки DP-IV може бути залучений в гемопоез. Інгібітор DP-IV, Val-Boro-Pro, стимулював гемопоез в мишачій моделі нейтропенії, індукованій циклофосфамідом [WO 99/56753]. Нейронні порушення: Інгібування DP-IV може бути використане для лікування або попередження різних нейронних або психіатричних порушень, оскільки деякі пептиди, залучені до різних нейронних процесів, розщеплюються in vitro за допомогою DP-IV. Інгібітор DP-IV, таким чином, може мати терапевтичну перевагу при лікуванні нейронних порушень. Показано, що ендоморфін-2, бета-казоморфін і субстанція Ρ все є in vitro субстратами для DP-IV. У всі х випадках розщеплення in vitro високоефективне, з kcat/K m приблизно 106 M-1s -1 або більше. У тестовій моделі анальгезії стрибка при електрошоці у щурів, інгібітор DP-IV показав значущий ефект, який не залежав від присутності екзогенного ендоморфіну-2 (Brain Research, 815:278-286(1999)). Нейропротективний і нейрорегенеративний ефекти інгібіторів DP-IV були також доведені здатністю інгібіторів захищати моторні нейрони від ексцитотоксичної загибелі клітин, захищати стриарну іннервацію додамінергічних нейронів при введенні конкурентно з МРТР, і захи щати відновлення щільності стриарної іннервації, якщо дається при терапевтичному лікуванні МРТР нижченаведеним способом [див. Yong-Q. Wu, і ін., "Neuroprotective Effects of Inhibitors of Dipeptidyl Peptidase-IV In Vitro and In Vivo, " Int. Conf. On Dipeptidyl Aminopeptidases: Basic Science and Clinical Applications, September 26-29, 2002 (Berlin, Germany)]. Інвазія пухлини і метастазів: Інгібування DP-IV може бути використане для лікування або попередження інвазії пухлини і метастазів, оскільки збільшення або зменшення в експресії деяких ектопептидаз, що включають в себе DP-IV виявлено в процесі трансформації нормальних клітин в злоякісний фенотип [J. Exp. Med., 190: 301-305 (1999)]. Виявлено, що збільшення або зменшення регуляції таких білків є специфічним для типу клітин і тканин. Наприклад, збільшена CD26/DP-IV експресія спостерігалася в лімфомі Τ клітин, гострої лімфобластної лейкемії Τ клітин, клітинах, похідних карциноми щитовидної залози, базальній клітинній карциномі і карциномі молочної залози. Таким чином, інгібітори DP-IV можуть бути використані при лікуванні таких карцином. Доброякісна гіпертрофія простати: Інгібування DP-IV може бути використане для лікування або попередження доброякісної гіпертрофії простати, оскільки була відмічена збільшена активність DP-IV в тканині простати пацієнтів з ДГП (Eur. J. Clin. Chem. Clin. Biochem.. 30: 333-338 (1992)). Рухливість сперматозоїдів/жіноча контрацепція: Інгібування DP-IV може бути використане для зміни рухливості сперматозоїдів і для контрацепції жінок, оскільки сім'яна рідина, простатосома, органели, виділені з простати, важливі для рухливості сперматозоїдів, володіють дуже високими рівнями активності DP-IV (Eur. J. Clin. Chem. Clin. Biochem.. 30: 333-338 (1992)). Гінгівіт: Інгібування DP-IV може бути використано для лікування гінгівіту, оскільки активність DP-IV виявлена в ясенній рідині в ясеневій борозні і в деяких дослідженнях, корельованих з тяжкістю періодонтального захворювання (Arch. Oral Biol., 37: 167-173 (1992)). Остеопороз: Інгібування DP-IV може бути використано для лікування або попередження остеопорозу, оскільки в остеобластах присутні GIP рецептори. Сполуки згідно з даним винаходом можуть бути використані при лікуванні або попередженні одного або декількох з нижченаведених станів або захворювань: (1) гіперглікемія, (2) низька толерантність до глюкози, (3) резистентність до інсуліну, (4) ожиріння, (5) ліпідні порушення, (6) дисліпідемія, (7) гіперліпідемія, (8) гіпертригліцеридемія, (9) гіперхолестеролемія, (10) низькі рівні HDL, (11) високі рівні LDL, (12) атеросклероз і його наслідки, (13) судинний рестеноз, (14) синдром подразнення кишечнику, (15) запальне захворювання кишечнику, включаючи хворобу Крона і виразковий коліт, (16) інші запальні стани, (17) панкреатит, (18) абдомінальне ожиріння, (19) нейродегенеративне захворювання, (20) ретинопатія, (21) нефропатія, (22) нейропатія, (23) синдром X, (24) оваріальний гіперандрогенізм (синдром полікістозу яєчників), (25) діабет типу II, (26) дефіцит гормону росту, (27) нейтропенія, (28) нейронні порушення, (29) метастази раку, (30) доброякісна гіпертрофія простати, (32) гінгівіт, (33) гіпертензія, (34) остеопороз і інші стани, які можуть бути вилікувані або попереджені інгібуванням DP-IV. Цільові сполуки, крім того, можуть бути використані для попередження і лікування вищезгаданих захворювань, порушень і станів в поєднанні з іншими агентами. Сполука згідно з даним винаходом може бути використана в поєднанні з одним або декількома іншими лікарськими засобами при лікуванні, попередженні, придушенні або полегшенні захворювань або станів, для яких сполуки формули І або інші лікарські засоби можуть бути використані, причому спільна комбінація лікарських засобів є більш безпечною і більш ефективною, ніж який-небудь один лікарський засіб. Такий інший лікарський засіб(засоби) можуть бути введені способом і в кількості, що звичайно використовується в цьому випадку, одночасно або послідовно із сполукою формули І. Якщо сполука формули І використовується одночасно з одним або декількома іншими лікарськими засобами, готують фармацевтичну композицію у вигляді стандартної лікарської дози, що містить ці інші лікарські засоби і сполуку формули І. Однак, комбіноване лікування також може включати в себе також види лікування, при яких сполука формули І і один або декілька інших лікарських засобів вводять при різних режимах, що перекриваються. Також передбачається, що при використанні в поєднанні з одним або декількома іншими активними інгредієнтами сполуки згідно з даним винаходом і інші активні інгредієнти могли б бути використані в більш низьких дозах, ніж коли кожне використовується окремо. Таким чином, фармацевтичні композиції згідно з даним винаходом включають в себе такі, які містять один або декілька інших активних інгредієнтів на додаток до сполуки формули І. Приклади інших активних інгредієнтів, які можуть бути введені в поєднанні із сполукою формули І, і або введені окремо, або в тій же фармацевтичній композиції, включають в себе, без обмежень: (a) інший інгібітор дипептидилпептидази IV (DP-IV); (b) інсулінові сенсибілізатори, включаючи (і) агоніст PPARg, такий як глітазони (наприклад, троглітазон, піоглітазон, енглітазон, МСС-555, розиглітазон і т.п.) і інші PPAR ліганди, що включають в себе подвійний агоніст PPARa/g, такі як KRP-297, і агоніст PPARa, такий як похідні фенофібринової кислоти (гемфіброзил, клофібрат, фенофібрат і безафібрат), (іі) бігуаніди, такі як метформін і фенформін, і (ііі) інгібітор білка тирозин фосфа тази-IB (PTP-1B); (c) інсулін або міметик інсуліну; (d) сульфонілсечовину і речовини, що підвищують секрецію інсуліну, такі як толбутамід, глібенкламід, гліпізид, глімепірид і меглітиніди, такі як репаглінід; (e) інгібітори a-глюкозидази (такі як акарбоз і міглітол); (f) антагоністи глюкагонового рецептора, такі як ті, які, розкриті [в WO 98/04528, WO 99/01423, WO 00/39088, WO 00/69810]; (g) GLP-1, міметик GLP-1 або агоністи GLP-1 рецептора, такі як ті, які розкриті [в WO 00/42O26 і WO 00/59887]; (h) GIF, міметик GIF, такий як той, який розкритий [в WO 00/58360], і агоніст GIF рецептора; (і) РАС АР, міметик РАСАР і агоністи РАСАР рецептора, такі як ті, які розкриті [в WO 01/23420]; (j) агенти, що понижують рівень холестерину, такі як (і) інгібітори HMG-CoA редуктази (ловастатин, симвастатин, правастатин, церивастатин, флувастатин, аторвастатин, ітавастатин, розувастатин і ін.), (іі) секвестранти (холестирамін, колестипол і похідні діалкіламіноалкілу декстрану з поперечними зв'язками), (ііі) нікотиніловий спирт, нікотинова кислота або її солі, (iv) агоністи PPARa, такі як похідні фенофібринової кислоти (гемфіброзил, клофібрат, фенофібрат і безафібрат), (ν) подвійний агоніст PPARa/g, такий як KRP-297, (vi) інгібітор абсорбції холестерину, такий як бета-ситостерол і езетиміб, (vii) інгібітори ацил СоА:холестерин ацилтрансферази, такі як авасиміб, і (viii) антиоксиданти, такі як пробукол; (k) агоністи PPAR d, такі як ті, які розкриті [в WO 97/28149]; (l) сполуки проти ожиріння, такі як фенфлурамін, дексфенфлурамін, фентермін, сибутрамін, орлістат, антагоністи нейропептиду Y1 або Y5, інверсивні агоністи і антагоністи рецептора СВ-1, агоністи β3 адренергічного рецептора, агоністи рецептора меланокортину, більш конкретно агоністи рецептора меланокортину-4, антагоністи греліну і антагоністи рецептора меланін-концентруючого гормону (МСН); (m) інгібітори ідеального транспортера для жовчних кислот; (n) агенти, призначені для використання при запальних станах, такі як аспірин, нестероїдні протизапальні лікарські засоби, глюкокортикоїди, азулфідин і інгібітори селективної циклооксигенази-2; (о) антигіпертензивні засоби, такі як інгібітори АСЕ (еналаприл, лізиноприл, каптоприл, хінаприл, тандолаприл), блокатори рецептора А-ІІ (лозартан, кандезартан, ірбезартан, валзартан, телмізартан, епрозартан), бета блокатори і блокатори кальцієвого каналу; і (р) активатори глюкокінази (GKA). Інгібітори дипептидилпептидази-IV, які можуть бути об'єднані із сполуками структурної формули І, включають в себе такі, які [описані в WO 03/004498 (16 січня 2003); WO 03/004496 (16 січня 2003); ЕР 1 258 476 (20 листопада 2002); WO 02/083128 (24 жовтня 2002); WO O2/062764 (15 серпня 2002); WO 03/00O250 (3 січня 2003); WO 03/002530 (9 січня 2003); WO 03/002531 (9 січня 2003); WO 03/0O2553 (9 січня 2003); WO 03/0O2593 (9 січня 2003); WO 03/000180 (3 січня 2003); і WO 03/000181 (3 січня 2003)]. Деякі сполуки інгібіторів DP-IV включають в себе тіазолідид ізолейцину; NVP-DPP728; Р32/98; Р93/01; і LAF 237. Сполуки проти ожиріння, які можуть бути об'єднані із сполуками структурної формули І, включають в себе фенфлурамін, дексфенфлурамін, фентермін, сибутрамін, орлістат, антагоністи нейропептиду Υ1 або Y5, антагоністи або інверсивні агоністи канабіноїдного СВ1 рецептора, агоністи рецепторів меланокортину, більш конкретно, агоністи рецепторів меланокортину-4, антагоністи греліну і антагоністи рецептора меланінконцентруючого гормону (МСН). Для огляду сполук проти ожиріння, які можуть бути об'єднані із сполуками структурної формули І, [див. S.Chaki і ін., "Recent advances in feeding suppressing agents: potential therapeutic strategy for the treatment of obesity, "Expert Opin. Ther. Patents. 11: 1677-1692 (2001) and D. Spanswick and K. Lee, "Emerging antiobesity drugs," Expert Opin. Emerging Drugs, 8:217-237(2003)]. Антагоністи нейропептиду Y5, які можуть бути об'єднані із сполуками структурної формули І включають в себе такі, які описані [в патенті США №6 335 345 (1 січня 2002) і WO 01/14376 (1 березня 2001)]; деякі сполуки, ідентифіковані як GW 59884A; GW 569180A; LY366377; і CGP-71683A. Антагоністи канабіноїдного СВ1 рецептора, які можуть бути об'єднані із сполуками структурної формули І включають в себе такі, які [описані в заявці РСТ WO 03/007887; патенті США №5 624 941], такі як римонабант; [заявці РСТ WO О2/076949], такі як SLV-319; [патенті США №6 028 084; заявці РСТ WO 98/41519; заявці РСТ WO 00/10968; заявці РСТ WO 99/02499; патенті США №5 532 237; і патенті США №5 292 736]. Агоністи рецептора меланокортину, які можуть бути об'єднані із сполуками структурної формули І включають в себе такі, які [описані в WO 03/009847 (6 лютого 2003); WO O2/068388 (6 вересня 2002); WO 99/640O2 (16 грудня 1999); WO 00/74679 (14 грудня 2000); WO 01/70708 (27 вересня 2001); і WO 01/70337 (27 вересня 2001)] а також [описані в J.D. Speake і ін., "Recent advances in the development of melanocortin-4 receptor agonists," Expert Opin. Ther. Patents, 12: 1631-1638 (2002)]. Потенційна корисність безпечних і ефективних активаторів глюкокінази (GKA) для лікування діабету [описана в J. Grimsby і ін., "Allosteric Activators of Glucokinase: Potential Role in Diabetes Therapy," Science, 301: 370-373 (2003)]. Вищезгадані комбінації включають в себе комбінації сполуки згідно з даним винаходом не тільки з якимнебудь одною активною сполукою, але також з двома або декількома іншими активними сполуками. Необмежувальні приклади включають в себе комбінації сполук, що мають формулу І, з двома або декількома активними сполуками, вибраними з бігуанідинів, сульфонілсечовини, інгібіторів редуктази HMG-CoA, агоністів PPAR, інгібіторів РТР-1В, інши х інгібіторів DP-IV і сполук проти ожиріння. Більш того сполуки згідно з даним винаходом можуть бути використані в поєднанні з іншими лікарськими засобами, які використовуються для лікування/попередження/придушення або полегшення захворювань або станів, для яких придатні сполуки згідно з даним винаходом. Ці інші лікарські засоби можуть бути введені способом і в кількості, що звичайно використовується в таких випадках, одночасно або послідовно із сполукою згідно з даним винаходом. Якщо сполука згідно з даним винаходом використовується одночасно з одним або декількома іншими лікарськими засобами, переважна фармацевтична композиція, що містить такі інші лікарські засоби додатково до сполуки згідно з даним винаходом. Отже, фармацевтичні композиції згідно з даним винаходом включають в себе такі, які також містять один або декілька інших активних інгредієнтів, додатково до сполуки згідно з даним винаходом. Масове співвідношення сполуки згідно з даним винаходом з другим активним інгредієнтом може бути різним, і буде залежати від ефективної дози кожного інгредієнта. У загальному випадку, може бути використана ефективна доза кожного. Таким чином, наприклад, якщо сполука згідно з даним винаходом об'єднана з іншим агентом, масове співвідношення сполуки згідно з даним винаходом з іншим агентом буде в загальному випадку знаходитися в межах від приблизно 1000:1 до приблизно 1:1000, переважно від приблизно 200:1 до приблизно 1:200. Комбінації сполуки згідно з даним винаходом і інших активних інгредієнтів буде в загальному випадку також знаходитися у вищезгаданому діапазоні, але в кожному випадку, повинна бути використана ефективна доза кожного активного інгредієнта. У таких комбінаціях сполука згідно з даним винаходом і інші активні агенти можуть вводитися окремо або в комбінації. Додатково, один елемент може бути введений перед введенням іншого агента(агентів), одночасно, або після нього. Сполука згідно з даним винаходом може вводитися орально, парентерально (наприклад, внутрішньом'язово, інтраперитонеально, внутрішньовенно, ICV, інтрацистеріально ін'єкцією або вливанням, підшкірною ін'єкцією або у вигляді імплантату), за допомогою інгаляційного спрею, назальним, вагінальним, ректальним, сублінгвальним або місцевим способами введення, і може бути розроблена рецептура, одної або спільно, у відповідному складі одиничної дози, що містить звичайні нетоксичні фармацевтично прийнятні носії, домішки і наповнювачі, відповідні для кожного способу введення. Крім лікування теплокровних тварин, таких як миші, щури, коні, велика рогата худоба, вівці, собаки, кішки, мавпи і т.д., сполуки згідно з даним винаходом ефективні для використання людьми. Фармацевтичні композиції для введення сполук згідно з даним винаходом можуть звичайно знаходитися у вигляді одиничної дози і можуть бути приготовані будь-яким способом, добре відомим в галузі фармацевтики. Всі способи включають в себе стадію об'єднання активного інгредієнта з носієм, який складає один або декілька додаткових інгредієнтів. У загальному випадку, фармацевтичні композиції готують шляхом однорідного і ретельного змішування активного інгредієнта з рідким носієм або тонко подрібненим твердим носієм, або з обома, а потім, якщо необхідно, формування продукту в бажаний склад. У фармацевтичній композиції активна цільова сполука включена в кількості, ефективній для створення бажаного ефекту в процесі або стані захворювання. Як використовується в даному описі, термін "композиція" призначений для охоплення продукту, що містить певні інгредієнти в певних кількостях, а також будь-який продукт, який отримують в результаті, прямо або опосередковано, з об'єднання певних інгредієнтів в певних кількостях. Фармацевтичні композиції, що містять активний інгредієнт, можуть бути у вигляді, відповідному для перорального застосування, наприклад, у вигляді пілюль, таблеток, коржиків, водних або масляних суспензій, дисперсних порошків або гранул, емульсій, твердих або м'яких капсул, сиропів або еліксирів. Композиції, призначені для перорального використання, можуть бути приготовані згідно з будь-яким способом, відомим в галузі отримання фармацевтичних композицій, і такі композиції можуть містити один або декілька агентів, вибраних з групи, що включає підсолоджувачі, смакові домішки, барвники і консерванти для отримання фармацевтично зручних і приємних ліків. Таблетки містять активний інгредієнт в суміші з нетоксичними фармацевтично прийнятними наповнювачами, які придатні для виробництва таблеток. Такі наповнювачі можуть бути, наприклад, інертними розріджувачами, такими як карбонат кальцію, карбонат натрію, лактоза, фосфа т кальцію або фосфат натрію; гранулювальними і розпушуючими агентами такими як, наприклад, кукурудзяний крохмаль або альгінова кислота; зв'язуючими агентами, такими як, наприклад крохмаль, або гуміарабік, і змащувальними агентами такими як, наприклад, стеарат магнію, стеринова кислота або тальк. Таблетки можуть бути непокритими, або вони можуть бути покриті добре відомими в даній галузі способами для сповільнення розпаду і абсорбції в травному тракті, і таким чином досягнення тривалого впливу протягом більш тривалого періоду. Наприклад, може бути використана речовина, затримуюча вивільнення, таке як гліцерилмоностеарат або гліцерилдистеарат. Також вони можуть бути покриті способами, [описаними в патентах США 4 256 108; 4 166 452; і 4 265 874], з отриманням осмотичних терапевтичних таблеток для регульованого вивільнення. Склади для перорального застосування також можуть бути представлені у вигляді желатинових капсул, де активний інгредієнт змішують з інертним твердим розріджувачем, наприклад, карбонатом кальцію, фосфатом кальцію або каоліном, або у вигляді м'яких желатинових капсул, де активний інгредієнт змішують з водним або масляним середовищем, наприклад, з арахісовою олією, рідким парафіном або оливковою олією. Водні суспензії містять активні речовини в суміші з наповнювачами, придатними для отримання водних суспензій. Такі наповнювачі являють собою суспендуючі агенти, наприклад, карбоксиметилцелюлозу натрію, метилцелюлозу, гідроксипропілметилцелюлозу, альгінат натрію, полівінілпіролідон, трагакантову камедь і аравійську камедь смолу; диспергуючі або змочувальні агенти можуть бути фосфатидами природного походження таким як, наприклад, лецитин, або продуктами конденсації оксиду алкілену з жирними кислотами, наприклад, поліоксіетилену стеарат, або продуктами конденсації оксиду етилену зі спиртами з довгим аліфатичним ланцюгом, наприклад, гептадекаетиленоксицетанол, або продуктами конденсації оксиду етилену з неповним ефіром, отриманим з жирних кислот і гекситолу, таких як поліоксіетиленмоноолеатсорбітолу, або продуктами конденсації оксиду етилену з неповним ефіром, отриманим з жирних кислот і ангідридів гекситолу, наприклад, поліетиленмоноолеатсорбітану. Водні суспензії також можуть містити один або декілька консервантів, наприклад, етил, або н-пропіл, п-гідроксибензоат, один або декілька барвників, і одну або декілька смакових домішок, і один або декілька підсолоджувачів, таких як сахароза або сахарин. Масляні суспензії можуть бути отримані суспендуванням активного інгредієнта в рослинній олії, наприклад арахісовій олії, оливковій олії, кунжутній олії, кокосовій олії, або в мінеральному маслі, такому як рідкий парафін. Масляні суспензії можуть містити загусники, наприклад, віск, тверді парафіни або цетиловий спирт. Можуть бути додані підсолоджувачі, такі як вказані вище, і смакові домішки для придания приємного смаку пероральним препаратам. Такі композиції можуть бути захищені шляхом додання антиоксидантів, таких як аскорбінова кислота. Дисперсні порошки і гранули, придатні для приготування водних суспензій шляхом додання води, являють собою активні інгредієнти в суміші з диспергуючими або змочувальними агентами, суспендуючими агентами і одним або декількома консервантами. Придатні диспергуючі або змочувальні агенти і суспендуючі агенти проілюстровані такими вже згаданими вище. Додаткові наповнювачі, наприклад, підсолоджувачі, смакові домішки і барвники, також можуть бути присутніми. Фармацевтичні композиції згідно з даним винаходом також можуть бути у вигляді емульсій масло-в-воді. Масляна фаза може бути рослинною олією, наприклад, оливковою олією або арахісовою олією, або мінеральним маслом, наприклад, рідкими парафінами або їх сумішшю. Придатні емульгатори можуть бути смолами природного походження, наприклад, акароїдною смолою або трагакантовою смолою, фосфатидами природного походження такими як, наприклад, соя, лецитин, і ефірами або неповними ефірами, отриманим з жирних кислот і ангідридами гекситолу, наприклад, моноолеат сорбітану, і продуктами конденсації вказаних неповних ефірів з оксидом етилену, наприклад, поліоксіетилен моноолеат сорбітану. Емульсії також можуть містити підсолоджувачі і смакові домішки. Сиропи і еліксири можуть бути приготовані разом з підсолоджувачами, наприклад, гліцерином, пропіленгліколем, сорбітолом або сахарозою. Такі склади можуть також містити заспокійливий засіб, консерванти, смакові домішки і барвники. Фармацевтичні композиції можуть бути у вигляді стерильних ін'єктованих водних або масляних суспензій. Така суспензія може бути приготована як відомо з рівня техніки з використанням таких придатних диспергуючих або змочувальних агентів і суспендуючих агентів, які були вказані вище. Стерильні ін'єктовані ліки також можуть бути стерильними ін'єктованими розчинами або суспензіями в нетоксичному розріджувачі або розчиннику, прийнятними для парентерального застосування, наприклад, у вигляді розчину в 1,3бутандїолі. Серед допустимих розріджувачів і розчинників, які можуть бути використані, можна вказати воду, розчин Рінгера і ізотонічний розчин хлориду натрію. Крім того, як розчинники або як суспендуюче середовище звичайно використовуються стерильні жирні масла. Для цієї мети може використовуватися будь-яке м'яке жирне масло, включаючи синтетичні моно- або дигліцериди. Додатково, жирні кислоти, такі як олеїнова кислота, знаходять застосування в ін'єктованих ліках. Сполуки згідно з даним винаходом також можуть бути введені у вигляді свічок для ректального введення лікарського засобу. Такі композиції можуть бути приготовані змішуванням лікарського засобу з відповідним неподразнювальним наповнювачем, який є твердим при звичайних температурах, але рідким при температурі прямої кишки, і, отже, може танути в прямій кишці, вивільняючи лікарську речовину. Такими речовинами є масло какао і поліетиленгліколі. Для місцевого застосування використовуються креми, мазі, желе, розчини або суспензії і т.д., що містять сполуку згідно з даним винаходом. (З метою такого використання місцеве використання повинно включати рідини для полоскання рота і розчини для полоскання горла.) Фармацевтична композиція і спосіб згідно з даним винаходом можуть додатково містити інші терапевтичні активні сполуки, як вказано в даному описі, які звичайно застосовуються при лікуванні вищезазначених патологічних станів. При лікуванні або попередженні станів, при яких потрібне інгібування активності ферменту дипептидилпептидази-IV, відповідна доза звичайно може становити приблизно 0,01-500мг на кг масу тіла пацієнта на добу, яка може бути введена у вигляді одиничної дози або більшою кількістю доз. Переважно, доза може складати від приблизно 0,1 до приблизно 250мг/кг на добу; більш переважно, від приблизно 0,5 до приблизно 100мг/кг на добу. Відповідна доза може складати від приблизно 0,01 до 250мг/кг на добу, від приблизно 0,05 до 100мг/кг на добу, або від приблизно 0,1 до 50мг/кг на добу. Всередині такого діапазону доза може становити 0,05-0,5, 0,5-5 або 5-50мг/кг на добу. Для перорального застосування, композиції переважно представлені у вигляді таблеток, що містять 1,0-1000мг активного інгредієнта, більш конкретно 1,0, 5,0, 10,0, 15,0, 20,0, 25,0, 50,0, 75,0, 100,0, 150,0, 200,0, 250,0, 300,0, 400,0, 500,0, 600,0, 750,0, 800,0, 900,0 і 1000,0мг активного інгредієнта для симптоматичного регулювання дози для пацієнта, якого необхідно вилікувати. Сполуки можуть вводитися в режимі від 1 до 4 разів на добу, переважно один або два рази на добу. При лікуванні або попередженні цукрового діабету і/або гіперглікемії або гіпертригліцеридемії або інших захворювань, для яких призначені сполуки згідно з даним винаходом, звичайно задовільні результати отримують, коли сполуки згідно з даним винаходом вводять добовою дозою від приблизно 0,1мг до приблизно 100мг на кілограм маси тіла тварини, переважно даючи у вигляді одиничної добової дози або розділених доз від двох до шести разів на добу, або у вигляді препарату уповільненого вивільнення. Для більшості ссавців загальна добова доза складає від приблизно 1,0мг до приблизно 1000мг, переважно, від приблизно 1мг до приблизно 50мг. У випадку дорослої людини масою 70кг, загальна добова доза може звичайно складати від приблизно 7мг до приблизно 350мг. Такий режим дозування може бути встановлений для забезпечення оптимальної терапевтичної відповіді. Однак, очевидно, що, конкретний рівень доз і частота доз для будь-якого конкретного пацієнта можуть бути різними і залежати від множини чинників, що включають активність конкретної сполуки, що використовується, метаболічну стабільність і тривалість впливу такої сполуки, вік, масу тіла, загальний стан здоров'я, стать, дієту, режим і час прийому, швидкість екскреції, поєднання лікарських засобів, тяжкість конкретного стану і лікування, якому піддають пацієнта. Деякі способи отримання сполук згідно з даним винаходом проілюстровані нижченаведеними схемами і прикладами. Вихідні речовини отримані згідно з способами, відомими в даній галузі техніки або як проілюстровано в даному описі. Сполуки згідно з даним винаходом можуть бути отримані з проміжних сполук з отриманням бетаамінокислоти, таких як сполуки формули II, і заміщених проміжних сполук з отриманням гексагідродіазепінону, таких як сполуки формули III, в стандартних умовах зв'язування пептидів з подальшим зняттям захисту. Отримання таких інтермедіатів описано на наступних схемах. де Аr, R1, R4, R5, R8 , і R9 є такими, як визначено вище, і Ρ являє собою відповідну групу, що захищає азот, таку як трет-бутоксикарбоніл (ВОС), бензилоксикарбоніл (Cbz), або 9-флуоренІлметоксикарбоніл (Fmoc). Сполуки формули II є комерційно доступними, відомими з літератури або можуть бути о тримані звичайним чином багатьма способами, добре відомими фахівцям в даній галузі техніки. Один із звичайних шляхів проілюстрований на схемі 1. Захищен у альфа-амінокислоту 1, яка може бути комерційно доступна або легко отримана з відповідної амінокислоти шляхом використання захисту, наприклад, ди-трет-бутилдикарбонату (для Р=ВОС ), карбобензилоксихлориду (для P=Cbz), або N-(9-флуоренілметоксикарбонілокси)сукциніміду (для P=Fmoc), обробляють ізобутилхлор форміатом і основою, такою як триетиламін або Ν,Νдіізопропілетиламін, далі діазометаном. Отриманий в результаті діазокетон потім обробляють бензоатом срібла в розчині, такому як метанол або водний розчин діоксану, і можуть піддати обробці ультразвуком слідуючи процедурі по Sewald і ін., Synthesis, 837 (1997) для надання бета-амінокислоти II. Як повинно бути зрозуміло фахівцям в даній галузі техніки, для отримання енантіомерно чистих бета-амінокислот II, можуть бути використані енантіомерно чисті альфа-амінокислоти І. Альтернативні способи отримання захищених інтермедіатів бета-амінокислоти II можуть бути знайдені в наступних оглядах: [Е. Juaristi, Enantioselective Synthesis of (B-Amino Acids, Ed., Wiley-VCH, New York: 1997; Juaristi et al., Aldrichimica Acta, 27: 3 (1994); and Cole et al., Tetrahedron, 32: 9517 (1994)]. Сполуки формули III є комерційно доступними, відомими з літератури або можуть бути отримані звичайним чином багатьма способами, добре відомими фахівцям в даній галузі техніки. Один із звичайних способів, в якому R1 є воднем, показаний на схемі 2. Аміноефір 2, що звичайно використовується у вигляді його гідрохлоридної солі, конденсують з акрилонітрилом 3 і захищають утворену аміногрупу продукту, наприклад, у вигляді його трет-бутоксикарбонільного (Вос) похідного, для надання 4, який відновлюють до первинного аміну 5. Циклізацію 5 в N-захищений гексагідродіазепінон 7 можна провести з використанням триетилалюмінію. Як альтернатива, аміноефір 5 може бути гідролізований з кислотою 6 і циклізований з використанням реагентів для зв'язування амінокислот, таких як EDC для отримання проміжної сполуки з отриманням 7. Зняття захисту, наприклад, у випадку Вос, шля хом обробки кислотою, такою як соляна в діоксані, або трифтороцтовою кислотою в дихлорметані, дає проміжну сполуку IIIа. Альтернативний спосіб отримання гексагідродіазепінону IIIb (в якому R 5, R8 і R9 являють собою водень) показаний на схемі 3. α-Кетокислоти 8, такі як піровиноградна кислота, можуть бути конденсовані з амінопропіонітрилом 9 для отримання ціаноетилоксопропанамідів 10, які можуть зазнавати відновної циклізації до гексагідродіазепінону IIIb відновником, таким як оксид платини і водень. Проміжні сполуки для синтезу гексагідродіазепінону III і проміжні сполуки для їх синтезу можуть бути перетворені різними способами. Наприклад, азот аміду проміжної сполуки 7, отриманий, як показано на схемі 2, може бути алкілований депротонуванням з основою, такою як гідрид натрію, з подальшою обробкою галогеналкілом, як показано на схемі 4. Зняття захисту отриманого проміжної сполуки 11 дає проміжну сполуку III. Інший такий приклад проілюстрований на схемі 5. Захищений гексагідродіазепінон 12, який може бути отриманий, як описано для проміжної сполуки 11 на схемі 4, де R4 і R8 являють собою водень, або за допомогою захисту проміжної сполуки IIIа з схеми 3, де R5 являє собою водень, може бути алкілований з використанням основи, такої як LDA з подальшою обробкою різними галогеналкілами. Спосіб може бути повторений для введення другої алкільної групи, R8. Зняття захисту дає проміжну сполуку III. Проміжні сполуки II і III зв'язують в стандартних умовах зв'язування пептидів, наприклад, використовуючи 1-етил-3-(3-диметиламінопропіл)карбодіімід і 1-гідроксибензотриазол (EDC/HOBT) або O-(7-азабензотриазол1-іл)-N,N,N',N'-тетраметилсечовини гексафторфосфат і 1-гідрокси-7-азабензотриазол (HATU/HOAT) в розчиннику, такому як Ν,Ν-диметилформамід (ДМФ) або дихлорметан, протягом від 3 до 48 годин при температурі навколишнього середовища з отриманням проміжної сполуки 13, як показано на схемі 6. В деяких випадках, проміжна сполука III може бути сіллю, такою як сіль гідрохлориду або трифтороцтової кислоти, і в цьому випадку зручно додавати основу, в загальному випадку Ν,Ν-діізопропілетиламін, для реакції зв'язування. Потім видаляють захисну груп у, наприклад, трифтороцтовою кислотою або метанольним розчином хлористоводневої кислоти у випадку Вос з отриманням бажаного аміну І. Продукт очи щають, якщо необхідно, перекристалізацією, розтиранням в порошок, препаративною тонкошаровою хроматографією, флеш-хроматографією на силікагелі, такою як з пристроєм Biotage®, або ВЕРХ. Сполуки, які очищені ВЕРХ, можуть бути виділені у вигляді відповідних солей. Очи щення проміжних сполук виконують таким же чином. У деяких випадках продукт І або синтетичні проміжні сполуки, проілюстровані у вищенаведених схемах, можуть бути додатково модифіковані, наприклад, за допомогою введення замісників на Аг, R1, R4, або R5. Такі введення можуть включати в себе, без обмежень, реакції відновлення, окислення, алкілування, ацилювання і гідролізу, які звичайно відомі фахівцям в даній галузі техніки. У деяких випадках для здійснення вищезгаданої взаємодії схеми можуть бути змінені для полегшення реакції або щоб уникнути небажаних продуктів реакції. Наступні приклади надані для того, щоб даний винахід міг бути зрозумілий більш повно. Такі приклади є тільки ілюстративними і не повинні бути витлумачені як такі, що обмежують даний винахід яким-небудь способом. (3R)-3-[(Бутоксикарбоніл)аміно]-4-(2,5-дифторфеніл)бутанова кислота Стадія A: (R,S)-N-(трет-Бутоксикарбоніл)-2,5-дифторфенілаланін До розчину 0,5г (2,49мМ) 2,5-дифтор-DL-фенілаланіну в 5мл трет-бутанолу додавали, послідовно, 1,5мл 2н водного розчину гідроксиду натрію і 543мг ди-трет-бутилдикарбонату. Реакційну суміш перемішували при температурі навколишнього середовища протягом 16год. і розбавляли етилацетатом. Органічну фазу промивали, послідовно, 1н соляною кислотою і сольовим розчином, сушили над сульфатом магнію і концентрували у вакуумі. Неочищену речовину очищали флеш-хроматографією (силікагель, 97:2:1 дихлорметан:метанол:оцтова кислота) і отримували вказану в заголовку сполук у. MS 302 (М+1). Стадія В: (R,S)-3-[(Бутоксикарбоніл)аміно]-1-діазо-4-(2,5-дифторфеніл)бутан-2-он До розчину 2,23г (7,4мМ) (R,S)-N-(трет-бутоксикарбоніл)-2,5-дифторфенілаланіну в 100мл діетилового ефіру при 0°С послідовно додавали 1,37мл (8,1мМ) триетиламіну і 0,931мл (7,5мМ) ізобутилхлорформіату, і реакційну суміш перемішували при даній температурі протягом 15хв. Потім додавали охолоджений розчин діазометану в ефірі доти, поки зберігався жовтий колір, і перемішування продовжували ще протягом 16 год. Надлишок діазометану видаляли додаванням по краплях оцтової кислоти, і реакційну суміш розбавляли етилацетатом і промивали послідовно 5% соляною кислотою, насиченим розчином бікарбонату натрію і сольовим розчином, сушили над суль фатом магнію і концентрували у вакуумі. Очищення флеш-хроматографією (силікагель, 4:1 гексан:етилацетат) давало діазокетон. 1 ЯМР (500МГц, CDCl3) δ 7,03-6,95 (м, 1H), 6,95-6,88 (м, 2Н), 5,43 (ушир.с, 1H), 5,18 (ушир.с, 1H), 4,45 (ушир.с, 1Н), 3,19-3,12 (м, 1H), 2,97-2,80 (м, 1Н), 1,38 (с, 9Н). Стадія С: (3R)-3-[(трет-Бутоксикарбоніл)аміно]-4-(2,5-дифторфеніл)бутанова кислота У розчин 2,14г (6,58мМ) (R,S)-3-[(трет-бутоксикарбоніл)аміно]-1-діазо-4-(2,5-дифторфеніл)бутан-2-ону, розчиненого в 100мл метанолу при -30°С, послідовно додавали 3,3мл (19мМ) діізопропілетиламіну і 302мг (1,32мМ) бензоату срібла. Реакційну суміш перемішували протягом 90хв., розбавляли етилацетатом і промивали послідовно 2н соляною кислотою, насиченим водним розчином бікарбонату натрію і сольовим розчином. Органічну фазу сушили над сульфатом магнію, концентрували у вакуумі, і розділяли енантіомери препаративною хіральною ВЕРХ (колонка Chiralpak AD, 5% етанол в гексані) з отриманням 550мг бажаного (R)-енантіомеру, який елюювали першим. Вказану речовину розчиняли в 50мл суміші тетрагідрофуран:метанол:1н водний розчин гідроксиду літію (3:1:1) і перемішували при 50°С протягом 4год. Реакційну суміш охолоджували, підкисляли 5% розбавленою соляною кислотою і екстрагували етилацетатом. Об'єднані органічні шари промивали сольовим розчином, сушили над сульфатом магнію і концентрували у вакуумі з отриманням вказаної в заголовку сполуки у вигляді білої піноподібної твердої речовини. 1 ЯМР (500МГц, CDC13) δ 7,21 (м, 1H), 6,98 (м, 2Н), 6,10 (ушир.с, 1Н), 5,05 (м, 1H), 4,21 (м, 1Н), 2,98 (м, 2Н), 2,60 (м, 2Н), 1,38 (с, 9Н). (3R)-3-[(трет-бутоксикарбоніл)аміно]-4-[2-фтор-4-(трифторметил)феніл]-бутанова кислота Стадія А: (2R,5S)-2,5-Дигідро-3,6-диметокси-2-(2'-фтор-4'-(трифторметил) бензил)-5-ізопропілпіразин До розчину 3,32г (18мМ) комерційно доступного (2S)-2,5-дигідро-3,6-диметокси-2-ізопропілпіразину в 100мл тетрагідрофурану при -70°С додавали 12мл (19мМ) 1,6Μ розчину бутил літію в гексані. Після перемішування при вказаній температурі протягом 20хв., додавали 5г (19,5мМ) 2-фтор-4трифторметилбензилброміду в 20мл тетрагідрофурану і продовжували перемішувати протягом 3год., потім нагрівали реакційну суміш до температури навколишнього середовища. Реакційну суміш гасили водою, концентрували у вакуумі, і екстрагували етилацетатом. Об'єднані органічні фази промивали сольовим розчином, сушили і концентрували у вакуумі. Очи щення флеш-хроматографією (силікагель, 0-5% етилацетат в гексані) давало вказану в заголовку сполук у. 1 ЯМР (500МГц, CDCI3) δ 7,33-7,25 (м, 3Н), 4,35-4,31 (м, 1Н), 3,75 (с, 3Н), 3,65 (с, 3Н), 3,60 (т, 1Н, J=3,4Гц), 3,33 (дд, 1H, J=4,6, 13,5Гц), 3,03 (дд, 1Н, J=7, 13,5Гц), 2,25-2,15 (м, lH), 1,0 (д, 3Н, J=7Гц), 0,66 (д, 3Н, J=7Гц). Стадія В: (R)-N-(трет-бутоксикарбоніл)-2-фтор-4-трифторметил-фенілаланінметиловий ефір До розчину 5,5г (15мМ) (2R,5S)-2,5-дигідро-3,6-диметокси-2-(2'-фтор-4'-(трифторметил)бензил)-5ізопропілпіразину в 50мл суміші ацетонітрил:дихлорметан (10:1) додавали 80мл 1н водного розчину трифтороцтової кислоти. Реакційну суміш перемішували протягом 6год., і органічні розчинники відганяли у вакуумі. Додавали карбонат натрію доти, поки розчин не ставав лужним (>рН8), і потім реакційну суміш розбавляли 100мл тетрагідрофурану, і додавали 10г (46мМ) ди-трет-бутилдикарбонату. Отриману суспензію перемішували протягом 16год., концентрували у вакуумі і екстрагували етилацетатом. Об'єднану органічну фазу промивали сольовим розчином, сушили і концентрували у вакуумі. Очищення флеш-хроматографією (силікагель, 20% етилацетат в гексані) давало вказану в заголовку сполуку. 1 ЯМР (500МГц, CDCI3) δ 7,38-7,28 (м, 3Н), 5,10 (шир.д, 1H), 4,65-3,98 (м, 1H), 3,76 (с, 3Н), 3,32-3,25 (м, 1H), 3,13-3,05 (м, 1H), 1,40 (с, 9Н). Стадія С: (R)-N-(трет-Бутоксикарбоніл)-2-фтор-4-трифторметил)фенілаланін Розчин 5,1г (14мМ) (R,S)-N-(трет-бутоксикарбоніл)-2-фтор-4-трифторметил)фенілаланінметилового ефіру в 350мл суміші тетрагідрофуран:метанол:1н гідроксид літію (3:1:1) перемішували при 50°С протягом 4год. Реакційну суміш о холоджували, підкисляли 5% соляною кислотою і екстрагували етилацетатом. Об'єднані органічні фази промивали сольовим розчином, сушили над сульфатом магнію і концентрували у вакуумі з отриманням вказаної в заголовку сполуки. 1 ЯМР (500МГц, CD3OD) δ 7,45-7,38 (м, 3Н), 4,44-4,40 (м, 1Н), 3,38-3,33 (м, 1Н), 2,98 (дд, 1H, J=9,6, 13,5Гц), 1,44 (с, 9Н). Стадія D: (3R)-3-[(Бутоксикарбоніл)аміно]-4-[2-фтор-4-(трифторметил)феніл] бутанова кислота До розчину 3,4г (9,7мМ) продукту зі стадії С в 60мл тетрагідрофурану при 0°С додавали, послідовно, 2,3мл (13мМ) діізопропілметиламіну, і 1,7мл (13мМ) ізобутилхлорформіату, і реакційну суміш перемішували при вказаній температурі протягом 30хв. Потім додавали охолоджений ефірний розчин діазометану доти, поки зберігався жовтий колір, і перемішування продовжили далі протягом 16год. Надлишок діазометану гасили додаванням по краплях оцтової кислоти, і реакційну суміш розбавляли етилацетатом і послідовно промивали 5% соляною кислотою, насиченим водним розчином бікарбонату натрію і сольовим розчином, сушили над сульфатом магнію і концентрували у вакуумі. Очищення флеш-хроматографією (силікагель, 9:1 гексан:етилацетат) давало 0,5г діазокетону. До розчину 0,5г (1,33мМ) діазокетону, розчиненого в 100мл метанолу, при 0°С послідовно додавали 0,7мл (4мМ) діізопропілетиламіну і 32мг (0,13мМ) бензоату срібла. Реакційну суміш перемішували протягом 2год., потім розбавляли етилацетатом і промивали послідовно 2н соляною кислотою, насиченим водним розчином бікарбонату натрію і сольовим розчином. Органічну фазу сушили над сульфатом магнію, концентрували у вакуумі і розчиняли в 50мл суміші тетрагідрофуран:метанол:1н водний розчин гідроксиду літію (3:1:1) і перемішували при 50°С протягом 3год. Реакційну суміш о холоджували, підкисляли 5% соляною кислотою і екстрагували етилацетатом. Об'єднані органічні шари промивали сольовим розчином, сушили над сульфатом магнію і концентрували у вакуумі з отриманням вказаної в заголовку сполуки у вигляді білої піноподібної твердої речовини. 1 ЯМР (500МГц, CD3OD) δ 7,47-7,33 (м, 3Н), 4,88 (ушир.с, 1H), 4,26-3,98 (м, 1Н), 3,06-3,01 (м, 1H), 2,83-2,77 (м, 1Н), 2,58-2,50 (м, 2Н), 1,29 (с, 9Н). (3R)-3[(Бутоксикарбоніл)аміно]-4-(2,4,5-трифторфеніл)бутанова кислота Стадія А: (2S,5R)-2,5-Дигідро-3,6-диметокси-2-ізопропіл-5-(2',4',5'трифторбензил)піразин Вказану в заголовку сполуку (3,81г) отримували з 3,42г (18,5мМ) (2S)-2,5-дигідро-3,6-диметокси-2ізопропілпіразину і 5г (22,3мМ) 2,4,5-три фторбензилброміду, використовуючи спосіб, описаний для проміжної сполуки 2, стадія А. 1 ЯМР (500МГц, CD3OD) δ 7,01 (м, 1H), 6,85 (м, 1H), 4,22 (м, 1H), 3,78 (м, 3Н), 3,64 (м, 3Н), 3,61 (м, 1H), 3,20 (м, 1Н), 2,98 (м, 1H), 2,20 (м, 1H), 0,99 (д, 3Н, J=8Гц), 0,62 (д, 3Н, J=8Гц). Стадія В: (R)-N-(трет-Бутоксикарбоніл)-2,4,5-трифторфенілаланш метиловий ефір До розчину 3,81г (11,6мМ) (2S,5R)-2,5-дигідро-3,6-диметокси-2-ізопропіл-5-(2',4',5'трифторбензил)піразину в 20мл ацетонітрилу додавали 20мл 2н соляної кислоти. Реакційну суміш перемішували протягом 72год. і концентрували у вакуумі. Реакційну суміш розчинили в 30мл дихлорметану і додавали 10мл (72мМ) триетиламіну і 9,68г (44,8мМ) ди-трет-бутилдикарбонату. Реакційну суміш перемішували протягом 16год., розбавляли етилацетатом і промивали послідовно 1н соляною кислотою і сольовим розчином. Органічну фазу сушили над сульфатом магнію, концентрували у вакуумі і очищали флеш-хроматографією (силікагель, 9:1 гексаніетилацетат) з отриманням вказаної в заголовку сполуки. 1 ЯМР (500МГц, CDCI3) δ 6,99 (м, 1H), 6,94 (м, 1H), 5,08 (м, 1Н), 4,58 (м, 1H), 3,78 (м, 3Н), 3,19 (м, 1H), 3,01 (м, 1Н), 1,41 (с, 9Н). Стадія С: (R)-N-(трет-Бутоксикарбоніл)-2,4,5-трифторфенілаланін Вказану в заголовку сполуку (2,01г) отримували з 2,41г (7,5Μ) (R)-N-(трет-бутоксикарбоніл)-2,4,5трифторфенілаланін метилового ефіру, використовуючи спосіб, описаний для проміжної сполуки 2, стадія С LC-MS 220,9 (М+1-ВОС). Стадія D: (3R)-3-[(Бутоксикарбоніл)аміно]-4-(2,4,5-трифторфенілбутанова кислота До розчину 0,37г (1,16мМ) (R)-N-(1,1-диметилетоксикарбон1H)-2,4,5-трифторфенілаланіну в 10мл діетилового ефіру при -20°С послідовно додавали 0,193мл (1,3мМ) триетиламіну і 0,18мл (1,3мМ) ізобутилхлорформіату, і реакційну суміш перемішували при вказаній температурі протягом 15хв. Потім додавали охолоджений ефірний розчин діазометану доти, поки зберігався жовтий колір, і перемішування продовжували далі протягом 1год. Надлишок діазометану гасили додаванням по краплях оцтової кислоти, і реакційну суміш розбавляли етилацетатом, і послідовно промивали насиченим водним розчином бікарбонату натрію і сольовим розчином, сушили над сульфа том магнію і концентрували у вакуумі. Очищення флешхроматографією (силікагель, 3:1 гексан:етилацетат) давало 0,36г діазокетону. До розчину 0,35г (1,15мМ) діазокетону, розчиненого в 12мл суміші 1,4 діоксан:вода (5:1), додавали 26мг (0,113мМ) бензоату срібла. Отриманий розчин обробляли ультразвуком протягом 2год., потім розбавляли етилацетатом і промивали послідовно 1н соляною кислотою і сольовим розчином, сушили над сульфатом магнію і концентрували у вакуумі. Очищення флеш-хроматографією (силікагель, 97:2:1 дислорметан:метанол:оцтова кислота) давало вказану в заголовку сполук у. 1 ЯМР (500МГц, CDCI3) δ 7,06 (м, 1Н), 6,95 (м, 1Н), 5,06 (ушир.с, 1H), 4,18 (м, 1H), 2,98 (м, 2Н), 2,61 (м, 2Н), 1,39 (с, 68 9Н). (3R)-4-(2-Бром-4,5-дифторфеніл)-3-[(трет-бутоксикарбоніл)амшо]-бутанова кислота До розчину 2,4г (10мМ) 2-бром-4,5-дифторбензойної кислоти [приготованої згідно з процедурою по Braish і ін., Syn. Comm., 3067-3074 (1992)] в 75мл тетрагідрофурану додавали 2,43г (15мМ) карбонілдіімідазолу. Розчин кип'ятили із зворотним холодильником протягом 3,5год., охолоджували до температури навколишнього середовища і додавали 0,38г (10мМ) боргідриду натрію в 15мл води. Реакційну суміш перемішували протягом 10хв. і розділяли між етилацетатом і 10% водним розчином бікарбонату натрію. Органічний шар промивали двічі теплою водою, сольовим розчином, сушили над сульфатом магнію і концентрували у вакуумі. Очи щення флеш-хроматографією (силікагель, 4:1 гексан:етилацетат) давало 1,9г 2бром-4,5-дифторбензиловий спирт. До розчину 1,9г (8,4мМ) 2-бром-4,5-дифторбензилового спирту в 30мл дихлорметану при 0°С додавали 3,4г (10мМ) тетраброміду вуглецю і 2,7г (10мМ) трифенілфосфіну. Реакційну суміш перемішували протягом 2год. при вказаній температурі, розчинник відганяли у вакуумі і залишок перемішували з 100мл діетилового ефіру. Розчин фільтрували, концентрували у вакуумі і очищали флешхроматографією (силікагель, 20:1 гексан:етилацетат) з отриманням 2,9г 2-бром-4,5-дифторбензилброміду, з домішкою тетраброміду вуглецю, який потім використовували без додаткового очищення. Використанням процедури, описаної з отриманням проміжної сполуки 2-4, перетворювали похідне бензилброміду у вказану в заголовку сполуку. LC-MS 394 і 396 (М+1). По суті слідуючи процедурам, описаним для отримання проміжних сполук 1-4, були отримані проміжні сполуки приведені в Таблиці 1. (3R)-4-[(3R)-3-Аміно-4-(2,4,5-трифторфеніл)бутаноїл]гексагідро-3-метил-2Н-1,4-діазепін-2-ону гідрохлорид Стадія А: Метил N-(трет-бутоксикарбоніл)-N-(2-ціаноетил)-D-аланінат До суспензії гідрохлориду D-аланінметилового ефіру (2,0г), що перемішується, і 5н водного розчину гідроксиду натрію (2,9мл) у воді (15мл) при 0°С додавали акрилонітрил (1,1мл). Отриману в результаті суміш перемішували при 70°С протягом 3,5год. і охолоджували до кімнатної температури. Додавали ди-третбутилдикарбонат (30мл), і реакційну суміш перемішували протягом двох днів. Реакційну суміш розбавляли насиченим водним розчином бікарбонату натрію і екстрагували етилацетатом. Органічний шар відділяли, промивали сольовим розчином, сушили над безводним сульфатом натрію і концентрували. Залишок очищали колонковою флеш-хроматографією (силікагель, етилацетат/гексан 2:3) з отриманням метил-N-(третбутоксикарбоніл)-N-(2-ціаноетил)-D-аланінату. Стадія В: Метил N-(3-амінопропіл)-N-(трет-бутоксикарбоніл)-D-аланінат До розчину метил N-(трет-бутоксикарбоніл)-N-(2-ціаноетил)-D-аланінату (1,5г) в етанолі (80мл) і хлороформі (1,4мл) додавали оксид платини (350мг), і реакційну суміш перемішували в атмосфері водню протягом 16год. Суміш фільтрували через целіт, і целіт промивали метанолом і дихлорметаном. Фільтрат концентрували з отриманням N-(3-амінопропіл)-N-(трет-бутоксикарбоніл)-D-аланінату у вигляді масляного залишку. Стадія С: трет-бутил-(2R)-гексагідро-2-метил-3-оксо-1Н-1,4-діазепін-1-карбоксилат До 2М розчину триметилалюмінію в дихлорметані (30мл) повільно додавали розчин метил-N-(3амінопропіл)-N-(трет-бутоксикарбоніл)-D-аланінату (11,5г) в дихлорметані. Реакційну суміш перемішували при кімнатній температурі протягом чотирьох днів і потім виливали в колбу, що містить 30г целіту. С уміш перемішували і гасили повільним доданням ~10мл насиченого водного розчину хлориду амонію. Додавали сульфат натрію (20г) і метанол (50мл). Суміш перемішували протягом 1 год., потім фільтрували. Тверду речовину промивали 5% сумішшю метанол/дихлорметан. Фільтрат концентрували. Залишок очищали флешхроматографією (силікагель, елююванням послідовно з 4, 6, 7 і 12% сумішшю 10:1 метанол/водний розчин концентрованого гідроксиду амонію в дихлорметані) з отриманням вказаної в заголовку сполуки, що містить менше 3% (3S)-ізомеру. LC/MS 228.9 (М+1). Стадія D: (3R)-гексагідро-3-метил-2Н-1,4-діазепін-2-ону гідрохлорид Трет-бутил-(2R)-гексагідро-2-метил-3-оксо-1H-1,4-діазепін-1-карбоксилат, отриманий на попередній стадії, розчиняли в 4М соляної кислоти в діоксані і через 2,5 год. упарювали з отриманням гідрохлоридної солі бажаної сполуки. Стадія Е: (3R)-4-[(3R)-3-[(трет-бутоксикарбоніл)аміно]-4-(2,4,5-трифторфеніл) бутаноїл]гексагідро-3-метил2Н-1,4-діазепін-2-он До розчину N-метилморфоліну (0,38мл) і (3R)-3-[(трет-бутоксикарбоніл)аміно]-4-(2,4,5трифторфеніл)бутанової кислоти (1,0г) в 20мл дихлорметану при -20°С додавали ізобутилхлор форміат (0,39мл). Отриману в результаті суміш перемішували протягом 1год. Додавали (3R)-гексагідро-3-метил-2Н-1,4діазепін-2-ону гідрохлорид (500мг) і N-метилморфолін (0,40мл) в дихлорметані (5мл) і DMF (8мл). С уміш перемішували протягом 28год., спочатку при -20°С і потім поступово нагрівали до температури навколишнього середовища. Реакційну суміш гасили доданням насиченого розчину хлориду амонію і екстрагували послідовно дихлорметаном і етилацетатом. Об'єднаний органічний шар промивали послідовно водою і сольовим розчином, сушили над сульфатом натрію і концентрували. Залишок очищали хроматографією (силікагель, від 3 до 7% 10:1 метанол/концентрований гідроксид амонію в дихлорметані) з отриманням подвійного продукту. Він був додатково очищений шляхом розчинення продукту в суміші етанол (7,5мл) і гексан (16мл) при 50°С. Розчин залишали остигати до кімнатної температури на всю ніч і потім вміщували в холодильник на 3год. Тверду речовину охолоджували і промивали сумішшю 5% етанол/гексан з отриманням вказаної в заголовку сполуки. Стадія F: (3R)-4-[(3R)-3-Аміно-4-(2,4,5-трифторфеніл)бутаноїл]гексагідро-3-метил-2Н-1,4-діазепін-2-ону гідрохлорид (3R)-4-[(3R)-3-[(Бутоксикарбоніл)аміно]-4-(2,4,5-трифторфеніл)бутаноїл] гексагідро-3-метил-2Н-1,4діазепін-2-он зі стадії Ε обробляли 4н соляною кислотою в діоксані, перемішували протягом 2,5год. і упарювали з отриманням вказаної в заголовку сполуки. LC/MS 344,1 (М+1). 4[(3R)-3-Аміно-4-(2,5-дифторфеніл)бутаноїл]гексагідро-1-метил-2Н-1,4-діазепін-2-ону гідрохлорид Стадія А: Метил-N-(3-амінопропіл)-N-(трет-бутоксикарбоніл)гліцинат Вказану в заголовку сполуку отримували з гідрохлориду гліцин метилового ефіру відповідно до способів, описаних у ви щезазначеному прикладі 1, стадія А-В. LC/MS 241,0 (М+1). Стадія В: Бутилгексагідро-3-оксо-Н-1,4-діазепін-1-карбоксилат До розчину метил-N-(3-амінопропіл)-N-(трет-бутоксикарбоніл)гліцинату (10,2г) в тетрагідрофурані (ТНР)/метанол (2/1, 300мл) додавали 1М водний розчин гідроксиду літію (60мл). Отриману суміш перемішували при кімнатній температурі протягом ночі. Додавали додаткові 20мл 1М водного розчину гідроксиду літію і суміш перемішували протягом 6год. Розчинник відганяли при зниженому тиску, і залишок розчиняли в 50мл метанолу і 200мл толуолу і концентрували у вакуумі. До залишку в дихлорметані (300мл) додавали 1-етил-3-(3-диметиламінопропіл)карбодіімід (EDC, 9,6г) і 1-гідроксибензотриазол (НОВТ, 6,8г). Суміш перемішували при кімнатній температурі протягом трьох днів, потім обробляли насиченим водним розчином хлориду амонію і екстрагували трьома частинами етилацетату. Об'єднані органічні фази промивали сольовим розчином, сушили над сульфатом натрію і концентрували. Залишок очищали хроматографією (силікагель, від 4 до 5% метанол/водний розчин гідроксиду амонію (10:1) в дихлорметані) з отриманням вказаної в заголовку сполуки. LS/MS 215,0 (М+1). Стадія С: трет-бутилгексагідро-4-метил-3-оксо-1Н-1,4-діазепін-1-карбоксилат Гідрид натрію (103мг) додавали до суміші трет-бутилгексагідро-3-оксо-1Н-1,4-діазепін-1-карбоксилату, що перемішується в DMF (5мл) при 0°С. Через 1год. додавали йодметан (0,15мл) і отриману в результаті суміш перемішували при 0°С, потім всієї ночі при кімнатній температурі. Розбавляли насиченим водним розчином хлориду амонію і екстрагували етилацетатом. Органічний шар відділяли, промивали послідовно насиченим водним розчином бікарбонату натрію і сольовим розчином, сушили над сульфатом натрію і концентрували з отриманням продукту, який використовували без додаткового очищення. Стадія D: Гексагідро-1-метил-2Н-1,4-діазепін-2-ону гідрохлорид Трет-бутилгексагідро-4-метил-3-оксо-1Н-1,4-діазепін-1-карбоксилат, отриманий в прикладі 2, Стадія С, розчиняли в 4М соляної кислоти в діоксані і через 2,5год. упарювали з отриманням вказаної в заголовку сполуки. Стадія Е: 4-[(3R)-3-[(трет-бутоксикарбоніл)аміно]-4-2,5-дифторфеніл)бутаноїл] гексагідро-1-метил-2Н-1,4діазепін-2-он До перемішуваного розчину (3R)-3-[(трет-бутоксикарбоніл)аміно]-4-(2,5-дифторфеніл)бутанової кислоти (40мг), EDC (29мг), і НОВТ (21мг) в дихлорметані додавали триетиламін (0,042мл) і гексагідро-1-метил-2Н-1,4діазепін-2-ону гідрохлорид (33мг). Отриману в результаті суміш перемішували при температурі навколишнього середовища протягом ночі і потім концентрували. Залишок очищали препаративною ТШХ (силікагель, 8% 10:1 метанол/концентрований гідроксид амонію в дихлорметані) з отриманням вказаної в заголовку сполуки. Стадія D: 4-[(3R)-3-Аміно-4-(2,5-дифторфеніл)бутаноїл]гексагідро-1-метил-2Н-1,4-діазепін-2-он (3R)-4-[(3R)-3-[(Бутоксикарбоніл)аміно]-4-(2,5-трифторфеніл)бутаноїл] гексагідро-3-метил-2Н-1,4-діазепін2-он з стадії Ε обробляли 4н соляною кислотою в діоксані, перемішували протягом 4год. і упарювали з отриманням вказаної в заголовку сполуки. LC/MS 326,0 (М+1). (3R)-4-[(3R)-3-Аміно-4-(2,4,5-трифторфеніл)бутаноїл]-3-бензилгексагідро-1-метил-2Н-1,4-діазепін-2-ону гідрохлорид Стадія А: трет-бутил-2-бензилгексагідро-4-метил-3-оксо-1Н-1,4-діазепін-1-карбоксилат До перемішуваного розчину трет-бутилгексагідро-4-метил-3-оксо-1Н-1,4-діазепін-1-карбоксилату, приготованого як описано в прикладі 2, стадія С (180мг), в THF (8мл) при -78°С додавали розчин діізопропіламід літію (LDA) (1,5Μ в циклогексані, 0,53мл). Після перемішування суміші протягом 40хв., додавали бензил бромід (0,28мл). Отриману в результаті суміш продовжували перемішувати при -78°С протягом 6 год. Потім реакційну суміш розбавляли насиченим водним розчином хлориду амонію і екстрагували етилацетатом. Органічний шар промивали послідовно насиченим водним розчином бікарбонату натрію і сольовим розчином, сушили над безводним сульфатом натрію і концентрували. Залишок очищали хроматографією (силікагель, 2% метанол/дихлометан) з отриманням вказаної в заголовку сполуки. Стадія В: 3-Бензилгексагідро-1-метил-2Н-1,4-діазепін-2-ону гідрохлорид Трет-бутил-2-бензилгексагідро-4-метил-3-оксо-1Н-1,4-діазепін-1-карбоксилат, отриманий на стадії А, розчиняли в 4М соляної кислоти в діоксані і через 2,5год. упарювали з отриманням гідрохлоридної солі бажаної сполуки. Стадія С: (3R)-4-[(3R)-3-[(Бутоксикарбоніл)аміно]-4-(2,4,5-трифторфеніл) бутаноїл]-3-бензилгексагідро-1метил-2Н-1,4-діазепін-2-он N-метилморфолін (0,048мл) і ізобутилхлор форміат (0,026мл) додавали до перемішуваного розчину (3R)-3[(трет-бутоксикарбоніл)аміно]-4-(2,4,5-трифторфеніл)бутанової кислоти (67мг) в THF (1мл) при -20°С, і отриману в результаті суміш перемішували протягом 1 год. Додавали 3-бензилгексагідро-1-метил-2Н-1,4діазепін-2-ону гідрохлорид, отриманий на стадії В вище (48мг), і Ν-метилмморфолін (0,024мл) в DMF (1мл). Суміш перемішували протягом 30хв. при -20°С і протягом 36год. при температурі навколишнього середовища і потім упарювали. Залишок обробляли насиченим водним розчином хлориду амонію, екстрагували етилацетатом і органічний екстракт упарювали. Отриманий продукт очищали препаративною ТШХ (силікагель, метанол/концентрований гідроксид амонію/дихлорметан 4,4:0,1:95,5) з отриманням подвійного продукту у вигляді суміші діастереомерів. Ізомери розділяли ВЕРХ (ChiralPAK AD, 14% етанол/гексан) і збирали той, що швидше елююється (R,S)-ізомер і той, що повільніше елююється (R, Я)-ізомер. Стадія D: Гідрохлорид (3R)-4-[(3R)-3-Аміно-4-(2,4,5-трифторфеніл)бутаноїл]-3-бензилгексагідро-1-метил2Н-1,4-діазепін-2-ону Вказану в заголовку сполуку зі стадії С розчиняли в 4М соляної кислоти в діоксані і через 2,5 год. упарювали з отриманням бажаного продукту. LC/MS434,1(M+1). (R)-4-[(3R)-3-Аміно-4-(2,4,5-трифторфеніл)бутаноїл]гексагідро-3-[4-(трифторметокси)бензил]-2Н-1,4діазепін-2-он Стадія А: трет-бутил-4-[(бензилокси)метил]гексагідро-3-оксо- 1Н-1,4-діазепін-1-карбоксилат Вказану в заголовку сполуку отримували з трет-бутилгексагідро-3-оксо-1H-1,4-діазепін-1-карбоксилату (приклад 2, стадія В) бензилхлорметилового ефіру, по суті відповідно до способу, описаному в прикладі 2, стадія С. Стадія В: трет-бутил-4-[(бензилокси)метил]гексагідро-3-оксо-2-[4-(трифторметокси)бензил]-1Н-1,4 діазепін-1-карбоксилат Вказану в заголовку сполуку отримували з трет-бутил-4-[(бензилокси)метил]гексагідро-3-оксо-1Н-1,4діазепін-1-карбоксилату і 4-(трифторметокси)бензилброміду, по суті відповідно до способу, описаному в прикладі 3, стадія 1. Стадія С: Бутилгексагідро-3-оксо-2-[4-(трифторметокси)бензил]-1Н-1,4-діазепін-1-карбоксилат До розчину трет-бутил-4-[(бензилокси)метил]гексагідро-3-оксо-2-[4-(трифторметокси)бензил]-1H-1,4діазепін-1-карбоксилату (520мг) в етанолі (17мл) додавали 10% паладій на вугіллі (300мг). Реакційну суміш перемішували протягом 22год. в атмосфері водню. Додавали декілька крапель води і продовжували перемішування протягом додаткових 20год. Суміш фільтрували через целіт, і целіт промивали етилацетатом. Фільтрат упарювали при зниженому тиску. Залишок очищали флеш-хроматографією на пристрої Biotage® (силікагель; метанол/концентрований водний розчин гідроксиду амонію/дихлорметан 1,5:0,1:98,4). Отриманий продукт розчиняли в толуолі і кип'ятили із зворотним холодильником протягом 3год. Упарювання у вакуумі дало вказану в заголовку сполуку, яку використали на наступних стадіях без додаткового очищення. Стадія D: Гідрохлорид гексагідро-3-[4-(трифторметокси)бензил]-2Н-1,4-діазепін-2-ону Трет-бутилгексагідро-3-оксо-2-[4-(трифторметокси)бензил]-1Н-1,4-діазепін-1-карбоксилат розчиняли в 4М соляної кислоті в діоксані і через 2,5год. упарювали з отриманням бажаного продукту. Стадія Е: (3R)-4-[(3R)-3-[(Бутоксикарбоніл)аміно]-4-(2,4,5-трифторфеніл) бутаноїл]гексагідро-3-[4трифторметокси)бензил]-2Н-1,4-діазепін-2-он N-метилморфолін (0,072мл) і ізобутилхлор форміат (0,039мл) додавали до пеермішуваного розчину (3R)-3[(трет-бутоксикарбоніл)аміно]-4-(2,4,5-трифторфеніл)бутанової кислоти (95мг) в дихлорметані (5мл) при -20°С і отриману в результаті суміш перемішували протягом 30хв. Додавали гексагідро-3-[4(трифторметокси)бензил]-2Н-1,4-діазепін-2-ону гідрохлорид, отриманий на стадії D, (91мг) і N-метилморфолін (0,036мл). Реакційну суміш перемішували протягом 30хв. при -20°С і 2год. при температурі навколишнього середовища і потім упарювали. Залишок очищали препаративною ТШХ (силікагель, метанол/насичений водний розчин гідроксиду амонію/дихлорметан 4,4:0,1:95,5), і ізомери послідовно розділяли ВЕРХ (ChiralPAK OD, 7% етанол/гексан) з отриманням більше повільно елюйованого (R,R)-ізомеру. Стадія F: Гідрохлорид (3R)-4-[(3R)-3-Аміно-4-(2,4,5-трифторфеніл)бутаноїл] гексагідро-3-[4(трифторметокси)бензил]-2Н-1,4-діазепін-2-ону (3R)-4-[(3R)-3-[(трет-бутоксикарбоніл)аміно]-4-(2,4,5-трифторфеніл)бутаноїл] гексагідро-3-[4(трифторметокси)бензил]-2Н-1,4-діазепін-2-он розчиняли в 4М соляної кислоти в діоксані і через 2,5год. упарювали з отриманням бажаного продукту. LC/MS 504,2 (М+1). (3R)-4-[(3R)-3-Аміно-4-(2,4,5-трифторфеніл)бутаноїл]-1-трет-бутилгексагідро-3-метил-2Н-1,4-діазепін-2-ону гідрохлорид Стадія А: N-(трет-Бутил)-N-(2-ціаноетил)-2-оксопропанамід Розчин бензотриазолу (2,4г, 20мМ) і тіонілхлориду (1,5мл) в дихлорметані (10мл) додавали по краплях до розчину піровиноградної кислоти, що перемішується в дихлорметані (10мл), і суміш перемішували протягом 10хв. Утворений залишок фільтрували і промивали дихлорметаном. Фільтрат обробляли сульфатом магнію, фільтрували і фільтрат перемішували протягом ночі з розчином 3-(трет-бутиламіно)пропіонітрилу, розчиненим в дихлорметані (10мл). Реакційну суміш обробляли насиченим водним розчином хлориду амонію і екстрагували етилацетатом. Органічний шар сушили над безводним сульфатом магнію, фільтрували, упарювали і очищали за допомогою Biotage® флеш-хроматографією (силікагель, етилацетат/гексан 1:1) з отриманням бажаного продукту у ви гляді олії. 1 Н ЯМР (400 МГц, CDCI3) δ 1,49 (с, 9Н), 2,45 (с, 3Н), 2,74 (т, J=7,4Гц, 2Н), 3,6 (ушир., 2Н). Стадія В: 1- трет-бутилгексагідро-3-метил-2Н-1,4-діазепін-2-он N-(трет-бутил)-N-(2-ціаноетил)-2-оксопропанамід, отриманий на стадії А, (440мг) і оксид платини (60мг) суспендували в етанолі (40мл), що містить хлороформ (0,3мл), і перемішували в шейкері Parr в атмосфері водню при 40фунт/дюйм 2 протягом 16год. Суміш фільтрували, каталізатор промивали сумішшю метанол/дихлорметан (10:90) і об'єднаний фільтрат упарювали і очищали за допомогою Biotage® флешхроматографії (силікагель, 5-10% метанол/дихлорметан) з отриманням бажаного продукту. 1 Н ЯМР (400МГц, CDCI3) δ 1,23 (д, J=6,6, 3Н), 1,43 (с, 9Н), 1,5 (м, 1H), 1,7 (м, 1Н), 2,9 (м, 1H), 3,2 (м, 1H),3,4 (м, 1Н.), 3,6 (м, 2Н). LC/MS 185,2 (М+1). Стадія С: (3R)-4-[(3R)-3-Аміно-4-(2,4,5-трифторфеніл)бутаноїл]-1-трет-бутил-гексагідро-3-метил-2Н-1,4діазепін-2-он Вказану в заголовку сполуку отримували з (3R)-3-[(Tpeт-бутоксикарбоніл)аміно]-4-(2,4,5трифторфеніл)бутанової кислоти і 1-трет-бутилгексагідро-3-метил-2Н-1,4-діазепін-2-ону способом, описаним в прикладі 3, стадії С і D. LC/MS 400,1 (М+1). 4-[(3R)-3-Аміно-4-(2,4,5-трифторфеніл)бутаноїл]гексагідро-5-метил-2Н-1,4-діазепін-2-ону гідрохлорид Стадія А: Гексагідро-5-метил-2Н-1,4-діазепін-2-он Вказану в заголовку сполук у отримували з кротононітрилу, по суті відповідно до процедур, описаних в прикладі 2, стадії А і В. Стадія В: 4-[(3R)-3-Аміно-4-(2,4,5-трифторфеніл)бутаноїл] гексагідро-5-метил-2Н-1,4-діазепін-2-он Вказану в заголовку сполуку отримували з (3R)-3-[(трет-бутоксикарбоніл)аміно]-4-(2,4,5трифторфеніл)бутанової кислоти гексагідро-5-метил-2Н-1,4-діазепін-2-ону способом, описаним в прикладі 3, стадії С і D. LC/MS 344,1 (М+1). (3R)-4[(3R)-3-Аміно-4(2,4,5-трифторфеніл)бутаноїл]гексагідро-3(1-оксидопіридин-2-іл)[метил]-2Н-1,4діазепін-2-он, сіль трифтороцтової кислоти Стадія А: (3R)-4-[(3R)-3-[(Бутоксикарбоніл)аміно]-4-(2,4,5-трифторфеніл) бутаноїл]гексагідро-3-[(1оксидопіридин-2-іл)метил]-2Н-1,4-діазепін-2-он Вказану в заголовку сполуку отримували, по суті відповідно до процедур, описаних в прикладі 4, стадії від А до Е. Стадія В: (3R)-4-[(3R)-3-Аміно-4-(2,4,5-трифторфеніл)бутаноїл]гексагідро-3-[(1-оксидопіридин-2-іл)метил]2Н-1,4-діазепін-2-он, сіль трифтороцтової кислоти До розчину (3R)-4-[(3R)-3-[(трет-бутоксикарбоніл)аміно]-4-(2,4,5-трифторфеніл) бутаноїл]гексагідро-3-[(1оксидопіридин-2-іл)метил]-2Н-1,4-діазепін-2-ону (20мг, 0,038мМ) в дихлорметані (2,5мл) при 0°С додавали МСРВА (28мг, 0,096мМ) і реакційну суміш перемішували всієї ночі при температурі навколишнього середовища. Розчин обробляли насиченим водним розчином бікарбонату натрію і екстрагували дихлорметаном. Органічну фазу відділяли, сушили над безводним сульфатом натрію, фільтрували і упарювали. Залишок очищали препаративною ТШХ (силікагель, 11:89 10% амоній в метанолі/дихлорметан) з отриманням N-BOC захищеного N-оксиду піридину. Зняття захисту сумішшю три фтороцтова кислотадихлорметан (1:1) при температурі навколишнього середовища протягом 1 год. з подальшою концентрацією давало бажаний продукт. MS 437,2 (М+1). (3R)-4-[(3R)-3-Аміно-4-(2,4,5-трифторфеніл)бутаноїл]гексагідро-3-[(1-оксидопіридин-3-іл)метил]-2Н-1,4діазепін-2-он, сіль трифтороцтової кислоти Вказану в заголовку сполуку о тримували, по суті відповідно до процедур, описаних в прикладі 7. MS 437,2 (М+1). (3R)-4-[(3R)-3-Аміно-4-(2,4,5-трифторфеніл)бутаноїл]гексагідро-3-(1Н-піразол-1-ілметил)-2Н-1,4-діазепін-2он, сіль трифтороцтової кислоти Стадія А: трет-бутил-4-[(бензилокси)метил]гексагідро-3-оксо-1Н-1,4-діазепін-1-карбоксилат Вказану в заголовку сполуку отримували з трет-бутилгексагідро-3-оксо-3H-1,4-діазепін-1-карбоксилату (приклад 2, стадія В) і бензилхлорметилового ефіру, по суті відповідно до способу, описаному в прикладі 2, стадія С. Стадія В: трет-бутил-4-[(бензилокси)метил]гексагідро-2-метилен-3-оксо-1,4-діазепін-1-карбоксилат Вказану в заголовку сполуку отримували з трет-бутил-4-[(бензилокси)метил]гексагідро-3-оксо-1Н-1,4діазепін-1-карбоксилату і бензилхлорметилового ефіру, по суті відповідно до способу, описаному в прикладі 3, стадія 1. Стадія С: трет-бутил-4-[(бензилокси)метил]гексагідро-2-(1H-піразол-1-ілметил)-3-оксо-1,4-діазепін-1карбоксилат До розчину піразолу (258мг, 3,78мМ) в 10мл DMF при 0°С додавали гідрид натрію (60%, 91мг). Отриману в результаті суміш перемішували протягом 30хв. і потім додавали продукт зі стадії В (655,4, 1,89мМ). Реакційну суміш перемішували при температурі навколишнього середовища протягом ночі і гасили доданням води. Водну суміш екстрагували трьома частинами етилацетату. Об'єднані органічні фази концентрували. Очищення флеш-хроматографією на приладі Biotage® (силікагель, градієнт 40-80% етилацетат/гексан) давало вказану в заголовку сполук у. Стадія D: 3-(Н-Піразол-1-ілметил)-1,4-діазепін-2-он Продукт зі стадії С3 обробляли трифтороцтовою кислотою. Реакційну суміш перемішували при температурі навколишнього середовища протягом ночі і потім концентрували. Залишок розчиняли в толуолі і кип'ятили із зворотним холодильником протягом 3год. Очищення флеш-хроматографією на приладі Biotage® (силікагель, 5-15% суміші 10:1 метанол/хлорид амонію в дихлорметані) давало вказану в заголовку сполуку. Стадія Е: (3R)-4-[(3R)-3-Аміно-4-(2,4,5-трифторфеніл)бутаноїл]гексагідро-3-(1Н-піразол-1-ілметил)-2Н-1,4діазепш-2-он, сіль трифтороцтової кислоти Вказану в заголовку сполуку отримували з продукту зі стадії D і (3R)-3-[(трет-бутоксикарбоніл)аміно]-4(2,4,5-трифторфеніл)бутанової кислоти, по суті відповідно до способу, описаному в прикладі 4, стадія Е. Очистка препаративною ТШХ (силікагель, 1:9 етанол/дихлорметан) давала N-BOC продукт у ви гляді суміші діастереомерів. ВЕРХ (колонка Chiralcell OJ, 7% етанол/гексан) давала окремі діастереомери. Зняття захисту сумішшю 1:1 трифтороцтова кислота/дихлорметан протягом 1 год. при температурі навколишнього середовища з подальшою концентрацією давала окремі діастереомери вказаної в заголовку сполуки. MS 410,2 (М+1). По суті, відповідно до способів, описаних в прикладах 1-9, отримували сполуки таблиці 2. Приклад фармацевтичного препарату Як конкретний варіант втілень фармацевтичної композиції для перорального застосування, готували таблетку із вмістом діючої речовини 100мг з 100мг будь-якої сполуки згідно з даним винаходом, 268мг мікрокристалічної целюлози, 20мг натрійкроскармелози і 4мг стеарату магнію. Діючу речовину, мікрокристалічну целюлозу і кроскармелозу змішували першими. Потім в суміш вводили змащувальний агент у вигляді стеарату магнію і пресували в таблетку. Хоча даний винахід описаний і проілюстрований з посиланнями на основні конкретні варіанти його здійснення, фахівці в даній галузі те хніки визнають, що різні доробки, зміни, модифікації, заміщення, скорочення або доповнення процедур і протоколів можуть бути зроблені без відступу від суті і об'єму згідно з даним винаходом. Наприклад, можуть бути придатними ефективні дози, відмінні від конкретних доз, приведених раніше в даному описі, як наслідок відмінностей реактивності ссавця, який знаходиться на лікуванні з будь-яким з вказаних симптомів сполуками згідно з даним винаходом, вказаними вище. Певні фармакологічні відповіді, що спостерігаються, можуть відрізнятися згідно і в залежності від конкретних вибраних активних сполук, або присутність фармакологічних носіїв, а також від типу складу і режиму введення, що використовується, і такі очікувані варіації або відмінності в результатах передбачаються такими, що відповідають задачам і видам практичного застосування згідно з даним винаходом. Отже, мається на увазі, що даний винахід визначений об'ємом нижченаведеної формули винаходу, і що вказана формула винаходу повинна бути інтерпретована максимально широко.
ДивитисяДодаткова інформація
Назва патенту англійськоюDipeptidylpeptidase-iv inhibitors for treatment or prevention of diseases
Назва патенту російськоюИнгибиторы бета-аминогетероциклической дипептидилпептидазы для лечения или предупреждения заболеваний
Автори російськоюBiftu, Tesfaye
МПК / Мітки
МПК: C07D 243/08, A61P 3/10, C07D 401/06, C07D 403/06
Мітки: дипептидилпептидази, попередження, бета-аміногетероциклічної, захворювань, лікування, інгібітори
Код посилання
<a href="https://ua.patents.su/26-78612-ingibitori-beta-aminogeterociklichno-dipeptidilpeptidazi-dlya-likuvannya-abo-poperedzhennya-zakhvoryuvan.html" target="_blank" rel="follow" title="База патентів України">Інгібітори бета-аміногетероциклічної дипептидилпептидази для лікування або попередження захворювань</a>
Попередній патент: Грунтовий теплообмінник
Наступний патент: Спосіб одержання 3-(метилтіо)пропаналю та спосіб одержання 2-гідрокси-4-(метилтіо)бутаннітрилу
Випадковий патент: Спосіб передпосівної підготовки насіння стоколосу безостого (bromus inermis)












