Антагоністи мускаринових рецепторів ацетилхоліну
Номер патенту: 95768
Опубліковано: 12.09.2011
Автори: Паловіч Майкл Р., Макклеланд Брент, Лен Драман, Томас Соня М., Неіпп Крістофер
Формула / Реферат
1. 4-[Гідрокси(дифеніл)метил]-1-{2-[(фенілметил)оксі]етил}-1-азоніабіцикло[2.2.2]-октану бромід формули:
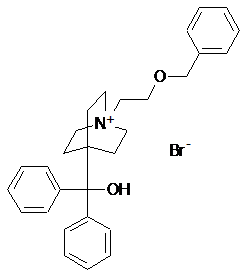 .
.
2. Фармацевтична композиція, що містить 4-[гідрокси(дифеніл)метил]-1-{2-[(фенілметил)оксі]етил}-1-азоніабіцикло[2.2.2]октану бромід та фармацевтично прийнятний носій.
3. Фармацевтична композиція за п. 2, яка додатково містить один або більше інших терапевтичних інгредієнтів.
4. Застосування сполуки за п. 1 для приготування лікарського засобу для лікування захворювань, опосередкованих мускариновими рецепторами ацетилхоліну, де ацетилхолін зв‘язується із зазначеним рецептором.
5. Застосування за п. 4, де захворювання в людини, що потребує лікування, вибране з групи, яка складається з хронічного обструктивного легеневого захворювання, хронічного бронхіту, астми, хронічної респіраторної обструкції, пневмосклерозу, емфіземи легенів або алергічного риніту.
6. Застосування за п. 4, де лікарський засіб вводять шляхом інгаляції через рот або ніс.
7. Застосування за п. 6, де введення здійснюють за допомогою пристрою подання лікарського засобу, вибраного з групи, що включає інгалятор сухого порошку з резервуаром, багатодозовий інгалятор сухого порошку та інгалятор відміряної дози.
Текст
1. 4-[Гідрокси(дифеніл)метил]-1-{2[(фенілметил)оксі]етил}-1-азоніабіцикло[2.2.2]октану бромід формули: C2 2 95768 1 (19) UA OH . Винахід відноситься до нових похідних хінуклідинів, фармацевтичних композицій та їх застосування при лікуванні захворювань дихальних шля хів, опосередкованих мускариновими рецепторами ацетилхоліну. 3 95768 4 Ацетилхолін, вивільнюваний з холінергічних Дисфункцію мускаринових рецепторів ацетилнейронів у периферійній і центральній нервових холіну в легенях було відзначено при безлічі різсистемах, впливає на багато різних біологічних них патофізіологічних станів. Зокрема, при астмі процесів шляхом взаємодії з двома основними та хронічному обструктивному легеневому захвокласами рецепторів ацетилхоліну - нікотиновими рюванні (COPD) запальні стани призводять до та мускариновими рецепторами ацетилхоліну. втрати інгібіторної функції М2 мускаринових аутоМускаринові рецептори ацетилхоліну (mAChRs) рецепторів ацетилхоліну на парасимпатичних нервідносяться до суперсімейства рецепторів, сполувах, які постачають легеневу гладку мускулатуру, чених з білком G, які мають 7 трансмембранних викликаючи збільшене вивільнення ацетилхоліну доменів. Існує 5 підтипів mAChRs, які мають назву після стимуляції блукаючих нервів (Fryer et al. М1-М5, і кожний з них являє собою продукт певного 1999 Life Sci 64 (6-7) 449-55). Ця дисфункція гену. Кожний з цих п'яти підтипів виявляє унікальні mAChRs призводить до гіперреактивності дихальфармакологічні властивості. Мускаринові рецептоних шляхів, опосередкованої збільшеної стимуляри ацетилхоліну широко поширені в органах хреції М3 mAChRs. Таким чином, ідентифікація сильбетних, де вони опосередковують багато із життєнодіючих антагоністів mAChRs була би корисною з во важливих функцій. Мускаринові рецептори урахуванням можливості їх застосування як лікарможуть опосередковувати і інгібувальну, і збуджуських засобів при цих патологічних станах, опосевальну дію. Наприклад, у гладкій мускулатурі, яку редкованих mAChRs. виявляють у дихальних шляхах, М3 mAChRs опоCOPD являє собою неточний термін, який середковують скорочувальні реакції (огляд подаохоплює різноманітні прогресуючі медичні проний у публікації Caufield (1993 Pharmac. Ther. блеми, включаючи хронічний бронхіт, хронічний 58:319-79). бронхіоліт та емфізему, і воно є основною причиУ легенях локалізацію mAChRs було визначеною смертності та захворюваності у світі. Куріння но в гладких м'язах у трахеї та бронхах, підслизоявляє собою основний фактор ризику розвитку вих залозах і парасимпатичних гангліях. Щільність COPD; тільки в США сигарети курять близько 50 мускаринових рецепторів є найвищою у парасиммлн людей, і, за оцінками, щоденно 3000 людей патичних гангліях і потім їх щільність зменшується здобувають цю звичку. В результаті, очікується, від підслизових залоз до гладкої мускулатури тращо до 2020 p. COPD стане однією з п'яти головних хеї та бронхів. Мускаринові рецептори майже відпроблем охорони здоров'я в усьому світі. Інгалясутні в альвеолах (Огляд експресії та функції ційну анти-холінергічну терапію у цей час вважаmAChRs у легенях поданий у публікації Fryer and ють «золотим стандартом» як терапію першої лінії Jacoby (1998 Am J Respir Crit Care Med 158(5, pt3) з приводу COPD (Pauwels et al. 2001 Am. J. S 154-60). Reespir. Crit. Care Med. 163:1256-1276). З підтипи mAChRs було ідентифіковано як ваНезважаючи на велику кількість доказів на піджливі у легенях, М1, М2 і М3 mAChRs. М3 mAChRs, тримку застосування анти-холінергічної терапії для що локалізуються на гладких м'язах дихальних лікування захворювань, пов'язаних з гіперреактившляхів, опосередковують м'язове скорочення. ністю дихальних шляхів, є порівняно небагато анСтимуляція М3 mAChRs активує фермент фосфати-холінергічних сполук для застосування в клініці тазу С через зв'язування стимулюючого білка G з приводу легеневих показань. Більш конкретно, у Gq/11 (Gs), призводячи до вивільнення фосфатиСША іпратропій бромід (Atrovent© і Combivent© у дил інозитол-4,5-бісфосфату, призводячи до фоскомбінації з албутеролом) являє собою єдиний форилювання скорочувальних білків. М3 mAChRs наявний у продажу інгаляційний антитакож виявляють на легеневих підслизових залохолінергічний препарат для лікування захворюзах. Стимуляція цієї популяції М3 mAChRs призвовань, пов'язаних із гіперреактивністю дихальних дить до секреції слизу. шляхів. Хоча ця сполука являє собою сильнодіюМ2 mAChRs складають приблизно 50-80% почий анти-мускариновий засіб, він характеризується пуляції холінергічних рецепторів на гладких м'язах короткою дією і, таким чином, його необхідно вводихальних шляхів. Хоча їх точна функція ще невідити до чотирьох разів на добу для забезпечення дома, вони інгібують катехоламінергічне розслабполегшення у пацієнта з COPD. У Європі та Азії лення м'язів дихальних шляхів через інгібування нещодавно був допущений до застосування антигенерування цАМФ. Нейронні М2 mAChRs локаліхолінергічний препарат тривалої дії тіотропій брозуються на постгангліонарних парасимпатичних мід (Spiriva©), однак у США цей продукт у цей час нервах. У нормальних фізіологічних умовах нейє недоступним. Таким чином, лишається необхідронові М2 mAChRs забезпечують жорсткий контність у нових сполуках, які здатні викликати блокароль вивільнення ацетилхоліну з парасимпатичних ду mAChRs, мають тривалу дію і можуть вводинервів. Інгібіторні М2 mAChRs були також продетись 1 раз на день, для лікування захворювань, монстровані на симпатичних нервах у легенях депов'язаних із гіперреактивністю дихальних шляхів, яких видів. Ці рецептори інгібують вивільнення таких як астма і COPD. норадреналіну, таким чином зменшуючи симпатиОскільки mAChRs широко розповсюджені по чну імпульсацію, що входить у легені. всьому організму, можливість наносити антиМ1 mAChRs виявляють у легеневих парасимхолінергічні засоби локально та/або місцево у дипатичних гангліях, де вони функціонують для похальні шляхи має особливі переваги, оскільки восилення нейропередання. Локалізацію цих рецепни б забезпечили можливість використання більш торів було також встановлено у периферійній низьких доз препарату. Крім того, можливість легеневій паренхімі, однак їхня функція в паренхістворення місцево активних препаратів, які мають мі є невідомою. велику тривалість дії і, зокрема, утримуються або 5 95768 6 у рецептора, або легенями, дозволила б уникнути Rс вибраний з групи, яка складається з водню, небажаних побічних ефектів, які можна спостерігаС1-15 алкілу, С1-15 алкокси, гетероциклічної та ти при системному застосуванні антиС1-15 алкілгетероциклічної частини, причому всі холінергічних засобів. частини можуть бути необов'язково заміщені; Винахід забезпечує спосіб лікування захворюR4 і R5 незалежно вибрані з групи, яка склавань, опосередкованих мускариновими рецептодається з водню, галогену, С1-С4 алкілу, арилу, рами ацетилхоліну (mAChRs), при якому ацетилС1-С4 алкілурилу, ціано, нітро, (CR7R7)pORb, холін зв'язується з mAChRs, і причому спосіб має у (CR7R7)pNRbRb, або R4 і R5 разом можуть утвосвоєму складі введення ефективної кількості спорювати 5-6-членне насичене або ненасичене кільлуки формули (І) або її фармацевтично прийнятної це; і де алкільна, арильна, арилукільна, гетероасолі. рильна, гетероалкільна, гетероциклічна, Цей винахід також відноситься до способу інгігетероциклоалкільна групи можуть бути необов'язбування зв'язування ацетилхоліну з його рецептоково заміщені; рами у ссавця, що його потребує, який маж у своR6 вибраний з групи, яка складається з водню, єму складі введення вказаному ссавцеві С1-4 алкілу; ефективної кількості сполуки формули (І). q = 0 або цілому числу, що має величину від 1 Цей винахід також забезпечує нові сполуки до 15; формули (І) та фармацевтичні композиції, які маn являє собою ціле число, що має величину ють у своєму складі сполуку формули (І) та фарвід 1 до 14; мацевтичний носій або розріджувач. m являє собою ціле число, що має величину Сполуки формули (І), які можна застосовувати від 1 до 15; у цьому винаході, представлені структурою: І являє собою ціле число, що має величину від 1 до 4; t = 0 або цілому числу, що має величину від 1 до 5; (I) p = 0 або цілому числу, що має величину від 1 до 4; Χ, Υ, Ζ і W незалежно вибрані з групи, яка де: складається з водню, С1-4 алкілу; R1 вибраний з групи, яка складається з С1-15 V вибраний з групи, яка складається з СН2, О, алкілу, галоїдзаміщеного С1-15 алкілу, С1-15 алкіS і NRb; лциклоалкілу, циклоалкілу, С2-С15 алкенілу, гідроΜ являє собою О або СН2; кси заміщеного С1-15 алкілу, С1-15 алкілурилу, Rb вибраний з групи, яка складається з водню, С1-15 алкілгетероарилу, (CR7R7)qNRaRa, С1-4 алкілу, арилу та С1-4 алкілурилу; (CR7R7)qNC(O)Ra, (CR7R7)qC(O)NRaRa, R7 вибраний з групи, яка складається з водню, (CR7R7)qC(O)Ra, (CR7R7)qOC(O)Ra, С1-4 алкілу, галоїд заміщеного С1-4 алкілу, і гідро(CR7R7)qNRaC(O)NRaRa, (CR7R7)qORc і ксизаміщеного С1-4 алкілу; (CR7R7)qNS(O)2Ra X являє собою фізіологічно прийнятний аніон, R1 вибраний з групи, яка складається з: такий як хлорид, бромід, йодид, гідроксид, сульфат, нітрат, фосфат, ацетат, трифторацетат, фумарат, цитрат, тартрат, оксалат, сукцинат, манделат, метансульфонат і п-толуолсульфонат. Цей винахід відноситься до нових сполук біарил-8-азоніабіцикло[3.2.1]октану, фармацевтичних композицій, способів їх одержання та їх застосування при лікуванні захворювань, опосередкота ваних mAChR. У кращому варіанті здійснення цього винаходу сполука має наведену нижче формулу (І): R1 вибраний з групи, яка складається з: (I) R2 і R3 незалежно вибрані з групи, яка складається з арилу, С1-4 алкілурилу, гетероарилу, С1-4алкілгетероарилу, гетероциклічної та С1-4 алкілгетероциклічної частини, причому все частини можуть бути необов'язково заміщені; Ra вибраний з групи, яка складається з водню, С1-15 алкілу, С1-15 алкокси, арилу, С1-15 алкілурилу, гетероарилу, С1-15 алкілгетероарилу, гетероциклічної та С1-15 алкілгетероциклічної частини, причому всі частини можуть бути необов'язково заміщені; де: R1 вибраний з групи, яка складається з С1-10 алкілу, галоїдзаміщеного С1-10 алкілу, С1-10 алкілурилу, С1-10 алкілциклоалкілу, циклоалкілу, гідроксизаміщеного С1-10 алкілу, С2-10 алкенілу, (CR7R7)qORe, (CR7R7)q)C(O)Ra і (CR7R7)qNS(O)2Ra; або R1 вибраний з групи, яка складається з: 7 95768 8 Терміни «частини» і «кільця» можуть бути використані з можливістю взаємозаміни у всьому описі. Використаний тут термін «необов'язково заміщений», доки немає конкретного визначення, повинен означати такі групи, як галоген, такий як фтор, хлор, бром або йод; гідрокси; гідроксизаміR2 і R3 незалежно вибрані з групи, яка склащений С1-10алкіл; С1-10алкокси, такі як метокси або дається з: етокси; S(O)mС1-10алкіл, де m' = 0, 1 або 2, такі як тіо, метилсульфініл або метилсульфоніл; аміно і ди-заміщена аміно, такі як група NR10R11; NHC(O)R9; C(O)NR10R11; C(O)OH; S(O)2NR10R11; NHS(O)29, С1-10алкіл, такий як метил, етил, пропіл, ізопропіл або т-бутил; галоїдзаміщений С1-10алкіл, такий як CF3; необов'язково заміщений арил, такий та як феніл, або необов'язково заміщений арилулкіл, такий як бензил або фенетил, необов'язково заміщений гетероциклічний радикал, необов'язково заміщений гетероциклоалкіл, необов'язково заміщений гетероарил, необов'язково заміщений гетеF, G, Η, Κ і L незалежно вибрані з групи, яка роарилулкіл, де ці арильна, гетероарильна або складається з водню, галогену, С1-4 алкілу, галоїгетероциклічна частини можуть бути заміщені 1-2 дзаміщеного С1-4 алкілу, гідроксизаміщеного С1-4 рази галогеном; гідрокси; гідроксизаміщеним алкіалкілу та С1-4 алкокси; лом; С1-10 алкокси; S(O)m'С1-10 алкілом; аміно; моно Ra вибраний з групи, яка складається з водню, і ди-заміщеною алкілуміно, такою як у групі С1-10 алкілу, С1-10 алкокси, арилу та гетероариNR10R11; С1-10 алкіл або галоїдзаміщений С1-10 аллу, причому всі частини можуть бути необов'язкокіл, такий як CF3. Наступні терміни, використані во заміщені; тут, відносяться до: Rс вибраний з групи, яка складається з водню, «галоїд» - всіх галогенів, тобто хлор-, фтор-, С1-5 алкілу, С1-5 алкокси, причому всі частини бром- і йод-; можуть бути необов'язково заміщені; «С1-10 алкіл» або «алкіл» - і до прямих, і до роR4 і R5 незалежно вибрані з групи, яка склазгалужено-ланцюгових частин з 1-10 атомів вугледається з водню, галогену, С1-С4 алкілу, арилу, цю, доки довжина ланцюга інакше не обмежена, С1-С4 алкілурилу, ціано, нітро, (CR7R7)pORb, включаючи, але не обмежуючись, метил, етил, н(CR7R7)pNRbRb, або R4 і R5 разом можуть утвопропіл, ізо-пропіл, н-бутил, втор-бутил, ізо-бутил, рювати 5-6-членне насичене або ненасичене кільтрет-бутил, н-пентил і подібні до них; це; «циклоалкіл» використовують тут для познаq = 0 або цілому числу, що має величину від 1 чення циклічної частини, краще з 3-8 вуглеців, до 5; включаючи, але не обмежуючись, циклопропіл, n являє собою ціле число, що має величину циклопентил, циклогексил і подібні до них; від 1 до 4; «алкеніл» використовують тут в усіх випадках m являє собою ціле число, що має величину для позначення прямої або розгалуженовід 1 до 5; ланцюгової частини з 2-10 атомів вуглецю, доки І = 1 або 2; довжина ланцюга інакше не обмежена, включаюt = 0, 1 або 2; чи, але не обмежуючись, етеніл, 1-пропеніл, 2p = 0, 1 або 2; пропеніл, 2-метил-1-пропеніл, 1-бутеніл-2-бутеніл і V являє собою О або СН2; подібні до них. R6 вибраний з групи, яка складається з водню, «арил» - феніл і нафтил; С1-4 алкілу; «гетероарил» (сам по собі або у будь-якій Μ являє собою О або СН2; комбінації, такій як «гетероарилокси» або «гетероRb вибраний з групи, яка складається з водню, арилалкіл») - 5-10-членна ароматична кільцева С1-4 алкілу та арил С1-4 алкілу; система, в якій одне або більше кілець містять R7 вибраний з групи, яка складається з водню один або більше гетероатомів, вибраних з групи, та С1-4 алкілу; яка складається з Ν, Ο або S, така як пірол, піраX являє собою фізіологічно прийнятний аніон, зол, фуран, тіофен, хінолін, ізохінолін, хіназолініл, такий як хлорид, бромід, йодид, гідроксид, сульпіридин, піримідин, оксазол, тетразол, тіазол, тіафат, нітрат, фосфат, ацетат, трифторацетат, фудіазол, тріазол, імідазол, індол або бензимідазол, марат, цитрат, тартрат, оксалат, сукцинат, мандеале не обмежується ними; лат, метансульфонат і п-толуолсульфонат. «гетероциклічний» (сам по собі або у будь-якій Усі частини, що містять арил, гетероарил і гекомбінації, такій як «гетероциклічний алкіл») - натероциклічні радикали, можуть бути необов'язково сичена або частково ненасичена 4-10-членна кільзаміщені, як визначено тут нижче. цева система, в якій одне або більше кілець місДля використання у цьому описі термін «частять один або більше гетероатомів, вибраних з тини, що містять арил, гетероарил і гетероциклічні групи, яка складається з Ν, Ο або S; така як пірорадикали» відноситься і до кільця, і до алкілу, або, лідин, піперидин, піперазин, морфолін, тетрагідропри включенні, до алкенільних кілець, таких як піран, тіоморфолін або імідазолідин, але не обмеарильні, арилалкільні та арилалкенільні кільця. жується ними. Крім того, сірка може бути 9 95768 10 необов'язково окислена у сульфон або сульфок4-[гідрокси(дифеніл)метил]-1-[3сид; (фенілокси)пропіл]-1«арилалкіл» або «гетероарилалкіл» або «геазоніабіцикло[2.2.2]октанбромід тероциклоалкіл» використовують тут для позна1-(2-{[(4-ціанофеніл)метил]окси}етил)-4чення С1-10 алкілу, як визначено вище, приєднано[гідрокси(дифеніл)метил]-1го до арильної, гетероарильної або азоніабіцикло[2.2.2]октанбромід гетероциклічної частини, як також визначено тут, 1-{3-[(4-бромфеніл)окси]пропіл}-4доки немає інших вказівок; [гідрокси(дифеніл)метил]-1«сульфініл» - оксид S(O) відповідного сульфіазоніабіцикло[2.2.2]октанбромід ду, термін «тіо» відноситься до сульфіду, а термін 4-[біс(4-фторфеніл)(гідрокси)метил]-1-[3«сульфоніл» відноситься до повністю окисленої (фенілокси)пропіл]-1частини S(O)2. азоніабіцикло[2.2.2]октанбромід «де частини R1 (або 2 частини Y) можуть ра1-{3-[(4-фторфеніл)окси]пропіл}-4зом утворювати 5- або 6-членне насичене або не[гідрокси(дифеніл)метил]-1насичене кільце» використовують тут для познаазоніабіцикло[2.2.2]октанбромід чення утворення ароматичної кільцевої системи, 4-[гідрокси(дифеніл)метил]-1-{2-[(1-метил-1такої як нафталін, або являє собою фенільну часфенілетил)окси]етил}-1тину, яка має приєднане 6-членне частково насиазоніабіцикло[2.2.2]октанбромід чене або ненасичене кільце, таке як С6 циклоалке4-[гідрокси(дифеніл)метил]-1-{2-[(2ніл, тобто гексен, або С6 циклоалкенільну частину, нафталенілметил)окси]етил}-1таку як циклопентен. азоніабіцикло[2.2.2]октанбромід Ілюстративні сполуки формули (І) мають у 4-[гідрокси(ди-3-тієніл)метил]-1-[3своєму складі: (фенілокси)пропіл]-11-(2-{[(3-фторфеніл)метил]окси}етил)-4азоніабіцикло[2.2.2]октанбромід [гідрокси(дифеніл)метил]-14-[гідрокси(дифеніл)метил]-1-[2азоніабіцикло[2.2.2]октанбромід (фенілокси)етил]-14-[гідрокси(дифеніл)метил]-1-{2азоніабіцикло[2.2.2]октанбромід [(фенілметил)окси]етил}-14-{гідрокси[біс(3-метилфеніл)]метил}-1-[3азоніабіцикло[2.2.2]октанбромід (фенілокси)пропіл]-11-(2-{[(4-бромфеніл)метил]окси}етил)-4азоніабіцикло[2.2.2]октанбромід [гідрокси(дифеніл)метил]-14-{гідрокси[біс(4-метилфеніл)]метил}-1-{3азоніабіцикло[2.2.2]октанбромід [(фенілокси)пропіл]-11-(2-{[(4-хлорфеніл)метил]окси}етил)-4азоніабіцикло[2.2.2]октанбромід [гідрокси(дифеніл)метил]-14-[гідрокси(дифеніл)метил]-1-(3-{[4азоніабіцикло[2.2.2]октанбромід (метилокси)феніл]окси}пропіл)-14-[біс(4-фторфеніл)(гідрокси)метил]-1-{2азоніабіцикло[2.2.2]октанбромід [(фенілметил)окси]етил}-14-[гідрокси(дифеніл)метил]-1-[3-(2азоніабіцикло[2.2.2]октанбромід нафталенілокси)пропіл]-14-{гідрокси[біс(3-метилфеніл)метил}-1-{2азоніабіцикло[2.2.2]октанбромід [(фенілметил)окси]етил}-14-[гідрокси(дифеніл)метил]-1-[2-({[3азоніабіцикло[2.2.2]октанбромід (метилокси)феніл]метил}окси)етил]-11-(2-{[(4-фторфеніл)метил]окси}етил)-4азоніабіцикло[2.2.2]октанбромід [гідрокси(дифеніл)метил]-14-[гідрокси(дифеніл)метил]-1-(2азоніабіцикло[2.2.2]октанбромід нафталенілметил)-14-[гідрокси(дифеніл)метил]-1-{2азоніабіцикло[2.2.2]октанбромід [(фенілкарбоніл)окси]етил}-14-[біс(3-фторфеніл)(гідрокси)метил]-1-[3азоніабіцикло[2.2.2]октанбромід (фенілокси)пропіл]-11-{3-[(3-фторфеніл)окси]пропіл}-4азоніабіцикло[2.2.2]октанбромід [гідрокси(дифеніл)метил]-14-[гідрокси(ди-2-тієніл)метил]-1-[2азоніабіцикло[2.2.2]октанбромід (фенілокси)етил]-14-{гідрокси[біс(4-метилфеніл)]метил}-1-{2азоніабіцикло[2.2.2]октанбромід [(фенілметил)окси]етил}-14-(гідрокси{біс[3-(метилокси)феніл]}метил)-1азоніабіцикло[2.2.2]октанбромід {2-[(фенілметил)окси]етил}-14-[гідрокси(дифеніл)метил]-1-{3азоніабіцикло[2.2.2]октанбромід [(метилсульфоніл)аміно]пропіл}-14-[гідрокси(дифеніл)метил]-1-{3-[(4азоніабіцикло[2.2.2]октанбромід нітрофеніл)окси]пропіл}-14-[біс(3-фторфеніл)(гідрокси)метил]-1-{2азоніабіцикло[2.2.2]октанбромід [(фенілметил)окси]етил}-11-{3-[(2-фторфеніл)окси]пропіл}-4азоніабіцикло[2.2.2]октанбромід [гідрокси(дифеніл)метил]-11-{3-[(3-хлорфеніл)окси]пропіл}-4азоніабіцикло[2.2.2]октанбромід [гідрокси(дифеніл)метил]-14-[гідрокси(дифеніл)метил]-1-{3-[(3азоніабіцикло[2.2.2]октанбромід нітрофеніл)окси]пропіл}-14-[гідрокси(ди-2-тієніл)метил]-1-[3азоніабіцикло[2.2.2]октанбромід (фенілокси)пропіл]-14-[гідрокси(дифеніл)метил]-1-({3азоніабіцикло[2.2.2]октанбромід [(трифторметил)окси]феніл}метил)-1азоніабіцикло[2.2.2]октанбромід 11 95768 12 4-[гідрокси(дифеніл)метил]-1-[(5-нітро-24-[гідрокси(ди-2-нафталеніл)метил]-1-[3фураніл)метил]-1-азоніабіцикло[2.2.2]октанбромід (фенілокси)пропіл]-14-[гідрокси(дифеніл)метил]-1-[2-(1Н-індол-3азоніабіцикло[2.2.2]октанбромід іл)етил]-1-азоніабіцикло[2.2.2]октанбромід 1-[(4-фторфеніл)метил]-41-[3-(4-біфенілокси)пропіл]-4[гідрокси(дифеніл)метил]-1[гідрокси(дифеніл)метил]-1азоніабіцикло[2.2.2]октанбромід азоніабіцикло[2.2.2]октанбромід 1-[(4-бромфеніл)метил]-44-[гідрокси(дифеніл)метил]-1-{3-[(2[гідрокси(дифеніл)метил]-1метилфеніл)окси]пропіл}-1азоніабіцикло[2.2.2]октанбромід азоніабіцикло[2.2.2]октанбромід 4-[гідрокси(дифеніл)метил]-1-{[34-[гідрокси(дифеніл)метил]-1-(фенілметил)-1(трифторметил)феніл]метил}-1азоніабіцикло[2.2.2]октанбромід азоніабіцикло[2.2.2]октанбромід 4-[гідрокси(дифеніл)метил]-1-(2-{[21-[(2-фторфеніл)метил]-4(метилокси)етил]окси}етил}-1[гідрокси(дифеніл)метил]-1азоніабіцикло[2.2.2]октанбромід азоніабіцикло[2.2.2]октанбромід 4-[гідрокси(дифеніл)метил]-1-{34-[гідрокси(дифеніл)метил]-1-{[4[(фенілметил)окси]пропіл}-1(трифторметил)феніл]метил}-1азоніабіцикло[2.2.2]октанбромід азоніабіцикло[2.2.2]октанбромід 4-[гідрокси(дифеніл)метил]-1-[41-(5-гексен-1-іл)-4-[гідрокси(дифеніл)метил]-1(фенілокси)бутил]-1азоніабіцикло[2.2.2]октанбромід азоніабіцикло[2.2.2]октанбромід 1-(3-циклогексилпропіл)-41-(1,3-діоксолан-2-ілметил)-4[гідрокси(дифеніл)метил]-1[гідрокси(дифеніл)метил]-1азоніабіцикло[2.2.2]октанбромід азоніабіцикло[2.2.2]октанбромід 4-[гідрокси(дифеніл)метил]-1-[2-(тетрагідро4-[гідрокси(дифеніл)метил]-1-{3-[(22Н-піран-2-ілокси)етил]-1гідроксифеніл)окси]пропіл}-1азоніабіцикло[2.2.2]октанбромід азоніабіцикло[2.2.2]октанбромід 1-[2-(1,3-діоксо-1,3-дигідро-2Н-ізоіндол-21-гексил-4-[гідрокси(дифеніл)метил]-1іл)етил]-4-[гідрокси(дифеніл)метил]-1азоніабіцикло[2.2.2]октанбромід азоніабіцикло[2.2.2]октанбромід 4-[гідрокси(ди-3-тієніл)метил]-1-[24-[гідрокси(дифеніл)метил]-1-(2-фенілетил)-1(фенілокси)етил]-1азоніабіцикло[2.2.2]октанбромід азоніабіцикло[2.2.2]октанбромід 1-етил-4-[гідрокси(дифеніл)метил]-14-[гідрокси(дифеніл)метил]-1-[3-({4азоніабіцикло[2.2.2]октанбромід [(фенілметил)окси]феніл}окси)пропіл]-14-[гідрокси(дифеніл)метил]-1-[(4азоніабіцикло[2.2.2]октанбромід метилфеніл)метил]-11-[(3-бромфеніл)метил]-4азоніабіцикло[2.2.2]октанбромід [гідрокси(дифенілметил-11-бутил-4-[гідрокси(дифеніл)метил]-1азоніабіцикло[2.2.2]октанбромід азоніабіцикло[2.2.2]октанбромід 4-[гідрокси(ди-2-нафталеніл)метил]-1-{24-[гідрокси(дифеніл)метил]-1-[2-(3-метил-1Н[(фенілметил)окси]етил}-1піразол-1-іл)етил]-1азоніабіцикло[2.2.2]октанбромід азоніабіцикло[2.2.2]октанбромід 4-[гідрокси(дифеніл)метил]-1-[24-(гідрокси{біс[4-(метилокси)феніл]}метил)-1(метилокси)етил]-1[3-(фенілокси)пропіл]-1азоніабіцикло[2.2.2]октанбромід азоніабіцикло[2.2.2]октанбромід 4-(гідрокси{біс[4-метилокси)феніл]}метил)-1-{21-[3-(3-бифенілілокси)пропіл]-4[(фенілметил)окси]етил}-1[гідрокси(дифеніл)метил]-1азоніабіцикло[2.2.2]октанбромід азоніабіцикло[2.2.2]октанбромід 1-{3-[(4-ціанофеніл)окси]пропіл}-44-[гідрокси(дифеніл)метил]-1-[(1S)-1-метил-2[гідрокси(дифеніл)метил-1оксо-2(феніламіно)етил]-1азоніабіцикло[2.2.2]октанбромід азоніабіцикло[2.2.2]октанбромід 1-[2-(1-бензофуран-2-іл)-2-оксоетил]-44-[гідрокси(дифеніл)метил]-1-пропіл-1[гідрокси(дифеніл)метил]-1азоніабіцикло[2.2.2]октанбромід азоніабіцикло[2.2.2]октанбромід 1-{3-[(2-бромфеніл)окси]пропіл}-41-[2-({[4-(1,1[гідрокси(дифеніл)метил]-1диметилетил)феніл]метил}окси)етил]-4азоніабіцикло[2.2.2]октанбромід [гідрокси(дифеніл)метил]-11-[(3-фторфеніл)метил]-4азоніабіцикло[2.2.2]октанбромід [гідрокси(дифеніл)метил]-14-[гідрокси(дифеніл)метил]-1-{[3азоніабіцикло[2.2.2]октанбромід (метилокси)феніл]метил}-11-[(3,4-дихлорфеніл)метил]-4азоніабіцикло[2.2.2]октанбромід [гідрокси(дифеніл)метил]-14-[гідрокси(дифеніл)метил]-1-({4азоніабіцикло[2.2.2]октанбромід [(трифторметил)окси]феніл}метил)-11-[(2-фтор-3-метилфеніл)метил]-4азоніабіцикло[2.2.2]октанбромід [гідрокси(дифеніл)метил]-14-[гідрокси(дифеніл)метил]-1-ноніл-1азоніабіцикло[2.2.2]октанбромід азоніабіцикло[2.2.2]октанбромід 13 95768 14 4-[гідрокси(дифеніл)метил]-1-{44-[гідрокси(дифеніл)метил]-1-[2-оксо-2-(4[(фенілметил)окси]бутил}-1пентилфеніл)етил]-1азоніабіцикло[2.2.2]октанбромід азоніабіцикло[2.2.2]октанбромід 1-[(4-ціанофеніл)метил]-41-(2-{[(2,4-дихлорфеніл)карбоніл]аміно}етил)[гідрокси(дифеніл)метил]-14-[гідрокси(дифеніл)метил]-1азоніабіцикло[2.2.2]октанбромід азоніабіцикло[2.2.2]октанбромід 4-[гідрокси{біс[3-(метилокси)феніл]}метил]-14-[гідрокси(дифеніл)метил]-1-(3-{[2{3-(фенілокси)пропіл}-1(метилокси)феніл]окси}пропіл)-1азоніабіцикло[2.2.2]октанбромід азоніабіцикло[2.2.2]октанбромід 1-(3-{[3-(діетиламіно)феніл]окси}пропіл)-44-[гідрокси(дифеніл)метил]-1-[(1[гідрокси(дифеніл)метил]-1{[(фенілметил)окси]карбоніл}-4азоніабіцикло[2.2.2]октанбромід піперидиніл)метил]-14-[гідрокси(дифеніл )метил]-1-(2-пропен-1-іл)азоніабіцикло[2.2.2]октанбромід 1-азоніабіцикло[2.2.2]октанбромід 4-[гідрокси(дифеніл)метил]-1-[2-(21-{[4-(1,1-диметилетил)феніл]метил}-4нафталеніл)-2-оксоетил]-1[гідрокси(дифеніл)метил]-1азоніабіцикло[2.2.2]октанбромід азоніабіцикло[2.2.2]октанбромід 4-[гідрокси(дифеніл)метил]-1-[(44-[гідрокси(дифеніл)метил]-1-(3-фенілпропіл)нітрофеніл)метил]-11-азоніабіцикло[2.2.2]октанбромід азоніабіцикло[2.2.2]октанбромід 1-[(2,6-дифторфеніл)метил]-41-бутил-4-[гідрокси(ди-3-тієніл)метил]-1[гідрокси(дифеніл)метил]-1азоніабіцикло[2.2.2]октанбромід азоніабіцикло[2.2.2]октанбромід 4-[гідрокси(дифеніл)метил]-1-(2-оксо-24-[гідрокси(дифеніл)метил]-1-[2-({[2фенілетил)-1-азоніабіцикло[2.2.2]октанбромід (фенілокси)-3-піридиніл]карбоніл}аміно)етил]-11-[(3,4-дифторфеніл)метил]-4азоніабіцикло[2.2.2]октанбромід [гідрокси(дифеніл)метил]-14-[гідрокси(ди-2-тієніл)метил]-1-(2-фенілетил)азоніабіцикло[2.2.2]октанбромід 1-азоніабіцикло[2.2.2]октанбромід 1-(циклопропілметил)-41-(3-бромфеніл)-4-[гідрокси(дифеніл)метил]-1[гідрокси(дифеніл)метил]-1азоніабіцикло[2.2.2]октанбромід азоніабіцикло[2.2.2]октанбромід 4-[гідрокси(дифеніл)метил]-1-(2-гідроксіетил)Кращі сполуки, які можна використовувати у 1-азоніабіцикло[2.2.2]октанбромід цьому винаході, мають у своєму складі: 1-[(3-ціанофеніл)метил]-41-(2-{[(3-фторфеніл)метил]окси}етил)-4[гідрокси(дифеніл)метил]-1[гідрокси(дифеніл)метил]-1азоніабіцикло[2.2.2]октанбромід азоніабіцикло[2.2.2]октанбромід 1-[2-({[2,44-[гідрокси(дифеніл)метил]-1-{2дихлорфеніл)аміно]карбоніл}аміно)етил]-4[(фенілметил)окси]етил}-1[гідрокси(дифеніл)метил]-1азоніабіцикло[2.2.2]октанбромід азоніабіцикло[2.2.2]октанбромід 1-(2-{[(4-бромфеніл)метил]окси}етил)-44-[гідрокси(дифеніл)метил]-1-(4-пентен-1-іл)-1[гідрокси(дифеніл)метил]-1азоніабіцикло[2.2.2]октанбромід азоніабіцикло[2.2.2]октанбромід 1-{2-[(2,4-дибромфеніл)окси]етил}-41-(2-{[(4-хлорфеніл)метил]окси}етил)-4[гідрокси(дифеніл)метил]-1[гідрокси(дифеніл)метил]-1азоніабіцикло[2.2.2]октанбромід азоніабіцикло[2.2.2]октанбромід 1-[(2,4-дифторфеніл)метил]-44-[біс(4-фторфеніл)(гідрокси)метил]-1-{2[гідрокси(дифеніл)метил]-1[(фенілметил)окси]етил}-1азоніабіцикло[2.2.2]октанбромід азоніабіцикло[2.2.2]октанбромід 4-[гідрокси(дифеніл)метил]-1-[34-{гідрокси[біс(3-метилфеніл)метил}-1-{2(метилокси)пропіл]-1[(фенілметил)окси]етил}-1азоніабіцикло[2.2.2]октанбромід азоніабіцикло[2.2.2]октанбромід 4-[гідрокси(дифеніл)метил]-1-[3-({21-(2-{[(4-фторфеніл)метил]окси}етил)-4[фенілметил)окси]феніл}окси)пропіл]-1[гідрокси(дифеніл)метил]-1азоніабіцикло[2.2.2]октанбромід азоніабіцикло[2.2.2]октанбромід [1-(2-аміноетил)-1-азоніабіцикло[2.2.2]окт-44-[гідрокси(дифеніл)метил]-1-{2іл](дифеніл)метанолаттрифторацетат [(фенілкарбоніл)окси]етил}-14-[гідрокси(ди-2-тієніл)метил]-1-(3азоніабіцикло[2.2.2]октанбромід фенілпропіл)-1-азоніабіцикло[2.2.2]октанбромід 1-{3-[(3-фторфеніл)окси]пропіл}-44-[гідрокси(дифеніл)метил]-1-метил-1[гідрокси(дифеніл)метил]-1азоніабіцикло[2.2.2]октанбромід азоніабіцикло[2.2.2]октанбромід 4-[гідрокси(дифеніл)метил]-1-(тетрагідро-2Н4-{гідрокси[біс(4-метилфеніл)]метил}-1-{2піран-2-ілметил)-1-азоніабіцикло[2.2.2]октанбромід [(фенілметил)окси]етил}-11-[(2,3-дифторфеніл)метил]-4азоніабіцикло[2.2.2]октанбромід [гідрокси(дифеніл)метил]-14-[гідрокси(дифеніл)метил]-1-{3азоніабіцикло[2.2.2]октанбромід [(метилсульфоніл)аміно]пропіл}-11-[2-(4-бифенілил)-2-оксіетил]-4азоніабіцикло[2.2.2]октанбромід [гідрокси(дифеніл)метил]-1азоніабіцикло[2.2.2]октанбромід 15 95768 16 4-[біс(3-фторфеніл)(гідрокси)метил]-1-{21-{3-[(2-фторфеніл)окси]пропіл}-4[(фенілметил)окси]етил}-1[гідрокси(дифеніл)метил]-1азоніабіцикло[2.2.2]октанбромід азоніабіцикло[2.2.2]октанбромід 1-{3-[(3-хлорфеніл)окси]пропіл}-4Ще кращі сполуки, які можна використовувати [гідрокси(дифеніл)метил]-1у цьому винаході, мають у своєму складі: азоніабіцикло[2.2.2]октанбромід 1-(2-{[(3-фторфеніл)метил]окси}етил)-44-[гідрокси(ди-2-тієніл)метил]-1-[3[гідрокси(дифеніл)метил]-1(фенілокси)пропіл]-1азоніабіцикло[2.2.2]октанбромід азоніабіцикло[2.2.2]октанбромід 4-[гідрокси(дифеніл)метил]-1-{24-[гідрокси(дифеніл)метил]-1-[3[(фенілметил)окси]етил}-1(фенілокси)пропіл]-1азоніабіцикло[2.2.2]октанбромід азоніабіцикло[2.2.2]октанбромід 1-(2-{[(4-бромфеніл)метил]окси}етил)-41-(2-{[(4-ціанофеніл)метил]окси}етил)-4[гідрокси(дифеніл)метил]-1[гідрокси(дифеніл)метил]-1азоніабіцикло[2.2.2]октанбромід азоніабіцикло[2.2.2]октанбромід 1-(2-{[(4-хлорфеніл)метил]окси}етил)-41-{3-[(4-бромфеніл)окси]пропіл}-4[гідрокси(дифеніл)метил]-1[гідрокси(дифеніл)метил]-1азоніабіцикло[2.2.2]октанбромід азоніабіцикло[2.2.2]октанбромід 4-[біс(4-фторфеніл)(гідрокси)метил]-1-{24-[біс(4-фторфеніл)(гідрокси)метил]-1-[3[(фенілметил)окси]етил}-1(фенілокси)пропіл]-1азоніабіцикло[2.2.2]октанбромід азоніабіцикло[2.2.2]октанбромід 4-{гідрокси[біс(3-метилфеніл)метил}-1-{21-{3-[(4-фторфеніл)окси]пропіл}-4[(фенілметил)окси]етил}-1[гідрокси(дифеніл)метил]-1азоніабіцикло[2.2.2]октанбромід азоніабіцикло[2.2.2]октанбромід 1-(2-{[(4-фторфеніл)метил]окси}етил)-44-[гідрокси(дифеніл)метил]-1-{2-[(1-метил-1[гідрокси(дифеніл)метил]-1фенілетил)окси]етил}-1азоніабіцикло[2.2.2]октанбромід азоніабіцикло[2.2.2]октанбромід 4-[гідрокси(дифеніл)метил]-1-{24-[гідрокси(дифеніл)метил]-1-{2-[(2[(фенілкарбоніл)окси]етил}-1нафталенілметил)окси]етил}-1азоніабіцикло[2.2.2]октанбромід азоніабіцикло[2.2.2]октанбромід 1-{3-[(3-фторфеніл)окси]пропіл}-44-[гідрокси(ди-3-тієніл)метил]-1-[3[гідрокси(дифеніл)метил]-1(фенілокси)пропіл]-1азоніабіцикло[2.2.2]октанбромід азоніабіцикло[2.2.2]октанбромід 4-{гідрокси[біс(4-метилфеніл)]метил}-1-{24-[гідрокси(дифеніл)метил]-1-[2[(фенілметил)окси]етил}-1(фенілокси)етил]-1азоніабіцикло[2.2.2]октанбромід азоніабіцикло[2.2.2]октанбромід 4-[гідрокси(дифеніл)метил]-1-{34-{гідрокси[біс(3-метилфеніл)]метил}-1-[3[(метилсульфоніл)аміно]пропіл}-1(фенілокси)пропіл]-1азоніабіцикло[2.2.2]октанбромід азоніабіцикло[2.2.2]октанбромід 4-[біс(3-фторфеніл)(гідрокси)метил]-1-{24-{гідрокси[біс(4-метилфеніл)]метил}-1-{3[(фенілметил)окси]етил}-1[(фенілокси)пропіл]-1азоніабіцикло[2.2.2]октанбромід азоніабіцикло[2.2.2]октанбромід 1-{3-[(3-хлорфеніл)окси]пропіл}-44-[гідрокси(дифеніл)метил]-1-(3-{[4[гідрокси(дифеніл)метил]-1(метилокси)феніл]окси}пропіл)-1азоніабіцикло[2.2.2]октанбромід азоніабіцикло[2.2.2]октанбромід 4-[гідрокси(ди-2-тієніл)метил]-1-[34-[гідрокси(дифеніл)метил]-1-[3-(2(фенілокси)пропіл]-1нафталенілокси)пропіл]-1азоніабіцикло[2.2.2]октанбромід азоніабіцикло[2.2.2]октанбромід 4-[гідрокси(дифеніл)метил]-1-[34-[гідрокси(дифеніл)метил]-1-[2-({[3(фенілокси)пропіл]-1(метилокси)феніл]метил}окси)етил)-1азоніабіцикло[2.2.2]октанбромід азоніабіцикло[2.2.2]октанбромід 1-(2-{[(4-ціанофеніл)метил]окси}етил)-44-[гідрокси(дифеніл)метил]-1-(2[гідрокси(дифеніл)метил]-1нафталенілметил)-1азоніабіцикло[2.2.2]октанбромід азоніабіцикло[2.2.2]октанбромід 1-{3-[(4-бромфеніл)окси]пропіл}-44-[біс(3-фторфеніл)(гідрокси)метил]-1-[3[гідрокси(дифеніл)метил]-1(фенілокси)пропіл]-1азоніабіцикло[2.2.2]октанбромід азоніабіцикло[2.2.2]октанбромід 4-[біс(4-фторфеніл)(гідрокси)метил]-1-[34-[гідрокси(ди-2-тієніл)метил]-1-[2(фенілокси)пропіл]-1(фенілокси)етил]-1азоніабіцикло[2.2.2]октанбромід азоніабіцикло[2.2.2]октанбромід 1-{3-[(4-фторфеніл)окси]пропіл}-44-(гідрокси{біс[3-(метилокси)феніл]}метил)-1[гідрокси(дифеніл)метил]-1{2-[(феніл метил )окси]етил}-1азоніабіцикло[2.2.2]октанбромід азоніабіцикло[2.2.2]октанбромід 4-[гідрокси(дифеніл)метил]-1-{2-[(1-метил-14-[гідрокси(дифеніл)метил]-1-{3-[(4фенілетил)окси]етил}-1нітрофеніл)окси]пропіл}-1азоніабіцикло[2.2.2]октанбромід азоніабіцикло[2.2.2]октанбромід 17 95768 18 4-[гідрокси(дифеніл)метил]-1-{2-[(24-[гідрокси(дифеніл)метил]-1-{2нафталенілметил)окси]етил}-1[(фенілкарбоніл)окси]етил}-1азоніабіцикло[2.2.2]октанбромід азоніабіцикло[2.2.2]октанбромід. 4-[гідрокси(ди-3-тієніл)метил]-1-[3СПОСОБИ ОДЕРЖАННЯ (фенілокси)пропіл]-1Сполуки формули (І) можна одержати застоазоніабіцикло[2.2.2]октанбромід суванням синтетичних процедур, деякі з яких проі4-[гідрокси(дифеніл)метил]-1-[2люстровані нижче у схемах. Синтез, поданий у цій (фенілокси)етил]-1схемі, можна застосовувати для одержання сполук азоніабіцикло[2.2.2]октанбромід формули (І), які мають розмаїття різних груп R1, 4-{гідрокси[біс(3-метилфеніл)]метил}-1-[3R2 і R3, що входять у взаємодію із використанням (фенілокси)пропіл]-1замісників, які підходящим чином захищені, для азоніабіцикло[2.2.2]октанбромід досягнення сумісності з описаними тут реакціями. Найкращі сполуки, які можна використовувати Подальше зняття захисту у вказаних випадках дає у цьому винаході, мають у своєму складі: потім сполуки розкритої природи. Хоча схеми по1-(2-{[(3-фторфеніл)метил]окси}етил)-4казані лише зі сполуками формули (І), це зроблено [гідрокси(дифеніл)метил]-1тільки з метою ілюстрації. азоніабіцикло[2.2.2]октанбромід Як показано на схемі 1, бажані сполуки фор4-[гідрокси(дифеніл)метил]-1-{2мули (І) можна одержати у 4 стадії синтезу з наяв[(фенілметил)окси]етил}-1ного у продажу попередника 1 етил-4азоніабіцикло[2.2.2]октанбромід піперидинкарбоксилату. Сполука 1 взаємодіє з 11-(2-{[(4-бромфеніл)метил]окси}етил)-4бром-2-хлоретаном відповідно до стандартних [гідрокси(дифеніл)метил]-1процедур алкілування, добре відомих у цій галузі, азоніабіцикло[2.2.2]октанбромід таких як карбонат калію в ацетоні, з подальшою 1-(2-{[(4-хлорфеніл)метил]окси}етил)-4взаємодією проміжної сполуки з діізопропіламідом [гідрокси(дифеніл)метил]-1літію в апротоновому розчиннику, такому як тетраазоніабіцикло[2.2.2]октанбромід гідрофуран, для одержання проміжної хінуклідино4-[біс(4-фторфеніл)(гідрокси)метил]-1-{2вої сполуки 2. Конденсація сполуки 2 металоорга[(фенілметил)окси]етил}-1нічними реагентами, такими як реагент Гриньяра, азоніабіцикло[2.2.2]октанбромід або літійорганічна похідна в апротоновому роз4-{гідрокси[біс(3-метилфеніл)метил}-1-{2чиннику, такому як тетрагідрофуран, призводить [(фенілметил)окси]етил}-1до утворення третинного спирту 3 формули (І) (R1 азоніабіцикло[2.2.2]октанбромід дорівнює нулю). Далі N-алкілування сполуки 3 1-(2-{[(4-фторфеніл)метил]окси}етил)-4придатним алкілгалідом в органічному розчиннику, [гідрокси(дифеніл)метил]-1такому як хлороформ або ацетонітрил, дає сполуазоніабіцикло[2.2.2]октанбромід ку 4 формули (І) (R1 не дорівнює нулю). Схема 1 Реагенти та умови: а) 1-бром-2-хлоретан, K2СO3, ацетон; b) LDA, THF; с) R2M, THF; d) RIX, CAN, CHCI3. ПРИКЛАДИ СИНТЕЗУ Тепер винахід буде описаний із посиланням на подальші приклади, які є суто ілюстраційними, і їх не слід розглядати як обмеження обсягу цього винаходу. Всі величини температури подані у °С. Тонкошарову хроматографію (l.t.c.) проводили на діоксиді кремнію і колонкову хроматографію на діоксиді кремнію (за відсутності інших вказівок, колонкову флеш-хроматографію із використанням Merck.9385). Нижче подані експериментальні умови для LC-MS (рідинної хроматографії - мас спектрометрії). 19 Експериментальні умови LC-MS: Рідинний хроматограф: 95768 20 Система: Система LC Shimatdzu з регулятором SCL-10 і подвійним УФ детектором Пристрій автоматичного взяття проб: Leap CTC з шестиканальним інжектором Valco Колонка: Aquasil/Aquasil (C1840 × 1 мм) Об'єм інжекції (мкл): 2,0 Розчинник А: Н2О, 0,02 % TFA Розчинник D: МеОН, 0,018 % TFA Градієнт: Лінійний Канал А: УФ 214нм Канал В: ELS Стадія 0 1 2 3 4 5 Мас спектрометр: Полярність: Тип обробки: Час (хв.) 0,00 0,00 0,01 3,21 4,21 4,31 Тривалість (хв.) 0,00 0,01 3,20 1,00 0,10 0,40 Потік (мкл/хв.) 300,00 300,00 300,00 300,00 300,00 300,00 Розчин А 95,00 95,00 10,00 10,00 95,00 95,00 Розчин Б 5,00 5,00 90,00 90,00 5,00 5,00 РЕ Sciex Single Quadrupole LC/MS API-150 Позитивна Профіль Препаративну ВЕРХ проводили, використовуючи систему ВЕРХ Gilson у таких умовах: Колонка: 75 × внутрішній діаметр 33 мм, S5мм, 12 мм Швидкість потоку: 30 мл/хв. Об'єм інжекції: 0,800 мл Кімнатна температура Розчинник А: вода Розчинник В: ацетонітрил Всі використані тут розчинники мають найвищу наявну чистоту, і доки немає інших вказівок, всі реакції проводять за безводних умов у повітряній атмосфері. Приклад 1: Одержання 1-азабіцикло[2.2.2]окт4-іл(дифеніл)метанолу. Етил-1 (2-хлоретил)-4-піперидинкарбоксилат До розчину етилніпекотату (20,0 мл, 130 ммоль) в ацетоні (180 мл) додають 1-бром-2хлоретан (21,6 мл, 260 ммоль) з подальшим додаванням безводного K2СО3 (27,12 г, 196 ммоль). Реакційну суміш перемішують впродовж 24 год. і потім концентрують у вакуумі. Одержаний залишок обробляють Н2О (75 мл) та екстрагують Et2O. Об'єднані органічні шари сушать MgSO4, фільтрують і концентрують у вакуумі. Очищення неочищеного залишку флеш-хроматографією (50% Et2O/50% гексан) на силікагелі дає вказану у заголовку сполуку (10,99 г, 38,6%). ΕΘ-MS m/z + 220(M+H ) Rt (1,20 хв.). Етил-1-азабіцикло[2.2.2]октан-4-карбоксилат Розчин етил-1(2-хлоретил)-4піперидинкарбоксилату (20,42 г, 92,9 ммоль) у THF (600 мл) охолоджують до -50°С в атмосфері Аr. LDA (2,0 Μ у гептан/ТНР/етилбензолі, 70 мл, 140 ммоль) повільно додають до розчину при -50°С впродовж 25 хв. Реакційній суміші дають можливість зігрітися до кімнатної температури впродовж 16 год. Реакцію гасять K2СО3 (насиченим водним) (500 мл) та екстрагують Et2O (3 × 500 мл). Об'єднані органічні шари сушать MgSO4, фільтрують і концентрують у вакуумі. Одержане оранжеве масло спільно випарюють 3 рази з DCM (дихлорметаном) для видалення надлишкового етилбензолу, що призводить до одержання вказаної у заголовку + сполуки (16,29 г, 95,7%). ΕΘ-MS m/z 184(M+H ) Rt (1,08 хв). 1-азабіцикло[2.2.2]окт-4-іл(дифеніл)метанол Розчин феніллітію (1,5-1,7 Μ в 70 циклогексану /30 простого ефіру, 20,0 мл, 32 ммоль) охолоджують до -30°С в атмосфері Аr. Етил-1азабіцикло[2.2.2]октан-4-карбоксилат у THF (20 мл) повільно додають до реакційної суміші при 30°С впродовж 25 хв. Реакційній суміші дають можливість зігрітися до кімнатної температури впродовж 16 год. Реакцію гасять Н2О і потім випарюють до сухості у вакуумі. Додають Н2О і ЕtOАс, викликаючи випад білої твердої речовини. Цю тверду речовину відфільтровують для одержання вказаної у заголовку сполуки (0,79 г). Водну фазу додатково екстрагують ЕtOАс, ΕΘ-MS m/z + 184(M+H ) Rt (1,08 хв). Об'єднані органічні шари сушать MgSO4, фільтрують і концентрують у вакуумі. Одержаний неочищений продукт обробляють ЕtOАс і гексаном та фільтрують для виходу додаткової кількості вказаної у заголовку сполуки (0,67 г). Загальний вихід (1,46 г, 60,7%). ΕΘ-MS m/z + 294(M+H ) Rt (1,37 хв.). Приклад 2: Одержання 4[гідрокси(дифеніл)метил]-1-(2-(фенілметил)-1азоніабіцикло[2.2.2]октанброміду. До розчину 1-азабіцикло[2.2.2]окт-4іл(дифеніл)метанолу (0,0775 г, 0,264 ммоль) в СН3СN / DСМ / МеОН (2 мл/2 мл/1 мл) додають (2брометил)бензол (0,38 мл, 2,78 ммоль). Розчину дають можливість перемішуватись при кімнатній температурі впродовж 4 днів і потім концентрують у вакуумі для одержання білої твердої речовини. Цей осад розчиняють у DMSO (диметилсульфоксиді) та очищують препаративною ВЕРХ для оде 21 95768 22 ржання вказаної у заголовку сполуки (0,0612 г, Приклад 8: Одержання 4+ 48,6%). ΕΘ-MS m/z 398(M ) Rt (2,06 хв.). [гідрокси(дифеніл)метил]-1-[2-(тетрагідро-2НПриклад 3: Одержання 4піран-2-ілокси)етил]-1[гідрокси(дифеніл)метил]-1-[2-(фенілокси)етил]-1азоніабіцикло[2.2.2]октанброміду. азоніабіцикло[2.2.2]октанброміду. Дотримуючись загальної процедури, описаної Загальна процедура утворення солі без очиу прикладі 4, здійснюють взаємодію 1щення ВЕРХ азабіцикло[2.2.2]окт-4-іл(дифеніл)метанолу До розчину 1-азабіцикло[2.2.2]окт-4(0,0696 г, 0,237 ммоль) і 2-[(2іл(дифеніл)метанолу (0,0550 г, 0,187 ммоль) у 2 брометил)окси}тетрагідро-2Н-пірану (0,080 г, 0,529 CH3CN / 3 СНСІ3 (2,5 мл) додають простий 2ммоль) у 2 CH3CN / 3 СНСІ3 (5,0 мл) для одержанброметилфенілефір (0,060 г, 0,29 ммоль). Розчин ня бажаного продукту (0,0348 г, 31,6%). ΕΘ-MS m/z + перемішують при 60°С впродовж 16 год. Реакційну 422(M ) Rt (1,85 xв). суміш охолоджують до кімнатної температури і Приклад 9: Одержання 4-[гідрокси(дифепотім розводять етилацетатом і гексаном, виклиніл)метил]-1-{4-[(фенілметил)окси]бутил}-1каючи випадання твердої речовини з розчину. Цю азоніабіцикло[2.2.2]октанброміду. тверду речовину відфільтровують і промивають Дотримуючись загальної процедури, описаної гексаном для одержання вказаної у заголовку споу прикладі 4, здійснюють взаємодію 1+ луки (0,063 г, 67,6%). ΕΘ-MS m/z414(M ) Rt (1,94 азабіцикло[2.2.2]окт-4-іл(дифеніл)метанолу хв). (0,0646 г, 0,220 ммоль) і простого 4Приклад 4: Одержання 1-(циклопропілметил)бромбутилфенілметилефіру (0,090 г, 0,472 ммоль) 4-[гідрокси(дифеніл)метил]-1-азоніабіцикло[2.2.2] у 2 CH3CN / 3 СНСІ3 (5,0 мл) для одержання бажа+ октанброміду. ного продукту (0,0531 г, 48,3%). ΕΘ-MS m/z 456(M ) Загальна процедура утворення солі без очиRt (2,09 хв.). щення ВЕРХ Приклад 10: Одержання 4-[гідрокси(дифеДо розчину 1-азабіцикло[2.2.2]окт-4ніл)метил]-1-{3-[(фенілметил)окси]пропіл}-1іл(дифеніл)метанолу (0,0552 г, 0,188 ммоль) у 2 азоніабіцикло[2.2.2]октанброміду. CH3CN / 3 СНСІ3 (2,5 мл) додають (бромеДотримуючись загальної процедури, описаної тил)циклопропін (0,025 г, 0,257 ммоль). Розчин у прикладі 4, здійснюють взаємодію 1перемішують при 60°С впродовж 16 год., охолоазабіцикло[2.2.2]окт-4-іл(дифеніл)метанолу джують до кімнатної температури і розчинники (0,0677 г, 0,231 ммоль) і простого 3випарюють у вакуумі. Залишок збирають у 2,5 мл бромпропілфенілметилефіру (0,070 г, 0,396 DMSO і очищують препаративною ВЕРХ (без TFA) ммоль) у 2 CH3CN / 3 СНСІ3 (4,0 мл) для одержандля одержання вказаної у заголовку сполуки ня бажаного продукту (0,0663 г, 55,2%). ΕΘ-MS m/z + + (0,0319 г, 39,9%). ΕΘ-MS m/z 348(M ) Rt (1,69 хв). 442(M ) Rt (2,23 хв.). Приклад 5: Одержання 4Приклад 11: Одержання 1-{2-[(2,4[гідрокси(дифеніл)метил]-1-(2-оксо-2-фенілетил)-1дибромфеніл)окси]етил}-4-[гідрокси (дифеазоніабіцикло[2.2.2]октанброміду. ніл)метил]-1-азоніабіцикло[2.2.2]октанброміду. Дотримуючись загальної процедури, описаної Дотримуючись загальної процедури, описаної у прикладі 4, здійснюють взаємодію 1у прикладі 4, здійснюють взаємодію 1азабіцикло[2.2.2]окт-4-іл(дифеніл)метанолу азабіцикло[2.2.2]окт-4-іл(дифеніл)метанолу (0,0567 г, 0,193 ммоль) і 2-бром-1-фенілетанону (0,0557 г, 0,190 ммоль) і простого 2-брометил-2,4(0,0487 г, 0,245 ммоль) у 2 CH3CN / 3 СНСІ3 (2,5 дибромфенілефіру (0,110 г, 0,306 ммоль) у 2 мл) для одержання бажаного продукту (0,0410 г, CH3CN / 3 СНСІ3 (4,0 мл) для одержання бажаного + + 43,0%). ΕΘ-MS m/z 412(M ) Rt (1,90 хв.). продукту (0,0525 г, 43,8%). ΕΘ-MS m/z 572(М ) Rt Приклад 6: Одержання 4(2,26 хв.). [гідрокси(дифеніл)метил]-1-[3-(фенілокси)пропіл]Приклад 12: Одержання 1-(3-бромпропіл)-41-азоніабіцикло[2.2.2]октанброміду. [гідрокси(дифеніл)метил]-1-азоніабіцикло[2.2.2] Дотримуючись загальної процедури, описаної октанброміду. у прикладі 3, здійснюють взаємодію 1Дотримуючись загальної процедури, описаної азабіцикло[2.2.2]окт-4-іл(дифеніл)метанолу (0,045 у прикладі 3, здійснюють взаємодію 1г, 0,153 ммоль) і простого 3-бромпропілфенілефіру азабіцикло[2.2.2]окт-4-іл(дифеніл)метанолу (0,035 г, 0,222 ммоль) у 2 CH3CN / 3 СНСІ3 (3,0 мл) (0,0979 г, 0,334 ммоль) і 1,3-дибромпропану (0,35 для одержання бажаного продукту (0,0662 г, мл, 3,448 ммоль) у 2 CH3CN / 3 СНСІ3 (15,0 мл) + 86,0%). ΕΘ-MS m/z 428(M ) Rt (1,97 хв.). для одержання бажаного продукту (0,0712 г, + Приклад 7: Одержання 443,1%). ΕΘ-MS m/z 415(M ) Rt (1,79 хв.). [гідрокси(дифеніл)метил]-1-[4-(фенілокси)бутил]-1Приклад 13: Одержання 4азоніабіцикло[2.2.2]октанброміду. [гідрокси(дифеніл)метил]-1-(тетрагідро-2Н-піран-2Дотримуючись загальної процедури, описаної ілметил)-1-азоніабіцикло[2.2.2]октанброміду. у прикладі 4, здійснюють взаємодію 1Дотримуючись загальної процедури, описаної азабіцикло[2.2.2]окт-4-іл(дифеніл)метанолу у прикладі 4, здійснюють взаємодію 1(0,0604 г, 0,206 ммоль) і простого 4азабіцикло[2.2.2]окт-4-іл(дифеніл)метанолу бромбутилфенілефіру (0,106 г, 0,463 ммоль) у 2 (0,0677 г, 0,231 ммоль) і 3-(бромметил)тетрагідроCH3CN / 3 СНСІ3 (5,0 мл) для одержання бажаного 2Н-пірану (0,050 мл, 0,390 ммоль) у 2 CH3CN / 3 + продукту (0,0649 г, 64,9%). ΕΘ-MS m/z 442(M ) Rt СНСІ3 (4,0 мл) для одержання бажаного продукту + (2,13 хв.). (0,0508 г, 50,8%). ΕΘ-MS m/z 392(M ) Rt (1,84 хв.). 23 95768 24 Приклад 14: Одержання 1-(1,3-діоксолан-2-іл (0,0638 г, 0,217 ммоль) і бромметану (2,0 Μ у прометил )-4-[гідрокси (дифеніл)метил]-1стому т-бутилметилефірі, 0,250 мл, 0,500 ммоль) у азоніабіцикло[2.2.2]октанброміду. 2 CH3CN / 3 СНСІ3 (4,0 мл) для одержання бажа+ Дотримуючись загальної процедури, описаної ного продукту (0,0739 г, 88,0%). ЕІ-MS m/z 308(M ) у прикладі 4, здійснюють взаємодію 1Rt (1,58 хв.). азабіцикло[2.2.2]окт-4-іл(дифеніл)метанолу Приклад 21: Одержання 4(0,0574 г, 0,196 ммоль) і 2-(бромметил)-1,3[гідрокси(дифеніл)метил]-1-[2-(метокси)етил]-1діоксолану (0,040 мл, 0,386 ммоль) у 2 CH3CN / 3 азоніабіцикло[2.2.2]октанброміду. СНСІ3 (4,0 мл) для одержання бажаного продукту Дотримуючись загальної процедури, описаної + (0,0112 г, 12,4%). ΕΘ-MS m/z 380(M ) Rt (1,64 хв.). у прикладі 4, здійснюють взаємодію 1Приклад 15: Одержання 1-етил-4азабіцикло[2.2.2]окт-4-іл(дифеніл)метанолу [гідрокси(дифеніл)метил]-1(0,0597 г, 0,203 ммоль) і простого 2азоніабіцикло[2.2.2]октанброміду. брометилметилефіру (0,030 мл, 0,319 ммоль) у 2 Дотримуючись загальної процедури, описаної CH3CN / 3 СНСІ3 (4,0 мл) для одержання бажаного + у прикладі 3, здійснюють взаємодію 1продукту (0,0372 г, 42,8%). ΕΘ-MS m/z 352(M ) Rt азабіцикло[2.2.2]окт-4-іл(дифеніл)метанолу (1,69 хв.). (0,0581 г, 0,198 ммоль) і брометану (0,030 мл, Приклад 22: Одержання 1-[2-(1,3-діоксо-1,30,402 ммоль) у 2 CH3CN / 3 СНСІ3 (4,0 мл) для дигідро-2Н-ізоіндол-2-іл)етил]-4-[гідрокси(дифеодержання бажаного продукту (0,0434 г, 54,9%). ніл)метил]-1-азоніабіцикло[2.2.2]октанброміду. + ΕΘ-MS m/z 322(M ) Rt (1,56 хв.). Дотримуючись загальної процедури, описаної Приклад 16: Одержання 4-[гідрокси(дифеу прикладі 3, здійснюють взаємодію 1ніл)метил]-1-ноніл-1-азоніабіцикло[2.2.2]октанброазабіцикло[2.2.2]окт-4-іл(дифеніл)метанолу міду. (0,0916 г, 0,312 ммоль) і 2-(2-брометил)-1НДотримуючись загальної процедури, описаної ізоіндол-1,3(2Н)-діону (0,130 г, 0,512 ммоль) у 2 у прикладі 4, здійснюють взаємодію 1CH3CN / 3 СНСІ3 (4,0 мл) для одержання бажаного + азабіцикло[2.2.2]окт-4-іл(дифеніл)метанолу продукту (0,0881 г, 51,8%). ΕΘ-MS m/z 467(M ) Rt (0,0561 г, 0,191 ммоль) і 1-бромнонану (0,055 мл, (1,91 хв.). 0,288 ммоль) у 2 CH3CN / 3 СНСІ3 (4,0 мл) для Приклад 23: Одержання 1-[3-(1,3-діоксо-1,3одержання бажаного продукту (0,0435 г, 45,8%). дигідро-2Н-ізоіндол-2-іл)пропіл]-4-[гідрокси(дифе+ ΕΘ-MS m/z 420(M ) Rt (2,349 хв.). ніл)метил]-1-азоніабіцикло[2.2.2]октанброміду. Приклад 17: Одержання 4Дотримуючись загальної процедури, описаної [гідрокси(дифеніл)метил]-1-(4-пентен-1-іл)-1у прикладі 3, здійснюють взаємодію 1азоніабіцикло[2.2.2]октанброміду. азабіцикло[2.2.2]окт-4-іл(дифеніл)метанолу Дотримуючись загальної процедури, описаної (0,0861 г, 0,293 ммоль) і 2-(3-бромпропіл)-1Ну прикладі 3, здійснюють взаємодію 1ізоіндол-1,3(2Н)-діону (0,118 г, 0,440 ммоль) у 2 азабіцикло[2.2.2]окт-4-іл(дифеніл)метанолу CH3CN / 3 СНСІ3 (5,0 мл) для одержання бажаного + (0,0608 г, 0,207 ммоль) і 5-бром-1-пентену (0,045 продукту (0,1319 г, 82,4%). ΕΘ-MS m/z 481 (M )Rt мл, 0,380 ммоль) у 2 CH3CN / 3 СНСІ3 (4,0 мл) для (1,90 хв.). одержання бажаного продукту (0,0806 г, 88,6%). Приклад 24: Одержання 4+ ΕΘ-MS m/z 362(M ) Rt (1,88 хв.). [гідрокси(дифеніл)метил]-1-(3-фенілпропіл)-1Приклад 18: Одержання 4азоніабіцикло[2.2.2]октанброміду. [гідрокси(дифеніл)метил]-1-(2-гідроксіетил)-1Дотримуючись загальної процедури, описаної азоніабіцикло[2.2.2]октанброміду. у прикладі 3, здійснюють взаємодію 1Дотримуючись загальної процедури, описаної азабіцикло[2.2.2]окт-4-іл(дифеніл)метанолу у прикладі 3, здійснюють взаємодію 1(0,0625 г, 0,213 ммоль) і (3-бромпропіл)бензолу азабіцикло[2.2.2]окт-4-іл(дифеніл)метанолу (0,050 мл, 0,329 ммоль) у 2 CH3CN / 3 СНСІ3 (5,0 (0,0638 г, 0,217 ммоль) і 2-брометанолу (0,035 мл, мл) для одержання бажаного продукту (0,0722 г, + 0,494 ммоль) у 2 CH3CN / 3 СНСІ3 (4,0 мл) для 72,2%). ΕΘ-MS m/z 412(M ) Rt (2,01 хв.). одержання бажаного продукту (0,0541 г, 60,1%). Приклад 25: Одержання 4+ ΕΘ-MS m/z 338(M ) Rt (1,42 хв.). [гідрокси(дифеніл)метил]-1-{[2-(метокси) Приклад 19: Одержання 1-(5-гексен-1-іл)-4етил]окси}етил)-1[гідрокси(дифеніл)метил]-1азоніабіцикло[2.2.2]октанброміду. азоніабіцикло[2.2.2]октанброміду. Дотримуючись загальної процедури, описаної Дотримуючись загальної процедури, описаної у прикладі 3, здійснюють взаємодію 1у прикладі 3, здійснюють взаємодію 1азабіцикло[2.2.2]окт-4-іл(дифеніл)метанолу азабіцикло[2.2.2]окт-4-іл(дифеніл)метанолу (0,0665 г, 0,227 ммоль) і 1-бром-2-{[2(0,0637 г, 0,217 ммоль) і 6-бром-1-гексену (0,050 (метилокси)етил]окси}етану (0,055 мл, 0,405 мл, 0,373 ммоль) у 2 CH3CN / 3 СНСІ3 (5,0 мл) для ммоль) у 2 CH3CN / 3 СНСІ3 (4,0 мл) для одержанодержання бажаного продукту (0,0664 г, 67,1%). ня бажаного продукту (0,0843 г, 78,8%). ΕΘ-MS m/z + + ΕΘ-MS m/z 376(M ) Rt (1,90 хв.). 396(M ) Rt (1,64 хв.). Приклад 20: Одержання 4Приклад 26: Одержання 1-[4-(етилокси)-4[гідрокси(дифеніл)метил]-1-метил-1оксобутил]-4-[гідрокси (дифеніл)метил]-1азоніабіцикло[2.2.2]октанброміду. азоніабіцикло[2.2.2]октанброміду. Дотримуючись загальної процедури, описаної Дотримуючись загальної процедури, описаної у прикладі 3, здійснюють взаємодію 1у прикладі 4, здійснюють взаємодію 1азабіцикло[2.2.2]окт-4-іл(дифеніл)метанолу азабіцикло[2.2.2]окт-4-іл(дифеніл)метанолу 25 95768 26 (0,0679 г, 0,231 ммоль) і етил-4-бромбутаноату 3-бромтіофен (1,15 мл, 12,3 ммоль), розчинений у (0,055 мл, 0,524 ммоль) у 2 CH3CN / 3 СНСІ3 (4,0 простому етиловому ефірі (4,0 мл), повільно домл) для одержання бажаного продукту (0,0637 г, дають до реакційної суміші. Реакційну суміш пе+ 57,9%). ΕΘ-MS m/z 408(M ) Rt (1,80 хв.). ремішують впродовж 30 хв. і потім додають етилПриклад 27: Одержання 11-азабіцикло[2.2.2]октан-4-карбоксилат (0,7640 г, азоніабіцикло[2.2.2]окт-4-іл(ди-2-тієніл) метанолу. 4,16 ммоль) у THF/Et2O (4 мл/4 мл). Реакційній Розчин 2-тієніллітію (1,0 Μ у THF, 9,10 мл, 9,10 суміші дають можливість зігрітися від -78°С до ммоль) охолоджують до -30°С в атмосфері Аr. кімнатної температури впродовж 16 год., потім Етил-1-азабіцикло[2.2.2]октан-4-карбоксилат повільно гасять водою. Реакційну суміш концент(0,4196 г, 2,289 ммоль) у THF (8 мл) повільно дорують, і одержану коричневу тверду речовину збидають до реакційної суміші впродовж 20 хв. Реакрають у воду і DCM. Органічну фазу відокремлюційній суміші дають можливість зігрітися до кімнатють, сушать над MgSO4, фільтрують і ної температури впродовж 16 год. Реакцію гасять концентрують у вакуумі для одержання коричневої водою і потім випарюють до сухості. Додають Н2О твердої речовини. Тверду речовину розчиняють у і DCM, викликаючи випадання світло-коричневої DMSO і очищують препаративною ВЕРХ для одетвердої речовини. Цю тверду речовину відфільтржання вказаної у заголовку сполуки (0,1736 г, + ровують для одержання вказаної у заголовку спо9,4%). ΕΘ-MS m/z 362(M ) Rt (1,73 хв.). + луки (0,4161 г, 59,5%). ЕІ-MS m/z 306(M+H ) Rt Приклад 33: Одержання 1(1,35 хв.). азоніабіцикло[2.2.2]окт-4-іл(ди-3-тієніл) метанолу. Приклад 28: Одержання 4-[гідрокси(ди-2Розчин н-бутиллітію (1,7 Μ в пентанах, 5,8 мл, тієніл)метил]-1-[2-(фенілокси)етил]-1-азоніабіцик9,86 ммоль) охолоджують до -78°С в атмосфері Аr. ло[2.2.2]октанброміду. 3-бромтіофен (0,46 мл, 4,90 ммоль), розчинений у Дотримуючись загальної процедури, описаної THF (4,0 мл), повільно додають до реакційної суу прикладі 4, здійснюють взаємодію 1міші впродовж 6 хв. Реакційну суміш перемішують азабіцикло[2.2.2]окт-4-іл(ди-2-тієніл)метанолу впродовж 30 хв. і потім додають етил-1(0,0693 г, 0,227 ммоль) і простого 2азабіцикло[2.2.2]октан-4-карбоксилат (0,3132 г, брометилфенілефіру (0,056 г, 0,279 ммоль) у 1 1,71 ммоль) у THF (4 мл). Реакційній суміші дають МеОН /1 СНСІ3 (3,0 мл) для одержання бажаного можливість зігрітися від -78°С до кімнатної темпе+ продукту (0,0822 г, 74,7%). ΕΘ-MS m/z 426(M ) Rt ратури впродовж 16 год. Через 16 год. реакцію (2,00 хв.). повільно гасять водою. Додають ЕtOАс, викликаюПриклад 29: Одержання 4-[гідрокси(ди-2чи випадання сірої твердої речовини. Тверду ретієніл)метил]-1-[3-(фенілокси)етил]-1-азоніабіцикчовину відфільтровують для одержання вказаної у ло[2.2.2]октанброміду. заголовку сполуки (0,3375 г, 64,6%). ΕΘ-MS m/z + Дотримуючись загальної процедури, описаної 306(M ) Rt (1,27 хв.). у прикладі 4, здійснюють взаємодію 1Приклад 34: Одержання 4-[гідрокси(ди-3азабіцикло[2.2.2]окт-4-іл(ди-2-тієніл)метанолу тієніл)метил]-1-[2-(фенілокси)етил]-1-азоніабіцик(0,0578 г, 0,189 ммоль) і простого 3ло[2.2.2]октанброміду. бромпропілфенілефіру (0,033 мл, 0,209 ммоль) у 1 Дотримуючись загальної процедури, описаної МеОН /1 СНСІ3 (4,0 мл) для одержання бажаного у прикладі 4, здійснюють взаємодію 1+ продукту (0,0448 г, 45,4%). ΕΘ-MS m/z 440(M ) Rt азабіцикло[2.2.2]окт-4-іл(ди-3-тієніл)метанолу (1,94 хв.). (0,0787 г, 0,258 ммоль) і простого 2Приклад 30: Одержання 4-[гідрокси(ди-2брометилфенілефіру (0,0839 г, 0,417 ммоль) у тієніл)метил]-1-(2-(фенілетил)-12МеОН / 3 СНСІ3 / 2 CH3CN (5,0 мл) для одержаназоніабіцикло[2.2.2]октанброміду. ня бажаного продукту (0,0709 г, 54,5%). ΕΘ-MS m/z + Дотримуючись загальної процедури, описаної 426(M )Rt (1,85 хв.). у прикладі 4, здійснюють взаємодію 1Приклад 35: Одержання 4-[гідрокси(ди-3азабіцикло[2.2.2]окт-4-іл(ди-2-тієніл)метанолу тієніл)метил]-1-[3-(фенілокси) пропіл]-1(0,0658 г, 0,215 ммоль) і (2-брометил)бензолу азоніабіцикло[2.2.2]октанброміду. (0,050 мл, 0,366 ммоль) у 1 МеОН / 1 СНСІ3 (4,0 Дотримуючись загальної процедури, описаної мл) для одержання бажаного продукту (0,0514 г, у прикладі 4, здійснюють взаємодію 1+ 48,9%). ΕΘ-MS m/z 410(M ) Rt (1,83 хв.). азабіцикло[2.2.2]окт-4-іл(ди-3-тієніл)метанолу Приклад 31: Одержання 4-[гідрокси(ди-2(0,0808 г, 0,264 ммоль) і простого 3тієніл)метил]-1-(3-фенілпропіл)-1бромпропілфенілефіру (0,070 г, 0,444 ммоль) у 2 азоніабіцикло[2.2.2]октанброміду. МеОН / 3 СНСІ3 / 2 CH3CN (5,0 мл) для одержання Дотримуючись загальної процедури, описаної бажаного продукту (0,0613 г, 44,7%). ΕΘ-MS m/z + у прикладі 4, здійснюють взаємодію 1440(М ) Rt (2,05 хв.). азабіцикло[2.2.2]окт-4-іл(ди-2-тієніл)метанолу Приклад 36: Одержання 1-бутил-4(0,0688 г, 0,225 ммоль) і (3-бромпропіл)бензолу [гідрокси(дифеніл)метил]-1-азоніабіцикло[2.2.2] (0,070 мл, 0,460 ммоль) у 1 МеОН / 1 СНСІ3 (4,0 октанброміду. мл) для одержання бажаного продукту (0,0685 г, Дотримуючись загальної процедури, описаної + 62,3%). ΕΘ-MS m/z 424(M ) Rt (1,97 хв.). у прикладі 3, здійснюють взаємодію 1Приклад 32: Одержання 1-бутил-4азабіцикло[2.2.2]окт-4-іл(дифеніл)метанолу [гідрокси(ди-3-тієніл)метил]-1(0,0496 г, 0,169 ммоль) і 1-бромбутану (0,030 мл, азоніабіцикло[2.2.2]октанброміду. 0,279 ммоль) у 2 CH3CN / 3 СНСІ3 (4,0 мл) для Розчин н-бутиллітію (2,5 Μ в гексанах, 5,0 мл, одержання бажаного продукту (0,0509 г, 70,7%). + 12,5 ммоль) охолоджують до -78°С в атмосфері Аr. ΕΘ-MS m/z 350(M ) Rt (1,83 хв.). 27 95768 28 Приклад 37: Одержання 1-гексил-4Приклад 43: Одержання 1-{3-[(4[гідрокси(дифеніл)метил]-1бромфеніл)окси]пропіл}-4-[гідрокси (дифеазоніабіцикло[2.2.2]октанброміду. ніл)метил]-1-азоніабіцикло[2.2.2]октанброміду. Дотримуючись загальної процедури, описаної Дотримуючись загальної процедури, описаної у прикладі 3, здійснюють взаємодію 1у прикладі 3, здійснюють взаємодію 1азабіцикло[2.2.2]окт-4-іл(дифеніл)метанолу азабіцикло[2.2.2]окт-4-іл(дифеніл)метанолу (0,0498 г, 0,170 ммоль) і 1-бромгексану (0,040 мл, (0,0486 г, 0,165 ммоль) і простого 4-бромпропіл-30,285 ммоль) у 2 CH3CN / 3 СНСІ3 (4,0 мл) для бромфенілефіру (0,0630 г, 0,214 ммоль) у 2 CH3CN одержання бажаного продукту (0,0562 г, 73,0%). / 3 СНСІ3 (4,0 мл) для одержання бажаного проду+ + ΕΘ-MS m/z 378(M ) Rt (2,09 хв.). кту (0,0731 г, 75,4%). ΕΘ-MS m/z 506(M ) Rt (2,18 Приклад 38: Одержання 4хв.). [гідрокси(дифеніл)метил]-1-пропіл-1Приклад 44: Одержання 4азоніабіцикло[2.2.2]октанброміду. [гідрокси(дифеніл)метил]-1-{3-[(4-нітрофеніл) окДотримуючись загальної процедури, описаної си]пропіл}-азоніабіцикло[2.2.2]октанброміду. у прикладі 3, здійснюють взаємодію 1Дотримуючись загальної процедури, описаної азабіцикло[2.2.2]окт-4-іл(дифеніл)метанолу у прикладі 3, здійснюють взаємодію 1(0,0518 г, 0,176 ммоль) і 1-бромпропану (0,030 мл, азабіцикло[2.2.2]окт-4-іл(дифеніл)метанолу 0,330 ммоль) у 2 CH3CN / 3 СНСІ3 (4,0 мл) для (0,0468 г, 0,159 ммоль) і простого 3-бромпропіл-3одержання бажаного продукту (0,0548 г, 75,1%). нітрофенілефіру (0,0550 г, 0,211 ммоль) у 2 CH3CN + ΕΘ-MS m/z 336(M ) Rt (1,97 хв.). / 3 СНСІ3 (4,0 мл) для одержання бажаного проду+ Приклад 39: Одержання 4кту (0,0590 г, 67,0%). ΕΘ-MS m/z 473(М ) Rt (2,06 [гідрокси(дифеніл)метил]-1-(3-{[2-(метилокси) фехв.). ніл]окси}пропіл)-1Приклад 45: Одержання 4-[гідрокси(дифеазоніабіцикло[2.2.2]октанброміду. ніл)метил]-1-[3-({2-[(фенілметил)окси]феніл}окси) Дотримуючись загальної процедури, описаної пропіл]-азоніабіцикло[2.2.2]октанброміду. у прикладі 3, здійснюють взаємодію 1Дотримуючись загальної процедури, описаної азабіцикло[2.2.2]окт-4-іл(дифеніл)метанолу у прикладі 3, здійснюють взаємодію 1(0,0467 г, 0,159 ммоль) і 1-[(3-бромпропіл)окси]-2азабіцикло[2.2.2]окт-4-іл(дифеніл)метанолу (метилокси)бензолу (0,0541 г, 0,221 ммоль) у 2 (0,0492 г, 0,168 ммоль) і 1-[(3-бромпропіл)окси]-2CH3CN / 3 СНСІ3 (4,0 мл) для одержання бажаного [(фенілметил)окси]бензолу (0,0706 г, 0,220 ммоль) + продукту (0,0625 г, 73,5%). ΕΘ-MS m/z 458(M )Rt у 2 CH3CN / 3 СНСІ3 (4,0 мл) для одержання бажа+ (1,96 хв.). ного продукту (0,0735 г, 71,4%). ЕІ-MS m/z 533(M ) Приклад 40: Одержання 4-[гідрокси(дифеRt (2,25 хв.). ніл)метил]-1-{3-[(2-гідроксифеніл)окси]пропіл}-1Приклад 46: Одержання 1-{3-[(2азоніабіцикло[2.2.2]октанброміду. бромфеніл)окси]пропіл}-4-[гідрокси(дифеніл)меДотримуючись загальної процедури, описаної тил]-азоніабіцикло[2.2.2]октанброміду. у прикладі 3, здійснюють взаємодію 1Дотримуючись загальної процедури, описаної азабіцикло[2.2.2]окт-4-іл(дифеніл)метанолу у прикладі 3, здійснюють взаємодію 1(0,0505 г, 0,172 ммоль) і 2-[(3азабіцикло[2.2.2]окт-4-іл(дифеніл)метанолу бромпропіл)окси]фенолу (0,0547 г, 0,236 ммоль) у (0,0472 г, 0,161 ммоль) і простого 2-бромфеніл-32 CH3CN / 3 СНСІ3 (4,0 мл) для одержання бажабромпропілефіру (0,0648 г, 0,220 ммоль) у 2 + ного продукту (0,0675 г, 75,0%). ΕΘ-MS m/z 444(M ) CH3CN / 3 СНСІ3 (4,0 мл) для одержання бажаного + Rt (1,91 хв.). продукту (0,0703 г, 74,8%). ΕΘ-MS m/z 507(M ) Rt Приклад 41: Одержання 4(2,18 хв.). [гідрокси(дифеніл)метил]-1-[3-(2-нафталенілокси) Приклад 47: Одержання 4пропіл]-1-азоніабіцикло[2.2.2]октанброміду. [гідрокси(дифеніл)метил]-1-[3-({4-[(фенілметил) Дотримуючись загальної процедури, описаної окси]феніл}окси)пропіл]у прикладі 3, здійснюють взаємодію 1азоніабіцикло[2.2.2]октанброміду. азабіцикло[2.2.2]окт-4-іл(дифеніл)метанолу Дотримуючись загальної процедури, описаної (0,0472 г, 0,160 ммоль) і простого 3-бромпропіл-2у прикладі 3, здійснюють взаємодію 1нафталенілефіру (0,0618 г, 0,233 ммоль) у 2 азабіцикло[2.2.2]окт-4-іл(дифеніл)метанолу CH3CN / 3 СНСІ3 (4,0 мл) для одержання бажаного (0,0479 г, 0,163 ммоль) і 1-[(3-бромпропіл)окси]-4+ продукту (0,0567 г, 63,7%). ΕΘ-MS m/z 478(М ) Rt [(фенілметил)окси]бензолу (0,0730 г, 0,227 ммоль) (2,22 хв.). у 2 CH3CN / 3 СНСІ3 (4,0 мл) для одержання бажа+ Приклад 42: Одержання 1-{3-[(3-хлорфеніл)окного продукту (0,0833 г, 83,3%). ЕІ-MS m/z 534(M ) си]пропіл}-4-[гідрокси(дифеніл)метил]-1-азоніабіRt (2,31 хв.). цикло[2.2.2]октанброміду. Приклад 48: Одержання 4Дотримуючись загальної процедури, описаної [гідрокси(дифеніл)метил]-1-[3-(метилокси) пропіл]у прикладі 3, здійснюють взаємодію 1азоніабіцикло[2.2.2]октанброміду. азабіцикло[2.2.2]окт-4-іл(дифеніл)метанолу Дотримуючись загальної процедури, описаної (0,0479 г, 0,163 ммоль) і простого 3-бромпропіл-3у прикладі 3, здійснюють взаємодію 1хлорфенілефіру (0,0552 г, 0,221 ммоль) у 2 CH3CN азабіцикло[2.2.2]окт-4-іл(дифеніл)метанолу / 3 СНСІ3 (4,0 мл) для одержання бажаного проду(0,0632 г, 0,215 ммоль) і простого бромпропілме+ кту (0,0655 г, 74,4%). ΕΘ-MS m/z 462(M )Rt (2,17 тилефіру (0,0461 г, 0,301 ммоль) у 2 CH3CN / 3 хв.). СНСІ3 (4,0 мл) для одержання бажаного продукту + (0,0826 г, 83,3%). ΕΘ-MS m/z 366(M ) Rt (1,55 хв.). 29 95768 30 Приклад 49: Одержання 4Приклад 53: Одержання 4-[біс(4[гідрокси(дифеніл)метил]-1-(2-пропен-1-іл)-1фторфеніл)(гідрокси)метил]-1{2-[(фенілметил) азоніабіцикло[2.2.2]октанброміду. окси]етил}-1-азоніабіцикло[2.2.2]октанброміду. Дотримуючись загальної процедури, описаної Дотримуючись загальної процедури, описаної у прикладі 3, здійснюють взаємодію 1у прикладі 3, здійснюють взаємодію 1азабіцикло[2.2.2]окт-4-іл(дифеніл)метанолу азабіцикло[2.2.2]окт-4-іл[біс(4(0,0577 г, 0,197 ммоль) і 3-бром-1-пропену (0,025 фторфеніл)]метанолу (0,0489 г, 0,148 ммоль) і мл, 0,289 ммоль) у 2 CH3CN / 3 СНСІ3 (4,0 мл) для простого 2-брометилфенілметилефіру (0,0352 мл, одержання бажаного продукту (0,0646 г, 79,8%). 0,222 ммоль) у 2 CH3CN / 3 СНСІ3 (4,0 мл) для + ΕΘ-MS m/z 334(M ) Rt (1,54 хв.). одержання бажаного продукту (0,0534 г, 66,1%). + Приклад 50: Одержання 4-[гідрокси(дифеЕІ-MS m/z 464(M ) Rt (1,99 xв.). ніл)метил]-1-(3-{[4-(метилокси)феніл]окси}пропіл)Приклад 54: Одержання 4-(гідрокси{біс[31-азоніабіцикло[2.2.2]октанброміду. (метилокси)феніл]}метил]-1-[3-(фенілокси)пропіл]Дотримуючись загальної процедури, описаної 1-азоніабіцикло[2.2.2]октанброміду. у прикладі 3, здійснюють взаємодію 11-азабіцикло[2.2.2]окт-4-іл[3-(метилокси)феазабіцикло[2.2.2]окт-4-іл(дифеніл)метанолу ніл]}метанол (0,0483 г, 0,164 ммоль) і 1-[(3-бромпропіл)окси]-4Розчин 3-(метилокси)фенілмагнійброміду (0,5 (метилокси)бензолом (0,052 мл, 0,21 ммоль) у 2 Μ в THF, 6,5 мл, 3,25 ммоль) охолоджують до 0°С CH3CN / 3 СНСІз (4,0 мл) для одержання бажаного в атмосфері Аr. Етил-1-азабіцикло[2.2.2]октан-4+ продукту (0,0687 г, 77,5%). ΕΘ-MS m/z 458(М ) Rt карбоксилат (0,1587 г, 0,866 ммоль) у THF (4 мл) (2,03 хв.). повільно додають до реакційної суміші при 0°С Приклад 51: Одержання [1-(2-аміноетил)-1впродовж 20 хв. Реакційній суміші дають можлиазоніабіцикло[2.2.2]окт-4вість зігрітися до кімнатної температури і потім іл](дифеніл)метанолаттрифторацетату. нагрівають при 60°С впродовж 16 год. Реакційну До розчину 1-[2-(1,3-діоксио-1,3-дигідро-2Нсуміш охолоджують у крижаній бані, гасять насиізоіндол-2-іл)етил]-4-[гідрокси (дифеніл)метил]-1ченим NH4CI і концентрують у вакуумі. Одержаний азоніабіцикло[2.2.2]октанброміду (0,078 г, 0,142 залишок обробляють Н2О та екстрагують ЕtOАс. ммоль) в ЕtOН (4,0 мл) додають гідразин (0,25 мл. Об'єднані органічні шари сушать MgSO4, фільтру7,96 ммоль). Розчин перемішують при кімнатній ють і концентрують у вакуумі для виходу бажаного + температурі впродовж 16 год. і потім фільтрують. продукту (0,2881 г, 92,9%). ΕΘ-MS m/z 354(M+H ) Rt Фільтрат концентрують і збирають у 2,5 мл DMSO (1,46 хв.). та очищують препаративною ВЕРХ (з TFA) для 4-(гідрокси{біс[3-(метилокси)феніл1}метил)-1одержання вказаної у заголовку сполуки (0,0200 г, [3-(фенілокси)пропіл]-1-азоніабіиикло[2.2.2]октан+ 31,2%). ΕΘ-MS m/z 338(M ) Rt (1,28 хв.). бромід Приклад 52: Одержання 4-[біс(4Дотримуючись загальної процедури, описаної фторфеніл)(гідрокси)метил]-1-[3-(фенілокси)проу прикладі 3, здійснюють взаємодію 1піл]-1-азоніабіцикло[2.2.2]октанброміду. азабіцикло[2.2.2]окт-4-іл{біс[41-азабіцикло[2.2.2]окт-4-іл[4-фторфеніл]мета(метилокси)феніл]}метанолу (0,0525 г, 0,148 нол ммоль) і простого 3-бромпропілфенілефіру (0,0351 Розчин 4-фторфенілмагнійброміду (1,0 Μ в мл, 0,214 ммоль) у 2 CH3CN / 3 СНСІ3 (4,0 мл) для THF, 4,4 мл, 4,4 ммоль) охолоджують до 0°С в одержання бажаного продукту (0,027 г, 33,2%). EI+ атмосфері Аr. Етил-1-азабіцикло[2.2.2]октан-4MS m/z 488(M ) Rt (2,02 хв.). карбоксилат (0,1973 г, 1,08 ммоль) у THF (4 мл) Приклад 55: Одержання 4-(гідрокси{біс[3повільно додають до реакційної суміші при 0°С (метилокси)феніл]}метил)-1-{2-[(фенілметил)окси] впродовж 20 хв. Реакційній суміші дають можлиетил}-1-азоніабіцикло[2.2.2]октанброміду. вість зігрітися до кімнатної температури і потім Дотримуючись загальної процедури, описаної нагрівають при 60°С впродовж 16 год. Реакційну у прикладі 3, здійснюють взаємодію 1суміш охолоджують у крижаній бані та гасять наазабіцикло[2.2.2]окт-4-іл{біс[3сиченим NH4CI і концентрують у вакуумі. Одержа(метилокси)феніл]}метанолу (0,0538 г, 0,152 ний залишок обробляють Н2О та екстрагують ммоль) і простого 2-брометилфенілметилефіру ЕtOАс. Об'єднані органічні шари сушать MgSO4, (0,0361 мл, 0,228 ммоль) у 2 CH3CN / 3 СНСІ3 (4,0 фільтрують і концентрують у вакуумі для виходу мл) для одержання бажаного продукту (0,0292 г, + бажаного продукту (0,3152 г, 88,9%). ΕΘ-MS m/z 33,8%). EI-MS m/z 488(M ) Rt (2,03 хв.). + 330(M+H ) Rt (1,65 хв.). Приклад 56: Одержання 4-(гідрокси{біс[44-[біс(4-фторфеніл)(гідрокси)метилі-1-[3(метилокси)феніл]}метил)-1-[3-(фенілокси)пропіл](фенілокси)пропіл]-1-азоніабіцикло[2.2.2]октанбро1-азоніабіцикло[2.2.2]октанброміду. мід 1-азабіцикло[2.2.2]окт-4-іл{біс[4-(метилокси) Дотримуючись загальної процедури, описаної феніл]}метанол у прикладі 3, здійснюють взаємодію 1Розчин 4-(метилокси)фенілмагнійброміду (0,5 азабіцикло[2.2.2]окт-4-іл[біс(4Μ в THF, 6,5 мл, 3,25 ммоль) охолоджують до 0°С фторфеніл)]метанолу (0,0538 г, 0,163 ммоль) і в атмосфері Аr. Етил-1-азабіцикло[2.2.2]октан-4простого 3-бромпропілфенілефіру (0,0386 мл, карбоксилат (0,1587 г, 0,866 ммоль) у THF (4 мл) 0,245 ммоль) у 2 CH3CN / 3 СНСІ3 (4,0 мл) для повільно додають до реакційної суміші при 0°С одержання бажаного продукту (0,058 г, 65,2%). ΕΘвпродовж 20 хв. Реакційній суміші дають можли+ MS m/z 464(M ) Rt (2,16 хв.). вість зігрітися до кімнатної температури і потім нагрівають при 60°С впродовж 16 год. Реакційну 31 95768 32 суміш охолоджують у крижаній бані, гасять насиазабіцикло[2.2.2]окт-4-іл[біс(3ченим NH4CI і концентрують у вакуумі. Одержаний фторфеніл)]метанолу (0,0507 г, 0,154 ммоль) і залишок обробляють Н2О та екстрагують ЕtOАс. простого 2-брометилфенілметилефіру (0,0365 мл, Об'єднані органічні шари сушать MgSO4, фільтру0,230 ммоль) у 2 CH3CN / 3 СНСІ3 (4,0 мл) для ють і концентрують у вакуумі для виходу бажаного одержання бажаного продукту (0,0362 г, 43,2%). + + продукту (0,273 г, 89,0%). ΕΘ-MS m/z 354(M+H ) Rt ЕІ-MS m/z 464(M ) Rt (2,02 хв.). (1,74 хв.). Приклад 60: Одержання 4-{гідрокси[біс(34-(гідрокси{біс[3-(метилокси)феніл)метил)-1-[3метилфеніл)метил}-1-[3-(фенілокси)пропіл]-1(фенілокси)пропіл]-1-азоніабіцикло[2.2.2]октанброазоніабіцикло[2.2.2]октанброміду. мід 1-азабіцикло[2.2.2]окт-4-іл[біс(3Дотримуючись загальної процедури, описаної метилфеніл)]метанол у прикладі 3, здійснюють взаємодію 1Розчин 3-метилфенілмагнійброміду (1,0 Μ у азабіцикло[2.2.2]окт-4-іл{біс[4THF, 3,3 мл, 3,3 ммоль) охолоджують до 0°С в (метилокси)феніл]}метанолу (0,0525 г, 0,148 атмосфері Аr. Етил-1-азабіцикло[2.2.2]октан-4ммоль) і простого 3-бромпропілфенілефіру (0,0351 карбоксилат (0,1484 г, 0,810 ммоль) у THF (4 мл) мл, 0,222 ммоль) у 2 CH3CN / 3 СНСІ3 (4,0 мл) для повільно додають до реакційної суміші при 0°С одержання бажаного продукту (0,0515 г, 61,0%). впродовж 20 хв. Реакційній суміші дають можли+ ЕІ-MS m/z 488(M ) Rt (2,04 хв.). вість зігрітися до кімнатної температури і потім Приклад 57: Одержання 4-(гідрокси{біс[4нагрівають при 60°С впродовж 16 год. Реакційну (метилокси)феніл]}метил)-1-{2суміш охолоджують у крижаній бані, гасять наси[(фенілметил)окси]етил}-1ченим NH4CI і концентрують у вакуумі. Одержаний азоніабіцикло[2.2.2]октанброміду. залишок обробляють Н2О та екстрагують ЕtOАс. Дотримуючись загальної процедури, описаної Об'єднані органічні шари сушать MgSO4, фільтруу прикладі 3, здійснюють взаємодію 1ють і концентрують у вакуумі для виходу бажаного + азабіцикло[2.2.2]окт-4-іл{біс[4продукту (0,1806 г, 69,4%). ΕΘ-MS m/z 322(M+H ) Rt (метилокси)феніл]}метанолу (0,0498 г, 0,141 (1,54 хв.). ммоль) і простого 2-брометилфенілметилефіру 4-(гідрокси{біс[3-(метилокси)феніл]}метил)-1(0,0334 мл, 0,211 ммоль) у 2 CH3CN / 3 СНСІ3 (4,0 [3-(фенілокси)пропіл]-1-азоніабіцикло[2.2.2]октанмл) для одержання бажаного продукту (0,0374 г, бромід + 46,7%). ЕІ-MS m/z 488(M ) Rt (1,94 хв.). Дотримуючись загальної процедури, описаної Приклад 58: Одержання 4-[біс-(3у прикладі 3, здійснюють взаємодію 1фторфеніл)(гідрокси)метил]-1-[3-(фенілокси)проазабіцикло[2.2.2]окт-4-іл[біс(3піл]-1-азоніабіцикло[2.2.2]октанброміду. (метилфеніл)]метанолу (0,0487 г, 0,151 ммоль) і 1-азабіцикло[2.2.2]окт-4-іл[біс[3простого 3-бромпропілфенілефіру (0,0358 мл, фторфеніл]}метанол 0,227 ммоль) у 2 CH3CN / 3 СНСІ3 (4,0 мл) для Розчин 3-фторфенілмагнійброміду (1,0 Μ у одержання бажаного продукту (0,0284 г, 34,9%). + THF, 3,3 мл, 3,3 ммоль) охолоджують до 0°С в ΕΘ-MS m/z 456(M ) Rt (2,14 хв.). атмосфері Аr. Етил-1-азабіцикло[2.2.2]октан-4Приклад 61: Одержання 4-{гідрокси[біс-(3карбоксилат (0,1756 г, 0,958 ммоль) у THF (4 мл) метилфеніл)]метил}-1-{2-[(фенілметил)окси]етил}повільно додають до реакційної суміші при 0°С 1-азоніабіцикло[2.2.2]октанброміду. впродовж 20 хв. Реакційній суміші дають можлиДотримуючись загальної процедури, описаної вість зігрітися до кімнатної температури і потім у прикладі 4, здійснюють взаємодію 1нагрівають при 60°С впродовж 16 год. Реакційну азабіцикло[2.2.2]окт-4-іл[біс(3суміш охолоджують у крижаній бані, гасять насифторфеніл)]метанолу (0,0496 г, 0,154 ммоль) і ченим NH4CI і концентрують у вакуумі. Одержаний простого 2-брометилфенілметилефіру (0,0364 мл, залишок обробляють Н2О та екстрагують ЕtOАс. 0,230 ммоль) у 2 CH3CN / 3 СНСІ3 (4,0 мл) для Об'єднані органічні шари сушать MgSO4, фільтруодержання бажаного продукту (0,0091 г, 11,0%). + ють і концентрують у вакуумі для виходу бажаного ΕΘ-MS m/z 456(M ) Rt (2,20 хв.). + продукту (0,242 г, 76,7%). ΕΘ-MS m/z 330(M+H ) Rt Приклад 62: Одержання 4-{гідрокси[біс(4(1,45 хв.). метилфеніл)]метил}-1-[3-(фенілокси)пропіл]-14-(гідрокси{біс[3-(метилокси)феніл]}метил)-1азоніабіцикло[2.2.2]октанброміду. [3-(фенілокси)пропіл]-1-азоніабіцикло[2.2.2]октан1-азабіиикло[2.2.2]окт-4-іл[біс(4-метилфеніл)] бромід метанол Дотримуючись загальної процедури, описаної Розчин 4-метилфенілмагнійброміду (1,0 Μ у у прикладі 3, здійснюють взаємодію 1THF, 3,3 мл, 3,3 ммоль) охолоджують до 0°С в азабіцикло[2.2.2]окт-4-іл[біс(3атмосфері Аr. Етил-1-азабіцикло[2.2.2]октан-4(фторфеніл)]метанолу (0,0515 г, 0,156 ммоль) і карбоксилат (0,1509 г, 0,823 ммоль) у THF (4 мл) простого 3-бромпропілфенілефіру (0,0370 мл, повільно додають до реакційної суміші при 0°С 0,234 ммоль) у 2 CH3CN / 3 СНСІ3 (4,0 мл) для впродовж 20 хв. Реакційній суміші дають можлиодержання бажаного продукту (0,0381 г, 61,0%). вість зігрітися до кімнатної температури і потім + ΕΘ-MS m/z 464(М ) Rt (2,01 хв.). нагрівають при 60°С впродовж 16 год. Реакційну Приклад 59: Одержання 4-[біс-(3суміш охолоджують у крижаній бані, гасять насифторфеніл)(гідрокси)метил]-1-{2-[(фенілметил) ченим NH4CI і концентрують у вакуумі. Одержаний окси]етил}-1-азоніабіцикло[2.2.2]октанброміду. залишок обробляють Н2О та екстрагують ЕtOАс. Дотримуючись загальної процедури, описаної Об'єднані шари сушать MgSO4, фільтрують і кону прикладі 3, здійснюють взаємодію 1центрують у вакуумі для виходу бажаного продук 33 95768 34 + ту (0,2291 г, 86,6%). ΕΘ-MS m/z 322(M+H ) Rt (1,57 Приклад 66: Одержання 1-{3-[(2хв.). фторфеніл)окси}пропіл}-4-[гідрокси (дифе4-(гідрокси{біс[3-(метилокси)феніл]}метил)-1ніл)метил]-1-азоніабіцикло[2.2.2]октанброміду. [3-(фенілокси)пропіл]-1Простий 3-бромпропіл-2-фторфенілефір азоніабіцикло[2.2.2]октанбромід До розчину 2-фторфенолу (0,040 мл, 0,448 Дотримуючись загальної процедури, описаної ммоль) в ацетонітрилі (4 мл) додають 1,3у прикладі 3, здійснюють взаємодію 1дибромпропан (0,450 мл, 4,43 ммоль) з подальазабіцикло[2.2.2]окт-4-іл[біс(4шим додаванням Cs2CO3 (0,232 г, 0,713 ммоль). (метилфеніл)]метанолу (0,0618 г, 0,192 ммоль) і Реакційну суміш перемішують впродовж 24 год. і простого 3-бромпропілфенілефіру (0,0454 мл, потім концентрують у вакуумі. Одержаний залишок 0,228 ммоль) у 2 CH3CN / 3 СНСІ3 (4,0 мл) для обробляють Н2О (4 мл) та екстрагують DCM (8 одержання бажаного продукту (0,0427 г, 41,5%). мл). Органічний шар сушать, пропускаючи крізь + ΕΘ-MS m/z 456(M ) Rt (1,99 хв.). фазовий сепаратор, і концентрують у вакуумі. ЗаПриклад 63: Одержання 4-{гідрокси[біс(4лишок збирають DMSO і очищують препаративметилфеніл)]метил}-1-{2-[(фенілметил)окси]етил}ною ВЕРХ (без TFA) для виходу бажаного продук1-азоніабіцикло[2.2.2]октанброміду. ту (0,0274 г, 26,2%). ΕΘ-MS Rt (2,24 хв.). Дотримуючись загальної процедури, описаної 1-{3-[(2-фторфеніл)окси]пропіл)-4-[гідрокси(диу прикладі 3, здійснюють взаємодію 1феніл)метил]-1-азоніабіиикло[2.2.2]октанбромід азабіцикло[2.2.2]окт-4-іл[біс(4Дотримуючись загальної процедури, описаної метилрфеніл)]метанолу (0,0387 г, 0,245 ммоль) і у прикладі 3, здійснюють взаємодію 1простого 2-брометилфенілметилефіру (0,0364 мл, азабіцикло[2.2.2]окт-4-іл(дифеніл)метанолу 0,230 ммоль) у 2 CH3CN / 3 СНСІ3 (4,0 мл) для (0,0282 г, 0,0960 ммоль) і простого 3-бромпропіл-2одержання бажаного продукту (0,0465 г, 53,1%). фторфенілефіру (0,0274 г, 0,118 ммоль) у 2 + ΕΘ-MS m/z 456(M ) Rt (2,09 хв.). CH3CN / 3 СНСІ3 (4,0 мл) для одержання бажаного + Приклад 64: Одержання 4-[гідрокси(ди-2продукту (0,0345 г, 68,3%). ΕΘ-MS m/z 446(M ) Rt нафталеніл)метил}-1-[3-(фенілокси)пропіл]-1(1,96 хв.). азоніабіцикло[2.2.2]октанброміду. Приклад 67: Одержання 1-{3-[(31-азабіцикло(2.2.2]окт-4-іл(ди-2-нафталеніл) фторфеніл)окси}пропіл}-4-[гідрокси(дифеніл)меметанол тил]-1-азоніабіцикло[2.2.2]октанброміду. Розчин (2-нафталеніл)магнійброміду (0,5 Μ у Простий 3-бромпропіл-3-фторфенілеФір THF, 6,5 мл, 3,25 ммоль) охолоджують до 0°С в До розчину 3-фторфенолу (0,040 мл, 0,448 атмосфері Аr. Етил-1-азабіцикло[2.2.2]октан-4ммоль) в ацетонітрилі (4 мл) додають 1,3карбоксилат (0,1597 г, 0,871 ммоль) у THF (4 мл) дибромпропан (0,450 мл, 4,43 ммоль) з подальповільно додають до реакційної суміші при 0°С шим додаванням Cs2CO3 (0,246 г, 0,756 ммоль). впродовж 20 хв. Реакційній суміші дають можлиРеакційну суміш перемішують впродовж 24 год. і вість зігрітися до кімнатної температури і потім потім концентрують у вакуумі. Одержаний залишок нагрівають при 60°С впродовж 16 год. Реакційну обробляють Н2О (4 мл) та екстрагують DCM (8 суміш охолоджують у крижаній бані, гасять насимл). Органічний шар сушать, пропускаючи крізь ченим NH4CI і концентрують у вакуумі. Одержаний фазовий сепаратор, і концентрують у вакуумі. Зазалишок обробляють Н2О та екстрагують ЕtOАс. лишок збирають DMSO і очищують препаративОб'єднані шари сушать MgSO4, фільтрують і конною ВЕРХ (без TFA) для виходу бажаного продукцентрують у вакуумі для виходу бажаного продукту (0,0137 г, 13,2%). ΕΘ-MS Rt (2,28 хв.). + ту (0,265 г, 77,3%). ΕΘ-MS m/z 394(M+H ) Rt (1,90 1-{3-[(3-фторфеніл)окси]пропіл}-4-[гідрокси хв.). (дифеніл)метил]-1-азоніабіцикло[2.2.2]октанбромід 4-(гідрокси{біс[3-(метилокси)феніл]}метил)-1Дотримуючись загальної процедури, описаної [3-(фенілокси)пропіл]-1-азоніабіцикло[2.2.2]октану прикладі 3, здійснюють взаємодію 1бромід азабіцикло[2.2.2]окт-4-іл(дифеніл)метанолу Дотримуючись загальної процедури, описаної (0,0137 г, 0,0467 ммоль) і простого 3-бромпропіл-3у прикладі 3, здійснюють взаємодію 1фторфенілефіру (0,0137 г, 0,0588 ммоль) у 2 азабіцикло[2.2.2]окт-4-іл(ди-2CH3CN / 3 СНСІ3 (4,0 мл) для одержання бажаного + нафталеніл)метанолу (0,0547 г, 0,139 ммоль) і продукту (0,0130 г, 53,1%). ΕΘ-MS m/z 446(М ) Rt простого 3-бромпропілфенілефіру (0,0329 мл, (2,03 хв.). 0,209 ммоль) у 2 CH3CN / 3 СНСІ3 (4,0 мл) для Приклад 68: Одержання 1-{3-[(4одержання бажаного продукту (0,0268 г, 31,7%). фторфеніл)окси}пропіл}-4-[гідрокси (дифе+ ΕΘ-MS m/z 528(M ) Rt (2,88 хв.). ніл)метил]-1-азоніабіцикло[2.2.2]октанброміду. Приклад 65: Одержання 4-[гідрокси(ди-2Простий 3-бромпропіл-4-фторфенілефір нафталеніл)метил]-1-{2-[(фенілметил)окси]етил}-1До розчину 4-фторфенолу (0,0567 мл, 0,506 азоніабіцикло[2.2.2]октанброміду. ммоль) в ацетонітрилі (4 мл) додають 1,3Дотримуючись загальної процедури, описаної дибромпропан (0,520 мл, 5,12 ммоль) з подальу прикладі 3, здійснюють взаємодію 1шим додаванням Cs2CO3 (0,252 г, 0,774 ммоль). азабіцикло[2.2.2]окт-4-іл(ди-2Реакційну суміш перемішують впродовж 24 год. і нафталеніл)метанолу (0,0637 г, 0,162 ммоль) і потім концентрують у вакуумі. Одержаний залишок простого 2-брометилфенілметилефіру (0,0384 мл, обробляють Н2О (4 мл) і екстрагують DCM (8 мл). 0,243 ммоль) у 2 CH3CN / 3 СНСІ3 (4,0 мл) для Органічний шар сушать, пропускаючи крізь фазоодержання бажаного продукту (0,0246 г, 25,0%). вий сепаратор, і концентрують у вакуумі. Залишок + ΕΘ-MS m/z 528(M ) Rt (2,36 хв.). збирають DMSO і очищують препаративною ВЕРХ 35 95768 36 (без TFA) для виходу бажаного продукту (0,0173 г, Приклад 71: Одержання 414,7%). ΕΘ-MS Rt (2,25 хв.). [гідрокси(дифеніл)метил]-1-{3-[(3-нітрофеніл) ок1-{3-[(4-фторфеніл)окси]пропіл}-4-[гідрокси(диси]пропіл}-1-азоніабіцикло[2.2.2]октанброміду. феніл)метил]-1-азоніабіцикло[2.2.2]октанбромід Простий 3-бромпропіл-3-нітрофенілефір Дотримуючись загальної процедури, описаної До розчину 3-нітрофенолу (0,0689 г, 0,495 у прикладі 3, здійснюють взаємодію 1ммоль) в ацетонітрилі (4 мл) додають 1,3азабіцикло[2.2.2]окт-4-іл(дифеніл)метанолу дибромпропан (0,500 мл, 3,05 ммоль) з подаль(0,0182 г, 0,0621 ммоль) і простого 3-бромпропіл-4шим додаванням Cs2CO3 (0,244 г, 0,748 ммоль). фторфенілефіру (0,0173 г, 0,0742 ммоль) у 2 Реакційну суміш перемішують впродовж 24 год. і CH3CN / 3 СНСІ3 (4,0 мл) для одержання бажаного потім концентрують у вакуумі. Одержаний залишок + продукту (0,0143 г, 43,7%). ΕΘ-MS m/z 446(M ) Rt обробляють Н2О (4 мл) та екстрагують DCM (8 (1,96 хв.). мл). Органічний шар сушать, пропускаючи крізь Приклад 69: Одержання 1-[3-(3фазовий сепаратор, і концентрують у вакуумі. Забіфенілокси)пропіл]-4-[гідрокси (дифеніл)метил]-1лишок збирають у DMSO і очищують препаративазоніабіцикло[2.2.2]октанброміду. ною ВЕРХ (без TFA) для одержання вказаної у Простий 3-біфеніліл-3-бромпропілефір заголовку сполуки (0,0730 г, 56,6%). ΕΘ-MS Rt (2,20 До розчину 3-біфенілолу (0,0574 г, 0,337 хв.). ммоль) в ацетонітрилі (4 мл) додають 1,34-[гідрокси(дифеніл)метил]-1-{3-[(3-нітродибромпропан (0,340 мл, 3,35 ммоль) з подальфеніл)окси]пропіл}-1шим додаванням Сs2СО3 (0,172 г, 0,529 ммоль). азоніабіцикло[2.2.2]октанбромід Реакційну суміш перемішують впродовж 24 год. і Дотримуючись загальної процедури, описаної потім концентрують у вакуумі. Одержаний залишок у прикладі 3, здійснюють взаємодію 1обробляють Н2О (4 мл) та екстрагують DCM (8 азабіцикло[2.2.2]окт-4-іл(дифеніл)метанолу мл). Органічний шар сушать, пропускаючи крізь (0,0608 г, 0,207 ммоль) і простого 3-бромпропіл-3фазовий сепаратор, і концентрують у вакуумі. Занітрофенілефіру (0,0730 г, 0,281 ммоль) у 2 CH3CN лишок збирають DMSO і очищують препаратив/ 3 СНСІ3 (4,0 мл) для одержання бажаного проду+ ною ВЕРХ (без TFA) для одержання бажаного кту (0,0942 г, 82,2%). ΕΘ-MS m/z 474(М ) Rt (2,04 продукту (0,0568 г, 57,8%). ΕΘ-MS Rt (2,59 хв.). хв.). 1-{3-(3-біФенілокси)пропіл]-4Приклад 72: Одержання 4[гідрокси(дифеніл)метил]-1[гідрокси(дифеніл)метил]-1-{3-[(2азоніабіцикло[2.2.2]октанбромід метилфеніл)окси]пропіл}-1Дотримуючись загальної процедури, описаної азоніабіцикло[2.2.2]октанброміду. у прикладі 3, здійснюють взаємодію 1Простий 3-бромпропіл-2-метилфенілефір азабіцикло[2.2.2]окт-4-іл(дифеніл)метанолу До розчину 2-нітрофенолу (0,0954 г, 0,924 (0,0433 г, 0,148 ммоль) і простого 3-біфеніліл-3ммоль) в ацетонітрилі (4 мл) додають 1,3бромпропілефіру (0,0568 г, 0,196 ммоль) у 2 дибромпропан (1,00 мл, 9,85 ммоль) з подальшим CH3CN / 3 СНСІ3 (4,0 мл) для одержання бажаного додаванням Cs2CO3 (0,469 г, 1,44 ммоль). Реак+ продукту (0,0610 г, 70,6%). ΕΘ-MS m/z 504(М ) Rt ційну суміш перемішують впродовж 24 год. і потім (2,37 хв.). концентрують у вакуумі. Одержаний залишок обПриклад 70: Одержання 1-[3-(4робляють Н2О (4 мл) та екстрагують DCM (8 мл). біфенілокси)пропіл]-4-[гідрокси (дифеніл)метил]-1Органічний шар сушать, пропускаючи крізь фазоазоніабіцикло[2.2.2]октанброміду. вий сепаратор, і концентрують у вакуумі. Залишок Простий 4-біфеніліл-3-бромпропілефір збирають у DMSO і очищують препаративною До розчину 4-біфенілолу (0,0514 мл, 0,302 ВЕРХ (без TFA) для одержання вказаної у заголоммоль) в ацетонітрилі (4 мл) додають 1,3вку сполуки (0,0934 г, 44,1%). ΕΘ-MS Rt (2,45 хв.). дибромпропан (0,310 мл, 3,05 ммоль) з подаль4-[гідрокси(дифеніл)метил]-1-{3-[(2шим додаванням Cs2CO3 (0,154 г, 0,472 ммоль). метилфеніл)окси]пропіл}-1Реакційну суміш перемішують впродовж 24 год. і азоніабіцикло[2.2.2]октанбромід потім концентрують у вакуумі. Одержаний залишок Дотримуючись загальної процедури, описаної обробляють Н2О (4 мл) та екстрагують DCM (8 у прикладі 3, здійснюють взаємодію 1мл). Органічний шар сушать, пропускаючи крізь азабіцикло[2.2.2]окт-4-іл(дифеніл)метанолу фазовий сепаратор, і концентрують у вакуумі. За(0,0447 г, 0,152 ммоль) і простого 3-бромпропіл-3лишок збирають DMSO і очищують препаративметилфенілефіру (0,0934 г, 0,407 ммоль) у 2 ною ВЕРХ (без TFA) для одержання бажаного CH3CN / 3 СНСІ3 (4,0 мл) для одержання бажаного + продукту (0,0562 г, 64,0%). ΕΘ-MS Rt (2,62 хв.). продукту (0,0586 г, 76,5%). ΕΘ-MS m/z 442(M ) Rt 1-[3-(4-біфенілокси)пропіл]-4-[гідрокси(дифе(2,17 хв.). ніл)метил]-1-азоніабіиикло[2.2.2]октанбромід Приклад 73: Одержання 1-(3-{[3Дотримуючись загальної процедури, описаної (діетиламіно)феніл]окси}пропіл}-4-[гідрокси(дифеу прикладі 3, здійснюють взаємодію 1ніл)метил]-1-азоніабіцикло[2.2.2]октанброміду. азабіцикло[2.2.2]окт-4-іл(дифеніл)метанолу 3-[(3-бромпропіл)окси]-N,N-діетиланілін (0,0437 г, 0,144 ммоль) і простого 4-біфеніліл-3До розчину 3-(діетиламіно)фенолу (0,0104 г, бромпропілефіру (0,0562 г, 0,194 ммоль) у 2 0,631 ммоль) в ацетонітрилі (4 мл) додають 1,3CH3CN / 3 СНСІ3 (4,0 мл) для одержання бажаного дибромпропан (0,640 мл, 6,30 ммоль) з подаль+ продукту (0,0655 г, 75,2%). ΕΘ-MS m/z 504(М ) Rt шим додаванням Cs2CO3 (0,313 г, 0,961 ммоль). (2,247 хв.). Реакційну суміш перемішують впродовж 24 год. і потім концентрують у вакуумі. Одержаний залишок 37 95768 38 обробляють Н2О (4 мл) та екстрагують DCM (8 заної у заголовку сполуки (114 мг, 42%). Продукт 1 мл). Органічний шар сушать, пропускаючи крізь характеризують Н ЯМР (400 мГц) у CDCI3. фазовий сепаратор, і концентрують у вакуумі. За1-{[(2-брометил)окси]метил}-3лишок збирають у DMSO і очищують препаратив(метилокси)бензол ною ВЕРХ (без TFA) для одержання вказаної у Розчин N-бромсукциніміду (272 мг, 1,53 заголовку сполуки (0,0314 г, 17,4%). ΕΘ-MS m/z ммоль) у DCM (2,5 мл) додають до зв'язаного зі + 286(M+H ) Rt (1,59 хв.). смолою трифенілфосфіну (510 мг, 1,53 міліеквіва1-(3-{[3-діетиламіно)феніл]окси}пропіл)-4ленти, Fluka) у DCM (2,5 мл). Реакційну суміш пе[гідрокси(дифеніл)метил-1-азоніабіцикло[2.2.2] ремішують при кімнатній температурі впродовж 10 октанбромід хв. До реакційної суміші додають 2-({[3Дотримуючись загальної процедури, описаної (метилокси)феніл]метил}окси)етанол (114 мг, у прикладі 3, здійснюють взаємодію 10,626 ммоль) у DCM (1,5 мл), і залишковий спирт азабіцикло[2.2.2]окт-4-іл(дифеніл)метанолу переносять додатковим DCM (1,5 мл). Реакційний (0,0257 г, 0,0876 ммоль) і 3-[(3-бромпропіл)окси]посуд обгортають в алюмінієву фольгу і переміN,N-діетиланіліну (0,0314 г, 0,110 ммоль) у 2 шують при кімнатній температурі впродовж 20 год. CH3CN / 3 СНСІ3 (4,0 мл) для одержання бажаного Реакційну суміш фільтрують крізь касету SPE (5 г + продукту (0,0320 г, 63,0%). ΕΘ-MS m/z 500(M ) Rt діоксиду кремнію), елююючи такими 10 мл фракці(1,58 хв.). ями: DCM (фракція 1), 30% ЕtOАс/гексанами (фраПриклад 74: Одержання 1-{3-[(4кція 2) і 50% ЕtOАс/гексанами (фракція 3) для ціанофеніл)окси]пропіл}-4-[гідрокси (дифеодержання вказаної у заголовку сполуки (160 мг). 1 ніл)метил]-1-азоніабіцикло[2.2.2]октанброміду. Продукт характеризують Н ЯМР (400 мГц) в 4-[(3-бромпропіл)окси]бензонітрил CDCI3. До розчину 4-гідроксибензонітрилу (0,109 г, 4-[гідрокси(дифеніл)метил]-1-[2-({[30,913 ммоль) в ацетонітрилі (4 мл) додають 1,3(метилокси)феніл]метил}окси)етил]-1дибромпропан (0,930 мл, 9,16 ммоль) з подальазоніабіцикло[2.2.2]октанбромід шим додаванням Cs2CO3 (0,439 г, 1,35 ммоль). 1-азабіцикло[2.2.2]окт-4-іл(дифеніл)метанол Реакційну суміш перемішують впродовж 24 год. і (30 мг, 0,102 ммоль) додають до розчину 1-{[(2потім концентрують у вакуумі. Одержаний залишок брометил)окси]метил}-3-(метилокси)бензолу (35 обробляють Н2О (4 мл) та екстрагують DCM (8 мг, 0,143 ммоль) у 2 CH3CN / 3 СНСІ3 (3,0 мл). Ремл). Органічний шар сушать, пропускаючи крізь акційну суміш нагрівають при 60°С впродовж 96 фазовий сепаратор, і концентрують у вакуумі. Загод. Реакційну суміш концентрують, і неочищений лишок збирають у DMSO і очищують препаративпродукт промивають ЕtOАс (3 × 1 мл) і потім Меною ВЕРХ (без TFA) для одержання вказаної у ОН (1 × 1 мл). Продукт сушать у високому вакуумі заголовку сполуки (0,156 г, 71,4%). ΕΘ-MS Rt (2,10 для одержання вказаної у заголовку сполуки (7,7 + хв.). мг, 14%). LC/MS ESI RT 1,97 хв. М 458. 1-{3-[(4міанофеніл)окси]пропіл}-4-[гідрокси(диПриклад 76: Одержання 1-[2-({[4-(1,1феніл)метил]-1-азоніабіцикло[2.2.2]октанбромід диметилетил)феніл]метил}окси)етил]-4-[гідрокси Дотримуючись загальної процедури, описаної (дифеніл)метил]-1у прикладі 3, здійснюють взаємодію 1азоніабіцикло[2.2.2]октанброміду. азабіцикло[2.2.2]окт-4-іл(дифеніл)метанолу 2-({[4-(1,1(0,0520 г, 0,177 ммоль) і 4-[(3диметилетил)феніл]метил)окси)етанол бромпропіл)окси]бензонітрилу (0,156 г, 0,652 Етиленгліколь (0,084 мл, 1,5 ммоль) додають ммоль) у 2 CH3CN / 3 СНСІ3 (4,0 мл) для одержандо NaH (38 мг, 1,52 ммоль, 95% в маслі) у THF (3 ня бажаного продукту (0,0726 г, 76,8%). ΕΘ-MS m/z мл). До реакційної суміші додають 1-(бромметил)+ 453(M ) Rt (1,86 хв.). 4-(1,1-диметилетил)бензол (0,28 мл, 1,5 ммоль) і Приклад 75: Одержання 4залишковий 1-(бромметил)-4-(1,1[гідрокси(дифеніл)метил]-1-[2-({[3диметилетил)бензол переносять у реакційну про(метилокси)феніл]метил}окси)етил]-1бірку додатковим THF (1 мл). Потім додають азоніабіцикло[2.2.2]октанброміду (Bu)4NI (55 мг, 0,15 ммоль), потім при кімнатній 2-({[3-(метилокси)феніл]метил}окси)етанол температурі впродовж 4 год. неочищений продукт Етиленгліколь (0,084 мл, 1,5 ммоль) додають очищають на касеті Biotage (5 г діоксиду кремнію), до NaH (38 мг, 1,52 ммоль, 95% в маслі) у THF (3 елююючи такими 10 мл фракціями: 10% мл) (застереження: екзотерм). До реакційної суміЕtOАс/гексанами (фракції 1,2), 30% ші додають м-метоксибензилхлорид (0,21 мл, 1,5 ЕtOАс/гексанами (фракції 3,4) і 50% ммоль) і залишковий м-метоксибензилхлорид пеЕtOАс/гексанами (фракції 5,6) для одержання вкареносять у реакційну пробірку додатковим THF (1 заної у заголовку сполуки (312 мг, 51%). Продукт 1 мл). Потім додають (Bu)4NI (55 мг, 0,15 ммоль), і характеризують Н ЯМР (400 мГц) у CDCI3. реакційну суміш нагрівають при 60°С впродовж 18 1-{[(2-брометил)окси]метил}-4-(1,1год. і потім охолоджують до кімнатної температури диметилетил)бензол впродовж 4 год. Додають Н2О (2 мл) і ЕtOАс (2 Розчин N-бромсукциніміду (272 мг, 1,53 мл), і шари відокремлюють за допомогою піпетки. ммоль) у DCM (2,5 мл) додають до зв'язаного зі Водний шар екстрагують ЕtOАс (1 × 1 мл), і об'єдсмолою трифенілфосфіну (510 мг, 1,53 міліеквіванані органічні шари концентрують. Неочищений ленти, Fluka) у DCM (2,5 мл), і реакційну суміш продукт очищують на касеті Biotage 12+М (8 г діокперемішують при кімнатній температурі впродовж сиду кремнію) з елююванням 30% 10 хв. До реакційної суміші додають розчин 2-({[4ЕtOАс/гексанами при 5 мл/хв. для одержання вка(1,1-диметилетил)феніл]метил}окси)етанолу (160 39 95768 40 мг, 0,768 ммоль) у DCM (1,5 мл), і залишковий 1-[2-{[(4-фторфеніл)метил]окси}етил]-4спирт переносять додатковим DCM (1,5 мл). Реак[гідрокси(дифеніл)метил]-1-азоніа6іцикло[2.2.2]окційний флакон закупорюють, обгортають в алюмітанбромід нієву фольгу і перемішують при кімнатній темпе1-азабіцикло[2.2.2]окт-4-іл(дифеніл)метанол ратурі впродовж 20 год. Реакційну суміш (30 мг, 0,102 ммоль) додають до розчину 1-{[(2фільтрують крізь касету SPE (5 г діоксиду кремброметил)окси]метил}-4-фторбензолу (33 мг, 0,143 нію), елююючи такими 10 мл фракціями: DCM ммоль) у 2:3 CH3CN / CHCI3 (3 мл), і реакційну су(фракція 1), 30% ЕtOАс/гексанами (фракція 2) і міш нагрівають при 60°С впродовж 96 год. Реак50% ЕtOАс/гексанами (фракція 3) для одержання ційну суміш концентрують, і неочищений продукт вказаної у заголовку сполуки (25 мг, 12%). Продукт промивають ЕtOАс (3 × 1 мл). Продукт сушать у 1 характеризують Н ЯМР (400 мГц) в CDCI3. високому вакуумі для одержання вказаної у заго1-(2-({[4-(1,1-диметилетил)феніл]метил}окси) ловку сполуки (9 мг, 16%). LC/MS ESI RT 1,89 хв. + етил]-4-[гідрокси(дифеніл)метил]-1М 446. азоніабіциклоі2.2.2]октанбромід Приклад 78: Одержання 1-(2-({[41-азабіцикло[2.2.2]окт-4-іл(дифеніл)метанол (хлорфеніл)метил]окси}етил)-4-[гідрокси(дифе(30 мг, 0,102 ммоль) додають до розчину 1-{[(2ніл)метил]-1-азоніабіцикло[2.2.2]октанброміду. брометил)окси]метил}-4-(1,1-диметилетил)бензолу 2-{[(4-хлорфеніл)метил]окси}етанол (25 мг, 0,143 ммоль) у 2:3 CH3CN / CHCI3 (3 мл), і Етиленгліколь (0,084 мл, 1,5 ммоль) додають реакційну суміш нагрівають при 60°С впродовж 96 до NaH (38 мг, 1,52 ммоль, 95% в маслі) у THF (3 год. Реакційну суміш концентрують, і неочищений мл). До реакційної суміші додають 1-(бромметил)продукт промивають ЕtOАс (3 × 1 мл). Продукт 4-хлорбензол (310 мг, 1,5 ммоль) і залишковий 1сушать у високому вакуумі для одержання вказа(бромметил)-4-хлорбензол переносять у реакційну ної у заголовку сполуки (9 мг, 16%). LC/MS ESI RT пробірку додатковим THF (1 мл). Додають (Bu)4NI + 2,28 хв. М 484. (55 мг, 0,15 ммоль), і реакційну суміш нагрівають Приклад 77: Одержання 1-(2-({[4при 60°С впродовж 18 год. і потім при кімнатній (фторфеніл)метил]окси}етил)-4-[гідрокси(дифетемпературі впродовж 4 год. додають Н2О (2 мл) і ніл)метил]-1-азоніабіцикло[2.2.2]октанброміду. ЕtOАс (2 мл), і шари розділяють за допомогою 2-({[4-фторфеніл)метил]окси}етанол піпетки. Водний шар екстрагують ЕtOАс (1 × 1 мл), Етиленгліколь (0,084 мл, 1,5 ммоль) додають і об'єднані органічні шари концентрують. Неочидо NaH (38 мг, 1,52 ммоль, 95% в маслі) у THF (3 щений продукт очищують на касеті SPE (5 г діокмл). До реакційної суміші додають 1-(бромметил)сиду кремнію), елююючи такими 10 мл фракціями: 4-фторбензол (0,19 мл, 1,5 ммоль), і залишковий 30% ЕtOАс/гексанами (фракції 1,2), 50% 1-(бромметил)-4-фторбензол переносять у реакЕtOАс/гексанами (фракція 3) і 75% ційну пробірку додатковим THF (1 мл). Додають ЕtOАс/гексанами (фракція 4) для одержання вка(Bu)4NI (55 мг, 0,15 ммоль), і реакційну суміш назаної у заголовку сполуки (129 мг, 46%). Продукт 1 грівають при 60°С впродовж 18 год. і потім при характеризують Н ЯМР (400 мГц) в CDCI3. кімнатній температурі впродовж 4 год. додають 1-{[(2-брометил)окси]метил}-4-хлорбензол Н2О (2 мл) і ЕtOАс (2 мл), і шари розділяють за Розчин N-бромсукциніміду (272 мг, 1,53 допомогою піпетки. Водний шар екстрагують ммоль) у DCM (2,5 мл) додають до зв'язаного зі ЕtOАс (1 × 1 мл), і об'єднані органічні шари концесмолою трифенілфосфіну (510 мг, 1,53 міліеквівантрують. Неочищений продукт очищують на касеті ленти, Fluka) у DCM (2,5 мл), і реакційну суміш SPE (5 г діоксиду кремнію), елююючи такими 10 мл перемішують при кімнатній температурі впродовж фракціями: 30% ЕtOАс/гексанами (фракції 1,2), 10 хв. До реакційної суміші додають розчин 2-{[(450% ЕtOАс/гексанами (фракція 3) і 75% хлорфеніл)метил]окси}етанолу (129 мг, 0,691 ЕtOАс/гексанами (фракція 4) для одержання вкаммоль) у DCM (1,5 мл), і залишковий спирт перезаної у заголовку сполуки (122 мг, 48%). Продукт носять додатковим DCM (1,5 мл). Реакційний фла1 характеризують Н ЯМР (400 мГц) у CDCI3. кон закупорюють, обгортають в алюмінієву фольгу 1-{[(2-брометил)окси]метил}-4-фторбензол і перемішують при кімнатній температурі впродовж Розчин N-бромсукциніміду (272 мг, 1,53 20 год. Реакційну суміш фільтрують крізь касету ммоль) у DCM (2,5 мл) до зв'язаного зі смолою SPE (5 г діоксиду кремнію), елююючи такими 10 мл трифенілфосфіну (510 мг, 1,53 міліеквіваленти, фракціями: DCM (фракція 1), 30% Fluka) у DCM (2,5 мл), і реакційну суміш переміЕtOАс/гексанами (фракція 2) і 50% шують при кімнатній температурі впродовж 10 хв. ЕtOАс/гексанами (фракція 3) для одержання вкаДо реакційної суміші додають розчин 2-{[(4заної у заголовку сполуки (98 мг, 57%). Продукт 1 фторфеніл)метил]окси}етанолу (122 мг, 0,717 характеризують Н ЯМР (400 мГц) у CDCI3. ммоль) у DCM (1,5 мл), і залишковий спирт пере1-[2-{[(4-хлорфеніл)метил]окси}етил]-4носять додатковим DCM (1,5 мл). Реакційний фла[гідрокси(дифеніл)метил]-1-азоніабіиикло[2.2.2]оккон закупорюють, обгортають в алюмінієву фольгу танбромід і перемішують при кімнатній температурі впродовж 1-азабіцикло[2.2.2]окт-4-іл(дифеніл)метанол 20 год. Реакційну суміш фільтрують крізь касету (30 мг, 0,102 ммоль) додають до розчину 1-{[(2SPE (5 г діоксиду кремнію), елююючи такими 10 мл брометил)окси]метил}-4-хлорбензолу (36 мг, 0,143 фракціями: DCM (фракція 1), 30% ммоль) у 2:3 CH3CN / CHCI3 (3 мл), і реакційну суЕtOАс/гексанами (фракція 2) і 50% міш нагрівають при 60°С впродовж 96 год. РеакЕtOАс/гексанами (фракція 3) для одержання вкаційну суміш концентрують, і неочищений продукт заної у заголовку сполуки (80 мг, 48%). Продукт промивають ЕtOАс (3 × 1 мл). Продукт сушать у 1 характеризують Н ЯМР (400 мГц) у CDCI3. високому вакуумі для одержання вказаної у заго 41 95768 42 ловку сполуки (17,4 мг, 32%). LC/MS ESI RT 2,09 реакційну пробірку додатковим THF (1 мл). Потім + хв. М 462 додають (Bu4NI (55 мг, 0,15 ммоль), і реакційну Приклад 79: Одержання 1-(2-{[(4суміш нагрівають при 60°С впродовж 18 год. і побромфеніл)метил]окси}етил)-4-[гідрокси(дифетім при кімнатній температурі впродовж 4 год. Доніл)метил]-1-азоніабіцикло[2.2.2]октанброміду. дають Н2О (2 мл) і ЕtOАс (2 мл), і шари розділяють 2-{[(4-бромфеніл)метил]окси}етанол за допомогою піпетки. Водний шар екстрагують Етиленгліколь (0,084 мл, 1,5 ммоль) додають ЕtOАс (1 × 1 мл), і об'єднані органічні шари концедо NaH (38 мг, 1,52 ммоль, 95% в маслі) у THF (3 нтрують. Неочищений продукт очищують на касеті мл). До реакційної суміші додають 1-бром-4SPE (5 г діоксиду кремнію), елююючи такими 10 мл (бромметил)бензол (370 мг, 1,5 ммоль), і залишкофракціями: 10% ЕtOАс/гексанами (фракції 1,2), вий 1-бром-4-(бромметил)бензол переносять у 30% ЕtOАс/гексанами (фракції 3,4), 530% реакційну пробірку додатковим THF (1 мл). Потім ЕtOАс/гексанами (фракції 5-7), і 75% додають (Bu4NI (55 мг, 0,15 ммоль), і реакційну ЕtOАс/гексанами (фракція 8) для одержання вкасуміш нагрівають при 60°С впродовж 18 год. і позаної у заголовку сполуки (95 мг, 36%). Продукт 1 тім при кімнатній температурі впродовж 4 год. дохарактеризують Н ЯМР (400 мГц) у CDCI3. дають Н2О (2 мл) і ЕtOАс (2 мл), і шари розділяють 4-{[(2-брометил)окси]метил}бензонитрил за допомогою піпетки. Водний шар екстрагують Розчин N-бромсукциніміду (272 мг, 1,53 ЕtOАс (1 × 1 мл), і об'єднані органічні шари концеммоль) у DCM (2,5 мл) додають до зв'язаного зі нтрують. Неочищений продукт очищують на касеті смолою трифенілфосфіну (510 мг, 1,53 міліеквіваSPE (5 г діоксиду кремнію), елююючи такими 10 мл ленти, Fluka) у DCM (2,5 мл), і реакційну суміш фракціями: 30% ЕtOАс/гексанами (фракції 1,2), перемішують при кімнатній температурі впродовж 50% ЕtOАс/гексанами (фракція 3) і 75% 10 хв. До реакційної суміші додають розчин 4-{[(2ЕtOАс/гексанами (фракція 4) для одержання вкагідроксіетил)окси]метил}бензонітрилу (95 мг, 0,536 заної у заголовку сполуки (139 мг, 40%). Продукт ммоль) у DCM (1,5 мл), і остаточний спирт перено1 характеризують Н ЯМР (400 мГц) у CDCI3. сять додатковим DCM (1,5 мл). Реакційний флакон 1-бром-4-{[(2-брометил)окси]метил)бензол закупорюють, обгортають в алюмінієву фольгу і Розчин N-бромсукциніміду (272 мг, 1,53 перемішують при кімнатній температурі впродовж ммоль) у DCM (2,5 мл) додають до зв'язаного зі 20 год. Реакційну суміш фільтрують крізь касету смолою трифенілфосфіну (510 мг, 1,53 міліеквіваSPE (5 г діоксиду кремнію), елююючи такими 10 мл ленти, Fluka) у DCM (2,5 мл), і реакційну суміш фракціями: DCM (фракція 1), 30% перемішують при кімнатній температурі впродовж ЕtOАс/гексанами (фракція 2) і 50% 10 хв. До реакційної суміші додають розчин 2-{[(4ЕtOАс/гексанами (фракція 3) для одержання вкабромфеніл)метил]окси}етанолу (139 мг, 0,601 заної у заголовку сполуки (60 мг, 47%). Продукт 1 ммоль) у DCM (1,5 мл), і залишковий спирт перехарактеризують Н ЯМР (400 мГц) у CDCI3. носять додатковим DCM (1,5 мл). Реакційний фла1-[2-{[(4міанофеніл)метил]окси}етил]-4кон закупорюють, обгортають в алюмінієву фольгу [гідрокси(дифеніл)метил]-1-азоніабіиикло[2.2.2]окі перемішують при кімнатній температурі впродовж танбpомід 20 год. Реакційну суміш фільтрують крізь касету 1-азабіцикло[2.2.2]окт-4-іл(дифеніл)метанол SPE (5 г діоксиду кремнію), елююючи такими 10 мл (30 мг, 0,102 ммоль) додають до розчину 4-{[(2фракціями: DCM (фракція 1), 30% брометил)окси]метил}бензонітрилу (34 мг, 0,143 ЕtOАс/гексанами (фракція 2) і 50% ммоль) у 2:3 CH3CN / CHCI3 (3 мл), і реакційну суЕtOАс/гексанами (фракція 3) для одержання вкаміш нагрівають при 60°С впродовж 96 год. Реакзаної у заголовку сполуки (87 мг, 49%). Продукт ційну суміш концентрують, і неочищений продукт 1 характеризують Н ЯМР (400 мГц) у CDCI3. промивають ЕtOАс (3 × 1 мл). Продукт сушать у 1-(2-{[(4-бромфеніл]метил]окси}етил)-4високому вакуумі для одержання вказаної у заго[гідрокси(дифеніл)метил]-1ловку сполуки (40 мг, 74%). LC/MS ESI RT 1,82 хв. + азоніабіиикло[2.2.2]октанбpомід М 453 1-азабіцикло[2.2.2]окт-4-іл(дифеніл)метанол Приклад 81: Одержання 4-[гідрокси(дифе(30 мг, 0,102 ммоль) додають до розчину 1-бром-4ніл)метил]-1-{2-[(2-нафталенілметил)окси]етил}-1{[(2-брометил)окси]метил}бензолу (42 мг, 0,143 азоніабіцикло[2.2.2]октанброміду. ммоль) у 2:3 CH3CN / CHCI3 (3 мл), і реакційну су2-[(2-нафталенілметил)окси]етанол міш нагрівають при 60°С впродовж 96 год. РеакЕтиленгліколь (0,084 мл, 1,5 ммоль) додають ційну суміш концентрують, і неочищений продукт до NaH (38 мг, 1,52 ммоль, 95% в маслі) у THF (3 промивають ЕtOАс (3 × 1 мл). Продукт сушать у мл). До реакційної суміші додають 2високому вакуумі для одержання вказаної у заго(бромметил)нафталін (330 мг, 1,5 ммоль), і залишловку сполуки (19,4 мг, 32%). LC/MS ESI RT 2,07 ковий 2-(бромметил)нафталін переносять у реак+ хв. М 506 ційну пробірку додатковим THF (1 мл). Потім доПриклад 80: Одержання 1-(2-{[(4-ціанофеніл) дають (Bu)4NI (55 мг, 0,15 ммоль), і реакційну метил]окси}етил)-4-[гідрокси(дифеніл)метил]-1суміш нагрівають при 60°С впродовж 18 год. і поазоніабіцикло[2.2.2]октанброміду. тім при кімнатній температурі впродовж 4 год. До4-{[(2-гідроксіетил)окси]метил}бензонітрилдають Н2О (2 мл) і ЕtOАс (2 мл), і шари розділяють Етиленгліколь (0,084 мл, 1,5 ммоль) додають за допомогою піпетки. Водний шар екстрагують до NaH (38 мг, 1,52 ммоль, 95% в маслі) у THF (3 ЕtOАс (1 × 1 мл), і об'єднані органічні шари концемл). До реакційної суміші додають 4нтрують. Неочищений продукт очищують на касеті (бромметил)бензонітрил (290 мг, 1,5 ммоль), і осSPE (5 г діоксиду кремнію), елююючи такими 10 мл таточний 4-(бромметил)бензонітрил переносять у фракціями: 30% ЕtOАс/гексанами (фракції 1,2), 43 95768 44 50% ЕtOАс/гексанами (фракція 3), і 75% фільтрують крізь кассету SPE (5 г діоксиду кремЕtOАс/гексанами (фракція 4) для одержання вканію), елююючи такими 10 мл фракціями: DCM заної у заголовку сполуки (101 мг, 33%). Продукт (фракція 1), 30% ЕtOАс/гексанами (фракція 2) і 1 характеризують Н ЯМР (400 мГц) в CDCI3. 50% ЕtOАс/гексанами (фракція 3) для одержання 2-{[(2-брометил)окси]метил}нафталін вказаної у заголовку сполуки (75 мг, 78%). Продукт 1 Розчин N-бромсукциніміду (272 мг, 1,53 характеризують Н ЯМР (400 мГц) у CDCI3. ммоль) у DCM (2,5 мл) додають до зв'язаного зі 1-(2-{[(3-фторфеніл)метил]окси}етил)-4смолою трифенілфосфіну (510 мг, 1,53 міліеквіва[гідрокси(дифеніл)метил]-1ленти, Fluka) у DCM (2,5 мл), і реакційну суміш азоніабіиикло[2.2.2]октанбромід перемішують при кімнатній температурі впродовж 1-азабіцикло[2.2.2]окт-4-іл(дифеніл)метанол 10 хв. До реакційної суміші додають розчин 2-[(2(94 мг, 0,321 ммоль) додають до розчину 1-{[(2нафталенілметил)окси]етанолу (101 мг, 0,499 брометил)окси]метил}-3-фторбензолу (75 мг, 0,321 ммоль) у DCM (1,5 мл), і залишковий спирт переммоль) у 2:3 CH3CN / CHCI3 (4 мл), і реакційну суносять додатковим DCM (1,5 мл). Реакційний фламіш нагрівають при 60°С впродовж 3 днів. Реаккон закупорюють, обгортають в алюмінієву фольгу ційну суміш концентрують під зниженим тиском, і і перемішують при кімнатній температурі впродовж неочищений продукт промивають ЕtOАс (3 × 2 мл). 20 год. Реакційну суміш фільтрують крізь касету Продукт сушать у високому вакуумі для одержання SPE (5 г діоксиду кремнію), елююючи такими 10 мл вказаної у заголовку сполуки (50 мг, 30%). LC/MS + фракціями: DCM (фракція 1), 30% ESI RT 1,95 хв. М 446. ЕtOАс/гексанами (фракція 2) і 50% Приклад 83: Одержання 4ЕtOАс/гексанами (фракція 3) для одержання вка[гідрокси(дифеніл)метил]-1-{2-[(1-метил-1заної у заголовку сполуки (57 мг, 43%). Продукт фенілетил)окси]етил}-1-азоніабіцикло[2.2.2]ок1 характеризують Н ЯМР (400 мГц) у CDCI3. танброміду. 4-[гідрокси(дифеніл)метил]-1-{2-[(22-[(1-метил-1-фенілетил)окси]етанол нафталенілметил)окси]етил}-1-азоніабіцикло[2.2.2] Каталітичну кількість або п-толуолсульфонової октанбромід кислоти · Н2О, або смоли Віо-Rad SCX (аналітич1-азабіцикло[2.2.2]окт-4-іл(дифеніл)метанол ний сорт, 5,1 міліеквіваленти/г, AG 50W-X8) дода(30 мг, 0,102 ммоль) додають до розчину 2-{[(2ють до □-метилстиролу (0,5 мл, 3,85 ммоль) та брометил)окси]метил}нафталіну (38 мг, 0,143 етиленгліколю (0,21 мл, 3,85 ммоль), і реакційну ммоль) у 2:3 CH3CN / CHCI3 (3 мл), і реакційну сусуміш перемішують при кімнатній температурі міш нагрівають при 60°С впродовж 96 год. Реаквпродовж 5 днів. Реакційну суміш завантажують ційну суміш концентрують, і неочищений продукт безпосередньо на касету SPE (10 г діоксиду кремпромивають ЕtOАс (3 × 1 мл). Продукт сушать у нію) та елююють такими 10 мл фракціями: 10% високому вакуумі для одержання вказаної у загоЕtOАс/гексанами (фракції 1,2), 30% ловку сполуки (48,1 мг, 84%). LC/MS ESI RT 2,04 ЕtOАс/гексанами (фракції 3,4), і 50% + хв. М 478. ЕtOАс/гексанами (фракції 5,6) для одержання вкаПриклад 82: Одержання 1-(2-{[(3заної у заголовку сполуки (30,5 мг, 4%) для обох 1 фторфеніл)метил]окси}етил)-4станів. Продукт характеризують Н ЯМР (400 мГц) [гідрокси(дифеніл)метил]-1-азоніабіцикло[2.2.2]оку CDCI3. танброміду. {1-[(2-брометил)окси]-1-метилетил}бензол 2-{[(3-фторфеніл)метил]окси}етанол N-бромсукцинімід (119 мг, 0,666 ммоль) додаЕтиленгліколь (0,1 мл, 1,79 ммоль) додають ють до зв'язаного зі смолою трифенілфосфіну (222 до NaH (46 мг, 1,81 ммоль, 95% в маслі) у THF (5 мг, 0,666 міліеквіваленти, Fluka) і 2-[(1-метил-1мл). До реакційної суміші додають 1-(бромметил)фенілетил)окси]етанолу (60 мг, 0,333 ммоль) у 3-фторбензол (0,22 мл, 1,79 ммоль), і реакційну DCM (4 мл). Реакційний флакон закупорюють висуміш нагрівають при 60°С впродовж 5 днів. Достеленим тефлоном ковпачком, обгортають в дають Н2О (2 мл) і ЕtOАс (2 мл), і шари розділяють алюмінієву фольгу і струшують при кімнатній темза допомогою піпетки. Водний шар екстрагують пературі впродовж 17 год. Реакційну суміш фільтЕtOАс (1 × 1 мл), і об'єднані органічні шари промирують крізь касету SPE (5 г діоксиду кремнію), вають насиченим NaCI (1 × 2мл), сушать (Na2SO4) елююючи такими 10 мл фракціями: DCM (фракція і концентрують. Неочищений продукт очищують на 1), 30% ЕtOАс/гексанами (фракція 2) і 50% касеті SPE (5 г діоксиду кремнію), елююючи такиЕtOАс/гексанами (фракція 3) для одержання вками 10 мл фракціями: 30% ЕtOАс/гексанами (фракзаної у заголовку сполуки (34 мг, 42%). Продукт 1 ції 1,2), 50% ЕtOАс/гексанами (фракція 3), і 75% характеризують Н ЯМР (400 мГц) у CDCI3. ЕtOАс/гексанами (фракція 4) для одержання вка4-[гідрокси(дифеніл)метил]-1-{2-[(1-метил-1заної у заголовку сполуки (76,2 мг, 25%). Продукт фенілетил)окси]етил}-1-азоніабіцикло[2.2.2]октан1 характеризують Н ЯМР (400 мГц) у CDCI3. бромід 1-{[(2-брометил)окси]метил}-3-фторбензол 1-азабіцикло[2.2.2]окт-4-іл(дифеніл)метанол N-бромсукцинімід (146 мг, 0,820 ммоль) дода(41 мг. 0,14 ммоль) додають до розчину {1-[(2ють до зв'язаного зі смолою трифенілфосфіну (274 брометил)окси]-1-метилетил}бензолу (34 мг, 0,14 мг, 0,822 міліеквіваленти, Fluka) і 2-{[(3ммоль) у 2:3 CH3CN / CHCI3 (3 мл), і реакційну суфторфеніл)метил]окси}етанол (70 мг, 0,411 міш нагрівають при 60°С впродовж 3 днів. Реакммоль) у DCM (4 мл). Реакційний флакон закупоційну суміш концентрують під зниженим тиском, і рюють вистеленим тефлоном ковпачком, обгорнеочищений продукт промивають ЕtOАс (3 × 1 мл). тають в алюмінієву фольгу і струшують при кімнаЗалишок збирають у 2,5 мл DMSO і очищують тній температурі впродовж 17 год. Реакційну суміш препаративною ВЕРХ (без TFA) для одержання 45 95768 46 вказаної у заголовку сполуки (18 мг, 24%). LC/MS Розчин перемішують при 60°С впродовж 16 год. + ESI RT 2,09 хв. М 456. Реакційну суміш охолоджують до кімнатної темпеПриклад 84: Одержання 4ратури і концентрують. ЕtOАс (200 мл) додають до [гідрокси(дифеніл)метил]-1-{2-[(фенілметил)окси] твердої речовини, і суміші дають можливість пеетил}-1-азоніабіцикло[2.2.2]октанброміду. ремішатись впродовж 1 год., потім фільтрують. Спосіб А: 1-азоніабіцикло[2.2.2]окт-4Одержану тверду речовину збирають у МеОН (125 іл(дифеніл)метанол (0,020 г, 0,068 ммоль) розвомл) і нагрівають до 60°С. Гарячий розчин фільтдять у СНСІ3 (1,8 мл) і подають безпосередньо у рують і знову охолоджують до кімнатної темперафлакон ємністю 1 драхми, який містить простий 2тури. Реакційну суміш концентрують до низького брометилфенілметилефір (0,022 г, 0,102 ммоль). об'єму МеОН (20 мл). Потім додають воду (75 мл) Додають CH3CN (1,2 мл); у флакон кладуть переі одержану суміш нагрівають при 55°С при енермішувальний брусок і закривають ковпачком. Реагійному перемішуванні впродовж 40 хв. Після охокційну суміш перемішують і нагрівають при 60°С лодження до кімнатної температури тверду речовпродовж 24 год. Вміст флакона переносять (після вину відфільтровують, промивають водою (20 мл) і видалення перемішувального бруска) у поліпропісушать у вакуумній печі 45°С впродовж 16 год. для ленову пробірку і концентрують в атмосфері азоту. одержання вказаної у заголовку сполуки (2,47 г, + 1 Неочищений продукт збирають на фриту поліпро43,3%). ΕΘ/MS m/z 428(M ) Rt 1,90 хв.) ЯМР піленової пробірки. Надлишок броміду видаляють (ДМСО-d6) δ 7,56 (d, 4H, J=1,2), 7,28 (m, 11H), 5,95 промиванням неочищеного продукту ЕtOАс (5 × 2 (s, 1Н), 4,50 (s, 2Н), 3,81 (d, 2Н, J=4,0), 3,48 (t, 6H, мл) і гексаном (5 × 2 мл). Потім продукт сушать у J=7,2), 3,38 (d, 2H, J=4,0), 2,01 (t, 6H, J=7,2); Елевакуумі для одержання вказаної у заголовку споментний аналіз (С29Н34NО2Вr) C,H,N: розрахунколуки (0,008 г, 23,8%). вий; 68,50, 6,74, 2,75; виявлений, 68,28, 6,68, 2,73. Спосіб В: До розчину 1-азабіцикло[2.2.2]окт-4Подальші приклади у Таблиці 1 були одержані іл(дифеніл)метанолу (3,30 г, 11,2 ммоль) у 2 згідно з процедурою, описаною у способі А прикCH3CN / 3 CHCI3 (200 мл) додають 2-простий 2ладу 84. брометилфенілметилефір (2,31 мл, 14,6 ммоль). 47 Приклад 112: Одержання 1-[2-(1-бензофуран2-іл)-2-оксоетил]-4-[гідрокси(дифеніл)метил]-1азоніабіцикло[2.2.2]октанброміду. 1-азабіцикло[2.2.2]окт-4-іл(дифеніл)метанол (0,022 г, 0,075 ммоль) розводять у СНСІ3 (1,8 мл) і подають безпосередньо у флакон ємністю 1 драхми, який містить 1-(1-бензофуран-2-іл)-2брометанон (0,027 г, 0,112 ммоль). Після додавання CH3CN (1,2 мл) у флакон кладуть перемішувальний брусок і закупорюють ковпачком. Реакційну суміш перемішують і нагрівають при 60°С впродовж 24 год. і концентрують у вакуумі для одержання білої твердої речовини. Цей залишок 95768 48 розчиняють у DMSO та очищують препаративною ВЕРХ (без TFA) для одержання вказаної у заголовку сполуки (0,022 г, 57,4%). LC/MS ESI RT 1,98 хв., + М 452. Наступні приклади у Таблиці 2 були одержані згідно з процедурою, описаною у прикладі 112. 49 Абревіатури Аr DCM DMF DMSO El/ESI HPLC LC LDA MS NMR Rt Rt SPE TEA TFA THF Аргон Дихлорметан Диметилформамід Д и мети л сул ьфоксид Електрораспилювальна іонізація Високоефективна рідинна хроматографія Рідинна хроматографія Діізопропіламід літію Мас спектрометрія Ядерний магнітний резонанс Час утримування Кімнатна температура Твердофазна екстракція Триетиламін Трифтороцтова кислота Тетрагідрофуран БІОЛОГІЧНІ ПРИКЛАДИ Інгібувальні ефекти сполук цього винаходу на mAChR визначаються наступними функціональними аналізами in vitro та in vivo: Аналіз інгібування активації рецепторів мобілізацією кальцію: Стимуляцію mAChRs, експресова 95768 50 них на клітинах СНО, аналізують моніторингом активованої рецепторами мобілізації кальцію, як описано раніше (H.M.Sarau et al., 1999. Моl. Pharmacol. 56, 657-663). Клітини СНО, які стійко експресують М3 mAChRs, висіюють у 96-лункові планшети з чорними стінками/прозорим дном. Через 18-24 год. середовище аспірують і заміщають 100 мкл завантажуваного середовища (ЕМЕМ із солями Earl, 0,1% BSA сорту RIA (Sigma, St. Louis МО) і 4 мкМ флюоресцентного індикаторного барвника простого флюо-3-ацетоксиметилефіру (Fluo3 AM, Molecular Probes, Eugene, OR) та інкубують 1 год. при 37°С. Середовище, що містить барвник, потім аспірують, замінюють на свіже середовище (без Fluo-3 AM), і клітини інкубують впродовж 10 хв. при 37°С. Потім клітини промивають 3 рази та інкубують впродовж 10 хв. при 37°С у 100 мкл аналітичного буфера (0,1% желатин (Sigma), 120 мМ NaCI, 4,6 мМ KСІ, 1 мМ KН2РО4, 25 мМ NaHCO3, 1,0мМ СаСІ2, 1,1 мМ МgСІ2, 11 мМ глюкози, 20 мМ HEPES (рН 7,4)). Додають 50 мкл спо-11 луки (кінцева концентрація в аналізі 1 × 10 - 1 × -5 10 М), і планшети інкубують впродовж 10 хв. при 37°С. Потім планшети кладуть у пристрій зчитування інтенсивності флюоресцентного світла для 51 95768 52 планшет (FLIPR, Molecula Probes), де завантажені ють з мембраною, яка містить рецептори, впробарвники клітини зазнають впливу збуджуючого довж 30 хв. при 4°С. Потім додають 50 мМ HEPES світла (488 нм) від аргонового лазера потужністю 6 і випробуваної сполуки та інкубують при кімнатній ватт. Клітини активують додаванням 50 мкл ацетемпературі (струшуючи) впродовж 2 год. Потім тилхоліну (кінцева концентрація 0,1-10 нМ), одеркульки відокремлюють центрифугуванням і рахужаного в буфері, що містить 0,1% BSA, зі швидкісють, використовуючи сцинтиляційний лічильник. тю 50 мкл/с. Моніторинг мобілізації кальцію у Оцінка сили і тривалості дії на ізольованій вигляді зміни концентрації цитозольного кальцію трахеї морських свинок Трахеї видаляють у доропроводять вимірюванням зміни інтенсивності світслих самців морських свинок Hartley (Charles River, ловипромінювання при 566 нм. Зміна інтенсивності Raleigh, NC; 400-600 г) і кладуть у модифікований світловипромінювання прямо пов'язана з рівнями розчин Кребса-Хенселейта. Склад розчину був цитозольного кальцію. Флюоресценцію, що випус(мМ): Na СІ 113,0, KСІ 4,8, СаСІ2 2,5, KН2РО4 1,2, кається з усіх 96 лунок, вимірюють одночасно із MgSO4 1,2, NaHCO3 25,0 і декстроза 11,0, який використанням охолодженої CCD камери. Збір газували 95% О2: 5% СО2 і підтримували при 37°С. даних проводять щосекунди. Потім ці дані наноКожну трахею очищають від прилиплої тканини та сять на графік та аналізують із використанням розтинають за довжиною. Епітелій видаляють програмного статку GraphPad PRISM. обережним тертям просвітної поверхні аплікатоВикликане метахоліном звуження бронхів - сиром із бавовняним наконечником. Відсікають ла і тривалість дії окремі смужки шириною приблизно 2 хрящових Реактивність бронхів на метахолін визначають кільця і підвішують за допомогою шовкової нитки у у тих, що пильнують, не обмежених у дії мишей ванні з водяним кожухом ємністю 10 мл для оргаBalb С (n = по 6 у кожній групі). Барометричну пленів, які містять розчин Кребса-Хенселейта і з'єднатизмографію використовують для вимірювання ні з перетворювачами сили-зсуву Grass FT03C. збільшеної паузи (Penh), показника, що не має Механічні реакції реєструють ізометрично приодиниці виміру, який, як було показано, корелюстроєм, що підтверджує одержання даних ється зі змінами опору дихальних шляхів, які виниMP100WS (ВІОРАС Systems, Goleta, CA, кають під час бронхіальної стимуляції метахоліном www.biopac.com), який працює на комп'ютерах (2). Мишам попередньо вводили 50 мкл сполуки Apple G4. Урівноважування тканин проводять при (0,003-10 мкг/миша) у 50 мкл носія (10% DMSO) напрузі спокою 1,5 г, яку визначають як оптимальінтраназально, і потім їх клали у плетизмографічну ну оцінкою довжини-напруги і промивають розчикамеру через визначений час після введення преном Кребса-Хенселейта через кожні 15 хв. впропарату (15 хв. - 96 год.). Для визначення сили дії довж 1 год. Після періоду врівноважування здійснювали визначення залежності реакції від легеневі тканини піддають скорочуванню дією 10 дози цього препарату, і всі виміри проводили чемМ карбахолу до досягнення плато, яке слугує як рез 15 хв. після інтраназального введення препаеталонне скорочення для аналізу даних. Потім рату. Для визначення тривалості дії вимірювання тканини ополіскують через кожні 15 хв. впродовж 1 проводили у будь-якому місці від 15 хв. до 96 год. год. до досягнення вихідного тонусу. Потім препапісля інтраназального введення препарату. рати залишають принаймні на 30 хв. перед початПісля покладання у камеру тваринам давали ком експерименту. можливість досягти врівноваження впродовж 10 Криві залежності реакції від концентрації одехв. перед проведенням вихідного вимірювання ржують кумулятивним додаванням карбахолу наPenh впродовж 5 хв. Потім у мишей проводили півлогарифмічними добавками (Van Rossum, 1963, стимуляцію аерозолем метахоліну (10 мг/мл) Arch. Int. Pharmacodyn., 143:299), які починаються впродовж 2 хв. Penh реєстрували безперервно при 1 нМ. Кожну концентрацію залишають у контавпродовж 7 хв. з початку введення аерозолю мекті з препаратом до тих пір, поки реакція не вихотахоліну і продовжували у подальшому впродовж дить на плато, перед додаванням наступної кон5 хв. Дані по кожній миші аналізували і наносили центрації карбахолу. Парні тканини піддають на графік із використанням програмного статку впливу сполук-антагоністів mAChR або носія GraphPad PRISM. Цей експеримент забезпечує впродовж 30 хв. перед побудовою кривих залежможливість визначення тривалості активності ввеності реакції від кумулятивної концентрації карбаденої сполуки. холу. Всі дані представлені у вигляді середньої Сполуки за цим винаходом можна застосовувеличини ± стандартна помилка середньої (s.e.m.), вати для лікування за різноманітними показанняпричому n являє собою кількість різних тварин. ми, включаючи, але не обмежуючись, розлади Для досліджень суперфузії (тривалості дії) дихальних шляхів, такі як хронічне обструктивне тканини безперервно перфузують розчином Креблегеневе захворювання, хронічний бронхіт, астму, са-Хенселейта зі швидкістю 2 мл/хв. впродовж хронічну респіраторну обструкцію, пневмосклероз, усієї тривалості експерименту. Маткові розчини емфізему легенів та алергічний риніт. агоніста та антагоніста інфузують (0,02 мл/хв.) Аналіз зв'язування радіоліганда з мускаринокрізь голку 22 калібра, введену у перфузійну трубвими рецепторами ку. Механічні реакції реєстрували ізометрично, Дослідження зв'язування радіоліганда із виковикористовуючи наявний у продажу пристрій, що 3 ристанням 0,5 нМ [ H]-N-метилскополаміну (NMS) підтверджує одержання даних MP100WS (ВІОРАС у форматі SPA використовують для оцінки зв'язуSystems, Goleta, CA, www.biopac.com). з'єднаний вання мускаринових антагоністів з М1, Μ2, М3, М4 і інтерфейсом з комп'ютером Macintosh G4 (Apple, M5 мускаринових рецепторів ацетилхоліну. У 96Cupertino, CA www.apple.com). Тканини суспендулунковій планшеті кульки SPA попередньо інкубують при оптимальній напрузі спокою 1,5 г. Через 53 95768 54 60 хв. періоду врівноваження тканини піддають суміш для інгаляції сполуки за винаходом і придаскороченню дією карбахолу (1 мМ) впродовж тритної порошкової основи (речовини новалості експерименту. Після досягнення тривалого сія/розріджувача/ексципієнта), такої як моно-, дискорочення вводять ізопротеренол (10 мМ) для або полісахариди (наприклад, лактоза або крохмаксимального розслаблення тканини, і ця зміна маль), органічні або неорганічні солі (наприклад, слугує як еталон. Вплив ізопротеренолу припиняхлорид кальцію, фосфат кальцію або хлорид нають і дають можливість відновитися напрузі, витрію), поліспирти (наприклад, манніт), або їхні сукликаній карбахолом. Антагоністи мускаринових міші, альтернативно, з одним або більше додаткорецепторів інфузують в одній концентрації на ткавими матеріалами, причому такі добавки включені нину до тих пір, поки не досягнутий стійкий рівень до змішаної препартивної форми для поліпшення інгібування. Потім сполуку видаляють і знову дахімічної та/або фізичної стійкості або ефекту преють можливість відновитися напрузі, викликаній паративної форми, як описано нижче, або її сумікарбахолом. шей. Кращим є використання лактози. Кожна капНаступні показники визначають для кожної сула або касета може у цілому містити від 20 мкг концентрації антагоніста і виражають у вигляді до 10 мг сполуки формули (І), необов'язково у середньої величини ± S.E.M для n окремих тварин. комбінації з іншим терапевтично активним інгредіІнгібування викликаного корбахолом скорочення єнтом. Альтернативно, сполука за винаходом мовиражають у вигляді процента еталонної реакції же бути представлена без ексципієнтів або може (ізопротеренол), і вимірюють час, потрібний для бути сформована у частки, які містять сполуку, досягнення половини цього розслаблення (почанеобов'язково інші терапевтично активні матеріаток реакції). Відновлення напруги після видалення ли, і матеріали ексципієнтів, наприклад, спільним сполуки визначають як час, потрібний для досягосадженням або покриттям. нення відновлення половини максимальної напруПристрій подання лікарського засобу може віги (компенсація реакції). Через 60 і 180 хв. після дноситься до типу, вибраного з групи, яка складавидалення антагоніста визначають рівень інгібується з інгалятора сухого порошку з резервуаром вання, що залишається, і виражають у вигляді (RDPI), багатодозового інгалятора сухого порошку процента еталонної реакції на ізопротеренол. (MDPI) та інгалятора відміряної дози (MDI). Криві залежності реакції від концентрації антаПід інгалятором сухого порошку з резервуаром гоніста одержують нанесенням на графік даних (RDPI) мають на увазі інгалятор, який має упаковку максимального розслаблення через 0,60 і 180 хв. у формі резервуара для вміщення багатьох (не після видалення антагоніста. Відновлення, яке відміряних) доз лікарського засобу у формі сухого називають зсувом, розраховують відносно кривої порошку і який містить засіб для відмірювання доінгібування ІС50 через 0 хв. до концентрації сполузи лікарського засобу з резервуара у положення ки, що дає аналогічне відновлення напруги через доставляння. Відмірювальним засобом може, на60 і 180 хв. приклад, бути мірний ковпачок або перфорована Половини часу до початку і компенсації реакції пластина, яка рухома з першого положення, у яконаносять на графік залежності від відповідної конму ковпачок може бути заповнений лікарським центрації, і дані коригують нелінійної регресією. Ці засобом з резервуара у друге положення, у якому величини екстраполюють при ІС50 (яку визначають відміряна доза лікарського засобу стає доступною за кривою залежності реакції від концентрації) та для інгаляції пацієнтом. позначають Ot50 (час, при концентрації ІС50, потріПід багатодозовим інгалятором сухого порошбний для досягнення половини початкової реакції) ку (MDPI) розуміють інгалятор, придатний для поі Rt50 (час, при концентрації ІС50, потрібний для давання лікарського засобу у формі сухого порошдосягнення половини реакції відновлення). ку, в якому лікарський засіб уміщений всередині ВВЕДЕННЯ ПРЕПАРАТИВНОЇ ФОРМИ багатодозової упаковки, який містить (або несе Відповідно, цей винахід, крім того, забезпечує іншим способом) численні, визначені дози (або їх фармацевтичну препаративну форму, яка містить частини) лікарського засобу. У кращому аспекті сполуку формули (І) або її фармацевтично прийнносій має форму блістерної упаковки, але він може ятну сіль, або фізіологічно функціональну похідну також мати, наприклад, форму упаковки на основі (наприклад, солі і складні ефіри) та фармацевтичкапсул або носія, на який був нанесений лікарсьно прийнятний носій або ексципієнт і, необов'язкокий засіб будь-яким підходящим способом, що во, один або більше інших терапевтичних інгредієвключає друк, забарвлення та вакуумну оклюзію. нтів. Препаративна форма може бути попередньо Далі термін «активний інгредієнт» означає відміряною (наприклад, як у Diskus, див. GB сполуку формули (І) або її фармацевтично прийн2242134, або Diskhaler, див. GB 2178965 і ятну сіль, сольват або фізіологічно функціональну 2169265) або відміряною при застосуванні (наприпохідну. клад, як у Turbuhaler, див. ЕР 69715). Прикладом Сполука формули (І) має бути введена шляпристрою стандартної дози є Rotahaler (див. GB хом інгаляції через рот або ніс. 2064336). Інгаляційний пристрій Diskus містить Сухі порошкові композиції для місцевого досподовжену смужку, утворену з листка-основи, що тавляння у легені шляхом інгаляції можуть, напримає безліч поглиблень, розташованих з проміжкаклад, бути представлені у капсулах і касетах, нами вздовж його довжини, і листок-кришку, встаноприклад з желатину, або блістерах, наприклад з влений на нього герметично, але з можливістю ламінованої алюмінієвої фольги, для використанвідшаровування, для відмежування безлічі коння в інгаляторі або інсуфляторі. Препаративні фотейнерів, причому кожний контейнер має в собі рми порошкової суміші у цілому містять порошкову інгальовану препаративну форму, яка містить спо 55 95768 56 луку формули (І), краще у комбінації з лактозою. утримуванні контейнера, або стискуванням конКраще, якщо смужка є досить гнучкою для згортейнера при стаціонарному утримуванні клапана. тання у рулон. Краще, якщо листок-кришка і лисРозпилювані композиції для місцевого доставток-основа мають частини ведучого кінця, які неляння у легені інгаляцією можна, наприклад, склагерметично з'єднані один з одним, і принаймні сти у препаративні форми у вигляді водних розчиодна з указаних частин ведучого кінця сконструйонів або суспензій або у вигляді аерозолів, які вана для прикріплення до згортального засобу. доставляють з упаковок під підвищеним тиском, Також краще, якщо герметичний ущільнювач між таких як інгалятор відміряної дози, використанням листком-основою і листком-кришкою простираєтьпідходящого зрідженого газу-витискача. Аерозолься за їхньою всією шириною. Краще, якщо листокні композиції, придатні для інгаляції, можуть являкришка може відшаровуватись від листка-основи у ти собою або суспензію, або розчин, і в цілому подовжньому напрямку від першого кінця вказаномістять сполуку формули (І), необов'язково у комго листка-основи. бінації з іншим терапевтично активним інгредієнВ одному аспекті, багатодозова упаковка явтом і підходящим газом-витискачем, таким як фтоляє собою блістерну упаковку, яка містить безліч рвуглець або хлорфторвуглець, який містить блістерів для розташування лікарського засобу у водень, або їх суміші, зокрема гідрофторалкани, формі сухого порошку. Блістери звичайно розтанаприклад, дихлордифторметан, трихлорфтормешовуються у впорядкованому вигляді для легкості тан, дихлортетрафторетан, зокрема 1,1,1,2вивільнення лікарського засобу з них. тетрафторетан, 1,1,1,2,3,3,3-гептафтор-н-пропан, В одному аспекті, багатодозова блістерна упаабо їх суміші. Як газ-витискач можна також викоковка вміщує безліч блістерів, розташованих у ристовувати діоксид вуглецю або інший придатний цілому по колу на блістерній упаковці у формі дисгаз. Аерозольна композиція може бути позбавлена ку. В іншому аспекті, багатодозова блістерна упаексципієнта або, необов'язково, може містити доковка є подовженою за формою, наприклад, тадаткові ексципієнти препаративної форми, добре кою, що вміщує смужку або стрічку. відомі у цій галузі, такі як поверхнево-активні реКраще, якщо багатодозова блістерна упаковка човини, наприклад олеїнову кислоту або лецитин, і відмежовується між двома елементами, які укріпспільні розчинники, наприклад етанол. Аерозольні лені один до одного з можливістю відшаровуванпрепаративні форми у цілому повинні утримуватиня. У патентах США №№ 5860419, 5873360 і ся у каністрі (наприклад, алюмінієвій каністрі), за5590645 описані упаковки для лікарських засобів критій клапаном (наприклад, відмірювальним клацього загального типу. У цьому аспекті, пристрій паном) і встановлюватись у привод, забезпечений звичайно забезпечений відриваючим пристроєм, мундштуком. який містить відшаровувальний засіб для відшаЛікарські засоби для введення інгаляцією баровування елементів один від одного для доступу жано мають регульований розмір часток. Оптимадо кожної дози лікарського засобу. Підходящим льний аеродинамічний розмір часток для інгаляції чином засіб прилаштований для використання, де у бронхіальну систему для локалізованого доставелементи, що відшаровуються, являють собою ляння у легені складає звичайно 1-10 мкм, краще подовжені листки, які відмежовують безліч контей2-5 мкм. Оптимальний аеродинамічний розмір часнерів лікарського засобу, розташованих з проміжток для інгаляції в альвеолярну ділянку для досягками вздовж їх довжини, причому пристрій забезнення системного доставляння у легені складає печений індексувальним засобом для індексації по приблизно 0,5-3 мкм, краще 1-3 мкм. Частки, які черзі кожного контейнера. Краще, якщо пристрій мають аеродинамічний розмір більше 20 мкм, у прилаштований для застосування, де один з листцілому надто великі при інгаляції для досягнення ків являє собою листок-основу, який має у собі дрібних дихальних шляхів. Середній аеродинамічбезліч кишень, а інший з листків являє собою лисний розмір часток препаративної форми можна ток-кришку, причому кожна кишеня і прилегла часвиміряти, наприклад, із використанням каскадного тина листка-кришки відмежовує відповідний один з імпактора. Середній геометричний розмір часток контейнерів, причому пристрій має у своєму складі можна виміряти, наприклад, лазерною дифракцізасіб приводу для витягування листка-кришки і єю, оптичними засобами. від'єднання його від листка-основи у відривальноДля досягнення бажаного розміру часток розго пристрою. мір одержаних часток активного інгредієнта можна Під інгалятором відміряної дози (MDI) мається зменшити звичайними засобами, наприклад, регуна увазі засіб подавання лікарського засобу, який є льованою кристалізацією, мікронізацією або нанопридатним для подавання лікарського засобу в помелом. Бажану фракцію можна відокремити аерозольній формі, де лікарський засіб міститься в повітряною класифікацією. Альтернативно, частки аерозольному контейнері, придатному для умібажаного розміру можна безпосередньо одержати, щення аерозольної препаративної форми лікарсьнаприклад, сушінням розпиленням, регулюючи кого засобу на основі газу-витискача. Аерозольний параметри сушіння розпиленням для створення контейнер звичайно оснащений відмірювальним часток бажаного діапазону розміру. Краще, вони клапаном, наприклад золотниковим клапаном, для повинні бути кристалічними, хоча за бажанням подання аерозольної препаративної форми лікарможна використовувати аморфний матеріал. Коли ського засобу пацієнту. Аерозольний контейнер у використовують ексципієнт, такий як лактоза, у цілому сконструйований для доставляння заданої цілому розмір часток має бути набагато більше, дози лікарського засобу при кожному приведенні у ніж інгальованого лікарського засобу, у межах цьодію за допомогою клапана, який може відкриватиго винаходу, так що «грубий» носій не можна вдися або натисканням клапана при стаціонарному хати. Коли ексципієнт являє собою лактозу, він 57 95768 58 звичайно має бути присутнім у вигляді меленої Розчини для інгаляції розпиленням можна лактози, де не більше ніж 85% часток лактози маскласти у препаративну форму з водним носієм із ють MMD 60-90 мкм і не менше ніж 15% мають додаванням таких агентів, як кислота або луг, буMMD менше ніж 15 мкм. Додаткові матеріали у ферні солі, засоби регулювання ізотонічності або сухій порошковій суміші на додаток до носія моантимікробні засоби. їх можна стерилізувати фільжуть бути або такими, що їх можна вдихати, тобто трацією або нагріванням в автоклаві, або предстааеродинамічно менше ніж 10 мкм, або такими, що вити у вигляді нестерильного продукту. їх не можна вдихати, тобто аеродинамічно більше Кращими стандартними дозованими препараніж 10 мкм. тивними формами є ті, що містять ефективну дозу Підходящі додаткові матеріали, які можна виактивного інгредієнта, як вказано тут вище, або її користовувати, мають у своєму складі амінокислофракцію. ти, такі як лейцин; розчинні у воді або нерозчинні у Поки контекст не потребує іншого, в усьому воді, натуральні або синтетичні, поверхневоописі та формулі винаходу, яка наведена нижче, активні речовини, такі як лецитин (наприклад, соєслово «мають у своєму складі» і такі варіації, як вий лецитин), і жирні кислоти у твердому стані «має у своєму складі» і «що має у своєму складі», (наприклад, лауринова, пальмітинова та стеарислід розуміти як такі, що мають на увазі включення нова кислоти) та їхні похідні (такі як солі або склавказаного цілого числа або інтервалу чи групи цідні ефіри); фосфатидилхоліни; складні ефіри цуклих чисел, але не відноситься до виключення рів. Додаткові матеріали можуть також вміщувати будь-якого іншого цілого числа або інтервалу чи барвники, смакові агенти (наприклад, сахарин), групи цілих чисел або інтервалів. антистатичні засоби, мастильні речовини (див., Всі публікації, включаючи, але не обмежуюнаприклад, опубліковану заявку на патент РСТ № чись, патенти і патентні заявки, наведені в цьому WO 87/905213, положення якої включені сюди як описі, включені до нього як посилання, як ніби копосилання), хімічні стабілізатори, буфери, консержна окрема публікація була визначено та окремо ванти, підсилювачі всмоктування та інші матеріавказана як включена сюди як повністю викладене ли, відомі середнім спеціалістам у цій галузі. посилання. Матеріали покриття для тривалого вивільненНаведений вище опис повністю розкриває виня (наприклад, стеаринову кислоту або полімери, нахід, включаючи його кращі варіанти здійснення. наприклад полівінілпіролідон, полімолочну кислоКонкретно вказані тут модифікації та удосконаленту) можна також використовувати на активному ня варіантів здійснення перебувають у межах обматеріалі або частках, які містять активний матесягу подальшої формули винаходу. Без додаткоріал (див., наприклад, патенти №№ US 3634582, вого уточнення вважають, що спеціаліст у цій GB 1230087, GB 1381872, положення яких вклюгалузі може, використовуючи попередній опис, чені сюди як посилання). використати цей винахід найповнішою мірою. Тому Інтраназальні спреї можна скласти у препаранаведені тут приклади слід розглядати просто як тивні форми з водними або не водними носіями з ілюстрацію, а жодним чином не як обмеження обдодаванням агентів, таких як загущувачі, буферні сягу цього винаходу. Варіанти здійснення винахосолі або кислоти чи луг для регулювання рН, засоду, в яких заявлена виключна власність або привіби регулювання ізотонічності або антиоксиданти. лей, визначені далі. Комп‟ютерна верстка Т. Чепелева Підписне Тираж 23 прим. Державна служба інтелектуальної власності України, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюMuscarinic acetylcholine receptor antagonists
Автори англійськоюLaine Dramane, Palovich Michael R, Mccleland Brent, Neipp Christopher, Thomas Sonia M.
Назва патенту російськоюАнтагонисты мускариновых рецепторов ацетилхолина
Автори російськоюЛен Драман, Палович Майкл Р., Макклеланд Брент, Неипп Кристофер, Томас Соня М.
МПК / Мітки
МПК: C07D 453/00, A61K 31/44
Мітки: мускаринових, рецепторів, антагоністи, ацетилхоліну
Код посилання
<a href="https://ua.patents.su/29-95768-antagonisti-muskarinovikh-receptoriv-acetilkholinu.html" target="_blank" rel="follow" title="База патентів України">Антагоністи мускаринових рецепторів ацетилхоліну</a>
Попередній патент: Вібромасажер для вгамування болю
Наступний патент: N-заміщені піперидини і їх застосування як фармацевтичних препаратів
Випадковий патент: Спосіб приготування чипсів з лавашу












