Тетрациклічні інгібітори цистеїнпротеаз, їх фармацевтична композиція та їх терапевтичне застосування
Номер патенту: 99116
Опубліковано: 25.07.2012
Автори: Жак Ксав'є, Дав'є Лоран, Формстеше Етьєнн, Рен Жан-Крістоф, Коллан Фредерік, Коломбо Маттео, Гюдо Філіпп
Формула / Реферат
1. Сполука формули (І):
 , (І)
, (І)
де:
![]() - або одинарний, або подвійний зв'язок, залежно від конкретного випадку;
- або одинарний, або подвійний зв'язок, залежно від конкретного випадку;
![]() - або відсутній, або одинарний зв'язок, залежно від конкретного випадку;
- або відсутній, або одинарний зв'язок, залежно від конкретного випадку;
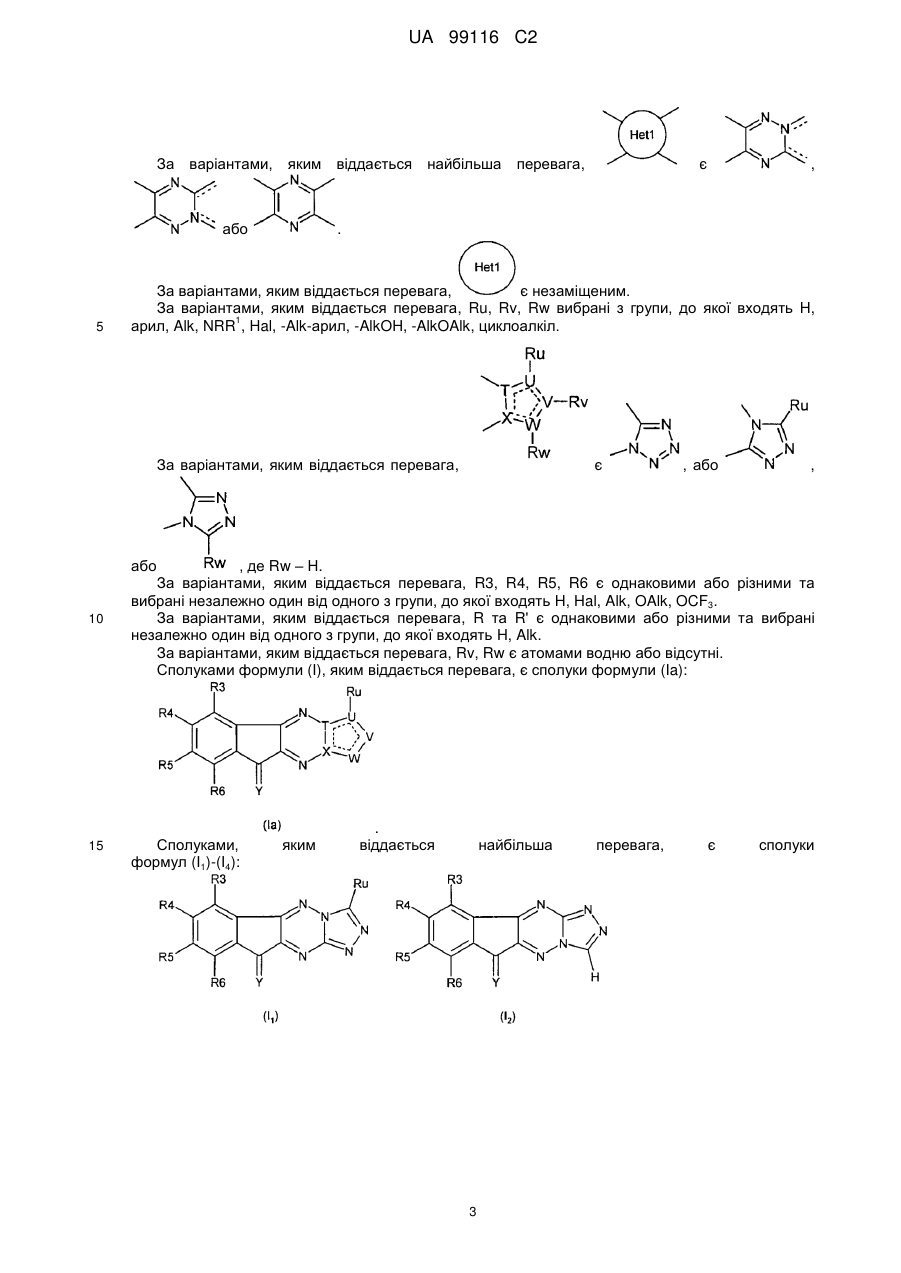
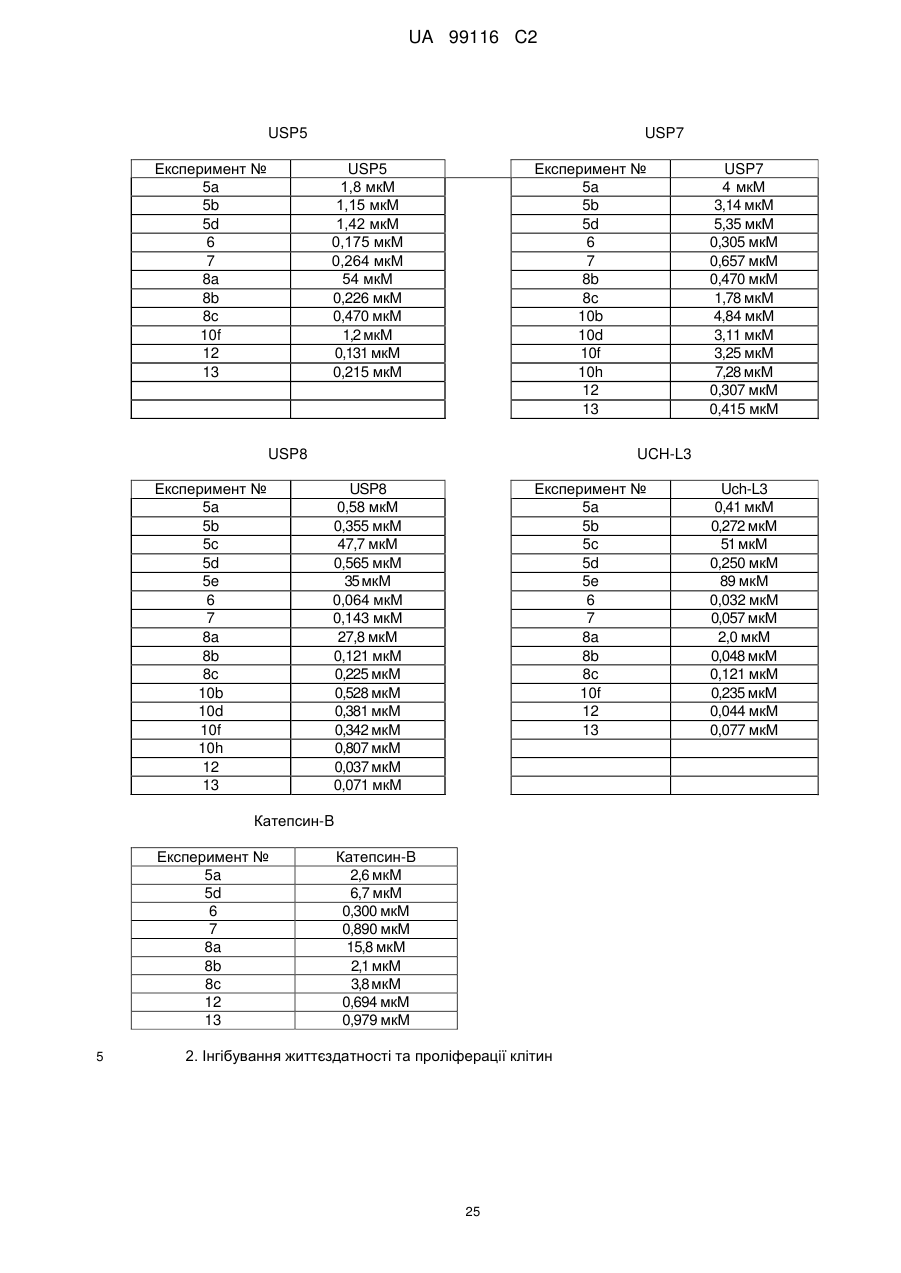
![]() - 5-7-членний гетероцикл, за переважними варіантами гетероарил, який включає від 1 гетероатома до 5 гетероатомів, необовязково заміщений одним або кількома замісниками, вибраними з групи, , що складається з Н, CN, =O, Hal, Alk, OAlk, OH, NRCN, C(CN)=C(OH)(OAlk), SR, NRR', C(O)NRR', гетероциклу, арилу, гетероарилу, де Alk, арил, гетероарил, гетероцикл необов’язково заміщені Hal, NRR', CN, ОН, CF3, арилом, гетероарилом, OAlk;
- 5-7-членний гетероцикл, за переважними варіантами гетероарил, який включає від 1 гетероатома до 5 гетероатомів, необовязково заміщений одним або кількома замісниками, вибраними з групи, , що складається з Н, CN, =O, Hal, Alk, OAlk, OH, NRCN, C(CN)=C(OH)(OAlk), SR, NRR', C(O)NRR', гетероциклу, арилу, гетероарилу, де Alk, арил, гетероарил, гетероцикл необов’язково заміщені Hal, NRR', CN, ОН, CF3, арилом, гетероарилом, OAlk;
де ![]() та
та 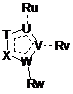 конденсовані між собою через Т та X;
конденсовані між собою через Т та X;
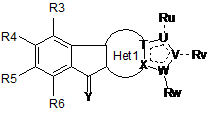
Т, U, V, W, X є однаковими або різними і можуть бути вибрані з групи, що складається з С, N, О, S;
Y - N-OR1, NR'l, CR2R'2;
R1 - Н, алкіл, алкеніл, алкоксіалкіл, арилоксіалкіл, арил алкіл, алкоксикарбонілалкіл, карбоксіалкіл;
R'1 - Н, алкіл, арил або аралкіл;
R2, R'2 є однаковими або різними і вибрані незалежно один від одного з групи, що складається з Н, алкілу, арилу та аралкілу;
Ru, Rv, Rw є однаковими або різними і можуть бути вибрані з групи, що складається з Н, CN, =O, Hal, Alk, OAlk, OH, NRCN, C(CN)=C(OH)(OAlk), SR, NRR', C(O)NRR', гетероциклу, арилу, гетероарилу, циклоалкілу, де Alk, арил, гетероарил, гетероцикл, циклоалкіл необов’язково заміщені Hal, NRR', CN, ОН, CF3, арилом, гетероарилом, OAlk;
R3, R4, R5, R6 є однаковими або різними і незалежно один від одного вибрані з групи, що складається з Н, OAlk, Alk, Hal, NRR', CN, OH, OCF3, CF3, арилу, гетероарилу;
R та R' є однаковими або різними і незалежно один від одного вибрані з групи, що складається з Н, Alk, де Alk необов’язково заміщений Hal, NRR', CN, OH, CF3, арилом, гетероарилом;
або її фармацевтично прийнятні солі, гідрати або гідратовані солі, або поліморфні кристалічні структури цієї сполуки, або її оптичні ізомери, рацемати, діастереомери або енантіомери, або її регіоізомери, геометричні ізомери (Е та Z) або їх суміші.
2. Сполука формули (І) за п. 1, де Т, U, V, W, X незалежно один від одного є С або N.
3. Сполука формули (І) за будь-яким із п. 1 або п. 2, де ![]() містить 2 гетероатоми або 3 гетероатоми.
містить 2 гетероатоми або 3 гетероатоми.
4. Сполука формули (І) за будь-яким із попередніх пунктів, де щонайменше один з Ru, Rv, Rw вибраний з групи, що складається з Н, арилу, Alk, NRR', Hal, -Alk-арилу, -AlkOH, -AlkOAlk, циклоалкілу.
5. Сполука за будь-яким із попередніх пунктів, де R3, R4, R5, R6 є однаковими або різними та кожний з них незалежно від інших вибраний з групи, яку складають Н, Hal, Alk, OAlk, OCF3.
6. Сполука за будь-яким із попередніх пунктів, де кожний з Rv, Rw незалежно один від одного є Н або відсутній.
7. Сполука формули (І) за будь-яким із попередніх пунктів, де сполука має формулу (Іа):
 , (Іа)
, (Іа)
де R3, R4, R5, R6, Y, T, U, V, W, X, Ru відповідають визначенням за будь-яким з попередніх пунктів.
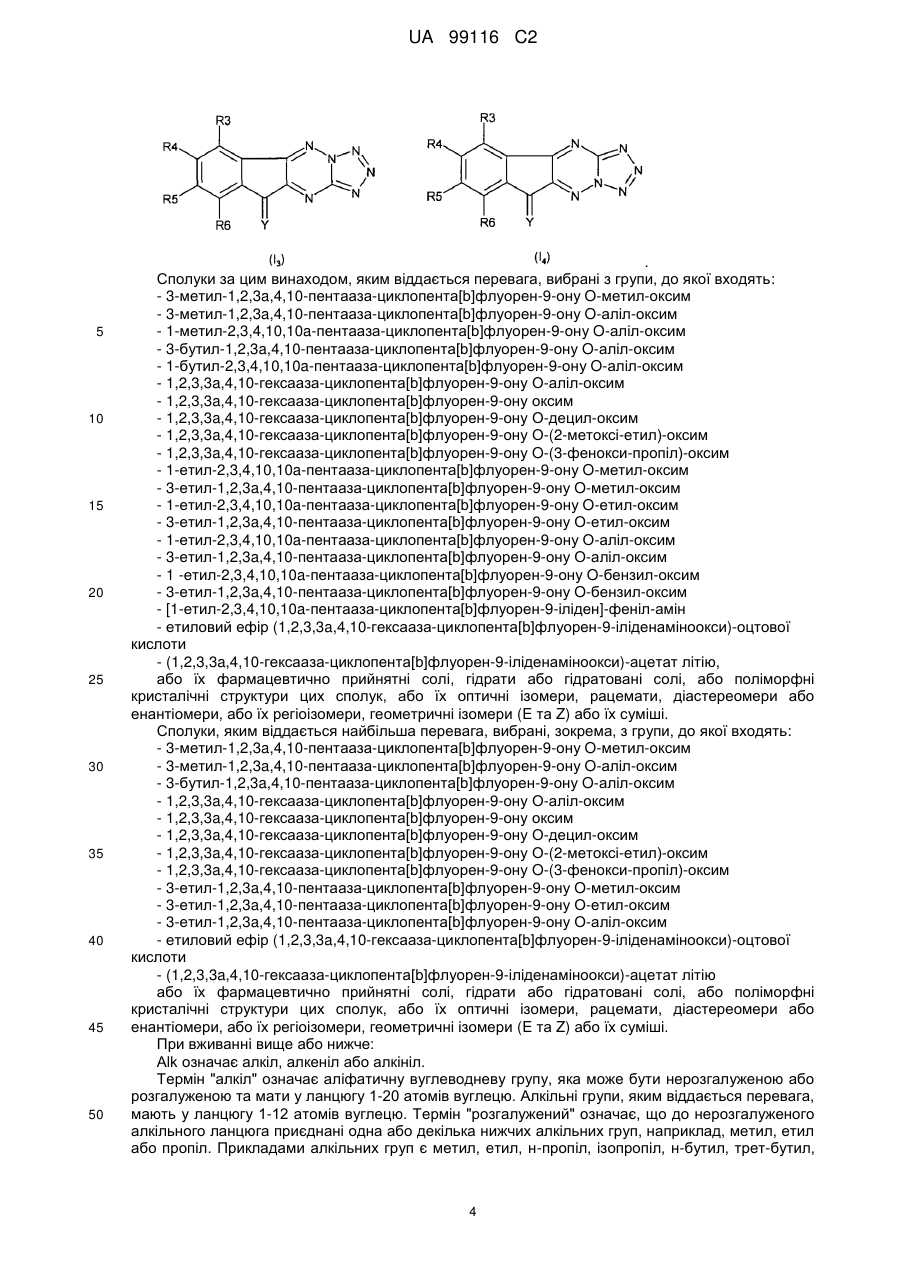
8. Сполука за будь-яким із попередніх пунктів, вибрана з групи, яку складають:
3-метил-1,2,3а,4,10-пентаазациклопента[b]флуорен-9-ону О-метилоксим;
3-метил-1,2,3а,4,10-пентаазациклопента[b]флуорен-9-ону О-алілоксим;
1-метил-2,3,4,10,10а-пентаазациклопента[b]флуорен-9-ону О-алілоксим;
3-бутил-1,2,3а,4,10-пентаазациклопента[b]флуорен-9-ону О-алілоксим;
1-бутил-2,3,4,10,10а-пентаазациклопента[b]флуорен-9-ону О-алілоксим;
1,2,3,3а,4,10-гексаазациклопента[b]флуорен-9-ону О-алілоксим;
1,2,3,3а,4,10-гексаазациклопента[b]флуорен-9-ону оксим;
1,2,3,3а,4,10-гексаазациклопента[b]флуорен-9-ону О-децилоксим;
1,2,3,3а,4,10-гексаазациклопента[b]флуорен-9-ону О-(2-метоксіетил)-оксим;
1,2,3,3а,4,10-гексаазациклопента[b]флуорен-9-ону О-(3-феноксипропіл)-оксим;
1-етил-2,3,4,10,10а-пентаазациклопента[b]флуорен-9-ону О-метилоксим;
3-етил-1,2,3а,4,10-пентаазациклопента[b]флуорен-9-ону О-метилоксим;
1-етил-2,3,4,10,10а-пентаазациклопента[b]флуорен-9-ону О-етилоксим;
3-етил-1,2,За,4,10-пентаазациклопента[b]флуорен-9-ону О-етилоксим;
1-етил-2,3,4,10,10а-пентаазациклопента[b]флуорен-9-ону О-алілоксим;
3-етил-1,2,3а,4,10-пентаазациклопента[b]флуорен-9-ону О-алілоксим;
1-етил-2,3,4,10,10а-пентаазациклопента[b]флуорен-9-ону О-бензилоксим;
3-етил-1,2,3а,4,10-пентаазациклопента[b]флуорен-9-ону О-бензилоксим;
[1-етил-2,3,4,10,10а-пентаазациклопента[b]флуорен-9-іліден]-феніламін;
етиловий ефір (1,2,3,3а,4,10-гексаазациклопента[b]флуорен-9-іліденамінооксі)-оцтової кислоти;
(1,2,3,3а,4,10-гексаазациклопента[b]флуорен-9-іліденамінооксі)-ацетат літію,
або їх фармацевтично прийнятні солі, гідрати або гідратовані солі, або поліморфні кристалічні структури цих сполук, або їх оптичні ізомери, рацемати, діастереомери або енантіомери, або їх регіоізомери, геометричні ізомери (Е та Z) або їх суміші.
9. Спосіб одержання сполуки формули (І) за будь-яким із попередніх пунктів 1-8, який включає стадію проведення реакції відповідної сполуки формули (I')
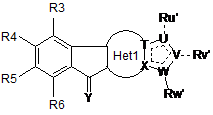 , (I')
, (I')
де R3, R4, R5, R6, Het1, T, U, V, W, X, Ru, Rv, Rw відповідають визначенням за будь-яким із пп. 1-7, та де кожна з груп Ru', Rv', Rw' є аналогічною Ru, Rv, Rw або є групою-попередником відповідної групи Ru, Rv, Rw, шляхом виконання однієї або кількох стадій, які забезпечують перетворення групи-попередника у цільову групу Ru, Rv або Rw, та необов’язково виділення сполуки формули (І).
10. Спосіб одержання сполуки за будь-яким із попередніх пп. 1-8, який включає стадію проведення реакції відповідних сполук формули (II) та формули (III):
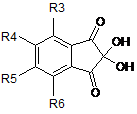 , (II)
, (II)
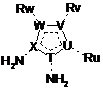 , (III)
, (III)
де R3, R4, R5, R6, Т, U, V, W, X, Ru, Rv, Rw відповідають визначенням за будь-яким із пп. 1-7.
11. Фармацевтична композиція, яка містить сполуку формули (І)
 , (І)
, (І)
де R3, R4, R5, R6, Т, U, V, W, X, Het1, Ru, Rv та Rw відповідають визначенням за пп. 1-8.
12. Сполука формули (І) за будь-яким з пп. 1-8 для інгібування однієї або декількох цистеїнпротеаз.
13. Сполука за п. 12, причому згадані цистеїнпротеази належать до однієї або декількох груп ензимів деубіквітинації, каспаз, катепсинів, кальпаїнів, а також вірусних, бактеріальних, грибкових або паразитарних цистеїнпротеаз.
14. Сполука формули (І) за будь-яким з пп. 1-8 для лікування та/або попередження раку та метастазів, нейродегенеративних захворювань, наприклад хвороби Альцгеймера та хвороби Паркінсона, запальних розладів, серцево-судинних захворювань та/або вірусних інфекцій та прихованих патологічних станів, зокрема вірусу-1 простого герпесу, вірусу Епштейна-Барра або коронавірусу SARS, запальних розладів, нейродегенеративних захворювань, за варіантом, якому віддається перевага, ушкоджень нервових клітин, спричинених інсультом, ушкодження печінки та печінкової недостатності, які є наслідком гострої або хронічної інфекції, ішемічного або хімічного ушкодження печінки, ушкодження нирок та ниркової недостатності, які є наслідком гострої або хронічної інфекції, ішемічного або хімічного ушкодження нирок, ушкодження серця та серцевої недостатності, які є наслідком гострої або хронічної інфекції, ішемічного або хімічного ушкодження серця, діабету, спричиненого гострим або хронічним аутоімунним, хімічним, окиснювальним або метаболічним ушкодженням інсулінових бета-клітин панкреатичних острівців, раку та метастазів, серцево-судинних захворювань, імунологічних розладів, захворювань кісток та суглобів, остеопорозу та артриту, вікових розладів, пізніх нападів діабету та катаракти, вірусних інфекцій та захворювань, у тому числі гепатиту А, гепатиту С, інфекції та захворювань, спричинених коронавірусом SARS, риновірусних інфекцій та захворювань, аденовірусних інфекцій та захворювань, поліомієліту, бактеріальних інфекцій та захворювань, у тому числі стрептококових інфекцій та захворювань, інфекцій та захворювань, спричинених бактеріями роду Clostridium sp., стафілококових інфекцій та захворювань, гінгівіту та періодонтальних захворювань, грибкових інфекцій та захворювань, інфекцій та захворювань, викликаних протозойними паразитами, інфекцій та захворювань, викликаних паразитами - плоскими черв'яками, інфекцій та захворювань, викликаних паразитами - круглими черв'яками.
15. Сполука формули (І) за будь-яким з пп. 1-8 для застосування у комбінації з однією або декількома терапіями, вибраними з протиракової терапії, неврологічної терапії, тромболітичної терапії, антиоксидантної терапії, протиінфекційної, антигіпертонічної терапії, діуретичної терапії, тромболітичної терапії, імуносупресивної терапії, серцево-судинної терапії, імуномодулювальної терапії, протизапальної терапії, противірусної терапії, протибактеріальної терапії, протигрибкової терапії, протипротозойної терапії, протипаразитної терапії, - для лікування та/або попередження раку та метастазів, нейродегенеративних захворювань, наприклад хвороби Альцгеймера та хвороби Паркінсона, запальних розладів, серцево-судинних захворювань та/або вірусних інфекцій та прихованих патологічних станів, зокрема вірусу-1 простого герпесу, вірусу Епштейна-Барра або коронавірусу SARS, запальних розладів, нейродегенеративних захворювань, за варіантом, якому віддається перевага, ушкоджень нервових клітин, спричинених інсультом, ушкодження печінки та печінкової недостатності, які є наслідком гострої або хронічної інфекції, ішемічного або хімічного ушкодження печінки, ушкодження нирок та ниркової недостатності, які є наслідком гострої або хронічної інфекції, ішемічного або хімічного ушкодження нирок, ушкодження серця та серцевої недостатності, які є наслідком гострої або хронічної інфекції, ішемічного або хімічного ушкодження серця, діабету, спричиненого гострим або хронічним аутоімунним, хімічним, окиснювальним або метаболічним ушкодженням інсулінових бета-клітин панкреатичних острівців, раку та метастазів, серцево-судинних захворювань, імунологічних розладів, захворювань кісток та суглобів, остеопорозу та артриту, вікових розладів, пізніх нападів діабету та катаракти, вірусних інфекцій та захворювань, у тому числі гепатиту А, гепатиту С, інфекції та захворювань, спричинених коронавірусом SARS, риновірусних інфекцій та захворювань, аденовірусних інфекцій та захворювань, поліомієліту, бактеріальних інфекцій та захворювань, у тому числі стрептококових інфекцій та захворювань, інфекцій та захворювань, спричинених бактеріями роду Clostridium sp., стафілококових інфекцій та захворювань, гінгівіту та періодонтальних захворювань, грибкових інфекцій та захворювань, інфекцій та захворювань, викликаних протозойними паразитами, інфекцій та захворювань, викликаних паразитами - плоскими черв'яками, інфекцій та захворювань, викликаних паразитами - круглими черв'яками.
Текст
Реферат: Цей винахід стосується нових сполук формули (І), способів їх одержання та їх терапевтичного застосування: Формула (І), де R3, R4, R5, R6, Y, Het1, T, U, V, W, X, Ru, Rv та Rw відповідають визначенням за п 1. UA 99116 C2 (12) UA 99116 C2 UA 99116 C2 5 10 15 20 25 30 35 40 45 50 55 Цей винахід стосується нових інгібіторів цистеїнпротеаз, способів їх виготовлення та їх терапевтичного застосування. Протеази можна класифікувати на основі їхньої специфічності до субстратів або механізмів каталізу. Відомі п’ять головних класів протеаз, що розрізняються за механізмами гідролізу пептидів: серинпротеази, цистеїнпротеази, аспартатпротеази, треонінпротеази та металопротеази. До цистеїнпротеаз належать, поряд з іншими, ензими деубіквітинації, каспази, катепсини, кальпаїни, а також вірусні, бактеріальні або паразитарні цистеїнпротеази. До ензимів деубіквітинації належать убіквітин-специфічні протеази (USP) та убіквітинкарбоксигідролази (UCH). Загалом кажучи, убіквітиновий провідний шлях регулює деградацію протеїнів і, більш конкретно, бере участь у процесах розвитку раку, нейродегенеративних захворювань, наприклад, хвороби Альцгеймера, хвороби Паркінсона, запалень, вірусних інфекцій та прихованих патологічних станів (зокрема, це стосується вірусу-1 простого герпесу, вірусу Епштейна-Барра, коронавірусу SARS), та серцево-судинних захворювань (Chem. Rev. 1997, 97, p. 133-171; Chem. Rev. 2002, 102, p. 4459-4488; J. Biochem. 2003, 134, p. 9-18; J. Virology, 2005, 79(7), p. 4550-4551; Cardiovasc. Res. 2004, 61, p. 11-21). Показано, що каспази беруть участь в апоптозі і, отже, є мішенями при гепатиті, печінковій недостатності, запаленнях, серцевій ішемії та серцевій недостатності, нирковій недостатності, нейродегенерації, глухоті, діабеті та інсульті (J. Pharmacol Exp. Ther., 2004, 308(3), p. 1191-1196, J. Cell. Physiol., 2004, 200(2), p. 177-200; Kidney Int, 2004, 66(2), p. 500-506; Am. J. Pathol., 2004, 165(2), p. 353-355; Mini Rev. Chem., 2004, 4(2), p. 153-165; Otol. Neurotol., 2004, 25(4), p. 627-632; Ref. 7, 21, 22, 23, 24, 25). Показано, що катепсини, як правило, беруть участь у розвитку раку та метастазів, запалень, імунологічних процесів та імунорегуляції (Eur. Respir. J., 2004, 23(4), p. 620-628) та атеросклерозу (Ageing Res. Rev.. 2003, 2(4), p. 407-418). Більш конкретно, до катепсинів належать катепсин-B та B-подібні катепсини, які відіграють роль у розвитку раку та метастазів, а також артриту (Cancer Metastasis Rev., 2003, 22(2-3), p. 271-286; Biol. Chem., 2003, 384(6), p. 845-854 та Biochem. Soc. Symp., 2003, 70, p. 263276); катепсин-D, який бере участь, зокрема, у розвитку раку та метастазів (Сlin. Exp. Metastasis, 2004, 21(2), p. 91-106); катепсин-K, який відіграє певну роль при остеопорозі та артриті (Int. J. Pharm., 2004, 277(1-2), p. 73-79): катепсин-S, який відіграє певну роль при презентації антигенів в імунології (Drug News Perspective, 2004, 17(6), p. 357-363). Кальпаїни відіграють певну роль взагалі при старінні (Ageing Res. Rev. 2003, 2(4), p. 407418), а також, більш конкретно, при діабеті (Mol. Cell. Biochem., 2004, 261(1), p. 161-167) та катаракті (Trends Mol. Med., 2004, 10(2), p. 78-84). Вірусні цистеїнпротеази ідентифіковано у риновірусах, вірусі поліомієліту, вірусі гепатиту A, вірусі гепатиту C, аденовірусі та коронавірусі SARS (Chem. Rev. 1997, 97, p. 133-171; Chem. Rev. 2002, 102, p. 4459-4488; J. Virology, 2005, 79(7), p. 4550-4551; Aсta Microbiol. Immunol. Hung., 2003, 50(1), p. 95-101). До бактеріальних цистеїнпротеаз належать стрептопаїн, стафілококова цистеїнпротеаза, клострипаїн та гінгіпаїни; показано також, що дріжджі, наприклад, Aspergillus flavus, також експресують цистеїнпротеази, які можуть бути вірулентним фактором (Chem. Rev. 1997, 97, p. 133-171). Огляд паразитарних цистеїнпротеаз подано, наприклад, у Molecular & Biochemical Parasitology (2002, 120, p. 1-21) та у Chem. Rev. (2002, 102, p. 4459-4488). Слід зазначити, що паразитарні організми, відповідальні за більшість головних паразитарних захворювань, використовують власні цистеїнпротеази на тій чи іншій стадії інфекційного, живильного або репродуктивного циклу; до таких захворювань належать малярія, хвороба Шагаса, африканський трипаносомоз, лейшманіоз, лямбліоз, трихомоноз, амебіоз, криптоспоридіоз, токсоплазмоз, шистозоматоз, фасціольоз, онхоцеркоз та інші інфекції, що викликаються деякими іншими плоскими або круглими черв’яками. Отже, віднайдення нового класу інгібіторів цистеїнпротеаз має важливе значення для лікування широкого різноманіття захворювань та патологічних станів. У патенті US 6,514,927 та заявках WO01/79209 та WO02/02562 описані сполуки, які включають 4 конденсовані цикли. Однак їх застосування як інгібіторів цистеїнпротеаз не пропонується. Згідно з першим аспектом, цей винахід стосується сполук формули (I): 1 UA 99116 C2 , де: – або одинарний, або подвійний зв’язок, залежно від конкретного випадку; – або відсутній, або одинарний зв’язок, залежно від конкретного випадку; 5 10 15 20 25 30 35 – 5-7-членний гетероцикл, за варіантами, яким віддається перевага, гетероарил, який включає від 1 гетероатому до 5 гетероатомів, факультативно заміщений одним або кількома замісниками, вибраними з групи, до якої входять H, CN, =О, Hal, Alk, OAlk, OH, NRCN, C(CN)=C(OH)(OAlk), SR, NRR', C(O)NRR', гетероцикл, арил, гетероарил, де Alk, арил, гетероарил, гетероцикл факультативно заміщені Hal, NRR', CN, OH, CF3, арилом, гетероарилом, OAlk; де та конденсовані між собою через T and X; Y – N-OR1,NR'1,CR2R'2; R1 – H, алкіл, алкеніл, алкоксіалкіл, арилоксіалкіл, арилалкіл, алкоксикарбонілалкіл, карбоксіалкіл; R'1 – H, алкіл, арил або аралкіл; R2, R'2 є однаковими або різними і вибрані незалежно один від одного з групи, до якої входять H, алкіл, арил та аралкіл; T, U, V, W, X є однаковими або різними і можуть бути вибрані з групи, до якої входять C, N, O, S. Ru, Rv, Rw є однаковими або різними і можуть бути вибрані з групи, до якої входять H, CN, =О, Hal, Alk, OAlk, OH, NRCN, C(CN)=C(OH)(OAIk), SR, NRR', C(O)NRR', гетероцикл, арил, гетероарил, циклоалкіл, де Alk, арил, гетероарил, гетероцикл, циклоалкіл факультативно заміщені Hal, NRR', CN, OH, CF3, арилом, гетероарилом, OAlk. R3, R4, R5, R6 є однаковими або різними і незалежно один від одного вибрані з групи, до якої входять H, OAlk, Alk, Hal, NRR', CN, OH, OCF3, CF3, арил, гетероарил; R та R' є однаковими або різними і незалежно один від одного вибрані з групи, до якої входять H, Alk, де Alk факультативно заміщений Hal, NRR', CN, OH, CF3, арилом, гетероарилом; або їх фармацевтично прийнятних солей, гідратів або гідратованих солей, або поліморфних кристалічних структур цих сполук, або їх оптичних ізомерів, рацематів, діастереомерів або енантіомерів, або їх регіоізомерів, геометричних ізомерів (E та Z) або їх сумішей. За варіантами, яким віддається перевага, T, U, V, W, X – С або N. За варіантами, яким віддається перевага, Y – N-ОR1 або NR'1, у варіантах, яким віддається більша перевага, – N-ОR1, особливо N-OH, N-алкіл, N-O-алкеніл, N-O-алкіл-О-алкіл, N-О-алкіл-CO-O-алкіл, N-О-алкіл-COOH. Мається на увазі, що, коли Y – CR2R2', R2 та/або R2' не можуть утворювати конденсований цикл з рештою структури формули (I). За варіантами, яким віддається перевага, містить 2 гетероатоми або 3 гетероатоми, більша перевага віддається 2 атомам або 3 атомам N. 2 UA 99116 C2 За варіантами, яким або 5 віддається найбільша перевага, є , . За варіантами, яким віддається перевага, є незаміщеним. За варіантами, яким віддається перевага, Ru, Rv, Rw вибрані з групи, до якої входять H, 1 арил, Alk, NRR , Hal, -Alk-арил, -AlkOH, -AlkOAlk, циклоалкіл. За варіантами, яким віддається перевага, є , або , або 10 15 , де Rw – H. За варіантами, яким віддається перевага, R3, R4, R5, R6 є однаковими або різними та вибрані незалежно один від одного з групи, до якої входять H, Hal, Alk, OAlk, OCF3. За варіантами, яким віддається перевага, R та R' є однаковими або різними та вибрані незалежно один від одного з групи, до якої входять H, Alk. За варіантами, яким віддається перевага, Rv, Rw є атомами водню або відсутні. Сполуками формули (I), яким віддається перевага, є сполуки формули (Ia): Сполуками, формул (I1)-(I4): яким . віддається найбільша 3 перевага, є сполуки UA 99116 C2 5 10 15 20 25 30 35 40 45 50 . Сполуки за цим винаходом, яким віддається перевага, вибрані з групи, до якої входять: - 3-метил-1,2,3a,4,10-пентааза-циклопента[b]флуорен-9-ону O-метил-оксим - 3-метил-1,2,3a,4,10-пентааза-циклопента[b]флуорен-9-ону O-аліл-оксим - 1-метил-2,3,4,10,10a-пентааза-циклопента[b]флуорен-9-ону O-аліл-оксим - 3-бутил-1,2,3a,4,10-пентааза-циклопента[b]флуорен-9-ону O-аліл-оксим - 1-бутил-2,3,4,10,10a-пентааза-циклопента[b]флуорен-9-ону O-аліл-оксим - 1,2,3,3a,4,10-гексааза-циклопента[b]флуорен-9-ону O-аліл-оксим - 1,2,3,3a,4,10-гексааза-циклопента[b]флуорен-9-ону оксим - 1,2,3,3a,4,10-гексааза-циклопента[b]флуорен-9-ону O-децил-оксим - 1,2,3,3a,4,10-гексааза-циклопента[b]флуорен-9-ону O-(2-метоксі-етил)-оксим - 1,2,3,3a,4,10-гексааза-циклопента[b]флуорен-9-ону O-(3-фенокси-пропіл)-оксим - 1-етил-2,3,4,10,10a-пентааза-циклопента[b]флуорен-9-ону O-метил-оксим - 3-етил-1,2,3a,4,10-пентааза-циклопента[b]флуорен-9-ону O-метил-оксим - 1-етил-2,3,4,10,10a-пентааза-циклопента[b]флуорен-9-ону O-етил-оксим - 3-етил-1,2,3a,4,10-пентааза-циклопента[b]флуорен-9-ону O-етил-оксим - 1-етил-2,3,4,10,10a-пентааза-циклопента[b]флуорен-9-ону O-аліл-оксим - 3-етил-1,2,3a,4,10-пентааза-циклопента[b]флуорен-9-ону O-аліл-оксим - 1 -етил-2,3,4,10,10a-пентааза-циклопента[b]флуорен-9-ону O-бензил-оксим - 3-етил-1,2,3a,4,10-пентааза-циклопента[b]флуорен-9-ону O-бензил-оксим - [1-етил-2,3,4,10,10a-пентааза-циклопента[b]флуорен-9-іліден]-феніл-амін - етиловий ефір (1,2,3,3a,4,10-гексааза-циклопента[b]флуорен-9-іліденаміноокси)-оцтової кислоти - (1,2,3,3a,4,10-гексааза-циклопента[b]флуорен-9-іліденаміноокси)-ацетат літію, або їх фармацевтично прийнятні солі, гідрати або гідратовані солі, або поліморфні кристалічні структури цих сполук, або їх оптичні ізомери, рацемати, діастереомери або енантіомери, або їх регіоізомери, геометричні ізомери (E та Z) або їх суміші. Сполуки, яким віддається найбільша перевага, вибрані, зокрема, з групи, до якої входять: - 3-метил-1,2,3a,4,10-пентааза-циклопента[b]флуорен-9-ону O-метил-оксим - 3-метил-1,2,3a,4,10-пентааза-циклопента[b]флуорен-9-ону O-аліл-оксим - 3-бутил-1,2,3a,4,10-пентааза-циклопента[b]флуорен-9-ону O-аліл-оксим - 1,2,3,3a,4,10-гексааза-циклопента[b]флуорен-9-ону O-аліл-оксим - 1,2,3,3a,4,10-гексааза-циклопента[b]флуорен-9-ону оксим - 1,2,3,3a,4,10-гексааза-циклопента[b]флуорен-9-ону O-децил-оксим - 1,2,3,3a,4,10-гексааза-циклопента[b]флуорен-9-ону O-(2-метоксі-етил)-оксим - 1,2,3,3a,4,10-гексааза-циклопента[b]флуорен-9-ону O-(3-фенокси-пропіл)-оксим - 3-етил-1,2,3a,4,10-пентааза-циклопента[b]флуорен-9-ону O-метил-оксим - 3-етил-1,2,3a,4,10-пентааза-циклопента[b]флуорен-9-ону O-етил-оксим - 3-етил-1,2,3a,4,10-пентааза-циклопента[b]флуорен-9-ону O-аліл-оксим - етиловий ефір (1,2,3,3a,4,10-гексааза-циклопента[b]флуорен-9-іліденаміноокси)-оцтової кислоти - (1,2,3,3a,4,10-гексааза-циклопента[b]флуорен-9-іліденаміноокси)-ацетат літію або їх фармацевтично прийнятні солі, гідрати або гідратовані солі, або поліморфні кристалічні структури цих сполук, або їх оптичні ізомери, рацемати, діастереомери або енантіомери, або їх регіоізомери, геометричні ізомери (E та Z) або їх суміші. При вживанні вище або нижче: Alk означає алкіл, алкеніл або алкініл. Термін "алкіл" означає аліфатичну вуглеводневу групу, яка може бути нерозгалуженою або розгалуженою та мати у ланцюгу 1-20 атомів вуглецю. Алкільні групи, яким віддається перевага, мають у ланцюгу 1-12 атомів вуглецю. Термін "розгалужений" означає, що до нерозгалуженого алкільного ланцюга приєднані одна або декілька нижчих алкільних груп, наприклад, метил, етил або пропіл. Прикладами алкільних груп є метил, етил, н-пропіл, ізопропіл, н-бутил, трет-бутил, 4 UA 99116 C2 5 10 15 20 25 30 35 40 45 50 55 60 н-пентил, 3-пентил, октил, ноніл, децил. Термін "алкеніл" означає аліфатичну вуглеводневу групу, яка містить вуглець-вуглецевий подвійний зв’язок, може бути нерозгалуженою або розгалуженою та має у ланцюгу 2-15 атомів вуглецю. Алкенільні групи, яким віддається перевага, мають у ланцюгу 2-12 атомів вуглецю; та за варіантом, якому віддається більша перевага, мають у ланцюгу приблизно 2-4 атоми вуглецю. Прикладами алкенільних груп є етеніл, пропеніл, н-бутеніл, ізобутеніл, 3-метилбут-2еніл, н-пентеніл, гептеніл, октеніл, ноненіл, деценіл. Термін "алкініл" означає аліфатичну вуглеводневу групу, яка містить вуглець-вуглецевий потрійний зв’язок, може бути нерозгалуженою або розгалуженою та має у ланцюгу 2-15 атомів вуглецю. Алкінільні групи, яким віддається перевага, мають у ланцюгу 2-12 атомів вуглецю; а за варіантом, якому віддається більша перевага, мають у ланцюгу 2-4 атоми вуглецю. Прикладами алкінільних груп є етиніл, пропініл, н-бутиніл, 2-бутиніл, 3-метилбутиніл, н-пентиніл, гептиніл, остиніл та дециніл. Термін "алкоксіалкіл" означає групу алкіл-O-алкіл, де алкільні групи незалежно одна від одної відповідають визначенню, поданому в цьому описі. Прикладом алкоксіалкілу є метоксіетил. Термін "алкоксикарбонілалкіл" означає групу алкіл-O-CO-алкіл-, де алкільні групи незалежно одна від одної відповідають визначенню, поданому в цьому описі. Прикладами алкоксикарбонілалкілів є метокси- та етоксикарбонілметил та -карбонілетил. Термін "атом галогену" означає атоми фтору, хлору, брому або йоду; за варіантом, якому віддається перевага, атоми фтору та хлору. Термін "арил" означає ароматичну моноциклічну або поліциклічну вуглеводневу систему із 6-14 атомів вуглецю, за варіантом, якому віддається перевага, із 6-10 атомів вуглецю. Прикладами арильних груп є феніл або нафтил. Термін "арилалкіл" означає групу арил-алкіл-, де арил та алкіл відповідають визначенням, поданим у цьому описі. Прикладом арилалкілу є бензил. Термін "арилоксіалкіл" означає групу арил-О-алкіл-, де арил та алкіл відповідають визначенням, поданим у цьому описі. Прикладом арилоксіалкілу є феноксипропіл. При вживанні у цьому описі терміни "гетероцикл" або "гетероциклічний" означають насичені, частково ненасичені або ненасичені, неароматичні стабільні 3-14-, за варіантом, якому віддається перевага, 5-10-членні моно-, бі- або поліциклічні системи, де щонайменше одним членом циклу є гетероатом. У типових випадках до гетероатомів належать, проте без обмеження ними, атоми кисню, азоту, сірки, селену та фосфору. До гетероатомів, яким віддається перевага, належать кисень, азот та сірка. th Придатні гетероцикли також описані у довіднику The Handbook of Chemistry and Physics, 76 Edition, CRC Press, Inc., 1995-1996, стор. з 2-25 до 2-26, зміст якого включено до цього опису шляхом посилання. До неароматичних гетероциклів, яким віддається перевага, належать, проте без обмеження ними, піролідиніл, піразолідиніл, імідазолідиніл, оксираніл, тетрагідрофураніл, діоксоланіл, тетрагідропіраніл, діоксаніл, діоксоланіл, піперидил, піперазиніл, морфолініл, піраніл, імідазолініл, піролініл, піразолініл, тіазолідиніл, тетрагідротіопіраніл, дитіаніл, тіоморфолініл, дигідропіраніл, тетрагідропіраніл, дигідропіраніл, тетрагідропіридил, дигідропіридил, тетрагідропіринідиніл, дигідротіопіраніл, азепаніл, а також конденсовані системи, які утворюються при конденсації з фенільною групою. При вживанні у цьому описі, терміни "гетероарил" або "ароматичний гетероцикл" означають 5-14-, за варіантом, якому віддається перевага, 5-10-членну ароматичну моно-, бі- або поліциклічну гетероциклічну систему. Прикладами є піроліл, піридил, піразоліл, тієніл, піримідиніл, піразиніл, тетразоліл, індоліл, хінолініл, пуриніл, імідазоліл, тієніл, тіазоліл, бензотіазоліл, фураніл, бензофураніл, 1,2,4-тіадіазоліл, ізотіазоліл, триазоліл, тетразоліл, ізохіноліл, бензотієніл, ізобензофурил, піразоліл, карбазоліл, бензимідазоліл, ізоксазоліл, піридил-N-оксид, а також конденсовані системи, одержані шляхом конденсування із фенільною групою. Термін "карбоксіалкіл" означає групу HOOC-алкіл-, де алкіл відповідає визначенню, поданому в цьому описі. До таких груп, яким віддається перевага, належать карбоксиметил та карбоксіетил. Терміни "алкіл", "циклоалкіл", "алкеніл", "алкініл", "арил", "гетероарил", "гетероцикл" тощо стосуються також відповідних "алкілену", "циклоалкілену", "алкенілену", "алкінілену", "арилену", "гетероарилену", "гетероциклену" тощо, які утворюються при видаленні двох атомів водню. При вживанні у цьому описі, термін "пацієнт" стосується як тварини, наприклад, тварини, корисної для розплодження, спілкування або збереження, або, за варіантом, якому віддається 5 UA 99116 C2 5 10 15 20 25 30 35 40 45 50 55 60 перевага, людини чи дитини, які страждають на одне або декілька захворювань та хворобливих станів, описаних у цьому документі, або можуть захворіти на них. При вживанні у цьому описі, термін "терапевтично ефективна кількість" означає кількість сполуки за цим винаходом, ефективну для попередження, послаблення, усунення, лікування або регулювання розвитку симптомів вищезгаданих захворювань та хворобливих станів. Термін "регулювання" призначений для позначення процесів, якими можуть бути сповільнення, припинення, затримання або припинення розвитку захворювань та хворобливих станів, описаних у цьому документі, але необов’язково означає повне усунення всіх симптомів захворювань та хворобливих станів, та охоплює профілактичне лікування. При вживанні у цьому описі, термін "фармацевтично прийнятний" стосується тих сполук, матеріалів, наповнювачів, композицій або лікарських форм, які є, в межах логічних медичних міркувань, придатними для контактування з тканинами людей та тварин без надмірної токсичності, подразнення, алергічної реакції або інших ускладнень, порівнянних із прийнятним співвідношенням корисність/ризик. При вживанні у цьому описі, термін "фармацевтично прийнятні солі" стосується похідних розкритих сполук, в яких вихідна сполука модифікована шляхом одержання солей цієї сполуки із кислотою або основою. Фармацевтично прийнятні солі охоплюють звичайні нетоксичні солі або четвертинні амонієві солі вихідної сполуки, утворені, наприклад, із нетоксичними неорганічними або органічними кислотами. Наприклад, такі звичайні нетоксичні солі охоплюють похідні неорганічних кислот, наприклад, хлористоводневої, бромистоводневої, сірчаної, сульфамінової, фосфорної, азотної тощо; та солі, одержані із застосуванням органічних кислот, наприклад, оцтової, пропіонової, бурштинової, винної, лимонної, метансульфонової, бензолсульфонової, глюкоронової, глутамінової, бензойної, саліцилової, толуолсульфонової, щавлевої, фумарової, малеїнової, молочної тощо. Крім того, до таких солей належать амонієві солі, наприклад, трометаміну, меглуміну, еполаміну тощо, солі металів, наприклад, натрію, калію, кальцію, цинку або магнію. Фармацевтично прийнятні солі за цим винаходом можуть бути синтезовані з вихідної сполуки, яка містить основні або кислотні фрагменти, звичайними хімічними способами. Взагалі, такі солі можуть бути одержані шляхом проведення реакції цих сполук у формах вільної кислоти або основи із стехіометричною кількістю прийнятної основи або кислоти у воді або у органічному розчиннику, або ж у їх суміші. Як правило, перевага віддається неводним розчинникам, наприклад, таким як діетиловий ефір, етилацетат, етанол, ізопропанол або ацетонітрил. Перелік придатних солей можна знайти у довіднику Remington's Pharmaceutical th Sciences, 17 ed., Mack Publishing Company, Easton, PA, 1985, стор. 1418, зміст якого включено до цього опису шляхом посилання. Сполуки загальної формули (I), які мають геометричні та стереоізомери, також є частиною цього винаходу. За подальшим аспектом, цей винахід також стосується способу одержання сполук формули (I). Сполуки та спосіб за цим винаходом можуть бути реалізовані численними шляхами, відомими фахівцю в галузі. Сполуки можуть бути синтезовані, наприклад, шляхом застосування або адаптації способів, описаних нижче, або їх варіюванням, що зрозуміло фахівцю в галузі. Прийнятні модифікації та заміни є очевидними та добре відомими або можуть бути легко запозичені фахівцем у галузі з наукової літератури. Зокрема, такі способи можна знайти у монографії Ларока (R.C. Larock, Comprehensive Organic Transformations, Wiley-VCH Publishers, 1999). Мається на увазі, що сполуки за цим винаходом можуть містити один або кілька асиметрично заміщених атомів вуглецю, та можуть бути виділені в оптично активних або рацемічних формах. Таким чином, маються на увазі усі хіральні, діастереомерні, рацемічні форми та ізомерні форми, якщо спеціально не вказано конкретну стереохімічну конфігурацію або ізомерну форму. Способи одержання та виділення таких оптично активних форм добре відомі в галузі. Наприклад, суміші стереоізомерів можна розділяти стандартними способами, необмежувальними прикладами яких є розділення рацемічних форм, хроматографія на нормальній фазі, з оберненою фазою та на хіральній фазі, переважне солеутворення тощо, або методами хірального синтезу із хіральних вихідних матеріалів чи цілеспрямованого синтезу цільових хіральних центрів. Крім того, за способом за цим винаходом можуть бути одержані різні регіоізомери, всі з яких охоплюються цим винаходом. Регіоізомери, як правило, виділяють шляхом хроматографування. Сполуки за цим винаходом можна одержувати різноманітними синтетичними методами. Реагенти та вихідні матеріали є наявними на ринку або можуть бути легко синтезовані фахівцем 6 UA 99116 C2 5 10 15 20 25 30 35 40 45 у галузі добре відомими способами. Усі замісники відповідають поданим вище визначенням, якщо не вказано інше. У реакціях, описаних нижче, може видатися необхідним захист реакційноздатних функціональних груп, наприклад, гідрокси-, аміно-, іміно-, тіо- або карбоксигруп, якщо бажаною є їх присутність у кінцевих продуктах, із метою запобігання їх небажаної участи в реакціях. Для цього можна застосовувати звичайні групи захисту згідно зі стандартною практикою. Приклади таких процесів можна знайти у монографіях Гріні та Вутса (T.W. Greene, P.G.M. Wuts, Protective rd Groups in Organic Chemistry, 3 ed., John Wiley and Sons, 1999) та Мак-Омі (J.F.W. McOmie, Protective Groups in Organic Chemistry, Plenum Press, 1973). Деякі реакції можна виконувати у присутності основи. Конкретних обмежень стосовно природи основ, які слід використосувати у таких реакціях, не існує, і будь-яка основа, звичайно застосовувана в реакціях цього типу, є придатною також у даному разі, за умови, що вона не впливає негативно на інші фрагменти молекули. Прикладами придатних основ є: гідроксид натрію, карбонат калію, триетиламін, гідриди лужних металів, наприклад, гідрид натрію та гідрид калію; алкіллітієві сполуки, наприклад, метиллітій та бутиллітій; та алкоголяти лужних металів, наприклад, метилат натрію та етилат натрію. Реакції звичайно проводять у придатному розчиннику. Можна застосовувати різноманітні розчинники за умови, що вони не впливають негативно на хід реакцій або на застосовані реагенти. Прикладами придатних розчинників є: вуглеводні, які можуть бути ароматичними, аліфатичними або циклоаліфатичними вуглеводнями, наприклад, гексан, циклогексан, бензол, толуол та ксилол; аміди, наприклад, диметилформамід; спирти, наприклад, етанол та метанол, та прості ефіри, наприклад, діетиловий простий ефір та тетрагідрофуран. Реакції можна проводити у широкому діапазоні температур. З’ясовано, що, як правило, зручно проводити реакції при температурі від 0°C до 150°C (за варіантом, якому віддається більша перевага, від температури, близької до кімнатної, до 100°C). Час, необхідний для протікання реакції, також може варіювати у широких межах, залежно від численних факторів, особливо від температури реакції та природи реагентів. Однак за умови, що реакція здійснюється у вказаних вище умовах, яким віддається перевага, достатнім, як правило, є період від 3 год до 20 год. Одержану таким чином сполуку можна виділити з реакційної суміші звичайними способами. Наприклад, сполуку можна виділити шляхом видалення з реакційної суміші розчинника шляхом дистиляції або, в разі необхідності, видалення розчинника з реакційної суміші, виливання залишку у воду з подальшим екстрагуванням органічним розчинником, що не змішується з водою, та видалення розчинника з екстракту. Крім того, продукт за бажанням можна додатково очистити різноманітними добре відомими способами, наприклад, перекристалізацією, переосадженням або різноманітними хроматографічними способами, зокрема, хроматографією на колонці або препаративною хроматографією в тонкому шарі. Спосіб одержання сполук формули (I) за цим винаходом є додатковим предметом цього винаходу. За першим аспектом, сполуки формули (I) за цим винаходом можуть бути одержані шляхом проведення реакції відповідних сполук формули (II) та формули (III): , де R3, R4, R5, R6, T, U, V, W, X, Ru, Rv, Rw відповідають визначенням для формули (I). Як правило, реакція може бути здійснена у органічному протонному розчиннику, наприклад, спирті (за варіантом, якому віддається перевага, етанолі), у присутності кислоти, наприклад, оцтової кислоти. За альтернативним та/або кумулятивним варіантом, сполуки формули (I) можна одержувати з відповідних сполук формули (I`): 7 UA 99116 C2 5 10 15 20 25 , де R3, R4, R5, R6, Het1, T, U, V, W, X, Ru, Rv, Rw відповідають визначенням, поданим для формули (I), де кожна з груп Ru', Rv, Rw аналогічна Ru, Rv, Rw або є групою-попередником відповідних груп Ru, Rv, Rw, шляхом виконання однієї або кількох стадій, які забезпечують перетворення групи-попередника у цільову групу Ru, Rv або Rw. Згідно із цим винаходом, вираз «попередник» стосовно до функціональної групи означає будь-яку групу, яка може бути із застосуванням однієї або кількох реакцій під впливом одного або кількох відповідних реагентів перетворена у бажану функціональну групу. До таких реакцій належать відщеплення групи захисту, а також звичайні реакції приєднання, заміщення або фукнціоналізації. Сполуки формули (I') можна одержати з відповідних сполук формули (II) та формули (III), описаних вище. Сполуки формули (I) можна одержати, зокрема, зі сполук формули (I'), розкритих у EP 05292612,8. Вищезазначені реакції можуть бути здійснені фахівцем шляхом застосування або адаптації способів, ілюстрованих у поданих нижче прикладах. Крім того, спосіб за цим винаходом може також включати додаткову стадію виділення сполуки формули (I). Ця стадія може бути здійснена фахівцем будь-яким відомим звичайним шляхом, наприклад, способами виділення, описаними вище. Вихідні продукти формули (II) та формули (III) є наявними на ринку або можуть бути одержані шляхом застосування або адаптації будь-яких відомих способів або способів, описаних у прикладах. Синтез може бути також проведений в одному реакторі у формі багатокомпонентної реакції. Згідно з іншим аспектом, цей винахід стосується також фармацевтичних композицій, які включають визначені нижче сполуки формули (I): , де: – або одинарний, або подвійний зв’язок, залежно від конкретного випадку; 30 35 – або відсутній, або одинарний зв’язок, залежно від конкретного випадку; – 5-7-членний гетероцикл, за варіантами, яким віддається перевага, гетероарил, який включає від 1 гетероатому до 5 гетероатомів, факультативно заміщений одним або кількома замісниками, вибраними з групи, до якої входять H, CN, =О, Hal, Alk, OAlk, OH, NRCN, C(CN)=C(OH)(OAlk), SR, NRR', C(O)NRR', гетероцикл, арил, гетероарил, де Alk, арил, гетероарил, гетероцикл факультативно заміщені Hal, NRR', CN, OH, CF3, арилом, гетероарилом, OAlk; 8 UA 99116 C2 5 10 15 20 25 30 35 40 45 50 де та конденсовані між собою через T and X; Y – N-ОR1, NR'1,CR2R'2; R1 – H, алкіл, алкеніл, алкоксіалкіл, арилоксіалкіл, арилалкіл, алкоксикарбонілалкіл, карбоксіалкіл; R'1 – H, алкіл, арил або аралкіл; R2, R'2 є однаковими або різними і вибрані незалежно один від одного з групи, до якої входять H, алкіл, арил та аралкіл; T, U, V, W, X є однаковими або різними і можуть бути вибрані з групи, до якої входять C, N, O, S. Ru, Rv, Rw є однаковими або різними і можуть бути вибрані з групи, до якої входять H, CN, =О, Hal, Alk, OAlk, OH, NRCN, C(CN)=C(OH)(OAIk), SR, NRR', C(O)NRR', гетероцикл, арил, гетероарил, циклоалкіл, де Alk, арил, гетероарил, гетероцикл, циклоалкіл факультативно заміщені Hal, NRR', CN, OH, CF3, арилом, гетероарилом, OAlk. R3, R4, R5, R6 є однаковими або різними і незалежно один від одного вибрані з групи, до якої входять H, OAlk, Alk, Hal, NRR', CN, OH, OCF3, CF3, арил, гетероарил; R та R' є однаковими або різними і незалежно один від одного вибрані з групи, до якої входять H, Alk, де Alk факультативно заміщений Hal, NRR', CN, OH, CF3, арилом, гетероарилом; або їх фармацевтично прийнятні солі, гідрати або гідратовані солі, або поліморфні кристалічні структури цих сполук, або їх оптичні ізомери, рацемати, діастереомери або енантіомери, або їх регіоізомери, геометричні ізомери (E та Z) або їх суміші. За варіантами, яким віддається перевага, T, U, V, W, X – С або N. Інші варіанти формули (I), яким віддається перевага, відповідають визначенням, поданим вище стосовно до сполук за цим винаходом. Сполуки за цим винаходом, яким віддається перевага для терапевтичного застосування, вибрані з групи, до якої входять: - 3-метил-1,2,3a,4,10-пентааза-циклопента[b]флуорен-9-ону O-метил-оксим - 3-метил-1,2,3a,4,10-пентааза-циклопента[b]флуорен-9-ону O-аліл-оксим - 1-метил-2,3,4,10,10a-пентааза-циклопента[b]флуорен-9-ону O-аліл-оксим - 3-бутил-1,2,3a,4,10-пентааза-циклопента[b]флуорен-9-ону O-аліл-оксим - 1-бутил-2,3,4,10,10a-пентааза-циклопента[b]флуорен-9-ону O-аліл-оксим - 1,2,3,3a,4,10-гексааза-циклопента[b]флуорен-9-ону O-аліл-оксим - 1,2,3,3a,4,10-гексааза-циклопента[b]флуорен-9-ону оксим - 1,2,3,3a,4,10-гексааза-циклопента[b]флуорен-9-ону O-децил-оксим - 1,2,3,3a,4,10-гексааза-циклопента[b]флуорен-9-ону O-(2-метоксі-етил)-оксим - 1,2,3,3a,4,10-гексааза-циклопента[b]флуорен-9-ону O-(3-фенокси-пропіл)-оксим - 1-етил-2,3,4,10,10a-пентааза-циклопента[b]флуорен-9-ону O-метил-оксим - 3-етил-1,2,3a,4,10-пентааза-циклопента[b]флуорен-9-ону O-метил-оксим - 1-етил-2,3,4,10,10a-пентааза-циклопента[b]флуорен-9-ону O-етил-оксим - 3-етил-1,2,3a,4,10-пентааза-циклопента[b]флуорен-9-ону O-етил-оксим - 1-етил-2,3,4,10,10a-пентааза-циклопента[b]флуорен-9-ону O-аліл-оксим - 3-етил-1,2,3a,4,10-пентааза-циклопента[b]флуорен-9-ону O-аліл-оксим - 1-етил-2,3,4,10,10a-пентааза-циклопента[b]флуорен-9-ону O-бензил-оксим - 3-етил-1,2,3a,4,10-пентааза-циклопента[b]флуорен-9-ону O-бензил-оксим - [1-етил-2,3,4,10,10a-пентааза-циклопента[b]флуорен-9-іліден]-феніл-амін - етиловий ефір (1,2,3,3a,4,10-гексааза-циклопента[b]флуорен-9-іліденаміноокси)-оцтової кислоти - (1,2,3,3a,4,10-гексааза-циклопента[b]флуорен-9-іліденаміноокси)-ацетат літію, або їх фармацевтично прийнятні солі, гідрати або гідратовані солі, або поліморфні кристалічні структури цих сполук, або їх оптичні ізомери, рацемати, діастереомери або енантіомери, або їх регіоізомери, геометричні ізомери (E та Z) або їх суміші. Сполуки за цим винаходом, яким віддається найбільша перевага для терапевтичного застосування, вибрані з групи, до якої входять: - 3-метил-1,2,3a,4,10-пентааза-циклопента[b]флуорен-9-ону O-метил-оксим - 3-метил-1,2,3a,4,10-пентааза-циклопента[b]флуорен-9-ону O-аліл-оксим 9 UA 99116 C2 5 10 15 20 25 30 35 40 45 50 55 60 - 3-бутил-1,2,3a,4,10-пентааза-циклопента[b]флуорен-9-ону O-аліл-оксим - 1,2,3,3a,4,10-гексааза-циклопента[b]флуорен-9-ону O-аліл-оксим - 1,2,3,3a,4,10-гексааза-циклопента[b]флуорен-9-ону оксим - 1,2,3,3a,4,10-гексааза-циклопента[b]флуорен-9-ону O-децил-оксим - 1,2,3,3a,4,10-гексааза-циклопента[b]флуорен-9-ону O-(2-метоксі-етил)-оксим - 1,2,3,3a,4,10-гексааза-циклопента[b]флуорен-9-ону O-(3-фенокси-пропіл)-оксим - 3-етил-1,2,3a,4,10-пентааза-циклопента[b]флуорен-9-ону O-метил-оксим - 3-етил-1,2,3a,4,10-пентааза-циклопента[b]флуорен-9-ону O-етил-оксим - 3-етил-1,2,3a,4,10-пентааза-циклопента[b]флуорен-9-ону O-аліл-оксим - етиловий ефір (1,2,3,3a,4,10-гексааза-циклопента[b]флуорен-9-іліденаміноокси)-оцтової кислоти - (1,2,3,3a,4,10-гексааза-циклопента[b]флуорен-9-іліденаміноокси)-ацетат літію або їх фармацевтично прийнятні солі, гідрати або гідратовані солі, або поліморфні кристалічні структури цих сполук, або їх оптичні ізомери, рацемати, діастереомери або енантіомери, або їх регіоізомери, геометричні ізомери (E та Z) або їх суміші. За ще одним аспектом, даний винахід стосується застосування сполуки формули (I), визначеної вище стосовно до фармацевтичної композиції за цим винаходом, для виготовлення лікарського засобу для інгібування цистеїнпротеази. Сполуки за цим винаходом корисні для інгібування цистеїнпротеаз, зокрема, ензимів деубіквітинації (нариклад, USP та UCH), каспаз, катепсинів (зокрема, катепсинів B, D, K, S тощо), кальпаїнів, а також вірусних, бактеріальних або паразитарних цистеїнпротеаз у пацієнтів, які потребують такого інгібування. Сполуки за цим винаходом, зокрема, корисні для лікування та/або попередження раку та метастазів, більш конкретно, рак простати та/або ободової кишки, нейродегенеративних захворювань, наприклад, хвороби Альцгеймера та хвороби Паркінсона, глухоти, розладів, пов’язаних із віком, запальних розладів, артриту, остеопорозу, гепатиту, печінкової недостатності, серцевої ішеміі та недостатності, інсульту, атеросклерозу, ниркової недостатності, діабету, катаракти; гострих або латентних вірусних інфекцій, спричинених вірусом-1 простого герпесу, вірусом Епштейна-Барра, коронавірусом SARS, риновірусами, вірусом поліомієліту, вірусом гепатиту A, вірусом гепатиту C, аденовірусами тощо; бактеріальних або грибкових інфекцій, спричинених патогенними агентами, що належать до груп Streptococcus sp., Staphylococcus sp., Clostidium sp., Aspergillus sp. тощо; протозойних інфекцій, спричинених видами, що належать до груп Trypanosoma sp., Plasmodium sp., Leishmania sp., Trichomonas sp., Entamoeba sp., Giardia sp., Toxoplasma sp., Cryptosporidium sp. тощо; інфекцій плоскими або круглими черв’яками видів, які належать до груп Fasciola sp., Schistosoma sp., Onchocerca sp., Ascaris sp., Taenia sp., Caenorhabitis sp., Toxocara sp., Haemonchus sp., Ancylostoma sp., Trichuris sp., Trichinella sp., Strongyloides sp., Brugia sp. тощо; а також розладів імунологічного, імунорегуляторного або антигенного походження. Цей винахід стосується також відповідних способів лікування, які включаєть введення сполуки за цим винаходом спільно із фармацевтично прийнятним носієм або наповнювачем в організм пацієнта, який потребує такого лікування. Ідентифікація суб’єктів, які потребують лікування описаних у цьому документі захворювань та патологічних станів, лежить у межах компетенції та знань фахівця у галузі. Кваліфікований ветеринар або медик може без утруднень визначити суб’єктів, які потребують такого лікування, шляхом застосування клінічних тестів, фізичного дослідження, анамнезу та родинного анамнезу або біологічних та діагностичних тестів. Терапевтично ефективну кількість може без утруднень визначити, будучи фахівцем, лікаркуратор, шляхом застосування звичайних способів та спостереження за результатами, одержаними за аналогічних обставин. При визначенні терапевтично ефективної кількості лікаркуратор бере до уваги численні фактори, до яких належать (але якими не обмежуються): біологічний вид суб’єкта; його маса тіла, вік та загальний стан здоров’я; конкретне захворювання; ступінь ураження або тяжкості захворювання; індивідуальна реакція суб’єкта; конкретна застосовувана сполука; спосіб введення; характеристика біодоступності застосовуваного препарату; обраний режим дозування; застосування супутньої терапії; та інші релевантні обставини. Кількість сполуки формули (I), необхідна для досягнення бажаного біологічного ефекту, варіює залежно від численних факторів, в тому числі від хімічних характеристик (наприклад, гідрофобності) застосовуваних сполук, ефективності сполук, типу захворювання, біологічного виду пацієнта, стану захворювання пацієнта, способу застосування, біодоступності сполуки при обраному шляху введення, усіх факторів, які визначають необхідну величину дози, спосіб 10 UA 99116 C2 5 10 15 20 25 30 35 40 45 50 55 60 постачання та режим дозування. Терміни "фармацевтичний" або "фармацевтично прийнятний" стосуються сполук та композицій, які не викликають шкідливих, алергічних або інших несприятливих реакцій при введенні в організм тварини або людини за відповідних обставин. При вживанні у цьому описі, термін "фармацевтично прийнятний наповнювач" охоплює будь-які носії, розріджувачі, допоміжні речовини або носії, наприклад, консерванти або антиоксиданти, наповнювачі, розпушувальні речовини, зволожувачі, емульгатори, суспензатори, розчинники, дисперсійні середовища, покриття, антибактеріальні та антигрибкові засоби, ізотонічні засоби та засоби, що уповільнюють абсорбцію, тощо. Застосування таких середовищ та засобів для фармацевтично активних речовин добре відоме в галузі. За винятком випадків, коли будь-який звичайний засіб або середовище є несумісним з активним інгредієнтом, застосування таких засобів у терапевтичних композиціях мається на увазі. До складу композицій можуть бути введені також додаткові активні інгредієнти у відповідних терапевтичних комбінаціях. У контексті цього винаходу термін "лікування" або "лікувати", при вживанні у цьому описі, означає обернення напрямку розвитку, полегшення, пригнічення розвитку або попередження розладу або патологічного стану, якого стосується даний термін, або одного або кількох симптомів такого розладу або патологічного стану Термін "терапевтично ефективна кількість" означає кількість сполуки або лікарського засобу за цим винаходом, ефективну з точки зору попередження або лікування патологічного стану, при якому необхідним є інгібування активної цистеїнпротеази, яка бере участь у патогенезі цього стану. Згідно із цим винаходом, терміни "пацієнт" або "пацієнт, що потребує такого лікування", означає тварину або людину, уражену або можливо уражену патологічним станом, у патогенезі якого бере участь активна цистеїнпротеаза. За варіантом, якому віддається перевага, пацієнтом є людина. У загальному випадку сполуки за цим винаходом можуть застосовуватися у формі розчину у водному буферованому фізіологічному розчині для парентерального застосування, який містить від 0,1% дo 10% (маси на об’єм) сполуки. Типова доза лежить у межах від 1 мкг/кг до 0,1 г/кг маси тіла на добу; перевага віддається дозам у межах від 0,01 мг/кг до 10 мг/кг маси тіла на добу або еквівалентним дозам для дітей. Дози застосовуваного лікарського засобу, яким віддається перевага, залежать від таких змінних параметрів, як тип та ступінь розвитку захворювання або розладу, загальний стан здоров’я конкретного пацієнта, відносна біологічна ефективність обраної сполуки, форма композиції, яка включає сполуку, спосіб введення в організм (внутрішньовенний, внутрішньом’язовий або інший), фармакокінетичні характеристики сполуки при обраному способі постачання та швидкість введення (наприклад, у вигляді болюсу або шляхом безперервної інфузії) та режиму застосування (кількість повторних застосувань за даний період часу). Сполуки за цим винаходом можуть застосовуватися також у формі одиничних доз, де термін "одинична доза" означає одиничну дозу, яка може бути застосована до пацієнта та є зручною для маніпулювання та пакування, залишаючись фізично та хімічно стабільною одиничною дозою, що містить або активну сполуку як таку, або фармацевтично прийнятну композицію, як описано нижче. У таких випадках типові добові дози лежать у межах 0,01-100 мг/кг маси тіла. Як загальну рекомендацію можна вказати на одиничні дози для людей в межах від 1 мг на добу до 3000 мг на добу. За варіантом, якому віддається перевага, одинична доза лежить у межах від 1 мг до 500 мг і застосовується 1-6 разів на добу, а за варіантом, якому віддається більша перевага – у межах від 10 мг до 500 мг і застосовується один раз на добу. Сполуки, що пропонуються цим винаходом, можна вводити до складу фармацевтичних композицій шляхом змішування з одним або кількома фармацевтично прийнятними наповнювачами. Такі композиції у формі одиничних доз можуть бути виготовлені для перорального застосування, зокрема, у формі таблеток, твердих або м’яких гелевих капсул; або для назального введення, зокрема, у формі порошків, крапель для носа або аерозолів; або для черезшкірного введення, наприклад, для місцевого застосування, у вигляді мазей, кремів, лосьйонів, гелів або спреїв, або у формі нашкірних пластирів. Згадані композиції зручно застосовувати у формі одиничних дозованих форм та виготовляти будь-яким зі способів, добре відомих у фармацевтичній галузі, наприклад, як описано у th Remington: The Science and Practice of Pharmacy, 20 ed.; Gennaro A.R., Ed.; Lippincott Williams & Wilkins: Philadelphia, PA, 2000. Перевага віддається лікарським формам фармацевтичних композицій, у яких сполука за цим винаходом знаходиться у формі, призначеній для перорального або парентерального 11 UA 99116 C2 5 10 15 20 25 30 35 40 45 50 застосування. У лікарських формах для перорального застосування таблетки, пігулки, порошки, капсули, пастилки тощо можуть містити один або кілька перелічених нижче інгредієнтів або сполук аналогічної природи: в’яжуче, наприклад, мікрокристалічну целюлозу або трагантову камедь; розріджувач, наприклад, крохмаль або лактозу; розпушувач, наприклад, крохмаль та похідні целюлози; змащувач, наприклад, стеарат магнію; ковзний агент, наприклад, колоїдний діоксид кремнію; підсолоджувач, наприклад, сахарозу або сахарин; або смакоароматичну домішку, наприклад, м’яту або метилсаліцилат. Капсули можуть мати форму твердих або м’яких капсул, які звичайно виготовляються з желатинвмісних сумішей, факультативно змішаних із пластифікаторами, а також із крохмалю. Крім того, дозовані одиничні форми можуть містить різноманітні інші матеріали, які модифікують фізичну форму одиничної дозованої форми, наприклад, покриття із цукру, шелаку або ентеричних засобів. Інші лікарські форми для перорального застосування, наприклад, сиропи або еліксири, можуть містити підсолоджувачі, консерванти, барвники, пігменти та ароматизатори. Крім того, активні сполуки можуть бути введені до складу препаратів та лікарських форм швидкого розчинення, модифікованого вивільнення або тривалого вивільнення, причому такі лікарські форми тривалого вивільнення за варіантом, якому віддається перевага, є бімодальними. Перевага віддається таблеткам, які містять лактозу, кукурудзяний крохмаль, силікат, магнію, натрієву кроскармелозу, повідон, стеарат магнію або тальк у будь-яких комбінаціях. До рідких препаратів для парентерального застосування належать стерильні водні або неводні розчини, суспензії та емульсії. Рідкі композиції можуть також включати в’яжучі, буфери, консерванти, комплексоутворювальні засоби, підсолоджувачі, ароматизатори та забарвлювальні засоби тощо. До неводних розчинників належать спирти, пропіленгліколь, поліетиленгліколь, рослинні олії, наприклад, оливкову олію, та органічні складні ефіри, наприклад, етилолеат. До водних носіїв належать суміші спиртів із водою, буферовані середовища та фізіологічний розчин. Наповнювачами, корисними для регулювання вивільнення активних сполук, можуть бути, зокрема, біосумісні полімери лактидів, співполімери лактидів із гліколідами або співполімери поліоксіетиленів із поліоксипропіленами, які піддаються біорозкладу. До наповнювачів для внутрішньовенних препаратів можуть належати домішки для регулювання плинності та поживні домішки, електроліти, наприклад, на основі декстрози Рінгера, тощо. Інші потенціально корисні системи для парентерального постачання цих активних сполук містять частинки співполімеру етилену з вінілацетатом, осмотичні насоси, імплантувальні інфузійні системи та ліпосоми. Альтернативні способи введення в організм забезпечуються лікарськими формами для інгаляції, до яких належать такі форми, як сухі порошки, аерозолі або краплі. Такі форми можуть являти собою водні розчини, які містять, наприклад, поліоксіетилен-9-лауриловий простий ефір, глікохолат та деоксихолат, або розчини на олійній основі для застосування у формі назальних крапель або гелю для назального введення. До лікарських форм для букального введення належать, наприклад, таблетки або пастилки, які можуть містити також смакоароматичну основу, наприклад, сахарозу та аравійську камедь, та інші наповнювачі, наприклад, глікохолат. Лікарські форми, придатні для ректального введення, за варіантом, якому віддається перевага, являють собою супозиторії з одиничними дозами на основі твердого носія, наприклад, какаової олії, та можуть містити саліцилат. Лікарські форми для місцевого нанесення на шкіру за варіантом, якому віддається перевага, мають вигляд мазей, кремів, лосьйонів, паст, гелів, спреїв, аерозолів або олій. До носіїв, які можуть бути використані в таких випадках, належать вазелін, ланолін, поліетиленгліколі, спирти та їх комбінації. Лікарські форми, придатні для черезшкірного введення, можуть мати вигляд окремих пластирів та містити ліпофільні емульсії або буферовані водні розчини, розчинені та/або дисперговані у полімерах або клейких основах. Подані нижче приклади ілюструють винахід, але не обмежують його обсяг. Приклади сполук за цим винаходом представлені у поданій нижче таблиці: Структурна формула Методика одержання за Прикладом Приклад 5a/E 12 UA 99116 C2 Структурна формула Методика одержання за Прикладом Приклад 5b/E Приклад 5c/E Приклад 5d/E Приклад 5e/E Приклад 6 Приклад 7 Приклад 8a/F Приклад 8b/F Приклад 8c/F Приклад 10a/K 13 UA 99116 C2 Структурна формула Методика одержання за Прикладом Приклад 10b/К Приклад 10с/К Приклад 10d/K Приклад 10е/К Приклад 10f/K Приклад 10g/K Приклад 10h/K 14 UA 99116 C2 Структурна формула Методика одержання за Прикладом Приклад 11 Приклад 12 Приклад 13 Експериментальна частина Типові сполуки за цим винаходом можна синтезувати за описаними нижче методиками: Загальна методика A: синтез пентааза-циклопента[b]флуорен-9-ону 5 10 15 20 25 Суміш заміщеного R1 (1,2,4)-триазол-3,4-діаміну (8,8 ммоль) та нінгідрину (1,57 г, 8,8 ммоль) в ЕtOН (етанол) (10 мл) та AcOH (оцтовая кислота) (1,5 мл) нагрівали зі зворотним холодильником протягом 2-16 год. Розчинник видаляли під зниженим тиском, а залишок розчиняли в EtOAc(етилацетат), промивали насиченим розчином K2CO3 та розсолом. Органічну фазу сушили над Na2SO4, фільтрували та видаляли розчинники випарюванням під зниженим тиском. Неочищений продукт очищали, як описано нижче: флеш-хроматографією на силікагелі (толуол/MeOH (метанол), зміна складу від 95:5 до 8:2 або CH2CI2/EtОAc, зміна складу від 9:1 до 1:1) для очищення суміші регіоізомерів, потім флеш-хроматографією на нейтральному оксиді алюмінію (гатунок II, CH2CI2/EtОAc, зміна складу від 7:3 до CH2CI2/ MeOH 1:1 + 5% HCOOH або AcOH) для розділення регіоізомерів. 1-метил-2,3,4,10,10a-пентааза-циклопента[b]флуорен-9-он (1b/A) 1 Одержано за загальною методикою A з виходом 13% у вигляді жовтої твердої речовини. Н + ЯМР (300 МГц, DMSO d6): 8,23 (d, 1H), 8,02 (m, 2H), 7,89 (ddd, 1H), 2,72 (s, 3H). ESI MS: + обчислено для C12H7N5O: 237,22; знайдено: 238,2 (MH ). 3-метил-1,2,3a,4,10-пентааза-циклопента[b]флуорен-9-он (1b/B) 1 Одержано за загальною методикою A з виходом 30% у вигляді жовтої твердої речовини. Н + ЯМР (300 МГц, DMSO d6): 8,16 (d, 1H), 8,05-7,95 (m, 2H), 7,85 (ddd, 1H), 2,77 (s, 3H). ESI MS: + обчислено для C12H7N5O: 237,22; знайдено: 238,2 (MH ). Загальна методика B: синтез пентааза-циклопента[b]флуорен-9-ону 15 UA 99116 C2 5 10 15 20 25 30 Діамінотриазоли одержували за методикою, описаною у Eur. J. Med. Chem.-Chim. Ther. 1986, 21, 235. Cуміш гідрохлориду діаміногуанідину (1 г, 8 ммоль) у надлишку (10 г) відповідної карбонової кислоти перемішували та витримували при 120-130°C протягом 12-24 год. Охолоджували розчин до кімнатної температури і додавали 37% HCI (10 мл). Нагрівали суміш зі зворотним холодильником протягом 2-3 год, після чого випарювали досуха у вакуумі. Одержаний неочищений продукт промивали Et2O (диетиловий ефір) (3) і використовували без додаткового очищення. Конденсацію неочищеного діамінотриазолу з нінгідрином виконували за загальною методикою А. 1-бутил-2,3,4,10,10a-пентааза-циклопента[b]флуорен-9-он (1f/A) Одержано за загальною методикою В з виходом 6% у вигляді жовтої твердої речовини. 1 Н ЯМР (300 МГц, DMSO d6): 8,23 (d, 1H), 8,02 (m, 2H), 7,89 (ddd, 1H), 3,10 (dd, 2H), 1,81 (m, + + 2H), 1,42 (m, 2H), 0,94 (t, 3H). ESI MS: обчислено для C15H13N5O: 279,30; знайдено: 280,2 (MH ). 3-бутил-1,2,3a,4,10-пентааза-циклопента[b]флуорен-9-он (1f/B) Одержано за загальною методикою В з виходом 10% у вигляді жовтої твердої речовини. 1 Н ЯМР (300 МГц, DMSO d6): 8,16 (d, 1H), 7,99 (m, 2H), 7,85 (dd, 1H), 3,16 (dd, 2H), 1,87 (m, + + 2H), 1,44 (m, 2H), 0,96 (t, 3H). ESI MS: обчислено для C15H13N5O: 279,30; знайдено: 280,3 (MH ). 1-етил-2,3,4,10,10a-пентааза-циклопента[b]флуорен-9-он (1g/A) Одержано за загальною методикою В з виходом 48% у вигляді жовтої твердої речовини. 1 Н ЯМР (300 МГц, CDCI3): 8,21 (d, 1H), 8,00 (d, 1H), 7,90 (ddd, 1H), 7,77 (ddd, 1H), 3,21 (q, + + 2H), 1,49 (t, 3H). ESI MS: обчислено для C13H9N5O: 251,25; знайдено: 252,1 (MH ). 3-етил-1,2,3a,4,10-пентааза-циклопента[b]флуорен-9-он (1g/B) Одержано за загальною методикою В з виходом 32% у вигляді жовтої твердої речовини. 1 Н ЯМР (300 МГц, CDCI3): 5 8,12 (d, 1H), 8,02 (d, 1H), 7,88 (ddd, 1H), 7,75 (ddd, 1H), 3,25 (q, + + 2H), 1,53 (t, 3H). ESI MS: обчислено для C13H9N5O: 251,25; знайдено: 252,1 (MH ). Загальна методика E: синтез O-алкоксимних похідних пентааза-циклопента[b]флуорен-9-ону a R1 = Me, R2 = Me - В регіоізомер b R1 = Me, R2 = аліл - В регіоізомер с R1= Me, R2 = аліл - A регіоізомер d R1= Bu, R2 = аліл - В регіоізомер 16 UA 99116 C2 5 10 15 20 25 30 35 40 e R1= Bu, R2 = аліл - A регіоізомер Суспензію сполуки 1 (1 ммоль), гідрохлориду O-алкілгідроксиламіну (3 ммоль) та молекулярних сит у піридині (10 мл) витримували при 60°C протягом 2-12 год. Нерозчинний залишок відділяли фільтруванням, розчинник випарювали, і неочищений продукт очищали флеш-хроматографією на силікагелі (CH2CI2/ацетон 85:15 або толуол/MeOH 9:1, або петролейний ефір/EtOAc 1:1). 3-метил-1,2,3a,4,10-пентааза-циклопента[b]флуорен-9-ону O-метил-оксим (5a) Одержано за загальною методикою E зі сполуки 1b/B з виходом 55% у вигляді жовтої 1 твердої речовини у формі суміші E/Z (2:1). Н ЯМР (300 МГц, DMSO d6) (суміш ізомерів): 8,43 (m, 1H), 8,16 (m, 1H), 7,81 (m, 2H), 4,34 (s, 3H), 2,75 (s, 3H). 8,05 (m, 1H), 7,92 (m, 1H), 7,72 (m, + + 2H), 4,30 (s, 3H), 2,75 (s, 3H). ESI MS: обчислено для C13Hi0N6O: 266,26; знайдено: 267,1 (MH ). 3-метил-1,2,3a,4,10-пентааза-циклопента[b]флуорен-9-ону O-аліл-оксим (5b) Одержано за загальною методикою E зі сполуки 1b/B з виходом 65% у вигляді жовтої 1 твердої речовини у формі суміші E/Z (1:1). Н ЯМР (300 МГц, CDCI3) (суміш ізомерів): 8,02 (d, 1H), 7,95 (d, 1H), 7,75-7,56 (m, 2H), 6,26-6,08 (m, 1H), 5,50 (dd, 1H), 5,35 (d, 1Н), 5,05 (d, 2H), 2:86 (s, ЗН). 8,49 (m, 1H), 8,13 (m, 1H), 7,77-7,56 (m, 2H), 6,26-6,08 (m, 1H), 5,50 (dd, 1H), 5,39 (d, 1H), + + 5,12 (d, 2H), 2,86 (s, ЗН). ESI MS: обчислено для C15H12N6O: 292,30; знайдено: 293,1 (MH ). 1-метил-2,3,4,10,10a-пентааза-циклопента[b]флуорен-9-ону O-аліл-оксим (5c) Одержано за загальною методикою E зі сполуки 1b/А з виходом 76% у вигляді жовтої 1 твердої речовини у формі суміші E/Z (7:3). Н ЯМР (300 МГц, CDCI3) (суміш ізомерів): 8,16 (m, 1H), 7,95 (m, 1H), 7,77-7,60 (m, 2H), 6,26-6,08 (m, 1H), 5,54 (ddt, 1H), 5,37 (ddt, 1H), 5,04 (ddd, 2H), 2,84 (s, 3H). 8,49 (m, 1H), 8,26 (m, 1H), 7,77-7,60 (m, 2H), 6,26-6,08 (m, 1H), 5,49 (ddt, 1H), 5,40 + (ddt, 1H), 5,09 (ddd, 2H), 2,88 (s, 3H). ESI MS: обчислено для C15H12N6O: 292,30; знайдено: 293,1 + (MH ). 3-бутил-1,2,3a,4,10-пентааза-циклопента[b]флуорен-9-ону O-аліл-оксим (5d) Одержано за загальною методикою E зі сполуки 1f/B з виходом 93% у вигляді жовтої твердої 1 речовини у формі суміші E/Z (6:4). Н ЯМР (300 МГц, CDCI3) (суміш ізомерів): 8,42 (m, 1H), 8,06 (m, 1H), 7,64 (m, 2H), 6,19-6,00 (m, 1H), 5,41 (m, 1H), 5,31 (m, 1H), 5,03 (ddd, 2H), 3,17 (dd, 2H), 1,88 (m, 2H), 1,43 (m, 2H), 0,93 (t, 3H). 7,96 (m, 1H), 7,87 (m, 1H), 7,55 (m, 2H), 6,19-6,00 (m, 1H), 5,41 (m, 1H), 5,26 (m, 1H), 4,97 (ddd, 2H), 3,17 (dd, 2H), 1,88 (m, 2H), 1,43 (m, 2H), 0,93 (t, 3H). + + ESI MS: обчислено для C18H18N6O: 334,38; знайдено: 335,1 (MH ). 1-бутил-2,3,4,10,10a-пентааза-циклопента[b]флуорен-9-ону O-аліл-оксим (5e) Одержано за загальною методикою E зі сполуки 1f/A з виходом 95% у вигляді жовтої твердої 1 речовини у формі суміші E/Z (1:1). Н ЯМР (300 МГц, CDCI3) (суміш ізомерів): 8,45 (m, 1H), 8,22 (m, 1H), 7,69 (m, 2H), 6,22-6,02 (m, 1H), 5,45 (m, 1H), 5,35 (m, 1H), 5,05 (ddd, 2H), 3,21 (dd, 2H), 1,91 (m, 2H), 1,45 (m, 2H), 0,95 (t, 3H). 8,12 (m, 1H), 7,91 (m, 1H), 7,62 (m, 2H), 6,22-6,02 (m, 1H), 5,49 (m, 1H), 5,32 (m, 1H), 4,99 (ddd, 2H), 3,18 (dd, 2H), 1,91 (m, 2H), 1,45 (m, 2H), 0,95 (t, 3H). + + ESI MS: обчислено для C18H18N6O: 334,38; знайдено: 335,2 (MH ). Синтез O-аліл-оксиму 1,2,3,3a,4,10-гексааза-циклопента[b]флуорен-9-ону та/або його відповідного регіоізомерного тетразолу (6) Суміш (6:4) регіоізомерів 45 50 Вищезазначену сполуку одержували за загальною методикою Е з суміші (6:4) регіоізомерів 1,2,3,3a,4,10-гексааза-циклопента[b]флуорен-9-ону (одержаного з нінгідрину та тетразол-1,5діаміну) з виходом 89% у вигляді жовтої твердої речовини у формі суміші E/Z та регіоізомерів. 1 Н ЯМР (300 МГц, CDCI3) (суміш ізомерів): 8,47 (m, 1H), 8,22 (m, 1H), 7,84-7,58 (m, 2H), 6,236,03 (m, 1H), 5,46 (m, 1H), 5,37 (m, 1H), 5,13 (ddd, 2H). 8,19 (m, 1H), 7,98 (m, 1H), 7,84-7,58 (m, + 2H), 6,23-6,03 (m, 1H), 5,46 (m, 1H), 5,34 (m, 1H), 5,06 (m, 2H). ESI MS: обчислено для C13H9N7O: + 279,26; знайдено: 280,2 (MH ). Синтез оксиму 1,2,3,3a,4,10-гексааза-циклопента[b]флуорен-9-ону та/або його відповідного регіоізомерного тетразолу (7) 17 UA 99116 C2 Суміш (6:4) регіоізомерів 5 Вищезазначену сполуку одержували за загальною методикою Е з суміші (6:4) регіоізомерів 1,2,3,3a,4,10-гексааза-циклопента[b]флуорен-9-ону (одержаного з нінгідрину та тетразол-1,5діаміну) з виходом 44% у вигляді жовтої твердої речовини у формі суміші E/Z та регіоізомерів. 1 Н ЯМР (300 МГц, CDCI3) (суміш ізомерів): 13,87 (bs, 1H), 8,59 (m, 1H), 8,14 (m, 1H), 7,78-7,52 + (m, 2H). 13,69 (bs, 1H), 8,05 (d, 1H), 7,91 (d, 1H), 7,78-7,52 (m, 2H). ESI MS: обчислено для + C10H5N7O: 239,20; знайдено: 240,1 (MH ). Загальна методика F: синтез O-алкілоксиму гексааза-циклопента[b]флуорен-9-ону н-децил 10 15 20 25 30 35 Суміш сполуки 7 (48 мг, 0,20 ммоль), алкілброміду (0,6 ммоль) та K2CO3 (55 мг, 0,4 ммоль) у DMF (N,N-диметилформамід) (2 мл) перемішували при кімнатній температурі протягом 16 год, після чого розчинник випарювали під зниженим тиском. Неочищений продукт очищали флешхроматографією (CH2CI2 у сумішах змінного складу з MeOH або петролейним ефіром). 1,2,3,3a,4,10-гексааза-циклопента[b]флуорен-9-ону O-децил-оксим та/або його відповідний регіоізомерний тетразол (8a) Вищезазначену сполуку одержували за загальною методикою F з виходом 53% у вигляді 1 жовто-зеленої твердої речовини у формі суміші E/Z та регіоізомерів.. Н ЯМР (300 МГц, CDCI3) (суміш ізомерів): 8,39 (m, 1H), 8,24 та 8,15 (m, 1H), 7,78-7,63 (m, 2H), 4,61-4,47 (m, 2H), 1,82 (m, + 2H), 1,47-1,06 (m, 14H), 0,75 (m, 3H). ESI MS: обчислено для C20H25N7O: 379,47; знайдено: 380,2 + (MH ). 1,2,3,3а,4,10-гексааза-циклопента[b]флуорен-9-ону O-(2-метоксіетил)-оксим та/або його відповідний регіоізомерний тетразол (8b) Вищезазначену сполуку одержували за загальною методикою F з виходом 29% у виляді 1 світло-коричневої твердої речовини у формі суміші E/Z та регіоізомерів. Н ЯМР (300 МГц, DMSO d6) (суміш ізомерів): 8,49 (m, 1H), 8,27 (m, 1H), 7,83-7,66 (m, 2H), 4,73 (m, 2H), 3,82 (m, 2H), 3,40 (s, 3H). 8,49 (m, 1H), 8,19 (m, 1H), 7,83-7,66 (m, 2H), 4,73 (m, 2H), 3,82 (m, 2H), 3,41 (s, + + 3H). ESI MS: обчислено для C13H11N7O2: 297,28; знайдено: 298,0 (MH ). 1,2,3,3a,4,10-гексааза-циклопента[b]флуорен-9-ону O-(3-фенокси-пропіл)-оксим та/або його відповідний регіоізомерний тетразол (8c) Вищезазначену сполуку одержували за загальною методикою F з виходом 42% у вигляді 1 жовто-зеленої твердої речовини у формі суміші E/Z та регіоізомерів. Н ЯМР (300 МГц, CDCI3) (суміш ізомерів): 8,41 (m, 1H), 8,15 (m, 1H), 7,76-7,58 (m, 2H), 7,18 (m, 2H), 6,83 (m, 3H), 4,874,70 (m, 2Н), 4,18-4,07 (m, 2H), 2,42-2,27 (m, 2H). 8,26 (m, 1H), 7,89 (d, 1H), 7,76-7,58 (m, 2H), 7,18 (m, 2H), 6,83 + (m, ЗН), 4,87-4,70 (m, 2H), 4,18-4,07 (m, 2H), 2,42-2,27 (m, 2H). ESI MS: обчислено для + С19H15N7O2: 373,38; знайдено: 374,1 (MH ). Загальна методика K: синтез O-алкілоксимних похідних етил-пентаазациклопента[b]флуорен-9-ону 18 UA 99116 C2 A регіоізомер B регіоізомер 5 10 15 20 25 30 35 a R = Me - A регіоізомер b R = Me - В регіоізомер с R = Et - A регіоізомер d R = Et - В регіоізомер e R = аліл - A регіоізомер f R = аліл - В регіоізомер g R = Bn - A регіоізомер h R = Bn - В регіоізомер r Суспензію сполуки 1g/A або 1g/B (1 ммоль), гідрохлориду O-алкілгідроксиламіну (2 ммоль) та молекулярних сит у піридині (10 мл) витримували при 60°C протягом 2-3 год. Нерозчинний залишок відділяли фільтруванням, розчинник випарювали, і неочищений продукт очищали флеш-хроматографією на силікагелі. 1-етил-2,3,4,10,10a-пентааза-циклопента[b]флуорен-9-ону O-метил-оксим (10a) Одержано за загальною методикою К (елюент: СН 2Сl2/ЕtOАс/МеОН, 80:17:3) зі сполуки 1g/A 1 з кількісним виходом у вигляді жовтої твердої речовини у формі суміші E/Z (7:3). Н ЯМР (300 МГц, CDCI3): 8,47 (m, 1H), 8,27 (m, 1H), 7,73 (m, 1H), 7,66 (m, 1H), 4,41 (s, 3H), 3,28 (q, 2H), 1,55 (t, 3H) та 8,17 (m, 1H), 7,96 (m, 1H), 7,73 (m, 1H), 7,63 (m, 1H), 4,37 (s, ЗН), 3,25 (q, 2H), 1,55 (t, + + 3H). ESI MS: обчислено для C14H12N6O: 280,29; знайдено: 281,1 (MH ). 3-етил-1,2,3a,4,10-пентааза-циклопента[b]флуорен-9-ону O-метил-оксим (10b) Одержано за загальною методикою К (елюент: СН 2Сl2/ЕtOАс/МеОН, 80:17:3) зі сполуки 1g/В 1 з кількісним виходом у вигляді жовтої твердої речовини у формі суміші E/Z (7:3). Н ЯМР (300 МГц, CDCI3): 8,50 (m, 1H), 8,17 (m, 1H), 7,63 (m, 2H), 4,45 (s, 3H), 3,30 (q, 2H), 1,57 (t, 3H) and 8,07 (d, 1H), 7,98 (d, 1H), 7,68 (ddd, 1H), 7,64 (ddd, 1H), 4,41 (s, 3H), 3,29 (q, 2H), 1,59 (t, 3H). + + ESI MS: обчислено для C14H12N6O: 280,29; знайдено: 281,1 (MH ). 1-етил-2,3,4,10,10a-пентааза-циклопента[b]флуорен-9-ону O-етил-оксим (10c) Одержано за загальною методикою К (елюент: CH2Cl2/EtОAc/MeОH, 70:25:5) зі сполуки 1g/A 1 з кількісним виходом у вигляді жовтої твердої речовини у формі суміші E/Z (6:4). Н ЯМР (300 МГц, CDCb): 8,17 (m, 1H), 7,96 (m, 1H), 7,73 (m, 1H), 7,65 (ddd, 1H), 4,60 (q, 2H), 3,26 (q, 2H), 1,55 (t, 3H), 1,55 (t, 3H) та 8,47 (m, 1H), 8,27 (m, 1H); 7,72 (m, 1H), 7,63 (ddd, 1H), 4,66 (q, 2H), 3,30 + (q, 2H), 1,54 (t, 3H), 1,51 (t, 3H). ESI MS: обчислено для C15H14N6O: 294,32; знайдено: 295,1 + (MH ). 3-етил-1,2,3a,4,10-пентааза-циклопента[b]флуорен-9-ону O-етил-оксим (10d) Одержано за загальною методикою К (елюент: CH2Cl2/EtОAc/MeОH, 70:25:5) зі сполуки 1g/В 1 з кількісним виходом у вигляді жовтої твердої речовини у формі суміші E/Z (1:1) Н ЯМР (300 МГц, CDCb): 8,49 (m, 1H), 8,13 (m, 1H), 7,70 (m, 1H), 7,62 (m, 1H), 4,69 (q, 2H), 3,27 (q, 2H), 1,58-1,48 (m, 6H), and 8,03 (m, 1H), 7,96 (m, 1H), 7,70 (m, 1H), 7,62 (m, 1H), 4,62 (q, 2H), 3,27 (q, + + 2H), 1,58-1,48 (m, 6H). ESI MS: обчислено для C15H14N6O: 294,32; знайдено: 295,1 (MH ). 1-етил-2,3,4,10,10a-пентааза-циклопента[b]флуорен-9-ону O-аліл-оксим (10e) 19 UA 99116 C2 5 10 15 20 25 30 35 Одержано за загальною методикою К (елюент: CH2CI2/EtОAc/MeОH, 80:16:4) зі сполуки 1g/A 1 з кількісним виходом у вигляді жовтої твердої речовини у формі суміші E/Z (6:4). Н ЯМР (300 МГц, CDCb): 8,17 (d, 1H), 7,95 (d, 1H), 7,65 (m, 2H), 6,26-6,07 (m, 1H), 5,54 (m, 1H), 5,37 (m, 1H), 5,04 (ddd, 2H), 3,26 (m, 2H), 1,54 (m, 3H) та 8,49 (d, 1H), 8,27 (d, 1H), 7,73 (m, 2H), 6,26-6,07 (m, + 1H), 5,49 (m, 1H), 5,40 (m, 1H), 5,09 (ddd, 2H), 3,26 (m, 2H), 1,54 (m, 3H). ESI MS: обчислено для + C16Hi4N6O: 306,33; знайдено: 307,1 (MH ). 3-етил-1,2,3a, 4,10-пентааза-циклопента[b]флуорен-9-ону O-аліл-оксим (10f) Одержано за загальною методикою К (елюент: СН 2Сl2/ЕtOАс/МеОН, 80:17:3) зі сполуки 1g/В 1 з виходом 96% у вигляді жовтої твердої речовини у формі суміші E/Z (65:35). Н ЯМР (300 МГц, CDCI3): 8,50 (m, 1H), 8,14 (m, 1H), 7,71 (m, 1H), 7,65 (m, 1H), 6,26-6,09 (m, 1H), 5,53 (m, 1H), 5,39 (m, 1H), 5,12 (ddd, 2H), 3,27 (q, 2H), 1,55 (t, 3H) та 8,04 (m, 1H), 7,95 (m, 1H), 7,71 (m, 1H), 7,61 (m, 1H), 6,26-6,09 (m, 1H), 5,47 (m, 1H), 5,36 (m, 1H), 5,106 (ddd, 2H), 3,27 (q, 2H), 1,56 (t, + + 3H). ESI MS: обчислено для C16H14N6O: 306,33; знайдено: 307,2 (MH ). 1-етил-2,3,4,10,10a-пентааза-циклопента[b]флуорен-9-ону O-бензил-оксим (10g) Одержано за загальною методикою К (елюент: СН 2Сl2/ЕtOАс/МеОН, 80:17:3) зі сполуки 1g/A 1 з виходом 86% у вигляді жовтої твердої речовини у формі суміші E/Z (65:35). Н ЯМР (300 МГц, CDCI3): 8,16 (m, 1H), 7,96 (m, 1H), 7,70 (m, 1H), 7,65 (m, 1H), 7,52 (m, 2H), 7,41 (m, 3H), 5,58 (s, 2H), 3,21 (q, 2H), 1,49 (t, 3H) та 8,43 (m, 1H), 8,26 (m, 1H), 7,70 (m, 1H), 7,65 (m, 1H), 7,52 (m, 2H), + 7,41 (m, 3H), H), 5,62 (s, 2H), 3,29 (q, 2H), 1,56 (t, 3H). ESI MS: обчислено для C20Hi6N6O: 356,39; + знайдено: 357,1 (MH ). 3-етил-1,2,3a,4,10-пентааза-циклопента[b]флуорен-9-ону O-бензил-оксим (10h) Одержано за загальною методикою К (елюент: СН 2Сl2/ЕtOАс/МеОН, 80:17:3) зі сполуки 1g/В 1 з виходом 99% у вигляді жовтої твердої речовини у формі суміші E/Z (6:4). Н ЯМР (300 МГц, CDCI3): 8,44 (m, 1H), 8,13 (m, 1H), 7,67 (m, 1H), 7,61 (m, 1H), 7,52 (m, 2H), 7,46-7,29 (m, 3H), 5,64 (s, 2H), 3,62 (q, 2H), 1,55 (t, 3H) та 8,01 (m, 1H), 7,92 (m, 1H), 7,70 (m, 1H), 7,65 (m, 1H), 7,52 + (m, 2H), 7,41 (m, 3H), 5,59 (s, 2H), 3,29 (q, 2H), 1,56 (t, 3H). ESI MS: обчислено для C20H16N6O: + 356,39; знайдено: 357,1 (MH ). Синтез [1-етил-2,3,4,10,10a-пентааза-циклопента[b]флуорен-9-іліден]-феніл-аміну (11) . До суспензії сполуки 1g/A (200 мг, 0,79 ммоль) та молекулярних сит у толуолі (4 мл) додавали анілін (72 мкл, 0,79 ммоль). Суміш перемішували при 130°C протягом 4 год, після чого розчинник випарювали, і неочищений продукт очищали флеш-хроматографією (CH2CI2/EtОAc/MeОH, 80:18:2), одержуючи сполуку 11 (231 мг, 90%) у вигляді оранжевої твердої речовини при співвідношенні діастереомерів 1:1. 1 Н ЯМР (300 МГц, CDCI3): 8,28 (d, 1H), 7,70 (ddd, 1H), 7,56-7,26 (m, 6H), 6,91 (d, 1H), 3,34 (q, 2H), 1,58 (t, 3H) та 8,22 (m, 2H), 7,81 (m, 2H), 7,47 (m, 1H), 7,07 (m, 4H), 2,80 (q, 2H), 1,21 (t, 3H). + + ESI MS: обчислено для C19H14N6: 326,36; знайдено: 327,2 (MH ). Етиловий ефір (1,2,3,3a,4,10-гексааза-циклопента[b]флуорен-9-іліденаміноокси)-оцтової кислоти та/або його відповідний регіоізомерний тетразол (12) (Суміш ізомерів) 40 Суміш оксиму 7 (560 мг, 2,34 ммоль) та карбонату цезію (1,54 г, 4,68 ммоль) перемішували у 20 UA 99116 C2 5 10 DMF (12 мл) протягом 5 хв, додавали краплями етилбромацетат (1,2 г, 7,02 ммоль), і після закінчення додавання інтенсивно забарвлену суміш перемішували протягом 3 год при кімнатній температурі. Випарювали розчинник, і неочищений продукт розчиняли у дихлорметані. Після фільтрування через шар діоксиду кремнію, випарювання, перекристалізації з суміші циклогексану з етилацетатом та розтирання з циклогексаном одержували 717 мг (94%) сполуки 12 у вигляді зеленого порошку. 1 Н ЯМР (400 МГц, d6-DMSO) (суміш ізомерів): (ppm) = 1,28 (m, 3H); 4,21 (m, 2H); 5,28 (m, + + 2H); 7;70 - 8,60 (m, 4H). LC-MS (ES): m/z = 651 (2M+H ), 326 (M+H ). (1,2,3,3a,4,10-гексааза-циклопента[b]флуорен-9-іліденаміноокси)-ацетат літію та/або його відповідний регіоізомерний тетразол (13) (Суміш ізомерів) 15 20 25 30 35 40 45 50 Розчин складного ефіру 12 (700 мг; 2,15 ммоль) та LiOH (451 мг, 10,75 ммоль) у 12 мл метанолу перемішували протягом 2 год при кімнатній температурі. Інтенсивно забарвлений розчин охолоджували до -20°C, і через 1 год осад, що утворився, відділяли фільтруванням і промивали охолодженим метанолом, одержуючи 380 мг (59%) сполуки 13 у вигляді зеленої 1 твердої речовини. Н ЯМР (400 МГц, D2O) (суміш ізомерів): (ppm) = 4,8 (s, 2H); 7,40 - 8,40 (m, + 4H). LC-MS (ES): m/z = 296 (M-H ). Типові цистеїнпротеази Випробування активності USP5 USP5 розводили у буфері USP (50 мМ Tris HCl; 0,5 мМ EDTA; 5 мМ DTT; 0,01% Triton X-100; бичачий сироватковий альбумін 0,05 мг/мл, pH 7,6). Вихідні розчини сполук у DMSO (100 мМ) зберігали при -20°C. Сполуки випробовували у таких кінцевих концентраціях: 100 мкМ; 33,3 мкМ; 11,1 мкМ; 3,7 мкМ; 1,23 мкМ; 412 нМ; 137 нМ; 45,7 нМ; 15,2 нМ; 5 нМ. Реакції проводили у двох паралельних пробах, використовуючи 96-лункові планшети Black LJL (мікропланшети HE, фірма Molecular Devices; кінцевий об’єм реакційних сумішей 20 мкл). Концентрація субстрату для USP5 становила 400 нМ Ub-AMC (фірма Boston Biochem). Концентрація ензиму (USP5) при випробуваннях специфічності становила 300 пМ. Концентрації визначали з метою виконання випробувань специфічності при початкових швидкостях в умовах фіксованої концентрації субстрату. Сполуки попередньо інкубували з ензимами протягом 30 хв при 25°C. Реакції ініціювали додаванням субстрату у планшети, що містили ензими (у присутності або за відсутності сполук), розведені у випробувальному буфері. Реакційні суміші інкубували протягом 60 хв при 37°C. Реакції припиняли доданням оцтової кислоти (кінцева концентрація 100 мМ). Сканування виконували із застосуванням приладу Pherastar Fluorescent Reader (фірма BMG) ( збудження 380 нм; випромінювання =460 нм). Дані (середні значення стандартне відхилення) виражали у відсотках від контролю (у відсутності сполуки) та графічно відображали як залежність відсотка ефекту від логарифма концентрації сполуки, застосовуючи програму GraphPad (фірма Prism). Результати апроксимували за сігмоїдною моделлю (змінний нахил). Клонування та очищення USP7 Одержували кДНК, що кодує USP7, шляхом ампліфікації із застосуванням PCR з м-РНК плаценти. субклонували кДНК USP7 із застосуванням PCR у вектор експресії бакуловіруса (pFastBac-HT; фірма Invitrogen). Генерували кДНК, що кодує мутантну USP7, застосовуючи мутагенний PCR. Відповідний протеїн кодує заміну цистеїну на аланін у залишку 223. Послідовності оцінювали шляхом визначення послідовностей усього відкритого для сканування діапазону. Бакміди, які кодують USP7, генерували відповідно до транспозиції DHIObac. Відповідні бакміди трансфікували у клітини комах (Sf9). Віруси добували з надосадової рідини культури та двічі ампліфікували. Клітини комах (Sf9 або High Five; Invitrogen) інфікували протягом 72 год. Збирали загальні лізати клітин та лізували у лізисному буфері (Tris HCl 50 мМ pH 7,6; 0,75% NP40; 500 мМ NaCl; 10% гліцерин; 1 мМ DTT; 10 мМ імідазол; суміш інгібіторів протеаз Protease Inhibitor Cocktail; AEBSF 20 мкг/мл; апротинін 10 мкг/мл). Протеїни очищали 21 UA 99116 C2 5 10 15 20 25 30 35 40 45 50 55 60 афінним способом на афінних смолах з іонами металів (Talon Metal affinity resin; фірма BD Biosciences). Зв’язані матеріали промивали великою кількістю промивального буфера (50 мM фосфат натрію, pH 7,0; 300 мМ NaCl; 10 мМ імідазол; 0,5% Triton X-100; 10% гліцерин) та елюювали зі смоли промивальним буфером із концентрацією імідазолу 250 мМ. Протеїни піддавали діалізу у діалізувальному буфері (Tris HCl, pH 7,6 20 мМ; NaCl 200 мМ; DTT 1 мМ; EDTA 1 мМ; 10% гліцерин). Очищені протеїни аналізували, застосовуючи 4-12% NuPAGE (фірма Invitrogen). Випробування активності USP7 USP7 розводили у буфері USP (50 мМ Tris HCl; 0,5 мМ EDTA; 5 мМ DTT; 0,01% Triton X-100; бичачий сироватковий альбумін 0,05 мг/мл, pH 7,6). Вихідні розчини сполук у DMSO (100 мМ) зберігали при -20°C. Сполуки випробовували у таких кінцевих концентраціях: 100 мкМ; 33,3 мкМ; 11,1 мкМ; 3,7 мкМ; 1,23 мкМ; 412 нМ; 137 нМ; 45,7 нМ; 15,2 нМ; 5 нМ. Реакції проводили у двох паралельних пробах, використовуючи 96-лункові планшети Black LJL (мікропланшети HE, фірма Molecular Devices; кінцевий об’єм реакційних сумішей 20 мкл). Концентрація субстрату для USP7 становила 400 нМ Ub-AMC (Chem. Biol., 2003, 10, p. 837-846) (фірма Boston Biochem). Концентрація ензиму (USP7) при випробуваннях специфічності становила 152 пМ. Концентрації визначали з метою виконання випробувань специфічності при початкових швидкостях в умовах фіксованої концентрації субстрату. Сполуки попередньо інкубували з ензимами протягом 30 хв при 25°C. Реакції ініціювали додаванням субстрату у планшети, що містили ензими (у присутності або за відсутності сполук), розведені у випробувальному буфері. Реакційні суміші інкубували протягом 60 хв при 37°C. Реакції припиняли доданням оцтової кислоти (кінцева концентрація 100 мМ). Сканування виконували із застосуванням приладу Pherastar Fluorescent Reader (фірма BMG) ( збудження 380 нм; випромінювання =460 нм). Дані (середні значення стандартне відхилення) виражали у відсотках від контролю (у відсутності сполуки) та графічно відображали як залежність відсотка ефекту від логарифма концентрації сполуки, застосовуючи програму GraphPad (фірма Prism). Результати апроксимували за сігмоїдною моделлю (змінний нахил). Клонування та очищення USP8 Одержували кДНК, що кодує USP8, шляхом ампліфікації із застосуванням PCR з м-РНК плаценти. субклонували кДНК USP8 із застосуванням PCR у вектор експресії бакуловіруса (pFastBac-HT; фірма Invitrogen). Генерували кДНК, що кодує мутантну USP8, застосовуючи мутагенний PCR. Відповідний протеїн кодує заміну цистеїну на аланін у залишку 786. Послідовності оцінювали шляхом визначення послідовностей усього відкритого для сканування діапазону. Бакміди, які кодують USP8, генерували відповідно до транспозиції DHIObac. Відповідні бакміди трансфікували у клітини комах (Sf9). Віруси добували з надосадової рідини культури та двічі ампліфікували. Клітини комах (Sf9 або High Five; Invitrogen) інфікували протягом 72 год. Збирали загальні лізати клітин та лізували у лізисному буфері (Tris HCl 50 мМ pH 7,6; 0,75% NP40; 500 мМ NaCl; 10% гліцерин; 1 мМ DTT; 10 мМ імідазол; суміш інгібіторів протеаз Protease Inhibitor Cocktail; AEBSF 20 мкг/мл; апротинін 10 мкг/мл). Протеїни очищали афінним способом на афінних смолах з іонами металів (Talon Metal affinity resin; фірма BD Biosciences). Зв’язані матеріали промивали великою кількістю промивального буфера (50 мM фосфат натрію, pH 7,0; 300 мМ NaCl; 10 мМ імідазол; 0,5% Triton X-100; 10% гліцерин) та елюювали зі смоли промивальним буфером із концентрацією імідазолу 250 мМ. Протеїни піддавали діалізу у діалізувальному буфері (Tris HCl, pH 7,6 20 мМ; NaCl 200 мМ; DTT 1 мМ; EDTA 1 мМ; 10% гліцерин). Очищені протеїни аналізували, застосовуючи 4-12% NuPAGE (фірма Invitrogen). Випробування активності USP8 USP8 розводили у буфері USP (50 мМ Tris HCl; 0,5 мМ EDTA; 5 мМ DTT; 0,01 % Triton X-100; бичачий сироватковий альбумін 0,05 мг/мл, pH 7,6). Вихідні розчини сполук у DMSO (100 мМ) зберігали при -20°C. Сполуки випробовували у таких кінцевих концентраціях: 100 мкМ; 33,3 мкМ; 11,1 мкМ; 3,7 мкМ; 1,23 мкМ; 412 нМ; 137 нМ; 45,7 нМ; 15,2 нМ; 5 нМ. Реакції проводили у двох паралельних пробах, використовуючи 96-лункові планшети Black LJL (мікропланшети HE, фірма Molecular Devices; кінцевий об’єм реакційних сумішей 20 мкл). Концентрація субстрату для USP7 становила 400 нМ Ub-AMC (Chem. Biol., 2003, 10, p. 837-846) (фірма Boston Biochem). Концентрація ензиму (USP8) при випробуваннях специфічності становила 630 пМ. Концентрації визначали з метою виконання випробувань специфічності при початкових швидкостях в умовах фіксованої концентрації субстрату. Сполуки попередньо інкубували з ензимами протягом 30 хв при 25°C. Реакції ініціювали додаванням субстрату у планшети, що містили ензими (у присутності або за 22 UA 99116 C2 5 10 15 20 25 30 35 40 45 50 55 60 відсутності сполук), розведені у випробувальному буфері. Реакційні суміші інкубували протягом 60 хв при 37°C. Реакції припиняли доданням оцтової кислоти (кінцева концентрація 100 мМ). Сканування виконували із застосуванням приладу Pherastar Fluorescent Reader (фірма BMG) ( збудження 380 нм; випромінювання =460 нм). Дані (середні значення стандартне відхилення) виражали у відсотках від контролю (у відсутності сполуки) та графічно відображали як залежність відсотка ефекту від логарифма концентрації сполуки, застосовуючи програму GraphPad (фірма Prism). Результати апроксимували за сігмоїдною моделлю (змінний нахил). Випробування активності UCH-L3 Uch-L3 розводили у буфері USP (50 мМ Tris HCl; 0,5 мМ EDTA; 5 мМ DTT; 0,01 % Triton X100; бичачий сироватковий альбумін 0,05 мг/мл, pH 7,6). Вихідні розчини сполук у DMSO (100 мМ) зберігали при -20°C. Сполуки випробовували у таких кінцевих концентраціях: 100 мкМ; 33,3 мкМ; 11,1 мкМ; 3,7 мкМ; 1,23 мкМ; 412 нМ; 137 нМ; 45,7 нМ; 15,2 нМ; 5 нМ. Реакції проводили у двох паралельних пробах, використовуючи 96-лункові планшети Black LJL (мікропланшети HE, фірма Molecular Devices; кінцевий об’єм реакційних сумішей 20 мкл). Концентрація субстрату для USP7 становила 400 нМ Ub-AMC (фірма Boston Biochem). Концентрація ензиму (Uch-L3) при випробуваннях специфічності становила 13 пМ. Концентрації визначали з метою виконання випробувань специфічності при початкових швидкостях в умовах фіксованої концентрації субстрату. Сполуки попередньо інкубували з ензимами протягом 30 хв при 25°C. Реакції ініціювали додаванням субстрату у планшети, що містили ензими (у присутності або за відсутності сполук), розведені у випробувальному буфері. Реакційні суміші інкубували протягом 60 хв при 37°C. Реакції припиняли доданням оцтової кислоти (кінцева концентрація 100 мМ). Сканування виконували із застосуванням приладу Pherastar Fluorescent Reader (фірма BMG) ( збудження 380 нм; випромінювання =460 нм). Дані (середні значення стандартне відхилення) виражали у відсотках від контролю (у відсутності сполуки) та графічно відображали як залежність відсотка ефекту від логарифма концентрації сполуки, застосовуючи програму GraphPad (фірма Prism). Результати апроксимували за сігмоїдною моделлю (змінний нахил). Випробування активності каспази-3 Каспазу-3 розводили у буфері каспази-3 (100 мМ Hepes, pH 7,5; 10% сахарози; 0,1% CHAPS). Вихідні розчини сполук у DMSO (100 мМ) зберігали при -20°C. Сполуки випробовували у таких кінцевих концентраціях: 100 мкМ; 33,3 мкМ; 11,1 мкМ; 3,7 мкМ; 1,23 мкМ; 412 нМ; 137 нМ; 45,7 нМ; 15,2 нМ; 5 нМ. Реакції проводили у двох паралельних пробах, використовуючи 96-лункові планшети Black LJL (мікропланшети HE, фірма Molecular Devices; кінцевий об’єм реакційних сумішей 20 мкл). Концентрація субстрату для випробувань специфічності каспази-3 становила 500 нМ (Ac-DEVD-AMC; фірма Promega). Концентрація ензиму (каспази-3) при випробуваннях специфічності становила 3,2 нМ. Концентрації визначали з метою виконання випробувань специфічності при початкових швидкостях в умовах фіксованої концентрації субстрату. Сполуки попередньо інкубували з ензимами протягом 30 хв при 25°C. Реакції ініціювали додаванням субстрату у планшети, що містили ензими (у присутності або за відсутності сполук), розведені у випробувальному буфері. Реакційні суміші інкубували протягом 60 хв при 37°C. Реакції припиняли доданням оцтової кислоти (кінцева концентрація 100 мМ). Сканування виконували із застосуванням приладу Pherastar Fluorescent Reader (фірма BMG) ( збудження 380 нм; випромінювання =460 нм). Дані (середні значення стандартне відхилення) виражали у відсотках від контролю (у відсутності сполуки) та графічно відображали як залежність відсотка ефекту від логарифма концентрації сполуки, застосовуючи програму GraphPad (фірма Prism). Результати апроксимували за сігмоїдною моделлю (змінний нахил). Випробування активності катепсину-B Катепсин-B розводили у буфері катепсину-B (20 мМ Tris HCl, pH 6,8; 1 мМ EDTA; 1 мМ DTT). Вихідні розчини сполук у DMSO (100 мМ) зберігали при -20°C. Сполуки випробовували у таких кінцевих концентраціях: 100 мкМ; 33,3 мкМ; 11,1 мкМ; 3,7 мкМ; 1,23 мкМ; 412 нМ; 137 нМ; 45,7 нМ; 15,2 нМ; 5 нМ. Реакції проводили у двох паралельних пробах, використовуючи 96-лункові планшети Black LJL (мікропланшети HE, фірма Molecular Devices; кінцевий об’єм реакційних сумішей 20 мкл). Концентрація субстрату для випробувань специфічності катепсинуB становила 36 мкМ (z-RR-AMC; фірма Calbiochem). Концентрація ензиму (катепсину-B) при випробуваннях специфічності становила 3,6 нМ. Концентрації визначали з метою виконання випробувань специфічності при початкових швидкостях в умовах фіксованої концентрації субстрату. Сполуки попередньо інкубували з ензимами протягом 30 хв при 25°C. Реакції ініціювали додаванням субстрату у планшети, що містили ензими (у присутності або за 23 UA 99116 C2 5 10 15 20 25 30 35 40 45 50 55 відсутності сполук), розведені у випробувальному буфері. Реакційні суміші інкубували протягом 60 хв при 37°C. Реакції припиняли доданням оцтової кислоти (кінцева концентрація 100 мМ). Сканування виконували із застосуванням приладу Pherastar Fluorescent Reader (фірма BMG). збудження 380 нм; випромінювання =460 нм. Дані (середні значення стандартне відхилення) виражали у відсотках від контролю (у відсутності сполуки) та графічно відображали як залежність відсотка ефекту від логарифма концентрації сполуки, застосовуючи програму GraphPad (фірма Prism). Результати апроксимували за сігмоїдною моделлю (змінний нахил). Методики випробування життєздатності та проліферації клітин випробування життєздатності та проліферації клітин HCT116 Клітини раку товстої кишки HCT116 одержували з Американської колекції типових культур (ATCC, American Type Culture Collection) та культивували у середовищі Мак-Коя 5A, яке містило 10% FBS, 3 мМ глутамін та 1% пеніциліну/стрептоміцину. Клітини інкубували при 37°C у зволоженій атмосфері із вмістом CO2 5%. Життєздатність клітин випробовували із застосуванням способу MTS у 96-лункових ® культивувальних планшетах (CellTiter 96 , проба на проліферацію клітин без радіоактивності у водному середовищі – Aqueous Non-Radioactive Cell Proliferation Assay, фірма Promega) згідно зі вказівками виробника. MTS (3-(4,5-диметилтіазол-2-іл)-5-(3-карбоксиметоксифеніл)-2-(4сульфофеніл)-2H-тетразолій) являє собою тетразолій – похідне MTT, який у метаболічно активних клітинах відновлюється у розчинний клітинно-проникний формазан. Кількість формазану, яка визначається за поглинальною здатністю на довжині хвилі 492 нм, пропорційна кількості живих метаболічно активних клітин. 3 Висівали по 10 клітин HCT116 у кожну лунку. Через 24 год середовище змінювали, і клітини обробляли у трьох паралельних дослідах такими концентраціями кожної сполуки: 10 мкМ, 3,33 мкМ, 1,11 мкМ, 370 нМ, 123 нМ, 41 нМ, 14 нМ та 5 нМ. Сполуки розводили у 100% DMSO, кінцева концентрація якого у кільтурах клітин підтримувалася на рівні 0,5%. Клітини інкубували зі сполуками протягом 72 год, після чого їхню життєздатність випробовували шляхом додавання MTS протягом 2 год. Поглинання на довжині хвилі 492 нм вимірювали безпосередньо у 96-лункових культивувальних планшетах. Обчислювали значення концентрацій GI50 (50% інгібування росту) для кожної сполуки із застосуванням апроксимації сігмоїдного змінного нахилу (програмне забезпечення Prism 4.0, Graphpad). Визначали середні значення для трьох незалежних дослідів. випробування життєздатності та проліферації клітин PC3 Клітини раку простати PC-3 одержували з ATCC та культивували в середовищі F-12K, яке містило 7% FBS та 1% пеніциліну/стрептоміцину. Клітини інкубували при 37°C у зволоженій атмосфері зі вмістом CO2 5%. Життєздатність клітин випробовували із застосуванням способу MTS у 96-лункових ® культивувальних планшетах (CellTiter 96 , проба на проліферацію клітин без радіоактивності у водному середовищі – Aqueous Non-Radioactive Cell Proliferation Assay, фірма Promega) згідно із вказівками виробника. MTS (3-(4,5-диметилтіазол-2-іл)-5-(3-карбоксиметоксифеніл)-2-(4сульфофеніл)-2H-тетразолій) являє собою тетразолій – похідне MTT, який у метаболічно активних клітинах відновлюється у розчинний клітинно-проникний формазан. Кількість формазану, яка визначається за поглинальною здатністю на довжині хвилі 492 нм, пропорційна кількості живих метаболічно активних клітин. 3 Висівали по 210 клітин PC3 у кожну лунку. Через 24 год середовище змінювали, і клітини обробляли у трьох паралельних дослідах такими концентраціями кожної сполуки: 10 мкМ, 3,33 мкМ, 1,11 мкМ, 370 нМ, 123 нМ, 41 нМ, 14 нМ та 5 нМ. Сполуки розводили у 100% DMSO, кінцева концентрація якого у кільтурах клітин підтримувалася на рівні 0,5%. Клітини інкубували зі сполуками протягом 72 год, після чого їхню життєздатність випробовували шляхом додавання MTS протягом 2 год. Поглинання на довжині хвилі 492 нм вимірювали безпосередньо у 96-лункових культивувальних планшетах. Обчислювали значення концентрацій GI50 (50% інгібування росту) для кожної сполуки із застосуванням апроксимації сігмоїдного змінного нахилу (програмне забезпечення Prism 4.0, Graphpad). Визначали середні значення для трьох незалежних дослідів. Результати 1. Інгібування активності цистеїнпротеаз 24 UA 99116 C2 USP5 Експеримент № 5a 5b 5d 6 7 8a 8b 8c 10f 12 13 USP7 Експеримент № 5a 5b 5d 6 7 8b 8c 10b 10d 10f 10h 12 13 USP5 1,8 мкМ 1,15 мкМ 1,42 мкМ 0,175 мкМ 0,264 мкМ 54 мкМ 0,226 мкМ 0,470 мкМ 1,2 мкМ 0,131 мкМ 0,215 мкМ USP8 Експеримент № 5a 5b 5c 5d 5e 6 7 8a 8b 8c 10b 10d 10f 10h 12 13 UCH-L3 Експеримент № 5a 5b 5c 5d 5e 6 7 8a 8b 8c 10f 12 13 USP8 0,58 мкМ 0,355 мкМ 47,7 мкМ 0,565 мкМ 35 мкМ 0,064 мкМ 0,143 мкМ 27,8 мкМ 0,121 мкМ 0,225 мкМ 0,528 мкМ 0,381 мкМ 0,342 мкМ 0,807 мкМ 0,037 мкМ 0,071 мкМ Катепсин-B Експеримент № 5a 5d 6 7 8a 8b 8c 12 13 5 USP7 4 мкМ 3,14 мкМ 5,35 мкМ 0,305 мкМ 0,657 мкМ 0,470 мкМ 1,78 мкМ 4,84 мкМ 3,11 мкМ 3,25 мкМ 7,28 мкМ 0,307 мкМ 0,415 мкМ Катепсин-B 2,6 мкМ 6,7 мкМ 0,300 мкМ 0,890 мкМ 15,8 мкМ 2,1 мкМ 3,8 мкМ 0,694 мкМ 0,979 мкМ 2. Інгібування життєздатності та проліферації клітин 25 Uch-L3 0,41 мкМ 0,272 мкМ 51 мкМ 0,250 мкМ 89 мкМ 0,032 мкМ 0,057 мкМ 2,0 мкМ 0,048 мкМ 0,121 мкМ 0,235 мкМ 0,044 мкМ 0,077 мкМ UA 99116 C2 HCT116 PC3 Експеримент № 5a 5b 5d 6 7 8а 8b 8с 10b 10d 10f 10h 12 13 Експеримент № 5a 5b 5d 6 7 8a 8b 8c 10f 12 13 HCT116 GI50 1,402 мкМ 1,64 мкМ 1,01 мкМ 0,096 мкМ 0,363 мкМ 0,398 мкМ 0,273 мкМ 0,265 мкМ 3,36 мкМ 3,93 мкМ 2,1 мкМ 1,91 мкМ 0,412 мкМ 0,832 мкМ PC3 GI50 D3 6,15 мкМ 6,69 мкМ 2,79 мкМ 0,180 мкМ 0,466 мкМ 0,391 мкМ 0,457 мкМ 0,502 мкМ 8,4 мкМ 0,548 мкМ 1,97 мкМ ФОРМУЛА ВИНАХОДУ 5 1. Сполука формули (І): R3 Ru R4 Het1 T X R5 R6 U V Rv W Rw Y , (І) де: - або одинарний, або подвійний зв'язок, залежно від конкретного випадку; - або відсутній, або одинарний зв'язок, залежно від конкретного випадку; 10 Het1 15 - 5-7-членний гетероцикл, за переважними варіантами гетероарил, який включає від 1 гетероатома до 5 гетероатомів, необовязково заміщений одним або кількома замісниками, вибраними з групи, що складається з Н, CN, =O, Hal, Alk, OAlk, OH, NRCN, C(CN)=C(OH)(OAlk), SR, NRR', C(O)NRR', гетероциклу, арилу, гетероарилу, де Alk, арил, гетероарил, гетероцикл необов’язково заміщені Hal, NRR', CN, ОН, CF3, арилом, гетероарилом, OAlk; Ru T X Het1 20 25 U V Rv W Rw де та конденсовані між собою через Т та X; Т, U, V, W, X є однаковими або різними і можуть бути вибрані з групи, що складається з С, N, О, S; Y - N-OR1, NR'l, CR2R'2; R1 - Н, алкіл, алкеніл, алкоксіалкіл, арилоксіалкіл, арил алкіл, алкоксикарбонілалкіл, карбоксіалкіл; R'1 - Н, алкіл, арил або аралкіл; R2, R'2 є однаковими або різними і вибрані незалежно один від одного з групи, що складається з Н, алкілу, арилу та аралкілу; Ru, Rv, Rw є однаковими або різними і можуть бути вибрані з групи, що складається з Н, CN, =O, Hal, Alk, OAlk, OH, NRCN, C(CN)=C(OH)(OAlk), SR, NRR', C(O)NRR', гетероциклу, арилу, гетероарилу, циклоалкілу, де Alk, арил, гетероарил, гетероцикл, циклоалкіл необов’язково заміщені Hal, NRR', CN, ОН, CF3, арилом, гетероарилом, OAlk; 26 UA 99116 C2 5 R3, R4, R5, R6 є однаковими або різними і незалежно один від одного вибрані з групи, що складається з Н, OAlk, Alk, Hal, NRR', CN, OH, OCF3, CF3, арилу, гетероарилу; R та R' є однаковими або різними і незалежно один від одного вибрані з групи, що складається з Н, Alk, де Alk необов’язково заміщений Hal, NRR', CN, OH, CF3, арилом, гетероарилом; або її фармацевтично прийнятні солі, гідрати або гідратовані солі, або поліморфні кристалічні структури цієї сполуки, або її оптичні ізомери, рацемати, діастереомери або енантіомери, або її регіоізомери, геометричні ізомери (Е та Z) або їх суміші. 2. Сполука формули (І) за п. 1, де Т,U, V, W, X незалежно один від одного є С або N. Het1 10 15 3. Сполука формули (І) за будь-яким із п. 1 або п. 2, де містить 2 гетероатоми або 3 гетероатоми. 4. Сполука формули (І) за будь-яким із попередніх пунктів, де щонайменше один з Ru, Rv, Rw вибраний з групи, що складається з Н, арилу, Alk, NRR', Hal, -Alk-арилу, -AlkOH, -AlkOAlk, циклоалкілу. 5. Сполука за будь-яким із попередніх пунктів, де R3, R4, R5, R6 є однаковими або різними та кожний з них незалежно від інших вибраний з групи, яку складають Н, Hal, Alk, OAlk, OCF3. 6. Сполука за будь-яким із попередніх пунктів, де кожний з Rv, Rw незалежно один від одного є Н або відсутній. 7. Сполука формули (І) за будь-яким із попередніх пунктів, де сполука має формулу (Іа): R3 Ru N R4 N R5 R6 20 25 30 35 40 45 T X U V W Y , (Іа) де R3, R4, R5, R6, Y, T, U, V, W, X, Ru відповідають визначенням за будь-яким з попередніх пунктів. 8. Сполука за будь-яким із попередніх пунктів, вибрана з групи, яку складають: 3-метил-1,2,3а,4,10-пентаазациклопента[b]флуорен-9-ону О-метилоксим; 3-метил-1,2,3а,4,10-пентаазациклопента[b]флуорен-9-ону О-алілоксим; 1-метил-2,3,4,10,10а-пентаазациклопента[b]флуорен-9-ону О-алілоксим; 3-бутил-1,2,3а,4,10-пентаазациклопента[b]флуорен-9-ону О-алілоксим; 1-бутил-2,3,4,10,10а-пентаазациклопента[b]флуорен-9-ону О-алілоксим; 1,2,3,3а,4,10-гексаазациклопента[b]флуорен-9-ону О-алілоксим; 1,2,3,3а,4,10-гексаазациклопента[b]флуорен-9-ону оксим; 1,2,3,3а,4,10-гексаазациклопента[b]флуорен-9-ону О-децилоксим; 1,2,3,3а,4,10-гексаазациклопента[b]флуорен-9-ону О-(2-метоксіетил)-оксим; 1,2,3,3а,4,10-гексаазациклопента[b]флуорен-9-ону О-(3-феноксипропіл)-оксим; 1-етил-2,3,4,10,10а-пентаазациклопента[b]флуорен-9-ону О-метилоксим; 3-етил-1,2,3а,4,10-пентаазациклопента[b]флуорен-9-ону О-метилоксим; 1-етил-2,3,4,10,10а-пентаазациклопента[b]флуорен-9-ону О-етилоксим; 3-етил-1,2,За,4,10-пентаазациклопента[b]флуорен-9-ону О-етилоксим; 1-етил-2,3,4,10,10а-пентаазациклопента[b]флуорен-9-ону О-алілоксим; 3-етил-1,2,3а,4,10-пентаазациклопента[b]флуорен-9-ону О-алілоксим; 1-етил-2,3,4,10,10а-пентаазациклопента[b]флуорен-9-ону О-бензилоксим; 3-етил-1,2,3а,4,10-пентаазациклопента[b]флуорен-9-ону О-бензилоксим; [1-етил-2,3,4,10,10а-пентаазациклопента[b]флуорен-9-іліден]-феніламін; етиловий ефір (1,2,3,3а,4,10-гексаазациклопента[b]флуорен-9-іліденамінооксі)-оцтової кислоти; (1,2,3,3а,4,10-гексаазациклопента[b]флуорен-9-іліденамінооксі)-ацетат літію, або їх фармацевтично прийнятні солі, гідрати або гідратовані солі, або поліморфні кристалічні структури цих сполук, або їх оптичні ізомери, рацемати, діастереомери або енантіомери, або їх регіоізомери, геометричні ізомери (Е та Z) або їх суміші. 9. Спосіб одержання сполуки формули (І) за будь-яким із попередніх пунктів 1-8, який включає стадію проведення реакції відповідної сполуки формули (I') 27 UA 99116 C2 R3 Ru' R4 Het1 T X R5 V Rv' W Rw' Y R6 5 U , (I') де R3, R4, R5, R6, Het1, T, U, V, W, X, Ru, Rv, Rw відповідають визначенням за будь-яким із пп. 1-7, та де кожна з груп Ru', Rv', Rw' є аналогічною Ru, Rv, Rw або є групою-попередником відповідної групи Ru, Rv, Rw, шляхом виконання однієї або кількох стадій, які забезпечують перетворення групи-попередника у цільову групу Ru, Rv або Rw, та необов’язково виділення сполуки формули (І). 10. Спосіб одержання сполуки за будь-яким із попередніх пп. 1-8, який включає стадію проведення реакції відповідних сполук формули (II) та формули (III): R3 O R4 OH OH R5 O R6 , (II) Rv Rw W V X H2N 10 T U Ru NH2 , (III) де R3, R4, R5, R6, Т, U, V, W, X, Ru, Rv, Rw відповідають визначенням за будь-яким із пп. 1-7. 11. Фармацевтична композиція, яка містить сполуку формули (І) R3 Ru R4 Het1 R5 R6 15 20 25 30 35 Y T X U V Rv W Rw , (І) де R3, R4, R5, R6, Т, U, V, W, X, Het1, Ru, Rv та Rw відповідають визначенням за пп. 1-8. 12. Сполука формули (І) за будь-яким з пп. 1-8 для інгібування однієї або декількох цистеїнпротеаз. 13. Сполука за п. 12, причому згадані цистеїнпротеази належать до однієї або декількох груп ензимів деубіквітинації, каспаз, катепсинів, кальпаїнів, а також вірусних, бактеріальних, грибкових або паразитарних цистеїнпротеаз. 14. Сполука формули (І) за будь-яким з пп. 1-8 для лікування та/або попередження раку та метастазів, нейродегенеративних захворювань, наприклад хвороби Альцгеймера та хвороби Паркінсона, запальних розладів, серцево-судинних захворювань та/або вірусних інфекцій та прихованих патологічних станів, зокрема вірусу-1 простого герпесу, вірусу Епштейна-Барра або коронавірусу SARS, запальних розладів, нейродегенеративних захворювань, за варіантом, якому віддається перевага, ушкоджень нервових клітин, спричинених інсультом, ушкодження печінки та печінкової недостатності, які є наслідком гострої або хронічної інфекції, ішемічного або хімічного ушкодження печінки, ушкодження нирок та ниркової недостатності, які є наслідком гострої або хронічної інфекції, ішемічного або хімічногоушкодження нирок, ушкодження серця та серцевої недостатності, які є наслідком гострої або хронічної інфекції, ішемічного або хімічного ушкодження серця, діабету, спричиненого гострим або хронічним аутоімунним, хімічним, окиснювальним або метаболічним ушкодженням інсулінових бета-клітин панкреатичних острівців, раку та метастазів, серцево-судинних захворювань, імунологічних розладів, захворювань кісток та суглобів, остеопорозу та артриту, вікових розладів, пізніх нападів діабету та катаракти, вірусних інфекцій та захворювань, у тому числі гепатиту А, 28
ДивитисяДодаткова інформація
Назва патенту англійськоюTetracyclic inhibitors of cysteine proteases, the pharmaceutical compositions thereof and their therapeutic applications
Автори англійськоюGuedat, Philippe, Jacq, Xavier, Colland, Frederic, Daviet, Laurent, Formstecher, Etienne, Rain, Jean-Christophe, Colombo, Matteo
Назва патенту російськоюТетрациклические ингибиторы цистеинпротеаз, их фармацевтическая композиция и их терапевтическое применение
Автори російськоюГюдо Филипп, Жак Ксавье, Коллан Фредерик, Давье Лоран, Формстеше Этьенн, Рен Жан-Кристоф, Коломбо Маттео
МПК / Мітки
МПК: C07D 487/04, A61P 25/00, A61K 31/41, A61P 35/00, A61K 31/4196, A61K 31/53, A61P 33/00
Мітки: терапевтичне, тетрациклічні, інгібітори, фармацевтична, застосування, цистеїнпротеаз, композиція
Код посилання
<a href="https://ua.patents.su/31-99116-tetraciklichni-ingibitori-cistenproteaz-kh-farmacevtichna-kompoziciya-ta-kh-terapevtichne-zastosuvannya.html" target="_blank" rel="follow" title="База патентів України">Тетрациклічні інгібітори цистеїнпротеаз, їх фармацевтична композиція та їх терапевтичне застосування</a>
Попередній патент: Водна композиція, що твердне, спосіб її одержання, спосіб скріплення нетканих волокон, скріплений зв’язуючим нетканий виріб та теплоізоляція будівель
Наступний патент: Білок h5 вірусу грипу, молекула нуклеїнової кислоти і вектор, який її кодує, та їх застосування
Випадковий патент: Спосіб очистки стічних вод