Способи і проміжні сполуки для отримання інгібіторів jak
Формула / Реферат
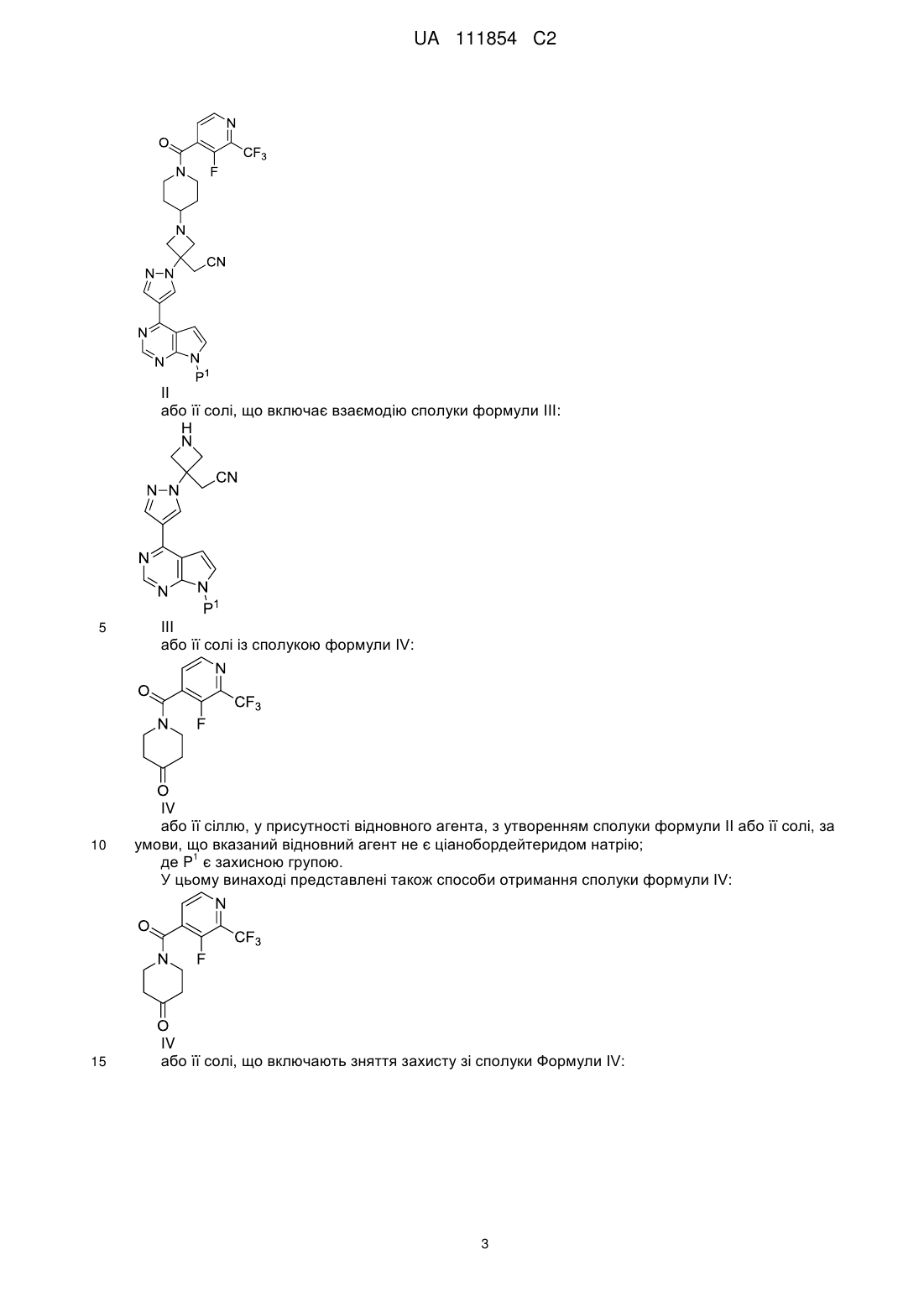
1. Спосіб, який включає взаємодію сполуки формули III
 III
III
або її солі зі сполукою формули IV
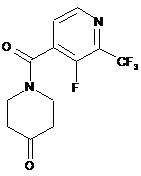 IV
IV
у присутності відновного агента з утворенням сполуки формули II
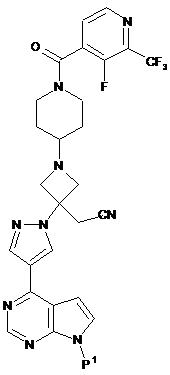 II
II
або її солі, за умови, що вказаний відновний агент не є ціанобордейтеридом натрію;
де Р1 є захисною групою.
2. Спосіб за п. 1, який відрізняється тим, що вказана захисна група є -CH2OCH2CH2Si(CH3)3.
3. Спосіб за будь-яким з пп. 1-2, який відрізняється тим, що вказаний відновний агент вибирають із ціаноборгідриду натрію та триацетоксиборгідриду натрію.
4. Спосіб за будь-яким з пп. 1-2, який відрізняється тим, що вказаний відновний агент є триацетоксиборгідридом натрію.
5. Спосіб за будь-яким з пп. 1-4, який відрізняється тим, що кожна сполука формул II, III і IV є вільною основою.
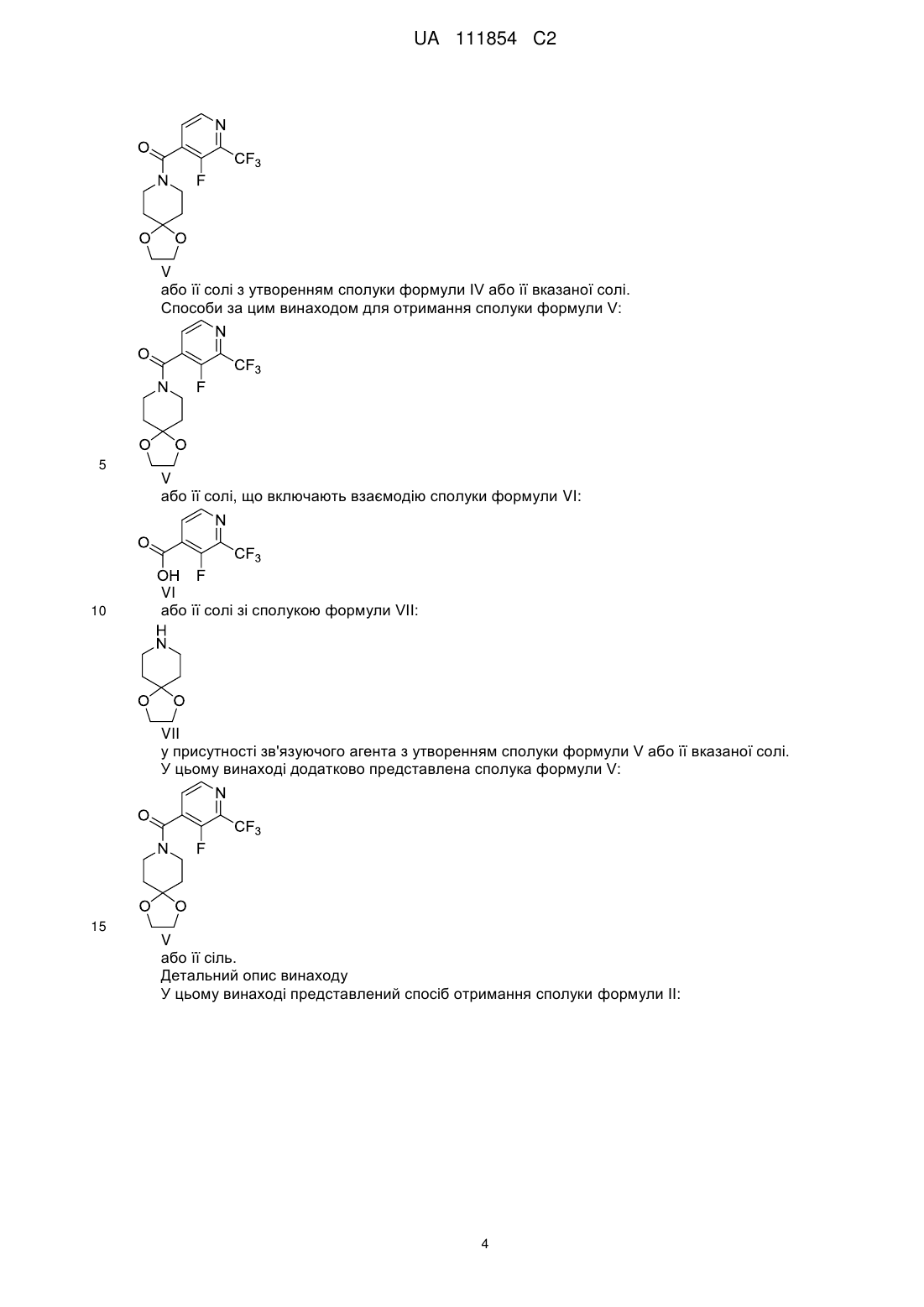
6. Спосіб за будь-яким з пп. 1-5, який додатково включає зняття захисту зі сполуки формули II або її вказаної солі з утворенням сполуки формули І
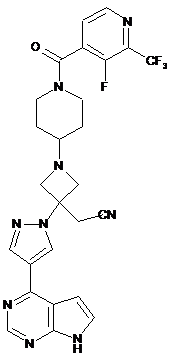 І
І
або її солі.
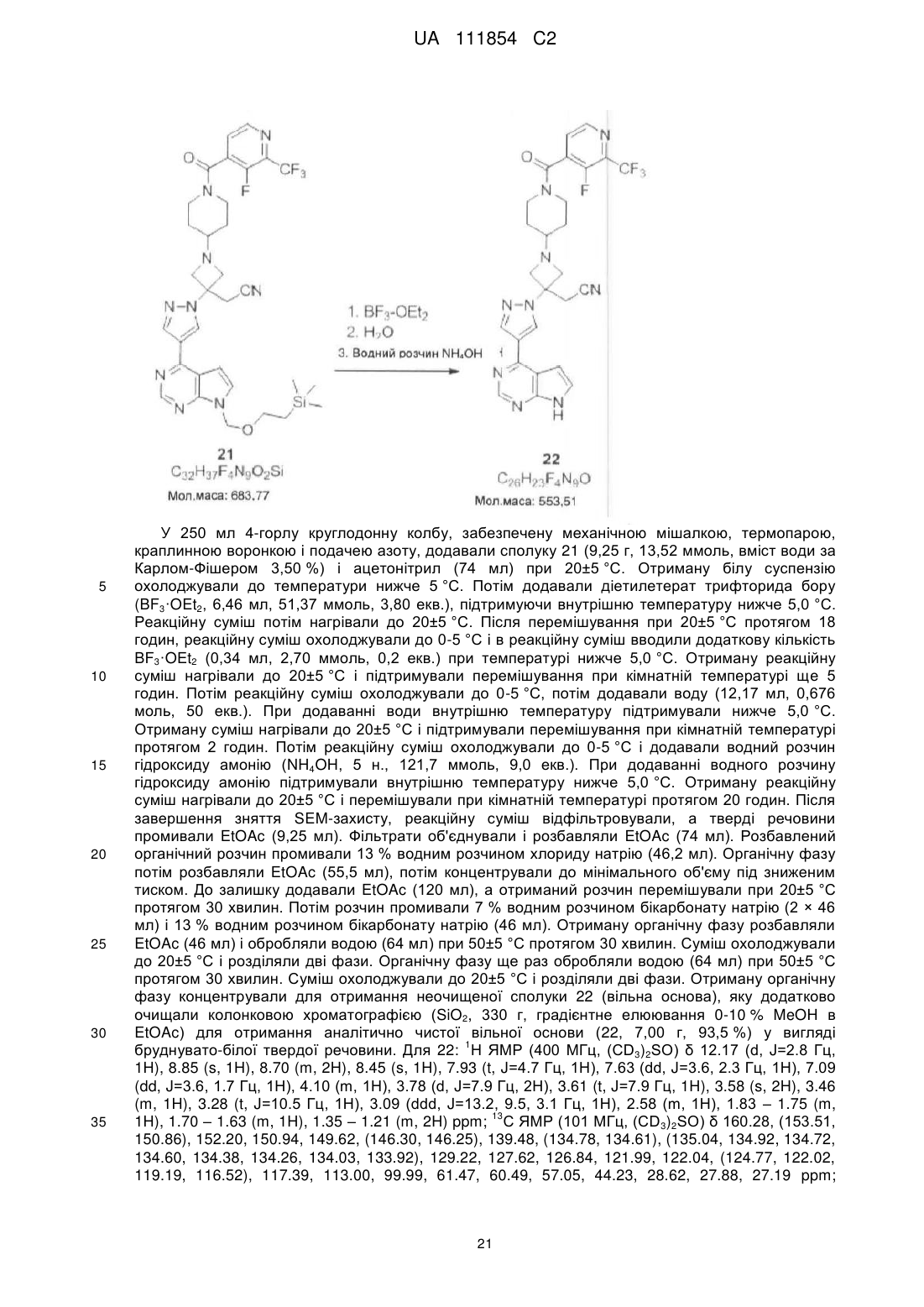
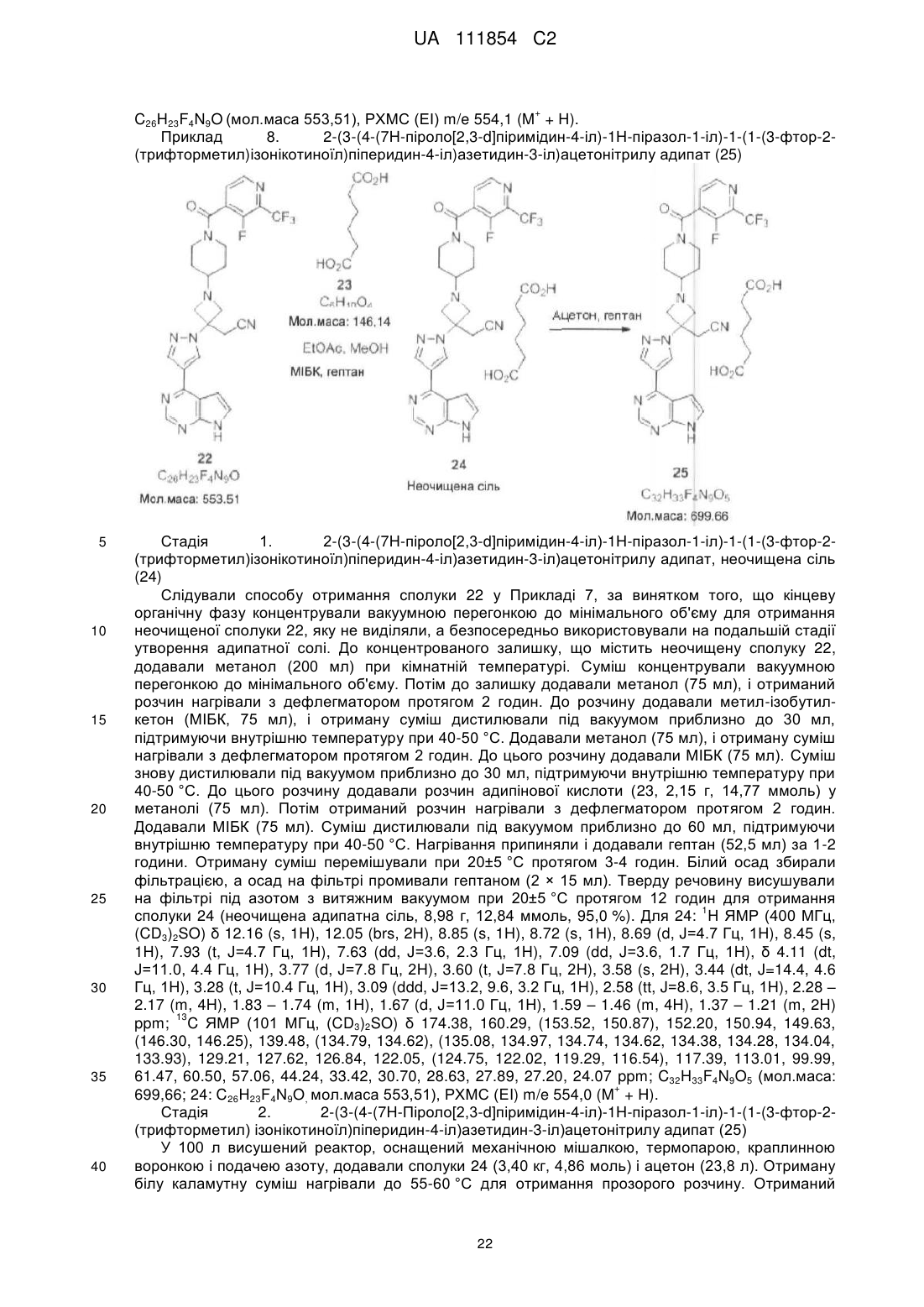
7. Спосіб за п. 6, який відрізняється тим, що вказане зняття захисту включає обробку етератом трифториду бору, з подальшою обробкою водним гідроксидом амонію.
8. Спосіб за будь-яким з пп. 6-7, який відрізняється тим, що вказаний спосіб додатково включає взаємодію сполуки формули І з адипіновою кислотою з утворенням адипатної солі.
9. Спосіб за будь-яким з пп. 6-8, який відрізняється тим, що кожна сполука формул І, II, III і IV є вільною основою.
10. Спосіб за будь-яким з пп. 6-7, який відрізняється тим, що вказаний спосіб додатково включає:
(a) нагрівання сполуки формули І у метанолі при дефлегмації для отримання суміші;
(b) після (а) - додавання метилізобутилкетону до суміші;
(c) після (b) - видалення частини розчинника перегонкою при внутрішній температурі від 40 °C до 50 °C для отримання концентрованої суміші;
(d) після (с) - додавання до концентрованої суміші метанолу для отримання розбавленої суміші;
(e) після (d) - нагрівання розбавленої суміші при дефлегмації для утворення суміші;
(f) після (e) - додавання метилізобутилкетону до суміші;
(g) після (f) - видалення частини розчинника перегонкою при внутрішній температурі від 40 °C до 50 °C для отримання концентрованої суміші;
(h) після (g) - додавання до концентрованої суміші адипінової кислоти і метанолу;
(і) після (h) - нагрівання суміші при дефлегмації; і
(j) після (і) - видалення частини розчинника перегонкою при внутрішній температурі від 40 °C до 50 °C для отримання концентрованої суміші;
(k) після (j) - додавання гептану до суміші; і
(l) після (k) - перемішування суміші при кімнатній температурі з утворенням адипінокислої солі сполуки формули І.
11. Спосіб за будь-яким з пп. 6-10, який відрізняється тим, що сполуку формули IV або її сіль отримують за способом, що включає зняття захисту зі сполуки формули V
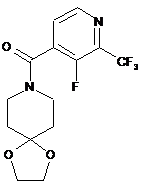 V
V
або її солі.
12. Спосіб за п. 11, який відрізняється тим, що вказане зняття захисту включає взаємодію з водною кислотою.
13. Спосіб за п. 12, який відрізняється тим, що вказана кислота є хлороводневою кислотою.
14. Спосіб за будь-яким з пп. 11-13, який відрізняється тим, що кожна сполука формул І, II, III, IV і V є вільною основою.
15. Спосіб за будь-яким з пп. 11-14, який відрізняється тим, що вказану сполуку формули V або її сіль отримують за способом, що включає взаємодію сполуки формули VI
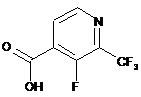 VI
VI
із сполукою формули VII
 VII
VII
у присутності зв'язуючого агента.
16. Спосіб за п. 15, який відрізняється тим, що зв'язуючий агент є бензотриазол-1-ілокситрис(диметиламіно)фосфонію гексафторфосфатом (ВОР).
17. Спосіб отримання сполуки формули IV
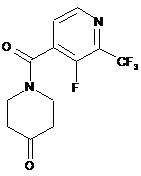 IV
IV
або її солі, що включає зняття захисту із сполуки формули V
 V
V
або її солі, з утворенням сполуки формули IV або її вказаної солі.
18. Спосіб за п. 17, який відрізняється тим, що вказане зняття захисту включає взаємодію з водною кислотою.
19. Спосіб за п. 18, який відрізняється тим, що вказана кислота є хлороводневою кислотою.
20. Спосіб за будь-яким з пп. 17-19, який відрізняється тим, що кожна сполука формул IV і V є вільною основою.
21. Спосіб отримання сполуки формули V
 V
V
або її солі, що включає взаємодію сполуки формули VI
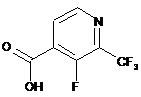 VI
VI
або її солі зі сполукою формули VII
 VII
VII
або її сіллю у присутності зв’язуючого агента з утворенням сполуки формули V або її вказаної солі.
22. Спосіб за п. 21, який відрізняється тим, що зв'язуючий агент є бензотриазол-1-ілокситрис(диметиламіно)фосфонію гексафторфосфатом (ВОР).
23. Сполука формули V
 V
V
або її сіль.
Текст
Реферат: Цей винахід стосується способів і проміжних сполук для отримання {1-{1-[3-фтор-2(трифторметил)ізонікотиноїл]піперидин-4-іл}-3-[4-(7Н-піроло[2,3-d]піримідин-4-іл)-1Н-піразол-1іл]азетидин-3-іл}ацетонітрилу, придатного для лікування захворювань, пов'язаних з активністю янус-кіназ (JAK), включаючи запальні розлади, аутоімунні розлади, рак та інші захворювання. UA 111854 C2 (12) UA 111854 C2 UA 111854 C2 5 10 15 20 25 30 35 40 45 50 55 60 Ця заявка заявляє пріоритет за попередньою заявкою на патент США 61/531896, поданою 7 вересня 2011 року, повний зміст якої включений у цей документ за допомогою посилання. Галузь техніки Цей винахід відноситься до способів і проміжних сполук для отримання {1-{1-[3-фтор-2(трифторметил)ізонікотиноїл]піперидин-4-іл}-3-[4-(7H-піроло[2,3-d]піримідин-4-іл)-1H-піразол-1іл]азетидин-3-іл}ацетонітрилу, придатного при лікуванні захворювань, пов'язаних з активністю Янус-кіназ (JAK), включаючи запальні розлади, аутоімунні розлади, рак та інші захворювання. Рівень техніки Протеїнкінази (РK) регулюють різні важливі біологічні процеси, включаючи, окрім іншого, ріст, виживання і диференціювання клітин, формування органів, морфогенез, неоваскуляризацію, відновлення і регенерацію тканин. Протеїнкінази також відіграють спеціалізовані ролі в носієві захворювань людини, включаючи рак. Цитокіни, поліпептиди низькою молекулярною масою, або глікопротеїни, регулюють багато шляхів, що беруть участь у запальній реакції на сепсис. Цитокіни впливають на диференціювання, проліферацію і активацію клітин, і можуть модулювати прозапальні і протизапальні реакції для забезпечення відповідної реакції на патогени. Передача сигналів широкого рядуцитокінів зачіпає сімейство янус-кіназ ((JAK) протеїн-тирозинкіназ) і сигнальні трансдуктори і активатори транскрипції (STAT). Існує чотири відомі JAK ссавців: JAK1 (Янус-кіназа-1), JAK2, JAK3 (також відома як Янус-кіназа, лейкоцит; JAKL; і L-JAK), і TYK2 (протеїн-тирозинкіназа 2). Цитокін-стимульовані імунні і запальні реакції, що сприяють патогенезу захворювань: патологій, таких, як важкий комбінований імунодефіцит (ВКІД), що виникає через придушення імунної системи, тоді як гіперактивна або невідповідна імунна/запальна реакція сприяє патології аутоіммунних захворювань (наприклад, астми, системного червоного вовчаку, тиреоїдиту, міокардиту) і хвороб, таких, як склеродермія і остеоартрит (Ortmann, R. A., T. Cheng, et al. (2000) Arthritis Res 2(1): 16-32). Нестача експресії JAK пов'язана з багатьма хворобливими станами. Наприклад, миші Jak1-/низькорослі від народження, відмовляються від годування і гинуть внутрішньоутробно (Rodig, S. J., M. A. Meraz, et al. (1998) Cell 93(3): 373-83). Ембріони мишей Jak2-/- є анемічними і гинуть приблизно на 12,5 день після запліднення через відсутність дефінітивного еритропоезу. Шлях JAK/STAT і, зокрема, всі чотири JAK, імовірно відіграють роль у патогенезі астматичної реакції, хронічній обструктивній хворобі легенів, бронхіті і інших споріднених запальних захворюваннях нижніх дихальних шляхів. Багато цитокінів, що передають сигнал через JAK, пов'язані із запальними захворюваннями/станами верхніх дихальних шляхів, такими як ті, що вражають ніс і пазухи (наприклад, риніт і синусит), які є класичними алергічними реакціями або не є ними. Шлях JAK/STAT також бере участь у запальних захворюваннях/станах очей і хронічних алергічних реакціях. Активація JAK/STAT при раку може виникати шляхом стимуляції цитокінів (наприклад, IL-6 або GM-CSF) або шляхом зниження передачі сигналів JAK у ендогенних супресорах, таких, як SOCS (супресор передачі сигналів цитокінів) або PIAS (білковий інгібітор активованого STAT) (Boudny, V., and Kovarik, J., Neoplasm. 49:349-355, 2002). Активація передачі сигналів STAT, а також інших низхідних шляхів JAK (наприклад, Akt) пов'язана з поганим прогнозом у багатьох типах раку (Bowman, T., et al. Oncogene 19:2474-2488, 2000). Підвищені рівні циркулюючих цитокінів, які передають сигнал через JAK/STAT, відіграють причинну роль у кахексії та/або хронічній втомі. Тому інгібування JAK може бути корисним для онкологічних пацієнтів за причинами, які виходять за межі потенційної протипухлинної активності. JAK2 тирозинкіназа може бути корисною для пацієнтів з мієлопроліферативними порушеннями, наприклад, дійсною поліцитемією (PV), ессенціальною тромбоцитемією (ET), мієлоїдною метаплазією з мієлофіброзом (MMM) (Levin, et al., Cancer Cell, том 7, 2005: 387-397). Інгібування кінази JAK2V617F знижує проліферацію гематопоетичних клітин, що дозволяє передбачити, що JAK2 є потенційною мішенню для фармакологічного інгібування у пацієнтів з PV, ET і MMM. Інгібування JAK може принести користь пацієнтам, які страждають на шкірні імунні розлади, такі, як псоріаз і шкірнасенсибілізація. Збереження псоріазу, імовірно, залежить від ряду запальних цитокінів, окрім різних хемокінів і факторів зростання (JCI, 113:1664-1675), багато з яких передає сигнал через JAK (Adv Pharmacol. 2000;47:113-74). JAK1 відіграє центральну роль у ряді сигнальних шляхів цитокінів і факторів зростання, які, при дисрегуляції, можуть призвести або сприяти хворобливим станам. Наприклад, рівні IL-6 підвищені при ревматоїдному артриті, захворюванні, в якому він імовірно дію (Fonesca, J.E. et al., Autoimmunity Reviews, 8:538-42, 2009). Оскільки IL-6 передає сигнал щонайменше частково через JAK1, то пряме або непряме антагонізування IL-6 шляхом інгібування JAK1 імовірно 1 UA 111854 C2 5 10 15 20 25 30 35 забезпечить клінічну перевагу (Guschin, D., N., et al Embo J 14:1421, 1995; Smolen, J. S., et al. Lancet 371:987, 2008). Більше того, у деяких видах раку JAK є мутованою, що призводить до небажаного і виживання клітинпухлини (Mullighan CG, Proc. Natl. Acad. Sci. USA 106:9414-8, 2009; Flex. E., et. al. J Exp. Med. 205:751-8, 2008). У інших аутоіммунних захворюваннях і типах раку підвищені системні рівні запальних цитокінів, які активують JAK1, також можуть сприяти захворюванню та/або супутнім симптомам. Тому пацієнти з такими захворюваннями можуть отримати користь від інгібування JAK1. Селективні інгібітори JAK1 можуть бути ефективними для запобігання непотрібним і потенційно небажаним ефектам інгібування інших JAK кіназ. Селективні інгібітори JAK1, порівняно з іншими JAK кіназами, можуть мати численні терапевтичні переваги порівняно з менш селективними інгібіторами. Відносно селективності проти JAK2, ряд важливих цитокінів і факторів передають сигнал через JAK2, включаючи, наприклад, еритропоетин (Epo) і тромбопоетин (Tpo) (Parganas E, et al. Cell. 93:385-95, 1998). Epo є ключовимфактором для продукування червоних кров'яних тілець; тому недостатність Epoзалежної передачі сигналів може призвести до зниженої кількості червоних кров'яних тілець і анемії (Kaushansky K, NEJM 354:2034-45, 2006). Tpo, інший приклад JAK2-залежного шинника, відіграє центральну роль у контролі проліферації і дозріванні мегакаріоцитів – клітин, з яких виробляються тробмоцити (Kaushansky K, NEJM 354:2034-45, 2006). Тому знижена передача сигналів Тро знижує кількість мегакаріоцитів (мегакаріоцитопенія) і знижує кількість циркулюючих тромбоцитів (тромбоцитопенія). Це може призвести до небажаної та∕або неконтрольованої кровотечі. Також може бути бажаним знижене інгібування інших JAK, таких, як JAK3 і Tyk2, оскільки було показано, що люди з нестачею функціональної версії цих кіназ страждають від багатьох хвороб, таких, як складний комбінований імунодефіцит або синдром гіперімуноглобуліну Е (Minegishi, Y, et al. Immunity 25:745-55, 2006; Macchi P, et. al. Nature. 377:65-8, 1995). Тому інгібітор JAK1 зі зниженою спорідненістю до інших JAK має істотні переваги порівняно з менш селективним інгібітором відносно зниженої кількості побічних ефектів, що включають придушення імунітету, анемію і тромбоцитопенію. Завдяки застосовності інгібіторів JAK існує необхідність у розробці нових способів отримання інгібіторів JAK. Даний винахід спрямований на задоволення цієї та інших потреб. Короткий опис винаходу Інгібітори JAK описані в публікації США з серійним номером 13/043986, поданої 9 березня 2011 року, повний якої включений у цей документ за допомогою посилання, включаючи {1-{1-[3фтор-2-(трифторметил) ізонікотиноїл]піперидин-4-іл}-3-[4-(7H-піроло[2,3-d]піримідин-4-іл)-1Hпіразол-1-іл]азетидин-3-іл}ацетонітрил, який зображений нижче як формула I. I У цьому винаході представлені, окрім іншого, способи і проміжні сполуки для отримання сполуки формули I. Зокрема, у цьому винаході представлені способи отримання сполуки формули II: 2 UA 111854 C2 II або її солі, що включає взаємодію сполуки формули III: 5 10 15 III або її солі із сполукою формули IV: IV або її сіллю, у присутності відновного агента, з утворенням сполуки формули II або її солі, за умови, що вказаний відновний агент не є ціанобордейтеридом натрію; 1 де P є захисною групою. У цьому винаході представлені також способи отримання сполуки формули IV: IV або її солі, що включають зняття захисту зі сполуки Формули IV: 3 UA 111854 C2 V або її солі з утворенням сполуки формули IV або її вказаної солі. Способи за цим винаходом для отримання сполуки формули V: 5 V або її солі, що включають взаємодію сполуки формули VI: 10 VI або її солі зі сполукою формули VII: VII у присутності зв'язуючого агента з утворенням сполуки формули V або її вказаної солі. У цьому винаході додатково представлена сполука формули V: 15 V або її сіль. Детальний опис винаходу У цьому винаході представлений спосіб отримання сполуки формули II: 4 UA 111854 C2 II або її солі, що включає взаємодію сполуки формули III: 5 10 15 20 25 III або її солі із сполукою формули IV:IV або її сіллю, у присутності відновного агента, з утворенням сполуки формули II або її 1 вказаної солі, за умови, що вказаний відновний агент не є ціанобордейтеридом натрію; де P є захисною групою. У деяких варіантах реалізації, сполуки формули III і IV бажано використовують у вигляді вільних основ, а сполуку формули II отримують бажано у вигляді вільної основи. При використанні в цьому документі "вільна основа" означає несольову форму сполуки. У деяких варіантах реалізації реакцію сполуки III і сполуки IV виконують у присутності третинного аміну (наприклад, триетиламіну). У деяких варіантах реалізації температура реакції складає ≤ 30 °C. У деяких варіантах реалізації реакцію виконують у відповідному розчиннику. У деяких варіантах реалізації відповідним розчинником є дихлорметан. 1 Відповідні захисні групи P включають, але не обмежуються ними, захисні групи для амінів, описані у публікації Wuts and Greene, Protective Groups in Organic Synthesis, 4е видавництво, John Wiley & Sons: Нью-Джерсі, сторінки 696-887 (і, зокрема, сторінки 872-887) (2007), повний 1 зміст якої включений у цей документ за допомогою посилання. У деяких варіантах реалізації P є бензилоксикарбонілом (Cbz), 2,2,2-трихлоретоксикарбонілом (Troc), 2(триметилсиліл)етоксикарбонілом (Teoc), 2-(4-трифторметилфенілсульфоніл)етоксикарбонілом (Tsc), трет-бутоксикарбонілом (ВОС), 1-адамантилоксикарбонілом (Adoc), 2адамантилкарбонілом (2-Adoc), 2,4-диметилпент-3-ілоксикарбонілом (Doc), циклогексилоксикарбонілом (Hoc), 1,1-диметил-2,2,2-трихлоретоксикарбонілом (TcBOC), 5 UA 111854 C2 5 10 15 20 25 30 вінілом, 2-хлоретилом, 2-фенілсульфонілетилом, алілом, бензилом, 2-нітробензилом, 4нітробензилом, дифеніл-4-піридилметилом, N",N’-диметилгідразинілом, метоксиметилом, третбутоксиметилом (Bum), бензилоксиметилом (BOM), 2-тетрагідропіранілом (THP), три(C14алкіл)силілом (наприклад, три(ізопропіл)силілом), 1,1-діетоксиметил -CH2OCH2CH2Si(CH3)3 1 (SEM) або N-півалоїлоксиметилом (POM). У деяких варіантах реалізації P є -CH2OCH2CH2Si(CH3)3. Відновний агент може бути будь-яким відновним агентом, придатним для використання у відновному амінуванні, включаючи різні боргідридні і боранові відновні агенти, такі як описані в публікації Ellen W. Baxter and Allen B. Reitz, Reductive Aminations of Carbonyl Compounds with Borohydride and Borane Reducing Agents, Organic Reactions, Глава 1, сторінки 1-57 (Wiley, 2002), повний зміст якої включений у цей документ за допомогою посилання. Необмежуючі класи відповідних відновних агентів включають боргідрид, ціаноборгідрид, три(C1-4ацил)оксиборгідрид (наприклад, триацетоксиборгідридні похідні), 9-боробіцикло[3.3.1]нонану гідрид, три(C14алкіл)боргідрид і дізопінокамптеїлціаноборгідридні похідні, аміноборани, боран-піридиновий комплекс і алкіламін-борани. Необмежуючі приклади відповідних відновних агентів включають ціаноборгідрид натрію, триацетоксиборгідрид натрію, натрію ціано-9-боробіцикло[3.3.1]нонану гідрид, тетрабутиламонію ціаноборгідрид, ціаноборгідрид на твердій підкладці, триметиламонію триацетоксиборгідрид, триацетоксиборгідрид натрію, триетилборгідрид літію, літію три(вторбутил)боргідрид, дізопінокамптеїлціаноборгідрид натрію, катехол-боран, борантетрагідрофуран, боргідрид натрію, боргідрид калію, боргідрид літію, паладій у присутності газоподібного водню, 5-етил-2-метилпіридин-боран (PEMB), 2-піколін-боран або триацетоксиборгідрид на полімерній підкладці. У деяких варіантах реалізації, будь-який з вищеперелічених, і бажано ціаноборгідрид натрію, використовують у комбінації з добавкою титану (IV), дегідратуючого агента або з добавкою галогеніду цинку. У деяких варіантах реалізації, відновний агент є тетра(C1-4алкіл)амонію ціаноборгідридом, ціаноборгідридом або триацетоксиборгідридом лужного металу, або ціаноборгідридом або триацетоксиборгідридом лужноземельного металу. У деяких варіантах реалізації відновний агент є ціаноборгідридом лужного металу. У деяких варіантах реалізації відновний агент вибраний з ціаноборгідрида натрію і триацетоксиборгідрида натрію. У деяких варіантах реалізації відновний агент є триацетоксиборгідридом натрію. При використанні у цьому документі добавка титану (IV) є кислотою Льюїса, що містить метал титан (IV) (наприклад, тетрахлорид титану, ізопропоксид титану, етоксид титану і тому подібні). У деяких варіантах реалізації спосіб додатково включає зняття захисту із сполуки формули II або її вказаної солі, з утворенням сполуки формули I: 35 40 I або її солі. У деяких варіантах реалізації сполуку формули I спочатку отримують у вигляді вільної основи з форми вільної основи сполуки формули II. У деяких варіантах реалізації зняття захисту включає взаємодію сполуки формули II з відповідним агентом для зняття захисту. У деяких варіантах реалізації зняття захисту включає обробку етератом трифториду бору з подальшою обробкою водним гідроксидом амонію. У деяких варіантах реалізації зняття захисту виконують у відповідному розчиннику при температурі ≤ 30 °C, ≤ 20 °C, ≤ 10 °C або ≤ 5 °C. У деяких варіантах реалізації відповідним 6 UA 111854 C2 5 10 15 20 25 30 35 40 45 50 розчинником є ацетонітрил. У деяких варіантах реалізації процес зняття захисту із сполуки формули II для отримання сполуки формули I додатково включає взаємодію сполуки формули I з адипіновою кислотою з утворенням адипатної солі. У деяких варіантах реалізації цей спосіб додатково включає: (a) нагрівання сполуки формули I у метанолі при дефлегмації для отримання суміші; (b) після (a) - додавання метилу-ізобутил-кетону до суміші; (c) після (b) - видалення частини розчинника перегонкою при внутрішній температурі від 40 °C до 50 °C для отримання концентрованої суміші; (d) після (c) - додавання до концентрованої суміші метанолу для отримання розбавленої суміші; (e) після (d) - нагрівання розбавленої суміші при дефлегмації для утворення суміші; (f) після (e) - додавання метил-ізобутил-кетону до суміші; (g) після (f) - видалення частини розчинника перегонкою при внутрішній температурі від 40 °C до 50 °C для отримання концентрованої суміші; (h) після (g) - додавання до концентрованої суміші адипінової кислоти і метанолу; (i) після (h) - нагрівання суміші при дефлегмації; і (j) після (i) - видалення частини розчинника перегонкою при внутрішній температурі від 40 °C до 50 °C для отримання концентрованої суміші; (k) після (j) - додавання гептану до суміші; і (l) після (k) - перемішування суміші при кімнатній температурі з утворенням адипінокислої солі сполуки формули I. 1 Обробка сполуки формули II для видалення групи P може бути виконана за способами, відомими у даній галузі, для видалення певних захисних груп для амінів, такими, як описані в публікації Wuts and Greene, Protective Groups in Organic Synthesis, 4е вид., John Wiley & Sons: Нью-Джерсі, сторінки 696-887 (і, зокрема, сторінки 872-887) (2007), повний зміст якої включений 1 у цей документ за допомогою посилання. Наприклад, у деяких варіантах реалізації групу P видаляють фторид-іоном (наприклад, обробкою фторидом тетрабутиламонію), хлороводневою кислотою, піридиній п-толуолсульфоновою кислотою (PPTS) або кислотою Льюїса (наприклад, тетрафторборатом літію)). У деяких варіантах реалізації, ця обробка включає обробку 1 тетрафторборатом літію з подальшою обробкою гідроксидом амонію (наприклад, якщо P є 2(триметилсиліл)етоксиметил). У деяких варіантах реалізації ця обробка включає обробку 1 основою (наприклад, P є N-півалоїлоксиметил). У деяких варіантах реалізації, основою є гідроксид лужного металу. У деяких варіантах реалізації основою є гідроксид натрію. У деяких варіантах реалізації ця обробка включає обробку гідроксидом натрію або аміаком у розчиннику, такому, як метанол або вода. У деяких варіантах реалізації сполуку формули IV або її сіль отримують за способом, що включає зняття захисту із сполуки формули V: V або її солі. У деяких варіантах реалізації сполуку формули V використовують бажано у вигляді вільної основи, а сполуку формули IV отримують бажано у формі вільної основи. У деяких варіантах реалізації зняття захисту включає взаємодію з водною кислотою. У деяких варіантах реалізації кислота є хлороводневою кислотою. У деяких варіантах реалізації використовують надлишок водної кислоти порівняно зі сполукою формули V. У деяких варіантах реалізації використовують надлишок у 5, 6, 7, 8, 9 або 10 еквівалентів водної кислоти порівняно із сполукою формули V. У деяких варіантах реалізації використовують надлишок у 6, 7, 8, 9 або 10 еквівалентів водної кислоти порівняно із сполукою формули V. У деяких варіантах реалізації використовують надлишок у 7, 8, 9 або 10 еквівалентів водної кислоти порівняно із сполукою формули V. У деяких варіантах реалізації використовують надлишок у 8, 9 або 10 еквівалентів водної кислоти порівняно із сполукою формули V. У деяких варіантах реалізації використовують надлишок у 9 або 10 еквівалентів 7 UA 111854 C2 5 10 водної кислоти порівняно із сполукою формули V. У деяких варіантах реалізації використовують надлишок у 9 або більше еквівалентів водної кислоти порівняно із сполукою формули V. У деяких варіантах реалізації зняття захисту виконують у розчиннику ацетонітрилі при температурі ≤ 30 °C, ≤ 20 °C, ≤ 10 °C або ≤ 5 °C. Інші відповідні умови для зняття захисту включають, але не обмежуючись цим, ті, що описані в публікації Wuts and Greene, Protective Groups in Organic Synthesis, 4е вид., John Wiley & Sons: Нью-Джерсі, сторінки 696-887 (і, зокрема, сторінки 872-887) (2007), повний зміст якої включений у цей документ за допомогою посилання. У деяких варіантах реалізації сполуку формули V отримують за способом, що включає взаємодію сполуки формули VI: VI або її солі із сполукою формули VII: 15 20 25 30 35 40 45 50 VII або її сіллю, у присутності зв'язуючого агента. Відповідні зв'язуючі агенти є будь-якими загальновідомими зв'язуючими агентами для зв'язування аміну з кислотою для отримання аміну. Необмежуючі приклади включають карбодііміди (наприклад, N, N’-дициклогексилкарбодіімід (DCC), N, N’-діізопропілкарбодіімід (DIC), 1-етил-3-(3-диметиламінопропіл або диметиламінопропіл)-N'-етилкарбодііміда гідрохлорид (EDC гідрохлорид)) карбодіімід (EDC), або 1,1'-карбонілдіімідазол (CDI)), карбодіімідний реагент у присутності 1-гідроксибензотріазолу (HOBt) або його гідрату, фосфонієві зв'язуючі агенти (наприклад, бензотріазол-1-ілокси-трис(диметиламіно)-фосфонію гексафторфосфат (BOP), (бензотріазол-1-ілокси) трипіролідинофосфонію гексафторфосфат (PyBOP), (7-азабензотріазол-1-ілокси)-трис-піролідинофосфонію гексафторфосфат (PyAOP), бромтрипіролідинофосфонію гексафторфосфат (PyBrOP), біс(2-оксо-3оксазолідиніл)фосфіновий хлорид (BOP-Cl)), амінієві реагенти (наприклад, O-(бензотріазол-1іл)-N, N,N",N’-тетраметилуронію гексафторфосфат (HBTU), O-(бензотріазол-1-іл)-N, N,N",N’тетраметилуронію тетрафторборат (TBTU), 3-(діетилфосфорилокси)-1,2,3-бензотріазин-4(3H)он (DEPBT), O-(7-азабензотріазол-1-іл)-N, N,N",N’-тетраметилуронію гексафторфосфат (HATU), O-(6-хлорбензотріазол-1-іл)-N, N,N",N’-тетраметилуронію гексафторфосфат (HCTU) і O-(7азабензотріазол-1-іл)-N, N,N',N'-тетраметилуронію тетрафторборат (TATU)), уронієві реагенти (O-(5-норборнен-2,3-дикарбоксімідо)-N, N,N',N'-тетраметилуронію тетрафторборат (TNTU) і O(N-сукцинімідил)-1,1,3,3-тетраметилуронію тетрафторборат (TSTU), O-(3,4-дигідро-4-оксо-1,2,3бензотріазин-3-іл)-N, N,N",N’-тетраметилуронію тетрафторборат (TDBTU)), O-(1,2-дигідро-2оксо-1-піридил-N, N,N',N'-тетраметилуронію тетрафторборат (TPTU) або O[(етоксикарбоніл)ціано-метиленаміно]-N, N,N',N'-тетраметилуронію тетрафторборат (TOTU)), інші реагенти, включаючи, але не обмежуючись цим, 3-(діетилфосфорилокси)-1,2,3бензотріазин-4(3H)-он (DEPBT), карбонілдіімідазол (CDI), N, N,N',N'тетраметилхлорформамідинію гексафторфосфат (TCFH) або розчин пропілфосфонового ангідриду. У деяких варіантах реалізації зв'язуючий агент є бензотріазол-1-ілокситрис(диметиламіно)-фосфонію гексафторфосфатом (BOP). У деяких варіантах реалізації сполуки формул V, VI і VII знаходяться, бажано, в їх несольових формах. У деяких варіантах реалізації реакцію сполуки формули VI і VII виконують у присутності третинного аміну (наприклад, триетиламіну). У деяких варіантах реалізації реакцію виконують у диметилформаміді (ДМФ) при температурі ≤ 30 °C, ≤ 20 °C або ≤ 15 °C. У деяких варіантах реалізації зв'язуючий агент присутній у кількості ≥ 1,05, ≥ 1,1 або ≥ 1,2 еквіваленту, порівняно із сполукою формули VI. У цьому винаході представлено також сполуку формули V: 8 UA 111854 C2 5 10 15 20 25 30 35 40 45 50 V або її сіль, яка є застосовною як проміжна сполука у способах, описаних вище. У деяких варіантах реалізації сполука формули V є вільною основою. Способи, описані в цьому документі, можуть контролюватися відповідно до будь-якого придатного способу, відомого в даній галузі. Наприклад, утворення продукту можна контролювати спектроскопічними способами, такими як спектроскопія ядерного магнітного 1 13 резонансу (наприклад, H або C), інфрачервона спектроскопія або спектрофотометрія (наприклад, УФ-видима); або хроматографією, такою, як високоефективна рідинна хроматографія (ВЕРХ) або тонкошарова хроматографія (ТШХ), або іншими спорідненими прийомами. При використанні в цьому документі термін "взаємодія" використовується так, як це відомо у даній галузі і, зазвичай, відноситься до зближення хімічних реагентів таким чином, що забезпечується можливість їх взаємодії на молекулярному рівні для досягнення хімічного або фізичного перетворення. У деяких варіантах реалізації, реакція включає два реагенти, причому використовують один або більше еквівалентів другого реагенту порівняно з першим реагентом. Стадії реакції способів, описаних у цьому документі, можуть бути виконані протягом часу і в умовах, придатних для отримання вказаного продукту. Отримання сполук може включати захист і зняття захисту з різних хімічних груп. Необхідність захисту або зняття захисту, а також вибір відповідних захисних груп, може бути легко встановлена фахівцем у даній галузі. Хімія захисних груп представлена, наприклад, у публікації Greene, et al., Protective Groups in Organic Synthesis, 4е вид., Wiley & Sons, 2007, повний зміст якої включений у цей документ за допомогою посилання. Підбір захисних груп і способи утворення і розщеплювання, описані у цьому документі, можуть бути при необхідності скоректовані для різних замісників. Реакції способів, описаних у цьому документі, можуть бути виконані у прийнятних розчинниках, які фахівець в галузі органічного синтезу може легко підібрати. Прийнятними розчинниками можуть бути розчинники, що здебільшого не реагують з первинними матеріалами (реагентами), проміжними сполуками або продуктами при температурах виконання реакції, наприклад, при температурах, які можуть змінюватися від температури замерзання розчинника до температури кипіння розчинника. Дана реакція може бути виконана в одному розчиннику або в суміші більше ніж одного розчинника. Залежно від конкретної стадії реакції, можуть бути вибрані придатні розчинники для конкретної стадії реакції. У деяких варіантах реалізації, реакції можуть бути виконані без розчинника, як у випадку, якщо один з реагентів є рідиною або газом. Відповідні розчинники можуть включати галогеновані розчинники, такі, як тетрахлорид вуглецю, бромдихлорметан, дибромхлорметан, бромоформ, хлороформ, бромхлорметан, дибромметан, бутилхлорид, дихлорметан, тетрахлоретилен, трихлоретилен, 1,1,1-трихлоретан, 1,1,2-трихлоретан, 1,1-дихлоретан, 2-хлорпропан, α,α,α-трифтортолуол, 1,2-дихлоретан, 1,2диброметан, гексафторбензол, 1,2,4-трихлорбензол, 1,2-дихлорбензол, хлорбензол, фторбензол, їх суміші і тому подібні. Відповідні ефірні розчинники включають: диметоксиметан, тетрагідрофуран, 1,3-діоксан, 1,4діоксан, фуран, діетиловий ефір, етиленгліколю диметиловий ефір, етиленгліколю діетиловий ефір, діетиленгліколю диметиловий ефір, діетиленгліколю діетиловий ефір, триетиленгліколю диметиловий ефір, анізол, метил-трет-бутиловий ефір, їх суміші і тому подібне. Відповідні протонні розчинники можуть включати, як приклад і без обмеження, воду, метанол, етанол, 2-нітроетанол, 2-фторетанол, 2,2,2-трифторетанол, етиленгліколь, 1пропанол, 2-пропанол, 2-метоксіетанол, 1-бутанол, 2-бутанол, ізо-бутиловий спирт, третбутиловий спирт, 2-етоксіетанол, діетиленгліколь, 1-, 2- або 3-пентанол, нео-пентиловий спирт, трет-пентиловий спирт, діетиленгліколю монометиловий ефір, діетиленгліколю моноетиловий ефір, циклогексанол, бензиловий спирт, фенол або гліцерин. Відповідні апротонні розчинники можуть включати, як приклад і без обмеження, тетрагідрофуран (ТГФ), N, N-диметилформамід (ДМФ), N, N-диметилацетамід (ДМА), 1,3диметил-3,4,5,6-тетрагідро-2(1Н)-піримідинон (DMPU), 1,3-диметил-2-імідазолідинон (DMI), N 9 UA 111854 C2 5 10 15 20 25 30 35 40 45 50 55 60 метилпіролідинон (NMP), формамід, N-метилацетамід, N-метилформамід, ацетонітрил, диметилсульфоксид, пропіонітрил, етилформіат, метилацетат, гексахлорацетон, ацетон, метилетил-кетон, етилацетат, сульфолан, N, N-диметилпропіонамід, тетраметилсечовину, нітрометан, нітробензол або гексаметилфосфорамід. Відповідні вуглеводневі розчинники включають бензол, циклогексан, пентан, гексан, толуол, циклогептан, метилциклогексан, гептан, етилбензол, м-, о- або п-ксилол, октан, індан, нонан або нафталін. Реакції способів, описаних у цьому документі, можуть бути виконані при відповідних температурах, які можуть бути легко визначені досвідченими фахівцями. Температури реакцій залежать, наприклад, від температур плавлення і кипіння реагентів і розчинника, при його наявності; термодинаміки реакції (наприклад, для виконання бурхливих екзотермічних реакцій може знадобитись виконання при знижених температурах); і кінетики реакції (наприклад, при високому бар'єрі енергії активації можуть знадобитись підвищені температури). "Підвищена температура" відноситься до температур вищих ніж кімнатна температура (близько 22 °C). Реакції способів, описаних у цьому документі, можуть бути виконані на повітрі або під інертною атмосферою. Як правило, реакції, що містять реагенти або продукти, які суттєво взаємодіють з повітрям, можуть бути виконані з використанням чутливих до повітря синтетичних прийомів, добре відомих фахівцям у даній галузі. У деяких варіантах реалізації отримання сполук може включати додавання кислот або основ для впливу, наприклад, на каталіз заданої реакції або для утворення сольових форм, таких, як солі приєднання кислот. Ілюстративні кислоти можуть бути неорганічними або органічними кислотами. Неорганічні кислоти включають хлороводневу кислоту, бромоводневу кислоту, сірчану кислоту, фосфорну кислоту і азотну кислоту. Органічні кислоти включають мурашину кислоту, оцтову кислоту, пропіонову кислоту, бутанову кислоту, бензойну кислоту, 4-нітробензойну кислоту, метансульфонову кислоту, п-толуолсульфонову кислоту, бензолсульфонову кислоту, винну кислоту, трифтороцтову кислоту, пропіолову кислоту, масляну кислоту, 2-бутинову кислоту, вінілоцтову кислоту, пентанову кислоту, гексанову кислоту, гептанову кислоту, октанову кислоту, нонанову кислоту і деканову кислоту. Приклади основ включають гідроксид літію, гідроксид натрію, гідроксид калію, карбонат літію, карбонат натрію і карбонат калію. Деякі приклади сильних основ включають, але не обмежуючись цим, гідроксид, алкоксид, аміди металів, гідриди металів, діалкіламіди і ариламіди металів, при цьому: алкоксиди включають літієві, натрієві і калієві солі метил, етил і третбутилоксидів; аміди металів включають амід натрію, амід калію і амід літію; гідриди металів включають гідрид натрію, гідрид калію і гідрид літію; і діалкіламіди металів включають натрієві і калієві солі метил, етил, н-пропіл, ізо-пропіл, н-бутил, трет-бутил, триметилсиліл і циклогексилзаміщених амідів. Проміжні сполуки і продукти також можуть включати солі сполук, описаних у цьому документі. При використанні у цьому документі термін "сіль" відноситься до солі, утвореної додаванням прийнятної кислоти або основи до сполуки, описаної в цьому документі. У деяких варіантах реалізації, солі є фармацевтично прийнятними солями. При використанні в цьому документі, вираз "фармацевтично прийнятна" відноситься до речовини, яка прийнятна для застосування у фармацевтичних застосуваннях з точки зору токсикології і не взаємодіє несприятливим чином з активним інгредієнтом. Фармацевтично прийнятні солі включають моноі бі-солі, включаючи, але не обмежуючись цим, солі, отримані з органічних і неорганічних кислот, таких, як оцтова, молочна, лимонна, корична, винна, бурштинова, фумарова, малеїнова, малонова, мигдальна, яблучна, щавлева, пропіонова, хлороводнева, бромоводнева, фосфорна, азотна, сірчана, гліколева, піровіноградна, метансульфонова, етансульфонова, толуолсульфонова, саліцилова, бензойна і аналогічні відомі прийнятні солі. Списки придатних солей представлені в публікаціях Remington Pharmaceutical Sciences, 17-е видання, Mack Publishing Company, Істон, штат Пенсільванія, 1985, с. 1418, і в Journal of Pharmaceutical Science, 66, 2 (1977), повний зміст кожної з яких включений у цю заявку за допомогою посилання. При здійсненні отримання сполук за способами, описаними у цьому документі, для виділення заданих продуктів можуть бути використані звичайні стадії виділення і очищення, такі як концентрація, фільтрація, екстракція, твердофазова екстракція, перекристалізація, хроматографія і тому подібні. У деяких варіантах реалізації, сполуки за цим винаходом і їх солі є, в основному, виділеними. Під "в основному, виділеними" мається на увазі, що сполука, щонайменше, частково або в основному відокремлена від довкілля, в якому вона було отримана або 10 UA 111854 C2 5 10 15 20 25 30 35 40 45 50 55 60 виявлена. Часткове розділення може включати, наприклад, композицію, збагачену сполукою за цим винаходом. Істотне розділення може включати композиції, що містять, щонайменше близько 50 %, щонайменше близько 60 %, щонайменше близько 70 %, щонайменше близько 80 %, щонайменше близько 90 %, щонайменше близько 95 %, щонайменше близько 97 % або щонайменше близько 99 % по масі сполуки за цим винаходом або її солі. Способи виділення сполук і їх солей є стандартними у даній галузі. Застосування Сполука формули I {1-{1-[3-фтор-2-(трифторметил) ізонікотиноїл]піперидин-4-іл}-3-[4-(7Hпіроло[2,3-d]піримідин-4-іл)-1H-піразол-1-іл]азетидин-3-іл}ацетонітрил є інгібітором JAK (наприклад, JAK1, JAK2). Інгібітори JAK придатні також для лікування різних JAK-пов'язаних захворювань або розладів. Приклади JAK-пов'язаних захворювань включають захворювання, що зачіпають імунну систему, включаючи, наприклад, відторгнення трансплантата органу (наприклад, відторгнення алотрансплантата і захворювання "трансплантат проти хазяїна"). Додаткові приклади JAK-пов'язаних захворювань включають аутоімунні захворювання, такі як розсіяний склероз, ревматоїдний артрит, ювенільний артрит, псоріатичний артрит, діабет I типа, вовчак, псоріаз, запальна хвороба кишковика, неспецифічний виразковий коліт, хвороба Крона, міастенія гравіс, імуноглобулін-нефропатія, міокардит, аутоімунні порушення щитовидної залози, хронічна обструктивна хвороба легенів (ХОХЛ) і тому подібні. У деяких варіантах реалізації аутоімунним захворюванням є аутоімунний бульозний розлад шкіри, такий, як звичайна пухирчатка (PV) або бульозний пемфігоїд (ВР). Додаткові приклади JAK-пов'язаних захворювань включають алергічні стани, такі як астма, харчові алергії, екзематозний дерматит, контактний дерматит, атопічний дерматит (атопічна екзема) і риніти. Додаткові приклади JAK-пов'язаних захворювань включають вірусні захворювання, такі, як вірус Епштейна-Барра (EBV), вірус гепатиту В, гепатиту С, ВІЛ, лімфотропний вірус людини типа 1 (HTLV 1), вірус вітряної віспи (VZV) і вірус папіломи людини (HPV). Додаткові приклади JAK-пов'язаних захворювань включають захворювання, пов'язані з оновленням хрящів, наприклад, подагричний артрит, септичний або інфекційний артрит, реактивний артрит, рефлекторну симпатичну дистрофію, альгодистрофію, синдром Тітце, реброву атропатію, деформуючий ендемічний остеоартрит, хворобу Мселіні, хворобу Хандигоду, дегенерацію в результаті фіброміалгії, системний червоний вовчак, склеродермію або анкілозуючий спондилоартрит. Додаткові приклади JAK-пов'язаних захворювань включають пороки оновлення хрящів, включаючи спадковий хрондроліз, хрондродисплазію і псевдохрондодисплазію (наприклад, мікротію, енотію і метафізарну хрондродисплазію). Додаткові приклади JAK-пов'язаних захворювань або станів включають шкірні розлади, такі як псоріаз (наприклад, звичайний псоріаз), атопічний дерматит, шкірні висипання, роздратування шкіри, сенсибілізація шкіри (наприклад, контактний дерматит або алергічний контактний дерматит). Наприклад, деякі речовини, включаючи деякі фармацевтичні засоби, при локальному нанесенні можуть викликати сенсибілізацію шкіри. У деяких варіантах реалізації спільне введення або послідовне введення, щонайменше, одного інгібітора JAK за цим винаходом разом з агентом, що викликає небажану сенсибілізацію, може бути корисним для лікування такої небажаної сенсибілізації або дерматиту. У деяких варіантах реалізації шкірний розлад лікують місцевим нанесенням, щонайменше, одного інгібітора JAK за цим винаходом. Додаткові приклади JAK-пов'язаних захворювань або станів включають ті, які характеризуються солідними пухлинами (наприклад, рак простати, рак нирок, рак печінки, рак підшлункової залози, рак шлунку, рак молочної залози, рак легенів, рак голови і шиї, рак щитовидної залози, гліобластома, саркома Капоши, хвороба Каслмана, маткова лейоміосаркома, меланома і так далі), гематологічні види раку (наприклад, лімфома, лейкоз, такий як гострий лімфобластний лейкоз (ALL), гострий мієлогенний лейкоз (AML) або множинна мієлома) і рак шкіри, такий як лімфома Т-клітин шкіри (CTCL) і лімфома В-клітин шкіри. Приклади CTCL включають синдром Сезарі і грибоподібний мікоз. Інші приклади JAK-пов'язаних захворювань або станів включають легеневу артеріальну гіпертензію. Інші приклади JAK-пов'язаних захворювань або станів включають ракові захворювання, пов'язані із запаленням. У деяких варіантах реалізації рак пов'язаний із запальною хворобою кишковика. У деяких варіантах реалізації запальна хвороба кишковика є неспецифічним виразковим колітом. У деяких варіантах реалізації запальна хвороба кишковика є хворобою Крона. У деяких варіантах реалізації запальна хвороба кишковика є раком, пов'язаним з колітом. У деяких варіантах реалізації раком, пов'язаним з колітом, є рак ободової кишки або колоректальний рак. У деяких варіантах реалізації рак є шлунковим раком, шлунково-кишковою 11 UA 111854 C2 5 10 15 20 25 30 35 40 45 50 55 60 карциноїдною пухлиною, шлунково-кишковою стромальною пухлиною (GIST), аденокарциномою, раком тонкої кишки або ректальним раком. JAK-пов'язані захворювання можуть додатково включати захворювання, які характеризуються експресією: мутантів JAK2, таких, як мутанти, що мають щонайменше одну мутацію в домені псевдо-кінази (наприклад, JAK2V617F); мутанти JAK2, що мають щонайменше одну мутацію за межами домена псевдо-кінази; мутанти JAK1; мутанти JAK3; мутанти рецептора еритропоетину (EPOR); або розрегульованої експресією CRLF2. JAK-пов'язані захворювання можуть додатково включати мієлопроліферативні розлади (MPD), такі як дійсна поліцитемія (PV), есенціальна тромбоцитемія (ET), мієлоїдна метаплазія з мієлофіброзом (MMM), первинний мієлофіброз (PMF), хронічний мієлолейкоз (CML), хронічний мієломоноцитарний лейкоз (CMML), гіпереозинофільний синдром (HES), системний мастоцитоз (SMCD) і тому подібні. У деяких варіантах реалізації, мієлопроліферативним розладом є мієлофіброз (наприклад, первинний мієлофіброз (PMF) або есенціальний мієлофіброз тромбоцитемії після дійсної поліцитемії (Post-PV/Post-ET MF)). У деяких варіантах реалізації, мієлопроліферативним розладом є пост-есенціальний мієлофіброз тромбоцитемії (POST-ET MF). У деяких варіантах реалізації, мієлопроліферативним розладом є пост-мієлофіброз після дійсної поліцитемії (POST-PV MF). Інші приклади JAK-пов'язаних захворювань або станів включають покращення дерматологічних побічних ефектів інших фармацевтичних засобів шляхом введення сполуки за цим винаходом. Наприклад, багато фармацевтичних агентів призводять до небажаних алергічних реакцій, які можуть виявлятися у вигляді вугреподібного висипу або супутнього дерматиту. Приклади фармацевтичних засобів, які мають такі небажані побічні ефекти, включають протиракові ліки, такі, як гефітиніб, цетуксимаб, ерлотиніб і тому подібні. Сполуки за цим винаходом можуть бути введені системно або місцево (наприклад, локально в області дерматиту) у комбінації (наприклад, одночасно або послідовно) з фармацевтичним агентом, що має небажаний дерматологічний побічний ефект. У деяких варіантах реалізації, сполука за цим винаходом може бути введена місцево разом з одним або більше іншими фармацевтичними засобами, причому вказані інші фармацевтичні засоби при місцевому застосуванні без сполуки за цим винаходом викликають контактний дерматит, алергічну контактну сенсибілізацію або схожі шкірні розлади. Відповідно, композиції за цим винаходом включають місцеві композиції, що містять сполуки за цим винаходом і додатково фармацевтичний агент, який може викликати дерматит, шкірні розлади або споріднені побічні ефекти. Додаткові JAK-пов'язані захворювання включають запалення і запальні захворювання. Приклади запальних захворювань включають саркоїдоз, запальні захворювання очей (наприклад, ірит, увеїт, склерит, кон'юнктивіт або споріднені захворювання), запальні захворювання дихальних шляхів (наприклад, верхніх дихальних шляхів, включаючи ніс і пазухи, такі, як риніт або синусит, або нижніх дихальних шляхів, включаючи бронхіт, хронічну обструктивну хворобу легенів і тому подібні), запальну міопатію, таку як міокардит, і інші запальні захворювання. У деяких варіантах реалізації запальним захворюванням очей є блефарит. Додаткові JAK-пов'язані захворювання включають ішемічні реперфузійні пошкодження, або захворювання або стан, пов'язаний з ішемічною подією, такою, як інсульт або зупинка серця, хворобливий стан під дією ендотоксину (наприклад, ускладнення після операції шунтування або хронічні ендотоксичні стани, сприяючі хронічній сердечній недостатності), анорексію, кахексію, стомлюваність, таку як стомлюваність, пов'язану з раком, рестеноз, склеродерміт, фіброз, стани, пов'язані з гіпоксією, або астрогліоз, такий, як, наприклад, діабетична ретинопатія, рак або нейродегенерацію і інші запальні захворювання, такі, як синдром системної запальної реакції (SIRS) і септичний шок. Інші JAK-пов'язані захворювання включають подагру і збільшення розміру простати, наприклад, через доброякісну гіпертрофію простати або доброякісну гіперплазію простати, а також захворювання резорбції кісток, такі, як остеопороз або остеоартрит, хвороби резорбції кісток, пов'язані з: гормональним дисбалансом та∕або гормональною терапією, аутоіммунними захворюваннями (наприклад, кістковий саркоїдоз) або раком (наприклад, мієлома). Додаткові JAK-пов'язані захворювання включають розлад сухості очей. При використанні в цьому документі, "розлад сухості очей" охоплює хворобливі стани, узагальнені у нещодавно опублікованому офіційному звіті Dry Eye Workshop (DEWS), в якому сухість очей визначена як "багатофакторне захворювання виділення сліз і поверхні очей, яке призводить до симптомів дискомфорту, порушення зору і нестабільності слізної плівки з потенційним пошкодженням поверхні очей. Воно супроводжується збільшеною осмолярністю слізної плівки і запаленням поверхні очей". Lemp, "The Definition and Classification of Dry Eye Disease: Report of the Definition 12 UA 111854 C2 5 10 15 20 25 30 35 and Classification Subcommittee of the International Dry Eye Workshop", The Ocular Surface, 5(2), 75-92, квітень 2007 р., повний зміст якого включений у цей документ за допомогою посилання. У деяких варіантах реалізації розлад сухості очей вибраний з сухості очей, пов'язаної з дефіцитом водянистих сліз (ADDE), або розладу сухості очей у результаті випаровування, або їх комбінації. У деяких варіантах реалізації розладом сухості очей є синдром сухості очей Шегрена (SSDE). У деяких варіантах реалізації сухістю очей є синдром сухості очей не-Шегрена (NSSDE). Додаткові JAK-пов'язані захворювання включають кон'юнктивіт, увеїт (включаючи хронічний увеїт), хоріоїдит, ретиніт, цикліт, склерит, епісклерит або ірит. Інші JAK-пов'язані захворювання включають дихальну дисфункцію або недостатність, пов'язану з вірусною інфекцією, таку, як грип і важкий гострий респіраторний синдром (SARS). Приклади Цей винахід буде детальніше описано на конкретних прикладах. Наступні приклади служать для цілей наочності, і жодним чином не обмежують цей винахід. Фахівцям у даній галузі зрозумілі різні некритичні параметри, які можуть бути змінені або модифіковані для отримання практично таких самих результатів. Приклад 1. Синтез 4-(1H-піразол-4-іл)-7-((2-(триметилсиліл)етокси)метил)-7H-піроло[2,3d]піримідину (5) Стадія 1. 4-хлор-7-((2-(триметилсиліл)етокси)метил)-7H-піроло[2,3-d]піримідин (3) У колбу, забезпечену подачею азоту, краплинною воронкою, отвором для термометра і механічною мішалкою додавали 4-хлор-7H-піроло[2,3-d]піримідин (1, 600 г, 3,91 міль) і N, Nдиметилацетамід (ДМАС, 9,6 л) при кімнатній температурі. Суміш охолоджували до 0-5 °C на бані з льоду і насиченого сольового розчину, потім частинами додавали твердий гідрид натрію (NaH, 60 мас. %, 174 г, 4,35 моль, 1,1 екв.) при 0-5 °C. Реакційна суміш перетворювалася на темний розчин через 15 хвилин. Потім повільно додавали триметилсилілоксиметил хлорид (2, SEM-Cl, 763 мл, 4,31 моль, 1,1 екв.) через краплинну воронку з такою швидкістю, щоб внутрішня температура реакційної суміші не перевищувала 5 °C. Потім реакційну суміш перемішували при 0-5 °C протягом 30 хвилин. Коли, за даними ТШХ і ВЕРХ, реакція була завершена, реакційну суміш гасили водою (1 л). Потім суміш розбавляли водою (12 л) і метил-трет-бутиловим ефіром (МТБЕ) (8 л). Два шари розділяли, а водний шар екстрагували МТБЕ (8 л). Об'єднані органічні шари промивали водою (2 × 4 л) і насиченим сольовим розчином (4 л), а розчинник замінювали на 1-бутанол. Розчин неочищеного продукту (3) в 1-бутанолі використовували на наступній реакції зв'язування Сузукі без додаткового очищення. Альтернативно, органічний розчин неочищеного продукту (3) у МТБЕ висушували над сульфатом натрію (Na2SO4). Розчинники видаляли під зниженим тиском. Потім залишок розчиняли в гептані (2 л), відфільтровували і завантажували на силікагелеву (SiO2, 3,5 кг) колонку, елююючи гептаном (6 л), 95 % гептаном в етилацетаті (12 л), 90 % гептаном в етилацетаті (10 л) і, нарешті, 80 % гептаном в етилацетаті (10 л). Фракції, що містять чистий заданий продукт, об'єднували і концентрували під зниженим 13 UA 111854 C2 5 10 15 20 25 30 35 40 45 тиском для отримання 4-хлор-7-((2-(триметилсиліл)етокси)метил)-7H-піроло[2,3-d]піримідину (3, 987 г, 1109,8 г теоретично, вихід 88,9 %) у вигляді блідо-жовтої маслянистої речовини, яка частково затверділа до маслянистої твердої речовини при стоянні при кімнатній температурі. 1 Для 3: H ЯМР (ДМСО-d6, 300 Мгц) δ 8.67 (s, 1H), 7.87 (d, 1H, J=3.8 Гц), 6.71 (d, 1H, J=3.6 Гц), 13 5.63 (s, 2H), 3.50 (t, 2H, J=7.9 Гц), 0.80 (t, 2H, J=8.1 Гц), 1.24 (s, 9H) ppm; C ЯМР (ДМСО-d6, 100 Мгц) δ 151.3, 150.8, 150.7, 131.5, 116.9, 99.3, 72.9, 65.8, 17.1, -1.48 ppm; C12H18ClN3OSi (мол.маса + 283,83), РХМС (EI) m/e 284/286 (M + H). Стадія 2. 4-(1Н-піразол-4-іл)-7-((2-(триметилсиліл)етокси)метил)-7Н-піроло[2,3-d]піримідин (5) У реактор, оснащений верхньою мішалкою, холодильником, отвором для термометра і подачею азоту, завантажували воду (H2O, 9,0 л), твердий карбонат калію (K2CO3, 4461 г, 32,28 моль, 2,42 екв.), 4-хлор-7-((2-(триметилсиліл) етокси)метил-7H-піроло[2,3-d]піримідин (3, 3597 г, 12,67 моль), 1-(1-етоксиетил)-4-(4,4,5,5-тетраметил-1,3,2-діоксаборолан-2-іл)-1H-піразол (4, 3550 г, 13,34 моль, 1,05 екв.) і 1-бутанол (27 л) при кімнатній температурі. Отриману реакційну суміш дегазовували три рази, кожного разу заповнюючи азотом, потім обробляли тетракис(трифенілфосфін)палладієм (0) (Pd(PPh3)4, 46 г, 0,040 моль, 0,003 екв.) при кімнатній температурі. Отриману реакційну суміш нагрівали до помірної дефлегмації (близько 90 °C) протягом 1-4 годин. Коли, за даними ВЕРХ, реакція була завершена, реакційну суміш поступово охолоджували до кімнатної температури, потім відфільтровували через шар целіта. Шар целіта промивали етилацетатом (2 × 2 л), потім фільтрати і промивальний розчин об'єднували. Два шари розділяли, а водний шар екстрагували етилацетатом (12 л). Об'єднані органічні шари концентрували під зниженим тиском для видалення розчинників, а неочищений 4-(1-(1етоксиетил)-1H-піразол-4-іл)-7-((2-(триметилсиліл)етокси)метил)-7H-піроло[2,3-d]піримідин (6) безпосередньо завантажували назад у реактор з тетрагідрофураном (ТГФ, 4,2 л) для подальшої реакції зняття захисту, що промотується кислотою, без додаткового очищення. До суспензії неочищеного 4-(1-(1-етоксиетил)-1H-піразол-4-іл)-7-((2(триметилсиліл)етокси)метил)-7H-піроло[2,3-d]піримідину (6), отриманого так, як описано вище, у тетрагідрофурані (ТГФ, 4,2 л) у реакторі додавали воду (H2O, 20,8 л) і 10 % водний розчин HCl (16,2 л, 45,89 моль, 3,44 екв.) при кімнатній температурі. Отриману реакційну суміш перемішували при 16 – 30 °C протягом 2-5 годин. Коли, за даними аналізу ВЕРХ, реакція була завершена, реакційну суміш обробляли 30 % водним розчином гідроксиду натрію (NaOH) (4 л, 50,42 моль, 3,78 екв.) при кімнатній температурі. Отриману реакційну суміш перемішували при кімнатній температурі протягом 1-2 годин. Тверді речовини зібрали фільтрацією і промивали водою (2 × 5 л). Вологий осад на фільтрі завантажували назад у реактор з ацетонітрилом (21,6 л), і отриману суспензію нагрівали до помірної дефлегмації протягом 1-2 годин. Потім прозорий розчин поступово охолоджували до кімнатної температури при перемішуванні, і при охолоджуванні тверді речовини випадали в осад з розчину. Суміш перемішували при кімнатній температурі ще 1-2 години. Тверді речовини зібрали фільтрацією, промивали ацетонітрилом (2 × 3,5 л) і висушували в печі під зниженим тиском при 45 – 55 °C до постійної маси, для отримання 4-(1H-піразол-4-іл)-7-((2-(триметилсиліл)етокси)метил)-7H-піроло[2,3-d]піримідину (5, 3281,7 г, 3996,8 г теоретично, вихід 82,1 %) у вигляді білої кристалічної речовини (площа по 1 ВЕРХ 99,5 %). Для 5: H ЯМР (ДМСО-d6, 400 Мгц) δ 13.41 (br. s, 1H), 8.74 (s, 1H), 8.67 (br. s, 1H), 8.35 (br. s, 1H), 7.72 (d, 1H, J=3.7 Гц), 7.10 (d, 1H, J=3.7 Гц), 5.61 (s, 2H), 3.51 (t, 2H, J=8.2 Гц), + 0.81 (t, 2H, J=8.2 Гц), 0.13 (s, 9H) ppm; C15H21N5OSi (мол.маса 315,45), РХМС (EI) m/e 316 (M + H). Приклад 2. Трет-бутил 3-(ціанометилен)азетидин-1-карбоксилат (13) 14 UA 111854 C2 5 10 15 20 25 30 35 Стадія 1. 1-Бензгідрилазетидин-3-ола гідрохлорид (9) Розчин дифенілметанаміна (7, 2737 г, 15,0 моль, 1,04 екв.) у метанолі (MeOH, 6 л) обробляли 2-(хлорметил)оксираном (8, 1330 г, 14,5 моль) через краплинну воронку при кімнатній температурі. При первинному додаванні відмітили невелику ендотерму. Отриману реакційну суміш перемішували при кімнатній температурі протягом 3 днів, потім нагрівали з дефлегматором ще 3 дні. Коли аналіз ТШХ показав, що реакція завершена, реакційну суміш спочатку охолоджували до кімнатної температури, а потім до 0 – 5 °C на крижаній бані. Тверді речовини зібрали фільтрацією і промивали ацетоном (4 л) для отримання першої партії неочищеного заданого продукту (9, 1516 г). Фільтрат концентрували під зниженим тиском, а отриману напівтверду речовину розбавляли ацетоном (1 л). Цю тверду речовину потім зібрали фільтрацією для отримання другої партії неочищеного заданого продукту (9, 221 г). Неочищений продукт, 1-бензгідрилазетидин-3-ола гідрохлорид (9, 1737 г, 3998,7 г теоретично, вихід 43,4 %) знайшли досить чистим для використання на наступній стадії без додаткового 1 очищення. Для 9: H ЯМР (ДМСО-d6, 300 Мгц), δ 12.28 (br. d, 1H), 7.7 (m, 5H), 7.49 (m, 5H), 6.38 (d, 1H), 4.72 (br. s, 1H), 4.46 (m, 1H), 4.12 (m, 2H), 3.85 (m, 2H) ppm; C16H18ClNO (вільна основа 9, + C16H17NO мол.маса 239,31), РХМС (EI) m/e 240 (M + H). Стадія 2. Трет-бутил 3-гідроксіазетидин-1-карбоксилат (10) Суспензію 1-бензгідрилазетидин-3-ола гідрохлориду (9, 625 г, 2,27 моль) у 10 % розчині водного карбонату натрію (Na2CO3, 5 л) і дихлорметані (CH2Cl2, 5 л) перемішували при кімнатній температурі до повного розчинення твердих речовин. Два шару розділили, а водний шар екстрагували дихлорметаном (CH2Cl2, 2 л). Об'єднані органічні екстракти висушували над сульфатом натрію (Na2SO4) і концентрували під зниженим тиском. Цю отриману неочищену вільну основу сполуки 9 потім розчиняли в ТГФ (6 л) і поміщали розчин у велику бомбу Парра. У бомбу Парра додавали ди-трет-бутилдикарбонат (BOC2O, 545 г, 2,5 моль, 1,1 екв.) і 20 % паладій (Pd) на вуглеці (125 г, вологість 50 %). Ємність заповнювали до 30 psi газоподібним воднем (H2) і перемішували під постійним тиском водню (ємність три рази поповнювали для підтримання тиску на рівні 30 psi) при кімнатній температурі протягом 18 годин. Коли дані ВЕРХ показували, що реакція завершена (коли припинялося поглинання водню), реакційну суміш відфільтровували через шар целіта, а шар целіта промивали ТГФ (4 л). Фільтрати концентрували під зниженим тиском для видалення розчинника, а залишок завантажували на колонку Biotage 150 з мінімальною кількістю дихлорметану (CH2Cl2). Колонку елюювали 20 – 50 % етилацетату в гептані, а фракції, що містять чистий заданий продукт (10), збирали і об'єднували. Розчинники видаляли під зниженим тиском для отримання трет-бутил 3гідроксіазетидин-1-карбоксилата (10, 357 г, 393,2 г теоретично, вихід 90,8 %) у вигляді 15 UA 111854 C2 5 10 15 20 25 30 35 40 45 безбарвної маслянистої речовини, яка затвердівала при стоянні при кімнатній температурі у 1 вакуумі. Для 10: H ЯМР (CDCl3, 300 Мгц), δ 4.56 (m 1H), 4.13 (m, 2H), 3.81 (m, 2H), 1.43 (s, 9H) ppm. Стадія 3. Трет-бутил 3-оксоазетидин-1-карбоксилат (11) Розчин трет-бутил 3-гідроксіазетидин-1-карбоксилату (10, 50 г, 289 ммоль) в етилацетаті (400 мл) охолоджували до 0 °C. Отриманий розчин потім обробляли твердим TEMPO (0,5 г, 3,2 ммоль, 0,011 екв.) і розчином броміду калію (KBr, 3,9 г, 33,2 ммоль, 0,115 екв.) у воді (60 мл) при 0 – 5 °C. Підтримуючи температуру реакції між 0-5 °C, додавали насичений водний розчин бікарбонату натрію (NaHCO3, 450 мл) і водний розчин гіпохлориту натрію (NaClO, доступний хлор 10-13 %, 450 мл). Після додавання розчину гіпохлориту натрію, колір реакційної суміші одразу змінювався. Після додавання додаткової кількості розчину гіпохлориту натрію, колір реакційної суміші поступово тьмянів. Коли дані ТШХ показували, що весь первинний матеріал витрачений, колір реакційної суміші більше не змінювався. Потім реакційну суміш розбавляли етилацетатом (EtOAc, 500 мл) і розділяли два шари. Органічний шар промивали водою (500 мл) і насиченим водним розчином хлориду натрію (500 мл) і висушували над сульфатом натрію (Na2SO4). Потім розчинник видаляли під зниженим тиском для отримання неочищеного продукту, трет-бутил 3-оксоазетидин-1-карбоксилату (11, 48 г, 49,47 г теоретично, вихід 97 %), який знайшли досить чистим і використовували безпосередньо на наступній реакції без 1 додаткового очищення. Для неочищеного 11: H ЯМР (CDCl3, 300 Мгц), δ 4.65 (s, 4H), 1.42 (s, 9H) ppm. Стадія 4. Трет-бутил 3-(ціанометилен)азетидин-1-карбоксилат (13) Діетілціанометил фосфат (12, 745 г, 4,20 моль, 1,20 екв.) і безводий тетрагідрофуран (ТГФ, 9 л) додавали у чотиригорлу колбу, забезпечену отвором для термометра, краплинною воронкою і трубкою для подачі захисного азоту, при кімнатній температурі. Розчин охолоджували на бані з льоду і метанолу до - 14 °C і додавали 1,0 М розчин калію третбутоксиду (t-BuOK) у безводому тетрагідрофурані (ТГФ, 3,85 л, 3,85 моль, 1,1 екв.) за 20 хвилин, підтримуючи температуру реакційної суміші нижче - 5 °C. Отриману реакційну суміш перемішували протягом 3 годин при - 10 °C і за 2 години додавали розчин 1-третбутоксикарбоніл-3-азетидинону (11, 600 г, 3,50 моль) у безводому тетрагідрофурані (ТГФ, 2 л), підтримуючи внутрішню температуру нижче - 5 °C. Реакційну суміш перемішували при температурі від - 5 до - 10 °C протягом 1 години, а потім повільно нагрівали до кімнатної температури і перемішували при кімнатній температурі протягом ночі. Потім реакційну суміш розбавляли водою (4,5 л) і насиченим водним розчином хлориду натрію (NaCl, 4,5 л), і екстрагували етилацетатом (EtOAc, 2 × 9 л). Об'єднані органічні шари промивали насиченим сольовим розчином (6 л) і висушували над безводим сульфатом натрію (Na2SO4). Органічний розчинник видаляли під зниженим тиском, а залишок розбавляли дихлорметаном (CH2Cl2, 4 л), потім абсорбували на силікагель (SiO2, 1,5 кг). Неочищений продукт, який абсорбували на силікагель, очищали колонковою флеш-хроматографією (SiO2, 3,5 кг, градієнтне елюювання 025 % EtOAc у гексанах) для отримання трет-бутил 3-(ціанометилен)азетидин-1-карбоксилата 1 (13, 414,7 г, 679,8 г теоретично, вихід 61 %) у вигляді білої твердої речовини. Для 13: H ЯМР (CDCl3, 300 Мгц), δ 5.40 (m, 1H), 4.70 (m, 2H), 4.61 (m, 2H), 1.46 (s, 9H) ppm; C10H14N2O2 (мол. + маса 194,23), РХМС (EI) m/e 217 (M + Na). Приклад 3. (3-Фтор-2-(трифторметил)піридин-4-іл)(1,4-діокса-8-азаспіро[4,5]декан-8іл)метанон (17) Стадія 1. 1,4-діокса-8-азаспіро[4.5]декан (15) У 30 л реактор, оснащений механічною мішалкою, краплинною воронкою і пробкою, завантажували гідроксид натрію (NaOH, 1,4 кг, 35 моль) і воду (7 л, 3,13 мг, 17,43 моль). До 16 UA 111854 C2 5 10 15 20 25 30 35 40 45 50 отриманого таким чином розчину додавали солянокислий 1,4-діокса-8-азаспіро[4.5]декан (14, 3,13 кг, 17,43 моль). Суміш перемішували при 25 °C протягом 30 хвилин. Потім розчин насичували хлоридом натрію (1,3 кг) і екстрагували 2-метил-тетрагідрофураном (3 × 7 л)). Об'єднаний органічний шар висушували безводим сульфатом натрію (1,3 кг), відфільтровували і концентрували під зниженим тиском (70 мм рт.ст.) при 50 °C. Отриману таким чином жовту маслянисту речовину дистилювали під зниженим тиском (80 мм рт.ст., т.кип.: 115 °C-120 °C) для отримання сполуки 15 (2,34 кг, 16,36 моль, 93,8 %) у вигляді прозорої маслянистої речовини, яку використовували безпосередньо в наступній реакції зв'язування. Стадія 2. (3-фтор-2-(трифторметил)піридин-4-іл)(1,4-діокса-8-азаспіро[4,5]декан-8-іл) метанон (17) У висушений 100 л реактор, оснащений механічною мішалкою, краплинною воронкою, термометром і вакуумним вихідним отвором, поміщали 3-фтор-2-(трифторметил)ізонікотинову кислоту (16, 3,0 кг, 14,35 моль), бензотріазол-1-ілокситрис(диметиламіно)фосфонію гексафторфосфат (реагент BOP, 7,6 кг, 17,2 моль, 1,20 екв.) у диметилформаміді (ДМФ, 18 л). До отриманого розчину додавали 1,4-діокса-8-азаспіро[4.5]декан (15, 2,34 кг, 16,36 моль, 1,14 екв.) при перемішуванні, за 20 хвилин. Потім за 1 годину додавали триетиламін (Et3N, 4 л, 28,67 моль, 2,00 екв.). Під час додавань підтримували температуру між 5 °C і 10 °C. Отриманий таким чином темно-коричневий розчин перемішували протягом 12 годин при 20 °C, а потім охолоджували до 10 °C. При енергійному перемішуванні, послідовно додавали 18 л насиченого розчину бікарбонату натрію і 36 л води, і підтримували температуру нижче 15 °C. Осад (осад на фільтрі), отриманий таким чином, зібрали фільтрацією. Потім водну фазу насичували за допомогою 12 кг твердого хлориду натрію і екстрагували EtOAc (2 × 18 л). Об'єднаний органічний шар промивали насиченим розчином бікарбонату натрію (18 л) і водою (2 × 18 л), послідовно. Осад на фільтрі від попередньої фільтрації знову розчиняли в органічній фазі. Темно-коричневий розчин, отриманий таким чином, двічі промивали по 18 л води, а потім концентрували під зниженим тиском (40 – 50 °C, 30 мм рт.ст.) для отримання 5,0 кг неочищеного продукту у вигляді в'язкої коричневої маслянистої речовини. Неочищений продукт 17, отриманий вище, розчиняли в EtOH (8,15 л) при 50 °C. За 30 хвилин додавали воду (16,3 л). У коричневий розчин внесли затравку, охолоджували до 20 °C за 3 години при перемішуванні, і перемішували при 20 °C протягом 12 годин. Осад, що утворився, відфільтровували, промивали сумішшю EtOH і води (EtOH: H2O=1: 20, 2 л) і висушували під зниженим тиском (50 мм рт.ст.) при 60 °C протягом 24 годин для отримання (3-фтор-2-(трифторметил) піридин-4-іл)(1,4-діокса8-азаспіро[4,5]декан-8-іл)метанона (17, 3,98 кг, 11,92 моль, 83,1 %) у вигляді білого порошку. 1 3 Для 17: H ЯМР (300 МГц, (CD3)2SO) 8.64 (d, JHH=4.68 Гц, 1 H, NCH у піридині), 7.92 (dd, 3 4 JHH=4.68 Гц, JHF=4.68 Гц, 1 H, NCCH у піридині), 3.87-3.91 (m, 4 H, OCH2CH2O), 3.70 (br s, 2 H, один від одного NCH2 у піперидиновому кільці, один від одного NCH2 у піперидиновому кільці, 3 обидва в аксіальному положенні), 3.26 (t, JHH=5.86 Гц, 2 H, один від одного NCH2 у піперидиновому кільці, один від одного NCH2 у піперидиновому кільці, обидва в 3 екваторіальному положенні), 1.67 (d, JHH=5.86 Гц, 2 H, один від одного NCCH2 у піперидиновому кільці, один від другого NCCH2 в піперидиновом кільці, обидва в екваторіальному положенні), 1.58 (br s, 2 H, один від одного NCCH2 у піперидиновому кільці, 13 один від одного NCCH2 у піперидиновому кільці, обидва в аксіальному положенні) ppm; C ЯМР 1 4 (75 МГц, (CD3)2SO) 161.03 (N-C=O), 151.16 (d, JCF=266.03 Гц, C-F), 146.85 (d, JCF=4.32 Гц, 2 2 NCH у піридині), 135.24 (d, JCF=11.51 Гц, C-C=O), 135.02 (квартет, JCF=34.57 Гц, NCCF3), 128.24 4 1 3 (d, JCF=7.48 Гц, NCCH у піридині), 119.43 (d×квартет, JCF=274.38 Гц, JCF=4.89 Гц, CF3), 106.74 (OCO), 64.60 (OCCO), 45.34 (NC у піперидиновому кільці), 39.62 (NC у піперидиновому кільці), 19 34.79 (NCC у піперидиновом кільці), 34.10 (NCC у піперидиновому кільці) ppm; F ЯМР (282 4 4 4 МГц, (CD3)2SO) -64.69 (d, JFF=15.85 Гц, F3C), -129.26 (d× квартет, JFF=15.85 Гц, JFH=3.96 Гц, + FC) ppm; C14H14F4N2O3 (мол.вес 334,27), РХМС (EI) m/e 335,1 (M + H). Приклад 4. (3-фтор-2-(трифторметил)піридин-4-іл)(1,4-діокса-8-азаспіро[4,5]декан-8іл)метанон (18) 17 UA 111854 C2 5 10 15 20 25 30 35 У 5 л 4-горлу круглодонну колбу, забезпечену механічною мішалкою, термопарою, краплинною воронкою і подачею азоту, поміщали (3-фтор-2-(трифторметил)піридин-4-іл)(1,4діокса-8-азаспіро[4,5]декан-8-іл)метанон (17, 100 г, 0,299 моль) в ацетонітрилі (ACN, 400 мл) при кімнатній температурі. Отриманий розчин охолоджували до температури нижче 10 °C. До цієї реакційної суміші додавали 6,0 н. водний розчин хлороводневої кислоти (HCl, 450 мл, 2,70 моль, 9,0 екв.), підтримуючи внутрішню температуру нижче 10 °C. Отриману реакційну суміш потім нагрівали до кімнатної температури, і в реакційну суміш при кімнатній температурі за 8 годин повільно вводили додаткову кількість 6,0 н. водного розчину хлороводневої кислоти (HCl, 1050 мл, 6,30 моль, 21,0 екв.) через краплинну воронку. Потім реакційну суміш охолоджували до 0 °C, потім обробляли 30 % водним розчином гідроксиду натрію (NaOH, 860 мл, 8,57 ммоль, 28,6 екв.), підтримуючи внутрішню температуру нижче 10 °C. Отриману реакційну суміш потім нагрівали до кімнатної температури, потім додавали твердий бікарбонат натрію (NaHCO3, 85,0 г, 1,01 моль, 3,37 екв.) за 1 годину. Потім суміш екстрагували EtOAc (2 × 1,2 л), а об'єднану органічну фазу промивали 16 % водним розчином хлориду натрію (2 × 800 мл) і концентрували приблизно до 1,0 л за допомогою вакуумної перегонки. До залишку додавали гептан (2,1 л), і отриману суміш концентрували до 1,0 л за допомогою вакуумної перегонки. До концентрованої суміші додавали гептан (2,1 л). Потім отриману білу суспензію концентрували до 1,0 л за допомогою вакуумної перегонки. У білу суспензію потім додавали метил-трет-бутиловий ефір (МТБЕ, 1,94 л). Білу каламутну суміш нагрівали до 40 °C для отримання прозорого розчину. Отриманий розчин концентрували приблизно до 1,0 л за допомогою вакуумної перегонки. Суміш перемішували при кімнатній температурі протягом 1 години. Білий осад зібрали фільтрацією з витяжним вакуумом. Осад на фільтрі промивали гептаном (400 мл) і висушували на фільтрі під азотом з витяжним вакуумом для отримання сполуки 18 (78,3 г, 90,1 %) у вигляді бруднувато1 3 білої твердої речовини. Для 18: H ЯМР (300 Мгц, (CD3)2SO) δ 8.68 (d, JHH=4.69 Гц, 1 H, NCH у 3 4 піридині), 7.97 (dd, JHH=4.69 Гц, JHF=4.69 Гц, 1 H, NCCH у піридині), 3.92 (br s, 2 H, один від одного NCH2 у піперидиновому кільці, один від одного NCH2 у піперидиновом кільці, обидва в 3 аксіальному положенні), 3.54 (t, JHH=6.15 Гц, 2 H, один від одного NCH2 у піперидиновому кільці, один від одного NCH2 у піперидиновому кільці, обидва в екваторіальному положенні), 2.48 (t, 3 3 13 JHH=6.44 Гц, 2 H, NCCH2), 2.34 (t, JHH=6.15 Гц, 2 H, NCCH2) ppm; C ЯМР (75 МГЦ, (CD3)2SO) 1 4 207.17 (C=O), 161.66 (N-C=O), 151.26 (d, JCF=266.89 Гц, C-F), 146.90 (d, JCF=6.05 Гц, NCH у 3 піридині), 135.56 (C-C=O), 134.78-135.56 (m, NCCF3), 128.27 (d, JCF=7.19 Гц, NCCH у піридині), 1 3 119.52 (d× квартет, JCF=274.38 Гц, JCF=4.89 Гц, CF3), 45.10 (NC у піперидиновому кільці) ppm, 19 один вуглець (NCC у піперидиновому кільці), пропущений через перекривання з (CD3)2SO; F 4 4 ЯМР (282 МГц, (CD3)2SO) -64.58 (d, JFF=15.85 Гц, F3C), -128.90 (d×квартет, JFF=1 5.85 Гц, 4 + JFH=4.05 Гц, FC) ppm; C12H10F4N2O2 (мол.маса 290,21), РХМС (EI) m/e 291,1 (M + H). Приклад 5. {3-[4-(7-{[2-(триметилсиліл)етокси]метил}-7H-піроло[2,3-d]піримідин-4-іл)-1Hпіразол-1-іл]азетидин-3-іл}ацетонітрилу дигідрохлорид (20) 18 UA 111854 C2 5 10 15 20 25 30 35 40 45 Стадія 1. Трет-бутил 3-(ціанометил)-3-(4-(7-((2-(триметилсиліл)етокси)метил)-7Н-піроло[2,3d]піримідин-4-іл)-1Н-піразол-1-іл)азетидин-1-карбоксилат (19) У висушений 30 л реактор, оснащений механічною мішалкою, термометром, краплинною воронкою і вакуумним виходом, поміщали 4-(1H-піразол-4-іл)-7-((2(триметилсиліл)етокси)метил)-7H-піроло[2,3-d]піримідин (5, 4,50 кг, 14,28 моль), трет-бутил 3(ціанометилен)азетидин-1-карбоксилат (13, 3,12 кг, 16,08 моль, 1,126 екв.) в ацетонітрилі (9 л) при 20±5 °C. До отриманої рожевої суспензії додавали 1,8-діазабіцикло[5.4.0]ундец-7-ен (DBU, 225 мл, 1,48 моль, 0,10 екв.) за 40 хвилин. Температуру суміші при додаванні підтримували між 10 °C і 20 °C. Отриманий коричневий розчин перемішували при 20 °C протягом 3 годин. Після завершення реакції, при перемішуванні за 80 хвилин додавали воду (18 л) при 20 °C. У суміш вносили затравку і перемішували при кімнатній температурі протягом 12 годин. Тверді речовини збирали фільтрацією, а осад на фільтрі промивали сумішшю ацетонітрила і води (1:2, 9 л) і висушували у вакуумній печі, продуваючи азотом, протягом 12 годин при 60 °C для отримання неочищеного продукту (19, 7,34 кг) у вигляді світло-жовтого порошку. Неочищений продукт, отриманий вище, розчиняли в метил-трет-бутиловому ефірі (МТБЕ, 22 л) при 60 °C у 50 л реакторі, оснащеному механічною мішалкою, термометром, краплинною воронкою і пробкою. За 1 годину додавали гексани (22 л) при 60 °C. Потім у розчин вносили затравку, охолоджували до 20 °C за 3 години і перемішували при 20 °C протягом 12 годин. Осад збирали фільтрацією. Отриманий осад на фільтрі промивали сумішшю МТБЕ і гексану (1:15, 3 л) і висушували у вакуумній печі протягом 10 годин при 50 °C для отримання сполуки 19 (6,83 кг, 13,42 моль, 1 94,0 %) у вигляді білого порошку. Для 19: H ЯМР (400 МГц, CDCl3) δ 8.87 (s, 1H), 8.46 (d, J=0.6 Гц, 1H), 8.36 (d, J=0.7 Гц, 1H), 7.44 (d, J=3.7 Гц, 1H), 6.82 (d, J=3.7 Гц, 1H), 5.69 (s, 2H), 4.57 (d, J=9.6 Гц, 2H), 4.32 (d, J=9.5 Гц, 2H), 3.59 – 3.49 (m, 2H), 3.35 (s, 2H), 1.49 (s, 9H), 0.96 – 0.87 (m, 13 2H), -0.03 – -0.10 (s, 9H) ppm; C ЯМР (101 МГц, CDCl3) δ 157.22, 153.67, 153.24, 151.62, 142.13, 130.16, 129.67, 124.47, 116.72, 115.79, 102.12, 82.54, 74.23, 68.01, 60.25, 58.23, 29.65, 29.52, + 19.15, -0.26 ppm; C25H35N7O3Si (мол.маса 509,68), РХМС (EI) m/e 510,1 (M + H). Стадія 2. 3-[4-(7-{[2-(триметилсиліл)етокси]метил}-7H-піроло[2,3-d]піримідин-4-іл)-1Hпіразол-1-іл]азетидин-3-іл}ацетонітрилу дигідрохлорид (20) У 2 л 4-горлу круглодонну колбу, забезпечену механічною мішалкою, термопарою, краплинною воронкою і подачею азоту, додавали сполуку 19 (55,0 г, 0,108 моль) і метанол (MeOH, 440 мл) при 20±5 °C. Отриману білу каламутну суміш перемішували протягом 20 хвилин при кімнатній температурі для отримання світло-жовтого розчину. Потім до реакційної суміші додавали розчин хлороводневої кислоти (HCl) в ізопропанолі (5,25 М, 165 мл, 0,866 моль, 8,02 екв.) через краплинну воронку, за 5 хвилин. Отриману реакційну суміш потім нагрівали до 40 °C за допомогою колбонагрівача. Через 2 години при 40 °C, до реакційної суміші додавали воду (165 мл, 9,17 моль, 84,8 екв.) через краплинну воронку для отримання світло-зеленого розчину при 40 °C. До отриманої суміші додавали метил-трет-бутиловий ефір (МТБЕ, 440 мл) через краплинну воронку при 40 °C. Отриману суміш повільно охолоджували до 10 °C. Тверді речовини збирали фільтрацією і промивали МТБЕ (2 × 220 мл). Білу тверду речовину висушували на фільтрі під азотом з витяжним вакуумом протягом 18 годин для отримання 1 сполуки 20 (52,2 г, вміст води по Карлу-Фішеру 5,42 %, виход 94,9 %). Для 20: H ЯМР (400 МГц, (CD3)2SO) δ 10.39 (brs, 1H), 10.16 (brs, 1H), 9.61 (s, 1H), 9.12 (s, 1H), 9.02 (s, 1H), 8.27 – 8.21 (d, J=3.8 Гц, 1H), 7.72 – 7.66 (d, J=3.8 Гц, 1H), 5.82 (s, 2H), 4.88 – 4.77 (m, 2H), 4.53 – 4.44 (m, 2H), 13 4.12 (s, 2H), 3.69 – 3.60 (m, 2H), 0.98 – 0.89 (m, 2H), 0.01 (s, 9H) ppm; C ЯМР (101 МГц, (CD3)2SO) δ 151.25, 146.45, 145.09, 140.75, 133.38, 132.44, 116.20, 116.09, 112.79, 102.88, 73.07, 66.14, 59.16, 53.69, 26.44, 17.15, -1.36 ppm; C20H29Cl2N7OSi (вільна основа 20, C20H27N7OSi, + мол.маса 409,56), РХМС (EI) m/e 410,2 (M + H). 19 UA 111854 C2 Приклад 6. 2-(1-(1-(3-фтор-2-(трифторметил)ізонікотиноїл)піперидин-4-іл)-3-(4-(7-((2(триметилсиліл)етокси)метил)-7H-піроло[2,3-d]піримідин-4-іл)-1H-піразол-1-іл)азетидин-3іл)ацетонітрил (21) 5 10 15 20 25 30 У 100 л висушений реактор, оснащений механічною мішалкою, термопарою, холодильником і подачею азоту, додавали (20, 3,24 кг, 6,715 моль) і дихлорметан (32 л) при 20±5 °C. Суміш перемішували при кімнатній температурі протягом 10 хвилин, потім обробляли триетиламіном (ТЕА, 1,36 кг, 13,44 моль, 2,00 екв.) з такою швидкістю додавання, щоб внутрішня температура зберігалася на рівні 15-30 °C. Потім у реактор додавали сполуку 18 (2,01 кг, 6,926 моль, 1,03 екв.) при кімнатній температурі. Через 10 хвилин у реактор частинами додавали триацетоксиборгідрид натрію (NaBH(OAc)3, 2,28 кг, 10,75 моль, 1,60 екв.) за 1 годину, підтримуючи внутрішню температуру при 15-30 °C. Отриману реакційну суміш перемішували при 15-30 °C ще одну годину. Після завершення реакції відновного амінування, реакційну суміш обробляли 4 % водним розчином бікарбонату натрію (NaHCO3, 32 л), щоб довести рН до 7-8. Після перемішування протягом 30 хвилин при кімнатній температурі, дві фази розділяли. Водну фазу екстрагували дихлорметаном (29 л). Об'єднану органічну фазу послідовно промивали 0,1 н. водним розчином хлороводневої кислоти (16 л), 4 % водним розчином бікарбонату натрію (16 л), 8 % водним розчином хлориду натрію (2 × 16 л). Отриману органічну фазу частково концентрували і відфільтровували. Фільтрат піддавали заміні розчинника, поступово додаючи ацетонітрил (65 л) під вакуумом. Тверду білу речовину збирали фільтрацією, промивали ацетонітрилом (10 л) і висушували при 40-50 °C у вакуумній печі, продуваючи азотом, для 1 отримання сполуки 21 (4,26 кг, 6,23 моль, 92,9 %). Для 21: H ЯМР (500 МГц, (CD3)2SO) δ 8.84 (s, 1H), 8.76 (s, 1H), 8.66 (d, J=4.7 Гц, 1H), 8.43 (s, 1H), 7.90 (t, J=4.7 Гц, 1H), 7.78 (d, J=3.7 Гц, 1H), 7.17 (d, J=3.7 Гц, 1H), 5.63 (s, 2H), 4.07 (dt, J=11.1, 4.9 Гц, 1H), 3.75 (d, J=7.8 Гц, 2H), 3.57 (dd, J=10.2, 7.8 Гц, 2H), 3.55 (s, 2h), 3.52 (dd, J=8.5, 7.4 Гц, 2H), 3.41 (dq, J=13.3, 4.3 Гц, 1H), 3.26 (t, J=10.0 Гц, 1H), 3.07 (ddd, J=13.1, 9.4, 3.2 Гц, 1H), 2.56 (dt, J=8.5, 4.7 Гц, 1H), 1.81 – 1.73 (m, 1H), 13 1.63 (m, 1H), 1.29 (m, 1H), 1.21 (m, 1H), 0.82 (dd, J=8.5, 7.4 Гц, 2H), -0.12 (s, 9H) ppm; C ЯМР (101 МГц, (CD3)2SO) δ 161.68, (154.91, 152.27), 153.08, 152.69, 151.53, 147.69, 140.96, (136.19, 136.02), (136.48, 136.36, 136.13, 136.0, 135.78, 135.66, 135.43, 135.32), 131.43, 130.84, 129.03, (126.17, 123.42, 120.69), 117.99, 122.77, 118.78, 114.71, 102.02, 73.73, 67.04, 62.86, 61.88, 58.51, 45.63, 30.03, 29.30, 28.60, 18.52, 0.00 ppm; C32H37F4N9O2Si (мол.маса 683,77), РХМС (EI) m/e + 684,2 (M + H). Приклад 7. 2-(3-(4-(7H-піроло[2,3-d]піримідин-4-іл)-1H-піразол-1-іл)-1-(1-(3-фтор-2(трифторметил)ізонікотиноїл)піперидин-4-іл)азетидин-3-іл)ацетонітрил (22) 20 UA 111854 C2 5 10 15 20 25 30 35 У 250 мл 4-горлу круглодонну колбу, забезпечену механічною мішалкою, термопарою, краплинною воронкою і подачею азоту, додавали сполуку 21 (9,25 г, 13,52 ммоль, вміст води за Карлом-Фішером 3,50 %) і ацетонітрил (74 мл) при 20±5 °C. Отриману білу суспензію охолоджували до температури нижче 5 °C. Потім додавали діетилетерат трифторида бору (BF3·OEt2, 6,46 мл, 51,37 ммоль, 3,80 екв.), підтримуючи внутрішню температуру нижче 5,0 °C. Реакційну суміш потім нагрівали до 20±5 °C. Після перемішування при 20±5 °C протягом 18 годин, реакційну суміш охолоджували до 0-5 °C і в реакційну суміш вводили додаткову кількість BF3·OEt2 (0,34 мл, 2,70 ммоль, 0,2 екв.) при температурі нижче 5,0 °C. Отриману реакційну суміш нагрівали до 20±5 °C і підтримували перемішування при кімнатній температурі ще 5 годин. Потім реакційну суміш охолоджували до 0-5 °C, потім додавали воду (12,17 мл, 0,676 моль, 50 екв.). При додаванні води внутрішню температуру підтримували нижче 5,0 °C. Отриману суміш нагрівали до 20±5 °C і підтримували перемішування при кімнатній температурі протягом 2 годин. Потім реакційну суміш охолоджували до 0-5 °C і додавали водний розчин гідроксиду амонію (NH4OH, 5 н., 121,7 ммоль, 9,0 екв.). При додаванні водного розчину гідроксиду амонію підтримували внутрішню температуру нижче 5,0 °C. Отриману реакційну суміш нагрівали до 20±5 °C і перемішували при кімнатній температурі протягом 20 годин. Після завершення зняття SEM-захисту, реакційну суміш відфільтровували, а тверді речовини промивали EtOAc (9,25 мл). Фільтрати об'єднували і розбавляли EtOAc (74 мл). Розбавлений органічний розчин промивали 13 % водним розчином хлориду натрію (46,2 мл). Органічну фазу потім розбавляли EtOAc (55,5 мл), потім концентрували до мінімального об'єму під зниженим тиском. До залишку додавали EtOAc (120 мл), а отриманий розчин перемішували при 20±5 °C протягом 30 хвилин. Потім розчин промивали 7 % водним розчином бікарбонату натрію (2 × 46 мл) і 13 % водним розчином бікарбонату натрію (46 мл). Отриману органічну фазу розбавляли EtOAc (46 мл) і обробляли водою (64 мл) при 50±5 °C протягом 30 хвилин. Суміш охолоджували до 20±5 °C і розділяли дві фази. Органічну фазу ще раз обробляли водою (64 мл) при 50±5 °C протягом 30 хвилин. Суміш охолоджували до 20±5 °C і розділяли дві фази. Отриману органічну фазу концентрували для отримання неочищеної сполуки 22 (вільна основа), яку додатково очищали колонковою хроматографією (SiO2, 330 г, градієнтне елюювання 0-10 % MeOH в EtOAc) для отримання аналітично чистої вільної основи (22, 7,00 г, 93,5 %) у вигляді 1 бруднувато-білої твердої речовини. Для 22: H ЯМР (400 МГц, (CD3)2SO) δ 12.17 (d, J=2.8 Гц, 1H), 8.85 (s, 1H), 8.70 (m, 2H), 8.45 (s, 1H), 7.93 (t, J=4.7 Гц, 1H), 7.63 (dd, J=3.6, 2.3 Гц, 1H), 7.09 (dd, J=3.6, 1.7 Гц, 1H), 4.10 (m, 1H), 3.78 (d, J=7.9 Гц, 2H), 3.61 (t, J=7.9 Гц, 1H), 3.58 (s, 2H), 3.46 (m, 1H), 3.28 (t, J=10.5 Гц, 1H), 3.09 (ddd, J=13.2, 9.5, 3.1 Гц, 1H), 2.58 (m, 1H), 1.83 – 1.75 (m, 13 1H), 1.70 – 1.63 (m, 1H), 1.35 – 1.21 (m, 2H) ppm; C ЯМР (101 МГц, (CD3)2SO) δ 160.28, (153.51, 150.86), 152.20, 150.94, 149.62, (146.30, 146.25), 139.48, (134.78, 134.61), (135.04, 134.92, 134.72, 134.60, 134.38, 134.26, 134.03, 133.92), 129.22, 127.62, 126.84, 121.99, 122.04, (124.77, 122.02, 119.19, 116.52), 117.39, 113.00, 99.99, 61.47, 60.49, 57.05, 44.23, 28.62, 27.88, 27.19 ppm; 21 UA 111854 C2 + C26H23F4N9O (мол.маса 553,51), РХМС (EI) m/e 554,1 (M + H). Приклад 8. 2-(3-(4-(7H-піроло[2,3-d]піримідин-4-іл)-1H-піразол-1-іл)-1-(1-(3-фтор-2(трифторметил)ізонікотиноїл)піперидин-4-іл)азетидин-3-іл)ацетонітрилу адипат (25) 5 10 15 20 25 30 35 40 Стадія 1. 2-(3-(4-(7H-піроло[2,3-d]піримідин-4-іл)-1H-піразол-1-іл)-1-(1-(3-фтор-2(трифторметил)ізонікотиноїл)піперидин-4-іл)азетидин-3-іл)ацетонітрилу адипат, неочищена сіль (24) Слідували способу отримання сполуки 22 у Прикладі 7, за винятком того, що кінцеву органічну фазу концентрували вакуумною перегонкою до мінімального об'єму для отримання неочищеної сполуки 22, яку не виділяли, а безпосередньо використовували на подальшій стадії утворення адипатної солі. До концентрованого залишку, що містить неочищену сполуку 22, додавали метанол (200 мл) при кімнатній температурі. Суміш концентрували вакуумною перегонкою до мінімального об'єму. Потім до залишку додавали метанол (75 мл), і отриманий розчин нагрівали з дефлегматором протягом 2 годин. До розчину додавали метил-ізобутилкетон (МІБК, 75 мл), і отриману суміш дистилювали під вакуумом приблизно до 30 мл, підтримуючи внутрішню температуру при 40-50 °C. Додавали метанол (75 мл), і отриману суміш нагрівали з дефлегматором протягом 2 годин. До цього розчину додавали МІБК (75 мл). Суміш знову дистилювали під вакуумом приблизно до 30 мл, підтримуючи внутрішню температуру при 40-50 °C. До цього розчину додавали розчин адипінової кислоти (23, 2,15 г, 14,77 ммоль) у метанолі (75 мл). Потім отриманий розчин нагрівали з дефлегматором протягом 2 годин. Додавали МІБК (75 мл). Суміш дистилювали під вакуумом приблизно до 60 мл, підтримуючи внутрішню температуру при 40-50 °C. Нагрівання припиняли і додавали гептан (52,5 мл) за 1-2 години. Отриману суміш перемішували при 20±5 °C протягом 3-4 годин. Білий осад збирали фільтрацією, а осад на фільтрі промивали гептаном (2 × 15 мл). Тверду речовину висушували на фільтрі під азотом з витяжним вакуумом при 20±5 °C протягом 12 годин для отримання 1 сполуки 24 (неочищена адипатна сіль, 8,98 г, 12,84 ммоль, 95,0 %). Для 24: H ЯМР (400 МГц, (CD3)2SO) δ 12.16 (s, 1H), 12.05 (brs, 2H), 8.85 (s, 1H), 8.72 (s, 1H), 8.69 (d, J=4.7 Гц, 1H), 8.45 (s, 1H), 7.93 (t, J=4.7 Гц, 1H), 7.63 (dd, J=3.6, 2.3 Гц, 1H), 7.09 (dd, J=3.6, 1.7 Гц, 1H), δ 4.11 (dt, J=11.0, 4.4 Гц, 1H), 3.77 (d, J=7.8 Гц, 2H), 3.60 (t, J=7.8 Гц, 2H), 3.58 (s, 2H), 3.44 (dt, J=14.4, 4.6 Гц, 1H), 3.28 (t, J=10.4 Гц, 1H), 3.09 (ddd, J=13.2, 9.6, 3.2 Гц, 1H), 2.58 (tt, J=8.6, 3.5 Гц, 1H), 2.28 – 2.17 (m, 4H), 1.83 – 1.74 (m, 1H), 1.67 (d, J=11.0 Гц, 1H), 1.59 – 1.46 (m, 4H), 1.37 – 1.21 (m, 2H) 13 ppm; C ЯМР (101 МГц, (CD3)2SO) δ 174.38, 160.29, (153.52, 150.87), 152.20, 150.94, 149.63, (146.30, 146.25), 139.48, (134.79, 134.62), (135.08, 134.97, 134.74, 134.62, 134.38, 134.28, 134.04, 133.93), 129.21, 127.62, 126.84, 122.05, (124.75, 122.02, 119.29, 116.54), 117.39, 113.01, 99.99, 61.47, 60.50, 57.06, 44.24, 33.42, 30.70, 28.63, 27.89, 27.20, 24.07 ppm; C32H33F4N9O5 (мол.маса: + 699,66; 24: C26H23F4N9O, мол.маса 553,51), РХМС (EI) m/e 554,0 (M + H). Стадія 2. 2-(3-(4-(7H-Піроло[2,3-d]піримідин-4-іл)-1H-піразол-1-іл)-1-(1-(3-фтор-2(трифторметил) ізонікотиноїл)піперидин-4-іл)азетидин-3-іл)ацетонітрилу адипат (25) У 100 л висушений реактор, оснащений механічною мішалкою, термопарою, краплинною воронкою і подачею азоту, додавали сполуки 24 (3,40 кг, 4,86 моль) і ацетон (23,8 л). Отриману білу каламутну суміш нагрівали до 55-60 °C для отримання прозорого розчину. Отриманий 22 UA 111854 C2 5 10 15 20 25 30 35 40 45 50 55 60 розчин відфільтровували через прохідний фільтр в іншій 100 л реактор. Гептан (23,8 л) відфільтровували через прохідний фільтр в окремий 50 л реактор. Відфільтрований гептан потім завантажували в ацетоновий розчин у 100 л реакторі з такою швидкістю, щоб внутрішня температура зберігалася при 55-60 °C. Реакційну суміш у 100 л реакторі потім охолоджували до 20±5 °C і перемішували при 20±5 °C протягом 16 годин. Білий осад збирали фільтрацією, а осад на фільтрі промивали гептаном (2 × 5,1 л) і висушували на фільтрі під азотом з витяжним вакуумом. Тверду речовину додатково висушували у вакуумній печі при 55-65 °C, продуваючи азотом, для отримання сполуки 25 (3,11 кг, 92,2 %) у вигляді бруднувато-білого порошку. Для 1 25: H ЯМР (400 МГц, (CD3)2SO) δ 12.16 (s, 1H), 12.05 (brs, 2H), 8.85 (s, 1H), 8.72 (s, 1H), 8.69 (d, J=4.7 Гц, 1H), 8.45 (s, 1H), 7.93 (t, J=4.7 Гц, 1H), 7.63 (dd, J=3.6, 2.3 Гц, 1H), 7.09 (dd, J=3.6, 1.7 Гц, 1H), δ 4.11 (dt, J=11.0, 4.4 Гц, 1H), 3.77 (d, J=7.8 Гц, 2H), 3.60 (t, J=7.8 Гц, 2H), 3.58 (s, 2H), 3.44 (dt, J=14.4, 4.6 Гц, 1H), 3.28 (t, J=10.4 Гц, 1H), 3.09 (ddd, J=13.2, 9.6, 3.2 Гц, 1H), 2.58 (tt, J=8.6, 3.5 Гц, 1H), 2.28 – 2.17 (m, 4H), 1.83 – 1.74 (m, 1H), 1.67 (d, J=11.0 Гц, 1H), 1.59 – 1.46 (m, 13 4H), 1.37 – 1.21 (m, 2H) ppm; C ЯМР (101 МГц, (CD3)2SO) δ 174.38, 160.29, (153.52, 150.87), 152.20, 150.94, 149.63, (146.30, 146.25), 139.48, (134.79, 134.62), (135.08, 134.97, 134.74, 134.62, 134.38, 134.28, 134.04, 133.93), 129.21, 127.62, 126.84, 122.05, (124.75, 122.02, 119.29, 116.54), 117.39, 113.01, 99.99, 61.47, 60.50, 57.06, 44.24, 33.42, 30.70, 28.63, 27.89, 27.20, 24.07 ppm; C32H33F4N9O5(мол.маса: 699,66; вільна основа: C26H23F4N9O (мол. маса 553,51), РХМС (EI) m/e + 554,0 (M + H). Приклад А: In vitro аналіз кінази JAK Сполуку формули I, описану в цьому документі, випробовували на інгібуючу активність відносно JAK мішеней відповідно до in vitro аналізу, описаного в публікації Park et al., Analytical Biochemistry 1999, 269, 94-104. Каталітичні домени людської JAK1 (а.к. 837-1142) і JAK2 (а.к. 828-1132) з N-кінцевою міткою His експресували за допомогою бакуловірусу у клітинах комах і очищали. Каталітичну активність JAK1 і JAK2 аналізували виміром фосфорилування біотинільованого пептиду. Фосфорилований пептид виявляли гомогенною флуоресценцією з часовою розрізняльною здатністю (HTRF). IC50 сполук вимірювали для кожної кінази у 40 мікролітрових реакціях, що містять фермент, АТФ і 500 нМ пептиду у 50 мМ буфера Tris (pH 7,8) з 100 мМ NaCl, 5 мМ DTT і 0,1 мг/мл (0,01 %) BSA. Для 1 мМ вимірів IC50, концентрація АТФ у реакціях складала 1 мМ. Реакції виконували при кімнатній температурі протягом 1 години, а потім зупиняли додаванням 20 мкл 45 мМ ЕДТА, 300 нМ SA-APC, 6 нМ Eu-Py20 в аналітичному буфері (Perkin Elmer, Бостон, штат Массачусетс). Зв'язування з антитілом, міченим європієм, сталося за 40 хвилин, а сигнал HTRF вимірювали на планшет-рідері Fusion (Perkin Elmer, Бостон, штат Массачусетс). Сполука Прикладу 1 і адипінокисла сіль мали IC50 у JAK1 ≤ 5 нМ (виміряну при 1 мМ АТФ), із співвідношенням JAK2/JAK1 > 10 (виміряним при 1 мМ АТФ). Приклад B: Клітинні аналізи Ракові клітинні лінії, залежні від цитокінів і, отже, сигнальної трансдукції JAK/STAT, для зростання можуть бути поміщені у планшет при 6000 клітин на лунку (96-лунковий формат планшета) у RPMI 1640, 10 % FBS, і 1 нг/мл відповідного цитокіна. Сполуки можуть бути додані у клітини у ДМСО/середовищі (кінцева концентрація 0,2 % ДМСО) і інкубовані протягом 72 годин при 37 °C, 5 % CO2. Вплив сполуки на життєздатність клітин оцінюють з використанням люмінесцентного аналізу життєздатності клітин CellTiter-Glo (Promega) з подальшим підрахунком за допомогою TopCount (Perkin Elmer, Бостон, штат Массачусетс). Паралельно вимірюють можливість нецільового впливу сполук з використанням не-JAK-керованої клітинної лінії з таким самим зчитуванням зразка. Всі експерименти зазвичай виконують у двох екземплярах. Представлені вище клітинні лінії можуть бути використані також для перевірки впливу сполук на фосфорилування JAK кіназ або потенційних низхідних субстратів, таких як білки STAT, Akt, Shp2 або Erk. Ці експерименти можуть бути виконані з подальшим цитокіновим вирощуванням клітин на мінімальному середовищі протягом ночі, з подальшою швидкою попередньою інкубацією із сполукою (2 години або менше) і цитокіновою стимуляцією приблизно протягом 1 години або менше. Потім білки екстрагують з клітин і аналізують за способами, відомими фахівцям у даній галузі, включаючи вестерн-блотинг або імуноферментні твердофазні аналізи, з використанням антитіл, що дозволяють розрізняти фосфорильовані і загальні білки. У цих експериментах можуть бути використані нормальні або ракові клітини для дослідження дії сполук на біологію виживання клітин пухлини або на медіатори запального захворювання. Наприклад, відносно останнього, такі цитокіни, як IL-6, IL-12, IL-23 або IFN можуть бути використані для стимулювання активації JAK, що призводить до фосфорилування білка (-ів) STAT і потенційно до транскрипційних профілів (оцінюваним за технологією з матрицями або кПЦР) або вироблення, та∕або секреції білків, таких, як IL-17. Здатність сполук 23 UA 111854 C2 5 10 15 20 25 30 35 40 45 50 55 60 інгібувати ці цитокін-опосередковані ефекти може бути виміряна з використанням способів, відомих фахівцям у даній галузі. Сполуки, описані в цьому документі, також можуть бути випробувані в клітинних моделях, розроблених для оцінки їх здатності і активності проти мутантів JAK, наприклад, мутації JAK2V617F, виявленій у мієлоїдних проліферативних розладах. У цих експериментах часто використовують цитокін-залежні клітини гематологічної лінії (наприклад, BaF/3), в яких ектопічно експресуються кінази дикого типа або мутанти JAK кінази (James, C., et al. Nature 434:11441148; Staerk, J., et al. JBC 280:41893-41899). Кінцеві точки включають дію сполук на виживання, проліферацію клітин і фосфорильовані білки JAK, STAT, Akt або Erk. Деякі сполуки, описані в цьому документі, можуть бути оцінені на їх активність інгібування Тклітинної проліферації. Таким аналізом може вважатись аналіз проліферації, керованої вторинними цитокінами (тобто JAK), а також спрощений аналіз придушення імунітету або інгібування імунної активації. Нижче представлений короткий огляд того, як можуть бути виконані такі експерименти. Мононкулеарні клітини периферичної крові (PBMС) готують зі зразків цілісної крові людини, використовуючи спосіб розділення Ficoll Hypaque, а Т-клітини (фракція 2000) можуть бути отримані з PBMS відстоюванням. Свіжовиділені Т-клітини людини можуть зберігатися в культуральному середовищі (RPMI 1640 з додаванням 10 % бичачої 6 плідної сироватки, 100 Е/мл пеніциліну, 100 мкг/мл стрептоміцину) при щільності 2 × 10 клітин/мл при 37 °C до 2 днів. Для аналізу IL-2-стимульованої клітинної проліферації, Т-клітини спочатку обробляють фітогемагглютиніном (PHA) при кінцевій концентрації 10 мкг/мл протягом 72 годин. Після однократного промивання PBS, 6000 клітин/лунку поміщають в 96-лункові планшети і обробляють сполуками при різних концентраціях у культуральному середовищі у присутності 100 Е/мл IL-2 людини (ProSpec-Tany TechnoGene; Реховот, Ізраїль). Планшети інкубують при 37 °C протягом 72 годин, а коефіцієнт проліферації оцінюють з використанням люмінесцентних реагентів CellTiter-Glo за протоколом, запропонованим виробником (Promega; Медісон, штат Вісконсін). Приклад C: In vivo протипухлинна ефективність Сполуки, описані в цьому документі, можуть бути оцінені в моделях ксенотрансплантату пухлини людини у мишей з порушеним імунітетом. Наприклад, онкогенний варіант клітинної лінії INA-6 плазмоцитоми може бути використаний для підшкірної інокуляції мишам SCID (Burger, R., et al. Hematol J. 2:42-53, 2001). Тварин з пухлиною потім можна рандомізувати на групи, що обробляються ліками або носієм, і можуть бути введені різні дози сполук за будь-яким з багаточисельних звичайних способів, включаючи пероральний, інтраперитонеальний або безперервну інфузію з використанням насосів, що імплантуються. Зростання пухлини з часом вимірюють за допомогою кронциркулів. Далі, зразки пухлин можуть бути зібрані у будь-який час після початку лікування для проведення аналізу, як описано вище (Приклад В), для оцінки впливу сполуки на активність JAK і низхідні сигнальні шляхи. Крім того, селективність сполуки (к) може бути оцінена з використанням моделей ксенотрансплантату пухлини, які управляються іншими відомими кіназами (наприклад, Bcr-Abl), таких, як модель пухлини K562. Приклад D: Випробування на мишах сповільненої реакції гіперчутливості при контакті зі шкірою Сполуки, описані в цьому документі, також можуть бути випробувані на їх ефективність (інгібування мішеней JAK) на моделі випробування сповільненої гіперчутливості, керованої Тклітинами. Реакція гіперчутливості сповільненого типа при контакті зі шкірою у мишей (DTH) вважається достовірною моделлю клінічного контактного дерматиту і інших Т-лімфоцитопосередкованих імунних розладів шкіри, таких, як псоріаз (Immunol Today. Січень 1998 г.; 19(1):37-44). DTH у мишей має багато спільних характеристик з псоріазом, включаючи імунний інфільтрат, супутнє збільшення запальних цитокінів і кератиноцитну гіперпроліферацію. Більше того, багато класів агентів, ефективних для лікування псоріазу в клінічних умовах, також є ефективними інгібіторами реакції DTH у мишей (Agents Actions. Січень 1993 г.; 38(1-2):116-21). На 0 і 1 день мишей Balb/c сенсибілізували місцевим нанесенням на поголені животи антигена 2,4-динітро-фторбензола (DNFB). На 5 день вимірювали товщину вух, використовуючи інженерний мікрометр. Цей вимір записували і використовували як базову лінію. Обидва вуха тварин потім випробовували місцевим нанесенням DNFB у загальній кількості 20 мкл (10 мкл на внутрішню сторону вушної раковини і 10 мкл на зовнішню сторону вушної раковини) при концентрації 0,2 %. Через час від двадцяти чотирьох до сімдесяти двох годин після випробування кожне вухо знову вимірювали. Обробку досліджуваними сполуками проводили протягом фази сенсибілізації і випробування (з -1 дня по 7 день) або від часу до фази випробування і до часу протягом самої фази випробування (зазвичай у другій половині дня з 4 дня по 7 день). Лікування досліджуваними сполуками (у різних концентраціях) проводили 24 UA 111854 C2 5 10 15 20 25 30 35 40 45 50 55 60 системно або локально (місцеве введення лікарського засобу на вуха). Ефективність досліджуваних сполук визначали за зниженням опухання вуха порівняно з ситуацією без лікування. Сполуки, що зумовили зниження 20 % або більше, вважали ефективними. У деяких експериментах мишей випробовували, але не сенсибілізували (негативний контроль). Інгібуючий ефект (інгібування активації шляхів JAK-STAT) досліджуваних сполук може бути підтверджений імуногістохімічним аналізом. Активація шляху (-ів) JAK-STAT призводила до утворення і транслокації функціональних факторів транскрипції. Більше того, приплив імунних клітин і збільшена проліферація кератиноцитів також забезпечували унікальні зміни профілю експресії у вусі, що можна досліджувати і оцінити кількісно. Фіксовані у формаліні і закладені в парафіні сегменти вуха (зібрані після фази випробування у моделі DTH) піддавали імуногістохімічному аналізу з використанням антитіла, яке специфічно взаємодіє з фосфорильованим STAT3 (клон 58E12, Cell Signaling Technologies). Вуха мишей обробляли досліджуваними сполуками, носієм або дексаметазоном (клінічно ефективний лікарський засіб при псоріазі), або без лікарського засобу, у моделі DTH для порівняння. Досліджувані сполуки і дексаметазон можуть давати однакові зміни транскрипцій як якісно, так і кількісно, і досліджувані сполуки і дексаметазон можуть знижувати кількість клітин, що інфільтруються. І системне, і локальне введення досліджуваних сполук може давати інгібуючу дію, тобто зниження кількості клітин, що інфільтруються і інгібування змін транскрипцій. Приклад E: In vivo протизапальна активність Сполуки, описані в цьому документі, можуть бути оцінені в моделях на гризунах або в моделях не на гризунах, розроблених для відтворення одиничної або комплексної запальної реакції. Наприклад, моделі артриту на гризунах можуть бути використані для оцінки терапевтичної ефективності сполук, що вводяться превентивно або терапевтично. Ці моделі включають, але не обмежуючись цим, колаген-індукований артрит мишей або щурів, ад'ювантіндукований артрит щурів і артрит, індукований колагеновим антитілом. Аутоімунні захворювання, включаючи, але не обмежуючись цим, розсіяний склероз, цукровий діабет I типа, увеоретиніт, тиреоїдит, міастенію гравіс, імуноглобулін-нефропатію, міокардит, сенсибілізацію дихальних шляхів (астму), вовчак або коліт, також можуть бути використані для оцінки терапевтичної ефективності сполук за цим документом. Ці моделі добре відомі у науковому співтоваристві і зрозумілі фахівцям у даній галузі (Current Protocols in Immunology, том 3., Coligan, J.E. et al, Wiley Press.; Methods in Molecular Biology: том 225, Inflammation Protocols., Winyard, P.G. and Willoughby, D.A., Humana Press, 2003.). Приклад F: Моделі на тваринах для лікування сухості очей, увеїту і кон'юнктивіту Агенти можна оцінити в одній або більше доклінічних моделей сухості очей, які відомі фахівцям в даній галузі, включаючи, але не обмежуючись цим, модель з конканаваліном А (ConA) у слізній залозі на кроликах, модель із скополаміном на мишах (підшкірно або трансдермально), модель з ботуліном у слізній залозі на мишах, або будь-яку з множини спонтанних аутоімунних моделей на гризунах, які призводять до дисфункції очних залоз (наприклад, NOD-SCID, MRL/lpr або NZB/NZW) (Barabino et al., Experimental Eye Research 2004, 79, 613-621 і Schrader et al., Developmental Opthalmology, Karger 2008, 41, 298-312, кожен з яких включений у цей документ за допомогою посилання в повному обсязі). Кінцеві точки цих моделей можуть включати гістопатологію очних залоз і очей (рогівки і тому подібного) і, можливо, класичний тест Ширмера або його модифіковані версії (Barabino et al.), в яких вимірюють вироблення слізної рідини. Активність може бути оцінена введенням доз різними способами (наприклад, системним або місцевим), яке може бути почате до появи вимірюваного захворювання або після нього. Агенти можуть бути оцінені в одній або декількох доклінічних моделях увеїту, відомих фахівцям у даній галузі. Вони включають, але не обмежуючись цим, моделі експериментального аутоіммунного увеїту (EAU) і ендотоксин-індукованого увеїту (EIU). Експерименти EAU можуть бути виконані на кроликах, щурах або мишах, і можуть включати пасивну або активну імунізацію. Наприклад, будь-який з множини або ретинальних антигенів може бути використаний для сенсибілізації тварин до відповідного імуногена, після чого ці тварини можуть бути окулярно випробувані тим самим антигеном. Модель EIU є точнішою і включає місцеве або системне введення ліпополісахариду у сублетальних дозах. Кінцеві точки обох моделей EIU і EAU можуть включати дослідження очного дна і гістопатологію, серед іншого. Ці моделі розглянуті вченими Smith et al. (Immunology and Cell Biology 1998, 76, 497-512, повний зміст якої включений у цей документ за допомогою посилання). Активність оцінюють введенням доз різними способами (наприклад, системним або місцевим), яке може бути розпочате до появи вимірюваного захворювання або після нього. Деякі моделі, перераховані вище, можуть також призводити до склериту/епісклериту, хоріоїдиту, цикліту або іриту, і тому 25 UA 111854 C2 5 10 15 20 25 30 корисні для вивчення потенційної активності сполук для терапевтичного лікування цих захворювань. Агенти також можуть бути оцінені в одній або більше доклінічних моделях кон'юнктивіту, які відомі фахівцям у даної галузі. Вони включають, але не обмежуючись цим, моделі на гризунах з використанням морських свинок, щурів або мишей. Моделі на морських свинках включають моделі, що використовують активну або пасивну імунізацію, та/або протоколи імунних випробувань з антитілами, такими як овальбумін або амброзія (розглянуті в публікації Groneberg, D.A., et al., Allergy 2003, 58, 1101-1113, яка включена у цей документ за допомогою посилання в повному об'ємі). Моделі на щурах і мишах є, у загальних рисах, такими самими, як і моделі на морських свинках (також розглянуті в публікації Groneberg). Активність може бути оцінена введенням доз різними способами (наприклад, системним або місцевим), яке може бути розпочате до появи вимірюваного захворювання або після нього. Кінцеві точки таких досліджень можуть включати, наприклад, гістологічний, імунологічний, біохімічний або молекулярний аналіз очних тканин, таких як кон'юнктива. Приклад G: In vivo захист кісток Сполуки можуть бути оцінені у різних доклінічних моделях остеопенії, остеопорозу або резорбції кісток, які відомі фахівцям у даній галузі. Наприклад, гризуни після оваріектомії можуть бути використані для оцінки здатності сполук впливати на ознаки і маркери реконструкції і щільності кісток (публікація W.S.S. Jee and W. Yao, J Musculoskel. Nueron. Interact., 2001, 1(3), 193-207, яка включена у цей документ за допомогою посилання у повному обсязі). Альтернативно, щільність кісток і їх структура можуть бути оцінені у контрольних мишах або мишах, оброблених сполуками, у моделях остеопенії, індукованою терапією (наприклад, глюкокортикоїдами) (Yao, et al. Arthritis and Rheumatism, 2008, 58(6), 3485-3497; і id. 58(11), 1674-1686, які включені у цей документ за допомогою посилання у повному об'ємі). Крім того, вплив сполук на резорбцію і щільність кісток може бути оцінений у моделях артриту на гризунах, описаних вище (Приклад Е). Кінцеві точки усіх цих моделей можуть варіюватися, але зазвичай включають гістологічні і радіологічні оцінки, а також імуногістологію і відповідні біохімічні маркери реконструкції кісток. Були описані декілька варіантів реалізації цього винаходу. Проте, треба розуміти, що можуть бути зроблені різні модифікації без відхилення від загальної ідеї і рамок цього винаходу. Відповідно, інші варіанти реалізації входять у рамки наступної формули винаходу. ФОРМУЛА ВИНАХОДУ 35 1. Спосіб, який включає взаємодію сполуки формули III H N N CN N N N N P 1 III або її солі зі сполукою формули IV 40 26 UA 111854 C2 N O CF3 N F O IV у присутності відновного агента з утворенням сполуки формули II N O CF3 N F N N CN N N N 5 10 15 N P 1 II або її солі, за умови, що вказаний відновний агент не є ціанобордейтеридом натрію; 1 де Р є захисною групою. 2. Спосіб за п. 1, який відрізняється тим, що вказана захисна група є -CH2OCH2CH2Si(CH3)3. 3. Спосіб за будь-яким з пп. 1-2, який відрізняється тим, що вказаний відновний агент вибирають із ціаноборгідриду натрію та триацетоксиборгідриду натрію. 4. Спосіб за будь-яким з пп. 1-2, який відрізняється тим, що вказаний відновний агент є триацетоксиборгідридом натрію. 5. Спосіб за будь-яким з пп. 1-4, який відрізняється тим, що кожна сполука формул II, III і IV є вільною основою. 6. Спосіб за будь-яким з пп. 1-5, який додатково включає зняття захисту зі сполуки формули II або її вказаної солі з утворенням сполуки формули І 27 UA 111854 C2 N O CF3 N F N N CN N N N 5 10 15 20 25 N H І або її солі. 7. Спосіб за п. 6, який відрізняється тим, що вказане зняття захисту включає обробку етератом трифториду бору, з подальшою обробкою водним гідроксидом амонію. 8. Спосіб за будь-яким з пп. 6-7, який відрізняється тим, що вказаний спосіб додатково включає взаємодію сполуки формули І з адипіновою кислотою з утворенням адипатної солі. 9. Спосіб за будь-яким з пп. 6-8, який відрізняється тим, що кожна сполука формул І, II, III і IV є вільною основою. 10. Спосіб за будь-яким з пп. 6-7, який відрізняється тим, що вказаний спосіб додатково включає: (a) нагрівання сполуки формули І у метанолі при дефлегмації для отримання суміші; (b) після (а) - додавання метилізобутилкетону до суміші; (c) після (b) - видалення частини розчинника перегонкою при внутрішній температурі від 40 °C до 50 °C для отримання концентрованої суміші; (d) після (с) - додавання до концентрованої суміші метанолу для отримання розбавленої суміші; (e) після (d) - нагрівання розбавленої суміші при дефлегмації для утворення суміші; (f) після (e) - додавання метилізобутилкетону до суміші; (g) після (f) - видалення частини розчинника перегонкою при внутрішній температурі від 40 °C до 50 °C для отримання концентрованої суміші; (h) після (g) - додавання до концентрованої суміші адипінової кислоти і метанолу; (і) після (h) - нагрівання суміші при дефлегмації; і (j) після (і) - видалення частини розчинника перегонкою при внутрішній температурі від 40 °C до 50 °C для отримання концентрованої суміші; (k) після (j) - додавання гептану до суміші; і (l) після (k) - перемішування суміші при кімнатній температурі з утворенням адипінокислої солі сполуки формули І. 11. Спосіб за будь-яким з пп. 6-10, який відрізняється тим, що сполуку формули IV або її сіль отримують за способом, що включає зняття захисту зі сполуки формули V 30 28
ДивитисяДодаткова інформація
Назва патенту англійськоюProcesses and intermediates for making a jak inhibitor
Автори англійськоюZhou, Jiacheng, Liu, Pingli, Cao, Ganfeng, Wu, Yongzhong
Автори російськоюЧжоу Цзячен, Лю Пинли, Цао Ганьфен, У Юнчжун
МПК / Мітки
МПК: C07D 487/04, C07D 491/10
Мітки: проміжні, отримання, інгібіторів, способи, сполуки
Код посилання
<a href="https://ua.patents.su/33-111854-sposobi-i-promizhni-spoluki-dlya-otrimannya-ingibitoriv-jak.html" target="_blank" rel="follow" title="База патентів України">Способи і проміжні сполуки для отримання інгібіторів jak</a>
Попередній патент: Автономний промисловий енергопарк
Випадковий патент: Водозабірна свердловина