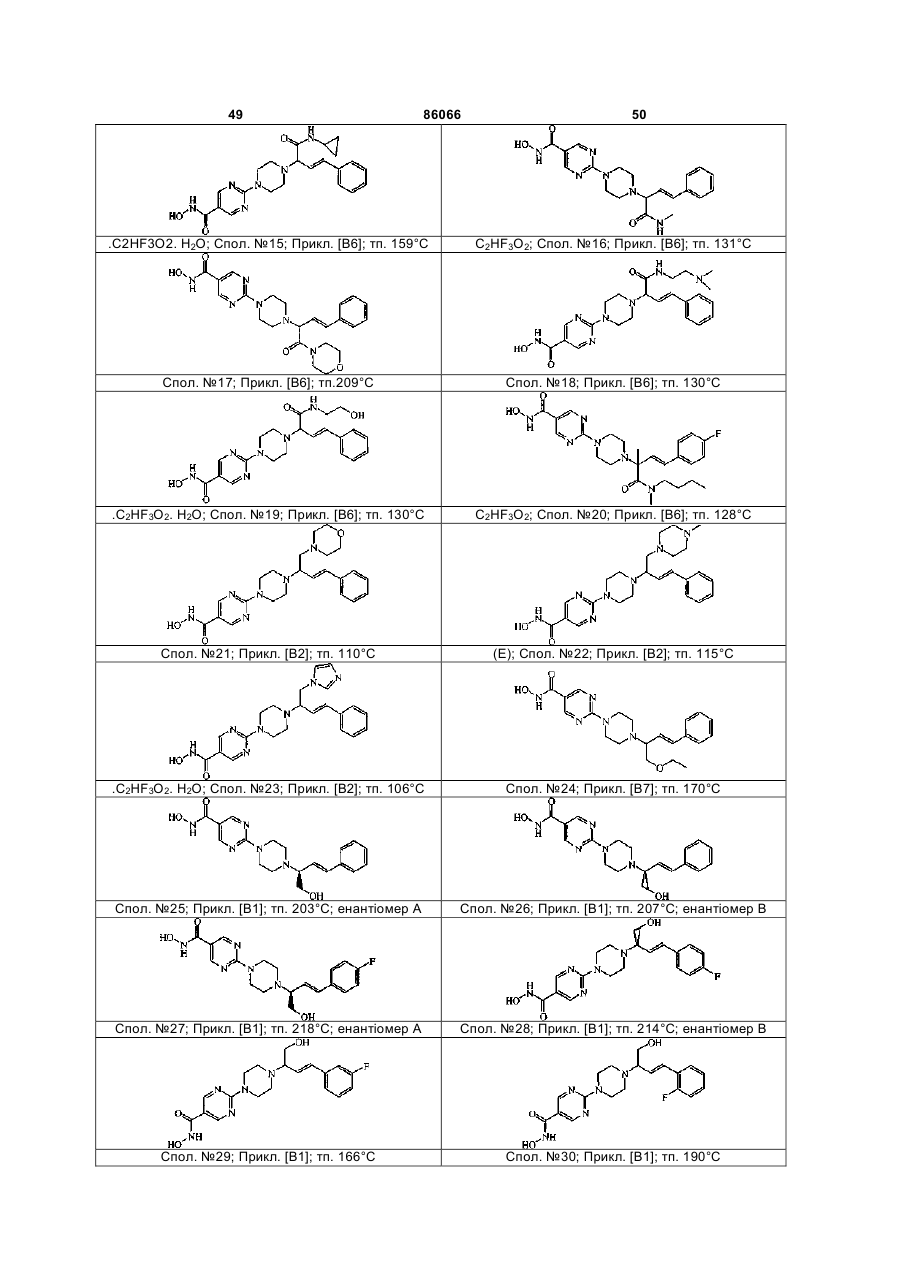
Похідні заміщеного пропенілпіперазину як інгібітори гістондеацетилази
Номер патенту: 86066
Опубліковано: 25.03.2009
Автори: ван Емелен Крістоф, Артс Жанін, Марконне-Декран Лоренс Франсуаз Бернадетт, Анджібо Патрік Рене, ван Брандт Свен Францискус Анна
Формула / Реферат
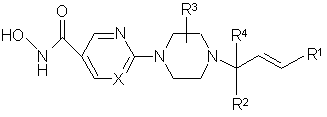
1. Сполука формули (І)
 , (I)
, (I)
її N-оксидні форми, фармацевтично прийнятні кислотно-адитивні солі та стереохімічно ізомерні форми, де
кожен X незалежно являє собою N або СН;
R1 являє собою феніл, нафталініл або гетероцикліл; де кожен зазначений феніл або нафталініл необов'язково заміщений одним або двома замісниками, кожний з яких незалежно вибраний з галогену, С1-6алкілу, С1-6алкокси, полігалогенС1-6алкілу, арилу, гідрокси, ціано, аміно, С1-6алкілкарбоніламіно, С1-6алкілсульфоніламіно, гідроксикарбонілу, С1-6алкоксикарбонілу, гідроксіС1-6алкілу, С1-6алкілоксиметилу, амінометилу, С1-6алкіламінометилу, С1-6алкілкарбоніламінометилу, С1-6алкілсульфоніламінометилу, аміносульфонілу, С1-6алкіламіносульфонілу або гетероциклілу;
R2 являє собою водень, -CH2-R5, трифторметил, -C(=O)-R6 або -CH2-NR7R8, де кожен R5 незалежно вибраний з водню, гідрокси, С1-6алкілокси, С1-6алкілоксіС1-6алкілокси, С1-6алкілкарбонілокси, піперазинілу, N-метилпіперазинілу, морфолінілу, тіоморфолінілу, імідазолілу або триазолілу; кожен R6 незалежно вибраний з гідрокси, С1-6алкілокси, аміно або моно- чи ді(С1-6алкіл)аміно, С1-6циклоалкіламіно, гідроксіС1-6алкіламіно, піперазинілу, моно- або ді(С1-6алкіл)аміноС1-6алкіламіно, N-метилпіперазинілу, морфолінілу або тіоморфолінілу; кожен R7 та R8 незалежно вибрані з водню, С1-6алкілу, С1-6алкілкарбонілу, С1-6алкілсульфонілу або моно- чи ді(С1-4алкіл)аміносульфонілу,
R3 являє собою водень, гідроксиметил, амінометил або моно- чи ді(С1-6алкіл)амінометил;
R4 являє собою водень або С1-6алкіл;
вищевказаний арил являє собою феніл або нафталініл, причому кожен зазначений феніл або нафталініл необов'язково заміщений одним або двома замісниками, кожний з яких незалежно вибраний з галогену, С1-6алкілу, С1-6алкокси, трифторметилу, ціано або гідроксикарбонілу; та
вищевказаний гетероцикліл являє собою фураніл, тієніл, піроліл, піролініл, піролідиніл, діоксоліл, оксазоліл, тіазоліл, імідазоліл, імідазолініл, імідазолідиніл, піразоліл, піразолініл, піразолідиніл, ізоксазоліл, ізотіазоліл, оксадіазоліл, триазоліл, тіадіазоліл, піраніл, піридиніл, піперидиніл, діоксаніл, морфолініл, дитіаніл, тіоморфолініл, піридазиніл, піримідиніл, піразиніл, піперазиніл, триазиніл, тритіаніл, індолізиніл, індоліл, індолініл, бензофураніл, бензотіофеніл, індазоліл, бензимідазоліл, бензтіазоліл, пуриніл, хінолізиніл, хінолініл, цинолініл, фталазиніл, хіназолініл, хіноксалініл або нафтиридиніл, де
кожний із зазначених гетероциклів необов'язково заміщений одним або двома замісниками, кожний з яких незалежно вибраний з галогену, С1-6алкілу, С1-6алкокси, ціано, аміно, моно- або ді(С1-4алкіл)аміно.
2. Сполука за п. 1, де кожен X являє собою N, R1 являє собою феніл або феніл, необов'язково заміщений галогеном, С1-6алкілом, С1-6алкілокси, полігалогенС1-6алкілом або арилом; R2 являє собою CH2-R5 або -C(=O)-R6, кожен R5 незалежно вибраний з водню, гідрокси, С1-6алкілокси, С1-6алкілоксіС1-6алкілокси, С1-6алкілкарбонілокси, N-метилпіперазинілу, морфолінілу або імідазолілу; кожен R6 незалежно вибраний з С1-6алкіламіно, С1-6циклоалкіламіно, гідроксіС1-6алкіламіно, ді(С1-6алкіл)аміноС1-6алкіламіно або морфолінілу, R3 являє собою водень та R4 являє собою водень або С1-6алкіл.
3. Сполука за пп. 1 та 2, де кожен X являє собою N, R1 являє собою феніл або феніл, заміщений галогеном; R2 являє собою -CH2-R5; кожен R5 незалежно вибраний з водню, гідрокси, С1-6алкілокси або С1-6алкілкарбонілокси; R3 являє собою водень та R4 являє собою водень.
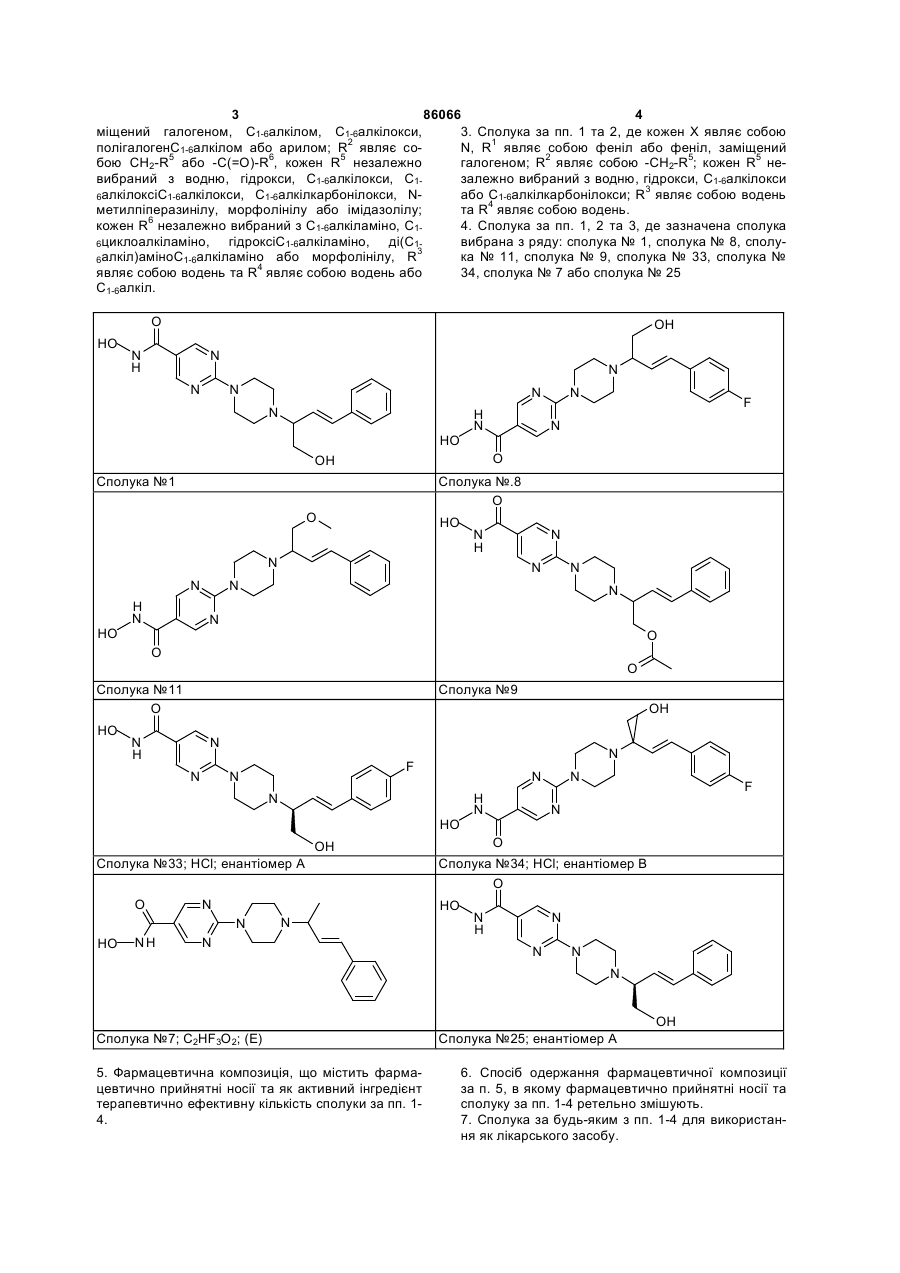
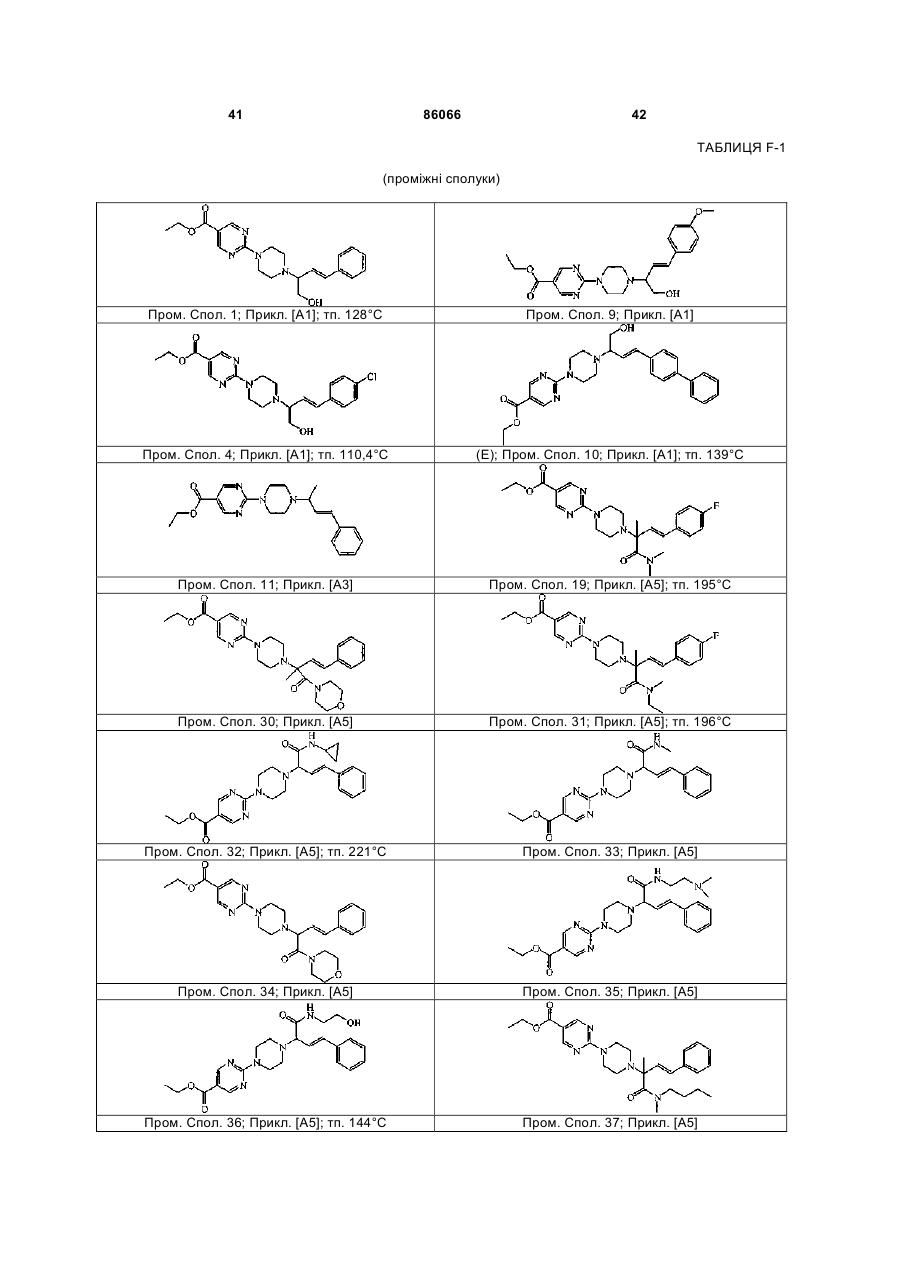
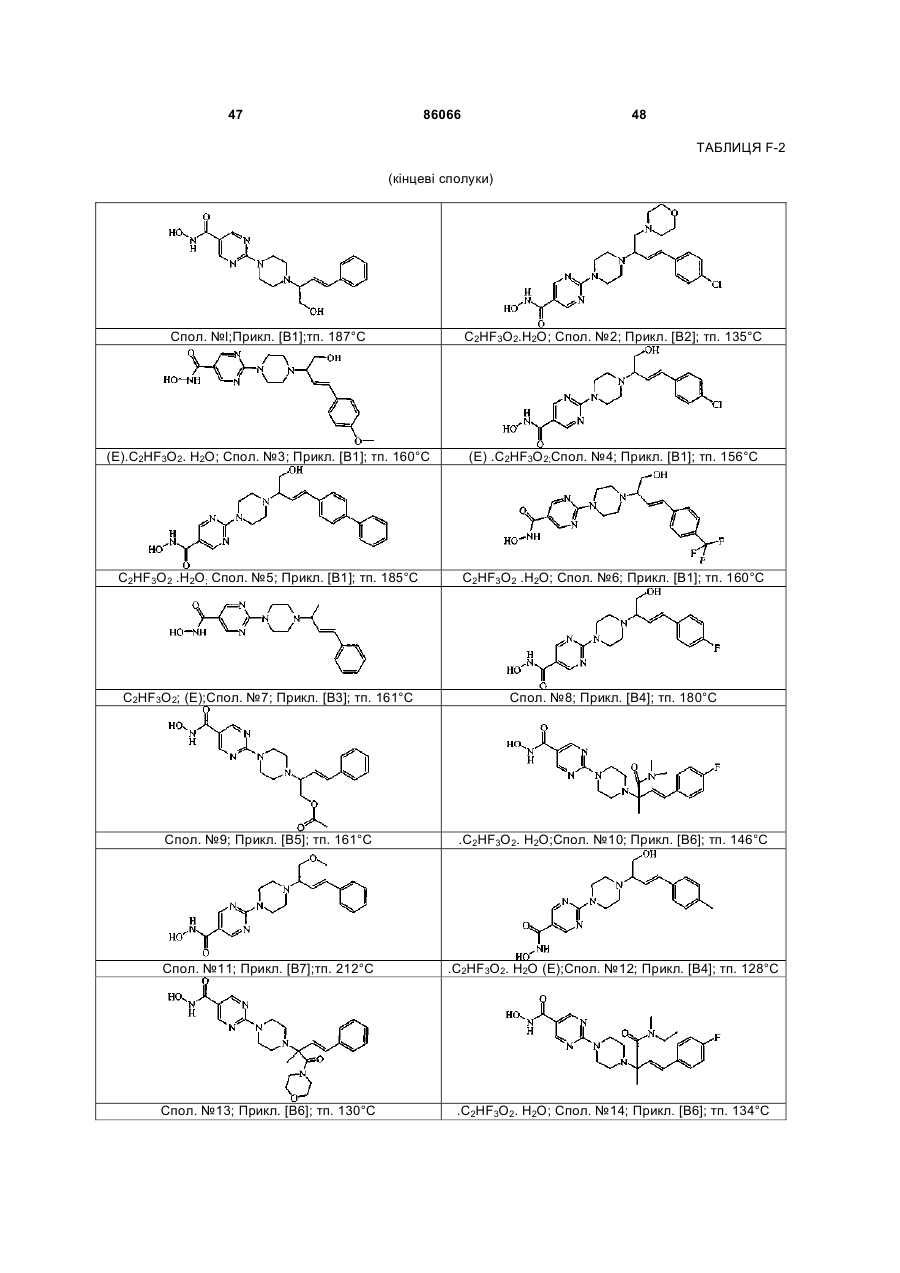
4. Сполука за пп. 1, 2 та 3, де зазначена сполука вибрана з ряду: сполука № 1, сполука № 8, сполука № 11, сполука № 9, сполука № 33, сполука № 34, сполука № 7 або сполука № 25
Сполука №1
Сполука №.8
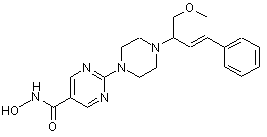
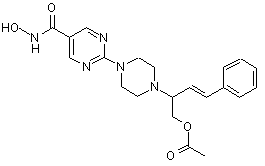
Сполука №11
Сполука №9
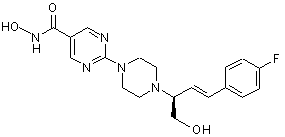
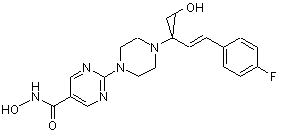
Сполука №33; HCl; енантіомер А
Сполука №34; HCl; енантіомер В
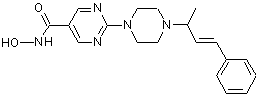
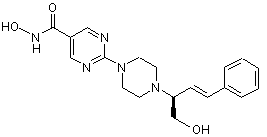
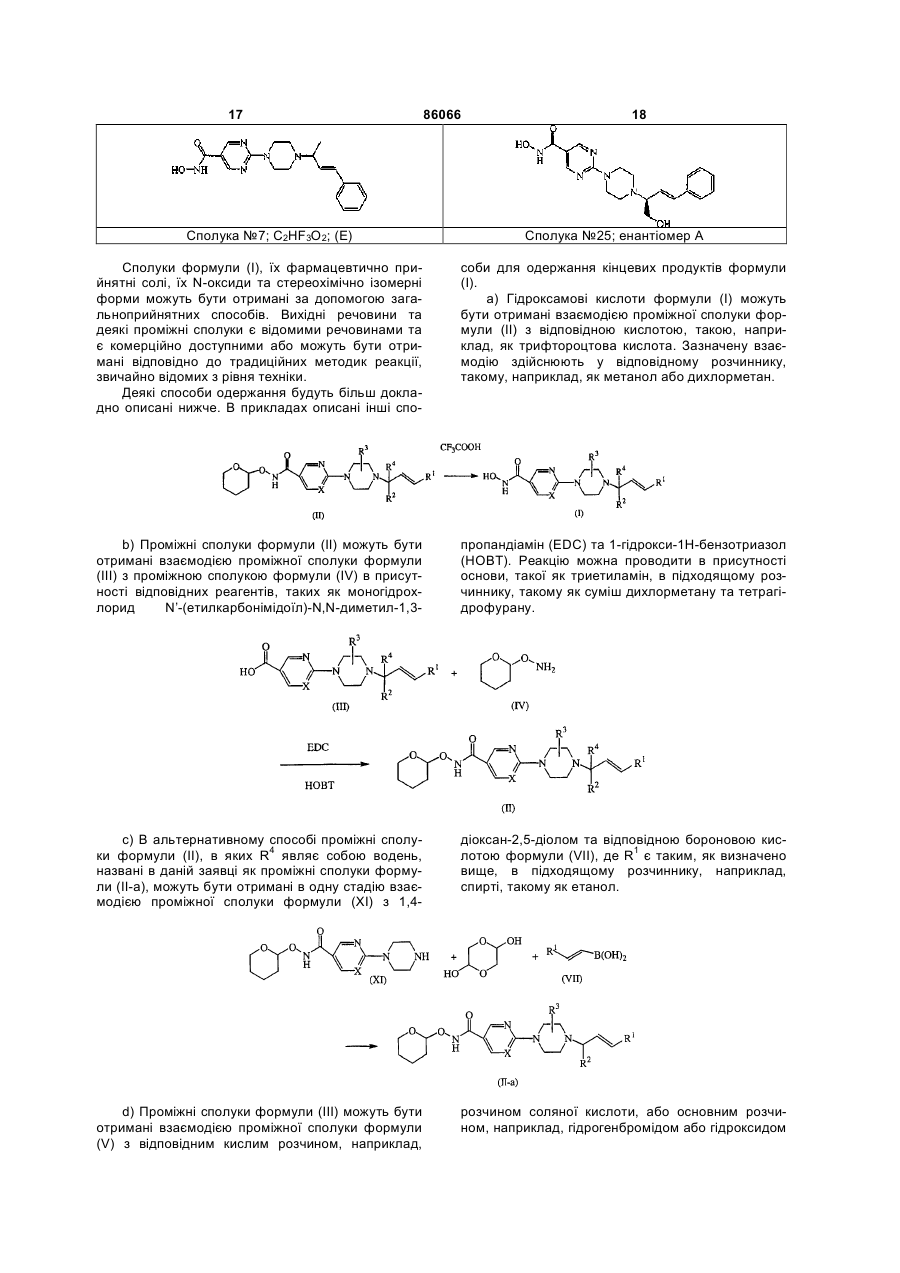
Сполука №7; C2HF3O2; (E)
Сполука №25; енантіомер А
5. Фармацевтична композиція, що містить фармацевтично прийнятні носії та як активний інгредієнт терапевтично ефективну кількість сполуки за пп. 1-4.
6. Спосіб одержання фармацевтичної композиції за п. 5, в якому фармацевтично прийнятні носії та сполуку за пп. 1-4 ретельно змішують.
7. Сполука за будь-яким з пп. 1-4 для використання як лікарського засобу.
8. Застосування сполуки за будь-яким з пп. 1-4 для виробництва лікарського засобу для лікування проліферативних захворювань.
9. Комбінація протиракового засобу та інгібітора HDAC за будь-яким з пп. 1-4.
10. Спосіб одержання сполуки за п. 1, який відрізняється тим, що здійснюють взаємодію проміжної сполуки формули (II) з відповідною кислотою з утворенням гідроксамової кислоти формули (І)
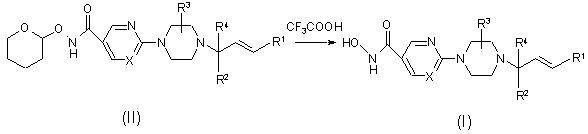 .
.
11. Сполука формули (V)
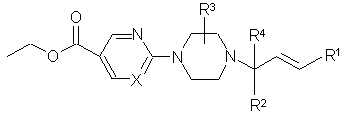 , (V)
, (V)
її N-оксидні форми, фармацевтично прийнятні кислотно-адитивні солі та стереохімічно ізомерні форми, де
кожен X незалежно являє собою N або СН;
R1 являє собою феніл, нафталініл або гетероцикліл; де кожен зазначений феніл або нафталініл необов'язково заміщений одним або двома замісниками, кожний з яких незалежно вибраний з галогену, С1-6алкілу, С1-6алкокси, полігалогенС1-6алкілу, арилу, гідрокси, ціано, аміно, С1-6алкілкарбоніламіно, С1-6алкілсульфоніламіно, гідроксикарбонілу, С1-6алкілоксикарбонілу, гідроксіС1-6алкілу, С1-6алкілоксиметилу, амінометилу, С1-6алкіламінометилу, С1-6алкілкарбоніламінометилу, С1-6алкілсульфоніламінометилу, аміносульфонілу, С1-6алкіламіносульфонілу або гетероциклілу;
R2 являє собою водень, -CH2-R5, трифторметил, -C(=O)-R6 або -CH2-NR7R8, де кожен R5 незалежно вибраний з водню, гідрокси, С1-6алкілокси, С1-6алкілоксіС1-6алкілокси, С1-6алкілкарбонілокси, піперазинілу, N-метилпіперазинілу, морфолінілу, тіоморфолінілу, імідазолілу або триазолілу; кожен R6 незалежно вибраний з гідрокси, С1-6алкілокси, аміно або моно- чи ді(С1-6алкіл)аміно, С1-6циклоалкіламіно, гідроксіС1-6алкіламіно, піперазинілу, моно- або ді(С1-6алкіл)аміноС1-6алкіламіно, N-метилпіперазинілу, морфолінілу або тіоморфолінілу; кожен R7 та R8 незалежно вибрані з водню, С1-6алкілу, С1-6алкілкарбонілу, С1-6алкілсульфонілу або моно- чи ді(С1-4алкіл)аміносульфонілу;
R3 являє собою водень, гідроксиметил, амінометил або моно- чи ді(С1-6алкіл)амінометил;
R4 являє собою водень або С1-6алкіл;
вищевказаний арил являє собою феніл або нафталініл, де кожен зазначений феніл або нафталініл необов'язково заміщений одним або двома замісниками, кожний з яких незалежно вибраний з галогену, С1-6алкілу, С1-6алкокси, трифторметилу, ціано або гідроксикарбонілу; та
вищевказаний гетероцикліл являє собою фураніл, тієніл, піроліл, піролініл, піролідиніл, діоксоліл, оксазоліл, тіазоліл, імідазоліл, імідазолініл, імідазолідиніл, піразоліл, піразолініл, піразолідиніл, ізоксазоліл, ізотіазоліл, оксадіазоліл, триазоліл, тіадіазоліл, піраніл, піридиніл, піперидиніл, діоксаніл, морфолініл, дитіаніл, тіоморфолініл, піридазиніл, піримідиніл, піразиніл, піперазиніл, триазиніл, тритіаніл, індолізиніл, індоліл, індолініл, бензофураніл, бензотіофеніл, індазоліл, бензимідазоліл, бензтіазоліл, пуриніл, хінолізиніл, хінолініл, цинолініл, фталазиніл, хіназолініл, хіноксалініл або нафтиридиніл, де
кожний із зазначених гетероциклів необов'язково заміщений одним або двома замісниками, кожний з яких незалежно вибраний з галогену, С1-6алкілу, С1-6алкокси, ціано, аміно, моно- або ді(С1-4алкіл)аміно.
12. Спосіб одержання сполуки за п. 11, який відрізняється тим, що здійснюють
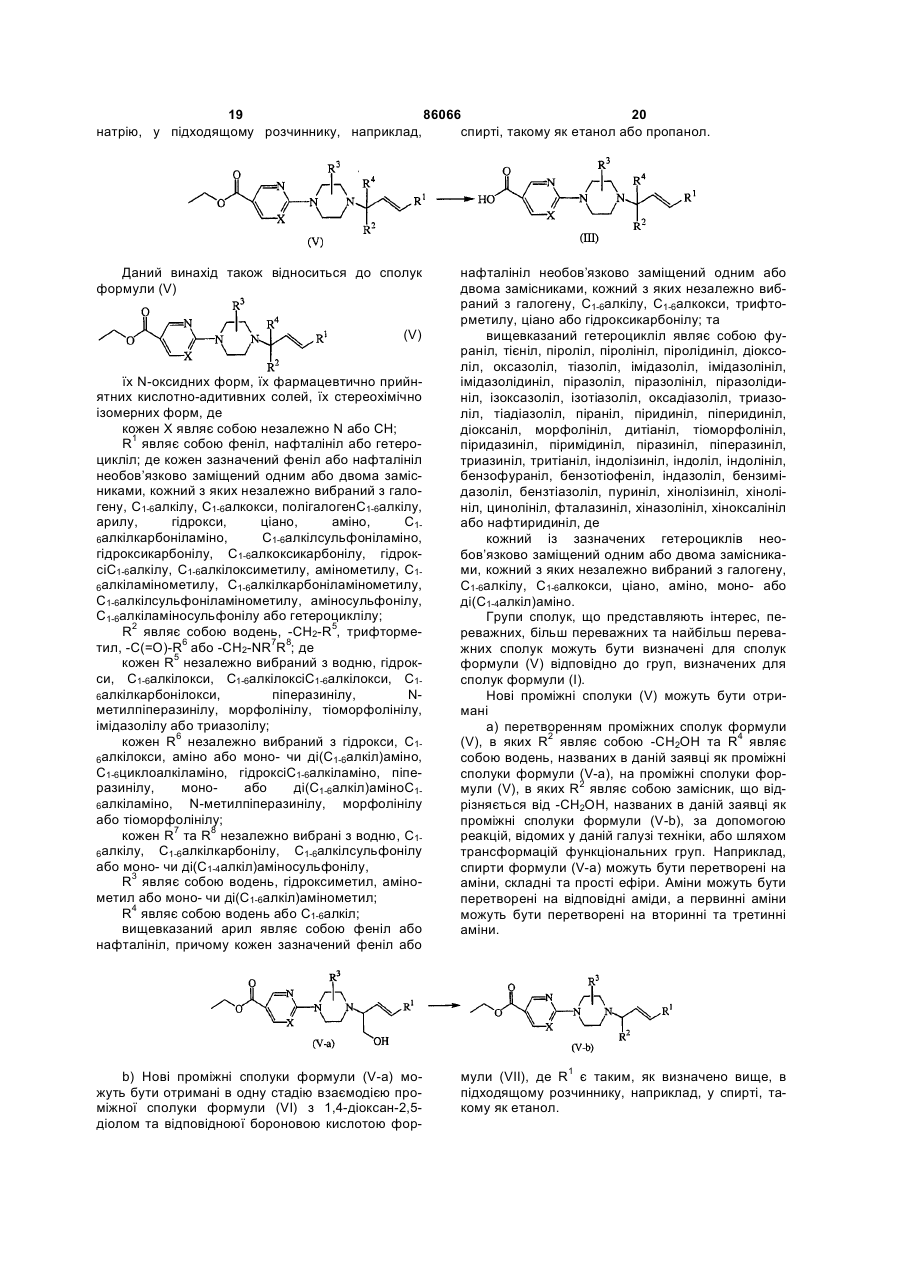
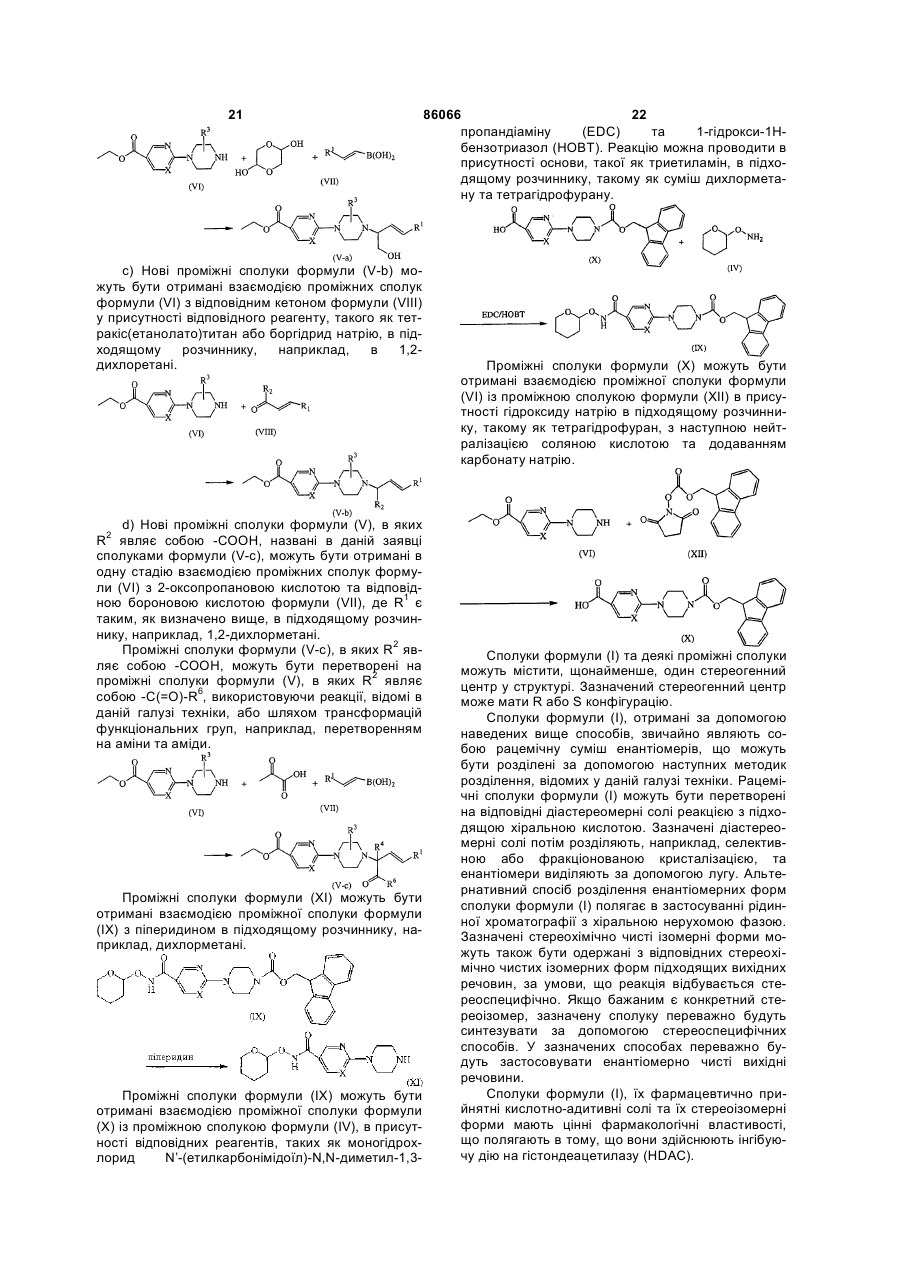
a) перетворення сполук формули (V), в яких R2 являє собою -СН2ОН та R4 являє собою водень, названих сполуками формули (V-a), на сполуки формули (V), в яких R2 являє собою замісник, що відрізняється від -СН2ОН, названих сполуками формули (V-b), за допомогою реакцій, відомих у даній галузі техніки, або шляхом трансформацій функціональних груп
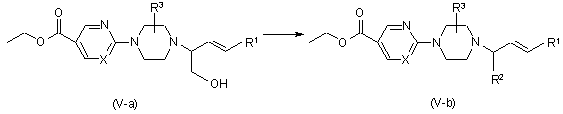 , та
, та
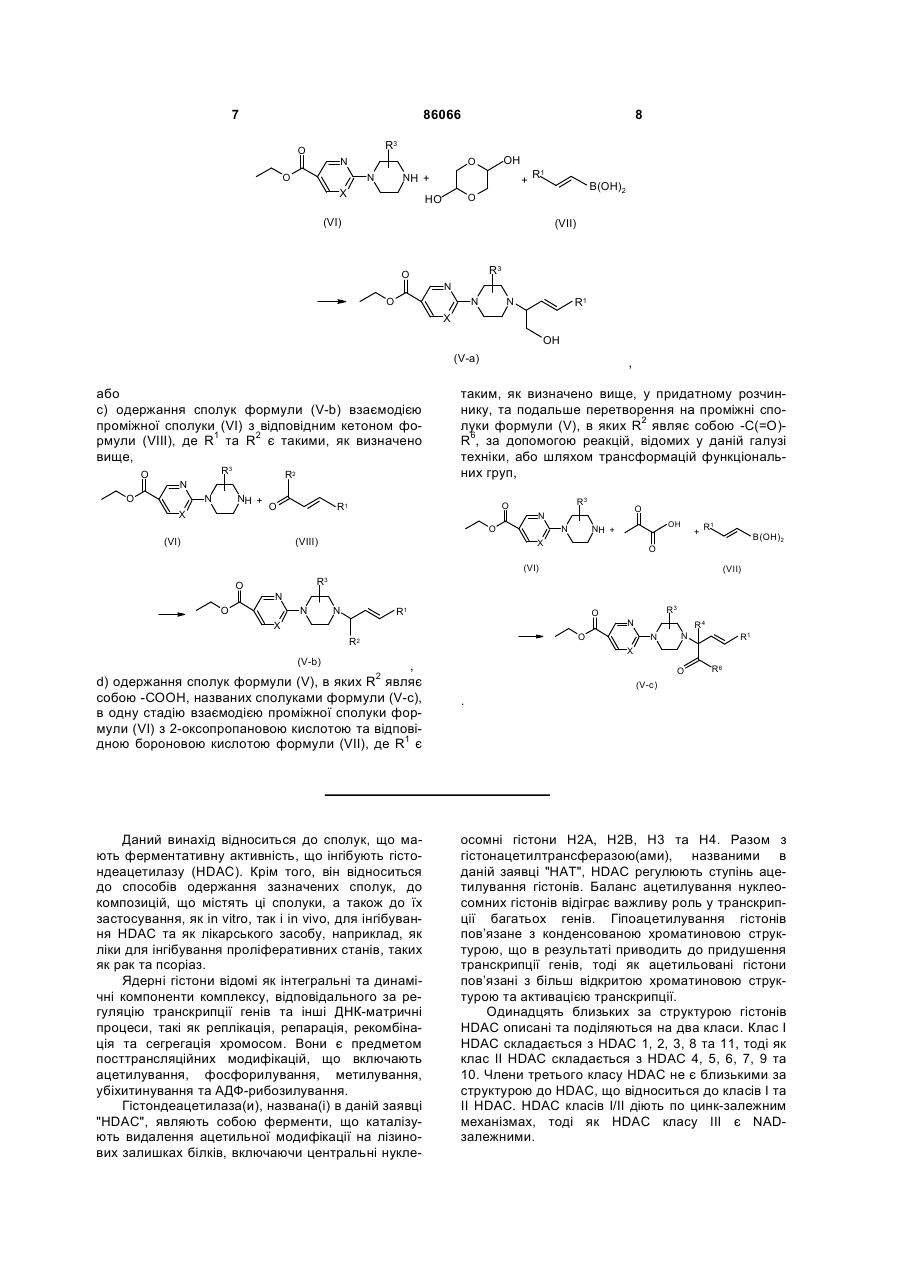
b) одержання сполук формули (V-a) в одну стадію взаємодією проміжної сполуки формули (VI) з 1,4-діоксан-2,5-діолом та відповідною бороновою кислотою формули (VII), де R1 є таким, як визначено вище,
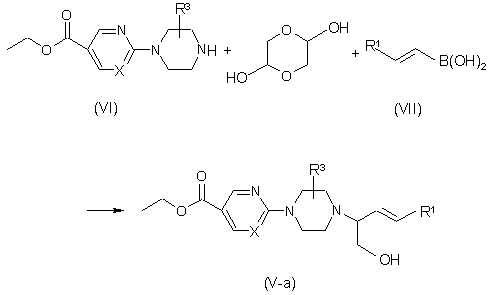 , або
, або
c) одержання сполук формули (V-b) взаємодією проміжної сполуки (VI) з відповідним кетоном формули (VIII), де R1 та R2 є такими, як визначено вище,
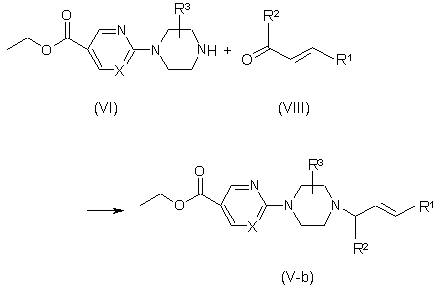 ,
,
d) одержання сполук формули (V), в яких R2 являє собою -СООН, названих сполуками формули (V-c), в одну стадію взаємодією проміжної сполуки формули (VI) з 2-оксопропановою кислотою та відповідною бороновою кислотою формули (VII), де R1 є таким, як визначено вище, у придатному розчиннику, та подальше перетворення на проміжні сполуки формули (V), в яких R2 являє собою -C(=О)-R6, за допомогою реакцій, відомих у даній галузі техніки, або шляхом трансформацій функціональних груп,
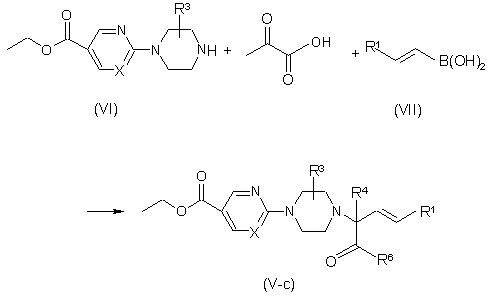 .
.
Текст
1. Сполука формули (І) C2 2 (19) 1 3 86066 4 міщений галогеном, С1-6алкілом, С1-6алкілокси, 3. Сполука за пп. 1 та 2, де кожен X являє собою полігалогенС1-6алкілом або арилом; R2 являє соN, R1 являє собою феніл або феніл, заміщений бою CH2-R5 або -C(=O)-R6, кожен R5 незалежно галогеном; R2 являє собою -CH2-R5; кожен R5 невибраний з водню, гідрокси, С1-6алкілокси, С1залежно вибраний з водню, гідрокси, С1-6алкілокси або С1-6алкілкарбонілокси; R3 являє собою водень 6алкілоксіС1-6алкілокси, С1-6алкілкарбонілокси, Nметилпіперазинілу, морфолінілу або імідазолілу; та R4 являє собою водень. 6 кожен R незалежно вибраний з С1-6алкіламіно, С14. Сполука за пп. 1, 2 та 3, де зазначена сполука гідроксіС1-6алкіламіно, ді(С1вибрана з ряду: сполука № 1, сполука № 8, сполу6циклоалкіламіно, 3 ка № 11, сполука № 9, сполука № 33, сполука № 6алкіл)аміноС1-6алкіламіно або морфолінілу, R являє собою водень та R4 являє собою водень або 34, сполука № 7 або сполука № 25 С1-6алкіл. O HO OH N H N N N N N HO H N F N O OH Сполука №1 Сполука №.8 O O HO N H N N H N N N N N HO N N N N O O O Сполука №11 O HO Сполука №9 OH N H N N N F N N N HO H N O N HO NH N N N Сполука №34; HCl; енантіомер В O HO N F O OH Сполука №33; HCl; енантіомер А N N H N N N N OH Сполука №7; C2HF3O2; (E) 5. Фармацевтична композиція, що містить фармацевтично прийнятні носії та як активний інгредієнт терапевтично ефективну кількість сполуки за пп. 14. Сполука №25; енантіомер А 6. Спосіб одержання фармацевтичної композиції за п. 5, в якому фармацевтично прийнятні носії та сполуку за пп. 1-4 ретельно змішують. 7. Сполука за будь-яким з пп. 1-4 для використання як лікарського засобу. 5 86066 6 8. Застосування сполуки за будь-яким з пп. 1-4 для 10. Спосіб одержання сполуки за п. 1, який відрізвиробництва лікарського засобу для лікування няється тим, що здійснюють взаємодію проміжної проліферативних захворювань. сполуки формули (II) з відповідною кислотою з 9. Комбінація протиракового засобу та інгібітора утворенням гідроксамової кислоти формули (І) HDAC за будь-яким з пп. 1-4. R3 O O N O N H R4 R1 N N R3 O CF3COOH HO N N H X R2 R4 R1 N N X R2 (II) (I) 11. Сполука формули (V) O R3 N O R4 R1 N N (V) X R2 , її N-оксидні форми, фармацевтично прийнятні кислотно-адитивні солі та стереохімічно ізомерні форми, де кожен X незалежно являє собою N або СН; R1 являє собою феніл, нафталініл або гетероцикліл; де кожен зазначений феніл або нафталініл необов'язково заміщений одним або двома замісниками, кожний з яких незалежно вибраний з галогену, С1-6алкілу, С1-6алкокси, полігалогенС1-6алкілу, арилу, гідрокси, ціано, аміно, С1С1-6алкілсульфоніламіно, 6алкілкарбоніламіно, гідроксикарбонілу, С1-6алкілоксикарбонілу, гідроксіС1-6алкілу, С1-6алкілоксиметилу, амінометилу, С16алкіламінометилу, С1-6алкілкарбоніламінометилу, С1-6алкілсульфоніламінометилу, аміносульфонілу, С1-6алкіламіносульфонілу або гетероциклілу; R2 являє собою водень, -CH2-R5, трифторметил, C(=O)-R6 або -CH2-NR7R8, де кожен R5 незалежно вибраний з водню, гідрокси, С1-6алкілокси, С16алкілоксіС1-6алкілокси, С1-6алкілкарбонілокси, піперазинілу, N-метилпіперазинілу, морфолінілу, тіоморфолінілу, імідазолілу або триазолілу; кожен R6 незалежно вибраний з гідрокси, С1-6алкілокси, аміно або моно- чи ді(С1-6алкіл)аміно, С16циклоалкіламіно, гідроксіС1-6алкіламіно, піперазинілу, моно- або ді(С1-6алкіл)аміноС1-6алкіламіно, Nметилпіперазинілу, морфолінілу або тіоморфолінілу; кожен R7 та R8 незалежно вибрані з водню, С1С1-6алкілкарбонілу, С1-6алкілсульфонілу 6алкілу, або моно- чи ді(С1-4алкіл)аміносульфонілу; O R3 являє собою водень, гідроксиметил, амінометил або моно- чи ді(С1-6алкіл)амінометил; R4 являє собою водень або С1-6алкіл; вищевказаний арил являє собою феніл або нафталініл, де кожен зазначений феніл або нафталініл необов'язково заміщений одним або двома замісниками, кожний з яких незалежно вибраний з галогену, С1-6алкілу, С1-6алкокси, трифторметилу, ціано або гідроксикарбонілу; та вищевказаний гетероцикліл являє собою фураніл, тієніл, піроліл, піролініл, піролідиніл, діоксоліл, оксазоліл, тіазоліл, імідазоліл, імідазолініл, імідазолідиніл, піразоліл, піразолініл, піразолідиніл, ізоксазоліл, ізотіазоліл, оксадіазоліл, триазоліл, тіадіазоліл, піраніл, піридиніл, піперидиніл, діоксаніл, морфолініл, дитіаніл, тіоморфолініл, піридазиніл, піримідиніл, піразиніл, піперазиніл, триазиніл, тритіаніл, індолізиніл, індоліл, індолініл, бензофураніл, бензотіофеніл, індазоліл, бензимідазоліл, бензтіазоліл, пуриніл, хінолізиніл, хінолініл, цинолініл, фталазиніл, хіназолініл, хіноксалініл або нафтиридиніл, де кожний із зазначених гетероциклів необов'язково заміщений одним або двома замісниками, кожний з яких незалежно вибраний з галогену, С1-6алкілу, С1-6алкокси, ціано, аміно, моно- або ді(С14алкіл)аміно. 12. Спосіб одержання сполуки за п. 11, який відрізняється тим, що здійснюють a) перетворення сполук формули (V), в яких R2 являє собою -СН2ОН та R4 являє собою водень, названих сполуками формули (V-a), на сполуки формули (V), в яких R2 являє собою замісник, що відрізняється від -СН2ОН, названих сполуками формули (V-b), за допомогою реакцій, відомих у даній галузі техніки, або шляхом трансформацій функціональних груп R3 O N O N N R1 X R3 N O N N R1 X R2 OH (V-a) та b) одержання сполук формули (V-a) в одну стадію взаємодією проміжної сполуки формули (VI) з 1,4 (V-b) , діоксан-2,5-діолом та відповідною бороновою кислотою формули (VII), де R1 є таким, як визначено вище, 7 86066 8 R3 O N OH O O N NH + X + R1 B(OH)2 O HO (VI) (VII) O R3 N O N N R1 X OH (V-a) або c) одержання сполук формули (V-b) взаємодією проміжної сполуки (VI) з відповідним кетоном формули (VIII), де R1 та R2 є такими, як визначено вище, O R3 R2 N O N NH + X , таким, як визначено вище, у придатному розчиннику, та подальше перетворення на проміжні сполуки формули (V), в яких R2 являє собою -C(=О)R6, за допомогою реакцій, відомих у даній галузі техніки, або шляхом трансформацій функціональних груп, O R1 O R3 O (VIII) (VI) O N N OH NH + X + R1 (VI) O B(OH)2 O (VII) R3 N O N N R1 O X O R2 (V-b) , d) одержання сполук формули (V), в яких R2 являє собою -СООН, названих сполуками формули (V-c), в одну стадію взаємодією проміжної сполуки формули (VI) з 2-оксопропановою кислотою та відповідною бороновою кислотою формули (VII), де R1 є Даний винахід відноситься до сполук, що мають ферментативну активність, що інгібують гістондеацетилазу (HDAC). Крім того, він відноситься до способів одержання зазначених сполук, до композицій, що містять ці сполуки, а також до їх застосування, як in vitro, так і in vivo, для інгібування HDAC та як лікарського засобу, наприклад, як ліки для інгібування проліферативних станів, таких як рак та псоріаз. Ядерні гістони відомі як інтегральні та динамічні компоненти комплексу, відповідального за регуляцію транскрипції генів та інші ДНК-матричні процеси, такі як реплікація, репарація, рекомбінація та сегрегація хромосом. Вони є предметом посттрансляційних модифікацій, що включають ацетилування, фосфорилування, метилування, убіхитинування та АДФ-рибозилування. Гістондеацетилаза(и), названа(і) в даній заявці "HDAC", являють собою ферменти, що каталізують видалення ацетильної модифікації на лізинових залишках білків, включаючи центральні нукле R3 N R4 N N R1 X O R6 (V-c) . осомні гістони H2A, H2B, H3 та H4. Разом з гістонацетилтрансферазою(ами), названими в даній заявці "HAT", HDAC регулюють ступінь ацетилування гістонів. Баланс ацетилування нуклеосомних гістонів відіграє важливу роль у транскрипції багатьох генів. Гіпоацетилування гістонів пов’язане з конденсованою хроматиновою структурою, що в результаті приводить до придушення транскрипції генів, тоді як ацетильовані гістони пов’язані з більш відкритою хроматиновою структурою та активацією транскрипції. Одинадцять близьких за структурою гістонів HDAC описані та поділяються на два класи. Клас I HDAC складається з HDAC 1, 2, 3, 8 та 11, тоді як клас II HDAC складається з HDAC 4, 5, 6, 7, 9 та 10. Члени третього класу HDAC не є близькими за структурою до HDAC, що відноситься до класів I та II HDAC. HDAC класів I/II діють по цинк-залежним механізмах, тоді як HDAC класу III є NADзалежними. 9 86066 10 Інші білки, крім гістонів, також є субстратом У заявці [EP 1 472 216, опублікованій 14 серпдля ацетилування, конкретно, транскрипційними ня 2003р.], описані біциклічні гідроксамати як інгіфакторами, такими як p53, GATA-1 та E2F; ядербітори гістондеацетилази. ними рецепторами, наприклад, такими як глюкокоУ патентних заявках [EP 1 485 099, EP 1 485 ртикоїдний рецептор, тироїдними рецепторами, 348, EP 1 485 353, EP 1 485 354, EP 1 485 364, EP естрогеновими рецепторами; та регуляторними 1 485 365, EP 1 485 370, EP 1 485 378, опубліковабілками клітинного циклу, такими як pRb. Ацетилуних на 18 вересня 2003р.], серед інших сполук вання білків пов’язане з їх стабілізацією, наприописані заміщені піперазинілпіримідинілгідрокклад, стабілізацією p53, рекрутингом кофакторів та самові кислоти як інгібітори гістондеацетилази, збільшеним зв’язуванням ДНК. p53 являє собою крім того, у заявці [EP 1 485 365] описаний супресор пухлин, що може викликати блокування R306465. клітинного циклу та апоптоз у відповідь на безліч У патентній заявці [EP 1 492 534, опубліковастрес-сигналів, таких як ушкодження ДНК. Головній на 9 жовтня 2003р.], описані похідні карбаміноною мішенню блокування p53-індукованого клітинвої кислоти, що містять піперазиновий фрагмент, ного циклу, очевидно, є ген p21. Після його актияк інгібітори HDAC. вації геном p53, p21 був ідентифікований завдяки У патентній заявці [EP 1 495 002, опубліковайого асоціації з циклін/циклін-залежними комплекній на 23 жовтня 2003р.], описані заміщені похідні сами кінази, що приводить до блокування клітинпіперазинілфенілбензаміду як інгібітори гістондеаного циклу, як у G1, так і G2 фазах, позитивній цетилази. регуляції під час старіння та його взаємодії з ядеУ патентній заявці [WO 04/009536, опубліковарним антигеном проліферуючих клітин. ній на 29 січня 2004р.], описані похідні, що містять Дослідження інгібіторів HDAC вказує на їх ваалкільний лінкер між арильною групою та гідрокжливу роль у блокуванні клітинного циклу, дифесаматом, як інгібітори гістондеацетилази. ренціації клітин, апоптозі та реверсії трансформоУ патентній заявці [EP 1 525 199, опубліковаваних фенотипів. ній на 12 лютого 2004р.], описані (гетеНаприклад, інгібітор трихостатин А (TSA) виро)арилалкеніл-заміщені біциклічні гідроксамати як кликає блокування клітинного циклу, як у G1, так і інгібітори гістондеацетилази. G2 фазах, реверсує трансформований фенотип У патентній заявці [WO 04/063146, опубліковарізних клітинних ліній та індукує диференціацію ній на 29 липня 2004р.], описані похідні Nклітин лейкемії Фрейнда й інших. Повідомляють, гідроксибензамідів з протизапальною та протипухщо TSA (та субероїланілід гідроксамової кислоти линною активністю. SAHA) інгібує ріст клітин, індукує термінальну диУ патентній заявці [WO 04/063169, опубліковаференціацію та запобігає утворенню пухлин у миній на 29 липня 2004р.], описані похідні заміщених шей [Finnin et al., Nature, 401: 188-193, 1999]. арилгідроксаматів як інгібітори гістондеацетилази. Повідомляють також, що трихостатин А (TSA) У патентній заявці [WO 04/072047, опубліковазастосовують при лікуванні фіброзу, наприклад, ній на 26 серпня 2004р.], описані індоли, бензиміфіброзу печінки та цирозу печінки. [Geerts et al., дазоли та нафтимідазоли як інгібітори гістондеаEuropean Patent Application EP 0 827 742, published цетилази. 11 March, 1998]. У патентній заявці [WO 04/082638, опубліковаФармакофор для інгібіторів HDAC складається ній на 30 вересня 2004р.], описані гідроксамати, з домену, що зв’язує метал, що взаємодіє з цинквз’єднані з неароматичними гетероциклічними кільмісним активним сайтом HDAC, лінкерним домецевими системами, як інгібітори гістондеацетиланом та поверхневим доменом розпізнавання або зи. кепіруючою областю, що взаємодіє із залишками У патентній заявці [WO 04/092115, опублікована краю активного сайта. ній на 28 жовтня 2004р.], описані похідні гідроксаТакож є повідомлення про те, що інгібітори матів як інгібітори гістондеацетилази. HDAC індукують експресію p21 гена. ТранскрипУ патентній заявці [WO 05/028447, опубліковаційна активація p21 гена зазначеними інгібіторами ній на 31 березня 2005р.], описані бензимідазоли прискорюється перебудовуванням хроматину, пояк інгібітори гістондеацетилази. тім ацетилуванням гістонів H3 та H4 в області У патентних заявках [WO 05/030704 та WO промотування p21 гена. Згадана активація p21 05/030705, опублікованих на 7 квітня 2005р.], опивідбувається незалежно від р53 та, отже, HDAC сані бензаміди як інгібітори гістондеацетилази. інгібітори діють в клітинах з мутованими генами У патентній заявці [WO 05/040101, опубліковаp53, відмітною ознакою численних пухлин. ній на 6 травня 2005р.], описані гідроксамати, Крім того, HDAC інгібітори можуть мати незв’язані з ацилсечовиною та сульфонілсечовиною, прямі види активності, такі як посилення імунних як інгібітори гістондеацетилази. відповідей „хазяїна” та інгібування ангіогенеза пуУ патентній заявці [WO 05/040161, також опухлин та, отже, вони можуть придушувати ріст перблікованій на 6 травня 2005р.], описані біарильні винних пухлин та перешкоджати утворенню метапохідні гідроксаматів як інгібітори гістондеацетиластаз [Mai et al., Medicinal Research Reviews, 25. зи. 261-309]. Сполуки за даним винаходом відрізняються Приймаючи до уваги зазначене вище, інгібітовід сполук, відомих з рівня техніки, за своєю струкри HDAC можуть мати великий потенціал у лікутурою, фармакологічною активністю та/або фарванні клітинних проліферативних захворювань або макологічною ефективністю. станів, у тому числі пухлин з мутованими генами Проблема, що повинна бути вирішена, полягає p53. в створенні інгібіторів гістондеацетилази з високою 11 86066 12 ферментативною та клітинною активністю, що мараний з галогену, С1-6алкілу, С1-6алкокси, трифтоють підвищену біодоступність та/або ефективність рметилу, ціано або гідроксикарбонілу; та in vivo. вищевказаний гетероцикліл являє собою фуНові сполуки за даним винаходом вирішують раніл, тієніл, піроліл, піролініл, піролідиніл, діоксовищеописану проблему. Сполуки за даним виналіл, оксазоліл, тіазоліл, імідазоліл, імідазолініл, ходом виявляють чудову ферментативну та кліімідазолідиніл, піразоліл, піразолініл, піразолідитинну активність, що інгібує гістондеацетилазу. ніл, ізоксазоліл, ізотіазоліл, оксадіазоліл, триазоВони мають високий потенціал для активації гена ліл, тіадіазоліл, піраніл, піридиніл, піперидиніл, p21, як на клітинному, так і на in vivo рівні. Вони діоксаніл, морфолініл, дитіаніл, тіоморфолініл, мають необхідний фармакокінетичний профіль та піридазиніл, піримідиніл, піразиніл, піперазиніл, низьку афінність у відношенні P450 ферментів, що триазиніл, тритіаніл, індолізиніл, індоліл, індолініл, знижує ризик небажаної взаємодії ліки-ліки та добензофураніл, бензотіофеніл, індазоліл, бензимізволяє також розширити межі безпеки. дазоліл, бензтіазоліл, пуриніл, хінолізиніл, хіноліПеревагами сполук за даним винаходом є меніл, цинолініл, фталазиніл, хіназолініл, хіноксалініл таболічна стабільність, розчинність та/або індукуабо нафтиридиніл, де юча здатність р21. Зокрема, багато сполук за дакожний із зазначених гетероциклів неоним винаходом мають збільшений період бов’язково заміщений одним або двома замісниканапіввиведення в гепатоцитах пацюків, мають підми, кожний з яких незалежно вибраний з галогену, вищену розчинність/стабільність у водних розчиС1-6алкілу, С1-6алкокси, ціано, аміно, моно- або нах та/або мають підвищену in vivo здатність індуді(С1-4алкіл)аміно. кувати промотор p21. Термін "інгібітор гістондеацетилази" викорисДаний винахід відноситься до сполук формули товують для ідентифікації сполуки, що здатна вза(I) ємодіяти з гістондеацетилазою та інгібувати її активність, більш конкретно, інгібувати її ферментативну активність. Інгібування фермента(I) тивної активності гістондеацетилази означає зменшення здатності гістондеацетилази видаляти ацетильну групу з гістона. Таке інгібування переїх N-оксидних форм, їх фармацевтично прийнважно є специфічним, тобто інгібітор гістондеацеятних кислотно-адитивних солей та їх стереохімічтилази зменшує здатність гістондеацетилази вино ізомерних форм, де даляти ацетильну групу з гістона при концентрації кожен X незалежно являє собою N або CH; нижче, ніж концентрація інгібітору, що потрібно R1 являє собою феніл, нафталініл або гетеродля одержання іншого, не зв’язаного із зазначеним цикліл; де кожен зазначений феніл або нафталініл вище, біологічного ефекту. необов’язково заміщений одним або двома замісУ приведених вище та нижче визначеннях тениками, кожний з яких незалежно вибраний з галормін “галоген” є загальним терміном для фтору, гену, С1-6алкілу, С1-6алкокси, полігалогенС1-6алкілу, хлору, брому та йоду; термін C1-4алкіл позначає арилу, гідрокси, ціано, аміно, С1насичені вуглеводневі радикали з лінійним або С1-6алкілсульфоніламіно, 6алкілкарбоніламіно, розгалуженим ланцюгом, що містять від 1 до 4 гідроксикарбонілу, С1-6алкоксикарбонілу, гідрокатомів вуглецю, такі як, наприклад, метил, етил, сіС1-6алкілу, С1-6алкілоксиметилу, амінометилу, С1пропіл, бутил, 1-метилетил, 2-метилпропіл та т.п.; 6алкіламінометилу, С1-6алкілкарбоніламінометилу, термін C1-6алкіл включає C1-4алкіл та більш складні С1-6алкілсульфоніламінометилу, аміносульфонілу, гомологи, що містять 5-6 атомів вуглецю, такі як, C1-6алкіламіносульфонілу або гетероциклілу; наприклад, пентил, 2-метилбутил, гексил, 2R2 являє собою водень, -CH2-R5, трифтормеметилпентил та т.п., полігалогенС1-6алкіл позначає тил, -C(=O)-R6 або -CH2-NR7R8, де кожен R5 незаC1-6алкіл, що містить три однакові або різні атоми лежно вибраний з водню, гідрокси, С1-6алкілокси, галогену як замісники, наприклад, трифторметил; С1-6алкілоксіС1-6алкілокси, С1-6алкілкарбонілокси, та C3-6циклоалкіл включає циклічні вуглеводневі піперазинілу, N-метилпіперазинілу, морфолінілу, групи, що містять від 3 до 6 атомів вуглецю, такі як тіоморфолінілу, імідазолілу або триазолілу; циклопропіл, циклобутил, циклопентил, циклопенкожен R6 незалежно вибраний з гідрокси, С1теніл, циклогексил та т.п. 6алкілокси, аміно або моно- чи ді(С1-6алкіл)аміно, Термін “фармацевтично прийнятні адитивні С1-6циклоалкіламіно, гідроксіС1-6алкіламіно, піпесолі” включає фармацевтично прийнятні кислотноразинілу, моноабо ді(С1-6алкіл)аміноC1адитивні солі та фармацевтично прийнятні основN-метилпіперазинілу, морфолінілу 6 алкіламіно, но-адитивні солі. Мається на увазі, що фармацевабо тіоморфолінілу; тично прийнятні кислотно-адитивні солі, як зазнакожен R7 та R8 незалежно вибрані з водню, С1чено вище, включають терапевтично активні алкілу, С1-6алкілкарбонілу, C1-6алкілсульфонілe 6 нетоксичні кислотно-адитивні сольові форми, що або моно- чи ді(C1-4алкіл)аміносульфонілу, здатні утворювати сполуки формули (I). Сполуки R3 являє собою водень, гідроксиметил, аміноформули (I), що мають основні властивості, можна метил або моно- чи ді(C1-6алкіл)амінометил; перетворити на їх фармацевтично прийнятні кисR4 являє собою водень або С1-6алкіл; лотно-адитивні солі обробкою зазначеної основної вищевказаний арил являє собою феніл або форми відповідною кислотою. Підходящі кислоти нафталініл, причому кожен зазначений феніл або включають, наприклад, неорганічні кислоти, такі як нафталініл необов’язково заміщений одним або галогенводневі кислоти, наприклад, хлористоводдвома замісниками, кожний з яких незалежно вибнева кислота або бромистоводнева кислота; сір 13 86066 14 чана, азотна, фосфорна та подібні кислоти; або гістону, включаючи H1, H2A, H2B, H3, H4 та H5, органічні кислоти, такі як, наприклад, оцтова, трибудь-яких різновидів. Людські білки HDAC або генфтороцтова, пропанова, гідроксіоцтова, молочна, ні продукти включають, але не обмежені ними, піровиноградна, щавлева, малонова, бурштинова HDAC-1, HDAC-2, HDAC-3, HDAC-4, HDAC-5, (тобто бутандіонова кислота), малеїнова, фумароHDAC-6, HDAC-7, HDAC-8, HDAC-9, HDAC-10 та ва, яблучна, винна, лимонна, метансульфонова, HDAC-11. Гістондеацетилазу можна також одеретансульфонова, бензолсульфонова, толуолсужати з найпростіших та грибів. льфонова, цикламова, саліцилова, пПерша група сполук, що представляють інтеаміносаліцилова, памова кислоти та подібні. рес, складається з тих сполук формули (I), до яких Сполуки формули (I), що мають кислотні власзастосовують одне або декілька наступних обметивості, можна перетворити в їх фармацевтично жень: прийнятні основно-адитивні солі обробкою зазнаa) R1 являє собою феніл або нафталініл, де ченої кислотної форми підходящою органічною кожен зазначений феніл або нафталініл заміщеабо неорганічною основою. Підходящі типи основний одним або двома замісниками, кожний з яких них солей включають, наприклад, амонієві солі, незалежно вибраний із С1-6алкілсульфоніламіно, солі лужних та лужноземельних металів, напригідроксикарбонілу, С1-6алкілоксиметилу, С1клад, солі літію, натрію, калію, магнію, кальцію та 6алкіламінометилу, С1-6алкілкарбоніламінометилу, т.п., солі, утворені з органічними основами, наприС1-6алкілсульфоніламінометилу, аміносульфонілу клад, солі бензатину, N-метил-D-глюкаміну, солі або C1-6алкіламіносульфонілу; або гідрабаміну та солі, утворені з амінокислотами, b) R2 являє собою -CH2-R5, трифторметил, такими як, наприклад, аргінін, лізин та подібні. C(=O)-R6 або -CH2-NR7R8; Термін “кислотно- або основно-адитивні солі” c) R4 являє собою С1-6алкіл. також включає гідрати та продукти приєднання Друга група сполук, що представляють інтерозчинника, що здатні утворювати сполуки форрес, складається з тих сполук формули (I), до яких мули (I). Прикладами таких форм є гідрати, алкозастосовують одне або декілька наступних обмеголяти та т.п. жень: Термін "стереохімічно ізомерні форми сполуки a) R1 являє собою феніл, нафталініл або гетеформули (I)" використовується в даній заявці для роцикліл; де кожен зазначений феніл заміщений позначення всіх можливих сполук, що складаютьодним або двома замісниками, кожний з яких неся з тих самих атомів, зв’язаних однаковими залежно вибраний з арилу, гідрокси, аміно, С1зв’язками в однаковій послідовності, але які мають 6алкілкарбоніламіно, С1-6алкілсульфоніламіно, С1різні тривимірні структури, що не є взаємозамінгідроксіС1-6алкілу, С16алкоксикарбонілу, ними, котрі можуть мати сполуки формули (I). Якамінометилу, С16алкілоксиметилу, що не згадано або не зазначено інше, хімічне позС1-6лкілкарбоніламінометилу, 6алкіламінометилу, начення сполуки включає суміш усіх можливих С1-6алкілсульфоніламінометилу, аміносульфонілу, стереохімічно ізомерних форм, що можуть мати C1-6алкіламіносульфонілу або гетероциклілу; або зазначені сполуки. Згадана суміш може містити всі b) R2 являє собою -CH2-R5, трифторметил, діастереомери та/або енантіомери основної молеC(=O)-R6 або -CH2-NR7R8; кулярної структури зазначеної сполуки. Мається c) R4 являє собою С1-6алкіл. на увазі, що всі стереохімічно ізомерні форми споТретя група сполук, що представляють інтелуки формули (I), як в чистому вигляді, так і у вирес, складається з тих сполук формули (I), до яких гляді суміші одна з одною включені в межі даного застосовують одне або декілька наступних обмевинаходу. жень: Мається на увазі, що N-oксидні форми сполуки a) R1 являє собою феніл, нафталініл або гетеформули (I) включають ті сполуки формули (I), в роцикліл; де кожен зазначений феніл або нафтаяких один або декілька атомів азоту окиснені в так лініл заміщений одним або двома замісниками, названий N-оксид, конкретно, ті N-oксиди, в яких кожний з яких незалежно вибраний із С1один або декілька атомів азоту в піперидин-, піпе6алкілсульфоніламіно, С1-6алкілоксиметилу, аміразин- або піридазинільних залишках є Nнометилу, С1-6алкіламінометилу, С1oкисненими. С16алкілкарбоніламінометилу, Деякі зі сполук формули (I) можуть також існуаміносульфонілу 6алкілсульфоніламінометилу, вати в таутомерних формах. Мається на увазі, що або C1-6алкіламіносульфонілу; або такі форми, хоча вони явно не зазначені у вищеb) R2 являє собою -CH2-R5, трифторметил, згаданій формулі, включені в межі даного винахоC(=O)-R6 або -CH2-NR7R8; ду. c) R4 являє собою С1-6алкіл. Мається на увазі, що при використанні у даній Четверта група сполук, що представляють інзаявці термін "сполуки формули (I)" включає також терес, складається з тих сполук формули (I), до їх фармацевтично прийнятні адитивні солі та всі їх яких застосовують одне або декілька наступних стереоізомерні форми. обмежень: Терміни "гістондеацетилаза" та "HDAC", що a) кожен R5 незалежно вибраний з водню, гідвикористовуються в даній заявці, призначені для рокси, С1-6алкілокси, піперазинілу, Nпозначення будь-якого сімейства ферментів, що метилпіперазинілу, морфолінілу, тіоморфолінілу, видаляють ацетильні групи з ε-аміногруп залишків імідазолілу або триазолілу; лізинової N-кінцевої частини гістона. Якщо в конb) кожен R6 незалежно вибраний з гідрокси, С1тексті не зазначено інше, мається на увазі, що 6алкілокси, аміно або моно- або ді(С1-6алкіл)аміно, термін "гістон" відноситься до будь-якого білкуС1-6циклоалкіламіно, піперазинілу, N 15 86066 16 метилпіперазинілу, морфолінілу або тіоморфолініb) R1 являє собою феніл або феніл, заміщений лу; галогеном; c) R4 являє собою водень. с) R2 являє собою -CH2-R5; П’ята група сполук, що представляють інтерес, d) кожен R5 незалежно вибраний з водню, гідскладається з тих сполук формули (I), до яких зарокси, С1-6алкілокси або С1-6алкілкарбонілокси; стосовують одне або декілька наступних обмее) R3 являє собою водень; жень: g) R4 являє собою водень. a) кожен Х являє собою N; Група переважних сполук складається з тих b) R1 являє собою феніл або феніл, заміщений сполук формули (I), в яких кожен X являє собою N, галогеном, С1-6алкілом, С1-6алкілокси, полігалоR1 являє собою феніл або феніл, необов’язково генС1-6алкілом або арилом; заміщений галогеном, С1-6алкілом, С1-6алкілокси, с) R2 являє собою -CH2-R5 або -C(=O)-R6; полігалогенС1-6алкілом або арилом; R2 являє соd) кожен R5 незалежно вибраний з водню, гідбою -CH2-R5 або -C(=O)-R6; кожен R5 незалежно рокси, С1-6алкілокси, С1-6алкілоксіС1-6алкілокси, С1вибраний з водню, гідрокси, С1-6алкілокси, С16алкілкарбонілокси, N-метилпіперазинілу, морфо6алкілоксіС1-6алкілокси, С1-6алкілкарбонілокси, Nлінілу або імідазолілу; метилпіперазинілу, морфолінілу або імідазолілу; е) кожен R6 незалежно вибраний із С1кожен R6 незалежно вибраний із С1-6алкіламіно, С1С1-6циклоалкіламіно, гідроксіС1гідроксіС1-6алкіламіно, ді(С16алкіламіно, 6циклоалкіламіно, 3 6алкіламіно, ді(С1-6алкіл)аміноС1-6алкіламіно або 6алкіл)аміноС1-6алкіламіно або морфолінілу; R 4 морфолінілу; являє собою водень та R являє собою водень або f) R3 являє собою водень; або С1-6алкіл. g) R4 являє собою водень або С1-6алкіл. Ще одна група переважних сполук складаєтьШоста група сполук, що представляють інтеся з сполук формули (I), в яких R2 являє собою рес, складається з тих сполук формули (I), до яких CH2-R5, трифторметил, -С(=O)-R6 або -CH2-NR7R8. застосовують одне або декілька наступних обмеЩе одна група переважних сполук складаєтьжень: ся з сполук формули (I), в яких кожен X являє соa) кожен R6 незалежно вибраний із С1бою N, R1 являє собою феніл або феніл, заміщеС1-6циклоалкіламіно, ді(С1ний галогеном; R2 являє собою -CH2-R5; кожен R5 6алкіламіно, алкіл)аміноС1-6алкіламіно або морфолінілу. незалежно вибраний з водню, гідрокси, С16 3 Сьома група сполук, що представляють інтеявляє 6алкілокси або С1-6алкілкарбонілокси; R 4 рес, складається з тих сполук формули (I), до яких собою водень та R являє собою водень. застосовують одне або декілька наступних обмеНайбільш переважною сполукою є сполука жень: №1, сполука №8, сполука №11, сполука №9, споa) кожен Х являє собою N; лука №33, сполука №34 та сполука №7 і сполука №25. Сполука №1 Сполука №8 Сполука №11 Сполука №9 Сполука №33; .HCl; енантіомер A Сполука №34; .HCl; енантіомер B 17 Сполука №7; C2HF3O2; (E) 86066 18 Сполука №25; енантіомер A Сполуки формули (I), їх фармацевтично прийнятні солі, їх N-оксиди та стереохімічно ізомерні форми можуть бути отримані за допомогою загальноприйнятних способів. Вихідні речовини та деякі проміжні сполуки є відомими речовинами та є комерційно доступними або можуть бути отримані відповідно до традиційних методик реакції, звичайно відомих з рівня техніки. Деякі способи одержання будуть більш докладно описані нижче. В прикладах описані інші спо соби для одержання кінцевих продуктів формули (I). a) Гідроксамові кислоти формули (I) можуть бути отримані взаємодією проміжної сполуки формули (II) з відповідною кислотою, такою, наприклад, як трифтороцтова кислота. Зазначену взаємодію здійснюють у відповідному розчиннику, такому, наприклад, як метанол або дихлорметан. b) Проміжні сполуки формули (II) можуть бути отримані взаємодією проміжної сполуки формули (III) з проміжною сполукою формули (IV) в присутності відповідних реагентів, таких як моногідрохлорид N’-(етилкарбонімідоїл)-N,N-диметил-1,3 пропандіамін (EDC) та 1-гідрокси-1H-бензотриазол (НОBT). Реакцію можна проводити в присутності основи, такої як триетиламін, в підходящому розчиннику, такому як суміш дихлорметану та тетрагідрофурану. c) В альтернативному способі проміжні сполуки формули (II), в яких R4 являє собою водень, названі в даній заявці як проміжні сполуки формули (II-a), можуть бути отримані в одну стадію взаємодією проміжної сполуки формули (XI) з 1,4 діоксан-2,5-діолом та відповідною бороновою кислотою формули (VII), де R1 є таким, як визначено вище, в підходящому розчиннику, наприклад, спирті, такому як етанол. d) Проміжні сполуки формули (III) можуть бути отримані взаємодією проміжної сполуки формули (V) з відповідним кислим розчином, наприклад, розчином соляної кислоти, або основним розчином, наприклад, гідрогенбромідом або гідроксидом 19 86066 20 натрію, у підходящому розчиннику, наприклад, спирті, такому як етанол або пропанол. Даний винахід також відноситься до сполук формули (V) (V) їх N-оксидних форм, їх фармацевтично прийнятних кислотно-адитивних солей, їх стереохімічно ізомерних форм, де кожен X являє собою незалежно N або CH; R1 являє собою феніл, нафталініл або гетероцикліл; де кожен зазначений феніл або нафталініл необов’язково заміщений одним або двома замісниками, кожний з яких незалежно вибраний з галогену, С1-6алкілу, С1-6алкокси, полігалогенС1-6алкілу, арилу, гідрокси, ціано, аміно, С1С1-6алкілсульфоніламіно, 6алкілкарбоніламіно, гідроксикарбонілу, С1-6алкоксикарбонілу, гідроксіС1-6алкілу, С1-6алкілоксиметилу, амінометилу, С16алкіламінометилу, С1-6алкілкарбоніламінометилу, С1-6алкілсульфоніламінометилу, аміносульфонілу, C1-6алкіламіносульфонілу або гетероциклілу; R2 являє собою водень, -CH2-R5, трифторметил, -C(=O)-R6 або -CH2-NR7R8; де кожен R5 незалежно вибраний з водню, гідрокси, С1-6алкілокси, С1-6алкілоксіС1-6алкілокси, С1піперазинілу, N6алкілкарбонілокси, метилпіперазинілу, морфолінілу, тіоморфолінілу, імідазолілу або триазолілу; кожен R6 незалежно вибраний з гідрокси, С1алкілокси, аміно або моно- чи ді(С1-6алкіл)аміно, 6 С1-6циклоалкіламіно, гідроксіС1-6алкіламіно, піперазинілу, моноабо ді(С1-6алкіл)аміноC1N-метилпіперазинілу, морфолінілу 6алкіламіно, або тіоморфолінілу; кожен R7 та R8 незалежно вибрані з водню, С1С1-6алкілкарбонілу, C1-6алкілсульфонілу 6алкілу, або моно- чи ді(C1-4алкіл)аміносульфонілу, R3 являє собою водень, гідроксиметил, амінометил або моно- чи ді(C1-6алкіл)амінометил; R4 являє собою водень або С1-6алкіл; вищевказаний арил являє собою феніл або нафталініл, причому кожен зазначений феніл або b) Нові проміжні сполуки формули (V-a) можуть бути отримані в одну стадію взаємодією проміжної сполуки формули (VI) з 1,4-діоксан-2,5діолом та відповідноюї бороновою кислотою фор нафталініл необов’язково заміщений одним або двома замісниками, кожний з яких незалежно вибраний з галогену, С1-6алкілу, С1-6алкокси, трифторметилу, ціано або гідроксикарбонілу; та вищевказаний гетероцикліл являє собою фураніл, тієніл, піроліл, піролініл, піролідиніл, діоксоліл, оксазоліл, тіазоліл, імідазоліл, імідазолініл, імідазолідиніл, піразоліл, піразолініл, піразолідиніл, ізоксазоліл, ізотіазоліл, оксадіазоліл, триазоліл, тіадіазоліл, піраніл, піридиніл, піперидиніл, діоксаніл, морфолініл, дитіаніл, тіоморфолініл, піридазиніл, піримідиніл, піразиніл, піперазиніл, триазиніл, тритіаніл, індолізиніл, індоліл, індолініл, бензофураніл, бензотіофеніл, індазоліл, бензимідазоліл, бензтіазоліл, пуриніл, хінолізиніл, хінолініл, цинолініл, фталазиніл, хіназолініл, хіноксалініл або нафтиридиніл, де кожний із зазначених гетероциклів необов’язково заміщений одним або двома замісниками, кожний з яких незалежно вибраний з галогену, С1-6алкілу, С1-6алкокси, ціано, аміно, моно- або ді(С1-4алкіл)аміно. Групи сполук, що представляють інтерес, переважних, більш переважних та найбільш переважних сполук можуть бути визначені для сполук формули (V) відповідно до груп, визначених для сполук формули (I). Нові проміжні сполуки (V) можуть бути отримані a) перетворенням проміжних сполук формули (V), в яких R2 являє собою -CH2OH та R4 являє собою водень, названих в даній заявці як проміжні сполуки формули (V-a), на проміжні сполуки формули (V), в яких R2 являє собою замісник, що відрізняється від -CH2OH, названих в даній заявці як проміжні сполуки формули (V-b), за допомогою реакцій, відомих у даній галузі техніки, або шляхом трансформацій функціональних груп. Наприклад, спирти формули (V-a) можуть бути перетворені на аміни, складні та прості ефіри. Аміни можуть бути перетворені на відповідні аміди, а первинні аміни можуть бути перетворені на вторинні та третинні аміни. мули (VII), де R1 є таким, як визначено вище, в підходящому розчиннику, наприклад, у спирті, такому як етанол. 21 c) Нові проміжні сполуки формули (V-b) можуть бути отримані взаємодією проміжних сполук формули (VI) з відповідним кетоном формули (VIII) у присутності відповідного реагенту, такого як тетракіс(етанолато)титан або боргідрид натрію, в підходящому розчиннику, наприклад, в 1,2дихлоретані. d) Нові проміжні сполуки формули (V), в яких R2 являє собою -COOH, названі в даній заявці сполуками формули (V-c), можуть бути отримані в одну стадію взаємодією проміжних сполук формули (VI) з 2-оксопропановою кислотою та відповідною бороновою кислотою формули (VII), де R1 є таким, як визначено вище, в підходящому розчиннику, наприклад, 1,2-дихлорметані. Проміжні сполуки формули (V-c), в яких R2 являє собою -COOH, можуть бути перетворені на проміжні сполуки формули (V), в яких R2 являє собою -C(=O)-R6, використовуючи реакції, відомі в даній галузі техніки, або шляхом трансформацій функціональних груп, наприклад, перетворенням на аміни та аміди. Проміжні сполуки формули (XI) можуть бути отримані взаємодією проміжної сполуки формули (IX) з піперидином в підходящому розчиннику, наприклад, дихлорметані. Проміжні сполуки формули (IX) можуть бути отримані взаємодією проміжної сполуки формули (X) із проміжною сполукою формули (IV), в присутності відповідних реагентів, таких як моногідрохлорид N’-(етилкарбонімідоїл)-N,N-диметил-1,3 86066 22 пропандіаміну (EDC) та 1-гідрокси-1Hбензoтриазол (НOBT). Реакцію можна проводити в присутності основи, такої як триетиламін, в підходящому розчиннику, такому як суміш дихлорметану та тетрагідрофурану. Проміжні сполуки формули (X) можуть бути отримані взаємодією проміжної сполуки формули (VI) із проміжною сполукою формули (XII) в присутності гідроксиду натрію в підходящому розчиннику, такому як тетрагідрофуран, з наступною нейтралізацією соляною кислотою та додаванням карбонату натрію. Сполуки формули (I) та деякі проміжні сполуки можуть містити, щонайменше, один стереогенний центр у структурі. Зазначений стереогенний центр може мати R або S конфігурацію. Сполуки формули (I), отримані за допомогою наведених вище способів, звичайно являють собою рацемічну суміш енантіомерів, що можуть бути розділені за допомогою наступних методик розділення, відомих у даній галузі техніки. Рацемічні сполуки формули (I) можуть бути перетворені на відповідні діастереомерні солі реакцією з підходящою хіральною кислотою. Зазначені діастереомерні солі потім розділяють, наприклад, селективною або фракціонованою кристалізацією, та енантіомери виділяють за допомогою лугу. Альтернативний спосіб розділення енантіомерних форм сполуки формули (I) полягає в застосуванні рідинної хроматографії з хіральною нерухомою фазою. Зазначені стереохімічно чисті ізомерні форми можуть також бути одержані з відповідних стереохімічно чистих ізомерних форм підходящих вихідних речовин, за умови, що реакція відбувається стереоспецифічно. Якщо бажаним є конкретний стереоізомер, зазначену сполуку переважно будуть синтезувати за допомогою стереоспецифічних способів. У зазначених способах переважно будуть застосовувати енантіомерно чисті вихідні речовини. Сполуки формули (I), їх фармацевтично прийнятні кислотно-адитивні солі та їх стереоізомерні форми мають цінні фармакологічні властивості, що полягають в тому, що вони здійснюють інгібуючу дію на гістондеацетилазу (HDAC). 23 86066 24 Даний винахід відноситься до способу інгібуматоміозит, акне, діабет, системна червона вовчавання аномального росту клітин, включаючи ріст нка, синдром Кавасакі, розсіяний склероз, емфізетрансформованих клітин, шляхом введення ефекма, муковісцидоз та хронічний бронхіт; тивної кількості сполуки за винаходом. Аномальe) лікування ендометріоза, фіброзів матки, диним ростом клітин називають ріст клітин, що не сфункціональної маткової кровотечі та ендометрізалежить від нормальних регуляторних механізмів альної гіперплазії; (наприклад, інгібування через порушення контакf) лікування окулярної васкуляризації, що ту). Винахід включає як безпосереднє інгібування включає васкулопатію, що впливає на сітківку та росту пухлин, що викликає зупинку росту, термінахоріоїдальні судини; льну диференціацію та/або апоптоз ракових кліg) лікування серцевої дисфункції; тин, так і непряме інгібування шляхом неоваскуляh) інгібування імунодепресивних станів, таких, ризаці пухлин. наприклад, як ВІЛ інфекції; Даний винахід також відноситься до способу і) лікування ниркової дисфункції; інгібування росту пухлин введенням ефективної j) усунення ендокринних порушень; кількості сполуки за даним винаходом суб’єкту, k) інгібування дисфункції глюконеогенезу; наприклад, ссавцю (та більш конкретно, людині), l) лікування невропатології, наприклад, хвороякий потребує такого лікування. Конкретно, винаби Паркінсона, або невропатології, що приводить хід відноситься до способу інгібування росту пухдо когнітивних розладів, наприклад, хвороби Альцлин введенням ефективної кількості сполуки за геймера, або неврональних захворювань, даним винаходом. Приклади пухлин, ріст яких мозв’язаних з поліглутаміном; же бути інгібований, включають, але не обмежуm) лікування психіатричних захворювань, наються ними, рак легень (наприклад, аденокарциприклад, шизофренії, біполярного розладу, депренома та недрібноклітинна карцинома легені), рак сії, тривожних станів та психозу; підшлункової залози (наприклад, карцинома підшn) інгібування нейром’язової патології, наприлункової залози, така як, наприклад, екзокрина клад, бічного аміотрофічного склерозу; карцинома підшлункової залози), різновиди раку o) лікування спінальної м’язової атрофії; товстої кишки (наприклад, колоректальні карциноp) лікування інших патологічних станів, що піми, такі як, наприклад, аденокарцинома товстої длягають лікуванню шляхом посилення експресії кишки та аденома товстої кишки), рак передміхугена; рової залози, включаючи пізню стадію захворюq) посилення генної терапії; вання, пухлини кровотворних органів лімфоїдного r) інгібування адіпогенеза; походження (наприклад, гострий лімфолейкоз, Вs) лікування паразитарних захворювань, таких клітинна лімфома, лімфома Беркіта), мієлоїдні як малярія. лейкемії (наприклад, гострий мієлобластний лейОтже, у даному винаході описані сполуки фокоз (АМ)), фолікулярний рак щитовидної залози, рмули (I) для застосування як лікарського засобу, мієлодиспластичний синдром (MDS), пухлини меа також застосування зазначених сполук формули зенхімального походження (наприклад, фібросар(I) для виробництва лікарського препарату для коми та рабдоміосаркоми), меланоми, тератокарлікування одного або декількох вищезгаданих зациноми, нейробластоми, гліоми, доброякісні хворювань. пухлини шкіри (наприклад, кератоакантома), карСполуки формули (I), їх фармацевтично прициному молочної залози (наприклад, запущений йнятні кислотно-адитивні солі та їх стереоізомерні рак молочної залози), карциному нирок, карциному форми можуть мати цінні діагностичні властивості, яєчника, карциному сечового міхура та епідерматому їх можна застосовувати для виявлення та льну карциному. ідентифікації HDAC у біологічному зразку, вклюСполуки за винаходом можна застосовувати і чаючи виявлення або вимір утворення комплексу для інших лікувальних цілей, наприклад, для між міченою сполукою та HDAC. a) підвищення чутливості пухлин до радіотеУ методах виявлення або ідентифікації можна рапії шляхом введення сполуки за винаходом певикористовувати мічені сполуки, що одержують ред опроміненням пухлини для лікування раку, під дією агентів для введення мітки, таких як радіоізочас опромінення або після нього; топи, ферменти, флуоресцентні речовини, люміb) лікування артропатій та остеопатологічних нуючі речовини та т.п. Приклади радіоізотопів станів, таких як ревматоїдний артрит, остеоартрит, включають 125I, 131I, 3H та 14C. Ферменти звичайно ювенільний артрит, подагра, поліартрит, псоріатироблять придатними для визначення шляхом чний артрит, анкілозуючий спондилоартрит та сискон’югування відповідного субстрату, що, у свою темна еритематозна вовчанка; чергу, каталізує реакцію виявлення. Приклади феc) інгібування проліферації клітин гладких рментів включають, наприклад, бетам’язів, включаючи судинні проліферативні поругалактозидазу, бета-глюкозидазу, лужну фосфаташення, атеросклероз та рестеноз; зу, пероксидазу та малатдегідрогеназу, переважно d) лікування запальних станів та шкірних запероксидазу хрону. Люмінуючі речовини включахворювань, таких як виразковий коліт, хвороба ють, наприклад, люмінал, похідні люміналу, люКрона, алергійний риніт, реакція "трансплантат циферин, екворин та люциферазу. проти хазяїна", кон’юктивит, астма, ARDS (синдБіологічні зразки можна визначити як тканини ром гострої дихальної недостатності), хвороба організму або рідини організму. Прикладами рідин Бехчета, відторгнення трансплантата, інфекція організму є спинномозкова рідина, кров, плазма, сечових шляхів, алергійний дерматит, осередкова сироватка, сеча, мокротиння, слина та т.п. алопеція, склеродермія, екзантема, екзема, дерЧерез їх корисні фармакологічні властивості 25 86066 26 розглянуті сполуки можуть бути включені до склаін’єкцій, форми для введення столовими або чайду різних фармацевтичних форм, призначених для ними ложками та подібні, та різноманітні складні введення. форми. Для одержання фармацевтичних композицій Фахівці в даній галузі техніки можуть легко виза даним винаходом ефективну кількість конкретзначити ефективну кількість за результатами досного сполуки у вигляді кислотно-адитивної або ліджень, представлених нижче. Звичайно вважаосновно-адитивної солі як активний інгредієнт поється, що терапевтично ефективна кількість єднують з фармацевтично прийнятним носієм, складає від 0,005мг/кг до 100мг/кг маси тіла, та причому носій може бути різноманітних видів, в конкретно, від 0,005мг/кг до 10мг/кг маси тіла. Мозалежності від форми препарату, бажаного для жливо, доцільно вводити необхідну дозу у вигляді введення. Зазначені фармацевтичні композиції двох, трьох, чотирьох або більше субдоз через бажано одержувати в стандартній лікарській форвідповідні інтервали часу протягом дня. Зазначені мі, що підходить для введення перорально, ректасубдози можуть бути виготовлені у вигляді станльно, крізьшкірно або шляхом парентеральної дартних лікарських форм, наприклад, що містять ін’єкції. Наприклад, при одержанні композицій у 0,5-500мг та, конкретно, 10-500мг активного інгревигляді лікарської форми для перорального введієнта на одиницю лікарської форми. дення можна використовувати будь-яке зі звичайВ іншому аспекті даного винаходу розгляданих фармацевтичних середовищ, наприклад, воду, ють комбінацію інгібітору HDAC із ще одним прогліколі, олії, спирти та т.п., у випадку рідких препатираковим засобом, особливо для застосування як ратів для перорального введення, таких як сулікарського препарату, більш конкретно для лікуспензії, сиропи, еліксири та розчини; або тверді вання раку або споріднених захворювань. носії, такі як крохмалі, цукри, каолін, речовини, що Для лікування вищевказаних захворювань сприяють ковзанню, зв’язуючі речовини, розпушусполуки за винаходом переважно можна викорисвачі та т.п., у випадку порошків, пігулок, капсул та товувати в сполученні з одним або декількома літаблеток. карськими засобами, більш конкретно з іншими Завдяки легкості введення, таблетки та капсупротираковими засобами. Прикладами протираколи являють собою найбільш переважну стандартвих засобів є: ну лікарську форму для перорального введення, у - координаційні сполуки платини, наприклад, випадку якої очевидно використовують тверді фацисплатин, карбоплатин або оксаліплатин; рмацевтичні носії. Носій у композиціях для парен- сполуки таксану, наприклад, паклітаксел або терального введення звичайно містить стерильну доксетаксел; воду, принаймні, в більшій частині, хоча можуть - інгібітори топоізомерази I, такі як сполуки кабути включені й інші інгредієнти, наприклад, що мптотецину, наприклад, іринотекан або топотекан; сприяють підвищенню розчинності. Можливе оде- інгібітори топоізомерази II, такі як протипухржання розчинів для ін’єкцій, в яких носій містить, линні похідні подофілотоксину, наприклад, етопонаприклад, фізіологічний розчин, розчин глюкози зид або теніпозид; або суміш фізіологічного розчину та розчину глю- протипухлинні вінкаалкалоїди, наприклад, вікози. Можливо також одержання суспензій для нбластин, вінкристин або вінорелбін; ін’єкцій, у випадку яких можуть бути використані - протипухлинні похідні нуклеозидів, напривідповідні рідкі носії, суспендуючі засоби та т.п. У клад, 5-фторурацил, гемцитабін або капецитабін; композиціях, що підходять для підшкірного вве- алкілуючі агенти, такі як нітроіприт або нітродення, носій необов’язково містить речовину, що зосечовина, наприклад, циклофосфамід, хлорамсприяє проникненню, та/або підходящий зволожубуцил, кармустин або ломустин; ючий засіб, необов’язково об’єднані з підходящи- протипухлинні похідні антрацикліну, наприми добавками будь-якої природи в незначній кільклад, даунорубіцин, доксорубіцин, ідарубіцин або кості, причому добавки не здійснюють шкідливої мітоксантрон; дії на шкіру. Зазначені добавки можуть сприяти - антитіла HER2, наприклад, трастузумаб; введенню через шкіру та/або можуть бути корисні - антагоністи естрогенових рецепторів або седля приготування потрібних композицій. Зазначені лективні модулятори естрогенових рецепторів, композиції можна вводити різними шляхами, нанаприклад, тамоксифен, тореміфен, дролоксифен, приклад, у вигляді трансдермального пластиру, фаслодекс або ралоксифен; крапкового нанесення або мазі. - інгібітори ароматази, такі як екземестан, анаОсобливо переважно для зручності введення строзол, летразол та ворозол; та дозування виготовляти вищезгадані фармацев- диференціюючі агенти, такі як ретиноїди, вітичні композиції у вигляді стандартної лікарської тамін D та блокатори метаболізму ретиноєвої кисформи. В описі та формулі винаходу даної заявки лоти (RAMBA), наприклад, акутан; термін стандартна лікарська форма відноситься - інгібітори ДНК метилтрансферази, напридо фізично дискретних одиниць, що підходять як клад, азатидин; однократні дози, причому кожна одиниця містить - інгібітори кінази, наприклад, флавоперидол, задану кількість активного інгредієнта, розраховамезилат іматиніба або гефітиніб; ну для одержання необхідного лікувального ефек- інгібітори фарнезилтрансферази; ту, разом з необхідним фармацевтичним носієм. - інші інгібітори HDAC; Прикладами таких стандартних лікарських форм є - інгібітори шляху убіквітин-протеасом, напритаблетки (включаючи таблетки з надсічками та клад, Велкад; або таблетки з покриттям), капсули, пігулки, пакети з - Yondelis. порошком, облатки, розчини або суспензії для Tермін "координаційна сполука платини" вико 27 86066 28 ристовують в даній заявці для позначення будьТрастузумаб являє собою рекомбінантне гуманіякої координаційної сполуки платини, що інгібує зоване моноклональне ДНК-похідне IgGl капаріст пухлинних клітин, яка надає платину у вигляді антитіло високого очищення, що зв’язується з поіона. заклітинним доменом рецептора HER2 з високою Термін "сполуки таксану" вказує на клас споафінністю та специфічністю. лук, що містять циклічну систему таксану та мають Багато видів раку молочної залози мають ествідношення до екстрактів деяких видів тисового рогенними рецепторами та ріст зазначених пухлин дерева (Taxus) або екстрагованих з них. може бути стимульований естрогеном. Терміни Термін "інгібітори топоізомерази" застосову"антагоністи естрогенових рецепторів" та "селекють для позначення ферментів, що здатні змінютивні модулятори естрогенових рецепторів" виковати топологію ДНК в еукаріотичних клітинах. Вони ристовують для позначення конкуруючих інгібітоє вкрай необхідними для важливих клітинних фунрів зв’язування естродіола з естрогеновим кцій та проліферації клітин. В еукаріотичних клітирецептором (ER). Селективні модулятори естрогенах існує два типи топоізомераз, що називаються нових рецепторів при зв’язуванні з ER, викликають топоізомеразами типу I та типу II. Топоізомераза зміну просторової форми рецептора, модулюючи типу I являє собою мономерний фермент, молекуйого зв’язування з естроген-чутливим елементом лярна маса якого складає приблизно 100 000. За(ERE) на ДНК. значений фермент зв’язує ДНК та вводить транзиУ жінок після постменопаузи основним джереторний однонитковий розрив, розгортає подвійну лом циркулюючого естрогена є перетворення адспіраль (або дозволяє їй розгорнутися) та потім ренальних та оваріальних андрогенів (андростензнову ліквідує розрив перед дисоціацією з ниток діону та тестостерону) на естрогени (естрон та ДНК. Топоізомераза II має аналогічний механізм естрадіол) під дією ферменту ароматази в перидії, що полягає у введенні розривів ниток ДНК або феричних органах. Депривація естрогену в реутворенні вільних радикалів. зультаті інгібування або інактивації ароматази явТермін "сполуки камптотецину" використовуляє собою ефективне та селективне лікування ється для позначення сполук, споріднених або гормонозалежного рака молочної залози для деотриманих з вихідної сполуки камптотецину, яка яких хворих в період постменопаузи. являє собою нерозчинний у воді алкалоїд, отриТермін "антіестрогенний агент" використовуманий з китайського дерева Camptothecin ють в даній заявці для позначення не тільки антаacuminata та індійського дерева Nothapodytes гоністів естрогенових рецепторів та селективних foetida. модуляторів естрогенових рецепторів, але також і Термін "сполуки подофілотоксину" використодля позначення інгібіторів ароматази, як описано вують для позначення сполук, споріднених або вище. отриманих з вихідного подофілотоксину, який ексTермін "диференціюючі агенти" включає спотрагують з рослини мандрагори. луки, що можуть різними шляхами інгібувати проТермін "протипухлинні вінкаалкалоїди" виколіферацію клітин та індукувати диференціювання. ристовують для позначення сполук, споріднених Як відомо, вітамін D та ретиноїди відіграють голоабо отриманих з екстрактів рослини барвінок вну роль у регуляції росту та диференціюванні (Vinca rosea). безлічі типів нормальних та злоякісних клітин. Термін "алкілуючі агенти" відноситься до групи Блокатори метаболізму ретиноєвої кислоти різних хімікатів, загальною властивістю яких є зда(RAMBA) збільшують рівні ендогенних ретиноєвих тність вводити алкільні групи в біологічно життєво кислот, інгібуючи катаболізм ретиноєвих кислот, важливі макромолекули, такі як ДНК, у фізіологічіндукований цитохромом P450. них умовах. Велика частина найбільш важливих Зміни в метилюванні ДНК відносяться до найалкілуючих агентів, таких як нітроіприт та нітрозобільш розповсюджених аномалій у неоплазмі люсечовина, генерує активні алкілуючі залишки in дини. Гіперметилювання в промоторах обраних vivo після складних реакцій розкладання, деякі з генів звичайно зв’язане з інактивацією залучених яких є ферментативними. Найбільш важливими генів. Термін "інгібітори ДНК метилтрансферази" фармакологічними ефектами алкілуючих агентів є використовується для позначення сполук, що діефекти, що порушують основні механізми, ють через фармакологічне інгібування ДНК метилпов’язані з проліферацією клітин, зокрема, механітрансферази та повторну активацію експресії гезми синтезу ДНК та розподілу клітин. Здатність на-супресора пухлин. алкілуючих агентів порушувати функцію ДНК та Tермін "інгібітори кінази" включає сильні інгібіцілісність у швидко проліферуючих тканинах ствотори кіназ, які беруть участь у прогресії клітинного рює основу для їх застосування в терапії та для циклу та запрограмованої загибелі клітин (апопбагатьох їх токсичних властивостей. тоз). Термін "протипухлинні похідні антрацикліну" Tермін "інгібітори фарнезилтрансферази" вивключає антибіотики, отримані з гриба Strep, користовують для позначення сполук, що признаpeuticus var. caesius та їх похідні, що відрізняються чені для того, щоб запобігати фарнезилюванню тим, що вони мають тетрациклінову кільцеву струRas та інших внутрішньоклітинних білків. Показактуру, з’єднану за допомогою глікозидного лінкера но, що вони впливають на проліферацію злоякісз незвичайним цукром, даунозаміном. них клітин та виживання. Показано, що ампліфікація білка 2 рецепторів Tермін "інші інгібітори HDAC" включає, але не людського епідермального фактора росту (HER 2) обмежується перерахованими нижче: у первинних карциномах молочної залози корелює - карбоксилати, наприклад, бутират, коричну з поганим клінічним прогнозом для деяких хворих. кислоту, 4-фенілбутират або валпроєва кислота; 29 86066 30 - гідроксамові кислоти, наприклад, субероїлази та схеми лікування для кожного компонента нілід гідроксамової кислоти (SAHA), комбінації будуть залежати від конкретних сполук, - аналоги SAHA, що містять піперазин, біарилщо вводяться-інгібітору HDAC та лікарського засогідроксамат A-161906 та його карбозоліловий пробу, конкретного шляху їх введення, конкретної пустий ефір, тетрагідропіридиновий та тетралоновий хлині, що підлягає лікуванню, та конкретного “хазяаналоги, біциклічні арил-N-гідроксикарбоксаміди, їна”, якого лікують. Фахівці в даній галузі техніки піроксамід, CG-1521, PXD-101, сульфонамід гідроможуть легко визначити оптимальні спосіб та поксамової кислоти, LAQ-824, LBH-589, трихостатин рядок введення, дозування та схему лікування, A (TSA), оксамфлатин, скриптаїд, споріднені з використовуючи загальноприйняті методи та маюскриптаїдом трициклічні молекули, мчи у вигляді інформацію, викладену в даній заявці. карбоксикорична кислота, бісгідроксамова кислота Координаційні сполуки платини ефективно (CBHA), CBHA-подібні гідроксамові кислоти, травводять у дозі, що складає 1-500мг на квадратний поксиновий аналог гідроксамової кислоти, метр (мг/м2) площі поверхні тіла, наприклад 50R306465 та споріднені бензоїл- та гетероарилгід400мг/м2, конкретно доза для цисплатину складає роксамові кислоти, аміносуберати та малонілдіаприблизно 75мг/м2, а доза для карбоплатину скламіди; дає приблизно 300мг/м2 на курс лікування. - циклічні тетрапептиди, наприклад, трапоксин, Сполуки таксану ефективно вводять у дозі, що апідицін, депсипептид, спирухостатин-споріднені складає 50-400мг на квадратний метр (мг/м2) плосполуки, RedFK-228, сульфгідрилвмісні циклічні щі поверхні тіла, наприклад, 75-250мг/м2, конкреттетрапептиди (SCOP), циклічні тетрапептиди, що но, доза для паклітакселю складає приблизно 175містять гідроксамову кислоту (CHAP), TAN-174 та 250мг/м2, а доза для доцетакселю складає прибазумаміди; лизно 75-150мг/м2 на курс лікування. - бензаміди, наприклад, MS-275 або CI-994, Сполуки камптотецину ефективно вводять у або дозі, що складає 0,1-400мг на квадратний метр - депудецин. (мг/м2) площі поверхні тіла, наприклад, 1-300мг/м2, Tермін "інгібітори циклу убіквітин-протеасоми" конкретно доза іринотекану складає приблизно використовують для ідентифікації сполук, що інгі100-350мг/м2, а доза топотекану складає приблизбують цілеспрямоване руйнування клітинних білків но 1-2мг/м2 на курс лікування. в протеасомі, включаючи регуляторні білки клітинПохідне подофілотоксину з протипухлинною ного циклу. активністю ефективно вводять у дозі, що складає Для лікування раку сполуки за даним винахо30-300мг на квадратний метр (мг/м2) площі повердом можна вводити пацієнту, як описано вище, у хні тіла, наприклад, 50-250мг/м2, конкретно доза сполученні з опроміненням. Опромінення означає етопозида складає близько 35-100мг/м2, а доза іонізуюче випромінювання, конкретно гамматеніпозиду складає приблизно 50-250мг/м2 на курс випромінювання, головним чином випромінюванлікування. ня, що випускається лінійними прискорювачами Вінкаалкалоїди з протипухлинною активністю або радіонуклідами, що широко використовуються ефективно вводять у дозі, що складає 2-30мг на в даний час. Опромінення пухлини радіонуклідами квадратний метр (мг/м2) площі поверхні тіла, конкможе бути зовнішнім або внутрішнім. ретно доза вінбластину складає приблизно 3Даний винахід також відноситься до комбінації 12мг/м2, доза вінкристину складає приблизно 1за винаходом протиракового засобу та інгібітору 2мг/м2 та доза вінорелбіну складає приблизно 10HDAC за винаходом. 30мг/м2 на курс лікування. Даний винахід також відноситься до комбінації Похідні нуклеозидів із протипухлинною активза винаходом для застосування в лікарській тераністю ефективно вводять у дозі, що складає 200пії, наприклад, для інгібування росту пухлинних 2500мг на квадратний метр (мг/м2) площі поверхні клітин. тіла, наприклад, 700-1500мг/м2, конкретно доза 5Даний винахід також відноситься до комбінації FU складає приблизно 200-500мг/м2, доза гемциза винаходом для інгібування росту пухлинних табіну складає приблизно 800-1200мг/м2 та доза клітин. капецитабіну складає приблизно 1000-2500мг/м2 Даний винахід також відноситься до способу на курс лікування. інгібування росту пухлинних клітин у суб’єкта (люАлкілуючі агенти, такі як нітроіприт або нітродини), який включає введення суб’єкту ефективної зосечовина ефективно вводять у дозі, що складає кількості комбінації за винаходом. 100-500мг на квадратний метр (мг/м2) площі повеКрім того, даний винахід відноситься до спорхні тіла, наприклад, 120-200мг/м2, конкретно доза собу інгібування аномального росту клітин, що для циклофосфаміду складає приблизно 100включає трансформовані клітини, шляхом введен500мг/м2, доза для хлорамбуцилу складає приблиня ефективної кількості комбінації за винаходом. зно 0,1-0,2мг/м2, доза для кармустину складає Інгібітор HDAC та ще один лікарський засіб приблизно 150-200мг/м2 та доза для ломустину можна вводити одночасно (наприклад, у вигляді складає приблизно 100-150мг/м2 на курс лікуванокремих композицій або у вигляді єдиної композиня. ції) або послідовно в будь-якому порядку. В останПохідні антрацикліну з протипухлинною активньому випадку дві сполуки повинні бути введені ністю ефективно вводять у дозі, що складає 10протягом того періоду часу, в такій кількості та 75мг на квадратний метр (мг/м2) площі поверхні такому способі, при яких досягається переважний тіла, наприклад, 15-60мг/м2, конкретно доза для або синергічний ефект. Слід розуміти, що перевадоксорубіцину складає приблизно 40-75мг/м2, доза жний спосіб та порядок введення та відповідні додля даунорубіцину складає приблизно 25-45мг/м2 31 86066 32 та доза ідарубіцину складає приблизно 10-15мг/м2 позначає етилацетат, "EtOH" позначає етанол, на курс лікування. "HOBT" позначає 1-гідрокси-1H-бензoтіазол, Tрастузумаб ефективно вводять у дозі, що "MeOH" позначає метанол, "ТФО" позначає трискладає 1-5мг на квадратний метр (мг/м2) площі фтороцтову кислоту та "TГФ" позначає тетрагідповерхні тіла, конкретно 2-4мг/м2 на курс лікуванрофуран. ня. А. Одержання проміжних сполук Антіестрогенний агент ефективно вводять у Приклад A1 дозі, що складає 1-100мг щодня в залежності від а) Одержання проміжної сполуки 1 конкретного агента та захворювання, що лікують. Тамоксифен ефективно вводять перорально в дозі, що складає 5-50 мг, переважно 10-20мг два рази на день, продовжуючи лікування протягом часу, достатнього для досягнення та збереження терапевтичного ефекту. Тореміфен ефективно вводять перорально в дозі, що складає приблизно Суміш етилового ефіру 2-(1-піперазиніл)-560мг один раз на день, продовжуючи лікування піримідинкарбонової кислоти (0,016моль), (2протягом часу, достатнього для досягнення та фенілетеніл)боронової кислоти (0,016моль) та 1,4збереження терапевтичного ефекту. Анастрозол діоксан-2,5-діолу (0,016моль) в EtOH (250мл) пеефективно вводять перорально в дозі, що складає ремішують протягом 2 днів при кімнатній темпера1мг один раз на день. Дролоксифен ефективно турі та потім розчинник випарюють у вакуумі. Завводять перорально в дозі, що складає приблизно лишок поміщають у DCM та воду, органічний шар 20-100мг один раз на день. Ралоксифен ефективвідокремлюють, сушать (MgSO4), фільтрують та но вводять перорально в дозі, що складає прибливипарюють розчинник. Залишок очищають за дозно 60мг один раз на день. Екземестан ефективно помогою колоночної хроматографії на силікагелі вводять перорально в дозі, що складає приблизно (15-40мкм) (елюент: суміш DCM/MeOH 97/1). Чисті 25мг один раз на день. фракції випарюють, одержуючи 4г (61%) проміжної Зазначені дози можна вводити, наприклад, сполуки 1, т.пл. 128°C. один раз, два рази або більше за курс лікування, Складні ефіри, що відповідають проміжній який можна повторювати, наприклад, кожні 7, 14, сполуці 1, можуть бути розділені за допомогою 21 або 28 днів. хіральної хроматографії. Завдяки їх корисним фармакологічним власb) Одержання проміжної сполуки 2 тивостям компоненти комбінацій за винаходом, тобто інгібітор HDAC та інший лікарський засіб можуть входити до складу різних фармацевтичних форм, призначених для введення. Зазначені компоненти можуть окремо входити до складу індивідуальних фармацевтичних композицій або до складу єдиної фармацевтичної композиції, що містить обидва компоненти. Суміш проміжної сполуки 1 (0,0007моль) в 1N Таким чином, даний винахід також відноситься розчині гідроксиду натрію (10мл) та ТГФ (20мл) до фармацевтичної композиції, що містить інгібіперемішують при кімнатній температурі протягом тор HDAC та інший лікарський засіб разом з одним 48 годин. Додають 1N соляну кислоту (10мл). Розабо декількома фармацевтичними носіями. чинник випарюють, осад відфільтровують, промиДаний винахід також відноситься до комбінації вають водою, потім DIPE та сушать, одержуючи у формі фармацевтичної композиції, що включає 0,2г (72%) проміжної сполуки 2, т.пл. 232°C. протираковий агент та інгібітор HDAC відповідно с) Одержання проміжної сполуки 3 до винаходу разом з одним або декількома фармацевтично прийнятними носіями. Даний винахід, крім того, також відноситься до застосування комбінації за винаходом у виробництві фармацевтичної композиції для інгібування росту пухлинних клітин. Крім того, даний винахід відноситься до продукту, що містить як перший активний інгредієнт Триетиламін (0,012моль), N’інгібітор HDAC за винаходом та як другий активний (етилкарбонімідоїл)-N,N-диметил-1,3-пропандіамін інгредієнт протираковий засіб, у вигляді комбіно(0,00593моль), 1-гідрокси-1H-бензoтриазол ваного препарату для одночасного, роздільного (0,00593моль) та O-(тетрагідро-2Н-піран-2-іл)або послідовного застосування в лікуванні хворих, гідроксиламін (0,00593моль) додають до суміші що страждають на рак. проміжної сполуки 2 (0,00395моль) у суміші DCM Експериментальна частина (70мл) та ТГФ (70мл), потім реакційну суміш переНижченаведені приклади приведені для ілюсмішують протягом 3 днів при кімнатній температутрації. Скорочення "EDC" позначає моногідрохлорі. Додають H2O. Органічний шар відокремлюють, рид N’-(етилкарбонімілоїл)-N,N-диметил-1,3сушать (MgSO4), фільтрують та випарюють розпропандіаміну, скорочення "DCM" позначає дихлочинник. Залишок очищають за допомогою колонорметан, "DIPE" позначає діізопропіловий ефір, чної хроматографії (градієнт елюювання: "ДМФА" позначає N,N-диметилформамід, "EtOAc" DCM/MeOH/NH OH 97/3/0,1). Фракції продукту 4 33 86066 34 збирають, випарюють органічний розчинник та Чисті фракції збирають та випарюють розчинник, одержують 1,5г (84%) проміжної сполуки 3. одержуючи 0,085г (29%) проміжної сполуки 6. Приклад A2 d) Одержання проміжної сполуки 7 а) Одержання проміжної сполуки 4 Суміш етилового ефіру 2-(1-піперазиніл)-5піримідинкарбонової кислоти (0,0042моль), 1,4діоксан-2,5-діолу (0,0042моль) та (E)-[2-(4хлорфеніл)етеніл]боронової кислоти (0,0042моль) в EtOH (100мл) перемішують при кімнатній температурі протягом 72 годин, виливають у воду та екстрагують DCM. Органічний шар відокремлюють, сушать (MgSO4), фільтрують та випарюють розчинник. Залишок (1,8г) очищають за допомогою колоночної хроматографії на силікагелі (15-40мкм) (елюент: суміш DCM/MeOH/NH4OH 97/3/0,1). Дві фракції збирають та випарюють розчинник, одержуючи 0,85г F1 (масло) та 0,25г F2 (загальний вихід: 63%). F1 кристалізують із суміші 2пропанон/DIPE. Осад відфільтровують та сушать, одержуючи 0,6г проміжної сполуки 4, т.пл. 110°C. b) Одержання проміжної сполуки 5 Метансульфонілхлорид (0,0012моль) при 5°C додають до розчину проміжної сполуки 4 (0,0006моль) та триетиламіну (0,0024моль) в ТГФ (15мл) в потоці N2. Температуру суміші доводять до кімнатної, потім перемішують протягом 1 години та виливають у крижану воду. Суміш екстрагують DCM. Органічний шар відокремлюють, сушать (MgSO4), фільтрують та випарюють розчинник, одержуючи 0,3г проміжної сполуки 5. Отриманий продукт відразу ж використовують на наступній стадії реакції. с) Одержання проміжної сполуки 6 Суміш проміжної сполуки 5 (0,0006моль), морфоліну (0,0009моль) та карбонату калію (0,0018моль) в ацетонітрилі (30мл) перемішують при 80°C протягом 15 годин, виливають у воду та екстрагують DCM. Органічний шар відокремлюють, сушать (MgSO4), фільтрують та випарюють розчинник. Залишок (0,27г) очищають за допомогою колоночної хроматографії на силікагелі (5мкм) (елюент: суміш DCM/MeOH від 100/0 до 90/10). Суміш проміжної сполуки 6 (0,0002моль) в 1N розчині гідроксиду натрію (1,5мл) та ТГФ (3мл) перемішують при кімнатній температурі протягом 72 годин. Додають 1N соляну кислоту (1,5мл). Суміш випарюють насухо, одержуючи проміжну сполуку 7. Отриманий продукт відразу ж використовують на наступній стадії реакції. е) Одержання проміжної сполуки 8 Суміш проміжної сполуки 7 (0,0002моль), O(тетрагідро-2H-піран-2-іл)-гідроксиламіну (0,0002моль), EDC (0,0002моль), HOBT (0,0002моль) та триетиламіну (0,0002моль) в суміші DCM/TГФ (10мл) перемішують при кімнатній температурі протягом 48 годин, виливають у воду та екстрагують EtOAc. Органічний шар відокремлюють, сушать (MgSO4), фільтрують та випарюють розчинник. Залишок (0,095г) очищають за допомогою колоночної хроматографії на силікагелі (5мкм) (елюент: суміш DCM/MeOН/NН4ОН 97/3/0,1). Чисті фракції збирають, розчинник випарюють, одержуючи 0,04г (41%) проміжної сполуки 8. Приклад A3 а) Одержання проміжної сполуки 11 Етилат титану (0,0085моль) додають при кімнатній температурі до розчину етилового ефіру 2(1-піперазиніл)-5-піримідинкарбонової кислоти (0,0042моль) та 4-феніл-3-бутен-2-ону (0,0051моль) в 1,2-дихлоретані (45мл) в потоці N2. Суміш перемішують при кімнатній температурі протягом 24 годин. Додають NaBH(OAc)3 (0,0085моль). Отриману суміш перемішують протягом 5 годин, виливають у крижану воду. Додають DCM. Суміш фільтрують через целіт. Органічний шар відокремлюють, сушать (MgSO4), фільтрують та розчинник випарюють. Залишок (1,16г) очищають за допомогою колоночної хроматографії на кромасилі (5мкм) (елюент: суміш DCM/MeOH від 100/0 до 95/5). Чисті фракції збирають, та розчинник випарюють, одержуючи 0,12г (8%) проміжної сполуки 11. b) Одержання проміжної сполуки 12 35 Суміш проміжної сполуки 11 (0,0003моль) та гідроксиду натрію (0,0013моль) в EtOH (15мл) перемішують та кип’ятять зі зворотним холодильником протягом 3 годин, потім охолоджують до кімнатної температури та випарюють насухо. Залишок змішують з діетиловим ефіром. Осад відфільтровують та сушать, одержуючи 0,12г (100%) проміжної сполуки 12, т.пл. >260°C. с) Одержання проміжної сполуки 13 EDC (0,0006моль) та HOBT (0,0006моль) додають при кімнатній температурі до розчину проміжної сполуки 12 (0,0003моль) в ТГФ (15мл) та DCM (15мл) в потоці N2. Суміш перемішують протягом 15 хвилин. Додають O-(тетрагідро-2H-піран2-іл)гідроксиламін (0,0006моль). Суміш перемішують при кімнатній температурі протягом 48 годин, виливають у крижану воду та екстрагують DCM. Органічний шар відокремлюють, сушать (MgSO4), фільтрують та випарюють розчинник. Залишок (0,25г) очищають за допомогою колоночної хроматографії на кромасилі (5мкм) (елюент: суміш DCM/MeOН від 100/0 до 95/5). Чисті фракції збирають та розчинник випарюють, одержуючи 0,1г (70%) проміжної сполуки 13. Приклад A4 а) Одержання проміжної сполуки 14 Суміш етилового ефіру 2-(1-піперазиніл)-5піримідинкарбонової кислоти (0,059моль) в ТГФ (300мл) та 1N розчину гідроксиду натрію (300мл) залишають на ніч при кімнатній температурі та потім перемішують. Додають 1N соляну кислоту (300мл) та суміш перемішують протягом 10хв. Додають карбонат натрію (0,178моль) та отриману суміш перемішують протягом 10 хвилин при кімнатній температурі, потім невеликими порціями додають 1-[[(9H-флуорен-9-ілметокси)карбоніл]окси]2,5-піролідиндіон (0,059моль) та реакційну суміш перемішують при кімнатній температурі протягом 15 годин. Суміш підкисляють концентрованою HCl, осад відфільтровують та сушать (у вакуумі), одержуючи 22,5г (90%) проміжної сполуки 14, т.пл. 218,5-221,2°C. b) Одержання проміжної сполуки 15 86066 36 До суміші проміжної сполуки 14 (0,0233моль) в DCM/TГФ (500мл) додають триетиламін (0,069моль), потім EDC (0,0303моль) та HOBT (0,0303моль), потім додають O-(тетрагідро-2Hпіран-2-іл)гідроксиламін (0,0303моль) та реакційну суміш перемішують при кімнатній температурі протягом 18 годин. Суміш розбавляють DCM та промивають водою. Органічний шар відокремлюють та промивають 10% розчином карбонату натрію. Відділений органічний шар сушать (MgSO4), фільтрують та випарюють розчинник. Залишок очищають за допомогою флеш колоночної хроматографії (елюент: суміш DCM/MeOН від 100/0 до 97,5/2,5 через 100 хв). Фракції продукту збирають, розчинник випарюють, одержуючи 8,4г (68%) проміжної сполуки 15. с) Одержання проміжної сполуки 16 Суміш проміжної сполуки 15 (0,016моль) у піридині (0,040моль) та DCM (200мл) перемішують протягом ночі при кімнатній температурі та реакційну суміш екстрагують водою, потім водний шар концентрують та випарюють разом з ацетонітрилом. Залишок (3,5г) очищають за допомогою флеш колоночної хроматографії (елюент: суміш DCM/MeOН/NН3, 95/5/0,5). Фракції продукту збирають, розчинник випарюють, одержуючи 2,5г (50%) проміжної сполуки 16, т.пл. 70,8-93,9°C. d) Одержання проміжної сполуки 17 Суміш проміжної сполуки 16 (0,002моль), (E)[2-(4-фторфеніл)етеніл]боронової кислоти (0,002моль) та 1,4-діоксан-2,5-діолу (0,002моль) в EtOH (25мл) перемішують при кімнатній температурі протягом 15 годин та виливають на лід. Додають NaHCO3. Суміш екстрагують DCM. Органічний шар відокремлюють, сушать (MgSO4), фільтрують та випарюють розчинник. Залишок (0,68г) очищають за допомогою флеш колоночної хроматографії на кромасилі (5мкм) (елюент: суміш DCM/MeOH від 100/0 до 90/10). Чисті фракції збирають та випарюють розчинник, одержуючи 0,27г (29%) проміжної сполуки 17, т.пл. 90°C. Приклад A5 а) Одержання проміжної сполуки 18 37 86066 38 До розчину [2-(4-фторфеніл)етеніл]боронової дають HOBT (0,0014моль), потім EDC кислоти (0,0169моль) в DCM (150мл) додають 2(0,0014моль) при кімнатній температурі. Суміш оксопропанову кислоту (0,0169моль), потім етилоперемішують при кімнатній температурі протягом вий ефір 2-(1-піперазиніл)-5-піримідинкарбонової 48 годин, виливають у воду та екстрагують DCM. кислоти (0,0169моль). Суміш перемішують при Органічний шар відокремлюють, сушать (MgSO4), кімнатній температурі протягом 15 годин. Додають фільтрують та розчинник випарюють. Залишок 2-оксопропанову кислоту (0,4екв.) та [2-(4(0,7г) очищають за допомогою колоночної хромафторфеніл)етеніл]боронову кислоту (0,1екв.). Сутографії на силікагелі (5мкм) (елюент: суміш міш перемішують при кімнатній температурі протяDCM/MeOH/NН4OH 99/1/0,1 до 94/6/0,6). Чисті гом 15 годин. Органічний шар промивають водою, фракції збирають, та розчинник випарюють, одерсушать (MgSО4), фільтрують та випарюють розжуючи 0,38г (75%) проміжної сполуки 21. чинник. Залишок (7,7г) очищають за допомогою Приклад A6 колоночної хроматографії на силікагелі (15-40мкм) а) Одержання проміжної сполуки 22 (елюент: суміш DCM/MeOH/NН4OH 92/8/0,1). Чисті фракції збирають та випарюють розчинник. Отриманий залишок (6г) розчиняють в 3N соляній кислоті. Суміш перемішують при кімнатній температурі протягом 2 годин. Осад відфільтровують, промивають водою (мінімум) та сушать, одержуючи 2,8г (36%) проміжної сполуки 18. b) Одержання проміжної сполуки 19 До розчину проміжної сполуки 1 (0,0065моль) в ТГФ (60мл) додають порціями гідрид натрію 60% (0,0085моль) при 5°C в потоці N2. Суміш перемішують при 5°C протягом 15 хвилин. Потім по краплях додають розчин йодометану (0,0078моль) в ТГФ (5мл). Суміш перемішують при 5°C протягом 1 години та при кімнатній температурі протягом 5 годин, виливають на лід та екстрагують EtOAc. Органічний шар відокремлюють, сушать (MgSO4), До розчину проміжної сполуки 18 фільтрують та випарюють розчинник. Залишок (0,0015моль), N-метилметанаміну (0,0022моль) та (1,75г) очищають за допомогою колоночної хроматриетиламіну (0,0075моль) в суміші DCM/ТГФ тографії на силікагелі (15-40мкм) (елюент: суміш (40мл) додають HOBT (0,0022моль), потім EDC DCM/MeOH 99/1). Чисті фракції збирають, та роз(0,0022моль). Суміш перемішують при кімнатній чинник випарюють, одержуючи 0,87г (34%) промітемпературі протягом 24 годин, виливають у воду жної сполуки 22. та екстрагують DCM. Органічний шар відокремb) Одержання проміжної сполуки 23 люють, сушать (MgSO4), фільтрують та випарюють розчинник. Залишок змішують з DIPE. Осад відфільтровують та сушать, одержуючи 0,58г (85%) проміжної сполуки 19, т.пл. 195°C. с) Одержання проміжної сполуки 20 Суміш проміжної сполуки 19 (0,0011моль) та гідроксиду літію (0,0023моль) в ТГФ (20мл) та воді (10мл) перемішують при кімнатній температурі протягом 15 годин. Додають 3N HCl. Випарюють ТГФ. Осад відфільтровують, промивають водою, потім діетиловим ефіром та сушать, одержуючи 0,45г (82%) проміжної сполуки 20. d) Одержання проміжної сполуки 21 До розчину проміжної сполуки 20 (0,0009моль), O-(тетрагідро-2H-піран-2іл)гідроксиламіну (0,0014моль) та триетиламіну (0,0043моль) в суміші DCM/ТГФ (50/50) (75мл) до Суміш проміжної сполуки 22 (0,0027моль) та моногідрату гідроксиду літію (0,0055моль) в ТГФ (40мл) та воді (20мл) перемішують при кімнатній температурі протягом 48 годин, підкисляють 1N HCl. ТГФ випарюють. Осад відфільтровують, промивають мінімальною кількістю води та сушать, одержуючи 0,91г (83%) проміжної сполуки 23. c) Одержання проміжної сполуки 24 До розчину проміжної сполуки 23 (0,0022моль), O-(тетрагідро-2H-піран-2іл)гідроксиламіну (0,0033моль) та триетиламіну (0,01моль) в суміші DCM/ТГФ (90мл) додають при кімнатній температурі HOBT (0,0033моль), потім EDC (0,0033моль) в потоці азоту. Суміш перемішують при кімнатній температурі протягом 48 го 39 86066 40 дин, виливають у воду та екстрагують DCM. Органічний шар відокремлюють, сушать (MgSO4), фільтрують та розчинник випарюють. Залишок (1,3г) очищають за допомогою колоночної хроматографії на силікагелі (15-40мкм) (елюент: суміш DCM/MeOH/NH4OH 97/3/0,1). Чисті фракції збирають, та розчинник випарюють, одержуючи 0,93г (89%) проміжної сполуки 24. До суміші проміжної сполуки 26 (0,0012моль) в Приклад A7 суміші DCM (50мл) та TГФ (50мл) додають триетиа) Одержання проміжної сполуки 25 ламін (0,0057моль), N’-(етилкарбонімідоїл)-N,Nдиметил-1,3-пропандіамін (0,0019моль), 1гідрокси-1H-бензoтриазол (0,0019моль) та O(тетрагідро-2Н-піран-2-іл)гідроксиламін (0,0019моль). Реакційну суміш перемішують протягом 24 годин при кімнатній температурі, потім виливають у H2O та екстрагують DCM. Органічний шар відокремлюють, сушать (MgSO4), фільтрують Суміш етилового ефіру 2-(1-піперазиніл)-5та випарюють розчинник. Залишок очищають за піридилкарбонової кислоти (0,0085моль), 1,4допомогою колоночної хроматографії на силікагелі діоксан-2,5-діолу (0,0093моль) та (E)-[2-(4(градієнт елюювання: суміш DCM/MeOH/NH4OH фторфеніл)етеніл]боронової кислоти (0,0042моль) 95/5/0,2). Фракції продукту збирають, та органічний в EtOH (200мл) перемішують при кімнатній темперозчинник випарюють, одержуючи 0,55г (91%). ратурі протягом 15 годин, потім фільтрують. ФільЗалишок змішують з діетиловим ефіром, осад вітрат випарюють. Залишок змішують з EtOAc. Ордфільтровують та сушать, одержуючи 0,5г проміжганічний шар промивають насиченим розчином ної сполуки 27, т.пл. 133°C. NaCl, сушать (MgSO4), фільтрують та розчинник Приклад A8 випарюють. Залишок (3,3г) розчиняють в діетилоОдержання проміжних сполук 28 та 29 вому ефірі та підкисляють, додаючи по краплях 56 N HCl в ізопропанолі (2мл) при 5°C. Осад відфільтровують, промивають діетиловим ефіром та сушать. Отриману фракцію змішують з водою. Додають K2CO3 та суміш екстрагують DCM. Органічний шар відокремлюють, сушать (MgSO4), фільтрують, та розчинник випарюють, одержуючи 2,7г (79%) проміжної сполуки 25. b) Одержання проміжної сполуки 26 проміжна сполука 28: вільна основа проміжна сполука 29: С2Н2О4 (1:1) Оцтовий ангідрид (0,014моль) додають по краплях при 5°C до суміші проміжної сполуки 3 (0,0014моль), 4-N-N-диметиламінопіридину (0,0095г) та піридину (2,5мл) в DCM (14мл). Суміш перемішують при кімнатній температурі протягом 24 годин, концентрують, змішують з водою та ексСуміш проміжної сполуки 25 (0,002моль), гідтрагують етилацетатом. Органічний шар сушать роксиду літію (0,004моль) у воді (20мл) та ТГФ (MgSO4), фільтрують та розчинник випарюють. (40мл) перемішують при кімнатній температурі Залишок очищають за допомогою колоночної хропротягом 15 годин. Суміш концентрують та додаматографії на силікагелі (5мкм) (градієнт елююють 3N соляну кислоту. Осад відфільтровують, вання: суміш DCM/MeOH 95/5). Чисті фракції збипромивають водою, потім діетиловим ефіром та рають, та органічний розчинник випарюють, сушать, одержуючи 0,52г (63%) проміжної сполуки одержуючи 0,48г (58%) проміжної сполуки 28. З 26. фракції (0,05г) одержують оксалатну сіль та крисc) Одержання проміжної сполуки 27 талізують із суміші 2-пропанон/діетиловий ефір. Осад відфільтровують та сушать, одержуючи 0,042г проміжної сполуки 29, т.пл. 154°C. В таблиці F-1 перераховані проміжні сполуки, отримані відповідно до одного з вищевказаних прикладів. 41 86066 42 ТАБЛИЦЯ F-1 (проміжні сполуки) Пром. Спол. 1; Прикл. [A1]; тп. 128°C Пром. Спол. 9; Прикл. [A1] Пром. Спол. 4; Прикл. [A1]; тп. 110,4°C (E); Пром. Спол. 10; Прикл. [A1]; тп. 139°C Пром. Спол. 11; Прикл. [A3] Пром. Спол. 19; Прикл. [A5]; тп. 195°C Пром. Спол. 30; Прикл. [A5] Пром. Спол. 31; Прикл. [A5]; тп. 196°C Пром. Спол. 32; Прикл. [A5]; тп. 221°C Пром. Спол. 33; Прикл. [A5] Пром. Спол. 34; Прикл. [A5] Пром. Спол. 35; Прикл. [A5] Пром. Спол. 36; Прикл. [A5]; тп. 144°C Пром. Спол. 37; Прикл. [A5] 43 86066 44 Пром. Спол. 38; Прикл. [A2] Пром. Спол. 39; Прикл. [A2] Пром. Спол. 40; Прикл. [A2] Пром. Спол. 22; Прикл. [A6] Спол. №41; Прикл. [A6] Пром. Спол. 42; Прикл. [A1] (енантіомер A) Пром. Спол. 43; Прикл. [A1]; тп. 146°C (енантіомер B) Пром. Спол. 44; Прикл. [A1]; тп. 167°C (енантіомер A) Пром. Спол. 45; Прикл. [A1] (енантіомер B) Пром. Спол. 25; Прикл. [A7] Пром. Спол. 46; Прикл. [A6] В. Одержання кінцевих продуктів Приклад В1 Одержання сполуки 1 Суміш проміжної сполуки 3 (0,00121моль) в ТФО (2,5мл) та MeOH (50мл) перемішують протягом 48 годин та потім випарюють розчинник. Залишок очищають за допомогою колоночної хроматографії на силікагелі LiChroprepÒ NH2 (25-40мкм) (елюент: суміш DCM/MeOH/H2O 80/20/2). Чисті фракції збирають та розчинник випарюють. Залишок змішують з діетиловим ефіром, осад потім відфільтровують та сушать (у вакуумі) при 50°C, одержуючи 0,26г (64%) сполуки 1, температура плавлення 187°C. Приклад В2 Одержання сполуки 2 45 86066 46 Суміш проміжної сполуки 8 (0,00007моль) в талізують з діетилового ефіру/DIPE. Осад відфільтрифтороцтовій кислоті (0,2мл) та MeOH (4,5мл) тровують та сушать, одержуючи 0,067г (34%) споперемішують при кімнатній температурі протягом луки 9, температура плавлення 161°C. 96 годин. Розчинник випарюють насухо. Залишок Приклад В6 кристалізують із суміші діетиловий ефір/2Одержання сполуки 10 пропанон. Осад відфільтровують та сушать, одержуючи 0,025г (57%) сполуки 2, температура плавлення 135°C. Приклад В3 Одержання сполуки 7 Суміш проміжної сполуки 13 (0,0002моль) в ТФО (0,5мл) та MeOH (10мл) перемішують при кімнатній температурі протягом 48 годин, потім випарюють насухо. Залишок кристалізують з діетилового ефіру. Осад відфільтровують та сушать, одержуючи 0,044г (44%) сполуки 7, температура плавлення 161°C. Приклад В4 Одержання сполуки 8 Суміш проміжної сполуки 17 (0,0005моль) в ТФО (1,2мл) та MeOH (24мл) перемішують при кімнатній температурі протягом 5 днів. Розчинник випарюють насухо. Залишок (0,26г) очищають за допомогою колоночної хроматографії на силікагелі LiChroprepÒ NH2 (25-40мкм) (елюент: суміш DCM/MeOH/H2O 70/30/3). Чисті фракції збирають та розчинник випарюють. Залишок (0,16г) кристалізують з діетилового ефіру. Осад відфільтровують та сушать, одержуючи 0,13г (66%) сполуки 8, температура плавлення 180°C. Приклад В5 Одержання сполуки 9 Суміш проміжної сполуки 28 (0,0004моль) в ТФО (1мл) та MeOH (20мл) перемішують при кімнатній температурі протягом 96 годин, потім випарюють. Залишок (0,23г) очищають за допомогою колоночної хроматографії на силікагелі LiChroprepÒ NH2 (25-40мкм) (елюент: суміш DCM/MeOH/H2O 80/20/2). Чисті фракції збирають та розчинник випарюють. Залишок (0,106г) крис До розчину проміжної сполуки 21 (0,0007моль) в MeOH (38мл) додають по краплях ТФО (1,9мл) при 5°C. Суміш перемішують при кімнатній температурі протягом 48 годин, потім випарюють насухо. Залишок кристалізують із суміші діетиловий ефір/CH3CN. Осад відфільтровують, промивають діетиловим ефіром та сушать, одержуючи 0,24г (62%) сполуки 10, температура плавлення 146°C. Приклад В7 Одержання сполуки 11 Суміш проміжної сполуки 24 (0,0018моль) в ТФО (4,4мл) та MeOH (87мл) перемішують при кімнатній температурі протягом 4 днів, потім випарюють насухо. Залишок (1,05г) очищають за допомогою колоночної хроматографії на силікагелі LiChroprepÒ NH2 (25-40мкм) (елюент: суміш DCM/MeOH/H2O 80/20/2). Чисті фракції збирають та сушать, та розчинник випарюють. Отриману фракцію (0,634г) поміщають у діетиловий ефір. Осад відфільтровують та сушать, одержуючи 0,43г сполуки 11, температура плавлення 212°C. Приклад В8 Одержання сполуки 31 Суміш проміжної сполуки 27 (0,0011моль) в трифтороцтовій кислоті (3мл) та MeOH (60мл) перемішують при кімнатній температурі протягом 48 годин. Розчинник випарюють насухо. Залишок кристалізують з діетилового ефіру. Осад відфільтровують та сушать, одержуючи 0,515г (89%) сполуки 31, температура плавлення 145°C. В таблиці F-2 перераховані сполуки, отримані відповідно до одному з вищевказаних прикладів. У таблицях використовують наступне скорочення: .C2HF3O2 позначає трифторацетатну сіль. 47 86066 48 ТАБЛИЦЯ F-2 (кінцеві сполуки) Спол. №l;Прикл. [B1];тп. 187°C C2HF3O2.H2O; Спол. №2; Прикл. [B2]; тп. 135°C (E).C2HF3O2. H2O; Спол. №3; Прикл. [B1]; тп. 160°C (E) .C2HF3O2;Спол. №4; Прикл. [B1]; тп. 156°C C2HF3O2 .H2O; Спол. №5; Прикл. [B1]; тп. 185°C C2HF3O2 .H2O; Спол. №6; Прикл. [B1]; тп. 160°C C2HF3O2; (E);Спол. №7; Прикл. [B3]; тп. 161°C Спол. №8; Прикл. [B4]; тп. 180°C Спол.№9; Прикл. [B5]; тп. 161°C .C2HF3O2. H2O;Спол. №10; Прикл. [B6]; тп. 146°C Спол. №11; Прикл. [B7];тп. 212°C .C2HF3O2. H2O (E);Спол. №12; Прикл. [B4]; тп. 128°C Спол. №13; Прикл. [B6]; тп. 130°C .C2HF3O2. H2O; Спол. №14; Прикл. [B6]; тп. 134°C 49 86066 50 .C2HF3O2. H2O; Спол. №15; Прикл. [B6]; тп. 159°C C2HF3O2; Спол. №16; Прикл. [B6]; тп. 131°C Спол. №17; Прикл. [B6]; тп.209°C Спол. №18; Прикл. [B6]; тп. 130°C .C2HF3O2. H2O; Спол. №19; Прикл. [B6]; тп. 130°C C2HF3O2; Спол. №20; Прикл. [B6]; тп. 128°C Спол. №21; Прикл. [B2]; тп. 110°C (E); Спол. №22; Прикл. [B2]; тп. 115°C .C2HF3O2. H2O; Спол. №23; Прикл. [B2]; тп. 106°C Спол. №24; Прикл. [B7]; тп. 170°C Спол. №25; Прикл. [B1]; тп. 203°C; енантіомер A Спол. №26; Прикл. [B1]; тп. 207°C; енантіомер B Спол. №27; Прикл. [B1]; тп. 218°C; енантіомер A Спол. №28; Прикл. [B1]; тп. 214°C; енантіомер B Спол. №29; Прикл. [B1]; тп. 166°C Спол. №30; Прикл. [B1]; тп. 190°C 51 Спол. №31; Прикл. [B8]; тп. 145°C 86066 52 Спол. №32; Прикл. [B7]; тп. 217°C .HCl; Спол. №33; Прикл. [B1]; тп. 256°C; енантіомер A .HCl; Спол. №34; Прикл. [B1]; тп. 254°C; енантіомер B (E); Спол. №35; Прикл. [B3]; тп. 202°C C. Фармакологічний приклад: У in vitro аналізі інгібування гістондеацетилази (див. приклад C.1) визначають інгібування ферментативної активності HDAC, викликане сполукою формули (I). Клітинну активність сполуки формули (I) визначають на пухлинних клітинах A2780 колориметричним аналізом токсичності або виживання клітин [Mosmann Tim, Journal of Immunological Methods 65: 55-63, 1983] (див. приклад C.2). Розчинність сполуки визначає здатність сполуки знаходитися в розчині. У першому способі вимірюють здатність сполуки залишатися у водному розчині при розведенні (див. приклад C.3.a). Вихідні розчини в ДМСО розводять водним буферним розчинником у три послідовні стадії. Для кожного розведення нефелометром вимірюють мутність. Другим способом можна вимірювати розчинність сполуки при різних значеннях рН, використовуючи хемілюмінесцентний детектор азоту (див. приклад C.3.b). Проникаюча здатність лікарського засобу виражає його здатність переходити з одного середовища в інше або проникати через інше. Зокрема, здатність лікарського засобу переходити через інтестинальну мембрану в кровоток та/або з кровотоку в мішень. Проникаючу здатність (див. приклад C.4) можна визначити за допомогою утворення іммобілізованої на фільтрі штучної мембрани фосфоліпідного подвійного шару. В аналізі з іммобілізованої на фільтрі штучною мембраною утвориться "сендвіч" з 96-лункового мікротитраційного планшета та 96-лункової фільтрувальної пластини, таким чином, що кожна складена лунка розділена на 2 камери з розчином-донором на дні та розчином-акцептором у верхній частині, що розділені дисковим мікрофільтром (125мкм із порами 0,45мкм), на який нанесений 2% (мас./об.) розчин діолеоїлфосфатидилхоліну в додекані, в умовах, де багатошарові подвійні шари утворюють канали у середині фільтра, коли система стикається з водним буферним розчином. Здатність сполук проникати через згадану штучну мембрану вимі рюють в см/с. Ціль полягає в тому, щоб визначити здатність лікарських засобів проникати через паралельну штучну мембрану при 2 різних значеннях рН: 4,0 та 7,4. Сполуки детектують УФспектрометрією при оптимальній довжині хвилі від 250 до 500нм. Метаболізм лікарських засобів означає, що розчинна в ліпідах ксенобіотична або ендобіотична сполука ензиматично трансформується в полярний, розчинний у воді та екскретуємий метаболіт(и). Головним органом для метаболізму ліків є печінка. Продукти метаболізму часто менш активні, ніж вихідні лікарські засоби, або взагалі неактивні. Однак деякі метаболіти, можливо, мають підвищену активність або підвищену токсичну дію. Отже, метаболізм лікарських засобів може включати, як "детоксикацію", так і "інтоксикацію". Одна з основних ферментних систем, що визначає здатність організму справлятися з лікарськими засобами та хімікатами, представлена цитохром P450залежними монооксигеназами, що є ферментами, залежними від NADPH. Mетаболічну стабільність сполук можна визначити in vitro, використовуючи субклітинні тканини людини. (див. приклад C.5.a.). В даній заявці метаболічна стабільність сполук виражається в % лікарського засобу, метаболізованого після інкубування зазначених сполук мікросомами протягом 15 хвилин. Кількісний аналіз сполук здійснюють РХ-МС. Метаболічну стабільність сполук також можна визначити, розраховуючи період напіврозпаду сполук у гепатоцитах пацюків (див. приклад C.5.b.). Показано, що різноманітні протипухлинні засоби активують білок p21, у тому числі засоби, що ушкоджують ДНК, та інгібітори гістондеацетилази. Засоби, що ушкоджують ДНК, активують ген p21 через пухлинний супресор p53, тоді як інгібітори гістондеацетилази транскрипціонально активують ген р21 за допомогою транскрипційного фактора Sp1. Отже, засоби, що ушкоджують ДНК, активують промотор p21 через p53-залежний елемент, тоді як інгібітори гістондеацетилази активують промотор p21 через сайти sp1 (розташовані в об 53 86066 54 ласті від -60 п.н. до +40 п.н. відносно TATA боксу), білкам CYP P450. Білки CYP P450 (E.coli експрепричому, як перші, так і другі приводять до збільсовані) 3A4, 2D6 en 2C9 перетворюють свої спешеної експресії білка p21. Коли промотор p21 у цифічні субстрати на флуоресцентні молекули. клітинах складається з фрагмента промотору p21 Білок CYP3A4 перетворює 71300 п.н., що не містить p53-залежних елементів, бензилокситрифторметилкумарин (BFC) на 7він відповідно не дає відповіді на засоби, що гідрокситрифторметилкумарин. Білок CYP2D6 пеушкоджують ДНК. Здатність сполук індукувати p21 ретворює 3-[2-(N,N-діетил-N-метиламіно)етил]-7можна оцінювати декількома методами. Перший метокси-4-метилкумарин (AMMC) на гідрохлорид метод полягає в тому, щоб обробити пухлинні клі3-[2-(N,N-діетиламіно)етил]-7-гідрокси-4тини сполукою, що представляє інтерес, та після метилкумарину та білок CYP2C9 перетворює 7лізису клітин визначити індукцію p21 твердофазмeтокси-4-трифторметилкумарин (MFC) на 7ним імуноферментним аналізом р21 (WAF1 ELISA гідрокситрифторметилкумарин. Сполуки, що інгіof Oncogene). Аналіз p21 являє собою "сендвіч" бують ферментативну реакцію, будуть приводити імуноферментний аналіз, в якому використовують, до зменшення флуоресцентного сигналу (див. як моноклональні антитіла миші, так і поліклонаприклад C.7). льні антитіла кролика. Поліклональні антитіла кроПриклад C.1: in vitro аналіз інгібування гістонлика, специфічні для людського білка p21, імобілідеацетилази зуються на поверхні пластмасових лунок, що є в Використовують флуоресцентний аналіз актинаборі. Будь-який білок p21, присутній в аналізовності HDAC/Drug Discovery Kit of Biomol (номер у ваному зразку, буде зв’язуватися з іммобілізовакаталозі AK-500-0001). Флуоресцентний аналіз ним антитілом. Біотинільоване ідентифікуюче моактивності HDAC базується на комбінації субстраноклональне антитіло також розпізнає людський ту Fluor de Lys [Fluorogenic Histon de Acetylase білок p21 та буде зв’язуватися будь-яким p21, що Lysyl] та проявника. Субстрат Fluor de Lys містить зберігається іммобілізованим антитілом. Ідентифібічний ланцюг ацетильованого лізину. Деацетилюкуюче антитіло, у свою чергу, зв’язується стрептавання субстрату сенсибілізує субстрат таким чивідином, кон’югованим з пероксидазою хрону. Пеном, що на другій стадії обробка проявником Fluor роксидаза хрону каталізує перетворення de Lys надає флуорофор. хромогенного субстрату тетраметилбензидину з Ядерні екстракти HeLa (постачальник-Biomol) безбарвного розчину на синій розчин (або жовтий інкубують при 60мкг/мл з 75мкм субстрату. Субпісля додавання стоп-реагенту), інтенсивність якострат Fluor de Lys додають у буфер, що містить го пропорційна кількості протеїну p21, зв’язаного з 25мM Tris, 137мM NaCl, 2,7мM KCl та 1мM планшетом. Забарвлений продукт реакції визнаMgCl2.6H2O при pН 7,4. Через 30хв. додають 1 чають кількісно за допомогою спектрофотометру. об’єм проявника. Флуорофор збуджують світлом Кількісний аналіз виконують шляхом побудови 355нм та світло, що випромінюється, (450 нм) вистандартної кривої відомих концентрацій p21 (за значають на флуорометричному планшет-рідері. умови його ліофілізації). Зазначений аналіз дозвоДля кожного експерименту паралельно проводять ляє вимірювати індукцію p21 як наслідок ушкоконтрольні досліди (містять ядерні екстракти HeLa дження ДНК або як наслідок інгібування гістондеата буфер) та “холості” досліди з інкубування клітин цетилази (див. приклад C.6.a). (містять буфер без ядерного екстракту HeLa) та Здатність сполук індукувати p21 як результат досліди зі зразками (містять сполуку, розчинену в інгібування HDAC на клітинному рівні визначають ДМСО та додатково розведену в буфері, та ядеріншим методом. Клітини можуть бути стабільно ний екстракт HeLa). У першому прикладі сполуки трансфіковані вектором експресії, що містить фравипробують при концентрації 10-5M. Коли сполуки гмент промотору p21 1300 п.н., що не містить p53виявляють активність при концентрації 10-5M, бузалежних елементів та де збільшення експресії дують криву концентрація-відповідь, для якої спогена-репортера, у порівнянні з рівнями контролю, луки випробують у концентраціях від 10-5M до 109 ідентифікує сполуку як здатну індукувати p21. ГенM. Усі зразки випробують по 4 рази. У кожному репортер являє собою флуоресціюючий білок та тесті значення холостих дослідів віднімають зі експресію гена-репортера вимірюють як кількість значень, отриманих у контрольних дослідах та в флуоресцентного випромінювання, що випускадослідах зі зразком. Контрольний зразок являє ється, (див. приклад C.6.b.). Останній метод являє собою 100% деацильований субстрат. Для кожнособою in vivo метод, де використовують мишей го зразка флуоресценцію виражають у відсотках для скринінгу фармацевтичної активності сполуки. від середнього значення контрольних дослідів. Вищеописані стабільно трансформовані пухлинні Коли це доцільно, розраховують значення IC50 (концентрація лікарського засобу, необхідна для клітини можна вводити мишам у кількості, достатзменшення росту клітин на 50% у порівнянні з конній, щоб здійснити продукування пухлини. Після тролем), застосовуючи пробіт-аналіз для кількістого як пухлинні клітини мали досить часу для фоних даних. У даній заявці ефекти досліджених рмування пухлини, тваринам можна вводити потесполук виражені в pIC50 (від’ємна величина логанційно активну сполуку, та дію зазначеної сполуки рифма значення IC50) (див. таблицю F-3). на пухлинні клітини оцінюють, вимірюючи експреПриклад C.2: Визначення антипроліферативсію гена-репортера. Інкубування фармацевтично ної активності на клітинах A2780 активними сполуками буде приводити до збільУсі досліджені сполуки розчиняють у ДМСО та шення експресії гена-репортера в порівнянні з конроблять подальші розведення в живильному сетрольними рівнями (див. приклад C.6.с.). редовищі. При визначенні проліферації клітин кінСпецифічні інгібітори HDAC не повинні інгібуцеві концентрації ДМСО ніколи не перевищували вати інші ферменти, подібно розповсюдженим 55 86066 56 0,1% (об./об.). Контрольні досліди містили клітини ефекти досліджених сполук виражені в pIC50 A2780 та ДМСО без сполуки, та холості досліди (від’ємна величина логарифма значення IC50) (див. містили ДМСО, але не містили клітин. MTT розчитаблицю F-3). няють при 5мг/мл у PBS. Готують гліциновий буПриклад C.3. Розчинність/Стабільність фер, що містить 0,1 M гліцину та 0,1 M NaCl, заC.3.a. Кінетична розчинність у водних середобуферений розчином 1N NaOH до pН 10,5 (усі вищах реагенти поставляються Merck). На першій стадії розведення 10мкл концентКлітини A2780 карциноми яєчника людини рованого вихідного розчину активної сполуки, со(люб’язно надані в дарунок доктором T.C. Hamilton любілізованої в ДМСО (5мM), додають до 100мкл [Fox Chase Cancer Centre, Pennsylvania, USA]) куфосфат-цитратного буфера з рН 7,4 та змішують. льтивують у середовищі RPMI 1640, до якого доНа другій стадії розведення аліквоту (20мкл) роздані 2мМ L-глутаміну, 50мкг/мл гентаміцину та чину після першої стадії розведення додатково 10% фетальна теляча сироватка. За стандартною розподіляють в 100мкл фосфат-цитратного буфеметодикою клітини фетальної телячої сироватки ра з рН 7,4 та змішують. В кінці, на третій стадії витримують як моношарові культури при 37°C в розведення зразок (20мкл) розчину після другої зволоженій атмосфері з 5% CO2. Клітини пересістадії розведення додатково розподіляють в вають 1 раз на тиждень, використовуючи розчин 100мкл фосфат-цитратного буфера з рН 7,4 та трипсин/EDTA при індексі розведення 1:40. Усі змішують. Усі розведення здійснюють у 96середовища та допоміжні засоби одержують від лункових планшетах. Відразу ж після останньої компанії Life Technologies. Клітини не забруднені стадії розведення нефелометром вимірюють мутмікоплазмою, як визначено за допомогою набору ність розчинів трьох послідовних стадій розведенGen-Probe Mycoplasma Tissue Culture kit (постачаня. Розведення повторюють по 3 рази для кожної льник: BioMérieux). сполуки, щоб виключити випадкові помилки. На Клітини висівають у NUNCTM 96-лункові планпідставі вимірів мутності сполуки поділяють на 3 шети (Постачальник: Life Technologies) та протякласи. Сполуки з високою розчинністю одержують гом ночі дають можливість клітинам «прилипнути» 3 бали, та для цих сполук при першому розведенні до пластмаси. Густина, яку використовували для одержують прозорий розчин. Сполуки із середкультивування, складала 1500 клітин на лунку при ньою розчинністю одержують 2 бали, та для цих загальному об’ємі середовища 200мкл. Після адсполук перше розведення дає непрозорий розчин, гезії клітин до планшетів середовище змінюють та а після другого розведення розчин прозорий. Спододають ліки та/або розчинники до кінцевого луки з низькою розчинністю одержують 1 бал та об’єму 200мкм. У наступні чотири дні інкубування для цих сполук і перше, і друге розведення не дасередовище заміняють 200мкм свіжого середовиють прозорого розчину (див. таблицю F-3). ща та густину і життєздатність клітин оцінюють C.3. b. Розчинність аналізом, заснованому на MTT. У кожну лунку доРозчинність сполуки при різних значеннях рН дають 25мкл розчину MTT та клітини додатково також можна вимірити за допомогою хемілюмінесінкубують протягом 2 годин при 37°C. Середовище центного детектору азоту (див. таблицю F-3). потім обережно відсмоктують та синій продукт Приклад C.4. Аналіз проникності паралельної MTT-формазан солюбілізують додаванням 2мкл штучної мембрани гліцинового буферу, потім 100мкл ДМСО. МікропВихідні зразки (аліквоти 10мкл вихідного розланшети для аналізу струшують протягом 10хв. на чину 5мМ у 100% ДМСО) розводять у планшеті з мікропланшетному шейкері та вимірюють поглиглибокими лунками або Pre-mix планшеті, що міснання при 540нм за допомогою Emax 96-лункового тить 2мл водні буферні системи з рН 4 або рН 7,4 спектрофотометра (постачальник: Sopachem). У (PSR4 System Solution Concentrate (pION)). рамках одного експерименту результати для кожДо додавання зразків до еталону 150мкл буного типу умов експерименту являють собою сефера додають у лунки та здійснюють "холосте" реднє значення з 3 відтворених лунок. Для первісУФ-вимірювання. Потім буфер відкидають, та ного скринінгу сполуки випробують при одній планшет використовують як еталонний. Усі виміфіксованій концентрації 10-6M. Для активних спорювання проводять у планшетах, стійких до УФлук експерименти повторюють, щоб побудувати опромінення (постачальник: Costar або Greiner). повні криві концентрація-відповідь. Для кожного Після холостого вимірювання 150мкл розвеексперименту паралельно проводять контрольні дених зразків додають в еталонний планшет та досліди (не містять ліки) та “холості” досліди з ін200мкл розведених зразків додають у планшеткубування (не містять клітини та ліки). Значення донор 1. На акцептор-фільтр-пластину 1 (постачадля холостих дослідів віднімають з усіх значень, льник: Millipore, тип: MAIP N45) наносять покриття отриманих у контрольних дослідах та дослідах зі з 4мкл розчину, що утворює штучну мембрану зразками. Для кожного зразка середнє значення (1,2-діолеоїл-sn-гліцер-3-фосфохолін в додекані, росту клітин (в одиницях поглинання) виражають у що містить 0,1% 2,6-ди-трет-бутил-4відсотках від середнього значення росту клітин у метилфенолу) та поміщають на верхню частину контролі. Коли це доцільно, розраховують значенпланшета-донора 1, утворюючи "сендвіч". Буфер ня IC50 (концентрація лікарського засобу, необхід(200мкл) розподіляють у лунках-акцепторах у верна для зменшення росту клітин на 50% у порівнянхній частині. "Сендвіч" закривають кришкою та ні з контролем), застосовуючи пробіт-аналіз для зберігають протягом 18год. при кімнатній темперакількісних даних [Finney, DJ, Probit Analyses, 2nd турі в темряві. "Холосте" вимірювання планшета-акцептора 2 Ed. Chapter 10, Graded Responses, Cambridge здійснюють шляхом додавання 150мкл буфера в University Press, Cambridge 1962]. У даній заявці 57 86066 58 Суміші попередньо інкубують протягом 5хв. лунки з наступним УФ-вимірюванням. Після "холопри 37 градусах Цельсію. Реакцію починають у стого" вимірювання планшета-акцептора 2 буфер нульовий момент часу (t=0) додаванням 0,8мМ відкидають та 150мкл розчину акцептора переноNADP та зразки інкубують протягом 15хв. (t=15). сять з акцептора-фільтр-пластини 1 на планшетРеакцію припиняють додаванням 2 об’ємів ДМСО. акцептор 2. Потім акцептор-фільтр-пластину 1 Потім зразки центрифугують протягом 10хв. при видаляють з "сендвіча". Після холостого вимірю900×g та супернатанти зберігають при кімнатній вання планшета-донора 2 (див. вище) 150мкл розтемпературі перед аналізом не більше 24 годин. чину донора переносять із планшета-донора 1 у Усі досліди з інкубування здійснюють по два рази. планшет-донор 2. УФ-спектри лунок планшетаАналіз супернатантів проводять LC-MS. Елюювандонора 2, планшета-акцептора 2 та еталонного планшета сканують (Spectra MAX 190). Усі спектри ня зразків здійснюють на Xterra MS C18 (50´4,6мм, обробляють для розрахунку проникності за допо5мкм, Waters, US). Використовують ВЕРХ систему могою програми PSR4p Command. Для всіх сполук Alliance 2790 (Supplier: Waters, US). Елюювання вимірювання здійснюють тричі. У кожному досліді проводять буфером A (25мM ацетату амонію як стандарти використовують карбамазепін, гризе(pН 5,2) у суміші H2O/ацетонітрил (95/5)), причому офулвін, ациклогуанізин, атенолол, фуросемід та розчинником В є ацетонітрил, а розчинником Схлортриазид. Сполуки поділяють на три категорії: метанол при швидкості потоку 2,4мл/хв. Викориссполуки з низькою проникаючою здатністю (середтовуваним градієнтом є лінійне збільшення конценій ефект середній ефект³ 0,5´10-6 см/с, кількість бадодаткових 1,5хв. Загальний об’єм зразків, що лів 2) або сполуки з високою проникаючою здатнівводяться, складав 25мкл. стю (³1´10-6см/с, кількість балів 3). Для детектування використовують Quattro (поПриклад C.5. Метаболічна стабільність стачальник: Micromass, Манчестер, ВеликобритаПриклад C.5.a. нія) мас-спектрометр із трьома квадрупольними Препарати субклітинної тканини одержують за лінзами, постачений ESI джерелом. Температуру методикою Горрода [Gorrod et al., Xenobiotica 5: джерела та температуру десольватації встанов453-462, 1975] поділом на центрифузі після мехалюють 120 та 350°C, відповідно, та як небулайзер нічної гомогенізації тканини. Тканину печінки прота газ-осушувач використовують азот. Дані одермивають охолодженим (0°C) 0,1М трис-HCl буфежують у позитивному режимі сканування (реакція ром (pН 7,4), щоб відмити надлишкову кров. Потім одиночного іона). Конус напруги встановлений при тканину піддають блотингу, сушать, зважують та 10 В та час перебування в системі складав 1 с. подрібнюють за допомогою хірургічних ножиців. Метаболічну стабільність виражають як% меШматочки тканини гомогенізують у 3 об’ємах охотаболізму сполуки після інкубування протягом 15 лодженого (0°C) фосфатного буфера (pН 7,4), вихвилин у присутності активних мікросом (Е(акт))(% користовуючи або Potter-S (Braun, Італія) гомогеніметаболізму =100%. затор, постачений товкачиком з тефлону, або Sorvall Omni-Mix гомогенізатор, для 7´10сек. В обох випадках посудину витримують в/на льоді під час гомогенізації. Сполуки, що мали% метаболізму менше 20% Гомогенати тканини центрифугують при 9000g визначають як сполуки з високої метаболічною протягом 20 хвилин при 4°С на центрифузі Sorvall стабільністю. Сполуки з метаболізмом від 20 до або ультрацентрифузі Beckman. Отриманий супе70% визначають як сполуки з проміжною метаборнатант зберігають при -80°С та позначають ‘S9’. лічною стабільністю та сполуки з метаболізмом Фракцію S9 можна додатково центрифугувати вище 70% визначають як сполуки з низькою метапри 100000´g протягом 60 хвилин (4°C) на ультраболічною стабільністю. Три сполуки-еталони центрифузі Beckman. Отриманий супернатант включають завжди, коли здійснюють скринінг меобережно відсмоктують, визначають кількість та таболічної стабільності. Верапаміл включають як називають ‘цитозол’. Таблетку повторно суспенсполуку з низькою метаболічною стабільністю (% дують у 0,1 M фосфатному буфері (pН 7,4) в остаметаболізму=73%). Цисаприд включають як споточному об’ємі 1мл на 0,5г вихідної маси тканини луку з проміжною метаболічною стабільністю (% та називають "мікросоми". метаболізму 45%) та пропанол включають як споУсі субклітинні фракції поділяють та негайно луку з високою метаболічною стабільністю (метазаморожують у рідкому азоті та зберігають при болізм 25%). Зазначені еталонні сполуки викорис80°С до використання. товують для того, щоб підтвердити результати Для досліджених зразків суміш для інкубувананалізу метаболічної стабільності. ня містила PBS (0,1M), сполуку (5 мкM), мікросоми C.5.b: Метаболічна стабільність з культурою (1мг/мл) та систему, що генерує NADPH, (0,8мМ клітин гепатоцитов пацюків глюкози-6-фосфату, 0,8мМ хлориду магнію та 0,8 Гепатоцити пацюків виділяють з пацюківодиниць глюкоза-6-фосфатдегідрогенази). Контсамців Sprague Dowley. Сполуки розчиняють у рольні зразки містили ті ж речовини, але мікросо5мM вихідного розчину в 100% ДМСО та інкубують ми були замінені інактивованими нагріванням мікпри кінцевій концентрації 5мкм протягом часу 0, росомами (10хв. при 95 градусах Цельсію). 15, 30, 60 та 120хв. із культурами клітин гепатоциПовернення сполук у контрольних зразках завжди тов пацюків (0,5 мільйона життєздатних кліскладало 100%. тин/0,5мл) у 24-лункових планшетах. 59 86066 60 Зразки для РХ-МС готують додаванням двох (1´) промивного буфера (20´ планшет промивний об’ємів ДМСО. Зразки ретельно струшують та поконцентрат: 100мл розчину PBS 20-кратної концетім центрифугують при 900 g протягом 10хв. (кімнтрації та поверхнево-активної речовини. Містить натна температура). Всі експерименти проводять 2% хлорацетаміду). Ліофілізований стандарт тричі. Отриманий супернатант (50мкл) аналізують p21WAF розбавляють дистильованою H2O та доРХ-МС. датково розводять розріджувачем зразків (поставДля РХ-МС елюювання зразків здійснюють на ляється в наборі). колонці Hypersil BDS C18 (50´4,6мм, 5мкм, Зразки готують розведенням їх у розріджувачі Thermohypersil, Великобританія). ВЕРХ система для зразків (1:4). Зразки (100мкл) та стандарти включає систему доставки Surveyor [Surveyor Inc., p21WAFl (100мкл) відбирають піпеткою у відповідSan Jose, США], постачену автосемплером ні лунки та інкубують при кімнатній температурі Surveyor. Елюювання здійснюють буфером Aпротягом 2 годин. Лунки 3 рази промивають 1´ (10мM ацетату амонію (pН 6,9) у суміші промивним буфером та потім 100мкл реагенту для H2O/ацетонітрил (95:5)) та розчинником B (ацетовизначення антитіл (розчин біотинільованих мононітрил) при швидкості потоку 1,2мл/хв. Використоклональних антитіл p21WAF1) вносять піпеткою в вуваний градієнт складає 0,5хв. розчинник A як кожну лунку. Лунки інкубують при кімнатній темпепочаткові умови з наступним лінійним збільшенратурі протягом 1 години та потім три рази проминям концентрації органічної фази від 0% B до 95% вають 1x промивним буфером. 400´ кон’югат B протягом 2хв. Зазначену фазу зберігають стаці(кон’югат пероксидази стрептовідину: 400-кратний онарною протягом наступних 2хв. та знову зменконцентрований розчин) розбавляють та додають шують В до 0% протягом 0,5хв. 100мкл 1´ розчину в лунки. Лунки інкубують при Загальний об’єм введених зразків складає кімнатній температурі протягом 30хв. та потім 3 50мкл. Температуру нагрівання колонки підтримурази промивають 1´ промивним буфером та 1 раз ють при 40°C. Потік ГХ розщеплюється для МС дистильованою H2O. Розчин субстрату (хромогендетектування та 0,1мл подається в джерело. Масний субстрат) (100мкл) додають у лунки та лунки спектрометр із трьома квадрупольними лінзами інкубують протягом 30хв. у темряві при кімнатній TSQ Quantum [Thermofinnigan, LaJolla, США], мастемпературі. Додають розчин стоп-реагенту в кожспектрометр, постачений ESI джерелом, викорисну лунку в тому ж порядку, що і раніше доданий товують для детектування. Напругу джерела встарозчин субстрату. У кожній лунці вимірюють погновлюють 3800 В, температуру капіляра-300°C. линання двохвильовим спектрофотометричним Мас-спектрометр використовують у режимі позипланшет-рідером при 450/595 нм. Для кожного тивних іонів у SIM, відрегульованому для маси експерименту паралельно здійснюють контрольні M+H із шириною сканування 1 Da для кількісних досліди (які не містять лікарський засіб) та холості цілей. Регулювання приладу, одержання та обробдосліди з інкубування (в яких відсутні клітини та ку даних здійснюють за допомогою програм лікарські засоби). Значення для холостого досліду Xcalibur [ThermoFinnigan, San Jose, CA, США]. Мевіднімають зі значень, отриманих у контрольних таболічну стабільність сполук у гепатоцитах пацюдослідах та дослідах зі зразками. Для кожного зраків виражають як періоди напіврозпаду in vitro. зка значення індукції для p21WAFl (в одиницях Як еталон використовують сполуку R306465 поглинання) виражають у вигляді процентного [WO 03/76422] (in vitro період напіврозпаду 8хв.). відношення значення для p21WAFl у контролі. Досліджували Сполуку 4 за даною заявкою, та її Процентне відношення індукції вище 130% визнаперіод напіврозпаду складає 23хв. чають як значну індукцію. Випробували чотири Приклад C.6. Індукуюча здатність p21 сполуки та всі вони показали значну індукцію. Приклад C.6.a. Твердофазний імуноферментПриклад C.6.b. Клітинний метод ний аналіз білка p21 Клітини A2780 (ATCC) культивують у середоНижченаведену методику застосовують для вищі RPMI 1640, до якого додані 10% FCS, 2мM Lвизначення рівня експресії білка p21 у клітинах глутаміну та гентаміцину при 37°C у вологому інA2780 карциноми яєчника людини. Клітини A2780 кубаторі з 5% CO2. Всі розчини культур клітин на(20000 клітин/180мкл) висівають у 96-мікролункові дані Gibco-BRL (Gaithersburg, MD). Інші речовини мікропланшети в середовищі RPMI 1640 з додапоставлені компанією Nunc. ванням 2г L-глутаміну, 50мкг/мл гентаміцину та Геномну ДНК екстрагують з проліферуючих 10% фетальної телячої сироватки. За 24 години до A2780 клітин та використовують як матрицю для лізису клітин додають сполуки в кінцевих концентвнутрішньогенного PCR виділення промотору p21. раціях 10-5, 10-6, 10-7 та 10-8M. Усі досліджені споПершу ампліфікацію здійснюють за 20 циклів при луки розчиняють у ДМСО, та подальші розведення температурі ренатурації 55°C, використовуючи здійснюють у живильному середовищі. Через 24 пари нуклеотидів GAGGGCGCGGTGCTTGG та години після додавання сполуки супернатанти TGCCGCCGCTCTCTCACC з геномною ДНК як видаляють із клітин. Клітини промивають 200мкл матрицею. Отриманий фрагмент (4,5 т.п.н.), що охолодженого на льоді PBS. Лунки аспірують та містить від -4551 до +88 фрагмент відносно TATA додають 30мкл лізисного буфера (50мM Tris.HCl боксу (боксу Хогнеса), реампліфікують олігонукле(pН 7,6), 150мM NaCl, 1% Nonidet p40 та 10% гліотидами TCGGGTACCGAGGGCGCGGTGCTTGG церин). Планшети інкубують протягом ночі при та ATACTCGAGTGCCGCCGCTCTCTCACC за 20 70°С. циклів при температурі ренатурації 88°C та одерВідповідну кількість мікротитрувальних лунок жують фрагмент (4,5 т.п.н.) та потім олігонуклеовидаляють з мішка з фольги та поміщають у поротидною парою жню камеру для лунок. Готують робочий розчин TCGGGTACCGGTAGATGGGAGCGGATAGACAC
ДивитисяДодаткова інформація
Назва патенту англійськоюSubstituted propenyl piperazine derivatives as novel inhibitors of histone deacetylase
Автори англійськоюVan Brandt Sven Franciscus Ann, van Emelen Kristof, Angibaud Patrick Rene, Marconnet-Decrane Laurence Francoise Bernadette, Arts Janine
Назва патенту російськоюПроизводные замещенного пропенилпиперазина как ингибиторы гистондеацетилазы
Автори російськоюван Брандт Свен Францискус Анна, ван Эмелен Кристоф, Анджибо Патрик Рене, Марконне-Декран Лоренс Франсуаз Бернадетт, Артс Жанин
МПК / Мітки
МПК: A61K 31/505, C07D 239/54, A61K 35/00, C07D 239/42, C07D 403/12
Мітки: пропенілпіперазину, інгібітори, гістондеацетилази, заміщеного, похідні
Код посилання
<a href="https://ua.patents.su/33-86066-pokhidni-zamishhenogo-propenilpiperazinu-yak-ingibitori-gistondeacetilazi.html" target="_blank" rel="follow" title="База патентів України">Похідні заміщеного пропенілпіперазину як інгібітори гістондеацетилази</a>