Піридинметиленазолідинони та їх застосування як інгібіторів фосфоінозитиду
Номер патенту: 88314
Опубліковано: 12.10.2009
Автори: Дорбе Жером, Помель Венсан, Куаттропані Анна, Бішофф Александер, Ковіні Дейвід, Рюкле Томас
Формула / Реферат
1. Похідне піридинметиленазолідинону за формулою (І)
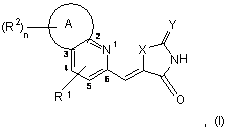
де R1 вибраний з групи, яку складають Н, галоген, С1-C6-алкіл, С2-С6-алкеніл та С2-С6-алкініл, С1-6-алкілалкоксигрупа, алкоксикарбоніл, ацил, сульфоніл, сульфаніл, сульфініл, алкокси- та аміногрупа;
R2 вибраний з групи, яку складають Н, галоген, С1-C6-алкіл, С2-С6-алкеніл, С2-С6-алкініл, арил, гетероарил, С3-С8-циклоалкіл, С3-С8-гетероциклоалкіл, арил-С1-C6-алкіл, гетероарил-С1-C6-алкіл, С3-С8-циклоалкіл-С1-C6-алкіл, С3-С8-гетероциклоалкіл-С1-C6-алкіл, С1-C6-алкілалкоксигрупа, алкоксикарбоніл, ацил, сульфоніл, сульфаніл, сульфініл, алкокси- та аміногрупа;
X вибраний з групи, яку складають S, NH та О;
Y вибраний з групи, яку складають О, S та NR3, де R3 вибраний із групи, яку складають Н, факультативно заміщена С1-C6-алкоксигрупа, факультативно заміщений С1-C6-алкіл, факультативно заміщений С2-С6-алкеніл, факультативно заміщений С2-С6-алкініл, факультативно заміщений С1-C6-алкіларил, ціаногрупа та факультативно заміщений сульфоніл;
А - гетероарилгрупа;
n - ціле число, вибране з-посеред 1 та 2;
а також геометричні ізомери, оптично активні форми, наприклад, енантіомери, діастереомери, та рацематні форми, а також фармацевтично прийнятні солі відповідних сполук.
2. Похідне піридинметиленазолідинону за п. 1, де R1 - Н.
3. Похідне піридинметиленазолідинону за пп. 1, 2, де R2 - Н.
4. Похідне піридинметиленазолідинону за пп. 1, 2, де R2 - С3-С8-гетероциклоалкіл.
5. Похідне піридинметиленазолідинону за пп. 1, 2, де R2 вибраний з групи, яку складають арил та гетероарил.
6. Похідне піридинметиленазолідинону за будь-яким попереднім пунктом, де X - S.
7. Похідне піридинметиленазолідинону за будь-яким попереднім пунктом, де Y - О.
8. Похідне піридинметиленазолідинону за будь-яким попереднім пунктом, де Y - S.
9. Похідне піридинметиленазолідинону за будь-яким попереднім пунктом, де n - 1.
10. Похідне піридинметиленазолідинону за будь-яким попереднім пунктом, де А утворює спільно з піридиновим циклом нижченаведену групу (Іа):
 ,
,
де R1 та R2 відповідають визначенням за будь-яким із попередніх пунктів.
11. Похідне піридинметиленазолідинону за будь-яким із пп. 1-9, де А утворює спільно з піридиновим циклом нижченаведену групу (Іb):
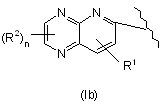 ,
,
де R1 та R2 відповідають визначенням за будь-яким із попередніх пунктів.
12. Похідне піридинметиленазолідинону за будь-яким із пп. 1-9, де А утворює спільно з піридиновим циклом нижченаведену групу (Іс):
 ,
,
де R1 та R2 відповідають визначенням за будь-яким із попередніх пунктів.
13. Похідне піридинметиленазолідинону за будь-яким із пп. 1-9, де А утворює спільно з піридиновим циклом нижченаведену групу (Id):
 ,
,
де R1 та R2 відповідають визначенням за будь-яким із попередніх пунктів.
14. Похідне піридинметиленазолідинону за будь-яким із пп. 1-10, де R1 - Н; R2 - С3-С8-гетероциклоалкіл; X - S; Y - О або S, а А утворює спільно з піридиновим циклом групу формули (Іа).
15. Похідне піридинметиленазолідинону за будь-яким попереднім пунктом, де R1 - Н; X - S; Y - О, а А утворює спільно з піридиновим циклом групу формули (Іb).
16. Похідне піридинметиленазолідинону за будь-яким попереднім пунктом, де R1 - Н; X - S; Y - О та А утворює спільно з піридиновим циклом групу формули (Іс).
17. Похідне піридинметиленазолідинону за будь-яким попереднім пунктом, де R1 - Н; X - S; Y - О та А утворює спільно з піридиновим циклом групу формули (Id).
18. Похідне піридинметиленазолідинону за будь-яким попереднім пунктом, вибране з нижченаведеної групи:
(5Z)-5-{[4-(1-піперидиніл)піридо[3,2-d]піримідин-6-іл]метилен}-1,3-тіазолідин-2,4-діон;
(5Z)-5-{[4-(4-фтор-1-піперидиніл)піридо[3,2-d]піримідин-6-іл]метилен}-1,3-тіазолідин-2,4-діон;
(5Z)-5-({4-[4-(трифторметил)-1-піперидиніл]піридо[3,2-d]піримідин-6-іл}метилен)-1,3-тіазолідин-2,4-діон;
5-піридо[2,3-b]піразин-6-ілметилентіазолідин-2,4-діон;
5-фуро[3,2-b]піридин-5-ілметилентіазолідин-2,4-діон;
5-[4-(4-фторпіперидин-1-іл)-піридо[3,2-d]піримідин-6-ілметилен]-2-тіоксотіазолідин-4-он;
5-(3-феніл-3Н-імідазо[4,5-b]піридин-5-ілметилен)-тіазолідин-2,4-діон;
5-[3-(3,5-диметоксифеніл)-3Н-імідазо[4,5-b]піридин-5-ілметилен]-тіазолідин-2,4-діон;
трет-бутиловий складний ефір 5-[5-(2,4-діоксотіазолідин-5-іліденметил)-імідазо[4,5-b]піридин-3-іл]-2,3-дигідроіндол-1-карбонової кислоти;
5-[3-(2,3-дигідро-1Н-індол-5-іл)-3Н-імідазо[4,5-b]піридин-5-ілметилен]-тіазолідин-2,4-діон;
5-[3-(1-ацетил-2,3-дигідро-1Н-індол-5-іл)-3Н-імідазо[4,5-b]піридин-5-ілметилен]-тіазолідин-2,4-діон;
5-{3-[1-(4-диметиламінобутирил)-2,3-дигідро-1Н-індол-5-іл]-3Н-імідазо[4,5-b]піридин-5-ілметилен}-тіазолідин-2,4-діон;
5-[3-(1-метансульфоніл-2,3-дигідро-1Н-індол-5-іл)-3Н-імідазо[4,5-b]піридин-5-ілметилен]-тіазолідин-2,4-діон;
5-[3-(1-хлорметансульфоніл-2,3-дигідро-1Н-індол-5-іл)-3Н-імідазо[4,5-b]піридин-5-ілметилен]-тіазолідин-2,4-діон;
5-{3-[1-(3-морфолін-4-ілпропан-1-сульфоніл)-2,3-дигідро-1Н-індол-5-іл]-3Н-імідазо[4,5-b]піридин-5-ілметилен}-тіазолідин-2,4-діон;
трет-бутиловий складний ефір 6-[5-(2,4-діоксотіазолідин-5-іліденметил)-імідазо[4,5-b]піридин-3-іл]-2,3-дигідроіндол-1-карбонової кислоти;
5-[3-(1-метансульфоніл-2,3-дигідро-1Н-індол-6-іл)-3Н-імідазо[4,5-b]піридин-5-ілметилен]-тіазолідин-2,4-діон.
19. Похідне піридинметиленазолідинону за будь-яким з пп. 1-18 для застосування як лікарського засобу.
20. Застосування похідного піридинметиленазолідинону за будь-яким з пп. 1-18, а також ізомерів та сумішей цих сполук для виготовлення лікарського засобу для профілактики та/або лікування аутоімунних захворювань та/або запальних захворювань, серцево-судинних захворювань, нейродегенеративних захворювань, бактеріальних або вірусних інфекцій, ниркових захворювань, агрегації тромбоцитів, раку, трансплантації, відторгнення трансплантата або ушкоджень легенів.
21. Застосування за п. 20, причому згадане захворювання вибране з групи, яку складають розсіяний склероз, псоріаз, ревматоїдний артрит, системний червоний вовчак, запальне захворювання кишечнику, запалення легенів, тромбоз або інфекції/запалення мозку, наприклад, менінгіт або енцефаліт.
22. Застосування за п. 20, причому згадане захворювання вибране з групи, яку складають захворювання Альцгеймера, захворювання Гантінгтона, травма ЦНС, інсульт та ішемічні стани.
23. Застосування за п. 20, причому згадане захворювання вибране з групи, яку складають атеросклероз, гіпертрофія серця, дисфункція серцевих міоцитів, підвищений кров'яний тиск та звуження кровоносних судин.
24. Застосування за п. 20, причому згадане захворювання вибране з групи, яку складають хронічне обструктивне легеневе захворювання, спричинений анафілактичним шоком фіброз, псоріаз, алергічні захворювання, астма, інсульт або ішемічні стани, ішемія-реперфузія, агрегація/активація тромбоцитів, атрофія/гіпертрофія скелетних м'язів, відновлення лейкоцитів у раковій тканині, ангіогенез, інвазійні метастази, меланома, саркома Капоші, гострі та хронічні бактеріальні та вірусні інфекції, сепсис, відторгнення трансплантата, гломерулосклероз, гломерулонефрит, прогресуючий нирковий фіброз, ендотеліальні та епітеліальні ураження при запаленнях легенів або загальних дихальних шляхів легенів.
25. Застосування за будь-яким із пп. 20-24 для модулювання, зокрема, для інгібування, активності кінази РІ3.
26. Застосування за п. 25, причому згадана кіназа РІ3 є кіназою РІ3γ.
27. Фармацевтична композиція, що містить щонайменше одне похідне піридинметиленазолідинону за будь-яким із пп. 1-18 та фармацевтично прийнятний носій, розріджувач або наповнювач.
28. Спосіб одержання похідного піридинметиленазолідинону за будь-яким із пп. 1-18, який включає стадію проведення реакції сполуки формули (II) з похідним формули (III) у присутності основи:
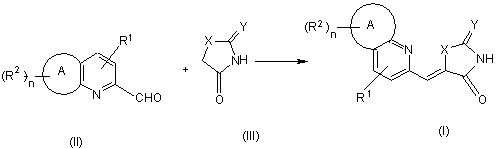 ,
,
де R1, R2, A, X, Y та n відповідають визначенням за будь-яким із попередніх пунктів.
29. Сполука формули (II):
 ,
,
де R1, R2, А, X, Y та n відповідають визначенням за будь-яким із попередніх пунктів, та де сполука формули (II) вибрана з групи, яку складають сполуки формули (IIа), формули (IIb), формули (IIс) та формули (IId):
 ,
,
де R4 вибраний з групи, яку складають Н та R2; R5 - група R2, де перший атом, приєднаний до піримідинового циклу, вибраний з групи, яку складають С, N, S та О, та де у разі, якщо R4 - NH2, то R5 не є NH2; R1, R2 та n відповідають визначенням за будь-яким із попередніх пунктів;
 ,
,
де R1, R2 та n відповідають визначенням за будь-яким із попередніх пунктів;
 ,
,
де R1, R2 та n відповідають визначенням за будь-яким із попередніх пунктів та де щонайменше один із R1 або R2 не є Н;
 ,
,
де R1, R2 та n відповідають визначенням за будь-яким із попередніх пунктів, та за умови, що сполука формули (IId) не є 2-(4-метоксифеніл)-3Н-імідазо[4,5-b]піридин-5-карбоксальдегідом.
30. Сполука за п. 29, вибрана з групи:
4-піперидин-1-ілпіридо[3,2-d]піримідин-6-карбальдегід;
4-(4-фторпіперидин-1-іл)-піридо[3,2-d]піримідин-6-карбальдегід;
4-(4-метилпіперидин-1-іл)-піридо[3,2-d]піримідин-6-карбальдегід;
піридо[2,3-b]піразин-6-карбальдегід;
2-триметилсиланілфуро[3,2-b]піридин-5-карбальдегід;
3-феніл-1Н-імідазо[4,5-b]піридин-5-карбальдегід;
3-(3,5-диметоксифеніл)-3H-імідазо[4,5-b]піридин-5-карбальдегід;
трет-бутил-5-(5-форміл-3H-імідазо[4,5-b]піридин-3-іл)індолін-1-карбоксилат;
3-(1-ацетил-2,3-дигідро-1H-індол-5-іл)-3H-імідазо[4,5-b]піридин-5-карбальдегід;
3-{1-[4-(диметиламіно)бутаноїл]-2,3-дигідро-1H-індол-5-іл}-3H-імідазо[4,5-b]піридин-5-карбальдегід;
3-[1-(метилсульфоніл)-2,3-дигідро-1H-індол-5-іл]-3H-імідазо[4,5-b]піридин-5-карбальдегід;
3-{1-[(хлорметил)сульфоніл]-2,3-дигідро-1H-індол-5-іл}-3H-імідазо[4,5-b]піридин-5-карбальдегід;
3-{1-[(3-морфолін-4-ілпропіл)сульфоніл]-2,3-дигідро-1H-індол-5-іл}-3H-імідазо[4,5-b]піридин-5-карбальдегід;
трет-бутил-6-(5-форміл-3H-імідазо[4,5-b]піридин-3-іл)індолін-1-карбоксилат та
3-[1-(метилсульфоніл)-2,3-дигідро-1H-індол-6-іл]-3H-імідазо[4,5-b]піридин-5-карбальдегід.
Текст
1. Похідне піридинметиленазолідинону за формулою (І) 2 (19) 1 3 де R1 та R2 відповідають визначенням за будьяким із попередніх пунктів. 11. Похідне піридинметиленазолідинону за будьяким із пп. 1-9, де А утворює спільно з піридиновим циклом нижченаведену групу (Іb): N N 2 (R ) n N R1 (Ib) , де R1 та R2 відповідають визначенням за будьяким із попередніх пунктів. 12. Похідне піридинметиленазолідинону за будьяким із пп. 1-9, де А утворює спільно з піридиновим циклом нижченаведену групу (Іс): 2 N (R ) n O R1 (Ic) , де R1 та R2 відповідають визначенням за будьяким із попередніх пунктів. 13. Похідне піридинметиленазолідинону за будьяким із пп. 1-9, де А утворює спільно з піридиновим циклом нижченаведену групу (Id): (R2 ) n N N N R1 (Id) , де R та R відповідають визначенням за будьяким із попередніх пунктів. 14. Похідне піридинметиленазолідинону за будьяким із пп. 1-10, де R1 - Н; R2 - С3-С8гетероциклоалкіл; X - S; Y - О або S, а А утворює спільно з піридиновим циклом групу формули (Іа). 15. Похідне піридинметиленазолідинону за будьяким попереднім пунктом, де R1 - Н; X - S; Y - О, а А утворює спільно з піридиновим циклом групу формули (Іb). 16. Похідне піридинметиленазолідинону за будьяким попереднім пунктом, де R1 - Н; X - S; Y - О та А утворює спільно з піридиновим циклом групу формули (Іс). 17. Похідне піридинметиленазолідинону за будьяким попереднім пунктом, де R1 - Н; X - S; Y - О та А утворює спільно з піридиновим циклом групу формули (Id). 18. Похідне піридинметиленазолідинону за будьяким попереднім пунктом, вибране з нижченаведеної групи: (5Z)-5-{[4-(1-піперидиніл)піридо[3,2-d]піримідин-6іл]метилен}-1,3-тіазолідин-2,4-діон; (5Z)-5-{[4-(4-фтор-1-піперидиніл)піридо[3,2d]піримідин-6-іл]метилен}-1,3-тіазолідин-2,4-діон; 1 2 88314 4 (5Z)-5-({4-[4-(трифторметил)-1піперидиніл]піридо[3,2-d]піримідин-6-іл}метилен)1,3-тіазолідин-2,4-діон; 5-піридо[2,3-b]піразин-6-ілметилентіазолідин-2,4діон; 5-фуро[3,2-b]піридин-5-ілметилентіазолідин-2,4діон; 5-[4-(4-фторпіперидин-1-іл)-піридо[3,2-d]піримідин6-ілметилен]-2-тіоксотіазолідин-4-он; 5-(3-феніл-3Н-імідазо[4,5-b]піридин-5-ілметилен)тіазолідин-2,4-діон; 5-[3-(3,5-диметоксифеніл)-3Н-імідазо[4,5b]піридин-5-ілметилен]-тіазолідин-2,4-діон; трет-бутиловий складний ефір 5-[5-(2,4діоксотіазолідин-5-іліденметил)-імідазо[4,5b]піридин-3-іл]-2,3-дигідроіндол-1-карбонової кислоти; 5-[3-(2,3-дигідро-1Н-індол-5-іл)-3Н-імідазо[4,5b]піридин-5-ілметилен]-тіазолідин-2,4-діон; 5-[3-(1-ацетил-2,3-дигідро-1Н-індол-5-іл)-3Німідазо[4,5-b]піридин-5-ілметилен]-тіазолідин-2,4діон; 5-{3-[1-(4-диметиламінобутирил)-2,3-дигідро-1Ніндол-5-іл]-3Н-імідазо[4,5-b]піридин-5-ілметилен}тіазолідин-2,4-діон; 5-[3-(1-метансульфоніл-2,3-дигідро-1Н-індол-5-іл)3Н-імідазо[4,5-b]піридин-5-ілметилен]-тіазолідин2,4-діон; 5-[3-(1-хлорметансульфоніл-2,3-дигідро-1Н-індол5-іл)-3Н-імідазо[4,5-b]піридин-5-ілметилен]тіазолідин-2,4-діон; 5-{3-[1-(3-морфолін-4-ілпропан-1-сульфоніл)-2,3дигідро-1Н-індол-5-іл]-3Н-імідазо[4,5-b]піридин-5ілметилен}-тіазолідин-2,4-діон; трет-бутиловий складний ефір 6-[5-(2,4діоксотіазолідин-5-іліденметил)-імідазо[4,5b]піридин-3-іл]-2,3-дигідроіндол-1-карбонової кислоти; 5-[3-(1-метансульфоніл-2,3-дигідро-1Н-індол-6-іл)3Н-імідазо[4,5-b]піридин-5-ілметилен]-тіазолідин2,4-діон. 19. Похідне піридинметиленазолідинону за будьяким з пп. 1-18 для застосування як лікарського засобу. 20. Застосування похідного піридинметиленазолідинону за будь-яким з пп. 1-18, а також ізомерів та сумішей цих сполук для виготовлення лікарського засобу для профілактики та/або лікування аутоімунних захворювань та/або запальних захворювань, серцево-судинних захворювань, нейродегенеративних захворювань, бактеріальних або вірусних інфекцій, ниркових захворювань, агрегації тромбоцитів, раку, трансплантації, відторгнення трансплантата або ушкоджень легенів. 21. Застосування за п. 20, причому згадане захворювання вибране з групи, яку складають розсіяний склероз, псоріаз, ревматоїдний артрит, системний червоний вовчак, запальне захворювання кишечнику, запалення легенів, тромбоз або інфекції/запалення мозку, наприклад, менінгіт або енцефаліт. 22. Застосування за п. 20, причому згадане захворювання вибране з групи, яку складають захворювання Альцгеймера, захворювання Гантінгтона, травма ЦНС, інсульт та ішемічні стани. 5 88314 23. Застосування за п. 20, причому згадане захворювання вибране з групи, яку складають атеросклероз, гіпертрофія серця, дисфункція серцевих міоцитів, підвищений кров'яний тиск та звуження кровоносних судин. 24. Застосування за п. 20, причому згадане захворювання вибране з групи, яку складають хронічне обструктивне легеневе захворювання, спричинений анафілактичним шоком фіброз, псоріаз, алергічні захворювання, астма, інсульт або ішемічні стани, ішемія-реперфузія, агрегація/активація тромбоцитів, атрофія/гіпертрофія скелетних м'язів, відновлення лейкоцитів у раковій тканині, ангіогенез, інвазійні метастази, меланома, саркома Капоші, гострі та хронічні бактеріальні та вірусні інфекції, сепсис, відторгнення трансплантата, гломерулосклероз, гломерулонефрит, прогресуючий нирковий фіброз, ендотеліальні та епітеліальні ураження при запаленнях легенів або загальних дихальних шляхів легенів. 25. Застосування за будь-яким із пп. 20-24 для модулювання, зокрема, для інгібування, активності кінази РІ3. 26. Застосування за п. 25, причому згадана кіназа РІ3 є кіназою РІ3γ. 27. Фармацевтична композиція, що містить щонайменше одне похідне піридинметиленазолідинону за будь-яким із пп. 1-18 та фармацевтично прийнятний носій, розріджувач або наповнювач. 28. Спосіб одержання похідного піридинметиленазолідинону за будь-яким із пп. 1-18, який включає стадію проведення реакції сполуки формули (II) з похідним формули (III) у присутності основи: Y R1 n N CHO (R 2 ) n A X R1 O (III) (II) Y N NH + A 2 (R ) X NH O (I) , де R1, R2, A, X, Y та n відповідають визначенням за будь-яким із попередніх пунктів. 29. Сполука формули (II): R 2 (R ) 1 A n N CHO (II) , де R1, R2, А, X, Y та n відповідають визначенням за будь-яким із попередніх пунктів, та де сполука формули (II) вибрана з групи, яку складають сполуки формули (IIа), формули (IIb), формули (IIс) та формули (IId): R5 N N R4 O H N R1 (IIa) , де R вибраний з групи, яку складають Н та R2; R5 - група R2, де перший атом, приєднаний до піримі4 6 динового циклу, вибраний з групи, яку складають С, N, S та О, та де у разі, якщо R4 - NH2, то R5 не є NH2; R1, R2 та n відповідають визначенням за будь-яким із попередніх пунктів; H N N O (R2)n N R1 (IIb) , де R1, R2 та n відповідають визначенням за будьяким із попередніх пунктів; O (R2)n N H O R1 (IIc) , де R1, R2 та n відповідають визначенням за будьяким із попередніх пунктів та де щонайменше один із R1 або R2 не є Н; O R2 N N H N R1 (IId) , де R1, R2 та n відповідають визначенням за будьяким із попередніх пунктів, та за умови, що сполука формули (IId) не є 2-(4-метоксифеніл)-3Німідазо[4,5-b]піридин-5-карбоксальдегідом. 30. Сполука за п. 29, вибрана з групи: 4-піперидин-1-ілпіридо[3,2-d]піримідин-6карбальдегід; 4-(4-фторпіперидин-1-іл)-піридо[3,2-d]піримідин-6карбальдегід; 4-(4-метилпіперидин-1-іл)-піридо[3,2-d]піримідин-6карбальдегід; піридо[2,3-b]піразин-6-карбальдегід; 2-триметилсиланілфуро[3,2-b]піридин-5карбальдегід; 3-феніл-1Н-імідазо[4,5-b]піридин-5-карбальдегід; 3-(3,5-диметоксифеніл)-3H-імідазо[4,5-b]піридин-5карбальдегід; трет-бутил-5-(5-форміл-3H-імідазо[4,5-b]піридин-3іл)індолін-1-карбоксилат; 3-(1-ацетил-2,3-дигідро-1H-індол-5-іл)-3Hімідазо[4,5-b]піридин-5-карбальдегід; 3-{1-[4-(диметиламіно)бутаноїл]-2,3-дигідро-1Hіндол-5-іл}-3H-імідазо[4,5-b]піридин-5карбальдегід; 3-[1-(метилсульфоніл)-2,3-дигідро-1H-індол-5-іл]3H-імідазо[4,5-b]піридин-5-карбальдегід; 3-{1-[(хлорметил)сульфоніл]-2,3-дигідро-1H-індол5-іл}-3H-імідазо[4,5-b]піридин-5-карбальдегід; 3-{1-[(3-морфолін-4-ілпропіл)сульфоніл]-2,3дигідро-1H-індол-5-іл}-3H-імідазо[4,5-b]піридин-5карбальдегід; 7 88314 8 трет-бутил-6-(5-форміл-3H-імідазо[4,5-b]піридин-3іл)індолін-1-карбоксилат та 3-[1-(метилсульфоніл)-2,3-дигідро-1H-індол-6-іл]3H-імідазо[4,5-b]піридин-5-карбальдегід. Цей винахід стосується застосування похідних піридинметиленазолідинону формули (І) для лікування та/або профілактики автоімунних захворювань та/або запальних захворювань, серцевосудинних захворювань, нейродегенеративних захворювань, бактеріальних або вірусних інфекцій, алергії, астми, панкреатиту, одночасної недостатності кількох органів, ниркових захворювань, агрегації тромбоцитів, раку, порушень рухливості сперматозоїдів, відторгнення трансплантата або ушкоджень легенів. Зокрема, цей винахід стосується похідних піридинметиленазолідинону для застосування з метою модулювання, особливо інгібування, активності або функціонування фосфоінозитид-3-кіназ, РІ3К. Рівень техніки Фосфоінозитид-3-кінази (РІ3К) відіграють вирішальну сигнальну роль у проліферації клітин, тривалості життя клітин, васкуляризації, транспорті через мембрани, переносі глюкози, розростанні нейритів, забезпеченні гофрування мембран, продукуванні пероксидів, реорганізації актину та хемотаксисі (Кентлі - Cantley, 2000, Science, 296, 1655-1657; Ванхазебрук та ін. - Vanhaesebroeck et al., 2001, Annu. Rev. Biochem., 70, 535-602). Терміном РІ3К позначається група ліпідкіназ, яка у ссавців складається з восьми ідентифікованих РІ3К, яка поділяється на три підгрупи відповідно до їх будови та специфічності до субстратів. Клас РІ3К групи І складається з двох підгруп класу ІА та класу IB. Клас ІА включає регуляторну одиницю з молекулярною масою 85 кДа (яка відповідає за взаємодію протеїнів із протеїнами шляхом взаємодії домена Src-гомології 2 (SH2) з фосфотирозиновими залишками інших протеїнів) та каталітичну субодиницю з молекулярною масою 110 кДа. У цьому класі існують три каталітичні форми (p100α, p110β та p110δ) та п'ять регуляторних ізоформ (p85α, p85β, p55γ, р55а та р50a). РІ3К класу IB стимулюються βγ-субодиницями протеїну G гетеродимерних G-протеїнів. Єдиним ідентифікованим членом класу IB є РІ3Кg (каталітична субодиниця р110g у комплексі з регуляторним протеїном молекулярної маси 101 кДа, р101). РІ3К класу II включають ізоформи α, β та γ, які мають молекулярну масу приблизно 170 кДа та характеризуються присутністю С-кінцевого домена С2. Клас III РІ3К включає фосфатидинінозитспецифічні 3-кінази. Еволюційно збережені ізоформи p110α та β експресуються у різноманітних тканинах, тоді як ізоформи δ та γ експресуються більш специфічно у гемопоетичній системі клітин, у клітинах гладких м'язів, міоцитах та клітинах ендотелію (Ванхазебрук та ін. - Vanhaesebroeck et al., 1997, Trends Biochem. Sci., 22(7), 267-72). їхню експресію можна також регулювати шляхом індукції залежно від типу клітин, тканин та подразників, а також від загальної картини захворювання. РІ3К є ензимами, які беруть участь у фосфоліпідній сигнальній системі та активуються під впливом різноманітних позаклітинних сигналів, наприклад, факторів росту, мітогенів, інтегринів (міжклітинної взаємодії) гормонів, цитокінів, вірусів та нейротрансмітерів, а також шляхом внутрішньоклітинної перехресної регуляції під впливом інших сигнальних молекул (перехресний обмін сигналами, при якому первинний сигнал може активувати деякі паралельні сигнальні шляхи, які на другій стадії передають сигнали до РІ3К за рахунок внутрішньоклітинних сигнальних подій), наприклад, низькомолекулярних гуанозинтрифосфатаз, кіназ або фосфатаз. Фосфатидилінозит (Ptdlns) є основним структурним блоком для міжклітинних інозитліпідів у еукаріотичних клітинах; його молекула складається з D-міо-інозит-1-фосфату (Ins1P), приєднаного через свою фосфатну групу до діацилгліцерину. Головна інозитова група Ptdlns містить п'ять вільних гідроксилів; виявлено, що у клітинах три з них фосфориловані у різних комбінаціях. Ptdlns та його фосфориловані похідні сполуки мають загальну назву інозитфосфоліпідів або фосфоінозитидів (Pls). У еукаріотичних клітинах виявлено вісім сполук типу PI (Vanhaesebroeck et al., 2001, див. вище). Усі РІ знаходяться у мембранах і є субстратами для кіназ, фосфатаз та ліпаз. In vitro РІ3К фосфорилують 3-гідроксил інозитового циклу у трьох різних субстратах: фосфатидилінозиті (Ptdlns), фосфатидилінозит-4-фосфаті (РІ(4)Р) та фосфатидилінозит-4,5-дифосфаті (РІ(4,5)Р2), утворюючи відповідно три ліпідні продукти, а саме фосфатидилінозит-3-монофосфат (РІ(3)Р), фосфатидилінозит-3,4-дифосфат (РІ(3,4)Р2) та фосфатидилінозит-3,4,5-трифосфат (РІ(3,4,5)Р3 (дивись схему А нижче). 9 Субстратом, якому віддається перевага, для класу І РІ3К є РІ(4,5)Р2. РІК класу II віддають сильну перевагу Ptdlns як субстрату перед РІ(4)Р та РІ(4,5)Р2. РІ3К класу III можуть використовувати як субстрат in vivo тільки Ptdlns і, ймовірно, відповідають за утворення більшої частини РІ(3)Р у клітинах (Vanhaesebroeck et al., 2001, див. вище). Внутрішньоклітинний фосфоінозитидний шлях передачі сигналу починається зі зв'язування сигнальної молекули (позаклітинного ліганду, подразника, димеризації рецепторів, трансактивації під впливом гетерологічного рецептора (наприклад, рецептора тирозинкінази)) зі з'єднаним з Gпротеїном трансмембранним рецептором, вбудованим у плазмову мембрану, що призводить до активації РІ3К. Активовані РІ3К перетворюють мембранний фосфоліпід РІ(4,5)Р2 у РІ(3,4,5)Р3, який, у свою чергу, може бути перетворений в іншу 3'фосфориловану форму фосфоінозитидів під впливом 5'-специфічних фосфоінозитидфосфатаз; отже, ензиматична активність РІ3К прямим або непрямим шляхом спричиняє утворення двох підтипів 3'-фосфоінозитидів, які діють як вторинні месенджери при внутрішньоклітинній передачі сигналу (Леслі та ін. - Leslie et al., 2001, Chem. Rev. 101(8) 2365-2380; Кацо та ін. -Katso et al., 2001, Annu. Rev. Cell Dev. Biol 1, 615-75; Токер та ін. - Toker et al., 2002, Cell Моl. Life Sci. 59(5) 761-779). У ролі вторинних месенджерів продукти фосфорилування Ptdlns беруть участь у різноманітних шляхах передачі сигналів, в тому числі у таких, що мають істотне значення для проліферації клітин, диференціації клітин, росту клітин, розміру клітин, тривалості життя клітин, апоптозу, адгезії, рухливості клітин, міграції клітин, хемотаксисі, інвазії, цитоскелетного переупорядкування, змін форм клітин, транспорту везикул та метаболізму (Штейн - Stein, 2000, Моl. Med. Today 6(9) 347-357). Хемотаксис, тобто спрямований рух клітин у напрямі градієнта концентрації хімічних атрактантів, що звуться також хімокінами, є істотним чинником при багатьох значних захворюваннях, наприклад, при запаленнях та автоімунних захворюваннях, нейродегенерації, ангіогенезі, інвазії та утворенні метастазів та при загоєнні ран (Уайман та ін. Wyman et al., 2000, Immunol. Today 21(6) 260-264; Гірш та ін. - Hirsch et al., 2000, Science 287(5455) 1049-1053; Гірш та ін., 2001, FASEB J. 15(11) 20192021; Жерар та ін. - Gerard et al., 2001, Nat. Immunol 2(2) 108-115). Таким чином, активація РІ3-кіназ вважається складовим елементом різноманітних клітинних реакцій, в тому числі росту, диференціації та апоптозу клітин (Паркер та ін. - Parker et al., 1995, Current Biology, 5, 577-599; Яо та ін. - Yao et al., 1995, Science, 267, 2003-2005). Недавно при біохімічних дослідженнях було виявлено, що РІ3К класу І (наприклад, ізоформа PI3Kg класу IB) є кіназами подвійної специфічності, тобто вони виявляють активність як ліпідкінази (фосфорилування фосфоінозитидів), а також як протеїнкінази, оскільки вони здатні індукувати фосфорилування інших протеїнів як субстратів, в 88314 10 тому числі автофосфорилування як внутрішньомолекулярний регуляторний механізм. Виявлено, що РІ3К відіграють певну роль у численних аспектах активації лейкоцитів. Показано, що активність РІ3-кіназ, пов'язана з р85, фізично зв'язана з цитоплазмовим доменом CD28, який є важливою коактивувальною молекулою для активації Т-клітин як реакції на антиген (Пейджес та ін. - Pages et al., 1994, Nature, 369, 327-329). Ці ефекти пов'язані з підвищенням транскрипції численних генів, в тому числі інтерлейкіну-2 (IL2), який є важливим фактором росту Т-клітин (Фрейзер та ін. — Fraser et al., 1991, Science, 251, 31316). Мутація CD28, внаслідок якої він може довше взаємодіяти з РІ3-кіназою, призводить до втрати здатності ініціювати продукування IL2, що вказує на вирішальну роль РІ3-кінази в активації Т-клітин. До клітинних процесів, у яких РІ3К відіграють істотну роль, належать пригнічення апоптозу, реорганізація скелета актину, ріст серцевих міоцитів, стимуляція глікогенсинтази під впливом інсуліну, опосередкований TNFa праймінг нейтрофілів та продукування пероксидів, а також міграція лейкоцитів та їх адгезія до клітин ендотелію. РІ3Ку ідентифіковано як медіатор регуляції активності JNK, залежної від бета-гамма-G, де бета-гамма-G є субодиниці гетеротримерних Gпротеїнів (Лопес-Іласака та ін. — Lopez-Ilasaca et al., 1998, J. Biol Chem. 273(5) 2505-2508). Нещодавно повідомлялося, РІ3Кg передає запальні сигнали через різноманітні рецептори, сполучені з G(i) (Лафарг та ін. - Laffargue et al., 2002, Immunity 16(3) 441-451), і його імунологічна функція, основна щодо гепариноцитів та подразників у контексті лейкоцитів, охоплює, наприклад, цитокіни, хімоміни, аденозини, антитіла, інтегрини, фактори агрегації, фактори росту, віруси або гормони (Лоулор та ін.— Lawlor et al., 2001, J. Cell. Sci., 114 (Pt 16) 2903-1; Стефенс та ін. - Stephens et al., 2002, Сurr. Opinion Cell Вiol. 14(2), 203-213). Специфічні інгібітори окремих ензимів або груп ензимів є цінними засобами для розшифрування функцій кожного ензиму. Як інгібітори РІ3-кіназ широко застосовуються дві сполуки - LY294002 та вортманін (дивись нижче). Ці сполуки є неспецифічними інгібіторами РІ3К, оскільки вони не розрізняють чотири члени класу І РІ3-кіназ. Значення ІС50 для вортманіну стосовно кожної з РІ3-кіназ класу І лежать у межах від 1 нМ до 10 нМ, а значення ІС50 для LY294002 стосовно кожної із цих РІ3-кіназ становлять приблизно 15-20 мМ (Фрумен та ін. - Fruman et al., 1998, Ann. Rev. Biochem., 67, 481-507), тоді як щодо СК2-протеїнкінази відповідний показник становить 5-10 мМ; ця 11 сполука виявляє також деяку інгібувальну активність щодо фосфоліпаз. Вортманін є продуктом метаболізму грибів, який незворотно інгібує активність РІ3К внаслідок ковалентного зв'язування з каталітичним доменом цього ензиму. Інгібування активності РІ3К вортманіном виключає подальшу клітинну реакцію на позаклітинний фактор (Телен та ін. - Thelen et al., 1994, Proc. Natl Acad. Sci. USA, 91, 4960-4964). Експерименти із застосуванням вортманіну показують, що активність РІ3К у клітинах гемопоетичної групи, зокрема, у нейтрофілах, моноцитах та інших типах лейкоцитів, є елементом багатьох позбавлених ефекту пам'яті імунних реакцій, пов'язаних із гострим та хронічним запаленням. На основі досліджень із застосуванням вортманіну доведено, що функція РІ3-кіназ потрібна також для деяких аспектів лейкоцитної сигнальної системи через посередництво рецепторів, сполучених із G-протеїном (Thelen et al., 1994). Крім того, показано, що вортманін та LY294002 блокують міграцію нейтрофілів та вивільнення пероксидів. Однак, оскільки ці сполуки не розрізняють різні ізоформи РІ3К, залишається неясним, яка саме конкретна ізоформа (або ізоформи) РІ3К беруть участь у цих явищах. Деякі результати вказують, що інгібітори РІ3К, наприклад, LY294002, здатні підвищувати протипухлинну активність деяких цитотоксичних агентів (наприклад, паклітакселю) in vivo (Грант - Grant, 2003, Current Drugs, 6(10), 946-948). Нещодавно було розроблено похідні тіазолідину, придатні як інгібітори РІ3К (WO 2004/007491; WO 2004/056820; WO 2004/052373). У WO 2004/007491 розкрито похідні конденсованого з бензолом азолідиндіон-вінілу такої структури: У WO 2004/056820 розкритопохідні бензоксазину такої структури: У WO 2004/052373 розкрито похідні бензоксазин-3-онів такої структури: 88314 12 Високий ступінь участі шляху РІ3К у деяких поширених захворюваннях підкреслює необхідність розроблення інгібіторів РІК, в тому числі селективних інгібіторів РІК. Суть винаходу Метою винаходу є створення речовин, корисних для лікування та/або профілактики розладів, пов'язаних із фосфоінозитид-3-кіназами, РІ3К. Ще однією метою даного винаходу є створення речовин, корисних для лікування та/або профілактики автоімунних та/або запальних захворювань. Ще однією метою даного винаходу є створення речовин, корисних для лікування та/або профілактики серцево-судинних захворювань. Ще однією метою даного винаходу є створення речовин, корисних для лікування та/або профілактики нейродегенеративних захворювань. Ще однією метою даного винаходу є створення речовин, корисних для лікування та/або профілактики захворювань, вибраних із групи, яку складають бактеріальні або вірусні інфекції, ниркові захворювання, агрегація тромбоцитів, рак, трансплантація, відторгнення трансплантата, ураження легенів, респіраторні захворювання та ішемічні стани. Головною метою даного винаходу є створення хімічних сполук, здатних модулювати, зокрема, інгібувати активність або функції фосфоінозитид3-кіназ, РІ3К при хворобливих станах у ссавців, особливо у людей. Додатковою метою даного винаходу є створення нових видів фармацевтичних композицій для лікування та/або профілактики захворювань, опосередкованих РІ3К, вибраних із групи, яку складають автоімунні, запальні захворювання, серцево-судинні захворювання, нейродегенеративні захворювання, бактеріальні або вірусні інфекції, ниркові захворювання, агрегація тромбоцитів, рак, трансплантація, відторгнення трансплантата, ураження легенів, респіраторні захворювання та ішемічні стани. Додатковою метою даного винаходу є створення способу лікування та/або профілактики захворювань, вибраних із групи, яку складають автоімунні, запальні захворювання, серцево-судинні захворювання, нейродегенеративні захворювання, бактеріальні або вірусні інфекції, ниркові захворювання, агрегація тромбоцитів, рак, трансплантація, відторгнення трансплантата або ушкодження легенів, респіраторні захворювання та ішемічні стани. За першим аспектом, цей винахід пропонує похідні піридинметиленазолідинону формули (І): 13 де A, R1, R2, Χ, Υ та n визначені нижче у детальному описі. За другим аспектом, цей винахід пропонує сполуку формули (І) для застосування як лікарський засіб. За третім аспектом, цей винахід пропонує застосування сполуки формули (І) для виготовлення фармацевтичної композиції для лікування захворювань, вибраних із групи, яку складають автоімунні, запальні захворювання, серцево-судинні захворювання, нейродегенеративні захворювання, бактеріальні та вірусні інфекції, ниркові захворювання, агрегація тромбоцитів, рак, трансплантація, відторгнення трансплантата або ушкодження легенів, респіраторні захворювання та ішемічні стани та інші захворювання та розлади, пов'язані із фосфоінозитид-3-кіназами, РІ3К, до яких належать РІ3К α та γ. За четвертим аспектом, цей винахід пропонує фармацевтичну композицію, що містить щонайменше одну сполуку формули (І) та фармацевтично прийнятний носій, розріджувач або наповнювач. За п'ятим аспектом, цей винахід пропонує спосіб лікування пацієнта, що страждає на захворювання, вибране з групи, яку складають автоімунні, запальні захворювання, серцево-судинні захворювання, нейродегенеративні захворювання, бактеріальні та вірусні інфекції, ниркові захворювання, агрегація тромбоцитів, рак, трансплантація, відторгнення трансплантата або ушкодження легенів, респіраторні захворювання та ішемічні стани та інші захворювання та розлади, пов'язані із фосфоінозитид-3-кіназами, РІ3К. Цей спосіб включає введення сполуки формули (І). За шостим аспектом, цей винахід пропонує спосіб синтезу сполуки формули (І). За сьомим аспектом, цей винахід пропонує сполуки формули (II). Детальний опис винаходу У нижченаведених абзацах подано визначення різноманітних хімічних груп, що утворюють сполуки за цим винаходом, призначені для вживання у всьому тексті опису та формулі винаходу, якщо інше подане в явній формі визначення не є більш широким. Термін "С1-С6-алкіл" означає одновалентні алкільні групи, що містять від 1 атому до 6 атомів вуглецю. Цей термін охоплює такі групи, як метил, етил, н-пропіл, ізопропіл, н-бутил, ізобутил, третбутил, н-гексил тощо. За аналогією, С1-С12-алкіл означає одновалентні алкільні групи, що містять від 1 атому до 12 атомів вуглецю, в тому числі метил, етил, н-пропіл, ізопропіл, н-бутил, ізобутил, трет-бугил, н-гексил, гептил, октил, ноніл, децил, ундецил, додецил тощо. 88314 14 Термін "арил" означає ненасичену ароматичну карбоциклічну групу з 6-14 вуглецевих атомів, що містить один цикл (наприклад, феніл) або декілька конденсованих циклів (наприклад, нафтил). Термін арил охоплює феніл, нафтил, фенантреніл тощо. Термін "С1-С6-алкіларил" означає С1-С6алкільні групи, заміщені арилом, в тому числі бензил, фенетил тощо. Термін "гетероарил" означає моноциклічну гетероароматичну, або біциклічну, або трициклічну конденсовану гетероароматичну групу. До конкретних прикладів гетероароматичних груп належать факультативно заміщені піридил, піроліл, піримідиніл, фурил, тієніл, імідазоліл, оксазоліл, ізоксазоліл, тіазоліл, ізотіазоліл, піразоліл, 1,2,3триазоліл, 1,2,4-триазоліл, 1,2,3-оксадіазоліл, 1,2,4-оксадіазоліл, 1,2,5-оксадіазоліл, 1,3,4оксадіазоліл, 1,3,4-триазиніл, 1,2,3-триазиніл, бензофурил, [2,3-дигідро]бензофурил, ізобензофурил, бензотієніл, бензотриазоліл, ізобензотієніл, індоліл, ізоіндоліл, 3Н-індоліл, бензимідазоліл, імідазо[1,2-а]піридил, бензотіазоліл, бензоксазоліл, хінолізиніл, хіназолініл, фталазиніл, хіноксалініл, цінолініл, нафтиридиніл, піридо[3,4-b]піридил, піридо[3,2-b]піридил, піридо[4,3-b]піридил, хіноліл, ізохіноліл, тетразоліл, 5,6,7,8-тетрагідрохіноліл, 5,6,7,8-тетрагідроізохіноліл, пуриніл, птеридиніл, карбазоліл, ксантеніл або бензохіноліл. Термін "С1-С6-алкілгетероарил" означає С1-С6алкільні групи, заміщені гетероарилом, в тому числі 2-фурилметил, 2-тієнілметил, 2-(1Н-індол-3іл)етил тощо. Термін "С2-С6-алкеніл" означає алкенільні групи, які відповідно до варіанта, якому віддається перевага, містять від 2 вуглецевих атомів до 6 вуглецевих атомів та включають щонайменше 1 або 2 алкенільні ненасичені зв'язки. До алкенільних груп, яким віддається перевага, належать етеніл (-СН=СН 2), н-2-пропеніл (аліл, -СН2СН=СН2) тощо. Термін "С2-С6-алкеніларил" означає С2-С6алкенільні групи, заміщені арилом, в тому числі 2фенілвініл тощо. Термін " С2-С6-алкенілгетероарил" означає С2С6-алкенільні групи, заміщені гетероарилом, в тому числі 2-(3-піридиніл)вініл тощо. Термін "С2-С6-алкініл" означає алкінільні групи, які відповідно до варіанта, якому віддається перевага, містять від 2 вуглецевих атомів до 6 вуглецевих атомів та мають щонайменше 1-2 алкінільні ненасичені зв'язки, до алкінільних груп, яким віддається перевага, належать етиніл (-С=СН ), пропаргіл (-СН2ОСН) тощо. Термін " С2-С6-алкініларил" означає С2-С6алкінільні групи, заміщені арилом, в тому числі фенілетиніл тощо. Термін "С2-С6-алкінілгетероарил" означає С2С6-алкінільні групи, заміщені гетероарилом, в тому числі 2-тієнілетиніл тощо. Термін "С3-С8-циклоалкіл" означає насичену карбоциклічну групу з 3-8 вуглецевих атомів, що містить один цикл (наприклад, циклогексил) або декілька конденсованих циклів (наприклад, норборніл). С3-С8-циклоалкіл охоплює циклопентил, циклогексил, норборніл тощо. 15 Термін "гетероциклоалкіл" означає С3-С8циклоалкільну групу відповідно до наведеного вище означення, в якій до 3 вуглецевих атомів замінені гетероатомами, вибраними з групи, яку складають О, S, NR, де R визначено як водень або метил. Термін "гетероциклоалкіл" охоплює піролідин, піперидин, піперазин, 1-метилпіперазин, морфолін, тетрагідрофуран тощо. Термін " С1-С6-алкілциклоалкіл" означає С1-С6алкільні групи, заміщені циклоалкілом, в тому числі циклогексилметил, циклопентилпропіл тощо. Термін " С1-С6-алкілгетероциклоалкіл" означає С1-С6-алкільні групи, заміщені гетероциклоалкілом, в тому числі 2-(1-піролідиніл)етил, морфолінілметил, морфолінілетил, морфолінілпропіл, піперидинілетил, тетрагідрофуранілметил тощо. Термін "карбокси(л)" означає групу -С(О)ОН. Термін "С1-С6-алкілкарбокси(група)" означає С1-С6-алкільні групи, заміщені карбоксильною групою, в тому числі 2-карбоксіетил тощо. Термін "ацил" означає групу -C(O)R, де R охоплює "С1-С6-алкіл", "арил", "гетероарил", " С3-С8циклоалкіл", "гетероциклоалкіл", " С1-С6-алкіларил" або "С1-С6-алкілгетероарил". Термін " С1-С6-алкілацил" означає С1-С6алкільні групи, заміщені ацильною групою, в тому числі 2-ацетилетил тощо. Термін "арилацил" означає арильні групи, заміщені ацильною групою, в тому числі 2ацетилфеніл тощо. Термін "гетероарилацил" означає гетероарильні групи, заміщені ацильною групою, в тому числі 2-ацетилпіридил тощо. Термін "С3-С8-(гетеро)циклоалкілацил" означає 3-8-членні циклоалкільні або гетероциклоалкільні групи, заміщені ацильною групою. Термін "ацилокси(група)" означає групу OC(O)R, де R охоплює Н, " С1-С6-алкіл", " С2-С6алкеніл", " С2-С6-алкініл", "С3-С8-циклоалкіл", "гетероциклоалкіл", "арил", "гетероарил", "С1-С6алкіларил" або "С1-С6-алкілгетероарил", "С2-С6алкеніларил", "С2-С6-алкенілгетероарил", "С2-С6алкініларил", "С2-С6-алкінілгетероарил", "С1-С6алкілциклоалкіл", " С1-С6-алкілгетероциклоалкіл ". Термін " С1-С6-алкілацилокси(група)" означає С1-С6-алкільні групи, заміщені ацилоксигрупою, в тому числі етиловий складний ефір амінопропіонової кислоти тощо. Термін "алкокси(група)" означає групу -O-R, де R означає" С1-С6-алкіл", або "арил", або "гетероарил", або "С1-С6-алкіларил", або "С1-С6алкілгетероарил". До алкоксигруп, яким віддається перевага, належать, наприклад, метокси-, етокси-, феноксигрупа тощо. Термін " С1-С6-алкілалкокси(група)" означає С1-С6-алкільні групи, заміщені алкоксигрупою, в тому числі метоксигрупу, метоксіетил тощо. Термін "алкоксикарбоніл" означає групу C(O)OR, де R означає Н, "С1-С6-алкіл", або "арил", або "гетероарил", або " С1-С6-алкіларил", або "С1С6-алкілгетероарил". Термін "С1-С6-алкілалкоксикарбоніл" означає С1-С5-алкільні групи, заміщені алкоксикарбонілом, в тому числі 2-(бензилоксикарбоніл)етил тощо. 88314 16 Термін "амінокарбоніл" означає групу C(O)NRR', де кожен із R, R' означає незалежно від іншого водень, або С1-С6-алкіл, або арил, або гетероарил, або "С1-С6-алкіларил", або "С1-С6алкілгетероарил". Термін "С1-С6-алкіламінокарбоніл" означає С1С6-алкільні групи, заміщені амінокарбонілом, в тому числі 2-(диметиламінокарбоніл)етил тощо. Термін "ациламіно(група)" означає групу NRC(O)R', де кожен із R, R' незалежно від іншого є водень, "С1-С6-алкіл", " С2-С6-алкеніл", "С2-С6алкініл", " С3-С8-циклоалкіл", "гетероциклоалкіл", "арил", "гетероарил", "С1-С6-алкіларил" або " С1С6-алкілгетероарил", "С2-С6-алкеніларил", "С2-С6алкенілгетероарил", " С2-С6-алкініларил", " С2-С6алкінілгетероарил", "С1-С6-алкілциклоалкіл", " С1С6-алкілгетероциклоалкіл". Термін " С1-С6-алкілациламіно(група)" означає С1-С6-алкільні групи, заміщені ациламіногрупою, в тому числі 2-(пропіоніламіно)етил тощо. Термін "уреїдо(група)" означає групу NRC(O)NR'R", де кожен із R, R', R" незалежно від іншого є водень, " С1-С6-алкіл", "С2-С6-алкеніл", "C2-С6-алкініл", "С3-С8-циклоалкіл", "гетероциклоалкіл", "арил", "гетероарил", " С1-С6-алкіларил" або " С1-С6-алкілгетероарил", "С2-С6-алкеніларил", "C2С6-алкенілгетероарил", " С2-С6-алкініларил", " С2С6-алкінілгетероарил", " С1-С6-алкілциклоалкіл", "С1-С6-алкілгетероциклоалкіл", та де R' та R", спільно з атомом азоту, до якого вони приєднані, можуть факультативно утворювати 3-8-членну гетероциклоалкільну групу. Термін " С1-С6-алкілуреїдо(група)" означає С1С6-алкільні групи, заміщені уреїдогрупою, в тому числі 2-(N’-метилуреїдо)етил тощо. Термін "карбамат" означає групу -NRC(O)OR', де кожен із R, R' незалежно від іншого є водень, " С1-С6-алкіл", "С2-С6-алкеніл", "С2-С6-алкініл", "С3С8-циклоалкіл", "гетероциклоалкіл", "арил", "гетероарил", " С1-С6-алкіларил" або " С1-С6алкілгетероарил", " С2-С6-алкеніларил", "С2-С6алкенілгетероарил", " С2-С6-алкініларил", " С2-С6алкінілгетероарил", "С1-С6-алкілциклоалкіл ", " С1С6-алкілгетероциклоалкіл ". Термін "аміно(група)" означає групу -NRR', де кожен із R,R' незалежно від іншого є водень, або " С1-С6-алкіл", або "арил", або "гетероарил", або " С1-С6-алкіларил", або " С1-С6-алкілгетероарил", або "циклоалкіл", або "гетероциклоалкіл", та де R та R', спільно з атомом азоту, до якого вони приєднані, можуть факультативно утворювати 3-8членну гетероциклоалкільну групу. Термін "С1-С6-алкіламіно(група)" означає С1С5-алкільні групи, заміщені аміногрупою, в тому числі 2-(1-піролідиніл)етил тощо. Термін "амоній" означає позитивно заряджену групу -N+RR'R", де кожен із R, R’, R" незалежно від інших є "С1-С6-алкіл", або " С1-С6-алкіларил", або "С1-С6-алкілгетероарил", або "циклоалкіл", або "гетероциклоалкіл", та де R та R', спільно з атомом азоту, до якого вони приєднані, можуть факультативно утворювати 3-8-членну гетероциклоалкільну групу. 17 Термін "С1-С6-алкіламоній" означає С1-С6алкільні групи, заміщені амонієм, в тому числі 2-(1піролідиніл)етил тощо. Термін "галоген" означає атоми фтору, хлору, брому та йоду. Термін "сульфонілокси(група)" означає групу OSO2-R, де R вибраний з групи, яку складають Н, "С1-С6-алкіл", "С1-С6-алкіл", заміщений галогенами, наприклад, група -OSO2-CF3, "С2-С6-алкеніл", " С2С6-алкініл", "С3-С8-циклоалкіл", "гетероциклоалкіл", "арил", "гетероарил", "С1-С6-алкіларил" або "С1-С6алкілгетероарил", "С2-С6-алкеніларил", "С2-С6алкенілгетероарил", "С2-С6-алкініларил", "С2-С6алкінілгетероарил", "С1-С6-алкілциклоалкіл", " С1С6-алкілгетероциклоалкіл ". Термін "С1-С6-алкілсульфонілокси(група)" означає С1-С5-алкільні групи, заміщені сульфонілоксигрупою, в тому числі 2(метилсульфонілокси)етил тощо. Термін "сульфоніл" означає групу "-SO2-R", де R вибраний з групи, яку складають Н, "арил", "гетероарил", "С1-С6-алкіл", " С1-С6-алкіл", заміщений галогенами, наприклад, група -SO2-CF3, " С2-С6алкеніл", " С2-С6-алкініл", "С3-С8-циклоалкіл", "гетероциклоалкіл", "арил", "гетероарил", " С1-С6алкіларил" або "С1-С6-алкілгетероарил", "С2-С6алкеніларил", " С2-С6-алкенілгетероарил", " С2-С6алкініларил", " С2-С6-алкінілгетероарил", "С1-С6алкілциклоалкіл", "С1-С6-алкілгетероциклоалкіл". Термін "С1-С6-алкілсульфоніл" означає С1-С5алкільні групи, заміщені сульфонілом, в тому числі 2-(метилсульфоніл)етил тощо. Термін "сульфініл" означає групу "-S(O)-R", де R вибраний з групи, яку складають Н, "С1-С6алкіл", "С1-С6-алкіл", заміщений галогенами, наприклад, група -SO-CF3, " С2-С6-алкеніл", " С2-С6алкініл", " С3-С8-циклоалкіл", "гетероциклоалкіл", "арил", "гетероарил", "С1-С6-алкіларил" або "С1-С6алкілгетероарил", "С2-С6-алкеніларил", " С2-С6алкенілгетероарил", " С2-С6-алкініларил", " С2-С6алкінілгетероарил", "С1-С6-алкілциклоалкіл", " С1С6-алкілгетероциклоалкіл". Термін " С1-С6-алкілсульфініл" означає С1-С5алкільні групи, заміщені сульфінілом, в тому числі 2-(метилсульфініл)етил тощо. Термін "сульфаніл" означає групи -S-R, де R вибраний з групи, яку складають Н, " С1-С6-алкіл", " С1-С6-алкіл", заміщений галогенами, наприклад, група -SO-CF3, "С2-С6-алкеніл", "С2-С6-алкініл", "С3С8-циклоалкіл", "гетероциклоалкіл", "арил", "гетероарил", " С1-С6-алкіларил" або "С1-С6алкілгетероарил", " С2-С6-алкеніларил", " С2-С6алкенілгетероарил", " С2-С6-алкініларил", " С2-С6алкінілгетероарил", " С1-С6-алкілциклоалкіл", "С1С6-алкілгетероциклоалкіл". До сульфанільних груп, яким віддається перевага, належать метилсульфаніл, етилсульфаніл тощо. Термін "С1-С6-алкілсульфаніл" означає С1-С5алкільні групи, заміщені сульфанілом, в тому числі 2-(етилсульфаніл)етил тощо. Термін "сульфоніламіно(група)" означає групу -NRSO2-R', де кожен із R, R' означає незалежно від іншого водень, " С1-С6-алкіл", "С2-С6-алкеніл", " С2С6-алкініл", "С3-С8-циклоалкіл", "гетероциклоалкіл", "арил", "гетероарил", " С1-С6-алкіларил" або "С1 88314 18 С6-алкілгетероарил", " С2-С6-алкеніларил", " С2-С6алкенілгетероарил", " С2-С6-алкініларил", "С2-С6алкінілгетероарил", " С1-С6-алкілциклоалкіл", "С1С6-алкілгетероциклоалкіл". Термін "С1-С6-алкілсульфоніламіно (група)" означає С1-С5-алкільні групи, заміщені сульфоніламіногрупою, в тому числі 2(етилсульфоніламіно)етил тощо. Термін "аміносульфоніл" означає групу -SO2NRR', де кожен із R, R' означає незалежно від іншого водень, " С1-С6-алкіл", "С2-С6-алкеніл", "С2С6-алкініл", "С3-С8-циклоалкіл", "гетероциклоалкіл", "арил", "гетероарил", "С1-С6-алкіларил" або "С1-С6алкілгетероарил", " С2-С6-алкеніларил", " С2-С6алкенілгетероарил", " С2-С6-алкініларил", " С2-С6алкінілгетероарил", " С1-С6-алкілциклоалкіл", " С1С6-алкілгетероциклоалкіл". Термін " С1-С6-алкіламіносульфоніл" означає С1-С6-алкільні групи, заміщені аміносульфонілом, в тому числі 2-(циклогексиламіносульфоніл)етил тощо. Термін "заміщені або незаміщені": якщо значення терміну не обмежене інакше визначенням конкретного замісника, усі вищезазначені групи, наприклад, "алкеніл", "алкініл", "арил", "гетероарил", "циклоалкіл", "гетероциклоалкіл" тощо, можуть факультативно бути заміщені 1-5 замісниками, вибраними з групи, яку складають " С1-С6алкіл", "С2-С6-алкеніл", " С2-С6-алкініл", "циклоалкіл", "гетероциклоалкіл", " С1-С6-алкіларил", "С1-С6алкілгетероарил", "С1-С6-алкілциклоалкіл", "С1-С6алкілгетероциклоалкіл", "аміногрупа", "амоній", "ацил", "ацилокси-", "ациламіногрупа", "амінокарбоніл", "алкоксикарбоніл", "уреїдогрупа", "арил", "карбамат", "гетероарил", "сульфініл", "сульфоніл", "алкоксигрупа", "сульфаніл", "галоген", "карбоксил", тригалометил, ціаногрупа, гідроксил, меркапто-, нітрогрупа тощо. Термін "заміщені" означає групи, заміщені 1-5 замісниками, вибраними з групи, яку складають " С1-С6-алкіл", " С2-С6-алкеніл", "С2-С6-алкініл", "циклоалкіл", "гетероциклоалкіл", " С1-С6-алкіларил", " С1-С6-алкілгетероарил", "С1-С6-алкілциклоалкіл", " С1-С6-алкілгетероциклоалкіл", "аміногрупа", "аміносульфоніл", "амоній", "ациламіногрупа", "амінокарбоніл", "арил", "гетероарил", "сульфініл", "сульфоніл", "алкоксигрупа", "алкоксикарбоніл", "карбамат", "сульфаніл", "галоген", тригалометил, ціаногрупа, гідроксил, меркапто-, нітрогрупа тощо. Вислів "фармацевтично прийнятні солі або комплекси" означає солі або комплекси нижчезазначених сполук формули (І), які зберігають бажану біологічну активність. До прикладів таких солей належать, але без обмеження ними, солі кислот, утворені з неорганічними кислотами (такими, наприклад, як хлористоводнева кислота, бромистоводнева кислота, сірчана кислота, фосфорна кислота, азотна кислота тощо), та солі, утворені з органічними кислотами, такими як, наприклад, оцтова кислота, щавелева кислота, винна кислота, бурштинова кислота, яблучна кислота, фумарова кислота, малеїнова кислота, аскорбінова кислота, бензойна кислота, дубильна кислота, памоєва кислота, альгінова кислота, поліглутамінова кислота, нафталінсульфонова кислота, нафталінди 19 сульфонова кислота та полігалактуронова кислота. Згадані сполуки можуть також бути застосовані у вигляді фармацевтично прийнятних четвертинних солей, відомих фахівцям у цій галузі, до яких, зокрема, належать четвертинні солі амонію формули -NR,R',R"+Z-, де R, R', R" незалежно один від одного є водень, алкіл або бензил, С1-С6-алкіл, С2С6-алкеніл, С2-С6-алкініл, С1-С6-алкіларил, С1-С6алкілгетероарил, циклоалкіл, гетероциклоалкіл, та Ζ є протиіон, в тому числі хлорид, бромід, йодид, О-алкіл, толуолсульфонат, метилсульфонат, сульфонат, фосфат або карбоксилат (наприклад, бензоат, сукцинат, ацетат, гліколят, малеат, малат, фумарат, цитрат, тартрат, аскорбат, цинамоат, манделоат та дифенілацетат). Вираз "фармацевтично активне похідне" означає будь-яку сполуку, яка при введенні в організм реципієнта здатна прямо або непрямо виявляти активність, розкриту у цьому описі. Поняття "непрямо" охоплює також проліки, які можуть бути перетворені в активну форму лікарської речовини за допомогою ендогенних ферментів або метаболізму. На цей час виявлено, що сполуки відповідно до даного винаходу є модуляторами фосфоінозитид-3-кіназ (РІ3К), в тому числі РІ3К α та γ. Коли фермент фосфоінозитид-3-кіназа ( РІ3К) інгібований сполуками за цим винаходом, РІ3К нездатна виявляти свої ферментні, біологічні та/або фармакологічні ефекти. Сполуки за цим винаходом, таким чином, є корисними при лікуванні та попередженні автоімунних захворювань та/або запальних захворювань, серцево-судинних захворювань, нейродегенеративних захворювань, бактеріальних або вірусних інфекцій, ниркових захворювань, агрегації тромбоцитів, раку, трансплантації, відторгнення трансплантата або ушкоджень легенів. Загальна формула (І) відповідно до даного винаходу також охоплює відповідні таутомери, геометричні ізомери, оптично активні форми, наприклад, енантіомери, діастереомери, та рацематні форми, а також фармацевтично прийнятні солі відповідних сполук. До фармацевтично прийнятних солей формули (І), яким віддається перевага, належать солі кислот, утворені фармацевтично прийнятними кислотами, наприклад, такі солі, як гідрохлориди, гідроброміди, сульфати або бісульфати, фосфати або гідрофосфати, ацетати, бензоати, сукцинати, фумарати, малеати, лактати, цитрати, тартрати, глюконати, метансульфонати, бензолсульфонати та пара-толуолсульфонати. Сполуки формули (І) є корисними для модулювання, особливо інгібування, активності фосфоінозитид-3-кіназ ( РІ3К). Таким чином, вважається, що сполуки даного винаходу також особливо корисні для лікування та/або попередження захворювань, опосередкованих РІ3К, особливо РІ3Ка та/або РІ3Ку. Згадане лікування включає модулювання - особливо інгібування або регулювання за типом зворотного негативного зв'язку фосфатоінозитид-3-кіназ. Сполуки формули (І) є корисними для застосування як лікарські засоби. Відповідно до одного з варіантів здійснення, цей винахід пропонує похідні піридинметиленазолідинону формули (І): 88314 20 де R1 вибраний з групи, яку складають Н, галоген, факультативно заміщений С1-С6-алкіл, факультативно заміщений С2-С6-алкеніл, факультативно заміщений С2-С6-алкініл, факультативно заміщена С1-С6-алкілалкоксигрупа, факультативно заміщений алкоксикарбоніл, факультативно заміщений ацил, факультативно заміщений сульфоніл, факультативно заміщений сульфаніл, факультативно заміщений сульфініл, факультативно заміщена алкоксигрупа та факультативно заміщена аміногрупа; R2 вибраний з групи, яку складають Н; галоген; факультативно заміщений С1-С6-алкіл; факультативно заміщений С2-С6-алкеніл; C2-С6-алкініл; факультативно заміщений арил, наприклад, феніл та 3,5-диметоксифеніл; факультативно заміщений гетероарил, наприклад, факультативно заміщений 2,3-дигідроіндоліл (наприклад, трет-бутловий складний ефір 2,3-дигідро-індол-1-карбонової кислоти, 2,3-дигідро-1Н-індол-5-іл, ацетил-2,3дигідро-1Н-індол-5-іл, 1-(4-диметиламіно-бутирил)2,3-дигідро-1Н-індол-5-іл, 1-метансульфоніл-2,3дигідро- 1Н-індол-5-іл, 1-хлорметансульфоніл-2,3дигідро-1Н-індол-5-іл, 1-(3-морфолін-4-іл-пропан1-сульфоніл)-2,3-дигідро-1Н-індол-5-іл); факультативно заміщений С3-С8-циклоалкіл; факультативно заміщений С3-С8-гетероциклоалкіл, в тому числі факультативно заміщений піперидиніл, наприклад, 1-піперидиніл, 4-фтор-1-піперидиніл, 4(трифторметил)-1-піперидиніл; факультативно заміщений арил-С1-С6-алкіл; факультативно заміщений гетероарил-С1-С6-алкіл; факультативно заміщений С3-С8-циклоалкіл-С1-С6-алкіл та факультативно заміщений С3-C8-гетероциклоалкіл-С1С6-алкіл; факультативно заміщена С1-С6алкілалкоксигрупа; факультативно заміщений алкоксикарбоніл; факультативно заміщений ацил; факультативно заміщений сульфоніл; факультативно заміщений сульфаніл; факультативно заміщений сульфініл; факультативно заміщена алкоксигрупа та факультативно заміщена аміногрупа; X вибраний з групи, яку складають S, NH та О; Υ вибраний з групи, яку складають О, S та NR3, де R3 вибраний з групи, яку складають Н, факультативно заміщена С1-С6-алкоксигрупа, факультативно заміщений С1-С6-алкіл, факультативно заміщений С2-С6-алкеніл, факультативно заміщений С2-С6-алкініл, факультативно заміщений С1-С6-алкіларил, ціаногрупа та факультативно заміщений сульфоніл; А - факультативно заміщений гетероарил, в тому числі факультативно заміщений піримідиніл, факультативно заміщений піразиніл, факультати 21 вно заміщений фурил та факультативно заміщений імідазоліл; n - ціле число, вибране з-посеред 1 та 2; а також геометричні ізомери, оптично активні форми, наприклад, енантіомери, діастереомери, та рацематні форми, а також фармацевтично прийнятні солі відповідних сполук. Відповідно до конкретного варіанта здійснення, цей винахід пропонує похідні піридинметиленазолідинону формули (І), де R1 - Н. Відповідно до іншого конкретного варіанта здійснення, цей винахід пропонує похідні піридинметиленазолідинону формули (І), де R2 - Н. Відповідно до іншого конкретного варіанта здійснення, цей винахід пропонує похідні піридинметиленазолідинону формули (І), де R2 - факультативно заміщений С3-С8-гетероциклоалкіл. Відповідно до іншого конкретного варіанта здійснення, цей винахід пропонує похідні піридинметиленазолідинону формули (І), де R2 вибраний з групи, яку складають факультативно заміщений арил та факультативно заміщений гетероарил. Відповідно до іншого конкретного варіанта здійснення, цей винахід пропонує похідні піридинметиленазолідинону формули (І), де R3 - Н. Відповідно до іншого конкретного варіанта здійснення, цей винахід пропонує похідні піридинметиленазолідинону формули (І), де X - S. Відповідно до іншого конкретного варіанта здійснення, цей винахід пропонує похідні піридинметиленазолідинону формули (І), де Υ - О. Відповідно до іншого конкретного варіанта здійснення, цей винахід пропонує похідні піридинметиленазолідинону формули (І), де Υ - S. Відповідно до іншого конкретного варіанта здійснення, цей винахід пропонує похідні піридинметиленазолідинону формули (І), де n - 1. Відповідно до іншого конкретного варіанта здійснення, цей винахід пропонує похідні піридинметиленазолідинону формули (І), де n - 2. Відповідно до варіанта здійснення, якому віддається перевага, цей винахід пропонує похідні піридинметиленазолідинону формули (І), де А утворює спільно з піридиновим циклом нижченаведену групу (Іа): де R1, R2 та n відповідають вищенаведеним визначенням. Відповідно до іншого варіанта здійснення, якому віддається перевага, цей винахід пропонує похідні піридинметиленазолідинону формули (І), де А утворює спільно з піридиновим циклом нижченаведену групу (Іb): 88314 22 де R1, R2 та n відповідають вищенаведеним визначенням. Відповідно до іншого варіанта здійснення, якому віддається перевага, цей винахід пропонує похідні піридинметиленазолідинону формули (І), де А утворює спільно з піридиновим циклом нижченаведену групу (Іс): де R1, R2 та n відповідають вищенаведеним визначенням. Відповідно до іншого варіанта здійснення, якому віддається перевага, цей винахід пропонує похідні піридинметиленазолідинону формули (І), де А утворює спільно з піридиновим циклом нижченаведену групу (Id): 21 де R1, R2 та п відповідають вищенаведеним визначенням. Відповідно до варіанта здійснення, якому віддається перевага, цей винахід пропонує похідні піридинметиленазолідинону формули (І), де R1 - Н; R2 факультативно заміщений С3-С8гетероциклоалкіл; X - S; Υ - О або S; А утворює спільно з піридиновим циклом групу формули (Іа) та n - 1. Відповідно до варіанта здійснення, якому віддається перевага, цей винахід пропонує похідні піридинметиленазолідинону формули (І), де R1 - Н; X- S;Y - О та А утворює спільно з піридиновим циклом групу формули (Іb). Відповідно до варіанта здійснення, якому віддається перевага, цей винахід пропонує похідні піридинметиленазолідинону формули (І), де R1 - Н; X - S; Υ - О та А утворює спільно з піридиновим циклом групу формули (Іс). Відповідно до варіанта здійснення, якому віддається перевага, цей винахід пропонує похідні піридинметиленазолідинону формули (І), де R1 - Н; X - S; Υ - О та А утворює спільно з піридиновим циклом групу формули (Id). 23 До сполук даного винаходу належать, зокрема, сполуки, які складають таку групу: 88314 24 корисні для лікування та/або профілактики серцево-судинних захворювань, наприклад, атеросклерозу, гіпертрофії серця, дисфункції серцевих міоцитів, підвищеного кров'яного тиску або звуження кровоносних судин. Відповідно до ще одного варіанта здійснення цього винаходу, сполуки формули (І) корисні для лікування та/або профілактики хронічного обструктивного легеневого захворювання, спричиненого анафілактичним шоком фіброзу, псоріазу, алергічних захворювань, астми, інсульту або ішемічних станів, ішемії-реперфузії, агрегації/активації тромбоцитів, атрофії/гіпертрофії скелетних м'язів, відновлення лейкоцитів у раковій тканині, ангіогенезу, інвазійних метастазів, зокрема, меланоми, саркоми Капоші, гострих та хронічних бактеріальних та вірусних інфекцій, сепсису, трансплантації, відторгнення трансплантата, гломерулосклерозу, гломерулонефриту, прогресуючого ниркового фіброзу, ендотеліальних та епітеліальних уражень при запаленнях легенів або загальних дихальних шляхів легенів. Відповідно до іншого варіанта здійснення цього винаходу, запропоновано спосіб одержання похідного піридинметиленазолідинону за формулою (І), який включає стадію проведення реакції сполуки формули (II) з похідним формули (III) у присутності основи: де R1, R2, А, X, Υ та n відповідають наведеним вище визначенням. Відповідно до іншого варіанта здійснення цього винаходу, запропоновано сполуки формули (II): Сполуки даного винаходу корисні як лікарські засоби. Вони можуть бути застосовані для виготовлення лікарського засобу для профілактики та/або лікування автоімунних захворювань та/або запальних захворювань, серцево-судинних захворювань, нейродегенеративних захворювань, бактеріальних або вірусних інфекцій, ниркових захворювань, агрегації тромбоцитів, раку, трансплантації, відторгнення трансплантата або ушкоджень легенів. Відповідно до одного з варіантів здійснення, сполуки формули (І) корисні для лікування та/або профілактики автоімунних захворювань або запальних захворювань, наприклад, розсіяного склерозу, псоріазу, ревматоїдного артриту, системного червоного вовчака, запального захворювання кишечнику, запалення легенів, тромбозу або інфекції/запалення мозку, наприклад, менінгіту або енцефаліту. Відповідно до іншого варіанта здійснення, сполуки формули (І) корисні для лікування та/або профілактики нейродегенеративних захворювань, в тому числі захворювання Альцгеймера, захворювання Гантінгтона, травми ЦНС, інсульту або ішемічних станів. Відповідно до ще одного додаткового варіанта здійснення цього винаходу, сполуки формули (І) де R1, R2, А, X, Υ та n відповідають наведеним вище визначенням та де сполуки формули II вибрані з групи, яка включає сполуки формули (IIа), формули (IIb) та формули (ІІс): де R4 вибраний з групи, яку складають Η та R2; R5 - група R2, де перший атом, приєднаний до піримідинового циклу, вибраний з групи, яку складають С, N, S та О, та де у разі, якщо R4 - ΝΗ2, R5 не є ΝΗ2; R1, R2 та n відповідають вищенаведеним визначенням; 25 де R1, R2 та n відповідають вищенаведеним визначенням; де R1, R2 та n відповідають вищенаведеним визначенням та де щонайменше один із R1 або R2 не є Н; та де R1, R2 та n відповідають вищенаведеним визначенням, за умови, що сполука формули (lId) не є 2-(4-метоксифеніл)-3Н-імідазо[4,5-b]піридин5-карбоксальдегідом (RN 142764-79-2). Відповідно до іншого варіанта здійснення цього винаходу, запропоновано сполуки формули (II), вибрані з групи, до якої входять: 4-піперидин-1-іл-піридо [3,2-d] піримідин-6карбальдегід; 4-(4-фтор-піперидин-1 -іл)-піридо [3,2d]піримідин-6-карбальдегід; 4-(4-метил-піперидин- 1-іл) -піридо [3,2-d] піримідин-6-карбальдегід; піридо[2,3-b]піразин-6-карбальдегід; 2-триметилсиланіл-фуро[3,2-b]піридин-5карбальдегід; 3-феніл-1Н-імідазо[4,5-b]піридин-5карбальдегід; 3-(3,5-диметоксифеніл)-3H-імідазо[4,5b]піридин-5-карбальдегід; трет-бутил-5-(5-форміл-3H-імідазо[4,5b]тридин-3-іл)індолін-1-карбоксилат; 3-(1-ацетил-2,3-дигідро-1H-індол-5-іл)-3Hімідазо[4,5-b]піридин-5-карбальдегід; 3-{1-[4-(диметиламіно)бутаноїл]-2,3-дигідро1H-індол-5-іл}-3Н-імідазо[4,5-b]піридин-5карбальдегід; 3-[1-(метилсульфоніл)-2,3-дигідро-1H-індол-5іл]-3H-імідазо[4,5-b] піридин- 5 -карбальдегід; 3-{1-[(хлорметил)сульфоніл]-2,3-дигідро-1Hіндол-5-іл}-3H-імідазо[4,5-b] піридин5 карбальдегід; 3-{1-[(3-морфолін-4-ілпропіл)сульфоніл]-2,3дигідро-1H-індол-5-іл}-3H-імідазо[4,5-b]піридин-5карбальдегід; трет-бутил-6-(5-форміл-3H-імідазо[4,5b]піридин-3-іл)індолін-1-карбоксилат; 3-[1-(метилсульфоніл)-2,3-дигідро-1H-індол-6іл]-3H-імідазо[4,5-b]піридин-5-карбальдегід. Похідні піридинметиленазолідинону, подані в описі цього винаходу як приклади, можуть бути одержані з легкодоступних вихідних матеріалів із застосуванням описаних нижче загальних способів та методик. Мається на увазі, що у випадках, коли вказано типові експериментальні умови або умови, яким віддається перевага (тобто температура проведення реакції, її тривалість, молярні кількості 88314 26 реагентів, розчинники тощо), можна застосовувати також інші експериментальні умови, якщо не вказано інакше. Оптимальні умови проведення реакцій можуть варіювати залежно від застосовуваних конкретних реагентів або розчинників, але такі умови фахівець у галузі може визначити шляхом проведення звичайних процедур оптимізації. При застосуванні як лікарські засоби сполуки за цим винаходом, як правило, вводять в організм у формі фармацевтичних композицій. Отже, цей винахід охоплює також фармацевтичні композиції, які містять сполуку формули (І) та фармацевтично прийнятний носій, розріджувач або наповнювач. Фахівцям у галузі відоме усе різноманіття таких носіїв, розріджувачів або наповнювачів, придатних для виготовлення фармацевтичної композиції. Сполукам за цим винаходом спільно зі звичайно уживаними допоміжними речовинами, носіями, розріджувачами або наповнювачами можна надавати форму фармацевтичних композицій та дозованих одиниць таких композицій, і в такій формі їх можна застосовувати у твердому стані, наприклад, у вигляді таблеток або заповнених капсул, або ж у рідкому стані, наприклад, у вигляді розчинів, суспензій, емульсій, еліксирів або капсул, заповнених такими рідкими формами, для перорального застосування, або ж у формі стерильних розчинів для ін'єкцій для парентерального (в тому числі підшкірного) введення. Такі фармацевтичні композиції та їх одиничні дозовані форми можуть включати інгредієнти у звичайних співвідношеннях спільно з додатковими активними речовинами або без них, і такі одиничні дозовані форми можуть містити будь-яку придатну ефективну кількість активного інгредієнта, порівнянну з призначеним для застосування діапазоном добових доз. Фармацевтичні композиції, які містять похідні піридинметиленазолідинону за цим винаходом, добре відомим у фармацевтичній практиці, і вони можуть включати щонайменше одну активну сполуку. Як правило, сполуки за цим винаходом застосовуються у фармацевтично ефективній кількості. Кількість реально застосовуваної сполуки у типових випадках визначає лікар з урахуванням релевантних обставин, в тому числі стану, що підлягає лікуванню, обраного шляху введення, конкретної застосовуваної сполуки, віку, маси тіла та індивідуальної реакції пацієнта, тяжкості симптомів, що спостерігаються у пацієнта, тощо. Фармацевтичні композиції за цим винаходом можна вводити в організм різноманітними шляхами, в тому числі пероральним, ректальним, черезшкірним, підшкірним, внутрішньовенним, внутрішньом'язовим та назальним. Композиції для перорального застосування можуть мати форму нефасованих рідких розчинів чи суспензій або нефасованих порошків. Проте частіше ці композиції постачаються у дозованих лікарських формах для спрощення точного дозування. Термін "дозована лікарська форма" означає фізично дискретні одиниці, придатні як одиничні дози для людей та інших ссавців, причому кожна одиниця містить заздалегідь визначену кількість активної речовини, розраховану на досягнення бажаного терапевтич 27 ного ефекту, у поєднанні з придатним фармацевтичним наповнювачем. До типових дозованих лікарських форм належать попередньо заповнені відміряною кількістю рідкої композиції ампули або шприци або пілюлі, таблетки, капсули тощо у випадку твердих композицій. У таких композиціях похідне піридинметиленазолідинону є звичайно неосновним компонентом (із вмістом звичайно від приблизно 0,1% (мас.) до приблизно 50% (мас), відповідно до варіанта, якому віддається перевага, від приблизно 1% (мас.) до приблизно 40% (мас.)), а решту становлять різноманітні носії та технологічні допоміжні речовини, які сприяють виготовленню бажаних дозованих форм. Рідкі форми, придатні для перорального застосування, можуть включати придатний водний або неводний носій із буферними сполуками, суспензаторами та диспергаторами, барвниками, ароматизаторами тощо. Тверді форми можуть включати, наприклад, будь-які з перелічених нижче інгредієнтів або сполук аналогічної природи: в'яжуче, наприклад, мікрокристалічну целюлозу, трагантову камедь або желатин; наповнювач, наприклад, крохмаль або лактозу, розпушувальну речовину наприклад, альгінову кислоту, примогель (Primogel) або кукурудзяний крохмаль; змащувальний агент, наприклад, стеарат магнію; ковзний агент, наприклад, колоїдний діоксид кремнію; підсолоджувач, наприклад, сахарозу або сахарин; або харчосмакову домішку, наприклад, м'яту, метилсаліцилат або цитрусовий ароматизатор. Композиції для ін'єкцій, як правило, виготовляють на основі сольового розчину для ін'єкцій або сольового розчину із фосфатним буфером для ін'єкцій, або інших носіїв для ін'єкцій, відомих у галузі. Як вказано вище, похідні піридинметиленазолідинону формули (І) у таких композиціях є звичайно неосновним компонентом, вміст якого становить часто від 0,05% (мас.) до 10% (мас), решту складає носій для ін'єкцій тощо. Вищезазначені компоненти композицій для перорального застосування або для ін'єкцій наведено лише як типові приклади. Подальші матеріали, а також способи перероблення тощо, описано у Частині 5 монографії Ремінгтона (Remington's Pharmaceutical Sciences, 20th Edition, 2000, Marck Publishing Company, Easton, Pennsylvania), яку включено до цього опису шляхом посилання. Сполуки за цим винаходом можна застосовувати також у формах із модифікованим вивільненням або із систем постачання лікарських речовин із модифікованим вивільненням. Опис типових матеріалів із модифікованим вивільненням також можна знайти у вищезазначеній монографії Remington's Pharmaceutical Sciences. Синтез сполук за винаходом Нові похідні піридинметиленазолідинону за формулою (І) можна одержати з легкодоступних вихідних матеріалів, використовуючи кілька принципів синтезу, із застосуванням методик синтезу як в розчинах, так і в твердій фазі (Бруммонд та ін. - Brummond et al., 1999, J.O.C., 64, 1723-1726). Нижче описано приклади схем синтезу згаданих сполук. 88314 28 У поданому нижче описі застосовано абревіатури, що мають такі значення: Å (армстронг), см (сантиметр), екв. (еквівалент), год (година), г (грам), Μ (молярний), МГц (мегагерц), мкл (мікролітр), хв (хвилина), мг (міліграм), мл (мілілітр), мм (міліметр), ммоль (мілімоль), мМ (мілімолярний), нм (нанометр), к.т. (кімнатна температура), ACN (ацетонітрил), АТР (аденозинтрифосфат), BSA (бичачий сироватковий альбумін), DCM (дихлорметан), DIBAL (діізобутилалюмінійгідрид), DMF (диметилформамід), DMSO (диметилсульфоксид), РХВЕ (рідинна хроматографія високої ефективності), Ins1P (Dміоінозит-1-фосфат), ІЧ (інфрачервоний), РХ (рідинна хроматографія), МС (мас-спектрометрія), ЯМР (ядерний магнітний резонанс), PBS (сольовий розчин із фосфатним буфером), PІs (фосфоінозитиди), PI3Ks (фосфоінозитид-3-кінази), РІ(3)Р (фосфатидилінозит-3-монофосфат), РІ(3,4)Р2 (фосфатидилінозит-3,4-дифосфат), РІ(3,4,5)Р3 (фосфатидилінозит-3,4,5-трифосфат), РІ(4)Р (фосфатидилінозит-4-фосфат), РІ(4,5)Р2) (фосфатидилінозит-4,5-дифосфат), Ptdlns (фосфатидилінозит), PVT (полівінілтолуол), SPA (проба на спорідненість зі сцинтиляційним детектуванням), TEA (триетиламін), TFA (трифтороцтова кислота), THF (тетрагідрофуран), ХТШ (хроматографія в тонкому шарі), TMS (триметилсиліл), УФ (ультрафіолетовий). Похідні піридинметиленазолідинону, подані в описі цього винаходу як приклади, можуть бути одержані з легкодоступних вихідних матеріалів із застосуванням описаних нижче загальних способів та методик. Мається на увазі, що у випадках, коли вказано типові експериментальні умови або умови, яким віддається перевага (тобто температура проведення реакції, її тривалість, молярні кількості реагентів, розчинники тощо), можна застосовувати також інші експериментальні умови, якщо не вказано інакше. Оптимальні умови проведення реакцій можуть варіювати залежно від застосовуваних конкретних реагентів або розчинників, але такі умови фахівець у галузі може визначити шляхом проведення звичайних процедур оптимізації. У способах, ілюстрованих нижченаведеними Схемами, R1, R2, А, X, Υ та n відповідають визначенням, наведеним вище у цьому описі. Взагалі, похідні піридинметиленазолідинону за Загальною формулою (І) можна одержати, використовуючи кілька принципів синтезу, із застосуванням методик синтезу як в розчинах, так і в твердій фазі (Бруммонд та ін. - Brummond et al., 1999, див. вище), як звичайними способами, так й із застосуванням мікрохвильової обробки. На першій стадії альдегідний реагент P1 (P1a, P1b, Р1с, P1d) та від 1 екв. до 2 екв. реагенту Р2 (зокрема, тіазолідиндіону або роданіну) нагрівають у присутності основи (перевага віддається слабким основам), і одержують відповідний олефін формули (І), як показано нижче на Схемі 1. На першій стадії Р1 можна замінювати сполукамипопередниками P1a, P1b, Р1с та P1d з метою одержання кінцевих сполук формули (Іа), формули (Іb), формули (Іс) та формули (Id) , відповідно, вказаних вище у цьому описі. 29 Способи за цим винаходом, яким віддається особлива перевага, ілюстровано поданими нижче Схемою 2, Схемою 3, Схемою 4 та Схемою 5, згідно з якими сполуки формули (Іа), формули (Іb), формули (Іс) та формули (Id), відповідно, можна одержати, використовуючи ті самі умови проведення реакції, згадані вище. Незважаючи на те, що цю стадію можна виконувати за відсутності розчинника при температурі, достатньо високій для щонайменше часткового плавлення реакційної суміші, перевага віддається виконанню її у присутності інертного розчинника. Діапазон температур, яким віддається перевага, становить від приблизно 70°С до 250°С, а особлива перевага віддається температурам від приблизно 80°С до 120°С. Прикладами розчинників для вищезгаданої реакційної суміші є такі розчинники, як диметоксиметан, ксилол, толуол, о-дихлорбензол та метанол. Прикладами слабких основ для вищезгаданої реакційної суміші є лужні та лужноземельні солі слабких кислот, наприклад, (С1-С12)алкілкарбонових кислот та бензойної кислоти, карбонати та бікарбонати лужних та лужноземельних металів, наприклад, карбонат кальцію, карбонат магнію, бікарбонат калію, та вторинні аміни, наприклад, піперидин, морфолін або піролідин, а також третинні аміни, наприклад, піридин, триети 88314 30 ламін, діізопропілетиламін, N-метилморфолін, Nетилпіперидин, N-метилпіперидин тощо. Слабкими основами, яким віддається особлива перевага з міркувань економічності та ефективності, є ацетат натрію або піролідин. У типовій реакційній суміші такого типу (дивись працю Тіце та ін. - Tietze et al., in "The Knoevenagel reaction ", p. 341 ff., Pergamon Press, Oxford 1991, Eds.: Trost B.M., Fleming І.) альдегід P1 та інший вихідний матеріал (наприклад, тіазолідиндіон) Р2 у приблизно еквімолярних кількостях змішують з 0,5-1 екв. піролідину у метанолі або аналогічному розчиннику та нагрівають при температурі від 70°С до 200°С, при цьому реакція практично завершується за час від приблизно 15 хв до 3 год. Потім цільовий олефін формули (І) відділяють фільтруванням, якщо його можна виділити в осад з реакційної суміші при охолодженні, або, наприклад, шляхом змішування суміші з водою з подальшим фільтруванням, і одержують неочищений продукт. Неочищений продукт в разі бажання очищають, наприклад, кристалізацією або стандартними хроматографічними способами. За альтернативним варіантом, сполуки формули (І) можна у типових випадках одержати шляхом змішування еквівалентних кількостей тіазолідиндіону Р2 та альдегіду Р1 з молярним надлишком безводного ацетату натрію та нагрівання суміші при достатньо високій температурі для забезпечення плавлення; при такій температурі реакція в основному завершується за час від приблизно 5 хв до 60 хв. Відповідно до варіанта, якому віддається перевага, вищезгадану реакцію виконують у кислотному середовищі, наприклад, в оцтовій кислоті, у присутності ацетату натрію або бета-аланіну. Відповідно до варіанта, якому віддається перевага, вищезгадану реакцію проводять у метанолі, використовуючи від 1,1 екв. до 2,0 екв. тіазолідиндіону Р2, 1 екв. альдегіду Р1 та 0,2-0,5 екв. піролідину у метанолі. За альтернативним способом, описані вище реакції можна виконувати з використанням мікрохвильової енергії як джерела тепла, У типових випадках альдегідний вихідний матеріал Р1 та тіазолідиндіон Р2 у приблизно еквімолярних кількостях змішують з 0,5-1 екв. піперидину в диметоксиметані або аналогічному розчиннику та нагрівають при температурі від 140°С до 240°С, при цьому реакція практично завершується за час від приблизно 3 хв до приблизно 10 хв. Фармацевтично прийнятні катіонні солі сполук за цим винаходом легко одержати шляхом проведення реакції кислотних форм цих сполук із придатною основою, звичайно в еквівалентному співвідношенні, у спільному розчиннику. Типовими основами є гідроксид натрію, метилат натрію, етилат натрію, гідрид натрію, гідроксид калію, метилат калію, гідроксид магнію, гідроксид кальцію, бензатин, холін, діетаноламін, етилендіамін, меглумін, бенетамін, діетиламін, піперазин та трометамін. Сіль виділяють шляхом концентрування досуха абододання осаджувача. У деяких випадках солі можна одержати шляхом змішування розчину кислоти з розчином катіону (етилгексаноату натрію, 31 олеату магнію) із застосуванням розчинника, з якого цільова катіонна сіль випадає в осад або може бути виділена іншими способами, наприклад, концентруванням та додаванням осаджувача. Похідні 2,4-азолідинону Р2 надходять на ринок від різних постачальників. Способи одержання проміжних продуктів для синтезу формули (І) Альдегіди формули Р1 одержують різноманітними добре відомими способами, наприклад, окислювально-відновлювальними методами, виходячи з придатного алкілового складного ефіру карбонової кислоти або з карбонової кислоти. У стандартних способах відновлення алкілових складних ефірів карбонових кислот, галогенангідридів карбонових кислот або карбонових кислот до бензилових спиртів застосовують алюмогідрид літію, діізопропілалюміній, три-трет-бутоксигідрид літію-алюмінію тощо. На кінцевій стадії відповідний бензиловий спирт піддають повторному окисненню до відповідного альдегіду із застосуванням слабких окиснювальних реагентів, наприклад, діоксиду марганцю, хромової кислоти, реактиву Десса-Мартіна (DessMartin) або окиснення за Сверном (Swern), або в інших відомих умовах одержання альдегідів із первинних спиртів. Альтернативним способом може бути безпосереднє відновлення відповідного алкілового складного ефіру кислоти або карбонової кислоти до відповідного альдегіду із застосуванням DIBAL при низькій температурі або будь-який інший спосіб, відомий у галузі. Альтернативним способом одержання відповідного альдегіду Р1 є селективне відновлення нітрильної групи до відповідного альдегіду із застосуванням відомих способів, наприклад, із використанням DIBAL. Іншим способом одержання альдегідів формули Р1 є селективне відновлення відповідних ацилхлоридів із застосуванням, наприклад, три-третбутоксигідриду літію-алюмінію (Cha et al., 1993, J.O.C, 58, ρ,4732-34). За ще одним способом синтезу альдегідів Р1 вихідними матеріалами є відповідні 2піридингалогеніди, які піддають реакції із застосуванням металоорганічних сполук із метою одержання відповідних 2-вінілпіридинів, які потім можна окиснити у відповідні альдегіди Р1, використовуючи стандартні окиснювальні реагенти, наприклад, тетроксид осмію, тетроксид рутенію, озон, хлорид рутенію (III) у присутності перйодату натрію та інші реагенти, відомі фахівцям у галузі. Ще одним способом одержання відповідних альдегідів Р1 є окиснення 2-метилпіридину із застосуванням таких окиснювачів, як, наприклад, діоксид селену або фенілселенінового ангідриду. Відповідно до способу за цим винаходом, якому віддається особлива перевага, ілюстрованому нижче Схемою 6, реагент Р1а можна одержати з похідного формули Р3а, де R вибраний з групи, яку складають метил, етил або будь-яка інша відома фахівцеві у галузі група, здатна до відновлення, шляхом факультативного застосування 88314 32 послідовності відновлення та окиснення, відповідно до варіанта, якому віддається перевага, з використанням алюмогідриду літію у тетрагідрофурані, з наступною стадією окиснення, відповідно до варіанта, якому віддається перевага, з використанням діоксиду марганцю в дихлорметані. Проміжним продуктом, який можна використати для вищезгаданого синтезу, є метил-2,4,8трихлорпіридо[3,2-d]піримідин-6-карбоксилат (Проміжна сполука 1.3), синтез якого описаний у літературі (Срінівасан та ін. - Srinivasan et al., 1979, J.O.C, 1979, 44, 3, p. 435) та показаний нижче на Схемі 7. Селективне заміщення хлору у положенні 3 уможливлює введення груп R1 та R2 з одержанням різних проміжних сполук формул Р3а (Р3а(1), Р3а(2), Р3а(3), Р3а(4), Р3а(5), Р3а(6), Р3а(7)), як показано нижче на Схемі 8. Стадії відновлення, показані на Схемі 8, можна виконувати із застосуванням стандартних відновлювачів, наприклад, водню або дитіатіону нікелю Ренея (Срінівасан та ін., - Srinivasan et al., 1979, див. вище). Відповідно до варіанта, якому віддається перевага, відновлення виконують у м'яких умовах, використовуючи форміат амонію у присутності паладію. Кількість форміату амонію визначається кількістю атомів хлору, які слід видалити (2-12 екв.)· 33 Введення груп R2 та R1 виконують із застосуванням стандартних реакцій, відомих фахівцям у галузі. Відповідно до іншого способу за цим винаходом, якому віддається особлива перевага, ілюстрованого нижче Схемою 9, альдегід P1b можна одержати з проміжної сполуки Р3b шляхом окиснювального розщеплення олефінового подвійного зв'язку. де R вибраний з групи, яку складають Н, факультативно заміщений С1-С6-алкіл, факультативно заміщений арил. При проведенні такої реакції розщеплюють олефіновий подвійний зв'язок, використовуючи окиснювачі для олефінових зв'язків, наприклад, тетроксид осмію, тетроксид рутенію, озон, хлорид рутенію (III) у присутності перйодату натрію та інші реагенти, відомі фахівцям у галузі. Проміжну сполуку Р3b можна синтезувати, виходячи з похідних 2-галогенпіридину, із застосуванням реакції сполучення за участю металоорганічних сполук для введення вінільної групи стандартним способом, відомим фахівцям у галузі. Відповідні 2-галогенпіридини легко одержати, наприклад, із 2-галоген-4-нітро-6-амінопіридину, як показано нижче на Схемі 10, де "Hal" означає галоген. Відповідно до ще одного способу за цим винаходом, якому віддається особлива перевага, ілюстрованого нижче Схемою 11, де R вибраний із групи, яку складають Н, факультативно заміщений С1-С6-алкіл, факультативно заміщений арил, проміжну сполуку Р1с можна одержати з проміжної сполуки Р3с шляхом окиснення 2-метилпіридинів. 88314 34 Таке окиснення можна здійснити, використовуючи діоксид селену або фенілселеніновий ангідрид в інертному розчиннику при температурі від 150°С до 250°С. Відповідно до варіанта, якому віддається перевага, таку реакцію проводять, використовуючи мікрохвильову енергію як джерело нагрівання. На другій стадії виконують відщеплення силільної групи у стандартних умовах, як описано Коценьським (Kocienski, 1994 (див. вище) та Гріні та ін. (Greene et al., 1999 (див. вище). Відповідно до варіанта, якому віддається перевага, триметилсилільну групу відщеплюють, використовуючи гідроксид натрію у концентрації від 2-н до 5-н. Введення групи R2 можна здійснити, як описано у WO2004/007491. Відповідно до ще одного способу, якому віддається більша перевага, проміжну сполуку Р1с можна одержати з проміжної сполуки Р3с шляхом перегрупування піколін-N-оксиду. У типових випадках проміжну сполуку Р3с піддають N-окисненню до проміжної сполуки Р3', використовуючи окиснювачі, наприклад, м-хлор-надбензойну кислоту (т-СРВА) при кімнатній температурі або інший окиснювач, відомий фахівцям у галузі. Подальша лужна обробка та нагрівання Р3с' в оцтовому ангідриді при 100°С протягом 5-15 хв (Кава та ін. - Cava et al., 1958, JOC, 23, 1616) дає відповідний спирт із захисною ацетильною групою, від якого, у свою чергу, можна одночасно відщепити групу захисту та силільну групу шляхом обробки гідроксидом натрію (2-н.) у метанолі при кімнатній температурі. Нарешті, первинний спирт Р3с" можна окиснити до відповідної альдегідної проміжної сполуки Ріс, використовуючи окиснювачі, наприклад, діоксид марганцю у дихлорметані або інші окиснювачі, відомі фахівцям у галузі (Схема 11 вище). Відповідно до ще одного способу за цим винаходом, якому віддається особлива перевага та який стосується азабензимідазолів, проміжну сполуку P4d можна одержати з проміжної сполуки P5d, як показано нижче на Схемі 12, де "Hal" означає галоген. Після заміщення галогену в положенні 2 групою R2NH2 у спиртовому середовищі (наприклад, в етанолі) у присутності основи відновлюють нітрогрупу із застосуванням металічного індію як каталізатора у присутності джерела водню. Потім одержують сполуку P4d як продукт циклізування шляхом конденсування з амідинами, після чого вводять вінільну групу, використовуючи реакцію сполучення із застосуванням металоорганічної сполуки за стандартними методиками, відомими фазівцям у галузі. Якщо R2 у проміжній сполуці P4d є хімічною групою, яка підлягає перетворенням у процесі синтезу, то такі перетворення виконують після завершення сполучення з вінільною групою. Необмежувальний перелік таких перетворень включає 35 відщеплення груп захисту, сполучення, окиснення та відновлення. Відповідно до одного варіанта здійснення винаходу, якому віддається особлива перевага, введений вінільний олефіновий зв'язок проміжної сполуки P3d (Схема 13 вище) розщеплюють, використовуючи окиснювачі для олефінових зв'язків, наприклад, тетроксид осмію або хлорид рутенію (III) у присутності перйодату натрію, озон та інші окиснювачі, відомі фахівцям у галузі. За ще одним загальним способом, сполуки Формули (І) можна перетворити в альтернативні сполуки Формули (І), застосовуючи придатні способи взаємного перетворення, добре відомі фахівцям у галузі. Якщо вищезазначена сукупність загальних способів синтезу є непридатною для одержання сполук Формули (І) та/або необхідних проміжних продуктів для синтезу сполук Формули (І), то слід застосовувати придатні способи підготовчих синтезів, відомі фахівцям у галузі. Як правило, способи синтезу будь-якої індивідуальної сполуки Формули (І) залежать від конкретних замісників у кожній молекулі та від доступності необхідних проміжних продуктів; такі фактори, знов-таки, можуть враховуватися пересічним фахівцем у галузі. Усі способи введення та відщеплення груп захисту, див. вищезгадані монографії Коценьського (Kocienski, 1994) та Гріні та ін. (Greene et al., 1999). Сполуки за цим винаходом можна виділяти в поєднанні з молекулами розчинника шляхом кристалізації після випарювання відповідного розчинника. Фармацевтично прийнятні солі сполук Формули (І), які містять основні центри, з кислотами можна одержати звичайним способом. Наприклад, розчин вільної основи можна обробити придатною кислотою, розчиненою у придатному розчиннику або нерозведеною, і відділити утворену сіль або фільтруванням, або випарюванням розчинника, в якому проводили реакцію, у вакуумі. Фармацевтично прийнятні солі з основами можна одержати аналогічним способом, шляхом оброблення розчину сполуки Формули (І) придатною основою. Обидва типи солей можна одержувати або перетворювати один в одного, застосовуючи іонообмінні смоли. Нижче цей винахід ілюстровано деякими прикладами, які не слід розглядати як такі, що обмежують обсяг винаходу. Приклади Використовують такі наявні на ринку проміжні сполуки: 5-аміноурацил, що постачається на ринок фірмою Aldrich; диметилацетилендикарбоксилат, що постачається на ринок фірмою Aldrich; Ν,Ν-діетиланілін, що постачається на ринок фірмою Aldrich; 88314 36 оксихлорид фосфору, що постачається на ринок фірмою Aldrich; N-етилдіізопропіламін, що постачається на ринок фірмою Aldrich; форміат амонію, що постачається на ринок фірмою Aldrich; алюмогідрид літію, що постачається на ринок фірмою Aldrich; оксид магнію, що постачається на ринок фірмою Aldrich; 2,4-тіазолідиндіон, що постачається на ринок фірмою Aldrich; роданін, що постачається на ринок фірмою Aldrich; бета-аланін, що постачається на ринок фірмою Aldrich; 4-фторпіперидин, що постачається на ринок фірмою Fluorochem; 4-трифторметилпіперидин, що постачається на ринок фірмою Lancaster; гліоксал (оксальдегід), що постачається на ринок фірмою Aldrich; тетракіс(трифенілфосфін)паладій, що постачається на ринок фірмою Aldrich; вінілтрибутилолово, що постачається на ринок фірмою Aldrich; 6-йод-2-піколін-5-ол, що постачається на ринок фірмою Acros; (триметилсиліл)ацетилен, що постачається на ринок фірмою Aldrich; дихлорбіс(трифенілфосфін)паладій(II), що постачається на ринок фірмою Aldrich; 1,2-дихлорбензол, що постачається на ринок фірмою Aldrich; 2-аміно-3-нітро-6-хлорпіридин, що постачається на ринок фірмою ACROS; порошок індію, що постачається на ринок фірмою Aldrich; ацетат формамідину, що постачається на ринок фірмою Aldrich; трибутил(вініл)олово, що постачається на ринок фірмою Aldrich; тетроксид осмію, що постачається на ринок фірмою Aldrich; перйодат натрію, що постачається на ринок фірмою Aldrich; 2,6-дихлор-3-нітропіридин, що постачається на ринок фірмою Aldrich; 3,5-диметоксіанілін, що постачається на ринок фірмою Aldrich; 5-нітроіндолін, що постачається на ринок фірмою Aldrich; 6-нітроіндолін, що постачається на ринок фірмою Aldrich; гідрохлорид 4-(диметиламіно)масляної кислоти, що постачається на ринок фірмою Aldrich; 3-хлорпропансульфонілхлорид, що постачається на ринок фірмою Aldrich; хлорметансульфонілхлорид, що постачається на ринок фірмою Alfa Aesar. Дані про РХВЕ, ЯМР та МС, подані у прикладах, описаних нижче, одержано при таких умовах: РХВЕ: колонка Waters Symmetry C8 50x4,6 мм, умови: MeCN/H2O, 5-100% (8 хв), максимальна висота піків на довжинах хвиль 230-400 нм; 37 мас-спектри: прилад PE-SCIEX АРІ 150 ЕХ (позитивна хімічна іонізація - АРСІ та іонізація електронним ударом - ESI); мас-спектри після рідинної хроматографії (LC/MS): прилад Waters ZMD (ES); 1 H-ЯМР: прилад Bruker DPX-300 МГц. Очищення методом препаративної РХВЕ виконується на системі РХВЕ Waters Prep LC 4000, обладнаній колонками Prep Nova-Pak®HR, C18, розмір зерен сорбенту 6 мкм, 60Å, розміри колонки 40x30 мм (кількість речовини до 100 мг) або XTerra® Prep MS C8, 10 мкм, 50x300 мм (до 1 г). Усі операції очищення виконуються при елююванні градієнтом MeCN/H2O з домішкою 0,09% TFA. Напівпрепаративне очищення РХВЕ з оберненою фазою виконуються із застосуванням системи Biotage Parallex Flex, обладнаної колонками Supelcosil™ ABZ+Plus (25 смх21,2 мм, 12 мкм); УФ детектування на довжинах хвиль 254 нм та 220 нм; об'ємна швидкість потоку 20 мл/хв (до 50 мг). Аналіз методом ТШХ виконується на пластинах Merck Precoated 60 F254· Очищення флешхроматографією виконується на носії SiO2 із застосуванням для елюювання сумішей циклогексан/EtOAc або ДХМ/МеОН. Проміжна сполука 1.1: Диметил (2Е)-2-[(2,4діоксо-1,2,3,4-тетрагідро-5-піримідиніл)-аміно]-2бутендіоат (Схема 7) До суспензії 5-аміноурацилу (В) (4,0 г; 31,5 ммоль; 1 екв.) у МеОН (120,00 мл) додавали диметилацетилевдикарбоксилат (С) (5,0 г; 35,2 ммоль; 1,1 екв.). Суспензію перемішували при кімнатній температурі протягом 46 год. За реакцією спостерігали за допомогою ЯМР. Тверду речовину відфільтровували, одержуючи диметил-(2Е)-2[(2,4-діоксо-1,2,3,4-тетрагідро-5-піримідиніл)аміно]2-бутендіоат (8,0 г, 95%) (Проміжна сполука 1.1). Кількість: 8,0 г; вихід: 95%; формула: С10Н11О6N3; чистота за даними РХВЕ: 95%; РХВЕ (Н2О TFA 0,1% - ACN TFA 0.05%): Rt (хв); площа піка, %: 1,37; 93,61; 1H ЯМР (DMSO-d6) δ 3,64 (s, 3Н), 3,66 (s, 3Н), 5,21 (s, 1Н), 7,42 (s, 1H), 9,07 (s, 1H), 10,86 (br, 1H), 11,31 (br, 1H); PX-MC: M/Z ESI: Rt (хв) 0,85; 210, 238, 270 (M+1); 208, 236, 268 (M1). Проміжна сполука 1.2: Метил-2,4,8-триоксо1,2,3,4,5,8-гексагідропіридо[3,2-d]піримідин-6карбоксилат (Схема 7) У 4-горлу колбу місткістю 2 л, споряджену дефлегматором, завантажували диметил-(2Е)-2[(2,4-діоксо-1,2,3,4-тетрагідро-5-піримідиніл)аміно]-2-бутендіоат (Проміжна сполука 1.1) (38,5 г; 0,14 моль; 1 екв.) та даутерм (R) А (1л) (евтектична суміш дифенілового простого ефіру з біфенілом). Суспензію перемішували механічною мішалкою у атмосфері аргону та нагрівали до 220°С. За реакцією спостерігали за допомогою РХВЕ/РХ/МС. Через 3 год реакцію зупиняли шляхом охолодження, після чого додавали 300 мл петролейного ефіру. Одержаний осад відфільтровували та промивали DMF (2x100 мл). Метил-2,4,8-триоксо1,2,3,4,5,8 гексагідропіридо[3,2-d]піримідин-6карбоксилат (21,02 г; 62%) (Проміжна сполука 1.2) виділяли у вигляді жовтого порошку (чистота за даними РХВЕ 100%). 88314 38 Кількість: 21,0 г; вихід: 62%; формула: C9H7O5N3; 1Н ЯМР (DMSO-d6) δ 3,87 (s, 3Н), 7,58 (s, 1Н), 10,90 (s, 1H), 11,56 (s, 1H), 12,10 (br, 1H). Проміжна сполука 1.3: Метил-2,4,8трихлорпіридо[3,2-d]тримідин-6-карбоксилат (Схема 7) Розчин метил-2,4,8-триоксо-1,2,3,4,5,8гексагідропіридо[3,2-d]піримідин-6-карбоксилату (Проміжна сполука 1,2) (9 г; 37,95 ммоль; 1 екв.) та Ν,Ν-діетиланіліну (10 мл) у оксихлориді фосфору (174 мл) нагрівали зі зворотним холодильником протягом ночі. Розчин випарювали у вакуумі. Одержане чорне масло повільно виливали на лід. Додавали етилацетат, одержану органічну фазу промивали водою до досягнення рН=6. Органічні шари сушили над сульфатом магнію, фільтрували та концентрували. Метил-2,4,8-трихлорпіридо[3,2d]піримідин-6-карбоксилат (Проміжна сполука 1.3) (6,5 г, 59%) осаджували циклогексаном у вигляді рожевої твердої речовини (чистота за даними РХВЕ 98%). Кількість: 6,5 г; вихід: 59%; формула: C9H4O2CI3N3; 1H ЯМР (СРСl3) δ 4,12 (s, 3Н), 8,70 (s, 1Н); РХВЕ (Н2О TFA 0,1% - ACN TFA 0.05%): Rt (хв); площа піка, %: 3,07; 98; РХ-МС: M/Z ESI: Rt (хв) 1,58 ; 293 (М+1). Проміжна сполука 1.4: Метил-2,8-дихлор-4-(1піперидиніл)піридо[3,2-d]піримідин-6-карбоксилат (Схема 8) До розчину метил-2,4,8-трихлорпіридо[3,2d]піримідин-6-карбоксилату (4,65 г; 15,9 ммоль; 1 екв.) (Проміжна сполука 1,3) у ацетонітрилі (140 мл) додавали N-етилдіізопропіламін (4 мл; 23,8 ммоль; 1,5 екв.). Суміш охолоджували до 0°С. Додавали краплями розчин піперидину (1,57 мл; 15,9 ммоль; 1 екв.) у ацетонітрилі (20 мл). Суміш перемішували 15 хв при 0°С. Суміш частково концентрували, одержаний осад відфільтровували, промивали МеОН та сушили у вакуумі, одержуючи метил-2,8-дихлор-4-(1-піперидиніл)піридо[3,2d]піримідин-6-карбоксилат (Проміжна сполука 1.4) (3,98 г; 73%) у вигляді рожевої твердої речовини (чистота за даними РХВЕ 98,8%); кількість: 3,98 г; вихід: 73%; формула: C14H14O2Cl2N4; 1Н ЯМР (DMSO-d6) δ 1,71 (s1, 6Н), 3,92 (s, 3Н), 4,01 (s1, 2Н), 4,82 (s1, 2Н), 8,42 (s, 1H); РХ-МС: M/Z ESI: Rt (хв) 2,02 ; 341,02, 342,89 (М+1); РХВЕ (Н2О TFA 0,1% -ACN TFA 0.05%): Rt (хв); площа піка, %: 4,27; 98,84. Проміжна сполука 1.5: Метил-4-(1піперидиніл)піридо[3,2-d]піримідин-6-карбоксилат (Схема 8) У круглодонну колбу завантажували паладій (540 мг; 0,51 ммоль; 0,05 екв.) та ізопропанол (90 мл). Цю суміш барботували Аr. Додавали знегажений водний розчин форміату амонію (2,56 г, 40,6 ммоль, 4 екв., у 4 мл води), а потім метил-2,8дихлор-4-(1-піперидиніл)піридо[3,2-d]піримідин-6карбоксилат (Проміжна сполука 1.4) (3,46 г; 10,5 ммоль; 1 екв.) та знегажений ізопропанол (10 мл). Через 30 хв додавали другу порцію форміату амонію у вигляді водного розчину (2,56 г, 40,6 ммоль, 4 екв., у 4 мл води). Нарешті, ще через 30 хв, додавали ще 8 екв. форміату амонію у воді (5,12 г, 81,2 ммоль, 8 екв., у 8 мл води). Потім суміш перемішували при кімнатній температурі протягом 39 ночі та фільтрували через целіт. Одержаний фільтрат випарювали. Неочищений продукт розчиняли у DCM та промивали водою та розсолом. Органічну фазу сушили над сульфатом магнію, фільтрували та випарювали, одержуючи метил-4-(1піперидиніл)піридо[3,2-d]піримідин-6-карбоксилат (2,29 г; 83%) (Проміжна сполука 1.5), у вигляді жовтої твердої речовини (чистота за даними РХВЕ 92,9%). Цей продукт використовували на наступній стадії без додаткового очищення. Кількість: 2,29 г; вихід: 82%; формула: C14H16O2N4; 1Н ЯМР (DMSO-d6) δ 1,70 (s1, 6Н), 3,92 (s, 3Н), 4,42 (s1, 4H), 8,19 (d, J=9 Гц, 1Н), 8,30 (d, J=9 Гц, 1H), 8,52 (s, 1H); PXBE (H2O TFA 0.1% ACN TFA 0,05%): Rt (хв); площа піка, %:1,83; 92,88; PX-MC: M/Z ESI: Rt (хв) 1,58 ; 273,10 (M+1). Проміжна сполука 1.6: [4-(1піперидиніл)піридо[3,2-d]піримідин-6-іл] метанол (Схема 6) Метил-4-(1-піперидиніл)піридо [3,2d]піримідин-6-карбоксилат (Проміжна сполука 1.5) (4,4 г; 16,2 ммоль; 1 екв.) розчиняли у THF (176 мл), і одержаний розчин охолоджували до -35°С (внутрішня температура). Додавали краплями алюмогідрид літію (8,1 мл; 1,00 М; 8,1 ммоль; 0,50 екв.). Через 2 год 30 хв при -35°С реакцію припиняли. Додавали воду (8,1 мл), та дозволяли суміші нагрітися до кімнатної температури. Після додавання МеОН (8 мл), фільтрували суміш через целіт, та промивали великою кількістю суміші DCM/MeOH (1:1). Розчинники видаляли під зниженим тиском, одержуючи [4-(1піперидиніл)піридо[3,2-d]піримідин-6-іл]метанол (Проміжна сполука 1.6) (3,99 г; кількісний вихід, чистота за даними РХВЕ 92,9%). Цей продукт використовували на наступній стадії без додаткового очищення. Кількість: 3,99 г; вихід: 100%; формула: C13H16ON4; 1Н ЯМР (DMSO-d6) δ 1,64 (m, 6H), 4,32 (s1, 4Н), 4,66 (s, 2Н), 7,86 (d, J=9 Гц, 1H), 8,06 (d, J=9 Гц, 1H), 8,44 (s, 1H); PX-MC: M/Z ESI: Rt (хв) 1,24; 245,08 (M+1); PXBE (H2O TFA 0,1% -ACN TFA 0,05%): Rt (хв); площа піка, %: 1,39; 92,88. Проміжна сполука 1.7: 4-(1піперидиніл)піридо[3,2-d]піримідин-6-карбальдегід (Схема 6) [4-(1-піперидиніл)піридо[3,2d]піримідин-6іл]метанол (Проміжна сполука 1.6) (3,95 г; 16,2 ммоль; 1,00 екв.) розчиняли у DCM (160 мл). Розчин охолоджували до 0°С та додавали оксид магнію (16,5 г; 0,162 моль; 10 екв.). Реакційну суміш перемішували 5 хв при 0°С, а потім протягом ночі при кімнатній температурі. Для завершення перетворення через 12 год та 20 год додавали МnО2 (дві порції по 4,96 г; 48,48 ммоль; 3 екв.). Через 20 год реакцію припиняли. Додавали МеОН (100 мл), фільтрували суміш через целіт, та промивали великою кількістю суміші DCM/MeOH (1:1). Розчинники видаляли під зниженим тиском, одержуючи 4(1-піперидиніл)піридо[3,2-d]піримідин-6карбальдегід (Проміжна сполука 1.7). Цей продукт використовували на наступній стадії без додаткового очищення. Кількість: 4,1 г; формула: C13H14ON4; чистота за даними РХВЕ: 58,84%; РХМС: M/Z ESI: Rt (хв) 1,53; 243,06 (М+1); РХВЕ (Н2О TFA 0,1% - ACN TFA 0,05%): Rt (хв); площа піка, 88314 40 %: 1,39; 58,84. 1Н ЯМР (DMSO-d6) δ 9,95 (s, 1H), 8,52 (s, 1H), 8,16 (m, 2H), 4,46 (1, 4H), 1,70 (1, 6H). Проміжна сполука 2.1: 4-(4-фтор-піперидин-1іл)-піридо[3,2-d]піримідин-6-карбальдегід (Схеми 6 та 8) Вказану в заголовку сполуку одержували, використовуючи 4-фтор-піперидин, за загальною методикою, описаною для синтезу проміжної сполуки 1.7 (Схеми 5 та 7). Кількість: 4,15 г; формула: C13H13FON4; чистота за даними РХВЕ: 89,16%; РХМС: M/Z ESI: Rt (10 хв) 2,26; 261,08 (М+1); РХВЕ (Н2О TFA 0,1% - ACN TFA 0,05%): Rt (хв); площа піка, %: 1,19; 89,16; 1H ЯМР (DMSO-d6) δ 10,01 (s, 1H), 8,60 (s, 1H), 8,23 (m, 2Н), 5,00 (m, 1H), 4,51 (1, 4Н), 1,91 (1, 4Н). Проміжна сполука 3.1: 4-(4-(трифторметил)піперидин-1-іл)-піридо[3,2-d]піримідин-6карбальдегід (Схеми 6 та 8) Вказану в заголовку сполуку одержували, використовуючи 4-трифторметил-піперидин, за загальною методикою, описаною для синтезу проміжної сполуки 1.7 (Схема 5 та Схема 7). Кількість: 4,8 г; формула: C14H13OF3N4; чистота за даними РХВЕ: 67,12%; РХ-МС: M/Z ESI: Rt (3 хв) 1,75; 311,04 (М+1); РХВЕ (Н2О TFA 0,1% - ACN TFA 0,05%): Rt (хв); площа піка, %: 1,89; 67,12; 1H ЯМР (DMSO-d6) δ 10,03 (s, 1Н), 8,62 (s, 1H), 8,18 (s, 2H), 3,22 (t, 2H), 2,48 (m, 2H), 2,08 (d, 2H), 1,80 (m, 3H). Проміжна сполука 4.1: 6-хлор-піридин-2,3діамін (Схема 10) 2-аміно-3-нітро-6-хлорпіридин (3 г, 17,3 ммоль, 1 екв.) розчиняли у THF (50 мл) при кімнатній температурі. Повільно додавали дигідрат хлориду олова (15,6 г, 70 ммоль, 4 екв.), попередньо розчинений у концентрованій НСl (5 мл), та реакційну суміш перемішували при кімнатній температурі протягом 4 год. Після завершення реакції реакційну суміш охолоджували до 0°С та обробляли 5М розчином гідроксиду натрію (12 мл) до досягнення рН 14, а відповідну сполуку екстрагували етилацетатом. Органічні фази сушили над сульфатом магнію, випарювали у вакуумі, а одержаний неочищений матеріал очищали флеш-хроматографією, використовуючи суміш циклогексан/етилацетат (1/1), і одержували 1,5 г червоного масла (Проміжна сполука 4.1). Кількість: 1,5 г; вихід: 60%; формула: C5H6N3CI; чистота за даними РХВЕ: 98%; РХВЕ (H2O TFA 0,1% - ACN TFA 0.05%): Rt (хв); площа піка, %: 0,5 хв; 98%; 1H ЯМР (DMSO-d6) δ 6,67 (d, 1H, H5, J=8 Гц), 6,36 (d, 1H, H4, J=8 Гц), 5,78 (m, 2H, NH2), 4,75 (m, 2H, NH2); PX-MC: M/Z ESI: Rt (хв) 0,1 хв, 144,0 (M+1). Проміжна сполука 4.2: 6-хлор-піридо[2,3b]піразин (Схема 10) 6-хлор-2,3-піридиндіамін (Проміжна сполука 4.1) (1 г, 6,96 ммоль, 1 екв.) розчиняли у THF (15 мл). Додавали гліоксаль (0,84 мл, 18,1 ммоль, 2,5 екв.), та перемішували реакційну суміш при кімнатній температурі протягом 2 год. За реакцією спостерігали за допомогою RP-PXBE. THF випарювали, залишок вдруге розчиняли у етилацетаті (30 мл). Органічні фази промивали двічі насиченим розчином Nа2СО3, сушили над сульфатом магнію та випарювали у вакуумі, одержуючи 1,15 г очікуваної сполуки у вигляді білої твердої речовини 41 (Проміжна сполука 4.2). Кількість: 1,15 г; вихід: 100%; формула: C7H4N3Cl; чистота за даними РХВЕ: 98%; РХВЕ (Н2О TFA 0,1% - ACN TFA 0,05%): Rt (хв); площа піка, %: 1,2 хв; 98%; 1H ЯМР (CDCl3) δ 9,0 (s, 1H), 8,88 (s, 1H), 8,36 (d, 1H, J=8 Гц), 7,67 (d, 1H, J=8 Гц); PX-MC: M/Z ESI: Rt (хв) 0,68 хв, 167,0 (M+1). Проміжна сполука 4.3: 6-вініл-піридо[2,3b]піразин (Схема 10) 6-хлорпіридо[2,3-b]піразин (Проміжна сполука 4.2) (3 г, 18,12 ммоль, 1,00 екв.) розчиняли у THF (150 мл) та знегажували азотом при кімнатній температурі протягом 10 хв. Додавали тетракіс(трифенілфосфін)паладій (0) (1,46 г, 1,27 ммоль, 0,07 екв.) та вінілтрибутилолово (7,47 мл, 23,5 ммоль, 1,3 екв.), та реакційну суміш перемішували при 65°С протягом 3 год. THF випарювали, а неочищений продукт одразу ж очищали флешхроматографією, використовуючи суміш циклогексан/етилацетат (8/2), і одержували 2,3 г очікуваної сполуки (Проміжна сполука 4.3) у вигляді оранжевого масла. Кількість: 2,3 г; вихід: 81%; формула: C9H7N3; чистота за даними РХВЕ: 98%; РХВЕ (Н2О TFA 0,1% - ACN TFA 0,05%): Rt (хв); площа піка, %: 1,32 хв; 98%; 1Н ЯМР (DMSO-d6) δ 9,10 (s, 1Н), 8,98 (s, 1H), 8,46 (d, 1H, J=8 Гц), 7,95 (d, 1H, J=8Гц), 6,90 (dd, 1H, Jтранс=17 Гц, Іцис=10 Гц), 6,50 (dd, 1H, Jтранс =17 Гц, Jгем=1,5 Гц), 5,80 (dd, 1H, Jцис=10 Гц, Jгем=1,5 Гц). PX-MC: M/Z ESI: Rt (хв) 0,78 хв, 158,13 (M+1). Проміжна сполука 4.4: Піридо[2,3-b]піразин-6карбальдегід (Схема 9) 6-вінілпіридо[2,3-b]піразин (Проміжна сполука 4.3) (1 г, 6,37 ммоль, 1 екв.) розчиняли у метанолі (20 мл) та охолоджували до -70°С. Одержаний розчин барботували протягом 20 хв слабким струменем суміші кисень/озон. За реакцією спостерігали за допомогою ХТШ, використовуючи суміш циклогексан/етилацетат (8/2). Після завершення реакції додавали диметилсульфід (0,1 мл), та залишали реакційну суміш при кімнатній температурі на 30 хв. Метанол випарювали у вакуумі, та одержували 600 мг піридо[2,3-b]піразин-6карбальдегіду. Неочищений матеріал аналізували без додаткового очищення (Проміжна сполука 4.4). Кількість: 0,60 г; вихід: 60%; формула: C8H5N3O; чистота за даними РХВЕ: 90%; РХВЕ (Н2О TFA 0,1% -ACN TFA 0.05%): Rt (хв); площа піка, %: 0,90 хв; 90%; 1H ЯМР (DMSO-d6) δ 10,1 (1, 1H), 9,05 (s, 1H), 8,95 (s, 1H), 8,70 (d, 1H, J=8 Гц), 8,20 (d, 1H, J=8 Гц); PX-MC: M/Z ESI: Rt (хв) 0,76 хв, 158,13 (M+1). Проміжна сполука 5.1: 5-метил-2триметилсиланіл-фуро[3,2-b]піридин (Схема 11) До знегаженого розчину 6-йод-2-піколін-5-олу (855 мг; 3,64 ммоль; 1,00 екв.) у триетиламіні (20,00 мл) додавали (триметилсиліл)ацетилен (1г; 10,19 ммоль; 2,80 екв.), йодид міді (І) (90,07 мг; 0,47 ммоль; 0,13 екв.) та дихлорбіс(трифенілфосфін)паладій(ІІ) (229,82 мг; 0,33 ммоль; 0,09 екв.). Розчин нагрівали зі зворотним холодильником. Через 3 год реакцію припиняли, та залишали для охолодження до кімнатної температури. Розчин фільтрували через целіт (промивали AcOEt та МеОН). Розчинники видаляли. 88314 42 Додавали AcOEt та воду, та об'єднані органічні шари сушили над сульфатом магнію, фільтрували та концентрували, одержуючи очікувану сполуку. Неочищений продукт очищали флешхроматографією на короткій колонці, використовуючи циклогексан, а потім суміш AcOEt/циклогексан (20/80), і одержували 603 мг бажаної сполуки у вигляді твердої речовини (Проміжна сполука 5.1). Кількість: 603 мг; вихід: 81%; Формула: C11H15NOSi; чистота за даними РХВЕ: 93,14%; РХВЕ (Н2О TFA 0,1% - ACN TFA 0,05%): Rt (хв); площа піка, %: 2,17 хв; 93,14%; 1H ЯМР (СDСl3) δ 7,65 (d, 1H, J=8,5 Гц), 7,10 (s, 1H), 7,06 (d, 1H, J=8,5 Гц), 2,67 (s, 3H), 0,36 (s, 9H); PX-MC: M/Z ESI: Rt (хв) 1,89 хв, 206,06 (M+1). Проміжна сполука 5.2: 2-триметилсиланілфуро[3,2-b]піридин-5-карбальдегід (Схема 11) До розчину 5-метил-2(триметилсиліл)фуро[3,2-b]піридину (Проміжна сполука 5.1) (600 мг; 2,92 ммоль; 1 екв.) у 1,2дихлорбензолі (12 мл) додавали діоксид селену (486 мг; 4,38 ммоль; 1,5 екв.). Реакційну суміш нагрівали у мікрохвильовій печі при 220°С протягом 6 год. Розчин концентрували у вакуумі. Додавали Et2O, та відфільтровували чорну тверду речовину. Фільтрат концентрували та очищали флеш-хроматографією, використовуючи циклогексан, а потім суміш циклогексан/AcOEt (90/10), і одержували тверду речовину (Проміжна сполука 5.2). Кількість: 130 мг; вихід: 20%; формула: C11H13NO2Si; чистота за даними РХВЕ: 81,8%; РХВЕ (Н2О TFA 0,1% - ACN TFA 0,05%): Rt (хв); площа піка, %: 3,84 хв; 81,83%; 1Н ЯМР (СDСl3) δ 10,19 (s, 1H), 7,99 (d, 1H, J=8,50 Гц), 7,89 (d, 1H, J=8,50 Гц), 7,27 (s, 1H), 0,40 (s, 9H); PX-MC: M/Z ESI: Rt (хв) 1,86 хв, 220 (M+1). Загальні методики синтезу проміжних сполук 6-16.3: Загальна методика І введення у проміжну сполуку P5d замісником R2NH2 (Схема 12): Розчин 2,6-дибром-3-нітропіридину (Проміжна сполука 6 формули P5d, де Hal - Вr та R1 - Н) (1 екв.), ариламіну (1,0-1,2 екв.) та триетиламіну (2 екв.) у етанолі (5 мл/ммоль) перемішують протягом 48 год при температурі навколишнього середовища. Одержаний осад відділяють фільтруванням, одержуючи відповідний заміщений продукт високої чистоти. Загальна методика II відновлення (Схема 12): Суміш бромпіридину (1 екв.), порошку індію (36 екв.), насиченого водного розчину хлориду амонію (8 мкл/ммоль) та етанолу (20 мкл/ммоль) перемішують при нагріванні зі зворотним холодильником протягом 4 год. Фільтрують через целіт, концентрують фільтрат у вакуумі, після чого екстрагують основою. Органічний шар сушать над сульфатом натрію та концентрують у вакуумі. Одержаний відповідний діамінопіридин використовують на наступній стадії без додаткового очищення. Загальна методика III пиклізування (Схема 12): Суміш діамінопіридину (1 екв.), формамідинацетату (3-5 екв.) та 2-метоксіетанолу (30 мкл/ммоль) перемішують при нагріванні зі зворотним холодильником протягом 15 год. Суміш концентрують у вакуумі та очищають хроматографією 43 (градієнт EtOAc/гексан), одержуючи відповідний бромімідазо[4,5-b]піридин. Загальна методика IV сполучення (Схема 12): Розчин бромімідазо[4,5-b]піридину (1 екв.), трибутил(вініл)олова (1,5-3 екв.) та тетракіс(трифенілфосфін)паладію (0) (0,1 екв.) у толуолі (знекиснений азотом, 20 мкл/ммоль мкл) перемішують при нагріванні зі зворотним холодильником протягом 4 год. Після концентрування у вакуумі та очищення хроматографією (EtOAc/гексан градієнт) одержують відповідний вінілімідазо[4,5-b]піридин. Загальна методика V окиснювання проміжної сполуки 4 (Схема 13): Суміш вінілімідазо[4,5-b]піридину (1 екв.), тетроксиду осмію (0,1 екв.), перйодату натрію (3-4 екв.), 1,4-діоксану (30 мкл/ммоль) та води (25 мкл/ммоль) перемішують протягом 15-30 хв при температурі навколишнього середовища. Одержану суспензію розводять однаковими кількостями води та етилацетату. Після фільтрування через целіт органічну фазу сушать над сульфатом натрію, концентрують у вакуумі та очищають флешхроматографією, одержуючи відповідний формілімідазо[4,5-b]піридин. Проміжна сполука 6: 2,6-дибром-3нітропіридин (Схема 12) Суміш наявного на ринку 2,6-дихлор-3нітропіридину (10,0 г; 51,8 ммоль) та 33% (мас.) НВr/АсОН (120 мл) нагрівають при 80°С протягом 3 год. Розчин концентрують у вакуумі, одержаний залишок розчиняють у EtOAc та промивають насиченим водним розчином бікарбонату натрію. Органічну фазу сушать над сульфатом натрію та концентрують у вакуумі. Одержаний продукт 14,4 г (99%) використовують без додаткового очищення (Проміжна сполука 6). GC/MC: чистота 94%, tR=7,56 хв (tR(SM)=6,93 хв), m/z (C5H2Br2N2) 280/282/284 (Μ, 38), 222/224/226 (35), 76 (100), система Finnegan LCQ. Проміжна сполука 7.1: N-(5-бром-2нітрофеніл)-N-феніламін (Схема 12) Вказану в заголовку сполуку одержують із 2,6дибром-3-нітропіридину (Проміжна сполука 6) та аніліну (вихід 95%) за загальною методикою І (Проміжна сполука 7.1). GC/MC: чистота 99%, tR=9,28 хв (tR(SM: нітропіридин)=7,62 хв), m/z 293/295 (Μ, 12), 168 (25), 140 (25), 77 (100), система Finnegan LCQ. 88314 44 Проміжна сполука 7.2: 6-бром-N2фенілпіридин-2,3-діамін (Схема 12) Вказану в заголовку сполуку одержують з N-(5бром-2-нітрофеніл)-N-феніламіну (Проміжна сполука 7.1) (вихід 97%) за загальною методикою II. GC/MC: чистота 99%, tR=9,69 хв (tR(SM)=9,27 хв), m/z 263/265 (Μ, 45), 183 (19), 104 (18), 92 (23), 77 (42), система Finnegan LCQ. Проміжна сполука 7.3: 5-бром-3-феніл-3Hімідазо[4,5-b]піридин (Схема 12) Вказану в заголовку сполуку одержують із 6бром-N2-фенілпіридин-2,3-діаміну (Проміжна сполука 7.2) (вихід 71%) за загальною методикою III. GC/MC: чистота 99%, tR=9,23 хв (tR(SM)=9,72 хв), m/z 273/275 (Μ, 55), 194 (36), 167 (30), 77 (100), система Finnegan LCQ. Проміжна сполука 7.4: 3-феніл-5-вініл-3Hімідазо[4,5-b]піридин (Схема 12) Вказану в заголовку сполуку одержують із 5бром-3-феніл-3H-імідазо[4,5-b]піридину (Проміжна сполука 7.3) (вихід 92%) за загальною методикою IV. GC/MC: чистота 97%, tR=8,94 хв (tR(SM)=9,23 хв), m/z 221 (Μ, 100), 77 (58), система Finnegan LCQ. Проміжна сполука 7.5: 3-феніл-3H-імідазо[4.5b]піридин-5-карбальдегід (Схема 13) Вказану в заголовку сполуку одержують із 3феніл-5-вініл-3H-імідазо[4,5-b]піридину (Проміжна сполука 7.4) (вихід 36%) за загальною методикою V. GC/MC: чистота 97%, tR=9,20 хв (tR(SM)=9,04 хв), m/z 223 (Μ, 55), 195 (63), 77 (100), система Finnegan LCQ. Проміжна сполука 8.1: N-(5-бром-2нітрофеніл)-N-(3,5-диметокси-феніл)амін (Схема 12) Вказану в заголовку сполуку одержують із наявного на ринку 2,6-дибром-3-нітропіридину та 3,5диметоксіаніліну (вихід 85%) за загальною методикою І. РХВЕ (протягом 10 хв 10-85% MeCN/100 45 мМ водн. NaOAc): чистота 98%, tR=10,12хв (tR(SM:нітропіридин)=7,98 хв). GC/MC: чистота 99%, tR=10,88 хв (tR(SM:нітропіридин) =7,50 хв), m/z 253/255 (Μ, 100), 228 (72), 122 (41), 77 (53), система Finnegan LCQ. 1H-ЯМР (400 МГц, DMSO-d6): δ 10,04 (s, 1H), 8,42 (d, 1H), 7,19 (d, 1H), 6,94 (s, 2H), 6,33 (s, 1H), 3,76 (s, 6H) млн.-1. Проміжна сполука 8.2; 6-бром-N2-(3,5диметоксифеніл)піридин-2,3-діамін (Схема 12) Вказану в заголовку сполуку одержують із N(5-бром-2-нітрофеніл)-N-(3,5диметоксифеніл)аміну (Проміжна сполука 8.1) (вихід 93%), використовуючи загальну методику ll. РХВЕ (протягом 10 хв 10-85% MeCN/100мМ водн. NaOAc): чистота 96%, tR=8,38 хв (tR(SM)=10,12 хв). GC/MC: чистота 97%, tR=11,47xв (tR(SM)=10,15 хв), m/z 323/325 (Μ, 100), 310/308 (33), 292/294 (39), система Finnegan LCQ. Проміжна сполука 8.3: 5-бром-3-(3,5диметоксифеніл)-3H-імідазо[4.5-b]піридин (Схема 12) Вказану в заголовку сполуку одержують із 6бром-N2-(3,5-диметоксифеніл)піридин-2,3-діаміну (Проміжна сполука 8.2) (вихід 43%) за загальною методикою III. РХВЕ (протягом 10 хв 10-85% MeCN/100 мМ водн. NaOAc): чистота 98%, tR=8,51 хв (tR(SM)=8,40 хв). GC/MC: чистота 98%, tR=10,56 хв (tR(SM)=11,47 хв), m/z333/335 (Μ, 79), 207 (100), система Finnegan LCQ. Проміжна сполука 8.4: 3-(3,5-диметоксифеніл)5-вініл-3H-імідазо[4,5-b] піридин (Схема 12) Вказану в заголовку сполуку одержують із 5бром-3-(3,5-диметоксифеніл)-3H-імідазо[4,5b]піридину (Проміжна сполука 8.3) (вихід 57%) за загальною методикою IV. РХВЕ (протягом 10 хв 10-85% MeCN/100мМ водн. NaOAc): чистота 99%, tR=8,39 хв (tR(SM)=8,51 хв). GC/MC: чистота 99%, tR=10,36 хв (tR(SM)= 10,56 хв), m/z 281 (Μ, 100), система Finnegan LCQ. 88314 46 Проміжна сполука 8.5: 3-(3,5-диметоксифеніл)3H-імідазо[4,5-b]піридин-5-карбальдегід (Схема 13) Вказану в заголовку сполуку одержують із 3(3,5-диметоксифеніл)-5-вініл-3Н-імідазо[4,5b]піридину (Проміжна сполука 8.4) (вихід 56%) за загальною методикою V. РХВЕ (протягом 10 хв 1085% MeCN/100 мМ водн. NaOAc): чистота 98%, tR=7,26 хв (tR(SM)=8,39 хв). GC/MC: чистота 99%, tR=10,32 хв (tR(SM)=10,36 хв), m/z 283 (Μ, 100), система Finnegan LCQ. Проміжна сполука 9.1: Трет-бутил-5-[(5-бром2-нітрофеніл)аміно]-індолін-1-карбоксилат (Схема 12) Вказану в заголовку сполуку одержують із 2,6дибром-3-нітропіридину та трет-бутил-5аміноіндолін-1-карбоксилату (одержаного з наявного на ринку 5-нітроіндоліну шляхом введення захисної групи N-Boc та подальшого відновлення нітрогрупи доданням Н2/Рd/С у MeOH/EtOAc) (вихід 97%) за загальною методикою І. РХВЕ (протягом 10 хв 10-85% MeCN/0,1% TFA/H2O): чистота 99%, tR= 10,35 хв (tR(SM:нітропіридин)=6,79 хв). 1H-ЯМР (400 МГц, CDCl3): δ 10,16 (s, 1H), 8,31 (d, 1H), 7,86 (br s, 0,4H), 7,49 (s, 1H), 7,45 (br s, 0,6H), 7,31 (d, 1H), 6,92 (d, 1H), 4,03 (br t, 2H), 3,14 (t, 2H), 1,56 (s, 9H) млн.-1. MC (ESI) m/z (C18H19O4BrN4) 435,2/437,1 (M+1, 100), система Finnegan LCQ. Проміжна сполука 9.2: Трет-бутил-5-[(3-аміно6-бромпіридин-2-іл)аміно]індолін-1-карбоксилат (Схема 12) Вказану в заголовку сполуку одержують із трет-бутил-5-[(5-бром-2-нітрофеніл)аміно]індолін1-карбоксилату (Проміжна сполука 9.1) (вихід 96%) за загальною методикою II. РХВЕ (протягом 10 хв 10-85% MeCN/100 мМ водн. NaOAc): чистота 98%, tR=9,86 хв (tR(SM)=11,66 хв). МС (ESI) m/z (C18H21BrN4O2) 405,1/407,0 (M+1, 100), 349,1/351,1 (82), система Finnegan LCQ. 47 Проміжна сполука 9.3: Трет-бутил-5-(5-бром3Н-імідазо[4,5-b]піридин-3-іл)індолін-1-карбоксилат (Схема 12) Вказану в заголовку сполуку одержують із трет-бутил-5-[(3-аміно-6-бромпіридин-2іл)аміно]індолін-1-карбоксилату (Проміжна сполука 9.2) (вихід 91%) за загальною методикою III. РХВЕ (протягом 10 хв 10-85% MeCN/100 мМ водн. NaOAc): чистота 97%, tR= 10,08 хв (tR(SM)=9,85 хв). МС (ESI) m/z (C19H19BrN4O2) 415,0/416,9 (M+1, 91), 359,1/361,0 (100), 315,1/317,2 (51), система Finnegan LCQ. Проміжна сполука 9.4: Трет-бутил-5-(5-вініл3Н-імідазо[4,5-b]піридин-3-іл)індолін-1-карбоксилат (Схема 12) Вказану в заголовку сполуку одержують із трет-бутил-5-(5-бром-3Н-імідазо[4,5-b]піридин-3іл)індолін-1-карбоксилату (Проміжна сполука 9.3) (вихід 94%) за загальною методикою IV. РХВЕ (протягом 10 хв 10-85% MeCN/0,1% TFA/H2O): чистота 96%, tR=7,21 хв (tR(SM)=8,51 хв). 1Н-ЯМР (400 МГц, CDCl3) δ 8,21 (s, 1H), 8,04 (d, 1H), 7,98 (br s, 0,5H), 7,56 (s, 1H), 7,55 (br s, 0,5H), 7,48 (d, 1H), 7,35 (d, 1H), 6,89 (dd, 1H), 6,19 (d, 1H), 5,42 (d, 1H), 4,05 (t, 2H), 3,18 (t, 2H), 1,55 (s, 9H) млн.-1. Проміжна сполука 9.5: Трет-бутил-5-(5форміл-3Н-імідазо[4,5-b]піридин-3-іл)індолін-1карбоксилат (Схема 13) Вказану в заголовку сполуку одержують із трет-бутил-5-(5-вініл-3Н-імідазо[4,5- b]піридин-3іл)індолін-1-карбоксилату (Проміжна сполука 9.4) (вихід 69%) за загальною методикою V. РХВЕ (протягом 10 хв 10-85% MeCN/0,1% TFA/H2O): чистота 96%, tR=7,31 хв (tR(SM)=7,21 хв). 88314 48 Проміжна сполука 10.1: 3-(2,3-дигідро-1Ніндол-5-іл)-5-вініл-3Н-імідазо[4,5- b]піридин (Схема 12) Суміш трет-бутил-5-(5-вініл-3Н-імідазо[4,5b]піридин-3-іл)індолін-1-карбоксилату (Проміжна сполука 9.4) (9,50 г, 26,21 ммоль), 4 Μ розчину НСІ у 1,4-діоксані (200 мкл), 2-пропанолу (30 мкл) та діоксану (50 мкл) перемішують протягом 1,5 год при температурі навколишнього середовища. Суміш концентрують досуха, одержуючи 9,50 г (вихід 98%) тригідрохлориду відповідного вільного аміну. РХВЕ (протягом 10 хв 10-85% MeCN/100 мМ водн. NaOAc): чистота 99%, tR=6,64 хв (tR(SM)=10,06 хв). 1 Η-ΗΜΡ (400 МГц, метанол-d4) δ 9,97 (s, 1Н), 8,34 (d, 1H), 8,12 (d, 1H), 8,04 (d, 1H), 7,85 (d, 1H), 7,82 (d, 1H), 7,63 (m, 1H), 7,54 (m, 1H), 6,98 (dd, 1H), 6,37 (d, 1H), 5,63 (d, 1H), 4,02 (t, 2H), 3,52 (t, 2H) млн.-1. MC (ESI) m/z (C16H14N4) 263,2 (M+1, 100), 219,2 (32), система Finnegan LCQ. Проміжна сполука 10.2: 3-(1-ацетил-2,3дигідро-1H-індол-5-іл)-5-вініл-3H-імідазо[4,5-b] піридин (Схема 12) Суміш 3-(2,3-дигідро-1H-індол-5-іл)-5-вініл-3Hімідазо[4,5- b]піридину (Проміжна сполука 10.1) (150,0 мг, 0,57 ммоль), льодяної оцтової кислоти (39,3 мкл, 0,69 ммоль), гідрохлориду N-етил-N’-(3диметиламінопропіл)-карбодііміду (175,4 мг, 0,91 ммоль), 4-диметиламінопіридину (419,2 мг, 3,43 ммоль) та дихлорметану (10 мкл) перемішують протягом 24 год при температурі навколишнього середовища. Суміш послідовно екстрагують насиченим водним розчином хлориду амонію та насиченим водним розчином бікарбонату натрію. Органічний шар сушать над сульфатом натрію та концентрують у вакуумі, одержуючи 139,1 мг (80%) відповідного аміду. РХВЕ (протягом 10 хв 10-85% MeCN/100 мМ водн. NaOAc): чистота 99%, tR=6,43 хв (tR(SM)=6,64 хв). GC/MC: чистота 96%, tR=13,98 хв, m/z 304 (Μ, 58), 262 (100), 207 (62), система Finnegan LCQ. Проміжна сполука 10.3: 3-(1-ацетил-2,3дигідро-1Н-індол-5-іл)-3Н-імідазо[4,5-b]піридин-5карбальдегід (Схема 13) Вказану в заголовку сполуку одержують із 3-(1ацетил-2,3-дигідро-1Н-індол-5-іл)-5-вініл-3Німідазо[4,5- b]піридину (Проміжна сполука 10.2) (вихід 44%) за загальною методикою V. РХВЕ (протягом 10 хв 10-85% MeCN/100 мМ водн. NaOAc): чистота 95%, tR=5,38 хв (tR(SM)=6,43 хв). 49 GC/MC: tR= 14,98 хв (tR(SM)=13,98 хв), m/z 306 (Μ, 60), 264 (100), система Finnegan LCQ. Проміжна сполука 11.1: N,N-диметил-N-{4оксо-4-[5-(5-вініл-3H-імідазо[4,5-b]піридин-3-іл)-2.3дигідро-1Н-індол-1-іл]бутил}амін (Схема 12) Суміш 3-(2,3-дигідро-1Н-індол-5-іл)-5-вініл-3Німідазо[4,5-6]піридину (48,0 мг, 0,14 ммоль) (Проміжна сполука 10.1), гідрохлориду 4(диметиламіно)-масляної кислоти (36,3 мг, 0,21 ммоль), гідрохлориду N-етил-N’-(3-диметиламінопропіл)карбодііміду (54,9 мг, 0,29 ммоль), 4диметиламінопіридину (122,5 мг, 1,00 ммоль) та дихлорметану (8 мкл) перемішують протягом 24 год при температурі навколишнього середовища. Суміш послідовно екстрагують насиченим водним розчином хлориду амонію та насиченим водним розчином бікарбонату натрію. Органічний шар сушать над сульфатом натрію та концентрують у вакуумі, одержуючи 50,4 мг (94%) відповідного аміду. РХВЕ (протягом 10 хв 10-85% MeCN/100 мМ водн. NaOAc): чистота 92%, tR=6,27 хв (tR(SM)=6,61 хв). Проміжна сполука 11.2: 3-{1-[4(диметиламіно)бутаноїл]-2.3-дигідро-1Н-індол-5іл}-3Н-імідазо[4,5-b]тридин-5-карбальдегід (Схема 13) Вказану в заголовку сполуку одержують із N,N’-диметил-N-{4-оксо-4-[5-(5-вініл-3H-імідазо[4,5b] піридин- 3-іл) -2,3 -дигідро-1H-індол-1-іл] бутил}аміну (Проміжна сполука 11.1) (вихід 45%) за загальною методикою V. РХВЕ (протягом 10 хв 10-85% MeCN/100 мМ водн. NaOAc): чистота 94%, tR=5,02 хв (tR(SM)=6,27 хв). Проміжна сполука 12.1: 3-[1-(метилсульфоніл)2,3-дигідро-1H-індол-5-іл]-5-вініл-3H-імідазо[4,5b]піридин (Схема 12) Розчин 3-(2,3-дигідро-1Н-індол-5-іл)-5-вініл-3Німідазо[4,5-b]піридину (2,53 г, 9,64 ммоль) (Проміжна сполука 10.1), метансульфонілхлориду (1,12 88314 50 мкл, 14,47 ммоль) та триетиламіну (2,94 мкл, 21,22 ммоль) у дихлорметані (50 мкл) перемішують протягом 30 хв при температурі навколишнього середовища. Суміш послідовно екстрагують насиченим водним розчином хлориду амонію та насиченим водним розчином бікарбонату натрію. Органічний шар сушать над сульфатом натрію та концентрують у вакуумі, одержуючи 3,24 г (99%) відповідного сульфонаміду. РХВЕ (протягом 10 хв 10-85% MeCN/100 мМ водн. NaOAc): чистота 92%, tR=7,16 хв (tR(SM)=6,64 хв). МС (ESI) m/z (C17H16N4O2S) 341,1 (M+1, 100), система Finnegan LCQ. Проміжна сполука 12.2: 3-[1-(метилсульфоніл)2,3-дигідро-1Н-індол-5-іл]-3Н-імідазо[4,5-b]піридин5-карбальдегід (Схема 13) Вказану в заголовку сполуку одержують із 3-[1(метилсульфоніл)-2,3-дигідро-1Н-індол-5-іл]-5вініл-3Н-імідазо[4,5-b]піридину (Проміжна сполука 12.1) (вихід 60%) за загальною методикою V. РХВЕ (протягом 10 хв 10-85% MeCN/100 мМ водн. NaOAc): чистота 98%, tR=6,13 хв (tR(SM)=7,16 хв). Проміжна сполука 13.1: 3-{1[(хлорметил)сульфоніл]-2,3-дигідро-1H-індол-5-іл}5-вініл-3Н-імідазо[4,5-b]піридин (Схема 12) Розчин 3-(2,3-дигідро-1H-індол-5-іл)-5-вініл-3Німідазо[4,5-b]піридину (2,57 г, 9,80 ммоль) (Проміжна сполука 10.1), хлорметансульфонілхлориду (2,00 мкл, 19,59 ммоль) та N,N’діізопропілетиламіну (11,98 мкл, 68,58 ммоль) у дихлорметані (100 мкл) перемішують протягом 20 хв при температурі навколишнього середовища. Суміш послідовно екстрагують насиченим водним розчином хлорид амонію та насиченим водним розчином бікарбонату натрію. Органічний шар сушать над сульфатом натрію та концентрують у вакуумі, одержуючи 3,61 г (98%) відповідного сульфонаміду. РХВЕ (протягом 10 хв 10-85% MeCN/100 мМ водн. NaOAc): чистота 92%, tR=8,05 хв (tR(SM)=6,64 хв). 1Н-ЯМР (400 МГц, DMSO-d6) δ 9,03 (s, 1H), 8,22 (d, 1H), 7,85 (s, 1H), 7,79 (d, 1H), 7,56 (m, 2H), 6,93 (dd, 1H), 6,25 (d, 1H), 5,50 (d, 1H), 5,41 (s, 2H), 4,21 (t, 2H), 3,28 (t, 2H) млн-1. MC (ESI) m/z (C17H15ClN4O2S) 375,0 (M+1, 100), система Finnegan LCQ. 51 Проміжна сполука 13.2: 3-{1[(хлорметил)сульфоніл]-2,3-дигідро-1H-індол-5-іл}3H-імідазо[4,5-b]- піридин-5-карбальдегід (Схема 13) Вказану в заголовку сполуку одержують із 3-{1[(хлорметил)сульфоніл]-2,3-дигідро-1Н-індол-5-іл}5-вініл-3Н-імідазо[4,5-b]піридину (Проміжна сполука 13.1) (вихід 86%) за загальною методикою V. РХВЕ (протягом 10 хв 10-85% MeCN/100 мМ водн. NaOAc): чистота 97%, tR=7,03 хв (tR(SM)=8,05 хв). MC (ESI) m/z (C16H13ClN4O3S) 377,0 (M+1, 100), система Finnegan LCQ. Проміжна сполука 14.1: 3-{1-[(3хлорпропіл)сульфоніл]-2,3-дигідро-1H-індол-5-іл}5-вініл-3H-імідазо[4,5-b]піридин (Схема 12) Розчин 3-(2,3-дигідро-1H-індол-5-іл)-5-вініл-3Німідазо[4,5-b]піридину (270 мг, 1,03 ммоль) (Проміжна сполука 10.1), 3хлорпропансульфонілхлориду (0,25 мкл, 2,06 ммоль) та N,N’-діізопропілетиламіну (1,08 мкл, 6,18 ммоль) у дихлорметані (15 мкл) перемішують протягом 10 хв при температурі навколишнього середовища. Суміш послідовно екстрагують насиченим водним розчином хлориду амонію та насиченим водним розчином бікарбонату натрію. Органічний шар сушать над сульфатом натрію та концентрують у вакуумі, одержуючи 351 мг (85%) відповідного сульфонаміду. РХВЕ (протягом 10 хв 10-85% MeCN/100 мМ водн. NaOAc): чистота 92%, tR=8,44 хв (tR(SM)=6,59 хв). МС (ESI) m/z (C19H19ClN4O2S) 403,0 (Μ, 100), 294,9 (65), система Finnegan LCQ. Проміжна сполука 14.2: 3-{1-[(3-морфолін-4ілпропіл)сульфонал]-2,3-дигідро-1H-індол-5-іл}-5вініл-3H-імідазо[4,5-b]піридин (Схема 12) Суміш 3-{1-[(3-хлорпропіл)сульфоніл]-2,3дигідро-1H-індол-5-іл}-5-вініл-3Н-імідазо[4,5b]піридину (Проміжна сполука 14,1) (351 мг, 0.87 ммоль), морфоліну (0,46 мкл, 5,23 ммоль), йодиду 88314 52 калію (144,6 мг, 0,87 ммоль) та N,N’диметилформаміду (10 мкл) перемішують протягом 24 год при температурі навколишнього середовища. Суміш екстрагують насиченим водним розчином хлориду амонію, і органічний шар сушать над сульфатом натрію. Після концентрування у вакуумі одержують 382 мг (97%) відповідної морфолінової сполуки. РХВЕ (протягом 10 хв 1085% MeCN/100 мМ водн. NaOAc): чистота 91%, tR=8,44 хв (tR(SM)=8,44 хв). 1H-ЯМР (400 МГц, CDCl3) δ 8,32 (s, 1H), 8,09 (d, 1H), 7,68 (s, 1H), 7,55 (m, 2H), 7,41 (d, 1H), 6,90 (dd, 1H), 6,22 (d, 1H), 5,48 (d, 1H), 4,14 (t, 2H), 3,70 (m, 4H), 3,40-3,18 (m, 8H), 2,36 (m, 2H) млн-1. МС (ESI) m/z (C23H27N5O3S) 454,0 (M, 10), система Finnegan LCQ. Проміжна сполука 14.3: 3-{1-[(3-морфолін-4ілпропіл)сульфоніл]-2,3-дигідро-1Н-індол-5-іл}-3Німідазо[4,5-b]піридин-5-карбальдегід (Схема 13) Вказану в заголовку сполуку одержують із 3-{1[(3-морфолін-4-ілпропіл)сульфоніл]-2,3-дигідро1H-індол-5-іл}-5-вініл-3H-імідазо[4,5-b]піридину (Проміжна сполука 14.2) (вихід 82%) за загальною методикою V. РХВЕ (протягом 10 хв 10-85% MeCN/100 мМ водн. NaOAc): tR=7,55 хв (tR(SM)=8,44 хв). МС (ESI) m/z (C22H25N5O4S) 456,1 (М+1, 100), система Finnegan LCQ. Проміжна сполука 15.1: Трет-бутил-6-[(5-бром2-нітрофеніл)аміно]-індолін-1-карбоксилат (Схема 12) Вказану в заголовку сполуку одержують із 2,6дибром-3-нітропіридину та трет-бутил-6аміноіндолін-1-карбоксилату (одержаного з наявного на ринку 6-нітроіндоліну шляхом введення захисної групи N-Boc та подальшого відновлення нітрогрупи доданням H2/Pd/C у MeOH/EtOAc) (вихід 51%) за загальною методикою І. РХВЕ (протягом 10 хв 10-85% MeCN/0,1% TFA/H2O): чистота 99%, tR= 10,45 хв (tR(SM:нітропіридин)=7,98 хв). МС (ESI) m/z (C18H19O4BrN4) 435,2/437,1 (М+1, 100), система Finnegan LCQ. 53 Проміжна сполука 15.2: Трет-бутил-6-[(3аміно-6-бромпіридин-2-іл)аміно]індолін-1карбоксилат (Схема 12) Вказану в заголовку сполуку одержують з трет-бутил-6-[(5-бром-2-нітрофеніл)аміно]індолін1-карбоксилату (Проміжна сполука 15.1) (вихід 98%) за загальною методикою II. РХВЕ (протягом 10 хв 10-85% MeCN/100 мМ водн. NaOAc): чистота 99%, tR=9,72 хв (tR(SM)=11,38 хв). МС (ESI) m/z (C18H21BrN4O2) 426,8/428,9 (M+Na+, 87), 405,1/407,0 (М+Н+, 23), 349,1/351,0 (100), 305,1/307,1 (56), система Finnegan LCQ. Проміжна сполука 15.3: Трет-бутил-6-(5-бром3Н-імідазо[4,5-b]піридин-3-іл)індолін-1-карбоксилат (Схема 12) Вказану в заголовку сполуку одержують із трет-бутил-6-[(3-аміно-6-бромпіридин-2іл)аміно]індолін-1-карбоксилату (Проміжна сполука 15.2) (вихід 76%) за загальною методикою III. РХВЕ (протягом 10 хв 10-85% MeCN/100мМ водн. NaOAc): чистота 99%, tR=9,78 хв (tR(SM)=9,72 хв). МС (ESI) m/z (C19H19BrN4O2) 415,0/416,9 (M+1, 74), 359,1/361,0 (100), 315,1/317,2 (51), система Finnegan LCQ. Проміжна сполука 15.4: Трет-бутил-6-(5-вініл3Н-імідазо[4,5-b]піридин-3-іл)індолін-1-карбоксилат (Схема 12) Вказану в заголовку сполуку одержують із трет-бутил-6-(5-бром-3Н-імідазо[4,5-b]піридин-3іл)індолін-1-карбоксилату (Проміжна сполука 15.3) (вихід 69%) за загальною методикою IV. РХВЕ (протягом 10 хв 10-85% MeCN/100мМ водн. NaOAc): чистота 99%, tR=9,76 хв (tR(SM)=9,78 хв). МС (ESI) m/z (C21H21N4O2) 363,0 (М+1, 100), 307,0 (92), система Finnegan LCQ. Проміжна сполука 15.5: Трет-бутил-6-(5форміл-3Н-імідазо[4,5-b]піридин-3-іл)індолін-1карбоксилат (Схема 13) Вказану в заголовку сполуку одержують із трет-бутил-6-(5-вініл-3Н-імідазо[4,5- b]піридин-3іл)індолін-1-карбоксилату (Проміжна сполука 15.4) (вихід 95%) за загальною методикою V. РХВЕ (протягом 10 хв 10-85% MeCN/100 мМ водн. NaOAc): чистота 88%, tR=8,61 хв (tR(SM)=9,76 хв). МС (ESI) m/z (C20H20N4O3) 365,1 (М+1, 100), система Finnegan LCQ. 88314 54 Проміжна сполука 16.1: 3-(2,3-дигідро-1Ніндол-6-іл)-5-вініл-3Н-імідазо[4,5-b]піридин (Схема 12) Суміш трет-бутил-6-(5-вініл-3Н-імідазо[4,5b]піридин-3-іл)індолін-1-карбоксилату (4,90 г, 13,52 ммоль) (Проміжна сполука 15.3), 4 Μ розчину НСl у 1,4-діоксані (200 мкл), 2-пропанолу (30 мкл) та діоксану (50 мкл) перемішують протягом 1 год при температурі навколишнього середовища. Суміш концентрують досуха, одержуючи 4,00 г (99% вихід) моногідрохлориду відповідного вільного аміну. РХВЕ (протягом 10 хв 10-85% MeCN/100 мМ водн. NaOAc): чистота 99%, tR=7,06 хв (tR(SM)=9,78 хв). МС (ESI) m/z (C16H14N4) 263,3 (М+1, 100), система Finnegan LCQ. Проміжна сполука 16.2: 3-[1-(метилсульфоніл)2,3-дигідро-1Н-індол-6-іл]-5-вініл-3H-імідазо[4,5b]піридин (Схема 12) Розчин 3-(2,3-дигідро-1H-індол-6-іл)-5-вініл-3Hімідазо[4,5-b]піридину (Проміжна сполука 16.1) (1,10 г, 4,19 ммоль), метансульфонілхлориду (0,65 мкл, 8,39 ммоль) та триетиламіну (3,49 мкл, 25,16 ммоль) у дихлорметані (50 мкл) перемішують протягом 15 хв при температурі навколишнього середовища. Суміш послідовно екстрагують насиченим водним розчином хлориду амонію та насиченим водним розчином бікарбонату натрію. Органічний шар сушать над сульфатом натрію та концентрують у вакуумі, одержуючи 1,40 г (98%) відповідного сульфонаміду. РХВЕ (протягом 10 хв 10-85% MeCN/100 мМ водн. NaOAc): чистота 99%, tR=7,03 хв (tR(SM)=7,06 хв). МС (ESI) m/z (C17H16N4O2S) 341,0 (M+1, 100), система Finnegan LCQ. Проміжна сполука 16.3: 3-[1-(метилсульфоніл)2.3-дигідро-1Н-індол-6-іл]-3Н-імідазо[4,5-b]піридин5-карбальдегід (Схема 13) Вказану в заголовку сполуку одержують із 3-[1(метилсульфоніл)-2,3-дигідро-1Н-індол-6-іл]-5вініл-3Н-імідазо[4,5- b]піридину (Проміжна сполука 16.2) (вихід 99%) за загальною методикою V. РХВЕ (протягом 10 хв 10-85% MeCN/100 мМ водн. NaOAc): чистота 93%, tR=6,09 хв (tR(SM)=7,03 хв). МС (ESI) m/z (C16H14N4O3S) 343,0 (M+1, 100), система Finnegan LCQ. 55 Приклад 1: Калієва сіль (5Z)-5-{[4-(1піперидиніл)піридо[3,2-d]піримідин-6-іл]метилен}1.3-тіазолідин-2,4-діону (1) (Схема 2) Суміш 2,4-тіазолідиндіону (3,4 г; 29,1 ммоль; 1,80 екв.) та піролідину (269,80 мкл; 3,2 ммоль; 0,2 екв.) у МеОН (50 мл) нагрівали до 70°С. Повільно додавали розчин 4-(1-піперидиніл)піридо[3,2d]піримідин-6-карбальдегіду (Проміжна сполука 1.7) (3,9 г; 16,2 ммоль; 1 екв.) у МеОН (50 мл) протягом 1,5 год при 70°С. Через 2 год нагрівання зі зворотним холодильником після додавання, реакція завершувалася. Утворювався осад. Гарячу реакційну суміш фільтрували, і тверду речовину промивали холодним МеОН, одержуючи (5Z)-5-{[4-(1піперидиніл)піридо[3,2-d]піримідин-6-іл]метилен}1,3-тіазолідин-2,4-діон (1) (2,70 г; 48%) у вигляді оранжевого порошку (чистота за даними РХВЕ 98%). (5Z)-5-{[4-(1-піперидиніл)піридо[3,2d]піримідин-6-іл]метилен}-1,3-тіазолідин-2,4-діон (2,7 г; 8,1 ммоль; 1 екв.) суспендували у THF (80 мл) та воді (80 мл). Додавали гідроксид калію (16,2 мл; 0,50 М; 8,1 ммоль; 1 екв.), розчин фільтрували через вату та промивали водою. Після ліофілізування одержували калієву сіль (5Z)-5-{[4-(1піперидиніл)піридо[3,2-d]піримідин-6-іл]метилен}1,3-тіазолідин-2,4-діону (1) (3,06 г, 98%) у вигляді жовтої твердої речовини (чистота за даними РХВЕ 99,36%). Кількість: 3,06 г; вихід: 99%; температура плавлення: 319°С; формула: C16H14O2SN5×K; ІЧ (без розчинника) ν 3355,1, 2932,9, 2852,7, 1674,1, 1519,6 см-1; 1H ЯМР (DMSO-d6) δ 1,68 (s1, 6H), 4,34 (s1, 4Н), 7,44 (s, 1H), 7,93 (d, J=9 Гц, 1Н), 8,04 (d, J=9 Гц, 1Н), 8,45 (s, 1H); PXBE (H2O TFA 0,1% ACN TFA 0,05%): Rt (хв); площа піка, %: 2,07; 99,10; PX-MC: M/Z ESI: Rt (хв) 1,36; 342,04 (M+1); 340,08 (M-1). Приклад 2: Калієва сіль (5Z)-5-{[4-(4-фтор-1піперидиніл)піридо[3,2-d]піримідин-6-іл]метилен}1,3-тіазолідин-2,4-діону (2) (Схема 2) Вказану в заголовку сполуку одержували за загальною методикою, описаною для Прикладу 1, використовуючи Проміжну сполуку 2.1, 4-(4-фторпіперидин-1-іл)-піридо[3,2-d]піримідин-6карбальдегід. Після ліофілізування одержували калієву сіль (5Z)-5-{[4-(4-фтор-1піперидиніл)піридо[3,2-d]пipимiдин-6-iл]мeтилeн} 88314 56 1,3-тiaзoлiдин-2,4-дioнy (2) у вигляді оранжевої твердої речовини (чистота за даними РХВЕ 98,8%); формула: C16H13FO2SN5×K; 1H ЯМР (DMSO-d6) δ 1,86 (m, 2Н), 2,07 (m, 2Н), 4,39 (m, 4Н), 5,00 (m, 1H), 7,44 (s, 1H), 7,97 (d, J=9 Гц, 1H), 8,07 (d, J=9 Гц, 1H), 8,50 (s, 1H); PXBE (H2O TFA 0,1% - ACN TFA 0,05%): Rt (хв); площа піка, %: 1,92; 98,76; PX-MC: M/Z ESI: Rt (хв) 1,27; 360,07 (M+1); 358,07 (M-1). Приклад 3: Калієва сіль (5Z)-5-({4-[4(трифторметил)-1-піперидиніл]-піридо[3,2b]піриміпин-6-іл}метилен)-1,3-тіазолідин-2,4-діону (3) (Схема 2) Вказану в заголовку сполуку одержували за загальною методикою, описаною для Прикладу 1, використовуючи Проміжну сполуку 3.1, 4-(4(тpифтopмeтил)-піпepидин-1-iл)-пipидo[3,2d]пipимiдин-6-кapбaльдeгiд. Після ліофілізування одержували калієву сіль (5Z)-5-({4-[4(трифторметил)-1-піперидиніл]піридо[3,2b]піримідин-6-іл}метилен)-1,3-тіазолідин-2,4-діону (3) у вигляді оранжевої твердої речовини (чистота за даними РХВЕ 99,5%); формула: C17H13O2SF3N5 K; 1H ЯМР (DMSO-d6) δ 1,39 (m, 2H), 1,76 (m, 2H), 2,59 (m, 1H), 3,05 (m, 2H), 5,44 (m, 2H), 7,24 (s, 1H), 7,76 (d, J=9 Гц, 1Н), 7,87 (d, J=9 Гц, 1H), 8,30 (s, 1H); PXBE (H2O TFA 0,1% - ACN TFA 0,05%): Rt (хв); площа піка, %: 2,44; 99,47; PX-MC: M/Z ESI: Rt (хв) 1,55; 410,09 (M+1); 408,09 (M-1). Приклад 4: 5-піридо[2,3-b]піразин-6-ілметилентіазолідин-2,4-діон (4) (Схема 3) Піридо[2,3-b]піразин-6-карбальдегід (Проміжна сполука 4.4) (300 мг, 1,89 ммоль, 1 екв.), 2,5тіазолідиндіон (397 мг, 3,4 ммоль, 1,8 екв.) та піролідин (0,03 мл, 0,38 ммоль, 0,2 екв.) нагрівали у метанолі (10 мл) протягом 3 год при 65°С. Після завершення реакції додавали воду (3 мл), відповідний коричневий осад відфільтровували, промивали метанолом, водою, після чого діетиловим ефіром, одержуючи 200 мг чистої очікуваної сполуки (4). З вільної основи (200 мг, 0,78 ммоль, 1 екв.) синтезували калієву сіль, використовуючи КОН (1 М, V=0,78 мл, 1 екв.), і одержували 231 мг 57 відповідної калієвої солі. Кількість: 231 мг (калієва сіль); вихід: 41%; Формула: C11H6O2SN4×K; чистота за даними РХВЕ: 98,7%; РХВЕ (Н2О TFA 0,1% ACN TFA 0,05%): Rt (хв); площа піка, %: 1,89 хв; 98,7%; 1H ЯМР (DMSO-d6) δ 9,09 (s, 1Н), 8,95 (s, 1H), 8,46 (d, 1H, J=8 Гц), 8,02 (d, 1H, J=8 Гц), 7,52 (s, 1H); PX-MC: M/Z ESI: Rt (хв) 0,76 хв, 259,07 (M+1). Приклад 5; 5-фуро[3,2-b]піридин-5-ілметилентіазолідин-2,4-діон (5) (Схема 4) Розчин 2-(триметилсиліл)фуро[3,2-b]піридин5-карбальдегіду (Проміжна сполука 5.2) (130 мг; 0,59 ммоль; 1 екв.), 2,4-тіазолідиндіону (125 мг; 1,07 ммоль; 1,8 екв.) та бета-аланіну (95 мг; 1,07 ммоль; 1,8 екв.) у оцтовій кислоті (2 мл) нагрівали при 100°С протягом 7 год. Додавали воду, і одержаний осад відфільтровували та промивали Et2O, одержуючи тверду речовину (чистота: 98,14%, вихід: 25%). Потім (5Z)-5-{[2-(триметилсиліл)фуро[3,2-b]піридин-5-іл]метилен}-1,3-тіазолідин2,4-діон (41 мг; 0,13 ммоль; 1 екв.) розчиняли у МеОН (5 мл). Додавали NaOH (5-н. водний розчин) (150,00 мкл). Розчин перемішували при кімнатній температурі. Через 24 год реакція завершувалася. Додавали АсОН (1 мл), і розчин випарювали у вакуумі. Додавали воду, і одержаний осад відфільтровували, промивали водою, Et2O та МеОН, одержуючи тверду речовину (5). З вільної основи (24 мг, 0,097 ммоль, 1 екв.) синтезували калієву сіль, використовуючи КОН (1М, V=0,097 мл, 1 екв.), і одержували 24 мг відповідної калієвої солі. Кількість: 24 мг (калієва сіль); вихід: 75%; формула: C11H6N2O3S×K; чистота за даними РХВЕ: 98,03%; РХВЕ (Н2О TFA 0.1% - ACN TFA 0,05%): Rt (хв); площа піка, %: 2,96 хв; 98,03%; 1H ЯМР (DMSO-d6) δ 8,30 (s, 1H), 8,00 (d, 1H, J=9 Гц), 7,51 (d, 1H, J=9 Гц), 7,37 (s, 1H), 7,13 (s, 1H); PX-MC: M/Z ESI: Rt (хв) 1,31 хв, 246,95 (M+1). Приклад 6: 5-[4-(4-фтор-піперидин-1-іл)піридо[3,2-d]піримідин-6-ілметилен]-2-тіоксотіазолідин-4-он (Схема 2) Вказану в заголовку сполуку одержували за загальною методикою, описаною для Прикладу 1, використовуючи роданін (замість тіазолідиндіону) 88314 58 та Проміжну сполуку 2.1, 4-(4-фтор-піперидин-1іл)-піридо[3,2-d]піримідин-6-карбальдегід. Після ліофілізуації одержували калієву сіль 5-[4-(4-фторпіпepидин-1-iл)-пipидo[3,2-d]пipимiдин-6iлмeтилeн]-2-тioкco-тiaзoлiдин-4-oнy (6) у вигляді оранжевої твердої речовини (чистота за даними РХВЕ 95,5%); формула: C16H13FOS2N5×K; 1Н ЯМР (DMSO-d6) δ 1,89 (m, 4H), 4,42 (m, 4H), 5,00 (m, 1Н), 7,29 (s, 1H), 8,07 (d, J=9 Гц, 2H), 8,52 (s, 1H); PXBE (H2O TFA 0.1% - ACN TFA 0,05%): Rt (хв); площа піка, %: 2,37 хв; 95,54%; PX-MC: M/Z ESI: Rt (хв) 1,38 хв; 376,11 (M+1); 374,11 (M-1). Приклад 7: (5Z)-5-[(3-феніл-3H-імідазо[4,5b]піридин-5-іл)метилен]-1,3-тіазолідин-2,4-діон (Схема 5) Вказану в заголовку сполуку одержували з 3феніл-3H-імідазо[4,5-b]піридин-5-карбальдегіду (вихід 55%) за загальною методикою, описаною для Прикладу 1. РХВЕ (протягом 10 хв 10-85% MeCN/100 мМ водн. NaOAc): чистота 96%, tR=4,95 хв. МС (ESI) m/z (C16H10N4O2S) 361,2 (М+К+, 100). 1H-ЯМР (JEOL 400 МГц, DMSO-d6): δ 8,97 (s, 1Η), 8,23 (d, 1H), 8,13 (d, 2H), 7,70-7,45 (m, 5H). Приклад 8: Одержання (5Z)-5-{[3-(3,5мметоксифеніл)-3H-імідазо[4,5-b]піридин-5іл]метилен}-1,3-тіазолідин-2,4-діону (Схема 5) Вказану в заголовку сполуку одержували з 3(3,5-даметоксифеніл)-3H-імідазо[4,5-b]піридин-5карбальдегіду (вихід 85%) за загальною методикою VI. РХВЕ (протягом 10 хв 10-85% MeCN/100 мМ водн. NaOAc): чистота 96%, tR=5,12 хв (tR(SM)=7,26 хв). 1H-ЯМР (JEOL 400 МГц, DMSO-d6): δ 8,90 (s, 1H), 8,16 (d, 1H), 7,58 (d, 1H), 7,41 (s, 1H), 7,24 (s, 2H), 6,60 (s, 1H), 3,87 (s, 6H). Приклад 9: Трет-бутил-5-{5-[(Z)-(2,4-діоксо-1,3тіазолідин-5-іліден)-метил]-3H-імідазо[4,5b]піридин-3-іл}індолін-1-карбоксилат (Схема 5) 59 Вказану в заголовку сполуку одержуювали з трет-бутил-5-(5-форміл-3Н-імідазо[4,5-b]піридин-3іл)індолін-1-карбоксилату (вихід 65%) за загальною методикою VI. РХВЕ (протягом 10 хв 10-85% MeCN/0,1% TFA/H2O): чистота 94%, tR=6,50 хв (tR(SM)=7,31 хв). 1H-ЯМР (JEOL 400 МГц, DMSO-d6) δ 8,89 (s, 1H), 8,17 (s, 1H), 8,12 (d, 1H), 7,92 (br s, 0,5H), 7,88 (s, 1H), 7,59 (br s, 0,5H), 7,58 (d, 1H), 7,28 (d, 1H), 4,06 (br t, 2H), 3,24 (t, 2H), 1,54 (s, 9H) млн-1. МС (ESI) m/z (C23H20N5O4S) 464,1 (M+1, 100), 408,1 (60), система Finnegan LCQ. Приклад 10: (5Z)-5-{[3-(2,3-дигідро-1H-індол-5іл)-3Н-імідазо[4,5-b]піридин-5-іл]метилен}-1,3тіазолідин-2,4-діон (Схема 5) Суміш трет-бутил-5-{5-[(Z)-(2,4-діоксо-1,3тіазолідин-5-іліден)метил]-3H-імідазо[4,5b]піридин-3-іл}івдолін-1-карбоксилату (35,0 мг, 75,5 ммоль) (Приклад 9), 4 Μ НСl у 1,4-діоксані (3 мкл) та 2-пропанолі (1 мкл) перемішували протягом 1,5 год при температурі навколишнього середовища. Суміш концентрували досуха, промивали водою та сушили у вакуумі, одержуючи 27,3 мг (вихід 89%) моногідрохлориду відповідного вільного аміну. РХВЕ (протягом 10 хв 10-85% MeCN/100 мМ водн. NaOAc): чистота 98%, tR=4,44 хв (tR(SM)=6,23 хв). 1 H-ЯМР (JEOL 400 МГц, DMSO-d6) δ 9,03 (s, 1H), 8,33 (d, 1H), 8,01 (s, 1H), 7,96 (s, 1H), 7,91 (d, 1H), 7,75 (d, 1H), 7,34 (d, 1H), 3,97 (br s, 4H), 3,74 (t, 2H), 3,22 (t, 2H) млн.-1. МС (ESI) m/z (C18H13N5O2S) 364,1 (M+1, 100), 329,2 (21), система Finnegan LCQ. Приклад 11: (5Z)-5-{[3-(1-ацетил-2,3-дигідро1H-індол-5-іл)-3H-імідазо[4,5-b]піридин-5іл]метилен}-1,3-тіазолідин-2,4-діон (Схема 5) Вказану в заголовку сполуку одержували із 3(1-ацетил-2,3-дигідро-1H-індол-5-іл)-3Hімідазо[4,5-b]піридин-5-карбальдегіду (проміжна сполука 10.3) (вихід 55%) за загальною методикою VI. РХВЕ (протягом 10 хв 10-85% MeCN/100мМ водн. NaOAc): чистота 99%, tR=4,46 хв (tR(SM)=5,38 хв). 1H-ЯМР (JEOL 400 МГц, DMSO-d6, 65°С) δ 12,23 (br s, 1H), 8,89 (s, 1H), 8,27 (d, 1H), 8,22 (br s, 1H), 7,93 (s, 1H), 7,90 (s, 1H), 7,83 (d, 1H), 7,70 (d, 1H), 4,23 (t, 2H), 3,29 (t, 2H), 2,23 (s, 3Н) млн.-1. МС 88314 60 (ESI) m/z (C20H15N5О3S) 406,3 (M+1, 100), система Finnegan LCQ. Приклад 12: (5Z)-5-[(3-{1-[4(диметиламіно)бутаноїл]-2,3-дигідро-1H-індол-5іл}-3H-імідазо[4,5-b]піридин-5-іл)метилен]-1,3тіазолідин-2,4-діон Вказану в заголовку сполуку одержували з 3{1-[4-(диметиламіно)бутаноїл]-2,3-дигідро-1Ніндол-5-іл}-3Н-імідазо[4,5-b]піридин-5карбальдегіду (проміжна сполука 11.2) (вихід 78%) за загальною методикою VI. РХВЕ (протягом 10 хв 10-85% MeCN/100 мМ водн. NaOAc): чистота 98%, tR=4,14 хв (tR(SM)=5,02 хв). 1Н-ЯМР (JEOL 400 МГц, DMSO-d6) δ 8,94 (s, 1H), 8,28 (d, 1H), 8,22 (d, 1H), 7,98 (s, 1H), 7,76 (br s, 3H), 4,23 (t, 2H), 3,45 (br s, mH), 3,31 (t, 2H), 2,71 (t, 2H), 2,59 (t, 2H), 2,52 (s, 6H), 1,88 (m, 2H) млн.-1. MC (ESI) m/z (C24H24N6O3S) 477,1 (M+1, 100), 432,2 (49), 272,3 (19), 260,4 (21), система Finnegan LCQ. Приклад 13: (5Z)-5-({3-[1-(метилсульфоніл)2,3-дигідро-1Н-індол-5-іл]-3Н-імідазо[4,5-b]піридин5-іл}метилен)-1,3-тіазолідин-2,4-діон (Схема 5) Вказану в заголовку сполуку одержували із 3[1-(метилсульфоніл)-2,3-дигідро-1Н-індол-5-іл]-3Німідазо[4,5-b]піридин-5-карбальдегіду (проміжна сполука 12.2) (вихід 62%) за загальною методикою VI. РХВЕ (протягом 10 хв 10-85% MeCN/100 мМ водн. NaOAc): чистота 99%, tR=4,80 хв (tR(SM)=6,13 хв). 1Н-ЯМР (JEOL 400 МГц, DMSO-d6) δ 8,97 (s, 1H), 8,32 (d, 1H), 7,96 (s, 2H), 7,87 (d, 1Н), 7,74 (d, 1H), 7,45 (d, 1H), 4,09 (t, 2H), 3,28 (t, 2H), 3,10 (s, 3H) млн-1. MC (ESI) m/z (C19H15N5O4S2) 442,1 (M+1, 100), 363,0 (27), 291,3 (22). Приклад 14: Одержання (5Z)-5-[(3-{1[(хлорметил)сульфоніл]-2,3-дигідро-1Н-індол-5-іл}3Н-імідазо[4,5-b]піридин-5-іл)метилен]-1,3тіазолідин-2,4-діону (Схема 5)
ДивитисяДодаткова інформація
Назва патенту англійськоюPyridine methylene azolidinones and use thereof phosphoinositide inhibitors
Автори англійськоюRueckle Thomas, Quattropani Anna, Pomel Vincent, Dorbais Jerome, Covini David, Bischoff Alexander
Назва патенту російськоюПиридинметиленазолидиноны и их применение как ингибиторов фосфоинозитида
Автори російськоюРюкле Томас, Куаттропани Анна, Помель Венсан, Дорбе Жером, Ковини Дейвид, Бишофф Александер
МПК / Мітки
МПК: C07D 471/04, C07D 491/04, C07D 487/04, A61K 31/4355, A61K 31/519
Мітки: інгібіторів, піридинметиленазолідинони, фосфоінозитиду, застосування
Код посилання
<a href="https://ua.patents.su/33-88314-piridinmetilenazolidinoni-ta-kh-zastosuvannya-yak-ingibitoriv-fosfoinozitidu.html" target="_blank" rel="follow" title="База патентів України">Піридинметиленазолідинони та їх застосування як інгібіторів фосфоінозитиду</a>
Попередній патент: Фосфонатні аналоги сполук інгібіторів віл
Наступний патент: Світлова вежа, опора світлової вежі (варіанти), спосіб роботи світлової вежі, блок керування роботою світлової вежі для реалізації способу
Випадковий патент: Спосіб оцінки функціонального стану організму людини












