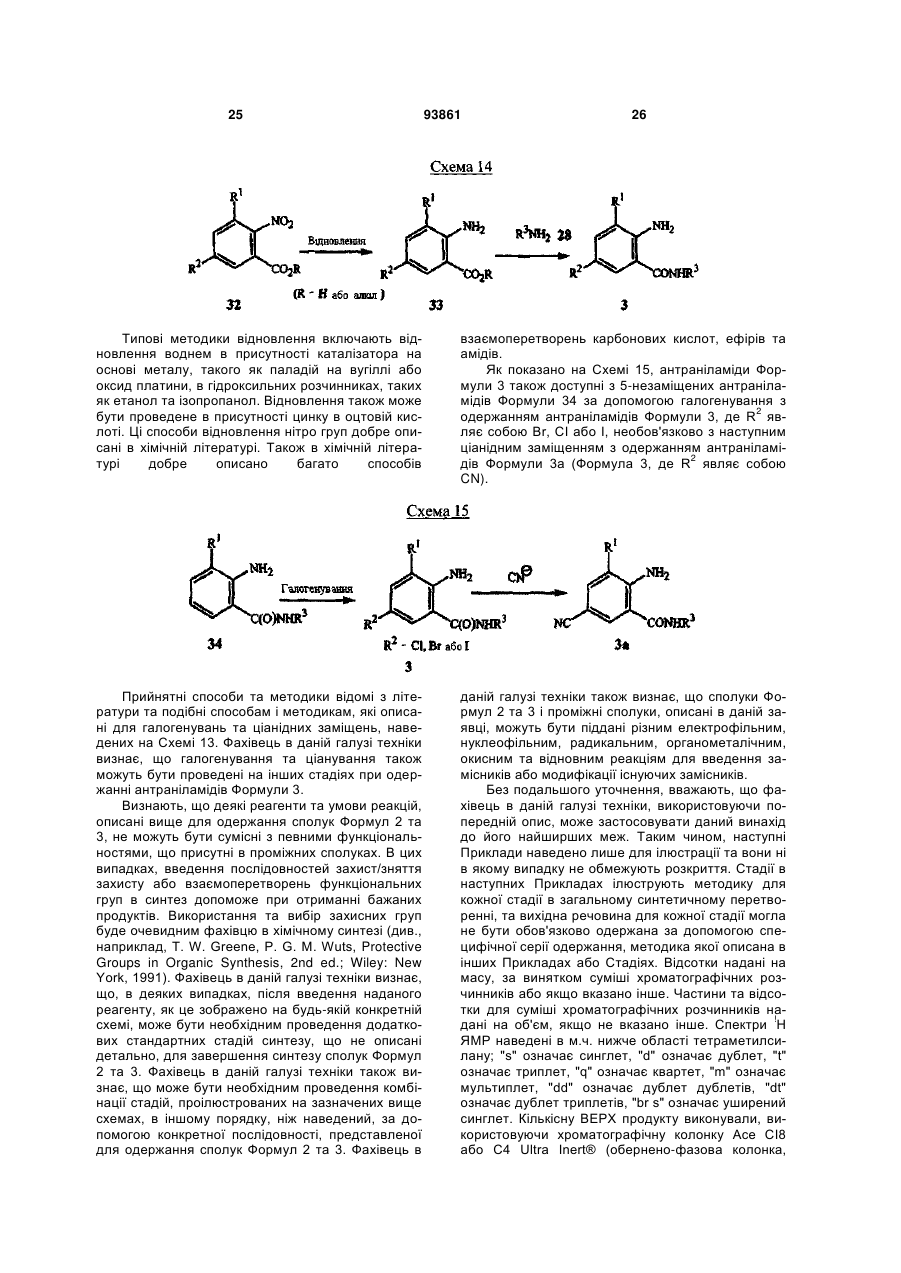
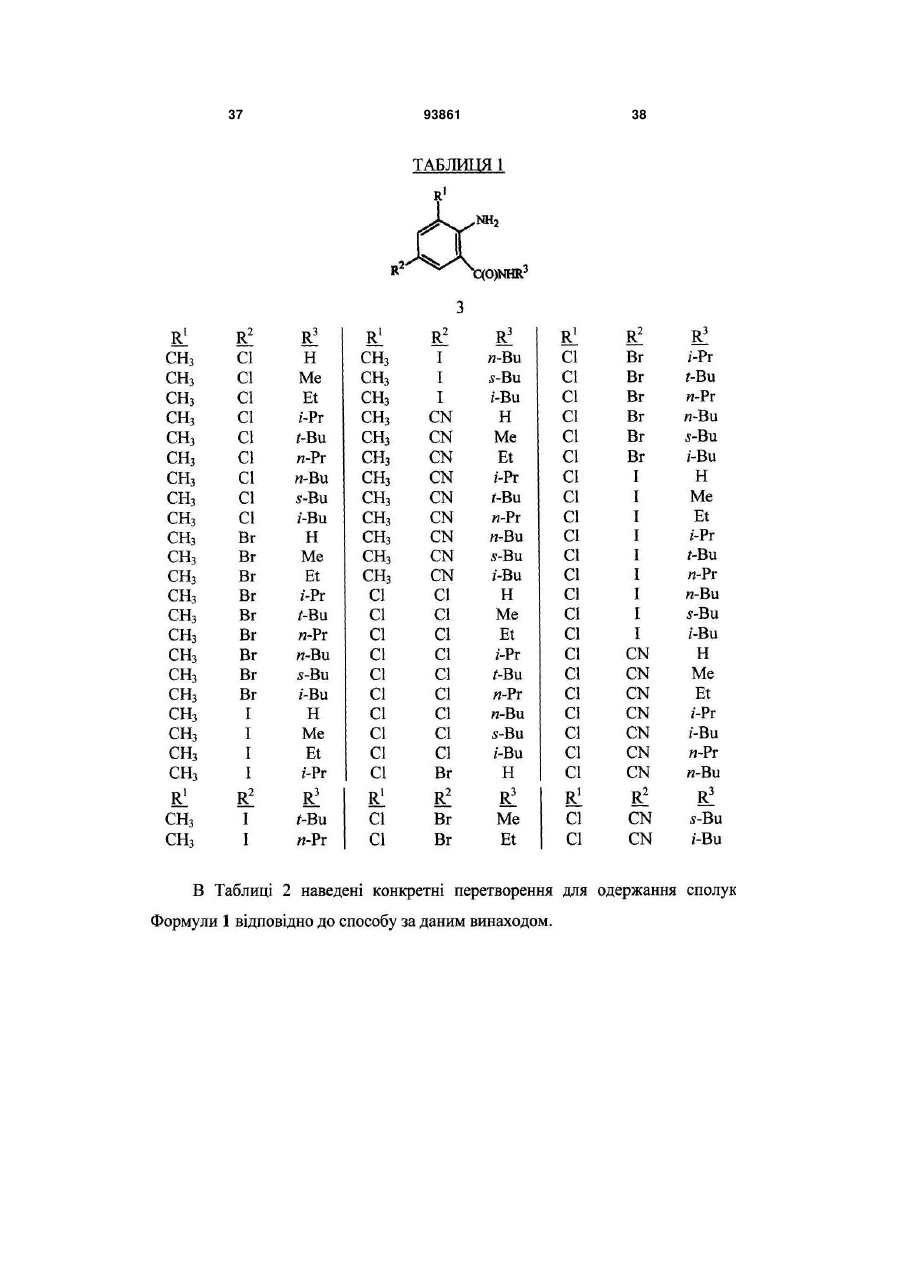
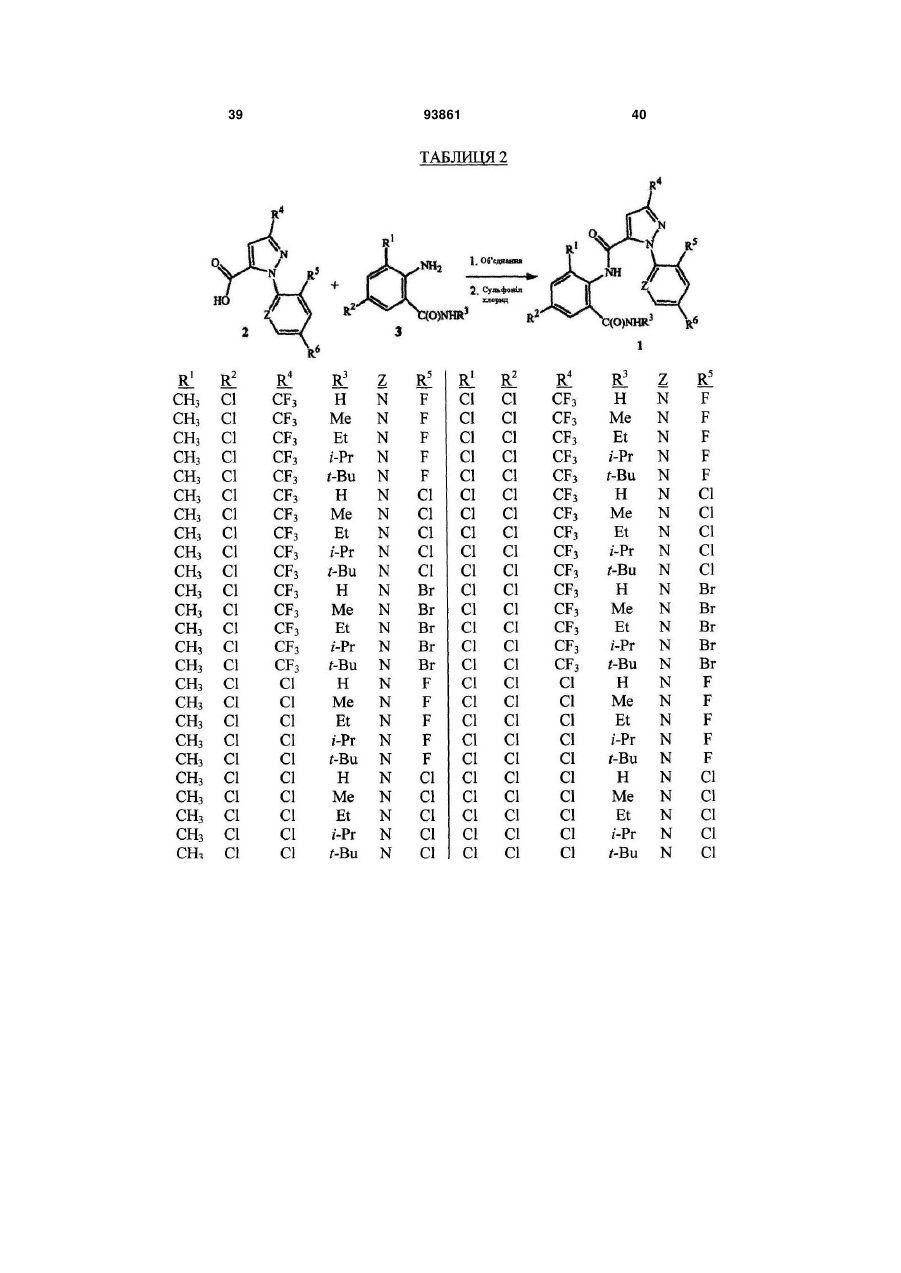
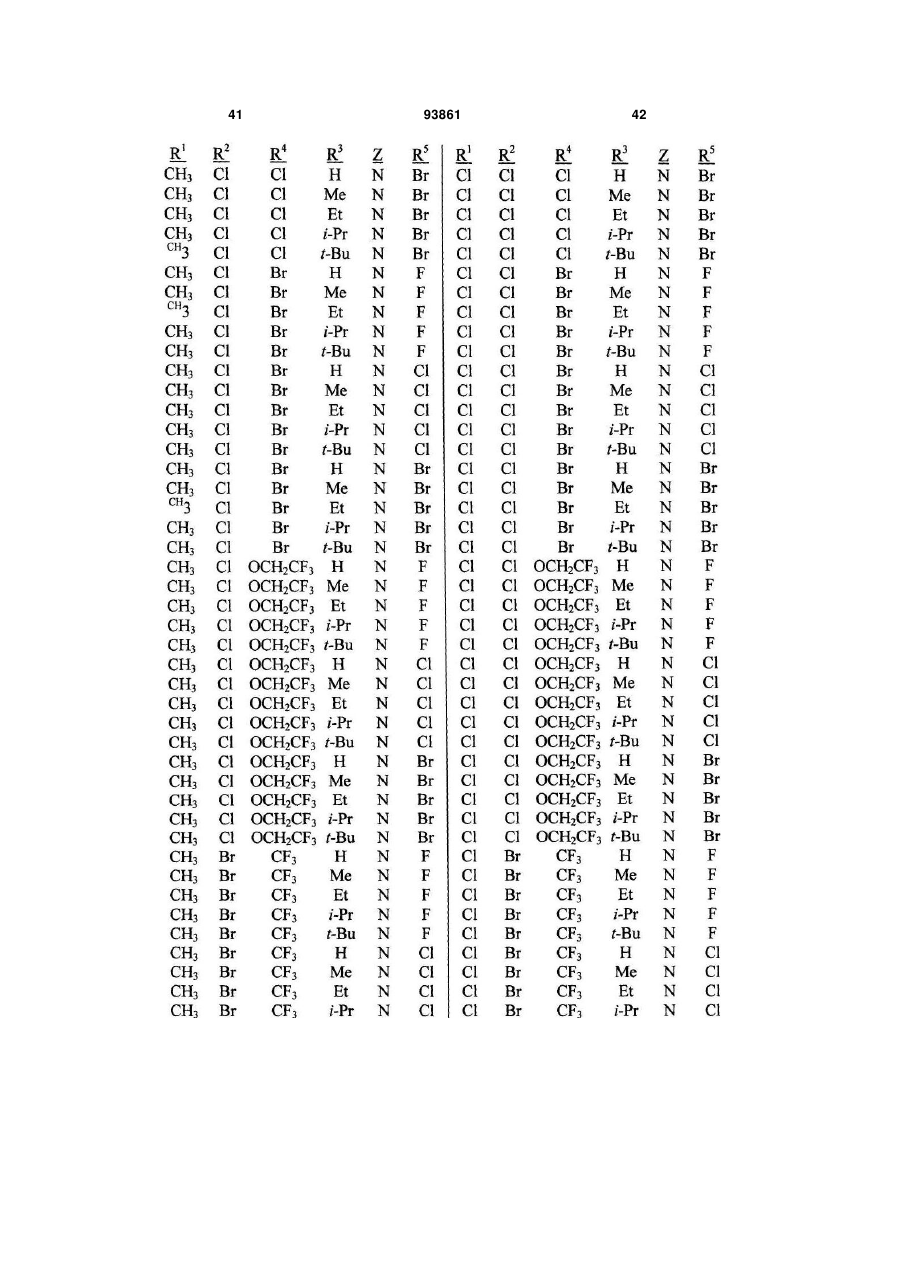
Спосіб одержання n-фенілпіразол-1-карбоксамідів та сполука аніліну
Номер патенту: 93861
Опубліковано: 25.03.2011
Автори: Шапіро Рафаель, Зіммерман Вільям Томас, Тейлор Ерік Де Гуйон
Формула / Реферат
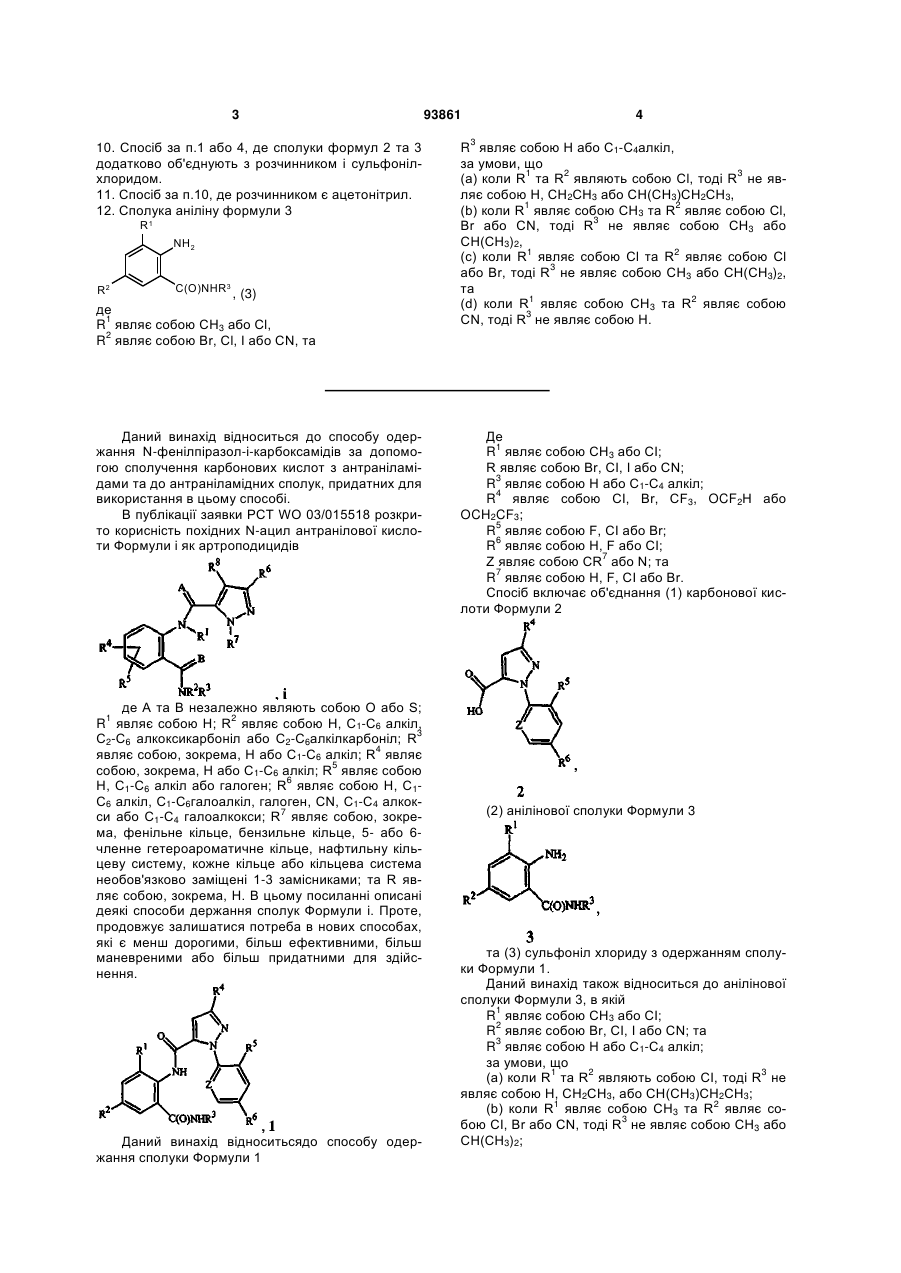
1. Спосіб одержання сполуки N-фенілпіразол-1-карбоксаміду формули 1
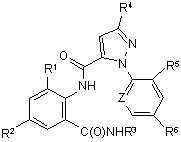 , (1)
, (1)
який включає:
об'єднання (a) карбонової кислоти формули 2
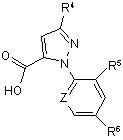 , (2)
, (2)
(b) анілінової сполуки формули 3
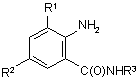 , (3)
, (3)
та (c) сульфонілхлориду з одержанням сполуки формули 1,
де
R1 являє собою СН3 або Сl,
R2 являє собою Вr, Сl, І або CN,
R3 являє собою Н або С1-С4алкіл;
R4 являє собою Сl, Br, CF3, OCF2H або OCH2CF3,
R5 являє собою F, Сl або Вr,
R6 являє собою Н, F або Сl,
Z являє собою CR7 або N, та
R7 являє собою Н, F, Сl або Вr.
2. Спосіб за п. 1, де сульфонілхлорид має формулу 4
R8S(O)2Сl, (4)
де R8 являє собою С1-С4алкіл, С1-С2галогеналкіл або феніл, необов'язково заміщений 1-3 замісниками, вибраними з групи, що включає галоген, С1-С3алкіл та нітрогрупу.
3. Спосіб за п. 2, де сульфонілхлорид являє собою метансульфонілхлорид.
4. Спосіб за п. 1, де карбонову кислоту формули 2 об'єднують з аніліном формули 3 з одержанням суміші та потім суміш об'єднують з сульфонілхлоридом.
5. Спосіб за п. 4, де сполуки формул 2 та 3 додатково об’єднують з основою з одержанням суміші, перед об'єднанням з сульфонілхлоридом.
6. Спосіб за п. 5, де основа вибрана з третинних амінів.
7. Спосіб за п. 6, де основа вибрана з необов'язково заміщених піридинів.
8. Спосіб за п. 7, де основа вибрана з 2-піколіну, 3-піколіну, 2,6-лутидину та піридину.
9. Спосіб за п. 8, де сульфонілхлорид має формулу 4
R8S(O)2Сl, (4)
де R8 являє собою С1-С4алкіл, С1-С2галогеналкіл або феніл, необов'язково заміщений 1-3 замісниками, вибраними з групи, що включає галоген, С1-С3алкіл та нітрогрупу.
10. Спосіб за п. 1 або 4, де сполуки формул 2 та 3 додатково об'єднують з розчинником і сульфонілхлоридом.
11. Спосіб за п. 10, де розчинником є ацетонітрил.
12. Сполука аніліну формули 3
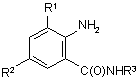 , (3)
, (3)
де
R1 являє собою СН3 або Сl,
R2 являє собою Вr, Сl, І або CN, та
R3 являє собою Н або С1-С4алкіл,
за умови, що
(a) коли R1 та R2 являють собою Сl, тоді R3 не являє собою Н, СН2СН3 або СН(СН3)СН2СН3,
(b) коли R1 являє собою СН3 та R2 являє собою Сl, Вr або CN, тоді R3 не являє собою СН3 або СН(СН3)2,
(c) коли R1 являє собою Сl та R2 являє собою Сl або Вr, тоді R3 не являє собою СН3 або СН(СН3)2, та
(d) коли R1 являє собою СН3 та R2 являє собою CN, тоді R3 не являє собою Н.
Текст
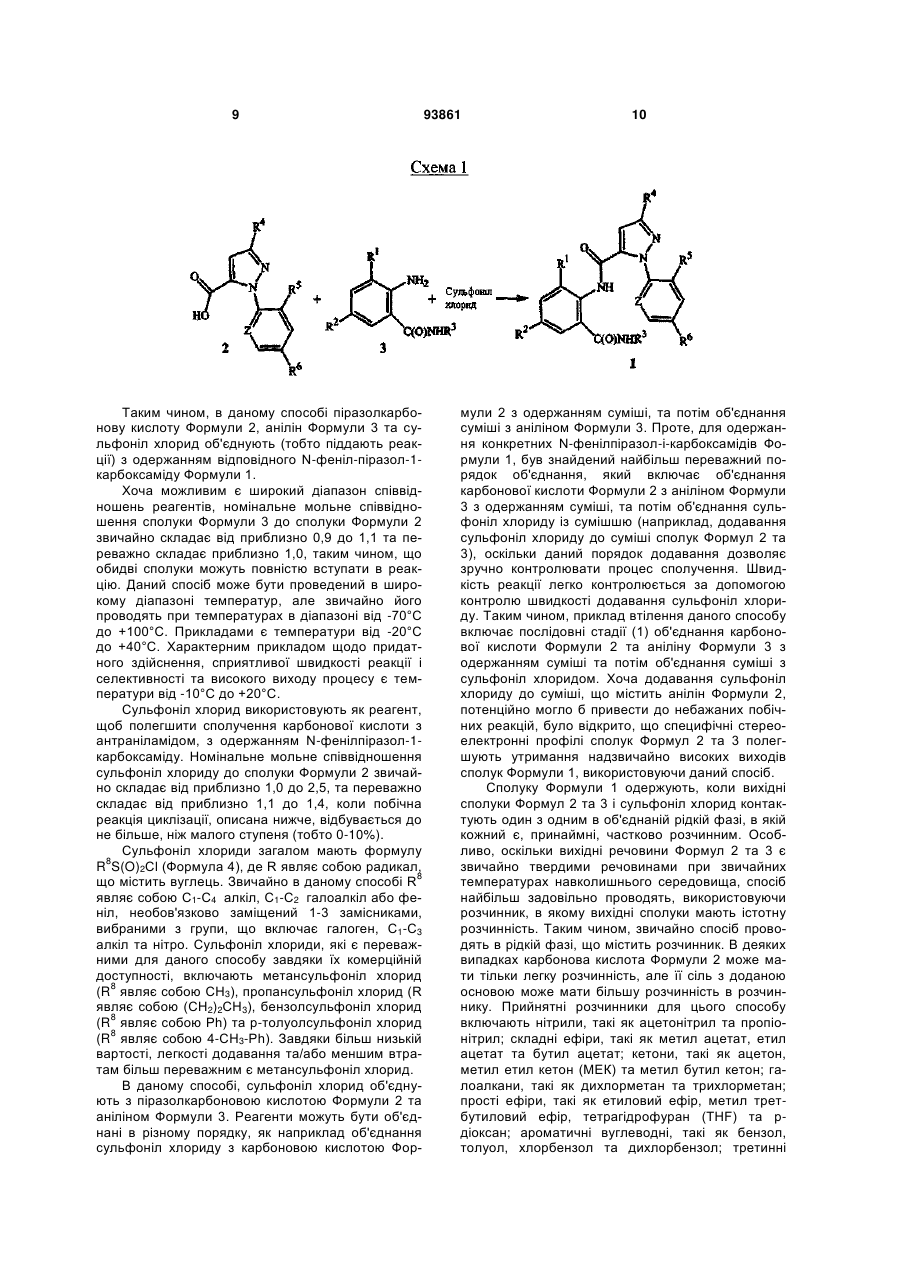
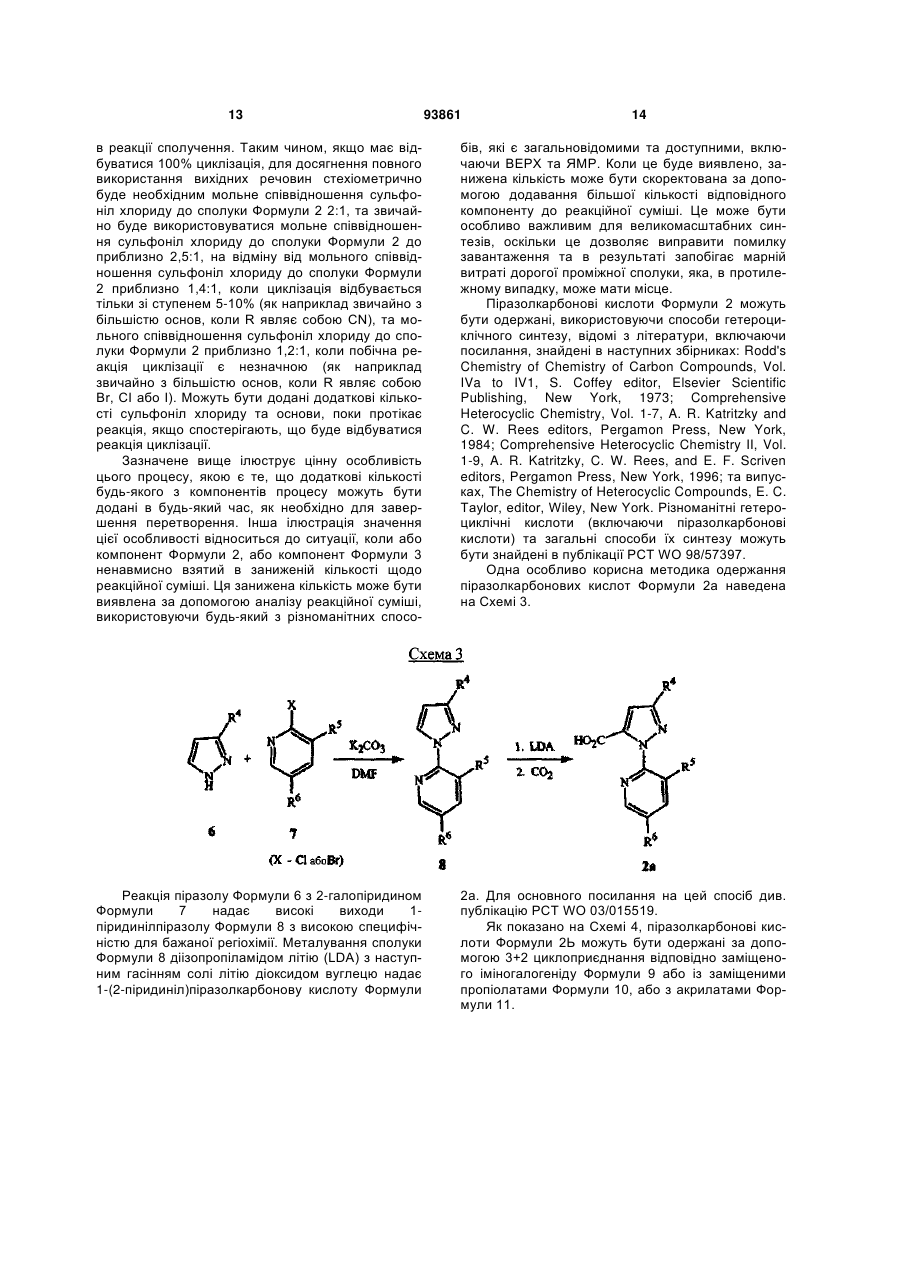
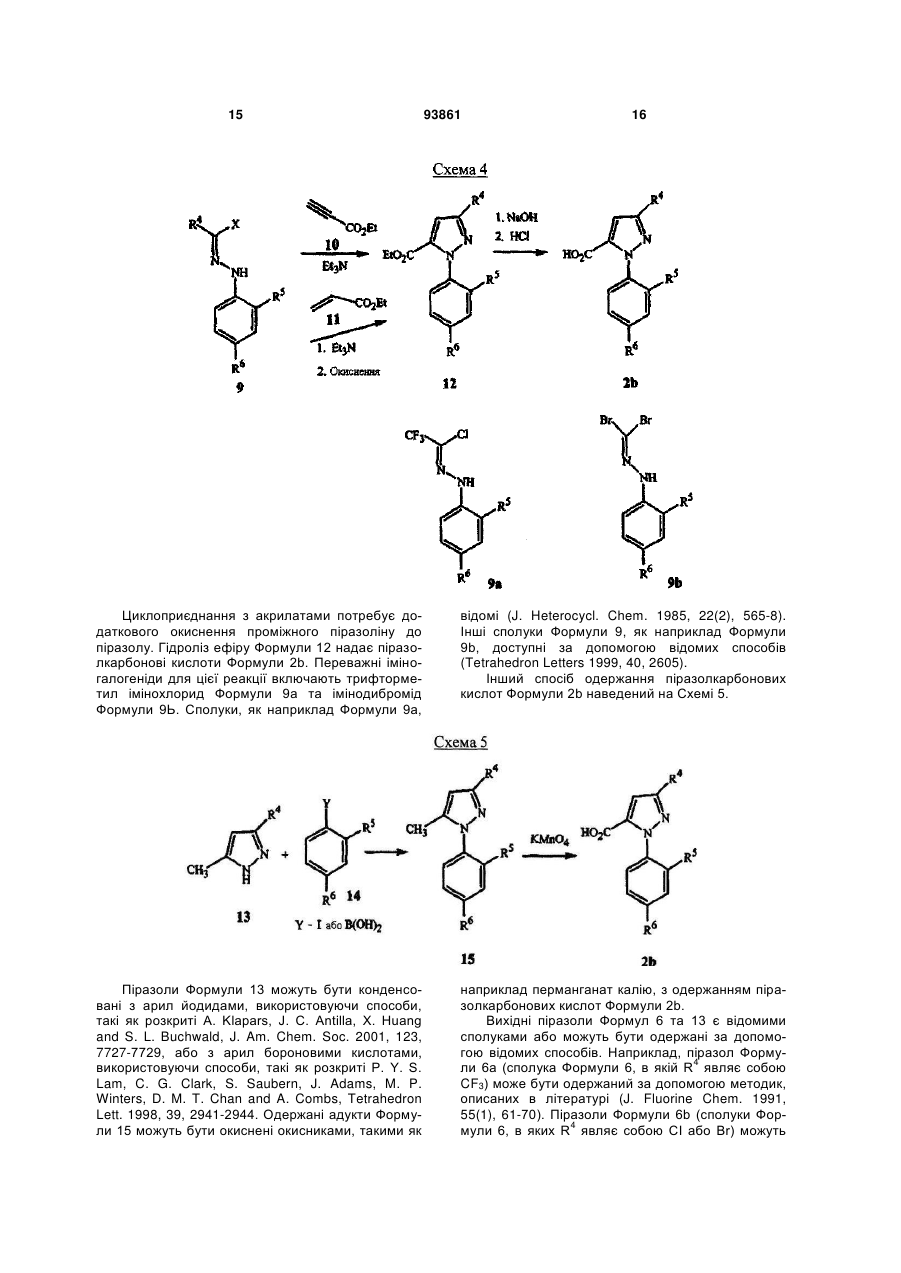
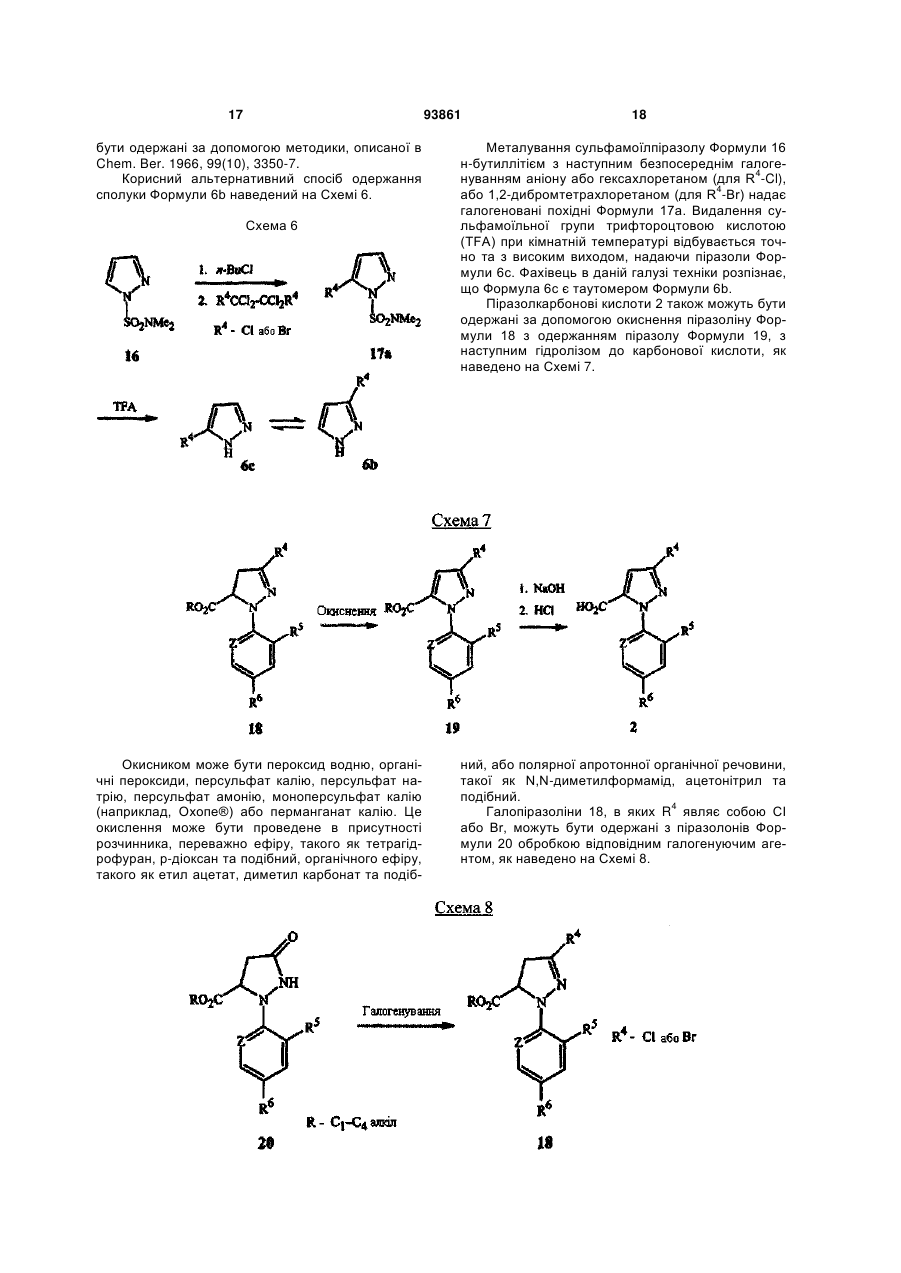
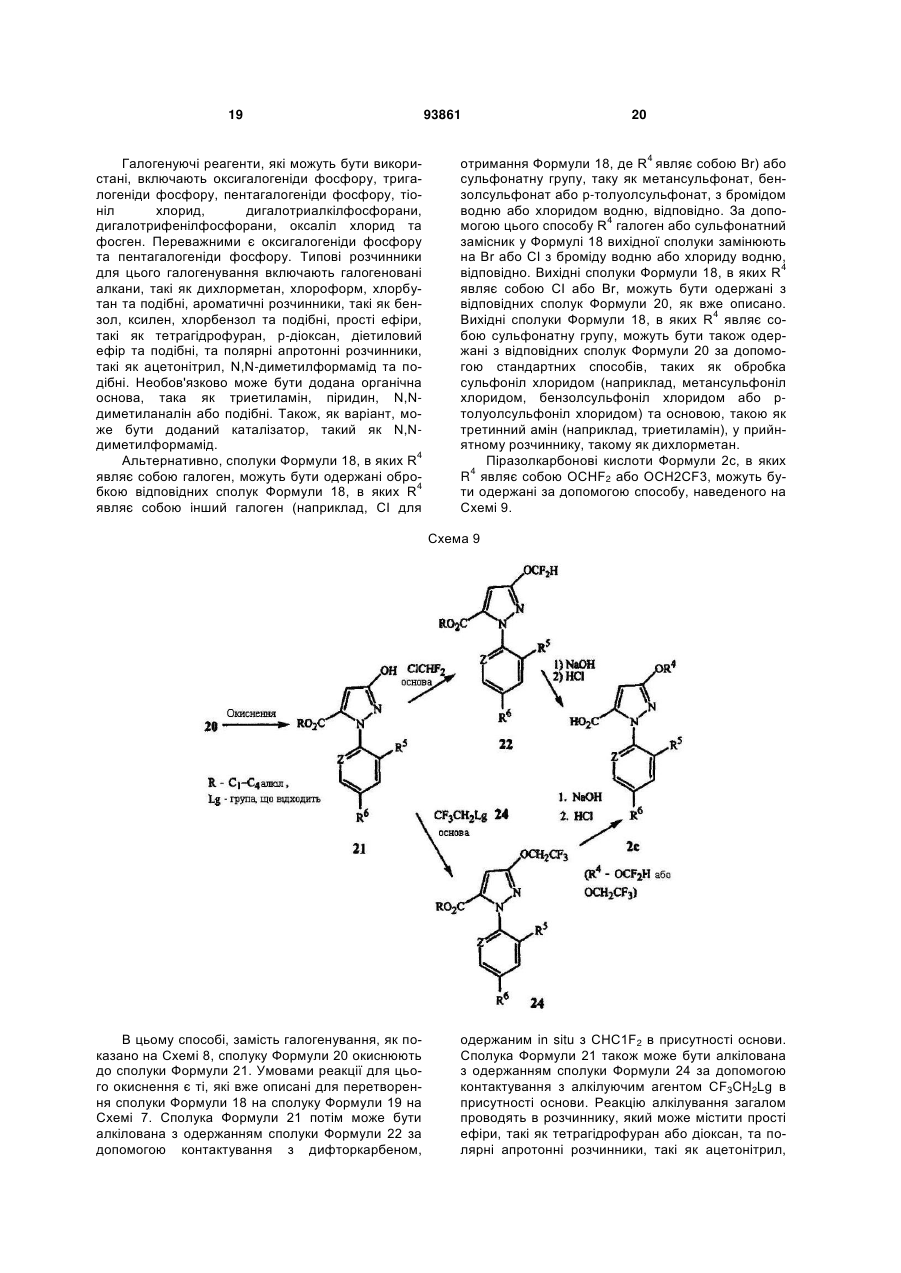
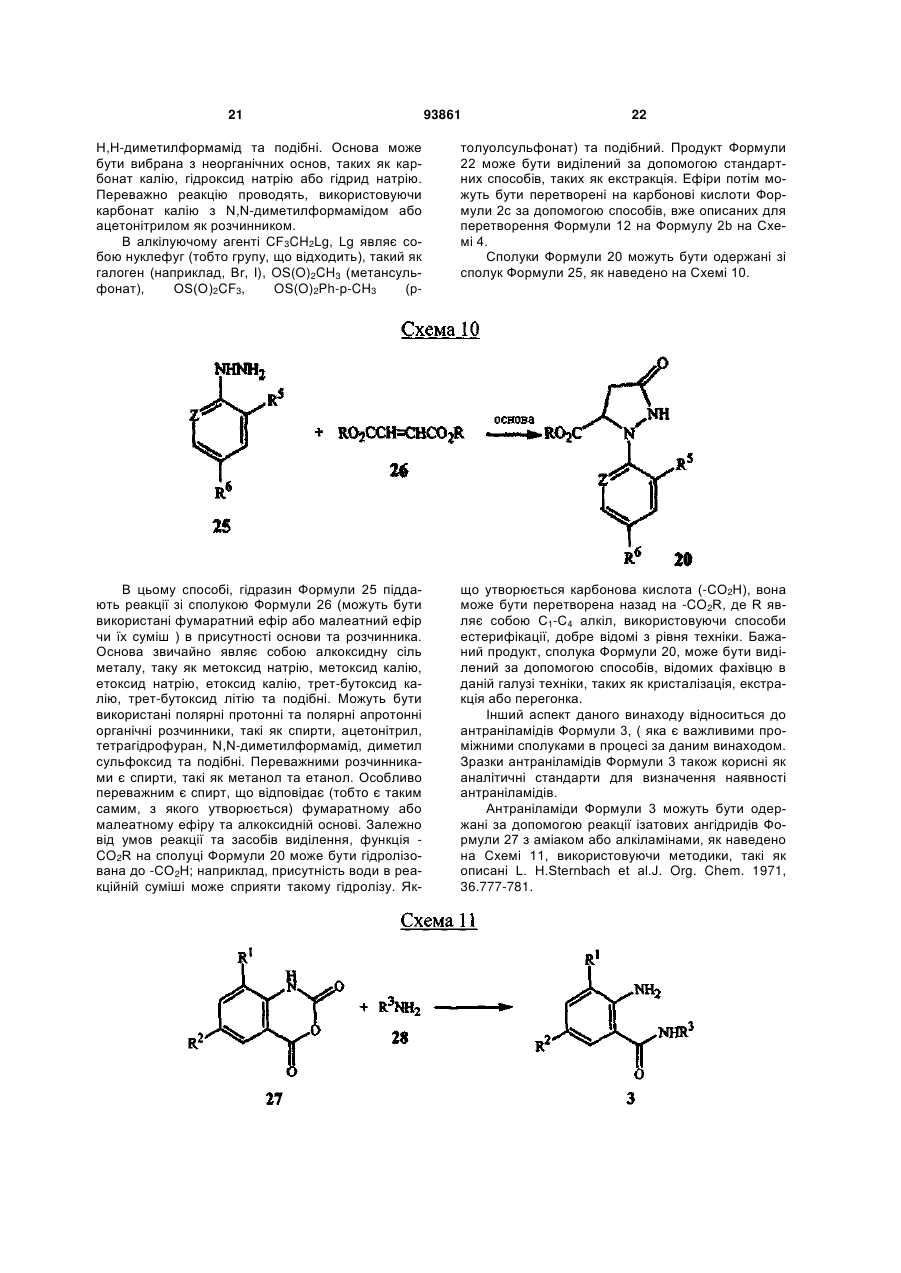
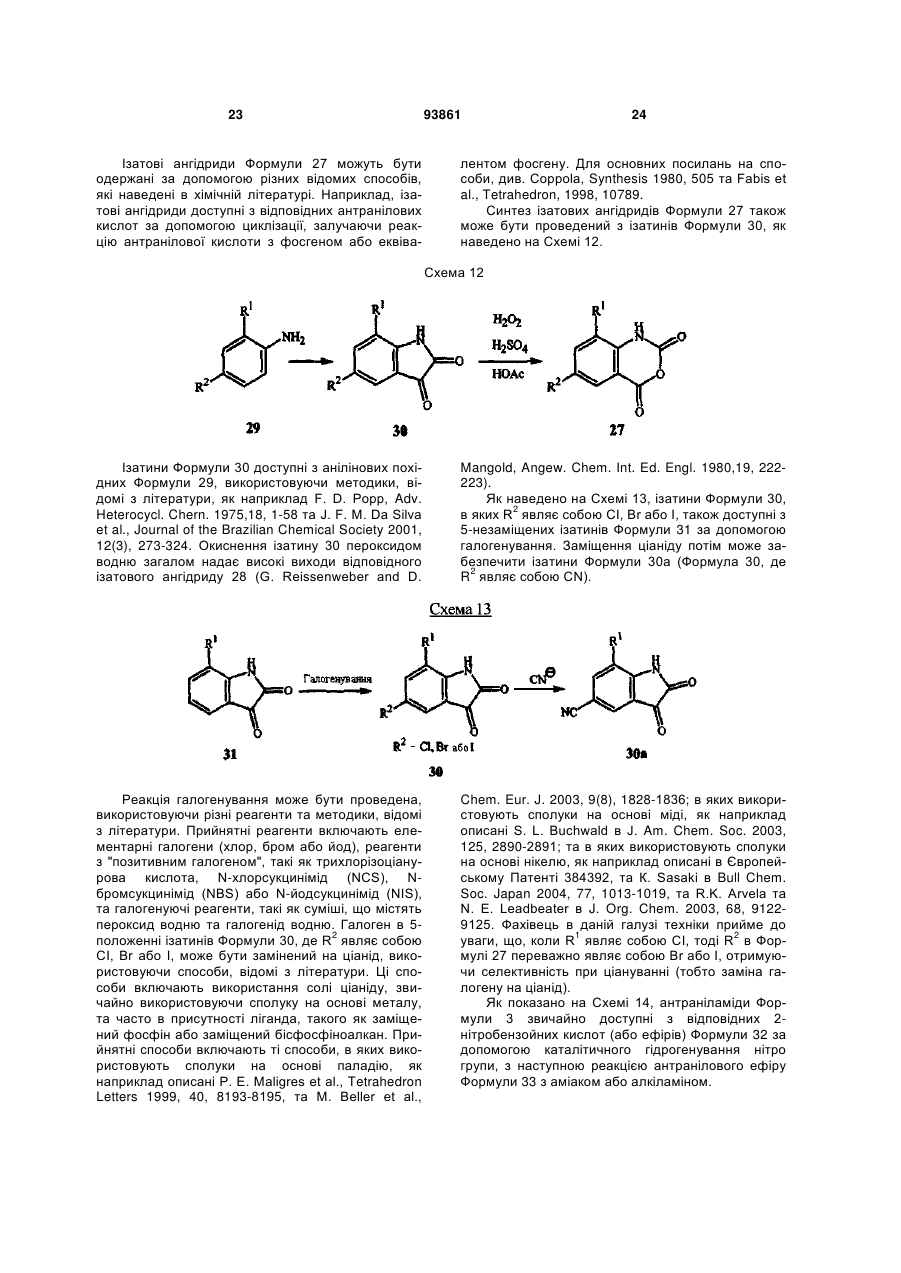
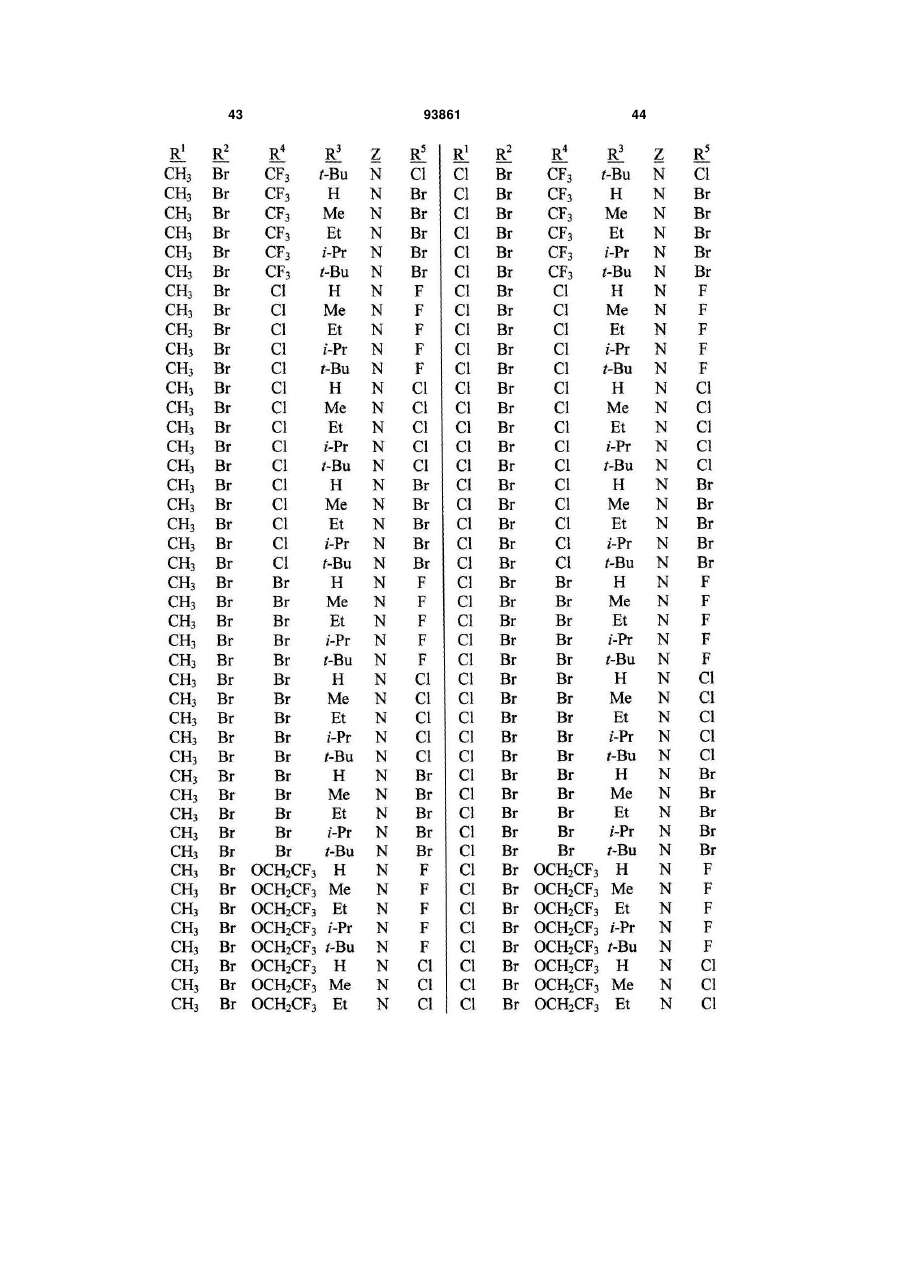
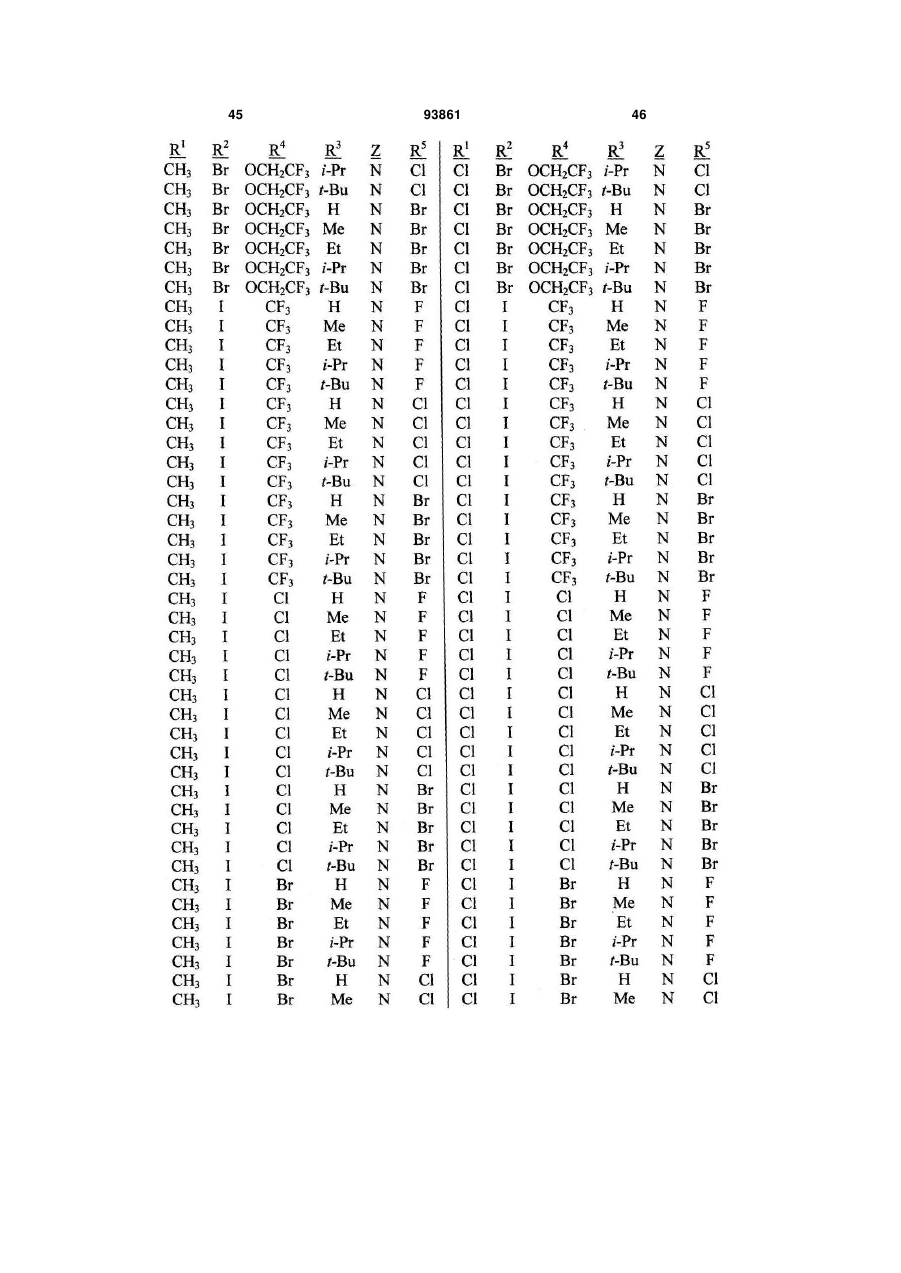
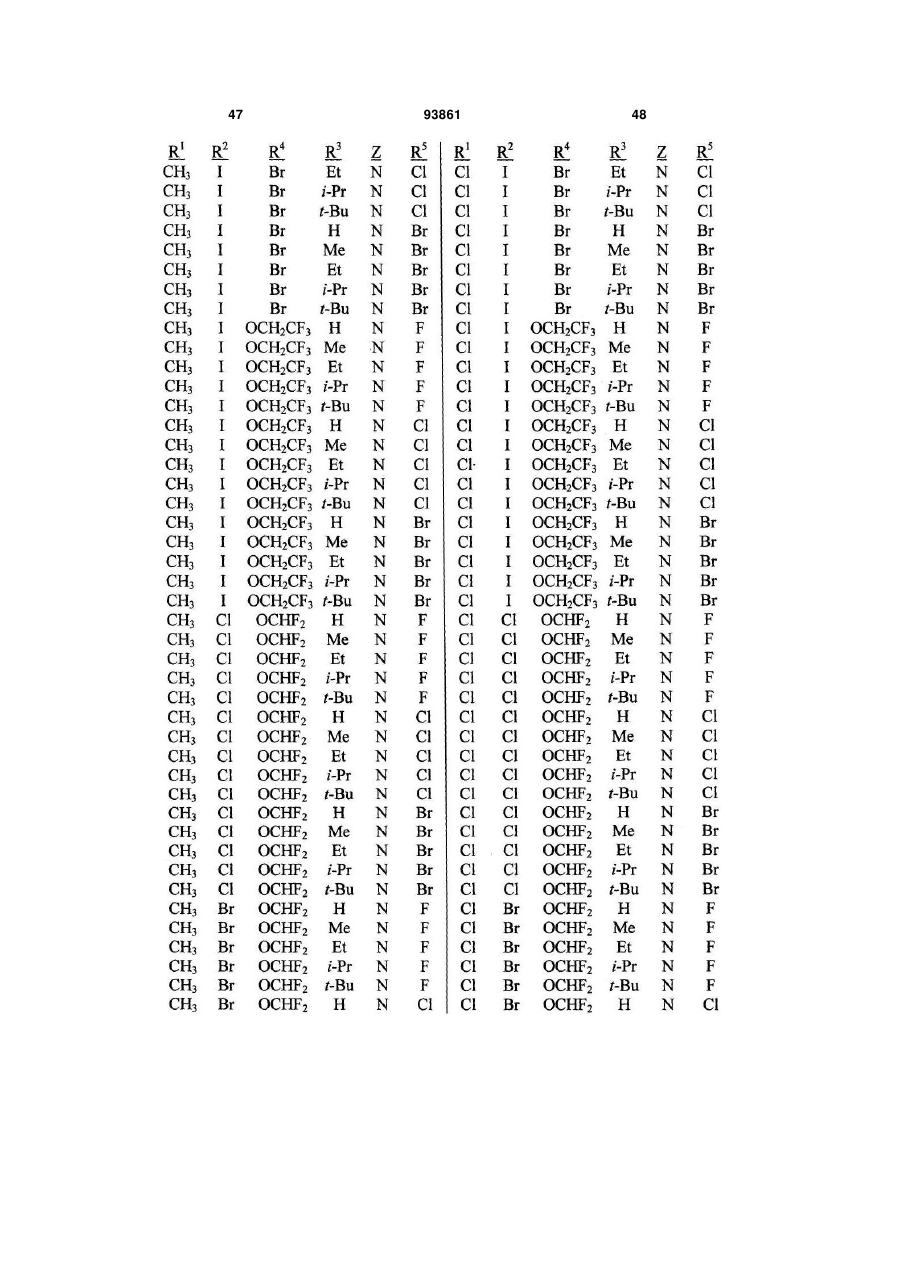
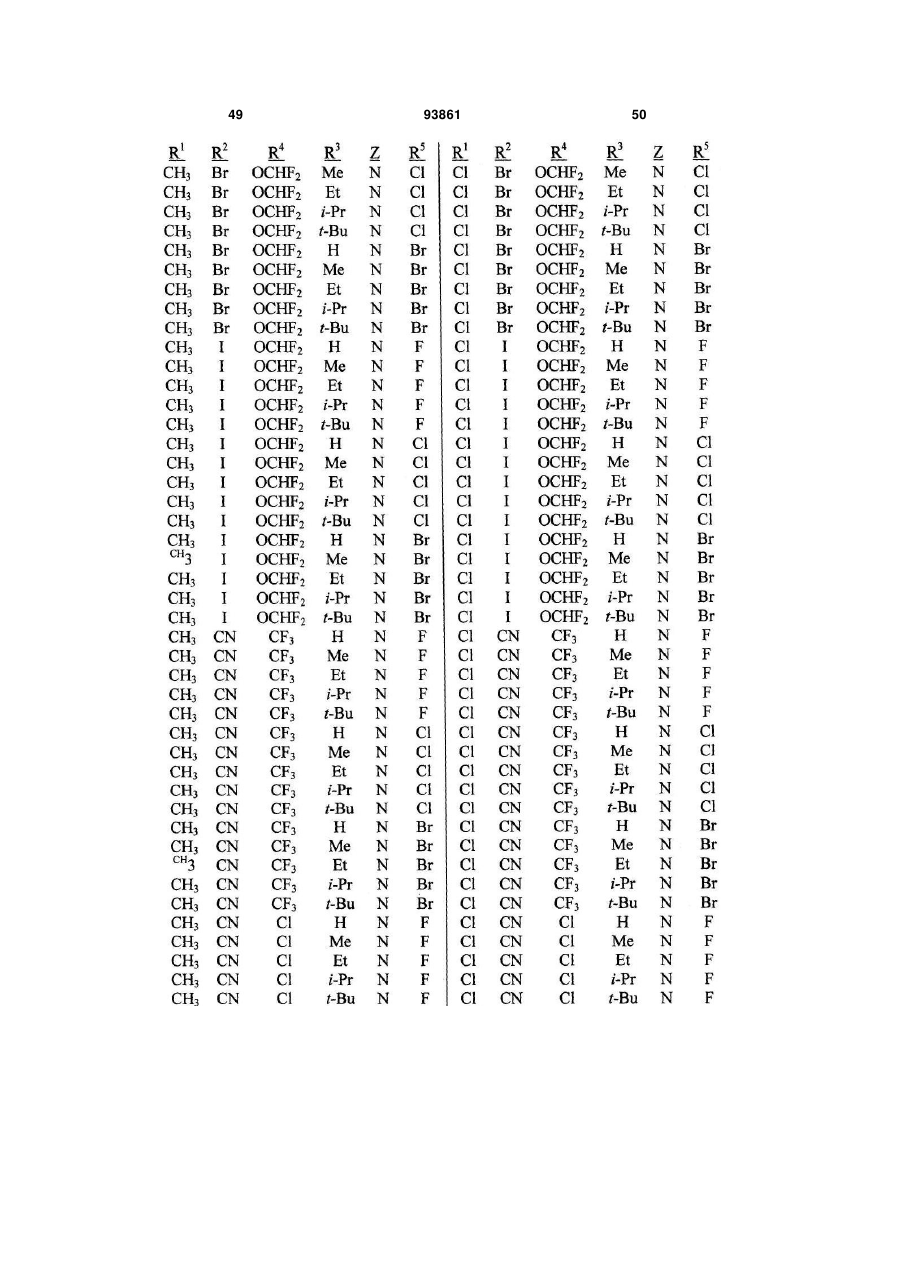
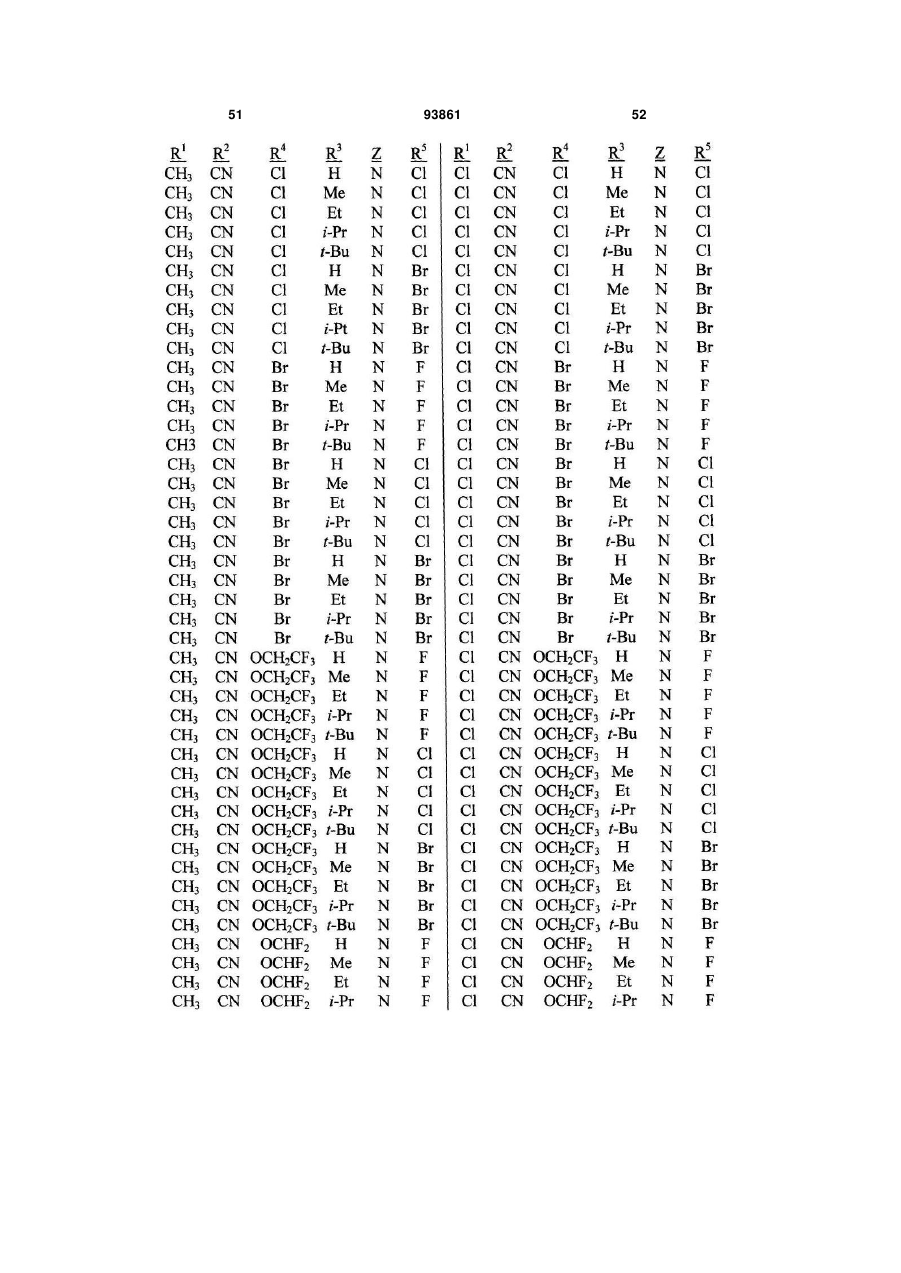
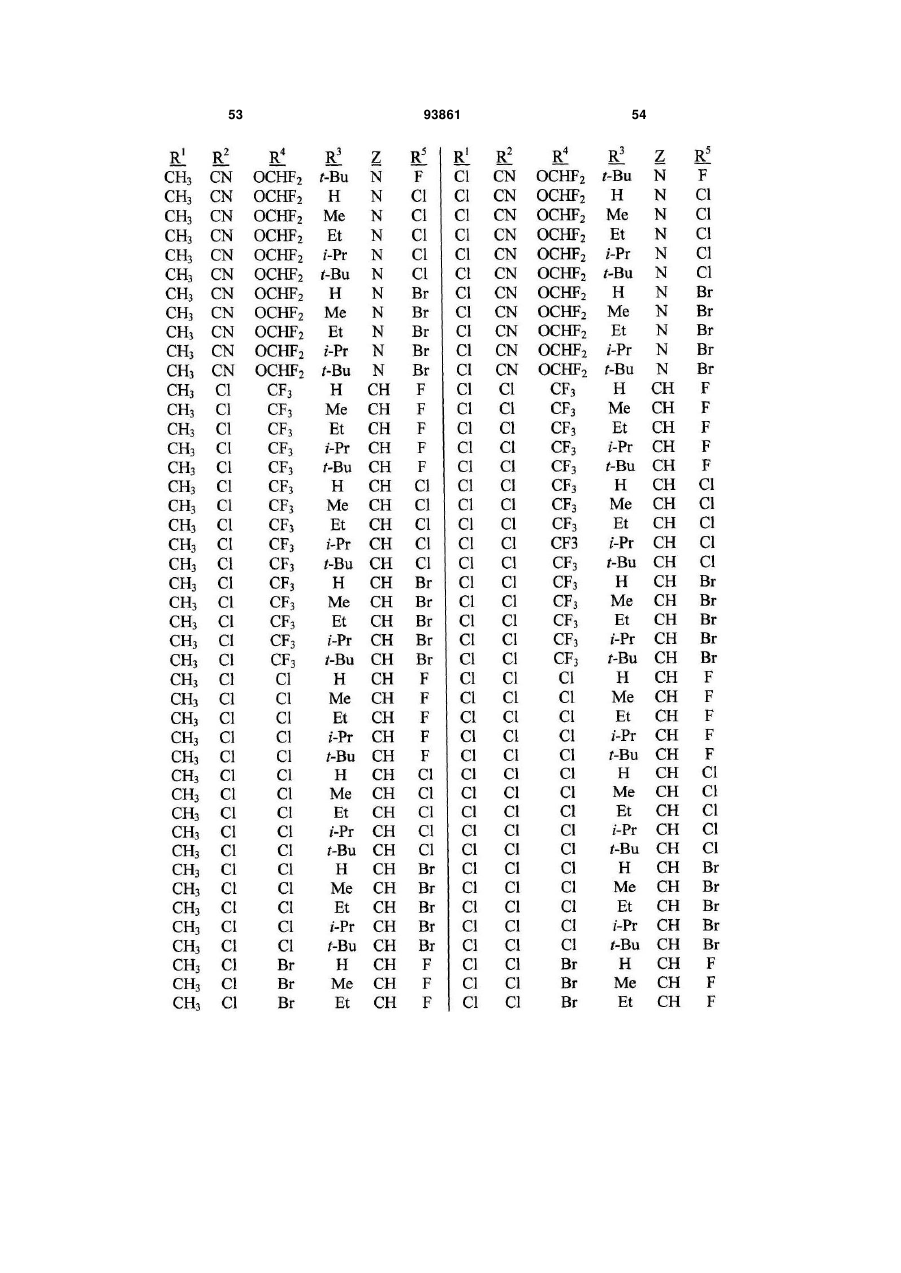
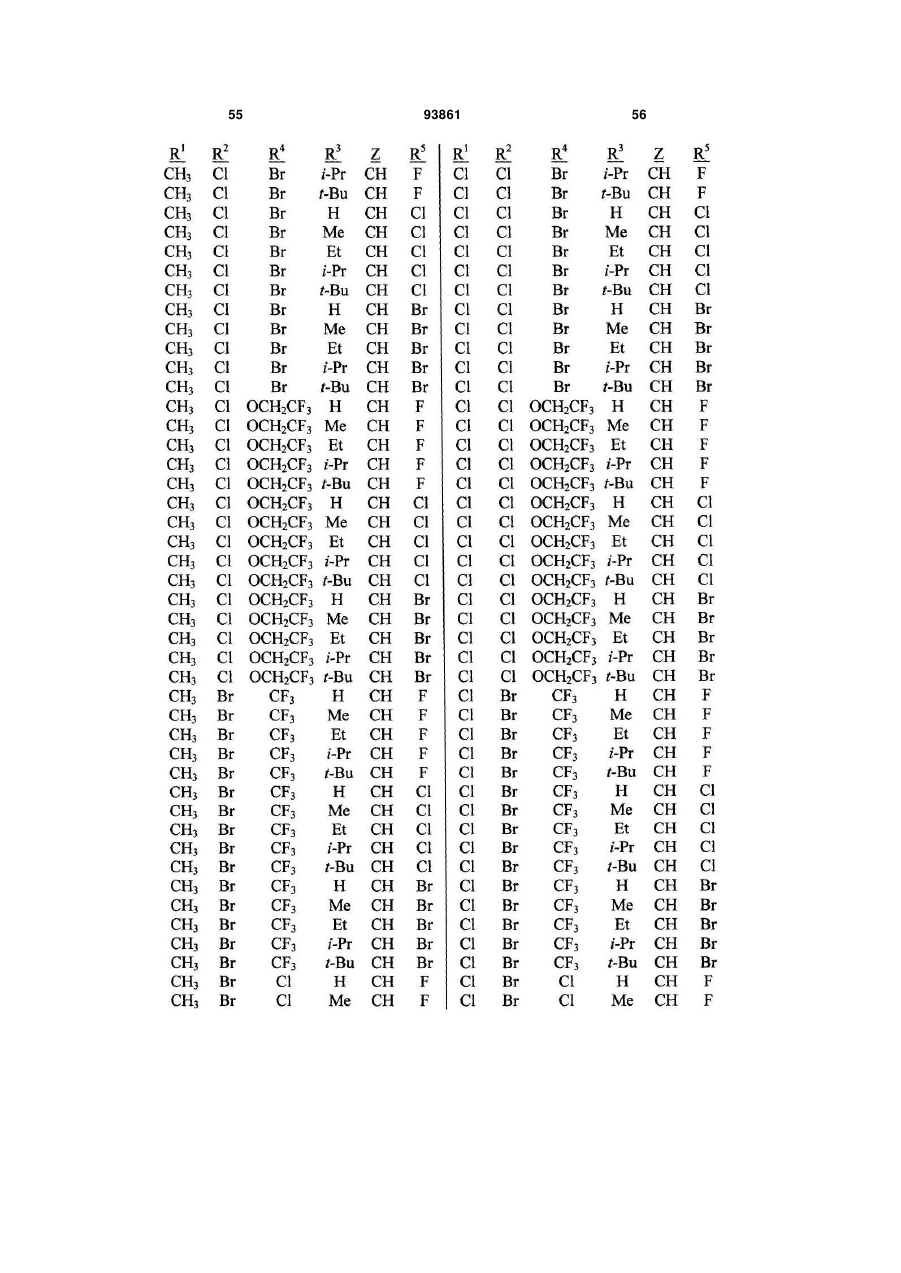
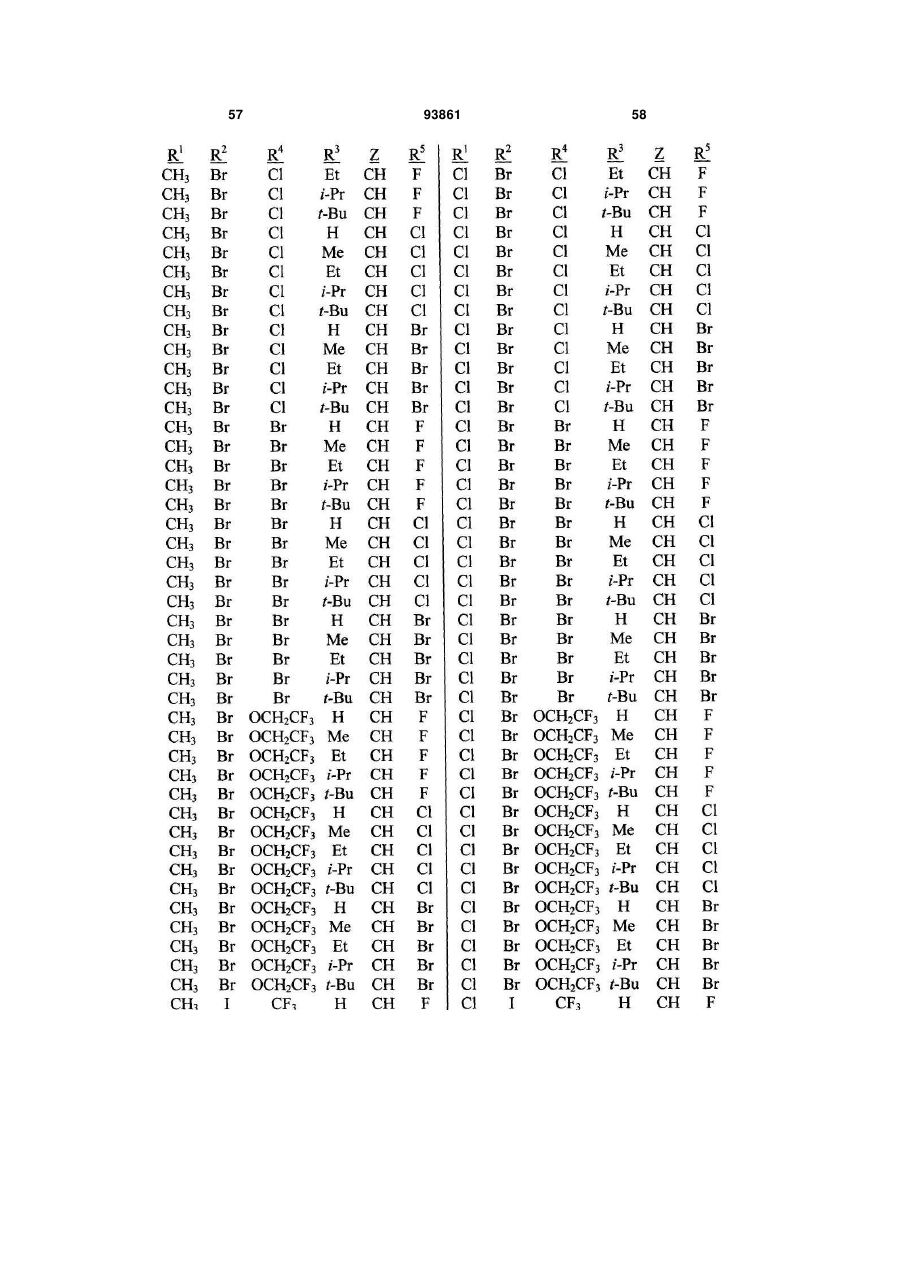
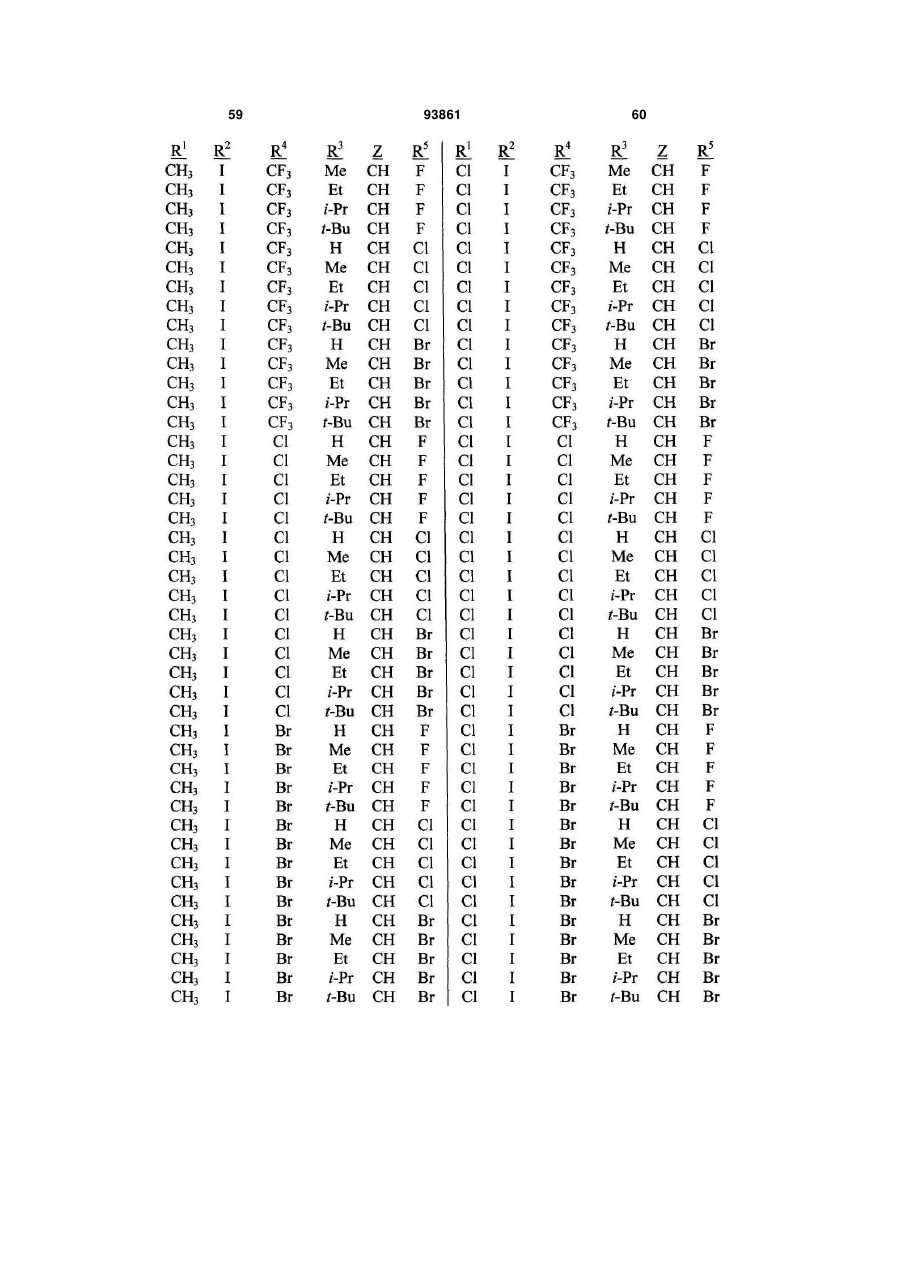
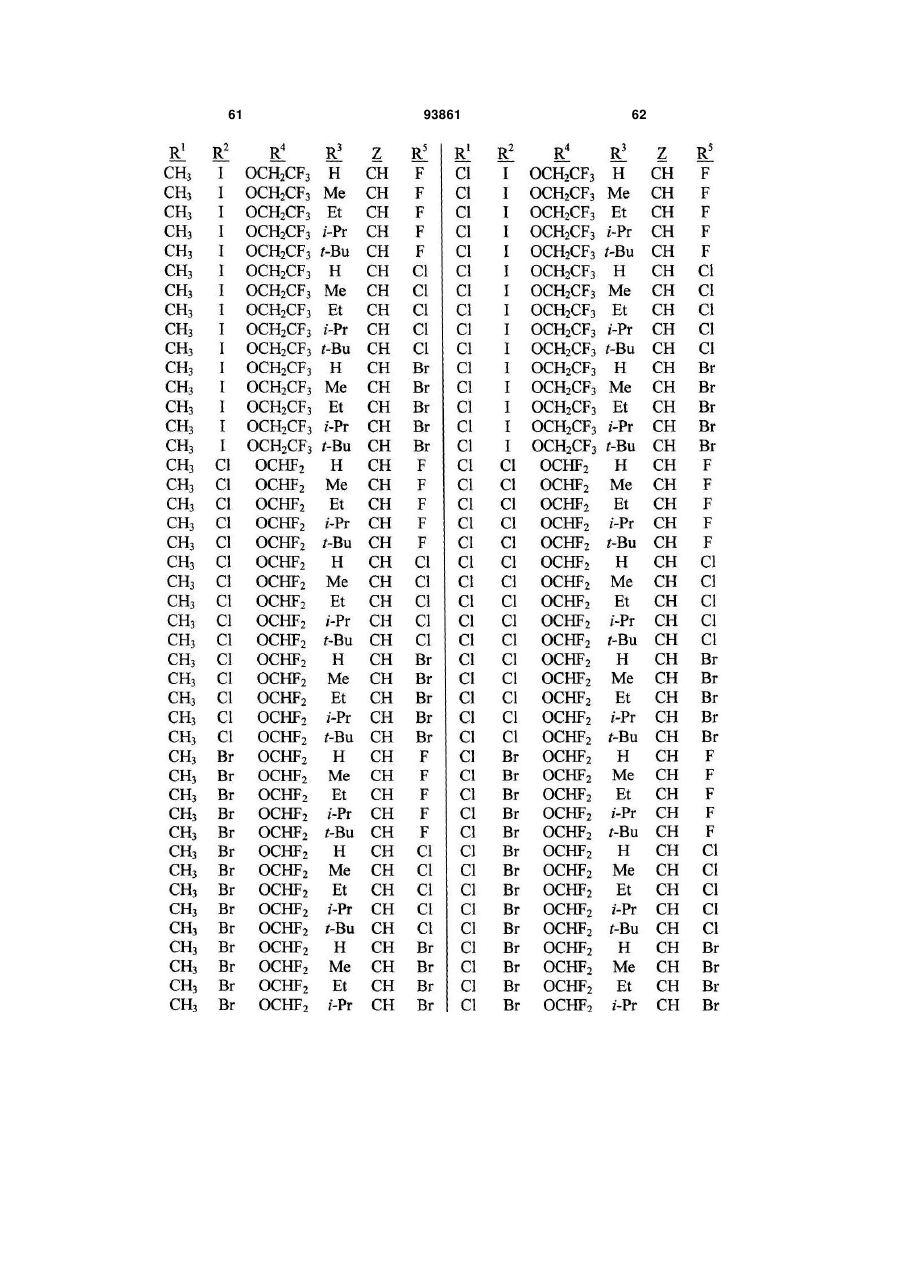
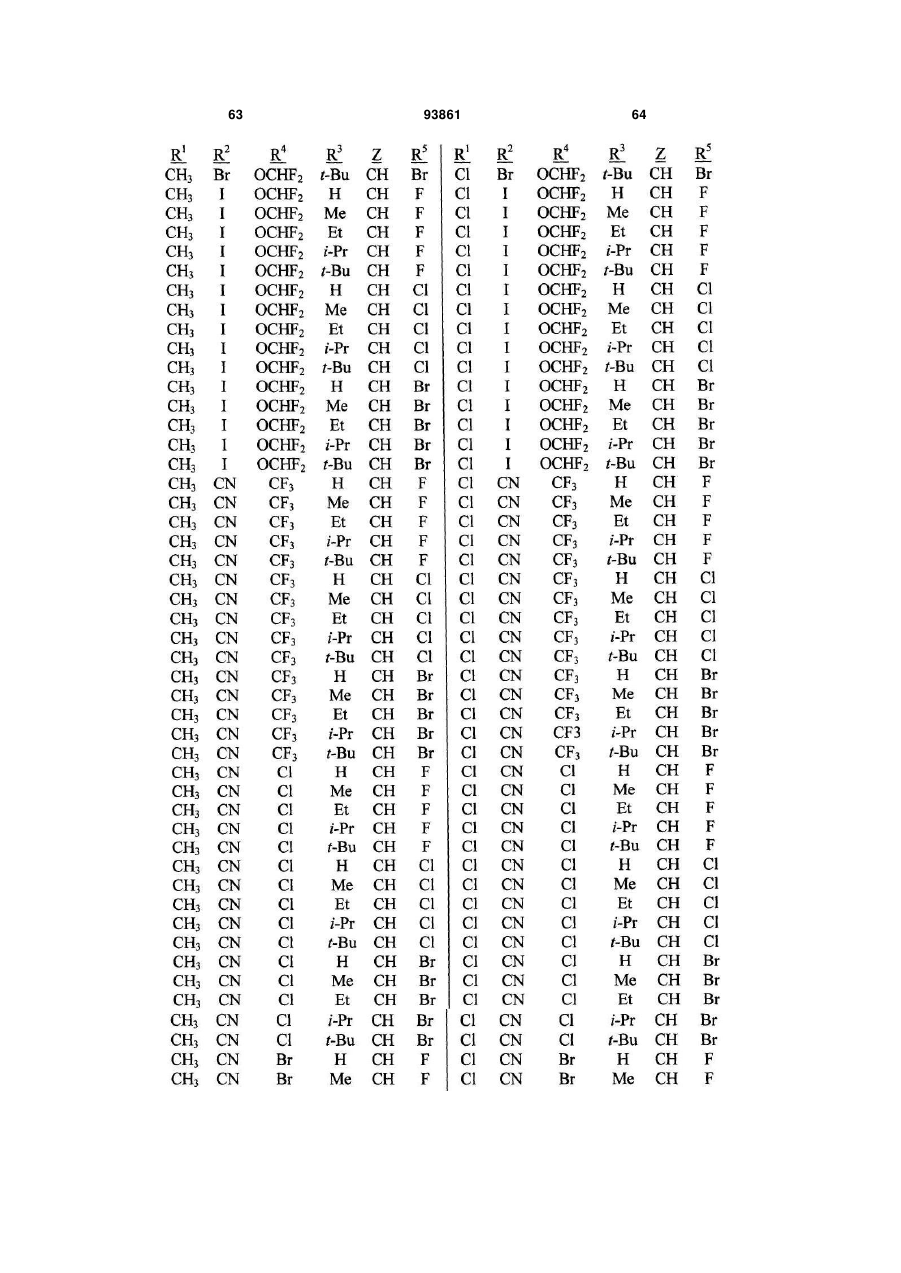
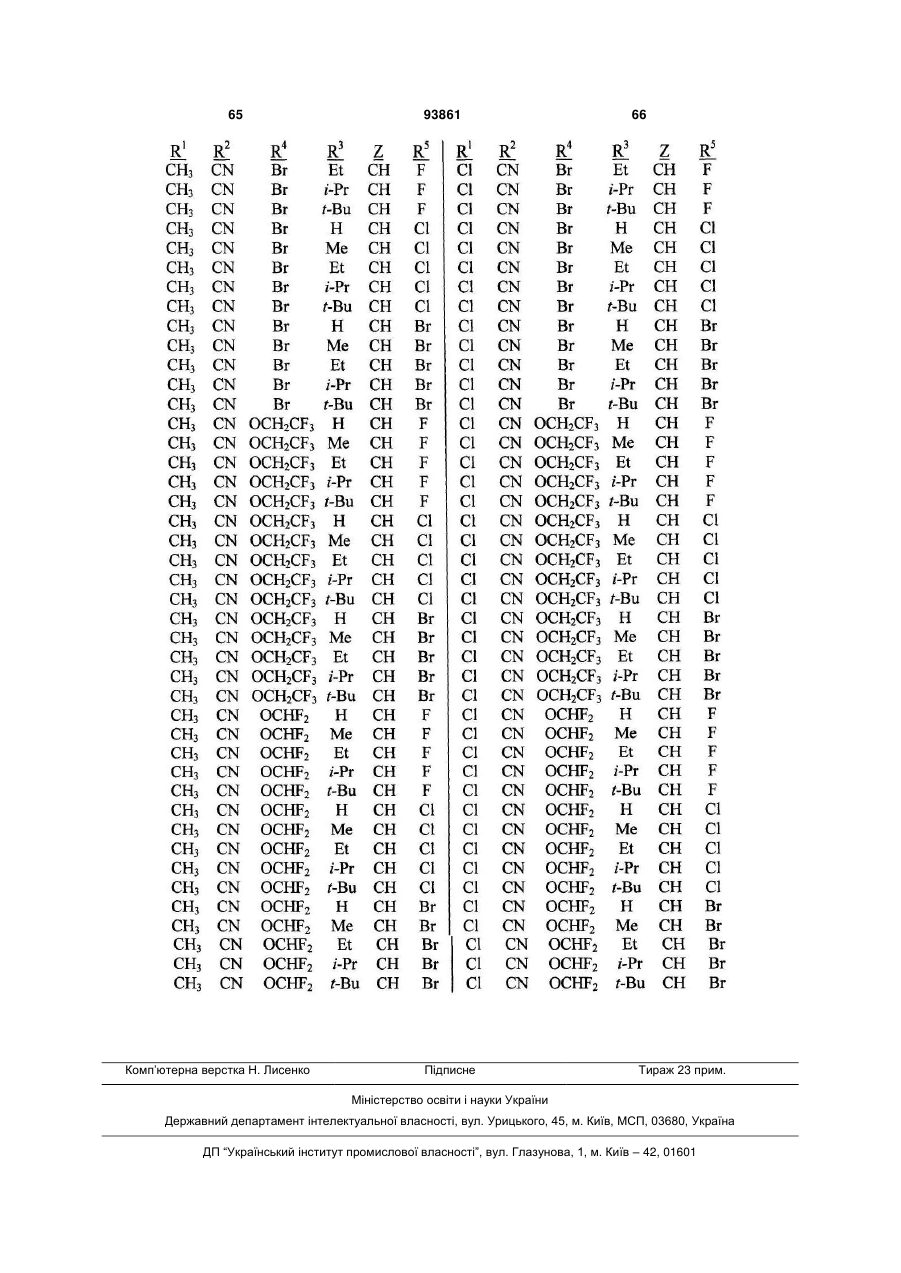
1. Спосіб одержання сполуки N-фенілпіразол1-карбоксаміду формули 1 2 (19) 1 3 10. Спосіб за п.1 або 4, де сполуки формул 2 та 3 додатково об'єднують з розчинником і сульфонілхлоридом. 11. Спосіб за п.10, де розчинником є ацетонітрил. 12. Сполука аніліну формули 3 R1 NH2 R2 C(O)NHR3 , (3) де R1 являє собою СН3 або Сl, R2 являє собою Вr, Сl, І або CN, та Даний винахід відноситься до способу одержання N-фенілпіразол-і-карбоксамідів за допомогою сполучення карбонових кислот з антраніламідами та до антраніламідних сполук, придатних для використання в цьому способі. В публікації заявки РСТ WO 03/015518 розкрито корисність похідних N-ацил антранілової кислоти Формули і як артроподицидів де А та В незалежно являють собою О або S; R1 являє собою Н; R2 являє собою Н, С1-С6 алкіл, С2-С6 алкоксикарбоніл або С2-С6алкілкарбоніл; R3 являє собою, зокрема, Н або С1-С6 алкіл; R4 являє собою, зокрема, Н або С1-С6 алкіл; R5 являє собою Н, С1-С6 алкіл або галоген; R6 являє собою Н, С1С6 алкіл, С1-С6галоалкіл, галоген, CN, С1-С4 алкокси або С1-С4 галоалкокси; R7 являє собою, зокрема, фенільне кільце, бензильне кільце, 5- або 6членне гетероароматичне кільце, нафтильну кільцеву систему, кожне кільце або кільцева система необов'язково заміщені 1-3 замісниками; та R являє собою, зокрема, Н. В цьому посиланні описані деякі способи держання сполук Формули і. Проте, продовжує залишатися потреба в нових способах, які є менш дорогими, більш ефективними, більш маневреними або більш придатними для здійснення. Даний винахід відноситьсядо способу одержання сполуки Формули 1 93861 4 R3 являє собою Н або С1-С4алкіл, за умови, що (a) коли R1 та R2 являють собою Сl, тоді R3 не являє собою Н, СН2СН3 або СН(СН3)СН2СН3, 1 2 (b) коли R являє собою СН3 та R являє собою Сl, 3 Вr або CN, тоді R не являє собою СН3 або СН(СН3)2, (c) коли R1 являє собою Сl та R2 являє собою Сl або Вr, тоді R3 не являє собою СН3 або СН(СН3)2, та (d) коли R1 являє собою СН3 та R2 являє собою CN, тоді R3 не являє собою Н. Де R1 являє собою СН3 або СІ; R являє собою Вr, СІ, І або CN; R3 являє собою Н або С1-С4 алкіл; 4 R являє собою СІ, Br, CF3, OCF2H або OCH2CF3; R5 являє собою F, СІ або Вr; R6 являє собою Н, F або СІ; Z являє собою CR7 або N; та R7 являє собою Н, F, СІ або Вr. Спосіб включає об'єднання (1) карбонової кислоти Формули 2 (2) анілінової сполуки Формули 3 та (3) сульфоніл хлориду з одержанням сполуки Формули 1. Даний винахід також відноситься до анілінової сполуки Формули 3, в якій R1 являє собою СН3 або СІ; R2 являє собою Вr, СІ, І або CN; та R3 являє собою Н або С1-С4 алкіл; за умови, що (a) коли R1 та R2 являють собою СІ, тоді R3 не являє собою Н, СН2СН3, або СН(СН3)СН2СН3; (b) коли R1 являє собою СН3 та R2 являє собою СІ, Вr або CN, тоді R3 не являє собою СН3 або СН(СН3)2; 5 (c) коли R являє собою СІ та R2 являє собою СІ або Вr, тоді R3 не являє собою СН3 або СН(СН3)2; та3 та R2 являє собою CN, тоді R3 не являє собою Н. Як використовується в даній заявці, мається на увазі, що терміни "містить", "що містить", "включає", "включаючи", "має", "маючи" або будь-яка їх інша варіація відносяться до невиняткового включення. Наприклад, композиція, процес, спосіб, продукт або апарат, який включає перелік елементів, не обмежується обов'язково лише цими елементами, а він може включати інші елементи не зазначені чітко в переліку або властиві такій композиції, процесу, способу, продукту або апарату. Надалі, якщо тільки не зазначено інше, "або" відноситься до включаючого "або" та до не виключаючого "або". Наприклад, умова А або В задовольняє будь-якому з наступного: А вірне (або присутнє) та В невірне (або відсутнє), А невірне (або відсутнє) та В вірне (або присутнє), та як А, так і В вірні (або присутні). Об'єднання хімічних сполук відноситься до контактування хімічних сполук одна з одною. Також, мається на увазі, що невизначені артиклі "а" та "an", що передують елементу або компоненту винаходу, необмежені щодо кількості прикладів (тобто випадків) елемента або компонента. Таким чином, потрібно читати, що "а" або "an" включають один або, принаймні, один, та однина елемента або компонента також включає множину, за винятком, коли число явно означає однину. Радикал, що містить вуглець, відноситься до моновалентного молекулярного компонента, що містить атом вуглецю, який зв'язує радикал із залишком хімічної структури через простий зв'язок. Радикали, що містять вуглець, необов'язково можуть включати насичені, ненасичені та ароматичні групи, ланцюги, кільця та кільцеві системи та гетероатоми. Хоча радикали, що містять вуглець, не мають ніякого конкретного обмеження за розміром, в контексті даного винаходу вони звичайно містять 1-16 атомів вуглецю та 0-3 гетероатомів. Прикладами є радикали, що містять вуглець, вибрані з С1-С6 алкілу, С1-С4 галоалкілу та фенілу, необов'язково заміщеного 1-3 замісниками, вибраними з Сі-С3 алкілу, галогену та нітро. В переліку термінів в даній заявці, абревіатура "Ph" означає феніл. Алкіл може бути лінійним або розгалуженим. Термін "галоген", сам по собі або в складених словах, таких як "галоалкіл", включає фтор, хлор, бром або йод. Надалі, коли він використовується в складених словах, таких як "галоалкіл", зазначений алкіл може бути частково або повністю заміщений атомами галогену, які можуть бути однаковими або різними. Приклади "галоалкілу" включають F3C, ClCH2, CF3CH2 та CF3CCl2. Втілення даного винаходу включають: Втілення МІ. Спосіб, в якому молярне співвідношення сполуки Формули 2 до сполуки Формули 3 складає від приблизно 1,2:1 до приблизно 1:1,2. Втілення М2. Спосіб за Втіленням М1, де молярне співвідношення сполуки Формули 2 до сполуки Формули 3 складає від приблизно 1:1 до приблизно 1:1,2. 93861 6 Втілення М3. Спосіб за Втіленням М2, де молярне співвідношення сполуки Формули 2 до сполуки Формули 3 складає приблизно 1:1,1. Втілення М4. Спосіб, в якому молярне співвідношення сульфоніл хлориду до сполуки Формули 2 складає, принаймні, приблизно 1:1. Втілення М5. Спосіб за Втіленням М4, в якому молярне співвідношення сульфоніл хлориду до сполуки Формули 2 складає від приблизно 1:1 до приблизно 2,5:1. Втілення М6. Спосіб за Втіленням М5, в якому молярне співвідношення сульфоніл хлориду до сполуки Формули 2 складає від приблизно 1,1:1 до приблизно 1,4:1. Втілення М7. Спосіб за Втіленням М6, де, коли R2 являє собою Br, Cl або І, тоді молярне співвідношення сульфоніл хлориду до сполуки Формули 2 складає 1,2:1. Втілення М8. Спосіб за Втіленням М6, де, коли R2 являє собою CN, тоді молярне співвідношення сульфоніл хлориду до сполуки Формули 2 складає приблизно 1,4:1. Втілення М9. Спосіб, в якому сульфоніл хлорид має Формулу 4 R8S(O)2Cl 4 де R являє собою радикал, що містить вуглець. Втілення М10. Спосіб за Втіленням М9, де R8 являє собою С1-С4алкіл, С1-С2 галоалкіл або феніл, необов'язково заміщений 1-3 замісниками, вибраними з групи, що включає галоген, C1-С3 алкіл та нітро. Втілення М11. Спосіб за Втіленням М10, де R являє собою С1-С2 алкіл, CF3, феніл або 4метилфеніл. Втілення М12. Спосіб за Втіленням М11, де R являє собою С1-С2 алкіл, феніл або 4-метилфеніл. Втілення М13. Спосіб за Втіленням М12, де R являє собою СН3. Втілення М14. Спосіб, в якому карбонову кислоту Формули 2, анілін Формули 3 та сульфоніл хлорид об'єднують при температурі від приблизно -70 до 100°С. Втілення М15. Спосіб за Втіленням М14, де температура знаходиться в межах від приблизно 20 до 40°С. Втілення М16. Спосіб за Втіленням М15, де температура знаходиться в межах від приблизно 10 до 20°С. Втілення М17. Спосіб, в якому карбонову кислоту Формули 2 об'єднують з аніліном Формули 3 з одержанням суміші, та потім суміш об'єднують з сульфоніл хлоридом. Втілення М18. Спосіб за Втіленням М17, де основу об'єднують з сумішшю або до, або після об'єднання з сульфоніл хлоридом. Втілення М19. Спосіб за Втіленням М17, де основу об'єднують зі сполукою Формул 2 та 3 з одержанням суміші до об'єднання з сульфоніл хлоридом. Втілення М20. Спосіб, в якому основу об'єднують зі сполуками Формули 2 та 3 і сульфоніл хлоридом. Втілення М21. Спосіб за будь-яким з Втілень М18-М20, де кількість основи складає, принаймні, 7 приблизно 2 еквівалентів щодо сульфоніл хлориду. Втілення М22. Спосіб за Втіленням М21, де кількість основи складає, принаймні, приблизно 2,1 еквівалентів щодо сульфоніл хлориду. Втілення М23. Спосіб за Втіленням М22, де кількість основи складає від приблизно 2,1 до 2,2 еквівалентів щодо сульфоніл хлориду. Втілення М24. Спосіб за будь-яким з Втілень М18-М20, де основа вибрана з третинних амінів (включаючи необов'язково заміщені піридини). Втілення М25. Спосіб за Втіленням М24, де основа вибрана з необов'язково заміщених піридинів та їх сумішей. Втілення М26. Спосіб за Втіленням М25, де основа вибрана з 2-піколіну, 3-піколіну, 2,6лутидину, піридину та сумішей наведеного вище. Втілення М27. Спосіб за Втіленням М26, де основа являє собою 3-піколін. Втілення М28. Спосіб, в якому розчинник об'єднують зі сполуками Формули 2 та 3 і сульфоніл хлоридом. Втілення М29. Спосіб за Втіленням М17, де розчинник об'єднують зі сполуками Формул 2 та 3 з одержанням суміші до об'єднання із сульфоніл хлоридом. Втілення М30. Спосіб за Втіленнями М28 або М29, де розчинник вибраний з нітрилів (наприклад, ацетонітрил, пропіонітрил), складних ефірів (наприклад, метил ацетат, етил ацетат, бутил ацетат), кетонів (наприклад, ацетон, метил етил кетон, метил бутил кетон), галоалканів (наприклад, дихлорметан, трихлорметан), простих ефірів (наприклад, етиловий ефір, метил трет-бутиловий ефір, тетрагідрофуран, р-діоксан), ароматичних вуглеводнів (наприклад, бензол, толуол, хлорбензол, дихлорбензол), третинних амінів (наприклад, триалкіламіни, діалкіланіліни, необов'язково заміщені піридини) та сумішей наведеного вище. Втілення М31. Спосіб за Втіленням М30, де розчинник вибраний з третинних амінів (наприклад, триалкіламіни, діалкіланіліни, необов'язково заміщені піридини) та сумішей наведеного вище. Втілення М32. Спосіб за Втіленням М30, де розчинник вибраний з нітрилів (наприклад, ацетонітрил, пропіонітрил), складних ефірів (наприклад, метил ацетат, етил ацетат, бутил ацетат), кетонів (наприклад, ацетон, метил етил кетон, метил бутил кетон, галоалкани (наприклад, дихлорметан, трихлорметан), простих ефірів (наприклад, етиловий ефір, метил трет-бутиловий ефір, тетрагідрофуран, р-діоксан), ароматичних вуглеводнів (наприклад, бензол, толуол, хлорбензол, дихлорбензол) та сумішей наведеного вище. Втілення М33. Спосіб за Втіленням М32, де розчинник являє собою ацетонітрил. 93861 8 Втілення С1. Сполука Формули 3, де R1 являє собою СН3. Втілення С2. Сполука Формули 3, де R2 являє собою Вr або Сl. 2 Втілення СЗ. Сполука Формули 3, де R являє собою І. Втілення С4. Сполука Формули 3, де R являє собою CN. Втілення С5. Сполука Формули 3, де R3 являє собою Н або СН3. Втілення С6. Сполука Формули 3, де R3 являє собою СН3. Прикладами є сполуки Формули 3, в яких R1 являє собою СН3, R2 являє собою СІ та R3 являє собою Н, СН2СН3, СН2СН2СН3, СН2СН2СН2СН3, СН2СН(СН3)2, СН(СН3)СН2СН3 або С(СН3)3. Також прикладами є сполуки Формули 3, в яких R1 являє собою СН3, R2 являє собою Вr та R3 являє собою Н, СН2СН3, СН2СН2СН3, СН2СН2СН2СН3, СН2СН(СН3)2, СН(СН3)СН2СН3 або С(СН3)3. Також прикладами є сполуки Формули 3, в яких R1 являє собою СН3, R2 являє собою І та R3 являє собою Н, СН3, СН2СН3, СН2СН2СН3, СН(СН3)2, СН2СН2СН2СН3, СН2СН(СН3)2, СН(СН3)СН2СН3 або С(СН3)3. Також прикладами є сполуки Формули 3, в яких R являє собою СН3, R являє собою CN та R3 являє собою СН2СН3, СН2СН2СН3, СН2СН2СН2СН3, СН2СН(СН3)2, СН(СН3)СН2СН3 або С(СН3)3. Також прикладами є сполуки Формули 3, в яких R1 являє собою СІ, R2 являє собою СІ та R3 являє собою СН2СН2СН3, СН2СН2СН2СН3, СН2СН(СН3)2 або С(СН3)3. Також прикладами є сполуки Формули 3, в яких R являє собою СІ, R являє собою Вr та R являє собою Н, СН2СН3, СН2СН2СН3, СН2СН2СН2СН3, СН2СН(СН3)2, СН(СН3)СН2СН3 або С(СН3)3. Також прикладами є сполуки Формули 3, в яких R являє собою СІ, R являє собою І та R3 являє собою Н, СН3, СН2СН3, СН2СН2СН3, СН(СН3)2, СН2СН2СН2СНз, СН2СН(СН3)2, СН(СН3)СН2СН3 або С(СН3)3. Також 1 прикладами є сполуки Формули 3, в яких R являє 2 3 собою СІ, R являє собою CN та R являє собою Н, СН3, СН2СН3, СН2СН2СН35 СН(СН3)2, СН2СН2СН2СН3, СН2СН(СН3)2, СН(СН3)СН2СН3 або С(СН3)3. На наступних Схемах визначення R1, R2, R3, 4 R , R5 та R6 в сполуках Формул 1-34 нижче є такими, як наведено вище в Короткому описі суті винаходу та описі втілень, якщо не вказано інше. Як показано на Схемі 1, даний винахід відноситься до способу одержання сполук Формули 1 за допомогою сполучення карбонових кислот Формули 2 з антраніламідами Формули 3, використовуючи сульфоніл хлорид, звичайно в присутності основи та розчинника. 9 Таким чином, в даному способі піразолкарбонову кислоту Формули 2, анілін Формули 3 та сульфоніл хлорид об'єднують (тобто піддають реакції) з одержанням відповідного N-феніл-піразол-1карбоксаміду Формули 1. Хоча можливим є широкий діапазон співвідношень реагентів, номінальне мольне співвідношення сполуки Формули 3 до сполуки Формули 2 звичайно складає від приблизно 0,9 до 1,1 та переважно складає приблизно 1,0, таким чином, що обидві сполуки можуть повністю вступати в реакцію. Даний спосіб може бути проведений в широкому діапазоні температур, але звичайно його проводять при температурах в діапазоні від -70°С до +100°С. Прикладами є температури від -20°С до +40°С. Характерним прикладом щодо придатного здійснення, сприятливої швидкості реакції і селективності та високого виходу процесу є температури від -10°С до +20°С. Сульфоніл хлорид використовують як реагент, щоб полегшити сполучення карбонової кислоти з антраніламідом, з одержанням N-фенілпіразол-1карбоксаміду. Номінальне мольне співвідношення сульфоніл хлориду до сполуки Формули 2 звичайно складає від приблизно 1,0 до 2,5, та переважно складає від приблизно 1,1 до 1,4, коли побічна реакція циклізації, описана нижче, відбувається до не більше, ніж малого ступеня (тобто 0-10%). Сульфоніл хлориди загалом мають формулу R8S(O)2Cl (Формула 4), де R являє собою радикал, що містить вуглець. Звичайно в даному способі R8 являє собою С1-С4 алкіл, С1-С2 галоалкіл або феніл, необов'язково заміщений 1-3 замісниками, вибраними з групи, що включає галоген, С1-С3 алкіл та нітро. Сульфоніл хлориди, які є переважними для даного способу завдяки їх комерційній доступності, включають метансульфоніл хлорид (R8 являє собою СН3), пропансульфоніл хлорид (R являє собою (СН2)2СН3), бензолсульфоніл хлорид (R8 являє собою Ph) та р-толуолсульфоніл хлорид (R8 являє собою 4-СН3-Ph). Завдяки більш низькій вартості, легкості додавання та/або меншим втратам більш переважним є метансульфоніл хлорид. В даному способі, сульфоніл хлорид об'єднують з піразолкарбоновою кислотою Формули 2 та аніліном Формули 3. Реагенти можуть бути об'єднані в різному порядку, як наприклад об'єднання сульфоніл хлориду з карбоновою кислотою Фор 93861 10 мули 2 з одержанням суміші, та потім об'єднання суміші з аніліном Формули 3. Проте, для одержання конкретних N-фенілпіразол-і-карбоксамідів Формули 1, був знайдений найбільш переважний порядок об'єднання, який включає об'єднання карбонової кислоти Формули 2 з аніліном Формули 3 з одержанням суміші, та потім об'єднання сульфоніл хлориду із сумішшю (наприклад, додавання сульфоніл хлориду до суміші сполук Формул 2 та 3), оскільки даний порядок додавання дозволяє зручно контролювати процес сполучення. Швидкість реакції легко контролюється за допомогою контролю швидкості додавання сульфоніл хлориду. Таким чином, приклад втілення даного способу включає послідовні стадії (1) об'єднання карбонової кислоти Формули 2 та аніліну Формули 3 з одержанням суміші та потім об'єднання суміші з сульфоніл хлоридом. Хоча додавання сульфоніл хлориду до суміші, що містить анілін Формули 2, потенційно могло б привести до небажаних побічних реакцій, було відкрито, що специфічні стереоелектронні профілі сполук Формул 2 та 3 полегшують утримання надзвичайно високих виходів сполук Формули 1, використовуючи даний спосіб. Сполуку Формули 1 одержують, коли вихідні сполуки Формул 2 та 3 і сульфоніл хлорид контактують один з одним в об'єднаній рідкій фазі, в якій кожний є, принаймні, частково розчинним. Особливо, оскільки вихідні речовини Формул 2 та 3 є звичайно твердими речовинами при звичайних температурах навколишнього середовища, спосіб найбільш задовільно проводять, використовуючи розчинник, в якому вихідні сполуки мають істотну розчинність. Таким чином, звичайно спосіб проводять в рідкій фазі, що містить розчинник. В деяких випадках карбонова кислота Формули 2 може мати тільки легку розчинність, але її сіль з доданою основою може мати більшу розчинність в розчиннику. Прийнятні розчинники для цього способу включають нітрили, такі як ацетонітрил та пропіонітрил; складні ефіри, такі як метил ацетат, етил ацетат та бутил ацетат; кетони, такі як ацетон, метил етил кетон (МЕК) та метил бутил кетон; галоалкани, такі як дихлорметан та трихлорметан; прості ефіри, такі як етиловий ефір, метил третбутиловий ефір, тетрагідрофуран (THF) та рдіоксан; ароматичні вуглеводні, такі як бензол, толуол, хлорбензол та дихлорбензол; третинні 11 93861 12 аміни, такі як триалкіламіни, діалкіланіліни та необов'язково заміщені піридини; та суміші наведеного вище. Приклади розчинників включають ацетонітрил, пропіонітрил, етил ацетат, ацетон, МЕК, дихлорметан, метил трет-бутиловий ефір, THF, рдіоксан, толуол та хлорбензол. Конкретним прикладом розчиннику є ацетонітрил, оскільки він часто забезпечує продукти з високим виходом-та/або чистотою. Оскільки реакція даного способу надає хлорид водню як побічний продукт, який буде, в протилежному випадку, зв'язуватися з основними центрами на сполуках Формул 1, 2 та 3, спосіб найбільш задовільно проводять в присутності, принаймні, однієї доданої основи. Основа також може полегшити конструктивну взаємодію карбонової кислоти з сульфоніл хлоридом та антраніламідом. В результаті реакції доданої основи з карбоновою кислотою Формули 2 одержують сіль, яка може мати більшу розчинність, ніж карбоноваг кислота в реакційному середовищі. Хоча основа може бути додана в той же час, по черзі або навіть після додавання сульфоніл хлориду, основу звичайно] додають перед додаванням сульфоніл хлориду. Деякі розчинники, такі як, третинні аміни, також служать, як основи, та коли їх використовують як розчинники, вони будуть знаходитися у великому стехіометричному надлишку, як основи. Коли основу не використовують як розчинник, номінальне мольне співвідношення необхідної основи до необхідного сульфоніл хлориду звичайно складає від приблизно 2,0 до 2,2, та переважно складає від приблизно 2,1 до 2,2. Переважними основами є третинні аміни, включаючи заміщені піридини. Більш переважні основи включають 2-піколін, 3піколін, 2,6-лутидин та піридин. Конкретним прикладом основи є 3-піколін, оскільки його солі з карбоновими кислотами Формули 2 є часто надзвичайно розчинними в розчинниках, таких як ацетонітрил. Особливості даного способу забезпечують ефективне одержання N-фенілпіразол-1карбоксаміду Формули 1, одночасно обмежуючи кількості карбонової кислоти, сульфоніл хлориду та антраніламіду, які витрачаються при утворенні N-фенілпіразол-і-карбоксаміду, та знижуючи втрати. Даний спосіб дозволяє зручний контроль процесу сполучення та забезпечує спосіб, що залучає меншу кількість та більш прості дії в порівнянні з попередньо відомими процесами для одержання N-фенілпіразол-і-карбоксамідів, таких як Формула 1. В переважному втіленні даного способу об'єднують піразолкарбонову кислоту Формули 2, антранілову кислоту Формули 3 та прийнятну основу в прийнятному розчиннику, з наступним додаванням сульфоніл хлориду (або самого по собі, або змішаного з прийнятним розчинником). Продукт N-фенілпіразол-і-карбоксамідів Формули 1 може бути виділений з реакційних сумішей за допомогою способів, відомих фахівцю в даній галузі техніки, включаючи кристалізацію, фільтрування та екстракцію. Як показано на Схемі 2, в деяких випадках, в умовах реакції сполучення відбувається часткова циклізація амідів 1 до імінобензоксазинів Формули цикло-1. В цих випадках, часто вигідним є перетворення сполуки Формули цикло-1 назад на амід Формули 1 перед виділенням продукту реакції. Це перетворення може бути завершене обробкою реакційної суміші водною кислотою. Альтернативно, суміш імінобензоксазину Формули цикло-1 та аміду Формули 1 може бути виділена та ця суміш потім може бути перетворена на амід Формули 1, наприклад, обробкою розбавленою водною кислотою, необов'язково в присутності прийнятного органічного розчинника. В переважних умовах цього процесу побічна реакція циклізації перетворення бажаного продукту Формули 1 на сполуку Формули цикло-1 звичайно відбувається лише в незначному ступені, якщо взагалі відбувається, в цих випадках переважні співвідношення сульфоніл хлориду та основи достатні для завершення реакції сполучення. Проте, для деяких піразолкарбонових кислот Формули 2, антранілових кислот Формули 3 (як наприклад ті, в яких R являє собою CN) та умов реакції (наприклад, використовуючи стерично блоковані заміщені піридини, такі як 2,6-лутидин як основи) перетворення бажаного продукту Формули 1 на сполуку Формули цикло-1 може відбуватися до більш значного ступеня або може бути переважною реакцією. В цих випадках, використання більших співвідношень сульфоніл хлориду та основи може полегшити завершення реакції сполучення. В побічній реакції циклізації стехіометрично поглинається еквівалент сульфоніл хлориду на додаток до еквівалента сульфоніл хлориду, що поглинається 13 93861 14 в реакції сполучення. Таким чином, якщо має відбуватися 100% циклізація, для досягнення повного використання вихідних речовин стехіометрично буде необхідним мольне співвідношення сульфоніл хлориду до сполуки Формули 2 2:1, та звичайно буде використовуватися мольне співвідношення сульфоніл хлориду до сполуки Формули 2 до приблизно 2,5:1, на відміну від мольного співвідношення сульфоніл хлориду до сполуки Формули 2 приблизно 1,4:1, коли циклізація відбувається тільки зі ступенем 5-10% (як наприклад звичайно з більшістю основ, коли R являє собою CN), та мольного співвідношення сульфоніл хлориду до сполуки Формули 2 приблизно 1,2:1, коли побічна реакція циклізації є незначною (як наприклад звичайно з більшістю основ, коли R являє собою Вr, СІ або І). Можуть бути додані додаткові кількості сульфоніл хлориду та основи, поки протікає реакція, якщо спостерігають, що буде відбуватися реакція циклізації. Зазначене вище ілюструє цінну особливість цього процесу, якою є те, що додаткові кількості будь-якого з компонентів процесу можуть бути додані в будь-який час, як необхідно для завершення перетворення. Інша ілюстрація значення цієї особливості відноситься до ситуації, коли або компонент Формули 2, або компонент Формули 3 ненавмисно взятий в заниженій кількості щодо реакційної суміші. Ця занижена кількість може бути виявлена за допомогою аналізу реакційної суміші, використовуючи будь-який з різноманітних спосо бів, які є загальновідомими та доступними, включаючи ВЕРХ та ЯМР. Коли це буде виявлено, занижена кількість може бути скоректована за допомогою додавання більшої кількості відповідного компоненту до реакційної суміші. Це може бути особливо важливим для великомасштабних синтезів, оскільки це дозволяє виправити помилку завантаження та в результаті запобігає марній витраті дорогої проміжної сполуки, яка, в протилежному випадку, може мати місце. Піразолкарбонові кислоти Формули 2 можуть бути одержані, використовуючи способи гетероциклічного синтезу, відомі з літератури, включаючи посилання, знайдені в наступних збірниках: Rodd's Chemistry of Chemistry of Carbon Compounds, Vol. IVa to IV1, S. Coffey editor, Elsevier Scientific Publishing, New York, 1973; Comprehensive Heterocyclic Chemistry, Vol. 1-7, A. R. Katritzky and C. W. Rees editors, Pergamon Press, New York, 1984; Comprehensive Heterocyclic Chemistry II, Vol. 1-9, A. R. Katritzky, C. W. Rees, and E. F. Scriven editors, Pergamon Press, New York, 1996; та випусках, The Chemistry of Heterocyclic Compounds, E. C. Taylor, editor, Wiley, New York. Різноманітні гетероциклічні кислоти (включаючи піразолкарбонові кислоти) та загальні способи їх синтезу можуть бути знайдені в публікації РСТ WO 98/57397. Одна особливо корисна методика одержання піразолкарбонових кислот Формули 2а наведена на Схемі 3. Реакція піразолу Формули 6 з 2-галопіридином Формули 7 надає високі виходи 1піридинілпіразолу Формули 8 з високою специфічністю для бажаної регіохімії. Металування сполуки Формули 8 діізопропіламідом літію (LDA) з наступним гасінням солі літію діоксидом вуглецю надає 1-(2-піридиніл)піразолкарбонову кислоту Формули 2а. Для основного посилання на цей спосіб див. публікацію РСТ WO 03/015519. Як показано на Схемі 4, піразолкарбонові кислоти Формули 2Ь можуть бути одержані за допомогою 3+2 циклоприєднання відповідно заміщеного іміногалогеніду Формули 9 або із заміщеними пропіолатами Формули 10, або з акрилатами Формули 11. 15 93861 16 Циклоприєднання з акрилатами потребує додаткового окиснення проміжного піразоліну до піразолу. Гідроліз ефіру Формули 12 надає піразолкарбонові кислоти Формули 2b. Переважні іміногалогеніди для цієї реакції включають трифторметил імінохлорид Формули 9а та імінодибромід Формули 9Ь. Сполуки, як наприклад Формули 9а, відомі (J. Heterocycl. Chem. 1985, 22(2), 565-8). Інші сполуки Формули 9, як наприклад Формули 9b, доступні за допомогою відомих способів (Tetrahedron Letters 1999, 40, 2605). Інший спосіб одержання піразолкарбонових кислот Формули 2b наведений на Схемі 5. Піразоли Формули 13 можуть бути конденсовані з арил йодидами, використовуючи способи, такі як розкриті A. Klapars, J. C. Antilla, X. Huang and S. L. Buchwald, J. Am. Chem. Soc. 2001, 123, 7727-7729, або з арил бороновими кислотами, використовуючи способи, такі як розкриті P. Y. S. Lam, C. G. Clark, S. Saubern, J. Adams, M. P. Winters, D. M. T. Chan and A. Combs, Tetrahedron Lett. 1998, 39, 2941-2944. Одержані адукти Формули 15 можуть бути окиснені окисниками, такими як наприклад перманганат калію, з одержанням піразолкарбонових кислот Формули 2b. Вихідні піразоли Формул 6 та 13 є відомими сполуками або можуть бути одержані за допомогою відомих способів. Наприклад, піразол Формули 6а (сполука Формули 6, в якій R4 являє собою CF3) може бути одержаний за допомогою методик, описаних в літературі (J. Fluorine Chem. 1991, 55(1), 61-70). Піразоли Формули 6b (сполуки Формули 6, в яких R4 являє собою СІ або Вr) можуть 17 93861 бути одержані за допомогою методики, описаної в Chem. Ber. 1966, 99(10), 3350-7. Корисний альтернативний спосіб одержання сполуки Формули 6b наведений на Схемі 6. Схема 6 Окисником може бути пероксид водню, органічні пероксиди, персульфат калію, персульфат натрію, персульфат амонію, моноперсульфат калію (наприклад, Охопе®) або перманганат калію. Це окислення може бути проведене в присутності розчинника, переважно ефіру, такого як тетрагідрофуран, р-діоксан та подібний, органічного ефіру, такого як етил ацетат, диметил карбонат та подіб 18 Металування сульфамоїлпіразолу Формули 16 н-бутиллітієм з наступним безпосереднім галогенуванням аніону або гексахлоретаном (для R4-Cl), або 1,2-дибромтетрахлоретаном (для R4-Br) надає галогеновані похідні Формули 17а. Видалення сульфамоїльної групи трифтороцтовою кислотою (TFA) при кімнатній температурі відбувається точно та з високим виходом, надаючи піразоли Формули 6с. Фахівець в даній галузі техніки розпізнає, що Формула 6с є таутомером Формули 6b. Піразолкарбонові кислоти 2 також можуть бути одержані за допомогою окиснення піразоліну Формули 18 з одержанням піразолу Формули 19, з наступним гідролізом до карбонової кислоти, як наведено на Схемі 7. ний, або полярної апротонної органічної речовини, такої як N,N-диметилформамід, ацетонітрил та подібний. Галопіразоліни 18, в яких R4 являє собою СІ або Вr, можуть бути одержані з піразолонів Формули 20 обробкою відповідним галогенуючим агентом, як наведено на Схемі 8. 19 Галогенуючі реагенти, які можуть бути використані, включають оксигалогеніди фосфору, тригалогеніди фосфору, пентагалогеніди фосфору, тіоніл хлорид, дигалотриалкілфосфорани, дигалотрифенілфосфорани, оксаліл хлорид та фосген. Переважними є оксигалогеніди фосфору та пентагалогеніди фосфору. Типові розчинники для цього галогенування включають галогеновані алкани, такі як дихлорметан, хлороформ, хлорбутан та подібні, ароматичні розчинники, такі як бензол, ксилен, хлорбензол та подібні, прості ефіри, такі як тетрагідрофуран, р-діоксан, діетиловий ефір та подібні, та полярні апротонні розчинники, такі як ацетонітрил, N,N-диметилформамід та подібні. Необов'язково може бути додана органічна основа, така як триетиламін, піридин, N,Nдиметиланалін або подібні. Також, як варіант, може бути доданий каталізатор, такий як N,Nдиметилформамід. Альтернативно, сполуки Формули 18, в яких R4 являє собою галоген, можуть бути одержані обробкою відповідних сполук Формули 18, в яких R4 являє собою інший галоген (наприклад, СІ для 93861 20 отримання Формули 18, де R4 являє собою Вr) або сульфонатну групу, таку як метансульфонат, бензолсульфонат або р-толуолсульфонат, з бромідом водню або хлоридом водню, відповідно. За допомогою цього способу R4 галоген або сульфонатний замісник у Формулі 18 вихідної сполуки замінюють на Вr або СІ з броміду водню або хлориду водню, відповідно. Вихідні сполуки Формули 18, в яких R4 являє собою СІ або Вr, можуть бути одержані з відповідних сполук Формули 20, як вже описано. Вихідні сполуки Формули 18, в яких R4 являє собою сульфонатну групу, можуть бути також одержані з відповідних сполук Формули 20 за допомогою стандартних способів, таких як обробка сульфоніл хлоридом (наприклад, метансульфоніл хлоридом, бензолсульфоніл хлоридом або ртолуолсульфоніл хлоридом) та основою, такою як третинний амін (наприклад, триетиламін), у прийнятному розчиннику, такому як дихлорметан. Піразолкарбонові кислоти Формули 2с, в яких R4 являє собою OCHF2 або OCH2CF3, можуть бути одержані за допомогою способу, наведеного на Схемі 9. Схема 9 В цьому способі, замість галогенування, як показано на Схемі 8, сполуку Формули 20 окиснюють до сполуки Формули 21. Умовами реакції для цього окиснення є ті, які вже описані для перетворення сполуки Формули 18 на сполуку Формули 19 на Схемі 7. Сполука Формули 21 потім може бути алкілована з одержанням сполуки Формули 22 за допомогою контактування з дифторкарбеном, одержаним in situ з CHC1F2 в присутності основи. Сполука Формули 21 також може бути алкілована з одержанням сполуки Формули 24 за допомогою контактування з алкілуючим агентом CF3CH2Lg в присутності основи. Реакцію алкілування загалом проводять в розчиннику, який може містити прості ефіри, такі як тетрагідрофуран або діоксан, та полярні апротонні розчинники, такі як ацетонітрил, 21 93861 22 Н,Н-диметилформамід та подібні. Основа може бути вибрана з неорганічних основ, таких як карбонат калію, гідроксид натрію або гідрид натрію. Переважно реакцію проводять, використовуючи карбонат калію з N,N-диметилформамідом або ацетонітрилом як розчинником. В алкілуючому агенті CF3CH2Lg, Lg являє собою нуклефуг (тобто групу, що відходить), такий як галоген (наприклад, Br, I), OS(O)2CH3 (метансульфонат), OS(O)2CF3, OS(O)2Ph-p-CH3 (р толуолсульфонат) та подібний. Продукт Формули 22 може бути виділений за допомогою стандартних способів, таких як екстракція. Ефіри потім можуть бути перетворені на карбонові кислоти Формули 2с за допомогою способів, вже описаних для перетворення Формули 12 на Формулу 2b на Схемі 4. Сполуки Формули 20 можуть бути одержані зі сполук Формули 25, як наведено на Схемі 10. В цьому способі, гідразин Формули 25 піддають реакції зі сполукою Формули 26 (можуть бути використані фумаратний ефір або малеатний ефір чи їх суміш ) в присутності основи та розчинника. Основа звичайно являє собою алкоксидну сіль металу, таку як метоксид натрію, метоксид калію, етоксид натрію, етоксид калію, трет-бутоксид калію, трет-бутоксид літію та подібні. Можуть бути використані полярні протонні та полярні апротонні органічні розчинники, такі як спирти, ацетонітрил, тетрагідрофуран, N,N-диметилформамід, диметил сульфоксид та подібні. Переважними розчинниками є спирти, такі як метанол та етанол. Особливо переважним є спирт, що відповідає (тобто є таким самим, з якого утворюється) фумаратному або малеатному ефіру та алкоксидній основі. Залежно від умов реакції та засобів виділення, функція CO2R на сполуці Формули 20 може бути гідролізована до -СО2Н; наприклад, присутність води в реакційній суміші може сприяти такому гідролізу. Як що утворюється карбонова кислота (-СО2Н), вона може бути перетворена назад на -CO2R, де R являє собою С1-С4 алкіл, використовуючи способи естерифікації, добре відомі з рівня техніки. Бажаний продукт, сполука Формули 20, може бути виділений за допомогою способів, відомих фахівцю в даній галузі техніки, таких як кристалізація, екстракція або перегонка. Інший аспект даного винаходу відноситься до антраніламідів Формули 3, ( яка є важливими проміжними сполуками в процесі за даним винаходом. Зразки антраніламідів Формули 3 також корисні як аналітичні стандарти для визначення наявності антраніламідів. Антраніламіди Формули 3 можуть бути одержані за допомогою реакції ізатових ангідридів Формули 27 з аміаком або алкіламінами, як наведено на Схемі 11, використовуючи методики, такі як описані L. H.Sternbach et al.J. Org. Chem. 1971, 36.777-781. 23 Ізатові ангідриди Формули 27 можуть бути одержані за допомогою різних відомих способів, які наведені в хімічній літературі. Наприклад, ізатові ангідриди доступні з відповідних антранілових кислот за допомогою циклізації, залучаючи реакцію антранілової кислоти з фосгеном або еквіва 93861 24 лентом фосгену. Для основних посилань на способи, див. Coppola, Synthesis 1980, 505 та Fabis et al., Tetrahedron, 1998, 10789. Синтез ізатових ангідридів Формули 27 також може бути проведений з ізатинів Формули 30, як наведено на Схемі 12. Схема 12 Ізатини Формули 30 доступні з анілінових похідних Формули 29, використовуючи методики, відомі з літератури, як наприклад F. D. Popp, Adv. Heterocycl. Chern. 1975,18, 1-58 та J. F. M. Da Silva et al., Journal of the Brazilian Chemical Society 2001, 12(3), 273-324. Окиснення ізатину 30 пероксидом водню загалом надає високі виходи відповідного ізатового ангідриду 28 (G. Reissenweber and D. Mangold, Angew. Chem. Int. Ed. Engl. 1980,19, 222223). Як наведено на Схемі 13, ізатини Формули 30, в яких R2 являє собою СІ, Вr або І, також доступні з 5-незаміщених ізатинів Формули 31 за допомогою галогенування. Заміщення ціаніду потім може забезпечити ізатини Формули 30а (Формула 30, де R2 являє собою CN). Реакція галогенування може бути проведена, використовуючи різні реагенти та методики, відомі з літератури. Прийнятні реагенти включають елементарні галогени (хлор, бром або йод), реагенти з "позитивним галогеном", такі як трихлорізоціанурова кислота, N-хлорсукцинімід (NCS), Nбромсукцинімід (NBS) або N-йодсукцинімід (NIS), та галогенуючі реагенти, такі як суміші, що містять пероксид водню та галогенід водню. Галоген в 5положенні ізатинів Формули 30, де R2 являє собою СІ, Вr або І, може бути замінений на ціанід, використовуючи способи, відомі з літератури. Ці способи включають використання солі ціаніду, звичайно використовуючи сполуку на основі металу, та часто в присутності ліганда, такого як заміщений фосфін або заміщений бісфосфіноалкан. Прийнятні способи включають ті способи, в яких використовують сполуки на основі паладію, як наприклад описані P. E. Maligres et al., Tetrahedron Letters 1999, 40, 8193-8195, та M. Beller et al., Chem. Eur. J. 2003, 9(8), 1828-1836; в яких використовують сполуки на основі міді, як наприклад описані S. L. Buchwald в J. Am. Chem. Soc. 2003, 125, 2890-2891; та в яких використовують сполуки на основі нікелю, як наприклад описані в Європейському Патенті 384392, та К. Sasaki в Bull Chem. Soc. Japan 2004, 77, 1013-1019, та R.K. Arvela та N. E. Leadbeater в J. Org. Chem. 2003, 68, 91229125. Фахівець в даній галузі техніки прийме до уваги, що, коли R1 являє собою СІ, тоді R2 в Формулі 27 переважно являє собою Вr або І, отримуючи селективність при ціануванні (тобто заміна галогену на ціанід). Як показано на Схемі 14, антраніламіди Формули 3 звичайно доступні з відповідних 2нітробензойних кислот (або ефірів) Формули 32 за допомогою каталітичного гідрогенування нітро групи, з наступною реакцією антранілового ефіру Формули 33 з аміаком або алкіламіном. 25 93861 26 Типові методики відновлення включають відновлення воднем в присутності каталізатора на основі металу, такого як паладій на вугіллі або оксид платини, в гідроксильних розчинниках, таких як етанол та ізопропанол. Відновлення також може бути проведене в присутності цинку в оцтовій кислоті. Ці способи відновлення нітро груп добре описані в хімічній літературі. Також в хімічній літературі добре описано багато способів взаємоперетворень карбонових кислот, ефірів та амідів. Як показано на Схемі 15, антраніламіди Формули 3 також доступні з 5-незаміщених антраніламідів Формули 34 за допомогою галогенування з одержанням антраніламідів Формули 3, де R2 являє собою Вr, СІ або І, необов'язково з наступним ціанідним заміщенням з одержанням антраніламідів Формули 3а (Формула 3, де R2 являє собою CN). Прийнятні способи та методики відомі з літератури та подібні способам і методикам, які описані для галогенувань та ціанідних заміщень, наведених на Схемі 13. Фахівець в даній галузі техніки визнає, що галогенування та ціанування також можуть бути проведені на інших стадіях при одержанні антраніламідів Формули 3. Визнають, що деякі реагенти та умови реакцій, описані вище для одержання сполук Формул 2 та 3, не можуть бути сумісні з певними функціональностями, що присутні в проміжних сполуках. В цих випадках, введення послідовностей захист/зняття захисту або взаємоперетворень функціональних груп в синтез допоможе при отриманні бажаних продуктів. Використання та вибір захисних груп буде очевидним фахівцю в хімічному синтезі (див., наприклад, Т. W. Greene, P. G. M. Wuts, Protective Groups in Organic Synthesis, 2nd ed.; Wiley: New York, 1991). Фахівець в даній галузі техніки визнає, що, в деяких випадках, після введення наданого реагенту, як це зображено на будь-якій конкретній схемі, може бути необхідним проведення додаткових стандартних стадій синтезу, що не описані детально, для завершення синтезу сполук Формул 2 та 3. Фахівець в даній галузі техніки також визнає, що може бути необхідним проведення комбінації стадій, проілюстрованих на зазначених вище схемах, в іншому порядку, ніж наведений, за допомогою конкретної послідовності, представленої для одержання сполук Формул 2 та 3. Фахівець в даній галузі техніки також визнає, що сполуки Формул 2 та 3 і проміжні сполуки, описані в даній заявці, можуть бути піддані різним електрофільним, нуклеофільним, радикальним, органометалічним, окисним та відновним реакціям для введення замісників або модифікації існуючих замісників. Без подальшого уточнення, вважають, що фахівець в даній галузі техніки, використовуючи попередній опис, може застосовувати даний винахід до його найширших меж. Таким чином, наступні Приклади наведено лише для ілюстрації та вони ні в якому випадку не обмежують розкриття. Стадії в наступних Прикладах ілюструють методику для кожної стадії в загальному синтетичному перетворенні, та вихідна речовина для кожної стадії могла не бути обов'язково одержана за допомогою специфічної серії одержання, методика якої описана в інших Прикладах або Стадіях. Відсотки надані на масу, за винятком суміші хроматографічних розчинників або якщо вказано інше. Частини та відсотки для суміші хроматографічних розчинників надані на об'єм, якщо не вказано інше. Спектри !Н ЯМР наведені в м.ч. нижче області тетраметилсилану; "s" означає синглет, "d" означає дублет, "t" означає триплет, "q" означає квартет, "m" означає мультиплет, "dd" означає дублет дублетів, "dt" означає дублет триплетів, "br s" означає уширений синглет. Кількісну ВЕРХ продукту виконували, використовуючи хроматографічну колонку Асе СІ8 або С4 Ultra Inert® (обернено-фазова колонка, 27 виробник MacMod Analytical Inc., Chadds Ford, PA 19317) (розмір часток 3мкм, 4,6мм×15см, елюент 5-80% ацетонітрилу/фосфатний буфер з рН 3). ПРИКЛАД 1 Одержання 2-аміно-5-хлор-N,3диметилбензаміду До суспензії 6-хлор-8-метил-2Н-3,1бензоксазин-2,4(1Н)-діону (211,6г, 1000ммоль) в ацетонітрилі (700 мл) додавали оцтову кислоту (7,3г, 122ммоль). Потім по краплям протягом 30 хвилин при 25-30°С додавали 40% водний метиламін (104мл). Перемішування продовжували протягом 2год, та потім повільно додавали воду (700мл). Одержану суспензію охолоджували до 5°С, та перемішували протягом 30 хвилин при цій температурі. Суспензію потім фільтрували, та тверді речовини промивали водою (3×200мл) та сушили під азотом, одержуючи зазначену у заголовку сполуку у вигляді не зовсім білих голчастих кристалів, 172,8г (вихід 87,0%), т.п.141-143°С. 1Н ЯМР (DMSO-d6) 2,08 (s, 3Н), 2,72 (d, J=4,5Гц, 3Н), 6,34 (br s, 2Н), 7,12 (d, J=2,4Гц, 1Н), 7,39 (d, J=2,4Гц, 1H), 8,31 (br d, 1H). ПРИКЛАД 2 Одержання метил 2-аміно-5-хлор-3метилбензоату Стадія А: Одержання 2-аміно-5-хлор-3метилбензойної кислоти До розчину 2-аміно-3-метилбензойної кислоти (Aldrich, 15,0г, 99,2ммоль) в N,Nдиметилформаміді (50мл) додавали Nхлорсукцинімід (13,3г, 99,2ммоль) та реакційну суміш нагрівали до 100°С протягом 30 хвилин. Нагрівання видаляли та реакційну суміш охолоджували до кімнатної температури та витримували протягом ночі. Реакційну суміш потім повільно виливали в льодяну воду (250мл), осаджуючи білу тверду речовину. Тверду речовину фільтрували та чотири рази промивали водою та потім переміщали в етил ацетат (900мл). Етил ацетатний розчин сушили (MgSO4) та випарювали під зниженим тиском, та залишкову тверду речовину промивали ефіром, одержуючи бажану проміжну сполуку у вигляді білої твердої речовини, 13,9г (вихід 75,4%). 1 Н ЯМР (DMSO-d6) 2,11 (s, 3Н), 7,22 (s, 1Н), 7,55 (s, 1H). Стадія В: Одержання метил 2-аміно-5-хлор-3метилбензоату До суспензії 2-аміно-5-хлор-3-метилбензойної кислоти (тобто продукту зі Стадії А) (92,8г, 500ммоль) в ацетонітрилі (500мл) при 0-5°С додавали 1,4-діаза-біцикло[5.4.0]ундец-7-ен (DBU, 90мл, 92г, 600ммоль), та потім по краплям додавали диметил сульфат (57мл, 76г, 600ммоль) при 0-5°С. Після перемішування протягом 3год при цій температурі, додавали додатковий DBU (15мл) та диметил сульфат (10мл). Після перемішування протягом інших 3год при цій температурі, додавали додатковий DBU (15мл) та диметил сульфат (10мл). Після перемішування протягом інших 2год. при цій температурі, по краплям додавали концентровану соляну кислоту (60мл, 720ммоль) при 010°С. Одержану суспензію перемішували протягом 30 хвилин при 0-5°С, потім фільтрували та тверді 93861 28 речовини промивали 2:1 льодяною водоюацетонітрилом (3×100мл), та сушили під азотом. Неочищений продукт суспендували в метанолі (250мл), додавали воду (1000мл) та суміш перемішували при кімнатній температурі протягом 1год. Потім тверді речовини фільтрували, промивали 4:1 водою-метанолом (100мл), потім водою (3×100мл) та сушили під азотом, одержуючи зазначену у заголовку сполуку у вигляді низькоплавкої білої твердої речовини, 87,6г (вихід 87,8%). ВЕРХ твердого продукту показували 99,7% за площиною піку зазначеного у заголовку ефіру. 1 НЯМР (CDCl3) 2,15 (s, 3Н), 3,87 (s, 3Н), 5,82 (br s, 2H), 7,15 (d, J=2,7Гц, 1H), 7,74 (d,J=2,7Гц,1Н). ПРИКЛАД 3 Одержання 2-аміно-5-хлор-N,3диметилбензаміду До суспензії метил 2-аміно-5-хлор-3метилбензоату (тобто продукту з Прикладу 2) (4,03г, 20,2ммоль) в ацетонітрилі (12,4г) додавали розчин метиламіну (3,1г, 0,10моль) в етилен гліколі (12,4г). Суміш нагрівали при 60°С протягом 23год., та потім охолоджували до кімнатної температури. По краплям додавали воду (25мл) та одержану суспензію охолоджували до 5°С та перемішували протягом 10 хвилин при цій температурі. Суміш фільтрували та тверді речовини промивали водою (3×10мл), та сушили під азотом, одержуючи зазначену у заголовку сполуку у вигляді білих голчастих кристалів, 3,43 г (вихід 85,5%). ПРИКЛАД 4 Одержання 2-аміно-5-хлор-N,3диметилбензаміду Стадія А: Одержання метил 2-аміно-3метилбензоату Метил 3-метил-2-нітробензоат (98,5г, 505ммоль), 5% Pd/C (Degussa CE 105 XRC/W, 1,0г) та ацетонітрил (300мл) об'єднували в 600-мл посудині високого тиску. Суміш нагрівали до 70°С та гідрогенізували при 65 фунт/дюйм (450кПа) протягом 8год. Додавали ще 5% Pd/C (1,0г) та гідрогенування продовжували при 100фунт/дюйм2 (690кПа) протягом 8,5год. Потім реакційну суміш охолоджували, очищали азотом та фільтрували через Celite® діатомовий допоміжний фільтруючий матеріал, промиваючи ацетонітрилом (3×25мл). Об'єднані фільтрати частково випарювали до маси ~160г, та потім розбавляли ацетонітрилом до загальної маси 200г. Кількісна ВЕРХ цього розчину показувала 40,3ваг% зазначеної у заголовку сполуки (80,6г, вихід 97,5%). Стадія В: Одержання метил 2-аміно-5-хлор-3метилбензоату Розчин, одержаний на Стадії А (195г, 475ммоль), розбавляли ацетонітрилом (50мл) та нагрівали до 50°С. Потім протягом 3,25год. додавали розчин сульфурил хлориду (70,6г, 523ммоль) в ацетонітрилі (100мл) при 50-55°С. Негайно після завершення додавання суміш охолоджували до 5°С, додавали воду (150г) та рН розчину коректували до 6,0 за допомогою повільного додавання 50% водного гідроксиду натрію (103г). Після перемішування протягом 10 хвилин при цій температурі, органічний шар відділяли та водний шар екстрагували ацетонітрилом (50мл). Органічні ари 29 об'єднували, сушили (MgSO4) та частково випарювали до маси 193,7г. Кількісна ВЕРХ цього розчину показували 41,5 ваг% зазначеної у заголовку сполуки (80,4г, вихід 84,8%). Стадія С: Одержання 2-аміно-5-хлор-N,3диметилбензаміду Розчин, одержаний на Стадії В (96,2г, 200ммоль), розбавляли ацетонітрилом (60,0г) та етилен гліколем (180г) та азеотропно сушили за допомогою перегонки з насадкою Кляйзена для перегонки до відгонки ~72мл летких речовин. Потім насадку для перегонки заміняли на холодильник, який охолоджували сухим льодом, залишковий розчин охолоджували до 0-5°С, та нижче поверхні реакційної суміші додавали газ метиламін (31,1г, 1000ммоль). Суміш нагрівали при 70°С протягом 17,5год., та потім повільно додавали воду (400мл), осаджуючи продукт. Суміш повільно охолоджували до 5°С, перемішували протягом 15 хвилин при цій температурі, фільтрували та тверді речовини промивали водою та сушили під азотом, одержуючи зазначену у заголовку сполуку (36,36г, вихід 91,5%). ВЕРХ показувала чистоту 99,3% за площиною піку. ПРИКЛАД 5 Одержання 2-аміно-5-хлор-N,3диметилбензаміду Стадія А: Одержання 2-аміно-N,3диметилбензаміду Суміш 2-метил-2Н-3,1-бензоксазин-2,4(1Н)діону (публікація РСТ WO 00/27831) (18г, 0,1моль) та оцтової кислоти (1,2г, 0,02моль) в етил ацетаті (200мл) нагрівали до 35°С, та по краплям додавали водний метиламін (40%, 9,0г, 0,12моль) протягом 50 хвилин при 35-37°С. Потім додавали додатковий водний метиламін (40%, 0,9г, 12ммоль) та суміш перемішували протягом додаткових 2,5год. при 36°С. Потім додавали воду (20мл), шари розділяли та органічний шар промивали водою, сушили (MgSO4) та випарювали, одержуючи зазначену у заголовку сполуку, 15,45г (92%). 1 Н ЯМР (CDCl3) 2,14 (s, 3Н), 2,94 (d, 3Н, J=5Гц), 5,37 (br s, 2H), 6,21 (br s, 1H), 6,56 (t, J=7,5Гц, 1Н), 7,10 (dd, J=7,5Гц, 7,5Гц, 1Н), 7,18 (dd, J=7,5Гц, 7,5Гц, 1H). Стадія В: Одержання 2-аміно-5-хлор-N,3диметилбензаміду Суміш 2-аміно-N,3-диметилбензаміду (тобто продукту зі Стадії А) (16,6г, 100ммоль) та N,Nдиметилформаміду (15,0г) охолоджували до 10°С та повільно додавали концентровану соляну кислоту (70г, 700ммоль). Потім суміш нагрівали до 30°С, та по краплям додавали 30% водний пероксид водню (18,5г, 160ммоль) протягом 15 хвилин при 30-35°С. Після перемішування при приблизно 35°С протягом 3год., суміш охолоджували до приблизно 10°С та потім додавали воду (200мл). Додавали сульфіт натрію (7,56г, 60ммоль) та потім рН коректували до 2,2 за допомогою повільного додавання 50% водного гідроксиду натрію (38,1г). Після перемішування при 10°С протягом 15 хвилин, суміш фільтрували та тверді речовини промивали водою (2×50мл), та сушили у вакуумній шафі, одержуючи зазначену у заголовку сполуку у вигляді рожевої твердої речовини, 14,61г (вихід 93861 30 72,7%). Кількісна ВЕРХ твердого продукту показувала 99,1ваг % зазначеної у заголовку сполуки. ПРИКЛАД 6 Одержання 2-аміно-5-ціано-N,3диметилбензаміду Стадія А: Одержання 2-аміно-5-бром-N,3диметилбензаміду Суміш 2-аміно-N,3-диметилбензаміду (тобто продукту зі Стадії А Прикладу 5) (14г, 85ммоль), оцтової кислоти (50мл) та води (50мл) охолоджували до 12°С та додавали концентровану бромистоводневу кислоту (28,5г, 0,34моль) протягом 10 хвилин при цій температурі. Потім додавали 30% водний пероксид водню (9г, 0,08 моль) протягом 5 хвилин при 10-11°С, та суміш залишали повільно нагріватися до кімнатної температури, одночасно перемішуючи протягом 2,5год. Потім додавали додаткову концентровану бромистоводневу кислоту (2,9г) та суміш перемішували протягом ночі при кімнатній температурі. До суміші потім додавали воду (50мл) та бісульфіт натрію (1,5г), та потім рН коректували до 5-6 за допомогою додавання 50% водного гідроксиду натрію (~15мл). Суміш фільтрували та тверді речовини промивали водою та сушили у вакуумі, одержуючи зазначену у заголовку сполуку, 19,5г (94%). 1 Н ЯМР (CDCl3) 2,14 (s, 3Н), 2,95 (d, J=5Гц, 3Н), 5,55 (br s, 2H), 6,01 (br s, 1H), 7,21 (m, 1H), 7,30 (d, J=2Гц, 1H). Стадія В: Одержання 2-аміно-5-ціано-N,3диметилбензаміду В колбу, очищену сухим азотом, поміщали ацетат паладію (II) (370мг, 1,64ммоль), 1,4біс(дифенілфосфіно)бутан (850мг, 2ммоль), активований порошкоподібний цинк (500мг, 7,64ммоль), ціанід цинку (II) (51г, 434ммоль) та 2аміно-5-бром-N,3-диметилбензамід (тобто продукт зі Стадії А) (200г, 820ммоль). Потім додавали щойно дегазований N,N-диметилформамід (500мл) та суміш нагрівали при 130°С протягом 25,5год. Потім температуру знижували до 95°С та додавали оцтову кислоту (200мл). Суміш барботували азотом, щоб видалити ціанід водню через газопромивні колонки, наповнені водними розчинами гідроксиду натрію та гіпохлориту натрію, одночасно охолоджуючи до кімнатної температури. Потім додавали воду (1500мл) протягом 1,5год та барботування азоту продовжували протягом ночі. Потім суміш фільтрували та тверді речовини промивали водою та сушили у вакуумній шафі, одержуючи зазначену у заголовку сполуку у вигляді рихлої світло-жовтої твердої речовини, 141,5г (вихід 90,9%). 1 Н ЯМР (CDCl3) 2,16 (s, 3Н), 2,98 (d, J=4,8Гц, ЗН), 6,17 (br s, 3H), 7,34 (d, J=1,8Гц, 1Н), 7,56 (d, J=1,8Гц, 1Н). ПРИКЛАД 7 Одержання 3-бром-N-[4-хлор-2-метил-6[(метиламіно)карбоніл]феніл]-1-(3-хлор-2піридиніл)-1Н-піразол-5-карбоксаміду До суміші 3-бром-1-(3 -хлор-2-піридиніл)-1Нпіразол-5-карбонової кислоти (для одержання див. публікацію РСТ WO 03/015519) (чистота 93,6%, 16,16г, 50,0ммоль) та 2-аміно-5-хлор-N,3диметилбензаміду (тобто продукту з Прикладів 1, 31 3, 4 та 5) (10,43г, 52,5ммоль) в ацетонітрилі (35мл) додавали 3-піколін (12,65мл, 12,11г, 130ммоль). Суміш охолоджували до -5°С та потім по краплям додавали розчин метансульфоніл хлориду (4,64мл, 6,89г, 60ммоль) в ацетонітрилі (10мл) при від -5 до 0°С. Суміш перемішували протягом 15 хвилин при цій температурі та потім протягом 3год при кімнатній температурі. Потім по краплям додавали воду (15мл) та суміш охолоджували до 0°С протягом 1год. Суміш фільтрували та тверді речовини промивали 3:1 ацетонітрилом-водою (2×10мл) та потім ацетонітрилом (2×10мл), та сушили під азотом, одержуючи зазначену у заголовку сполуку у вигляді світло-жовто-коричневого порошку, 23,98г (вихід без поправок 92,9%), т.п.від 239 до 240°С. 1 Н ЯМР (CDCl3) 2,18 (s, 3Н), 2,95 (s, 3Н), 6,21 (m, 1H), 7,10 (s, 1H), 7,24 (m, 2H), 7,39 (m, 1H), 7,80 (d, 1H), 8,45 (d, 1H). ПРИКЛАД 8 Одержання 3-бром-N-4-хлор-2-метил-6[(метиламіно)карбоніл]феніл]-1-(3-хлор-2піридиніл)-1Н-піразол-5-карбоксаміду, використовуючи піридин як основу До суміші 3-бром-1-(3-хлор-2-піридиніл)-1Hпіразол-5-карбонової кислоти (для одержання див. публікацію РСТ WO 03/015519) (6,05г, 20,0ммоль) та 2-аміно-5-хлор-N,3-диметилбензаміду (тобто продукту з Прикладів 1, 3, 4 та 5) (4,17г, 21,0ммоль) в ацетонітрилі (18мл) додавали піридин (4,20мл, 4,11г, 52ммоль). Суміш охолоджували до -5 °С та потім по краплям додавали метансульфоніл хлорид (1,86мл, 2,75г, 24ммоль) при від -5 до 0°С. Суміш перемішували протягом 1год. при цій температурі та потім протягом 3год при кімнатній температурі. Потім по краплям додавали воду (6мл) та суміш перемішували при кімнатній температурі протягом 1год. Суміш фільтрували та тверді речовини промивали 3:1 ацетонітрилом-водою (2×4мл) та потім ацетонітрилом (2×4мл), та сушили під азотом, одержуючи зазначену у заголовку сполуку у вигляді не зовсім білого порошку, 9,35г (вихід без поправок 96,8%). ПРИКЛАД 9 Одержання 3-бром-N-[4-хлор-2-метил-6[(метиламіно)карбоніл]феніл]-1-(3-хлор-2піридиніл)-1Н-піразол-5-карбоксаміду, використовуючи "змішані піколіни" як основу До суміші 3-бром-1-(3-хлор-2-шридиніл)-1Нпіразол-5-карбонової кислоти (для одержання див. публікацію РСТ WO 03/015519) (6,05г, 20,0 ммоль) та 2-аміно-5-хлор-N,3-диметилбензаміду (тобто продукту з Прикладів 1, 3, 4 та 5) (4,17г, 21,0ммоль) в ацетонітрилі (18мл) додавали 3піколін (2,53мл, 2,42г, 26ммоль), потім додавали 4піколін (2,53мл, 2,42г, 26ммоль). Суміш ставала більш густою після додавання 4-піколіну. Суміш охолоджували до -5 °С та потім по краплям додавали метансульфоніл хлорид (1,86мл, 2,75г, 24ммоль) при від -5 до 0°С. Суміш перемішували протягом 2год. при від 0 до 5°С. Потім по краплям додавали воду (6мл) та суміш перемішували при 0°С протягом 1год. Суміш фільтрували та тверді речовини промивали 3:1 ацетонітрилом-водою (2×4мл) та потім ацетонітрилом (2×4мл), та суши 93861 32 ли під азотом, одержуючи зазначену у заголовку сполуку у вигляді жовтого порошку, 9,15г (вихід без поправок 94,7%). ПРИКЛАД 10 Одержання 3-бром-N-[4-хлор-2-метил-6[(метиламіно)карбоніл]феніл]-1-(3-хлор-2піридиніл)-1Н-піразол-5-карбоксаміду в ацетоні До суміші 3-бром-1-(3-хлор-2-пІридиніл)-1Нпіразол-5-карбонової кислоти (для одержання див. публікацію РСТ WO 03/015519) (6,05г, 20,0ммоль) та 2-аміно-5-хлор-N,3-диметилбензаміду (тобто продукту з Прикладів 1, 3, 4 та 5) (4,17г, 21,0ммоль) в ацетоні (18мл) додавали 3-піколін (5,06мл, 4,84г, 52ммоль). Суміш охолоджували до -5°С та потім по краплям додавали метансульфоніл хлорид (1,86мл, 2,75г, 24ммоль) при від -5 до 0°С. Суміш перемішували протягом 3год при 05°С. Потім по краплям додавали воду (9мл) та суміш перемішували при 0°С протягом 1год. Суміш фільтрували та тверді речовини промивали 2:1 льодяним ацетоном-водою (2×4мл), та сушили під азотом, одержуючи зазначену у заголовку сполуку у вигляді майже білого порошку, 9,32г (вихід без поправок 96,4%). ПРИКЛАД 11 Одержання 3-бром-N-[4-хлор-2-метил-6[(метиламіно)карбоніл]феніл]-1-(3-хлор-2піридиніл)-1Н-піразол-5-карбоксаміду в тетрагідрофурані До суміші 3-бром-1-(3-хлор-2-піридиніл)1Н-піразол-5-карбонової кислоти (для одержання див. публікацію РСТ WO 03/015519) (6,05г, 20,0ммоль) та 2-аміно-5-хлор-N,3диметилбензаміду (продукту з Прикладів 1, 3, 4 та 5) (4,17г, 21,0ммоль) в тетрагідрофурані (THF, 18мл) додавали 3-піколін (5,06мл, 4,84 г, 52ммоль). Суміш охолоджували до -5°С та потім по краплям додавали метансульфоніл хлорид (1,86мл, 2,75г, 24ммоль) при від -5 до 0°С. Суміш перемішували протягом 3год. при від 0 до 5°С. Потім по краплям додавали воду (9мл) та суміш перемішували при 0°С протягом 1год. Суміш фільтрували та тверді речовини промивали 2:1 льодяним THF-водою (2×4мл), та сушили під азотом, одержуючи зазначену у заголовку сполуку у вигляді майже білого порошку, 6,93 г (вихід без поправок 71,7%). ПРИКЛАД 12 Одержання 3-бром-N-[4-хлор-2-метил-6[(метиламіно)карбоніл]феніл]-1-(3-хлор-2піридиніл)-1Н-піразол-5-карбоксаміду в дихлорметані До суміші 3-бром-1-(3-хлор-2-піридиніл)-1Нпіразол-5-карбонової кислоти (для одержання див. публікацію РСТ WO 03/015519) (6,05г, 20,0ммоль) та 2-аміно-5-хлор-N,3-диметилбензаміду (тобто продукту з Прикладів 1, 3, 4 та 5) (4,17г, 21,0ммоль) в дихлорметані (18мл) додавали 3піколін (5,06мл, 4,84г, 52ммоль). Суміш охолоджували до -5°С та потім по краплям додавали метансульфоніл хлорид (1,86 мл, 2,75г, 24ммоль) при від -5 до 0°С. Суміш перемішували протягом 3год. при від 0 до 5°С. Потім по краплям додавали воду (9мл). Додавали додатковий дихлорметан (18мл) при перемішуванні до густої суспензії та суміш перемішували при 0°С протягом 1год. Суміш філь 33 трували та тверді речовини промивали 2:1 льодяним дихлорметаном-водою (2×4,5мл), та сушили під азотом, одержуючи зазначену у заголовку сполуку у вигляді майже білого порошку, 8,86г (вихід без поправок 91,7%). ПРИКЛАД 13 Одержання 3-бром-N-[4-хлор-2-метил-6[(метиламіно)карбоніл]феніл]-1-(3-хлор-2піридиніл)-1Н-піразол-5-карбоксаміду в пропіонітрилі До суміші 3-бром-1-(3-хлор-2-піридиніл)-1Нпіразол-5-карбонової кислоти (для одержання див. публікацію РСТ WO 03/015519) (6,05г, 20,0ммоль) та 2-аміно-5-хлор-N,3-диметилбензаміду (тобто продукту з Прикладів 1, 3, 4 та 5) (4,17г, 21,0ммоль) в пропіонітрилі (18мл) додавали 3піколін (5,06мл, 4,84г, 52ммоль). Суміш охолоджували до -5°С та потім по краплям додавали метансульфоніл хлорид (1,86мл, 2,75г, 24ммоль) при від -5 до 0°С. Суміш перемішували протягом 1 год при від 0 до 5°С та потім протягом 3год. при кімнатній температурі. Потім по краплям додавали воду (9мл) та суміш перемішували при кімнатній температурі протягом 1год. Суміш фільтрували та тверді речовини промивали 3:1 пропіонітрилом-водою (2×4мл), потім пропіонітрилом (2×4мл) та сушили під азотом, одержуючи зазначену у заголовку сполуку у вигляді майже білого порошку, 9,37г (вихід без поправок 97,0%). ПРИКЛАД 14 Одержання 3-бром-N-[4-хлор-2-метил-6[(метиламіно)карбоніл]феніл]-1-(3-хлор-2піридиніл)-1Н-тразол-5-карбоксамід в метил етил кетоні До суміші 3-бром-1-(3-хлор-2-піридиніл)-1Нпіразол-5-карбонової кислоти (для одержання див. публікацію РСТ WO 03/015519) (6,05г, 20,0ммоль) та 2-аміно-5-хлор-N,3-диметилбензаміду (продукт з Прикладів 1, 3, 4 та 5) (4,17г, 21,0ммоль) в метил етил кетоні (МЕК, 18мл) додавали 3-піколін (5,06мл, 4,84г, 52ммоль). Суміш охолоджували до -5°С та потім по краплям додавали метансульфоніл хлорид (1,86мл, 2,75г, 24ммоль) при від -5 до 0°С. Суміш перемішували протягом 3 год при від 0 до 5°С. Потім по краплям додавали воду (9мл) та суміш перемішували при кімнатній температурі протягом 1 год. Суміш фільтрували та тверді речовини промивали 3:1 МЕК-водою (2×4мл), потім МЕК (2×4мл) та сушили під азотом, одержуючи зазначену у заголовку сполуку у вигляді майже білого порошку, 9,27г (вихід без поправок 95,9%). ПРИКЛАД 15 Одержання 3-бром-1-(3-хлор-2-піридиніл)-N-[4ціано-2-метил-6-[(метиламіно)-карбоніл]феніл]-1Нпіразол-5-карбоксаміду До суміші 3-бром-1-(3-хлор-2-піридиніл)-1Нпіразол-5-карбонової кислоти (для одержання див. публікацію РСТ WO 03/015519) (чистота 95,4%, 15,85г, 50,0ммоль) та 2-аміно-5-ціано-N,3диметилбензаміду (тобто продукту з Прикладу 6) (9,93г, 52,5ммоль) в ацетонітрилі (120 мл) додавали 3-піколін (17,5мл, 16,7г, 180ммоль). Суміш охолоджували до -10°С та потім по краплям додавали розчин метансульфоніл хлориду (5,4мл, 8,0г, 70ммоль) при від -10 до -5°С. Суміш перемішували протягом 5 хвилин при цій температурі та потім 93861 34 протягом 3год. при від 0 до 5°С. Потім по краплям додавали воду (55мл). Суміш перемішували протягом 15 хвилин, потім по краплям додавали концентровану соляну кислоту (5,0мл, 60ммоль) та суміш перемішували при від 0 до 5°С протягом 1год. Потім суміш фільтрували та тверді речовини промивали 2:1 ацетонітрилом-водою (2×10мл) та потім ацетонітрилом (2×10мл), та сушили під азотом, одержуючи зазначену у заголовку сполуку у вигляді не зовсім білого порошку, 24,70г (вихід без поправок 99,5%), т.п.177-181°С (розкладання). Кристалізацією неочищеного продукту (5,00г) з 1-пропанолу (50мл) одержували зазначену у заголовку сполуку у вигляді білих кристалів, 4,44г (вихід 88,8 ), т.п.217-219°С. 1 Н ЯМР (DMSO-d6) 2,21 (s, 3Н), 2,67 (d, J=4,8Гц, 3Н), 7,41 (s, 1H), 7,60 (m, 1H), 7,76 (d, J=1,8Гц, 1H), 7,87 (d, J=1,8 Гц, 1H), 8,16 (dd, 1H), 8,36 (m, 1H), 8,49 (dd, 1H). ПРИКЛАД 16 Одержання 3-бром-1-(3-хлор-2-піридиніл)-N-[4ціано-2-метил-6-[(метиламіно)-карбоніл]феніл]-1Нпіразол-5-карбоксаміду, використовуючи піридин як основу До суміші 3-бром-1-(3-хлор-2-гаридиніл)-1Hпіразол-5-карбонової кислоти (для одержання див. публікацію РСТ WO 03/015519) (чистота 95,4%, 15,85г, 50,0ммоль) та 2-аміно-5-ціано-N,3диметилбензаміду (продукт з Прикладу 6) (9,93г, 52,5ммоль) в ацетонітрилі (120мл) додавали піридин (14,6мл, 14,3г, 180ммоль). Суміш охолоджували до -10°С та потім по краплям додавали розчин метансульфоніл хлориду (5,4мл, 8,0г, 70ммоль) при від -10 до -5°С. Суміш перемішували протягом 5 хвилин при цій температурі та потім протягом 3 год при від 0 до 5°С. Потім суміш нагрівали до кімнатної температури та по краплям додавали воду (85 мл). Суміш перемішували протягом 15 хвилин, потім по краплям додавали концентровану соляну кислоту (5,0мл, 60ммоль) та суміш перемішували протягом 1 год. Потім суміш фільтрували та тверді речовини промивали 4:3 ацетонітрилом-водою (2×10мл) та потім ацетонітрилом (2×1мл), та сушили під азотом, одержуючи зазначену у заголовку сполуку у вигляді не зовсім білого порошку, 24,29г (вихід без поправок 97,9%). ПРИКЛАД 17 Одержання 3-бром-1-(3-хлор-2-піридиніл)-N-[4ціано-2-метил-6-[(метиламіно)-карбоніл]феніл]-1Нпіразол-5-карбоксаміду, використовуючи 2-піколін як основу До суміші 3-бром-1-(3-хлор-2-піридиніл)-1Нпіразол-5-карбонової кислоти (для одержання див. публікацію РСТ WO 03/015519) (чистота 96,7%, 15,64г, 50,0ммоль) та 2-аміно-5-ціано-]Ч,3диметилбензаміду (тобто продукту з Прикладу 6) (9,93г, 52,5ммоль) в ацетонітрилі (120мл) додавали 2-піколін (17,8мл, 16,8г, 180ммоль). Суміш охолоджували до -10°С та потім по краплям додавали розчин метансульфоніл хлориду (5,4мл, 8,0г, 70ммоль) при від -10 до -5°С. Суміш перемішували протягом 5 хвилин при цій температурі, потім протягом 3год. при від 0 до 5°С та потім протягом 18год. при кімнатній температурі. Потім по краплям додавали воду (25мл). Суміш перемішували 35 протягом 15 хвилин, потім по краплям додавали концентровану соляну кислоту (5,0мл, 60ммоль) та суміш перемішували протягом 1 год. Потім суміш фільтрували та тверді речовини промивали 4:1 ацетонітрилом-водою (2×10мл), та потім ацетонітрилом (2×10мл), та сушили під азотом, одержуючи зазначену у заголовку сполуку у вигляді не зовсім білого порошку, 22,52г (вихід без поправок 92,0%). ПРИКЛАД 18 Одержання 3-бром-1-(3-хлор-2-піридиніл)-N-[4ціано-2-метил-6-[(метиламіно)-карбоніл]феніл]-1Нпіразол-5-карбоксаміду, використовуючи 2,6лутидин як основу До суміші 3-бром-1-(3-хлор-2-піридиніл)-1Нпіразол-5-карбонової кислоти (для одержання див. публікацію РСТ WO 03/015519) (чистота 97,6%, 15,50г, 50,0ммоль) та 2-аміно-5-ціано-N,3диметилбензаміду (тобто продукту з Прикладу 6) (9,93г, 52,5ммоль) в ацетонітрилі (120мл) додавали 2,6-лутидин (21,0мл, 19,3г, 180ммоль). Суміш охолоджували до -10°С та потім по краплям додавали розчин метансульфоніл хлориду (5,4мл, 8,0 г, 70ммоль) при від -10 до -5°С. Суміш перемішували протягом 5 хвилин при цій температурі, потім протягом 1год. при від 0 до 5°С та потім протягом 1год. при кімнатній температурі. Аналіз ЯМР реакційної суміші показував, що присутня незначна кількість зазначеної у заголовку сполуки, але було одержано 10,3% циклізованого похідного. Додавали додатковий 2,6-лутидин (11,7мл, 10,8г, 100ммоль) та метансульфоніл хлорид (3,9мл, 5,8г, 50ммоль) та суміш перемішували протягом 22год при кімнатній температурі. Аналіз ЯМР реакційної суміші показував 9,6% зазначеної у заголовку сполуки та було одержано 89,8% циклізованого похідного. По краплям додавали воду (55мл). Суміш перемішували протягом 15 хвилин, потім по краплям додавали концентровану соляну кислоту (5,0мл, 60ммоль) та суміш перемішували протягом 1 год. Потім суміш фільтрували та тверді речовини промивали 2:1 ацетонітрилом-водою (2×10мл), та потім ацетонітрилом (2×10мл), та сушили під азотом, одержуючи світло-жовтий порошок, 21,92г. Цю тверду речовину суспендували в ацетонітрилі (60мл), та додавали воду (10мл) та соляну кислоту (1N, 10мл), та суміш перемішували при кімнатній температурі протягом 30 хвилин. Потім суміш фільтрували та тверді речовини промивали 3:1 ацетонітрилом-водою (2×10мл), та потім ацетонітрилом (2×10мл), та сушили у вакуумній шафі, одержуючи зазначену у заголовку сполуку у вигляді не зовсім білого порошку, 20,72г (вихід без поправок 85,4%). ПРИКЛАД 19 Одержання 3-бром-1-(3-хлор-2-піридиніл)-N-[4ціано-2-метил-6-[(метиламіно)-карбоніл]феніл]-1Нпіразол-5-карбоксаміду в ацетоні До суміші 3-бром-1-(3-хлор-2-піридиніл)-1Нпіразол-5-карбонової кислоти (для одержання див. публікацію РСТ WO 03/015519) (97,6% чистота, 15,50г, 50,0ммоль) та 2-аміно-5-ціано-N,3диметилбензаміду (тобто продукту з Прикладу 6) (9,93г, 52,5ммоль) в ацетоні (120мл) додавали 3 93861 36 піколін (17,5мл, 16,7г, 180ммоль). Суміш охолоджували до -10°С та потім по краплям додавали розчин метансульфоніл хлориду (5,4мл, 8,0г, 70ммоль) при від -10 до -5°С. Суміш перемішували протягом 5 хвилин при цій температурі, потім протягом 3год. при від 0 до 5°С. Потім по краплям додавали воду (55мл). Суміш перемішували протягом 15 хвилин, потім по краплям додавали концентровану соляну кислоту (5,0мл, 60ммоль) та суміш перемішували при від 0 до 5°С протягом 1год. Потім суміш фільтрували та тверді речовини промивали 2:1 ацетоном-водою (3×10мл), та сушили під азотом, одержуючи зазначену у заголовку сполуку у вигляді не зовсім білого порошку, 24,07г (вихід без поправок 99,2%). Титрування по Карлу Фішеру (KFT) цієї твердої речовини показувало, що вона містить 5,5 ваг% води. Частину твердої речовини (23,35г) сушили у вакуумній шафі, одержуючи зазначену у заголовку сполуку у вигляді не зовсім білого порошку, 22,16г, що містив 0,76ваг % води, визначено за допомогою KFT. ПРИКЛАД 20 Одержання 3-бром-1-(3-хлор-2-піридиніл)-N-[4ціано-2-метил-6-[(метиламіно)-карбоніл]феніл]-1Нпіразол-5-карбоксаміду в пропіонітрилі До суміші 3-бром-1-(3-хлор-2-піридиніл)-1Нпіразол-5-карбонової кислоти (для одержання див. публікацію РСТ WO 03/015519) (97,6% чистота, 15,50г, 50,0ммоль) та 2-аміно-5-ціано-N,3диметилбензаміду (продукт з Прикладу 6) (9,93г, 52,5ммоль) в пропіонітрилі (120мл) додавали 3піколін (17,5мл, 16,7г, 180ммоль). Суміш охолоджували до -10°С та потім по краплям додавали розчин метансульфоніл хлориду (5,4мл, 8,0г, 70ммоль) при від -10 до -5°С. Суміш перемішували протягом 5 хвилин при цій температурі, потім протягом 4 год при від 0 до 5°С. Потім вода (55мл) додавали по краплям. Суміш перемішували протягом 15 хвилин, потім по краплям додавали концентровану соляну кислоту (5,0мл, 60ммоль) та суміш перемішували при від 0 до 5°С протягом 1год. Потім суміш фільтрували та тверді речовини промивали 2:1 пропіонітрилом-водою (2×10мл), потім пропіонітрилом (2×10мл) та сушили під азотом, одержуючи зазначену у заголовку сполуку у вигляді не зовсім білого порошку, 21,85г (вихід без поправок 90,1%). Титрування по Карлу Фішеру (KFT) цієї твердої речовини показувало, що вона містить 5,4ваг% води. Частину твердої речовини (21,03г) сушили у вакуумній шафі, одержуючи зазначену у заголовку сполуку у вигляді не зовсім білого порошку, 20,07г, що містив 0,9ваг % води, визначено за допомогою KFT. В Таблицях, наведених нижче, використовують наступні скорочення: t означає третинний, s означає вторинний, н означає нормальний, і означає ізо, Me означає метил, Et означає етил, Рr означає пропіл, i-Рr означає ізопропіл та Вu означає бутил. За допомогою методик, описаних в даній заявці, разом з методами, відомими з рівня техніки, наступні сполуки в Таблиці 1 можуть бути одержані та використані в способі за даним винаходом. 37 93861 38 39 93861 40 41 93861 42 43 93861 44 45 93861 46 47 93861 48 49 93861 50 51 93861 52 53 93861 54 55 93861 56 57 93861 58 59 93861 60
ДивитисяДодаткова інформація
Назва патенту англійськоюMethod for preparing n-phenylpyrazole-1-carboxamides and aniline compound
Автори англійськоюShapiro Rafael, Taylor Eric De Guyon, Zimmerman William Thomas
Назва патенту російськоюСпособ получения n-фенилпиразол-1-карбоксамидов и соединение анилина
Автори російськоюШапиро Рафаэль, Тейлор Эрик Де Гуйон, Зиммерман Вильям Томас
МПК / Мітки
МПК: C07D 231/20, C07D 401/04, C07C 233/65, C07D 231/16, C07D 231/14, C07C 255/58
Мітки: n-фенілпіразол-1-карбоксамідів, сполука, аніліну, одержання, спосіб
Код посилання
<a href="https://ua.patents.su/33-93861-sposib-oderzhannya-n-fenilpirazol-1-karboksamidiv-ta-spoluka-anilinu.html" target="_blank" rel="follow" title="База патентів України">Спосіб одержання n-фенілпіразол-1-карбоксамідів та сполука аніліну</a>
Попередній патент: Спосіб одержання піразолів, спосіб регіоселективного алкілування та застосування фосфату або фосфонату у способі
Наступний патент: Дверна та віконна рама
Випадковий патент: Експериментальна установка для вимірювання середніх температур стінки та температурних напорів