Похідні спірокеталів і їх застосування як лікарського засобу проти діабету
Номер патенту: 90290
Опубліковано: 26.04.2010
Автори: Нісімото Масахіро, Кобаясі Такаміцу, Сато Цутому
Формула / Реферат
1. Сполука Формули (І):
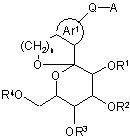 , (I)
, (I)
де R1, R2, R3 і R4 кожний незалежно вибраний з атома водню, С1-С6алкільної групи, яка може бути заміщена одним або більше Ra, C7-C14аралкільної групи, яка може бути заміщена одним або більше Rb, і -C(=O)Rx;
Rx представляє С1-С6алкільну групу, яка може бути заміщена одним або більше Ra, арильну групу, яка може бути заміщена одним або більше Rb, гетероарильну групу, яка може бути заміщена одним або більше Rb, C1-C6алкоксигрупу, яка може бути замішена одним або більше Ra, або -NReRf;
Аr1 представляє ароматичне карбоциклічне кільце, яке може бути заміщене одним або більше Rb, або ароматичне гетероциклічне кільце, яке може бути заміщене одним або більше Rb;
Q представляє -(CH2)m-(L)p- або -(L)р-(СН2)m-;
m представляє ціле число, вибране з 0-2,
n представляє ціле число, вибране з 1 і 2, і
р представляє ціле число, вибране з 0 і 1;
L представляє -О-, -S- або -NR5-,
R5 вибраний з атома водню, С1-С6алкільної групи, яка може бути заміщена одним або більше Ra, і -C(=O)Rx;
А представляє арильну групу, яка може бути заміщена одним або більше Rb, або гетероарильну групу, яка може бути заміщена одним або більше Rb, де арильна група або гетероарильна група може утворювати конденсоване кільце з ароматичним карбоциклічним кільцем або ароматичним гетероциклічним кільцем;
Ra незалежно вибраний з атома галогену, гідроксильної групи, ціаногрупи, нітрогрупи, карбоксильної групи, С1-С6алкоксигрупи, яка може бути заміщена одним або більше Rc, арильної групи, яка може бути заміщена одним або більше Rd, арилоксигрупи, яка може бути заміщена одним або більше Rd, гетероарильної групи, яка може бути заміщена одним або більше Rd, гетероарилоксигрупи, яка може бути заміщена одним або більше Rd, меркаптогрупи, С1-С6алкілтіогрупи, яка може бути заміщена одним або більше Rс, C1-C6алкілсульфінільної групи, яка може бути заміщена одним або більше Rс, С1-С6алкілсульфонільної групи, яка може бути заміщена одним або більше Rc, -NRfRg, C1-C6алкоксикарбонільної групи, яка може бути заміщена одним або більше Rс, і С1-С6 алкілкарбонільної групи, яка може бути заміщена одним або більше Rс;
Rb незалежно вибраний з С1-С6алкільної групи, яка може бути заміщена одним або більше Rc, C3-C8циклоалкільної групи, яка може бути заміщена одним або більше Rc, C2-C6алкенільної групи, яка може бути заміщена одним або більше Rc, C2-C6алкінільної групи, яка може бути заміщена одним або більше Rc, C7-C14аралкільної групи, яка може бути заміщена одним або більше Rd, атома галогену, гідроксильної групи, ціаногрупи, нітрогрупи, карбоксильної групи, С1-С6алкоксигрупи, яка може бути заміщена одним або більше Rс, арильної групи, яка може бути заміщена одним або більше Rd, арилоксигрупи, яка може бути заміщена одним або більше Rd, гетероарильної групи, яка може бути заміщена одним або більше Rd, гетероарилоксигрупи, яка може бути заміщена одним або більше Rd, меркаптогрупи, С1-С6алкілтіогрупи, яка може бути заміщена одним або більше Rc, С1-С6алкілсульфінільної групи, яка може бути заміщена одним або більше Rc, C1-С6алкілсульфонільної групи, яка може бути заміщена одним або більше Rc, -NRfRg, C1-C6алкілкарбонільної групи, яка може бути заміщена одним або більше Rc, С1-С6алкоксикарбонільної групи, яка може бути заміщена одним або більше Rc, C1-C3алкілендіоксигрупи, гетероциклільної групи і гетероциклілоксигрупи;
Rс незалежно вибраний з атома галогену, гідроксильної групи, ціаногрупи, нітрогрупи, карбоксильної групи, С1-С6алкоксигрупи, арильної групи, яка може бути заміщена одним або більше Rd, арилоксигрупи, яка може бути заміщена одним або більше Rd, гетероарильної групи, яка може бути заміщена одним або більше Rd, гетероарилоксигрупи, яка може бути заміщена одним або більше Rd, аміногрупи, С1-С6алкіламіногрупи і ді-(С1-С6алкіл)аміногрупи;
Rd незалежно вибраний з С1-С6алкільної групи, яка може бути заміщена одним або більше атомами галогену, С7-С14аралкільної групи, атома галогену, гідроксильної групи, ціаногрупи, нітрогрупи, аміногрупи, С1-С6алкіламіногрупи і ді-(С1-С6алкіл)аміногрупи;
Re представляє атом водню, С1-С6алкільну групу, яка може бути заміщена одним або більше Rс, арильну групу, яка може бути заміщена одним або більше Rd, або гетероарильну групу, яка може бути заміщена одним або більше Rd;
Rf представляє атом водню або С1-С6алкільну групу, яка може бути заміщена одним або більше Rс, і
Rg представляє атом водню, С1-С6алкільну групу, яка може бути заміщена Rс, С1-С6алкілкарбонільну групу, яка може бути заміщена одним або більше Rс, арильну групу, яка може бути заміщена одним або більше Rd, гетероарильну групу, яка може бути заміщена одним або більше Rd, карбамоїльну групу, С1-С6алкоксикарбонільну групу, яка може бути заміщена одним або більше Rс, або С1-С6алкілсульфонільну групу, яка може бути заміщена одним або більше Rс, або
Re і Rf або Rf і Rg можуть утворювати 4-7-членне гетероциклічне кільце разом з атомом азоту, до якого вони приєднані,
або її проліки, або її фармацевтично прийнятна сіль.
2. Сполука за п. 1, де R1, R2, R3 і R4 незалежно вибрані з атома водню і -C(=O)Rx, і Rx являє собою С1-С6алкільну групу, яка може бути заміщена одним або більше Ra, або С1-С6алкоксигрупу, яка може бути заміщена одним або більше Ra, або її проліки, або її фармацевтично прийнятна сіль.
3. Сполука за п. 1, де R1, R2, R3 і R4 кожний являє собою атом водню, або її проліки, або її фармацевтично прийнятна сіль.
4. Сполука за будь-яким з пп. 1-3, де Аr1 являє собою феніленову групу або тієніленову групу, кожна з яких може бути заміщена одним або більше Rb, або її проліки, або її фармацевтично прийнятна сіль.
5. Сполука за будь-яким з пп. 1-4, де m дорівнює 1, і р дорівнює 0, або її проліки, або її фармацевтично прийнятна сіль.
6. Сполука за будь-яким з пп. 1-4, де n дорівнює 1, або її проліки, або її фармацевтично прийнятна сіль.
7. Сполука за будь-яким з пп. 1-6, де Аr1 має замісник -Q-A на кільцевому атомі, який відділений двома атомами від кільцевого атома, безпосередньо приєднаного до заміщеної глюцитольної групи, або її проліки, або її фармацевтично прийнятна сіль.
8. Сполука за будь-яким з пп. 1-7, представлена Формулою (Іа):
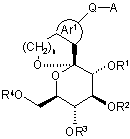 , (Ia)
, (Ia)
або її проліки, або її фармацевтично прийнятна сіль.
9. Сполука за будь-яким з пп. 1-8, яка являє собою 1,1-ангідро-1-С-[5-(4-етилфеніл)метил-2-(гідроксиметил)феніл]-![]() -D-глюкопіранозу, або її проліки, або її фармацевтично прийнятна сіль.
-D-глюкопіранозу, або її проліки, або її фармацевтично прийнятна сіль.
10. Сполука, вибрана з:
1,1-ангідро-1-С-[5-(4-етилфеніл)метил-2-(гідроксиметил)феніл]-![]() -D-глюкопіранози,
-D-глюкопіранози,
1,1-ангідро-1-С-[5-(2-бензотіофеніл)метил-2-(гідроксиметил)феніл]-![]() -D-глюкопіранози,
-D-глюкопіранози,
1,1-ангідро-1-С-[5-(4-метоксифеніл)метил-2-(гідроксиметил)феніл]-![]() -D-глюкопіранози,
-D-глюкопіранози,
1,1-ангідро-1-С-[5-(4-ізопропілфеніл)метил-2-(гідроксиметил)феніл]-![]() -D-глюкопіранози,
-D-глюкопіранози,
1,1-ангідро-1-С-[5-(4-циклопропілфеніл)метил-2-(гідроксиметил)феніл]-![]() -D-глюкопіранози,
-D-глюкопіранози,
1,1-ангідро-1-С-[5-(4-н-пропілфеніл)метил-2-(гідроксиметил)феніл]-![]() -D-глюкопіранози,
-D-глюкопіранози,
1,1-ангідро-1-С-[5-(4-етилфенілокси)-2-(гідроксиметил)феніл]-![]() -D-глюкопіранози,
-D-глюкопіранози,
1,1-ангідро-1-С-[5-(4-етилфеніл)метил-2-(2-гідроксіетил)тіофен-3-іл]-![]() -D-глюкопіранози,
-D-глюкопіранози,
1,1-ангідро-1-С-[5-(4-біфеніл)метил-2-гідроксиметил]феніл]-![]() -D-глюкопіранози,
-D-глюкопіранози,
1,1-ангідро-1-С-[5-(4-((S)-тетрагідрофуран-3-ілокси)феніл)метил-2-(гідроксиметил)феніл]-![]() -D-глюкопіранози,
-D-глюкопіранози,
1,1-ангідро-1-С-[5-(4-((R)-тетрагідрофуран-3-ілокси)феніл)метил-2-(гідроксиметил)феніл]-![]() -D-глюкопіранози,
-D-глюкопіранози,
1,1-ангідро-1-С-[5-(4-етинілфеніл)метил-2-(гідроксиметил)феніл]-![]() -D-глюкопіранози,
-D-глюкопіранози,
1,1-ангідро-1-С-[5-(4-гідроксифеніл)метил-2-(гідроксиметил)феніл]-![]() -D-глюкопіранози,
-D-глюкопіранози,
1,1-ангідро-1-С-[5-(4-піразол-1-ілфеніл)метил-2-(гідроксиметил)феніл]-![]() -D-глюкопіранози,
-D-глюкопіранози,
1,1-ангідро-1-С-[5-(4-метоксифеніл)етил-2-(гідроксиметил)феніл]-![]() -D-глюкопіранози,
-D-глюкопіранози,
1,1-ангідро-1-С-[5-(4-метилфеніл)метил-2-(гідроксиметил)феніл]-![]() -D-глюкопіранози,
-D-глюкопіранози,
1,1-ангідро-1-С-[5-(3-ацетамідофеніл)метил-2-(гідроксиметил)феніл]-![]() -D-глюкопіранози,
-D-глюкопіранози,
1,1-ангідро-1-С-[5-(3,4-метилендіоксифеніл)метил-2-(гідроксиметил)феніл]-![]() -D-глюкопіранози,
-D-глюкопіранози,
1,1-ангідро-1-С-[5-(4-ціанофеніл)метил-2-(гідроксиметил)феніл]-![]() -D-глюкопіранози,
-D-глюкопіранози,
1,1-ангідро-1-С-[5-(3,4-дихлорфеніл)метил-2-(гідроксиметил)феніл]-![]() -D-глюкопіранози,
-D-глюкопіранози,
1,1-ангідро-1-С-[5-(4-етоксифеніл)метил-2-(гідроксиметил)феніл]-![]() -D-глюкопіранози,
-D-глюкопіранози,
1,1-ангідро-1-С-[5-(4-трифторметилфеніл)метил-2-(гідроксиметил)феніл]-![]() -D-глюкопіранози,
-D-глюкопіранози,
1,1-ангідро-1-С-[5-(4-трифторметоксифеніл)метил-2-(гідроксиметил)феніл]-![]() -D-глюкопіранози,
-D-глюкопіранози,
1,1-ангідро-1-С-[5-(4-метилсульфанілфеніл)метил-2-(гідроксиметил)феніл]-![]() -D-глюкопіранози,
-D-глюкопіранози,
1,1-ангідро-1-С-[5-(4-хлорфеніл)метил-2-(гідроксиметил)феніл]-![]() -D-глюкопіранози,
-D-глюкопіранози,
1,1-ангідро-1-С-[5-(нафталін-2-іл)метил-2-(гідроксиметил)феніл]-![]() -D-глюкопіранози,
-D-глюкопіранози,
1,1-ангідро-1-С-[5-(4-гідроксиметилфеніл)метил-2-(гідроксиметил)феніл]-![]() -D-глюкопіранози,
-D-глюкопіранози,
1,1-ангідро-1-С-[5-(4-фторфеніл)метил-2-(гідроксиметил)феніл]-![]() -D-глюкопіранози,
-D-глюкопіранози,
1,1-ангідро-1-С-[5-(2-метилфеніл)метил-2-(гідроксиметил)феніл]-![]() -D-глюкопіранози,
-D-глюкопіранози,
1,1-ангідро-1-С-[5-(3-метилфеніл)метил-2-(гідроксиметил)феніл]-![]() -D-глюкопіранози,
-D-глюкопіранози,
1,1-ангідро-1-С-[5-(3-бензилоксифеніл)метил-2-(гідроксиметил)феніл]-![]() -D-глюкопіранози,
-D-глюкопіранози,
1,1-ангідро-1-С-[5-(2,4-дифторфеніл)метил-2-(гідроксиметил)феніл]-![]() -D-глюкопіранози,
-D-глюкопіранози,
1,1-ангідро-1-С-[5-(4-(2-фторетил)феніл)метил-2-(гідроксиметил)феніл]-![]() -D-глюкопіранози,
-D-глюкопіранози,
1,1-ангідро-1-С-[5-(піридин-3-іл)метил-2-(гідроксиметил)феніл]-![]() -D-глюкопіранози,
-D-глюкопіранози,
1,1-ангідро-1-С-[5-(4-метансульфонілфеніл)метил-2-(гідроксиметил)феніл]-![]() -D-глюкопіранози,
-D-глюкопіранози,
1,1-ангідро-1-С-[5-(піридин-4-іл)метил-2-(гідроксиметил)феніл]-![]() -D-глюкопіранози,
-D-глюкопіранози,
1,1-ангідро-1-С-[5-(1Н-індол-2-іл)метил-2-(гідроксиметил)феніл]-![]() -D-глюкопіранози,
-D-глюкопіранози,
1,1-ангідро-1-С-[5-(3-гідроксифеніл)метил-2-(гідроксиметил)феніл]-![]() -D-глюкопіранози,
-D-глюкопіранози,
1,1-ангідро-1-С-[5-(4-вінілфеніл)метил-2-(гідроксиметил)феніл]-![]() -D-глюкопіранози,
-D-глюкопіранози,
1,1-ангідро-1-С-[5-(4-метоксикарбонілфеніл)метил-2-(гідроксиметил)феніл]-![]() -D-глюкопіранози,
-D-глюкопіранози,
1,1-ангідро-1-С-[5-(4-карбоксифеніл)метил-2-(гідроксиметил)феніл]-![]() -D-глюкопіранози,
-D-глюкопіранози,
1,1-ангідро-1-С-[5-(4-(2,2-дифторетил)феніл)метил-2-(гідроксиметил)феніл]-![]() -D-глюкопіранози,
-D-глюкопіранози,
1,1-ангідро-1-С-[5-(4-етилфеніл)метил-2-(гідроксиметил)-4-метилфеніл]-![]() -D-глюкопіранози,
-D-глюкопіранози,
1,1-ангідро-1-С-[5-(4-(2,2,2-трифторетил)феніл)метил-2-(гідроксиметил)феніл]-![]() -D-глюкопіранози,
-D-глюкопіранози,
1,1-ангідро-1-С-[5-(4-етилфеніл)метил-2-(гідроксиметил)піразин-3-іл]-![]() -D-глюкопіранози,
-D-глюкопіранози,
1,1-ангідро-1-С-[5-(4-ацетилфеніл)метил-2-(гідроксиметил)феніл]-![]() -D-глюкопіранози і
-D-глюкопіранози і
1,1-ангідро-1-С-[5-(4-(1-гідроксіетил)феніл)метил-2-(гідроксиметил)феніл]-![]() -D-глюкопіранози,
-D-глюкопіранози,
або її проліки, або її фармацевтично прийнятна сіль.
11. Сполука Формули (Іb):
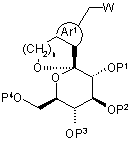 , (Ib)
, (Ib)
де n представляє ціле число, вибране з 1 і 2;
Аr1 представляє ароматичне карбоциклічне кільце, яке може бути заміщене одним або більше Rb, або ароматичне гетероциклічне кільце, яке може бути заміщене одним або більше Rb;
W представляє -O-Z або атом галогену;
Z представляє атом водню, ацильну групу або бензильну групу;
Р1, Р2, Р3 і Р4 кожний незалежно вибраний з атома водню, ацильної групи або бензильної групи, і
Rb визначений в п. 1.
12. Фармацевтична композиція для застосування як інгібітора котранспортера Nа+-глюкози, що містить сполуку за будь-яким з пп. 1-10 або її проліки, або її фармацевтично прийнятну сіль.
13. Фармацевтична композиція для застосування для профілактики або лікування діабету, гіперглікемії, викликаних нею діабетичних ускладнень або ожиріння, що містить сполуку за будь-яким з пп. 1-10 або її проліки, або її фармацевтично прийнятну сіль.
14. Фармацевтична композиція за п. 13, де діабет являє собою інсулінозалежний цукровий діабет (діабет І типу) або інсулінонезалежний цукровий діабет (діабет II типу).
15. Спосіб профілактики або лікування діабету, викликаних гіперглікемією діабетичних ускладнень або ожиріння, при якому пацієнту вводять терапевтично ефективну кількість сполуки за будь-яким з пп. 1-10 або її проліків, або її фармацевтично прийнятної солі.
16. Спосіб за п. 15, де діабет являє собою інсулінозалежний цукровий діабет (діабет І типу) або інсулінонезалежний цукровий діабет (діабет II типу).
Текст
1. Сполука Формули (І): 2 (19) 1 3 щена одним або більше Rc, C2-C6алкенільної групи, яка може бути заміщена одним або більше Rc, C2-C6алкінільної групи, яка може бути заміщена одним або більше Rc, C7-C14аралкільної групи, яка може бути заміщена одним або більше Rd, атома галогену, гідроксильної групи, ціаногрупи, нітрогрупи, карбоксильної групи, С1С6алкоксигрупи, яка може бути заміщена одним або більше Rс, арильної групи, яка може бути заміщена одним або більше Rd, арилоксигрупи, яка може бути заміщена одним або більше Rd, гетероарильної групи, яка може бути заміщена одним або більше Rd, гетероарилоксигрупи, яка може бути заміщена одним або більше Rd, меркаптогрупи, С1-С6алкілтіогрупи, яка може бути заміщена одним або більше Rc, С 1С6алкілсульфінільної групи, яка може бути заміщена одним або більше Rc, C 1С6алкілсульфонільної групи, яка може бути заміщена одним або більше Rc, -NRfRg, C1C6алкілкарбонільної групи, яка може бути заміщена одним або більше Rc, С 1С6алкоксикарбонільної групи, яка може бути заміщена одним або більше Rc, C 1C3алкілендіоксигрупи, гетероциклільної групи і гетероциклілоксигрупи; Rс незалежно вибраний з атома галогену, гідроксильної групи, ціаногрупи, нітрогрупи, карбоксильної групи, С1-С6алкоксигрупи, арильної групи, яка може бути заміщена одним або більше Rd, арилоксигрупи, яка може бути заміщена одним або більше Rd, гетероарильної групи, яка може бути заміщена одним або більше Rd, гетероарилоксигрупи, яка може бути заміщена одним або більше Rd, аміногрупи, С1-С6алкіламіногрупи і ді(С1-С6алкіл)аміногрупи; Rd незалежно вибраний з С1-С6алкільної групи, яка може бути заміщена одним або більше атомами галогену, С7-С14аралкільної групи, атома галогену, гідроксильної групи, ціаногрупи, нітрогрупи, аміногрупи, С1-С6алкіламіногрупи і ді-(С1С6алкіл)аміногрупи; Re представляє атом водню, С1-С6алкільну групу, яка може бути заміщена одним або більше Rс, арильну групу, яка може бути заміщена одним або більше Rd, або гетероарильну групу, яка може бути заміщена одним або більше Rd; Rf представляє атом водню або С1-С6алкільну групу, яка може бути заміщена одним або більше Rс, і Rg представляє атом водню, С1-С6алкільну групу, яка може бути заміщена Rс, С 1С6алкілкарбонільну групу, яка може бути заміщена одним або більше Rс, арильну групу, яка може бути заміщена одним або більше Rd, гетероарильну групу, яка може бути заміщена одним або більше Rd, карбамоїльну групу, С 1С6алкоксикарбонільну групу, яка може бути заміщена одним або більше Rс, або С1С6алкілсульфонільну групу, яка може бути заміщена одним або більше Rс, або Re і Rf або Rf і Rg можуть утворювати 4-7-членне гетероциклічне кільце разом з атомом азоту, до якого вони приєднані, або її проліки, або її фармацевтично прийнятна 90290 4 сіль. 2. Сполука за п. 1, де R1, R2, R3 і R4 незалежно вибрані з атома водню і -C(=O)Rx, і Rx являє собою С1-С6алкільну групу, яка може бути заміщена одним або більше Ra, або С1-С6алкоксигрупу, яка може бути заміщена одним або більше Ra, або її проліки, або її фармацевтично прийнятна сіль. 3. Сполука за п. 1, де R1, R2, R3 і R4 кожний являє собою атом водню, або її проліки, або її фармацевтично прийнятна сіль. 4. Сполука за будь-яким з пп. 1-3, де Аr1 являє собою феніленову групу або тієніленову групу, кожна з яких може бути заміщена одним або більше Rb, або її проліки, або її фармацевтично прийнятна сіль. 5. Сполука за будь-яким з пп. 1-4, де m дорівнює 1, і р дорівнює 0, або її проліки, або її фармацевтично прийнятна сіль. 6. Сполука за будь-яким з пп. 1-4, де n дорівнює 1, або її проліки, або її фармацевтично прийнятна сіль. 7. Сполука за будь-яким з пп. 1-6, де Аr1 має замісник -Q-A на кільцевому атомі, який відділений двома атомами від кільцевого атома, безпосередньо приєднаного до заміщеної глюцитольної групи, або її проліки, або її фармацевтично прийнятна сіль. 8. Сполука за будь-яким з пп. 1-7, представлена Формулою (Іа): Q A Ar1 (CH2)n O R4O O OR1 OR2 OR3 , (Ia) або її проліки, або її фармацевтично прийнятна сіль. 9. Сполука за будь-яким з пп. 1-8, яка являє собою 1,1-ангідро-1-С-[5-(4-етилфеніл)метил-2(гідроксиметил)феніл]- -D-глюкопіранозу, або її проліки, або її фармацевтично прийнятна сіль. 10. Сполука, вибрана з: 1,1-ангідро-1-С-[5-(4-етилфеніл)метил-2(гідроксиметил)феніл]- -D-глюкопіранози, 1,1-ангідро-1-С-[5-(2-бензотіофеніл)метил-2(гідроксиметил)феніл]- -D-глюкопіранози, 1,1-ангідро-1-С-[5-(4-метоксифеніл)метил-2(гідроксиметил)феніл]- -D-глюкопіранози, 1,1-ангідро-1-С-[5-(4-ізопропілфеніл)метил-2(гідроксиметил)феніл]- -D-глюкопіранози, 1,1-ангідро-1-С-[5-(4-циклопропілфеніл)метил-2(гідроксиметил)феніл]- -D-глюкопіранози, 1,1-ангідро-1-С-[5-(4-н-пропілфеніл)метил-2(гідроксиметил)феніл]- -D-глюкопіранози, 1,1-ангідро-1-С-[5-(4-етилфенілокси)-2(гідроксиметил)феніл]- -D-глюкопіранози, 1,1-ангідро-1-С-[5-(4-етилфеніл)метил-2-(2гідроксіетил)тіофен-3-іл]- -D-глюкопіранози, 1,1-ангідро-1-С-[5-(4-біфеніл)метил-2гідроксиметил]феніл]- -D-глюкопіранози, 5 1,1-ангідро-1-С-[5-(4-((S)-тетрагідрофуран-3ілокси)феніл)метил-2-(гідроксиметил)феніл]- -Dглюкопіранози, 1,1-ангідро-1-С-[5-(4-((R)-тетрагідрофуран-3ілокси)феніл)метил-2-(гідроксиметил)феніл]- -Dглюкопіранози, 1,1-ангідро-1-С-[5-(4-етинілфеніл)метил-2(гідроксиметил)феніл]- -D-глюкопіранози, 1,1-ангідро-1-С-[5-(4-гідроксифеніл)метил-2(гідроксиметил)феніл]- -D-глюкопіранози, 1,1-ангідро-1-С-[5-(4-піразол-1-ілфеніл)метил-2(гідроксиметил)феніл]- -D-глюкопіранози, 1,1-ангідро-1-С-[5-(4-метоксифеніл)етил-2(гідроксиметил)феніл]- -D-глюкопіранози, 1,1-ангідро-1-С-[5-(4-метилфеніл)метил-2(гідроксиметил)феніл]- -D-глюкопіранози, 1,1-ангідро-1-С-[5-(3-ацетамідофеніл)метил-2(гідроксиметил)феніл]- -D-глюкопіранози, 1,1-ангідро-1-С-[5-(3,4метилендіоксифеніл)метил-2(гідроксиметил)феніл]- -D-глюкопіранози, 1,1-ангідро-1-С-[5-(4-ціанофеніл)метил-2(гідроксиметил)феніл]- -D-глюкопіранози, 1,1-ангідро-1-С-[5-(3,4-дихлорфеніл)метил-2(гідроксиметил)феніл]- -D-глюкопіранози, 1,1-ангідро-1-С-[5-(4-етоксифеніл)метил-2(гідроксиметил)феніл]- -D-глюкопіранози, 1,1-ангідро-1-С-[5-(4-трифторметилфеніл)метил2-(гідроксиметил)феніл]- -D-глюкопіранози, 1,1-ангідро-1-С-[5-(4трифторметоксифеніл)метил-2(гідроксиметил)феніл]- -D-глюкопіранози, 1,1-ангідро-1-С-[5-(4метилсульфанілфеніл)метил-2(гідроксиметил)феніл]- -D-глюкопіранози, 1,1-ангідро-1-С-[5-(4-хлорфеніл)метил-2(гідроксиметил)феніл]- -D-глюкопіранози, 1,1-ангідро-1-С-[5-(нафталін-2-іл)метил-2(гідроксиметил)феніл]- -D-глюкопіранози, 1,1-ангідро-1-С-[5-(4-гідроксиметилфеніл)метил2-(гідроксиметил)феніл]- -D-глюкопіранози, 1,1-ангідро-1-С-[5-(4-фторфеніл)метил-2(гідроксиметил)феніл]- -D-глюкопіранози, 1,1-ангідро-1-С-[5-(2-метилфеніл)метил-2(гідроксиметил)феніл]- -D-глюкопіранози, 1,1-ангідро-1-С-[5-(3-метилфеніл)метил-2(гідроксиметил)феніл]- -D-глюкопіранози, 1,1-ангідро-1-С-[5-(3-бензилоксифеніл)метил-2(гідроксиметил)феніл]- -D-глюкопіранози, 1,1-ангідро-1-С-[5-(2,4-дифторфеніл)метил-2(гідроксиметил)феніл]- -D-глюкопіранози, 1,1-ангідро-1-С-[5-(4-(2-фторетил)феніл)метил-2(гідроксиметил)феніл]- -D-глюкопіранози, 1,1-ангідро-1-С-[5-(піридин-3-іл)метил-2(гідроксиметил)феніл]- -D-глюкопіранози, 1,1-ангідро-1-С-[5-(4метансульфонілфеніл)метил-2(гідроксиметил)феніл]- -D-глюкопіранози, 90290 6 1,1-ангідро-1-С-[5-(піридин-4-іл)метил-2(гідроксиметил)феніл]- -D-глюкопіранози, 1,1-ангідро-1-С-[5-(1Н-індол-2-іл)метил-2(гідроксиметил)феніл]- -D-глюкопіранози, 1,1-ангідро-1-С-[5-(3-гідроксифеніл)метил-2(гідроксиметил)феніл]- -D-глюкопіранози, 1,1-ангідро-1-С-[5-(4-вінілфеніл)метил-2(гідроксиметил)феніл]- -D-глюкопіранози, 1,1-ангідро-1-С-[5-(4метоксикарбонілфеніл)метил-2(гідроксиметил)феніл]- -D-глюкопіранози, 1,1-ангідро-1-С-[5-(4-карбоксифеніл)метил-2(гідроксиметил)феніл]- -D-глюкопіранози, 1,1-ангідро-1-С-[5-(4-(2,2дифторетил)феніл)метил-2(гідроксиметил)феніл]- -D-глюкопіранози, 1,1-ангідро-1-С-[5-(4-етилфеніл)метил-2(гідроксиметил)-4-метилфеніл]- -Dглюкопіранози, 1,1-ангідро-1-С-[5-(4-(2,2,2трифторетил)феніл)метил-2(гідроксиметил)феніл]- -D-глюкопіранози, 1,1-ангідро-1-С-[5-(4-етилфеніл)метил-2(гідроксиметил)піразин-3-іл]- -D-глюкопіранози, 1,1-ангідро-1-С-[5-(4-ацетилфеніл)метил-2(гідроксиметил)феніл]- -D-глюкопіранози і 1,1-ангідро-1-С-[5-(4-(1-гідроксіетил)феніл)метил2-(гідроксиметил)феніл]- -D-глюкопіранози, або її проліки, або її фармацевтично прийнятна сіль. 11. Сполука Формули (Іb): W Ar1 (CH2)n O P4 O O OP1 OP2 OP3 , (Ib) де n представляє ціле число, вибране з 1 і 2; Аr1 представляє ароматичне карбоциклічне кільце, яке може бути заміщене одним або більше Rb, або ароматичне гетероциклічне кільце, яке може бути заміщене одним або більше Rb; W представляє -O-Z або атом галогену; Z представляє атом водню, ацильну групу або бензильну групу; Р1, Р2, Р3 і Р4 кожний незалежно вибраний з атома водню, ацильної групи або бензильної групи, і Rb визначений в п.1. 12. Фармацевтична композиція для застосування як інгібітора котранспортера Nа+-глюкози, що містить сполуку за будь-яким з пп.1-10 або її проліки, або її фармацевтично прийнятну сіль. 13. Фармацевтична композиція для застосування для профілактики або лікування діабету, гіперглікемії, викликаних нею діабетичних ускладнень або ожиріння, що містить сполуку за будь-яким з пп.1-10 або її проліки, або її фармацевтично прийнятну сіль. 14. Фармацевтична композиція за п.13, де діабет являє собою інсулінозалежний цукровий діабет 7 90290 8 (діабет І типу) або інсулінонезалежний цукровий діабет (діабет II типу). 15. Спосіб профілактики або лікування діабету, викликаних гіперглікемією діабетичних ускладнень або ожиріння, при якому пацієнту вводять терапевтично ефективну кількість сполуки за будь-яким з пп.1-10 або її проліків, або її фармацевтично прийнятної солі. 16. Спосіб за п.15, де діабет являє собою інсулінозалежний цукровий діабет (діабет І типу) або інсулінонезалежний цукровий діабет (діабет II типу). Даний винахід стосується фармацевтично корисних похідних спірокеталів, їх проліків і фармацевтично прийнятних солей. Зокрема, даний винахід стосується похідних спірокеталів і їх проліків і солей, які корисні як профілактичні або терапевтичні агенти проти захворювань, викликаних гіперглікемією таких, як діабет, включаючи інсулінзалежний цукровий діабет (діабет ї типу) і інсуліннезалежний цукровий діабет (діабет II типу), діабетичні ускладнення і ожиріння, внаслідок їх здатності інгібувати котранспортер 2Nа+-глюкози (SGLT2). В останні роки, кількість пацієнтів з діабетом збільшилася через західні дієти і хронічну недостатність фізичного навантаження і т.д. У пацієнтів з діабетом хронічна гіперглікемія спричиняє зниження як секреції інсуліну, так і чутливості до інсуліну, що в свою чергу спричиняє підвищення рівнів глюкози в крові і приводить до загострення симптомів. Лікарські засоби, що традиційно використовуються як терапевтичні агеніи проти діабету включають бігуаніди, сульфонілсечовини, інгібітори глікозидази і агенти, що поліпшують резистентність до інсуліну. Однак були повідомлення про несприятливі побічні ефекти даних лікарських засобів; наприклад, молочний ацидоз для бігуанідів, гіпоглікемія для сульфонілсечовин і діарея для інгібіторів глікозидази. В даний час існує велика потреба в розробці терапевтичних агентів проти діабету, які мають новий механізм дії, який відрізняється від традиційно запропонованих. За відомостями, флоридзин, похідне глюкози, що зустрічається в природі, чинить гіпоглікемічний ефект шляхом інгібування натрійзалежного котранспортера 2 глюкози (SGLT2), присутнього на сайт і S1 проксимальних ниркових трубочок, що приводить до інгібування надмірного повторного всмоктування глюкози в нирках і до прискорення екскреції глюкози (див. Непатентний Документ І). До даного часу все більша кількість досліджень направлена на розробку терапевтичних агентів проти діабету, що залежать від інгібування SGLT2. Наприклад, сполуки, що використовуються як інгібітори SGLT2, описані в JP 2000-080041 А (Патентний Документ 1), Міжнародній Публікації WO 01/068660 (Патентний Документ 2), Міжнародній Публікації WO 04/007517 (Патентний Документ 3) і так далі. Однак, з флоридзином і сполуками, розкритими в даних патентних заявках, пов'язана проблема, що полягає в тому, що при пероральному введенні вони легко гідролізуються за рахунок дії глікозидази і т.п., присутньої в тонкій кишці і, отже, швидко втрачають свою фармакологічну дію. Крім того, у випадку флоридзину, його аглікон флоретин, за відомостями, сильно інгібує транспортери цукру типу полегшеної дифузії. Наприклад, є пові домлення, які демонструють, що флоретин створює несприятливий ефект зниження внутрішньоцеребральних рівнів глюкози при внутрішньовенному введенні щурам (див., наприклад, Непатентний Документ 2). По вказаних причинах, були зроблені спроби перетворення даних сполук в форми їх проліків для уникнення таких проблем при перетравленні і для поліпшення ефективності всмоктування. Однак незважаючи на те, що потрібно, щоб проліки при введенні були точно метаболізовані в активні сполуки в цільових органах або поблизу них, стійкого ефекту часто важко досягнути через дію різних метаболічних ферментів, присутніх в організмі, і великих відмінностей між індивідуумами. Також були зроблені інші спроби заміни глікозидних зв'язків в даних сполуках вуглець-вуглецевими зв'язками (див. Патентні Документи 4-8). Однак досі існує потреба в подальших поліпшеннях їх фармацевтичних властивостей, включаючи активність і метаболічну стабільність. Патентний Документ1: Японська Патентна Публікація 2000-080041 А Патентний Документ 2: Міжнародна Публікація WO 01/068660, опис Патентний Документ 3: Міжнародна Публікація WO 04/007517, опис Патентний Документ 4: Публікація Патенту US 2001/041674 А Патентний Документ 5: Публікація Патенту US 2002/137903 А Патентний Документ 6: Міжнародна Публікація WO 01/027128, опис Патентний Документ 7: Міжнародна Публікація WO 02/083066. опис Патентний Документ 8: Міжнародна Публікація WO 04/013118, опис Непатентний Документі 1: J. Clin. Invest., 93, 397 (1994) Непатентний Документ 2: Stroke, 14. 388 (1983) Задачі, що вирішуються за допомогою винаходу Метою даного винаходу є забезпечення похідного спірокеталю, що має фармацевтично переважні властивості. Зокрема, даний винахід націлений на забезпечення похідного спірокеталю, що має гіпоглікемічну дію і що додатково має фармацевтично переважні властивості, такі як пролонгована ефективність, метаболічна стабільність або безпека. Іншою метою даного винаходу є забезпечення фармацевтичної композиції, що використовується для профілактики або лікування захворювань, викликаних гіперглікемією, таких, як діабет, включаючи інсулін-залежний цукровий діабет (діа 9 90290 бет І типу) і інсулін-незалежний цукровий діабет (діабет II типу), діабетичні ускладнення і ожиріння. Засоби для вирішення задач Внаслідок широких і інтенсивних дій, пророблених для досягнення викладених вище цілей, автори даного винаходу виявили, що похідне спірокеталю Формули (І) має виняткову інгібуючу активність по відношенню до SGLT2. Дане відкриття привело до створення даного винаходу. А саме, відповідно до одного аспекту даного винаходу, забезпечена сполука Формули (І)· Формула 1 (I) , де R1, R2, W і R4 кожний незалежно вибраний з атома водню. С1-С6 алкільної групи, яка може бути заміщена одним або більше Ra, C7-C14 аралкільної групи, яка може бути заміщена одним або більше Rb, І -C(=O)Rx; Rx являє С1-С6 алкільну групу, яка може буї и заміщена одним або більше Ra. арильну групу, яка може бути заміщена одним або більше Rb, гетероарильну групу, яка може бути заміщена одним або більше Rb, C1-C6 алкоксигруну, яка може бути заміщена одним або більше Ra, або -NReRf; Аr представляє ароматичне карбоциклічне кільце, яке може бути заміщене одним або більше Rb, або ароматичне гетероциклічне кільце, яке може бути заміщене одним або більше Rb; Q представляє -(CH2)m-(L)p- або -(L)p-(CH2)m-, m представляє ціле число, вибране від 0 до 2, n представляє ціле число, вибране з 1 і 2, і р представляє ціле число, вибране з 0 і 1, L представляє -О-, -S- або -NR5-, R5 вибраний з атома водню, С1-С6 алкільної групи, яка може бути заміщена одним або більше Ra, і -C(=O)Rx; А представляє арильну групу, яка може бути заміщена одним або більше Rb, або гетероарильну групу, яка може бути заміщена одним або більше Rb, де арильна група або гетероарильна група може утворювати конденсоване кільце з ароматичним карбоциклічним кільцем або ароматичним гетероциклічним кільцем; Ra незалежно вибраний з атома галогену. гідроксильної групи, ціаногрупи. нітрогрупи, карбоксильної групи, C1-C6 алкоксигрупи, яка може бути заміщена одним або більше Rс, арильної групи, яка може бути заміщена одним або більше Rd, арилоксигрупи, яка може бути заміщена одним або більше Rd, гетероарильної групи, яка може бути заміщена одним або більше Rd, гетероарилоксигрупи. яка може бути заміщена одним або більше Rd, меркаптогрупи, C1-C6 алкілтіогрупи, яка може бути заміщена одним або більше Rс, C1-C6 алкілсульфінільної групи, яка може бути заміщена одним або більше Rс, C1-C6 алкілсульфонільної групи, яка може бути заміщена одним або більше Rс, -NRfRg, C1-C6 алкоксикарбонільної групи, яка може 10 бути заміщена одним або більше Rс і C1-C6 алкілкарбонільної групи, яка може бути заміщена одним або більше Rс; Rb незалежно вибраний з C1-C6 алкільної групи, яка може бути заміщена одним або більше Rс, С3-C8 циклоалкільної групи, яка може бути заміщена одним або більше Rс, C2-C6 алкенільної групи, яка може бути заміщена одним або більше Rс, С2С6 алкінільної групи, яка може бути заміщена одним або більше Rс, C7-C!4 аралкільної групи, яка може бути заміщена одним або більше Rd, атома галогену, гідроксильної групи, ціаногрупи, нітрогрупи. карбоксильної групи, C1-C6 алкоксигрупи. яка може бути заміщена одним або більше Rс, арильної групи, яка може бути заміщена одним або більше Rd, арилоксигрупи, яка може бути заміщена одним або більше Rd, гетероарильної групи, яка може бути заміщена одним або більше Rd, гетероарилоксигрупи, яка може бути заміщена одним або більше Rd, меркаптогрупи, C1-C6 алкілтіогрупи, яка може бути заміщена одним або більше Rс, C1-C6 алкілсульфінільної групи, яка може бути заміщена одним або більше Rс, C1-C6 алкілсульфонільної групи, яка може бути заміщена одним або більше Rс, -NRfRg, C1-C6 алкілкарбонільної групи, яка може бути заміщена одним або більше Rс, C1C6 алкоксикарбонільної групи, яка може бути заміщена одним або більше Rс, C1-C3 алкілендіоксигрупи, гетероциклільної групи і гетероциклілоксигрупи; Rс незалежно вибраний з атома галогену, гідроксильної гр>пи, ціаногрупи, нітрогрупи, карбоксильної групи, C1-C6 алкоксигрупи, арильної групи, яка може бути заміщена одним або більше Rd, арилоксигрупи, яка може буї и заміщена одним або більше Rd, гетероарильної групи, яка може бути заміщена одним або більше Rd, гетероарилоксиїрупи. яка може бути заміщена одним або більше Rd, аміногрупою, C1-C6 алкіламіногрупи і ди(C1-C6алкіл)аміногрупи; Rd незалежно вибраний з C1-C6 алкільної групи, яка може бути заміщена одним або більше атомами галогену, C7-С14 аралкільної групи, атома галогену, гідроксильної групи, ціаногрупи, нітрогрупи, аміногрупи, C1-C6 алкіламіногрупи, і ди-(C1C6алкіл )аміногрупи: Re представляє атом водню, C1-C6 алкільну групу, яка може бути заміщена одним або більше Rс, арильну групу, яка може бути заміщена одним або більше Rd, або гетероарильну групу, яка може бути замішена одним або більше Rd; Rf представляє атом водню або C1-C6 алкільну групу, яка може бути заміщена одним або більше Rс і Rg представляє атом водню, C1-C6 алкільну групу, яка може бути заміщена Rс, C1-C6 алкілкарбонільну групу, яка може бути заміщена одним або більше Rс, арильну групу, яка може бути заміщена одним або більше Rd, гетероарильну групу, яка може бути заміщена одним або більше Rd, карбамоїльну групу, C1-C6 алкоксикарбонільну групу, яка може бути замішена одним або більше Rс, або C1C6 алкілсульфонільну групу, яка може бути замішена одним або більше Rс, або 11 90290 Re і Rf, або Rf і Rg можуть формувати 4-7членне гетероциклічне кільце разом з атомом азоту, до якого вони приєднані, або її проліки. або її фармацевтично прийнятна сіль. Відповідно до іншого аспекту даного винаходу, забезпечена сполука Формули (Іа): Формула 2 (Ia) , де Ar1, Q, n, R1, R2, R3, R4 і А визначені вище, або її проліки, або її фармацевтично прийнятна сіль. У даному винаході Аr1 переважно являє собою бензольне кільце або тіофенове кільце (кожне з яких може бути заміщене одним або більше Rb) Аналогічно, m переважно дорівнює 1 і n переважно дорівнює 1. Крім того. R1, R2, R3 і R4 кожний незалежно вибраний з атома водню і -C(=O)Rx, і Rx переважно являє собою C1-C6 алкільну групу, яка може бути заміщена одним або більше Ra, або C1C6 алкоксигрупу, яка може бути заміщена одним або більше Ra. У переважному порядку заміщення, Аr1 має замісник -(СН2)m-А на кільцевому атомі, який відділений двома атомами від кільцевого атома, безпосередньо приєднаного до заміщеної глюцитольної групи. Наприклад, коли Аr1 являє собою бензольне кільце, переважною є мета-заміщена форма; коли Аr1 являє собою піридинове кільце, переважною є 2,4-заміщена, 3,5-заміщена або 2,6заміщена форма. Альтернативно, коли Аr1 являє собою тіофенове кільце, переважною є 2,5заміщена або 3,5-заміщена форма. До кільцевого атома азоту можуть бути приєднані заміщена глюцитольна група і замісник -(СН2)m-А. Відповідно до ще одного аспекту даного винаходу, забезпечена сполука Формули (Іb): Формула 3 (Ib) , де n представляє ціле число, вибране з 1 і 2; Аr1 представляє ароматичне карбоциклічне кільце, яке може бути заміщене одним або більше Rb, або ароматичне гетероциклічне кільце, яке може бути заміщене одним або більше Rb; W представляє -O-Z або атом галогену; Ζ представляє атом водню, ацильну групу або бензильпу групу; Р1, Р2, Р3 і Р4 кожний незалежно вибраний з атома водню, ацильної групи або бензильної групи і Rb визначений вище. Ця сполука корисна, напри 12 клад, як проміжний продукт синтезу для сполуки згідно з даним винаходом, представленої Формулою (І) Термін "ацильна група", що використовується в даному описі, є звичайною назвою для груп, представлених RCO- і охоплює формшьну групу, C1-C6 алкілкарбонільну групу (наприклад, ацетильну групу, пропіонільну групу), арилкарбонільну групу (наприклад, бензоїльну групу, нафтоїльну групу). С7-С14 аралкілкарбонільну групу (наприклад, бензилкарбонільну групу) і так далі. Відповідно до ще одного аспекту даного винаходу, представлена фармацевтична композиція для застосування як інгібітора котранспортера Na+-глюкози, яка містить сполуку наведеної вище Формули (І) або (Іа) або її проліки, або її фармацевтично прийнятну сіль. Відповідно до ще одного аспекту даного винаходу, представлена фармацевтична композиція для застосування при профілактиці або лікуванні діабету (наприклад, інсулін-залежного цукрового діабету (діабету І типу) або інсулін-незалежною цукрового діабету (діабету II типу)) або викликаних гіперглікемією діабетичних ускладнень, або ожиріння, яка містить сполуки наведеної виїде Формули (І) або (Іа) або її проліки, або її фармацевтично прийнятну сіль. Відповідно до ще одного аспекту даного винаходу, представлений спосіб для профілактики або лікування діабету (наприклад, інсулін-залежного цукрового діабету (діабету І типу) або інсуліннезалежного цукрового діабету (діабету ІІ типу)), викликаних гіперглікемією діабетичних ускладнень або ожиріння, який містить введення пацієнту терапевтично ефективної кількості сполуки наведеної вище Формули (І) або (Іа) або її проліків, або її фармацевтично прийнятної солі. У наведених вище Формулах (І) і (Іа). групи, визначені, як R1, R2, R3 і R4, включають, наприклад, атом водню, C1-C6 алкільиу групу, C1-C6 алкокси-C1-C6алкільну групу, С7-С14 аралкільну групу, C1-C6 алкілкарбонільну групу, С7-С14 аралкілкарбонільну групу. C1-C6 алкоксикарбонільну групу і С7-С14 аралкілоксикарбонільну групу. Ці групи можуть бути заміщені одним або більше замісниками, кожний з яких незалежно вибраний з атома галогену, гідроксильної групи, C1-C6 алкоксигрупи, C1C6 алкілкарбонільної групи, карбоксильної групи, аміногрупи і заміщеної аміногрупи, переважно, кожна незалежно вибрана з C1-C6 алкілкарбонільної групи. Атом водню є особливо переважним як R1, R2, R3 і R4. У наведених вище Формулах (І) і (Іа) Аr1 може бути заміщений 1-4 однаковими або різними замісниками, наприклад, кожний з яких незалежно вибраний з атома галогену; гідроксильної групи; C1C6 алкільної групи, С3-С8 циклоалкільної групи, C1C6 алкоксигрупи і C1-C6 алкілтіогрупи (дані 4 групи можуть бути заміщені 1-4 замісниками, вибраними з атома галогену, гідроксильної групи і аміногрупи); метилендіоксигрупи; ціаногрупи; C1-C6 алкілсульфонільної групи, C1-C6 алкілсульфоніламіногрупи; нітрогрупи; карбоксильної групи; заміщеної аміногрупи і 4-6-членної гетероциклільної групи. Серед груп, визначених як Аr1, ароматичне карбоциклічне кільце переважно означає ароматич 13 не карбоциклічне кільце, що містить 5-6 атомів вуглецю, включаючи бензольне кільце. Ароматичне гетероциклічне кільце переважно означає 5-6членну ароматичну гетероциклічну групу, включаючи пірольне кільце, тіофенове кільце, фуранове кільце, піридинове кільце, тіазольне кільце, ізотіазольне кільце, піразольне кільце, індазольне кільце, оксазольне кільце, ізоксазольне кільце, імідазольне кільце, триазольне кільце, піримідинове кільце, уридинове кільце, піразинове кільце і піридазинове кільце. Серед них Аr1, переважно, являє собою бензольне кільце, пірольне кільце, тіофенове кільце, фуранове кільце або піразольне кільце і, більш переважно, бензольне кільце, тіофенове кільце або піразольне кільце. У наведених вище Формулах (І) і (Іа). А може бути заміщений 1-3 однаковими або різними замісниками, наприклад, кожний з яких незалежно вибраний з атома галогену; гідроксильної групи; C1C6 алкільної групи. С3-C8 циклоалкільної групи, C1C6 алкілоксигрупи і C1-C6 алкілтіогрупи (дані 4 групи можуть бути заміщені 1-4 замісниками, кожний з яких незалежно вибраний з атома галогену або гідроксильної групи або аміногрупи): метилендіоксигрупи. ціаногрупи; C1-C6 алкілсульфонільної групи; C1-C6 алкілсульфоніламіногрупи, нітрогрупи; карбоксильної групи; заміщеної аміногрупи; 5- або 6-членної гетероарильної групи і 4-6-членної гетероциклільної групи. Групи, визначені як А, включають, наприклад, фенільну групу, нафтильну групу, азуленільну групу, піролільну групу, індолільну групу, піридильну групу, хінолільну групу, ізохінолінільну групу, тієнільну групу, бензотієнільну групу, фурильну групу, бензофуранільну групу, тіазолільну групу, бензотіазолільну групу, ізотіазолільну групу, бензоізотіазолільну групу, піразолільну групу, індазолільну групу, оксазолільну групу, бензоксазолільну групу, ізоксазолільну групу, бензоізоксазолільну групу, імідазолільну групу, бензоімідазолільну групу, триазолільну групу, бензотриазолільну групу, піримідинільну групу, уридильну групу, піразилільну групу, піридазинільну групу, імідазопіридильну групу, триазолопіридильну групу і піролопіридильну групу. Переважними є фенільна група, нафтильна група, тієнільна група, бензотієнільна група, фурильна група і бензофуранільна група і більш переважними є фенільна група, тієнільна група і бензотієнільна група. Термін "С1-С6 алкільна група", що використовується в даному описі, означає лінійну або розгалужену алкільну групу, що містить 1-6 атомів вуглецю Приклади включають метил, етил, н-пропіл, і-пропіл, н-бутил, с-бутил, і-бутил, т-бутил, нпетил, 3-метилбутил, 2-метилбутил, 1-метилбутил, 1-етилпропіл, н-гексил, 4-метилпентил, 3метилпентил, 2-метилпентил, 1-метилпентил, 3етилбутил і 2-етилбутил. Переважними C1-С6 алкільними групами є, наприклад, лінійні або розгалужені алкільні групи, що містять 1-3 атоми вуглецю, особливо переважними є метил і етил. Термін "С2-С6 алкенільна група", що використовується в даному описі, означає лінійну або розгалужену алкенільну групу, що містить 2-6 атомів вуглецю. Приклади включають етеніл (вініл), 1 90290 14 пропеніл, 2-пропеніл (аліл), пропен-2-іл і 3-бутеніл (гомоаліл). Термін "С2-С6 алкінільна група", що використовується в даному описі, означає лінійну або розгалужену алкінільну групу, що містить 2-6 атомів вуглецю. Приклади включають етиніл, 1-пропініл, 2-пропініл, 1-бутиніл, 2-бутиніл і 3-бутиніл. Термін "C3-C8 циклоалкільна група", що використовується в даному описі, означає циклічну алкільну групу, що містить 3-8 атомів вуглецю. Приклади включають циклопропіл, циклобутил, циклопентил, циклогексил, циклогептил і циклооктил. Термін "C1-С6 алкоксигрупа", що використовується в даному описі, означає алкілоксигрупу, алкільна частина якої являє собою лінійну або розгалужену алкільну групу, що містить 1-6 атомів вуглецю. Приклади включають метокси, етокси, нпропокси, і-пропокси, н-бутокси, с-бутокси. ібутокси, т-бутокси, н-пентокси, 3-метилбутокси, 2метилбутокси, 1-метилбутокси, 1-етилпропокси, нгексилокси, 4-метилпентокси, 3-метилпентокси, 2метилпентокси, 1-метилпентокси і 3-етилбутокси. Термін "C7-C14 аралкільна група", що використовується в даному описі, означає арилалкільну групу, що містить 7-14 атомів вуглецю, яка включає арильну групу Приклади включають бензил, 1фенетил, 2-фенетил, 1-нафтилметил і 2нафтилметил. Термін "С7-С14 аралкілоксигрупа", що використовується в даному описі, означає арилалкілоксигрупу, що містить 7-14 атомів вуглецю, яка включає визначену вище аралкільну групу. Приклади включають бензилокси, 1-фенетилокси, 2-фенетилокси, 1-нафтилметилокси і 2-нафтилметилокси. Термін "арильна група", що використовується в даному описі, означає арильну групу, що має кільце ароматичного вуглеводню, що містить 6-10 атомів вуглецю. Приклади включають феніл, 1нафтил і 2-нафтил. Термін "гетероарильна група", що використовується в даному описі, означає 5-10-членну ароматичну гетероциклічну групу, що містить один або більше гетероатомів, незалежно вибраних з атома кисню, атома азоту і атома сірки. Приклади включають фурил, тієніл, піроліл, імідазоліл, піразоліл, оксазоліл, ісоксазоліл, тіазоліл, ісотіазоліл, оксадіазоліл, тіадіазоліл, триазоліл. тетразоліл, піридиніл, піримідиніл, піразиніл, піридазиліл, індоліл, хінолініл і ізохінолініл. Переважними гетероарильними групами є 5-6-членні циклічні гетероарильні групи такі, як фурильна група, піразолільна група, тієнільна група і піридинільна група, особливо переважною є тієнільна група. Термін "арилоксигрупа", що використовується в даному описі, означає арилоксигрупу, арильна частина якої являє собою визначену вище групу ароматичного вуглеводню, що містить 6-10 атомів вуглецю. Приклади включають фенокси, 1нафтокси і 2-нафтокси. Термін "гетероарилоксигрупа", що використовується в даному описі, означає гетероарилоксигрупу, гетероарильна частина якої являє собою визначену вище 5-10-членну ароматичну гетероциклічну групу, що містить один або більше гете 15 роатомів, вибраних з атома кисню, атома азоту і атома сірки. Приклади включають фурилокси, тієнілокси, піролілокси, імідазолілокси, піразолілокси, оксазолілокси, ізоксазолілокси, тіазолілокси, ізотіазолілокси, оксадіазолілокси, тіадіазолілокси, триазолілокси, тетразолілокси, піридинілокси, піримідинілокси, піразинілокси, піридазинілокси, індолілокси, хінолінілокси і ізохінолінілокси. Переважними гетероарилоксигрупами є 5-6-членні гетероарилоксигрупи. Термін "С1-С6 алкіламіногрупа", що використовується в даному описі, означає алкіламіногрупу, алкільна частина якої являє собою лінійну або розгалужену алкільну групу, що містить 1-6 атомів вуглецю. Приклади включають метиламіно, етиламіно, н-пропіламіно, і-пропіламіно, н-бутиламіно, с-бутиламіно, і-бутиламіно, т-бутиламіно, нпентиламіно, 3-метилбутиламіно, 2метилбутиламіно, 1-метилбутиламіно, 1етилпропіламіно, н-гексиламіно, 4метилпетиламіно, 3-метилпентиламіно, 2метилпентиламіно, 1-метилпентиламіно, 3етилбутиламіно і 2-етилбутиламіно. Термін "ди-(С1-С6алкіл)аміногрупа", що використовується в даному описі, означає діалкіламіногрупу, дві алкільних частини якої являють собою однакові або різні лінійні або розгалужені алкільні групи, що містять 1-6 атомів вуглецю. Приклади "ди-(С1-С6алкіл)аміногрупи" включають диметиламіно, діетиламіно ди-н-пропіламіно, ді-іпропіламіно, ди-н-бутиламіно, метил-н-бутиламіно, метил-с-бутиламіно, метил-і-бутиламіно, метил-тбутиламіно, етил-н-бутиламіно, етил-с-бутиламіно, етил-і-бутиламіно і етил-т-бутиламіно. Термін ''С1-С6 алкілтіогрупа", що використовується в даному описі, означає алкілтіогрупу, алкільна частина якої являє собою лінійну або розгалужену алкільну групу, що містить 1-6 атомів вуглецю. Приклади включають метилтіо, етилтіо, н-пропілтіо, і-пропілтіо, н-бутилтіо, с-бутилтіо, ібутилтіо, т-бутилтіо, н-пентилтіо, 3-метилбутилтіо, 2-метилбутилтіо, 1-метилбутилтіо, 1етилпропілтіо, н-гексилтіо, 4-метилпентилтіо, 3метилпентилтіо, 2-метилпентилтіо, 1метилпетилтіо, 3-етилбутилтіо і 2-етилбутилтіо. Термін "С1-С6 агікілсульфінільна група", що використовується в даному описі, означає алкілсульфінільну групу (-SO-R), алкільна частина якої являє собою лінійну або розгалужену алкільну групу, що містить 1-6 атомів вуглецю. Приклади включають метилсульфініл, етилсульфініл, нпропілсульфініл. і-пропілсульфініл. нбутилсульфініл, с-бутилсульфініл, ібутилсульфініл, т-бутилсульфініл, нпентилсульфініл, 3-метилбутилсульфініл, 2метилбутилсульфініл, 1-метилбутилсульфініл, 1етилпропілсульфініл, н-гексилсульфініл, 4метилпентилсульфініл, 3-метилпентилсульфініл, 2-метилпентилсульфініл, 1-метилпентилсульфініл, 3-етилбутилсульфініл і 2-етилбутилсульфініл. Термін "С1-С6 алкілсульфонільна група", що використовується в даному описі, означає алкілсульфонільну групу, алкільна частина якої являє собою лінійну або розгалужену алкільну групу, що містить 1-6 атомів вуглецю. Приклади включають 90290 16 метилсульфоніл, етилсульфоніл, нпропілсульфоніл, і-пропілсульфоніл, нбутилсульфоніл, с-бутилсульфоніл, ібутилсульфоніл, т-бутилсульфоніл, нпентилсульфоніл, 3-метилбутилсульфоніл, 2метилбутилсульфоніл, 1-метилбутилсульфоніл, 1етилпропілсульфоніл, н-гексилсульфоніл, 4метилпентилсульфоніл, 3-метилпентилсульфоніл, 2-метилпентилсульфоніл, 1метилпентилсульфоніл, 3-етилбутилсульфоніл і 2етилбутилсульфоніл. Використовуваний в даному описі, "-C(-O)-Rx" охоплює С1-С6 алкілкарбонільну групу, С7-С14 аралкілкарбонільну групу, С1-С6 алкоксикарбонільиу групу, С7-С14 аралкілоксикарбонільну групу і т.п.Приклади С1-С6 алкілкарбонільної групи включають ацетильну групу, пропіонільну групу, бутирильну групу і півалоїльну групу, особливо переважною с ацетильна група. Приклади С7-С14 аралкілкарбонільної групи включають бензилкарбонільну групу і нафтилметилкарбонільну групу, переважною є бензилкарбонільна група. Приклади С1-С6 алкоксикарбонільної групи включають метоксикарбонільну групу і етоксикарбонільну групу, переважною є метоксикарбонільна група. Приклади С7-С14 аралкілоксикарбонільної групи включають бензилоксикарбонільну групу і нафтилметилоксикарбонільну групу, переважною є бензилоксикарбонільна група. Термін "атом галогену", що використовується в даному описі, охоплює атом фтору, атом хлору, атом брому, атом йоду і т.п. Термін "4-7-членне гетероциклічне кільце", що використовується в даному описі, означає гетероциклічне кільце, яке може бути повністю насиченим або частково або повністю ненасиченим і яке містить один атом азоту і може додатково містити один або більше гетероатомів, незалежно вибраних з атома кисню, атома азоту і атома сірки. Приклади включають азетидин, піролідин, піперидин і морфолін, особливо переважним є піперидин. Термін "ароматичне карбоциклічне кільце", що використовується в даному описі, означає 6-10членне ароматичне карбоциклічне кільце. Приклади включають бензольне кільце і нафталінове кільце. Термін "ароматичне гетероциклічне кільце", що використовується в даному описі, означає 5-6членне ароматичне гетероциклічне кільце, що містить один або більше гетероатомів, незалежно вибраних з атома кисню, атома азоту і атома сірки. Приклади включають пірольне кільце, індольне кільце, тіофенове кільце, бензотіофенове кільце, фуранове кільце, бензофуранове кільце, піридинове кільце, хінолінове кільце, ізохінолінове кільце, тіазольне кільце, бензотіазольне кільце, ізотіазольне кільце, бензоізотіазольне кільце, піразольне кільце, індазольне кільце, оксазольне кільце, бензоксазольне кільце, ізоксазольне кільце, бензоізоксазольне кільце, імідазольне кільце, бензоімідазольне кільце, триазольне кільце, бензотриазольне кільце, піримідинове кільце, уридинове кільце, піразинове кільце і піридазинове кільце. 17 Термін "заміщена аміногрупа", що використовується в даному описі, охоплює -NReRf, де Rе представляє атом водню, С1-С6 алкільну групу, С1С6 алкілкарбонільну групу, карбамоїльну або С1-С6 алкоксикарбонільну групу і Rf представляє атом водню або С1-С6 алкільну групу, або Rе і Rf можуть формувати 4-7-членне гетероциклічне кільце разом з атомом азоту, до якого вони приєднані і т.п. Термін "С1-С3 алкілевдіоксигрупа'', що використовується в даному описі, означає двовалентну групу, представлену формулою -О-(С1-С3 алкілен)О-. Приклади включають метилендіоксигрупу, етилендіоксигрупу і диметилметилендіоксигрупу. Термін ''гетероциклільна група'', що використовується в даному описі, означає 4-7-членну гетероциклічну групу, яка може бути повністю насиченою або частково або повністю ненасиченою і яка містить один або більше гетероатомів, незалежно вибраних з атома кисню, атома азоту і атома сірки. Приклади включають азетидиніл, піролідиніл, піперидиніл, піперазиніл, піроліл, імідазоліл, імідазолініл, піразоліл, піразолініл, оксазолініл, морфолініл, тіоморфолініл, піридиніл, піразиніл, піримідиніл, піридазиніл, гексаметиленіміно, фурил, тетрагідрофурил, тієніл, гетрагідротієніл, діоксоланіл, оксатіоланіл і діоксаніл. Така гетероциклічна група може бути заміщена в будь-якому положенні, що заміняється на атомі (атомах) вуглецю або азоту. Термін ''гетероциклілоксигрупа'', що використовується в даному описі, означає оксигрупу, приєднану до 4-7-членного гетероциклічного кільця, яке може бути повністю насиченим або частково або повністю ненасиченим і яке містить один або більше гетероатомів, незалежно вибраних з атома кисню, атома азоту і атома сірки. Приклади включають азетидинілокси, піролідинілокси, піперидинілокси, піперазинілокси, піролілокси, імідазолілокси, імідазолінілокси, піразолілокси, піразолінілокси, оксазолінілокси, морфолінілокси, тіоморфолінілокси, піридинілокси, піразинілокси, піримідинілокси, піридазилілокси, гексаметиленімінокси, фурилокси, гетрагідрофурилокси, тієнілокси, тетрагідротієнілокси, діоксоланілокси, оксатіоланілокси і діоксанілокси. Така гетероциклічна група може бути замішена в будь-якому положенні, що заміняється, на атомі (атомах) вуглецю або азоту. Сполука згідно з даним винаходом також включає суміші або виділені форми різних стереоізомерів такі, як таутомери і оптичні ізомери. У деяких випадках, сполука згідно з даним винаходом може утворювати кислотно-адитивну сіль. В залежності від типу замісника сполука згідно з даним винаходом може також утворювати сіль з основою. Конкретні приклади такої солі включають кислотно-адитивні солі з неорганічними кислотами (наприклад, хлористоводневою кислотою, бромистоводневою кислотою, йодистоводневою кислотою, сірчаною кислотою, азотною кислотою, фосфорною кислотою), з органічними кислотами (наприклад, мурашиною кислотою, оцтовою кислотою, пропіоновою кислотою, щавлевою кислотою, малоновою кислотою, янтарною 90290 18 кислотою, фумаровою кислотою, малеїновою кислотою, молочною кислотою, яблучною кислотою, винною кислотою, лимонною кислотою, метансульфоновою кислотою, етансульфоновою кислотою) і з кислотними амінокислотами (наприклад, аспарагіновою кислотою, глутаміновою кислотою). Аналогічно, приклади соль утвореної з основою, включають солі з неорганічними основами (наприклад, солі натрію, калію, магнію, кальцію, алюмінію), солі з органічними основами (наприклад, метиламіном, етиламіном, етаноламіном), солі з основними амінокислотами (наприклад, лізином, орнітином), а також солі амонію. Крім того, сполука згідно з даним винаходом також включає гідрати, різні фармацевтично прийнятні сольвати і поліморфні кристалічні форми і т.д. Потрібно зазначити, що сполука згідно з даним винаходом не обмежена сполуками, вказаними в розділі «Приклади», наведеному нижче, і вона охоплює всі наведені вище похідні спірокеталів Формули (І) і їх фармацевтично прийнятні солі. Крім того, даний винахід також охоплює так звані проліки. тобто, сполуки. які в процесі обміну речовин in vivo перетворюються в сполуки наведеної вище Формули (І) або їх фармацевтично прийнятні солі Приклади груп, що утворюють проліки для сполуки згідно з даним винаходом, включають групи, що знаходяться в Prog Med vol.5, pp.2157-2161 (1985) і "Iyakuhin no Kaihatsu (розробка фармацевтичних препаратів)" vol.7 (Molecular Design), pp.163-198. опублікованому у 1990 в Hirokawa Publishing Co., Японія. Сполука згідно з даним винаходом може бути отримана шляхом застосування різних відомих способів синтезу, з урахуванням її характеристик, що залежать від структури скелета або типів замісників. У деяких випадках, в залежності від типу функціональної групи, технічно переважно захищати дану функціональну групу відповідною захисною групою на стадії вихідного матеріалу або на проміжній стадії. У цьому випадку, захисна група може бути видалена на подальшому етапі для отримання необхідної сполуки. Як приклад функціональної групи, яку необхідно захистити в ході процесу продукування, можуть бути наведені гідроксильна група або карбоксильна група. Захисні групи для даних груп включають описані в "Protective Groups in Organic Synthesis" 2nd edition, написаному Greene and Wuts. Тип захисної групи, що використовується, а також умови реакції для введення і видалення захисної групи можуть бути відповідним чином вибрані на основі відомих методик таких, як методики, показані в наведеному вище документі. Сполука згідно з даним винаходом має інгібуючу активність по відношенню до натрійзалежного котранспортера 2 глюкози (SGLT2), що бере участь в зворотному всмоктуванні глюкози в нирках (J. Clin. Invest., vol.93, р.397, 1994). Інгібування SGLT2 запобігає зворотному всмоктуванню цукру і сприяє видаленню надмірного цукру з тіла зі створенням, таким чином, терапевтичного ефекту відносно діабету і ефекту поліпшення резистентності до інсуліну шляхом корекції гіперглікемії, без прик 19 ладення навантаження на β-клітини підшлункової залози. Таким чином, відповідно до одного аспекту даного винаходу, забезпечена фармацевтична композиція для профілактики або лікування захворювань або станів, перебіг яких може бути поліпшений за рахунок інгібування активності SGLT2, наприклад, діабету, пов'язаних з діабетом захворювань і діабетичних ускладнень. Термін "діабет", що використовується в даному описі, охоплює діабет І типу, діабет II типу і інші типи діабету з характерною етіологією. Аналогічно, термін "пов'язані з діабетом захворювання" включає, наприклад, ожиріння, гіперінсулінемію, порушення обміну вуглеводів, гіперліпідемію, гіперхолестеринемію, гіпертригліцеридемію, порушення обміну ліпідів, гіпертензію, застійну серцеву недостатність, набрякову хворобу, гіперурикемію і подагру. Термін "діабетичні ускладнення", що використовується в даному описі, включає як гострі ускладнення, так і хронічні ускладнення. Приклади "гострих ускладнень" включають гіперглікемію (наприклад, кетоацидоз), інфекції (наприклад, інфекції шкіри, м'яких тканин, жовчної системи, дихальної системи і сечових шляхів) і т.д. Приклади "хронічних ускладнень" включають мікроангіонатію (наприклад, нефропатію, ретинопатію), артеріосклероз (наприклад, атеросклероз, інфаркт серця, інфаркт головного мозку, артеріальну оклюзію нижньої кінцівки), невропатію (наприклад, чутливих нервів, рухових нервів, вегетативних нервів), гангрену ніг і т.д. Головні діабетичні ускладнення включають діабетичну ретинопатію, діабетичну нефропатію і діабетичну невропатію. Сполука згідно з даним винаходом також може бути використана в поєднанні з будь-яким терапевтичним агентом проти діабету, діабетичних ускладнень, гіперліпідемії або артеріальної гіпертензії, який залежить від механізму дії, який відрізняється від інгібування активності SGLT2. При комбінуванні з іншими препаратами можна чекати, що сполука згідно з даним винаходом створить адитивний ефект по відношенню до даних захворювань, який більше, ніж будь-який нарізно. Приклади "терапевтичного агента проти діабету або діабетичних ускладнень" прийнятного для комбінованого застосування включають, наприклад, сенсибилізатори інсуліну (наприклад, агоністи PPARγ, агоністи PPARα/γ, агоністи PPARδ, агоністи PPARα/γ/δ), інгібітори глікозидази, бігу аніди, стимулятори секреції інсуліну, інсулінові препарати, антагоністи глюкагонового рецептора, стимулятори кінази інсулінового рецептора, інгібітори трипептидил-пептидази II, інгібітори дипептидил пептидази IV, білкові інгібітори іирозинфосфатази-1В, інгібітори глікоген-фосфорилази, інгібітори глюкоза-6-фосфатази, інгібітори глюконеогенезу, інгібітори фруктоза-біфосфатази, інгібітори піруват-дегідрогенази, активатори глюкокінази, D-хіроїнозитол, інгібітори глікоген-синтазакінази-3, глюкагонподібний пептид 1, аналоги глюкагонподібного пептиду 1, агоністи глюкагонподібпого пептиду 1, амілін, аналоги аміліну, агоністи аміліну, антагоністи глюкокортикоїдного рецепто 90290 20 ра, інгібітори 11β-гідроксистероїд дегідрогенази, інгібітори альдоза-редуктази, інгібітори протеїнкінази С, антагоністи рецептора γ-аміномасляної кислоти, антагоністи натрієвого каналу, інгібітори фактора транскрипції NF-κΒ, інгібітори ΘΚΚβ. інгібітори ліпід-пероксидази, інгібітори дипептидази Nацетильованих-α-зв'язаних кислот, інсуліноподібний фактор росту І, фактори росту тромбоцитів (PDGF), аналоги факторів росту тромбоцитів (PDGF), епідермальні фактори росту (EGF), фактори росту нервів, похідні карнітину, уридин, 5гідрокси-1-метилгідантоїн, EGB-761, бімокломол, сулодексид, Υ-128 і TAR-428. Ілюстративними прикладами терапевтичного агента проти діабету або діабетичних ускладнень с наступні агенти. "Бігуаніди" включають гідрохлорид метформіну і фенформін. "Стимулятори секреції інсуліну" включають сполуки сульфонілсечовинного типу такі, як глібурид (глібенкламід), гліпізид, гліклазид і хлорпропамід, а також сполуки несульфонілсечовинного типу такі, як натеглінід, репаглінід і мітиглінід. "Інсулінові препарати" охоплюють як рекомбінантно продукований інсулін людини, так і інсулін, отриманий з тварин. Такі препарати можуть бути розділені на три групи в залежності від тривалості дії: швидкодіючі препарати (наприклад, інсулін людини, нейтральний інсулін людини); препарати із середньою тривалістю дії (наприклад, водна суспензія інсулін-ізофанінсулін людини, водна суспензія нейтральний інсулін людини-ізофанінсулін людини, водна суспензія інсулін-цинку людини, водна суспензія інсулін-цинку) і препарати тривалої дії (наприклад, суспензія кристалічного інсулінцинку людини). "Інгібітори глікозидази" включають акарбозу, воглібозу і міглітол. "Сенсибилізатори інсуліну" включають агоністи PPARγ такі, як троглітазон, піоглітазон і росиглітазон, подвійні агоністи PPARα/γ такі, як МK-767 (K.RP-297), тесаглітазар, LM4156, LY510929, DRF4823 і TY-51501, а також агоністи PPARδ такі, як GW-501516. "Інгібітори трипептидил пептидази II" включають UCL-139. "Інгібітори дипептидил пептидази IV" включають NVP-DPP728A, LAF-237. МK-0431, Р32/98 і TSL-225. "Інгібітори альдоза редуктази" включають аскорбіл гамоленат, толрестат, епалрестат, фідарестат, сорбініл, поналрестат, ризарестат і зенарестат. "Антагоністи рецептора γ-аміномасляної кислоти" включають топірамат. "Антагоністи натрієвого каналу" включають гідрохлорид мексилетину. "Інгібітори фактора транскрипції NF-κΒ" включають дексліпотам. "Інгібітори ліпід пероксидази" включають тирилазад мезилат. "Інгібітори дипептидази N-ацетильованих-αзв'язаних кислот" включають GPI-5693. "Похідні карнітину" включають карнітин і гідрохлорид о-ацетил-L-карнітину. 21 Приклади "терапевтичного агента проти гіперліпідемії або артеріальної гіпертензії" прийнятного для комбінованого застосування включають, наприклад, інгібітори гідроксиметилглутарилкофермент А редуктази, фібратні сполуки, агоністи β3-адренергічного рецептора, активатори АМРK, інгібітори ацил-кофермент А:холестерин ацилтрансферази, пробукол, агоністи рецептора тиреоїдного гормону, інгібітори всмоктування холестерину, інгібітори ліпази, інгібітори мікросомального білка-переносника тригліцеридів, інгібітори ліпооксигенази, інгібітори карнітин-пальмітоїлтрансферази, інгібітори сквален-синтази, промотори рецептора ліпопротеїнів низької щільності, похідні нікотинової кислоти, смоли, що зв'язують жовчну кислоту, інгібітори натрійзалежного транспортера жовчної кислоти, інгібітори білкатранспортера складного ефіру холестерину, інгібітори ангіотензин-перетворюючого ферменту, антагоністи рецептора ангіотензину II, інгібітори ендотелін-перетворюючого ферменту, антагоністи рецептора ендотеліну, діуретики, антагоністи кальцію, судинорозширювальні антигіпертензивні засоби, симпатолітичні агенти, антигіпертензивні засоби центральної дії, агоністи α2-адренергічного рецептора, антитромбоцитарні агенти, інгібітори продукування сечової кислоти, стимулятори екскреції сечової кислоти, підлужувачі сечі, анорексигенні засоби, інгібітори АСЕ, агоністи рецептора адипонектину, агоністи GPR40 і антагоністи GPR40. Ілюстративними прикладами терапевтичного агента проти гіперліпідемії або артеріальної гіпертензії є наступні агенти. "Інгібітори гідроксиметилглутарил-кофермент А редуктази" включають флувастатин, ловастатин, правастатин, церивастатин і пітавастатин. "Фібратні сполуки" включають безафібрат, беклобрат і бініфібрат. "Інгібітори сквален синтази" включають ТАK475 і похідні α-фосфоносульфонату (Патент США №5712396). "Інгібітори ацил-кофермент А:холестерин ацилтрансферази" включають СІ-1011, NTE-122, FCE27677, RP-73163, МСС-147 і DPU-129. "Промотори рецептора ліпопротеїнів низької щільності" включають MD-700 і LY-295427. "Інгібітори мікросомального білка-переносника тригліцеридів (інгібітори МТР)" включають сполуки, описані, наприклад, в Патентах США №5739135, 5712279 і 5760246. "Аноректичні засоби" включають агоністи адреналіну/норадреналіну (наприклад, мазіндол, ефедрин), агоністи серотоніну (селективні інгібітори зворотного захоплення серотоніну такі, як флувоксамін), агоністи адреналіну/серотоніну (наприклад, сибутрамін), агоністи рецептора меланокортину 4 (MC4R), α-меланоцитконцентруючі гормони (α-МСН), лептин, а також кокаїн- і амфетамін-регульовані транскрипти (CART). "Агоністи рецептора тиреоїдного гормону" включають ліотиронін натрію і левотироксин натрію. 90290 22 "Інгібітори всмоктування холестерину" включають езетиміб. "Інгібітори ліпази" включають орлістат. "Інгібітори карнітин-пальмітоїл-трансферази" включають етомоксир. "Похідні нікотинової кислоти" включають нікотинову кислоту, нікотинамід, нікомол і нікорандил. "Смоли, що зв'язують жовчну кислоту" включають холестирамін, колестилан і гідрохлорид колесевеламу. "Інгібітори ангіотензин-перетворюючого ферменту" включають капторил, малеат еналаприлу, алацеприл і цилазаприл. "Антагоністи рецептора ангіотензину II" включають кандесартан цилексетил, лосартан калію і мезилат епросартану. "Інгібітори ендотелін-перетворюючого ферменту" включають CGS-31447 і CGS-35066. "Антагоністи рецептора ендотеліну" включають L-749805, ТВС-3214 і BMS-182874 Як приклад, при лікуванні діабету і т.п., було б переважне застосування сполуки згідно з даним винаходом в поєднанні, щонайменше, з одним лікарським засобом, вибраним з групи, що складається з сенсибілізатора інсуліну (наприклад, агоніста PPARγ, агоніста PPARα/γ, агоніста PPARδ, агоніста PPARα/γ/δ), інгібітору глікозидази, бігуаніду, стимулятора секреції інсуліну, інсулінового препарату і інгібітору дипептидил пептидази IV. Альтернативно, було б переважне застосування сполуки згідно з даним винаходом в поєднанні, щонайменше, з одним лікарським засобом, вибраним з групи, що складається з інгібітору гідроксиметилглутарил-кофермент А редуктази, фібратної сполуки, інгібітору сквален-синтази, інгібітору ацил-кофермент А:холестерин ацилтрансферази, промотора рецептора ліпопротеїнів низької щільності, інгібітору мікросомального білка-переносника тригліцеридів і анорексигенного засобу. Фармацевтична композиція згідно з даним винаходом може бути введена системно або місцево пероральним шляхом або парентеральним (наприклад, внутрішньоректальним, підшкірним, внутрішньом'язовим, внутрішньовенним, черезшкірним) шляхом. Для застосування як фармацевтична композиція, сполука згідно з даним винаходом може бути отримана в будь-якій необхідній лікарській формі, вибраній з твердих композицій, рідких композицій і інших композицій, прийнятній для передбачуваної мети. Фармацевтична композиція згідно з даним винаходом може бути отримана шляхом змішування сполуки згідно з даним винаходом з фармацевтично прийнятним носієм (носіями). Конкретно, сполука згідно з даним винаходом може бути доповнена допоміжними речовинами, що звичайно використовуються, наповнювачами, зв'язувальними речовинами, дезінтегруючими агентами, агентами покриття, агентами цукрової глазурі, регуляторами рН, солюбілізаторами, водними або неводними розчинниками і так далі і потім отримана із застосуванням стандартних методик в формі таблеток, пілюль, капсул, гранул, порошків, розчинів, емульсій, суспензій, ін'єкцій і т.д. Приклади допоміжних речовин і наповнювачів включають, 23 90290 наприклад, лактозу, стеарат магнію, крохмаль, тальк, желатин, агар, пектин, гуміарабік, оливкову олію, кунжутну олію, масло какао, етиленгліколь і інші звичайно використовувані матеріали. Крім того, перед приготуванням лікарської форми сполука згідно з даним винаходом може бути модифікована для формування сполуки включення, наприклад, з α-, β-, або γ-циклодекстрином або метильованим циклодекстрином. Дозу сполуки згідно з даним винаходом змінюють в залежності від захворювання або симп 24 тому, від якого лікують, ваги тіла, віку, статі, шляху введення і т. д. Доза для дорослих переважно становить 0,1-1000мг/кг ваги тіла/день, більш переважно 0,1-200мг/кг ваги тіла/день, при прийомі у вигляді разової дози або дробових доз. Сполука згідно з даним винаходом може бути синтезована, наприклад, як показано на схемах отримання нижче. Сполука згідно з даним винаходом може бути синтезована як показано на схемі 1: Схема 1 Формула 4 де R11 і R12 мають значення, аналогічне визначеному вище для замісників на Аr1, А визначений вище і Ρ представляє захисну групу для гідроксильної групи. Більш конкретно, після того, як Сполука (II) захищена захисною групою Ρ (наприклад, тритильною групою, трет-бутилдиметилсилільною групою або тетрагідропіранільною групою, переважно групою, що відщеплюється під впливом кислоти), Сполуку (III), що виходить, обробляють алкіллітієм мання Сполуки (VII). Дану сполуку перетворюють в Сполуку (VIII) обробкою металевим реагентом, таким, як реактив Гріньяра з подальшим дебензилюванням, наприклад, шляхом каталітичної гідрогенізації в присутності паладієвого каталізатора або методики із застосуванням кислоти Льюїса (триброміду бору, трихлориду бору, комплексу трихлорид бору-диметилсульфід, комплексу трифторид бору-діетиловий ефір плюс етанті (наприклад, н-бутиллітієм, втор-бутиллітієм) і піддають реакції із Сполукою (IV) для отримання Сполуки (V). При наявності або у відсутність силанового реагенту (наприклад, триетилсилану) Сполуку (V) потім обробляють кислотою (наприклад, трифтороцтовою кислотою або комплексом трифторид бору-діетиловий ефір) і перетворюють в Сполуку (VI) з подальшою обробкою окислювачем (наприклад, реактивом Деса-Мартіна. ΤΡАΡ-ΝΜΟ, ДМСО-оцтовим ангідридом) для отри ол, комплексу трифторид бору-діетиловий ефір плюс диметилсульфід) для отримання Сполуки згідно з даним винаходом. Потрібно зазначити, що Сполуки (II) і (IV) можуть бути синтезовані як описано, наприклад, в J. Org. Chem., vol.29. p.2034, 1964 і Carbohydr. Rсs., vol.260, p.243, 1994, відповідно. Сполука згідно з даним винаходом може також бути отримана як показано на наступній Схемі 2: 25 90290 26 Схема 2 Формула 5 де R11 і R12 мають значення, аналогічне визна1 ченому виїде для замісників на Аr . А визначений 1 вище, X представляє атом галогену і X2 представляє атом галогену або B(OR13)3, де R13 представляє водень або нижчий алкіл. Більш конкретно, Сполуку (VI) обробляють відповідним галогенуючим реагентом (наприклад, Nбромсукцимідом, тетрабромідом вуглецю). Потім Сполуку (IX), що виходить, піддають реакції із Сполукою (X) в присутності відповідного паладієвого каталізатора для отримання Сполуки (XI) з подальшим дебензилюванням, наприклад, шляхом каталітичного гідрування в присутності паладієвого каталізатора або методики із застосуванням кислоти Льюїса (триброміду бору, трихлориду бору, комплексу трихлорид бору-диметилсульфід, комплексу трифторид бору-діетиловий ефір плюс етантіол, комплексу трифторид бору-діетиловий ефір плюс диметилсульфід) для отримання сполуки згідно з даним винаходом. Сполука згідно з даним винаходом може також бути отримана як показано на схемі 3. Схема 3 Формула 6 де R11 і R12 мають значення, аналогічне визначеному вище для замісників на Ar1. R13 представляє нижчий алкіл, А визначений вище, Ρ предста вляє захисну групу для гідроксильної групи і X1 представляє атом галогену. Більш конкретно, після того, як гідроксильна група Сполуки (XII) захищена відповідною захис 27 90290 ною групою Ρ (наприклад, тритильною групою, трет-бутилдиметилсилільною групою, тетрагідропіранільною групою), Сполуку (XIII), що отримується, обробляють відповідним алкіллітієм (наприклад, н-бутиллітієм, втор-бутиллітієм) і піддають реакції із Сполукою (IV) для отримання Сполуки (XIV). При наявності або у відсутність силанового реагенту (наприклад, триетилсилану) Сполуку (XIV) потім обробляють кислотою (наприклад, трифтороцтовою кислотою або комплексом трифторид бору-діетиловий ефір) для отримання 28 Сполуки (XV) з подальшою обробкою гексаалкілдитином в присутності відповідного паладієвою каталізатора, для отримання Сполуки (XVI). У присутності відповідного паладієвого каталізатора, Сполуку (XVI) потім обробляють Сполукою (XVII) для отримання Сполуки (XI) з подальшим відщепленням захисної групи для синтезу Сполуки згідно з даним винаходом. Сполука згідно з даним винаходом може також бути отримана як показано на наступній Схемі 4: Схема 4 Формула 7 де R11 і R12 мають значення, аналогічне визначеному вище для замісників на Аr1, А визначений вище. Ρ представляє захисну групу для гідроксильної групи, і X представляє атом галогену. Сполуку (XVIII) бромують відповідним агентом бромування (наприклад, бромом, Nбромсукцимідом) і його гідроксильну групу захищають відповідною захисною групою Ρ (наприклад, трипільною групою, третбутилдиметилсилільною групою, тетрагідропіранільною групою) з подальшим використанням реактиву Гріньяра або подібного для отримання Аддукту (XXI). Гідроксильну групу, що виходить, відщеплюють шляхом обробки силановим реаген том (наприклад, триетилсиланом) в присутності кислоти (наприклад, трифтороцтової кислоти або комплексу трифторид бору-діетиловий ефір) для отримання Сполуки (XXII). У разі необхідності, гідроксильну групу знов захищають для отримання Сполуки (XXIII) Реакцію між Сполуками (IV) і (XXIII) виконують способом, аналогічним показаному на схемі 3, для реакції між Сполуками (IV) і (XIII). Перетворення Сполуки (XXIV) в Сполуку (XI) виконують способом, аналогічним показаному на схемі 3, для перетворення Сполуки (XIV) в Сполуку (XV). Сполука згідно з даним винаходом також може бути отримана як показано на наступній Схемі 5 Схема 5 Формула 8 29 90290 де R11 і R12 мають значення, аналогічне визначеному вище для замісників на Аr1. L, m, р і А визначені вище і X1 представляє атом галогену. Сполуку (VI) дебензилують, наприклад, шляхом каталітичного гідрування в присутності паладієвого каталізатора або методики із застосуванням кислоти Льюїса (триброміду бору, трихлориду бору, комплексу трихлорид бору-диметилсульфід, комплексу трифторид бору-діетиловий ефір плюс етантіол, комплексу трифторид бору-діетиловий ефір плюс диметилсульфід) і Сполуку (XXV), що отримується, обробляють у відповідному розчиннику (наприклад, диметилсульфоксиді, диметилформаміді) галоїдуючим агентом (наприклад, триметилсилілхлоридом, триметилсилілбромідом) для отримання Сполуки (XXVI), Після того, як кожна гідроксильна група додатково захищена відповідною захисною групою (наприклад, ацетильною 30 групою, трет-бутилдиметилсилільною групою) Сполуку (XXVII), що отримується, піддають реакції з бороновою кислотою (наприклад, фенілбороновою кислотою) в присутності відповідного паладієвого каталізатора (наприклад, ацетату паладію, DPPF) або, альтернативно, піддають реакції з реактивом Гріньяра в присутності або у відсутність хлориду міді або, альтернативно, піддають реакції з нуклеофільним реагентом (наприклад, фенолом, аніліном, тіофенолом) в присутності основи (наприклад, карбонату калію) для отримання Сполуки (XXVIII). Від даної сполуки може бути відщеплена захисна група для отримання Сполуки згідно з даним винаходом. Сполука згідно з даним винаходом також може бути отримана як показано на наступній Схемі 6: Схема 6 Формула 9 31 90290 32 де R13 представляє складноефірну групу, Ar1, L, m, p і А визначені вище, Ρ представляє захисну групу для гідроксильної групи і X1 представляє атом галогену. У розчиннику (наприклад, диметилформаміді). Сполуку (XXIX) піддають реакції з нуклеофільним реагентом (наприклад, фенолом, бензиловим спиртом, тіофенолом, аніліном, бензиламіном) в присутності основи (наприклад, карбонату калію) для отримання Сполуки (XXX) з подальшим відно вленням складного ефіру і захистом гідроксильної групи, що отримується, для отримання Сполуки (XXXII). Перетворення Сполуки (XXXII) в Сполуку (XXXIV) виконують способом, аналогічним показаному па схемі 4 для перетворення Сполуки (XXIII) в Сполуку (XI). Від Сполуки (XXXIV) може бути відщеплена захисна група для отримання сполуки згідно з даним винаходом. Сполука згідно з даним винаходом також може бути отримана як показано на наступній Схемі 7: Схема 7 Формула 10 де R11 має значення, аналогічне визначеному вище для замісників на Аr1, G представляє -О-, -Sабо -NP-, Ρ представляє захисну групу для аміногрупи, А визначений вище, і X1 представляє атом галогену. Сполуку (XXXV) обробляють реактивом Гріньяра або подібним для отримання Сполуки (XXXVI) з подальшим застосуванням відновника такого, як триетилсилан, для отримання Сполуки (XXXVII). Дану сполуку обробляють основою такою, як LDA, і потім обробляють оксираном для отримання Сполуки (XXXVIII) з подальшим захистом гідроксильної групи для отримання Сполуки (XXXIX). Перетворення Сполуки (XXXIX) в Сполуку (ХХХХ) виконують способом, аналогічним показаному на схемі 4, для перетворення Сполуки (XXIII) в Сполуку (XI). Від Сполуки (ХХХХІ) може бути відщеплена захисна група для отримання Сполуки згідно з даним винаходом. Сполука згідно з даним винаходом також може бути отримана як показано на наступній Схемі 8: Схема 8 Формула 11 33 де R11 має значення, аналогічне визначеному вище для замісників на Аr1, А визначений вище, X1 представляє атом галогену і Ρ представляє захисну групу для гідроксильної групи. Сполуку (ХХХХІІІ). приготовану шляхом реакції поєднання із застосуванням Сполуки (ХХХХІІ), піддають циклізації і від неї відщеплюють захисну групу в присутності кислоти такої, як птолуолсульфонова кислота, для отримання Сполуки (XXXXIV). Сполуку, що отримується, обробляють галогенуючим реагентом (наприклад, триметилсилілхлоридом, триметилсилілбромідом і т.п.) у відповідному розчиннику (наприклад, диметилсульфоксидом, диметилформамідом і т.п.) для отримання Сполуки (XXXXV). Після цього сполуку, що отримується, піддають реакції з бороновою кислотою (наприклад, фенілбороновою кислотою і т.п.) в присутності паладієвого каталізатора (наприклад, ацетату паладію, DPPF і т.п.) для отримання Сполуки (XXXXVI). Сполука згідно з даним винаходом може бути продукована шляхом відщеплення захисної групи від отримуваної сполуки. Спосіб отримання Сполуки згідно з даним винаходом не обмежений варіантами виконання, проілюстрованими вище. Наприклад, сполука згідно з даним винаходом також може бути синтезо(2-бром-4-гідроксиметилфеніл)метанолу У потоці азоту до розчину 2-бромтерефталевої кислоти (5,0г, 20,4ммоль) в ТГФ (50мл), при 0°С додавали по краплях розчин ВН3 (1,09М, 74,9мл) в ТГФ і суміш перемішували при кімнатній температурі протягом 4 годин. Після додавання до даного розчину ТГФ-води (1:1). реакційну суміш екстрагували етилацетатом. Органічний шар сушили над безводним сульфатом магнію і потім випарювали при зниженому тиску для видалення розчинника. Залишок, що отримувався, очищали колонковою хроматографією на силікагелі (елюент=етилацетат:н-гексан (1:2)) для отримання сполуки, вказаної в заголовку (4,1г, 92%). 1 Н-ЯМР (DMSO-d5) δ: 4,48 (4Н, т, J=5,1Гц), 5,27 (1Н, т, J=6Гц), 5,37 (1Н, т, J=5,7Гц), 7,31 (1Η, д, J=7,8Гц), 7,45-7,49 (2H, м). MS (ESІ+):240[M+Na]+ 2) Синтез 2-бром-1,4біс(тритилоксиметил)бензолу У потоці азоту до розчину трифенілхлорметану (11,58г, 41,6ммоль) і (2-бром-4гідроксиметилфеніл)метанолу (4,1г, 18,9ммоль) в 90290 34 вана шляхом будь-якої комбінації стадій, включених в Схеми 1-8. Приклади Даний винахід додатково буде більш детально описаний за допомогою наступних прикладів і прикладів тестів, які не мають на увазі обмеження об'єму винаходу. У наступних прикладах окремі символи визначені нижче: ЯМР: спектр ядерного магнітного резонансу (внутрішній стандарт TMS). MS: мас-спектрометрія і ВЕРХ: високоефективна рідинна хроматографія. ЯМР, MS і ВЕРХ проводили із застосуванням наступних приладів. ЯМР: JEOL JNM-EX-270 (270МГц) або Brucker ARX300 (300МГц) або Vanan Mercury 300 (300МГц) або JEOL JNM-ECP400 (400МГц) MS: Мас-спектрометр Thermo Finigan LCQ або Waters micromass ZQ або Q-micro Triple Quadrupole ВЕРХ: Waters 2690/2996 (детектор) Приклад 1 1,1-Ангідро-1-С-[5-(4-етилфеніл)метил-2(гідроксиметил)феніл]-β-D-глюкопіранозу 1) Синтез ДМФА (12мл) додавали триетиламін (5,8мл, 41,6ммоль) і DMAP (369,2мг, 3,02ммоль), і суміш перемішували протягом 18 годин при кімнатній температурі. Реакційну суміш випарювали при зниженому тиску для видалення розчинника і потім екстрагували метиленхлоридом. Органічний шар промивали водою і насиченим водним розчином хлориду натрію, сушили над безводним сульфатом магнію і потім випарювали при зниженому тиску для видалення розчинника. Залишок, що отримувався, очищали колонковою хроматографією на силікагелі (елюент=етилацетат:н-гексан (1:2)) для отримання сполуки, вказаної в заголовку (2,4г, 18%). 1 Н-ЯМР (CDCІ3) δ: 4,20 (4Н, д, J=18Гц), 7,227,34 (21Н, м), 7,47-7,53 (12Н, м) 3) Синтез 3,4,5-трис-бензилокси-6бензилоксиметил-2-(2,5біс(тритилоксиметил)феніл)тетрагідропіран-2-олу У потоці азоту до розчину 2-бром-1,4біс(тритилоксиметил)бензолу (255,3мг, 0,36ммоль) в толуолі (1,5мл), при кімнатній температурі додавали по краплях розчин втор-бутиллітію (0,99М, 367мкл, 0,36ммоль) в циклогексані і розчин пере 35 мішували протягом 30 хвилин. Цей розчин додавали по краплях при -78°С до розчину 3,4,5трисбензилокси-6(бензилоксиметил)тетрагідропіран-2-ону (140мг, 0,26ммоль) в толуолі (1,5мл) і суміш перемішували при тій же температурі протягом 30 хвилин. Після додавання води реакційну суміш екстрагували етилацетатом. Органічний шар промивали насиченим водним хлоридом натрію, сушили над безводним сульфатом магнію і потім випарювали при зниженому тиску для видалення розчинника. Залишок, що отримувався, очищали колонковою хроматографією на силікагелі (елюентетилацетат:н-гексан (1:5)) для отримання сполуки, вказаної в заголовку (242мг, 80%). 1 Н-ЯМР (CDCІ3) δ: 3,34 (1Н, т, J=9,3Гц), 3,463,51 (3Н, м), 3,78 (1Н, д, J=10,8Гц), 3,92 (1Н, т, J=9,3Гц), 4,00-4,05 (1Н, м), 4,08-4,16 (3Н, м), 4,31 (2Н, с), 4,41 (1Н, д, J=12,3Гц), 4,49-4,58 (2Н, м), 4,77-4,84 (3Н, м), 6,75 (2Н, д, J=7,2Гц), 6,95 (2Н, т, J=7,2Гц), 7,02-7,07 (1Н, м), 7,11-7,32 (3511, м), 7,47-7,59 (12Н, м), 7,69 (1Н, д, J=7,5Гц). MS (ESІ+):1184 [M+Na]+ 4) Синтез 1,1-ангідро-1-С-[2,5біс(гідроксиметил)феніл]-2,3,4,6- тетра-О-бензилβ-D-глюкопіранози У потопі азоту до розчину 3,4,5трисбензилокси-6-бензилоксиметил-2-(2,5біс(тритилоксиметил)феніл)тетрагідропіран-2-олу (242мг, 0,21ммоль) в ацетонітрилі (3мл), при -40°С додавали триетилсилан (36мкл, 0,23ммоль) і комплекс трифториду бору і діетилового ефіру (29мкл, 0,23ммоль) і суміші перемішували при тій же температурі протягом 1 години. Після перемішування при 0°С протягом додаткової 1 години додавали воду і реакційну суміш екстрагували метиленхлоридом. Органічний шар промивали насиченим водним хлоридом натрію, сушили над безводним сульфатом магнію і потім випарювали при зниженому тиску для видалення розчинника. Залишок, що отримувався, очищали колонковою хроматографією на силікагелі (елюент=етилацетат:н-гексан (1:4)) для отримання сполуки, вказаної у заголовку (77,5мг, 56%). 1 Н-ЯМР (CDCІ3) δ: 3,62-3,71 (1Н, д, J=11,1Гц), 3,77-3,92 (3Н, м), 4,07-4,18 (3Н, м), 4,40-4,63 (6Н, м), 4,83-4,95 (3Н, м), 5,17 (2Н, с), 6,75 (2Н, с), 7,067,31 (25Н, м). MS (ESI+):681 [M+Na]+ 5) Синтез 1,1-ангідро-1-С-[5-форміл-2(гідроксиметил)феніл]-2,3,4,6-тетра-О-бензил-β-Dглюкопіранози У потоці азоту до розчину 1,1-ангідро-1-С-[2,5біс-(гідроксиметил)феніл]-2,3,4,6-тегра-О-бензилβ-D-глюкопіранози (77,5мг, 0,12ммоль) в метиленхлориді (1,5мл) при кімнатній температурі додавали реагент періодинану Деса-Мартіна (74,8мг, 0,18ммоль) і суміш перемішували протягом 30 хвилин. Після додавання води реакційну суміш екстрагували метиленхлоридом. Органічний шар промивали насиченим водним хлоридом натрію, сушили над безводним сульфатом магнію і потім випарювали при зниженому тиску для видалення розчинника. Залишок, що отримувався, очищали колонковою хроматографією на силікагелі (елю 90290 36 ент=етилацетат:н-гексан (1:4)) для отримання сполуки, вказаної в заголовку (25,2мг, 33%) 1 Н-ЯМР (CDCІ3) δ: 3,66 (1Н, д, J=10,8Гц), 3,763,95 (3Н, м), 4,08-4,11 (1Н, м), 4,15-4,27 (2Н, м), 4,47 (2Н, дд, J=12, 21,3Гц), 4,65 (2Н, д, J=10,8Гц), 4,88 (1Н, д, J=10,8Гц), 4,95 (2Н, с), 5,24 (2Н, с), 6,77 (2Н, д, J=6,9Гц), 7,03-7,15 (3Н, м), 7,19-7,41 (18Н, м), 7,53 (1Н, с), 7,87 (1Н, д, J=7,8Гц), 9,85 (1Н, с). MS (ESI+): 679 [M+Na]+ 6) Синтез 1,1-ангідро-1-С-[5-(4етилфеніл)іідроксиметил-2-(гідроксиметил)феніл]2,3,4,6-тетра-О-бензил-β-D-глюкопіранози У потоці азоту до розчину 1,1-ангідро-1-С-[5форміл-2-(гідроксиметил)феніл]-2,3,4,6-тетра-Обензил-β-D-глюкопіранози (25,2мг, 0,038ммоль) в діетиловому ефірі (0,3мл) при 0°С додавали розчин броміду 4-етилфенілмагнію (0,5М, 153мкл, 0,077ммоль) в ТГФ і суміш перемішували протягом 3 днів при кімнатній температурі. Після додавання води реакційну суміш екстрагували етилацетатом. Органічний шар промивали насиченим водним хлоридом натрію, сушили над безводним сульфатом магнію і потім випарювали при зниженому тиску для видалення розчинника. Залишок, що отримувався, очищали колонковою хроматографією на силікагелі (елюент=етилацетат:н-гексан (1:4)) для отримання сполуки, вказаної в заголовку (23,3мг, 80%). 1 Н-ЯМР (CDCІ3) δ: 1,13 (3Н, т, J=7,5Гц), 2,53 (2Н, кв, J=7,2 Гц, J=7,8Гц), 3,63 (1Н, д, J=9,9Гц), 3,78-3,90 (3Н, м), 4,08-4,11 (2Н, м), 4,43-4,64 (411, м), 4,89 (3Н, д, J=10,2Гц), 5,17 (2Н, с), 5,81 (1Н, с), 6,67 (2Н, с), 7,00-7,47 (25Н, м). 7) Синтез 1,1-ангідро-1-С-[5-(4етилфеніл)мстил-2-(гідроксиметил)феніл]-2,3,4,6тегра-О-бензил-β-D-глюкопіранози У потоці азоту до розчину 1,1-ангідро-1-С-[5(4-етилфеніл)гідроксиметил-2(гідроксиметил)феніл]-2,3,4,6-тетра-О-бензил-β-Dглюкопіраиози (23,3мг, 0,031ммоль) в ацегонітрилі (1мл) при -40°С додавали триетилсилан (5,8мкл, 0,037ммоль) і комплекс трифториду бору і діетилового ефіру (3,8мкл, 0,031ммоль) і суміш перемішували при тій же температурі протягом 2 годин. Після додавання води реакційну суміш екстрагували метиленхлоридом. Органічний шар промивали насиченим водним хлоридом натрію, сушили над безводним сульфатом магнію і потім випарювали при зниженому тиску для видалення розчинника. Залишок, що отримувався, очищали колонковою хроматографією на силікагелі (елюент=етилацетат:н-гексан (1:10)) для отримання сполуки, вказаної в заголовку (18,9мг, 83%). 1 Н-ЯМР (CDCІ3) δ: 1,15 (3Н, т, J=7,5Гц), 2,55 (2Н, кв, J=7,2, 7,8Гц), 3,63 (1Н, д, J=9,3Гц), 3,773,81 (1Н, дд, J=3,6, 3,9Гц), 3,83 (1Н, с), 3,86 (1Н, с), 3,95 (2Н, с), 4,00 (1Н, д, J=10,8Гц), 4,06-4,11 (2Н, м), 4,47 (2Н, д, J=12Гц), 4,60 (2Н, д, J=12,3Гц), 4,64 (1Н, с), 4,84 (1Н, д, J=3Гц), 4,89 (2Н, д, J=4,8Гц), 5,17 (2Н, дд, J=5,1, 12,3Гц), 6,71 (2Н, д, J=6,3Гц), 6,96-7,31 (25Н, м). MS (ESI+): 769 [M+Na]+ 37 8) Синтез 1,1-ангідро-1-С-[5-(4етилфеніл)мстил-2-(гідроксиметил)феніл]-β-Dглюкопіранози До розчину 1,1-ангідро-1-С-[5-(4-етилфеніл)метил-2-(гідроксиметил)феніл]-2,3,4,6-тетра-Обензил-β-D-глюкопіранози (18,9мг, 0,025ммоль) в метанолі (1мл) і етилацетаті (1мл), додавали 10% паладієвий каталізатор (2мг). Реакційну суміш перемішували в атмосфері водню протягом 5 годин при кімнатній температурі і поїш фільтрували для видалення каталізатора. Після відгонки розчинника при зниженому тиску залишок, що отримувався, очищали колонковою хроматографією на силікагелі (елюент=метиленхлорид: метанол (10:1)) для отримання сполуки, вказаної в заголовку (9,8мг, 99%). 1 H-ЯМР (CD3OD) δ: 1,19 (3Н, т, J=7,5Гц), 2,57 (2Н, кв, J=7,5, 7,8Гц), 3,41-3,47 (1Н, м), 3,64 (1Н, дд, J=6Гц), 3,73-3,83 (4Н, м), 3,95 (2Н, с), 5,11 (2Н, дд, J=7,8, 12,3Гц), 7,06-7,12 (4Н, м), 7,16-7,23 (3Н, м). МS (ЕSI+): 387 [М+1]+ Час утримування ВЕРХ: 11,4 хвилини Умови ВЕРХ Колонка: YMC-Pack ODS-A 6,0 150мм, 5мкм Рухома фаза: 20-хвилинний градієнт від 0,1% ТΦΟК/MeCN (5%)+0,1% ТФОК/Н2О (95%) до 0,1% ТΦΟК/MeCN (100%), з подальшою 5-хвилинною елюцією при тих же умовах (0,1% ТΦΟК/MeCN (100%)). Швидкість потоку; 1,5мл/хв. Температура колонки: кімнатна температура. Умови детекції: повна крива, просумована по всьому діапазону довжин хвиль 230-400нм Приклад 2 1,1-Ангідро-1-С-[5-(2-бензотіофеніл)метил-2(гідроксиметил)феніл]-β-D-глюкопіраноза 1) Синтез 1,1-ангідро-1-С-[5-(2бензотіофеніл)гідроксиметил-2(гідроксиметил)феніл]-2,3,4,6-тетра-О-бензил-β-Dілюкопіранози У потоці азоту до розчину бензотіофену (51,8мг, 0,386ммоль) в ТГФ (750мкл) при -78°С додавали по краплях розчин н-бутиллітію (2,71М, 130мкл, 0,352ммоль) в гексані і суміш перемішували протягом 10 хвилин. Після перемішування при кімнатній температурі протягом 30 хвилин реакційну суміш охолоджували до -78°С і до неї додавали по краплях розчин 1,1-ангідро-1-С-[5форміл-2-(гідроксиметил)феніл]-2,3,4,6-тетра-Обензил-β-D-глюкопіранози (207мг, 0,315ммоль) в ГГФ (450мкл). Після перемішування при кімнатній температурі протягом 1 години, додавали насичений водний хлорид амонію і реакційну суміш екстрагували етилацетатом Органічний шар промивали насиченим водним хлоридом натрію, сушили над безводним сульфатом магнію і потім випарювали при зниженому тиску для видалення розчинника. Залишок, що отримувався, очищали хроматографією на силікагелі (елюент=етилацетат:нгексан (1:3)) для отримання сполуки, вказаної в заголовку (266мг) у вигляді суміші діастереоізомерів з кількісним виходом. 1 Н-ЯМР (CDCІ3) δ: 2,45 (0,6Η, д, J=3,8Гц), 2,56 (0,4Η, д, J=4,0Гц), 3,61-3,69 (1H, м), 3,75-3,87 (2H, 90290 38 м), 3,90 (1Н, дд, J=9,6, 9,6Гц), 4,05-4,18 (3Н, м), 4,43-4,65 (4Н, м), 4,84-4,95 (3Н, м), 5,21 (2Н, с), 6,08 (0,4Н, д, J=3,8Гц), 6,11 (0,6Н, д, J=4,0Гц), 6,68-6,76 (2Н, м), 7,00-7,40 (21Н, м), 7,40-7,70 (5Н, м). 2) Синтез 1,1-ангідро-1-С-[5-(2бензотіофеніл)метил-2-(гідроксиметил)феніл]2,3,4,6-тетра-О-бензил-β-D-глюкопіранози У потоці азоту до розчину 1,1-ангідро-1-С-[5(2-бензотіофеніл)-гідроксиметил-2(гідроксиметил)феніл]-2,3,4,6-тетра-О-бензил-β-Dглюкопіранози (249мг, 0,315ммоль) в ацетонітрилі (3мл) при -40°С додавали триетилсилан (60мкл, 0,376ммоль) і комплекс трифториду бору і діетилового ефіру (42мкл, 0,331ммоль) і суміш перемішували при тій же температурі протягом 2 годин. Після додавання насиченою водного карбонату калію реакційну суміш екстрагували етилацетатом. Органічний шар промивали насиченим водним хлоридом натрію, сушили над безводним сульфатом магнію і потім випарювали при зниженому тиску для видалення розчинника. Залишок, що отримувався, очищали хроматографією на силікагелі (елюент=етилацетат:н-гексан (1:4)) для отримання сполуки, вказаної в заголовку (103мг, 42%) у вигляді суміші діастереоізомерів. 1 Н-ЯМР (CDCІ3) δ: 3,66 (1Н, дд, J=1,8, 11,1Гц), 3,80 (1Н, дд, J=3,7, 11,2Гц), 3,84 (1Н, дд, J=9,5, 9,5Гц), 3,88 (1Н, д, J=9,5Гц), 4,05-4,15 (3Н, м), 4,21 (1Н, д, J=16,0Гц), 4,25 (1Н, д, J=16,0Гц), 4,46 (1Н, д, J=12,2Гц), 4,49 (1Н, д, J=10,7Гц), 4,58 (1Н, д, J=12,2Гц), 4,61 (1Н, д, J=10,7Гц), 4,83-4,95 (3Н, м), 5,18 (1Н, д, J=12,7Гц), 5,19 (1Н, д, J=12,5Гц), 6,74 (1Н, дд, J=8,2, 1,7Гц), 6,93 (1Н, с), 7,06-7,36 (23Н, м), 7,50 (1Н, дд, J=7,2, 1,4Гц), 7,61 (1Н, д, J=7,9Гц). 3) Синтез 1,1-ангідро-1-С-[5-(2бензотіофеніл)метил-2-(гідроксиметил)феніл]-β-Dглюкопіранози У потоці азоту до розчину 1,1-ангідро-1-С-[5(2-бензотіофеніл)метил-2-(гідроксиметил)феніл]2,3,4,6-тетра-О-бензил-β-D-глюкопіранози (30,7мг, 0,0396ммоль) і пентаметилбензолу (60,6мг, 0,409ммоль) в дихлорметані (2мл) при -78°С додавали 1,0 Μ розчин трихлориду бору (400мкл, 0,400ммоль) в дихлорметані і суміш перемішували при тій же температурі протягом 1 години. Після додавання метанолу реакційну суміш нагрівали до кімнатної температури і випарювали при зниженому тиску для видалення розчинника. Залишок, що отримувався, очищали тонкошаровою хроматографією (елюент=метанол:дихлорметан (1:10)) для отримання сполуки, вказаної в заголовку (10,4мг, 63,8%). 1 Н-ЯМР (CD3OD) δ: 3,44 (1Н, ддд, J=9,0, 5,3, 3,5Гц), 3,65 (1Н, дд, J=11,6, 5,3Гц), 3,72-3,86 (4Н, м), 4,27 (2Н, с), 5,10 (1Н, д, J=12,7Гц), 5,14 (1Н, д, J=12,7Гц), 7,07 (1Н, с), 7,18-7,37 (5Н, м), 7,66 (1Н, дд, J=1,5, 7,0Гц), 7,72 (1Н, д, J=8,1Гц). MS (ESI+):414[M]+ Час утримування ВЕРХ: 12,3 хвилини. Умови ВЕРХ Колонка: YMC-Pack ODS-A 6,0 150мм, 5мкм. Рухома фаза: 20-хвилинний градієнт від 0,1% ТΦΟК/MеCN (5%)+0,1% ТФОК/Н2О (95%) до 0,1% ТΦΟК/MeCN (100%) з подальшою 5-хвилинною 39 елюцією при тих же умовах (0,1% ТΦΟК/MeCN (100%)). Швидкість потоку: 1,5мл/хв. Температура колонки: кімнатна температура. Умови детекції: повна крива, просумована по всьому діапазону довжин хвиль 230-400нм Приклад 3 1,1-Ангідро-1-С-[5-(4-метоксифеніл)метил-2(гідроксиметил)феніл]-β-D-глюкопіраноза 1) Синтез 1,1-ангідро-1-С-[5-(4метоксифеніл)гідроксиметил-2(гідроксиметил)феніл]-2,3,4,6-тетра-O-бензил-β-Dглюкопіранози У потоці азоту до розчину 1,1-ангідро- 1-С-[5форміл-2-(гідроксиметил)феніл]-2,3,4,6-гегра-Oбензил-β-D-глюкопіранози (2,01г, 3,06ммоль) в діетиловому ефірі (24мл) при 0°С додавали розчин броміду 4-метоксифенілмагнію (0,5М, 12,24мл, 6,12ммоль) в ТГФ і суміш перемішували протягом 2 годин і 30 хвилин при кімнатній температурі. Після додавання води реакційну суміш екстрагували етилацетатом. Органічний шар промивали насиченим водним хлоридом натрію, сушили над безводним сульфатом магнію і потім випарювали при зниженому тиску для видалення розчинника. Залишок, що отримувався, очищали колонковою хроматографією на силікагелі (елюент=етилацeтат:н-гексан (1:4)) для отримання сполуки, вказаної в заголовку (2,15г, 92%). 1 Н-ЯМР (СDCI3) δ, 3,63 (1Н, д, J=9,9Гц), 3,69 (3Н, с), 3,78-3,90 (3Н, м), 4,08-4,11 (2Н, м), 4,434,64 (4Н, м), 4,89 (3Н, д, J=10,2Гц), 5,17 (2Н, с), 5,81 (1Н, с), 6,67 (2Н, м), 7,06-7,48 (25Н, м). 2) Синтез 1,1-ангідро-1-С-[5-(4метоксифеніл)метил-2-(гідроксиметил)феніл]2,3,4,6-тетра-О-бензил-β-D-глюкопіранози У потоці азоту до розчину 1,1-ангідро- 1-С-[5(4-метоксифеніл)гідроксиметил-2(гідроксиметил)феніл]-2,3,4,6-тетра-О-бензил-β-Dглюкопіранози (270мг, 0,353ммоль) в метиленхлориді (2,7мл) при -40°С додавали триетилсилан (281мкл, 1,764ммоль) і комплекс трифториду бору і діетилового ефіру (47мкл, 0,37ммоль) і суміш перемішували при тій же температурі протягом 15 хвилин. Після додавання води реакційну суміш екстрагували метиленхлоридом Органічний шар промивали насиченим водним хлоридом натрію, сушили над безводним сульфатом магнію і потім випарювали при зниженому тиску для видалення розчинника. Залишок, що отримувався, очищали колонковою хроматографією на силікагелі (елюент=етилацетат:н-гексан (1:10)) для отримання сполуки, вказаної в заголовку (260мг, 90%). 1 Н-ЯМР (CDCІ3) δ: 3,63 (1Н, д, J=9,3Гц), 3,69 (3Н, с), 3,77-3,81 (1Н, дд, J=3,9, 3,6Гц), 3,83 (1Н, с), 3,86 (1Н, с), 3,92 (2Н, с), 3,99 (1Н, д, J=10,8Гц), 4,06-4,14 (2Н, м), 4,47 (2Н, д, J=12Гц), 4,56 (1Н, с), 4,61 (2Н, д, J=12,3Гц), 4,84 (1Н, д, J=3Гц), 4,89 (2Н, д, J=4,8Гц), 5,16 (2Н, дд, J=12,3, 5,1Гц), 6,60-6,70 (4Н, м), 6,98 (2Н, д, J=6,3Гц), 7,07-7,31 (21Н, м). 3) Синтез 1,1-ангідро-1-С-[5-(4метоксифеніл)метил-2-(гідроксиметил)феніл]-β-Dглюкопіранози До розчину 1,1-ангідро-1-С-[5-(4метоксифеніл)метил-2-(гідроксиметил)феніл] 90290 40 2,3,4,6-тетра-О-бензил-β-D-глюкопіранози (280мг, 0,381ммоль) в метанолі (1мл) і етилацетаті (1мл) додавали 10% паладієвий каталізатор (28,7мг) і додатково додавали 2н НСІ (15,2мкл). В атмосфері водню реакційну суміш перемішували протягом 45 хвилин при кімнатній температурі і потім фільтрували для видалення каталізатора. Після відгонки розчинника при зниженому тиску залишок, що виходив, очищали колонковою хроматографією на силікагелі (елюент=метиленхлорид:метанол (10:1)) для отримання сполуки, вказаної в заголовку (114мг, 98%). 1 Н-ЯМР (CD3OD) δ: 3,36-3,42 (1Н, м), 3,60 (1Н, дд, J=6Гц), 3,70 (3Н, с), 3,71-3,79 (4Н, м), 3,88 (2Н, с), 5,02 (2Н, дд, J=12,3, 7,8Гц), 6,74-6,78 (2Н, м), 6,79-7,08 (2Н, м), 7,12-7,18 (3Н, м). MS (ESH): 388 [M]+f Час утримування ВЕРХ: 9,62 хвилин Умови ВЕРХ Колонка: YMC-Pack ODS-A 6,0 150мм, 5мкм Рухома фаза: 20-хвилинний градієнт від 0,1% ТΦΟК/MeCN (5%)+0,1% ТФОК/Н2О (95%) до 0,1% ТΦΟК/MeCN (100%) з подальшою 5-хвилинною елюцією при тих же умовах (0,1% ТΦΟК/MeCN (100%)) Швидкість потоку: 1,5мл/хв. Температура колонки: кімнатна температура. Умови детекції повна крива, просумована по всьому діапазону довжин хвиль 230-400нм Приклад 4 1,1-Ангідро-1-С-[5-(4-ізопропілфеніл)метил-2(гідроксиметил)феніл]-β-D-глюкопіраноза 1) Синіез 1,1-ангідро-1-С-[5-(4ізопропілфеніл)гідроксиметил-2(гідроксиметил)феніл]-2,3,4,6-тетра-О-бензил-β-Dглюкопіранози У потоці азоту розчин 4-бромізопропілбензол (27,20г, 136,62ммоль) в ГГФ (242мл) охолоджували до -78°С і до нього додавали по краплях розчин н-бутиллітію (2,67М, 54,37мл) в гексані. Реакційну суміш перемішували при тій же температурі протягом 1,5 години. Додавали по краплях розчин 1,1ангідро-1-С-[5-форміл-2-(гідроксиметил)феніл]2,3,4,6-тетра-О-бензил-β-D-глюкопіраіюзи (56,08г, 85,39ммоль) в ТГФ (232мл) і суміш перемішували при -78°С протягом 1,5 години. Додавали насичений водний хлорид амонію для зупинки реакції. Реакційну суміш екстрагували етилацетатом. Органічний шар промивали насиченим водним хлоридом натрію, сушили над безводним сульфатом магнію і потім випарювали при зниженому тиску для видалення розчинника. Залишок, що виходив, очищали колонковою хроматографією на силікагелі (елюент=етилацетат:н-гексан (1:3)) для отримання сполуки, вказаної в заголовку (57,78г, 87%) у вигляді суміші діастереоізомерів. 1 Н-ЯМР (CDCІ,) δ: 1,14 (6Н, д, J=6,9Гц), 2,08 (0,6 Η, д, J=3,3Гц), 2,15 (0,4 Η, д, J=3,6Гц), 2,752,81 (1Н, м), 3,63-3,67 (1Н, м), 3,76-4,15 (6Н, м), 4,42-4,64 (4Н, м), 4,84-4,94 (3Н, м), 5,12-5,22 (2Н, м), 5,80-5,84 (1Н, м), 6,64-6,68 (2Н, с), 7,02-7,49 (25Н, м) 2) Синтез 1,1-ангідро-1-С-[5-(4ізопропілфеніл)метил-2-(гідроксиметил)феніл]2,3,4,6-тетра-О-бензил-β-D-глюкопіранози 41 У потопі азоту до 1,1-ангідро-1-С-[5-(4ізопропілфеніл)гідроксиметил-2(гідроксиметил)феніл]-2,3,4,6-тетра-О-бензил-β-Dглюкопіранози (2,186г, 2,81ммоль) в дихлорметані (28мл) при -40°С додавали триетилсилан (2,24мл, 14,02ммоль) і комплекс трифториду бору і діетилового ефіру (0,38мл, 3,00ммоль) і суміш перемішували при тій же температурі протягом 1,5 години. Після додавання насиченою водного карбонату калію реакційну суміш екстрагували метиленхлоридом. Органічний шар промивали насиченим водним хлоридом натрію, сушили над безводним сульфатом магнію і потім випарювали при зниженому тиску для видалення розчинника. Залишок, що виходив, очищали колонковою хроматографією на силікагелі (елюент=етилацетат:н-гексан (1:5)) для отримання сполуки, вказаної в заголовку (1,81г, 85%). 1 Н-ЯМР (CDCІ3) δ: 1,16 (6Н, дд, J=6,9, 0,8Гц), 2,77-2,81 (1Н, м), 3,65 (1Н, дд, J=11,0, 1,6Гц), 3,783,87 (3Н, м), 3,95-4,01 (3Н, м), 4,06-4,15 (2Н, м), 4,45 (2Н, д, J=12,1Гц), 4,56-4,63 (2Н, м), 4,64 (1Н, с), 4,85-4,94 (3Н, м), 5,15 (2Н, дд, J=17,6, 12,4Гц), 6,68-6,71 (2Н, м), 7,00-7,31 (2511, м). 3) Синтез 1,1-ангідро-1-С-[5-(4ізопропілфеніл)-метил-2-(гідроксиметил)феніл]-βD-ілюкопіранози До розчину 1,1-ангідро-1-С-[5-(4ізопропілфеніл)метил-2-(гідроксиметил)феніл]2,3,4,6-тетра-О-бензил-β-D-глюкопіранози (1,78г, 2,34ммоль) в метанолі (11мл) і етилацетаті (11мл), додавали 10% паладієвий каталізатор (0,22г). В атмосфері водню реакційну суміш перемішували протягом 1 години при кімнатній температурі і потім фільтрували для видалення каталізатора. Після відгонки розчинника при зниженому тиску залишок, що виходив, очищали колонковою хроматографією на силікагелі (елюент=метиленхлорид:метанол (10:1)) для отримання сполуки, вказаної в заголовку (0,75г, 80%). 1 Н-ЯМР (CD3OD) δ: 1,21 (6Н, д, J=6,9Гц), 2,822,86 (1Н, м), 3,43-3,47 (1Н, м), 3,64 (1Н, дд, J=12,1, 5,8Гц), 3,74-3,81 (4Н, м), 3,95 (2Н, с), 5,11 (2Н, дд, J=19,5, 12,4Гц), 7,11 (4Н, с), 7,16-7,22 (3Н, м). MS (ESI+): 401 [М+1]+ Час утримування ВЕРХ: 12,1 хвилини Умови ВЕРХ Колонка: YMC-Pack ODS-A 6,0 150мм, 5мкм Рухома фаза 20-хвилинний градієнт від 0,1% ТΦΟК/MeCN (5%)+0,1% ТФОК/Н2О (95%) до 0,1% ТΦΟК/MeCN (100%) з подальшою 5-хвилинною елюцією при тих же умовах (0,1% ТΦΟК/MeCN (100%)) Швидкість потоку 1,5мл/хв. Температура колонки: кімнатна температура Умови детекції: повна крива, просумована по всьому діапазону довжин хвиль 230-400нм Приклад 5 1,1-ангідро-1-С-[5-(4-циклопропілфеніл)метил2-(гідроксиметил)феніл]-β-D-глюкопіраноза 1) Синтез 1,1-ангідро-1-С-[5-(4циклопропілфеніл)гідроксиметил-2(гідроксиметил)феніл]-2,3,4,6-тетра-О-бензил-β-Dглюкопіранози 90290 42 У потоці азоту до суспензії магнію (0,27г, 11,11ммоль) і 4-бромциклопропілбензолу (2,00г, 10,15ммоль) в ефірі (21мл), додавали 1,2диброметан (0,014мл, 0,16ммоль). Реакційну суміш перемішували при кімнатній температурі протягом 1,5години і потім охолоджували до 0°С з подальшим додаванням по краплях розчину 1,1ангідро1-С-[5-форміл-2-(гідроксиметил)феніл]2,3,4,6-тетра-О-бензил-β-D-глюкопіранози (5,10г, 7,77ммоль) в ефірі (21мл). Після перемішування при 0°С протягом 1 години додавали насичений водний хлорид амонію для зупинки реакції. Реакційну суміш двічі екстрагували ефіром. Органічний шар промивали насиченим водним хлоридом натрію, сушили над безводним сульфатом магнію і потім випарювали при зниженому тиску для видалення розчинника. Залишок, що виходив, очищали хроматографією на силікагелі (елюент=нгексан:ацетон (3:1)) для отримання сполуки, вказаної в заголовку (5,18г, 86%). 1 Н-ЯМР (CDCІ3) δ: 0,55-0,59 (2Н, м), 0,86-0,92 (2Н, м), 1,75-1,82 (1Н, м), 2,12 (1Н, д, J=3,6Гц), 3,62-4,15 (7Н, м), 4,43-4,64 (4Н, м), 4,86-4,90 (3Н, м), 5,12-5,21 (2Н, м), 5,78-5,88 (1Н, м), 6,65-6,69 (1Н, м), 6,85-7,41 (26Н, м). 2) Синтез 1,1-ангідро-1-С-[5-(4циклопропілфеніл)метил-2-(гідроксиметил)феніл]2,3,4,6-тетра-О-бензил-β-D-глюкопіранози У потоці азоту до 1,1-ангідро-1-С-[5-(4циклопропілфеніл)гідроксиметил-2(гідроксиметил)феніл]-2,3,4,6-тетра-О-бензил-β-Dглюкопіранози (5,16г, 6,66ммоль) в дихлорметані (67мл) при -40°С додавали триетилсилан (5,30мл, 33,18ммоль) і комплекс трифториду бору і діетилового ефіру (0,91мл, 7,18ммоль) і суміш перемішували при тій же температурі протягом 1,5 години. Після додавання насиченою водного карбонату калію реакційну суміш екстрагували метиленхлоридом. Органічний шар промивали насиченим водним хлоридом натрію, сушили над безводним сульфатом магнію і потім випарювали при зниженому тиску для видалення розчинника. Залишок, що виходив, очищали колонковою хроматографією на силікагелі (елюент=етилацетат:н-гексан (1:4)) для отримання сполуки, вказаної в заголовку (4,27г, 85%). 1 Н-ЯМР (CDCІ3) δ: 0,56-0,58 (2Н, м), 0,86-0,90 (2Н, м), 1,74-1,84 (1Н, м), 3,63-3,67 (1Н, м), 3,773,86 (3Н, м), 3,94 (2Н, с), 3,99 (1Н, д, J=10,4Гц), 4,07-4,14 (2Н, м), 4,45 (2Н, д, J=12,1Гц), 4,56-4,63 (2Н, м), 4,85-4,90 (3Н, м), 5,11-5,20 (2Н, м), 6,686,71 (2Н, м), 6,83-6,86 (2Н, м), 6,97 (2Н, д, J=8,2Гц), 7,09-7,31 (21Н, м). 3) Синтез 1,1-ангідро-1-С-[5-(4циклопропілфеніл)метил-2-(гідроксиметил)феніл]β-D-глюкопіранози У потоці азоту до розчину 1,1-ангідро-1-С-[5(4-ииклопропілфеніл)метил-2(гідроксиметил)феніл]-2,3,4,6-тетра-О-бензил-β-Dглюкопіранози (2,55г, 3,36ммоль) і пентаметилбензолу (4,99г, 33,66ммоль) в дихлорметані (185мл), при -78°С додавали 1,0Μ розчин трихлориду бору (33,26мл, 33,26ммоль) в дихлорметані і суміш перемішували при тій же температурі протягом 2 годин. Після додавання метанолу (185мл) реакцій 43 ну суміш нагрівали до кімнатної температури і випарювали при зниженому тиску для видалення розчинника. Залишок, що виходив. очищали тонкошаровою хроматографією (елюент=метанол:дихлорметан (1:10)) для отримання сполуки, вказаної в заголовку (0,67г, 50%). 1 Н-ЯМР (CD3OD) δ: 0,59-0,64 (2Н, м), 0,87-0,94 (2Н, м), 1,82-1,87 (1Н, м), 3,40-3,47 (1Н, м), 3,61 (1Н, дд, J=12,1, 5,8Гц), 3,74-3,83 (4Н, м), 3,94 (2Н, с), 5,09 (2Н, дд, J=20,3, 12,4Гц), 6,94-6,97 (2Н, м), 7,05-7,08 (2Н, м), 7,19 (3Н, м). MS (ESІ+): 398 [M]+ Час утримування ВЕРХ: 11,4 хвилини Умови ВЕРХ Колонка: YMC-Pack ODS-A 6,0 150мм, 5мкм Рухома фаза: 20-хвилинний градієнт від 0,1% ТΦΟК/MeCN (5%)+0,1% ТΦΟК/H2Ο (95%) до 0,1% ТΦΟК/MeCN (100%) з подальшою 5-хвилинною елюцією при тих же умовах (0,1% ТΦΟК/MeCN (100%)) Швидкість потоку, 1,5мл/хв. Температура колонки: кімнатна температура Умови детекції: повна крива, просумована по всьому діапазону довжин хвиль 230-400нм Приклад 6 1,1-Ангідро-1-С-[5-(4-н-пропілфеніл)метил-2(гідроксиметил)феніл]-β-D-глюкопіраноза 1,1-ангідро-1-С-[5-(4-циклопропілфеніл)метил-2-(гідроксиметил)феніл]-2,3,4,6-тетра-Обензил-β-D-глюкопіранозу, отриману в Прикладі 5 (1,68г, 2,21ммоль), розчиняли в метанолі (10мл) і етилацетаті (10мл). До даного розчину додавали 10% паладієвий каталізатор (0,21г). В атмосфері водню реакційну суміш перемішували протягом 1,5 години при кімнатній температурі і потім фільтрували для видалення каталізатора. Після відгонки розчинника при зниженому тиску залишок, що виходив, очищали колонковою хроматографією на силікагелі (елюент=метиленхлорид:метанол (10:1)) для отримання сполуки, вказаної в заголовку (0,65г, 73%). 1 Н-ЯМР (CD3OD) δ: 0,92 (3Н, т, J=7,4Гц), 1,571,64 (2Н, м), 2,50-2,55 (2Н, м), 3,43-3,49 (1Н, м), 3,65 (1Н, дд, J=11,8, 5,5Гц), 3,75-3,85 (4Н, м), 3,95 (2Н, с), 5,09 (2Н, дд, J=19,2, 12,4Гц), 7,04-7,22 (7Н, м). MS (ESI+), 401 [M+1]+ Час утримування ВЕРХ: 12,3 хвилини Умови ВЕРХ Колонка: YMC-Pack ODS-A 6,0 150мм, 5мкм Рухома фаза: 20-хвилинний градієнт від 0,1% ТΦΟК/MeCN (5%)-0,1% ТФОК/Н2О (95%) до 0,1% ТΦΟК/MeCN (100%) з подальшою 5-хвилинною елюцією при тих же умовах (0,1% ТΦΟК/MeCN (100%)) Швидкість потоку: 1,5мл/хв. Температура колонки: кімнатна температура Умови детекції: повна крива, просумована по всьому діапазону довжин хвиль 230-400нм Приклад 7 1,1-ангідро-1-С-[5-(4-етилфенілокси)-2(гідроксиметил)феніл]-β-D-глюкопіраноза 1) Синтез метилового ефіру 2-бром-4(етилфенокси)-бензойної кислоти 90290 44 До розчину метилового ефіру 2-бром-4фторбензойної кислоти (488мг, 2,09ммоль) в безводному ДМФА (15мл) при кімнатній температурі додавали 4-етилфенол (256мг, 2,09ммоль) і карбонат калію (289мг, 2,09ммоль) з подальшим перемішуванням в атмосфері азоту протягом 16 годин при 160°С. Реакційну суміш охолоджували і потім, після додавання насиченого водного хлориду амонію, екстрагували етилацетатом. Органічний шар промивали насиченим водним хлоридом натрію і сушили над сульфатом натрію. Після фільтрації розчинник відганяли при зниженому тиску і залишок, що виходив, очищали колонковою хроматографією на силікагелі (елюент=етилацетат:нгексан (1:20)) для отримання сполуки, вказаної в заголовку (455мг, 65%). 1 Н-ЯМР (CDCІ3) δ: 1,26 (3Н, т, J=7,6Гц), 2,67 (2Н, кв, J=7,6Гц), 3,90 (3Н, с), 6,88-6,93 (1Н, м), 6,94-7,01 (2Н, м), 7,19-7,26 (3Н, м), 7,83 (1Н, д, J=8,7Гц). 2) Синтез [2-бром-4-(4етилфснокси)феніл]метанолу У потоці азоту до розчину метилового ефіру 2бром-4-(етилфенокси)-бензойної кислоти (90мг, 0,269ммоль) в безводному толуолі (2мл) при -78°С додавали по краплях розчин DIBAL (1М, 0,537мл, 0,537ммоль) в толуолі. Реакційну суміш перемішували при -78°С протягом 1,5 години і при кімнатній температурі протягом 1,5 години. Реакційну суміш знов охолоджували до -78°С з подальшим додаванням 1н хлористоводневої кислоти (0,2мл) і ефіру (3,5мл). Реакційну суміш екстрагували етилацетатом. Органічний шар промивали насиченим водним хлоридом натрію і сушили над сульфатом натрію. Після фільтрації розчинник відганяли при зниженому тиску і залишок, що виходив, очищали колонковою хроматографією на силікагелі (елюент=етилацетат:н-гексан (1:5)) для отримання сполуки, вказаної в заголовку (78мг, 94%). 1 Н-ЯМР (CDCІ3) δ: 1,25 (3Н, т, J=7,6Гц), 2,65 (2Н, кв, J=7,6Гц), 4,71 (2Н, с), 6,91-6,97 (3Н, м), 7,15-7,21 (3Н, м), 7,39 (1Н, д, J=8,4Гц). 3) Синтез (2-тритилоксиметил)-5-(4етилфенокси)-фенілброміду У потоці азоту до розчину [2-бром-4-(4етилфенокси)феніл]метанолу (493мг, 1,61ммоль) в суміші безводного ДМФА (5мл) і метиленхлориду (5мл) додавали трифенілхлорметан (492мг, 1,77ммоль), триетиламін (0,247мл, 1,77ммоль) і 4диметиламінопіридин (50мг). Реакційну суміш перемішували при кімнатній температурі протягом 12 годин. Після додавання води реакційну суміш екстрагували етилацетатом. Органічний шар промивали насиченим водним хлоридом натрію і сушили над сульфатом натрію. Після фільтрації розчинник відганяли при зниженому тиску і залишок, що виходив, очищали колонковою хроматографією на силікагелі (елюент=етилацетат:н-гексан (1:9)) для отримання сполуки, вказаної в заголовку (880мг, 99%). 1 Н-ЯМР (CDCІ3) δ: 1,25 (3Н, т, J=7,6Гц), 2,65 (2Н, кв, J=7,6Гц), 4,19 (2Н, с), 6,91-7,34 (1511, м), 7,49-7,53 (6Н, м), 7,64-7,68 (1Н, м). 45 4) Синтез 3,4,5-трис-бензилокси-6бензилоксиметил-2-[5-(4-етилфенокси)-2тритилоксиметилфеніл]тетрагідропіран-2-олу У потоці азоту до розчину (2тритилоксиметил)-5-(4-етилфенокси)фенілброміду (766мг, 1,39ммоль) в безводному ТГФ (15мл) при 78°С додавали по краплях розчин н-бутиллітію (1,6Μ, 0,92мл, 1,47ммоль) в гексані і суміш перемішували протягом 15 хвилин. До даного розчину при -78°С по краплях додавали розчин 3,4,5трисбснзилокси-6(бензилоксиметил)тетрагідропіран-2-ону (751мг, 1,39ммоль) в безводному ТГФ (1,5мл) і розчин, що виходив, перемішували при тій же температурі протягом 10 хвилин. Після додавання насиченого водного хлориду амонію реакційну суміш екстрагували етилацетатом. Органічний шар промивали насиченим водним хлоридом натрію, сушили над безводним сульфатом натрію і потім випарювали при зниженому тиску для видалення розчинника. Залишок, що виходив, очищали колонковою хроматографією на силікагелі (елюент=етилацетат:нгексан (1:7)) для отримання сполуки, вказаної в заголовку (615мг, 43%). 1 Н-ЯМР (CDCІ3) δ: 1,22 (3Н, т, J=7,6Гц), 2,62 (2Н, кв, J=7,6Гц), 3,30-3,59 (4Н, м), 3,80-4,05 (3Н, м), 4,25-4,39 (5Н, м), 4,46-4,62 (2Н, м), 4,72-4,85 (3Н, м), 6,80-7,59 (42Н, м). 5) Синтез 1,1-ангідро-1-С-[5-(4-етилфенокси)2-(гідроксиметил)-феніл]-2,3,4,6-тетра-О-бензил-βD-глюкопіранози У потоці азоту до розчину 3,4,5-трисбензилокси-6-бензилоксиметил-2-[5-(4етилфенокси)-2тритилоксиметилфеніл]тетрагідропіран-2-олу (547мг, 0,54ммоль) в метиленхлориді (10мл) при 0°С додавали триетилсилан (0,095мл, 0,60ммоль) і ТФОК (0,046мл, 0,60ммоль) з подальшим перемішуванням при кімнатній температурі протягом 2 годин. Після додавання насиченого водного карбонату калію, реакційну суміш екстрагували метиленхлоридом. Органічний шар промивали насиченим водним хлоридом натрію, сушили над безводним сульфатом натрію і потім випарювали при зниженому тиску для видалення розчинника. Залишок, що виходив, очищали колонковою хроматографією на силікагелі (елюент=етилацетат:нгексан (1:4)) для отримання сполуки, вказаної в заголовку (405мг, 99%). 1 Н-ЯМР (CDCІ3) δ: 1,22 (3Н, т, J=7,6Гц), 2,62 (2Н, кв, J=7,6Гц), 3,59-3,87 (4Н, м), 4,04-4,21 (3Н, м), 4,41-4,68 (4Н, м), 4,81-4,95 (3Н, м), 5,11-5,24 (2Н, м), 6,77-6,91 (4Н, м), 6,95 (1Н, д, J=1,9Гц), 7,01-7,36 (22Н, м). MS (ESI+): 772 [M+Na]+ 6) Синтез 1,1-ангідро-1-С-[5-(4-етилфенокси)2-(гідроксиметил)феніл]-β-D-глюкопіранози До розчину 1,1-ангідро-1-C-[5-(4етилфенокси)-2-(гідроксиметил)феніл]-2,3,4,6тетра-О-бензил-β-D-глюкопіранози (429мг, 0,57ммоль) в суміші етилацетату (12мл) і метанолу (12мл) додавали 10% паладієвий каталізатор (400мг). В атмосфері водню реакційну суміш перемішували протягом 12 годин при кімнатній температурі і потім фільтрували для видалення ката 90290 46 лізатора. Після відгонки розчинника при зниженому тиску залишок, що виходив, очищали колонковою хроматографією на силікагелі (елюент=метиленхлорид:метанол (10:1)) для отримання сполуки, вказаної в заголовку (195мг, 88%). 1 Н-ЯМР (CD3OD) δ: 1,23 (3Н, т, J=7,6Гц), 2,63 (2Н, кв, J=7,6Гц), 3,40-3,46 (1Н, м), 3,63-3,85 (5Н, м), 5,10 (2Η, м), 6,87-7,03 (4Н, м), 7,14-7,28 (3Н, м). MS (ESI+): 411 [M+Na]+ Приклад 8 1,1-ангідро-1-С-[5-(4-етилфеніл)метил-2-(2гідроксіетил)тіофен-3-іл]-β-D-глюкопіраноза 1) Синтез (4-бромтіофен-2-іл)-(4-етилфеніл)метанолу У потоці азоту до розчину 4-бром-2тіофенкарбоксальдегіду (10,0г, 52,3ммоль) в безводному ТГФ (100мл) при -78°С додавали по краплях розчин гексану н-бутиллітію (1,6Μ, 34,35мл, 55,0ммоль) протягом 5 хвилин. Після перемішування при тій же температурі протягом 10 хвилин додавали по краплях розчин 1-бром-4етилбензолу (10,2г, 55,0ммоль) в ТГФ (50мл). Реакційну суміш перемішували при -78°С протягом 2 годин і потім, після додавання насиченого водного хлориду амонію, екстрагували етилацетатом. Органічний шар промивали насиченим водним хлоридом натрію, сушили над безводним сульфатом магнію і потім випарювали при зниженому тиску для видалення розчинника. Залишок, що виходив, очищали колонковою хроматографією на силікагелі (елюент=етилацетат:н-гексан (1:10)) для отримання сполуки, вказаної в заголовку (7,1г, 45%). 1 Н-ЯМР (CDCІ3) δ: 1,24 (3Η, т, J=7,5Гц), 2,42 (1Н, с), 2,65 (2Н, кв, J=7,5Гц), 5,93 (1Н, с), 6,76 (1Н, с), 7,14 (1Н, с), 7,20 (2Н, д, J=8,1Гц), 7,32 (2Н, д, J=8,1Гц). 2) Синтез 4-бром-2-(4-етилфеніл)метидтіофену У потоці азоту до розчину (4-бромтіофен-2-іл)(4-етилфеніл)-метанолу (7,10г, 23,9ммоль) в метиленхлориді (70мл) при 0°С додавали триетилсилан (4,6мл, 28,7ммоль) і комплекс трифториду бору і діетилового ефіру (3,33мл, 26,3ммоль) з подальшим перемішуванням при кімнатній температурі протягом 2 годин. Після додавання 50% розчину метанол-вода (1мл) реакційну суміш екстрагували метиленхлоридом. Органічний шар промивали насиченим водним хлоридом натрію, сушили над безводним сульфатом магнію і потім випарювали при зниженому тиску для видалення розчинника. Залишок, що виходив, очищали колонковою хроматографією на силікагелі (елюент=етилацетат:н-гексан (1:50)) для отримання сполуки, вказаної в заголовку (3,4г, 51%). 1 Н-ЯМР (CDCІ3) δ: 1,23 (3Н, т, J=7,5Гц), 2,63 (2Н, кв. J=7,5Гц), 4,06 (2Н, с), 6,70 (1Н, с), 7,02 (1Н, с), 7,14 (4Н, с). 3) Синтез 2-[3-бром-5-((4етилфеніл)метил)тіофен-2-іл]етанолу У потоці азоту до 4-бром-2-((4етилфеніл)метил)тіофену (2,80г, 10,0ммоль) в безводному ГГФ (40мл) при -78°С додавали по краплях LDA (2,0 Μ, 5,50мл, 11,0мл) протягом 5 хвилин. Після перемішування реакційної суміші 47 при 0°С протягом 30 хвилин при -78°С додавали по краплях розчин етиленоксиду (10мл) в ТГФ. Реакційну суміш нагрівали до кімнатної температури і перемішували протягом 3 годин. Після додавання води реакційну суміш екстрагували ефіром. Органічний шар промивали насиченим водним хлоридом натрію, сушили над безводним сульфатом натрію і потім випарювали при зниженому тиску для видалення розчинника. Залишок, що виходив. очищали колонковою хроматографією на силікагелі (елюент=етилацетат:н-гексан (1:9)) для отримання сполуки, вказаної в заголовку (2,55г, 78%). 1 Н-ЯМР (CDCІ3) δ: 1,23 (3Н, т, J=7,5Гц), 1,60 (1Н, с), 2,63 (2Н, кв. J=7,5Гц), 2,96 (2Н, т, J=6,3Гц), 3,80 (2Н, т, J=6,3Гц), 4,00 (2Н, с), 6,62 (1Н, с), 7,14 (4Н, с). 4) Синтез 3-бром-5-(4-етилфеніл)-метил-2-(2тритилоксіетил)тіофену У потоці азоту до розчину 2-[3-бром-5-((4етилфеніл)метил)пофен-2-іл]-етанолу (2,55г, 7,84ммоль) в суміші безводного ДМФА (15мл) і метиленхлориду (15мл) додавали трифенілхлорметан (3,29г, 11,8ммоль). До цього розчину при 0°С додавали триетиламін (1,64мл, 11,8ммоль) і 4диметиламіноптридин (77мг, 0,63ммоль). Реакційну суміш перемішували при 40°С протягом 4 годин. Після додавання води реакційну суміш екстрагували метиленхлоридом. Органічний шар промивали насиченим водним хлоридом натрію і сушили над сульфатом натрію. Після фільтрації розчинник відганяли при зниженому тиску і залишок, що виходив, очищали колонковою хроматографією на силікагелі (елюент=етилацетат:н-гексан (1:20)) для отримання сполуки, вказаної в заголовку (3,60г, 81%). 1 Н-ЯМР (CDCІ3) δ: 1,22 (3Н, т, J=7,5Гц), 2,62 (2Н, кв, J=7,5Гц), 2,96 (2Н, т, J=6,3Гц), 3,26 (2Н, т, J=6,3Гц), 4,00 (2Н, с), 6,60 (1Н, с), 7,12 (4Н, с), 7,12-7,27 (9Н, м), 7,37-7,40 (6Н, м). 5) Синтез 3,4,5-трис-бензилокси-6бензилоксиметил-2-[5-(4-етилфеніл)метил-2-(2тритилоксіетил)тіофен-3-іл]-тетрагідропіран-2-олу У потоці азоту до розчину 3-бром-5-((4етилфеніл)метил)-2-(2-тритилоксіетил)тіофену (1,45г, 2,55ммоль) в безводному ТГФ (40мл) при 78°С додавали по краплях розчин гексану нбутиллітію (1,6Μ, 1,76мл, 2,8 ίммоль) і суміш перемішували протягом 15 хвилин. До даного розчину при -78°С додавали по краплях розчин 3,4,5трисбензилокси-6(бензилоксиметил)тетрагідропіран-2-ону (1,50г, 2,81ммоль) в безводному ТГФ (10мл) і розчин, що виходив, перемішували при тій же температурі протягом 10 хвилин. Після додавання насиченого водного хлориду амонію реакційну суміш екстрагували етилацетатом. Органічний шар промивали насиченим водним хлоридом натрію, сушили над безводним сульфатом магнію і потім випарювали при зниженому тиску для видалення розчинника. Залишок, що виходив, очищали колонковою хроматографією на силікагелі (елюент=етилацетат:нгексан (1:20)) для отримання сполуки, вказаної в заголовку (1,70г, 65%). 90290 48 1 Н-ЯМР (CDCІ3) δ: 1,22 (3Н, т, J=4,5Гц), 2,56 (1Н, д, J=9,3Гц), 2,62 (2Н, кв, J=4,5Гц), 3,26-3,31 (2Н, м), 3,39 (1Н, д, J=6,0Гц), 3,47 (1Н, д, J=5,4Гц), 3,75-4,08 (8Н, м), 4,48 (2Н, т, J=7,5Гц), 4,60 (1Н, д, J=7,2Гц), 4,66 (1Н, д, J=6,6Гц), 4,87 (2Н, кв, J=3,3Гц), 4,95 (1Н, д, J=6,6Гц), 5,25 (1Н, с), 6,84 (1Н, с), 7,02-7,31 (39Н, м). MS (ESІ+): 1049 [M+Na]+ 6) Синтез 1,1-ангідро-1-С-[5-(4-етилфеніл)метил-2-(2-гідроксіетил)-тіофен-3-іл]-2,3,4,6-теіраО-бензил-β-D-глюкопіранози У потоці азоту до розчину 3,4,5-трисбензилокси-6-бензилоксиметил-2-[5-(4етилбензил)-2-(2-тритилоксіетил)-тіофен-3-іл]тетрагідропіран-2-олу (1,70г, 1,68ммоль) в метиленхлориді (60мл) при 0°С додавали триетилсилан (0,30мл, 1,85ммоль) i комплекс діетилового ефіру (0,234мл, 1,85ммоль) з подальшим перемішуванням при кімнатній температурі протягом 2 годин. Після додавання насиченого водного карбонату калію реакційну суміш екстрагували метиленхлоридом. Органічний шар промивали насиченим водним хлоридом натрію, сушили над безводним сульфатом магнію і потім випарювали при зниженому тиску для видалення розчинника. Залишок, що виходив, очищали колонковою хроматографією на силікагелі (елюент=етилацетат:нгексан (1:9)) для отримання сполуки, вказаної в заголовку (1,14г, 84%). 1 Н-ЯМР (CDCІ3) δ: 1,19 (3Н, т, J=4,5Гц), 2,562,59 (3Н, м), 3,02-3,09 (1Н, м), 3,69 (1Н, д, J=6,0Гц), 3,75-3,81 (3Н, м), 3,95-4,12 (6Н, м), 4,18 (1Н, д, J=7,3Гц), 4,50 (2Н, дд, J=6,9, 9,0Гц), 4,60 (2Н, м), 4,86 (2Н, д, J=5,4Гц), 4,93 (1Н, д, J=6,6Гц), 6,62 (1Н, с), 6,88 (2Н, д, J=3,9Гц), 7,03 (2Н, д, J=4,8Гц), 7,08 (2Н, д, J=4,8Гц), 7,16-7,33 (18Н, м). MS (ESD: 789 [M+Na]+ 7) Синтез 1,1-ангідро-1-С-[(4-етилфеніл)метил-2-(2-гідроксіетил)-тіофен-3-іл]-β-Dглюкопіранози У потоці азоту до розчину 1,1-ангідро-1-С-[5(4-етилфеніл)метил-2-(2-гідроксіетил)тіофен-3-іл]2,3,4,6-тетра-О-бензил-β-D-глюкопіранози (1,14г, 1,46ммоль) в безводному метиленхлориді (50мл) при -78°С додавали пентаметилбензол (3,25г, 21,9ммоль). Додатково додавали трихлорид бору (14,6мл, 14,6ммоль) з подальшим перемішуванням при -78°С протягом 2 годин. Після додавання метанолу розчинник відганяли при зниженому тиску і залишок, що виходив, очищали колонковою хроматографією на силікагелі (елюент=метиленхлорид:метанол (20:1)) для отримання сполуки, вказаної в заголовку (350мг, 59%). 1 Н-ЯМР (CD3OD) δ: 1,20 (3Н, т, J=7,5Гц), 2,522,64 (3Н, м), 2,93-3,03 (1Н, м), 3,34-3,37 (1Н, м), 3,61-3,83 (5Η, м), 3,96-4,05 (4Н, м), 6,67 (1Н, с), 7,09-7,15 (4Н, м). MS (ESI+): 407 [M+1]+ Приклад 9 1,1-Ангідро-1-С-[5-(4-біфеніл)-метил-2гідроксиметил]феніл]-β-D-глюкопіраноза 1) Синтез 1,1-ангідро-1-С-[2,5-біс(гідроксиметил)феніл]-β-D-глюкопіранози 1,1-ангідро-1-С-[2,5-біс-(гідроксиметил )феніл]2,3,4,6-тетра-О-бензил-β-D-глюкопіранозу, синте 49 зовану в Прикладі 1 (0,59г, 0,90ммоль), і пентаметилбензол (1,33г, 8,95ммоль) розчиняли в дихлорметані (48мл). До даного розчину в потоці азоту при -78°С додавали 1,0Μ розчин трихлориду бору (8,95мл, 8,95ммоль) в дихлорметані і суміш перемішували при тій же температурі протягом 2 годин. Після додавання метанолу (48мл) реакційну суміш нагрівали до кімнатної температури і випарювали при зниженому тиску для видалення розчинника. Залишок, що виходив, очищали тонкошаровою хроматографією (елюент=метанол:дихлорметан (1:6)) для отримання сполуки, вказаної в заголовку (0,18г, 67%). 1 Н-ЯМР (CD3OD) δ: 3,47-3,50 (1Н, м), 3,63-3,69 (1Н, м), 3,75-3,85 (4Н, м), 4,63 (2Н, с), 5,13 (2Н, дд, J=12,6, 19,5Гц), 7,23-7,37 (3Н, м). MS (ESІ+): 299[M+1]+ 2) Синтез 1,1-ангідро-1-С-[5-хлорметил-2(гідроксиметил)феніл]-2,3,4,6-тетра-О-ацетил-β-Dглюкопіранози У потоці азот} до розчину 1,1-ангідро-1-С-[2,5біс(гідроксиметил)феніл]-β-D-глюкопіранози (100мг, 0,34ммоль) в диметилсульфоксиді (0,19мл, 2,68ммоль) при кімнатній температурі додавали по краплях хлортриметилсилан (114мкл, 0,91ммоль) і суміш перемішували при тій же температурі протягом 1,5 години. До необробленого продукту, отриманого шляхом відгонки летких компонентів, послідовно додавали N-метилморфолін (0,74мл, 6,70ммоль), 4-диметиламіноитридин (41мг, 0,34ммоль) і оцтовий ангідрид (0,32мл, 3,35ммоль) і перемішували суміш на льоду протягом 1 години і 10 хвилин. Після додавання насиченого водного хлориду натрію (1мл) і води (1мл) реакційну суміш екстрагували етилацетатом (10мл). Органічний шар промивали водою (1,5мл) і насиченим водним хлоридом натрію (1мл), сушили над сульфатом натрію і потім концентрували при зниженому тиску. Залишок, що виходив, очищали колонковою флеш-хроматографісю (елюент=етилацетат:нгексан (1:2,5)) для отримання сполуки, вказаної в заголовку (122,9мг, 76%). 1 Н-ЯМР (СDСІ3) δ: 1,74 (3Н, с), 2,01 (3Н, с), 2,05 (1Н, с), 2,08 (3Н, с), 3,99-4,08 (1Н, м), 4,244,37 (2Н, м), 4,61 (2Н, с), 5,12-5,34 (3Н, м), 5,565,67 (2Н, м), 7,22-7,28 (1Н,м), 7,38-7,47 (2Н, м). 3) Синтез 1,1-ангідро-1-С-[5-(4-біфеніл)-метил2-(гідроксиметил)феніл]-2,3,4,6-тегра-О-ацетил-βD-глюкопіранози У погоці азоту до розчину 1,1-ангідро-1-С-[5хлорметил-2-(гідроксиметил)феніл]-2,3,4,6-тетраО-ацетил-β-D-глюкопіранози (250мг, 0,516ммоль) в толуолі (2,5мл) додавали трифенілфосфін (20,3мг, 0,078ммоль), ацетат паладію (8,7мг, 0,039ммоль), 4-біфенілборонову кислоту (204мг, 1,03ммоль) і фосфат калію (219мг, 1,03ммоль). Реакційну суміш нагрівали до 80°С і перемішували протягом 15 годин. Після додавання води і етилацетату реакційну суміш промивали насиченим водним хлоридом натрію. Органічний шар сушили над сульфатом магнію, фільтрували і потім випарювали при зниженому тиску для видалення розчинника. Залишок очищали колонковою флешхроматографією (елюент=етилацетат:гексан (1:2)) 90290 50 для отримання сполуки, вказаної в заголовку (280мг, 90%). 1 Н-ЯМР (CDCІ3) δ: 1,71 (3Н, с), 2,00 (3Н, с), 2,05 (3Н, с), 2,06 (3Н, с), 4,04 (2Н, с), 4,25-4,36 (2Н, м), 5,17 (2Н, дд, J=12,5, 25,8Гц), 5,26-5,33 (2Н, м), 5,58-5,63 (2Н, м), 7,15-7,34 (6Н, м), 7,39-7,44 (2Н, м), 7,51-7,58 (4Н, м). 4) Синтез 1,1-ангідро-1-С-[5-(4-біфеніл)метил2-(гідроксиметил)феніл]-β-D-глюкопіранози До розчину 1,1-ангідро-1-С-[5-(4-біфеніл)метил-2-(гідроксиметил)феніл]-2,3,4,6-тетра-Оацетил-β-D-глюкопіранози (280мг, 0,465ммоль) в метанолі (3,0мл) додавали карбонат калію (45мг, 0,326ммоль) і суміш перемішували при кімнатній температурі протягом 1 години. Після додавання води реакційну суміш екстрагували етилацетатом. Органічний шар промивали насиченим водним хлоридом натрію і сушили над сульфатом магнію. Після фільтрації, розчинник концентрували при зниженому тиску. Залишок, що виходив, очищали колонковою флеш-хроматографією (елюент^метанол: метиленхлорид (1:15)) для отримання сполуки, вказаної в заголовку (84мг, 42%). 1 Н-ЯМР (CD3OD) δ: 3,40-3,51 (1Н, м), 3,63-3,69 (1Н, м), 3,75-3,84 (4Н, м), 4,04 (2Н, с), 5,11 (2Н, м), 7,20-7,31 (6Н, м), 7,37-7,42 (2Н, м), 7,50-7,58 (4Н, м). MS (ESI+): 457 [M+Na]+ Приклад 10 1,1-Ангідро-1-С-[5-(4-((S)-тетрагідрофуран-3ілокси)феніл)-метил-2-(гідроксиметил)феніл]-β-Dглюкопіраноза 1) Синтез 1,1-ангідро-1-С-[5-(4бензилоксифеніл)-метил-2-(гідроксиметил)феніл]2,3,4,6-тетра-О-ацетил-β-D-глюкопірапози Для отримання сполуки, вказаної в заголовку повторювали процедуру, аналогічну тій, що використовується в Прикладі 9, з використанням 1,1ангідро-1-С-[5-хлорметил-2-(гідроксиметил)феніл]2,3,4,6-тетра-О-анетил-β-D-глюкопіранози і відповідних реагентів. 1 Н-ЯМР (CDCl3) δ: 1,70 (3Н, с), 2,00 (3Н, с), 2,05 (3Н, с), 2,07 (3Н, с), 3,94 (2Н, с), 4,01-4,09 (1Н, м), 4,23-4,36 (2Н, м), 5,04 (2Н, с), 5,15 (2Н, дд, J=12,6, 25,9Гц), 5,24-5,33 (1Н, м), 5,53-5,66 (2Н, м), 6,85-6,94 (2Н, м), 7,03-7,47 (10Н, м). MS (ESІ+): 655 [M+Na]+ 2) Синтез 1,1-ангідро-1-С-[5-(4гідроксифеніл)метил-2-(гідроксиметил)феніл]2,3,4,6-тетра-О-ацетил-β-D-глюкопіранози До розчину 1,1-ангідро-1-С-[5-(4бензилоксифеніл)метил-2-(гідроксиметил)феніл]2,3,4,6-тетра-О-ацетил-β-D-глюкопіранози (250мг, 0,57ммоль) в суміші ТГФ (7мл) і метанолу (7мл) додавали 10% паладієвий каталізатор (200мг). В атмосфері водню реакційну суміш перемішували при 35°С протягом 12 годин і потім фільтрували для видалення каталізатора. Після відгонки розчинника при зниженому тиску залишок, що виходив, очищали колонковою хроматографією на силікагелі (елюент=етилацетат:н-гексан (1:1)) для отримання сполуки, вказаної в заголовку (193мг, 90%). 1 H-ЯМР (CDCІ3) δ: 1,70 (3Н, с), 2,00 (3Н, с), 2,05 (3Н, с), 2,07 (3Н, с), 3,93 (2Н, с), 4,01-4,09 (1Н, 51 м), 4,23-4,36 (2H, м), 4,65 (1Н, с), 5,15 (2Н, дд, J=12,2, 25,9Гц), 5,24-5,33 (1Н, м), 5,53-5,66 (2Н, м), 6,72-6,78 (2Н, м), 6,98-7,05 (2Н, м), 7,11-7,24 (3Н, м). + + MS (ESl ):565 [M+Na] 3) Синтез 1,1-ангідро-1-С-[5-(4-((S)тетрагідрофуран-3-ілокси)-феніл)-метил-2(гідроксиметил)феніл]-2,3,4,6-тетра-О-ацетил-β-Dглюкопіранози До розчину 1,1-ангідро-1-С-[5-(4гідроксифеніл)метил-2-(гідроксиметил)феніл]2,3,4,6-тетра-O-ацетил-β-D-глюкопірапози (190мг, 0,35ммоль) в ДМФА (3мл) додавали тетрагідрофуран-3-іловий ефір (R)-п-толуолсульфонової кислоти (102мг, 0,42ммоль) і карбонат цезію (137мг, 0,42ммоль) і суміш перемішували при кімнатній температурі протягом 12 годин. Після додавання води реакційну суміш екстрагували етилацетатом. Органічний шар промивали насиченим водним хлоридом натрію і сушили над сульфатом натрію. Після фільтрації розчинник концентрували при зниженому тиску. Залишок, що виходив, очищали колонковою флеш-хроматографією (елюент=етилацетат:н-гексан (1:2)) для отримання сполуки, вказаної в заголовку (170мг, 79%). 1 Н-ЯМР (CDCІ3) δ: 1,71 (3Н, с), 2,00 (3Н, с), 2,04 (3Н, с), 2,07 (3Н, с), 2,12-2,21 (2Н, м), 3,844,08 (7Н, м), 4,22-4,36 (2Н, м), 4,85-4,93 (1Н, м), 5,16 (2Н, дд, J=12,5, 25,7Гц), 5,24-5,33 (1Н, м), 5,53-5,66 (2Н, м), 6,74-6,81 (2Н, м), 7,01-7,10 (2Н, м), 7,11-7,19 (2Н, м), 7,23 (1Н, с). + + MS (ESI ): 635 [M+Na] 4) Синтез 1,1-ангідро-1-С-[5-(4-((S)тетрагідрофуран-3-ілокси)-феніл)-метил-2(гідроксиметил)феніл]-β-D-глюкопіранози Для отримання сполуки, вказаної в заголовку повторювали процедуру, аналогічну тій, що використовується в Прикладі 9, з використанням 1,1ангідро-1-С-[5-(4-((S)-тетрагідрофуран-3ілокси)феніл)-метил-2-(гідроксиметил)феніл]2,3,4,6-тетра-О-ацетил-β-D-глюкопіранози і відповідних реагентів. 1 H-ЯМР (CD3OD) δ: 2,00-2,28 (2Н, м), 3,39-3,49 (1Н, м), 3,60-3,98 (11Н, м), 4,92-5,00 (1Н, м), 5,10 (2Н, м), 6,76-6,84 (2Н, м), 7,08-7,15 (2Н, м), 7,177,25 (3Н, м). MS (ESI+): 467 [M+Na]+ Приклад 11 1,1-ангідро-1-С-[5-(4-((R)-тетрагідрофуран-3ілокси)феніл)-метил-2-(гідроксиметил)феніл]-β-Dглюкопіраноза Для отримання сполуки, вказаної в заголовку повторювали процедуру, аналогічну тій, що використовується в Прикладі 10, з використанням 1,1ангідро-1-С-[5-хлорметил-2-(гідроксиметил)феніл]2,3,4,6-тетра-О-ацетил-β-D-глюкопіранози і відповідних реагентів. 1 H-ЯМР (CD3OD) δ: 2,01-2,29 (2Н, м), 3,39-3,49 (1Н, м), 3,60-4,01 (11Н, м), 4,92-5,00 (1Н, м), 5,10 (2Н, м), 6,77-6,84 (2Н, м), 7,08-7,16 (2Н, м), 7,177,25 (3Н, м). MS (ESI+):467 [M+Na]+ Приклад 12 1,1-Ангідро-1-С-[5-(4-етинілфеніл)метил-2(гідроксиметил)феніл]-β-D-глюкопіраноза 90290 52 1) Синтез 1,1-ангідро-1-С-[5-(4трифторметансульфонілоксифеніл)метил-2(гідроксиметил)феніл]-2,3,4,6-тетра-О-ацетил-β-Dглюкопіранози 1,1-Ангідро-1-С-[5-(4-гідроксифеніл)метил-2(гідроксиметил)феніл]-2,3,4,6-тетра-О-ацетил-β-Dглюкопіранозу, синтезовану в Прикладі 10 (185мг, 0,341ммоль), розчиняли в безводному метиленхлориді (5,0мл). До даного розчину в потоці азоту при кімнатній температурі додавали пiридин (0,083мл, 1,02ммоль) і додатково додавали по краплях ангідрид трифторметансульфонової кислоти (0,086мл, 0,511ммоль). Реакційну суміш перемішували протягом 2 годин при кімнатній температурі. Після відгонки розчинника при зниженому тиску залишок, що виходив, очищали колонковою флеш-хроматографією (елюент=етилацетат:нгексан (1:1)) для отримання сполуки, вказаної в заголовку (217мг, 94%). 1 Н-ЯМР (CDCІ3) δ: 1,70 (3Н, с), 2,00 (3Н, с), 2,05 (3Н, с), 2,07 (3Н, с), 3,97-4,15 (3Н, м), 4,234,37 (2Н, м), 5,17 (2Н, дд, J=12,6, 25,9Гц), 5,24-5,33 (1Н, м), 5,54-5,66 (2Н,м), 7,13-7,33 (7Н, м). 2) Синтез 1,1-ангідро-1-С-[5-(4триметилсиланілетинілфеніл)метил-2(гідроксиметил)феніл]-2,3,4,6-тетра-О-ацетил-β-Dглюкопірапози У потоці азоту змішували 1,1-Ангідро-1-С-[5-(4трифторметансульфонілоксифеніл)метил-2(гідроксиметил)феніл]-2,3,4,6-тетра-О-ацетил-β-Dглюконіранозу (212мг, 0,314ммоль), триметилсилілацетилен (0,089мл, 0,628ммоль), триетиламін (0,2мл, 1,44ммоль) і дихлорбіс(трифенілфосфін)паладій (11,0мг, 0,016ммоль). До даної суміші додавали безводний ДМФЛ (3мл) і суміш перемішували при 90°С протягом 4 годин. Реакційну суміш розбавляли водою і екстрагували етилацетатом. Органічний шар промивали насиченим водним хлоридом натрію і сушили над сульфатом натрію. Після фільтрації, розчинник концентрували при зниженому тиску. Залишок, що виходив, очищали колонковою флешхроматографією (елюент=етилацетат:н-гексан (1:2)) для отримання сполуки, вказаної в заголовку (95мг, 48%). 1 Н-ЯМР (CDCІ3) δ: 0,23 (9Н, с), 1,70 (3Н, с), 2,00 (3Н, с), 2,05 (3Н, с), 2,07 (3Н, с), 3,93-4,08 (3Н, м), 4,23-4,37 (2Н, м), 5,16 (2Н, дд, J=12,6, 25,2Гц), 5,24-5,33 (1Н, м), 5,51-5,66 (2Н, м), 7,04-7,18 (4Η, м), 7,22 (1Н, с), 7,35-7,42 (2Н, м). 3) Синтез 1,1-ангідро-1-С-[5-(4етинілфеніл)метил-2-(гідроксиметил)феніл]-β-Dглюкопіранози Для отримання сполуки, вказаної в заголовку повторювали процедуру, аналогічну тій, що використовується в Прикладі 9, з використанням 1,1ангідро-1-С-[5-(4триметилсиланілетинілфеніл)метил-2(гідроксиметил)феніл]-2,3,4,6-тетра-О-ацетил-β-Dглюкопіранози і відповідних реагентів. 1 Н-ЯМР (CD3OD) δ: 3,40 (1Н, с), 3,41-3,49 (1Н, м), 3,62-3,70 (1Н, м), 3,72-3,85 (4Н, м), 4,01 (2Н, с), 5,11 (2Н, м), 7,17-7,25 (5Н, м), 7,34-7,40 (2Н, м). MS (ESI+): 383 [M+1]+ Приклад 13 53 1,1-Ангідро-1-С-[5-(4-гідроксифеніл)метил-2(гідроксиметил)феніл]-β-D-глюкопіраноза Для отримання сполуки, вказаної в заголовку повторювали процедуру, аналогічну тій, що використовується в Прикладі 9, з використанням 1,1ангідро-1-С-[5-(4-гідроксифеніл)метил-2(гідроксиметил)феніл]-2,3,4,6-тетра-О-ацетил-β-Dглюкопіранози, синтезованої в Прикладі 10, і відповідних реагентів. 1 Н-ЯМР (CD3OD) δ: 3,39-3,52 (1Н, м), 3,61-3,71 (1Н, м), 3,72-3,85 (4Н, м), 3,90 (2Н, с), 5,10 (2Н, м), 6,64-6,74 (2Н, м), 6,97-7,06 (2Н, м), 7,15-7,25 (3Н, м). MS (ESI+): 397 [M+Na]+ Приклад 14 1,1-Aнriдpo-1-C-[5-(4-пірaзoл-1-iлфeнiл)мeтил2-(гiдpoкcимeтил)фeніл]-β-D-глюкопіраноза 1) Синтез 4-піразол-1-ілфенілборонової кислоти У потоці азоту до розчину 1-(4-бромфеніл)-1Нпіразолу (995мг, 4,46ммоль) в безводному ТГФ (12мл) при -78°С додавали по краплях розчин нбутиллітію (1,6М, 2,79мл, 4,46ммоль) в гексані. Після перемішування при тій же температурі протягом 1 години даний розчин при -78°С додавали по краплях до розчину триметилборату (1,07мл, 9,37ммоль) в безводному ТГФ (8мл). Після перемішування при тій же температурі протягом 1 години реакційну суміш перемішували при кімнатній температурі протягом одного дня і ночі. Після додавання насиченого водного хлориду амонію реакційну суміш екстрагували етилацетатом. Органічний шар промивали насиченим водним хлоридом натрію і сушили над сульфатом магнію. Після фільтрації розчинник концентрували при зниженому тиску. Залишок, що виходив, очищали колонковою флеш-хроматографією (елюент=метиленхлорид:метанол (50:1)) для отримання сполуки, вказаної в заголовку (314мг, 37%). 1 Н-ЯМР (CDCІ3) δ: 6,45-6,50 (1Н, м), 7,52-7,64 (4Н, м), 7,72 (1Н, д, J=1,5Гц), 7,89 (1Н, д, J=2,3Tц). MS (ESI+): 189 [M+1]+ 2) Синтез 1,1-ангідро-1-С-[5-(4-піразол-1ілфеніл)метил-2-(гідроксиметил)феніл]-β-Dглюкопіранози Для отримання сполуки, вказаної в заголовку повторювали процедуру, аналогічну тій, що використовується в Прикладі 9, з використанням 4піразол-1-ілфенілборонової кислоти, 1,1-ангідро-1С-[5-хлорметил-2-(гідроксиметил)феніл]-2,3,4,6тетра-О-ацетил-β-D-глюкопіранози і відповідних реагентів. 1 H-ЯМР CCD3OD) δ: 3,40-3,52 (1Н, м), 3,613,70 (1Н, м), 3,72-3,85 (4Н, м), 4,05 (2Н, с), 5,11 (2Н, дд, J=12,6, 19,8Гц), 6,46-6,52 (1Н, м), 7,19-7,39 (5Н, м), 7,59-7,72 (3Н,м), 8,12-8,17 (1Н, м). 90290 54 MS (ESI+):425[M+1]+ Приклад 15 1,1-Ангідро-1-С-[5-(4-метоксифеніл)етил-2(гідроксиметил)феніл]-β-D-глюкопіраноза 1) Синтез 1,1-ангідро-1-С-[5-(4метоксифеніл)етил-2-(гідроксиметил)феніл]2,3,4,6-тетра-О-адетил-β-D-глюкопіранози У потоці азоту до розчину 1,1-ангідро-1-С-[5хлорметил-2-(гідроксиметил)феніл]-2,3,4,6-тетраО-аиетил-β-D-глюкопіранози (200мг, 0,41ммоль) в безводному ТУФ (1,0мл) при кімнатній температурі додавали по краплях розчин тетрахлоркупрату літію (0,1М, 0,124мл, 0,012ммоль) в ТГФ і Νметилпіролідинон (0,16мл, 1,64ммоль). Розчин броміду 4-метоксибензилмагаію (0,25М, 1,72мл) в ТГФ додавали по краплях протягом 5 хвилин при кімнатній температурі. Реакційну суміш перемішували при кімнатній температурі протягом одного дня і ночі. Після додавання 2н хлористоводневої кислоти (2мл) реакційну суміш екстрагували етилацетатом. Органічний шар промивали насиченим водним хлоридом натрію і сушили над сульфатом магнію. Після фільтрації розчинник концентрували при зниженому тиску. Залишок, що виходив, очищали колонковою флеш-хроматографією (елюент=етилацетат:н-гексан (2:3)) для отримання сполуки, вказаної в заголовку (13мг, 6%). 1 Н-ЯМР (CDCІ3) δ: 1,73 (3Н, с), 2,01 (3Н, с), 2,05 (3Н, с), 2,08 (3Н, с), 2,80-2,95 (4Н, м), 3,79 (3Н, с), 4,01-4,07 (1Н, м), 4,27-4,37 (2Н, м), 5,13 (1Н, д, J=12,3Гц), 5,21 (1Н, д, J=12,3Гц), 5,27-5,34 (1Н, м), 5,57-5,67 (2Н, м), 6,80 (2Н, д, J=8,6Гц), 7,07 (2Н, д, J=8,6Гц), 7,14 (2Н, с), 7,25-7,26 (1Н, м). 2) Синтез 1,1-ангідро-1-С-[5-(4метоксифеніл)етил-2-(гідроксиметил)феніл]-β-Dглюкопіранози Для отримання сполуки, вказаної в заголовку повторювали процедуру, аналогічну тій, що використовується в Прикладі 9, з використанням 1,1ангідро-1-С-[5-(4-метоксифеніл)етил-2(гідроксиметил)феніл]-2,3,4,6-тетра-О-ацетил-β-Dглюкопіранози і відповідних реагентів. 1 Н-ЯМР (CD3OD) δ: 2,70-2,90 (4Н, м), 3,38-3,44 (1Н, м), 3,57-3,78 (8Н, м), 5,02 (1Н, д, J=12,3Гц), 5,07 (1Н, д, J=12,3Гц), 6,74 (2Н, д, J=8,7Гц), 7,03 (2Н, д, J=8,7Гц), 7,10 (2Н, м), 7,15 (1Н, с). MS (ESІ+): 402 [М]+ У таблицях 1-1 і 1-2 показані структурні формули сполук, отриманих в наведених вище прикладах. Сполуки, наведені в таблицях (1-3)-(1-8), можуть також бути легко отримані способом, аналогічним показаним в наведених вище прикладах або схемах отримання, з незначними змінами або без змін, очевидних для фахівців в даній галузі. 55 90290 56 57 90290 58 59 90290 60
ДивитисяДодаткова інформація
Назва патенту англійськоюSpiroketal derivatives and use thereof as diabetic medicine
Автори англійськоюKobayashi Takamitsu, Sato Tsutomu, Nishimoto Masahiro
Назва патенту російськоюПроизводные спирокеталов и их применение в качестве лекарственного средства против диабета
Автори російськоюКобаяси Такамицу, Сато Цутому, Нисимото Масахиро
МПК / Мітки
МПК: A61P 43/00, A61K 31/7048, A61P 3/10, C07H 19/01, A61P 3/04
Мітки: діабету, спірокеталів, лікарського, похідні, засобу, застосування
Код посилання
<a href="https://ua.patents.su/34-90290-pokhidni-spiroketaliv-i-kh-zastosuvannya-yak-likarskogo-zasobu-proti-diabetu.html" target="_blank" rel="follow" title="База патентів України">Похідні спірокеталів і їх застосування як лікарського засобу проти діабету</a>
Попередній патент: Напівпровідникове джерело випромінювання
Наступний патент: Система доставки низькокалорійних наповнювачів
Випадковий патент: Сполуки з активністю антагоністів мускаринових рецепторів і агоністів адренергічного рецептора бета2












