Проліки адреномедуліну на основі поліетиленгліколю і їх застосування
Номер патенту: 111098
Опубліковано: 25.03.2016
Автори: ЛЕРХЕН Ханс-Георг, Прітчард Айан, Вітрок Свен, Марлі Джулі, Фламме Інго, Шое-Лоп Рудольф, Кнорр Андреас, Грібенов Нільс, Редліх Горден, Кьольнбергер Маріа, Вундер Франк, Кьобберлінг Йоганнес
Формула / Реферат
1. Сполука формули
 , (І)
, (І)
у якій
n являє собою число 0, 1, 2 або 3,
R1 являє собою водень, метил, етил, н-пропіл або ізопропіл,
R2 являє собою лінійний або розгалужений ПЕГ 20-80 кДа, ендкепований метоксигрупою,
або одна з її солей, її сольватів або сольватів солей.
2. Сполука за п. 1, яка відрізняється тим, що
n являє собою число 1 або 2,
R1 являє собою водень або метил,
R2 являє собою лінійний ПЕГ 40 кДа, ендкепований метоксигрупою.
3. Сполука за будь-яким із пп. 1 і 2, яка відрізняється тим, що
n являє собою число 1 або 2,
R1 являє собою водень,
R2 являє собою лінійний ПЕГ 40 кДа, ендкепований метоксигрупою.
4. Спосіб одержання сполуки формули (І) або однієї з її солей, її сольватів або сольватів солей за п. 1, який відрізняється тим, що сполука формули (ІІ)
 , (ІІ)
, (ІІ)
у якій
n і R1 кожний має значення, як зазначено в п. 1,
вступає в реакцію зі сполукою формули (III)
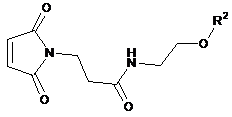 , (ІІІ)
, (ІІІ)
у якій
R2 має значення, як зазначено в п. 1.
5. Сполука за будь-яким із пп. 1-3 для лікування й/або профілактики захворювань.
6. Спосіб застосування сполуки за будь-яким із пп. 1-3 для одержання лікарського засобу для лікування й/або профілактики захворювань.
7. Спосіб застосування сполуки за будь-яким із пп. 1-3 для одержання лікарського засобу для лікування й/або профілактики серцево-судинних, набрякових ї/або запальних захворювань.
8. Лікарський засіб, що містить сполуку за будь-яким із пп. 1-3 у комбінації з інертним нетоксичним фармацевтично придатним ексципієнтом.
9. Лікарський засіб, що містить сполуку за будь-яким із пп. 1-3 у комбінації з додатковим активним компонентом.
10. Лікарський засіб за п. 8 або 9 для лікування й/або профілактики серцево-судинних, набрякових і/або запальних захворювань.
11. Спосіб застосування сполук за будь-яким із пп. 1-3 для виробництва лікарського засобу для лікування й/або профілактики серцевої недостатності, ішемічної хвороби серця, ішемічного й/або геморагічного інсульту, гіпертонії, легеневої гіпертензії, оклюзійного захворювання периферичних артерій, прееклампсії, хронічної обструктивної хвороби легенів, астми, гострого й/або хронічного набряку легенів, алергійного альвеоліту й/або пневмоніту, викликаного вдиханням органічного пилу або частинок грибків актиноміцетного або іншого походження, і/або гострого хімічного бронхіту, гострого й/або хронічного хімічного набряку легенів, нейрогенного набряку легенів, гострих і/або хронічних легеневих проявів, викликаних радіацією, гострих і/або хронічних інтерстиціальних захворювань легенів, гострого ушкодження легенів/гострого респіраторного дистрес-синдрому (ГУЛ/ГРДС) у дорослого або дитини, включаючи немовлят, ГУЛ/ГРДС вторинного відносно пневмонії й сепсису, аспіраційної пневмонії й ГУЛ/ГРДС вторинних відносно аспірації, ГУЛ/ГРДС вторинного відносно вдихання коптильного газу, синдрому гострого посттрансфузійного ушкодження легенів (СГПУЛ), ГУЛ/ГРДС або гострої легеневої недостатності після операції, травми й/або опіків, вентиляторного ушкодження легенів (ВУЛ), ушкодження легенів наступного за аспірацією меконія, легеневого фіброзу й гірської хвороби, хронічних захворювань нирок, гломерулонефриту, гострого ушкодження нирок, кардіоренального синдрому, лімфедеми, запального захворювання кишечнику, сепсису, септичного шоку, синдрому системної запальної реакції (ССЗР) неінфекційного походження, анафілактичного шоку, запального захворювання кишечнику й/або кропивниці.
12. Сполука за будь-яким із пп. 1-3 для використання в процесі для лікування й/або профілактики серцево-судинних, набрякових і/або запальних порушень.
Текст
Реферат: Винахід стосується нових пролінів адреномедуліну на основі поліетиленгліколю (ПЕГ), способів їх одержання, їх застосування для лікування і/або профілактики захворювань і їх застосування для одержання лікарських засобів для лікування і/або профілактики захворювань, особливо серцево-судинних, набрякових і/або запальних захворювань. UA 111098 C2 (12) UA 111098 C2 UA 111098 C2 5 10 15 20 25 30 35 40 45 50 55 60 Винахід відноситься до нових проліків адреномедуліну на основі поліетиленгліколю (ПЕГ), до способів їх одержання, до їх застосування для лікування і/або профілактики захворювань, і до їх застосування для одержання лікарських засобів для лікування і/або профілактики захворювань, особливо серцево-судинних, набрякових і/або запальних захворювань. 52-амінокислотний пептидний гормон адреномедулін (ADM) виробляється в надниркових залозах, легенях, нирках, серцевому м'язі й інших органах. Рівні в плазмі ADM знаходяться у нижньому пікомолярному діапазоні. ADM є членом кальцитоніну ген-зв’язаного пептиду (CGRP) родини пептидів і як такий зв'язується із гетеродимерним рецептором G-білка, що складається з CRLR і RAMP 2 або 3 (рецептор подібний до рецептора кальцитоніну й рецептор, що модифікує активність білка 2 або 3). Активація рецептора ADM призводить до внутрішньоклітинного підвищення аденозин-3',5'-циклічного монофосфату (цАМФ) у клітинах, що несуть рецептор. Рецептори ADM присутні на різних типах клітин у практично всіх органах, включаючи ендотеліальні клітини. ADM, як вважається, метаболізується нейтральною ендопептидазою і переважно очищається в легенях, де ADM-рецептори експресуються на високому рівні [див. Gibbons C., Dackor R., Dunworth W., Fritz-Six K., Caron K.M., Mol Endocrinol 21(4), 783-796 (2007)]. Експериментальні дані з літератури показують, що ADM бере участь в різних функціональних ролях, які включають, зокрема, регулювання кров'яного тиску, бронходилатацію, функції нирок, секрецію гормону, ріст клітин, диференціювання, нейротрансмісію, і модуляцію імунної реакції. Крім того, ADM відіграє важливу роль як аутокринний фактор під час проліферації й регенерації ендотеліальних клітин [див. García M.A., Martín-Santamaría S., de Pascual-Teresa B., Ramos A., Julián M., Martínez A., Expert Opin Ther Targets, 10(2), 303-317 (2006)]. Існує велика сукупність доказів з літератури, що показує, що ADM є необхідною умовою для функції неушкодженості ендотеліального бар'єру й, що введення ADM надфізіологічним рівням виконує сильну протинабрякову й протизапальну дію при різних запальних захворюваннях в експериментальних тварин, включаючи сепсис, гостре ушкодження легенів і запалення кишечнику [див. Temmesfeld-Wollbrück B., Hocke A.C., Suttorp N., Hippenstiel S., Thromb Haemost; 98, 944–951 (2007)]. Клінічні випробування ADM дотепер проводилися при серцево-судинних показниках з вимірною гемодинамічною кінцевою точкою, такою як, легенева гіпертензія, гіпертензія, серцева недостатність і гострий інфаркт міокарда. ADM продемонстрував гемодинамічну дію у декількох дослідженнях у пацієнтів, що страждають від вищезгаданих станів. Проте, ефект був тільки короткостроковим і відразу закінчувався після закінчення введення. Ці висновки добре корелюють із відомим фармакокінетичним профілем ADM. Фармакодинамічна дія включала, серед іншого, зниження системного й легеневого артеріального тиску й збільшення хвилинного об'єму серця [Troughton R.W., Lewis L.K., Yandle T.G., Richards A.M., Nicholls M.G., Hypertension, 36(4), 588-93 (2000); Nagaya N., Kangawa K., Peptides, 25(11), 2013-8 (2004); Kataoka Y., Miyazaki S., Yasuda S., Nagaya N., Noguchi T., Yamada N., Morii I., Kawamura A., Doi K., Miyatake K., Tomoike H., Kangawa K., J Cardiovasc Pharmacol, 56(4), 413-9 (2010)]. Таким чином, на основі одержаних з багатьох експериментальних даних при клінічних випробуваннях із тваринами й першими клінічними випробуваннями з підвищенням людського ADM для надфізіологічних рівнів може розглядатися як цільовий механізм для лікування різних хворобливих станів у людей і тварин. Проте, основні обмеження застосування ADM як терапевтичного засобу є незручна застосовність безперервної інфузійної терапії, що виключає можливість його використання для більшості потенційних показань і потенційно обмежених меж безпеки відносно гіпотонії, які можуть виникнути в результаті болюсних введень ADM. Завданням даного винаходу є забезпечення нових сполук, які можуть бути використані для лікування захворювань, зокрема, серцево-судинних, набрякових і запальних захворювань. Багато терапевтично активні пептиди або білки страждають від високого кліренсу в природних умовах. Існують кілька підходів для формування ін'єкційних депо таких препаратів, які передбачають використання макромолекул. Полімерні матриці, які містять молекулу ліків у не ковалентно-зв'язаному стані є добре відомими. Вони також можуть бути введені, як гідрогелі, мікрочастинки або міцели. Кінетики вивільнення таких лікарських засобів можуть бути досить ненадійними з високою мінливістю серед пацієнтів. Виробництво таких полімерів може завдати шкоди чутливій речовині ліків або можуть піддаватися побічним реакціям з полімером під час його деградації (D.H. Lee et al., J. Contr. Rel., 2003, 92, 291-299). Постійне ПЕГілування пептидів або білків для підвищення їхньої розчинності, зниження іммуногенності й збільшення періоду напіврозпаду й за рахунок зниження ниркового кліренсу є добре відомою концепцією з початку 1980-х років (Caliceti P., Veronese F.M., Adv. Drug Deliv. 1 UA 111098 C2 5 10 15 20 25 30 35 40 45 50 55 60 Rev.2003, 55, 1261-1277). Для декількох препаратів це використовувалося з успіхом, але з більшою кількістю прикладів ПЕГілування знижує ефективність лікарської речовини настільки, що це поняття більше не є придатним (T. Peleg-Shulman et al., J. Med. Chem., 2004, 47, 48974904). Придатною альтернативою є проліки на основі полімеру. Теперішні визначення для проліків відповідно до МСТПХ (IUPAC) затверджені наступними термінами (International Union of Pure and Applied Chemistry and International Union of Biochemistry: GLOSSARY OF TERMS USED в MEDICINAL CHEMISTRY (Recommendations 1998); в Pure & Appl. Chem. Vol 70, No. 5, 1998, p. 1129-1143): Проліки: проліки є будь-якою сполукою, що піддається біотрансформації перед проявом її фармакологічних ефектів. Проліки, таким чином, можна розглядати як лікарські засоби, що містять спеціалізовані нетоксичні захисні групи, використовувані перехідним чином для зміни або усунення небажаних властивостей у вихідній молекулі. Проліки, пов'язані з носієм (проліки носій): пов'язані з носієм проліки є проліками, що містять тимчасовий зв'язок заданої активної речовини з перехідною групою носія, що робить покращені фізико-хімічні або фармакокінетичні властивості і які можуть бути легко вилучені в природних умовах, як правило, шляхом гідролітичного розщеплення. Каскадні проліки: каскадні проліки є проліками, для яких розщеплення групи носія стає ефективним тільки після демаскування групи, що активує. Деякі приклади проліків носія на основі ПЕГ існують, більшість із них з необхідністю ферментативної активації лінкера між активним лікарським засобом і носієм, в основному, ініційованою за допомогою ферментативного гідролізу. Оскільки складні ефіри розщеплюються дуже легко й непередбачено в природних умовах, прямі ефірні лінкери для ліків носія мають обмеження до їх застосовності (J. Rautio et al., Nature Reviews Drug discovery, 2008, 7 255-270). Часто використовувані альтернативні підходи являють собою каскадні лінкери, приєднані до функціональності аміну в пептиді або білку. У каскадних лінкерах група, що маскує, повинна бути вилучена, як стадія обмеження швидкості в каскаді. Це активізує розкладання лінкера в іншому положенні, щоб звільнити пептид або білок. Звичайно, маскуюча група може бути вилучена за допомогою ферментативного механізму (R.B.Greenwald et al. в WO2002/089789, Greenwald, et al., J. Med. Chem. 1999, 42, 3657-3667, F.M.H. DeGroot et al. в WO2002/083180 і WO2004/043493, і D. Shabat et al. в WO2004/019993). Альтернатива, що не розраховує на ферментативну активацію є концепцією У. Херсель і співавт. в WO2005/099768. У їхньому підході група, що маскує, на фенолі віддаляється чисто рН-залежним чином, шляхом атаки внутрішнього нуклеофілу. Це активізує лінкер для подальшого розкладання. Як відзначено У. Херселем і співавт. в WO2005/099768, "Недолік у вищевказаних системах проліків, описаний Грінвальдом, Дегрутом і Шабатом є вивільненням потенційно токсичних ароматичних малих молекул бічних продуктів, таких як хінонметиди, після розщеплення тимчасового зв'язку. Потенційно токсичні речовини вивільняються в 1:1 стехіометрії з ліками й можуть допускати високі концентрації в природних умовах". Та ж проблема також відноситься й до системи за У. Херсель і співавт. Для невеликих органічних молекул існує безліч різних пролікарських підходів (J. Rautio et al., Nature Reviews Drug discovery, 2008, 7 255-270). Підхід, використовуваний У. Херселем і співавт. як механізм вивільнення для їхньої маскувальної групи був використаний як пролікарський підхід для фенольних груп малих молекул, починаючи з кінця 1980-х років. (W.S. Saari в EP 0296 811 і W.S. Saari et al., J. Med. Chem. 1990, Vol 33, No 1, p 97-101). Альтернативна пролікарська система на основі аміну базується на повільному гідролізі бісгідроксіетил гліцину в якості каскадних проліків. Гідрокси групи біс-гідроксіетил гліцину замасковані за допомогою складних ефірів, які схильні до гідролізу естераз (R. Greenwald et al., J. Med. Chem. 2004, 47, 726-734 і D. Vetter et al. в WO 2006/136586). Мічені похідні адреномедуліну для використання як зображення, а також терапевтичного агента, є відомими (J. Depuis et al. в CA 2567478 і WO 2008/138141). У цих похідних ADM комплексоутворююча клітина, як молекулярна структура, здатна зв'язувати радіоактивні ізотопи, була приєднана до N-кінця ADM безпосереднім чином або через спейсерсну область потенційно також короткі ПЕГ спейсери. Діагностична або терапевтична цінність цих ліків виникають із цільової доставки радіоактивної молекули. На відміну від пролікарських підходів, перерахованих вище, які всі ґрунтуються на маскуванні функціональних амінів, даний винахід заснований на маскуванні фенольної групи тирозину в ADM. Використовуються пов'язані з носієм проліки, засновані на підтримці внутрішнього нуклеофілу розщеплення карбамату на цій фенольній групі. Ключовою перевагою 2 UA 111098 C2 5 10 інших класів проліків згаданих вище є токсикологічна нешкідливість лінкерного продукту розкладання, циклічної сечовини, міцно прикріпленої до носія. Крім того, розкладання проліків не залежить від ферментативних механізмів, які можуть викликати високу мінливість кінетики розщеплення серед пацієнтів. Механізм розщеплення винятково залежить від рН як внутрішній амін, що протонується коли кислий рН активується, коли більш високий (нейтральний) рН діє в якості нуклеофілу, що атакує фенольний карбамат на основі тирозину. У контексті даного винаходу, сполуки описані як ті, які діють як ADM-проліки повільного вивільнення з розширеною тривалістю фармакологічної дії в порівнянні з ADM, і які на основі цього конкретного механізму дії - після парентерального введення - у природних умовах демонструють стійкі анти-запальні й гемодинамічні ефекти, такі як стабілізація функції ендотеліального бар'єру, і зниження артеріального тиску, відповідно. Даний винахід забезпечує сполуки формули O HN O O N H R N 1 H N R 2 O H N S O O n O O NH2 O 1 52 2 Y NH2 N H RQSMNNFQGLRSFGCRFGTCTVQKLAHQIYQFTDKDKDNVAPRSKISPQGY-NH2 (I), 15 20 25 30 35 40 45 де n являє собою число 0, 1, 2 або 3, 1 R являє собою водень, метил, етил, н-пропіл або ізопропіл, 2 R являє собою лінійний або розгалужений ПЕГ 20кДа - 80кДа, ендкепований метоксигрупою, і їх солі, їх сольвати і їх сольвати солей. Сполуки відповідно до даного винаходу являють собою сполуки формули (I) і їх солі, їх сольвати і їх сольвати солей, сполуки які охоплює формула (I) і є сполуками формул, які зазначені нижче і їх солями, сольватами й сольватами солей, і сполуки які охоплює формула (I) і які зазначені нижче як робочі приклади і їх солі, сольвати й сольвати солей, якщо сполуки, які охоплює формула (I) і які зазначені нижче не є ще солями, сольватами, і сольватами солей. Залежно від їхньої структури, сполуки відповідно до даного винаходу можуть існувати в стереоізомерних формах (енантіомери, діастереомери). Таким чином, винахід охоплює енантіомери або діастереомери і їх особливі суміші. Стереоізомерно однорідні компоненти можуть бути виділені відомим способом з таких сумішей енантіомерів і/або діастереомерів. Якщо сполуки відповідно до даного винаходу можуть існувати в таутомерних формах, даний винахід охоплює всі таутомерні форми. У контексті даного винаходу, кращими солями є фізіологічно прийнятні солі сполук відповідно до даного винаходу. Також включені солі, які не підходять як такі для фармацевтичної промисловості, але, наприклад, можуть бути використані для виділення або очищення сполук відповідно до даного винаходу. Фізіологічно прийнятні солі сполук відповідно до даного винаходу включають кислотноадитивні солі мінеральних кислот, карбонові кислоти й сульфонові кислоти, наприклад, солі соляної кислоти, бромисто-водневої кислоти, сірчаної кислоти, фосфорної кислоти, метансульфонової кислоти, етансульфонової кислоти, толуолсульфонової кислоти, бензолсульфонової кислоти, нафталіндисульфонової кислоти, оцтової кислоти, трифтороцтової кислоти, пропіонової кислоти, молочної кислоти, винної кислоти, малеїнової кислоти, лимонної кислоти, фумарової кислоти, малеїнової кислоти й бензойної кислоти. Фізіологічно прийнятні солі сполук відповідно до даного винаходу також включають солі стандартних основ, наприклад і переважно, солі лужних металів (наприклад, солі натрію й калію), солі лужноземельних металів (наприклад, солі магнію й кальцію) і солі амонію, одержані з аміаку або органічних амінів, що містять від 1 до 16 атомів вуглецю, наприклад і переважно, 3 UA 111098 C2 5 10 15 20 25 етиламін, триетиламін, діетиламін, етилдіізопропіламін, моноетаноламін, діетаноламін, триетаноламін, дициклогексиламін, диметиламіноетанол, прокаїн, дибензиламін, Nметилморфолін, аргінін, лізин, етилендіамін і N-метилпіперидин. У контексті даного винаходу, сольвати відносяться до тих форм сполук відповідно до даного винаходу, які, у твердому або рідкому стані, утворюють комплекс по координації з молекулами розчинника. Гідрати являють собою специфічну форму сольватів, де відбувається координація з водою. Кращими сольватами в контексті даного винаходу є гідрати. 2 У контексті даного винаходу ендкепована зазначена в R метокси-група виходить, що поліетиленгліколь (ПЕГ) є заміщеним за допомогою метокси-групи на кінці, що не приєднана до кисню, тобто, - ПЕГ 40кДа-OMe. Переваги віддається сполукам формули (I), у якій n являє собою число 1 або 2, 1 R являє собою водень або метил, 2 R являє собою лінійний ПЕГ 40кДа, ендкепований метокси-групою. Переваги також віддається сполукам формули (I), у якій n являє собою число 1 або 2, 1 R являє собою водень, 2 R являє собою лінійний ПЕГ 40кДа, ендкепований метокси-групою. Переваги також віддається сполукам формули (I), у якій n являє собою число 1. Переваги також віддається сполукам формули (I), у якій 1 R являє собою водень. Переваги також віддається сполукам формули (I), у якій 1 атом вуглецю, до якого замісник -NHR приєднаний, має S конфігурацію. Переваги також віддається сполукам формули (I), у якій 2 R являє собою лінійний ПЕГ 40кДа, ендкепований метокси-групою. Переваги також віддається сполукам формули (I), які мають структуру формули (Ia) O HN O O N H R N 1 H N R 2 O H N S O O n O O NH2 O 1 52 2 Y NH2 N H RQSMNNFQGLRSFGCRFGTCTVQKLAHQIYQFTDKDKDNVAPRSKISPQGY-NH2 (Ia), 30 35 40 де 1 2 n, R і R кожний має значення, зазначене вище, і їх солі, їх сольвати і їх сольвати солей. Конкретні визначення радикалів, наведені в конкретних комбінаціях або кращих комбінаціях радикалів, незалежно від конкретної комбінації зазначеного радикала, також є заміненим якимнебудь із визначень радикала інших комбінацій. Особлива перевага віддається комбінаціям двох або більше з вищевказаних переважних діапазонів. Винахід також забезпечує спосіб одержання сполук формули (I), або їх солей, їх сольватів або їх сольватів солей, де сполуки формули (II) 4 UA 111098 C2 1 HN O O N H R H N SH n O O NH2 O 2 1 Y NH2 5 N H 52 RQSMNNFQGLRSFGCRFGTCTVQKLAHQIYQFTDKDKDNVAPRSKISPQGY-NH2 (II), у якій 1 n і R кожний має значення, зазначене вище, піддають реакції зі сполуками формули (III) 2 R O N O O 10 15 O H N (III), у якій 2 R має значення, зазначене вище. Реакцію звичайно здійснюють в інертних розчинниках, переважно в діапазоні температур від 0 °C до 50 °C при нормальному тиску. Інертні розчинники являють собою, наприклад, цитратні буфери, гліцин-гідрохлоридні буфери, фталатові буфери або ацетатні буфери зі значенням рН від 3 до 5, перевага віддається цитратному буферу зі значенням рН 4. Сполука формули (III) є відомою і може бути синтезована за допомогою відомих методик з відповідних вихідних сполук. Сполуки формули (II) є відомими або можуть бути одержані за допомогою реакції зі сполуками формули (IV) CH3 H3C O O O O N H CH3 N R 1 H N S n O O NH2 O H3C H3C OH O NH CH3 O (IV), 20 у якій 1 n і R кожний має значення, зазначене вище, на першій стадії зі сполукою формули (V) 5 UA 111098 C2 (V), 5 10 15 20 25 30 35 40 45 і на другій стадії з кислотою. Реакцію на першій стадії, як правило, здійснюють у середовищі інертних розчинників, у присутності дегідратуючого реагенту, необов'язково в присутності основи, переважно в діапазоні температур від кімнатної температури до 70 °C при нормальному тиску. Інертні розчинники являють собою, наприклад, галогеновані вуглеводні, такі як дихлорметан, трихлорметан або 1,2-дихлоретан, прості ефіри, такі як діоксан, тетрагідрофуран або 1,2-диметоксіетан, або інші розчинники, такі як ацетон, диметилформамід, диметилацетамід, 2-бутанон або ацетонітрил. Рівною мірою можливо використати суміші розчинників. Перевага віддається диметилформаміду. Придатними дегідратуючими реагентами в даному контексті є, наприклад, карбодііміди, наприклад, N,N'-діетил-, N,N'-дипропіл-, N,N'-діізопропіл, N,N'-дициклогексилкарбодіімід, N-(3диметиламіноізопропіл)-N'-етилкарбодіімід гідрохлорид (EDC), N-циклогексилкарбодіімід-N'пропілоксиметилполістирол (PS-карбодіімід), або карбонільні сполуки, такі як карбонілдіімідазол, або 1,2-оксазолійні сполуки, такі як 2-етил-5-феніл-1,2-оксазолій 3-сульфат або 2-трет-бутил-5-метилізоксазолій перхлорат, або сполуки ациламіно, такі як 2-етокси-1етоксикарбоніл-1,2-дигідрохінолін, або пропанфосфорний ангідрид, або ізобутил хлорформіату, або біс-(2-оксо-3-оксазолідиніл) фосфорилхлорид або бензотриазолілокситри (диметиламіно)фосфоній, або O-(бензотриазол-1-іл)-N,N,N',N'-тетраметилуроній гексафторфосфат (HBTU), бензотриазол-1-іл-N-тетраметилуроній тетрафторборат (TBTU), 2-(2оксо-1-(2Н)-піридил)-1,1,3,3-тетраметилуроній тетрафторборат (TPTU) або O-(7азабензотриазол-1-іл)-N,N,N',N'-тетраметилуроній гексафторфосфат (HATU), або 1гідроксибензотриазол (HOBt), або бензотриазол-1-ілокситріс(диметиламіно)фосфоній гексафторфосфат (ВОР), або бензотриазол-1-ілокситріс (піролідино)фосфоній гексафторфосфат (PYBOP), або N-гідроксисукцинімід, або їх суміші з основами. Основами є, наприклад, карбонати лужних металів, наприклад, карбонат натрію або карбонат калію, вуглеводні натрію або калію, або органічні основи, такі як триалкіламіни, наприклад, триетиламін, N-метилморфолін, N-метилпіперидин, 4-диметиламінопіридин або N,N-діізопропілетиламін, перевага віддається N,N-діізопропілетиламіну. Переважно, конденсацію здійснюють із TBTU у присутності N,N-діізопропілетиламіну. Реакцію другої стадії необов'язково здійснюють у середовищі інертних розчинників, переважно в діапазоні температур від кімнатної температури до 60 °C при нормальному тиску. Інертні розчинники являють собою, наприклад, галогеновані вуглеводні, такі як дихлорметан, трихлорметан, тетрахлорид вуглецю або 1,2-дихлоретан, або прості ефіри, такі як тетрагідрофуран або діоксан, перевага віддається дихлорметану. Кислоти являють собою, наприклад, трифтороцтову кислоту або водень хлорид у діоксані, переваги віддається концентрованій трифтороцтовій кислоті. Концентрована трифтороцтова кислота може бути використана з додаванням очисників, таких як вода, фенол, тіоанізол і 1,2етандіол. Перевага віддається від 1 до 5 % кожного із цих очисників. Сполука формули (V) є відомою і може бути синтезована за допомогою відомих методик з відповідних вихідних сполук (приклад 14A). Сполуки формули (IV) є відомими й можуть бути одержані за допомогою реакції зі сполуками формули (VI) 6 UA 111098 C2 CH3 H3C O O O O N H CH3 N R 1 H N S n O O NH2 O H3C H3C O O CH3 O 5 10 15 20 NH CH2 (VI), у якій 1 n і R кожний має значення, зазначене вище, із джерелом палладію(0) агента, що відновлює. Реакцію звичайно здійснюють в інертних розчинниках, необов'язково в присутності слабкої основи, переважно в діапазоні температур від 0 °C до 50 °C при нормальному тиску. Інертні розчинники являють собою, наприклад, галогеновані вуглеводні, такі як дихлорметан, трихлорметан або 1,2-дихлоретан, прості ефіри, такі як діоксан, тетрагідрофуран або 1,2-диметоксіетан, або інші розчинники, такі як ацетон, диметилформамід, диметилацетамід, 2-бутанон або ацетонітрил. Рівною мірою можливо використати суміші розчинників. Перевага віддається тетрагідрофурану. Джерела палладію(0), наприклад, являють собою тетракіс(трифенілфосфін)палладій(0), тріс(дибензиліденацетон)дипалладій(0) або джерела палладію(II), які відновлюються in situ, до палладію(0) у процесі реакції, перевага віддається тетракіс(трифенілфосфін)-палладію(0). Відновниками є, наприклад, мурашина кислота або триетил сілан, перевага віддається мурашиній кислоті. Основами є, наприклад, триетиламін, N,N-діізопропілетиламін або розчин фосфату калію, переваги віддається триетиламіну. Сполуки формули (VI) є відомими й можуть бути одержані за допомогою реакції сполук формули (VII) 7 UA 111098 C2 CH3 H3C O O O N R 1 OH N H O CH3 n O O H3C H3C O O CH3 5 NH O CH2 (VII), у якій 1 n і R кожний має значення, зазначене вище, із сполукою формули (VIII) S H2N O 10 15 20 25 30 NH2 (VIII). Реакцію звичайно здійснюють в інертних розчинниках, у присутності дегідратуючого реагенту, необов'язково в присутності основи, переважно в діапазоні температур від кімнатної температури до 70 °C при нормальному тиску. Інертні розчинники являють собою, наприклад, галогеновані вуглеводні, такі як, дихлорметан, трихлорметан або 1,2-дихлоретан, прості ефіри, такі як, діоксан, тетрагідрофуран або 1,2-диметоксіетан, або інші розчинники, такі як, ацетон, диметилформамід, диметилацетамід, 2-бутанон або ацетонітрил. Рівною мірою можливо використати суміші розчинників. Перевага віддається дихлорметану. Придатними дегідратуючими агентами в даному контексті є, наприклад, карбодііміди, наприклад N,N'-діетил-, N,N'-дипропіл-, N,N'-діізопропіл, N,N'-дицикло гексилкарбодіімід, N-(3диметиламіноізопропіл)-N'-етилкарбодіімід гідрохлорид (EDC), N-циклогексилкарбодіімід-N'пропілоксиметилполістирол (PS-карбодіімід), або карбонільні сполуки, такі як карбонілдіімідазол, або 1,2-оксазолійні сполуки, такі як 2-етил-5-фенил-1,2-оксазолій 3-сульфат або 2-трет-бутил-5-метилізоксазолій перхлорат, або ациламіно сполуки, такі як 2-етокси-1етоксикарбоніл-1,2-дигідрохінолін, або пропанфосфоновий ангідрид, або ізобутил хлорформіат, або біс-(2-оксо-3-оксазолідиніл) фосфорилхлорид або бензотриазолілокситри(диметиламіно) фосфоній гексафторфосфат, або O-(бензотриазол-1-іл)-N,N,N',N'-тетраметилуроній гексафторфосфат (HBTU),бензотриазол-1-іл-N-тетраметил-уроній тетрафторборат (TBTU), 2(2-оксо-1-(2H)-піридил)-1,1,3,3-тетраметилуроній тетрафторборат (TPTU) або O-(7азабензотриазол-1-іл)-N,N,N',N'-тетраметилуроній гексафторфосфат (HATU), або 1гідроксибензотриазол (HOBt), або бензотриазол-1-ілокситріс(диметиламіно)фосфоній гексафторфосфат (ВОР), або бензотриазол-1-ілокситріс(піролідино)фосфоній гексафторфосфат (PYBOP), або N-гідроксисукцинімід, або їх суміші з основами. 8 UA 111098 C2 5 10 Основа є, наприклад, карбонати лужних металів, наприклад, карбонат натрію або карбонат калію, або гідрокарбонат натрію або калію, або органічні основи, такі як триалкиламіни, наприклад, триетиламін, N-метилморфолін, N-метилпіперидин, 4-диметиламінопіридин або N,N-діізопропілетиламін, перевага віддається N,N-діізопропілетиламіну. Переважно, конденсацію здійснюють із HATU у присутності N,N-діізопропілетиламіну. Сполуки формули (VII) і (VIII) є відомими або можуть бути синтезовані відомими методиками з відповідних вихідних сполук. Одержання сполук відповідно до даного винаходу можна проілюструвати наступною схемою синтезу: Схема 1 O + N O O O + OH Cl Br H2C DIEA O H3C O H3C NH CH3 O CH3 O O O O O DIEA, DMAP O OH H3C O H3C N O OH O O O H3C O H3C NH CH2 NH CH2 CH3 O CH3 H3C O мікрохвильове випромінення CH3 NH O OH H2N O CH3 CH3 H3C O O O O N H H3C O CH3 NH H N S O Тетракіс H3C 20 25 30 35 NH H3C H3C O O H N O S S NH H2N O O NH2 O O CH3 NH2 OH N H O HATU O O OH O CH3 15 N H NH2 O H3C CH3 NH O O O O H3C O CH3 H3C O O H3C NH O O CH3 CH3 O NH O CH2 CH2 Сполуки відповідно до даного винаходу демонструють непередбачений корисний спектр фармакологічної активності. Відповідно, вони є придатними для використання як лікарські засоби для лікування і/або профілактики захворювань, в організмі людини й тварин. Сполуки відповідно до даного винаходу відрізняються як специфічні проліки, які виділяють адреномедулін (ADM). Даний винахід додатково забезпечує спосіб використання сполук відповідно до даного винаходу для лікування і/або профілактики захворювань, особливо серцево-судинних, набрякових і/або запальних захворювань. Для даного винаходу, термін "лікування" або "терапія" включає інгібування, затримку, звільнення, пом'якшення, припинення, зменшення, або виклик регресії хвороби, розладу, захворювання, або стану, їх розвитку і/або прогресування, і/або їх симптомів. Термін "попередження" або "запобігання" включає зниження ризику мати, заразитися або випробовувати, хворобу, розлад, захворювання, або стан, їх розвиток і/або прогресування, і/або їх симптоми. Термін попередження включає профілактику. Лікування або попередження хвороби, розладу, захворювання, або стану може бути частковим або повним. На основі їх фармакологічних властивостей, сполуки відповідно до даного винаходу можуть бути використані для лікування і/або профілактики серцево-судинних захворювань, зокрема, серцевої недостатності, особливо хронічної й гострої серцевої недостатності, діастолічної і систолічної (застійна) серцевої недостатності, гострої декомпенсованої серцевої недостатності, серцевої слабкості, ішемічної хвороби серця, стенокардії, інфаркту міокарда, травми ішемії/реперфузії, ішемічного й геморагічного інсульту, артеріосклерозу, атеросклерозу, гіпертензії, особливо гіпертонічної гіпертензії, злоякісної гіпертонічної гіпертензії, вторинної гіпертензії, вазоренальної артеріальної гіпертензії й гіпертензії вторинної відносно ниркових і 9 UA 111098 C2 5 10 15 20 25 30 35 40 45 50 55 60 ендокринних розладів, гіпертонічної хвороби серця, гіпертонічного захворювання нирок, легеневої гіпертензії, особливо, вторинної легеневої гіпертензії, легеневої гіпертензії наступної за легеневою емболією з і без гострого легеневого серця, первинної легеневої гіпертензії, і оклюзійного захворювання периферичних артерій. Сполуки відповідно до даного винаходу є, крім того, придатними для лікування і/або профілактики гестаційного [викликаного вагітністю] набряку й протеїнурії з і без гіпертонії (прееклампсії). Сполуки відповідно до даного винаходу є, крім того, придатними для лікування і/або профілактики захворювань легенів, таких як хронічна обструктивна хвороба легенів, бронхіальна астма, гострий і хронічний набряк легенів, алергійний альвеоліт і пневмоніт, викликаний вдихуваними органічним пилом й частками грибків актиноміцетного або іншого походження, гострий хімічний бронхіт, гострий і хронічний хімічний набряк легенів (наприклад, після вдихання фосгену, окису азоту), нейрогенний набряк легенів, гострі і хронічні легеневі вияви, викликані радіацією, гострі й хронічні міжтканинні хвороби легенів (наприклад, але не обмежуючись ними, міжтканинні хвороби легенів, викликані наркотиками, наприклад, вторинні відносно лікування за допомогою блеоміцину), гостре ушкодження легенів/гострий респіраторний дистрес-синдром (ГУЛ/ГРДС) у дорослого або дитини, включаючи немовлят, ГУЛ/ГРДС вторинно відносно пневмонії й сепсису, аспіраційна пневмонія й ГУЛ/ГРДС вторинно по відношенню до аспірації (наприклад, але не обмежуючись, аспіраційна пневмонія через виплюнутий вміст шлунка), ГУЛ/ГРДС вторинно відносно вдихання коптильного газу, синдром гострого посттрансфузійного ушкодження легень (СГПУЛ), ГУЛ/ГРДС або гостра легенева недостатність після операції, травми або опіків, вентиляторне ушкодження легенів (ВУЛ), ушкодження легенів наступне за аспірацією меконія, легеневий фіброз і гірська хвороба. Сполуки відповідно до даного винаходу є, крім того, придатними для лікування і/або профілактики хронічного захворювання нирок (етапи 1-5), ниркової недостатності, діабетичної нефропатії, гіпертонічного хронічного захворювання нирок, гломерулонефриту, швидко прогресуючого й хронічного ниркового синдрому, неспецифічного ниркового синдрому, нефротичного синдрому, спадкоємної нефропатії, гострого й хронічного тубулоінтерстиціального нефриту, гострого ушкодження нирок, гострої ниркової недостатності, посттравматичної ниркової недостатності, травматичного й післяопераційного ушкодження нирок, кардіоренального синдрому, і для захисту й поліпшення функції трансплантатів нирок. Сполуки є також придатними для лікування і/або профілактики цукрового діабету і його послідовних симптомів, таких як, наприклад, діабетична макро- і мікроангіопатія, діабетична нефропатія й нейропатія. Сполуки відповідно до даного винаходу можуть також бути використані для лікування і/або профілактики захворювань центральної й периферичної нервової системи, таких як вірусний і бактеріальний менінгіт і енцефаліт (наприклад, лишайний енцефаліт), черепно-мозкова травма, первинні або вторинні [метастази] злоякісні новоутворення головного мозку й спинного мозку, радикуліт і полірадикуліт, синдром Гієна-Баре [гострий (пост-) інфекційний поліневрит, синдром Мілера-Фішера], бічний аміотрофічний склероз [прогресивна спинна атрофія м'язів], хвороба Паркінсона, гострі й хронічні поліневропатії, біль, набряк мозку, хвороба Альцгеймера, дегенеративні захворювання нервової системи й демієлінізуючі захворювання центральної нервової системи, такі як, але не обмежуючись, розсіяний склероз. Сполуки відповідно до даного винаходу є, крім того, придатними для лікування і/або профілактики портальної гіпертензії й фіброзу печінки [цироз] і його ускладнень, таких як варикозне розширення вен стравоходу й асцит, для лікування і/або профілактики плевральних випотів вторинно відносно злоякісних пухлин або запалень і для лікування і/або профілактики лімфедеми й набряку, вторинно відносно варикозного розширення вен. Сполуки відповідно до даного винаходу є, крім того, придатними для лікування і/або профілактики запальних захворювань шлунково-кишкового тракту, таких як, запальні захворювання кишечнику, хвороба Крона, виразковий коліт, і токсичні розлади кишок. Сполуки відповідно до даного винаходу є, крім того, придатними для лікування і/або профілактики сепсису, септичного шоку, синдрому системної запальної реакції (ССЗР) неінфекційного походження, геморагічного шоку, сепсису або ССЗР із органною дисфункцією або поліорганною недостатністю (MOF), травматичного шоку, токсичного шоку, анафілактичного шоку, кропивниці, алергій, пов'язаних із комахами, що кусають і жалять, набряку Квінке [гігантська кропивниця, набряк Квінке], гострого ларінгіту й трахеїту, і гострого обструктивного ларінгіту [круп] і епіглотиту. Сполуки є, крім того, придатними для лікування і/або профілактики захворювань ревматичного типу й інших форм хвороби, які вважаються аутоімунними захворюваннями, 10 UA 111098 C2 5 10 15 20 25 30 35 40 45 50 55 такими як, але не обмежуючись, поліартрит, червона вовчанка, склеродермія, пурпура й васкуліт. Сполуки відповідно до даного винаходу є, крім того, придатними для лікування очної гіпертензії (глаукома), діабетичної ретинопатії й макулярного набряку. Сполуки відповідно до даного винаходу можуть крім того бути використані для лікування і/або профілактики пов'язаних з операціями станів ішемії і його послідовних симптомів після хірургічних втручань, зокрема втручань на серце з використанням апарата штучного кровообігу (наприклад, операції з відключенням, імплантати клапана серця), втручань на сонних артеріях, втручань на аорті й втручань із інструментним відкриттям або проникненням черепа. Сполуки є, крім того, придатними для загального лікування і/або профілактики у випадку хірургічних втручань із метою прискорення загоєння рани й скорочення часу реконвалесценції. Вони також підходять для поліпшення загоєння ран. Сполуки є, крім того, придатними для лікування і/або профілактики розладів щільності кісткової тканини й структури, таких як, але не обмежуючись, остеопороз, остеомаляція й хвороби кісток, пов'язані з гіперпаратиреозом. Сполуки є, крім того, придатними для лікування і/або профілактики сексуальних дисфункцій, зокрема еректильної дисфункції в чоловіків. Кращі сполуки є придатними для лікування і/або профілактики серцевої недостатності, ішемічної хвороби серця, ішемічного і/або геморагічного інсульту, гіпертонії, легеневої гіпертензії, оклюзійного захворювання периферичних артерій, прееклампсії, хронічної обструктивної хвороби легенів, астми, гострого і/або хронічного набряку легенів, алергійного альвеоліту і/або пневмоніту, викликаного вдиханням органічного пилу або часток грибків актиноміцетного або іншого походження, і/або гострого хімічного бронхіту, гострого і/або хронічного хімічного набряку легенів, нейрогенного набряку легенів, гострих і/або хронічних легеневих проявів, викликаних радіацією, гострих і/або хронічних інтерстиціальних захворювань легенів, гострого ушкодження легенів/гострого респіраторного дистрес-синдрому (ГУЛ/ГРДС) у дорослого або дитини, включаючи немовлят, ГУЛ/ГРДС вторинно відносно пневмонії й сепсису, аспіраційної пневмонії й ГУЛ/ГРДС вторинно відносно аспірації, ГУЛ/ГРДС вторинно відносно вдихання коптильного газу, синдрома гострого посттрансфузійного ушкодження легень (СГПУЛ), ГУЛ/ГРДС або гострої легеневої недостатності після операції, травми і/або опіків, вентиляторного ушкодження легенів (ВУЛ), ушкодження легенів наступного за аспірацією меконія, легеневого фіброзу й гірської хвороби, хронічних захворювань нирок, гломерулонефриту, гострого ушкодження нирок, кардіоренального синдрому, лімфедеми, запального захворювання кишечнику, сепсису, септичного шоку, синдрому системної запальної реакції (ССЗР) неінфекційного походження, анафілактичного шоку, запального захворювання кишечнику і/або кропивниці. Більш переважні сполуки є придатними для лікування і/або профілактики серцевої недостатності, гіпертонії, легеневої гіпертензії, астми, гострого і/або хронічного хімічного набряку легенів, гострого ушкодження легенів/гострого респіраторного дистрес-синдрома (ГУЛ/ГРДС) у дорослих або дітей, включаючи немовлят, ГУЛ/ГРДС вторинно відносно пневмонії й сепсису, аспіраційної пневмонії й ГУЛ/ГРДС вторинно відносно аспірації, ГУЛ/ГРДС вторинно відносно вдихання коптильного газу, синдрому гострого посттрансфузійного ушкодження легень (СГПУЛ), ГУЛ/ГРДС і/або гострої легеневої недостатності після операції, травми і/або опіків, і/або вентиляторного ушкодження легенів (ВУЛ), ушкодження легенів, що випливає за аспірацією меконія, сепсису, септичного шоку, синдрому системної запальної реакції (ССЗР) неінфекційного походження, анафілактичного шоку, запального захворювання кишечнику і/або кропивниці. Даний винахід додатково забезпечує спосіб використання сполук відповідно до даного винаходу для лікування і/або профілактики захворювань, зокрема, порушень, згаданих вище. Даний винахід додатково забезпечує спосіб використання сполук відповідно до даного винаходу для приготування лікарського засобу для лікування і/або профілактики захворювань, зокрема, порушень, згаданих вище. Даний винахід додатково забезпечує спосіб для лікування і/або профілактики захворювань, зокрема, порушень, згаданих вище, з використанням активної кількості сполук, відповідно до даного винаходу. Крім того, винахід забезпечує лікарські засоби, що містять сполуку відповідно до винаходу й один або більше додатковий активний компонент, зокрема, для лікування і/або профілактики розладів, зазначених вище. Зразковими й кращими комбінаціями активних компонентів є: 11 UA 111098 C2 5 10 15 20 25 30 35 40 45 50 55 60 Інгібітори АПФ, антагоністи рецепторів ангіотензину, агоністи рецептора бета-2, інгібітори фосфодіестерази, агоністи рецептори глюкокортикоїдів, діуретики, або рекомбінантний ангіотензин, що перетворює ензим-2 або ацетилсаліцилову кислоту (аспірин). У кращому варіанті здійснення винаходу сполуки відповідно до даного винаходу вводять у комбінації з інгібітором АПФ, таким як, для наведення приклада й для вираження переваги, еналаприл, хінаприл, каптоприл, лізиноприл, раміприл, делаприл, фозіноприл, періндоприл, цилазаприл, імідаприл, беназеприл, моексиприл, спіраприл або трандоприл. У кращому варіанті здійснення винаходу сполуки відповідно до даного винаходу вводять у комбінації з антагоністом рецепторів ангіотензину, таким як, як наведення приклада й для вираження переваги, лозартан, кандесартан, валсартан, телмісартан або ембусартан. У кращому варіанті здійснення винаходу сполуки відповідно до даного винаходу вводять у комбінації з агоністом бета-2 рецепторів, таким як, як наведення приклада й для вираження переваги, сальбутамол, пірбутерол, сальметерол, тербуталін, фенотерол, тулобутерол, кленбутерол, репротерол або формотерол. У кращому варіанті здійснення винаходу сполуки відповідно до даного винаходу вводять у комбінації з інгібітором фосфодіестерази (ФДЕ), таким як, для наведення приклада й для вираження переваги, мілринон, амринон, пімобендан, цилостазол, сілденафіл, варденафіл або тадалафіл. У кращому варіанті здійснення винаходу сполуки відповідно до даного винаходу вводять у комбінації з агоністом рецепторів глюкокортикоїдів, таким як, для наведення приклада й для вираження переваги, кортіозол, кортизон, гідрокортизон, преднізон, преднізолон метилпредніліден, дефлазакорт, флуокортолон, триамцинолон, дексаметазон або бетаметазон. У кращому варіанті здійснення винаходу сполуки відповідно до даного винаходу вводять у комбінації з діуретиками, такими як, для наведення приклада й для вираження переваги, фуросемід, торасемід і гідрохлортіазид. Даний винахід також відноситься до лікарських засобів, які містять щонайменше одну сполуку відповідно до винаходу, звичайно разом з одним або більше інертним, нетоксичним, фармацевтично придатним носієм, і до їх застосування для вищевказаних цілей. Сполуки відповідно до даного винаходу можуть діяти системно і/або місцево. Для цієї мети вони можуть бути введені придатним чином, наприклад, парентеральним, легеневим, назальним, під'язичним, язичним, букальним, шкірним, трансдермальним, кон'юнктивальним, очним шляхом, або у вигляді імплантату або стента. Сполуки відповідно до даного винаходу можуть бути введені в лікарських формах, придатних для цих шляхів введення. Парентеральне введення може відбуватися з уникненням стадії абсорбції (наприклад, внутрішньовенно, внутрішньоартеріально, внутрішньосерцево, інтраспінально або інтралюмбально) або із включенням абсорбції (наприклад, внутрішньом`язово, підшкірно, внутрішньошкірно, крізьшкірно або внутрішньочеревинно). Лікарські форми, що підходять для парентерального введення, включають препарати для ін'єкцій і інфузій у вигляді розчинів, суспензій, емульсій, ліофілізатів або стерильних порошків. Придатними для інших шляхів введення є, наприклад, лікарські форми для інгаляції (у тому числі порошкові інгалятори, розпилювачі), краплі в ніс, очні краплі, розчини або спреї; плівки/брикети або водні суспензії (лосьйони, суміші, що струшують), ліпофільні суспензії, мазі, креми, трансдермальні терапевтичні системи (наприклад, пластири), молоко, пасти, піни, присипки, імплантати або стенти. Парентеральне введення є кращим, особливо внутрішньовенне введення. Сполуки відповідно до даного винаходу можуть бути перетворені в зазначені лікарські форми. Це може здійснюватися відомим способом шляхом змішування з інертними, нетоксичними, фармацевтично придатними наповнювачами. Ці наповнювачі включають носії (наприклад, мікрокристалічна целюлоза, лактоза, маніт), розчинники (наприклад, рідкі поліетилен гліколі), емульгатори й диспергатори або змочувальні речовини (наприклад, додецилсульфат натрію, поліоксисорбітан олеат), зв'язувальні речовини (наприклад, полівінілпіролідон), синтетичні й природні полімери (наприклад, альбумін), стабілізатори (наприклад, антиоксиданти, наприклад, аскорбінова кислота), барвники (наприклад, неорганічні пігменти, наприклад, оксиди заліза) і речовини, що маскують аромати і/або запахи. Виявилося вигідним, у випадку парентерального введення, введення кількостей, приблизно від 0.001 до 5 мг/кг, переважно, приблизно від 0.01 до 1 мг/кг ваги тіла для досягнення ефективних результатів. Проте, у деяких випадках може бути необхідно відхилятися від зазначених кількостей, зокрема, залежно від ваги тіла, шляхи введення, індивідуальної реакції на активний компонент, 12 UA 111098 C2 5 10 характеру одержання й години або інтервалу, за який здійснюється введення. Наприклад, менше зазначеної вище мінімальної кількості може бути недостатньо в деяких випадках, причому в інших випадках заявлена верхня межа повинна бути перевищена. У випадку введення більших кількостей, може бути бажаним розділити їх на безліч індивідуальних доз протягом дня. Наступні робочі приклади ілюструють винахід. Винахід не обмежується цими прикладами. Відсотки в наступних тестах і прикладах являють собою, якщо не зазначене інше, відсотки за вагою; частини являють собою частини за вагою. Співвідношення розчинників, коефіцієнти розведення й дані концентрації для рідини/рідких розчинів - усі залежати від об'єму. A. Приклади Скорочення AA Acm ADM ADM(2-52) амінокислота ацетамідометил адреномедулін (людини) пептидна послідовність ADM AA 2-AA 52, включаючи дисульфідний зв'язок і C-кінцевий амід приблизно трет-бутилоксикарбоніл карбонілдіімідазол день(дні), дуплет (у ЯМР) тонкошарова хроматографія пряма хімічна іонізація (в MС) дуплет дуплетів (у ЯМР) N,N-діізопропілетиламін 4-диметиламінопіридин N,N-диметилформамід диметил сульфоксид від теорії (вихід) еквівалент(и) іонізація електророзпиленням (в MС) (9H-флуорен-9-ілметокси)карбоніл година(и) O-(7-азабензотриазол-1-іл)-N,N,N',N'-тетраметилуроній гексафторфосфат високоефективна рідинна хроматографія при високому тиску рідинна хроматографія- з мас-спектрометрією мультиплет (у ЯМР) хвилина(и) мас-спектрометрія спектроскопія ядерного магнітного резонансу 2,2,4,6,7-пентаметилдигідробензофуран-5-сульфоніл поліетилeн гліколь обернена фаза (у ВЕРХ) кімнатна температура година утримання (в ВЕРХ) синглет (у ЯМР) бензотриазол-1-іл-N-тетраметил-уроній тетрафторборат трет-бутил трифтороцтова кислота тетрагідрофуран тритил прибл. Boc CDI д/d ТШХ DCI dd DIEA DMAP ДМФА ДМСО від теор. екв. ESI Fmoc год. HATU ВЕРХ РХ-МС m хв MС ЯМР pbf ПЕГ RP КТ Rt s TBTU tBu ТФО ТГФ Trt 15 Номенклатура амінокислот і пептидних послідовностей відповідно до: Міжнародного союзу теоретичної й прикладної хімії й Міжнародного союзу біохімії: Nomenclature and Symbolism for Amino Acids and Peptides (Recommendations 1983). В: Pure & Appl. Chem. 56, Vol. 5, 1984, p. 595-624 Однобуквений символ Тривіальна назва Символ Аланін Ala A 13 UA 111098 C2 Аргінін Аспарагін Аспарагінова кислота Цистеїн Глютамінова кислота Глютамін Гліцин Гістидин Ізолейцин Лейцин Лізин Метіонін Фенілаланін Пролін Серин Треонін Триптофан Тірозин Валін 5 10 15 20 25 30 35 Arg Asn R N Asp D Cys C Glu E Gln Gly His Ile Leu Lys Met Phe Pro Ser Thr Trp Tyr Val Q G H I L K M F P S T W Y V РХ-МС і MС способи Спосіб 1 (РХ-МС): Тип пристрою: Waters ACQUITY SQD UPLC System; колонка: Waters Acquity UPLC HSS T3 1.8 мк 50 мм 1 мм; мобільна фаза A: 1 л води + 0.25 мл 99 %-ої мурашиної кислоти, мобільна фаза Б: 1 л ацетонітрилу + 0.25 мл 99 %-ої мурашиної кислоти; градієнт: 0.0 хв. 90 % A → 1.2 хв 5 % A → 2.0 хв. 5 % A; піч: 50 °C; потік: 0.40 мл/хв.; УФдетектування: 210-400 нм. Спосіб 2 (РХ-МС): МС тип пристрою: Waters (Micromass) Quattro Micro; ВЕРХ тип пристрою: Agilent 1100 series; колонка: Thermo Hypersil GOLD 3 мк 20 мм 4 мм; мобільна фаза A: 1 л води + 0.5 мл 50 %-ої мурашиної кислоти, мобільна фаза Б: 1 л ацетонітрилу + 0.5 мл 50 %-ої мурашиної кислоти; градієнт: 0.0 хв. 100 % A → 3.0 хв. 10 % A → 4.0 хв. 10 % A; піч: 50 °C; потік: 2.0 мл/хв.; УФ-детектування: 210 нм. Спосіб 3 (ВЕРХ): Тип пристрою: HP 1200 Series; УФ DAD; колонка: Phenomenex Luna 5 мкм C5 100Å, 150 мм 4.6 мм; мобільна фаза A: 1 л води + 0.5 мл 50 %-ої мурашиної кислоти, мобільна фаза Б: 1 л ацетонітрилу + 0.5 мл 50 %-ої мурашиної кислоти; градієнт: 0.0 хв. 95 %A → 5 хв. 5 % A; → 5.8 хв. 95 % A → 6.2 хв. 95 % A; швидкість потоку: 2.5 мл/хв.; піч: КТ; УФдетектування: 210 нм. Спосіб 4 (ВЕРХ): Тип пристрою: HP 1200 Series; УФ DAD; колонка: Merck Chromolith Fastgradient RP18 50 мм 2 мм; мобільна фаза A: 1 л води + 0.5 мл 50 %-ої мурашиної кислоти, мобільна фаза Б: 1 л ацетонітрилу + 0.5 мл 50 %-ої мурашиної кислоти; градієнт: 0.0 хв. 95 %A → 2.9 хв. 5 % A → 3.2 хв. 5 % A; швидкість потоку: 3 мл/хв.; піч: КТ; УФ-детектування: 210 нм. Спосіб 5 (ДХІ МС): Тип пристрою: Thermo Fisher-Scientific DSQ; хімічна іонізація; реагент газоподібний аміак; температура джерела: 200 °C; енергія іонізації 70 ев. Спосіб 6 (МАЛДІ МС): Тип пристрою Kratos PC-Kompact SEQ V1.2. 2 MALDI TOF MS, режим позитивної іонізації, лінійний високий, потужність: 75. Мікрохвильовий синтезатор: Biotage Emrys Initiator II синтезатор, зі змінним розміром флакона до 20 мл об'єму реакції й "Robot 60" процесор зразка pH 4 цитратний буфер: Fluka No 82566; цитратний буфер pH 4, стабілізований з композицією азиду натрію: лимонна кислота, ~0.056 M; азид натрію, ~0.05 %; хлорид натрію, ~0.044 M; гідроксид натрію, ~0.068 M. 40кДа метокси полі(етилeн гліколь) малеімідо пропіонамід (лінійний 40k мПЕГ малеімід); CAS No 724722-89-8; фірми Dr. Reddys Inc., Lot No 233101301; вага - середня молекулярна маса, Mw (GPC) 40500 Да; полідисперсність (GPC) 1.08. Вихідні сполуки Приклад 1A Аліл-N-(трет-бутоксикарбоніл)-O-[(4-нітрофенокси)карбоніл]-L-тирозинат 14 UA 111098 C2 O + N O O O O O O H3C O H3C NH CH2 CH3 O 5 10 15 36.7 г (114.3 ммоль) складні ефіри N-Boc-L-тирозин алілу, 23.0 г (114.3 ммоль) 4-нітрофеніл хлорформіату, 17.5 мл (125.7 ммоль) триетиламіну й 1.40 г (11.4 ммоль) 4-диметиламіно піридину поєднували в 1000 мл дихлорметану й перемішували при кімнатній температурі протягом 2 годин. Реакційну суміш виділяли за допомогою, приблизно, 500 мл води й за допомогою, приблизно, 250 мл сольового розчину й сушили над, приблизно, 100 г сульфату натрію. Розчинник видаляли за допомогою роторного випарювання (приблизно, 40 °C, приблизно, 200 мбар, приблизно, 30 хв.) і продукт розчиняли в теплому діетиловому ефірі й кристалізували протягом ночі при 4 °C. Кристали відфільтровували, промивали за допомогою холодного діетилового ефіру й сушили у високому вакуумі (приблизно 0.1 мбар, 18 год.). Вихід склав 29.86 г, (59.6 ммоль, 52 % від теорії) бажаної речовини. + РХ-МС (спосіб 1): Rt=1.23 хв., m/z=487 (M+H) Приклад 2A (2S)-4-{[(4-{(2S)-3-(алілокси)-2-[(трет-бутоксикарбоніл)аміно]-3оксопропіл}фенокси)карбоніл]-аміно}-2-[(трет-бутоксикарбоніл)аміно]бутанова кислота CH3 H3C O O O O CH3 NH OH N H O O H3C H3C O O CH3 20 25 NH O CH2 4.0 г (8.22 ммоль) сполуки із приклада 1A розчиняли в 60 мл дихлорметану. 1.795 (8.22 ммоль) (2S)-4-аміно-2-[(трет-бутоксикарбоніл)аміно]бутанової кислоти й 1.43 мл (8.22 ммоль) N,N-діізопропілетиламіну додавали. Реакційну суміш розділяли на 3 порції. Порції нагрівали протягом 30 хв. у закупореній трубці при 75 °C у мікрохвильовому синтезаторі. З об'єднаної реакційної суміші розчинник видаляли за допомогою роторного випарювання (приблизно 40 °C, приблизно 200 мбар, приблизно 30 хв). Неочищений продукт розчиняли в дихлорметані й хроматографували над, приблизно, 600 мл силікагелю. Використовуваними розчинниками були 15 UA 111098 C2 5 дихлорметан/етилацетат 4/1, дихлорметан/етилацетат 1/1, дихлорметан/метанол 4/1 і дихлорметан/ метанол 1/1. Фракції, що містять продукт обєднували й концентрували до сухого стану при зниженому тиску. Це забезпечило 4.02 г (6.54 ммоль, 80 % від теорії) бажаної речовини. РХ-МС (спосіб 1): Rt=1.07 хв., m/z=564 (M-H) Приклад 3A Аліл O-({(3S)-4-{[(2R)-1-аміно-1-oксo-3-(тритилсульфаніл)пропан-2-іл]аміно}-3-[(трет-бутоксикарбоніл)аміно]-4-оксобутил}карбамоїл)-N-(трет-бутоксикарбоніл)-L-тирозинат CH3 H3C O O O O CH3 NH N H O H N O S NH2 O H3C H3C 10 15 20 25 O O CH3 NH O CH2 2.50 г (4.42 ммоль) сполуки із приклада 2A розчиняли в 100 мл дихлорметану. 1.602 г (4.42 ммоль) S-тритил-L-цистеїнаміду, 0.77 мл (4.42 ммоль) N,N-діізопропілетиламіну й 1.68 г (4.42 ммоль) HATU додавали. Реакційну суміш розділяли на 5 порцій. Порції нагрівали протягом 30 хв. у закупореній трубці при 60 °C у мікрохвильовому синтезаторі. З об'єднаної реакційної суміші розчинник видаляли за допомогою роторного випарювання (приблизно, 40 °C, приблизно, 200 мбар, приблизно, 30 хв.). Неочищений продукт розчиняли в дихлорметані й хроматографували над приблизно 600 мл силікагелю. Використовуваними розчинниками були дихлорметан/етилацетат 2/1, дихлорметан/етилацетат 1/1, дихлорметан/метанол 20/1 і дихлорметан/метанол 10/1. Фракції, що містять продукт об’єднували й концентрували до сухого стану при зниженому тиску. Це забезпечило 4.12 г (3.30 ммоль, 75 % від теорії, 73 % чистоти) бажаної речовини. + РХ-МС (спосіб 1): Rt=1.36 хв., m/z=911 (M+H) Приклад 4A O-({(3S)-4-{[(2R)-1-аміно-1-oксo-3-(тритилсульфаніл)пропан-2-іл]аміно}-3-[(третбутоксикарбоніл)-аміно]-4-оксобутил}карбамоїл)-N-(трет-бутоксикарбоніл)-L-тирозин 16 UA 111098 C2 CH3 H3C O NH O O O CH3 N H H N O O S NH2 O H3C H3C OH O CH3 5 10 15 20 NH O 4.14 г (4.55 ммоль) сполуки із приклада 3A розчиняли в 90 мл тетрагідрофурану. 3.17 мл (22.8 ммоль) триетиламіну, 0.86 мл (22.8 ммоль) мурашиної кислоти й 0.526 г (0.455 ммоль) тетракіс(трифенілфосфін)палладію(0) додавали. Реакційну суміш перемішували протягом ночі при кімнатній температурі. Реакцію розбавляли за допомогою, приблизно, 100 мл води, і двічі виділяли за допомогою, приблизно, 100 мл дихлорметану. Об'єднані органічні фази виділяли за допомогою сольового розчину, сушили над сульфатом натрію й концентрували до сухого стану при зниженому тиску. Неочищений продукт розчиняли в дихлорметані й хроматографували над, приблизно, 500 мл силікагелю. Використовуваними розчинниками були дихлорметан, дихлорметан/метанол 20/1 і дихлорметан/метанол 1/1. Фракції, що містять продукт об’єднували й концентрували до сухого стану при зниженому тиску. Це забезпечило 2.62 г неочищеного продукту із чистотою 94.5 %. Продукт далі був очищений за допомогою препаративної ОФ-ВЕРХ на C18 за допомогою градієнта вода/метанол з виходом 2.35 г (2.70 ммоль, 59 % від теорії) чистого продукту. + РХ-МС (спосіб 1): Rt=1.22 хв., m/z=871 (M+H) 1 H-ЯМР (400 МГц, ДМСО-d6, δ/м.д.): δ = 7.92 (d, 1H), 7.65 (t, 1H), 7.28-7.35 (m, 12H), 7.25-7.28 (t, 3H), 7.15-7.20 (m, 4H), 6.95 (d, 2H), 4.29 (q, 1H), 4.00 (m, 1H), 3.92 (m, 1H), 3.11 (m, 3H), 2.90 (m, 1H), 2.36 (m, 2H), 1.84 (m, 1H), 1.68 (m, 1H), 1.34 (d, 18H). Приклад 5A Трет-бутил-метил(2-oксoтетрагідрофуран-3-іл)карбамат CH3 CH3 H3 C O O O N O CH3 25 30 Сполуку синтезували відповідно до Alberico, Dino; Paquin, Jean-Francois; Lautens, Mark; Tetrahedron, 2005, vol. 61, p. 6283-6297. 5.18 г (25.7 ммоль) трет-бутил(тетрагідро-2-oксo-3-фураніл)карбамату, 4.81 мол (77.2 ммоль) йодметану розчиняли в 100 мл сухого диметил формаміду. Розчин охолоджували до 0 °C і 1.34 г (60 % у мінеральному маслі, 33.5 ммоль) гідрид натрію додавали. Реакцію нагрівали до кімнатної температури й перемішували протягом ночі. Реакційну суміш додавали до, приблизно, 400 мл води й суміш виділяли три рази за допомогою, приблизно, 300 мл етилацетату. Об'єднані органічні фази сушили над сульфатом натрію й концентрували до 17 UA 111098 C2 5 сухого стану при зниженому тиску. Це забезпечило 8.70 г (25.7 ммоль, 100 % від теорії, 63 % чистоти) бажаної речовини. Аналітичні дані були у відповідності з літературою. Продукт був використаний у наступній стадії синтезу без додаткового очищення. Приклад 6A 2-[(трет-бутоксикарбоніл)(метил)аміно]-4-(1,3-діоксо-1,3-дигідро-2H-ізоіндол-2-іл)бутанова кислота O O OH N O O 10 15 20 N CH3 CH3 O CH3 CH3 8.70 г (приблизно, 25 ммоль, приблизно, 63 % чистоти) сполуки із приклада 5A розчиняли в 560 мл диметил формаміді. 8.23 г (44.4 ммоль) калій офталіміду додавали й реакційну суміш нагрівали до 150 °C протягом 7 годин. Приблизно, 400 мл розчинника видаляли за допомогою роторного випарювання (приблизно 60 °C, приблизно 10 мбар, приблизно 30 хв.). Реакційну суміш виливали в суміш, приблизно, 100 мл води, 200 г льоду й 15 мл оцтової кислоти. Після того, що як лід, що залишився розтанув, реакційну суміш фільтрували й фільтрат виділяли 3 рази за допомогою, приблизно, 100 мл дихлорметану. Об'єднані органічні фази сушили над сульфатом натрію й концентрували до сухого стану при зниженому тиску. Неочищений продукт розчиняли в дихлорметані й хроматографували над приблизно 70 мл силікагелю. Використовуваними розчинниками були від дихлорметан/етилацетат 9/1 до дихлорметан/етилацетат 6/4. Фракції, що містять продукт об’єднували й концентрували до сухого стану при зниженому тиску. Це забезпечило 2.39 г (6.04 ммоль, 24 % від теорії) продукту. + РХ-МС (спосіб 1): Rt=0.92 хв., m/z=363 (M+H) Приклад 7A 4-аміно-2-[(трет-бутоксикарбоніл)(метил)аміно]бутанова кислота O OH H2N O 25 30 35 N CH3 CH3 O CH3 CH3 11.8 г (32.6 ммоль) сполуки із приклада 6A розчиняли в, приблизно, 640 мл етанолу й 23.8 мл (488 ммоль) гідразин гідрату додавали до реакційної суміші. Після перемішування протягом ночі, реакційну суміш фільтрували й фільтрат концентрували до сухого стану при зниженому тиску. Неочищений продукт розчиняли в етанолі й приблизно 50 г силікагелю додавали, розчинник видаляли при зниженому тиску. Тверду речовину, що залишилася, додавали на колонці з, приблизно, 500 г силікагелю й хроматографували. Використовуваними розчинниками були від дихлорметан/метанол 9/1 до дихлорметан/метанол 1/1. Фракції, що містять продукт об’єднували й концентрували до сухого стану при зниженому тиску. Це забезпечило 2.98 г (12.8 ммоль, 39 % від теорії) продукту. + РХ-МС (спосіб 2): Rt=0.21 хв., m/z=233 (M+H) + ДХІ МС (спосіб 5): m/z=233 (M+H) Приклад 8A 4-{[(4-{(2S)-3-(алілокси)-2-[(трет-бутоксикарбоніл)аміно]-3-оксопропіл}фенокси)карбоніл]аміно}-2-[(трет-бутоксикарбоніл)(метил)аміно]бутанова кислота 18 UA 111098 C2 CH3 H3C O N O O CH3 OH N H O CH3 O O O H3C O H3C CH3 5 10 NH O CH2 0.931 г (1.92 ммоль) сполуки із приклада 1A розчиняли в 30 мл дихлорметану. 0.455 г (1.92 ммоль) сполуки із приклада 7A додавали. Реакційну суміш розділяли на 2 порції. Порції нагрівали протягом 30 хв. у закупореній трубці при 80 °C у мікрохвильовому синтезаторі. З об'єднаної реакційної суміші розчинник видаляли при зниженому тиску. Неочищений продукт очищали за допомогою препаративної ОФ-ВЕРХ на C18 колонці із градієнтом вода/метанол від 9/1 дo 1/9. Фракції, що містять продукт об’єднували й концентрували до сухого стану при зниженому тиску. Це забезпечило 0.523 г (0.85 ммоль, 44 % від теорії) бажаної речовини у вигляді суміші двох діастереомерів. РХ-МС (спосіб 1): Rt=1.08 і 1.11 хв., m/z=578 (M-H) Приклад 9A Аліл O-[(4-{[(2R)-1-аміно-1-oксo-3-(тритилсульфаніл)пропан-2-іл]аміно}-3-[(третбутоксикарбоніл)-(метил)аміно]-4-оксобутил)карбамоїл]-N-(трет-бутоксикарбоніл)-L-тирозинат 15 CH3 H3C O O O O CH3 N N H CH3 H N O O S NH2 O H3C H3C O O CH3 20 NH O CH2 2.24 г (3.86 ммоль) сполуки із приклада 8A розчиняли в 100 мл дихлорметану. 1.401 г (3.86 ммоль) S-тритил-L-цистеїнаміду, 0.67 мл (3.86 ммоль) N,N-діізопропілетиламіну й 1.47 г (3.86 ммоль) HATU додавали. Реакційну суміш розділяли на 5 порції. Порції нагрівали протягом 30 хв. у закупореній трубці при 60 °C у мікрохвильовому синтезаторі. З об'єднаної реакційної суміші 19 UA 111098 C2 5 розчинник видаляли за допомогою роторного випарювання (приблизно 40 °C, приблизно 200 мбар, приблизно 30 хв.). Неочищений продукт очищали за допомогою препаративної ОФ-ВЕРХ на C18 колонці із градієнтом вода/метанол від 9/1 дo 1/9. Фракції, що містять продукт обєднували й концентрували до сухого стану при зниженому тиску. Це забезпечило 3.26 г (2.75 ммоль, 71 % від теорії, 78 % чистоти) бажаної речовини у вигляді суміші діастереомерів. + РХ-МС (спосіб 1): Rt=1.41 і 1.43 хв., m/z=924 (M+H) Приклад 10A O-[(4-{[(2R)-1-аміно-1-oксo-3-(тритилсульфаніл)пропан-2-іл]аміно}-3-[(трет-бутоксикарбоніл)(метил)аміно]-4-оксобутил)карбамоїл]-N-(трет-бутоксикарбоніл)-L-тирозин 10 CH3 H3C O O O O CH3 N N H CH3 H N O O S NH2 O H3C H3C OH O CH3 15 20 25 30 NH O 2.2 г (2.38 ммоль) сполуки із приклада 9A розчиняли в 48 мл тетрагідрофурану. 1.66 мл (11.9 ммоль) триетиламіну, 0.45 мл (11.9 ммоль) мурашиної кислоти й 0.275 г (0.238 ммоль) тетракіс(трифенілфосфін)палладію(0) додавали. Реакційну суміш перемішували протягом ночі при кімнатній температурі. Реакцію розбавляли за допомогою, приблизно, 50 мл води й двічі виділяли за допомогою, приблизно, 50 мл дихлорметану. Об'єднані органічні фази виділяли за допомогою сольового розчину, сушили над сульфатом натрію й концентрували до сухого стану при зниженому тиску. Неочищений продукт розчиняли в дихлорметані й хроматографували над приблизно 100 г силікагелю. Використовуваними розчинниками були дихлорметан, дихлорметан/метанол 50/1 і дихлорметан/метанол 4/1. Фракції, що містять продукт обєднували й концентрували до сухого стану при зниженому тиску. Це забезпечило 1.44 г (1.61 ммоль, 68 % від теорії) продукту у вигляді суміші діастереомерів. + РХ-МС (спосіб 1): Rt=1.20 і 1.24 хв., m/z=884 (M+H) 1 H-ЯМР (400 МГц, ДМСО-d6, δ м.д.): δ = 8.00 (m, 1H), 7.65-7.90 (m, 4H), 7.18-7.35 (m, 18H), 7.10 (m, 2H), 6.96 (m, 4H), 4.60 (m, 1H), 4.46 (m, 1H), 4.30 (m, 2H), 4.05 (m, 2H), 3.00 (m, 4H), 2.75 (m, 6H), 2.36 (m, 3H), 2.00 (m, 2H), 1.82 (m, 2H), 1.40 (m, 3H), 1.35 (s, 18H). Приклад 11A 5 2 N -[(4-{(2S)-3-(алілокси)-2-[(трет-бутоксикарбоніл)аміно]-3-оксопропіл}фенокси)карбоніл]-N (трет-бутоксикарбоніл)-L-орнітин 20 UA 111098 C2 O O OH N H O O O O H3C H3C CH3 5 10 15 NH O CH2 6.00 г (12.33 ммоль) сполуки із приклада 1A розчиняли в 120 мл дихлорметану. 2.57 г (12.33 2 ммоль) N -(трет-бутоксикарбоніл)-L-орнітину додавали. Реакційну суміш розділяли на 6 порції. Порції нагрівали протягом 90 хв. у закупореній трубці при 75 °C у мікрохвильовому синтезаторі. Об'єднану реакційну суміш виділяли за допомогою, приблизно, 100 мл насиченого розчину хлориду амонію. Водну фазу двічі знову виділяли за допомогою приблизно 30 мл дихлорметану щоразу. Об'єднані органічні фази виділяли за допомогою, приблизно, 50 мл сольового розчину й сушили над сульфатом натрію. Розчинник видаляли при зниженому тиску. Неочищений продукт розчиняли в дихлорметані й хроматографували над приблизно 600 мл силікагелю. Використовуваними розчинниками були дихлорметан, дихлорметан/метанол 40/1 дихлорметан/метанол 1/1. Фракції, що містять продукт обєднували й концентрували до сухого стану при зниженому тиску. Це забезпечило 2.63 г (4.06 ммоль, 33 % від теорії, 89 % чистоти) бажаної речовини. РХ-МС (спосіб 1): Rt=1.03 хв., m/z=578 (M-H) Приклад 12A 5 2 N -[(4-{(2S)-3-(алілокси)-2-[(трет-бутоксикарбоніл)аміно]-3-оксопропіл}фенокси)карбоніл]-N (трет-бутоксикарбоніл)-L-орнітил-S-тритил-L-цистеїнамід O O O N H O H3C H3C 25 30 O O CH3 NH O O 20 CH3 H3C CH 3 O O NH O NH2 N H S CH3 H3C CH 3 NH O CH2 1.20 г (2.07 ммоль) сполуки із приклада 11A розчиняли в 48 мл дихлорметану. 0.750 г (2.07 ммоль) S-тритил-L-цистеїнаміду, 0.36 мл (2.07 ммоль) N,N-діізопропілетиламіну й 0.787 г (2.07 ммоль) HATU додавали. Реакційну суміш розділяли на 3 порції. Порції нагрівали протягом 30 хв. у закупореній трубці при 60 °C у мікрохвильовому синтезаторі. З об'єднаної реакційної суміші розчинник видаляли за допомогою роторного випарювання (приблизно 40 °C, приблизно 200 мбар, приблизно 30 хв.). Неочищений продукт розчиняли в дихлорметані й хроматографували над приблизно 400 мл силікагелю. Використовуваними розчинниками були дихлорметан/етилацетат 2/1, дихлорметан/етилацетат 1/1. Фракції, що містять продукт обєднували й концентрували до сухого стану при зниженому тиску. Це забезпечило 1.30 г (1.5 ммоль, 56 % від теорії, 82 % чистоти) бажаної речовини. 21 UA 111098 C2 + РХ-МС (спосіб 1): Rt=1.35 хв., m/z=924 (M+H) Приклад 13A 2 5 N -(трет-бутоксикарбоніл)-N -[(4-{(2S)-2-[(трет-бутоксикарбоніл)аміно]-2карбоксіетил}фенокси)-карбоніл]-L-орнітил-S-тритил-L-цистеїнамід 5 O O O N H O O O H3C H3C OH O NH O NH2 N H S CH3 H3C CH 3 NH CH3 O 10 15 20 25 30 35 3.06 г (2.33 ммоль) сполуки із приклада 12A розчиняли в 46 мл тетрагідрофурану. 1.63 мл (11.6 ммоль) триетиламіну, 0.44 мл (11.6 ммоль) мурашиної кислоти й 0.265 г (0.233 ммоль) тетракіс(трифенілфосфін)палладію(0) додавали. Реакційну суміш перемішували протягом ночі при кімнатній температурі. Реакцію розбавляли за допомогою, приблизно, 50 мл води й двічі виділяли за допомогою, приблизно, 50 мл дихлорметану. Об'єднані органічні фази виділяли за допомогою сольового розчину, сушили над сульфатом натрію й концентрували до сухого стану при зниженому тиску. Неочищений продукт розчиняли в дихлорметані й хроматографували над, приблизно, 500 мл силікагелю. Використовуваними розчинниками були дихлорметан, дихлорметан/метанол 40/1 і дихлорметан/метанол 1/1. Фракції, що містять продукт обєднували й концентрували до сухого стану при зниженому тиску. Це забезпечило 1.40 г неочищеного продукту 86 % чистоти. Продукт далі був очищений за допомогою препаративної ОФ-ВЕРХ на C18 колонці за допомогою градієнта вода/метанол з виходом в 2 фракції: 0.93 г продукту (45 % від теорії). + РХ-МС (спосіб 1): Rt=1.18 хв., m/z=885 (M+H) 1 H-ЯМР (400 МГц, ДМСО-d6, δ /м.д.): δ = 7.89 (d, 1H), 7.65 (t, 1H), 7.25-7.35 (m, 12H), 7.207.25 (m, 6H), 7.10-7.20 (m, 3H), 6.95 (d, 2H), 4.29 (m, 1H), 4.05 (m, 1H), 3.88 (m, 1H), 3.11 (d, 1H), 3.00 (m, 4H), 2.75 (m, 2H), 2.36 (m, 3H), 1.64 (m, 1H), 1.51 (m, 3H), 1.36 (s, 9H), 1.32 (s, 9H). Приклад 14A Зв'язування ADM і амідної смоли на основі тентагелю ADM (2-52) Пептид збирали східчасто на амідній смолі на основі тентагелю на автоматичному пептидному синтезаторі (Protein Technologies Inc. Symphony). 8 полі-пропіленових реакційних посудин використали, паралельно здійснюючи однакову хімічну реакцію. У кожну посудину завантажували 0.05 ммоль смоли Рінка на основі тентагелю для загального розміру партії 0.4 ммоль. Кожну аміно кислоту додавали в 8-кратному молярному підході відносно завантаження смоли. Амінокислоти були захищені Fmoc як N-кінцевою захисною групою й захисні групи зазначені нижче минулого використані для бічного ланцюга функціональних можливостей. Також 188 мг (0.59 ммоль, 7.8 екв.) TBTU і 0.21 мл (1.2 ммоль, 16 екв.) DIEA додавали. Реакції 22 UA 111098 C2 5 проводили в ДМФА як розчиннику, причому ДМФА використали в кількості достатній для набрякання смоли і її вільного збовтування. Час реакції для амінокислоти склав, приблизно, 1 годину. Розщеплення захисних груп Fmoc було досягнуто за допомогою 20 % піперидину/ДМФА, причому 20 % піперидин/ДМФА використали в кількості достатній для набрякання смоли і її вільного збовтування. Послідовність сполучення була наступною: 1. Tyr(tBu) (Tyr=Y = AA 52 людського ADM) 2. Gly (Gly=G = AA 51 людського ADM) 3. Gln(Trt) (Gln=Q = AA 50 людського ADM) 4. Pro (Pro=P = AA 49 людського ADM) 5. Ser(tBu) (Ser=S = AA 48 людського ADM) 6. Ile (Ile=I = AA 47 людського ADM) 7. Lys(Boc) (Lys=K = AA 46 людського ADM) 8. Ser(tBu) (Ser=S = AA 45 людського ADM) 9. Arg(pbf) (Arg=R = AA 44 людського ADM) 10. Pro (Pro=P = AA 43 людського ADM) 11. Ala (Ala=A = AA 42 людського ADM) 12. Val (Val=V = AA 41 людського ADM) 13. Asn(Trt) (Asn=N = AA 40 людського ADM) 14. Asp(OtBu) (Asp=D = AA 39 людського ADM) 15. Lys(Boc) (Lys=K = AA 38 людського ADM) 16. Asp(OtBu) (Asp=D = AA 37 людського ADM) 17. Lys(Boc) (Lys=K = AA 36 людського ADM) 18. Asp(OtBu) (Asp=D = AA 35 людського ADM) 19. Thr(tBu) (Thr=T = AA 34 людського ADM) 20. Phe (Phe=F = AA 33 людського ADM) 21. Gln(Trt) (Gln=Q = AA 32 людського ADM) 22. Tyr(tBu) (Tyr=Y = AA 31 людського ADM) 23. Ile (Ile=I = AA 30 людського ADM) 24. Gln(Trt) (Gln=Q = AA 29 людського ADM) 25. His(Trt) (His=H = AA 28 людського ADM) 26. Ala (Ala=A = AA 27 людського ADM) 27. Leu (Leu=L = AA 26 людського ADM) 28. Lys(Boc) (Lys=K = AA 25 людського ADM) 29. Gln(Trt) (Gln=Q = AA 24 людського ADM) 30. Val (Val=V = AA 23 людського ADM) 31. Thr(tBu) (Thr=T = AA 22 людського ADM) 32. Cys(Trt) (Cys=C = AA 21 людського ADM) 33. Thr(tBu) (Thr=T = AA 20 людського ADM) 34. Gly (Gly = г = AA 19 людського ADM) 35. Phe (Phe=F = AA 18 людського ADM) 36. Arg(pbf) (Arg=R = AA 17 людського ADM) 37. Cys(Acm) (Cys=C = AA 16 людського ADM) 38. Gly (Gly = г = AA 15 людського ADM) 39. Phe (Phe=F = AA 14 людського ADM) 40. Ser(tBu) (Ser=S = AA 13 людського ADM) 41. Arg(pbf) (Arg=R = AA 12 людського ADM) 42. Leu (Leu=L = AA 11 людського ADM) 43. Gly (Gly = г = AA 10 людського ADM) 44. Gln(Trt) (Gln=Q = AA 9 людського ADM) 45. Phe (Phe=F = AA 8 людського ADM) 46. Asn(Trt) (Asn=N = AA 7 людського ADM) 47. Asn(Trt) (Asn=N = AA 6 людського ADM) 48. Met (Met=M = AA 5 людського ADM) 49. Ser(tBu) (Ser=S = AA 4 людського ADM) 50. Gln(Trt) (Gln=Q = AA 3 людського ADM) 51. Arg(pbf) (Arg=R = AA 2 людського ADM) Окислювання на смолі було досягнуто за допомогою Cys(Trt) і Cys(Acm) захисту із супутнім розщепленням захисних груп і окислювання до дисульфідного зв'язку, використовуючи йод (8 23 UA 111098 C2 5 еквівалентів йоду плюс 8 еквівалентів DIEA, із часом реакції 30 хвилин). Окислювання було підтверджено зразком розщеплення й аналізом з використанням ВЕРХ і МАЛДІ-МС. 8 партій були об'єднані для подальшого використання. Приклад 15A O-{[(3S)-3-аміно-4-{[(2R)-1-аміно-1-oксo-3-сульфанілпропан-2-іл]аміно}-4-оксобутил]карбамоїл}-L-тирозіл-адреномедулін(2-52) NH2 O N H O O H N O SH NH2 O 1 2 Y NH2 10 15 20 25 N H 52 RQSMNNFQGLRSFGCRFGTCTVQKLAHQIYQFTDKDKDNVAPRSKISPQGY-NH2 До 0.075 ммоль сполуки приклада 14A 520 мг (0.6 ммоль, 8 екв.) сполуки приклада 4A додавали. Також 188 мг (0.59 ммоль, 7.8 екв.) TBTU і 0.21 мл (1.2 ммоль, 16 екв.) DIEA додавали. Реакцію здійснювали за допомогою ДМФА як розчинник, причому ДМФА використали в кількості достатній для набрякання смоли і її вільного збовтування. Час реакції являло собою, приблизно, 1 годину при кімнатній температурі. Пептид відщеплювали від смоли із супутнім глобальним зняттям захисту з використанням концентрованого ТФО в кількості достатній для набрякання смоли і її вільного збовтування, причому ТФО містить акцептори (1-5 % кожного з води, фенолу, тіоанізолу й 1,2-етандіолу), із часом реакції, що становить 2 ½ години. Твердий продукт ліофілізували й очищали за допомогою ОФ-хроматографії, використовуючи 0.1 % ТФО у воді й 0.1 % ТФО в ацетонітрилі як мобільні фази для того, щоб забезпечити, щоб значення pН залишалося нижче 4 кожний раз під час процесу очищення або ліофілізації. Всі фракції, що містять потрібний іон по аналізу МАЛДІ-МС поєднували. Вихід склав 44.0 мг частково очищеного пептиду (приблизно 0.0035 ммоль, приблизно 4.7 % від теорії; оцінена чистота: приблизно 50 %, основна домішка: ADM (2-52)). +і + МАЛДІ МС (спосіб 6): m/z=6275(M+H) 5866 (домішка: (ADM(2-52)+H) ) Приклад 16A O-{[4-{[(2R)-1-аміно-1-oксo-3-сульфанілпропан-2-іл]аміно}-3-(метиламіно)-4-оксобутил]карбамоїл}-L-тирозіл-адреномедулін(2-52) HN O O N H CH3 H N O O SH NH2 O 2 1 Y NH2 N H 52 RQSMNNFQGLRSFGCRFGTCTVQKLAHQIYQFTDKDKDNVAPRSKISPQGY-NH2 30 35 40 До 0.075 ммоль сполуки приклада 14A 530 мг (0.6 ммоль, 8 екв.) сполуки приклада 10A додавали. Також 188 мг (0.59 ммоль, 7.8 екв.) TBTU і 0.21 мл (1.2 ммоль, 16 екв.) DIEA додавали. Реакцію здійснювали за допомогою ДМФА як розчинник, причому ДМФА використали в кількості достатній для набрякання смоли і її вільного збовтування. Час реакції являло собою приблизно 1 годину при кімнатній температурі. Пептид відщеплювали від смоли із супутнім глобальним зняттям захисту з використанням концентрованого ТФО в кількості достатній для набрякання смоли і її вільного збовтування, причому ТФО містить акцептори (1-5 % кожного з води, фенолу, тіоанізолу й 1,2-етандіолу), згодом реакції, що становить 2 ½ години. Твердий продукт ліофілізували й очищали за допомогою ОФ-хроматографії використовуючи 0.1 % ТФО у воді й 0.1 % ТФО в ацетонітрилі як мобільні фази для того, щоб забезпечити, щоб значення pН 24 UA 111098 C2 5 залишалося нижче 4 кожний раз під час процесу очищення або ліофілізації. Всі фракції, що містять потрібний іон по аналізу МАЛДІ-МС поєднували. Вихід склав 34.0 мг частково очищеного пептиду (приблизно 0.0026 ммоль, приблизно 3.5 % від теорії; оцінена чистота: приблизно 50 %, основна домішка: ADM (2-52)). + + МАЛДІ МС (спосіб 6): m/z=6289(M+H) і 5866 (домішка: (ADM(2-52)+H) ) Приклад 17A O-{[(4R)-4-аміно-5-{[(2R)-1-аміно-1-oксo-3-сульфанілпропан-2-іл]аміно}-5-оксопентил]карбамоїл}-L-тирозіл-адреномедулін(2-52) O O O N H NH2 O NH2 N H SH O 1 2 Y 10 15 20 25 30 35 NH2 N H 52 RQSMNNFQGLRSFGCRFGTCTVQKLAHQIYQFTDKDKDNVAPRSKISPQGY-NH2 До 0.075 ммоль сполуки приклада 14A 530 мг (0.6 ммоль, 8 екв.) сполуки приклада 13A додавали. Також 188 мг (0.59 ммоль, 7.8 екв.) TBTU і 0.21 мл (1.2 ммоль, 16 екв.) DIEA додавали. Реакцію здійснювали за допомогою ДМФА як розчинник, причому ДМФА використали в кількості достатній для набрякання смоли і її вільного збовтування. Час реакції являло собою приблизно 1 годину при кімнатній температурі. Пептид відщеплювали від смоли із супутнім глобальним зняттям захисту з використанням концентрованого ТФУ в кількості достатнім для набрякання смоли і її вільного збовтування, причому ТФУ містить акцептори (1-5 % кожного з води, фенолу, тіоанізолу й 1,2-етандіолу), згодом реакції, що становить 2 ½ години. Твердий продукт ліофілізували й очищали за допомогою ОФ-хроматографії використовуючи 0.1 % ТФО у воді й 0.1 % ТФО в ацетонітрилі як мобільні фази для того, щоб забезпечити, щоб значення pН залишалося нижче 4 кожного разу під час процесу очищення або ліофілізації. Всі фракції, що містять потрібний іон по аналізу МАЛДІ-МС поєднували. Вихід склав 47 мг частково очищеного пептиду (приблизно 0.0037 ммоль, приблизно 5.0 % від теорії; оцінена чистота: приблизно 50 %, основна домішка: ADM (2-52)). + + МАЛДІ МС (спосіб 6): m/z=6289(M+H) і 5866 (домішка: (ADM(2-52)+H) ) Робочі приклади Приклад 1 O-{[(3S)-3-аміно-4-({(2R)-1-аміно-3-[(2,5-діоксо-1-{3-oксo-3-[(2-{ω-метокси-поліоксіетилeн[40кДа]}етил)аміно]пропіл}піролідин-3-іл)сульфаніл]-1-oксoпропан-2-іл}аміно)-4оксобутил]карбамоїл}-L-тирозил-адреномедулін(2-52) 44 мг неочищеного пептиду приклада 15А перемішували з 426 мг (10.5 мкмоль, 1.5 екв, одержаними від Dr. Reddys) 40 кДа метокси полі(етилен гліколь) малеімідо пропіонаміду в 9 мл 25 UA 111098 C2 5 10 15 цитратного буфера рН 4 протягом ночі при кімнатній температурі. Неочищену реакційну суміш вводили у дві порції на препаративну ВЕРХ систему з Phenomenex Luna 10 мк 100A Proteo C5 AXIA 250 мм 21.2 мм колонка і хроматографували за допомогою градієнта вода/ацетонітрил (обидва з 0.1 % ТФО). Фракції збирали в пробірки по 20 мл на автоматизованому колекторі фракцій. Для забезпечення достатньої кислотності кожний флакон був заповнений 0.5 мл оцтової кислоти до збору. ADM (2-52), що є побічним продуктом приклада 15A і який не піддавали ПЕГілуванню в цій реакції, а також непрореагований ПЕГ були вилучені повністю. Всі фракції, що містять приклад 1, поєднували. Ацетонітрил частково видаляли на роторному випарнику при температурі води у ванні 30 °C і, приблизно, 50 мбар протягом, приблизно, 30 хв. Після додавання 0.5 мл оцтової кислоти, одержаний розчин ліофілізували. Загальний вихід приклада 1 склав 109 мг (2.35 мкмоль, 33 % від теорії). ВЕРХ (спосіб 3): Rt=4.23-4.30 хв. Приклад 2 O-{[(3-N-метил-аміно-4-({(2R)-1-аміно-3-[(2,5-діоксо-1-{3-oксo-3-[(2-{ω-метокси-поліоксіетилeн[40кДа]}етил)аміно]пропіл}піролідин-3-іл)сульфаніл]-1-oксoпропан-2-іл}аміно)-4оксобутил]карбамоїл}-L-тирозил-адреномедулін(2-52) 20 25 30 35 15 мг неочищеного пептиду приклада 16А перемішували з 145 мг (3.58 мкмоль, 1.5 екв, одержані від Dr. Reddys) 40 кДа метокси полі(етилен гліколь) малеімідо пропіонаміду в 5 мл цитратного буфера рН 4 протягом ночі при кімнатній температурі. Неочищену реакційну суміш вводили на препаративну ВЕРХ систему з Phenomenex Luna 10 мк C18 300A 250 мм 21.2 мм колонка і хроматографували за допомогою градієнта вода/ацетонітрил (обидва з 0.1 % ТФО). Фракції збирали в пробірки по 20 мл на автоматизованому колекторі фракцій. Для забезпечення достатньої кислотності кожний флакон був заповнений 0.5 мл оцтової кислоти до збору. ADM (2-52), що є побічним продуктом приклада 16A і який не піддавали ПЕГілуванню в цій реакції, а також непрореагований ПЕГ були вилучені повністю. Всі фракції, що містять приклад 2 поєднували. Ацетонітрил частково видаляли на роторному випарнику при температурі води у ванні 30 °C і приблизно 50 мбар протягом приблизно 30 хв. Після додавання 0.5 мл оцтової кислоти, одержаний розчин ліофілізували. Загальний вихід приклада 2 склав 50 мг (1.08 мкмоль, 43 % від теорії). ВЕРХ (спосіб 3): Rt=2.02-2.08 хв. Приклад 3 O-{[(4S)-4-аміно-5-({(2R)-1-аміно-3-[(2,5-діоксо-1-{3-oксo-3-[(2-ω-метокси-поліоксіетилeн[40кДа]}етил)аміно]пропіл}піролідин-3-іл)сульфаніл]-1-oксoпропан-2-іл}аміно)-5оксопентил]карбамоїл}-L-тирозил-адреномедулін(2-52) 40 26 UA 111098 C2 5 10 15 20 25 30 35 40 45 15 мг неочищеного пептиду приклада 17А перемішували з 145 мг (3.58 мкмоль, 1.5 екв, отримані від Dr. Reddys) 40 кДа метокси полі(етилен гліколь) малеімідо пропіонаміду в 5 мл цитратного буфера рН 4 протягом ночі при кімнатній температурі. Неочищену реакційну суміш вводили на препаративну ВЕРХ систему з Phenomenex Luna 10 мк Proteo 90A AXIA 250 мм 21.2 мм колонка і хроматографували за допомогою градієнта вода/ацетонітрил (обоє з 0.1 % ТФО). Фракції збирали в пробірки по 20 мл на автоматизованому колекторі фракцій. Для забезпечення достатньої кислотності кожний флакон був заповнений 0.5 мл оцтової кислоти до збору. ADM (2-52), що є побічним продуктом приклада 17A і який не піддавали ПЕГілуванню в цій реакції, а також непрореагований ПЕГ були вилучені повністю. Всі фракції, що містять приклад 3 поєднували. Ацетонітрил частково видаляли на роторному випарнику при температурі води у ванні 30 °C і приблизно 50 мбар протягом приблизно 30 хв. Після додавання 0.5 мл оцтової кислоти, одержаний розчин ліофілізували. Загальний вихід приклада 3 склав 19.5 мг (0.42 мкмоль, 17 % від теорії). ВЕРХ (спосіб 3): Rt=2.02-2.08 хв. Б. Оцінка фармакологічної активності Придатність сполук відповідно до даного винаходу для лікування захворювань може бути продемонстрована з використанням наступних систем аналізу: 1) Опис випробувань (in vitro) 1a) Випробування на рекомбінантній клітині репортера рецептора адреномедуліну Активність сполук відповідно до даного винаходу кількісно оцінювали за допомогою рекомбінантної клітинної лінії яєчника китайського хом'ячка (СНО), що несе адреномедулін рецептор людини. Активація рецептора лігандами може бути вимірювана екворін люмінесценцією. Конструкція клітинної лінії й процедура вимірювання були описані в деталях [Wunder F., Rebmann A., Geerts A, and Kalthof B., Mol Pharmacol, 73, 1235-1243 (2008)]. Коротко: клітини висівали на непрозорі 384-лункові планшети для мікротитрування при щільності 4000 клітин/лунка й вирощували протягом 24 годин. Після видалення культурального середовища, 2+ клітини завантажували протягом 3 годин з 0.6 мкг/мл коелентеразину в розчин Тіроде без Ca (130 мМ хлориду натрію, 5 мМ хлориду калію, 20 мМ HEPES (4-(2-гідроксіетил)-1піперазінетансульфонова кислота), 1 мМ хлориду магнію, і 4.8 мМ гідрокарбонату натрію, рН 7.4) з додаванням 0.2 мМ 3-ізобутил-1-метилксантину (IBMX) в інкубаторі для клітинних культур. 2+ Сполуки додавали протягом до 6 хв. у розчин Тіроде без Ca , що містить 0.1 % бичачого 2+ сироваткового альбуміну. Безпосередньо перед додаванням Ca у кінцевій концентрації 3 мМ вимірювання екворін люмінесценцією запускали з використанням придатного люмінометра. Світіння вимірювали протягом 60 секунд. У типовому експерименті сполуки тестували у -13 -6 концентрації в діапазоні від 1 10 дo 3 10 M. Для того, щоб визначити вивільнення активного адреномедуліну зі сполук відповідно до даного винаходу, сполуки інкубували при різних концентраціях для різних проміжків часу до 24 годин у розчині Тіроде, доповненим фетальною телячою сироваткою, клітинним культуральним 2+ середовищем або плазмою з різних видів при рН 7.4. Вміст Ca у відповідному інкубаційному середовищі буферизували додаванням 4 мМ ЕДТА (етилендіамін тетраоцтова кислота) перед додаванням зразків до клітин репортера рецептора адреномедуліну. Після відповідної попередньої інкубації, приклади здійснення активують клітка-репортер рецептора адреномедуліну більш сильно, ніж перед попередньою інкубацією. На це вказує той факт, що значення EC50 визначаються з коефіцієнтом до 10 менше після попередньої інкубації, чим раніше й пояснюється вивільненням активного адреномедуліну зі сполук. 27 UA 111098 C2 Типові значення EC50 для прикладів здійснення перед і після інкубації протягом 24 годин у буфері з додаванням 2.5 % фетальної телячої сироватки наведені в наступній Таблиці 1: Tаблиця 1 Приклад № ADM 1 2 3 5 10 15 20 25 30 35 40 45 50 EC50 T=0 год. [нМ] 0.5 110 > 1000 124 EC50 T=24 год. [нМ] 2.5 8.4 161 12.3 1б) Аналізи трансцелюлярного електричного опору в ендотеліальних клітинах Активність сполук відповідно до даного винаходу характеризується в in vitro тестах на проникність у клітинах пуповинної вени людини (HUVEC, Lonza). За рахунок використання апарата ECIS (ECIS: Electric Cell-substrate Impedance Sensing; Applied Biophysics Inc; Troy, NY) зміни трансендотеліального електричного опору (TEER) над ендотеліальним моношаром, постійно вимірюється з використанням невеликого золотого електрода, на який клітини були висіяні. HUVEC вирощували на 96-лункових сенсорних електродних планшетах (96W1E, Ibidi Gmb, Martinsried) для зливання моношарів і проникність може бути викликана запальними стимулами, такими як тромбін, TNF-α, IL-1β, VEGF, гістамін і водень пероксид, які були продемонстровані, як ті, що викликають розрив контактів ендотеліальних клітин і скорочення TEER. Тромбін використали в кінцевій концентрації 0.5 од/мл. Випробувані сполуки додавали до або після додавання тромбіну. У типовому експерименті сполуки тестували у концентрації в -10 -6 діапазоні від 1 10 дo 1 10 M. Приклади здійснення інгібують тромбін індуковану проникність у цьому випробуванні при -6 концентраціях ≤ 10 M. 1в) аналіз проникності in vitro в ендотеліальних клітинах В іншій моделі in vitro ендотеліальної проникності активність сполук відповідно до даного винаходу розглядається у відношенні до модуляції макромолекулярної проникності. Ендотеліальні клітини пуповинної вени людини (HUVECS) вирощують до зливання на покритих фібронектином фільтр мембранах Transwell® (24-лункові планшети, 6.5 мм - вставки з 0.4 мкМ полікарбонатної мембрани; Costar #3413), які відокремлюють верхній з нижньої камери культури тканини з ендотеліальними клітинами, що ростуть на нижній частині верхньої камери. Середовище верхньої камери доповнюється 250 мкг/мл 40 кДа FITC-декстрану (інвітроген, D1844). Підвищену проникність моношару індукували з додаванням тромбіну до кінцевої концентрації 0.5 од/мл. Зразки середовища збирали з нижньої камери кожні 30 хв. і відносну флуоресцентність як параметр для зміни макромолекулярної проникності із часом вимірюють у підходящому флуориметрі. Стимулювання тромбіном викликає майже подвоєння переходу FITC-декстрану через ендотеліальні моношари. У типовому експерименті сполуки тестували у -10 -6 концентрації в діапазоні від 1 10 до 1 10 M. Приклади здійснення інгібують тромбін індуковану проникність у цьому випробуванні при -6 концентраціях ≤ 10 M. 2) Опис випробувань (in vivo) 2a) Вимірювання кров'яного тиску й серцевого ритму в телеметричних пацюків Вістар з нормальним артеріальним тиском Серцево-судинні ефекти, викликані сполуками відповідно до даного винаходу досліджуються у самок пацюків Вістар, що вільно рухаються, у свідомості (маса тіла > 200 г) шляхом радіотелеметричних вимірювань кров'яного тиску й частоти серцевих скорочень. Коротенько, телеметрична система (DSI Data Science International, MN, USA) складається з 3 основних елементів: імплантовані передавачі (TA11PA-C40), приймачі (RA1010) і програмне забезпечення на основі комп'ютера для збору даних (Dataquest™ A.R.T. 4.1 для Windows). Пацюків оснащували імплантатами тиску для постійного використання, принаймні за 14 днів до експериментів. Сенсорний катетер пов'язаний з 4-0 швом кілька разів, щоб одержати пробку 0.5 см від кінчика катетера. Під час імплантації катетера пацюків анестезували за допомогою пентобабіталу (нембутал, санофі: 50 мг/кг внутрішньочеревинно). Після гоління шкіри із черевця, по середній лінії живота робили розріз, і заповнений рідиною сенсорний катетер вставляли нагору по потоку у відкриту спадну аорту між поздовжньою біфуркацією й нирковими артеріями. Катетер зв'язували кілька разів біля пробки. Кінчик телеметричного катетера знаходиться саме каудально відносно ниркових артерій і закріплений за допомогою тканинного клею. Корпус передавача прикріплений до внутрішньої стінки черевини перед закриттям 28
ДивитисяДодаткова інформація
Назва патенту англійськоюNovel polyethylene glycol based prodrug of adrenomedullin
Автори англійськоюFlamme, Ingo, Kobberling, Johannes, Lerchen, Hans-Georg, Griebenow, Nils, Schohe-Loop, Rudolf, Wittrock, Sven, Koellnberger, Maria, Wunder, Frank, Redlich, Gorden, Knorr, Andreas, Marley, July, Pritchard, Iain
Назва патенту російськоюНовые пролекарства адреномедуллина на основе полиэтиленгликоля и их применение
Автори російськоюФламме Инго, Кьобберлинг Йоганнес, Лэрхен Ханс-Георг, Грибенов Нильс, Шоэ-Лоп Рудольф, Витрок Свэн, Кёльнбергер Мариа, Вундер Франк, Редлих Горден, Кнорр Андрэас, Марли Джули, Притчард Айан
МПК / Мітки
МПК: A61P 29/00, A61K 38/23, A61P 11/00, A61K 47/48, A61P 9/00
Мітки: поліетиленгліколю, основі, застосування, адреномедуліну, проліки
Код посилання
<a href="https://ua.patents.su/35-111098-proliki-adrenomedulinu-na-osnovi-polietilenglikolyu-i-kh-zastosuvannya.html" target="_blank" rel="follow" title="База патентів України">Проліки адреномедуліну на основі поліетиленгліколю і їх застосування</a>
Попередній патент: Система для маркування нелюдського біологічного об’єкта і відбору зразка біологічного об’єкта
Наступний патент: Багатокристальний світлодіодний модуль
Випадковий патент: Спосіб профілактики гнійно-септичних ускладнень гострого панкреатиту












