Фармацевтична таблеткова композиція негайного вивільнення
Номер патенту: 82191
Опубліковано: 25.03.2008
Автори: Туне Мікаель, Маґнуссон Андерс, Інґгардт Торд, Абрамсен Аламі Сусанна, Сіґфрідссон Карл-Ґустаф
Формула / Реферат
1. Фармацевтична таблеткова композиція негайного вивільнення для орального введення, яка містить як активний інгредієнт сполуку формули (І):
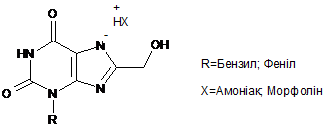 (І),
(І),
де
R1 представляє -CHF2 aбo CH2CH2F;
R2 представляє гідроген, гідроксил, метоксил або етоксил; а
n дорівнює 0, 1 або 2;
або її фармацевтичнo прийнятну сіль; та
щонайменше один фармацевтично прийнятний розріджувач або носій в кількості до 40 % (ваг/ваг.) від ваги кінцевої композиції, вибраний з моноосновного фосфату кальцію, двоосновного фосфату кальцію (включаючи дигідрат двоосновного фосфату кальцію та ангідрат двоосновного фосфату кальцію), триосновного фосфату кальцію, лактози, мікрокристалічної целюлози, кварцованої мікрокристалічної целюлози, маніту, сорбіту, крохмалю (такого як кукурудзяний, картопляний або рисовий), глюкози, лактату кальцію та карбонату кальцію;
де активний інгредієнт та інші необов'язкові розріджувачі або ексципієнти складають в композиції 100 % ваг./ваг.
2. Фармацевтична композиція для негайного вивільнення за п. 1, в якій фармацевтично прийнятною сіллю сполуки формули (І) є кислотно-адитивна сіль.
3. Фармацевтична композиція для негайного вивільнення за п. 1 або 2, де активний інгредієнт вибраний з наступних сполук:
Ph(3-Cl)(5-OCHF2)-(R)CH(OH)C(O)-(S)Aze-Pab(OMe);
Ph(3-Cl)(5-OCHF2)-(R)CH(OH)C(O)-(S)Aze-Pab(2,6-диF)(OMe);
Ph(3-Cl)(5-OCH2CH2F)-(R)CH(OH)C(O)-(S)Aze-Pab(OMe);
Ph(3-Cl)(5-OCHF2)-(R)CH(OH)C(O)-(S)Aze-Pab;
Ph(3-Cl)(5-OCHF2)-(R)CH(OH)C(O)-(S)Aze-Pab(OH);
Ph(3-Cl)(5-OCHF2)-(R)CH(OH)C(O)-(S)Aze-Pab(2,6-диF);
Ph(3-Cl)(5-OCHF2)-(R)CH(OH)C(O)-(S)Aze-Pab(2,6-диF)(OH);
Ph(3-Cl)(5-OCH2CH2F)-(R)CH(OH)C(O)-(S)Aze-Pab aбo
Ph(3-Cl)(5-OCH2CH2F)-(R)CH(OH)C(O)-(S)Aze-Pab(OH),
або фармацевтично прийнятних солей будь-якої з них.
4. Композиція за п. 1, 2 або 3, де активним інгредієнтом є кристалічна сіль сполуки:
Ph(3-Cl)(5-OCHF2)-(R)CH(OH)C(O)-(S)Aze-Pab(OMe);
Ph(3-Cl)(5-OCHF2)-(R)CH(OH)C(O)-(S)Aze-Pab(2,6-диF)(OMe) aбo
Ph(3-Cl)(5-OCH2CH2F)-(R)CH(OH)C(O)-(S)Aze-Pab(OMe).
5. Композиція за будь-яким одним з пп. 1-4, де активним інгредієнтом є кислотно-адитивна сіль етансульфонової кислоти, н-пропансульфонової кислоти, бензолсульфонової кислоти, 1,5-нафталіндисульфонової кислоти або н-бутансульфонової кислоти сполук Рh(3-Cl)(5-OCHF2)-(R)CH(OH)C(O)-(S)Aze-Pab(OMe) або Ph(3-Cl)(5-OCHF2)-(R)CH(OH)C(O)-(S)Aze-Раb(2,6-диF)(ОМе).
6. Композиція за будь-яким одним з пп. 1-5, де активним інгредієнтом є бензолсульфонатна сіль Ph(3-Cl)(5-OCHF2)-(R)CH(OH)C(O)-(S)Aze-Pab(OMe).
7. Композиція за будь-яким одним з пп. 1-5, де активним інгредієнтом є бензолсульфонат Ph(3-Cl)(5-OCHF2)-(R)CH(OH)C(O)-(S)Aze-Pab(OMe), який характеризується рентгенодифрактограмою порошку, що характеризується піками з d-параметрами при 5,9, 4,73, 4,09 та 4,08![]() .
.
8. Композиція за будь-яким одним з пп. 1-5, де активним інгредієнтом є гемі-1,5-нафталіндисульфонат Рh(3-Сl)(5-ОСНF2)-(R)СН(ОН)С(O)-(S)Aze-Pab(2,6-диF)(ОМе).
9. Композиція за будь-яким одним з пп. 1-5, де активним інгредієнтом є гемі-1,5-нафталіндисульфонат Рh(3-Сl)(5-ОСНF2)-(R)СН(ОН)С(O)-(S)Aze-Pab(2,6-диF)(ОМе), який характеризується рентгенодифрактограмою порошку, що характеризується піками з d-параметрами при 18,3, 9,1, 5,6, 5,5, 4,13, 4,02, 3,86, 3,69 та 3,63![]() .
.
Текст
1. Фармацевтична таблеткова композиція негайного вивільнення для орального введення, яка містить як активний інгредієнт сполуку формули (І): C2 2 (19) 1 3 5. Композиція за будь-яким одним з пп. 1-4, де активним інгредієнтом є кислотно-адитивна сіль етансульфонової кислоти, н-пропансульфонової кислоти, бензолсульфонової кислоти, 1,5нафталіндисульфонової кислоти або нбутансульфонової кислоти сполук Рh(3-Cl)(5OCHF2)-(R)CH(OH)C(O)-(S)Aze-Pab(OMe) або Ph(3-Cl)(5-OCHF2)-(R)CH(OH)C(O)-(S)Aze-Раb(2,6диF)(ОМе). 6. Композиція за будь-яким одним з пп. 1-5, де активним інгредієнтом є бензолсульфонатна сіль Ph(3-Cl)(5-OCHF2)-(R)CH(OH)C(O)-(S)AzePab(OMe). 7. Композиція за будь-яким одним з пп. 1-5, де активним інгредієнтом є бензолсульфонат Ph(3Cl)(5-OCHF2)-(R)CH(OH)C(O)-(S)Aze-Pab(OMe), який характеризується рентгенодифрактограмою Цей винахід стосується нових фармацевтичних композицій для негайного вивільнення, що забезпечують доставку певних фармацевтичних засобів, виробництва такої композиції та застосування такої композиції у лікуванні або попередженні тромбозу. Часто бажано формувати фармацевтично активні сполуки для негайного вивільнення після перорального та/або парентерального застосування з огляду на забезпечення достатньої концентрації ліків у плазмі в межах часу, потрібного для досягнення потрібної терапевтичної реакції. Негайне вивільнення може бути особливо бажаним у випадках, наприклад, коли потрібна швидка терапевтична реакція (наприклад у лікуванні гострих випадків), або, у випадку парентерального застосування, коли пероральна доставка до шлунково-кишкового тракту є нездатною до забезпечення достатнього системного поглинання в потрібних межах часу. У випадку лікування чи профілактики тромбозу, композиції для негайного вивільнення можуть бути необхідними для гарантування забезпечення достатньої кількості ліків у плазмі протягом короткого періоду часу для можливості швидкого початку дії. Композиції для негайного вивільнення є також звичайно простішими для розробки, ніж композиції для модифікованого вивільнення, та можуть також забезпечувати більшу гнучкість стосовно варіації доз, що слід застосовувати до пацієнтів. Композиції для негайного вивільнення є кращими, коли не є потрібними багатократні дози та коли нема необхідності підтримувати концентрацію у плазмі при постійному рівні тривалий час. [Міжнародна Патентна заявка №PCT/SE01/02657 (WO 02/44145, з датою пріоритету 01 грудня 2000, зареєстрована 30 листопада 2001, опублікована 06 червня 2002)] розкриває ряд сполук, що є сполуками, абр метаболізують до сполук, які є конкурентними інгібіторами трипсино-подібних протеаз, як-то 82191 4 порошку, що характеризується піками з d o параметрами при 5,9, 4,73, 4,09 та 4,08 A . 8. Композиція за будь-яким одним з пп. 1-5, де активним інгредієнтом є гемі-1,5нафталіндисульфонат Рh(3-Сl)(5-ОСНF2)(R)СН(ОН)С(O)-(S)Aze-Pab(2,6-диF)(ОМе). 9. Композиція за будь-яким одним з пп. 1-5, де активним інгредієнтом є гемі-1,5нафталіндисульфонат Рh(3-Сl)(5-ОСНF2)(R)СН(ОН)С(O)-(S)Aze-Pab(2,6-диF)(ОМе), який характеризується рентгенодифрактограмою порошку, що характеризується піками з dпараметрами при 18,3, 9,1, 5,6, 5,5, 4,13, 4,02, 3,86, 3,69 та o 3,63 A . тромбін. Наступні три сполуки є серед тих, що розкрито конкретно: (a) Ph(3-CI)(5-OCHF2)-(R)CH(OH)C(O)-(S)-AzePab(OMe): цю сполуку позначено тут далі як Сполука А; (b) Ph(3-CI)(5-OCHF2)-(R)CH(OH)C(O)-(S)-AzePab(2,6-диF)(OMe): та цю сполуку позначено тут далі як Сполука В; (c) Ph(3-CI)(5-OCH2CH2F)-(R)CH(OH)C(O)-(S)Aze-Pab(OMe): цю сполуку позначено тут далі як Сполука С Метоксіамідинові Сполуки А, В та С метаболізують після перорального та/або парентерального застосування до ссавця та утворюють вільні амідинові сполуки, які мають 5 виявлені як потужні інгібітори тромбіну. Таким чином: Сполука А метаболізується до Ph(3-CI)(5OCHF2)-(R)CH(OH)C(O)-(S)-Aze-Pab (цю сполуку позначено тут далі як Сполука D) через проміжні проліки Ph(3-CI)(5-OCHF2)-(R)CH(OH)C(O)-(S)-AzePab(OH) (цю сполуку позначено тут далі як Сполука G); Сполука В метаболізується до Ph(3-CI)(5OCHF2)-(R)CH(OH)C(O)-(S)-Aze-Pab(2,6-диF) (цю сполуку позначено тут далі як Сполука Е) через проміжні проліки Рh(3-СІ)(5-OCHF2)(R)CH(OH)C(O)-(S)-Aze-Pab(2,6-диF)(OH) (цю сполуку позначено тут далі як Сполука Н); а Сполука С метаболізується до Ph(3-CI)(5OCH2CH2F)-(R)CH(OH)C(O)-(S)-Aze-Pab (цю сполуку позначено тут далі як Сполука F) через проміжні проліки Ph(3-CI)(5-OCH2CH2F)(R)CH(OH)C(O)-(S)-Aze-Pab(OH) (цю сполуку позначено тут далі як Сполука J). Способи синтезу сполук А, В, С, D, Е, F, G та J описано у прикладах 12, 40, 22, 3, 39, 21, 2 та 31 (відповідно) міжнародної патентної заявки № PCT/SE01 /02657. Композиція для негайного вивільнення цих сполук, або їх метаболітів описана у літературі. Ми виявили, що сполуки формули (І) та їх солі можна формувати як фармацевтичні композиції для негайного вивільнення, які є готовими для застосування, наприклад перорального або парентерального застосування.) Згідно з першим аспектом винаходу, запропоновано фармацевтичну композицію для негайного вивільнення, що містить, як активний інгредієнт сполуку формули (І): де R1 представляє С1-2алкіл, заміщений одним чи більше флуор-замісниками; R2 представляє гідроген, гідроксил, метоксил або етоксил; а n дорівнює 0, 1 або 2; або її фармацевтично прийнятну сіль; та фармацевтично прийнятний розріджувач або носій; за умови, що композиція не містить тільки: розчин одного активного інгредієнту та води; розчин одного активного інгредієнту та диметилсульфоксиду; або, розчин одного активного інгредієнту у суміші етанол:ПЕГ 660 12-гідроксистеарат: вода 5:5:90; ці композиції позначено тут далі як "композиції винаходу". ПЕГ 660 12-гідроксистеарат є неіоногенним ПАР та є відомим як Solutol К™. Згідно з другим аспектом представленого винаходу запропоновано сполуку Н, Ph(3-CI)(5OCHF2)-(R)CH(OH)C(O)-(S)Aze-Pab(2,6-диF)(OH), 82191 6 яку можна отримати способами, подібними описаним нижче для отримання сполук G та J. Сполука формули (І) її або фармацевтично прийнятна сіль може бути у формі сольвату, гідрату, змішаного сольвату/гідрату або, переважно, ансольвату, як-то ангідрат. Coльвати можуть бути від одного чи більше органічних розчинників, як-то нижчі (наприклад С1-4) алкілспирти (наприклад метанол, етанол або ізопропанол), кетони (як-то ацетон), естери (як-то етилацетат) або їх суміші. Згідно з одним особливим аспектом винаходу R1 представляє CHF2 або CH2CH2F. Змінна n дорівнює переважно 0 або 2. Більш кращі сполуки формули (І) залучають сполуки, в яких n дорівнює 0, або сполуки, в яких n дорівнює 2, забезпечуючи тим два атоми флуору, розташовані у 2- та 6-позиціях (тобто двох ортопозиціях, стосовно точки приєднання бензольного кільця до групи -NH-CH2-). Сполукою формули (І) є особливо Сполука А, Сполука В або Сполука С. Кращими солями сполук формули (І) є кислотно-адитивні солі. Кислотно-адитивні солі залучають неорганічні кислотно-адитивні солі, якто солі сульфатної кислоти, нітратної кислоти, фосфатної кислоти та гідрогалогенідних кислот, як-то гідробромідної кислоти та гідрохлоридної кислоти. Більш кращі кислотно-адитивні солі залучають солі органічних кислот, як-то солі диметилфосфатної кислоти; сахаринової кислоти; циклогексилсульфамової кислоти; солі карбонової кислоти (як-то малеїнової кислоти, фумарової кислоти, аспарагінової кислоти, бурштинової кислоти, малонової кислоти, оцтової кислоти, бензойної кислоти, терефталевої кислоти, гіпурової кислоти, 1-гідрокси-2-нафтойної кислоти, 1,1'-метилен-біс-(2-гідрокси-3-нафтойної кислоти, гідроксибензойної кислоти та подібне); солі гідроксикислот (як-то саліцилової кислоти, винної кислоти, лимонної кислоти, яблучної кислоти (залучаючи L-(-)-яблучну кислоту та, D,L-яблучну кислоту), глюконової кислоти (залучаючи Dглюконову кислоту), гліколевої кислоти, аскорбінової кислоти, молочної кислоти та подібне); солі амінокислот (як-то глутамінової кислоти (залучаючи D-глутамінову, L-глутамінову, та D,L-глутамінову кислоти), аргінін (залучаючи Lаргінін), лізин (залучаючи L-лізин та L-лізин гідрохлорид), гліцин та подібне); та, особливо, солі сульфонових кислот, (як-то 1,2етандисульфонової кислоти, камфорсульфонової кислоти (залучаючи 1S-(+)-10-камфорсульфонову кислоту та (+/-)-камфорсульфонову кислоту), етансульфонової кислоти, пропансульфонової кислоти (залучаючи н-пропансульфонову кислоту), бутансульфо-нової кислоти, пентансульфонової кислоти, толуолсульфонової кислоти, метансульфоно-вої кислоти, п-ксилолсульфонової кислоти, 2-мезитиленсульфонової кислоти, нафталін-сульфонових кислот (залучаючи 1,5нафталінсульфонову кислоту та нафталінсульфонову кислоту), бензолсульфонової кислоти, гідроксибензолсульфонової кислоти, 2 7 гідроксіетансульфонової кислоти, 3гідроксіетансульфонової кислоти та подібне). Особливо кращі солі залучають солі C16(наприклад С1-4-алкансульфонових кислот, як-то етансульфонової кислоти (езилат) та пропансульфонової кислоти (наприклад нпропансульфонової кислоти), та як варіант, заміщених (наприклад одним чи більше C1арилсульфонових кислот, як-то 2алкілами), бензолсульфонової кислоти (безилат) та нафталіндисульфонової кислоти. Придатні стехіометричні співвідношення кислоти до вільної основи знаходяться у межах 0,25:1,5 - 3,0:1, як-то 0,45:1,25 - 1,25:1, залучаючи 0,50:1 - 1:1. Згідно з наступним аспектом винаходу запропоновано композицію, що містить сполуку формули (І) по суті у кристалічній формі. Хоча нами виявлено, що можливо отримувати сполуки винаходу у формі, якає більше, ніж на 80% кристалічною, "по суті кристалічною" ми вважаємо більше, ніж на 20%, переважно більше, ніж на 30%, та більш переважно більше, ніж на 40% (наприклад, більше, ніж на 50, 60, 70, 80 або 90%) кристалічною. Згідно з наступним аспектом винаходу також запропоновано сполуку винаходу у частково кристалічній формі. "Частково кристалічною" ми вважаємо 5% або між 5% та 20% кристалічності. Ступінь (%) кристалічності може визначати фахівець, застосовуючи рентгенодифра-кцію порошку (РДП). Інші способи, як-то ЯМР твердого стану, FT-IR, спектроскопія Рамана, диференційна сканувальна калориметрія (ДСК) та мікрокапориметрія, застосовувати можна також. Кращі сполуки формули (І), що можна отримувати у кристалічній формі, залучають солі С1-6-(наприклад С2-6, як-то C2-4) алкансульфонових кислот, як-то етансульфонової кислоти, пропансульфонової кислоти (наприклад нпропансульфонової кислоти) та як варіант, заміщених арилсульфонових кислот, як-то бензолсульфонової кислоти та нафталіндисульфонової кислоти. Термін "негайне вивільнення" стосовно фармацевтичної композиції залучає будь-яку композицію, в якій швидкість вивільнення ліків з композиції та/або поглинання ліків, не є суттєво чи навмисно уповільнено фармакологічними маніпуляціями. У представленому випадку, негайне вивільнення можна забезпечити підхожим фармацевтично прийнятним розріджувач або носієм, цей розріджувач або носії не подовжує, у прийнятних межах, швидкість вивільнення ліків та/або поглинання. Отже, термін виключає композиції, які пристосовано для забезпечення "модифікованого", "регульованого", "безперервного", "подовженого", "розтягнутого" або "затриманого" вивільнення ліків. У цьому контексті, термін "вивільнення" залучає забезпечення (або подачу) ліків з композиції до шлунково-кишкового тракту, тканин тіла та/або у системну циркуляцію. Для вивільнення у шлунково-кишковому тракті вивільнення відбувається при рН=1-3, особливо 82191 8 приблизно при рН=1. Згідно з одним аспектом винаходу композиція, яку описано тут, зі сполукою формули (І), або її кислотно-адитивною сіллю у кристалічній формі вивільняє ліки в межах рН. Згідно з другим винаходу композиція, яку описано тут, зі сполукою формули (І), або її кислотноадитивною сіллю, вивільняє ліки при рН=1-3, особливо приблизно при рН=1. Отже, композиції винаходу можуть вивільняти принаймні 70% (переважно 80%) активного інгредієнту в межах 4 годин, як-то в межах 3 годин, переважно 2 годин, більш переважно в межах 1,5 годин, та особливо в межах години (як-то в межах 30 хвилин), після застосування, перорального або парентерального. Композиції винаходу можна формувати різними відомими способами, наприклад як описано [Μ. Ε. AuKon у "Pharmaceutics: The Science of Dosage Form Design" (1988) (Churchill Livingstone)], розкриття цього документу уведено як посилання. Композиції винаходу можуть бути придатними для перорального застосування, або їх можна адаптувати для цього різними стандартними способами, наприклад у формі таблетки для негайного вивільнення, капсули для негайного вивільнення, або як рідка дозована форма, що містить активний інгредієнт. Ці типи композицій є добре відомі фахівцям та їх можна отримати різними відомими у рівні техніки способами. Придатні розріджувачі/носії (які можуть також бути названими "наповнювачами") для застосування у пероральних композиціях винаходу, наприклад у формі таблеток для негайного вивільнення, містять моноосновний кальцій фосфат, двоосновний кальцій фосфат (залучаючи двоосновний кальцій фосфат дигідрат та двоосновний кальцій фосфат безводний), триосновний кальцій фосфат, лактозу, мікрокристалічну целюлозу, силіцифіковану мікрокристалічну целюлозу, маніт, сорбіт, крохмаль (як-то кукурудзяний, картопляний або рисовий), глюкозу, кальцій лактат, кальцій карбонат тощо. Переважні розріджувачі/носії залучають двоосновний кальцій фосфат та мікрокристалічну целюлозу, які можна застосовувати поодинці або у комбінації з іншим розріджувачем/носієм, як-то маніт. Композиція винаходу у формі таблетки для негайного вивільнення можуть містити один або більше наповнювачів для поліпшення фізичних та/або хімічних властивостей кінцевої композиції для полегшення виробництва. Такі наповнювачі є звичайними у складі композиції для негайного вивільнення для пероральної доставки ліків, та містять одне або більше з наступного: одну або більше ковзних речовин (як-то магній стеарат, стеаринова кислота, кальцій стеарат, стеариловий спирт або, переважно, натрій стеарилфумарат); ковзний засіб (як-то тальк або колоїдний оксид силіцію); одне або більше зв'язуючих (як-то полівінілпіро-лідон, мікрокристалічна целюлоза, поліетиленгліколь (ПЕГ), поліетиленоксид, гідроксипропілметилцелюлоза (ГПМЦ) низької молекулярної маси, метилцелюлоза (МЦ) низької молекулярної маси, гідроксипропілцелюлоза (ГПЦ) 9 низької молекулярної маси, гідроксіетилцелюлоза (ГЕЦ) низької молекулярної маси, крохмаль (як-то кукурудзяний, картопляний або рисовий), або натрійкарбоксиметилцелюлоза низької молекулярної маси, (кращими зв'язуючими є полівінілпіролідон або ГПМЦ низької молекулярної маси), один або більше засобів регулювання рН (як-то органічні кислоти, наприклад, лимонна кислота), чи солі лужного чи лужноземельного металу (наприклад, натрію кальцію чи калію) сульфати, мета-бісульфати, пропіонати чи сорбати, один або більше дезинтеграторів (наприклад, натрій-гліколят крохмалю, перехресно зшитий полівінілпіролідон, перехресно зшита натрій-карбоксиметилцелюлоза, крохмаль (як-то кукурудзяний, картопляний або рисовий), або алгінат), барвники, ароматизатори, засоби тонічності, засоби покриття чи консерванти. Ясно, що деякі з вищезазначених наповнювачів у кінцевій пероральній композиції для негайного вивільнення (наприклад, таблетці) можуть мати більше одної з вищезазначених функцій. Згідно з наступним аспектом винаходу рідку композицію адаптовано до перорального застосування. Придатні рідкі композиції для перорального застосування залучають композиції, в яких сполука формули (І), особливо Сполука А, Сполука В або Сполука С, чи її фармацевтично прийнятна сіль представлена разом з водним носієм, як-то вода. Однак, слід зауважити, що деякі конкретні композиції не заявлені (дивись конкретні аспекти та формулу винаходу). Композиція винаходу, що містить водний носій, може крім того містити один або більше наповнювачів, як-то антимікробні консерванти, модифікатори тонічності, засоби регулювання рН, (тобто буфери, наприклад, винна кислота, оцтова кислота чи лимонна кислота), ПАВ (наприклад, натрій додецилсульфат (НДС) чи Solutol™); солюбілізатори, що допомагають солюбілізувати активний інгредієнт (наприклад етанол, поліетиленгліколь або гідроксипропіл-βциклодекстрин або полівінілхлорид (ПВП)); або антіоксидант. Рідкі композиції для перорального застосування можуть мати форму суспензій активного інгредієнту в асоціації* з водним розчинником чи, краще, водними розчинами (тобто розчинами активної сполуки з водою як розчинником). У цьому контексті, термін "водний розчин" залучає композиції, в яких принаймні 99% активного інгредієнту є у розчині при температурі вище 5°С та атмосферному тиску, а термін "суспензія" означає, що більше 1% активного інгредієнту не є у розчині в таких умовах. Типовими диспергаторами для суспензій є гідроксипропілметилцелюлоза, АОТ (діоктилсульфосукцинат), ПВП та НДС. Можуть бути можливими інші альтернативи. Згідно з другим представлений винахід стосується рідкої пероральної композиції, що містить сполуку формули (І), або її фармацевтично 82191 10 прийнятну сіль, воду та принаймні один додатковий засіб. Додаткові засоби залучають: і. поліетиленгліколь (ПЕГ) та, як варіант, також етанол та/або винну кислоту та/або лимонну кислоту та/або гідрохлоридну кислоту; або іі. натрій хлорид (який розчинено у композиції), та, як варіант, також етанол; або ііі. гідрохлоридну кислоту та/або натрій гідроксид для доведення рН до придатної величини (переважно у межах 3 - 8 для сполук формули (І), де R2 - метокси або етокси, як-то Сполука А, В або С); або iv. ДМА (диметилацетамід) та, як варіант, також тригліцерид з середніми ланцюгами (як-то мігліол); або ν. β-циклодекстрин (як-то гідроксипропіл-βциклодекстрин); vi. модифікатор тонічності як-то натрій хлорид та/або маніт. Згідно з наступним аспектом представлений винахід стосується перорального розчину, що містить сполуку формули (І), або її фармацевтично прийнятну сіль, (переважно Сполук А, В або С) вод та принаймні один додатковий засіб, який вищенаведено у (і) до (vi). Згідно з іншим аспектом винахід стосується водної композиції сполуки формули (І) (як-то сполуки А, В або С), що містить солюбілізатор, як-то поліетиленгліколь, βциклодекстрин (як-то гідроксипропіл-βциклодекстрин), сорбіт або етанол. Згідно з наступним аспектом представлений винахід стосується розчину пероральної композиції, що містить сполуку формули (І) та етанол. Ця композиція може крім того містити тригліцерид з середніми ланцюгами (як-то мігліол). Згідно з ще одним аспектом представлений винахід стосується розчину пероральної композиції, що містить сполуку формули (І) та ДМА. Ця композиція може крім того містити тригліцерид з середніми ланцюгами (як-то мігліол). Згідно з другим аспектом сполука формули (І) є кристалічною (особливо сіль сполуки А; переважно С1-6(наприклад С2-6, як-то С2кислоти, як-то 4)алкансульфонової етансульфонової кислоти, пропансульфонової кислоти (наприклад н-опансульфонової кислоти) або, як варіант, заміщеної арилсульфонової кислоти, як-то бензолсульфонової кислоти та нафта-ліндисульфонової кислоти). Запропоновано конкретні рідкі пероральні фармацевтичні композиції для негайного вивільнення за п. 1, де активним інгредієнтом є: Ph(3-CI)(5-OCHF2)-(R)CH(OH)C(O)-(S)AzePab(OMe), Ph(3-CI)(5-OCHF2)-(R)CH(OH)C(O)-(S)A2ePab(2,6-диF)(OMe), Ph(3-CI)(5-OCH2CH2F)-(R)СH(OH)C(О)-(S)AzePab(OMe), або їх фармацевтично прийнятна сіль. Запропоновано наступні конкретні рідкі пероральні фармацевтичні композиції для негайного вивільнення за п. 1, де активним інгредієнтом є: 11 Ph(3-CI)(5-OCHF2)(R)CH(OH)C(OH(S)AzePab(OMe) або її С1-6алкансульфонат або, як варіант, заміщений арилсульфонат. Запропоновано крім того конкретні рідкі пероральні фармацевтичні композиції за п.1, де активним інгредієнтом є: Ph(3-CI)(5-OCHF2)-(R)CH(OH)C(O)-(S)AzePab(2,6-диF)(OMe) або, як варіант, заміщений арилсульфонат її (як-то нафталін-1,5дисульфонат). Однак, слід зауважити, що деякі конкретні композиції не заявлено (дивись конкретні аспекти та формулу винаходу). Згідно з наступним аспектом винаходу композицію винаходу адаптовано для парентерального застосування. Термін "парентеральний" залучає будь-який режим застосування, що не залучає пероральне застосування до шлунково-кишкового тракту, а залучає підшкірне, внутрішньовенне, інтраартеріальне, крізьшкірне, інтраназальне, защічне, внутрішньошкірне, внутрішньом'язове, інтраліпоматозне, інтраперитональне, ректальне, сублінгвальне, місцеве застосування, застосування інгаляціями, або будь-яким іншим парентеральним шляхом. Придатні композиції винаходу, що слід застосовувати парентерально, залучають композиції, в яких сполуку формули (І) або її фармацевтично прийнятну сіль представлено разом з водним носієм, як-то вода. Композиція представленого винаходу, що містить водний носій, може крім того містити один або більше наповнювачів, як-то антимікробний консервант; модифікатор тонічності (наприклад натрій хлорид, маніт або глюкоза); засіб регулювання рН (наприклад звичайна неорганічна кислота або основа, залучаючи гідрохлоридну кислоту або натрій гідроксид); засоби регулювання рН (тобто буфер; наприклад винна кислота, оцтова кислота або лимонна кислота); ПАР (наприклад натрій додецилсульфат (НДС) або Solutol™); солюбілізатор, що допомагає солюбілізувати активний інгредієнт (наприклад етанол, поліетиленгліколь або гідроксипропіл-βциклодекстрин або полівінілхлорид (ПВП)); або антіоксидант. Парентеральні композиції можуть мати форму суспензій активного інгредієнту в асоціації з водним розчинником або, більш переважно, водними розчинами (тобто розчинами активної сполуки з водою як розчинником). У цьому контексті, термін "водний розчин" залучає композиції, в яких принаймні 99% активного інгредієнту є у розчині при температурі вище 5°С та атмосферному тиску, а термін "суспензія" означає, що більше 1% активного інгредієнту не є у розчині в таких умовах. Типовими диспергаторами для суспензій є гідроксипропілметилцелюлоза, АОТ, ПВП та НДС, але можливі інші альтернативи. Ряд наповнювачів, застосовуваних у пероральних та парентеральних композиціях винаходу залежить від багатьох факторів, як-то природа і кількість активного інгредієнту, та 82191 12 кількість розріджувачу/носія (водний розчинник або інакше), що залучено. Згідно з іншим аспектом представлений винахід стосується парентеральної композиції, що містить сполуку формули (І), або її фармацевтично прийнятну сіль, воду та принаймні один додатковий засіб. Додаткові засоби залучають: і. поліетиленгліколь (ПЕГ) та, як варіант, також етанол та/або винну кислоту та/або гідрохлоридну кислоту; або іі. натрій хлорид (який розчинено у композиції), та, як варіант, також етанол; або ііі. гідрохлоридну кислоту та/або натрій гідроксид для доведення рН до придатної величини (переважно у межах 3-8 для сполук формули (І) де R2 - гідроген, як-то сполука D, Ε або F; або переважно у межах 3,5-8 для сполук формули (І) де R2 - метокси або етокси, як-то . сполука А, В або С); або iv. ДМА (диметилацетамід) та, як варіант, також тригліцерид з середніми ланцюгами (як-то мігліол); або ν. β-циклодекстрин (як-то гідроксипропіл-βциклодекстрин); vi. модифікатор тонічності як-то натрій хлорид та/або маніт. Згідно з наступним аспектом представлений винахід стосується розчину для ін'єкцій, що містить сполуку формули (І), або її фармацевтично прийнятну сіль, (переважно сполуку D, Ε або F) воду та принаймні один додатковий засіб, який вищенаведено у (і) - (vi). Згідно з другим аспектом винахід стосується водної композиції сполуки формули (І) (як-то сполука D, Ε або F), що містить солюбілізатор як-то поліетиленгліколь, βциклодекстрин (як-то гідроксипропіл-βциклодекстрин), сорбіт або етанол. Згідно з наступним аспектом представлений винахід стосується парентеральної композиції, що містить сполуку формули (І) та етанол. Ця композиція може крім того містити тригліцерид з середніми ланцюгами (як-то мігліол). Згідно з ще одним аспектом представлений винахід стосується парентеральної композиції, що містить сполуку формули (І) та ДМА. Ця композиція може крім того містити тригліцерид з середніми ланцюгами (як-то мігліол). Згідно з другим аспектом сполука формули (І) є кристалічною (особливо сіль сполуки А; переважно С1-6(наприклад C2-6, як-то С2кислоти, як-то 4)алкансульфонової етансульфонової кислоти, пропансульфонової кислоти (наприклад н-опансульфонової кислоти) або, як варіант, заміщеної арилсульфонової кислоти, як-то бензолсульфонової кислоти та нафталіндисульфонової кислоти). Згідно з ще одним аспектом композиція представленого винаходу є у твердій дозованій формі де R2 - гідрокси, метокси або етокси (переважно метокси) (сполукою формули (І) є особливо сполука А, сполука В або сполука С). Згідно з ще одним аспектом представлений винахід стосується парентеральної композиції (особливо на основі води, розчину для ін'єкцій), що 13 містить сполуку формули (І) у формі вільної основи. Згідно з наступним аспектом представлений винахід стосується парентеральної композиції, що містить сполуку формули (І) у формі вільної основи де R2 - гідроген. Згідно з ще одним аспектом представлений винахід стосується твердої композиції, що містить мікрокристалічну целюлозу та полівінілпіролідон (ПВП); або містить мікрокристалічну целюлозу та натрій-гліколят крохмалю. Композиції винаходу, як-то парентеральні композиції, що містять солі, можна отримати додаванням розріджувачу/носія до підхожої попередньо отриманої солі. Композиції, що залучають активний інгредієнт можна також забезпечити у твердій формі, придатній для застосування при отриманні композиції винаходу (наприклад розчину, як-то водного розчину, наприклад для парентерального застосування). Такі композиції можуть бути у формі твердого продукту, що містить активний інгредієнт, як варіант, у присутності одного або більше інших наповнювачів, які тут вищезазначено та, як варіант, до 10мас.% розріджувачу та/або носія, які тут вищезазначено, ця композиція далі позначена як "тверда композиція винаходу". Тверді композиції винаходу можна отримувати видаленням розріджувачу/носія (наприклад розчиннику) з композиції винаходу, або концентрованої композиції винаходу, яка може, наприклад бути у формі розчину, як-то водний розчин. Згідно з другим аспектом представлений винахід стосується придатної для перорального застосування композиції для негайного вивільнення, що містить сполуку формули (І), або її сіль, носій (як-то мікрокристалічну целюлозу), дезинтегратор (як-то натрій-гліколят крохмалю), зв'язуюче (як-то полівінілпіролідон) та ковзну речовину (як-то натрій стеарилфумарат). Така композиція може також містити додатковий носій (або наповнювач) як-то маніт. Композиції винаходу, що є у формі таблеток для негайного вивільнення, можна отримати асоціацією активного інгредієнту з розріджувачем/носієм, застосовуючи стандартні способи, та застосовуючи стандартне обладнання, відоме фахівцям, залучаючи вологу чи суху грануляцію, пряме пресування, сушку, розмелювання, змішування, таблетування та нанесення покриття, а також комбінації цих способів, наприклад, як описано далі. Згідно з одним аспектом винаходу, кислотно-адитивні солі сполук формули (Г) у кристалічній формі формують у таблетки. Тому запропоновано спосіб утворення твердої композиції, придатної для застосування при отриманні композиції винаходу (наприклад розчину, як-то водний розчин), спосіб залучає видалення розріджувачу/носія (наприклад розчиннику) з композиції винаходу, або концентрованої композиції винаходу. Розчинник можна видаляти різними способами, відомими фахівцям, наприклад випарюванням (під зменшеним тиском або 82191 14 інакше), сушкою сублімацією, або будь-яким способом видалення розчиннику (сушкою), що видаляє розчинник (як-то воду), зберігаючи цілісність активного інгредієнту. Прикладом сушки є сушка сублімацією. Отже згідно з наступним аспектом винаходу запропоновано висушену сублімацією (ліофілізовану) тверду композицію винаходу. При отриманні твердої композиції винаходу, фахівцям ясно, що підхожі додаткові наповнювачі можна додавати на придатному етапі до видалення розріджувачу/носія. Наприклад, у випадку водних розчинів, рН можна регулювати та/або доводити, як тут раніше описано. Крім того, підхожі додаткові наповнювачі можна додавати з огляду на допомогу утворенню твердої композиції винаходу при видаленні розріджувачу/носія (наприклад маніту, сахарози, глюкози, манози або трегалози). Тверда композиція сполуки формули (І) або її солі, отже залучає композицію, в якій вміст розчиннику (наприклад води), інший, ніж розчиннику кристалізації, є не більше 10%, як-то менше 2% незв'язаного розчиннику, як-то води. Композиції винаходу можна стерилізувати, наприклад стерильним фільтруванням або автоклавуванням, та/або уводити у первинні упаковки, як-то ампули, склянки та попередньо заповнені шприци. Такі етапи обробки можна також проводити до сушки для утворення твердої композиції винаходу. Перед застосуванням висушену тверду композицію можна відтворювати та/або розбавляти, наприклад, у воді, фізіологічному розчині, розчині глюкози або будь-якому іншому придатному розчині. Кількість розріджувачу/носія у пероральній (наприклад, таблетці негайного вивільнення) композиції винаходу залежить від багатьох факторів, як-то природа і кількість активного інгредієнту, що застосовують, та природа і кількість будь-яких інших складових (наприклад інших наповнювачів), що є у композиції, але звичайно дорівнює до 40мас.%, переважно до 30%, більш переважно до 20%, та особливо до 10мас.% кінцевої композиції. Кількість додаткових наповнювачів у такій пероральній композиції винаходу також залежить від таких факторів, як природа і кількість активного інгредієнту, що застосовують, а також природа і кількість будьяких інших складових (наприклад розріджувачів/носіїв та/або інших наповнювачів), що є у композиції, але для ковзних речовин та ковзних засобів дорівнює звичайно до 5мас.%, а для зв'язуючих та дезинтеграторів є звичайно до 10мас.% кінцевої композиції. Композиції винаходу застосовують до ссавців (залучаючи людей), а сполуки формули (І), де R2 не є гідрогеном, далі метаболізують у тілі з утворенням сполук формули (І), де R2 представляє гідроген, які є фармакологічно активними. Згідно з наступним аспектом винаходу тому запропоновано композицію винаходу для застосування як фармацевтичну. 15 Зокрема, сполуки формули (І) є потужними інгібіторами тромбіну, або метаболізують після застосування з утворенням цих інгібіторів, що наприклад можна продемонструвати у тестах, описаних [у міжнародній патентній заявці №PCT/SEO 1/02657, а також міжнародних патентних заявках WO 02/14270, WO 01/87879 та WO 00/42059], доречне розкриття цих документів уведене тут як посилання. Під "проліками інгібітору тромбіну", розуміють сполуки, що метаболізують після застосування та утворюють інгібітор тромбіну у експериментально визначуваній кількості, після застосування. Під "активним інгредієнтом" та "активною речовиною" розуміють фармацевтичний засіб (що охоплює інгібітор тромбіну та його проліки) представлено у композиції. Композиції винаходу є таким чином очікуваною як корисна у станах, де потрібне інгібування тромбіну, та/або станах, де показана антикоагулянтна терапія, залучаючи наступне: Лікування та/або профілактика тромбозу та здатність до гіперкоагуляції у крові та/або тканинах тварин, залучаючи людину. Відомо, що здатність до гіперкоагуляції може призводити до тромбоемболічних захворювань. Стани, асоційовані зі здатністю до гіперкоагуляції та тромбоемболічних захворювань, які можна згадати, залучають резистентність до успадкованого або набутого активованого білку С, як-то фактор V-мутації (фактор V Лейдена), та успадкованого або набутого дефіциту антитромбіну III, білку С, білку S, кофактору гепарину II. Інші стани, відомі як асоційовані зі здатністю до гіперкоагуляції та тромбоемболічних захворювань залучають циркулюючі антифосфоліпідні антитіла (антикоагулянт при вовчаку), гомоцистеїнемію, індуковану гепарином тромбоцитопенію та дефекти фібринолізу, а також коагуляційні синдроми (наприклад розсіяну внутрішньосудинну коагуляцію (РВСК)) та судинне поранення взагалі (наприклад внаслідок хірургії). Лікування станів, де існує небажаний надлишок тромбіну без ознак здатності до гіперкоагуляції, наприклад у нейродегенеративних захворюваннях, як-то хвороба Альцгеймера. Певні захворювання, які можна згадати, залучають терапевтичне та/або профілактичне лікування венозного тромбозу (наприклад ГТВ) та легеневої емболії, артеріального тромбозу (наприклад, при інфаркті міокарду, залучаючи нестабільну стенокардію, напад внаслідок тромбозу та периферійний артеріальний тромбоз), та системну емболію, звичайно від передсердя при передсерцевій фібриляції (наприклад неклапанній передсерцевій фібриляції) або від лівого шлуночка після трансмурального інфаркту міокарду, або викликаній застійною серцевою нестачею; профілактику реоклюзії (тромбозу) після тромбо-лізу, підшкірну транслюмінальну ангіопластику (ПТА) та операції коронарного шунтування; попередження ретромбозу після мікрохірургії та судинної хірургії взагалі. Крім того показання залучають терапевтичне та/або профілактичне лікування розсіяної 82191 16 внутрішньосудинної коагуляції, викликаної бактеріями, складною травмою, інтоксикацією або будь-яким іншим механізмом; антикоагулянтну обробку, коли кров є у контакті з чужинними поверхнями у тілі, як-то судинними трансплантатами, судинними стентами, судинними катетерами, механічними та біологічними простетичними клапанами або будьяким іншим медичним пристроєм; та антикоагулянтну обробку, коли кров є у контакті з медичними пристроями зовні тіла, як-то при серцево-судинній хірургії, застосовуючи апарат серце-легені або при гемодіалізі; терапевтичне та/або профілактичне лікування ідіопатич-ного респіраторного дистрес-синдрому та респіраторного дистрес-синдрому дорослих, фіброзу легенів після лікування радіацією або хемотерапією, септичного шоку, септицемії, запальних реакцій, які залучають, але без обмеження, набряк, гострий або хронічний атеросклероз, як-то коронарне артеріальне захворювання та утворення атеросклеротичних бляшок, церебральне артеріальне захворювання, церебральний інфаркт, церебральний тромбоз, церебральна емболія, периферійні артеріальні захворювання, ішемія, стенокардія (залучаючи нестабільну стенокардію), реперфузійні пошкодження, рестеноз після підшкірної транслюмінальної ангіопластики (ПТА) та хірургії шунтування коронарної артерії. Композиція представленого винаходу може також містити будь-які антитромботичні засоби з відмінним від сполук формули (І) механізмом дії, як-то одне чи більше з наступного: антитромбоцитні засоби ацетилсаліцилова кислота, тиклопідин та клопідогрел; тромбоксановий рецептор та/або інгібітори синтетази; антагоністи рецептору фібриногену; простациклінові міметики; інгібітори фосфодіестерази; антагоністи ADP-рецептору (Р2Т); та інгібітори карбоксипептидази U (КПU). Сполуки формули (І), що інгібують трипсин та/або тромбін, можуть також бути корисними у лікуванні панкреатиту. Композиції винаходу, таким чином, показані у терапевтичному та/або профілактичному лікуванні цих станів. Згідно з наступним аспектом представленого винаходу запропоновано спосіб лікування стану, де потрібне інгібування тромбіну, спосіб залучає застосування терапевтично ефективної кількості композиції винаходу до особи, що потерпає від такого стану, або схильна до нього. Згідно з ще одним аспектом представлений винахід стосується композиції винаходу у виробництві медикаменту для застосування у лікуванні тромбозу. Згідно з наступним аспектом винаходу, запропоновано спосіб лікування тромбозу, спосіб залучає застосування композиції винаходу до особи, яка потерпає від такого стану чи схильна до нього. Для попередження невизначеності "лікування" залучає терапевтичне лікування, а також профілактику станів. 17 Придатні кількості активного інгредієнту у композиції (пероральній або парентеральній), концентрованій композиції, та твердій композиції винаходу залежать від багатьох факторів, як-то природа інгредієнту (вільна основа/сіль), доза, що потрібна у пероральній композиції або у кінцевій "готовій до застосування" парентеральній композиції, яку отримано чи треба отримати, та природа і кількість інших складових композиції. Однак, типова добова доза сполуки формули (І), або її фармацевтично прийнятної солі, є у межах 0,001-100мг/кг маси тіла при пероральному застосуванні та 0,001 - 50мг/кг маси тіла при парентеральному застосуванні, виключаючи масу будь-якого протиіона кислоти, незалежно від числа індивідуальних доз, що застосовують на добу. У випадку парентеральної композиції для негайного вивільнення застосування може бути безперервним (наприклад вливанням). Кращою добовою пероральною дозою є 20 - 500мг, а кращою парентеральна доза є у межах 0,1 - 50мг. Загальні способи ТШХ проводять на силікагелі. Хіральний ВЕРХ-аналіз проводять, застосовуючи колонку Chiralcel OD 46ммΧ250мм із запобіжною колонкою 5см. Колонку тримають при температурі 35°С. Швидкість потоку 1,0мл/хвилин. Застосовують детектор Gilson 115 УФ при 228нм. Рухома фаза складається з гексану, етанолу та трифлуороцтової кислоти, а прийнятне співвідношення наведено для кожної сполуки. Звичайно, продукт розчиняють у мінімальній кількості етанолу та це розбавляють рухомою фазою. В отриманнях А - І нижче, РХ-МС/МС проводять, застосовуючи прилад НР-1100, оснащений інжектором CTC-PAL та колонкою Hypersil BDS-C18 Tm, 4´100мм ThermoQuest,. Застосовують детектор АРІ-3000 (Sciex) MC. Швидкість потоку 1,2мл/хвилин, а рухома фаза (градієнт) складається з 10-90% ацетонітрилу з 90 - 10% 4мМ водного амоній ацетату, з вмістом 0,2% мурашиної кислоти. Інакше, реєструють масспектри низького розділення (LR)-(S), застосовуючи спектрометр Micromass ZQ у ІЕР перемикальний режим позитивної/негативної іонізації (межі мас m/z 100 - 800); а мас-спектри високого розділення (HR)-(S) реєструють, застосовуючи спектрометр Micromass LCT у режимі негативної іонізації електророзпиленням (ЕР) (межі мас m/z 100 - 1000) з Лейцином Енкефалі-ном (C28H37 N5O7) як внутрішнім стандартом маси. Спектри 1Н ЯМР реєструють, застосовуючи тетраметилсилан як внутрішній стандарт. Способи синтезу сполук формули (І) представлені [у Міжнародній Патентній заявці №PCT/SEO1/02657 (WO 02/44145, дата пріоритету 01 грудня 2000, зареєстровано 30 листопада 2001, опубліковано 06 червня 2002)], доречну інформацію з якої уведено тут. Отримання А: Отримання сполуки А (і) 3-хлор-5-метоксибензальдегід 3,5-Дихлоранізол (74,0г, 419ммоль) у ТГФ (200мл) додають краплями до металевого машію 82191 18 (14,2г, 585ммоль, попередньо промитий 0,5N НСІ) у ТГФ (100мл) при 25°С. Після додавання додають краплями 1,2-диброметан (3,9г, 20,8ммоль). Утворену темно-коричневу суміші гріють при кипінні під зворотним холодильником протягом 3 годин. Суміш охолоджують до 0°С, та додають одною порцією Ν,Ν-диметилформамід (60мл). Суміш розподіляють між діетиловим етером (3´400мл) та 6N НСІ (500мл). Комбіновані органічні екстракти промивають розсолом (300мл), сушать сульфатом натрію, фільтрують та концентрують у вакуумі, отримуючи масло. Флешхроматографують (2´) на силікагелі, елюючи сумішшю гексан:ЕtOАс (4:1), отримуючи названу сполуку (38,9г, 54%) як жовте масло. 1 H ЯМР (300МГц, CDCI 3) δ 9,90 (s, 1Н), 7,53 (s, 1Н), 7,38 (s, 1Н), 7,15 (s, 1Н), 3,87 (s, 3Н). (іі) 3-хлор-5-гідроксибензальдегід Розчин 3-хлор-5-метоксибензальдегіду (22,8г, 134ммоль; дивись етап (і) вище) у СН2СІ 2 (250мл) охолоджують до 0°С. Трибромід бору (15,8мл, 167ммоль) додають краплями протягом 15 хвилин. Після перемішування реакційної суміші протягом 2 годин, повільно додають воду (50мл). Розчин тоді екстрагують ефіром (2´100мл). Органічний шари поєднують, сушать сульфатом натрію, фільтрують та концентрують у вакуумі. Флешхроматографують на силікагелі, елюючи сумішшю гексан:ЕtOАс (4:1), отримуючи названу сполуку (5,2г, 25%). 1 Н ЯМР (300МГц, CDCl3) δ 9,85 (s, 1H), 7,35 (s, 1H), 7,20 (s, 1H), 7,10 (s, 1H), 3,68 (s, 1H) (ііі) 3-Хлор-5-дифлуорметоксибензальдегід Розчин 3-хлор-5-гідроксибензальдегіду (7,5г, 48ммоль; дивись етап (іі) вище) у 2-пропанолі (250мл) та 30% КОН (100мл) гріють до кипіння під зворотним холодильником. При перемішуванні продувають у реакційну суміші протягом 2 годин CHCIF2. Реакційну суміші охолоджують, підкислюють 1H НСІ та екстрагують ЕtOАс (2´100мл). Органічні продукти промивають розсолом (100мл), сушать сульфатом натрію, фільтрують та концентрують у вакуумі. Флешхроматографують на силікагелі, елюючи сумішшю гек-сан:ЕtOАс (4:1), отримуючи названу сполуку (4,6г, 46%). 1 Н ЯМР (300МГц, CDCI 3) δ 9,95 (s, 1H), 7,72 (s, 1H), 7,52 (s, 1H), 7,40 (s, 20 1H), 6,60 (t, J HF=71,1Гц, 1H) (iv) Ph(3-CI)(5-OCHF2)-((R,S)CH(OTMS)CN Розчин 3-хлор-5дифлуорметоксибензальдегіду (4,6г, 22,3ммоль; дивись етап (ііі) вище) у СН2СІ 2 (200мл) охолоджують до 0°С. Znl2 (1,8г, 5,6ммоль) та триметилсилілціа-нід (2,8г, 27,9ммоль) додають і реакційній суміші дають нагрітися до кімнатної температури та перемішують протягом години. Суміш частково концентрують у вакуумі, отримуючи названу сполуку як рідину, яку застосовують безпосередньо на етапі (ν) нижче без очистки або ідентифікації. (v) Ph(3-CI)-(5-OCHF2)-(R,S)CH(OH)C(NH)OEt Ph(3-CI)(5-OCHF2)-(R,S)CH(OTMS)CN (6,82г, 22,3ммоль; дивись етап (iv) вище) додають краплями до HCI/EtOH (500мл). Реакційну суміші 19 перемішують годин, тоді частково концентрують у вакуумі, отримуючи названу сполуку як рідину, яку застосовують на етапі (vi) без очистки або ідентифікації. (vi) Ph(3-CI)(5-OCHF2)-(R,S)CH(OH)C(O)OEt Ph(3-CI)-(5-OCHF2)-(R,S)CH(OH)C(NH)OEt (6,24г, 22,3ммоль; дивись етап (ν) вище) розчиняють у ТГФ (250мл), додають 0,5М H2SO4 (400мл) та реакційну суміші перемішують при 40°С протягом 65 годин, охолоджують, а тоді частково концентрують у вакуумі для видалення більшості ТГФ. Реакційну суміші тоді екстрагують ефіром (3´100мл), сушать сульфатом натрію, фільтрують та концентрують у вакуумі, отримуючи названу сполуку як твердий продукт, який застосовують на етапі (vii) без очистки або ідентифікації. (vii) Ph(3-CI)(5-OCHF2)-(R,S)CH(OH)C(O)OH Суміш Ph(3-CI)(5-OCHF2)-(R,S)CH(OH)C(O)OH (3,2г, 12,7ммоль; дивись етап (vii) вище) та Lipase PS "Amano" (-2,0г) у вінілацетаті (125мл) та МТВЕ (125мл) гріють при кипінні під зворотним холодильником протягом 48 годин. Реакційну суміші охолоджують, фільтрують через Celite® та шар на фільтрі промивають ЕtOАс. Фільтрат концентрують у вакуумі та флешхроматографують на силікагелі, елюючи сумішшю " СНСІ 3:МеОН:концентрований амоній гідроксид (6:3:1), отримуючи солі амонію названих сполук (а) та (b). Сполуку (а) як сіль розчиняють у воді підкислюють 2N НСІ та екстрагують ЕtOАс. Органічний шар промивають розсолом, сушать сульфатом натрію, фільтрують та концентрують у вакуумі, отримуючи названу сполуку (а) (1,2г, 37%). Для названої сполуки (а) 1Н ЯМР (300МГц, CD3OD) 67,38 (s, 1Н), 7,22 (s, 1Н), 7,15 (s, 1Н), 6,89 (t, JH-F=71,1Гц, 1Н), 5,17(s, 1H) (ix) Ph(3-CI)(5-OCHF2)-(R)CH(OH)C(O)-AzePab(Teoc) До розчину Ph(3-CI)(5-OCHF2)(R)CH(OH)C(O)OH (1,1г, 4,4ммоль; дивись етап (viii) вище) та H-Aze-Pab(Teoc) ([дивись міжнародну патентну заявку WO 00/42059], 2,6г, 5,7ммоль) у ДМФ (50мл) при 0°С додають РуВОР (2,8г, 5,3ммоль) та колідин (1,3г, 10,6ммоль). Реакційну суміші перемішують при 0°С протягом 2 годин, а тоді при кімнатній температурі протягом ще години. Реакційну суміші концентрують у вакуумі та флеш-хроматографують на силікагелі (3´), елюючи спершу СНСІ 3:ЕtOН (9:1), тоді ЕtOАс:ЕtOН (20:1) та під кінець, елюючи СН2СІ 2:СН3ОН (95:5), отримуючи названу сполуку (1,0г, 37%) як білий твердий продукт. 1 Н ЯМР (300МГц, CD3OD, суміш ротамерів) 7,79-7,85 (d, J=8,7Гц, 2Н), 7,15-7,48 (m, 5Н), 6,89 та 6,91 (t, JH-F=71,1Гц, 1Н), 5,12 та 5,20 (s, 1H), 4,754,85 (m, 1H), 3,97-4,55 (m, 6Н), 2,10-2,75 (m, 2H), 1,05-1,15 (m, 2H), 0,09 (s, 9H) MC(m/z)611(M+1)+ (x) Ph(3-CI)(5-OCHF2)-(R)CH(OH)C(O)-AzePab(OMe,Teoc) Ph(3-CI)(5-OCHF2)-(R)CH(OH)C(O)-AzePab(Teoc) (0,40г, 0,65ммоль; дивись етап (іх) вище), розчиняють у 20мл ацетонітрилу та додають 0,50г (6,0ммоль) О-метилгідроксиламіну 82191 20 гідрохлориду. Суміш гріють при 70°С протягом 2 годин. Розчинник випарюють та залишок розподіляють між водою та етилацетатом. Водну фазу екстрагують удвічі більше етилацетатом та комбіновану органічну фазу промивають водою, розсолом, сушать сульфатом натрію, фільтрують та випарюють. Вихід: 0,41г (91%). 1 H ЯМР (400МГц; CDCI 3): δ 7,83 (bt, 1H), 7,57 (bs, 1H), 7,47 (d, 2H), 7,30 (d, 2H), 7,20 (m, 1H), 7,14 (m, 1H), 7,01 (m, 1H), 6,53 (t, 1H), 4,89 (s, 1H), 4,87 (m, 1H), 4,47 (m, 2H), 4,4-4,2 (b, 1Н), 4,17-4,1 (m, 3Н), 3,95 (s, 3Н), 3,67 (m, 1H), 2,68 (m, 1H), 2,42 (m, 1H) 0,97 (m, 2Н), 0,01 (s, 9H). (хі) Сполука А Ph(3-CI)(5-OCHF2)-(R)CH(OH)C(O)-AzePab(OMe,Teoc) (0,40г, 0,62ммоль; дивись етап (х) вище), розчиняють у 5мл ТФОК та дають реагувати протягом 30 хвилин. ТФОК випарюють та залишок розподіляють між етилацетатом та водним розчином натрій гідрокарбонату. Водну фазу екстрагують двічі більш етилацетатом та комбіновану органічну фазу промивають водою, розсолом, сушать сульфатом натрію, фільтрують та випарюють. Продукт сушать сублімацією з води/ацетонітрилу. Очистка не потрібна. Вихід: 0,28г (85%). 1 Н ЯМР (600МГц; CDCI 3): 7,89 (bt, 1H), 7,57 (d, 2H), 7,28 (d, 2H), 7,18 (m, 1H), 7,13 (m, 1Н), 6,99 (m, 1H), 6,51 (t, 1H), 4,88 (s, 1H), 4,87 (m, 1H), 4,80 (bs, 2H),4,48 (dd, 1H), 4,43 (dd, 1Н), 4,10 (m, 1Н), 3,89 (s, 3Н), 3,68 (m, 1H), 2,68 (m, 1H), 2,40 (m, 1H). 13 С-ЯМР (125МГц; CDCI 3): (карбонільний та/або амідиновий атоми карбону, ротамери) δ 172,9, 170,8, 152,7, 152,6 МСВР розраховано для C22H23CIF2N4O5 (М-H)495,1242, виявлено 495,1247 Отримання В: Отримання сполуки В (і) 2,6-Дифлуор4[(метилсульфініл)(метилтіо)метил]бензонітрил (Метилсульфініл)(метилтіо)метан (7,26г, 0,0584моль) розчиняють у 100мл сухого ТГФ під аргоном та охолоджують до -78°С. Бутиллітій у гексані (16мл, 1,6М, 0,0256моль) додають краплями з перемішуванням. Суміш перемішують протягом хвилин. Між тим, розчин 3,4,5трифлуорбензонітрилу (4,0г, 0,025ммоль) у 100мл сухого ТГФ охолоджують до -78°С під аргоном та попередній розчин додають через канюлю в останній розчин протягом 35 хвилин. Через 30 хвилин, баню охолодження видаляють, а коли реакційна суміш досягла кімнатної температури, це виливають у 400мл води. ТГФ випарюють та залишок водного шару екстрагують тричі діетиловим етером. Комбіновану етерну фазу промивають водою, сушать сульфатом натрію та випарюють. Вихід: 2,0г (30%). 1 Н ЯМР (500МГц, CDCI 3) 7,4-7,25 (m, 2Н), 5,01 (s, 1Н, діастереомер), 4,91 (s, 1Н, діастереомер), 2,88 (s, 3Н, діастереомер), 2,52 (s, 3Н, діастереомер), 2,49 (s, 3Н, діастереомер), 2,34 (s, 3Н, діастереомер), 1,72 (широкий, 1Н) (іі) 2,6-Дифлуор-4-формілбензонітрил 2,6-Дифлуор4[(метилсульфініл)гметилтіо)метил]бензонітрил (2,17г, 8,32ммоль; дивись етап (і) вище) 21 розчиняють у 90мл ТГФ та додають 3,5мл концентрованої сульфатної. кислоти. Суміш залишають при кімнатній температурі на 3 доби, а тоді виливають у 450мл води. Екстрагують тричі EtOAc та комбіновану ефірну фазу промивають двічі водним натрій гідрокарбонатом та розсолом, сушать сульфатом натрію та випарюють. Вихід: 1,36г (98%). Позицію форміл-групи встановлюють за допомогою 13С ЯМР. Сигнал від флуорованих атомів карбону при 162,7млн-1 виявляє очікувану картину сполучення з двома константами сполучення порядку 260Гц та 6,3Гц відповідно до іпсо та мета сполучення від атомів флуору, 1Н ЯМР (400МГц, CDCI 3) δ 10,35 (s, 1 Μ), 7,33 (m, 2H) (iii) 2,6-Дифлуор-4-гідроксиметилбензонітрил Дифлуор-4-формілбензонітрил (1,36г, 8,13ммоль; дивись етап (іі) вище) розчиняють у 25мл метанолу та охолоджують на бані з льодом. Натрій борогідрид (0,307г, 8,12ммоль) додають порціями з перемішуванням та реакційну суміші залишають на 65 хвилин. Розчинник випарюють та залишок розподіляють між діетиловим етером та водним натрій гідрокарбонатом. Ефірний шар ще промивають водним натрій гідрокарбонатом та розсолом, сушать сульфатом натрію та випарюють. Сирий продукт кристалізують та застосовують без очистки. Вихід: 1,24г (90%). 1 Н ЯМР (400МГц, CDCI3) 7,24 (m, 2Н), 4,81 (s, 2Н), 2,10 (широкий, 1Н) (iv) 4-ціано-2,6-дифлуорбензил метансульфонат До охолодженого льодом розчину 2,6дифлуор-4-гідроксиметилбензонітрилу (1,24г, 7,32ммоль; дивись етап (ііі) вище) та метансульфонілхлориду (0,93г, 8,1ммоль) у 60мл метиленхлориду додають триетиламін (0,81г, 8,1ммоль) з перемішуванням. Через 3 годин при 0°С, суміш промивають двічі 1Μ НСІ та раз водою, сушать сульфатом натрію та випарюють. Продукт застосовують без наступної очистки. Вихід: 1,61г (89%). 1 Н ЯМР (300МГц, CDCI3) 7,29 (m, 2Н), 5,33 (s, 2Н), 3,07 (s, 3Н) (v) 4-Азидометил-2,6-дифлуорбензонітрил Суміш 4-ціано-2,6-дифлуорбензил метансульфонату (1,61г, 6,51ммоль; дивись етап (iv) вище) та натрій азиду (0,72г, 0,0111моль) у 10мл води та 20мл ДМФ перемішують при кімнатній температурі протягом ночі і виливають у 200мл води та екстрагують тричі діетиловим етером. Комбіновану ефірну фазу промивають 5 разів водою, сушать сульфатом натрію та випарюють. Невеликий зразок випарюють для ЯМР та продукт кристалізують. Решту випарюють обережно, але не зовсім досуха. Вихід (теоретично 1,26г) є майже кількісним на основі ЯМР та аналітичної ВЕРХ. 1 Н ЯМР (400МГц, CDCI3) 7,29 (m, 2H), 4,46 (s, 2H) (vі)4-Амінометил-2,6-дифлуорбензонітрил Цю реакцію проводять способом, описаним у [J. Chem. Res. (M) (1992) 3128]. До суспензії 520мг 10% Pd/C (50% вологості) у 20мл води додають розчин натрій боро гідриду (0,834г, 0,0221моль) у 82191 22 20мл води. Відбувається виділення газу. 4Азидометил-2,6-дифлуорбензонітрил (1,26г, 6,49ммоль; дивись етап (ν) вище) розчиняють у 50мл ТГФ та додають до водної суміші на бані з льодом протягом 15 хвилин. Суміш перемішують протягом 4 годин, додають 20мл 2Μ НСІ та суміш фільтрують через броунмілерит. Броунмі-лерит промивають ще водою та комбіновану водну фазу промивають EtOAc, а тоді підлужують 2Μ NaOH. Екстрагують тричі метиленхлоридом та комбіновану органічну фазу промивають водою, сушать сульфатом натрію та випарюють. Вихід: 0,87г (80%). 1 Н ЯМР (400МГц, CDCI 6) δ 7,20 (m, 2H), 3,96 (s, 2H), 1,51 (широкий, 2Н) (vіі) 2,6-Дифлуор-4-третбутоксикарбоніламінометилбензонітрил Розчин 4-амінометил-2,6дифлуорбензонітрилу (0,876г, 5,21ммоль; дивись етап (vi) вище) розчиняють у 50мл ТҐФ та додають ди-трет-бутилдикарбонат (1,14г, 5,22ммоль) у 10мл ТГФ. Суміш перемішують протягом 3,5 годин. ТГФ випарюють та залишок розподіляють між водою та етилацетатом. Органічний шар промивають тричі 0,5Μ НСІ та водою, сушать сульфатом натрію та випарюють. Продукт застосовують без очистки. Вихід: 1,38г (99%). 1 Н ЯМР (300МГц, CDCI 3) 7,21 (m, 2Н), 4,95 (широкий, 1Н), 4,43 (широкий, 2Н), 1,52(s, 9Н) (viii) Boc-Pab(2,6-диF)(OH) Суміш 2,6-дифлуор-4-третбутоксикарбоніламінометилбензонітрилу (1,38г, 5,16ммоль; дивись етап (vii) вище), гідроксиламіну гідрохлориду (1,08г, 0,0155моль) та триетиламіну (1,57г, 0,0155моль) у 20мл етанолу перемішують при кімнатній температурі протягом 36 годин. Розчинник випарюють та залишок є розподіляють між водою та метиленхлоридом. Органічний шар промивають водою, сушать сульфатом натрію та випарюють. Продукт застосовують без очистки. Вихід: 1,43г (92%). 1 Н ЯМР (500МГц, CD3OD) δ 7,14 (m, 2H), 4,97 (широкий, 1Н), 4,84 (широкий, 2Н), 4,40 (широкий, 2Н), 1,43 (s, 9H) (ix) Boc-Pab(2,6-диF)´HOAc Цю реакцію проводять способом, описаним [Judkins et al, Synth. Comm. (1998) 4351]. BocPab(2,6-диF)(OH) (1,32г, 4,37ммоль; дивись етап (viii) вище), оцтовий ангідрид (0,477г, 4,68ммоль) та 442мг 10% Pd/C (50% вологості) у 100мл оцтової кислоти гідрують при атмосферному тиску протягом 3,5 годин. Суміш фільтрують через броунмілерит, промивають етанолом та випарюють. Залишок сушать сублімацією з ацетонітрилу та води і кількома краплями етанолу. Названий продукт застосовують без очистки. Вихід: 1,49г (99%). 1 Н ЯМР (400МГц, CD3OD) δ 7,45 (m, 2H), 4,34 (s, 2H), 1,90 (s, 3Н), 1,40 (s, 9H) (x) Вос-Раb(2,6-диF)(Теос) До розчину Boc-Pab(2,6-диF)´HOAc (1,56г, 5,49ммоль; дивись етап (іх) вище) у 100мл ТГФта 1мл води додають 2-(триметилсиліл)етил пнітрофенілкарбонат (1,67г, 5,89ммоль). Розчин калій карбонату (1,57г, 0,0114моль) у 20мл води 23 додають краплями протягом 5 хвилин. Суміш перемішують протягом ночі. ТГФ випарюють та залишок розподіляють між водою та метиленхлоридом. Водний шар екстрагують метиленхлоридом та комбіновану органічну фазу промивають двічі водним натрій гідрокарбонатом, сушать сульфатом натрію та випарюють. Флешхроматографія на силікагелі з сумішшю гептан/ЕtOАс=2/1 дає 1,71г (73%) чистої сполуки 1 Н ЯМР (400МГц, CDCI 3) δ 7,43 (m, 2Н), 4,97 (широкий, 1Н), 4,41 (широкий, 2Н), 4,24 (m, 2Н), 1,41 (s, 9Н), 1,11 (m, 2Н), 0,06 (s, 9H) (хі) Boc-Aze-Pab(2,6-диF)(Teoc) Boc-Pab(2,6-диF)(Teoc) (1,009г, 2,35ммоль; дивись етап (х) вище) розчиняють у 50мл ЕtOАс, насиченого НСІ(г). Суміш залишають протягом 10 хвилин., випарюють та розчиняють у 18мл ДМФ, а тоді охолоджують на бані з льодом. Boc-Aze-OH (0,450г, 2,24ммоль), РуВОР (1,24г, 2,35ммоль) та на останнє діізопропілетиламін (1,158г, 8,96ммоль) додають. Реакційну суміші перемішують протягом 2 годин, а тоді виливають у 350мл води та екстрагують тричі ЕtOАс. Комбіновану органічну фазу промивають розсолом, сушать сульфатом натрію та випарюють. Флеш-хроматографія на силікагелі з сумішшю гептан:ЕtOАс (1:3) дає 1,097г (96%) потрібної сполуки. 1 Н ЯМР (500МГц, CDCI 3) δ 7,46 (m, 2H), 4,6545 (m, 3Н), 4,23 (m, 2H), 3,87 (m, 1H), 3,74 (m, 1H), 2,45-2,3 (m, 2H), 1,40 (s, 9H), 1,10 (m, 2H), 0,05 (s, 9H) (xii) Ph(3-CI)(5-OCHF2)-(R)CH(OH)C(O)-AzePab(2,6-диF)(Teoc) Boc-Aze-Pab(2,6-диF)(Teoc) (0,256г, 0,500ммоль; дивись етап (хі) вище) розчиняють у 20мл ЕtOАс, насиченого НСІ(г). Суміш залишають протягом 10 хвилин, та випарюють та розчиняють умл ДМФ. Ph(3-CI)(5-OCHF2)-(R)CH(OH)C(O)OH (0,120г, 0,475ммоль; дивись Отримання A(viii) вище), РуВОР (0,263г, 0,498ммоль) та на останнє діізопропілетиламін (0,245г, 1,89ммоль) додають. Реакційну суміші перемішують протягом 2 годин, а тоді виливають у 350мл води та екстрагують тричі ЕtOАс. Комбіновану органічну фазу промивають розсолом, сушать сульфатом натрію та випарюють. Флеш-хроматографія на силікагелі з дає 0,184г (60%) потрібної названої сполуки. 1 Н ЯМР (400МГц, CD3OD, суміш ротамерів) 7,55-7,45 (m, 2Н), 7,32 (m, 1Н, головний ротамер), 7,27 (m, 1Н, другорядний ротамер), 7,2-7,1 (m, 2Н), 6,90 (t, 1Н, головний ротамер), 6,86 (t, 1H, другорядний ротамер), 5,15 (s, 1H, головний ротамер), 5,12 (m, 1H, другорядний ротамер), 5,06 (s, 1H, другорядний ротамер), 4,72 (m, 1H, головний ротамер), 4,6-4,45 (m, 2Н), 4,30 (m, 1Н, головний ротамер), 4,24 (m, 2Н), 4,13 (m, 1Н, головний ротамер), 4,04 (m, 1H, другорядний ротамер), 3,95 (m, 1H, другорядний ротамер), 2,62 (m, 1H, другорядний ротамер), 2,48 (m, 1H, головний ротамер), 2,22 (m, 1H, головний ротамер), 2,10 (m, 1Н, другорядний ротамер), 1,07 (m, 2Н), 0,07 (m, 9Н) (xiii) Ph(3-CI)(5-OCHF2)-(R)CH(OH)C(O)-AzePab(2,6-диF)(OMe,Teoc) 82191 24 Суміш Ph(3-CI)(5-OCHF2)-(R)CH(OH)C(O)-AzePab(2,6-диF)(Teoc) (64мг, 0,099ммоль; дивись етап (хіі) вище) та О-метилгідроксиламіну гідрохлориду (50мг, 0,60ммоль) у 4мл ацетонітрилу гріють при 70°С протягом 3 годин. Розчинник випарюють та залишок розподіляють між водою та етилацетатом. Водний шар екстрагують двічі EtOAc та комбіновану органічну фазу промивають водою, сушать сульфатом натрію та випарюють. Продукт застосовують без очистки. Вихід: 58мг (87%). 1 H ЯМР (400МГц, CDCI 3) 7,90 (bt, 1H), 7,46 (m, 1H), 7,25-6,95 (m, 5H), 6,51, t, 1H), 4,88 (s, 1Н), 4,83 (m, 1Н), 4,6-4,5 (m, 2Н), 4,4-3,9 (m, 4Н), 3,95 (s, 3Н), 3,63 (m, 1H), 2,67 (m, 1Н), 2,38 (m, 1Н). 1,87 (широкий, 1Н), 0,98 (m, 2H), 0,01, s, 9H) (xiv) Сполука В Ph(3-CI)(5-OCHF2)-(R)CH(OH)C(O)-AzePab(2,6-диF)(OMe,Teoc) (58мг, 0,086ммоль; дивись етап (хііі) вище) розчиняють у 3мл ТФОК, охолоджують на бані з льодом та дають реагувати протягом 2 годин. ТФОК випарюють та залишок розчиняють у EtOAc. Органічний шар промивають двічі водним натрій карбонатом та водою, сушать сульфатом натрію та випарюють. Залишок сушать сублімацією з води та ацетонітрилу, отримуючи 42мг (92%) названої сполуки. 1 Н ЯМР (300МГц, CDCI 3) δ 7,95 (bt, 1H), 7,2-7,1 (m, 4H), 6,99 (m, 1H), 6,52 (t, 1H), 4,88 (s, 1H), 4,854,75 (m, 3Н), 4,6-4,45 (m, 2H), 4,29 (широкий, 1Н), 4,09 (m, 1H), 3,89 (s, 3Н), 3,69 (m, 1Н), 2,64 (m, 1Н), 2,38 (m, 1Н), 1,85 (широкий, 1Н) 13 С-ЯМР (100МГц; CDCI 3): (карбонільний та/або амідиновий атоми карбону) δ 172,1, 169,8, 151,9 ХІАТ-МС: (М +1)=533/535 m/z Отримання С: Отримання сполуки С (і) (2-Монофлуоретил)метансульфонат До перемішуваного магнітом розчину 2флуоретанол (5,0г, 78,0ммоль) у СН2СІ 2 (90мл) в атмосфері азоту при 0°С додають триетиламін (23,7г, 234ммоль) та метансульфонілхлорид (10,7г, 93,7ммоль). Суміш перемішують при 0°С протягом 1,5 годин, розбавляють СН2СІ 2 (100мл) та промивають 2N НСІ (100мл). Водний шар екстрагують СН2СІ 2 (50мл) та комбіновані органічні екстракти промивають розсолом (75мл), сушать сульфатом натрію, фільтрують та концентрують у вакуумі, отримуючи названу сполуку (9,7г, 88%) як жовте масло, яке застосовують без очистки. 1 Н ЯМР (300МГц, CDCI 3) 54,76 (t, J=4Гц, 1Н), 4,64 (t, J=4Гц, 1Н), 4,52 (t, J=4Гц, 1H), 4,43 (t, J=4Гц, 1Н), 3,09 (s, 3Н). (іі) 3-хлор-5-монофлуоретоксибензальдегід До розчину 3-хлор-5-гідроксибензальдегіду (8,2г, 52,5ммоль; дивись Отримання А(іі) вище) та калій карбонату (9,4г, 68,2ммоль) у ДМФ (10мл) в атмосфері азоту додають краплями при кімнатній температурі розчин (2монофлуоретил)метансульфонату (9,7г, 68,2ммоль; дивись етап (і) вище) у ДМФ (120мл). Суміш гріють до 100°С протягом години, а тоді перемішують протягом ночі при кімнатній температурі. Реакційну суміші охолоджують до 0°С, виливають в охолоджену льодом 2H НСІ та 25 екстрагують EtOAc. Комбіновані органічні екстракти промивають розсолом, сушать сульфатом натрію, фільтрують та концентрують у вакуумі. Коричневе масло хроматографують на силікагелі, елюючи сумішшю гексан:ЕtOАс (4:1), отримуючи названу сполуку (7,6г, 71%) як жовте масло. 1 Н ЯМР (300МГц, CDCI 3) δ 9,92 (s, 1H), 7,48 (s, 1H), 7,32 (s, 1H), 7,21 (s, 1 N), 4,87 (t, J=4Гц, 1 N), 4,71 (t, J=3Гц, 1 N), 4,33 (t, J=3Гц, 1 N), 4,24 (t, J=3Гц, 1Н). (iii) Ph(3-CI)(5-OCH2CH2F)-(R,S)CH(OTMS)CN До розчину 3-хлор-5монофлуоретоксибензальдегіду (7,6г, 37,5ммоль; дивись етап (іі) вище) та цинк йодиду (3,0г, 9,38ммоль) у дихлорметані (310мл) додають краплями триметилсилілціанід (7,4г, 75,0ммоль) при 0°С в атмосфері азоту. Суміш перемішують при 0°С протягом 3 годин та при кімнатній температурі протягом ночі. Реакційну суміші розбавляють водою (300мл), органічний шар відокремлюють, сушать сульфатом натрію, фільтрують та концентрують у вакуумі, отримуючи названу сполуку (10,6г, 94%) як коричневе масло, що застосовують без очистки або ідентифікації. (iv) Ph(3-CI)(5-OCH2CH2F)(R,S)CH(O)H)C(O)OH Концентровану НСІ (100мл) додають до Ph(3CI)(5-OCH2CH2F)-(R,S)CH(OTMS)CN (10,6г, 5,8ммоль; дивись етап (ііі) вище) та розчин перемішують при 100°С протягом 3 годин. Після охолодження до кімнатної температури реакційну суміші охолоджують до 0°С, підлужують повільно 3H NaOH (-300мл) та промивають ефіром (3´200мл). Водний шар підкислюють 2 N НСІ (80мл) та екстрагують ЕtOАс (3´300мл), Комбіновані ЕtOАс-екстракти сушать сульфатом натрію, фільтрують та концентрують у вакуумі, отримуючи названу сполуку (8,6г, 98%) як блідожовтий твердий продукт, що застосовують без очистки. Rf=0,28 (90:8:2 СНСІ 3:МеОН:концентрований амоній гідроксид) 1Н ЯМР (300МГц, CD3OD) δ 7,09 (s, 1H), 7,02 (s, 1H), 6,93 (s, 1H), 5,1 1 (s, 1H), 4,774,81 (m, 1H), 4,62-4,65 (m, 1H), 4,25-4,28 (m, 1H), 4,15-4,18 (m, 1H). (v) Ph(3-CI)(5-OCH2CH2F)-(R)CH(O)H)C(O)OH (а) та Ph(3-CI)(5-OCH2CH2F)-(S)CH(O)H)C(O)OH (b) Розчин Ph(3-CI)(5-OCH2CH2F)(R,S)CH(O)H)C(O)OH (8,6г, 34,5ммоль; дивись етап (iv) вище) та Lipase PS "Amano" (4,0г) у вінілацетаті (250мл) та МТВЕ (250мл) гріють при 70°С в атмосфері азоту протягом 3 діб. Реакційну суміші охолоджують до кімнатної температури та фермент видаляють фільтруванням через Celite®. Шар на фільтрі промивають ЕtOАс та фільтрат концентрують у вакуумі. Флеш-хроматографують на силікагелі, елюючи сумішшю CHCl3:MeOH:Et3N (90:8:2), отримуючи триетиламінову сіль названої сполуки (а) як жовте масло. На додаток, отримують триетиламінову сіль названої сполуки (b) (4,0г). Сіль названої сполуки (b) розчиняють у воді (250мл), підкислюють 2H НСІ та екстрагують ЕtOАс (3´200мл). Комбіновані органічні екстракти сушать сульфатом натрію, фільтрують та 82191 26 концентрують у вакуумі, отримуючи названу сполуку (b) (2,8г, 32%) як жовте масло. Дані для названої сполуки (b): Rf=0,28 (90:8:2 СНСІ 3:МеОН:концентрований амоній гідроксид) 1Н ЯМР (300МГц, CD3OH) 7,09 (s, 1H), 7,02 (s, 1H), 6,93 (s, 1H), 5,11 (s, 1H), 4,77-4,81 (m, 1Н), 4,62465 (m, 1H), 4,25-4,28 (m, 1H), 4,15418 (m, 1H). (vi) Сполука С До розчину Ph(3-CI)(5-OCH2CH2F)(R)CH(OH)C(O)OH (818мг, 3,29ммоль; дивись етап (ν) вище) у ДМФ (30мл) в атмосфері азоту при 0°С додають H-Aze-Pab(OMe) 2НСІ (1,43г, 4,27ммоль, [дивись міжнародну патентну заявку WO 00/42059]), РуВОР (1,89г, 3,68ммоль), та DIPEA (1,06г, 8,23ммоль). Реакційну суміші перемішують при 0°С протягом 2 годин, а тоді при кімнатній температурі протягом ночі. Суміш концентрують у вакуумі та залишок хроматографують два рази на силікагелі, елю-ючи спершу CHCl3:EtOH (15; 1), а вдруге ЕtOАс:ЕtOН (20:1), отримуючи названу сполуку (880мг, 54%). Rf=0,60(10:1 СНСІ 3:ЕtOН) 1Н ЯМР (300МГц, CD3OD, складна суміш ротамерів) δ 7,58-7,60 (d, J=8Гц, 2Н), 7,34 (d, J=7Гц, 2Н), 7,05-7,08 (m, 2H), 6,95-6,99 (m, 1H), 5,08-5,13 (m, 1Н), 4,77-4,82 (m, 1Н), 4,60-4,68 (m, 1Н), 3,99-4,51 (m, 7Н), 3,82 (s, 3Н), 2,10-2,75 (m, 2H). 13 С-ЯМР (150МГц; CD3OD): (карбонільний та/або амідиновий атоми карбону) δ 173,3, 170,8, 30 152,5. XIAT-MC:(M+1)=493m/z. Отримання сполуки D (Ph(3-CI)(5-OCHF 2)(R)CH(OH)C(O)-Aze-Pab) Сполук D Ph(3-CI)(5-OCHF2)-(R)CH(OH)C(O)-AzePab(Teoc) (0,045г, 0,074ммоль; дивись Отримання А (іх) вище), розчиняють у 3мл ТФОК та дають реагувати протягом 1 години. ТФОК випарюють та залишок сушать сублімацією з води/ацетонітрилу, отримуючи 0,043г (100%) названої сполуки як її трифлуорацетат. 1 Н ЯМР (400МГц; CD3OD) ротамери: δ 7,8-7,75 (m, 2H), 7,55-7,5 (m, 2H), 7,35 (m, 1H, головний ротамер), 7,31 (m, 1Н, другорядний ротамер), 7,19 (m, 1Н, головний ротамер), 7,15 (m, 1H), 7,12 (m, 1H, другорядний ротамер), 6,89 (t, 1H, головний ротамер), 6,87 (t, 1H, другорядний ротамер), 5,22 (m, 1H, другорядний ротамер), 5,20 (s, 1H, головний ротамер), 5,13 (s, 1H, другорядний ротамер), 4,80 (m, 1H, головний ротамер), 4,6-4,4 (m, 2H), 4,37 (m, 1Н, головний ротамер), 4,19 (m, 1H, головний ротамер), 4,07 (m, 1H, другорядний ротамер), 3,98 (m, 1H, другорядний ротамер), 2,70 (m, 1H, другорядний ротамер), 2,55 (m, 1Н, головний ротамер), 2,29 (m, 1H, головний ротамер), 2,15 (m, 1H, другорядний ротамер) 13 С-ЯМР (100МГц; CD3OD): (карбонільний та/або амідиновий атоми карбону, ротамери) δ 172,6, 172,5, 172,0, 171,7, 167,0 МС (m/z)465 (Μ-1), 467 (Μ+1)+ Отримання сполуки Ε (Ph(3-CI)(5-OCHF2)(R)CH(OH)C(O)-Aze-Pab(2,6-ди-F)) Сполука Е Ph(3-CI)(5-OCHF2)-(R)CH(OH)C(O)-AzePab(2,6-AHF)(Teoc) (81мг, 0,127ммоль; дивись Отримання В (хіі) вище) розчиняють у 0,5мл 27 метиленхлориду та охолоджують на бані з льодом. ТФОК (3мл) додають та реакційну суміші залишають на 75 хвилин. ТФОК випарюють та залишок сушать сублімацією з води та ацетонітрилу. Сирий продукт очищають препаративною ОФРХ з CH3CN:0,1Μ NH4OAc (35:65) для отримання 39мг (55%) названої сполуки як її ацетату, чистота: 99%. 1 H ЯМР (400МГц, CD3OD суміш ротамерів) 7,57,4 (m, 2Н), 7,32 (m, 1Н, головний рота-мер), 7,28 (m, 1Н, другорядний ротамер), 7,2-7,1 (m, 3Н) 6,90 (t, 1H, головний ротамер), 6,86 (t, другорядний ротамер), 5,15 (s, 1H, головний ротамер), 5,14 (m, 1H, другорядний ротамер), 5,07 (s, 1Н, другорядний ротамер), 4,72 (m, 1Н, головний ротамер), 4,65-4,45 (m, 2Н), 4,30 (m, 1Н, головний ротамер), 4,16 (m, 1H, головний ротамер), 4,03 (m, 1H, другорядний ротамер), 3,95 . (m, 1Н, другорядний ротамер), 2,63 (m, 1Н, другорядний ротамер), 2,48 (m, 1Н, головний ротамер), 2,21 (m, 1H, головний ротамер), 2,07 (m, 1H, другорядний ротамер), 1,89 (s, 3Н) 13 С-ЯМР (75МГц; CD3OD): (карбонільний та/або амідиновий атоми карбону, суміш ротамерів) δ 171,9, 171,2, 165,0,162,8, 160,4 ХІАТ-МС: (М+1)=503/505 m/z. Отримання сполуки F (Ph(3-CI)(5-OCH2CH2F)(R)CH(OH)(O)-Aze-Pab´ТФОК) R1) Ph(3-CI)(5-OCH2CH2F)-(R)CH(OH)C(O)-AzePab(Teoc) До розчину Ph(3-CI)(5-OCH2CH2F)(R)CH(OH)C(O)OH (940мг, 3,78ммоль; дивись Отримання С (ν) вище) у ДМФ (30мл) в атмосфері азоту при 0°С додають H-Aze-Pab(Teoc) HCI (2,21г, 4,91ммоль), РуВОР (2,16г, 4,15ммоль), та DIPEA (1,22г, 9,45ммоль). Реакційну суміші перемішують, при 0°С протягом 2 годин, а тоді при кімнатній температурі протягом 4 годин. Суміш концентрують у вакуумі та залишок хроматографують двічі на силікагелі, елюючи спершу СНСІ 3:ЕtOН (15:1), а вдруге ЕtOАс:ЕtOН (20:1), отримуючи названу сполуку (450мг, 20%) як крихку білу піну. Темп, пл.: 80-88°С Rf=0,60(10:1 СНСІ 3:ЕtOН) 38 1 Н ЯМР (300МГц, CD3OD, складна суміш ротамерів) δ 7,79 (d, J=8Гц, 2Н), 7,42 (d, J=8Гц, 2Н), 7,05-7,08 (m, 1H), 6,93-6,99 (m, 2H), 5,08-5,13 (m, 1H), 4,75-4,80 (m, 2H), 4,60-4,68 (m, 1Н), 3,954,55 (m, 8Н), 2,10-2,75 (m, 2Н), 1,05-1,11(m, 2H), 0,08 (s, 9H). ХІАТ-МС: (Μ 41)=607 m/z. (ii) Сполука F Ph(3-CI)(5-OCH2CH2F)-(R)CH(OH)C(O)-AzePab(Teoc) (0,357г, 0,589ммоль; дивись етап (і) вище), розчиняють у 10мл ТФОК та дають реагувати протягом 40 хвилин. ТФОК випарюють та залишок сушать сублімацією з води/ацетонітрилу, отримуючи 0,33г (93%) названої сполуки як її трифлуорацетат. 1 Н-ЯМР (600МГц; CD3OD) ротамери: δ 7,8-7,7 (m, 2H), 7,54 (d, 2H), 7,08 (s, 1H, головний ротамер), 7,04 (s, 1Н, другорядний ротамер), 6,99 (s, 1Н, головний ротамер), 6,95 (s, 1Н), 6,92 (s, 1H, другорядний ротамер), 5,18 (m, 1H, другорядний 82191 28 ротамер), 5,14 (s, 1H, головний ротамер), 5,08 (s, 1H, другорядний ротамер), 4,80 (m, 1H, головний ротамер), 4,73 (m, 1H), 4,65 (m, 1H), 4,6-4,4 (m, 2Н), 4,35 (m, 1H, головний ротамер), 4,21 (дублет мульти-плетів, 2Н), 4,12 (m, 1Н, головний ротамер), 4,06 (m, 1Н, другорядний ротамер), 3,99 (m, 1Н, другорядний ротамер), 2,69 (m, 1Н, другорядний ротамер), 2,53 (m, 1Н, головний ротамер), 2,29 (m, 1H, головний ротамер), 2,14 (m, 1H, другорядний ротамер). 13 С-ЯМР (150МГц; CD3OD): (карбонільний та/або амідиновий атоми карбону) δ 172,8,172,1,167,4. IEP-MC+:(M+1)=463(m/z) Отримання сполуки G (Ph(3-CI)(5-OCHF 2)(R)CH(OH)C(O)-Aze-Pab(OH)) (i) Ph(3-CI)(5-OCHF2)-(R)CH(OH)C(O)-AzePab(OH,Teoc) Ph(3-CI)(5-OCHF2)-(R)CH(OH)C(O)-AzePab(Teoc) (0,148г, 0,24ммоль; дивись Отримання А етап (іх) вище), розчиняють у 9мл ацетонітрилу та додають 0,101г (1,45ммоль) гідроксиламіну гідрохлориду. Суміш гріють при 70°С протягом 2,5 годин, фільтрують через Celite® та випарюють. Сирий продукт (0,145 π 75% чистоти) застосовують безпосередньо на наступному етапі без очистки. (ii) Ph(3-CI)(5-OCHF2)-(R)CH(OH)C(O)-AzePab(OH) Ph(3-CI)(5-OCHF2)-(R)CH(OH)C(O)-AzePab(OH, Teoc) (0,145г, 0,23ммоль; дивись етап (і) " вище), розчиняють у 0,5мл СН2СІ 2 та 9мл ТФОК. Реакційній суміші дають реагувати протягом 60 хвилин. ТФОК випарюють та залишок очищають, застосовуючи препаративну ВЕРХ. Потрібні фракції об'єднують та сушать сублімацією (2´), отримуючи 72мг (вихід за два етапи 62%) названої сполуки. МС (m/z) 482 (Μ-1); 484 (Μ+1)+ 1 Н ЯМР (400МГц; CD3OD): δ 7,58 (d, 2H), 7,33 (m, 3Н), 7,15 (m, 2H), 6,89 (t, 1H головний ротамер), 6,86 (t, 1Н другорядний ротамер), 5,18 (s, 1H головний ротамер; та m, 1Н другорядний ротамер), 5,12 (s, 1H другорядний ротамер), 4,77 (m, 1H головний ротамер),4,42 (m, 2H), 4,34 (m, 1Н головний ротамер), 4,14 (m, 1Н головний ротамер), 4,06 (m, 1H другорядний ротамер), 3,95 (m, 1H другорядний ротамер), 2,66 (m, 1H другорядний ротамер), 2,50 (m, 1H головний ротамер), 2,27 (m, 1Н головний ротамер), 2,14 (m, 1H другорядний ротамер) 13 С-ЯМР (100МГц; CD3OD): (карбонільний та/або амідиновий атоми карбону, ротамери) δ 172,4,172,3,172,0,171,4 152,3,152,1 (i) Boc-(S)-Aze-NHCH2-Ph(2,6-диF)4-CN) Отримання сполуки Н: Ph(3-CI)(5-OCHF2)(R)CH(OH)C(O)(S)-Aze-Pab(2,6-диF)(OH) I 29 Boc-(S)-Aze-OH (1,14г, 5,6ммоль) розчиняють у 45мл ДМФ. 4-Амінометил-2,6-дифлуорбензонітрил (1,00г, 5,95моль, дивись приклад 1 (xiv) вище), РуВОР (3,10г, 5,95ммоль) та DIPEA (3,95мл, 22,7ммоль) додають та розчин перемішують при кімнатній температурі протягом 2 годин. Розчинник випарюють та залишок розподіляють між водою та EtOAc (75мл кожного). Водну фазу екстрагують 2´50мл ЕtOАс та комбіновану органічну фазу промивають розсолом та сушать натрій сульфатом. Флеш-хроматографія (SiO2, EtOAc/гептан (3/1)) дає названу сполуку (1,52г, 77%) як масло, яке кристалізується у холодильнику. 1 Н ЯМР (400МГц; CD3OD): δ 7,19 (m, 2H), 4,654,5 (m, 3Н), 3,86 (m, 1H), 3,73 (m, 1H), 2,45-2,3 (m, 2H), 1,39 (s, 9H) (ii) H-(S)-Aze-NHCH2-Ph(2,6-диF,CN)´HCI Boc-(S)-Aze-NHCH2-Ph(2,6-диF,4-CN) (0,707г, 2,01ммоль, дивись етап (і) вище) розчиняють у 60мл ЕtOАс, насиченого НСІ(г). Після перемішування при кімнатній температурі протягом 15 хвилин, розчинник випарюють. Залишок розчиняють у CH3CN/H2O (1/1) та сушать сублімацією, отримуючи названу сполуку (0,567г, 98%) як білуватий аморфний порошок. 1 Н ЯМР (400МГц; CD3OD): δ 7,49 (m, 2H), 4,99 (m, 1H), 4,58 (m, 2H), 4,12 (m, 1H), 3,94 (m, 1H), 2,80 (m, 1H), 2,47 (m, 1H) MC (m/z) 252,0 (M+1)+ (iii) Ph(3-CI)(5-OCHF 2)-(R)CH(OH)C(O)-(S)-AzeNHCH2-Ph(2,6-диF,CN) Ph(3-CI)(5-OCHF2HR)CH(OH)C(O)OH (0,40г, 1,42ммоль, дивись приклад 1(viii) вище) розчиняють у 10мл ДМФ та H-(S)-Aze-NHCH2Ph(2,6-диF,4-CN) 30´HCI (0,43г, 1,50ммоль, дивись етап (11) вище) та додають РуВОР (0,779г, 1,50ммоль), а потім DIPEA (1,0мл, 5,7ммоль). Після перемішування при кімнатній температурі протягом 2 годин розчинник випарюють. Залишок розподіляють між водою (200мл) та ЕtOАс (75мл). Водну фазу екстрагують 2´75мл ЕtOАс та комбіновану органічну фазу промивають розсолом та сушать натрій сульфатом. Флешхроматографують (SiO2, ЕtOАс/гептан (4/1)), отримуючи названу сполуку (0,56г, 81%) як масло. 1 H ЯМР (400МГц; CD3OD) ротамери: δ 7,43 (m, 2H), 7,31 (m, 1H, головний ротамер), 7,26 (m, 1H, другорядний ротамер), 7,2-7,1 (m, 2H), 6,90 (t, 1H, головний ротамер), 6,86 (t, 1Н, другорядний ротамер), 5,14 (s, 1H, головний ротамер), 5,11 (m, 1H, другорядний ротамер), 5,04 (s, 1H, другорядний ротамер), 4,71 (m, 1H, головний ротамер), 4,6-4,45 (m, 2H), 4,30 (m, 1Н, головний ротамер), 4,2-3,9 (m, 1Н; та 1Н, другорядний ротамер), 2,62 (m, 1H, другорядний ротамер), 2,48 (m, 1H, головний ротамер), 2,21 (m, 1H, головний ротамер), 2,09 (m, 1H, другорядний ротамер) 13 С-ЯМР (100МГц; CD3OD): (карбонільні атоми карбону) δ 171,9, 171,8 МС (m/z) 484,0,485,9 (Μ-1)-, 486,0, 487,9 (Μ+1)+ (iv) Ph(3-CI)(5-OCHF2)-(R)CH(OH)C(O)-(S)-AzePab(2,6-диF)(OH) Ph(3-CI)(5-OCHF2)-(R)CH(OH)C(O)-(S)-AzeNHCH2-Ph(2,6-диF,4-CN) (0,555г, 1,14ммоль, з 82191 30 етапу (ііі) вище) розчиняють у 10мл ЕtOН (95%). До цього розчину додають гідроксиламін гідрохлорид (0,238г, 3,42ммоль) та Еt2N (0,48мл, 3,44ммоль). Після перемішування при кімнатній температурі протягом 14 годин розчинник видаляють та залишок розчиняють у ЕtOАс. Органічну фазу промивають розсолом та водою і сушать натрій сульфатом. Сирий продукт очищають препаративною ОФРХ з CH3CN:0,1М NH4OAc як елюент, отримуючи названу сполуку як аморфний порошок (0,429г, 72%) після сушки сублімацією. 1 Н ЯМР (400МГц; CD3OD) ротамери: δ 7,35-7,1 (m, 5H), 6,90 (t, 1H, головний ротамер), 6,85 (t, 1H, другорядний ротамер), 5,15 (s, 1H, головний ротамер), 5,12 (m, 1H, другорядний ротамер), 5,08 (s, 1H, другорядний ротамер), 4,72 (m, 1H, головний ротамер), 4,6-4,4 (m, 2Н), 4,30 (m, 1Н, головний ротамер), 4,12 (m, 1Н, головний ротамер), 4,04 (m, 1Н, другорядний ротамер), 3,94 (m, TH, другорядний ротамер), 2,62 (m, 1H, другорядний ротамер), 2,48 (m, 1H, головний ротамер), 2,22 (m, 1H, головний ротамер), 2,10 (m, 1H, другорядний ротамер) 13 С-ЯМР (100МГц; CD3OD): (карбонільний та амідиновий атоми карбону, ротамери) 172,4, 171,9,171,0, 152,3, 151,5 МС (m/z) 517,1, 519,0 (Μ-1)-, 519,1, 521,0 (М+1)+ Отримання сполуки J (Ph(3-CI)(5-OCH2CHF2)(R)CH(OH)(O)-Aze-Pab(OH)) Ph(3-CI)(5-OCH2CHF2)-(R)CH(OH)(O)-AzePab(2) ([дивись міжнародну патентну заявку WO 97/02284], 92мг, 0,197ммоль) розчиняють у 10мл ЕtOАс, насиченого НСІ(г) та дають реагувати протягом 10 хвилин. Розчинник випарюють та залишок змішують з Рh(3-СІ)(5-OCH2CHF2)(R)CH(OH)C(O)OH (50мг, 0,188ммоль; дивись Отримання С (ν) вище), РуВОР (109мг, 0,209ммоль) та під кінець діізопропілетиламін (96мг, 0,75ммоль) у 2мл ДМФ. Суміш перемішують протягом 2 годин, а тоді виливають у 50мл води та екстрагують тричі ЕtOАс. Комбіновану органічну фазу промивають водою, сушать сульфатом натрію та випарюють. Сирий продукт флешхроматографують на силікагелі сумішшю EtOAc:MeOH (9:1). Вихід: 100мг (87%). 1 Н ЯМР (300МГц, CD3OD, суміш ротамерів) δ 7,85-7,75 (m, 2H), 7,45-7,25 (m, 7H), 7,11 (m, 1H, головний ротамер), 7,08 (m, 1H, другорядний ротамер), 7,05-6,9 (m, 2H), 6,13 (bt, 1Н), 5,25-5,05 (m, 3Н), 4,77 (m, 1Н, частково перекрито сигналом CD3OH), 4,5-3,9 (m, 7Н), 2,64 (m, 1H, другорядний ротамер), 2,47 (m, 1H, головний ротамер), 2,25 (m, 1H, головний ротамер), 2,13 (m, 1H, другорядний ротамер) (ii) Ph(3-CI)(5-OCH2CHF2)-(R)CH(OH)(O)-AzePab(OH) Гідроксиламіну гідрохлорид (65мг, 0,94ммоль) та триетиламін (0,3 19г, 30 3,16ммоль) змішують у 8мл ТГФ та обробляють ультразвуком протягом 1 години при 40°С. Ph(3-CI)(5-OCH2CHF2)(R)CH(OH)(O)-Aze-Pab(Z) (96мг, 0,156ммоль; дивись етап (і) вище) додають з 8мл ТГФ. Суміш перемішують при 40°С протягом 4,5 діб. Розчинник 31 випарюють та сирий продукт очищають препаративною ОФРХ з CH3CN:0,1M NH4OAc (40:60). Вихід: 30мг (38%). Чистота: 99%, 1Н ЯМР (300МГц, CD3OD. Суміш ротамерів) 7,6-7,55 (m, 2H), 7,35-7,3 (m, 2Н), 7,12 (m, 1Н, головний ротамер), 7,09 (m, 1H, другорядний ротамер), 7,056,9 (m, 2Н),6,15 (триплет мультиплетів, 1Н), 5,15 (m, 1H, другорядний ротамер), 5,13 (s, 1H, головний ротамер), 5,08 (s, 1Н, другорядний ротамер), 4,77 (m, 1Н, головний ротамер), 4,5-4,2 (m, 5Н), 4,08 (m, 1Н, головний ротамер), 3,97 (m, 1H, другорядний ротамер), 2,66 (m, 1Н, другорядний ротамер), 2,50 (m, 1H головний ротамер), 2,27 (m, 1H, головний ротамер), 2,14 (m, 1Н, другорядний ротамер). 13 С-ЯМР (100МГц; CD3OD): (карбонільний та/або амідиновий атоми карбону, суміш ротамерів) δ 172,8,172,2,171,4, 159,1,158,9,154,2. ХІАТ-МС: (М+1)=497/499 m/z Способи 1 та 2: Отримання солей сполук А Спосіб 1: Загальний спосіб отримання солей Наступний спосіб застосовують для отримання солей сполуки А: 200мг сполуки А (дивись Отримання А вище) розчиняють у 5мл МеОН. До цього розчину додають розчин доречної кислоти (1,0 молярний еквівалент) у 5мл МеОН. Після перемішування протягом 10 хвилин при кімнатній температурі розчинник видаляють на роторному випарнику. Залишок твердого матеріалу знов розчиняють у 8мл ацетонітрилу-Н2О (1:1). Сушка сублімацією дала безбарвний аморфний матеріал у кожному випадку. Застосовані кислоти: (1S)-(+)-10-камфорсульфонова яблучна цикпогексилсульфамова фосфатна диметилфосфатна п-толуолсульфонова L-лізин L-лізин гідро хлорид cахаринова метансульфонова гідрохлоридна Прийнятні характеристичні дані показано у таблиці 1. 82191 32 Усі солі, утворені цим способом, є аморфними. Спосіб 2 Крім того аморфні солі сполуки А отримують, застосовуючи аналогічні способу 1 способи з таких кислот: гідробромідна кислота (сіль 1:1) гідрохлоридна кислота (сіль 1:1) сульфатна кислота (сіль 1:0,5) 1,2-етандисульфонова кислота (сіль 1:0,5) 1S-камфорсульфонова кислота (сіль 1:1) (+/-)-камфорсульфонова кислота (сіль 1:1) етансульфонова кислота (сіль 1:1) нітратна кислота (сіль 1:1) толуолсульфонова кислота (сіль 1:1) метансульфонова кислота (сіль 1:1) п-ксилолсульфонова кислота (сіль 1:1) І 2-мезитиленсульфонова кислота (сіль 1:1) 1,5-нафталінсульфонова кислота (сіль 1:0,5) нафталінсульфонова кислота (сіль 1:1) 33 бензолсульфонова кислота (сіль 1:1) сахаринова кислота (сіль 1:1) малеїнова кислота (сіль 1:1) фосфатна кислота (сіль 1:1) D-глутамінова кислота (сіль 1:1) L-глутамінова кислота (сіль 1:1) D,L-глутамінова кислота (сіль 1,1) L-аргінін(сіль 1:1) L-лізин(сіль 1;1) L-лізин гідрохлорид (сіль 1:1) гліцин (сіль 1:1) саліцилова кислота (сіль 1:1) винна кислота (сіль 1:1) фумарова кислота (сіль 1:1) лимонна кцелота (сіль 1:1) L-(-)-яблучна кислота (сіль 1:1) D,L-яблучна кислота (сіль 1:1) D-глюконова кислота (сіль 1:1) Спосіб 3: Отримання аморфного етансульфонату сполуки А Сполуку А (203мг, дивись Отримання А вище) розчиняють в етанолі (3мл) та додають до розчину етансульфонової кислоти (1екв., 95%, 35мкл). Суміш перемішують протягом кількох хвилин, а тоді розчинник випарюють. Утворене масло суспендують в ізооктані та випарюють досуха, отримуючи твердий матеріал. Під кінець, речовину знов суспендують в ізооктані та розчинник випарюють, знов отримуючи білий, сухий, аморфний твердий продукт. Речовину сушать у вакуумі при 40°С протягом ночі. Способи 4-9: Отримання кристалічного етансульфонату сполуки А Спосіб 4: Кристалізація аморфного матеріалу Аморфну Сполуку А, етансульфонат (17,8мг; дивись Спосіб 3 вище) суспендують у метилізобутилкетоні (600мкл). Після 1 доби спостерігають кристалічні голки, як відфільтровують та сушать на повітрі. Способи 5-7; Реакція кристалізації' (без антирозчиннику) Спосіб 5 Сполуку А (277мг; дивись Отримання А вище) розчиняють у метил-ізо-бутилкетоні (3,1мл). Етансульфонову кислоту додають (1екв., 95%, 48мкл). Осадження аморфного етансульфонату відбувається негайно. Ще додають метилізобутилкетон (6мл) та кашку обробляють ультразвуком. Під кінець, третю порцію метилізобутилкетону (3,6мл) додають, а тоді кашку залишають на ніч з перемішуванням (магнітна мішалка). Наступної доби речовина перетворилася у кристалічні голки. Кашку відфільтровують, промивають метилізобутилкетоном (0,5мл) та сушать на повітрі. Спосіб 6 Сполуку А (236мг; дивись Отримання А вище) розчиняють при кімнатній температурі [пропуск] промивають метил-ізо-бутилкетоном (2´6мл) та сушать під зменшеним тиском при 40°С. Після сушки загалом отримують 2,57г білого кристалічного продукту, вихід 89%. Способи 8 та 9: Реакція кристалізації з антирозчинником) Спосіб 8 82191 34 Сполуку А (163мг; дивись Отримання А вище) розчиняють у ізопропанолі (1,2мл). Розчин гріють до 35°С. Додають етансульфонову кислоту (28мкл). Тоді додають етилацетат (4,8мл) та розчин засівають кристалічним етансульфонатом сполуки А (дивись Способи 4-7 вище). Кристалізація починається майже негайно. Кашку залишають протягом приблизно 80 хвилин при 35°С перед охолодженням до температури довкілля (21°С). Дві годин пізніше кристали відфільтровують, промивають тричі етилацетатом (3´0,4мл), та сушать під зменшеним тиском при 40°С. Загалом отримують 170мг кристалічного названого продукту, вихід приблизно 82%. Спосіб 9 Сполуку А (20,0г; дивись Отримання А вище) розчиняють у ізопропанолі (146,6мл) при 40°С та етансульфонову кислоту (3,46мл, 95%, 1екв.) додають до розчину. До утвореного прозорого розчину додають засівальні кристали етансульфонату сполуки А (50мг; дивись Способи 4-8 вище). Тоді додають етилацетат (234мл) протягом 10 хвилин. Утворений трохи каламутний розчин засівають ще (70мг) та залишають протягом 1 години при 40°С з перемішуванням для початку кристалізації. Після цього загалом 352мл етилацетату додають при постійній швидкості протягом 1 години. Коли увесь етилацетат додано, кашку залишають на 1 годину, а потім охолоджують до 21°С протягом 2 годин. Кристалізації дають продовжуватися протягом 1 години при 21°С, а потім кристали відфільтровують, промивають двічі етилацетатом (50мл+60мл) та під кінець, сушать під зменшеним тиском при 40°С протягом ночі. Загалом отримують 21,6г білої кристалічної солі, вихід приблизно 90%. Етансульфонат сполуки А характеризують ЯМР таким чином: 23мг солі розчиняють у дейтерованому метанолі (0,7мл). Застосовують комбінацію ЯМР-експериментів 1D (1H, 13С та селективний ΝΟΕ) та 2D (gCOSY, gHSQC та gHMBC). Усі дані гарно узгоджуються з теоретичною структурою солі, показаною нижче. Молекула існує у двох конформаціях у метанолі. На основі інтегрального піку, віднесеного до Н5 (домінантний конформер) та піку, віднесеного до Н5' (інший конформер), співвідношення між двома конформерами виявлено як 70:30. Н22 не спостерігати, оскільки ці протони швидко обмінюються з розчинником CD3OD. 35 82191 36 Резонанс протону та карбону, відповідних позиції 1 розщеплюється внаслідок спінсполучення з двома ядрами флуору у тій позиції. Константи сполучення дорівнюють 2JH-F=73Гц та 1 JC-F=263Гц. Віднесення хімічного зсуву 1Н та 13С ЯМР та кореляції протон-протон показано у таблиці 2. МСВР розраховано для C24H29ClF2N4O8S (MH)- 605,1284, виявлено 605,1296. Кристали етансульфонату сполуки А (отримано з одного чи більше прикладів 4-9 вище) аналізовано РДП та результати нижченаведено (Таблиця 3) та показано у Фіг.1. 37 ДСК показала ендотерм з ектрапольованою температурою початку плавлення приблизно 131°С. ТГМА показав зменшення маси приблизно 0,2мас.% біля температури плавлення. ДСК аналіз, повторений зі зразком нижчого вмісту розчиннику, показав температуру початку плавлення приблизно 144°С. Спосіб 10 Отримання аморфного бензолсульфонату сполуки А Сполуку А (199мг, дивись Отримання А вище) розчиняють в етанолі (2мл). Бензолсульфонову кислоту (1екв. 90%, 70мг) розчиняють в етанолі (1мл) у колбі. Етанольний розчин кислоти додають 82191 38 до розчину сполуки А та колбу промивають 1мл етанолу, який тоді додають до суміші. Суміш перемішують протягом кількох хвилин, а тоді етанол випарюють до масла. Етилацетат (3мл) додають та розчинник випарюють знов досуха. Утворюється аморфний твердий продукт. Способи 11-13: Отримання кристалічного бензолсульфонату сполуки А Спосіб 11: Кристалізація аморфного матеріалу Аморфний бензолсульфонат сполуки А (20,7мг; дивись Спосіб вище) суспендують в етилацетаті (600мкл). Через 5 діб кристалічні голки спостерігають у кашці. Способи 12 та 13: Реакція Кристалізації Спосіб 12 Сполуку А (128мг; дивись Отримання А вище) розчиняють в етилацетаті (3мл). Розчин засівають кашкою зі способу 11 вище. Тоді додають бензолсульфонову кислоту (1екв., 90%, 45мг). Осадження бензолсульфонату відбувається негайно. До кашки додають ізопропанол (0,8мл) та суміш засівають знов. Дві доби пізніше речовина перетворюється у кристалічні голки. Кашку відфільтровують, промивають етилацетатомом (3´0,2мл) та недовго сушать під вакуумом при 40°С. Загалом отримують приблизно 140мг білого твердого продукту. Спосіб 13 Сполуку А (246мг; дивись Отримання А вище) розчиняють в ізо-пропанолі (1,52мл). Додають бензолсульфонову кислоту (88мг, 90%). До прозорого розчину додають етилацетат (3мл), а ході суміш засівають для виклику кристалізації. Через 1 годину, додають ще етилацетат (2,77мл). Під кінець, кашці дають кристалізуватися протягом ночі, а потім кристали відфільтровують, промивають етилацетатом (3´0,3мл) та сушать при 40°С під вакуумом. Загалом отримують 279мг солі, вихід приблизно 86%. Бензолсульфонат сполуки А характеризують ЯМР таким чином: 20мг солі розчиняють у дейтерованому метанолі (0,7мл). Застосовують комбінацію ЯМР-експериментів 1D (1Н, 13С та селективний ΝΟΕ) та 2D (gCOSY, gHSQC та gHMBC). Усі дані гарно узгоджуються з теоретичною структурою солі, показаною нижче. Молекула існує у двох конформаціях у метанолі. На основі інтегрального піку, віднесеного до Н12 (домінантний конфор-мер) та піку, віднесеного до Н12' (інший конформер), співвідношення між двома конформерами виявлено як 70:30. Н22 не спостерігати, оскільки ці протони швидко обмінюються з розчинником CD3OD. 39 82191 40 Резонанс протону та карбону, відповідних позиції 1 розщеплюється внаслідок спінсполучення з двома ядрами флуору у тій позиції. Константи сполучення дорівнюють 2JH-F=74Гц та 1 JC-F=260Гц. Віднесення хімічного зсуву 1Н та 13С ЯМР та кореляції протон-протон показано у таблиці 4. f Множинність важка для визначення внаслідок перекривання між резонансом 102 та 103 МСВР розраховано для C28H29CIF2N4O8S (MH)- 653,1284, виявлено 653,1312. Кристали бензолсульфонату сполуки А (отримано з одного чи більше прикладів 11-13 вище) аналізують РДП та результати нижченаведено (Таблиця 5) та показано у Фіг.2. 41 82191 42 Способи 15 та 16: Отримання кристалічного нпропансульфонату сполуки А Спосіб 15: Кристалізація аморфного матеріалу Аморфний н-пропансульфонат сполуки А (20мг; дивись Спосіб 14 вище) розчиняють в ізопропанолі (60 TL) та додають ізо-пропілацетат (180 TL). Через 3 доби спостерігають кристалічні голки. Спосіб 16: Реакція кристалізації Сполуку А (229мг; дивись Отримання А вище) розчиняють в ізопропанолі (1,43мл) і додають нпропансульфонову кислоту (1екв., 95%, 48 TL). Етилацетат додають (2мл), а тоді розчин засівають кристалічною сіллю зі способу вище. Ще додають етилацетат (5мл) та кашку залишають на ніч кристалізуватися. Кристали відфільтровують, промивають етилацетатом (3´0,3мл) та сушать під вакуумом при 40°С. Н-пролансульфонат сполуки А характеризують ЯМР таким чином: 20мг солі розчиняють у дейтерованому метанолі (0,7мл). Застосовують комбінацію ЯМР-експериментів 1D (1Н, 13С та селективний NOE) та 2D (gCOSY, gHSQC та gHMBC). Усі дані гарно узгоджуються з теоретичною структурою солі, показаною нижче. Молекула існує у двох конформаціях у метанолі. На основі інтегрального піку, віднесеного до Н12 (домінантний конформер) та піку, віднесеного до Н12' (інший конформер), співвідношення між двома конформерами виявлено як 70:30. Н22 не спостерігати, оскільки ці протони швидко обмінюються з розчинником CD3OD. ДСК показала ендотерм з ектрапольованою температурою початку плавлення приблизно 152°С. ТГМА показав зменшення маси приблизно 0,1мас.% біля температури плавлення. Спосіб 14 Отримання аморфного н-пропансульфонату сполуки А Сполуку А (186мг; дивись Отримання А вище) розчиняють в ізопропанолі (1,39мл) та нпропансульфонов кислот (1екв., 95%, 39 TL) додають, Етилацетат (5,6мл) додають та розчинник випарюють досуха, утворюється аморфний твердий продукт. Резонанс протону та карбону, відповідних позиції 1 розщеплюється внаслідок спінсполучення з двома ядрами флуору у тій позиції. Константи сполучення дорівнюють 2JH-F=74Гц та 1 JC-F=260Гц. Віднесення хімічного зсуву 1Н та 13С ЯМР та кореляції протон-протон показано у таблиці 6. 43 МСВР розрахованодля C25H31CIF2N4O8S (М-Н)619,1441, виявлено 619,1436,66 Кристали нпропансульфонату сполуки А (отримано з одного чи більше прикладів 15 - 16 вище) аналізують РДП та результати нижченаведено (Таблиця 7) та показано У Фіг 3. 82191 44 45 82191 46 ДСК показала ендотерм з ектрапольованою температурою початку плавлення приблизно 135°С. ТГМА не показав зменшення маси біля температури плавлення. Спосіб 17 Спосіб 17-А: Отримання аморфного бутансульфонату сполуки А Аморфну сполуку А (277мг) розчиняють в ІРА (1,77мл) та додають бутансульфонову кислоту (приблизно 1екв. 70мкл). Етилацетат (6мл) додають та розчинник випарюють досуха, утворюється аморфний твердий продукт. Спосіб 17-В: Отримання кристалічного бутансульфонату сполуки А Аморфний бутансульфонат сполуки А (71,5мг; дивись отримання вище) суспендують в етилацетаті (500р,1) протягом ночі. Кристали відфільтровують та сушать на повітрі. Бутансульфонат сполуки А характеризують ЯМР таким чином: 20мг солі розчиняють у дейтерованому метанолі (0,7мл) та досліджують спектроскопією 1Н та 13С ЯМР. Спектри дуже подібні до інших солей тої ж сполуки і гарно узгоджуються з теоретичною структурою солі, показаною нижче. Більшість резонансів у спектрах присутні як сукупності двох піків внаслідок повільного обертання навкруги зв'язку C9-N10, що призводить до двох атропізомерів, які одночасно існують у розчині. Це показано для інших солей тої ж сполуки. Два ядра флуору у позиції 1 призводять до розщеплення резонансів для протону та карбону у тій позиції. Константи сполучення дорівнюють 2JH1 F=73Гц та J C-F=258Гц. Хімічні зсуви для протонів та атомів карбону представлені у таблиці 1. Протони у позиці 22 та 24 не визначено внаслідок хімічного обміну. Існує дуже широкий максимум між 8 та 9млн-1 у спектрі протонів, відповідному цим протонам. па=не відповідно, nd=нe визначено МСВР розраховано для (М-Н)- 633.1597, виявлено 633,1600 Кристали бутансульфонаггу сполуки А (отримано як описано вище у способі 17-В) аналізують РДП та результати нижненаведено (Таблиця 9) та показано у Фіг.4. 47 82191 48 Наступний загальний спосіб застосовують для отримання солей сполуки В: 200мг сполуки В (дивись Отримання В вище) розчиняють у 5мл МІБК (метил-ізо-бутилкетон). До цього розчину додають розчин доречної кислоти (1,0 або 0,5 молярного еквіваленту, як визначено у таблиці 10) у розчині у 1,0мл МІБК. Після перемішування протягом 10 хвилин при кімнатній температурі розчинник видаляють на роторному випарнику. Залишок твердого матеріалу знов розчиняють у приблизно 8мл ацетонітрилугводи (1:1). Сушкою сублімацією у кожному випадку отримують безбарвний аморфний матеріал. Застосовані кислоти: Езилат (етансульфонова кислота) Безилат (бензолсульфонова кислота) Циклогексилсульфамат Сульфат Бромід п-Толуолсульфонат 2-Нафталінсульфонат Гемі сульфат Метансульфонат Нітрат Гідро хлорид Прийнятні характеристичні дані показано у таблиці 10 ДСК показала ендотерм з ектрапольованою температурою початку плавлення приблизно 118°С та ТГМА показав зменшення маси 0,04%. Спосіб 18: Отримання солей сполуки В Спосіб 18-А: Загальний спосіб отримання солей Усі утворені аморфними. Спосіб 18-В у цьому прикладі солі ε 49 Крім того аморфні солі сполуки В отримують, застосовуючи способи, аналогічні описаним у способі 18-А вище для таких кислот: 1,2-Етандисульфонова (0,5 сіль) 1S-камфорсульфонова (+/-)-камфорсульфонова п-Ксилолсульфонова 2-Мезитиленсульфонова Сахарин Малеїнова Фосфатна D-глутамінова L-аргінін L-лізин L-лізин·НСІ Спосіб 18-С: Отримання аморфної сполуки В. Гемі-1,5-нафталіндисульфонат Аморфну сполуку В (110,9мг) розчиняють у 2,5мл 2-пропанолу та додають 0,5 еквіваленту 1,5нафтапін-дисульфонової кислоти тетрагідрату (розчинено у 1мл 2-пропанолу). Зразок перемішують протягом ночі. У мікроскопі спостерігають тільки невеликі частинки (аморфні) або масляні краплі. Зразок випарюють досуха. Спосіб 18-D: Отримання кристалічного гемі1,5-нафталіндисульфонату сполуки В Кристалізаційний експеримент проводять при температурі довкілля. Аморфну сполуку В (0,4г) розчиняють в етанолі (1,5мл) та додають 0,5екв. 1,5-нафталіндисульфонової кислоти тетрагідрату (1,35г, 10 % в етанолі). Гептан (0,7мл) тоді додають до розчину, що стає слабко каламутним. Після приблизно 15 хвилин розчин стає каламутним. Після приблизно 30 хвилин отримують рідку кашку та додатково додають гептан (1,3мл). Кашку тоді залишають протягом ночі для визрівання. До розбавленої густої кашки додають суміш етанолу та гептану (1,5мл та 1,0мл відповідно). Після приблизно 1 години кашку фільтрують та кристали промивають сумішшю етанолу та гептану (1,5:1) та під кінець чистим гептаном. Кристали сушать при зовнішній температурі 1 добу. Сухі кристали важать 0,395г. Спосіб 18-Е: Отримання кристалічного гемі1,5-нафталіндисульфонату сполуки В Аморфну сполуку В (1,009г) розчиняють у 20мл 2-пропанолу + 20мл етилацетату. 351,7мг 1,5-нафталіндисульфонової кислоти тетрагідрату, розчиняють у 20мл 2-пропанолу і додають краплями. Осадження відбувається приблизно протягом 5 хвилин. Кашку перемішують протягом ночі, а тоді фільтрують. Спосіб 18-F: Отримання кристалічного гемі1,5-нафталіндисульфонату сполуки В 430,7мг 1,5нафталін-дисульфонату розчиняють у 30мл 1пропанолу. Розчин гріють до кипіння для розчинення речовини. Розчин залишають протягом ночі при температурі довкілля для кристалізації, а тоді кристали відфільтровують. Спосіб 18-G: Отримання кристалічного гемі1,5-нафталіндисульфонату сполуки В Маточник зі способу 18-F випарюють та твердий залишок (61,2мг) розчиняють у 6мл суміші ацетонітрил/1пропанол, співвідношення 2:1. Розчин залишають 82191 50 на ніч при температурі довкілля кристалізуватися, а тоді кристали відфільтровують. Спосіб 18-Н: Отримання кристалічного гемі1,5-нафталіндисульфонату сполуки В Зразок зі способу 18-С розчиняють у приблизно 2мл метанолу. Етанол (приблизно 3мл) додають як анти-розчинник при температурі довкілля та додають засівальні кристали. Кристалізація не відбувається, відтак розчинники випарюють (приблизно половину кількості) та додають нову порцію етанолу (приблизно 2мл) та засівальні кристали. Кристалічні частинки утворюються при перемішуванні при температурі довкілля протягом ночі. Спосіб 18-1: Отримання кристалічного гемі1,5-нафталіндисульфонату сполуки В Аморфну сполуку В (104,1мг) розчиняють у 2-пропанолі та 1 еквівалент 1,5-нафталін-дисульфонової кислоти тетрагідрату розчиняють у 2-пропанолі і додають Загалом, кількість 2-пропанолу складає приблизно 2,5мл. Розчин перемішують при 44°С протягом приблизно 80 хвилин та утворюється осад. Частинки є кристалічними згідно поляризованому світловому мікроскопу. Зразок фільтрують. Спосіб 18-J: Отримання кристалічного гемі-1,5нафталіндисульфонату сполуки В Гемі-1,5нафталіндисульфонат сполуки В (56,4мг) розчиняють у 1,5мл метанолу. Метилетилкетон (3мл) додають. До розчину додають засівальні кристали та кристалізація починається. Кристали відфільтровують, промивають метилетилкетоном та сушать на повітрі. Спосіб 18-К: Отримання кристалічного гемі1,5-нафталіндисульфонату сполуки В Аморфну сполуку В (161,0мг) розчиняють у 3,5мл 1бутанолу та розчин гріють до 40°С. В іншому стакані розчиняють 57,4мг 1,5-нафталіндисульфонової кислоти тетрагідрату у 3мл 1бутанолу. Кілька крапель розчину кислоти додають до розчину сполуки В. Тоді до розчину додають засівальні кристали та після 2 годин повільно додають залишок розчину кислоти (при 40°С). Тоді температур повільно зменшують до кімнатної температури та експеримент залишають з перемішуванням протягом ночі. Кашку фільтрують, промивають 1-бутанолом . та сушать під вакуумом при 44°С протягом 2 годин. Вихід 83%. Ідентифікація Кристали гемі-1,5-нафталіндисульфонату сполуки В, отримані шляхом способу 18-D вище, характеризують ЯМР таким чином: 21,3мг солі розчиняють у дейтерованому метанолі, 0,7мл досліджують спектроскопією ЯМР. Застосовують комбінацію ЯМР-експериментів 1D (1Н, 13С та селективний NOE) та 2D (gCOSY, gHSQC та gHMBC). Усі дані гарно узгоджуються з пропонованою структурою солі, показаною нижче. Усі атоми карбону та протони, приєднані до атоми карбону номіновано. Протони, приєднані до гетероатомів, обмінюються з дейтерієм розчиннику та є не визначеними. Більшість резонансів у ЯМР-спектрах 1D 1Н та 13С присутні 51 82191 52 як сукупності двох піків. Причиною цього є повільне обертання навкруги зв'язку C9-N10 що призводить до двох атропізомерів, які одночасно існують у розчині. Експеримент 1D NOE є свідоцтвом цього. Коли резонанс одного атропізомеру є випромінюваним, насичення переносять до відповідного піку іншого атропізомеру. Резонанси, відповідні протиіону 1,5нафталіндисульфонату не показують атропізомерії. Існує 4 атоми флуору у молекул. Вони призводять до розщеплення резонансів для деяких протонів та атомів карбону. Резонанс протону та карбону, відповідний позиції 1, розщеплюється внаслідок спін-сполучення з двома ядрами флуору у тій позиції. Константи сполучення дорівнюють 2JH-F=73Гц та 1JС-F=263Гц. Крім того, резонанс протону, відповідний до Н19 є перекрученим дублетом з 3JH-F=6,9Гц внаслідок спін-сполучення з ядрами флуору у позиції 18. Резонанси карбону, відповідні С17, С18, С19 та С20 також виявляють сполучення з цими ядрами флуору. Резонанси С17 та С20 є триплетами з 2JC3 F=19Гц та J C-F=11Гц, відповідно. Резонанс С18 є дублетом дублетів з константами сполучення 1JC3 та JC-F=8Гц. Резонанс С19 є F=251Гц мультиплетом. Порівняння величин інтегралів для резонансів, відповідних протиіону 1,5-нафталіндисульфонат та основній сполуці, дає стехіометричне співвідношення для одиничного, протиіону 1,5нафталіндисульфонату, що кристалізується з двома молекулами основної сполуки. Віднесення хімічного зсуву 1Н та 13С ЯМР та кореляції протон-протон показано у таблиці 11. а Відносно резонансу розчиннику при 49,0млн-1. Відносно резонансу розчиннику при 3,30млн-1. c s=синтет, d=дублет, dd=дублет дублетів, t=триплет, m=мультиплет. Отримано у експерименті gCOSY. d Резонансом є триплет внаслідок сполучення з двома ядрами флуору F1.1 JC-F=263Гц. t Резонансом є триплет внаслідок сполучення з двома ядрами флуору F18. 2JC-F=19Гц. g Резонансом є дублет дублетів внаслідок сполучення з двома ядрами флуору F18. 1 JC-F=251Гц та 3JC-F=8Гц b 53 g Резонансом є мультиплет внаслідок сполучення з двома ядрами флуору F18. i Резонансом є триплет внаслідок сполучення з двома ядрами флуору F18. k Резонансом є триплет внаслідок сполучення з двома ядрами флуору F18. 3JC-F=11Гц n Сполучення 4JHH з мета-протонами не є повністю розв'язаним. nа= не відповідно, nd=нe визначено Кристали гемі-1,5-нафталіндисульфонату сполуки В (отримано способом 18-1 вище, аналізують РДП та результати нижченаведено (Таблиця 12) та показано у Фіг.5. ДСК показала ендотерм з ектрапольованою температурою початку плавлення приблизно 183°С, а ТГА показав 0,3% втрати маси між 25110°С. Скорочення: Ас= ацетил АсОН= оцтова кислота ХІАТ= хімічна іонізація при атмосферному тиску (стосовно МС) 82191 54 ІАТ= іонізація при атмосферному тиску (стосовно МС) AUC= площа під кривою Aze= (S)-азетидин-2-карбоксилат (якщо не визначено інакше) AzeOH= азетидин-2-карбонова кислота Вn= бензил Воc= трет-бутилоксикарбоніл Вu= бутил Bzl= бензил XI= хімічна іонізація (стосовно МС) DCC= дициклогексилкарбодіімід DIBAL-H= ді-ізобутилалюміній гідрид DIPEA= діізопропілетиламін DMAP= 4-(N,N-диметиламіно)піридин ДМФ= диметилформамід ДМСО= диметилсульфоксид ' DVT= глибокий тромбоз вен EDC= 1-(3-диметиламінопропіл)-3етилкарбодіімідгідрохлорид е.н.= енантіомерний надлишок Et= етил Et2O= діетиловий етер EtOAc= етилацетат EtOH= етанол Ефір= діетиловий етер HATU= О-(аза6ензотриазол-1-іл)-N,N,N',N'тетраметилуроній гексафлуорфосфат HUTU= [N,N,N',N'-тетраметил-O(бензотриазол-1-іл)уронм гексафлуорфосфат] НСІ= гідрохлоридна кислота, газ гідрогенхлорид або гідрохлорид (залежно від контексту НОАс= оцтова кислота ВЕРХ= високоефективна рідинна хроматографія РХ= рідинна хроматографія Me= метил MEM= метоксіетоксиметил MeOH= метанол МС= мас-спектроскопія МТВЕ= метил-трет-бутиловий етер NADH= нікотинамід аденін динуклеотид, відновлена форма NADPH= нікотинамід аденін динуклеотид фосфат, відновлена форма NIH= Національний інститут здоров'я (США) NIHU= одиниці Національного інституту здоров'я ЯМР= ядерний магнітний резонанс ОАс= ацетат Pab= пара-амідинобензиламіно H-Pab= пара-амідинобензиламін Ph= феніл Рr= пропіл Pro= (S)-nponiHm РуВОР= (бензотриазол-іілокси)трипіролідинофосфоній гексафлуорфосфат QF= тетрабутиламоній флуорид RedAI= натрій біс(2-метоксіетокси)алюміній гідрид ОФРХ= оберено-фазова високоефективна рідинна хроматографія SOP= стандартний спосіб роботи 55 TBTU= [N,N,N',N'-тетраметил-O(бензотриазол-1-іл)уроній тетрафлуорбораті TEA= триетиламін Теос= 2-(триметилсиліл)етоксикарбоніл TEMPO= 2,2,6,6-тетраметил-1піперидинілоксил, вільний радикал ТФОК= трифлуороцтова кислота ТГФ= тетрагідрофуран ТГП= тетрагідропіраніл ТШХ= тонкошарова хроматографія TMSCl= триметилсилілхлорид TMSCN= триметилсилілціанід УФ= ультрафіолет Ζ= бензилоксикарбоніл Префікси н, втор, і та t мають їх звичайні значення: нормальний, вторинний, ізо та третинний, с означає циклічний. Винахід ілюстровано, але без обмеження, наступними прикладами. Приклад 1 Сполука А 30мкмоль ПЕГ 400/етанол/вода 50/5/45мас.% до 1мл Композицію отримують розчиненням сполуки А у суміші ПЕГ 400/етанол/вода 50/5/45мас%, а потім обережно перемішують. Цю композицію уводять собакам перорально через шлунковий зонд раз на добу протягом 5 діб. Доза 150мкмоль/кг дає максимум концентрації у плазмі у межах 118-254мкМ (118-254мкмоль/л) після першої дози та 186-286мкМ (186-286мкмоль/л) після п'ятої дози. Приклад 2 Сполука А 40мкмоль ПЕГ 400/етанол/вода 50/5/45мас.% до 1мл Композицію отримують розчиненням сполуки А у суміші ПЕГ 400/етанол/вода 50/5/45мас.%, а потім обережно перемішують. Цю композицію уводять щурам перорально через шлунковий зонд раз на добу протягом 5 діб. Доза 400мкмоль/кг дає максимум концентрації у плазмі у межах 3,176,91мкМ (3,17-6,91мкмоль/л) після першої дози та 3,01-10,5мкМ (3,01-10,5мкмоль/л) після п'ятої дози. Приклад 3 Сполука А 80мкмоль ПЕГ 400/етанол/вода 50/5/45мас.% до 1мл Композицію отримують розчиненням сполуки А у суміші ПЕГ 400/етанол/вода 50/5/45мас.%, а потім обережно перемішують Цю композицію уводять щурам перорально через шлунковий зонд раз на добу протягом 5 діб. Доза 800мкмоль/кг дає максимум концентрації у плазмі у межах 7,0023,9мкМ (7,00-23,9мкмоль/л) після першої дози та 10,3-32,8мкМ (10,3-32,8мкмоль/л) після п'ятої дози. Приклад 4 Сполука А Сполука А 250мкмоль ПЕГ 400/етанол/вода 50/5/45мас.% до 1мл Композицію отримують розчиненням сполуки А у суміші ПЕГ 400/етанол/вода 50/5/45мас.%, а потім обережно перемішують. Розчинність сполуки А є принаймні у 1000 разів вище у цьому носи у порівнянні з водою поодинці. Приклад 5 Сполука А 21мкмоль ПЕГ 400/етанол/вода 20/10/70мас.% до1мл 82191 56 Композицію отримують розчиненням сполуки А у суміші ПЕГ 400/етанол/вода 20/10/70мас.%, а потім обережно перемішують. Розчинність сполуки А є принаймні у 100 разів вище у цьому носи у порівнянні з водою поодинці, Приклад 6 Сполука А 51мкмоль ПЕГ 400/етанол/вода 20/10/70мас.% до 1мл Вода містить 50мкмоль/мл винної кислоти Композицію отримують розчиненням сполуки А у підкисленій суміші ПЕГ 400/етанол/вода 20/10/70мас.%, а потім обережно перемішують. рН цього розчину є 3,6. Розчинність сполуки А є принаймні у 250 разів вище у цьому носії у порівнянні з водою поодинці. Приклад 7 Сполука А 44мкмоль ПЕГ 400/етанол/вода 30/5/65мас.% до 1мл Композицію отримують розчиненням сполуки А у суміші ПЕГ 400/етанол/вода 30/5/65мас.%, а потім обережно перемішують. Розчинність сполуки А є принаймні у 200 разів вище у цьому носії у порівнянні з водою поодинці. Приклад 8 Сполука А 88мкмоль ПЕГ 400/етанол/вода 30/5/65мас.% до 1мл Сполука А 88мкмоль ПЕГ 400/етанол/вода 30/5/65мас.% до 1мл Вода містить 50мкмоль/мл винної кислоти НСІ до рН3,6 Композицію отримують розчиненням сполуки А у підкисленій суміші ПЕГ 400/етанол/вода 30/5/65мас.%, а потім обережно перемішують. рН цього розчину доводять до 3,6 додаванням НСІ. Розчинність сполуки А є принаймні у 400 разів вище у цьому носи у порівнянні з водою поодинці. Приклад 9 Сполука А 120мкмоль ПЕГ 400/етанол/вода 40/5/55мас.% до 1мл Композицію отримують розчиненням сполуки А у суміші ПЕГ 400/етанол/вода 40/5/55мас.%, а потім обережно перемішують. Розчинність сполуки А є принаймні у 600 разів вище у цьому носії у порівнянні з водою поодинці. Приклад 10 Сполука А 198мкмоль ПЕГ 400/етанол/вода 40/5/55мас.% до 1мл Вода містить 50мкмоль/мл винної кислоти НСІ до рН 3,8 Композицію отримують розчиненням сполуки А у підкисленій суміші ПЕГ 400/етанол/вода 40/5/55мас.%, а потім обережно перемішують. рН цього розчину доводять до 3,8 додаванням НСІ. Розчинність сполуки А є принаймні у 1000 разів вище у цьому носії у порівнянні з водою поодинці. Композиції сполуки А у цьому носії є стабільними протягом принаймні 3 місяці при менше -15°С. Приклад 11 Сполука А 136мкмоль 57 Гідроксипропіл-βциклодекстрин/вода 40/60мас.% до 1мл НСІ до рН 3,7 Композицію отримують розчиненням сполуки А у суміші гідроксипропіл-β-циклодекстрин/вода 40/60мас.%, а потім обережно перемішують. рН цього розчину доводять до 4,7 додаванням НСІ. Розчинність сполуки А є принаймні у 700 разів вище у цьому носії у порівнянні з водою поодинці. Приклад 12 Сполука А 76мкмоль Гідроксипропіл-βциклодекстрин/вода 28/72мас.% до 1мл Композицію отримують розчиненням сполуки А у суміші гідроксипропіл-β-циклодекстрин/вода 28/72мас.%, а потім обережно перемішують. Розчинність сполуки А є принаймні у 400 разів вище у цьому носії у порівнянні з водою поодинці. Приклад 13 Сполука А 40мкмоль ПЕГ400/етанол/solutol™/вода 50/5/5/40мас.% до 1мл Композицію отримують розчиненням сполуки А у суміші ПЕГ 400/етанол/ solutol™/вода 50/5/5/40мас.%, а потім обережно перемішують. Розчинність сполуки А є принаймні у 80 разів вище у цьому носи у порівнянні з водою поодинці. Приклад 14 Сполука А 40мкмоль ПЕГ 400/вода 40/60мас.% до 1мл Композицію отримують розчиненням сполуки А у ПЕГ 400, а потім обережно перемішують протягом принаймні 1 години, потім додають воду до кінцевого об'єму. Розчинність сполуки А є принаймні у 200 разів вище у цьому носії у порівнянні з водою поодинці. Приклад 15 Сполука А 52мкмоль ПЕГ 400/вода 35/65мас.% до 1мл Вода містить 50мкмоль/мл винної кислоти Композицію отримують розчиненням сполуки А у ПЕГ 400, а потім обережно перемішують протягом принаймні 1 години, потім додають воду до кінцевого об'єму. Розчинність сполуки А є принаймні у 250 разів вище у цьому носії у порівнянні з водою поодинці. Приклад 16 Сполука А 58мкмоль ПЕГ 400/вода 50/50мас.% до 1мл Композицію отримують розчиненням сполуки А у ПЕГ 400, а потім обережно перемішують протягом принаймні 1 години, потім додають воду до кінцевого об'єму. Розчинність сполуки А є принаймні у 300 разів вище у цьому носії у порівнянні з водою поодинці. 63 Приклад 17 Сполука А 88мкмоль ПЕГ 400/вода 67/33мас.% до 1мл Композицію отримують розчиненням сполуки А у ПЕГ 400, а потім обережно перемішують протягом принаймні 1 години, потім додають воду до кінцевого об'єму. Розчинність сполуки А є принаймні у 400 разів вище у цьому носії у порівнянні з водою поодинці. Приклад 18 82191 58 Сполука А 92мкмоль ПЕГ 400/етанол/вода 45/1/54мас.% до 1мл Композицію отримують розчиненням сполуки А у суміші ПЕГ 400/етанол/вода 45/1/54мас.%, а потім обережно перемішують. Розчинність сполуки А є принаймні у 450 разів вище у цьому носії у порівнянні з водою поодинці. Приклад 19 Сполука А 159мкмоль ПЕГ 400/етанол/вода 45/1/54мас.% до 1мл Вода містить 50мкмоль/мл винної кислоти НСІ до рН 4,2 Композицію отримують розчиненням сполуки А у підкисленій суміші ПЕГ 400/етанол/вода 45/1/54мас.%, а потім обережно перемішують. рН цього розчину доводять до 4,2 з НСІ. Розчинність сполуки А є принаймні у 800 разів вище у цьому носи у порівнянні з · водою поодинці. Приклад 20 Сполука А 101мкмоль ПЕГ 400/етанол/вода 45/2/53мас.% до1мл Композицію отримують розчиненням сполуки А у суміші ПЕГ 400/етанол/вода 45/2/53мас.%, а потім обережно перемішують. Розчинність сполуки А є принаймні у 500 разів вище у цьому носії у порівнянні з водою поодинці. Приклад 21 Сполука А 167мкмоль ПЕГ 400/етанол/вода 45/2/53мас.% до1мл Вода містить 50мкмоль/мл винної кислоти НСІ до рН4,3 Композицію отримують розчиненням сполуки А у підкисленій суміші ПЕГ 400/етанол/вода 45/2/53мас.%, а потім обережно перемішують. рН цього розчину доводять до 4,3 додаванням НСІ. Розчинність сполуки А є принаймні у 800 разів вище у цьому носії у порівнянні з водою поодинці. Приклад 22 Сполука А 46мкмоль ДМА/вода 50/50мас.% до 1мл Композицію отримують розчиненням сполуки А у носії, а потім обережно перемішують протягом принаймні 1 години. Розчинність сполуки А є принаймні у 230 разів вище у цьому носії у порівнянні з водою поодинці. Приклад 23 Сполука А 29мкмоль ДМА/вода 25/75мас.% до 1мл Композицію отримують розчиненням сполуки А у носії, а потім обережно перемішують протягом принаймні 1 години. Розчинність сполуки А є принаймні у 150 разів вище у цьому носії у порівнянні з водою поодинці. Приклад 24 Сполука А 6мкмоль HCl 10мкмоль Вода до 1мл HCI/NaOH до рН3,6 Композицію отримують розчиненням сполуки А у меншому об'ємі подвійної еквімо-лярної кількості НСІ, а потім обережно перемішують та 59 розводять до 1мл. рН кінцевого розчину доводять до 3,6. Розчинність сполуки А є принаймні у 20 разів вище у цьому носії у порівнянні з водою поодинці. Приклад 25 Сполука А 10мкмоль Вода до 1мл НСІ до рН1,0 NaOH до рН3,0. Композицію отримують розчиненням сполуки А у воді та додають НСІ до рН1, потім розчин обережно перемішують. рН кінцевого розчину доводять до 3,0 NaOH. Розчинність сполуки А є принаймні у 40 разів вище у цьому носії у порівнянні з водою поодинці. Цю композицію уводять перорально щурам у порівняльному кінетичному дослідженні. Приклад 26 Сполука А 100мкмоль Мігліол 0,25г/г сполуки А ДМА до 1мл Композицію отримують розчиненням сполуки А у 1мл ДМА/мігліол, а потім обережно перемішують. Розчинність сполуки А є принаймні у 4000 разів вище у цьому носії у порівнянні з водою поодинці. Приклад 27 Сполука А 100мкмоль Мігліол 0,25г/г сполуки А Етанол до 1мл Композицію отримують розчиненням сполуки А у 1мл суміші етанол/мігліол, а потім обережно перемішують. Розчинність сполуки А є принаймні у 4000 разів вище у цьому носії у порівнянні з водою поодинці. Приклад 28 Сполука А 130мкмоль Етанол до 1мл Композицію отримують розчиненням сполуки А у 1мл етанолу, а потім обережно перемішують. Речовина є стабільною у цій композиції більше 1 тижня. Приклад 29 Для отримання використовують приблизно 100мМ вихідний розчин наночастинок сполуки А в етанолі. Залучено також 25мас.% мігліолу, розраховано від кількості речовини. Розчини розводять 1/10 стабілізаційним розчином, що складається з 0,2мас.% ПВП та 0,25мМ НДС у воді. Змішування, що є важливим як критичний параметр при отриманні наночастинок, є швидким та негайним. Розчин ліків швидко уводять у стабілізаційний розчин протягом обробки ультразвуком. Після розведення 1/10 у водному розчині, досягають наночастинок приблизно по 150нм. Після б годин при кімнатній температурі, розміри частинок не змінюється. Приклад 30 Сполука А 4мкмоль Фізіологічний розчин солі/етанол/солютол 90/5/5мас.% до 1мл Композицію отримують розчиненням сполуки А у суміші фізіологічний розчин солі/етанол/солютол 90/5/5мас.%, а потім обережно перемішують. Розчин уводять 82191 60 перорально щурам, концентрація у плазмі сполуки D є 0,56мкмоль/л після 1 години. Розчин уводять підшкірно щурам та концентрації у плазмі сполук D та А є 0,24мкмоль/л та 0,6мкмоль/л, відповідно, після 1 години. Приклад 31 Сполука В 4мкмоль Фізіологічний розчин солі/етанол/солютол 90/5/5мас.% до 1мл Композицію отримують розчиненням сполуки В у суміші фізіологічний розчин солі/етанол/солютол 90/5/5мас.%, а потім обережно перемішують. Розчин уводять перорально щурам та концентрації у плазмі сполук В та Сполук Ε є відповідно 0,07мкмоль/л та 0,65мкмоль/л, після 1 години. Розчин уводять перорально щурам та концентрації у плазмі сполук В та Ε є 0,4мкмоль/л та 0,3мкмоль/л, відповідно, після 1 години. Приклад 32 Сполука С 4мкмоль Фізіологічний розчин солі/етанол/солютол 90/5/5мас.% до 1мл Композицію отримують розчиненням сполуки С у суміші фізіологічний розчин солі/етанол/солютол 90/5/5мас.%, а потім обережно перемішують. Розчин уводять перорально щурам та концентрації у плазмі сполук С та F є відповідно 0,2мкмоль/л та 0,5мкмоль/л після 1 години. Розчин уводять перорально щурам та концентрації у плазмі сполук С та F є 0,35мкмоль/л та 0,5мкмоль/л, відповідно, після 1 години. Приклад 33 Сполука D (трифлуорацетат) 5мкмоль Фізіологічний розчин солі 9мг/мл до 1мл Композицію отримують розчиненням солі сполуки D у 1мл фізіологічного розчину солі, а потім обережно перемішують. Приклад 34 Сполука D (трифлуорацетат) 75мкмоль Фізіологічний розчин солі 9мг/мл до 1мл Композицію отримують розчиненням солі сполуки D у 1мл фізіологічного розчину солі/ етанол розчин, а потім обережно перемішують. Приклад 35 Сполука D (трифлуорацетат) 4мкмоль Етанол 0,02мл Фізіологічний розчин солі до 1мл Композицію отримують розчиненням солі сполуки D у 1мл суміші фізіологічний розчин солі/етанол, а потім обережно перемішують. Розчин уводять перорально щурам та концентрація у плазмі сполуки D є 0,55мкмоль/л після 1 години. Приклад 36 Сполука Ε (трифлуорацетат) 4мкмоль Етанол 0,02мл Фізіологічний розчин солі до 1мл Композицію отримують розчиненням солі сполуки Ε у 1мл суміші фізіологічний розчин солі/етанол, а потім обережно перемішують. Розчин уводять перорально щурам та концентрація у плазмі сполуки Ε є 0,75мкмоль/л після 1 години.
ДивитисяДодаткова інформація
Назва патенту англійськоюImmediate release pharmaceutical formulation
Автори англійськоюAbrahmsen Alami Susanna, Inghardt Tord, Magnusson Anders, Sigfridsson Carl-Gustaf, Thune Mikael
Назва патенту російськоюФармацевтическая таблеточная композиция немедленного высвобождения
Автори російськоюАбрамсен Алами Сусанна, Инггардт Торд, Магнуссон Андерс, Сигфридссон Карл-Густаф, Туне Микаель
МПК / Мітки
МПК: A61P 9/00, A61K 31/397, A61K 9/22, A61P 7/02
Мітки: вивільнення, композиція, негайного, фармацевтична, таблеткова
Код посилання
<a href="https://ua.patents.su/35-82191-farmacevtichna-tabletkova-kompoziciya-negajjnogo-vivilnennya.html" target="_blank" rel="follow" title="База патентів України">Фармацевтична таблеткова композиція негайного вивільнення</a>
Попередній патент: Пристрій для визначення швидкості і якісного складу речовини
Наступний патент: Композиція для обробки рослин, що містить алкоксилований спирт як ад’ювант
Випадковий патент: Спеціалізована аптечка невідкладної долікарської самодопомоги












