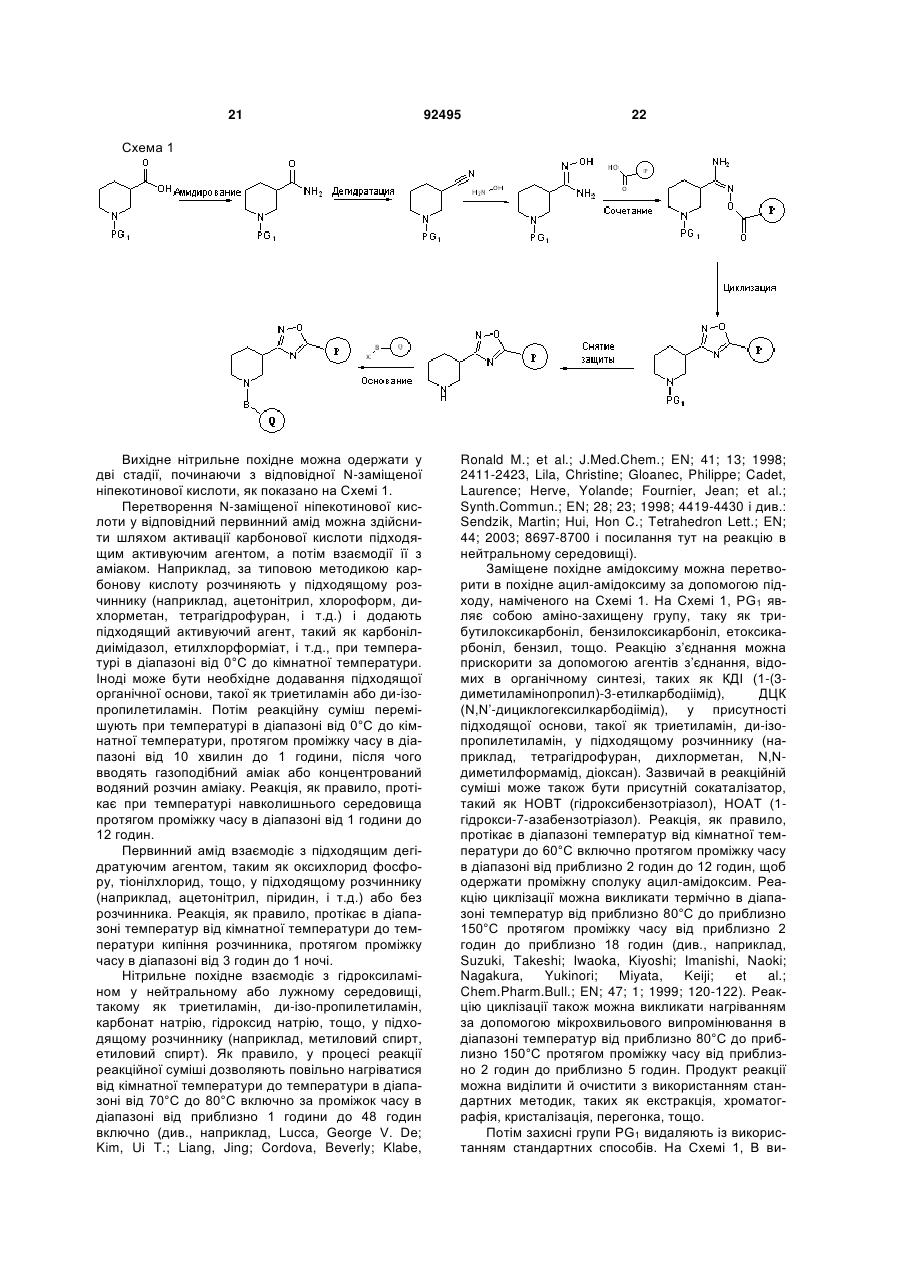
Заміщені похідні оксадіазолу як позитивні алостеричні модулятори метаботропних глутаматних рецепторів
Номер патенту: 92495
Опубліковано: 10.11.2010
Автори: Фаріна Марко, Мютєл Венсан, Полі Соня Марія, Роше Жан-Філіп, Льо Пул Еманюел, Паломбі Джованні, Гагліарді Стефанія
Формула / Реферат
1. Сполука формули І-В
 , I-B
, I-B
де:
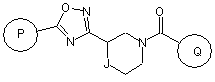
Р й Q незалежно один від одного являють собою арильну або гетероарильну групу формули:
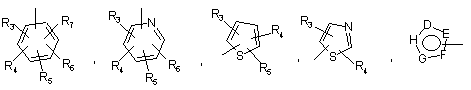 ,
,
R3, R4, R5, R6, і R7 незалежно один від одного являють собою наступні замісники: водень, галоген, -NO2, -(С1-С6)алкіл, -(С3-С6)циклоалкіл, -(С3-С7)циклоалкілалкіл, -(С2-С6)алкеніл, -(С2-С6)алкініл, галоген-(С1-С6)алкіл, гетероарил, гетероарилалкіл, арилалкіл, арил, -OR8, -NR8R9, -C(=NR10)NR8R9, -NR8COR9, NR8CO2R9, NR8SO2R9, -NR10CO NR8R9, -SR8, -S(=O)R8, -S(=O)2R8, -S(=O)2NR8R9, -С(-O)R8, -C(=O)-O-R8, -C(=O)NR8R9, -C(=NR8)R9 або C(=NOR8)R9; при цьому, можливо, два замісники разом з атомами, що знаходяться між ними, утворюють біциклічне гетероциклоалкільне, арильне або гетероарильне кільце; причому кожне кільце можливо додатково заміщене 1-5 групами, кожна з яких незалежно являє собою: галоген, -CN, -(С1-С6)алкіл, -O-(С0-С6)алкіл, -O-(С3-С7)циклоалкілалкіл, -О(арил), -О(гетероарил), -O-(-С1-С3)алкіларил, -O-(С1-С3)алкілгетероарил, -N((-С0-С6)алкіл)((С0-С3)алкіларил) або -N((С0-С6)алкіл)((С0-С3-)алкілгетероарил);
R8, R9, R10 незалежно один від одного являють собою: водень, (C1-С6)алкіл, (С3-С6)циклоалкіл, (С3-С7)циклоалкілалкіл, (С2-С6)алкеніл, (С2-С6)алкініл, галоген-(С1-С6)алкіл, гетероциклоалкіл, гетероарил, гетероарилалкіл, арилалкіл або арил, кожен з яких, можливо, заміщений 1-5 незалежними замісниками: галоген, -CN, -(С1-С6)алкіл, -O-(С0-С6)алкіл, -O-(С3-С7)циклоалкілалкіл, -О(арил), -О(гетероарил), -N((C0-С6)алкіл)2, -N((С0-С6)алкіл)((С3-С7)циклоалкіл) або -N((С0-С6)алкіл)(арил);
D, Е, F, G й Н незалежно один від одного являють собою -С(R3)=, -С(R3)=С(R4)-, -С(=O)-, -C(=S)-, -O-, -N=, -N(R3)- або -S-;
будь-який N може являти собою N-оксид;
або фармацевтично прийнятна сіль, гідрат або сольват зазначеної сполуки.
2. Сполука за п. 1, що може існувати у вигляді оптичних ізомерів, причому зазначена сполука являє собою або рацемічну суміш, або індивідуальний оптичний ізомер.
3. Сполука за будь-яким із пп. 1 або 2, яка відрізняється тим, що зазначену сполуку вибирають з:
(4-фторфеніл)-{(S)-3-[5-(4-фторфеніл)-[1,2,4]оксадіазол-3-іл]-піперидин-1-іл}-метанону;
(4-фторфеніл)-{(R)-3-[5-(4-фторфеніл)-[1,2,4]оксадіазол-3-іл]-піперидин-1-іл}-метанону;
(3,4-дифторфеніл)-{3-[5-(2-фторфеніл)-[1,2,4]оксадіазол-3-іл]-піперидин-1-іл}-метанону;
(2,4-дифторфеніл)-{3-[5-(2-фторфеніл)-[1,2,4]оксадіазол-3-іл]-піперидин-1-іл}-метанону;
(4-фтор-2-метиламінофеніл)-{3-[5-(2-фторфеніл)-[1,2,4]оксадіазол-3-іл]-піперидин-1-іл}-метанону;
{3-[5-(2-фторфеніл)-[1,2,4]оксадіазол-3-іл]-піперидин-1-іл}-(5-фторпіридин-2-іл)-метанону;
{3-[5-(2-фторфеніл)-[1,2,4]оксадіазол-3-іл]-піперидин-1-іл}-(5-метилізоксазол-4-іл)-метанону;
(4-фторфеніл)-[3-(5-тіазол-4-іл-[1,2,4]оксадіазол-3-іл)-піперидин-1-іл]-метанону;
{3-[5-(4-фторфеніл)-[1,2,4]оксадіазол-3-іл]-піперидин-1-іл}-(6-фторпіридин-3-іл)-метанону;
(3,4-дифторфеніл)-{3-[5-(4-фторфеніл)-[1,2,4]оксадіазол-3-іл]-піперидин-1-іл}-метанону;
(4-фторфеніл)-[3-(5-піридин-2-іл-[1,2,4]оксадіазол-3-іл)-піперидин-1-іл]-метанону;
(6-фторпіридин-3-іл)-[3-(5-піридин-2-іл-[1,2,4]оксадіазол-3-іл)-піперидин-1-іл]-метанону;
{3-[5-(2,4-дифторфеніл)-[1,2,4]оксадіазол-3-іл]-піперидин-1-іл}-(4-фторфеніл)-метанону;
(4-фторфеніл)-[3-(5-піридин-4-іл-[1,2,4]оксадіазол-3-іл)-піперидин-1-іл]-метанону;
(3,4-дифторфеніл)-[3-(5-піридин-4-іл-[1,2,4]оксадіазол-3-іл)-піперидин-1-іл]-метанону;
(2,4-дифторфеніл)-[3-(5-піридин-4-іл-[1,2,4]оксадіазол-3-іл)-піперидин-1-іл]-метанону;
(3,4-дифторфеніл)-{3-[5-(2,4-дифторфеніл)-[1,2,4]оксадіазол-3-іл]-піперидин-1-іл}-метанону;
(2,4-дифторфеніл)-{3-[5-(4-фторфеніл)-[1,2,4]оксадіазол-3-іл]-піперидин-1-іл}-метанону;
(2,4-дифторфеніл)-{3-[5-(2,4-дифторфеніл)-[1,2,4]оксадіазол-3-іл]-піперидин-1-іл}-метанону;
(5-метилізоксазол-4-іл)-[3-(5-піридин-4-іл-[1,2,4]оксадіазол-3-іл)-піперидин-1-іл]-метанону;
(6-фторпіридин-3-іл)-[3-(5-піридин-4-іл-[1,2,4]оксадіазол-3-іл)-піперидин-1-іл]-метанону;
(4-фтор-2-метилфеніл)-[3-(5-піридин-4-іл-[1,2,4]оксадіазол-3-іл)-піперидин-1-іл]-метанону;
(4-фтор-2-метилфеніл)-{3-[5-(2-фторфеніл)-[1,2,4]оксадіазол-3-іл]-піперидин-1-іл}-метанону;
{3-[5-(2,4-дифторфеніл)-[1,2,4]оксадіазол-3-іл]-піперидин-1-іл}-(5-метилізоксазол-4-іл)-метанону;
{3-[5-(2,4-дифторфеніл)-[1,2,4]оксадіазол-3-іл]-піперидин-1-іл}-(6-фторпіридин-3-іл)-метанону;
(4-фторфеніл)-[3-(5-феніл-[1,2,4]оксадіазол-3-іл)-піперидин-1-іл]-метанону;
(4-фтор-2-метилфеніл)-{3-[5-(4-фторфеніл)-[1,2,4]оксадіазол-3-іл]-піперидин-1-іл}-метанону;
{3-[5-(4-фторфеніл)-[1,2,4]оксадіазол-3-іл]-піперидин-1-іл}-(5-метилізоксазол-4-іл)-метанону;
(6-фторпіридин-3-іл)-[3-(5-феніл-[1,2,4]оксадіазол-3-іл)-піперидин-1-іл]-метанону;
(6-фторпіридин-3-іл)-[3-(5-тіазол-4-іл-[1,2,4]оксадіазол-3-іл)-піперидин-1-іл]-метанону;
{3-[5-(2,4-дифторфеніл)-[1,2,4]оксадіазол-3-іл]-піперидин-1-іл}-(4-фтор-2-метилфеніл)-метанону;
(3,4-дифторфеніл)-[3-(5-феніл-[1,2,4]оксадіазол-3-іл)-піперидин-1-іл]-метанону;
(2,4-дифторфеніл)-[3-(5-феніл-[1,2,4]оксадіазол-3-іл)-піперидин-1-іл]-метанону;
(4-фтор-2-метилфеніл)-[3-(5-феніл-[1,2,4]оксадіазол-3-іл)-піперидин-1-іл]-метанону;
{(S)-3-[5-(4-фторфеніл)-[1,2,4]оксадіазол-3-іл]-піперидин-1-іл}-(6-фторпіридин-3-іл)-метанону;
(3,4-дифторфеніл)-{(S)-3-[5-(4-фторфеніл)-[1,2,4]оксадіазол-3-іл]-піперидин-1-іл}-метанону;
(3,5-диметилізоксазол-4-іл)-{(3)-3-[5-(4-фторфеніл)-[1,2,4]оксадіазол-3-іл]-піперидин-1-іл}-метанону;
{(S)-3-[5-(4-фторфеніл)-[1,2,4]оксадіазол-3-іл]-піперидин-1-іл}-(5-метилізоксазол-4-іл)-метанону;
{(S)-3-[5-(4-фторфеніл)-[1,2,4]оксадіазол-3-іл]-піперидин-1-іл}-(2-фторпіридин-4-іл)-метанону;
{(S)-3-[5-(4-фторфеніл)-[1,2,4]оксадіазол-3-іл]-піперидин-1-іл}-(3-фторпіридин-4-іл)-метанону;
{(S)-3-[5-(4-фторфеніл)-[1,2,4]оксадіазол-3-іл]-піперидин-1-іл}-(5-фторпіридин-2-іл)-метанону;
{(S)-3-[5-(4-фторфеніл)-[1,2,4]оксадіазол-3-іл]-піперидин-1-іл}-(5-фторпіридин-3-іл)-метанону;
(S)-(4-фторфеніл)-{3-[5-(5-фторпіридин-2-іл)-[1,2,4]оксадіазол-3-іл]-піперидин-1-іл}-метанону;
(S)-(3,4-дифторфеніл)-{3-[5-(5-фторпіридин-2-іл)-[1,2,4]оксадіазол-3-іл]-піперидин-1-іл}-метанону;
(S)-(4-фторфеніл)-{3-[5-(піридин-2-іл)-[1,2,4]оксадіазол-3-іл]-піперидин-1-іл}-метанону;
(S)-(3,4-дифторфеніл)-{3-[5-(піридин-2-іл)-[1,2,4]оксадіазол-3-іл]-піперидин-1-іл}-метанону;
(4-фторфеніл)-{(S)-3-[5-(1-метил-1Н-імідазол-4-іл)-[1,2,4]оксадіазол-3-іл]-піперидин-1-іл}-метанону;
(3,4-дифторфеніл)-{(S)-3-[5-(3-фторпіридин-4-іл)-[1,2,4]оксадіазол-3-іл]-піперидин-1-іл}-метанону;
(4-фторфеніл)-{(S)-3-[5-(3-фторпіридин-4-іл)-[1,2,4]оксадіазол-3-іл]-піперидин-1-іл}-метанону;
[(S)-3-(5-піридин-2-іл-[1,2,4]оксадіазол-3-іл)-піперидин-1-іл]-(2,4,6-трифторфеніл)-метанону;
[(S)-3-(5-піридин-2-іл-[1,2,4]оксадіазол-3-іл)-піперидин-1-іл]-(2,3,4-трифторфеніл)-метанону;
(2,6-дифторфеніл)-[(S)-3-(5-піридин-2-іл-[1,2,4]оксадіазол-3-іл)-піперидин-1-іл]-метанону;
(2,5-дифторфеніл)-[(S)-3-(5-піридин-2-іл-[1,2,4]оксадіазол-3-іл)-піперидин-1-іл]-метанону;
(2,3-дифторфеніл)-[(S)-3-(5-піридин-2-іл-[1,2,4]оксадіазол-3-іл)-піперидин-1-іл]-метанону
або фармацевтично прийнятних солей, гідратів або сольватів зазначених сполук.
4. Фармацевтична композиція, що містить терапевтично ефективну кількість сполуки за будь-яким із пп. 1-3 і фармацевтично прийнятний носій та/або наповнювач.
5. Сполука за будь-яким із пп. 1-3, що прийнятна для лікування або запобігання стану в ссавця, включаючи людину, причому лікуванню або запобіганню зазначеного стану сприяє, або на нього впливає, нейромодуляторна дія позитивних алостеричних модуляторів mGlu5, що виступають у ролі посилюючих агентів.
6. Сполука за будь-яким із пп. 1-3, що прийнятна для лікування або запобігання розладу центральної нервової системи, вибраному із групи, що включає тривожні розлади: агорафобію, генералізований тривожний розлад (ГТР), обсесивно-компульсивний розлад (ОКР), панічний розлад, посттравматичний стресовий розлад (ПТСР), соціофобію, інші фобії, тривожний розлад, пов'язаний із вживанням психоактивних речовин.
7. Сполука за будь-яким із пп. 1-3, що прийнятна для лікування або запобігання розладу центральної нервової системи, вибраному із групи, що включає розлади в дітей: синдром дефіциту уваги з гіперактивністю.
8. Сполука за будь-яким із пп. 1-3, що прийнятна для лікування або запобігання розладу центральної нервової системи, вибраному із групи, що включає розлади харчової поведінки, такі як нервова анорексія й нервова булімія.
9. Сполука за будь-яким із пп. 1-3, що прийнятна для лікування або запобігання розладу центральної нервової системи, вибраному із групи, що включає розлади настрою: біполярні розлади (типів І і II), циклотимічний розлад, депресію, дистимічний розлад, великий депресивний розлад і розлад настрою, пов'язаний з вживанням психоактивних препаратів.
10. Сполука за будь-яким із пп. 1-3, що прийнятна для лікування або запобігання розладу центральної нервової системи, вибраному із групи, що включає психотичні розлади: шизофренію, маревний розлад, шизоафективний розлад, шизофреноформний розлад і психотичний розлад, пов'язаний з вживанням психоактивних речовин.
11. Сполука за будь-яким із пп. 1-3, що прийнятна для лікування або запобігання розладу центральної нервової системи, вибраному з групи, що включає когнітивні розлади: делірій, персистуючий делірій, пов'язаний з вживанням психоактивних речовин, деменцію, деменцію, викликану ВІЛ, деменцію, викликану хореєю Гентінгтона, деменцію, викликану хворобою Паркінсона, деменцію типу Альцгеймера, персистуючу деменцію, пов'язану із вживанням психоактивних речовин, і помірне когнітивне порушення.
12. Сполука за будь-яким із пп. 1-3, що прийнятна для лікування або запобігання розладу центральної нервової системи, вибраному із групи, що включає розлади особистості: обсесивно-компульсивний розлад особистості, шизоїдний розлад особистості й шизотипальний розлад особистості.
13. Сполука за будь-яким із пп. 1-3, що прийнятна для лікування або запобігання розладу центральної нервової системи, вибраному із групи, що включає розлади, пов'язані із вживанням психоактивних речовин: зловживання алкоголем, алкогольну залежність, алкогольну абстиненцію, синдром відміни алкоголю з делірієм, алкогольний психотичний розлад, амфетамінову залежність, амфетамінову абстиненцію, кокаїнову залежність, кокаїнову абстиненцію, нікотинову залежність, нікотинову абстиненцію, опіоїдну залежність й опіоїдну абстиненцію.
14. Сполука за будь-яким із пп. 1-3, що прийнятна для лікування або запобігання запальному захворюванню центральної нервової системи, вибраному серед форм розсіяного склерозу, таких як доброякісний розсіяний склероз, ремітуючий розсіяний склероз, вторинно прогресуючий розсіяний склероз, первинно прогресуючий розсіяний склероз і рецидивуючий розсіяний склероз.
15. Фармацевтична композиція, що містить терапевтично ефективну кількість сполуки за будь-яким із пп. 5-14 і фармацевтично прийнятний носій та/або наповнювач.
16. Спосіб лікування або запобігання розладу центральної нервової системи у суб'єкта, що включає введення суб'єкту, який цього потребує, терапевтично ефективної кількості сполуки за будь-яким із пп. 5-14.
17. Спосіб за п. 16, який відрізняється тим, що зазначений розлад центральної нервової системи вибирають з групи, що включає:
тривожні розлади, такі як агорафобія, генералізований тривожний розлад (ГТР), обсесивно-компульсивний розлад (ОКР), панічний розлад, посттравматичний стресовий розлад (ПТСР), соціофобія, інші фобії й тривожний розлад, пов'язаний із вживанням психоактивних речовин;
розлади у дітей, такі як синдром дефіциту уваги з гіперактивністю;
розлади харчової поведінки, такі як нервова анорексія й нервова булімія;
розлади настрою, такі як біполярні розлади (типів І і II), циклотимічний розлад, депресію, дистимічний розлад, великий депресивний розлад і розлад настрою, пов'язаний із вживанням психоактивних препаратів;
психотичні розлади, такі як шизофренія, маревний розлад, шизоафективний розлад, шизофреноформний розлад і психотичний розлад, пов'язаний із вживанням психоактивних речовин;
когнітивні розлади, такі як делірій, персистуючий делірій, пов'язаний із вживанням психоактивних речовин, деменція, деменція, викликана ВІЛ, деменція, викликана хореєю Гентінгтона, деменція, викликана хворобою Паркінсона, деменція типу Альцгеймера, персистуюча деменція, пов'язана із вживанням психоактивних речовин, і помірне когнітивне порушення;
розлади особистості, такі як обсесивно-компульсивний розлад особистості, шизоїдний розлад особистості й шизотипальний розлад особистості;
розлади, пов'язані із вживанням психоактивних речовин, такі як зловживання алкоголем, алкогольна залежність, алкогольна абстиненція, синдром відміни алкоголю з делірієм, алкогольний психотичний розлад, амфетамінова залежність, амфетамінова абстиненція, кокаїнова залежність, кокаїнова абстиненція, нікотинова залежність, нікотинова абстиненція, опіоїдна залежність й опіоїдна абстиненція;
запальні розлади центральної нервової системи, такі як доброякісний розсіяний склероз, ремітуючий розсіяний склероз, вторинно прогресуючий розсіяний склероз, первинно прогресуючий розсіяний склероз і рецидивуючий розсіяний склероз.
18. Спосіб лікування або запобігання розладу центральної нервової системи у суб'єкта, що включає введення суб'єкту, який цього потребує, терапевтично ефективної кількості фармацевтичної композиції за п. 15.
19. Спосіб за п. 18, який відрізняється тим, що зазначений розлад центральної нервової системи вибирають з групи, що включає:
тривожні розлади, такі як агорафобія, генералізований тривожний розлад (ГТР), обсесивно-компульсивний розлад (ОКР), панічний розлад, посттравматичний стресовий розлад (ПТСР), соціофобія, інші фобії й тривожний розлад, пов'язаний із вживанням психоактивних речовин;
розлади в дітей, такі як синдром дефіциту уваги з гіперактивністю;
харчові розлади, такі як нервова анорексія й нервова булімія;
розлади настрою, такі як біполярні розлади (типів І і II), циклотимічний розлад, депресію, дистимічний розлад, великий депресивний розлад і розлад настрою, пов'язаний із вживанням психоактивних препаратів;
психотичні розлади, такі як шизофренія, маревний розлад, шизоафективний розлад, шизофреноформний розлад і психотичний розлад, пов'язаний із вживанням психоактивних речовин;
когнітивні розлади, такі як делірій, персистуючий делірій, пов'язаний із вживанням психоактивних речовин, деменція, деменція, викликана ВІЛ, деменція, викликана хореєю Гентінгтона, деменція, викликана хворобою Паркінсона, деменція типу Альцгеймера, персистуюча деменція, пов'язана із вживанням психоактивних речовин, і помірне когнітивне порушення;
розлади особистості, такі як обсесивно-компульсивний розлад особистості, шизоїдний розлад особистості й шизотипальний розлад особистості;
розлади, пов'язані із вживанням психоактивних речовин, такі як зловживання алкоголем, алкогольна залежність, алкогольна абстиненція, синдром відміни алкоголю з делірієм, алкогольний психотичний розлад, амфетамінова залежність, амфетамінова абстиненція, кокаїнова залежність, кокаїнова абстиненція, нікотинова залежність, нікотинова абстиненція, опіоїдна залежність й опіоїдна абстиненція;
запальні розлади центральної нервової системи, такі як доброякісний розсіяний склероз, ремітуючий розсіяний склероз, вторинно прогресуючий розсіяний склероз, первинно прогресуючий розсіяний склероз і рецидивуючий розсіяний склероз.
20. Застосування сполуки за будь-яким із пп. 1-3 для приготування лікарського препарату для лікування або запобігання захворюванням і станам, зазначеним у пп. 6-14.
21. Застосування сполуки за п. 1 для приготування індикаторів для одержання зображень метаботропних глутаматних рецепторів.
Текст
1. Сполука формули І-В O N O C2 (21) a200714065 (22) 17.05.2006 (24) 10.11.2010 (86) PCT/IB2006/001881, 17.05.2006 (31) 0510138.1 (32) 18.05.2005 (33) GB (31) 0601709.9 (32) 27.01.2006 (33) GB (46) 10.11.2010, Бюл.№ 21, 2010 р. (72) ФАРІНА МАРКО, IT, ГАГЛІАРДІ СТЕФАНІЯ, IT, ЛЬО ПУЛ ЕМАНЮЕЛ, CH, МЮТЄЛ ВЕНСАН, CH, ПАЛОМБІ ДЖОВАННІ, IT, ПОЛІ СОНЯ МАРІЯ, IT, РОШЕ ЖАН-ФІЛІП, CH (73) АДДЕКС ФАРМА СА, CH 3 будь-який N може являти собою N-оксид; або фармацевтично прийнятна сіль, гідрат або сольват зазначеної сполуки. 2. Сполука за п. 1, що може існувати у вигляді оптичних ізомерів, причому зазначена сполука являє собою або рацемічну суміш, або індивідуальний оптичний ізомер. 3. Сполука за будь-яким із пп. 1 або 2, яка відрізняється тим, що зазначену сполуку вибирають з: (4-фторфеніл)-{(S)-3-[5-(4-фторфеніл)[1,2,4]оксадіазол-3-іл]-піперидин-1-іл}-метанону; (4-фторфеніл)-{(R)-3-[5-(4-фторфеніл)[1,2,4]оксадіазол-3-іл]-піперидин-1-іл}-метанону; (3,4-дифторфеніл)-{3-[5-(2-фторфеніл)[1,2,4]оксадіазол-3-іл]-піперидин-1-іл}-метанону; (2,4-дифторфеніл)-{3-[5-(2-фторфеніл)[1,2,4]оксадіазол-3-іл]-піперидин-1-іл}-метанону; (4-фтор-2-метиламінофеніл)-{3-[5-(2-фторфеніл)[1,2,4]оксадіазол-3-іл]-піперидин-1-іл}-метанону; {3-[5-(2-фторфеніл)-[1,2,4]оксадіазол-3-іл]піперидин-1-іл}-(5-фторпіридин-2-іл)-метанону; {3-[5-(2-фторфеніл)-[1,2,4]оксадіазол-3-іл]піперидин-1-іл}-(5-метилізоксазол-4-іл)-метанону; (4-фторфеніл)-[3-(5-тіазол-4-іл-[1,2,4]оксадіазол-3іл)-піперидин-1-іл]-метанону; {3-[5-(4-фторфеніл)-[1,2,4]оксадіазол-3-іл]піперидин-1-іл}-(6-фторпіридин-3-іл)-метанону; (3,4-дифторфеніл)-{3-[5-(4-фторфеніл)[1,2,4]оксадіазол-3-іл]-піперидин-1-іл}-метанону; (4-фторфеніл)-[3-(5-піридин-2-іл-[1,2,4]оксадіазол3-іл)-піперидин-1-іл]-метанону; (6-фторпіридин-3-іл)-[3-(5-піридин-2-іл[1,2,4]оксадіазол-3-іл)-піперидин-1-іл]-метанону; {3-[5-(2,4-дифторфеніл)-[1,2,4]оксадіазол-3-іл]піперидин-1-іл}-(4-фторфеніл)-метанону; (4-фторфеніл)-[3-(5-піридин-4-іл-[1,2,4]оксадіазол3-іл)-піперидин-1-іл]-метанону; (3,4-дифторфеніл)-[3-(5-піридин-4-іл[1,2,4]оксадіазол-3-іл)-піперидин-1-іл]-метанону; (2,4-дифторфеніл)-[3-(5-піридин-4-іл[1,2,4]оксадіазол-3-іл)-піперидин-1-іл]-метанону; (3,4-дифторфеніл)-{3-[5-(2,4-дифторфеніл)[1,2,4]оксадіазол-3-іл]-піперидин-1-іл}-метанону; (2,4-дифторфеніл)-{3-[5-(4-фторфеніл)[1,2,4]оксадіазол-3-іл]-піперидин-1-іл}-метанону; (2,4-дифторфеніл)-{3-[5-(2,4-дифторфеніл)[1,2,4]оксадіазол-3-іл]-піперидин-1-іл}-метанону; (5-метилізоксазол-4-іл)-[3-(5-піридин-4-іл[1,2,4]оксадіазол-3-іл)-піперидин-1-іл]-метанону; (6-фторпіридин-3-іл)-[3-(5-піридин-4-іл[1,2,4]оксадіазол-3-іл)-піперидин-1-іл]-метанону; (4-фтор-2-метилфеніл)-[3-(5-піридин-4-іл[1,2,4]оксадіазол-3-іл)-піперидин-1-іл]-метанону; (4-фтор-2-метилфеніл)-{3-[5-(2-фторфеніл)[1,2,4]оксадіазол-3-іл]-піперидин-1-іл}-метанону; {3-[5-(2,4-дифторфеніл)-[1,2,4]оксадіазол-3-іл]піперидин-1-іл}-(5-метилізоксазол-4-іл)-метанону; {3-[5-(2,4-дифторфеніл)-[1,2,4]оксадіазол-3-іл]піперидин-1-іл}-(6-фторпіридин-3-іл)-метанону; (4-фторфеніл)-[3-(5-феніл-[1,2,4]оксадіазол-3-іл)піперидин-1-іл]-метанону; (4-фтор-2-метилфеніл)-{3-[5-(4-фторфеніл)[1,2,4]оксадіазол-3-іл]-піперидин-1-іл}-метанону; {3-[5-(4-фторфеніл)-[1,2,4]оксадіазол-3-іл]піперидин-1-іл}-(5-метилізоксазол-4-іл)-метанону; 92495 4 (6-фторпіридин-3-іл)-[3-(5-феніл-[1,2,4]оксадіазол3-іл)-піперидин-1-іл]-метанону; (6-фторпіридин-3-іл)-[3-(5-тіазол-4-іл[1,2,4]оксадіазол-3-іл)-піперидин-1-іл]-метанону; {3-[5-(2,4-дифторфеніл)-[1,2,4]оксадіазол-3-іл]піперидин-1-іл}-(4-фтор-2-метилфеніл)-метанону; (3,4-дифторфеніл)-[3-(5-феніл-[1,2,4]оксадіазол-3іл)-піперидин-1-іл]-метанону; (2,4-дифторфеніл)-[3-(5-феніл-[1,2,4]оксадіазол-3іл)-піперидин-1-іл]-метанону; (4-фтор-2-метилфеніл)-[3-(5-феніл[1,2,4]оксадіазол-3-іл)-піперидин-1-іл]-метанону; {(S)-3-[5-(4-фторфеніл)-[1,2,4]оксадіазол-3-іл]піперидин-1-іл}-(6-фторпіридин-3-іл)-метанону; (3,4-дифторфеніл)-{(S)-3-[5-(4-фторфеніл)[1,2,4]оксадіазол-3-іл]-піперидин-1-іл}-метанону; (3,5-диметилізоксазол-4-іл)-{(3)-3-[5-(4фторфеніл)-[1,2,4]оксадіазол-3-іл]-піперидин-1-іл}метанону; {(S)-3-[5-(4-фторфеніл)-[1,2,4]оксадіазол-3-іл]піперидин-1-іл}-(5-метилізоксазол-4-іл)-метанону; {(S)-3-[5-(4-фторфеніл)-[1,2,4]оксадіазол-3-іл]піперидин-1-іл}-(2-фторпіридин-4-іл)-метанону; {(S)-3-[5-(4-фторфеніл)-[1,2,4]оксадіазол-3-іл]піперидин-1-іл}-(3-фторпіридин-4-іл)-метанону; {(S)-3-[5-(4-фторфеніл)-[1,2,4]оксадіазол-3-іл]піперидин-1-іл}-(5-фторпіридин-2-іл)-метанону; {(S)-3-[5-(4-фторфеніл)-[1,2,4]оксадіазол-3-іл]піперидин-1-іл}-(5-фторпіридин-3-іл)-метанону; (S)-(4-фторфеніл)-{3-[5-(5-фторпіридин-2-іл)[1,2,4]оксадіазол-3-іл]-піперидин-1-іл}-метанону; (S)-(3,4-дифторфеніл)-{3-[5-(5-фторпіридин-2-іл)[1,2,4]оксадіазол-3-іл]-піперидин-1-іл}-метанону; (S)-(4-фторфеніл)-{3-[5-(піридин-2-іл)[1,2,4]оксадіазол-3-іл]-піперидин-1-іл}-метанону; (S)-(3,4-дифторфеніл)-{3-[5-(піридин-2-іл)[1,2,4]оксадіазол-3-іл]-піперидин-1-іл}-метанону; (4-фторфеніл)-{(S)-3-[5-(1-метил-1Н-імідазол-4-іл)[1,2,4]оксадіазол-3-іл]-піперидин-1-іл}-метанону; (3,4-дифторфеніл)-{(S)-3-[5-(3-фторпіридин-4-іл)[1,2,4]оксадіазол-3-іл]-піперидин-1-іл}-метанону; (4-фторфеніл)-{(S)-3-[5-(3-фторпіридин-4-іл)[1,2,4]оксадіазол-3-іл]-піперидин-1-іл}-метанону; [(S)-3-(5-піридин-2-іл-[1,2,4]оксадіазол-3-іл)піперидин-1-іл]-(2,4,6-трифторфеніл)-метанону; [(S)-3-(5-піридин-2-іл-[1,2,4]оксадіазол-3-іл)піперидин-1-іл]-(2,3,4-трифторфеніл)-метанону; (2,6-дифторфеніл)-[(S)-3-(5-піридин-2-іл[1,2,4]оксадіазол-3-іл)-піперидин-1-іл]-метанону; (2,5-дифторфеніл)-[(S)-3-(5-піридин-2-іл[1,2,4]оксадіазол-3-іл)-піперидин-1-іл]-метанону; (2,3-дифторфеніл)-[(S)-3-(5-піридин-2-іл[1,2,4]оксадіазол-3-іл)-піперидин-1-іл]-метанону або фармацевтично прийнятних солей, гідратів або сольватів зазначених сполук. 4. Фармацевтична композиція, що містить терапевтично ефективну кількість сполуки за будь-яким із пп. 1-3 і фармацевтично прийнятний носій та/або наповнювач. 5. Сполука за будь-яким із пп. 1-3, що прийнятна для лікування або запобігання стану в ссавця, включаючи людину, причому лікуванню або запобіганню зазначеного стану сприяє, або на нього впливає, нейромодуляторна дія позитивних алос 5 теричних модуляторів mGlu5, що виступають у ролі посилюючих агентів. 6. Сполука за будь-яким із пп. 1-3, що прийнятна для лікування або запобігання розладу центральної нервової системи, вибраному із групи, що включає тривожні розлади: агорафобію, генералізований тривожний розлад (ГТР), обсесивнокомпульсивний розлад (ОКР), панічний розлад, посттравматичний стресовий розлад (ПТСР), соціофобію, інші фобії, тривожний розлад, пов'язаний із вживанням психоактивних речовин. 7. Сполука за будь-яким із пп. 1-3, що прийнятна для лікування або запобігання розладу центральної нервової системи, вибраному із групи, що включає розлади в дітей: синдром дефіциту уваги з гіперактивністю. 8. Сполука за будь-яким із пп. 1-3, що прийнятна для лікування або запобігання розладу центральної нервової системи, вибраному із групи, що включає розлади харчової поведінки, такі як нервова анорексія й нервова булімія. 9. Сполука за будь-яким із пп. 1-3, що прийнятна для лікування або запобігання розладу центральної нервової системи, вибраному із групи, що включає розлади настрою: біполярні розлади (типів І і II), циклотимічний розлад, депресію, дистимічний розлад, великий депресивний розлад і розлад настрою, пов'язаний з вживанням психоактивних препаратів. 10. Сполука за будь-яким із пп. 1-3, що прийнятна для лікування або запобігання розладу центральної нервової системи, вибраному із групи, що включає психотичні розлади: шизофренію, маревний розлад, шизоафективний розлад, шизофреноформний розлад і психотичний розлад, пов'язаний з вживанням психоактивних речовин. 11. Сполука за будь-яким із пп. 1-3, що прийнятна для лікування або запобігання розладу центральної нервової системи, вибраному з групи, що включає когнітивні розлади: делірій, персистуючий делірій, пов'язаний з вживанням психоактивних речовин, деменцію, деменцію, викликану ВІЛ, деменцію, викликану хореєю Гентінгтона, деменцію, викликану хворобою Паркінсона, деменцію типу Альцгеймера, персистуючу деменцію, пов'язану із вживанням психоактивних речовин, і помірне когнітивне порушення. 12. Сполука за будь-яким із пп. 1-3, що прийнятна для лікування або запобігання розладу центральної нервової системи, вибраному із групи, що включає розлади особистості: обсесивнокомпульсивний розлад особистості, шизоїдний розлад особистості й шизотипальний розлад особистості. 13. Сполука за будь-яким із пп. 1-3, що прийнятна для лікування або запобігання розладу центральної нервової системи, вибраному із групи, що включає розлади, пов'язані із вживанням психоактивних речовин: зловживання алкоголем, алкогольну залежність, алкогольну абстиненцію, синдром відміни алкоголю з делірієм, алкогольний психотичний розлад, амфетамінову залежність, амфетамінову абстиненцію, кокаїнову залежність, кокаїнову абстиненцію, нікотинову залежність, ні 92495 6 котинову абстиненцію, опіоїдну залежність й опіоїдну абстиненцію. 14. Сполука за будь-яким із пп. 1-3, що прийнятна для лікування або запобігання запальному захворюванню центральної нервової системи, вибраному серед форм розсіяного склерозу, таких як доброякісний розсіяний склероз, ремітуючий розсіяний склероз, вторинно прогресуючий розсіяний склероз, первинно прогресуючий розсіяний склероз і рецидивуючий розсіяний склероз. 15. Фармацевтична композиція, що містить терапевтично ефективну кількість сполуки за будьяким із пп. 5-14 і фармацевтично прийнятний носій та/або наповнювач. 16. Спосіб лікування або запобігання розладу центральної нервової системи у суб'єкта, що включає введення суб'єкту, який цього потребує, терапевтично ефективної кількості сполуки за будь-яким із пп. 5-14. 17. Спосіб за п. 16, який відрізняється тим, що зазначений розлад центральної нервової системи вибирають з групи, що включає: тривожні розлади, такі як агорафобія, генералізований тривожний розлад (ГТР), обсесивнокомпульсивний розлад (ОКР), панічний розлад, посттравматичний стресовий розлад (ПТСР), соціофобія, інші фобії й тривожний розлад, пов'язаний із вживанням психоактивних речовин; розлади у дітей, такі як синдром дефіциту уваги з гіперактивністю; розлади харчової поведінки, такі як нервова анорексія й нервова булімія; розлади настрою, такі як біполярні розлади (типів І і II), циклотимічний розлад, депресію, дистимічний розлад, великий депресивний розлад і розлад настрою, пов'язаний із вживанням психоактивних препаратів; психотичні розлади, такі як шизофренія, маревний розлад, шизоафективний розлад, шизофреноформний розлад і психотичний розлад, пов'язаний із вживанням психоактивних речовин; когнітивні розлади, такі як делірій, персистуючий делірій, пов'язаний із вживанням психоактивних речовин, деменція, деменція, викликана ВІЛ, деменція, викликана хореєю Гентінгтона, деменція, викликана хворобою Паркінсона, деменція типу Альцгеймера, персистуюча деменція, пов'язана із вживанням психоактивних речовин, і помірне когнітивне порушення; розлади особистості, такі як обсесивнокомпульсивний розлад особистості, шизоїдний розлад особистості й шизотипальний розлад особистості; розлади, пов'язані із вживанням психоактивних речовин, такі як зловживання алкоголем, алкогольна залежність, алкогольна абстиненція, синдром відміни алкоголю з делірієм, алкогольний психотичний розлад, амфетамінова залежність, амфетамінова абстиненція, кокаїнова залежність, кокаїнова абстиненція, нікотинова залежність, нікотинова абстиненція, опіоїдна залежність й опіоїдна абстиненція; запальні розлади центральної нервової системи, такі як доброякісний розсіяний склероз, ремітуючий розсіяний склероз, вторинно прогресуючий 7 92495 розсіяний склероз, первинно прогресуючий розсіяний склероз і рецидивуючий розсіяний склероз. 18. Спосіб лікування або запобігання розладу центральної нервової системи у суб'єкта, що включає введення суб'єкту, який цього потребує, терапевтично ефективної кількості фармацевтичної композиції за п. 15. 19. Спосіб за п. 18, який відрізняється тим, що зазначений розлад центральної нервової системи вибирають з групи, що включає: тривожні розлади, такі як агорафобія, генералізований тривожний розлад (ГТР), обсесивнокомпульсивний розлад (ОКР), панічний розлад, посттравматичний стресовий розлад (ПТСР), соціофобія, інші фобії й тривожний розлад, пов'язаний із вживанням психоактивних речовин; розлади в дітей, такі як синдром дефіциту уваги з гіперактивністю; харчові розлади, такі як нервова анорексія й нервова булімія; розлади настрою, такі як біполярні розлади (типів І і II), циклотимічний розлад, депресію, дистимічний розлад, великий депресивний розлад і розлад настрою, пов'язаний із вживанням психоактивних препаратів; психотичні розлади, такі як шизофренія, маревний розлад, шизоафективний розлад, шизофреноформний розлад і психотичний розлад, пов'язаний із вживанням психоактивних речовин; когнітивні розлади, такі як делірій, персистуючий делірій, пов'язаний із вживанням психоактивних O P N B N W R1 Q R2 I Даний винахід представляє собою нові сполуки формули I як позитивні алостеричні модулятори метаботропних рецепторів - підтипу 5 (“mGluR5”), які придатні для лікування або запобігання захворювань центральної нервової системи, таких як, наприклад: зниження пізнавальних функцій, як позитивні, так і негативні симптоми шизофренії, а також різні інші розлади центральної або периферичної нервової системи, у які залучені глутаматні метаботропні рецептори підтипу mGluR5. Даний винахід також відноситься до фармацевтичних сполук та композицій для запобігання або лікування зазначених захворювань, у які залучені mGluR5. Глутамат, основний амінокислотний трансмітер у центральній нервовій системі (ЦНС) ссавців, опосередує збудливу синаптичну нейротрансмісію завдяки активації рецепторних каналів іонотропних глутаматних рецепторів (iGluRs, а саме NMDA, AMPA і каінатних) та метаботропних глутаматних рецепторів (mGluRs). iGluRs відповідають за шви 8 речовин, деменція, деменція, викликана ВІЛ, деменція, викликана хореєю Гентінгтона, деменція, викликана хворобою Паркінсона, деменція типу Альцгеймера, персистуюча деменція, пов'язана із вживанням психоактивних речовин, і помірне когнітивне порушення; розлади особистості, такі як обсесивнокомпульсивний розлад особистості, шизоїдний розлад особистості й шизотипальний розлад особистості; розлади, пов'язані із вживанням психоактивних речовин, такі як зловживання алкоголем, алкогольна залежність, алкогольна абстиненція, синдром відміни алкоголю з делірієм, алкогольний психотичний розлад, амфетамінова залежність, амфетамінова абстиненція, кокаїнова залежність, кокаїнова абстиненція, нікотинова залежність, нікотинова абстиненція, опіоїдна залежність й опіоїдна абстиненція; запальні розлади центральної нервової системи, такі як доброякісний розсіяний склероз, ремітуючий розсіяний склероз, вторинно прогресуючий розсіяний склероз, первинно прогресуючий розсіяний склероз і рецидивуючий розсіяний склероз. 20. Застосування сполуки за будь-яким із пп. 1-3 для приготування лікарського препарату для лікування або запобігання захворюванням і станам, зазначеним у пп. 6-14. 21. Застосування сполуки за п. 1 для приготування індикаторів для одержання зображень метаботропних глутаматних рецепторів. дку збуджувальну трансмісію (Nakanishi S et al., (1998) Brain Res. Rev., 26:230-235), тоді як mGluRs мають більш модулюючу роль, що сприяє регуляції синаптичної ефективності. Глутамат здійснює численні фізіологічні функції, такі як тривале потенціювання (LTP), процес, що, як передбачають, лежить в основі навчання й пам'яті, а також серцево-судинної регуляції, почуттєвого сприйняття і розвитку синаптичної пластичності. Крім того, глутамат відіграє важливу роль у патофізіології різних неврологічних і психіатричних захворювань, особливо якщо спостерігається дисбаланс у глутаматергічній нейротрансмісії. MGluRs складається із семи трансмембранних рецепторів, зв'язаних з G-білками. Вісім членів сімейства розділені на три групи (Групи I, II та III) відповідно до гомології їх амінокислотних послідовностей та їх фармакологічних властивостей (Schoepp DD et al. (1999) Neuropharmacology, 38:1431-1476). Активація mGluRs призводить до великої різноманітності внутрішньоклітинних реакцій та до активації різних трансдукційних каскадів. Серед членів mGluR підтип mGluR5 становить найбільший інтерес для урівноваження нестачі або надлишку нейротрансмісії при нейропсихіатричних захворюваньх. MGluR5 є членом групи I і його активація ініціює клітинні реакції за допомогою опосередкованих G-білком механізмів. MGluR5 зв'язується з фосфоліпазою С та стимулює 9 фосфоінозитидний гідроліз і внутрішньоклітинну мобілізацію кальцію. Доведено, що білки mGluR5 локалізовані в постсинаптичних елементах що граничать із постсинаптическим ущільненням (Lujan R et al. (1996) Eur. J. Neurosci., 8:1488-500; Lujan R et al. (1997) J. Chem. Neuroanat., 13:219-41), і їх рідко відмічають у пресинаптичних елементах (Romano C et al. (1995) J. Comp. Neurol., 355:455-69). Рецептори mGluR5 можуть внаслідок цього змінювати постсинаптичні реакції на нейротрансмітер або регулювати вивільнення нейротрансмітеру. У ЦНС рецептори mGluR5 широко поширені, в основному, по відношенню щодо кори, гиппокампу, каудато-путамену і прилеглого ядра. Оскільки було показано, що зазначені області головного мозку спричиняють прояв емоцій, мотиваційні процеси й численні аспекти когнітивної функції, прогнозують, що модулятори mGluR5 можуть представляти великий терапевтичний інтерес. Припускають, що нові підтипи селективних модуляторів mGluR можуть виявитися корисними, здебільшого, при різних клінічних застосуваннях. Можливі клінічні показання включають епілепсію, нейропатичний та запальний біль, численні психічні розлади (наприклад, тривога й шизофренія), рухові порушення (наприклад, хвороба Паркінсона), нейропротективну дію (інсульт або травма голови), мігрень і звикання/наркотичну залежність (для огляду див. Brauner-Osborne H et al. (2000) J. Med. Chem., 43:2609-45; Bordi F and Ugolini A. (1999) Prog. Neurobiol., 59:55-79; Spooren W et al. (2003) Behav. Pharmacol., 14:257-77). Припущенням є те, що причиною шизофренії може служити гіпофункція глутаматергічної системи, що відображена гіпофункцією рецептора NMDA, одержало в останні кілька років зростаючу підтримку (Goff DC and Coyle JT (2001) Am. J. Psychiatry, 158:1367-1377; Carlsson A et al. (2001) Annu. Rev. Pharmacol. Toxicol., 41:237-260 для огляду). Свідчення залученої дисфункції глутаматергічної нейротрансмісії підтримує те відкриття, що антагоністи підтипу NMDA глутаматних рецепторів можуть породжувати повний спектр симптомів, а також психологічних проявів шизофренії, таких як гіпофронтальність, порушене преімпульсне інгібування та підвищене вивільнення дофаміну в підкірці. Крім того, клінічні дослідження дозволяють припустити, що частота алелей mGluR5 пов'язана із шизофренією в деяких групах населення (Devon RS et al. (2001) Mol. Psychiatry., 6:311-4), і що збільшення сигналу mGluR5 виявлено в шарах пірамідальних клітин кори головного мозку хворих шизофренією (Ohnuma T et al. (1998) Brain Res. Mol. Brain Res., 56:207-17). Залучення mGluR5 у неврологічні та психіатричні захворювання підтверджують дані, які показують, що активація in vivo mGluRs групи I викликає потенціювання функції рецепторів NMDA у багатьох областях головного мозку, головним чином за рахунок активації рецепторів mGluR5 (Mannaioni G et al. (2001) Neurosci., 21:5925-34; Awad H et al. (2000) J. Neurosci., 20:7871-7879; Pisani A et al. (2001) Neuroscience, 106:579-87; Benquet P et al (2002) J. Neurosci., 22:9679-86). 92495 10 Роль глутамату в процесах пам'яті також твердо встановлена протягом останнього десятиліття (Martin SJ et al. (2000) Annu. Rev. Neurosci., 23:649711; Baudry M and Lynch G. (2001) Neurobiol. Learn. Mem., 76:284-297). Використання мишей з нульовою мутацією по mGluR5 сильно підтримало роль mGluR5 у навчанні й пам'яті. Зазначені миші показують селекційну втрату у двох завданнях на просторове навчання й пам'ять, та відновлення CA1 LTP(Lu et al. (1997) J. Neurosci., 17:5196-5205; Schulz B et al. (2001) Neuropharmacology, 41:1-7; Jia Z et al. (2001) Physiol. Behav., 73:793-802; Rodrigues et al. (2002) J. Neurosci., 22:5219-5229). Виявлення того, що mGluR5 відповідає за потенціацію опосередкованих рецепторами NMDA токів, указує з більшою ймовірністю, що агонисти зазначених рецепторів можуть бути корисні як засоби, що поліпшують когнітивну функцію, а також як нові антипсихотичні засоби, що діють завдяки селективному поліпшенню функції рецепторів NMDA. Активація NMDARs може потенціювати у нейронному ланцюзі характерні для шизофренії гіпофункціональні NMDARs. Останні дані in vivo рішуче навели на думку, що активація mGluR5 може бути новим й ефективним підходом до лікування зниження когнітивної функції і як позитивних, так і негативних симптомів шизофренії (Kinney GG et al. (2003) J. Pharmacol. Exp. Ther., 306(1):116-123). Тому рецептор mGluR5 розглядають як потенційну лікарську ціль для лікування психіатричних і неврологічних розладів, включаючи виліковні захворювання, якими в даному контексті є тривожні розлади, порушення уваги, харчові порушення, розлади настрою, психотичні розлади, когнітивні розлади, розлади особистості та розлади смислової сфери. Більшість існуючих у цей час модуляторів функції mGluR5 були розроблені як структурні аналоги глутамату, квісквалату або фенілгліцину (Schoepp DD et al. (1999) Neuropharmacology, 38:1431-1476) і вкрай перспективно розробити in vivo активні й селективні модулятори mGluR5, що діють на глутаматний центр зв'язування. Новий шлях розробки селективних модуляторів полягає в ідентифікації молекул, що діють за алостеричними механізмами, модулюючи рецептор шляхом зв'язування з місцем, що відмінне від висококонсервативного ортостеричного місця зв'язування. Позитивні алостеричні модулятори mGluRs виявлени недавно як нові лікарські форми, що виявляють зазначену привабливу альтернативу. Цей тип молекул був відкритий для mGluR1, mGluR2, mGluR4, і mGluR5 (Knoflach F et al. (2001) Proc. Natl. Acad. Sci. U S A., 98:13402-13407; O'Brien JA et al. (2003) Mol. Pharmacol., 64:731-40; Johnson K et al. (2002) Neuropharmacology, 43:291; Johnson MP et al. (2003) J. Med. Chem., 46:3189-92; Marino MJ et al. (2003) Proc. Natl. Acad. Sci. U S A., 100(23):13668-73; як огляд див. Mutel V (2002) Expert Opin. Ther. Patents, 12:1-8; Kew JN (2004) Pharmacol. Ther., 104(3):233-44; Johnson MP et al. (2004) Biochem. Soc. Trans., 32:881-7). DFB і родинні молекули описані як позитивні алостеричні модулятори mGluR5 in vitro, однак вони мають 11 92495 низьку активність. (O'Brien JA et al. (2003) Mol. Pharmacol., 64:731-40). Були запатентовані похідні бензаміду (WO 2004/087048; O'Brien JA (2004) J. Pharmacol. Exp. Ther., 309:568-77), а останнім часом як позитивні алостеричні модулятори mGluR5 в минулому описані похідні амінопіразолу (Lindsley et al. (2004) J. Med. Chem., 47:5825-8; WO 2005/087048). Серед похідних амінопіразолу, CDPPB (3-ціано-N-(1,3-дифеніл-1H-піразол-5іл)бензамід) виявив при дії in vivo ефект, подібний антипсихотичному в моделях поведінки пацюків (Kinney GG et al. (2005) J. Pharmacol. Exp. Ther., 313:199-206). Цей звіт узгоджується з гіпотезою, що алостеричне потенціювання mGluR5 може забезпечити новий підхід до розробки антипсихотичних засобів. Недавно була описана нова серія позитивних алостерних модуляторів рецепторів mGluR5(WO 2005/044797). Описані похідні арилоксадіазолу (WO 04/014902 й WO 04/014370); зазначені сполуки являють собою негативні алостеричні модулятори рецепторів mGluR5. Міжнародна публікація №WO 4/054973 описує арилоксиоксадіазоли як антагоністи гістамінового рецептора H3. Інший клас 2пиперидиніл-арилоксадіазолів розкритий в WO 99/45006; описані похідні є інгібіторами ферменту ротамази. Сполуки циклопропилоксадіазолу розкриті в US 3966748. Жодні із описаних сполук не пов’язані структурно із сполуками згідно даного винаходу. Даний винахід відноситься до способу лікування або запобігання захворювань у ссавців, включаючи людину, на лікування або запобігання якого впливає або полегшує його нейромодуляторну дію позитивних алостерних модуляторів mGluR5. Фіг.1 показує дію 10µМ речовини з Приклада R7 R3 R3 N R6 R4 R5 , №1 даного винаходу на культуру первинних кортикальних клітин, експресуючих mGluR5, у відсутності або в присутності 300нМ глутамату. Фіг.2 показує, що типова сполука №1 даного винаходу значно послаблює збільшення локомоторної активності, викликаної амфетаміном у дозуванні 30мг/кг внутрічеревно. Згідно даному винаходу, представлені нові сполуки загальної формули I O N , B P N W R1 Q R2 I , або фармацевтичні прийнятні солі, гідрати або сольвати зазначених сполук. У яких W являє собою (C5-C7)циклоалкільне, (C3C7)гетероциклоалкільне, (C3-C7)гетероциклоалкіл(C1-C3)алкільне або (C3-C7)гетероциклоалкенільне кільце; R1 й R2 являють собою незалежно один від одного водень, -(C1-C6)алкіл, -(C2-C6)алкеніл -(C2C6)алкініл, арилалкіл, гетероарилалкіл, гідроксил, аміногрупу, аміноалкіл, гідроксиалкіл, -(C1C6)алкокси, або R1 й R2 разом можуть утворювати (C3-C7)циклоалкільне кільце, вуглецевий зв'язок C=O або вуглець-вуглецевий подвійний зв'язок; P й Q вибирають незалежно один від одного, і кожен з них вказує на циклоалкільну, гетероциклоалкільну, арильну або гетероарильну групу формули R3 R6 R4 12 S R5 , D N R3 R4 S H R4 , G E F R5 R3, R4, R5, R6, і R7 незалежно один від одного являють собою наступні замісники: водень, галоген, -NO2, -(C1-C6)алкіл, -(C3-C6)циклоалкіл, -(C3C7)циклоалкілалкіл, -(C2-C6)алкеніл, -(C2C6)алкініл, галоген-(C1-C6)алкіл, гетероарил, гетероарилалкіл, арилалкіл, арил, -OR8, -NR8R9, C(=NR10)NR8R9, -NR8COR9, NR8CO2R9, NR8SO2R9, NR10CO NR8R9, -SR8, -S(=O)R8, -S(=O)2R8, S(=O)2NR8R9, -C(=O)R8, -C(=O)-O-R8, -C(=O)NR8R9, -C(=NR8)R9, або C(=NOR8)R9; при цьому, можливо, два замісники разом з атомами, що знаходяться між ними, утворюють біцикличне гетероциклоалкільне, арильне або гетероарильне кільце; причому кожне кільце, можливо, додатково заміщене 1-5 групами, незалежно обраними серед наступних: галоген, -CN, -(C1-C6)алкіл, -O-(C0-C6)алкіл, -O-(C3C7)циклоалкілалкіл, -O(арил), -O(гетероарил), -O-(C1-C3)алкіларил, -O-(C1-C3)алкілгетероарил, -N((C0-C6)алкіл)((C0-C3)алкіларил) або -N((C0C6)алкіл)((C0-C3-)алкілгетероарил); R8, R9, R10 кожен незалежно один від одного являють собою: водень, (C1-C6)алкіл, (C3C6)циклоалкіл, (C3-C7)циклоалкілалкіл, (C2C6)алкеніл, (C2-C6)алкініл, галоген-(C1-C6)алкіл, гетероциклоалкіл, гетероарил, гетероарилалкіл, арилалкіл або арил; кожен з яких, можливо, заміщений 1-5 незалежними замісниками: галоген, CN, -(C1-C6)алкіл, -O-(C0-C6)алкіл, -O-(C3C7)циклоалкілалкіл, -O(арил), -O(гетероарил), N((C0-C6)алкіл)2, -N((C0-C6)алкіл)((C3C7)циклоалкіл) або -N((C0-C6)алкіл)(арил); D, E, F, G й H незалежно один від одного являють собою -C(R3)=, -C(R3)=C(R4)-,-C(=O)-,-C(=S), -O-, -N=, -N(R3)- або -S-; B являє собою одинарний зв'язок, -C(=O)-(C0C2)алкіл-, -C(=O)-(C2-C6)алкеніл-, -C(=O)-(C2C6)алкініл-, -C(=O)-O-, -C(=O)NR8-(C0-C2)алкіл-, C(=NR8)NR9-S(=O)-(C0-C2)алкіл-, -S(=O)2-(C0C2)алкіл-, -S(=O)2NR8-(C0-C2)алкіл-, C(=NR8)-(C0C2)алкіл-, -C(=NOR8)-(C0-C2)алкілабо 13 C(=NOR8)NR9-(C0-C2)алкіл-; R8 й R9, незалежно один від одного являють собою групи, вказані вище. Будь-який N може являти собою N-оксид. Даний винахід включає обидва можливих стереоізомери, а також включає як рацемічні сполуки, так й індивідуальні енантіомери. Щоб уникнути сумнівів, варто розуміти, що в даному описі «(C1-C6)» позначає вуглецеву групу, що містить 1, 2, 3, 4, 5 або 6 атомів вуглецю. «(C0C6)» позначає вуглецеву групу, що містить 0, 1, 2, 3, 4, 5 або 6 атомів вуглецю. У даному описі «C» позначає атом вуглецю. У наведеному вище визначенні термін «(C1C6)алкіл» включає такі групи, як метил, етил, пропил, ізо-пропил, бутил, ізо-бутил, ди-бутил, третбутил, пентил, ізо-пентил, нео-пентил, третпентил, гексил, або інше. «(C2-C6)алкеніл» включає такі групи, як етеніл, 1-пропеніл, аліл, ізо-пропеніл, 1-бутеніл, 3-бутеніл, 4-пентеніл, тощо. «(C2-C6)алкініл» включає такі групи, як етиніл, пропиніл, бутиніл, пентиніл, тощо. «Галоген» включає такі атоми, як фтор, хлор, бром і йод. «Циклоалкіл» відноситься до заміщеного вуглецевого кільця, який не містить гетероатомів, включаючи моно-, ди- і трициклічні насичені вуглецеві кільця, а також системи з комбінованими кільцями. Зазначені системи з комбінованими кільцями можуть включати повністю або частково ненасичені кільця, такі як бензольне кільце, з утворенням систем з комбінованими кільцями, таких як вуглецеві кільця, комбіновані з бензольним кільцем. Циклоалкіл включає такі системи з комбінованими кільцями, як спіро-комбіновані кільцеві системи. Приклади циклоалкілів включають циклопропил, циклобутил, циклопентил, циклогексил, декагідронафталін, адамантан, індан, флуорен, 1,2,3,4-тетрагідронафталін, тощо. «Гетероциклоалкіл» відноситься до заміщеного карбоциклу, що містить, щонайменше, один гетероатом, обраний незалежно серед O, N, S. Цей термін включає моно-, ди- і трициклічні насичені вуглецеві кільця, а також системи з комбінованими кільцями. Зазначені системи з комбінованими кільцями можуть включати одне повністю або частково ненасичене кільце, таке як бензольне кільце, з утворенням систем з комбінованими кільцями, таких як вуглецеві кільця, комбіновані з бензольним кільцем. Приклади гетероциклоалкілів включають піперидин, піперазин, морфолін, тетрагідротіофен, індолін, ізохінолін, тощо. «Арил» включає (C6-C10)арильну групу, таку як феніл, 1-нафтіл, 2-нафтіл, тощо. «Арилалкіл» включає (C6-C10)арил-(C1C3)алкільную групу, таку як бензильна група, 1фенілетильна група, 2-фенілетильна група, 1фенілпропильна група, 2-фенілпропильна група, 3фенілпропильна група, 1-нафтілметильна група, 2нафтілметильна група, тощо. «Гетероарил» включає 5-10-членну гетероциклічну групу, що містить від 1 до 4 гетероатомів, обраних серед кисню, азоту або сірки, з утворенням такого кільця, як фурил (фуранове кільце), 92495 14 бензофураніл (бензофуранове кільце), тіеніл (тіофенове кільце), бензотіеніл (бензотіофенове кільце), піроліл (пірольне кільце) імідазоліл (імідазольне кільце), піразоліл (піразольне кільце), тіазоліл (тіазольне кільце), ізотіазоліл (ізотіазольне кільце), триазоліл (триазольне кільце), тетразоліл (тетразольне кільце), піридил (піридинове кільце), піразиніл (піразинове кільце), піримідил (піримідинове кільце), піридазил (пирідазинове кільце), індоліл (індольне кільце), ізоіндоліл (ізоіндольне кільце), бензоімідазоліл (бензоімідазольне кільце), пуриніл (пуринове кільце), хіноліл (хінолінове кільце), фталазиніл (фталазинове кільце), нафтиридініл (нафтиридінове кільце), хіноксалініл (хіноксалінове кільце), циноліл (цинолінове кільце), птеридиніл (птеридинове кільце), оксазоліл (оксазольне кільце), ізоксазоліл (ізоксазольне кільце), бензоксазоліл (бензоксазольне кільце), бензотіазоліл (бензотіазольне кільце), фуразаніл (фуразанове кільце), тощо. «Гетероарилалкіл» включає гетероарил-(C1C3)алкільную групу, причому приклади гетероарилу ті ж самі, що й наведені у визначенні вище, такі як 2-фурилметильна група, 3-фурилметильна група, 2-тіенілметильна група, 3-тіенілметильна група, 1-імідазолілметильна група, 2імідазолілметильна група, 2-тіазолілметильна група, 2-піридилметильна група, 3-піридилметильна група, 1-хінолілметильна група, або інше. «Сольват» відноситься до комплексу непостійної стехіометрії, утвореному розчиненою речовиною (наприклад, сполукою формули I) і розчинником. Розчинник являє собою фармацевтично прийнятний розчинник, переважно, такий як вода; зазначений розчинник не повинен впливати на біологічну активність речовини, яку розчиняють. «Можливо» означає, що описана після подія(ї) можуть відбуватися або не відбуватися, і включає обидва випадки, коли подія(ї) відбувається, і коли подія(ї) не відбувається. Термін «заміщений» відноситься до заміщення зазначеним замісником або замісниками, численні ступені заміщення припускаються, якщо не визначено інше. Сполуки, що переважають, згідно із заявленим винаходом являють собою сполуки формули I-A, зображеної нижче O P N B N N Q J I-A R1 R 2 , або фармацевтично прийнятні солі, гідрати або сольвати зазначених сполук, у яких: R1 й R2 являють собою незалежно один від одного водень, -(C1-C6)алкіл, -(C2-C6)алкеніл -(C2C6)алкініл, арилалкіл, гетероарилалкіл, гідроксил, аміногрупу, аміноалкіл, гідроксиалкіл, -(C1C6)алкоксил, або R1 й R2 разом можуть утворювати (C3-C7)циклоалкільне кільце, вуглецевий зв'язок C=O або вуглець-вуглецевий подвійний зв'язок; 15 92495 P й Q вибирають незалежно один від одного, і кожний з них позначає циклоалкільну, гетероцикR7 R3 R3 N R6 R4 , R5 лоалкільну, арильну або гетероарильну групи формули R3 R6 R4 R3 N R6 R5 , H G , R4 S E F R5 R7 R4 R5 D N R3 R4 S , R3, R4, R5, R6, і R7 незалежно один від одного являють собою наступні замісники: водень, галоген, -NO2, -(C1-C6)алкіл, -(C3-C6)циклоалкіл, -(C3C7)циклоалкілалкіл, -(C2-C6)алкеніл, -(C2C6)алкініл, галоген-(C1-C6)алкіл, гетероарил, гетероарилалкіл, арилалкіл, арил, -OR8, -NR8R9, C(=NR10)NR8R9, -NR8COR9, NR8CO2R9, NR8SO2R9, NR10CO NR8R9, -SR8, -S(=O)R8, -S(=O)2R8, S(=O)2NR8R9, -C(=O)R8, -C(=O)-O-R8, -C(=O)NR8R9, -C(=NR8)R9, або C(=NOR8)R9; при цьому, можливо, два замісники разом з атомами, що перебувають між ними, утворюють біциклічне гетероциклоалкільне, арильне або гетероарильне кільце; причому кожне кільце, можливо, додатково заміщене 1-5 групами, незалежно обраними серед наступних: галоген, -CN, -(C1-C6)алкіл, -O-(C0-C6)алкіл, -O-(C3C7)циклоалкілалкіл, -O(арил), O(гетероарил), -O-(C1-C3)алкіларил, -O-(C1-C3)алкілгетероарил, -N((C0-C6)алкіл)((C0-C3)алкіларил) або -N((C0C6)алкіл)((C0-C3-)алкілгетероарил); R8, R9, R10 кожен незалежно один від одного являють собою: водень, (C1-C6)алкіл, (C3C6)циклоалкіл, (C3-C7)циклоалкілалкіл, (C2C6)алкеніл, (C2-C6)алкініл, галоген-(C1-C6)алкіл, гетероциклоалкіл, гетероарил, гетероарилалкіл, арилалкіл або арил; кожен з яких, можливо, заміщений 1-5 незалежними замісниками: галоген, CN, -(C1-C6)алкіл, -O-(C0-C6)алкіл, -O-(C3C7)циклоалкілалкіл, -O(арил), -O(гетероарил), N((C0-C6)алкіл)2, -N((C0-C6)алкіл)((C3C7)циклоалкіл) або -N((C0-C6)алкіл)(арил); D, E, F, G й H незалежно один від одного являють собою -C(R3)=, -C(R3)=C(R4)-,-C(=O)-,-C(=S), -O-, -N=, -N(R3)- або -S-; B являє собою одинарний зв'язок, -C(=O)-(C0C2)алкіл-, -C(=O)-(C2-C6)алкеніл-, -C(=O)-(C2C6)алкініл-, -C(=O)-O-, -C(=O)NR8-(C0-C2)алкіл-, C(=NR8)NR9-S(=O)-(C0-C2)алкіл-, -S(=O)2-(C0C2)алкіл-, -S(=O)2NR8-(C0-C2)алкіл-, C(=NR8)-(C0 R3 16 , P , N N Q J I-B , або фармацевтично прийнятні солі, гідрати або сольвати зазначених сполук; у яких P й Q вибирають незалежно один від одного, і кожен з них означає циклоалкільну, гетероциклоалкільну, арильну або гетероарильну групу формули R3 R6 R4 C2)алкіл-, -C(=NOR8)-(C0-C2)алкілабо C(=NOR8)NR9-(C0-C2)алкіл-; R8 й R9, незалежно один від одного являють собою групи, вказані вище; J являє собою одинарний зв'язок, -C(R11)(R12), -O-, -N(R11)- або -S-; R11, R12 незалежно один від одного являють собою водень, -(C1-C6)алкіл, -(C3-C6)циклоалкіл, (C3-C7)циклоалкілалкіл, -(C2-C6)алкеніл, -(C2C6)алкініл, галоген-(C1-C6)алкіл, гетероарил, гетероарилалкіл, арилалкіл або арил; кожної з яких, можливо, заміщений 1-5 незалежними замісниками: галоген, -CN, -(C1-C6)алкіл, -O(C0-C6)алкіл, O(C3-C7)циклоалкілалкіл, -O(арил), O(гетероарил), -N((C0-C6)алкіл)((C0-C6)алкіл),N((C0-C6)алкіл)((C3-C7)циклоалкіл) або -N((C0C6)алкіл)(арил). Будь-який N може являти собою N-оксид. Даний винахід включає декілька можливих стереоізомерів, а також включає як рацемічну сполуку, так й індивідуальні енантіомери. Сполуки, що переважають, згідно з даним винаходом являють собою сполуки формули I-B O N O S R5 , D N R3 R4 S H R4 , G E F R5 R3, R4, R5, R6, і R7 незалежно один від одного являють собою наступні замісники: водень, галоген, -NO2, -(C1-C6)алкіл, -(C3-C6)циклоалкіл, -(C3C7)циклоалкілалкіл, -(C2-C6)алкеніл, -(C2C6)алкініл, галоген-(C1-C6)алкіл, гетероарил, гетероарилалкіл, арилалкіл, арил, -OR8, -NR8R9, C(=NR10)NR8R9, -NR8COR9, NR8CO2R9, NR8SO2R9, NR10CO NR8R9, -SR8, -S(=O)R8, -S(=O)2R8, S(=O)2NR8R9, -C(=O)R8, -C(=O)-O-R8, -C(=O)NR8R9, -C(=NR8)R9, або -C(=NOR8)R9; при цьому, можливо, два замісники разом з атомами, що перебувають між ними, утворять біциклічне гетероциклоалкільне, арильне або гетероарильне кільце; причому кожне кільце, можливо, додатково заміщене 1-5 групами, незалежно вибраними серед наступних: галоген, -CN, -(C1-C6)алкіл, -O-(C0 17 C6)алкіл, -O-(C3-C7)циклоалкілалкіл, -O(арил), O(гетероарил), -O-(-C1-C3)алкіларил, -O-(C1C3)алкілгетероарил, -N((-C0-C6)алкіл)((C0C3)алкіларил) або -N((C0-C6)алкіл)((C0-C3)алкілгетероарил); R8, R9, R10 кожен незалежно один від одного являють собою: водень, (C1-C6)алкіл, (C3C6)циклоалкіл, (C3-C7)циклоалкілалкіл, (C2C6)алкеніл, (C2-C6)алкініл, галоген-(C1-C6)алкіл, гетероциклоалкіл, гетероарил, гетероарилалкіл, арилалкіл або арил; кожен з яких, можливо, заміщений 1-5 незалежними замісниками: галоген, CN, -(C1-C6)алкіл, -O-(C0-C6)алкіл, -O-(C3C7)циклоалкілалкіл, -O(арил), -O(гетероарил), N((C0-C6)алкіл)2, -N((C0-C6)алкіл)((C3C7)циклоалкіл) або -N((C0-C6)алкіл)(арил); D, E, F, G й H незалежно один від одного являють собою -C(R3)=, -C(R3)=C(R4)-,-C(=O)-,-C(=S), -O-, -N=, -N(R3)- або -S-; J являє собою одинарний зв'язок, -C(R11)(R12), -O-, -N(R11)- або -S-; R11, R12 незалежно один від одного являють собою водень, -(C1-C6)алкіл, -(C3-C6)циклоалкіл, (C3-C7)циклоалкілалкіл, -(C2-C6)алкеніл, -(C2C6)алкініл, галоген-(C1-C6)алкіл, гетероарил, гетероарилалкіл, арилалкіл або арил; кожної з яких, можливо, заміщений 1-5 незалежними замісниками: галоген, -CN, -(C1-C6)алкіл, -O(C0-C6)алкіл, O(C3-C7)циклоалкілалкіл, -O(арил), O(гетероарил), -N((C0-C6)алкіл)((C0-C6)алкіл),N((C0-C6)алкіл)((C3-C7)циклоалкіл) або -N((C0C6)алкіл)(арил). Будь-який N може являти собою N-оксид. Даний винахід включає й можливі стереоізомери, а також включає як рацемічні сполуки, так і індивідуальні енантіомери. Особливо переважними сполуками є: (4-фторфеніл)-{(S)-3-[5-(4-фторфеніл)[1,2,4]оксадіазол-3-іл]-піперидин-1-іл}-метанон (4-фторфеніл)-{(R)-3-[5-(4-фторфеніл)[1,2,4]оксадіазол-3-іл]-піперидин-1-іл}-метанон (3,4-дифторфеніл)-{3-[5-(2-фторфеніл)[1,2,4]оксадіазол-3-ил]-піперидин-1-іл}-метанон (2,4-дифторфеніл)-{3-[5-(2-фторфеніл)[1,2,4]оксадіазол-3-ил]-піперидин-1-іл}-метанон (4-фтор-2-метиламінофеніл)-{3-[5-(2фторфеніл)-[1,2,4]оксадіазол-3-іл]-піперидин-1-іл}метанон {3-[5-(2-фторфеніл)-[1,2,4]оксадіазол-3-іл]піперидин-1-іл}-(5-фторпіридин-2-іл)-метанон {3-[5-(2-фторфеніл)-[1,2,4]оксадіазол-3-іл]піперидин-1-іл}-(5-метилізоксазол-4-іл)-метанон (4-фторфеніл)-[3-(5-тіазол-4-іл[1,2,4]оксадіазол-3-іл)-піперидин-1-іл]-метанон {3-[5-(4-фторфеніл)-[1,2,4]оксадіазол-3-іл]піперидин-1-іл}-(6-фторпіридин-3-іл)-метанон (3,4-дифторфеніл)-{3-[5-(4-фторфеніл)[1,2,4]оксадіазол-3-іл]-піперидин-1-іл}-метанон (4-фторфеніл)-[3-(5-піридин-2-іл[1,2,4]оксадіазол-3-іл)-піперидин-1-іл]-метанон (6-фторпіридин-3-іл)-[3-(5-піридин-2-іл[1,2,4]оксадіазол-3-іл)-піперидин-1-іл]-метанон {3-[5-(2,4-дифторфеніл)-[1,2,4]оксадіазол-3-іл]піперидин-1-іл}-(4-фторфеніл)-метанон (4-фторфеніл)-[3-(5-піридин-4-іл 92495 18 [1,2,4]оксадіазол-3-іл)-піперидин-1-іл]-метанон (3,4-дифторфеніл)-[3-(5-піридин-4-іл[1,2,4]оксадіазол-3-іл)-піперидин-1-іл]-метанон (2,4-дифторфеніл)-[3-(5-піридин-4-іл[1,2,4]оксадіазол-3-іл)-піперидин-1-іл]-метанон (3,4-дифторфеніл)-{3-[5-(2,4-дифторфеніл)[1,2,4]оксадіазол-3-іл]-піперидин-1-іл}-метанон (2,4-дифторфеніл)-{3-[5-(4-фторфеніл)[1,2,4]оксадіазол-3-іл]-піперидин-1-іл}-метанон (2,4-дифторфеніл)-{3-[5-(2,4-дифторфеніл)[1,2,4]оксадіазол-3-іл]-піперидин-1-іл}-метанон (5-метилізоксазол-4-ил)-[3-(5-піридин-4-іл[1,2,4]оксадіазол-3-іл)-піперидин-1-іл]-метанон (6-фторпіридин-3-іл)-[3-(5-піридин-4-іл[1,2,4]оксадіазол-3-іл)-піперидин-1-іл]-метанон (4-фтор-2-метилфеніл)-[3-(5-піридин-4-іл[1,2,4]оксадіазол-3-іл)-піперидин-1-іл]-метанон (4-фтор-2-метилфеніл)-{3-[5-(2-фторфеніл)[1,2,4]оксадіазол-3-іл]-піперидин-1-іл}-метанон {3-[5-(2,4-дифторфеніл)-[1,2,4]оксадіазол-3-іл]піперидин-1-іл}-(5-метилізоксазол-4-іл)-метанон {3-[5-(2,4-дифторфеніл)-[1,2,4]оксадіазол-3-іл]піперидин-1-іл}-(6-фторпіридин-3-іл)-метанон (4-фторфеніл)-[3-(5-феніл-[1,2,4]оксадіазол-3іл)-піперидин-1-іл]-метанон (4-фтор-2-метилфеніл)-{3-[5-(4-фторфеніл)[1,2,4]оксадіазол-3-іл]-піперидин-1-іл}-метанон {3-[5-(4-фторфеніл)-[1,2,4]оксадіазол-3-іл]піперидин-1-іл}-(5-метилізоксазол-4-іл)-метанон (6-фторпіридин-3-іл)-[3-(5-феніл[1,2,4]оксадіазол-3-іл)-піперидин-1-іл]-метанон (6-фторпіридин-3-іл)-[3-(5-тіазол-4-іл[1,2,4]оксадіазол-3-іл)-піперидин-1-іл]-метанон {3-[5-(2,4-дифторфеніл)-[1,2,4] оксадіазол-3іл]-піперидин-1-іл}-(4-фтор-2-метилфеніл) метанон (3,4-дифторфеніл)-[3-(5-феніл[1,2,4]оксадіазол-3-іл)-піперидин-1-іл]-метанон (2,4-дифторфеніл)-[3-(5-феніл[1,2,4]оксадіазол-3-іл)-піперидин-1-іл]-метанон (4-фтор-2-метилфеніл)-[3-(5-феніл[1,2,4]оксадіазол-3-іл)-піперидин-1-іл]-метанон (4-фторфеніл)-[3-(5-циклопентіл[1,2,4]оксадіазол-3-іл)-піперидин-1-іл]-метанон {(S)-3-[5-(4-фторфеніл)-[1,2,4]оксадіазол-3-іл]піперидин-1-іл}-(6-фторпіридин-3-іл)-метанон (3,4-дифторфеніл)-{(S)-3-[5-(4-фторфеніл)[1,2,4]оксадіазол-3-іл]-піперидин-1-іл}-метанон (3,5-диметилізоксазол-4-іл)-{(S)-3-[5-(4фторфеніл)-[1,2,4]оксадіазол-3-іл]-піперидин-1-іл}метанон {(S)-3-[5-(4-фторфеніл)-[1,2,4]оксадіазол-3-іл]піперидин-1-іл}-(5-метилізоксазол-4-іл)-метанон {(S)-3-[5-(4-фторфеніл)-[1,2,4]оксадіазол-3-іл]піперидин-1-іл}-(2-фторпіридин-4-іл)-метанон {(S)-3-[5-(4-фторфеніл)-[1,2,4]оксадіазол-3-іл]піперидин-1-іл}-(3-фторпіридин-4-іл)-метанон {(S)-3-[5-(4-фторфеніл)-[1,2,4]оксадіазол-3-іл]піперидин-1-іл}-(5-фторпіридин-2-іл)-метанон {(S)-3-[5-(4-фторфеніл)-[1,2,4]оксадіазол-3-іл]піперидин-1-іл}-(5-фторпіридин-3-іл)-метанон (S)-(4-фторфеніл)-{3-[5-(5-фторпіридин-2-іл)[1,2,4]оксадіазол-3-іл]-піперидин-1-іл}-метанон (S)-(3,4-дифторфеніл)-{3-[5-(5-фторпіридин-2іл)-[1,2,4]оксадіазол-3-іл]-піперидин-1-іл}-метанон 19 (S)-(4-фторфеніл)-{3-[5-(піридин-2-іл)[1,2,4]оксадіазол-3-іл]-піперидин-1-іл}-метанон (S)-(3,4-дифторфеніл)-{3-[5-(піридин-2-іл)[1,2,4]оксадіазол-3-іл]-піперидин-1-іл}-метанон (4-фторфеніл)-{(S)-3-[5-(1-метил-1H-імідазол4-іл)-[1,2,4]оксадіазол-3-іл]-піперидин-1-іл}метанон (3,4-дифторфеніл)-{(S)-3-[5-(3-фторпіридин-4іл)-[1,2,4]оксадіазол-3-іл]-піперидин-1-іл}-метанон (4-фторфеніл)-{(S)-3-[5-(3-фторпіридин-4-іл)[1,2,4]оксадіазол-3-іл]-піперидин-1-іл}-метанон [(S)-3-(5-піридин-2-іл-[1,2,4]оксадіазол-3-іл)піперидин-1-іл]-(2,4,6-трифторфеніл)-метанон [(S)-3-(5-піридин-2-іл-[1,2,4]оксадіазол-3-іл)піперидин-1-іл]-(2,3,4-трифторфеніл)-метанон (2,6-дифторфеніл)-[(S)-3-(5-піридин-2-іл[1,2,4]оксадіазол-3-іл)-піперидин-1-іл]-метанон (2,5-дифторфеніл)-[(S)-3-(5-піридин-2-іл[1,2,4]оксадіазол-3-іл)-піперидин-1-іл]-метанон (2,3-дифторфеніл)-[(S)-3-(5-піридин-2-іл[1,2,4]оксадіазол-3-іл)-піперидин-1-іл]-метанон. Даний винахід відноситься до фармацевтично прийнятних солей, утворених додаванням кислот до сполук формули I або до фармацевтично прийнятних носіїв або розріджувачів. Даний винахід відноситься до способу лікування або запобігання захворювань у ссавців, включаючи людину, на лікування або запобігання якого впливає або полегшує його нейромодуляторну дію позитивних алостерних модуляторів mGluR5. Даний винахід відноситься до способу, який придатний для лікування або запобігання різних розладів периферичної й центральної нервової системи, таких як терпимість або залежність, тривога, депресія, психічних захворювань, таких як психоз, запальна або нейропатична біль, погіршення пам'яті, хвороба Альцгеймера, ішемія, зловживання та схильність до наркотиків, як описано в прикладеній формулі винаходу. Даний винахід відноситься до фармацевтичних композицій, які забезпечують від приблизно 0,01 до 1000мг активного компоненту на окрему дозу. Зазначені композиції можна вводити будьяким підходящим способом. Наприклад, орально у формі капсул або таблеток, парентерально у формі розчинів для ін'єкцій, поверхнево у формі мазей або лосьйонів, через очі у формі очної примочки, ректально у формі супозиторіїв. Фармацевтичні композиції згідно даному винаходу можна виготовити загальноприйнятими в даній області способами; тип застосовуваних фармацевтичних композицій може залежати від обраного способу введення. Загальна добова доза зазвичай варіюється від приблизно 0,05 до 2000мг. Способи синтезу Сполуки загальної формули I можна одержати способами, відомими в органічному синтезі, як це частково описано в наступних схемах синтезу. У всіх описаних нижче схемах варто розуміти, що 92495 20 захисні групи для чутливих або реакційноспроможних груп застосовують, якщо буде потреба, відповідно до загальних принципів хімії. На захисні групи впливають у відповідності зі стандартними способами органічного синтезу (Green T.W. and Wuts P.G.M. (1991) Protecting Groups in Organic Synthesis, John Wiley et Sons). Зазначені групи видаляють на підходящій стадії синтезу сполуки з використанням способів, очевидних для фахівців у даній галузі. Вибір процесу, як і умов реакції й порядку їхнього виконання, повинен відповідати приготуванню сполук формули I. Сполуки формули I можуть бути представлені у виді суміші енантіомерів, яку можна розділити на індивідуальні чисті R- або S-енантіомери. Якщо, наприклад, обраний конкретний енантіомер сполуки формули I, його можна одержати шляхом асиметричного синтезу, або одержанням з використанням хіральної допоміжної речовини, при цьому розділяють одержану суміш диастереомерів і видаляють допоміжну групу, щоб одержати чисті обрані енантіомери. Як варіант, якщо молекула містить основну функціональну групу, таку як аміногрупа, або кислотну функціональну групу, таку як карбоксил, зазначений поділ легко можна здійснити шляхом часткової кристалізації з різних розчинників солей сполук формули I й оптично активних кислот, або іншими відомими в літературі способами, наприклад, хіральною колонковою хроматографією. Поділ кінцевого продукту й проміжної або вихідної речовини можна здійснювати будь-яким підходящим способом, відомим у даній галузі, як описано Eliel E.L., Wilen S.H. and Mander L.N. (1984) Stereochemistry of Organic Compounds, Wiley-Interscience. Безліч гетероциклических сполук формули I можна одержати, використовуючи широко відомі в даній галузі синтетичні підходи (Katrizky A.R. and. Rees C.W. (1984) Comprehensive Heterocyclic Chemistry, Pergamon Press). Продукт реакції можна виділити й очистити, застосовуючи стандартні методики, такі як екстракція, хроматографія, кристалізація, перегонка, тощо. Сполуки формули I, у яких W являє собою 3заміщене піперидинове кільце, можна одержати відповідно до послідовності синтезу, показаної на Схемі 1. При цьому P й Q незалежно один від одного являють собою арил або гетероарил, як описано вище B являє собою -C(=O)-(C0-C2)алкіл-; -S(=O)2(C0-C2)алкіл-. Описане нижче оксадіазольне кільце одержують відповідно до шляхів синтезу, добре відомих в даній галузі (Katrizky A.R. and Rees C.W. (1984) Comprehensive Heterocyclic Chemistry, Pergamon Press). 21 92495 22 Схема 1 Вихідне нітрильне похідне можна одержати у дві стадії, починаючи з відповідної N-заміщеної ніпекотинової кислоти, як показано на Схемі 1. Перетворення N-заміщеної ніпекотинової кислоти у відповідний первинний амід можна здійснити шляхом активації карбонової кислоти підходящим активуючим агентом, а потім взаємодії її з аміаком. Наприклад, за типовою методикою карбонову кислоту розчиняють у підходящому розчиннику (наприклад, ацетонітрил, хлороформ, дихлорметан, тетрагідрофуран, і т.д.) і додають підходящий активуючий агент, такий як карбонілдиімідазол, етилхлорформіат, і т.д., при температурі в діапазоні від 0°С до кімнатної температури. Іноді може бути необхідне додавання підходящої органічної основи, такої як триетиламін або ди-ізопропилетиламін. Потім реакційну суміш перемішують при температурі в діапазоні від 0°С до кімнатної температури, протягом проміжку часу в діапазоні від 10 хвилин до 1 години, після чого вводять газоподібний аміак або концентрований водяний розчин аміаку. Реакція, як правило, протікає при температурі навколишнього середовища протягом проміжку часу в діапазоні від 1 години до 12 годин. Первинний амід взаємодіє з підходящим дегідратуючим агентом, таким як оксихлорид фосфору, тіонілхлорид, тощо, у підходящому розчиннику (наприклад, ацетонітрил, піридин, і т.д.) або без розчинника. Реакція, як правило, протікає в діапазоні температур від кімнатної температури до температури кипіння розчинника, протягом проміжку часу в діапазоні від 3 годин до 1 ночі. Нітрильне похідне взаємодіє з гідроксиламіном у нейтральному або лужному середовищі, такому як триетиламін, ди-ізо-пропилетиламін, карбонат натрію, гідроксид натрію, тощо, у підходящому розчиннику (наприклад, метиловий спирт, етиловий спирт). Як правило, у процесі реакції реакційної суміші дозволяють повільно нагріватися від кімнатної температури до температури в діапазоні від 70°С до 80°С включно за проміжок часу в діапазоні від приблизно 1 години до 48 годин включно (див., наприклад, Lucca, George V. De; Kim, Ui T.; Liang, Jing; Cordova, Beverly; Klabe, Ronald M.; et al.; J.Med.Chem.; EN; 41; 13; 1998; 2411-2423, Lila, Christine; Gloanec, Philippe; Cadet, Laurence; Herve, Yolande; Fournier, Jean; et al.; Synth.Commun.; EN; 28; 23; 1998; 4419-4430 і див.: Sendzik, Martin; Hui, Hon C.; Tetrahedron Lett.; EN; 44; 2003; 8697-8700 і посилання тут на реакцію в нейтральному середовищі). Заміщене похідне амідоксиму можна перетворити в похідне ацил-амідоксиму за допомогою підходу, наміченого на Схемі 1. На Схемі 1, PG1 являє собою аміно-захищену групу, таку як трибутилоксикарбоніл, бензилоксикарбоніл, етоксикарбоніл, бензил, тощо. Реакцію з’єднання можна прискорити за допомогою агентів з’єднання, відомих в органічному синтезі, таких як КДІ (1-(3диметиламінопропил)-3-етилкарбодіімід), ДЦК (N,N’-дициклогексилкарбодіімід), у присутності підходящої основи, такої як триетиламін, ди-ізопропилетиламін, у підходящому розчиннику (наприклад, тетрагідрофуран, дихлорметан, N,Nдиметилформамід, діоксан). Зазвичай в реакційній суміші може також бути присутній сокаталізатор, такий як HOВT (гідроксибензотріазол), HOAT (1гідрокси-7-азабензотріазол). Реакція, як правило, протікає в діапазоні температур від кімнатної температури до 60°С включно протягом проміжку часу в діапазоні від приблизно 2 годин до 12 годин, щоб одержати проміжну сполуку ацил-амідоксим. Реакцію циклізації можна викликати термічно в діапазоні температур від приблизно 80°С до приблизно 150°С протягом проміжку часу від приблизно 2 годин до приблизно 18 годин (див., наприклад, Suzuki, Takeshi; Iwaoka, Kiyoshi; Imanishi, Naoki; Nagakura, Yukinori; Miyata, Keiji; et al.; Chem.Pharm.Bull.; EN; 47; 1; 1999; 120-122). Реакцію циклізації також можна викликати нагріванням за допомогою мікрохвильового випромінювання в діапазоні температур від приблизно 80°С до приблизно 150°С протягом проміжку часу від приблизно 2 годин до приблизно 5 годин. Продукт реакції можна виділити й очистити з використанням стандартних методик, таких як екстракція, хроматографія, кристалізація, перегонка, тощо. Потім захисні групи PG1 видаляють із використанням стандартних способів. На Схемі 1, B ви 23 92495 значено вище,xявляє собою галоген або гідроксил; наприклад, похідне піперидину взаємодіє з арилабо гетероарил-ацилхлоридом, за допомогою способів, легко зрозумілих фахівцям. Реакцію можна прискорити за допомогою основи, такої як триетиламін, ди-ізо-пропиламін, піридин, у підходящому розчиннику (наприклад, тетрагідрофуран, дихлорметан). Як правило, у процесі реакції реакційну суміш повільно нагрівають від 0°С до кімнатної температури протягом проміжку часу від приблизно 4 до 12 годин. Якщоxявляє собою OH, реакцію з’єднання можна прискорити за допомогою відомих в органічному синтезі агентів з’єднання, таких як КДІ (1-(3диметиламінопропил)-3-етилкарбодіімід), ДЦК (N,N’-дициклогексилкарбодіімід), або агентів з’єднання на полімерному носії, таких як карбодіімід на полімерному носії (PS-DCC, ex Argonaut Technologies), у присутності підходящої основи, такої як триетиламін, ди-ізо-пропилетиламін, у підходящому розчиннику (наприклад, тетрагідрофуран, дихлорметан, N,N-диметилформамід, діоксан). Зазвичай в реакційній суміші може також бути присутній сокаталізатор, такий як HOBT (гідроксибензотриазол), HOAT (1-гідрокси-7азабензотриазол), тощо. Реакція, як правило, прог (грами) мг (міліграми) мл (миллилитры) μл (мікролітри) M (молярний) МГц (мегагерц) ммоль (мілімолі) хв (хвилини) AcOEt (етилацетат) K2CO3 (карбонат калію) CDCl3 (дейтерований хлороформ) КДІ.HCl (1-(3-диметиламінопропил)-3етилкарбодіімід, гідрохлорид) EtOH (етиловий спирт) % (відсоток) DCM (дихлорметан) DIEA (ди-ізо-пропилетиламін) Т. пл. (температура плавлення) 24 тікає при кімнатній температурі протягом проміжку часу в діапазоні від приблизно 2 годин до 12 годин. Сполуки формули I, що мають основну природу, можуть утворювати широкий спектр різних фармацевтично прийнятних солей з різними органічними й неорганічними кислотами. Зазначені солі легко одержати обробкою основних сполук, власне кажучи, еквівалентною кількістю обраної мінеральної або органічної кислоти в підходящому органічному розчиннику, такому як метанол, етанол або ізо-пропанол (див. Stahl P.H., Wermuth C.G., Handbook of Pharmaceuticals Salts, Properties, Selection and Use, Wiley, 2002). Наступні не обмежуючі приклади призначені для ілюстрації даного винаходу. Фізичні дані, наведені для сполук, що служать прикладами, погоджуються із установленою структурою зазначених сполук. Приклади Якщо не оговорено інше, всі вихідні речовини одержані від промислових постачальників і використані без подальшого очищення. Зокрема, наступні скорочення можуть бути використані в прикладах і протягом опису. кт (кімнатна температура) MeOH (метанол) Гц (Герц) РХ-МС (Рідинна Хроматографія - Мас-спектрометрія) ВЕРХ (Високо Ефективна Рідинна Хроматографія) ЯМР (Ядерний Магнітний Резонанс) 1H (протон) Na2SO4 (сульфат натрію) MgSO4 (сульфат магнію) HOBT (1-гідроксибензотриазол) RT (час утримання) NaOH (гідроксид натрію) год (година) HCl (соляна кислота) n-BuLi (н-бутиллітій) ТГФ (тетрагідрофуран) Всі посилання на розчин солі відносяться до насиченого водяного розчину NaCl. Якщо не зазначено інше, всі температури виражені в°C (градуси Цельсія). Всі реакції проводять в інертній атмосфері при кімнатній температурі, якщо не відзначене інше. 1 H ЯМР спектри записують на приладі Brucker 500МГц або на Brucker 300МГц. Хімічні здвиги виражені в мільйонних частках (м. буд., одиниці δ). Константи взаємодії виражені в герцах (Гц). Структури розщеплення описують видимі мультиплетності й позначені як с (синглет), д (дублет), т (триплет), кв (квадруплет), кв (квінтуплет), м (мультиплет). РХ-МС записують у наступних умовах: Спосіб A) Прилад Waters Alliance 2795 HT Micromass ZQ. Колонка Waters XTerra MS C18 (50x4,6мм, 2,5μм). Витрата 1мл/хв. Рухлива фаза: фаза A=вода/CH3CN 95/5+0,05% TFA, фаза B=вода/CH3CN=5/95+0,05% TFA. 0-1хв. (A: 95%, B: 5%), 1-4хв. (A: 0%, B: 100%), 4-6хв. (A: 0%, B: 100%), 6-6,1хв. (A: 95%, B: 5%). T=35°C; УФдетектування: Waters Photodiode array 996, 200400нм. Спосіб B) Прилад Waters Alliance 2795 HT Micromass ZQ. Колонка Waters XTerra MS C18 (50x4,6мм, 2,5μм). Витрата 1,2мл/хв. Рухлива фаза: фаза A=вода/CH3CN 95/5+0,05% TFA, фаза B=вода/CH3CN=5/95+0,05% TFA. 0-0,8хв. (A: 95%, B: 5%), 0,8-3,3хв. (A: 0%, B: 100%), 3,3-5хв. (A: 0%, B: 100%), 5-5,1хв. (A: 95%, B: 5%). T=35°C; УФдетектування: Waters Photodiode array 996, 200400нм. Спосіб C) Прилад Waters Alliance 2795 HT Micromass ZQ. Колонка Waters Symmetry C18 (75x4,6мм, 3,5μм). Витрата 1мл/хв. Рухлива фаза: 25 фаза A=вода/CH3CN 95/5+0,05% TFA, фаза B=вода/CH3CN=5/95+0,05% TFA. 0-0,1хв. (A: 95%, B: 5%), 1-11хв. (A: 0%, B: 100%), 11-12хв. (A: 0%, B: 100%), 12-12,1хв. (A: 95%, B: 5%). T=35°C; УФдетектування: Waters Photodiode array 996, 200400нм. Спосіб D) Прилад Waters Alliance 2795 HT Micromass ZQ. Колонка Waters Symmetry C18 (75x4,6мм, 3,5μм). Витрата 1,5мл/хв. Рухлива фаза: фаза A=вода/CH3CN 95/5+0,05% TFA, фаза B=вода/CH3CN=5/95+0,05% TFA. 0-0,5хв. (A: 95%, B: 5%), 0,5-7хв. (A: 0%, B: 100%), 7-8хв. (A: 0%, B: 100%), 8-8,1хв. (A: 95%, B: 5%). T=35°C; УФдетектування: Waters Photodiode array 996, 200400нм. Спосіб E): Pump 515, 2777 Sample Manager, Micromass ZQ Single quadrupole (Waters). Колонка 2,1*50мм нержавіюча сталь, набита 3,5μм SunFire RP C-18 (Waters); витрата 0,25мл/хв., коефіцієнт поділу MS: відходи / 1:4; Рухлива фаза: фаза A=вода/ацетонітрил 95/5+0,1% TFA, фаза B=вода/ацетонітрил 5/95+0,1% TFA. 0-1,0хв. (A: 98%, B: 2%), 1,0-5,0хв. (A: 0%, B: 100%), 5,0-9,0хв. (A: 0%, B: 100%), 9,1-12хв. (A: 98%, B: 2%); УФдетектування: довжина хвилі 254нм; Об’єм ін’єкції: 5μл. Спосіб F) Прилад Waters Alliance 2795 HT Micromass ZQ. Колонка Waters XTerra MS C18 (50x4,6мм, 2,5μм). Витрата 1,2мл/хв. Рухлива фаза: фаза A=вода/CH3CN 95/5+0,05% TFA, фаза B=вода/CH3CN=5/95+0,05% TFA. 0-0,5хв. (A: 90%, B: 10%), 0,5-3,5хв. (A: 0%, B: 100%), 3,5-5,5хв. (A: 0%, B: 100%), 5,5-5,51хв. (A: 90%, B: 10%). T=35°C; УФ-детектування: Waters Photodiode array 996, 200-400нм. Спосіб G): Pump 1525u (Waters), 2777 Sample Manager, Micromass ZQ2000 Single quadrupole (Waters); PDA детектор: 2996 (Waters). Колонка 2,1*30мм нержавіюча сталь, набита 3,0μм Luna C18; витрата 0,25мл/хв.; коефіцієнт поділу MS: відходи / 1:4; Рухлива фаза: фаза A=вода/ацетонітрил 95/5+0,1% TFA, фаза B=вода/ацетонітрил 5/95+0,1% TFA. 0-1,5хв. (A: 98%, B: 2%), 1,0-8,0хв. (A: 0%, B: 100%), 8,011,0хв. (A: 0%, B: 100%), 11,1-13хв. (A: 98%, B: 2%); УФ-детектування: довжина хвилі 254нм; Об’єм ін’єкції: 5μл. Спосіб H): система UPLC: Waters Acquity, Micromass ZQ2000 Single quadrupole (Waters). Колонка 2,1*50мм нержавіюча сталь, упакована 1,7μм Acquity UPLC-BEH; витрата 0,40мл/хв.; Рухлива фаза: фаза A=вода/ацетонітрил 95/5+0,1% TFA, фаза B=вода/ацетонітрил 5/95+0,1% TFA. 00,25хв. (A: 98%, B: 2%), 0,25-4,0хв. (A: 0%, B: 100%), 4,0-5,0хв. (A: 0%, B: 100%), 5,1-6хв. (A: 98%, B: 2%); УФ-детектування: довжина хвилі 254нм. Спосіб I): система ВЕРХ: Waters Acquity, MS детектор: Waters ZQ2000. Колонка: Acquity UPLCBEH C18 50x2,1ммx1,7 м; витрата 0,4мл/хв.; Рухлива фаза: фаза A=вода/ацетонітрил 95/5+0,1% TFA, фаза B=вода/ацетонітрил 5/95+0,1% TFA. 00,25хв. (A: 98%, B: 2%), 0,25-4,0хв. (A: 0%, B: 100%), 4,0-5,0хв. (A: 0%, B: 100%), 5,1-6хв. (A: 98%, B: 2%); УФ-детектування: довжина хвилі 92495 26 254нм. Спосіб L): система ВЕРХ: Waters Acquity, MS детектор: Waters ZQ2000. Колонка: Acquity UPLCBEH C18 50x2,1ммx1,7 м; витрата 0,3мл/хв; Рухлива фаза: фаза A=вода/ацетонітрил 95/5+0,1% TFA, фаза B=вода/ацетонітрил 5/95+0,1% TFA. 00,5хв. (A: 98%, B: 2%), 2,0хв. (A: 20%, B: 80%), 6,0хв. (A: 0%, B: 100%), 6,0-9,5хв. (A: 0%, B: 100%), 9,6хв. (A: 98%, B: 2%), 9,6-11,0хв. (A: 98%, B: 2%); УФ-детектування: довжина хвилі 254нм. Спосіб M) Прилад Waters Alliance 2795 HT Micromass ZQ. Колонка Waters Symmetry C18 (75x4,6мм, 3,5μм). Витрата 1,5мл/хв. Рухлива фаза: фаза A=вода/CH3CN 95/5+0,05% TFA, фаза B=вода/CH3CN=5/95+0,05% TFA. 0-2хв. (A: 95%, B: 5%), 6хв. (A: 0%, B: 100%), 6-8хв. (A: 0%, B: 100%), 8-8,1хв. (A: 95%, B: 5%). T=35°C; УФ-детектування: Waters Photodiode array 996, 200-400нм. Спосіб N): система СВЕРХ: Waters Acquity, Micromass ZQ2000 Single quadrupole (Waters). Колонка 2,1*50мм нержавіюча сталь, набита 1,7μм Acquity UPLC-BEH; витрата 0,50мл/хв.; Рухлива фаза: фаза A=вода/ацетонітрил 95/5+0,05% TFA, фаза B=вода/ацетонітрил 5/95+0,05% TFA. 00,1хв. (A: 95%, B: 5%), 1,6хв. (A: 0%, B: 100%), 1,61,9хв. (A: 0%, B: 100%), 2,4хв. (A: 95%, B: 5%); УФдетектування: довжина хвилі 254нм. Всі мас-спектри зняті способами електророспилювальної іонізації (ESI). За більшістю реакцій спостерігали за допомогою тонкошарової хроматографії на 0,25мм пластинах силікагелю Macherey-Nagel (60F-2254), візуалізація за допомогою УФ освітлення. Високошвидкісну колонкову хроматографію виконували на силікагелі (220-440 меш, Fluka). Визначення температури плавлення виконували на приладі Buchi B-540. Приклад 1 (4-фторфеніл)-{(S)-3-[5-(4-фторфеніл)[1,2,4]оксадіазол-3-іл]-піперидин-1-іл}-метанон O O N N N F F 1 (A) (S)-3-карбамоілпіперидин-1-карбонової кислоти три-бутиловий ефір. Триетиламін (1,21мл, 8,72ммоль), а потім етилхлорформіат (0,8мл, 8,30ммоль) додають по краплях при 0°C до розчину (S)-1-Boc-піперидин-3карбонової кислоти (2м, 8,72ммоль) у хлороформі (40мл), в атмосфері азоту. Після перемішування протягом 10хв. при 0°C, у розчин пропускають NH3 (газ) протягом 1год. Потім реакційну суміш перемішують при кімнатній температурі протягом 3год., додають 5% NaHCO3 (водн.) і розділяють фази. Органічний шар висушують над сульфатом натрію й випарюють при зниженому тиску, щоб одержати цільову сполуку, яку використовують на наступній стадії без подальшого очищення. Вихід: кількісний; РХ-МС (RT): 3,31хв. (Спосіб A); МС (ES+) дає m/z: 229,0. 1 (B) (S)-3-ціанопіперидин-1-карбоновой кислоти три-бутиловий ефір. Оксихлорид фосфору (812 л, 8,72ммоль) по 27 краплях додають при 0°C до розчину (S)-3карбамоілпіперидин-1-карбонової кислоти трибутилового ефіру (2м, 8,72ммоль) у піридині (20мл), в атмосфері азоту. Після перемішування протягом ночі при кімнатній температурі, додають етилацетат і промивають розчин 10% HCl (2 рази). Розділяють фази, висушують органічний шар над сульфатом натрію й випарюють досуха при зниженому тиску. Цільову сполуку використовують на наступній стадії без подальшого очищення. Вихід: кількісний; РХ-МС (RT): 4,48хв. (Спосіб A); МС (ES+) дає m/z: 211,1. 1 (C) (S)-3-(N-гідроксикарбамімідоіл)піперидин-1-карбонової кислоти три-бутиловий ефір. Розчин (S)-3-ціанопіперидин-1-карбонової кислоти три-бутилового ефіру (1,8м, 8,72ммоль) і водного гідроксиламіну (50% у воді, 2,1мл, 34,88ммоль) в етанолі (20мл) кип'ятять зі зворотним охолодженням протягом 2год. Розчинник випарюють при зниженому тиску, щоб одержати цільову сполуку, яку використовують на наступній стадії без подальшого очищення. Вихід: кількісний; РХ-МС (RT): 2,71хв. (Спосіб A); МС (ES+) дає m/z: 244,0. 1 (D) (S)-3-[5-(4-фторфеніл)-[1,2,4]оксадіазол3-ил]-піперидин-1-карбонової кислоти трибутиловий ефір. Суміш (S)-3-(N-гідроксикарбамімідоіл)піперидин-1-карбонової кислоти три-бутилового ефіру (500мг, 2,05ммоль), 4-фторбензойної кислоти (0,288м, 2,05ммоль), HOBT (0,277м, 2,05ммоль), КДІ.HCl (0,590м, 3,08ммоль) і сухого триетиламіну (0,571мол, 4,1ммоль) у сухому діоксані (5мл) витримують при перемішуванні й температурі навколишнього середовища протягом 20год., в атмосфері азоту. Потім реакційну суміш кип'ятять зі зворотним охолодженням протягом 2год. і випарюють розчинник при зниженому тиску. Одержаний залишок розбавляють водою (40мл) і етилацетатом (40мл), розділяють фази й промивають органічний шар послідовно водою (40мл, двічі), Na2CO3 1N (40мл, двічі) і розчином солі. Органічний шар висушують над сульфатом натрію й видаляють розчинник у вакуумі, щоб одержати залишок, який очищають за допомогою високошвидкісної хроматографії (силікагель, елюент: петролейний ефір/етилацетат 9:1), щоб одержати чисту цільову сполуку (161мг). Вихід: 23%; РХ-МС (RT): 6,65хв. (Спосіб A); МС (ES+) дає m/z: 348,0. 1 (E) (S)-3-[5-(4-фторфеніл)-[1,2,4]оксадіазол3-іл]-піперидину гідрохлорид. До розчину (S)-3-[5-(4-фторфеніл)[1,2,4]оксадіазол-3-іл]-піперидин-1-карбонової кислоти три-бутилового ефіру (0,160м, 0,46ммоль) у дихлорметані (5мл), додають 1,5мл 4N HCl (діоксановий розчин) при 0°С, залишають реакційну суміш нагрітися до кімнатної температури й перемішують протягом 1,5год. Розчинник випарюють при зниженому тиску, щоб одержати цільову сполуку у виді білої твердої речовини, яку використовують на наступній стадії без подальшого очищення. 92495 28 Вихід: кількісний; РХ-МС (RT): 3,03хв. (Спосіб A); МС (ES+) дає m/z: 248,0. 1 (F) (4-фторфеніл)-{(S)-3-[5-(4-фторфеніл)[1,2,4]оксадіазол-3-іл]-піперидин-1-іл}-метанон. До суспензії (S)-3-[5-(4-фторфеніл)[1,2,4]оксадіазол-3-іл]-піперидину гідрохлориду (114мг, 0,46ммоль) у сухому дихлорметані (10мл) додають по краплях при 0°С триетиламін (128 л, 0,92ммоль) і 4-фторбензоілхлорид (65 л, 0,55ммоль). Залишають реакційну суміш нагрітися до кімнатної температури й перемішують протягом 2год. в атмосфері азоту. Потім розчин обробляють водою (5мл) і розділяють фази. Органічний шар промивають послідовно 1N HCl (10мл, 2 рази), 5% NaHCO3 (10мл, двічі), потім висушують над Na2SO4 і випарюють при зниженому тиску. Неочищений продукт очищають за допомогою високошвидкісної хроматографії (силікагель, елюент: петролейний ефір/етилацетат 7:3), щоб одержати чисту цільовусполуку (79мг) у виді білої твердої речовини. Вихід: 47%; т. пл.=157-160°C; [α]D20=+65,4° (c=0,4, MeOH); РХ-МС (RT): 7,54хв. (Спосіб E); МС (ES+) дає m/z: 370,1. H-NMR (DMSO-d6, 300 MHz), δ (ppm): 8.13 (dd, 2H); 7.50-7.39 (m, 4H); 7.22 (dd, 2H); 4.23 (m, 1H); 3.81 (m, 1H); 3.40 (dd, 1H); 3.25 (ddd, 1H); 3.14 (m, 1H); 2.21 (m, 1H); 1.99-1.76 (m, 2H); 1.65 (m, 1H). Приклад 2 (4-фторфеніл)-{(R)-3-[5-(4-фторфеніл)[1,2,4]оксадіазол-3-іл]-піперидин-1-іл}-метанон O O N N N F F 2 (A) (R)-3-карбамоілпіперидин-1-карбонової кислоти три-бутиловий ефір Триетиламін (304μл, 2,18ммоль), а потім етилхлорформіат (0,22мл, 2,29ммоль) додають по краплях при 0°C до розчину (R)-1-Boc-піперидин-3карбонової кислоти (0,5м, 2,18ммоль) у хлороформі (10мл), в атмосфері азоту. Після перемішування протягом 10хв. при 0°C, у розчин пропускають NH3 (газ) протягом 1год. Потім реакційну суміш перемішують при кімнатній температурі протягом 3год., додають 5% NaHCO3 (водн.) і розділяють фази. Органічний шар висушують над сульфатом натрію й випарюють при зниженому тиску, щоб одержати цільову сполуку, що використовують на наступній стадії без подальшого очищення. Вихід: кількісний; РХ-МС (RT): 3,31хв. (Спосіб A); МС (ES+) дає m/z: 229,0. 2 (B) (R)-3-ціанопіперидин-1-карбонової кислоти три-бутиловий ефір. Оксихлорид фосфору (203µл, 2,18ммоль) по краплях додають при 0°C до розчину (R)-3карбамоілпіперидин-1-карбонової кислоти трибутилового ефіру (0,5м, 2,18ммоль) у піридині (10мл), в атмосфері азоту. Після перемішування протягом ночі при кімнатній температурі, додають етилацетат і промивають розчин 10% HCl (2 рази). Розділяють фази, висушують органічний шар над сульфатом натрію й випарюють досуха при зниженому тиску. 29 Цільову сполуку використовують на наступній стадії без подальшого очищення. Вихід: кількісний; РХ-МС (RT): 4,48хв. (Спосіб A); МС (ES+) дає m/z: 211,1. 2 (C) (R)-3-(N-гідроксикарбамімідоіл)піперидин-1-карбонової кислоти три-бутиловий ефір. Розчин (R)-3-ціанопіперидин-1-карбонової кислоти три-бутилового ефіру (457мг, 2,18ммоль) і водного гідроксиламіну (50% у воді, 0,534мол, 8,72ммоль) в етанолі (10мл) кип'ятять зі зворотним охолодженням протягом 2год. Розчинник випарюють при зниженому тиску, щоб одержати цільову сполуку, яку використовують на наступній стадії без подальшого очищення. Вихід: 80%; РХ-МС (RT): 2,71хв. (Спосіб A); МС (ES+) дає m/z: 244,0. 2 (D) (R)-3-[5-(4-фторфеніл)-[1,2,4]оксадіазол3-іл]-піперидин-1-карбонової кислоти трибутиловий ефір. Суміш (R)-3-(N-гідроксикарбамімідоіл)піперидин-1-карбонової кислоти три-бутилового ефіру (423мг, 1,74ммоль), 4-фторбензойної кислоти (0,244м, 1,74ммоль), HOBT (235мг, 1,74ммоль), КДІ.HCl (500мл, 2,61ммоль) і сухого триетиламіну (0,485мл, 3,48ммоль) у сухому діоксані (5мл) витримують при перемішуванні й температурі навколишнього середовища протягом 20год., в атмосфері азоту. Потім реакційну суміш кип'ятять зі зворотним охолодженням протягом 2год. і випарюють розчинник при зниженому тиску. Одержаний залишок розбавляють водою (40мл) і етилацетатом (40мл), розділяють фази й промивають органічний шар послідовно водою (40мл, двічі), Na2CO3 1N (40мл, двічі) і розчином солі. Органічний шар висушують над сульфатом натрію й видаляють розчинник у вакуумі, щоб одержати залишок, який очищають за допомогою високошвидкісної хроматографії (силікагель, елюент: петролейний ефір/етилацетат 9:1), щоб одержати чисту цільову сполуку (263мг). Вихід: 44%; РХ-МС (RT): 6,65хв. (Спосіб A); МС (ES+) дає m/z: 348,0. 2 (E) (R)-3-[5-(4-фторфеніл)-[1,2,4]оксадіазол3-іл]-піперидину гідрохлорид. До розчину (R)-3-[5-(4-фторфеніл)[1,2,4]оксадіазол-3-іл]-піперидин-1-карбонової кислоти три-бутилового ефіру (100мг, 0,29ммоль) у дихлорметані (5мл), додають 1мл 4N HCl (діоксановий розчин) при 0°С, залишають реакційну суміш нагрітися до кімнатної температури й перемішують протягом 1,5год. Розчинник випарюють при зниженому тиску, щоб одержати цільову сполуку у виді білої твердої речовини, що використовують на наступній стадії без подальшого очищення. Вихід: кількісний; РХ-МС (RT): 3,03хв. (Спосіб A); МС (ES+) дає m/z: 248,0. 2 (F) (4-фторфеніл)-{(R)-3-[5-(4-фторфеніл)[1,2,4]оксадіазол-3-іл]-піперидин-1-іл}-метанон. До суспензії (R)-3-[5-(4-фторфеніл)[1,2,4]оксадіазол-3-іл]-піперидину гідрохлориду (71мг, 0,29ммоль) у сухому дихлорметані (5мл), додають по краплях при 0°С триетиламін (0,121мл, 0,87ммоль) і 4-фторбензоілхлорид (41 л, 0,35ммоль). Залишають реакційну суміш 92495 30 нагрітися до кімнатної температури й перемішують протягом 2год. в атмосфері азоту. Потім розчин обробляють водою (5мл) і розділяють фази. Органічний шар промивають послідовно 1N HCl (10мл, 2 рази), 5% NaHCO3 (10мл, двічі), потім висушують над Na2SO4 і випарюють при зниженому тиску. Неочищений продукт очищають за допомогою високошвидкісної хроматографії (силікагель, елюент: петролейний ефір/етилацетат 7:3), щоб одержати чисту цільову сполуку (79мг) у виді білої твердої речовини. Вихід: 51%; т. пл.=120-123°C; [α]D20=-76,38° (c=0,7, MeOH); РХ-МС (RT): 7,17хв. (Спосіб E); МС (ES+) дає m/z: 370,1 1 H-NMR (DMSO-d6,), δ (ppm): 8.13 (dd, 2H); 7.50-7.39 (m, 4H); 7.22 (dd, 2H); 4.24 (m, 1H); 3.81 (m, 1H); 3.40 (dd, 1H); 3.29-3.09 (m, 2H); 2.21 (m, 1H); 1.99-1.76 (m, 2H); 1.64 (m, 1H). Приклад 3 (3,4-дифторфеніл)-{3-[5-(2-фторфеніл)[1,2,4]оксадіазол-3-іл]-піперидин-1-іл}-метанон O F O N N F F N 3 (A) 3-карбамоілпіперидин-1-карбонової кислоти три-бутиловий ефір. Триетиламін (0,96мл, 6,89ммоль) а потім етилхлорформіат (0,69мл, 7,23ммоль) додають по краплях при 0°C до розчину 1-Boc-піперидин-3карбонової кислоти (1,58м, 6,89ммоль) у хлороформі (10мл), в атмосфері азоту. Після перемішування протягом 10хв. при 0°C, у розчин пропускають NH3 (газ) протягом 1год. Потім реакційну суміш перемішують при кімнатній температурі протягом 3год., додають 5% NaHCO3 (водн.) і розділяють фази. Органічний шар висушують над сульфатом натрію й випарюють при зниженому тиску, щоб одержати цільову сполуку, яку використовують на наступній стадії без подальшого очищення. Вихід: кількісний; РХ-МС (RT): 3,31хв. (Спосіб A); МС (ES+) дає m/z: 229.0. 3 (B) 3-ціанопіперидин-1-карбонової кислоти три-бутиловий ефір Оксихлорид фосфору (0,64мол, 6,89ммоль) по краплях додають при 0°C до розчину 3карбамоілпіперидин-1-карбонової кислоти трибутилового ефіру (1,58м, 6,89ммоль) у піридині (15мл), в атмосфері азоту. Після перемішування протягом ночі при кімнатній температурі, додають етилацетат і промивають розчин 10% HCl (2 рази). Розділяють фази, висушують органічний шар над сульфатом натрію й випарюють досуха при зниженому тиску. Цільову сполуку використовують на наступній стадії без подальшого очищення. Вихід: кількісний; РХ-МС (RT): 4,48хв. (Спосіб A); МС (ES+) дає m/z: 211,1. 3 (C) 3-(N-гідроксикарбамімідоіл)-піперидин-1карбонової кислоти три-бутиловий ефір. Розчин 3-ціанопіперидин-1-карбонової кислоти 31 три-бутилового ефіру (1,4м, 6,89ммоль) і водного гідроксиламіну (50% у воді, 1,7мол, 27,5ммоль) в етанолі (15мл) кип'ятять зі зворотним охолодженням протягом 2год. Розчинник випарюють при зниженому тиску, щоб одержати цільову сполуку, яку використовують на наступній стадії без подальшого очищення. Вихід: кількісний; РХ-МС (RT): 2,71хв. (Спосіб A); МС (ES+) дає m/z: 244,0. 3 (D) 3-[5-(2-фторфеніл)-[1,2,4]оксадіазол-3-іл]піперидин-1-карбонової кислоти три-бутиловий ефір. Суміш 3-(N-гідроксикарбамімідоіл)-піперидин1-карбонової кислоти три-бутилового ефіру (1м, 4,1ммоль), 2-фторбензойної кислоти (574мг, 4,1ммоль), HOBT (554мг, 4,1ммоль), КДІ.HCl (1,18м, 6,15ммоль) і сухого триетиламіну (1,14мл, 8,2ммоль) у сухому діоксані (15мл) витримують при перемішуванні й температурі навколишнього середовища протягом 20год., в атмосфері азоту. Потім реакційну суміш кип'ятять зі зворотним охолодженням протягом 2год. і випарюють розчинник при зниженому тиску. Одержаний залишок розбавляють водою (40мл) і етилацетатом (40мл), розділяють фази й промивають органічний шар послідовно водою (40мл, двічі), Na2CO3 1N (40мл, двічі) і розчином солі. Органічний шар висушують над сульфатом натрію й видаляють розчинник у вакуумі, щоб одержати залишок, який очищають за допомогою високошвидкісної хроматографії (силікагель, елюент: петролейний ефір/етилацетат 9:1), щоб одержати чисту цільову сполуку (524мг). Вихід: 35%; РХ-МС (RT): 6,48хв. (Спосіб A); МС (ES+) дає m/z: 370,0. 3 (E) 3-[5-(2-фторфеніл)-[1,2,4]оксадіазол-3-іл]піперидину гідрохлорид. До розчину 3-[5-(2-фторфеніл)[1,2,4]оксадіазол-3-іл]-піперидин-1-карбонової кислоти три-бутилового ефіру (0,524м, 1,5ммоль) у дихлорметані (5мл), додають 1,5мл 4N HCl (діоксановий розчин) при 0°С, залишають реакційну суміш нагрітися до кімнатної температури й перемішують протягом 1,5год. Розчинник випарюють при зниженому тиску, щоб одержати цільову сполуку у виді білої твердої речовини, яку використовують на наступній стадії без подальшого очищення. Вихід: кількісний; РХ-МС (RT): 2,84хв. (Спосіб A); МС (ES+) дає m/z: 248,0. 3 (F) (3,4-дифторфеніл)-{3-[5-(2-фторфеніл)[1,2,4]оксадіазол-3-іл]-піперидин-1-іл}-метанон. До суспензії 3-[5-(2-фторфеніл)[1,2,4]оксадіазол-3-іл]-піперидину гідрохлориду (51мг, 0,21ммоль) у сухому дихлорметані (5мл) додають по краплях при 0°С триетиламін (88µл, 0,63ммоль) і 3,4-дифторбензоілхлорид (65 л, 0,55ммоль). Залишають реакційну суміш нагрітися до кімнатної температури й перемішують протягом 2год. в атмосфері азоту. Потім розчин обробляють водою (5мл) і розділяють фази. Органічний шар промивають послідовно 1N HCl (10мл, 2 рази), 5% NaHCO3 (10мл, двічі), потім висушують над Na2SO4 і випарюють при зниженому тиску. Неочищений продукт очищають за допомогою високошвидкісної хроматографії (силікагель, елюент: пет 92495 32 ролейний ефір/етилацетат 7:3), щоб одержати чисту цільову сполуку (79мг) у виді білої твердої речовини. Вихід: 47%; т. пл.=80-83°C; РХ-МС (RT): 7,64хв. (Спосіб E); МС (ES+) дає m/z: 388,1. 1 H-NMR (DMSO-d6), δ (ppm): 8.07 (dd, 1H); 7.75 (m, 1H); 7.52-7.38 (m, 4H); 7.27 (m, 1H); 4.21 (m, 1H); 3.78 (m, 1H); 3.43 (dd, 1H); 3.33-3.17 (m, 2H); 2.21 (m, 1H); 2.00-1.76 (m, 2H); 1.65 (m, 1H). Приклад 4 (2,4-дифторфеніл)-{3-[5-(2-фторфеніл)[1,2,4]оксадіазол-3-іл]-піперидин-1-іл}-метанон F O F O N F N N Зазначену сполуку одержують відповідно до процедури, описаної в Прикладі 3 (F), з використанням 3-[5-(2-фторфеніл)-[1,2,4]оксадіазол-3-іл]піперидину гідрохлориду (одержаного, як описано в Прикладі 3 (E)) і 2,4-дифторбензоілхлориду. Очистку кінцевої сполуки здійснюють за допомогою високошвидкісної хроматографії на силікагелі (елюент: AcOEt, гексан 5:5) Вихід: кількісний (біла смолиста тверда речовина); РХ-МС (RT): 7,62хв. (Спосіб E); МС (ES+)дає m/z: 388,1. 1 H-NMR (DMSO-d6), δ (ppm): 8.08 (m, 1H); 7.75 (m, 1H); 7.52-7.41 (m, 3H); 7.22 (dd, 1H); 7.12 (dd, 1H); 4.53 (m br, 1H); 3.89 (m br, 1H); 3.42 (m, 1H); 3.27 (m, 1H); 3.17 (m, 1H); 2.22 (m, 1H); 2.02-1.77 (m, 2H); 1.62 (m, 1H). Приклад 5 (4-фтор-2-метиламінофеніл)-{3-[5-(2фторфеніл)-[1,2,4]оксадіазол-3-іл]-піперидин-1-іл}метанон HN O F O N N F N Суміш 3-[5-(2-фторфеніл)-[1,2,4]оксадіазол-3іл]-піперидину гідрохлориду (51мг, 0,21ммоль, одержаного, як описано в Прикладі 3 (E)), 4-фтор2-метиламінобензойної кислоти (43мг, 0,25ммоль), КДІ.HCl (60мг, 0,32ммоль), HOBT (28мг, 0,21ммоль) і ТЕА (0,088мл, 0,63ммоль) у діоксані (10мл) перемішують протягом ночі при кімнатній температурі, в атмосфері азоту. Розчинник випарюють при зниженому тиску. Одержаний залишок розбавляють водою (5мл) і етилацетатом (10мл), розділяють фази, промивають органічний шар 2N Na2CO3 (5млx2 рази) і висушують над Na2SO4. Випарювання розчинника при зниженому тиску дає неочищений продукт у виді твердої речовини, яку очищають за допомогою високошвидкісної хроматографії (силікагель, градієнт елюенту: від петро 33 92495 лейний ефір/етилацетату 7:3 до петролейний ефір/етилацетату 1:1). Одержують (4-фтор-2-метиламінофеніл)-{3-[5(2-фторфеніл)-[1,2,4]оксадіазол-3-іл]-піперидин-1іл}-метанон у виді безбарвного масла (64мг). Вихід: 75% (безбарвне масло); РХ-МС (RT): 7,95хв. (Спосіб E); МС (ES+) дає m/z: 399,2 1 H-NMR (DMSO-d6), δ (ppm): 8.07 (ddd, 1H); 7.75 (m, 1H); 7.52-7.41 (m, 2H); 7.06 (dd, 1H); 6.37 (s, 1H); 6.33 (m, 1H); 4.23 (dd, 1H); 3.77 (ddd, 1H); 3.40 (dd, 1H); 3.21 (m, 2H); 2.71 (s, 3H); 2.19 (m, 1H); 1.97-1.75 (m, 2H); 1.62 (m, 1H). Приклад 6 {3-[5-(2-фторфеніл)-[1,2,4]оксадіазол-3-іл]піперидин-1-іл}-(5-фторпіридин-2-іл)-метанон O F O N F N N N Зазначену сполуку одержують відповідно до процедури, описаної в Прикладі 5, з використанням 6-фторнікотинової кислоти як обраної кислоти й починаючи з 3-[5-(2-фторфеніл)[1,2,4]оксадіазол-3-іл]-піперидину гідрохлориду (одержаного, як описано в Прикладі 3 (E)). Очистку кінцевої сполуки здійснюють за допомогою високошвидкісної хроматографії на силікагелі (градієнт елюенту: від петролейний ефір/етилацетат 7:3 до петролейний ефір/етилацетат 1:1). Вихід: кількісний (біла смолиста тверда речовина); РХ-МС (RT): 7,07хв. (Спосіб E); МС (ES+) дає m/z: 371,2. 1 H-NMR (DMSO-d6), δ (ppm): 8.31 (m, 1H); 8.117.99 (m, 2H); 7.75 (m, 1H); 7.51-7.41 (m, 2H); 7.21 (dd, 1H); 4.23 (m, 1H); 3.80 (m, 1H); 3.46 (dd, 1H); 3.31 (ddd, 1H); 3.24 (ddd, 1H); 2.22 (m, 1H); 1.94 (m, 1H); 1.82 (m, 1H); 1.68 (m, 1H). Приклад 7 {3-[5-(2-фторфеніл)-[1,2,4]оксадіазол-3-іл]піперидин-1-іл}-(5-метилізоксазол-4-іл)-метанон O O F O N N N N Зазначену сполуку одержують відповідно до процедури, описаної в Прикладі 5, з використанням 5-метилізоксазол-4-карбонової кислоти як обраної кислоти й починаючи з 3-[5-(2-фторфеніл)[1,2,4]оксадіазол-3-іл]-піперидину гідрохлориду (одержаного, як описано в Прикладі 3 (E)). Очистку кінцевої сполуки здійснюють за допомогою високошвидкісної хроматографії на силікагелі (градієнт елюенту: від петролейний ефір/етилацетат 7:3 до петролейний ефір/етилацетат 1:1). Вихід: 95% (біла смолиста тверда речовина); РХ-МС (RT): 6,90хв. (Спосіб E); МС (ES+) дає m/z: 357,1. 1 H-NMR (DMSO-d6), δ (ppm): 8.58 (s, 1H); 8.08 (ddd, 1H); 7.76 (m, 1H); 7.53-7.41 (m, 2H); 4.25 (m, 34 1H); 3.83 (m, 1H); 3.45 (dd, 1H); 3.31 (ddd, 1H); 3.20 (ddd, 1H); 2.47 (s, 3H); 2.22 (m, 1H); 2.01-1.78 (m, 2H); 1.65 (m, 1H). Приклад 8 (4-фторфеніл)-[3-(5-тіазол-4-іл[1,2,4]оксадіазол-3-іл)-піперидин-1-іл]-метанон N S O N N O N F 8 (A) 3-(5-тіазол-4-іл-[1,2,4]оксадіазол-3-іл)піперидин-1-карбонової кислоти три-бутиловий ефір. Зазначену сполуку одержують відповідно до процедури, описаної в Прикладі 3 (D), з використанням 3-(N-гідроксикарбамімідоіл)-піперидин-1карбонової кислоти три-бутилового ефіру (одержаного, як описано в Прикладі 3 (C)) і тіазол-4карбонової кислоти. Очистку кінцевої сполуки здійснюють за допомогою високошвидкісної хроматографії на силікагелі (елюент AcOEt:гексан 1:1). Вихід: 63% (безбарвна олія); РХ-МС (RT): 5,1хв. (Спосіб A); МС (ES+) дає m/z: 337,0. 8 (B) 3-(5-тіазол-4-іл-[1,2,4]оксадіазол-3-іл)піперидину гідрохлорид. Зазначену сполуку одержують відповідно до процедури, описаної в Прикладі 3 (E), починаючи з 3-(5-тіазол-4-іл-[1,2,4]оксадіазол-3-іл)-піперидин-1карбонової кислоти три-бутилового ефіру (одержаного, як описано в Прикладі 8 (A)) Вихід: кількісний (білий порошок); РХ-МС (RT): 1,24хв. (Спосіб A); МС (ES+) дає m/z: 237,0. 8 (C) (4-фторфеніл)-[3-(5-тіазол-4-іл[1,2,4]оксадіазол-3-іл)-піперидин-1-іл]-метанон. Зазначену сполуку одержують відповідно до процедури, описаної в Прикладі 3 (F), з використанням 3-(5-тіазол-4-іл-[1,2,4]оксадіазол-3-іл)піперидину гідрохлориду (одержаного, як описано в Прикладі 8 (B)) і 4-фторбензоілхлориду. Очистку кінцевї сполуки здійснюють за допомогою високошвидкісної хроматографії на силікагелі (елюент: AcOEt: гексан 4:1) Вихід: 63% (біла тверда речовина); т. пл.=128°C; РХ-МС (RT): 6,18хв. (Спосіб E); МС (ES+) дає m/z: 359,1. 1 H-NMR (DMSO-d6), δ (ppm): 9.32 (d, 1H); 8.71 (d, 1H); 7.48 (dd, 2H); 7.23 (dd, 2H); 4.24 (m, 1H); 3.82 (m, 1H); 3.39 (dd, 1H); 3.29-3.11 (m, 2H); 2.22 (m, 1H); 1.99-1.77 (m, 2H); 1.64 (m, 1H). Приклад 9 {3-[5-(4-фторфеніл)-[1,2,4]оксадіазол-3-іл]піперидин-1-іл}-(6-фторпіридин-3-іл)-метанон O N F N O N N F 9 (A) 3-[5-(4-фторфеніл)-[1,2,4]оксадіазол-3-іл]піперидин-1-карбонової кислоти три-бутиловий ефір. Зазначену сполуку одержують відповідно до процедури, описаної в Прикладі 3 (D), з використанням 3-(N-гідроксикарбамімідоіл)-піперидин-1карбонової кислоти три-бутилового ефіру (одер 35 92495 жаного, як описано в Прикладі 3 (C)) і 4фторбензойної кислоти. Очистку кінцевої сполуки здійснюють за допомогою високошвидкісної хроматографії на силікагелі (елюент DCM/MeOH 99:1). Вихід: 51% (жовта олія); РХ-МС (RT): 4,8хв. (Спосіб D); МС (ES+) дає m/z: 348,1. 9 (B) 3-[5-(4-фторфеніл)-[1,2,4]оксадіазол-3-іл]піперидину гідрохлорид. Зазначену сполуку одержують відповідно до процедури, описаної в Прикладі 3 (E), починаючи з 3-[5-(4-фторфеніл)-[1,2,4]оксадіазол-3-іл]піперидин-1-карбонової кислоти три-бутилового ефіру (одержаного, як описано в Прикладі 9 (A)). Вихід: 79% (білий порошок); РХ-МС (RT): 4,6хв. (Спосіб C); МС (ES+) дає m/z: 248,1. 9 (C) {3-[5-(4-фторфеніл)-[1,2,4]оксадіазол-3іл]-піперидин-1-іл}-(6-фторпіридин-3-іл)-метанон. Зазначену сполуку одержують відповідно до процедури, описаної в Прикладі 5, з використанням 6-фторнікотинової кислоти як обраної кислоти й 3-[5-(4-фторфеніл)-[1,2,4]оксадіазол-3-іл]піперидину гідрохлориду (одержаного, як описано в Прикладі 9 (B)). Очистку кінцевої сполуки здійснюють за допомогою розтирання з ди-ізопропиловим ефіром. Вихід: 71% (біла тверда речовина); т. пл.=131134°C; РХ-МС (RT): 6,77хв. (Спосіб E); МС (ES+) дає m/z: 371,1. 1 H-NMR (DMSO-d6), δ (ppm): 8.31 (m, 1H); 8.13 (dd, 2H); 8.03 (ddd, 1H); 7.44 (dd, 2H); 7.20 (dd, 1H); 4.23 (m, 1H); 3.80 (m, 1H); 3.44 (dd, 1H); 3.31 (ddd, 1H); 3.21 (ddd, 1H); 2.21 (m, 1H); 1.93 (m, 1H); 1.83 (m, 1H); 1.67 (m, 1H). Приклад 10 (3,4-дифторфеніл)-{3-[5-(4-фторфеніл)[1,2,4]оксадіазол-3-іл]-піперидин-1-іл}-метанон O N O N F N F F Зазначену сполуку одержують відповідно до процедури, описаної в Прикладі 3 (F), з використанням 3-[5-(4-фторфеніл)-[1,2,4]оксадіазол-3-іл]піперидину гідрохлориду (одержаного, як описано в Прикладі 9 (B)) і 3,4-дифторбензоілхлориду. Очистку кінцевої сполуки здійснюють за допомогою розтирання з ди-ізо-пропиловим ефіром. Вихід: 81% (біла тверда речовина); т. пл.=149152°C; РХ-МС (RT): 7,42хв. (Спосіб E); МС (ES+) дає m/z: 388,1. 1 H-NMR (DMSO-d6), δ (ppm): 8.14 (dd, 2H); 7.50-7.39 (m, 4H); 7.27 (m, 1H); 4.21 (m, 1H); 3.79 (m, 1H); 3.41 (dd, 1H); 3.27 (ddd, 1H); 3.18 (ddd, 1H); 2.21 (m, 1H); 1.92 (m, 1H); 1.82 (m, 1H); 1.65 (m, 1H). Приклад 11 (4-фторфеніл)-[3-(5-піридин-2-іл[1,2,4]оксадіазол-3-іл)-піперидин-1-іл]-метанон N O N N O N F 36 11 (A) 3-(5-піридин-2-іл-[1,2,4]оксадіазол-3-іл)піперидин-1-карбонової кислоти три-бутиловий ефір. Зазначену сполуку одержують відповідно до процедури, описаної в Прикладі 3 (D), з використанням 3-(N-гідроксикарбамімідоіл)-піперидин-1карбонової кислоти три-бутилового ефіру (одержаного, як описано в Прикладі 3 (C)) і піридин-2карбонової кислоти. Очистку кінцевої сполуки здійснюють за допомогою високошвидкісної хроматографії на силікагелі (елюент AcOEt:гексан 4:6). Вихід: 51% (біла тверда речовина); РХ-МС (RT): 4,79хв. (Спосіб A); МС (ES+) дає m/z: 331,0. 11 (B) 2-(3-піперидин-3-іл-[1,2,4]оксадіазол-5іл)-піридину дигідрохлорид. Зазначену сполуку одержують відповідно до процедури, описаної в Прикладі 3 (E), починаючи з 3-(5-піридин-2-іл-[1,2,4]оксадіазол-3-іл)-піперидин1-карбонової кислоти три-бутилового ефіру (одержаного, як описано в Прикладі 11 (A)). Вихід: кількісний (білий порошок); РХ-МС (RT): 0,71хв. (Спосіб A); МС (ES+) дає m/z: 231,1. 11 (C) (4-фторфеніл)-[3-(5-піридин-2-іл[1,2,4]оксадіазол-3-іл)-піперидин-1-іл]-метанон. Зазначену сполуку одержують відповідно до процедури, описаної в Прикладі 3 (F), з використанням 2-(3-піперидин-3-іл-[1,2,4]оксадіазол-5-іл)піридину дигідрохлориду (одержаного, як описано в Прикладі 11 (B)) і 4-фторбензоілхлориду. Очистку кінцевої сполуки здійснюють за допомогою високошвидкісної хроматографії на силікагелі (елюент: гексан:AcOEt 3:7). Вихід: 64% (біла тверда речовина); т. пл.=126129°C; РХ-МС (RT): 6,23хв. (Спосіб E); МС (ES+) дає m/z: 353,1. 1 H-NMR (DMSO-d6), δ (ppm): 8.81 (m, 1H); 8.17 (m, 1H); 8.07 (ddd, 1H); 7.68 (ddd, 1H); 7.47 (dd, 2H); 7.23 (dd, 2H); 4.25 (m, 1H); 3.83 (m, 1H); 3.42 (dd, 1H); 3.30-3.14 (m, 2H); 2.23 (m, 1H); 2.00-1.78 (m, 2H); 1.65 (m, 1H). Приклад 12 (6-фторпіридин-3-іл)-[3-(5-піридин-2-іл[1,2,4]оксадіазол-3-іл)-піперидин-1-іл]-метанон N O N N O N N F Зазначену сполуку одержують відповідно до процедури, описаної в Прикладі 5, з використанням 6-фторнікотинової кислоти як обраної кислоти й 2-(3-піперидин-3-іл-[1,2,4]оксадіазол-5-іл)піридину дигідрохлориду (одержаного, як описано в Прикладі 11 (B)). Очистку кінцевої сполуки здійснюють за допомогою високошвидкісної хроматографії на силікагелі (елюент: гексан:AcOEt 3:7). Вихід: 50% (біла тверда речовина); т. пл.=124126°C; РХ-МС (RT): 5,78хв. (Спосіб E); МС (ES+) дає m/z: 354,1. 1 H-NMR (DMSO-d6), δ (ppm): 8.81 (m, 1H); 8.32 (m, 1H); 8.18 (d, 1H); 8.05 (m, 2H); 7.68 (ddd, 1H); 7.21 (ddd, 1H); 4.24 (m, 1H); 3.81 (m, 1H); 3.47 (dd, 1H); 3.37-3.20 (m, 2H); 2.23 (m, 1H); 1.95 (m, 1H), 1.84 (m, 1H); 1.68 (m, 1H). 37 92495 Приклад 13 {3-[5-(2,4-дифторфеніл)-[1,2,4]оксадіазол-3-іл]піперидин-1-іл}-(4-фторфеніл)-метанон O N F O N N F F 13 (A) 3-[5-(2,4-дифторфеніл)[1,2,4]оксадіазол-3-іл]-піперидин-1-карбонової кислоти три-бутилового ефіру. Зазначену сполуку одержують відповідно до процедури, описаної в Прикладі 3 (D), з використанням 3-(N-гідроксикарбамімідоіл)-піперидин-1карбонової кислоти три-бутилового ефіру (одержаного, як описано в Прикладі 3 (C)) і 2,4дифторбензойної кислоти. Очистку кінцевої сполуки здійснюють за допомогою високошвидкісної хроматографії на силікагелі (елюент AcOEt:гексан 1:4). Вихід: 55% (безбарвна олія); РХ-МС (RT): 6,61хв. (Спосіб A); МС (ES+) дає m/z: 366,0. 13 (B) 3-[5-(2,4-дифторфеніл)[1,2,4]оксадіазол-3-іл]-піперидину гідрохлорид. Зазначену сполуку одержують відповідно до процедури, описаної в Прикладі 3 (E), починаючи з 3-[5-(2,4-дифторфеніл)-[1,2,4]оксадіазол-3-іл]піперидин-1-карбонової кислоти три-бутилового ефіру (одержаного, як описано в Прикладі 13 (A)). Вихід: кількісний (білий порошок); РХ-МС (RT): 2,8хв. (Спосіб A); МС (ES+) дає m/z: 266,0. 13 (C) {3-[5-(2,4-дифторфеніл)[1,2,4]оксадіазол-3-іл]-піперидин-1-іл}-(4фторфеніл)-метанон. Зазначену сполуку одержують відповідно до процедури, описаної в Прикладі 3 (F), починаючи з 3-[5-(2,4-дифторфеніл)-[1,2,4]оксадіазол-3-іл]піперидину гідрохлориду (одержаного, як описано в Прикладі 13 (B)) і 4-фторбензоілхлориду. Очистку кінцевої сполуки здійснюють за допомогою високошвидкісної хроматографії на силікагелі (елюент AcOEt: гексан 1:3). Вихід: 71% (біла тверда речовина); т. пл.=88°C; РХ-МС (RT): 7,21хв. (Спосіб E); МС (ES+) дає m/z: 388,1. 1 H-NMR (DMSO-d6), δ (ppm): 8.15 (ddd, 1H); 7.54-7.42 (m, 3H); 7.33 (ddd, 1H); 7.22 (dd, 2H); 4.23 (m, 1H); 3.82 (m, 1H); 3.40 (dd, 1H); 3.30-3.12 (m, 2H); 2.21 (m, 1H); 1.98-1.77 (m, 2H); 1.64 (m, 1H). Приклад 14 (4-фторфеніл)-[3-(5-піридин-4-іл[1,2,4]оксадіазол-3-іл)-піперидин-1-іл]-метанон O O N N F N N 14 (A) 3-(5-піридин-4-ил-[1,2,4]оксадіазол-3-іл)піперидин-1-карбонової кислоти три-бутилового ефіру. Зазначену сполуку одержують відповідно до процедури, описаної в Прикладі 3 (D), з використанням 3-(N-гідроксикарбамімідоіл)-піперидин-1 38 карбонової кислоти три-бутилового ефіру (одержаного, як описано в Прикладі 3 (C)) і піридин-4карбонової кислоти. Очистку кінцевої сполуки здійснюють за допомогою високошвидкісної хроматографії на силікагелі (елюент AcOEt:гексан 4:6). Вихід: 44% (біла тверда речовина); РХ-МС (RT): 5,27хв. (Спосіб A); МС (ES+) дає m/z: 331,1. 14 (B) 4-(3-піперидин-3-іл-[1,2,4]оксадіазол-5іл)-піридини дигідрохлорид. Зазначену сполуку одержують відповідно до процедури, описаної в Прикладі 3 (E), починаючи з 3-(5-піридин-4-іл-[1,2,4]оксадіазол-3-іл)-піперидин1-карбонової кислоти три-бутилового ефіру (одержаного, як описано в Прикладі 14 (A)). Вихід: кількісний (білий порошок); РХ-МС (RT): 0,81хв. (Спосіб A); МС (ES+) дає m/z: 231,1. 14 (C) (4-фторфеніл)-[3-(5-піридин-4-іл[1,2,4]оксадіазол-3-іл)-піперидин-1-іл]-метанон. Зазначену сполуку одержують відповідно до процедури, описаної в Прикладі 3 (F), з використанням 4-(3-піперидин-3-іл-[1,2,4]оксадіазол-5-іл)піридину дигідрохлориду (одержаного, як описано в Прикладі 14 (B)) і 4-фторбензоілхлориду. Очистку кінцевої сполуки здійснюють за допомогою високошвидкісної хроматографії на силікагелі (елюент: гексан:AcOEt 3:7). Вихід: 65% (біла тверда речовина); т. пл.=149151°C; РХ-МС (RT): 5,79хв. (Спосіб E); МС (ES+) дає m/z: 353,1. 1 H-NMR (DMSO-d6), δ (ppm): 8.87 (d, 2H); 7.97 (d, 2H); 7.46 (dd, 2H); 7.22 (dd, 2H); 4.25 (m, 1H); 3.81 (m, 1H); 3.43 (dd, 1H); 3.31-3.14 (m, 2H); 2.22 (m, 1H); 2.00-1.78 (m, 2H); 1.65 (m, 1H). Приклад 15 (3,4-дифторфеніл)-[3-(5-піридин-4-іл[1,2,4]оксадіазол-3-іл)-піперидин-1-іл]-метанон O N N N O F N F Зазначену сполуку одержують відповідно до процедури, описаної в Прикладі 3 (F), з використанням 4-(3-піперидин-3-іл-[1,2,4]оксадіазол-5-іл)піридину дигидрохлориду (одержаного, як описано в Прикладі 14 (B)) і 3,4-дифторбензоілхлорду. Очистку кінцевої сполуки здійснюють за допомогою високошвидкісної хроматографії на силікагелі (елюент: гексан: AcOEt 3:7). Вихід: 45% (біла тверда речовина); т. пл.=132134°C; РХ-МС (RT): 5,96хв. (Спосіб E); МС (ES+) дає m/z: 371,1. 1 H-NMR (DMSO-d6), δ (ppm): 8.87 (d, 2H); 7.96 (d, 2H); 7.45 (m, 2H); 7.27 (m, 1H); 4.22 (m, 1H); 3.78 (m, 1H); 3.43 (dd, 1H); 3.33-3.17 (m, 2H); 2.22 (m, 1H); 2.00-1.76 (m, 2H); 1.66 (m, 1H). Приклад 16 (2,4-дифторфеніл)-[3-(5-піридин-4-іл[1,2,4]оксадіазол-3-іл)-піперидин-1-іл]-метанон O F O N N N N F 39 92495 Зазначену сполуку одержують відповідно до процедури, описаної в Прикладі 3 (F), з використанням 4-(3-піперидин-3-іл-[1,2,4]оксадіазол-5-іл)піридину гідрохлориду (одержаного, як описано в Прикладі 14 (B)) і 2,4-дифторбензоілхлориду. Очистку кінцевої сполуки здійснюють за допомогою високошвидкісної хроматографії на силікагелі (елюент: гексан: AcOEt 3:7). Вихід: 71% (біла тверда речовина); т. пл.=137139°C; РХ-МС (RT): 5,89хв. (Спосіб E); МС (ES+) дає m/z: 371,1. 1 H-NMR (DMSO-d6), δ (ppm): 8.86 (d, 2H); 7.95 (d br, 2H); 7.46 (ddd, 1H); 7.23 (ddd, 1H); 7.13 (ddd, 1H); 4.52 (m br, 1H); 4.01 (m br, 1H); 3.43 (m, 1H); 3.27 (m, 1H); 3.18 (m, 1H); 2.22 (m, 1H); 2.02-1.77 (m, 2H); 1.62 (m, 1H). Приклад 17 (3,4-дифторфеніл)-{3-[5-(2,4-дифторфеніл)[1,2,4]оксадіазол-3-іл]-піперидин-1-іл}-метанон O F O N N F N F F Зазначену сполуку одержують відповідно до процедури, описаної в Прикладі 3 (F), починаючи з 3-[5-(2,4-дифторфеніл)-[1,2,4]оксадіазол-3-іл]піперидину гідрохлориду (одержаного, як описано в Прикладі 13 (B)) і 3,4-дифторбензоілхлориду. Очистку кінцевої сполуки здійснюють за допомогою високошвидкісної хроматографії на силікагелі (елюент: AcOEt: гексан 1:3). Вихід: 70% (біла тверда речовина); т. пл.=91°C; РХ-МС (RT): 7,37хв. (Спосіб E); МС (ES+) дає m/z: 406,1. 1 H-NMR (DMSO-d6), δ (ppm): 8.15 (ddd, 1H); 7.54-7.40 (m, 3H); 7.37-7.24 (m, 2H); 4.21 (m, 1H); 3.79 (m, 1H); 3.42 (dd, 1H); 3.33-3.14 (m, 2H); 2.21 (m, 1H); 1.99-1.76 (m, 2H); 1.66 (m, 1H). Приклад 18 (2,4-дифторфеніл)-{3-[5-(4-фторфеніл)[1,2,4]оксадіазол-3-іл]-піперидин-1-іл}-метанон O F O N N N F F Зазначену сполуку одержують відповідно до процедури, описаної в Прикладі 3 (F), з використанням 3-[5-(4-фторфеніл)-[1,2,4]оксадіазол-3-іл]піперидину гідрохлориду (одержаного, як описано в Прикладі 9 (B)) і 2,4-дифторбензоілхлориду. Очистку кінцевої сполуки здійснюють за допомогою розтирання з ди-ізо-пропиловим ефіром. Вихід: 81% (біла тверда речовина); т. пл.=137139°C; РХ-МС (RT): 7,37хв. (Спосіб E); МС (ES+) дає m/z: 388,1. 1 H-NMR (DMSO-d6), δ (ppm): 8.13 (m, 2H); 7.44 (dd, 2H); 7.43 (m, 1H); 7.23 (ddd, 1H); 7.12 (ddd, 1H); 4.50 (m br, 1H); 3.96 (m br, 1H); 3.41 (m, 1H); 3.26 (m, 1H); 3.12 (m, 1H); 2.21 (m, 1H); 2.01-1.77 (m, 2H); 1.63 (m, 1H). Приклад 19 (2,4-дифторфеніл)-{3-[5-(2,4-дифторфеніл) 40 [1,2,4]оксадіазол-3-іл]-піперидин-1-іл}-метанон O F O N N N F F F Зазначену сполуку одержують відповідно до процедури, описаної в Прикладі 3 (F), починаючи з 3-[5-(2,4-дифторфеніл)-[1,2,4]оксадіазол-3-іл]піперидину гідрохлориду (одержаного, як описано в Прикладі 13 (B)) і 2,4-дифторбензоілхлориду. Очистку кінцевої сполуки здійснюють за допомогою високошвидкісної хроматографії на силікагелі (елюент: AcOEt: гексан 1:3). Вихід: 74% (біла тверда речовина); т. пл.=101°C; РХ-МС (RT): 7,32хв. (Спосіб E); МС (ES+) дає m/z: 406,1. 1 H-NMR (DMSO-d6), δ (ppm): 8.15 (m, 1H); 7.457.41 (m, 2H); 7.33 (ddd, 1H); 7.23 (ddd, 1H); 7.12 (ddd, 1H); 4.54 (m br, 1H); 3.97 (m br, 1H); 3.41 (m, 1H); 3.26 (m, 1H); 3.15 (m, 1H); 2.21 (m, 1H); 2.011.77 (m, 2H); 1.63 (m, 1H). Приклад 20 (5-метилізоксазол-4-іл)-[3-(5-піридин-4-іл[1,2,4]оксадіазол-3-іл)-піперидин-1-іл]-метанон O O N O N N N N Зазначену сполуку одержують відповідно до процедури, описаної в Прикладі 5, з використанням 5-метилізоксазол-4-карбонової кислоти як обраної кислоти й починаючи з 4-(3-піперидин-3іл-[1,2,4]оксадіазол-5-іл)-піридину гідрохлориду (одержаного, як описано в Прикладі 14 (B)). Очистку кінцевої сполуки здійснюють за допомогою високошвидкісної хроматографії на силікагелі (елюент: гексан: AcOEt 3:7). Вихід: 55% (кремоподібна тверда речовина); РХ-МС (RT): 5,32хв. (Спосіб E); МС (ES+) дає m/z: 340,1. 1 H-NMR (DMSO-d6), δ (ppm): 8.88 (d, 2H); 8.58 (s, 1H); 7.97 (d, 2H); 4.26 (m, 1H); 3.83 (m, 1H); 3.46 (dd, 1H); 3.31 (ddd, 1H); 3.22 (ddd, 1H); 2.47 (s, 3H); 2.22 (m, 1H); 1.96 (m, 1H); 1.85 (m, 1H); 1.65 (m, 1H). Приклад 21 (6-фторпіридин-3-іл)-[3-(5-піридин-4-іл[1,2,4]оксадіазол-3-іл)-піперидин-1-іл]-метанон O N N N O N N F Зазначену сполуку одержують відповідно до процедури, описаної в Прикладі 5, з використанням 6-фторнікотинової кислоти як обраної кислоти й починаючи з 4-(3-піперидин-3-іл[1,2,4]оксадіазол-5-іл)-піридину дигидрохлориду (одержаного, як описано в Прикладі 14 (B)). Очистку кінцевої сполуки здійснюють за допомогою високошвидкісної хроматографії на силікагелі (елюент: гексан: AcOEt 3:7). 41 92495 Вихід: 47% (біла тверда речовина); т. пл.=132134°C; РХ-МС (RT): 5,38хв. (Спосіб E); МС (ES+) дає m/z: 354,1. 1 H-NMR (DMSO-d6), δ (ppm): 8.87 (d, 2H); 8.31 (m, 1H); 8.03 (ddd, 1H); 7.96 (d, 2H); 7.21 (dd, 1H); 4.25 (m, 1H); 3.80 (m, 1H); 3.47 (dd, 1H); 3.37-3.21 (m, 2H); 2.22 (m, 1H); 1.95 (m, 1H); 1.82 (m, 1H); 1.68 (m, 1H). Приклад 22 (4-фтор-2-метилфенілl)-[3-(5-піридин-4-іл[1,2,4]оксадіазол-3-іл)-піперидин-1-іл]-метанон O N N O N N F Зазначену сполуку одержують відповідно до процедури, описаної в Прикладі 5, з використанням 4-фтор-2-метилбензойної кислоти як обраної кислоти й починаючи з 4-(3-піперидин-3-іл[1,2,4]оксадіазол-5-іл)-піридину гідрохлориду (одержаного, як описано в Прикладі 14 (B)). Очистку кінцевої сполуки здійснюють за допомогою високошвидкісної хроматографії на силікагелі (елюент: гексан: AcOEt 3:7). Вихід: 37% (біла смолиста тверда речовина); РХ-МС (RT): 5,96хв. (Спосіб E); МС (ES+) дає m/z: 367,1. 1 H-NMR (DMSO-d6), δ (ppm): 8.87 (d, 2H); 7.96 (d br, 2H); 7.22 (m, 1H); 7.11-6.96 (m, 2H); 4.51 (m br, 1H); 4.02 (m br, 1H); 3.41 (dd, 1H); 3.29-3.10 (m, 2H); 2.23 (s, 3H); 2.19 (m, 1H); 1.92 (m, 1H); 1.79 (m, 1H); 1.60 (m, 1H). Приклад 23 (4-фтор-2-метилфеніл)-{3-[5-(2-фторфеніл)[1,2,4]оксадіазол-3-іл]-піперидин-1-іл}-метанон F O O N N N F Зазначену сполуку одержують відповідно до процедури, описаної в Прикладі 5, з використанням 4-фтор-2-метилбензойної кислоти як обраної кислоти й починаючи з 3-[5-(2-фторфеніл)[1,2,4]оксадіазол-3-іл]-піперидину гідрохлориду (одержаного, як описано в Прикладі 3 (E)). Очистку кінцевої сполуки здійснюють за допомогою високошвидкісної хроматографії на силікагелі (градієнт елюента: від петролейний ефір/етилацетату 7:3 до петролейний ефір/етилацетату 1:1). Вихід: 77% (безбарвне масло); РХ-МС (RT): 7,8хв. (Спосіб E); МС (ES+) дає m/z: 384,1. 1 H-NMR (DMSO-d6,), δ (ppm): 8.07 (m, 1H); 7.75 (m, 1H); 7.52-7.39 (m, 2H); 7.22 (m, 1H); 7.12-6.95 (m, 2H); 4.36 (m br, 1H); 3.78 (m br, 1H); 3.40 (dd, 1H); 3.27-3.08 (m, 2H); 2.23 (s, 3H); 2.20 (m, 1H); 1.98-1.74 (m, 2H); 1.60 (m, 1H). Приклад 24 {3-[5-(2,4-дифторфеніл)-[1,2,4]оксадіазол-3-іл]піперидин-1-іл}-(5-метилізоксазол-4-іл)-метанон 42 O O N N N N O F F Зазначену сполуку одержують відповідно до процедури, описаної в Прикладі 5, з використанням 5-метилізоксазол-4-карбонової кислоти як обраної кислоти й починаючи з 3-[5-(2,4дифторфеніл)-[1,2,4]оксадіазол-3-іл]-піперидину гідрохлориду (одержаного, як описано в Прикладі 13 (B)). Очистку кінцевої сполуки здійснюють за допомогою високошвидкісної хроматографії на силікагелі (елюент AcOEt: гексан 1:1). Вихід: 46% (біла тверда речовина); т. пл.=79°C; РХ-МС (RT): 6,67хв. (Спосіб E); МС (ES+) дає m/z: 375,2. 1 H-NMR (DMSO-d6), δ (ppm): 8.58 (s, 1H); 8.16 (m, 1H); 7.50 (ddd, 1H); 7.33 (ddd, 1H); 4.25 (m, 1H); 3.83 (m, 1H); 3.44 (dd, 1H); 3.31 (ddd, 1H); 3.19 (ddd, 1H); 2.47 (s, 3H); 2.21 (m, 1H); 2.01-1.76 (m, 2H); 1.65 (m, 1H). Приклад 25 {3-[5-(2,4-дифторфеніл)-[1,2,4]оксадіазол-3-іл]піперидин-1-іл}-(6-фторпіридин-3-іл)-метанон O O N N N F N F F Зазначену сполуку одержують відповідно до процедури, описаної в Прикладі 5, з використанням 6-фторнікотинової кислоти як обраної кислоти й починаючи з 3-[5-(2,4-дифторфеніл)[1,2,4]оксадіазол-3-іл]-піперидину гідрохлориду (одержаного, як описано в Прикладі 13 (B)). Очистку кінцевої сполуки здійснюють за допомогою високошвидкісної хроматографії на силікагелі (елюент AcOEt: гексан 1:1). Вихід: 56% (біла тверда речовина); т. пл.=87°C; РХ-МС (RT): 6,74хв. (Спосіб E); МС (ES+) дає m/z: 389,1. 1 H-NMR (DMSO-d6, 300 MHz), δ (ppm): 8.31 (m, 1H); 8.15 (m, 1H); 8.03 (ddd, 1H); 7.50 (ddd, 1H); 7.33 (m, 1H); 7.21 (ddd, 1H); 4.22 (m, 1H); 3.79 (m, 1H); 3.45 (dd, 1H); 3.31 (ddd, 1H); 3.24 (ddd, 1H); 2.22 (m, 1H); 1.94 (m, 1H); 1.83 (m, 1H); 1.68 (m, 1H). Приклад 26 (4-фторфеніл)-[3-(5-феніл-[1,2,4]оксадіазол-3іл)-піперидин-1-іл]-метанон O O N N N F 26 (A) 3-[5-(феніл)-[1,2,4]оксадіазол-3-іл]піперидин-1-карбонової кислоти три-бутилового ефіру. Зазначену сполуку одержують відповідно до процедури, описаної в Прикладі 3 (D), з використанням 3-(N-гідроксикарбамімідоіл)-піперидин-1карбонової кислоти три-бутилового ефіру (одержаного, як описано в Прикладі 3 (C)) і бензойної 43 92495 кислоти. Очистку кінцевої сполуки здійснюють за допомогою високошвидкісної хроматографії на силікагелі (елюент DCM/MeOH 99:1). Вихід: 47% (біла тверда речовина); РХ-МС (RT): 4,1хв. (Спосіб D); МС (ES+) дає m/z: 330,1. 26 (B) 3-[5-(феніл)-[1,2,4]оксадіазол-3-іл]піперидину гідрохлориду. Зазначену сполуку одержують відповідно до процедури, описаної в Прикладі 3 (E), починаючи з 3-[5-(феніл)-[1,2,4]оксадіазол-3-іл]-піперидин-1карбонової кислоти три-бутилового ефіру (одержаного, як описано в Прикладі (A)). Вихід: кількісний (білий порошок); РХ-МС (RT): 4,4хв. (Спосіб C); МС (ES+) дає m/z: 230,1. 26 (C) (4-фторфеніл)-[3-(5-феніл[1,2,4]оксадіазол-3-іл)-піперидин-1-іл]-метанон. Зазначену сполуку одержують відповідно до процедури, описаної в Прикладі 3 (F), з використанням 3-[5-(феніл)-[1,2,4]оксадіазол-3-іл]піперидину гідрохлориду (одержаного, як описано в Прикладі 26 (B)) і 4-фторбензоілхлориду. Очистку кінцевої сполуки здійснюють за допомогою високошвидкісної хроматографії на силікагелі (елюент: DCM:MeOH 99:1). Вихід: 8% (біла тверда речовина); РХ-МС (RT): 7,16хв. (Спосіб E); МС (ES+) дає m/z: 352,1. 1 H-NMR (DMSO-d6), δ (ppm): 8.07 (d, 2H); 7.747.57 (m, 3H); 7.47 (dd, 2H); 7.22 (dd, 2H); 4.24 (m, 1H); 3.82 (m, 1H); 3.41 (dd, 1H); 3.31-3.11 (m, 2H); 2.22 (m, 1H); 1.99-1.76 (m, 2H); 1.64 (m, 1H). Приклад 27 (4-фтор-2-метилфеніл)-{3-[5-(4-фторфеніл)[1,2,4]оксадіазол-3-іл]-піперидин-1-іл}-метанон O O N N F N F Зазначену сполуку одержують відповідно до процедури, описаної в Прикладі 5, з використанням 4-фтор-2-метилбензойної кислоти як обраної кислоти й 3-[5-(4-фторфеніл)-[1,2,4]оксадіазол-3іл]-піперидину гідрохлориду (одержаного, як описано в Прикладі 9 (B)). Очистку кінцевої сполуки здійснюють за допомогою високошвидкісної хроматографії на силікагелі (елюент: DCM:MeOH 99:1). Вихід: 23% (біла тверда речовина); т. пл.=129131°C; РХ-МС (RT): 7,45хв. (Спосіб E); МС (ES+) дає m/z: 384.1. 1 H-NMR (DMSO-d6), δ (ppm): 8.13 (m, 2H); 7.44 (dd, 2H); 7.22 (m, 1H); 7.12-6.95 (m, 2H); 4.53 (m br, 1H); 4.07 (m br, 1H); 3.39 (dd, 1H); 3.27-3.05 (m, 2H); 2.23 (s, 3H); 2.20 (m, 1H); 2.01-1.71 (m, 2H); 1.60 (m, 1H). Приклад 28 {3-[5-(4-фторфеніл)-[1,2,4]оксадіазол-3-іл]піперидин-1-іл}-(5-метилізоксазол-4-іл)-метанон O O N N N N O F Зазначену сполуку одержують відповідно до процедури, описаної в Прикладі 5, з використан 44 ням 5-метилізоксазол-4-карбонової кислоти як обраної кислоти й 3-[5-(4-фторфеніл)[1,2,4]оксадіазол-3-іл]-піперидину гідрохлориду (одержаного, як описано в Прикладі 9 (B)). Очистку кінцевої сполуки здійснюють за допомогою високошвидкісної хроматографії на силікагелі (елюент: DCM:MeOH 99:1). Вихід: 44%; т. пл.=105-107°C; РХ-МС (RT): 6,7хв. (Спосіб E); МС (ES+) дає m/z: 357,1. 1 H-NMR (DMSO-d6), δ (ppm): 8.58 (s, 1H); 8.14 (dd, 2H); 7.44 (dd, 2H); 4.25 (m, 1H); 3.83 (m, 1H); 3.44 (dd, 1H); 3.31 (ddd, 1H); 3.17 (ddd, 1H); 2.47 (s, 3H); 2.21 (m, 1H); 2.01-1.77 (m, 2H); 1.64 (m, 1H). Приклад 29 (6-фторпіридин-3-іл)-[3-(5-феніл[1,2,4]оксадіазол-3-іл)-піперидин-1-іл]-метанон O O N N N F N Зазначену сполуку одержують відповідно до процедури, описаної в Прикладі 5, з використанням 6-фторнікотинової кислоти як обраної кислоти й 3-[5-(феніл)-[1,2,4]оксадіазол-3-іл]-піперидину гідрохлориду (одержаного, як описано в Прикладі 26 (B)). Очистку кінцевої сполуки здійснюють за допомогою розтирання з ди-ізо-пропиловим ефіром. Вихід: 79% (біла тверда речовина); т. пл.=109111°C; РХ-МС (RT): 6,6хв. (Спосіб E); МС (ES+) дає m/z: 353,1. 1 H-NMR (DMSO-d6), δ (ppm): 8.31 (m, 1H); 8.04 (m, 3H); 7.74-7.58 (m, 3H); 7.21 (dd, 1H); 4.23 (m, 1H); 3.80 (m, 1H); 3.45 (dd, 1H); 3.37-3.15 (m, 2H); 2.22 (m, 1H); 1.94 (m, 1H); 1.83 (m, 1H); 1.67 (m, 1H). Приклад 30 (6-фторпіридин-3-іл)-[3-(5-тіазол-4-іл[1,2,4]оксадіазол-3-іл)-піперидин-1-іл]-метанон N S O N N O N N F Зазначену сполуку одержують відповідно до процедури, описаної в Прикладі 5, з використанням 6-фторнікотинової кислоти як обраної кислоти й 3-(5-тіазол-4-іл-[1,2,4]оксадіазол-3-іл)-піперидину гідрохлориду (одержаного, як описано в Прикладі 8 (B)). Очистку кінцевої сполуки здійснюють за допомогою високошвидкісної хроматографії на силікагелі (елюент AcOEt:гексан 4:1). Вихід: 65% (біла тверда речовина); т. пл.=90°C; РХ-МС (RT): 5,75хв. (Спосіб E); МС (ES+) дає m/z: 360,1. 1 H-NMR (DMSO-d6), δ (ppm): 9.32 (d, 1H); 8.71 (d, 1H); 8.32 (d, 1H); 8.04 (dt, 1H); 7.21 (dd, 1H); 4.24 (m, 1H); 3.81 (m, 1H); 3.45 (dd, 1H); 3.36-3.17 (m, 2H); 2.22 (m, 1H); 1.94 (m, 1H); 1.83 (m, 1H); 1.67 (m, 1H). Приклад 31 {3-[5-(2,4-дифторфеніл)-[1,2,4]оксадіазол-3-іл]піперидин-1-іл}-(4-фтор-2-метилфеніл)-метанон 45 92495 O N F N O N F F Зазначену сполуку одержують відповідно до процедури, описаної в Прикладі 5, з використанням 4-фтор-2-метилбензойної кислоти як обраної кислоти й починаючи з 3-[5-(2,4-дифторфеніл)[1,2,4]оксадіазол-3-іл]-піперидину гідрохлориду (одержаного, як описано в Прикладі 13 (B)). Очистку кінцевої сполуки здійснюють за допомогою високошвидкісної хроматографії на силікагелі (елюент AcOEt: гексан 1:3). Вихід: 58% (біла тверда речовина); т. пл.=110°C; РХ-МС (RT): 7,29хв. (Спосіб E); МС (ES+) дає m/z: 402,2. 1 H-NMR (DMSO-d6), δ (ppm): 8.14 (m br, 1H); 7.50 (ddd, 1H); 7.33 (ddd, 1H); 7.22 (m, 1H); 7.04 (m, 2H); 4.54 (m br, 1H); 4.09 (m br, 1H); 3.38 (dd, 1H); 3.28-3.08 (m, 2H); 2.22 (s, 3H); 2.19 (m, 1H); 1.981.73 (m, 2H); 1.60 (m, 1H). Приклад 32 (3,4-дифторфеніл)-[3-(5-феніл[1,2,4]оксадіазол-3-іл)-піперидин-1-іл]-метанон O N N O N F F Зазначену сполуку одержують відповідно до процедури, описаної в Прикладі 3 (F), з використанням 3-[5-(феніл)-[1,2,4]оксадіазол-3-іл]піперидину гідрохлориду (одержаного, як описано в Прикладі 26 (B)) і 3,4-дифторбензоілхлориду. Очистку кінцевої сполуки здійснюють за допомогою високошвидкісної хроматографії на силікагелі (елюент: DCM:MeOH 99:1) Вихід: 78% (біла тверда речовина); т. пл.=116118°C; РХ-МС (RT): 7,27хв. (Спосіб E); МС (ES+) дає m/z: 370,1. 1 H-NMR (DMSO-d6), δ (ppm): 8.07 (d, 2H); 7.70 (dd, 1H); 7.62 (dd, 2H); 7.51-7.39 (m, 2H); 7.27 (m, 1H); 4.21 (m, 1H); 3.78 (m, 1H); 3.42 (dd, 1H); 3.323.14 (m, 2H); 2.20 (m, 1H); 2.00-1.77 (m, 2H); 1.65 (m, 1H). Приклад 33 (2,4-дифторфеніл)-[3-(5-феніл[1,2,4]оксадіазол-3-іл)-піперидин-1-іл]-метанон O N N O F N F Зазначену сполуку одержують відповідно до процедури, описаної в Прикладі 3 (F), з використанням 3-[5-(феніл)-[1,2,4]оксадіазол-3-іл]піперидину гідрохлориду (одержаного, як описано в Прикладі 26 (B)) і 2,4-дифторбензоілхлориду. Очистку кінцевої сполуки здійснюють за допомогою високошвидкісної хроматографії на силікагелі (елюент: DCM:MeOH 99:1). Вихід: 78% (біла тверда речовина); т. пл.=116117°C; РХ-МС (RT): 7,27хв. (Спосіб E); МС (ES+) 46 дає m/z: 370,1. 1 H-NMR (DMSO-d6), δ (ppm): 8.07 (m, 2H); 7.747.58 (m, 3H); 7.46 (m, 1H); 7.30-7.06 (m, 2H); 4.58 (m br, 1H); 4.02 (m br, 1H); 3.55-3.07 (m, 3H); 2.21 (m, 1H); 2.01-1.77 (m, 2H); 1.63 (m, 1H). Приклад 34 (4-фтор-2-метилфеніл)-[3-(5-феніл[1,2,4]оксадіазол-3-іл)-піперидин-1-іл]-метанон O N O N N F Зазначену сполуку одержують відповідно до процедури, описаної в Прикладі 5, з використанням 4-фтор-2-метилбензойної кислоти як обраної кислоти й починаючи з 3-[5-(феніл)[1,2,4]оксадіазол-3-іл]-піперидину гідрохлориду (одержаного, як описано в Прикладі 26 (B)). Очистку кінцевої сполуки здійснюють за допомогою високошвидкісної хроматографії на силікагелі (елюент: DCM:MeOH 99:1) Вихід: 78% (блідо-жовта олія); РХ-МС (RT): 7,10хв. (Спосіб E); МС (ES+) дає m/z: 366,2. 1 H-NMR (DMSO-d6), δ (ppm): 8.07 (d, 2H); 7.737.58 (m, 3H); 7.22 (dd, 1H); 7.08-6.94 (m, 2H); 4.16 (m br, 1H); 3.71 (m br, 1H); 3.42 (dd, 1H); 3.32-3.07 (m, 2H); 2.25 (s, 3H); 2.21 (m, 1H); 1.96 (m, 1H); 1.84 (m, 1H); 1.62 (m, 1H). Приклад 35 (4-фторфеніл)-[3-(5-циклопентил[1,2,4]оксадіазол-3-іл)-піперидин-1-іл]-метанон O N N O N F 35 (A) 3-(5-циклопентил-[1,2,4]оксадіазол-3-іл)піперидин-1-карбонової кислоти три-бутилового ефіру. Зазначену сполуку одержують відповідно до процедури, описаної в Прикладі 3 (D), з використанням 3-(N-гідроксикарбамімідоіл)-піперидин-1карбонової кислоти три-бутилового ефіру (одержаного, як описано в Прикладі 3 (C)) і циклопентанкарбонової кислоти. Очистку кінцевої сполуки здійснюють шляхом пропускання неочищеного продукту через ампулу з силікагелем (елюент: DCM:MeOH 99.5:0.5). Вихід: 47% (жовта олія); РХ-МС (RT): 4,47хв. (Спосіб F); МС (ES+) дає m/z: 322,2. 35 (B) 3-(5-циклопентил-[1,2,4]оксадіазол-3-іл)піперидину гідрохлорид. Зазначену сполуку одержують відповідно до процедури, описаної в Прикладі 3 (E), починаючи з 3-(5-циклопентил-[1,2,4]оксадіазол-3-іл)-піперидин1-карбонової кислоти три-бутилового ефіру (одержаного, як описано в Прикладі 35 (A)). Вихід: кількісний (блідо-жовта олія); РХ-МС (RT): 3,03хв. (Спосіб F); МС (ES+) дає m/z: 222,3. 35 (C) (4-фторфеніл)-[3-(5-циклопентил[1,2,4]оксадіазол-3-іл)-піперидин-1-іл]-метанон. Зазначену сполуку одержують відповідно до процедури, описаної в Прикладі 3 (F), з використанням 3-(5-циклопентил-[1,2,4]оксадіазол-3-іл) 47 92495 піперидину гідрохлориду (одержаного, як описано в Прикладі 35 (B)) і 4-фторбензоілхлориду. Очистку кінцевої сполуки здійснюють шляхом пропускання неочищеного продукту через ампулу з силікагелем (елюент: DCM:MeOH 99:1) і наступного розтирання з пентаном. Вихід: 34% (біла тверда речовина); т. пл.=7476°C; РХ-МС (RT): 11,6хв. (Спосіб G); МС (ES+) дає m/z: 362,2. 1 H-NMR (343 K, DMSO-d6), δ (ppm): 7.517.40(m, 2H); 7.25(m, 1H); 4.13(m, 1H); 3.76(m, 1H); 3.45-3.15(m, 3H); 3.07(m, 1H); 2.18-2.00(m, 3H); 1.90-1.52(m, 9H). Приклад 36 {(S)-3-[5-(4-фторфеніл)-[1,2,4]оксадіазол-3-іл]піперидин-1-іл}-(6-фторпіридин-3-іл)-метанон 48 гою перекристалізації з диетилового ефіру. Вихід: 69% (біла тверда речовина); т. пл.=120°C; [α]D20=+78,75° (c=0,995, MeOH); РХ-МС (RT): 8,38хв. (Спосіб G); МС (ES+) дає m/z: 388,2. 1 H-NMR (343 K, DMSO-d6), δ (ppm): 8.14(dd, 2H); 7.45(m, 2H); 7.44(dd, 2H); 7.27(m, 1H); 4.21(m, 1H); 3.78(m, 1H); 3.41(dd, 1H); 3.26(ddd, 1H); 3.18(m, 1H); 2.20(m, 1H); 1.99-1.76(m, 2H); 1.64(m, 1H). Приклад 38 (3,5-диметилізоксазол-4-іл)-{(S)-3-[5-(4фторфеніл)-[1,2,4]оксадіазол-3-іл]-піперидин-1-іл}метанон O N F O O N N F N F Суміш (S)-3-[5-(4-фторфеніл)[1,2,4]оксадіазол-3-іл]-піперидину гідрохлориду (103мг, 0,36ммоль, одержаного, як описано в Прикладі 1 (E)), 6-фторнікотинової кислоти (61мг, 0,44ммоль), КДІ.HCl (104мг, 0,55ммоль), HOBT (82мг, 0,55ммоль) і ТЕА (0,102мл, 0,73ммоль) у дихлорметані (5мл) перемішують при кімнатній температурі протягом 5год. в атмосфері азоту. Розчинник випарюють при зниженому тиску. Одержаний залишок розбавляють водою (5мл) і етилацетатом (10мл), розділяють фази й промивають органічний шар 5% NaHCO3 (водн.) (5млx2 рази), потім розчином солі, і висушують над Na2SO4. Випарювання розчинника при зниженому тиску дає неочищений продукт у виді твердої речовини, що очищають за допомогою високошвидкісної хроматографії (силікагель, елюент: петролейний ефір/етилацетат 1:1). Одержують {(S)-3-[5-(4-фторфеніл)[1,2,4]оксадіазол-3-іл]-піперидин-1-іл}-(6фторпіридин-3-іл)-метанон у виді білої твердої речовини (104мг). Вихід: 77% (біла тверда речовина); т. пл.=103104°C; [α]D20=+95,80° (c=0,95, MeOH); РХ-МС (RT): 7,07хв. (Спосіб E); МС (ES+) дає m/z: 371,2. 1 H-NMR (373 K, DMSO-d6), δ (ppm): 8.31(d, 1H); 8.12(dd, 2H); 8.00(ddd, 1H); 7.41(dd, 2H); 7.18(dd, 1H); 4.25(dd, 1H); 3.84(ddd, 1H); 3.51(dd, 1H); 3.36(ddd, 1H); 3.24(m, 1H); 2.23(m, 1H); 2.051.80(m, 2H); 1.69(m, 1H). Приклад 37 (3,4-дифторфеніл)-{(S)-3-[5-(4-фторфеніл)[1,2,4]оксадіазол-3-іл]-піперидин-1-іл}-метанон O F N N N N N O N O N O F F Зазначену сполуку одержують відповідно до процедури, описаної в Прикладі 3 (F), з використанням (S)-3-[5-(4-фторфеніл)-[1,2,4]оксадіазол-3іл]-піперидину гідрохлориду (одержаного, як описано в Прикладі 1 (E)) і 3,4-дифторбензоілхлориду. Очистку кінцевої сполуки здійснюють за допомо . Зазначену сполуку одержують відповідно до процедури, описаної в Прикладі 36, з використанням (S)-3-[5-(4-фторфеніл)-[1,2,4]оксадіазол-3-іл]піперидину гідрохлориду (одержаного, як описано в Прикладі 1 (E)) і 3,5-диметилізоксазол-4карбонової кислоти. Очистку кінцевої сполуки здійснюють за допомогою високошвидкісної хроматографії (силікагель, елюент: петролейний ефір/етилацетат 1:1). Вихід: 67% (біла тверда речовина); т. пл.=85°C; [α]D20=+73,65° (c=1,015, MeOH); РХ-МС (RT): 9,28хв. (Спосіб G); МС (ES+) дає m/z: 371,2. 1 H-NMR (373 K, DMSO-d6), δ (ppm): 8.14(dd, 2H); 7.41(dd, 2H); 4.18(dd, 1H); 3.75(ddd, 1H); 3.50(dd, 1H); 3.36(ddd, 1H); 3.14(ddd, 1H); 2.37(s, 3H); 2.21(m, 1H); 2.17(s, 3H); 1.97(m, 1H); 1.86(m, 1H); 1.62(m, 1H). Приклад 39 {(S)-3-[5-(4-фторфеніл)-[1,2,4]оксадіазол-3-іл]піперидин-1-іл}-(5-метилізоксазол-4-іл)-метанон O N F N O N N O Зазначену сполуку одержують відповідно до процедури, описаної в Прикладі 36, з використанням (S)-3-[5-(4-фторфеніл)-[1,2,4]оксадіазол-3-іл]піперидину гідрохлориду (одержаного, як описано в Прикладі 1 (E)) і 5-метилізоксазол-4-карбонової кислоти. Очистку кінцевої сполуки здійснюють за допомогою високошвидкісної хроматографії (силікагель, елюент: петролейний ефір/етилацетат 1:1). Вихід: 69% (біла тверда речовина); т. пл.=65°C; [α]D20=+83,11° (c=1,01, MeOH); РХ-МС (RT): 6,98хв. (Спосіб E); МС (ES+) дає m/z: 357,2. 1 H-NMR (373 K, DMSO-d6), δ (ppm): 8.50(s, 1H); 8.13(dd, 2H); 7.41(dd, 2H); 4.40(dd, 1H); 3.82(ddd, 1H); 3.47(dd, 1H); 3.32(ddd, 1H); 3.17(m, 1H); 2.48(s, 3H); 2.22(m, 1H); 2.01-1.80(m, 2H); 1.68(m, 1H). Приклад 40 {(S)-3-[5-(4-фторфеніл)-[1,2,4]оксадіазол-3-іл]піперидин-1-іл}-(2-фторпіридин-4-іл)-метанон 49 92495 F O O N N N N F . Зазначену сполуку одержують відповідно до процедури, описаної в Прикладі 5, з використанням (S)-3-[5-(4-фторфеніл)-[1,2,4]оксадіазол-3-іл]піперидину гідрохлориду (одержаного, як описано в Прикладі 1 (E)) і 2-фторізонікотинової кислоти. Цільову сполуку одержують у чистому виді після обробки. Вихід: кількісний (біла тверда речовина); т. пл.=117-119°C; [α]D20=+74,49° (c=0,52, MeOH); РХМС (RT): 2,93хв. (Спосіб H); МС (ES+) дає m/z: 371,2. 1 H-NMR (353 K, DMSO-d6), δ (ppm): 8.31(d, 1H); 8.13(dd, 2H); 7.40(dd, 2H); 7.30(dd, 1H); 7.11(d, 1H); 4.19(m br, 1H); 3.76(m br, 1H); 3.46(dd, 1H); 3.30(m, 1H); 3.21(m, 1H); 2.20(m, 1H); 2.00-1.79(m, 2H); 1.69(m, 1H). Приклад 41 {(S)-3-[5-(4-фторфеніл)-[1,2,4]оксадіазол-3-іл]піперидин-1-іл}-(3-фторпіридин-4-іл)-метанон F O O N N N N F Зазначену сполуку одержують відповідно до процедури, описаної в Прикладі 5, з використанням (S)-3-[5-(4-фторфеніл)-[1,2,4]оксадіазол-3-іл]піперидину гідрохлориду (одержаного, як описано в Прикладі 1 (E)) і 3-фторізонікотинової кислоти. Цільову сполуку одержують у чистому виді після обробки. Вихід: кількісний (жовта смолиста тверда речовина); [α]D20=+66,67° (c=0,58, MeOH); РХ-МС (RT): 2,76хв. (Спосіб H); МС (ES+) дає m/z: 371,2. 1 H-NMR (373 K, DMSO-d6), δ (ppm): 8.59(s, 1H); 8.49(dd, 1H); 8.12(dd, 2H); 7.41(dd, 2H); 7.41(dd, 1H); 4.19(m br, 1H); 3.76(m br, 1H); 3.50(dd, 1H); 3.35(m, 1H); 3.20(m, 1H); 2.25(m, 1H); 2.06-1.82(m, 2H); 1.69(m, 1H). Приклад 42 {(S)-3-[5-(4-фторфеніл)-[1,2,4]оксадіазол-3-іл]піперидин-1-іл}-(5-фторпіридин-2-іл)-метанон O O N в Прикладі 1 (E)) і 5-фторпіридин-2-карбонової кислоти. Цільову сполуку одержують у чистому виді після очистку за допомогою високошвидкісної хроматографії (силікагель, елюент: DCM/MeOH/NH4OH 98/2/0.2) і наступне розтирання з гексаном/диетиловим ефіром 1:1. Вихід: 16% (білий порошок); т. пл.=93-95°C; РХ-МС (RT): 2,92хв. (Спосіб H); МС (ES+) дає m/z: 371,1. 1 H-NMR (353 K, DMSO-d6), δ (ppm): 8.54(s, 1H); 8.13(m, 2H); 7.78(m, 1H); 7.66(m, 1H); 7.44(dd, 2H); 3.97(m br, 1H); 3.44(m br, 1H); 3.28(m, 1H); 3.17(m, 1H); 3.05(m, 1H); 2.23(m, 1H); 2.02-1.77(m, 2H); 1.66(m, 1H). Приклад 43 {(S)-3-[5-(4-фторфеніл)-[1,2,4]оксадіазол-3-іл]піперидин-1-іл}-(5-фторпіридин-3-іл)-метанон O O N N N F N F Зазначену сполуку одержують відповідно до процедури, описаної в Прикладі 36, з використанням (S)-3-[5-(4-фторфеніл)-[1,2,4]оксадіазол-3-іл]піперидину гідрохлориду (одержаного, як описано в Прикладі 1 (E)) і 5-фторпіридин-3-карбонової кислоти. Цільову сполуку одержують у чистому виді після очистки спочатку за допомогою первинної високошвидкісної хроматографії (силікагель, елюент: петролейний ефір/етилацетат 1:1), а потім за допомогою вторинної високошвидкісної хроматографії (силікагель, елюент: петролейний ефір/етилацетат 6:4). Вихід: 43% (біла смолиста тверда речовина); [α]D20=+79,3° (c=0,99, MeOH); РХ-МС (RT): 2,81хв. (Спосіб I); МС (ES+) дає m/z: 371,2. 1 H-NMR (DMSO-d6, 353K), δ (ppm): 8.61 (d, 1H); 8.48 (dd, 1H); 8.13 (dd, 2H); 7.73 (ddd, 1H); 7.43 (dd, 2H); 4.21 (m, 1H); 3.78 (m, 1H); 3.47 (dd, 1H); 3.33 (ddd, 1H); 3.22 (ddd, 1H); 2.22 (m, 1H); 1.96 (m, 1H); 1.84 (m, 1H); 1.69 (m, 1H). Приклад 44 (S)-(4-фторфеніл)-{3-[5-(5-фторпіридин-2-іл)[1,2,4]оксадіазол-3-іл]-піперидин-1-іл}-метанон O O N N N F N F N F N N F 50 . Зазначену сполуку одержують відповідно до процедури, описаної в Прикладі 5, з використанням (S)-3-[5-(4-фторфеніл)-[1,2,4]оксадіазол-3-іл]піперидину гідрохлориду (одержаного, як описано 44 (A) (S)-3-карбамоілпіперидин-1-карбонової кислоти три-бутиловий ефір. Триетиламін (1,21мл, 8,72ммоль) а потім етилхлорформіат (0,8мл, 8,30ммоль) додають по краплях при 0°С до розчину (S)-1-Boc-піперидин-3карбонової кислоти (2м, 8,72ммоль) у хлороформі (40мл), в атмосфері азоту. Після перемішування протягом 10хв. при 0°C, у розчин пропускають NH3 газ) протягом 1год. Реакційну суміш перемішують при кімнатній температурі протягом 3год., потім додають 5% NaHCO3 (водн.) і розділяють фази. 51 Органічний шар висушують над сульфатом натрію й випарюють при зниженому тиску, щоб одержати цільову сполуку, яку використовують на наступній стадії без подальшого очищення. Вихід: кількісний; РХ-МС (RT): 3,31хв. (Спосіб A); МС (ES+) дає m/z: 229,0. 44 (B) (S)-3-ціанопіперидин-1-карбонової кислоти три-бутиловий ефір. Оксихлорид фосфору (812 л, 8,72ммоль) додають по краплях при 0°С до розчину (S)-3карбамоілпіперидин-1-карбонової кислоти трибутилового ефіру (2м, 8,72ммоль) у піридині (20мл), в атмосфері азоту. Після перемішування протягом ночі при кімнатній температурі, додають етилацетат і промивають розчин 10% HCl (2 рази). Розділяють фази й висушують органічний шар над сульфатом натрію, розчинник випарюють досуха при зниженому тиску. Цільову сполуку використовують на наступній стадії без подальшого очищення. Вихід: кількісний; РХ-МС (RT): 4,48хв. (Спосіб A); МС (ES+) дає m/z: 211,1. 44 (C) (S)-1-(4-фторбензоіл)-піперидин-3карбонітрил (S)-3-ціанопіперидин-1-карбонової кислоти три-бутиловий ефір (1,5м, 7.14ммоль) розчиняють у діоксані (15мл) і додають по краплях 10мл 4N HCl (діоксановий розчин) при 0°С. Одержану суміш перемішують при кімнатній температурі протягом 5год. Випарюють розчинник при зниженому тиску, щоб одержати (S)-піперидин-3-карбонітрилу гідрохлорид у виді білої твердої речовини, яку використовують на наступній стадії без подальшого очищення. До суспензії (S)-піперидин-3-карбонітрилу гідрохлориду (7,14ммоль) у сухому дихлорметані (100мл) додають по краплях при 0°С триетиламін (3мл, 21,4ммоль) і 4-фторбензоілхлорид (930 л, 7,85ммоль). Залишають реакційну суміш нагрітися до кімнатної температури й перемішують протягом 3год. в атмосфері азоту. Одержаний розчин обробляють 5% NaHCO3 (50мл, двічі) і розділяють фази. Органічний шар промивають 1N HCl (50мл) і розчином солі (50мл), а потім висушують над Na2SO4 і випарюють при зниженому тиску. Неочищений продукт очищають за допомогою високошвидкісної хроматографії (силікагель, градієнт елюента: від петролейний ефір/етилацетат 7:3 до петролейний ефір/етилацетат 1:1), щоб одержати 1,01м цільову сполуку. Вихід: 61% (жовта олія); РХ-МС (RT): 3,7хв. (Спосіб D); МС (ES+) дає m/z: 233,1. 44 (D) (S)-1-(4-фторбензоіл)-Nгідроксипіперидин-3-карбоксамідин. Розчин (S)-1-(4-фторбензоіл)-піперидин-3карбонітрилу (1,01м, 4,35ммоль) і водного гідроксиламіну (50% у воді, 1,1мл, 17,4ммоль) в етанолі (10мл) кип'ятять зі зворотним охолодженням протягом 4год. Випарюють розчинник при зниженому тиску, щоб одержати цільову сполуку (1,15г), яку використовують на наступній стадії без подальшого очищення. Вихід: кількісний: 1H-NMR (DMSO-d6), δ (ppm): 8.61 (s br, 1H); 7.44 (dd, 2H); 7.22 (dd, 2H); 5.12 (s br, 2H); 4.00 (m, 2H); 3.17-2.82 (m, 3H); 2.23 (m, 92495 52 1H); 1.98 (m, 1H); 1.78-1.55 (m, 2H). 44 (E) (S)-(4-фторфеніл)-{3-[5-(5-фторпіридин2-іл)-[1,2,4]оксадіазол-3-іл]-піперидин-1-іл}метанон. Суміш (S)-1-(4-фторбензоіл)-Nгідроксипіперидин-3-карбоксамідину (150мг, 0,56ммоль), 5-фторпіридин-2-карбонової кислоти (79мг, 0,56ммоль), HOAT (76мг, 0,56ммоль), КДІ.HCl (163мг, 0,85ммоль) у сухому діоксані (15мл) витримують протягом ночі при перемішуванні й температурі навколишнього середовища, в атмосфері азоту. Потім реакційну суміш нагрівають при 80°С протягом 5год., і випарюють розчинник при зниженому тиску. Одержаний залишок розбавляють водою (40мл) і етилацетатом (40мл), розділяють фази й промивають органічний шар послідовно водою (40мл, двічі), 1N NaOH (40мл, двічі) і розчином солі. Органічний шар висушують над сульфатом натрію й видаляють розчинник у вакуумі, щоб одержати залишок, який очищають за допомогою високошвидкісної хроматографії (силікагель, елюент: гексан/етилацетат 1:1) і наступної препаративної ВЕРХ, щоб одержати цільову сполуку (50мг). Вихід: 24% (білий порошок); [α]D20=+67,5° (c=1,0, MeOH); т. пл.=108-110°C; РХ-МС (RT): 2,70хв. (Спосіб I); МС (ES+) дає m/z: 371,1. 1 H-NMR (DMSO-d6, 353K), δ (ppm): 8.80 (d, 1H); 8.27 (dd, 1H); 7.97 (ddd, 1H); 7.48 (dd, 2H); 7.23 (dd, 2H); 4.25 (m, 1H); 3.83 (m, 1H); 3.43 (dd, 1H); 3.313.14 (m, 2H); 2.22 (m, 1H); 1.94 (m, 1H); 1.83 (m, 1H); 1.66 (m, 1H). Приклад 45 (S)-(3,4-дифторфеніл)-{3-[5-(5-фторпіридин-2іл)-[1,2,4]оксадіазол-3-іл]-піперидин-1-іл}-метанон O O N N N F F N F 45 (A) (S)-3-[5-(5-фторпіридин-2-іл)[1,2,4]оксадіазол-3-іл]-піперидин-1-карбонової кислоти три-бутилового ефіру. Суміш 3-фторпіридин-6-карбонової кислоти (0,2м, 1,43ммоль), HOAT (0,195м, 1,43ммоль), КДІ.HCl (0,415м, 2,14ммоль) у сухому діоксані (30мл) нагрівають при 50°C протягом 2год., в атмосфері азоту, потім додають (S)-3-(Nгідроксикарбамімідоіл)-піперидин-1-карбонової кислоти три-бутиловий ефір (350мг, 1,43ммоль), одержаний, як описано в Прикладі 1 (C), і нагрівають реакційну суміш при 80°С протягом ночі. Розчинник випарюють при зниженому тиску. Одержаний залишок розбавляють водою (40мл) і етилацетатом (40мл), розділяють фази й промивають органічний шар послідовно водою (40мл, двічі), 1N Na2CO3 (40мл, двічі) і розчином солі. Органічний шар висушують над сульфатом натрію й видаляють розчинник у вакуумі, щоб одержати залишок, що очищають за допомогою високошвидкісної хроматографії (силікагель, градієнт елюента: від гексан/етилацетат 8:2 до гексан/етилацетат 53 92495 6:4), щоб одержати чисту цільову сполуку (70мг). Вихід: 14%; РХ-МС (RT): 4,3хв. (Спосіб A); МС (ES+) дає m/z: 349,0. 45 (B) 5-фтор-2-((S)-3-піперидин-3-іл[1,2,4]оксадіазол-5-іл)-піридину гідрохлорид. (S)-3-[5-(5-фторпіридин-2-іл)-[1,2,4]оксадіазол3-іл]-піперидин-1-карбонової кислоти трибутиловий ефір (70мг, 0,2ммоль), розчиняють у DCM (10мл) і додають по краплях 2мл 4N HCl (діоксановий розчин) при 0°C. Одержану суміш перемішують при кімнатній температурі протягом 3год. Випарюють розчинник при зниженому тиску, щоб одержати 5-фтор-2-((S)-3-піперидин-3-іл[1,2,4]оксадіазол-5-іл)-піридину гідрохлорид (68мг) у виді блідо-жовтої олії, яку використовують на наступній стадії без подальшого очищення. Вихід: кількісний; РХ-МС (RT): 0,81хв. (Спосіб N); МС (ES+) дає m/z: 249,0. 45 (C) (S)-(3,4-дифторфеніл)-{3-[5-(5фторпіридин-2-іл)-[1,2,4]оксадіазол-3-іл]піперидин-1-іл}-метанон. До суспензії 5-фтор-2-((S)-3-піперидин-3-іл[1,2,4]оксадіазол-5-іл)-піридину гідрохлориду (0,20ммоль) у сухому дихлорметані (10мл), додають по краплях при 0°С триетиламін (45 л, 0,30ммоль) і 3,4-дифторбензоілхлорид (35 л, 0,26ммоль). Залишають реакційну суміш нагрітися до кімнатної температури й перемішують протягом ночі в атмосфері азоту. Розчинник видаляють при зниженому тиску. Неочищений продукт очищають за допомогою високошвидкісної хроматографії (силікагель, елюент: гексан/етилацетат 1:1), а потім за допомогою препаративної ВЕРХ, щоб одержати чисту цільову сполуку (10мг) у виді білої твердої речовини. Вихід: 13% (біла тверда речовина); РХ-МС (RT): 2,81хв. (Спосіб I); МС (ES+) дає m/z: 389,3. 1 H-NMR (DMSO-d6, 353K), δ (ppm): 8.79 (d, 1H); 8.27 (dd, 1H); 7.97 (ddd, 1H); 7.51-7.40 (m, 2H); 7.28 (m, 1H); 4.22 (m, 1H); 3.79 (m, 1H); 3.44 (dd, 1H); 3.33-3.17 (m, 2H); 2.23 (m, 1H); 1.95 (m, 1H); 1.84 (m, 1H); 1.66 (m, 1H). Приклад 46 (S)-(4-фторфеніл)-{3-[5-(піридин-2-іл)[1,2,4]оксадіазол-3-іл]-піперидин-1-іл}-метанон O O N N N F N 46 (A) (S)-3-(5-піридин-2-іл-[1,2,4]оксадіазол-3іл)-піперидин-1-карбонової кислоти три-бутилового ефіру. (S)-3-(5-піридин-2-іл-[1,2,4]оксадіазол-3-іл)піперидин-1-карбонової кислоти три-бутиловий ефір одержують відповідно до процедури експерименту, описаної в Прикладі 45 (A), починаючи з піридин-2-карбонової кислоти й (S)-3-(Nгідроксикарбамімідоіл)-піперидин-1-карбонової кислоти три-бутилового ефіру. Очистку здійснюють за допомогою високошвидкісної хроматографії (силікагель, градієнт елюента: від петролейний ефір/етилацетат 8:2 до петролейний 54 ефір/етилацетат 7:3), щоб одержати чисту цільову сполуку. Вихід: 54%; РХ-МС (RT): 5,31хв. (Спосіб D); МС (ES+) дає m/z: 331,1. 46 (B) 2-((S)-3-піперидин-3-іл-[1,2,4]оксадіазол5-іл)-піридину гідро хлорид. 2-((S)-3-піперидин-3-іл-[1,2,4]оксадіазол-5-іл)піридину гідрохлорид одержують відповідно до процедури експерименту, описаної в Прикладі 45(B), починаючи з (S)-3-(5-піридин-2-іл[1,2,4]оксадіазол-3-іл)-піперидин-1-карбонової кислоти три-бутилового ефіру. Вихід: кількісний; РХ-МС (RT): 0,75хв. (Спосіб M); МС (ES+) дає m/z: 231,0. 46 (C) (S)-(4-фторфеніл)-{3-[5-(піридин-2-іл)[1,2,4]оксадіазол-3-іл]-піперидин-1-іл}-метанон. (S)-(4-фторфеніл)-{3-[5-(піридин-2-іл)[1,2,4]оксадіазол-3-іл]-піперидин-1-іл}-метанон одержують відповідно до процедури експерименту, описаної в Прикладі 45(C), починаючи з 2-((S)3-піперидин-3-іл-[1,2,4]оксадіазол-5-іл)-піридину гідрохлориду й 4-фторбензоілхлориду. Очистку здійснюють за допомогою високошвидкісної хроматографії (силікагель, елюент: петролейний ефір/етилацетат 1:2), щоб одержати чисту цільову сполуку. Вихід: 67% (біла смолиста тверда речовина); РХ-МС (RT): 3,14хв. (Спосіб I); МС (ES+) дає m/z: 353,5. 1 H-NMR (DMSO-d6, 343K), δ (ppm): 8.82 (m, 1H); 8.18 (ddd, 1H); 8.08 (ddd, 1H); 7.69 (m, 1H); 7.48 (dd, 2H); 7.24 (dd, 2H); 4.26 (m, 1H); 3.83 (m, 1H); 3.42 (dd, 1H); 3.30-3.15 (m, 2H); 2.24 (m, 1H); 2.00-1.78 (m, 2H); 1.66 (m, 1H). Приклад 47 (S)-(3,4-дифторфеніл)-{3-[5-(піридин-2-іл)[1,2,4]оксадіазол-3-іл]-піперидин-1-іл}-метанон O O N N N F F N (S)-(3,4-дифторфеніл)-{3-[5-(піридин-2-іл)[1,2,4]оксадіазол-3-іл]-піперидин-1-іл}-метанон одержують відповідно до процедури експерименту, описаної в Прикладі 45(C), починаючи з 2-((S)3-піперидин-3-іл-[1,2,4]оксадіазол-5-іл)-піридину гідрохлориду, одержаного, як описано в Прикладі 46 (B), і 3,4-дифторбензоілхлориду. Очистку здійснюють за допомогою високошвидкісної хроматографії (силікагель, елюент: петролейний ефір/етилацетат 1:2) і наступної препаративної ВЕРХ, щоб одержати чисту цільову сполуку. Вихід: 15% (безбарвна смолиста тверда речовина); РХ-МС (RT): 2,61хв. (Спосіб I); МС (ES+) дає m/z: 371,3. 1 H-NMR (CDCl3), δ (ppm): 8.86 (m, 1H); 8.20 (d br, 1H); 7.94 (ddd, 1H); 7.54 (ddd, 1H); 7.31 (m, 1H); 7.21 (m, 2H); 5.18-3.00 (m br, 2H) 3.54 (m, 1H); 3.23 (m, 2H); 2.32 (m, 1H); 2.13-1.89 (m, 2H); 1.71 (m, 1H). 55 92495 Приклад 48 (4-фторфеніл)-{(S)-3-[5-(1-метил-1H-імідазол4-іл)-[1,2,4]оксадіазол-3-іл]-піперидин-1-іл}метанон O N N N O N N F Суміш 1-метилімідазол-4-карбонової кислоти (0,15м, 1,2ммоль), HOAT (0,136м, 1ммоль), КДІ.HCl (0,192м, 1ммоль) і триетиламину (400 л) у сухому DCM (10мл) і ДМФА (5мл) перемішують при кімнатній температурі протягом 15хв., а потім додають (S)-1-(4-фторбензоіл)-Nгідроксипіперидин-3-карбоксамідін (265мг, 1ммоль), одержаний, як описано в Прикладі 44 (D). Реакційну суміш перемішують при кімнатній температурі протягом 2год. Суміш розбавляють DCM і промивають 0,2N NaOH. Видаляють розчинник та одержаний неочищений залишок очищають, пропускаючи його через ампулу із силікагелем (градієнт елюента: від етилацетата до метанол/етилацетат 1:9). Одержану в такий спосіб білу тверду речовину розчиняють в ацетонітрилі (2мл) і нагрівають у мікрохвильовій печі при 80°C протягом 1год., потім при 95°C протягом 1год., а потім при 120°C протягом 1год. Видаляють розчинник і завантажують одержаний залишок у ампулу із силікагелем (градієнт елюента: від етилацетата до метанол/етилацетат 6:94), щоб одержати (4фторфеніл)-{(S)-3-[5-(1-метил-1H-імідазол-4-іл)[1,2,4]оксадіазол-3-іл]-піперидин-1-іл}-метанон у виді безбарвної скляноподібної речовини (120мг). Вихід: 57%; [α]D20=+86° (c=0,55, MeOH); РХ-МС (RT): 2,02хв. (Спосіб I); МС (ES+) дає m/z: 356,2. 1 H-NMR (DMSO-d6, 353K), δ (ppm): 8.01 (d br, 1H); 7.80 (d br, 1H); 7.47 (dd, 2H); 7.23 (dd, 2H); 4.22 (m, 1H); 3.84 (m, 1H); 3.77 (s, 3H); 3.34 (dd, 1H); 3.20 (ddd, 1H); 3.09 (m, 1H); 2.19 (m, 1H); 1.95-1.77 (m, 2H); 1.67 (m, 1H). Приклад 49 (4-фторфеніл)-{(S)-3-[5-(3-фторпіридин-4-іл)[1,2,4]оксадіазол-3-іл]-піперидин-1-іл}-метанон O F O N N F N N Суміш 3-фторпіридин-4-карбонової кислоти (0,133м, 0,94ммоль), (S)-1-(4-фторбензоіл)-Nгідроксипіперидин-3-карбоксамідину (250мг, 0,94ммоль), одержаного, як описано в Прикладі 44 (D), HOBT (0,127м, 0,94ммоль), КДI.HCl (0,270м, 1,41ммоль) і триетиламіну (262 л) у сухому діоксані (30мл) перемішують при кімнатній температурі протягом 4год., після чого реакційну суміш нагрівають при 80°С протягом 4год. Розчинник випарюють при зниженому тиску. Одержаний неочищений залишок очищають за допомогою високошвидкісної хроматографії (силікагель, елюент: 56 петролейний ефір/етилацетат 6:4), щоб одержати чисту цільову сполуку (146мг). Вихід: 42%; [α]D20=+65,5° (c=0,61, MeOH); РХМС (RT): 3,42хв. (Спосіб I); МС (ES+) дає m/z: 371,1. 1 H-NMR (DMSO-d6, 353K), δ (ppm): 8.88 (d, 1H); 8.71 (dd, 1H); 8.03 (ddd, 1H); 7.48 (dd, 2H); 7.23 (dd, 2H); 4.26 (m, 1H); 3.82 (m, 1H); 3.43 (dd, 1H); 3.26 (m, 2H); 2.24 (m, 1H); 1.98 (m, 1H); 1.85 (m, 1H); 1.66 (m, 1H). Приклад 50 (3,4-дифторфеніл)-{(S)-3-[5-(3-фторпіридин-4іл)-[1,2,4]оксадіазол-3-іл]-піперидин-1-іл}-метанон F O O N N N N F F 50 (A) (S)-1-(3,4-дифторбензоіл)-піперидин-3карбонітрил (S)-1-(3,4-дифторбензоіл)-піперидин-3карбонітрил одержують відповідно до процедури експерименту, описаної в Прикладі 44 (C), з використанням 3,4-дифторбензоілхлориду як ацилюючого агенту. Неочищений продукт очищають за допомогою високошвидкісної хроматографії (силікагель, градієнт елюента: від петролейний ефір/етилацетат 7:3 до петролейний ефір/етилацетат 1:1). Вихід: 18%; РХ-МС (RT): 4,0хв. (Спосіб D); МС (ES+) дає m/z: 251,0. 50 (B) (S)-1-(3,4-дифторбензоіл)-Nгідроксипіперидин-3-карбоксамідин (S)-1-(3,4-дифторбензоіл)-Nгідроксипіперидин-3-карбоксамідин одержують відповідно до процедури експерименту, описаної в Прикладі 44 (D), починаючи з (S)-1-(3,4дифторбензоіл)-піперидин-3-карбонітрилу. РХ-МС (RT): 1,19хв. (Спосіб D); МС (ES+) дає m/z: 284,2. 50 (C) (3,4-дифторфеніл)-{(S)-3-[5-(3фторпіридин-4-іл)-[1,2,4]оксадіазол-3-іл]піперидин-1-іл}-метанон. Цільову сполуку одержують відповідно до процедури експерименту, описаної в Прикладі 49, починаючи з (S)-1-(3,4-дифторбензоіл)-Nгідроксипіперидин-3-карбоксамідину й 3фторпіридин-4-карбонової кислоти. Очистку здійснюють за допомогою високошвидкісної хроматографії (силікагель; елюент: петролейний ефір/етилацетат 6:4). Вихід: 44%; [α]D20=+60,4° (c=0,55, MeOH); РХМС (RT): 2,78хв. (Спосіб I); МС (ES+) дає m/z: 389,1. 1 H-NMR (DMSO-d6, 353K), δ (ppm): 8.88 (d, 1H); 8.70 (dd, 1H); 8.02 (dd, 1H); 7.51-7.40 (m, 2H); 7.28 (m, 1H); 4.23 (m, 1H); 3.79 (m, 1H); 3.45 (dd, 1H); 3.35-3.21 (m, 2H); 2.23 (m, 1H); 1.95 (m, 1H); 1.82 (m, 1H); 1.68 (m, 1H). Приклад 51 [(S)-3-(5-піридин-2-іл-[1,2,4]оксадіазол-3-іл)піперидин-1-іл]-(2,4,6-трифторфеніл)-метанон 57 92495 58 F F O O O N N F N N F N [(S)-3-(5-піридин-2-іл-[1,2,4]оксадіазол-3-іл)піперидин-1-іл]-(2,4,6-трифторфеніл)-метанон одержують відповідно до процедури експерименту, описаної в Прикладі 45(C), починаючи з 2-((S)3-піперидин-3-іл-[1,2,4]оксадіазол-5-іл)-піридину гідрохлориду, одержаного, як описано в Прикладі 46 (B), і 2,4,6-трифторбензоілхлориду. Очистку здійснюють за допомогою високошвидкісної хроматографії (силікагель, елюент: петролейний ефір/етилацетат 1:2) щоб одержати чисту цільову сполуку Вихід: 42% (безбарвна смолиста тверда речовина); [α]D20=+68,28° (c=0,63, MeOH); РХ-МС (RT): 2,68хв. (Спосіб I); МС (ES+) дає m/z: 389,2. 1 H-NMR (DMSO-d6 , 373K), δ (ppm): 8.81 (m, 1H); 8.18 (d br, 1H); 8.06 (ddd, 1H); 7.67 (ddd, 1H); 7.56-7.41 (m, 2H); 4.20 (m br, 1H); 3.72 (m br, 1H); 3.48 (dd, 1H); 3.31 (m, 1H); 3.20 (ddd, 1H); 2.24 (m, 1H); 1.99 (m, 1H); 1.87 (m, 1H); 1.66 (m, 1H). Приклад 52 [(S)-3-(5-піридин-2-іл-[1,2,4]оксадіазол-3-іл)піперидин-1-іл]-(2,3,4-трифторфеніл)-метанон F O O F N N F N (2,6-дифторфеніл)-[(S)-3-(5-піридин-2-іл[1,2,4]оксадіазол-3-іл)-піперидин-1-іл]-метанон одержують відповідно до процедури експерименту, описаної в Прикладі 45(C), починаючи з 2-((S)3-піперидин-3-іл-[1,2,4]оксадіазол-5-іл)-піридину гідрохлориду, одержаного, як описано в Прикладі 46 (B), і 2,6-дифторбензоілхлориду. Очистку здійснюють за допомогою високошвидкісної хроматографії (силікагель, елюент: петролейний ефір/етилацетат 1:2) щоб одержати чисту цільову сполуку. Вихід: 42% (безбарвна смолиста тверда речовина); [α]D20=+70,76° (c=0,52, MeOH); РХ-МС (RT): 2,53хв. (Спосіб I); МС (ES+) дає m/z: 371,3. 1 H-NMR (DMSO-d6, 300 MHz, rotamers present), δ (ppm): 8.83 (m, 1H); 8.27 and 8.12 (ddd, 1H); 8.09 (m, 1H); 7.71 (m, 1H); 7.62-7.48 (m, 1H); 7.29-7.19 (m, 1H); 7.23 and 7.04 (dd, 1H); 4.68 (m, 1H); 4.02 (m, 1H); 3.73 and 3.60 (dd, 1H); 3.43 (m, 1H); 3.13 (m, 1H); 2.21 (m, 1H); 2.09-1.77 (m, 2H); 1.73-1.47 (m, 1H). Приклад 54 (2,5-дифторфеніл)-[(S)-3-(5-піридин-2-іл[1,2,4]оксадіазол-3-іл)-піперидин-1-іл]-метанон F O N N N F O N O N [(S)-3-(5-піридин-2-іл-[1,2,4]оксадіазол-3-іл)піперидин-1-іл]-(2,3,4-трифторфеніл)-метанон одержують відповідно до процедури експерименту, описаної в Прикладі 45(C), починаючи з 2-((S)3-піперидин-3-іл-[1,2,4]оксадіазол-5-іл)-піридину гідрохлориду, одержаного, як описано в Прикладі 46 (B), і 2,3,4-трифторбензоілхлориду. Очистку здійснюють за допомогою високошвидкісної хроматографії (силікагель, елюент: петролейний ефір/етилацетат 1:2) щоб одержати чисту цільову сполуку. Вихід: 54% (біла смолиста тверда речовина); [α]D20=+62,9° (c=1,8, MeOH); РХ-МС (RT): 2,70хв. (Спосіб I); МС (ES+) дає m/z: 389,2. 1 H-NMR (DMSO-d6, 373K), δ (ppm): 8.81 (ddd, 1H); 8.17 (d br, 1H); 8.07 (ddd, 1H); 7.67 (ddd, 1H); 7.37-7.23 (m, 2H); 4.20 (m br, 1H); 3.75 (m br, 1H); 3.51 (dd, 1H); 3.33 (m, 1H); 3.20 (ddd, 1H); 2.24 (m, 1H); 1.99 (m, 1H); 1.87 (m, 1H); 1.66 (m, 1H). Приклад 53 (2,6-дифторфеніл)-[(S)-3-(5-піридин-2-іл[1,2,4]оксадіазол-3-іл)-піперидин-1-іл]-метанон N N N F (2,5-дифторфеніл)-[(S)-3-(5-піридин-2-іл[1,2,4]оксадіазол-3-іл)-піперидин-1-іл]-метанон одержують відповідно до процедури експерименту, описаної в Прикладі 45(C), починаючи з 2-((S)3-піперидин-3-іл-[1,2,4]оксадіазол-5-іл)-піридину гідрохлориду, одержаного, як описано в Прикладі 46 (B), і 2,5-дифторбензоілхлориду. Очистку здійснюють за допомогою високошвидкісної хроматографії (силікагель, елюент: петролейний ефір/етилацетат 1:2) щоб одержати чисту цільову сполуку. Вихід: 30% (безбарвна смолиста тверда речовина); РХ-МС (RT): 3,27хв. (Спосіб L); МС (ES+) дає m/z: 371,3. 1 H-NMR (DMSO-d6 ,373K), δ (ppm): 8.81 (ddd, 1H); 8.17 (d br, 1H); 8.06 (ddd, 1H); 7.67 (ddd, 1H); 7.26 (m, 3H); 4.19 (m br, 1H); 3.77 (m br, 1H); 3.47 (dd, 1H); 3.37-3.14 (m, 2H); 2.25 (m, 1H); 1.98 (m, 1H); 1.87 (m, 1H); 1.66 (m, 1H). Приклад 55 (2,3-дифторфеніл)-[(S)-3-(5-піридин-2-іл[1,2,4]оксадіазол-3-іл)-піперидин-1-іл]-метанон 59 92495 F O O N N F N N (2,3-дифторфеніл)-[(S)-3-(5-піридин-2-іл[1,2,4]оксадіазол-3-іл)-піперидин-1-іл]-метанон одержують відповідно до процедури експерименту, описаної в Прикладі 45(C), починаючи з 2-((S)3-піперидин-3-іл-[1,2,4]оксадіазол-5-іл)-піридину гідрохлориду, одержаного, як описано в Прикладі 46 (B), і 2,6-дифторбензоілхлориду. Очистку здійснюють за допомогою високошвидкісної хроматографії (силікагель, елюент: петролейний ефір/етилацетат 1:2) щоб одержати чисту цільову сполуку. Вихід: 37% (безбарвна смолиста тверда речовина); [α]D20=+64,76° (c=0,875, MeOH); РХ-МС (RT): 2,58хв. (Спосіб I); МС (ES+) дає m/z: 371,3. 1 H-NMR (DMSO-d6, 373K), δ (ppm): 8.81 (ddd, 1H); 8.17 (d br, 1H); 8.06 (ddd, 1H); 7.67 (ddd, 1H); 7.44 (m, 1H); 7.32-7.18 (m, 2H); 4.22 (m br, 1H); 3.76 (m br, 1H); 3.49 (dd, 1H); 3.31 (m, 1H); 3.19 (m, 1H); 2.26 (m, 1H); 2.00 (m, 1H); 1.88 (m, 1H); 1.67 (m, 1H). Фармакологія: Сполуки, що представлені в даному винаході є позитивними алостеричними модуляторами mGluR5. Зазначені сполуки, як такі, не зв'язуються з ортостеричною глутаматною ділянкою розпізнавання, і самі по собі не активують mGluR5. Замість цього в присутності сполук формули I зростає вплив mGluR5 на концентрацію глутамату або агоністу mGluR5. Припускають, що сполуки формули I позитивно діють на mGluR5 завдяки їхній здатності поліпшувати функціонування рецептора. Приклад A Тест на mGluR5 у культурі астроцитів кори головного мозку пацюків Під дією факторів росту (основний фактор росту фібробластів, епідермальний фактор росту), культивуючі щурячі астроцити експресують групу пов'язаних з I-Gq транскриптів mGluR, а саме mGluR5, але не сплайсингові варіанти mGluR1, наслідком чого є функціональне експресування рецепторів mGluR5 (Miller et al. (1995) J. Neurosci. 15:6103-9): Стимуляція рецепторів mGluR5 селективним агоністом CHPG і повна блокада глутаматіндукованого фосфоінозитидного (ФI) гідролізу й наступній внутрішньоклітинній мобілізації кальцію специфічним антагоністом, таким як MPEP, підтверджує однозначне експресування рецепторів mGluR5 у даному препараті. Зазначений препарат є загальноприйнятим, і його застосовують для оцінки властивостей сполук, згідно даному винаходу, збільшувати мобілізацію Ca2+, індуковану глутаматом, не проявляючи якої-небудь істотної активності при застосуванні у відсутності глутамату. Первинна культура астроцитів кори головного мозку: Первинні гліальні культури готують з кори го 60 ловного мозку ембріонів пацюків Sprague-Dawley у віці від 16 до 19 днів, використовуючи різновид способів, описаних Mc Carthy й de Vellis (1980) J. Cell Biol. 85:890-902 й Miller et al. (1995) J. Neurosci. 15(9):6103-9. Кору головного мозку розрізають, а потім розділяють шляхом розтирання в порошок у стерильному буферному розчині, що містить 5,36мМ KCl, 0,44мМ NaHCO3, 4,17мМ KH2PO4, 137мМ NaCl, 0,34мМ Na2PO4, 1г/л глюкози. Одержаний гомогенат клітин наносять на попередньо покриті полі-D-лізином T175 колби (BIOCOAT, Becton Dickinson Biosciences, Erembodegem, Belgium) у середовищі Ігла в модифікації Дульбеко (D-MEM GlutaMAX I, Invitrogen, Basel, Switzerland), що містить буфери 25мМ HEPES й 22,7мМ NaHCO3, і додають 4,5г/л глюкози, 1мМ пірувату й 15% сироватки ембріонів великої рогатої худоби (FBS, Invitrogen, Basel, Switzerland), пеніцилін і стрептоміцин, та інкубують при 37°C в атмосфері 5% CO2. Для наступного посіву вміст FBS знижують до 10%. Через 12 днів клітини переносять шляхом трипсинізації на попередньо покриті полі-D-лізином планшети на 384 чарунки із густиною 20000 клітин на одиницю у культуральном буфері. Тест на мобілізацію Ca2+ з використанням астроцитів кори головного мозку пацюків: Після одного дня інкубації клітини змивають буфером для аналізу, що містить: 142мМ NaCl, 6мМ KCl, 1мМ MgSO4, 1мМ CaCl2, 20мМ HEPES, 1г/л глюкози, 0,125мМ сульфінпіразону, p 7,4. Через 60хв. після завантаження 4μм Fluo-4 (TefLabs, Austin, TX), клітини промивають три рази 50μл буфера ФСБ і знову суспензують в 45μл буфера для аналізу. Потім планшети переносять у планшет-рідер флуорометричного зображення (FLIPR, Molecular Devices, Sunnyvale, CA) для оцінки внутрішньоклітинного переносу кальцію. Після спостереження флуоресцентної лінії протягом 10 с, додають на клітинний планшет розчин, що містить 10μм типової сполуки згідно до заявленого винаходу, розведеного буфером для аналізу (15μл 4X розведення), у відсутності або в присутності 300нМ глутамату. В описаних умовах експерименту така концентрація індукує менше ніж 20% максимального впливу глутамату, і зазначену концентрацію використовують для визначення властивостей позитивних алостерних модуляторів у сполук згідно даного винаходу. Кінцева концентрація DMSO в тесті становить 0,3%. У кожному досліді флуоресценцію потім спостерігають протягом 3 хвилин як функцію часу й аналізують дані за допомогою Microsoft Excel й GraphPad Prism. Кожну точку даних також вимірюють два рази. Результати на Фіг.1 представляють дію 10µМ сполуки з Приклада №1 на первинну культуру mGluR5-експресуючих клітин кори головного мозку у відсутності або в присутності 300нМ глутамату. Дані представлені як відсоток від максимального впливу глутамату, що спостерігається при обробці клітин 30μм . Кожна стовпчаста діаграма являє собою середнє значення й стандартну погрішність середнього для двох точок даних і відображає три незалежних експерименти. Дані, показані в Прикладі A, демонструють, що
ДивитисяДодаткова інформація
Назва патенту англійськоюSubstituted oxadiazole derivatives as positive allosteric modulators of metabotropic glutamate receptors
Автори англійськоюFarina Marco, Gagliardi Stefania, Le Poul Emmanuel, Mutel Vincent, Palombi Giovanni, Poli Sonia-Maria, Rocher Jean-Philippe
Назва патенту російськоюЗамещенные производные оксадиазола как положительные аллостерические модуляторы метаботропных глутаматных рецепторов
Автори російськоюФарина Марк, Гаглиарди Стефания, Льо Пул Эманюэл, Мютел Венсан, Паломби Джованни, Поли Соня Мария, Роше Жан-Филип
МПК / Мітки
МПК: A61K 31/454, C07D 413/04, C07D 417/14, C07D 413/14, A61P 25/00
Мітки: похідні, заміщені, позитивні, глутаматних, метаботропних, модулятори, рецепторів, оксадіазолу, алостеричні
Код посилання
<a href="https://ua.patents.su/35-92495-zamishheni-pokhidni-oksadiazolu-yak-pozitivni-alosterichni-modulyatori-metabotropnikh-glutamatnikh-receptoriv.html" target="_blank" rel="follow" title="База патентів України">Заміщені похідні оксадіазолу як позитивні алостеричні модулятори метаботропних глутаматних рецепторів</a>
Попередній патент: Похідні піролу як позитивні алостеричні модулятори метаботропних глутаматних рецепторів
Наступний патент: Похідні оксадіазолу та їх застосування як позитивних алостеричних модуляторів метаботропних глутаматних рецепторів
Випадковий патент: Спосіб оцінки ризику розвитку інфекційних ускладнень у хворих з імунодефіцитом