Похідні гідроксамової кислоти, спосіб їх одержання, проміжна сполука, фармацевтична та ветеринарна композиції, спосіб лікування чи попередження медичних станів, при яких показаний інгібітор ммр
Формула / Реферат
1. Похідні гідроксамової кислоти формули (І)
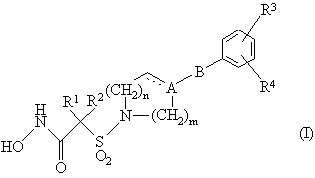
або її фармацевтично чи ветеринарно прийнятна сіль, або її фармацевтично чи ветеринарно прийнятний сольват будь-якої сутності,
де переривчаста лінія представляє, як варіант, зв'язок,
А - С чи СН,
В - СН2, О чи відсутній,
R1 та R2, кожний незалежно - вибрано з групи, що складається з гідрогену, С1-6алкілу, заміщеного, як варіант, С1-4алкоксилом чи фенілом, та С1-6алкенілу, або разом з атомом карбону, до якого вони приєднані, вони утворюють С3-6циклоалкіл, в який, як варіант, вбудовано вибрану з О, SO, SО2 та NR6 гетероатомну групу, або який, як варіант, конденсований з бензольним кільцем,
R3 - гідроген, галоген, R7 чи ОR7,
R4- гідроген, С1-4алкіл, С1-4алкоксил, трифлуорметил чи галоген,
R6- гідроген чи С1-4алкіл,
R7 - моноциклічна чи дициклічна система, яку вибрано з групи, що складається з фенілу, тієнілу, фурилу, піридинілу піримідинілу, нафтилу, інданілу, бензотієнілу, бензофуранілу, 2,3-дигідробензофуранілу, індолілу, хінолінілу, ізохінолінілу, бензодіоксолілу, бензимідазолілу, бензоксазолілу, бензотіазолілу та бензодіоксанілу, кожний з яких заміщено, як варіант, одним чи двома замісниками, які вибрано з групи, що складається з С1-4алкілу, який заміщений, як варіант, С1-4алкоксилом чи гідроксилом, С1-4алкоксилу, який заміщений, як варіант, С1-4алкоксилом чи гідроксилом, С1-4алкілтіогрупи, трифлуорметилу, трифлуорметоксилу, ціаногрупи та галогену,
m = 1 чи 2, а
n = 0, 1 чи 2,
за умови, що В не є О, коли А - С.
2. Сполука за п. 1, яка відрізняється тим, що В відсутній, R1 - гідроген, С1-4алкіл, заміщений, як варіант, метоксилом чи фенілом, або С1-5алкеніл, R2- гідроген чи С1-4алкіл, або R1 та R2 разом з атомом карбону, до якого вони приєднані, утворюють С4-5циклоалкіл, в який, як варіант, вбудовано вибрану з О та NR6 гетероатомну групу, або який, як варіант, конденсований з бензольним кільцем, R3 вибрано з групи, що складається з 4-фенілу, 4-піридинілу, 4-індан-5-ілу, 4-(2,3-дигідробензофуран-5-ілу), 4-хінолін-3-ілу, 4-бензодіоксол-5-ілу та 4-бензимідазол-5-ілу, кожний з яких заміщено, як варіант, одним чи двома замісниками, які вибрано з групи, що складається з С1-3алкілу, який заміщений, як варіант, метоксилом чи гідроксилом, С1-3алкоксилу, який заміщений, як варіант, метоксилом чи гідроксилом, метилтіогрупи, трифлуорметилу, трифлуорметоксилу, ціаногрупи, флуору чи хлору, R4 - гідроген, метил, етил, метоксил, трифлуорметил, флуор чи хлор, R6 - метил, m = 2, а n = 1.
3. Сполука за п. 2, яка відрізняється тим, що R1 - гідроген, метил, етил, 2-метилпроп-1-іл, бут-1-ил, 2-метоксіетил, бензил, 3-фенілпроп-1-іл, аліл, 2-метилаліл, 3,3-диметилаліл, R2 - гідроген, метил чи етил, або R1 та R2 разом з атомом карбону, до якого вони приєднані, утворюють циклобутил, циклопентил, тетрагідропіран-4,4-дііл, 1-метилпіперидин-4,4-діїл, або індан-2,2-діїл, R3 - 4-феніл, 4-(2-метилфеніл), 4-(3-метилфеніл), 4-(3-етилфеніл), 4-[3-(проп-2-іл)феніл], 4-(3,5-диметилфеніл), 4-(3-метоксиметилфеніл), 4-(3-етоксиметилфеніл), 4-(4-етоксиметилфеніл), 4-[3-(проп-1-окси)феніл], 4-[3-(проп-2-окси)феніл], 4-[4-(проп-2-окси)феніл], 4-(3,4-диметоксифеніл), 4-[3-(2-метоксіетокси)феніл], 4-[3-(2-гідроксіетокси)феніл], 4-(3-метилтіофеніл), 4-(3-трифлуорметилфеніл), 4-(3-трифлуорметоксифеніл), 4-(2-флуорфеніл), 4-(3-хлор-4-флуорфеніл), 4-(3-ціанофеніл), 4-(піридин-2-іл), 4-(піридин-3-іл), 4-(піридин-4-іл), 4-(6-етоксипіридин-2-іл), 4-(5-етоксипіридин-3-іл), 4-(індан-5-іл), 4-(2,3-дигідробензофуран-5-іл), 4-(хінолін-3-іл), 4-(бензодіоксол-5-іл), 4-(2,2-диметилбензодіоксол-5-іл) та 4-(1,2-диметилбензімідазол-5-іл), a R4 - гідроген, 2-метил, 3-метил, 3-етил, 3-метоксил, 3-трифлуорметил, 3-флуор або 3-хлор.
4. Сполука за п. 3, яка відрізняється тим, що обидва R1 та R2 - гідроген чи метил, або разом з атомом карбону, до якого приєднані, вони утворюють циклобутил, циклопентил, тетрагідропіран-4,4-діїл чи 1-метилпіперидин-4,4-діїл, R3- 4-феніл, 4-(3-метоксифеніл), 4-(3-етоксифеніл), 4-[3-(2-метоксіетокси)феніл], 4-[3-(2-гідроксіетокси)феніл] або 4-(6-етоксипіридин-2-іл), а R4 - 3-метил чи 3-метоксил.
5. Сполука за п.1, яка відрізняється тим, що представляє:
N-гідрокси-2-{4-[4-(3-етоксифеніл)-3-метилфеніл]-1,2,3,6-тетрагідропіридин-1-ілсульфоніл}ацетамід,
N-гідрокси-2-{4-[4-(3-етоксифеніл)-3-метилфеніл]-1,2,3,6-тетрагідропіридин-1-ілсульфоніл}-2-метилпропанамід,
N-гідрокси-2-{4-[4-(3-етоксифеніл)-3-метилфеніл]піперидин-1-ілсульфоніл}-2-метилпропанамід,
N-гідрокси-1-{4-[4-(3-метоксифеніл)-3-метилфеніл]піперидин-1-ілсульфоніл}циклопентанкарбоксамід,
N-гідрокси-1-{4-[4-(3-метоксифеніл)-3-метилфеніл]піперидин-1-ілсульфоніл}циклобутанкарбоксамід,
N-гідрокси-2-{4-[4-(3-етоксифеніл)-3-метоксифеніл]піперидин-1-ілсульфоніл}-2-метилпропанамід,
Ν-гідрокси-2-{4-[4-(6-етоксипіридин-2-іл)-3-метилфеніл]піперидин-1-ілсульфоніл}-2-метилпропанамід,
N-гідрокси-2-{4-[4-(3-[2-метоксіетокси]феніл)-3-метилфеніл]-піперидин-1-ілсульфоніл}-2-метилпропанамід та
N-гідрокси-2-{4-[4-(3-[2-гідроксіетокси]феніл)-3-метилфеніл]піперидин-1-ілсульфоніл}-2-метилпропанамід.
6. Сполука формули (I), її фармацевтично прийнятна сіль чи фармацевтично прийнятний сольват за п. 1, яка відрізняється тим, що її використовують як лікувальний засіб для людини.
7. Сполука формули (І), її ветеринарно прийнятна сіль чи ветеринарно прийнятний сольват за п. 1, яка відрізняється тим, що її використовують як лікувальний засіб для тварини.
8. Сполука формули (I) за будь-яким з пп. 1-5, яка відрізняється тим, що її, її фармацевтично прийнятну сіль чи фармацевтично прийнятний сольват використовують для виготовлення лікувального засобу для лікування чи профілактики станів людини, при яких показаний інгібітор ММР.
9. Сполука формули (I) за будь-яким з пп. 1-5, яка відрізняється тим, що її, її фармацевтично прийнятну сіль чи фармацевтично прийнятний сольват використовують для виготовлення лікувального засобу для лікування чи профілактики медичних станів тварини, при яких показаний інгібіторММР.
10. Сполука формули (I) за пп. 8 або 9, яка відрізняється тим, що інгібітор є інгібітором ММР-3.
11. Сполука формули (I) за будь-яким з пп. 1-5, яка відрізняється тим, що її, її фармацевтично прийнятну сіль чи фармацевтично прийнятний сольват використовують для виготовлення лікувального засобу для лікування чи профілактики відриву атеросклеротичних бляшок, інфаркту міокарда, серцевої недостатності, рестенозу, нападу, періодонтального захворювання, ульцерації тканин, заживлення поранень, захворювань шкіри, ракових метастазів, пухлинного ангіогенезу, пов'язаної з віком плямистості, фіброзної хвороби, ревматоїдного артриту, остеоартриту та залежних від міграції запальних клітин запальних хвороб у людини.
12. Сполука формули (I) за будь-яким з пп. 1-5, яка відрізняється тим, що її, її фармацевтично прийнятну сіль чи фармацевтично прийнятний сольват використовують для виготовлення лікувального засобу для лікування чи профілактики відриву атеросклеротичних бляшок, інфаркту міокарда, серцевої недостатності, рестенозу, нападу, періодонтального захворювання, ульцерації тканин, заживлення поранень, захворювань шкіри, ракових метастазів, пухлинного ангіогенезу, пов'язаної з віком плямистості, фіброзної хвороби, ревматоїдного артриту, остеоартриту та залежних від міграції запальних клітин запальних хвороб у тварини.
13. Фармацевтична композиція, що включає сполуку формули (I) або її фармацевтично прийнятну сіль, чи фармацевтично прийнятний сольват за будь-яким з пп. 1-5 разом з фармацевтично прийнятним розріджувачем чи носієм.
14. Фармацевтична композиція за п. 13, яка відрізняється тим, що її використовують як лікувальний засіб для людини.
15. Ветеринарна композиція, що включає сполуку формули (I), її ветеринарно прийнятну сіль чи ветеринарно прийнятний сольват за будь-яким з пп. 1-5 разом з ветеринарно прийнятним розріджувачем чи носієм.
16. Ветеринарна композиція за п. 15, яка відрізняється тим, що її використовують як лікувальний засіб для тварини.
17. Проміжна сполука формули (II) для отримання сполуки формули (І):
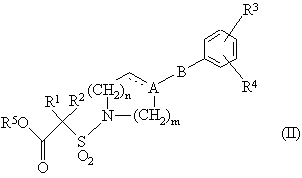 ,
,
де R5 - гідроген чи С1-3алкіл, а переривчасту лінію, А, В, R1, R2, R3, R4, m та n визначено раніше для формули (I) у п.1.
18. Спосіб лікування чи попередження медичних станів, при яких показаний інгібітор ММР, у ссавців (включаючи людину), який включає призначення вказаній тварині терапевтично ефективної кількості сполуки формули (І), її фармацевтично чи ветеринарно прийнятної солі або фармацевтично чи ветеринарно прийнятного сольвату будь-якої сутності за будь-яким з пп. 1-5, або фармацевтичної чи ветеринарної композиції, яка містить будь-що з перерахованого, за пп. 6 чи 7, відповідно.
19. Спосіб за п. 18, який відрізняється тим, що інгібітор є інгібітором ММР-3.
20. Спосіб лікування чи попередження відриву атеросклеротичних бляшок, інфаркту міокарда, серцевої недостатності, рестенозу, нападу, періодонтального захворювання, ульцерації тканин, заживлення поранень, захворювань шкіри, ракових метастазів, пухлинного ангіогенезу, пов'язаної з віком плямистості, фіброзної хвороби, ревматоїдного артриту, остеоартриту та залежних від міграції запальних клітин запальних хвороб, у ссавців (включаючи людину), який включає призначення вказаній тварині терапевтично ефективної кількості сполуки формули (I), її фармацевтично чи ветеринарно прийнятної солі або фармацевтично чи ветеринарно прийнятного сольвату будь-якої сутності за будь-яким з пп. 1-5, або фармацевтичної чи ветеринарної композиції, яка містить будь-що з перерахованого, за пп. 13 чи 15, відповідно.
21. Спосіб отримання сполуки формули (I):

або її фармацевтично чи ветеринарно прийнятної солі, або її фармацевтично чи ветеринарно прийнятного сольвату будь-якої сутності,
де переривчаста лінія представляє, як варіант, зв'язок,
А - С чи СН,
В - СН2, О чи відсутній,
R1 та R2, кожний незалежно - вибрано з групи, що складається з гідрогену, С1-6алкілу, заміщеного, як варіант, С1-4алкоксилом чи фенілом, та С1-6алкенілу, або разом з атомом карбону, до якого вони приєднані, вони утворюють С3-6циклоалкіл, в який, як варіант, вбудовано вибрану з О, SO, SО2 та NR6 гетероатомну групу, або який, як варіант, конденсований з бензольним кільцем,
R3 - гідроген, галоген, R7 чи OR7 ,
R4 - гідроген, С1-4алкіл, С1-4алкоксил, трифлуорметил чи галоген,
R6 - гідроген чи С1-4алкіл,
R7 - моноциклічна чи дициклічна система, яку вибрано з групи, що складається з фенілу, тієнілу, фурилу, піридинілу піримідинілу, нафтилу, інданілу, бензотієнілу, бензофуранілу, 2,3-дигідробензофуранілу, індолілу, хінолінілу, ізохінолінілу, бензодіоксолілу, бензимідазолілу, бензоксазолілу, бензотіазолілу та бензодіоксанілу, кожний з яких заміщено, як варіант, одним чи двома замісниками, які вибрано з групи, що складається з С1-4алкілу, який заміщений, як варіант, С1-4алкоксилом чи гідроксилом, С1-4алкоксилу, який заміщений, як варіант, С1-4алкоксилом чи гідроксилом, С1-4алкілтіогрупи, трифлуорметилу, трифлуорметоксилу, ціаногрупи та галогену, m = 1 чи 2, а
n = 0,1 чи 2,
за умови, що В не представляє О, коли А - С, який включає реакцію сполуки формули (II):
 ,
,
де R5 - гідроген чи С1-3алкіл, а переривчасту лінію, А, В, R1, R2, R3, R4 , m та n визначено раніше для формули (I), з гідроксиламіном, з наступним утворенням, як варіант, її фармацевтично чи ветеринарно прийнятної солі, або її фармацевтично чи ветеринарно прийнятного сольвату будь-якої сутності.
22. Спосіб за п. 21, який відрізняється тим, що R5 - С1-3алкіл, а естер формули (II) обробляють 3-разовим надлишком гідрохлориду гідроксиламіну у присутності молярно еквівалентної кількості придатної основи у придатному розчиннику при температурі від кімнатної до приблизно 85°С.
23. Спосіб за п. 22, який відрізняється тим, що основою є карбонат чи гідрокарбонат лужного металу, розчинником є метанол, скомбінований, як варіант, з тетрагідрофураном чи дихлорметаном як співрозчинниками, а температура реакції приблизно 65-70°С.
24. Спосіб за п. 23, який відрізняється тим, що R5 - гідроген, кислоту формули (II) у присутності 1,1-2,0 молекулярних еквівалентів активуючого засобу та 1,0-4,0 молекулярних еквівалентів третинного аміну у придатному розчиннику обробляють приблизно 3-разовим надлишком гідрохлориду гідроксиламіну у тому ж розчиннику при температурі від приблизно 0°С до кімнатної.
25. Спосіб за п. 24, який відрізняється тим, що активуючим засобом є гексафлуорфосфат О-(7-азабензотріазол-1-іл)-1,1,3,3-тетраметилуронію (НАТU), третинним аміном є N-етилдіізопропіламін, розчинником є безводний диметилформамід чи безводний 1-метилпіролідин-2-он, а температура реакції приблизно кімнатна.
Текст
1 ПОХІДНІ пдроксамової кислоти формули (І) R3 НО (0 або и фармацевтично чи ветеринарно прийнятна сіль, або її фармацевтично чи ветеринарно прийнятний сольват будь-якої сутності, де переривчаста ЛІНІЯ представляє, як варіант, зв'язок, А-СчиСН, В - СЬІ2, О чи відсутній, R1 та R2, кожний незалежно - вибрано з групи, що складається з гідрогену, Сі єалкілу, заміщеного, як варіант, Сі 4алкоксилом чи фенілом, та Сі єалкенілу, або разом з атомом карбону, до якого вони приєднані, вони утворюють Сз єциклоалкіл, в який, як варіант, вбудовано вибрану з О, SO, SO2 та NR6 гетероатомну групу, або який, як варіант, конденсований з бензольним кільцем, R3 - гідроген, галоген, R7 чи OR7, R4- гідроген, Сі 43ЛКІЛ, Сі 4алкоксил, трифлуорметил чи галоген, R 6 - ГІДрОГеН ЧИ С і 43ЛКІЛ, R7 - моноциклічна чи дициклічна система, яку вибрано з групи, що складається з фенілу, тієнілу, фурилу, піридинілу піримідинілу, нафтилу, індані лу, бензотієнілу, бензофуранілу, 2,3дипдробензофуранілу, індолілу, хінолінілу, ізохінолінілу, бензодюксолілу, бензимідазолілу, бензоксазолілу, бензотіазолілу та бензодюксанілу, кожний з яких заміщено, як варіант, одним чи двома замісниками, які вибрано з групи, що складається з Сі 4алкілу, який заміщений, як варіант, Сі 4алкоксилом чи гідроксилом, Сі 4алкоксилу, який заміщений, як варіант, Сі 4алкоксилом чи гідроксилом, Сі 4алкілтюгрупи, трифлуорметилу, трифлуорметоксилу, ціаногрупита галогену, m = 1 чи 2, а п = 0, 1 чи 2, за умови, що В не є О, коли А - С 2 Сполука за п 1, яка відрізняється тим, що В відсутній, R1 - гідроген, Сі 4алкіл, заміщений, як варіант, метоксилом чи фенілом, або Сі балкеніл, R2- гідроген чи Сі 4алкіл, або R1 та R2 разом з атомом карбону, до якого вони приєднані, утворюють С4 бЦиклоалкіл, в який, як варіант, вбудовано вибрану з О та NR6 гетероатомну групу, або який, як варіант, конденсований з бензольним кільцем, R3 вибрано з групи, що складається з 4-фенілу, 4піридинілу, 4-шдан-5-ілу, 4-(2,3дипдробензофуран-5-ілу), 4-хінолш-З-ілу, 4бензодюксол-5-ілута 4-бензимідазол-5-ілу, кожний 3 яких заміщено, як варіант, одним чи двома замісниками, які вибрано з групи, що складається з Сі залкілу, який заміщений, як варіант, метоксилом чи гідроксилом, Сі залкоксилу, який заміщений, як варіант, метоксилом чи гідроксилом, метилтюгрупи, трифлуорметилу, трифлуорметоксилу, ціаногрупи, флуору чи хлору, R4 - гідроген, метил, етил, метоксил, трифлуорметил, флуор чи хлор, R6 метил, m = 2, а п = 1 З Сполука за п 2, яка відрізняється тим, що R1 гідроген, метил, етил, 2-метилпроп-1-іл, бут-1-ил, 2-метоксіетил, бензил, З-фенілпроп-1-іл, аліл, 2метилаліл, 3,3-диметилаліл, R2 - гідроген, метил чи етил, або R1 та R2 разом з атомом карбону, до якого вони приєднані, утворюють циклобутил, циклопентил, тетрапдропіран-4,4-дил, 13 метилпіперидин-4,4-дмл, або шдан-2,2-дмл, R - 4феніл, 4-(2-метилфеніл), 4-(3-метилфеніл), 4-(3етилфеніл), 4-[3-(проп-2-іл)феніл], 4-(3,5диметилфеніл), 4-(3-метоксиметилфеніл), 4-(3 О ю 52791 етоксиметилфеніл), 4-(4-етоксиметилфеніл), 4-[3(проп-і-окси)феніл], 4-[3-(проп-2-окси)феніл], 4-[4(проп-2-окси)феніл], 4-(3,4-диметоксифеніл), 4-[3(2-метоксіетокси)феніл], 4-[3-(2пдроксіетокси)феніл], 4-(3-метилтюфеніл), 4-(3трифлуорметилфеніл), 4-(3трифлуорметоксифеніл), 4-(2-флуорфеніл), 4-(3хлор-4-флуорфеніл), 4-(3-ціанофеніл), 4-(піридин2-іл), 4-(піридин-3-іл), 4-(піридин-4-іл), 4-(6етоксипіридин-2-іл), 4-(5-етоксипіридин-3-іл), 4(шдан-5-іл), 4-(2,3-дипдробензофуран-5-іл), 4(хінолш-3-іл), 4-(бензодюксол-5-іл), 4-(2,2диметилбензодюксол-5-іл) та 4-(1,24 диметилбензімідазол-5-іл), a R - гідроген, 2метил, 3-метил, 3-етил, 3-метоксил, 3трифлуорметил, 3-флуор або 3-хлор 4 Сполука за п 3, яка відрізняється тим, що обидва R1 та R2 - гідроген чи метил, або разом з атомом карбону, до якого приєднані, вони утворюють циклобутил, циклопентил, тетрапдропіран4,4-дмл чи 1-метилпіперидин-4,4-дмл, R3- 4-феніл, 4-(3-метоксифеніл), 4-(3-етоксифеніл), 4-[3-(2метоксіетокси)феніл], 4-[3-(2-пдроксіетокси)феніл] або 4-(6-етоксипіридин-2-іл), a R4 - 3-метил чи 3метоксил 5 Сполука за п 1 , яка відрізняється тим, що представляє І\І-пдрокси-2-{4-[4-(3-етоксифеніл)-3-метилфеніл]1,2,3,6-тетрапдропіридин-1-ілсульфоніл}ацетамід, І\І-пдрокси-2-{4-[4-(3-етоксифеніл)-3-метилфеніл]1,2,3,6-тетрапдропіридин-1-ілсульфоніл}-2метилпропанамід, І\І-пдрокси-2-{4-[4-(3-етоксифеніл)-3метилфеніл]піперидин-1-ілсульфоніл}-2метилпропанамід, І\І-пдрокси-1-{4-[4-(3-метоксифеніл)-3метилфеніл]піперидин-1ілсульфоніл}циклопентанкарбоксамід, І\І-пдрокси-1-{4-[4-(3-метоксифеніл)-3метилфеніл]піперидин-1ілсульфоніл}циклобутанкарбоксамід, І\І-пдрокси-2-{4-[4-(3-етоксифеніл)-3метоксифеніл]піперидин-1-ілсульфоніл}-2метилпропанамід, І\І-пдрокси-2-{4-[4-(6-етоксипіридин-2-іл)-3метилфеніл]піперидин-1-ілсульфоніл}-2метилпропанамід, М-пдрокси-2-{4-[4-(3-[2-метоксіетокси]феніл)-3метилфеніл]-піперидин-1-ілсульфоніл}-2метилпропанамід та М-пдрокси-2-{4-[4-(3-[2-пдроксіетокси]феніл)-3метилфеніл]піперидин-1-ілсульфоніл}-2метилпропанамід 6 Сполука формули (І), и фармацевтично прийнятна сіль чи фармацевтично прийнятний сольват за п 1, яка відрізняється тим, що и використовують як лікувальний засіб для людини 7 Сполука формули (І), и ветеринарно прийнятна сіль чи ветеринарно прийнятний сольват за п 1, яка відрізняється тим, що и використовують як лікувальний засіб для тварини 8 Сполука формули (І) за будь-яким з пп 1-5, яка відрізняється тим, що її, и фармацевтично прийнятну сіль чи фармацевтично прийнятний сольват використовують для виготовлення лікувального засобу для лікування чи профілактики станів людини, при яких показаний інгібітор ММР 9 Сполука формули (І) за будь-яким з пп 1-5, яка відрізняється тим, що її, и фармацевтично прийнятну сіль чи фармацевтично прийнятний сольват використовують для виготовлення лікувального засобу для лікування чи профілактики медичних станів тварини, при яких показаний інгібітор ММР 10 Сполука формули (І) за пп 8 або 9, яка відрізняється тим, що інгібітор є інгібітором ММР-3 11 Сполука формули (І) за будь-яким з пп 1-5, яка відрізняється тим, що її, и фармацевтично прийнятну сіль чи фармацевтично прийнятний сольват використовують для виготовлення лікувального засобу для лікування чи профілактики відриву атеросклеротичних бляшок, інфаркту міокарда, серцевої недостатності, рестенозу, нападу, періодонтального захворювання, ульцерацм тканин, заживления поранень, захворювань шкіри, ракових метастазів, пухлинного анпогенезу, пов'язаної з віком плямистості, фіброзної хвороби, ревматоїдного артриту, остеоартриту та залежних від міграції запальних клітин запальних хвороб у людини 12 Сполука формули (І) за будь-яким з пп 1-5, яка відрізняється тим, що її, и фармацевтично прийнятну сіль чи фармацевтично прийнятний сольват використовують для виготовлення лікувального засобу для лікування чи профілактики відриву атеросклеротичних бляшок, інфаркту міокарда, серцевої недостатності, рестенозу, нападу, періодонтального захворювання, ульцерацм тканин, заживления поранень, захворювань шкіри, ракових метастазів, пухлинного анпогенезу, пов'язаної з віком плямистості, фіброзної хвороби, ревматоїдного артриту, остеоартриту та залежних від міграції запальних клітин запальних хвороб у тварини 13 Фармацевтична композиція, що включає сполуку формули (І) або и фармацевтично прийнятну сіль, чи фармацевтично прийнятний сольват за будь-яким з пп 1-5 разом з фармацевтично прийнятним розріджувачем чи носієм 14 Фармацевтична композиція за п 13, яка відрізняється тим, що и використовують як лікувальний засіб для людини 15 Ветеринарна композиція, що включає сполуку формули (І), и ветеринарно прийнятну сіль чи ветеринарно прийнятний сольват за будь-яким з пп 1-5 разом з ветеринарно прийнятним розріджувачем чи носієм 16 Ветеринарна композиція за п 15, яка відрізняється тим, що и використовують як лікувальний засіб для тварини 17 Проміжна сполука формули (II) для отримання сполуки формули (І) R3 R5O (П) 52791 де R - гідроген чи Сі залкіл, а переривчасту ЛІНІЮ, 1 2 3 4 А, В, R , R , R , R , m та п визначено раніше для формули (І) у п 1 18 Спосіб лікування чи попередження медичних станів, при яких показаний інгібітор ММР, у ссавців (включаючи людину), який включає призначення вказаній тварині терапевтично ефективної КІЛЬКОСТІ сполуки формули (І), и фармацевтично чи ветеринарно прийнятної солі або фармацевтично чи ветеринарно прийнятного сольвату будь-якої сутності за будь-яким з пп 1-5, або фармацевтичної чи ветеринарної композиції, яка містить будь-що з перерахованого, за пп 6 чи 7, ВІДПОВІДНО 19 Спосіб за п 18, який відрізняється тим, що інгібітор є інгібітором ММР-3 20 Спосіб лікування чи попередження відриву атеросклеротичних бляшок, інфаркту міокарда, серцевої недостатності, рестенозу, нападу, періодонтального захворювання, ульцерацм тканин, заживления поранень, захворювань шкіри, ракових метастазів, пухлинного анпогенезу, пов'язаної з віком плямистості, фіброзної хвороби, ревматоїдного артриту, остеоартриту та залежних від міграції запальних клітин запальних хвороб, у ссавців (включаючи людину), який включає призначення вказаній тварині терапевтично ефективної КІЛЬКОСТІ сполуки формули (І), и фармацевтично чи ветеринарно прийнятної солі або фармацевтично чи ветеринарно прийнятного сольвату будь-якої сутності за будь-яким з пп 1-5, або фармацевтичної чи ветеринарної композиції, яка містить будь-що з перерахованого, за пп 13 чи 15, ВІДПОВІДНО 21 Спосіб отримання сполуки формули (І) R3 НО (І) або и фармацевтично чи ветеринарно прийнятної солі, або и фармацевтично чи ветеринарно прийнятного сольвату будь-якої сутності, де переривчаста ЛІНІЯ представляє, як варіант, зв'язок, А-СчиСН, В - СЬІ2, О чи відсутній, R1 та R2, кожний незалежно - вибрано з групи, що складається з гідрогену, Сі єалкілу, заміщеного, як варіант, Сі 4алкоксилом чи фенілом, та Сі єалкенілу, або разом з атомом карбону, до якого вони приєднані, вони утворюють Сз єциклоалкіл, в який, як варіант, вбудовано вибрану з О, SO, SO2 та NR6 гетероатомну групу, або який, як варіант, конденсований з бензольним кільцем, R3 - гідроген, галоген, R7 чи OR 7 , R4 - гідроген, Сі 43ЛКІЛ, Сі 4алкоксил, трифлуорметил чи галоген, R 6 - ГІДрОГеН ЧИ С і 43ЛКІЛ, R7 - моноциклічна чи дициклічна система, яку виб рано з групи, що складається з фенілу, тієнілу, фурилу, піридинілу піримідинілу, нафтилу, інданілу, бензотієнілу, бензофуранілу, 2,3дипдробензофуранілу, індолілу, хінолінілу, ізохінолінілу, бензодюксолілу, бензимідазолілу, бензоксазолілу, бензотіазолілу та бензодюксанілу, кожний з яких заміщено, як варіант, одним чи двома замісниками, які вибрано з групи, що складається з Сі 4алкілу, який заміщений, як варіант, Сі 4алкоксилом чи гідроксилом, Сі 4алкоксилу, який заміщений, як варіант, Сі 4алкоксилом чи гідроксилом, Сі 4алкілтюгрупи, трифлуорметилу, трифлуорметоксилу, ціаногрупи та галогену, m = 1 чи 2, а п = 0,1 чи 2, за умови, що В не представляє О, коли А - С, який включає реакцію сполуки формули (II) R3 R5O (П) де R - гідроген чи Сі залкіл, а переривчасту ЛІНІЮ, А, В, R1, R2, R3, R4 , m та п визначено раніше для формули (І), з пдроксиламіном, з наступним утворенням, як варіант, її фармацевтично чи ветеринарно прийнятної солі, або її фармацевтично чи ветеринарно прийнятного сольвату будь-якої сутності 22 Спосіб за п 21, який відрізняється тим, що R5 - Сі залкіл, а естер формули (II) обробляють 3разовим надлишком пдрохлориду пдроксиламшу у присутності молярно еквівалентної КІЛЬКОСТІ придатної основи у придатному розчиннику при температурі від кімнатної до приблизно 85°С 23 Спосіб за п 22, який відрізняється тим, що основою є карбонат чи гідрокарбонат лужного металу, розчинником є метанол, скомбінований, як варіант, з тетрапдрофураном чи дихлорметаном як співрозчинниками, а температура реакції приблизно 65-70°С 24 Спосіб за п 23, який відрізняється тим, що R5 - гідроген, кислоту формули (II) у присутності 1,12,0 молекулярних еквівалентів активуючого засобу та 1,0-4,0 молекулярних еквівалентів третинного аміну у придатному розчиннику обробляють приблизно 3-разовим надлишком пдрохлориду пдроксиламіну у тому ж розчиннику при температурі від приблизно 0°С до кімнатної 25 Спосіб за п 24, який відрізняється тим, що активуючим засобом є гексафлуорфосфат О-(7азабензотріазол-1-іл)-1,1,3,3-тетраметилуронію (HATU), третинним аміном є Nетилдмзопропіламін, розчинником є безводний диметилформамід чи безводний 1метилпіролідин-2-он, а температура реакції приблизно кімнатна 52791 Згідно З винаходом запропоновано серію заміщених а-амшосульфонілацетопдроксамових кислот, які є інгібіторами цинк-залежних металопротеазних ферментів Зокрема сполуки є інгібіторами родини матричних металопротеаз (ММР) Матричні металопротеази (ММР) складають родину структурно подібних цинковмісних матричних металопротеаз, які включені в перетворення та розкладання ЗОВНІШНЬОКЛІТИННИХ матричних білків при нормальних фізіологічних процесах та в патологічних станах Внаслідок високої деструктивної здатності ММР звичайно підлягають суворій регуляції, а нездатність підтримувати регуляцію ММР може бути складовою ряду захворювань та патологічних станів, включаючи відрив атеросклеротичних бляшок, серцеву нестачу, рестеноз, перюдонтальні захворювання, ульцерацію тканин, заживления поранень, ракові метастази, пухлинФермент ММР-1 ММР-2 ММР-3 ММР-8 ММР-9 ММР-13 ММР-14 8 ний анпогенез, пов'язану з віком плямистість, фіброзну хворобу, ревматоїдний артрит, остеоартрит та залежні від міграції запальних клітин запальні хвороби Іншою важливою функцією деяких ММР є активація різних ферментів, включаючи ІНШІ ММР, відщепленням про-доменів від їх протеазних доменів Тому деякі ММР діють як регулятори активності інших ММР, так що перепродукування одної ММР може призвести до надлишкового протеолізу та ЗОВНІШНЬОКЛІТИННОІ матриці іншими Більш того, ММР мають різні субстратні преференції (показані в нижченаведеній таблиці для вибраних членів родини та різні функції в рамках нормальних та патологічних станів Нещодавно огляд ММР представлено в Current Pharmaceutical Design, 1996, 2, 624 та Exp 0pm Ther Patents, 1996, 6, 1305, Переважні субстрати Інша назва колагеназа-1 внутрішньотканинна колаге- колагени III, VII, X, желатини наза желатиназа-А, желатиназа 72 кДа желатини, колагени IV, V, VII, X, еластш фібронектин, активує про-ММР-13 стромелізин-1 протеоглікани, ламінін, фібронектин, желатини колагеназа-2, нейтрофільна колагеназа колагени І, II, III, желатиназа-В, желатиназа 92 кДа желатини, колагени IV, V, еластин колагеназа-3 колагени І, II, III, VII, X, желатини МТ-ММР-1 активує про ММР - 2 & 13 желатини Можна думати, що надлишкове продукування ММР-3 відповідне за патологічне руйнування тканин, що лежить в основі ряду захворювань та станів Наприклад, було виявлено наявність ММР-3 в суглобовій сумці та хрящі пацієнтів з остеоартритом та ревматоїдним артритом, отже, залучення ММР-3 при ураженнях суглобів викликане цими захворюваннями див Biochemistry, 1989, 28, 8691 та Biochem J , 1989, 258, 115, Можна думати, що ММР-3 також грає важливу роль при патології остеоартритів та ревматоїдних артритів див Lab Invest, 1997, 76, 717 та Arthritis Rheum , 1997, 40, 1391, Сполуки згідно з винаходом інгібують як ММР-3, так і ММР-13, атому їх можна використати при лікуванні цих захворювань Можна думати також, що надекспресія ММР-3 відповідна за багато уражень тканин та, що лежить в основі ряду захворювань та станів, як-то венозні та діабетичні виразки, пролежень див BntJ Dermatology, 1996,135, 115, Більш ТОГО, продукування ММР-3 може викликати також ураження тканини в умовах, коли наявна ульцерація товстої кишки (як ульцеративні коліти та хвороба Крона див J Immunoi , 1997, 158, 1582 та J Clm Pathol , 1994, 47, 113), або дванадцятипалої кишки (Am J Pathol, 1996, 148 519) Крім того ММР-3 може бути залучено у такі захворювання шкіри, як дистрофічний епідермолізний пухир (див Arch Dermatol Res, 1995, 287, 428) та герпетиформний дерматит (див J Invest Dermatology, 1995,105, 184) Нарешті, відрив атеросклеротичних бляшок під дією ММР-3 може призводити до серцевого чи мозкового інфаркту див Circulation, 1997, 96, 396, Тому інгібітори ММР-3 можуть знайти застосування при попередженні серцевого нападу та паралічу Дослідження раку людини виявило, що ММР-2 активується на поверхні швазивних пухлинних клітин (J ВюІ Chem , 1993, 268 14033) та було повідомлено, що ВВ-94, неселективний пептидний пдроксаматний інгібітор ММР, зменшує важкість пухлини та подовжує виживання мишей, що несуть ксенотрансплантати карциноми яєчнику людини (див Cancer Res, 1993, 53, 2087) Деякі сполуки згідно з винаходом інгібують ММР-2, а тому можуть бути корисними при лікуванні ракових метастазів та пухлинного анпогенезу У патентній літературі представлено різні серії інгібіторів ММР Наприклад, а-арилсульфонамідозаміщені ацетопдроксамові кислоти розкрито в ЕРА-0606046, WO-A-9627583 та WO-A-9719068, а в ЕР-А-0780386 розкрито деякі споріднені сульфонзаміщені пдроксамові кислоти Сполуки згідно з винаходом є інгібіторами деяких членів родини ММР Зокрема, вони є потужними інгібіторами ММР-3 та ММР-13 з деякими сполуками, що виявляють різного ступеню селективність відносно таких інших ММР, як ММР-1, ММР-2 та ММР-9, Деякі сполуки є потужними інгібіторами ММР-2 Отже, згідно з винаходом запропоновано сполуку формули (І) 52791 10 тично активною кислотою чи основою діастереоізомерних солей Крім того, сполуки формули (І), що мають алкеніли, можуть існувати як цис-стереоізомери чи транс-стереоізомери, а також їх суміші До рамок винаходу включено також радюмічені ПОХІДНІ сполук формули (1), що придатні для біологічних ДОСЛІДІВ або її фармацевтичне чи ветеринарне прийнятну сіль, або її фармацевтично чи ветеринарне прийнятний сольват (включаючи гідрат) будь-якої сутності, де переривчаста ЛІНІЯ представляє, як варіант, зв'язок, А-С чи СН, В - СЬІ2, О чи відсутня, R1 та R2, кожний незалежно - вибрано з групи, що складається з гідрогену, Сі % алкілу, заміщеного, як варіант, Сі А алкоксилом чи фенілом, та Сі % алкенілу, або разом з атомом карбону, до якого вони приєднані, вони утворюють Сз є циклоалкіл, в який, як варіант, вбудовано вибрану з О, SO, SO2 та NR6 гетероатомну групу, або який, як варіант, конденсований з бензольним кільцем, R3- гідроген, галоген, R7 чи OR , R4- гідроген, Сі 4 алкіл, Сі А алкоксил, трифлуорметил чи галоген, R6- гідроген чи Сі 4 алкіл, R7- моноциклічна чи дициклічна система, яку вибрано з групи, що складається з фенілу, тієнілу, фурилу, піридинілу піримідинілу, нафтилу, інданілу, бензотієнілу, бензофуранілу, 2,3дипдробензофуранілу, індолілу, хінолінілу, ізохінолінілу, бензодюксолілу, бензімідазолілу, бензоксазолілу, бензотіазолілу та бензодюксанілу, кожний з яких заміщено, як варіант, одним чи двома замісниками, які вибрано з групи, що складається з Сі 4 алкілу, який заміщений, як варіант, Сі 4 алкоксилом чи гідроксилом, Сі 4 алкоксилу, який заміщений, як варіант, Сі 4 алкоксилом чи гідроксилом, Сі 4 алкілтюгрупи, трифлуорметилу, трифлуорметоксилу, ціаногрупита галогену, m = 1 чи 2, а п = 0, 1 чи 2, за умови, що В не представляє О, коли А - С У вищенаведених позначеннях, якщо не визначено інше, алкіл, алкоксил, алкілтюгрупа та алкеніл, що мають три чи більше атоми карбону, можуть мати ЛІНІЙНИЙ ЧИ розгалужений ланцюг Галоген означає флуор, хлор, бром чи йод Сполуки формули (І) можуть мати один чи більше хіральні центри, а тому існувати як стереоізомери, тобто, енантюмери чи діастереоізомери, а також їх суміші До рамок винаходу включено як окремі стереоізомери формули (І), так і будь-які їх суміші Розділення діастереоізомерів можна досягти звичайними способами, наприклад, фракційною кристалізацією чи хроматографією (включаючи ВЕРХ) діастереоізомерної суміші сполуки формули (І) чи її придатної солі чи похідного Окремий енантюмер сполуки формули (І) можна виготовити з ВІДПОВІДНОГО оптично чистого інтермедіату, або розділенням за допомогою ВЕРХ з використанням придатного хірального наповнювачу, або за прийнятністю, фракційною кристалізацією утворених реакцією рацемату з придатною оп Сполуки формули (І) можуть утворювати фармацевтичне чи ветеринарне прийнятні солі з основами, зокрема солі з нетоксичними лужними металами, з основами Приклади включають солі натрію та калію Фармацевтичне чи ветеринарне прийнятні солі сполук формули (І), що містять основні групи, представляють, наприклад, утворені такими неорганічними кислотами, як пдрохлоридна, пдробромідна, сульфатна та фосфорна, такими органічними кислотами, як карбонові та сульфонові, нетоксичні солі приєднання Краща група сполук формули (І) включає ті, в яких В відсутня, R1 - гідроген, Сі 4 алкіл, заміщений, як варіант, метоксилом чи фенілом, або Сі 5 алкеніл, R - гідроген чи Сі А алкіл, або R1 та R2 разом з атомом карбону, до якого вони приєднані, утворюють С4-5 циклоалкіл, в який, як варіант, вбудовано вибрану з О та NR6 гетероатомну групу, або який, як варіант, конденсований з бензольним кільцем, R3 вибрано з групи, що складається з 4фенілу, 4-піридинілу, 4-шдан-5-ілу, 4-(2,3дипдробензофуран-5-ілу), 4-хінолш-З-ілу, 4бензодюксол-5-ілу та 4-бензімідазол-5-ілу, кожний з яких заміщено, як варіант, одним чи двома замісниками, які вибрано з групи, що складається з Сі з алкілу, який заміщений, як варіант, метоксилом чи гідроксилом, Сі з алкоксилу, який заміщений, як варіант, метоксилом чи гідроксилом, метилтюгрупи, трифлуорметилу, трисЬлуорметоксилу, ціаногрупи, флуору чи хлору, R - гідроген, метил, етил, метоксил, трифлуорметил, флуор чи хлор, R6метил, m = 2, а п = 1, Ще краща група сполук формули (І) включає ті, в яких R1 - гідроген, метил, етил, 2-метилпроп-1іл, бут-1-ил, 2-метоксіетил, бензил, З-фенілпроп-1іл, аліл, 2-метилаліл, 3,3-диметилаліл, R2- гідроген, метил чи етил, або R1 та R2 разом з атомом карбону, до якого вони приєднані, утворюють циклобутил, циклопентил, тетрапдропіран-4,4-дил, 1метилпіперидин-4,4-дмл, або шдан-2,2-дмл, R3 - 4феніл, 4-(2-метилфеніл), 4-(3-метилфеніл), 4-(3етилфеніл), 4-[3-(проп-2-іл)феніл], 4-(3,5диметилфеніл), 4-(3-метоксиметилфеніл), 4-(3етоксиметилфеніл), 4-(4-етоксиметилфеніл), 4-[3(проп-і-окси)феніл], 4-[3-(проп-2-окси)феніл], 4-[4(проп-2-окси)феніл], 4-(3,4-диметоксифеніл), 4-[3(2-метоксіетокси)феніл], 4-[3-(2пдроксіетокси)феніл], 4-(3-метилтюфеніл), 4-(3трифлуорметилфеніл), 4-(3трифлуорметоксифеніл), 4-(2-флуорфеніл), 4-(3хлор-4-флуорфеніл), 4-(3-ціанофеніл), 4-(піридин2-іл), 4-(піридин-3-іл), 4-(піридин-4-іл), 4-(6етоксипіридин-2-іл), 4-(5-етоксипіридин-3-іл), 4(шдан-5-іл), 4-(2,3-дипдробензофуран-5-іл), 4(ХІНОЛІН-3-ІЛ), 4-(бензодюксол-5-іл), 4-(2,2диметилбензодюксол-5-іл) та 4-(1,2диметилбензімідазол-5-іл), a R4 - гідроген, 2метил, 3-метил, 3-етил, 3-метоксил, З 52791 12 11 трифлуорметил, 3-флуор або 3-хлор піперидинове похідне (приклад 29) Найкраща група сполук формули (І) включає Нижченаведені способи ілюструють загальний 1 2 ті, в яких обидва R та R - гідроген чи метил, або шлях синтезу, який можна пристосовувати для разом з атомом карбону, до якого приєднані, вони отримання сполук згідно з винаходом утворюють циклобутил, циклопентил, тетСполуку формули (І) можна виготовити безпорапдропіран-4,4-дмл чи 1-метилпіперидин-4,4-дмл, середньо з естеру формули 3 R 4-феніл, 4-(3-метоксифеніл), 4-(3етоксифеніл), 4-[3-(2-метоксіетокси)феніл], 4-[3-(2пдроксіетокси)феніл] або 4-(6-етоксипіридин-2-іл), 4 a R - 3-метил чи 3-метоксил Особливо кращі індивідуальні сполуки згідно з винаходом включають І\І-пдрокси-2-{4-[4-(3-етоксифеніл)-3S RO метилфеніл]-1,2,3,6-тетрапдропіридин-1ілсульфоніл}ацетамід, г\І-пдрокси-2-{4-[4-(3-етоксифеніл)-3де R - Сі з алкіл, а переривчаста ЛІНІЯ, А, В, метилфеніл]-1,2,3,6-тетрапдропіридин-1R1, R2, R3, R4, m та п визначено раніше для форілсульфоніл}-2-метилпропанамід, мули (І), або через проміжне утворення карбонової г\І-пдрокси-2-{4-[4-(3-етоксифеніл)-3кислоти формули (II), де R5 - гідроген метилфеніл]піперидин-1-тсульфоніл}-2При виготовленні безпосередньо з естеру фометилпропанамід, рмули (II) реакцію можна проводити обробкою есг\І-пдрокси-1-{4-[4-(3-метоксифеніл)-3теру 3-разовим надлишком пдроксиламшу в приметилфеніл]піперидин-1датному розчиннику при температурі від кімнатної ілсульфоніл}циклопентанкарбоксамід, до приблизно 85°С Гідроксиламін звичайно утвоІ\І-пдрокси-1-{4-[4-(3-метоксифеніл)-3рюють на МІСЦІ з його пдрохлориду реакцією з екметилфеніл(]піперидин-1вівалентною КІЛЬКІСТЮ основи, як-то карбонати чи ілсульфоніл}циклобутанкарбоксамід, гідрокарбонати лужних металів, наприклад, карбог\І-пдрокси-2-{4-[4-(3-етоксифеніл)-3нат калію Розчинником, переважно, є метанол, метоксифеніл]піперидин-1-тсульфоніл}-2поєднаний, як варіант, з тетрапдрофураном чи метилпропанамід, дихлорметаном, при температурі реакції приблизМ-пдрокси-2-{4-[4-(6-етоксипіридин-2-1Л)-3но 65 - 70°С метилфеніл]піперидин-1-тсульфонфл}-2метилпропанамід, М-пдрокси-2-{4-[4-(3-[2-метоксіетокси]феніл)-3метилфеніл]-піперидин-1-ілсульфоніл}-2метилпропанамід та М-пдрокси-2-{4-[4-(3-[2-пдроксіетокси]феніл)-3метилфеніл]піперидин-1-ілсульфоніл}-2метилпропанамід Згідно З подальшим аспектом винаходу запропоновано спосіб виготовлення сполуки формули (І) або и фармацевтичне чи ветеринарне прийнятної солі, або її фармацевтичне чи ветеринарне прийнятного сольвату (включаючи гідрат) будь-якої сутності, який ілюстровано нижче Фахівці повинні розуміти, що деякі з описаних способів, порядок синтезу можна змінювати, що залежить від таких факторів, як природа інших присутніх на конкретній молекулі функціональних груп, доступність ключових штермедіатів та пристосовна стратегія протектування (коли треба) груп Ясно, що ці фактори також впливатимуть на вибір реагентів для використання у вказаному синтезі Ілюстрацію стратегії протектування наведено у способі синтезу в прикладі 64, де до проведення потрібної реакції Сузукі утворюють протектований О-бензилом пдроксамат, та в прикладі 66, де застосовують трет-бутилдифенілсиліл для протектування спиртової групи Треба також розуміти, що різні взаємоперетворення та трансформації стандартних замісників чи функціональних груп в рамках деяких сполук формули (І) забезпечуватимуть ІНШІ сполуки формули (І) Прикладом є перетворення гідруванням тетрапдропіридинового похідного (приклад 28) в Альтернативно, звичайним гідролізом естер можна перетворити у відповідну карбонову кислоту, яку потім перетворюють у потрібну пдроксамову кислоту формули (II) Гідроліз, переважно, здійснюють в основних умовах, використовуючи приблизно 6-разовий надлишок гідроксиду лужного металу у водному розчині, як варіант, у присутності співрозчиннику, при температурі від кімнатної до приблизно 85°С Звичайно співрозчинник вибирають з метанолу, 1,4-дюксану, суміші метанолу і тетрапдрофурану та суміші метанолу і 1,4-дюксану при температурі реакції приблизно 40 - 70°С Наступний етап сполучення провести звичайним способом утворення амідного зв'язку, наприклад, через ацилхлоридне похідне та пдрохлорид пдроксиламіну у присутності надлишку такого третинного аміну, як тріетиламш чи піридин для зв'язування кислоти, як варіант, у присутності такого каталізатору, як 4-диметиламшопіридин, у такому придатному розчиннику, як дихлорметан, при температурі від приблизно 0°С до кімнатної Для зручності як розчинник можна використовувати піридин Зокрема, можна використовувати будь-який з множинності варіантів амінокислотного сполучення Наприклад, кислоту формули (II), де R5 - гідроген, можна активувати таким карбодммідом, як 1,3дициклогексилкарбодммід або 1-етил-3-(3диметиламшопроп-1-іл)карбодммід, як варіант, у присутності 1-пдроксибензотріазолу та/або такого каталізатору, як 4-диметиламшопіридин, або такою сіллю галогентрисамшофосфонію, як гексафлуорфосфат бромтрис(піролідино)фосфонію Кож 13 52791 ний тип сполучення проводять в такому придатному розчиннику, як дихлорметан чи диметилформамід, як варіант, у присутності такого третинного аміну, як N-метилморфолш чи Nетилдмзопропіламін (наприклад, коли пдроксиламін чи активаційний реагент присутні у формі солі приєднання кислоти), при температурі від приблизно 0°С до кімнатної Звичайно використовують 1,1 - 2,0 молярних еквіваленти активаційного реагенту та 1,0 - 4,0 молярних еквіваленти третинного аміну Кращим реагентом для опосередковування сполучення є гексафлуорфосфат О-(7азабензотріазол-1-іл)-1,1,3,3-тетраметилуронію (HATU) Переважно розчин кислоти та 1,0 - 1,2 молярних еквіваленти N-етилдмзопропіламіну у такому придатному розчиннику, як безводний диметилформамід чи безводний 1-метилпіролідин-2-он, обробляють під азотом при приблизно кімнатній температурі 50% надлишком HATU, а потім, через приблизно 15-30 хвилин, приблизно 3-разовим надлишком пдрохлориду пдроксиламшу та 4разовим надлишком N-етилдмзопропіламіну, як варіант, в тому ж розчиннику при тій же температурі Естер формули (II) можна виготовити з аміну формули (III) R3 H N де переривчаста ЛІНІЯ, А, В, R3, R4, значено раніше для формули ванням сполукою формули (IV) m та п ви (І), сульфонілу ffO О де Z - галоген, R5 - Смалкій, a R1 та R2 визначено раніше для формули (II) Переважно, Z -хлор Коли R6- гідроген, краще, звичайно, протектувати його поєднанням з вторинним аміном для утворення протектувальної аміногрупи Реакцію можна провести з 50% надлишком прийнятної основи в прийнятному розчиннику при температурі від приблизно 0°С до кімнатної Наприклад, коли обидва R1 та R2 - пдрогени, прийнятною основою є 1,8-діазабіцикло[5,4,0]ундец-7-ен, а придатним розчинником - дихлорметан Альтернативно, можна спочатку утворити аніон сполуки формули (III) використанням 20% надлишку сильної основи в прийнятному розчиннику під азотом, а потім здійснюють сульфонування 1,0 -1,2 молярними еквівалентами (IV) Зручно проводити таке сполучення при кімнатній температурі з N,0біс(триметилсиліл)ацетамідом як основою та безводним тетрапдрофураном як розчинником Наступний спосіб виготовлення естеру формули (II), де R3 представляє R7, полягає в проведенні реакції Сузукі або реакції Стилла, з естером 14 формули (II), де R3 (але не R4) представляє бром чи йод Так, в реакції Сузукі останній естер обробляють 1,0 - 1,5 молярними еквівалентами боронової кислоти формули R7B(OH)2, у присутності 2,0 - 3,0 молярних еквівалентів флуориду лужного металу, приблизно 0,1 молярного еквіваленту триарилфосфіну та приблизно 0,5 молярного еквіваленту паладієвого каталізатору в придатному розчиннику під азотом при температурі приблизно 65 - 100°С Флуоридом, звичайно, є флуорид цезію, фосфіном трі-о-толілфосфін, каталізатором трис(дибензиліденацетон)-дипаладій(0), а розчинником -дегазований 1,2-диметоксіетан, як варіант, з 1-метил пірол ід ин-2-оном якспіврозчинником В реакції Стилла вищезгаданий естерний вихідний матеріал формули (II) обробляють 1,0 - 2,0 молярними еквівалентами придатного похідного тріалкілстануму формули R7Sn(anKin)3, де алкілом є, наприклад, н-бутил, у присутності 2,0 - 3,0 молярних еквівалентів третинної основи, 0,3 - 0,6 молярного еквіваленту триарилфосфшу та приблизно 0,05 - 0,2 молярного еквіваленту паладієвого каталізатору в придатному розчиннику під азотом при температурі приблизно 65 - 100°С Основою, звичайно, є тріетиламш, фосфіном - тріо-толілфосфш, каталізатором - ацетат паладію(ІІ) у присутності, як варіант, тетракіс(трифенілфосфш)паладію(0), а розчинником безводний ацетонітрил Деякі естери формули (II), де щонайменше один з R1 та R2 не є гідрогеном, можна зручно отримати з а-карбанюну естеру формули (II), де щонайменше один з R1 та R2 є гідрогеном, звичайним С-алкілуванням, використовуючи в якості алкілувального засобу сполуки формул (VA) та (VB) RX (VA), X-W-Y (VB), де R є визначеним раніше для R1 та R2, але не є гідрогеном, X та Y можуть бути однаковими чи різними відщеплюваними групами, a W - C-z 5 алкілен, в який, як варіант, вбудовано вибрану з О, SO SO2 та NR6 гетероатомну групу, або який, як варіант, конденсований з бензольним кільцем Коли у сполуці формули (І) R6 - гідроген, протягом алкілування може бути кращою звичайна стратегія протектування аміном Придатну відщеплювану групу можна вибрати з галогену (наприклад, хлору, брому чи йоду), Сі &, алкансульфонілоксилу, трифлуорметансульфонілоксилу та арилсульфонілоксилу (наприклад, бензолсульфонілоксилу чи п-толуолсульфонілоксилу) Переважно, X та Y вибирають з брому, йоду та п-толуолсульфонілоксилу Карбанюн можна утворити використанням придатної основи в придатному розчиннику Типові комбінації основа-розчинник можна вибрати з гідридів ЛІТІЮ, натрію чи калію, біс(триметилсиліл)амідів ЛІТІЮ, натрію чи калію, дмзопропіламіду ЛІТІЮ та бутиллітію разом з толуолом ефіром, 1,2-метоксіетаном, тетрапдрофураном, 1,4-дюксаном, диметилформамідом, N,Nдиметилацетамідом, 1-метил пірол ід ин-2-оном та будь-якою їх сумішшю Переважно, основою є гідрид натрію, а розчинником - безводний диметилформамід, як варіант, з безводним тетрапдрофураном як співроз 15 52791 16 чинником, або безводний 1-метилпіролідин-2-он хпоретилхлорформіат в киплячому толуолі, а поДля моноалкілування застосовують надлишок остім обробкою реакційної суміші при кімнатній темнови приблизно до 10%, а для діалкілування звипературі метанолом чи етанолом чайно прийнятний надлишок у 2,0 - 3,0 молярних Цей ненасичений піперидин можна перетвориеквіваленти ти у сполуку формули (III), де переривчаста ЛІНІЯ 3 4 відсутня, А - С, В відсутній, m = 2, п =1, a R та R Карбанюн звичайно утворюють приблизно при визначено раніше для формули (III), в звичайних кімнатній температурі під азотом, а потім обробумовах каталітичного або з каталітичним переноляють приблизно 30% надлишком потрібного алкісом гідрування Альтернативно, ці умови гідруванлувального засобу при тій же температурі ня можна застосувати для перетворення раніше Зрозуміло, що коли потрібне діалкілування, а 1 2 описаного N-бензил-алкену (1,2,3,6R та R різні, замісники можна вводити тандемом в одному чи різних етапах тетрапдропіридинового похідного) у те ж саме піперидинове похідне безпосередньо одним етапом Особливо зручний альтернативний спосіб алКрім того, цей повністю насичений піперидин можкілування, що включає обробку субстрату потрібна одержати в один етап з (VIII), в якому Р - Вое, ним алкілувальним засобом у присутності 3,0 - 3,5 стандартним іонним гідруванням, використовуючи, молярних еквівалентів безводного карбонату канаприклад, тріетилсилан та трифлуороцтову кислію у безводному диметилсульфоксиді чи безводлоту в дихлорметані ному 1,2-метоксіетані при кімнатній температурі під азотом Інші аміни формули (III), що не доступні комеЯсно, що альтернативний варіант виготовленрційне або не описані потім, можна отримати за ня сполуки формули (І) полягає у введенні R аналогією з описаним в розділі Синтези способом, та/або R у придатний бромо- чи йодоштермедіат або звичайним способом синтезу згідно зі стандаперед подальшим проведенням, наприклад, реакртними довідниками з органічної хімії чи літератуції Сузукі чи Стилла рними джерелами з легко доступних вихідних матеріалів, використовуючи прийнятні реагенти та Амін формули (III) можна отримати стандартумови реакцій ними способами синтезу Наприклад, коли В відсутня, m = 2, а п =1, придатний N-протектований Більш ТОГО, фахівцям ВІДОМІ варіанти або альпіперидин-4 он формули (VI) тернативи описаних тут у розділах Приклади та Синтези способів, що дозволять одержати сполуки формули (І) Фармацевтичне чи ветеринарно прийнятні солі де Р - звичайна амінопротектувальна група, основних сполук формули (І) можна також одержати звичайними способами Наприклад, розчин реагує з карбанюнним похідним формули (VII) пдроксамової кислоти обробляють прийнятною R3 основою, чистою чи в придатному розчиннику, а утворену сіль виділяють фільтруванням або випарюванням під вакуумом реакційного розчиннику Фармацевтичне чи ветеринарно прийнятні солі де Z - визначено раніше для формули (IV), а приєднання кислоти можна отримати аналогічно 3 4 R та R визначено раніше для формули (III), з обробкою розчину основної сполуки формули (І) отриманням сполуки формули (VIII) прийнятною кислотою Можна утворити або перетворити обидва типи солі, використовуючи іонообмінну смолу Біологічну активність сполук згідно з винаходом визначали нижченаведеними тестами, які ба(VHI) зуються на здатності сполук інгібувати розщепПереважно, Z - хлор, бром чи йод лення різних флуорогенних поліпептидів дією Зручно перетворювати (VII) в ариллітієве чи ММР1, 2, 3, 9, 13та14 арильне грин'ярівське похідне, при цьому з багаДослідження ММР 2, 3, 9, 13 та 14 базується тьох придатних амінопротектувальних груп придана описаному у FEBS, 1992, 296, 263 оригінальнотним Р єтрет-бутоксикарбоніл (Вос) чи бензил му протоколі з невеликими описаними нижче моКоли Р - Вос, (VIII) можна перетворити безподифікаціями середньо в сполуку формули (III), де переривчаста Виготовлення ферменту Каталітичний домен ЛІНІЯ представляє зв'язок, А - С, В відсутня, m = 2, ММР-1 виготовили у Pfizer Central Research labora3 4 п =1, a R та R визначено раніше для формули tories Вихідний розчин ММР-1 (1мкМ) активували (III), використовуючи трифлуороцтову кислоту, як додаванням амінофенілпдрарпрумацета-ту (АРваріант, у такому придатному розчиннику, як дихМА), при кінцевій концентрації 1мМ, 20 хвилин при лорметан, приблизно при кімнатній температурі 37°С ММР-1 далі розбавляли у буфері для аналіАльтернативно, коли Р - бензил, (VIII) можна перезу Трис-НСІ (50мМ Трис, 200мМ NaCI 5мМ СаСІ2, творити в два етапи в ту ж сполуку формули (III) 20пМ ZnSO4 та 0,05% Bnj 35, рН 7,5)до концентНаприклад, на першому етапі дегідратацію можна рації ЮнМ Використана в аналізі кінцева конценпровести в киплячому толуолі, використовуючи птрація ферменту 1 нМ толуолсульфонову кислоту та апаратуру ДинаСубстрат Використаний в аналізі флуорогенСтарка N-депротектування утвореного алкену ний субстрат представляє Dnp-Pro-п-циклогексил(1,2,3,6-тетрапдропіридинового похідного) на друAla-Gly-Cys(Me)-His-Ala-Lys-(N-Me-Ala)-NH2 як гому етапі можна провести, використовуючи 1вперше описано у Anal Biochem , 1993, 212, 58, ГГ° 52791 18 17 Використана в аналізі кінцева концентрація субІнгібування ММР-13 страту 10 м кМ Виготовлення ферменту Рекомбшантний ММР-13 людини виготовили у PanVera Corporation Визначення інгібування ферменту Тест(Madison Wisconsin) та охарактеризували у Pfizer сполуку розчиняли у диметилсульфоксиді та розCentral Research laboratories Вихідний розчин бавляли буфером для аналізу до концентрації ММР-13 (1,9мкМ) активували додаванням 2мМ диметилсульфоксиду не більше 1% Тест-сполуку АРМА протягом 2 годин при 37°С ММР-13 далі та фермент додавали до кожної комірки 96розбавляли у буфері для аналізу (50мМ Трис, коміркового планшету та давали урівноважитися 200мМ NaCI, 5мМ СаСІ2, 20мкМ ZnCI2 та 0,02% Bnj протягом 15 хвилин при 37°С в орбітальному 35, рН 7,5) до концентрації 5,ЗнМ Використана в струшувані до додавання субстрату Далі планшеаналізі кінцева концентрація ферменту 1,ЗнМ ти шкубували 1 годину при 37°С до визначення флуоресценції (розщеплення субстрату) викорисСубстрат Використаний в аналізі флуорогентовуючи флуориметр (Fluostar, BMG LabTechnoloний субстрат представляє Dnp-Pro-Cha-Glygies Aylesbury, UK) при збуджувальному випроміCys(Me)-His-Ala-Lys(NMA)-NH2 Використана в нюванні з довжиною хвилі 355нм та довжиною аналізі кінцева концентрація субстрату ЮпМ хвилі емісії 440нм Потужність інгібування вимірюВизначення інгібування Ферменту Тествали за КІЛЬКІСТЮ отриманого розщепленого субсполуку розчиняли у диметилсульфоксиді та розстрату, використовуючи ряд концентрацій тестбавляли буфером для аналізу до концентрації сполуки, з отриманої кривої залежності від дози диметилсульфоксиду не більше 1% Тест-сполуку розраховували величину IKso (потрібна для інгібута фермент додавали до кожної комірки 96вання 50% активності ферменту концентрація інгікоміркового планшету, Додаванням субстрату інібітору) ціювали реакцію Інтенсивність флуоресценції визначали, використовуючи 96-комірковий планшетІнгібування ММР-2, ММР-Зта ММР-9 ний флуориметр при збуджувальному Виготовлення ферменту Каталітичні домени випромінюванні з довжиною хвилі 328нм та довММР-2, ММР-3 та ММР-9 виготовили у Pfizer Cenжиною хвилі емісії 393нм Потужність інгібування tral Research laboratories ВИХІДНІ розчини ММР-2, вимірювали за КІЛЬКІСТЮ отриманого розщепленого ММР-3 або ММР-9 (1мкМ) активували додаванням субстрату, використовуючи ряд концентрацій тестамінофенілпдрарпрумацетату (АРМА), при кінцесполуки, з отриманої кривої залежності від дози вій концентрації 1мМ для ММР-2 та ММР-9 і нарозраховували величину IKso (потрібна для інгібуступному інкубуванні протягом 1 години при 37°С, вання 50% активності ферменту концентрація інгі20 хвилин при 37°С ММР-3 активували додаванбітору) ням 2мМ АРМА і далі шкубували протягом 3 годин при 37°С Ферменти далі розбавляли у буфері для Інгібування ММР-14 аналізу Трис-НСІ (ЮОмМ Трис, ЮОмМ NaCI ЮмМ Каталітичний домен ММР-14 виготовили у СаСЬ, та 0,16% Bnj 35, рН 7,5) до концентрації Pfizer Central Research laboratories Вихідний розЮнМ Використана в аналізі кінцева концентрація чин ММР-14 (ЮмкМ) активували протягом 20 хвиферменту 1нМ лин при 25°С, а далі додавали 5мкг/мл трипсину (Sigma, Dorset UK) Активність трипсину нейтраліСубстрат Використаний в аналізі флуорогензували додаванням 50мкг/мл інгібітору трипсину ний субстрат представляє Mca-Arg-Pro-Lys-Proсої (Sigma, Dorset UK), а потім розбавляли вихідTyr-Ala-Nva-Trp-MeTpeT-Lys(Dnp)-NH2 (Bachem Ltd ний розчин ферменту буфером для аналізу ТрисEssex UK) як вперше описано в J Biol Chem НСІ (ЮОмМ Трис, ЮОмМ NaCI ЮмМ СаСІ2, та 1994, 269, 20952, Цей субстрат вибрали, оскільки 0,16% Bnj 35, рН 7,5) до концентрації ЮнМ Виковін має збалансовану швидкість гідролізу для ММР 1 1 ристана в аналізі кінцева концентрація ферменту 2, 3 та 9 (kcat/Km 54,000, 59,400 та 55,300 с • М 1нМ ВІДПОВІДНО) Використана в аналізі кінцева концентрація субстрату 5мкМ Субстрат Використаний в аналізі флуорогенний субстрат представляє Mca-Pro-Leu-Gly-LeuВизначення інгібування ферменту ТестDpa-Ala-Arg-NH2 (Bachem Ltd Essex UK) як описполуку розчиняли у диметилсульфоксиді та розсано в J Biol Chem 1996, 271 17119 бавляли буфером для аналізу до концентрації диметилсульфоксиду не більше 1% Тест-сполуку Визначення інгібування ферменту Проведено та фермент додавали до кожної комірки 96як описано для ММР-2, ММР-3 та ММР-9 коміркового планшету та давали урівноважитися При лікуванні людини сполуки формули протягом 15 хвилин при 37°С в орбітальному (І), їх фармацевтичне прийнятні солі та фармацевструшувачі до додавання субстрату Далі планшетичне прийнятні сольвати будь-якої сутності можна ти шкубували 1 годину при 37°С до визначення призначати поодинці, але звичайно їх призначають флуоресценції (розщеплення субстрату) викорису суміші з вибраним з огляду на спосіб призначентовуючи флуориметр (Fluostar, BMG LabTechnoloня та стандартну фармацевтичну практику фарgies Aylesbury, UK) при збуджувальному випромімацевтичним носієм нюванні з довжиною хвилі 328нм та довжиною їх можна призначати перорально у формі табхвилі емісії 393нм Потужність інгібування вимірюлеток з вмістом таких наповнювачів, як крохмаль вали за КІЛЬКІСТЮ отриманого розщепленого субчи лактоза, у формі капсул поодинці чи у суміші з страту, використовуючи ряд концентрацій тестнаповнювачем, або у формі еліксирів, розчинів чи сполуки, з отриманої кривої залежності від дози суспензій з вмістом смакового засобу чи барвнику, розраховували величину IKso (потрібна для інгібуїх також можна ін'єктувати, наприклад, внутрішвання 50% активності ферменту концентрація інгіньовенно, внутрішньом'язово чи підшкірне, а найбітору) краще застосовувати у формі стерильних водних 19 розчинів, що можуть містити ІНШІ речовини, наприклад, досить солі чи моносахариду, щоб зробити розчин ІЗОТОНІЧНИМ з кров'ю Для інших способів парентерального призначення, як-то букального чи під'язичного, їх можна призначати у формі таблеток чи пастилок, які можна сформувати звичайними способами Крім того, сполуки та їх солі можна призначати місцеве у формі стерильного крему, гелю, суспензії, лосьйону, мазі, розпилюваного порошку, спрею, перев'язочного матеріалу з вмістом ЛІКІВ або нашкірного пластиру Наприклад, їх можна уводити в крем, що складається з водної чи масляної емульсії поліетиленгліколю чи рідкого парафіну, або їх можна уводити в мазь, що складається з основи м'якого парафіну білого воску, або як пдрогель з целюлозними чи поліакрилатними похідними або іншими модифікаторами в'язкості, або як сухі порошки чи рідкі спреї чи аерозолі з пропелентами бутан/пропан, HFA та CFC, або як перев'язочний матеріал з вмістом ЛІКІВ ЯК просочений білим м'яким парафіном чи поліетиленгліколем перев'язочний матеріал з марлі, або з пдро-гелем, пдроколоідом альгінатом чи плівковим перев'язочним матеріалом Більш того, сполуки та їх солі можна призначати внутрішньоочно з прийнятним буфером, модифікатором в'язкості (наприклад, целюлозними похідними), консервантами (наприклад, хлоридами бензалконію (BZK)) та засобами для регулювання тонічності(наприклад, хлориду натрію) Усі такі композиції можуть також включати консерванти та стабілізатори Залежно від способу призначення людині добова доза сполук формули (І) та їх солей може складати 0,0001-20мкг/кг, разовою чи поділеними дозами Тому, наприклад, таблетки чи капсули можуть містити 0,02 - 500мг активної сполуки з призначенням один, два чи більше рази на добу, за прийнятністю Лікар в будь-якому випадку повинен визначити потрібну дозу, що найпридатніша для конкретного пацієнта, і яка залежить від віку, маси та чутливості конкретного пацієнта Вищевказані дози є прикладами для пересічного випадку, безумовно, в окремих випадках вони можуть бути вищими чи нижчими, залишаючись при цьому в рамках винаходу Для використання у ветеринарії сполуки формули (І) чи їх ветеринарне прийнятні солі або ветеринарне прийнятні сольвати будь-якої сутності призначають як придатне прийнятні композиції згідно з нормальною ветеринарною практикою, а ветеринар визначатиме найсприятливіший для конкретної тварини режим дозування та спосіб призначення Тому згідно з винаходом запропоновано фармацевтичну композицію, що включає сполуку формули (І), и фармацевтичне прийнятну сіль, чи фармацевтичне прийнятний сольват будь-якої сутності разом з фармацевтичне прийнятним розріджувачем чи носієм Крім того згідно з винаходом запропоновано ветеринарну композицію, що включає сполуку формули (І), и ветеринарне прийнятну сіль, чи ветеринарне прийнятний сольват будь-якої сутності 52791 20 разом з ветеринарне прийнятним розріджувачем чи носієм Також згідно з винаходом запропоновано сполуку формули (І), и фармацевтичне прийнятну сіль, чи фармацевтичне прийнятний сольват будьякої сутності або фармацевтичну композицію, що включає будь-що з перерахованого, для використання в якості лікувального засобу для людини Крім того згідно з винаходом запропоновано включає сполуку формули (І), и ветеринарне прийнятну сіль, чи ветеринарне прийнятний сольват будь-якої сутності або ветеринарну композицію, що включає будь-що з перерахованого, для використання в якості лікувального засобу для тварини Згідно З подальшим аспектом винаходу запропоновано також використання сполуки формули (І), и ветеринарне прийнятної солі, чи ветеринарне прийнятного сольвату будь-якої сутності для виготовлення лікувального засобу для лікування чи профілактики медичних станів людини, при яких показаний інгібітор ММР Згідно З подальшим аспектом винаходу запропоновано також використання сполуки формули (І), и ветеринарне прийнятної солі, чи ветеринарне прийнятного сольвату будь-якої сутності для виготовлення лікувального засобу для лікування чи профілактики медичних станів тварини, при яких показаний інгібітор ММР Крім того згідно з винаходом запропоновано використання сполуки формули (І), и фармацевтичне прийнятної солі, чи фармацевтичне прийнятного сольвату будь-якої сутності для виготовлення лікувального засобу для людини для лікування чи профілактики відриву атеросклеротичних бляшок, інфаркту міокарду, серцевої нестачі, рестенозу, нападу, перюдонтального захворювання, ульцерацм тканин, заживления поранень, захворювань шкіри, ракових метастазів, пухлинного анпогенезу, пов'язаної з віком плямистості, фіброзної хвороби, ревматоїдного артриту, остеоартриту та залежних від міграції запальних клітин запальних хвороб Також запропоновано використання сполуки формули (І), и ветеринарно прийнятної солі, чи ветеринарне прийнятного сольвату будь-якої сутності для виготовлення лікувального засобу для тварини для лікування чи профілактики відриву атеросклеротичних бляшок, інфаркту міокарду, серцевої нестачі, рестенозу, нападу, перюдонтального захворювання, ульцерацм тканин, заживления поранень, захворювань шкіри, ракових метастазів, пухлинного анпогенезу, пов'язаної з віком плямистості, фіброзної хвороби, ревматоїдного артриту, остеоартриту та залежних від міграції запальних клітин запальних хвороб Крім того згідно з винаходом запропоновано спосіб лікування чи попередження медичних станів, при яких показаний інгібітор ММР, у ссавців (включаючи людину), який включає призначення вказаній тварині терапевтичне ефективної КІЛЬКОСТІ сполуки формули (І), и фармацевтично чи ветеринарно прийнятної солі, або фармацевтично чи ветеринарно прийнятного сольвату будь-якої сутності, або фармацевтичної чи ветеринарної композиції, яка містить будь-що з перерахованого Далі згідно з винаходом запропоновано спосіб 52791 22 21 лікування чи попередження відриву атеросклероілсульфоніліацетамід Отримали як безбарвну тичних бляшок, інфаркту міокарду, серцевої нетверду речовину (58%), т пл 190-191 °С, з титульстачі, рестенозу, нападу, перюдонтального захвоної сполуки з синтезу 9, використовуючи спосіб з рювання, ульцерацм тканин, заживления прикладу 1, знайдено С 62,05, Н 5,74, N 7,12, розпоранень, захворювань шкіри, ракових метастазів, раховано для C20H22N2O4S С 62,16, Н 5,74, пухлинного анпогенезу, пов'язаної з віком плямисN 7,25% 5(ДМСО Й 6 ) 2,23 (s,3H) 2,60 (m,2H), 3,47 тості, фіброзної хвороби, ревматоїдного артриту, (t,2H), 3,90 (s,2H), 3,95 (m,2H) 6,20 (brs 1H) 7,17 остеоартриту та залежних від міграції запальних (d,1H), 7,30-7,48 (m,7H), 9,20 (s,1H), 10,80 (s,1H) + клітин запальних хвороб, у ссавців (включаючи LRMS (терморозпилення) 388(М+Н) людину), який включає призначення вказаній тваПриклад 3 N-пдро КС и-2-[4-(4 рині терапевтичне ефективної КІЛЬКОСТІ сполуки формули (І), и фармацевтично чи ветеринарно прийнятної солі, або фармацевтично чи ветеринарно прийнятного сольвату будь-якої сутності, або фармацевтичної чи ветеринарної композиції, яка містить будь-що з перерахованого До рамок винаходу включено кожний з описаних тут нових штермедіатів, наприклад, інтермедіати формули (II) Синтези сполук згідно з винаходом та інтермедіатів для використання при цьому ілюстровано нижченаведеними прикладами синтезами Кімнатна температура означає 20 - 25°С Флеш-хроматографія відноситься до хроматографії на колонці з силікагелем (Kieselgel 60, 230 240 меш) Точки плавлення не коректували Спектри 1Н ЯМР реєстрували на спектрометрах Bruker AC300, Vanan Unity lnova-300 чи Vanan Unity lnova-400, в усіх випадках вони підтверджують запропоновану структуру Характерні ХІМІЧНІ зсуви (5) представлені в частках на мільйон відносно тетраметилсилану, використовуючи звичайні скорочення для позначення головних ПІКІВ напри клад, s - синглет, d - дублет, t - триплет, q - квартет, m - мультиплет, br - широкий Мас-спектри реєстрували на масспектрометрах Fmmgan Mat TSQ 7000 або Fisons Instruments Trio 1000 LRMS означає мас-спектри низького розділення, а розраховані та спостережені дані для ІОНІВ відносяться до ізотопних ком позицій найнижчої маси Приклад 1 М-пдрокси-2-Г4-(4-Фенілфеніл)1,2,3,6-тетрапдропіридин-1-ілсульфоніл1ацетамід Карбонат_калію (207мг, 1,5ммоль) додали при перемішуванні до суміші титульної сполуки з синтезу 8 (186мг, 0,5ммоль), пдрохлориду пдроксиламшу (104мг, 1,5ммоль), тетрапдрофурану (2мл) та метанолу (Змл) Реакційну суміш гріли під зворотним холодильником 20 годин, давали охолонути, розбавляли водою (15 мл) та етилацетатом (Юмл) та підкислювали концентрованою пдрохлори-дною кислотою Цю суміш далі недовго гріли при 100°С, давали охолонути та фільтрували Отриманий так матеріал промивали послідовно водою та етилацетатом, далі сушили під вакуумом, одержавши титульну сполуку (125мг, 67%) як безбарвну тверду речовину, т пл 216-218°С знайдено С 61,05, Н, 5,35, N, 7,41, розраховано для C19H20N2O4S C, 61,27, Н, 5,41, N 7,52% 5(ДМСОЙ6) 2,62 (т,2Н), 3,50 (т,2Н), 3,92 (s,2H), 3,98 (т,2Н), 6,24 (brs, 1H), 7,35 (т,1Н), 7,41-7,48 (т,2Н) 7,52-7,58 (т,2Н), 7,62-7,73 (т,4Н), 9,22 (s,1H), 10,82 (s,1H) LRMS (АРСІ) 373 (М+Н)+ Приклад 2 М-пдрокси-2-Г4-(3-метил-4фенілфеніл)-1,2,3,6-тетрапдропіридин-1 фенілФеніл)піперидин-1-ілсульфоніл1ацетамід Отримали як безбарвну тверду речовину (62%), т пл 200-201 °С, з титульної сполуки з синтезу 10, використовуючи спосіб з прикладу 1, знайдено С 60,96, Н 5,86, N 6,97, розраховано для C19H22N2O4S С 60,94, Н 5,92, N 7,48% 5(ДМСО Й 6 ) 1,63 ( т , 2 Н ) 1,83 (т,2Н) 2,66 (т,1Н), 2,98 (t,2H), 3,70 ( т , 2 Н ) , 3,83 (s,2H), 7,30 (т,ЗН), 7,40 (t,2H), 7,54-7,60 ( т , 4 Н ) , 9,18 (s,1H), 10,75 (s,1H) LRMS (терморозпилення) 375 (М+Н) + Приклад 4 М-пдрокси-2-(4-Феніл-1,2,3,6тетрапдропіридин-1-ілссульфоніл)ацетамід Отримали як безбарвну тверду речовину (76%), т пл 175-176°С, з титульної сполуки з синтезу 1 1 , використовуючи спосіб з прикладу 1, знайдено С 52,41, Н 5,39, N9,35, розраховано для C13H16N2O4S С 52,69, Н 5,44, N 9,45% 5(ДМСО Й 6 ) 2,58 ( т , 2 Н ) , 3,46 (t,2H) 3,90 (s,2H) 3,95 ( т , 2 Н ) , 6,18 (brs, 1H), 7,23-7,48 ( т , 5 Н ) 9,20 (s,1H), 10,80 (s,1H) Приклад 5 М-пдрокси-2-(4-Фенілпіперидин-1ілсульфоніл)ацетамід Отримали як безбарвну тверду речовину (44%), т пл 185-187°С, з титульної сполуки з синтезу 12, використовуючи спосіб з прикладу 1, знайдено С,52,08, Н 6,04, N 9,23, розраховано для C13H18N2O4S С 52,33, Н 6,08, N,9,39% 5(ДМСО Й 6 ) 1,62 ( т , 2 Н ) 1,82 (т,2Н), 2,62 ( т , 1 Н ) 2,98 (t,2H), 3,70 (т,2Н), 3,84 (s,2H), 7,157,33 ( т , 5 Н ) , 9,20 (s,1H), 10,78 (s,1H) Приклад 6 №пдрокси-2-(4-бензилтперидин-1ілсульфоніл)ацетамід Отримали як безбарвну тверду речовину (35%), т пл 132-135 ( І С, з титульної сполуки з синтезу 13, використовуючи спосіб з прикладу 1, знайдено С 53,66, Н 6,43, N,8,82, розраховано для C14H20N2O4S С,53,83, Н 6,45, N,8,97% 5(flMCO d 6 ) 1,13 (m,2H), 1,58 (m,3H), 2,49 (d,2H), 2,75 (t,2H), 3,50 (d,2H), 3,73 (s,2H), 7,10 (m,3H), 7,22 (m,2H), 9,10 (s,1H), 10,70 (s,1H) Приклад 7 №пдрокси-2(Т98 2) при очистці хроматографією 6(ДМСО и а) 1,65 (s,3H) 2,40-2,80 (m,4H), 3,52 (m,2H), 3,90 (dd,1H) 4,00 (m,2H), 4,70 (s,1H), 4,78 (s,1H), 6,23 (brs,1H), 7,35 (m,1H), 7,44 (m,2H), 7,52 (d,2H), 7,65 (m,4H), 9,22 (s,1H), 10,85 (s,1H) LRMS(APCI) 4 2 7 ( M + H ) + Приклад 15 N-riflpoKCH-2(R,S)-MeTHn-2-r4-(3метил-4-фенілфеніл)-1,2,3,6-тетрапдропіридин-1ілсульфоніліпент-4-енамід Отримали як безбарвну губоподібну речовину (20%) з титульної сполуки з синтезу 29, використовуючи спосіб з прикладу 7, але з елюювальним градієнтом дихлорметан метанол (100 0 -Ї 98 2 -Ї 95 5) при очистці хроматографією 5(ДМСОсі6) 1,60 (s,3H), 2,28 (s,3H) 2,64 (m,3H), 3,00 (m,1H), 3,62 (m,2H), 4,10 (m,2H) 5,21 (m,2H), 5,70 (m,1H), 6,03 (brs,1H), 7,20-7,44 (m,8H) LRMS (APCI) 441 ( М + Н Г Приклад 16 N -гід роке и -2- [3- (4фенілфенокси)азетидин-1-ілсульфоніл1ацетамід Отримали як безбарвну тверду речовину (66%) з титульної сполуки з синтезу 32, використовуючи спосіб з прикладу 1, 5(flMCO d 6 ) 4,03 (S,2H), 4,05 (dd,2H), 5,09 (m,1H), 6,94 (d,2H) 7,30 (m,1H), 7,40 (m,2H), 7,60 (m,4H), 9,25 (s,1H), 10,80(brs,1H) LRMS (терморозпилення) 364 (M+H) + Приклад 17 М-гідрокси-2-(4-Г4-(3етоксифеніл)-3-метилфеніл1-1 2,3,6тетрапдропіридин-1-ілсульфоніл)ацетамід Карбонат калію (406мг, Зммоль) додали при перемішуванні до суміші титульної сполуки з синтезу 41 (429мг, Іммоль), пдрохлориду пдроксиламшу (212мг, Зммоль) та метанолу (20мл) Реакційну суміш гріли під зворотним холодильником приблизно 6 годин, давали охолонути та розподіляли між етилацетатом та 1М пдрохлоридною кислотою Відділену органічну фазу сушили сульфатом магнію та випарювали під зниженим тиском, далі залишок перетирали з дмзопропіловим етером та кристалізували з етилацетату, одержавши титульну сполуку (148мг, 34%) як безбарвну тверду речовину, т пл 151-153°С знайдено С 61,01, Н 6,04, N, 6,48, розраховано для C22H26N2O5S C, 61,38, Н, 6,09, N, 6 , 5 1 % 5(ДМСО Й 6 ) 1,33 (t,3H) 2,23 (s,3H) 2,60 (m,2H), 3,46 (t,2H), 3,91 (s,2H), 3,96 (m,2H), 4,03 (q,2H), 6,10 (brs,1H) 6,80-6,95 (m,3H) 7,17 (d,1H), 7,28-7,38 (m,3H) 9,20 (brs 1 H), 10,8 (brs, 1 H) LRMS (APCI) 431 (M+H) + Приклад 18 М-пдрокси-2-[4-(3-метокси-4фенілфеніл)-1,2,3,6-тетрапдропіридин-1ілсульфоніліацетамід Карбонат калію (95мг 0,7ммоль) додали при перемішуванні до суміші титульної сполуки з синтезу 45 (170мг, 0,4ммоль), пдрохлориду пдроксиламіну (49мг 0,7ммоль) та метанолу (Змл) Реакційну суміш гріли під зворот 25 52791 ним холодильником приблизно 2 години, давали охолонути, розбавляли фосфатним буфером (15мл) та екстрагували етилацетатом (2 х 15мл) Поєднані органічні фази сушили сульфатом магнію та випарювали під зниженим тиском, далі залишок перетирали з етилацетатом, одержавши титульну сполуку (50мг 30%) як безбарвну тверду речовину, т пл 175-177°С знайдено С 58,84, Н 5,51, N 6,70, розраховано для C20H20N2O5SСН 2 СІ 2 С 58,75, Н 5,45, N 6,82% 5(ДМСО Й 6 ) 2,63 ( т , 2 Н ) 3,50 (t,2H) 3,80 (s,3H) 3,93 (s,2H) 3,99 (s,2H) 6,27 (s,1H) 7,10 (d,1H) 7,16 (s,1H), 7,27 (d,1H) 7,31 (d,1H) 7,41 (t ( 2H), 7,47 (d,2H) 9,23 (brs,1H) 10,80 (brs,1H) LRMS (терморозпилення) + 420 (M+H) Приклад 19 М-пдрокси-2-[4-(3-метокси-4фенілфеніл)-1,2,3,6-тетрапдропіридин-1ілсульфонілі-2-метилпропанамід Гексафлуорфосфат О-(7-азабензотріазол-1 -іл)-1, 1, З, 3тетраметилуронію (274мг 0,72ммоль) додали при перемішуванні до розчину титульної сполуки з синтезу 50 (200мг, 0,48ммоль) та Nетилдмзопропіламіну (0,08мл 0,48ммоль) у безводному диметилформаміді (4мл), під азотом, при кімнатній температурі Через 15 хвилин додавали пдрохлорид пдроксиламшу (ЮОмг, 1,44ммоль) та N-етилдмзопропіламін (0,33мл, 1,9ммоль) та реакційну суміш перемішували приблизно 3 годин, далі розподіляли між етилацетатом та водним фосфатним буфером (рН 7) Органічну фазу ВІДДІЛЯЛИ, промивали водою, сушили сульфатом магнію та випарювали під зниженим тиском, далі залишок перетирали з дизопропіловим етером, одержавши титульну сполуку (71 мг, 36%) як безбарвну аморфну тверду речовину, т пл 156-158°С знайдено С 60,80, Н, 6,17, N, 6,25, розраховано для C22H26N2O5S-0,10 Н 2 О С, 61,12, Н, 6,11, N 6,48% 5(flMCO d 6 ) 1,51 (s,6H), 2,57 (m,2H) 3,43 (t,2H), 3,80 (s,3H), 4,03 (m,2H), 6,25 (brs,1H), 7,09 (d,1H), 7,13 (s,1H), 7,26 (d,1H), 7,31 (d,1H), 7,39 (t,2H), 7,46 (d,2H), 9,24 (brs,1H), 10,79 (brs,1H) LRMS (APCI) 431 (M+H) + Приклад 20 №пдрокси-2-Г4-(3-флуор-4фенілфеніл)-1,2,3,6-тетрапдропіридин-1ілсульфоніліацетамід Отримали як безбарвну тверду речовину (40%), т пл 184-188°С з титульної сполуки з синтезу 47, використовуючи спосіб з прикладу 1, знайдено С 58,39, Н 4,90, N,6,84, розраховано для C19H19FDN2O4S С,58,45, Н,4,91, N,7,17% 5(ДМСО Й 6 ) 2,61 ( т , 2 Н ) 3,47 (t,2H) 3,94 (s,2H), 4,00 (s,2H), 6,35 (brs,1H) 7,33-7,60 (м,8Н), 9,23 (brs,1H), 10,80 (brs,1H) LRMS (терморозпилення) 4 0 8 ( M + N H 4 ) + Приклад 21 N-riflpoKcn-2-{4-r4-(3етоксифеніл)фенілЦ,,2,3,6-тетрапдропіридин-1ілсульфоніл}ацетамід Отримали як безбарвну тверду речовину (76%), т пл 168-170°С, з титульної сполуки з синтезу 56, використовуючи спосіб з прикладу 1, 5(ДМСО Й 6 ) 1,34 (t,3H), 2,61 (m,2H), 3,49 (t,2H), 3,94 (s,2H) 3,98 (s,2H) 4,10 (q,2H), 6,25 (brs,1H), 6,91 (d,1H), 7,17 (s,1H), 7,22 (d,1H), 7,33 (t,1H), 7,52 (d,2H), 7,66 (d,2H), 9,22 (brs,1H), 10,80 (brs,1H) LRMS (терморозпилення) 434 (M+NH4) + Приклад 22 N-riflpoKcn-2-(4-r4-(3метоксифеніл)-3-метилфеніл!-1,2,3,6тетрапдропіридин-1-ілсульфоніл)ацетамід Отри 26 мали як безбарвну тверду речовину (76%), т пл 162-165°С, з титульної сполуки з синтезу 6 1 , використовуючи спосіб з прикладу 1, знайдено С 60,26, Н, 5,86, N, 6,43, розраховано для C21H24N2O5S С, 60,56, Н, 5,81, N 6,73% 5(ДМСО Й 6 ) 2,23 (s,3H), 2,60 (т,2Н), 3,47 (t,2H), 3,77 (s,3H), 3,93 (s,2H), 3,97 (s,2H), 6,20 (brs,1H), 6,83-6,94 (m,3H), 7,18 (d,1H), 7,27-7,39 (m, 3H), 9,22(brs,1H) 10,80 (brs,1H) LRMS(APCI) 416 (M)* Приклад 23 №пдрокси-2-І4-Г4-(3-етилфеніл)-3метилфенілЦ,2,3,6-тетрапдропіридин-1ілсульфоніл)ацетамід Отримали як безбарвну тверду речовину (58%), т пл 151-154°С з титульної сполуки з синтезу 63, використовуючи спосіб з прикладу 1, знайдено С 62,75, Н, 6,24, N, 6,26, розраховано для C22H26N2O4S • 0,50Н 2 О С, 62,39, Н, 6,43, N, 6 , 6 1 % 5(ДМСО Й 6 ) 1,20 (t,3H) 2,24 (s,3H), 2,61 (m,4H), 3,47 (t,2H), 3,92 (s,2H), 3,97 (s,2H), 6,20 (brs,1H) 7,10-7,23 (m,4H), 7,27-7,38 (m,3H), 9,22 (brs,1H), 10,81 (brs,1H) LRMS(APCI) 414 (M) + Приклад 24 №пдрокси-4-{4-Г4-(3метоксиФеніл)-3-метилфенілЦ,2,3,6тетрапдропіридин-1-ілсульфоніл}тетрапдропіран4-карбоксамід Отримали як блідожовту тверду речовину (47%), т пл 160-170°С з титульної сполуки з синтезу 65, використовуючи спосіб з прикладу 19, 5(ДМСО Й 6 ) 1,93 ( т , 2 Н ) , 2,23 (s,3H), 2,39 ( т , 2 Н ) , 2,43 (т,2Н), 3,20 (t,2H), 3,49 (т,2Н), 3,77 (s,3H) 3,86 ( т , 2 Н ) , 4,00 (т,2Н), 6,16 (brs,1H), 6,836,94 (т,ЗН), 7,17 (d,1H), 7,36 (т,ЗН), 9,21 (brs,1H), 11,00 (brs,1 Н) LRMS (APCI) 487 (М+Н) + Приклад 25 №пдрокси-4-(4-Г4-(3метоксифеніл)-3-метилфеніл!піперидин-1ілсульфоніл)тетрапдропіран-4-карбоксамід Отримали як білу тверду речовину (82%), т пл 200202°С, з титульної сполуки з синтезу 67, використовуючи спосіб з прикладу 19, за винятком того, що залишок кристалізували з метанолу Знайдено С, 60,02, Н, 6,78, N, 5,45, розраховано для C25H32N2O6S • СНзОН С, 59,98, Н 6,97, N, 5,38% 5(ДМСО Й 6 ) 1,60 ( т , 2 Н ) , 1,78 ( т , 2 Н ) , 1,90 (т,2Н), 2,20 (s,3H), 2,38 ( т , 2 Н ) , 2,64 (т,1Н) 3,04 (t,2H), 3,20 (t,2H), 3,70 ( т , 2 Н ) , 3,77 (s,3H), 3,86 ( т , 2 Н ) , 6,87 (т,ЗН), 7,13 (т,ЗН) 7,33 (t,1H), 9,16 (brs,1H) 10,97 (brs,1H) LRMS (APCI) 489 (M+H) + Приклад 26 №пдрокси-2-(4-ГЗ-метокси-4-(3метоксифенілфеніл1піперидин-1-ілсульфоніл)-2метилпропанамід Отримали як білу тверду речовину (47%), т пл 161-163°С, з титульної сполуки з синтезу 74, використовуючи спосіб з прикладу 19, за винятком того, що залишок очищали флешхроматографіею використовуючи дихлорметан метанол концентрований водний розчин аміаку (90 10 1) як елюент, знайдено С 59,39, Н, 6,58, N, 6,13, розраховано для C22H30N2O6S С, 59,72, Н,6,54, N, 6,06% 5(ДМСО Й 6 ) 1,49 (s,6H), 1,64 (m,2H), 1,81 (m,2H), 2,70 (m,1H), 3,06 (t,2H), 3,75 (s,8H), 6,87 (m,2H) 6,98 (m,3H) 7,20 (d,1H), 7,27 (t,1H), 8,99 (brs,1H), 10,75 (brs,1H) LRMS (терморозпилення) 480 (M+NH 4 ) + Приклад 27 №пдрокси-2-{4-Г4-(3етоксифеніл)-3-метоксифеніл1піперидин-1ілсульФоніл}-2-метилпропанамщ Отримали як білу тверду речовину (39%), т пл 134-136°С, з титульної сполуки з синтезу 77, використовуючи 27 спосіб з прикладу 26, знайдено С 60,60, Н, 6,80, N, 5,82, розраховано для C24H32N2O6S С, 60,48, Н, 6,77, N, 5,88% 5(ДМСО Й 6 ) 1,32 (t,3H), 1,49 (s,6H), 1,66 (m,2H), 1,81 (m,2H), 2,70 (m,1H) 3,07 (t,2H), 3,76 (s,5H), 4,02 (q,2H), 6,85 (m,2H), 6,98 (m,3H), 7,20 (d,1H), 7,27 (t,1H) 9,00 (brs,1H), 10,76 (brs,1H) LRMS (терморозпилення) 494 (M+NH 4 ) + 1 Приклад 28 №пдрокси-4-{4-Г4-(3етоксифеніл)-3-метилфеніл!-1,2,3,6тетрапдропіридин-1-ілсульфоніл}гетрапдропіран4-карбоксамід Отримали як безбарвну тверду речовину (87%), т пл 152-154°С, з титульної сполуки з синтезу 79, використовуючи спосіб з прикладу 19, знайдено С,61,99, Н, 6,47, N, 5,54, C26H32N2O6S С, 62,38, Н, 6,44, N, 5,60% 5(ДМСО Й 6 ) 1,33 (t,3H), 1,93 (m,2H), 2,24 (s,3H), 2,40 (d,2H), 2,52 (m,2H), 3,21 (dd,2H) 3,50 (m,2H), 3,88 (m,2H), 3,98-4,10 (m,4H), 6,18 (brs,1H), 6,806,95 (m,3H), 7,18 (d,1H), 7,26-7,37 (m,3H), 9,22 (brs,1H), 11,05 (brs,1H) LRMS(APCI) 501 (M+H) + Приклад 29 №пдрокси-4-{4-Г4-(3-етоксиФеніл)З-метилфеніліпіперидин-1 ілсульфоніл}тетрапдропіран-4-карбоксамід Паладій на сульфаті барію (5%, 5мг) додали при перемішуванні до розчину титульної сполуки з прикладу 28 (50мг, 0,1ммоль) у суміші 1,2-диметоксіетану (1мл) та метанолу (Змл), далі реакційну суміш гідрували при 345кПа приблизно 20 годин Наступну порцію паладію на сульфаті барію (5%, 5мг) додали та гідрування продовжували ще 20 годин Каталізатор видаляли фільтруванням, розчинник випарювали під зниженим тиском та залишок кристалізували з ефіру-гексану, одержавши титульну сполуку (34мг, 66%) як безбарвну тверду речовину, т пл 165-167°С знайдено С,60,81, Н, 6,76, N, 5,35, розраховано для C26H34N2O6S • 0,50 Н 2 О С, 61,03, Н, 6,89, N, 5,47% 5(ДМСО Й 6 ) 1,35 (t,3H), 1,60 (m,2H), 1,78 (m,2H), 1,92 (m,2H), 2,20 (s,3H), 2,40 (d,2H), 2,62 (m,1H), 3,03 (dd,2H), 3,20 (dd,2H), 3,73 (m,2H), 3,86 (m,2H), 4,04 (q,2H), 6,806,92 (m,3H), 7,07-7,17 (m,3H), 7,30 (t,1H), 9,18 (brs,1H) 11,0 (brs,1H) LRMS (терморозпилення) (M+NH 4 ) + Приклад 30 М-пдрокси-2-{4-Г4-(3етоксифеніл)-3-метилфеніл!-1,2,3,6тетрапдропіридин-1-ілсульфоніл}-2метилпропанамід Отримали як безбарвну тверду речовину (33%), т пл 116-118°С, з титульної сполуки з синтезу 8 1 , використовуючи спосіб з прикладу 19, знайдено С,62,52, Н, 6,47, N, 6,00, розраховано для C24H30N2O5S С, 62,86, Н, 6,59, N, 6,11% 5(ДМСО Й 6 ) 1,34 (t,3H), 1,52 (s,6H), 2,23 (s,3H), 2,53 (m,2H) 3,50 (m,2H), 4,00-4,10 (m,4H) 6,18 (brs,1H), 6,80-6,95 (m,3H) 7,18 (d,1H), 7,287,38 (m,3H), 9,03 (brs,1H),10,8(brs,1H) LRMS (терморозпилення) 459 (M+H) + Приклад 31 М-пдрокси-2-{4-Г4-(3етоксифеніл)-3-метилфеніл!піперидин-1ілсульфоніл}ацетамід Отримали як безбарвну тверду речовину (48%), т пл 179-180°С (кристалізували з дмзопропілового етеру), з титульної сполуки з синтезу 82, використовуючи спосіб з прикладу 17, знайдено С 60,72, Н 6,49, N,6,36, розраховано для C22H28N2O5S С 61,09, Н,6,53, N,6,48% 5(ДМСО Й 6 ) 1,31 (t,3H), 1,68 (m,2H), 1,86 (m,2H), 2,20 (s,3H), 2,65 (m,1H), 3,00 (m,2H), 3,72 52791 28 (m,2H), 3,86 (s,2H), 4,03 (q,2H), 6,80-6,90 (m,3H), 7,10 (s,2H), 7,17 (s,1H), 7,30 (t,1H), 9,20 (brs,1H), 10,8(brs,1H) LRMS(APCI) 433 (M+H) + Приклад 32 №пдрокси-2-{4-Г4-(3-етоксиФеніл)3-метилфеніл1піперидин-1-ілсульфоніл}-2метилпропанамід Отримали як безбарвну тверду речовину (53%), т пл 172-174°С (кристалізували з дмзопропілового етеру), з титульної сполуки з синтезу 84, використовуючи спосіб з прикладу 19, знайдено С 62,20, Н 6,99, N,6,02, розраховано для C24H32N2O5S С 62,58, Н 7,00, N 6,08%, 5(ДМСО Й 6 ) 1,31 (t,3H), 1,50 (s,6H), 1,61 (m,2H), 1,79 (m,2H), 2,20 (s,3H), 2,65 (m,1H), 3,05 (m,2H), 3,75 (m,2H) 4,03 (q,2H), 6,80-6,90 (m,3H), 7,08-7,18 (m,3H), 7,30 (dd,1H), 8,98 (brs,1H), 10,75 (brs,1H) LRMS (APCI) 461 (M+H) + Приклад 33 №пдрокси-2-{4-ГЗ-метил-4(піридин-2-іл)феніл1-1,2,3,6-тетрапдропіридин-1ілсульфоніл}ацетамід Отримали як безбарвну аморфну тверду речовину (50%) з титульної сполуки з синтезу 85, використовуючи спосіб з прикладу 17, 5(ДМСО Й 6 ) 2,33 (s,3H), 2,60 (т,2Н), 3,46 (t,2H), 3,91 (s,2H), 3,97 (т,2Н), 6,12 (brs,1H), 7,307,40 (т,4Н), 7,50 (d,1H), 7,84 (dd,1H), 8,63 (d,1H) 9,20 (brs,1H), 10,8 (brs,1H) LRMS (APCI) 388 + Приклад 34 №пдрокси-2-{4-ГЗ-метил-4(піридин-3-іл)феніл1-1,2,3,6-тетрапдропіридин-1ілсульфоніл}ацетамід Отримали як безбарвну тверду речовину (57%), т пл 132-136°С, з титульної сполуки з синтезу 86, використовуючи спосіб з прикладу 3 1 , 5(ДМСО Й 6 ) 2,23 (s,3H), 2,60 (m,2H) 3.46 (t,2H), 3,91 (s,2H), 3,97 (m,2H), 6,12 (brs,1H) 7.21 (d,1H), 7,35 (d,1H), 7,40 (s,1H) 7,45 (dd,1H), 7.78 (d,1H), 8,55 (m,2H), 9,20(brs,1H), 10,8 (brs,1H) LRMS (APCI) 388 (M+H) + Приклад 35 №пдрокси-2-{4-[3-метил-4(піридин-4іл)феніл1-1,2,3,6-тетрапдропіридин-1ілсульфоніл}ацетамід Отримали як безбарвну тверду речовину (20%), т пл 165-167° С, з титульної сполуки з синтезу 87, використовуючи спосіб з прикладу 3 1 , 5(ДМСО Й 6 ) 2,26 (s,3H), 2,60 (m,2H) 3.47 (t,2H), 3,92 (s,2H), 3,97 (m,2H), 6,12 (brs,1H), 7.22 (d,1H) 7,35-7,42 (m,4H), 8,62 (d,2H), 9,20 (brs,1H), 10,8(brs,1H) LRMS (APCI) 388 (M+H) + Приклад 36 N-riflpoKcn-2-{4-r4-(6етоксипіридин-2-іл)-3-метилФеніл!піперидин-1ілсульфоніл}-2-метилпропанамід Отримали як безбарвну тверду речовину (30%), т пл 184-187° С, з титульної сполуки з синтезу 9 1 , використовуючи спосіб з прикладу 19, за винятком того, що залишок очищали флеш-хроматографією використовуючи дихлорметан етанол (98 2) як елюент 5(ДМСО Й 6 ) 1,30 (t,3H), 1,48 (8,6Н), 1,63 (т,2Н), 1.79 (т,2Н), 2,35 (s,3H), 2,67 (т,1Н) 3,05 (t,2H), 3,75 (d,2H), 4,30 (q,2H), 6,72 (d,1H), 7,05 (d,1H), 7,15 (m,2H), 7,34 (q,1H), 7,73 (t,1H), 9,00 (brs,1H), 10,75(brs,1H) HRMS (елекгророзпилення ПОЗИТИВНИХ ІОНІВ) 462,206 (M+H) + Приклад 37 №пдрокси-4-Г4-(4-Фенілфеніл)1,2,3 6-тетрапдропіридин-1ілсульфонілітетрапдропіран-4-карбоксамід Отримали як безбарвну тверду речовину (68%), т пл 191-193°С, з титульної сполуки з синтезу 93, використовуючи спосіб з прикладу 19, але з кристалізацією залишку з метанолу 5(ДМСОсіє) 1,93 52791 30 29 (m,2H), 2,40 (d,2H), 2,55 (m,2H), 3,20 (t,2H), 3,48 тетрапдропіридин-1-ілсульфоніл}ацетамід Отри(m,2H), 3,85 (m,2H) 4,00 (m,2H), 6,11 (brs,1H) 7,35 мали як безбарвну тверду речовину (64%), т пл (t,1H), 7,44 (m,2H), 7,52 (d,2H), 7,65 (m,4H), 9,22 158-160°С (кристалізували з етилацетату), з титу(brs,1H),11 05(brs,1H) LRMS(APCI) 443 (M+H)+ льної сполуки з синтезу 107, використовуючи споПриклад 38 М-пдрокси-4-{4-Г4-(4етоксифеніл)-3-метилфеніл!-1,2,3,6тетрапдропіридин-1-ілсульфоніл-}тетрапдропіран4-карбоксамід Отримали як безбарвну тверду речовину (36%) т пл 159-161 °С, з титульної сполуки з синтезу 95, використовуючи спосіб з прикладу 19, але з кристалізацією залишку з дихлорметану-дмзопропілового етеру 5(ДМСОсіє) 1,35 (t,3H), 1,94 (m,2H), 2,22 (s,3H) 2,38 (d,2H) 2,50 (brs,2H), 3,20 (t,2H) 3,50 (brs,2H), 3,87 (dd,2H) 3,98 (brs,2H), 4,04 (q,2H), 6,15 (brs,1H), 6,96 (d,2H) 7,13 (d,1H), 7,22 (d,2H), 7,28 (d,1H) 7,33 (s,1H), 9,20 (brs,1H), 11,05 (brs,1H) LRMS (терморозпилення) 515(M+NH4)+ Приклад 39 М-пдрокси-2-{4-Г4-(3пдроксиметилфеніл)-3-метилфеніл1-1,2,3,6тетрапдропіридин-1-ілсульфоніл}ацетамід Отримали як безбарвну тверду речовину (63%), т пл 174-176°С (кристалізували з метанолудмзопропілового етеру), з титульної сполуки з синтезу 97, використовуючи спосіб з прикладу 17, знайдено С 60,35, Н 5,75, N,6,70, розраховано для C21H24N2O5S С 60,56, Н 5,81, N,6,73% 5(ДМСО Й 6 ) 2,22 (s,3H), 2,60 (т,2Н), 3,47 (t,2H), 3,93 (S,2H), 3,97 (s,2H), 4,53 (d,2H) 5,19 (t,1H обмінюваний), 6,20(brs,1H) 7,15-7,42 (м,7Н), 9,20 (brs,1H) 10,80 (brs,1H) LRMS(APCI) 4 1 7 ( M + H ) + Приклад 40 №пдрокси-2-метил-2-{4-ГЗ-метил4-(хінолін-3-іл)феніл1-1,2,3 6-тетрапдропіридин-1ілсульфоніл}пропан амід Отримали як безбарвну тверду речовину (51%), т пл 158-160°С, з титульної сполуки з синтезу 100, використовуючи спосіб з прикладу 19, 5(flMCO d 6 ) (s,6H) 2,32 (s,3H), 2,57 (m,2H), 3,53 (m,2H), 4,03 (m,2H) 6,23 (brs,1H), 7,34-7,48 (m,3H), 7,63 (t,1H) 7,79 (t,1H) 8,04 (t,2H), 8,37 (s,1H), 8,91 (s,1H) 9,04 (brs,1H) 10,8 (brs,1H) LRMS (APCI) 466 (M+H) + Приклад 41 №пдрокси-2-{4-ГЗ-метил-4-(3метилтюфенілфенілі-1,2,3,6-тетрапдропіридин-1 ілсульфоніл}ацетамід Отримали як безбарвну тверду речовину (17%), з титульної сполуки з синтезу 102, використовуючи спосіб з прикладу 1, 5(ДМСО Й 6 ) 2,23 (s,3H), 2,49 (s,3H), 2,60 (m,2H), 3,47 (t,2H), 3,91 (s,2H) 3,97 (s,2H), 6,22 (brs,1H), 7,08 (d,1H), 7,17 (m,2H) 7,24 (d,1H), 7,34 (m, 3H), 9,22 (brs,1H), 10,80 (brs,1H) LRMS(APCI) 432 (M) + Приклад 42 №пдрокси-2-{4-Г4-(3метоксиметилфеніл)-3-метилфеніл!-1,2 3 6тетрапдропіридин-1-ілсульфоніл}ацетамід Отримали як безбарвну тверду речовину (28%), т пл 151-153°С (кристалізували з етилацетатудмзопропілового етеру), з титульної сполуки з синтезу 104, використовуючи спосіб з прикладу 17, знайдено С 60,16, Н 6,00, N 6,28, розраховано для C22H26N2O5S • 0 10 Н 2 О С 60,11, Н6.19, N,6,37%, 5(flMCO d 6 ) 2,22 (s,3H), 2,60 (m,2H), 3,30 (s,3H) 3,47 (t,2H), 3,93 (s,2H), 3,97 (s,2H), 4,04 (s,2H) 6,20 (brs,1H), 7,17 (d,1H), 7,21-7,42 (m,6H), 9,20 (brs,1H), 10,80 (brs,1H) LRMS (терморозпилення) 432 (M+H) + Приклад 43 N-riflpoKcn-2-f4-r4-(3-r2метоксіетокси1феніл)-3-метилфенілЦ,2,3,6 сіб з прикладу 17, знайдено С 59,78, Н,6,10, N 6 , 0 1 , розраховано для C23H28N2O6S C 59,98, Н6.13, N,6,08% 5(flMCO d 6 ) 2,24 (s,3H), 2,60 (m,2H), 3,30 (s,3H), 3,47 (t,2H), 3,66 (m,2H), 3,92 (s,2H) 3,97 (m,2H), 4,12 (t,2H), 6,20 (brs,1H), 6,89 (m,3H), 7,18 (d,1H), 7,34 (m,3H), 9,20 (brs,1H), 10,80 (brs,1H) LRMS (терморозпилення) 460 (M) + Приклад 44 №пдрокси-2-{4-Г4-(2,3дипдробензофуран-5-іл)-3-метилфеніл1-1,2,3,6тетрапдропіридин-1-ілсульфоніл}ацетамід Отримали як безбарвну тверду речовину (56%), т пл 158-162°С, з титульної сполуки з синтезу 112, використовуючи спосіб з прикладу 17, знайдено С 57,01, Н 5,47, N5,26, розраховано для C22H26N2O5S • 0,60 СН 2 СІ 2 С 56,61, Н5.30, N,5,84% 5(flMCO d 6 ) 2,23 (s,3H), 2,58 (m,2H), 3,20 (t,2H) 3,44 (t,2H), 3,92 (s,2H) 3,96 (s,2H) 4,55 (t,2H), 6,20 (brs,1H), 6,78 (d,1H), 7,01 (d,1H), 7,12 (d,1H), 7,17 (s,1H), 7,27 (d,1H), 7,33 (s,1H), 9,20 + (brs,1H), 10,80 (brs,1H) LRMS (APCI) 428 (M+H) Приклад 45 №пдрокси-2-(4-ГЗ-метил-4-(3трифлуорметилфеніл)феніл!-1 2,3,6тетрапдропіридин-1 -ілсульфоніл}ацетамід Отримали як безбарвну тверду речовину (50%), т пл 168-170°С (кристалізували з дмзопропілового етеру), з титульної сполуки з синтезу 116, використовуючи спосіб з прикладу 17, за винятком того, що використовували тетрапдрофуран як співрозчинник для реакції Знайдено С 54,96, Н 4,73, N,5,97, розраховано для C21H21F3N2O4S • 0,25 Н 2 О С 54,96, Н4.72, N,6,10% 5(flMCO d 6 ) 2,24 (s,3H), 2,60 (m,2H), 3,47 (t,2H), 3,93 (s,2H) 3,97 (m,2H) 29 6,22 (brs,1H), 7,23 (d,1H), 7,36 (d,1H), 7,41 (s,1H) 7,68 (m,4H) 9,20 (brs,1H), 10,80 (brs,1H) LRMS (APCI) 455 (M+H) + Приклад 46 N-гідро КС и-2-[4-(4феноксифенілпіперидин)-1-ілсульфоніл1ацетамщ Отримали як безбарвну тверду речовину (13%), т пл 176-179°С, з титульної сполуки з синтезу 119, використовуючи спосіб з прикладу 17, за винятком того, що дихлорметан використовували як співрозчинник для реакції Знайдено С,57,92, Н 5,62, N,6,97, розраховано для Ci 9 H22N 2 O s S • 0,20 Н 2 О С 57,91, Н5.73, N,7,11% 5(flMCO d 6 ) 1,63 (m,2H), 1.84 (m,2H), 2,63 (m,1H), 2,98 (t,2H) 3,69 (m,2H), 3.85 (8,2H), 6,96 (m,4H), 7,10 (t,1H), 7,27 (d,2H), 7,36 (t,2H), 9,20 (brs,1H), 10,80(brs,1H) LRMS (терморо-зпилення) 392 (M+H) + Приклад 47 №пдрокси-2-(4-Г4-(3-Г2ілсульфоніл}-2-метилпропанамід Отримали як безбарвну тверду речовину (42%), т пл, 155-156°С, з титульної сполуки з синтезу 122, використовуючи спосіб з прикладу 19, за винятком того, що залишок очищали флеш-хроматографією, використовуючи дихлорметан,метанол (97 3) як елюент, до кристалізації з дихлорметану-дмзопропілового етеру 5(flMCO d 6 ) 1,50(s,6H), 1,60(m,2H), 1,80 (m,2H) 2,20 (s,3H), 2,65 (m,1H) 3,05 (t,2H), 3,30 (s,3H) 3,62 (t,2H), 3,74 (d,2H), 4,10 (t,2H) 6,80-6,92 (m,3H), 7,10-7,17 (m,3H), 7,30 (t,1H), 9,02 (brs,1H) 31 10,7(brs,1H) LRMS (електророзпилення) + 513(M+Na) Приклад 48 N-riflpoKCM-4-MeTOKCM-2(R,SH4-(3метил-4-фенілФеніл)-1,2,3 6-тетрапдропіридин-1ілсульфонілібутанамід Отримали як безбарвну тверду речовину (39%), т пл 135-136°С, з титульної сполуки з синтезу 124, використовуючи спосіб з прикладу 19, за винятком того, що залишок очищали флеш-хроматографією використовуючи дихлорметан метанол (97 3) як елюент, до кристалізації з дмзопропілового етеру 5(ДМСОсіє) 2,10 (гл,2Н), 2,23 (s,3H), 2,57 (m,2H),3,20 (s,4H), 3,36 ( т , 1 Н ) , 3,48 (т,2Н), 3,87 (dd,1H), 3,98 (т,2Н) 6,20 (brs,1H), 7,16 (d,1H), 7,32 ( т , 5 Н ) , 7,43 (т,2Н), 9,22 (brs,1H), 10,95 (brs,1H) LRMS (терморозпилення) + 444 (М) Приклад 49 №пдрокси-4-Г4-(3-метил-4фенілфеніл)-1,2,3,6-тетрапдропіридин-1ілсульфонілітетрапдропіран-4-карбоксамід Отримали як безбарвну тверду речовину (91%), т пл 188-190°С, з титульної сполуки з синтезу 126, використовуючи спосіб з прикладу 38, знайдено С,61,89, Н6.15, N5,94, розраховано для C24H28N2O5S • 0,50 Н 2 О С 61,91, НД28, N,6,02% 5(flMCO d 6 ) 1,95 (m,2H) 2,22 (s,3H) 2,39 (d,2H), 2,50 (m,2H) 3,20 0 (t,2H), 3,48 (brs,2H), 3,87 (dd,2H) 4,00 (brs,2H), 6,17 (brs,1H), 7,16 (d,1H), 7,31 (m,5H), 7,42 (m,2H) 9,22 (brs,1H) 11,05 (brs,1H) LRMS(APCI) 4 5 7 ( M + H ) + Приклад 50 N-riflpoKcn-2-{4-r4-(3метоксифеніл)-3-метилфеніл!піперидин-1ілсульфоніл}індан-2-карбоксамщ Отримали як безбарвну тверду речовину (63%), т пл 199-202°С, з титульної сполуки з синтезу 130, використовуючи спосіб з прикладу 19, але з кристалізацією залишку з дмзопропі-лового етеру знайдено С,66,25, НД18, N 5,18, розраховано для C29H32N2O5S • 0,30 Н2О С 61,21, Н,6,25, N,5,33%, 5(ДМСО Й 6 ) 1,55 ( т , 2 Н ) , 1,76 (т,2Н), 2,20 (s,3H), 2,54 ( т , 1 Н ) , 2,89 (t,2H), 3,48 ( т , 2 Н ) , 3,77 (т,7Н), 6,87 (т,ЗН), 7,077,35 ( т , 8 Н ) , 9,10(brs,1H) 11,05 (brs,1H) Приклад 51 №пдрокси-1-{4-Г4-(3метоксиФеніл)-3-метилФеніл1піперидин-1ілсульфоніл}циклобутанкарбоксамід Отримали як безбарвну тверду речовину (52%), т пл 157-160°С, з титульної сполуки з синтезу 132, використовуючи спосіб з прикладу 50, знайдено С 62,79, Н 6,60, N 5,93, розраховано для C24H30N2O5S C 62,86, Н6.59, N,6,11% 5(flMCO d 6 ) 1,60 (m,2H), 1,78 (m,3H), 1,93 (m,1H), 2,20 (s,3H), 2,57 (m,5H), 2,97 (t,2H), 3,72 (m,2H), 3,77 (s,3H), 6,87 (m,3H), 7,11 (s,2H), 7,15 (s,1H), 7,36 (t,1H), 9,10 (brs,1H) 10,92 (brs,1H) LRMS (терморозпилення) 459 (M+H) + Приклад 52 №пдрокси-4-{4-Г4-(3метоксиФеніл)-3-метилФеніл!піперидин-1ілсульФоніл}-1 -метил піперидин-4-карбоксамщ Отримали як безбарвну тверду речовину (13%) з титульної сполуки з синтезу 134, використовуючи спосіб з прикладу 19, за винятком того, що залишок очищали флеш-хроматографією, використовуючи дихлорметан метанол концентрований водний розчин аміаку (90 10 1) як елюент 5(ДМСО Й 6 ) 1,79 ( т , 2 Н ) , 1,90 ( т , 2 Н ) , 2,16 (т,2Н), 2,27 (s,3H), 2,30 (s,3H), 2,33 ( т , 4 Н ) , 2,64 ( т , 1 Н ) , 2,91 (brd,2H), 3,10 (t,2H), 3,83 (s,3H) 3,91 ( т , 2 Н ) , 6,88 (т,ЗН), 7,08 (т,2Н) 7,18 (d,1H), 7,30 (t,1H) 52791 32 + LRMS (терморозпилення) 502 (М+Н) Приклад 53 N-riflpoKcn-3^eHin-2(R,SH4-(4ФенілФеніл)-1,2,3 6-тетрапдропіридин-1 ілсульфоніліпропан амід Отримали як безбарвну тверду речовину (31%), т пл 202-205°С, з титульної сполуки з синтезу 136, використовуючи спосіб з прикладу 19, за винятком того, що залишок перетирали з дихлорметаном знайдено С,66,05, Н 5,82, N 6,15, розраховано для C26H26N2O4S • 0,50 Н2О С 66,22, Н 5,77, N 5,94% 5(ДМСО Й 6 ) 2,60 ( т , 2 Н ) , 3,15 (т,2Н), 3,57 (т,2Н) 4,03 (т,ЗН), 6,07 (brs,1H), 7,16-7,36 ( т , 6 Н ) 7,45 (т,2Н), 7,57 (т,2Н), 7,65 (т,4Н) 9,17 (brs,1H), 10,70 (brs,1H) + LRMS(APCI) 463 (М+Н) Приклад 54 Пдрокси-2-[4-(4-Фенілфеніл)1,2,3,6-тетрапдропіридин-1-ілсульфоніл1індан-2карбоксамід Отримали як безбарвну тверду речовину (27%), т пл 159-161 °С, з титульної сполуки з синтезу 138, використовуючи спосіб з прикладу 19, за винятком того, що залишок очищали флешхроматографією, використовуючи дихлорметан метанол (98 2) як елюент, а потім перетиранням з дмзопропіловим етером 5(ДМСОсіє) 2,55 ( т , 2 Н ) , 3,41 ( т , 2 Н ) , 3,53 (d,2H) 3,77 (d,2H), 3,96 (т,2Н), 6,18 (brs,1H) 7,16 ( т , 2 Н ) П 7,23 (т,2Н), 7,34-7,53 ( т , 5 Н ) , 7,65 (т,4Н), 9,15 (brs,1H), 11,10 (brs,1H) LRMS (АРСІ) 463 (М+Н) + Приклад 55 №пдрокси-2-{4-[4-(3-хлор-4флуорфеніл)-3-метилфеніл!-1,2,3,6тетрапдропіридин-1-ілсульфоніл}ацетамід Отримали як безбарвну тверду речовину (60%), т пл 181-183°С (кристалізували з етеру), з титульної сполуки з синтезу 142, використовуючи спосіб з прикладу 17, за винятком того, що тетрапдрофуран використовували як співрозчинник для реакції, знайдено С 54,65, Н 4,61, N,6,13, розраховано для C20H20CIFN2O4S С 54,73, Н 4,59, N,6,38% 5(ДМСО Й 6 ) 2,24 (s,3H), 2,60 (т,2Н), 3,47 (t,2H), 3,90 (s,2H), 3,97 ( т , 2 Н ) 6,22 (brs,1H), 7,20 (d,1H), 7,30-7,40 (т,ЗН), 7,45 (t,1H), 7,56 ( т , 1 Н ) , 9,20 (brs,1H), 10,80 (brs,1H) LRMS (АРСІ) 439 (M+H) + Приклад 56 №пдрокси-2-{4-Г4-И ,3бензодюксол-5-іл)-3-метилфеніл1-1,2,3,6тетрапдропіридин-1-ілсульфоніл}ацетамід Отримали як безбарвну тверду речовину (69%), т пл 165-167°С, з титульної сполуки з синтезу 146, використовуючи спосіб з прикладу 45, знайдено С 58,60, Н5.10, N,6,01, розраховано для C21H22N2O6S С 58,59, Н 5,15, N 6 , 5 1 % 5(ДМСО Й 6 ) 2,22 (s,3H), 2,59 ( т , 2 Н ) , 3,46 (t,2H), 3,90 (s,2H), 3,96 ( т , 2 Н ) , 6,04 (s,2H), 6,20 (brs,1H), 6,76 (d,1H) 6,89 (s,1H), 6,95 (d,1H) 7,15 (d,1H), 7,28 (d,1H) 7,35 (s,1H), 9,20 (brs,1H), 10,80 (brs,1H) LRMS (APCI) 431 (M+H) + Приклад 57 №пдрокси-2-{4-Г4-(2-флуорфеніл)3-метилФеніл1-1,2,3,6-тетрапдропіридин-1ілсульфоніл}ацетамід Отримали як безбарвну тверду речовину (32%), т пл 160-163°С, з титульної сполуки з синтезу 150, використовуючи спосіб з прикладу 17, за винятком того, що тетрапдрофуран використовували як співрозчинник для реакції 5(ДМСО Й 6 ) 2,12 (s,3H), 2,60 (т,2Н), 3,48 (t,2H), 3,84 (s,2H), 3,98 ( т , 2 Н ) , 6,21 (brs,1H), 7,17 (d,1H), 7,23-7,35 ( т , 4 Н ) , 7,40 (s,1H), 7,42 (т,1Н) LRMS (АРСІ) 405 (М+Н) + 33 Приклад 58 N-riflpoKCM-2-f4-r4-f3 4диметоксифеніл)-3-метилФеніл!-1,2 3,6тетрапдропіридин-1 -ілсульфоніл}ацетамід Отримали як безбарвну тверду речовину (61%), т пл 172-174°С, з титульної сполуки з синтезу 151, використовуючи спосіб з прикладу 57, знайдено С 59,36, Н 6,08, N 5,87, 32 розраховано для C22H26N2O6S С 59,18, Н5.87, N,6,27% 5(flMCO d 6 ) 2,25 (s,3H) 2,60 (m,2H), 3,48 (t,2H), 3,75 (s,3H), 3,78 (s,3H), 3,90 (s,2H), 3,96 (m,2H), 6,19 (brs,1H) 6,82 (d,1H), 6,88 (s,1H), 7,00 (d,1H), 7,19 (d,1H) 7,29 (d,1H) 7,36 (s,1H) 9,20 (brs,1H) 10,80 (brs,1H) LRMS(APCI) 4 4 7 ( M + H ) + Приклад 59 №пдрокси-2-{4-[4-0ндан-5-іл)-3метилФеніл!-1,2,3,6-тетрапдропіридин-1ілсульфоніл}ацетамід Отримали як безбарвну тверду речовину (58%), т пл 149-152°С, з титульної сполуки з синтезу 152, використовуючи спосіб з прикладу 17, 5(ДМСО Й 6 ) 2,03 (т,2Н) 2,22 (s,3H), 2,59 (т,2Н) 2,90 (т,4Н), 3,47 (т,2Н), 3,90 (s,2H) 3,96 (т,2Н), 6,19 (brs,1H), 7,05 (d,1H), 7,15 (т,2Н), 7,23-7,30 (т,2Н), 7,36 (s,1H), 9,20 (brs,1H), 10,80 (brs,1H) LRMS(APCI) 4 2 7 ( M + H ) + Приклад 60 №пдрокси-2-{4-[3-метил-4-(3триФлуорметоксиФенілФенілі-1,2,3,6тетрапдропіридин-1-ілсульфоніл}ацетамід Отримали як безбарвну тверду речовину (13%), т пл 154°С (кристалізували з дихлорметанудмзопропілового етеру), з титульної сполуки з синтезу 153, використовуючи спосіб з прикладу 17, 5(ДМСО Й 6 ) 2,23 (s,3H), 2,59 (т,2Н), 3,47 (t,2H) 3,90 (s,2H), 3,96 (т,2Н), 6,22 (brs,1H), 7,20 (d,1H), 7,30-7,40 (м,5Н) 7,58 (t,1H) 9,20 (brs,1H), 10,80 (brs,1H) LRMS (терморозпилення) 488 (M+NH 4 ) + Приклад 61 М-пдрокси-2-Г4-(4-Феніл-3триФлуорметилфеніл)-1,2,3,6-тетрапдропіридин-1ілсульфоніліацетамід Отримали як безбарвну тверду речовину (43%), т пл 143-145°С, з титульної сполуки з синтезу 157, використовуючи спосіб з прикладу 17, знайдено С 54,63, Н 4,35, N5,90, розраховано для C20H19F3N2O4S С 54,54, Н 4,35, N 6,36% 5(ДМСО Й 6 ) 2,66 (т,2Н), 3,50 (т,2Н) 3,93 (s,2H), 4,00 (т,2Н), 6,38 (brs,1H), 7,30 (т,2Н) 7,357,47 (т,4Н), 7,79 (d,1H), 7,82 (s,1H), 9,20 (brs,1H) 10,80 (brs,1H) LRMS (терморозпилення) 458 (M+NH 4 ) + Приклад 62 М-пдрокси-2-{4-[4-(2,2-диметил1,3-бензодюксол-5-іл)-3-метилФеніл1-піперидин-1 ілсульфоніл}-2-метилпропюнамід Отримали як безбарвну тверду речовину (52%), т пл 184-186°С, з титульної сполуки з синтезу 161, використовуючи спосіб з прикладу 19, 5(flMCO d 6 ) 1,47 (s,6H), 1,60 (m,2H), 1,65 (s,6H), 1,78 (m,2H), 2,20 (s,3H), 2,65 (m,1H), 3,04 (m,2H), 3,73 (m,2H), 6,68 (d,1H), 6,77 (s,1H), 6,83 (d,1H), 7,07 (s,2H), 7,12 (s,1H), 9,00 (brs,1H), 10,75 (brs,1H) LRMS(APCI) 489 (M+H) + Приклад 63 М-пдрокси-2-Г4-Г4-П,2диметилбензімідазол-5-іл)-3метилФеніл1піперидин-1-ілсульфоніл}-2метилпропюнамщ Отримали як безбарвну тверду речовину (22%), т пл 213-215°С, з титульної сполуки з синтезу 165, використовуючи спосіб з прикладу 19, 5(ДМСО Й 6 ) 1,48 (s,6H), 33 1,62 (т,2Н), 1,80 (т,2Н), 2,20 (s,3H), 2,52 (s,3H), 2,67 (т,1Н), 3,08 (t,2H), 3,73 (s,3H) 3,75 (т,2Н), 7,08-7,15 (т,4Н) 7,39 (s,1H), 7,47 (d,1H), 9,00 (brs,1H), 11,75 52791 34 (brs,1H) LRMS (терморозпилення) 485 (M+H) + Приклад 64 М-пдрокси-2-{4-Г4-(3-щаноФеніл-3метилФеніл1піперидин-1-ілсульФоніл}-2метилпропюнамщ Паладій на сульфаті барію (5% Юмг) додали при перемішуванні до розчину титульної сполуки з синтезу 168 (70мг, 0,13ммоль) у метанолі (2 мл), далі реакційну суміш гідрували при 345кПа приблизно 20 годин Наступну порцію паладію на сульфаті барію (5%, Юмг) додавали та гідрування продовжували ще 4 доби Каталізатор видаляли фільтруванням, розчинник випарювали під зниженим тиском та залишок очищали флешхроматографією, використовуючи метанол дихлорметан (5 95) як елюент, одержавши титульну сполуку (13мг, 23%) як безбарвну аморфну тверду речовину 5(CDCI 3 ) 1,63 (s,6H), 1,63-1,95 (m,4H), 2,26 (s,3H), 2,67 (m,1H), 3,10 (m,2H), 3,96 (m,2H), 7,04-7,20 (m,3H), 7,50-7,70 (m,4H) ІЧ (KBr) 2240 см 1 для ціаногрупи М-гідрокси-2-(4-Г4-(5Приклад 65 етоксипіридин-3-іл)-3-метилфеніл!піперидин-1ілсульФоніл}-2-метилпропюнамід Отримали як безбарвну піну (62%), з титульної сполуки з синтезу 172, використовуючи спосіб з прикладу 19, за винятком того, що залишок очищали флешхроматографією, використовуючи дихлорметан етанол (95 5) як елюент 5(flMCO d 6 ) 1-32 (t,3H) 1,48 (s,6H), 1,61 (m,2H), 1,79 (m,2H) 2,21 (s,3H) 2,67 (m,1H), 3,05 (t,2H) 3,75 (d2H), 4,13 (q,2H), 7,15-7,20 (m,3H), 7,30 (s,1H) 8,10 (s,1H), 8,23 (s,1H), 8,98 (brs,1H), 10,75 (brs,1H) LRMS (терморозпилення) 462 (M+H) + Приклад 66 І\І-пдрокси-2-Г4-Г4-(3-Г2пдроксіетокси1Феніл)-3-метилФеніл1піперидин-1ілсульфоніл}-2-метилпропанамід Гексафлуорфосфат О-(7-азабензотріазол-1-іл)-1,1,3,3тетраметилуронію (510мг, 1,15ммоль) додали при перемішуванні до розчину титульної сполуки з синтезу 178 (530мг, 0,76ммоль) та Nетилдмзопропіламіну (0,20мл, 0,9ммоль) у безводному ди-метилформаміді (4мл), під азотом, при кімнатній температурі Через 15 хвилин додавали пдро-хлорид пдроксиламшу (188мг 2,2ммоль) та N-етилдмзопропіламін (0,6мл 2,7ммоль) і реакційну суміш перемішували приблизно 16 годин, далі розподіляли між етилацетатом та водним фосфатним буфером (рН 7) Органічну фазу ВІДДІЛЯЛИ, промивали водою, сушили сульфатом магнію та випарювали під зниженим тиском Залишок розчиняли у безводному тетрагідрофурані (15мл), додавали флуорид тетра-н-бутиламонію (1,4мл 1,0М розчин у тетрагідрофурані, 1,4ммоль) та утворений розчин перемішували при кімнатній температурі 1,5 години, далі розподіляли між етилацетатом та водним фосфатним буфером (рН 7) Органічну фазу ВІДДІЛЯЛИ, промивали водою, сушили сульфатом магнію та випарювали під зниженим тиском Очисткою залишку флешхроматографією, використовуючи дихлорметан метанол концентрований водний розчин аміаку (90 10 1) як елюент, а потім кристалізацією з метанолу-води одержали продукт як безбарвну тверду речовину (155мг 43%), т пл 147-150°С Знайдено С, 60,26, Н,6,81, N,5,76, розраховано для C24H32N2O6S С,60,48, Н,6,77, N,5,88% 5(ДМСО Й 6 ) 1,49 (s,6H) 1,63 (т,2Н) 1,80 (т,2Н) 35 52791 36 2,21 (s,3H), 2,67 (m,1H) 3,08 (t,2H) 3,74 (m,4H) води (приблизно 2 години), далі давали охолонути 4,02 (t,2H) 4,83 (t,1H) 6,82-6,92 (m,3H) 7,10 (s,2H) та розбавляли водою (200мл) Утворену суміш 7,16 (s,1H) 7,30 (t,1H) 9,00(brs,1H) 10,75 (brs,1H) підлужували концентрованим водним розчином аміаку та екстрагували дихлорметаном (4 х СИНТЕЗ 1 Трет-бугил 4-пдрокси-4-(4200мл), далі поєднані екстракти сушили сульфаФенілФеніл)піперидин-1 -ілкарбоксилат 2 5М розтом магнію та випарювали під зниженим тиском, чин н-бутиллітію у гексані (8мл 20ммоль) додаваодержавши титульну сполуку (10,6г) як білувату ли протягом приблизно 10 хвилин, до суміші додаречовину 5(CDCI3) 2,57 (m,2H) 2,70 (m,2H) 3,18 ли при перемішуванні 4-бромдифеніл (4,66г, (m,2H) 3,62 (s,2H) 6,10 (brs 1H) 7,20-7,60 20ммоль), безводний етер (ЮОмл) та безводний (M,14H) тет-рапдрофуран (Юмл), під азотом, при приблизно -75°С Через 1 годину додали розчин третСИНТЕЗ 5 4-(4-ФенілФеніл)піперидин При бутил 4-оксопіперидин-1-ілкарбоксилату (3,98г перемішуванні суміш титульної сполуки з синтезу 20ммоль) у безводному тетрапдрофурані (Юмл), 4 (5,07г 15,6ммоль), форміат амонію (4г підтримуючи температуру реакції нижче -60°С 62ммоль) гідроксид паладію на вуглеці (500мг) та Реакційну суміш перемішували при приблизно метанол (50мл) гріли під зворотним холодильни75°С 3 години та гасили водним розчином хлориду ком 4,5 годин, давали охолонути та фільтрували амонію, далі органічну фазу ВІДДІЛЯЛИ, промивали Фільтрат випарювали під зниженим тиском та заводою, сушили сульфатом магнію та випарювали лишок розподіляли між 2М водним розчином гідпід зниженим тиском Кристалізацією залишку з роксиду натрію та дихлорметан Органічну фазу дмзопропілового етеру одержали титульну сполуку ВІДДІЛЯЛИ та поєднували з дихлорметановими екс(4,29г) як безбарвну тверду речовину, т пл 144трактами (3 х ЮОмл) водної фази, далі поєднані 146°С 5(CDCI3) 1,50 (s,9H) 1,78 (d,2H) 2,06 дихлорметанові розчини сушили сульфатом маг(m,2H) 3,28 (dd,2H) 4,06 (m,2H) 7,35 (t,1H) 7,43 нію та випарювали під зниженим тиском, одержа+ (m,2H) 7,50-7,65 (м,6Н) LRMS(APCI) 354 (M+H) вши титульну сполуку (3,5г) як білувату речовину, тпл Ю4-Ю7°С 5(CDCI3) 1,50 (brs,1H) 1,63 СИНТЕЗ 2 4-(4-ФенілФенмт)-1,2 3,6(m,2H) 1,83 (m,2H) 2,62 (m,1H) 2,75 (m,2H) 3,19 тетрапдропіридин Трифлуороцтову кислоту (d,2H) 7,25 (m,3H), 7,40 (m,2H) 7,53 (m,4H) (20мл) додавали при перемішуванні до розчину титульної сполуки з синтезу 1 (4,2г 11,9ммоль) у дихлорметані (20мл) при кімнатній температурі Через 3 годин, реакційну суміш випарювали під зниженим тиском та залишок підлужували 1М водним розчином гідроксиду натрію Утворену суміш екстрагували дихлорметаном, далі поєднані екстракти промивали водою, сушили сульфатом магнію та випарювали під зниженим тиском, одержавши титульну сполуку (2,79г) як безбарвну тверду речовину 5(CDCI3) 1,53 (s,1H) 2,50 (m,2H) 3,14 (t,2H), 3,58 (m,2H) 6,20 (brs,1H) 7,34 (t,1H) 7,45 (m,4H) 7,60 (m,4H) LRMS (терморозпилення) 236 + 1-бензил-4-пдрокси-4-(4СИНТЕЗ фенілфеніл)піперидин 1 6M розчин н-бутиллітію у гексані (39мл, 63 ммоль) додавали при перемішуванні до розчину 4-бромдифенілу (11,7г 50ммоль) у безводному тетрапдрофурані (50мл), під азотом, при приблизно -50°С, підтримуючи температуру реакції нижче -40°С Через 1 годину, розчин 1бензил-4-оксопіперидину (10,4г 55ммоль) у безводному тетрапдрофурані (ЗОмл) додавали з такою швидкістю, щоб підтримувати температуру реакції нижче -40°С Охолоджувальну баню далі видаляли та, через 1 годину реакційну суміш розподіляли між дихлорметаном (400мл) та розсолом (200мл) Органічну фазу ВІДДІЛЯЛИ, промивали водою, сушили сульфатом магнію та випарювали під зниженим тиском, далі залишок кристалізували з етилацетату, одержавши титульну сполуку (13,9г) як безбарвну тверду речовину, 5(ДМСОсіє) 1,80 (d,2H) 2,52 (m,2H) 3,24 (rn,4H) 4,33 (d,2H) 7,28-7,75 (м,14Н) 11,30 (brs,1H) СИНТЕЗ 4 1-бензил-4-(4-ФенілФенмт)-1,2,3,6тетрапдропіридин Розчин титульної сполуки з синтезу 3 (13,8г, 40,2ммоль) та птолуолсульфонової кислоти (15,3г, 80,4ммоль) у толуолі (ЮОмл) гріли під зворотним холодильником в апараті Дина-Старка до повного видалення СИНТЕЗ б трет-бутил 4-пдрокси-4-(3-метил-4фенілфеніл)піперидин-1-карбоксил ат Отримали як безбарвну тверду речовину (60%), т п л 142144°С з 4-бром-2-метилдифенілу (J AmerChem Soc , 1926, 48, 1372) та трет-бутил 4-оксопіперидин-1-ілкарбоксилату, використовуючи спосіб з синтезу 1, 5(CDCI3) 1,48 (s,9H), 1,78 (m,2H) 2,04 (m,2H) 2,30 (s,3H) 3,28 (m,2H) 4,05 (m,2H) 7,20-7,42 (м,8Н) LRMS (терморозпилення) 468 (M+H)+ СИНТЕЗ 7 4-(3-Метил-4-ФенілФеніл)-1,2 3 6тетрапдропіридин Отримали як безбарвну тверду речовину (90%) з титульної сполуки з синтезу 6, використовуючи спосіб з синтезу 2, 5(CDCI3) 1,85 (S1H), 2,28 (s,3H) 2,50 (m,2H), 3,14 (t,2H), 3,57 (m,2H), 6,18 (brs, 1H), 7,20-7,42 (m,8H) LRMS(APCI) 250 (M+H)+ СИНТЕЗ 8 Метил 2-Г4-(4-ФенілФеніл)1,2,3,6тетрапдропіридин-1-ілсульФоніліацетат Розч и н метил хлорсульфонілацетату (0,35г, 2ммоль) у дихлорметані (2мл) краплями додали при перемішуванні до розчину титульної сполуки з синтезу 2 (470мг, 2ммоль) та 1,8-діазадицикло [5,4,0]ундец7-ену (0,3мл, 2ммоль) у дихлорметані (8мл) при приблизно 0°С, охолоджувальну баню видаляли та реакційну суміш перемішували при кімнатній температурі 4 години, далі розбавляли дихлорметаном Утворену суміш промивали 0,1 М пдрохлоридною кислотою, сушили сульфатом магнію та випарювали під зниженим тиском Залишок очищали флеш-хроматографіею, використовуючи дихлорметан як елюент, а потім кристалізацією з дмзопропілового етеру, одержавши титульну сполуку (250мг) як безбарвну тверду речовину, т пл, 182-183°С знайдено С 64,32, Н 5,59, N3,77, розраховано для C20H21NO4S С 64,66, Н 5,70, N,3,77% 5(CDCI3) 2,66 (m,2H), 3,62 (t,2H), 3,78 (s,3H), 3,99 (s,2H), 4,08 (m,2H), 6,08 (brs 1H) 7,32 (m,1H), 7,38-7,44 (m,4H), 7,53-7,60 (m,4H) LRMS 37 52791 (АРСІ) 372 (M+H) СИНТЕЗ 9 Метил 2-Г4-(3-метил-4фенілфеніл)-1 2,3,6-тетрапдротридин-1ілсульфоніліацетат Отримали як безбарвну тверду речовину (30%), т пл 104-105°С, з титульної сполуки з синтезу 7 та метил хлорсульфонілацетату, використовуючи спосіб з синтезу 8, знайдено С 65,18, Н 6,03, N,3,59, розраховано для C21H23NO4S 65,43, Н 6,01, N,3,63% 5(CDCI 3 ) 2,28 (s,3H), 2,68 (m,2H) 3,64 (t,2H), 3,81 (s,3H), 4,02 (s,2H), 4,10 (m,2H), 6,08 (brs,1H), 7,20-7,47 (m,8H) LRMS (терморозпи-лення) 386 (M+H) + СИНТЕЗ 10 Метил 2-Г4-ИФенілФенілпіперидин)-1-ілсульФоніл1ацетат Отримали як безбарвну тверду речовину (27%), т пл 169-170°С, з титульної сполуки з синтезу 5 та метил хлорсульфонілацетату, використовуючи спосіб з синтезу 8, знайдено С 63,99, Н 6,18, N,3,69, розраховано для C20H23NO4S С 64,32, Н 6,21, N3,75, 5(CDCI3) 1,83 (m(2H) 1,95 (m,2H) 2,68 (m,1H), 3,00 (t,2H) 3,80 (s,3H) 3,95 (s,2H) 3,97 (m,2H), 7,20-7,35 (m,3H), 7,40 (t,2H), 7,50-7,60 (m,4H) СИНТЕЗ 11 Метил 2-(4-феніл-1,2,3,6тетрапдропіридин-1-ілсульФоніл)ацетат Отримали як безбарвну тверду речовину (20%), т пл 9394°С, з 4-феніл-1,2,3,6-тетрапдропіридину та метил хлорсульфонілацетату, використовуючи спосіб з синтезу 8, знайдено С 56,86, Н 5,79, N 4,76, розраховано для C14H17NO4S С 56,93, Н 5,80, N 4,74% 5(CDCI3) 2,62 (m,2H), 3,60 (t,2H), 3,78 (s,3H), 3,99 (s,2H), 4,05 (m,2H), 6,00 (brs,1 H), 7,227,35 (M,5H) СИНТЕЗ 12 Метил 2-(4-фенілпіперидин-1 ілсульфоніл)ацетат Отримали як безбарвну тверду речовину (35%), т п л 98-100°С, з 4фенілпіперидин та метил хлорсульфонілацетат, використовуючи спосіб з синтезу 8, знайдено С,56,43, Н6.41, N,4,64, розраховано для C14H19NO4S С 56,55, НД44, N 4 , 7 1 % 5(СОСІз) 1,80 (т,2Н), 1,90 (т,2Н), 2,60 (т,1Н), 2,97 (т,2Н), 3,80 (s,3H), 3,92 (s,2H) 3,93 (т,2Н), 7,15-7,33 (т,5Н) СИНТЕЗ 13 Метил 2-(4-бензилпіперидин-1 ілсульФоніл)ацетат Отримали як аморфну речовину (24%) з 4-бензилпіперидину та метил хлорсульфонілацетату, використовуючи спосіб з синтезу 8, але з елюювальним градієнтом дихлорметан метанол (100 0 -> 95 5) при очистці хроматографією 5(СОСІз) 1,30 (т,2Н) 1,62 (т,1Н), 1,70 (т,2Н), 2,54 (d,2H), 2,78 (t,2H) 3,73 (s,3H), 3,76 (т,2Н), 3,88 (s,2H), 7,08 (d,2H), 7,17 (t,1 H) 7,24 (m,2H) LRMS(APCI) 312(M+H) + СИНТЕЗ 14 Метил 2(КЗ)-Г4-(4-ФенілФеніл)1,2,3,6-тетрапдропіридин-1-ілсульФоніл1пент-4еноат 60% гідрид натрію в дисперсії мінерального масла (21 мг, 0,53ммоль) додали при перемішуванні до розчину титульної сполуки з синтезу 8 (180мг, 0,48ммоль) у суміш безводного тетрапдрофурану (1мл) та безводного диметилформаміду (1мл), під азотом, при кімнатній температурі Через ЗО хвилин, додали алілбромід (0,05мл, 0,53ммоль) та перемішування продовжували ще 2 години, далі утворену суміш розподіляли між етилацетатом та водним фосфатним буфером (рН 7) Органічну фазу ВІДДІЛЯЛИ, промивали водою, су 38 шили сульфатом магнію та випарювали під зниженим тиском, далі залишок перетирали з дмзопропіловим етером, одержавши титульну сполуку (170мг) як безбарвну тверду речовину 5(CDCI 3 ) 2,60-2,85 (т,4Н), 3,55-3,77 (т,2Н), 3,79 (s,3H), 4,03 (dd,1H), 4,12 (т,2Н) 5,10-5,22(т,2Н), 5,74 (т,1Н), 6,08 (brs, 1H), 7,36 (т,1Н), 7,43 (т,4Н), 7,60 (т,4Н) LRMS(APCI) 411 (М+Н) + СИНТЕЗ 15 2^,3)-Г4-(4-Фенілфеніл)-1,2 3 6тетрапдропіридин-1-ілсульФоніл1пент-4-енова кислота 1М Водний розчин гідроксиду натрію (1,2мл, 1,2ммоль) додали при перемішуванні до розчину титульної сполуки з синтезу 14 (160мг, 0,39ммоль) у суміш тетрапдрофурану (5мл) та метанолу (Юмл) Утворений розчин гріли при 50°С 3 години, далі випарювали під зниженим тиском та залишок розчиняли у воді Цей водний розчин підкислювали концентрованою пдрохлоридною кислотою та утворену емульсію екстрагували етилацетатом Поєднані екстракти сушили сульфатом магнію та випарювали під зниженим тиском, далі залишок очищали флеш-хроматографією, використовуючи елюювальний градієнт етилацетат метанол льодяна оцтова кислота (100 0 0 -> 97 3 0 -> 96 3 1), а потім розтиранням з гексаном, одержавши титульну сполуку (90мг) як безбарвну аморфну тверду речовину 5(CDCI 3 ) 2,60-2,87 (m,4H), 3,60-3,72 (m,2H) 4,05 (dd,1H), 4,12 (s,2H), 5,105,23 (m,2H) 5,79 (m,1H) 6,06 (brs,1H), 7,30-7,43 (M,5H) 7,50-7,60 (m,4H) І_РМЗ(терморозпилення) 415(M+NH 4 ) + СИНТЕЗ 16 Метил 2(R,SH4-(3-MeTnn-4ФенілФеніл)-1 2,3,6-тетрапдропіридин-1ілсульфоніліпент-4-еноат Отримали як тверду речовину (67%) з титульної сполуки з синтезу 9 та алілброміду, використовуючи спосіб з синтезу 14, але з очисткою флеш-хроматографією, застосовуючи елюювальний градієнт гексан етилацетат (100 0 -» - 80 2) 5(CDCI3) 2,30 (s,3H), 2,68 (m,2H), 2,85 (m,2H), 3,56 (m,1H), 3,70 (m,1H), 3,80 (s,3H), 4,03 (dd,1H), 4,10 (m,2H), 5,10-5,22 (m,2H) 5,73 (m, 1 H), 6,06 (brs, 1 H), 7,20-7,45 (m,8H) LRMS (терморозпилення) 426 (M+H) + СИНТЕЗ 17 2^,ЗН4-(3-Метил-4-ФенілФеніл)1,2,3,6-тетрапдропіридин-1-ілсульФоніл1пент-4енова кислота Отримали як аморфну речовину (46%) з титульної сполуки з синтезу 16, використовуючи спосіб з синтезу 15, 5(CDCI3) 2,30 (s,3H), 2,66 (m,2H) 2,87 (m,2H) 3,60 (m,1H) 3,70 (m,1H), 4,03 (dd,1H), 4,12 (m,2H), 5,13-5,25 (m,2H) 5,78 (m,1H) 6,04 (brs,1H), 7,20-7,43 (M,8H) LRMS (терморозпилення) 368 (M+H-CO 2 ) + СИНТЕЗ 18 Метил 5-Феніл-2^ S)-[4-(4ФенілФеніл)-1,2,3,6-тетрапдропіридин-1ілсульфоніліпентаноат Отримали як безбарвну тверду речовину (65%), т пл 146-148°С, з титульної сполуки з синтезу 8 та 1-бром-З-фенілпропану, використовуючи спосіб з синтезу 14, 5(CDCI3) 1,70 (m,2H), 2,15 (m,2H) 2,64 (m,4H), 3,52 (m,1H), 3,63 (m,1H), 3,79 (s,3H) 3,98 (dd,1H), 4,06 (m,2H), 6,05 (m,1H) 7,10-7,50 (m,10H), 7,60 (m,4H) LRMS (терморозпилення) 490 (M+H) + СИНТЕЗ 19 2-Метил-2-Г4-(4-ФенілФеніл)1,2,3,6-тетрапдропіридин-1ілсульфоніліпропанова кислота 60% Дисперсію гідриду натрію в мінеральному маслі (48мг 39 52791 1,2ммоль) додали при перемішуванні до розчину титульної сполуки з синтезу 8 (150мг, 0,4ммоль) у суміші безводного тетрапдрофурану (Змл) та безводного диметилформаміду (1мл), під азотом, при кімнатній температурі Через ЗО хвилин додавали метил п-толуолсульфонат (220мг, 1,2ммоль) та перемішування продовжували ще 20 годин, далі утворену суміш розподіляли між етилацетатом та водою Водну фазу підкислювали 2М пдрохлоридною кислотою та екстрагували дихлорметаном (3 х 50мл) Поєднані екстракти сушили сульфатом магнію та випарювали під зниженим тиском, далі залишок очищали флеш-хроматографією використовуючи дихлорметан метанол льодяну оцтову кислоту (89 10 1) як елюент , одержавши титульну сполуку (60мг) як блідожовту аморфну тверду речовину 5(CDCI 3 ) 1,70 (s,6H) 2,63 (m,2H) 3,67 (m,2H) 4,17 (m,2H) 6,08(brs,1H) 7,25-7,70 (m,9H) СИНТЕЗ 20 Метил 1-Г4-(3-метил-4ФенілФеніл)-1,2,3,6-тетрапдропіридин-1Ілсульфоніліциклопентан карбоксилат 60% Дисперсію гідриду натрію в мінеральному маслі (43мг 1,07ммоль) додали при перемішуванні до розчину титульної сполуки з синтезу 9 (380мг 0,99ммоль) у безводному диметилформаміді (5мл), під азотом, при кімнатній температурі Через ЗО хвилин додавали 1,4-дійодбутан (0,14мл 1,06ммоль) та перемішування продовжували 18 годин, додавали далі ще 60% дисперсії гідриду натрію (43мг 1,07ммоль) та перемішування продовжували ще 4 годин Утворену суміш розподіляли між етилацетатом та водою, далі органічну фазу ВІДДІЛЯЛИ, промивали водою, сушили сульфатом магнію та випарювали під зниженим тиском Залишок очищали флешхроматографією, використовуючи гексан етил ацетат (9 1) як елюент, одержавши титульну сполуку (340мг) як аморфну речовину 5(СОСІз) 1,64 (т,2Н), 1,88 (т,2Н), 2,28 (s,3H), 2,37 ( т , 2 Н ) , 2,52 ( т , 2 Н ) 2,63 (т,2Н), 3,60 (t,2H), 3,80 (s,3H), 4,10 (т,2Н), 6,03 (brs,1H), 7,20-7,43 (т,8Н) LRMS (терморозпилення) 440 (М+Н) + СИНТЕЗ 21 1 -Г-4-(3-Метил-4-ФенілФеніл)1,2 3,6-тетрапдропіридин-1ілсульфоніліциклопентанкарбонова кислота Отримали як тверду речовину (54%) з титульної сполуки з синтезу 20, використовуючи спосіб з синтезу 15, але з елюювальним градієнтом гексану етилацетату (75 25 -> 0 100) при очистці хроматографією 5(CDCI 3 ) 1,65 (m,2H), 1,88 (m,2H) 2,27 (s,3H), 2,39 (m,2H), 2,50 (m,2H), 2,63 (m,2H) 3,64 (t,2H), 4,12 (m,2H), 6,03 (brs,1H), 7,207,43 (m,8H) LRMS (терморозпилення) 426 (M+H) + СИНТЕЗ 22 Метил 2-етил-2-Г4-(4-ФенілФеніл)1,2 3 6-тетрапдропіридин-1-ілілсульФонілібутаноат Це провели як Синтез 19 та при тому ж молярному співвідношенні використовуючи титульну сполуку з синтезу 8 та етилйодид Однак, в цьому випадку очевидна непотрібність гідролізу естеру, а тому потрібний продукт виділяли з органічної фази протягом обробки та очищали флеш-хроматографією, використовуючи дихлорметан як елюент, одержавши титульну сполуку (125мг) як білу аморфну тверду речовину, 5(CDCI 3 ) 1,04 (t,6H), 2,08-2,26 (m,4H), 2,66 (m,2H) 3,60 (m,2H), 3,80 (s,3H), 4,10 (m,2H), 6,08 (brs,1H), 7,35 (m, 1 H), 7,43 (m,4H), 7,60 (m,4H) 40 СИНТЕЗ 23 2-етил-2-[4-(4-Фенілфеніл)1,2 3,6-тетрапдропіридин-1-ілсульФоніл1-бутанова кислота 1М водний розчин гідроксиду натрію (1,5мл, 1,5ммоль) додали при перемішуванні до розчину титульної сполуки з синтезу 22 (120мг 0,28ммоль) у суміші тетрапдрофурану (5мл) та метанолу (2мл) Утворену суміш гріли під зворотним холодильником 70 годин, дали охолонути до кімнатної температури, підкислювали 2М пдрохлоридною кислотою та екстрагували дихлорметаном (3 х 20мл) Поєднані екстракти сушили сульфатом магнію та випарювали під зниженим тиском, одержавши титульну сполуку (95мг) як блідожовту аморфну тверду речовину 5(СОСІз) 1,10 (t,6H), 2,10-2,28 (m,4H) 2,64 (m,2H), 3,65 (т,2Н), 4,15 (m,2H) 6,08 (brs,1H), 7,35 (т,1Н), 7,43 (т,4Н), 7,58 (т,4Н) СИНТЕЗ 24 Метил 2^,3)-Г4-(4-фенілфеніл1,2,3,6-тетрапдропіридин-1-ілсульфоніл1гексаноат Це провели по суті як Синтез 14, використовуючи титульну сполуку з синтезу 8 та н-бутилйодид, але застосовуючи 1,0 молярний еквівалент гідриду натрію, 1-метилпіролідин-2-он як розчинник та час реакції алкілування 70 годин, одержавши титульну сполуку (78%) як безбарвну тверду речовину, т пл 152-154°С знайдено С, 67,09, Н 6,76, N, 3,22, розраховано для C24H29NOC4S С 67,42, Н, 6,84, N, 3,28% 5(CDCI 3 ) 0,90 (t,3H), 1,30 (m,4H) 2,05 (m,1H), 2,15 (m,1H), 2,60-2,75 (m,2H) 3,55 (m,1H) 3,70 (m,1H) 3,80 (s,3H), 3,95 (dd,1H), 4,10 (m,2H) 6,08 (brs 1H), 7,35 (m,1H), 7,43 (m,4H), 7,58 (m,4H) LRMS (терморозпилення) 428 (M+H) + СИНТЕЗ 25 2^,3)-Г4-(4-Фенілфеніл)-1,2 3,6тетрапдропіридин-1-ілсульфонілі-гексанова кислота 1М Водний розчин гідроксиду натрію (1,5мл, 1,5ммоль) додали при перемішуванні до розчину титульної сполуки з синтезу 24 (220мг, 0,51ммоль) у суміші 1,4-дюксану (Змл) та метанолу (Юмл) Утворену суміш гріли під зворотним холодильником 45 хвилин, розбавляли водою та підкислювали концентрованою пдрохлоридною кислотою, далі осад збирали та сушили під вакуумом, одержавши титульну сполуку (200мг) як безбарвну кристалічну речовину, т п л 180-182°С знайдено С, 65,64, Н, 6,42, N, 3,30, розраховано для C23H27NO4S С 65,38, Н, 6,68, N, 3,32% 5(ДМСО Й 6 ) 0,83 (t,3H), 1,27 (rn,4H), 1,81 (m,1H), 1,93 (m,1H), 2,58 (m,2H), 3,50 (m,2H), 4,00 (m,2H) 4,05 (dd,1H), 6,22 (brs, 1H), 7,33 (m,1H), 7,43 (m,2H), 7,52 (m,2H), 7,64 (m,4H) 13,30 (brs,1H) LRMS (терморозпилення) 387 (M+HCO 2 ) + СИНТЕЗ 26 Метил 4-MeTnn-2(R,S)-[4-(4ФенілФеніл)-1,2,3,6-тетрапдропіридин-1ілсульфоніліпент-4-еноат Отримали як тверду речовину (79%) т п л 149-151 °С після кристалізації з дмзопропілового етеру, з титульної сполуки з синтезу 8 та 3-бром-2-метилпроп-1-ену, використовуючи спосіб з синтезу 14, 5(CDCI 3 ) 1,77 (s,3H), 2,60-2,75 (m,3H), 2,80 (dd,1H), 3,57 (m,1H), 3,70 (m,1H), 3,78 (s,3H), 4,10 (m,2H) 4,18 (dd,1H) 4,75 (S1H) 4,62 (S1H) 6,10(brs,1H) 7,35 (m,1H) 7,44 (m,4H) 7,60 (m,4H) LRMS (терморозпилення) 426 (M+H) + СИНТЕЗ 27 4-Метил-2^,3)-Г4-(4-фенілфеніл)1,2,3,6-тетрапдропіридин-1-ілсульфоніл1пент-4енова кислота Отримали як безбарвну тверду 52791 42 41 речовину (94%), т пл 153-155°С, з титульної спогідрували при 345кПа при 50°С 20 годин, далі філуки з синтезу 26, використовуючи спосіб з синтельтрували Фільтр промивали етанолом та поєдзу 15, 5(CDCI 3 ) 1,79 (s,3H), 2,65 (m,2H), 2,75 нані промивки та фільтрат випарювали під зниже(dd,1H), 2,90 (dd,1H) 3,60 (m,1H), 3,70 (m,1H), 4,13 ним тиском, далі залишок підлужували 2М водним (m,2H), 4,20 (dd,1H), 4,80 (s,1H) 4,88 (s,1H), 6,08 розчином гідроксиду натрію Суміш екстрагували (s,1H), 7,35 (m,1H), 7,44 (m,4H), 7,60 (m,4H) LRMS етилацетатом та поєднані екстракти сушили су+ (терморозпилення) 368 (M+HCO 2 ) льфатом магнію та випарювали під зниженим тиском, одержавши титульну сполуку з вмістом 1 моСИНТЕЗ 28 Метил 2(R,S)-MeTnn-2-[4-(3лярного еквіваленту дифенілметану* (456мг) як метил-4-Фенілфеніл)-1,2,3,6-тетрапдропіридин-1безбарвну аморфну тверду речовину 5(CDCI3) ілсульФоніліпент-4-еноат 6 0 % Дисперсію гідриду 1,75(brs,1H) 3,83 (m,2H) 3,94 (m,2H), 3,98 (s,2H)* натрію в мінеральному маслі (70мг, 1,75ммоль) 6,82 (d,2H) 7,20-7,55 (м,17Н)* LRMS (терморозпидодавали до розчину додали при перемішуванні + лення) 226(M+H) до титульної сполуки з синтезу 9 (600мг, 1,56ммоль) у безводному диметилформаміді СИНТЕЗ 32 Метил 2-ГЗ-И(5мл), під азотом, при кімнатній температурі Чефенілфенокси)азетидин-1-ілсульФоніл!ацетат рез 20 хвилин додавали алілбромід (0,145мл, Отримали як безбарвну аморфну тверду речовину 1,72ммоль) та перемішування продовжували 2 (22%) з титульної сполуки з синтезу 31 та метил години, далі додавали ще 6 0 % дисперсію гідриду хлорсульфонілаце-тату, використовуючи спосіб з натрію (70мг, 1,75ммоль), а через 20 хвилин месинтезу 8, 5(CDCI3) 3,81 (s,3H) 4,07 (s,2H) 4,23 тилйодид (0,11 мл, 1,72ммоль) Реакційну суміш (dd,2H) 4,42 (dd,2H), 4,98 (m,1H) 6,80 (d,2H) 7,34 перемішували ще 20 годин, далі розподіляли між (m,1H) 7,42 (m,2H) 7,54 (m,4H) LRMS(APCI) 362 + етилацетатом та водою Органічну фазу ВІДДІЛЯЛИ, сушили сульфатом магнію та випарювали під зниТрет-бугил 4-(4-бром-3СИНТЕЗ 33 женим тиском, далі залишок очищали флешметилфеніл)-4-пдроксипіперидин-1-карбоксилат хроматографією, використовуючи гексан етилаА 2,5М розчин н-бутиллітію у гексані (3,8мл цетат (92,5 7,5) як елюент, одержавши титульну 9,4ммоль) додавали протягом приблизно 10 хвисполуку (263мг) як безбарвну гумоподібну речовилин при перемішуванні до суміші 2,5ну 5(CDCI 3 )1,62 (s,3H), 2,30 (s,3H) 2,59 (m,1H) дибромтолуолу (2,35г 9,4ммоль) у безводному 2,66 (m,2H), 3,14 (m,1H), 3,62 (m,2H), 3,80 (8,3H), ефірі (50мл), під азотом, при приблизно -75°С 4,10 (m,2H), 5,20 (m,2H), 5,62 (m,1H), 6,08 (brs,1H) Через 1 годину, додавали розчин трет-бутил 47,20-7,44 (m,8H) LRMS (терморозпилення) 440 оксопіперидин-1-карбоксилату (1,7г 8,5ммоль) у (M+H) + безводному тетрапдрофуран (5мл) з такою швидкістю, щоб підтримувати температуру реакції нижСИНТЕЗ 29 2^,3)-Метил-2-Г4-(3-метил-4че -60°С Реакційну суміш перемішували при приФенілФеніл)-1 2 3 6-тетрапдропіридин-1близно -75°С 1 годину, давали нагрітися до ілсульфоніліпент-4-енова кислота Отримали як приблизно 0°С та гасили водним розчином хлорибезбарвну гумоподібну речовину (90%) з титульної ду амонію Органічну фазу ВІДДІЛЯЛИ, промивали сполуки з синтезу 28, використовуючи спосіб з водою, сушили сульфатом магнію та випарювали синтезу 15, але часом реакції 24 години 5(СОСІ 3 ) під зниженим тиском Залишок очищали флеш1,63 (s,3H), 2,30 (s,3H), 2,62 (т,ЗН), 3,13 (т,1Н), хроматографією Використовуючи ефір тексан 3,68 (т,2Н), 4,18 (т,2Н), 5,22 (т,2Н), 5,70 (т,1Н) (50 50) як елюент, одержавши два ізомерних 6,07 (brs,1H), 7,17-7,45 (т,8Н) LRMS (терморозпродукти Менш полярний ізомер (0,6г 20%) видіпилення) 382 (М+Н-СО 2 ) + , 426 (М+Н) + ляли як безбарвну піну та ідентифікували як третСИНТЕЗ ЗО 1-бензпдрил-3-(4бутил 4-(4-бром-2-метилфеніл)-4Фенілфеноксразетидин Карбонат калію (2,39г пдроксипіперидин-1-карбоксилат 5(CDCI 3 ) 1,46 17,4ммоль) додали при перемішуванні до суміші 1(s,9H) 1,55 (s,1H) 1,82-2,03 (т,4Н) 2,58 (s,3H) бензпдрил-3-метансульфонілоксіазетидину 3,23 (т,2Н) 4,01 (т,2Н) 7,20-7,33 (т,ЗН) LRMS (J Org Chem , 1972, 37, 3953, 5г 15,8ммоль), 4+ (терморозпилення) 369/371 (М+Н) фенілфенолу (2,95г 17,4ммоль) та безводного диметилформаміду (65мл), далі утворену суміш Полярніший ізомер, збирали як 4 1 суміш тигріли під зворотним холодильником 4 години, датульної сполуки трет-бутил 14-оксопіперидин-1вали охолонути та розподіляли між етилацетатом карбоксилату (2,15г), частину якого кристалізували та водою Органічну фазу ВІДДІЛЯЛИ, промивали з дмзопропілового етеру, одержавши чисту титульнасиченим розсолом, сушили сульфатом магнію ну сполуку (570мг) як безбарвну тверду речовину, та випарювали під зниженим тиском, далі залишок т п л 102-103°С Знайдено С 55,14, Н 6,58, N 3,76, очищали флеш-хроматографією, використовуючи розраховано для Ci 7 H 2 4BrNO 3 С 55,14, Н 6,53, гексан етилацетат (95 5) як елюент, одержавши N 3 , 7 8 % 5(CDCI 3 )1,48 (s,9H) 1,51 (s,1H) 1,70 титульну сполуку (1,32г) як безбарвну аморфну (d,2H) 1,96 (m,2H) 2,40 (s,3H) 3,22 (t,2H) 4,02 тверду речовину 5(CDCI 3 ) 3,17 (dd,2H) 3,75 (m,2H) 7,15 (dd,1H), 7,36 (d,1H) 7,50 (d,1H) LRMS (dd,2H) 4,43 (s,2H) 4,83 (m,1H) 6,81 (d,1H) 7,16(терморозпилення) 369/371 (M+H) + 7,55 ( M , 1 7 H ) LRMS (терморозпилення) 392 В 2,5М розчин н-бутиллітію у гексані (38мл (M+H) + 94ммоль) додавали протягом приблизно 10 хвилин при перемішуванні до суміші 2-бром-5СИНТЕЗ 31 3-(4-Фенілсренокси)азетидин При йодтолуолу (28г 94ммоль) у безводному ефірі перемішуванні суміш титульної сполуки з синтезу (500мл), під азотом, при приблизно -75°С Через ЗО (1,03г, 2,63ммоль), 10% гідроксид паладію на 15 хвилин додавали розчин трет-бутил 4активованому вугіллі (ЮОмг), етанол (ЮОмл), етиоксопіперидин-1-карбоксилату (17г 85ммоль) у лацетат (20мл) та льодяну оцтову кислоту (Юмл) 43 безводному тетрапдрофуран (50мл) з такою швидкістю, щоб підтримувати температуру реакції підтримували нижче -60°С Реакційну суміш перемішували при приблизно -75°С 1 годину, давали нагрітися до 0°С та гасили водним розчином хлориду амонію Органічну фазу ВІДДІЛЯЛИ, промивали водою, сушили сульфатом магнію та випарювали під зниженим тиском Залишок розчиняли у пентані та утворений розчин охолоджували до 0°С, коли кристалізувалася титульна сполука, и збирали та сушили, одержавши безбарвну тверду речовину (20,1г 64%), ідентичну отриманій у Синтезі ЗЗА СИНТЕЗ 34 Трет-бугил 4-(4-бромФенмт)-1пдроксипіперидин-1-карбоксилат Отримали як аморфну речовину (74%) з 1,4-дибромбензолу та трет-бутил 4-оксопіперидин-1-карбоксилату, використовуючи спосіб з синтезу 33, 5(СОСІз) 1,50 (s,9H) 1,69 (т,2Н) 1,95 (т,2Н) 3,22 (t,2H) 4,02 (т,2Н) 7,34 (d,2H) 7,47 (d,2H) LRMS (терморозпилення) 357 (М+Н)+ СИНТЕЗ 35 4-(4-бром-3-метилфенмт)-1,2,3,6тетрапдропіридин Трифлуороцтову кислоту (ЮОмл) додали при перемішуванні до розчину титульної сполуки з синтезу 33 (20г) у дихлорметані (ЮОмл) при кімнатній температурі Через 18 годин, реакційну суміш випарювали під зниженим тиском та залишок підлужували 2М водним розчином гідроксиду натрію до рН > 12 Утворену суміш екстрагували ефіром, далі поєднані екстракти промивали водою, сушили сульфатом магнію та випарювали під зниженим тиском, одержавши титульну сполуку (13,6г) як легкоплавку тверду речовину 5(CDCI3) 1,60 (brs,1H) 2,40 (м,5Н) 3,10 (t,2H) 3,52 (m,2H) 6,10(brs,1H) 7,05(dd,1H) 7,22 (d,1H), 7,46 (d,1H), LRMS (терморозпилення) 251/253 (M+H)+ СИНТЕЗ 36 4-(4-бромфеніл)-1,2,3,6тетрапдропіридин Отримали як тверду речовину (87%), т пл 76-78°С, з титульної сполуки з синтезу 34 та трифлуороцтової кислоти, використовуючи спосіб з синтезу 35, 5(СОСІ3) 2,43 (т,2Н), 3,12 (t,2H), 3,53 (т,2Н), 6,13 (s,1H), 7,25 (d,2H) 7,44 (d,2H) LRMS (терморозпилення) 239 (M+H) СИНТЕЗ 37 Метил 2-Г4-(4-бром-3метилфеніл)-1,2 3,6-тетрапдропіридин-1ілсульФоніліацетат N,0біс(триметилсиліл)ацетамід (0,9мл 4,0ммоль) додали при перемішуванні до розчину титульної сполуки з синтезу 35 (2г, 7,9ммоль) у безводному тетрапдрофурані (40мл), під азотом, при кімнатній температурі Розчин метил хлорсульфоні л ацетату (1,64г, 9,5ммоль) у безводному тетрапдрофурані (15мл) далі додавали та реакційну суміш перемішували при кімнатній температурі 18 годин Утворену суміш випарювали під зниженим тиском, залишок розподіляли між етилацетатом та водним розчином гідрокарбонату натрію, далі органічну фазу ВІДДІЛЯЛИ, промивали водою, сушили сульфатом магнію та випарювали під зниженим тиском Залишок очищали флеш-хроматографією, використовуючи дихлорметан як елюент, а потім кристалізацією з дмзопропілового етеру, одержавши титульну сполуку (1,65г, 55%) як безбарвну тверду речовину, т пл 110-112°С знайдено С 46,32, Н 4,62, N 3,55, розраховано для С 46,40, 52791 44 Н 4,67, N,3,61% 5(CDCI3) 2,40 (s,3H) 2,60 (m,2H), 3,60 (t,2H) 3,80 (s,3H), 4,01 (s,2H), 4,07 (m,2H), 6,02 (brs,1H), 7,02 (dd,1H) 7,21 (d,1H), 7,50 (d,1H) LRMS (терморозпилення) 404/406 (M+NH4)+ СИНТЕЗ 38 Метил 2-Г4-(4-бромФенмт)-1,2,3,6тетрапдропіридин-1-ілсульфоніліацетат Отримали як безбарвну тверду речовину (32%), т пл 100102°С з титульної сполуки з синтезу 36 та метил хлорсульфонілацетату, використовуючи спосіб з синтезу 37, знайдено С 44,95, Н 4,26, N,3,65, розраховано для Ci 5 Hi 6 BrNO 4 S С 44,93, Н4.31, N,3,74% §(DMSO(,6) 2,47 (m,2H), 3,46 (t,2H), 3,70 (8,3H), 3,94 (m,2H), 4,37 (s,2H), 6,03 (s,1H), 7,40 (d,2H), 7,55 (d,2H) LRMS (терморозпилення) 393 (M+NH4)+ СИНТЕЗ 39 Метил 4-Г4-(4-бром-3-метилФеніл1,2,3,6-тетрапдропіридин-1-ілсульФоніл1тетрапдропіран-4-карбоксилат Біс-2-йодетиловий етер (3,9г, 12ммоль) додали при перемішуванні до суміші титульної сполуки з синтезу 37 (3,6г, 9,3ммоль), безводного карбонату калію (3,8г, 27,8ммоль) та безводного диметилсульфоксиду (50мл), під азотом, при кімнатній температурі Через 18 годин, реакційну суміш розподіляли між етером та водою, далі органічну фазу промивали водою, сушили сульфатом магнію та випарювали під зниженим тиском Залишок очищали флешхроматографією використовуючи дихлорметан метанол (99 1) як елюент, а потім кристалізацією з дмзопропілового етеру, одержавши титульну сполуку (3,43г, 80%) як безбарвну тверду речовину, т п л 128-130°С знайдено С 49,92, Н 5,40, N 2,90, розраховано для Ci9H24BrNO5S C 49,78, Н 5,28, N 3,06% 5(CDCI3) 2,23 (m,2H) 2,40 (s,3H), 2,42 (m,2H), 2,58 (m,2H) 3,30 (m,2H), 3,58 (m,2H), 3,87 (s,3H) 4,00-4,10 (m,4H), 6,00 (brs,1H) 7,02 (dd,1H) 7,21 (d,1H),7,49(d,1H) LRMS (терморозпилення) 477(M+NH 4 ) + СИНТЕЗ 40 Метил 2-Г4-(4-бром-3метилФеніл)-1,2,3,6-тетрапдропіридин-1ілсульфонілі-2-метилпропаноат Йод метан (2мл 32,1ммоль) додали при перемішуванні до суміші титульної сполуки з синтезу 37 (5г 12,9ммоль), безводного карбонату калію (5,4г, 39,1ммоль) та безводного диметилсульфоксиду (50мл), під азотом, при кімнатній температурі Через 24 години реакційну суміш розподіляли між етером та водою, далі органічну фазу промивали водою, сушили сульфатом магнію та випарювали під зниженим тиском Залишок очищали флеш-хроматографією, використовуючи елюювальнии градієнт ефір пентан (40 60 -Ї 100 0), а потім кристалізацією з дмзопропілового етеру, одержавши титульну сполуку (4,7г 87%) як безбарвну тверду речовину, т пл 100-101 °С, знайдено С 49,00, Н 5,33, N 3,28, розраховано для Ci7H22BrNO4S С 49,04, Н 5,33, N3,36% 5(CDCI3) 1,67 (s,6H), 2,40 (s,3H) 2,58 (m,2H) 3,60 (t,2H), 3,80 (s,3H) 4,08 (m,2H) 6,00 (brs,1H) 7,03(dd,1H) 7,21 (d,1H) 7,49 (d,1H) СИНТЕЗ 41 Метил 2-Щ4-(3-етоксиФеніл)-3метилфенілі-1,2 3,6-тетрапдропіридин-1ілсульфоніл}ацетат До розчину титульної сполуки з синтезу 37 (776мг, 2ммоль) у дегазованому 1,2диметоксіетані (20мл) додавали 3етоксифенілборонову кислоту (430мг 2,6ммоль), флуорид цезію (790мг 5,2ммоль) трі-о 45 толілфосфш (61 мг 0,2ммоль) та трис(дибензиліденацетон)дипаладій(0) (91 мг 0,1ммоль), далі реакційну суміш гріли під зворотним холодильником приблизно 3 години під азотом Утворену суміш охолодили до кімнатної температури, далі розбавляли дихлорметаном та промивали водою Органічну фазу сушили сульфатом магнію та випарювали під зниженим тиском Далі залишок очищали флешхроматографією використовуючи дихлорметан як елюент, а потім кристалізацією з дмзопропілового етеру, одержавши титульну сполуку (665мг, 78%) як безбарвну тверду речовину, т пл 79-81 °С знайдено С 64,40, Н 6,37, N 3,17, розраховано для C23H27NO5S С 64 31 Н 6 34 N 3 2fi% 5(CDCI 3 ) 1,43 (t,3H) 2,31 (s,3H) 2,70 (m,2H) 3,63 (t,2H) 3,82 (s,3H) 4,03 (s,2H) 4,10 (m,4H) 6,08(brs,1H) 6,846,93 (m,3H) 7,20-7,37 (m,4H) LRMS (терморозпилення) 447 (M+NH 4 ) + СИНТЕЗ 42 4-бром-2-метоксидиФеніл нАмілнітрит (8,1мл бОммоль) повільно додавали при перемішуванні до суміші 4-бром-2метоксіаніліну (J Med Chem 1989, 32, 1936, 8,1г, бОммоль) та бензолу (175мл), під азотом, при приблизно 50°С Після ПОВНОГО додавання реакційну суміш гріли під зворотним холодильником приблизно 3 годин, далі дали охолонути до кімнатної температури та випарювали під зниженим тиском Залишок азеотропували з тетрапдрофураном, далі етилацетатом, та очищали флешхроматографією, використовуючи елюювальний градієнт гексану етилацетату (100 0 -> 95 5), одержавши титульну сполуку (1,66г) як безбарвну тверду речовину, т пл 50-52°С 5(CDCI 3 ) 3,77 (s,3H) 7,08 (s,1H), 7,14 (s,2H) 7,30 (m,1H) 7,367,41 (m,2H) 7,41-7,49 (m,2H) СИНТЕЗ 43 Трет-бутил 4-пдрокси-4-(3метокси-4-фенілфеніл)піперидин-1-карбоксилат 2 5М розчин н-бутиллітію у гексані (4,4мл 11ммоль) додавали протягом приблизно 10 хвилин при перемішуванні до суміші титульної сполуки з синтезу 42 (2,6г Юммоль) у безводному тетрапдро-фурані (ЗОмл), під азотом, при приблизно 75°С Через 1 годину, розчин трет-бутил 4оксопіперидин-1-карбоксилату (2,2г 11ммоль) у безводному тетрапдрофурані (Юмл) додавали з такою швидкістю, щоб підтримувати температуру реакції нижче -60°С Реакційну суміш перемішували при приблизно -75°С 1 годину, далі повільно нагріли до кімнатної температури та гасили водним розчином хлориду натрію Органічну фазу ВІДДІЛЯЛИ, промивали водою, сушили сульфатом магнію та випарювали під зниженим тиском Очисткою залишку флеш-хроматографіею, використовуючи гексан етилацетат (3 1) як елюент , одержали титульну сполуку (3,4г) як безбарвну напівтверду речовину 5(CDCI 3 ) 1,50 (s,9H) 1,78 (m,2H), 2,04 (m,2H) 3,27 (m,2H) 3,83 (s,3H) 4,08 (m,2H) 7,09 (d,1H) 7,16 (s,1H) 7,27-7,37 (m,2H) 7,40 (m,2H), 7,52 (d, 2H) СИНТЕЗ 44 4-(3-метокси-4-ФенілФеніл)1,2,3,6-тетрапдропіридин Трифлуороцтову кислоту (20мл) додали при перемішуванні до розчину титульної сполуки з синтезу 43 (3,4г 11,9ммоль) у дихлорметані (20мл) при кімнатній температурі Через 72 годин, реакційну суміш випарювали під 52791 46 зниженим тиском та залишок підлужували 2М водним розчином гідроксиду натрію Утворену суміш екстрагували дихлорметаном, далі поєднані екстракти промивали водою, сушили сульфатом магнію та випарювали під зниженим тиском, одержавши титульну сполуку (2 79г) як блідо-жовте густе масло 5(CDCI 3 ) 1,73 (s,1H) 2,51 (m,2H) 3,14 (t,2H) 3,57 (m,2H) 3,83 (s,3H) 6,19 (s,1H) 7,01 (s,1H) 7,05 (d,2H) 7,27-7,37 (m,2H) 7,40 (t,2H) + 7,52 (d 2H) LRMS (терморозпилення) 266 (M+H) СИНТЕЗ 45 Метил 2-[4-(3-мето кс и-4ФенілсЬеніл)-1,2 3 6-тетрапдропіридин-1ілсульфоніліацетат N,0біс(триметилсиліл)ацетамід (1,0мл, 4,4ммоль) додавали при перемішуванні краплями до розчину титульної сполуки з синтезу 44 (1,95г, 7,3ммоль) у безводному тетра-пдрофурані (40мл) при кімнатній температурі Реакційну суміш перемішували при кімнатній температурі 1 годину, далі додавали розчин метил хлорсульфонілацетату (1,5г, 8,8ммоль) у тетрап-дрофурані (Юмл) Утворену суміш перемішували при кімнатній температурі приблизно 1,5 годин та далі додавали насичений водний розчин гідрокарбонату натрію (50мл) Суміш екстрагували дихлорметаном (3 х ЮОмл), далі поєднані екстракти сушили сульфатом магнію та випарювали під зниженим тиском Залишок очищали флеш-хроматографією, використовуючи дихлорметан як елюент, одержавши титульну сполуку (1,0г) як блідо-жовту тверду речовину, т пл 92-95°С Знайдено С 62,24, Н 5,70, N 3,42, C 2 i H 2 3 N O 5 S С 62,82, Н 5 . 7 7 , N,3,49% 5(CDCI 3 ) 2,73 (m,2H) 3,67 (t,2H) 3,84 (s,3H) 3,86 (s,3H) 4,06 (s,2H) 4,08 (m,2H) 6,12 (s,1H) 6,98 (s,1H) 7,04 (d,2H) 7,27-7,37 (m,2H) 7,44 (t,2H) 7,56 (d,2H) LRMS (терморозпилення) 402 (M) + СИНТЕЗ 46 Трет-бутил 4-(3-Флуор-4фенілфеніл)-4-пдроксипіперидин-1 -карбоксил ат Отримали як безбарвне масло (67%) з 4-бром-Зфлуордифенілу та трет-бутил 4-оксопіперидин-1карбоксилату, використовуючи спосіб з синтезу 43, 5(CDCI 3 ) 1,50 (s,9H) 1,78 (m,2H) 2,03 (m,2H) 3,26 (t,2H) 4,05 (m,2H) 7,27-7,51 (м,6Н) 7,57 (d 2H) СИНТЕЗ 47 4-(3-флуор-4-фенілФеніл)-1,2 3 6тетрапдропіридин Отримали як безбарвну тверду речовину (90%) т пл 79-82°С з титульної сполуки з синтезу 46 та трифлуороцтової кислоти, використовуючи спосіб з синтезу 44, 5(CDCI 3 ) 1,85 (s,1H) 2,49 (m,2H) 3,13 (t,2H) 3,58 (m,2H) 6,24 (brs, 1H), 7,12-7,27 (m,2H) 7,35-7,52 (m,4H) 7,59 (d,2H) LRMS (терморозпилення) 253 (M) + СИНТЕЗ 48 Метил 2-[4-(3-Флуор-4фенілФеніл)-1,2,3,6-тетрапдропіридин-1ілсульФоніліацетат Отримали як безбарвну тверду речовину (38%), з титульної сполуки з синтезу 47 та метил хлорсульфонілацетату, використовуючи спосіб з синтезу 45, 5(flMCO d 6 ) 2,60 (m,2H), 3,47 (t,2H), 3,68 (s,3H) 3,96 (s,2H), 4,37 (s,2H) 6,33 (brs,1H), 7,34-7,57 (m,8H) LRMS (терморозпилення) 407 (M+NH 4 ) + СИНТЕЗ 49 Метил 2-[4-(3-мето кс и-4ФенілФеніл)-1 2,3 6-тетрапдропіридин-1ілсульФонілі-2-метилпропаноат Йодметан (0,2мл, 3,4ммоль) додали при перемішуванні до суміші титульної сполуки з синтезу 45 (0,54г, 1,4ммоль), безводного карбонату калію (0,56г, 4,1ммоль) та 47 безводного диметилсульфоксиду (5мл), далі реакційну суміш перемішували при кімнатній температурі приблизно 16 годин Утворену суміш розподіляли між етилацетатом та водою, далі органічну фазу промивали водою, сушили сульфатом магнію та випарювали під зниженим тиском, одержавши титульну сполуку (540мг) як блідо-жовте масло 5(CDCI 3 ) 1,69 (s,6H), 2,67 (m,2H), 3,64 (t,2H), 3,82 (s,3H), 3,84 (s,3H), 4,14 (m,2H) 6,09 (s,1H), 6,98 (s,1H), 7,03 (d,2H) 7,27-7,37 (m,2H), 7,42 (t,2H), 7,54 (d,2H) LRMS (терморозпилення) 430 (M+H) + СИНТЕЗ 50 2-Г4-(3-метокси-4-ФенілФеніл)1,2,3 6-тетрапдропіридин-1-ілсульФоніл1-2метилпропанова кислота 1М водний розчин гідроксиду натрію (1,2мл 1,2ммоль) додали при перемішуванні до розчину титульної сполуки з синтезу 49 (250мг 0,58ммоль) у метанолі (5мл) Утворений розчин гріли при 50°С приблизно 2 години, далі дали охолонути до кімнатної температури та вилили в етилацетат Цю суміш промивали 2М пдрохлоридною кислотою, далі органічну фазу сушили сульфатом магнію та випарювали під зниженим тиском, одержавши титульну сполуку (210мг) як блідо-жовту напівтверду речовину 5(CDCI 3 ) 1,69 (s,6H) 2,67 (т,2Н) 3,64 (t,2H) 3,83 (S,3H) 4,17 ( т , 2 Н ) 6,08 (S,1H) 6,97 (s,1H) 7,03 (d,2H) 7,277,36 (m,2H) 7,40 (t,2H) 7,53 (d,2H) LRMS (терморозпилення) 433 (M+NH 4 ) + СИНТЕЗ 51 4-6POM-2метоксифенілдіазонійтетрафлуорборат Розчин 4бром-2-метоксіаніліну (J Med Chem 1989, 32, 1936, 17,9г 88,6ммоль) у безводному ефірі (350мл) додавали протягом приблизно 1 години до трифлуориду етерату бору (27мл 212ммоль) при 15°С Утворений розчин перемішували при -15°С приблизно 5 хвилин та далі повільно додавали розчин трет-бутилнітриту (11,4мл Юбммоль) у безводному ефірі (ЮОмл), підтримуючи температуру приблизно -15°С Реакційну суміш перемішували при -15°С ще 15 хвилин та далі при 4°С приблизно 4 години Пентан додавали та утворений осад збирали, промивали пентаном та сушили під зниженим тиском, одержавши титульну сполуку (20,1г) як пурпурову речовину 5(CD 3 CN) 4,20 (s,3H) 7,58 (d,1H) 7,80 (s,1H) 8,16 (d,1H) LRMS (терморозпилення) 301 (M) + СИНТЕЗ 52 4-(3-етоксиФеніл)-3метоксибромбензол Безводний 1,4-дюксан (80мл) додавали до суміші титульної сполуки з синтезу 51 (8,0г, 26,6ммоль), 3-етоксифенілбороновоі кислоти (5,3г 31,9ммоль) та ацетату паладію(ІІ) (0,35г, 1 .Зммоль) і реакційну суміш перемішували при кімнатній температурі приблизно 16 годин Утворену суміш розбавляли водою (ЮОмл) та ефіром (ЮОмл), фільтрували та фільтрат екстрагували ефіром (2 х ЮОмл) Поєднані екстракти сушили сульфатом магнію та випарювали під зниженим тиском Очисткою залишку флеш-хроматографією, використовуючи пентан етер (20 1) як елюент, одержали титульну сполуку (6,9г) як безбарвне масло 5(CDCI 3 ) 1,45 (t,3H), 3,83 (s,3H), 4,10 (q,2H), 6,89 (d,1H), 7,06 (d,2H), 7,10-7,24 (m,3H), 7,27-7,38 (m,1H) LRMS(APCI) 308 (M+H) + СИНТЕЗ 53 Трет-бугил 4-Г4-(3-етоксиФеніл)-3метоксифеніл1-4-пдроксипіперидин-1карбоксилат Отримали як безбарвне масло (60%), 52791 48 з титульної сполуки з синтезу 52 та трет-бутил 4оксопіперидин-1-карбоксилату, використовуючи спосіб з синтезу 43, 5(CDCI 3 ) 1,44 (t,3H), 1,50 (s,9H) 1,79 (m,2H), 2,03 (m,2H), 3,27 (t,2H) 3,83 (s,3H), 4,06 (m,4H) 6,86 (d,1H), 7,08 (m,3H), 7,15 (s, 1H),7,31(m,2H) СИНТЕЗ 54 4-Г4-(3-етоксиФеніл)-3метоксифенілі-1 2,3,6-тетрапдропіридин Отримали як блідо-жовте густе масло (91%), з титульної сполуки з синтезу 53 та трифлуороцтової кислоти, використовуючи спосіб з синтезу 44, 5(CDCI 3 ) 1,44 (t,3H), 2,53 (m,2H), 3,16 (t,2H), 3,58 (s,2H), 3,83 (s,3H), 4,07 (q,2H), 6,19 (brs,1H) 6,86 (d,1H) 7,00 (s,1H) 7,07 (m,3H), 7,31 (m,2H) LRMS (терморозпилен-ня) ЗЮ(М+Н)++ СИНТЕЗ 55 Метил 2-{4-Г4-(3-етоксиФеніл-3метоксифенілі-1 2,3,6-тетрапдропіридин-1ілсульфоніл}ацетат Отримали як жовту напівтверду речовину (22%), з титульної сполуки з синтезу 54 та метил хлорсульфонілацетату, використовуючи спосіб з синтезу 45, 5(CDCI 3 ) 1,43 (t,3H), 2,69 (m,2H), 3,65 (t,2H), 3,81 (s,3H), 3,84 (s,3H), 4,04 (s,2H), 4,08 (m,4H), 6,10 (brs,1H), 6,87 (d,1H), 6,96 (s,1H), 7,02 (d,1H), 7,09 (m,2H)+, 7,31 (m,2H) LRMS (терморозпилення) 446 (M+H) + СИНТЕЗ 56 Метил 2-Щ4ЧЗетоксиФеніл)Феніл!-1,2 3 6-тетрапдропіридин-1ілсульфоніл}ацетат До розчину титульної сполуки з синтезу 38 (250мг 0,7ммоль) у 1,2диметоксіетані (8мл) додавали 3етоксифенілборонову кислоту (168мг, 1,0ммоль), флуорид цезію (226мг 1,5ммоль), трі-отолілфосфш (21 мг 0,07ммоль) та трис(дибензиліденацетон)дипаладій(О) (31 мг, 0,035ммоль), далі реакційну суміш гріли під зворотним холодильником приблизно 4 годин під азотом Утвореній суміші дали охолонути до кімнатної температури, далі розбавляли етилацетатом та промивали насиченим водним розчином гідрокарбонату натрію Органічну фазу сушили сульфатом магнію та випарювали під зниженим тиском, далі залишок перетирали з гексаном-етером, одержавши титульну сполуку (222мг) як блідо-жовту тверду речовину, т пл 120-122°С знайдено С,64,25, Н6.01, N,2,99, розраховано для C22H25NO4S С 63,60, Н 6,06, N,3,37% 5(ДМСО Й 6 ) 1,32 (t,3H), 2,62 (m,2H), 3,50 (t,2H), 3,71 (s,3H), 3,98 (d,2H), 4,10 (q,2H), 4,37 (s,2H), 6,27 (brs,1H), 6,91 (d,1H) 7,18 (s,1H), 7,22 (d,1H),7,36 (t,1H), 7,52 (d,2H), 7,66 (d,2H) LRMS (терморозпилення) 433 (M+NH 4 ) + СИНТЕЗ 57 Тетрафлуорборат 4-бром-2метилФенілдіазонію Отримали як жовту тверду речовину (93%), з 4-бром-2-метиланіліну та третбутилнітриту, використовуючи спосіб з синтезу 5 1 , 5(CD 3 CN) 2,70 (s,3H), 7,93 (d,1H) 8,04 (s,1H), 8,50 СИНТЕЗ 58 4-(3-метоксиФеніл)-3метилбромбензол Отримали як блідо-жовте масло (25%), з титульної сполуки з синтезу 57 та 3метоксифенілборонової кислоти, використовуючи спосіб з синтезу 52, 5(CDCI 3 ) 2,15 (s,3H), 3,84 (s,3H) 6,79-6,94 (m,3H), 7,09 (s,1H), 7,33 (d,1H), 7,37 (d,1H), 7,43 (s,1H) СИНТЕЗ 59 Трет-бутил 4-пдрокси-4-Г4-(3метоксиФеніл)-3-метилФеніл1піперидин-1 49 52791 карбоксилат Отримали як безбарвне масло (63%), з титульної сполуки з синтезу 58 та трет-бутил 4оксопіперидин-1-карбоксилату, використовуючи спосіб з синтезу 43, 5(CDCI 3 ) 1,50 (s,9H), 1,79 (m,2H), 2,04 (m,2H), 2,19 (s,3H) 3,27 (t,2H), 3,83 (s,3H), 4,06 (m,2H), 6,85 (s,1H), 6,90 (d,2H), 7,26 (m, 1H), 7,34 (t,2H), 7,38 (s,1H) LRMS (терморозпилення) 3 9 9 ( М + Н ) + СИНТЕЗ 60 4-Г4-(3-метоксиФеніл)-3метилфенілі-112,3 6-тетрапдропіридин Отримали як блідо-жовту напівтверду речовину (93%), з титульної сполуки з синтезу 59 та трифлуороцтової кислоти, використовуючи спосіб з синтезу 44, 5(CDCI 3 ) 2,30 (s,3H), 2,42 (s,2H), 3,15 (t,2H), 3,57 (s,2H), 3,83 (s,3H), 6,18 (brs,1H), 6,90 (m,3H), 7,167,36 (m, 4H) LRMS (терморозпилення) 280 (M+H) + СИНТЕЗ 61 Метил 2-{4-Г4-(3-метоксиФеніл)-3метилФеніл!-1,2,3,6-тетрапдропіридин-1ілсульфоніл}ацетат Розчин метил хлорсульфонілацетату (0,65г, 3,7ммоль) у дихлорметані (Юмл) додавали краплями при перемішуванні до розчину титульної сполуки з синтезу 60 (0,92г, З.Зммоль) та 1,8-діазадицикло [5,4,0]ундец-7-ену (0,76г, 4,9ммоль) у дихлорметані (20мл) при приблизно 0°С, охолоджувальну баню видаляли та реакційну суміш перемішували при кімнатній температурі 4 години, далі розбавляли дихлорметаном Утворену суміш промивали 0,1 М пдрохлори-дною кислотою, сушили сульфатом магнію та випарювали під зниженим тиском, далі залишок очищали флешхроматографією, використовуючи дихлорметан як елюент, одержавши титульну сполуку (250мг) як безбарвну тверду речовину, т пл 83-85°С 5(CDCI 3 ) 2,30 (s,3H) 2,69 (m,2H) 3,66 (t,2H), 3,85 (s,3H), 3,86 (s,3H), 4,03 (s,2H), 4,11 (m,2H) 6,09 (brs,1H) 6,83-6,97(m,3H), 7,17-7,35 (m, 4H) LRMS (терморозпилення) 4 1 6 ( М + Н ) + СИНТЕЗ 62 3-етилфенілборонова кислота Розчин н-бутиллітію (11 мл, 2,5М у гексані, 28ммоль) додали при перемішуванні до розчину 3етилбромбензолу (Chem, Pharm Bull 1968.J6, 2456, 4,6г 25ммоль) у безводному тетрапдрофурані (50мл), підтримуючи температуру нижче 60°С Суміш перемішували при приблизно -70°С 1 годину, далі додавали краплями триметилборат (4,4мл, 38ммоль), знов підтримуючи температуру нижче -60°С Реакційну суміш перемішували при 70°С ЗО хвилин, далі дали повільно нагрітися до кімнатної температури, додавали 2М пдрохлоридну кислоту, суміш екстрагували дихлорметаном (З х 50мл) та поєднані екстракти концентрували під зниженим тиском Залишок розчиняли в ефірі (50мл), розчин екстрагували 2М водним розчином гідроксиду натрію (2 х ЗОмл) та водну фазу підкислювали 2М пдрохлоридною кислотою, далі екстрагували ефіром (3 х 50мл) Поєднані екстракти сушили сульфатом магнію та випарювали під зниженим тиском, одержавши титульну сполуку як білу тверду речовину (0,9г, 24%) 5(flMCO d 6 ) 1,17 (t,3H) 2,57 (q,2H) 7,22 (t,2H) 7,57 (t,1H) 7,61 (s,1H) 7,93 (s,2H) СИНТЕЗ 63 Метил 2-Щ4-(3-етилФеніл)-3метилФенілЦ,2,3,6-тетрапдропіридин-1ілсульфоніліацетат Отримали як жовту тверду речовину (75%) т пл 58-60°С з титульних сполук з синтезу 62 та синтезу 37, використовуючи спосіб з 50 синтезу 4 1 , 5(CDCI 3 ) 1,27 (t,3H) 2,50 (s,3H) 2,68 (m,4H), 3,64 (t,2H) 3,82 (s,3H) 4,03 (s,2H) 4,10 (s,2H) 6,08 (brs,1H) 7,14-7,37 (м,7Н) LRMS (терморозпилення) 431 (M+NH 4 ) + СИНТЕЗ 64 Метил 4-{4-Г4-(3-метоксифеніл-3метилфенілі-1,2 3 6-тетрапдропіридин-1ілсульФоніл}тетрапдропіран-4-карбоксилат Отримали як склоподібну речовину (20%), з титульної сполуки з синтезу 61 та біс-2-йодетилового етеру, використовуючи спосіб з синтезу 39, 5(CDCI 3 ) 2,20-2,34 (m,5H), 2,45 (m,2H), 2,67 (m,2H), 3,33 (t,2H), 3,62 (m,2H), 3,83 (s,3H), 3,89 (s,3H), 4,01 (m,2H), 4,10 (m,2H), 6,05 (brs,1H), 6,91 (m,3H), 7,23-7,36 (m,4H) LRMS(APCI) 486 (M+H) + СИНТЕЗ 65 4-{4-Г4-(3-метоксиФеніл)-3метилФеніл!-1,2,3,6-тетрапдропіридин-1ілсульфоніл}тетрапдропіран-4-карбонова кислота Отримали як блідо-жовту тверду речовину (93%), т пл 180-190°С, з титульної сполуки з синтезу 64, використовуючи спосіб з синтезу 50, 5(CDCI 3 ) 2,20-2,33 (m,5H) 2,43 (m,2H), 2,65 (m,2H), 3,43 (t,2H), 3,67 (m,2H), 3,82 (s,3H), 4,04 (m,2H), 4,14 (m,2H), 6,04 (brs,1H) 6,88 (m,3H), 7,21-7,36 (m,4H) СИНТЕЗ 66 Метил 4-{4-Г4-(3-метоксифеніл)-3метилфеніліпіперидин-1-ілсульфоніл}тетрагщропіран-4-карбоксилат При перемішуванні суміш титульної сполуки з синтезу 64 (315мг, 0,65ммоль), форміату амонію (200мг, 3,2ммоль), 10% паладію на вуглеці (50мг) та метанолу (5мл) гріли під зворотним холодильником 1,5 години, далі давали охолонути та фільтрували Фільтрат випарювали під зниженим тиском та залишок розподіляли між етером та водою Органічну фазу сушили сульфатом магнію та випарювали під зниженим тиском, далі залишок кристалізували з метанолу, одержавши титульну сполуку (215мг) як білу тверду речовину, т пл 137-139°С 5(CDCI 3 ) 1,75-1,94 (m,4H), 2,19 (d,1H) 2,22 (d,1H), 2,27 (s,3H), 2,43 (m,2H), 2,66 (m,1H), 3,07 (t,2H) 3,32 (t,2H) 3,83 (s,3H), 3,90 (s,3H), 3,96 (m,2H), 4,00 (d,1H) 4,02 (d,1H), 6,87 (m,3H) 7,08 (m,2H), 7,19 + (d,1H), 7,32 (m,1H) LRMS(APCI) 486 (M+H) СИНТЕЗ 67 4-{4-Г4-(3-метоксиФеніл)-3метилФеніліпіперидин-1 ілсульФоніл}тетрапдропіран-4-карбонова кислота Отримали як білу тверду речовину (84%), т пл 225-228°С, з титульної сполуки з синтезу 66, використовуючи спосіб з синтезу 50, але з сумішшю метанолу (5мл) та тетрапдрофурану (Юмл) розчинником Знайдено С, 63,04, Н 6,59, N, 2,91, розраховано для C 2 5 H 3 i N O 6 S С 63,40, Н, 6,60, N, 2,96% 5(flMCO d 6 ) 1,60 (m,2H) 1,80 (m,2H) 1,93 (dt,2H), 2,20 (s,3H), 2,24 (m,2H) 2,68 (m,1H), 3,05 (t,2H), 3,20 (t,2H), 3,75 (s,3H) 3,77 (m,2H), 3,88 (d,1H) 3,92 (d,1H), 6,86 (m,3H), 7,11 (m,3H), 7,31 (m,1H), 13,80 (brs,1H) LRMS(APCI) 474 (M) + СИНТЕЗ 68. 3-мето КС и-4-(3метоксиФеніл)бром бензол Отримали як блідожовте масло (78%), з титульної сполуки з синтезу 51 та 3-метоксифенілбороновоі кислоти, використовуючи спосіб з синтезу 52, знайдено С 57,77, Н 4,51, розраховано для СмНігВгОг С, 57,36, Н, 4,47, 5(CDCI 3 ) 3,82 (s,3H) 3,86 (s,3H), 6,91 (d,1H), 7,03-7,39 (м,6Н) LRMS (терморозпилення) 311 (M+NH 4 ) + 51 СИНТЕЗ 69 Трет-бутил 4-пдрокси-4-[3метокси-4-(3-метоксифеніл)Феніл1піперидин-1карбоксилат Отримали як безбарвне масло (67%), з титульної сполуки з синтезу 68 та трет-бутил 4оксопіперидин-1-карбоксилату, використовуючи спосіб з синтезу 43, 5(CDCI 3 ) 1,50 (s,9H), 1,79 (m,2H), 2,06 (m,2H), 3,28 (t,2H), 3,83 (s,6H), 4,06 (m,2H), 6,88 (d,1H), 7,08 (m,3H) 7,14 (s, 1H) 7,32 + (m,2H) LRMS (терморозпилення) 436 (M+Na) СИНТЕЗ 70 4-ГЗ-метокси-4-(3метоксиФеніл)Феніл!-1,2 3,6-тетрапдропіридин При перемішуванні розчин титульної сполуки з синтезу 69 (6,7г, 16,2ммоль) та птолуолсульфонової кислоти (6,17г, 32,5ммоль) у толуолі (70мл) гріли під зворотним холодильником в апараті Дина-Старка до повного видалення води (приблизно 4 години), далі давали охолонути та розбавляли етилацетатом (ЮОмл) Утворену суміш промивали 2М водним розчином гідроксиду натрію (3 х 50мл), далі органічну фазу сушили сульфатом магнію та випарювали під зниженим тиском, одержавши титульну сполуку (3,3г) як жовте масло 5(CDCI 3 ) 1,80 (brs,1H), 2,50 (m,2H), 3,14 (t,2H) 3,57 (m,2H), 3,84 (s,6H), 6,20 (brs,1H), 6,88 (d,1H) 6,98-7,36 (m, 6H) LRMS (терморозпилення) 296 (M+H) + СИНТЕЗ 71 Метил 2-ЩЗ-метокси-4-(3метоксиФеніл)Феніл!-1 2 3 6-тетрапдропіридин-1ілсульфоніл}ацетат Отримали як жовту напівтверду речовину (40%), з титульної сполуки з синтезу 70 та метил хлорсульфонілацетату, використовуючи спосіб з синтезу 45, знайдено С 58,87, Н, 5,65, N 3,11, розраховано для C22H25NO6S C, 58,78, Н, 6,05, N, 3,12% 5(CDCI 3 ) 2,71 (m,2H), 3,64 (t,2H), 3,81 (s,3H), 3,84 (s,6H), 4,02 (s,2H) 4,11 (m,2H), 6,10(brs,1H), 6,88 (d,1H), 6,97 (s,1H), 7,02 (d,1H), 7,12 (171,2Н), 7,32 (m,2H) LRMS (терморозпилення) 449 (M+H) + СИНТЕЗ 72 Метил 2-ЩЗ-метокси-4-(3метоксиФеніл)Феніл!-1 2,3,6-тетрапдропіридин-1ілсульФоніл}-2-метилпропаноат Отримали як безбарвну напівтверду речовину (40%), з титульної сполуки з синтезу 71 та йодметану, використовуючи спосіб з синтезу 49, знайдено С 62,30, Н, 6,29, N 3,00, розраховано для C 2 4H 2 9NO 6 S С, 62,73, Н, 6,36, N, 3,05% 5(CDCI 3 ) 1,68 (s,6H), 2,67 (m,2H), 3,64 (t,2H), 3,82 (s,3H), 3,84 (s,3H), 3,85 (s,3H), 4,13 (m,2H) 6,07 (brs,1H), 6,88 (d,1H) 6,97 (s,1H), 7,02 (d,1H) 7,13 (m,2H) 7,31 (m,2H) LRMS (терморозпилення) 460 (M+H) + СИНТЕЗ 73 Метил 2-ЩЗ-метокси-4-(3метоксифеніл)феніл1піперидин-1-ілсульФоніл}-2метилпропаноат Отримали як безбарвну тверду речовину (80%) т пл 140-142°С, з титульної сполуки з синтезу 72, використовуючи спосіб з синтезу 66, знайдено С 62,31, Н 6,87, N 2,91, розраховано для C 2 4 H 3 i N O 6 S С, 62,45, Н 6,77, N, 3,03% 5(CDCI 3 ) 1,66 (s,6H), 1,87 (m,4H) 2,49 (m,1H), 3,09 (t,2H), 3,82 (s,6H), 3,84 (s,3H) 3,93 (m,2H) 6,81 (s,1H), 6,86 (d,2H) 7,08 (m,2H), 7,29 (m,2H) LRMS (терморозпилення) 462 (M+H) + СИНТЕЗ 74 2-ЩЗ-метокси-4-(3метоксифеніл)феніл1піперидин-1-ілсульфоніл}-2метилпропанова кислота Отримали як безбарвну тверду речовину (80%), т пл 164-165°С, з титульної сполуки з синтезу 73, використовуючи спосіб з 52791 52 синтезу 50, знайдено С 61,64, Н, 6,53, N, 3,06, розраховано для C 2 3 H 2 9NO 6 S С, 61,73, Н, 6,53, N, 3,13% 5(CDCI 3 ) 1,69 (s,6H) 1,87 (m,4H) 2,69 (m,1H), 3,10 (t,2H), 3,81 (s,3H), 3,82 (s,3H), 4,02 (m,2H), 6,80 (s,1H), 6,87 (m,2H), 7,07 (m,2H), 7,27 + (m,2H) LRMS (терморозпилення) 465 (M+NH 4 ) СИНТЕЗ 75 Метил 2-Щ4-(3-етоксиФеніл)-3метоксифенілі-1 2,3,6-тетрапдропіридин-1ілсульфоніл}-2-метилпропаноат Отримали як блідо-жовте масло (29%), з титульної сполуки з синтезу 55 та йодметану, використовуючи спосіб з синтезу 49, знайдено С 62,99, Н, 6,64, N, 2,88, розраховано для C 2 5 H 3 i N O 6 S С, 63,40, Н, 6,60, N, 2,96% 5(CDCI 3 ) 1,43 (t,3H) 1,67 (s,6H), 2,66 (m,2H), 3,63 (t,2H), 3,81 (s,3H), 3,83 (s,3H), 4,07 (q,2H), 4,13 (m,2H), 6,07 (brs,1H), 6,87 (d,1H), 6,96 (s,1H), 7,02 (d,1H) 7,10 (m,2H)+, 7,31 (m,2H) LRMS (терморозпилення) 474 (M+H) + СИНТЕЗ 76 Метил 2-Щ4-(3-етоксиФеніл)-3метоксиФеніл1піперидин-1-ілсульФоніл}-2метилпропаноат Отримали як безбарвну напівтверду речовину (83%) з титульної сполуки з синтезу 75, використовуючи спосіб з синтезу 66, знайдено С 62,86, Н, 7,12, N, 2,68, розраховано для C 2 5 H 3 3 N O 6 S С, 63,14, Н, 6,99,N 2,95% 5(CDCI 3 ) 1,43 (t,3H) 1,67 (s,6H), 1,86 (m,4H), 2,70 (m,1H), 3,09 (t,2H), 3,82 (s,6H), 3,97 (m,2H), 4,06 (q,2H), 6,80 (s,1H), 6,86 (m,2H), 7,08 (m,2H), 7,27 (m,2H) LRMS (терморозпилення) 476 (M+H) + СИНТЕЗ 77 2-Щ4-(3-етоксифеніл)-3метоксифеніл1піперидин-1-ілсульФоніл}-2-метилпропанова кислота Отримали як безбарвну тверду речовину (95%), з титульної сполуки з синтезу 76, використовуючи спосіб з синтезу 50, знайдено С 61,92, Н 7,00, N, 2,72, розраховано для C 2 4 H 3 i N O 6 S С, 62,45, Н, 6,77, N, 3,03% 5(CDCI 3 ) 1,42 (t,3H), 1,70 (s,6H), 1,87 (m,4H) 2,70 (m,1H), 3,11 (t,2H), 3,80 (s,3H), 4,04 (m,4H), 6,80 (s,1H), 6,85 (d,2H), 7,08 (m,2H) 7,27 (m,2H) LRMS (терморозпилення) 479 (M+NH 4 ) + СИНТЕЗ 78 Метил 4-Щ4-(3-етоксиФеніл)-3метилФенілі-1,2,3 6-тетрапдропіридин-1ілсульфоніл}тетрапдропіран-4-карбоксилат Отримали як безбарвну піну (86%), з титульної сполуки з синтезу 39 та 3-етоксифенілбороновоі кислоти, використовуючи спосіб з синтезу 4 1 , але з метанолом дихлорметаном (1 99) як елюентом 5(CDCI 3 ) 1,42 (t,3H) 2,22 (m,2H), 2,28 (s,3H), 2,44 (d,2H) 2,65 (m,2H), 3,34 (dd,2H), 3,60 (m,2H) 3,90 (s,3H) 4,00-4,15 ( M , 6 H ) 6,03 (brs,1H), 6,83-6,92 (m,3H), 7,20-7,36 (m,4H) 0 LRMS (терморозпилення) 500 (M+H) + СИНТЕЗ 79 4-{4-Г4-(3-етоксиФеніл)-3метилФенілі-1,2,3 6-тетрапдропіридин-1ілсульфоніл}тетрапдропіран-4-карбонова кислота 1М Водний розчин гідроксиду натрію (2,3мл, 2,3ммоль) додали при перемішуванні до розчину титульної сполуки з синтезу 78 (290мг, 0,58ммоль) у суміші метанолу (Юмл) та 1,4-дюксану (2мл) Утворений розчин гріли при 80°С приблизно 5 годин, далі дали охолонути до кімнатної температури та випарювали під зниженим тиском Залишок розподіляли між 1М пдрохлоридною кислотою та етилацетатом, далі органічну фазу сушили сульфатом магнію та випарювали під зниженим тиском Залишок кристалізували з дмзопропілового 53 етеру, одержавши титульну сполуку (220мг) як безбарвну тверду речовину, т пл 203-205°С знайдено С 64,14, Н, 6,47, N, 2,87, розраховано для C 2 6H3iNO 6 S С 64,31, Н, 6,44, N, 2,89% 5(CDCI 3 ) 1,43 (t,3H), 2,27 (m,2H), 2,29 (s,3H), 2,42 (d,2H), 2,68 (m,2H), 3,42 (dd,2H), 3,67 (m,2H), 4,004,18 (m,6H), 6,04 (brs,1H), 6,82-6,93 (m,3H), 7,207,35 (m,4H) LRMS (терморозпилення) 486 (M+H) + СИНТЕЗ 80 Метил 2-{4-Г4-(3-етоксиФеніл)-3метилФеніл!-1,2,3,6-тетрапдропіридин-1ілсульФоніл}-2-метилпропаноат Отримали як безбарвну тверду речовину (80%), т пл 75-76°С, з титульної сполуки з синтезу 41 та йодметану, використовуючи спосіб з синтезу 40, знайдено С 65,55, Н, 6,82, N, 2,98, розраховано для C25H31NO5S С, 65,62, Н 6,83, N, 3,06% 5(CDCI 3 ) 1,43 (t,3H), 1,68 (3,6Н), 2,28 (s,3H) 2,65 (m,2H), 3,62 (m,2H) 3,81 (s,3H) 4,06 (q,2H), 4,12 (m,2H), 6,06 (brs,1H), 6,83-6,92 (m,3H), 7,20-7,35 (m,4H) LRMS (терморозпилення) 458 (M+H) + СИНТЕЗ 81 2-Щ4-(3-етоксифеніл)-3метилфеніл!-1,2,3,6-тетрапдропіридин-1ілсульфоніл}-2-метилпропанова кислота Отримали як безбарвну аморфну тверду речовину (50%), з титульної сполуки з синтезу 80, використовуючи спосіб з синтезу 79, але з очисткою флешхроматографіею використовуючи метанол дихлорметан (2 98) 5(CDCI 3 ) 1,43 (t,3H), 1,68 (s,6H), 2,25 (s,3H), 2,60 (m,2H), 3,62 (m,2H), 4,05 (q,2H), 4,15 (m,2H), 6,03 (brs,1H), 6,78-6,90 (m,3H), 7,207,35 (m,4H) LRMS(APCI) 444 (M+H) + СИНТЕЗ 82 Метил 2-{4-Г4-(3-етоксифеніл)-3метилфеніл1піперидин-1-ілсульфоніл}ацетат Отримали як безбарвну аморфну тверду речовину (99%), з титульної сполуки з синтезу 4 1 , використовуючи спосіб з синтезу 66, 5(CDCI 3 ) 1,43 (t,3H), 1,85 (m,2H), 1,97 (m,2H), 2,28 (s,3H), 2,67 (m,1H), 3,01 (m,2H), 3,84 (s,3H), 3,98 (s,2H), 4,01 (m,2H), 4,05 (q,2H), 6,80-6,90 (m,3H), 7,05-7,34 (m,4H) LRMS (терморозпилення) 432 (M+H) + СИНТЕЗ 83 Метил 2-{4-Г4-(3-етоксиФеніл)-3метилфеніл1піперидин-1-ілсульФоніл}-2метилпропаноат Отримали як безбарвну гумоподібну речовину (91%), з титульної сполуки з синтезу 82 та йодметану, використовуючи спосіб з синтезу 40, 5(CDCI 3 ) 1,42 (t,3H), 1,67 (s,6H), 1,80-1,95 (m,4H), 2,29 (s,3H) 2,67 (m,1H), 3,10 (m,2H), 3,82 (s,3H), 3,97 (m,2H), 4,06 (q,2H), 6,82-6,90 (m,3H), 7,06-7,35 (m,4H) LRMS (терморозпилення) 460 + 2-Щ4-(3-етоксиФеніл)-3СИНТЕЗ 84 метилФеніл1піперидин-1-ілсульФоніл}-2-метилпропанова кислота Отримали як безбарвну тверду речовину (72%), т пл 125-128°С, з титульної сполуки з синтезу 83, використовуючи спосіб з синтезу 79, за винятком того, що сирий продукт очищали феш-хроматографією використовуючи метанол дихлорметан (3 97) до кристалізації з дмзопропілового етеру Знайдено С 64,14, Н, 7,01, N, 3,06, розраховано для C 2 4 H 3 i N O 5 S С, 64,69, Н, 7,01, N, 3,14% 5(CDCI 3 ) 1,41 (t,3H), 1,68 (s,6H) 1,77-1,97 (m,4H), 2,26 (s,3H), 2,66 (m,1H), 3,10 (m,2H), 4,00-4,10 (m,4H) 6,80-6,90 (m,3H), 7,037,35 (m,4H) LRMS (APCI) 446 (M+H) + СИНТЕЗ 85 Метил 2-{4-ГЗ-метил-4-(піридин-2іл)-Феніл!-1,2,3,6-тетрапдропіридин-1 52791 54 ілсульфоніліацетат При перемішуванні розчин титульної сполуки з синтезу 37 (206мг, 0,53ммоль), 2-(три-н-бутилстаніл)піридину (TeTpahedron, 1997 53, 859, 295мг, 0,80ммоль), трі-о-толілфосфшу (50мг, 0,16ммоль), ацетату паладію(ІІ) (12мг, 0,05ммоль) та тріетиламшу (0,2мл, 1,44ммоль) у безводному ацетонітрилі (бмл), під азотом, гріли під зворотним холодильником 6 годин Додали додаткові порції трі-о-толілфосфшу (50мг, 0,16ммоль) та ацетату паладію (12мг, 0,05ммоль), далі продовжували кип'ятити ще 24 годин Утворену холодну суміш розподіляли між етилацетатом та водним розчином гідрокарбонату натрію, далі відділену органічну фазу промивали водою, сушили сульфатом магнію та випарювали під зниженим тиском Залишок очищали флеш-хроматографіею, використовуючи елюювальний градієнт гексану етил ацетату (100 0 -> 55 45), одержавши титульну сполуку (20мг, 10%) як безбарвну аморфну тверду речовину 5(CDCI 3 ) 2,39 (s,3H) 2,68 (m,2H) 3,65 (t,2H), 3,81 (s,3H), 4,02 (s,2H), 4,10 (m,2H), 6,10 (brs,1H), 7,23-7,30 (m,3H) 7,40 (m,2H), 7,75 (dd,1H), 8,70 (d,1H) LRMS (APCI) 387 (M+H) + СИНТЕЗ 86 Метил 2-Й-ГЗ-метил-4-(піридин-3іл-фенілі-1 2,3 6-тетрапдропіридин-1ілсульфоніл}ацетат Отримали як безбарвну піну (78%), з титульної сполуки з синтезу 37 та 3-(трин-бутилстаніл)піридину, використовуючи спосіб з синтезу 85, за винятком того, що час реакції 5 годин під зворотним холодильником, а потім 72 години при кімнатній температурі Знайдено С, 62,07, Н, 5,78, N, 7,09, розраховано для C20H22N2O4S С, 62,16, Н, 5,74, N, 7,25% 5(CDCI 3 ) 2,30 (s,3H), 2,70 (m,2H), 3,68 (t,2H), 3,83 (s,3H), 4,03 (s,2H), 4,14 (m,2H), 6,10 (brs,1H), 7,20-7,40 (m,4H) 7,66 (d,1H) 8,60 (m,2H) LRMS(APCI) 387 (M+H) + СИНТЕЗ 87 Метил 2ЩЗ-метил-4-(піридин-4іл)Феніл!-1,,2,3,6-тетрапдропіридин-1ілсульфоніл}ацетат Отримали як безбарвну піну (54%), з титульної сполуки з синтезу 37 та 4-(трин-бутилстаніл)піридину, використовуючи спосіб з синтезу 85, знайдено С, 61,98, Н, 5,80, N, 7,13, розраховано для C20H22N2O4S С 62 16, Н, 5,74, N 7,25% 5(CDCI 3 ) 2,30 (s,3H) 2,70 (m,2H), 3,64 (t,2H), 3,81 (s,3H), 4,02 (s,2H), 4,10 (m,2H), 6,10 (brs,1H) 7,20-7,30 ( M , 5 H ) 8,66 (d,2H) LRMS(APCI) 387 (M+H) + СИНТЕЗ 88. 6-етокси-2-(три-нбутилстаніл)піридин 2,5М розчин н-бутиллітію у гексані (4,5мл, 11,3ммоль) додали при перемішуванні до розчину 2-бром-6-етоксипіридину (Rec Trav chim , 1965, 84і 53, 2,1 г, 11,3 ммоль) у безводному ефірі (25мл), під азотом, при приблизно 40°С Через приблизно 20 хвилин повільно додавали хлорид три-н-бутилстануму (3,1 мл, 11,4ммоль) та, через ще 15 хвилин реакційній суміші дали нагрітися до кімнатної температури Утворену суміш гасили додаванням водного розчину хлориду амонію, далі органічну фазу ВІДДІЛЯЛ И , промивали водою, сушили сульфатом магнію та випарювали під зниженим тиском Залишок очищали флеш-хроматографією використовуючи елюювальний градієнт пентану дихлорметану (100 0 -Ї 80 20), одержавши титульну сполуку (1,6г 34%) як безбарвне масло 5(CDCI 3 ) 0,90 55 (t,9H) 1,08 (t,6H), 1,30-1,42 (м,9Н) 1,58 (м,6Н) 4,40 (q,2H) 6,53 (d,1H) 6,97 (d,1H) 7,39(dd,1H) СИНТЕЗ 89 Метил 2-(4-Г4-(6-етоксипіридин-2іл)-3-метилФеніл1-1,2 3,6-тетрапдропіридин-1ілсульфоніл}-2-метилпропаноат При перемішуванні суміш титульних сполук з синтезу 40 (500мг 1,2ммоль) та синтезу 88 (745мг, 1,8ммоль) трі-отолілфосфшу (109мг О.Збммоль) ацетату паладію(ІІ) (ЗОмг 0,13ммоль) тетракіс(трифенілфосфш)паладію(0) (ЗОмг 0,025ммоль) тріетила-мшу (0,45мл 3,2ммоль) та безводного ацетонітрилу (15мл), під азотом, гріли під зворотним холодильником 18 годин Холодну суміш розподіляли між етилацетатом та водним розчином гідрокарбонату натрію, далі органічну фазу ВІДДІЛЯЛИ, промивали водою, сушили сульфатом магнію та випарювали під зниженим тиском Залишок очищали флеш-хроматографією, використовуючи елюювальний градієнт пентану ефіру (95 -Ї 80 20), одержавши титульну сполуку (290мг 52%) як безбарвну піну 5(CDCI 3 ) 1,40 (t,3H) 1,68 (s,6H) 2,46 (s,3H) 2,66 (m,2H) 3,63 (m,2H) 3,81 (s,3H) 58 4,12 (m,2H) 4,40 (q,2H) 6,07 (brs,1H) 6,68 (d,1H) 6,98 (d,1H), 7,26 (m,2H) 7,40 (d,1H) 7,60(dd,1H) LRMS(APCI) 459 (M+H) + СИНТЕЗ 90 Метил 2-{4-Г-4-(6-етоксипіридин-2іл)-3-метилФеніл1піперидин-1-ілсульФоніл}-2метилпропаноат При перемішуванні розчин титульної сполуки з синтезу 89 (280мг, О.бммоль) у метанолі (12мл) гідрували при 345кПа над 10% паладієм на вуглеці (50мг) 18 годин, далі утворену суміш фільтрували Фільтрат випарювали під зниженим тиском та залишок очищали флешхроматографіею, використовуючи елюювальний градієнт пентану ефіру (90 10 ^ 70 ЗО), одержавши титульну сполуку (70мг, 25%) як безбарвну піну 5(CDCI 3 ) 1,40 (t,3H), 1,67 (s,6H), 1,82 (m,2H) 1,89 (m,2H), 2,43 (s,3H) 2,67 (m,1H), 3,08 (m,2H), 3,81 (s,3H), 3,95 (brd,2H), 4,38 (q,2H), 6,67 (d,1H) 6,96 (d,1H), 7,10 (m,2H), 7,38 (d,1H), 7,60 (dd,1H) LRMS (APCI) 461 (M+H) + СИНТЕЗ 91 2-{4-Г4-(6-етоксипіридин-2-іл)-3метилФеніліпіперидин-1 -ілсульФоніл}І-2-метилпропанова кислота Розчин титульної сполуки з синтезу 91 (68мг, 0,15ммоль) у суміші 1,4-дюксану (2мл) та 1М водного розчину гідроксиду натрію (0,26мл, 0,26ммоль) перемішували при кімнатній температурі 18 годин Утворений розчин розбавляли водою (20мл), підкислювали льодяною оцтовою кислотою до рН ~4 та екстрагували етилацетатом Екстракт сушили сульфатом магнію та випарювали під зниженим тиском, одержавши титульну сполуку (60мг, 87%) як безбарвну тверду речовину, т п л 178-179°С знайдено С 61,53, Н, 6,81, N, 6,09, розраховано для C23H30N2O5S C, 61,86, Н 6,77, N 6,27% 5(CDCI 3 ) 1,39 (t,3H), 1,68 (s,6H), 1,82 (m,2H), 1,90 (m,2H), 2,43 (s,3H) 2,67 (m,1H), 3,10 (m,2H), 4,00 (brd,2H), 4,38 (q,2H), 6,65 (d,1H), 6,96 (d,1H), 7,10 (m,2H) 7,38 (d,1H), 7,60 (dd,1H) СИНТЕЗ 92 Метил 4-Г4-(4-фенілфеніл)1,2 3,6-тетрапдропіридин-1ілсульФонілітетрапдропіран-4-карбоксилат Отримали як безбарвну тверду речовину (67%), т пл 203-206°С, з титульної сполуки з синтезу 8 та біс2-йодетилового етеру, використовуючи спосіб з 52791 56 синтезу 39, 5(CDCI 3 ) 2,25 (m,2H), 2,44 (d,2H), 2,66 (m,2H), 3,32 (t,2H), 3,61 (m,2H), 3,90 (s,3H) 4,01 (dd,2H), 4,10 (m,2H), 6,08 (brs,1H), 7,30-7,62 (м,9Н) + LRMS (терморозпилення) 442 (M+H) СИНТЕЗ 93 4-Г-4-(4-Фенілфеніл)-1,2,3,6тетрагідропіридин-1-ілсульфонілітетрапдропіран4-карбонова кислота Отримали як безбарвну тверду речовину (66%), т п л 214°С з титульної сполуки з синтезу 92, використовуючи спосіб з синтезу 79, 5(CDCI 3 ) 2,27 (m,2H) 2,42 (d,2H), 2,66 (m,2H), 3,41 (t,2H), 3,62 (m,2H) 4,04 (dd,2H), 4,15 (m,2H) 6,08 (brs,1H), 7,30-7,48 (m,5H) 7,58 (m,4H) LRMS(APCI) 427 (M+H)* СИНТЕЗ 94 Метил 4-{4-Г4-(4-етоксифеніл)-3метилфенілЦ,2,3,6-тетрапдропіридин-1ілсульфоніл}тетрапдропіран-4-карбоксилат Отримали як безбарвну тверду речовину (66%), 140141 °С, з титульної сполуки з синтезу 39 та 4етоксифенілборонової кислоти, використовуючи спосіб з синтезу 4 1 , але з етилацетатом тексаном (ЗО 70) як елюентом Знайдено С 64,59, Н, 6,60, N, 2,74, розраховано для C 2 7H 3 3NO 6 S С, 64,91, Н, 6,66, N, 2,80% 5(flMCO d 6 ) 1,34 (t,3H), 2,00 (m,2H), 2,22 (s,3H), 2,28 (d,2H) 2,55-98-(brs,2H), 3,19 (t,2H), 3,50 (brs,2H), 3,80 (s,3H), 3,90 (dd,2H), 3,99 (brs,2H), 4,06 (q,2H), 6,17 (brs,1H), 6,96 (d,2H), 7,14 (d,1H), 7,22 (d,2H), 7,28 (d,1H)+, 7,33 (s,1H) LRMS (терморозпилення) 500 (M+H) + СИНТЕЗ 95 4-(4-Г4-(4-етоксиФеніл-3метилФеніл!-1,2,3,6-тетрапдропіридин-1ілсульфоніл}тетрапдропіран-4-карбонова кислота Отримали як безбарвну тверду речовину (56%), т пл 212-214°С, з титульної сполуки з синтезу 94, використовуючи спосіб з синтезу 79, 5(CDCI 3 ) 1,34 (t,3H), 1,98 (m,2H), 2,22 (s,3H), 2,24 (d,2H), 2,55 (brs,2H), 3,19 (t,2H) 3,52 (brs,2H), 3,90 (dd,2H) 4,01 (brs,2H), 4,04 (q,2H), 6,17 (brs,1 H), 6,96 (d,2H) 7,13 (d,1H), 7,22 (d,2H) 7,28 (d,1H)+ 7,33 (s,1H) LRMS (терморозпилення) 486 (M+H) + СИНТЕЗ 96 Метил 2-Щ4-(3-ФормілФеніл)-3метилФенілі-1,2 3,6-тетрапдропіридин-1ілсульфоніл}ацетат Отримали як безбарвну гумоподібну речовину (86%) з титульної сполуки з синтезу 37 та 3-формілфенілбороновоі кислоти, використовуючи спосіб з синтезу 4 1 , але з мета-нолом дихлорметаном (1 99) як елюентом 5(CDCI 3 ) 2,30 (s,3H) 2,70 (m,2H), 3,64 (t,2H), 3,82 (s,3H), 4,02 (s,2H), 4,12 (m,2H), 6,10 (brs,1H) 7,20-7,33 (m,3H) 7,60 (m,2H), 7,85 (m,2H), 10,08 (S,1H) LRMS (APCI) 4 1 4 ( M + H ) + СИНТЕЗ 97 Метил 2-Щ4ЧЗпдроксиметилФеніл)-3-метилфеніл1-1 2,3 6тетрапдропіридин-1-ілсульфоніл}ацетат ТИТУЛЬНУ сполуку з синтезу 96 (ЗОЗмг, 0,73ммоль) розчиняли у суміші метанолу (15мл) та 1,2-диметоксіетану (5мл), додавали підтриманий полімером боропдрид на Amberhte™ IRA-400 (360мг 0,91ммоль) та реакційну суміш перемішували 3 години при кімнатній температурі Смолу видаляли фільтруванням та фільтрат випарювали під зниженим тиском, одержавши титульну сполуку як безбарвну піну (270мг, 90%) 5(CDCI 3 ) 2,30 (s,3H) 2,70 (m,2H) 3,64 (t,2H) 3,82 (8,3H), 4,02 (s,2H) 4,12 (m,2H) 4,77 (brs,2H) 6,10(brs,1H) 7,20-7,50 (м,7Н) LRMS (терморозпилення) 4 1 6 ( М + Н ) + СИНТЕЗ 98 Хінолін-3-ілборонова кислота 57 52791 2,5М розчин н-бутиллітію у гексані (4,4мл 11ммоль) повільно додали при перемішуванні до розчину 3-бромхінолшу (2,08г, Юммоль) у безводному ефірі (20мл), під азотом, при -75°С Через 20 хвилин при -75°С додавали триметилборат (1,46мл ІЗммоль), при цьому червоний колір змінився на жовтий Реакційній суміші дали нагрітися до кімнатної температури та гасили водою, а потім 1М водним розчином гідроксиду натрію (Юмл) Утворену суміш перемішували ЗО хвилин та далі додавали льодяну оцтову кислоту до рН 5 - 6, що призвело до утворення гумоподібного осаду Дмзопропіловий етер додали до цієї суміші, перемішування продовжували 1 годину та далі прозору водну та органічну фази декантували з твердої речовини та відкидали Твердий залишок розчиняли в етилацетаті та промивали розчин водою, сушили сульфатом магнію та випарювали під зниженим тиском, одержавши титульну сполуку як блідожовту тверду речовину (580мг, 34%) Знайдено С 62,74, Н 4,11, N 7,92, розраховано для C9H8BNO2 С 62,49, Н 4,66, N 8,10% 5( DMSOA) 7,59 (t,1H) 7,76 (t,1H) 7,98 (m,2H) 8,42 (brs,2H, обмінюваний) 8,70 (s,1H) 9,18 (s,1H) СИНТЕЗ 99 Метил 2-метил-2-ШЗ-метил-4(ХІНОЛІН-З-ІЛ)ФЄНІЛМ 2 3,6-тетрапдропіридин-1 ілсульфоніл}пропаноат Отримали як безбарвну тверду речовину (82%), т пл 149-151 °С, з титульних сполук з синтезів 40 та 98, використовуючи спосіб з синтезу 41, але використовуючи 25% 1метилпіролідин-2-он у 1,2-диметоксіетані як реакційний розчинник та ефір пентан (80 20) як елюент для флеш-хроматографм Знайдено С, 67,02, Н, 6,20, N, 5,78, розраховано для C26H28N2O4S C, 67,22, Н, 6,08, N, 6,03% 5(CDCI3) 1,67 (s,6H), 2,36 (s,3H), 2,67 (m,2H), 3,65 (m,2H), 3,82 (s,3H), 4,13 (m,2H), 6,10 (brs,1H), 7,32 (m,3H), 7,60 (t,1H), 7,75 (t,1H), 7,87 (d,1H), 8,10 (S,1H), 8,16 (d,1H), 8,93 (s,1H) LRMS (терморозпилення) 465 (M+H)+ СИНТЕЗ 100 2-Метил-2-{4-ГЗ-метил-4-(хінолін3-іл)Феніл1-1,2,3,6-тетрапдропіридин-1ілсульфоніл}пропюнова кислота Розчин титульної сполуки з синтезу 99 (500мг, 1,08ммоль) у суміші 1,4-дюксану (5мл), метанолу (10мл) та 1М водного розчину гідроксиду натрію (3,2мл, 3,2ммоль) перемішували під зворотним холодильником протягом ЗО хвилин Утвореному розчину давали охолонути, підкислювали льодяною оцтовою кислотою до рН 4, розбавляли водою (15мл) та утворену суміш частково випарювали під зниженим тиском для здійснення кристалізації Тверду речовину збирали та сушили, одержавши титульну сполуку (440мг, 90%) як безбарвну тверду реновину, т пл 222-224°С знайдено С 66,17, Н 5,77, N, 6,15, розраховано для C25H26N2O4S С, 66,64, Н, 65,82, N, 6,22% 5(ДМСОЙ6) 1,51 (s,6H) 2,31 (s,3H), 2,59 (m,2H), 3,58 (m,2H), 4,08 (m,2H), 6,26 (brs,1 H), 7,33-7,50 (m,3H), 7,65 (t,1 H), 7,78 (t,1H), 8,05 (t,2H), 8,37 (s,1H), 8,90 (s,1H), 13,4 (brs,1H) LRMS (APCI) 451 (M+H)+ СИНТЕЗ 101 3-метилтюфенілборонова кислота Розчин 3-бромтюанізолу (10,3г 50,9ммоль) у безводному тетрапдрофурані (15мл) додавали краплями при перемішуванні до суміші магнієвої стружки (1,86г, 75ммоль) та кристалічного йоду під азотом Коли реакція почалася, залишки розчину 58 додавали з такою швидкістю, щоб підтримувати кипіння реакційної суміші Після повного додавання суміш перемішували під зворотним холодильником ще 1 годину, дали охолонути до кімнатної температури та потім додавали до розчину триметилборату (5,8мл, 51ммоль) у безводному тетрапдрофурані (25мл), підтримуючи температуру приблизно -10°С Реакційній суміші давали нагрітися до приблизно 0°С, перемішували ЗО хвилин та гасили далі 2М пдрохлоридною кислотою Утворену суміш екстрагували ефіром, далі поєднані екстракти екстрагували 2М водним розчином гідроксиду натрію Поєднані водні екстракти підкислювали концентрованою пдрохлоридною кислотою та екстрагували ефіром Поєднані ефірні екстракти сушили сульфатом магнію та випарювали під зниженим тиском, одержавши титульну сполуку (7,8 г, 100%) як білу тверду речовину 5(ДМСОсіє) 2,45 (s,3H) 7,27 (т,2Н) 7,54 (т,1Н), 7,67 (s,1H) 8,05 (brs,2H) СИНТЕЗ 102 Метил 2-{4-ГЗ-метил-4-(3метилтюФеніл)Феніл1-1,2 3,6-тетрапдропіридин-1ілсульфоніл}ацетат Отримали як безбарвну тверду речовину (83%) з титульних сполук з синтезів 101 та 37, використовуючи спосіб з синтезу 41, але використовуючи дихлорметан гексан (3 1) як елюент 5(СОСІ3) 2,28 (s,3H) 2,50 (s,3H) 2,68 (m,2H) 3,64 (t,2H), 3,81 (s,3H) 4,02 (s,2H) 4,10 (m,2H) 6,08(brs,1H) 7,07 (d,1H) 7,20-7,36 (m 6H) LRMS (APCI) 432 (M+H)+ СИНТЕЗ 103 3-метоксиметилфенілборонова кислота Отримали як жовту тверду речовину (100%), з 1-бром-З-метоксиметилбензолу (J Amer Chem Soc , 1989, ГГК. 6311, TeTpahedron 1985, 41, 1435) та триметилборату, використовуючи спосіб з синтезу 101, 5(ДМСОсі6) 3,27 (s,3H) 4,38 (S,2H), 7,31 (m,2H), 7,68 (m,2H), 7,98 (brs,2H) СИНТЕЗ 104 Метил 2-Щ4ЧЗметоксиметилфеніл)-3-метилфеніл!-1і2,3,6тетрапдропіридин-1-ілсульфоніл}ацетат Отримали як безбарвне масло (35%), з титульної сполуки з синтезу 103 та Синтез 37, використовуючи спосіб з синтезу 41, але використовуючи ефір гексан (60 40) як елюент 5(CDCI3) 2,27 (s,3H), 2,68 (m,2H) 3,42 (s,3H), 3,64 (t,2H) 3,81 (s,3H), 4,02 (S,2H), 4,10 (m,2H), 4,51 (s,2H), 6,08 (brs,1H), 7,207,32 (m, 7H) LRMS (терморозпилення) 430 + 105 1-бром-3-(2СИНТЕЗ метоксіетокси)бензол Безводний карбонат калію (4,2г, 30,4ммоль) додавали при перемішуванні до розчину 3-бромфенолу (5,0г 28,9ммоль) у безводному диметилформаміді (ЮОмл) Через 5 хвилин додавали 1-йод-2-метокісиетан (Annalen 1967, 710, 59, 5,9 г, 31,8ммоль) та реакційну суміш перемішували при кімнатній температурі приблизно 16 годин, потім суміш гріли при приблизно 50°С приблизно 72 години, потім додавали 1 -хлор-2метоксіетан (1,8мл 19,8ммоль) та продовжували гріти ще 24 години Утворену суміш випарювали під зниженим тиском та залишок розподіляли між етилацетатом та водою Шари ВІДДІЛЯЛИ та водний шар ще екстрагували етилацетатом Поєднані органічні фази промивали насиченим водним розчином хлориду натрію, сушили сульфатом магнію та концентрували до червоного масла, яке очищали 59 флеш-хроматографією використовуючи гексан етилацетат (3 1) як елюент, одержавши титульну сполуку як безбарвне масло (1,7г, 25%) 5(CDCI3) 3,43 (s,3H), 3,74 (t,2H), 4,10 (t,2H), 6,87 (d,1H), 7,10 (m,3H) СИНТЕЗ 10(3 3-(2метоксіетокси)фенілборонова кислота Отримали як безбарвну тверду речовину (74%), т пл 101103°С, з титульної сполуки з синтезу 105 та триметилборату, використовуючи спосіб з синтезу 101, знайдено С, 55,09, Н, 6,70, розраховано для С9Н13ВО4 С 55,15, Н, 6,69% 5(ДМСОЙ6) 3,30 (s,3H), 3,63 (t,2H), 4,06 (t,2H), 6,94 (dd,1H), 7,22 (t,1H), 7,32 (m,2H), 7,98 (brs,2H) LRMS (термороз+ пилення) (M+NH4) СИНТЕЗ 107 Метил 2-Щ4-(3-Г2метоксіетокси!Феніл)-3-метилфеніл1-1,2 3,6тетрапдропіридин-1-ілсульфоніл}ацетат Отримали як безбарвне масло (59%), з титульних сполук з синтезів 106 та 37, використовуючи спосіб з синтезу 41, але використовуючи ефір гексан (1 1) як елюент 5(CDCI3) 2,28 (s,3H), 2,67 (m,2H) 3,45 (s,3H), 3,63 (t,2H), 3,77 (t,2H) 3,80 (s,3H) 4,02 (s,2H), 4,09 (s,2H), 4,15 (s,2H), 6,07 (brs,1 H), 6,90 (m,3H), 7,19-7,34 (m 4H) СИНТЕЗ 108 2,3-дипдробензофуран-5ілборонова кислота Отримали як безбарвну тверду речовину (38%), т пл -240°С (розкл ), з 5-бром2,3-дипдробензофурану (Synthesis, 1988, 952) та триметилборату, використовуючи спосіб з синтезу 101, 5(ДМСОЙ6) 3,33 (t,2H), 4,48 (t,2H), 6,68 (d,1H) 7,56 (d,1H), 7,63 (S,1H) 7,70 (brs,2H) СИНТЕЗ 109 5-(4-бром-2-метилФеніл)2,3дипдробензоФуран Титульну сполуку з синтезу 108 (2,0г, 12,2ммоль) додавали порціями протягом 5 хвилин при перемішуванні до суміші титульної сполуки з синтезу 57 (3,4г, 12,0ммоль) та ацетату паладію(ІІ) (0,15г, О.бммоль) у безводному метанолі (ЗОмл) і реакційну суміш гріли під зворотним холодильником 1,5 години Утвореній суміші дали охолонути до кімнатної температури, фільтрували, далі фільтрат розбавляли водою (ЮОмл) та екстрагували ефіром (2 х ЮОмл) Поєднані екстракти сушили сульфатом магнію та випарювали під зниженим тиском, далі залишок очищали флешхроматографією, використовуючи гексан як елюент, одержавши титульну сполуку (1,7г) як блідооранжеве масло 5(CDCI3) 2,25 (s,3H), 3,25 (t,2H), 4,62 (t,2H) 6,83 (d,1H), 7,02 (d,1H), 7,09 (m,2H) 7,34 (d, 1H), 7,60 (s,1H) LRMS(APCI) 289 (M)+ СИНТЕЗ 110 Трет-бугил 4-Г4-(2 3дипдробензоФуран-5-іл)-3-метилФеніл1-4пдроксипіперидин-1-карбоксилат Отримали як білу тверду речовину (66%), з титульної сполуки з синтезу 109 та трет-бутил 4-оксопіперидин-1карбоксилату, використовуючи спосіб з синтезу 43, 5(CDCI3) 1,50 (s,9H), 1,78 (m,2H), 2,06 (m,2H), 2,29 (s,3H) 3,26 (m,4H), 4,05 (m,2H), 4,62 (t,2H) 6,82 (d,1H), 7,05 (d,1H), 7,15 (s,1H) 7,21 (d, 1H), 7,30 (m,1H) 7,36 (s,1H) LRMS (терморозпилення) 432 (M+Na)+ СИНТЕЗ 111 4-Г4Ч2 З-дипдробензофуран-5іл)-3-метилфенілЦ,2,3,6-тетрапдропіридин Отримали як безбарвне в'язке масло (98%), з титульної сполуки з синтезу 110 та трифлуороцтової кислоти, використовуючи спосіб з синтезу 44, 5(CDCI3) 52791 60 2,30 (s,3H), 2,49 (m,2H), 3,12 (t,2H), 3,26 (t,2H), 3,56 (s,2H), 4,62 (t,2H), 6,17 (brs,1H), 6,82 (d,1H), 7,07 (d,1H) 7,16(m,2H), 7,26 (m,2H) LRMS (термороз+ пилення) 292 (M+H) СИНТЕЗ 112 Метил 2-Щ4-(2,3дипдробензофуран-5-іл)-3-метилФенілЦ,2,3,6тетрапдропіридин-1-ілсульфоніл}ацетат Отримали як блідо-жовту пшоподібну речовину, (45%), т пл 118-122°С, з титульної сполуки з синтезу 111 та метил хлорсульфонілацетату, використовуючи спосіб з синтезу 61, 5(СОСІз) 2,30 (s,3H), 2,67 (m,2H), 3,24 (t,2H), 3,62 (t,2H), 3,79 (s,3H) 4,01 (s,2H), 4,06 (s,2H), 4,62 (t,2H), 6,08 (brs,1H), 6,82 (d,1H), 7,05 (d,1H) 7,26 (m,4H) LRMS (термороз+ пилення) 428 (M+H) СИНТЕЗ V\3 З-метил-4-ОтриФлуорметилФеніл)бром бензол Отримали як безбарвне масло (66%), з титульної сполуки з синтезу 57 та 3-трифлуорметилфенілбороновоі кислоти, використовуючи спосіб з синтезу 109, 5(CDCI3) 2,23 (s,3H), 7,08 (d,1H) 7,40-7,64 (m, 6H) СИНТЕЗ 114 Трет-бутил 4-пдрокси-4-[3-метил4-(3-триФлуорметилФеніл)Феніл1 піперидин-1 Карбоксилат Отримали як жовте масло (54%), з титульної сполуки з синтезу 113 та трет-бутил 4оксопіперидин-1-карбоксилату, використовуючи спосіб з синтезу 43, але з гексаном етилацетатом (85 15) як елюентом, 5(CDCI3) 1,50 (s,9H) 1,77 (m,2H), 2,04 (m,2H) 2,27 (s,3H), 3,26 (m,2H), 4,05 (m,2H), 7,04 (d,1H), 7,15 (s,1H) 7,37 (m,2H), 7,55 (m,4H) LRMS (терморозпилення) 436 (M+H)+ A СИНТЕЗ V\5 4-ГЗ-Метил-4-(3триФлуорметилФеніл)Феніл1 -1,2,3 6тетрапдропіридин Отримали як безбарвне масло (98%), з титульної сполуки з синтезу 114 та трифлуороцтової кислоти, використовуючи спосіб з синтезу 44, знайдено С, 70,90, Н 5,84, N, 4,38, розраховано для Ci9Hi8F3N-0,25 Н20 С, 70,90, Н, 5,79, N, 4,35% 5(CDCI3) 2,26 (s,3H), 2,49 (brs,2H), 3,12 (brs,2H), 3,56 (brs,2H) 6,20 (brs,1H), 7,18 (d,1H), 7,26 (m,2H), 7,55 (m,4H) LRMS (APCI) 318(M)+ СИНТЕЗ 116 Метил 2-{4-ГЗ-метил-4-(3триФлуорметилФеніл)Феніл!-1,2,3,6тетрапдропіридин-1-ілсульфоніл}ацетат Отримали як блідо-жовту піну (31%), з титульної сполуки з синтезу 115 та метил хлорсульфонілацетату, використовуючи спосіб з синтезу 61, але з дихлорметаном гексаном (80 20) як елюентом, знайдено С, 56,38, Н, 4,77, N, 2,96, розраховано для C22H22F3NO4S • 0,25 СН2СІ2 С 56,30, Н, 4,78, N 2,95% 5(CDCI3) 2,27 (s,3H), 2,70 (m,2H) 3,64 (t,2H), 3,82 (s,3H) 4,03 (s,2H), 4,11 (s,2H) 6,10 (brs,1H) 7,24 (m,3H), 7,55 (rn,4H) LRMS(APCI) 453 (M)+ СИНТЕЗ 117 Трет-бутил 4-пдрокси-4-(4Феноксифеніл)піперидин-1-карбоксилат Отримали як білу піну (54%) з 4-феноксибромбензолу та трет-бутил 4-оксопіперидин-1-карбоксилату, використовуючи спосіб з синтезу 43, але з сумішшю безводного етеру та безводного тетрагідрофурану як розчиннику та ефіртексан (60 40) як елюент 5(CDCI3) 1,50 (s,9H) 1,75 (m,2H) 1,99 (m,2H) 3,25 (m,2H) 4,04 (m,2H) 7,00 (m,4H), 7,12 (t,1H) 7,37 (t,2H) 7,44 (d,2H) СИНТЕЗ 118 4-(4-феноксиФеніл)піперидин Тріетилсилан (3,0мл 18,9ммоль) додали при пе
ДивитисяДодаткова інформація
Назва патенту англійськоюHydroxamic acid derivatives as inhibitors of matrix metal proteases (mmp)
Назва патенту російськоюПроизводные гидроксамовой кислоты как ингибиторы матричных металопротеаз (ммп)
МПК / Мітки
МПК: A61P 9/10, A61K 31/445, C07D 205/00, A61K 31/4709, A61P 29/00, A61P 17/02, A61P 9/00, A61K 31/453, C07D 405/10, A61K 31/4427, C07D 405/12, A61P 35/04, C07D 211/22, A61K 31/4545, A61P 19/02, A61K 31/451, A61K 31/44, C07D 211/70, A61K 31/397, C07D 401/10, A61K 31/443, A61P 43/00, C07D 211/16, C07D 211/96, A61P 9/04, A61P 17/00, A61K 31/4525, A61K 31/454
Мітки: спосіб, ммр, яких, сполука, гідроксамової, кислоти, показаний, проміжна, композиції, попередження, одержання, ветеринарна, інгібітор, фармацевтична, станів, медичних, похідні, лікування
Код посилання
<a href="https://ua.patents.su/37-52791-pokhidni-gidroksamovo-kisloti-sposib-kh-oderzhannya-promizhna-spoluka-farmacevtichna-ta-veterinarna-kompozici-sposib-likuvannya-chi-poperedzhennya-medichnikh-staniv-pri-yakikh-poka.html" target="_blank" rel="follow" title="База патентів України">Похідні гідроксамової кислоти, спосіб їх одержання, проміжна сполука, фармацевтична та ветеринарна композиції, спосіб лікування чи попередження медичних станів, при яких показаний інгібітор ммр</a>
Попередній патент: Мийна машина для зерна камінського в.д.
Наступний патент: Пристрій для об’єднання двох енергосистем
Випадковий патент: Лебідка шахтна маневрова монтажна









































