Кристалічна форма похідних 1-[2-(2,4-диметилфенілсульфаніл)-феніл]піперазину як сполука з комбінованою активністю стосовно зворотного захоплення серотоніну, 5-ht3 та 5-ht1a для лікування когнітивних порушень
Номер патенту: 93250
Опубліковано: 25.01.2011
Автори: Холм Рене, Лопес де Дієґо Хейді, Рок Майкл Харольд, Стенсбьол Тіне Брайан, Мур Ніколас, Йорґенсен Мортен, Фалт Андре, Бродерсен Йорґен, Мьорк Арне, Банг-Андерсен Бенні, Мілі Майкл Дж., Рінґор Лоне Мунк
Формула / Реферат
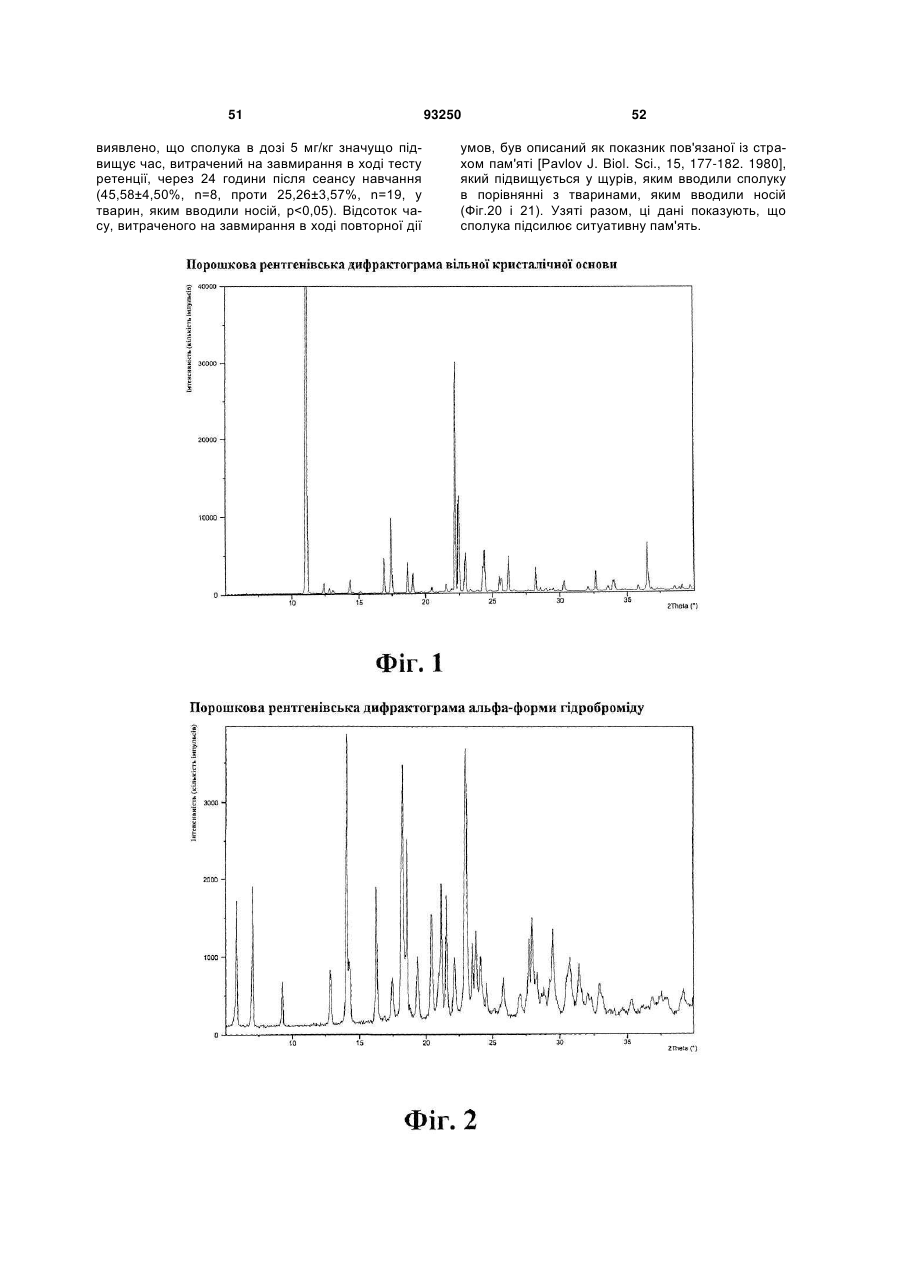
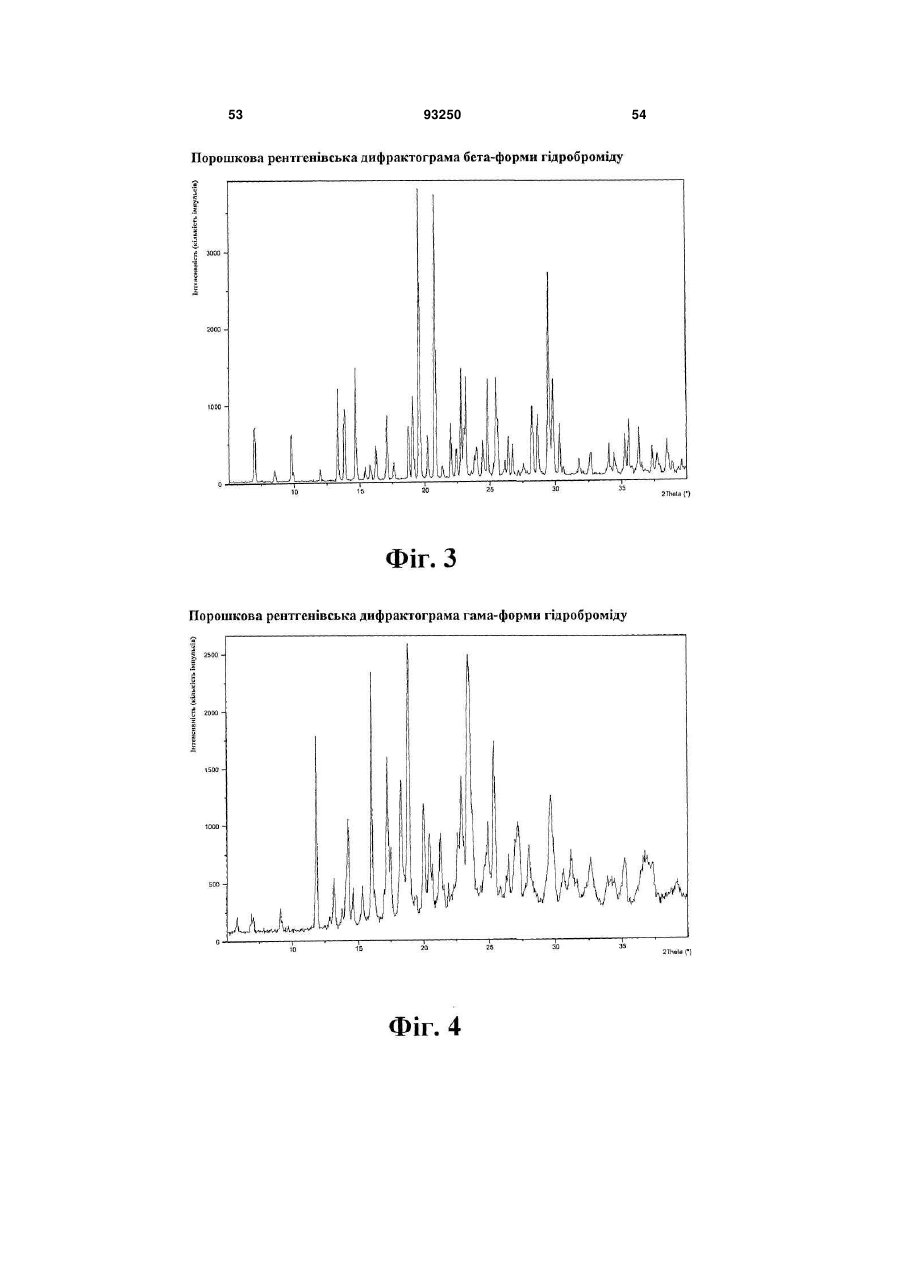
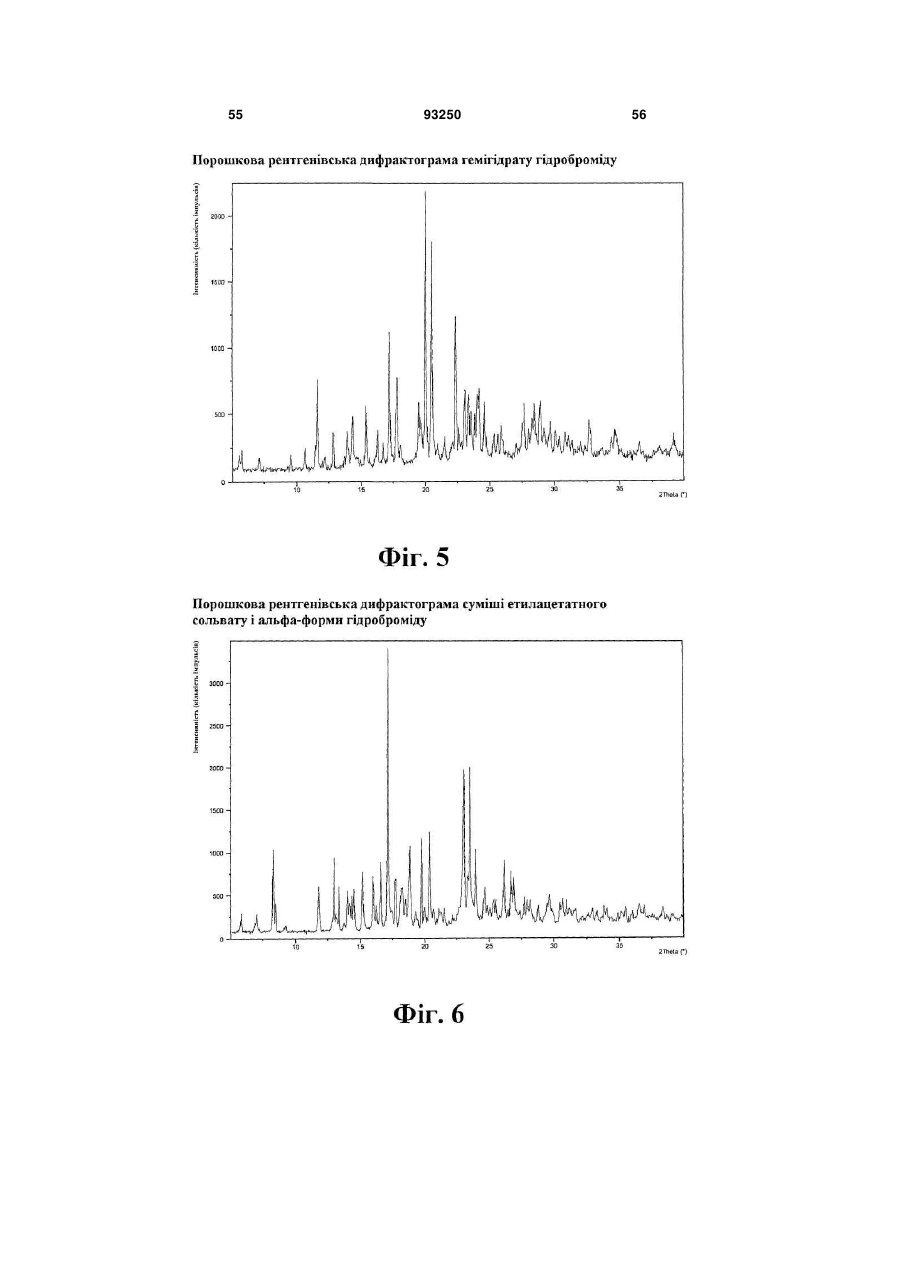
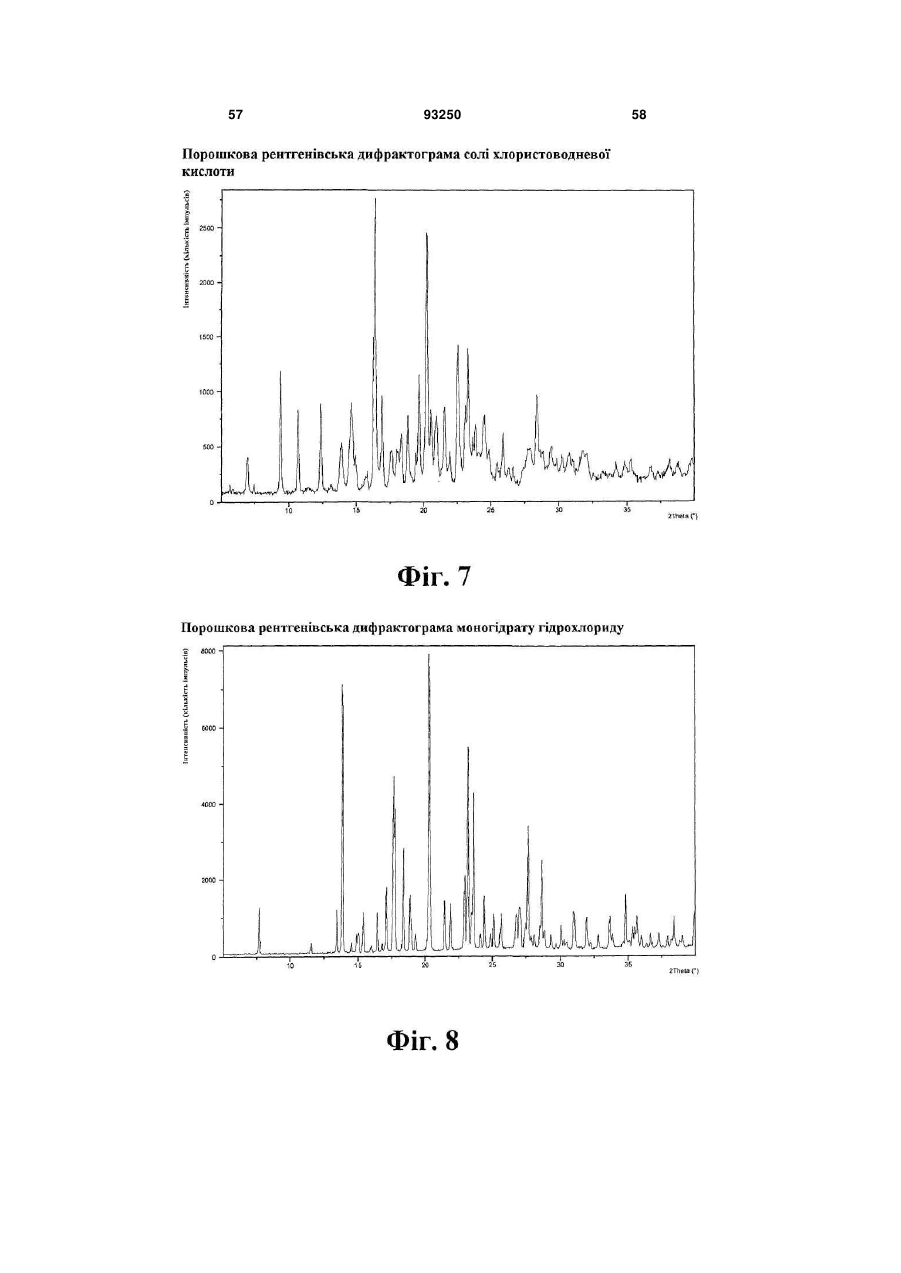
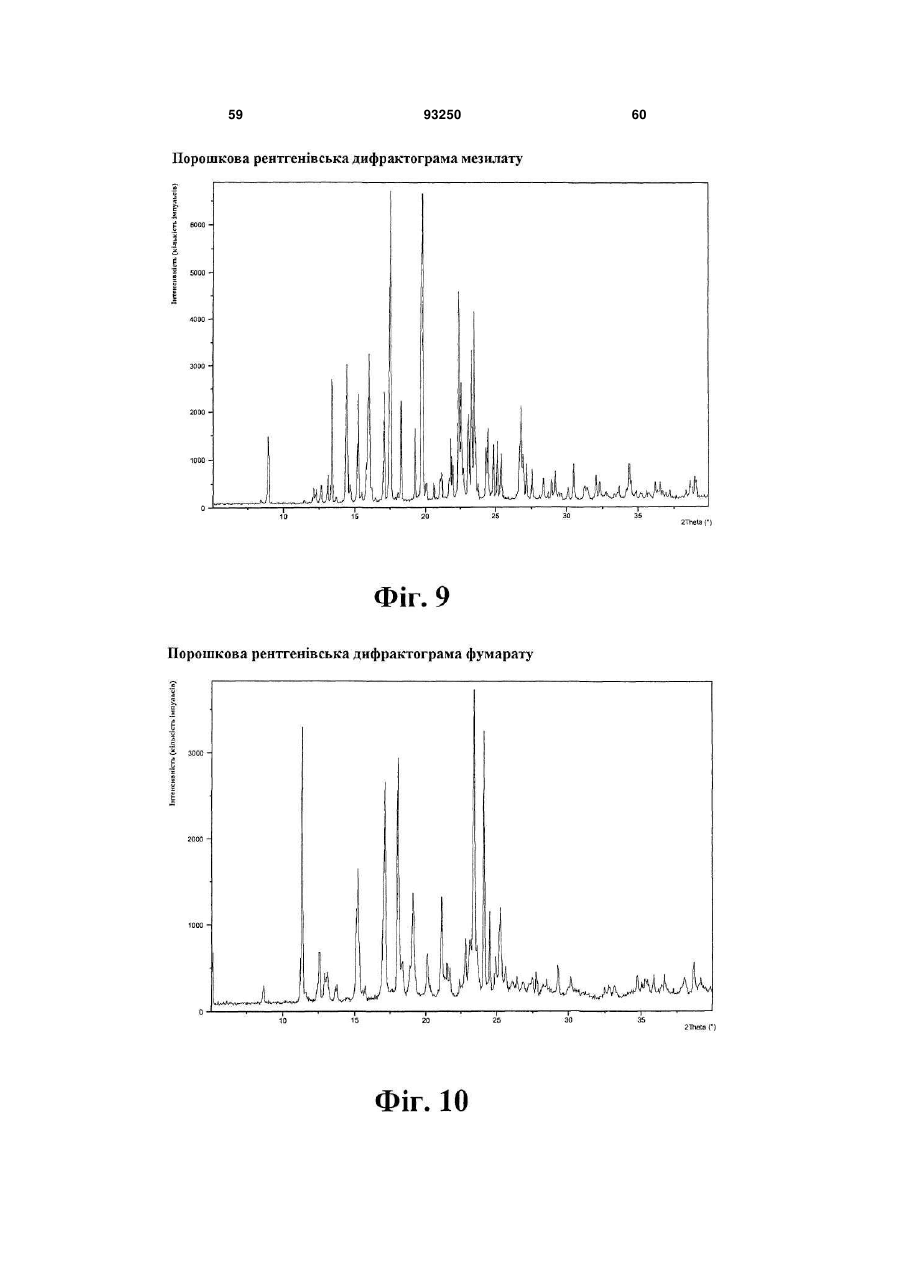
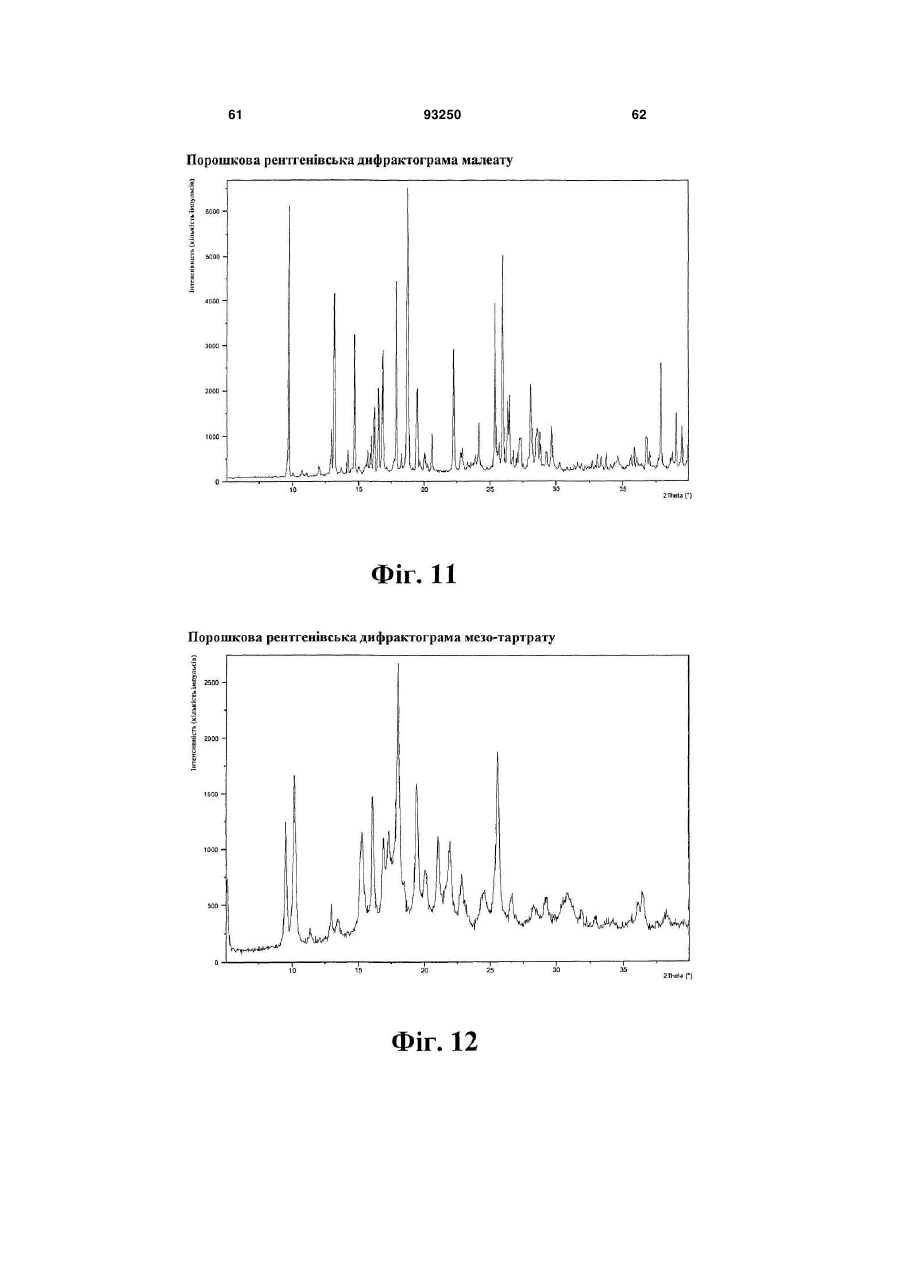
1. Кристалічна форма 1-[2-(2,4-диметилфенілсульфаніл)феніл]піперазину і його фармацевтично прийнятних солей, гідратів та сольватів, вибрана з кристалічної основи, гідроброміду (α), гідроброміду (β), гідроброміду (γ), гідроброміду (гідрату), гідроброміду (етилацетатного сольвату), гідрохлориду, гідрохлориду (моногідрату), мезилату, солі фумарової кислоти, солі малеїнової кислоти, солі мезовинної кислоти, солі L-(+)-винної кислоти, солі D-(-)-винної кислоти, солі сірчаної кислоти, дигідрофосфату, нітрату, де вказана сполука та її фармацевтично прийнятні солі, гідрати та сольвати характеризуються наступними відбиваннями на порошковій рентгенограмі (XRPD), одержаній із застосуванням СuКα-випромінювання, при кутах 2θ (±0,1°):
кристалічна основа
гідробромід (α)
гідробромід (β)
гідробромід (γ)
гідробромід (гідрат)
гідробромід (етилацетатний сольват)
гідрохлорид
гідрохлорид (моногідрат)
мезилат
сіль фумарової кислоти
сіль малеїнової кислоти
сіль мезовинної кислоти
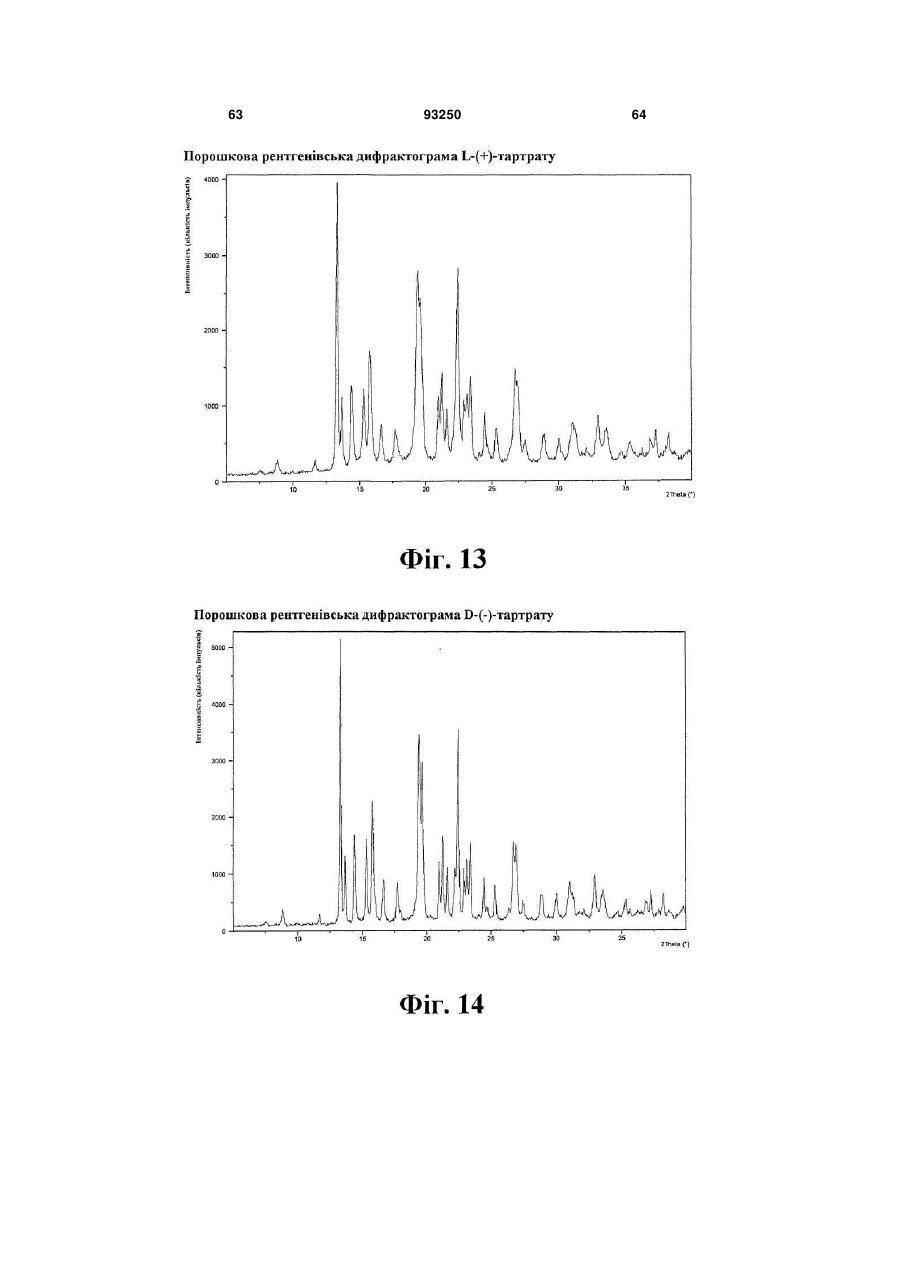
сіль L-(+)-винної кислоти
сіль D-(-)-винної кислоти
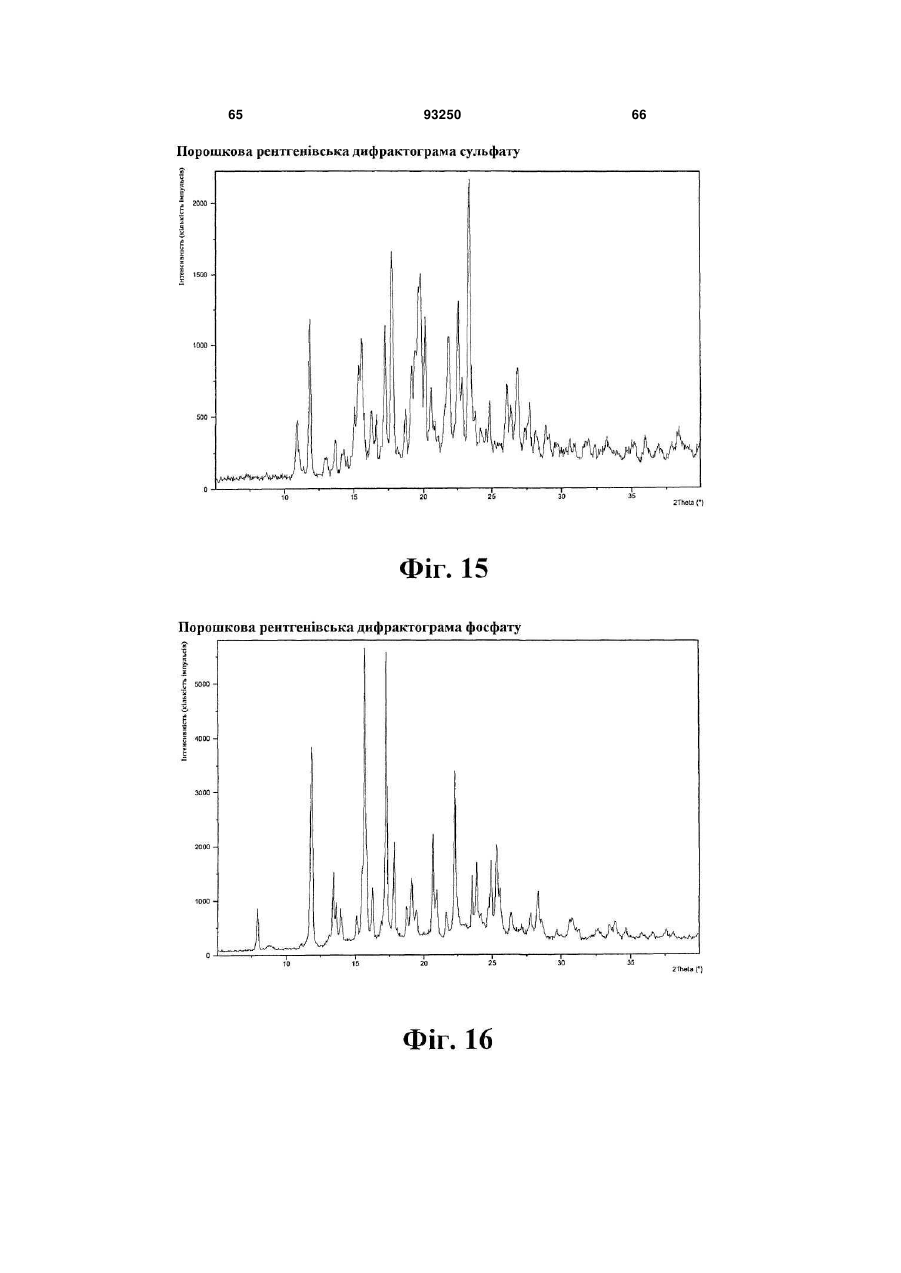
сіль сірчаної кислоти
дигідрофосфат
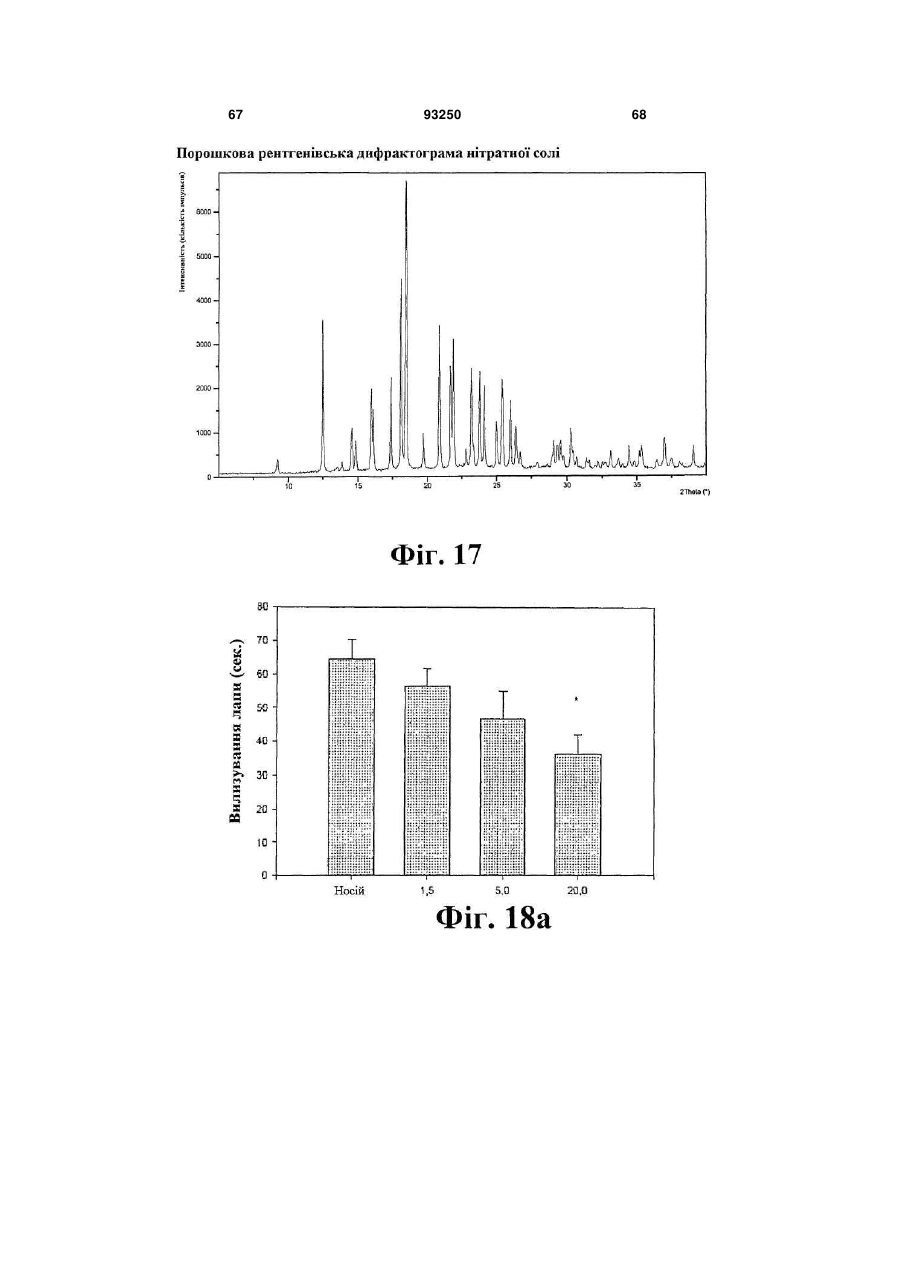
нітрат
11,10
5,85
6,89
11,82
10,69
8,29
9,41
7,72
8,93
5,08
9,72
9,51
13,32
13,32
11,82
7,91
12,50
16,88
9,30
9,73
16,01
11,66
13,01
12,37
13,45
13.39
11,32
13,19
10,17
13,65
13,65
17,22
11,83
17,41
17,42
17,49
13,78
17,22
15,40
13,39
19,66
15,39
15,22
17,12
14,72
16,10
14,41
14,41
17,72
15,69
18,12
22,23
18,58
14,62
18,84
17,86
16,62
22,55
17,10
17,09
18,04
17,88
25,58
15,80
15,80
20,13
17,24
18,47.
2. Кристалічна форма за п. 1, яка відрізняється тим, що є сіллю 1-[2-(2,4-диметилфенілсульфаніл)феніл]піперазину з бромистоводневою кислотою.
3. Кристалічна форма за п. 2, яка відрізняється тим, що характеризується відбиваннями на порошковій рентгенограмі (XRPD), одержаній із застосуванням СuКα-випромінювання, при кутах 2θ приблизно 6,89, 9,73, 13,78 і 14,64.
4. Кристалічна форма за п. 3, яка відрізняється тим, що має гранулометричний склад, що відповідає:
D98%: 650-680 мкм; D50%: 230-250 мкм і D5%: 40-60 мкм;
D98%: 370-390; D50%: 100-120 мкм; D5%: 5-15 мкм;
D98%: 100-125 мкм; D50%: 15-25 мкм і D5%: 1-3 мкм; або
D98%: 50-70 мкм; D50%: 3-7 мкм і D5%: 0,5-2.
5. Кристалічна форма за будь-яким з пп. 1-4 для використання в терапії.
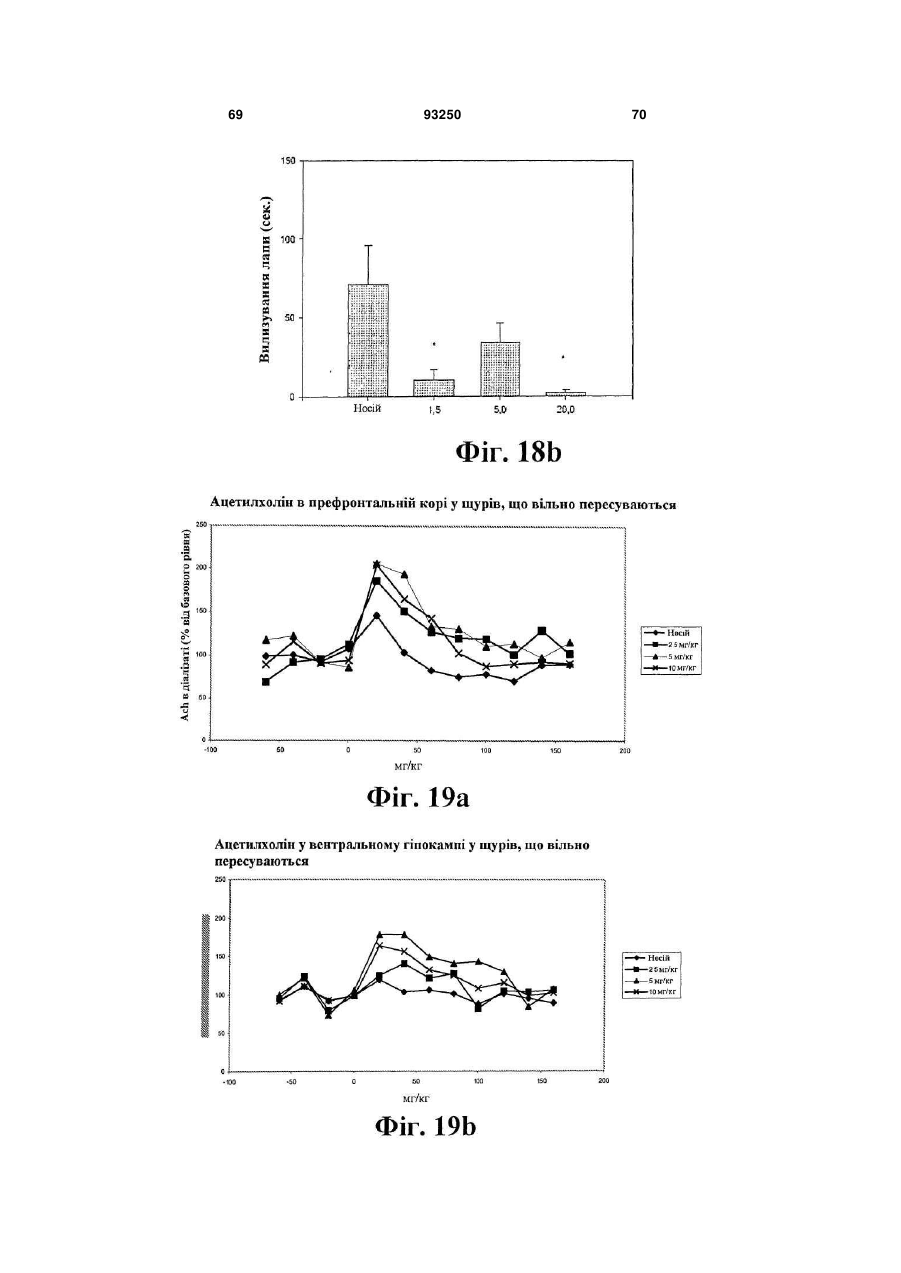
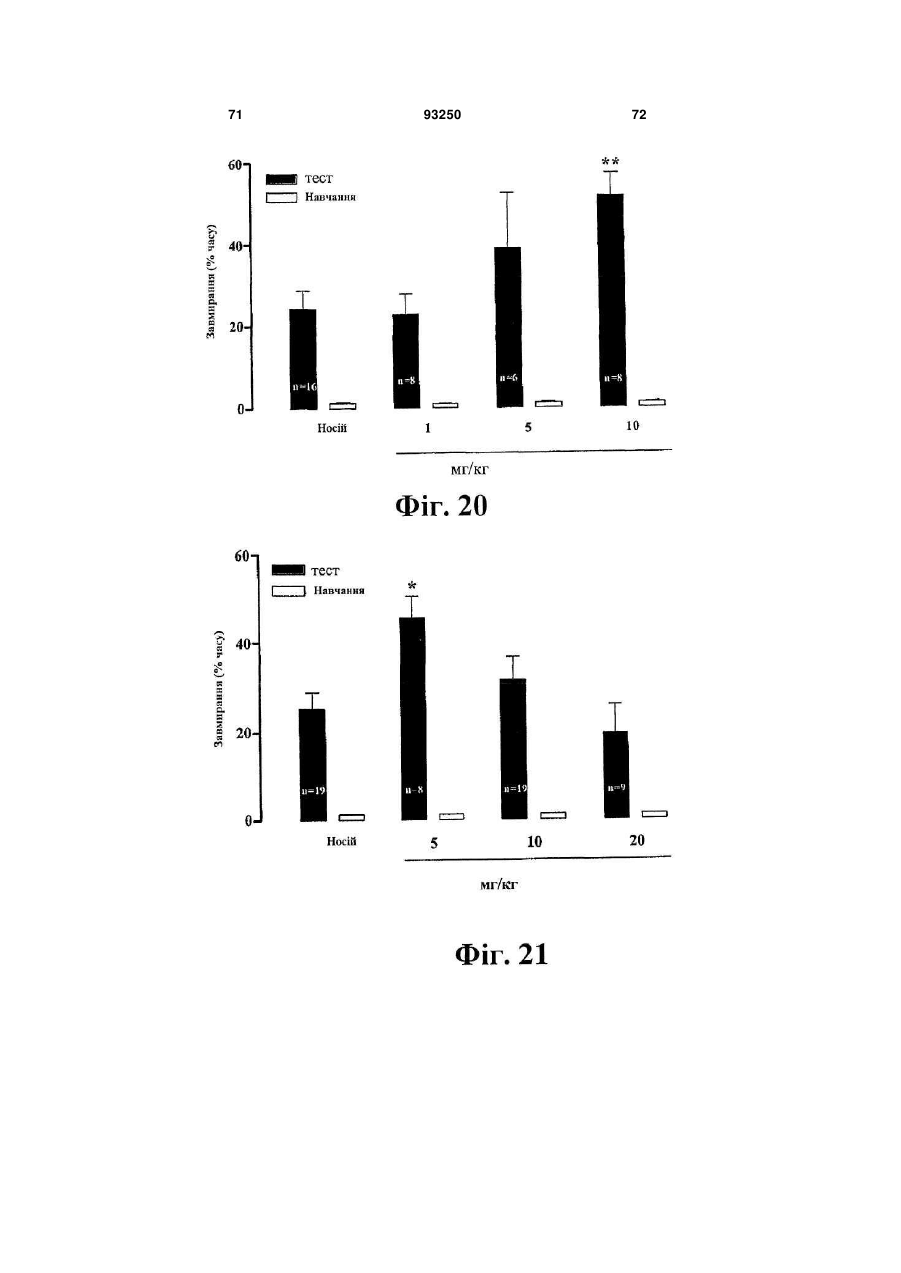
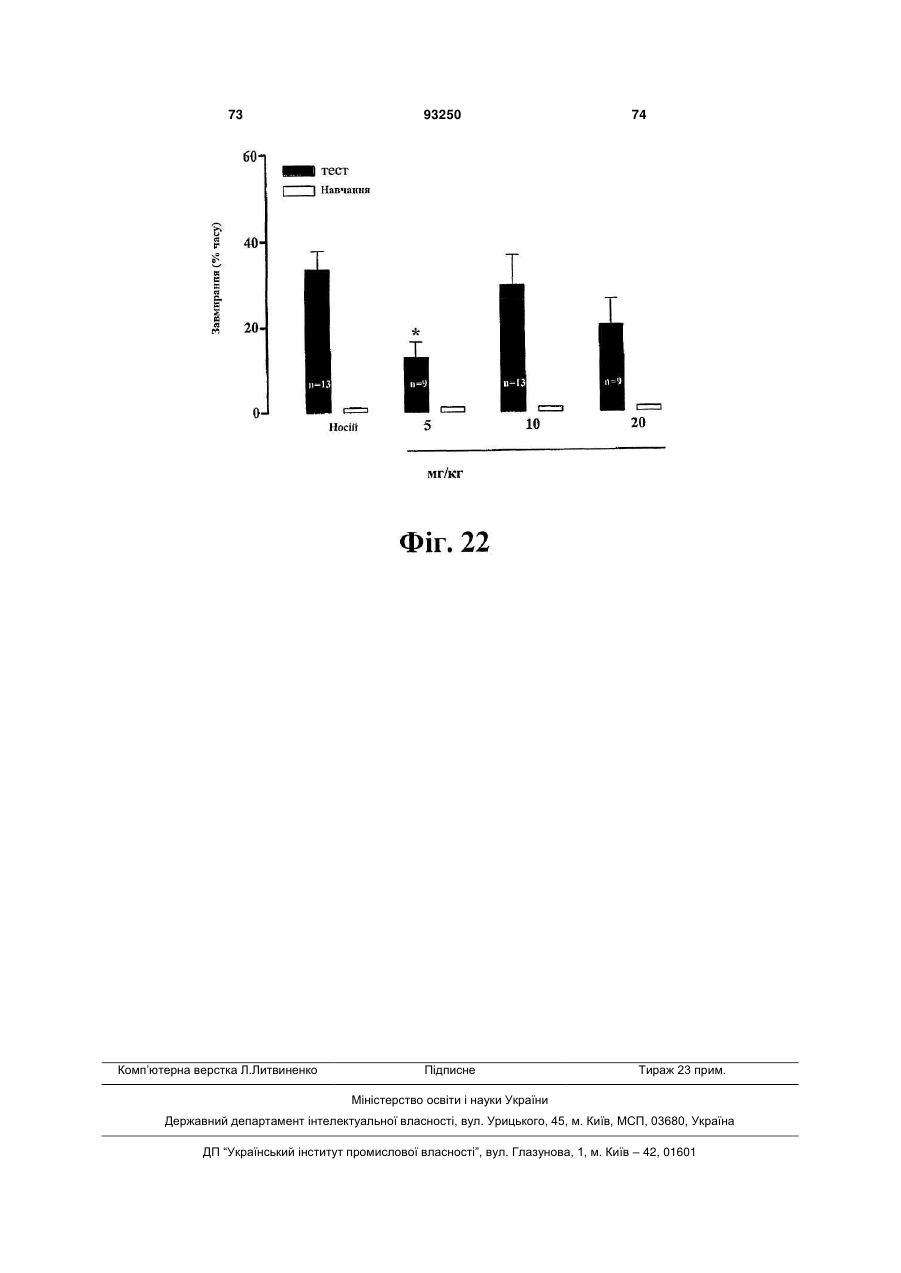
6. Кристалічна форма за будь-яким з пп. 1-4 для використання при лікуванні когнітивних порушень і захворювань ЦНС, які супроводжуються когнітивними порушеннями, та які вибрані з афективних розладів, таких як депресія, загальний депресивний розлад, післяродова депресія, депресія, що асоціюється з біполярним розладом, хвороби Альцгеймера, психозу, пов’язаного зі старінням захворювання або хвороби Паркінсона, тривожності, генералізованого тривожного розладу, соціального тривожного розладу, обсесивно-компульсивного розладу, панічного розладу, панічних атак, стійкої до лікування депресії, синдрому дефіциту уваги з гіперактивністю (ADНD), меланхолії.
7. Фармацевтична композиція, яка містить сполуку у відповідності з будь-яким з пп. 1-4 разом з фармацевтично прийнятним ексципієнтом.
8. Фармацевтична композиція за п. 7, яка містить сполуку у відповідності з п. 2 або 3.
9. Фармацевтична композиція за п. 7, де вказана композиція є пігулкою, одержаною вологою грануляцією і яка містить безводний гідрофосфат кальцію, кукурудзяний крохмаль, співполімер PVP-VA, мікрокристалічну целюлозу, натрію крохмалю гліколят, тальк і стеарат магнію.
10. Фармацевтична композиція за п. 9, яка містить, %:
сіль НВr
3-8
безводний гідрофосфат кальцію
35-45
кукурудзяний крохмаль
15-25
співполімер PVP-VA
2-6
мікрокристалічну целюлозу
20-30
натрію крохмалю гліколят
1-3
тальк
2-6
стеарат магнію
0,5-2.
11. Фармацевтична композиція за п. 9, яка містить, %:
сіль НВr
приблизно 5
безводний гідрофосфат кальцію
приблизно 39
кукурудзяний крохмаль
приблизно 20
співполімер PVP-VA
приблизно 3
мікрокристалічну целюлозу
приблизно 25
натрію крохмалю гліколят
приблизно 3
тальк
приблизно 4
стеарат магнію
приблизно 1.
12. Спосіб лікування когнітивних порушень і захворювань ЦНС, які супроводжуються когнітивними порушеннями, та які вибрані з афективних розладів, таких як депресія, загальний депресивний розлад, післяродова депресія, депресія, що асоціюється з біполярним розладом, хвороби Альцгеймера, психозу, пов’язаного зі старінням захворювання або хвороби Паркінсона, тривожності, генералізованого тривожного розладу, соціального тривожного розладу, обсесивно-компульсивного розладу, панічного розладу, панічних атак, стійкої до лікування депресії, синдрому дефіциту уваги з гіперактивністю (ADНD), меланхолії, при якому здійснюють введення терапевтично ефективної кількості сполуки у відповідності з будь-яким з пп. 1-4 пацієнтові, що потребує цього.
13. Застосування сполуки за будь-яким з пп. 1-4 для одержання лікарського засобу для лікування когнітивних порушень і захворювань ЦНС, які супроводжуються когнітивними порушеннями, та які вибрані з афективних розладів, таких як депресія, загальний депресивний розлад, післяродова депресія, депресія, що асоціюється з біполярним розладом, хвороби Альцгеймера, психозу, пов’язаного зі старінням захворювання або хвороби Паркінсона, тривожності, генералізованого тривожного розладу, соціального тривожного розладу, обсесивно-компульсивного розладу, панічного розладу, панічних атак, стійкої до лікування депресії, синдрому дефіциту уваги з гіперактивністю (ADНD), меланхолії.
14. Спосіб одержання сполуки формули
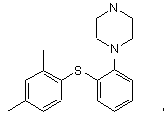
причому спосіб включає проведення реакції сполуки II
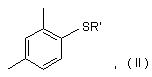
де R' є воднем або одновалентним іоном металу, із сполукою формули III
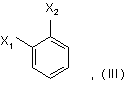
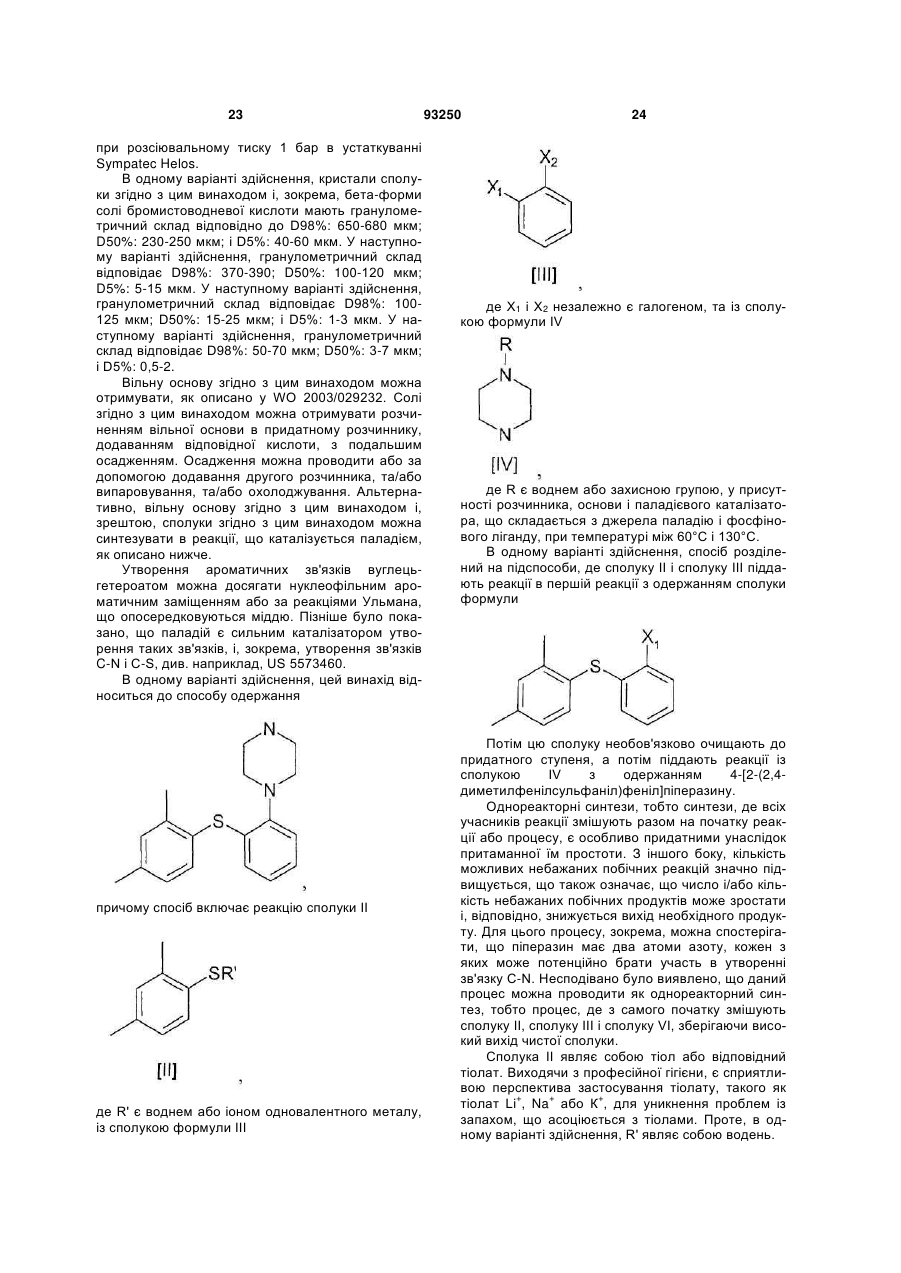
де Х1 і Х2 незалежно є галогеном, та із сполукою формули IV
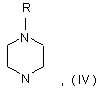
де R є воднем або захисною групою, у присутності розчинника, основи і паладієвого каталізатора, що складається з джерела паладію і фосфінового ліганду, при температурі між 60 °С і 130 °С.
15. Спосіб за п. 14, де сполуку II і сполуку ІІІ піддають взаємодії в першій реакції, і де продукт реакції
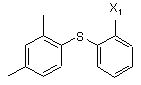
вказаної першої реакції необов'язково виділяють і очищають, з подальшою реакцією із сполукою IV.
16. Спосіб за п. 14, де сполуку II, сполуку III і сполуку IV змішують разом на початку процесу.
17. Спосіб за будь-яким з пп. 14-16, де Х1 і Х2 незалежно являють собою Вr або І.
18. Спосіб за п. 17, де Х1 являє собою Вr, а Х2 являє собою І.
19. Спосіб за будь-яким з пп. 14-18, який відрізняється тим, що вказаним розчинником є апротонний розчинник.
20. Спосіб за будь-яким з пп. 14-19, який відрізняється тим, що розчинник вибраний з толуолу, ксилолу, триетиламіну, трибутиламіну, діоксину або N-метилпіролідону.
21. Спосіб за п. 20, де розчинник являє собою толуол.
22. Спосіб за будь-яким з пп. 14-21, де джерело паладію вибране з Pddba2, Pd(OAc)2 і Pd2dba3.
23. Спосіб за п. 22, де вказане джерело паладію являє собою Pddba2 або Pd2dba3.
24. Спосіб за будь-яким з пп. 14-23, який відрізняється тим, що вказаний фосфіновий ліганд вибраний з:
2,2'-біс-дифенілфосфаніл-[1,1']бінафталенілу (rac-BINАР),
1,1'-біс(дифенілфосфіно)фероцену (DPPF),
біс-(2-дифенілфосфінофеніл)етеру (DPEphos),
тритретбутилфосфіну (солі Fu),
біфеніл-2-ілдитретбутилфосфіну,
біфеніл-2-ілдициклогексилфосфіну,
(2'-дициклогексилфосфанілбіфеніл-2-іл)диметиламіну,
[2'-(дитретбутилфосфаніл)біфеніл-2-іл]диметиламіну і
дициклогексил-(2',4',6'-трипропілбіфеніл-2-іл)фосфану.
25. Спосіб за п. 24, де вказаний фосфіновий ліганд являє собою rac-BINAP.
26. Спосіб за будь-яким з пп. 14-24, який відрізняється тим, що вказана основа вибрана з NaO(t-Bu), KO(t-Bu), Cs2CO3, DBU і DABCO.
27. Спосіб за п. 26, який відрізняється тим, що вказана основа являє собою NaO(t-Bu).
28. Спосіб за будь-яким з пп. 14-27, де R являє собою водень.
29. Спосіб за будь-яким з пп. 14-27, який відрізняється тим, що R є захисною групою, вибраною з Вос, Вn, Cbz, C(=O)Oet і Me.
30. Спосіб за будь-яким з пп. 14-29, який відрізняється тим, що R' являє собою водень.
31. Спосіб за будь-яким з пп. 14-30, який відрізняється тим, що температура становить між приблизно 80 °С і приблизно 120 °С.
32. Спосіб за п. 16, який включає стадії:
a) розчинення або диспергування 1-1,5 еквівалента сполук І, II і IІI в толуолі з одержанням суміші А;
b) додавання 1-2 мол. % Pddba2 і 1-2 мол. % rac-BINAP разом з 2-3 еквівалентами NaO(t-Bu) до суміші А з одержанням суміші В, яку нагрівають до приблизно 100 °С до повного перетворення сполук II і III;
с) підвищення температури суміші, одержаної на стадії b), до приблизно 120 °С до повного перетворення сполуки IV, і
d) необов'язково видалення захисної групи додаванням водної кислоти, якщо сполука IV являє собою захищений піперазин.
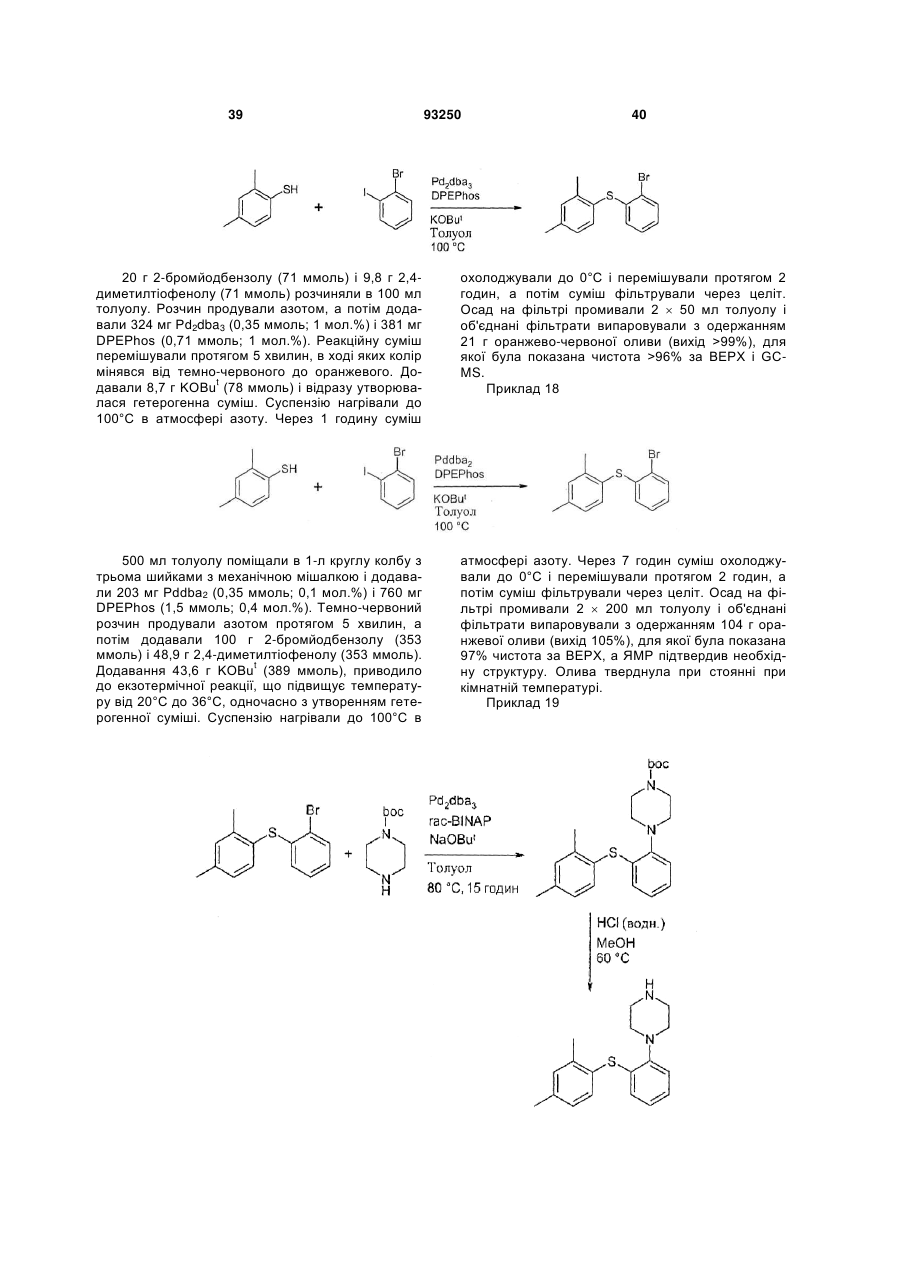
33. Спосіб за п. 16, який відрізняється тим, що 1-1,5 еквівалента 2,4-диметилтіолу, 1-бром-1-йодбензолу (або 1,2-дибромбензолу) і піперазину диспергують в толуолі, а потім додають 2-5 еквівалентів NaO(t-Bu) і 1-2 мол. % Pd2dba3 і rac-BINAP, диспергованих в толуолі, з одержанням суміші, яку нагрівають до 100-130 °С протягом 2-10 годин з одержанням продукту у вигляді 1-[2-(2,4-диметилфенілсульфаніл)феніл]піперазину.
34. Спосіб за п. 33, який відрізняється тим, що вказану суміш нагрівають до температури дефлегмації протягом 3-5 годин, і, причому, після цього процесу іде наступна стадія, в якій одержаний продукт далі піддають реакції з водною НВr з одержанням відповідної адитивної солі бромистоводневої кислоти.
35. Спосіб за п. 16, який відрізняється тим, що 2-5 еквівалентів NaO(t-Bu), 2-5 еквівалентів піперазину, 0,2-0,6 мол. % Pddba2 і 0,6-1 мол. % rac-BINAP диспергують в толуолі з одержанням суміші А', причому до цієї суміші додають приблизно 1 еквівалент 2-бромйодбензолу з одержанням суміші В', причому до цієї суміші додають 1 еквівалент 2,4-диметилтіофенолу і одержану суміш нагрівають до температури дефлегмації протягом 3-7 годин з одержанням 1-[2-(2,4-диметилфенілсульфаніл)феніл]піперазину.
36. Спосіб за п. 35, де вказану одержану суміш нагрівають до температури дефлегмації протягом 4-6 годин, і, причому, після цього процесу іде наступна стадія, в якій одержаний продукт далі піддають реакції з водною НВr з одержанням відповідної адитивної солі бромистоводневої кислоти.
37. Спосіб за будь-яким з пп. 14-33, який відрізняється тим, що здійснюють стадію додавання водної НВr до продукту

причому вказаний продукт необов'язково знаходиться в очищеній формі, з одержанням відповідної солі бромистоводневої кислоти.
38. Спосіб одержання адитивної солі 1-[2-(2,4-диметилфенілсульфаніл)феніл]піперазину з бромистоводневою кислотою, причому в цьому способі 1-1,5 еквівалента 2,4-диметилтіолу, 1-бром-1-йодбензолу (або 1,2-дибромбензолу) і піперазину диспергують в толуолі, а потім додають 2-5 еквівалентів NaO(t-Bu) і 1-2 мол. % Рd2dba3 і rac-BINAP, диспергованих в толуолі, з одержанням суміші, яку нагрівають до температури дефлегмації протягом 3-5 годин з одержанням продукту у вигляді 1-[2-(2,4-диметилфенілсульфаніл)феніл]піперазину, який далі піддають реакції з водною бромистоводневою кислотою.
39. Спосіб виготовлення адитивної солі 1-[2-(2,4-диметилфенілсульфаніл)феніл]-піперазину з бромистоводневою кислотою, причому в цьому способі 2-5 еквівалентів NaO(t-Bu), 2-5 еквівалентів піперазину, 0,2-0,6 мол. % Pddba2 і 0,6-1 мол. % rac-BINAP диспергують в толуолі з одержанням суміші А', причому до цієї суміші додають приблизно 1 еквівалент 2-бромйодбензолу з одержанням суміші В', причому до цієї суміші додають 1 еквівалент 2,4-диметилтіофенолу і одержану суміш нагрівають до температури дефлегмації протягом 4-6 годин з одержанням 1-[2-(2,4-диметилфенілсульфаніл)феніл]піперазину, який далі піддають реакції з водною бромистоводневою кислотою.
Текст
1. Кристалічна форма 1-[2-(2,4-диметилфенілсульфаніл)феніл]піперазину і його фармацевтично прийнятних солей, гідратів та сольватів, вибрана з кристалічної основи, гідроброміду (α), гідроброміду (β), гідроброміду (γ), гідроброміду (гідрату), гідроброміду (етилацетатного сольвату), гідрохлориду, гідрохлориду (моногідрату), мезилату, солі фумарової кислоти, солі малеїнової кислоти, солі мезовинної кислоти, солі L-(+)-винної кислоти, солі D-(-)-винної кислоти, солі сірчаної кислоти, дигідрофосфату, нітрату, де вказана сполука та її фармацевтично прийнятні солі, гідрати та сольвати характеризуються наступними відбиваннями на порошковій рентгенограмі (XRPD), 2 3 4. Кристалічна форма за п. 3, яка відрізняється тим, що має гранулометричний склад, що відповідає: D98%: 650-680 мкм; D50%: 230-250 мкм і D5%: 4060 мкм; D98%: 370-390; D50%: 100-120 мкм; D5%: 5-15 мкм; D98%: 100-125 мкм; D50%: 15-25 мкм і D5%: 1-3 мкм; або D98%: 50-70 мкм; D50%: 3-7 мкм і D5%: 0,5-2. 5. Кристалічна форма за будь-яким з пп. 1-4 для використання в терапії. 6. Кристалічна форма за будь-яким з пп. 1-4 для використання при лікуванні когнітивних порушень і захворювань ЦНС, які супроводжуються когнітивними порушеннями, та які вибрані з афективних розладів, таких як депресія, загальний депресивний розлад, післяродова депресія, депресія, що асоціюється з біполярним розладом, хвороби Альцгеймера, психозу, пов’язаного зі старінням захворювання або хвороби Паркінсона, тривожності, генералізованого тривожного розладу, соціального тривожного розладу, обсесивно-компульсивного розладу, панічного розладу, панічних атак, стійкої до лікування депресії, синдрому дефіциту уваги з гіперактивністю (ADНD), меланхолії. 7. Фармацевтична композиція, яка містить сполуку у відповідності з будь-яким з пп. 1-4 разом з фармацевтично прийнятним ексципієнтом. 8. Фармацевтична композиція за п. 7, яка містить сполуку у відповідності з п. 2 або 3. 9. Фармацевтична композиція за п. 7, де вказана композиція є пігулкою, одержаною вологою грануляцією і яка містить безводний гідрофосфат кальцію, кукурудзяний крохмаль, співполімер PVP-VA, мікрокристалічну целюлозу, натрію крохмалю гліколят, тальк і стеарат магнію. 10. Фармацевтична композиція за п. 9, яка містить, %: сіль НВr 3-8 безводний гідрофосфат кальцію 35-45 кукурудзяний крохмаль 15-25 співполімер PVP-VA 2-6 мікрокристалічну целюлозу 20-30 натрію крохмалю гліколят 1-3 тальк 2-6 стеарат магнію 0,5-2. 11. Фармацевтична композиція за п. 9, яка містить, %: сіль НВr приблизно 5 безводний гідрофосфат кальцію приблизно 39 кукурудзяний крохмаль приблизно 20 співполімер PVP-VA приблизно 3 мікрокристалічну целюлозу приблизно 25 натрію крохмалю гліколят приблизно 3 тальк приблизно 4 стеарат магнію приблизно 1. 12. Спосіб лікування когнітивних порушень і захворювань ЦНС, які супроводжуються когнітивними порушеннями, та які вибрані з афективних розладів, таких як депресія, загальний депресивний ро 93250 4 злад, післяродова депресія, депресія, що асоціюється з біполярним розладом, хвороби Альцгеймера, психозу, пов’язаного зі старінням захворювання або хвороби Паркінсона, тривожності, генералізованого тривожного розладу, соціального тривожного розладу, обсесивно-компульсивного розладу, панічного розладу, панічних атак, стійкої до лікування депресії, синдрому дефіциту уваги з гіперактивністю (ADНD), меланхолії, при якому здійснюють введення терапевтично ефективної кількості сполуки у відповідності з будь-яким з пп. 1-4 пацієнтові, що потребує цього. 13. Застосування сполуки за будь-яким з пп. 1-4 для одержання лікарського засобу для лікування когнітивних порушень і захворювань ЦНС, які супроводжуються когнітивними порушеннями, та які вибрані з афективних розладів, таких як депресія, загальний депресивний розлад, післяродова депресія, депресія, що асоціюється з біполярним розладом, хвороби Альцгеймера, психозу, пов’язаного зі старінням захворювання або хвороби Паркінсона, тривожності, генералізованого тривожного розладу, соціального тривожного розладу, обсесивно-компульсивного розладу, панічного розладу, панічних атак, стійкої до лікування депресії, синдрому дефіциту уваги з гіперактивністю (ADНD), меланхолії. 14. Спосіб одержання сполуки формули N N S , причому спосіб включає проведення реакції сполуки II SR' , ( II ) де R' є воднем або одновалентним іоном металу, із сполукою формули III X2 X1 , ( III ) де Х1 і Х2 незалежно є галогеном, та із сполукою формули IV R N N , ( IV ) де R є воднем або захисною групою, у присутності розчинника, основи і паладієвого каталізатора, що складається з джерела паладію і фосфінового ліганду, при температурі між 60 °С і 130 °С. 5 15. Спосіб за п. 14, де сполуку II і сполуку ІІІ піддають взаємодії в першій реакції, і де продукт реакції X1 S вказаної першої реакції необов'язково виділяють і очищають, з подальшою реакцією із сполукою IV. 16. Спосіб за п. 14, де сполуку II, сполуку III і сполуку IV змішують разом на початку процесу. 17. Спосіб за будь-яким з пп. 14-16, де Х1 і Х2 незалежно являють собою Вr або І. 18. Спосіб за п. 17, де Х1 являє собою Вr, а Х2 являє собою І. 19. Спосіб за будь-яким з пп. 14-18, який відрізняється тим, що вказаним розчинником є апротонний розчинник. 20. Спосіб за будь-яким з пп. 14-19, який відрізняється тим, що розчинник вибраний з толуолу, ксилолу, триетиламіну, трибутиламіну, діоксину або N-метилпіролідону. 21. Спосіб за п. 20, де розчинник являє собою толуол. 22. Спосіб за будь-яким з пп. 14-21, де джерело паладію вибране з Pddba2, Pd(OAc)2 і Pd2dba3. 23. Спосіб за п. 22, де вказане джерело паладію являє собою Pddba2 або Pd2dba3. 24. Спосіб за будь-яким з пп. 14-23, який відрізняється тим, що вказаний фосфіновий ліганд вибраний з: 2,2'-біс-дифенілфосфаніл-[1,1']бінафталенілу (racBINАР), 1,1'-біс(дифенілфосфіно)фероцену (DPPF), біс-(2-дифенілфосфінофеніл)етеру (DPEphos), тритретбутилфосфіну (солі Fu), біфеніл-2-ілдитретбутилфосфіну, біфеніл-2-ілдициклогексилфосфіну, (2'-дициклогексилфосфанілбіфеніл-2іл)диметиламіну, [2'-(дитретбутилфосфаніл)біфеніл-2іл]диметиламіну і дициклогексил-(2',4',6'-трипропілбіфеніл-2іл)фосфану. 25. Спосіб за п. 24, де вказаний фосфіновий ліганд являє собою rac-BINAP. 26. Спосіб за будь-яким з пп. 14-24, який відрізняється тим, що вказана основа вибрана з NaO(tBu), KO(t-Bu), Cs2CO3, DBU і DABCO. 27. Спосіб за п. 26, який відрізняється тим, що вказана основа являє собою NaO(t-Bu). 28. Спосіб за будь-яким з пп. 14-27, де R являє собою водень. 29. Спосіб за будь-яким з пп. 14-27, який відрізняється тим, що R є захисною групою, вибраною з Вос, Вn, Cbz, C(=O)Oet і Me. 30. Спосіб за будь-яким з пп. 14-29, який відрізняється тим, що R' являє собою водень. 31. Спосіб за будь-яким з пп. 14-30, який відрізняється тим, що температура становить між приблизно 80 °С і приблизно 120 °С. 32. Спосіб за п. 16, який включає стадії: 93250 6 a) розчинення або диспергування 1-1,5 еквівалента сполук І, II і IІI в толуолі з одержанням суміші А; b) додавання 1-2 мол. % Pddba2 і 1-2 мол. % racBINAP разом з 2-3 еквівалентами NaO(t-Bu) до суміші А з одержанням суміші В, яку нагрівають до приблизно 100 °С до повного перетворення сполук II і III; с) підвищення температури суміші, одержаної на стадії b), до приблизно 120 °С до повного перетворення сполуки IV, і d) необов'язково видалення захисної групи додаванням водної кислоти, якщо сполука IV являє собою захищений піперазин. 33. Спосіб за п. 16, який відрізняється тим, що 11,5 еквівалента 2,4-диметилтіолу, 1-бром-1йодбензолу (або 1,2-дибромбензолу) і піперазину диспергують в толуолі, а потім додають 2-5 еквівалентів NaO(t-Bu) і 1-2 мол. % Pd2dba3 і racBINAP, диспергованих в толуолі, з одержанням суміші, яку нагрівають до 100-130 °С протягом 2-10 годин з одержанням продукту у вигляді 1-[2-(2,4диметилфенілсульфаніл)феніл]піперазину. 34. Спосіб за п. 33, який відрізняється тим, що вказану суміш нагрівають до температури дефлегмації протягом 3-5 годин, і, причому, після цього процесу іде наступна стадія, в якій одержаний продукт далі піддають реакції з водною НВr з одержанням відповідної адитивної солі бромистоводневої кислоти. 35. Спосіб за п. 16, який відрізняється тим, що 25 еквівалентів NaO(t-Bu), 2-5 еквівалентів піперазину, 0,2-0,6 мол. % Pddba2 і 0,6-1 мол. % racBINAP диспергують в толуолі з одержанням суміші А', причому до цієї суміші додають приблизно 1 еквівалент 2-бромйодбензолу з одержанням суміші В', причому до цієї суміші додають 1 еквівалент 2,4-диметилтіофенолу і одержану суміш нагрівають до температури дефлегмації протягом 3-7 годин з одержанням 1-[2-(2,4диметилфенілсульфаніл)феніл]піперазину. 36. Спосіб за п. 35, де вказану одержану суміш нагрівають до температури дефлегмації протягом 4-6 годин, і, причому, після цього процесу іде наступна стадія, в якій одержаний продукт далі піддають реакції з водною НВr з одержанням відповідної адитивної солі бромистоводневої кислоти. 37. Спосіб за будь-яким з пп. 14-33, який відрізняється тим, що здійснюють стадію додавання водної НВr до продукту N N S , причому вказаний продукт необов'язково знаходиться в очищеній формі, з одержанням відповідної солі бромистоводневої кислоти. 38. Спосіб одержання адитивної солі 1-[2-(2,4диметилфенілсульфаніл)феніл]піперазину з бромистоводневою кислотою, причому в цьому способі 1-1,5 еквівалента 2,4-диметилтіолу, 1-бром-1 7 93250 8 йодбензолу (або 1,2-дибромбензолу) і піперазину диспергують в толуолі, а потім додають 2-5 еквівалентів NaO(t-Bu) і 1-2 мол. % Рd2dba3 і racBINAP, диспергованих в толуолі, з одержанням суміші, яку нагрівають до температури дефлегмації протягом 3-5 годин з одержанням продукту у вигляді 1-[2-(2,4-диметилфенілсульфа-ніл)феніл]піперазину, який далі піддають реакції з водною бромистоводневою кислотою. 39. Спосіб виготовлення адитивної солі 1-[2-(2,4диметилфенілсульфаніл)феніл]-піперазину з бромистоводневою кислотою, причому в цьому спо собі 2-5 еквівалентів NaO(t-Bu), 2-5 еквівалентів піперазину, 0,2-0,6 мол. % Pddba2 і 0,6-1 мол. % rac-BINAP диспергують в толуолі з одержанням суміші А', причому до цієї суміші додають приблизно 1 еквівалент 2-бромйодбензолу з одержанням суміші В', причому до цієї суміші додають 1 еквівалент 2,4-диметилтіофенолу і одержану суміш нагрівають до температури дефлегмації протягом 46 годин з одержанням 1-[2-(2,4-диметилфенілсульфаніл)феніл]піперазину, який далі піддають реакції з водною бромистоводневою кислотою. Галузь техніки, до якої відноситься винахід Цей винахід відноситься до сполук, які демонструють активність відносно інгібування зворотного захоплення серотоніну у поєднанні з активністю відносно рецептора серотоніну 1A (5-HT1A) і рецептора серотоніну 3 (5-НТ3) і які по суті придатні для лікування пов'язаних з ЦНС захворювань. Попередній рівень техніки Селективні інгібітори зворотного захоплення серотоніну (SSRI) багато років були лікарськими засобами першого вибору для лікування певних пов'язаних з ЦНС захворювань, зокрема, депресії, тривоги і соціальних фобій, оскільки вони є ефективними, добре переносяться і мають сприятливий профіль безпеки в порівнянні з вживаними раніше сполуками, тобто з класичними трициклічними сполуками. Проте, медикаментозне лікування з використанням SSRI утруднене у значної частини несприйнятливих пацієнтів, тобто у пацієнтів, які не відповідають на лікування SSRI або відповідають на нього тільки в обмеженому ступені. Більш того, як правило, ефект лікування SSRI не виявляється протягом декількох тижнів лікування. В цілях подолання деяких з цих недоліків лікування SSRI, психіатри іноді застосовують стратегії посилення. Посилення антидепресантів можна забезпечувати, наприклад, комбінуванням із стабілізаторами настрою, такими як карбонат літію або трийодтиронін, або за допомогою одночасного застосування електрошоку. Відомо, що поєднання інгібування транспортера серотоніну (SERT) з активністю у відношенні одного або декількох рецепторів серотоніну може бути переважним. Раніше було виявлено, що поєднання інгібітора зворотного захоплення серотоніну із сполукою, що має антагоністичний або зворотний агоністичний ефект на 5-НТ2С (сполуки, що мають негативну дію на рецептор 5-НТ2С), забезпечує значне підвищення рівня 5-НТ (серотоніну) в термінальних ділянках, при вимірюванні в експериментах з мікродіалізом (WO 01/41701). Це може привести до швидкого початку дії антидепресанту в клініці і до посилення або потенціювання терапевтичного ефекту інгібітора зворотного захоплення серотоніну (SRI). Аналогічно, було описано, що поєднання піндололу, який є частковим агоністом 5-НТ1А, з інгібітором зворотного захоплення серотоніну приво дить до швидкої появи ефекту [Psych. Res., 125, 81-86, 2004]. Пов'язані з CNS захворювання, такі як, наприклад, депресія, тривога і шизофренія, часто супроводжуються іншими розладами або дисфункціями, такими як когнітивні розлади або порушення [Scand.J. Psych., 43, 239-251, 2002; Am.J.Psych, 158, 1722-1725, 2001]. Вважають, що в нейрональні процеси, регулюючі пізнання, залучено декілька нейротрансмітерів. Зокрема, холінергічна система грає значну роль в пізнанні, і сполуки, що впливають на холінергічну систему, таким чином, потенційно придатні для лікування когнітивного порушення. Відомо, що сполуки, які впливають на рецептор 5-НТ1А і/або рецептор 5-НТ3, впливають на холінергічну систему, і вони самостійно можуть бути придатними для лікування когнітивного порушення. Таким чином, можна чекати, що сполука, яка виявляє активність стосовно рецептора 5-НТ1А і/або 5-НТ3, є придатною для лікування когнітивного порушення. Сполука, яка, більш того, виявляє активність SERT, може бути особливо придатною для лікування когнітивного порушення у пацієнтів з депресією, оскільки така сполука також може забезпечити швидкий початок лікування депресії. У WO 03/029232 описано, наприклад, сполуку 1-[2-(2,4-диметилфенілсульфаніл)-феніл]піперазин (приклад 1е) як сполуку, що має активність SERT. Суть винаходу Автори цього винаходу несподівано виявили, що 1-[2-(2,4-диметилфенілсульфаніл)-феніл]піперазин приводить до поєднання інгібування SERT, антагонізму 5-НТ3 і часткового агонізму 5-НТ1А. Таким чином, в одному варіанті здійснення цей винахід відноситься до сполуки І, яка являє собою 1-[2-(2,4-диметилфенілсульфаніл)феніл]піперазин, і до її фармацевтично прийнятних солей, за умови, що вказана сполука не є вільною основою в некристалічній формі. У одному варіанті здійснення, цей винахід відноситься до застосування сполуки І в терапії. У одному варіанті здійснення, цей винахід відноситься до фармацевтичної композиції, яка містить сполуку І. У одному варіанті здійснення, цей винахід відноситься до способів лікування, які включають введення ефективної кількості сполуки І пацієнтові, що потребує цього. 9 У одному варіанті здійснення, цей винахід відноситься до застосування сполуки І для одержання лікарського засобу. Стислий опис ілюстративних матеріалів Фіг.1: XRPD (порошкова рентгенівська дифрактограма) кристалічної основи; Фіг.2: XRPD альфа-форми солі бромистоводневої кислоти; Фіг.3: XRPD бета-форми солі бромистоводневої кислоти; Фіг.4: XRPD гама-форми солі бромистоводневої кислоти; Фіг.5: XRPD гемігідрату солі бромистоводневої кислоти; Фіг.6: XRPD суміші етилацетатного сольвату і альфа-форми солі бромистоводневої кислоти; Фіг.7: XRPD солі хлористоводневої кислоти; Фіг.8: XRPD моногідрату солі хлористоводневої кислоти; Фіг.9: XRPD мезилатної солі; Фіг.10: XRPD солі фумарової кислоти; Фіг.11: XRPD солі малеїнової кислоти; Фіг.12: XRPD солі мезо-винної кислоти; Фіг.13: XRPD солі L-(+)-винної кислоти; Фіг.14: XRPD солі D-(-)-винної кислоти; Фіг.15: XRPD сульфатної солі; Фіг.16: XRPD фосфатної солі; Фіг.17: XRPD нітратної солі; Фіг.18: ефект сполук згідно з цим винаходом в тесті з внутрішньошкірним введенням формаліну. По осі X показана кількість сполуки, що вводиться; по осі Υ показана кількість часу (сек.), витрачена на вилизування лапи. Фіг.18а: відповідь в періоді 0-5 хвилин; Фіг.18b: відповідь в періоді 20-30 хвилин; Фіг.19а: позаклітинні рівні ацетилхоліну (Ach) в префронтальній корі у щурів, що вільно пересуваються, при введенні солі 1-[2-(2,4диметилфенілсульфаніл)феніл]-піперазину з НВr. Фіг.19b: позаклітинні рівні ацетилхоліну у вентральному гіпокампі у щурів, що вільно пересуваються, при введенні солі 1-[2-(2,4диметилфенілсульфаніл)феніл]-піперазину з НВr. Фіг.20: вплив солі 1-[2-(2,4диметилфенілсульфаніл)феніл]піперазину з НВr на прояв стану ситуативного умовнорефлекторного страху у щурів Sprague-Dawley при введенні за 60 хвилин до навчання. Завмирання оцінювали протягом 58-секундного періоду звикання перед шоком лап (безумовний подразник (US)) (навчання перед шоком) (білі стовпці). Завмирання визначали через 24 години після навчання (тест ретенції) (чорні стовпці). Фіг.21: вплив солі 1-[2-(2,4диметилфенілсульфаніл)феніл]піперазину з НВr на прояв стану ситуативного умовнорефлекторного страху у щурів Sprague-Dawley при введенні за 1 годину до тесту ретенції. Завмирання оцінювали протягом 58 секунд перед шоком лап (безумовний подразник (US)) (навчання) (білі стовпці). Завмирання визначали через 24 години після навчання (тест ретенції) (чорні стовпці). Фіг.22: вплив АА21004 на прояв стану ситуативного умовно-рефлекторного страху у щурів Sprague-Dawley при введенні відразу після на 93250 10 вчання. Завмирання оцінювали протягом 58 секунд перед шоком лап US (навчання перед шоком) (білі стовпці). Завмирання визначали через 24 години після навчання (тест ретенції) (чорні стовпці). Докладний опис винаходу Цей винахід відноситься до сполуки І, 1-[2-(2,4диметилфенілсульфаніл)феніл]-піперазину, структура якої є наступною і до її фармацевтично прийнятних солей, за умови, що сполука І не є вільною основою в некристалічній формі. В одному варіанті здійснення, вказаними фармацевтично прийнятними солями є кислотноадитивні солі кислот, які є нетоксичними. Вказані солі включають солі, одержані з органічних кислот, таких як малеїнова, фумарова, бензойна, аскорбінова, бурштинова, щавлева, бісметиленсаліцилова, метансульфонова, етандисульфонова, оцтова, пропіонова, винна, саліцилова, лимонна, глюконова, молочна, яблучна, мигдалева, корична, цитраконова, аспарагінова, стеаринова, пальмітинова, ітаконова, гліколева, памінобензойна, глутамінова, бензолсульфонова, теофіліноцтові кислоти, а також 8галогентеофіліни, наприклад, 8-бромтеофілін. Також вказані солі можна отримувати з неорганічних солей, таких як солі хлористоводневої, бромистоводневої, сірчаної, сульфамінової, фосфорної і азотної кислот. Конкретно згадуються солі, одержані з метансульфонової кислоти, малеїнової кислоти, фумарової кислоти, мезо-винної кислоти, (+)винної кислоти, (-)-винної кислоти, хлористоводневої кислоти, бромистоводневої кислоти, сірчаної кислоти, фосфорної кислоти і азотної кислоти. Окремо згадується сіль бромистоводневої кислоти. Пероральні дозовані форми і, зокрема пігулки, часто є переважними для пацієнтів і лікаря, унаслідок простоти введення і, отже, кращого дотримання схеми лікування. Для пігулок переважно, щоб активні інгредієнти були кристалічними. В одному варіанті здійснення, сполуки згідно з цим винаходом є кристалічними. В одному варіанті здійснення кристали згідно з цим винаходом є сольватами, тобто кристалами, де молекули розчинника утворюють частину кристалічної структури. Сольват може бути утворений з води, і в цьому випадку сольвати часто називають гідратами. Альтернативно, сольвати можуть бути утворені з іншими розчинниками, такими як, наприклад, етанол, ацетон або етилацетат. Точна 11 кількість сольвату часто залежить від умов. Наприклад, гідрати, як правило, втрачатимуть воду при підвищенні температури або при зниженні відносної вологості. В одному варіанті здійснення, сполуки згідно з цим винаходом є несольватованими кристалами. Деякі сполуки є гігроскопічними, тобто поглинають воду під впливом вологості. Гігроскопічність, як правило, вважають за небажану властивість сполук, які призначені для присутності у фармацевтичному складі, зокрема в сухому складі, такому як пігулки. В одному варіанті здійснення, цей винахід відноситься до кристалів з низькою гігроскопічністю. Для пероральних дозованих форм з використанням кристалічних активних інгредієнтів, також є переважним, якщо вказані кристали є строго визначеними. У даному контексті, термін "строго визначений", зокрема, означає, що стехіометрія є строго визначеною, тобто що співвідношення між створюючими сіль іонами являє собою співвідношення між невеликими числами, таке як 1:1, 1:2, 2:1, 1:1:1 і так далі. В одному варіанті здійснення, сполуки згідно з цим винаходом є строго визначеними кристалами. 93250 12 Кристалічні сполуки згідно з цим винаходом можуть існувати більш ніж в одній формі, тобто вони можуть існувати в поліморфних формах. Поліморфні форми існують, якщо сполука може кристалізуватися більш ніж в одній формі. Мається на увазі, що цей винахід охоплює усі такі поліморфні форми або як чисті сполуки, або як їх суміші. В одному варіанті здійснення, сполуки згідно з цим винаходом знаходяться в очищеній формі. Мається на увазі, що термін "очищена форма" указує на те, що сполука по суті не містить інші сполуки або інші форми тієї ж сполуки, залежно від обставин. В одному варіанті здійснення, цей винахід відноситься до кристалічних солей сполук згідно з цим винаходом з XRDP (порошкова рентгенівська дифрактограма), як показано на Фіг.1-17, і зокрема на Фіг.2, 3, 4 і 5. У таблиці, представленій нижче, показані основні відбиття XRDP для сполук згідно з цим винаходом. Вибрані рентгенівські пікові положення (°2), всі значення +-0,1 ° Таблиця Кристалічна основа - гідробромід () - гідробромід () - гідробромід () - гідробромід (гідрат) - гідробромід (етилацетатний сольват) - гідрохлорид - гідрохлорид (моногідрат) - мезилат - фумарова кислота - малеїнова кислота - мезо-винна кислота - L-(+)-винна кислота - D-(-)-винна кислота - сірчана кислота - дигідрофосфат - нітрат Як очевидно слідує, наприклад, з Фіг.2-5, сполуки згідно з цим винаходом, у разі солі бромистоводневої кислоти, можуть існувати в декількох формах, тобто бути поліморфними. Поліморфні форми мають різні властивості, як показано в прикладі 4d. Бета-форма солі бромистоводневої кислоти є більш стабільною, що підтверджується більш високою температурою плавлення DSC і більш низькою розчинністю. Більш того, бетаформа має привабливе поєднання низької гігроскопічності і розчинності, що робить цю сполуку особливо придатною для виготовлення пігулок. Таким чином, в одному варіанті здійснення, цей винахід відноситься до солі 1-[2-(2,4диметилфенілсульфаніл)-феніл]піперазину і бромистоводневої кислоти з відбиттями за XRDP при приблизно 6,89, 9,73, 13,78 і 14,62 (°2), і зокрема з XRPD, як показано на Фіг.3. 11,10 5,85 6,89 11,82 10,69 8,29 9,41 7,72 8,93 5,08 9,72 9,51 13,32 13,32 11,82 7,91 12,50 16,88 9,30 9,73 16,01 11,66 13,01 12,37 13,45 13,39 11,32 13,19 10,17 13,65 13,65 17,22 11,83 17,41 17,42 17,49 13,78 17,22 15,40 13,39 19,66 15,39 15,22 17,12 14,72 16,10 14,41 14,41 17,72 15,69 18,12 22,23 18,58 14,62 18,84 17,86 16,62 22,55 17,10 17,09 18,04 17,88 25,58 15,80 15,80 20,13 17,24 18,47 Розчинність активного інгредієнта також має значення для вибору дозованої форми, оскільки вона може мати прямий вплив на біодоступність. Вважають, що для пероральних дозованих форм, як правило, є сприятливою більш висока розчинність активного інгредієнта, оскільки вона підвищує біодоступність. Кортикальна і гіпокампальна холінергічна нейротрансмісія має велике значення для пізнання, і ряд доклінічних спостережень вказує на важливість рецептора серотоніну 1А (5-НТ1А) для цієї системи. Т. Koyama в Neurosci. Lett., 265, 33-36, 1999, повідомляє, що агоніст 5-НТ1А BAYX3702 підвищує вихід ацетилхоліну з кори і гіпокампу у щурів. Цікаво, що антагоніст 5-НТ1А WAY-100635 здатний усувати ефект BAYX3702, показуючи, що ефект BAYX3702 опосередковується 5-НТ1А.· У ряді досліджень описаний вплив модуляторів 5-НТ1А на когнітивне порушення. А. Meneses в 13 Neurobiol. Learn. Memory, 71, 207-218, 1999, повідомляє, що частковий агоніст 5-НТ1А (±)-8гідрокси-2-(ди-н-пропіламіно)тетралін, НСl (8-OHDPAT) сприяє консолідації навчання у нормальних щурів і нормалізує когнітивні функції у щурів з когнітивними порушеннями. Ці доклінічні спостереження також, як виявилось, відбилися в клініці. Т. Sumiyoshi в Am.J. Psych., 158, 1722-1725, 2001, повідомляє про дослідження, де пацієнти отримували типові антипсихотичні засоби, такі як галоперидол, сульпірид і пімозид, усі з яких позбавлено активності 5-НТ1А, у поєднанні з плацебо або тандоспіроном, який є агоністом 5-НТ1А. У пацієнтів, які окрім антипсихотичного засобу отримували тандоспірон, було видно поліпшення в їх пізнавальній роботі, тоді як у пацієнтів, які отримували плацебо, не було видно поліпшення. Аналогічно, атипові антипсихотичні засоби, такі як клозапін, які також є агоністами 5НТ1А, підсилюють пізнання у пацієнтів з шизофренією, тоді як типові антипсихотичні засоби, такі як галоперидол, які не мають активності щодо 5-НТ1А, не підсилюють його, Y. Chung, Brain Res., 1023, 5463, 2004. Як згадувалося вище, вважають, що холінергічна система залучена в нейрональні процеси, регулюючі пізнання, і холінергічна система може піддаватися інгібіторному контролю за допомогою рецептора серотоніну 3 (5-НТ3) [(Giovannini et al, J. Pharmacol Exp Ther 1998, 285:1219-1225; Costall and Naylor, Current Drug Targets - CNS & Neurobiol Disord 2004, 3:27-37)]. У тесті навчання у мишей, в посиленому завданні, що чергується, з Т-подібним лабіринтом, і в завданні на відмінність об'єктів і переробку навику у мавп, ондансетрон знижував порушення, викликані мускариновим антагоністом, скополаміном, або осередки пошкодження холінергічних каскадів, що виникають з базального ядра (Barnes et al, Pharamcol Biochem Behav 1990, 35: 955-962; Carey et al, Pharamcol Biochem Behav 1992, 42: 75-83). Boast та інші (Neurobiol Learn Mem 1999, 71: 259271) використовували МК-801, неконкурентний антагоніст рецептора NMDA, для припинення когнітивної роботи у щурів, навчених на завданні з відстроченим не співпадаючим із зразком радіальним лабіринтом. Було показано, що ондансетрон блокує когнітивне порушення. Більш того, в дослідженні амнестичного ефекту етанолу у мишей в завданні пасивного уникнення, цей амнестичний ефект етанолу практично відновлювався до норми за допомогою ондансетрону (Napiorkowska-Pawlak et al, Fundam Clin pharmacol 2000, 14: 125-131). Таким чином, полегшення холінергічної трансмісії за допомогою антагонізму 5-НТ3 після порушення холінергічної системи в доклінічних моделях (DiezAriza et al, Psychopharmacology 2003, 169: 35-41; Gil-Bea et al, Neuropharmcol 2004, 47: 225-232), підтверджує підставу для застосування цього лікування в цілях терапії когнітивних порушень. У рандомізованому подвійному сліпому перехресному дослідженні у здорових чоловіків, оцінка вербальної і просторової пам'яті і фіксованої уваги показала, що антагоніст 5-НТ3, алосетрон, послаблює індукований скополаміном дефіцит вербаль 93250 14 ної і просторової пам'яті (Preston, Recent Advances in the treatment of Neurodegenerative disorders and cognitive function, 1994, (eds.) Racagni and Langer, Basel Karger, p. 89-93). Нарешті, вважають, що сполуки, що виявляють часткову агоністичну активність 5-НТ1А у поєднанні з антагоністичною активністю 5-НТ3, є особливо придатними для лікування когнітивного порушення. Сполуки, які, крім того, виявляють інгібування зворотного захоплення серотоніну, можуть бути особливо придатними для лікування когнітивного порушення, що асоціюється з депресією, оскільки інгібування зворотного захоплення серотоніну у поєднанні з частковим агонізмом 5НТ1А приведе до більш швидкої появи ефекту лікування депресії. Як показано в прикладі 1, сполуки згідно з цим винаходом є сильними інгібіторами транспортера серотоніну людини, тобто вони інгібують зворотне захоплення серотоніну. Більш того, сполуки є сильними антагоністами рецептора 5-НТ3 мишей, щурів, морських свинок і собак. Було виявлено, що сполуки є антагоністами рецептора 5-НТ3 людини, клонованого в ооцити, в низьких концентраціях (ІС50 приблизно 30 нМ), тоді як у більш високих концентраціях сполуки демонструють агоністичні властивості (ED50=2,1 мкМ). Подальше застосування сполук згідно з цим винаходом у високій концентрації не показало будь-якої агоністичної відповіді, що може бути наслідком швидкого зменшення чутливості або прямого антагонізму in vitro. Таким чином, при низьких концентраціях,сполуки згідно з цим винаходом виявляють виражений антагонізм рецептора 5-НТ3 людини, як спостерігалося для рецептора 5-НТ3 з інших видів. Сполуки згідно з цим винаходом зв'язуються з рецептором 5-НТ1А з дуже низькою афінністю в гомогенаті головного мозку як щурів, так і мишей. Проте, сполуки згідно з цим винаходом зв'язуються з рецептором 5-НТ1А людини з Ki, що становить 40 нМ. Більш того, функціональні дані показують, що сполуки згідно з цим винаходом є частковими агоністами рецептора 5-НТ1А людини, які демонструють ефективність у 85%. Очікується, що активність згідно з цим винаходом на SERT, рецептори 5-НТ3 і 5-НТ1А вносить внесок в профіль сполуки у людини in vivo. Як показано в прикладі 26, сполуки згідно з цим винаходом приводять до підвищення позаклітинного рівня ацетилхоліну в префронтальній корі і вентральному гіпокампі у щурів. Очікується, що ці доклінічні дані перейдуть в клінічний ефект при лікуванні когнітивних порушень, що можна порівняти із застосуванням інгібіторів ацетилхолінестерази при лікуванні когнітивних порушень, наприклад при хворобі Альцгеймера. Подальше підтвердження цього можна знайти в прикладі 27, де дані показують, що сполуки згідно з цим винаходом підсилюють ситуативну пам'ять у щурів. В цілому, фармакологічний профіль сполук згідно з цим винаходом у поєднанні з впливом на рівні ацетилхоліну і пам'ять у щурів строго підтверджує, що сполуки згідно з цим винаходом придатні для лікування когнітивного порушення. 15 В одному варіанті здійснення, цей винахід відноситься до способу лікування когнітивних розладів або когнітивного порушення, де вказаний спосіб включає введення терапевтично ефективної кількості сполуки згідно з цим винаходом пацієнтові, що потребує цього. Когнітивні розлади або когнітивне порушення включають зміну когнітивних функцій або когнітивних доменів, наприклад, робочої пам'яті, уваги і активної уваги, вербального навчання і пам'яті, зорового навчання і пам'яті, міркування і здатності вирішувати завдання, наприклад, виконавчої функції, швидкості обробки інформації і/або соціального пізнання. Зокрема, на когнітивні розлади або когнітивне порушення можуть указувати дефіцит уваги, дезорганізоване мислення, повільне мислення, трудність розуміння, слабка концентрація, порушення здатності вирішувати завдання, слабка пам'ять, трудність виразу думок і/або трудність інтеграції думок, відчуттів і поведінки, або трудність гальмування неістотних думок. Мається на увазі, що терміни "когнітивні розлади" і "когнітивне порушення" вказують на одне і те ж, і їх використовують взаємозамінним чином. У одному варіанті здійснення, у вказаного пацієнта також діагностовано інший розлад ЦНС, такий як афективні розлади, такі як депресія; генералізована депресія; загальний депресивний розлад; тривожні розлади, що включають генералізований тривожний розлад і панічний розлад; обсесивно-компульсивний розлад; шизофренія; хвороба Паркінсона; деменція; деменція, пов'язана зі СНІДом; ADHD; асоційоване із старінням порушення пам'яті; або хвороба Альцгеймера. Когнітивне порушення відноситься до класичних ознак депресії, такої як, наприклад, загальний депресивний розлад. Когнітивні порушення можуть бути в деякій мірі вторинними щодо депресії в тому сенсі, що поліпшення депресивного стану також приведе до поліпшення когнітивного порушення. Проте, також існує переконливий доказ того, що когнітивні порушення, насправді, не залежать від депресії. Наприклад, дослідження показали тривале когнітивне порушення при одужанні від депресії [J.Nervous Mental Disease, 185, 748-754, 197]. Більш того, диференціальний вплив антидепресантів на депресію і когнітивні порушення забезпечує подальше підтвердження уявлення про те, що депресія і когнітивне порушення є незалежними, хоча і часто сумісними, станами. Незважаючи на те, що лікарські засоби на основі серотоніну і норадреналіну забезпечують порівнянне поліпшення симптомів депресії, деякі дослідження показали, що модуляція норадренергічної системи не покращує когнітивні функції настільки, наскільки модуляція серотоніну [Brain Res. Bull, 58, 345-350, 2002; Hum Psychpharmacol, 8, 41-47, 1993]. Вважають, що лікування когнітивного порушення у пацієнтів з депресією введенням сполук згідно з цим винаходом має конкретні переваги. Чекають, що багатогранна фармакологія сполук згідно з цим винаходом, зокрема відносно SERT, 5-НТ3 і 5-НТ1А, приведе до поліпшення когнітивного функціонування у поєднанні зі швидким початком лікування депресивного стану. 93250 16 Когнітивне порушення є особливо важливим чинником у літніх людей. Когнітивне порушення в нормі зростає з віком, і, крім того, при депресії. Таким чином, в одному варіанті здійснення, пацієнт, що підлягає лікуванню від когнітивного порушення, є літньою людиною, і, зокрема, літньою людиною з депресією. Когнітивні функції, як згадано вище, часто порушуються у пацієнтів з шизофренією. Дослідження також привели до висновку, що когнітивне функціонування асоційоване з професійним функціонуванням при шизофренії [Scizophrenia Res., 45, 175-184, 2000]. В одному варіанті здійснення, пацієнтом, що потребує лікування від когнітивного порушення, є шизофренік. Антагоністи рецептора 5-НТ3, крім того, були запропоновані для лікування захворювань, таких як блювота, індукована хіміотерапією блювота, пристрасті, зловживання психоактивними речовинами, біль, синдром роздратованої кишки (IBS), шизофренія і розлади харчування [Eur. J. Pharmacol, 560, 1-8, 2007; Pharmacol. Therapeut., 111,855-876,2006; Alimentary Pharmacol. Ther., 24, 183-205,2006]. Клінічні дослідження показують, що поєднання міртазипіну і SSRI є кращим, ніж SSRI окремо, відносно лікування пацієнтів з депресією з недостатньою клінічною відповіддю (стійкою до лікування депресією (TRD) або рефрактерною депресією) [Psychother. Psychosom., 75, 139-153, 2006]. Міртазапін являє собою антагоніст 5-НТ2 і 5-НТ3, який обґрунтовує уявлення, що сполуки згідно з цим винаходом придатні для лікування TRD. Приливи крові є симптомом, що асоціюється з менопаузальним переходом. Деякі жінки можуть страждати цим настільки, що це заважає сну або активності взагалі і що їм необхідне лікування. Заміщувальна гормональна терапія естрогеном є загальноприйнятою практикою протягом десятиліть, проте, останнім часом увага зосереджена на побічних ефектах, таких як рак молочної залози і серцеві явища. Клінічні випробування SSRI показали, що ці сполуки мають вплив на приливи крові, хоча менший ніж естроген [J.Am.Med.Ass., 295, 2057-2071, 2006]. Проте лікування приливів сполуками, що інгібують зворотне захоплення серотоніну, наприклад, сполуками згідно з цим винаходом, може бути альтернативним лікуванням для жінок, які не можуть або не будуть приймати естроген. Апное уві сні або обструктивний синдром апное-гіпопное уві сні, або обструктивне порушене дихання уві сні являє собою порушення, ефективну фармакотерапію якого ще належить ідентифікувати. Проте деякі дослідження на тваринах дозволяють припустити, що антагоністи 5-НТ3, наприклад, сполуки згідно з цим винаходом можуть бути ефективними для лікування цих захворювань [Sleep, 21, 131-136, 1998; Sleep, 8, 871, 878, 2001]. В одному варіанті здійснення, цей винахід відноситься до способу лікування захворювання, вибраного з афективних розладів, депресії, загального депресивного розладу, післяродової депресії, депресії, що асоціюється з біполярним розладом, хвороби Альцгеймера, психозу, раку, пов'язаного із старінням захворювання або хвороби Паркінсо 17 на, тривоги, генералізованого тривожного розладу, соціального тривожного розладу, обсесивнокомпульсивного розладу, панічного розладу, панічних атак, фобії, соціальної фобії, агорафобії, нетримання сечі при напруженні, блювоти, IBS, розладів харчування, хронічного болю, часткової відповіді, лікування стійкої депресії, хвороби Альцгеймера, когнітивного порушення, ADHD, меланхолії, PTSD, приливів, апное уві сні, пристрасті до алкоголю, нікотину або вуглеводів, зловживання психоактивними речовинами і алкоголем або залежності від алкоголю або лікарських засобів, причому спосіб включає введення терапевтично ефективної кількості сполуки згідно з цим винаходом пацієнтові, що потребує цього. В одному варіанті здійснення, у вказаного пацієнта, якого лікують від будь-якого з наведених вище захворювань, початково діагностовано вказане захворювання. Добре відомо, що лікування, взагалі, антидепресантами і, зокрема, SSRI може бути асоційоване із статевою дисфункцією, яка часто приводить до припинення лікування. Аж до 30-70% пацієнтів, яких лікують SSRI, повідомляють про порушення статевої функції [J.Clin.Psych., 66, 844-848, 2005], причому ці дефекти включають зниження статевого потягу, уповільнення, зниження або відсутність оргазмів, понижене збудження і еректильну дисфункцію. У клінічних випробуваннях лікуванню сполуками згідно з цим винаходом піддавали загалом 114 суб'єктів; серед цих 114 суб'єктів тільки один суб'єкт повідомив про статеву дисфункцію. Ці дані підтверджують, що клінічне втручання з використанням сполук згідно з цим винаходом асоційоване з дивно невеликою кількістю дефектів статевого функціонування. Як згадувалося вище, сполуки згідно з цим винаходом особливо придатні для лікування хронічного болю. Хронічний біль включає показання, такі як фантомний біль кінцівки, невропатичний біль, діабетична невропатія, постгерпетична невралгія (PHN), зап'ястний тунельний синдром (CTS), HIVневропатія, синдром комплексного регіонарного болю (CPRS), тригемінальна невралгія/невралгія трійчастого нерва/tic douloureux, хірургічне втручання (наприклад, постопераційні анальгетики), діабетична васкулопатія, резистентність капілярів або діабетичні симптоми, що асоціюються з інсулітом, біль, що асоціюється із стенокардією, біль, що асоціюється з менструацією, біль, що асоціюється із раком, зубний біль, головний біль, мігрень, головний біль напруження, тригемінальна невралгія, синдром скронево-нижньощелепного суглоба, м'язове пошкодження з міофасциальним болем, синдром фіброміалгії, біль кісток і суглобів (остеоартрит), ревматоїдний артрит, ревматоїдний артрит і набряк унаслідок травми, що асоціюється з опіками, розтягування або біль кісток при переломах унаслідок остеоартриту, остеопорозу, метастазів в кістці або з невідомих причин, подагра, фіброзит, міофасциальний біль, компресійний синдром верхньої апертури грудної клітки, біль у верхній частині спини або біль в нижній частині спини (де біль в спині є наслідком системного, регіонарного або первинного захворювання спинного мозку (радікулопатії), біль в тазу, серцевий біль в грудях, несе 93250 18 рцевий біль в грудях, біль, що асоціюється з пошкодженням спинного мозку (SCI), центральний постінсультний біль, невропатія при раку, біль при СНІД, біль, пов'язаний з серповидними клітинами, або біль при геріатрії. Дані, представлені в прикладі 16, показують, що сполуки згідно з цим винаходом придатні для лікування болю, і що вони навіть можуть надавати болезаспокійливий ефект, крім того, дослідження невропатичного болю в моделі на тваринах підтверджують це спостереження. Термін "терапевтично ефективна кількість" сполуки, як використовується в цьому описі, означає кількість, достатню для лікування, пом'якшення або часткової зупинки клінічних проявів даного захворювання і його ускладнень при терапевтичному втручанні, що включає введення вказаної сполуки. Кількість, достатню для досягнення цього, визначають як "терапевтично ефективну кількість". Ефективні кількості для кожної мети залежатимуть від тяжкості захворювання або пошкодження, а також від маси і загального стану здоров'я суб'єкта. Буде зрозуміло, що визначення придатного дозування можна досягти шляхом використання загальноприйнятого експериментування, за допомогою конструювання матриці значень і тестування різних точок в матриці, - все це знаходиться в межах кваліфікації підготовленого терапевта. Термін "лікування" і "проведення лікування", як використовується в цьому описі, означає управління перебігом і догляд за пацієнтом в цілях боротьби із станом, таким як захворювання або порушення. Мають на увазі, що термін включає повний спектр способів лікування даного стану, від якого страждає пацієнт, таких як введення активної сполуки для пом'якшення симптомів або ускладнень, для уповільнення прогресу захворювання, порушення або стану, для пом'якшення або полегшення симптомів і ускладнень і/або для лікування або усунення захворювання, порушення або стану, а також для профілактики стану, де профілактику розуміють як обслуговування і догляд за пацієнтом в цілях боротьби із захворюванням, станом або порушенням, і включають введення активних сполук для запобігання виникненню симптомів або ускладнень. Проте, профілактичне (превентивне) і терапевтичне (лікувальне) лікування є двома окремими аспектами цього винаходу. Пацієнт, що підлягає лікуванню, переважно являє собою ссавця, зокрема, людину. Як правило, лікування згідно з цим винаходом залучатиме щодобове введення сполук згідно з цим винаходом. Воно може включати введення один раз на добу, або введення двічі на добу, або навіть більш часте введення. В одному варіанті здійснення, цей винахід відноситься до застосування сполуки згідно з цим винаходом для виготовлення лікарського засобу для лікування афективних розладів, депресії, загального депресивного розладу, післяродової депресії, депресії, що асоціюється з біполярним розладом, хвороби Альцгеймера, психозу, раку, пов'язаного із старінням захворювання або хвороби Паркінсона, тривоги, генералізованого тривож 19 ного розладу, соціального тривожного розладу, обсесивно-компульсивного розладу, панічного розладу, панічних атак, фобії, соціальної фобії, агорафобії, нетримання сечі при напруженні, блювоти, IBS, розладів харчування, хронічного болю, часткової відповіді, лікування стійкої депресії, хвороби Альцгеймера, когнітивного порушення, ADHD, меланхолії, PTSD, приливів, апное уві сні, пристрасті до алкоголю, нікотину або вуглеводів, зловживання психоактивними речовинами або алкоголем або залежності від алкоголю або лікарських засобів. В одному варіанті здійснення, цей винахід відноситься до сполук згідно з цим винаходом для застосування при лікуванні захворювання, вибраного з афективних розладів, депресії, загального депресивного розладу, післяродової депресії, депресії, що асоціюється з біполярним розладом, хвороби Альцгеймера, психозу, раку, пов'язаного із старінням захворювання або хвороби Паркінсона, тривоги, генералізованого тривожного розладу, соціального тривожного розладу, обсесивнокомпульсивного розладу, панічного розладу, панічних атак, фобії, соціальної фобії, агорафобії, нетримання сечі при напруженні, блювоти, IBS, розладів харчування, хронічного болю, часткової відповіді, лікування стійкої депресії, хвороби Альцгеймера, когнітивного порушення, ADHD, меланхолії, PTSD, приливів, апное уві сні, пристрасті до алкоголю, нікотину або вуглеводів, зловживання психоактивними речовинами або алкоголем або залежності від алкоголю або лікарських засобів. Вплив сполук згідно з цим винаходом на пізнання у людини можна оцінювати рядом способів. Вплив можна оцінювати в тестах, де здоровим добровольцям вводять сполуку, а потім вимірюють когнітивну роботу у визнаних тестах, таких як, наприклад, тест аудиторно-вербального навчання (AVLT), тест Вісконсіна сортування карток (WCST) або фіксована увага [Psycopharmacol, 163, 106110, 2002; Psychiatry Clin. Neurosci., 60, 70-76, 2006]. Ефект, безумовно, також можна оцінювати у пацієнтів, страждаючих когнітивним порушенням, з використанням того ж набору тестів. Альтернативно, можна використовувати когнітивні моделі, де когнітивне порушення індукують у здорових добровольців і де вимірюють відновлювальний ефект сполук згідно з цим винаходом. Когнітивне порушення може бути індуковане, наприклад, скополаміном, позбавленням сну, алкоголем і триптофановим виснаженням. Фармацевтичні склади згідно з цим винаходом можна приготувати за загальноприйнятими в даній галузі способами. Конкретно згадуються пігулки, які можна отримувати змішуванням активного інгредієнта із звичайними ад'ювантами та/або розчинниками і подальшим пресуванням суміші в загальноприйнятому таблетувальному пристрої. Приклади ад'ювантів або розчинників включають: безводний гідрофосфат кальцію, PVP, сополімери PVP-VA, мікрокристалічну целюлозу, натрію крохмалю гліколят, кукурудзяний крохмаль, маніт, картопляний крохмаль, тальк, стеарат магнію, желатин, лактозу, камеді і тому подібне. Можна використовувати будь-які інші ад'юванти або до 93250 20 бавки, зазвичай використовувані для таких цілей, такі як барвники, смакові добавки, консерванти тощо, за умови, що вони сумісні з активними інгредієнтами. Розчини для ін'єкцій можна отримувати розчиненням активного інгредієнта і можливих добавок в частині розчинника для ін'єкції, переважно в стерильній воді, доведенням розчину до необхідного об'єму, стерилізацією розчину і заповненням ним придатних ампул і флаконів. Можна додавати будь-яку придатну добавку, зазвичай використовувану в даній галузі, таку як засоби, що змінюють тонічність, консерванти, антиоксиданти тощо. Фармацевтичні композиції згідно з цим винаходом або композиції, які виготовляють відповідно до цього винаходу, можна вводити будь-яким придатним способом, наприклад, перорально у формі пігулок, капсул, порошків, сиропів тощо, або парентеральний у формі розчинів для ін'єкції. Для виготовлення таких композицій можна використовувати способи, добре відомі в даній галузі, і можна використовувати будь-які фармацевтично прийнятні носії, розчинники, ексципієнти або інші добавки, зазвичай використовувані в даній галузі. Зручно, щоб сполуки згідно з цим винаходом вводили в одиничній дозованій формі, що містить вказані сполуки в кількості приблизно від 1 до 50 мг. Вважають, що верхня межа визначається залежністю концентрації від активності стосовно 5НТ3. Загальна добова доза, як правило, знаходиться в діапазоні приблизно 1 -20 мг, такому як приблизно від 1 до 10 мг, приблизно 5-10 мг, приблизно 10-20 мг або приблизно 10-15 мг сполуки згідно з цим винаходом. Конкретно згадуються добові дози, що становлять 5, 10, 15 або 20 мг. Пігулки, що містять сполуку згідно з цим винаходом, можуть бути зручним чином одержані вологою грануляцією. При використанні цього способу сухі тверді речовини (активні інгредієнти, наповнювач, зв'язувальна речовина тощо) змішують і змочують водою або іншою змочувальною речовиною (наприклад, спиртом) і із змочених твердих речовин утворюють агломерати або гранули. Вологу компоновку продовжують до тих пір, поки не досягають необхідного гомогенного розміру частинок, після чого висушують гранульований продукт. Сполуки згідно з цим винаходом, як правило, змішують з моногідратом лактози, кукурудзяним крохмалем і коповідоном в мішалці з великими зусиллями зсуву разом з водою. Після утворення гранул, ці грануляти можна просівати в ситі з придатним розміром отворів сита і висушувати. Потім одержані висушені грануляти змішують з мікрокристалічною целюлозою, кроскармелозою натрію і стеаратом магнію, після чого пігулки пресують. Альтернативне вологе гранулювання сполук згідно з цим винаходом можна здійснювати з використанням маніту, кукурудзяного крохмалю і коповідону, і ці грануляти змішують з мікрокристалічною целюлозою, натрію крохмалю гліколятом і стеаратом магнію, перед пресуванням пігулок. Альтернативно, вологу грануляцію сполук згідно з цим винаходом можна забезпечувати з використанням безводного гідрофосфату кальцію, кукурудзяного крохмалю і коповідону, і ці грануляти змішують з 21 мікрокристалічною целюлозою, натрію крохмалю гліколятом (тип А), тальком і стеаратом магнію, перед пресуванням пігулок. Коповідон є сополімером PVP-VA. В одному варіанті здійснення, сполука згідно з цим винаходом є сіллю бромистоводневої кислоти, наприклад, в бета-формі, і придатні пігулки можуть мати наступний склад - вказані відсотки є масовими (w/w-%). Сіль НВr 2-20% Моногідрат лактози 30-50% Крохмаль 15-30% Коповідон 3-5% Мікрокристалічна целюлоза 15-25% Кроскармелоза натрію 2-5% Стеарат Mg 0,5-5%. Зокрема, пігулки можуть мати наступний склад Сіль НВr 3-4% Моногідрат лактози 44-46% Крохмаль 22-23% Коповідон 3-4% Мікрокристалічна целюлоза 20-22% Кроскармелоза натрію 3-3,5% Стеарат Mg 0,5-1%. або Сіль НВr 15-16% Моногідрат лактози 35-38% Крохмаль 18-20% Коповідон 3-4% Мікрокристалічна целюлоза 20-22% Кроскармелоза натрію 3-3,5% Стеарат Mg 0,5-1%. або Сіль НВr 1-2% Моногідрат лактози 44-46% Крохмаль 20-24% Коповідон 3-4% Мікрокристалічна целюлоза 22-24% Кроскармелоза натрію 3-4% Стеарат Mg 0,5-1%. В одному варіанті здійснення, сполука згідно з цим винаходом є сіллю бромистоводневої кислоти, наприклад в бета-формі, і придатні пігулки можуть мати наступний склад Сіль НВr 2-30% Маніт 25-45% Кукурудзяний крохмаль 10-20% Коповідон 2-4% Мікрокристалічна целюлоза 22-27% Натрію крохмалю гліколят 4-5% Стеарат Mg 0,25-5%, наприклад 0,252%. Зокрема, пігулки можуть мати наступний склад Сіль НВr 20-22% Маніт 35-36% Кукурудзяний крохмаль 10-12% Коповідон 2,5-3% Мікрокристалічна целюлоза 24-25% Натрію крохмалю гліколят 3-4% Стеарат Mg 0,25-1%. або Сіль НВr 12-13% Маніт 36-37% Кукурудзяний крохмаль 18-19% 93250 22 Коповідон 3-4% Мікрокристалічна целюлоза 24-25% Натрію крохмалю гліколят 3-4% Стеарат Mg 0,25-1%. або Сіль НВr 25-27% Маніт 27-29% Кукурудзяний крохмаль 13-15% Коповідон 3-4% Мікрокристалічна целюлоза 24-25% Натрію крохмалю гліколят 3-5% Стеарат Mg 0,25-1%. або Сіль НВr 3-4% Маніт 40-42% Кукурудзяний крохмаль 20-22% Коповідон 3-4% Мікрокристалічна целюлоза 26-28% Натрію крохмалю гліколят 3-5% Стеарат Mg 0,5%. В одному варіанті здійснення, сполука згідно з цим винаходом є сіллю бромистоводневої кислоти, а придатні пігулки можуть мати наступний склад Сіль НВr 3-8% Безводний гідрофосфат кальцію 35-45% Кукурудзяний крохмаль 15-25% Коповідон 2-6% Мікрокристалічна целюлоза 20-30% Натрію крохмалю гліколят 1-3% Тальк 2-6% Стеарат магнію 0,5-2%. Зокрема, пігулки можуть мати наступний склад Сіль НВr приблизно 5% Безводний гідрофосфат кальцію приблизно 39% Кукурудзяний крохмаль приблизно 20% Коповідон приблизно 3% Мікрокристалічна целюлоза приблизно 25% Натрію крохмалю гліколят приблизно 3% Тальк приблизно 4% Стеарат магнію приблизно 1%. Пігулки з різними кількостями активної сполуки, такими як кількості, відповідні, наприклад 2,5, 5, 10, 20, 25, 30, 40, 50, 60 або 80 мг вільної основи, можна отримувати вибором правильної кількості сполуки згідно з цим винаходом у поєднанні з пігулкою відповідного розміру. Розмір кристалів, використовуваних для одержання пігулок, що містять сполуки згідно з цим винаходом, є важливим. Якщо кристали є дуже маленькими, вони можуть прилипати до поршня в таблетувальних машинах. З іншого боку, вони також не можуть бути дуже великими. Швидкість розчинення в кишечнику знижується при збільшенні розміру кристалів. Таким чином, якщо кристали є дуже великими, вони можуть погіршити біодоступність сполук. Гранулометричний склад можна описати з використанням квантилів, наприклад, D5%, D10%, D50%, D90%, D95% і D98%. Як використовується в цьому описі, термін "гранулометричний склад" означає сумарний об'ємний розподіл розміру еквівалентних сферичних діаметрів, як визначають за допомогою лазерної дифракції 23 при розсіювальному тиску 1 бар в устаткуванні Sympatec Helos. В одному варіанті здійснення, кристали сполуки згідно з цим винаходом і, зокрема, бета-форми солі бромистоводневої кислоти мають гранулометричний склад відповідно до D98%: 650-680 мкм; D50%: 230-250 мкм; і D5%: 40-60 мкм. У наступному варіанті здійснення, гранулометричний склад відповідає D98%: 370-390; D50%: 100-120 мкм; D5%: 5-15 мкм. У наступному варіанті здійснення, гранулометричний склад відповідає D98%: 100125 мкм; D50%: 15-25 мкм; і D5%: 1-3 мкм. У наступному варіанті здійснення, гранулометричний склад відповідає D98%: 50-70 мкм; D50%: 3-7 мкм; і D5%: 0,5-2. Вільну основу згідно з цим винаходом можна отримувати, як описано у WO 2003/029232. Солі згідно з цим винаходом можна отримувати розчиненням вільної основи в придатному розчиннику, додаванням відповідної кислоти, з подальшим осадженням. Осадження можна проводити або за допомогою додавання другого розчинника, та/або випаровування, та/або охолоджування. Альтернативно, вільну основу згідно з цим винаходом і, зрештою, сполуки згідно з цим винаходом можна синтезувати в реакції, що каталізується паладієм, як описано нижче. Утворення ароматичних зв'язків вуглецьгетероатом можна досягати нуклеофільним ароматичним заміщенням або за реакціями Ульмана, що опосередковуються міддю. Пізніше було показано, що паладій є сильним каталізатором утворення таких зв'язків, і, зокрема, утворення зв'язків C-N і C-S, див. наприклад, US 5573460. В одному варіанті здійснення, цей винахід відноситься до способу одержання причому спосіб включає реакцію сполуки II де R' є воднем або іоном одновалентного металу, із сполукою формули III 93250 24 де X1 і Х2 незалежно є галогеном, та із сполукою формули IV де R є воднем або захисною групою, у присутності розчинника, основи і паладієвого каталізатора, що складається з джерела паладію і фосфінового ліганду, при температурі між 60°С і 130°С. В одному варіанті здійснення, спосіб розділений на підспособи, де сполуку II і сполуку III піддають реакції в першій реакції з одержанням сполуки формули Потім цю сполуку необов'язково очищають до придатного ступеня, а потім піддають реакції із сполукою IV з одержанням 4-[2-(2,4диметилфенілсульфаніл)феніл]піперазину. Однореакторні синтези, тобто синтези, де всіх учасників реакції змішують разом на початку реакції або процесу, є особливо придатними унаслідок притаманної їм простоти. З іншого боку, кількість можливих небажаних побічних реакцій значно підвищується, що також означає, що число і/або кількість небажаних побічних продуктів може зростати і, відповідно, знижується вихід необхідного продукту. Для цього процесу, зокрема, можна спостерігати, що піперазин має два атоми азоту, кожен з яких може потенційно брати участь в утворенні зв'язку C-N. Несподівано було виявлено, що даний процес можна проводити як однореакторний синтез, тобто процес, де з самого початку змішують сполуку II, сполуку III і сполуку VI, зберігаючи високий вихід чистої сполуки. Сполука II являє собою тіол або відповідний тіолат. Виходячи з професійної гігієни, є сприятливою перспектива застосування тіолату, такого як тіолат Li+, Na+ або К+, для уникнення проблем із запахом, що асоціюється з тіолами. Проте, в одному варіанті здійснення, R' являє собою водень. 25 Сполука III являє собою активований 1,2дигалогенбензол, і галогени можуть бути будьякими з СІ, Вr і І. Зокрема, сполука II являє собою 1-бром-2-йодбензол або 1,2-дибромбензол. Розчинник, використовуваний в процесі згідно з цим винаходом, можна вибирати з апротонних органічних розчинників або сумішей таких розчинників з температурою кипіння в межах діапазону температур реакції, тобто 60-130°С. Як правило, розчинник вибирають з толуолу, ксилолу, триетиламіну, трибутиламіну, діоксану, N-метилпіролідону або з будь-якої їх суміші. Конкретно, як розчинник згадується толуол. Центральним для цього процесу є застосування паладієвого каталізатора, без якого реакції не протікають. Паладієвий каталізатор складається з джерела паладію і фосфінового ліганду. Придатні джерела паладію включають паладій з різними ступенями окиснення, наприклад, такими як 0 і II. Прикладами джерел паладію, які можна використовувати в способі згідно з цим винаходом, є Рd2dа3, Pddba2 і Pd(OAc)2. "dba" є скороченням дибензиліденацетону. Конкретно згадується Pddba2 і Pd2dba3. Джерело паладію, як правило, застосовують в кількості 0,1-10 мол.%, такій як 110 мол.%, наприклад 1-5 мол.%. Скрізь в цій заявці мол.% обчислюють щодо ключового компонента реакції. Відома безліч фосфінових лігандів як монодентатних, так і бідентатних. Придатні фосфінові ліганди включають рацемічний 2,2'-бісдифенілфосфаніл-[1,1']бінафталеніл (rac-BINAP), 1,1'-біс(дифенілфосфіно)фероцен (DPPF), біс-(2дифенілфосфінофеніл)етер (DPEphos), три-третбутилфосфін (сіль Fu), біфеніл-2-ілди-третбутилфосфін, біфеніл-2-ілдициклогексилфосфін, (2'-дициклогексилфосфанілбіфеніл-2-іл)диметиламін, [2'-(ди-трет-бутилфосфаніл)біфеніл-2іл]диметиламін і дициклогексил-(2',4',6'-трипропілбіфеніл-2-іл)фосфан. Крім того, замість фосфінових лігандів можна використовувати карбенові ліганди, такі як, наприклад, хлорид 1,3-біс-(2,6діізопропілфеніл)-3Н-імідазол-1-ію. В одному варіанті здійснення, фосфіновий ліганд являє собою rac-BINAP, DPPF або DPEphos і, зокрема, racΒΓΝΑΡ. Фосфіновий ліганд, як правило, наносять в кількості між 0,1 і 10 мол.%, такій як 1 і 5 мол.%, як правило, приблизно 1-2 мол.%. Основу додають в реакційну суміш для підвищення pH. Зокрема, придатними є основи, вибрані з NaOt-Bu, KOt-Bu і CS2CO3. Також можна застосовувати органічні основи, такі як 1,8діазабіцикло[5,4,0]ундец-7-ен (DBU) і 1,4діазабіцикло[2,2,2]октан (DABCO). Конкретно згадуються NaO(t-Bu) і KO(t-Bu). Як правило, основу додають в кількості приблизно 1-5 еквівалентів, такій як 1-3 еквіваленти, наприклад 2-3 еквіваленти. Сполука IV являє собою сполуку піперазину. Піперазин має два атоми азоту, тільки один з яких бере участь в утворенні зв'язку C-N. В одному варіанті здійснення, утворення зв'язків з другим атомом азоту уникають, використовуючи монозаміщений піперазин, тобто варіант здійснення, де R являє собою захисну групу. У даній галузі відома 93250 26 безліч захисних груп, і придатні приклади включають boc, Bn, Cbz, С(=О)О і Me, а, зокрема, bос. "Bn" є скороченням бензилу; "boc" є скороченням трет-бутилоксикарбонілу; і "cbz" є скороченням бензилоксикарбонілу. Якщо в реакціях використовують захищений піперазин, захисну групу необхідно видаляти в подальшій стадії, як правило, за допомогою додавання водної кислоти. Якщо як захисну групу використовують метил, метил можна видаляти реакцією з карбаматом і подальшим видаленням цієї групи. Несподівано було виявлено, що незахищений піперазин можна використовувати також без утворення небажаних зв'язків з другим атомом азоту. Захищений і незахищений піперазин має різну розчинність в різних розчинниках; як приклад, піперазин практично нерозчинний в толуолі, тоді як boc-захищений піперазин високо розчинний в толуолі. У нормі очікується, що для успішної реакції потрібно, щоб всі учасники реакції були добре розчинними у вживаному розчиннику. Проте, було виявлено, що процес згідно з цим винаходом протікає з високим виходом у разі толуолу, як розчинника, і незахищеного піперазину, тобто у варіанті здійснення, де R є воднем. Таким чином, в одному варіанті здійснення, розчинником є толуол, а сполука IV є піперазином. У наступному варіанті здійснення, це поєднання умов використовують в однореакторному синтезі. В одному варіанті здійснення температура проведення процесу складає приблизно 80°С приблизно 120°С. В одному варіанті здійснення 1-[2-(2,4диметилфенілсульфаніл)феніл]піперазин отримують в способі, який включає наступні стадії: a. Розчинення або диспергування 1-1,5 еквівалента сполук II, III і IV в толуолі з одержанням суміші А; b. Додавання 1-2 мол.% Pddba2 і 1-2 мол.% rac-BINAP разом з 2-3 еквівалентами NaOt-Bu, необов'язково диспергованими або розчиненими або диспергованими в толуолі, до суміші А з одержанням суміші В, яку нагрівають до приблизно 100°С до повного перетворення сполук II і III, як правило, протягом 5-10 годин; с Підвищення температури суміші, одержаної на стадії b, до приблизно 120°С до повного перетворення сполуки IV, як правило, протягом 16-32 годин; і d. Необов'язкове видалення захисної групи додаванням водної кислоти, якщо сполука III являє собою захищений піперазин. Необов'язково в представлену вище послідовність стадій реакції можна включати стадії очищення. В одному варіанті здійснення, 1-1,5 еквівалента 2,4-диметилтіолу, 1-бром-2-йодбензолу (або 1,2-дибромбензолу) і піперазину диспергують в толуолі, а потім додають 2-5, наприклад, 3 еквіваленти NaOt-Bu і 1-2 мол.% Pd2dba3 і rac-BINAP, диспергованих в толуолі, з одержанням суміші, яку кип'ятять із зворотним холодильником протягом 210 годин, як правило, 3-5 годин, з одержанням 1[2-(2,4-диметилфенілсульфаніл)феніл]-піперазину. Необов'язково, цей продукт можна далі піддавати 27 реакції з водною НВr з одержанням відповідної адитивної солі бромистоводневої кислоти. В одному варіанті здійснення, 2-5 еквівалентів NaOt-Bu, 2-5еквівалентів піперазину, 0,2-0,6 мол.% Pddba2 і 0,6-1 мол.% rac-BINAP диспергують в толуолі з одержанням суміші А', і до цієї суміші додають приблизно 1 еквівалент 2-бромйодбензолу з одержанням суміші В', і до цієї суміші додають 1 еквівалент 2,4-диметилтіофенолу, і одержану суміш нагрівають до температури дефлегмації протягом 3-7 годин, наприклад, протягом 4-6 годин, з одержанням 1-[2-(2,4диметилфенілсульфаніл)феніл]-піперазину. Необов'язково, цей продукт можна далі піддавати реакції з водною НВr з одержанням відповідної адитивної солі бромистоводневої кислоти. В деяких випадках може бути бажаним одержання кислотно-адитивної солі 1-[2-(2,4диметилфенілсульфаніл)феніл]піперазину, а не вільної основи. Кислотно-адитивні солі можна отримувати в наступній стадії способу, в якій одержану вільну основу піддають реакції з відповідною кислотою, такою як, наприклад, фумарова кислота, сірчана кислота, хлористоводнева кислота або бромистоводнева кислота. Кислоту можна додавати безпосередньо в реакційну суміш або, альтернативно, перед такою стадією вільну основу можна спочатку очищати до придатного ступеня. Якщо вільна основа виділена як суха сполука, може бути необхідним застосування розчинника в цілях переведення вільної основи в розчин перед реакцією з кислотою. В одному варіанті здійснення, водну бромистоводневу кислоту додають безпосередньо в реакційну суміш без початкового очищення вільної основи. У способах, де використовують захищений піперазин, захисну групу необхідно видаляти за допомогою додавання водної кислоти, як пояснено вище. В одному варіанті здійснення, вказана водна кислота може бути вибрана для досягнення двох перетворень, тобто видалення захисної групи із захищеного піперазину і утворення кислотноадитивної солі. Зокрема, для видалення захисної групи з піперазину і для одержання адитивної солі бромистоводневої кислоти в одній стадії способу можна використовувати бромистоводневу кислоту. Для всіх реакцій і реакційних сумішей, згаданих в цьому описі, може бути переважним продувати їх інертним газом або піддавати реакції під шаром інертного газу. Прикладом недорогого і легко доступного інертного газу є азот. Всі посилання, включаючи публікації, патентні заявки і патенти, що процитовані в цьому описі, включені в цей опис шляхом посилання в повному обсязі і в тому ступені, як мовби було вказано, що кожне вказане посилання включено окремо і конкретно як посилання, і наведене в його повному обсязі в цьому описі (до максимального ступеня, що допускається законом), незалежно від будьякого окремо наданого включення конкретних документів, зробленого в іншій частині цього опису. Застосування форми однини і схожих об'єктів посилання в контексті опису цього винаходу слід тлумачити як таке, що охоплю як однину, так і множину, якщо інше не вказано в цьому описі або 93250 28 якщо контекст явно цьому не суперечить. Наприклад, вираз "сполука" слід розуміти як вказівки на різні сполуки згідно з цим винаходом або конкретний описаний аспект, якщо інше не вказано. Якщо інше не вказано, всі точні значення, представлені в цьому описі, відображають відповідні приблизні значення (наприклад, можна вважати, що всі точні ілюстративні значення, представлені відносно конкретного чинника або вимірювання, також відносяться до відповідного приблизного значення, модифікованого за допомогою слова "приблизно", коли це доцільно). Приведений в цьому документі опис будьякого аспекту або аспекту цього винаходу з використанням термінів, таких як "що містить", "що має", "що включає" або "що охоплює" з посиланням на елемент або елементи, призначено для надання підстави для схожого аспекту або аспекту цього винаходу, який "складається з", "по суті складається з" цього конкретного елементу або елементів або "по суті містить" їх, якщо інше не вказано або якщо контекст явно цьому не суперечить (наприклад, композицію, описану в цьому описі як таку, що містить конкретний елемент, слід також розуміти як опис композиції, що складається з цього елементу, якщо інше не вказано або якщо контекст явно цьому не суперечить). Приклади Способи аналізу Спектри 1НЯМР реєструють при 500,13 МГц на пристрої Bruker Avance DRX500. Як розчинник використовують диметилсульфоксид (99,8%D), а як внутрішній контрольний стандарт використовують тетраметилсилан (TMS). Температури плавлення вимірюють з використанням диференціальної скануючої калориметрії (DSC). Устаткування являє собою ТА-Instruments DSC-Q1000, відкалібрований на 5°/хв., що дає температуру плавлення як початкове значення. Приблизно 2 мг зразка нагрівають при 5°/хв. в нещільно закритому контейнері в потоці азоту. Термогравіметричний аналіз (TGA), використовуваний для оцінки вмісту розчинника/води в сухому матеріалі, проводять з використанням ТАinstruments TGA-Q500. 1-10 мг зразка нагрівають при 10°/хв. у відкритому контейнері в потоці азоту. Порошкові рентгенограми отримували на рентгенівському дифрактометрі PANalytical X'Pert PRO з використанням випромінювання CuKi. Вимірювання для зразків проводили в режимі відбиття в 2-діапазоні 5-40° з використанням пристрою для детекції X'celerator. Приклад 1 Фармакологія рецептора in vitro Транспортер серотоніну щура: ІС50 5,3 нМ (блокада захоплення 5-НТ). Транспортер серотоніну людини: ІС50 40 нМ (блокада захоплення 5-НТ). Рецептор 5-НТ1A людини: Кi 40 нМ з частковим агонізмом (ефективність 85%). Рецептор 5-НТ3 щура: ІС50 0,2 нМ (антагонізм у функціональному аналізі). Рецептор 5-НТ3A людини: ІС50 приблизно 20 нМ (антагонізм у функціональному аналізі). При більш високій концентрації ця сполука проявляє агоністичну активність з ED50 2,1 мкМ. Сполука 29 згідно з цим винаходом також показала високу афінність до рецептора 5НТ3 людини в аналізі зв'язування in vitro (Кi 4,5 нМ). Приклад 2 Когнітивні ефекти Як розглянуто вище, сполуки згідно з цим винаходом взаємодіють з холінергічною системою, і можна чекати побачити ефект в одній з наступних моделей in vivo. - Серійний тест часу реакції з п'ятьма альтернативами (5-CSRT), який є придатним для демонстрації ефекту на тривалу увагу. - Просторовий тест з Y-подібним лабіринтом, який придатний для того, щоб показати вплив на короткочасну, тривалу і робочу пам'ять. - Тест перемикання уваги, який придатний для того, щоб показати вплив на виконавчу функцію, тобто на мотивування і вирішення завдань. Приклад 3а Одержання вільної основи сполуки І 10 г гідроброміду 1-[2-(2,4-диметилфенілсульфаніл)феніл]піперазину обробляли перемішаною сумішшю 100 мл 3 Μ NaOH і 100 мл етилацетату протягом 10 хвилин. Органічну фазу відокремлювали, промивали 100 мл 15% мас. NaCl (водного), сушили над MgSO4, фільтрували і концентрували у вакуумі з одержанням 7,7 г (98%) основи сполуки І у вигляді прозорої безбарвної оливи. ЯМР узгоджується із структурою. Приклад 3b Одержання кристалічної основи сполуки І 3,0 г безбарвної оливи 1-[2-(2,4-диметилфенілсульфаніл)феніл]піперазину обробляли 70 мл ацетонітрилу і нагрівали до температури дефлегмації. Майже прозорий розчин фільтрували і прозорий фільтрат охолоджували спонтанно, причому незабаром після фільтрації починалося осадження. Суміш перемішували при кімнатній температурі (22°С) протягом 2 годин і продукт виділяли фільтрацією і сушили у вакуумі (40°С) протягом ночі. Виділяли 2,7 г кристалічної основи у вигляді білої твердої речовини (90%). ЯМР узгоджується із структурою. Елементний аналіз: 72,40%С, 9,28%N, 7,58%H (теорія: 72,26%С, 9,36%N, 7,42%Н). Приклад 3с Характеристика кристалічної основи сполуки І Основа, що отримується за прикладом 3b, є кристалічною (XRPD) - див. Фіг.1. Вона має температуру плавлення ~117°С. Вона не є гігроскопічною і має розчинність у воді 0,1 мг/мл. Приклад 4а Одержання альфа-форми солі сполуки І з бромистоводневою кислотою 2,0 г 1-[2-(2,4-диметилфенілсульфаніл)феніл]піперазину розчиняли в 30 мл гарячого етилацетату і додавали 0,73 мл 48% мас. НВr (водної). Це додавання приводило до утворення густої маси і для забезпечення належного перемішування додавали додаткові 10 мл етилацетату. Масу перемішували при кімнатній температурі протягом однієї години. Фільтрація і висушування у вакуумі (20°С) протягом ночі приводили до одержання 2,0 г продукту у вигляді білої твердої речовини (80%). ЯМР узгоджується із структурою. Елементний аналіз: 57,05%С, 7,18%N, 6,16%H (теорія для солі 1:1: 56,99%С, 7,39%N, 6,11%Н). 93250 30 Приклад 4b Характеристика альфа-форми гідроброміду сполуки І Альфа-форма гідроброміду, одержаного за прикладом 4а, є кристалічною (XRPD) - див. Фіг.2. Вона має температуру плавлення ~226°С. Вона поглинає приблизно 0,3% води під впливом високої відносної вологості і має розчинність у воді 2 мг/мл. Приклад 4с Одержання бета-форма солі сполуки І з бромистоводневою кислотою 49,5 г безбарвної оливи 1-[2-(2,4-диметилфенілсульфаніл)феніл]піперазину розчиняли в 500 мл етилацетату і додавали 18,5 мл 48% мас. НВr (водної). Це додавання приводило до утворення густої маси, яку перемішували протягом ночі при кімнатній температурі. Фільтрація і висушування у вакуумі (50°С) протягом ночі приводили до одержання 29,6 г продукту у вигляді білої твердої речовини (47%). ЯМР узгоджується із структурою. Елементний аналіз: 56,86%С, 7,35%N, 6,24%H (Теорія для солі 1:1: 56,99%С, 7,39%N, 6,11%Н). Приклад 4d Характеристика бета-форми гідроброміду сполуки І Бета-форма гідроброміду, одержана за прикладом 4с, є кристалічною (XRPD), див. Фіг.3. Вона має температуру плавлення -231°С. Вона поглинає приблизно 0,6% води під впливом високої відносної вологості і має розчинність у воді 1,2 мг/мл. Приклад 4е Одержання гама-форми солі сполуки І з бромистоводневою кислотою До 1 г гідроброміду 1-[2-(2,4-диметилфенілсульфаніл)феніл]піперазину, одержаного за прикладом 4а, додавали 20 мл води і нагрівали до 85°С. Розчин був практично прозорим. Додавання 1 краплі НВr забезпечувало його прозорість. HBr додавали, доки спостерігали точку помутніння. Розчин охолоджували до кімнатної температури і висушували. ЯМР узгоджується із структурою. Елементний аналіз: 56,63%С, 7,18%N, 6,21%Н (теорія для солі 1:1: 56,99%С, 7,39%N, 6,11%Н). Приклад 4f Характеристика гама-форми гідроброміду сполуки І Гідробромід, одержаний за прикладом 4е, є кристалічним (XRPD) - див. Фіг.4. Крива DSC показує деякі термічні явища приблизно при 100°С; вірогідна зміна кристалічної форми. Далі, він плавиться при приблизно 220°С. Він поглинає приблизно 4,5% води під впливом високої відносної вологості, а при 30% відносній вологості (RH) при кімнатній температурі поглинає приблизно 2% води. Приклад 4g Одержання гідрату гідроброміду сполуки І До 1,4 г оливи 1-[2-(2,4-диметилфенілсульфаніл)феніл]піперазину додавали 20 мл води і нагрівали до 60°С. pH доводили до 1 з використанням 48% HBr. Розчин охолоджували до кімнатної температури і висушували. ЯМР узгоджується із структурою. Елементний аналіз: 55,21%С, 7,16%N, 6,34%H (теорія для гемігідрату солі 1:1: 55,68%С, 7,21%N, 6,23%H). Приклад 4h Характеристика гемігідрату гідроброміду сполуки І Гідрат, одержаний за прикладом 4g, є кристалічним (XRPD) - див. Фіг.5. Вміст води строго за 31 лежить від відносної вологості. При кімнатній температурі і 95% відносній вологості (RH) вміст води складає приблизно 3,7%. Дегідратація відбувається за допомогою нагрівання до приблизно 100°С. Приклад 4і Одержання етилацетатного сольвату солі сполуки І з бромисто-водневою кислотою 0,9 г оливи 1-[2-(2,4-диметилфенілсульфаніл)феніл]піперазину розчиняли в 35 мл етилацетату і додавали 0,5 мл 48% мас. HBr (водної). Це додавання приводило до утворення густої маси, яку перемішували протягом ночі при кімнатній температурі. Фільтрація і промивання 30 мл діетилового етеру з подальшим висушуванням у вакуумі (50°С) протягом ночі приводили до одержання 1,0 г EtOAc-сольвату 1-[2-(2,4-диметилфенілсульфаніл)феніл]піперазину HBr (65%). ЯМР узгоджується із структурою. Елементний аналіз: 56,19%С, 6,60%N, 6,56%H (теорія для солі 1:1 при корекції по 8% етилацетату і 0,5% води, як визначено за допомогою TGA і KF: 56,51%С, 6,76%N, 6,38%Н). Приклад 4j Характеристика етилацетатного сольвату гідроброміду сполуки І Етилацетатний сольват, одержаний за прикладом 4і, є кристалічним (XRPD) - див. Фіг.6. Партія містить суміш сольвату і альфа-форми сполуки І, ймовірно унаслідок того, що висушування викликає часткову десольватацію. Десольватація починається при ~75°С при нагріванні 10°/хв. Після десольватації утворюється альфа-форма. При дії високої відносної вологості, етилацетат заміщується водою, яка вивільняється при подальшому зниженні вологості. Одержана тверда речовина є гігроскопічною і поглинає 3,2% води при високій відносній вологості. Приклад 5а Одержання солі сполуки І з хлористоводневою кислотою 1,0 г оливи 1-[2-(2,4-диметилфенілсульфаніл)феніл]піперазину розчиняли в 20 мл етилацетату з використанням слабкого нагрівання (30°С). Коли отримували прозорий розчин, тоді поволі додавали розчин 2 Μ НСl в діетиловому етері до тих пір, поки значення pH не склало приблизно 1-2. В ході додавання спостерігали спонтанне осадження. Після закінчення додавання, суспензію перемішували протягом 1 години, а потім білий осад виділяли фільтрацією і сушили у вакуумі (40°С) протягом ночі. Виділили 1,1 г гідрохлориду 1-[2-(2,4-диметилфенілсульфаніл)феніл]піперазину (99%). ЯМР узгоджується із структурою. Елементний аналіз: 64,18%С, 8,25%Ν, 6,96%Η (теорія для солі 1:1 після корекції по 0,66% води, як визначено за допомогою TGA: 64,13%С, 8,31%Ν, 6,95%Н). Приклад 5b Характеристика гідрохлориду сполуки І Гідрохлорид, одержаний за прикладом 5а, є кристалічним (XRPD) - див. Фіг.7. Він має температуру плавлення ~236°С. Він поглинає приблизно 1,5% води під впливом високої відносної вологості і має розчинність у воді 3 мг/мл. Приклад 5с Одержання моногідрату гідрохлориду сполуки І 11,9 г оливи 1-[2-(2,4-диметилфенілсульфаніл)феніл]піперазину розчиняли в 100 мл етанолу з використанням нагрівання. Після одержання го 93250 32 могенного розчину, додавали 3,5 мл концентрованої НСl (водної), що викликає негайне осадження білої твердої речовини. Суспензію перемішували спочатку протягом 5 хвилин, а потім на льодяній бані протягом іще години, а потім фільтрували. Білу тверду речовину промивали з використанням 100 мл свіжого холодного етанолу (поміщеного в морозилку при -18°С на 2 години), 50 мл ацетону і нарешті 50 мл діетилового етеру, а потім сушили у вакуумі (50°С) протягом ночі. Виділили 5,1 г 1-[2(2,4-диметилфенілсульфаніл)феніл]піперазину HCl (38%). ЯМР узгоджується із структурою. Елементний аналіз: 61,23%С, 7,91%Ν, 7,16%Η (теорія для моно гідратної солі 1:1: 61,26%С, 7,94%Ν, 7,14%Η). Приклад 5d Характеристика моногідрату гідрохлориду сполуки І Моногідрат гідрохлориду, одержаний за прикладом 5с, є кристалічним (XRPD) - див. Фіг.8. Його дегідратація відбувається, починаючи від приблизно 50°С. При подальшому нагріванні відбуваються деякі термічні явища, вірогідне перебудування, і він плавиться при приблизно 230°С з подальшою перекристалізацією і плавленням при приблизно 236°С. Він не поглинає додаткової кількості води під впливом високої відносної вологості та зв'язана гідратом вода не вивільняється, поки відносна вологість не знизиться до менш ніж 10% при кімнатній температурі. Він має розчинність у воді приблизно 2 мг/мл. Приклад 6а Одержання мезилатної солі сполуки І 1,0 г оливи 1-[2-(2,4-диметилфенілсульфаніл)феніл]піперазину розчиняли в 20 мл етилацетату за допомогою нагрівання (70°С). Коли отримували прозорий розчин, поволі додавали 0,35 г метансульфонової кислоти (1,1 екв.). Після закінчення додавання розчин охолоджували на льоду і поволі додавали діетиловий етер, викликаючи осадження продукту. Суспензію перемішували протягом 2 годин на льоду, а потім білий осад виділяли фільтрацією і сушили у вакуумі (40°С) протягом ночі. Виділили 1,1г мезилату 1-[2-(2,4диметилфенілсульфаніл)феніл]піперазину (85%). ЯМР узгоджується із структурою. Елементний аналіз: 57,81%С, 6,81%N, 6,68%Н (теорія для солі 1:1: 57,81 %С, 7,10%N, 6,64%Н). Приклад 6b Характеристика мезилату сполуки І Мезилат, одержаний за прикладом 6а, є кристалічним (XRPD) - див. Фіг.9. Він має температуру плавлення ~163°С. Він є гігроскопічним (поглинає приблизно 8% води при дії відносної вологості у 80% і за допомогою цього перетворюється на гідратовану форму). Останні 6% поглиненої води не вивільняються до тих пір, поки відносна вологість не досягає менш 10%. Він має дуже високу розчинність у воді (>45 мг/мл). Приклад 7а Одержання фумарату сполуки І 5,5 г оливи 1-[2-(2,4-диметилфенілсульфаніл)феніл]піперазину нагрівали до температури дефлегмації в суміші 50 мл метанолу і 50 мл етилацетату. Розчин залишали трохи охолонути, а потім додавали 2,1 г фумарової кислоти, викликаючи екзотермічну реакцію і осадження білої твер 33 дої речовини. Суспензію перемішували, дозволяючи охолоджуватися до кімнатної температури, а потім протягом 2 годин в морозилці при -18 °С. Білу тверду речовину збирали фільтрацією і промивали 20 мл холодного етилацетату, а потім сушили у вакуумі (50°С) протягом ночі. Виділили 3,1 г продукту (44%). ЯМР узгоджується із структурою. Елементний аналіз: 63,42%С, 6,64%N, 6,42%H (теорія для солі 1:1: 63,74%С, 6,76%N, 6,32%H). Приклад 7b Характеристика фумарату сполуки І Фумарат, одержаний за прикладом 7а, є кристалічним (XRPD) - див. Фіг.10. Він має температуру плавлення ~194°С. Розчинність у воді складає 0,4 мг/мл. Приклад 8а Одержання малеату сполуки І 2,5 г оливи 1-[2-(2,4-диметилфенілсульфаніл)феніл]піперазину розчиняли в 50 мл етилацетату і нагрівали до 60°С, а потім додавали 1,1г малеїнової кислоти. Суміш знову нагрівали до температури дефлегмації протягом 5 хвилин і залишали охолоджуватися до кімнатної температури при перемішуванні. В ході охолоджування починалося осадження, і його закінчували протягом 4 годин в морозилці (-18°С). Білу тверду речовину збирали фільтрацією і промивали 50 мл діетилового етеру, а потім сушили у вакуумі (50°С) протягом ночі. Це привело до одержання 1,3 г малеату 1-[2-(2,4диметилфенілсульфаніл)феніл]піперазину (38%), який перекристалізовували обробкою 40 мл етилацетату і 5 мл метанолу при кип'ятінні із зворотним холодильником. Прозорий розчин охолоджували до кімнатної температури, з подальшими 2 годинами в морозилці (-18°С), а потім фільтрували і промивали двічі 10 мл холодного етилацетату з подальшим висушуванням у вакуумі (50°С) протягом двох діб. Виділили 0,9 г малеату 1-[2-(2,4диметилфенілсульфаніл)феніл]піперазину (69%). ЯМР узгоджується із структурою. Елементний аналіз: 63,57%С, 6,79%N, 6,39%Н (теорія для солі 1:1: 63,74%С, 6,76%N, 6,32%Н). Приклад 8b Характеристика малеату сполуки І Малеат, одержаний за прикладом 8а, є кристалічним (XRPD) - див. Фіг.11. Він має температуру плавлення ~152°С. Розчинність у воді складає ~1 мг/мл. Приклад 9а Одержання мезо-тартрату сполуки І 11,1 мл 0,30 Μ розчину 1-[2-(2,4-диметилфенілсульфаніл)феніл]піперазину в ацетоні обробляли 0,5 г мезо-винної кислоти, розчиненої в 5 мл ацетону. Суміш перемішували при кімнатній температурі протягом 30 хвилин, в ході яких відбувалося осадження. Фільтрація і промивання спочатку 5 мл ацетону, а потім 3 мл діетилового етеру приводили до одержання продукту у вигляді білої твердої речовини, яку сушили у вакуумі (50°С) протягом ночі. Виділили 1,4 г мезо-тартрату 1-[2-(2,4диметилфенілсульфаніл)феніл]піперазину (93%). ЯМР узгоджується із структурою. Елементний аналіз: 58,58%С, 6,29%Ν, 6,40%Η (теорія для солі 1:1: 58,91%С, 6,25%Ν, 6,29%Η). Приклад 9b Характеристика мезо-тартрату сполуки І 93250 34 Мезо-тартрат, одержаний за прикладом 9а, є кристалічним (XRPD) - див. Фіг.12. Він має температуру плавлення ~164°С. Розчинність у воді складає -0,7 мг/мл. Приклад 10а Одержання L-(+)-тартрату сполуки І 11,1 мл 0,30 Μ розчину 1-[2-(2,4-диметилфенілсульфаніл)феніл]піперазину в ацетоні обробляли 0,5 г L-(+)-винної кислоти, розчиненої в 5 мл ацетону. Суміш перемішували при кімнатній температурі протягом 30 хвилин, в ході яких відбувалося осадження. Фільтрація і промивання спочатку 5 мл ацетону, а потім 3 мл діетилового етеру привели до продукту у вигляді білої твердої речовини, який сушили у вакуумі (50°С) протягом ночі. Виділили 1,2 г (+)-тартрату 1-[2-(2,4-диметилфенілсульфаніл)феніл]піперазину (81%). ЯМР узгоджується із структурою. Елементний аналіз: 58,86%С, 6,30%N, 6,38%H (теорія для солі 1:1: 58,91%С, 6,25%N, 6,29%H). Приклад 10b Характеристика L-(+)-тартрату сполуки І L-(+)-тартрат, одержаний за прикладом 10а, є кристалічним (XRPD) - див. Фіг.13. Він має температуру плавлення ~171°С. Розчинність у воді складає ~0,4 мг/мл. Приклад 11 а Одержання D-(-)-тартрату сполуки І 11,1 мл 0,30 Μ розчину 1-[2-(2,4-диметилфенілсульфаніл)феніл]піперазину в ацетоні обробляли 0,5 г D-(-)-винної кислоти, розчиненої в 5 мл ацетону. Суміш перемішували при кімнатній температурі протягом 30 хвилин, в ході яких відбувалося осадження. Фільтрація і промивання спочатку 5 мл ацетону, а потім 3 мл діетилового етеру, привели до одержання продукту у вигляді білої твердої речовини, яку сушили у вакуумі (50°С) протягом ночі. Виділили 1,0 г D-(-)-тартрату 1-[2-(2,4диметилфенілсульфаніл)феніл]піперазину (68%). ЯМР узгоджується із структурою. Елементний аналіз: 58,90%С, 6,26%N, 6,35%H (теорія для солі 1:1: 58,91%С, 6,25%N, 6,29%H). Приклад 11b Характеристика D-(-)-тартрату сполуки І D-(-)-тартрат, одержаний за прикладом 11а, є кристалічним (XRPD) - див. Фіг.14. Він має температуру плавлення ~175°С. Розчинність у воді складає ~0,4 мг/мл. Приклад 12а Одержання сульфату сполуки І 11,1 мл 0,30 Μ розчину 1-[2-(2,4-диметилфенілсульфаніл)феніл]піперазину в ацетоні обробляли 2,2 мл 3 Μ розчину H2SO4 (водної). Суміш перемішували при кімнатній температурі протягом 30 хвилин, а потім на льодяній бані протягом іще 4 годин, а потім відбувалося і завершувалося осадження. Фільтрація і промивання спочатку 5 мл ацетону, а потім 3 мл діетилового етеру приводили до одержання продукту у вигляді білої твердої речовини, яку сушили у вакуумі (50°С) протягом ночі. Виділили 0,51 г сульфату 1-[2-(2,4-диметилфенілсульфаніл)феніл]піперазину (39%). ЯМР узгоджується із структурою. Елементний аналіз: 54,53%С, 7,22%Ν, 6,28%Н (теорія для солі 1:1: 54,52%С, 7,07%Ν, 6,10%Н). 35 Приклад 12b Характеристика сульфату сполуки І Сульфат, одержаний за прикладом 12а, є кристалічним (XRPD) - див. Фіг.15. Він має температуру плавлення ~166°С. Розчинність у воді складає ~0,1 мг/мл. Приклад 13а Одержання фосфату сполуки І 11,1 мл 0,30 Μ розчину 1-[2-(2,4-диметилфенілсульфаніл)феніл]піперазину в ацетоні обробляли 0,2 мл 65% Н3РО4 (водної). Суміш перемішували при кімнатній температурі протягом 30 хвилин, в ході яких відбувалося охолоджування. Фільтрація і промивання спочатку 5 мл ацетону, а потім 3 мл діетилового етеру привели до одержання продукту у вигляді білої твердої речовини, яку сушили у вакуумі (50°С) протягом ночі. Виділили 1,23 г фосфату 1-[2-(2,4-диметилфенілсульфаніл)феніл]піперазину (94%). ЯМР узгоджується із структурою. Елементний аналіз: 54,21%С, 7,15%Ν, 6,43%Η (теорія для солі 1:1: 54,53%С, 7,07%Ν, 6,36%Η). Приклад 13b Характеристика фосфату сполуки І Фосфат, одержаний за прикладом 13а, є кристалічним (XRPD) - див. Фіг.16. Він має температуру плавлення ~224°С. Розчинність у воді складає ~1 мг/мл. Приклад 14а Одержання нітрату сполуки І 11,1 мл 0,30 Μ розчину 1-[2-(2,4-диметилфенілсульфаніл)феніл]піперазину в ацетоні обробляли 0,2 мл 16,5 Μ ΗΝΟ3 (водної). Суміш перемішували при кімнатній температурі протягом 30 хвилин, в ході яких відбувалося осадження. Фільтрація і промивання спочатку 5 мл ацетону, а потім 3 мл діетилового етеру, приводили до одержання продукту у вигляді білої твердої речовини, яку сушили у вакуумі (50°С) протягом ночі. Виділили 0,87 г нітрату 1-[2-(2,4-диметилфенілсульфаніл)феніл]піперазину (73%). ЯМР узгоджується із структурою. Елементний аналіз: 59,80%С, 11,67%Ν, 6,51%Н (теорія для солі 1:1: 59,81%С, 11,63%Ν, 6,41%Η). Приклад 14b Характеристика нітрату сполуки І Нітрат, одержаний за прикладом 14а, є кристалічним (XRPD) - див. Фіг.17. Він не плавиться, а розкладається в екзотермічній реакції при приблизно 160°С. Розчинність у воді складає ~0,8 мг/мл. Приклад 15 Пігулка У прикладах, представлених нижче, показані репрезентативні приклади того, яким чином можна отримувати пігулки, що містять сполуки згідно з цим винаходом. У всіх прикладах використовували бета-форму солі бромистоводневої кислоти. Приклад 15а 63,55 г солі бромистоводневої кислоти, 923,65 г Lactosum 350M, 461,8 г кукурудзяного крохмалю і 76,0 г Kollidon VA64 змішували протягом 2 хвилин в мішалці з великим зусиллям зсуву Diosna PP1 із швидкістю лопаті 1000 об./хв. Далі, швидкість лопаті знижували до 800 об./хв. і протягом хвилини додавали 220 г води. Компоновку проводили протягом 7 хвилин і одержані гранули пропускали через сито розміром 4000 мкм. Гранули сушили і пропускали через сито розміром 710 мкм. 1383,5 г одержаних гранул змішували з 400 г Avicel PH200 і 93250 36 60 г Ac-Di-Sol. Після змащування суміші змішуванням з 15 г стеарату магнію, порошкову суміш переносили в таблетувальний прес. Виготовляли пігулки, що мають цільову масу серцевини 200 мг і діаметр 8 мм, з одержанням пігулок з цільовим вмістом, що відповідає 5 мг вільної основи. Приклад 15b 317,75 г солі бромистоводневої кислоти, 754,15 г Lactosum 350M, 377,1 г кукурудзяного крохмалю і 76,0 г Kollidon VA64 змішували протягом 2 хвилин в мішалці з великим зусиллям зсуву Diosna PP1 із швидкістю лопаті 1000 об./хв. Далі, швидкість лопаті знижували до 800 об./хв. і протягом хвилини додавали 210 г води. Компоновку проводили протягом 7 хвилин і одержані гранули пропускали через сито розміром 4000 мкм. Гранули сушили і пропускали через сито розміром 710 мкм. 1386,2 г одержаних гранул змішували з 400 г Avicel PH200 і 60 г Ac-Di-Sol. Після змащування суміші змішуванням з 15 г стеарату магнію, порошкову суміш переносили в таблетувальний прес. Виготовляли пігулки, що мають цільову масу серцевини 200 мг і діаметр 8 мм, з одержанням пігулок з цільовим вмістом, що відповідає 25 мг вільної основи. Приклад 15с 32,2 г солі бромистоводневої кислоти, 944,82 г Lactosum 350M, 472,4 г кукурудзяного крохмалю і 76,0 г Kollidon VA64 змішували протягом 2 хвилин в мішалці з великим зусиллям зсуву Diosna PP1 із швидкістю лопаті 1000 об./хв. Далі, швидкість лопаті знижували до 800 об./хв. і протягом хвилини додавали 220 г води. Компоновку проводили протягом 7 хвилин і одержані гранули пропускали через сито розміром 4000 мкм. Гранули сушили і пропускали через сито розміром 710 мкм. 1317г одержаних гранул змішували з 400 г Avicel PH200 і 60 г Ac-Di-Sol. Після змащування суміші змішуванням з 15 г стеарату магнію, порошкову суміш переносили в таблетувальний прес. Виготовляли пігулки, що мають цільову масу серцевини 208 мг і діаметр 8 мм, з одержанням пігулок з цільовим вмістом, що відповідає 2,5 мг вільної основи. Приклад 15d 540,85 г солі бромистоводневої кислоти, 953,00 г Pearlitol 50C, 296,22 г кукурудзяного крохмалю і 70,5 г Kollidon VA64 змішували протягом 2 хвилин в мішалці з великим зусиллям зсуву Aeromatic-Fielder PMA1 із швидкістю лопаті 1000 об./хв. Далі, швидкість лопаті знижували до 800 об./хв. і протягом хвилини додавали 241,87 г води. Компоновку проводили протягом 7 хвилин і одержані гранули пропускали через сито розміром 4000 мкм. Гранули сушили і пропускали через сито розміром 710 мкм. 1500 г одержаних гранул змішували з 531,91 г Avicel PH200 і 85,11 г Primojel. Після змащування суміші змішуванням з 10,64 г стеарату магнію, порошкову суміш переносили в таблетувальний прес. Виготовляли пігулки, що мають цільову масу серцевини 125 мг і діаметр 6 мм, з одержанням пігулок з цільовим вмістом, що відповідає 25 мг вільної основи. Приклад 15е 270,45 г солі бромистоводневої кислоти, 772,0 г Pearlitol 50C, 386,41 г кукурудзяного крохмалю і 37 70,5 г Kollidon VA64 змішували протягом 2 хвилин в мішалці з великим зусиллям зсуву AeromaticFielder PMA1 із швидкістю лопаті 1000 об./хв. Далі, швидкість лопаті знижували до 800 об./хв. і протягом хвилини додавали 195 г води. Компоновку проводили протягом 5,5 хвилин і одержані гранули пропускали через сито розміром 4000 мкм. Гранули сушили і пропускали через сито розміром 710 мкм. 1200,3 г одержаних гранул змішували з 425,5 г Avicel PH200 і 68,09 г Primojel. Після змащування суміші змішуванням з 8,8 г стеарату магнію, порошкову суміш переносили в таблетувальний прес. Виготовляли пігулки, що мають цільову масу серцевини 100 мг і діаметр 6 мм, з одержанням пігулок з цільовим вмістом, що відповідає 10 мг вільної основи. Приклад 15f 504,85 г вільної основи, 552,95 г Pearlitol 50C, 276,53 г кукурудзяного крохмалю і 65,7 г Kollidon VA64 змішували протягом 2 хвилин в мішалці з великим зусиллям зсуву Aeromatic-Fielder PMA1 із швидкістю лопаті 1000 об./хв. Далі, швидкість лопаті знижували до 800 об./хв. і протягом хвилини додавали 182 г води. Компоновку проводили протягом 5,5 хвилин і одержані гранули пропускали через сито розміром 4000 мкм. Гранули сушили і пропускали через сито розміром 710 мкм. 1250,7 г одержаних гранул змішували з 443,31 г Avicel PH200 і 70,8 г Primojel. Після змащування суміші змішуванням з 8,92 г стеарату магнію, порошкову суміш переносили в таблетувальний прес. Виготовляли пігулки, що мають намічену масу серцевини 250 мг і діаметр 8 мм, з одержанням пігулок з цільовим вмістом, що відповідає 50 мг вільної основи. Приклад 15g 135,23 г солі бромистоводневої кислоти, 863,2 г Pearlitol 50C, 432,69 г кукурудзяного крохмалю і 70,66 г Kollidon VA64 змішували протягом 2 хвилин в мішалці з великим зусиллям зсуву AeromaticFielder PMA1 із швидкістю лопаті 1000 об./хв. Далі, швидкість лопаті знижували до 800 об./хв. і протягом хвилини додавали 195 г води. Компоновку проводили протягом 5,5 хвилин і одержані гранули пропускали через сито розміром 4000 мкм. Гранули сушили і пропускали через сито розміром 710 мкм. 1200 г одержаних гранул змішували з 425,28 г Avicel PH200 і 68,2 г Primojel. Після змащування суміші змішуванням з 8,58 г стеарату магнію, порошкову суміш переносили в таблетувальний прес. Виготовляли пігулки, що мають цільову масу серцевини 100 мг і діаметр 6 мм, з одержанням пігулок з цільовим вмістом, що відповідає 5 мг вільної основи. Приклад 15h 67,6 г солі бромистоводневої кислоти, 908,0 г Pearlitol 50C, 453,9 г кукурудзяного крохмалю і 70,51 г Kollidon VA64 змішували протягом 2 хвилин в мішалці з великим зусиллям зсуву Diosna PP1 із швидкістю лопаті 1000 об./хв. Далі, швидкість лопаті знижували до 800 об./хв. і протягом хвилини додавали 195 г води. Компоновку проводили протягом 5,5 хвилин і одержані гранули пропускали через сито розміром 4000 мкм. Гранули сушили і 93250 38 пропускали через сито розміром 710 мкм. 1325 г одержаних гранул змішували з 531,91 г Avicel PH200 і 85,11 г Primojel. Після змащування суміші змішуванням з 10,64 г стеарату магнію, порошкову суміш переносили в таблетувальний прес. Виготовляли пігулки, що мають цільову масу серцевини 207,8 мг і діаметр 7 мм, з одержанням пігулок з цільовим вмістом, що відповідає 5 мг вільної основи. Приклад 15і 2290,1 г солі бромистоводневої кислоти, 17568 г безводного гідрофосфату кальцію, 8783 г кукурудзяного крохмалю і 1510г коповідону змішували протягом 3 хвилин в мішалці з великим зусиллям зсуву Aeromatic-Fielder PMA100 із швидкістю лопаті 200 об./хв. Далі, додавали 5130 г води протягом 2 хвилин із швидкістю лопаті 150 об./хв. Компоновку проводили протягом 15 хвилин і одержані гранули пропускали через конусний млин, що працює приблизно при 2700 об./хв. з екраном розміром 9,525 мм. Гранули сушили і пропускали через конусний млин, що працює при 1500 об./хв. з екраном розміром 2,388 мм. 28747 г одержаних гранул змішували з 11250 г мікрокристалічної целюлози, 1350 г натрію крохмалю гліколяту (тип А) і 1800 г тальку. Після змащування суміші змішуванням з 450 г стеарату магнію, порошкову суміш переносили в таблетувальний прес. Виготовляли пігулки, що мають цільову масу серцевини 125 мг і діаметр 6 мм, з одержанням пігулок з цільовим вмістом гідробромідної солі, що відповідає 5 мг вільної основи. Крім того, виготовляли пігулки, що мають цільову масу серцевини 250 мг і діаметр 8 мм, з одержанням пігулок з цільовим вмістом гідробромідної солі, що відповідає 10 мг вільної основи. Приклад 16 Больові ефекти в тесті внутрішньошкірного введення формаліну у мишей У цій моделі мишам робили ін'єкцію формаліну (4,5%, 20 мкл) в ліву задню лапу. Подразнення, викликане ін'єкцією формаліну, приводить до характерної двофазної поведінкової реакції, яку кількісно виражають за допомогою кількості часу, витраченого на вилизування пошкодженої лапи. Перша фаза (~0-10 хвилин) є прямим хімічним подразненням і ноцицепцією, тоді як друга фаза (~20-30 хвилин), як вважають, відображає біль невропатичного походження. Дві фази розділяються періодом спокою, в ході якого поведінка повертається до норми. Ефективність тестованих сполук відносно зниження хворобливих стимулів оцінюють підрахунком кількості часу, витраченого на вилизування пошкодженої лапи в двох фазах. Сполуки згідно з цим винаходом показали значуще зниження показників болю другої фази (Фіг.18b), що вказує на ефективність проти болю невропатичного походження. Більш того, сполуки згідно з цим винаходом показали значуще зниження показників першої фази (Фіг.18а), що вказує на більшу знеболюючу дію при найбільш високій дозі. Загалом, ці результати указують на те, що сполуки згідно з цим винаходом, ймовірно, є ефективними відносно лікування пов'язаних з болем порушень. Приклад 17 39 93250 40 20 г 2-бромйодбензолу (71 ммоль) і 9,8 г 2,4диметилтіофенолу (71 ммоль) розчиняли в 100 мл толуолу. Розчин продували азотом, а потім додавали 324 мг Рd2dba3 (0,35 ммоль; 1 мол.%) і 381 мг DPEPhos (0,71 ммоль; 1 мол.%). Реакційну суміш перемішували протягом 5 хвилин, в ході яких колір мінявся від темно-червоного до оранжевого. Додавали 8,7 г KOBut (78 ммоль) і відразу утворювалася гетерогенна суміш. Суспензію нагрівали до 100°С в атмосфері азоту. Через 1 годину суміш охолоджували до 0°С і перемішували протягом 2 годин, а потім суміш фільтрували через целіт. Осад на фільтрі промивали 2 50 мл толуолу і об'єднані фільтрати випаровували з одержанням 21 г оранжево-червоної оливи (вихід >99%), для якої була показана чистота >96% за ВЕРХ і GCMS. Приклад 18 500 мл толуолу поміщали в 1-л круглу колбу з трьома шийками з механічною мішалкою і додавали 203 мг Pddba2 (0,35 ммоль; 0,1 мол.%) і 760 мг DPEPhos (1,5 ммоль; 0,4 мол.%). Темно-червоний розчин продували азотом протягом 5 хвилин, а потім додавали 100 г 2-бромйодбензолу (353 ммоль) і 48,9 г 2,4-диметилтіофенолу (353 ммоль). Додавання 43,6 г KOBut (389 ммоль), приводило до екзотермічної реакції, що підвищує температуру від 20°С до 36°С, одночасно з утворенням гетерогенної суміші. Суспензію нагрівали до 100°С в атмосфері азоту. Через 7 годин суміш охолоджували до 0°С і перемішували протягом 2 годин, а потім суміш фільтрували через целіт. Осад на фільтрі промивали 2 200 мл толуолу і об'єднані фільтрати випаровували з одержанням 104 г оранжевої оливи (вихід 105%), для якої була показана 97% чистота за ВЕРХ, а ЯМР підтвердив необхідну структуру. Олива тверднула при стоянні при кімнатній температурі. Приклад 19 41 93250 42 До розчину 10 г 1-(2-бромфенілсульфаніл)-2,4диметилбензолу (34 ммоль) у 50 мл сухого толуолу додавали 7 г boc-піперазину (38 ммоль), дегазували азотом протягом 5 хвилин, додавали 312 мг Рd2dba3 (2 мол.%) і 637 мг rac-BINAP (3 мол.%), дегазували протягом іще 5 хвилин, а потім додавали 3,9 г ButONa (41 ммоль) і нагрівали до 80°С протягом 15 годин. Реакційну суміш охолоджували до кімнатної температури (RT) і екстрагували двічі 20 мл 15% сольового розчину, сушили над Na2SO4, додавали активоване вугілля, кип'ятили із зворотним холодильником протягом 15 хвилин, фільтрували через целіт і випаровували з одержанням 14,2 г коричневої оливи (4-[2-(2,4диметилфенілсульфаніл)феніл]-ВОС-піперазин), що має 95% частоту, визначену за допомогою ЯМР. Неочищену оливу розчиняли в 200 мл МЕОН і 20 мл 6М HCl (водної) і кип'ятили із зворотним холодильником протягом 1 години, після чого ВЕРХ показала повне видалення захисної групи. Після охолоджування до кімнатної температури метанол видаляли за допомогою вакууму на роторному випарнику, додавали 20 мл концентрованого NaOH (pH вимірювали до 13-14), після чого перемішували протягом 15 хвилин з 100 мл ЕtOАс. Органічну фазу збирали і екстрагували двічі 30 мл 15% сольового розчину, сушили над Na2SO4 і додавали 5,2 г фумарової кислоти (44 ммоль) в 30 мл МЕОН. В процесі нагрівання до температури дефлегмації утворюється гомогенний розчин, з якого починається швидке осадження, або при подальшому нагріванні, або при охолоджуванні. Осад збирали, промивали 20 мл ЕtOАс і 20 мл ацетону, сушили у вакуумі з одержанням 9,3 г фумарату 1-[2-(2,4диметилфенілсульфаніл)феніл]піперазину (22 ммоль) у вигляді білого порошку із загальним виходом 66% з чистотою 99,5% за РХ-МС (LC-MS). Приклад 20 100 г 1,2-дибромбензолу (424 ммоль) і 58,6 г 2,4-диметилтіофенолу (424 ммоль) розчиняють в 800 мл толуолу. Розчин продувають азотом, а потім додають 4,6 г Pddba2 (8 ммоль; 2 мол.%) і 13,1 г rac-BINAP (21 ммоль; 5 мол.%). Реакційну суміш перемішують протягом 5 хвилин, в ході яких колір міняється з темно-червоного на оранжевий. Додавали 61 г NaOBut (636 ммоль) і 200 мл толуолу і відразу утворювалася гетерогенна суміш. Суспензію нагрівали до 80°С в атмосфері азоту. Через 10 годин суміш охолоджують до 60°С, а потім додають масу з 102,6 г boc-піперазину (551 ммоль) та іще 61 г NaOBut (636 ммоль) в 500 мл толуолу. Реакційну суміш продували азотом, а потім додавали іншу частину 4,6 г Pddba2 (8 ммоль; 2 мол.%) і 13,1 г rac-BINAP (21 ммоль; 5 мол.%). Суміш нагрівали до температури дефлегмації цього разу (110°С) протягом іще 6 годин або до тих пір, поки ВЕРХ не показувала повне перетворення. Реакційну суміш охолоджували на льоду протягом 2 годин, а потім суміш фільтрували через целіт. Осад на фільтрі промивали 2 200 мл толуолу і об'єднані фільтрати випаровували з одержанням 242 г червоної оливи. Оливу розчиняли в 1000 мл МЕОН і поволі додавали 115 мл 48% мас. HBr (водної), а потім нагрівали до температури дефлегмації протягом 2годин, після чого за допомогою ВЕРХ виявляли повне видалення захисних груп. Суміш охолоджували, додавали 1000 мл ЕtOАс і МЕОН видаляли за допомогою випаровування. Додавання 1000 мл Et2O привело до осадження. Перемішування продовжували при кімнатній температурі протягом 2 годин, а потім масу залишали в морозилці протягом ночі (-18°С). Фільтрація і промивання двічі 200 мл Et2O приводили до одержання 172 г коричнюватої твердої речовини після висушування у вакуумі при 40°С. Коричнювату тверду речовину обробляли 1500 мл киплячої Н2О протягом 1 години, а потім охолоджували до кімнатної температури протягом іще 2 годин. Фільтрація і висушування у вакуумі при 40°С протягом ночі привели до одержання 98 г гідроброміду 4-[2(2,4-диметилфенілсульфаніл)-феніл]піперазину (61%). Приклад 21 43 93250 44 102 г 2-бромйодбензолу (362 ммоль) і 50 г 2,4диметилтіофенолу (362 ммоль) розчиняють в 1000 мл толуолу. До цього розчину додавали 81 г ВОСпіперазину (434 ммоль), а потім 2,08 г Pddba2 (1 мол.%) і 4,51 г rac-BINAP (2 мол.%). Суміш продували азотом протягом 5 хвилин, а потім додавали масу з 87 г NaOBut (905 ммоль) в 300 мл толуолу. Суспензію нагрівали до 100°С в атмосфері азоту протягом ночі. Аналіз GC-MS показав повне перетворення на проміжний продукт (1-(2бромфенілсульфаніл)-2,4-диметилбензол) і температуру підвищували до температури дефлегмації (120°С) протягом іще 24 годин. Аналіз ВЕРХ показав повне перетворення на проміжну сполуку (1-ВОС-4-[2-(2,4-диметилфенілсульфаніл)феніл]піперазин). Реакційну суміш охолоджували на льоду протягом однієї години, а потім суміш філь трували. Осад на фільтрі промивали 2 200 мл толуолу і до об'єднаних фільтратів додавали 80 мл 48% мас. HBr (водної), а потім нагрівали до температури дефлегмації протягом 18 годин, після чого за допомогою ВЕРХ виявляли повне видалення захисних груп. Суміш охолоджували на льоду протягом 2 годин і фільтрували. Коричнювату тверду речовину розчиняли в 1000 мл киплячої Н2О протягом 1 години разом з активованим вугіллям (25 г), фільтрували в гарячому стані і залишали охолоджуватися. Осад збирали фільтрацією і висушуванням у вакуумі при 40°С протягом ночі, що приводило до одержання 49 г гідроброміду 4[2-(2,4-диметилфеніл-сульфаніл)феніл]піперазину (36%) у вигляді білої твердої речовини. Приклад 22 500 мл толуолу поміщали в 1-л круглу колбу з трьома шийками з механічною мішалкою і додавали 809 мг Pd2dba3 (0,88 ммоль; 0,5 мол.%) і 952 мг DPEPhos (1,77 ммоль; 0,5 мол.%). Темночервоний розчин продували азотом протягом 5 хвилин, а потім додавали 100 г 2-бромйодбензолу (353 ммоль) і 48,9 г 2,4-диметилтіофенолу (353 ммоль). Додавання 43,6 г KOBut (389 ммоль), приводило до екзотермічної реакції, що підвищує температуру від 20°С до 42°С, одночасно з утворенням гетерогенної суміші, і колір мінявся з темночервоного на оранжевий/коричнюватий. Суспензію нагрівали до 100°С в атмосфері азоту. Тільки через 20 хвилин ВЕРХ показала повне перетворення в 1-(2-бромфенілсульфаніл)-2,4-диметилбензол. Суміш охолоджували до 40°С, додавали 600 мл 15% мас. NaCl і перемішували протягом 5 хвилин. Органічну фазу розділяли і водну фазу промивали 2 100 мл толуолу. Об'єднані органічні фази промивали 100 мл 2 Μ HCl (водної), 100 мл 15% мас. NaCl, сушили над Na2SO4, кип'ятили із зворотним холодильником протягом 15 хвилин з активованим вугіллям (10 г), фільтрували двічі і випаровували з одержанням 107,3 г оранжево-червоної оливи (103%), яка, як було виявлено за допомогою ВЕРХ, була на 98% чистою. До розчину 90 г оранжево-червоної оливи (307 ммоль) в 500 мл сухого толуолу додавали 57 г boc-піперазину (307 ммоль), дегазували азотом протягом 5 хвилин, додавали 1,4 г Pd2dba3 (1,53 ммоль; 0,5 мол.%) і 2,9 г rac-BINAP (4,6 ммоль; 1,5 мол.%), дегазували протягом іще 2 хвилин, а потім додавали 35,4 г ButONa (368 ммоль) і нагрівали до 80°С протягом 18 годин. ВЕРХ показала повне перетворення і реакційну суміш охолоджували до кімнатної температури, фільтрували і осад на фільтрі промивали 2 100 мл толуолу. Об'єднані фільтрати екстрагували двічі 2 150 мл 15% мас. NaCl, сушили над Na2SO4, додавали активоване вугілля, кип'ятили із зворотним холодильником протягом 30 хвилин, фільтрували двічі і випаровували з одержанням 140,7 г коричнюватої оливи (4[2-(2,4-диметилфенілсульфаніл)феніл]-ВOСпіперазину). Неочищену оливу розчиняли в 300 мл МЕОН і 200 мл 6М HCl (водної) і кип'ятили зі зворотним холодильником протягом 1 години, після чого ВЕРХ показала повне видалення захисних груп. Після охолоджування до кімнатної температури, метанол видаляли за допомогою вакууму на роторному випарнику, додавали 200 мл концентрованого NaOH (pH вимірювали до 13-14), після чого суміш перемішували протягом 15 хвилин з 1000 мл ЕtOАс. Органічну фазу збирали і екстра 45 93250 46 гували 300 мл 15% мас. сольового розчину, сушили над Na2SO4 і додавали до розчину 46,3 г фумарової кислоти (399 ммоль) в 300 мл МЕОН. Суміш нагрівали до температури дефлегмації, охолоджували до кімнатної температури, а потім залишали в морозилці протягом ночі (-18°С). Осад збирали, промивали 100 мл ЕtOАс і 100 мл ацетону, сушили у вакуумі (50°С) з одержанням 103,2 г фумарату 1[2-(2,4-диметилфенілсульфаніл)феніл]піперазину (249 ммоль) у вигляді білого порошку із загальним виходом 81% з чистотою 99% за РХ-МС. Фумарат перетворювали на вільну основу (1-[2-(2,4диметилфенілсульфаніл)феніл]піперазину) з використанням ЕtOАс/Н2О/концентрований NaOH, органічну фазу промивали сольовим розчином, сушили з використанням Na2SO4, фільтрували і до фільтрату додавали 34 мл 48% мас. HBr (водної), викликаючи осадження білої твердої речовини. Тверду речовину збирали, обробляли 1000 мл киплячої Н2О, яка при охолоджуванні до кімнатної температури утворювала рідку масу. Кінцевий продукт (гідробромід 1-[2-(2,4-диметилфенілсульфаніл)-феніл]піперазину) збирали фільтрацією і сушили у вакуумі (50°С) з одержанням 83 г білого порошку (загальний вихід 71%), CHN (теоретично) 56,99; 6,11; 7,39; CHN (виявлено) 57,11; 6,15; 7,35. Приклад 23 815 г NaOBut (8,48 моль), 844 г піперазину (9,8 моль), 6,6 г Pd(dba)2 (11,48 ммоль) і 13,6 г racBINAP (21,84 ммоль) перемішували з 4 л толуолу протягом 50 хвилин. Потім додавали 840 г 2бромйодбензолу (2,97 моль) разом з 1,5 л толуолу і перемішування продовжували протягом 30 хвилин. Нарешті додавали 390,8 г 2,4-диметилтіофенолу (2,83 моль) з 1,5 л толуолу. Суспензію нагрівали до температури дефлегмації і кип'ятіння із зворотним холодильником продовжували протягом 5 годин. Реакційну суміш охолоджували протягом ночі. Додавали 2 л води і перемішували протягом 1 години, а потім суміш фільтрували через допоміжну фільтрувальну речовину. Потім фільтрат промивали 3 1 л сольового розчину. Потім об'єднані водні фази екстрагували 600 мл толуолу. Потім об'єднані фази толуолу нагрівали до 70°С, а потім додавали 329,2 мл 48% мас. HBr (водної) і 164,6 мл води. Суміш охолоджували до кімнатної температури протягом ночі. Кінцевий продукт (гідробромід 1-[2-(2,4-диметилфенілсульфаніл)феніл]піперазину) збирали фільтрацією і сушили у вакуумі (60°С) з одержанням 895 г (вихід 84%). Приклад 24 40,76 г NaOBut (424,1 моль), 0,33 г Pddba2 (0,57 ммоль) і 0,68 г rac-BINAP (1,09 ммоль) перемішували з 200 мл толуолу. Додавали 42 г 2бромйодбензолу (362 ммоль) і 19,54 г 2,4диметилтіофенолу (362 ммоль) з 50 мл толуолу. Суспензію нагрівали до температури дефлегмації і кип'ятіння із зворотним холодильником продовжували протягом ночі. Аналіз ВЕРХ показав повне перетворення на проміжний продукт (1-(2бромфенілсульфаніл)-2,4-диметилбензол). Реакційну суміш охолоджували до кімнатної температури і фільтрували через допоміжну фільтрувальну речовину. Фільтрат додавали до суміші 40,76 г NaOBut (424,1 ммоль), 42,2 г піперазину (489,9 ммоль), 0,33 г Pddba2 (0,57 ммоль) і 0,68 г racBINAP (1,09 ммоль) і нагрівали до температури дефлегмації протягом 2 годин. Реакційну суміш охолоджували протягом ночі. Додавали 100 мл води і водну фазу відділяли. Органічну фазу фільтрували через допоміжну фільтрувальну речовину, а потім фільтрат промивали 3 80 мл сольового розчину. Потім об'єднані водні фази екстрагували 50 мл толуолу. Потім об'єднані фази толуолу нагрівали до 70°С, а потім додавали 16,5 мл 48% мас. HBr (водної) і 8,25 мл води. Суміш охолоджували до кімнатної температури протягом ночі. Кінцевий продукт (гідробромід 1-[2-(2,4-диметилфенілсульфаніл)феніл]піперазину) збирали фільтрацією і сушили у вакуумі (60°С) з одержанням 40,18 г не зовсім білого порошку (вихід 75%). Приклад 25 47 40,76 г NaOBut (424,1 ммоль), 0,33 г Pddba2 (0,57 ммоль) і 0,68 г rac-BINAP (1,09 ммоль) перемішували з 200 мл толуолу. Додавали 42 г 2бромйодбензолу (148,5 ммоль) і 19,54 г 2,4диметилтіофенолу (141,4 ммоль) з 50 мл толуолу. Суспензію нагрівали до температури дефлегмації і кип'ятіння із зворотним холодильником продовжували протягом ночі. Аналіз ВЕРХ показав повне перетворення на проміжний продукт (1-(2бромфенілсульфаніл)-2,4-диметилбензол). Реакційну суміш охолоджували до 50°С і додавали 42,2 г піперазину (489,9 ммоль) разом з 100 мл толуолу. Суміш нагрівали до температури кипіння дефлегмації протягом 4 годин. Реакційну суміш охолоджували до кімнатної температури протягом ночі. Додавали 100 мл води і реакційну суміш фільтрували через допоміжну фільтрувальну речовину. Потім осад на фільтрі промивали 50 мл толуолу. Водну фазу відокремлювали і органічну фазу потім промивали 3 25 мл сольового розчину і 25 мл води. Потім об'єднані водні фази екстрагували 30 мл толуолу. Потім об'єднані фази толуолу нагрівали до 70°С, а потім додавали 16,46 мл 48% мас. HBr (водної) і 8,23 мл води. Суміш охолоджували до кімнатної температури протягом ночі. Кінцевий продукт (гідробромід 1-[2-(2,4диметилфенілсульфаніл)феніл]піперазину) збирали фільтрацією і сушили у вакуумі (60°С) з одержанням 46,8 г (вихід 87%). Приклад 26 Вплив на позаклітинні рівні ацетилхоліну в головному мозку щурів, що вільно пересуваються Способи Тваринам вводили 1-[2-(2,4-диметилфенілсульфаніл)феніл]піперазин, сіль HBr. Тварини Використовували самців щурів SpragueDawley, з початковою масою 275-300 г. Тварин тримали в приміщенні з 12-годинним циклом світло/темрява в контрольованих умовах постійної внутрішньої температури (21±2°С) і вологості (55±5%) з харчуванням і водопровідною водою, доступними без обмежень. Експерименти з хірургічною операцією і мікродіалізом Щурам проводили анестезію за допомогою гіпнорму/дормікуму (2 мл/кг) і інтрацеребральні направляючі канюлі (СМА/12) стереотаксично імплантували в головний мозок, націлюючись на розміщення кінця зонда для діалізу у вентральному гіпокампі (координати: 5,6 мм позаду брегми, латерально -5,0 мм, на 7,0 мм вентральніше твердої оболонки) або у префронтальній корі (координати: 3,2 мм попереду брегми; латерально, 0,8 мм; на 4,0 мм вентральніше твердої оболонки). Для 93250 48 фіксації направляючих канюль використовували анкерний гвинт і акриловий цемент. Температуру тіла тварин піддавали моніторингу за допомогою ректального детектора і підтримували при 37°С. Щурам дозволяли видужувати після хірургічної операції протягом 2 діб, їх розміщували в клітках поокремо. В день експерименту через направляючу канюлю вводили зонд для мікродіалізу (СМА/12, діаметр 0,5 мм, довжина 3 мм). Зонди сполучали через двоканальне поворотне з'єднання з мікроін'єкційним дозатором. Перфузію зонда для мікродіалізу фільтрованим розчином Рінгера (145 мм NaCl, 3 мМ КСl, 1 мМ MgCl2, 1,2 мМ СаСl2, що містить 0,5 мкМ неостигміну) починали незабаром перед введенням зонда в головний мозок і продовжували в ході експерименту з постійною швидкістю потоку, що становить 1 мкл/хв. Після 180 хвилин стабілізації починали експерименти. Діалізати збирали кожні 20 хвилин. Після експериментів тварин убивали, їх головний мозок виймали, заморожували і розрізали для перевірки розміщення зонда. Сполуку розчиняли в 10% HPbetaCD і ін'єктували підшкірно (2,5-10 мг/кг). Дози виражено в мг солі/кг маси тіла. Сполуку вводили в об'ємі 2,5 мл/кг. Аналіз ацетилхоліну діалізату Концентрацію ацетилхоліну (ACh) в діалізатах аналізували за допомогою ВЕРХ з електрохімічною детекцією з використанням рухомої фази, що складається з 100 мМ динатрій гідрофосфату, 2,0 мМ октансульфонової кислоти, 0,5 мМ хлориду тетраметиламонію і 0,005% MB (ESA), pH 8,0. Передколонковий ферментний реактор (ESA), що містить імобілізовану холіноксидазу, видаляв холін з ін'єктованого зразка (10 мкл) перед розділенням ACh на аналітичній колонці (ESA ACH-250); витрата потоку 0,35 мл/хв., температура 35°С. Після аналітичної колонки зразок пропускали через післяколонковий твердофазний реактор (ESA), що містить імобілізовану ацетилхолінестеразу і холіноксидазу. Останній реактор перетворював ACh на холін, а потім холін в бетаїн і Н2О2. Останній з них піддавали електрохімічній детекції з використанням платинового електроду (аналітична комірка: ESA, model 5040). Представлення даних У експериментах з одноразовою ін'єкцією середнє значення для 3 послідовних зразків Ach, безпосередньо передуючих введенню сполуки, служили як базовий рівень для кожного експерименту, і дані перетворювали у відсотки від базових (середні базові значення до ін'єкції, нормалізовані до 100%). Результати 49 Сполука значущо підвищувала позаклітинні рівні ACh в префронтальній корі щура і у вентральному гіпокампі - див. Фіг.19а і 19b. Приклад 27 Прояв ситуативного умовнорефлекторного страху у щурів Сполукою, що вводилася в цьому експерименті, була HBr-сіллю 1-[2-(2,4-диметилфенілсульфаніл)феніл]піперазину. Автори цього винаходу досліджували вплив сполуки на навчання, консолідацію і скасування ситуативного умовно-рефлекторного страху у щурів. У парадигмі вироблення умовно-рефлекторного страху, тварин навчають асоціювати нейтральне навколишнє середовище (контекст, навчальна камера, CS) із викликаючим огиду досвідом (електричний шок лап, US). В ході повторного впливу в навчальній камери тварини виявляють завмирання, яке вважають за прямий показник пов'язаної із страхом пам'яті [Pavlov J. Biol. Sci., 15, 177-182, 1980]. Нейроанатомія появи ситуативного умовнорефлекторного страху була ретельно досліджена і декілька досліджень показали, що гіпокамп і мигдалина мозочка необхідні для формування цієї пам'яті [Hippocampus, 11,8-17, 2001; J Neurosci., 19, 1106-1114, 1999; Behav. Neurosci., 106,274-285, 1992]. Тваринні і лікарські засоби Використовували дорослих самців щурів Sprague-Dawley (масою 250-300 г у момент навчання) з Charles River Laboratories, яких розміщували по двоє на клітку з 12-годинним циклом світло/темрява. Їжа і вода були доступні без обмежень. Щурів використовували через 1 тиждень після одержання. Сполуку розчиняли в 10% HPbetaCD і ін'єктували підшкірно. Лікарський засіб вводили в об'ємі 2,5 мл/кг. Апаратура Навчання і тестування проводили в звукоізолюючій камері (302040 см), що знаходиться в ізольованій кімнаті і сполученій з вентиляційною системою. Освітлення забезпечували за допомогою білого світла (60 Ват). Підлога камери складалася з металевої сітки, сполученої з генератором електрошоку. Перед навчанням і тестуванням камеру очищали 70% розчином етанолу. Відеокамера дозволяла спостерігати за поведінкою і запис сеансу навчання для автономного аналізу. Тест навчання і ретенції В ході навчання тваринам дозволяли вільно досліджувати нове навколишнє середовище протягом періоду звикання, що становить 1 хвилину, який завершували з одночасним одиничним неминучим шоком лап (безумовний подразник (US)), через електрифіковані грати підлоги. Шок лап мав тривалість 2 секунди і інтенсивність 0,75 мА. Тварини залишалися в камері для вироблення умовних рефлексів протягом додаткових 60 секунд після цього US. Завмирання оцінювали в ході перших 58 секунд (передшокове навчання; причому експериментатор не мав інформації про групи) для визначення базових реакцій завмирання на оточення. В кінці навчання тварин обережно витягували і поміщали в їх домашні клітки. Через 24 години тих же тварин повторно поміщали в навчальні умови (камера для викликання умовних рефлексів на 93250 50 страх) і проводили тест ретенції протягом 2 хвилин. В ході цього періоду шок лап не застосовували. Завмирання оцінювали в ході всього періоду тестування експериментатором, що не мав інформації про групи, і представляли як відсоткову частину від загального періоду тестування. Результати і обговорення Вплив сполуки на ситуативне викликання страху у щурів Вплив сполуки на ситуативне викликання страху у щурів досліджували (і) відносно навчання (лікарський засіб застосовували до навчання, Фіг.20), (іі) у відношенні відтворення спогаду (лікарський засіб застосовували перед тестом, Фіг.21) і (ііі) відносно консолідації (лікарський засіб застосовували відразу після навчання, Фіг.22). У першій групі експериментів, сполуку (1, 5 і 10 мг/кг) вводили за 1 годину перед сеансом навчання. На Фіг.20 зображено придбання поведінки завмирання в ході навчання (за 58 секунд перед шоком стопи) і тест ретенції через 24 години. Були виявлені наступні дані: - сполука не впливає на базове завмирання перед здійсненням шоку лап в будь-якій тестованій дозі; - сполука в дозі 5 мг/кг мала тенденцію до підвищення часу, витраченого на завмирання в ході тесту ретенції через 24 години після навчання (39,24±13,76%, n=6, проти 24,30±4,40%, n=16, у тварин, яким вводили носій); - сполука в дозі 10 мг/кг значущо підвищує час, витрачений на завмирання в ході тесту на ретенцію через 24 години після навчання (52,15±5,68%, n=10, проти 24,30±4,40%, n=16, у тварин, яким вводили носій, р
ДивитисяДодаткова інформація
Назва патенту англійськоюCrystalline form of 1- [2- (2,4-dimethylphenylsulfanyl)-phenyl] piperazine derivatives as a compound with combined serotonin reuptake, 5-ht3 and 5-ht1a activity for the treatment of cognitive impairment
Автори англійськоюBang-Andersen Benny, Faldt Andre, Mork Arne, Lopez De Diego Heidi, Holm Rene, Stensbol Tine Bryan, Ringgaard Lone Munch, Mealy Michael J., Rock Michael Harold, Brodersen Jorgen, Jorgensen Morten, Moore Nicholas
Назва патенту російськоюКристаллическая форма производных 1-[2-(2,4-диметилфенилсульфанил)-фенил]пиперазина kak соединение c комбинированной активностью b отношении обратного захвата серотонина, 5-ht3 и 5-ht1a для лечения когнитивных нарушений
Автори російськоюБанг- Андерсен Бенни, Фалт Андре, Мьорк Арне, Лопес де Диего Хейди, Холм Рене, Стенсбьол Тине Брайан, Ринггор Лоне Мунк, Мили Майкл Дж., Рок Майкл Харольд, Бродерсен Йорген, Йоргенсен Мортен, Myp Николас
МПК / Мітки
МПК: C07D 295/08, A61K 31/495, A61P 25/28
Мітки: 5-ht1a, 5-ht3, активністю, серотоніну, захоплення, кристалічна, форма, сполука, 1-[2-(2,4-диметилфенілсульфаніл)-феніл]піперазину, когнітивних, зворотного, порушень, лікування, комбінованою, стосовно, похідних
Код посилання
<a href="https://ua.patents.su/37-93250-kristalichna-forma-pokhidnikh-1-2-24-dimetilfenilsulfanil-fenilpiperazinu-yak-spoluka-z-kombinovanoyu-aktivnistyu-stosovno-zvorotnogo-zakhoplennya-serotoninu-5-ht3-ta-5-ht1a-dlya-l.html" target="_blank" rel="follow" title="База патентів України">Кристалічна форма похідних 1-[2-(2,4-диметилфенілсульфаніл)-феніл]піперазину як сполука з комбінованою активністю стосовно зворотного захоплення серотоніну, 5-ht3 та 5-ht1a для лікування когнітивних порушень</a>