Заміщені 2-гетероарилом бензотіофени та бензофурани
Формула / Реферат
1. Сполука формули Ia
 , (Ia)
, (Ia)
де
R1 вибрано з групи: Н, галоген, метил, С1-5флуороалкіл, С1-3алкіленОС1-3алкіл, С1-3алкіленОС1-3флуороалкіл, С1-3алкіленNН2, С1-3алкіленNНС1-3алкіл, С1-3алкіленN(С1-3алкіл)2, С1-3алкіленNНС1-3флуороалкіл, С1-3алкіленN(С1-3флуороалкіл)2, С1-3алкіленN(С1-3алкіл)С1-3флуороалкіл, гідрокси, метокси, С1-5флуороалкокси, С1-5алкілтіо, C1-5флуороалкілтіо, аміно, NHC1-3алкіл, NНС1-3флуороалкіл, N(С1-3алкіл)2, N(C1-3алкіл)C1-3флуороалкіл, NН(СО)С1-3алкіл, NН(СО)С1-3флуороалкіл, NН(СО)С1-3алкокси, NH(CO)C1-3флуороалкокси, NHSO2C1-3алкіл, NHSO2C1-3флуороалкіл, (СО)С1-3алкіл, (СО)С1-3флуороалкіл, (СО)С1-3алкокси, (СО)С1-3флуороалкокси, (CO)NH2, (СО)NНС1-3алкіл, (СО)NНС1-3флуороалкіл, (СО)N(С1-3алкіл)2, (СО)N(С1-3алкіл)С1-3флуороалкіл, (CO)N(C4-6алкілен), (СО)N(С4-6флуороалкілен), ціано, SO2NHC1-3флуороалкіл, нітро та SO2NH2;
R2 вибрано з групи: Н, галоген, метил, С1-5флуороалкіл, С1-3алкіленОС1-3алкіл, С1-3алкіленОС1-3флуороалкіл, С1-3алкіленNН2, С1-3алкіленNНС1-3алкіл, С1-3алкіленN(С1-3алкіл)2, С1-3алкіленNНС1-3флуороалкіл, С1-3алкіленN(С1-3флуороалкіл)2, С1-3алкіленN(С1-3алкіл)С1-3флуороалкіл, гідрокси, метокси, С1-5флуороалкокси, С1-5алкілтіо, С1-5флуороалкілтіо, аміно, NHC1-3алкіл, NНС1-3флуороалкіл, N(С1-3алкіл)2, N(С1-3алкіл)С1-3флуороалкіл, NН(СО)С1-3алкіл, NН(СО)С1-3флуороалкіл, NН(СО)С1-3алкокси, NH(СО)С1-3флуороалкокси, NHSO2С1-3алкіл, NНSO2С1-3флуороалкіл, (СО)С1-3алкіл, (СО)С1-3флуороалкіл, (СО)С1-3алкокси, (CO)C1-3флуороалкокси, (CO)NH2, (СО)NНС1-3алкіл, (СО)NНС1-3флуороалкіл, (CO)N(C1-3алкіл)2, (СО)N(С1-3алкіл)С1-3флуороалкіл, (СО)N(С4-6алкілен), (СО)N(С4-6флуороалкілен), ціано, SO2NHC1-3флуороалкіл, нітро та SO2NH2; або
R1 та R2 разом утворюють кільце:
 ;
;
Х9 вибрано з О;
Q - нітрогеновмісний ароматичний гетероцикл, вибраний з Q2:
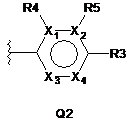 ,
,
де
Q2 - 6-членний ароматичний гетероцикл, що містить один або два атоми N, де Х1, X2, X3 та Х4 є незалежно вибраними з N або С; та де один або два з Х1, Х2, Х3 та Х4 - N, а залишковий - С, а коли атом Х1 - С, вказаний С є заміщеним R4; а коли атом Х2 - С, вказаний С є заміщеним R5;
R3 вибрано з групи: метокси, С1-4флуороалкокси, аміно, NНС1-3алкіл, NHC1-3флуороалкіл, N(С1-3алкіл)2, N(С1-3алкіл)С1-3флуороалкіл, NН(СО)С1-3алкіл, NH(CO)C1-3флуороалкіл, NH(CO)G2, (CO)NH2, (CO)C1-3алкокси, метилтіо, С1-6флуороалкілтіо, SO2NH2, N(C4-6алкілен) та G1;
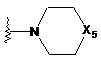
Х5 вибрано з групи: О, NH, NC1-3алкіл та N(СО)От-бутил;
G2 - феніл або 5- або 6-членний ароматичний гетероцикл, необов'язково заміщений одним замісником, вибраним з групи: флуор, С1-3алкокси, С1-3флуороалкокси та йод;
R4 вибрано з групи: Н, флуор, бром та йод;
R5 вибрано з групи: Н, флуор, бром та йод;
один або більше складових атомів необов'язково є визначуваними ізотопами;
як вільна основа або її фармацевтично прийнятні сіль, сольват або сольват солі;
за умови, що вилучено нижченаведені сполуки:
 ,
,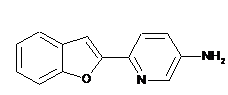 .
.
2. Сполука за п. 1, де R1 вибрано з групи: Н, гідрокси та метокси.
3. Сполука за будь-яким з пп. 1-2, де R2 вибрано з групи: Н, флуор, гідрокси та метокси.
4. Сполука за будь-яким з пп. 1-3, де Q2 - піридинове кільце, де Х3 та Х4 є незалежно вибраними з N або С, та де один з Х3 та Х4 - N, а залишкові X1, Х2, Х3 та Х4 - С.
5. Сполука за будь-яким з пп. 1-4, де R3 вибрано з групи: аміно, NНметил та (CO)NH2.
6. Сполука за будь-яким з пп. 1-5, де R4 вибрано з групи: Н та флуор.
7. Сполука за будь-яким з пп. 1-6, де R5 вибрано з групи: Н та флуор.
8. Сполука за п. 1, якою є:
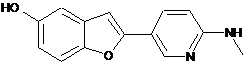
2-(6-метиламінопіридин-3-іл)-1-бензофуран-5-ол
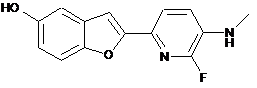
2-(6-флуоро-5-метиламінопіридин-2-іл)-бензофуран-5-ол

2-(5-флуоро-6-метиламінопіридин-3-іл)-бензофуран-5-ол
та один або більше складових атомів необов'язково є визначуваними ізотопами;
як вільна основа або її фармацевтично прийнятні сіль, сольват або сольват солі;
9. Сполука за п. 1, якою є:
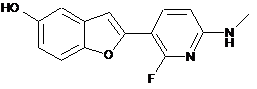
2-(2-флуоро-6-метиламінопіридин-3-іл)-бензофуран-5-ол
та один або більше складових атомів необов'язково є визначуваними ізотопами; як вільна основа або її фармацевтично прийнятні сіль, сольват або сольват солі;
10. Сполука за будь-яким з пп. 1-9, де один зі складових атомів необов'язково є визначуваним ізотопом, вибраним з групи: 11С або 18F.
11. Сполука формули Іb
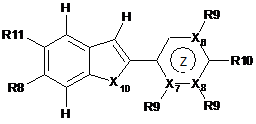 , (Ib)
, (Ib)
де
Z - 6-членний ароматичний гетероцикл, що містить один або два атоми N, де Х6, Х7 та Х8 незалежно вибрані з N або С, та де один або два з Х6, Х7 та Х8 - N, а залишковий - С, та де Х6 - С, вказаний С необов'язково заміщений R9, де Х7 - С, вказаний С необов'язково заміщений R9, та де Х8 - С, вказаний С, необов'язково заміщений R9;
Х10 вибрано з О;
R8 вибрано з групи: OSi(G3)3, Sn(C1-4aлкіл)3, N(CH3)3+, IG6+, N2+ та нітро;
R9 вибрано з групи: Н, бром, хлор, йод, флуор, Sn(С1-4алкіл)3, N(CH3)3+, IG6+, N2+ та нітро;
R10 вибрано з групи: аміно, метиламіно, NH(CH2)2-4G7, диметиламіно N(CH3)CHO, N(CH3)COCH3, N(СН3)СО2-т-бутил, метокси, гідрокси, (CO)NH2 та О(СН2)2-4G7;
R11 вибрано з групи: OSi(G3)3, OCH2C4, OG5, Н, бром, флуор, гідрокси, метокси, Sn(С1-4алкіл)3, N(CH3)3+, IG6+, N2+ та нітро;
G3 вибрано з групи: С1-4алкіл та феніл;
G4 вибрано з групи: 2-(триметилсиліл)етокси, С1-3алкокси, 2-(С1-3алкоксі)етокси, С1-3алкілтіо, циклопропіл, вініл, феніл, п-метоксифеніл, о-нітрофеніл та 9-антрил;
G5 вибрано з групи: тетрагідропіраніл, 1-етоксіетил, фенацил, 4-бромфенацил, циклогексил, т-бутил, т-бутоксикарбоніл, 2,2,2-трихлороетилкарбоніл та трифенілметил;
IG6+ - складова частина солі йодонію, де атом йоду є гіпервалентним та має позитивний формальний заряд, де G6 - феніл, необов'язково заміщений одним замісником, вибраним з групи: метил та бром;
G7 вибрано з групи: бром, йод, OSO2CF3, OSO2CH3 та OSO2феніл, вказаний феніл необов'язково заміщений метилом або бромом;
з посиланням на формулу Іb, один або кілька замісників, вибраних з R8, R9, R10 та R11, є одною з функціональних груп, вибраних з брому, флуору, гідрокси, Sn(С1-4алкіл)3 N(CH3)3+, IG6+, N2+, нітро, аміно, метиламіно, NH(CH2)2-4G7, N(CH3)CHO, N(CH3)COCH3, N(СН3)СО2-т-бутил, (CO)NH2, O(CH2)2-4G7, OSi(G3)3 та OCH2G4;
як вільна основа або її сіль, сольват або сольват солі;
за умови, що вилучено нижченаведені сполуки:
 ,
, .
.
12. Сполука за п. 11, де Z - піридинове кільце, де Х6 та Х7 - С, а Х8 - N.
13. Сполука за п. 11, де Z - піридинове кільце, де Х6 та Х8 - С, а Х7 - N.
14. Застосування сполуки за будь-яким з пп. 11-13 як синтетичного попередника у отриманні міченої сполуки за будь-яким з пп. 1-10, де вказана мітка складається з одного [11С]метилу та одного атома 18F.
15. Фармацевтична композиція, що містить сполуку за будь-яким з пп. 1-10 разом з фармацевтично прийнятним носієм.
16. Спосіб вимірювання амілоїдних відкладень in vivo у особи, в якому здійснюють етапи: (а) застосування виявлюваної кількості фармацевтичної композиції за п. 15, та (b): визначення зв'язування сполуки в амілоїдних відкладеннях у особи.
17. Спосіб за п. 16, де вказане визначення проводять способами, вибраними з групи: гамма-відображення, магнітно-резонансне відображення та магнітно-резонансна спектроскопія.
18. Спосіб за п. 17, де особа має підозру на хворобу або синдром з групи: хвороба Альцгеймера, споріднена хвороба Альцгеймера, синдром Дауна та гомозиготи для алелі аполіпопротеїну Е4.
19. Сполука за будь-яким з пп. 1-10 для застосування у терапії.
20. Застосування сполуки за будь-яким з пп. 1-10 у виробництві медикаменту для лікування та/або попередження хвороби Альцгеймера, споорідненої хвороби Альцгеймера, синдрому Дауна та гомозигот для алелі аполіпопротеїну Е4.
Текст
Реферат: Заявлений винахід стосується нових заміщених 2-гетероарилом похідних бензотіофену та бензофурану та терапевтичного застосування таких сполук, що мають формулу (Іа), а також їх фармацевтично прийнятних солей, композицій та способів застосування. Крім того, винахід стосується нових заміщених 2-гетероарилом похідних бензотіофену та бензофурану, що є придатними для відображення амілоїдних відкладень у пацієнтів, їх композицій, способів застосування та створення таких сполук. Більш конкретно, заявлений винахід стосується способу відображення амілоїдних відкладень у мозку in vivo для діагностики хвороби Альцгеймера до смерті, а також вимірювання клінічної ефективності терапевтичних агентів проти хвороби Альцгеймера. (Ia) UA 98481 C2 (12) UA 98481 C2 H H R1 Q X9 R2 H (Ia) UA 98481 C2 5 10 15 20 25 30 35 40 45 50 55 Заявлений винахід стосується нових заміщених 2-гетероарилом похідних бензотіофену та бензофурану та терапевтичного застосування таких сполук. Крім того, винахід стосується нових заміщених 2-гетероарилом похідних бензотіофену та бензофурану, що є придатними для відображення амілоїдних відкладень у пацієнтів, їх композицій, способи застосування та створення таких сполук. Більш конкретно, заявлений винахід стосується способу відображення амілоїдних відкладень у мозку іn vіvо для діагностики хвороби Альцгеймера до смерті, а також вимірювання клінічної ефективності терапевтичних агентів проти хвороби Альцгеймера. Амілоїдоз є прогресуючою, невиліковною метаболічною хворобою невідомого спричинення, що характеризується анормальними відкладеннями білку в одному або більше органах або системах організму. Амілоїдні білки виробляються, наприклад, несправною роботою кісткового мозку. Амілоїдоз, котрий трапляється при накопиченні амілоїдних відкладень, порушує нормальну функцію організму, може спричинювати неспроможність або смерть органу. Він є рідкою хворобою, що трапляється приблизно у восьми з кожного 1000000 людей. Він вражає чоловіків та жінок однаковою мірою та звичайно розвивається після 40. Принаймні 15 типів амілоїдозу ідентифіковані. Кожний асоціюється із відкладеннями відмінних різновидів білку. Головними формами амілоїдозів є первинний системний, вторинний та родинний або спадковий амілоїдоз. Є також ще одна форм амілоїдозу що асоціюється з хворобою Альцгеймера. Первинний системний амілоїдоз звичайно розвивається між 50 та 60. Приблизно з 2000 нових випадків, діагнозованих щорічно, первинний системний амілоїдоз є найчастішою формою цієї хвороби у США. Також відомий як пов'язаний з легкими ланцюгами амілоїдоз може також траплятися в асоціації з множинною мієломою (рак кісткового мозку). Вторинний амілоїдоз є результатом хронічної інфекційної або запальної хвороби. Це часто асоціюється з родинною середньоземноморською лихоманкою (бактеріальною інфекцією, що характеризується застудою, слабкістю, головним болем, та рекурентною лихоманкою), грануломатозним ілеїтом (запалення тонкого кишечнику), хворобою Годжкіна, проказою, остеомієлітом та ревматоїдним артритом. Родинний або спадковий амілоїдоз є тільки спадковою формою хвороби. Він відбувається у членів більшості етнічних груп, та кожна родина має відмінну картину симптомів та втягання органів. Спадковий амілоїдоз, можна вважати, є аутосомною домінантою, що означає, що тільки одна копія дефективного гена є необхідною для спричинення хвороби. Дитина з родинним амілоїдозом має ризик 50-50 розвинення хвороби. Амілоїдоз може вражати будь-який орган або систему в організмі. Серце, нирки, шлунковокишкова система та нервова система є враженими найбільш часто. Інші звичайні ділянки накопичення амілоїду охоплюють мозок, суглоби, печінку, селезінку, підшлункову залозу, респіраторну систему та шкіру. Хвороба Альцгеймера (АD) є найчастішою формою деменції, неврологічної хвороби, що характеризується втратою розумової здатності, суворої навіть для нормального життя, протягом принаймні 6 місяців, та відсутня від народження. АD звичайно трапляється у похилому віці, та знижує когнітивні функції як-то запам'ятовування, міркування та планування. 2-4 мільйони американців мають АD; це число, як очікують, зростатиме до 14 мільйонів до середини 21 сторіччя. Тоді як невелику число людей у 40 та 50 років виявляють хворобу, АD перш за все вражає старих. АD вражає приблизно 3 % усіх людей віком між 65 та 74, приблизно 20 % людей віком між 75 та 84, та приблизно 50 % людей віком більше 85. Трохи більш жінок, ніж чоловіків є враженими АD, навіть, зважаючи на довше життя жінок, так що є вища пропорція жінок у найбільш вражених вікових групах. Накопичення амілоїдного А-пептиду у мозку є патологічною ознакою усіх форм АD. Загальновизнано, що відкладення церебрального амілоїдного А-пептиду є первинним впливом, що запускає патогенез АD. (Наrdу J та Sеlkое D.J., Sсіеnсе. 297: 353-356, 2002). Способи відображення, як-то позитронна емісійна томографія (РЕТ) та однофотонна емісійна комп'ютерна томографія (SРЕСТ), є ефективними у моніторингу накопичення амілоїдних відкладень у мозку та корелюванню їх з прогресуванням АD (Shоghі-Jаdіd еt аl. Тhе Аmеrісаn jоurnаl оf gеrіаtrіс рsусhіаtrу 2002, 10, 24; Міllеr, Sсіеnсе, 2006, 313, 1376; Соіmbrа еt аl. Сurr. Тор. Меd. Сhеm. 2006, 6, 629; Nоrdbеrg, Lаnсеt Nеurоl. 2004, 3, 519). Застосування цих способів потребує розробки радіолігандів, що легко входять у мозок та селективно зв'язується з амілоїдними відкладеннями іn vіvо. Існує необхідність у сполуках, що зв'язують амілоїд, що можуть перетинати бар'єр кровмозок, та тому можуть бути застосовуваними у діагностиці. Крім того, важливо відстежувати ефективності лікування АD-пацієнтів вимірюванням дії вказаного лікування вимірюванням зміни АD рівня бляшок. 1 UA 98481 C2 5 10 15 20 Властивості визначуваної сполуки, що зв'язує амілоїд, опріч високої афінності стосовно амілоїдних відкладень іn vіvо та високого та швидкого доступу до мозку охоплюють низьке неспецифічне зв'язування з нормальними тканинами та швидкий кліренс. Ці властивості є звичайно залежними від ліпофільності сполуки (Соіmbrа еt аl. Сurr. Тор. Меd. Сhеm. 2006, 6, 629). Поміж запропонованих невеликих молекул для відображення бляшок амілоїду, синтезовані деякі незаряджені аналоги тіофлавіну Т для потенційного застосування (Маthіs еt аl. J. Меd. Сhеm. 2003, 46, 2740). Відмінні ізостеричні гетероцикли є повідомленими як потенційні стосовно зв'язування лігандів амілоїду (Саі еt аl. J. Меd. Сhеm. 2004, 47, 2208; Кung еt аl. J. Меd. Сhеm. 2003, 46, 237). Бензофуранові похідні раніше описані для застосування як агентів відображення амілоїду (Оnо еt аl. J. Меd. Сhеm. 2006, 49, 2725; Lосkhаrt еt аl. J. Віоl. Сhеm. 2005, 280(9), 7677; Кung еt аl. Nuсlеаr Меd. Віоl. 2002, 29(6), 633; WО2003051859 та для застосування у попередженні агрегації Абета (Тwуmаn еt аl. Теtrаhеdrоn Lеtt. 1999, 40(52), 9383; Ноwlеtt еt аl. Віосhеmісаl Jоurnаl 1999, 340(1), 283; Сhоі еt аl. Аrсhіvеs оf Рhаrmасаl Rеsеаrсh 2004, 27(1), 19; Тwуmаn еt аl. Віооrg. Меd. Сhеm. Lеtt. 2001, 11(2), 255; WО9517095). Бензотіофенові похідні раніше описані для застосування як агенти відображення амілоїду (Сhаng еt аl. Nuсlеаr Меdісіnе та Віоlоgу 2006, 33, 811) та для застосування як нейропротектант проти -амілоїдної токсичності (JР11116476). Існує необхідність у поліпшених сполуках для отримання співвідношення сигнал-шум, достатньо високого для детального визначення амілоїдних відкладень в усіх регіонах мозку, та забезпечення поліпшеної надійності у кількісних дослідженнях амілоїдних бляшок відносно лікування ліками. Заявлений винахід стосується нових заміщених 2-гетероарилом похідних бензотіофену та бензофурану для застосування як агентів відображення амілоїду та лікування пов'язаних з амілоїдом хвороб. Згідно з винаходом запропоновано сполуку формули (Іа): H H R1 Q X9 R2 H (Ia) 25 30 35 40 45 де R1 вибрано з групи: Н, галоген, метил, С1-5 флуоралкіл, С1-3 алкіленОС1-3 алкіл, С1-3 алкіленОС1-3 флуоралкіл, С1-3 алкіленNН2, С1-3 алкіленNНС1-3 алкіл, С1-3 алкіленN(С1-3 алкіл)2, С1-3 алкіленNНС1-3 флуоралкіл, С1-3 алкіленN(С1-3 флуоралкіл)2, С1-3 алкіленN(С1-3 алкіл)С1-3 флуоралкіл, гідрокси, метокси, С1-5 флуоралкокси, С1-5 алкілтіо, С1-5 флуоралкілтіо, аміно, NНС1-3 алкіл, NНС1-3 флуоралкіл, N(С1-3 алкіл)2, N(С1-3 алкіл)С1-3 флуоралкіл, NН(СО)С1-3 алкіл, NН(СО)С1-3 флуоралкіл, NН(СО)С1-3 алкокси, NН(СО)С1-3 флуоралкокси, NНSО2С1-3 алкіл, NНSО2С1-3 флуоралкіл, (СО)С1-3 алкіл, (СО)С1-3 флуоралкіл, (СО)С1-3 алкокси, (СО)С1-3 флуоралкокси, (СО)NН2, (СО)NНС1-3 алкіл, (СО)NНС1-3 флуоралкіл, (СО)N(С1-3 алкіл)2, (СО)N(С13 алкіл)С1-3 флуоралкіл, (СО)N(С4-6 алкілен), (СО)N(С4-6 флуоралкілен), ціано, SО2NНС1-3 флуоралкіл, нітро та SО2NН2; R2 вибрано з групи: Н, галоген, метил, С1-5 флуоралкіл, С1-3 алкіленОС1-3 алкіл, С1-3 алкіленОС1-3 флуоралкіл, С1-3 алкіленNН2, С1-3 алкіленNНС1-3 алкіл, С1-3 алкіленN(С1-3 алкіл)2, С1-3 алкіленNНС1-3 флуоралкіл, С1-3 алкіленN(С1-3 флуоралкіл)2, С1-3 алкіленN(С1-3 алкіл)С1-3 флуоралкіл, гідрокси, метокси, С1-5 флуоралкокси, С1-5 алкілтіо, С1-5 флуоралкілтіо, аміно, NНС1-3 алкіл, NНС1-3 флуоралкіл, N(С1-3 алкіл)2, N(С1-3 алкіл)С1-3 флуоралкіл, NН(СО)С1-3 алкіл, NН(СО)С1-3 флуоралкіл, NН(СО)С1-3 алкокси, NН(СО)С1-3 флуоралкокси, NНSО2С1-3 алкіл, NНSО2С1-3 флуоралкіл, (СО)С1-3 алкіл, (СО)С1-3 флуоралкіл, (СО)С1-3 алкокси, (СО)С1-3 флуоралкокси, (СО)NН2, (СО)NНС1-3 алкіл, (СО)NНС1-3 флуоралкіл, (СО)N(С1-3 алкіл)2, (СО)N(С13 алкіл)С1-3 флуоралкіл, (СО)N(С4-6 алкілен), (СО)N(С4-6 флуоралкілен), ціано, SО 2NНС1-3 флуоралкіл, нітро та SО2NН2; або R1 та R2 разом утворюють кільце; O 50 O 2 UA 98481 C2 Х9 вибрано з О та S. Q - нітрогеновмісний ароматичний гетероцикл, вибраний з Q1-Q10; R4 X1 O N R6 R5 X2 R6 N R3 N N R6 N X3 X4 Q1 N Q3 Q2 Q6 R6 S Q7 Q8 N N NH R6 R6 N N N N R6 N Q5 Q4 N N S Q9 Q10 5 10 15 де Q2-6-членний ароматичний гетероцикл, що містить один або два атоми N, де Х 1, Х2, Х3 та Х4 є незалежно вибраними з N або С; та де один або два з Х 1, Х2, Х3 та Х4-N, а залишковий - С, а коли атом Х1 - С, вказаний С є заміщеним R4; а коли атом Х2 - С, вказаний С є заміщеним R5; R3 вибрано з групи: метокси, С1-4 флуоралкокси, аміно, NНС1-3 алкіл, NНС1-3 флуоралкіл, N(С1-3 алкіл)2, N(С1-3 алкіл)С1-3 флуоралкіл, NН(СО)С1-3 алкіл, NН(СО)С1-3 флуоралкіл, NН(СО)G2, (СО)NН2, (СО)С1-3 алкокси, метилтіо, С1-6 флуоралкілтіо, SО2NН2, N(С4-6 алкілен) та G1; N X5 G1 20 25 Х5 вибрано з групи: О, NН, NС1-3 алкіл та N(СО)О-т-бутил; G2 - феніл або 5- або 6-членний ароматичний гетероцикл, необов'язково заміщений одним замісником, вибраним з групи: флуор, С1-3 алкокси, С1-3 флуоралкокси та йод; R4 вибрано з групи: Н та галоген; R5 вибрано з групи: Н, флуор, бром та йод; R6 вибрано з групи: Н, метил та (СН2)0-4СН2F; один або більше складових атомів необов'язково є визначуваним ізотопом; як вільну основу або її фармацевтично прийнятні сіль, сольват або сольват солі; за умови, що вилучено нижченаведені сполуки: 3 N NH UA 98481 C2 5 10 В одному аспекті запропоновано сполуки формули (Іа), де R4 вибрано з групи: Н, флуор, бром та йод. У ще одному аспекті запропоновано сполуки формули (Іа), де R1 вибрано з групи: Н, галоген, метил, С1-5 флуоралкіл, гідрокси, метокси, С1-5 флуоралкокси, метилтіо, С 1-5 флуоралкілтіо, аміно, NНметил, NНС1-3 флуоралкіл, N(СН3)СН3, N(С1-3 алкіл)С1-3 флуоралкіл, NН(СО)С1-3 алкіл, NН(СО)С1-3 флуоралкіл, NН(СО)С1-3 алкокси, NН(СО)С1-3 флуоралкокси, NНSО2С1-3 алкіл, NНSО2С1-3 флуоралкіл, (СО)С1-3 флуоралкіл, (СО)С1-3 алкокси, (СО)С1-3 флуоралкокси, (СО)NН2, (СО)NНС1-3 флуоралкіл, ціано, SО2NНС1-3 флуоралкіл, нітро та SО2NН2; або R1 та R2 разом утворюють кільце; O O 15 20 25 30 35 40 У ще одному аспекті запропоновано сполуки формули (Іа), де R1 вибрано з групи: Н, флуор, йод, метил, С1-5 флуоралкіл, гідрокси, метокси, ціано, С1-5 флуоралкокси, метилтіо, аміно, NНметил, NНС1-3 флуоралкіл, NН(СО)С1-3 алкіл, NН(СО)С1-3 флуоралкіл, NН(СО)С1-3 флуоралкокси, (СО)С1-3 алкокси та (СО)NН2. У ще одному аспекті запропоновано сполуки формули (Іа), де R1 вибрано з групи: Н, гідрокси та метокси. У ще одному аспекті запропоновано сполуки формули (Іа), де R2 вибрано з групи: Н, флуор, йод, С1-5 флуоралкіл, гідрокси, метокси, (СО)NН2, ціано та метилтіо. У ще одному аспекті запропоновано сполуки формули (Іа), де R2 вибрано з групи: Н, флуор, гідрокси та метокси. У ще одному аспекті запропоновано сполуки формули (Іа), де R2 - Н. У ще одному аспекті запропоновано сполуки формули (Іа), де Q-Q1. У ще одному аспекті запропоновано сполуки формули (Іа), де Q-Q2. У ще одному аспекті запропоновано сполуки формули (Іа), де Q вибрано з Q3-Q10. У ще одному аспекті запропоновано сполуки формули (Іа), де Q2 - піридинове кільце, де Х3 та Х4 є незалежно вибраними з N або С, та де один з Х 3 та Х4-N, а залишкові з Х1, Х2, Х3 та Х4 С. У ще одному аспекті запропоновано сполуки формули (Іа), де Q2 - піримідинове кільце, де Х2 та Х4-N, та де Х1 та Х3 - С. У ще одному аспекті запропоновано сполуки формули (Іа), де Q2 - піримідинове кільце, де Х1 та Х3-N, та де Х2 та Х4 - С. У ще одному аспекті запропоновано сполуки формули (Іа), де Q2 - піридазинове кільце, де Х3 та Х4-N, та де Х1 та Х2 - С. У ще одному аспекті запропоновано сполуки формули (Іа), де Q2 - піразинове кільце, де Х1 та Х4-N, та де Х2 та Х3 - С; або де Х1 та Х4 - С, та де Х2 та Х3-N. 4 UA 98481 C2 5 10 15 У ще одному аспекті запропоновано сполуки формули (Іа), де R3 вибрано з групи: метокси, С1-4 флуоралкокси, аміно, NНС1-3 алкіл, NНС1-3 флуоралкіл, N(С1-3 алкіл)2, N(С1-3 алкіл)С1-3 флуоралкіл, NН(СО)С1-3 алкіл, NН(СО)С1-3 флуоралкіл, (СО)NН2, (СО)С1-3 алкокси, метилтіо, С1-6 флуоралкілтіо, SО2NН2, та G1; де Х5 вибрано з групи: О, NН та N-метил. У ще одному аспекті запропоновано сполуки формули (Іа), де R3 вибрано з групи: аміно, NН-метил та (СО)NН2. У ще одному аспекті запропоновано сполуки формули (Іа), де R4 вибрано з групи: Н та флуор. У ще одному аспекті запропоновано сполуки формули (Іа), де R4 - Н. У ще одному аспекті запропоновано сполуки формули (Іа), де R4 - флуор. У ще одному аспекті запропоновано сполуки формули (Іа), де R5 вибрано з групи: Н та флуор. У ще одному аспекті запропоновано сполуки формули (Іа), де R5 - Н. У ще одному аспекті запропоновано сполуки формули (Іа), де R5 - флуор. У ще одному аспекті запропоновано сполуки формули (Іа), де R6 вибрано з групи: Н та метил. У ще одному аспекті запропоновано сполуки формули (Іа), де R6 - Н. У ще одному аспекті запропоновано сполуки формули (Іа), де R6 - метил. У ще одному аспекті запропоновано сполуки формули (Іа), вказаною сполукою є: 20 2-[6-(метиламіно)піридин-3-іл]-1-бензофуран-5-ол 5-(5-метокси-1-бензофуран-2-іл)піридин-2-карбоксамід 6-(5-гідрокси-1-бензофуран-2-іл)нікотинамід 5-(5-гідрокси-1-бензофуран-2-іл)піридин-2-карбоксамід 5-(5-метокси-1-бензофуран-2-іл)-N-метилпіридин-2-амін 6-(5-метокси-1-бензофуран-2-іл)піридазин-3-амін 2-(1-бензофуран-2-іл)-6-метоксиімідазо[1,2-а]піридин 5-(1-бензотієн-2-іл)піридин-2-карбоксамід 5-(1-бензофуран-2-іл)піридин-2-карбоксамід 6-(5-метокси-1-бензофуран-2-іл)нікотинамід 5 UA 98481 C2 2-(6-амінопіридазин-3-іл)-1-бензофуран-5-ол У ще одному аспекті запропоновано сполуки формули (Іа), вказаною сполукою є: 2-(2-флуор-6-метиламіно-піридин-3-іл)-бензофуран-5-ол 2-(6-флуор-5-метиламіно-піридин-2-іл)-бензофуран-5-ол 2-(5-флуор-6-метиламіно-піридин-3-іл)-бензофуран-5-ол 5 У ще одному аспекті запропоновано сполуку де 1-6 складовими атомами є визначуваний 3 13 ізотоп Н, або де 1-3 складовими атомами є визначуваний ізотоп С, або де одним складовим 18 11 75 76 120 123 125 131 14 атомом є визначуваний ізотоп, вибраний з групи: F, С, Вr, Вr, І, І, І, І та С, вказана сполука є вибраною з групи: 10 11 15 В одному втіленні цього аспекту де одним зі складових атомів є визначуваний ізотоп С. У 18 ще одному втіленні цього аспекту де одним зі складових атомів є визначуваний ізотоп F. У ще одному аспекті запропоновано сполуки формули (Іа), де одним або більше з атомів молекули є визначуваний ізотоп. У ще одному аспекті запропоновано сполуки формули (Іа), де 1-6 зі складових атомів є 3 визначуваний ізотоп Н, або де 1-3 складовими атомами є визначуваний ізотоп, вибраний з 6 UA 98481 C2 19 5 10 13 18 групи: F та С, або де одним складовим атомом є визначуваний ізотоп, вибраний з групи: F, 11 75 76 120 123 125 131 14 С, Вr, Вr, І, І, І, І та С. У ще одному аспекті запропоновано сполуки формули (Іа), де 1-6 зі складових атомів є 3 19 визначуваний ізотоп Н, або де 1-3 складовими атомами є визначуваний ізотоп F, або де 18 11 123 одним складовим атомом є визначуваний ізотоп, вибраний з групи: F, С та І. У ще одному аспекті запропоновано сполуки формули (Іа), де 1-6 зі складових атомів є 3 19 визначуваний ізотоп Н, або де 1-3 складовими атомами є визначуваний ізотоп F, або де 18 11 одним складовим атомом є визначуваний ізотоп, вибраний з групи: F та С. У ще одному аспекті запропоновано сполуки формули (Іа), де одним складовим атомом є 11 визначуваний ізотоп С. У ще одному аспекті запропоновано сполуки формули (Іа), де одним складовим атомом є 18 визначуваний ізотоп F. У ще одному аспекті запропоновано сполуки формули Іb: H H R9 R11 X6 R10 Z x10 R8 H 15 20 25 30 35 40 X7 R9 X8 R9 (Ib) де Z-6-членний ароматичний гетероцикл, що містить один або два атоми N, де Х 6, Х7 та Х8 є незалежно вибраними з N або С, та де один або два з Х 6, Х7 та Х8-N, а залишковий - С, та де Х6 - С, вказаний С є необов'язково заміщеним R9; Х10 вибрано з О та S; R8 вибрано з групи: ОSі(G3)3, ОСН2G4, ОG5, Н, бром, флуор, гідрокси, метокси, Sn(С 1-4 + + + алкіл)3, N(СН3)3 , ІG6 , N2 та нітро; + + + R9 вибрано з групи: Н, бром, флуор, Sn(С1-4 алкіл)3, N(СН3)3 , ІG6 , N2 та нітро; R10 вибрано з групи: аміно, метиламіно, NН(СН 2)2-4G7, диметиламіно, метокси, гідрокси, (СО)NН2 та О(СН2)2-4G7; R11 вибрано з групи: ОSі(G3)3, ОСН2G4, ОG5, Н, бром, флуор, гідрокси, метокси, Sn(С 1-4 + + + алкіл)3, N(СН3)3 , ІG6 , N2 та нітро; G3 вибрано з групи: С1-4 алкіл та феніл; G4 вибрано з групи: 2-(триметилсиліл)етокси, С1-3 алкокси, 2-(С1-3алкокси)етокси, С1-3 алкілтіо, циклопропіл, вініл, феніл, п-метоксифеніл, о-нітрофеніл, та 9-антрил; G5 вибрано з групи: тетрагідропіраніл, 1-етоксіетил, фенацил, 4-бромфенацил, циклогексил, т-бутил, т-бутоксикарбоніл, 2,2,2-трихлоретилкарбоніл та трифенілметил; + ІG6 є складовою солі йодинію, у котрій атом йоду є гіпервалентним та має позитивний формальний заряд, та у котрому G6 - феніл, необов'язково заміщений одним замісником, вибраним з групи: метил та бром; G7 вибрано з групи: бром, йод, ОSО2СF3, ОSО2СН3 та ОSО2феніл, вказаний феніл необов'язково заміщений метилом або бромом; згідно з формулою Іb, один або кілька замісників, вибраних з групи: R8, R9, R10 та R11 є + + + одною з функціональних груп: бром, флуор, гідрокси, Sn(С 1-4 алкіл)3, N(СН3)3 , ІG6 , N2 , нітро, аміно, метиламіно, NН(СН2)2-4G7; вільну основу або її сіль, сольват або сольват солі; за умови, що вилучено нижченаведені сполуки: 45 7 UA 98481 C2 5 10 15 20 25 У ще одному аспекті запропоновано сполуки формули Іb, де Х 7 - С, вказаний С є необов'язково заміщеним R9, а коли Х8 - С, вказаний С є необов'язково заміщеним R9. У ще одному аспекті запропоновано сполуки формули Іb, де R9 вибрано з групи: Н, бром, + + + флуор, хлор, йод, Sn(С1-4 алкіл)3, N(СН3)3 , ІG6 , N2 та нітро. У ще одному аспекті запропоновано сполуки формули Іb, де згідно з формулою Іb, один або кілька замісників, вибраних з групи: R8, R9, R10 та R11 є одною з функціональних груп: бром, + + + флуор, гідрокси, Sn(С1-4 алкіл)3, N(СН3)3 , ІG6 , N2 , нітро, аміно, метиламіно, NН(СН2)2-4G7, N(СН3)СНО, N(СН3)СОСН3, N(СН3)СО2-т-бутил, (СО)NН2, О(СН2)2-4G7, ОSі(G3)3 та ОСН2G4. У ще одному аспекті запропоновано сполуки формули Іb, де R10 вибрано з групи: аміно, метиламіно, NН(СН2)2-4G7, диметиламіно, N(СН3)СНО, N(СН3)СОСН3, N(СН3)СО2-т-бутил, метокси, гідрокси, (СО)NН2 та О(СН2)2-4G7; У ще одному аспекті запропоновано сполуки формули Іb, де R8 - Н; R10 вибрано з групи: аміно, метиламіно, диметиламіно та NН(СН2)2-4G7; R11 вибрано з групи: ОSі(СН3)2С(СН3)3, Н, + флуор, гідрокси, метокси, Sn(С1-4 алкіл)3 та N2 . У ще одному аспекті запропоновано сполуки формули Іb, де R8 - Н; R9 - Н, F, NО2; R10 вибрано з групи: аміно, метиламіно, диметиламіно, NН(СН 2)2-4G7, N(СН3)СНО, N(СН3)СОСН3, N(СН3)СО2-т-бутил, (СО)NН2 та О(СН2)2-4G7; R11 вибрано з групи: ОSі(СН 3)2С(СН3)3, Н, флуор, + гідрокси, метокси, ОСН2G4, Sn(С1-4 алкіл)3 та N2 . У ще одному аспекті запропоновано сполуки формули Іb, де Z - піридинове кільце, де Х6 та Х7 - С, а Х8-N. У ще одному аспекті запропоновано сполуки формули Іb, де Z - піридинове кільце, де Х6 та Х8 - С, а Х7-N. У ще одному аспекті запропоновано сполуки формули Іb, де Z - піримідинове кільце, де Х6 та Х8-N, а Х7 - С. У ще одному аспекті запропоновано сполуки формули Іb, де Z - піразинове кільце, де Х6 та Х7-N, а Х8 - С. У ще одному аспекті запропоновано сполуки формули Іb, де Z - піридазинове кільце, де Х7 та Х8-N, а Х6 - С. У ще одному аспекті запропоновано сполуки формули Іb, вказаною сполукою є: 30 2-[6-{метиламіно)піридин-3-іл)-1-бензофуран-5-ол 5-(5-метокси-1-бензофуран-2-іл)піридин-2-карбоксамід 6-(5-гідрокси-1-бензофуран-2-іл)нікотинамід 5-(5-гідрокси-1-бензофуран-2-іл)піридин-2-карбоксамід 5-(5-метокси-1-бензофуран-2-іл)-N-метилпіридин-2-амін 6-(5-метокси-1-бензофуран-2-іл)піридазин-3-амін 5-(1-бензотієн-2-іл)піридин-2-карбоксамід 8 UA 98481 C2 5-(1-бензофуран-2-іл)піридин-2-карбоксамід 6-(5-метокси-1-бензофуран-2-іл)нікотинамід 2-(6-амінопіридазин-3-іл)-1-бензофуран-5-ол У ще одному аспекті запропоновано сполуки формули Іb, вказаною сполукою є: 2-{2-флуор-6-метиламіно-піридин-3-іл)-бензофуран-5-ол 2-(6-флуор-5-метиламіно-піридин-2-іл)-бензофуран-5-ол 2-{5-флуор-6-метиламіно-піридин-3-іл}-бензофуран-5-ол [6-Флуор-5-(5-метокси-бензофуран-2-іл)-піридин-2-іл]карбамової кислоти трет-бутил естер 6-Флуор-5-(5-метокси-бензофуран-2-іл)-піридин-2-іламін 2-Флуор-6-(5-метокси-бензофуран-2-іл)-піридин-3-іламін [6-Флуор-5-(5-метокси-бензофуран-2-іл)-піридин-2-іл]-метилкарбамової кислоти трет-бутил естер 5 10 15 20 У ще одному аспекті запропоновано застосування сполуки формули Іb, як попередника синтезу у способі отримання міченої сполуки, де вказана мітка складається з одного 11 [ С]метилу. У ще одному аспекті запропоновано застосування сполуки формули Іb, як попередника 18 синтезу у способі отримання міченої сполуки, де вказана мітка складається з одного атома F. У ще одному аспекті запропоновано застосування сполуки формули Іb, як попередника синтезу у способі отримання міченої сполуки, де вказана мітка складається з одного атома, 120 123 125 131 вибраного з групи: І, І, І та І. У ще одному аспекті запропоновано фармацевтичну композицію, що містить сполуку формули (Іа), разом із фармацевтично прийнятним носієм. У ще одному аспекті запропоновано фармацевтичну композицію для іn vіvо відображення амілоїдних відкладень, що містить радіо-мічену сполуку формули (Іа), разом із фармацевтично прийнятним носієм. У ще одному аспекті запропоновано іn vіvо спосіб вимірювання амілоїдних відкладень у особи, що має етапи: (а) застосування визначуваної кількості фармацевтичної композиції, що містить радіо-мічену сполуку формули (Іа), та (b): визначення зв'язування сполуки амілоїдним відкладенням у особи. 9 UA 98481 C2 5 10 15 20 25 30 35 40 45 50 55 60 В одному втіленні цього аспекту вказане визначення проводять способами, вибраними з групи: гамма відображення, магніто-резонансне відображення та магніто-резонансна спектроскопія. У ще одному втіленні цього аспекту вказана особа має підозру на хворобу або синдром, вибрані з групи: хвороба Альцгеймера, родинна хвороба Альцгеймера, синдром Дауна та гомозиготи для алелі аполіпопротеїну Е4. У ще одному аспекті запропоновано сполук формули (Іа) для застосування у терапії. У ще одному аспекті запропоновано застосування сполуки формули (Іа), у виробництві медикаменту для лікування та/або попередження хвороби Альцгеймера, родинної хвороби Альцгеймера, синдрому Дауна та гомозигот для алелі аполіпопротеїну Е4. У ще одному аспекті запропоновано спосіб лікування та/або попередження хвороби Альцгеймера, родинної хвороби Альцгеймера, синдрому Дауна та гомозигот для алелі аполіпопротеїну Е4, що полягає у застосуванні до ссавця, у тому числі людини, при необхідності такого лікування та/або попередження, терапевтично ефективної кількості сполуки формули (Іа). Визначення Як застосовано тут, "алкіл", "алкіленіл" або "алкілен" поодинці або як суфікс чи префікс, охоплюють насичені аліфатичні вуглеводневі групи з розгалуженим та нерозгалуженим ланцюгом з 1 до 12 атомами карбону. Наприклад, "С 1-6 алкіл" позначає алкіл, що має 1, 2, 3, 4, 5 або 6 атомів карбону. Коли певне число, що позначає алкіл-групу дорівнює 0, атом гідрогену є замісником у позиції алкіл-групи. Наприклад, "N(С0 алкіл)2" є еквівалентним "NН2" (аміно). Коли певне число, що позначає число алкіленіл або алкілен-груп, 0, групи є зв'язаними зв'язком. Наприклад, "NН(С0 алкілен)NН2" є еквівалентним "NНNН2" (гідразино). Як застосовано тут, коли групи, зв'язані алкіленом або алкіленілом, вони є приєднаними до першого та останнього карбонів алкілену або алкіленілу. У випадку метилену, перший та останній карбон є одним. Наприклад, "N(С4 алкілен)”, "N(С5 алкілен)” та "N(С2 алкілен)2NН" є еквівалентними піролідинілу, піперидинілу та піперазинілу, відповідно. Приклади алкілу охоплюють, але без обмеження, метил, етил, н-пропіл, і-пропіл, н-бутил, ібутил, втор-бутил, т-бутил, пентил, та гексил. Приклади алкілену або алкіленілу охоплюють, але без обмеження, метилен, етилен, пропілен та бутилен. Як застосовано тут, "алкокси" представляє алкіл, що виначено вище, з вказаним числом атомів карбону приєднаних через оксигеновий місток. Приклади алкокси охоплюють, але без обмеження, метокси, етокси, н-пропокси, ізопропокси, н-бутокси, ізобутокси, т-бутокси, нпентокси, ізопентокси, циклопропілметокси, алілокси та пропаргілокси. Подібно, "алкілтіо" або "тіоалкокси" представляють алкіл, що виначено вище з вказаним числом атомів карбону приєднаних через сульфурний місток. Як застосовано тут, "флуоралкіл", "флуоралкілен" та "флуоралкокси", поодинці або як суфікс чи префікс, стосується груп, у котрих один, два, або три гідрогени, приєднані до карбону відповідного алкілу, алкілену та алкоксигрупи є заміщеними флуором. Приклади флуоралкілу охоплюють, але без обмеження, трифлуорметил, дифлуорметил, флуорметил, 2,2,2трифлуоретил, 2-флуоретил та 3-флуорпропіл. Приклади флуоралкілену охоплюють, але без обмеження, дифлуорметилен, флуорметилен, 2,2-дифлуорбутилен та 2,2,3-трифлуорбутилен. Приклади флуоралкокси охоплюють, але без обмеження, трифлуорметокси, 2,2,2трифлуоретокси, 3,3,3-трифлуорпропокси та 2,2-дифлуорпропокси. Як застосовано тут, "ароматичний" стосується гідрокарбонілів, що мають одне або більше ненасичених карбонових кілець, що мають ароматичний характер, (наприклад, 4n+2 делокалізовані електрони, де "n" - ціле число) та містять приблизно до 14 атомів карбону. На додаток, "гетероароматичний" стосується груп, що мають одне або більше ненасичених кілець, що містять карбон та один або більше гетеро атомів, як-то нітроген, оксиген або сульфур, що мають ароматичний характер (наприклад, 4n+2 делокалізовані електрони). Як застосовано тут, термін "арил" стосується ароматичної кільцевої структури з 5-14 атомів карбону. Кільцеві структури, що містять 5, 6, 7 та 8 атомів карбону можуть бути одно-кільцевими ароматичними групами, як-то феніл. Кільцеві структури, що містять 8, 9, 10, 11, 12, 13, або 14 можуть бути поліциклічними, як-то нафтил. Ароматичне кільце може бути заміщеним на одній або більше позицій кільця такими замісниками, як описано вище. Термін "арил" також стосується поліциклічної кільцевої системи, що має два або більше циклічних кільця, у котрих два або більше карбонів є спільними для двох прилеглих кілець (кільця є "конденсованими кільцями") де принаймні одне з кілець є ароматичним, наприклад, іншими циклічними кільцями 10 UA 98481 C2 5 10 15 20 25 30 35 40 45 50 55 можуть бути циклоалкіли, циклоалкеніли, циклоалкініли, арили та/або гетероцикліли. Терміни орто, мета та пара стосуються 1,2-, 1,3- та 1,4-дизаміщених бензенів, відповідно. Наприклад, назви 1,2-диметилбензен та орто-диметилбензен є синонімами. Як застосовано тут, термін "циклоалкіл" охоплює насичені кільцеві групи, що мають певне число атомів карбону. Вони можуть охоплювати конденсовані або місткові поліциклічні системи. Кращі циклоалкіли мають від 3 до 10 атомів карбону у їх кільцевій структурі, та більш переважно мають 3, 4, 5, та 6 карбонів у кільцевій структурі. Наприклад, "С3-6 циклоалкіл" позначає так групи як циклопропіл, циклобутил, циклопентил, або циклогексил. Як застосовано тут, "галоген" стосується флуору, хлору, брому та йоду. "Протиіон", наприклад, представляє невеликі, негативно заряджені групи як-то хлорид, бромід, гідроксид, ацетат, сульфат, тозилат, бензенсульфонат, тощо. Як застосовано тут, термін "гетероцикліл" або "гетероциклічний" або "гетероцикл" стосується насиченого, ненасиченого або частково насиченого, моноциклічного, біциклічного або трициклічного кільця (якщо не вказане інше), що містить 3-20 атомів з котрих 1, 2, 3, 4 або 5 кільцевих атомів є вибраними з групи: нітроген, сульфур або оксиген, котрі можуть, якщо не вказане інше, бути зв'язаними через карбон або нітроген, де група -СН2- є необов'язково заміщеною -С(О)-; та де, якщо не вказане інше, кільцевий атом нітрогену або сульфуру є необов'язково окисненим до N-оксиду або S-оксидів або кільцевий нітроген є необов'язково кватернізованим; де кільцевий -NН є необов'язково заміщеним ацетилом, формілом, метилом або мезилом; та кільце є необов'язково заміщеним одним або більше галогенами. Зрозуміло, що коли загальне число атомів S та О у гетероциклілі перевищує 1, тоді ці гетероатоми не є суміжними. Якщо вказаний гетероцикліл є бі- або трициклічним, тоді принаймні одне з кілець може необов'язково бути гетероароматичним або ароматичним кільцем, за умови, що принаймні одне з кілець не є гетероароматичним. Якщо вказаний гетероцикліл є моноциклічним, тоді він повинен не бути ароматичним. Приклади гетероциклілів охоплюють, але без обмеження, піперидиніл, N-ацетилпіперидиніл, N-метилпіперидиніл, Nформілпіперазиніл, N-мезилпіперазиніл, гомопіперазиніл, піперазиніл, азетидиніл, оксетаніл, морфолініл, тетрагідроізохінолініл, тетрагідрохінолініл, індолініл, тетрагідропіраніл, дигідро-2Нпіраніл, тетрагідрофураніл та 2,5-діоксоімідазолідиніл. Як застосовано тут, "гетероарил" стосується гетероароматичного гетероциклу, що має принаймні один гетероатомний кільцевий член як-то сульфур, оксиген, або нітроген. Гетероарили охоплюють моноциклічні та поліциклічні системи (наприклад, що мають 2, 3 або 4 конденсовані кільця). Приклади гетероарилів охоплюють без обмеження, піридил (тобто, піридиніл), піримідиніл, піразиніл, піридазиніл, триазиніл, фурил (тобто, фураніл), хіноліл, ізохіноліл, тієніл, імідазоліл, тіазоліл, індоліліл, пірил, оксазоліл, бензофурил, бензотієніл, бензтіазоліл, ізоксазоліл, піразоліл, триазоліл, тетразоліл, індазоліл, 1,2,4-тіадіазоліл, ізотіазоліл, бензотієніл, пуриніл, карбазоліл, бензімідазоліл, індолініл, тощо. Як застосовано тут, вираз "захисна група" означає тимчасові замісники, котрі захищають потенційно реакційноздатні функціональні групи від небажаних хімічних перетворень. Приклади таких захисних груп охоплюють естери карбонових кислот, силіл-етери спиртів, та ацеталей і кеталей альдегідів та кетонів, відповідно. Підгрупою захисних груп є ті, що захищають нуклеофільну групу (наприклад, ароматичну гідроксигрупу) від алкілування, а тому дозволяють селективне N-алкілування аміногруп в одній молекулі в основних умовах. Приклади таких захисних груп охоплюють, але без обмеження, метил, 2-(триметилсиліл)етоксиметил, алкоксиметил та т-бутилдиметилсиліл. Як застосовано тут, "фармацевтично прийнятний" стосується сполук, матеріалів, композицій, та/або дозованих форм, котрі є у рамках медичних вимог, придатні для застосування у контакті з тканинами людей та тварин без надлишкової токсичності, подразнення, алергічної реакції, або іншої проблем або ускладнення та відповідні розумному співвідношенню користь/ризик. Як застосовано тут, "фармацевтично прийнятні солі" стосуються похідних розкритих сполук, де вихідну сполуку модифіковано створенням її солі з кислотою або основою. Приклади фармацевтично прийнятних солей охоплюють, але без обмеження, солі мінеральних або органічних кислот основних залишків як-то аміни; лужні або органічні солі кислотних залишків як-то карбонових кислот; тощо. Фармацевтично прийнятні солі охоплюють звичайні нетоксичні солі або солі четвертинного амонію вихідної сполуки, утворені, наприклад, з нетоксичними неорганічними або органічними кислотами. Наприклад, такі звичайні нетоксичні солі охоплюють похідні від неорганічних кислот як-то хлоридна, фосфатна, тощо; та солі органічних кислот як-то молочна, малеїнова, лимонна, бензойна метансульфонова, тощо. 11 UA 98481 C2 5 10 15 20 25 30 35 40 45 50 55 60 Фармацевтично прийнятні солі заявленого винаходу можуть бути синтезованими з вихідної сполуки, що містить основну або кислотну групу звичайними хімічними способами. Загалом, такі солі можна отримати реакцією вільної кислоти або основи цих сполук зі стехіометричною кількістю прийнятної основи або кислоти у воді або в органічному розчиннику,або їх суміші; загалом, неводні середовища типу етеру, етилацетату, етанолу, ізопропанолу або ацетонітрилу є застосовуваними. Як застосовано тут, "іn vіvо здатні до гідролізу попередники" означає здатні до гідролізу (або розщеплення) іn vіvо естерні сполуки винаходу, що містять карбокси або гідроксигрупу. Наприклад, естери амінокислот, естери С1-6 алкоксиметилу типу метоксиметилу; естери С1-6алканоїлоксиметилу типу півалоїлоксиметилу; естери С 3-8циклоалкоксикарбонілокси С1-6алкілу типу 1-циклогексилкарбонілоксіетилу, ацетоксиметокси, або фосфорамідні циклічні естери. Як застосовано тут, "таутомер" означає інші структурні ізомери, що існують у рівновазі, утворені від міграції атому гідрогену. Наприклад, кето-енольна таутомерія, де в результаті сполука має властивості кетону та ненасиченого спирту. Як застосовано тут "стабільна сполука" та "стабільна структура" означає сполуку, що є достатньо міцною при виділенні до корисного ступеню чистоти з реакційної суміші, та наступного подовженого зберігання на холоду або при температурі довкілля, та необов'язково сформованою у ефективний терапевтичний або діагностичний агент. Сполуки винаходу крім того охоплюють гідрати та сольвати. Заявлений винахід стосується мічених ізотопом сполук винаходу. "Мічені ізотопом", "радіомічені", "мічені", або "що зв'язує амілоїд" сполука або "радіоліганд" є сполукою винаходу, де один або більше атомів є заміщеними атомом, що має атомну масу або масове число, відмінні від атомної маси або масового числа звичайно, знайдених у природі. Одним необмежувальним 19 винятком є F, котрий дозволяє визначення молекул, котрі містять цей елемент без збагачення 19 до вищого ступеню, ніж існує у природі. Сполуки, що несуть замісник F, можуть тому також бути "міченими". Придатні радіонукліди (тобто, "визначувані ізотопи"), що можна уводити у 2 3 11 13 14 13 15 сполуки заявленого винаходу охоплюють але без обмеження Н (D), Н (Т), С, С, С, N, N, 15 17 18 18 35 36 82 75 76 77 123 124 125 131 О, О, О, F, S, Сl, Вr, Вr, Вr, Вr, І, І, І та І. Зрозуміло, що мічену ізотопом сполуку винаходу необхідно тільки збагачувати визначуваним ізотопом до ступеню, котрий 11 дозволяє визначення, наприклад, у визначуваній сполуці винаходу міченій С, атом карбону 12 міченої групи міченої сполуки може бути С або іншим ізотопом карбону у частці молекул. Радіонуклід, що уводять у радіомічені сполуки, залежатиме від конкретного застосування радіоміченої сполуки. Наприклад, для іn vіtrо мічення бляшок або рецептору та конкурентних 3 14 125 аналізів, сполуки, що уводять Н, С, або І загалом є найбільш корисними. Для іn vіvо 11 13 18 19 120 123 131 75 76 відображення застосування С, С, F, F, І, І, І, Вr, або Вr є загалом найбільш корисним. Приклади "ефективної кількості" охоплюють кількості, що дають змогу відображення амілоїдних відкладень іn vіvо, що дають прийнятну токсичність та рівні біозасвоюваності для фармацевтичного застосування, та/або попередження дегенерації клітин та токсичності, асоційованої з утворенням фібрил. Цей винахід також стосується радіомічених заміщених 2-гетероарилом похідних бензотіофену та бензофурану як агентів відображення амілоїду та попередників синтезу сполук, з котрих їх отримують. Способи застосування Сполуки заявленого винаходу можна застосовувати для визначення присутності, розташування та/або кількості одного або більше амілоїдних відкладень в органі, у тому числі мозку, тварини або людини. Амілоїдні відкладення охоплюють, без обмеження, відкладення А. Для відстеження тимчасових наслідків амілоїдного відкладення сполуки винаходу можна крім того застосовувати для кореляції амілоїдного відкладення з початком клінічних симптомів, асоційованих з хворобою, розладом або станом. Сполуки винаходу можна зрештою застосовувати для лікування та діагностування хвороби, розладу або стану, що характеризуються амілоїдним відкладенням, як-то АD, родинна АD, синдром Дауна, амілоїдоз та гомозиготи для алелі аполіпопротеїну Е4. Спосіб цього винаходу визначає присутність та розташування амілоїдних відкладень у органі, переважно мозку, пацієнта. Заявлений спосіб полягає у застосуванні визначуваної кількості фармацевтичної композиції, що містить сполуку, що зв'язує амілоїд заявленого винаходу - "визначувану сполуку, " або її фармацевтично прийнятну водорозчинну сіль до пацієнта. "Визначувана кількість" означає кількість визначуваної сполуки, що застосовують, достатню для визначення зв'язування сполуки з амілоїдом. "Відображення ефективної кількості" 12 UA 98481 C2 5 10 15 20 25 30 35 40 45 50 55 60 означає, що кількість визначуваної сполуки, що застосовують, є достатньою для відображення зв'язування сполуки з амілоїдом. Винахід стосується амілоїдних зондів, котрі у сполученні з неінвазивними способами нейровідображення як-то магніто-резонансна спектроскопія (МRS) або відображення (МІNІ), або гамма відображення як-то позитронна емісійна томографія (РЕТ) або однофотонна емісійна комп'ютерна томографія (SРЕСТ), є застосовуваними для кількісного дослідження амілоїдного відкладення іn vіvо. Термін "іn vіvо відображення", або "відображення", стосується будь-якого способу, що дозволяє визначення мічених заміщених гетероарилом похідних бензофурану або бензотіофену, як описано тут. Для гамма відображення випромінювання від визначуваного органу або зони вимірюють та виражають як загальне зв'язування або як співвідношення, у котрому загальне зв'язування в одній тканині є нормалізованим відносно загального зв'язування у ще одній тканині тієї ж особи при відображенні іn vіvо. Загальне зв'язування іn vіvо є визначеним як сигнал, визначений у тканині іn vіvо відображенням без необхідності коректування другим уведенням ідентичної кількості міченої сполуки разом з великим надлишком неміченої, але хімічно ідентичної сполуки. А "особою" є ссавець, переважно людина, а найбільш переважно людина, що має підозру на деменцію. Для іn vіvо відображення, тип інструменту визначення є головним фактором у виборі мітки. 19 Наприклад, радіоактивні ізотопи та F є особливо придатними для іn vіvо відображення у способах заявленого винаходу. Тип застосовуваного інструменту диктуватиме вибір радіонукліду або стабільного ізотопу. Наприклад, радіонуклід повинен мати тип розпаду, визначуваний типом інструменту. Ще один фактор стосується періоду напіврозпаду радіонукліду. Період напіврозпаду повинен бути довгим настільки, щоб можна було проводити визначення під час максимального поглинання мішенню, але коротким настільки, щоб хазяїн не отримував шкідливого випромінювання. Радіомічені сполуки винаходу можуть бути визначеними гамма-відображенням де визначають гамма-випромінювання прийнятної довжини хвилі. Способи гамма-відображення охоплюють, але без обмеження, SРЕСТ та РЕТ. Переважно, для SРЕСТ-визначення, вибрана радіомітка не має емісії частинок, але продукує велике число фотонів у межах 140-200 кеВ. 18 Для РЕТ-визначення радіомітка повинна бути емітуючим позитрон радіонуклідом, як-то F 11 або С, котрий анігілюватиме з утворенням двох гамма-квантів, що визначають РЕТ-камерою. У заявленому винаході, отримані сполуки, що зв'язують амілоїд/зонди, котрі є корисними для іn vіvо відображення та кількісного дослідження амілоїдного відкладення. Ці сполуки слід застосовувати у сполученні з неінвазивними способами нейровідображення як-то магніторезонансна спектроскопія (МRS) або відображення (МRІ), позитронна емісійна томографія (РЕТ), та однофотонна емісійна комп'ютерна томографія (SРЕСТ). Згідно з цим винаходом, 19 заміщені 2-гетероарилом похідні бензотіофену та бензофурану можуть бути міченими F або 13 18 11 75 76 С для МRS/МRІ. Сполуки можуть також бути радіоміченими, наприклад, F, С, Вr, Вr, або 120 І для РЕТ добре відомими способами, описаними Fоwlеr, J. та Wоlf, А. у "Роsіtrоn Еmіssіоn Тоmоgrарhу аnd Аutоrаdіоgrарhу" 391-450 (Rаvеn Рrеss, 1986). Сполуки можуть також бути 123 131 радіоміченими І та І для SРЕСТ будь-якими відомими способами. Дивись, наприклад, Кulkаrnі, Іnt. J. Rаd. Аррl. &Іnst. (Раrt В) 18: 647 (1991). Сполуки можуть також бути 99m радіоміченими відомими металевими радіомітками, як-то Технецій-99m ( Тс). Модифікації замісників для уведення лігандів, що зв'язують такі металеві іони, може досягти без надмірного експериментування спеціаліст. Радіомічену металом сполуку можна тоді застосовувати для визначення амілоїдних відкладень. Отримання радіомічених похідних Тс-99m є добре відомим. Дивись, наприклад, Zhuаng еt аl. Nuсlеаr Меdісіnе & Віоlоgу 26(2):217-24, (1999); Оуа еt аl. Nuсlеаr Меdісіnе &Віоlоgу 25(2):135-40, (1998), та Ноm еt аl. Nuсlеаr Меdісіnе &Віоlоgу 24(6):4853 14 125 98, (1997). На додаток, сполуки можуть бути міченими Н, С та І, добре відомими спеціалісту способами визначення амілоїдних бляшок у зразках іn vіtrо та після смерті. Крім того, флуоресцентні сполуки заявленого винаходу можна застосовувати для визначення бляшок у зразках іn vіtrо та після смерті добре відомими способами на основі визначення флуоресценції. Способи заявленого винаходу можуть застосовувати ізотопи, визначувані спектроскопією ядерного магнітного резонансу для іn vіvо відображення та спектроскопії. Елементи, особливо 19 13 корисні у магніто-резонансній спектроскопії охоплюють F та С. Придатні радіоізотопи для цього винаходу охоплюють бета-емітери, гамма-емітери, 120 123 131 125 18 11 75 позитрон-емітери, та рентгеноемітери. Ці радіоізотопи охоплюють І, І, І, І, F, С, Вr, 76 та Вr. Придатні стабільні ізотопи для застосування у магніто-резонансному відображенні (МRІ) 19 13 або спектроскопі (МRS), згідно з цим винаходом, охоплюють F та С. Придатні радіоізотопи для іn vіtrо кількісного дослідження амілоїду у гомогенатах тканин від біопсії або після смерті 125 14 3 11 18 охоплюють І, С, та Н. Кращими радіомітками є С та F для застосування у РЕТ 13 UA 98481 C2 123 5 10 15 20 25 30 35 40 45 50 55 60 19 3 14 відображенні іn vіvо, І для застосування у SРЕСТ-відображенні, F для МRS/МRІ, та Н та С для іn vіtrо досліджень. Однак, будь-який звичайний спосіб з діагностичними зондами можна застосовувати згідно з цим винаходом. Сполуки заявленого винаходу можна застосовувати будь-якими засобами. відомими спеціалісту. Наприклад, застосування до тварини може бути локальним або системним та виконуваним перорально, парентерально, інгаляцією, місцево, ректально, назально, букально, вагінально, або з імплантованого резервуару. Термін "парентеральний" як застосовано тут, стосується підшкірних, внутрішньовенних, внутрішньоартеріальних, внутрішньом'язових, інтраперитонеальних, інтратекальних, інтравентрикулярних, інтрастернальних, інтракраніальних та ендостальних ін'єкцій та вливання. Точний протокол застосування залежить від різних факторів у тому числі віку, маси тіла, загального здоров'я, статі та харчу пацієнта; визначення конкретного способу застосування. Рівні дозування порядку приблизно 0,001 мкг/кг/добу - 10000 мг/кг/добу сполуки винаходу є корисними для способи винаходу. В одному втіленні рівень дозування є приблизно 0,001 мкг/кг/добу - 10 г/кг/добу. У ще одному втіленні рівень дозування є приблизно 0,01 мкг/кг/добу - 1,0 г/кг/добу. У ще одному втіленні рівень дозування є приблизно 0,1 мг/кг/добу - 100 мг/кг/добу. Конкретний рівню дозування для будь-як конкретного пацієнта залежить від різних факторів, у тому числі активності та можливої токсичності конкретної застосовуваної сполуки; віку, маси тіла, загального здоров'я, статі та харчу пацієнта; часу застосування; швидкості виведення; комбінації ліків; та форми застосування. Звичайно, іn vіtrо доза-ефект забезпечує корисне керівництво стосовно правильної дози для застосування пацієнтом. Дослідження тваринних моделей є також корисними. Міркування стосовно визначення правильних рівнів дозування є добре відомими спеціалісту. Будь-який відомий режим застосування для регулювання розкладу та послідовності споживання ліків можна застосовувати та повторювати, як необхідно для ефективного лікування у способах винаходу. Режим може охоплювати попереднє лікування та/або співзастосування з додатковим терапевтичним агентом. В одному втіленні сполуки винаходу застосовують до тварини, що має підозру або ризик розвинення хвороби, розладу або стану, що характеризуються амілоїдним відкладенням. Наприклад, тварина може бути людиною похилого віку. У ще одному втіленні є запропонованими сполуки, корисні як попередники, та способи їх отримання. Такі попередники можна застосовувати як вихідні матеріали для уведення мічених молекулярних фрагментів, що дає радіомічені заміщені 2-гетероарилом похідні бензотіофену та бензофурану як агенти відображення амілоїду. Спосіб визначення амілоїдних відкладень Іn vіtrо Цей винахід крім того стосується способу визначення амілоїдних відкладень іn vіtrо, що полягає у: (і) контактування тілесної тканини з ефективною кількістю сполуки винаходу, де сполука зв'язує будь-які амілоїдні відкладення у тканині; та (іі) визначення зв'язування сполуки амілоїдними відкладеннями у тканині. Зв'язування можна визначати будь-якими засобами, відомими у рівні техніки. Приклади засобів визначення охоплюють, без обмеження, засоби мікроскопії, як-то флуоресцентної, лазерної та перехресно-поляризаційної мікроскопії. Фармацевтичні композиції Це винахід крім того стосується фармацевтичної композиції, що містить: (і) ефективну кількість принаймні одної сполуки винаходу; та (іі) фармацевтично прийнятний носій. Композиція може містити один або більше додаткових фармацевтично прийнятних інгредієнтів, у тому числі без обмеження, один або більше змочувальних агентів, буферувальних агентів, суспендувальних агентів, змащувальних агентів, емульгаторів, дезінтеграторів, абсорбентів, консервантів, сурфактантів, барвників, ароматизаторів, підсолоджувачів та терапевтичних агентів. Композицію можна формувати у тверду або рідку форму для: (1) перорального застосування як, наприклад, водні або неводні розчин або суспензія), таблетки (наприклад націлюваної для букальної, сублінгвальної або системної абсорбції), болюси, порошки, гранули, пасти для застосування до язика, тверді желатинові капсули, м'які желатинові капсули, спреї, емульсії та мікроемульсії для рота; (2) парентерального застосування підшкірними, внутрішньом'язовими, внутрішньовенними або епідуральними ін'єкціями як, наприклад, стерильний розчин, суспензія або композиція з безперервним вивільненням; (3) місцевого застосування як, наприклад, крем, 14 UA 98481 C2 5 10 15 20 25 30 35 40 45 50 55 60 мазь, пов'язка з регульованим вивільненням або спрей для шкіри; (4) вагінального або ректального застосування як, наприклад, песарій, крем або пінка; (5) сублінгвального застосування; (6) окулярного застосування; (7) трансдермального застосування; або (8) назального застосування. В одному втіленні композицію формують для внутрішньовенного застосування та носієм є текуча та/або поживна добавка. У ще одному втіленні композиція є здатною до зв'язування специфічно з амілоїдом іn vіvо, є здатною до перетинання бар'єру кров-мозок, є нетоксичною при прийнятних рівнях дозування та/або має задовільну тривалість дії. У ще одному втіленні композиція містить приблизно 10 мг альбуміну сироватки людини та приблизно від 0,0005 до 500 мг сполуки заявленого винаходу на мл фосфатного буферу, що містить NаСl. Заявлений винахід крім того стосується композицій, що містять сполуку формули Іа, та принаймні один фармацевтично прийнятний носій, розріджувач або наповнювач. Заявлений винахід крім того стосується способів лікування або попередження пов'язаної з А патології у пацієнта, що полягають у застосуванні до пацієнта терапевтично ефективної кількості сполуки формули Іа. Заявлений винахід крім того стосується сполук, описаних тут, для застосування як медикаменту. Заявлений винахід крім того стосується сполук, описаних тут, для виробництва медикаменту. Деякі сполуки формул Іа та Іb можуть мати стереогенні центри та/або геометричні ізомерні центри (Е- та Z- ізомери), та зрозуміло, що винахід стосується усіх таких оптичних ізомерів, енантіомерів, діастереоізомерів, атропізомерів та геометричних ізомерів. Заявлений винахід стосується застосування сполуки формули Іа, а також її солей. Солі для застосування у фармацевтичних композиціях є фармацевтично прийнятними солями, але інші солі можуть бути корисними у продукуванні сполук формули Іа. Сполуки винаходу можна застосовувати як медикаменти. У деяких втіленнях заявлений винахід стосується сполуки формули Іа, або її фармацевтично прийнятної солі, таутомерів або іn vіvо-здатних до гідролізу попередників, для застосування як медикаментів. У деяких втіленнях заявлений винахід стосується сполук, описаних тут для застосування як як медикаментів для лікування або попередження А-пов'язаних патологій. В інших втіленнях А-пов'язаною патологією є синдром Дауна, -амілоїдна ангіопатія, церебральна амілоїдна ангіопатія, спадкова церебральна кровотеча, розлад асоційований з когнітивними порушеннями, МСІ ("слабке когнітивне порушення"), хвороба Альцгеймера, втрата пам'яті, симптоми дефіциту уваги, асоційовані з хворобою Альцгеймера, нейродегенерація, асоційована з хворобою Альцгеймера, деменція змішаного судинного походження, деменція дегенеративного походження, пресенільна деменція, сенільна деменція, деменція, асоційована з хворобою Паркінсона, прогресуючий супрануклеарний параліч або кортикальна базальна дегенерація. Способи отримання Заявлений винахід також стосується способів отримання сполук формули Іа та Іb як вільних основ, кислот, або їх солей. З наступного опису таких способів зрозуміло, що, де прийнятно, придатні захисні групи повинні бути приєднаними, а далі видаленими від різних реагентів та інтермедіатів, що повинно бути легко зрозумілим спеціалісту. Звичайні способи застосування таких захисних груп, а також приклади придатних захисних груп, є описаними, наприклад, у "Рrоtесtіvе Grоuрs іn Оrgаnіс Sуnthеsіs", 3rd еd., Т.W. Grееn, Р.G.М. Wuts, Wіlеу-Іntеrsсіеnсе, Nеw Yоrk (1999). Також зрозуміло, що перетворення групи або заміснику у ще одну групу або замісник можна проводити на будь-якому інтермедіаті або кінцевому продукті на шляху синтезу наступного кінцевого продукту, де можливий тип перетворення є обмеженим тільки притаманною несумісністю інших функціональних груп молекули на цьому етапі з умовами або реагентами, застосовуваними у перетворенні. Такі притаманні несумісності та шляхи обходу їх проведенням прийнятних перетворень та етапів синтезу у придатному порядку, повинні бути легко зрозумілими спеціалісту. Приклади перетворень нижченаведено, та зрозуміло, що описані перетворення не є обмеженими групами або замісниками, для котрих представлені перетворення. Посилання та описи інших придатних перетворень є у "Соmрrеhеnsіvе Оrgаnіс Тrаnsfоrmаtіоns - А Guіdе tо Funсtіоnаl Grоuр Рrераrаtіоns", 2nd еd., R.С. Lаrосk, Wіlеу-VСН, Nеw Yоrk (1999). Посилання та описи інших придатних реакцій є описаними у посібниках з органічної хімії, наприклад, "Маrсh's Аdvаnсеd Оrgаnіс Сhеmіstrу", 5th еd., М.В. Smіth, J. Маrсh, Jоhn Wіlеу & Sоns (2001) або, "Оrgаnіс Sуnthеsіs", 2nd еd., М.В. Smіth, МсGrаw-Ніll, (2002). Способи очистки інтермедіатів та кінцевих продуктів охоплюють, наприклад, прямо- та зворотно-фазову хроматографію на колонці або обертовому планшеті, перекристалізацію, дистиляцію та екстракцією рідина-рідина або твердий продукт-рідина, що легко зрозуміло спеціалісту. 15 UA 98481 C2 5 10 Визначення замісників та груп є у формулах Іа та Іb. Терміни "кімнатна температура" та "температура довкілля" означають, якщо не вказане інше, температуру між 16 та 25 °C. Термін "кипіння під зворотним холодильником" означає, якщо не вказане інше, температуру кипіння розчиннику або трохи вище. Зрозуміло, що мікрохвилі можна застосовувати для нагрівання реакційної суміші. Терміни "флеш-хроматографія" або "колонкова флеш-хроматографія" означають препаративну хроматографію на силікагелі, застосовуючи органічний розчинник або його суміші як рухому фазу. Скорочення Ас ацетат; Вос2О ді - трет - бутил дикарбонат; DВU 1,8-діазобіцикло[5,4,0]ундец- 7-ен; DМЕ 1,2-диметоксіетан; DМА; N, N - диметилацетамід; DМF N, N - диметилформамід; DМSО диметилсульфоксид; dррf 1,1'-біс(дифенілфосфіно)фероцен; ЕtОАс етилацетат; ЕtОН етанол; Еt2О діетил - етер; геп гептан; гекс гексан; ВЕРХ високоефективна рідинна хроматографія; МеСN ацетонітрил; МеОН метанол; NВS N - бромсукцинімід; Рd(dррf)Сl2 1,1'-біс(дифенілфосфіно)фероцен)дихлорпаладій(ІІ); Рd(dbа)2 біс(дибензиліденацетон)паладій(0); Рd(РРh3)2Сl2 дихлорбіс(трифенілфосфін)паладій; преп. ВЕРХ препаративна ВЕРХ; ПТСК п - толуєнсульфонова кислота; ТБАФ тетрабутиламонію флуорид; ТФОК трифлуороцтова кислота; ТНF тетрагідрофуран; Тоs тозилат; ОТf трифлуорметансульфонат. Отримання інтермедіатів Сполуки формули ІІ - VІ є корисними інтермедіатами при отриманні сполук формул Іа та Іb. Сполуки формул ІІ - VІ є у продажу або їх можна отримати з будь-яких наявних у продажу або описаних у літературі сполуки. Наприклад, сполуки, у котрих одне або більше з Y 1-Y3, R1 або R2 не відповідає формулам ІІ - VІ, можна застосовувати для отримання сполук формул ІІ - VІ перетворенням або уведенням замісників або груп. Такі приклади є нижченаведеними: 15 H H R1 Y1 (ІІ) X9 R2 H , Y1 = В(ОН)2, В(Оалкіл)2, Sn(n-Вu)3, Вr, Сl, І, ОТf Q (ІІІ) Y2 , 16 UA 98481 C2 Q = Q1-10 за п. 1 Y2 = Вr, Сl, І, ОТf, В(ОН)2, В(Оалкіл)2, Sn(n-Вu)3, СНСН2, ССН H Y3 R1 (ІV) R2 OH H , 5 Y3 = І, Вr, СН2СОСl Q H R1 (V) OH R2 H 10 15 20 25 , 1) Отримання сполук формули ІІ, у котрих Y1 - В(Оалкіл)2 або В(ОН)2: Обробкою відповідного бензофурану ВuLі та гасінням триалкілборатом, а далі гасінням кислотним гідролізом. З відповідних хлоридів, бромідів, йодидів або трифлатів каталізованим паладієм борилуванням, наприклад, з біс(пінаколято)дибораном або діалкоксиборанами як реагентами з каталізом паладієм, застосовуючи, наприклад, РdСl2(dррf), або Рd(dbа)2 з доданим трициклогексилфосфіном, як каталізаторами, разом зі стехіометричними кількостями основ, якто КОАс та NЕt3, у розчинниках як-то ДМСО, ДМФ, ДМА або діоксан при температурі від кімнатної температури до 80 °C, альтернативно, а далі гасінням кислотним гідролізом [Іshіуаmа еt аl. Теtrаhеdrоn 2001, 57, 9813; Мurаtа еt аl. J. Оrg. Сhеm. 2000, 65, 164]. 2) Отримання сполук формули ІІ, у котрих Y1 - галоген: a) Галогенування при 2-позиції похідних бензофурану можна отримати обробкою трет-бутил літій, а потім обробкою І2 для уведення галогену (Zhаng еt аl. J. Оrg. Сhеm. 2002, 67, 7048). b) З відповідних нітропохідних обробкою РВr 3 при 175 °C (Lіn, S.-Y. еt аl. J. Оrg. Сhеm. 2003, 68, 2968). c) Каталізованою паладієм-купрумом реакцією сполуки формули ІV з триметилсилілацетиленом. R1 Si I (i) + R2 30 OH H R1 Si O R2 (ii) (iii) R1 Br (і) Рd(Рh3Р)2Сl2/СuІ, Еt3N/СН3СN; (іі) ТБАФ; (ііі) NВS Наступним видаленням захисної групи ТМС та галогенуванням, бромсукцинімідом (Аquіlа, В.М., Теtrаhеdrоn Lеtt. 1997, 38, 2795). 17 O R2 наприклад, N UA 98481 C2 5 10 3) Отримання сполук формули ІІ, у котрих Y1-Sn(n-Вu)3, Sn(Ме)3 або SnРh3: a) Уведення станумалкілу можна досягти обміном галоген-метал з відповідних галогенідів. Застосування, наприклад, ВuLі як джерела літію для обробки відповідного заміщеного галогеном бензофурану, наприклад, де Y1=галоген. Далі гасіння реагентом Sn(алкіл)3Сl (Lі, J.J. еt аl., Віооrg. Меd. Сhеm., 2003, 11, 3777). b) Металування реагентом алкіллітію на субстраті де Y1=Н, а далі переметалування, застосовуючи Sn(алкіл)3Сl, дає станумілування (Еіnhоrn еt аl. Sуnthеsіs 1984, 11, 978). 4) Отримання сполук формули ІV із Y3=СН2СОСl Хлорангідриди сполук формули ІV можна отримати чотири-етапним способом з відповідних бензилових спиртів. OH R1 R2 15 20 25 Cl R1 (i), (ii), (iii), (iv) O R2 O O (і) SОСl2, ТНF; (іі) NаСN, ДМФ; (ііі) Н2SО4, АсОН, Н2О; (іv) SОСl2, СН2Сl2. Хлорування, застосовуючи, наприклад, SОСl2, а далі уведення нітрилу. Гідроліз нітрилу до карбонової кислоти, з наступною обробкою SОСl2 дає хлорангідриді формули ІV (М.D. Соllіnі еt аl., Віооrg. Меd. Сhеm. Lеtt., 2004, 14, 4925). 5) Отримання сполук формули V Каталізованим паладієм сполученням арилацетиленів формули ІІІ з 2-йодфенолами формули ІV у стандартних умовах Соногашира (Yіn, Y.; Lіеbsсhеr, J.; Сhеm. Rеv. 2007, 107, 133). Способи отримання немічених сполук формул Іа та Іb Необмежувальні приклади способів отримання сполук формул Іа та Іb є нижченаведеними: 1) Отримання каталізованим паладієм перехресним сполученням інтермедіатів (ІV) та (ІІІ) з Y2 = СНСН2: Каталізоване паладієм сполучення стиренів та 2-гідроксіарилгалогенідів дає продукт стильбену. Альтернативно, продукт стильбену можна отримати реакцією Віттига між відповідними фосфоній бромідом та альдегідом. Q R2 HO R2 HO (i) + R1 I R1 Q (ii) HO R1 Q R2 R2 (iii) O Q O R1 30 35 (і) Каталізатор паладій, основа; (іі) епоксидування; (ііі) слабка кислота. Епоксидування стильбену, а потім циклізація у слабких кислотних умовах дає похідне бензофурану (Аslаm еt аl., Теtrаhеdrоn, 2006, 62, 4214). 2) Отримання каталізованого паладієм перехресного сполучення інтермедіатів (ІV) та (ІІІ) з Y2 = ССН: При тому що перехресне сполучення етиленів потребує наступної обробки до бензофурану, перехресне сполучення в умовах Соногашира гідроксіарилйодидів та більш реакційноздатних ацетиленів безпосередньо дає похідне бензофурану (Аslаm еt аl., Теtrаhеdrоn, 2006, 62, 4214). 40 18 UA 98481 C2 R2 HO R1 (i) + Q Q R1 I O R2 (і) Каталізатор паладій, СuІ, основа, ДМФ Q R1 (i) R1 Q OH R2 10 15 (і) НАuСl4 При необхідності циклізацію можна індукувати застосуванням золота як каталізатору при кімнатній температурі у розчиннику як-то Еt2О або ЕtОН. Метал утворює π-комплекс із алкіном, котрий тоді перетворюється у σ-комплекс при нуклеофільній атаці оксигену та протодеметалування дає бензофуран (V. Веltіng еt аl. Оrg. Lеtt., 2006, 8, 4489). 3) Отримання з інтермедіату (ІІІ): Реакція Фриделя-Крафтса між прийнятним Q та ацетилхлоридом формули ІІІ, а потім зняттям захисту, наприклад, піридин гідробромідом, при високій температурі призводить до циклізації та дає сполуки формули І (М.D. Соllіnі еt аl., Віооrg. Меd. Сhеm. Lеtt., 2004, 14, 4925). Cl R1 R2 20 25 30 35 40 O R2 5 O O (i) Q R1 R2 (ii) O O R1 Q R2 O (і) АlСl3, Q; (і) Піридин гідробромід, підвищена температура. 4) Отримання каталізованим паладієм перехресним сполученням інтермедіатів (ІІ) та (ІІІ): Каталізоване паладієм сполучення Сузукі або Стилла арилгалогенідів або псевдогалогенідів, інтермедіатів формули ІІІ (наприклад, Y2 = Сl, Вr, І або трифлат) з бороновими кислотами або естерами формули ІІ (наприклад, Y1 = В(ОН)2 або В(Оалкіл)2) або станами формули ІІ (наприклад, Y1=Sn(n-Вu)3). Каталіз паладієм як-то Рd(dррf)Сl2 або Рd(РРh3)Сl2 можна застосовувати у розчиннику як-то ДМФ або ЕtОН при температурі, наприклад, 80 °C. (Коthа еt аl. Теtrаhеdrоn 2002, 58, 96339695; Suzukі J. Оrgаnоmеt. Сhеm. 1999, 576, 147168; Fugаmі еt аl. Тор. Сurr. Сhеm. 2002, 219, 87130.) Способи отримання мічених сполук формули Іа Загалом, однакові реакції синтезу, застосовувані для немічених сполук формули Іа з немічених реагентів або інтермедіатів, можна застосовувати для аналогічного уведення ізотопу застосуванням відповідних мічених реагентів або інтермедіатів. Краще уводити мітку на останньому етапі синтезу сполук формули Іа, особливо якщо міткою 11 є ізотоп з відносно коротким періодом напіврозпаду, як-то С. Найкраще робити це уведення як останній етап синтезу. Кілька корисних реагентів або інтермедіатів, мічених довговічними або нерадіоактивними 2/3 2/3 13/14 13/14 13/14 ізотопами, у тому числі, наприклад, [ Н]Н2, [ Н]СН3І, [ С]СН3І, [ С]СN , [ С]СО2 є у продажу та можуть, при необхідності, бути перетвореним звичайними способами синтезу. 11 18 Реагенти, мічені відносно більш недовговічними ізотопами, як-то С та F, створюють на циклотроні, а далі придатним відділенням та необов'язково синтезом потрібного реагенту. Створення та синтез мічених реагентів та інтермедіатів, та застосування цих попередників для синтезу більш складних мічених молекул, є добре відомі спеціалісту (Långström еt аl. Асtа Сhеm. Sста. 1999, 53, 651). Для додаткових посилань дивись, наприклад: Аlі еt аl. Sуnthеsіs 1996, 423 19 UA 98481 C2 5 10 15 20 25 30 35 40 45 50 55 60 стосовно мічення галогенами; Аntоnі G., Кіhlbеrg Т., та Långström В. (2003) Наndbооk оf nuсlеаr chemistry, еdіtеd bу Vеrtеs А., Nаgу S., та Кlеnsсаr Z., Vоl. 4, 119-165 стосовно мічення для РЕТ3 застосування; Sаljоughіаn еt аl. Sуnthеsіs 2002, 1781 стосовно мічення Н; МсСаrthу еt аl. Сurr. 14 Рhаrm. Dеs. 2000, 6, 1057 стосовно мічення С. Визначувані ізотопи, корисні для мічення сполук формули Іа, які виначено тут охоплюють, 11 18 75 76 120 123 131 для застосування у РЕТ: С, F, Вr, Вr та І, для застосування у SРЕСТ: І та І, для 19 13 3 14 125 МRІ-застосування: F та С, для визначення у зразках іn vіtrо та після смерті: Н, С та І. 11 18 123 19 3 14 Найбільш корисними ізотопами для мічення є С, F, І, F, Н та С. Нижченаведено необмежувальні описи способів отримання міченої сполукии формули Іа: Сполуки формул Іа та Іb, котрі несуть гідрокси-, аміно- або аміноалкіл є корисними попередниками для О- та N-алкілування, відповідно, міченим алкілувальним агентом, як-то [11С]метилйодид або трифлат, як описано у, наприклад, Sоlbасh еt аl. Applied Radiation and Isotopes 2005, 62, 591 та Маthіs еt аl. J. Меd. Сhеm. 2003, 46, 2740, або [3Н]-метилйодид, або 14 [ С]-метилйодид. Наприклад, сполуки формули Іа, у котрих один з R1 та R2 є гідрокси (іншим є гідроген), або сполуки формули Іb, у котрих один з R8 та R11 є гідрокси (іншим є гідроген), або попередники 11 для мічення. Коли такий попередник обробляють [ С]метилйодидом в основних умовах, як-то у присутності калій карбонату, у розчиннику, як-то ДМСО, селективне О-алкілування відбувається у присутності N-нуклеофілів, як-то аміно або амінометил, внаслідок відносно вищої реактивності атому оксигену після депротонування, та тому в утворенні сполук формул Іа та Іb, у котрих ОН11 групу перетворено у О[ С]СН3-групу. Сполуки формули Іb, у котрих R8 або R11 є захищеними (наприклад, із ТВDМS) гідроксигрупами, Х 8-N, а R10 - гідрокси, є корисними попередниками для 11 мічення О-алкілуванням застосуванням С-метилйодиду у присутності Аg2СО3 як основи (Shіnzо К. Sуnth Соmm 2006, 36, 1235). 11 Найкращими попередниками для мічення селективним уведенням С-метилу Nалкілуванням, є сполуки, у котрих реактивність до алкілування присутніх конкурентних нуклеофільних функціональних груп, як-то гідрокси або ароматичні N-Н функціональні групи, є зниженою або блокованою придатною захисною групою. Функція захисної групи у цьому контексті полягає у захисті нуклеофільної функціональної групи від алкілування та повинна переважно бути стабільною у неводних основних умовах, у котрих потрібне N-алкілування є полегшеним, але легко видаляються іншими засобами після виконання. Такі захисні групи та способи їх уведення та видалення, є добре відомими спеціалісту. Приклади захисних груп, корисних для захисту ароматичних гідроксигруп проти конкурентного алкілування охоплюють, але без обмеження, метил, 2-(триметилсиліл)етоксиметил, алкоксиметил та тбутилдиметилсиліл. Видалення такої захисної групи після алкілування є добре відомим спеціалісту та охоплює, у випадку захисної групи на основі силілу, як-то т-бутилдиметилсиліл, наприклад, обробку джерелом іонів флуориду, як-то ТБАФ, або обробку водою в основних умовах у придатному розчиннику, як-то ДМСО у присутності КОН при кімнатній температурі. Приклади захисних груп, корисних для захисту ароматичних N-Н функціональних груп проти конкурентного алкілування, охоплюють, але без обмеження, SО 2N(СН3)2, SО2(п-метил)феніл, СО2СН2ССl3, СО2(СН2)2Sі(СН3)2, т-бутилдиметилсиліл та Р(=S)феніл2. У випадку, де ароматична гідрокси-функціональна група, та ароматична N-Н функціональна група є одночасно захищеними проти алкілування, краще застосовувати одну захисну групу, як-то тбутилдиметилсиліл, або дві відмінні захисні групи, котрі дозволяють одночасне зняття захисту з обох функціональних груп одним етапом застосуванням одного реагенту зняття захисту. Сполуки формули Іа або Іb, що несуть ароматичну аміногрупу, є корисними попередниками + для мічення спочатку діазотуванням (тобто, перетворенням аміногрупи у N 2 ), коли прийнятно, а далі перетворенням у відповідне похідне триазину перед наступною обробкою міченими нуклеофільними реагентами стандартними реакціями. Визначувані ізотопи, що можна уводити 18 75 123 125 131 цим шляхом, охоплюють, але без обмеження, F, Вr, І, І та І як описано, наприклад, Zhu еt аl. J. Оrg. Сhеm. 2002, 67, 943; Маеdа еt аl. J. Lаbеl Соmрd Rаdіорhаrm 1985, 22, 487; Веrrіdgе еt аl. J. Lаbеl Соmрd Rаdіорhаrm 1985, 22, 687; Suеhіrо еt аl. J. Lаbеl Соmрd Rаdіорhаrm 1987, 24, 1143; Strоuрhаuеr еt аl. Іnt. J. Аррl. Rаdіаt. Іsоt. 1984, 35, 787; Коrtуlеvісz еt аl. J. Lаbеl Соmрd Rаdіорhаrm 1994, 34, 1129; Кhаlаj еt аl. J. Lаbеl Соmрd Rаdіорhаrm 2001, 44, 235 та Rzесzоtаrskі еt аl. J. Меd. Сhеm. 1984, 27, 156. У сполуках формули Іb, що несуть ароматичну триалкілстанум-групу, галогенування міченими реагентами призводить до заміщення триалкілстанум-групи як описано, наприклад, Stаеlеns еt аl. J. Lаbеl Соmрd Rаdіорhаrm 2005, 48, 101; Носkе еt аl. Віооrg. Меd. Сhеm. Lеtt. 2004, 14, 3963; Zhuаng еt аl. J. Меd. Сhеm. 2003, 46, 237; Füсhtnеr еt аl. Аррl. Rаd. Іsоt. 2003, 58, 575 та Као еt аl. J. Lаbеl Соmрd Rаdіорhаrm 2001, 44, 889. Такі ж попередники є також 20 UA 98481 C2 11 5 10 15 20 25 30 35 40 45 50 55 корисними для каталізованого паладієм перетворення у відповідні С-мічені кетони та метилпохідні, як описано, наприклад, Lіdström еt аl. J. Сhеm. Sос. Реrkіn Тrаns. 1 1997, 2701 та Таrkіаіnеn еt аl. J. Lаbеl Соmрd Rаdіорhаrm 2001, 44, 1013. Заміщені триалкілстанумом сполуки переважно отримують з відповідних галогенідів або псевдо-галогенідів, як-то трифлати, добре відомими способами застосування паладію як каталізатору у реакції із відповідним дистананом. Коли застосовують цей спосіб, триалкілстанум-групою є переважно триметилстанум або трибутилстанум. Сполуки формули Іb, котрі несуть ароматичну триалкілстанум-групу, переважно nВu3Sn, Х6 карбон, Х7 або Х8 - нітроген (інший - карбон), а R10 - метиламіно, диметиламіно або метокси, є 123 125 придатними попередниками для мічення І або І йоддестанілуванням в окиснювальних умовах у присутності міченого йодиду способом, описаним, наприклад, у Zhuаng еt аl. Nuсl. Меd. Віоl. 2001, 28, 887. Коли будь-який з гетероциклічних замісників у попереднику є відщеплюваною групою, придатною для нуклеофільного ароматичного заміщення, мічений нуклеофіл, як-то галогенід або ціанід, можна уводити таким заміщенням, отримуючи мічену сполуку формули Іа, як описано, наприклад, Zhаng еt аl. Аррl. Rаd. Іsоt. 2002, 57, 145. Ароматичне кільце із заміщенням є переважно відносно електроно-збідненим для полегшення реакції, та може тому потребувати заміщення електрон-відтягувальною активувальною групою, як-то ціано, карбальдегід або нітро. Корисні реакції, тісно пов'язані з нуклеофільним ароматичним заміщенням та добре відомі спеціалісту, охоплюють застосування стехіометричної кількості купрум-солі для уведення 11 міченого атому йоду, та застосування каталізу паладієм для уведення С-міченої ціано-групи, як описано, наприклад, Мusасіо еt аl. J. Lаbеl Соmрd Rаdіорhаrm 1997, 34, 39 та Таеrssоn еt аl. 18 J. Lаbеl Соmрd Rаdіорhаrm 1998, 41, 567 відповідно. Також, F-атом можна уводити, 18 наприклад, застосуванням К[ F]-К222 у ДМСО, як описано Каrrаmkаm, М. еt аl. J. Lаbеllеd Соmрd. Rаd. 2003, 46, 979. Якщо ароматичне кільце, на котрому розташована відщеплювана група, є більш електроно-дефіцитним при порівнянні з бензеном, як-то у 2-галоген-піридинах та піримідинах, загалом нема необхідності застосування активувальних груп для електрофільного ароматичного заміщення. Сполуки формули Іа, де Q-Q2, та Іb, де R3 та R10, відповідно, є будь-яким з відщеплюваних груп: флуор, хлор, бром, йод або сульфонат-естер, та будь-який або обидва з Х2 та Х4, та Х6 та Х8 - нітрогеном, є придатними попередники для мічення нуклеофільним ароматичним заміщенням. Крім того краще застосовувати відщеплювану групу, що хімічно відмінна від групи, уведеної реакцією з міченим нуклеофілом для полегшення хроматографічного віддділення міченого продукту реакції від попереднику. Сполуки формули Іb, у котрих R8 або R11 є захищеними (наприклад, ТВDМS) гідроксигрупами (іншим є гідроген), а R10 - О(СН2)2ОТоs або NН(СН2)2ОТоs, є корисними 18 попередниками для мічення флуором застосуванням будь-якого комплексу 2,2,2-[ F]флуориду 18 (Sсhіrrmасhеr еt аl. J. Lаbеllеd Соmрd. Rаd. 2001, 44, 627), або тетрабутиламонію [ F]флуориду у СН3СN при нагріванні (Наmасhеr еt аl. Аррl. Rаdіаt. Ізотопи 2002, 57, 853), як джерела 18 нуклеофільного F для нуклеофільного заміщення відщеплюваної групи ОТоs . Інші придатні відщеплювані групи, що можна застосовувати, є добре відомими спеціалісту та охоплюють, але без обмеження, бром, йод, ОSО2СF3, ОSО2СН3 та ОSО2феніл. Сполуки формули 1b, у котрих R8 - Н, R11 - ОSі(G3)3 або ОСН2G4, R10-N(СН3)СНО, + N(СН3)СОСН3, N(СН3)СО2-т-бутил або СОNН2 та R9 - нітро, N(СН3)3 , бром, йод, хлор є 18 корисними попередниками для мічення флуором застосуванням комплексу 2,2,2-[ F]флуориду 18 як джерела нуклеофільного F для нуклеофільного заміщення відщеплюваної групи R9 (F. Dоllе, Сurr. Рhаrm. Dеsіgn 2005, 11, 3221-3235). Додаткові корисні способи, добре відомі спеціалісту, для отримання мічених сполук формули Іа перетворенням функціональних груп придатних попередників охоплюють N11 14 3 11 14 ацилування амінів [ С], [ С], або [ Н]ацилхлоридами, каталізоване паладієм [ С] або [ С] ціанування ароматичних хлоридів, бромідів або йодидів, каталізоване перехідним металом 3 3 заміщення придатних галогенідів Н у присутності [ Н]Н2, та каталізоване паладієм 11/14 карбонілування [ С]СО (Реrrу еt аl. Organometallics 1994, 13, 3346). Приклади сполук Нижченаведено ряд необмежувальних прикладів сполук винаходу. Усі з нижченаведених сполук, або їх відповідних немічених аналогів, котрі не є виключно попередниками, виявляють ІК50 менше, ніж 20 мкМ в аналізі конкурентного зв'язування, описаного тут. Загальні способи 21 UA 98481 C2 5 10 15 20 25 30 35 40 45 Усі застосовувані розчинники були аналітичного гатунку та для реакції були застосовуваними наявні у продажу безводні розчинники. Реакції звичайно проводили в інертній атмосфері азоту або аргону. 1 Н спектри реєстрували на спектрометрі Вrukеr аv400 ЯМР при 400 МГц для протону, або на спектрометрі Вrukеr DРХ400 ЯМР при 400 МГц для протону. 1 Якщо не вказане інше у прикладах, Н-спектри реєстрували при 400 МГц у ДМСО-d6 як розчиннику. Сигнал залишкового розчиннику застосовували як внутрішній стандарт. Наступні стандартні сигнали були застосовуваними: середня лінія ДМСО-d6 2,50; середня лінія СD3ОD 3,31; СDСl3 7,26. У випадках, де спектри отримували у суміші СDСl3 та СD3ОD, стандарт був -1 -1 3,31 млн . Усі хімічні зсуви є у млн на дельта-шкалі () та реєстрували чітке розщеплення сигналів (s: синглет, d: дублет, t: триплет, q: квартет, m: мультиплет, br: широкий сигнал), або 1 13 Н та С ЯМР-спектри реєстрували при 400 МГц для протону та 100 МГц для карбону-13 на спектрометрі Vаrіаn Меrсurу Рlus 400 ЯМР із зондом Vаrіаn 400 АТВ РFG. Усі дейтеровані розчинники містили звичайно 0,03 % - 0,05 об. % тетраметилсилану, котрий застосовували як 1 13 стандартний сигнал ( 0,00 для Н та С). 3 Н-спектри реєстрували на спектрометрі Вrukеr DRХ600 ЯМР при 640 МГц для тритію та при 1 3 600 МГц для протону. Н Н розділені спектри реєстрували на зразках, розчинених у СD 3ОD. 3 Для Н ЯМР-спектрів порівняння зі стандартом, побічною стандартною частотою застосовували, 1 як розрахований множенням частоти внутрішнього ТМС у спектрі Н на Ларморовське 3 1 співвідношення частот між Н та Н (1,06663975), згідно з описом Аl-Rаwі еt аl. J. Сhеm. Sос. Реrkіn Тrаns. ІІ 1974, 1635. Мас-спектри реєстрували на мас-спектрометрі Wаtеrs РХ-МС, що складається з системи Аllіаnсе 2795 або Асquіtу (РХ), Wаtеrs РDА 2996, та детектору ЕLS (Sеdех 75) та одиничноквадрупольного ZМD або мас-спектрометрі ZQ. Мас-спектрометр був з джерелом електророзпилення іонів (ЕР) у позитивному або негативному режимі. Напруга капіляру була 3 кВ, а напруга конуса була 30 V. Мас-спектрометр було скановано між m/z 100-600 з часом сканування 0,7 с. Температура колонки була 40 С (Аllіаnсе) або 65 °C (Асquіtу). Застосовували лінійний градієнт, починаючи при 100 % А (А: 10 мМ NН4ОАс у 5 % МеСN) та закінчуючи при 100 % В (В: МеСN). Застосовуваною колонкою була Х-Теrrа МS С8, 3,0 × 50; 3,5 мкм (Wаtеrs) ТМ при 1,0 мл/хвил (Аllіаnсе), або Асquіtу UРLС ВЕН С8 1,7 мкм 2,1 × 50 мм при 1,2 мл/хвил. Мас-спектри (ЕР-МС) реєстрували на Wаtеrs МS, що складається з Аllіаnсе 2795 (РХ) та детектору Wаtеrs Місrоmаss ZQ при 120 °C. Мас-спектрометр був з джерелом електророзпилення іонів (ЕР) у позитивному або негативному режимі. Мас-спектрометр було скановано між m/z 100-1000 з часом сканування 0,3 с. Препаративну хроматографію (преп. ВЕРХ) проводили будь-якою з двох ВЕРХ: (1) з діодною матрицею та колонкою ХТеrrа МS С8, 19 × 300 мм, 10 мкм. (2), з детектором масспектрометру ZQ з ІЕР у позитивному режимі при напрузі капіляру 3 кВ та напрузі конуса 30 V, застосовуючи змішаний запуск УФ- та МС-сигналу для визначення збору фракції. Колонка: ТМ ТМ ХВrіdgе Рrер С8 5 мкм ОВD 19 × 100 мм. Градієнти з МеСN/(95:5 0,1М NН4ОАс:МеСN) були застосовуваними при швидкості потоку 20 або 25 мл/хвил. Мікрохвильове нагрівання проводили у мікрохвильовій камері Сrеаtоr, Іnіtіаtоr або Smіth Sуnthеsіzеr, що продукує безперервне випромінювання при 2450 МГц або мікрохвильове нагрівання проводили на системі СЕМ Dіsсоvеr LаbМаtе або на Віоtаgе Іnіtіаtоr при вказаній температурі у мікрохвильових тубах. Попередники Наступні приклади є корисними як попередники для отримання радіо-мічених сполук формули Іа та виявляють ІК50 більше, ніж 20 мкМ в аналізі конкурентного зв'язування, описаному тут. 5-Метоксибензофуран-боронова кислота 50 O OH B O 55 OH н-Бутиллітій 2,5М у гексанах (5,6 мл) додавали повільно до розчину 5-метоксибензофурану (13,5 ммоль) у сухому ТГФ (30 мл) при -78 °C. Після 1h перемішування при -78 °C, триізопропілборат (27,0 ммоль) додавали краплями та суміш перемішували протягом 20 хвил 22 UA 98481 C2 5 при -78 °C. Баню з сухим льодом видаляли та додавали НСl 2 Н (водн. 40 мл) та суміші дозволяли нагрітися до кімнатної температури та тоді виливали у воду (50 мл). Утворений водний розчин екстрагували етером, органічний шар промивали розсолом, сушили МgSО 4, фільтрували та концентрували під вакуумом, отримуючи заголовну сполуку як бежевий порошок 1 -1 (2,40 г). Н ЯМР млн 8,49 (s, 2 Н) 7,45 (d, 1 Н) 7,38 (s, 1 Н) 7,18 (d, 1 Н) 6,93 (dd, 1 Н) 3,78 (s, 3 Н). 5-(5-Метокси-бензофуран-2-іл)-піридин-2-ол O OH O N 10 15 20 25 5-метоксибензофуран-боронову кислоту (230 мг, 1,2 ммоль), 5-йод-2-піридон (221 мг, 1,0 ммоль), Рd(РРh3)2Сl2 (17 мг, 0,024 ммоль) та NЕt3 (317 мкл, 2,4 ммоль) змішували у ЕtОН (10 мл) у мікрохвильовій склянці на 20 мл. Суміш перемішували при 140 °C протягом 10 хвил у мікрохвильовому реакторі. Розчинник видаляли під вакуумом, додавали воду та розчин екстрагували ЕtОАс. Органічний шар сушили безводним натрій сульфатом, фільтрували та розчинник видаляли під вакуумом. Сиру речовину очищали препаративною ВЕРХ, отримуючи 1 -1 заголовну сполуку як білий твердий продукт (20 мг). Н ЯМР млн 11,95 (br. s., 1 Н) 7,94 (dd, 1 Н) 7,88 (s, 1 Н) 7,44 (d, 1 Н) 7,00-7,20 (m, 2 Н) 6,84 (dd, 1 Н) 6,48 (d, 1 Н) 3,78 (s, 3 Н); МС m/z 242 (М+Н). Сполуки Нижченаведено ряд необмежувальних прикладів сполук винаходу. Усі з нижченаведених сполуки, або їх відповідних немічених аналогів, відповідних немічених аналогів, котрі не є виключно попередниками, виявляють ІК50 менше, ніж 20 мкМ в аналізі конкурентного зв'язування, описаному тут. Приклад 1 5-(5-Метокси-бензофуран-2-іл)-піридин-2-карбонової кислоти амід O O O 30 35 N 5-метоксибензофуран-боронову кислоту (1,2 ммоль), 5-бромпіридин-2-карбоксамід (1,0 ммоль), Рd(РРh3)2Сl2 (0,024 ммоль) та NЕt3 (317 мкл) змішували у ЕtОН (10 мл) у мікрохвильовій склянці на 20 мл. Суміш перемішували при 140 °C протягом 10 хвил у мікрохвильовому реакторі, фільтрували, та осад промивали водою та ЕtОАс та сушили під 1 -1 вакуумом, отримуючи заголовну сполуку (75 мг). Н ЯМР млн 9,10 (d, 1 Н) 8,34 (dd, 1 Н) 8,21 (br. s., 1 Н) 8,00 (d, 1 Н) 7,52-7,72 (m, 3 Н) 7,25 (d, 1 Н) 7,00 (dd, 1 Н) 3,82 (s, 3 Н); МС m/z 269 (М+Н). Приклад 2 5-(5-Гідрокси-бензофуран-2-іл)-піридин-2-карбонової кислоти амід HO 40 45 NH2 O O N NH2 5-(5-Метокси-бензофуран-2-іл)-піридин-2-карбонової кислоти амід (0,21 ммоль) змішували із СН2Сl2 (3 мл) при 0 °C в атмосфері аргону. ВВr3 (1М у СН2Сl2) (1,0 мл) додавали краплями та суміш перемішували протягом 2 годин при кімнатній температурі. Суміш гідролізували Н 2О, а далі гасили NаНСО3 (насич. водн.). Утворену суміш фільтрували, та отриманий осад промивали Н2О та ЕtОАс. Твердий продукт сушили при 40 °C протягом 15 годин під вакуумом, отримуючи 23 UA 98481 C2 заголовну сполуку (20 мг). Н ЯМР млн 9,08 (d, 1 Н) 8,33 (dd, 1 Н) 8,20 (br. s., 1 Н) 7,97 (d, 1 Н) 7,61 (br. s., 1 Н) 7,54 (s, 1 Н) 7,47 (d, 1 Н) 7,02 (d, 1 Н) 6,85 (нон, 1 Н); МС m/z 255 (М+Н). Приклад 3 6-(5-Метокси-бензофуран-2-іл)-нікотинамід 1 -1 5 O O O 10 15 N NH2 5-метоксибензофуран-боронову кислоту (1,2 ммоль), 6-бромнікотинамід (1,0 ммоль), Рd(РРh3)2Сl2 (0,024 ммоль) та NЕt3 (317 мкл) змішували у ЕtОН (10 мл) у мікрохвильовій склянці на 20 мл. Суміш перемішували при 140 °C протягом 10 хвил у мікрохвильовому реакторі. Суміш фільтрували, отриманий осад промивали водою та ЕtОАс та сушили під вакуумом, отримуючи 1 -1 заголовну сполуку (85 мг). Н ЯМР млн 9,14 (d, 1 Н) 8,42 (dd, 1 Н) 7,97-8,25 (m, 2 Н) 7,63-7,80 (m, 2 Н) 7,58 (d, 1 Н) 7,22 (d, 1 Н) 6,98 (dd, 1 Н) 3,81 (s, 3 Н); МС m/z 269 (М+Н). Приклад 4 6-(5-Гідрокси-бензофуран-2-іл)-нікотинамід HO O O 20 25 N NH2 6-(5-Метокси-бензофуран-2-іл)-нікотинамід (0,25 ммоль) змішували із СН2Сl2 (3 мл) при 0 °C в атмосфері аргону. ВВr3 (1М у СН2Сl2) (1,0 мл) додавали краплями та суміш перемішували протягом 2 годин при кімнатній температурі. Суміш гідролізували Н 2О, а далі гасили NаНСО3 (насич. водн.). Утворену суміш фільтрували, та отриманий осад промивали Н 2О та ЕtОАс. 1 -1 Твердий продукт сушили при 40 °C протягом 15 годин під вакуумом (12 мг). Н ЯМР млн 9,11 (d, 1 Н) 8,38 (dd, 1 Н) 8,01-8,23 (m, 2 Н) 7,63-7,76 (m, 1 Н) 7,59 (s, 1 Н) 7,46 (d, 1 Н) 7,00 (d, 1 Н) 6,83 (dd, 1 Н); МС m/z 256 (М+Н). Приклад 5 [5-(5-Метокси-бензофуран-2-іл)-піридин-2-іл]-метиламін O H N O N 30 35 40 5-метоксибензофуран-боронову кислоту (1,2 ммоль), 5-бромпіридин-2-метиламін (1,0 ммоль), Рd(РРh3)2Сl2 (0,024 ммоль) та NЕt3 (317 мкл) змішували у ЕtОН (10 мл) у мікрохвильовій склянці на 20 мл. Суміш перемішували при 140 °C протягом 10 хвил у мікрохвильовому реакторі. Розчинник видаляли під вакуумом, додавали воду та розчин екстрагували ЕtОАс. Органічний шар сушили безводним натрій сульфатом, фільтрували та концентрували під вакуумом. Сиру речовину очищали препаративною ВЕРХ, отримуючи 1 -1 заголовну сполуку як білий твердий продукт (100 мг). Н ЯМР млн 8,53 (d, 1 Н) 7,84 (dd, 1 Н) 7,44 (d, 1 Н) 7,08 (d, 1 Н) 7,04 (s, 1 Н) 6,91 (d, 1 Н) 6,81 (dd, 1 Н) 6,55 (d, 1 Н) 3,78 (s, 3 Н) 2,83 (d, 3 Н); МС m/z 255 (М+Н). Приклад 6 2-(6-Метиламіно-піридин-3-іл)-бензофуран-5-ол HO H N O N 24 UA 98481 C2 5 10 [5-(5-Метокси-бензофуран-2-іл)-піридин-2-іл]-метиламін (0,24 ммоль) змішували із СН2Сl2 (3 мл) при 0 °C в атмосфері аргону. ВВr3 (1М у СН2Сl2) (1,0 мл, 1,0 ммоль) додавали краплями та суміш перемішували протягом 2 годин при кімнатній температурі. Суміш гідролізували Н 2О, а далі гасили розчином NаНСО3 (насич. водн.). Утворену суміш екстрагували ЕtОАс та органічні екстракти сушили безводним натрій сульфатом. Після фільтрування та випарювання розчиннику, сирий матеріал очищали препаративною ВЕРХ, отримуючи заголовну сполуку як 1 -1 білий твердий продукт (21 мг). Н ЯМР млн 9,10 (s, 1 Н) 8,50 (d, 1 Н) 7,81 (dd, 1 Н) 7,32 (d, 1 Н) 6,96 (s, 1 Н) 6,81-6,94 (m, 2 Н) 6,66 (dd, 1 Н) 6,54 (d, 1 Н) 2,82 (d, 3 Н); МС m/z 241 (М+Н). Приклад 7 6-(5-Метокси-бензофуран-2-іл)-піридазин-3-іламін O NH2 O 15 20 N N 5-метоксибензофуран-боронову кислоту (1,2 ммоль), 6-бром-3-піридазинамін (1,0 ммоль), Рd(РРh3)2Сl2 (0,024 ммоль) та NЕt3 (317 мкл) змішували у ЕtОН (10 мл) у мікрохвильовій склянці на 20 мл. Суміш перемішували при 140 °C протягом 10 хвил у мікрохвильовому реакторі. Розчинник видаляли під вакуумом, додавали воду та розчин екстрагували ЕtОАс. Органічний шар сушили безводним натрій сульфатом, фільтрували та розчинник видаляли під вакуумом. Сиру речовину очищали препаративною ВЕРХ, отримуючи заголовну сполуку як білий твердий 1 -1 продукт (51 мг). Н ЯМР млн 7,77 (d, 1 Н) 7,52 (d, 1 Н) 7,35 (s, 1 Н) 7,19 (d, 1 Н) 6,79-6,98 (m, 2 Н) 6,72 (s, 2 Н) 3,80 (s, 3 Н); МС m/z 242 (М+Н). Приклад 8 2-(6-Аміно-піридазин-3-іл)-бензофуран-5-ол HO NH2 O 25 30 35 N N 6-(5-Метокси-бензофуран-2-іл)-піридазин-3-іламін (0,14 ммоль) змішували із СН2Сl2 (3 мл) при 0 °C в атмосфері аргону. ВВr3 (1М у СН2Сl2, 1,0 мл) додавали краплями та суміш перемішували протягом 2 годин при кімнатній температурі. Суміш гідролізували Н 2О, а далі гасили NаНСО3 (насич. водн.). Утворену суміш екстрагували ЕtОАс та органічні екстракти сушили безводним натрій сульфатом. Після фільтрування та випарювання розчиннику, сирий матеріал очищали препаративною ВЕРХ, отримуючи заголовну сполуку як жовтий твердий 1 -1 продукт (8 мг). Н ЯМР млн 9,21 (s, 1 Н) 7,74 (d, 1 Н) 7,40 (d, 1 Н) 7,27 (s, 1 Н) 6,96 (d, 1 Н) 6,86 (d, 1 Н) 6,76 (dd, 1 Н) 6,69 (s, 2 Н); МС m/z 228 (М+Н). Приклад 9 5-(1-бензотієн-2-іл)піридин-2-карбоксамід NH2 S 40 45 N O 2-Бензотієнілборонову кислоту (1,8 ммоль), 5-бромпіридин-2-карбоксамід (1,2 ммоль), 2М К2СО3 (2,4 мл), Рd(dррf)Сl2 (0,12 ммоль) змішували та перемішували при 80 С у ДМФ протягом 3 годин. Реакційну суміш фільтрували та до фільтрованого додавали ЕtОАс та Н 2О. Шари відокремлювали та водну фазу двічі екстрагували ЕtОАс. Органічні екстракти сушили безводним натрій сульфатом. Розчинник випарювали під вакуумом, отримуючи коричневий твердий продукт. Сирий продукт піддавали зворотно-фазовій ВЕРХ, отримуючи заголовну 1 -1 сполуку як світло-коричневий твердий продукт (11mg). Н ЯМР млн 9,07 (d, 1 Н) 8,34 (dd, 1 Н) 8,24-8,02 (m, 5 Н) 7,73 (s br, 1 Н) 7,54-7,37 (m, 2 Н); МС m/z 255 (М+Н). Приклад 10 5-(1-Бензофуран-2-іл)піридин-2-карбоксамід 25 UA 98481 C2 NH2 O 5 10 O N 2-Бензофуранборонову кислоту (3,1 ммоль), 5-бромпіридин-2-карбоксамід (3,7 ммоль), 2М К2СО3 (водн., 6 мл) та Рd(dррf)Сl2 (0,31 ммоль) змішували та перемішували при 80 С у ДМФ протягом 2 годин. Реакційну суміш фільтрували та промивали Н 2О та ЕtОАс. ДМСО додавали до твердого залишку та фільтрували. Фільтрат збирали та очищали зворотно-фазовою ВЕРХ, 1 -1 отримуючи заголовну сполуку як білий твердий продукт (2,5 мг). Н ЯМР млн 9,18 (d, 1 Н) 8,46 (dd, 1 Н) 8,13-8,19 (m, 2 Н) 7,68-7,78 (m, 4 Н) 7,43-7,30 (m, 2 Н); МС m/z 239 (М+Н). Приклад 11 2-(1-бензофуран-2-іл)-6-метоксиімідазо[1,2-а]піридин N N O 15 20 O Бензофуран-боронову кислоту (0,289 ммоль), 2-бром-6-метоксиімідазо[1,2-а]піридин (0,263 ммоль), Рd(dррf)Сl2 (0,013 ммоль) та К2СО3 (водн.) перемішували у ДМФ при 80 С в атмосфері аргону протягом 1 години. Реакційній суміші дозволяли охолонути до кімнатної температури та додавали розсол. Реакційну суміш екстрагували СН 2Сl2 та органічну фазу фільтрували. Розчинники видаляли під зменшеним тиском та залишок очищали зворотно1 -1 фазовою ВЕРХ, отримуючи заголовну сполуку (0,5 мг). Н ЯМР млн 7,95 (s, 1 Н) 7,67 (d, 1 Н) 7,65-7,60 (m, 1 Н) 7,58-7,51 (m, 2 Н) 7,33-7,20 (m, 3 Н) 7,03 (dd, 1 Н) 3,86 (s, 3 Н); МС m/z 265 (М+Н). Приклад 12 2-(6-Флуор-5-метиламіно-піридин-2-іл)-бензофуран-5-ол 25 HO O N H N F а) 6-Бром-2-флуор-піридин-3-іламін NH2 30 35 40 Br N F При перемішуванні до розчину 2-флуор-піридин-3-іламіну (3,0 г, 26,79 ммоль) у оцтовій кислоті (24 мл), додавали натрію ацетат (2,17 г, 26,46 ммоль). Реакційну суміш охолоджували до 0-5 °C та розчин брому (1,37 мл, 26,74 ммоль) в оцтовій кислоті (8 мл) додавали краплями. Після 1 години реакційну суміш охолоджували до 0 °C, 10 % водний розчин натрію гідроксиду додавали до рН ~5 та продукт екстрагували етилацетатом (200 мл). Органічний шар промивали водою, розсолом, сушили безводним магній сульфатом та концентрували під зменшеним тиском. Сирий продукт очищали колонковою флеш-хроматографією, застосовуючи 20 % етилацетат у гексані, отримуючи 6-бром-2-флуор-піридин-3-іламін (3,9 г) як коричневий твердий 1 продукт. Н ЯМР (400 МГц, СDСl3) : 7,15 (d, J=7,8 Гц, 1Н), 7,00 (dd, J=10,1, 7,8 Гц, 1Н), 3,80 (s, + 2Н). ЕР-МС: m/z 191,32, 193,34 [М+1] b) 2-Флуор-6-(5-метокси-бензофуран-2-іл)-піридин-3-іламін 26 UA 98481 C2 O NH2 O N F 5 10 5-Метоксибензофуран-боронову кислоту (345 мг, 1,80 ммоль), 6-бром-2-флуор-піридин-3іламін (286,5 мг, 1,50 ммоль), Рd(РРh3)2Сl2 (25,2 мг, 0,036 ммоль) та Еt3N (475,5 мкл, 3,41 ммоль) змішували у ЕtОН (10 мл) у мікрохвильовій склянці. Реакційну суміш перемішували при 140 °C протягом 10 хвилин у мікрохвильовому реакторі. Летючі речовини тоді видаляли під зменшеним тиском та додавали воду (20 мл). Продукт екстрагували етилацетатом (30 мл). Органічний шар сушили безводним натрій сульфатом та концентрували під вакуумом. Очистка сирого продукту колонковою флеш-хроматографією, застосовуючи 25 % етилацетат у гексані дала 2-флуор-6-(5-метокси-бензофуран-2-іл)-піридин-3-іламін (268 мг) як білуватий твердий продукт, 1Н ЯМР (400 МГц, СDСl3) : 7,58 (d, J=7,6 Гц, 1Н), 7,39 (d, J=9,0 Гц, 1Н), 7,15 (m, 1Н), 7,14 (s, 1Н), 7,04 (d, J=2,6 Гц, 1Н), 6,88 (m, 1Н), 3,95 (s, 2Н), 3,85 (s, 3Н). ЕР-МС: m/z 259,47 + [М+1] с) [2-Флуор-6-(5-метокси-бензофуран-2-іл)-піридин-3-іл]-метил-амін 15 O O N H N F 20 25 30 При перемішуванні до розчину 2-флуор-6-(5-метокси-бензофуран-2-іл)-піридин-3-іламіну (97 мг, 0,376 ммоль) у суміші МеОН (2 мл) та дихлоретану (1 мл), додавали формальдегід (37 % розчин у воді, 0,167 мл, 2,23 ммоль) та оцтову кислоту (50 мкл, 0,87 ммоль). Реакційну суміш перемішували протягом 2 годин при кімнатній температурі, тоді додавали одною порцією NаСNВН3 (94 мг, 1,50 ммоль) та перемішування продовжували протягом 45 хвилин. Реакцію тоді гасили додаванням води (2 мл). Летючі речовини видаляли під зменшеним тиском та залишок екстрагували дихлорметаном (50 мл). Органічний шар промивали водою, сушили безводним натрій сульфатом, фільтрували та концентрували. Продукт очищали колонковою флеш-хроматографією, застосовуючи 20 % етилацетат у гексані, отримуючи [2-флуор-6-(51 метокси-бензофуран-2-іл)-піридин-3-іл]-метил-амін (35,7 мг) як білуватий твердий продукт. Н ЯМР (400 МГц, СDСl3) : 7,64 (d, J=8,2 Гц, 1Н), 7,38 (d, J=8,98 Гц, 1Н), 7,09 (s, 1Н), 7,03 (d, J=2,34 Гц, 1Н), 6,99 (dd, J=10,15, 8,20 Гц, 1Н), 6,87 (dd, J=8,78, 2,54 Гц, 1Н), 4,21 (br. s, 1Н), 3,85 (s, 3Н), 2,94 (d, J=5,07 Гц, 3Н) d) 2-(6-Флуор-5-метиламіно-піридин-2-іл)-бензофуран-5-ол HO O N H N F 35 40 45 При перемішуванні до розчину [2-флуор-6-(5-метокси-бензофуран-2-іл)-піридин-3-іл]-метиламіну (31 мг, 0,114 ммоль) у дихлорметані (3 мл) при 0 °C в атмосфері азоту, ВВr3 (1М розчин у СН2Сl2, 0,568 мл, 0,568 ммоль) додавали краплями. Реакційну суміш перемішували протягом 1,5 годин при кімнатній температурі. Суміш тоді охолоджували до 0 °C, додавали насичений розчин натрію гідрогенкарбонату (5 мл) та утворену суміш екстрагували дихлорметаном (50 мл). Органічний шар промивали розсолом, сушили безводним натрій сульфатом та концентрували під зменшеним тиском. Очистка сирого продукту флеш-хроматографією, застосовуючи 30 % етилацетату у гексані дала заголовну сполуку 2-(6-флуор-5-метиламіно-піридин-2-іл)1 бензофуран-5-ол (22 мг) як білуватий твердий продукт. Н ЯМР (400 МГц, МЕТАНОЛ-d4) : 7,62 (d, J=7,90 Гц, 1Н), 7,28 (d, J=8,78 Гц, 1Н), 7,08 (dd, J=10,54, 8,20 Гц, 1Н), 6,97 (s, 1Н), 6,92 (d, + J=2,34 Гц, 1Н), 6,74 (dd, J=8,78, 2,34 Гц, 1Н), 2,87 (s, 3Н). ЕР-МС: m/z 259,47 [М+1] Приклад 13 2-(2-Флуор-6-метиламіно-піридин-3-іл)-бензофуран-5-ол 27 UA 98481 C2 HO O N N H F а) 5-Бром-6-флуор-піридин-2-іламін Br 5 10 15 F N NH2 При перемішуванні до розчину 6-флуор-піридин-2-іламіну (1,0 г, 8,93 ммоль) в ацетонітрилі (50 мл), захищеного від світла та в атмосфері азоту, додавали N-бромсукцинімід (0,79 г, 4,46 ммоль). Після 1 години додаткову порцію N-бромсукциніміду (0,79 г, 4,46 ммоль) додавали та перемішування продовжували протягом 3 годин. Летючі речовини видаляли під зменшеним тиском та сирий матеріал очищали колонковою флеш-хроматографією, застосовуючи градієнт 25 % - 30 % етилацетату у гексані, отримуючи 5-бром-6-флуор-піридин-2-іламін (1,45 г) як білий 1 твердий продукт. Н ЯМР (400 МГц, ХЛОРОФОРМ-d) : 7,60 (t, J=8,59 Гц, 1 Н) 6,15-6,36 (m, 1 Н) 4,58 (br. s., 2 Н) + 81 ЕР-МС: m/z 193,34 [М+1] для Вr ізотоп b) 6-Флуор-5-(5-метокси-бензофуран-2-іл)-піридин-2-іламін O NH2 O N F 20 25 30 5-Метоксибензофуран-боронову кислоту (230 мг, 1,20 ммоль), 5-бром-6-флуор-піридин-2іламін (191 мг, 1,00 ммоль), Рd(РРh3)2Сl2 (16,8 мг, 0,024 ммоль) та Еt3N (317 мкл, 2,27 ммоль) змішували у ЕtОН (10 мл) у мікрохвильовій склянці. Реакційну суміш перемішували при 140 °C протягом 15 хвилин у мікрохвильовому реакторі. Летючі речовини тоді видаляли під зменшеним тиском, залишок суспендували у воді та продукт екстрагували етилацетатом. Органічний шар сушили безводним натрій сульфатом, фільтрували та концентрували під вакуумом. Очистка сирого продукту колонковою флеш-хроматографією, застосовуючи 25 % етилацетат у гексані дала 6-флуор-5-(5-метокси-бензофуран-2-іл)-піридин-2-іламін (130 мг) як білуватий твердий 1 продукт. Н ЯМР (400 МГц, ХЛОРОФОРМ-d) : 8,05-8,21 (m, 1 Н) 7,36 (d, J=8,59 Гц, 1 Н) 7,03 (d, J=1,95 Гц, 1 Н) 6,97 (d, J=3,12 Гц, 1 Н) 6,86 (dd, J=8,78, 2,54 Гц, 1 Н) 6,45 (d, J=6,63 Гц, 1 Н) 4,66 (br. s., 2 Н) 3,86 (s, 3 Н) с) [6-Флуор-5-(5-метокси-бензофуран-2-іл)-піридин-2-іл]-карбамової кислоти трет-бутил естер O O O O N N H F 35 40 При перемішуванні до розчину 6-флуор-5-(5-метокси-бензофуран-2-іл)-піридин-2-іламіну (220 мг, 0,853 ммоль) у ТГФ (10 мл) при 0 °C додавали NаНМDS (1,02 мл, 1,02 ммоль, 1М розчин у ТГФ) та перемішували протягом 15 хвилин, а далі додавали ді-трет-бутил дикарбонату (262 мг, 1,2 ммоль) у ТГФ (5 мл) протягом 5 хвилин. Реакційну суміш перемішували протягом 2 годин при кімнатній температурі. ЕtОАс та насичений водний NаНСО 3 додавали та шари відокремлювали. Органічний шар промивали розсолом, сушили безводним натрій сульфатом, фільтрували, та концентрували під зменшеним тиском. Сирий продукт очищали колонковою флеш-хроматографією, застосовуючи 10 % етилацетат у гексані, отримуючи заголовну сполуку 1 (81 мг) як білуватий твердий продукт. Н ЯМР (400 МГц, ХЛОРОФОРМ-d) : 8,31-8,38 (m, 1 Н) 28
ДивитисяДодаткова інформація
Назва патенту англійською2-heteroaryl substituted benzothiophenes and benzofuranes
Автори англійськоюArzel, Erwan, Swahn, Britt-Marie, Wensbo, David
Назва патенту російськоюЗамещенные 2-гетероарилом бензотиофены и бензофураны
Автори російськоюАрзель Эрван, Свен Бритт-Мари, Венсбо Давид
МПК / Мітки
МПК: C07D 409/04, C07D 471/04, C07D 405/04, A61K 31/501, A61K 31/443, A61K 31/4436
Мітки: бензотіофени, бензофурани, заміщені, 2-гетероарилом
Код посилання
<a href="https://ua.patents.su/37-98481-zamishheni-2-geteroarilom-benzotiofeni-ta-benzofurani.html" target="_blank" rel="follow" title="База патентів України">Заміщені 2-гетероарилом бензотіофени та бензофурани</a>












