Похідні конденсованих азепінів і їх використання як антидіуретичних агентів
Номер патенту: 73177
Опубліковано: 15.06.2005
Автори: Семпле Граеме, Дженкінс Девід Пол, Пітт Гері Роберт Вільям, Ешворс Дорін Мері, Йей Крістофер Мартін, Френклін Річард Джеремі, Хадсон Пітер
Формула / Реферат
1. Сполука загальної формули 1 або 2 або її таутомер, або фармацевтично прийнятна сіль,
 ,
,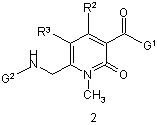 ,
,
де:
W є aбo N, aбo C-R4;
R1-R4 незалежно вибирають з Н, F, Сl, Вr, алкілу, СF3, фенілу, ОН, О-алкілу, NH2, NH-алкілу, N(алкіл)2, NO2 і CN, або R2 і R3 разом можуть бути -СН=СН-СН=СН-;
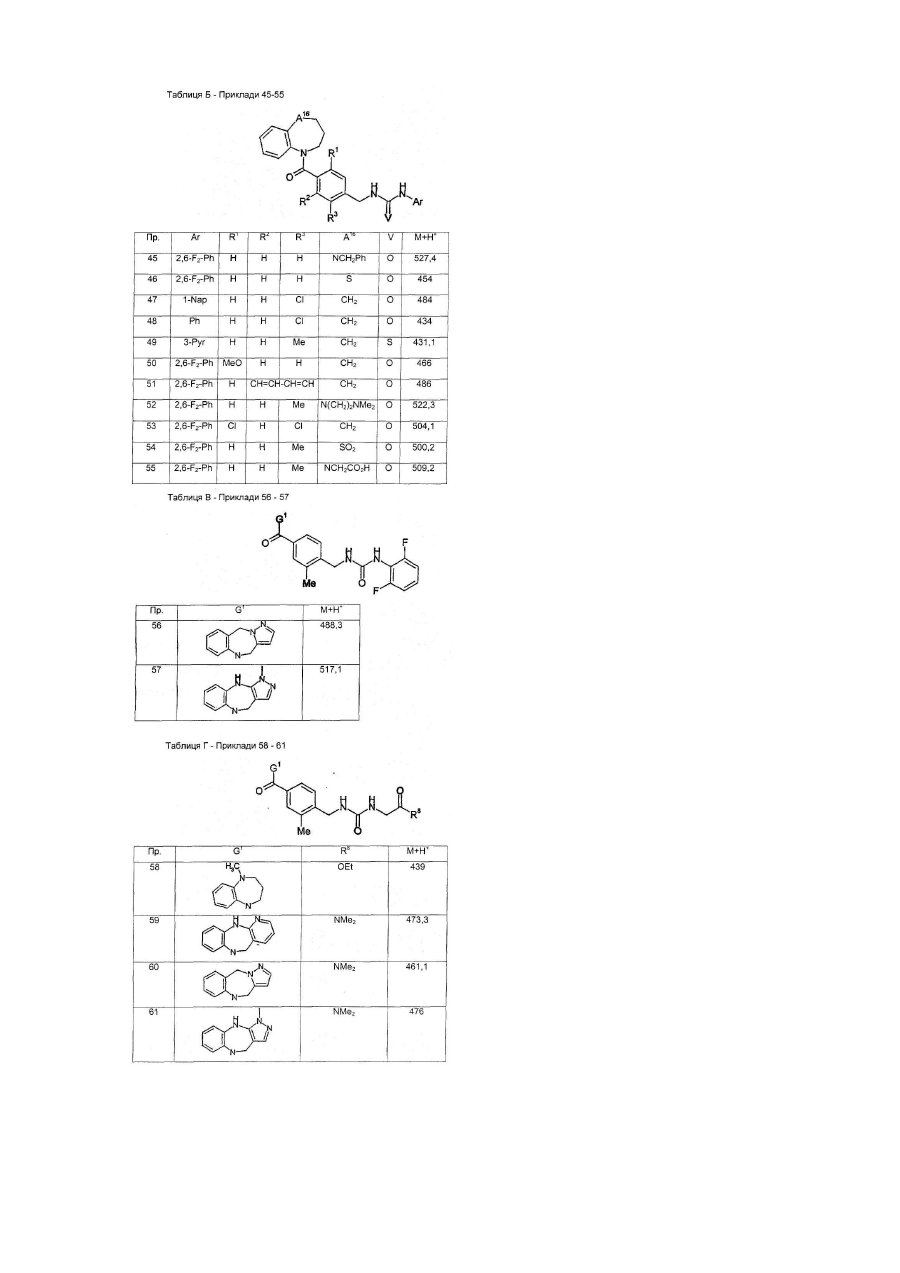
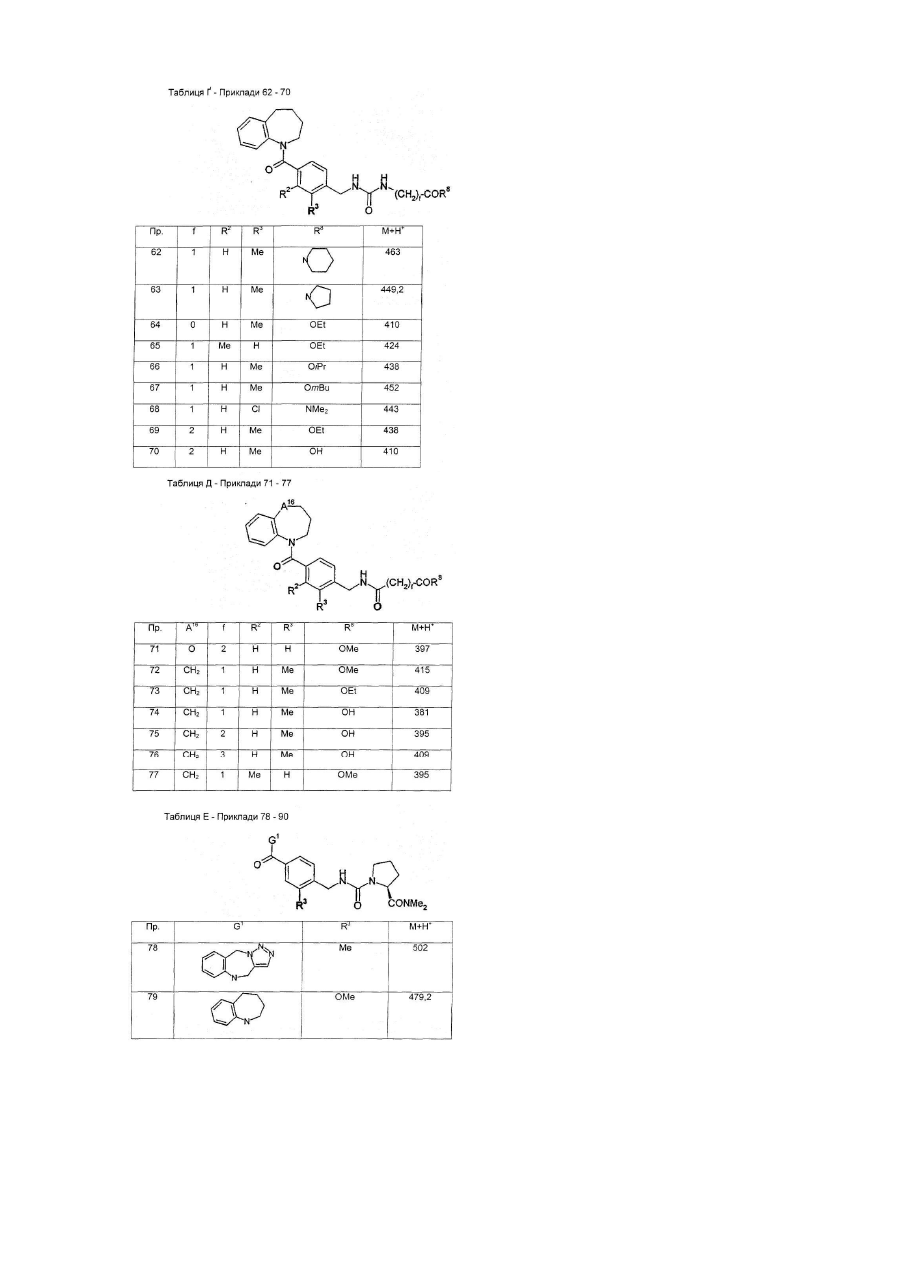
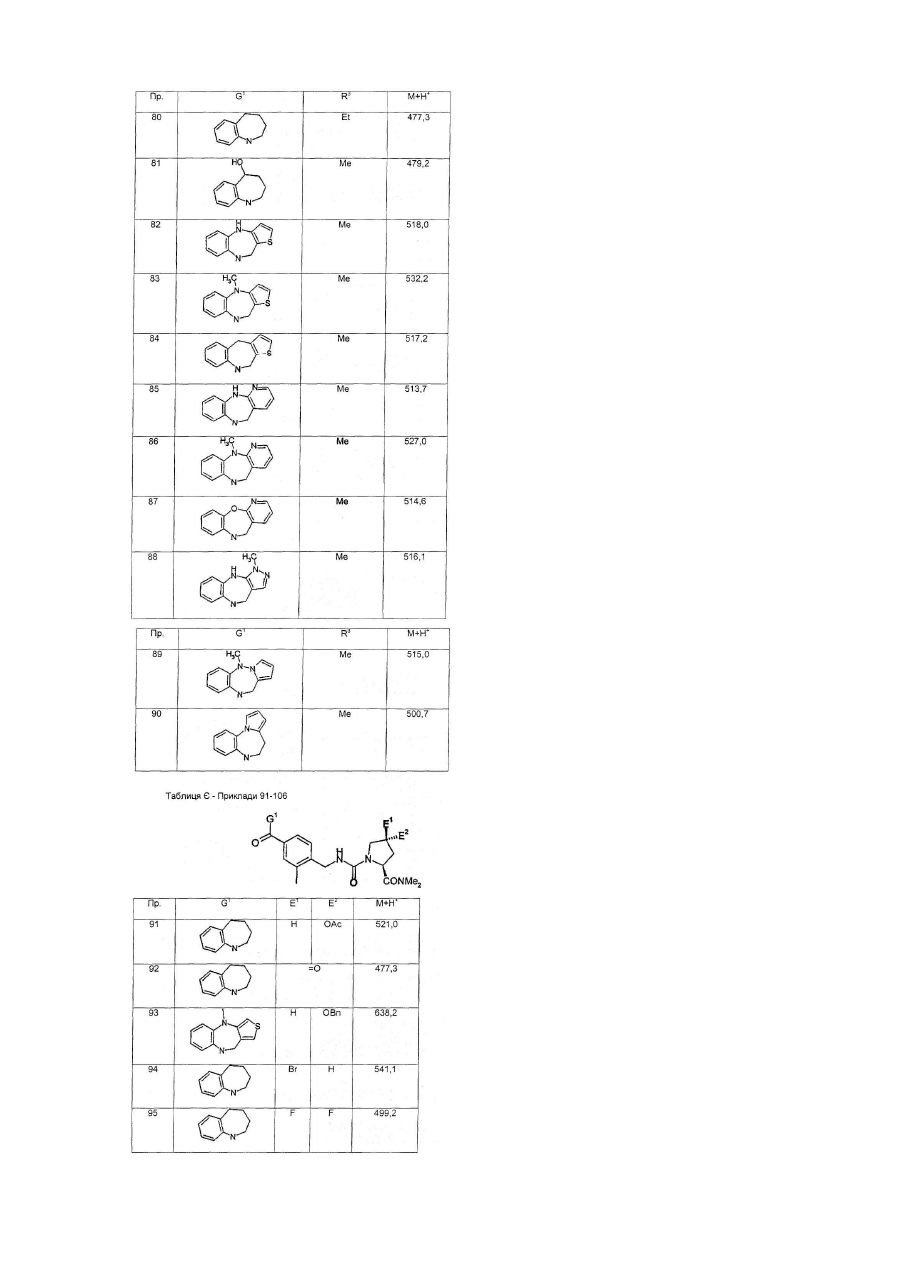
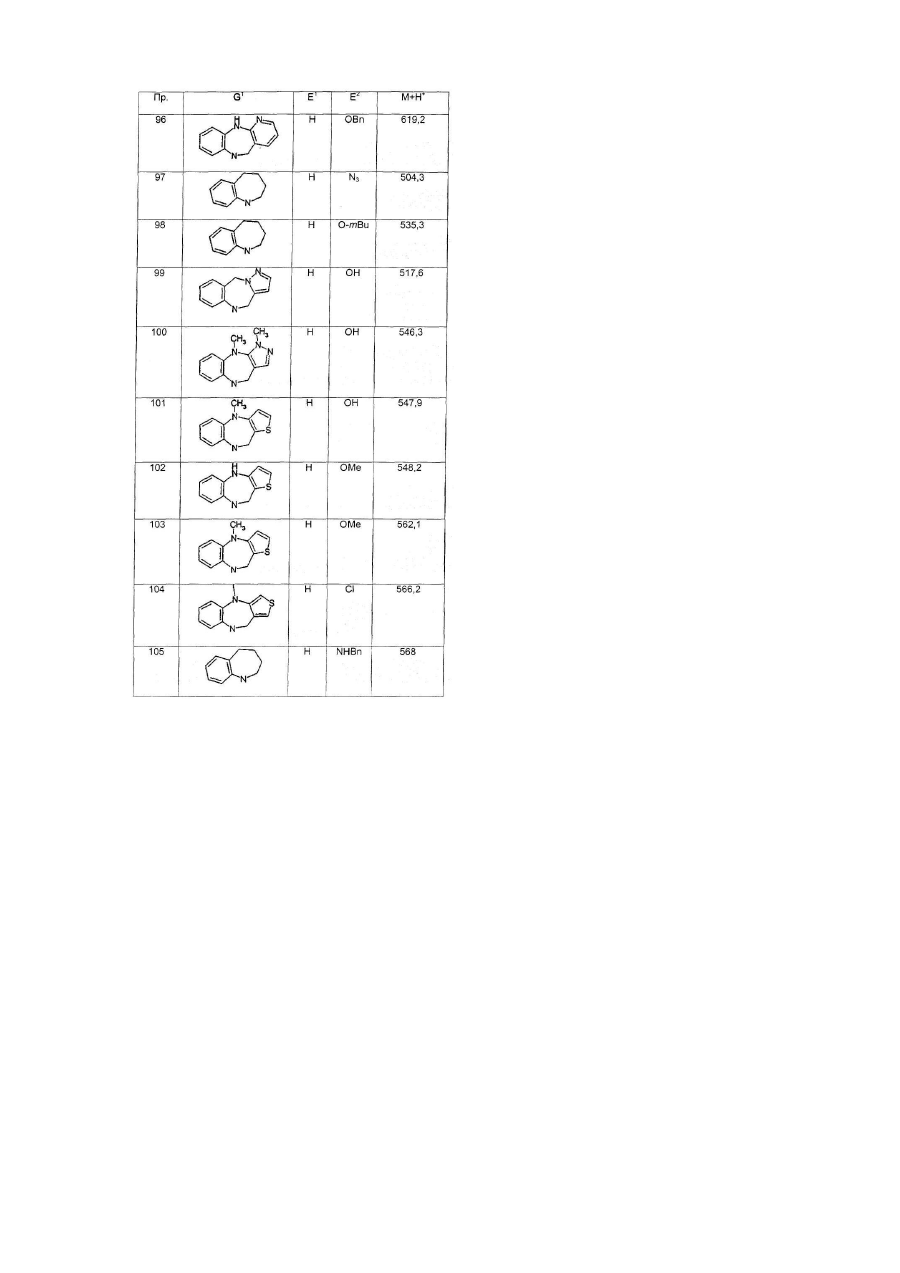
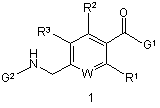
G1 є біциклічним або трициклічним конденсованим похідним азепіну, що вибирають з формул 3-8,
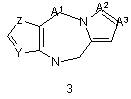 ,
,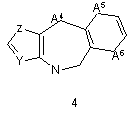 ,
,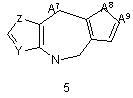 ,
,
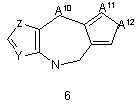 ,
,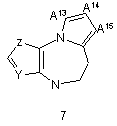 ,
,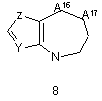 ,
,
в яких А1, А4, А7 і А10 кожен, незалежно, вибирають з СН2, О і NR5;
А2, А3, А9, А11, А13, А14 і А15 кожен, незалежно, вибирають з СН і N;
або А5 є ковалентним зв'язком і А6 є S, або А5 є N=CH і А6 є ковалентним зв'язком;
А8 і А12 кожен, незалежно, вибирають з NH, N-СН3 і S;
А16 і А17 обидва є СН2, або один з А16 і А17 є CH2 і інший вибирають з СН(ОН), CF2, О, SOa і NR5;
R5 вибирають з Н, алкілу, CO-алкілу і (CH2)bR6;
R6 вибирають з фенілу, піридилу, ОН, О-алкілу, NН2, NH-алкілу, N(алкіл)2, NO2, CO2H і CN;
а є 0, 1 або 2;
b є 1, 2, 3 або 4;
Y є СН або N;
Z є СН=СН або S; і
G2 є групою, що вибирають з загальних формул 9-11,
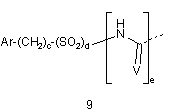 ,
, 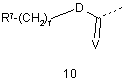 ,
,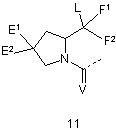 ,
,
в яких Аr вибирають з фенілу, піридилу, нафтилу і моно- або полізаміщеного фенілу або піридилу, в яких замісники вибирають з F, Сl, Вr, алкілу, ОН, O-алкілу, NH2, NH-алкілу, N(алкіл)2, NO2 і CN;
D є ковалентним зв'язком або NH;
Е1 і Е2 обидва Н, ОМе або F, або один з Е1 і Е2 є ОН, O-алкілом, OBn, OPh, OAc, F, Сl, Br, N3, NH2, NHBn або NHAc і інший є Н, або Е1 і Е2 разом є =O, -O(СН2)gО- або -S(CH2)gS-;
F1 і F2 обидва Н, або разом є =O або =S;
L вибирають з ОН, O-алкілу, NH2, NH-алкілу і NR9R10;
R7 вибирають з Н, алкілу, алкенілу і COR8;
R8 вибирають з ОН, O-алкілу, NH2, NH-алкілу, N(алкіл)2, піролідинілу і піперидинілу;
R9 і R10 обидва алкіли, або разом є -(CH2)h- або -(CH2)2O(CH2)2-;
V є O, N-CN або S;
с є 0 або 1;
d є 0 або 1;
е є 0 або 1;
f є 0, 1, 2, 3 або 4;
g є 2 або 3; і
h є 3, 4 або 5,
при умові, що d і е не є обидва 0.
2. Сполука згідно з пунктом 1 або її таутомер, або фармацевтично прийнятна сіль, яка має загальну формулу 1.
3. Сполука згідно з пунктом 2 або її таутомер, або фармацевтично прийнятна сіль, в якій W є С-R4.
4. Сполука згідно з пунктом 3 або її таутомер, або фармацевтично прийнятна сіль, в якій принаймні один з R1-R4 не є H.
5. Сполука згідно з пунктом 4 або її таутомер, або фармацевтично прийнятна сіль, в якій один з R1-R4 є метилом, F або Сl і всі інші є H.
6. Сполука згідно з пунктом 1 або її таутомер, або фармацевтично прийнятна сіль, яка має загальну формулу 2.
7. Сполука згідно з будь-яким з попередніх пунктів або її таутомер, або фармацевтично прийнятна сіль, в якій G1 є однією з груп загальної формули 3-7.
8. Сполука згідно з пунктом 7 або її таутомер, або фармацевтично прийнятна сіль, в якій Y є СН.
9. Сполука згідно з пунктом 8 або її таутомер, або фармацевтично прийнятна сіль, в якій Z є -СН=СН-.
10. Сполука згідно з пунктом 8 або її таутомер, або фармацевтично прийнятна сіль, в якій Z є S.
11. Сполука згідно з пунктом 7 або її таутомер, або фармацевтично прийнятна сіль, в якій Y є N і Z є -СН=СН-.
12. Сполука згідно з будь-яким з пунктів 7-11 або її таутомер, або фармацевтично прийнятна сіль, в якій G1 є групою загальної формули 3.
13. Сполука згідно з пунктом 12 або її таутомер, або фармацевтично прийнятна сіль, в якій А1 є СН2 і А2 і А3 обидва є СН.
14. Сполука згідно з будь-яким з пунктів 7-11 або її таутомер, або фармацевтично прийнятна сіль, в якій G1 є групою загальної формули 6.
15. Сполука згідно з пунктом 14 або її таутомер, або фармацевтично прийнятна сіль, в якій А11 є СН і А12 є S.
16. Сполука згідно з будь-яким з пунктів 1-6 або її таутомер, або фармацевтично прийнятна сіль, в якій G1 є групою загальної формули 8.
17. Сполука згідно з пунктом 16 або її таутомер, або фармацевтично прийнятна сіль, в якій А17 є СН2.
18. Сполука згідно з пунктом 16 або 17 або її таутомер, або фармацевтично прийнятна сіль, в якій А16 є СН2.
19. Сполука згідно з будь-яким з попередніх пунктів або її таутомер, або фармацевтично прийнятна сіль, в якій G2 є групою загальної формули 9.
20. Сполука згідно з пунктом 19 або її таутомер, або фармацевтично прийнятна сіль, в якій Аr є моно- або полізаміщеним фенілом.
21. Сполука згідно з пунктом 19 або 20 або її таутомер або фармацевтично прийнятна сіль, в якій Аr є фенілом, заміщеним принаймні двома атома галогену, що вибирають з F і Сl.
22. Сполука згідно з будь-яким з пунктів 19-21 або її таутомер, або фармацевтично прийнятна сіль, в якій Аr є 2,6-дифторфенілом.
23. Сполука згідно з будь-яким з пунктів 1-18 або її таутомер, або фармацевтично прийнятна сіль, в якій G2 є групою загальної формули 10.
24. Сполука згідно з пунктом 23 або її таутомер, або фармацевтично прийнятна сіль, в якій R7 є COR8.
25. Сполука згідно з пунктом 24 або її таутомер, або фармацевтично прийнятна сіль, в якій R8 є N(алкіл)2.
26. Сполука згідно з будь-яким з пунктів 1-18 або її таутомер, або фармацевтично прийнятна сіль, в якій G2 є групою загальної формули 11.
27. Сполука згідно з пунктом 26 або її таутомер, або фармацевтично прийнятна сіль, в якій F1 і F2 разом є =О.
28. Сполука згідно з пунктом 26 або 27 або її таутомер, або фармацевтично прийнятна сіль, в якій Е1 і Е2 обидва Н або один є Н і інший є О-алкілом.
29. Сполука згідно з будь-яким з пунктів 26-28 або її таутомер, або фармацевтично прийнятна сіль, в якій один з Е1 і Е2 є Н і інший є О-алкілом, і СЕ1Е2 хіральний центр має R-конфігурацію.
30. Сполука згідно з будь-яким з пунктів 26-29 або її таутомер, або фармацевтично прийнятна сіль, в якій сусідній з атомом азоту хіральний центр має S-конфігурацію.
31. Сполука згідно з пунктом 1 або її таутомер, або фармацевтично прийнятна сіль, яку вибирають з:
1-(4-[3-(2-хлор-6-фторфеніл)уреїдометил]-3-метилбензоїл)-2,3,4,5-тетрагідро-1Н-1-бензазепіну,
1-(4-[3-(2,6-дифторфеніл)уреїдометил]-3-метилбензоїл)-5-(3-піридил)метил-2,3,4,5-тетрагідро-1Н-1,5-бензодіазепіну,
1-(3-хлор-4-[3-(2-хлор-6-фторфеніл)уреїдометил]бензоїл)-5-етил-2,3,4,5-тетрагідро-1Н-1,5-бензодіазепіну,
4-(3-хлор-4-[3-(2,6-дифторфеніл)уреїдометил]бензоїл)-5,6,7,8-тетрагідротієно[3,2-b]азепіну,
1-(3-хлор-4-(3-(метилоксикарбоніл)пропаноїламінометил)бензоїл)-2,3,4,5-тетрагідро-1-бензазепіну,
1-(2-метил-4-(5-(3-піридилметил)-2,3,4,5-тетрагідро-1,5-бензодіазепін-1-ілкарбоніл)бензил)-3-(метилоксикарбонілметил)сечовини,
1-(2-метил-4-(2,3,4,5-тетрагідро-1-бензазепін-1-ілкарбоніл)бензилкарбамоїл)-L-пролін-N,N-диметиламіду,
(4R)-4-гідрокси-1-(2-метил-4-(2,3,4,5-тетрагідро-1-бензазепін-1-ілкарбоніл)бензилкарбамоїл)-L-пролін-N,N-диметиламіду,
(4R)-1-(3-хлоp-4-(2,3,4,5-тетрагідро-1-бензазепін-1-ілкарбоніл)бензилкарбамоїл)-4-метокси-L-пролін-N,N-диметиламіду,
(4R)-1-(2-хлор-4-(2,3,4,5-тетрагідро-1-бензазепін-1-ілкарбоніл)бензилкарбамоїл)-4-метокси-L-пролін-N,N-диметиламіду,
(4R)-4-бензилокси-1-(2-метил-4-(2,3,4,5-тетрагідро-1-бензазепін-1-ілкарбоніл)-бензилкарбамоїл)-L-пролін-N,N-диметиламіду,
(4R)-4-метокси-1-(2-метил-4-(2,3,4,5-тетрагідро-1-бензазепін-1-ілкарбоніл)бензилкарбамоїл)-L-пролін-N,N-диметиламіду,
(4R)-4-метокси-1-(3-метил-4-(2,3,4,5-тетрагідро-1-бензазепін-1-ілкарбоніл)бензилкарбамоїл)-L-пролін-N,N-диметиламіду,
(4R)-1-(2-хлор-4-(5,6,7,8-тетрагідро-4Н-тієно[3,2-b]азепін-4-ілкарбоніл)бензилкарбамоїл)-4-метокси-L-пролін-N,N-диметиламіду,
(4R)-1-(4-(10,11-дигідро-5Н-піроло[2,1-с](1,4)бензодіазепін-10-ілкарбоніл)-2-метилбензилкарбамоїл)-4-метокси-L-пролін-N,N-диметиламіду,
(4R)-1-(2-хлор-4-(10,11-дигідро-5Н-піроло[2,1-с](1,4)бензодіазепін-10-ілкарбоніл)-бензилкарбамоїл)-4-метокси-L-пролін-N,N-диметиламіду і
(4R)-1-(4-(10,11-дигідро-5Н-піроло[2,1-с](1,4)бензодіазепін-10-ілкарбоніл)-2-метилбензилкарбамоїл)-4-метокси-L-пролін-N,N-диметилтіоаміду.
32. Сполука згідно з пунктом 1 або її таутомер, або фармацевтично прийнятна сіль, яку вибирають з:
1-(2-метил-4-(2,3,4,5-тетрагідро-1-бензазепін-1-ілкарбоніл)бензилкарбамоїл)-L-пролін-N,N-диметиламіду і
(4R)-4-гідрокси-1-(2-метил-4-(2,3,4,5-тетрагідро-1-бензазепін-1-ілкарбоніл)бензилкарбамоїл)-L-пролін-N,N-диметиламіду.
33. Сполука згідно з будь-яким з пунктів 1-32 або її фармацевтично прийнятна сіль як компонент фармацевтичної композиції.
34. Сполука згідно з будь-яким з пунктів 1-32 або її фармацевтично прийнятна сіль як терапевтичний агент для лікування нічного енурезу, ноктурії, поліурії в наслідок центрального нецукрового діабету, нетримання сечі або кровотеч.
35. Фармацевтична композиція, яка містить як активний агент сполуку згідно з будь-яким з пунктів 1-32.
36. Фармацевтична композиція згідно з пунктом 35, яка використовується для лікування поліурії.
37. Фармацевтична композиція згідно з пунктом 35, яка використовується для контролювання нетримання сечі.
38. Фармацевтична композиція згідно з пунктом 37, яка використовується для відстрочки спорожнення.
39 Фармацевтична композиція згідно з пунктом 35, яка використовується для лікування кровотеч.
40. Спосіб лікування нічного енурезу, ноктурії і нецукрового діабету, який полягає у введенні особі, яка потребує такого лікування, ефективної кількості композиції згідно з пунктом 35.
41. Спосіб контролювання нетримання сечі, який полягає у введенні особі, яка потребує такого лікування, ефективної кількості композиції згідно з пунктом 35.
42. Спосіб контролювання нетримання сечі згідно з пунктом 41, наслідком якого є відстрочка спорожнення.
43. Спосіб лікування кровотеч, який полягає у введенні особі, яка потребує такого лікування, ефективної кількості композиції згідно з пунктом 35.
Текст
Представлений винахід стосується нового класу хімічних сполук, які проявляють активність агоністів пептидного гормону-вазопресину. Вони зменшують виділення сучі нирками і тому є корисними при лікуванні деяких захворювань людей, що характеризуються поліурією. Вони також є корисними при контролюванні нетримання сечі і захворювань, що супроводжуються кровотечею. Вазопресин є пептидним гормоном, що секретується задньою долею гіпофізу. Він діє на нирки підвищуючи утримування води і таким чином зменшує виділення сечі. З цієї причини, вазопресин також відомий під назвою "антидіуретичний гормон". Він також діє на судини, викликаючи гіпертензивну дію. Описані клітинні рецептори, що опосередковують ці дві дії, і показано, що вони різні. Антидіуретична дія опосередкована рецептором вазопресину типу-2, за зазвичай називають рецептор V2. Агенти, що можуть взаємодіяти з рецептором V2 і активувати його тим же самим шляхом що і вазопресин, називаються агоністами V2 рецептору (або простіше агоністи V2). Такі агенти також будуть мати антидіуретичну дію. Якщо ці агенти селективно взаємодіють з V2 рецептором і не взаємодіють з іншими підтипами рецепторів вазопресину, тоді вони не будуть мати гіпертензивної дії вазопресину. Це важливо з точки зору безпеки і виготовлення таких агентів, що привабливі для лікування захворювань у людей, що характеризуються поліурією (які тут використовується і означає надмірне продукування сечі). На справді, такі агенти вже використовуються у лікуванні людей. Десмопресин (або ж [1-дезаміно, ОАrg8]вазопресин, Minirin™, DDAVP™, Octostim™) є пептидиним аналогами вазопресину, який є селективними агоністом V2 рецептору. Він використовується при лікуванні центрального нецукрового діабету, який є станом обумовленим недостатнім продукуванням вазопресину. Він також використовується для контролювання нічного енурезу і також може використовуватись для контролювання нуктурії. Однак, демсмопресин не є ідеальним агентом у всіх відношеннях. Навіть найбільш сучасний синтез агенту є досить довгим, і десмопресин не може бути очищений з використанням загальновідомих методик очищення, такої як кристалізація. Відповідно, десмопресин є відносно дорогим. Він має досить малу біодоступність і це є непостійним його параметром. Взагалі, селективний агоніст V2 рецептору вазопресину повинен легко одержуватись і очищатись і повинен мати високу і передбачувану біодоступність. Такі властивості є найбільш придатними для одержуваних непептдиних сполук. Приклади таких сполук описані Огава та ін., в міжнародній заявці на патент PCT/JP96/03652 (WO97/22591), Фаіллі та ін., в PCT/US98/15487 (W099/06403), PCT/US00/00885 (WO00/46224), і PCT/US00/00358 (WO00/46227), Дусца та ін. в PCT/US98/15495 (WO99/06409), і Стеффан та Фаіллі в PCT/US00/00886 (WO00/46225), і PCT/US00/00658 (WO00/46228). Однак сполуки описані в цих документах не є ідеальними кандидатами в лікарські засоби. Наприклад, деякі мають тільки помірну селективність до V2 рецептору і більшість має тільки дуже обмежену оральну біодоступність, імовірно, тому, що вони мають незадовільну розчинність у водному середовищі. Представлений винахід стосується сполук, що мають кращу комбінацію властивостей. Антидіуретична дія десмопресину призводить до зменшення осмотичності крові, і він показав корисність при лікуванні і профілактиці сервповидноклітинного захворювання. Крім того, завдяки його антидіуретичній дії, десмопресин використовується для підвищення концентрації в крові коуголяційних протеїнів відомих як Фактор VIII і фактор вон Віллебранда. В клінічному контексті, це робить десмопресин корисним при лікуванні гемофілії А і хвороби вон Віллебранда. Також було показано, що десмопресин діє на центральну нервову систему. Наприклад, було відзначено ефективність при лікуванні хвороби Тоуретта і корисність при терапії кокаїнової залежності. Подібне використання було відкрито і для непептидних агоністів представленого винаходу. Представлений винахід стосується ряду сполук загальних формул 1 і 2, і їх солей і таутомеріє, що є непептидними агоністами вазопресину і які є селективними для підтипу V2 рецептору. в яких: W є або N, або C-R4; R1-R4 незалежно вибирають з Н, F, СІ, Вr, алкілу, CF3, фенілу, ОН, О-алкілу, NH2, NH-алкілу, N(алкіл)2, NO2 і CN, або R2 і R3 разом можуть бути-СН=СН-СН=СН-; G1 є біциклічним або трициклічним конденсованим похідним азепіну, що вибирають з формул 3-8, в яких А1, А4, А7 і А10 кожен, незалежно, вибирають з СН2, О і NR5; А2, А3, А9, А11, А13, А14 і А15 кожен, незалежно, вибирають з СН і N; або А5 є ковалентним зв'язком і А6 є S, або А5 є N=CH і А6 є ковалентним зв'язком; А8 і А12 кожен, незалежно, вибирають з NH, N-CH3 і S; А16 і А17 обидва є СН2, або один з А16 і А17 є СН2 і інший вибирають з СН(ОН), CF2, О, SOa і NR5; R5 вибирають з Н, алкілу і (CH2)bR6; R6 вибирають з фенілу, піридилу, ОН, О-алкілу, NH2, NH-алкілу, N(алкіл)2, NO2, СО2Н і CN; а є 0, 1 або 2; b є 1, 2, 3 або 4; Y є СН або N; Z є СН=СН або S; і G2 є групою, що вибирають з загальних формул 9-11, в яких Аr вибирають з фенілу, піридилу, нафтилу і моно-або полізаміщеного фенілу або піридилу, в яких замісники вибирають з F, СІ, Вr, алкілу, ОН, О-алкілу, NH2, NH-алкілу, N(алкіл)2, NO2 і CN; D є ковалентним зв'язком або NH; Е1 і Е2 обидва Н, ОМе або F, або один з Е1 і Е2 є ОН, О-алкілом, OBn, OPh, OAc, F, СІ, Br, N3, NH2, NHBn або NHAc і інший є Н, або Е1 і Е2 разом є =O,-О(СН2)9О-або-S(CH2)gS-; F1 і F2 обидва Н, або разом є =O або =S; L вибирають з ОН, О-алкілу, NH2, NH-алкілу і NR9R10; R7 вибирають з Н, алкілу, алкенілу і COR8; R8 вибирають з ОН, О-алкілу, NH2, NH-алкілу, N(aлкiл)2, піролідинілу і піперидинілу; R9 і R10 обидва алкіли, або разом є-(CH2)h-або-(СН2)2О(СН2)2-; V є О, N-CN або S; с є 0 або 1; d є 0 або 1; e є 0 або 1; f є 0, 1, 2, 3 або 4; g є 2 або 3; і h є 3, 4 або 5, при умові, що d і e не є обидва 0. Винахід в подальшому стосується фармацевтичних композицій, що містять агоністи вазопресину, які особливо корисні при лікуванні центрального нецукрового діабету, нічного енурезу і нуктурії. В першому аспекті, представлений винахід стосується нових похідних 4-(амінометил)бензаміду і 6(амінометил)нікотинаміду загальних формул 1 і 2. В загальній формулі 1, W означає або атом азоту (N) або заміщений атом вуглецю (C-R4). Замісники R1-R4 кожен, незалежно, вибирають з водню (Н), фтору (F), хлору (СІ) і брому (Вr), і алкілу, трифторметилу (CF3), фенілу (Ph), гідроксилу (ОН), алкокси (О-алкіл), первинного аміно (NH2), моноалкіламіно (NH-алкіл), діалкіламіно (N(алкіл)2), нітро (NO2) і ціано (CN) груп. Альтернативно, R2 і R3 разом можуть бути-СН=СН СН=СН-, так що разом з кільцем до якого вони приєднані, вони утворюють нафталін, ізохінолін або ізохінолін3-он конденсовану кільцеву систему. Відмінності між двома загальними формулами приведенми вище будуть зрозумілі, коли розглянути сполуку формули 1, в якій W є азотом і R1 є гідроксилом. Утворюваний 2гідроксипіридин також може існувати як його 2-піридоновий таутомер. В цій таутомерній формі атом азоту здатен нести замісник еквівалентний R4, і такі сполуки представлені загальною формулою 2. Група G1 є біциклічним або трициклічним конденсованим похідним азепіну, що вибирають з формул 3-8. Вона приєднана до карбонільної групи основної молекули (1 або 2) через атом азоту азепінового кільця всіх формул 3-8, так що утворюється амідний зв'язок. В цих формулах, А1, А4, А7 і А10 кожен представляє атом кисню (-О-) або метилен (-СН2-) або заміщену іміно (-NR5-) групу. А2, А3, А9, А11, А13, А14 і А15 кожен представляє метинову групу (=СН-) або атом азоту (=N-). Коли в кожній групі зустрічається два або більша кількість цих замісників, кожен, незалежно, є іншим. Таким чином, наприклад, у формулі 3, А2 і А3 можуть обидва бути азотом, обидва метином, або один може бути метином і інший азотом. А5 і А6 вибрані разом, так що або А5 є ковалентним зв'язком і А6 є атомом сірки (-S-), утворюючи тіофенове кільце, або А5 є групою-N=CH-і А6 є ковалентним зв'язком утворюючи піридинове кільце. А8 і А12 кожен представляє іміногрупу (-NH-), N-метиліміно групу (-NCH3-) або атомом сірки (-S-). А16 і А17 можуть обидва представляти метиленову групу (-СН2-) або один з А16 і А17 може представляти метиленову групу, в той час як інший представляє гідроксиметиленову групу (-СН(ОН)-), дифторметиленову групу (-CF2-), заміщену іміногрупу (-NR5-), атом кисню (-О-), або, необов'язково, окислений атом сірки (-SOa-), де а є нулем, 1 або 2. Група R5 представляє атом водню (Н), алкільну групу або групу-(CH2)bR6, де b є 1, 2, 3 або 4. Група R6 представляє групу, що вибирають з фенілу, піридилу, гідрокси (-ОН), алкокси (-О-алкіл), первинного аміно (NH2), моно-і діалкіламіно (-NH-алкіл і N(алкіл)2), нітро (-NO2), карбокси (-СО2Н) і ціано (-CN) груп. Y представляє або метинову групу (=СН-), або атом азоту (=N-). Z представляє або атомом сірки (-S-), або групу-СН=СН-. Групу G вибирають з загальних формул 9-11. В цих формулах, V представляє дивалентний залишок, що вибирають з атомів кисню (=O) і сірки (=S) і ціанідину (=N-CN). В загальній формулі 9, Аr представляє ароматичну групу, що вибирають з фенілу, піридилу, нафтилу і моно-або полізаміщеного фенілу і піридилу, де замісники вибирають з фтору (F), хлору (СІ) і брому (Вr) і алкілу, гідрокси (-OН), алкокси (-О-алкіл), первинного аміно (-NH2), моно-і діалкіламіно (-NH-алкіл і N(алкіл)2), нітро (-NO2), карбокси (-СО2Н) і ціано (-CN) груп. Значення с, d і є незалежно нуль або 1, при умові що d і e не є обидва нулем. В загальній формулі 10, D представляє ковалентний зв'язок або іміногрупу (-NH-). Група R7 представляє атом водню (Н), алкільну або алкенільну групу, або групу-COR8, в якій R8 представляє гідрокси (-ОН), алкокси (-О-алкіл), первинний амін (-NH2) або моно-або діалкіламіно (-NH-алкіл і N(алкіл)2) групу, або циклічну аміно групу, що вибирають з піролідинілу (-N(CH2)4) і піперидинілу (-N(CH2)5). Значенням f є нулем, 1, 2, 3 або 4. В загальній формулі 11, Е1 і Е2 представляє або два моновалентні атоми або групи, які можуть бути однаковими або різними, або разом вони представляють дивалентний атом або групу. Коли Е1 і Е2 представляють моновалентні атоми або групи, вони можуть обидва одночасно бути воднем (Н) або фтором (F) або метокси (-ОМе) групами, або один може бути фтором (F), хлором (СІ) або бромом (Вr), або гідрокси (ОН), алкокси (-О-алкіл), бензилокси (-ОВn), фенокси (-OPh), ацетокси (-ОАс), азидо (-N3), первинним аміно (NH2), бензиламіно (-NHBn) або ацетамідо (-NHAc) групою і інший є атомом водню (Н). Коли Е1 і Е2 разом представляють дивалетний атом або групу, вони можуть бути атомом кисню (=O) або a,w-діокса-або дитіаполіметиленовою групою (-О(СН2)9О-або-S(CH2)gS-), в яких значення g є або 2 або 3. F1 і F2 можуть обидва представляти атом водню (Н). Альтернативно, вони можуть разом представляти атом кисню (=O) або сірки (=S). L представляє групу, що вибирають з гідрокси (-OН), алкокси (-О-алкіл), первинного аміно (-NH2) і моноалкіламіно (-NH-алкіл) груп і-NR9R10, де або R9 і R10 кожен представляє алкільну групу, які можуть бути однаковими або різними, або разом вони представляють поліметиленову групу (-(CH2)h), в якій h може бути 3, 4 або 5, або-(СН2)2О(СН2)2-. Як тут використовується, термін "алкіл" включає насичені вуглеводневі радикали, включаючи лінійні, розгалужені і циклічні групи, що містять до шести атомів вуглецю. Прикладами алкільних груп є, але не обмежується, метил, етил, пропіл, ізопропіл, н-бутил, втор-бутил, ізобутил, трет-бутил, неопентил і циклогексил. Термін "алкеніл" включає моно-ненасичені вуглеводневі залишки, включаючи лінійні, розгалужені і циклічні групи, що містять від двох до шести атомів вуглецю. Прикладами алкенільних груп є, але не обмежується, вініл, 1-пропеніл, аліл, 2-метил-2-пропеніл, 2-бутеніл, 3-циклопентеніл і 2,3-диметил-2-бутеніл. Деякі сполуки в межах представленого винаходу можуть існувати у вигляді таутомерів. Наприклад, коли W є азотом і R1 або R2 є гідрокси групою, або коли Аr є піридилом заміщеним гідрокси групою, одержаний гідроксипіридин може існувати у вигляді піридонового таутомеру. Всі такі таутомери розглядаються в межах представленого винаходу. Деякі сполуки загальної формули 1 здатні утворювати солі з кислотами або основами. Наприклад, сполуки, що містять один або більшу кількість основних атомів азоту можуть утворювати адитивні солі з мінеральними і органічними кислотами, такими як хлорводнева кислота, сірчана кислота, фосфорна кислота, оцтова кислота, трифтороцтова кислота, метансульфонова кислота, лимонна кислота і бензойна кислота. Сполуки, що містять кислотні групи, можуть утворювати солі з основами. Прикладами таких солей є натрієві, калієві, кальцієві, триетиламонієві і тетраетиламонієві солі. Крім того, сполуки, що мають кислотні і основні групи, можуть утворювати внутрішні солі (цвітеріони). Остільки оскільки ці солі є фармацевтично прийнятними, вони включені в межі винаходу. Переважним втіленням винаходу є сполука загальної формули 1. Більш переважно є сполука загальної формули 1, в якій W є C-R4. Навіть більш переважно є така сполука, в якій, принаймні, один з R1-R4 є іншим ніж водень. Найбільш переважно є сполука, в якій один з R1-R4 є метилом, хлором або фтором і інші три є воднями. Іншим переважним втіленням винаходу є сполука загальної формули 2. Більш переважно є сполука загальної формули 2, в якій R2 і R3 обидва водні. Іншим переважним втіленням винаходу є сполука загальних формул 1 або 2, в яких G1 є будь-якою з груп загальних формул 3-7. Більш переважно є сполука, в якій Y є СН. Навіть більш переважно є сполука, в якій Z є-СН = СН-, так що утворюється бензольне кільце. Альтернативно, Z може бути S, утворюючи тіофенове кільце. Коли Y є N, це особливо переважно, що Z буде-СН=СН-, утворюючи піридинове кільце. В межах згаданого вище переважного втілення, більш переважними сполуками є такі, в яких G1 є групою загальною формулою 3, особливо такі, в яких А1 є СН2 і обидва А2 і А3 є СН, і сполуки, в яких G1 є групою загальної формули 6, особливо такі, в яких А11 є СН i A12 є S. Іншим переважним втіленням винаходу є сполука загальних формул 1 або 2, в яких G1 є групою загальної формули 8. Більш переважно є сполука, в якій один з А16 і А17 є СН2. Навіть більш переважно є сполука, в якій обидва А16 і А17 є СН2. Іншим переважним втіленням винаходу є сполука загальних формул 1 або 2, в яких G2 є групою загальної формули 9. Більш переважно є такі сполуки, в яких Ar є моно-або полізаміщеним фенілом. Навіть більш переважно є фенільними групами з, принаймні, двома замісниками-галогенами (фтор або хлор). Найбільш переважно, Ar є 2,6-дифторфенілом. Іншим переважним втіленням винаходу є сполука загальних формул 1 або 2, в яких G2 є групою загальної формули 10. Більш переважно є такі сполуки, в яких R7 є COR8. Найбільш переважними є такі сполуки, в яких R8 є N(алкіл)2. Іншим переважним втіленням винаходу є сполука загальної формули 1 або 2, в яких G2 є групою загальної формули 11. Більш переважно є такі сполуки, в яких F1 і F2 разом є =O. Також переважно є такі сполуки, в яких обидва Е1 і Е2 є Н, або один є Н і інший є О-алкілом. Для цих сполук, в яких один з Е1 і Е2 є Н і інший є Оалкілом, переважно, що СЕ1Е2 група має R конфігурацію. В подальшому переважному втіленні, суміжний з атомом азоту центр буде мати S конфігурацію. Ці конфігурації показані нижче. Об'єм, що характеризується згаданими вище переважними втіленнями, незалежить один від одного, і вони можуть комбінуватись у втіленнях, що є більш переважними. Таким чином, особливо переважними втіленнями винаходу є такі сполуки, що об'єднують переважні варіанти для W i R1-R4 з переважними варіантами для G1 і G2. Найбільш переважним втіленням винаходу є сполука, що вибирають з наступного переліку. 1-(4-[3-(2-Хлор-6-фторфеніл)уреїдометил]-3-метилбензоїл)-2,3,4,5-тетрагідро-1Н-1-бензазепін 1-(4-[3-(2,6-Дифторфеніл)уреїдометил]-3-метилбензоїл)-5-(3-піридил)метил-2,3,4,5-тетрагідро-1Н-1,5бензодіазепін 1-(3-Хлор-4-[3-(2-хлор-6-фторфеніл)уреїдометил]бензоїл)-5-етил-2,3,4,5-тетрагідро-1Н-1,5-бензодіазепін 4-(3-Хлор-4-[3-(2,6-дифторфеніл)уреїдометил]бензоїл)-5,6,7,8-тетрагідротієно[3,2-b]азепін 1-(3-Хлор-4-(3-(метилоксикарбоніл)пропаноїламінометил)бензоїл)-2,3,4,5-тетрагідро-1-бензазепін 1-(2-Метил-4-(5-(3-піридилметил)-2,3,4,5-тетрагідро-1,5-бензодіазепін-1-ілкарбоніл)бензил)-3(метилоксикарбонілметил)сечовина 1-(2-Метил-4-(2,3,4,5-тетрагідро-1-бензазепін-1-iлкарбоніл)бензилкарбамоїл)-L-пролін-N,N-диметиламід (4R)-4-Гідрокси-1-(2-метил-4-(2,3,4,5-тетрагідро-1-бензазепін-1-ілкарбоніл)бензил-карбамоїл)-L-пролінN,N-диметиламід (4R)-1-(3-Хлор-4-(2,3,4,5-тетрагідро-1-бензазепін-1-ілкарбоніл)бензилкарбамоїл)-4-метокси-L-пролiн-N,Nдиметиламід (4R)-1-(2-Хлор-4-(2,3,4,5-тетрагідро-1-бензазепін-1-ілкарбоніл)бензилкарбамоїл)-4-метокси-L-пролін-N,Nдиметиламід (4R)-4-Бензилокси-1-(2-метил-4-(2,3,4,5-тетрагідро-1-бензазепін-1-ілкарбоніл)-бeнзилкapбaмoїл)-L-пpoлiнN,N-димeтилaмiд (4R)-4-Метокси-1-(2-метил-4-(2,3,4,5-тетрагідро-1-бензазепін-1-ілкарбоніл)бензил-карбамоїл)-L-пролiнN,N-диметиламід (4R)-4-Метокси-1-(3-метил-4-(2,3,4,5-тетрагідро-1-бензазепін-1-ілкарбоніл)бензил-карбамоїл)-L-пролінN,N-диметиламід (4R)-1-(2-Хлор-4-(5,6,7,8-тетрагідро-4Н-тієно[3,2-b]азепін-4-ілкарбоніл)бензил-карбамоїл)-4-метокси-Lпролін-N,N-диметиламід (4R)-1-(4-(10,11-Дигідро-5Н-піроло[2,1-с](1,4)бензодіазепін-10-ілкарбоніл)-2-метил-бензилкарбамоїл)-4метокси-L-пролін-N,N-диметиламід (4R)-1-(2-Хлор-4-(10,11-Дигідро-5Н-піроло[2,1-с](1,4)бензодіазепін-10-ілкарбоніл)-бензилкарбамоїл)-4метокси-L-пролін-N,N-диметиламід (4R)-1-(4-(10,11-Дигідро-5Н-піроло[2,1-с](1,4)бензодіазепін-10-ілкарбоніл)-2-метил-бензилкарбамоїл)-4метокси-L-пролін-N,N-диметилтіоамід Серед цих згаданих вище сполук, 1-(2-метил-4-(2,3,4,5-тетрагідро-1-бензазепін-1ілкарбоніл)бензилкарбамоїл)-L-пролін-N,N-диметиламід і (4R)-4-гідрокси-1-(2-метил-4-(2,3,4,5-тетрагідро-1бензазепін-1-ілкарбоніл)бензилкарбамоїл)-L-пролін-N,N-диметиламід показали оптимальну рівновагу властивостей. Представлений винахід в подальшому стосується фрамацевтичних композицій, що містять, принаймні, одну сполуку, що були описані вище як активний компонент. Композиція також може містити другий фармакологічний агент, такий як спазмолітичний агент або блокатор кальцієвих каналів, ці агенти відомі в цій галузі і використовуються для зменшення розладів міхура. Переважно, композиція містить тільки один активний компонент. Композиція буде містити екципієнти, що вибирають з зв'язуючих агентів, агентів, що збільшують об'єм, диспергатори, розчинники, стабілізатори і їм подібні, такі екципієнти відомі в цій галузі. Вибір екципієнта буде залежати від плануємої природи рецептури, яка буде, по черзі, залежати від плануємого шляху введення. Введення може бути оральним, трансмукозальним (таким як сублінгвальне, букальне, інтраназальне, вагінальне і ректальне), трансдермальним або за допомогою ін'єкції (такої як підшкірної, внутрішньом'язової і внутрішньовенної). Оральне введення є особливо переважним. Для орального введення, рецептура буде мати вигляд таблетки або капсули. Іншими рецептурами є сухі порошки, розчини, суспензії, супозиторії і їм подібні. В наступному аспекті, винаходом є спосіб лікування або контролювання фізіологічних розладів у людини. Цей спосіб включає введення особі, що потребує такого лікування ефективної кількості фармацевтичної композиції, де композиція як активний компонент містить сполуку, що була описана вище. Сполуки зменшують виділення сечі і тому спосіб винаходу використовується при всіх станах, в яких підвищення виділення сечі є супроводжуючим фактором. Сполуки також підвищують продукування протеїнів згортання крові, відомих як Фактор VIII і фактор вон Віллебранда, і так можуть бути використані при лікуванні кровотеч. В переважному втіленні, станом, що може лікуватись, є центральний нецукровий діабет. Це є стан, що викликаний нездатністю тіла продукувати і секретувати фізіологічноактивний вазопресин, в наслідок чого значно зменшується повторне поглинання води і продукуються великі об'єми сечі. В іншому переважному втіленні, станом, що лікується, є нічний енурез. Цей стан характеризується спорожнюванням міхура, в той час як особа спить. Це стан, що головним чином проявляється у дітей і ряд факторів може бути втягнутий у його етіологію. В іншому переважному втіленні, станом, що лікується, є нуктурія. Цей стан характеризується продукуванням достатньої кількості сечовини протягом ночі, що потрібна особі для пробудження і спорожнення ним (або нею) міхура. Знову, цей стан може бути наслідком ряду факторів. В іншому переважному втіленні, станом, що лікується, є нетримання. Цей стан характеризується, частково, зменшенням ємності міхура і контролю, так що мимовільно відбувається сечовипускання, так що міхур часто спорожнюється. Нетримання розділяється на два підтипи, нетримання в наслідок стресу і позивне нетримання. Як припускають в це втягнуто ряд етіологічних факторів. Лікування згідно з винаходом є особливо корисним для затримування потреби у спорожненні міхура ("відстрочка спорожнювання ") для того, щоб дати особі, що страждає нетриманням, декілька годин без спорожнювання (наприклад, до чотирьох годин). Така відстрочка спорожнювання також може бути корисна і для осіб, що не страждають нетриманням, наприклад, людей змушених залишатись на мітингах довгий час. В іншому переважному втіленні, станом, що лікується, є гемофілія А або хвороба вон Віллебранда. Це стан, який характеризується низьким продукуванням Фактору VIII або фактору вон Віллебранда і особа страждає від тривалої кровотечі. В іншому переважному втіленні, композиція вводиться перед хірургічним втручанням (включаючи зубну хірургію) для підвищення коагуляційної здатності крові і як наслідок зменшення часу післяоперативної втрати крові. Введення композицій представленого винаходу зазвичай здійснюється під наглядом лікаря. Лікар визначить кількість композиції: що буде вводитись і графік введення, беручи до уваги фізичний стан пацієнту і терапевтичні цілі. Для повнолітніх пацієнтів з нецукровим діабетом, типова доза може знаходитись в інтервалі від 50мг до 1г активної сполуки на день, що вводиться у вигляді від однієї таблетки до чотирьох таблеток на день. Для шляхів введення, що є іншими ніж оральний шлях, кількість сполуки буде зменшуватись, коли неоральні шляхи мають тенденцію до більш ефективних значень вивільнення терапевтичних агентів в системну циркуляцію. Для лікування хвороби вон Віллебранда і гемофілії А, кількість сполуки може бути більшою ніж для лікування нецукрового діабету. Сполуки представленого винаходу можна одержати використовуючи загальновідомі методики. Сполуки загальних формул 1 і 2 можна розглядати як комбінацію трьох зв'язаних фрагментів, G1, G2 і центральний ароматичний замісник (який в подальшому тут буде позначений як "ядро"). Реагенти, що відповідають трьом фрагментам, будуть одержуватись окремо і потім об'єднуватись на наступних стадіях синтезу. Деякі окремі приклади різних груп і замісників можуть бути несумісні з цими перетвореннями і тому будуть потребувати використання захисних груп. Використання таких захисних груп добре відоме в цій галузі (дивись наприклад "Захисні групи в органічному синтезі", T.W. Greene, Wiley-lnterscience, 1981). Особливо групами, що можуть потребувати захисту є аміни (після захищення аміди або карбамати), спирти (після захищення естери або етери) і карбонові кислоти (після захищення естери). Для цілей цього опису, будуть прийнятні, такі захисні групи, що є необхідні в цьому місці. Три фрагменти можна об'єднати у дві стадії одержуючи сполуки формул1 і 2. По перше, фрагменти, що відповідають, G1 і ядру зв'язують разом одержуючи фрагмент, що відповідає, ядро-G1, який потім об'єднують з фрагментом G2. По друге, фрагменти, що відповідають, ядру і G2 зв'язують одержуючи фрагмент, що відповідає, С2-ядро, який потім об'єднують з фрагментом G1. Хімія процесів, що включає конденсування фрагменту G1 з фрагментом ядра і конденсування фрагменту ядра з фрагментом G2, буде однаковою, стратегія якого приведена далі. Утворення фрагменту ядро-G1 Синтез цього фрагменту потребує утворення амідного зв'язку між двома замісниками. Реакції цього типу добре відомі в цій галузі. Найбільш легко, хлорид кислоти, відповідного фрагменту ядра, можна піддати реакції з вільною групою вторинного аміну G1 азепінового кільця. Таку реакцію зазвичай проводять в апротонному розчиннику, такому як дихлорметан або диметилформамід при кімнатній температурі або трохи нижчій за кімнатну. Як правило додають третинний амін, такий як триетиламін або диметиламінопіридин. Альтернативно, карбонову кислоту відповідного фрагменту ядра можна сконденсувати з вторинним аміном використовуючи один з багатьох реагентів, що використовуються для утворення амідного зв'язку і відомих в хімії пептидів. Прикладами таких реагентів є DCC (дициклогексилкарбодіімід), ВОР (гексафторфосфат (бензтриазол-1-ілокси)тріс(диметиламіно)фосфонію), РуВОР® (гексафторфосфат (бензтриазол-1ілокси)трипіролідинофосфонію), РуВrоР® (гексафторфосфат бромтрипіролідинофосфонію) і HBTU (гексафторфосфат O-(бензтриазол-1-іл)-N,N,N',N'-тетраметилуронію). Також відомі інші реагенти. Деталі методу синтезу будуть залежати від вибору реагенту, але зазвичай реакцію проводять в апротонному розчиннику і в присутності основи-третинного аміну, як описано вище. Або реагент додають до суміші карбонової кислоти і азепіну, або карбонову кислоту і реагент змішують з утворенням активної проміжної сполуки (яку не виділяють) і до якої додають азепін. Утворення фрагменту G2-ядро В залежності від природи G2, зв'язок G2-ядро може бути частиною аміду або тіоаміду, сульфонаміду, сечовини або тіосечовини, сульфонілсечовини або сульфонілтіосечовини, або ціаноамідину, ціаногуанідину або сульфонілціаногуанідину. Хімія утворення зв'язку G2-ядро буде відрізнятись в залежності від групи, що утворюється. (і.а) Аміди {G2=10, D=ковалентний зв'язок, V=O} Ці сполуки можна одержати за допомогою реакції карбонової кислоти або хлориду кислоту відповідного фрагменту G2 з первинним аміном фрагменту ядра. Умови реакції зазвичай подібні до описаних для утворення зв'язку ядро-G1, за винятком того, що первинний амін є більш реакційноздатним ніж атом азоту азепіну і для проведення реакції може знадобитися нижча температура і менший проміжок часу. (і.б) Тіоаміди {G2=10, D=ковалентний зв'язок, V=S} Ці сполуки можна одержати за допомогою реакції придатного тіокарбонілу, такого як дитіоестер (RCS2R') з первинним аміном за способом аналогічним описаному для відповідних амідів, вище. Альтернативно, їх можна одержати з відповідних амідів (V=О) за допомогою реакції з реагентом Лавессона. (іі) Сульфонаміди {G2=9, d=1, е=нуль} Ці сполуки зазвичай одержують за допомогою реакції сульфонілхлориду відповідного фрагменту G2 з первинним аміном фрагменту ядра. Реакцію зазвичай проводять за умов, що подібні описаним вище для реакції хлориду карбонової кислоти з первинним аміном, що дає аміди. (ііі.а) Сечовини {G2=9, d=нуль, е=1, V=О; G2=10, D=NH, V=О; G2=11, V=О} Ці сполуки можна одержати за допомогою реакції аміну з ізоціанатом або його еквівалентом. В наслідок симетричності сечовини, можливо вибрати, який компонент взаємодіє як амін і який як ізоціанат. Більш просто, коли G2 є групою 9 або 10, відповідний ізоціанат є легко доступним. Він може легко реагувати з первинним аміном фрагменту ядра в апротонному розчиннику без присутності додаткових реагентів. Коли G2 є групою 11, ізоціанат не є доступним, і замість нього можна використати карбамоїлхлорид. Карбамоїлхлорид зазвичай одержують безпосередньо перед використанням, обробляючи відповідний воринний амін фосгеном або еквівалентним реагентом, таким як дифоген або трифоген. Альтернативно, використання карбонілдіімідазолу призводить до утворення похідного карбамоїлімідазолу, що можна використовувати замість карбамоїлхлориду. Реакцію карбамоїлхлориду з первинним аміном зазвичай потребує додавання третинного аміну, як основи, для нейтралізації хлориду водню, що утворюється. В деяких випадках, може буту краще обробити первинний амін відповідного фрагменту ядра фосфегеном (або карбонілдіімідазолом) з утворенням ізоціанату, що може надалі реагувати з первинним або вторинним аміном відповідного G2 фрагменту. (ііі.б) Тіосечовини {G2=9, d=нуль, е=1, V=S; G2=10, D=NH, V=S; G2=11, V=S} Ці сполуки можна одержати за методиками аналогічними описаним вище для сечовин, просто використовуючи відповідні ізотіоціанати і тіофосген. (iv.a) Сульфонілсечовини{G2=9, d=1, e=1, V=O} Ці сполуки можна одержати за допомогою реакції первинного аміну відповідного фрагменту ядра з прийнятним сульфонілізоціанатом. Умови реакції є подібними описаним вище для реакції аміну з ізоціанатом з утворенням сечовин. (iv.б) Сульфонілтіосечовини{G2=9, d=1, e=1, V=S} Ці сполуки можна одержати аналогічно одержанню сульфонілсечовин шляхом реакції первинного аміну відповідного фрагменту ядра з прийнятним сульфонілізотіоціанатом. (v.а) Ціаноамідини {G2=10, D=ковалентний зв'язок, V=N-CN} Ці сполуки можна одержати за допомогою реакції первинного аміну фрагменту ядра з N-ціанотіоамідом або N-ціанотіоімідатом відповідного G2 фрагменту. (v.6) Ціаногуанідини {G2=9, d=нуль, e=1, V=N-CN; G2=10, D=NH, V=N-CN; G2=11, V=N-CN} Ці сполуки можна одержати за допомогою реакції первинного аміну фрагменту ядра з ціанотіосечовиною відповідного G2 фрагменту в присутності карбодііміду. (v.в) Сульфонілціаногуанідини {G2=9, d=1, e=1, V=N-CN} Ці сполуки можна одержати за аналогічною методикою використовуючи реакцію первинного аміну фрагменту ядра з N-сульфоніл-N'-ціанотіосечовиною відповідного G2 фрагменту в присутності карбодііміду. Реагенти відповідних фрагментів є комерційно доступними, або їх можна легуо одержати за методиками описаними в літературі. Серед особливо релевантних посилань слід згадати наступні. Синтез похідних конденсованих азепінів для G1: Aranapakam et аі, Bioorg. Med. Chem. Lett. 1993, 1733; Artico et al., Farmaco. Ed. Sei. 24,1969, 276; Artico et al., Farmaco. Ed. Sei. 32, 1977, 339; Chakrabarti et al., J. Med. Chem. 23, 1980, 878; Chakrabarti et al., J. Med. Chem. 23, 1980, 884; Chakrabarti et al., J. Med. Chem. 32, 1989, 2573; Chimirri et al., Heterocycles 36, 1993, 601; Grunewald et al., J. Med. Chem. 39, 1996, 3539; Klunder et al., J. Med. Chem. 35, 1992, 1887; Liegeois et al., J. Med. Chem. 37, 1994, 519; Olagbemiro et al., J. Met. Chem. 19, 1982, 1501; Wright et al., J. Med. Chem. 23, 1980, 462; Yamamoto et al., Tet. Lett. 24, 1983, 4711; і Міжнародна заявка на патент, номер публікації WO99/06403. Синтез амідин передаючого реагенту для G2, V=N-CN Mestres etal., Synthesis, 1980, 755; Petersen etal., J. Med. Chem. 21, 1978, 773; і Cord, J. Chem. Soc, 1948, 1620. Синтез похідних проліну для G2=група 11 Dugave etal., Tet. Lett. 39, 1998, 1169; Petrillo et a/., J. Med. Chem. 31, 1988, 1148; і Smith etal., J. Med. Chem. 31,1988, 875. Приведені вище загальні методики проілюстровані нижче рядом необмежуючих прикладів. ПРИКЛАДИ Скорочення Були використані наступні скорочення. AIBN ВОС (ВОС)2О ДМФА ЕtOАс ІРА MC NBS Азо-біс-(ізобутиронітрил) трет-Бутилоксикарбоніл Ди-трет-бутил дикарбонат Диметилформамід Етилацетат Ізопропанол Масспектрометрія N-Бромсукцинімід петролейний ефір, фракція, що кипить пет. ефір при 60-80°С ТГФ Тетрагідрофуран ВРКДІ Водорозчинний карбодіімід Одержання проміжних сполук Реагенти відповідних фрагментів G1 і G2 одержували з комерційних джерел або одержували згідно з приведеними методиками, за винятком деталей окремих Прикладів. Реагенти відповідного фрагменту ядра одержували як показано нижче. Приклад А 4-(трет-Бутилоксикарбоніламінометил)-3-хлорбензойна кислота А1. Метил 4-бромметил-3-хлорбензоат До розчину метил 3-хлор-4-метилбензоату (5,0г, 27,1ммоль) в тетрахлориді вуглецю (50мл) додавали NBS (5,8г, 32,0ммоль) і AIBN (0,442г, 2,70ммоль). Суміш перемішували при температурі кипіння протягом 18г. Суміш залишали охолоджуватись до кімнатної температури і потім концентрували у вакуумі. Залишок очищали за допомогою флеш хроматографії на силікагелі (елюент ЕtOАс:пет. ефір 0:100 до 5:95); вихід 5,96г (84%). А2. 4-(трет-Бутилоксикарбоніламінометил)-3-хлорбензойна кислота До насиченого розчину аміаку в етанолі (170мл) додавали метил 4-бромметил-3-хлорбензоат з Прикладу А1 (5,5г, 20,9ммоль). Суміш перемішували при кімнатній температурі протягом 1г і потім концентрували у вакуумі. Залишок розтирали з діетиловим етером і одержані білі кристали відфільтровували і промивали діетиловим етером. До розчину цієї твердої речовини у воді (100мл) додавали розчини (ВОС)2О (5,0г, 23,0ммоль) в діоксані (100мл) і гідроксиду натрію (1,86г, 46,0ммоль) у воді (100мл). Суміш перемішували при кімнатній температурі протягом 18г і потім концентрували у вакуумі. Водний залишок підкислювали лимонною кислотою і екстрагували хлороформ/ІРА. Органічний шар промивали водою, сушили над MgSO4 і концентрували у вакуумі одержуючи білу тверду речовину; вихід 2,8г (67%). Приклад В 4-(трет-Бутилоксикарбоніламінометил)-3-нітробензойна кислота 4-Бромметил-3-нітробензойна кислота (4,75г, 18,2ммоль) реагує за методикою Прикладу А2 даючи жовту тверду речовину; вихід 2,6г (49%). Приклад С 4-Ціано-3-метилбензойна кислота До розчину 4-бром-2-метилбензонітрилу (2,0г, 10,2ммоль) в ТГФ (100мл) при -78°С в атмосфері азоту по краплям додавали 2,5М розчин н-бутиллітію (4,48мл, 11,2ммоль). Суміш перемішували при -78°С протягом 1г і потім виливали на твердий діоксид вуглецю (5г) в ТГФ (50мл). Суміш залишали нагріватись до кімнатної температури. Додавали воду (200мл) і суміш екстрагували діетиловим етером (3 рази). Водний шар підкислювали додаючи концентровану НСІ і екстрагували хлороформом (3 рази). Об'єднані хлороформні екстракти промивали водою, сушили над MgSO4 і концентрували у вакуумі одержуючи білу тверду речовину; вихід 1,2г (73%). Приклад D 4-Ціано-2-метилбензойна кислота 4-Бром-3-метилбензонітрил (2,0г, 10,2ммоль) реагує за методикою Прикладу С даючи жовту тверду речовину, яку розтирали з гексаном і відфільтровували; вихід 0,96г (59%). Приклад Е 4-(трет-Бутилоксикарбоніламінометил)-2-фторбензойна кислота Е1. 2-Фтор-4-метилбензойна кислота 4-Бром-3-фтортолуол (8,33г, 44,07ммоль) реагує за методикою Прикладу С даючи білу тверду речовину; 4,89г (72%). Е2. Метил 2-фтор-4-метилбензоат До розчину 2-фтор-4-метилбензойної кислоти з Прикладу Е1 (6,04г, 39,18ммоль) в толуолі (80мл) додавали тіонілхлорид (65мл, 89,11ммоль). Суміш нагрівали при температурі кипіння протягом 2,5г, охолоджували і концентрували у вакуумі. Залишок розчиняли в дихлорметані (50мл) і додавали метанол (50мл). Суміш перемішували при кімнатній температурі протягом 2,5г і потім концентрували у вакуумі. Залишок розчиняли в дихлорметані (100мл), промивали насиченим розчином бікарбонату натрію і насиченим водним розчином хлориду натрію, сушили над MgSO4 і концентрували у вакуумі одержуючи жовто-коричневу тверду речовину; вихід 5,07г (77%). Е3. Метил 4-бромметил-2-фторбензоат Метил 2-фтор-4-метилбензоат з Прикладу Е2 (5,07г, 30,16ммоль) реагує за методикою Прикладу А1. Продукт очищали за допомогою флеш хроматографії на силікагелі (елюент ЕtOАс:пет. ефір 20:80); вихід 5,9г (80%). Е4. 4-(трет-Бутилоксикарбоніламінометил)-2-фторбензойна кислота Метил 4-бромметил-2-фторбензоат з Прикладу Е3 (5,9г, 24,13ммоль) реагує за методикою Прикладу А2. Продукт перекристалізували з діоксан/пет. ефір одержуючи білі кристали; вихід 2,46г (38%). Приклад F 6-(трет-Бутилоксикарбоніламінометил)-2-хлорнікотинова кислоти F1. Метил 2-хлор-6-метилнікотинат До суспензії 2-хлор-6-метилнікотинової кислоти (5,3г, 30,8ммоль) в дихлорметані (100мл) при 0°С додавали ДМФА (1мл) і оксалілхлорид (3,2мл, 36,9ммоль). Суміш залишали нагріватись до кімнатної температури і перемішували протягом 5г. Розчинники видаляли у вакуумі і залишок розчиняли в дихлорметані (50мл) і метанолі (50мл). Суміш перемішували при кімнатній температурі протягом 18г і потім концентрували у вакуумі. Залишок розчиняли в хлороформі, промивали насиченим розчином бікарбонату натрію і насиченим водним розчином хлориду натрію, сушили над MgSO4 і концентрували у вакуумі одержуючи коричневе масло; вихід 5,70г (100%). F2. Метил 6-бромметил-2-хлорнікотинат Метил 2-хлор-6-метилнікотинат з Прикладу F1 (5,70г, 30,8ммоль) реагує за методикою Прикладу А1. Продукт очищали за допомогою флеш хроматографії на силікагелі (елюент ЕtOАс:пет. ефір 20:80); вихід 4,8г (58%). F3. Метил 6-(трет-бутилоксикарбоніламінометил)-2-хлорнікотинат Метил 6-бромметил-2-хлорнікотинат з Прикладу F2 (4,8г, 18,0ммоль) реагує за методикою Прикладу А2 одержуючи майже-білу тверду речовину; вихід 1,45г (28%). Приклад G 6-(трет-Бутилоксикарбоніламінометил)нікотинова кислота G1. Метил 6-(6ромметил)нікотинат Метил 6-метилнікотинат (5,0г, 33,0ммоль) реагує за методикою Прикладу А1. Продукт очищали за допомогою флеш хроматографії на силікагелі (елюент ЕtOАс:пет. ефір 20:80); вихід 3,7г (49%). G2. Метил 6-(азидометил)нікотинат До розчину метил 6-(бромметил)нікотинату з Прикладу G1 (2,0г, 8,60ммоль) в ДМФА (15мл) додавали азид натрію (0,84г, 12,9ммоль). Суміш перемішували при кімнатній температурі протягом 18г. Додавали ЕtOАс (100мл) і суміш промивали водою (3 рази), сушили над MgSO4 і концентрували у вакуумі. Залишок очищали за допомогою флеш хроматографії на силікагелі (елюент ЕtOАс:пет. ефір 20:80) одержуючи жовту гумоподібну речовину; вихід 1,55г (93%). G3. Метил 6-(трет-бутилоксикарбоніламінометил)нікотинат До дегазованого розчину метил 6-(азидометил)нікотинату з Прикладу G2 (1,6г, 8,30ммоль) в метанолі (50мл) додавали 10% паладію на вугіллі (0,15г). Водень барботували крізь суміш протягом 2г при кімнатній температурі. Каталізатор видаляли фільтруванням крізь шар целіту і фільтрат випарювали у вакуумі. Залишок розчиняли в дихлорметані і охолоджували до 0°С. До цього розчину додавали триетиламін (1,67г, 16,0ммоль) і (ВОС)2О (2,17г, 9,96ммоль). Суміш залишали нагріватись до кімнатної температури і перемішували протягом 18г, потім концентрували у вакуумі. Залишок розчиняли в ЕtOАс і промивали водою, сушили над MgSO4 і концентрували у вакуумі. Залишок очищали за допомогою флеш хроматографії на силікагелі (елюент ЕtOАс:пет. ефір 50:50) одержуючи жовту тверду речовину; вихід 1,57г (71%). G4. 6-(трет-Бутилоксикарбоніламінометил)нікотинова кислота До розчину метил 6-(трет-бутилоксикарбоніламінометил)нікотинату з Прикладу G3 (1,56г, 5,84ммоль) в ТГФ (20мл) і воді (5мл) додавали моногідрат гідроксиду літію (0,37г, 8,76ммоль). Суміш перемішували при кімнатній температурі протягом 18г і потім концентрували у вакуумі. Водний залишок підкислювали додаючи 1М розчин лимонної кислоти і екстрагували хлороформ/ІРА (3 рази). Об'єднані органічні екстракти промивали насиченим водним розчином хлориду натрію, сушили над MgSO4 і випарювали у вакуумі одержуючи білу тверду речовину; вихід 1,38г (94%). Приклад Н 4/5-Бром-6-(трет-бутилоксикарбоніламінометил)-1-метил-2-оксо-1,2-дигідропіридин-3-карбонова кислота Н1. Метил 1,6-диметил-2-оксо-1,2-дигідропіридин-3-карбоксилат До розчину 3-гідрокси-6-метилнікотинової кислоти (10г, 65,0ммоль) в ДМФА (100мл) при 0°С додавали гідрид натрію (4,83г, 60% дисперсія, 140ммоль). Суміш перемішували при 0°С протягом 1,5г, потім додавали метилйодид (12,4мл, 195ммоль) і суміш залишали нагріватись до кімнатної температури, перемішували протягом ще 18г. Суміш розділяли між водою і ЕtOАс і Водний шар підкислювали до pH 5. Шари розділяли і органічний шар промивали насиченим водним розчином хлориду натрію, сушили над MgSO4 і концентрували у вакуумі. Залишок очищали за допомогою флеш хроматографії на силікагелі (елюент дихлорметан/метанол 95:5) одержуючи білу тверду речовину. її перекристалізували з метанолу і фільтрат випарювали у вакуумі одержуючи бажаний продукт; вихід 6,1г (52%). Н2. Метил 4/5-бром-6-бромметил-1-метил-2-оксо-1,2-дигідропіридин-3-карбоксилат Метил 1,6-диметил-2-оксо-1,2-дигідропіридин-3-карбоксилат з Прикладу Н1 (6,0г, 33,0ммоль) реагує за методикою Прикладу А1. Продукт очищали за допомогою флеш хроматографії на силікагелі (елюент дихлорметан/метанол 95:5); вихід 5,2г (46%). Н3. 4/5-Бром-6-(трет-бутилоксикарбоніламінометил)-1-метил-2-оксо-1,2-дигідропіридин-3-карбонова кислота Метил 4/5-бром-6-бромметил-1-метил-2-оксо-1,2-дигідропіридин-3-карбоксилат з Прикладу Н2 (5,2г, 14,8ммоль) реагує за методикою Прикладу А2 даючи коричневу гупоподібну речовину; вихід 1,3г (24%). Приклад І. 4-ціано-3,5-диметилбензойна кислота І1. 4-Бром-2,6-диметилбензонітрил 4-Бром-2,6-диметиланілін (4,49г, 22,4ммоль) переносили у воду (25мл) і додавали концентровану хлорводневу кислоту (8,0мл). Суміш сонікували до утворення тонкої суспензії і потім охолоджували до 0°С. Потім по краплям додавали розчин нітриту натрію (1,67г, 24,2ммоль) у воді (5мл) підтримуючи температуру реакційної суміші в межах 0-5°С. Суміш перемішували при 0-5°С протягом ½г і потім нейтралізували додаючи твердий карбонат натрію. Одержаний розчин порціями додавали до розчину ціаніду міді (2,42г, 27,0ммоль) і ціаніду калію (3,65г, 56,1ммоль) у воді (25мл) при 70°С. Суміш перемішували при 70°С протягом ½г, залишали охолоджуватись і потім екстрагували толуолом (2 рази). Об'єднані екстракти промивали водою і насиченим водним розчином хлориду натрію, сушили над MgSO4 і концентрували у вакуумі. Залишок очищали за допомогою флеш хроматографії на силікагелі (елюент ЕtOАс:пет. ефір 5:95) одержуючи оранжеву тверду речовину; вихід 3,2г (68%). 12. 4-Ціано-3,5-диметилбензойна кислота 4-Бром-2,6-диметилбензонітрил з Прикладу 11 (3,20г, 15,2ммоль) реагує за методикою Прикладу С даючи жовто-коричневу тверду речовину; вихід 1,5г (56%). Реагенти відповідних фрагментів А, В і С об'єднували одержуючи характерні Приклади, як показано нижче. Приклад 1 1-(4-[3-(2,6-Дифторфеніл)уреїдометил]бензоїл)-2,3,4,5-тетрагідро-1Н-1-бензазепін 1А. 1-(4-Ціанобензоїл)-2,3,4,5-тетрапдро-1Н-1-бензазепін До розчину 2,3,4,5-тетрагідро-1Н-1-бензазепіну (1,05г, 7,14ммоль) в дихлорметані (40мл) додавали 4ціанобензойну кислоту (1,26г, 8,57ммоль), триетиламін (1,00г, 7,14ммоль), 4-(диметиламіно)піридин (0,87г, 7,14ммоль) і ВРКДІ (2,86г, 14,28ммоль). Суміш перемішували при температурі кипіння протягом 18г, охолоджували і випарювали у вакуумі. Залишок розділяли між ЕtOАс і 1М KHSO4. Органічний шар промивали насиченим розчином бікарбонату натрію і насиченим водним розчином хлориду натрію, сушили над MgSO4 і концентрували у вакуумі одержуючи білу тверду речовину; вихід 1,50г (76%). 1В. 1-(4-(Амінометил)бензоїл)-2,3,4,5-тетрагідро-1Н-1-бензазепін До дегазованого розчину ціанобензоїлбензазепіну з Прикладу 1А (1,50г, 5,43ммоль) в метанолі (50мл) додавали концентровану хлорводневу кислоту (1,4мл, 16,2ммоль) і 10% паладій на вугіллі (1,15г). Водень барботували крізь суміш протягом 5г при кімнатній температурі. Каталізатор видаляли фільтруванням крізь шар целіту і фільтрат випарювали у вакуумі. Залишок розділяли між ЕtOАс і водою. Водний шар підлуговували додаючи насичений розчин бікарбонату натрію і екстрагували дихлорметаном (2 рази). Об'єднані органічні екстракти промивали насиченим водним розчином хлориду натрію, сушили над MgSO4 і концентрували у вакуумі одержуючи білу тверду речовину; вихід 1,12г (74%). 1С. 1-(4-[3-(2,6-Дифторфеніл)уреїдометил]бензоїл)-2,3,4,5-тетрагідро-1Н-1-бензазепін До розчину аміну з Прикладу 1В (0,50г, 1,79ммоль) в дихлорметані (20мл) додавали триетиламін (0,27мл, 1,97ммоль) і 2,6-дифторфенілізоціанат (0,31г, 1,97ммоль). Суміш перемішували при кімнатній температурі протягом 2г і потім випарювали у вакуумі. Залишок очищали за допомогою флеш хроматографії на силікагелі (елюент ЕtOАс:пет. ефір 50:50) одержуючи білу тверду речовину; вихід 0,62г (80%). MC: розраховано m/e=435,18; знайдено [М+Н]+=436. Приклад 2. 1-(4-[3-(2,6-Дифторфеніл)ціаногуанідинометил]бензоїл)-2,3,4,5-тетрагідро-1Н-1-бензазепін До розчину аміну з Прикладу 1В (0,12г, 0,379ммоль) в ДМФА (20мл) додавали 1-(2,6-дифторфеніл)-3ціанотіосечовину (0,16г, 0,758ммоль, одержували згідно Atwal et al., TeTpahedron Lett., 30, р7313, 1989.), діізопропілетиламін (0,16мл, 0,947ммоль) і ВРКДІ (0,087г, 0,455ммоль). Суміш перемішували при кімнатній температурі протягом 72г і потім випарювали у вакуумі. Залишок розділяли між дихлорметаном і 1М KHSO4. Органічний шар промивали насиченим розчином бікарбонату натрію і насиченим водним розчином хлориду натрію, сушили над MgSO4 і концентрували у вакуумі. Залишок очищали за допомогою флеш хроматографії на силікагелі (елюент ЕtOАс:пет. ефір 50:50-70:30) одержуючи білу тверду речовину; вихід 0,084г (48%). MC: розраховано m/e=459,19; знайдено [М+Н]+=460,0 Приклад 3. 1-(6-[3-(2,6-Дифторфеніл)уреїдометил]нікотиноїл)-2,3,4,5-тетрагідро-1Н-1-бензазепін 3А. 1-[6-(трет-Бутилоксикарбоніламінометил)нікотиноїл-2,3,4.5-тетрагідро-1Н-1-бензазепін Карбонова кислота з Прикладу G4 (1,38г, 5,45ммоль) реагувала з 2,3,4,5-тетрагідро-1Н-1-бензазепіном (0,80г, 5,50ммоль) згідно до методики Прикладу 1А. Продукт очищали за допомогою флеш хроматографії на силікагелі (елюент ЕtOАс:пет. ефір 30:70-70:30); вихід 1,14г (55%). 3В. 1-[6-(Амінометил)нікотиноїл]-2,3,4,5-тетрагідро-1H-1-бензазепіну гідрохлорид ВОС амін з Прикладу 3А (1,14г, 2,98ммоль) розчиняли в 4N НСІ/діоксан, перемішували при кімнатній температурі протягом 1г і потім випарювали у вакуумі, азеотропували з толуолом, одержуючи майже-білу тверду речовину; вихід 1,0г (кількісний). 3С. 1-(6-[3-(2,6-Дифторфеніл)уреїдометил]нікотиноїл)-2,3,4,5-тетрагідро-1Н-1-бензазепін Гідрохлорид аміну з Прикладу 3В (0,070г, 0,220ммоль) реагував з 2,6-дифторфенілізоціанатом (0,038г, 0,242ммоль) згідно до методики Прикладу 1С. Продукт очищали розтираючи з діетиловим етером і одержували білу тверду речовину; вихід 0,060г (63%). MC: розраховано m/e=436,47; знайдено [М+Н]+=437,2. Приклад 4. 1-(3-Хлор-4-[3-(3-метоксифеніл)уреїдометил]бензоїл)-2,3,4,5-тетрагідро-1H-1-бензазепін 4А. 1-(4-[трет-Бутилоксикарбоніламінометил]-3-хлорбензоїл)-2,3,4,5-тетрагідро-1H-1-бензазепін Карбонова кислота з Прикладу А2 (1,0г, 3,50ммоль) реагувала з 2,3,4,5-тетрагідро-1Н-1-бензазепіном (0,47г, 3,20ммоль) згідно до методики Прикладу 1А. Продукт очищали за допомогою флеш хроматографії на силікагелі (елюент ЕtOАс:пет. ефір 30:70-40:60); вихід 0,88г (66%). 4В. 1-(4-[Аміном етил]-3-хлорбензоїл)-2,3,4,5-тетрагідро-1H-1-бензазепіну гідрохлорид ВОС амін з Прикладу 4А (0,88г, 2,10ммоль) розчиняли в 4N НСІ/діоксан і перемішували при кімнатній температурі протягом 1г, потім випарювали у вакуумі, азеотропували з толуолом, одержуючи білу тверду речовину; вихід 0,70г (95%). 4С. 1-(3-Хлор-4-[3-(3-метоксифеніл)уреїдометил]бензоїл)-2,3,4,5-тетрагідро-1H-1-бензазепін Гідрохлорид аміну з Прикладу 4В (0,050г, 0,140ммоль) реагував з 3-метоксифенілізоціанатом (0,021г, 0,140ммоль) згідно до методики Прикладу 1С. Продукт очищали розтираючи з діетиловим етером і одержували білу тверду речовину; вихід 0,060г (93%). MC: розраховано m/e=463,17; знайдено [М+Н]+=464,2. Приклад 5. 1-(3-Хлор-4-[3-(2-хлорфеніл)уреїдометил]бензоїл)-2,3,4,5-тетрагідро-1H-1-бензазепін Гідрохлорид аміну з Прикладу 4В (0,050г, 0,140ммоль) реагував з 2-хлорфенілізоціанатом (0,022г, 0,140ммоль) згідно до методики Прикладу 1С. Продукт очищали розтираючи з діетиловим етером і одержували білу тверду речовину; вихід 0,063г (98%). MC: розраховано m/e=467,12; знайдено [М+Н]+; 35СІ=468,1. Приклад 6. 1-(3-Хлор-4-[3-(2,6-дифторфеніл)тіоуреїдометил]бензоїл)-2,3,4,5-тетрагідро-1Н-1-бензазепін Гідрохлорид аміну з Прикладу 48 (0,075г, 0,214ммоль) реагував з 2,6-дифторфенілізотіоціанатом (0,054г, 0,320ммоль) згідно до методики Прикладу 1С. Продукт очищали за допомогою флеш хроматографії на силікагелі (елюент ЕtOАс:пет. ефір 30:70-45:55); вихід 0,068г (66%). MC: розраховано m/e=485,11; знайдено [М+Н]+; 35СІ=486,2, [М+Н]+; 37СІ=488,1 Приклад 7. 1-(4-[3-(2,6-Дифторфеніл)уреїдометил]-2-метилбензоїл)-2,3,4,5-тетрагідро-1Н-1-бензазепін 7А. 1-(4-ціано-2-метилбензоїл)-2,3,4,5-тетрагідро-1H-1-бензазепін Карбонова кислота з Прикладу D (0,96г, 5,95ммоль) реагувала з 2,3,4,5-тетрагідро-1Н-1-бензазепіном (0,80г, 5,44ммоль) згідно до методики Прикладу 1А. Продукт очищали за допомогою флеш хроматографії на силікагелі (елюент EtOAc:пет. ефір 30:70); вихід 0,59г (38%). 7В. 1-(4-[Амінометил1-2-метилбензоїл)-2,3,4,5-тетрагідро-1Н-1-бензазепіну гідрохлорид Ціанобензоїлбензазепін з Прикладу 7А (0,59г, 2,03ммоль) гідрували згідно до методики Прикладу 1В. Продукт виділяли як НСІ сіль; вихід 0,55г (82%). 7С. 1-(4-[3-(2,6-Дифторфеніл)уреїдометил]-2-метилбензоїл)-2,3,4,5-тетрагідро-1H-1-бензазепін Гідрохлорид аміну з Прикладу 7В (0,050г, 0,151ммоль) реагував з 2,6-дифторфенілізоціанатом (0,028г, 0,181ммоль) згідно до методики Прикладу 1С. Продукт очищали за допомогою флеш хроматографії на силікагелі (елюент EtOAc:пет. ефір 50:50); вихід 0,041г (62%). MC: розраховано m/e=449,19; знайдено [М+Н]+=450,1. Приклад 8. 1-(3-Метил-4-[3-(Фенілсульфоніл)уреїдометил]бензоїл)-2,3,4,5-тетрагідро-1Н-1-бензазепін 8А. 1-(4-ціано-3-метилбензоїл)-2,3,4,5-тетрагідро-1H-1-бензазепін Карбонова кислота з Прикладу С (0,96г, 5,95ммоль) реагувала з 2,3,4,5-тетрагідро-1Н-1-бензазепіном (0,80г, 5,44ммоль) згідно до методики Прикладу 1А. Продукт очищали за допомогою флеш хроматографії на силікагелі (елюент EtOAc:пет. ефір 30:70); вихід 1,10г (70%). 8В. 1-(4-[Амінометил]-3-метилбензоїл)-2,3,4,5-тетрагідро-1H-1-бензазепіну гідрохлорид Ціанобензоїлбензазепін з Прикладу 8А (1,10г, 3,79ммоль) гідрували згідно до методики Прикладу 1В. Продукт виділяли як НСІ сіль; вихід 1,23г (98%). 8С. 1-(3-Метил-4-[3-(Фенілсульфоніл)уреїдометил]бензоїл)-2,3,4,5-тетрагідро-1H-1-бензазепін Гідрохлорид аміну з Прикладу 8В (0,050г, 0,151ммоль) реагував з фенілсульфонілізоціанатом (0,028г, 0,151ммоль) згідно до методики Прикладу 1С. Продукт очищали за допомогою флеш хроматографії на силікагелі (елюент EtOAc:пет. ефір 80:20); вихід 0,026г (22%). MC: розраховано m/e=477,17; знайдено [М+Н]+=478,2. Приклад 9. 1-(3-Метил-4-[3-(2-оксо-1,2-дигідропірид-3-ил)уреїдометил]бензоїл)-2,3,4,5-тетрагідро-1H-1-бензазепін До суспензії 2-гідроксинікотинової кислоти (95мг, 0,68ммоль) в діоксані (5мл) додавали триетиламін (0,11мл, 0,771ммоль) і дифенілфосфорилазид (0,16мл, 0,725ммоль). Суміш перемішували при температурі кипіння протягом 3г. Додавали гідрохлорид аміну з Прикладу 8В (0,15г, 0,453ммоль) і триетиламін (0,095мл, 0,680ммоль) і суміш перемішували при температурі кипіння протягом ще 18г, охолоджували і випарювали у вакуумі. Залишок розділяли між дихлорметаном і 1М KHSO4. Органічний шар промивали насиченим розчином бікарбонату натрію і насиченим водним розчином хлориду натрію, сушили над MgSO4 і концентрували у вакуумі. Залишок очищали за допомогою флеш хроматографії на силікагелі (елюент метанол:дихлорметан 2:98-5:95) одержуючи білу тверду речовину; вихід 0,084г (43%). MC: розраховано m/e=430,20; знайдено [М+Н]+=431,1. Приклад 10, 1-(4-[3-(2,6-Дифторфеніл)уреїдометил]-3-метилбензоїл)-2,3,4,5-тетрагідро-1Н-1-бензазепін Гідрохлорид аміну з Прикладу 8В (0,050г, 0,151ммоль) реагував з 2,6-дифторфенілізоціанатом (0,028г, 0,181ммоль) згідно до методики Прикладу 1С. Продукт очищали за допомогою флеш хроматографії на силікагелі (елюент EtOAc:пет. ефір 50:50); вихід 0,044г (65%). MC: розраховано m/e=449,19; знайдено [М+Н]+=450,1. Приклад 11. 1-(3-Нітро-4-[2-нітробензилсульфоніламінометил]бензоїл)-2,3,4,5-тетрагідро-1Н-1-бензазелін 11А. 1-(4-[трет-Бутилоксикарбоніламінометил]-3-нітробензоїл)-2,3,4,5-тетрагідро-1Н-1-бензазепін Карбонова кислота з Прикладу В (0,911г, 3,08ммоль) реагувала з 2,3,4,5-тетрагідро-1Н-1-бензазепіном (0,453г, 3,08ммоль) згідно до методики Прикладу 1А. Продукт очищали за допомогою флеш хроматографії на силікагелі (елюент EtOAc.пет. ефір 50:50); вихід 0,58г (43%). 11В. 1-(4-[Аміном етил]-3-нітробензоюл)-2,3,4,5-тетрагідро-1Н-1-бензазепіну гідрохлорид ВОС-амінометилбензоїлбензазепіну з Прикладу 11А (0,33г, 0,764ммоль) реагував згідно до методики Прикладу 4В. Продукт виділяли як НСІ сіль; вихід 0,27г (98%). 11С. 1-(3-Нітро-4-[2-нітробензилсульфоніламінометил]бензоїл)-2,3,4,5-тетрагідро-1Н-1-бензазепін Гідрохлорид аміну з Прикладу 11В (0,068г, 0,188ммоль) реагував з 2-нітробензилсульфонілхлоридом (0,033г, 0,226ммоль) згідно до методики Прикладу 1С. Продукт очищали за допомогою флеш хроматографії на силікагелі (елюент EtOAc:пет. ефір 25:75-50:50); вихід 0,010г (10%). MC: розраховано m/е=524,14; знайдено [М+Н]+=525,2. Приклад 12. 1-(3-Аміно-4-[3-(2,6-дифторфеніл)уреїдометил]бензоїл)-2,3,4,5-тетрагідро-1Н-1-бензазепін 12А. 1-(3-Аміно-4-[трет-бутилоксикарбоніламінометил]бензоїл)-2,3,4,5-тетрагідро-1Н-1-бензазепін До дегазованого розчину нітробензоїлбензазепіну з Прикладу 11А (0,30г, 0,700ммоль) в метанолі (50мл) додавали 10% паладій на вугіллі (0,10г). Водень барботували крізь суміш протягом 1,5г при кімнатній температурі. Каталізатор видаляли фільтруванням крізь шар целіту і фільтрат випарювали у вакуумі; вихід 0,254г (92%). 12В. 1-(3-Аміно-4-[амінометил]бензоїл)-2,3,4,5-тетрагідро-1Н-1-бензазепіну дигідрохлорид ВОС-амінометилбензоїлбензазепін з Прикладу 12А (0,14г, 0,354ммоль) реагував згідно до методики Прикладу 4В. Продукт виділяли як диНСІ сіль; вихід 0,098г (75%). 12С. 1-(3-Аміно-4-[3-(2,6-дифторфеніл)уреїдометил]бензоїл)-2,3,4,5-тетрагідро-1Н-1-бензазепін Гідрохлорид аміну з Прикладу 12В (0,132г, 0,35ммоль) реагував з 2,6-дифторфенілізоціанатом (0,055г, 0,35ммоль) згідно до методики Прикладу 1С. Продукт очищали за допомогою флеш хроматографії на силікагелі (елюент EtOAc:пет. Ефір 70:30) і потім препаративною ВЕРХ (градієнт вода:ацетонітрил 80:2020:80; 0,1% ТФО). ВЕРХ фракції сушили виморожуванням одержуючи білу тверду речовину; вихід 0,027г (17%). MC: розраховано m/e=450,19; знайдено [М+Н]+=451,2. Приклад 13. 1-(4-[3-(2,6-Дифторфеніл)уреїдометил]-3-диметиламінобензоїл)-2,3,4,5-тетрагідро-1Н-1-бензазепін 13А. 1-(4-[трет-Бутилоксикарбоніламінометил]-3-диметиламінобензоїл)-2,3,4,5-тетрагідро-1H-1-бензазепін До охолодженого льодом розчину аміну з Прикладу 12А (0,16г, 0,40ммоль) в 1% оцтова кислота/метанол (25мл) додавали формальдегід (37% розчин у воді, 0,050мл, 0,60ммоль). Суміш перемішували при 0°С протягом 10хв і потім додавали боргідрид натрію (0,050г, 0,80ммоль). Суміш залишали нагріватись до кімнатної температури, перемішували протягом 1г і потім випарювали у вакуумі. Залишок розділяли між EtOAc і насиченим розчином бікарбонату натрію. Органічний шар промивали насиченим водним розчином хлориду натрію, сушили над MgSO4 і концентрували у вакуумі. Залишок очищали за допомогою флеш хроматографії на силікагелі (елюент EtOAc:пет. ефір 30:70-70:30) одержуючи білу тверду речовину; вихід 0,091г (56%). 13В. 1-(4-[Аміном етил]-3-диметиламінобензоїл)-2,3,4,5-тетрагідро-1Н-1-бензазепін ВОС-амінометилбензоїлбензазепін з Прикладу 13А (0,089г, 0,225ммоль) реагував згідно до методики Прикладу 4В. Продукт виділяли як НСІ сіль; вихід 0,075г (97%). 13С. 1-(4-[3-(2,6-Дифторфеніл)уреїдометил]-3-диметиламінобензоїл)-2,3,4,5-тетрагідро-1Н-1-бензазепін Гідрохлорид аміну з Прикладу 13В (0,075г, 0,20ммоль) реагував з 2,6-дифторфенілізоціанатом (0,032г, 0,20ммоль) згідно до методики Прикладу 1С. Продукт очищали за допомогою флеш хроматографії на силікагелі (елюент EtOAc:пет. ефір 90:10); вихід 0,044г (65%). MC: розраховано m/e=478,22; знайдено [М+Н]+=479,2. Приклад 14. 1-(4-[3-(2,6-Дифторфеніл)уреїдометил]-2-фторбензоїл)-2,3,4,5-тетрагідро-1Н-1-бензазепін 14А. 1-(4-[трет-Бутилоксикарбоніламінометил]-2-фторбензоїл)-2,3,4,5-тетрагідро-1Н-1-бензазепін Карбонова кислота з Прикладу Е4 (0,50г, 2,22ммоль) реагувала з 2,3,4,5-тетрагідро-1Н-1-бензазепіном (0,28г, 1,89ммоль) згідно до методики Прикладу 1А. Продукт очищали за допомогою флеш хроматографії на силікагелі (елюент EtOAc:пет. ефір 40:60); вихід 0,58г (77%). 14В. 1-(4-[Аміном етил]-2-фторбензоїл)-2,3,4,5-тетрагідро-1Н-1-бензазепін ВОС-амінометилбензоїлбензазепін з Прикладу 14А (0,58г, 1,42ммоль) реагував згідно до методики Прикладу 4В. Продукт виділяли як НСІ сіль; вихід 0,29г (60%). 14С. 1-(4-[3-(2,6-Дифторфеніл)уреїдометил]-2-фторбензоїл)-2,3,4,5-тетрагідро-1Н-1-бензазепін Гідрохлорид аміну з Прикладу 14В (0,040г, 0,12ммоль) реагував з 2,6-дифторфенілізоціанатом (0,020г, 0,13ммоль) згідно до методики Прикладу 1С. Продукт очищали за допомогою флеш хроматографії на силікагелі (елюент EtOAc:пет. ефір 40:60-100:0); вихід 0,038г (70%). MC: розраховано m/e=453,17; знайдено [М+Н]+=454,1. Приклад 15. 1-(4-[3-(2,6-Дифторфеніл)уреїдометил]-3-метилбензоїл)-2,3,4,5-тетрагідро-1H-1,5-бензодіазепін 15А. 2,3,4,5-Тетрагідро-1H-1,5-бензодіазепін До охолодженого льодом розчину алюмогідриду літію (4,68г, 123ммоль) в сухому ТГФ (100мл), в атмосфері азоту, по краплям додавали розчин 2,3,4,5-тетрагідро-1Н-1,5-бензодіазепін-2-ону (5,0г, 30,9ммоль) в сухому ТГФ (50мл). Суміш залишали нагріватись до кімнатної температури і потім нагрівали при температурі кипіння протягом 2г. Суміш потім охолоджували до 0°С і по краплям додавали розчин водного гідроксиду амонію (10мл) в ТГФ (60мл). Одержану суспензію перемішували протягом 1г і потім фільтрували крізь шар целіту. Фільтрат випарювали у вакуумі одержуючи жовто-коричневу тверду речовину; вихід 4,36г (95%). 15В. 1-(4-ціано-3-метилбензоїл )-2,3,4,5-тетрагідро-1H-1,5-бензодіазепін Карбонова кислота з Прикладу С (0,65г, 4,03ммоль) реагувала з 2,3,4,5-тетрагідро-1Н-1,5-бензодіазепіном з Прикладу 15А (0,50г, 3,36ммоль) згідно до методики Прикладу 1А. Продукт очищали за допомогою флеш хроматографії на силікагелі (елюент EtOAc:пет. ефір 50:50); вихід 0,36г (37%). 15С. 1-(4-[Амінометил]-3-метилбензоїл)-2,3,4,5-тетрагідро-1Н-1,5-бензодіазепіну гідрохлорид Ціанобензоїлбензодіазепін з Прикладу 15В (0,36г, 1,24ммоль) гідрували згідно до методики Прикладу 1В. Продукт виділяли як НСІ сіль; вихід 0,17г (40%). 15D. 1-(4-[3-(2,6-Дифторфеніл)уреїдометил]-3-метилбензоїл)-2,3,4,5-тетрагідро-1Н-1,5-бензодіазепін Гідрохлорид аміну з Прикладу 15С (0,170г, 0,46ммоль) реагував з 2,6-дифторфенілізоціанатом (0,071г, 0,46ммоль) згідно до методики Прикладу 1С. Продукт очищали за допомогою флеш хроматографії на силікагелі (елюент EtOAc:пет. ефір 80:20); вихід 0,089г (43%). MC: розраховано m/e=450,19; знайдено [М+Н]+=451,2. Приклад 16. 1-(4-[3-(2,6-Дифторфеніл)уреїдометил]-3-метилбензоїл)-5-(3-піридил)метил-2,3,4,5-тетрагідро-1H-1,5бензодіазепін 16А. 1-(3-Піридил)метил-2,3,4,5-тетрагідро-1Н-1,5-бензодіазепін До розчину 2,3,4,5-тетрагідро-1Н-1,5-бензодіазепіну з Прикладу 15А (0,50г, 3,38ммоль) в 1% оцтова кислота/метанол (25мл), при кімнатній температурі, додавали піридин-3-карбоксальдегід (0,35мл, 03,72ммоль). Суміш перемішували при температурі кипіння протягом 18г і потім залишали охолоджуватись до кімнатної температури. Додавали боргідрид натрію (0,050г, 0,80ммоль). Суміш перемішували протягом 2г і потім випарювали у вакуумі. Залишок розділяли між EtOAc і насиченим розчином бікарбонату натрію. Органічний шар промивали насиченим водним розчином хлориду натрію, сушили над MgSO4 і концентрували у вакуумі. Залишок очищали за допомогою флеш хроматографії на силікагелі (елюент EtOAc) одержуючи білу тверду речовину; вихід 0,386г (40%). 16В. 1-(4-ціано-3-метилбензоїл)-5-(3-піридил)метил-2,3,4,5-тетрагідро-1Н-1,5-бензодіазепін Карбонова кислота з Прикладу С (0,31г, 1,93ммоль) реагувала з 1-(3-піридил)метил-2,3,4,5-тетрагідро-1Н1,5-бензодіазепіном з Прикладу 16А (0,39г, 1,61ммоль) згідно до методики Прикладу 1А. Продукт очищали за допомогою флеш хроматографії на силікагелі (елюент EtOAc); вихід 0,28г (45%). 16С. 1-(4-Амінометил-3-метилбензоїл)-5-(3-піридил)метил-2,3,4,5-тетрагідро-1H-1,5-бензодіазепін До розчину нітрилу з Прикладу 16В (0,28г, 0,72ммоль) в метанолі (20мл) додавали хлорид кобальту (0,338г, 1,42ммоль) і боргідрид натрію (0,27г, 7,20ммоль). Суміш перемішували при кімнатній температурі протягом 1г і потім додавали насичений водний розчин хлориду амонію (10мл). Суміш концентрували у вакуумі і водний залишок розділяли між діетиловим етером і водою. Водний шар підлуговували додаючи насичений розчин бікарбонату натрію і екстрагували хлороформом (3 рази). Об'єднані органічні екстракти промивали насиченим водним розчином хлориду натрію, сушили над MgSO4 і концентрували у вакуумі одержуючи білу тверду речовину; вихід 0,20г (72%). 16D. 1-(4-[3-(2,6-Дифторфеніл)уреїдометил]-3-метилбензоїл)-5-(3-піридил)метил-2,3,4,5-тетрагідро-1H-1,5бензодіазепін Амін з Прикладу 16С (0,065г, 0,168ммоль) реагував з 2,6-дифторфенілізоціанатом (0,027г, 0,17ммоль) згідно до методики Прикладу 1С. Продукт очищали за допомогою флеш хроматографії на силікагелі (елюент EtOAc); вихід 0,068г (75%). MC: розраховано m/e=541,23; знайдено [М+Н]+=542,2. Приклад 17. 1-(4-[3-(2,6-Дифторфеніл)уреїдометил]-3-метилбензоїл)-5-(2-гідроксиетил)-2,3,4,5-тетрагідро-1H-1,5бензодіазепін 17А. Метил (2-оксо-2,3,4,5-тетрагідро-1Н-1,5-бензодіазепін-1-іл)ацетат До розчину 1,3,4,5-тетрагідробензо[b][1,4]діазепін-2-он (5,0г, 30,8ммоль) в ДМФА (30мл), при -10°С, додавали гідрид натрію (1,35г, 60% дисперсія, 33,9ммоль). Суміш перемішували при -10°С протягом 15хв, потім додавали метил бромацетат (2,92мл, 30,8ммоль). Суміш перемішували при -10°С ще 1г і потім концентрували у вакуумі. Залишок переносили в EtOAc і промивали насиченим водним розчином хлориду натрію (3 рази), сушили над MgSO4 і концентрували у вакуумі. Залишок очищали за допомогою флеш хроматографії на силікагелі (елюент EtOAc) одержуючи білу тверду речовину; вихід 7,08г (98%). 17В. 2-(2,3,4,5-Тетрагідро-1H-1,5-бензодіазепін-1-іл)етанол Метил (2-оксо-[1,3,4,5-тетрагідро-бензо[b][1,4]діазепін-1-іл)ацетат з Прикладу 17А (7,08г, 30,2ммоль) відновлювали алюмогідридом літію згідно до методики Прикладу 15А; вихід 4,33г (75%). 17С. 1-(4-ціано-3-метилбензоїл)-5-(2-гідроксиетил)-2,3,4,5-тетрагідро-1H-1,5-бензодіазепін До розчину карбонової кислоти з Прикладу 1С (1,38г, 8,58ммоль) в дихлорметані (50мл) додавали тіонілхлорид (3,33мл, 43,0ммоль). Суміш перемішували при температурі кипіння протягом 2г і потім випарювали у вакуумі, азеотропували з толуолом (2 рази). Залишок розчиняли в дихлорметані (50мл) і додавали 2-(2,3,4,5-тетрагідро-1Н-1,5-бензодіазепін-1-іл)етанол з Прикладу 17В (1,5г, 7,80ммоль). Суміш перемішували при кімнатній температурі протягом 18г і потім випарювали у вакуумі. Залишок розділяли між EtOAc і насиченим розчином бікарбонату натрію. Органічний шар промивали насиченим водним розчином хлориду натрію, сушили над MgSO4 і концентрували у вакуумі. Залишок розтирали з EtOAc і одержану тверду речовину відфільтровували; вихід 1,25г (48%). 17D. 1-(4-Амінометил-3-метилбензоїл)-5-(2-гідроксиетил)-2,3,4,5-тетрагідро-1H-1,5-бензодіазепін Ціанобензоїлбензодіазепін з Прикладу 17С (1,25г, 3,73ммоль) гідрував згідно до методики Прикладу 1В. Продукт виділяли як вільну основу; вихід 0,94г (74%). 17E. 1-(4-[3-(2,6-Дифторфеніл)уреїдометил]-3-метилбензоїл)-5-(2-гідроксиетил)-2,3,4,5-тетрагідро-1H-1,5бензодіазепін Амін з Прикладу 17D (0,94г, 2,76ммоль) реагував з 2,6-дифторфенілізоціанатом (0,47г, 3,04ммоль) згідно до методики Прикладу 1С. Продукт очищали за допомогою флеш хроматографії на силікагелі (елюент EtOAc); вихід 0,068г (75%). MC: розраховано m/e=494,21; знайдено [М+Н]+=495,2. Приклад 18. 1-(3-Хлор-4-[3-(2,6-дифторфеніл)уреїдометил]бензоїл)-5-метил-2,3,4,5-тетрагідро-1H-1,5-бензодіазепін 18А. 1-Метил-2-оксо-2,3,4,5-тетрагідро-1H-1,5-бензодіазепін До розчину 2,3,4,5-тетрагідро-1Н-1,5-бензодіазепін-2-ону (2,0г, 12,3ммоль) в ДМФА (30мл), при -10°С, додавали гідрид натрію (0,54г, 60% дисперсія, 13,6ммоль). Суміш перемішували при -10°С протягом 15хв, потім додавали метилйодид (0,77мл, 12,3ммоль). Суміш перемішували при -10°С протягом ще 1г і потім концентрували у вакуумі. Залишок переносили в EtOAc і промивали насиченим водним розчином хлориду натрію (З рази), сушили над MgSO4 і концентрували у вакуумі. Залишок очищали за допомогою флеш хроматографії на силікагелі (елюент EtOAc) одержуючи білу тверду речовину; вихід 1,70г (78%). 18В. 1-Метил-2,3,4,5-тетрагідро-1H-1,5-бензодіазепін 1-Метил-2-оксо-2,3,4,5-тетрагідро-1Н-1,5-бензодіазепін з Прикладу 18А (1,7г, 9,65ммоль) відновлювали алюмогідридом літію згідно до методики Прикладу 15А; вихід 1,34г (86%). 18C. 1-(4-[трет-Бутилоксикарбоніламінометил]-3-хлорбензоїл)-5-метил-2,3,4,5-тетрагідро-1H-1,5бензодіазепін Карбонова кислота з Прикладу А2 (0,506г, 1,77ммоль) реагувала з 1-метил-2,3,4,5-тетрагідро-1Н-1,5бензодіазепіном з Прикладу 18В (0,24г, 1,48ммоль) згідно до методики Прикладу 1А. Продукт очищали за допомогою флеш хроматографії на силікагелі (елюент EtOAc:пет. ефір 50:50); вихід 0,30г (47%). 18D. 1-(4-Амінометил-3-хлорбензоїл)-5-метил-2,3,4,5-тетрагідро-1Н-1,5-бензодіазепін ВОС-амінометилбензоїлбензазодіазепін з Прикладу 18С (0,30г, 0,698ммоль) реагував згідно до методики Прикладу 4В. Продукт виділяли як НСІ сіль; вихід 0,25г (98%). 18Е. 1-(3-Хлор-4-[3-(2,6-дифторфеніл)уреїдометил]бензоїл)-5-метил-2,3,4,5-тетрагідро-1H-1,5бензодіазепін Гідрохлорид аміну з Прикладу 18D (0,060г, 0,164ммоль) реагував з 2,6-дифторфенілізоціанатом (0,021г, 0,164ммоль) згідно до методики Прикладу 1С. Продукт очищали розтираючи з діетиловим етером і одержували білу тверду речовину; вихід 0,058г (87%). MC: розраховано m/e=484,15; знайдено [М+Н]+; 35СІ=485,1. Приклад 19. 1-(4-[3-(2,6-Дифторфеніл)уреїдометил]-2-метилбензоїл)-5-метил-2,3,4,5-тетрагідро-1Н-1,5-бензодіазепін 19А. 1-(4-ціано-2-метилбензоїл)-5-метил-2,3,4,5-тетрагідро-1Н-1,5-6ензодіазепіну гідрохлорид Карбонова кислота з Прикладу D (0,50г, 3,10ммоль) реагувала з 1-метил-2,3,4,5-тетрагідро-1Н-1,5бензодіазепіном з Прикладу 18В (0,46г, 2,80ммоль) згідно до методики Прикладу 1А. Продукт очищали за допомогою флеш хроматографії на силікагелі (елюент EtOAc:пет. ефір 30:70-70:30); вихід 0,27г (32%). 19В. 1-(4-Амінометил-2-метилбензоїл)-5-метил-2,3,4,5-тетрагідро-1Н-1,5-бензодіазепіну гідрохлорид Ціанобензоїлбензазепін з Прикладу 19А (0,26г, 0,88ммоль) гідрували згідно до методики Прикладу 1В. Продукт виділяли як НСІ сіль; вихід 0,30г (99%). 19С. 1-(4-[3-(2,6-Дифторфеніл)уреїдометил]-2-метилбензоїл)-5-метил-2,3,4,5-тетрагідро-1H-1,5бензодіазепін Гідрохлорид аміну з Прикладу 19В (0,060г, 0,17ммоль) реагував з 2,6-дифторфенілізоціанатом (0,027г, 0,17ммоль) згідно до методики Прикладу 1С. Продукт очищали за допомогою флеш хроматографії на силікагелі (елюент EtOAc.пет. ефір 80:20); вихід 0,070г (93%). MC: розраховано m/e=464,20; знайдено [М+Н]+=465,2. Приклад 20. 1-(4-[3-(2,6-Дифторфеніл)уреїдометил]-3,5-диметилбензоїл)-2,3,4,5-тетрагідро-1Н-1-бензазепін 20А. 1-(4-ціано-3,5-диметилбензоїл)-2,3,4,5-тетрагїдро-1Н-1-бензазепін Карбонова кислота з Прикладу 12 (0,49г, 2,80ммоль) реагувала з 2,3,4,5-тетрагідро-1Н-1-бензазепіном (0,39г, 2,63ммоль) згідно до методики Прикладу 17С. Продукт очищали за допомогою флеш хроматографії на силікагелі (елюент EtOAc:пет. ефір 30:70); вихід 0,66г (77%). 20В. 1-(4-Амінометил-3,5-диметилбензоїл)-2,3,4,5-тетрагідро-1Н-1-бензазепін Нітрил з Прикладу 20А (0,65г, 2,12ммоль) відновлювали згідно до методики Прикладу 16С; вихід 0,42г (64%). 20С. 1-(4-[3-(2,6-Дифторфеніл)уреїдометил]-3,5-диметилбензоїл)-2,3,4,5-тетрагідро-1H-1-бензазепін Амін з Прикладу 20В (0,070г, 0,23ммоль) реагував з 2,6-дифторфенілізоціанатом (0,043г, 0,28ммоль) згідно до методики Прикладу 1С. Продукт очищали за допомогою флеш хроматографії на силікагелі (елюент EtOAc:пет. ефір 40:60); вихід 0,033г (31%). MC: розраховано m/e=463,21; знайдено [М+Н]+=464,2. Приклад 21. 1-(2-Хлор-6-[3-(2,6-дифторфеніл)уреїдометил]нікотиноїл)-2,3,4,5-тетрагідро-1Н-1-бензазепін 21А. 1-(6-[трет-Бутиламінометил]-2-хлорнікотиноїл)-2,3,4,5-тетрагідро-1H-1-бензазепін Карбонова кислота з Прикладу F3 (0,50г, 1,74ммоль) реагувала з 2,3,4,5-тетрагідро-1Н-1-бензазепіном (0,26г, 1,74ммоль) згідно до методики Прикладу 1А. Продукт очищали за допомогою флеш хроматографії на силікагелі (елюент EtOAc.пет. ефір 55:45); вихід 0,038г (5%). 21В. 1-(6-Амінометил-2-хлорнікотиноїл)-2,3,4,5-тетрагідро-1Н-1-бензазепіну гідрохлорид ВОС-амінометилнікотиноїлбензазепін з Прикладу 21А (0,036г, 0,074ммоль) реагував згідно до методики Прикладу 4В. Продукт виділяли як НСІ сіль; вихід 0,026г (98%). 21С. 1-(2-Хлор-6-[3-(2,6-дифторфеніл)уреїдометил]нікотиноїл)-2,3,4,5-тетрагідро-1Н-1-бензазепін Гідрохлорид аміну з Прикладу 21В (0,026г, 0,073ммоль) реагував з 2,6-дифторфенілізоціанатом (0,014г, 0,08ммоль) згідно до методики Прикладу 1С. Продукт очищали за допомогою флеш хроматографії на силікагелі (елюент EtOAc:пет. ефір 90:10); вихід 0,031г (90%). MC: розраховано m/e=470,13; знайдено [М+Н]+; 35СІ=471,1. Приклад 22. 1-(6-[3-(2,6-Дифторфеніл)уреїдометил]-1-метил-2-оксо-1,2-дигідропіриділ-3-карбоніл)-2,3,4,5-тетрагідро1H-1-бензазепін 22А. 1-(4/5-Бром-6-[трет-бутилоксикарбоніламінометил]-1-метил-2-оксо-1,2-дигідропіридил-3-карбоніл)2,3,4,5-тетрагідро-1Н-1-бензазепін Карбонова кислота з Прикладу Н3 (1,30г, 3,60ммоль) реагувала з 2,3,4,5-тетрагідро-1Н-1-бензазепіном (0,53г, 3,60ммоль) згідно до методики Прикладу 1А. Продукт очищали за допомогою флеш хроматографії на силікагелі (елюент EtOAc:пет. ефір 60:40); вихід 0,70г (40%). 22В. 1-(4/5-Бром-6-[трет-бутилоксикарбоніламінометил]-1-метил-2-оксо-1,2-дигідропіридил-3-карбоніл)2,3,4,5-тетрагідро-1H-1-бензазепін Бензазепін з Прикладу 22А (0,60г, 1,23ммоль) гідрували згідно до методики Прикладу 12А; вихід 0,50г (99%). 22С. 1-(6-Амінометил-1-метил-2-оксо-1,2-дигідропіридил-3-карбоніл)-2,3,4,5-тетрагідро-1H-1-бензазепіну гідрохлорид ВОС-амінометилпіридон з Прикладу 22В (0,50г, 1,22ммоль) реагував згідно до методики Прикладу 4В. Продукт виділяли як НСІ сіль; вихід 0,43г (99%). 22D. 1-(6-[3-(2,6-Дифторфеніл)уреїдометил]-1-метил-2-оксо-1,2-дигідропіриділ-3-карбоніл)-2,3,4,5тетрагідро-1H-1-бензазепін Гідрохлорид аміну з Прикладу 22С (0,050г, 0,144ммоль) реагував з 2,6-дифторфенілізоціанатом (0,025г, 0,144ммоль) згідно до методики Прикладу 1С. Продукт очищали за допомогою флеш хроматографії на силікагелі (елюент EtOAc:метанол 90:10); вихід 0,064г (95%). MC: розраховано m/e=466,18; знайдено [М+Н]+=467,2. Приклад 23. 1-(4-[3-(2,6-Дифторфеніл)уреїдометил]-3-метилбензоїл)-5-етил-2,3,4,5-тетрагідро-1Н-1,5-бензодіазепін 23А. 1-Етил-2-оксо-2,3,4,5-тетрагідро-1Н-1,5-бензодіазепін 2-Оксо-2,3,4,5-тетрагідро-1Н-1,5-бензодіазепін (1,95г, 11,96ммоль) реагував з етилйодидом (1,4мл, 17,5ммоль) згідно до методики Прикладу 18А. Продукт очищали за допомогою флеш хроматографії на силікагелі (елюент EtOAc); вихід 1,70г (75%). 23В. 1-Етил-2,3,4,5-тетрагідро-1H-1,5-бензодіазепін 1-Етил-2-оксо-2,3,4,5-тетрагідро-1Н-1,5-бензодіазепін з Прикладу 23А (1,7г, 8,94ммоль) відновлювали алюмогідридом літію згідно до методики Прикладу 15А; вихід 1,55г (98%). 23С. 1-(4-ціано-3-метилбензоїл)-5-етил-2,3,4,5-тетрагідро-1H-1,5-бензодіазепін Карбонова кислота з Прикладу С (0,53г, 3,29ммоль) реагувала з 1-етил-2,3,4,5-тетрагідро-1H-1,5бензодіазепіном з Прикладу 23В (0,514г, 2,92ммоль) згідно до методики Прикладу 1А. Продукт очищали за допомогою флеш хроматографії на силікагелі (елюент EtOAc:пет. ефір 60:40); вихід 0,55г (59%). 23D. 1-(4-Амінометил-3-метилбензоїл)-5-етил-2,3,4,5-тетрагідро-1H-1,5-бензодіазепіну гідрохлорид Нітрил з Прикладу 23С (0,55г, 1,73ммоль) гідрували згідно до методики Прикладу 1В. Продукт виділяли як НСІ сіль; вихід 0,60г (96%). 23E. 1-(4-[3-(2,6-Дифторфеніл)уреїдометил]-3-метилбензоїл)-5-етил-2,3,4,5-тетрагідро-1H-1,5бензодіазепін Гідрохлорид аміну з Прикладу 23D (0,071г, 0,20ммоль) реагував з 2,6-дифторфенілізоціанатом (0,038г, 0,25ммоль) згідно до методики Прикладу 1С. Продукт очищали за допомогою флеш хроматографії на силікагелі (елюент EtOAc:пет. ефір 50:50-100:0); вихід 0,044г (46%). MC: розраховано m/e=478,22; знайдено [М+Н]+=479,2. Приклад 24. 5-(4-[3-(2,6-Дифторфеніл)уреїдометил]-3-метилбензоїл)-6,7,8,9-тетрагідро-5Н-піридо[2,3-b]азепін 24А. 5-(4-Ціано-3-метилбензоїл)-6,7,8,9-тетрагідро-5Н-піридо[2,3-b]азепін Карбонова кислота з Прикладу С (0,36г, 2,26ммоль) реагувала з 6,7,8,9-тетрагідро-5Н-піридо[2,3b]азепіном (0,33г, 2,23ммоль) згідно до методики Прикладу 17С. Продукт очищали за допомогою флеш хроматографії на силікагелі (елюент EtOAc:пет. ефір 80:20); вихід 0,47г (73%). 24В. 5-(4-Амінометил-3-метилбензоїл)-6,7,8,9-тетрагідро-5Н-піридо[2,3-b]азепін Ціанобензоїлпіридоазепін з Прикладу 24А (0,46г, 1,58ммоль) гідрували згідно до методики Прикладу 1В. Продукт виділяли як вільну основу; вихід 0,28г (60%). 24С. 5-(4-[3-(2,6-Дифторфеніл)уреїдометил]-3-метилбензоїл)-6,7,8,9-тетрагідро-5Н-піридо[2,3-b]азепін Амін з Прикладу 24В (0,071г, 0,20ммоль) реагував з 2,6-дифторфенілізоціанатом (0,035г, 0,23ммоль) згідно до методики Прикладу 1С. Продукт очищали за допомогою флеш хроматографії на силікагелі (елюент EtOAc); вихід 0,020г (19%). MC: розраховано m/e=450,19; знайдено [М+Н]+=451,2 Приклад 25. 5-(4-[3-(2,6-Дифторфеніл)уреїдометил]-3-метилбензоїл)-1-оксо-1l4-2,3,4,5-тетрагідро-1,5-бензотіазепін 25А. 5-(4-Ціано-3-метилбензоїл)-2,3,4,5-тетрагідро-1,5-бензотіазепін Карбонова кислота з Прикладу С (0,27г, 1,68ммоль) реагувала з 2,3,4,5-тетрагідро-1,5-бензотіазепіном (0,28г, 1,70ммоль) згідно до методики Прикладу 1А. Продукт очищали за допомогою флеш хроматографії на силікагелі (елюент EtOAc:пет. ефір 60:40); вихід 0,43г (84%). 25В. 5-(4-Амінометил-3-метилбензоїл)-2,3,4,5-тетрагідро-1,5-бензотіазепін Ціанобензоїлбензотіазепін з Прикладу 25А (0,43г, 1,40ммоль) гідрували згідно до методики Прикладу 1В. Продукт виділяли як вільну основу; вихід 0,10г (29%). 25С. 5-(4-[3-(2,6-Дифторфеніл)уреїдометил]-3-метилбензоїл)-2,3,4,5-тетрагідро-1,5-бензотіазепін Амін з Прикладу 25В (0,10г, 0,32ммоль) реагував з 2,6-дифторфенілізоціанатом (0,061г, 0,39ммоль) згідно до методики Прикладу 1С. Продукт очищали розтираючи з діетиловим етером і одержували білу тверду речовину; вихід 0,112г (75%). 25D. 5-(4-[3-(2,6-Дифторфеніл)уреїдометил]-3-метилбензоїл)-1-оксо-1l4-2,3,4,5-тетрагідро-1,5бензотіазепін До суспензії тіазепіну з Прикладу 25С (0,15г, 0,33ммоль) в метанолі (40мл), дихлорметані (10мл) і воді (10мл) додавали перйодат натрію (0,21г, 0,99ммоль). Суміш перемішували при кімнатній температурі протягом 70г і потім фільтрували. Фільтрат випарювали у вакуумі і залишок очищали за допомогою флеш хроматографії на силікагелі (елюент EtOAc); вихід 0,013г (8%). MC: розраховано m/e=483,14; знайдено [М+Н]+=484,1. Приклад 26. 4-(4-[3-(2,6-Дифторфеніл)уреїдометил]-3-метилбензоїл)-5,6,718-тетрагідро-4Н-тіено[3,2-b]азепін 26А. 4-(4-Ціано-3-метилбензоїл)-5,6,7,8-тетрагідро-4Н-тієно[3,2-b]азепін Карбонова кислота з Прикладу С (0,50г, 3,10ммоль) реагувала з 5,6,7,8-тетрагідро-4Н-тієно[3,2-b]азепіном (0,45г, 2,95ммоль) згідно до методики Прикладу 1А. Продукт очищали перекристалізацією з EtOAc:пет. ефір; вихід 0,48г (55%). 26В. 4-(4-Амінометил-3-метилбензоїл)-5,6,7,8-тетрагідро-4Н-тієно[3,2-b]азепін Нітрил з Прикладу 26А (0,48г, 1,60ммоль) відновлювали згідно до методики Прикладу 16С; вихід 0,16г (33%). 26С. 4-(4-[3-(2,6-Дифторфеніл)уреїдометил]-3-метилбензоїл)-5,6,7,8-тетрагідро-4Н-тієно[3,2-b]азепін Амін з Прикладу 26В (0,05г, 0,18ммоль) реагував з 2,6-дифторфенілізоціанатом (0,027г, 0,18ммоль) згідно до методики Прикладу 1С. Продукт очищали розтираючи з діетиловим етером і одержували білу тверду речовину; вихід 0,052г (67%). MC: розраховано m/e=455,15 знайдено [М+Н]+=456,1. Приклад 27. 4-(3-Метил-4-[3-(2,3,5,6-тетрафторфеніл)уреїдометил]бензоїл)-5,6,7,8-тетрагідро-4Н-тієно[3,2-b]азепін Амін з Прикладу 26В (0,062г, 0,206ммоль) реагував з 2,3,5,6-тетрафторфенілізоціанатом (0,079г, 0,413ммоль, одержували з аніліну згідно з методикою Kurita. К, et al., J. Org. Chem., 41, 1976, p2070.) згідно до методики Прикладу 1С. Продукт очищали за допомогою флеш хроматографії на силікагелі (елюент EtOAc:пет. ефір 50:50); вихід 0,045г (44%). MC: розраховано m/e=491,13 знайдено [М+Н]+=492,1. Приклад 28. 1-(4-[N-(4-Метокси-4-оксобутаноїл)амінометил]-3-метилбензоїл)-2,3,4,5-тетрагідро-1Н-1-бензазепін 28А. 1-(4-Ціано-3-метилбензоїл)-2,3,4,5-тетрагідро-1H-1-бензазепін До розчину 2,3,4,5-тетрагідро-1Н-1-бензазепіну (0,80г, 5,44ммоль) в дихлорметані (40мл) додавали 4ціано-3-метилбензойну кислоту з Прикладу С (0,96г, 5,95ммоль), триетиламін (0,76г, 5,44ммоль), 4(диметиламіно)піридин (0,66г, 5,44ммоль) і ВРKДІ (2,17г, 10,88ммоль). Суміш перемішували при температурі кипіння протягом 18г, охолоджували і випарювали у вакуумі. Залишок розділяли між EtOAc і 1М KHSO4. Органічний шар промивали насиченим розчином бікарбонату натрію і насиченим водним розчином хлориду натрію, сушили над MgSO4 і концентрували у вакуумі. Залишок очищали за допомогою флеш хроматографії на силікагелі (елюент EtOAc.пет. ефір 30:70); вихід 1,10г (70%). 28В. 1-(4-[Аміном етил]-3-метилбензоїл)-2,3,4,5-тетрагідро-1Н-1-бензазепіну гідрохлорид До дегазованого розчину ціанобензоїлбензазепіну з Прикладу 28А (1,10г, 3,79ммоль) в метанолі (40мл) додавали концентровану хлорводневу кислоту (0,98мл, 11,3ммоль) і 10% паладій на вугіллі (0,80г). Водень барботували крізь суміш протягом 5г при кімнатній температурі. Каталізатор видаляли фільтруванням крізь шар целіту і фільтрат випарювали у вакуумі одержуючи продукт як НСІ сіль; вихід 1,23г (98%). 28С. 1-(4-[N-(4-Метокси-4-оксобутаноїл)аміном етил]-3-метилбензоїл)-2,3,4,5-тетрагідро-1H-1-бензазепін До розчину аміну з Прикладу 28В (0,10г, 0,30ммоль) в дихлорметані (10мл) додавали триетиламін (0,061мл, 0,90ммоль) і 3-карбометоксипропіонілхлорид (0,046г, 0,30ммоль). Суміш перемішували при кімнатній температурі протягом 18г і потім промивали 1М KHSO4 (3 рази), водою і насиченим водним розчином хлориду натрію, сушили над Na2SO4 і концентрували у вакуумі одержуючи білу тверду речовину; вихід 0,10г (81%). MC; розраховано m/e=408; знайдено [М+Н]+=409. Приклад 29 1.(4-[N-(2-Метокси-2-оксоетаноїл)аміном етил]-3-метилбензоїл)-2,3,4,5-тетрагідро-1Н-1-бензазепін Гідрохлорид аміну з Прикладу 28В (0,10г, 0,30ммоль) реагував з метил оксалілхлоридом (0,037г, 0,30ммоль) згідно до методики Прикладу 28С одержуючи білу тверду речовину; вихід 0,085г (76%). MC: розраховано m/e=380; знайдено [М+Н]+=381. Приклад 30 1-(4-[N-(2-Гідрокси-2-оксоетаноїл)амінометил]-3-метилбензоїл)-2,3,4,5-тетрагідро-1Н-1-бензазепін До розчину метилового естеру з Прикладу 29 (0,045г, 0,118ммоль) в ТГФ (10мл) і воді (5мл) додавали моногідрат гідроксиду літію (0,010г, 0,23ммоль). Суміш перемішували при кімнатній температурі протягом 2г, підкислювали до pH 1 додаючи 1М НСІ і екстрагували EtOAc (3 рази). Об'єднані органічні екстракти промивали насиченим водним розчином хлориду натрію, сушили над Na2SO4 і концентрували у вакуумі одержуючи білу тверду речовину; вихід 0,034г (76%). MC: розраховано m/e=366; знайдено [М+Н]+=367. Приклад 31 1-(4-[N-(5-Метокси-5-оксопентаноїл)амінометил]-3-метилбензоїл)-2,3,4,5-тетрагідро-1H-1-бензазепін Гідрохлорид аміну з Прикладу 28В (0,10г, 0,30ммоль) реагував з метил 4-(хлорформіл)бутиратом (0,050г, 0,30ммоль) згідно до методики Прикладу 1С одержуючи білу тверду речовину; вихід 0,061г (48%). MC: розраховано m/e=422; знайдено [М+Н]+=423. Приклад 32 1-(4-[N-(2-Етокси-2-оксоетилкарбамоїл)амінометил]-3-метилбензоїл)-2,3,4,5-тетрагідро-1H-1-бензазепін До розчину аміну з Прикладу 28В (0,10г, 0,30ммоль) в дихлорметані (10мл) додавали триетиламін (0,061мл, 0,90ммоль) і етил ізоціанатоацетат (0,059г, 0,45ммоль). Суміш перемішували при кімнатній температурі протягом 18г і потім промивали 1М KHSO4 (3 рази), водою і насиченим водним розчином хлориду натрію, сушили над Na2SO4 і концентрували у вакуумі одержуючи білу тверду речовину; вихід 0,10г (81%). MC: розраховано m/e=423; знайдено [М+Н]+=424. Приклад 33 1-(4-[N-(Карбоксиметилкарбамоїл)амінометил]-3-метилбензоїл)-2,3,4,5-тетрагідро-1Н-1-бензазепін До розчину етилового естеру з Прикладу 32 (0,050г, 0,10ммоль) в ТГФ (20мл) і воді (5мл) додавали моногідрат гідроксиду літію (0,020г, 0,45ммоль). Суміш перемішували при кімнатній температурі протягом 4г. Суміш концентрували у вакуумі і залишок розводили водою потім промивали діетиловим етером. Водний шар підкислювали pH 1 додаючи 1М НСІ і екстрагували EtOAc (3 рази). Об'єднані органічні екстракти промивали насиченим водним розчином хлориду натрію, сушили над Na2SO4 і концентрували у вакуумі одержуючи білу тверду речовину; вихід 0,046г (99%). MC: розраховано m/e=395; знайдено [М+Н]+=396. Приклад 34 1-(4-[N-(2-Метиламіно-2-оксоетилкарбамоїл)амінометил]-3-метилбензоїл)-2,3,4,5-тетрагідро-1H-1бензазепін До розчину карбонової кислоти з Прикладу 33 (0,10г, 0,25ммоль) в дихлорметані (25мл) додавали DIEA (0,221мл, 1,26ммоль) і РуВrоР (0,129г, 0,278ммоль). Суміш перемішували при кімнатній температурі протягом 10хв і потім додавали гідрохлорид метиламіну (0,085г, 1,26ммоль). Перемішування продовжували протягом 3г. Суміш потім промивали 1М KHSO4 (3 рази), насиченим розчином бікарбонату натрію (3 рази) і насиченим водним розчином хлориду натрію, сушили над Na2SO4 і концентрували в вакуумі. Залишок очищали за допомогою флеш хроматографії на силікагелі (елюент дихлорметан:метанол 96:4) одержуючи білу тверду речовину; вихід 0,018г (17%). MC: розраховано m/e=408; знайдено [М+Н]+=409. Приклад 35 1-(4-[N-(2-Диметиламіно-2-оксоетилкарбамоїл)амінометил]-3-метилбензоїл)-2,3,4,5-тетрагідро-1H-1бензазепін Карбонова кислота з Прикладу 33 (0,07г, 0,18ммоль) реагувала з гідрохлоридом диметиламіну (0,072г, 0,88ммоль) згідно до методики Прикладу 7. Продукт очищали за допомогою флеш хроматографії на силікагелі (елюент хлороформ:метанол:оцтова кислота 98:1:1) одержуючи білу тверду речовину; вихід 0,08г (11%). MC: розраховано m/e=422; знайдено [М+Н]+=423. Приклад 36 1-(4-[N-(2-Метокси-2-оксоетилкарбамоїл)амінометил]-3-метилбензоїл)-2,3,4,5-тетрагідро-1H-1-бензазепін До розчину карбонової кислоти з Прикладу 33 (0,050г, 0,20ммоль) в атмосфері азоту в дихлорметані (25мл) при 0°С додавали ДМФА (20мкл) і оксалілхлорид (31мг, 0,24ммоль). Суміш перемішували при температурі від 0°С до кімнатної температури протягом 2г і потім концентрували у вакуумі. Залишок розчиняли в метанолі (4мл) і дихлорметані (16мл) і суміш перемішували при кімнатній температурі протягом 16г. Суміш потім промивали 1М KHSO4 (3 рази), насиченим розчином бікарбонату натрію (З рази) і насиченим водним розчином хлориду натрію, сушили над Na2SO4 і концентрували у вакуумі. Залишок очищали за допомогою флеш хроматографії на силікагелі (елюент дихлорметан:метанол 96:4) одержуючи білу тверду речовину; вихід 0,049г (60%). MC: розраховано m/e=409; знайдено [М+Н]+=410. Приклад 37 1-(4-[N-(2-Аміно-2-оксоетилкарбамоїл)амінометил]-3-метилбензоїл)-2,3,4,5-тетрагідро-1H-1-бензазепін До розчину карбонової кислоти з Прикладу 33 (0,10г, 0,25ммоль) в дихлорметані (20мл) додавали гідроксибензтриазол (34мг, 0,25ммоль) і ВРКДІ (51мг, 0,25ммоль). Суміш перемішували при кімнатній температурі протягом 10хв. Потім додавали аміак 880 (0,5мл) і перемішували реакційну суміш 16г. Суміш концентрували у вакуумі і залишок очищали за допомогою флеш хроматографії на силікагелі (елюент етилацетат) одержуючи білу тверду речовину; вихід 0,008г (8%). MC: розраховано m/e=394; знайдено [М+Н]+=395. Приклад 38 4-(4-[N-(4-Метокси-4-оксобутаноїл)амінометил]-3-хлорбензоїл)-5,6,7,8-тетрагідро-4Н-тієно[3,2-b]азепін 38А. 4-(4-[N-(трет-Бутилоксикарбоніл)амінометил]-3-хлорбензоїл)-5,6,7,8-тетрагідро-4Н-тієно[3,2-b]азепіну гідрохлорид Карбонова кислота з Прикладу А2 (0,60г, 2,10ммоль) реагувала з 5,6,7,8-тетрагідро-4Н-тієно[3,2b]азепіном (0,28г, 1,80ммоль) згідно до методики Прикладу 28А. Продукт очищали за допомогою флеш хроматографії на силікагелі (елюент EtOAcпет. ефір 40:60) одержуючи жовту тверду речовину. 38В. 4-(4-[Амінометил]-3-хлорбензоїл)-5,6,7,8-тетрагідро-4Н-тіено[3,2-b]азепіну гідрохлорид ВОС амін з Прикладу 38А розчиняли в 4N НСІ/діоксан (30мл). Суміш перемішували при кімнатній температурі протягом 40хв потім концентрували у вакуумі одержуючи жовто-коричневу тверду речовину; вихід 0,41г (63%, після 2 стадій). 38С. 4-(4-[N-(4-Метокси-4-оксобутаноїл)амінометил]-3-хлорбензоїл)-5,6,7,8-тетрагідро-4Н-тіено[3,2b]азепін До розчину аміну з Прикладу 38В (0,032г, 0,08ммоль) в дихлорметані (10мл) додавали триетиламін (0,025мл, 0,18ммоль) і 3-карбометоксипропіонілхлорид (0,014г, 0,08ммоль). Суміш перемішували при кімнатній температурі протягом 18г і потім промивали 1М KHSO4 (3 рази), водою і насиченим водним розчином хлориду натрію, сушили над Na2SO4 і концентрували у вакуумі. Залишок очищали за допомогою флеш хроматографії на силікагелі (елюент EtOAc:пет. ефір 50:50-90:10); вихід 0,022г (56%). MC: розраховано m/e=434; знайдено [М+Н]+ 35СІ=435. Приклад 39 1-(2-Метил-4-(2,3,4,5-тетрагідро-1-бензазепін-1-ілкарбоніл)бензилкарбамоїл)-L-пpoлiн-N,N-димeтилaмiд 39А. 2-Метил-4-((2,3,4,5-тетрагідро-1Н-бензо[b]азепін)-1-карбоніл)-бензонітрил. До розчину 2,3,4,5-тетрагідро-1Н-бензо[b]азепіну (0,80г, 5,44ммоль) в дихлорметані (50мл) додавали 4ціано-3-метилбензойну кислоту (0,96г, 5,95ммоль), триетиламін (0,60г, 5,95ммоль), 4-(диметиламіно)піридин (0,73г, 5,95ммоль) і ВРКДІ (1,24г, 6,48ммоль). Суміш перемішували при температурі кипіння протягом 18г, охолоджували і випарювали у вакуумі. Залишок розділяли між EtOAc і 1М KHSO4. Органічний шар промивали насиченим розчином бікарбонату натрію і насиченим водним розчином хлориду натрію, сушили над MgSO4 і концентрували у вакуумі. Неочищений матеріал очищали за допомогою флеш хроматографії на силікагелі (елюент EtOAc:пет. ефір 30:70); вихід 1,10г (70%). 39В. 1-(4-(Амінометил)-3-метилбензоїл)-2,3,4,5-тетрагідро-1H-бензо[b]азепіну гідрохлорид. До дегазованого розчину ціанобензазепіну Прикладу 39А (1,10г, 3,79ммоль) в метанолі (50мл) додавали концентровану хлорводневу кислоту (0,98мл, 11,3ммоль) і 10% паладій на вугіллі (0,80г). Водень барботували крізь суміш протягом 5г при кімнатній температурі. Каталізатор видаляли фільтруванням крізь шар целіту і фільтрат випарювали; вихід 1,23г (98%). 39C. 1-(2-Метил-4-(2,3,4,5-тетрагідро-1-бензазепін-1-ілкарбоніл)бензилкарбамоїл)-L-пролін-N,Nдиметиламід До розчину аміну Прикладу 39В (0,10г, 0,302ммоль) в ДМФА (10мл), в атмосфері азоту, додавали N,Nдизопроптетиламiн (43мг, 0,332ммоль) і карбонілдіімідазол (0,074г, 0,453ммоль). Суміш перемішували при кімнатній температурі протягом 40 хвилин. Додавали розчин пролін-N,N-диметиламіду (0,107г, 0,756ммоль) в ДМФА (1мл). Суміш перемішували при кімнатній температурі протягом ще 16г. Розчинник видаляли у вакуумі і неочищений матеріал очищали за допомогою флеш хроматографії на силікагелі (елюент метанол:дихлорметан 5:95); вихід 0,115г (82%). MC: розраховано m/e=462,26; знайдено [М+Н]+=463,2 Приклад 40 (4R)-4-Гідрокси-1-(2-метил-4-(2,3,4,5-тетрагідро-1-бензазепін-1-ілкарбоніл)бензил-карбамоїл)-L-пролінN,N-диметиламід 40А. L-транс-4-Гідроксипролін-N,N-диметиламіду гідрохлорид До розчину ВОС-гідроксипроліну (2,99г, 13,89ммоль) в дихлорметані (100мл) додавали N,Nдіізопропілетиламін (3,7мл, 21,24ммоль), 4-(диметиламіно)піридин (1,74г, 14,24ммоль), гідрохлорид диметиламіну (1,72г, 21,09ммоль) і ВРКДІ (3,17г, 16,68ммоль). Суміш перемішували при кімнатній температурі протягом 30г. Суміш розводили дихлорметаном (100мл) і промивали 0,3М KHSO4, насиченим розчином бікарбонату натрію і насиченим водним розчином хлориду натрію, сушили над MgSO4 і концентрували у вакуумі одержуючи безбарвну гупоподібну речовину. Цей неочищений продукт переносили в 4N НСІ/діоксан (50мл) і перемішували при кімнатній температурі протягом 1г і потім концентрували у вакуумі. Залишок азеотропували з толуолом і діетиловим етером одержуючи білу тверду речовину; вихід 0,45г (17%). 40В. (4R)-4-Гідрокси-1-(2-метил-4-(2,3,4,5-тетрагідро-1-бензазепін-1-ілкарбоніл)бензилкарбамоїл)-Lпролін-N,N-диметиламід. Амін Прикладу 39В (0,10г, 0,302ммоль) реагував з аміном Прикладу 40А (0,153мг, 0,785ммоль) за методикою Прикладу 39С. Продукт очищали за допомогою флеш хроматографії на силікагелі (елюент хлороформ:метанол:оцтова кислота 95:4:1); вихід 0,95г (66%). MC: розраховано m/e=478,26; знайдено [М+Н]+=479,2 Використовуючи приведені вище методики одержували приведені далі сполуки. Таблиця А - Приклади 41-44
ДивитисяДодаткова інформація
Назва патенту англійськоюCondensed azepins derivatives and use thereof as antidiuretic agents
Назва патенту російськоюПроизводные конденсированных азепинов и их использование как антидиуретических агентов
МПК / Мітки
МПК: A61P 13/02, A61P 13/00, A61K 31/551, C07D 471/04, C07D 403/12, A61K 31/5517, C07D 519/00, C07D 498/04, A61K 31/5513, C07D 243/12, C07D 243/14, C07D 401/12, C07D 495/04, A61K 31/554, A61P 43/00, C07D 487/04, C07D 255/00, C07D 223/00, C07D 413/12, A61K 31/553, A61K 31/55, A61P 25/00, C07D 267/00, C07D 281/00, C07D 401/06
Мітки: агентів, використання, антидіуретичних, азепінів, похідні, конденсованих
Код посилання
<a href="https://ua.patents.su/39-73177-pokhidni-kondensovanikh-azepiniv-i-kh-vikoristannya-yak-antidiuretichnikh-agentiv.html" target="_blank" rel="follow" title="База патентів України">Похідні конденсованих азепінів і їх використання як антидіуретичних агентів</a>
Попередній патент: Спосіб нанесення антибіотикового покриття на вироби зі сполученими між собою мікропорожнинами (варіанти), виріб (варіанти)
Наступний патент: Мобільний комунікаційний пристрій, спосіб для автентифікації об’єкта, блок та система для автентифікації об’єкта і пристрій для автентифікації
Випадковий патент: Засіб з амізоном для лікування захворювань пародонта та слизової оболонки порожнини рота у вигляді полімерної плівки