Похідні 4-діариламінопіперидину, їх використання, фармацевтична композиція на їх основі, спосіб лікування (варіанти), проміжна сполука
Формула / Реферат
1. Сполука формули І
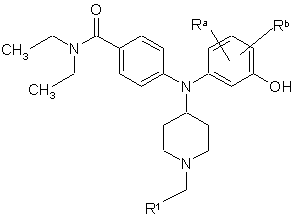 , (І)
, (І)
де
R1 вибрано з групи, яка складається з
(і) фенілу;
(іі) піридинілу
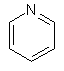 ;
;
(ііі) тієнілу
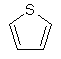 ;
;
(iv) фурилу
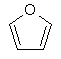 ;
;
(v) імідазолілу
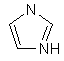 ;
;
(vi) триазолілу
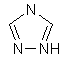 ;
;
де кожне фенільне кільце R1 і гетероароматичне кільце R1 може бути як варіант і, незалежно, крім того, заміщеним 1, 2 або 3 замісниками, вибраними з лінійних та розгалужених С1-С6алкілу, NО2, CF3, С1-С6алкоксилу, хлору, флуору, брому та йоду,
замісники на фенільному кільці та гетероароматичному кільці можуть знаходитися у будь-якій позиції на зазначених кільцевих системах;
Rа та Rb кожне і незалежно вибране з групи, яка складається з гідрогену, лінійного та розгалуженого С1-С6алкілу, NО2, СF3, С1-С6алкоксилу, хлору, флуору, брому та йоду;
а також її фармацевтично прийнятні солі.
2. Сполука за п. 1, яка відрізняється тим, що Ra та Rb обидва є гідрогеном.
3. Сполука за п. 1 або 2, яка відрізняється тим, що кожне фенільне кільце R1 і гетероароматичне кільце R1 може бути як варіант і незалежно, крім того, заміщеним 1, 2 або 3 замісниками, вибраними з лінійних та розгалужених С1-С6алкілу, NО2, CF3, С1-С6алкоксилу, хлору, флуору, брому та йоду.
4. Сполука, вибрана з;
N,N-діетил-4-[[(3-гідроксифеніл)[1-(фенілметил)-4-піперидиніл]аміно]бензаміду;
N,N-діетил-4-[(2-бром-5-гідроксифеніл)[1-(фенілметил)-4-піперидиніл]аміно]бензаміду;
N,N-діетил-4-[(5-гідрокси-2-йодфеніл)[1-(фенілметил)-4-піперидиніл]аміно]бензаміду;
4-[(2-хлор-5-гідроксифеніл)[1-(фенілметил)-4-піперидиніл]аміно]-N,N-діетилбензаміду;
N,N-діетил-4-[(2-флуор-5-гідроксифеніл)[1-(фенілметил)-4-піперидиніл]аміно]бензаміду;
N,N-діетил-4-[[1-(3-фуранілметил)-4-піперидиніл](3-гідроксифеніл)аміно]бензаміду;
N,N-діетил-4-[(3-гідроксифеніл)[1-(3-тієнілметил)-4-піперидиніл]аміно]бензаміду;
N,N-діетил-4-[(3-гідроксифеніл)[1-[[4-(трифлуорметил)феніл]метил]-4-піперидиніл]аміно]бензаміду;
N,N-діетил-4-[(3-гідроксифеніл)[1-[(4-йодфеніл)метил]-4-піперидиніл]аміно]бензаміду;
N,N-діетил-4-[[1-[(4-бромфеніл)метил]-4-піперидиніл](3-гідроксифеніл)аміно]бензаміду;
N,N-діетил-4-[[1-[(4-хлорфеніл)метил]-4-піперидиніл](3-гідроксифеніл)аміно]бензаміду;
N,N-діетил-4-[[1-[(4-флуорфеніл)метил]-4-піперидиніл](3-гідроксифеніл)аміно]бензаміду;
4-[[1-[(2,4-дихлорфеніл)метил]-4-піперидиніл](3-гідроксифеніл)аміно]-N,N-діетилбензаміду;
N,N-діетил-4-[[1-[(3-флуорфеніл)метил]-4-піперидиніл](3-гідроксифеніл)аміно]бензаміду;
N,N-діетил-4-[[1-[(2-флуорфеніл)метил]-4-піперидиніл](3-гідроксифеніл)аміно]бензаміду; і
N,N-діетил-4-[(3-гідроксифеніл)[1-[(4-метилфеніл)метил]-4-піперидиніл]аміно]бензаміду.
5. Сполука за будь-яким з попередніх пунктів, у формі її солі гідрохлориду, сульфату, тартрату або цитрату.
6. Сполука за будь-яким з пп. 1-5 для використання у терапії.
7. Сполука за п. 6, яка відрізняється тим, що терапія охоплює вгамування болю.
8. Сполука за п. 6, яка відрізняється тим, що терапію призначають для шлунково-кишкових розладів.
9. Сполука за п. 6, яка відрізняється тим, що терапію призначають для пошкоджень спинного мозку.
10. Сполука за п. 6, яка відрізняється тим, що терапію призначають для розладів симпатичної нервової системи.
11. Використання сполуки за п. 1 у виготовленні медикаменту для використання при вгамуванні болю.
12. Використання сполуки за п. 1 у виготовленні медикаменту для використання у лікуванні шлунково-кишкових розладів,
13. Використання сполуки за п. 1 у виготовленні медикаменту для використання у лікуванні пошкоджень спинного мозку.
14. Фармацевтична композиція, яка містить сполуку за п. 1, як активний інгредієнт, разом з фармакологічно і фармацевтично прийнятним носієм.
15. Спосіб лікування болю, який полягає у тому, що ефективну кількість сполуки за п. 1 уводять пацієнту для вгамування болю.
16. Спосіб лікування шлунково-кишкових розладів, який полягає у тому, що ефективну кількість сполуки за п. 1 уводять пацієнту, який страждає від шлунково-кишкового розладу.
17. Спосіб лікування пошкоджень спинного мозку, який полягає у тому, що ефективну кількість сполуки за п. 1 уводять пацієнту, який страждає від зазначеного пошкодження спинного мозку.
18. Сполука формули II
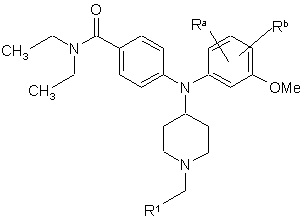 , (ІІ)
, (ІІ)
де
R1 вибрано з групи, яка складається з
(і) фенілу;
(іі) піридинілу
 ;
;
(ііі) тієнілу
 ;
;
(iv) фурилу
 ;
;
(v) імідазолілу
 ;
;
(vi) триазолілу
 ;
;
де кожне фенільне кільце R1 і гетероароматичне кільце R1 може бути як варіант і незалежно, крім того, заміщеним 1, 2 або 3 замісниками, вибраними з лінійних та розгалужених С1-С6алкілу, NО2, CF3, С1-С6алкоксилу, хлору, флуору, брому та йоду, замісники на фенільному кільці та гетероароматичному кільці можуть знаходитися у будь-якій позиції на зазначених кільцевих системах; Rа та Rb кожне і незалежно вибране з групи, яка складається з гідрогену, лінійних та розгалужених С1-С6алкілу, NO2, CF3, C1-С6алкоксилу, хлору, флуору, брому та йоду.
Текст
МПК 7 C07D401/06,405/06,409/06,A61K31/4468,31/4525,31/4535,31/454.А61Р25/04 Винахід стосується нових сполук, способу їх виго товлення, їх використання, а також фармацевтичних композицій, які містять нові сполуки. Нові сполуки придатні для використання у терапії, і зокрема для вгамування болю. d-рецептор було визначено як такий, що відіграє роль у здійсненні багатьох фізичних функцій, наприклад, відповідає за системи циркуляції та болю. Тому, ліганди для d-рецептору можуть виявитися потенційно корисними як аналгетики, та/або як гіпотензивні засоби. Ліганди для d-рецептору також було виявлено як такі, що мають імуномодуляторну активність. Зараз добре визначено щонайменше три різні популяції опіоїдних рецепторів (m,d і к), і всі вони наявні у центральній і периферійній нервових системах багатьох видів, включно з людиною. Аналгезію спостерігали у багатьох моделях тварин, коли було активовано один або більше таких рецепторів. За деяким винятком, наявні зараз селективні опіоїдні д ліганди є пептидними за своєю природою і не придатні для уведення системними шляхами. Одним прикладом непептидного d-агоністу є SNC80 (ВіІСку E.J. et al., Journal of Рhаrmacolоgу and ЕхреrімеntаІ TherapeuticC, 273(1), pp. 359-366 (1995 J). Однак, все ще існує потреба у селективних d-агоністах, які мають не лише удосконалену селективність, але й удосконалений профіль побічної дії. Отже, проблема даного винаходу полягала у тому, щоб винайти нові аналгетики, що мають удосконалену аналгезивну дію, з удосконаленим профілем побічної дії, на відміну від наявних зараз m-агоністів, і удосконалену системну ефективність. Аналгетики, які було визначено, і, які присутні у рівні техніки, мають багато недоліків у тому, що мають погану фармакокінетику і не є аналгезивними, якщо уводити їх системними шляхами. Також, було задокументовано, що бажані сполуки d-агоністу, описані у рівні техніки, виявляють значну конвульсивну дію. Ми зараз виявили, що певні сполуки, які недостатньо описані, але включені до WO 98/28270, виявляють надзвичайно удосконалені властивостіd -агоністу та потенційність in vivo, якщо уводити їх системно. На відміну від сполук, описаних в W098/28270, сполуки даного винаходу виявляють значні та несподівано збільшені рівні агонізму g-рецептору та метаболічної стабільності. Нові сполуки згідно з винаходом визначено за формулою І де R1 вибрано з групи, яка складається з (і) фенілу; (іі) піридинілу (ііі) тіофенілу (iv) фуранілу (v) імідазолілу І (vi) триазолілу де кожне фенільне кільце R1 і гетероароматичне кільце R1 може бути, як варіант і незалежно крім того заміщеним 1, 2 або 3 замісниками, вибраними з лінійних та розгалужених С 1-С6алкілу, NO2, CF 3, С1С6алкоксилу, хлор у, флуор у, брому та йоду. Замісники на фенільному кільці та гетероароматичному кільці можуть знаходитися у будь-якій позиції на зазначених кільцевих системах; Ra та Rb кожне і незалежно вибране з групи, яка складається з гідрогену, лінійного та розгалуженого С 1С6алкілу, NO2, CF3 , С4-С6алкоксилу, хлору, флуору, брому та йоду. Ra тa R b замісники можуть бути розміщені у будь-якій одній орто-, мета- і пара-позиції фенольного кільця. Переважно, Ra та Rb обидва є гідрогеном. В рамках винаходу також передбачено фармацевтично прийнятні солі сполук формули І. Коли фенільне і гетероароматичне кільце(я) заміщено, бажані замісники вибрано з групи, яка складається з CF3, метилу, йоду, брому, флуору та хлору. Нові сполуки згідно з винаходом придатні для використання у терапії, зокрема для вгамування різних станів болю, наприклад, хронічного, невропатологічного, різкого, болю, викликаного раком, болю, викликаного ревматичним артритом, мігренню, вісцерального болю, та інших видів болю. Однак, цей список не можна вважати обмеженим. Сполуки згідно з винаходом придатні для використання як імуномодулятори, зокрема для лікування автоімунних захворювань, наприклад, артриту, трансплантатів шкіри, трансплантатів органів та подібних хірургічни х потреб, для лікування колагенових захворювань, алергій різного виду, для використання як антиракових та антивірусних засобів. Сполуки згідно з винаходом придатні для використання у станах захворювання, де присутня або включена у таку парадигму дегенерація або дисфункція опіоїдних рецепторів. Це може включати використання мічених ізотопами сполук згідно з винаходом при застосуванні в діагностиці та візуалізації, наприклад, при застосуванні позитронної емісійної томографії (ПЕТ) Сполуки згідно з винаходом придатні для використання у лікуванні діареї, депресії, збудження, невтримання сечі, різних психічних захворювань, кашлю, набряку легенів різних шлунково-кишкових розладів, пошкодження спинного мозку та залежності від ліків, а також для лікування зловживання алкоголем, нікотином, опіоїдними та іншими ліками, і для лікування розладів симпатичної нервової системи, наприклад, гіпертонії. Сполуки згідно з винаходом придатні для використання як аналгезивний засіб для використання під час загальної та місцевої анестезій. Комбінації засобів з різними властивостями часто використовують для досягнення рівноваги ефектів, необхідних для підтримання стану анестезії (наприклад, амнезії, аналгезії, релаксації м'язів та седативного ефекту). Також до цієї комбінації входять анестезуючі засоби для вдихання, гіпнотичні засоби, анксіолітики, нервово-м'язові блокатори та опіоїдні засоби. Також, в рамки винаходу входить використання будь-якої зі сполук згідно з вищенаведеної формулою І, у виготовленні медикаменту для лікування будь-якого з вищеописаних станів. Ще одним аспектом винаходу є спосіб лікування пацієнта, який страждає від будь-якого з вищеописаних станів, причому пацієнту, який потребує такого лікування, уводять ефективну кількість сполуки згідно з вищенаведеною формулою І. Також в рамках винаходу передбачено проміжні сполуки формули II, придатні для синтезу сполук вищенаведеної формули І де R1 вибрано з групи, яка складається з (і) фенілу; (іі) піридинілу (ііі) тіофенілу (iv) фуранілу (v) імідазолілу І (vi) триазолілу де кожне фенільне кільце R1 і гетероароматичне кільце R1 може бути як варіант і незалежно крім того заміщеним 1, 2 або 3 замісниками, вибраними з лінійних та розгалужених С 1-С6алкілу, NO2, CF 3, С1С6алкоксилу, хлору, флуору, брому та йоду. Замісники на фенільному кільці та гетероароматичному кільці можуть знаходитися у будь-якій позиції на зазначених кільцевих системах; Ra та R b кожне і незалежно вибране з групи, яка складається з гідрогену, лінійного та розгалуженого С 1-С6алкілу, NO2, CF3 , C1-С6алкоксилу, хлор у, флуору, брому та йоду; Способи виготовлення І. Сполуки згідно з винаходом можна виготовити за допомогою способу, описаного на схемі І, представленій нижче. Ці відомі способи описано в C.G. FroCt and P. Mendonca; Perkin 1 (1998), 2615; and in J.F.W. МсОміе, Ml. WattC, D.E. WeCt, Tetrahedron, 1969, 24, 2289; які уведено сюди посиланням. У вищенаведеній схемі І R1, Ra та Rв визначено для сполук вищезгаданої формули І. II. З іншого боку, синтез можна проводити як показано на Схемі 2, наведеній нижче, через подвійне арилування в одній посудині (описано у C.G. FroCt and P. Mendonca; Perkin 1 (1998), 2615) комерційно наявного 4-аміно-1-бензилпіперидину для виходу інтермедіату. З Схеми 1 Коли R1 = феніл, кінцевий продукт можна тоді отримати селективним етерним розщепленням (J.F.W. МсОміе. M.L WattC, D.E. WeCt, Tetrahedron, 1969, 24, 2289), як показано на Схемі 2, наведеній нижче. \ Приклади Тепер винахід буде описано детальніше з посиланнями на приклади, які не повинні виходити за рамки даного винаходу. I. (і) Виготовлення 4-бром-N,N-діетилбензаміду (сполука 1). До охолодженого льодом розчину 4-бромбензилхлориду (19,5г, 86,8ммоль) у 150мл СН 2СІ2 додають краплями діетиламін (13,5мл, 130ммоль). Реакційну суміш перемішують протягом ночі, тоді концентрують. Суміш уводять у етер і 1 НСІ, а водний шар розділяють. Органічний шар екстрагують наступні два рази етером, тоді промивають розсолом і висушують над Na2SO4. Отримане масло уводять у етилацетат і піддають кристалізації. Ще 2 кристалізації маточного розчину дали вихід 18,6г, 83,6%. (іі) Виготовлення N-(3-метоксифеніл)-1-(фенілметил)-4-піперидинаміну (сполука 2). До 1-бензилпіперидону (10мл, 0,56ммоль) і 3-метоксианіліну (7,5мл, 67,2ммоль) додають Ті(і-ОРr)4 (33,3, 112,06ммоль). Реакційну суміш перемішують до її завершення, що визначали газовою хроматографією (ГХ). Тоді додають ЕtOН (200мл), потім NaBH4 (3,18г, 84ммоль). Реакційну суміш перемішують при кімнатній температурі. Хід реакції спостерігали за допомогою ГХ. По завершенні, до білої суміші додають NH4OH і продовжують перемішувати наступні 30хв. Тоді отриману суміш розводять СН2СІ2) додаючи після цього Целіт. Отриману пасту фільтрують і екстрагують фільтрат декілька разів СН 2СІ2. Поєднані органічні фази концентрують, а продукт очищають флеш-хроматографією (1:1, гексани:ацетон) Вихід: 13,6г, 82%.Очищення також можна досягти дистиляцією Кугельрора у високому вакуумі з 2´103 м бар при темп, приблизно 225°С. З 25,6г бензилпіперидону вийшло 28,4г, 71,6%. (ііі) Виготовлення -діетил-4-[(3-метоксифеніл)[1-фенілметил)-4піперидиніл]аміно]-3 бензаміду (сполука 3). До 250мл круглодонної колби, у сухій камері в атмосфері N2, було додано 10г (0,34ммоль, 1екв.) сполуки 2,13г (50,7ммоль, 1.5екв.) сполуки 1, Pd2(dba)3 (783мг, 0,85ммоль), BINAP (784мг, 1,26ммоль), та Nat-OBu, (6,53г, 68ммоль, 2екв.).До цієї суміші додавали через канюлю толуол на три чверті від об'єму колби. Тоді суміш нагрівали при темп. 110°С протягом приблизно 6 годин, до зникнення сполуки 2, як визначено високоефективною рідинною хроматографією (ВЕРХ). Реакційну суміш залишили охолоджуватися. Тоді додали етер, суспензію профільтрували через Целіт і концентрували. Це масло перенесли у етер і залишили настоюватися протягом 15хв., а тоді знову профільтрували через Целіт. Фільтрат екстрагували 5 разів 2 H НС1. Водну фазу тоді було взято за основу з 4 H NaOH і виділено етером. Поєднані шари етеру висушили над Na2SO4, профільтрували та концентрували. Отримане масло було перенесено у етилацетат/гексан, залишено відстоюватися на тиждень. 8г твердої речовини (50%) було отримано фільтрацією, і промито етилацетатом/гексанами, 8/2. Залишений продукт від концентрованого маточного розчину не було виділено. (iv) Виготовлення N,N-діетил-4-[(3-метоксифеніл)-4-піперидиніламіно]-бензаміду (сполука 4). До розчину сполуки 3 (2,5g, 5,3ммоль) у 1,2-дихлоретані при темп. 0°С було додано a-хлоретил хлорформіат (0,93мл, 8,6ммоль). Тоді реакційну суміш нагрівали під зворотним холодильником протягом 3 годин і перемішували протягом ночі при кімнатній температурі. Розчинник було виділено і отримане масло було перенесено у метанол і нагріто під зворотним холодильником протягом 3 годин. Тоді те, що було концентровано, було перенесено у СН 2Сl2 і екстраговано 5 разів 1 N НСІ. Поєднані водні шари було зроблено основними за допомогою 5 N NaOH і екстраговано декілька разів СН 2СІ2-Органічні шари було концентровано і отримане масло очищено флеш-хроматографією на силікагелі СН 2СІ2/2% МеОН, збільшуючи полярність до 20%.Вихід: 1,68г, 83% II. Загальний синтез сполук формули II. До розчину сполуки 4 (1,05ммоль, 1екв.) у 10мл метанолу було додано (1,58ммоль, 1,5екв.) гетероциклічного або ароматичного альдегіду, з наступним додаванням NaBH3CN (1,05ммоль, 3екв.). Рівень рН реакції тоді було доведено до приблизно 6 льодяною оцтовою кислотою. Реакційну суміш перемішували протягом ночі. Додають 2 N НСІ і продовжують перемішувати протягом 1 години. Цю суміш концентрують для ' виділення метанолу, взятого за основу, з NaOH і виділяють СН2СІ2, з наступним висушуванням над Na2SO4. Очищують флеш-хроматографією на силікагелі, використовуючи СН2СІ/МеОН, з послідовним градієнтом. Збільшення полярності від 0,025% до 4% МеОН дає чистий продукт. III. Загальний синтез фенольних сполук формули І. До розчину сполуки 5 (1екв.) у СН2СІ2 при темп. -78°С було додано 3екв. ВВr3 (1 М у СН2СІ2). Перемішували протягом приблизно 45хв., тоді при кімнатній темп, протягом 2 годин. Було додано МеОН з наступним додаванням насиченого NaHCO3. Фази було розділено, а водний шар екстраговано декілька разів СН2СІ2. Поєднані органічні шари було висушено над MgSO4 і концентровано. Очищено флеш-хроматографією на силікагелі. СН2СІ2/МеOН, 100/0,25, повільно збільшуючи кількість МеОН. Подальшого очищення можна досягти у багатьох випадках кристалізацією з етилацетату. Очи щення також досягли, використовуючи обернено-фазову ВЕРХ з градієнтом 0,1% ТФОК (Три флуороцтова кислота) у Н20/0,1% ТФОК у CH3CN. Утворення солі НСІ: До розчину 1,1г вільного аміну у 10мл сухого СН 2СІ2 при перемішуванні було додано 40мл сухого етер у з наступним додаванням 20мл 1 N НСІ у етері. Наступні 40мл сухо го етеру було додано і білу суспензію перемішували протягом 30хв. Під струмом N2 твердий продукт було зібрано фільтрацією і промито етером. Продукт є гігроскопічним. Перед тим, як висушити твердий продукт, воронку Бюхнера помістили відразу під домашній вакуум у сушильній шафі на усю ніч. 1,14г білого твердого розчину було зібрано. Як варіант, фенол можна розчинити в етилацетаті, з наступним додаванням надлишку 1 N НСІ у етері, потім етеру. Надлишковий етер і НСl видалили під вакуумом. Солі трифлуороцтової кислоти було виділено після обернено-фазової ВЕРХ. Приклад 1 Виготовлення N,Nдіетил-4-[[(3-гiдроксифеніл)[1-(фенілметил)-4-піперидиніламіно]бензаміду (сполука 5) Названу сполуку 5 виготовили, до тримуючись синтетичної процедури, описаної на вищезазначеній Схемі І. Mac-спектрометрія (МС): (М+1) обчислено: 458,62 (МН+); (М+1) виявлено: 458,24 (МН+). ІЧ-спектр: Плівка НСІ солі: 3047, 2974, 2531, 1600, 1471, 1455, 1283, 1186, 1093, 735, 701см -1.1Н ЯМР: (400 МГц, CDCI3 Тетраметилсилан (ТМС), Вільний амін): 7,39-7,10 (9Н, m, Аr), 6.58-6.45 (3Н, m, Аr), 6.23-6.22 (1Н, m, Аr), 3.833.77 (1Н, m, СН), 3.52 (3Н, С, СН3О), 3.43 (4Н, С широкий, CH2N), 2.98 (2Н, d, СН2), 2.17-2.11 (2Н, t, СН2), 1.85 (2Н, d, СН2), 1.59-1.51 (2Н, м, СН,), 1.20-1.16 (6Н, м, СН,). ВЕРХ: >95% (215нм) >98% (254нм) >99% (280нм) Аналіз: C29H35N3 О2, X 2.4 НСІ, X 0.2С4Н10 О, X 0.1 СН2СІ2 Виявлено: С 63.20%, Н 7.07%, N 7.36%, Обчисл.: С 63.18%, H 7.02%, N 7.39%, 06.19%, Сl 16.22% IV. Синтез похідних п-галофенолу Похідні п-галофенолу формул (8) і (9) виго товили, дотримуючись Схеми синтезу II, представленої нижче. (і) Виготовлення N,N-діетил-4-[[3-[[(1,1-диметилетил)диметилсиліл]окси]феніл][1-(фенілметил)-4-піперидиніл]амінобензаміду (сполука 6). (200мг, 0,4ммоль) 5, TBDMCCI (302мг, 2,0ммоль) та імідазолу(138мг, 2,0ммоль) у 15мл диметилформаміду (ДМФ) нагрівали протягом 3 годин при темп. 100°С. Розчинник було видалено і отримане масло очищено флеш-хроматографією на силікагелі, використовуючи 100% СН2СІ2, потім 1% і 2% МеОН. Вихід: 200мг, 87%. (іі) Виготовлення N,N-діетил-4-[[2-бром-5-[[(1,1-диметилетил)диметилсиліл]окси]феніл][1-(фенілметил)-4-піперидиніл]аміно]бензаміду (сполука 7). До розчину (82,9мг, 0,145ммоль) 6 у 6мл ДМФ при 0°С було додано розчин NBC (27,7мг, 0,155ммоль) у 2мл ДМФ. Реакційну суміш перемішували протягом 2 годин, концентрували, флеш-хроматографували 10% ацетону/гексану, з наступним додаванням 20%ацетону. Зібрано 61,25мг, 65%. Приклад 2 Виготовлення N,N-діетил-4-[(2-бром-5-гідроксифеніл)[1-(фенілметил)-4-піперидиніл]аміно]-бензаміду (сполука 8) Сполуку 6 у діоксані було оброблено 4 N НСІ у діоксані. Реакційну суміш перемішували до повного закінчення реакції. Очищення було здійснено препаративною обернено-фазовою ВЕРХ, використовуючи CH3CN/H2O. Анал. Обчисл. для C29H34N3O 2Br ´ 1.4 GF3CO2H ´ 0.3 Н2O: С, 54.44; H, 5.17; N, 5.99; Виявлено: С, 54.43; H, 5.06; N, 6.05.; М.С (Обчисл.): 537.15(МН+), М.С (виявлено): 536.16 (МН+) Умови ВЕРХ: колонка: Luna С-18, Градієнт 20-50% В за 25хв., потік: 1мл/хв, 40°С, А- 0.1% ТФОК у Н 2O, В- 0.1% ТФОК в CH3CN, k¢: 7.94. Чистота: >97%(215нм), >97% (254нм) Приклад 3 Виготовлення N,N-діетил-4-[(5-гідрокси-2-йодофеніл)[1-(фенілметил)-4-піперидиніл]аміно]-бензаміду (сполука 9). До суспензії солі трифлуороцтової кислоти (25мг, 0,044ммоль)бензольного аналогу 5 і (11,3мг, 0,044ммоль) трифлату (трифлуорацетату) аргентум у у 5мл СН2СІ2 при 0°С було додано краплями розчин 23мг І2 у 2мл СН 2СІ2. По завершенні реакційну суміш ; концентрували та очищали препаративною ВЕРХ. Вихід 7,9мг. Анал. Обчисл. для C29H34N3O 2I ´ 1,6 C 2H O2F 3 ´ 0,5 Н20: С, 49,91; H, 4,76; N, 5.42; Виявлено: С, 49.84.; H, 4.75; N, 5.60 М.С (Обчисл.): 584.51 (МH+), М.С (виявили): 584.16 (МН+) умови ВЕРХ: колонка: Zorbax CB-C18, Градієнт 20-50% В за 25хв., потік 1мл/хв, 40 С, А- 0.1% ТФОК в Н 2O, В- 0.1% ТФОК в CH3CN, к': 8.56.Чистота: >96%(215нм), 5>96% (254нм) V. Синтез 2-флуор-5-метоксианаліну (і) Виготовлення 1,3-дібром-5-флуор-2-метоксибензолу (сполука 11). До розчину 10, 2,6-дібром-4-флуорфенолу (1г, 3.7ммоль), у 50мл ацетону було додано К2СО3 (0,56г, 4,1ммоль), з наступним додаванням СН 3І (0,58г, 255мкл, 4,1ммоль). Реакційну суміш нагрівали під зворотним холодильником протягом 2 годин, охолоджували, тоді фільтрували і промивали повторно СНСІ3. Концентрований фільтрат дав 1г кольорової кремової твердої речовини. 95.2%. (іі) Виготовлення 1,3-дібром-5-флуор-2-метокси-4-нітро-бензолу (сполука 12). До каламутного розчину 11 (920мг, 3,24ммоль) у 3мл H2SO4, о холодженій у льоді, було додано краплями розчин H2SO4/HNO3 (3мл/163мкл, 3,9ммоль). Реакційну суміш перемішували протягом 2 годин, тоді 30хв. при кімнатній темп. Тоді було додано лід і реакційну суміш екстрагували декілька разів СН 2СІ2. Поєднані органічні шари промивали Na2CO3 (Cat), висушували над Na2SO4, фільтрували і концентрували. Очи щення через силікагель 100 гексанами, потім 10% етилацетатом/гексанами дало 685мг, 64%. (ііі) Виготовлення 2-флуор-5-метоксианіліну (сполука 13). В апараті Парра при 40фунт/кв.дюйм стр ушували суспензію 66мг Pd/C 10% 12 (670мг, 0,2ммоль) у 40мл етанолу протягом 36 годин. Реакційну суміш фільтрували і концентрований фільтрат очищували флешхроматографією на силікагелі, збільшуючи полярності 10, 20, тоді 30 етилацетат/гексани. Вихід 200мг, 70,8%. Приклад 4 Виготовлення 4-[(2,4-дібром-5-метоксифеніл)[1-(фенілметил)-4-піперидиніл]аміно]-N,N-діетил-бензаміду (сполука 14) 510мг сполуки 3 розчиняють у льодяній оцтовій кислоти/СН 2СІ2 при 0°С. 90мкл брому додають краплями, з перемішуванням протягом 15хв. Після концентрації реакційну суміш переносили у СН 2СІ2 і Н2О. С уміш роблять основною за допомогою 2 H NaOH і екстрагують 3 рази СН2СІ2, тоді промивають розсолом. Сполуку очистили препаративною ВЕРХ. Сіль ТФОК було перетворено на вільний амін (347мг), екстракцією з 1 N NaOH і СН2СІ2. Сіль НСІ було отримано з 1 N НСІ в етері. Анал. Обчисл. для C30H35N3O 2Br2 ´ 1,5 НСІ X 0.7 Н20; С, 51.72; H, 5.48; N, 6.03; Виявлено: С, 51.67; H, 5.50; N, 5.88 М.С (Обчисл.): 630.44(МН+), М.С (виявлено): 630.15 (МН+) Умови ВЕРХ: колонка: Luna С-18, Градієнт 30-50% В за 25хв., потік: 1мл/хв., 40°С, А- 0.1% ТФОК в Н 2О, В- 0.1% ТФОК в CH3CN, k': 3.25. Чисто та: >95%(215нм), >99% (254нм) Приклад 5 Виготовлення 4-[(2-хлор-5-гідроксифеніл)[1-(фенілметил)-4-піперидиніл]аміно]-N,N-діетил-бензаміду (сполука 15) Названу сполуку 15 виготовили, слідуючи синтетичного способу, представленого на вищенаведеній Схемі І, використовуючи 2-хлор-3-метоксианалін на етапі 1. М.С (Обчисл.): 492.24 (МН+), М.С (виявлено): 491.92 (МН+) Умови ВЕРХ: колонка: Luna C-18, Градієнт 30-80% В за 25хв., потік: 1мл/хв., 25°С, А-0.1% ТФОК в Н2О, В0.1%ТФОК в CH3CN, k': 2.60. Чистота: >90%(215нм), >92% (254нм) Приклад 6 Виготовлення N,N-дієтил-4-[(2-флуор-5-гідроксифеніл)[1-(фенілметил)-4-піперидиніл]аміно]-бензаміду (сполука 16). Названу сполуку 16 було отримано на основі вищенаведеної Схеми І, використовуючи 2-флуор-3метоксианалін на етапі 1. 1 Н ЯМР: CDCl3 d 1.15-1.19, (м, 6Н), 1.49-1.57, (м, 2Н), 1.87-1.90 (м, 2Н), 2.12-2.19 (, м 2Н), 2.97-3.01 (м, 2Н), 3.42 (brs, 4Н), 3.53 (С, 2Н), 3.80-3.55 (м, 2Н), 6.27-6.29 (м, 1H), 6.45 (d, J=8.7 Гц, 2H) 6.51-6.55 (м, 1Н), 6.89 (час, 1Н), 7.20 (d, J=8.7 Гц, 2Н), 7.24-7.27 (м, 5Н). ІЧ: 3160.1, 2936.0, 1602.6, 1502.1, 1472.0, 1456.3, 1283.3 М.С (Обчисл.): 476.61 (МН+), М.С (виявлено): 476.16 (МН+) Умови ВЕРХ: колонка: Zorbax СВ-С18, Градієнт 30-80% В за 25хв, потік: 1мл/хв, 40 С, А- 0.1% ТФОК в Н 2О, В- 0.1% ТФОК в CH3CN, k¢: 6.61. Чистота: >99% (215нм), >99% (254нм) Приклад 7 Виготовлення 4-[(4-бром-3-метоксифеніл)[1-(фенілметил)-4-піперидиніл]аміно]-N,N-діетил-бензаміду (сполука 17) Названу сполуку 17 виготовили згідно з вищенаведеною Схемою І, використовуючи 2-бром-3-метоксианалінна етапі 1. 1 Н ЯМР: CDCl3 d 1.16, (br t, 6Н), 1.43-1.53, (м, 2Н), 1.86-1.89 (м, 2Н), 2.06-2.11 (м, 2Н), 2.91-2.94 (м, 2Н), 3.38 (br С, 4Н), 3.37 (С, 2Н), 3.46 (С, 2Н), 3.75 (С, 3Н), 3.77-3.83 (м, 1Н), 6.44-6.46 (м, 2Н), 6.63 (d, J= 8.8 Гц, 2Н), 7.19-7.27 (м, 7Н), 7.44 (d,l H) Анал. Обчисл. і для C30H36N3O2Br ´ 1.9 НСІX 0.2 Н2O: С, 57.80; Н. 6.19; N, 6.74; Виявлено: С, 57.83; Н, 6.17; N, 7.16. М.С (Обчисл.): 551.54(МН+), М.С (виявлено): 550.39, 552.38 (МН+, бромінована сполука) Умови ВЕРХ: колонка: Luna C-18, Градієнт 20-50% В in 25хв., потік: 1мл/хв, 40°С, А- 0.1% ТРА в Н А В0.1% ТФОК в CH3CN, k': 5.05. Чистота: >99%(215нм), >99% (254нм) Приклад 8 Виготовлення (1R)-N-[4-[(1-iminoethvl)aміно]-(1R)-[[(1.2.3.4-тетрагідро-1-нафталеніламіно]карбоніл]бутил)1-(феніл)-циклогексилкарбоксаміду (сполука 18) Названу сполуку 18 виготовили згідно з вищенаведеною схемою І, використовуючи 2-хлор-3метоксианалін на етапі 1. М.С (Обчисл.): 507 М.С (виявили): 505,91. 507.85 (МН+, хлоринова на сполука) Умови ВЕРХ: колонка: Luna С-18, Градієнт 30-80% В за 25 хвм потік: 1мл/хвм 40°С, А-0.1% ТФОК в Н2 О В-0.1% ТФОК в CH3CN, к':4.06.Чистота: >88%(215нм), >90%(254нм) Приклад 9 Виготовлення N,N-діетил-4-[(2-флуор-5-метоксифеніл)[1-(фенілметил)-4-піперидиніл]аміно]-бензаміду (сполука 19) Названу сполуку 19 виготовили згідно з вищенаведеною схемою І, використовуючи 2-флуор-3метоксианалін на етапі 1. 1 H ЯМР: CDCl3 d 1.15-1.18, (m, 6Н), 1.50-1.59, (m, 2Н), 1.96-1.99 (m, 2Н), 2.09-2.15 (m, 2Н), 2.95-2.98 (m, 2Н), 3.42 (br s, 4Н). 3.50 (s, 2Н), 3.77 (s, 3Н), 3.84-3.90 (m, 2H), 6.27-6.29 (m, 1Н), 6.51 (d, J=8.9 Гц, 2Н) 6.6 (dd, J=3.3 Гц. 6.3 Гц 1Н), 7.08 (dt, J=3.4 Гц, 8.9 Гц, 1Н), 7.08 (t, J=9.0 Гц, 2Н), 7.22 (d, J=8.9 Гц, 2Н) 7.24-7.32 (m, 5H). М.С (Обчисл.): 490.63 (МН+), М.С (виявили): 490.08 (МН+) Умови ВЕРХ: колонка: Luna С-18; градієнт 30-80% В за 25хв., потік: 1мл/хв, 40С, А-0.1% ТФОК в Н 2 O, В0.1% ТФОК в CH3CN, к':4.6І. Чистота: >99% (215нм), >99% (254нм) Приклад 10 Виготовлення N,N-діетил-4-[[1-(3-фуранілметил)-4-піперидиніл](3-метоксифеніл]аміно]-бензаміду (сполука 20) Названу сполука 20 виготовили згідно з вищенаведеною схемою І, використовуючи фуран-3карбоксалдегід. 1 H ЯМР: CDCl3 d 1.18, (t, 6H), 1.48-1.58, (m, 2H), 1.92-1.96 (m, 2H), 2.06-2.12 (m, 2H), 2.96-2.99 (м, 2Н), 3.37 (s, 2Н), 3.42 (br s, 4Н), 3.50 (S, 2Н), 3.77 (s, 3Н), 3.79-3.86 (m, 1Н), 6.34 (m, 1Н), 6.51-6.52 (m, 1Н) 6.55-6.57 (m, 1Н), 6.64-6.66 (m, 2Н), 6.73 (dd, J=2.4, 8.1 Гц, 1Н), 7.23-7.26 (m, 3Н) 7.31 (m, 1Н), 7.36-7.37 (m, 1Н) ІЧ спектр: 2935.4, 1611.0, 1595.4, 1469.4, 1425.6, 1280.7 М.С (Обчисл.): 462.60(МН+), М.С (виявили): 462.21 (МН+) Умови ВЕРХ: колонка: Luna С-18; градієнт: 20-50% В за 25хв., 1мл/хв., 25°С, А- 0.1% ТФОК в Н2O, В- 0.1% ТФОК в CH3CN; к¢: 7.5; Чистота: >99 %(215нм), >99% (254нм) Приклад 11 Виготовлення N,N-діетил-4-[[1-(2-фуранілметил)-4-піперидиніл](3-метоксифеніл)аміно]-бензаміду (сполука 21) Названу сполуку 21 виготовили згідно з вищенаведеною схемою І, використовуючи фуран-2карбоксалдегід. 1 H ЯМР: CDCl3 d 1.19, (t, 6H), 1.54-1.64, (m, 2H), 1.92-1.96 (m, 2H), 2.13-2.19 (m, 2H), 2.96-2.99 (m, 2H), 3.42 (br s, 4H), 3.53 (s, 2H), 3.76 (s, 3H), 3.80-3.86 (m, 1H), 6.18 (d, J=ГЦ, 1H), 6.31 (dd, J= 2.1 Гц, 3.3 Гц, 1H) 6.49-6.51 (m, 1H), 6.53-6.56 (m, 1H), 6.71 (d, 8.4 Гц, 2Н) 6.73 (dd, J=2.5, 8.2 Гц, 1H), 7.23-7.26 (m, 3Н) 7.36-7.37 (m, 1H) ІЧ спектр: 2935.5, 1611.3, 1595.2, 1469.0, 1424.6, 1280.6 М.С (Обчисл.): 462.60(МН+), М.С (виявили): 462.21 (МН+) Анал. Обчисл. для C28H36N3O3 ´ 1.7 НС1 X 0.3 Н2O: С, 63.58; H, 7.11; N, 7.94; Виявили: С, 63.70; H, 7.04; N, 7.84. Умови ВЕРХ: колонка: Luna С-18; Градієнт 20-50% В за 25 хв.; потік: 1мл/хв., 25°С, А- 0.1% ТФОК в Н2 O, В0.1% ТФОК в CH3CN, к¢: 7.19. Чистота: >95% (215нм), >99% (254нм) Приклад 12 Виготовлення N,N-діетил-4-[(3-метоксифеніл)[1-(3-тіенілметил)-4-піперидиніл]аміно]-бензаміду (сполука 22) Названу сполуку 22 виготовили згідно з вищенаведеною схемою І, використовуючи тіо фен-3карбоксалдегід. 1 H ЯМР: CDCl3 d 1.18, (t, 6H), 1.52-1.58. (m, 2H), 1.92-1.95 (m, 2H), 2.08-2.13 (m, 2H), 2.95-2.98 (m, 2H), 3.42 (br s, 4H), 3.53 (s, 2H), 3.77 (s, 3H), 3.79-3.86 (m, 1H), 6.51-6.52 (m, 1H) 6.55-6.57 (m, 1H), 6.65 (d, J= 8.5 Гц, 2H), 6.72-6.74 (m, 1H), 7.00-7.01 (m, 1H). 7.08-7.09 (m, 1H), 7.24-7.26 (m, 4H) ІЧ спектр: 2936.1, 1611.1.1595.6, 1469.4, 1425.1, 1280.6 M.C (Обчисл.): 478.67(МН+), M.C (виявили): 478.07 (MH+) Умови ВЕРХ: колонка: Luna С-18; градієнт: 20-50% В за 25хв., 1мл/хв., 25°С, А- 0.1% ТФОК в Н2O, В- 0.1% ТФОК в CH3CN; к¢: 7.0; Чистота: >99 % (215нм), >99% (254нм) Приклад 13 Виготовлення N,N-діетил-4-[(3-метоксифеніл)[1-(2-тіенілметил)-4-піперидиніл]аміно]-бензаміду (сполука 23) Названу сполуку 23 виготовили згідно з вищенаведеною схемою І, використовуючи тіо фен-2карбоксалдегід. М.С (Обчисл.¢): 477.67(МН+), М.С (виявили): 478.09 (МН+) Умови ВЕРХ: колонка: Luna С-18; градієнт: 20-50% В за 25хв„ 1мл/хв. (25°С, А- 0.1% ТФОК в Н2O, В- 0.1% ТФОК в CH3CN; к¢: 7.64; Чистота: >99 %(215нм), >99% (254нм) Приклад 14 Виготовлення N,N-діетил-4-[[1-(1H-імідазол-2-ілметил)-4-піперидиніл](3-метоксифеніл)аміно]-бензаміду (сполука 24) Названу сполуку 24 виготовили згідно з вищенаведеною схемою І, використовуючи імідазол-2карбоксалдегід. ‘H ЯМР: CDCl3 d 1.18, (t, 6H), 1.46-1.55, (m, 2H), 1.95-1.97 (m, 2H), 2.24-2.30 (m, 2Н), 2.88-2.91 (m, 2Н), 3.43 (br s, 4Н), 3.63 (s, 2Н), 3.50 (s, 2Н), 3.78 (s, ЗН), 3.88-3.92 (m, 2Н), 6.50 (t, 1Н), 6.54-6.57 (m, 1Н), 6.71 (d, J= Гц, 2H), 6.74 (dd, 2.3 Гц, 8.3 Гц, 1Н) 6.96 (s, 2H), 7.24-7.29 (m, 3Н) lЧ спектр.- 2935.6, 1615.0, 1601.8, 1503.4, 1469.8, 1454.2, 1425.2, 1281.4 М.С (Обчисл.): 462.61 (МН+), М.С (виявили): 462.10 (МН+) Умови ВЕРХ: колонка: Luna С-18; градієнт: 20-50% В за 25хв., 1мл/хв., 25°С, А- 0.1% ТФОК в Н2О, В- 0.1% ТФОК в CH3CN; к¢: 4.9; Чистота: >99 %(215нм), >99% (254нм) Приклад 15 Виготовлення N,N-діетил-4-[[1-(3-фуранілметил)-4-піперидиніл](3-гідроксифеніл)аміно]-бензаміду (сполука 25) Названу сполуку 25 виготовили згідно з вищенаведеною схемою І, використовуючи фуран-3карбоксалдегід. ‘H ЯМР: CDC13 d 1.17-1.20, (m, 6H), 1.54-1.63, (m, 2H), 1.90-1.93 (m, 2H), 2.12-2.17 (m, 2H), 3.02-3.05 (m, 2H), 3.42 (br s, 6H), 3.42 (br s, 4H), 3.80-3.86 (m, 1H), 6.29-6.30 (m, 1H), 6.35-6.37 (m, 1H) 6.47-6.50 (m, 1H), 6.536.56 (m, 1H), 6.60-6.63 (m, 2H), 7.12-7.22 (m, 1H) 7.23-7.28 (s, 4H), 7.28-7.34 (m, 1H) M.C (Обчисл.): 448.58(МН+), M.C (виявили): 448.21 (MH+) Умови ВЕРХ: колонка: Luna С-18; градієнт: 20-50% В за 25хв., 1мл/хв., 25°С, А- 0.1% ТФОК в Н2O, В- 0.1% ТФОК в CH3CN; к¢: 5.53; Чистота: >99 % (215нм). >99% (254нм) Приклад 16 Виготовлення N,N-діетил-4-[(3-гідроксифеніл)[1-(3-тіенілметил)-4-піперидиніліаміноі-бензаміду (сполука 26) Названу сполуку 26 виготовили згідно з вищенаведеною схемою І, використовуючи тіо фен-3карбоксалдегід. М.С (Обчисл.): 464.64 (МН+), М.С (виявили): 464.15 (МН+) Умови ВЕРХ: колонка: Luna С-18; градієнт: 20-50% В за 25 хв., 1мл/хв., 25°С, А- 0 .1% ТФОК в Н 2O, В- 0.1% ТФОК в CH3CN; к¢: 7.64; Чистота: >99 %(215нм), >99% (254нм) Приклад 17 Виготовлення N,N-діетил-4-[(5-метокси-2-метилфеніл)[1-(фенілметил)-4-піперидиніл)аміно]-бензаміду (сполука 27) Названу сполуку 27 вигото вили згідно з вищенаведеною схемою І, використовуючи 2-метил-5метоксианалін на етапі 1. М.С (Обчисл.): 486.67(МН+), М.С (виявили): 486.19 (МН+) Умови ВЕРХ: колонка: Luna С-18; градієнт: 20-50% В за 25хв., 1мл/хв., 25°С, А-і 0.1% ТФОК в Н2O, В- 0.1% ТФОК в CH3CN; к¢: 8.46; Чистота: >99 % (215нм), >99% (254нм) Приклад 18 Виготовлення N,N-діетил-4-[(3-гідроксифеніл)[1-[[4-(трифлуорметил)феніл]метил]-4-піперидиніл]аміно]бензаміду (сполука 28) Названу сполуку 28 виготовили згідно з вищенаведеною схемою І, використовуючи 4трифлуорметилбензалдегід. Анал. Обчисл. для C30H34N3O 2F 3 ´1.4 CF 3CO2H: С, 57.34; Н, 5.22; N, 6.12; Виявили: С.57.31; Н, 5.18; N,6.23. М.С (Обчисл.): 526.61 (МН+), М.С (виявили): 526.29 (МН+) Умови ВЕРХ: колонка: Zorbax СВ С-18, Градієнт 30-80% В за 25хв., потік: 1мл/хв., 40°С, А- 0.1% ТФОК в Н2O, В- 0.1% ТФОК в CH3CN, к': 3.29. Чистота: >96%(215нм), >98% (254нм) Приклад 19 Виготовлення N,N-діетил-4-[(3-гідроксифеніл)[1-[(4-йодфеніл)метил]-4-піперидиніл]аміно]-бензаміду (сполука 29) Названу сполуку 29 виготовили згідно з вищенаведеною схемою І, використовуючи 4-йодбензалдегід. ‘H ЯМР: CDC13 d 1.16, (br s, 6Н), 1.88-.2.06, (br m, 6Н), 2.78-2.84 (m, 2Н). 3.40-3.43 (m, 4Н), 3.39-3.49 (br m, 4Н), 3.92 (m, 1H), 4.12 (s, 2H), 4.32 (s, 2H), 6.54 (d, J= 8.8 Гц, 2Н), 6.61 (s, 1Н), 6.71 (d, J= 7.7 Гц, 2H), 7.44 (d, J=7.7 Гц, 2H), 7.13 (t, 1H), 7.36-7.45 (m, 5Н) Анал. Обчисл. для C29H34N3O 2I ´1.5 C 2HO 2F3 ´ 0.1 Н2O: С, 50.82; H, 4.76; N, 5.56; Виявили: С, 50.79; H, 4.77; N, 5.62. М.С (Обчисл.): 584.51 (МH+), М.С (виявили): 584.14 (МН+) Умови ВЕРХ: колонка: Zorbax СВ С-18, Градієнт 20-50% В за 25хв., потік: 1мл/хв., 40°С, А- 0.1% ТФОК в Н2O, В- 0.1% ТФОК в CHCCN, k': 7.96. Чистота: >98%(215нм), >98% (254нм) Приклад 20 Виготовлення N,N-діетил-4-[[1-[(4-бромфеніл)метил]-4-піперидиніл](3-гідроксифеніл)аміно]-бензаміду (сполука 30) Названу сполуку 30 виготовили згідно з вищенаведеною схемою І, використовуючи 4-бромбензалдегід. Анал. Обчисл. для C29H34BrN3O 2 X 1.30 ТФОК Обчисл..: С 55.43%, H 5.20%, N 6.14%; Виявили: С 55.43%, H 5.25%, N 5.94%. М.С (Обчисл.): 537.51 (МH+), М.С (виявили): 536.54 (МН+), 538.04 (бромінована сполука) Умови ВЕРХ: колонка: Zorbax СВ С-18, Градієнт 20-50% В за 25хв., потік: 1мл/хв., 40°С, А- 0.1% ТФОК в Н2О, В- 0.1% ТФОК в CH3CN, к¢: 7.58. Чистота: > 99% (215нм), >99%(254нм) Приклад 21 Виготовлення N,N-діетил-4-[[1-(4-хлорфеніл)метил]-4-піперидиніл](3-гідроксифеніл]аміно]-бензаміду (сполука 31) Названу сполуку 31 виготовили згідно з вищенаведеною схемою І, використовуючи 4-хлоролбензалдегід. Анал. Обчисл. для C29H34N3O 2C1 ´ 1.4 CF 3CO2H ´ 0.3 Н2 O: С, 57.64; H, 5.43; N, 6.34; Виявили: С, 57.49; H, 5.36; N, 6.41 М.С (Обчисл.): 496.06 (МH+), М.С (виявили): 496.68 (МН+) Умови ВЕРХ: колонка: Zorbax СВ С-18, Градієнт 20-50% В за 25хв., потік: 1мл/хв., 40°С, А- 0.1% ТФОК в Н2О, В- 0.1% ТФОК в CH3CN, к': 7.36. Чистота: >99%(2І5нм), >98% (254нм) Приклад 22 Виготовлення N,N-діетил-4-[[1-(4-флуорфеніл)метил]-4-піперидиніл](3-гідроксифеніл)аміно]-бензаміду (сполука 32) Названу сполуку 32 виготовили згідно з вищенаведеною схемою І, використовуючи 4-флуорбензалдегід. Анал. Обчисл. для C29H34FN3 O2 X1.90 ТФОК: С 56.91 %, H 5.23%, N 6.07%; Виявили: С 56.77%, H 5.39 %, N 5.95%, М.С (Обчисл.): 476.61 (МH+), М.С (виявили): 476.18 (МH+) Умови ВЕРХ: колонка: Zorbax СВ С-18, Градієнт 20-50% В за 25хв., потік: 1мл/хв., 40°С, А- 0.1% ТФОК в Н2О, В- 0.1% ТФОК в CH3CN, к¢: 2.45. Чистота: >91%(215нм), >96%(254нм) Приклад 23 Виготовлення 4-[[1-[(2,4-дихлорфеніл)метил]-4-піперидиніл](3-гідроксифеніл)аміно]-N,N-діетил-бензаміду (сполука 33) Названу сполуку 33 виготовили згідно з вищенаведеною схемою І, використовуючи 2,4дихлоролбензалдегід. Анал. Обчисл. для C29H33C12N 3O2 , X 0.10 Н2 O, X 1.60 ТФОК: С 54.42%, H 4.94%, N 5.91% Виявили: С 54.46%, H 4.94%, N 5.83%, М.С (Обчисл.): 527.51 (МH+), М.С (виявили): 527.84 (МН+) 3 Умови ВЕРХ: колонка: Zorbax СВ С-18, Градієнт 20-50% В за 25хв., потік: 1мл/хв., 40°С, А- 0.1% ТФОК в Н2O, В- 0.1% ТФОК в CHCCN, k¢: 8.14. Чистота: >99%(215нм), >99% (254нм) Приклад 24 Виготовлення N,N-діетил-4-[[1-(3-флуорфеніл)метил]-4-піперидиніл](3-гідроксифеніл)аміно]-бензаміду (сполука 34) Названу сполуку 34 виготовили згідно з вищенаведеною схемою І, використовуючи 3-флуорбензалдегід. Анал. Обчисл. для C29H34N3O 2F ´ 1.2 C 2H O2F 3 ´ 1.1 Н2O: С, 59.56; H, 6.11; N, 6.64; Виявили: С, 59.43.; H, 5.48; N, 6.54. М.С (Обчисл.): 476.61 (МH+), М.С (виявили): 476.18 (МН+) Умови ВЕРХ: колонка: Zorbax СВ С-18, Градієнт 20-50% В за 25хв., потік: 1мл/хв., 40°С, А- 0 .1% ТФОК в Н2 O, В- 0.1% ТРА в CHCCN, k¢: 6.53. Чистота: >99%(215нм),>99%(254нм) Приклад 25 Виготовлення N,N-діетмл-4-[[1-(2-флуорфеніл)метил]-4-піперидиніл](3-гідроксифеніл)аміно]-бензаміду (сполука 35) Названу сполука 35 виготовили згідно з вищенаведеною схемою І, використовуючи 2-флуорбензалдегід. Анал. Обчисл. для C29H34N3O 2F ´ 1.4 C 2H O2F 3: С, 60.09; H, 5.62; N, 6.61; Виявили: С60.09; H, 5.59; N, 6.62. М.С (Обчисл.): 476.61 (МH+), М.С (виявили): 476.18 (MH+) Умови ВЕРХ: колонка: Zorbax СВ С-18, Градієнт 20-50% В за 25хв., потік: 1мл/хв., 40°С, А- 0.1% ТФОК в Н2О, В- 0.1% ТФОК в CHCCN, k¢: 5.63. Чистота: >99%(215нм), >99% (254нм) Приклад 26 Виготовлення N,N-діетил-4-[(3-гідроксифеніл)[1-(4-метилфеніл)метил]-4-піперидиніл]аміно]-бензаміду (сполука 36) Названу сполуку 36 виготовили згідно з вищенаведеною схемою І, використовуючи 4-метилбензалдегід. Анал. Обчисл. для C30H37N3O 2 ´ 1.4 C 2HO 2F3 ´ 0.4 Н2O: С, 61.70; H, 6.19; N, 6.58; Виявили: С, 61.78.; H, 6.25; N, 6.55. М.С (Обчисл.): 472.64 (МH+), М.С (виявили): 472.18 (МН+) Умови ВЕРХ: колонка: Zorbax СВ С-18, Градієнт 20-50% В за 25хв., потік: 1мл/хв., 40°С, А- 0 .1% ТФОК в Н2 O, В- 0.1% ТФОК в CH3CN, к¢: 7.12. Чистота: >98%(215нм), >98% (254нм) Приклад 27 Виготовлення N,N-діетил-4-[[1-(2-фуранілметил)-4-піперидиніл](3-гідроксифеніл)аміно]-бензаміду (сполука 37) Названу сполуку 37 виготовили згідно з вищенаведеною схемою І, використовуючи 2-фуралдегід. 400 МГц, DMSO) d 1.07 (t, J=7.4 Гц, 6H, 2 ´ СН3), 1.53-1.63 (m, 2H, 2 ´ СН), 2.04-2.08 (m, 2H, 2 ´ СН), 3.113.18 (m, 2 ´ СН), 3.37-3.41 (m, 2 X СН), 3.48 (Br, 2 X CH2), 4.17-4.24 (m, 1H, NCH), 4.33 (s, 2H, NCH2), 6.36-6.38 (m, 1H), 6.44-6.46 (m, 1H), 6.55-6.56 (m, 1H), 6.62-6.68 (m, 4H), 7.16-7.23 (m, 3H), 7.81 (m, 1H), 9.53 (br, 1H) Анал. Обчисл. для C27H33N3O 3 ´ 1.3 С2НР3 O2 ´ 1.0 H 2 O: С , 58.09; H, 5.95; Н, 6.87; Виявили: С, 58.03; H, 5.90; N, 6.94. М.С (Обчисл.): 448.58(МН+), М.С (виявили): 448.21 (МH+) Умови ВЕРХ: колонка: Luna С-18; градієнт: 20-50% В за 25 хв., 1мл/хв.., 25°С, А-0.1% ТФОК в Н 2O, В- 0.1% ТФОК в CH3CN; к¢: 2.83; Чистота: >99 % (215нм), >99% (254нм) Приклад 28 Виготовлення N,N-діетил-4-[(3-гідроксифеніл)[1-(2-тіенілметил)-4-піперидиніл]аміно]-бензаміду (сполука 38) Названу сполуку 38 виготовили згідно з вищенаведеною схемою І, використовуючи 2тіофенкарбоксалдегід. ‘H ЯМР: (400 МГц, DMSO) d 1.18 (t, J=7.4 Гц, 6H, 2 ч СН3), 1.52-1.62 (m, 2H, 2 ´ СН), 1.89-1.93 (m, 2H, 2 ´ СН), 2.14-2.21 (m, 2 ´ СН), 3 .00-3.03 (m, 2 X СН), 3.42 ( Br, 2 ´ CH2), 3.74 (s, 2H, NCH2), 3.80-3.83 (m, 1H, NCH). 6.33-6.35 (m, 1H), 6.47-6.49 (m, 1H), 6.56-6.59 (m, 1H), 6.62-6.65 (m, 2H), 6.89-6.94 (m, 2H), 7.13 -7.17 (m, 1H), 7.20-7.22 (m, 1H), 7.22-7.26 (m, 2H) ‘H ЯМР: (Анал. Обчисл. для C27H33N3O 2C ´ 1.3 C 2HF3 O2 ´ 0.5 Н 2O: С, 57.26; H, 5.73; N, 6.77; Виявили: С, 57.32; H, 5.79; N, 6.73. М.С (Обчисл.): 464.64 (МН+), М.С (виявили): 464.15 (МН+) Умови ВЕРХ: колонка: Luna С-18; градієнт: 20-50% В за 25 хв., 1мл/хв.., 25°С, А- 0.1 % ТФОК в Н2O, В- 0.1 % ТФОК в CH3CN; к¢: 5.99; Чистота: >99 %(215нм), >99% (254нм) Приклад 29 Виготовлення N,N-діетил-4-{3-гідрокси[1-(1H-iмідазол-2-ілметил)-4-піперидиніл] аніліно}бензаміду (сполука 39) Названу сполуку 39 виготовили згідно з вищенаведеною схемою І, використовуючи 2імідазолкарбоксалдегід. ‘H ЯМР: (400 МГц, DMSO) 5 1.08 (t, 6H, 2 ´ СН3), 1.54-1.63 (m, 2H, 2 ´ СН), 2.04-2.08 (m, 2H, 2 ´ СН), 3.093.17 (m, 2 ´ СН), 3.27-3.33 (m, 2 X CH2), 3.40-3.45 (2 X СН), 4.16-4.22 (m, 3H, NCH, NCH2), 6.38 (s, 1H), 6.456.48 (м, 1Н), 6.64 (d, J=8.4 Гц, 2Н), 6.66-6.69 (м, 1Н), 7.18 (d, J=8.4 Гц, 2Н), 7.20-7.22 (m, 1H), 7.48 (s 1H), 8.28 Анал. Обчисл. для C26H33N5O 2 ´ 2.0 C 2HF 3O2 X 1.1 Н2 O: С, 51.81; Н, 5.39; N, 10.07; Виявили: С, 51.87; Н, 5.40; N, 10.01. М.С (Обчисл.1): 448.58 (МН+), М.С (виявили): 448.22 (МН+) Умови ВЕРХ: колонка: Luna С-18; градієнт; 20-50% В за 25хв., 1мл/хв., 25°С, А- 0.1% ТФОК в Н2O, В- 0.1% ТФОК в CH3CN; к¢: 2.92; Чистота: >99 %(215нм), >99% (254нм) Приклад 30 Виготовлення N,N-діетил-4-{3-гідрокси[1-[2-піридинілметил)-4-піперидиніл] аніліно}бензаміду (сполука 40) Названу сполуку 40 виготовили згідно з вищенаведеною схемою І, використовуючи 2піридинкарбоксалдегід. ¢H ЯМР: (400 МГц, DMSO) 8 1.07 (t, 6H, 2 ´ СН3), 1.66-1.75 (m, 2H, 2 ´ СН), 2.01-2.05 (m, 2H, 2 ´ СН), 3.213.46 (m, 8H, 2 ´ СН, 2 ´ СН2, 2 ´ СН), 4.20-4.23 (m, 1H, NCH), 4.39 (С, 2Н, NCH2), 6.37-39 (m, 1Н), 6.45-6.48 (m, 1Н), 6.64 (d, J=8.4 Гц, 2Н), 6.66-6.68 (m, 1H), 7.18 Гц (d, J=8.4 Гц. 2Н), 7.21-7.24 (m, 1Н), 7.43-7.51 (m, 2Н), 7.887.92 (С, 1Н). 8.62-8.63 (m, 1Н), 9.53 (br s, 1Н), 9.69 (br s, 1Н) Анал. Обчисл. для C28H34N4O 2 ´ 1.5 C 2HF 3O2 X 0.2 Н2 O: С, 58.80; Н, 5.71; N, 8.85; Виявили: С, 58.78; Н, 5.77; N, 8.74. М.С (Обчисл.): 459.60 (МН+), М.С (виявили): 459.23 (МН+) Умови ВЕРХ: колонка: Luna С-18; градієнт: 20-50% В за 25хв., 1мл/хв.., 25°С, А- 0.1% ТФОК в Н 2O, В- 0.1% ТФОК в CH3CN; к': 4.89; Чистота: >99 %(215нм), >99% (254нм) Приклад 31 Виготовлення N,N-діетил-4-(3-гідрокси[1-(1Н-імідазол-5-ілметил)-4-піперидиніл] аніліно}бензаміду (сполука 41) Названу сполуку 41 виготовили згідно з вищенаведеною схемою І, використовуючи 4імідазолкарбоксалдегід. ‘H ЯМР: (400 МГц, DMSO) 5 1.08 (t, 6Н. 2 ´ СН3), 1.54-1.63 (m, 2Н, 2 ´ СН), 2.04-2.08 (m, 2Н, 2 ´ СН), 3.093.17 (m, 2 ´ СН), 3.27-3.33 (m, 2 X CH2), 3.40-3.45 (2 X СН), 4.16-4.22 (m, 3H, NCH, NCH2), 6.38 (С, 1Н), 6.456.48 (m, 1H), 6.64 (d, J=8.4 Гц, 2Н), 6.66-6.69 (m, 1Н), 7.18 (d, J=8.4 Гц, 2H), 7.20-7.22 (m, 1H), 7.48 (С 1Н), 8.28 (br s, 1H), 9.53 (br s, 1H) Анал. Обчисл. для C26H33N5O 2 ´ 2.3 C 2HF 3O2 X 0.8 Н2 O: С, 50.75; H, 5.14; N, 9.67; Виявили: С, 50.80; H, 5.15; N, 9.56. М.С (Обчисл.¢): 448.58 (МН+), М.С (виявили): 448.23 (МН+) Умови ВЕРХ: колонка: Luna С-18; градієнт: 20-50% В за 25 хв., 1мл/хв.., 25°С, А- 0.1% ТФОК в Н2O, В0.1% ТФОК в CH3CN; к': 2.92; Чистота: >99 %(215нм), >99% (254нм) Приклад 32 Виготовлення N,N-діетил-4-{3-гідроксил[1-піридинілметил)-піперидиніл] aніліно]бензаміду (сполука 42) Названу сполуку 42 виготовили згідно з вищенаведеною схемою І, використовуючи 4піридинкарбоксалдегід. ‘H ЯМР: (400 МГц, DMSO) d 1.06 (t, 6Н, 2 ´ СН3), 1.53-1.62 (m, 2Н. 2 ´ СН), 2.04-2.08 (m, 2Н, 2 ´ СН), 3.153.21 (m, 2Н, 2 ´ СН), 3.26-3.31 (m, 4Н, 2 ´ СН2), 3.39-3.42 (m, 2H, 2 ´ СН), 4.18-4.24 (m, 1H, NCH), 4.30 (С, 2Н, NCH2), 6.36-39 (m, 1H), 6.44-6.47 (m, 1H), 6.62 (d, J=8.4 Гц, 2H), 6.66-6.689(м, 1Н), 7.18 Гц (d, J=8.4 Гц, 2Н), 7.21-7.24 (м, 1Н). 7.51 (d, J= 5.6Гц, 2Н), 8.68 (d, J =5.6 Гц, 1 Н), 9.45 (br s.1H) Анал. Обчисл. для C28H34N4O 2 ´ 2.4 C 2HF 3O2 X 1.1 Н2 O: С, 52.38; Н, 5.17; N, 7.45; Виявили: С, 52.42; Н, 5.27; N, 7.35. М.С (Обчисл.): 459.60 (МН+), М.С (виявили): 459.23 (МН+) Умови ВЕРХ: колонка: Luna С-18; градієнт: 20-50% В за 25 хв., 1мл/хв.., 25°С, А-0.1% ТФОК in H 2O, В0.1% ТРА in CH 3CN; к¢: 3.07; Чистота: >99 %(215нм), >99% (254нм) Приклад 33 Виготовлення N,N-дiетил-4-(3-гідрокси{1-[(1-метил-1H-імідазол-2-іл)метил]-4-піперидиніл}анілін)бензаміду (сполука 43) Названу сполуку 43 було виготовлено на основі вищенаведеної Схеми І, використовуючи 1-мeтил-2імідазолекарбоксалдегід. 1 Н ЯМР: (400 МГц, (CD30D) d 1,15-1,20 (m, 6Н, 2 ´ СН3), 1,57-1,67 (m, 2Н, 2 ´ СН), 2,02-2,08 (m, 2Н, 2 ´ СН), 2,59-2,66 (m, 2 ´ СН), 3,03-3,09 (m, 2 ´ СН), 3,44 (br s, 2 ´ CH2), 3,83 (s, 3H, NCH3), 3,99 (Br s, NCH2), 4,014,09 (m, 1H, CH), 6,48-6,50 (m, 1H), 6,53-6,56 (m, 1H), 6,64-6,67 (m, 2H), 6,72-6,75 (m, 1H), 7,19-7,25 (m, 3H), 7,37 (m, 1H), 7,44 (m, 1.H) Анал. Обчисл. для C27H35N5O 2 ´ 2,0 C 2HF 3O2 X 0,2 H 2 O: С, 53,71; H, 5,44; N, 10,10; Виявлено: С, 53,67; H, 5,80; N. 10,20. М.С (Обчисл.): 462,61 (МH+), М.С (виявлено): 462,23 (МH+) Умови ВЕРХ: колонка: Luna C-18; градієнт: 20-50% В за 25хв., 1мл/хв., 25°С, А-0,1% ТФОК в Н2О, В- 0,1% ТФОК в CH3CN; k': 3.07; Чистота: >99 %(215нм), >99% (254нм) Фармацевтичні композиції Нові сполуки згідно з винаходом можна уводити перорально, внутрішньом'язово, підшкірно, місцево, через ніс, інтраперитонально, через грудну клітку, внутрішньовенно, епідурально, інтратекально, внутрішньоцереброшлуночково (інтрацеребровентикулярно), та ін'єкцією в суглоби. Бажаним шляхом уведення є пероральний, внутрішньовенний або внутрішньом'язовий. Доза залежатиме від шляху уведення, складності захворювання, віку і маси пацієнта та інших факторів, які звичайно враховує обслуговуючий лікар, при визначенні індивідуального режиму та рівня дози, як найбільш характерних для кожного пацієнта. Для виготовлення фармацевтичних композицій зі сполук згідно з винаходом, інертні, фармацевтично прийнятні носії можуть бути або у рідкій, або у твердій формі. До препаратів у вигляді твердої форми належать порошки, таблетки, дисперговані гранули, капсули, крохмальні облатки, та супозиторії. Твердим носієм може бути одна або більше речовин, які також можуть діяти як розріджувачі, ароматизатори, солюбілізатори, змащувальні, суспендувальні засоби, зв'язувальні засоби, або дезинтегратори таблеток; ним також може бути капсулюючий матеріал. В порошках носієм є тонкоподрібнена тверда речовина у суміші з тонкоподрібненим активним компонентом. В таблетках активний компонент змішано з носієм, що має необхідні зв'язувальні властивості у відповідних пропорціях, і спресовано у бажану форму і розмір. Для виготовлення супозиторних композицій, спочатку розплавляють низькоплавкий віск, як наприклад, суміш гліцеридів жирної кислоти і масла какао, а активний інгредієнт диспергують у ньому, наприклад, перемішуванням. Розплавлену однорідну суміш тоді виливають у форми відповідного розміру і залишають охолоджуватися і твердіти. Придатними носіями є карбонат магнію, стеарат магнію, тальк, лактоза, сахароза, пектин, декстрин, крохмаль, трагакант, метилцелюлоза, натрій-карбоксиметилцелюлоза, низькоплавкий віск, масло какао, та подібні їм. Фармацевтично прийнятними солями є ацетат, бензолсульфонат, бензоат, гідрокарбонат, гідротартрат, бромід, ацетат кальцію, камзилат, карбонат, хлорид, цитрат, дигідрохлорид, едетат, едизилат, естолат, езилат, фумарат, глюкаптат, глюконат, глютамат, гліколіларазанілат, гексилрезорцинат, гідрабамін, гідробромід, гідрохлорид, гідроксинафтоат, йодид, ізетіонат, лактат, лактобіонат, малат, малеат, манделат, мезилат, метилбромід, метилнітрат, метилсульфат, мукат, напсилат, нітрат, памоат (ембонат), пантотенат, фосфа т/ди фосфат, полігалактуронат, саліцилат, стеарат, субацетат, сукцинат, сульфат, танат, тартрат, теоклат, триетіодид, бензатин, хлорпрокаїн, холін, діетаноламін, етилендіамін, меглумін, прокаїн, солі алюмінію, кальцію, літію, магнію, калію, натрію та цинку. Бажаними фармацевтично прийнятними солями є гідрохлориди, і гідротартрати. Гідрохлориди і сульфати є бажанішими. Названа композиція повинна включати композицію активного компоненту з капсулюючим матеріалом у вигляді носія, що забезпечує капсулу, в якій активний компонент (з іншими носіями або без них) оточений носієм, який таким чином пов'язаний з ним. Подібним чином, включені і крохмальні облатки. Таблетки, порошки, крохмальні облатки, і капсули можуть бути використані як тверді дозовані форми, придатні для перорального уведення. Рідина з композицій включає розчини, суспензії, та емульсії. Стерильну воду або водо-пропіленгіколеві розчини активних сполук можна визнати як приклад рідких препаратів, придатних для парентерального уведення. Рідкі композиції також можуть бути сформовані у розчині у водному розчині поліетиленгліколю. Водні розчини для перорального уведення можна виготовити розчиненням активного компоненту у воді і додаванням відповідних барвників, коригент.в, стабілізаторів, та згущувачів, як бажаних елементів. Водні суспензії для перорального застосування можна виготовити розподіленням тонкоподрібненого активного компонента у воді разом з клейким матеріалом, як наприклад, натуральна синтетична гума, смола, метилцелюлоза, натрій-карбоксиметилцелюлоза, та інші суспендувальні засоби, відомі у рівні фармацевтичного складу. Бажано, щоб фармацевтичні композиції були у формі одиничної (разової) дози. У такій формі, композицію розподіляють на одиничні дози, які містять відповідну кількість активного компонента. Одинична доза може бути упакованим препаратом, упаковкою, що містить роздільні кількості препаратів, наприклад, упаковані таблетки, капсули, та порошки в пузирьках або ампулах. Одинична доза сама також може бути капсулою, крохмальною облаткою, або таблеткою, або нею може бути відповідна кількість будь-якої з цих упакованих форм. Біологічна оцінка Модель In vitro Клітинна культура Клітини 293S людини, що експресують рецептори m, d і к людини і резистентні до неоміцину було вирощено у суспензіях при 37°С і 5% СО2 у вібраційних колбах, що містять вільний від кальцію DMEM10% FBS, 5% BCS, 0,1% Pluronic F-68, і 600мкг/мл генетицину. Виготовлення мембран Клітини гранулювали і повторно суспендували в лізісному буфері (50мМ Трис, рН 7.0, 2.5мМ EDTA, з PMSF, який додають як безпосередньо перед використанням до 0,1мМ з 0.1М вихідного розчину в етанолі), інкубували на льоді протягом 15хв., потім гомогенізували з політроном протягом 30с Суспензію центрифугували (прокручували) при 1000g. (макс.) протягом 10хв. при 4°С. Супернатант (надосадковий шар) було збережено на льоді, а гранули повторно суспендували і центрифугували як раніше. Супернатанти з двох центрифугувань, було поєднано і центрифуговано при 46000g (макс.) протягом 30хв. Гранули було повторно суспендовано у холодному буфері Трис (50мМ Трис/СІ, рН 7.0) і центрифуговано знову. Отримані гранули було повторно суспендовано в буфері для мембран (50мМ Трис, 0.32М сахароза, рН 7.0). Аліквоти (1мл) у поліпропіленових трубках було заморожено у сухому льоді/етанолі і збережено при -70°С до використання. Концентрації білків було визначено модифікованим аналізом за Лоурі за допомогою SDS. Аналіз зв'язування Мембрани розморожували при 37°С, охолоджували на льоді, пропускали 3 рази через голку 25 розміру, і розбавляли буфером для зв'язування (50мМ Трис, 3мМ МgСІ 2, 1мг/мл BSA (Sigма А-7888), рН 7.4, які зберігали при 4°С, після фільтрування через 0,22м фільтр, і до яких тільки що було додано 5мкг/мл апротиніну, 10мкМ бестатину, 10мкМ дипротину А, без DTT). Аліквоти по 100мкл (на мкг білку, див. Таблицю 1) було додано у о холоджені льодом пропіленові туби 12x75мм, що містять 100мкл відповідного радіоліганду (див. Таблиця 1) і 100мкл тестованих при різних концентраціях пептидів. Загальне (33) та неспецифічне (НС) зв'язування визначали у відсутності і присутності 10мкМ налоксану, відповідно. Туби стр ушували та інкубували при 25°С протягом 60-75хв., після чого вміст швиденько фільтрували у вакуумі та промивали приблизно 12 мл/тубу льодяним буфером для промивання (50мМ Трис, рН 7,0, 3мМ МgСІ2) через фільтри GF/B (Whatмan), попередньо просочених протягом щонайменше 2 годин у 0,1% поліетиленіміні. Радіоактивність (dpм), що залишилась на фільтрах, було визначено бета-лічильником, після промочування фільтрів протягом щонайменше 12 годин в мінісклянках, що містять 6-7мл сцинтиляційної рідини. Якщо аналіз проведено у планшетах з 96 глибокими комірками, фільтрування здійснювали на 96-місцевих попередньо просочених РЕІ уніфільтрах, які було промито 3 ´ 1мл промивочним буфером, і висушено у сушильній шафі при 55°С протягом 2 годин. Фільтр-плати було підраховано лічильником TopCount (Packard) після додавання 50мкл/комірку сцинтиляційної рідини MS-20. Усі біологічні дані зафіксовано у Таблиці 1. Таблиця 1 Біологічні дані для Прикладів, наведених у описі. HDELTA мозок пацюків Мозок мишей ML M Приклад HDELTA % 10000 100000 № EC50 % EMAX EC50 % EMAX EC50 EMAX %REM %REM 1 0.436 0.61 105.4 9.61 99.49 14.97 112.07 10.4 85.2 6 0.466 0.21 107.1 3.41 133.06 3.54 134.25 2 69 15 0.221 0.22 104.82 429 140.11 7.5 131.28 3.5 83.5 16 0.271 0.22 96.86 5.53 123.99 7.92 140.7 5 83 19 1.296 1.26 103.63 50.48 88.32 30.667 61.667 20 1.324 0.98 99.86 36.88 86.02 20.72 74.02 30.5 81.5 21 0.987 1.52 98.72 81.24 101.79 16.333 85 22 2.127 1.23 109.06 19.03 102.46 23.98 96.36 8.5 85 23 1.436 0.4 98.85 6.83 102.98 4.74 91.08 30.5 93 24 0.704 2.63 92.31 45.93 92.88 43.21 91.26 3.5 71.5 25 0.763 1.13 111.21 14.1 113.59 16.14 112.12 0 71 26 0.641 1.14 104.65 11.72 78.42 9.3 88.34 31.5 86 27 0.416 1.29 101.34 19.64 129.03 44.19 130.03 2 65 28 0.651 0.7 106.46 23.45 141.23 40.24 144.02 1.5 80 29 0.3 1.17 118.27 18.68 107.04 31.03 130.01 6 92.5 30 0.24 0.26 95.88 4.12 158.09 6.55 159.09 26 82 31 1.61 14.05 105.52 130.53 41.3 152.57 50.26 32 1.023 3.92 114.6 85 122.51 119.46 115.43 33 1.707 13.3 87.74 125.51 100.37 217.34 100.53 RLM 10000 100000 %REM %REM 4.333 66.125 5.333 81.333 8 73 1.5 66.5 0 35.667 4.5 51.5 2.333 45 17 63 20.5 75 3.5 87.5 4 71 3.5 63.5 3.5 54.5 1.5 52 36.5 74.5 31 74 Аналіз даних Специфічне зв'язування (С3) було обчислено як TB-NS, і С3 у присутності різних тестованих пептидів було виражено як процент від контрольного С3. Значення ІК50 і коефіцієнту Хілла (nн) для лігандів при витісненні специфічно зв'язаного радіоліганду було обчислено за логіт-перетворенням графіків або програмами підгонки кривих, наприклад, Ligand, GraphPad PrisM, SigiviaPlot, або ReceptorFit. Значення Ki було обчислено за рівнянням Ченга-Пруссофа. Значення ± стандартна похибка величин ІК50, Ki та nн повідомлено для лігандів, тестованих за щонайменше трьома кривими заміщення. Експерименти на насичення рецепторів Значення радіоліганду Кd було визначено на основі проведення аналізу зв'язування на мембранах клітин з прийнятними радіолігандами при концентраціях в межах 0,2-5 разів оціненого Кd (до 10 разів, якщо кількості необхідного радіоліганду є допустимими). Специфічне зв'язування радіолігандів було виражено як пмоль/мг мембранного білку. Значення Кd і Вмакс з окремих експериментів було отримано з нелінійних пригінок специфічно зв'язаного (В) проти нМ вільного радіоліганду (F) від індивідуалу згідно з одномісцевою моделлю. Bизначення механо-алодинії, використовуючи тестування вон-фрея Тестування проводили між 08:00 і 16:00, застосовуючи спосіб, описаний Chaplan et al. (1994). Щурів помістили у клітки з плексигласу на сітчасте дно з дроту, яке дає доступ до лапи, і залишили там для звикання на 10-15хв. Зоною тестування було вибрано середину підошви лівої задньої лапи, уникаючи менш чутливи х подушечок ступні. До лап торкалися набором з 8 волосинок Вон Фрея з логарифмічно зростаючою жорсткістю (0,41, 0,69, 1,20, 2,04, 3,63, 5,50, 8,51, і 15,14г.; Stoelting, 111, USA). Волосинку Вон Фрея підкладали з під-низу сітчастої підлоги, перпендикулярно до поверхні підошви, з достатньою силою, щоб спричинити таким чином легкий вигин лапи, і тримали приблизно 6-8сек. Позитивну реакцію було помічено, коли лапа різко відсмикувалася. Відсмикування відразу після усування волосинки, також приймалося за позитивну реакцію. Рухомість вважали сумнівною реакцією, і у таких випадках подразнення повторювали знову. Протокол тестування Тварин тестували в день 1 після операції для FCA-лікувальної групи. 50% поріг відсмикування визначали, використовуючи понижуючий спосіб Діксона (1980). Тестування почали з волосинки 2,04г, у середині набору. Стимули завжди представляли у послідовному напрямку, при зростанні чи зменшенні. У відсутність реакції відсмикування лапи на спочатку вибрану волосинку, спостерігали сильне збуджування; якщо лапа відсмикувалася, спостерігали наступне слабше збудження. Для обчислення оптимального порогу на основі цього способу необхідно 6 реакцій у безпосередній близькості до 50% порогу, і підраховування 6 реакцій почалося тоді, коли відбулася перша зміна реакції, наприклад, поріг було вперше перейдено. У випадках, коли пороги виходили за межі стимулів, значення 15,14 (нормальна чутливість) або 0,41 (максимальна алодинічна) задавалися відповідно. Отриману картину позитивної та негативної реакцій було занесено у таблицю, використовуючи умовні позначення, X = ніякого відсмикування; 0 = відсмикування, а 50% поріг відсмикування було уведено, використовуючи формулу: 50% г поріг = I0(Xf+Кd)/10,000 де Xf = значення останньої використаної волосинки вон Фрея (у логарифмічних одиницях); k = табличне значення (з Chaplan et al. (1994)) для зразка позитивної/негативної реакцій; і d = слабка різниця між стимулами (у логарифмічних одиницях). Тут d = 0,224. Пороги вон Фрея було перетворено у процент максимально можливої дії (% МРЕ), згідно з Chaplan et al. 1994. Наступне рівняння було використано для обчислення % МРЕ: % МРЕ = Поріг обробки ліками (g) - поріг алодинії fg) X 100 поріг для контролю (g) - поріг алодинії (g) Уведення тест-речовини Щурам робили ін'єкції (підшкірно, інтраперитонально, внутрішньовенно або перорально) з тест-речовиною до початку тестування за Вон Фреєм, час між уведенням тест-сполуки і тестом Вон Фрея змінювали, залежно від природи тест-сполуки. Тест вритинга Оцтова кислота призвела би до абдомінальних скорочень при інтраперитональному уведенні мишам, витягуючи таким чином їх тіло у типовій картині. Коли уводять аналгезивні ліки, цю описану зміну спостерігали рідше, і ліки вибирали як потенційно гарний засіб. Повним і типовим рефлекс Вритинга вважають лише тоді, коли присутні наступні елементи: тварина не рухається; нижча частина спини послаблена; видно підошву обох лап. (і) Виготовлення розчинів Оцтова кислота (АсОН): 120мкл Оцтової кислоти додають до 19,88мл дистильованої води для того, щоб отримати кінцевий об'єм 20мл з кінцевою концентрацією 0,6% АсОН. Розчин тоді змішують (перемішують мішалкою) і він готовий для ін'єкцій. Сполука (лікувальний засіб): Кожну сполуку виготовляють і розчиняють у найпридатнішому носії згідно зі стандартними способами. (іі) Уведення розчинів Сполуку (лікувальний засіб) уводять перорально, інтраперитонально (і.р.), підшкірно (s.c.) або внутрішньовенно (i.v.)) при 10мл/кг (враховуючи середню масу тіла мишей) за 20, 30 або 40хв. (згідно з класом сполук і їх характеристиками) перед тестуванням. Коли сполуку уводять центральним шляхом: інтравентркулярно (i.c.v.) або інтратекально (i.t.) уводять об'єм 5мкл. АсОН уводять інтраперитонально (і.р.) у двох місцях при концентрації 10мл/кг (враховуючи середню масу тіла мишей) відразу до тестування. (ііі) Тестування За твариною (мишею) спостерігали протягом 20хв. і записували кількість випадків (рефлекс Вритинга), і компілювали під кінець експерименту. Мишей тримали в індивідуальних клітках типу "коробка для взуття" з контактною підкладкою. Всього спостерігали за 4 мишами протягом того самого часу: одна контрольна і три для доз лікувального засобу.
ДивитисяДодаткова інформація
Назва патенту англійською4-diarylaminopyperidine derivatives, use thereof, a pharmaceutical composition based thereon, a method for treatment (variants), an intermediary compound
Назва патенту російськоюПроизводные 4-диариламинопиперидина, их применение, фармацевтическая композиция на их основе, способ лечения (варианты), промежуточное соединение
МПК / Мітки
МПК: A61P 35/00, A61K 31/4545, A61P 25/36, A61P 1/12, C07D 211/58, A61K 31/4535, A61P 19/08, C07D 401/06, A61P 9/12, A61P 25/32, C07D 409/06, A61P 25/22, A61K 31/4525, A61P 25/34, A61P 11/00, C07D 405/06, A61K 31/4468, A61P 25/04, A61K 31/454, A61P 23/00, A61P 29/00, A61P 1/00, A61P 13/02, A61P 25/06, A61P 25/02, A61P 37/02, A61P 25/24, A61P 31/12
Мітки: сполука, основі, лікування, спосіб, 4-діариламінопіперидину, похідні, фармацевтична, використання, проміжна, варіанти, композиція
Код посилання
<a href="https://ua.patents.su/22-72287-pokhidni-4-diarilaminopiperidinu-kh-vikoristannya-farmacevtichna-kompoziciya-na-kh-osnovi-sposib-likuvannya-varianti-promizhna-spoluka.html" target="_blank" rel="follow" title="База патентів України">Похідні 4-діариламінопіперидину, їх використання, фармацевтична композиція на їх основі, спосіб лікування (варіанти), проміжна сполука</a>