Похідні бензазепіну, придатні для використання як антагоністів вазопресину
Номер патенту: 98966
Опубліковано: 10.07.2012
Автори: Ямада Кейго, Като Юсуке, Кондо Казумі, Мацуда Такакуні, Томохіра Юсо, Мендзо Ясухіро, Міямура Сін, Томоясу Такахіро
Формула / Реферат
1. Сполука бензазепіну, представлена загальною формулою (1)
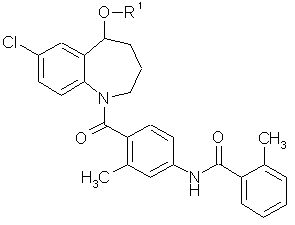 , (1)
, (1)
в якій R1 означає групу з (1-1) до (1-7):
(1-1) являє собою групу -CO-(CH2)n-COR2, в якій n означає ціле число від 1 до 4, R2 означає (2-1) гідроксильну групу; (2-2) нижчу алкоксигрупу, у випадку необхідності заміщену гідроксильною групою, нижчою алканоїльною групою, нижчою алканоїлоксигрупою, нижчою алкоксикарбонілоксигрупою, циклоалкілоксикарбонілоксигрупою або 5-метил-2-оксо-1,3-діоксол-4-ілом; або (2-3) аміногрупу, у випадку необхідності заміщену гідрокси-нижчим алкілом;
(1-2) являє собою групу -CO-(CH2)р-O-CO-NR5R6, в якій р означає ціле число від 1 до 4, R5 означає нижчу алкільну групу, і R6 означає групу нижчий алкоксикарбоніл-нижчий алкіл;
(1-3) являє собою групу -CO-(CH2)q-X-R7, в якій q означає ціле число від 1 до 4, X означає атом кисню, атом сірки або сульфонільну групу, і R7 означає групу карбокси-нижчий алкіл або групу нижчий алкоксикарбоніл-нижчий алкіл;
(1-4) являє собою групу -CO-R, в якій R означає (8-1) алкільну групу, у випадку необхідності заміщену атомом галогену, нижчою алканоїлоксигрупою або фенільною групою (заміщеною дигідроксифосфорилоксигрупою, в якій гідроксильні групи можуть бути заміщені бензильними групами, і нижчою алкільною групою), (8-2) нижчу алкоксигрупу, заміщену атомом галогену, нижчою алканоїлоксигрупою або дигідроксифосфорилоксигрупою, (8-3) піридильну групу або (8-4) нижчу алкоксифенільну групу;
(1-5) являє собою нижчу алкільну групу, заміщену групою, вибраною з групи, що складається з нижчої алкілтіогрупи, дигідроксифосфорилоксигрупи і нижчої алканоїлоксигрупи; і
(1-6) являє собою пептидний залишок, вибраний з групи, що складається з:
саркозил-гліцил, гліцил-гліцил, гліцил-саркозил, саркозил-саркозил, гліцил-аланіл, аланіл-гліцил, гліцил-фенілаланіл, фенілаланіл-гліцил, фенілаланіл-фенілаланіл, гліцил-гліцил-гліцил, N-етилгліцил-гліцил, N-пропілгліцил-гліцил, N,N-диметилгліцил-гліцил, N,N-діетилгліцил-гліцил, N-метил-N-етилгліцил-гліцил, саркозил-гліцил-гліцил, N-етилгліцил-гліцил-гліцил і N,N-диметилгліцил-гліцил-гліцил, кожний з яких у випадку необхідності захищений однією або більше захисними групами; або її сіль.
2. Сполука за п. 1, де, у формулі (1), R1 означає групу, вибрану з групи, що складається з: -СО-(СН2)n-СООН, в якій n означає ціле число від 1 до 4; -CO-R8, в якій R8 означає алкільну групу; і пептидний залишок, вибраний з групи, що складається з: саркозил-гліцил, гліцил-гліцил, гліцил-саркозил, саркозил-саркозил, гліцил-аланіл, аланіл-гліцил, гліцил-фенілаланіл, фенілаланіл-гліцил, фенілаланіл-фенілаланіл, гліцил-гліцил-гліцил, N-етилгліцил-гліцил, N-пропілгліцил-гліцил, N,N-диметилгліцил-гліцил, N,N-діетилгліцил-гліцил, N-метил-N-етилгліцил-гліцил, саркозил-гліцил-гліцил, N-етилгліцил-гліцил-гліцил і N,N-диметилгліцил-гліцил-гліцил, кожний з яких у випадку необхідності захищений однією або більше захисними групами; або її сіль.
3. Сполука за п. 1, де, у формулі (1), R1 означає пептидний залишок, вибраний з групи, що складається з наведених далі залишків: саркозил-гліцил, гліцил-гліцил, гліцил-саркозил, гліцил-аланіл, аланіл-гліцил, саркозил-саркозил, гліцил-фенілаланіл, фенілаланіл-гліцил, фенілаланіл-фенілаланіл, гліцил-гліцил-гліцил, N,N-диметилгліцил-гліцил, N-метил-N-етилгліцил-гліцил, саркозил-гліцил-гліцил і N,N-диметилгліцил-гліцил-гліцил, кожний з яких може бути захищений однією або більше захисними групами; або її сіль.
4. Сполука за п. 3, де, у формулі (1), R1 означає пептидні залишки, вибрані з групи, що складається з наведених далі залишків: саркозил-гліцил, гліцил-гліцил, гліцил-саркозил, гліцил-аланіл, аланіл-гліцил, гліцил-фенілаланіл, фенілаланіл-гліцил, фенілаланіл-фенілаланіл, гліцил-гліцил-гліцил, N,N-диметилгліцил-гліцил, N-метил-N-етилгліцил-гліцил і N,N-диметилгліцил-гліцил-гліцил, кожний з яких може бути захищений однією або більше захисними групами; або її сіль.
5. Фармацевтичний препарат, що містить сполуку бензазепіну за п. 1 або її фармакологічно прийнятну сіль і фармакологічно прийнятний розріджувач і/або носій.
6. Фармацевтичний препарат за п. 5, що використовується як судинорозширювальний засіб, гіпотензивний лікарський засіб, акваретик або інгібітор агрегації тромбоцитів.
Текст
Реферат: Даний винахід стосується сполуки бензазепіну, яка може підтримувати протягом тривалого періоду часу рівень у крові толваптану, що дозволяє забезпечити бажані фармацевтичні ефекти. Сполука бензазепіну відповідно до даного винаходу представлена загальною формулою (1) UA 98966 C2 (12) UA 98966 C2 O R 1 Cl N O H3C O CH3 N H , (1) 1 2 2 в якій R означає групу -CO-(CH2)n-COR (де n означає ціле число від 1 до 4, і R означає (2-1) гідроксильну групу; (2-2) нижчу алкоксигрупу, у випадку необхідності заміщену гідроксильною групою, нижчою алканоїльною групою, нижчою алканоїлоксигрупою, нижчою алкоксикарбонілоксигрупою, циклоалкілоксикарбонілоксигрупою або 5-метил-2-оксо-1,3діоксол-4-ілом; або (2-3) аміногрупу, у випадку необхідності заміщену групою гідрокси-нижчий алкіл), і т. п. UA 98966 C2 Даний винахід стосується нової сполуки бензазепіну і фармацевтичного препарату. Толваптан, представлений наведеною нижче формулою (2), є відомою сполукою і розкритий, наприклад, у патенті США 5258510 (Приклад 1199). 5 10 15 20 Відомо, що толваптан може бути використаний як антагоніст вазопресину, що має акваретичну ефективність (Circulation, 107, pp. 2690-2696 (2003)). Однак, через свою низьку водорозчинність толваптан має проблеми, пов'язані з його поганою абсорбцією зі шлунковокишкового тракту, і його лікарська форма і шлях введення обмежені. З погляду лікування, було б бажано розробити новий лікарський засіб, який міг би підтримувати протягом тривалого періоду часу рівень толваптану у крові, що дозволяє забезпечити бажані фармацевтичні ефекти. Метою даного винаходу є одержання нової сполуки бензазепіну, яка мала б чудові властивості, такі як підтримка рівня толваптану у крові протягом тривалого періоду часу, що дозволяє забезпечити бажані фармацевтичні ефекти. Автори даного винаходу провели значні дослідження для рішення зазначеної задачі і у результаті виявили, що сполуки бензазепіну, представлені загальною формулою (1), мають чудові властивості, такі як підтримка фармацевтичних ефектів активного інгредієнта толваптану протягом тривалого періоду часу в організмі. Даний винахід був здійснений на підставі зазначених відкриттів. Даний винахід стосується наведених нижче сполук бензазепіну і фармацевтичних препаратів, що містять сполуки, показані нижче у пунктах 1-3. Пункт 1. Сполука бензазепіну, представлена загальною формулою (1) 25 1 30 35 40 в якій R означає групу з (1-1) до (1-7): 2 2 (1-1) являє собою групу -CO-(CH2)n-COR , в якій η означає ціле число від 1 до 4, R означає (2-1) гідроксильну групу; (2-2) нижчу алкокси-групу, у випадку необхідності заміщену гідроксильною групою, нижчою алканоїльною групою, нижчою алканоїлокси-групою, нижчою алкоксикарбонілокси-групою, циклоалкілоксикарбонілокси-групою або 5-метил-2-оксо-1,3діоксол-4-ілом; або (2-3) аміногрупу, у випадку необхідності заміщену гідрокси-нижчим алкілом; 3 4 3 (1-2) являє собою групу -CO-(CH2)m-NR R , в якій m означає ціле число від 0 до 4, R 4 означає атом водню або нижчу алкільну групу, R - (4-1) атом водню; (4-2) нижчу алкільну групу, у випадку необхідності заміщену атомом галогену, нижчою алкіламіногрупою, нижчою алкоксикарбонільною групою або 5-метил-2-оксо-1,3-діоксол-4-ілом; або (4-3) нижчу алкоксикарбонільну групу, у випадку необхідності заміщену атомом галогену, нижчою 3 4 алканоїлокси-групою або 5-метил-2-оксо-1,3-діоксол-4-ілом, R і R можуть утворювати 5-63 4 членне насичене гетероциклічне кільце шляхом зв'язування R і R один з одним, разом з 1 UA 98966 C2 3 5 10 15 20 25 30 35 40 45 50 55 4 атомом азоту, з яким R і R зв'язані безпосередньо або через атом азоту, або через атом кисню, причому гетероциклічне кільце може бути заміщене (4-4) нижчою алкільною групою, у випадку необхідності заміщеною гідрокси-нижчим алкокси; (4-5) нижчу алкоксикарбонільну групу; (4-6) алкілкарбонільну групу (у випадку необхідності заміщену по алкільній групі карбоксильною групою або нижчою алкоксикарбонільною групою); (4-7) арилкарбонільну групу; або (4-8) фурилкарбонільну групу; 5 6 5 (1-3) являє собою групу -CO-(CH2)р-O-CO-NR R , в якій ρ означає ціле число від 1 до 4, R 6 означає нижчу алкільну групу і R означає групу нижчий алкоксикарбоніл-нижчий алкіл; 7 (1-4) являє собою групу -CO-(CH2)q-X-R , в якій q означає ціле число від 1 до 4, X означає 7 атом кисню, атом сірки або сульфонільну групу, і R означає групу карбокси-нижчий алкіл або групу нижчий алкоксикарбоніл-нижчий алкіл; 8 8 (1-5) являє собою групу -CO-R , в якій R означає (8-1) алкільну групу, у випадку необхідності заміщену атомом галогену, нижчою алканоїлокси-групою або фенільною групою (заміщеною дигідроксифосфорилокси-групою, в якій гідроксильні групи можуть заміщені бензильними групами, і нижчою алкільною групою), (8-2) нижчу алкокси-групу, заміщену атомом галогену, нижчою алканоїлокси-групою або дигідроксифосфорилокси-групою, (8-3) піридильну групу або (8-4) нижчу алкоксифенільну групу; (1-6) являє собою нижчу алкільну групу, заміщену групою, вибраною з групи, що складається з нижчої алкілтіо-групи, дигідроксифосфорилокси-групи і нижчої алканоїлокси-групи; і (1-7) являє собою амінокислотний або пептидний залишок, у випадку необхідності захищений однією або більше захисними групами; або її сіль. 1 Пункт 2. Сполука відповідно до Пункту 1, де, у формулі (1), R означає групу, вибрану з 8 групи, що складається з: -СО-(СН2)n-СООН, в якій η означає ціле число від 1 до 4; -CO-R , в якій 8 R означає алкільну групу; і амінокислотний або пептидний залишок, у випадку необхідності захищений однією або більше захисними групами; або її сіль. 1 Пункт 3. Сполука відповідно до Пункту 1, де, у формулі (1), R означає аланіл, саркозил, Nетилгліцил, N-пропілгліцил, N-метил-N-етилгліцил, N-метил-N-пропілгліцил, N-метил-Nбутилгліцил, N-метил-N-пентилгліцил або N-метил-N-гексилгліцил; або пептидний залишок, вибраний з групи, що складається з наведених нижче залишків: саркозил-гліцил, гліцил-гліцил, гліцил-саркозил, гліцил-аланіл, аланіл-гліцил, саркозил-саркоцил, фенілгліцил-аланіл, фенілаланіл-гліцил, фенілаланіл-фенілаланіл, гліцил-гліцил-гліцил, Ν,Ν-диметилгліцил-гліцил, N-метил-N-етилгліцил-гліцил, саркозил-гліцил-гліцил і Ν,Ν-диметилгліцил-гліцил-гліцил, кожний з яких може бути захищений однією або більше захисними групами; або її сіль. 1 Пункт 4. Сполука відповідно до Пункту 3, де, у формулі (1), R означає пептидні залишки, вибрані з групи, що складається з наведених нижче залишків: саркозил-гліцил, гліцил-гліцил, гліцил-саркозил, гліцил-аланіл, аланіл-гліцил, фенілгліцил-аланіл, фенілаланіл-гліцил, фенілаланіл-фенілаланіл, гліцил-гліцил-гліцил, Ν,Ν-диметилгліцил-гліцил, N-метил-Nетилгліцил-гліцил і Ν,Ν-диметилгліцил-гліцил-гліцил, кожний з яких може бути захищений однією або більше захисними групами; або її сіль. Пункт 5. Фармацевтичний препарат, що містить сполуку бензазепіну за Пунктом 1 або її фармакологічно прийнятну сіль і фармакологічно прийнятний розріджувач і/або носій. Пункт 6. Фармацевтичний препарат відповідно до Пункту 5, що використовується як судинорозширювальний засіб, гіпотензивний лікарський засіб, акваретик або інгібітор агрегації тромбоцитів. Окремими прикладами груп у загальній формулі (1) є наведені нижче. У цьому описі термін "нижчий" стосується "С1-6", якщо не зазначено інше. Приклади нижчих алканоїльних груп включають прямі або розгалужені С 2-6 алканоїльні групи, такі як ацетил, н-пропіоніл, н-бутирил, ізобутирил, н-пентаноїл, трет-бутилкарбоніл і нгексаноїл. Приклади нижчої алканоїлокси-групи включають прямі або розгалужені С2-6 алканоїлокси групи, такі як ацетилокси, н-пропіонілокси, н-бутирилокси, ізобутирилокси, н-пентаноїлокси, трет-бутилкарбонілокси і н-гексаноїлокси група. Приклади нижчої алкоксикарбонілокси-групи включають алкоксикарбонілокси-групи, в яких алкокси-група є прямою або розгалуженою С1-6 алкокси-групою, такі як метоксикарбонілокси, етоксикарбонілокси, н-пропоксикарбошлокси, ізопропоксикарбонілокси, н-бутоксикарбонілокси, ізобутоксикарбонілокси, трет-бутоксикарбонілокси, втор-бутоксикарбонілокси, нпентилоксикарбонілокси, неопентилоксикарбонілокси, н-гексилоксикарбонілокси, ізогексилоксикарбонілокси і 3-метшшентилоксикарбонілокси. 2 UA 98966 C2 5 10 15 20 25 30 35 40 45 50 55 Приклади циклоалкілоксикарбонілокси-груп включають циклоалкілоксикарбонілокси-групи, в яких циклоалкільна група є С3-8 циклоалкільною групою, такі як циклопропілоксикарбонілокси, циклобутилоксикарбонілокси, циклопентилоксикарбонілокси, циклогексилокси-карбонілокси, циклогептилоксикарбонілокси і циклооктилоксикарбонілокси. Приклади циклоалкілкарбонільних груп включають циклоалкілкарбонільні групи, в яких циклоалкільна група є C3-8 циклоалкільною групою, такі як циклопропілкарбоніл, циклобутилкарбоніл, циклопентилкарбоніл, циклогексил-карбоніл, циклогептилкарбоніл і циклооктилкарбоніл. Приклади нижчої алкокси-групи включають прямі або розгалужені С1-6 алкокси-групи, такі як метокси, етокси, н-пропокси, ізопропокси, н-бутокси, ізобутокси, трет-бутокси, втор-бутокси, нпентилокси, ізопентилокси, неопентилокси, н-гексилокси, ізогексилокси і 3-метилпентилокси. Приклади груп гідрокси-нижчий алкіл включають прямі або розгалужені С1-6 алкільні групи, що мають від однієї до трьох гідроксильних груп, такі як гідроксиметил, 2-гідроксіетил, 1гідроксіетил, 3-гідроксипропіл, 2,3-дигідрокси-пропіл, 4-гідроксибутил, 3,4-дигідроксибутил, 1,1диметил-2-гідроксіетил, 5-гідроксипентил, 6-гідроксигексил, 3,3-диметил-З-гідроксипропіл, 2метил-3-гідроксипропіл і 2,3,4-тригідроксибутил. Приклади нижчої алкільної групи включають прямі або розгалужені С 1-6 алкільні групи, такі як метил, етил, н-пропіл, ізопропіл, н-бутил, ізобутил, трет-бутил, втор-бутил, н-пентил, ізопентил, неопентил, н-гексил, ізогексил і 3-метилпентил. Приклади атомів галогену включають фтор, хлор, бром і йод. Приклади нижчої алкіламіногрупи включають аміногрупи, заміщені однією-двома прямими j або розгалуженими С1-6 алкільними групами, такими як метиламіно, етиламіно, н-пропіламіно, ізопропіламіно, н-бутиламіно, трет-бутиламіно, н-пентиламіно, н-гексиламіно, диметиламіно, діетиламіно, ди-н-пропіламіно, ди-н-бутиламіно, ди-н-пентиламіно, ди-н-гексиламіно, N-метилN-етиламіно, N-етил-N-н-пропіламіно, N-метил-N-н-бутиламіно і N-метил-N-н-гексиламіно. Приклади нижчої алкоксикарбонільної групи включають алкоксикарбонільні групи, в яких алкокси-група є прямою або розгалуженою C1-6 алкокси-групою, такою як метоксикарбоніл, етоксикарбоніл, н-пропоксикарбоніл, ізопропоксикарбоніл, н-бутоксикарбоніл, ізобутоксикарбоніл, трет-бутокси-карбоніл, втор-бутоксикарбоніл, н-пентилоксикарбоніл, неопентилоксикарбоніл, н-гексилоксикарбоніл, ізогексилоксикарбоніл і 3метилпентилоксикарбоніл. 3 4 Приклади 6-членних насичених гетероциклічних кілець, утворених з'єднанням R і R один з 3 4 одним разом з атомом азоту, з яким R і R зв'язані безпосередньо або через атом азоту, або через атом кисню, включають піперазин, піперидин, морфолін і т.п. Приклади груп гідрокси-нижчий алкокси включають гідроксіалкокси-групи, які мають одну або дві гідроксильних групи, причому алкокси-група є прямою або розгалуженою С1-6 алкоксигрупою, такою як гідроксиметокси, 2-гідроксіетокси, 1-гідроксіетокси, 3-гідроксипропокси, 4гідроксибутокси, 5-гідроксипентилокси, 6-гідроксигексилокси, 1,1 -диметил-2-гідроксіетокси і 2метил-3-гідроксипропокси. Приклади алкілкарбонільних груп включають алкілкарбонільні групи, в яких алкільна група є прямою або розгалуженою С1-20 алкільною групою, такою як метилкарбоніл, етилкарбоніл, нпропілкарбоніл, ізопропілкарбоніл, н-бутилкарбоніл, ізобутилкарбоніл, трет-бутилкарбоніл, вторбутилкарбоніл, н-пентилкарбоніл, ізопентилкарбоніл, неопентилкарбоиіл, н-гексилкарбоніл, ізогексилкарбоніл, 3-метилпентилкарбоніл, н-гептилкарбоніл, н-октилкарбоніл, н-нонілкарбоніл, н-децилкарбоніл, н-ундецилкарбоніл, н-додецилкарбоніл, н-тридецилкарбоніл, нтетрадецилкарбоніл, н-пентадецилкарбоніл, н-гексадецилкарбоніл, н-гептадецилкарбоніл, ноктадецилкарбоніл, н-нонадецилкарбоніл і н-ікозилкарбоніл. Приклади арилкарбонільних груп включають фенілкарбоніл, (1- або 2-) нафтилкарбоніл і т.п. Приклади фурилкарбонільних груп включають (2- або 3-)фурилкарбоніл. Приклади груп нижчий алкоксикарбоніл-нижчий алкіл включають алкоксикарбонілалкільні групи, в яких алкокси-група є прямою або розгалуженою С1-6 алкокси-групою, і алкільна група є прямою або розгалуженою С1-6 алкільною групою, такі як метоксикарбонілметил, етоксикарбонілметил, 2-метоксикарбонілетил, 2-етоксикарбонілетил, 1-етоксикарбонілетил, 3метоксикарбонілпропіл, 3-етоксикарбонілпропіл, 4-етоксикарбонілбутил, 5ізопропоксикарбонілпентил, н-пропоксикарбонілгексил, 1,1 -диметил-2-н-бутоксикарбонілетил, 2-метил-3-трет-бутоксикарбонілпропіл, 2-н-пентилокси-карбонілетил і нгексилоксикарбонілметил. Приклади груп карбокси-нижчий алкіл включають карбоксіалкільні групи, в яких алкільна група є прямою або розгалуженою С1-6 алкільною групою, такі як карбоксиметил, 2-карбоксіетил, 3 UA 98966 C2 5 10 15 20 25 1-карбоксіетил, 3-карбоксипропіл, 4-карбоксибутил, 5-карбоксипентил, 6-карбоксигексил, 1,1диметил-2-карбоксіетил і 2-метил-З-карбоксипропіл. Приклади нижчий алкокси-фенільних груп включають алкоксифенільні групи, в яких алкоксигрупа є прямою або розгалуженою С1-6 алкокси-групою, такі як метоксифеніл, етоксифеніл, нпропоксифеніл, ізопропоксифеніл, н-бутоксифеніл, ізобутоксифеніл, трет-бутоксифеніл, вторбутоксифеніл, н-пентилоксифеніл, ізопентилоксифеніл, неопентилоксифеніл, нгексилоксифеніл, ізогексилоксифеніл і 3-метилпентилоксифеніл. Приклади нижчої алкілтіо-групи включають прямі або розгалужені С 1-6 алкілтіо групи, такі як метилтіо, етилтіо, н-пропілтіо, ізопропілтіо, н-бутилтіо, трет-бутилтіо, н-пентилтіо і н-гексилтіо. Приклади амінокислотних або пептидних залишків включають амінокислотні залишки, такі як аланіл, фенілаланіл, саркозил, валіл, лейцил, ізолейцил, проліл, N-етилгліцил, N-пропілгліцил, N-ізопропілгліцил, N-бутилгліцил, N-трет-бутилгліцил, N-пентилгліцил, N-гексилгліцил, Ν,Νдіетилгліцил, Ν,Ν-дипропілгліцил, Ν,Ν-дибутилгліцил, Ν,Ν-дипентилгліцил, Ν,Ν-дигексилгліцил, N-метил-N-еталгліцил, N-метил-N-пропілгліцил, N-метил-N-бутилгліцил, N-метил-Nпентилгліцил і Ν-метил-N-гексилгліцил; і пептидні залишки, такі як саркозил-гліцил, гліцилгліцил, гліцил-саркозил, саркозил-саркозил, аланіл-гліцил, фенілаланіл-гліцил, фенілаланілфенілаланіл, гліцил-гліцил-гліцил, N-етилгліцил-гліцил, Ν-пропілгліцил-гліцил, Ν,Νдиметилгліцил-гліцил, Ν,Ν-діетилгліцил-гліцил, N-метил-N-етилгліцил-гліцил, саркозил-гліцилгліцил, N-етилгліцил-гліцил-гліцил і Ν,Ν-диметилгліцил-гліцил-гліцил. Приклади захисних груп для амінокислот і пептидів включають звичайно використовувані для захисту аміногруп амінокислот або пептидів, такі як трет-бутоксикарбоніл, бензилоксикарбоніл, флуоренілметоксикарбоніл і ацетил. Сполуки бензазепіну, представлені загальною формулою (1), можуть бути одержані різними способами; наприклад, способами відповідно до наведених нижче реакційних схем. Серед сполук бензазепіну, представлених загальною формулою (1), або їх солей, сполука 1 (1а), в якій R означає групу з (1-1) до (1-5) або (1-7), як визначено вище, може бути одержана з толваптану формули (2) відповідно до реакційної схеми 1, 2 або 3. Реакційна схема 1 30 2 35 40 45 2 3 4 де R означає -(CH2)n-COR (в якій n і R мають значення, визначені вище), -(CH2)m-NR R (в 3 4 5 6 5 6 якій m, R і R мають значення, визначені вище), -(СН2)p-О-СО-NR R (в якій р, R і R мають 7 7 8 значення, визначені вище), -(CH2)q-X-R (в якій q, X і R мають значення, визначені вище), -R (в 8 якій R має значення, визначені вище), або групу, утворену видаленням карбонільної групи (групи CO) від амінокислотного або пептидного залишку, у випадку необхідності захищеного однією або більше захисними групами (наприклад, амінометилом для гліцилу, (R)-1аміноетилом для аланілу, (R)-1-аміно-2-фенілпропілом для фенілаланілу, (метиламіно)метилом для саркозилу, (R)-1-аміно-3-метилбутилом для лейцилу, третбутоксикарбоніл(етил)амінометилом для N-трет-бутоксикарбоніл-N-етилгліцилу, (S)-2-амінопропанамідометилом для аланіл-гліцилу, 2-(метиламіно)ацетамідометилом для саркозилгліцилу, (S)-2-аміно-3-фенілпропанамідометилом для фенілаланіл-гліцилу, (2аміноацетамідо)ацетамідо-метилом для гліцил-гліцил-гліцилу, [2(метиламіно)ацетамідо]ацетамідометилом для саркозил-гліцил-гліцилу і т.п.). Відповідно до способу, показаного на реакційній схемі 1, сполуку (1а) одержують, вводячи сполуку (2) у реакцію з ангідридом кислоти (3) у присутності або за відсутності основної сполуки у придатному розчиннику. Кількість ангідриду кислоти (3) звичайно складає від приблизно 1 моль до великого надлишку, і переважно від приблизно 1 до приблизно 10 моль на моль сполуки (2). 4 UA 98966 C2 5 10 15 Розчинник може бути будь-яким відомим розчинником, що не впливає несприятливим чином на реакцію. Приклади таких розчинників включають прості ефіри, такі як простий діетиловий ефір, діоксан, тетрагідрофуран, моноглім і диглім; галогеновані вуглеводні, такі як метиленхлорид, хлороформ, 1,2-дихлоретан і тетрахлорметан; складні ефіри, такі як етилацетат; ароматичні вуглеводні, такі як бензол, толуол і ксилол; апротонні полярні розчинники, такі як ацетонітрил, диметилформамід (DMF), диметилсульфоксид (ДМСО) і Nметилпіролідон (NMP); і суміші цих розчинників. Приклади основних сполук включають триетиламін, піридин і т.п. Кількість основної сполуки звичайно складає щонайменше приблизно 1 моль, і переважно від приблизно 1 до приблизно 10 моль на моль сполуки (2). Така основна сполука може також використовуватися як розчинник. Коли каталізатор, такий як 4-диметиламінопіридин, є присутнім у реакційній системі у вказаній вище реакції, реакція може бути промотована. Температура реакції вказаної вище реакції звичайно являє собою температуру від температури навколишнього середовища до 150 °C, і переважно від температури навколишнього середовища до 100 °C. Час реакції звичайно складає від 15 хвилин до 24 годин, переважно від 30 хвилин до 6 годин, і більш переважно від 1 до 3 годин. Реакційна схема 2 20 1 25 30 35 40 45 де R має значення, визначені вище, і X означає атом галогену. Відповідно до способу, показаного на реакційній схемі 2, сполуку (2) вводять у реакцію з галогенангідридом кислоти (4) у присутності основної сполуки у придатному розчиннику, одержуючи сполуку (1а). Кількість галогенангідриду кислоти (4) звичайно складає від приблизно 1 моль до великого надлишку, і переважно від приблизно 1 до приблизно 10 моль на моль сполуки (2). Розчинник може бути будь-яким відомим розчинником, що не впливає несприятливим чином на реакцію. Приклади таких розчинників включають прості ефіри, такі як простий діетиловий ефір, діоксан, тетрагідрофуран, моноглім і диглім; галогеновані вуглеводні, такі як метиленхлорид, хлороформ, 1,2-дихлоретан і тетрахлорметан; складні ефіри, такі як етилацетат; ароматичні вуглеводні, такі як бензол, толуол і ксилол; апротонні полярні розчинники, такі як ацетонітрил, DMF, ДМСО і NMP; і суміші цих розчинників. Приклади основних сполук включають карбонати, такі як карбонат натрію, карбонат калію, гідрокарбонат натрію, гідрокарбонат калію і карбонат цезію; фосфати, такі як фосфат калію і фосфат натрію; органічні основи, такі як піридин, імідазол, N-етилдіізопропіламін, диметиламінопіридин, тристиламін, триметиламін, диметиланілін, N-метилморфолін, 1,5діазабіцикло[4.3.0]нонен-5 (DBN), 1,8-діазабіцикло[5.4.0]ундецен-7 (DBU) і 1,4діазабіцикло[2.2.2]октан (DABCO); і їх суміші. Кількість основної сполуки звичайно складає щонайменше приблизно 1 моль, і переважно від приблизно 1 до приблизно 10 моль на моль сполуки (2). Така органічна основа може також використовуватися як розчинник. Коли каталізатор, такий як 4-диметиламінопіридин, є присутнім у реакційній системі у вказаній вище реакції, реакція може бути промотована. Температура реакції вказаної вище реакції звичайно складає від -10 °C до 100 °C, і переважно від 0 °C до 50 °C, і більш переважно від 0 °C до температури навколишнього середовища. Час реакції звичайно складає від 15 хвилин до 24 годин, переважно від ЗО хвилин до 6 годин, і більш переважно від 1 до 3 годин. 5 UA 98966 C2 Реакційна схема 3 5 10 15 20 25 30 де R має значення, визначені вище. Відповідно до способу, показаного на реакційній схемі 3, сполуку (2) конденсують з карбоновою кислотою (5) у присутності активатора, одержуючи сполуку (1а). Кількість карбонової кислоти (5) звичайно складає від приблизно 1 до приблизно 10 моль, і переважно від приблизно 1 до приблизно 5 моль на моль сполуки (2). Приклади активаторів включають дициклогексилкарбодіімід, 1-(3-диметиламінопропіл)-3етилкарбодіімід (WSC), карбонілдіімідазол і т.п. Такі активатори можуть використовуватися окремо або у комбінації двох або більше. Кількість активатора звичайно складає щонайменше приблизно 1 моль, і переважно від приблизно 1 моль до приблизно 5 моль на моль сполуки (2). Реакцію конденсації звичайно здійснюють у придатному розчиннику у присутності або за відсутності основної сполуки. Приклади розчинників, які можуть використовуватися, включають прості ефіри, такі як простий діетиловий ефір, діоксан, тетрагідрофуран, моноглім і диглім; галогеновані вуглеводні, такі як метиленхлорид, хлороформ, 1,2-дихлоретан і тетрахлорметан; складні ефіри, такі як етилацетат; ароматичні вуглеводні, такі як бензол, толуол і ксилол; апротонні полярні розчинники, такі як ацетонітрил, DMF, ДМСО і NMP; і суміші цих розчинників. Приклади основних сполук включають триетиламін, піридин і т.п. Кількість основної сполуки звичайно складає щонайменше приблизно 1 моль, і переважно від приблизно 1 до приблизно 10 моль на моль сполуки (2). Така основна сполука може також використовуватися як розчинник. Коли каталізатор, такий як 4-диметиламінопіридин, є присутнім у реакційній системі, реакція може бути промотована. Реакцію звичайно здійснюють при температурі від приблизно -20 °C до приблизно 100 °C, і переважно від 0 °C до температури навколишнього середовища. Реакція звичайно проходить від приблизно 5 хвилин до приблизно 90 годин. Серед сполук бензазепіну, представлених загальною формулою (1), або їх солей, сполука 1 (1b), в якій R означає групу (1-6), визначену вище (нижча алкільна група, заміщена нижчою алкілтіо-групою), може бути одержана з толваптану формули (2) способом відповідно до наведеної нижче реакційної схеми 4: Реакційна схема 4 35 6 UA 98966 C2 1a 5 10 де R означає нижчу алкільну групу, заміщену нижчою алкілтіо-групою. Спосіб, показаний на реакційній схемі 4, являє собою реакцію перетворення атома водню гідроксильної групи сполуки (2) у нижчу алкільну групу, заміщену нижчою алкілтіо-групою. Наприклад, для перетворення атома водню гідроксильної групи сполуки (2) у метилтіометильну групу, сполуку (2) піддають звичайній реакції утворення ефірного зв'язку, так званій реакції Pummerer, або подібній. Звичайну реакцію утворення ефірного зв'язку звичайно проводять у звичайному розчиннику, що не впливає на реакцію, і температура реакції не є критичною. Реакція Pummerer є такою, як показано нижче на реакційній схемі 4-1; сполуку (2) вводять у реакцію з сульфоксидом (6), таким як диметилсульфоксид, у присутності оцтового ангідриду і оцтової кислоти при температурі від температури навколишнього середовища до приблизно 70 °C протягом часу від приблизно 4 до приблизно 72 годин. Реакційна схема 4-1 15 1b 20 1c де R і R незалежно означають нижчу алкільну групу. Серед сполук бензазепіну, представлених загальною формулою (1), або їх солей, сполука 1 (1с), в якій R означає групу (1-6), визначену вище (нижчу алкільну групу, заміщену дигідроксифосфорилокси-групою), може бути одержана, наприклад, зі сполуки (1b) способом відповідно до наведеної нижче реакційної схеми 5: Реакційна схема 5 25 7 UA 98966 C2 1b 5 10 15 20 25 30 35 1a де R означає нижчу алкільну групу, заміщену дигідроксифосфорилокси-групою, і R має значення, визначені вище. Спосіб, показаний на реакційній схемі 5, являє собою реакцію перетворення нижчої 1 алкільної групи, заміщеної нижчою алкілтіо-групою R , у нижчу алкільну групу, заміщену 1 дигідроксифосфорилокси-групою. Наприклад, для перетворення метилтіометильної групи R у дигідроксифосфорилоксиметильну групу, як показано нижче на реакційній схемі 5-1, сполуку (1b") вводять у реакцію з галогенуючим реагентом (наприклад, сульфурилхлоридом, Nйодсукцинімідом і т.п.), і одержану сполуку потім вводять у реакцію з фосфорною кислотою у присутності основної сполуки. Реакційна схема 5-1 1c де r означає ціле число, яке може складати від 1 до 4, і R означає нижчу алкільну групу. Реакцію сполуки (1b") з галогенуючим реагентом переважно здійснюють у галогенованому вуглеводні (наприклад, метиленхлориді, 1,2-дихлоретані і т.п.) при приблизно температурі навколишнього середовища. Кількість галогенуючого реагенту звичайно складає щонайменше приблизно 1 моль, і переважно від приблизно 1 до приблизно 10 моль на моль сполуки (1b"). Ця реакція займає від приблизно 5 хвилин до приблизно 1 години. Потім реакцію одержаної сполуки з фосфорною кислотою переважно проводять у присутності інертного органічного розчинника (наприклад, тетрагідрофурану, ацетонітрилу і т.п.). Кількість фосфорної кислоти звичайно складає щонайменше приблизно 1 моль, і переважно від приблизно 1 до приблизно 10 моль на моль сполуки (1b"). Приклади основних сполук включають карбонати, такі як карбонат натрію, карбонат калію, гідрокарбонат натрію, гідрокарбонат калію і карбонат цезію; фосфати, такі як фосфат калію і фосфат натрію; органічні основи, такі як піридин, імідазол, N-етилдіізопропіламін, диметиламінопіридин, триетиламін, триметиламін, диметиланілін, N-метилморфолін, DBN, DBU і DABCO; і їх суміші. Кількість основної сполуки звичайно складає щонайменше приблизно 1 моль, і переважно від приблизно 1 до приблизно 10 моль на моль сполуки (1b"). Температура реакції вказаної вище реакції звичайно являє собою температуру від температури навколишнього середовища до приблизно 200 °C, і переважно від 50 °C до приблизно 150 °C. Реакція звичайно проходить від приблизно 10 хвилин до приблизно 10 годин. Серед сполук бензазепіну, представлених загальною формулою (1), або їх солей, сполука 1 (1d), в якій R означає групу (1-6), визначену вище (нижчу алкільну групу, заміщену нижчою алканоїлокси-групою), може бути одержана, наприклад, зі сполуки (1Ь) способом відповідно до наведеної нижче реакційної схеми 6: Реакційна схема 6 8 UA 98966 C2 1f 5 10 15 20 25 30 1a де R означає нижчу алкільну групу, заміщену нижчою алканоїлокси-групою, і R має значення, визначені вище. Спосіб, показаний на реакційній схемі 6, являє собою реакцію перетворення нижчої 1 "алкільної групи, заміщеної нижчою алкілтіо-групою R , у нижчу алкільну групу, заміщену нижчою алканоїлокси-групою. Наприклад, як показано нижче на реакційній схемі 6-1, сполуку (1b") вводять у реакцію з галогенуючим реагентом (наприклад, сульфурилхлоридом, Nйодсукцинімідом і т.п.), і одержану сполуку потім вводять у реакцію з карбоновою кислотою або її сіллю. Реакційна схема 6-1 1g 1e де R означає нижчу алкільну групу і R має значення, визначені вище. Реакцію сполуки (1b") з галогенуючим реагентом переважно проводять у галогенованому вуглеводні (наприклад, метиленхлориді, 1,2-дихлоретані і т.п.) приблизно при температурі навколишнього середовища. Кількість галогенуючого реагента звичайно складає щонайменше приблизно 1 моль, і переважно від приблизно 1 до приблизно 10 моль на моль сполуки (1Ь"). Ця реакція проходить від приблизно 5 хвилин до приблизно 1 години. Потім реакцію одержаної сполуки з карбоновою кислотою або її сіллю переважно проводять у присутності інертного органічного розчинника (наприклад, тетрагідрофурану, ацетонітрилу і т.п.).Кількість карбонової кислоти звичайно складає щонайменше приблизно 1 моль, і переважно від приблизно 1 до приблизно 10 моль на моль сполуки (1Ь). Температура реакції звичайно являє собою температуру від температури навколишнього середовища до приблизно 200 °C, і переважно від 50 °C до приблизно 150 °C. Час реакції звичайно складає від приблизно 10 хвилин до приблизно 10 годин. Серед сполук бензазепіну, представлених загальною формулою (1), або їх солей, сполука 1 2 (1f), в якій R означає групу (1-1), визначену вище, і R означає групу (2-2), визначену вище, 1 2 може бути одержана зі сполуки (1е), в якій R означає групу (1-1), визначену вище, і R означає групу (2-1), визначену вище, способом відповідно до наведеної нижче реакційної схеми 7: Реакційна схема 7 9 UA 98966 C2 2a 5 10 15 20 25 30 35 де R означає нижчу алкокси-групу, у випадку необхідності заміщену гідрокси, нижчим алканоїлом, нижчим алканоїлокси, нижчим алкоксикарбонілокси, циклоалкілоксикарбонілокси 2d або 5-метил-2-оксо-1,3-діоксол-4-ілом, R означає нижчу алкокси-групу, у випадку необхідності заміщену гідрокси, нижчим алканоїлом, нижчим алканоїлокси, нижчим алкоксикарбонілокси, 1 циклоалкілоксикарбонілокси або 5-метил-2-оксо-1,3-діоксол-4-ілом, і n, і X мають значення, визначені вище. Реакцію сполуки (1е) зі сполукою (8) проводять у присутності основної сполуки у придатному розчиннику. Кількість сполуки (8) звичайно складає від приблизно 1 моль до великого надлишку, і переважно від приблизно 1 до приблизно 10 моль на моль сполуки (1е). Приклади розчинників реакції включають прості ефіри, такі як простий діетиловий ефір, діоксан, тетрагідрофуран, моноглім і диглім; галогеновані вуглеводні, такі як метиленхлорид, хлороформ, 1,2-дихлоретан і тетрахлорметан; складні ефіри, такі як етилацетат; ароматичні вуглеводні, такі як бензол, толуол і ксилол; апротонні полярні розчинники, такі як ацетонітрил, DMF, ДМСО і NMP; і суміші цих розчинників. Приклади основних сполук включають карбонати, такі як карбонат натрію, карбонат калію, гідрокарбонат натрію, гідрокарбонат калію і карбонат цезію; фосфати, такі як фосфат калію і фосфат натрію; органічні основи, такі як піридин, імідазол, N-етилдіізопропіламін, диметиламінопіридин, триетиламін, триметиламін, диметиланілін, N-метилморфолін, DBN, DBU і DABCO; і т.п. Такі сполуки можуть використовуватися окремо або у комбінації двох або більше. Кількість основної сполуки звичайно складає щонайменше приблизно 1 моль, і переважно від приблизно 1 до приблизно 10 моль на моль сполуки (1е). Така основна сполука може також використовуватися як розчинник. Температура реакції звичайно являє собою температуру від температури навколишнього середовища до 150 °C, і переважно від температури навколишнього середовища до 100 °C. Час реакції звичайно складає від 15 хвилин до 24 годин, переважно від 30 хвилин до 6 годин, і більш переважно від 1 до 3 годин. Серед сполук бензазепіну, представлених загальною формулою (1), або їх солей, сполука 1 2 (1g), в якій R означає групу (1-1), визначену вище, і R означає аміногрупу, заміщену однією або більше групами гідрокси-нижчий алкіл, може бути одержана, наприклад, зі сполуки (1е), в 1 2 якій R означає групу (1-1), визначену вище, і R означає групу (2-1), визначену вище, способом відповідно до наведеної нижче реакційної схеми 8: Реакційна схема 8 10 UA 98966 C2 2b 5 10 15 20 25 де R означає аміногрупу, заміщену однією або більше групами гідрокси-нижчий алкіл, і η має значення, визначені вище. Реакцію сполуки (1е) зі сполукою (9) проводять в умовах реакції, звичайно використовуваних для карбодіімідного способу. Більш конкретно, сполуку (1е) конденсують зі сполукою (9) у присутності активатора, такого як дициклогексилкарбодіімід, 1-(3-диметиламінопропіл)-3етилкарбодіімід (WSC) або карбонілдіімідазол. Кількість активатора звичайно складає щонайменше приблизно 1 моль, і переважно від приблизно 1 до приблизно 5 моль на моль сполуки (1е). Реакцію конденсації проводять у придатному розчиннику у присутності або за відсутності основної сполуки. Приклади розчинників, які можуть використовуватися, включають прості ефіри, такі як простий діетиловий ефір, діоксан; тетрагідрофуран, моноглім і диглім; галогеновані вуглеводні, такі як метиленхлорид, хлороформ, 1,2-дихлоретан і тетрахлорметан; складні ефіри, такі як етилацетат; ароматичні вуглеводні, такі як бензол, толуол і ксилол; апротонні полярні розчинники, такі як ацетонітрил, DMF, ДМСО і NMP; і суміші цих розчинників. Приклади основних сполук включають триетиламін, піридин і т.п. Кількість основної сполуки звичайно складає щонайменше приблизно 1 моль, і переважно від приблизно1 до приблизно 10 моль на моль сполуки (1е). Така основна сполука може також використовуватися як розчинник. Коли WSC використовується як активатор у вказаній вище реакції, присутність каталізатора, такого як 1-гідроксибензотриазол (HOBt), у реакційній системі може промотувати реакцію. Реакцію звичайно проводять при температурі від приблизно -20 °C до приблизно 180 °C, і переважно від 0 °C до приблизно 150 °C. Реакція звичайно займає від приблизно 5 хвилин до приблизно 90 годин. Серед сполук бензазепіну, представлених загальною формулою (1), або їх солей, сполуки, в яких аміногрупа захищена захисною групою, можуть бути перетворені шляхом видалення захисної групи у відповідні сполуки, в яких аміногрупа не захищена захисною групою, наприклад, способом, показаним на наведеній нижче реакційній схемі 9: Реакційна схема 9 30 1h 35 40 45 1 де R є таким самим, як R , визначений вище, що має аміногрупу, з якої зазначена 1i 1 аміногрупа захищена захисною групою для аміногрупи; R є таким самим, як R , визначений 1 вище, що має аміногрупу, яка відповідає R , у якої захисна група для аміногрупи видалена. Реакцію перетворення сполуки (1h) у сполуку (1і) проводять у присутності кислоти у придатному розчиннику або не використовуючи жодного розчинника. Приклади розчинників, які можуть використовуватися, включають воду; нижчі спирти, такі як метанол, етанол, ізопропанол і трет-бутанол; кетони, такі як ацетон і метилетилкетон; прості ефіри, такі як простий діетиловий ефір, діоксан, тетрагідрофуран, моноглім і диглім; жирні кислоти, такі як оцтова кислота і мурашина кислота; складні ефіри, такі як метилацетат і етилацетат; галогеновані вуглеводні, такі як хлороформ, дихлорметан, дихлоретан і тетрахлорметан; аміди, такі як DMF, Ν,Ν-диметилацетамід і NMP; диметилсульфоксид; триамід гексаметилфосфорної кислоти; і суміші цих розчинників. Приклади кислот включають неорганічні кислоти, такі як соляна кислота, сірчана кислота і бромистоводнева кислота; і органічні кислоти, наприклад, карбонові кислоти, такі як мурашина кислота, оцтова кислота і трифтороцтова кислота, і сульфонові кислоти, такі як птолуолсульфонова кислота. 11 UA 98966 C2 5 10 15 20 25 30 35 40 Кількість кислоти звичайно складає щонайменше приблизно 1 моль, і переважно приблизно від 1 до 10 моль на моль сполуки (1h). Великий надлишок кислоти може використовуватися як розчинник. Реакцію звичайно проводять при температурі від приблизно 0 °C до приблизно 200 °C, і переважно від 0 °C до приблизно 150 °C. Реакція звичайно проходить від приблизно 10 хвилин до приблизно 30 годин. Серед сполук бензазепіну, представлених загальною формулою (1), або їх солей, сполуки, 1 що мають атом галогену в R , можуть бути введені у реакцію з аміном для перетворення атома галогену у відповідну аміногрупу, наприклад, способом, показаним на наведеній нижче реакційній схемі 10: Реакційна схема 10 1j 1 1k де R є таким самим, як R , визначений вище, що має атом галогену, і R означає'групу, в 1j якій атом галогену R перетворений в аміногрупу, що відповідає аміну, який бере участь у реакції. Реакцію сполуки (1j) з аміном проводять у придатному інертному розчиннику у присутності основної сполуки. Приклади інертних розчинників включають ароматичні вуглеводні, такі як бензол, толуол і ксилол; прості ефіри, такі як простий діетиловий ефір, тетрагідрофуран, діоксан, моноглім і диглім; галогеновані вуглеводні, такі як дихлорметан, дихлоретан, хлороформ і тетрахлорметан; кетони, такі як ацетон і метилетилкетон; ацетонітрил, ДМСО, DMF, триамід гексаметилфосфорної кислоти; і суміші цих розчинників. Приклади основних сполук включають карбонати, такі як карбонат натрію, карбонат калію, гідрокарбонат натрію, гідрокарбонат калію і карбонат цезію; органічні основи, такі як піридин, імідазол, N-етилдіізопропіламін, диметиламінопіридин, триетиламін, триметиламін, диметиланілін, N-метилморфолін, DBN, DBU і DABCO. Такі основи можуть використовуватися окремо або у комбінації двох або більше. Кількість основної сполуки звичайно складає щонайменше приблизно 1 моль, і переважно від приблизно 1 до приблизно 10 моль на моль сполуки (1j). Кількість аміну (8) звичайно складає щонайменше приблизно 1 моль, і переважно від приблизно 1 до приблизно 10 моль на моль сполуки (lj). Галогеніди лужного металу, такі як йодид натрію і йодид калію, та інші сполуки можуть бути присутніми у реакційній системі цієї реакції. Реакцію звичайно проводять при температурі від приблизно 0 °C до приблизно 200 °C, і переважно при температурі від 0 °C до приблизно 150 °C. Реакція звичайно проходить від приблизно 5 хвилин до приблизно 80 годин. Серед сполук бензазепіну, представлених загальною формулою (1), або їх солей, сполуки, 1 що мають аміногрупу в R , можуть бути піддані гідроалкілуванню для перетворення аміногрупи в N-алкіламіногрупу. Реакційна схема 11 12 UA 98966 C2 11 5 10 15 20 25 30 35 40 45 1 1m де. R таким самим, як R , визначений вище, що має аміногрупу, і R означає групу, в якій il аміногрупа R перетворена.в N-алкіламіногрупу, що відповідає карбонільній сполуці, яка бере участь у реакції. Реакцію сполуки (11) з карбонільною сполукою проводять, наприклад, у присутності відновника, не використовуючи жодного розчинника або у придатному розчиннику. Приклади розчинників, які можуть використовуватися, включають воду; нижчі спирти, такі як метанол, етанол, ізопропанол, н-бутанол, трет-бутанол і етиленгліколь; ацетонітрил; жирні кислоти, такі як мурашина кислота і оцтова кислота; прості ефіри, такі як простий діетиловий ефір, тетрагідрофуран, діоксан, моноглім і диглім; ароматичні вуглеводні, такі як бензол, толуол і ксилол; галогеновані вуглеводні, такі як дихлорметан, дихлоретан, хлороформ і тетрахлорметан; і суміші цих розчинників. Приклади відновників включають жирні кислоти, такі як мурашина кислота; солі лужного металу жирної кислоти, такі як форміат натрію і ацетат натрію; гідридні відновники, такі як боргідрид натрію, ціаноборгідрид натрію і триацетилоксиборгідрид натрію; суміші таких гідридних відновників; відновники каталітичного гідрування, такі як паладієва чернь, паладій на вугіллі, оксид платини, платинова чернь і нікель Ренея; і т.п. Коли як відновник використовується жирна кислота, така як мурашина кислота, або сіль лужного металу жирної кислоти, така як форміат натрію або ацетат натрію, температура реакції переважно являє собою температуру від температури навколишнього середовища до приблизно 200 °C, і переважно від 50 °C до приблизно 150 °C. Реакція звичайно проходить від приблизно 10 хвилин до приблизно 10 годин. Кількість жирної кислоти або солі лужного металу жирної кислоти переважно складає великий надлишок відносно сполуки (11). Коли використовується гідридний відновник, температура реакції звичайно складає від 80 °C до приблизно 100 °C, переважно від -80 °C до приблизно 70 °C. Реакція звичайно проходить від приблизно 30 хвилин до приблизно 60 годин. Кількість гідридного відновника звичайно складає від приблизно 1 до приблизно 20 моль, і переважно від приблизно 1 до приблизно 6 моль на моль сполуки (11). Аміни, такі як триметиламін, триетиламін і Nетилдіізопропіламін, або молекулярні сита, такі як молекулярні сита 3А (MS-3A), і молекулярні сита 4А (MS-4А) можуть бути додані до цієї реакційної системи. Коли використовується каталітичний водневий відновник, реакцію звичайно проводять при тиску від нормального до приблизно 20 атм., і переважно від нормального до приблизно 10 атм., в атмосфері водню або у присутності донора водню, такого як мурашина кислота, форміат амонію, циклогексен або безводний гідразин. Температура реакції звичайно складає від приблизно -30 °C до приблизно 100 °C, і переважно від приблизно 0 °C до приблизно 60 °C. Реакція звичайно проходить від приблизно 1 до приблизно 12 годин. Кількість каталітичного водневого відновника звичайно складає від приблизно 0,1 до приблизно 40 ваг. %, і переважно від приблизно 1 до приблизно 20 ваг. %, відносно сполуки (11). Кількість сполуки (9), використовуваної у реакції сполуки (11) зі сполукою (9), звичайно складає щонайменше 1 моль, - і переважно від 1 моль до великого надлишку, на моль сполуки (11). Серед сполук бензазепіну, представлених загальною формулою (1), або їх солей, сполуки, в 1 3 4 4 яких R означає -CO-(CH2)m-NR R , і R означає (4-3) нижчу алкоксикарбонільну групу, у випадку необхідності заміщену атомом галогену, нижчою алканоїлокси-групою або 5-метил-2-оксо-1,34 діоксол-4-ілом, можуть бути одержані реакцією сполуки, в якій R означає (4-1) атом водню, з галогенангідридом (10) способом відповідно до наведеної нижче реакційної схеми 12: Реакційна схема 12 13 UA 98966 C2 4b 5 10 15 20 25 30 де R означає нижчу алкоксикарбонільну групу, у випадку необхідності заміщену атомом 3 1 галогену, нижчою алканоїлокси-групою або 5-метил-2-оксо-1,3-діоксол-4-ілом, і R , m і X мають значення, визначені вище. Реакцію сполуки (In) з галогенангідридом (10) проводять у придатному розчиннику у присутності основної сполуки. Кількість галогенангідриду (10) звичайно складає від 1 моль до великого надлишку, і переважно від 1 до 10 моль на моль сполуки (1n). Приклади розчинників реакції включають прості ефіри, такі як простий діетиловий ефір, діоксан, тетрагідрофуран, моноглім і диглім; галогеновані вуглеводні, такі як метиленхлорид, хлороформ, 1,2-дихлоретан і тетрахлорметан; складні ефіри, такі як етилацетат; ароматичні вуглеводні, такі як бензол, толуол і ксилол; апротонні полярні розчинники, такі як ацетонітрил, DMF, ДМСО і NMP; і суміші цих розчинників. Приклади основних сполук включають карбонати, такі як карбонат натрію, карбонат калію, гідрокарбонат натрію, гідрокарбонат калію і карбонат цезію; фосфати, такі як фосфат калію і фосфат натрію; і органічні основи, такі як піридин, імідазол, N-етилдіізопропіламін, диметиламінопіридин, триетиламін, триметиламін, диметиланілін, N-метилморфолін, DBN, DBU і DABCO. Кількість основної сполуки звичайно складає щонайменше приблизно 1 моль, і перевалено від приблизно 1 до приблизно 10 моль на моль сполуки (1n). Така органічна основа може також використовуватися як розчинник. Коли каталізатор, такий як 4-диметиламінопіридин, є присутнім у реакційній системі у вказаній вище реакції, реакція може бути промотована. Температура реакції вказаної вище реакції звичайно складає від -10 °C до 100 °C, переважно від 0 °C до 50 °C, і більш переважно від 0 °C до температури навколишнього середовища. Час реакції звичайно складає від 15 хвилин до 24 годин, переважно від 30 хвилин до 6 годин, і більш переважно від 1 до 3 годин. Серед сполук бензазепіну, представлених загальною формулою (1), або їх солей, сполуки, в 1 4 4 яких R означає групу -CO-NHR , і R означає (4-2) нижчу алкільну групу, у випадку необхідності заміщену атомом галогену, нижчою алкіламіногрупою, нижчою алкоксикарбонільною групою або 5-метил-2-оксо-1,3-діоксол-4-ілом, можуть бути одержані реакцією сполуки (2) з ізоціанатною сполукою (11) способом відповідно до реакційної схеми 13. Реакційна схема 13 35 14 UA 98966 C2 4c 5 10 15 20 25 30 35 40 45 де R означає нижчу алкільну групу, у випадку необхідності заміщену атомом галогену, нижчою алкіламіногрупою, нижчою алкоксикарбонільною групою або 5-метил-2-оксо-1,3діоксол-4-ілом. Реакцію сполуки (2) зі сполукою (11) проводять у присутності або за відсутності основної сполуки, переважно за відсутності основної сполуки, у придатному інертному розчиннику або не використовуючи жодного розчинника. Приклади інертних розчинників включають ароматичні вуглеводні, такі як бензол, толуол і ксилол; прості ефіри, такі як простий діетиловий ефір, тетрагідрофуран, діоксан, 2метоксіетанол, моноглім і диглім; галогеновані вуглеводні, такі як дихлорметан, дихлоретан, хлороформ і тетрахлорметан; складні ефіри, такі як етилацетат і метилацетат; кетони, такі як ацетон і метилетилкетон; ацетонітрил, піридин, ДМСО, DMF, триамід гексаметилфосфорної кислоти; і суміші цих розчинників. Приклади основних сполук включають триетиламін, піридин і т.п. Кількість основної сполуки звичайно складає щонайменше приблизно 1 моль, і переважно від приблизно 1 до приблизно 10 моль на моль сполуки (2). Така основна сполука може також використовуватися як розчинник. Кількість сполуки (11) звичайно складає від приблизно 1 до приблизно 5 моль, і переважно приблизно від 1 до 3 моль, на моль сполуки (2). Цю реакцію звичайно проводять при температурі від приблизно 0 °C до приблизно. 200 °C, і переважно від приблизно температури навколишнього середовища до приблизно 150 °C. Реакція звичайно проходить від приблизно 5 хвилин до приблизно 30 годин. Коли каталізатор, такий як 4-диметиламінопіридин, є присутнім у реакційній системі у вказаній вище реакції, реакція може бути промотована. Сполуки (2), (3), (4), (5), (6), (7), (8), (9), (10), (11), (1b), (1b"), (1e), (1h), (1j), (11), (1n), карбонові кислоти, амін і карбонільна сполука, які використовуються як вихідні матеріали у вказаних вище реакційних схемах, являють собою відомі сполуки або сполуки, які можуть бути легко одержані відповідно до відомих способів, таких як способи, описані у прикладах нижче. Сполуки (2), (3), (4), (5), (6), (7), (8), (9), (10), (11), (1b), (1b"), (1e), (1h), (1j), (11), (1n), карбонові кислоти, амін і карбонільна сполука, які використовуються як вихідні матеріали у вказаних вище реакційних схемах, можуть знаходитися у формі придатних солей або реакційноздатних похідних. Приклади таких придатних солей включають солі, зазначені вище відносно сполуки (1), такі як солі натрію, солі калію, солі цезію і подібні солі лужних металів. Сполуки, представлені загальною формулою (1) відповідно до даного винаходу, і їх солі включають стереоізомери, оптичні ізомери і сольвати (гідрати, етанолати і т.п.). Серед сполук бензазепіну, представлених загальною формулою (1) за винаходом, сполуки, що мають основну групу, можуть бути легко перетворені у солі приєднання з кислотою реакцією сполуки з фармацевтично прийнятними кислотами. Приклади таких солей включають солі з неорганічною кислотою, такі як гідрохлорид, сульфат, фосфат, гідробромат, гідройодат і нітрат; солі з органічною кислотою, такі як ацетат, оксалат, сукцинат, малеат, фумарат, малат, тартрат, цитрат, малонат, метансульфонат, бензоат, трифторацетат, бензолсульфонат, форміат і толуолсульфонат; і солі амінокислот (наприклад, аргінат, аспартат, глутамат і т.п.). Серед сполук бензазепіну, представлених загальною формулою (1) за винаходом, сполуки, що мають кислу групу, можуть бути легко перетворені у солі з основою реакцією сполуки з фармацевтично прийнятними основними сполуками. Приклади таких солей включають солі металу, такі як солі лужного металу (наприклад, солі натрію, солі калію і т.п.) і солі лужно 15 UA 98966 C2 5 10 15 20 25 30 35 40 45 50 55 земельного металу (наприклад, солі кальцію, солі магнію і т.п.); солі амонію; солі органічної основи (наприклад, солі триметиламіну, солі триетиламіну, солі піридину, солі піколіну, солі дициклогексиламіну, солі Ν,Ν'-дибензилетилендіаміну, солі трис(гідроксиметил)амінометану і т.п.); і т.п. Приклади основних сполук включають гідроокис натрію, гідроксид калію, гідроксид кальцію, карбонат натрію, гідрокарбонат калію, гідрокарбонат натрію і т.п. Ці солі включені в обсяг даного винаходу. Кожна зі сполук, одержаних відповідно до вказаних вище реакційних схем, може бути виділена і очищена з реакційної суміші, наприклад, після охолодження, шляхом здійснення на реакційній суміші процедур виділення, таких як фільтрація, концентрація, екстракція і т.п., для відділення сирого продукту реакції, з подальшим здійсненням звичайних процедур очищення, таких як хроматографія на колонках, перекристалізація і т.п. Сполука відповідно до даного винаходу має, наприклад, антагоністичну активність відносно вазопресину, судинорозширювальну активність, гіпотензивну активність, активність, що інгібує вивільнення глюкози з печінки, активність, що інгібує ріст мезангіальних клітин, акваретичну активність і активність, що інгібує агрегацію тромбоцитів. Ця сполука може бути використана як судинорозширювальний засіб, гіпотензивний засіб, акваретик та інгібітор агрегації тромбоцитів і ефективна у профілактиці і лікуванні артеріальної гіпертензії, набряку (наприклад, набряку серця, набряку печінки, набряку нирок, набряку мозку), асциту, серцевої недостатності (наприклад, тяжкої серцевої недостатності), дисфункції нирок, синдрому неадекватної секреції вазопресину (SIADH), цирозу печінки, гіпонатріємії, гіпокаліємії, , діабету, недостатності кровообігу, полікістозного захворювання нирок (PKD) і т.п. При введенні в організм людини як лікарського засобу, сполука за винаходом може використовуватися одночасно або окремо від інших фармацевтичних лікарських засобів, таких як антагоністи вазопресину, інгібітори АСЕ, -блокатори, акваретики, антагоністи ангіотензину (ARB) і/або дигоксин. Сполука за винаходом може використовуватися у формі загальної фармацевтичної композиції. Така фармацевтична композиція може бути одержана звичайним способом з використанням звичайно використовуваних розріджувачів і/або ексципієнтів, таких як наповнювачі, розширюючі агенти, зв'язуючі, зволожувачі, дезінтегратори, поверхнево-активні речовини і лубриканти. Форма фармацевтичної композиції, що містить сполуку за винаходом, може бути відповідним чином вибрана в залежності від мети лікування. Приклади включають таблетки, пігулки, порошки, розчини, суспензії, емульсії, гранули, капсули, супозиторії, ін'єкції (розчини, суспензії і т.п.), мазі і т.п. Для одержання таблеток може використовуватися будь-який з різних носіїв, традиційно використовуваних у даній галузі. Приклади включають ексципієнти, такі як лактоза, білий цукор, хлорид натрію, глюкоза, карбамід, крохмаль, карбонат кальцію, каолін, кристалічна целюлоза і кремнієва кислота; зв'язуючі, такі як вода, етанол, пропагюл, простий сироп, розчини глюкози, розчини крохмалю, розчини желатину, карбоксиметилцелюлоза, шелак, метилцелюлоза, фосфат калію і полівінілпіролідон; дезінтегратори, такі як сухий крохмаль, альгінат натрію, порошок агар-агару, порошок ламінарану, гідрокарбонат натрію, карбонат кальцію, складні ефіри жирної кислоти і поліоксіетилен сорбітану, лаурилсульфат натрію, моногліцериди стеаринової кислоти, крохмаль і лактоза; інгібітори подрібнювання, такі як білий цукор, стеарин, олія какао і гідровані масла; абсорбенти, такі як четвертинні амонієві основи і лаурилсульфат натрію; змочувальні речовини, такі як гліцерин і крохмаль; адсорбуючі речовини, такі як крохмаль, лактоза, каолін, бентоніт і колоїдна кремнієва кислота; лубриканти, такі як очищений тальк, стеарати, порошок борної кислоти і поліетиленгліколь; і т.п. Далі, такі таблетки можуть бути таблетками, що мають за необхідності звичайне покриття, наприклад, таблетками з цукровим покриттям, таблетками у желатиновій капсулі, таблетками, покритими ентеросолюбільною оболонкою, таблетками з плівковим покриттям, двох- або багатошаровими таблетками і т.п. Для одержання пігулок може використовуватися будь-який з різних носіїв, традиційно використовуваних у даній галузі. Приклади включають ексципієнти, такі як глюкоза, лактоза, крохмаль, олія какао, гідровані рослинні олії, каолін і тальк; зв'язуючі, такі як порошок гуміарабіку, порошок трагаканту, желатин і етанол; дезінтегратори, такі як ламінарин і агар-агар; і т.п. Для одержання супозиторіїв може використовуватися будь-який з різних носіїв, традиційно використовуваних у даній галузі. Приклади включають поліетиленгліколь, олію какао, вищі спирти, складні ефіри вищих спиртів, желатин, напівсинтетичні гліцериди і т.п. 16 UA 98966 C2 5 10 15 20 25 30 35 40 45 50 55 Капсули можуть бути одержані відповідно до звичайного способу шляхом змішування активного інгредієнта з різними носіями, як зазначено вище, і заповнення сумішшю твердої желатинової капсули, м'якої желатинової капсули і т.п. Для ін'єкцій розчини, емульсії і суспензії переважно стерилізують і роблять ізотонічними відносно крові. Коли ін'єкції одержують у формі розчинів, емульсій і суспензій, будь-який з розріджувачів, звичайно використовуваних у даній галузі, може використовуватися. Приклади таких розріджувачів включають воду, водні розчини молочної кислоти, етанол, пропіленгліколь, етоксилований ізостеариловий спирт, поліоксилований ізостеариловий спирт, ефіри жирної кислоти і поліоксiетиленсорбітану, і т.п. У цьому випадку у фармацевтичну композицію можуть бути включені ізотонізуючі засоби, такі як хлорид натрію, глюкоза, маніт і гліцерин у кількості, достатній для одержання ізоосмотичного розчину. Можуть також бути додані звичайно використовувані агенти для регулювання рН, зріджуючі агенти, буфери, розгладжуючі агенти і т.п. Інші домішки, такі як барвники, консерванти, ароматизатори і підсолоджувачі, та інші лікарські засоби можуть також бути додані у випадку необхідності. Кількість сполуки, представленої загальною формулою (1), або ЇЇ солі у фармацевтичному препараті за винаходом особливо не обмежена і може бути відповідним чином вибрана з різних кількостей. Загалом, пропорція сполуки переважно складає' від приблизно 0,01 до приблизно 70 ваг. % від маси фармацевтичного препарату. Шлях введення фармацевтичного препарату за винаходом особливо не обмежений, і він може вводитися способом, що підходить для форми препарату, віку, статі пацієнта та інших умов, і серйозності захворювання. Наприклад, таблетки, пігулки, розчини, суспензії, емульсії, гранули і капсули вводять перорально. Ін'єкції вводять внутрішньовенно окремо або у суміші з типовою замінною рідиною, такою як розчини глюкози, розчини амінокислот і т.п., або вводять окремо внутрішньом'язово, внутрішньошкірно, підшкірно або внутрішньочеревинно. Дозу фармацевтичного препарату за винаходом вибирають відповідно до режиму введення, віку, статі пацієнта та інших умов, і серйозності захворювання. Доза звичайно є такою, що сполуку, представлену загальною формулою (1), що є ефективним інгредієнтом, вводять у кількості від 0,001 до 100 мг, і переважно від 0,001 до 50 мг, на кг маси тіла на добу за одне або більше введень. Доза варіює в залежності від різних умов. Доза, менша, ніж вказаний вище діапазон, може бути достатньою, у той час як доза, більша, ніж вказаний вище діапазон, може бути необхідною. Патенти, заявки на патент і документи, процитовані тут, включені шляхом посилання. Відповідно до даного винаходу можна одержати нову сполуку бензазепіну, що має чудові властивості, такі як підтримка рівня толваптану у крові протягом тривалого періоду часу, що дозволяє забезпечити бажані фармацевтичні ефекти. При введенні в організм людини, сполука (1) за винаходом або її сіль може легко перетворюватися у толваптан, що є активним інгредієнтом. Далі, сполука (1) за винаходом або її сіль легко кристалізується і є простою у поводженні з нею. Крім того, сполука (1) за винаходом або її сіль має чудову хімічну стабільність. Композицію, що може забезпечити фармацевтичні ефекти, еквівалентні корисним ефектам лікарського засобу толваптану, можна одержати урізних формах при використанні сполуки (1) за винаходом або її солі. Наведені нижче приклади ілюструють даний винахід більш детально. Приклад 1 {7-хлор-1-[2-метил-4-(2-метил-бензоїламіно)-бензоїл]-2,3,4,5-тетрагідро-1Н-бензо[b]азепiн-5іл}сукцинат. Толваптан (1,0 г, 2,2 ммоль), ангідрид бурштинової кислоти (0,33 г, 3,3 ммоль) і 4дйметиламінопіридин (DMAP) (27 мг, 0,22 ммоль) додавали до 1-метил-2-піролідону (3 мл), і суміш перемішували при 100 °C протягом 1 години. До реакційної суміші додавали воду і одержані осади збирали фільтрацією. Осади очищали, використовуючи флеш-хроматографію на силікагелі (н-гексан:етилацетат = 50:50 → 20:80). Очищений продукт концентрували при зниженому тиску. Осад розчиняли у водному розчині ацетонітрилу і очищали заморожуванням, одержуючи 300 мг {7-хлор-1-[2-метил-4-(2-метил-бензоїламіно)-бензоїл]-2,3,4,5-тетрагідро-1Hбензо[b]азепін-5-іл}сукцинату у формі аморфної твердої речовини білого кольору. 1 H-ЯМР (ДМСО-d6, 100°C) м.ч.: 1,6-2,1 (4Н, м), 2,37 (6Н, с), 2,5-2,6 (2Н, м), 2,6-2,7 (2Н, м), 3,0-4,3 (2Н, м), 5,9-6,0 (1H, м), 6,87,1 (2Н, м), 7,1-7,3 (3Н, м), 7,3-7,5 (4Н, м), 7,56 (1H, с), 9,8 (1Н, ушир.). Приклад 2 17 UA 98966 C2 5 10 15 20 25 30 35 40 45 50 55 60 {7-хлор-1-[2-метил-4-(2-метил-бензоїламіно)-бензоїл]-2,3,4,5-тетрагідро-1Н-бензо[b]азепін-5іл}сукцинат натрію. Водний розчин (2 мл) гідрокарбонату натрію (46 мг, 0,55 ммоль) додавали до метанольного розчину (2 мл) {7-хлор-1-[2-метил-4-(2-метил-бензоїламіно)-бензоїл]-2,3,4,5-тетрагідро-1Нбензо[b]азепін-5-іл}сукцинату (0,30 г, 0,55 ммоль), і суміш перемішували при температурі навколишнього середовища протягом 1 години. Метанол відганяли при зниженому тиску при приблизно 30 °C. Одержаний розчин висушували сублімацією, одержуючи 0,29 г (94 %) {7-хлор1-[2-метил-4-(2-метил-бензоїламіно)-бензоїл]-2,3,4,5-тетрагідро-1Н-бензо[b]азепін-5іл}сукцинату натрію у формі аморфної речовини. 1 Н-ЯМР (ДМСО-(d6, 100 °C) м.ч.: 1,70-2,10 (4Н, м), 2,19 (2Н, т, J=7,1 Гц), 2,37 (6Н, с), 2,56 (2Н, τ, J=7,1 Гц), 3,05-3,50 (1H, м), 3,65-4,25 (1H, м), 5,85-5,95 (1H, м), 6,75-6,90 (1Н, м), 6,90-7,10 (2Н, м), 7,15-7,55 (6Н, м), 7,58 (1H, с), 9,80 (1H, ушир.). Приклад 3 {7-хлор-1-[2-метил-4-(2-метил-бензоїламіно)-бензоїл]-2,3,4,5-тетрагідро-1Н-бензо[b]азепін-5іл}сукцинат калію. Аморфну речовину, що являє собою {7-хлор-1-[2-метил-4-(2-метил-бензоїламіно)-бензоїл]2,3,4,5-тетрагідро-1Н-бензо[b]азепін-5-іл}сукцинат калію, одержували за аналогією з наведеним вище прикладом 2. 1 Н-ЯМР (ДМСО-d6, 100 °C) м.ч.: 1,70-2,10 (4Н, м), 2,16 (2Н, т, J=7,1 Гц), 2,37 (6Н, с), 2,48 (2Н, τ, J=7,1 Гц), 2,95-3,50 (1Н, м), 3,70-4,25 (1H, м), 5,85-5,95 (1H, м), 6,75-6,90 (1H, м), 7,00-7,15 (2Н, м), 7,20-7,45 (6Н, м), 7,58 (1H, с), 9,77 (1Н, ушир.). Приклад 4 4-{7-хлор-1-[2-метил-4-(2-метил-бензоїламіно)-бензоїл]-2,3,4,5-тетрагідро-1Н-бензо[b]азепін5-ілоксикарбоніл}бутират натрію. 4-{7-хлор-1-[2-метил-4-(2-метил-бензоїламіно)-бензоїл]-2,3,4,5-тетрагідро-1Н-бензо[b]азепін5-ілоксикарбоніл}масляну кислоту (0,30 г, 0,53 ммоль) розчиняли в ацетоні (2 мл). Додавали водний розчин (2 мл) гідрокарбонату натрію (45 мг, 0,53 ммоль), і суміш перемішували при температурі навколишнього середовища протягом 1 години. Реакційну суміш концентрували і залишок промивали етилацетатом, і потім висушували на повітрі, одержуючи 0,14 г (45 %) 4-{7хлор-1-[2-метил-4-(2-метил-бензоїламіно)-бензоїл]-2,3,4,5-тетрагідро-1Н-бензо[b]азепін-5ілоксикарбоніл}бутирату натрію у формі аморфної речовини. 1 Н-ЯМР (ДМСО-d6, 100 °C) м.ч.: 1,70-2,10 (8Н, м), 2,37 (6Н, с), 2,45-2,55 (2Н, м), 3,10-3,55 (1Н, м), 3,70-4,10 (1Н, м), 5,90-6,00 (1H, м), 6,85-6,95 (1H, м), 7,00-7,10 (1H, м), 7,10-7,45 (7Н, м), 7,58 (1Н, с), 9,83 (1H, ушир.). Приклад 5 {7-хлор-1-[2-метил-4-(2-метил-бензоїламіно)бензоїл]-2,3,4,5-тетрагідро-1Н-бензо[b]азепін-5іл}метилсукцинат. Йодометан (34 мкл, 0,55 ммоль) додавали до суспензії у DMF (5 мл) {7-хлор-1-[2-метил-4-(2метил-бензоїламіно)бензоїл]-2,3,4,5-тетрагідро-1Н-бензо[b]азепін-5-іл}сукцинату (0,25 г, 0,46 ммоль) і карбонату калію (76 мг, 0,55 ммоль), і суміш перемішували при температурі навколишнього середовища протягом 2 годин. Потім до реакційної;суміші додавали воду і одержані осади збирали фільтрацією, і висушували на повітрі. Висушений продукт очищали хроматографією на силікагелі (н-гексан:етилацетат). Очищений продукт кристалізували з суміші метанол/вода, таким чином одержуючи 0,20 г (77 %) {7-хлор-1-[2-метил-4-(2-метилбензоїламіно)-бензоїл]-2;3,4,5-тетрагідро-1Н-бензо[b]азепін-5-іл}метил сукцинату у формі білого порошку. Точка плавлення: 173,6-175,5 °C. 1 Н--ЯМР (ДМСО-d6, 100 °C) м.ч.: 1,70-2,05 (4Н, м), 2,37 (6Н, с), 2,55-2,70 (2Н, м), 2,70-2,80 (2Н, м), 3,10-3,45 (1Н, м), 3,62 (ЗН, с), 3,80-4,10 (1H, м), 5,90-6,00 (1H, м), 6,80-7,00 (2Н, м), 7,05-7,25 (3Н, м), 7,30-7,45 (4Н, м), 7,56 (1H, с), 9,79 (1Н, ушир.). Приклад 6 7-хлор-5-[Н-(2-гідроксіетил)-сукцинамоїлокси]-1-[2-метил-4-(2-метил-бензоїламіно)-бензоїл]2,3,4,5-тетрагідро-1H-бензо[b]азепін. {7-хлор-1-[2-метил-4-(2-метил-бензоїламіно)бензоїл]-2,3,4,5-тетрагідро-1Н-бензо[b]азепін-5іл}сукцинат (0,30 г, 0,55 ммоль), 2-аміноетанол (40 мкл, 0,66 ммоль), WSC (0,13 г, 0,66 ммоль) і 1-гідроксибензотриазол (HOBt) (0,10 г, 0,66 ммоль) розчиняли у DMF (5 мл), і суміш перемішували при температурі навколишнього середовища протягом ночі. Потім до реакційної 18 UA 98966 C2 5 10 15 20 25 30 35 40 45 50 55 60 суміші додавали воду. Одержані осади збирали фільтрацією і висушували на повітрі. Висушений продукт очищали основною хроматографією на силікагелі (етилацетат:метанол), таким чином одержуючи 0,19 г (59 %) 7-хлор-5-[N-(2-гідроксіетил)-сукцинамоїлокси]-1-[2-метил4-(2-метил-бензоїламіно)-бензоїл]-2,3,4,5-тетрагідро-1Н-бензо[b]азепін у формі аморфної речовини. 1 Н--ЯМР(СDСl3) м.ч.: 1,25-2,90 (12Н, м), 2,95-3,75 (7Н, м), 4,60-4,95 (1Н, м), 5,80-6,05 (1H, м), 6,35-6,65 (2Н, м), 6,80-7,05 (2Н, м), 7,10-7,70 (8Н, м), 8,00-8,25 (1H, м). Приклад 7 {7-хлор-1-[2-метил-4-(2-метил-бензоїламіно)-бензоїл]-2,3,4,5-тетрагідро-1H-бензо[b]азепін-5ілоксикарбонілметилтіо}оцтова кислота (також відома як: толваптан моноефір тіодигліколевої кислоти). Толваптан (1,0 г, 2,2 ммоль) і 4-диметиламінопіридин (27 мг, 0,22 ммоль) розчиняли у піридині (5 мл). Додавали ангідрид тіодигліколевої кислоти (2,9 г, 22 ммоль)" і суміш перемішували при температурі навколишнього середовища протягом 1 години. До реакційної суміші додавали 1н. соляну кислоту і потім суміш екстрагували етилацетатом. Органічний шар промивали 1н. соляною кислотою, висушували над безводним сульфатом натрію. Після фільтрації і концентрації при зниженому тиску залишок очищали флеш-хроматографією на силікагелі (дихлорметан:метанол = 100:0 83:17), і кольоровий компонент видаляли хроматографією на колонках з силікагелем (етилацетат). Одержаний у результаті продукт додатково очищали флеш-хроматографією на силікагелі (н-гексан:етилацетат = 50:50 0:100) і очищений продукт концентрували при зниженому тиску. Залишок розчиняли у водному ацетонітрилі і потім висушували сублімацією, одержуючи 350 мг {7-хлор-1-[2-метил-4-(2-метилбензоїламіно)-бензоїл]-2,3,4,5-тетрагідро-1Н-бензо[b]азепін-5-ілоксикарбонілметилтіо} оцтової кислоти у формі аморфної твердої речовини білого кольору. 1 Н-ЯМР (ДМСО-d6, 100 °C) м.ч.: 1,6-2,2 (4Н, м), 2,4 (6Н, с), 3,0-4,4 (2Н, м), 3,39 (2Н, с), 3,60 (2Н, с), 5,8-6,0 (1H, м), 6,8-7,1 (2Н, м), 7,2-7,5 (7Н, м), 7,57 (1Н, с), 9,8 (1H, ушир.). Приклад 8 {7-хлор-1-[2-метил-4-(2-метил-бензоїламіно)-бензоїл]-2,3,4,5-тетрагідро-1Н-бензо[b]азепін-5ілоксикарбонілметилтіо}-метилацетат. Толваптан (1,0 г, 2,2 ммоль) і 4-диметиламінопіридин (27 мг, 0,22 ммоль) розчиняли у піридині (5 мл). Додавали ангідрид тіодигліколевої кислоти (0,43 г, 3,3 ммоль) і суміш перемішували при температурі навколишнього середовища протягом ночі. Знову додавали ангідрид тіодигліколевої кислоти (0,86 г, 6,5 ммоль) і потім суміш перемішували при температурі навколишнього середовища протягом 2 годин. До реакційної суміші додавали 1н. соляну кислоту, потім суміш екстрагували етилацетатом. Органічний шар промивали 1н. соляною кислотою, висушували над безводним сульфатом натрію. Після фільтрації і концентрації при зниженому тиску до залишку додавали триметилсилілдіазометан і суміш перемішували при температурі навколишнього середовища протягом 1 години. Одержану суміш концентрували при зниженому тиску і залишок очищали хроматографією на колонках з силікагелем (нгексан:етилацетат = 60:40 0:100). Очищений продукт концентрували при зниженому тиску, залишок розчиняли у водному ацетонітрилі і потім висушували сублімацією, одержуючи 880 мг {7-хлор-1-[2-метил-4-(2-метил-бензоїламіно)-бензоїл]-2,3,4,5-тетрагідро-1Н-бензо[b]азепін-5ілоксикарбонілметилтіо}-метилацетату у формі аморфної твердої речовини білого кольору. 1 Н-ЯМР (ДМСО-d6, 100 °C) м.ч.: 1,5-1,9 (4Н, м), 2,37 (6Н, с), 2,8-4,3 (2Н, м), 3,48 (2Н, с), 3,61 (2Н, с), 3,63 (ЗН, с), 5,9-6,1 (1Н, м), 6,8-7,1 (2Н, м), 7,1-7,3 (ЗН, м), 7,3-7,5 (4Н, м), 7,57 (1Н, с), 9,82 (1H, ушир.)· Приклад 9 {7-хлор-1-[2-метил-4-(2-метил-бензоїламіно)-бензоїл]-2,3,4,5-тетрагідро-1Н-бензо[b]азепін-5ілоксикарбонілметилсульфоніл}-метилацетат. {7-хлор-1-[2-метил-4-(2-метил-бензоїламіно)-бензоїл]-2,3,4,5-тетрагідро-1Н-бензо[b]азепін-5ілоксикарбонілметилтіо}-метилацетат (480 мг, 0,81 ммоль) розчиняли у метанолі (5 мл) і воді (2 мл). Додавали Охоnе® (2KHSO5/K2SO4/KHSO4) (1,5 г, 2,4 ммоль), і суміш перемішували при температурі навколишнього середовища протягом 20 годин. До реакційної суміші додавали воду і суміш екстрагували етилацетатом. Екстракт висушували над безводним сульфатом натрію. Після фільтрації і концентрації при зниженому тиску залишок очищали флешхроматографією на силікагелі (н-гексан:етилацетат = 50:50 20:80). Очищений продукт концентрували при зниженому тиску, залишок розчиняли у водному ацетонітрилі і висушували сублімацією, одержуючи 200 мг {7-хлор-1-[2-метил-4-(2-метил-бензоїламіно)-бензоїл]-2,ЗД5 19 UA 98966 C2 5 10 15 20 25 30 35 40 45 50 55 60 тетрагідро-1Н-бензо[b]азепін-5-ілоксикарбонілметилсульфоніл}-метилацетату у формі аморфної твердої речовини білого кольору. 1 Н-ЯМР (ДМСО-d6, 100 °C) м.ч.: 1,5-1,9 (4Н, м), 2,37 (6Н, с), 2,8-4,3 (2Н, м), 3,48 (2Н, с),3,61 (2Н, с), 3,63 (ЗН, с), 5,9-6,1 (1H, м), 6,8-7,1 (2Н, м), 7,1-7,3 (ЗН, м), 7,3-7,5 (4Н, м), 7,57 (1Н, с), 9,82 (1Н, ушир.). Приклад 10 {7-хлор-1-[2-метил-4-(2-метил-бензоїламіно)-бензоїл]-2,3,4,5-тетрагідро-1Н-бензо[b]азепін-5іл}гексадеканоат. Пальмітоїлхлорид (1,24 мл, 4,4 ммоль) додавали до розчину толваптану (2,00 г, 4,4 ммоль) і піридину (0,40 мл, 5,0 ммоль) у дихлорметані (20 мл), і суміш перемішували при температурі навколишнього середовища протягом ночі. До реакційної суміші додавали воду і суміш екстрагували дихлорметаном. Об'єднаний органічний шар промивали водою і насиченим водним розчином хлориду натрію, і висушували над сульфатом магнію. Після фільтрації і концентрації залишок очищали хроматографією на силікагелі (н-гексан:етилацетат), таким чином одержуючи 2,25 г (74 %) {7-хлор-1-[2-метил-4-(2-метил-бензоїламіно)-бензоїл]-2,3,4,5тетрагідро-1Н-бегоо[b]азепін-5-іл}гексадеканоату у формі аморфної речовини. 1 Н--ЯМР (ДМСО-d6, 100 °C) м.ч.: 0,85 (ЗН, т, J=6,8 Гц), 1,15-1,45 (24Н, м), 1,55-1,70 (2Н, м), 1,75-2,10 (4Н, м), 2,37 (6Н, с), 2,40-2,50 (2Н, м), 3,05-3,55 (1Н, м), 3,60-4,30 (1H, м), 5,90-6,00 (1Н, м), 6,80-7,05 (2H, м), 7,107,45 (7Н, м), 7,56 (1H, с), 9,81 (1Н, ушир.). Приклад 11 {7-хлор-1-[2-мети л-4-(2-метил-бензоїл аміно)-бензоїл]-2,3,4,5 -тетрагідро-1Н-бензо[b]азепін5-іл} хлорацетат. Толваптан (10 г, 22 ммоль) і піридин (2,7 мл, 33 ммоль) суспендували у дихлорметані (100 мл), і хлорацетилхлорид (2,6 мл, 33 ммоль) додавали по краплях при охолодженні з льодом. Одержану суміш перемішували при температурі навколишнього середовища протягом 1 години. До реакційної суміші додавали 1н. соляну кислоту і суміш екстрагували дихлорметаном. Органічний шар промивали 1н. соляною кислотою, висушували над безводним сульфатом натрію. Після фільтрації і концентрації при зниженому тиску залишок очищали флешхроматографією на силікагелі (н-гексан:етилацетат = 60:40 46:54). Очищений продукт концентрували при зниженому тиску, одержуючи 12 г {7-хлор-1-[2-метил-4-(2-метилбензоїламіно)-бензоїл]-2,3,4,5-тетрагідро-1H-бензо[b]азепін-5-іл}хлорацетату у формі аморфної твердої речовини білого кольору. 1 Н-ЯМР (ДМСО-d6, 100 °C) м.ч.: 1,7-2,2 (4Н, м), 2,36 (6Н, с), 2,6-4,3 (2Н, м), 4,44 (2Н, с), 5,9-6,0 (1H, м), 6,8-7,1 (2Н, м), 7,1-7,3 (ЗН, м), 7,3-7,5 (4Н, м), 7,57 (1Н, с), 9,8 (1Н, ушир.). Приклад 12 4-{7-хлор-1-[2-метил-4-(2-метил-бензоїламіно)-бензоїл]-2,3,4,5-тетрагідро-1H-бензо[b]азепін5-ілоксикарбонілметил}-піперазин-1-трет-бутилкарбоксилат. {7-хлор-1-[2-метил-4-(2-метил-бензоїламіно)-бензоїл]-2,3,4,5-тетрагідро-1H-бензо[b]азепін-5іл}хлорацетат (1,2 г, 2,3 ммоль), піперазин-1-трет-бутилкарбоксилат (1-ВОС-піперазин) (0,47 г, 2,5 ммоль) і карбонат калію (0,35 г, 2,5 ммоль) додавали до ацетонітрилу (10 мл), і суміш перемішували при температурі навколишнього середовища протягом 2 годин. Потім до реакційної суміші додавали етилацетат і нерозчинну речовину видаляли фільтрацією. Фільтрат концентрували при зниженому тиску і залишок очищали флеш-хроматографією на силікагелі (нгексан:етилацетат = 50:50 20:80). Очищений продукт концентрували при зниженому тиску, одержуючи 1,2 г 4-{7-хлор-1-[2-метил-4-(2-метил-бензоїламіно)-бензоїл]-2,3,4,5-тетрагідро-1Hбензо[b]азепін-5-ілоксикарбонілметил}-піперазин-1-трет-бутилкарбоксилату у формі жовтого масла. 1 Н-ЯМР (ДМСО-d6, 100 °C) м.ч.: 1,42 (9Н, с), 1,7-2,2 (4Н, м), 2,39 (6Н, с), 2,56 (4Н, т, J=5,1 Гц), 3,37 (4Н, τ, J=5,1 Гц), 3,42 (2Н, с), 2,6-4,3 (2Н, м), 5,9-6,1 (1Н, м), 6,9-7,0 (1Н, м), 7,0-7,1 (1H, м), 7,1-7,5 (7Н, м), 7,59 (1Н, с), 9,8 (1H, ушир.)· Приклад 13 1-{7-хлор-1-[2-метйл-4-(2-метил-бензоїламіно)-бензоїл]-2,3,4,5-тетрагідро-1Н-бензо[b]азепін5-ілоксикарбонілметил}-піперазин дигідрохлорид. 4н. розчин гідрохлориду етилацетату (3,7 мл) додавали до розчину 4-{7-хлор-1-[2-метил-4(2-метил-бензоїламіно)-бензоїл]-2,3,4,5-тетрагідро-1Н-бензо[b]азепін-5-ілоксикарбонілметил}піперазин-1-трет-бутилкарбоксилату (1,2 г, 1,8 ммоль) в етилацетаті (15 мл), і суміш перемішували при температурі навколишнього середовища протягом 12 годин. Осади збирали 20 UA 98966 C2 5 10 15 20 25 30 35 40 45 50 55 60 фільтрацією, промивали етилацетатом і висушували, одержуючи 800 мг 1-{7-хлор-1-[2-метил-4(2-метил-бензоїламіно)-бензоїл]-2,3,4,5-тетрагідро-1H-бензо[b]азепін-5-ілоксикарбонілметил}піперазин дигідрохлориду у формі жовтого порошку. 1 Н-ЯМР (ДМСО-d6, 100 °C) м.ч.: 1,6-2,4 (4Н, м), 2,369 (ЗН, с), 2,374 (ЗН, с), 2,8-3,0 (4Н, м), 3,0-3,2 (4Н, м), 3,4-3,7 (2Н, м), 3,04,3 (2Н, м), 5,7 (1Н, ушир.), 5,9-6,1 (1Н, м), 6,8-7,1 (2Н, м), 7,1-7,3 (ЗН, м), 7,3-7,5 (4Н, м), 7,56 (1Н, с), 9,2 (2Н, ушир.), 9,87 (1H, ушир.) Приклад 14 1-{7-хлор-1-[2-метил-4-(2-метил-бензоїламіно)-бензоїл]-2,3,4,5-тетрагідро-1H-бензо[b]азепін5-ілоксикарбонілметил}-4-метилпіперазин дигідрохлорид. 1-{7-хлор-1-[2-метил-4-(2-метил-бегаоїламіно)-бензоїл]-2,3,4,5-тетрагідро-1H-бензо[b]азепін5-ілоксикарбонілметил}-піперазин дигідрохлорид (400 мг, 0,62 ммоль), водний розчин формальдегіду (0,15 мл, 1,9 ммоль), ацетат натрію (61 мг, 0,74 ммоль) і ціанотригідроборат натрію (119 мг, 1,9 ммоль) додавали до метанолу (5 мл), і суміш перемішували при температурі навколишнього середовища протягом 1 години. До реакційної суміші додавали воду і водний розчин гідроксиду натрію, і осади збирали фільтрацією, промивали водою і потім висушували. Одержану тверду речовину розчиняли в етилацетаті і додавали 4н. розчин гідрохлориду етилацетату (0,5 мл). Осади збирали фільтрацією, промивали етилацетатом і висушували, одержуючи 240 мг 1-{7-хлор-1-[2-метил-4-(2-метил-бетоїламіно)-бензоїл]-2,3,4,5-тетрагідро-1Нбензо[b]азепін-5-ілоксикарбонілметил}-4-метилпіперазин дигідрохлориду у формі білого порошку. 1 Н-ЯМР (ДМСО-d6, 100 °C) м.ч.: 1,6-2,1 (4Н, м), 2,369 (ЗН, с), 2,374 (ЗН, с), 2,73 (ЗН, с), 2,8-4,3 (2Н, м), 2,8-3,0 (4Н, м), 3,0-3,4 (4Н, м), 3,54 (2Н, с), 5,9-6,1 (1H, м), 6,8-7,1 (2Н, м), 7,1-7,4 (7Н, м), 7,54 (1H, с), 9,8 (1Н, ушир.). Приклад 15 {7-хлор-1-[2-метил-4-(2-метил-бензоїламіно)-бензоїл]-2,3,4,5-тетрагідро-1Н-бензо[b]азепін-5іл}-4-диметиламінобутиратгідрохлорид. Толваптан (1,0 г, 2,2 ммоль), гідрохлорид 4-диметиламіно-масляної кислоти (0,48 г, 2,9 ммоль) і 4-диметиламінопіридин (27 мг, 0,22 ммоль) суспендували у дихлорметані (5 мл). Додавали триетиламін (0,4 мл) і 1-(3-диметиламінопропіл)-3-етилкарбодіімід гідрохлорид (WSC) (0,55 г, 2,9 ммоль), і суміш перемішували при температурі навколишнього середовища протягом 12 годин. До реакційної суміші додавали насичений водний розчин гідрокарбонату натрію і суміш екстрагували етилацетатом. Органічний шар промивали насиченим водним розчином хлориду натрію, висушували над безводним сульфатом натрію. Після фільтрації і концентрації при зниженому тиску залишок очищали флеш-хроматографією на силікагелі (н-гексан: етилацетат = 50:50 0:100). Очищений продукт концентрували при зниженому тиску. Залишок потім розчиняли в етилацетаті, додавали 4н. розчин гідрохлориду етилацетату і одержану суміш концентрували при зниженому тиску. До залишку додавали воду (10 мл). Після фільтрації фільтрат висушували сублімацією, одержуючи 0,91 г 7-хлор-1-[2-метил-4-(2-метилбензоїламіно)-бензоїл]-2,3,4,5-тетрагідро-1Н-бензо[b]азепін-5-іл 4-диметиламіно-бутирату гідрохлориду у формі аморфної твердої речовини білого кольору. 1 Н-ЯМР (ДМСО-d6, 100 °C) м.ч.: 1,6-2,1 (6Н, м), 2,37 (ЗН, с), 2,38 (ЗН, с), 2,5-2,6 (2Н, м), 2,74 (6Н, с), 3,0-3,1 (2Н, м), 3,0-4,3 (2Н, м), 5,9-6,0 (1Н, м), 6,7-7,1 (2Н, м), 7,1-7,2 (ЗН, м), 7,2-7,5 (4Н, м), 7,54 (1Н, с), 9,8 (1H, ушир.). Приклад 16 7-хлор-1-(2-метил-4-(2-метилбензамідо)бензоїл)-2,3,4,5-тетрагідро-1Н-бензо[b]азепін-5-іл 4хлорбутират. Толваптан (10,0 г, 22,3 ммоль) диспергували у дихлорметані (100 мл). Додавали піридин (2,7 мл) і суміш перемішували. До одержаної суміші поступово додавали хлорангідрид 4хлормасляної кислоти (3,74 мл) і суміш перемішували при температурі навколишнього середовища протягом ночі. Реагент лили у воду і суміш екстрагували дихлорметаном, промивали водним розчином гідросульфату натрію, висушували над сульфатом магнію. Після фільтрації і концентрації при зниженому тиску, одержаний залишок кристалізували простим діетиловим ефіром. Одержані кристали збирали фільтрацією і висушували, одержуючи 10,7 г 7хлор-1-[2-метил-4-(2-метилбензамідо)бензоїл]-2,3,4,5-тетрагідро-1Н-бензо[b]азепін-5-іл 4хлорбутирату у формі білого порошку. 1 Н-ЯМР (CDCl3-d6, 100 °C) м.ч.: 1,50-2,92 (16Н, м), 3,10-4,02 (2,4Н, м), 4,70-5,13 (1H, м), 5,86-6,19 (1,2Н, м), 6,48-6,68 (1H, м), 6,82-7,82 (8,8Н, м). 21 UA 98966 C2 5 10 15 20 25 30 35 40 45 50 55 60 Приклад 17 7-хлор-1-(2-метил-4-(2-метилбешамідо)бензоїл)-2,3,4,5-тетрагідро-1H-беизо[b]азепін-5-іл 4(4-ацетилпіперазин-1-іл)бутират. 7-хлор-1-(2-метил-4-(2-метилбензамідо)бензоїл)-2,3,4,5-тетрагідро-1Н-бензо[b]азепін-5-іл 4хлорбутират (0,5 г) розчиняли в ацетонітрилі (10 мл). До розчину додавали 1-ацетилпіперазин (0,35 г), йодид натрію (0,41 г) і карбонат натрію (0,19 г), і суміш нагрівали зі зворотним холодильником протягом 19 годин. Реагент лили у воду і суміш екстрагували етилацетатом, промивали водою, висушували над карбонатом натрію. Після фільтрації і концентрації при зниженому тиску залишок очищали хроматографією на колонках з силікагелем (дихлорметангметанол = 100:1 100:10), одержуючи 0,3 г 7-хлор-1-(2-метил-4-(2метилбензамідо)бензоїл)-2,3,4,5-тетрагідро-1Н-бензо[b]азепін-5-іл 4-(4-ацетил-піперазин-1іл)бутирату у формі безбарвного масла. 1 Н-ЯМР (СDСl3) м.ч.: 1,52-2,66 (23,6Н, м), 2,70-2,92 (1Н, м), 3,03-4,07 (4,4Н, м), 4,72-5,14 (1Н, м), 5,83-6,20 (1,2Н, м), 6,45-6,68 (1H, м), 6,79-7,78 (8,8Н, м). Приклад 18 7-хлор-1-[2-метил-4-(2-метилбензамідо)-бензоїл]-2,3,4,5-тетрагідро-1Н-бензо[b]азепін-5іл[(1-хлоретоксикарбоніл)метиламіно]ацетат. 1-хлоретил хлорформіат (0,12 мл, 1,2 ммоль) додавали по краплях до розчину 7-хлор-1-[2метил-4-(2-метилбензамідо)бензоїл]-2,3,4,5-тетрагідро-1Н-бензо[b]азепін-5-іл метиламіноацетату (0,60 г, 1,2 ммоль) у дихлорметані (10 мл), і суміш охолоджували льодом. Потім по краплях поступово додавали N-метилморфолін (0,15 мл, 1,4 ммоль). Після перемішування одержаної суміші при температурі навколишнього середовища протягом 1 години реакційну суміш розбавляли етилацетатом, промивали водою і насиченим водним розчином хлориду натрію, висушували над сульфатом натрію. Після фільтрації і концентрації залишок очищали хроматографією на силікагелі (н-гексан:етилацетат), одержуючи 0,67 г (93 %) 7-хлор-1-[2-метил-4-(2-метилбензамідо)-бензоїл]-2,3,4,5-тетрагідро-1H-бензо[b]азепін-5-іл[(1хлоретоксикарбоніл)метиламіно]ацетату у формі аморфної речовини. 1 Н-ЯМР (CDCl3), м.ч.: 1,70-1,95 (5Н, м), 2,10-2,55 (7Н, м), 2,75-3,15 (4Н, м), 3,85-4,55 (2Н, м), 4,70-5,10 (1Н, м), 5,856,20 (1Н, м), 6,45-6,65 (2Н, м), 6,75-7,75 (11Н, м). +1 MS (М ): 626. Приклад 19 7-хлор-1-[2-метил-4-(2-метил-бензоїламіно)-бензоїл]-2,3,4,5-тетрагідро-1Н-бензо[b]азепін-5іл[(і-ацетоксі-етоксикарбоніл)метиламіно]ацетат. N-метилморфолін (0,31 мл, 2,8 ммоль) додавали по краплях при охолодженні з льодом до розчину 7-хлор-1-[2-метил-4-(2-метилбензамідо)бензоїл]-2,3,4,5-тетрагідро-1H-бензо[b]азепін-5іл[(1-хлоретоксикарбоніл)метиламіно]ацетату (0,35 г, 0,56 ммоль) в оцтовій кислоті (0,32 мл, 5,6 ммоль), і суміш перемішували при температурі навколишнього середовища протягом двох днів. До реакційної суміші додавали воду і потім одержані осади збирали фільтрацією, і висушували на повітрі. Висушений продукт очищали хроматографією на силікагелі (н-гексан:етилацетат), одержуючи 0,26 г (72 %) 7-хлор-1-[2-метил-4-(2-метил-бегооїламіно)-бензоїл]-2,3,4,5-тетрагідро1H-бензо[b]азепін-5-іл [(1-ацетоксі-етоксикарбоніл)метиламіно]ацетату у формі аморфної речовини. 1 Н-ЯМР (ДМСО-d6) м.ч.: 1,35-1,45 (ЗН, м), 1,75-2,15 (7Н, м), 2,37 (6Н, с), 2,95 (ЗН, с), 3,15-3,50 (1H, м), 3,70-4,15 (1H, м), 4,17 (2Н, с), 5,95-6,05 (1Н, м), 6,55-6,70 (1Н, м), 6,85-7,00 (2Н, м), 7,10-7,25 (3Н, м), 7,30-7,45 (4Н, м), 7,56 (1H, с), 9,77 (1H, ушир.). Приклад 20 7-хлор-1-[2-метил-4-(2-метил-бензоїламіно)-бензоїл]-2,3,4,5-тетрагідро-1Н-бензо[b]азепін-5іл 3-[2-(біс-бензилокси-фосфорилокси)-4,6-диметилфеніл]-3-метилбутират. Толваптан (0,63 г), 3-[2-(біс-бензилокси-фосфорилокси)-4,6-диметилфеніл]-3-метилмасляну кислоту (0,70 г) і 4-диметиламінопіридин (DMAP) (24 мг, 0,22 ммоль) суспендували у 1 3 3 дихлорметані (10 мл). Додавали N -((етиліміно)метилен)-N ,N -диметилпропан-1,3-діамін гідрохлорид (WSC) (383 мг), і суміш перемішували при температурі навколишнього середовища протягом 3 годин. До реакційної суміші додавали воду і суміш екстрагували етилацетатом, висушували над безводним сульфатом натрію. Після фільтрації і концентрації при зниженому тиску залишок очищали флеш-хроматографією на силікагелі (н-гексан:етилацетат = 70:30 35:65). Очищений продукт концентрували при зниженому тиску, одержуючи 0,92 г 7хлор-1-[2-метил-4-(2-метил-бензоїламіно)-бензоїл]-2,3,4,5-тетрагідро-1H-бензо[b]азепін-5-іл 3 22 UA 98966 C2 5 10 15 20 25 30 35 40 45 50 55 60 [2-(біс-бензилокси-фосфорил~окси)-4,6-диметилфеніл]-3-метилбутирату у формі аморфної твердої речовини білого кольору. 1 Н-ЯМР (ДМСО-d6, 100 °C) м.ч.: 1,5-1,9 (7Н, м), 2,10 (3Н, с), 2,32 (3Н, с), 2,36 (3Н, с), 2,6-4,3 (2Н, м), 2,91 (2Н, д, J=15,3 Гц), 3,13 (2Н, д, J=15,3 Гц), 5,11 (2Н, с), 5,14 (2Н, с), 5,7-5,9 (1Н, м), 6,74 (1H, с), 6,75-7,4 (20Н, м), 7,54 (1Н, с), 9,8 (1Н, ушир.). Приклад 21 7-хлор-1-[2-метил-4-(2-метил-бензоїламіно)-бензоїл]-2,3,4,5-тетрагідро-1H-бензо[b]азепін-5іл 3-(2,4-диметил-6-фосфоноокси-феніл)-3-метилбутират. Суміш 7-хлор-1-[2-метил-4-(2-метилбензоїламіно)-бензоїл]-2,3,4,5-тетрагідро-1Нбензо[b]азепін-5-іл - 3-[2-(біс-бензилокси-фосфорилокси)-4,6-диметилфеніл]-3-метилбутирату (0,92 г) в етилацетаті (10 мл) гідрували на 5 % платині на вугіллі (100 мг). Каталізатор видаляли фільтрацією через шар Целіту і фільтрат концентрували при зниженому тиску. Залишок очищали флеш-хроматографією на силікагелі- (дихлорметан:метанол = 90:10 50:50). Очищений продукт концентрували при зниженому тиску і розчин залишку у водному розчині ацетонітрилу висушували сублімацією, одержуючи 0,21 г 7-хлор-1-[2-метил-4-(2-метилбегооїламіно)-бензоїл]-2,3,4,5-тетрагідро-1Н-бензо[b]азепін-5-іл 3-(2,4-диметил-6-фосфонооксифеніл)-3-метилбутирату у формі аморфної твердої речовини білого кольору. 1 Н-ЯМР (ДМСО-d6, 100 °C) м.ч.: 1,60 (3Н, с), 1,61 (3Н, с), 1,6-2,0 (4Н, м), 2,10 (3Н, с), 2,34 (3Н, с), 2,37 (3Н, с), 2,42 (3Н, с), 2,3-4,2 (2Н, м), 2,9-3,4 (2Н, м), 5,8-5,9 (1H, м), 6,45 (1H, с), 6,8-6,9 (1Н, м), 6,9-7,0 (1Н, с), 7,0-7,4 (7Н, м), 7,43 (1H, д, Гц J=7,4), 7,63 (3Н, с), 9,91 (1H, ушир.). Приклад 22 {7-хлор-1-[2-метил-4-(2-метил-бензоїламіно)-бензоїл]-2,3,4,5-тетрагідро-1Н-бензо[b]азепін-5іл}хлорметилкарбонат. Толваптан (5,0 г) і піридин (1,1 мл) суспендували у дихлорметані (50 мл). При охолодженні льодом додавали хлорметил хлорформіат (1,1 мл) і суміш перемішували при температурі навколишнього середовища протягом 30 хвилин. Реакційну суміш промивали водою, висушували над безводним сульфатом натрію. Після фільтрації і концентрації при зниженому тиску залишок очищали флеш-хроматографією на силікагелі (н-гексан:етилацетат = 70:30 50:50). Очищений продукт концентрували при зниженому тиску, одержуючи 6,1 г {7-хлор1-[2-метил-4-(2-метил-бензоїламіно)-бензоїл]-2,3,4,5-тетрагідро-1Н-бензо[b]азепін-5іл}хлорметилкарбонату уформі аморфної твердої речовини білого кольору. 1 Н-ЯМР (ДМСО-d6, 100 °C) м.ч.: 1,7-2,2 (4Н, м), 2,36 (6Н, с), 2,6-5,8 (2Н, м), 5,9-6,0 (3Н, м), 6,8-7,1 (2Н, м), 7,1-7,5 (7Н, м), 7,58 (1H, с), 9,8 (1H, ушир.). Приклад 23 {7-хлор-1-[2-метил-4-(2-метил-бензоїламіно)-бензоїл]-2,3,4,5-тетрагідро-1Н-бензо[b]азепін-5іл}йодометилкарбонат. {7-хлор-1-[2-метил-4-(2-метил-бензоїламіно)-бензоїл]-2,3,4,5-тетрагідро-1Н-бензо[b]азепін-5іл}хлорметилкарбонат (3,8 г) і йодид натрію (5,3 г) додавали до ацетону (27 мл), і потім суміш нагрівали зі зворотним холодильником протягом 3 годин. Після охолодження до температури навколишнього середовища додавали воду і одержані осади збирали фільтрацією. Осади промивали водою і висушували, одержуючи 4,2 г {7-хлор-1-[2-метил-4-(2-метил-бензоїламіно)бензоїл]-2,3,4,5-тетрагідро-1Н-бензо[b]азепін-5-іл}йодометилкарбонату у формі жовтуватого порошку. 1 Н-ЯМР (толуол-d8, 100 °C) м.ч.: 1,3-1,8 (4Н, м), 2,31 (ЗН, с), 2,42 (ЗН, с), 2,7-4,3 (2Н, м), 5,48 (2Н, д, J=5,1 Гц), 5,53 (2Н, д, J=5,1 Гц), 5,5 (1H, м), 6,4-6,8 (3Н, м), 6,8-7,2 (6Н, м), 7,2 (1H, м), 7,36 (1H, c). Приклад 24 {7-хлор-1-[2-метил-4-(2-метил-бензоїламіно)-бензоїл]-2,3,4,5-тетрагідро-1Н-бензо[b]азепін-5іл}ацетоксиметилкарбонат. Ацетат натрію (300 мг) додавали до розчину {7-хлор-1-[2-метил-4-(2-метил-бензоїламіно)бензоїл]-2,3,4,5-тетрагідро-1H-бензо[b]азепін-5-іл}йодометилкарбонату в ацетонітрилі (5 мл) і потім суміш нагрівали зі зворотним холодильником протягом 8 годин. Реакційну суміш охолоджували до температури навколишнього середовища і нерозчинну речовину видаляли фільтрацією. Фільтрат концентрували при зниженому тиску і залишок очищали флешхроматографією на силікагелі (н-гексан:етилацетат = 71:29 30:70). Очищений продукт концентрували при зниженому тиску. Розчин залишку у водному розчині ацетонітрилу висушували сублімацією, одержуючи 6,1 г {7-хлор-1-[2-метил-4-(2-метил-бензоїламіно)-бензоїл] 23 UA 98966 C2 5 10 15 20 25 30 35 40 45 50 55 60 2,3,4,5-тетрагідро-1Н-бензо[b]азепін-5-іл}ацетоксиметилкарбонату у формі аморфної твердої речовини білого кольору. 1 Н-ЯМР (толуол-d8, 100 °C) м.ч.: 1,3-1,8 (4Н, м), 1,6 (3Н, с), 2,3 (3Н, с), 2,4 (3Н, с), 2,7-4,4 (2Н, м), 5,6 (2Н, дд, J=5,5 Гц, 10,4 Гц), 5,6-5,9 (1H, м), 6,5 (1Н, д, J=8,4 Гц), 6,6 (1H, ушир.), 6,7 (1Н, дд, J=2,3, 8,4-Гц), 6,8-7,2 (5Н, м), 7,3 (1H, д, J=2,1 Гц), 7,4 (1Н, 1,6 Гц). Приклад 25 7-хлор-1-[2-метил-4-(2-метил-бензоїламіно)-бензоїл]-5-метилтіометокси-2,3,4,5-тетрагідро1Н-бензо[b]азепін. Диметилсульфоксид (ДМСО) (3 мл), оцтовий ангідрид (1,5 мл) і оцтову кислоту (1,5 мл) додавали до толваптану (1,0 г, 2,2 ммоль), і суміш перемішували при 70 °C протягом 4 годин. До реакційної суміші додавали воду і 1н. водний розчин гідроксиду натрію, і суміш екстрагували етилацетатом, промивали насиченим водним розчином хлориду натрію, висушували над безводним сульфатом натрію. Після фільтрації і концентрації при зниженому тиску залишок очищали флеш-хроматографією на силікагелі (н-гексан:етилацетат = 80:20 20:80). Очищений продукт концентрували при зниженому тиску, одержуючи 0,62 г 7-хлор-1-[2-метил-4-(2-метилбензоїламіно)-бензоїл]-5-метилтіометокси-2,3,4,5-тетрагідро-1H-бензо[b]азепіну у формі аморфної твердої речовини білого кольору. 1 Н-ЯМР (ДМСО-d6, 100 °C) м.ч.: 1,7-2,2 (4Н, м), 2,17 (3Н, с), 2,36 (6Н, с), 2,6-4,3 (2Н, м), 4,70 (2Н, д, J=11,2 Гц), 4,83 (2Н, д, J=11,2 Гц), 4,9 (1Н, м), 6,7-7,0 (1Н, м), 7,0-7,5 (8Н, м), 7,56 (1H, с), 9,8 (1Н, ушир.). Приклад 26 {7-хлор-1-[2-метил-4-(2-метил-бензоїламіно)-бензоїл]-2,3,4,5-тетрагідро-1Н-бензо[b]азепін-5ілоксиметил}дигідрофосфат. 7-хлор-1-[2-метил-4-(2-метил-бензоїламіно)-бензоїл]-5-метилтіометокси-2,3,4,5-тетрагідро1Н-бензо[b]азепін (509 мг, 1,0 ммоль) розчиняли в 1,2-дихлоретані (10 мл). Додавали хлорид сірки (0,12 мл, 1,5 ммоль) і суміш перемішували при температурі навколишнього середовища протягом 15 хвилин. Реакційну суміш концентрували при зниженому тиску. До залишку додавали ацетонітрил (10 мл), мурашину кислоту (0,68 мл, 10 ммоль) і триетиламін (1,4 мл, 10 ммоль), і суміш перемішували при 70 °C протягом 30 хвилин. Після охолодження до температури навколишнього середовища додавали воду і суміш екстрагували етилацетатом. Органічний шар екстрагували насиченим водним розчином гідрокарбонату натрію двічі. До водного шару поступово додавали лимонну кислоту до зникнення піни і водний шар екстрагували дихлорметаном двічі. Об'єднаний органічний шар висушували над безводним сульфатом натрію. Після фільтрації і концентрації при зниженому тиску залишок розчиняли в етилацетаті при нагріванні, і нерозчинну речовину видаляли фільтрацією, не даючи їй охолонути. Після охолодження фільтрату одержані осади збирали фільтрацією і висушували, одержуючи 180 мг {7-хлор-1-[2-метил-4-(2-метил-бензоїламіно)-бензоїл]-2,3,4,5-тетрагідро-1Нбензо[b]азепін-5-ілоксиметил}дигідрофосфату у формі білого порошку. 1 Н-ЯМР (ДМСО-d6, 100 °C) м.ч.: 1,6-2,2 (4H, м), 2,3-2,4 (6Н, м), 2,8-4,3 (2Н, м), 4,9-5,2 (2Н, м), 5,2-5,3 (1H, м), 6,7-7,7 (10Н, м), 9,81 (1H, ушир.)· Приклад 27 5-Ацетоксиметокси-7-хлор-1-[2-метил-4-(2-метил-бензоїламіно)-бензоїл]-2,3,4,5-тетрагідро1H-бензо[b]азепін. 7-хлор-1-[2-метил-4-(2-метил-бензоїламіио)-бензоїл]-5-метилтіометокси-2,3,4,5-тетрагідро1Н-бензо[b]азепін (509 мг, 1,0 ммоль) розчиняли в 1,2-дихлоретані (10 мл). Додавали хлорид сірки (0,12 мл, 1,5 ммоль) і суміш перемішували при температурі навколишнього середовища протягом 15 хвилин. Одержану суміш концентрували при зниженому тиску і до залишку додавали ацетонітрил (10 мл), ацетат натрію (246 мг, 2,0 ммоль) і йодид натрію (450 мг, 3,0 ммоль), і потім суміш нагрівали зі зворотним холодильником протягом 1 години. Після охолодження до температури навколишнього середовища додавали етилацетат і нерозчинний матеріал видаляли фільтрацією. Фільтрат концентрували при зниженому тиску і залишок очищали флеш-хроматографією на силікагелі (н-гексан:етилацетат - 65:35 50:50). Очищений продукт концентрували при зниженому тиску і залишок розчиняли у водному розчині ацетонітрилу. Після концентрації при температурі навколишнього середовища при зниженому тиску одержані осади збирали фільтрацією і висушували, одержуючи 280 мг 5-ацетоксиметокси7-хлор-1-[2-метил-4-(2-метил-бензоїламіно)-бензоїл]-2,3,4,5-тетрагідро-1H-бензо[b]азепіну у формі білого порошку. 1 Н-ЯМР (толуол-d8, 100 °C) м.ч.: 24 UA 98966 C2 5 10 15 20 25 30 35 40 45 50 55 1,3-1,9 (7Н, м), 2,32 (3Н, с), 2,41 (3Н, с), 2,8-4,1 (2Н, м), 4,6-4,8 (1Н, м), 5,17 (2Н, с), 6,4-6,8 (3Н, м), 6,8-7,3 (6Н, м), 7,39 (1H, с). Приклад 28 {7-хлор-1-[2-метил-4-(2-метил-бензоїламіно)-бензоїл]-2,3,4,5-тетрагідро-1Н-бензо[b]азепін-5іл}(2-хлоретил)карбамат. Толваптан (1,0 г, 2,2 ммоль) суспендували у толуолі (7 мл). Додавали 2-хлоретил ізоціанат (0,28 мл, 3,3 ммоль) і 4-диметиламінопіридин (DMAP) (27 мг, 0,22 ммоль), і суміш перемішували при 80 °C протягом 24 годин. Після охолодження до температури навколишнього середовища нерозчинні матеріали відфільтровували і промивали етилацетатом. Фільтрат концентрували при зниженому тиску. Залишок очищали флеш-хроматографією на силікагелі (нгексан:етилацетат = 54:46 33:67). Очищений продукт концентрували при зниженому тиску, одержуючи 1,0 г {7-хлор-1-[2-метил-4-(2-метил-бензоїламіно)-бензоїл]-2,3,4,5-тетрагідро-1Нбензо[b]азепін-5-іл}(2-хлоретил)карбамату у формі аморфної твердої речовини білого кольору. 1 Н-ЯМР (ДМСО-d6, 100 °C) м.ч.: 1,6-2,2 (4Н, м), 2,36 (6Н, с), 2,6-4,3 (2Н, м), 3,42 (2Н, т, J=6,0 Гц), 3,64 (2Н, дд, J=6,0, 12,1 Гц), 5,8-5,9 (3Н, м), 6,7-7,5 (10Н, м), 7,56 (1H, с), 9,8 (1Н, ушир.). Приклад 29 (2-{7-хлор-1-[2-метил-4-(2-метил-бензоїламіно)-бензоїл]-2,3,4,5-тетрагідро-1Hбензо[b]азепін-5-ілоксикарбоніламіно}-етил)-триметиламонійхлорид. Триметиламін (30 %-й розчин, 0,5 мл) додавали до розчину {7-хлор-1-[2-метил-4-(2-метилбензоїламіно)-бензоїл]-2,3,4,5-тетрагідро-1Н-бензо[b]азепін-5-іл}(2-хлоретил)карбамату (330 мг) в етанолі (10 мл), і суміш нагрівали при 170 °C протягом 15 хвилин (мікрохвильовий реактор). Після охолодження до температури навколишнього середовища реакційну суміш концентрували при зниженому тиску. До залишку додавали етилацетат і одержані осади збирали фільтрацією, і висушували, одержуючи 120 мг (2-{7-хлор-1-[2-метил-4-(2-метилбензоїламіно)-бензоїл]-2,3,4,5-тетрагідро-1H-бензо[b]азепін-5-ілоксикарбоніламіно}-етил)триметиламонійхлориду у формі білого порошку. 1 Н-ЯМР (ДМСО-d6, 100 °C) м.ч.: 1,6-2,2 (4Н, м), 2,34 (3Н, с), 2,37 (3Н, с), 2,8-4,3 (2Н, м), 3,1-3,9 (9Н, м), 3,3-3,7 (5Н, м), 5,8-6,0 (1Н, м), 6,7-7,1 (2Н, м), 7,1-7,5 (7Н, м), 7,56 (1H, с), 9,88 (1Н, ушир.). Приклад 30 {7-хлор-1-[2-метил-4-(2-метил~бензоїламіно)-бензоїл]-2,3,4,5-тетрагідро-1H-бензо[b]азепін5-іл} 2,2-диметил-пропіонілоксиметил сукцинат. Аморфний матеріал, що являє собою {7-хлор-1-[2-метил-4-(2-метил-бензоїламіно)-бензоїл]2,3,4,5-тетрагідро-1Н-бензо[b]азепін-5-іл} 2,2-диметил-пропіонілоксиметил сукцинат, одержували за аналогією з наведеним вище прикладом 5. 1 Н-ЯМР (ДМСО-d6, 100 °C) м.ч.: 1,14 (9Н, с), 1,75-2,10 (4Н, м), 2,37 (6Н, с), 2,65-2,80 (4Н, м), 3,10-3,55 (1H, м), 3,65-4,15 (1H, м), 5,71 (2Н, с), 5,85-6,00 (1H, м), 6,85-7,05 (2Н, м), 7,10-7,25 (3Н, м), 7,30-7,45 (4Н, м), 7,55 (1H, с), 9,76 (1Н, ушир.). Приклад 31 {7:хлор-1-[2-метил-4-(2-метил-беизоїламіно)-бензоїл]-2,3,4,5-тетрагідро-1Н-бензо[b]азепін-5іл}(етоксикарбонілметил-метил-карбамоїлокси)ацетат. {7-хлор-1-[2-метил-4-(2-метил-бензоїламіно)-бензоїл]-2,3,4,5-тетрагідро-1Н-бензо[b]азепін-5іл}хлорацетат (500 мг, 0,95 ммоль), етилсаркозинат гідрохлорид (230 мг, 1,5 ммоль) і карбонат калію (414 мг, 3,0 ммоль) додавали до диметилформаміду (DMF) (5 мл), і суміш перемішували при 60 °C протягом 1 години. До реакційної суміші додавали воду і одержані осади збирали фільтрацією, і промивали водою. Осади розчиняли в етилацетаті, висушували над безводним сульфатом натрію, фільтрували і концентрували при зниженому тиску. Залишок очищали флеш-хроматографією на силікагелі (н-гексан: етил ацетат = 36:64 15:85). Очищений продукт концентрували при зниженому тиску. До залишку додавали воду і одержані осади збирали фільтрацією, і висушували, одержуючи 330 мг {7-хлор-1-[2-метил-4-(2-метил-бензоїламіно)бензоїл]-2,3,4,5-тетрагідро-1H-бензо[b]азепін-5-іл}(етоксикарбонілметил-метилкарбамоїлокси)ацетату у формі білого порошку. 1 Н-ЯМР(ДМСО-d6) м.ч.: 1,19 (3Н, т, J=7,1 Гц), 1,6-2,2 (4Н, м), 2,37 (6Н, с), 2,8-4,3 (2Н, м), 2,85 (2Н, с), 2,96 (ЗН, с), 4,04 (2Н, с), 4,13 (2Н, кВ, J=7,1 Гц), 4,75 (2Н, с), 5,9-6,1 (1H, м), 6,8-7,1 (2Н, м), 7,1-7,3 (3Н, м), 7,3-7,5 (4Н, м), 7,56 (1Н, с), 9,80 (1Н, ушир.). Приклад 32 25 UA 98966 C2 5 10 15 20 25 30 35 40 45 50 55 {7-хлор-1-[2-метил-4-(2-метил-бензоїламіно)-бензоїл]-2,3,4,5-тетрагідро-1Н-бензо[b]азепін-5іл}[метил-(5-метил-2-оксо-1,3-діоксол-4-іл-метоксикарбоніл)-аміно]ацетат. 7-хлор-1-[2-метил-4-(2-метил-бензоїламіно)бензоїл]-2,3,4,5-тетрагідро-1Н-бензо[b]азепін-5ілметиламіноацетат (0,34 г, 0,65 ммоль) і (5-метил-1,3-діоксолан-2-он-4-іл)-метил-нітрофеніл карбонат (0,22 г, 0,74 ммоль) розчиняли у DMF (5 мл), і суміш перемішували при температурі навколишнього середовища протягом ночі. До реакційної суміші додавали воду і суміш екстрагували етилацетатом. Органічний шар промивали водою, насиченим водним розчином хлориду натрію і потім висушували над сульфатом натрію. Після фільтрації і концентрації залишок очищали хроматографією на силікагелі (н-гексан:етилацетат), одержуючи 0,44 г (43 %) {7-хлор-1-[2-метил-4-(2-метил-бензоїламіно)-бензоїл]-2,3,4,5-тетрагідро-1Н-бензо[b]азепін-5-іл} [метил-(5-метил-2-оксо-1,3-діоксол-4-іл-метоксикарбоніл)-аміно]ацетату у формі аморфної речовини. 1 Н-ЯМР (ДМСО-d6, 100 °C) м.ч.: 1,75-2,15 (4Н, м), 2,10 (ЗН, с), 2,37 (6Н, с), 2,96 (ЗН, с), 3,15-3,50 (1H, м), 3,70-4,25 (ЗН, м), 4,91 (2Н, с), 5,95-6,05 (1H, м), 6,85-7,05 (2Н, м), 7,10-7,45 (7Н, м), 7,56 (1Н, с), 9,76 (1Н, ушир.). Приклад 33 {7-хлор-1-[2-метил-4-(2-метил-бензоїламіио)-бензоїл]-2,3,4,5-тетрагідро-1Н-бензо[b]азепін-5іл}[метил-(5-метил-2-оксо-1,3-діоксол-4-іл-метил)-аміно]ацетат гідро хлорид. 4-бромметил-5-метил-1,3-діоксол-2-он (0,12 г, 0,61 ммоль) додавали до розчину 7-хлор-1-[2метил-4-(2-метил-бензоїламіно)-бензоїл]-2,3,4,5-тетрагідро-1Н-бензо[b]азепін-5-іл метиламіноацетату (0,30 г, 0,58 ммоль) і триетиламіну (0,10 мл, 0,69 ммоль) в ацетонітрилі (5 мл), і суміш перемішували при температурі навколишнього середовища протягом ночі. Реакційну суміш концентрували і до залишку додавали воду. Суміш екстрагували етилацетатом, промивали насиченим водним розчином хлориду натрію і висушували над сульфатом натрію. Після фільтрації і концентрації залишок очищали хроматографією на силікагелі (н-гексан:етилацетат). Одержаний залишок розчиняли в етилацетаті і додавали суміш 4н. хлористоводнева кислота-етилацетат, одержуючи гідрохлорид, і потім кристалізували. Одержані кристали збирали фільтрацією і висушували на повітрі, одержуючи 90 мг (23 %) {7хлор-1-[2-метил-4-(2-метил-бензоїламіно)-бензоїл]-2,3,4,5-тетрагідро-1Н-бензо[b]азепін-5-іл} [метил-(5-метил-2-оксо-1,3-діоксол-4-іл-метил)-аміно]ацетату гідрохлориду у формі білого порошку. Точка плавлення: 162,0-163,6 °C. 1 Н-ЯМР (ДМСО-d6, 100 °C) м.ч.: 1,75-2,15 (4Н, м), 2,08 (3Н, с), 2,37 (6Н, с), 2,45-2,55 (3Н, м), 3,15-4,10 (6Н, м), 5,95-6,05 (1Н, м), 6,85-7,05 (2Н, м), 7,10-7,45 (7Н, м), 7,56 (1Н, с), 9,78 (1H, ушир.). Приклад 34 {7-хлор-1-[2-метил-4-(2-метил-бензоїламіно)-бензоїл]-2,3,4,5-тетрагідро-1Н-бензо[b]азепін-5іл}[4-(2,2-диметил-пропіоніл)-піперазин-1-іл]ацетат гідро хлорид. 1-{7-хлор-1-[2-метил-4-(2-метил-бензоїламіно)-бензоїл]-2,3,4,5-тетрагідро-1Н-бензо[b]азепін5-ілоксикарбонілметил}-піперазин дигідрохлорид (200 мг, 0,31 ммоль) розчиняли у піридині (2 мл). Додавали триметилацетилхлорид (0,1 мл, 0,75 ммоль) і суміш перемішували при температурі навколишнього середовища протягом 20 годин. До реакційної суміші додавали етилацетат і суміш послідовно промивали водним розчином сульфату міді і насиченим водним розчином сульфату натрію, висушували над безводним сульфатом натрію. Після фільтрації і концентрації при зниженому тиску залишок очищали флеш-хроматографією на силікагелі (етилацетат:метанол = 100:0 98:2). Очищений продукт концентрували при зниженому тиску і до розчину залишку в етилацетаті (2 мл) додавали 4н. розчин гідрохлориду етилацетату (0,5 мл). До розчину додавали простий діетиловий ефір і одержані осади збирали фільтрацією, і висушували, одержуючи 70 мг {7-хлор-1-[2-метил-4-(2-метил-бензоїламіно)-бензоїл]-2,3,4,5тетрагідро-1Н-бензо[b]азепін-5-іл}[4-(2,2-диметил-пропіоніл)-піперазин-1-іл]ацетату гідрохлориду у формі білого порошку. Точка плавлення: 194-195 °C. 1 Н-ЯМР (ДМСО-d6) м.ч.: 1,20 (9Н, с), 1,6-2,2 (4Н, м), 2,33 (3Н, с), 2,37 (3Н, с), 2,7-3,0 (1Н, м), 3,44 (8Н, ушир.с), 4,0-5,0 (ЗН, м), 6,0-6,2 (1Н, м), 6,6-7,8 (10Н, м), 10,29 (1H, с). У таблиці 1 показані хімічні формули сполук, одержаних у прикладах 1-34. 26 UA 98966 C2 Таблиця 1 27 UA 98966 C2 5 10 15 20 25 Приклад 35 - Приклад 104 Сполуки наведених далі прикладів 36, 37 і 63 одержували тим самим чином, як у прикладі 1, використовуючи відповідні вихідні матеріали. Сполуки наведених далі прикладів 62, 64, 65, 66, 86 і 87 одержували тим самим чином, як у прикладі 5, використовуючи відповідні вихідні матеріали. Сполуки наведених далі прикладів 35, 45, 46, 47, 48, 49, 50, 51, 52, 68, 92, 69 і 93 одержували тим самим чином, як у прикладі 10, використовуючи відповідні вихідні матеріали. Сполуки наведених далі прикладів 42, 43, 67, 77, 78, 85, 95 і 103 одержували тим самим чином, як у прикладі 12, використовуючи відповідні вихідні матеріали. Сполуки наведених далі прикладів 39, 55, 56, 57, 58, 60, 61, 74, 75, 76, 81, 82 і 84 одержували тим самим чином, як у прикладі 13, використовуючи відповідні вихідні матеріали. Сполуки наведених далі прикладів 38, 41, 53, 54, 59, 70, 71, 72, 73, 79, 80 і 83 одержували тим самим чином, як у прикладі 15, використовуючи відповідні вихідні матеріали. Сполуки наведеного далі прикладу 91 одержували тим самим чином, як у прикладі 17, використовуючи відповідні вихідні матеріали. Сполуки наведених далі прикладів 88, 89 і 90 одержували тим самим чином, як у прикладі 19, використовуючи відповідні вихідні матеріали. Сполуки наведеного далі прикладу 40 одержували тим самим чином, як у прикладі 24, використовуючи відповідні вихідні матеріали. Сполуки наведеного далі прикладу 44 одержували тим самим чином, як у прикладі 28, використовуючи відповідні вихідні матеріали. Сполуки наведеного далі прикладу 94 одержували тим самим чином, як у прикладі 32, використовуючи відповідні вихідні матеріали. Сполуки наведених далі прикладів 96, 97, 98, 99, 100, 101, 102 і 104 одержували тим самим чином, як у прикладі 34, використовуючи відповідні вихідні матеріали. У таблиці 2 показані хімічні формули і фізичні властивості, такі як ЯМР і MS, сполук, одержаних у Прикладах 35-104. 28
ДивитисяДодаткова інформація
Назва патенту англійськоюBenzazepine derivatives useful as vasopressin antagonists
Автори англійськоюKondo, Kazumi, Menjo, Yasuhiro, Tomoyasu, Takahiro, Miyamura, Shin, Tomohira, Yuso, Matsuda, Takakuni, Yamada, Keigo, Kato, Yusuke
Назва патенту російськоюПроизводные бензазепина, пригодные для использования в качестве антагонистов вазопрессина
Автори російськоюКондо Казуми, Мендзо Ясухиро, Томоясу Такахиро, Миямура Син, Томохира Юсо, Мацуда Такакуни, Ямада Кейго, Като Юсуке
МПК / Мітки
МПК: C07D 223/16, A61P 7/00, A61K 31/55, A61P 9/00, C07D 405/12
Мітки: похідні, використання, антагоністів, придатні, вазопресину, бензазепіну
Код посилання
<a href="https://ua.patents.su/39-98966-pokhidni-benzazepinu-pridatni-dlya-vikoristannya-yak-antagonistiv-vazopresinu.html" target="_blank" rel="follow" title="База патентів України">Похідні бензазепіну, придатні для використання як антагоністів вазопресину</a>
Попередній патент: Спосіб одержання похідних 5-галоалкіл-4,5-дигідроізоксазолу
Наступний патент: Способи кристалографічної переорієнтації монокристалічного тіла
Випадковий патент: Доїльний стакан












