Спосіб одержання 5-ціанофталіду
Формула / Реферат
1. Спосіб одержання 5-ціанофталіду, який включає:
а) перетворення 5-карбоксифталіду в амід формули IV:
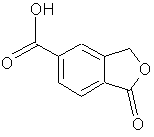
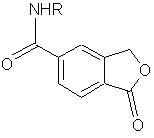
![]()
Формула III
Формула IV,
де R являє собою водень або С1-6алкіл, та
b) наступну взаємодію аміду формули IV з дегідратуючим агентом з одержанням 5-ціанофталіду
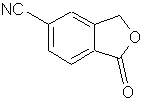
Формула V.
2. Спосіб за п. 1, де перетворення 5-карбоксифталіду в амід формули IV здійснюють через складний ефір формули VI
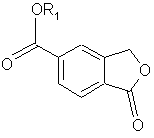
Формула VI,
де R1 являє собою С1-6алкіл або феніл,
шляхом обробки 5-карбоксифталіду спиртом R1OH у присутності кислоти з наступним амідуванням складного ефіру формули VI аміаком або С1-6алкіламіном.
3. Спосіб за п. 1, де перетворення 5-карбоксифталіду в амід формули IV здійснюють через хлорангідрид формули VII
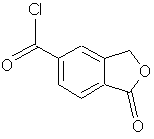
Формула VII
шляхом обробки 5-карбоксифталіду РОСl3, РСl5 або SOCl2 з наступним амідуванням хлорангідриду формули VII аміаком або С1-6алкіламіном.
4. Спосіб за п. 1, де перетворення 5-карбоксифталіду в амід формули IV здійснюють через хлорангідрид формули VII і складний ефір формули VI:

Формула VI
Формула VII,
де R1 являє собою С1-6алкіл або феніл, шляхом обробки 5-карбоксифталіду РОСl3, РСl5 або SOСl2, з наступною взаємодією отриманого в такий спосіб хлорангідриду формули VII зі спиртом R1OH і амідуванням складного ефіру формули VI аміаком або С1-6алкіламіном.
5. Спосіб за п. 2, де використовуваною кислотою є мінеральна кислота або кислота Льюіса, переважно, НСl, H2SO4, РОСl3, PCl5 або SOCl2.
6. Спосіб за п. 2, 4 або 5, де R1 являє собою метил або етил.
7. Спосіб за будь-яким з пп. 1-6, де зазначеним дегідратуючим агентом, використовуваним на стадії b), є SOСl2, РОСl3 або РСl5, переважно SOСl2.
8. Спосіб за будь-яким з пп. 1-7, де взаємодію на стадії b) проводять без розчинника або в придатному розчиннику, такому як толуол, сульфолан або ацетонітрил, переважно у толуолі.
9. Спосіб за п. 8, де зазначеним дегідратуючим агентом, використовуваним на стадії b), є SOСl2, і зазначену взаємодію здійснюють у толуолі, який містить каталітичну кількість Ν,Ν-диметилформаміду.
10. Спосіб за будь-яким з пп. 1-9, де R являє собою Η або трет-бутил.
11. Спосіб за п. 2, де 5-карбоксифталід формули III піддають взаємодії зі спиртом R1OH, переважно з етанолом або метанолом, у присутності РОСlз, з одержанням складного ефіру формули VI, який потім піддають взаємодії з аміаком з одержанням 5-карбамоїлфталіду, який, у свою чергу, піддають взаємодії з SOСl2 з одержанням 5-ціанофталіду.
12. Спосіб за п. 11, де 5-карбоксифталід формули III піддають взаємодії з етанолом у присутності РОСlз, з одержанням етилового складного ефіру формули VI, який потім піддають взаємодії з аміаком у метанолі з одержанням 5-карбамоїлфталіду, який, у свою чергу, піддають взаємодії з SОСl2 з одержанням 5-ціанофталіду.
Текст
1. Спосіб одержання 5-ціанофталіду, який включає: а) перетворення 5-карбоксифталіду в амід формули IV: 3 70979 4 6. Спосіб за п.2, 4 або 5, де R1 являє собою метил 11. Спосіб за п.2, де 5-карбоксифталід формули III або етил. піддають взаємодії зі спиртом R1OH, переважно з 7. Спосіб за будь-яким з пп.1-6, де зазначеним етанолом або метанолом, у присутності РОСlз, з дегідратуючим агентом, використовуваним на стаодержанням складного ефіру формули VI, який дії b), є SOСl2 , РОСl3 або РСl5, переважно SOСl2. потім піддають взаємодії з аміаком з одержанням 8. Спосіб за будь-яким з пп.1-7, де взаємодію на 5-карбамоїлфталіду, який, у свою чергу, піддають стадії b) проводять без розчинника або в придатвзаємодії з SOСl2 з одержанням 5-ціанофталіду. ному розчиннику, такому як толуол, сульфолан 12. Спосіб за п.11, де 5-карбоксифталід формули або ацетонітрил, переважно у толуолі. III піддають взаємодії з етанолом у присутності 9. Спосіб за п.8, де зазначеним дегідратуючим РОСlз, з одержанням етилового складного ефіру агентом, використовуваним на стадії b), є SOСl2, і формули VI, який потім піддають взаємодії з аміазазначену взаємодію здійснюють у толуолі, який ком у метанолі з одержанням 5-карбамоїлфталіду, містить каталітичну кількість Ν,Νякий, у свою чергу, піддають взаємодії з SОСl2 з диметилформаміду. одержанням 5-ціанофталіду. 10. Спосіб за будь-яким з пп.1-9, де R являє собою Η або трет-бутил. Цей винахід відноситься до нового способу одержання 5-ціанофталіду, який є проміжною сполукою, яку використовують для одержання добре відомого антидепресивного лікарського засобу циталопраму, 1-[3-(диметиламіно)пропіл]-1-(4фтор феніл)-1,3-дигідро-5ізобензофуранкарбонітрилу. Циталопрам являє собою добре відомий антидепресивний лікарський засіб, який існує в продажі вже протягом декількох років і який має наступну стр уктур у: Циталопрам є селективним, що впливає на центральну нервову систему, інгібітором повторного захоплення серотоніну (5-гідрокситриптаміну; 5-НТ), який проявляє антидепресивну активність. Про антидепресивну активність даної сполуки повідомлялося в ряді публікацій, наприклад, J.Hyttel, Prog. Neuro-Psychopharmacol. & Biol. Psychiat, 1982, б, 277-295 та A.Gravem, Ada Psychiatr, Scand., 1987, 75, 478-486. Циталопрам був отриманий способом, описаним у патенті США №4 650 884, відповідно до якого 5-ціанофталід піддають двом послідовним реакціям Гриньяра, тобто реакціям з 4фторофенілмагнійгалогенідом і Ν,Νдиметиламінопропілмагній-галогенідом, відповідно, і отриману сполуку формули: піддають реакції замикання кільця шляхом дегідратації в присутності сильної сірчаної кислоти. Енантіомери циталопраму можуть бути отримані способом, описаним у патенті США №4 943 590, тобто шля хом розподілу енантіомерів проміжної сполуки формули II і здійснення енантіоселективного замикання кільця з одержанням потрібного енантіомера. Таким чином, 5-ціанофталід є важливою проміжною сполукою для одержання циталопраму і важливою сполукою для одержання зазначеного продукту необхідної якості зручним і економічно вигідним способом. Спосіб одержання 5-ціанофталіду був раніше описаний у Bull. Soc. Sci. Bretagne, 26,1951, 35 та Levy & Stephen, J.Chem. Soc. 1931, 867. Відповідно до цього способу 5-амінофталід перетворюють у відповідний 5-ціанофталід шляхом діазотування з наступною взаємодією з CuCN. 5-амінофталід був отриманий з 4-амінофталіміду шляхом двостадійного відновлення. Синтез деяких алкіл- і фенілнітрилів із хлорангідридів описаний у Tetrahedron Letters, 1982, 23, 14,1505-1508, і в Tetrahedron, 1998, 54, 9281. Незважаючи на неефективність ряду інших методів, було виявлено, що 5-ціанофталід може бути отриманий з високими виходами з 5карбоксифталіду зручним і економічно вигідним способом. Таким чином, цей винахід забезпечує новий спосіб одержання 5-ціанофталіду з 5карбоксифталіду, який містить а) перетворення 5-карбоксифталіду в амід формули IV: де R являє собою водень або С1-6алкій, та b) наступну взаємодію аміду формули IV з дегідратуючим агентом з одержанням 5ціанофталіду 5 70979 6 способом, наприклад, додаванням води, фільтрацією і наступним промиванням кристалів. Наступне очищення, якщо це необхідно, може бути здійснено шляхом перекристалізації. У кращому варіанті здійснення винаходу, R у формулі IV являє собою Η або трет-бутил. Якщо реакцію на стадії а) здійснюють через складний Перетворення 5-карбоксифталіду в амід форефір, то R1, переважно, являє собою метил або мули IV може бути здійснено через складний ефір етил. формули VI або хлорангідрид формули VII, або В особливо кращому варіанті здійснення виначерез складний ефір та хлорангідрид ходу, 5-карбоксифталід формули llІ піддають взаємодії зі спиртом R1OH, переважно, з етанолом у присутності РОСl3, з одержанням відповідного складного ефіру формули VI, який потім піддають взаємодії з аміаком з одержанням 5карбамоілфталіду, який, у свою чергу, піддають взаємодії з SOCI2 у толуолі, що містить каталітичну кількість Ν,Ν-диметилформаміду. де R1 представляє С 1-6алкіл або феніл. ХлорангідНесподівано було виявлено, що реакція у лакрид звичайно одержують шляхом обробки 5тонового кільця звичайно не відбувається. У відкарбоксифталіду нерозбавленими РОСІ3, РСІ5 або повідності зі способом цього винаходу, 5SOCl2 або в придатному розчиннику, такому як ціанофталід одержують з високими виходами, і толуол або толуол, який містить каталітичну кільзазначений спосіб є набагато більш ефективним, кість Ν,Ν-диметилформаміду. Складний ефір оденіж відомий спосіб, і дозволяє використовувати ржують шляхом обробки 5-карбоксифталіду спирбільш придатні і більш дешеві реагенти та ще й у том R1OH, де R1 є таким, як визначено вище, у більш зручних умовах. присутності кислоти, переважно, мінеральної кис5-Карбоксифталід, який використовують як вилоти або кислоти Льюіса, такої як НСІ, H2SO4, РОхідну сполуку, може бути отриманий способами, СІ3, РСІ5 або SOCl2. Альтернативно, складний описаними в патенті США №3 607 884 або в патеефір може бути отриманий із хлорангідриду реакнті Німеччини №2630927, тобто, шляхом взаємодії цією взаємодії зі спиртом. Потім складний ефір концентрованого розчину терефталевої кислоти з формули VI або хлорангідрид формули VII переформальдегідом у рідкому SO3 або шляхом електтворюють в амід формули IV шля хом амідування рохімічного гідрування тримелітової кислоти. аміаком або С 1-6алкіламіном, переважно, третПриклади бутиламіном. Цей винахід далі проілюстровано наступними У цьому описі і формулі винаходу С1-6алкіл прикладами. означає розгалужену або нерозгалужену алкільну Приклад 1 груп у, яка має від одного до шести атомів вуглецю, Одержання 5-ціанофталіду включно, таку як метил, етил, 1-пропіл, 2-пропіл, 15-Хлоркарбонілфталід бутил, 2-бутил, 2-метил-2-пропіл, 2,2-диметил-15-Карбоксифталід (53г, 0,3моль) суспендують етил і 2-метил-1-пропіл. у толуолі (200мл) і тіонілхлориді (44г, 0,6моль). Дегідратуючим агентом, що використовують Потім додають Ν,Ν-диметилформамід (ДМФ) (1мл) на стадії b), може бути будь-який придатний дегіді суміш кип'ятять зі зворотним холодильником проратуючий агент, і оптимальний агент може бути тягом 3 годин. Отриману суміш прохолоджують до легко обраний фахівцем. Прикладами придатних кімнатної температури і додають н-гептан (200мл). дегідратуючи х агентів є SOCl2, РОСl3 та РСІ5, пеУтворені кристали збирають і промивають гептареважно, SOCI2. ном (100мл). Вихід: 52г, 88%. Початкова темпераРеакцію на стадії b) здійснюють або без розтура ДСК: 131°С. 1Н-ЯМР (CDCI3, 500МГц): 5,47 чинника, або в придатному розчиннику, такому як (2Н, с), 8,06 (1Н, д, J=7,5Гц), 8,28 (1Н, д, J=7,5Гц), толуол, сульфолан або, звичайно, ацетонітрил. 8,3 (1Н, с). 13С-ЯМР (CDCI3, 125МГц): 69,4; 125,1; Якщо цю реакцію здійснюють у розчиннику, то ви126,1; 131,1; 131,6; 137,8; 146,6; 167,4; 169,0. користовують 1,0-1,5, а переважно, 1,0-1,2 еквіва5-трет-Бутилкарбамілфталід ленту дегідратуючого агента на еквівалент аміду Метод А): формули V. Крім того, якщо використовують роз5-Карбоксифталід (36г, 0,2моль) суспендують чинник, то може виявитися необхідним використоу тіонілхлориді (100мл). Потім додають ДМФ вувати каталітичну кількість Ν,Ν(1,5мл) і суміш кип'ятять зі зворотним холодильнидиметилформаміду, зокрема, якщо дегідратуючим ком протягом 1 години. Потім додають толуол агентом є SOCI2. У якості розчинника, переважно, (200мл) і розчинники випарюють у вакуумі. Заливикористовують толуол, і, якщо це необхідно, у шок розчиняють у тетрагідрофурані (ТГФ) (200мл) і присутності каталітичної кількості Ν,Νдодають у розчин трет-бутиламіну (31г, 0,42моль) диметилформаміду. у ТГФ (200мл) при 5°С. Суміш залишають для наРеакцію на стадії b) здійснюють при підвищегрівання до кімнатної температури і перемішують ній температурі і, переважно, при температурі протягом ночі. Потім реакційну суміш виливають у флегми розчинника. крижану воду (400мл) і кристали, що випали, відЧас реакції не має вирішального значення і фільтровують. Отримані кристали промивають може бути легко визначений фахівцем. водою (100мл). Вихід: 41г, 87%. Початкова темпе5-ціанофталід може бути виділений звичайним 7 70979 8 ратура ДСК: 189,5°С. туру підтримують при 80°С протягом 20 годин. Метод В): Після охолодження реакційну суміш виливають на Розчин 5-хлоркарбонілфталіду (39г, 0,2моль) у лід (250г) і рН доводять до 1 з використанням конТГФ (200мл) додають до розчину трет-бутиламіну центрованої соляної кислоти. Суміш перемішують (19г, 0,25моль) і триетиламіну (26г, 0,25моль) у протягом 2 годин. Кристали, які утворилися, відфіТГФ (200мл) при кімнатній температурі. Суміш льтровують, промивають водою (4´100мл) і суперемішують протягом 1 години. Потім реакційну шать у вакуумі. Вихід: 33г, 93%. Початкова темпесуміш виливають у крижану воду (500мл). Кристаратура ДСК: 237°С. 1Н-ЯМР (ДМСО-d6, 250МГц): лічний продукт, який утворився, збирають і проми5,47 (2Н, с), 7,65 (1Н, с (ΝΗ)), 7,92 (1Н, д, J=7,5Гц), вають водою (100мл). Вихід: 42,5г, 91%. Початкова 8,06 (1Н, д, J=7,5Гц), 8,14 (1Н, с), 8,22 (1Н, с (NH)). 13 температура ДСК: 192°С. Чистота: 99,5% (рідинна С-ЯМР (ДМСО-d6, 62,5МГц): 70,0, 122,2, 124,9, хроматографія високого розділення (hplc), площа 127,2, 128,2, 139,7, 147,4, 167,1, 170,1. піка). 1Н-ЯМР (ДМСО-d6, 500МГц): 1,4 (9Н, с), 5,46 Метод В): (2Н, с), 7,88 (1Н, д, J=7,5Гц), 7,95 (1Н, д, J=7,5Гц), 5-Хлоркарбонілфталід (20г, 0,1моль) розчиня8,04 (1Н, с). 13С-ЯМР (ДMCO-d6, 125МГц): 28,5; ють у ТГФ (100мл) і додають до гідроксиду амонію 51,2; 70,0; 122,0; 124,6; 126,6; 128,2; 141,3; 147,2; (50мл) у крижаній воді (300мл). Суміш перемішу165,5; 170,1. ють протягом 30 хвилин і осаджені кристали відфі5-Етоксикарбонілфталід льтровують. Кристали промивають водою (100мл) Метод А): і суша ть у вакуумі. Вихід: 17,1г, 97%. Початкова 5-Карбоксифталід (37г, 0,2моль) суспендують температура ДСК: 237°С. у етанолі (400мл). Потім по краплям додають 5-Ціанофталід РОСl3 (10г, 0,07моль) і реакційну суміш кип'ятять зі Метод А): зворотним холодильником протягом 5 годин. Після Сухий 5-карбамілфталід (36г, 0,2моль) суохолодження до кімнатної температури, зазначена спендують у толуолі (600мл) і додають тіонілхлов заголовку сполука кристалізується. Кристали рид (36г, 0,3моль). Потім додають ДМФ (2мл). Ревідфільтровують і промивають етанолом (50мл). акційну суміш нагрівають при 75°С протягом 6 Вихід: 35г, 87%. Початкова температура ДСК: годин. Толуол (100мл) видаляють шляхом дисти151°С. 1Н-ЯМР (ДМСО-d6, 250 МГц): 1,36 (3Н, т, ляції і розчин, який залишився, охолоджують до J=7Гц), 4,38 (2Н, кв., J=7Гц), 5,48 (2Н, с), 7,95 (1Н, кімнатної температури. Кристали, які утворилися, д, J=7,5Гц), 8,12 (1Н, д, J=7,5Гц). 13С-ЯМР (ДМСОвідфільтровують і промивають толуолом (150мл) і d6, 62,5МГц): 14,5; 61,5; 70,1; 124,0; 125,2; 128,8; водою (100мл). Отриманий продукт перекристалі129,6; 134,8; 147,6; 164,9; 169,8. зовують з толуолу. Ви хід: 22г, 80%. Початкова теМетод В): мпература ДСК: 203°С. 5-Хлоркарбонілфталід (39г, 0,2моль) суспенМетод В): дують у етанолі (200мл). Суміш кип'ятять зі звороТрет-бутилкарбамілфталід (23,3г, 0,1моль) сутним холодильником протягом 15 хвилин. Після спендують у тіонілхлориді (100мл). Суміш кип'я охолодження кристалічну речовину, яка утворилатять зі зворотним холодильником протягом 30 ся, відфільтровують і промивають етанолом хвилин. Потім додають толуол (100мл) і розчинни(50мл). Вихід: 36г, 88%. Початкова температура ки видаляють у вакуумі. Зазначений у заголовку ДСК: 151°С. продукт кристалізують з оцтової кислоти або толу5-Карбамілфталід олу. Вихід: 15,5г, 93% з толуолу. Початкова темМетод А): пература ДСК: 203°С. Чистота: 98% (hplc, площа 5-Етоксикарбонілфталід (41г, 0,2моль) супіка). спендують в аміаку (10Μ розчин у метанолі, 200мл) у реакторі під тиском. Реакційну темпера Комп’ютерна в ерстка Т. Чепелев а Підписне Тираж 37 прим. Міністерство осв іт и і науки України Держав ний департамент інтелектуальної в ласності, вул. Урицького, 45, м. Київ , МСП, 03680, Україна ДП “Український інститут промислов ої в ласності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюA method for the preparation of 5-cyanophtalide
Автори англійськоюPetersen Hans
Назва патенту російськоюСпособ получения 5-цианофталида
Автори російськоюПетерсен Ханс
МПК / Мітки
МПК: C07D 307/87, C07D 307/88
Мітки: спосіб, одержання, 5-ціанофталіду
Код посилання
<a href="https://ua.patents.su/4-70979-sposib-oderzhannya-5-cianoftalidu.html" target="_blank" rel="follow" title="База патентів України">Спосіб одержання 5-ціанофталіду</a>
Попередній патент: Пристрій для панеферентної детоксикації крові і перитонеального лаважа
Наступний патент: Контактний пристрій для масообмінних апаратів
Випадковий патент: Автономна система каналізації








