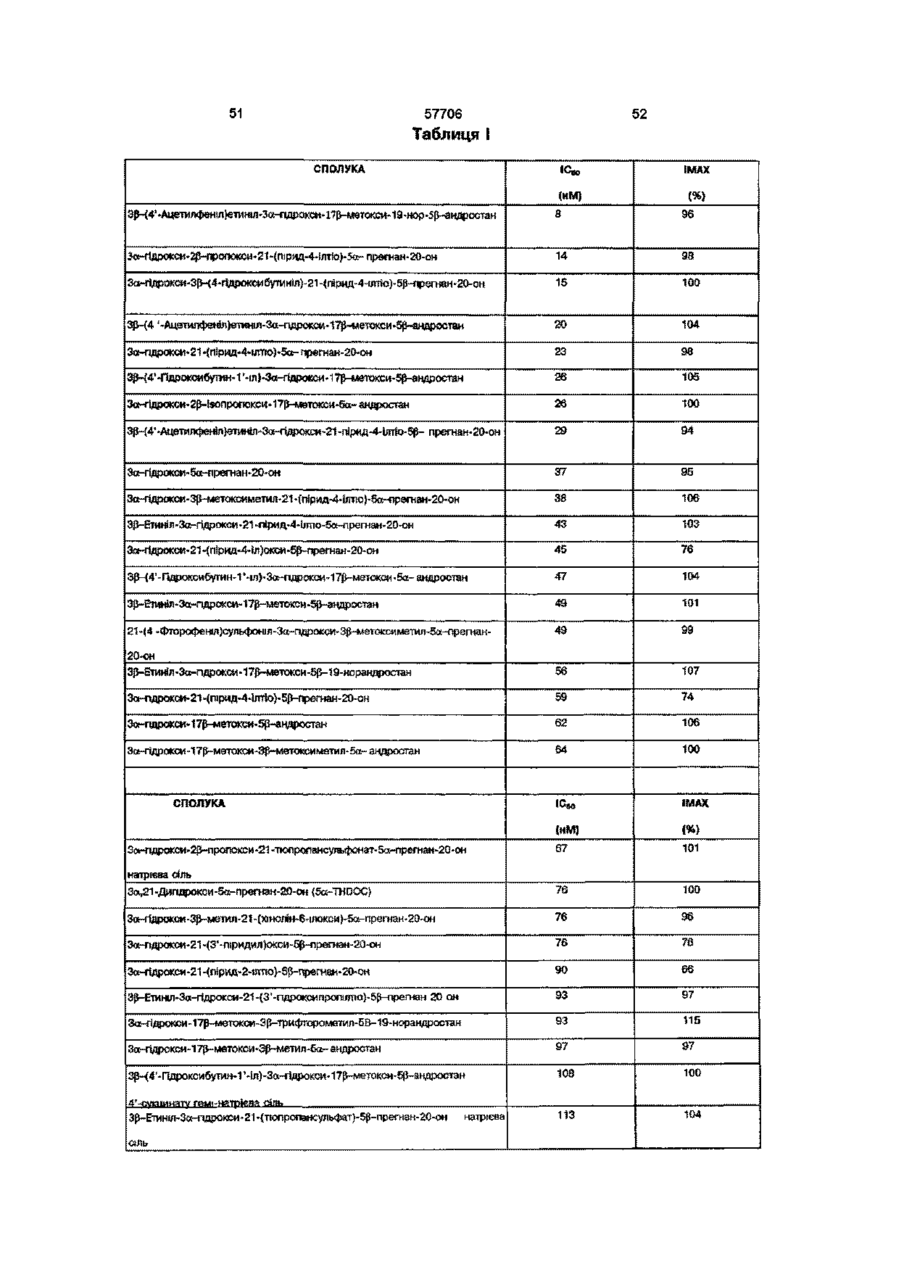
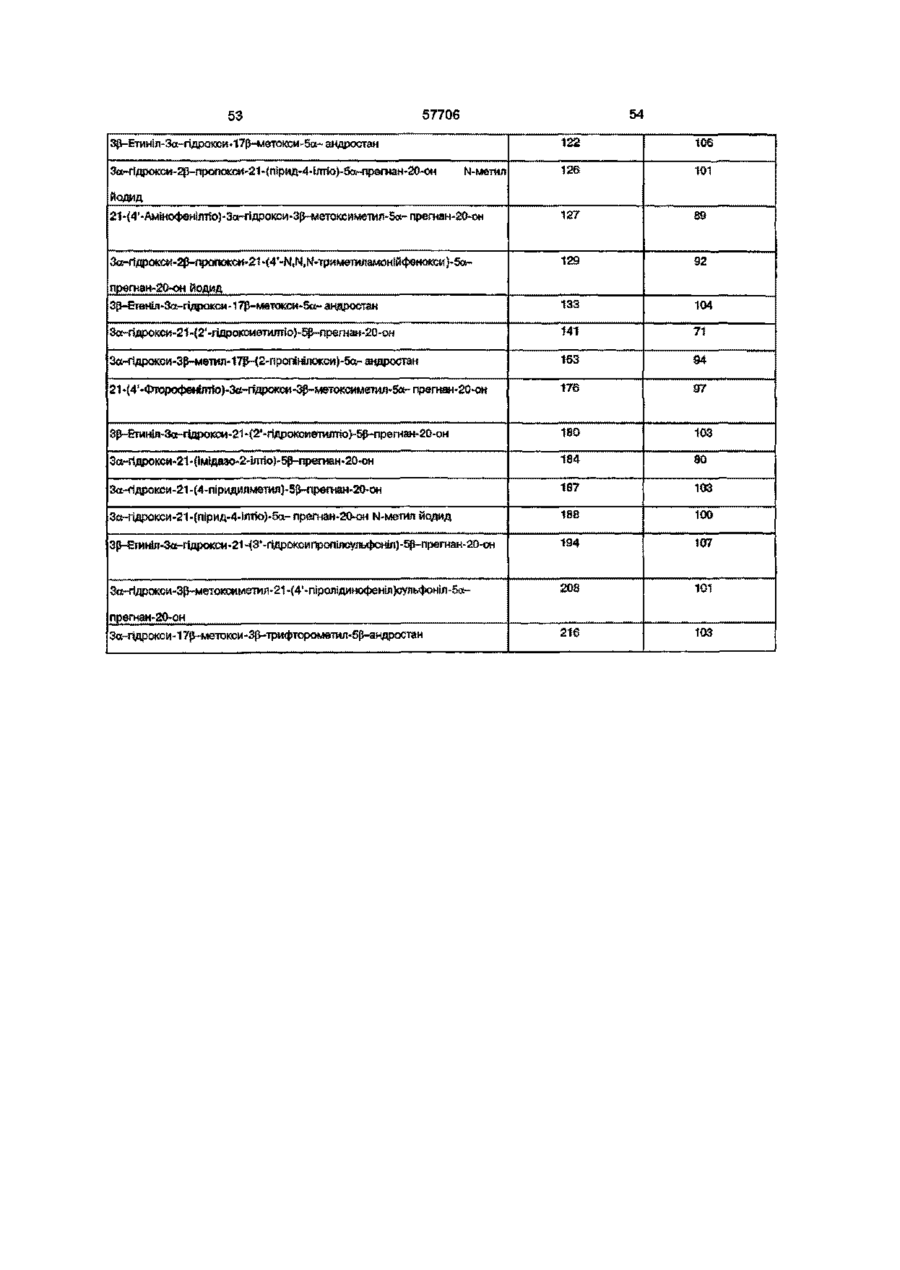
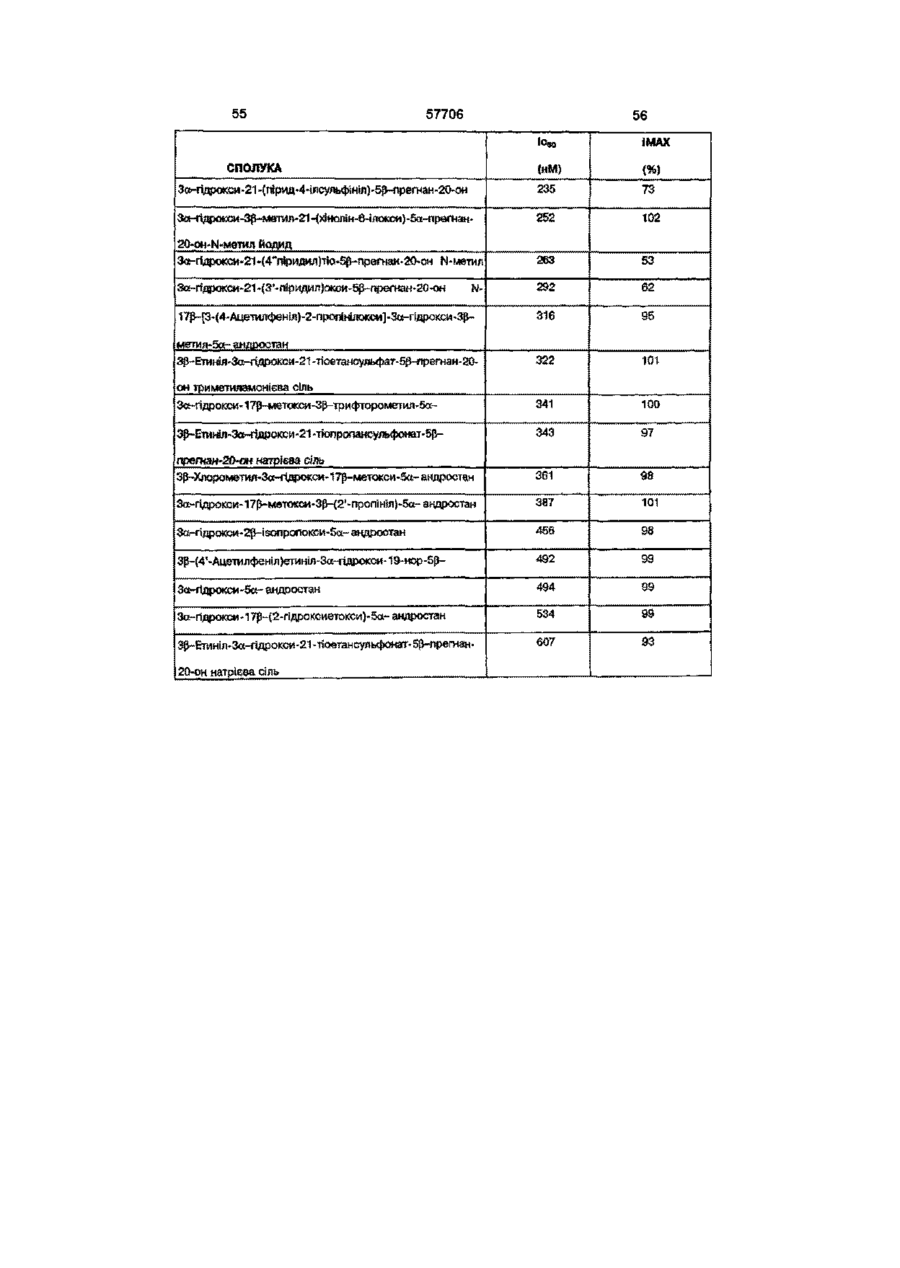
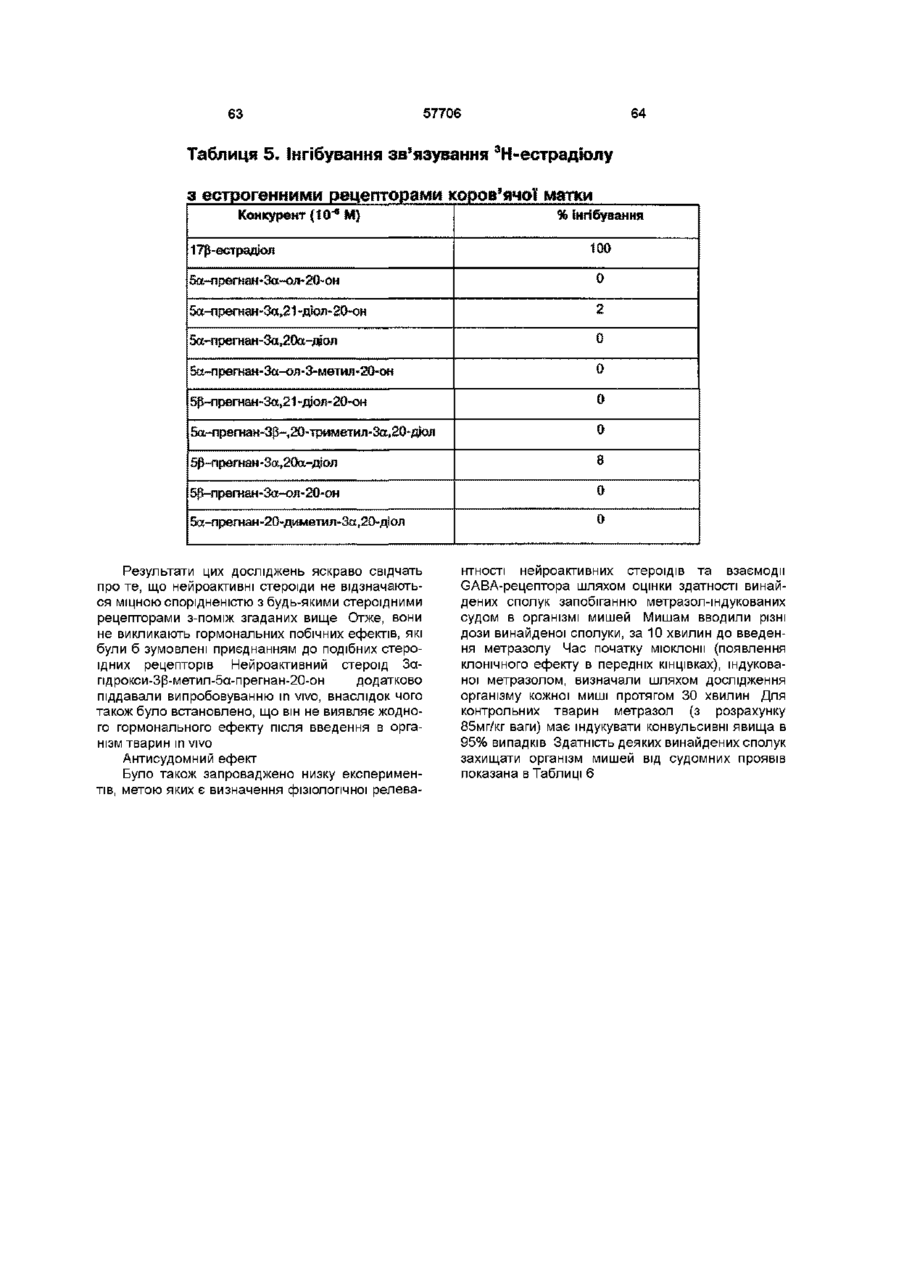
Нейроактивні стероїди ряду андростанів та прегнанів, фармацевтична композиція і спосіб лікування (варіанти)
Номер патенту: 57706
Опубліковано: 15.07.2003
Автори: УПАСАНІ Равіндра Б., ХОГЕНКАМП Дерк Дж., ФІК Девід Б., ЛЕН Ненсі К.
Формула / Реферат
1. Нейроактивные стероиды ряда андростана или прегнана общей формулы I:
,(І)
или их физиологически приемлемые сложные 3-эфиры, где
R означает водород или низшую алкоксигруппу;
R1 означает водород, С1-10алкил, С2-10алкенил, С2-10алкинил, тригалогенС1-10алкил, гидроксиС2-10алкинил, алкоксиС1-10алкил, необязательно замещенный фенил, алкоксиС2-10алкинил, оксоалкинил или его кеталь, необязательно замещенный фенилалкенил, сложный гемиэфир гидроксиалкинилдикарбновой кислоты;
R2 означает водород или кетогруппу;
R3означает необязательно замещенную алкокси-, алкинилокси-, необязательно замещенную фенилалкинилоксигруппу, -C(O)-CH2-Y-G, -C(O)-CH2-O-D-, -C(O)-CH2-O-E, -C(O)-CH2-Z-G или C(O)-CH2-Y-Z-A, где
Y обозначает О, S, SO или SO2;
Z обозначает C1-10алкилен;
G обозначает пиридил или необязательно замещенный фенил;
D обозначает хинолин, присоединенный к атому углерода;
Е - необязательно замещенный фенил;
А обозначает гидроксил, карбоксил или сульфонат;
R4 обозначает водород или метил;
R5 - водород;
R6 - водород;
R7 - водород или гидроксил;
R8 - водород;
R9 - водород;
R10 - водород;
при условии, что:
когда R3 - С1-3алкоксигруппа и R - водород, то R1 отличен от водорода;
когда R3 - С1-4алкокси(С1-4)алкоксигруппа, то R1 отличен от водорода или 1-пропенила;
когда R3 - -C(O)-CH2-Y-G и G - пиридил, присоединенный к атому углерода, то R1 отличен от водорода или С1-10алкила; или
когда R3 - -C(O)-CH2-Z-G, то R1 отличен от водорода.
2. Соединение по п. 1, отличающееся тем, что R обозначает водород или низший алкокси;
R1 обозначает водород, С1-10алкил, С2-10алкенил, С2-10aлкинил, тригалогенС1-10алкил, гидроксиС2-10aлкинил, алкоксиС1-10aлкил, необязательно замещенный фенил, алкоксиС2-10алкинил, оксоалкинил или его кеталь, необязательно замещенный фенилалкинил, сложный гемиэфир гидроксиалкинилдикарбоновой кислоты;
R2 обозначает водород или кетогруппу;
R3 обозначает необязательно замещенную алкокси-, алкинилокси- или необязательно замещенную фенилалкинилоксигруппу; и
R4 - водород или метил; и
R5, R6, R7, R8, R9 и R10 каждый представляет собой водород;
при условии,что
когда R3 - С1-3алкоксигруппа и R - водород, то R1 отличен от водорода;
или
когда R3 - С1-4алкокси(С1-4)алкоксигруппа, то R1 отличен от водорода или 1-пропенила.
3. Соединение по п. 2, отличающееся тем, что оно представляет собой 3a-гидрокси-3-метил-17-(2-пропинилокси)-5-андростан или 17-[3-(4-ацетилфенил)-2-пропинилокси]-3a-гидрокси-3-метил-5-андростан.
4. Соединение по п. 2, отличающееся тем, что R3 - необязательно замещенная алкоксигруппа.
5. Соединение по п. 4, отличающееся тем, что R3 - незамещенная алкоксигруппа.
6. Соединение по п. 5, отличающееся тем, что R1 - замещенный фенилэтинил.
7. Соединение по п. 6, отличающееся тем, что оно представляет собой 3-гидрокси-3-(4'-нитрофенил)этинил-17-метокси-5-андростан; 3-гидрокси-3-(4'-метоксифенил)этинил-17-метокси-5-андростан; 3-гидрокси-3-[2-(3',4'-диметоксифенил)этинил]-17-метокси-5-андростан; 3-гидрокси-3-(4'-метилфенил)этинил-17-метокси-5-андростан; 3-(4'-трифторметилфенил)этинил-3-гидрокси-17-метокси-5-андростан; 3-гидрокси-3-(2'-метоксифенил)этинил-17-метокси-5-андростан; 3-(4'-диметиламинофенил)этинил-3-гидрокси-17-метокси-5-андростан; 3-(4'-ацетилфенил)этинил-3-гидрокси-17-метокси-5-андростан; 3-(4'-хлорфенил)этинил-3-гидрокси-17-метокси-5-андростан; 3-(4'-ацетилфенил)этинил-3-гидрокси-17-метокси-5-андростан; этиловый эфир 3-(4'-карбоксифенилэтинил)-3-гидрокси-17-метокси-5-андростана; 3-гидрокси-3-(4'-ацетоксиацетилфенил)этинил-17-метокси-5-андростан или 3-(4'-цианофенил)этинил-3-гидрокси-17-метокси-5-андростан.
8. Соединение по п. 6, отличающееся тем, что оно представляет собой 3-(4'-ацетилфенилэтинил)-3-гидрокси-19-нор-17-метокси-5-андростан; этиловый эфир 3-(4'-карбоксифенилэтинил)-3-гидрокси-19-нор-17-метокси-5-андростана; этиловый эфир 3-(4'-карбоксифенилэтинил)-3-гидрокси-17-метокси-5-андростана; 3-[4'-(N,N-диэтилкарбоксиамидо)фенил]этинил-3-гидрокси-17-метокси-5-андростан или 3-(4'-ацетоксифенилэтинил)-3-гидрокси-17-метокси-5-андростан.
9. Соединение по п. 5, отличающееся тем, что R1 является необязательно замещенным фенилом.
10. Соединение по п. 9, отличающееся тем, что оно представляет собой 3-гидрокси-3-бензил-17-метокси-5-андростан; 3-гидрокси-3-(2'-фенилэтил)-17-метокси-5-андростан; 3-гидрокси-3-(3'-фенилпропил)-17-метокси-5-андростан; 3-гидрокси-3-[2-(3',4'-диметоксифенил)этил]-17-метокси-5-андростан или 3-гидрокси-3-фенил-17-метокси-5-андростан.
11. Соединение по п. 5, отличающееся тем, что R1 - один из следующих заместителей: оксоалкинил, гидроксиалкинил или физиологически приемлемый сложный эфир гидроксиалкинила.
12. Соединение по п. 11, отличающееся тем, что оно представляет собой 3-гидрокси-3-(5'-циано-1'-пентинил)-17-метокси-5-андростан; 3-гидрокси-3-(4'-циано-1’-бутинил)-17-метокси-5-андростан; 3-гидрокси-3-(6'-оксо-1'-гептинил)-17-метокси-5-андростан; 3-гидрокси-3-(7'-оксо-1’-октинил)-17-метокси-5-андростан; 3-гидрокси-3-(5'-оксо-1'-гептинил)-17-метокси-5-андростан; 3-гидрокси-3-(5'-оксо-1'-пентинил)-17-метокси-5-андростан; 3-[4'(R/S)-гидpoкcипeнтинил)]-3-гидpoкcи-17-метокси-5-андростан; 3-[5'(R/S)-гидроксигексинил]-3-гидрокси-17-метокси-5-андростан; 3-(5'-гидрокси-1'-пентинил]-3-гидрокси-17-метокси-5-андростан; натриевая соль 3-(5'-гидрокси-1'-пентинил)-3-гидрокси-17-метокси-5-андростан гемисукцинат; 3-(6'-гидрокси-1'-гeкcинил)-3-гидpoкcи-17-мeтoкcи-5-aндpocтaн; натриевая соль 3-(6'-гидрокси-1'-гексинил)-3-гидрокси-17-метокси-5-андростан-6'-гемисукцинат; 3-(4'-гидрокси-1'-бутинил)-3-гидрокси-17-метокси-5-андростан; натриевая соль 3-(4'-гидрокси-1'-бутинил)-3-гидрокси-17-метокси-5-андростан-4'-гемисукцинат; 3-(4'-гидрокси-1'-бутинил)-3-гидрокси-17-метокси-5-андростан; натриевая соль 3-(4'-гидрокси-1'-бутинил-3-гидрокси-17-метокси-5-андростан-4'-гемисукцинат; 3-(4'-гидрокси-1'-бутинил)-3-гидрокси-17-метокси-5-19-норандростан; натриевая соль 3-(4'-гидрокси-1'-бутинил)-3-гидрокси-17-метокси-5-19-норандростан-4'-гемисукцинат; 3-[3'(R/S)-гидрокси-1'-бутинил)]-3-гидрокси-17-метокси-5-андростан или 3-(3'-гидрокси-1'-пропинил)-3-гидрокси-17-метокси-5-андростан.
13. Соединение по п. 5, отличающееся тем, что R1 - алкокси-С2-10алкинил.
14. Соединение по п. 13, отличающееся тем, что оно представляет собой 3-(3'-ацетокси-1'-пропинил)-3-гидрокси-17-метокси-5-андростан3-(4'-aцeтoкcи-1'-бyтинил)-3-гидpoкcи-17-мeтoкcи-5-aндpocтaн; 3-(4'-ацетокси-1'-бутинил)-3-гидрокси-17-метокси-5-андростан; 3-(5'-ацетокси-1’-пентинил)-3-гидрокси-17-метокси-5-андростан; 3-(6'-ацетокси-1’-гексинил)-3-гидрокси-17-метокси-5-андростан; 3-гидрокси-3-[3-(2'-пропинилокси)-1-пропинил]-17-метокси-5-андростан; 3-гидрокси-3-(3-метокси-1-пропинил)-17-метокси-5-андростан или 3-гидрокси-3-(3-мeтoкcи-1-пpoпинил)-17-мeтoкcи-5-aндpocтaн.
15. Соединение по п. 5, отличающееся тем, что R1 представляет собой необязательно замещенный фенилалкинил.
16. Соединение по п. 15, отличающееся тем, что оно представляет собой 3-гидрокси-3-(2-пиридил)этинил-17-метокси-5-андростан или 3-гидрокси-3-(4--пиридил)этинил-17-метокси-5-андростан.
17. Соединение по п. 5, отличающееся тем, что R1 означает С2-10алкинил.
18. Соединение по п. 17, отличающееся тем, что оно представляет собой 3-этинил-3-гидрокси-17-метокси-5-андростан; 3-бутинил-3-гидрокси-17-метокси-5-андростан; 3-этинил-3-гидрокси-17-метокси-5-андростан; 3пентинил-3-гидрокси-17-метокси-5-андростан; 3-циклопропилэтинил-3-гидрокси-17-метокси-5-андростан; 3-(бут-3'-ен-1'-инил)-3-гидрокси-17-метокси-5-андростан; 3-(3'-метилбут-2'-ен-1'-инил)-3-гидрокси-17-метокси-5-андростан или 3-гексинил-3-гидрокси-17-метокси-5-андростан.
19. Соединение по п. 5, отличающееся тем, что R1 означает С1-10алкил, С2-10алкенил, тригалогенС1-10алкил, галогенС1-10алкил, алкокси-C1-10aлкил.
20. Соединение по п. 19, отличающееся тем, что оно представляет собой 3-этенил-3-гидрокси-17-метокси-5-андростан; 3-этенил-3-гидрокси-17-метокси-5-андростан; 3-метил-3-гидрокси-17-метокси-5-андростан; 3-бутил-3-гидрокси-17-метокси-5-андростан; 3-метил-3-гидрокси-17-метокси-5-андростан; 3-пентил-3-гидрокси-17-метокси-5-андростан; 3-гексил-3-гидрокси-17-метокси-5-андростан; 3-трифторметил-3-гидрокси-17-метокси-5-андростан; 3-трифторметил-3-гидрокси-17-метокси-5-андростан; 3-фторметил-3-гидрокси-17-метокси-5-андростан; 3-бромметил-3-гидрокси-17-метокси-5-андростан; 3-йодметил-3-гидрокси-17-метокси-5-андростан; 3-хлорметил-3-гидрокси-17-метокси-5-андростан; 3-метоксиметил-3-гидрокси-17-метокси-5-андростан; 3-этоксиметил-3-гидрокси-17-метокси-5-андростан; 3-пропоксиметил-3-гидрокси-17-метокси-5-андростан; 3-изопропоксиметил-3-гидрокси-17-метокси-5-андростан; 3-цианометил-3-гидрокси-17-метокси-5-андростан.
21. Соединение по п. 2, отличающееся тем, что R - низшая алкоксигруппа и R3 - необязательно замещенная алкоксигруппа.
22. Соединение по п. 21, отличающееся тем, что оно представляет собой 2,17-диметокси-3-гидрокси-5-андростан; 2-этокси-3-гидрокси-17-метокси-5-андростан; 2-пpoпoкcи-3-гидpoкcи-17-мeтoкcи-5-aндpocтaн или 2-изoпpoпoкcи-3-гидpoкcи-17-мeтoкcи-5-aндpocтaн.
23. Соединение по п. 1, отличающееся тем, что R означает водород или низшую алкокси группу;
R1 означает водород, С1-10алкил, C2-10алкил, C2-10алкенил тригалогенС1-10алкил, гидроксиС2-10алкинил, алкоксиС1-10алкил, необязательно замещенный фенил, алкоксиС2-10алкинил, оксоалкинил или его кеталь, необязательно замещенный фенилалкинил, сложный гемиэфир гидроксиалкинилдикарбоновой кислоты;
R2 означает водород или кетогруппу;
R3 означает -C(O)-CH2-Y-G;
Y обозначает S или SO;
G обозначает пиридил;
R4 - водород или метил; и
R5, R6, R7, R8, R9 и R10 каждый означает водород;
при условии, что,
когда R3 означает -C(O)-CH2-Y-G и
G обозначает пиридил,
то R1 отличен от водорода или С1-10алкила.
24. Соединение по п. 23, отличающееся тем, что оно представляет собой 3a-гидрокси-3-(4-гидроксибутинил)-21-(пирид-4-илтио)-5-прегнан-20-он;
3a-гидрокси-2-пропокси-21-(пирид-4-илтио)-5-прегнан-20-он N-метилйодид; 3a-гидрокси-21-(пирид-4-илтио)-5-прегнан-20-он N-метилйодид; 3-гидрокси-21-(пирид-4-илтио)-5-прегнан-20-он N-метилйодид; 3a-гидрокси-3-метоксиметил-21-(пирид-4-илтио)-5-прегнан-20-он; 3-этинил-3a-гидрокси-21-(пирид-4-илтио)-5-прегнан-20-он; 3-(4'-ацетилфенил)этинил-3a-гидрокси-21-(пирид-4-илтио)-5-прегнан-20-он; 3a-гидрокси-3-(4'-гидроксибутинил)-21-(пирид-4-илтио)-5-прегнан-20-он; 3-гидрокси-3-метоксиметил-21-(пирид-4-илтио)-5-прегнан-20-он или 3a-гидрокси-3-(4-гидроксибутинил)-21-(пирид-4-илтио)-5-прегнан-20-он.
25. Соединение по п. 1, отличающееся тем, что оно представляет собой 21-(4'-димeтилaминoфeнилтиo)-3a-гидрокси-3-мeтoкcимeтил-5-пpeгнaн-20-он; 3a-гидрокси-3-метоксиметил-21-(4'-нитрофенилтио)-5-прегнан-20-он; 3a-гидрокси-3-метоксиметил-21-(4'-нитрофенилсульфинил)-5-прегнан-20-он 3a-гидрокси-3-метоксиметил-21-(4‘-нитрофенилсульфонил)-5-прегнан-20-он; 21-(4'-фтopфeнилтиo)-3-гидpoкcи-3-мeтoкcимeтил-5-пpeгнaн-20-он; 21-(4'-фторфенил)сульфонил-3гидрокси-3-метоксиметил-5-прегнан-20-он; 3a-гидрокси-3-метоксиметил-21-(4'-пирролидинофенил)сульфонил-5-прегнан-20-он или 21-(4'-аминофенилтио)-3-гидрокси-3-метоксиметил-5-прегнан-20-он.
26. Соединение по п. 1, отличающееся тем, что оно представляет собой 3-гидрокси-21-(пирид-4-илтио)-5-прегнан-20-он; 3a-гидрокси-21-(пирид-3-илокси)-5-прегнан-20-он; 21-(4'-диметиламинофенокси)-3-гидрокси-3-метил-5-прегнан-20-он; 3a-гидрокси-3-метил-21-(4'-нитрофенокси)-5-прегнан-20-он; йодид 3-гидрокси-3-метил-21-(4'-триметиламмонийфенокси)-5-прегнан-20-он; йодид 3-гидрокси-2-пропокси-21-(4'-N,N,N-триметиламмонийфенокси)-5-прегнан-20-он; 3a-гидрокси-3-метил-21-(хинолин-6-илокси)-5-прегнан-20-он N-метилйодид; 3a-гидрокси-3-метил-21-(xинoлин-6-илoкcи)-5-пpeгнaн-20-oн.
27. Соединение по п. 1, отличающееся тем, что оно представляет собой натриевую соль 3a-гидрокси-2-пропокси-21-тиопропансульфонат-5-прегнан-20-она; 3-этинил-3a-гидрокси-21-(3'-гидроксипропилтио)-5-прегнан-20-он; натриевую соль 3-этинил-3-гидрокси-21-(тиопропансульфат)-5-прегнан-20-она; 3-этинил-3a-гидрокси-21-(2'-гидроксиэтилтио)-5-прегнан-20-он; триметиламмонийную соль 3-этинил-3-гидрокси-21-тиоэтансульфат-5-прегнан-20-она; натриевую соль 3-этинил-3-гидрокси-21-тиопропансульфонат-5-прегнан-20-она; 3-этинил-3-гидрокси-21-(3'-гидроксипропилсульфонил)-5-прегнан-20-он; 3a-гидрокси-21-(3'-гидроксипропилтио)-2-пропокси-5-прегнан-20-он; 3a-гидрокси-21-(3'-гидроксипропилсульфонил)-2-пропокси-5-прегнан-20-он; натриевую соль 3a-гидрокси-2-пропокси-21-сульфонилпропансульфат-5-прегнан-20-она или 3-гидрокси-21-(2'-гидроксиэтилтио)-5-прегнан-20-он.
28. Фармацевтический препарат для лечения и профилактики состояний тревоги, стресса, депрессии, нарушений настроения, судорожной активности, бессоницы, предменструального синдрома и послеродовой депрессии, индукции анестезии, индукции сна и поддержания уровня REM-сна, который обнаруживается при нормальном сне, содержащий активный ингредиент в сочетании с фармацевтически приемлемым носителем, отличающийся тем, что в качестве активного ингредиента он содержит соединение по п. 1 в эффективном количестве.
29. Способ модулирования комплекса рецептор ГАМКА - хлоридный ионофор на животном объекте путем связывания участка нейростероида на указанном комплексе, отличающийся тем, что указанному животному объекту вводят эффективное для модулирования указанного комплекса количество соединения по п. 1.
30. Способ лечения или профилактики стресса или состояния тревоги у животного, отличающийся тем, что указанному животному, нуждающемуся в таком лечении, вводят эффективное количество соединения по п. 1.
31. Способ лечения или профилактики судорожной активности у животного, отличающийся тем, что указанному животному, нуждающемуся в таком лечении, вводят эффективное количество соединения по п. 1.
32. Способ лечения или профилактики бессоницы у животного, отличающийся тем, что указанному животному, нуждающемуся в таком лечении, вводят эффективное количество соединения по п. 1.
33. Способ индукции сна и поддержания уровня REM-сна, который обнаруживается при нормальном сне, отличающийся тем, что объекту вводят эффективное количество соединения по п. 1.
34. Способ лечения или профилактики предменструального синдрома или послеродовой депрессии у животного, отличающийся тем, что указанному животному, нуждающемуся в таком лечении, вводят эффективное количество соединения по п. 1.
35. Способ лечения или профилактики нарушений настроения у животного, отличающийся тем, что указанному животному, нуждающемуся в таком лечении, вводят эффективное количество соединения по п. 1.
36. Способ по п. 35, отличающийся тем, что указанное нарушение настроения является депрессией.
37. Способ индукции анестезии у животного, отличающийся тем, что указанному животному, нуждающемуся в таком лечении, вводят эффективное количество соединения по п. 1.
38. Способ по любому из пп. 29-37, отличающийся тем, что указанное соединение является фармацевтически приемлемым сложным 3-эфиром или сложным 3-диэфиром кислоты, выбранной из группы, состоящей из уксусной, пропионовой, малеиновой, фумаровой, аскорбиновой, пимелиновой, янтарной, глутаровой, бис-метиленсалициловой, метансульфоновой, этандисульфоновой, щавелевой, винной, салициловой, лимонной, глюконовой, итаконовой, гликолевой, пара-аминобензойной, аспарагиновой, глутаминовой, -аминомасляной, a-(2-гидроксиэтиламино)пропионовой, глицина и других о-аминокислот, фосфорной, серной, глюкуроновой и 1-метил-1,4-дигидроникотиновой.
39. Способ по любому из пп. 29-37, отличающийся тем, что указанное эффективное количество составляет от 1мг до 100мг на унифицированную дозу при внутривенном введении и от 100мг до 500мг на унифицированную дозу при введении, отличном от внутривенного.
Текст
1 Нейроаісгивньїе стероиды ряда андростана или прегнана общей формулы I или их физиологически приемлемые сложные 3эфиры, где R означает водород или низшую алкоксигруппу, Ri означает водород, Сі юалкил, С2 юалкенил, С2 юалкинил, тригалогенСі юалкил, гидроксиС2 юалкинил, алкоксиСі юалкил, необязательно замещенный фенил, алкоксиС2 юалкинил, оксоалкинил или его кеталь, необязательно замещенный фенилалкенил, сложный гемиэфир гидроксиалкинилдикарбновой кислоты, R2 означает водород или кетогруппу, Рзозначает необязательно замещенную алкокси-, алкинилокси-, необязательно замещенную фенилалкинилоксигруппу, -C(O)-CH2-Y-G, -С(О)-СН2-ОD-, -С(О)-СН2-О-Е, -C(O)-CH2-Z-G или C(O)-CH2-YZ-A, где Y обозначает О, S, SO или SO2, Z обозначает Сі юалкилен, G обозначает пиридил или необязательно замещенный фенил, D обозначает хинолин, присоединенный к атому углерода, Е - необязательно замещенный фенил, А обозначает гидроксил, карбоксил или сульфонат, F 4 обозначает водород или метил, ? R5- водород, R 6 -водород, R7 - водород или гидроксил, R8- водород, R g - ВОДОРОД, Rio- водород, при условии, что когда R3 - Сі зал кокси груп па и R - водород, то Ri отличен от водорода, когда R3 - Сі 4алкокси(Сі 4)алкоксигруппа, то Ri отличен от водорода или 1-пропенила, когда R3 - -C(O)-CH2-Y-G и G - пиридил, присоединенный к атому углерода, то Ri отличен от водорода или Сі юалкила, или когда R3 - -C(O)-CH2-Z-G, то Ri отличен от водорода 2 Соединение по п 1, отличающееся тем, что R обозначает водород или низший алкокси, Ri обозначает водород, Сі юалкил, С2 юалкенил, С2 юалкинил, тригалогенСі юалкил, гидроксиС2 юалкинил, алкоксиСі юалкил, необязательно замещенный фенил, алкоксиС2 юалкинил, оксоалкинил или его кеталь, необязательно замещенный фенилалкинил, сложный гемиэфир гидроксиалкинилдикарбоновой кислоты, R2 обозначает водород или кетогруппу, R3 обозначает необязательно замещенную алкокси-, алкинилокси- или необязательно замещенную фенилалкинилоксигруппу, и R4 - водород или метил, и R5, R6, R7, Rs, R9 и R-іо каждый представляет собой водород, при условии,что когда R3 - Сі зал кокси груп па и R - водород, то Ri отличен от водорода, или когда R3 - Сі 4алкокси(Сі 4)алкоксигруппа, то Ri отличен от водорода или 1-пропенила О (О о 1 ю 57706 3 Соединение по п 2, отличающееся тем, что оно представляет собой За-гидрокси-Зр-метил17 р -(2-пропинилокси)-5 а-андростан или 17 р [3-(4-ацетилфенил)-2-пропинилокси]-За-гидрокси3 р -метил-5 а-андростан 4 Соединение по п 2, отличающееся тем, что R3 - необязательно замещенная алкоксигруппа 5 Соединение по п 4, отличающееся тем, что R3 - незамещенная алкоксигруппа 6 Соединение по п 5, отличающееся тем, что Ri - замещенный фенилэтинил 7 Соединение по п 6, отличающееся тем, что оно представляет собой 1 3 а -гидрокси-3 р -(4 ацетоксифенилэтинил)-3 а -гидрокси-17 р метокси-5 р -андростан 9 Соединение по п 5, отличающееся тем, что Ri является необязательно замещенным фенилом 10 Соединение по п 9, отличающееся тем, что оно представляет собой 3 а -гидрокси-3 р -бензил17 р -метокси-5 р -андростан, За-гидрокси-Зр (2'-фенилэтил)-17р -метокси-5 р -андростан, З а гидрокси-3 р -(3'-фенилпропил)-17 р -метокси-5 р андростан, 3 а -гидрокси-3 р -[2-(3',4' диметоксифенил)этил]-17р -метокси-5 р нитрофенил)этинил-17р -метокси-5 р -андростан, андростан За-гидрокси-Зр -(4'-метоксифенил)этинил-17 р метокси-5 р -андростан 11 Соединение по п 5, отличающееся тем, что Ri - один из следующих заместителей оксоалкинил, гидроксиалкинил или физиологически приемлемый сложный эфир гидроксиалкинила 12 Соединение по п 11, отличающееся тем, что метокси-5 р -андростан, За-гидрокси-Зр -[2-(3',4'диметоксифенил)этинил]-17р -метокси-5 р 3 а -гидрокси-3 р -(41 андростан, метилфенил)этинил-17р -метокси-5 р -андростан, 3 р -(4'-трифторметилфенил)этинил-За-гидрокси17 р -метокси-5 р -андростан, За-гидрокси-Зр (2'-метоксифенил)этинил-17р -метокси-5 р андростан, 3 р -(4'-диметиламинофенил)этинил За-гидрокси-17р -метокси-5 р -андростан, Зр (4'-ацетилфенил)этинил-За-гидрокси-17 р 3 р -(41 метокси-5 р -андростан, оно или представляет 3 а -гидрокси-3 р -фенил-17 р собой 3 а -гидрокси-3 р -(51 циано-1 '-пентинил)-17 р -метокси-5 р -андростан, 3 а -гидрокси-3 р -(4'-циано-1 '-бутинил)-17 р метокси-5 р -андростан, За-гидрокси-Зр -(61 оксо-1'-гептинил)-17р -метокси-5 р -андростан, 3 а -гидрокси-3 р -(7'-оксо-1 '-октинил)-17 р метокси-5 р -андростан, За-гидрокси-Зр -(51 оксо-1'-гептинил)-17р -метокси-5 р -андростан, хлорфенил)этинил-3 а -гидрокси-17 р -метокси 3 а -гидрокси-3 р -(5'-оксо-1 '-пентинил)-17 р 5 р -андростан, З р -(4'-ацетилфенил)этинил-За метокси-5 р -андростан, гидрокси-17 р -метокси-5 а -андростан, этиловый эфир 3 р -(4'-карбоксифенилэтинил)-3 а -гидрокси17 р -метокси-5 р -андростана, 3 а -гидрокси-3 р (4'-ацетоксиацетилфенил)этинил-17р -метокси5 р -андростан или 3 р -(4'-цианофенил)этинил 3 а -гидрокси-17 р -метокси-5 р -андростан представляет 3 р -(41 собой ацетилфенилэтинил)-3 а -гидрокси-19-нор-17 р метокси-5 р -андростан, этиловый эфир 3 р -(41карбоксифенилэтинил)-3 а -гидрокси-19-нор-17 р метокси-5 р-андростана, этиловый эфир Зр-(4'карбоксифенилэтинил)-3 а-гидрокси-17 р метокси-5 а-андростана, гидроксипентинил)]-3 а -гидрокси-17 р -метокси5 р -андростан, 3 р -[5'^/3)-гидроксигексинил] 3 а-гидрокси-17 р -метокси-5 р -андростан, Зр (5'-гидрокси-1 '-пентинил]-3 а -гидрокси-17 р метокси-5 р -андростан, натриевая соль 3 р -(51гидрокси-1 '-пентинил)-3 а -гидрокси-17 р -метокси 8 Соединение по п 6, отличающееся тем, что оно 3 р -[4'(R/S) З р -[4'-(N,N диэтилкарбоксиамидо)фенил]этинил-3агидрокси-17 р -метокси-5 р -андростан или 3 р -(41 5 р -андростан гемисукцинат, 3 р -(6'-гидрокси-1 'гексинил)-3 а-гидрокси-17 р -метокси-5 р андростан, натриевая соль З р -(6'-гидрокси-1' гексинил)-3 а-гидрокси-17 р -метокси-5 р андростан-б'-гемисукцинат, 3 р -(4'-гидрокси-1 ' бутинил)-3 а -гидрокси-17 р -метокси-5 р андростан, натриевая соль З р -(4'-гидрокси-1' бутинил)-3 а -гидрокси-17 р -метокси-5 р андростан-4'-гемисукцинат, 3 р -(4'-гидрокси-1 ' бутинил)-3 а -гидрокси-17 р -метокси-5 а 5 андростан, 57706 натриевая соль З р -(4'-гидрокси-1' (бут-3'-ен-1 '-инил)-3 а -гидрокси-17 р -метокси бутинил-3 а-гидрокси-17 р -метокси-5 а 5 р -андростан, андростан-4'-гемисукцинат, 3 а-гидрокси-17 р -метокси-5 р -андростан 3 р -(4'-гидрокси-1 ' бутинил)-3 а -гидрокси-17 р -метокси-5 р -19 3 р -(3'-метилбут-2'-ен-1 '-инил)или гидрокси-1 '-бутинил)]-3 а -гидрокси-17 р -метокси 3 р -гексинил-3 а-гидрокси-17 р -метокси-5 р андростан 19 Соединение по п 5, отличающееся тем, что Ri означает Сі юалкил, C-z юалкенил, тригалогенСі юалкил, галогенСі юалкил, алкокси-Сі юалкил 20 Соединение по п 19, отличающееся тем, что 5 а-андростан или Зр-(3'-гидрокси-1'-пропинил) оно представляет собой З р -этенил-За-гидрокси 3 а -гидрокси-17 р -метокси-5 р -андростан 13 Соединение по п 5, отличающееся тем, что Ri - алкокси-Сг юалкинил 14 Соединение по п 13, отличающееся тем, что 17 р -метокси-5 р -андростан, оно 3 р -бутил-3 а -гидрокси-17 р -метокси-5 р норандростан, натриевая соль Зр-(4'-гидрокси-1'бутинил)-3 а -гидрокси-17 р -метокси-5 р -19норандростан-4'-гемисукцинат, представляет собой 3 р -[3'(R/S) З р -(3'-ацетокси-1' З р -этенил-За гидрокси-17р -метокси-5 а-андростан, Зр метил-3 а-гидрокси-17 р -метокси-5 р -андростан, пропинил)-3 а-гидрокси-17 р -метокси-5 р андростан, андростанЗ р -(4'-ацетокси-1 '-бутинил)-3 а метокси-5 а -андростан, 3 р -пентил-3 а -гидрокси гидрокси-17р -метокси-5 р -андростан, З р -(41 3 р -метил-3 а -гидрокси-17 р 17 р -метокси-5 р -андростан, З р -гексил-За ацетокси-1'-бутинил)-3 а-гидрокси-17 р -метокси гидрокси-17р -метокси-5 р -андростан, 5 а -андростан, 3 р -(5'-ацетокси-1 '-пентинил)-3 а три фтор метил-3 а -гидрокси-17 р -метокси-5 а гидрокси-17р -метокси-5 р -андростан, З р -(61 андростан, З р -три фтор метил-3 а-гидрокси-17 р ацетокси-1 '-гексинил)-3 а -гидрокси-17 р -метокси метокси-5 р -андростан, 5 р -андростан, гидрокси-17р -метокси-5 а-андростан, 3 а -гидрокси-3 р -[3-(2' Зр З р -фторметил-За пропинилокси)-1-пропинил]-17 р -метокси-5 р бромметил-3 а-гидрокси-17 р -метокси-5 а андростан, андростан, Зр За-гидрокси-3 р -(З-метокси-1 3 р -йодметил-3 а -гидрокси-17 р пропинил)-17 р -метокси-5 р -андростан или З а метокси-5 а -андростан, гидрокси-Зр -(3-метокси-1-пропинил)-17 р метокси-5 а-андростан 15 Соединение по п 5, отличающееся тем, что Ri представляет собой необязательно замещенный фенилалкинил 16 Соединение по п 15, отличающееся тем, что гидрокси-17 р -метокси-5 а-андростан, оно представляет собой 3 а -гидрокси-3 р -(2 пиридил)этинил-17р -метокси-5 р -андростан или За-гидрокси-3 р -(4-пиридил)этинил-17р метокси-5 р -андростан 17 Соединение по п 5, отличающееся тем, что Ri означает C-z юалкинил 18 Соединение по п 17, отличающееся тем, что оно представляет собой З р -этинил-За-гидрокси17 р -метокси-5 р -андростан, З р -бутинил-За гидрокси-17р -метокси-5 р -андростан, Зр этинил-3 а -гидрокси-17 р -метокси-5 а андростан, 3 р -циклопропилэтинил 3 а-гидрокси-17 р -метокси-5 р -андростан, Зр метоксиметил-3 а -гидрокси-17 р -метокси-5 а андростан, З р -этоксиметил-3 а -гидрокси-17 р метокси-5 а -андростан, 3 р -пропоксиметил-3 а гидрокси-17 р -метокси-5 а-андростан, Зр изопропоксиметил-3 а -гидрокси-17 р -метокси5 а -андростан, 3 р -цианометил-3 а -гидрокси 17 р -метокси-5 а-андростан 21 Соединение по п 2, отличающееся тем, что R - низшая алкоксигруппа и R3 - необязательно замещенная алкоксигруппа 22 Соединение по п 21, отличающееся тем, что оно представляет собой 2 р ,17р-диметокси-Загидрокси-5 а -андростан, 2 р -этокси-3 а гидрокси-17 р -метокси-5 а-андростан, 2р пропокси-3 а-гидрокси-17 р -метокси-5 а 3 р пентинил-3 а -гидрокси-17 р метокси-5 р -андростан, 3 р -хлорметил-3 а Зр андростан или 2 р -изопропокси-3 а -гидрокси 17 р -метокси-5 а-андростан 23 Соединение по п 1, отличающееся тем, что R означает водород или низшую алкокси группу, 57706 Ri означает водород, Сі юалкил, Сг юалкил, Сг юалкенил тригалогенСі юалкил, гидроксиСг юалкинил, алкоксиСі юалкил, необязательно замещенный фенил, алкоксиСг юалкинил, оксоалкинил или его кеталь, необязательно замещенный фенилалкинил, сложный гемиэфир гидроксиалкинилдикарбоновой кислоты, R2 означает водород или кетогруппу, R3 означает -C(O)-CH2-Y-G, Y обозначает S или SO, G обозначает пиридил, R4 - водород или метил, и R5, R6, R7, Rs, R9 и Rio каждый означает водород, при условии, что, когда R3 означает-C(O)-CH2-Y-G и G обозначает пиридил, то Ri отличен от водорода или Сі юалкила 24 Соединение по п 23, отличающееся тем, что оно представляет собой За-гидрокси-3 р -(4 гидроксибутинил)-21-(пирид-4-илтио)-5 р -прегнан20-он, За-гидрокси-2 р -пропокси-21 -(пирид-4-илтио)-5 (X прегнан-20-он N-метилйодид, За-гидрокси-21 (пирид-4-илтио)-5 (X -прегнан-20-он N-метилйодид, 3 (X -гидрокси-21 -(пирид-4-илтио)-5 р -прегнан-20он N-метилйодид, За-гидрокси-3 р-метоксиметил21 -(пирид-4-илтио)-5 (X -прегнан-20-он, 3р этинил-За-гидрокси-21 -(пирид-4-илтио)-5 (X прегнан-20-он, 3 р -(4'-ацетилфенил)этинил-За гидрокси-21-(пирид-4-илтио)-5 р -прегнан-20-он, За-гидрокси-3 р -(4'-гидроксибутинил)-21 -(пирид-4илтио)-5 р -прегнан-20-он, 3 (X -гидрокси-3 р метоксиметил-21 -(пирид-4-илтио)-5 р -прегнан-20он или За-гидрокси-3 р -(4-гидроксибутинил)-21 (пирид-4-илтио)-5 (X -прегнан-20-он 25 Соединение по п 1, отличающееся тем, что оно представляет собой 21 -(41диметиламинофенилтио)-3а-гидрокси-3 р метоксиметил-5 а-прегнан-20-он, За-гидрокси 3 р -метоксиметил-21-(4'-нитрофенилтио)-5 (Xпрегнан-20-он, За-гидрокси-3 р -метоксиметил-21(4'-нитрофенилсульфинил)-5 (X -прегнан-20-он Загидрокси-3 р -метоксиметил-21-(4'нитрофенилсульфонил)-5 (X -прегнан-20-он, 21 -(41фторфенилтио)-3-гидрокси-3 р -метоксиметил5 (X -прегнан-20-он, 21 -(4'-фторфенил)сульфонилЗгидрокси-3 р -метоксиметил-5 (X -прегнан-20-он, За-гидрокси-3 р -метоксиметил-21-(41пирролидинофенил)сульфонил-5 а-прегнан-20-он или 21 -(4'-аминофенилтио)-3 (X -гидрокси-3 р метоксиметил-5 а-прегнан-20-он 26 Соединение по п 1, отличающееся тем, что оно представляет собой За-гидрокси-21-(пирид 8 4-илтио)-5 р -прегнан-20-он, За-гидрокси-21 1 (пирид-3-илокси)-5 р -прегнан-20-он, 21 -(4 диметиламинофенокси)-3 а-гидрокси-3 р -метил1 5 (X -прегнан-20-он, За-гидрокси-3 р -метил-21 -(4 нитрофенокси)-5 а -прегнан-20-он, йодид З (X 1 гидрокси-3 р -метил-21 -(4 триметиламмонийфенокси)-5 (X -прегнан-20-он, йодид 3(Х-гидрокси-2р -пропокси-21-(4'-N,N,N триметиламмонийфенокси)-5 (X -прегнан-20-он, За-гидрокси-3 р -метил-21 -(хинолин-6-илокси)5 а -прегнан-20-он N-метилйодид, За-гидрокси 3 р -метил-21 -(хинолин-6-илокси)-5 (X -прегнан-20он 27 Соединение по п 1, отличающееся тем, что оно представляет собой натриевую соль Загидрокси-2 р -пропокси-21 -тиопропансульфонат5 (X -прегнан-20-она, 3 р -этинил-За-гидрокси-21 (3'-гидроксипропилтио)-5 р -прегнан-20-он, триевую соль на 3 р -этинил-3 (X -гидрокси-21 (тиопропансульфат)-5 р -прегнан-20-она, 3р этинил-За-гидрокси-21-(2'-гидроксиэтилтио)-5 р прегнан-20-он, триметиламмонийную соль 3 р этинил-3 (X -гидрокси-21 -тиоэтансульфат-5 р прегнан-20-она, натриевую соль З р -этинил-3 (X гидрокси-21-тиопропансульфонат-5 р -прегнан-20она, 3 р -этинил-3 (X -гидрокси-21 -(З1 гидроксипропилсульфонил)-5 р -прегнан-20-он, За-гидрокси-21 -(3'-гидроксипропилтио)-2 р пропокси-5 а -прегнан-20-он, За-гидрокси-21 -(З1 гидроксипропилсульфонил)-2 р -пропокси-5 (X прегнан-20-он, натриевую соль За-гидрокси-2 р пропокси-21 -сульфонилпропансульфат-5 (X прегнан-20-она или 3 (X -гидрокси-21 -(21гидроксиэтилтио)-5 р -прегнан-20-он 28 Фармацевтический препарат для лечения и профилактики состояний тревоги, стресса, депрессии, нарушений настроения, судорожной активности, бессоницы, предменструального синдрома и послеродовой депрессии, индукции анестезии, индукции сна и поддержания уровня REM-сна, который обнаруживается при нормальном сне, содержащий активный ингредиент в сочетании с фармацевтически приемлемым носителем, отличающийся тем, что в качестве активного ингредиента он содержит соединение по п 1 в эффективном количестве 29 Способ модулирования комплекса рецептор ГАМКд - хлоридный ионофор на животном объекте путем связывания участка нейростероида на указанном комплексе, отличающийся тем, что указанному животному объекту вводят эффективное 57706 для модулирования указанного комплекса количество соединения по п 1 30 Способ лечения или профилактики стресса или состояния тревоги у животного, отличающийся тем, что указанному животному, нуждающемуся в таком лечении, вводят эффективное количество соединения по п 1 31 Способ лечения или профилактики судорожной активности у животного, отличающийся тем, что указанному животному, нуждающемуся в таком лечении, вводят эффективное количество соединения по п 1 32 Способ лечения или профилактики бессоницы у животного, отличающийся тем, что указанному животному, нуждающемуся в таком лечении, вводят эффективное количество соединения по п 1 33 Способ индукции сна и поддержания уровня REM-сна, который обнаруживается при нормальном сне, отличающийся тем, что объекту вводят эффективное количество соединения по п 1 34 Способ лечения или профилактики предменструального синдрома или послеродовой депрессии у животного, отличающийся тем, что указанному животному, нуждающемуся в таком лечении, вводят эффективное количество соединения по п 1 35 Способ лечения или профилактики нарушений настроения у животного, отличающийся тем, что указанному животному, нуждающемуся в таком лечении, вводят эффективное количество соединения по п 1 Ця заявка являє собою часткове продовження Appl No 08/467,404, зареєстрованої 6 червня 1995 року, зміст якої повністю охоплюється посиланням на неї Цей винахід стосується нових стероїдних похідних андростанового та прегнанового рядів, а також фармацевтичних композицій і методів регулювання збудливості головного мозку Більш конкретно, винахід стосується За-пдрокси, 17(не)заміщуваних похідних андростанового ряду та 21-заміщуваних похідних прегнанового ряду Збудливість головного мозку визначається як рівень збудження організму тварини, проявленого у формах від коми до конвульсій, і регулюється різними нейротрансмітерами Загалом, нейротрансмітери є відповідальними за регулювання проведення ІОНІВ крізь нейронні мембрани Як відомо, нейронна мембрана має значення потенціалу (або амплітуду електрограми) близько -80мВ, внутрішня поверхня клітини є негативно зарядженою відносно зовнішньої Потенціал (амплітуда електрограми) є наслідком балансу іонного (К+, Na+, СІ, органічні аніони) обміну крізь нейронну напівпроникну мембрану Нейротрансмітери зберігаються в пресинаптичних міхурцях та вивільнюються під впливом нейронових потенціалів дії Вивільнювання в синаптичну щілину подразнюючого ХІМІЧНОГО трансмітера, наприклад, ацетилхоліну, призводить до деполярізацм мембрани (зміна значення потенціалу від -80мВ до -50мВ) Цей ефект опосередковується і досягається за 10 36 Способ по п 35, отличающийся тем, что указанное нарушение настроения является депрессией 37 Способ индукции анестезии у животного, отличающийся тем, что указанному животному, нуждающемуся в таком лечении, вводят эффективное количество соединения по п 1 38 Способ по любому из пп 29-37, отличающийся тем, что указанное соединение является фармацевтически приемлемым сложным 3-эфиром или сложным 3-диэфиром кислоты, выбранной из группы, состоящей из уксусной, пропионовой, малеиновой, фумаровой, аскорбиновой, пимелиновой, янтарной, глутаровой, бисметиленсалициловой, метансульфоновой, этандисульфоновой, щавелевой, винной, салициловой, лимонной, глюконовой, итаконовой, гликолевой, пара-аминобензойной, аспарагиновой, глутаминовой, у -аминомасляной, а-(2гидроксиэтиламино)пропионовой, глицина и других о-аминокислот, фосфорной, серной, глюкуроновой и 1-метил-1,4-дигидроникотиновой 39 Способ по любому из пп 29-37, отличающийся тем, что указанное эффективное количество составляет от 1мг до 100мг на унифицированную дозу при внутривенном введении и от 100мг до 500мг на унифицированную дозу при введении, отличном от внутривенного допомогою постсинаптичних нікотинових рецепторів, утворення яких стимулюється ацетилхоліном, що покращує мембранну проникність йонів Na+ Зменшення мембранного потенціалу стимулює нейронну збудливість в формі постсинаптичного потенціалу дії (ППД) Що стосується GABA-рецепторного комплексу (GRC), збудливість головного мозку зумовлюється дією GABA (аміномасляної кислоти), яка являє собою нейротрансмітер GABA справляє істотний вплив на збудливість усього головного мозку, оскільки вона функціонує як трансмітер для майже 40% нейронів мозку GABA регулює збудливість окремих нейронів шляхом регулювання провідності хлоридних ІОНІВ крізь нейронну мембрану Молекула GABA взаємодіє своєю розпізнавальною ділянкою з GRC, сприяючи проходженню потоку хлоридних ІОНІВ в клітину проти електрохімічного градієнту GRC Внутрішньоклітинне зростання рівнів цього типу аніонів призводить до пперполяризацм трансмембранного потенціалу, що, у свою чергу, спричиняє зменшення чутливості нейрону до збуджуючих втручань (тобто, власне зменшення збудливості нейрону) Інакше кажучи, чим вищою є концентрація хлоридного юну в нейроні, тим нижчою є збудливість головного мозку (рівень активації) Існують надійні документальні докази того, що GRC відповідає за нейромедіацію страху, епілептичного нападу та седативного ефекту Таким чином, GABA і препарати, що діють так само, як GABA, або краще за неї (наприклад, терапевтично 12 11 57706 використовувані барбітурати та бензодіазепіни 2 8-20 (1983)) Виявилося, що стероїд деоксикор(BZ), такі як Valium), справляють терапевтично тикостерон є ефективним для лікування хворих на корисний вплив шляхом взаємодії специфічних епілептичні напади, що пов'язуються з їх менструнейрорегулюючих ділянок своїх молекул з GRC альними циклами (Aird, R В та Gordan, G , J Amer Med Soc 145 715-719(1951)) Зібрані останнім часом докази свідчать, що у додаток до зв'язуючих ділянок молекул бензодіаСиндром, який також пов'язується з низькими зепіну та барбітурату, GRC містить в собі окрему рівнями прогестерону, є відомий як післяродова структурну ділянку, що слугує для взаємодії з нейдепресія (PND - postnatal depression) Безпосередроактивними стероїдами (Lan, N С et al, Neuroньо після пологів рівні прогестерону зменшуються chem Res 76 347-356(1991)) Нейроактивні стедо критичних значень, що і призводить до ініціації роїди можуть утворюватися ендогенним шляхом PND Симптоми PND є різноманітними від легкого Найбільш ефективні ендогенні нейроактивні стероступеня депресії до проявів психозу, коли необхідїди - це За-пдрокси-5-відновлений прегнан-20-он ною стає госпіталізація PND також асоціюється з та За,21-дипдрокси-5-відновлений прегнан-20-он, тяжкими проявами синдрому страху та подразлиметаболіти гормональних стероїдів прогестерону вістю Пов'язана з PND депресія не підлягає лікута деоксикортикостерону, ВІДПОВІДНО Здатність ванню класичними антидепресантами, і досвід таких стероїдних метаболітів змінювати збудлиспостереження PND у жінок свідчить про пов'язане вість головного мозку було визнано в 1986 році 3 ним збільшення частоти PMS (Dalton, К, Pre(Majewska, M D et al_, Science 2J21004-1007 menstrual Syndrome and Progesterone Therapy, 2nd (1986), Harrison, N L et al_, J Pharmacol Exp Ther edition, Chicago Yearbook, Chicago (1984)) Зага277 346-353 (1987)) Однак, терапевтична корислом, згадані дослідження в якійсь мірі вказують на ність стероїдних метаболітів та їх похідних (нейровирішальну роль прогестерону та деоксикортикосактивних стероїдів) не визнавалася фахівцями терону і ще більш їх метаболітів в гомеостатичночерез недостатнє розуміння ефективності дії та му регулюванні збудливості головного мозку, це характеру активної ділянки згаданих нейростероімає прояв у формі зростання активності нападів дів Винахід Подавця цієї Заявки, зокрема, стосуабо посилення симптомів, що пов'язуються з менється фармацевтичного використання досвіду, струальною епілепсією, PMS та PND Кореляція набутого з більш досконалого розуміння ефективміж зменшенням рівнів прогестерону і симптоманості дії та характеру активної ділянки певних нейми, пов'язаними з PMS, PND та менструальною ростероідних сполук епілепсією (Backstrom, T et al, J Psychosom Obstet Gynaecol 2 8-20 (1983)), Dalton, K, PremenВідомо, ЩО ЯЄЧНИКОВИЙ гормон прогестерон та strual Syndrome and Progesterone Therapy, 2nd його метаболіти справляють істотний вплив на edition, Chicago Yearbook, Chicago (1984)) свідчать збудливість головного мозку (Backstrom, Т et al_, про корисність прогестерону для лікування цих Acta Obstet GynecoL Scand, SuppL 130 19'24 хвороб (Mattson et al, "Мedroxyprogesterone therapy (1985), Ptaff, DW та McEwen, B S , Science of catamenial epilepsy", in Advances in epileptology 279 808-814 (1983), Gyermek et al , J Med Chem XVth Epilepsy International Symposium, Raven 77 117 (1968), Lambert, J et al , Trends PharmacoL Press, New York (1984), pp 279-282, та Dalton, K, Sci 8 224-227 (1987)) РІВНІ прогестерону та його Premenstrual Syndrome and Progesterone Therapy, метаболітів змінюються у ВІДПОВІДНОСТІ З фазами 2nd edition, Chicago Yearbook, Chicago (1984)) менструального циклу Існують надійні документаОднак, прогестерон не є достатньо ефективним льні докази того, що вміст прогестерону та його для лікування згаданих вище синдромів Наприметаболітів зменшується перед початком менстклад, не існує чітко встановлених визначень реакруацій Щомісячний рецидив певних соматичних ції організму на прогестерон під час лікування PMS симптомів перед початком менструацій також є (Maddocks, et al, Obstet Gynecol, 754 573-581 добре висвітленим у спеціальній літературі До цих (1986), Dennerstem, et al , Brit, Med J 290 16-17 симптомів, які стали пов'язувати з передменструа(1986)) льним синдромом (РMS-Premenstrual Syndrome), належать стрес, синдром страху та головний біль Тімплтон та ін в Steroides 48 339-346 (1986) з ознаками мігрені (Dalton, К, Premenstrual Synрозкривають стереоселективне та репоселективне drome та Progesterone Therapy, 2nd edition, Chiвідновлення стероїдних кетонів з утворенням аксіcago Yearbook, Chicago (1984)) У пацієнтів з PMS альних спиртів (С-3) 3 17р-метокси-2а,3а-епоксиспостерігається щомісячний рецидив симптомів, 5а-андростану утворюється сполука 17р-метоксиякі нагадують про себе у перед менструальний 2р-метил-5а-андростан-3а-ол період і відсутні у постменструальний період Греко та ін в J Am Chem Soc 11 7799-7801 (1990) розкриває використання 17р-метокси-5аАналогічним чином, зменшення вмісту прогесандростан-За-олу як вихідної речовини (матеріалу) терону пов'язувалося в часі із зростанням частоти для утворення ХІМІЧНИХ спряжень, за допомогою нападів при ЖІНОЧІЙ епілепсії, а саме при менструяких металопорфірини приєднуються до стероїдальній епілепсії (Laidlaw, J , Lancet, 1235-1237 них субстратів (1956)) Ще більш чітку кореляцію досліджено для метаболітів прогестерону (Roseiszewsкас et al , J Бебкокташ B U S Patent No 4,297,350, видаNeurol Neurosurg Psych, 49 47-51 (1986)) Крім ному 27 жовтня 1991 року, у загальних рисах розтого, для пацієнтів із первинною малою чоловічою криває стероїдний андростан- і андростен-17епілепсією частота нападів та час їх відбування ефіри та їх застосування як контрацептиви для корелювалося з частотою виникнення симптомів, ЧОЛОВІКІВ властивих для предменструального синдрому Ніф та ш в Terpahedron Letters 27 903-906 (Backstrom, Т et al, J Psychos, Obstet Gynaecol (1980) розкриває сполуку 17р-метоксиметокси-3р 14 13 57706 (1-пропшіл)-5а-андростен-3а-ол як проміжний продукт в утворенні стероїдних похідних В FR 1,437,361, опублікованому 6 травня 1966 року і в U S Patent No 3,135,744, виданому 2 червня 1964 року, розкриті 17-(2-метил-2-бутеніл)- і циклоалкеніл- ефіри 5а-андростан-3а,17р-дюлу та їх 3-нижчі-алканоіл-складні ефіри Вивчалися андрогенні та/або анаболічні властивості цих сполук ФІЛІПС та ш в U S Patent No 4,197,296, виданому 8 квітня 1980 року, розкривають стероїди андростан ряду, що містять За-пдрокси-групу, 5ачи 5р-водень-атом, і 11а-заміщену аміногрупу, де 17-позиція може бути незаміщеною де R, R-i, R2, R3, R4, R5, R5, R6, R7, Rs, R9 та R-ю Також є розкритою сполука 11a-N,Nдодатково визначені у тексті, і пунктирні лінії ознадиметиламшо-2р-етокси-5а-андростан-3а-ол В чають прості або ПОДВІЙНІ зв'язки Структура молепатенті розкриті анестезуючи властивості згаданих кули, що представлена Формулою І, включає андсполук ростани, прегнани (R4 = метил), 19-норандростани Філіпсташ B U S Patent No 3,882,151, видата норпрегнани (R4 = Н) ному 6 травня 1975 року, і ФІЛІПС та ш, в U S PatЦей винахід також охоплює фармацевтично ent No 3,969,345, виданому 13 липня 1976 року, прийнятні складні ефіри і солі сполук згідно з Форрозкривають За-окислені прегнан-21-ефіри, що мулою І, включаючи солі кислотних присадок містять За-пдрокси-групу або и складний ефір, Вважається, що За-пдроксил також може бути кето-групу в 20-позицм, та ефіризовану гідроксиприхованим фармацевтично прийнятним складльну групу в 21-позиції 21-ефір-заміщувач переним ефіром, враховуючи той факту, що складний важно являє собою алкокси-, циклоалкокси-, аралефір повинен розщеплюватись під час перетвококси-, або арилокси-групу, що забезпечують рення предмедикаментів у активну форму ЛІКІВ В можливість додаткових заміщень В патенті розданому винаході для таких сполук прийнято спількриті анестезуючи властивості згаданих сполук ну назву "розщеплювані складні ефіри" ФІЛІПС та ІН В U S Patent No 3,959,260, видаСполуки згідно цього винаходу є модулятораному 25 травня 1976 року, розкривають стероїдні ми збудливості центральної нервової системи заанестетики прегнанового та 19-норпрегнанового вдяки їх здатності регулювати функціонування ряду, які містять За-пдрокси-групу, 20-оксо-групу і хлорид них іонних каналів, пов'язаних із GABAрадикал сірковміщуючого нуклеофіла в 21-позиції, рецепторним комплексом Дослідження, проведені або сульфонову чи сульфоксидну групу Зрподавцями заявки, дали змогу встановити, що ці заміщувач може бути або воднем, або алкілом сполуки справляють антиконвульсивний, заспокійКлейтон та ін в U S Patent No 3,822,298, виливий, седативний та снодійний ефект, аналогічданому 2 липня 1974 року, розкривають процес ний дії відомих агентів, наприклад, BZ, але розприготування За-пдрокси-5а-стероідів В патенті глядувані сполуки впливають на певну ділянку також розкрито приготування 21 -бензилокси-ЗаGRC пдрокси-5а-прегнан-11,20-дюну Взаємозв'язок ендогенних метаболітів прогесЦей винахід стосується нових стероїдних похітерону з процесами, що пов'язані з функцією роздних андростанового та прегнанового рядів, а тамноження (естральний цикл та вагітність), є добре кож фармацевтичних композицій та методів модувивченим (Marker, RE et al J Am Chem Soc лювання (регулювання) збудливості головного 59 616-618 (1937)) Однак, лише останнім часом мозку Більш конкретно, винахід стосується Застало відомою методика лікування розладів за пдрокси, 17-(не)заміщуваних похідних андростадопомогою модулювання збудливості головного нового ряду та 21-заміщуваних похідних прегнаномозку шляхом використання стероїдних метаболівого ряду Ці ПОХІДНІ мають властивість діяти в тів та їх похідних Див , U S Patent No 5,208,227, нещодавно виявленій ДІЛЯНЦІ GRC, таким чином, виданий 4 травня 1993 року, U S Patent No модулюючи збудливість головного мозку і, ВІДПОВІ5,120,723, виданий 9 червня 1992 року та U S ДНО, пом'якшуючи стрес, синдром страху, безсонPatent No 5,232,917, виданий 3 серпня 1993 року ня, розлади настрою, що пов'язані з дією GRCактивних агентів (наприклад, депресією) та протіГоловною метою застосування фармацевтичканням епілептичних нападів них композицій та методів, запропонованих в цьому винаході, є лікування стресу, синдрому страху, Стероїдними похідними згідно цього винаходу PMS, PND, та епілептичних нападів, для полегвважаються такі, що мають загальну структурну шення або цілковитого запобігання наступів страформулу (А) ху, напруження м'язів та депресії, що супроводжують пацієнтів, які страждають від розладів і аномального функціонування центральної нервової системи Додатковою важливою метою застосування композицій та методів цього винаходу є лікування інсомнм та створення гіпнотичного ефекту Ще однією метою застосування сполук та методів є індукування анестетичних властивостей, зокрема, шляхом внутрішньовенного введення 16 15 57706 Цей винахід стосується нових сполук та їх викориJournal of Pharmacology, 136 419-423 (1987), Wieстання в фармацевтичних композиціях та методів land et al , Psychopharmacology 118(1)65-71 лікування згаданих вище розладів шляхом моду(1995)) 3 метою застосування як нейроактивні лювання збудливості головного мозку вироблено вже багато різних синтетичних стероїдів Див, наприклад, U S Patent No 5,232,917, Інший аспект цього винаходу стосується метовиданий 3 серпня 1993 року, в якому розкриваютьду індукування нормального сну та збереження ся нейроактивні стероїдні сполуки, що застосовутого рівня долі швидкого сну (REM), який шляхом ються для лікування стресу, синдрому страху, шдосліджень виявлено під час нормального сну, сомнм, нападу та психічних розладів, які залежать коли не спостерігається суттєвих ознак згаданої від впливу GRC-активних агентів, наприклад, девище інсомнм, що може бути викликаною перевтопресії, з терапевтично обгрунтованою ДОЦІЛЬНІСТЮ мленням Цей метод передбачає введення ефекКрім того, попередні дослідження довели, що ці тивної дози сполуки згідно цього винаходу Такі стероїди впливають на GRC специфічною ділянсполуки спроможні збільшити тривалість нешвидкою, що відрізняється від інших відомих ділянок кого сну (NREM) та загальний період нормального хімічної взаємодії (тобто барбітурату, BZ, та сну без істотного збільшення долі REM-сну GABA), для яких терапевтично доцільний вплив на Цей винахід можна краще зрозуміти, а його стрес, синдром страху, розлади сну, ПСИХІЧНІ розпереваги ліпше оцінити, розглянувши ВІДПОВІДНИЙ лади та епілептичні напади вже було встановлено ілюстративний матеріал, де (Гі К У та Ямамура X І , "Benzoazepms and BarbituФіг 1 являє собою графік залежності від часу rates Drugs for the treatment of Anxiety, Insomnia антиметразольної ефективності предмедикаменту and Seizure Disorders", в Central Nervous System За-пдрокси-ІУр-метокси-ба-андростан (введенноDisorders, Д К Хорвелл, вид Марсел-Деккер, Ньюго за допомогою внутрішньочеревної ін'єкції, доза Йорк (1985 р), crop 123-147, Ллойд К Г та Морз розрахунку 20 Омг/кг) селлі П Л , "Psychopharmacology of GABAergic Стислий опис оптимальних варіантів реалізації Drugs", в Psychopharmacology The Third Generaсполуки згідно цього винаходу є похідними різних tion of Progress, X Й Мелтцер, вид Ревен Прес, За-пдроксилованих-прегнанів та ЗаН-Й (1987 р ), стор 183-195, та Гі, К У та ін , пдроксилованих-андростанів, а також їх складного European Journal of Pharmacology, 136 419-423 ефіру, простого ефіру, сульфонату, сульфату, фо(1987 p) Ці сполуки мають ІСТОТНІ переваги завдясфонату, фосфату, оксиму, тіосульфату, гетероцики тривалості їх дії, підвищеній ефективності та клічних та гетероарильних похідних і тих похідних, можливості застосування оральним шляхом (поякі являють собою пред медикаменти Вираз ряд із іншими формами введення в організм) "предмедикамент" означає похідну відомого медикаменту прямої дії, яка ліпше проникає до ВІДПОВІЗгідно З ЦИМ винаходом та в контексті його заДНИХ органів і терапевтично є більш прийнятною у стосування, наведені нижче за текстом терміни, порівнянні з власне медикаментом, а також може окремо чи як частка сполучення термінів, містять у перетворюватися у активний медикамент внаслісобі ВІДПОВІДНІ поняття (за винятком інших спеціадок ензиматичного (ферментативного) або ХІМІЧНОльних чітко окреслених значень) ГО процесу, див Notan, R Е , Methods in ErnymolТермін "алкіл" згідно цього винаходу у всіх виogy, 772 309-323 (1985), Bodor, N, Drugs of the падках стосується насичених аліфатичних груп, Future, 6(3) 165-182 (1981), та Bundgaard, H , Deщо містять групи з прямим (ЛІНІЙНИМ) ланцюжком, sign of Prodrugs Bioreversible-Denvatives for Variрозгалуженим ланцюжком, та ЦИКЛІЧНІ групи, кожна ous Functional Groops and Chemical Entities", в Deз яких може бути варіативно заміщеною В оптиsign of Prodrugs, H Bundgaard, ed , Elsevier, New мальному варіанті алкілові групи містять від 1 до York (1985) Слід зазначити, що деякі з синтетич10 атомів вуглецю Прийнятні алкілові групи місних похідних, які є часткою реалізації цього винатять метил, етил тощо, і є варіативно заміщуваниходу можуть не бути власне лише предмедикамеми нтами, оскільки, у додаток до перелічених Термін "алкеніл", в контексті цього винаходу у властивостей, вони також справляють реальний всіх випадках стосується ненасичених груп, які лікувальний ефект Однак, у контексті, обмеженомістять принаймні один вуглець-вуглець подвійний му цією заявкою, вони вважаються предмедиказв'язок та включає групи з прямим ланцюжком, ментами Попередні дослідження (Gee, KW et al, розгалуженим ланцюжком та ЦИКЛІЧНІ групи, кожна European Journal of Pharmacology, 136 419-423 з яких може варіативно заміщуватись В оптима(1987)) показали, що певні За-пдроксиловані стельному варіанті алкенілові групи мають від 2 до 10 роїди відзначаються більшими порядками значень атомів вуглецю ефективності модулювання GRC, ніж ІНШІ модуляТермін "алкініл" в контексті цього винаходу у тори (Majewska, М D et al, Science 232 1004-1007 всіх випадках стосується ненасичених вуглевод(1986), Harrison, N L et al, J PharmacoL Exp Ther невих груп, які містять принаймні один вуглець247 346-353 (1987)) Маєвска та ш , а також Харвуглець потрійний зв'язок та включає групи з прярисон та ш Дослідили, ЩО лише Замим ланцюжком та розгалуженим ланцюжком, які пдроксиловані-5-відновлені стероїди відрізняються можуть варіативно заміщуватися Оптимально значно нижчими рівнями ефективності Експериалкінілові групи мають від двох до вісімнадцяти ментальні дані in vitro та in vivo останнім часом атомів вуглецю Більш прийнятними є алкінілові свідчать про те, що висока модулятивна ефективгрупи, що мають від двох до дванадцяти атомів ність цих стероїдів зумовлює їх терапевтичну ковуглецю Найбільш оптимальними є такі алкінілові рисність для модулювання збудливості головного групи, що мають від двох до семи атомів вуглецю мозку за участю GRC (Gee, KW et al , European Прийнятні алкінілові групи включають етиніл, про 18 17 57706 ПІНІЛ, бутиніл, пентиніл тощо, які варіативно мовизначень, стосується груп, заміщуваних від одножуть заміщуватися ціано, ацетокси, гало, гідрокси го до п'яти заміщувачами, які незалежно вибираабо кето ються з-поміж нижчого алкілу (ациклічного та цикТермін "алкокси" стосується ефіру -О-алкілу, лічного), арилу (карбоарилу та гетероарилу), де алкіл відповідає наведеному вище визначенню алкенілу, алкінілу, алкокси, гало, галоалкілу Термін "арилокси" стосується ефіру -О-арилу, (включаючи тригалоалкіл, наприклад, трифтороде арил відповідає наведеному вище визначенню метил), аміно, меркапто, алкілтю, алкілсульфінілу, алкілсульфонілу, нітро, алканоілу, алканоілокси, Термін "арил" стосується ароматичних груп, алканоілоксиалканоілу, алкоксикарбокси, карбалякі містять принаймні одне кільце, що має спряже1 J кокси (-COOR , де R є нижчим алкілом), карбоксану pi-електронну систему та включає карбоциклічk k 1 мідо (-CONR R', де R тз R відповідають наведений арил та біарил, кожний з яких може варіативно ним вище визначенням), формілу, карбокси, заміщуватись Оптимально арилові групи мають гідрокси, ціано, азидо, кето та їх циклічних кеталів, від 6 до 10 атомів вуглецю Прийнятні арилові груалканоіламідо, гетероарилокси, гетерокарбоцикпи включають феніл та нафтил локси та солі складного гемісукцінат-ефіру Термін "карбоциклічний арил" стосується груп, де кільцеві атоми на ароматичному КІЛЬЦІ Є атоТермін "нижчий" в контексті цього винаходу мами вуглецю Карбоциклічні арилові групи вклюстосується органічних радикалів або сполук, які чають фенілові та нафтилові групи, які можуть звичайно містять від одного до десяти включно, варіативно заміщуватися Заміщуваний феніл мооптимально від одного до шести включно та найже оптимально заміщуватися радикалами, КІЛЬбільш оптимально від одного до чотирьох включно КІСТЬ яких може становити від одного до трьох, атомів вуглецю Такі групи можуть являти собою чотирьох або п'яти, переважно такими заміщувапрямий ланцюжок, розгалужений ланцюжок, або чами є нижчий алкіл, аміно, амінокарбоніл, ціано, циклічну структуру складний карбоксилат-ефір, гідрокси, нижчий алТермін "гетероциклічний" стосується вуглецькокси, галоген, нижчий ацил та нітро вміщуючих радикалів, що складаються з трьох, чотирьох, п'яти, шести або семи-членних кілець та Термін "аралкіл" стосується алкілової групи, одного або двох гетероатомів О, N або S, таких як заміщуваної ариловою групою Прийнятні аралкілтіазолідин, тетрапдрофуран, 1,4-дюксан, 1,3,5групи включають бензил тощо, та можуть варіатитриоксан, піролідин, піперидин, хінуклідин, дитіан, вно заміщуватися тетрапдропіран, є-капролактон, є-капролактам, соТермін "алканоілокси" стосується -O-C(O)Ra, тюкапролактам та морфолін де Ra є алкілом, алкенілом, алкінілом, арилом або а рал кіл ом Термін "гетероарил" стосується вуглецьТермін "карбалкокси" стосується -C(O)ORb, де вміщуючих 5-14-членних циклічних ненасичених Rb є алкілом, алкенілом, алкінілом, арилом або радикалів, які містять один, два, три або чотири О, а рал кіл ом N або S атоми та мають 6, 10 або 14 ті-електронів, делокалізованих в одному чи декількох кільцях, Термін "карбоксамідо" стосується -C(O)NRcRd, таких як піридин, оксазол, індол, пурин, піримідин, де Rc та Rd є незалежно вибраними з-поміж водню, імідазол, бензімідазол, індазол, 2Н-1,2,4-тріазол, алкілу, алкенілу, алкінілу, арилу або аралкілу 1,2,3-тріазол, 2Н-1,2,3,4-тетразол, 1Н-1,2,3,4Термін "ацил" стосується алканоіл-групи тетразол, бензотріазол, 1,2,3-триазоло[4,5C(O)R9, де R9 є алкілом, алкенілом, алкінілом, Р]піридин, тіазол, ізоксазол, піразол, ХІНОЛІН, ЦИТОарилом або аралкілом ЗИН, ТИМІН, урацил, аденін, гуанін, піразин, ПІКОЛІТермін "аміно" стосується -NRhR', де Rh та R1 є нова кислота, ПІКОЛІН, фурова кислота, фурфурал, незалежно воднем або нижчим алкілом, або, об'фуриловий спирт, карбазол, 9Н-піридо[3,4-р]шдол, єднуючись разом (з атомом азоту, до якого вони ІЗОХІНОЛІН, пірол, тюфен, фуран, 9(10Н)-акрідон, приєднані), утворюють 5 або 6-членне кільце, нафеноксазин та фенотіазин, кожний з яких може приклад, піролідинові, морфолінові або піперидиваріативно заміщуватися згідно з наведеним вище нові кільця Термін "діалкіламшо" стосується описом NReRf, де Re та Rf є незалежно групами нижчого алкілу, або разом з атомом азоту, до якого вони Термін "четвертинна амонієва сіль" стосується приєднані, утворюють залишок морфоліно-групи четвертинних амонієвих солей сполук аміно та Прийнятні діалкіламшо-групи включають диметигетероарилових сполук, описаних вище, утворюламіно, діетиламшота морфоліно ваних шляхом реакції сполуки аміно або гетероТермін "тю" стосується -SRm, де Rm є воднем, арилової сполуки з електрофільним реагентом, алкілом, алкенілом, алкінілом, арилом або арилтаким як алкіл, алкеніл, алкініл, циклоалкілалкіл, (нижчим)алкілом аралкіл або аралкініл, галогенід, тозилат, сульфат, 11 11 Термін "сульфініл" стосується -SOR , де R є мезилат і т п До специфічних прикладів електроалкілом, алкенілом, алкінілом, арилом або арилфільних реагентів належать метил йодид, етил (нижчим)алкілом йодид, п-бутил йодид та фенетил йодид Термін "сульфоніл" стосується -SO2R0, де R0 є Термін "EDA" стосується етилендіаміну Терводнем, алкілом, алкенілом, алкінілом, арилом або мін "фармацевтично прийнятні складні ефіри або арил-(нижчим)алкілом солі" стосується складних ефірів та солей згідно з Термін "сульфонамідо" стосується -SO2RkR', Формулою І, що є похідними від ХІМІЧНОГО комбінуде Rk та R1 є незалежно воднем або нижчим алківання сполуки, що запропонована в цьому виналом ході, та органічної чи неорганічної кислоти, або Термін "варіативно заміщуються" або "заміщуоснови Основні СОЛІ утворюються шляхом змішувані", за винятком інших спеціально підкреслених вання розчину конкретної сполуки з розчином фа 19 рмацевтично прийнятної нетоксичної основи, такої, як гідроксид натрію, гідроксид калію, бікарбонат натрію, карбонат натрію, або зі сполукою аміно, такою, як гідроксид холіну, Тріс, біс-Тріс, Nметилглукамш, аргінін тощо Кислотні солі утворюються шляхом змішування розчину конкретної сполуки з розчином фармацевтично прийнятної нетоксичної органічної кислоти або дюєвої кислоти, такої, як оцтова, пропюнова, малеїнова, фумарова, аскорбінова, пімелінова, бурштинова, глутарова, бісметилен-саліцилова, метансульфонова, етан-дисульфонова, щавлева, винна, саліцилова, цитринова, глуконова, ітаконова, гліколева, рамінобензойна, аспарагінова, глутамова, гаммааміно-бутирова, а-(2пдроксиетиламіно)пропюнова, гліцин та ІНШІ ааміно кислоти, такі, як фосфорна, сірчана, глюкуронова, а також 1 -метил-1,4-дипдронікотинова Складні ефіри утворюються зі стероїдних спиртів та ВІДПОВІДНО активованої кислоти Проблема складних ефірів обговорюється нижче у тексті цього винаходу Термін "дюєві (dioic) кислоти" стосується Сі 5алкіленових груп, заміщуваних двома групами карбокси, наприклад, малонової кислоти, бурштинової кислоти, глутарової кислоти, адипінової кислоти, пімелової кислоти, а також суберинової кислоти До гемі(напів)-ефірних солей діоєвих кислот належать їх натрієві, ЛІТІЄВІ, калієві, магнієві та кальцієві солі Згідно З винаходом, кетали включають діефіри нижчих алканолів, такі, як диметил та діетил кетали, а також ЦИКЛІЧНІ кетали, до яких належать діефіри С2 з-алкандюлів, котрі можуть варіативно заміщуватись, наприклад, етилен кетали і пропілен кетали Варіант реалізації 1а В найбільш широкому розумінні цей винахід стосується стероїдних похідних, які мають загальну Формулу І Де R являє собою один з таких радикалів, як водень, аміно, тю, сульфініл, сульфоніл, галоген, нижчий алкокси, алкіл, заміщуваний алкіл, алкеніл, алкініл заміщуваний алкініл, Ri являє собою один з таких радикалів, як водень, алкіл, алкеніл, алкініл, галоалкіл, дигалоалкіл, тригалоалкіл, варіативно заміщувані аралкініл, алкоксиалкіл, аміноалкіл, ціано, ціаноалкіл, тюціаноалкіл, азидоалкіл, варіативно заміщувані арилалкіл, арилалкеніл, варіативно заміщуваний арил, варіативно заміщувані аралкілалкініл, алканоілоксиалкініл, варіативно заміщувані гетероарилокси 57706 20 алкініл, оксоалкініл або його кетал, ціаноалкініл, варіативно заміщувані гетероарилалкініл, пдроксиалкініл, алкоксиалкініл, аміноалкініл, ациламіноалкініл, меркаптоалкініл, пдроксиалкініл, дюєвої кислоти складний гемі-ефір або його сіль, або алкінілоксиалкініл, R2 являє собою один з таких радикалів, як водень, гідрокси, алкокси, алканоілокси, карбалкокси, групу кето або групу аміно, F 3 являє собою один з таких радикалів як во? день, алкокси, заміщуваний алкокси, алкенілокси, амінокарбоніл, моноалкіламшокарбоніл, діалкіламінокарбоніл, сульфініл, сульфоніл, тю, сульфонамідо, алкінілокси, варіативно заміщувані арилокси, варіативно заміщувані арилалкілокси, варіативно заміщуваний 1,3-дюксолан-4-он ацетил-групи, варіативно заміщуваний 1,3-дюксан-4он ацетил-групи, варіативно заміщуваний 1,3оксатюлан-5-он ацетил-групи, варіативно заміщуваний 1,3-оксатюан-5-он ацетил-групи, -O-C(O)-NR'R", -C(O)-CH2-Y-G, -C(O)-CH2-O-D С(О)-СН2-О-Е, -C(O)-CH2-Z-G, -C(O)-CH2-Y'-Z-G або -C(O)-CH2-Y'-Z-A, де R' та R" незалежно являють собою водень або варіативно заміщуваний алкіл, або, взяті разом із атомом азоту, до якого вони приєднані, утворюють від 3- до 6-членне гетероциклічне кільце, Y являє собою один з таких радикалів, як S, SO або SO2, Y являє собою один з таких радикалів, як О, S, SO або SO2, Z являє собою один з таких радикалів, як алкіл, алкеніл або алкініл, G являє собою один з таких радикалів, як Сприєднаний гетероарил, варіативно заміщуваний арил, четвертинна амонієва сіль азот-вміщуючої гетероарилової групи або четвертинна сіль амінозаміщуваної арилової групи, D являє собою С-приєднаний гетероарил або четвертинну амонієву сіль азот-вміщуючої гетероарилової групи, Е являє собою варіативно заміщуваний арил або четвертинну амонієву сіль аміно-заміщуваної арилової групи, А являє собою один з таких радикалів, як зміно, амідо, ціано, тюціано, азидо, нітро, гідрокси, гало, карбоксил, алкокси, алкоксикарбоніл, алканоїлокси, водень, сульфат, тіосульфат, сульфонат, алкілтю, алкілсульфініл, алкілсульфоніл або меркапто, R4 являє собою один з таких радикалів, як водень або нижчий алкіл, Rs являє собою один з таких радикалів, як водень, або, при наявності подвійного зв'язку між С4 і Сб стероїдної кільцевої системи, Rs є відсутнім, R6 являє собою один з таких радикалів, як водень, алканоїл, амінокарбоніл або алкоксикарбоніл, R7 являє собою один з таких радикалів, як водень, галоген, гідрокси, алкокси, алканоілокси або карбалкокси, Rs являє собою один з таких радикалів, як водень або галоген, Rg являє собою один з таких радикалів, як водень, галоген, алкіл, алкокси, арилалкокси або аміно, 21 R-іо являє собою один з таких радикалів, як водень, галоген, алкіл, галоалкіл, гідрокси, алкокси, алканоілокси, карбалкокси, ціано, тюціано або меркапто, і пунктирні лінії відображають наявність простого або подвійного ХІМІЧНОГО зв'язку, за умови якщо R3 є Сі з-алкокси або Сі є-алкенілокси і R являє собою водень або а-метил, тоді Ri не є воднем, або якщо R3 є Сі 4-алкокси(Сі 4)-алкокси, тоді Ri не є воднем або 1-пропшіл, або якщо R3 є воднем та R2 є воднем, гідрокси, групою кето або групою аміно, тоді Ri не є воднем, алкілом або ціаноалкілом, або якщо R3 є амінокарбонілом, моноалкіламшокарбонілом, діалкіламшокарбонілом, тоді Ri не є воднем або алкілом, або якщо R3 є -C(O)-CH2-Y-G, і G є С-приєднаним гетероарилом або варіативно заміщуваним арилом, тоді Ri не є воднем або алкілом, або якщо R3 є -С(О)-СЬІ2-О-Е, та Е є варіативно заміщуваним арилом, тоді Ri не є воднем, або якщо R3 є -C(O)-CH2-Y'-Z-G, і Y' являє собою О, та G являє собою арил, тоді Ri не є воднем, або якщо R3 є -C(O)-CH2-Y'-Z-G, та Y являє собою S, SO, або SG-2, та G є арилом, тоді Ri не є воднем або алкілом, або якщо R3 є -C(O)-CH2-Z-G, тоді Ri не є воднем, або якщо R3 є -C(O)-CH2-Y'-Z-A, та Y являє собою О, та А є воднем, гало, карбоксилом, алкоксикарбонілом, алкокси, ціано або аміно, тоді Ri не є воднем, або якщо R3 є -C(O)-CH2-Y'-Z-A, та Y являє собою S, SO, або SO2, і А є воднем, гало, карбоксилом, алкоксикарбонілом, або аміно, тоді Ri не є воднем або алкілом Цей винахід також охоплює фармацевтично прийнятні складні ефіри та солі сполуки згідно з Формулою 7, включаючи солі кислотних присадок Встановлено, що За-пдроксил також може мати приховані властивості фармацевтично прийнятного складного ефіру, завдяки тому, що такий складний ефір піддається розщепленню під час перетворення пред медикаменту у справжній препарату В цьому тексті такі сполуки трактуються як розщеплювані складні ефіри Варіант реалізації 16 Одна з груп корисних сполук, що охоплюються винаходом у широкому його аспекті, включає сполуки згідно з Формулою І, де зв'язок між С4 та Cs стероїдної кільцевої системи є простим зв'язком, R являє собою один з таких радикалів, як водень, галоген, нижчий алкокси, алкіл, заміщуваний алкіл, алкініл або заміщуваний алкініл, R-і, R2, R4, R6, R7, Rs, R9 та R-ю відповідають наведеним вище визначенням, R3 являє собою один з таких радикалів, як водень, алкокси, заміщуваний алкокси, алкенілокси, алкінілокси, варіативно заміщуваний арилокси, варіативно заміщуваний арилалкілокси, -О-С(О)NR'R", -C(O)-CH 2 -Y-G, -C(O)-CH 2 -O-D -C(O)-CH 2 -OЕ, -C(O)-CH2-Y'-Z-G, або -C(O)-CH2-Y'-Z-A, де R' та R" незалежно являють собою водень або 57706 22 варіативно заміщуваний алкіл, або, взяті разом із атомом азоту, до якого вони приєднані, утворюють 5- чи 6-членне гетероциклічне кільце, Y, Y , Z, G, D, Е, та А відповідають наведеним вище визначенням, Rs є воднем, і де усі ВІДПОВІДНІ умови, перелічені вище в описі Варіанта реалізації 1а, є прийнятними для цього підвиду сполук Варіанти реалізації 1 а' та 1 б' В аспекті ДОЦІЛЬНОСТІ Варіантів реалізації 1а та 16 стероїдні ПОХІДНІ мають загальну Формулу І, де R, Ri, R2, R 3l R', R", Y, Y , Z, G, D, E, A, R4, R 5l Re, R7, Rs, R9 і R10 відповідають наведеним вище визначенням для Варіантів 1а або 16 Однак, для кожного з перелічених вище варіантів передбачені такі умови якщо R3 являє собою Сі є-алкокси або Сі єалкенілокси, тоді Ri не є воднем або метилом, або якщо R3 є воднем і R2 є воднем, гідрокси, групою кето або аміно, тоді Ri не є воднем, алкілом або ціаноалкілом, або якщо R3 являє собою -C(O)-CH2-Y-G, і G являє собою С-приєднаний гетероарил або варіативне заміщуваний арил, тоді Ri не є воднем або алкілом, або якщо R3 являє собою -C(O)-CH2-Z-G, тоді Ri не є воднем або алкілом, або якщо R3 являє собою -С(О)-СЬІ2-О-Е, і Е є варіативно заміщуваним арилом, тоді Ri не є воднем або метилом, або якщо R3 являє собою -C(O)-CH2-Y'-Z-G, і G є варіативно заміщуваним арилом, тоді Ri не є воднем або алкілом, або якщо R3 являє собою -C(O)-CH2-Y'-Z-A, і А являє собою водень, гало, карбоксил, алкоксикарбоніл, алкокси, ціано або аміно, тоді Ri не є воднем або алкілом ДОЦІЛЬНІСТЬ КОЖНОГО З Варіантів реалізацій ви находу Кожна з наступних груп доцільних властивостей стосується усіх варіантів реалізації цього винаходу, за винятком інших, окремо передбачених До доцільних сполук згідно з Формулою 1 належать сполуки, де R є воднем або нижчим алкокси, причому водень є більш доцільним, R3 відповідає наведеним вище визначенням, і оптимально являє собою одну з груп, описаних нижче у цьому тексті, R5, R6, R7, Rs, R9 та R-ю являють собою водень, і Ri являє собою заміщуваний арилалкініл, наприклад, Ri являє собою 4-заміщуваний фенілалкініл, такий як 4-ацетилфенілетиніл, 4-метоксифенілетиніл, 4N.N-диметиламінофенілетиніл, 4ціанофенілетиніл, 4-карбоксифенілетинілу складний ефір, 4-г\І,г\І-діалкіламідофенілетиніл, або де Ri являє собою оксоалкініл, пдроксиалкініл, ацетоксиалкініл, ціаноалкініл, або алкоксиалкініл До додаткового переліку доцільних сполук належать сполуки згідно з Формулою 7, де R являє собою водень, гало, нижчий алкокси, алкініл збо заміщуваний алкініл, Ri являє собою заміщуваний арилетиніл, R2 являє собою водень, групу кето або диметиламшо, R4 являє собою водень або метил, кожний з радикалів R5, R6, R7, Rs, R9 і Rio являє собою водень, всі пунктирні лінії відображають прості зв'язки 24 23 57706 До інших доцільних сполук належать такі спопдрокси-^В-метокси-бВ-андростан, ЗВ-(4'луки згідно з Формулою 7, які являють собою біфеніл)етиніл-За-пдрокси-17В-метокси-5Вскладні ефіри гідроксильних груп в 3-позицм Найандростан, За-пдрокси-ЗВ-(4'-нітрофеніл)етинілбільш доцільними є складні ефіри, видобуті з таких 17В-метокси-5В-андростан, За-пдрокси-ЗВ-(4'ВІДПОВІДНИХ кислот та дюєвих кислот, як оцтова, метоксифеніл)етиніл-17В-метокси-5В-андростан, пропюнова, малеїнова, фумарова, аскорбінова, ЗВ-(4' трифторометилфеніл)етиніл-3а-пдроксипімелова, бурштинова, глутарова, бісметилен17В-метокси-5В-андростан, ЗВ-(4'саліцилова, метансульфонова, етан-дихлорофеніл)етиніл-За-пдрокси-17В-метокси-5Всульфонова, щавлева, винна, саліцилова, цитриандростан, ЗВ-(4'-ціанофеніл)етиніл-За-пдроксинова, глюконова, ітаконова, гліколева, В17В-метокси-5В-андростан, 3B-(4'(R/S)амінобензойна, аспарагова, глутамова, гаммапдроксипентиніл-За-пдрокси-^В-метокси-бВаміно-бутирова, а-(2андростан, За-пдрокси-ЗВ-феніл-17В-метокси-5Вандростан, За-пдрокси-ЗВ-бензил-17В-метокси-5Впдроксиетиламіно)пропюнова, гліцинова та ІНШІ аандростан, За-пдрокси-ЗВ-(2'-фенілетил)-17Ваміно кислоти, фосфорна, сірчана, глюкуронова, а метокси-5В-андростан, За-пдрокси-ЗВ-[2-(3',4'також 1 -метил-1, 4-дипдронікотинова кислоти диметоксифеніл)етил]-17В-метокси-5В-андростан, 17-ефір-похідні За-Гідрокси-Андростанів За-пдрокси-ЗВ-[6'-оксо-1 '-гептиніл]-17В-метокси-5ВДо першого підвиду сполук згідно з цим винаандростан, За-пдрокси-ЗВ-(7'-оксо-1 '-октиніл)-17Входом належать 17-ефір-похідні За-пдроксиметокси-5В-андростан, За-пдрокси-ЗВ-(4'-оксо-1'андростанів До стероїдних похідних в цьому аспепентиніл-17В-метокси-5В-андростан, 3p-[5'-(R/S)кті винаходу належать ті ПОХІДНІ, ЩО мають струкпдроксигексиніл]-За-пдрокси-17В-метокси-5Втурну Формулу І, наведену вище, де андростан, ЗВ-(4'-пдроксибутиніл)-За-пдрокси-17ВR, Ri, R2, R3, R4, R5, Re, R7, Re, Rg і R10 відповіметокси-5В-андростан, ЗВ-(4'-пдроксибутиніл)-Задають наведеному вище для Варіанта реалізації пдрокси-^В-метокси-ба-андростан, Зр-(4'1а, і ацетоксифенілетиніл)-За-пдрокси-17В-метокси-5ВR3 являє собою один з таких радикалів, як аландростан, ЗВ-(4'-ацетилфенілетиніл)-За-пдроксикокси, заміщуваний алкокси, алкенілокси, алкініло19-нор-17В-метокси-5В-андростан, ЗВ-(4'кси, варіативно заміщуваний арилокси, варіативно заміщуваний арилалкілокси або -OC(O)NR'R", де карбоксифенілетиніл)-3а-пдрокси-19-нор-17Вметокси-5В-андростану складний етил-ефір, ЗВ-(4'R' та R" незалежно являють собою водень, карбоксифенілетиніл)-За-пдрокси-17В-метокси-5аваріативно заміщуваний алкіл, або, взяті разом, андростану складний етил-ефір, 3p-[4'-(N,Nутворюють 5- чи 6-членне гетероциклічне кільце, діетилкарбоксамідо)феніл]етиніл-За-пдрокси-17Вза умови метокси-5В-андростан, За-пдрокси-ЗВ-[5-оксо-1якщо R3 являє собою Сі є-алкокси або Сі єгексинілі-17В-метокси-5В-андростан, За-пдроксиалкенілокси і R являє собою водень або а-метил, ЗВ-[5'-оксо-1 '-гексиніл]-17В-метокси-5В-андростан тоді R, не є воднем, і циклічний 5'-(1,2-етандмл)ацеталь], ЗВ-(5-ціано-1якщо R3 являє собою Сі 4-алкокси(Сі пентиніл)-За-пдрокси-17В-метокси-5В-андростан, 4)алкокси, тоді Ri не є воднем чи 1-пропшіл За-пдрокси-ЗВ-(2-піридил)етиніл-17В-метокси-5ВДОЦІЛЬНІСТЬ ЦЬОГО аспекту винаходу охоплює ті андростан, ЗВ-(6-пдрокси-1-гексиніл)-За-пдроксийого ЦІННОСТІ, які було зазначено вище в загально17В-метокси-5[3-андростан, Зр-(6'-пдрокси-1 'му переліку цінностей винаходу, а також наступні гексиніл)-3а-пдрокси-17р-метокси-5р-андростан 6'специфічні риси гемісукцинату натрієва сіль, Зр-(5'-пдрокси-1'R3 являє собою алкокси, такий як метокси, пентиніл)-3а-пдрокси-17р-метокси-5р-андростан, етокси або пропокси, або заміщуваний алкокси, Зр-(5'-пдрокси-1 '-пентиніл)-3а-пдрокси-17ртакий як -ОСН2СН2ОН, -ОСН2С=СН або ОСН2С=Сметокси-5р-андростан 5'-гемісукцшату натрієва РпСОМе, сіль, Зр-(4'-пдрокси-1 '-бутиніл)-3а-пдрокси-17рR4 являє собою водень або нижчий алкіл, метокси-5р-андростан 4'-гемісукцшату натрієва більш доцільно, водень або метил, сіль, Зр-(4'-ціано-1 '-бутиніл)-3а-пдрокси-17рКожний з радикалів R5, R6, R7, Rs, R9 і Rio опметокси-5р-андростан, Зр-(5'-ацетокси-1'-пентинт)тимально являє собою водень, всі пунктирні лінії За-Гідрокси-^р-метокси-бр-андростан, Зр-(4'відображають прості зв'язки ацетокси-1 '-бутиніл)-3а-пдрокси-17р-метокси-5рДо доцільних сполук згідно з цим аспектом виандростан, Зрр-(4'-ацетокси-1'бутиніл)-3анаходу належать такі За-пдрокси-ЗВ-фенілетинілпдрокси-^р-метокси-ба-андростан, Зр-(6'17В-метокси-5В-андростан, За-пдрокси-ЗВфенілетиніл-17В-метокси-5а-андростан, Заацетокси-1'-гексиніл)-3а-пдрокси-17р-метокси-5рпдрокси-ЗВ-(3'4'-диметоксифеніл)етиніл-17Вандростан, За-пдрокси-Зр-[3-(2'-пропшілокси)-1метокси-5В-андростан, За-пдрокси-ЗВ-(4'пропшіл]-17р-метокси-5р-андростан, За-пдроксиЗр-(3-метокси-1 -пропшіл)-17р-метокси-5рметилфеніл)етиніл-17В-метокси-5В-андростан, Заандростан, За-пдрокси-Зр-(З-метокси-і-пропшіл)пдрокси-ЗВ-(2'-метоксифеніл)етиніл-17В-метокси17р-метокси-5а-андростан, За-пдрокси-Зр-[3-(4'5В-андростан, За-пдрокси-ЗВ-(4'піридинілокси)-1 -пропшіл]-17р-метокси-5ркарбоксифеніл)етиніл-17В-метокси-5В-андростану андростан, За-пдрокси-Зр-[3-(1'Н-1,2,3-триазол- 1 і складний етил-ефір, За-пдрокси-ЗВ-(4'іл)-1 -пропшіл]-17р-метокси-5р-андростан, Заацетоксиацетилфеніл)етиніл-17В-метокси-5Впдрокси-Зр-[3-(2'Н-1,2,3-триазол-2'-іл)-1 -пропініл]андростан, ЗВР-(4'-ацетилфеніл)етиніл-За17р-метокси-5р-андростан, За-пдрокси-Зр-(2'пдрокси-^В-метокси-ба-андростан, ЗВ-(4'тієніл)етиніл-17р-метокси-5р-андростан, Заацетилфеніл)етиніл-За-пдрокси-17В-метокси-5Вандростан, ЗВ-(4'-диметиламшофеніл)етиніл-Запдрокси-3р-(3'-феніл-1 '-пропшіл)-17р-метокси-5р 26 25 57706 андростан, За-пдрокси-3р-(3'-фенілпропіл)-17рR6, R7, Rs, R9 та Rio належать ті, що їх перелічено метокси-5р-андростан, За-пдрокси-Зр-[3-(1'Нвище для усіх варіантів винаходу піразол-1 '-іл)-1 -пропініл]-17р-метокси-5р21-заміщувані За-Гідрокси-похідні прегнану андростан, Зр-(3'-ацетилфенілетиніл)-3а-пдроксиТретя категорія корисних сполук, запропоно17р-метокси-5р-андростан, і Зр-(3'-ацетокси-3'ваних у цьому винаході включає За-пдрокси ПОХІДпропшіл)-3а-пдрокси-17р-метокси-5р-андростан НІ прегнану, які мають 21-ефір- чи 21-тюефірзв'язані, або 21-алкіл-, 21-алкеніл- або 21-алкшілДо більш доцільних нейроаісгивних стероїдів у зв'язані заміщувачі До сполук, що використовуцьому аспеїсп винаходу належать Зр-(4'ються в цьому аспекті винаходу, належать ті, що ацетилфеніл)етиніл-3а-пдрокси-17р-метокси-5амають наведену вище структурну Формулу 7, де андростан, Зр-(4'-карбоксилфеніл)етиніл-Запдрокси-^р-метокси-ба-андростану складний R, R-і, R2, R4, R5, R6, R7, Rs, R9 та Rio відповіетил-ефір, Зр-(4-ацетилфеніл)етиніл-За-пдроксидають наведеному вище для Формули 1, 17р-метокси-5р-андростан, Зр-(4'R3 являє собою один з таких радикалів, як карбоксилфеніл)етиніл-3а-пдрокси-17р-метоксиC(O)-CH2-Y-G, -C(O)-CH2-O-D, -C(O)-CH2-O-E, 5р-андростану складний етил-ефір, Зр-(4'C(O)-CH2-Y'-Z-G або -C(O)-CH2-Y'-Z-A, ацетилфеніл)етиніл-3а-пдрокси-17р-метокси-5рY являє собою один з таких радикалів, як S, 19-норандростан, Зр-(4'-карбоксилфеніл)етинілSO або SO2, За-пдрокси-17р-метокси-5р-19-норандростану Y являє собою один з таких радикалів, як О, складний етил-ефір, Зр-(4'S, SO або SO2, диметиламшофеніл)етиніл-17р-метокси-5рZ являє собою один з таких радикалів, як аландростан, Зр-(4'-біфеніл)етиніл-За-пдрокси-17ркіл, алкеніл або алкініл, метокси-5р-андростан, За-пдрокси-Зр-(4'G являє собою один з таких радикалів, як Сприєднаний гетероарил, варіативно заміщуваний метоксифеніл)етиніл-17р-метокси-5р-андростан, арил, четвертинну амонієву сіль азот-вміщуючої Зр-(4'-трифторометилфеніл)етиніл-За-пдроксигетероарилової групи або четвертинну амонієву 17р-метокси-5р-андростан, Зр-(4'сіль аміно-заміщуваної арилової групи, хлорофеніл)етиніл-3а-пдрокси-17р-метокси-5рандростан, Зр- [4' (Р/3)-пдроксипентиніл] -ЗаD являє собою С-приєднаний гетероарил або пдрокси-^р-метокси-бр-андростан, Зр-(4'четвертинну амонієву сіль азот-вміщуючої гетероарил груп, пдроксибутиніл)-3а-пдрокси-17р-метокси-5рандростан, Зр-(4'-пдроксибутиніл)-За-пдрокси-17рЕ являє собою варіативно заміщуваний арил метокси-5а-андростан, та За-пдрокси-Зр-[3-(2'Набо четвертинну амонієву сіль аміно-заміщуваної 1,2,3-триазол-2'-іл)-1 -пропшіл]-17р-метокси-5рарилової групи, андростан А являє собою один з таких радикалів, як аміно, амідо, ціано, тюціано, азидо, нітро, гідрокси, До найбільш доцільних нейроактивних стероїгало, карбоксил, алкокси, алкоксикарбоніл, алканодів у цьому аспекті винаходу належать Зр-(4'їлокси, водень, сульфат, тіосульфат, сульфонат, ацетилфеніл)етиніл-3а-пдрокси-17р-метокси-5аалкілтю, алкілсульфініл, алкілсульфоніл або мерандростан, Зр-(4'-ацетилфеніл)етиніл-За-пдроксикапто, 17р-метокси-5р-андростан, Зр-(4'карбоксилфеніл)етиніл-3а-пдрокси-17р-метоксиза умови 5а-андростану складний етил-ефір, Зр-(4'якщо R3 являє собою -C(O)-CH2-Y-G, і G являє карбоксифеніл)етиніл-3а-пдрокси-17р-метокси-5рсобою С-приєднаний гетероарил або варіативно андростану складний етил-ефір, Зр-(4'заміщуваний арил, тоді Ri не є воднем або алкідиметиламшофеніл)етиніл-17р-метокси-5рлом, або андростан, Зр-(4'-біфеніл,етиніл-За-пдрокси-17рякщо R3 являє -С(О)-СН2-О-Е, тоді Ri не є вометокси-5р-андростан, Зр-(4'-пдроксибутиніл)-Заднем, або пдрокси-^р-метокси-бр-андростан, Зр-(4'якщо R3 являє собою -C(O)-CH2-Y'-Z-G, Y являє собою О, і G являє собою арил, тоді Ri не є пдроксибутиніл)-3а-пдрокси-17р-метокси-5аводнем,або андростан, За-пдрокси-Зр-[3-(2 Н-1,2,3-триазол-2'іл)-1 -пропшіл]-17р-метокси-5р-андростан, Зр-(4'якщо R3 являє собою -C(O)-CH2-Y'-Z-G, і Y явацетилфеніл)етиніл-3а-пдрокси-17р-метокси-5рляє собою S, SO, або SO2, і G являє собою арил, 19-норандростан, та Зр-[4'(Р/3)-пдроксипентиніл]тоді Ri не є воднем або алкілом, або За-гідрокси-^р-метокси-бр-андростан якщо R3 являє собою -C(O)-CH2-Y'-Z-A, і Y являє собою О, та А являє собою водень, гало, карЗа-Гідрокси ПОХІДНІ андростану боксил, алкоксикарбоніл, алкокси, ціано або аміно, До другого підвиду доцільних сполук згідно тоді Ri не є воднем, або цього винаходу належать За-пдрокси ПОХІДНІ андростану, які є незаміщуваними в 17р-позици стероякщо R3 являє собою -C(O)-CH2-Y'-Z-A, і Y1 явїдної кільцевої системи, тобто в них R3 є воднем ляє собою S, SO, або SO2, і А являє собою водень, До стероїдних похідних в цьому аспекті винаходу гало, карбоксил, алкоксикарбоніл, або аміно, тоді належать ті, що мають структурну Формулу І, наRi не є воднем або алкілом ведену вище, де Як варіант, R3 може також являти собою -С(О)CH2-Z-G, де Z та G відповідають наведеному безF 3 є воднем, і R, R-i, R2, R4, R5, R6, R7, Rs, R9 і ? посередньо вище, за умови якщо R3 являє собою R-іо відповідають наведеному вище для Варіанта -C(O)-CH2-Z-G, тоді Ri не є воднем реалізації 1а, за умови, що Якщо D чи G являють собою С-приєднаний гетероарил, оптимальними є складові гетероарилу, Ri не є воднем, алкілом або ціаноалкілом до яких належать піридил, піримідиніл, піразиніл, До доцільних властивостей R, Ri, R2, R4, R5, 28 27 57706 імідазоліл, тріазоліл, тетразоліл, ХІНОЛІНІЛ, ІНДОЛІЛ, метил-21 -(4'-триметиламонійфенокси)-5абензімідазоліл, а також ІЗОХІНОЛІНІЛ прегнан-20-ону пірид сіль, Зр-етиніл-За-пдрокси21 -тюпропансульфонат-5р-прегнан-20-он натрієва Якщо Е чи G являють собою заміщуваний сіль, Зр-етиніл-3а-пдрокси-21-(3'арил, оптимальними є групи, до яких належать феніл, заміщуваний одним, двома або трьома, пдроксипропілсульфоніл))-5р-прегнан-20-он, Занайбільш доцільно одним з радикалів, до яких напдрокси-21 -(3'-пдроксипропілтю))-2р-пропокси-5аі лежать нітро, аміно, диметиламшо, карбокси, мепрегнан-20-он, За-пдрокси-21-(3 тил, гідрокси, метокси, фторо, хлоро, бромо, ціано пдроксипропілсульфоніл))-2р-пропокси-5аабо піролідиніл прегнан-20-он, За-пдрокси-2р-пропокси-21Прикладами заміщувачів з ВІДПОВІДНИМИ корисульфонілпропансульфат-5а-прегнан-20-он натрісними властивостями, які застосовуються в струкєва сіль, 21-(4'-фторофенілтю)-За-пдрокси-Зртурній позиції R3 в цьому аспекті винаходу, є такі метоксиметил-5а-прегнан-20-он, Зр-етиніл-Зарадикали -COCH2S-(4-PhNH2), пдрокси-21 -(пірид-4-ілтю)-5а-прегнан-20-он, Зр-(4'+ ацетилфеніл)етиніл-За-пдрокси-21-(пірид-4-ілтю)-COCH2O-(4-PhN Me3)l-, -СОСН2О-4-піридил, 5р-прегнан-20-он, За-пдрокси-2р-пропокси-21-(4'СОСН2О-3-піридил, -СОСН23-(4-піридил) N-метил N,N,N-тpимeтилaмoнlйфeнoкcи)-5а-пpeгнaн-20-oнy йодид, пірид сіль, За-пдрокси-Зр-метил-21-(ХІНОЛІН-6-COCH2SCH2CH2OH, -СОСН2ОСН2СН2ОН, ілокси)-5а-прегнан-20-он N-метил пірид, За-COCH2SCH2CH2CH2OH, пдрокси-Зр-метил-21 -(хшолш-6-ілокси)-5аCOCH2SOCH2CH2CH2OH, прегнан-20-он, 21-(4'-фторофеніл)сульфоніл-За-COCH2SO2CH2CH2CH2OH, -COCH2SCH2COO + пдрокси-3р-метоксиметил-5а-прегнан-20-он, та ЗаNa , + пдрокси-Зр-метоксиметил-21-(4'-COCH2SCH2CH2COO Na , -COCH2SCH2OSO3 + піролідинофеніл)сульфоніл-5а-прегнан-20-он TMA (TMA - це абревіатура триметиламоній), + COCH2SCH2CH2CH2OSO3 Na , До найбільш доцільних нейроактивних стероїдів згідно цього аспекту винаходу належать За-COCH2SCH2CH2SO3 Na+, пдрокси-Зр-(4'-пдроксибутиніл)-21 -(пірид-4-ілтю)COCH2SCH2CH2CH2SO3 Na+, 5р-прегнан-20-он, За-пдрокси-21 -(пірид-4-ілокси)-COCH2SO2CH2CH2O2 Na+ 1 5р-прегнан-20-он, За-пдрокси-2р-пропокси-21 тюCOCH2OCH2CH2CH2SO3 Na+ пропансульфонат-5а-прегнан-20-ону натрієва сіль, Додатковими радикалами з корисними власЗр-етиніл-3а-пдрокси-21-(3'-пдроксипропілтю))-5ртивостями є -СОСН23-(4-фторофеніл), -СОСН2Опрегнан-20-он, За-пдрокси-Зр-метоксиметил-21(6-ХІНОЛІНІЛ), -СОСН2ЗО-(4-фторофеніл), (пірид-4-ілтю)-5а-прегнан-20-он, За-пдрокси-ЗрСОСН2ЗО2-(4-піролідшофеніл), -СОСН2СН2-(4метоксиметил-21-(4'-нітрофенілсульфшіл)-5апіридил), -СОСН2О-(4-нітрофеніл), -СОСН2О-(4прегнан-20-он, За-пдрокси-Зр-метоксиметил-21диметиламшофеніл), -СОСН2ЗО-(4-нітрофеніл) і (4'-нітрофенілсульфоніл)-5а-прегнан-20-он, ЗаСОСН2ЗО2-(4-нітрофеніл) пдрокси-Зр-метил-21 -(4'-нітрофенокси)-5аДо оптимальних сполук, використовуваних в прегнан-20-он, За-пдрокси-21-(3іцьому аспекті винаходу, належать За-пдрокси-Зр(4-пдроксибутиніл)-21-(пірид-4-ілтіо)-5р-прегнанпдроксипропілтю))-2р-пропокси-5а-прегнан-20-он, 20-он, За-пдрокси-21-(пірид-4-ілокси)-5р-прегнанЗа-пдрокси-21 -(3'-пдроксипропілсульфоніл))-2р20-он, За-пдрокси-2р-пропокси-21 пропокси-5а-прегнан-20-он, та За-пдрокси-2рпропокси-21 -сульфонілпропансульфат-5атюпропансульфонат-5а-прегнан-20-ону натрієва сіль, Зр-етиніл-3а-пдрокси-21-(3'прегнан-20-он натрієва сіль пдроксипропілтю))-5р-прегнан-20-он, Зр-етиніл-ЗаДо найбільш доцільних нейроактивних стероїпдрокси-21-(тюпропансульфат)-5р-прегнан-20-ону дів згідно цього аспекту винаходу належать Занатрієва сіль, 8а-пдрокси-2р-пропокси-21 -(піридпдрокси-Зр-(4-пдроксибутиніл)-21-(пірид-4-ілтю)4-ілтю)-5а-прегнан-20-ону N-метил пірид, За5р-прегнан-20-он, За-пдрокси-Зр-метоксиметилпдрокси-21-(2'-пдроксиетилтю)-5р-прегнан-20-он, 21-(пірид-4-ілтю)-5а-прегнан-20-он, За-пдрокси-21 Зр-етиніл-3 а-пдрокси-21 -(2'-пдроксиетилтю)-5р-(3'-пдроксипропілсульфоніл))-2р-пропокси-5апрегнан-20-он, За-пдрокси-21 -(пірид-4-ілтю)-5апрегнан-20-он, та За-пдрокси-21-(пірид-4-ілокси)прегнан-20-он N-метил пірид, За-пдрокси-21 5р-прегнан-20-он (пірид-4-ілтю)-5р-прегнан-20-ону N-метил пірид, Діастереомери Зр-етиніл-3а-пдрокси-21-тюетансульфат-5рДля фахівців є очевидним, що сполуки, опис прегнан-20-ону триметиламонієва сіль, Заяких наведено вище у тексті, можуть бути предпдрокси-Зр-метоксиметил-21 -(пірид-4-ілтю)-5аставлені як суміші діастереомерів, що піддаються прегнан-20-он, 21-(4'-амінофенілтю)-За-пдроксирозділенню на окремі діастереомери Розділення Зр-метоксиметил-5а-прегнан-20-он, діастереомерів виконується за допомогою, газової та рідинної хроматографії або шляхом виділення з 21-(4'-диметиламофенілтю)-За-пдрокси-Зрприродної сировини За винятком спеціально заметоксиметил-5а-прегнан-20-он, За-пдрокси-Зрзначених моментів, посилання в технічному описі метоксиметил-21-(4'-нітрофенілтю)-5а-прегнан-20та формулі винаходу на ВІДПОВІДНІ сполуки, які он, За-пдрокси-Зр-метоксиметил-21-(4'наведено вище, спрямовані на охоплення усіх ізонітрофенілсульфоніл)-5а-прегнан-20-он, Замерів, як розділених на окремі сполуки, так і взяпдрокси-Зр-метоксиметил-21 -(4іі тих у суміші у випадку розділених ізомерів бажанітрофенілсульфоніл)-5а-прегнан-20-он, 21 -(4 ний фармакологічний ефект часто-густо є диметиламшофенокси)-3а-пдрокси-3р-метил-5адомінуючим в одному з діастереомерів Як розкрипрегнан-20-он, За-пдрокси-Зр-метил-21 -(4іто вище, таким сполукам є властивою високий нітрофенокси)-5а-прегнан-20-он, За-пдрокси-Зр 30 29 57706 ступінь стереоспецифічності Зокрема, до сполук, стосування, може бути як тверда, так і рідка або що мають найбільшу спорідненість з GABAтимчасово утворювана речовина (див , наприклад, рецепторним комплексом, належать сполуки з 3(3Remington's Pharmaceutical Sciences, 14th Edition заміщуваний-За-пдроксипрегнановим стероїдним (1970)) Прикладами твердих носив є лактоза, біла скелетом глина, сахароза (цукроза), тальк, желатин, агар, пектин, акація, стеарат магнію, стеаринова кислоСинтетичні методи та, мікрокристалічна целюлоза, полімерні пдрогелі Сполуки згідно з цим винаходом можна приготощо До типових рідких носив належать пропілен тувати за допомогою будь-якого, традиційного гліколь, глікофурол, водні розчини циклодекстриметоду, наприклад, використовуючи технологію, нів, сироп, арахісова олія, маслинна олія і тому описану у Djerassi, Steroid Reactions, Холден-Дей, подібні емульсії Аналогічно, носій або розріджуІнк , Сан-Франциско (1963), або у Fried та Edwards, вач можуть включати будь-які ВІДОМІ В ЦІЙ галузі Organic Reactions in Steroid Chemistry, Ванречовини відкладеної дії, такі як гліцерол моностеНостранд Рейнолд Ко , Нью-Йорк (1972) арат або гліцерол дистеарат, в чистому вигляді Складні С-17-ефіри згідно цього винаходу виабо з воском, в мікрокапсулах, мікрокульках (мікготовляються з 170-пдрокси-сполук за допомогою рогранулах), ліпосомних сполуках та/або пдрогеметодів, відомих фахівцям у справі приготування лях ефірів з ВІДПОВІДНИХ спиртів БІЛЬШІСТЬ З ЦИХ методів описано у Larock, Comprehensive Organic Фармацевтичні прописи можуть бути різномаTransformations вид VCH Publishers, Нью-Йорк нітними Отже, з використанням твердого носія (1989) ВИХІДНІ 17р-пдрокси речовини добре ВІДОМІ препарат може приготовлятися у вигляді звичайфахівцям Доцільним Є захищати групу 3-кето ного порошку з перемеленими до мікроскопічних шляхом попереднього утворення кеталу Далі керозмірів частинками, у вигляді масляної речовини, тал можна піддавати ВІДОМІЙ реакції, здобуваючи таблеток, поміщатися в тверду желатинову оболоС-17-ефір та пдролізувати його, здобуваючи 3нку, або в формі порошку чи мікроскопічних кульок кето-17-ефірні сполуки 3 метою здобуття похідних поміщатися в капсулу з ентеросолюбільним по3[3-заміщуваний-За-пдрокси-С17-ефіру до частки криттям, або приготовлятися у вигляді найрізно3-он таких сполук можна додавати різні нуклеофіманітніших за формою пілюль Сполуки згідно цьоли го винаходу також можуть призначатися в формі супозиторіїв (свічок) ДЛЯ ректального введення Інший метод здобуття С-17-ефірів полягає у Сполуки можуть змішуватися в таких речовинах, реакціїС17-кеталів, отриманих з ВІДПОВІДНИХ С17як масло какао та поліетилен-гліколі або інших онів, з літій-алюмінієвим гідридом та АІСІз, як опинеподразнюючих матеріалах, які є твердими при сано у Cross et al_, Steroides 5 557 (1965) кімнатній температурі, але стають рідкими при Фенілетинілові заміщувачі можна приготувати температурі, що існує у ректальному середовищі за допомогою каталізованої паладієм (Pd) реакції З використанням рідкого носія застосування през'єднання ВІДПОВІДНИХ похідних етинілу із фенілпіпарату можливо у рідкому вигляді, в ампулах чи у ридами або фенілбромідами в присутності аміну вигляді водної чи неводної суспензії Дозовані рідкі Усі С21-броміди, що їх використано як ВИХІДНІ препарати потребують також добавлення фармаматеріали в прикладах, здобували з використанцевтично прийнятних консервантів У додаток, ням процедури приготування альфа-бромо-кетонів через достатність застосування відносно малих з метил-кетонів Ця процедура є добре відомою доз, якщо виходити з наведеного вище опису, мофахівцям жливим є парентеральне введення, назальна Фармацевтичне застосування пульверизація, введення під язик та за щоку, а Сполуки, які запропоновано та використано в також місцеве застосування фармацевтично прицьому винахіді і які є нетоксичними, фармацевтичйнятних діючих з часом шкірних пластирів но прийнятними, природними чи синтетичними, прямої дії чи різновидами "предмедикаментів" Метод створення транквілізуючих, протисудостероїдних похідних були досі не дослідженими з мних, психотропних (таких як антидепресанти) або точки зору їх впливу на мозок через їх САВАдгіпнотичних ефектів, згідно з винаходом, передбарецепторний комплекс Запропонований винахід чає введення в організм пацієнта (що потребує має пріоритет у відкритті цих перше невідомих такого втручання) сполуки в ХІМІЧНІЙ КОМПОЗИЦІЇ, механізмів та ефектів яка узгоджується з наведеним вище описом і в сукупності з фармацевтично прийнятним носієм, в Фармацевтичні композиції згідно цього винанетоксичному, але достатньому для створення ходу приготовляються у вигляді традиційно дозозгаданого ефекту об'ємі ваних одиниць шляхом змішування активної сполуки винаходу або суміші таких сполук з Під час менструацій рівні вивільнюваного менетоксичним фармацевтичним носієм, згідно з таболітів прогестерону змінюються приблизно в прийнятими правилами, в нетоксичному об'ємі, чотири рази (Rosciszewska et al , J NeuroL Neuroдостатньому для створення бажаного фармакодиsurg Psych 49 47-51 (1986)) Отже, терапевтичні намічного ефекту в організмі конкретного об'єкта, заходи з контролювання симптомів передбачають тварини або людини Оптимально ефективний, збереження у пацієнта більш високого рівня метаале нетоксичний вміст активного компонента комболітів прогестерону, ніж нормальний рівень позиції становить від близько 1 мг до близько пред менструальної стадії для пацієнтів з PMS 500мг на дозовану одиницю Цей вміст залежить РІВНІ активних та найбільш важливих метаболітів в від конкретного бажаного біологічного ефекту та плазмі хворих регулюються в пред- і постменструвід стану здоров'я пацієнта альні періоди Таким чином, об'єм сполук згідно цього винаходу, які вводяться окремо чи в суміші, Фармацевтичним носієм, придатним для за 32 31 57706 встановлюється з того розрахунку, щоб досягти сан ацетон 85 15) = 0 21 однакового або вищого рівня впливу на GABAAПриклад 2 рецептор у порівнянні з рівнем метаболітів прогесЗа-(4'-Гідрокси-1 '-бутинил)-3р-пдрокси-17ртерону в нормальному організмі під час предменсметокси-5р-андростан та Зр-(4'-Гідрокси-1'труальної стадії бутиніл)-3а-пдрокси-17р-метокси-5р-андростан Метод викликаного (індукованого) сну та доРозчин З-бутин-1-олу (0 114мл, 1 5 ммол) в сустатнього збереження рівня REM-сну, виявленого хому тетрапдрофурані (15мл) обробляли n-BuLi в нормальному сні, без викликання істотної реакції (1 2мл, 2 5М в THF, 3 ммол) при -75°С Після позворотної інсомнм, згідно цього винаходу, передмішування при -78°С протягом 0 5 год добавляли бачає введення в організм потребуючого пацієнта розчин 17р-метокси-5р-андростан-3-ону (152мг, ефективної дози стероїдної похідної, опис якої 0 5 ммол) в THF (20мл), і суміш помішували при наведено у цьому тексті Сполуки згідно винаходу 78°С протягом 5 хв Далі охолоджену ванну забиспроможні збільшити NREM-сон і сумарну триварали геть, та помішування продовжували при кімлість періоду сну, без суттєвого впливу на REMнатній температурі протягом 45 хв Суміш після сон Зворотна ІНСОМНІЯ є визначеною як зменшенцього миттєво охолоджували розчином NH4CI ня NREM-сну після того, як гіпнотичний вплив ліку(5мл) Розчинники видаляли, і залишок екстрагування повертається до контрольного рівня Метовали за допомогою ЕЮАс Органічний шар промиди оцінки ефективності впливу сполук згідно з вали водою та розсолом Після просушування над винаходом на REM-та NREM-сон розкриваються в анпдр Розчин MgSO4 фільтрували та випарювали, W094/27608, опублікованому 8 грудня 1994 року, здобуваючи на виході сирий продукт Цей сирий зміст якого повністю охоплюється посиланнями у продукт далі розчиняли в малому об'ємі СН2СІ2 та цьому тексті Шляхом введення сполук може вваобробляли на силікагелевій колонці Елюювання з жатися будь-який шлях ефективного транспортусумішшю толуол ацетон (4 1) дало на виході Завання активної сполуки до GABAA рецепторів, котрі (4 -пдрокси-1 '-бутиніл)-3а-пдрокси-17р-метокси-5рпідлягають стимулюванню Введення може здійсандростан (20мг), та після цього - Зр-(4'-пдроксинюватись парентерально, ентерально, ректально, 1 '-бутиніл)-3а-пдрокси-17р-метокси-5р-андростан внутрішньоматочно, крізь шкіру, внутрішньом'язо(70мг) у вигляді безбарвної твердої речовини, т п во, через усмоктування під язиком, назально, най132 - 134°С, Коеф ТШХ Rf (толуол ацетон 4 1) = більш доцільними є оральний, внутрішньом'язовий 019 та штрадермальний шляхи введення Наприклад, Приклад З одна доза, що міститься в нашкірному пластирі, Зр-(4'-Гідрокси-Г-бутиніл)-За-пдрокси-17рможе забезпечити пацієнта активним компонентом метокси-5а-андростан 4'-гемісукцинат та їх натрієсполуки на термін до одного тижня Однак, для ва сіль випадків status epilepticus доцільним є парентераРозчин Зр-(4'-пдрокси-1'-бутиніл)-За-пдроксильний шлях 17р-метокси-5а-андростану (350мг, 0 93 ммол) в піридині (бмл) обробляли бурштиновим ангідриНаступні приклади характеризують, але не дом (372мг, 37 ммол) та 4-(N,Nобмежують застосування методів і композицій цьодиметил)амшопіридином (20мг) Суміш нагрівали го винаходу Ідея та мета цього винаходу охоплюдо 70 - 75°С протягом 3 год ТШХ дала 100%-ву ють ІНШІ придатні модифікації та адаптовані варіаконверсію Продукт охолоджували до кімнатної нти, в яких враховані різноманітні умови і температури та вливали в льодяну - 2N НСІ Орпараметри, з котрими доводиться мати справу ганічні рештки екстрагували за допомогою ЕЮАс фахівцям Органічний шар промивали 0 2N НСІ, водою та Приклад 1 розсолом Після просушування над анпдр Розчин За-Пдрокси-17р-метокси-Зр-(3'-метилбут-3'-енMgSO4 фільтрували та випарювали, здобуваючи 1 '-шіл)-5р-андростан на виході сирий продукт Цей сирий продукт далі Розчин 2-метил-1-бутен-3-шу (150мг, 0 21мл, розчиняли в малому об'ємі СН2СІ2 та обробляли 2 25 ммол) в сухому тетрапдрофурані (THF) на силікагелевій колонці Елюювання з сумішшю (20мл) було оброблено n-BuLi (2 5М in THF, 2 25 гексан ацетон (7 3) дало на виході Зр-(4'-пдроксиммол, 0 9мл) при -70°С Після помішування суміші 1 '-бутиніл)-3а-пдрокси-17р-метокси-5а-андростан при -75°С протягом 0 5 год було добавлено розчин 4'-гемісукцинат (360мг) 17р-метокси-5р-андростан-3-ону (228мг, 0 75 ммол) в THF (20мл), після чого суміш помішували Суміш згаданого гемісукцинату (360мг 0 76 при -78°С протягом ЗО хв Охолоджуючу ванну ммол), ІЧаНСОз (64мг 0 76 ммол), води (Змл) та забирали геть, і суміш піддавали миттєвому охоСН2СІ2 (5мл) помішували при кімнатній темпералодженню за допомогою розчину МН4СІ (2мл) турі протягом 1 год Розчинник видаляли, та залиПісля ЦЬОГО видаляли розчинники, і залишок екстшок суспендовали в ацетоні (5мл) Білу тверду рагували ЕЮАс Органічний шар промивали вовеличину після цього збирали за допомогою фільдою та розсолом Після просушування над анпдр трації та висушували, здобуваючи на виході сіль MgSO4, розчин фільтрували та випаровували, винатрію у вигляді безбарвної твердої речовини добуваючи сирий продукт Цей сирий продукт далі (210мг) розчиняли в малому об'ємі СН2СІ2 та піддавали Приклад 4 обробці на силікагелевій колонці Елюювання суЗр-(4'-Гідрокси-1 '-бутиніл)-3а-пдрокси-17рмішшю гексану ацетону (9 1) дало на виході Заметокси-5а-андростан та За-(4'-пдрокси-1'пдрокси-17р-метокси-3р-(3'-метилбут-3'-ен-1'-ініл)бутиніл)-3р-пдрокси-17р-метокси-5а-андростан 5р-андростану (133мг) у вигляді безбарвної тверРозчин З-бутин-1-олу (0 15мл, 2 ммол) в суходої речовини, т п 145 - 147°С, коеф ТШХ Rf (гекму тетрапдрофурані (15мл) обробляли n-BuLi 34 33 57706 (1 6мл, 2 5М в THF, 4 ммол) при -75°С Після пообробляли на силікагелевій колонці Елюювання з мішування при -78°С протягом 0 5 год добавляли сумішшю гексангетил ацетату (9 1) дало на виході розчин ІУр-метокси-ба-андростан-З-ону (304мг, 1 Зр-трифторометил-За-пдрокси-^р-метокси-баммол) в THF (20мл) та суміш помішували при андростан (9мг), ТШХ Rf (гексан ЕЮАс 8 2) = 0 51, 78°С протягом 5 хв Охолоджуючу ванну після цьота після цього - За-трифторометил-Зр-пдроксиго забирали геть, і помішування продовжували при 17р-метокси-5а-андростан (170мг) у вигляді безкімнатній температурі протягом 45 хв Суміш після барвної твердої речовини, коеф ТШХ Rf (гекцього миттєво охолоджували розчином ІЧЬЦСІ сан ЕЮАс 8 2) = 0 45 (5мл) Розчинники видаляли, та залишок екстрагуПриклад 7 вали за допомогою ЕЮАс Органічний шар промиЗа-Гідрокси-17р-метокси-Зр-трифторометилвали водою та розсолом Після просушування над 5р-андростан анпдр Розчин MgSO4 фільтрували та випарювали, Розчин 17р-метокси-5р-андростан-3-ону здобуваючи на виході сирий продукт Цей сирий (304мг, 1 ммол) в сухому тетрагідрофурані (20мл) продукт далі розчиняли в малому об'ємі СН2СІ2 та обробляли трифторометилтриметилсиланом (7мл, обробляли на силікагелевій колонці Елюювання з 0 5М в THF, 3 5 ммол), та TBAF (Юмг) при 0°С сумішшю толуол ацетон (4 1) дало на виході 3(3Після помішування при 23°С протягом 2 год суміш (4'-пдрокси-1 '-бутиніл)-3а-пдрокси-17 [3-мето кс и-5азнову охолоджували до 0°С Добавляли розчин андростану (50мг), т п 184 - 186°С, коеф ТШХ Rf TBAF ( 1 M B THF, 3 5мл, 3 5 ммол) Суміш помішу(толуол ацетон 4 1) = 0 35, та після цього - здобували при кімнатній температурі протягом 10 хв, та вали За-(4'-пдрокси-1 '-бутиніл)-3р-пдрокси-17рпісля цього - реакцію гасили миттєвим охолодженметокси-5а-андростан (225мг) у вигляді безбарвням розчином МЬЦСІ (5мл) Розчинники видаляли, ної твердої речовини, т п 185 - 187°С, коеф ТШХ та залишок екстрагували за допомогою ЕЮАс Rf (толуол ацетон 4 1) = 0 24 Органічний шар промивали водою та розсолом Після просушування над анпдр Розчин MgSO4 Приклад 5 фільтрували та випарювали, здобуваючи на вихоЗаа-Пдрокси-^р-метокси-Зр-метил-бааді сирий продукт Цей сирий продукт далі розчиняандростан та Зр-Гідрокси-17р-метокси-За-метилли в малому об'ємі СН2СІ2 та обробляли на силіка5а-андростан гелевій колонці Елюювання з сумішшю Розчин 17р-метокси-5а-андростан-3-ону гексан етил ацетату (91) дало на виході Зр(101 мг, 0 33 ммол) в сухому тетрагідрофурані трифторометил-3а-пдрокси-17р-метокси-5р(20мл) обробляли MeLi (1мл, 1 5М в THF, 1 5 андростан (220мг), т п 122 - 127°С, коеф ТШХ Rf ммол) при -75°С Після помішування при -78°С (гексан ЕЮАс 8 2) = 0 38 протягом 0 5 год, суміш піддавали миттєвому охо лодженню розчином МЬЦСІ (5мл) Розчинники видаляли, та залишок екстрагували за допомогою ЕЮАс Органічний шар промивали водою та розсолом Після просушування над анпдр Розчин MgSO4 фільтрували та випарювали, здобуваючи на виході сирий продукт Цей сирий продукт далі розчиняли в малому об'ємі СН2СІ2 та обробляли на силікагелевій колонці Елюювання з сумішшю толуол ацетон (95 5) дало на виході Зр-метил-Запдрокси-^р-метокси-ба-андростан (35мг), т п 151 - 154°С, Коеф ТШХ Rf (гексан ацетон 7 3) = 0 43, та після цього - За-метил-3р-пдрокси-17р-метокси5а-андростан (30мг) у вигляді безбарвної твердої речовини, коеф ТШХ Rf (гексан ацетон 7 3) = 0 27 Приклад 6 За-пдрокси-17р-метокси-3р-трифторометил5а-андростан та Зр-Гідрокси-17р-метокси-Затрифторометил-5а-андростан Розчин 17р-метокси-5а-андростан-3-ону (220мг, 0 75 ммол) в сухому тетрагідрофурані (20мл) обробляли трифторометилтриметилсиланом (Змл, 0 5М в THF, 1 5 ммол), та тетрабутиламонію фторидом (TBAF) (Юмг) при 0°С Після помішування при 23°С протягом 2 год, суміш знову охолоджували до 0°С Добавляли розчин TBAF ( 1 M B THF, 2мл, 2 ммол) Суміш помішували при кімнатній температурі протягом 10 хв, погасивши реакцію миттєвим охолодженням розчином ІЧЬЦСІ (5мл) Розчинники видаляли, та залишок екстрагували за допомогою ЕЮАс Органічний шар промивали водою та розсолом Після просушування над анпдр Розчин MgSO4 фільтрували та випарювали, здобуваючи на виході сирий продукт Цей сирий продукт далі розчиняли в малому об'ємі СН2СІ2 та Приклад 8 За-Гідрокси-^р-метокси-бр-андростан Розчин 17р-метокси-5р-андростан-3-ону (130мг, 0 42 ммол) в сухому тетрагідрофурані (15мл) обробляли ЛІТІЙ три(три-бутокси)алюмшію гідридом (1 мл, 1 M B THF, 1 ммол) при -73°С Після помішування при -75°С протягом 3 год та після цього - при -10°С протягом 1 5 год - суміш піддавали миттєвому охолодженню розчином NaOH (1N, 2мл) Розчинники видаляли, та залишок екстрагували за допомогою ЕЮАс Органічний шар промивали водою та розсолом Після просушування над анпдр Розчин MgSO4 фільтрували та випарювали, здобуваючи на виході сирий продукт Цей сирий продукт далі розчиняли в малому об'ємі СН2СІ2 та обробляли на силікагелевій колонці Елюювання з сумішшю толуол ацетон (9 1) дало на виході За-пдрокси-^р-метокси-бр-андростан (107мг), т п 151 - 156°С, ТШХ Rf (гексан ацетон 7 3) = 0 18 Приклад 9 17р-(2-Пропшілокси)-5а-андростан-3-он Розчин 17р-пдрокси-5а-андростан-3-ону циклічного 3-(1,2-етандмл ацеталю) (1 03г, 3 ммол) в сухому тетрагідрофурані (20мл) обробляли KOt-Bu (12мл, 1М в THF, 12 ммол) при 23°С Після помішування при 55°С протягом 2 5 год його охолоджували до -50°С Добавляли пропарпл бромід (80%-ий розчин в толуолі, 1 Змл, 11 ммол), і помішування продовжували при 50 - 55°С протягом 2 5 год Розчинники видаляли, та залишок обробляли ацетоном (25мл) Після підкислення суміші за допомогою 2N НСІ и помішували при кімнатній температурі протягом 15 год Суміш нейтралізували 36 35 57706 2N розчином NaOH Розчинники видаляли, і залинічний шар промивали розб НСІ, водою та розсошок екстрагували за допомогою ЕЮАс Органічний лом Після просушування над анпдр Розчин шар промивали водою та розсолом Після просуMgSO4 фільтрували та випарювали, здобуваючи шування над анпдр Розчин MgSO4 фільтрували та на виході сирий продукт Цей сирий продукт далі випарювали, здобуваючи на виході сирий продукт розчиняли в малому об'ємі СН2СІ2 та обробляли Цей сирий продукт далі розчиняли в малому об'ємі на силікагелевій колонці Елюювання з сумішшю СН2СІ2 та обробляли на силікагелевій колонці гексан ацетон (8 2) дало на виході 17р-(2Елюювання з сумішшю гексан ацетон (8 2) дало на пдроксиетокси)-3а-пдрокси-5а-андростан (123мг), виході 17[3-(2-пропінілокси)-5а-андростан-3-он т п 181 - 183°С, коеф ТШХ Rf (гексан ацетон 7 3) (700м г) = 0 31 Приклад 10 Приклад 13 За-Гідрокси-3[3-метил-17[3-(2-пропінілокси)-5аЗр-Етиніл-За-пдрокси-^р-метокси-брандростан та Зр-пдрокси-За-метил-17р-(2андростан пропшілокси)-5а-андростан Розчин 1,2-дибромоетилену (1 бмл, 3 7г, 19 71 ммол) в сухому тетрапдрофурані (Юмл) обробляРозчин 17р-(2-Пропшілокси)-5а-андростан-3ли n-BuLi (16 4мл, 2 4М в THF, 39 4 ммол) при ону (230мг, 0 7 ммол) в сухому тетрапдрофурані 75°С Після помішування при -78°С протягом 0 25 (20мл) обробляли МеІ_і (5мл, 1 M B THF, 5 ммол) год добавляли розчин 17р-метокси-5р-андростанпри -70°С Після помішування при -70°С протягом 3-ону (2г, 6 57 ммол) в THF (20мл), і суміш помішу0 5 год охолоджуючу ванну забирали, і розчин навали при -78°С протягом 15 хв Охолоджуючу вангрівали до 10°С Суміш після цього миттєво охону після цього забирали геть, і суміш піддавали лоджували розчином МЬЦСІ (5мл) Розчинники миттєвому охолодженню розчином МЬЦСІ (Змл) видаляли, і залишок екстрагували за допомогою Розчинники видаляли, і залишок екстрагували за ЕЮАс Органічний шар промивали водою та роздопомогою ЕЮАс Органічний шар промивали солом Після просушування над анпдр Розчин водою та розсолом Після просушування над анMgSO4 фільтрували та випарювали, здобуваючи пдр Розчин MgSO4 фільтрували та випарювали, на виході сирий продукт Цей сирий продукт далі здобуваючи на виході сирий продукт Цей сирий розчиняли в малому об'ємі СН2СІ2 та обробляли продукт далі розчиняли в малому об'ємі СН2СІ2 та на силікагелевій колонці Елюювання з сумішшю обробляли на силікагелевій колонці Елюювання з толуол ацетон (98 2) дало на виході За-пдроксисумішшю толуол ацетон (95 5) дало на виході ЗрЗр-метил-17р-(2-пропшілокси)-5а-андростан етиніл-За-пдрокси-^р-метокси-бр-андростан (40мг), коеф ТШХ Rf (толуол ацетон 95 5) = 0 31, (1 70г) у вигляді безбарвної твердої речовини, т п та після цього - Зр-пдрокси-За-метил-17р-(262 - 65°С, коеф ТШХ Rf (толуол ацетон 95 5) = пропшілокси)-5а-андростан (70мг) у вигляді безба0 23 рвної твердої речовини, ТШХ Rf (гексан ацетон 7 3) = 0 27 Приклад 14 Приклад 11 Зр-(4'-Ацетилфенілетиніл)-За-пдрокси-17метокси-5 р-андростан 17р-[3-(4-Ацетилфеніл)-2-пропшілокси]-Запдрокси-3р-метил-5а-андростан Розчин 4-йодоацетофенону (112мг, 0 45 ммол) та Зр-етиніл-За-пдрокси-^р-метокси-брРозчин 4-йодоацетофенону (16мг, 0 06 ммол), За-пдрокси-Зр-метил-17р-(2-пропшілокси)-5аандростан (150мг, 0 45 ммол) в сухому дегазоваандростану (22мг, 0 06 ммол) в сухому дегазованому триетиламші (1мл) помішували під аргоном ному триетиламші (1мл) помішували під аргоном при 23°С Добавляли біс(трифенілфосфш)паладію при 23°С Добавляли біс(трифенілфосфш)паладію хлорид (5мг) та Cul (5мг), і суміш помішували при хлорид (2мг) та Cul (2мг), і суміш помішували при цій темп, протягом 45 хв Добавляли СН2СІ2 (5мл), цій темп, протягом 45 хв і суміш помішували при 23°С протягом 1 год ТШХ дала 100%-ву конверсію вихідної речовини, після Добавляли СН2СІ2 (4мл), і суміш помішували чого розчинник видаляли, та залишок виділяли за при 23°С протягом 1 год ТШХ дала 100%-ву кондопомогою хроматографії на силікагелевій основі версію вихідної речовини, після чого розчинник Елюювання з гексан ЕЮАс (7 3) дало на виході Зрвидаляли, та залишок виділяли за допомогою (4'-ацетилфенілетиніл)-За-пдрокси-17р-метоксихроматографії на силікагелевій основі Елюювання 5р-андростан (130мг) у вигляді безбарвної твердої з сумішшю гексан ацетон (85 15) дало на виході речовини, т п 189 - 191 °С, коеф ТШХ Rf (гек17р-[3-(4-ацетилфеніл)-2-пропшілокси]-Засан ацетон 4 1)=0,31 пдрокси-3р-метил-5а-андростан (19мг) у вигляді безбарвної твердої речовини, т п 52 - 55°С, ТШХ Приклад 15 Rf (гексан ацетон 85 15) = 0 15 За-Етиніл-Зр-пдрокси-^р-метокси-баПриклад 12 андростан та Зр-Етиніл-За-пдрокси-^р-метокси5а-андростан 17р-(2-Гідроксиетокси)-За-пдрокси-5аандростан Розчин 1,2-дибромоетилену (1 7мл, 21 ммол) в сухому тетрапдрофурані (25мл) обробляли n-BuLi Розчин За-пдрокси-5а-андростан-17-ону цик(16 8мл, 2 5М в THF, 42 ммол) при -65°С Після лічного 17-(1,2-етандмл ацеталю) (166мг, 0 5 помішування при -70°С протягом 0 25 год добавммол) в сухому тетрапдрофурані (Юмл) обробляляли розчин 17р-метокси-5а-андростан-3-ону ли LAH (18мг, 0 5 ммол) та АІСІз (266мг, 2 ммол) (2 128г, 7 ммол) в THF (22мл), і суміш помішували при 23°С Після помішування при 45°С протягом 2 при -78°С протягом ЗО хв Охолоджуючу ванну год, суміш піддавали миттєвому охолодженню після цього забирали геть, і суміш піддавали митрозчином МЬЦСІ (2мл) Розчинники видаляли, і тєвому охолодженню розчином МЬЦСІ (Змл) Роззалишок екстрагували за допомогою ЕЮАс Орга 38 37 57706 чинники видаляли, і залишок екстрагували за доTBAF ( 1 M B THF, 3 5мл, 3 5 ммол) добавляли Супомогою ЕЮАс Органічний шар промивали водою міш помішували при кімнатній температурі протята розсолом Після просушування над анпдр Розгом 10 хв, і після цього реакцію гасили миттєвим чин MgSO4 фільтрували та випарювали, здобуваохолодженням розчином МЬЦСІ (5мл) Розчинники ючи на виході сирий продукт Цей сирий продукт видаляли, і залишок екстрагували за допомогою далі розчиняли в малому об'ємі СН2СІ2 та обробЕЮАс Органічний шар промивали водою та розляли на силікагелевій колонці Елюювання з сумісолом Після просушування над анпдр Розчин шшю толуол ацетон (95 5) дало на виході 3(3MgSO4 фільтрували та випарювали, здобуваючи Етиніл-За-пдрокси-ІУр-метокси-ба-андростан на виході сирий продукт Цей сирий продукт далі (ЮОмг) у вигляді безбарвної твердої речовини, т п розчиняли в малому об'ємі СН2С2 та обробляли на 138 - 145°С, коеф ТШХ Rf (гексан ацетон 7 3) = силікагелевій колонці Елюювання з сумішшю гек0 45, та після цього - За-Етиніл-Зр-пдрокси-17рсан ацетон (9 1) дало на виході За-пдрокси-17рметокси-5а-андростан (1 6г) у вигляді безбарвної метокси-3р-трифторометил-19-нор-5р-андростан твердої речовини (210мг), т п 40 - 42°С, коеф ТШХ Rf (гексан ацетон 7 3) = 0 66 Приклад 16 Зр-Етиніл-За-пдрокси-17р-метокси- 19-нор-5рандростан Розчин 1,2-дибромоетилену (0 9мл, 2 0г, 10 85 ммол) в сухому тетрапдрофурані (Юмл) обробляли n-BuLi (9мл, 2 4М в THF, 21 7 ммол) при -75°С Після помішування при -78°С протягом 0 25 год добавляли розчин 17р-метокси-19-нор-5рандростан-3-ону (1г, 3 62 ммол) в THF (20мл), і суміш помішували при -78°С протягом 20 хв Охолоджуючу ванну після цього забирали геть, і суміш піддавали миттєвому охолодженню розчином МЬЦСІ (Змл) Розчинники видаляли, і залишок екстрагували за допомогою ЕЮАс Органічний шар промивали водою та розсолом Після просушування над анпдр Розчин MgSO4 фільтрували та випарювали, здобуваючи на виході сирий продукт Цей сирий продукт далі розчиняли в малому об'ємі СН2СІ2 та обробляли на силікагелевій колонці Елюювання з сумішшю толуол ацетон (98 2) дало на виході Зр-Етиніл-За-пдрокси-^р-метокси-Юнор-5р-андростан (750мг) у вигляді безбарвної твердої речовини, т п 152 - 154°С, коеф ТШХ Rf (гексан ацетон 7 3) = 0 58 Приклад 17 Зр-(4'-Ацетилфенілетиніл)-За-Гідрокси-17рметокси-19-нор-5р-андростан Розчин 4-йодоацетофенону (117мг, 0 47 ммол) та Зр-Етиніл-За-пдрокси-17р-метокси-19-нор-5рандростану (150мг, 0 47 ммол) в сухому дегазованому триетиламші (1мл) помішували під аргоном при 23°С Добавляли біс(трифенілфосфш)паладію хлорид (5мг) та Cul (5мг), та суміш помішували при цій темп, протягом 45 хв Добавляли СН2СІ2 (5мл) та суміш помішували при 23°С протягом 1 год ТШХ дала 100% конверсію вихідної речовини, після чого розчинник видаляли, і залишок виділяли за допомогою хроматографії на силікагелевій основі Елюювання з сумішшю толуол ацетон (95 5) дало на виході Зр-(4'-ацетилфенілетиніл)-Запдрокси-17р-метокси-19-нор-5р-андростан (105мг) у вигляді безбарвної твердої речовини, т п 148 150°С, коеф ТШХ Rf (гексан ацетон 4 1) = 0 52 Приклад 18 За-Гідрокси-17р-метокси-Зр-трифторометил19-нор-5р-андростан Розчин 17р-метокси-19-нор-5р-андростан-3ону (ЗООмг, 1 08 ммол) в сухому тетрапдрофурані (15мл) обробляли трифторометилтриметилсиланом (5мл, 0 5М в THF, 2 5 ммол), та TBAF (5мг) при 0°С Після помішування при 23°С протягом 2 год, суміш знову охолоджували до 0°С Розчин Приклад 19 3()-Спіро-2'-оксиран-17р-метокси-5аандростан Розчин триметилсульфоксонію йодиду (2 42г, 11 ммол) та KOt-Bu (1 12г, 10 ммол) в сухому тетрапдрофурані (40мл) підігрівали зі зворотним охолодженням протягом 2 год Після охолодження до кімнатної температури добавляли 17р-метокси-5аандростан-3-ону (2 432г, 8 ммол), і суміш помішували при цій температурі протягом 3 год Після цього суміш миттєво охолоджували водою (5мл) Розчинники видаляли, і залишок екстрагували за допомогою ЕЮАс Органічний шар промивали розб НСІ, водою та розсолом Після просушування над анпдр Розчин MgSO4 фільтрували та випарювали, здобуваючи на виході сирий 3(R)-cmpo2'-оксиран-17р-метокси-5а-андростан (2 5г) Сирий продукт після цього використовували для наступної стадії приготування Приклад 20 За-Гідрокси-17р-метокси-Зр-(2-пропшіл)-5аандростан Розчин сирого 3(R)-cnipo-2'-OKcnpaH-17pметокси-5а-андростану (318мг, 1 ммол) та ацетиліду ЛІТІЮ EDA (95%, 485мг, 5 ммол) в DMSO (Юмл) помішували при кімнатній температурі протягом 15 год Після ЦЬОГО реакцію миттєво гасили водою (ЗОмл) та екстрагували ЕЮАс Органічний шар промивали водою та розсолом Після просушування над анпдр Розчин MgSO4 фільтрували та випарювали, здобуваючи сирий продукт Цей сирий продукт далі розчиняли в малому об'ємі СН2СІ2 та виливали на силікагелеву колонку Елюювання зі сумішшю гексан ацетон (8 2) дало За-Гідрокси-17р-метокси-Зр-(2-пропшіл)-5аандростан (200мг), т п 145 - 150°С, ТШХ Rf (гексан ацетон 7 3) = 0 6 Приклад 21 За-Гідрокси-^р-метокси-Зр-метоксиметил-баандростан Розчин сирого 3(R)-cnipo-2'-OKcnpaH-17pметокси-5а-андростану (318мг, 1 ммол) та натрію (29мг, 1 3 ммол) в МеОН (Юмл) нагрівали зі зворотним охолодженням протягом 2 5 год Після цього реакцію миттєво гасили водою (1мл) Розчинники видаляли, і залишок екстрагували за допомогою ЕЮАс Органічний шар промивали водою та розсолом Після просушування над анпдр Розчин MgSO4 фільтрували та випарювали з виходом сирого продукту Цей сирий продукт далі розчиняли в малому об'ємі СН2СІ2 і виливали на силікаге 40 39 57706 леву колонку Елюювання зі сумішшю гекрозчиняли в малому об'ємі СН2СІ2 та обробляли сан ацетон (8 2) дало За-пдрокси-17р-метокси-3рна силікагелевій колонці Елюювання з сумішшю метоксиметил-5а-андростан (230мг), т п 93 - 99°С, гексангацетон (9 1) дало на виході За-пдрокси-2рТШХ Rf (гексан ацетон 7 3) = 0 56 ізопропокси-17р-метокси-5а-андростан (43мг) у вигляді пшоподібної речовини, коеф ТШХ Rf (гекПриклад 22 сан ацетон 7 3) = 0 41 Зр-Хлорометил-За-пдрокси-ІУр-метокси-баандростан Приклад 25 Розчин сирого 3(Р)-спіро-2'-оксиран-17рЗа-Гідрокси-Зр-(4-пдроксибутиніл)-21-(пірид-4метокси-5а-андростану (318мг, 1 ммол), тетрамеілтю)-5р-прегнан-20-он тиламонію хлориду (166мг, 1 5 ммол) та оцтової Розчин 21-бромо-За-пдрокси-Зр-(4кислоти (0 5мл) в диметилфурані (DMF) (Юмл) пдроксибутиніл)-5р-прегнан-20-ону (230мг, 0 494 помішували при 90 - 95°С протягом 2 5 год Його ммол), 4-меркаптопіридину 90% (77мг, 0 618 охолоджували до кімнатної температури і після ммол) та триетиламшу (86мкл, 0 618 ммол) в Юмл цього миттєво гасили реакцію водою (25мл) Після ацетонітрилу помішували при кімнатній темперанейтралізації 2N NaOH суміш екстрагували за дотурі протягом 3 год Суміш було розподілено між помогою EtOAc Органічний шар промивали водою ЕЮАс та водою Органічний шар промивали ната розсолом Після просушування над анпдр Розсич водн розч NaCI, просушеним за допомогою чин MgSO4 фільтрували та випарювали, здобуваNa2SO4 і концентрованим in vacuo Сирий залишок ючи на виході сирий продукт Цей сирий продукт піддавали "миттєвій" колонковій хроматографії далі розчиняли в малому об'ємі СН2СІ2 та обробЕлюювання з 35% - 50%-им ацетоном в СН2СІ2 ляли на силікагелевій колонці Елюювання з сумідало на виході За-Пропокси-Зр-(4шшю гексан ацетон (95 5) дало на виході ЗрГідроксибутиніл)-21-(пірид-4-ілтю)-5р-прегнан-20хлорометил-За-пдрокси-ІУр-метокси-баону (196мг) у вигляді жовтої пшоподібної речовиандростан (138мг), т п 138 - 145°С, коеф ТШХ Rf ни ТШХ R (ацетон СН 2 СІ 2 45 55) = 0 36 (гексан ацетон 8 2) = 0 26 Аналогічно приготовляли Приклад 23 За-пдрокси-21-(пірид-4-ілтю)-5р-прегнан-20он, т п 193 - 195°С, коеф ТШХ Rf (гексан ЕЮАс Зр-Етеніл-За-пдрокси-ІУр-метокси-ба 1 1 ) = 011, андростан Розчин триметилсульфонію йодиду (632мг, 3 1 За-пдрокси-21-(пірид-4-ілтю)-5а-прегнан-20-он, ммол) в сухому тетрапдрофурані (Юмл) оброблят п 154 - 156°С, ТШХ Rf (CH2CI2 ацетон 4 1) = 0 18, ли n-BuLi (2 5M в THF, 3 ммол, 1 2мл) при -5°С За-пдрокси-Зр-метоксиметил-21-(пірид-4Після помішування при 0°С протягом 0 5 год добаілтю)-5а-прегнан-20-он, вляли розчин 3(R)-cmpo-2'-OKCHpaH-17p-MeTOKCH21-(4'-амінофенілтю)-За-пдрокси-Зр5а-андростану (318мг, 1 ммол) в THF (Юмл) Охометоксиметил-5а-прегнан-20-он, т п 150 - 156°С, лоджуючу ванну видаляли, та суміш помішували коеф ТШХ Rf (гексан ЕЮАс 3 1) = 0 045, при кімнатній температурі протягом 2 год Після За-пдрокси-Зр-метоксиметил-21-(4'цього її миттєво охолоджували розчином ІЧЬЦСІ нітрофенілтю)-5а-прегнан-20-он, коеф ТШХ Rf (2мл) Розчинники видаляли, і залишок екстрагу(гексан ЕЮАс 31)= 0 17, вали ЕЮАс Органічний шар промивали водою та 21-(4'-фторофенілтю)-За-пдрокси-Зррозсолом Після просушування над анпдр Розчин метоксиметил-5а-прегнан-20-он, коеф ТШХ Rf MgSO4 фільтрували та випарювали, здобуваючи (гексан ацетон 85 15) = 0 25, на виході сирий продукт Цей сирий продукт далі Зр-Етиніл-За-пдрокси-21 -(пірид-4-ілтю)-5арозчиняли в малому об'ємі СН2СІ2 та обробляли прегнан-20-он, коеф ТШХ Rf (гексан ЕЮАс 1 1) = на силікагелевій колонці Елюювання з сумішшю 0 26, і гексан ацетон (7 3) дало на виході Зр-етеніл-ЗаЗр-(4'-ацетилфеніл)етиніл-За-пдрокси-21пдрокси-17р-метокси-5а-андростан (220мг) у ви(пірид-4-ілтю)-5р-прегнан-20-он, коеф ТШХ Rf (гегляді безбарвної твердої речовини, т п 104 ксан ЕЮАс 2 1) = 0 15 111 °С, ТШХ Rf (гексан ацетон 7 3) = 0 5 Приклад 26 Приклад 24 За-Гідрокси-21-(пірид-4-ілтю)-5р-прегнан-20-он N-метил йодид За-Гідрокси-2р-Ізопропокси-17р-метокси-5аандростан Розчин За-пдрокси-21-(пірид-4-ілтю)-5рРозчин За-пдрокси-2р-ізопропокси-5апрегнан-20-ону (62мг, 0 145 ммол) та 1мл метил йодиду в 5мл ЕЮАс нагрівали до зворотного охоандростан-17-ону 17-диметил ацеталю (приготовлодження протягом кількох годин перед здійсненлений шляхом розриву епоксидних ХІМІЧНИХ зв'язням реакції за допомогою ТШХ Суміш після цього ків 2а,3а-ерокси-5а-андростан-17-ону ізопропоксиохолоджували до кімнатної температури та концедом та подальшої ацеталізацм 17-ону) (490мг, 1 25 нтрували in vacua з виходом сирого залишку Заммол) в сухому тетрапдрофурані (15мл) оброблялишок розтирали до порошкоподібного стану з ли LAH (48мг, 1 33 ммол) та АІСІз (332мг, 2 5 ефіром та висушували під вакуумом, здобуваючи ммол) при -30°С Після помішування при 23°С прона виході За-пдрокси-21-(пірид-4-ілтю)-5р-прегнантягом 1 год розчин піддавали миттєвому охоло20-он N-метил йодид (70мг) у вигляді оранжевої дженню розчином МЬЦСІ (2мл) Розчинники видатвердої речовини ляли, і залишок екстрагували за допомогою ЕЮАс Органічний шар промивали розб НСІ, водою та Приклад 27 розсолом Після просушування над анпдр Розчин За-пдрокси-21-(пірид-4-ілтю)-5а-прегнан-20-он MgSO4 фільтрували та випарювали, здобуваючи N-метил йодид на виході сирий продукт Цей сирий продукт далі Розчин За-пдрокси-21-(пірид-4-ілтю)-5а 42 41 57706 прегнан-20-ону (29мг, 0 068 ммол) та ЮОмкп меміш було розподілено між ЕЮАс та 2N НСІ Оргатил йодиду 5мл THF нагрівали зі зворотним охонічний шар промивали водою, нас водн розч лодженням По 15 хв тверда фаза осаджувалася, і NaCI, просушували Na2SO4 та концентрували m нагрівання зі зворотним охолодженням продовжуvacua до отримання осаду Залишок (осад) розчивалося на протязі кількох наступних годин Далі няли в 5мл СН2СІ2, і добавляли 1 екв бікарбонату суміш охолоджували до кімнатної температури, натрію в 1мл води Суміш помішували протягом ЗО після чого надлишкові метил йодиду давали випахв і після цього концентрували до сухості під виритися Тоді тверду фазу фільтрували, промивши соким вакуумом, видобуваючи на виході Зру холодному THF, здобуваючи на виході ЗаЕтиніл-За-пдрокси-21 -тюетаноат-5р-прегнан-20пдрокси-21 -(пірид-4-ілтю)-5а-прегнан-20-он Nону натрієвої солі (120мг) у вигляді твердої речометил йодиду (26мг) у вигляді світло-оранжевої вини білого кольору, дек > 120°С твердої речовини Аналогічно приготовляли Приклад 28 Зр-етиніл-За-пдрокси-21 -тюпропаноат-5рпрегнан-20-ону натрієву сіль, За -пдрокси-2[3-пропокси-21-(пірит-4-ілтіо)-5апрегнан-20-он N-метил йодид Зр-етиніл-За-пдрокси-21 -тюетансульфонатРозчин За-пдрокси-2р-пропокси-21-(пірид-45р-прегнан-20-ону натрієву сіль, дек > 85°С, коеф ілтю)-5а-прегнан-20-ону (50мг, 0103 ммол) та ТШХ Rf (хлороформ метанол 4 1) = 0 25, ІЗОмкл метил йодиду в 5мл THF нагрівали зі звоЗр-етиніл-За-пдрокси-21 -тюпропансульфонатротним охолодженням протягом кількох годин пе5р-прегнан-20-ону натрієву сіль, коеф ТШХ Rf ред здійсненням реакції за допомогою ТШХ Суміш (хлороформ метанол 4 1) = 0 21, та після цього охолоджували до кімнатної темпераЗа-пдрокси-2р-пропокси-21 тури та концентрували in vacua, здобуваючи Затюпропансульфонат-5а-прегнан-20-ону натрієву пдрокси-2р-пропокси-21-(пірид-4-ілтю)-5а-прегнансіль, коеф ТШХ Rf (хлороформ метанол 85 15) = 20-он N-метил йодид (64мг) у вигляді жовтої твер0 22 дої речовини Приклад 31 Аналогічно приготовляли Зр-Етинліл-За-пдрокси-21-тюетансульфат-5рпрегнан-20-он триметил амонієва сіль За-пдрокси-Зр-метил-21 -(4ітриметиламонійфенокси)-5а-прегнан-20-ону йоРозчин Зр-Етиніл-За-пдрокси-21 пдроксиетилтю-5р-прегнан-20-ону (140мг, 0 335 ДИД, ммол), триоксид сірки триметиламшового компле3a-riflpoKCH-2p-nponoKCH-21-(4'-N,N,Nксу (ЮОмг, 0 736 ммол) та триоксид сірки піридитриметиламонійфенокси)-5а-прегнан-20-ону йонового комплексу (50мг) в 4мл хлороформу помідид, та шували при кімнатній температурі протягом доби За-пдрокси-Зр-метил-21 -(хшолш-6-ілокси)-5аТверду фазу фільтрували, і фільтрат концентрупрегнан-20-он N-метил йодид вали до отримання малого об'єму Залишок піддаПриклад 29 вали обробці на хроматографічній колонці ЕлююЗр-Етиніл-За-пдрокси-21-пдроксиетилтю-5рвання з сумішшю хлороформ метанол 8515 прегнан-20-он дозволило одержати Зр-Етинліл-За-пдрокси-21 Розчин 21-бромо-Зр-Етиніл-За-пдрокси-5ртюетансульфат-5р-прегнан-20-он триметил амоніпрегнан-20-ону (150мг, 0 356 ммол), 2єву сіль (69мг) у вигляді твердої речовини, Dec > меркаптоетанолу (31мкл, 0 445 ммол) та триети120°С ламіну (62мкл, 0 445 ммол) в 5мл THF помішували при кімнатній температурі протягом доби Суміш Приклад 32 після цього розподілили між ЕЮАс та водою ОрЗр-Етиніл-За-Гідрокси-21 -тюпропансульфатганічний шар промивали насич водн розч NaCI, 5р-прегнан-20-он натрієва сіль просушували Na2SO4 та концентрували в вакуумі, Розчин Зр-етиніл-За-пдрокси-21 здобуваючи на виході Зр-етиніл-За-пдрокси-21пдроксипропілтю-5р-прегнан-20-ону (50мг, 0 115 пдроксиетилтю-5р-прегнан-20-он (141мг) у вигляді ммол) та триоксид сірки триметиламшового комбілої твердої речовини, т п 122 - 126°С, ТШХ Rf плексу (19мг, 0 139 ммол) в 0 5мл піридину помі(гексан ацетон 3 1) = 0 11 шували при кімнатній температурі протягом доби Суміш розбавляли хлороформом та промивали 2N Аналогічно приготовляли НСІ, нас водн розч NaCI, просушували Na2SO4 та Зр-Етиніл-За-пдрокси-21-пдроксипропілтю-5рконцентрували in vacuo до отримання сирого запрегнан-20-он, коеф ТШХ Rf (гексан ацетон 3 1) = лишку Залишок піддавали колонковій хроматог0 12, рафії Елюювання з сумішшю хлороформ метанол За-пдрокси-21-пдроксипропілтю-2р-пропокси85 15 дало на виході в Зр-Етиніл-За-Гідрокси-215а-прегнан-20-он, т п 133 - 136°С, коеф ТШХ Rf тюпропансульфат-5р-прегнан-20-ону натрієву сіль (гексан ацетон 3 1) = 0 175, та (20мг) у вигляді твердої речовини, коеф ТШХ Rf За -пдрокси-21 -пдроксиетилтю-5р-прегнан-20(хлороформ метанол 85 15) = 0 12 он.тп 150- 152°С Приклад ЗО Аналогічно приготовляли За-пдрокси-2рЗр-Етиніл-За-пдрокси-21-тюетаноат-5рпропокси-21 -сульфонілпропансульфат-5апрегнан-20-ону натрієва сіль прегнан-20-ону натрієву сіль, ТШХ Rf (хлороформ метанол 85 15) = 0 15 Розчин 21 -бромо-Зр-етиніл-За-пдрокси-брпрегнан-20-ону (150мг, 0 356 ммол), меркаптооцПриклад 33 тової кислоти (31 мкл, 0 445 ммол) та триетиламшу Зр-Етиніл-За-пдрокси-21 (124мкл, 0 89 ммол) в 5мл DMF помішували при пдроксипропілсульфшіл-5р-прегнан-20-он кімнатній температурі протягом кількох годин СуСуспензію Зр-Етиніл-За-пдрокси-21 44 43 57706 пдроксипропілтіо-5р-прегнан-20-ону (90мг, 0 208 пдрокси-5а-андростан-17-он тозилпдразон ммол) та перюдату натрію (~200мг в 0 5мл води) в (1 113г), який використовували без додаткового суміші метанол THF 3 1 помішували, підвищуючи очищення у наступній стадії температуру від 0°С до кімнатної протягом доби б 2-Ізопропокси-За-пдрокси- 5а-андростан Суміш концентрували до отримання малого об'єму До суміші 2р-ізопропокси-3а-пдрокси-5ата розподіляли між ЕЮАс та водою, Органічний андростан-17-он тозилпдразону (ЗООмг), ІЧаВНзСІЧ шар промивали насич водн розч NaCI, просушу(144мг) та р-толуолсульфонової кислоти (ЗОмг) вали Na2SO4 та концентрували in vacuo, здобувадобавляли DMF та сульфолан (1 1,3мл), і здобуту ючи на виході Зр-Етиніл-За-пдрокси-21суміш нагрівали до 110°С протягом 3 год Після пдроксипропілсульфшіл-5р-прегнан-20-ону (83мг) цього добавляли додатковий (надлишковий) об'єм у вигляді пшоподібної речовини, ТШХ Rf (гекІЧаВНзСІЧ (144мг)та р-толуолсульфонової кислоти сан ацетон 2 1) = 0 035 Аналогічно приготовляли (ЗОмг), і суміш підігрівали протягом ще однієї годиЗа-пдрокси-2р-пропокси-21 ни Після ЦЬОГО добавляли воду, і суміш екстрагусульфшілпропансульфонат-5а-прегнан-20-ону вали за допомогою ЕЮАс (2х45мл) Комбіновані натрієву сіль екстракти просушували над Na2SO4, і сирий продукт, здобутий після видалення розчинника, очиПриклад 34 щали за допомогою хроматографії на силікагелеЗр -Етиніл-За-пдрокси-21 вій основі, видобуваючи на виході чистий 2пдроксипропілсульфоніл-5р-прегнан-20-он ізопропокси-За-пдрокси-ба-андростан (37мг), коРозчин Зр-етиніл-За-пдрокси-21 еф ТШХ Rf (ЕЮАс гексан 1 9) = 0 17 пдроксипропілсульфшіл-5р-прегнан-20-ону (65мг, Приклад 37 0 145 ммол), тСРВА 57% - 86% (42мг) та шпатель бікарбонату натрію в 5мл СН2СІ2 помішували, підіЗа-Гідрокси-5р -19-норандростан гріваючи від 0°С до кімнатної температури протяа За-пдрокси-5р-19-норандростан-17-он гом доби Суміш розподіляли між СН2СІ2 та водДо розчину 5р-19-норандростан-3,17-дюну ним розчином бікарбонату натрію Органічний шар (0 76г, 2 77 ммол) в THF (ЗОмл) при -78°С добавпромивали насич водн розч NaCI, просушували ляли розчин ЛІТІЮ триОвгт.-бутокси)алюміній гідриNa2SO4 та концентрували in vacuo до сухості, здоду Суміш реакції після цього виливали в ділильну буваючи на виході Зр-етиніл-За-пдрокси-21воронку, яка містила розчин ІЧЬЦСІ (50мл), і пропдроксипропілсульфоніл-5р-прегнан-20-ону (66мг) дукт екстрагували за допомогою ЕЮАс (Зх50мл) у вигляді твердої речовини білого кольору, ТШХ Rf Комбіновані екстракти просушували над Na2SO4, і (СН2СІ2 ацетон 1 1) = 0 61 після видалення розчинника отримували сирий і продукт, котрий далі очищали за допомогою хроАналогічно приготовляли За-пдрокси-21 -(3 матографії на силікагелевій основі, здобуваючи на пдроксипропілсульфоніл)-2р-пропокси-5а-прегнанвиході чистий За-пдрокси-бр-ІЕЗ-норандростан-і?20-он, коеф ТШХ Rf (гексан ацетон 2 1)= 0 26 он (605мг), т п 159 - 161 °С, коеф ТШХ Rf (гекПриклад 35 сан ацетон 7 3) = 0 ЗО За-пдрокси-21 -(пірид-3-іл)окси-5р-прегнан-20он б За-Гідрокси-5р-19-норандростан До розчину За-пдрокси-5р-19-норандростанДо розчину За-пдрокси-21 -бромо-5р-прегнан17-ону (0 59г, 2 13 ммол) та р20-ону (ЗООмг, 0 76 ммол) в диметилфурані (DMF) толуолсульфонілпдразиду (480мг, 2 6 ммол) до(5мл) добавляли 3-пдроксипіридин (215мг, 2 27 бавляли етанол (2мл), і здобуту суміш нагрівали зі ммол) та К2СО3 (313мг, 2 27 ммол), і видобуту сузворотним охолодженням протягом 5 год Після міш помішували при 25°С протягом 0 5 год цього суміш реакції розчиняли в СН2С2 (ЮОмл) та Суміш реакції після цього виливали в ділильну промивали водою (2х30мл) Далі и просушували воронку, в котрій містилася вода (ЗОмл) і екстрагунад Na2SO4, і, після видалення розчинника m вали за допомогою ЕЮАс (Зх35мл) Комбіновані vacuo, отримували сирий продукт (1 0г) Цей сирий екстраговані фази промивали водою (2х25мл), продукт змішували з ІЧаВІзСІЧ (555мг), рпісля чого просушували над Na2SO4 Після видатолуолсульфоновою кислотою (68мг) та сумішшю лення розчинника in vacua було отримано сирий DMF з сульфоланом (1 1, Юмл), і здобуту таким продукт, котрий очищали за допомогою хроматогчином суміш нагрівали до 130°С протягом 2 год рафії на силікагелевій основі, здобуваючи на виДалі добавляли надлишковий об'єм ІЧаВІзСІЧ ході чистий За-пдрокси-21-(пірид-3-іл)окси-5р(200мг) та р-толуолсульфонової кислоти (ЗОмг), і прегнан-20-он, т п 63 - 66°С, коеф ТШХ Rf суміш нагрівали протягом ще однієї години Після (МеОНСН 2 СІ 2 5 95) = 0 15 цього додавали воду (80мл), і суміш екстрагували Приклад 36 за допомогою ЕЮАс (Зх50мл) Комбіновані екстра2-Ізопропокси-За-пдрокси-5а-андростан кти просушували над Na2SO4, і сирий продукт, а 2-Ізопропокси-За-пдрокси-5а-андростан-17отриманий після видалення розчинника, очищали онтозилпдразон за допомогою хроматографії на силікагелевій осДо суміші 2р-ізопропокси-3а-пдрокси-5анові, здобуваючи на виході чистий За-пдрокси-5рандростан-17-ону (700мг, 2 0 ммол) та р19-норандростан (217мг), т п 129 - 132°С, коеф толуолсульфонпдразиду (450мг, 2 4 ммол) добавТШХ Rf (ЕЮА гексан 1 9) = 0 ЗО ляли етанол (2мл) та здобуту суміш нагрівали зі Приклад 38 зворотним охолодженням протягом 12 год Після цього суміш реакції розчиняли в СН2СІ2 (150мл) та За-Гідрокси-Зр-етиніл-5р -19-норандростан промивали водою (4х45мл) Далі и просушували а 5р-19-Норандростан-3-он над Na2SO4, і, після видалення розчинника In До розчину За-пдрокси-5р-19-норандростану vacua видобували сирий 2-Ізопропокси-За(210мг, 0 8 ммол) в СН2СІ2 (25мл) добавляли 45 NaOAc (100мг, 1 2 ммол) та РСС (520мг, 2 4 ммол), і здобуту суміш помішували при 25°С протягом 1 год Після цього суміш реакції фільтрували крізь Флоризил-фільтр (15г) в воронці Бюхнера після елюювання із розчинником (сумішшю ефіру та СН2СІ2 (1 1, 70мл)) Розчинник після цього видаляли in vacuo, і отриманий таким чином сирий продукт очищали за допомогою хроматографії на силікагелевій основі, здобуваючи на виході чистий 5(3-19-норандростан-З-он (190мг), коеф ТШХ Rf (ЕЮАстексан 5 95) = 0 20 б За-пдрокси-3р-етиніл-5р-19-норандростан До розчину 1,2-дибромоетилену (410мг, 2 2 ммол) добавляли n-BuLi (2 5М, 1 8мл, 4 4 ммол) при -78°С, і проміжну суміш реакції помішували при цій температурі протягом 45 хв Після цього утвореного ЛІТІЄВОГО реагенту по краплинах добавляли розчин 5(3-19-норандростан-З-ону (190мг, 0 73 ммол) в THF (Юмл) Далі суміш реакції вливали в ділильну воронку, яка містила розчин МЬЦСІ (50мл), і продукт екстрагували за допомогою ЕЮАс (Зх40мл) Комбіновані екстракти просушували над Na2SO4, і сирий продукт, отриманий після видалення розчинника, очищали за допомогою хроматографії на силікагелевій основі, здобуваючи на виході чистий За-пдрокси-3р-етиніл-5р19-норандростан (120мг), т п 152 - 154°С, коеф ТШХ Rf (ЕЮА гексан 1 9) = 0 19 Приклад 39 За-Пдрокси-Зр-(4'-ацетилфеніл)етиніл-5р-19норандростан До суміші За-пдрокси-Зр-Етиніл-5р-19норандростану (120мг, 0 42 ммол), 4йодоацетофенону (115мг, 0 46 ммол), біс(трифенілфосфш)паладію(ІІ) хлориду (в об'ємі каталізатора) та йодиду МІДІ(І) (в об'ємі каталізатора), добавляли триетиламш (1 5мл), і здобуту суміш помішували під аргоном протягом 45 хв звикористанням колби, загорнутої в алюмінієву фольгу Після ЦЬОГО добавляли СН2СІ2 (5мл), і реагуючу суміш помішували протягом 3 год Тоді розчинник видаляли in vacua, і залишок очищали за допомогою хроматографії на силікагелевій основі, здобуваючи на виході За-пдрокси-Зр-(4'ацетилфеніл)етиніл-5р-19-норандростан (37мг), коеф ТШХ Rf (ЕЮА гексан 15 85) = 0 2 Приклад 40 За-Ізобутирилокси-17р -метокси-5р-андростан Розчин За-пдрокси-17р-метокси-5рандростану (250мг, 0 82 ммол) в сухому піридині (2мл) обробляли ізобутирил хлоридом (0 12мл, 1 15 ммол) і N.N-диметиламінопіридином (5мг) при 5°С Після помішування при 5 - 10°С протягом 1 год суміш піддавали миттєвому охолодженню розчином НСІ (0 5N, 25мл) Суміш екстрагували за допомогою ЕЮАс Органічний шар промивали розб НСІ, водою та розсолом Після просушування над анпдр Розчин MgSO4 фільтрували та випарювали, здобуваючи на виході сирий продукт Цей сирий продукт далі розчиняли в малому об'ємі СН2СІ2 та обробляли на силікагелевій колонці Елюювання з сумішшю гексан ацетон (9 1) дало на виході За-ізобутирилокси-17р-метокси-5рандростан (266мг), т п 82 - 87°С, коеф ТШХ Rf (гексан ацетон 9 1) = 0 6 Приклад 41 57706 46 За-Гідрокси-21-(пірид-4-ілокси)-5р-прегнан-20он Розчин 21-бромо-3а-пдрокси-5р-прегнан-20ону (500мг, 1 26 ммол), 4-пдроксипіридину (144мг, 1 51 ммол) та триетил аміну (200мкл) в Юмл THF нагрівали зі зворотним охолодженням протягом 4 год Суміш охолоджували до кімнатної температури та розподіляли між ЕЮАс та водою Органічний шар промивали насич водн розч NaCI, просушували MgSO4Ta концентрували in vacua Сирий залишок піддавали колонковій хроматографії Елюювання з 50% ацетоном в СН2СІ2 дало на виході За-пдрокси-21-(пірид-4-ілокси)-5рпрегнан-20-он (40мг) у вигляді маслоподібної твердої речовини, ТШХ Rf (ацетон СН 2 СІ 2 1 1) = 0 28 Приклад 42 За-Гідрокси-30-метил-21-(4'-нітрофенокси)-5апрегнан-20-он Розчин 21-бромо-3а-пдрокси-3р-метил-5апрегнан-20-ону (250мг, 0 61 ммол), 4-нітрофенолу (127мг, 0 912 ммол), триетиламшу (127мкл, 0 912 ммол) та невеликого об'єму йодиду натрію в суміші 2 1 ацетонітрил DMF помішували при нагріванні до -60°С протягом 6 годин Суміш розподіляли між ЕЮАс та сумішшю 1 1 вода нас водн розч бікарбонату натрію Органічний шар промивали 2N НСІ, водою та насич водн розч NaCI, просушували Na2SO4 та концентрували in vacuo Сирий залишок піддавали колонковій хроматографії Елюювання з 20% ацетоном в гексані дало на виході Запдрокси-Зр-метил-21-(4'-нітрофенокси)-5апрегнан-20-он (147мг) у вигляді твердої речовини, т п 169 - 172°С, ТШХ Rf (гексан ацетон 4 1)= 0 35 Аналогічно приготовляли За-пдрокси-Зрметил-21 -(хшолш-6-ілокси)-5а-прегнан-20-он, коеф ТШХ Rf (гексан ацетон 3 1) = 0 22 Приклад 43 21-(4'-Диметиламшофенокси)-За-пдрокси-Зрметил-5а-прегнан-20-он Розчин За-пдрокси-Зр-метил-21-(4'нітрофенокси)-5а-прегнан-20-ону (100мг, 0 213 ммол), формальдегіду (37% водний розчин, 800мл), та 5% Pd/C (30мг, в каталітичному об'ємі) в етанолі поміщали під штучну Нг атмосферу при 53 psi (близько 3,72кг/см2) на вібраторі Парра протягом доби Каталізатор фільтрували, промиваючи ЕЮАс, і фільтрат промивали в ділильну воронку водою та нас водн розч NaCI Органічний шар після цього просушували над Na2SO4 та концентрували in vacuo Сирий залишок піддавали колонковій хроматографії Елюювання з 20%-им ацетоном в гексані дало 21-(4'-диметиламшофенокси)За-пдрокси-3р-метил-5а-прегнан-20-ону (64мг) у вигляді пшоподібної речовини, ТШХ Rf (гексан ацетон 2 1) = 0 55 Аналогічно приготовляли 21 -(4ідиметиламінофенілтю)-3а-пдрокси-3рметоксиметил-5а-прегнан-20-ону, коеф ТШХ Rf (гексан ацетон 3 1) = 0 35 Приклад 44 За -Пдрокси-Зр-метоксиметил-21-^)-(4'нітрофенілсульфшіл)-5а-прегнан-20-он, За-Гідрокси-Зр-метоксиметил-21-(3)-(4'нітрофенілсульфшіл)-5а-прегнан-20-он, і За-пдрокси-Зр-'метоксиметил-21-(4'нітрофенілсульфоніл)-5а-прегнан-20-он 48 47 57706 Розчин За-пдрокси-Зр-метоксиметил-21-(4'пдрокси-За-трифторометил-бр-Ю- норпрегнан, динітрофенілтю)-5а-прегнан-20-ону (120мг, 0 23 калієва сіль ммол), тСРВА 57% - 86% (111 мг), та NaHCO3 Суміш За-пдрокси-3р-трифторометил-5р-19(80мг, 4 екв) в СН2СІ2 помішували з нагріванням норпрегнан-20-ону (1 0г, 2 68 ммол), диметил Lвід 0°С до кімнатної температури протягом 2 год тартрату (1 0г, 5 61 ммол), р-толуолсульфонової Реакцію розподіляли між СН2СІ2 та водн розч кислоти моногідрату (13мг, 0 068 ммол) та тримеІЧаНСОз Органічний шар промивали насич водн тилортоформату (0 35мл) в 15мл толуолу нагріварозч NaCI, після чого просушували Na2SO4 та ли зі зворотним охолодженням при азеотропічноконцентрували in vacuo Сирий залишок піддавали му видаленню води Через 1 год суміші реакції колонковій хроматографії Елюювання з 40% - 50% давали охолонути до кімнатної температури та ЕЮАс в гексані дало на виході спочатку Задобавляли твердий ІЧаНСОз (130мг) Результативпдрокси-Зр-метоксиметил-21-(4'ну суміш розподіляли між насич водн розч нітрофенілсульфоніл-5а-прегнан-20-он (65мг) у ІЧаНСОз та етилацетатом Шар водного розчину вигляді твердої речовини, ТШХ Rf (гексан ЕЮАс ВІДДІЛЯЛИ та ДВІЧІ промивали етил ацетатом (2 х 11) = 0 38, далі - За-пдрокси-Зр-метоксиметил-2120мл) Комбіновані шари етил ацетату промивали (R)-(4'-нlтpoфeнlлcyльфlHlл)-5а-пpeгнaн-20-oн та насич розчином NaCI, просушували (Na2SO4) та За-пдрокси-Зр-метоксиметил-21 -(R)-(4'концентрували in vacua Залишок піддавали хроматографічній обробці (17 5% ацетон/гексан), здонітрофенілсульфшіл)-5а-прегнан-20-он в невизнабуваючи на виході пшоподібну речовину білого ченій ПОСЛІДОВНОСТІ кольору, яку далі розтирали до порошкоподібного Аналогічно приготовляли 21 -(4істану з гексаном, внаслідок чого було отримано фторофеніл)сульфоніл-3а-пдрокси-3рдиметил-ефір у вигляді твердої речовини білого метоксиметил-5а-прегнан-20-он кольору Розчин діефіру в метанолі (2мл) та воді Приклад 45 (1мл) обробляли твердим КОН (78мг), після поміЗа-Гідрокси-Зр -метоксиметил-21-(4'шування протягом доби суміш реакції концентрупіролідинофеніл)сульфоніл-5а-прегнан-20-он вали до сухості, здобуваючи на виході головну Розчин 21-(4'-фторофеніл)сульфоніл-Засполуку у вигляді твердої речовини блідо-жовтого пдрокси-3р-метоксиметил-5а-прегнан-20-ону кольору (ЮОмг, 0 192 ммол) та піролідину (21мкл, 0 25 ммол) в 5мл DMSO нагрівали на масляній бані при Приклад 49 100°С протягом 5 годин, після чого помішували Фармакологічний ефект при кімнатній температурі протягом доби Далі Ефективність та вплив на GRC-ДІЛЯНЦІ добавляли воду, і суміш екстрагували за допомоЕкспериментальні дані in vitro та in vivo свідгою СН2СІ2 Органічну фазу просушували Na2SO4 чать про те, що природні метаболіти прогестерота концентрували in vacuo ну/деоксикортикостерону та їх ПОХІДНІ З ВИСОКИМ ступенем молекулярного притяжіння взаємодіють Залишок піддавали колонковій хроматографії із нововиявленими та специфічними розпізнавашляхом елюювання зі сумішшю гексан ЕЮАс, льними ділянками на GRC, сприяючи проведенню здобуваючи головну сполуку (62мг) у вигляді тверхлоридних ІОНІВ крізь нейронні мембрани, чутливі дої речовини жовтого кольору до GABA (Gee, K W et al, European Journal of Приклад 46 Pharmacology, 136 419-423 (1987), Hamson N L et За-Гідрокси-21-(4'-піридилметилен)-5-рal , J PharmacoL Exp Ther 241 346-353 (1987)) прегнан-20-он Розчин етоксиду натрію, приготовлений з Фахівцям добре відомо, що модуляція зв'язків 35 35 ЗООмг натрію та Юмл етанолу, добавляли до роз[ 3]і-бутилбіциклофосфоротюнату ([ S]TBPS) є чину За-пдрокси-5р-прегнан-20-ону (500мг, 1 57 мірою ефективності та впливу на GRC препаратів, ммол) та піридин-4-карбоксалдепду (165мкл, 1 73 які мають потенційну терапевтичну корисність для ммол) в Юмл етанол через канюлю Суміш інтенлікування стресу, синдрому страху та хвороб, посивно помішували при кімнатній температурі пров'язаних із наступами (Squires, R F , et al, Мої, тягом ЗО годин Тверду фазу осаджували, фільтPharmacoL, 23 326 (1983), Lawrence, L J , et al, рували та промивали етанолом, після чого Biochem Biophys Res Comm, 123 1130-1137 висушували у вакуумі, здобуваючи на виході голо(1984), Wood et al , Pharmacol, Exp Ther, 231 572вну (260м г) 576 (1984)) Для визначення природи модуляції [35S]TBPS - з точки зору впливу на них нейроактиПриклад 47 вних стероїдів - було здійснено декілька експериЗа-пдрокси-21 -(4-піридилметил)-5р-прегнанментів Виявилося, що ці сполуки взаємодіють з 20-он новою ділянкою GRC, котра не має перекриття з Розчин За-пдрокси-21-(4-піридилметилен)-5рбарбітуратом, бензодіазепіном або будь-якими прегнан-20-ону (ЮОмг, 0 245 ммол) в 4мл і етаноіншими відомими досі ділянками До того ж ці сполу, і THF, що містять 20мг 5% Pd/C, піддавали облуки мають високу ефективність та справляють робці воднем з балону і помішували протягом 5 вплив на GRC, задовольняючи чітким структурним годин Каталізатор після цього відфільтровували, і вимогам щодо такої ефективності розчин концентрували in vacuo Залишок піддавали колонковій хроматографії шляхом елюювання зі Процедури для виконання цього аналізу повнісумішшю гексан ацетон, здобуваючи на виході стю обговорені в (1) Gee, K W et al, European головну сполуку (38мг) у вигляді твердої речовини, Journal of Pharmacology, 136 419-423 (1987)), та (2) коеф ТШХ Rf (гексан ацетон 2 1) = 0 28 Gee, et al , Molecular Pharmacology 30 218 (1986) Ці процедури відповідали операціям, опис яких Приклад 48 надається нижче за текстом 20,20-[2',3'-Біс(карбокси)етилендюкси]-За 50 49 57706 Мозок щурів-самців Спрег-Доулі (Spragueприпинено швидким фільтруванням крізь скловоDawley rats) вилучено одразу після того, як тварин локняні фільтри (No 32, Schleicher and Schuell, було позбавлено життя, і тканини кори головного Keene, NH) Пов'язану з фільтруванням радіоактимозку було розтято на льоді Гомогенат P-z приговність було оцінено за допомогою рідинної сцинтовляли аналогічно тому, як було описано у попетиляцюнної спектрометрії Кінетичні дані та криві 35 редніх працях (Gee, et al Molecular Pharmacology залежності "доза - ефект" для сполуки [ S]TBPS 30 218 (1986)) Якщо описувати стисло, тканини аналізувалися шляхом оцінки нелінійної регресії з мозку було гомогенізовано в 0 32М сахарозі, після використанням комп'ютерної обробки в ітеративчого їх піддавали центрифугуванню з прискоренному режимі, що дозволило встановити значення ням 1000 х g протягом 10 хв Супернатант було констант швидкості реакції та ICso (концентрації зібрано та піддано центрифугуванню з прискоренсполуки, при якій відбувається напів-максимальне 35 ням 9000 х g протягом 20 хв Видобутий осад P-z інгібування базального [ 3]ТВРЗ-зв'язування) було суспендовано у вигляді 10% (вихідна ваРІЗНІ сполуки випробовувалися з метою визнага/об'єм) суспензії в 50мМ Na/K-фосфатному бучення їх потенціалу з погляду на спроможність 35 фері (рН 7 4) 200мМ NaCI, з утворенням гомогенамодулювати [ S]TBPS- зв'язування in vitro Ці доту сліди виконувалися у ВІДПОВІДНОСТІ З вище розглянутими процедурами Виходячи з цих ДОСЛІДІВ, Сто мікролітрових (мл) порцій гомогенату Рг автори встановили структурно-ефективні вимоги (0 5 міліграму (мг) білку) було шкубовано з 2 нано(норми) до конкретного впливу цих сполук на GRC, молями (нМ) [35S]TBPS (70 - 110 кюрі/мілімоль, а також розробили їх рангову класифікацію за New England Nuclear, Boston, MA) в присутності впливом та ефективністю Експериментальні дані, або за відсутністю природних стероїдів чи їх синотримані внаслідок цих ДОСЛІДІВ ДЛЯ ряду похідних тетичних похідних, що підлягають тестуванню За-пдроксипрегнан-20-ону розглядалися у П К У Тестовувані сполуки розчиняли в диметилсульфота ш , European Journal of Pharmacology, 136 419ксиді (Baker Chem Co , Philhpsburg, NJ) та дода423 (1987) та в U S Patent No 5,232,917 В Табл 1 вали до культивованої (шкубованої) суміші порціпоказані значення ICso та максимального показниями по 5мкл Остаточний об'єм культивованої ка інгібування (ІМАХ) для численних сполук, вклюсуміші довели до 1мл за допомогою буфера Нечаючи ті приклади, які розкриті та сформульовані в специфічний ХІМІЧНИЙ зв'язок визначався як зв'язок цьому винаході ICso визначено як концентрацію в присутності 2мм TBPS Ефект та специфічність сполук, що забезпечує 50%-ове інгібування контGABA (Sigma Chem Co , St Louis, MO) було оцірольного [353]ТВРЗ-зв'язування Цей показник вінено через виконання усіх аналізів в присутності дображає ступінь впливу сполук in vitro МаксимаGABA, плюс (+)бікукулш (Sigma Chem Co) Кульльне інгібування відображає ефективність сполук тивування (інкубація) відбувалося при 25°С протяin vitro гом 90 хв (у стабільних стійких умовах) та було 51 52 57706 Таблиця І СПОЛУКА ІСво (иМЇ І МАХ (%) ЗМ4'-Меїилфенш)етинал-За-гіярокси- 1?р-метокси-19-нор-5р-андростан а 96 За-гідрокш-^ніротюкш-21Чпірид-4-їлтіо)-5а~прегнан-ЕЮ-ш 14 98 За-гідажси-ЗН4-гШрсжси6ушн1л)-21ЧгййіД-4-ттіо)-5р-н^іетшм-20-он 15 100 3JH4 '-Ацеталфе^я)е™мл-Зй-гицз(жси-17|І~метокси-5|ї^індоостЕИ 20 104 За-лдрсжси'21 '{пірид-4-!лтю)-5аг- прегнан-20-он 23 93 ЗрЧ4'-Пдрою^%тин-1ЧлЬЗсе
ДивитисяДодаткова інформація
Назва патенту англійськоюNeuroactive steroids of the androstane and pregnane series, a method for treatment (variants)
Автори англійськоюHogenkamp Derk J
Назва патенту російськоюНейроактивные стероиды ряда андростанов и прегнанов, фармацевтическая композиция и способ лечения (варианты)
Автори російськоюХОГЕНКАМП Дерк Дж.
МПК / Мітки
МПК: C07J 41/00, A61P 25/00, C07J 31/00, C07J 17/00, C07J 21/00, C07J 1/00, C07J 43/00, A61K 31/565
Мітки: нейроактивні, фармацевтична, лікування, спосіб, андростанів, варіанти, ряду, композиція, прегнанів, стероїди
Код посилання
<a href="https://ua.patents.su/40-57706-nejjroaktivni-sterodi-ryadu-androstaniv-ta-pregnaniv-farmacevtichna-kompoziciya-i-sposib-likuvannya-varianti.html" target="_blank" rel="follow" title="База патентів України">Нейроактивні стероїди ряду андростанів та прегнанів, фармацевтична композиція і спосіб лікування (варіанти)</a>
Попередній патент: Спосіб розспорядження снарядів
Наступний патент: Спосіб отримання штаби з сталі, яка формується
Випадковий патент: Багатоступінчаста ракета легкого класу для пуску з пускової установки ракети середнього класу