4-заміщені похідні феноксифенілоцтової кислоти
Формула / Реферат
1. Сполука загальної формули (І):
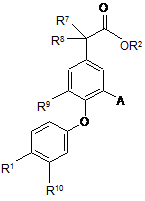 (I)
(I)
або її сіль, в якій:
R1 є Ar1-L1-W-L2-;
L2 є -(CRcRd)m-;
W є -CONR3a- або -NR3bCO-;
R3a та R3b кожний є Н або метил;
L1 є -(CRaRb)n-, -(СН=СН)- або -O(CRaRb), за умови, що, коли
W є -NR3bCO-, тоді L1 не є -(СН=СН)-;
n та m незалежно є 0, 1 або 2;
кожний Ra, Rb, Rc та Rd незалежно є Н, F, ОН, метил або циклопропіл, або Ra та Rb або Rc та Rd разом з вуглецем, до якого вони прикріплені, утворюють циклопропільне кільце;
Аr1 є феніл або нафтил, кожний з яких незаміщений або заміщений одним або більше замісниками, незалежно вибраними з F, Сl, CN, CF3, CHF2, CH2F, SF5, метилу, етилу, циклопропілу, t-бутилу або OMe, або Аr1 є 1,2,3,4-тетрагідронафтил, незаміщений або заміщений метоксигрупою,
за умови, що, коли Аr1 є нафтил або 1,2,3,4-тетрагідронафтил, тоді n є 0;
R2 є Н, С1-С6алкіл, залишок амінокислоти чи дипептид або CHRe(CH2)qRf;
q є від 1 до 6;
Re є Н, метил або етил;
Rf є NRgRh, де Rg та Rh кожний незалежно представляє атом водню або С1-С4алкільну групу, або Rg та Rh разом з атомом азоту, до якого вони прикріплені, утворюють 5-6-членне гетероциклічне кільце, яке необов'язково містить другий кільцевий гетероатом, вибраний з N та О, причому згадане гетероциклічне кільце необов'язково заміщене однією або більше групами, незалежно вибраними з С1-С6алкілу;
А є CN, CH2NH2, CH2NR4aC(=O)R5 або CH2NR4bSO2R6, Сl, ОМе, (1-4С)алкіл, циклопропіл, Н, F, Br, CH2NH(1-4Cалкіл), CH2N(1-4Cалкіл)2, тієніл або феніл, незаміщений або заміщений SO2Me;
R4a та R4b кожний є Н або метил;
R5 є С1-С6алкіл, С1-С6алкокси, С3-С6циклоалкіл, hetAr1 або Аr2;
R6 є С1-С6алкіл, NH(C1-C6алкіл), N(C1-C6алкіл)2, Аr3 або hetAr2;
hetAr1 є 6-членний гетероарил, незаміщений або заміщений однією або більше групами, незалежно вибраними з атома галогену та групи формули -NR5aR5b, в якій кожний з R5a та R5b незалежно представляє атом водню або (1-4С)алкільну групу або разом з атомом азоту, до якого вони прикріплені, утворюють піролідинільну, піперидинільну або морфоліногрупу;
hetAr2 є 5-6-членний гетероарил, незаміщений або заміщений однією або більше групами, незалежно вибраними з С1-С4алкілу;
Аr2 є феніл, незаміщений або заміщений однією або більше групами, незалежно вибраними з атома галогену, CN, SF5, циклопропілу, С1-С4алкільної групи, С1-С4алкоксигрупи та фторС1-С4алкільної групи;
Аr3 є таким, як визначено для Аr2;
R7 та R8 незалежно є Н, метил або F;
R9 є Н або метил; та
R10 є Н або F.
2. Сполука за п. 1, яка відрізняється тим, що має формулу Іа
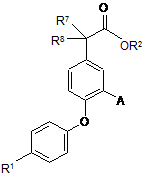 , Іa
, Іa
в якій
R1 є Ar1-L1-W-L2-;
L2 є -(CRcRd)m-;
W є -CONR3a- або -NR3bCO-;
R3a та R3b кожний є Н або метил;
L1 є - (CRaRb)n-, -(CH=CH)- або -O(CRaRb)-, за умови, що, коли
W є -NR3CO-, тоді L1 не є - (СН=СН)-;
n та m незалежно є 0, 1 або 2;
кожний Ra, Rb, Rc та Rd незалежно є Н, F, метил або циклопропіл, або Ra та Rb чи Rc та Rd разом з вуглецем, до якого вони прикріплені, утворюють циклопропільне кільце;
Аr1 є феніл або нафтил, кожний з яких незаміщений або заміщений одним або більше замісниками, незалежно вибраними з F, Сl, CN, CF3, CHF2, CH2F, SF5, метилу, етилу та циклопропілу, за умови, що, коли Аг1 є нафтил, тоді n є 0;
R2 є Н, С1-С6алкіл, залишок амінокислоти або дипептиду або CHRe(CH2)qRf;
q є від 1 до 6;
Re є Н, метил або етил;
Rf є NRgRh, де Rg та Rh кожний незалежно представляє атом водню або С1-С4алкільну групу, або Rg та Rh разом з атомом азоту, до якого вони прикріплені, утворюють 5-6-членне гетероциклічне кільце, яке необов'язково містить другий кільцевий гетероатом, вибраний з N та О, причому згадане гетероциклічне кільце необов'язково заміщене однією або більше групами, незалежно вибраними з С1-С6алкілу;
А є CN, CH2NH2, CH2NR4aC(=O)R5, CH2NR4bSO2R6, Сl, ОМе, (1-4С)алкіл або циклопропіл;
R4a та R4b кожний є Н або метил;
R5 є С1-С6алкіл, С1-С6алкокси, С3-С6циклоалкіл, hetAr1 або Аr2;
R6 є С1-C6алкіл, NH(C1-C6алкіл), N(C1-C6алкіл)2, Аr3 або hetAr2;
hetAr1 є 6-членний гетероарил, незаміщений або заміщений однією або більше групами, незалежно вибраними з атома галогену та групи формули -NR5aR5b, в якій кожний з R5a та R5b незалежно представляє атом водню або (1-4С)алкільну групу або разом з атомом азоту, до якого вони прикріплені, утворюють піролідинільну, піперидинільну або морфоліногрупу;
hetAr2 є 5-6-членний гетероарил, незаміщений або заміщений однією або більше групами, незалежно вибраними з С1-С4алкілу;
Аr2 є феніл, незаміщений або заміщений однією або більше групами, незалежно вибраними з атома галогену, CN, SF5, циклопропілу, С1-С4алкільної групи, С1-С4алкоксигрупи та фторС1-С4алкільної групи;
Аr3 є таким, як визначено для Аr2; та
R7 та R8 незалежно є Н або метил.
3. Сполука за пп. 1 або 2, яка відрізняється тим, що -L1-W-L2- вибирають з -CONH-, -CH2CONH-, -CH2CH2CONH-, -CONHCH2-, -CH2CONHCH2-, -NHCO-, -CH2NHCO-, -NHCOCH2-, -CH2CH2NHCO-, -CH2NHCOCH2-, -CH2CH2NHCOCH2-, CH2N(CH3)COCH2-, циклопропіліденСН2NНСО, -CH2ONHCO-, CH(OH)CH2NHCO- та -циклопропілідинNНСО-.
4. Сполука за будь-яким із пп. 1-3, яка відрізняється тим, що Аr1 є нафтильна група або фенільна група, незаміщена або заміщена одним або двома замісниками, незалежно вибраними з F, Сl, CF3, ОМе, Me та t-Bu, або 1,2,3,4-тетрагідронафтильна група, незаміщена або заміщена ОМе.
5. Сполука за п. 4, яка відрізняється тим, що Аr1 є нафтил, феніл, 4-фторфеніл, 3,4-дифторфеніл, 2-хлорфеніл, 3-хлорфеніл, 4-хлорфеніл, 3,4-дихлорфеніл, 4-хлор-3-фторфеніл, 3-хлор-4-фторфеніл, 4-трифторметилфеніл, 3-фтор-4-трифторметилфеніл, 3-трифторметилфеніл, 2,6-дихлорфеніл, 2,4-дихлорфеніл, 3-метоксифеніл, 4-метоксифеніл, 4-тертбутилфеніл, 3-фторфеніл та 4-метилфеніл, 1,2,3,4-тетрагідронафт-2-ил або 6-метокси-1,2,3,4-тетрагідронафт-2-ил.
6. Сполука за будь-яким із пп. 1-5, яка відрізняється тим, що 6-членна гетероарильна група в hetAr1 є піридильна група та 5-6-членний гетероарил в hetАr2 є імідазолільна або піридильна група.
7. Сполука за п. 6, яка відрізняється тим, що R5 є С1-С6алкіл; С1-С6алкокси; С3-С6циклоалкіл; піридин, незаміщений або заміщений атомом галогену, або група формули -NR5aR5b, в якій кожний з R5a та R5b незалежно представляє атом водню або (1-4С)алкільну групу або разом з атомом азоту, до якого вони прикріплені, утворюють піролідинільну, піперидинільну або морфоліногрупу; або фенольна група, незаміщена або заміщена одним або двома атомами галогену, та R6 є С1-С6алкіл, NH(C1-C6алкіл), N(С1-C6алкіл)2, фенільна група, незаміщена або заміщена одним або двома атомами галогену, піридил або імідазоліл, незаміщений або заміщений С1-С3алкільною групою.
8. Сполука за п. 7, яка відрізняється тим, що R5 є метил, метокси, циклогексил, пірид-2-ил, пірид-3-ил, пірид-4-ил, 6-хлорпірид-3-ил, 6-амінпірид-3-ил, 6-піролідин-1-ілпірид-3-ил або 4-фторфеніл та R6 є метил, диметиламін, 4-фторфеніл, 2,4-дихлорфеніл, пірид-3-ил, 1-метилімідазол-5-іл або 6-диметиламінпірид-3-ил.
9. Сполука за пп. 1-5, в якій А вибирають з ціано, ацетамідметилу, циклогексиламідметилу, метоксикарбоніламінметилу, піколінамідметилу, нікотинамідметилу, ізонікотинамідметилу, 6-хлорпірид-3-іламідметилу, 6-амінпірид-3-іламідметилу, 6-піролідин-1-ілпірид-3-иламідметилу, 4-фторбензамідметилу, метилсульфонамідметилу, N,N-диметилсульфамоїламіну, 4-фторфенілсульфонамідметилу, 2,4-дихлорфенілсульфонамідметилу, 1-метилімідазол-5-ілсульфонамідметилу, пірид-3-илсульфонамідметилу, 6-диметиламінпірид-3-иламідметилу, 2-(4-фторфенілсульфонамід)ацетамідметилу, диметиламінметилу, (N-метилметилсульфонамід)метилу, Н, F, Вr, Сl, метилу, етилу, циклопропілу, CH2NH2, CH2NMe2, тієнілу, фенілу, 3-метилсульфонілфенілу та 4-метилсульфонілфенілу.
10. Сполука за п. 9, яка відрізняється тим, що А вибирають з ціано, ацетамідметилу, циклогексиламідметилу, метоксикарбоніламінметилу, піколінамідметилу, нікотинамідметилу, ізонікотинамідметилу, 4-фторбензамідметилу, метилсульфонамідметилу, N,N-диметилсульфамоїламіну, 4-фторфенілсульфонамідметилу, 2,4-дихлорфенілсульфонамідметилу, пірид-3-илсульфонамідметилу, 6-диметиламінпірид-3-иламідметилу, 2-(4-фторфенілсульфонамід)ацетамідметилу, диметиламінметилу, (N-метилметилсульфонамід)метилу, Н, F, Вr, Сl, метилу, етилу, циклопропілу, CH2NH2, CH2NMe2, тієнілу, SO2Me, фенілу, 3-метилсульфонілфенілу та 4-метилсульфонілфенілу.
11. Сполука за будь-яким із пп. 1-10, яка відрізняється тим, що R2 є водень.
12. Сполука за будь-яким із пп. 1-11, яка відрізняється тим, що R7 тa R8є H.
13. Сполука за будь-яким із пп. 1 або 3-12, яка відрізняється тим, що R9 є Н.
14. Сполука за будь-яким із пп. 1 або 3-13, яка відрізняється тим, що R10є H.
15. Фармацевтична композиція, яка містить сполуку формули (І) за будь-яким із пп. 1-14 або її фармацевтично прийнятну сіль та фармацевтично прийнятний розріджувач або носій.
16. Спосіб лікування імунологічного порушення у ссавця, який полягає у введенні згаданому ссавцеві терапевтично ефективної кількості сполуки формули (І) за будь-яким із пп. 1-14 або її фармацевтично прийнятної солі.
17. Спосіб за п. 16, який відрізняється тим, що імунологічне порушення вибирають із запальних станів, імунних порушень, астми, алергічного риніту, екземи, псоріазу, атопічного дерматиту, лихоманки, сепсису, систематичного червоного вовчака, діабету, ревматоїдного артриту, множинного склерозу, атеросклерозу, відторгнення трансплантата, запального захворювання кишок, раку, вірусної інфекції, тромбозу, фіброзу, гіперемії, хвороби Крона (Crohn), виразкового коліту, хронічного обструктивного захворювання легенів, запалення, болю, кон'юнктивіту, закупорки носового каналу та кропивниці.
18. Сполука формули (І) за будь-яким із пп. 1-14 або її фармацевтично прийнятна сіль для застосування у лікуванні.
19. Застосування сполуки формули (І) за будь-яким із пп. 1-14 або її фармацевтично прийнятної солі у виготовленні медикаменту для лікування імунологічного порушення.
20. Спосіб одержання сполуки за будь-яким із пп. 1-14, який включає:
(a) для сполуки формули (І), в якій А є CN, R7 та R8 незалежно є Н або Me та R10 є Н або F, реагування відповідної сполуки, що має формулу:
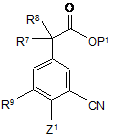 , (II)
, (II)
в якій Р1 представляє атом водню або карбоксильну захисну групу, a Z1 представляє відхідний атом або групу, з відповідною сполукою, що має формулу
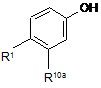 , (III)
, (III)
в якій R10a є Н або F, у присутності основи; або
(b) для сполуки формули (І), в якій А є -CH2NH2, R10 є Н, a R7 та R8 незалежно є Н або Me, відновлення відповідної сполуки формули (IV)
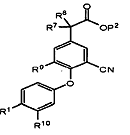 , (IV)
, (IV)
в якій Р2 є таким, як визначено для Р1; або
(c) для сполуки формули (І), в якій А є -CH2NH2, R7 та R8 незалежно є Н або Me, a R10 є Н, розщеплення відповідної сполуки формули (V)
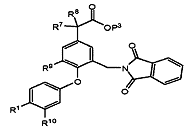 , (V)
, (V)
в якій Р3 є таким, як визначено для Р1; або
(d) для сполуки формули (І), в якій А є CH2NR4C(=O)R5 або CH2NR4SO2R6, R7 та R8 незалежно є Н або Me, a R10 є Н, реагування відповідної сполуки формули (VI)
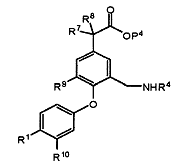 , (VI)
, (VI)
в якій Р4 є таким, як визначено для Р1; зі сполукою формули R5COZ2 або R6SO2Z3, в якій Z2 та Z3 кожний представляє відхідний атом або групу; або
(e) для сполуки формули (І), в якій R7 та R8 незалежно є Н або Me, a R10 є Н, зв'язування сполуки формули (VII)
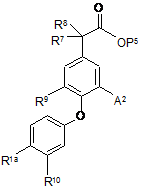 , (VII)
, (VII)
в якій Р5 є таким, як визначено для Р1, А2 представляє А або її захищену форму, a R1a представляє Н-Ха-L2-, в якій Xа представляє HN або ОС(=О), або його реакційноздатну похідну; зі сполукою формули (VIII)
Ar1-L1-Xb-H, (VIII)
в якій Xb є С(=О)О або NH, або його реакційноздатну похідну; або
(f) для сполуки формули (І), в якій А є Н, F або Сl, R7 та R8 незалежно є Н або Me, a R10 є Н, зв'язування відповідної сполуки, що має формулу (IX)
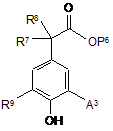 , (IX)
, (IX)
в якій А3 є Н, F або Сl, а Р6 є таким, як визначено для Р1, з відповідною сполукою, що має формулу (X)
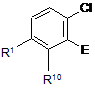 , (X)
, (X)
в якій Е є групою, що вивільняє електрон, у присутності основи; та, за бажанням, видалення згаданої групи, що вивільняє електрон; або
(g) для сполуки формули (І), в якій А є ОМе або (1-4С)алкіл, R7 та R8 незалежно є Н або Me, a R10 є Н, зв'язування відповідної сполуки, що має формулу (XI)
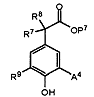 , (XI)
, (XI)
в якій А4 є відповідно ОМе або (1-4С)алкіл, а Р7 є таким, як визначено для Р1, з відповідною сполукою, що має формулу (XII)
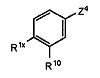 , (XII)
, (XII)
у присутності основи, в якій Z4 представляє відхідний атом або групу, a R1x представляє групу, що вивільняє електрон, здатний до перетворення на групу R1; або
(h) для сполуки формули (І), в якій А є Вr або циклопропіл, R7 та R8 є Н, a R10 є Н, зв'язування відповідної сполуки, що має формулу (XIV)
 , (XIV)
, (XIV)
в якій Z5 є відхідна група або атом, зі сполукою, що має формулу (XV)
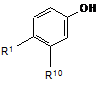 , (XV)
, (XV)
у присутності основи з подальшим перетворенням карбонільної групи на карбоксильну групу; або
(і) для сполуки формули (І), в якій А є метил, тієніл, феніл або феніл, заміщений SO2Me, R9 є Н, R7 та R8 незалежно є Н або Me, a R10 є Н, реагування відповідної сполуки, що має формулу (XVI)
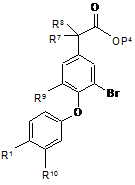 , (XVI)
, (XVI)
зі сполукою, що має формулу A5-ZnX, у присутності каталізатора паладію (0), або зі сполукою, що має формулу А5В(ОН)2, у присутності основи та каталізатора паладію (0), в якій А5 є метил, тієніл, феніл або феніл, заміщений SO2Me, a X є галід; або
(j) для сполуки формули (І), в якій R7 є F, R8 є Н, a R10 є Н, обробляння відповідної сполуки, що має формулу (XVII)
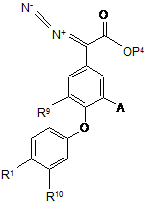 , (XVII)
, (XVII)
фторидом водню; та
видалення будь-якої захисної групи або груп і, за бажанням, утворення солі.
21. Сполука за п. 1, що вибирана з групи:
2-(4-(4-(3,4-дихлорбензамід)фенокси)-3-((4-фторфенілсульфонамід)метил)феніл)оцтової кислоти;
2-(4-(4-(3,4-дихлорбензамід)фенокси)-3-метилсульфонамідометил)феніл)оцтової кислоти;
2-(4-(4-(3,4-дихлорбензамід)фенокси)-3-((2,4-дихлорфенілсульфонамідо)метил)феніл)оцтової кислоти;
2-(4-(4-(3,4-дихлорбензамід)фенокси)-3-(нікотинамідметил)феніл)оцтової кислоти;
2-(4-(4-(3,4-дихлорбензамід)фенокси))-3-((N,N-диметилсульфамоїламін)метил)феніл)оцтової кислоти;
2-(4-(4-(3,4-дихлорбензамід)фенокси)-3-(метилсульфонамідометил)феніл)оцтової кислоти;
2-(3-(циклогексакарбоксіамідометил)-4-(4-(3,4-дихорбензамід)фенокси)феніл)оцтової кислоти;
2-(3-(ацетоамідметил)-4-(4-(3,4-дихлорбензамід)фенокси)феніл)оцтової кислоти;
2-(4-(4-(3,4-дихлорбензамід)фенокси-3-(ізонікотинамідметил)феніл)оцтової кислоти;
2-(4-(4-(3,4-дихлорбензамід)фенокси)-3-((4-фторбензамідметил)феніл)оцтової кислоти;
2-(4-(4-(3,4-дихлорбензамід)фенокси)-3-(піколінамідметил)феніл)оцтової кислоти;
2-(4-(4-(3,4-дихлорбензамід)фенокси)-3-(метоксикарбоніламін)метил)феніл)оцтової кислоти;
2-(4-(4-(3,4-дихлорбензамід)фенокси)-3-(пуридин-3-сульфонамід)метил)феніл)оцтової кислоти;
2-(4-(4-(3,4-дихлорфенілкарбомоїл)фенокси)-3-(метилсульфонамідметил)феніл)оцтової кислоти;
2-(4-(4-(3,4-дихлорфенетилкарбомоїл)фенокси)-3-(метилсульфонамідметил)феніл)оцтової кислоти ;
2-(3-(метилсульфонамідметил)-4-(4-(нафталеніл-2-ілкарбомоїл)фенокси)феніл)оцтової кислоти ;
2-(4-(4-(4-фторфенілкарбомоїл)фенокси)-3-(метилсульфонамідметил)феніл)оцтової кислоти; 2-(3-(метилсульфонамідметил)-4-(4-(фенетилкарбомоїл)фенокси)феніл)оцтової кислоти;
2-(3-(метилсульфонамідметил)-4-(4-(фенілкарбомоїл)фенокси)феніл)оцтової кислоти;
2-(4-(4-(бензилкарбомоїл)фенокси)-3-(метилсульфонамідметил)феніл)оцтової кислоти;
2-(4-(4-(4-хлорфенілкарбомоїл)фенокси)-3-(метилсульфонамідметил)феніл)оцтової кислоти;
2-(4-(4-(2-(4-хлорбензиламіно)-2-оксіетил)фенокси)-3-(метилсульфонамідметил)феніл)оцтової кислоти;
2-(4-(4-(2-(бензиламіно)-2-оксіетил)фенокси)-3-(метилсульфонамідметил)феніл)оцтової кислоти;
2-(3-(метилсульфонамідметил)-4-(4-(2-окси-2-(фенетиламіно)етил)фенокси)феніл)оцтової кислоти;
2-(4-(4-(2-(бензил(метил)аміно)-2-оксіетил)фенокси)-3-(метилсульфонамідметил)феніл)оцтової кислоти;
2-(3-(метилсульфонамідметил)-4-(4-(2-окси-2-(феніламіно)етил)фенокси)феніл)оцтової кислоти;
2-(4-(4-бензамідфенокси)-3-((4-фторфенілсульфонамід)метил)феніл)оцтової кислоти;
2-(4-(4-(4-хлорбензамід)фенокси)-3-((4-фторфенілсульфонамід)метил)феніл)оцтової кислоти;
2-(4-(4-(3-хлорбензамід)фенокси)-3-((4-фторфенілсульфонамід)метил)феніл)оцтової кислоти;
2-(4-(4-(3,4-дифторбензамід)фенокси)-3-(метилсульфонамідметил)феніл)оцтової кислоти;
2-(4-(4-(2-хлорбензамід)фенокси)-3-(метилсульфонамідметил)феніл)оцтової кислоти;
2-(4-(4-(3,4-дихлорбензамід)фенокси)-3-метоксифеніл)оцтової кислоти;
2-(4-(4-(бензилоксикарбомоїл)фенокси)-3-(метилсульфонамідметил)феніл)оцтової кислоти;
2-(3-хлор-4-(4-(4-хлорфенілкарбомоїл)фенокси)феніл)оцтової кислоти;
2-(3-ціано-4-(4-(3,4-дихлорбензамід)фенокси)феніл)пропіонової кислоти;
2-(4-(4-(3,4-дихлорбензамід)фенокси)-3-(метилсульфонамідметил)феніл)пропіонової кислоти;
2-(4-(4-(3,4-дихлорбензамід)фенокси)-3-(метилсульфонамідметил)феніл)-2-метилпропіонової кислоти;
2-(3-(метилсульфонамідметил)-4-(4-(4-трифторметил)фенілкарбомоїл)фенокси)феніл)оцтової кислоти;
2-(3-(метилсульфонамідметил)-4-(4-(3-(трифторметил)фенілкарбомоїл)фенокси)феніл)оцтової кислоти;
2-(4-(4-(4-хлор-3-фторфенілкарбомоїл)фенокси)-3-(метилсульфонамідметил)феніл)оцтової кислоти;
2-(4-(4-(3-хлор-4-фторфенілкарбомоїл)фенокси)-3-(метилсульфонамідметил)феніл)оцтової кислоти;
2-(4-(4-(4-хлорфенілкарбомоїл)фенокси)феніл)оцтової кислоти;
2-(4-(4-(4-хлорфенілкарбомоїл)фенокси)-3-фторфеніл)оцтової кислоти;
2-(3-ціано-4-(4-(4-хлорфенілкарбомоїл)фенокси)феніл)оцтової кислоти;
2-(3-ціано-4-(4-(2,4-дихлороксіетилкарбомоїл)фенокси)феніл)оцтової кислоти;
2-(3-бром-4-(4-(2,4-дихлороксіетилкарбомоїл)фенокси)феніл)оцтової кислоти;
2-(4-(4-(4-хлорфенілкарбомоїл)фенокси)3,5-диметилфеніл)оцтової кислоти;
2-(4-(4-(4-хлорфенілкарбомоїл)фенокси)3-метилфеніл)оцтової кислоти;
2-(4-(4-(4-хлорфенілкарбомоїл)фенокси)3-тіофен-2-ілфеніл)оцтової кислоти;
2-(6-(4-(4-хлорфенілкарбомоїл)фенокси)біфеніл-3-іл)оцтової кислоти;
2-(6-(4-(4-хлорфенілкарбомоїл)фенокси)-3'-(метилсульфоніл)біфеніл-3-іл)оцтової кислоти;
2-(4-(4-(4-хлорфенілкарбомоїл)фенокси)-3-циклопропілфеніл)оцтової кислоти;
2-(4-(4-(4-хлорфенілкарбомоїл)феноксі)-3-етилфеніл)оцтової кислоти;
2-(6-(4-(4-хлорфенілкарбомоїл)фенокси)-4'-(метилсульфоніл)біфеніл-3-іл)оцтової кислоти;
2-(3-(метилсульфонамідметил)-4-(4-(3-(трифторметил)оксіетилкарбомоїл)фенокси)феніл)оцтової кислоти;
2-(4-(4-((1-(4-хлорфеніл)циклопропіл)метилкарбомоїл)фенокси)-3-(метилсульфонамідметил)феніл)оцтової кислоти;
2-(4-(4-(4-хлорфенілкарбомоїл)фенокси)-3-(нікотинамідметил)феніл)оцтової кислоти;
2-(4-(4-(4-хлорфенілкарбомоїл)фенокси)-3-(піридин-3-сульфонамід)метил)феніл)оцтової кислоти;
2-(4-(4-(4-хлорфенілкарбомоїл)фенокси)-3-((1-метил-1Н-імідазол-5-сульфонамід)метил)феніл)оцтової кислоти;
2-(4-(4-(4-хлорфенілкарбомоїл)фенокси)-3-((6-диметиламіно)нікотинамід)метил)феніл)оцтової кислоти;
2-(4-(4-(4-хлорфенілкарбомоїл)фенокси)-3-((2-(4-фторфенілсульфонамід)ацетоамід)метил)феніл)оцтової кислоти;
2-(3-((6-амінонікотинамід)метил)-4-(4-(4-хлорфенілкарбомоїл)фенокси)феніл)оцтової кислоти;
2-(4-(4-(4-хлорфенетилкарбомоїл)фенокси)-3-((диметиламіно)метил)феніл)оцтової кислоти;
2-(4-(4-(4-хлорфенілкарбомоїл)фенокси)-3-((N-метилметилсульфонамід)метил)феніл)оцтової кислоти;
2-(3-ціано-4-(4-(оксіетилкарбомоїл)фенокси)феніл)оцтової кислоти;
2-(4-(4-(4-хлорфенілкарбомоїл)-3-(трифторметил)феніл)оцтової кислоти;
2-(4-(4-(4-хлорфенілкарбомоїл)фенокси)-3-ціанофеніл)пропіонової кислоти;
2-(3-ціано-4-(2,4-дихлороксіетилкарбомоїл)фенокси)феніл)пропіонової кислоти;
2-(4-(4-(4-хлорфенілкарбомоїл)-3-метоксифеніл)оцтової кислоти;
2-(3-ціано-4-(4-(2,4-дихлороксіетилкарбомоїл)-3-фторфенокси)феніл)оцтової кислоти;
2-(3-ціано-4-(4-(2,6-дихлороксіетилкарбомоїл)фенокси)феніл)оцтової кислоти;
2-(3-ціано-4-(4-(4-фторфенілкарбомоїл)фенокси)феніл)оцтової кислоти;
2-(3-ціано-4-(4-(3-метоксіоксіетилкарбомоїл)фенокси)феніл)оцтової кислоти;
2-(3-ціано-4-(4-(4-трет-бутилоксіетилкарбомоїл)фенокси)феніл)оцтової кислоти;
2-(3-ціано-4-(4-(4-трифторметилоксіетилкарбомоїл)фенокси)феніл)оцтової кислоти;
2-(3-ціано-4-(4-(3-хлорфенілкарбомоїл)фенокси)феніл)оцтової кислоти;
2-(3-ціано-4-(4-(3-фторфенілкарбомоїл)фенокси)феніл)оцтової кислоти;
2-(3-ціано-4-(4-(4-метоксіоксіетилкарбомоїл)фенокси)феніл)оцтової кислоти;
2-(3-ціано-4-(4-(4-метилоксіетилкарбомоїл)фенокси)феніл)оцтової кислоти;
2-(3-ціано-4-(4-(4-метилоксіетилкарбомоїл)фенокси)феніл)оцтової кислоти;
2-(4-(4-(2-(4-хлорфеніл)-2-гідроксіетилкарбомоїл)фенокси)-3-ціанофеніл)оцтової кислоти;
2-(4-(4-(1-(4-хлорфеніл)циклопропілкарбомоїл)фенокси)-3-ціанофеніл)оцтової кислоти;
2-(3-ціано-4-(4-(2-фенілциклопропілкарбомоїл)фенокси)феніл)оцтової кислоти;
2-(4-(4-(4-хлорфенілкарбомоїл)фенокси)-3-ціанофеніл)-2-фтороцтової кислоти;
2-(4-(4-((1-(4-хлорфеніл)циклопропіл)метилкарбомоїл)фенокси)-3-ціанофеніл)оцтової кислоти;
2-(4-(4-(2-(4-хлорфеніл)циклопропілкарбомоїл)фенокси)-3-ціанофеніл)оцтової кислоти;
2-(3-ціано-4-(4-(1,2,3,4-тетрагідронафтален-2-ілкарбамоїл)фенокси)феніл)оцтової кислоти.
Текст
1. Сполука загальної формули (І): 2 (19) 1 3 гетероатом, вибраний з N та О, причому згадане гетероциклічне кільце необов'язково заміщене однією або більше групами, незалежно вибраними з С1-С6алкілу; 4a 5 А є CN, CH2NH2, CH2NR C(=O)R або 4b 6 CH2NR SO2R , Сl, ОМе, (1-4С)алкіл, циклопропіл, Н, F, Br, CH2NH(1-4Cалкіл), CH2N(1-4Cалкіл)2, тієніл або феніл, незаміщений або заміщений SO2Me; 4a 4b R та R кожний є Н або метил; 5 R є С1-С6алкіл, С1-С6алкокси, С3-С6циклоалкіл, 1 2 hetAr або Аr ; 6 3 R є С1-С6алкіл, NH(C1-C6алкіл), N(C1-C6алкіл)2, Аr 2 або hetAr ; 1 hetAr є 6-членний гетероарил, незаміщений або заміщений однією або більше групами, незалежно вибраними з атома галогену та групи формули 5a 5b 5a 5b NR R , в якій кожний з R та R незалежно представляє атом водню або (1-4С)алкільну групу або разом з атомом азоту, до якого вони прикріплені, утворюють піролідинільну, піперидинільну або морфоліногрупу; 2 hetAr є 5-6-членний гетероарил, незаміщений або заміщений однією або більше групами, незалежно вибраними з С1-С4алкілу; 2 Аr є феніл, незаміщений або заміщений однією або більше групами, незалежно вибраними з атома галогену, CN, SF5, циклопропілу, С1-С4алкільної групи, С1-С4алкоксигрупи та фторС1-С4алкільної групи; 3 2 Аr є таким, як визначено для Аr ; 7 8 R та R незалежно є Н, метил або F; 9 R є Н або метил; та 10 R є Н або F. 2. Сполука за п. 1, яка відрізняється тим, що має формулу Іа O R7 R8 OR2 A O R1 , Іa в якій 1 1 1 2 R є Ar -L -W-L -; 2 c d L є -(CR R )m-; 3a 3b W є -CONR - або -NR CO-; 3a 3b R та R кожний є Н або метил; 1 a b a b L є - (CR R )n-, -(CH=CH)- або -O(CR R )-, за умови, що, коли 3 1 W є -NR CO-, тоді L не є - (СН=СН)-; n та m незалежно є 0, 1 або 2; a b c d кожний R , R , R та R незалежно є Н, F, метил a b c d або циклопропіл, або R та R чи R та R разом з вуглецем, до якого вони прикріплені, утворюють циклопропільне кільце; 1 Аr є феніл або нафтил, кожний з яких незаміщений або заміщений одним або більше замісниками, незалежно вибраними з F, Сl, CN, CF3, CHF2, 96459 4 CH2F, SF5, метилу, етилу та циклопропілу, за умо1 ви, що, коли Аг є нафтил, тоді n є 0; 2 R є Н, С1-С6алкіл, залишок амінокислоти або диe f пептиду або CHR (CH2)qR ; q є від 1 до 6; e R є Н, метил або етил; f g h g h R є NR R , де R та R кожний незалежно представляє атом водню або С1-С4алкільну групу, або g h R та R разом з атомом азоту, до якого вони прикріплені, утворюють 5-6-членне гетероциклічне кільце, яке необов'язково містить другий кільцевий гетероатом, вибраний з N та О, причому згадане гетероциклічне кільце необов'язково заміщене однією або більше групами, незалежно вибраними з С1-С6алкілу; 4a 5 4b 6 А є CN, CH2NH2, CH2NR C(=O)R , CH2NR SO2R , Сl, ОМе, (1-4С)алкіл або циклопропіл; 4a 4b R та R кожний є Н або метил; 5 R є С1-С6алкіл, С1-С6алкокси, С3-С6циклоалкіл, 1 2 hetAr або Аr ; 6 3 R є С1-C6алкіл, NH(C1-C6алкіл), N(C1-C6алкіл)2, Аr 2 або hetAr ; 1 hetAr є 6-членний гетероарил, незаміщений або заміщений однією або більше групами, незалежно вибраними з атома галогену та групи формули 5a 5b 5a 5b NR R , в якій кожний з R та R незалежно представляє атом водню або (1-4С)алкільну групу або разом з атомом азоту, до якого вони прикріплені, утворюють піролідинільну, піперидинільну або морфоліногрупу; 2 hetAr є 5-6-членний гетероарил, незаміщений або заміщений однією або більше групами, незалежно вибраними з С1-С4алкілу; 2 Аr є феніл, незаміщений або заміщений однією або більше групами, незалежно вибраними з атома галогену, CN, SF5, циклопропілу, С1-С4алкільної групи, С1-С4алкоксигрупи та фторС1-С4алкільної групи; 3 2 Аr є таким, як визначено для Аr ; та 7 8 R та R незалежно є Н або метил. 3. Сполука за пп. 1 або 2, яка відрізняється тим, 1 2 що -L -W-L - вибирають з -CONH-, -CH2CONH-, CH2CH2CONH-, -CONHCH2-, -CH2CONHCH2-, NHCO-, -CH2NHCO-, -NHCOCH2-, -CH2CH2NHCO-, CH2NHCOCH2-, -CH2CH2NHCOCH2-, CH2N(CH3)COCH2-, циклопропіліденСН2NНСО, CH2ONHCO-, CH(OH)CH2NHCOта циклопропілідинNНСО-. 4. Сполука за будь-яким із пп. 1-3, яка відрізня1 ється тим, що Аr є нафтильна група або фенільна група, незаміщена або заміщена одним або двома замісниками, незалежно вибраними з F, Сl, CF3, ОМе, Me та t-Bu, або 1,2,3,4тетрагідронафтильна група, незаміщена або заміщена ОМе. 1 5. Сполука за п. 4, яка відрізняється тим, що Аr є нафтил, феніл, 4-фторфеніл, 3,4-дифторфеніл, 2хлорфеніл, 3-хлорфеніл, 4-хлорфеніл, 3,4дихлорфеніл, 4-хлор-3-фторфеніл, 3-хлор-4фторфеніл, 4-трифторметилфеніл, 3-фтор-4трифторметилфеніл, 3-трифторметилфеніл, 2,6дихлорфеніл, 2,4-дихлорфеніл, 3-метоксифеніл, 4метоксифеніл, 4-тертбутилфеніл, 3-фторфеніл та 4-метилфеніл, 1,2,3,4-тетрагідронафт-2-ил або 6метокси-1,2,3,4-тетрагідронафт-2-ил. 5 6. Сполука за будь-яким із пп. 1-5, яка відрізняється тим, що 6-членна гетероарильна група в 1 hetAr є піридильна група та 5-6-членний гетероа2 рил в hetАr є імідазолільна або піридильна група. 5 7. Сполука за п. 6, яка відрізняється тим, що R є С1-С6алкіл; С1-С6алкокси; С3-С6циклоалкіл; піридин, незаміщений або заміщений атомом галогену, 5a 5b 5a або група формули -NR R , в якій кожний з R та 5b R незалежно представляє атом водню або (14С)алкільну групу або разом з атомом азоту, до якого вони прикріплені, утворюють піролідинільну, піперидинільну або морфоліногрупу; або фенольна група, незаміщена або заміщена одним або 6 двома атомами галогену, та R є С1-С6алкіл, NH(C1-C6алкіл), N(С1-C6алкіл)2, фенільна група, незаміщена або заміщена одним або двома атомами галогену, піридил або імідазоліл, незаміщений або заміщений С1-С3алкільною групою. 5 8. Сполука за п. 7, яка відрізняється тим, що R є метил, метокси, циклогексил, пірид-2-ил, пірид-3ил, пірид-4-ил, 6-хлорпірид-3-ил, 6-амінпірид-3-ил, 6 6-піролідин-1-ілпірид-3-ил або 4-фторфеніл та R є метил, диметиламін, 4-фторфеніл, 2,4дихлорфеніл, пірид-3-ил, 1-метилімідазол-5-іл або 6-диметиламінпірид-3-ил. 9. Сполука за пп. 1-5, в якій А вибирають з ціано, ацетамідметилу, циклогексиламідметилу, метоксикарбоніламінметилу, піколінамідметилу, нікотинамідметилу, ізонікотинамідметилу, 6-хлорпірид-3іламідметилу, 6-амінпірид-3-іламідметилу, 6піролідин-1-ілпірид-3-иламідметилу, 4фторбензамідметилу, метилсульфонамідметилу, N,N-диметилсульфамоїламіну, 4фторфенілсульфонамідметилу, 2,4дихлорфенілсульфонамідметилу, 1метилімідазол-5-ілсульфонамідметилу, пірид-3илсульфонамідметилу, 6-диметиламінпірид-3иламідметилу, 2-(4фторфенілсульфонамід)ацетамідметилу, диметиламінметилу, (N-метилметилсульфонамід)метилу, Н, F, Вr, Сl, метилу, етилу, циклопропілу, CH2NH2, CH2NMe2, тієнілу, фенілу, 3метилсульфонілфенілу та 4метилсульфонілфенілу. 10. Сполука за п. 9, яка відрізняється тим, що А вибирають з ціано, ацетамідметилу, циклогексиламідметилу, метоксикарбоніламінметилу, піколінамідметилу, нікотинамідметилу, ізонікотинамідметилу, 4-фторбензамідметилу, метилсульфонамідметилу, N,Nдиметилсульфамоїламіну, 4фторфенілсульфонамідметилу, 2,4дихлорфенілсульфонамідметилу, пірид-3илсульфонамідметилу, 6-диметиламінпірид-3иламідметилу, 2-(4фторфенілсульфонамід)ацетамідметилу, диметиламінметилу, (N-метилметилсульфонамід)метилу, Н, F, Вr, Сl, метилу, етилу, циклопропілу, CH2NH2, CH2NMe2, тієнілу, SO2Me, фенілу, 3метилсульфонілфенілу та 4метилсульфонілфенілу. 11. Сполука за будь-яким із пп. 1-10, яка відрізня2 ється тим, що R є водень. 12. Сполука за будь-яким із пп. 1-11, яка відрізня7 8 ється тим, що R тa R є H. 96459 6 13. Сполука за будь-яким із пп. 1 або 3-12, яка ві9 дрізняється тим, що R є Н. 14. Сполука за будь-яким із пп. 1 або 3-13, яка ві10 дрізняється тим, що R є H. 15. Фармацевтична композиція, яка містить сполуку формули (І) за будь-яким із пп. 1-14 або її фармацевтично прийнятну сіль та фармацевтично прийнятний розріджувач або носій. 16. Спосіб лікування імунологічного порушення у ссавця, який полягає у введенні згаданому ссавцеві терапевтично ефективної кількості сполуки формули (І) за будь-яким із пп. 1-14 або її фармацевтично прийнятної солі. 17. Спосіб за п. 16, який відрізняється тим, що імунологічне порушення вибирають із запальних станів, імунних порушень, астми, алергічного риніту, екземи, псоріазу, атопічного дерматиту, лихоманки, сепсису, систематичного червоного вовчака, діабету, ревматоїдного артриту, множинного склерозу, атеросклерозу, відторгнення трансплантата, запального захворювання кишок, раку, вірусної інфекції, тромбозу, фіброзу, гіперемії, хвороби Крона (Crohn), виразкового коліту, хронічного обструктивного захворювання легенів, запалення, болю, кон'юнктивіту, закупорки носового каналу та кропивниці. 18. Сполука формули (І) за будь-яким із пп. 1-14 або її фармацевтично прийнятна сіль для застосування у лікуванні. 19. Застосування сполуки формули (І) за будьяким із пп. 1-14 або її фармацевтично прийнятної солі у виготовленні медикаменту для лікування імунологічного порушення. 20. Спосіб одержання сполуки за будь-яким із пп. 1-14, який включає: 7 8 (a) для сполуки формули (І), в якій А є CN, R та R 10 незалежно є Н або Me та R є Н або F, реагування відповідної сполуки, що має формулу: O R8 R7 OP1 R9 CN Z1 , (II) 1 в якій Р представляє атом водню або карбокси1 льну захисну групу, a Z представляє відхідний атом або групу, з відповідною сполукою, що має формулу OH R1 R10a , (III) в якій R є Н або F, у присутності основи; або (b) для сполуки формули (І), в якій А є -CH2NH2, 10 7 8 R є Н, a R та R незалежно є Н або Me, відновлення відповідної сполуки формули (IV) 10a 7 96459 8 O R8 R7 OP5 A2 R9 O , (IV) 2 1 в якій Р є таким, як визначено для Р ; або 7 (c) для сполуки формули (І), в якій А є -CH2NH2, R 8 10 та R незалежно є Н або Me, a R є Н, розщеплення відповідної сполуки формули (V) , (V) 3 1 в якій Р є таким, як визначено для Р ; або (d) для сполуки формули (І), в якій А є 4 5 4 6 7 8 CH2NR C(=O)R або CH2NR SO2R , R та R неза10 лежно є Н або Me, a R є Н, реагування відповідної сполуки формули (VI) R1a R10 , (VII) 1 2 в якій Р є таким, як визначено для Р , А предста1a вляє А або її захищену форму, a R представляє а 2 а Н-Х -L -, в якій X представляє HN або ОС(=О), або його реакційноздатну похідну; зі сполукою формули (VIII) 1 1 b Ar -L -X -H, (VIII) b в якій X є С(=О)О або NH, або його реакційноздатну похідну; або (f) для сполуки формули (І), в якій А є Н, F або Сl, 7 8 10 R та R незалежно є Н або Me, a R є Н, зв'язування відповідної сполуки, що має формулу (IX) O R8 5 R7 OP6 R9 A3 OH , (IX) 6 в якій А є Н, F або Сl, а Р є таким, як визначено 1 для Р , з відповідною сполукою, що має формулу (X) Cl 3 E R1 R10 , (VI) 4 1 в якій Р є таким, як визначено для Р ; зі сполукою 5 2 6 3 2 3 формули R COZ або R SO2Z , в якій Z та Z кожний представляє відхідний атом або групу; або 7 8 (e) для сполуки формули (І), в якій R та R неза10 лежно є Н або Me, a R є Н, зв'язування сполуки формули (VII) , (X) в якій Е є групою, що вивільняє електрон, у присутності основи; та, за бажанням, видалення згаданої групи, що вивільняє електрон; або (g) для сполуки формули (І), в якій А є ОМе або (17 8 10 4С)алкіл, R та R незалежно є Н або Me, a R є Н, зв'язування відповідної сполуки, що має формулу (XI) , (XI) 4 7 в якій А є відповідно ОМе або (1-4С)алкіл, а Р є 1 таким, як визначено для Р , з відповідною сполукою, що має формулу (XII) 9 96459 10 N O N+ OP4 , (XII) 4 у присутності основи, в якій Z представляє відхід1x ний атом або групу, a R представляє групу, що вивільняє електрон, здатний до перетворення на 1 групу R ; або (h) для сполуки формули (І), в якій А є Вr або цик7 8 10 лопропіл, R та R є Н, a R є Н, зв'язування відповідної сполуки, що має формулу (XIV) O O R1 R10 Br R9 Z5 , (XIV) в якій Z є відхідна група або атом, зі сполукою, що має формулу (XV) 5 OH R1 R10 , (XV) у присутності основи з подальшим перетворенням карбонільної групи на карбоксильну групу; або (і) для сполуки формули (І), в якій А є метил, тіє9 7 ніл, феніл або феніл, заміщений SO2Me, R є Н, R 8 10 та R незалежно є Н або Me, a R є Н, реагування відповідної сполуки, що має формулу (XVI) O R8 R7 OP4 Br R9 O R1 R10 , (XVI) 5 зі сполукою, що має формулу A -ZnX, у присутності каталізатора паладію (0), або зі сполукою, що 5 має формулу А В(ОН)2, у присутності основи та 5 каталізатора паладію (0), в якій А є метил, тієніл, феніл або феніл, заміщений SO2Me, a X є галід; або 7 8 (j) для сполуки формули (І), в якій R є F, R є Н, a 10 R є Н, обробляння відповідної сполуки, що має формулу (XVII) A R9 , (XVII) фторидом водню; та видалення будь-якої захисної групи або груп і, за бажанням, утворення солі. 21. Сполука за п. 1, що вибирана з групи: 2-(4-(4-(3,4-дихлорбензамід)фенокси)-3-((4фторфенілсульфонамід)метил)феніл)оцтової кислоти; 2-(4-(4-(3,4-дихлорбензамід)фенокси)-3метилсульфонамідометил)феніл)оцтової кислоти; 2-(4-(4-(3,4-дихлорбензамід)фенокси)-3-((2,4дихлорфенілсульфонамідо)метил)феніл)оцтової кислоти; 2-(4-(4-(3,4-дихлорбензамід)фенокси)-3(нікотинамідметил)феніл)оцтової кислоти; 2-(4-(4-(3,4-дихлорбензамід)фенокси))-3-((N,Nдиметилсульфамоїламін)метил)феніл)оцтової кислоти; 2-(4-(4-(3,4-дихлорбензамід)фенокси)-3(метилсульфонамідометил)феніл)оцтової кислоти; 2-(3-(циклогексакарбоксіамідометил)-4-(4-(3,4дихлорбензамід)фенокси)феніл)оцтової кислоти; 2-(3-(ацетоамідметил)-4-(4-(3,4дихлорбензамід)фенокси)феніл)оцтової кислоти; 2-(4-(4-(3,4-дихлорбензамід)фенокси-3(ізонікотинамідметил)феніл)оцтової кислоти; 2-(4-(4-(3,4-дихлорбензамід)фенокси)-3-((4фторбензамідметил)феніл)оцтової кислоти; 2-(4-(4-(3,4-дихлорбензамід)фенокси)-3(піколінамідметил)феніл)оцтової кислоти; 2-(4-(4-(3,4-дихлорбензамід)фенокси)-3(метоксикарбоніламін)метил)феніл)оцтової кислоти; 2-(4-(4-(3,4-дихлорбензамід)фенокси)-3-(пуридин3-сульфонамід)метил)феніл)оцтової кислоти; 2-(4-(4-(3,4-дихлорфенілкарбомоїл)фенокси)-3(метилсульфонамідметил)феніл)оцтової кислоти; 2-(4-(4-(3,4-дихлорфенетилкарбомоїл)фенокси)-3(метилсульфонамідметил)феніл)оцтової кислоти ; 2-(3-(метилсульфонамідметил)-4-(4-(нафталеніл2-ілкарбомоїл)фенокси)феніл)оцтової кислоти ; 2-(4-(4-(4-фторфенілкарбомоїл)фенокси)-3(метилсульфонамідметил)феніл)оцтової кислоти; 2-(3-(метилсульфонамідметил)-4-(4(фенетилкарбомоїл)фенокси)феніл)оцтової кислоти; 2-(3-(метилсульфонамідметил)-4-(4(фенілкарбомоїл)фенокси)феніл)оцтової кислоти; 2-(4-(4-(бензилкарбомоїл)фенокси)-3(метилсульфонамідметил)феніл)оцтової кислоти; 11 2-(4-(4-(4-хлорфенілкарбомоїл)фенокси)-3(метилсульфонамідметил)феніл)оцтової кислоти; 2-(4-(4-(2-(4-хлорбензиламіно)-2оксіетил)фенокси)-3(метилсульфонамідметил)феніл)оцтової кислоти; 2-(4-(4-(2-(бензиламіно)-2-оксіетил)фенокси)-3(метилсульфонамідметил)феніл)оцтової кислоти; 2-(3-(метилсульфонамідметил)-4-(4-(2-окси-2(фенетиламіно)етил)фенокси)феніл)оцтової кислоти; 2-(4-(4-(2-(бензил(метил)аміно)-2оксіетил)фенокси)-3(метилсульфонамідметил)феніл)оцтової кислоти; 2-(3-(метилсульфонамідметил)-4-(4-(2-окси-2(феніламіно)етил)фенокси)феніл)оцтової кислоти; 2-(4-(4-бензамідфенокси)-3-((4фторфенілсульфонамід)метил)феніл)оцтової кислоти; 2-(4-(4-(4-хлорбензамід)фенокси)-3-((4фторфенілсульфонамід)метил)феніл)оцтової кислоти; 2-(4-(4-(3-хлорбензамід)фенокси)-3-((4фторфенілсульфонамід)метил)феніл)оцтової кислоти; 2-(4-(4-(3,4-дифторбензамід)фенокси)-3(метилсульфонамідметил)феніл)оцтової кислоти; 2-(4-(4-(2-хлорбензамід)фенокси)-3(метилсульфонамідметил)феніл)оцтової кислоти; 2-(4-(4-(3,4-дихлорбензамід)фенокси)-3метоксифеніл)оцтової кислоти; 2-(4-(4-(бензилоксикарбомоїл)фенокси)-3(метилсульфонамідметил)феніл)оцтової кислоти; 2-(3-хлор-4-(4-(4хлорфенілкарбомоїл)фенокси)феніл)оцтової кислоти; 2-(3-ціано-4-(4-(3,4дихлорбензамід)фенокси)феніл)пропіонової кислоти; 2-(4-(4-(3,4-дихлорбензамід)фенокси)-3(метилсульфонамідметил)феніл)пропіонової кислоти; 2-(4-(4-(3,4-дихлорбензамід)фенокси)-3(метилсульфонамідметил)феніл)-2метилпропіонової кислоти; 2-(3-(метилсульфонамідметил)-4-(4-(4трифторметил)фенілкарбомоїл)фенокси)феніл)оцтової кислоти; 2-(3-(метилсульфонамідметил)-4-(4-(3(трифторметил)фенілкарбомоїл)фенокси)феніл)оцтової кислоти; 2-(4-(4-(4-хлор-3-фторфенілкарбомоїл)фенокси)-3(метилсульфонамідметил)феніл)оцтової кислоти; 2-(4-(4-(3-хлор-4-фторфенілкарбомоїл)фенокси)-3(метилсульфонамідметил)феніл)оцтової кислоти; 2-(4-(4-(4хлорфенілкарбомоїл)фенокси)феніл)оцтової кислоти; 2-(4-(4-(4-хлорфенілкарбомоїл)фенокси)-3фторфеніл)оцтової кислоти; 2-(3-ціано-4-(4-(4хлорфенілкарбомоїл)фенокси)феніл)оцтової кислоти; 96459 12 2-(3-ціано-4-(4-(2,4дихлороксіетилкарбомоїл)фенокси)феніл)оцтової кислоти; 2-(3-бром-4-(4-(2,4дихлороксіетилкарбомоїл)фенокси)феніл)оцтової кислоти; 2-(4-(4-(4-хлорфенілкарбомоїл)фенокси)3,5диметилфеніл)оцтової кислоти; 2-(4-(4-(4-хлорфенілкарбомоїл)фенокси)3метилфеніл)оцтової кислоти; 2-(4-(4-(4-хлорфенілкарбомоїл)фенокси)3-тіофен2-ілфеніл)оцтової кислоти; 2-(6-(4-(4-хлорфенілкарбомоїл)фенокси)біфеніл-3іл)оцтової кислоти; 2-(6-(4-(4-хлорфенілкарбомоїл)фенокси)-3'(метилсульфоніл)біфеніл-3-іл)оцтової кислоти; 2-(4-(4-(4-хлорфенілкарбомоїл)фенокси)-3циклопропілфеніл)оцтової кислоти; 2-(4-(4-(4-хлорфенілкарбомоїл)феноксі)-3етилфеніл)оцтової кислоти; 2-(6-(4-(4-хлорфенілкарбомоїл)фенокси)-4'(метилсульфоніл)біфеніл-3-іл)оцтової кислоти; 2-(3-(метилсульфонамідметил)-4-(4-(3(трифторметил)оксіетилкарбомоїл)фенокси)феніл)оцтової кислоти; 2-(4-(4-((1-(4хлорфеніл)циклопропіл)метилкарбомоїл)фенокси)3-(метилсульфонамідметил)феніл)оцтової кислоти; 2-(4-(4-(4-хлорфенілкарбомоїл)фенокси)-3(нікотинамідметил)феніл)оцтової кислоти; 2-(4-(4-(4-хлорфенілкарбомоїл)фенокси)-3(піридин-3-сульфонамід)метил)феніл)оцтової кислоти; 2-(4-(4-(4-хлорфенілкарбомоїл)фенокси)-3-((1метил-1Н-імідазол-5сульфонамід)метил)феніл)оцтової кислоти; 2-(4-(4-(4-хлорфенілкарбомоїл)фенокси)-3-((6диметиламіно)нікотинамід)метил)феніл)оцтової кислоти; 2-(4-(4-(4-хлорфенілкарбомоїл)фенокси)-3-((2-(4фторфенілсульфонамід)ацетоамід)метил)феніл)оцтової кислоти; 2-(3-((6-амінонікотинамід)метил)-4-(4-(4хлорфенілкарбомоїл)фенокси)феніл)оцтової кислоти; 2-(4-(4-(4-хлорфенетилкарбомоїл)фенокси)-3((диметиламіно)метил)феніл)оцтової кислоти; 2-(4-(4-(4-хлорфенілкарбомоїл)фенокси)-3-((Nметилметилсульфонамід)метил)феніл)оцтової кислоти; 2-(3-ціано-4-(4(оксіетилкарбомоїл)фенокси)феніл)оцтової кислоти; 2-(4-(4-(4-хлорфенілкарбомоїл)-3(трифторметил)феніл)оцтової кислоти; 2-(4-(4-(4-хлорфенілкарбомоїл)фенокси)-3ціанофеніл)пропіонової кислоти; 2-(3-ціано-4-(2,4дихлороксіетилкарбомоїл)фенокси)феніл)пропіонової кислоти; 2-(4-(4-(4-хлорфенілкарбомоїл)-3метоксифеніл)оцтової кислоти; 13 2-(3-ціано-4-(4-(2,4-дихлороксіетилкарбомоїл)-3фторфенокси)феніл)оцтової кислоти; 2-(3-ціано-4-(4-(2,6дихлороксіетилкарбомоїл)фенокси)феніл)оцтової кислоти; 2-(3-ціано-4-(4-(4фторфенілкарбомоїл)фенокси)феніл)оцтової кислоти; 2-(3-ціано-4-(4-(3метоксіоксіетилкарбомоїл)фенокси)феніл)оцтової кислоти; 2-(3-ціано-4-(4-(4-третбутилоксіетилкарбомоїл)фенокси)феніл)оцтової кислоти; 2-(3-ціано-4-(4-(4трифторметилоксіетилкарбомоїл)фенокси)феніл)оцтової кислоти; 2-(3-ціано-4-(4-(3хлорфенілкарбомоїл)фенокси)феніл)оцтової кислоти; 2-(3-ціано-4-(4-(3фторфенілкарбомоїл)фенокси)феніл)оцтової кислоти; 2-(3-ціано-4-(4-(4метоксіоксіетилкарбомоїл)фенокси)феніл)оцтової кислоти; У даній заявці заявлений пріоритет попередніх заявок США № 60/839,018, поданої 21 серпня 2006 p., і № 60/851,385, поданої 13 жовтня 2006 p., повний зміст яких включений до даної заявки як посилання. Даний винахід стосується нових сполук, фармацевтичних композицій, які містять ці сполуки, способу виготовлення цих сполук та їх застосування у лікуванні. Більш конкретно, він стосується певних 4-заміщених похідних феноксифенілоцтової кислоти, які є корисними у лікуванні та попереджанні алергічних захворювань, таких як астма, алергічний риніт і атопічнийдерматит, та інших запальних захворювань, опосередкованих простагландином D2 (PGD2). У міжнародній патентній заявці, номер публікації WO 2004/058164, розкриті, поряд з іншим, певні 2-заміщені похідні феноксифенілоцтової кислоти, які модулюють РGD2-селективний рецептор CRTH2 (хемоатрактантну гомологічну рецептору молекулу, експресовану на Th2 клітинах), що їх зараз здебільшого називають DP2. Ці сполуки вважають корисними у лікуванні імунологічних захворювань, таких як астма та алергічне запалення. Нині було виявлено, що певні 4-заміщені похідні феноксифенілоцтової кислоти, які несуть особливу замісну мета частку на частці оцтової кислоти, є модуляторами DP2 рецептора. Використаний тут термін «модулятор» включає антагоністи. Відповідно до одного аспекту цей винахід забезпечує сполуку загальної формули (І): 96459 14 2-(3-ціано-4-(4-(4метилоксіетилкарбомоїл)фенокси)феніл)оцтової кислоти; 2-(3-ціано-4-(4-(4метилоксіетилкарбомоїл)фенокси)феніл)оцтової кислоти; 2-(4-(4-(2-(4-хлорфеніл)-2гідроксіетилкарбомоїл)фенокси)-3ціанофеніл)оцтової кислоти; 2-(4-(4-(1-(4хлорфеніл)циклопропілкарбомоїл)фенокси)-3ціанофеніл)оцтової кислоти; 2-(3-ціано-4-(4-(2фенілциклопропілкарбомоїл)фенокси)феніл)оцтової кислоти; 2-(4-(4-(4-хлорфенілкарбомоїл)фенокси)-3ціанофеніл)-2-фтороцтової кислоти; 2-(4-(4-((1-(4хлорфеніл)циклопропіл)метилкарбомоїл)фенокси)3-ціанофеніл)оцтової кислоти; 2-(4-(4-(2-(4хлорфеніл)циклопропілкарбомоїл)фенокси)-3ціанофеніл)оцтової кислоти; 2-(3-ціано-4-(4-(1,2,3,4-тетрагідронафтален-2ілкарбамоїл)фенокси)феніл)оцтової кислоти. (I) або її сіль, в якій: 1 1 1 2 R є Ar -L -W-L -; 2 c d L є -(CR R )m; 3a 3b W є -CONR - або -NR CO-; 3a 3b R та R кожний є Η або метил; 1 a b a b L є -(CR R )n-, -(СН=СН)- або -O(CR R ), за 3 1 умови, що коли W є -NR CO-, тоді L не є (СН=СН)-; n та m незалежно є 0, 1 або 2; a b c d кожний R , R , R та R незалежно є Η, F, ОН, a b c d метил або циклопропіл, або R та R або R та R разом з вуглецем, до якого вони прикріплені, утворюють циклопропільне кільце; 1 Аr є феніл або нафтил, кожний з яких незаміщений або заміщений одним або більше замісниками, незалежно вибраними з F, СІ, CN, CF3, CHF2, CH2F, SF5, метилу, етилу, циклопропілу, t1 бутилу або ОМе, або Аr є 1,2,3,4тетрагідронафтил, незаміщений або заміщений метокси групою, 1 за умови, що коли Аr є нафтил або 1,2,3,4тетрагідронафтил, тоді n є 0; 15 96459 2 R є Н, С1-C6 алкіл, залишок амінокислоти або e f дипептиду або CHR (CH2)qR ; q є від 1 до 6; e R є Н, метил або етил; f 9 h g h R є NR R , в якому R та R кожний незалежно представляє атом водню або C1-C4 алкільну групу, g h або R та R разом з атомом азоту, до якого вони прикріплені, утворюють 5-6-членне гідроциклічне кільце, яке необов'язково містить другий кільцевий гетероатом, вибраний з N та О, причому згадане гідроциклічне кільце необов'язково заміщене однією або більше групами, незалежно вибраними з С1-C6 алкілу; 4a 5 А є CN, CH2NH2, CH2NR C(=O)R або 4b 6 CH2NR SO2R , СІ, ОМе, (1-4С)алкіл, циклопропіл, Н, F, Br, CH2NH(1-4C алкіл), CH2N(1-4C алкіл)2, тієніл або феніл, незаміщений або заміщений SO2Me; 4a 4b R та R кожний є Η або метил; 5 R є С1-C6 алкіл, С1-C6 алкокси, С3-С6 циклоал1 2 кіл, hetAr або Аr ; 6 R є С1-C6 алкіл, NH(С1-C6 алкіл), N(С1-C6 ал3 2 кіл)2, Аr або hetAr ; 1 hetAr є 6-членний гетероарил, незаміщений або заміщений однією або більше групами, незалежно вибраними з атому галогену та групи фор5a 5b 5a 5b мули -NR R , в якій кожний з R та R незалежно представляє атом водню або (1-4С) алкільну групу або разом з атомом азоту, до якого вони прикріплені, утворюють піролідинільну, піперидинільну або морфоліно групу; 2 hetAr є 5-6-членний гетероарил, незаміщений або заміщений однією або більше групами, незалежно вибраними з С1-С4 алкілу; 2 Аr є феніл, незаміщений або заміщений однією або більше групами, незалежно вибраними з атому галогену, CN, SF5, циклопропілу, С1-С4 алкільної групи, С1-С4 алкокси групи та фторзаміщеної С1-С4 алкільної групи; 3 2 Аr є таким, як визначено для Аr ; 7 8 R та R незалежно є Н, метил або F; 9 R є Η або метил; та 10 R є Η або F. У деяких втіленнях сполука формули І має формулу Іа Ia в якій: 1 1 1 2 R є Ar -L -W-L -; 2 c d L є -(CR R )m-; 3a 3b W є -CONR - або -NR CO; 3a 3b R та R кожний є Η або метил; 1 a b a b L є -(CR R )n-, -(СН=СН)- або -O(CR R ) за 3 1 умови, що коли W є -NR CO-, тоді L не є (СН=СН)-; n та m незалежно є 0, 1 або 2; a b c d кожний R , R , R та R незалежно є Η, F, меa b тил або циклопропіл, або R та R або 16 c d R та R разом з вуглецем, до якого вони прикріплені, утворюють циклопропільне кільце; 1 Аr є феніл або нафтил, кожний з яких незаміщений або заміщений одним або більше замісниками, незалежно вибраними з F, СІ, CN, CF3, CHF2, CH2F, SF5, метилу, етилу, циклопропілу, за умови, що ко1 ли Аr є нафтил, тоді n є 0; 2 R є Н, С1-С6 алкіл, залишок амінокислоти або e f дипептиду або CHR (CH2)qR ; q є від 1 до 6; e R є Н, метил або етил; f g h g h R є NR R , в якому R та R кожний незалежно представляє атом водню або С1-С4 алкільну групу, 9 h або R та R разом з атомом азоту, до якого вони прикріплені, утворюють 5-6-членне гетероциклічне кільце, яке необов'язково містить другий кільцевий гетероатом, вибраний з N та О, де згадане гетероциклічне кільце необов'язково заміщене однією або більше групами, незалежно вибраними з С1-С6 алкілу; 4a 5 А є CN, CH2NH2, CH2NR C(=O)R або 4b 6 CH2NR SO2R , СІ, ОМе, (1-4С)алкіл, циклопропіл; 4a 4b R та R кожний є Η або метил; 5 R є С1-С6 алкіл, С1-С6 алкокси, С3-С6 циклоал1 2 кіл, hetAr або Аr ; 6 R є С1-С6 алкіл, NH(С1-С6 алкіл), N(С1-С6 ал3 2 кіл)2, Аr або hetAr ; 1 hetAr є 6-членний гетероарил, незаміщений або заміщений однією або більше групами, незалежно вибраними з атому галогену та групи фор5a 5b 5a 5b мули -NR R , в якій кожний з R та R незалежно представляє атом водню або (1-4С) алкільну групу або разом з атомом азоту, до якого вони прикріплені, утворюють піролідинільну, піперидинільну або морфоліно групу; 2 hetAr є 5-6-членний гетероарил, незаміщений або заміщений однією або більше групами, незалежно вибраними з С1-С4 алкілу; 2 Аr є феніл, незаміщений або заміщений однією або більше групами, незалежно вибраними з атому азоту, CN, SF5, циклопропілу, С1-С4 алкільної групи, С1-С4 алкокси групи та фторзаміщеної С1-С4 алкільної групи; 3 2 Аr є таким, як визначено для Аr ; та 7 8 R та R незалежно є Н, метил. Було виявлено, що сполуки за цим винаходом є модуляторами DP2 і є корисними у лікуванні імунологічних захворювань, таких як астма та алергічне запалення. Має бути зрозумілим, що деякі сполуки за цим винаходом можуть містити один або більше центри асиметрії і тому можуть бути приготовані та виділені у суміші ізомерів, такій як рацемічна суміш, або у енантіомерно чистій формі. Крім того, має бути зрозумілим, що сполуки формули (І) або їх солі можуть бути виділені у формі сольватів і, відповідно, що будь-який такий сольват входить до обсягу цього винаходу. Сполуки формули І включають їх фармацевтично прийнятні солі. Крім того, сполуки формули І також включають інші солі таких сполук, які не обов'язково є фармацевтично прийнятними солями і які можуть бути корисними як проміжні сполуки для приготування та/або очищення сполук фо 17 рмули І та/або для відокремлення енантіомерів сполук формули І. Використаний тут термін «галоген» включає F, СІ, Вr та І. Використані тут терміни «С1-С4 алкіл» та «С1С6 алкіл» стосуються насиченого лінійного або з розгалуженим ланцюгом одновалентного радикалу вуглеводню відповідно з від одного до чотирьох або від одного до шести атомів вуглецю. Прикладами алкільних груп є, але вони не є обмежувальними, метил, етил, 1-пропіл, 2-пропіл, 1-бутил, 2метил-1-пропіл, 2-бутил, 2-метил-2-пропіл, 2,2диметилпропіл, 1-пентил, 2-пентил, 3-пентил, 2метил-2-бутил, 3-метил-2-бутил, 3-метил-1-бутил, 2-метил-1-бутил, 1-гексил, 2-гексил, 3-гексил, 2метил-2-пентил, 3-метил-2-пентил, 4-метил-2пентил, 3-метил-3-пентил, 2-метил-3-пентил, 2,3диметил-2-бутил та 3,3-диметил-2-бутил. Використаний тут термін «гетероарил» стосується одновалентного ароматичного радикалу з 5-, 6- або 7-членним кільцем. Прикладами гетероарильних груп є, але вони не є обмежувальними, піридиніл, імідазоліл, імідазопіридиніл, піримідиніл, піразоліл, тріазоліл, піразиніл, тетразоліл, фурил, тієніл, ізоксазоліл, тіазоліл, оксазоліл, ізотіазоліл та піроліл. Використаний тут термін «фторзаміщений С1С4 алкіл» стосується С1-С4 алкільної групи, в якій один або більше атомів водню заміщений атомом фтору. Прикладами є CF3, CH2F, CHF2, CH2CH2F, CH2CH2F2, CH2CF3, CH2CH2 CH2F, CH2CH2 CHF2, CH2CH2CF3, CHF(CH3)2, CH2CHF(CH3)2 і подібні. Використаний тут термін «С1-С6 алкокси» стосується С1-С6 алкілокси групи. Показовими алкокси групами є метокси, етокси, пропокси, ізопропокси, бутокси, t-бутокси та ізобутокси. 3a В одному втіленні W є -CONR -. Прикладом 3a конкретного значення R є водень. В одному вті3b 3b ленні W є -NR CO-. В одному втіленні R є во3b день. В іншому втіленні R є метил. Прикладами конкретних значень W є CONH, NHCO та N(CH3)CO. 1 a b В одному втіленні L є -(CR R )n-. Прикладами конкретних значень n є 0, 1 та 2. 1 В одному втіленні L є зв'язок. 1 a b В одному втіленні L є -(CR R ). В деяких втіa b a леннях R та R є водень. В деяких втіленнях R є a b ОН. В деяких втіленнях R та R разом з атомом вуглецю, до якого вони прикріплені, утворюють циклопропілідинове кільце. 1 a b В одному втіленні L є -(CR R )2. В деяких втіa b a леннях R та R є водень. В деяких втіленнях R та b R разом з атомом вуглецю, до якого вони прикріплені, утворюють циклопропілідинове кільце. В a b деяких втіленнях R та R прикріплені до одного й a b того самого вуглецю. В інших втіленнях R та R прикріплені до різних атомів вуглецю. 1 Прикладами конкретних значень L є зв'язок, СН2-, -СН2СН2- та циклопропіліден СН2. 1 Іншим прикладом L є СН(ОН)СН2. 1 Іншими прикладами L є циклопропілідинові групи, які можуть бути представлені такими структурами: 96459 18 1 a b В одному втіленні L є -O(CR R )-. Показовим втіленням є -ОСН2-. 2 Стосовно L , прикладами конкретних значень m є 0 та 1. Прикладами конкретних значень L є зв'язок та -СН2-. У деяких втіленнях сумою m та n є 0, 1 та 2. Особливо необхідно зазначити сполуки, в яких сумою m та n є 0 або 2. 1 2 Приклади значень -L -W-L - є -CONH-, CH2CONH-, -CH2CH2CONH-, -CONHCH2-, СН2СОNНСН2-, -NHCO-, -CH2NHCO-, -NHCOCH2-, CH2CH2NHCO-, -CH2NHCOCH2-, CH2CH2NHCOCH2-, -CH2N(CH3)COCH2-, циклопропіліден-CH2NHCO та -CH2ONHCO-. 1 2 Іншими прикладами значень -L -W-L - є CH(OH)CH2NHCO- та -циклопропілідинNНСО-. 1 2 Особливими значеннями -L -W-L - є -CONH-, NHCO-, -CH2NHCO-, -NHCOCH2-, -CH2CH2NHCO-, CH2NHCOCH2-, -СН2СН2NНСОСН2-, CH2N(CH3)COCH2-, циклопропіліденСН2NНСО, CH(OH)CH2NHCO- та -циклопропілідинNНСО-. 1 В одному втіленні Аr є нафтильна група або фенільна група, заміщена одним або двома замісниками, незалежно вибраними з F, СІ CF3, OMe, Me та t-Bu. 1 В одному втіленні Аr є нафтильна група або фенільна група, незаміщена або заміщена одним або двома замісниками, незалежно вибраними з F, СІ та CF3. 1 В одному втіленні Аr є нафтильна група або фенільна група, заміщена одним або двома замісниками, незалежно вибраними з OMe, Me та t-Bu. 1 В одному втіленні Аr є 1,2,3,4тетрагідронафтил, незаміщений або заміщений ОМе. В конкретному втіленні А вибирають з таких структур: 1 Прикладами конкретних значень Аr є нафтил, феніл, 4-фторфеніл, 3,4-дифторфеніл, 2хлорфеніл, 3-хлорфеніл, 4-хлорфеніл, 3,4дихлорфеніл, 4-хлор-3-фторфеніл, 3-хлор-4фторфеніл, 4-трифторметилфеніл, 3-фтор-4трифторметил-феніл, 3-трифторметилфеніл, 2,6дихлорфеніл, 2,4-дихлорфеніл, 3-метоксифеніл, 4метоксифеніл, 4-тертбутилфеніл, 3-фторфеніл, 4метилфеніл, 1,2,3,4-тетра-гідронафт-2-ил та 6метокси-1,2,3,4-тетрагідронафт-2-ил. 1 У деяких втіленнях Аr вибирають з нафтилу, фенілу, 4-фторфенілу, 3,4-дифторфенілу, 2хлорфенілу, 3-хлорфенілу, 4-хлорфенілу, 3,4дихлорфенілу, 4-хлор-3-фторфенілу, 3-хлор-4фторфенілу, 4-трифторметилфенілу та 3-фтор-4трифторметилфенілу. 1 У деяких втіленнях Аr вибирають з 3трифторметилфенілу, 2,6-дихлорфенілу, 2,4дихлорфенілу, 3-метоксифенілу, 4-метоксифенілу, 4-терт-бутилфенілу, 3-фторфенілу і 4метилфенілу та 1,2,3,4-тетрагідронафт-2-илу і 6метокси-1,2,3,4-тетрагідронафт-2-илу. 19 96459 20 В одному втіленні А є CN. В одному втіленні А є Н. В одному втіленні А вибирають з F, Вr та СІ. В одному втіленні А вибирають з (1-4С)алкілу. Конкретними прикладами є метил та етил. В одному втіленні А є циклопропіл. В одному втіленні А вибирають з CH2NH2, CH2NH(1-4C алкілу) та CH2N(1-4C алкілу)2. Конкретними прикладами є CH2NH2 та CH2NMe2. В одному втіленні А є тієніл. У конкретному втіленні А є 2-тієніл. В одному втіленні А є феніл, незаміщений або заміщений SO2Me. Конкретними прикладами є феніл, 3-метилсульфонілфеніл та 4метилсульфоніл-феніл. 4a 5 В одному втіленні А є CH2NR C(=O)R . Прик4a ладом конкретного значення для R є водень. В 5 1 одному втіленні R є hetAr . Прикладом конкретного значення для гетероарильної групи, представ1 леної hetAr , є піридильна група. Прикладами необов'язкових замісників на гетероарильній групі є NH2, СІ та піролідиніл. 5 В іншому втіленні R є С1-С6 алкіл; С1-С6 алкокси; С3-С6 циклоалкіл; піридил, незаміщений або заміщений атомом галогену або групою формули 5a 5b 5a 5b NR R , в якій кожний з R та R незалежно представляє атом водню або (1-4С) алкільну групу або разом з атомом азоту, до якого вони прикріплені, утворюють піролідинільну, піперидинільну або морфоліно групу; або фенільну групу, незаміщену або заміщену одним або двома атомами галогену. 5 Прикладами конкретних значень для R є метил, метокси, циклогексил, пірид-2-ил, пірид-3-ил, пірид-4-ил, 6-хлор-пірид-3-ил, 6-амін-пірид-3-ил, 6піролідин-1-ілпірид-3-ил або 4-фторфеніл. Додат5 ковим прикладом R є 6-диметиламінпірид-3-ил. 4b 6 В одному втіленні А є CH2NR SO2R . Прикла4b дом конкретного значення для R є водень. В од6 2 ному втіленні R є hetAr . Прикладами конкретних значень для гетероарильної групи, представленої 2 hetAr , є імідазолільна та піридильна групи. Прикладами необов'язкових замісників на гетероарильній групі є С1-С4 алкіл, наприклад, метил. 6 В іншому втіленні R є С1-С6 алкіл, NH(С1-С6 алкіл), N(С1-С6 алкіл)2, фенільна група, незаміщена або заміщена одним або двома атомами галогену, піридил або імідазоліл, незаміщений або заміщений С1-C3 алкільною групою. 6 Прикладами конкретних значень для R є метил, диметиламін, 4-фторфеніл, 2,4-дихлорфеніл, пірид-3-ил та 1-метилімідазол-5-іл. Додатковим 6 прикладом R є пірид-4-ил. Прикладами конкретних значень для А є ацетамідметил, циклогексиламід-метил, метоксикарбоніламінметил, піколінамідметил, нікотинамідметил, ізонікотинамідметил, 6-хлорпірид-3іламідметил, 6-амінпірид-3-іламідметил, 6піролідин-1 -ілпірид-3-іламідметил, 4фторбензамідметил, метилсульфонамід-метил, Ν,Ν-диметилсульфамоїламін, 4фторфенілсульфон-амідметил, 2,4-дихлорфенілсульфонамідметил, 1-метилімідазол-5-ілсульфонамідметил та пірид-3-илсульфонамідметил, які можуть бути представлені відповідно такими структурами: Особливо необхідно зазначити ацетамід метил, циклогексиламідметил, метоксикарбоніламінметил, піколінамідметил, нікотинамідметил, ізонікотинамідметил, 4-фторбензамідметил, метилсульфонамідметил, Ν,Νдиметилсульфамоїламін, 4фторфенілсульфонамідметил, 2,4-дихлорфеніл сульфонамідметил та пірид-3илсульфонамідметил. Конкретні значення для А також включають 6диметиламінпірид-3-іламідметил, 2-(4фторфенілсульфонамід)ацетамідметил, диметиламінметил та (N-метилметилсульфонамід)метил, які можуть бути відповідно представлені такими структурами: 21 96459 2 Прикладами конкретних значень для R , коли він представляє С1-С6 алкільну групу, є метил, етил, пропіл, ізопропіл і t-бутил. 2 e f В одному втіленні R є CHR (CH2)qR . Приклаe дами значень для R є водень і метил. В одному f втіленні R є ди(1-4С)алкіламін, морфоліно або піперазиніл, необов'язково заміщені (1-4С)алкілом. 2 В одному втіленні R є водень. 7 8 В одному втіленні R та R є Н. У деяких вті7 8 леннях R є Н, a R є метил. В інших втіленнях 7 8 кожний з R та R є метил. Відповідно до іншого аспекту цей винахід забезпечує спосіб приготування сполуки формули (І) або її солі, як визначено вище, який має у своєму складі: 7 (a) для сполуки формули (І), в якій А є CN, R 8 10 та R незалежно є Η або Me, a R є Η або F, реагування відповідної сполуки, що має формулу: (II) 1 в якій Р представляє атом водню або карбок1 сильну захисну групу, a Z представляє відхідний атом або групу, з відповідною сполукою, що має формулу 22 f Прикладами конкретних значень для R є диметиламін, діетиламін, морфоліно, піперазиніл та 1метилпіперазиніл. Додатковими прикладами є NH2 та NHMe. 2 Прикладами конкретних значень для R , коли e f він представляє CHR (CH2)qR , є: 2 1 в якій Р є таким, як визначено для Р ; або (c) для сполуки формули (І), в якій А є 7 8 10 CH2NH2, R та R незалежно є Η або Me, a R є Н, розщеплення відповідної сполуки формули (V) (V) 3 1 в якій Р є таким, як визначено для Р ; або (d) для сполуки формули (І), в якій А є 4 5 4 6 7 8 CH2NR C(=O)R або CH2NR SO2R , R та R неза10 лежно є Η або Me, a R є Н, реагування відповідної сполуки формули (VI) (III) (VI) 10a в якій R є Η або F, у присутності основи; або (b) для сполуки формули (І), в якій А є 10 7 8 CH2NH2, R є Η, a R та R незалежно є Η або Me, відновлення відповідної сполуки формули (IV) (IV) 4 1 в якій Р є таким, як визначено для Р ; відпові5 2 6 3 дно зі сполукою формули R COZ або R SO2Z , в 2 3 якій Z та Z кожний представляє відхідний атом або групу; або 7 8 (e) для сполуки формули (І), в якій R та R не10 залежно є Η або Me, a R є Н, зв'язування сполуки формули (VII) 23 96459 24 (h) для сполуки формули (І), в якій А є Вr або 7 8 10 циклопропіл, R та R є Н, а R є Н, зв'язування відповідної сполуки, що має формулу (XIV) (VII) (XIV) 5 5 1 2 в якій Р є таким, як визначено для Р , А 1a представляє А або його захисну групу, а R преда 2 а ставляє Н-Х -L -, в якій X представляє ΗΝ або ОС(=О) або їх реактивну похідну; зі сполукою формули (VIII) 1 1 b Ar -L -X -H (VIII) b в якій Х представляє С(=О)О або ΝΗ або їх реактивну похідну; або (f) для сполуки формули (І), в якій А є Н, F або 7 8 10 СІ, R та R незалежно є Η або Me, a R є Н, зв'язування відповідної сполуки, що має формулу (IX) в якій Z є відхідна група або атом, зі сполукою, що має формулу (XV) (XV) у присутності основи із подальшим перетворенням карбонільної групи на карбоксильну групу; або (і) для сполуки формули (І), в якій А є метил, 9 тієніл, феніл або феніл, заміщений SO2Me, R є Н, 7 8 10 R та R незалежно є Η або Me, a R є Н, реагування відповідної сполуки, що має формулу (XVI) (IX) 3 6 в якій А є Н, F або СІ, а Р є таким, як визна1 чено для Р , з відповідною сполукою, що має формулу (X) (XVI) (X) 5 в якій Ε є групою, що виводить електрон, у присутності основи; і, за бажанням, видалення згаданої групи, що виводить електрон; або (g) для сполуки формули (І), в якій А є ОМе 7 8 або (1-4С)алкіл, R та R незалежно є Η або Me, a 10 R є Н, зв'язування відповідної сполуки, що має формулу (XI) зі сполукою, що має формулу Α -ΖnΧ, у присутності каталізатора паладію (0), або зі сполукою, 5 що має формулу А В(ОН)2, у присутності основи 5 та каталізатора паладію (0), де А є метил, тієніл, феніл або феніл, заміщений SO2Me, а X є галід; або 7 8 (j) для сполуки формули (І), в якій R є F, R є 10 Н, a R є Н, обробку відповідної сполуки, що має формулу (XVII) (XI) (XVII) 4 в якій А відповідно є ОМе або (1-4С)алкіл, а 7 1 Р є таким, як визначено для Р , з відповідною сполукою, що має формулу (XII) (XII) 4 у присутності основи, в якій Ζ представляє ві1x дхідний атом або групу, a R представляє групу, що виводить електрон, перетворювану на групу 1 R ; або фторидом водню; (k) для сполуки формули (І), в якій А є 7 8 CH2NH(1-4C алкіл) або CH2N(1-4C алкіл)2, R та R 10 незалежно є Η або Me, a R є Н, реагування відповідної сполуки, що має формулу 25 96459 з альдегідом, що має формулу НС(О)(1-4С алкіл); та видалення будь-якої захисної групи або груп і, за бажанням, утворення солі. Стосовно способу (а), відхідний атом або гру1 па, представлені Z , можуть бути, наприклад, атомом галогену, таким як атом фтору. Карбоксильна захисна група може бути будь-якою зручною карбоксильною захисною групою, наприклад, як описано у Greene & Wuts, eds., "Protecting Groups in Organic Synthesis" («Захисні групи в органічному синтезі»), John Wiley & Sons, Inc. Прикладами карбоксильних захисних груп є (1-6С)алкільні групи, такі як метил, етил і t-бутил. Основою може бути, наприклад, гідрид або карбонат лужного металу, такий як гідрид натрію, карбонат натрію або карбонат калію, або третинний амін, такий як тріетиламін або Ν,Ν-діізопропілетиламін. Підходящими розчинниками є аміди, сульфоксиди та нітрили, такі як ДМФ, ДМСО або ацетонітрил. Реакція може бути проведена при підвищеній температурі, такій як у межах від 50 до 150°С. Сполуки формули (II) є відомими або їх можна приготувати з відповідної 3-гало сполуки, такої як 3-бром сполука, шляхом обробки CuCN. Стосовно способу (b), сполука формули (IV) може бути відновлена гідруванням у присутності каталізатора металу групи VIII, такого як нікель Ренея, метанолом/аміаком. Реакція може бути проведена при температурі в межах від 0 до100°С. Стосовно способу (с), діоксоізоіндолінільна група може бути розщеплена із застосуванням НВr та оцтової кислоти або гідразину. Сполуки формули (V) можуть бути приготовані шляхом реагування сполуки формули (XIII) (XIII) зі сполукою формули (XII) (XII) 4 у присутності основи, в якій Z представляє відхідний атом або групу, наприклад атом фтору, a 1x R представляє групу, що виводить електрон, 1 перетворювану на групу R , наприклад нітрогрупу, 26 що може бути відновлена до амінної групи, а потім ацильована. Основою може бути, наприклад, гідрид або карбонат лужного металу, такий як гідрид натрію, карбонат натрію або карбонат калію. Сполуки формули (IX) можуть бути приготовані шляхом реагування 4-гідроксифенілоцтової кислоти з 2-(гідроксиметил)ізоіндолін-1,3-діоном у присутності сульфонової кислоти, такої як метансульфонова кислота, із подальшим, за бажанням, 3 введенням захисної групи Р . Стосовно способу (d), відхідним атомом або 2 3 групою, представленою Z та Z , можуть бути, наприклад, атом галогену, такий як атом фтору. Реакція може бути проведена у присутності основи, наприклад третинного аміну, такого як діізопропілетиламін або піридин. Підходящими розчинниками є галогеновані вуглеводні, такі як метиленхлорид. Реакція може бути проведена при температурі у межах від 0 до 100°С. Стосовно способу (e), зв'язування сполуки формули (VII) зі сполукою формули (VIII) може бути проведене із застосуванням звичайних умов утворення амідного зв'язку, наприклад, шляхом реагування аміну з реактивною похідною карбонової кислоти, наприклад кислотним галідом, таким 1 як кислотний хлорид. Прикладом А , коли він представляє захищену форму А, є група формули 4 6 6 -CH2NR P , в якій Р представляє амінозахисну групу. Амінозахисна група може бути будь-якою зручною амінозахисною групою, наприклад, як описано у Greene & Wuts, eds., "Protecting Groups in Organic Synthesis" («Захисні групи в органічному синтезі»), John Wiley & Sons, Inc. Прикладами амінозахисних груп є ацильні та алкоксикарбонільні групи, такі як t-бутоксикарбоніл (ВОС). Стосовно способу (f), прикладом груп, що виводять електрон, є NO2. У втіленнях, в яких групою, що виводить електрон, є NO2, ця група може бути видалена, за бажанням, шляхом відновлення нітрогрупи до аміногрупи із застосуванням будьяких зручних відновлювальних умов (наприклад, Zn та NH4CI) із подальшим розщепленням аміногрупи (наприклад, шляхом обробки амінної сполуки ізобутилнітритом). Стосовно способу (g), основою може бути, наприклад, гідрид або карбонат лужного металу, такий як гідрид натрію, карбонат натрію або кар4 бонат калію. Z група представляє підходящий відхідний атом або групу, такий як атом фтору, а 1x R представляє групу, що виводить електрон, 1 перетворювану на групу R , наприклад нітрогрупу, що може бути відновлена до аміногрупи, а потім ацильована. Стосовно способу (h), відхідний атом або гру5 па, представлена Z , може бути, наприклад, атомом галогену, таким як атом фтору. Основа може бути, наприклад, гідридом або карбонатом лужного металу, таким як гідрид натрію, карбонат натрію або карбонат калію. Підходящими розчинниками є сульфоксиди, такі як ДМСО. Реакція може бути проведена при підвищених температурах, наприклад, у межах від 50 до 100°С, наприклад при 85°С. Карбонільна група може бути перетворена на карбоксильну групу шляхом обробки продукту зв'язування метилсульфонілом/метилтіометаном 27 96459 для одержання проміжної сполуки, що має формулу (XVIII) (XVIII) із подальшим перетворенням проміжної сполуки (XVIII) на відповідний метил складний ефір після обробки НСІ у метанолі. Складний ефір може бути перетворений на відповідну кислоту за стандартних умов гідролізу. Стосовно способу (і), галід, представлений X, може бути F, СІ або Вr. Підходящими розчинниками є ефіри, такі як ТГФ (тетрагідрофуран) або діоксан. Підходящими каталізаторами паладію (0) є Pd(PPh3)4 та біс(три-t-бутилфосфін)паладій (0). Підходящою основою, коли сполука (XVI) реагує з реагентом борної кислоти, є DBU. Реакція може бути проведена при підвищених температурах, наприклад, у межах від 50 до 100°С, наприклад при 60°С. Стосовно способу (j), реакцію зручно проводити у присутності амінної основи, наприклад піридину. Стосовно способу (k), реакцію зручно проводити у присутності основи, наприклад гідриду, такого як ціаноборгідрид натрію, у спиртовому розчиннику, такому як метанол. Реакцію краще проводити у присутності каталітичної кількості кислоти, наприклад оцтової кислоти. Реакцію зручно проводити при температурі навколишнього середовища. Здатність випробуваних сполук діяти як модулятори DP2 рецептора може бути продемонстрована за допомогою дослідження, описаного у Прикладі А. Сполуки, що є модуляторами DP2, корисні у лікуванні захворювань та порушень, опосередкованих PGD2, наприклад захворювань або порушень, пов'язаних з надмірним виробленням або аномальною регуляцією PGD2. Використаний тут термін «лікування» включає профілактику, а також лікування існуючого стану. Прикладами порушень або захворювань, які можна лікувати сполуками за цим винаходом, є імунологічні захворювання. Прикладами імунологічних захворювань є алергічні запальні захворювання, такі як астма, атопічний дерматит, алергічний риніт, сезонні алергії, харчові алергії, контактна гіперчутливість (наприклад, чутливість до нікелевої руди), гіпереозинофільні синдроми та алергічні кон'юнктивіти. Іншими захворюваннями або порушеннями, які можна лікувати сполуками за цим винаходом, є запальні захворювання кишок, такі як хвороба Крона (Crohn), виразковий коліт, ілеїт та ентерит, васкуліт, синдром Бехсета (Behcet), псоріаз та запальні захворювання шкіри, такі як дерматит, 28 екзема, кропивниця, вірусні шкірні патології, такі як спричинені папіломавірусом людини, інфекцією ВІЛ або вірусом лейкозу Раушера (ВЛР), бактерійні, грибкові та інші паразитні шкірні патології, шкірний червоний вовчак, запальні алергічні захворювання, такі як хвороби гіперчутливості легенів, хронічне обструктивне захворювання легенів і подібні, аутоімунні захворювання, такі як артрит (у тому числі ревматоїдний та псоріазний), систематичний червоний вовчак, діабет типу І, астенічний бульбарний параліч, множинний склероз, базедова хвороба, гломерулонефрит і подібні, відторгнення трансплантату (у тому числі відторгнення алотрансплантату (гомотрансплантату) та реакція «трансплантат проти хазяїна»), наприклад, відторгнення трансплантату шкіри, відторгнення трансплантату твердого органу, відторгнення трансплантату кісткового мозку, лихоманка, серцево-судинні порушення, такі як гостра серцева недостатність, гіпотензія, гіпертензія, стенокардія, інфаркт міокарда, кардіоміопатія, застійна серцева недостатність, атеросклероз, захворювання коронарних артерій, рестеноз, тромбоз і стеноз судин, цереброваскулярні порушення, такі як травматичне ушкодження мозку, інсульт, ішемічне реперфузійне ушкодження та аневризма, рак грудей, шкіри, простати, шийки матки, матки, яєчників, яєчок, сечового міхура, легенів, печінки, гортані, ротової порожнини, товстої кишки та шлунковогокишкового тракту (наприклад, стравоходу, шлунка, підшлункової залози), мозку, щитовидної залози, крові та лімфатичної системи, фіброз, захворювання з'єднувальної тканини та саркоїдоз, генітальні та репродуктивні стани, такі як еректильна дисфункція, шлунково-кишкові порушення, такі як гастрит, виразка, нудота, панкреатит та блювання; неврологічні порушення, такі як хвороба Альцгеймера, порушення сну, таке як безсоння, нарколепсія, синдром апное уві сні (синдром раптової смерті дитини) та синдром Піквіка (Pickwick), біль, ниркові порушення, очні порушення, такі як глаукома, інфекційні хвороби, вірусні інфекції, такі як ВІЛ, та бактерійні інфекції, такі як сепсис, запалення, гіперемія, закупорка носового каналу та середній отит. Відповідно, інший аспект цього винаходу забезпечує спосіб лікування захворювань або медичних станів у ссавця, опосередкованих PGD2, який полягає у введенні згаданому ссавцеві однієї або більше сполук формули І або їх фармацевтично прийнятної солі чи проліків у кількості, ефективній для лікування або попереджання цього порушення. Фраза «ефективна кількість» означає кількість сполуки, яка при введенні ссавцеві, що потребує такого лікування, є достатньою для (і) лікування або попереджання конкретної хвороби, стану чи порушення, опосередкованого PGD2, (іі) послаблення, покращення або усунення одного або більше симптомів конкретного захворювання, стану чи порушення або (ііі) запобігання або відкладання появи одного або більше симптомів конкретного захворювання, стану чи порушення, які описані тут. 29 Кількість сполуки формули І, яка відповідатиме такій кількості, варіюватиметься залежно від таких факторів, як конкретна сполука, стан захворювання та його серйозність, особа (наприклад, вага) ссавця, що потребує лікування, але, в той же час, спеціаліст зможе її легко визначити. Використаний тут термін «ссавець» стосується теплокровної тварини, що страждає на або має ризик розвитку описаного тут захворювання і включає, але не обмежується цим, морських свинок, собак, котів, пацюків, мишей, хом'яків і приматів, у тому числі людей. Цей винахід також забезпечує сполуки формули І для застосування у лікуванні РGD2опосередкованих станів. Додатковий аспект винаходу полягає у застосуванні сполуки формули І у приготуванні лікарського засобу для терапії, такої як лікування або попереджання РGD2-опосередкованих станів. Сполуки за цим винаходом можуть бути використані у поєднанні з одними або більше додатковими ліками, наприклад із протизапальною сполукою, що має інший механізм дії. Сполуки за винаходом можуть бути введені будь-яким зручним шляхом, наприклад у шлунково-кишковий тракт (наприклад, ректально або перорально), ніс, легені, мускулатуру або судинну мережу або трансдермально. Сполуки можуть бути введенні у будь-якій зручній формі для введення, наприклад, як таблетки, порошки, капсули, розчини, дисперсії, суспензії, сиропи, спреї, супозиторії, гелі, емульсії, пластирі тощо. Такі композиції можуть містити компоненти, що є традиційними для застосування у фармацевтичних препаратах, наприклад, розріджувачі, носії, модифікатори рівня рН, підсолоджувачі, наповнювачі та інші активні інгредієнти. Якщо бажаним є парентеральне введення, композиції мають бути стерильними у вигляді розчину або суспензії, підходящої для ін'єкцій або вливань (інфузій). Такі композиції становлять інший аспект винаходу. Відповідно до іншого аспекту цей винахід забезпечує фармацевтичну композицію, яка містить сполуку формули (І) або її фармацевтично прийнятну сіль, як визначено вище. В одному втіленні фармацевтична композиція містить сполуку формули (І) разом із фармацевтично прийнятним розріджувачем або носієм. Відповідно до іншого аспекту цей винахід забезпечує сполуку формули (І) або її фармацевтично прийнятну сіль для застосування у терапії. Відповідно до іншого аспекту цей винахід забезпечує застосування сполуки формули (І) або її фармацевтично прийнятної солі у виготовленні лікарського засобу для лікування імунологічного порушення, як визначено вище. Наведені далі приклади ілюструють винахід. В описаних нижче прикладах, якщо не вказано інакше, всі температури подані у градусах Цельсію. Реактиви були придбані у комерційних постачальників, таких як Aldrich Chemical Company, 96459 30 Lancaster, TCI або Maybridge, і їх застосовували без додаткового очищення, якщо не вказано інакше. Тетрагідрофуран (ТГФ), дихлорметан (ДХМ, метиленхлорид), толуол і діоксан були придбані у Aldrich в пляшках «Sure seal», і їх застосовували в одержаному вигляді. Викладені нижче реакції проводили звичайно під позитивним тиском азоту або аргону або із осушувальним патроном (якщо не вказано інакше) у безводних розчинниках, а реакційні колби звичайно обладнували резиновими мембранами для введення субстратів та реактивів крізь шприц. Скляний посуд висушували у печі та/або нагріванням. 1 Н ЯМР спектри одержували як CDCI3, CD3OD, -1 D2O або d6-ДМСО розчини (повідомлені у млн ) із -1 застосуванням тетраметилсилану (0,00 млн ) або -1 залишкового розчинника (CDCI3: 7,25 млн ; -1 -1 CD3OD: 3,31 млн ; D2O: 4,79 млн ; d6-ДМСО: 2,50 -1 млн ) як стандартний зразок (еталон). При повідомленні пікових множинностей застосовували такі абревіатури: s (одинична), d (дублетна), t (триплетна), m (мультиплетна), br (розширена), dd (дублет дублетів), dt (дублет триплетів). Константи взаємодії, коли такі надавались, повідомляли у Герцях (Гц). Приклад А Оцінювання інгібування DP-2 зв'язування Кодувальну послідовність людського DP2 ввели у лінію лейкозних клітин людини K562 електропорацією, і були одержані стабільні клони, які експресували DP2, шляхом обмеження розведення із подальшим зафарбовуванням поверхні клітин моноклональним антитілом пацюка, специфічним для людського DP2. Мембрани готували з одного із цих клонів, що експресують DP2, та застосовували для визначення здатності сполук за цим винаходом інгібувати зв'язування простагландину D2 (PGD2) з його рецептором DP2 за допомогою наведеної далі процедури. Мембрани (1,25 мг/лунка) 3 змішували з Н-міченим PGD2 та різними концентраціями досліджуваних сполук у 150 мкл зв'язувального буфера (50 мМ Трис-НСІ, рН 7,4, 40 мМ МgСІ2, 0,1%-ний бичачий сироватковий альбумін, 0,1%-ний NaN3) у 96-лункових поліпропіленових планшетах з дугоподібним дном. Після інкубування впродовж 60 хвилин при кімнатній температурі зразок для аналізу перенесли у фільтраційний планшет (#MAFB; Millipore Corporation, Бедфорд, штат Масачусетс) і тричі промили зв'язувальним буфером. Радіоактивність вимірювали за домопогою сцинтиляційного лічильника (TopCount; PerkinElmer Life Sciences, Бостон, Масачусетс). Неспецифічне зв'язування визначали інкубуванням у присутності 1 мкМ неміченого PGD2 або 5 мкМ відомого DP2 антагоніста. Значення ІС50 для інгібування зв'язування визначали для кожної досліджуваної сполуки від точки вигину стандартної 4параметрової логістичної кривої, прилаштованої до одержаних величин. Усі розкриті тут сполуки мали значення ІС50, менше 1 мікромоля. 31 Приклад 1 2-(4-(4-(3,4-Дихлорбензамід)фенокси)-3-((4фторфенілсульфонамід)метил)-феніл)оцтова кислота Етап А: 2-(4-гідроксифеніл)оцтову кислоту (7,0 г, 46 ммоль) розбавили метансульфоновою кислотою (100 мл) та охолодили до -10°С. 2(Гідроксиметил) ізоіндолін-1,3-діон (8,2 г, 46 ммоль) додавали порціями впродовж 15 хвилин. Реакційну суміш залишили нагріватись до кімнатної температури та збовтували впродовж ночі. Реакційну суміш вилили на лід та збовтували впродовж 1 години. Реакційну суміш відфільтрували та промили водою. Матеріал висушували на повітрі впродовж ночі, а потім поклали у високий вакуум на 5 годин. Після цього матеріал поклали у ДМФ (диметилформамід) із застосуванням тепла для забезпечення того, щоб весь матеріал перебував у розчині. Додавали невеликі кількості води, поки зберігався осад. Суміш відфільтрували, і твердий матеріал відповідав біс-алкільованому матеріалу. Додали додаткову воду для виділення 2-(3((1,3-діоксоізоіндолін-2-іл)метил)-4гідроксифеніл)оцтової кислоти, який відфільтрували та висушили. Цей матеріал перенесли на наступний етап без додаткового очищення. Етап В: Продукт етапу А (6,7 г, 22 ммоль) розбавили НВr (21 г, 258 ммоль) та оцтовою кислотою (20 мл). Реакційну суміш нагріли до рефлюксу та збовтували впродовж ночі. Потім реакційну суміш охолодили до 0°С і нейтралізували твердими гранулами NaOH до рівня рН~10 з одержанням розчину 2-(3-(амінметил)-4-гідроксифеніл)оцтової кислоти, яку використовували на наступному етапі без додаткового очищення. Етап С: До 2-(3-(амінметил)-4гідроксифеніл)оцтової кислоти (3,9 г, 21,5 ммоль) додали Вос2О (5,40 г, 24,8 ммоль) у 30 мл діоксану. Після збовтування впродовж 4 годин реакційну суміш розбавили етилацетатом та 1Н НСІ. Органічний шар висушили над MgSO4 та концентрували. Тверду речовину поклали у мінімальну кількість метиленхлориду, відфільтрували та промили метиленхлоридом. Фільтрат концентрували для одержання 3,0 г 2-(3-((тертбутоксикарбоніл)амінметил)-4гідроксифеніл)оцтової кислоти у вигляді білої піни. Етап D: 2-(3-((Тертбутоксикарбоніл)амінметил)-4гідроксифеніл)оцтову кислоту (1,6 г, 5,69 ммоль) розбавили ТГФ (10 мл) та метанолом (5 мл) із подальшим додаванням краплями TMSCHN2 (14,2 мл, 28,4 ммоль). Реакційну суміш збовтували впродовж 30 хвилин, а потім розбавили етилацетатом і водою. Шари відокремили, і органічний 96459 32 шар висушили над MgSO4, відфільтрували та концентрували. Матеріал очистили із застосуванням картриджа Biotage 40S з елююванням гексанами:етилацетатом (4:1), вихід 860 мг чистої олії, яку потім загустили до метил 2-(3-((тертбутоксикарбоніл)амінметил)-4-гідроксифеніл) ацетату. Етап Е: Метил 2-(3-((тертбутоксикарбоніл)амінметил)-4-гідроксифеніл) ацетат (200 мг, 0,677 ммоль) розбавили ACN (2 мл) із подальшим додаванням K2СО3 (206 мг, 1,49 ммоль) та 1-фтор-4-нітробензолу (0,103 мл, 0,948 ммоль). Реакційну суміш нагріли до рефлюксу (при приблизно 82°С) та збовтували впродовж 5 годин. Потім реакційну суміш розбавили етилацетатом і водою. Шари відокремили, і органічний шар висушили над MgSO4, відфільтрували та концентрували. Матеріал очистили із використанням Biotage 40S з елююванням гексанами/етилацетатом (3:1) для одержання 242 мг метил 2-(3-((тертбутоксикарбоніл)амінметил)-4-(4нітрофенокси)феніл)ацетату у вигляді прозорої олії. Етап F: Метил 2-(3-((тертбутоксикарбоніл)амінметил)-4-(4-нітрофенокси) феніл)ацетат (242 мг, 0,581 ммоль) розбавили ТГФ (3 мл) із подальшим додаванням пилу Zn (38,0 мг, 0,581 ммоль). Додали краплями близько 2 мл насиченого хлориду амонію. Після збовтування реакційної суміші впродовж 10 хвилин її розбавили етилацетатом і насиченим бікарбонатом натрію. Шари відокремили, і органічний шар висушили над MgSO4, відфільтрували та концентрували для одержання 225 мг метил 2-(4-(4-амінфенокси)-3((терт-бутоксикарбоніл)амінметил)феніл)ацетату. Етап G: Метил 2-(4-(4-амінфенокси)-3-((тертбутоксикарбоніл)амінметил) феніл)ацетат (100 мг, 0,259 ммоль) розбавили метиленхлоридом (3 мл) із подальшим додаванням 3,4-дихлорбензоїл хлориду (81,3 мг, 0,388 ммоль) та Ν,Νдіізопропілетиламіну (0,0451 мл, 0,259 ммоль). Реакційну суміш збовтували впродовж 3 годин. Реакційну суміш розбавили метиленхлоридом і водою. Шари відокремили, і органічний шар висушили над MgSO4, відфільтрували та концентрували. Матеріал очистили із застосуванням Biotage 12i з елююванням гексанами :етилацетатом (3:1) для одержання 130 мг метил 2-(3-((тертбутоксикарбоніл)амінметил)-4-(4-(3,4дихлорбензамід)фенокси)феніл)ацетату. Етап Н: Метил 2-(3-((тертбутоксикарбоніл)амінметил)-4-(4-(3,4дихлорбензамід)фенокси)феніл)ацетат (130 мг, 0,232 ммоль) обробили НСІ (0,581 мл, 2,32 ммоль). Після збовтування впродовж 3 годин матеріал концентрували для одержання 100 мг метил 2-(3-(амінметил)-4-(4-(3,4-дихлорбензамід) фенокси)феніл)ацетату. Етап І: Продукт етапу Η (30 мг, 0,065 ммоль) розбавили метиленхлоридом (1 мл) із подальшим додаванням 4-фторбензол-1-сульфонілхлориду (15 мг, 0,078 ммоль) і ДІЕА (0,024 мл, 0,14 ммоль). Після збовтування реакційної суміші впродовж 4 годин її поклали безпосередньо у планшет препаративної тонкошарової хроматографії 0,5 мм та 33 елюювали гексанами етилацетатом (3:1) для одержання 30 мг метил 2-(4-(4-(3,4дихлорбензамід)фенокси)-3-((4-фторфенілсульфонамід)метил)феніл)ацетату. Етап J: Метил 2-(4-(4-(3,4дихлорбензамід)фенокси)-3-((4-фторфенілсульфонамід)метил)феніл)ацетат (40 мг, 0,065 ммоль) розбавили МеОН (1 мл) із подальшим додаванням NaOH (0,32 мл, 1,3 ммоль). Після збовтування впродовж 1 години реакційну суміш розбавили етилацетатом і 2N НСІ. Шари відокремили, і органічний шар висушили над MgSO4, відфільтрували та концентрували. Матеріал очистили із застосуванням 0,5 мм препаративного планшета з елююванням метиленхлоридом:МеОН:АсОН (90:9:1) для одержання 12 мг вказаної у заголовку 1 сполуки у вигляді твердої речовини. Н ЯМР (400 МГц, CDCI3/CD3OD) 8,1 (m, 1Н), 7,85 (m, 1Н), 7,8 (m, 2Н), 7,7 (d, 1Н), 7,6 (d, 1Н), 7,25 (s, 1Н), 7,2 (m, 3Н), 6,85 (d, 2Н), 6,7 (d, 1Н), 4,15 (s, 2H), 3,55 (s, 2H). Приклад 2 2-(4-(4-(3,4-Дихлорбензамід)фенокси)-3(метилсульфонамідметил)феніл)оцтова кислота Готували способом прикладу 1 із заміщенням 4-фторбензол-1-сульфоніл хлориду на етапі Η 1 метансульфонілхлоридом. Н ЯМР (400 МГц, d6ДМСО) 12,4 (s, 1Н), 10,4 (s, 1Н), 8,20 (m, 1Н), 7,95 (m, 1Н), 7,85 (d, 1H), 7,75 (d, 2H), 7,55 (t, 1H), 7,4 (m, 1Н), 7,19 (m, 1Н), 7,05 (d, 2Н), 6,8 (d, 1Н), 4,2 (d, 2Н), 3,55 (s, 2Н), 2,85 (s, 3Н). Приклад 3 2-(4-(4-(3,4-Дихлорбензамід)фенокси)-3-((2,4дихлорфенілсульфонамід)метил)-феніл)оцтова кислота Готували способом прикладу 1 із заміщенням 4-фторбензол-1-сульфонілхлориду на етапі Η 2,41 дихлорбензил-1-сульфонілхлоридом. Н ЯМР (400 МГц, CDCI3/CD3OD) 8,1 (s, 1Η), 7,85 (m, 2Н), 7,65 (m, 3Н), 7,50 (m, 1Η), 7,35 (d, 1Η), 7,2 (s, 1H), 7,10 (d, 1H), 6,90 (d, 2H), 6,60 (d, 1H), 4,20 (s, 2H), 3,45 (s, 2H). 96459 34 Приклад 4 2-(4-(4-(3,4-Дихлорбензамід)фенокси)-3(нікотинамідметил)феніл)оцтова кислота Етап А: 4-Амінфенол (1,9 г, 17 ммоль) розбавили ДМФ (40 мл) із подальшим додаванням піридину (0,978) (1,4 мл, 17 ммоль) і 3,4-дихлорбензоїл хлориду (3,0 г, 14 ммоль) у 5 мл ДМФ. Після збовтування впродовж 12 годин реакційну суміш розбавили етилацетатом і 2Н НСІ. Водний шар екстрагували один раз етилацетатом. Органічні шари поєднали, промили водою, соляним розчином, висушили над MgSO4, відфільтрували та концентрували у силікагель. Матеріал очистили із застосуванням колонки Biotage 40M з елююванням гексанами:етилацетатом (9:1) із застосуванням 2 л, а потім (60:40) 1 л для одержання 3,4-дихлор-N-(4гідроксифеніл)-бензаміду (1,5 г, вихід 37%) у вигляді твердої речовини. Етап В: Терт-бутил 2-(3-ціано-4фторфеніл)ацетат (2,0 г, 8,5 ммоль) та продукт етапу А (2,9 г, 10 ммоль) розбавили ДМСО (22 мл) із подальшим додаванням карбонату калію (1,4 г, 10 ммоль). Реакційну суміш нагріли до 125°С та збовтували впродовж 12 годин. Потім реакційну суміш охолодили до кімнатної температури, розбавили етилацетатом та 10%-ним водним карбонатом натрію. Шари відокремили, і органічний шар промили ще двічі 10%-ним водним карбонатом натрію, а потім водою та соляним розчином. Органічний матеріал висушили над MgSO4, відфільтрували та концентрували. Матеріал очистили із застосуванням колонки Biotage 40M з елююванням гексанами:етилацетатом (8:2) для одержання терт-бутил 2-(3-ціано-4-(4-(3,4дихлорбензамід)фенокси)феніл)ацетату (2,5 г, вихід 59%) у вигляді твердої речовини. Етап С: Продукт етапу В (100 мг, 0,201 ммоль) розбавили 7Н аміак/метанол (10 мл), а потім додали етилацетат (10 мл). Після розчинення матеріалу додали нікель Ренея (1,72 мг, 0,0201 ммоль), і реакційну суміш тричі очистили воднем з балону. Після збовтування впродовж 12 годин реакційну суміш відфільтрували крізь скловолоконний фільтр та концентрували. Осад очистили із застосуванням колонки Biotage 12i з елююванням метиленхлоридом:МеОН:МН4ОН (90:9:1) для одержання терт-бутил 2-(3-(амінметил)-4-(4-(3,4дихлорбензамід)фенокси)феніл)ацетату (100 мг, вихід 99,2%) у вигляді прозорої олії. Етап D: Продукт етапу С (0,050 г, 0,997 ммоль) розчинили у 1 мл ДХМ у невеликій пробірці. Додали піридин (0,017 г, 0,219 ммоль) та нікотиноїлхлорид (0,0195 г, 0,110 ммоль), і реакційну суміш 35 збовтували впродовж 12 годин. Потім реакційну суміш розбавили метиленхлоридом та водою. Шар метиленхлориду відокремили і завантажили безпосередньо у колонку Biotage 12i з елююванням метиленхлоридом:МеОН (95:5) для одержання терт-бутил 2-(4-(4-(3,4-дихлорбензамід)фенокси)3-(нікотинамідметил)феніл)-ацетату (44 мг, вихід 73%) у вигляді прозорої олії. Етап Е: Продукт етапу D (44 мг, 0,073 ммоль) розбавили метиленхлоридом:TFA (1:1) та збовтували впродовж 3 годин. Реакційну суміш концентрували, поклали в ефір і диспергували за допомогою ультразвуку. Тверду речовину відфільтрували, промили ефіром та висушили у вакуумі для одержання вказаної у заголовку сполуки (35 мг, вихід 1 88%) у вигляді білої твердої речовини. Н ЯМР (400 МГц, CDCI3/CD3OD) 8,75 (m, 1H), 8,65 (m, 1H), 8,15 (m, 1H), 8,10 (m, 1Н), 8,0 (m, 1Н), 7,60 (m, 3Н), 7,45 (m, 1H), 7,20 (m, 1H), 6,95 (d, 2H), 6,90 (d, 1H), 4,65 (m, 2H), 3,62 (s, 2H). Приклад 5 2-(4-(4-(3,4-Дихлорбензамід)фенокси)-3-((N,Nдиметилсульфамоїламін)метил)-феніл)оцтова кислота Готували способом прикладу 4 із заміщенням нікотиноїлхлориду на етапі D диметилсульфамої1 лхлоридом. Н ЯМР (400 МГц, CDCI3/CD3OD) 8,05 (s, 1H), 7,80 (m, 1Н), 7,65 (m, 2H), 7,55 (d, 1H), 7,35 (m, 1H), 7,18 (m, 1H), 7,00 (d, 2H), 6,82 (d, 1Η), 4,25 (s, 2H), 3,60 (s, 2H), 2,75 (s, 6H). Приклад 6 2-(4-(4-(3,4-Дихлорбензамід)фенокси)-3(метилсульфонамідметил)феніл)оцтова кислота Готували способом прикладу 4 із заміщенням нікотиноїлхлориду на етапі D метансульфонілхло1 ридом. Н ЯМР (400 МГц, d6-ДМСО) 12,4 (s, 1H), 10,4 (s, 1H), 8,20 (m, 1H), 7,95 (m, 1H), 7,85 (d, 1H), 7,75 (d, 2H), 7,55 (t, 1H), 7,4 (m, 1H), 7,19 (m, 1Н), 7,05 (d, 2Н), 6,8 (d, 1Н), 4,2 (d, 2Н), 3,55 (s, 2Н), 2,85 (s, 3Н). Приклад 7 2-(3-(Циклогексанкарбоксамідметил)-4-(4-(3,4дихлорбензамід)фенокси)феніл)-оцтова кислота 96459 36 Готували способом прикладу 4 із заміщенням нікотиноїлхлориду на етапі D циклогексанкарбоні1 лхлоридом. Н ЯМР (400 МГц, CDCI3/CD3OD) 8,10 (m, 1H), 7,80 (m, 1H), 7,65 (d, 2H), 7,55 (d, 1H), 7,25 (m, 1H), 7,15 (d, 1H), 6,95 (d, 2H), 6,85 (d, 1Н), 2,10 (m, 1H), 1,6-1,8 (m, 5H), 1,2-1,4 (m, 6H). Приклад 8 2-(3-(Ацетамідметил)-4-(4-(3,4дихлорбензамід)фенокси)феніл)оцтова кислота Готували способом прикладу 4 із заміщенням 1 нікотиноїлхлориду на етапі D ацетилхлоридом. Н ЯМР (400 МГц, CDCI3/CD3OD) 8,10 (m, 1H), 7,80 (m, 1H), 7,60 (m, 3Н), 7,30 (m, 1Н), 7,15 (m, 1Н), 6,95 (d, 2Н), 6,85 (d, 1Н), 4,42 (s, 2Н), 3,40 (s, 2Н), 1,95 (s, 3H). Приклад 9 2-(4-(4-(3,4-Дихлорбензамід)фенокси)-3(ізонікотинамідметил)феніл)оцтова кислота Готували способом прикладу 4 із заміщенням нікотиноїлхлориду на етапі D ізонікотиноїлхлори1 дом. Н ЯМР (400 МГц, CDCI3/CD3OD) 8,62 (m, 1H), 8,05 (m, 1H), 7,88 (m, 1Н), 7,80 (m, 1Н), 7,65 (m, 2Н), 7,58 (m, 3Н), 7,35 (m, 1H), 7,20 (m, 1H), 6,95 (d, 2H), 6,90 (d, 1H), 4,65 (d, 2H), 3,62 (s, 2H). Приклад 10 2-(4-(4-(3,4-Дихлорбензамід)фенокси)-3-((4фторбензамід)метил)феніл)оцтова кислота 37 Готували способом прикладу 4 із заміщенням нікотиноїлхлориду на етапі D 41 фторбензоїлхлоридом. Н ЯМР (400 МГц, CD3OD) 8,10 (s, 1Н), 7,85 (m, 1Η), 7,80 (m, 2H), 7,70 (d, 1H), 7,62 (d, 2H), 7,35 (s, 1H), 7,25 (d, 1H), 7,35 (m, 2H), 6,95 (d, 2Н), 6,90 (d, 1Н), 4,62 (s, 2Н), 3,60 (s, 3Н). Приклад 11 2-(4-(4-(3,4-Дихлорбензамід)фенокси)-3(піколінамідметил)феніл)оцтова кислота Готували способом прикладу 4 із заміщенням нікотиноїлхлориду на етапі D піколіноїлхлоридом. 1 Н ЯМР (400 МГц, CD3OD) 8,60 (d, 1Н), 8,10 (m, 1H), 8,05 (m, 1Н), 7,95 (m, 1H), 7,85 (m, 1H), 7,70 (d, 1H), 7,60 (d, 2H), 7,55 (m, 1H), 7,35 (m, 1H), 7,20 (d, 1H), 7,00 (d, 2H), 6,85 (d, 1H), 4,64 (s, 2H), 3,60 (s, 2H). Приклад 12 2-(4-(4-(3,4-Дихлорбензамід)фенокси)-3((метоксикарбоніламін)метил)феніл)-оцтова кислота Готували способом прикладу 4 із заміщенням нікотиноїлхлориду на етапі D метилхлорформа1 том. Н ЯМР (400 МГц, CDCI3) 8,10 (m, 1H), 7,80 (m, 1H), 7,65 (m, 2Н), 7,58 (m, 1H), 7,30 (m, 1H), 7,19 (m, 1H), 6,95 (m, 2H), 6,85 (m, 1H), 4,40 (s, 2H), 3,65 (s, 3Н), 3,60 (s, 2H). Приклад 13 2-(4-(4-(3,4-Дихлорбензамід)фенокси)-3((піридин-3-сульфонамід)метил)феніл)-оцтова кислота 96459 38 Готували способом прикладу 4 із заміщенням нікотиноїлхлориду на етапі D піридин-31 сульфонілхлоридом. Н ЯМР (400 МГц, CDCI3) 8,95 (s, 1H), 8,60 (m, 1H), 8,10 (m, 1Н), 8,05 (d, 1Н), 7,80 (d, 1Н), 7,60 (m, 3Н), 7,35 (m, 1H), 7,22 (m, 1H), 7,05 (d, 1H), 6,80 (d, 2H), 6,62 (d, 1H), 4,25 (s, 1H), 3,55 (s, 2H). Приклад 14 2-(4-(4-(3,4-Дихлорфенілкарбамоїл)фенокси)3-(метилсульфонамідметил)феніл)-оцтова кислота Етап А: Терт-бутил 2-(3-ціано-4фторфеніл)ацетат (2,6 г, 11,1 ммоль) та метил 4гідроксибензоат (3,36 г, 22,1 ммоль) розбавили ДМСО (22 мл) із подальшим додаванням карбонату калію (1,83 г, 13,3 ммоль). Реакційну суміш нагріли до 125°С та збовтували впродовж 5 годин. Реакційну суміш розбавили етилацетатом і 10%ним водним карбонатом натрію. Шари відокремили, і органічний шар ще двічі промили 10%-ним водним карбонатом натрію, а потім водою та соляним розчином. Органічний матеріал висушили над MgSO4, відфільтрували та концентрували. Матеріал очистили із застосуванням колонки Biotage 40M з елююванням гексанами:етилацетатом (9:1) для одержання метил 4-(4(2-терт-бутокси-2-оксоетил)-2ціанофенокси)бензоату (2,65 г, вихід 65,3) у вигляді прозорої олії. Етап В: Продукт етапу А (2,5 г, 6,80 ммоль) розбавили 7Н аміак/метанол (30 мл) із подальшим додаванням нікеля Ренея (0,0583 г, 0,680 ммоль). Реакційну суміш тричі очистили воднем і збовтували впродовж 12 годин. Потім реакційну суміш відфільтрували крізь скловолоконний фільтр та концентрували. Осад очистили із застосуванням колонки Biotage 40M з елююванням метиленхлоридом: MeOH:NH4OH (90:9:1) для одержання метил 4-(2-(амінметил)-4-(2-терт-бутокси-2оксоетил)фенокси)бензоату (1,87 г, вихід 74,0%) у вигляді прозорої олії. Етап С: Продукт етапу В (1,87 г, 5,03 ммоль) розбавили метиленхлоридом (2 мл) із подальшим додаванням піридину (0,489 мл, 6,04 ммоль) та 39 метансульфонілхлориду (0,779 мл, 10,1 ммоль). Після збовтування впродовж 12 годин реакційну суміш розбавили метиленхлоридом і 2Н НСІ, шари відокремили, і органічний шар висушили над MgSO4, відфільтрували та концентрували. Матеріал очистили із застосуванням картриджа Biotage 40M з елююванням гексанами :етилацетатом (1:1) для одержання метил 4-(4-(2-терт-бутокси-2оксоетил)-2(метилсульфонамідметил)фенокси)бензоату (1,53 г, вихід 67,6%) у вигляді прозорої олії. Етап D: Продукт етапу С (900 мг, 2,00 ммоль) розбавили діоксаном (10 мл) із подальшим додаванням LiOH-H2O (126 мг, 3,00 ммоль), розчиненого у воді (2 мл). Після збовтування впродовж 12 годин реакційну суміш розбавили етилацетатом і 2Н НСІ. Шари відокремили, і органічний шар висушили над MgSO4, відфільтрували та концентрували. Матеріал очистили із застосуванням картриджа Biotage 40M з елююванням метиленхлоридом:МеОН (95:5) для одержання 4(4-(2-терт-бутокси-2-оксоетил)-2(метилсульфонамідметил)фенокси)бензойної кислоти (710 мг, вихід 81,4%) у вигляді прозорої олії. Етап Е: Продукт етапу D (62 мг, 0,14 ммоль) розбавили метиленхлоридом (1 мл) із подальшим додаванням оксалілдихлориду (0,093 мл, 0,19 ммоль) та 1 краплі ДМФ. Реакційну суміш збовтували впродовж 30 хвилин із подальшим додаванням 3,4-дихлорбензоламіну (46 мг, 0,28 ммоль). Реакційну суміш залишили збовтуватись впродовж 1 години. Реакційну суміш завантажили безпосередньо у колонку 12і та очистили на системі Biotage Horizon з елююванням метиленхлоридом:МеОН (від 99.5-0,5 до 95:5) для одержання 30 мг терт-бутил 2-(4-(4-((3,4дихлорфеніл)карбамоїл)фенокси)-3(метилсульфонамід-метил)феніл) ацетату у вигляді прозорої олії. Етап F: Продукт етапу Ε (22 мг, 0,038 ммоль) розбавили метиленхлоридом (1 мл) із подальшим додаванням TFA (1 мл). Після збовтування впродовж 1 години реакційну суміш концентрували, розбавили ефіром, диспергували за допомогою ультразвуку та концентрували для одержання 2-(4(4-((3,4-дихлорфеніл)карбамоїл)фенокси)-3(метилсульфонамідметил)феніл)оцтової кислоти 1 (15 мг, вихід 75%) у вигляді твердої речовини. Н ЯМР (400 МГц, CDCI3/CD3OD) 7,92 (m, 1H), 7,90 (d, 2H), 7,59 (m, 1H), 7,42 (m, 2H), 7,25 (m, 1H), 7,10 (d, 2Н), 6,90 (d, 1Н), 4,28 (s, 2Н), 3,62 (s, 2Н), 2,85 (s, 3Н). Приклад 15 2-(4-(4-(3,4Дихлорфенетилкарбамоїл)фенокси)-3(метилсульфонамідметил)-феніл)оцтова кислота 96459 40 Готували способом прикладу 14 із заміщенням 3,4-дихлорбензоламіну на етапі Ε 2-(3,41 дихлорфеніл)етанаміном. Н ЯМР (400 МГц, CDCI3/CD3OD) 7,75 (d, 2Н), 7,35 (m, 3Н), 7,22 (d, 1H), 7,10 (d, 1H), 6,95 (d, 2H), 6,90 (d, 1H), 4,25 (s, 2H), 3,62 (m, 4Н), 3,40 (s, 2Н), 2,90 (t, 2Н), 2,85 (s, 3Н). Приклад 16 2-(3-(Метилсульфонамідметил)-4-(4(нафтален-2-ілкарбамоїл)фенокси)феніл)-оцтова кислота Готували способом прикладу 14 із заміщенням 3,4-дихлорбензоламіну на етапі Ε нафтален-21 аміном. Н ЯМР (400 МГц, CDCI3/CD3OD) 8,35 (s, 1H), 7,96 (d, 2Н), 7,83 (m, 3Н), 7,70 (d, 1Н), 7,45 (m, 3Н), 7,25 (d, 1H), 7,05 (d, 2H), 6,95 (d, 1H), 4,30 (d, 2Н), 3,62 (s, 2Н), 2,85 (s, 3Н). Приклад 17 2-(4-(4-(4-Фторфенетилкарбамоїл)фенокси)-3(метилсульфонамідметил)феніл)-оцтова кислота Готували способом прикладу 14 із заміщенням 3,4-дихлорбензоламіну на етапі Ε 2-(41 фторфеніл)етанаміном. Н ЯМР (400 МГц, CDCI3/CD3OD) 7,70 (d, 2Н), 7,40 (m, 1Н), 7,22 (m, 3Н), 7,10 (m, 2H), 6,90 (d, 2H), 6,70 (d, 1H), 4,30 (s, 2H), 3,65 (m, 4Н), 2,90 (t, 2Н), 2,85 (s, 3Н). Приклад 18 2-(3-(Метилсульфонамідметил)-4-(4(фенетилкарбамоїл)фенокси)феніл)оцтова кислота 41 Готували способом прикладу 14 із заміщенням 3,4-дихлорбензоламіну на етапі Ε фенетиламіном. 1 Н ЯМР (400 МГц, CDCI3/CD3OD) 7,70 (d, 2H), 7,40 (m, 1H), 7,31 (m, 1Н), 7,25 (m, 5Н), 6,95 (d, 2Н), 6,90 (d, 1Н), 4,30 (s, 2Н), 3,68 (t, 2Н), 3,61 (s, 2Н), 2,90 (t, 2Н), 2,85 (s, 3Н). Приклад 19 2-(3-(Метилсульфонамідметил)-4-(4(фенілкарбамоїл)фенокси)феніл)оцтова кислота Готували способом прикладу 14 із заміщенням 1 3,4-дихлорбензоламіну на етапі Ε аніліном. Н ЯМР (400 МГц, CDCI3/CD3OD) 7,92 (d, 2Н), 7,65 (d, 2Н), 7,45 (s, 1Н), 7,38 (m, 2H), 7,25 (d, 1H), 7,18 (m, 1H), 7,05 (d, 2H), 6,95 (d, 1H), 4,30 (s, 2H), 3,65 (s, 2Н), 2,85 (s, 3Н). Приклад 20 2-(4-(4-(Бензилкарбамоїл)фенокси)-3(метилсульфонамідметил)феніл)оцтова кислота Готували способом прикладу 14 із заміщенням 3,4-дихлорбензоламіну на етапі Ε бензиламіном. 1 Н ЯМР (400 МГц, CDCI3/CD3OD) 7,80 (d, 2H), 7,40 (m, 1H), 7,35 (m, 4Н), 7,22 (d, 1Н), 6,95 (m, 3Н), 6,90 (d, 1H), 4,62 (d, 2H), 4,30 (s, 2H), 3,62 (s, 2Н), 2,85 (s, 3Н). Приклад 21 2-(4-(4-(4-Хлорфенетилкарбамоїл)фенокси)-3(метилсульфонамідметил)феніл)-оцтова кислота 96459 42 Готували способом прикладу 14 із заміщенням 3,4-дихлорбензоламіну на етапі Ε 2-(41 хлорфеніл)етанаміном. Н ЯМР (400 МГц, CDCI3/CD3OD) 7,7 (d, 2H), 7,4 (s, 1H), 7,25 (d, 2H), 7,22 (d, 1H), 7,18 (d, 2H), 6,95 (d, 2H), 6,90 (d, 1H), 6,82 (brt, 1Η), 4,3 (s, 2Η), 3,65 (t, 2Н), 3,4 (br s, 2H), 2,9 (t, 2H), 2,85 (s, 3Н). Приклад 22 2-(4-(4-(2-(4-Хлорбензиламін)-2оксоетил)фенокси)-3-(метилсульфонамідметил)феніл)оцтова кислота Готували способом прикладу 14 із заміщенням метил 4-гідроксибензоату на етапі А метил 2-(4гідроксилфеніл)ацетатом та із заміщенням 3,4дихлорбензоламіну на етапі Ε 41 хлорбензиламіном. Н ЯМР (400 МГц, CDCI3/CD3OD) 7,38 (m, 1Н), 7,25 (m, 4Н), 7,20 (m, 3Н), 6,95 (d, 2H), 6,85 (d, 1H), 4,38 (m, 2Н), 4,32 (s, 2Н), 3,61 (s, 2Н), 3,55 (s, 2Н), 2,85 (s, 3Н). Приклад 23 2-(4-(4-(2-(Бензиламін)-2-оксоетил)фенокси)-3(метилсульфонамідметил)феніл)-оцтова кислота Готували способом прикладу 14 із заміщенням метил 4-гідроксибензоату на етапі А метил 2-(4гідроксилфеніл)ацетатом та із заміщенням 3,41 дихлорбензоламіну на етапі Ε бензиламіном. Н ЯМР (400 МГц, CDCI3/CD3OD) 7,38 (m, 1H), 7,157,30 (m, 8H), 6,95 (d, 2H), 6,85 (d, 1H), 4,40 (d, 2H), 4,32 (s, 2H), 3,61 (s, 2Н), 3,56 (s, 2Н), 2,82 (s, 3Н). Приклад 24 2-(3-(Метилсульфонамідметил)-4-(4-(2-оксо-2(фенетиламін)етил)фенокси)феніл)-оцтова кислота 43 96459 44 Приклад 27 2-(4-(4-Бензамідфенокси)-3-((4фторфенілсульфонамід)метил)феніл)оцтова лота Готували способом прикладу 14 із заміщенням метил 4-гідроксибензоату на етапі А метил 2-(4гідроксилфеніл)ацетатом та із заміщенням 3,41 дихлорбензоламіну на етапі Ε фенетиламіном. Н ЯМР (400 МГц, CDCI3/CD3OD) 7,38 (m, 1H), 7,28 (m, 1H), 7,25 (m, 1H), 7,18-7,22 (m, 2H), 7,15 (d, 2H), 7,10 (d, 1H), 6,92 (d, 2Н), 6,82 (d, 1Н), 4,38 (s, 2Н), 3,62 (s, 2Н), 3,48 (m, 4Н), 2,82 (s, 3Н), 2,75 (t, 2Н). Приклад 25 2-(4-(4-(2-(Бензил(метил)амін)-2оксоетил)фенокси)-3-(метилсульфонамідметил)феніл)оцтова кислота Готували способом прикладу 14 із заміщенням метил 4-гідроксибензоату на етапі А метил 2-(4гідроксилфеніл)ацетатом та із заміщенням 3,4дихлорбензоламіну на етапі Ε N1 метилбензиламіном. Н ЯМР (400 МГц, CDCI3/CD3OD) 7,10-7,40 (m, 9H), 6,94 (m, 2H), 6,82 (m, 1H), 4,60 (d, 2H), 4,35 (m, 2Н), 3,75 (d, 2Н), 3,62 (m, 2Н), 2,97 (d, 3Н), 2,82 (s, 3Н). Приклад 26 2-(3-(Метилсульфонамідметил)-4-(4-(2-оксо-2(феніламін)етил)фенокси)феніл)-оцтова кислота Готували способом прикладу 14 із заміщенням метил 4-гідроксибензоату на етапі А метил 2-(4гідроксилфеніл)ацетатом та із заміщенням 3,41 дихлорбензоламіну на етапі Ε аніліном. Н ЯМР (400 МГц, CDCI3/CD3OD) 7,55 (d, 2Н), 7,30-7,35 (m, 5Н), 7,18 (m, 1Н), 7,10 (m, 1Н), 6,95 (d, 2Н), 6,85 (d, 1Н), 4,35 (s, 2Н), 3,68 (s, 2Н), 3,60 (s, 2Н), 2,85 (s, 3Н). кис Готували способом прикладу 1 із заміщенням 3,4-дихлорбензоїлхлориду на етапі G бензоїлхлоридом. MS + 534,9 [М + 1]. Приклад 28 2-(4-(4-(4-Хлорбензамід)фенокси)-3-((4фторфенілсульфонамід)метил)феніл)-оцтова кислота Готували способом прикладу 1 із заміщенням 3,4-дихлорбензоїлхлориду на етапі G 41 хлорбензоїлхлоридом. Н ЯМР (400 МГц, CD3OD) 7,85 (d, 2H), 7,70 (m, 1Н), 7,45-7,55 (m, 5Н), 7,35 (m, 1Н), 7,15 (m, 2Н), 6,60-6,70 (m, 3Н), 4,55 (s, 2H), 3,58 (s, 2H). Приклад 29 2-(4-(4-(3-Хлорбензамід)фенокси)-3-((4фторфенілсульфонамід)метил)феніл)-оцтова кислота Готували способом прикладу 1 із заміщенням 3,4-дихлорбензоїлхлориду на етапі G 31 хлорбензоїлхлоридом. Н ЯМР (400 МГц, CD3OD) 7,90 (s, 1H), 7,80 (d, 1Н), 7,65 (m, 1H), 7,52 (m, 4H), 7,45 (t, 1H), 7,35 (m, 1H), 7,15 (m, 2H), 6,60 (m, 4H), 4,45 (s, 2H), 3,50 (brs, 2H). Приклад 30 2-(4-(4-(3,4-Дифторбензамід)фенокси)-3(метилсульфонамідметил)феніл)оцтова кислота 45 96459 46 гідроксифеніл)ацетату на етапі Ε метил 2-(41 гідрокси-3-метоксифеніл)ацетатом. Н ЯМР (400 МГц, CDCI3) 9,64 (s, 1H), 8,17 (d, 1H), 7,97 (dd, 1H), 7,72-7,75 (m, 4H), 7,13 (d, 1H), 6,99 (d, 1H), 6,93 (d, 1H), 6,87 (m, 2Н), 3,80 (s, 3Н), 3,66 (s, 2H). Приклад 33 2-(4-(4-(бензилоксикарбамоїл)фенокси)-3(метилсульфонамідметил)феніл)оцтова кислота Готували способом прикладу 1 із заміщенням 3,4-дихлорбензоїлхлориду на етапі G 3,4дифторбензоїлхлоридом та із заміщенням 4фторбензол-1-сульфоніл хлориду на етапі І мета1 нсульфонілхлоридом. Н ЯМР (400 МГц, CD3OD) 7,88 (m 1Н), 7,80 (m, 1H), 7,65 (d, 2H), 7,42 (m, 2H), 7,20 (m, 2H), 7,00 (d, 2H), 6,82 (m, 1H), 4,33 (s, 2Н), 3,62 (s, 2Н), 2,85 (s, 3Н). Приклад 31 2-(4-(4-(2-Хлорбензамід)фенокси)-3(метилсульфонамідметил)феніл)оцтова кислота Готували способом прикладу 1 із заміщенням 3,4-дихлорбензоїлхлориду на етапі G 2хлорбензоїлхлоридом та із заміщенням 4фторбензол-1-сульфонілхлориду на етапі І метан1 сульфонілхлоридом. Н ЯМР (400 МГц, CD3OD) 7,68 (d, 2H), 7,40-7,55 (m, 5H), 7,20 (d, 1H), 7,05 (d, 2H), 6,85 (d, 1H), 4,35 (s, 2H), 3,65 (br s, 2H), 2,85 (s, 3Н). Приклад 32 2-(4-(4-(3,4-Дихлорбензамід)фенокси)-3метоксифеніл)оцтова кислота Готували відповідно до етапів Е, F, G та J прикладу 1 із заміщенням метил 2-(3-((тертбутоксикарбоніл)амінметил)-4 Готували способом прикладу 14 із заміщенням 3,4-дихлорбензоламіну на етапі Ε О1 бензилгідроксиламінгідрохлоридом. Н ЯМР (400 МГц, CD3OD) 7,76 (d, J=8,6 Гц, 2Н), 7,50 (t, J = 6,3 Гц, 1Н), 7,33-7,48 (m, 5H), 7,23 (d, J=6,3 Гц, 1Н), 6,99 (d, J=8,7 Гц, 2Н), 6,91 (d, J= 8,4 Гц, 2Н), 4,91 (s, 2H), 4,10 (d, J=6,3 Гц, 2Н), 3,60 (s, 2Н), 2,85 (s, 3Н). Приклад 34 2-(3-Хлор-4-(4-(4хлорфенетилкарбамоїл)фенокси)феніл)оцтова кислота Етап А: 2-(3-Хлор-4-гідроксифеніл)оцтова кислота (5,0 г, 26,8 ммоль) розчинили у 30 мл МеОН і краплями додали H2SO4 (0,744 мл, 13,4 ммоль) при температурі навколишнього середовища. Реакційну суміш рефлюксували впродовж чотирьох годин і потім концентрували у вакуумі. Осад розбавили 150 мл ЕtOАс і послідовно промили насиченим NaHCO3, водою та соляним розчином, висушили над H2SO4 та концентрували у вакуумі для одержання метил 2-(3-хлор-4гідроксифеніл)ацетату (5,16 г, вихід 96,0%) у вигляді напівпрозорої густої олії. Етап В: Метил 2-(3-хлор-4гідроксифеніл)ацетат (177 мг, 0,885 ммоль) розбавили ДМСО (3 мл) із подальшим додаванням K2СО3 (122 мг, 0,885 ммоль) та N-(4хлорфенетил)-4-хлор-3-нітробензаміду (300 мг, 0,885 ммоль) (синтезованого на етапі С). Реакційну суміш нагріли до 85°С та збовтували впродовж 12 годин. Реакційну суміш охолодили, розбавили ДХМ і промили 10%-ним водним карбонатом натрію, водою та соляним розчином. Шари відокре 47 мили, і органічний шар висушили над H2SO4, відфільтрували та концентрували. Матеріал очистили із застосуванням картриджа Biotage 40S з елююванням ДХМ:МеОН (99:1) для одержання метил 2(4-(4-((4-хлорфенетил)карбамоїл)-2нітрофенокси)-3-хлорфеніл)ацетату (206 мг, вихід 46,3%). Етап С: 2-(4-Хлорфеніл)етанамін (2,3 мл, 16 ммоль) розбавили ДХМ (40 мл) із подальшим додаванням ДІЕА (2,9 мл, 16 ммоль) та 4-хлор-3нітробензоїлхлориду (3,0 г, 14 ммоль) у 10 мл ДХМ. Після збовтування впродовж 30 хвилин реакційну суміш завантажили безпосередньо у картридж Biotage 40M та еллюювали гексанами:етилацетатом (2:1) для одержання N-(4хлорфенетил)-4-хлор-3-нітробензаміду (4,0 г, вихід 86%) у вигляді твердої речовини. Етап D: Метил 2-(4-(4-((4хлорфенетил)карбамоїл)-2-нітрофенокси)-3хлорфеніл)ацетат (110 мг, 0,219 ммоль) розбавили ТГФ (1 мл) із подальшим додаванням пилу Zn (14,3 мг, 0,219 ммоль) та насиченого NH4CI (1 мл). Після збовтування впродовж 1 години реакційну суміш розбавили ДХМ і 10%-ним водним карбонатом натрію. Шари відокремили, і органічний шар висушили над MgSO4, відфільтрували та концентрували для одержання метил 2-(4-(4-((4хлорфенетил)карбамоїл)-2-амінфенокси)-3хлорфеніл)ацетату (102 мг, вихід 98,6%). Етап Е: Ізобутилнітрит (0,0751 мл, 0,634 ммоль) розбавили ДМФ (1 мл), поклали під азот та нагріли до 60°С. Додали краплями метил 2-(4-(4((4-хлорфенетил)карбамоїл)-2-амінфенокси)-3хлорфеніл)ацетат (100 мг, 0,211 ммоль) у ДМФ (1 мл), і реакційну суміш збовтували 1 годину. Реакційну суміш охолодили, розбавили етилацетатом і промили 2Н НСІ, насиченим бікарбонатом натрію та соляним розчином. Органічний шар висушили над MgSO4, відфільтрували та концентрували. Матеріал очистили із застосуванням колонки Biotage 12i з елююванням ДХМ:МеОН (99:1) для одержання метил 2-(4-(4-((4хлорфенетил)карбамоїл)фенокси)-3хлорфеніл)ацетату (70 мг, вихід 72,3%). Етап F: Метил 2-(4-(4-((4хлорфенетил)карбамоїл)фенокси)-3-хлорфеніл) ацетат (33 мг, 0,0720 ммоль) розбавили ТГФ (500 мкл) із подальшим додаванням NaOH (0,144 мл, 0,720 ммоль) та 100 мкл води. Після збовтування впродовж 2 годин реакційну суміш розбавили ДХМ та 2Н НСІ. Шари відокремили, і органічний шар висушили над MgSO4, відфільтрували та концентрували для одержання 2-(4-(4-((4хлорфенетил)карбамоїл)фенокси)-3хлорфеніл)оцтової кислоти (19 мг, вихід 59,4%) у 1 вигляді твердої речовини. Н ЯМР (400 МГц, CDCI3/CD3OD) δ 7,65 (d, 2H), 7,42 (m, 1H), 7,25 (d, 2H), 7,20 (d, 1H), 7,15 (d, 2H), 7,05 (d, 1H), 6,85 (d, 2H), 3,65 (t, 2H), 3,60 (s, 2H), 2,90 (t, 2H). Приклад 35 2-(3-ціано-4-(4-(3,4дихлорбензамід)фенокси)феніл)пропіонова кислота 96459 48 Етап А: До збовтуваного розчину діізопропіламіну (357 мкл, 2,55 ммоль) у ТГФ (3 мл) при -78°С додали n-бутиллітій (2,5М у гексанах, 1,02 мл, 2,55 ммоль). Реакційну суміш збовтували впродовж 30 хвилин, після чого краплями додали розчин ацетату (500 мг, 2,13 ммоль) у ТГФ (3,5 мл) та збовтували впродовж 20 хвилин при -78°С, потім нагріли до 0°С. Додали Mel (133 мкл, 2,13 ммоль), і реакційну суміш збовтували ще 30 хвилин. Реакційну суміш окислили 2М НСІ та екстрагували EtOAc. Потім поєднані органічні речовини промили соляним розчином та висушили над MgSO4. Осад очистили на системі Biotage Horizon (40+М, від 5% до 50% В:ЕtOАс, 21 мл-1008 мл) для одержання тертбутил 2-(3-ціано-4-фторфеніл)пропаноату (0,368 г, 1 1,48 ммоль, 70%). Н ЯМР (400 МГц, CDCI3) δ 7,507,60 (m, 2H), 7,17 (t, J=8,7 Гц, 1Н), 3,63 (q, J=7,1 Гц, 1Н), 4,60 (d, J=7,2 Гц, 3H), 1,40 (s,9H). Етап В: До збовтуваного розчину 4амінфенолу (2,50 г, 22,9 ммоль) у ДМФ (55 мл) додали піридин (1,85 мл, 22,9 ммоль), а потім 3,4дихлорбензоїлхлорид (4,0 г, 19,1 ммоль) у ДМФ (7 мл). Реакційну суміш збовтували при температурі навколишнього середовища впродовж ночі, потім розбавили 2М НСІ та EtOAc. Після цього водний шар екстрагували EtOAc, і поєднані органічні шари промили соляним розчином та висушили над MgSO4. Осад очистили на системі Biotage Horizon (65+M від 5% до 75% В:ЕtOАс, 51 мл-2448 мл). 3,4-Дихлор-N-(4-гідроксифеніл)бензамід зібрали у вигляді твердої речовини (3,91 г, 13,9 ммоль, 1 73%). Н ЯМР (400 МГц, CD3OD) δ 8,09 (s, 1H), 7,84 (d, J=8,5 Гц, 1Н), 7,67 (d, J=8,6 Гц, 1H), 7,45 (d, J=8,8 Гц, 2H), 6,78 (d, J=8,4 Гц, 2Н). Етап С: До збовтуваного розчину терт-бутил 2(3-ціано-4-фторфеніл) пропаноату (360 мг, 1,44 ммоль) з етапу А та 3,4-дихлор-N-(4гідроксифеніл) бензаміду (488 мг, 1,73 ммоль) з етапу В у ДМСО (4 мл) додали K2СО3 (240 мг, 1,73 ммоль). Реакційну суміш збовтували при температурі 125°С впродовж ночі, потім охолодили до температури навколишнього середовища та розбавили ЕtOАс і 10%-ним водним карбонатом натрію. Водну фазу екстрагували ЕtOАс, і поєднані органічні речовини промили 10%-ним водним карбонатом натрію та соляним розчином, висушили над MgSO4, концентрували та очистили на системі Biotage Horizon (40+М від 5% до 50% В:ЕtOАс, 21 мл - 1008 мл). Потім відповідні фракції поєднали і концентрували для одержання терт-бутил 2-(3ціано-4-(4-(3,4дихлорбензамід)фенокси)феніл)пропаноату (0,476 1 г, 0,797 ммоль, 55%). Н ЯМР (400 МГц, CDCI3 ) δ 7,99 (s, 1H), 7,84 (bs, N-H), 7,72 (d, J=9,3 Гц, 1Н), 7,67 (d, J=8,7 Гц, 2H), 7,60 (m, 2H), 7,42 (d, J=8,6 49 Гц, 1H), 7,11 (d, 0=7,7, 2H), 6,83 (d, J=8,7 Гц, 1H), 3,61 (q, J=7,1 Гц, 1Η), 1,45 (d, J=7,5 Гц, 3H), 1,42 (s, 9H). Етап D: До збовтуваного розчину терт-бутил 2(3-ціано-4-(4-(3,4дихлорбензамід)фенокси)феніл)пропаноату (25 мг, 0,049 ммоль) у ДХМ (1 мл) додали TFA (250 мкл). Реакційну суміш збовтували при температурі навколишнього середовища впродовж 4 годин і потім концентрували. Сирий продукт очистили препаративною тонкошаровою хроматографією (5% МеОН/ДХМ) для одержання 2-(3-ціано-4-(4(3,4-дихлорбензамід)фенокси)феніл) пропіонової 1 кислоти (0,0174 г, 0,0382 ммоль, 78%). Н ЯМР (400 МГц, CDCI3): 8,04 (bs, N-H), 7,96 (s, 1H), 7,647,71 (m, 3H), 7,61 (s, 1H), 7,55 (d, J=7,7 Гц, 1Н), 7,44 (dd, J=8,6, 2,2 Гц, 1Н), 7,08 (d, J=8,9 Гц, 2Н), 6,83 (d, J=8,5 Гц, 1Н), 3,74 (q, J=7,4 Гц, 1Н), 1,53 (d, J=6,9 Гц, 3Н). Приклад 36 2-(4-(4-(3,4-дихлорбензамід)фенокси)-3(метилсульфонамідметил)феніл)пропіонова кислота Готували способом прикладу 14 із заміщенням метил 4-(4-(2-терт-бутокси-2-оксоетил)-2ціанофенокси)бензоату на етапі В терт-бутил 2-(3ціано-4-(4-(3,4дихлорбензамід)фенокси)феніл)пропаноатом та 1 наступними етапами С та F. Н ЯМР (400 МГц, CD3OD): 8,10 (s, 1Н), 7,85 (s, 1Н), 7,60-7,70 (m, 3Н), 7,50 (s, 1H), 7,20 (d, 1H), 7,1 (d, 2H), 6,80 (d, 1H), 4,30 (s, 2H), 3,75 (q, 1H), 2,80(2, 3Н), 1,45 (d, 3Н). Приклад 37 2-(4-(4-(3,4-дихлорбензамід)фенокси)-3(метилсульфонамідметил)феніл)-2метилпропіонова кислота Етап А: До збовтуваного розчину NaOH (60%ного в олії, 195 мг, 4,88 ммоль) у ДМФ (10 мл) при температурі 0°С додали краплями розчин тертбутил 2-(3-ціано-4-фторфеніл)ацетату (500 мг, 2,125 ммоль) та Mel (330 мкл, 5,31 ммоль) у ДМФ (1 мл). Реакційну суміш нагріли до температури 96459 50 навколишнього середовища, збовтували впродовж ночі, а потім розбавили 1Н НСІ та ЕtOАс. Водний шар екстрагували ЕtOАс, і поєднані органічні речовини промили соляним розчином та висушили над MgSO4. Потім сирий концентрований продукт очистили на системі Biotage Horizon (40+М від 5% до 50% В:ЕtOАс, 18 мл - 864 мл) для одержання терт-бутил 2-(3-ціано-4-фторфеніл)-21 метилпропаноату (0,423 г, 1,602 ммоль, 75%). Н ЯМР (400 МГц, CDCI3) δ 7,56-7,63 (m, 2H), 7,17 (t, J=8,1 Гц, 1Н), 1,54 (s, 6H), 1,38 (s, 9H). Етап В: 2-(4-(4-(3,4-Дихлорбензамід)фенокси)3-(метилсульфонамідметил) феніл)-2метилпропіонову кислоту готували з терт-бутил 2(3-ціано-4-фторфеніл)-2-метилпропаноату способом прикладу 35 із заміщенням терт-бутил 2-(3ціано-4-фторфеніл)пропаноату на етапі В тертбутил 2-(3-ціано-4-фторфеніл)-2метилпропаноатом і наступними етапами В,С та F 1 прикладу 14. Η ЯМР (400 МГц, CD3OD): 8,15 (s, 1Н), 7,85 (d, 1Н), 7,65-7,75 (m, 3Н), 7,55 (s, 1H), 7,30 (d, 1H), 7,05 (d, 2Н), 6,80 (d, 1Н), 4,35 (s, 2Н), 2,80 (s, 3Н), 1,55 (s, 6H). Приклад 38 2-(3-(Метилсульфонамідметил)-4-(4-(4(трифторметил)фенілкарбамоїл)фенокси)феніл)оцтова кислота Готували способом прикладу 14 із заміщенням 3,4-дихлорбензоламіну на етапі Ε 41 трифторметилбензоламіном. Н ЯМР (400 МГц, CD3CI3, CD3OD) 7,95 (d, 2H), 7,82 (d, 2H), 7,62 (d, 1H), 7,45 (s, 1H), 7,25 (d, 1H), 7,05 (d, 2H), 6,95 (d, 1H), 4,30 (s, 2H), 3,62 (s, 2H), 2,82 (s, 3Н). Приклад 39 2-(3-(Метилсульфонамідметил)-4-(4-(3(трифторметил)фенілкарбамоїл)фенокси)феніл)оцтова кислота Готували способом прикладу 14 із заміщенням 3,4-дихлорбензоламіну на етапі Ε 31 трифторметилбензоламіном. Н ЯМР (400 МГц, CD3CI3, CD3OD) 8,05 (s, 1H), 7,90 (m, 3Н), 7,50 (m, 51 1H), 7,45 (s, 1H), 7,40 (m, 1H), 7,25 (d, 1H), 7,05 (d, 2H), 6,85 (d, 1H), 4,30 (s, 2H), 3,65 (s, 2H), 2,85 (s, 3Н). Приклад 40 2-(4-(4-(4-хлор-3фторфенілкарбамоїл)фенокси)-3(метилсульфонамідметил)феніл)оцтова кислота Готували способом прикладу 14 із заміщенням 3,4-дихлорбензоламіну на етапі Ε 4-хлор-31 фторбензоламіном. Н ЯМР (400 МГц, CD3CI3, CD3OD) 7,90 (d, 2Н), 7,75 (m, 1Н), 7,30-7,45 (m, 3Н), 7,25 (d, 1Н), 7,05 (d, 2Н), 6,95 (d, 1Н), 4,3 (s, 2Н), 3,65 (s, 2Н), 2,85 (s, 3Н). Приклад 41 2-(4-(4-(3-хлор-4фторфенілкарбамоїл)фенокси)-3(метилсульфонамідметил)феніл)оцтова кислота Готували способом прикладу 14 із заміщенням 3,4-дихлорбензоламіну на етапі Ε 3-хлор-41 фторбензоламіном. Н ЯМР (400 МГц, CD3CI3, CD3OD) 7,93 (d, 2H), 7,85 (m, 1H), 7,55 (m, 1H), 7,45 (s, 1H), 7,25 (d, 1H), 7,15 (t, 1H), 7,05 (d, 2H), 6,85 (d, 1H), 4,30 (s, 2H), 3,65 (s, 2H), 2,85 (s, 3Н). Приклад 42 2-(4-(4-(4хлорфенетилкарбамоїл)фенокси)феніл)оцтова кислота Етап А: 2-(4-гідроксифеніл)оцтову кислоту (1,0 г, 6,57 ммоль) розбавили ТГФ (4 мл) із подальшим додаванням реагента 2 (2,63 г, 13,1 ммоль). Реак 96459 52 ційну суміш збовтували впродовж 12 годин. Реакційну суміш відфільтрували та завантажили безпосередньо у картридж Biotage 40M з елююванням гексанами:етилацетатом (3:1) для одержання терт-бутил 2-(4-гідроксифеніл) ацетату (800 мг, вихід 58,4%) у вигляді прозорої олії, яка згодом затверділа і стала білою твердою речовиною. Етап В: 2-(4-хлорфеніл)етанамін (0,321 мл, 2,27 ммоль) розбавили ДХМ (10 мл) із подальшим додаванням ДІЕА (d 0,742) (0,395 мл, 2,27 ммоль) та 4-фторбензоїлхлориду (0,231 мл, 1,89 ммоль). Після збовтування впродовж 30 хвилин реакційну суміш завантажили безпосередньо у картридж Biotage 40S та елюювали гексанами:етилацетатом (2:1) для одержання N-(4-хлорфенетил)-4фторбензаміду (393 мг, вихід 74,8%) у вигляді твердої речовини. Етап С: Терт-бутил 2-(4-гідроксифеніл)ацетат (200 мг, 0,960 ммоль) розбавили ДМСО (4 мл) із подальшим додаванням K2СО3 (133 мг, 0,960 ммоль) та N-(4-хлорфенетил)-4-фторбензамщу (267 мг, 0,960 ммоль). Реакційну суміш збовтували при температурі 85°С впродовж ночі, а потім збовтували при температурі 138°С впродовж 12 годин. Реакційну суміш охолодили до температури навколишнього середовища, розбавили ДХМ та 10%ним водним карбонатом натрію. Шари відокремили, і органічний шар висушили над MgSO4, відфільтрували та концентрували. Сирий матеріал очистили силікагелевою хроматографією з елююванням гексанами:етилацетатом (4:1) для одержання терт-бутил 2-(4-(4-((4хлорфенетил)карбамоїл)фенокси)феніл)ацетату (20 мг, вихід 4,47%) у вигляді не зовсім білої твердої речовини. Етап D: Терт-бутил 2-(4-(4-((4хлорфенетил)карбамоїл)фенокси)феніл) ацетат (20 мг, 0,043 ммоль) розбавили ДХМ (1 мл) із подальшим додаванням TFA (1 мл). Після збовтування впродовж 2 годин реакційну суміш концентрували, розбавили ефіром та концентрували для одержання 2-(4-(4-((4-хлорфенетил) карбамоїл)фенокси)феніл)оцтової кислоти (17 мг, вихід 1 97%) у вигляді твердої речовини. Н ЯМР (400 МГц, CD3CI3, CD3OD) 7,70 (d, 2H), 7,30 (m, 4H), 7,19 (m, 2H), 7,00 (m, 4H), 3,62 (m, 4H), 2,90 (t, 2H). Приклад 43 2-(4-(4-(4-хлорфенетилкарбамоїл)фенокси)-3фторфеніл)оцтова кислота Етап А: 2-(3-Фтор-4-гідроксифеніл)оцтову кислоту (1,0 г, 5,88 ммоль) розбавили ТГФ:МеОН (3:1) (10 мл) із подальшим додаванням TMSCHN2 (5,88 мл, 11,8 ммоль). Після збовтування впродовж 1 години реакційну суміш погасили 2Н НСІ та розба 53 вили ДХМ. Шари відокремили, і органічний шар висушили над MgSO4, відфільтрували та концентрували. Матеріал очистили силікагелевою хроматографією з елююванням гексанами:етилацетатом (2:1) для одержання метил 2-(3-фтор-4гідроксифеніл)ацетату (700 мг, вихід 64,7%) у вигляді прозорої олії. Етап В: 2-(4-Хлорфеніл)етанамін (2,3 мл, 16 ммоль) розбавили ДХМ (40 мл) із подальшим додаванням краплями ДІЕА (2,9 мл, 16 ммоль) та 4хлор-3-нітробензоїлхлориду (3,0 г, 14 ммоль) у 10 мл ДХМ. Після збовтування впродовж 30 хвилин реакційну суміш завантажили безпосередньо у силікагелеву колонку та елюювали гексанами:етилацетатом (2:1) для одержання N-(4хлорфенетил)-4-хлор-3-нітробензаміду (4,0 г, вихід 86%) у вигляді твердої речовини. Етап С: Метил 2-(3-фтор-4гідроксифеніл)ацетат (приготований на етапі А; 163 мг, 0,885 ммоль) розбавили ДМСО (3 мл) із подальшим додаванням K2СО3 (122 мг, 0,885 ммоль) та М-(4-хлорфенетил)-4-хлор-3нітробензаміду (приготованого на етапі В; 300 мг, 0,885 ммоль). Реакційну суміш збовтували при температурі 80°С впродовж 12 годин. Реакційну суміш охолодили, розбавили ДХМ та промили 10%-ним водним карбонатом натрію, водою та соляним розчином. Шари відокремили, і органічний шар висушили над MgSO4, відфільтрували та концентрували. Матеріал очистили силікагелевою хроматографією з елююванням гексаном:ацетоном (2:1) для одержання метил 2-(4-(4((4-хлорфенетил)карбамоїл)-2-нітрофенокси)-3фторфеніл)ацетату (200 мг, вихід 46,4%). Етап D: Метил 2-(4-(4-((4хлорфенетил)карбамоїл)-2-нітрофенокси)-3фторфеніл)ацетат (100 мг, 0,205 ммоль) розбавили ТГФ (2 мл) із подальшим додаванням пилу Zn (13,4 мг, 0,205 ммоль) та насиченого водного NH4CI (1 мл). Після збовтування впродовж 1 години реакційну суміш розбавили етилацетатом та 10%-ним карбонатом натрію. Шари відокремили, і органічний шар висушили над MgSO4, відфільтрували та концентрували для одержання метил 2-(4-(4-((4хлорфенетил)карбамоїл)-2-амінфенокси)-3фторфеніл)ацетату (93 мг, вихід 99,1%). Етап Е: Ізобутилнітрил (0,060 мл, 0,51 ммоль) розбавили ДМФ (2 мл), поклали під азот та нагріли до 60°С із подальшим додаванням метил 2-(4-(4((4-хлорфенетил)карбамоїл)-2-амінфенокси)-3фторфеніл)ацетату (93 мг, 0,20 ммоль) у 500 мкл ДМФ. Реакційну суміш збовтували 30 хвилин і потім охолодили. Реакційну суміш розбавили етилацетатом та промили 2Н НСІ і насиченим бікарбонатом натрію. Шари відокремили, і органічний шар висушили над MgSO4, відфільтрували та концентрували. Матеріал очистили силікагелевою хроматографією з елююванням гексанами:етилацетатом (2:1) для одержання метил 2-(4-(4-((4хлорфенетил)карбамоїл)фенокси)-3фторфеніл)ацетату (35 мг, вихід 39%). Етап F: Метил 2-(4-(4-((4хлорфенетил)карбамоїл)фенокси)-3-фторфеніл) ацетат (32 мг, 0,072 ммоль) розбавили діоксаном 96459 54 (1 мл) із подальшим додаванням NaOH (0,072 мл, 0,36 ммоль) та 200 мкл води. Після збовтування впродовж З годин реакційну суміш розбавили етилацетатом та 2Н НСІ. Органічний шар висушили над MgSO4, відфільтрували та концентрували для одержання 2-(4-(4-((4хлорфенетил)карбамоїл)фенокси)-3фторфеніл)оцтової кислоти (15 мг, вихід 48%) у 1 вигляді твердої речовини. Н ЯМР (400 МГц, CD3CI3, CD3OD) 7,70 (d, 2H), 7,25 (d, 2H), 7,19 (m, 3Н), 7,10 (m, 2H), 6,95 (d, 2H), 3,65 (m, 4H), 2,90 (t, 2H). Приклад 44 2-(3-ціано-4-(4-(4хлорфенетилкарбамоїл)фенокси)феніл)оцтова кислота Етап А: Колбу наповнили терт-бутил 2-(3ціано-4-фторфеніл)ацетатом (9,410 г, 40,00 ммоль), метил 4-гідроксибензоатом (7,303 г, 48,00 ммоль), K2СО3 (6,634 г, 48,00 ммоль) та ДМСО (160 мл). Суміш нагрівали до температури 90°С в атмосфері азоту впродовж 17 годин. Суміш охолодили до температури навколишнього середовища та вилили у суміш ЕtOАс (250 мл) та 10%-ного розчину K2СО3 (250 мл). Одержаний нерозчинний осад розчинили у воді і додали до водної суміші ЕtOАс. Суміш збовтували впродовж 1 години, і шари відокремили. Водний шар екстрагували ЕtOАс, і поєднані екстракти промили насиченим K2СО3, водою та соляним розчином, висушили над MgSO4, відфільтрували крізь цеолітову прокладку і концентрували при зниженому тиску для одержання 14,7 г сирого продукту у вигляді олії. Сирий матеріал очистили силікагелевою хроматографією для одержання метил 4-(4-(2-терт-бутокси-2оксоетил)-2-ціанофенокси)бензоату (11,6 г, 79%) у вигляді твердої речовини. Етап В: Метил 4-(4-(2-терт-бутокси-2оксоетил)-2-ціанофенокси)бензоат (11,60 г, 31,57 ммоль) розчинили у діоксані (160 мл), і розчин охолодили до 10°С у крижаній ванні. LiOH-H2O, 1M (37,89 мл, 37,89 ммоль) додали до розчину, і суміш збовтували при температурі навколишнього середовища впродовж 5 годин. Суміш розбавили 2Н НСІ (100 мл) та СН2СІ2 (200 мл). Шари відокремили, і водний шар екстрагували СН2СІ2. Поєднані екстракти промили соляним розчином (100 мл), висушили над MgSO4, відфільтрували крізь цеолітову прокладку та концентрували під зниженим тиском. Сирий матеріал очистили силікагелевою хроматографією для одержання 4-(4-(2-тертбутокси-2-оксоетил)-2-ціанофенокси)бензойної кислоти (7,29 г) у вигляді твердої речовини. 55 Етап С: До 4-(4-(2-терт-бутокси-2-оксоетил)-2ціанофенокси)бензойної кислоти (0,34 г, 0,962 ммоль), 2-(4-хлорфеніл)етанаміну (0,165 г, 1,06 ммоль) у ДМФ (5 мл) додали діізопропіламін (0,200 мл, 1,15 ммоль) та HBTU (0,149 г, 1,15 ммоль). Реакційну суміш збовтували при температурі навколишнього середовища впродовж 90 хвилин. Реакційну суміш розбавили водою, і продукт екстрагували в етилацетат. Поєднані органічні шари висушили (MgSO4), відфільтрували та концентрували для одержання терт-бутил 2-(4-(4-((4хлорфенетил)карбамоїл)фенокси)-3ціанофеніл)ацетату (0,40 г, 85%) у вигляді твердої речовини після колонкової хроматографії. Етап D: Терт-бутил 2-(4-(4-((4хлорфенетил)карбамоїл)фенокси)-3ціанофеніл)ацетат (4,40 г, 8,96 ммоль) у ДХМ (20 мл) обробили TFA (20 мл). Після збовтування впродовж 2 годин реакційну суміш концентрували, і сирий матеріал очистили силікагелевою хроматографією із застосуванням градієнта від 0,5% МеОН/ДХМ із вмістом 0,5% АсОН до 10% МеОН/ДХМ із вмістом 0,5% АсОН для одержання 2-(4-(4-((4хлорфенетил)карбамоїл)фенокси)-3ціанофеніл)оцтової кислоти (3,30 г, вихід 84,7%). 1 Н ЯМР (400 МГц, CD3OD) 7,85 (d, 2H), 7,65 (s, 1H), 7,45 (d, 1H), 7,35 (s, 1H), 7,25 (d, 2H), 7,20 (d, 2H), 7,10 (d, 2H), 6,95 (d, 1H), 3,62 (m, 4H), 2,90 (t, 2H). Приклад 45 2-(3-ціано-4-(4-(2,4дихлорфенетилкарбамоїл)фенокси)феніл)оцтова кислота Готували способом прикладу 44 із заміщенням 2-(2,4-дихлорфеніл) етанаміну 2-(41 хлорфеніл)етанаміном на етапі D. Н ЯМР (400 МГц, CD3CI3, CD3OD) 7,79 (d, 2H), 7,65 (m, 1H), 7,45 (d, 1H), 7,40 (m, 1H), 7,21 (m, 2H), 7,10 (d, 2Н), 6,85 (d, 1H), 3,65 (m, 4H), 3,05 (t, 2H). Приклад 46 2-(3-бром-4-(4-(2,4дихлорфенетилкарбамоїл)фенокси)феніл)оцтова кислота Етап А: N-(4-хлорфенетил)-4-гідроксибензамід (1,5 г, 5,4 ммоль) розбавили ДМСО (15 мл) із по 96459 56 дальшим додаванням K2СО3 (0,89 г, 6,4 ммоль) та 3-бром-4-фторбензальдегіду (1,0 г, 4,9 ммоль). Реакційну суміш збовтували при температурі 85°С впродовж ночі і потім охолодили до температури навколишнього середовища. Реакційну суміш розбавили етилацетатом і двічі промили 10%-ним карбонатом натрію, водою та соляним розчином і потім концентрували. Сирий матеріал очистили силікагелевою хроматографією з елююванням гексанами етилацетатом (1:1), а потім 100%-ним етилацетатом для одержання N-(4-хлорфенетил)4-(2-бром-4-формілфенокси)бензаміду (1,6 г, вихід 71%). Етап В: N-(4-хлорфенетил)-4-(2-бром-4формілфенокси)бензамід (1,6 г, 3,5 ммоль) розбавили ТГФ (10 мл) із подальшим додаванням Ν,Ν,Ν-триметил(феніл)метанаміній гідроксиду (0,79 мл, 1,7 ммоль) та метилсульфініл(метилтіо)метану (0,87 г, 7,0 ммоль). Реакційну суміш збовтували при температурі 70°С впродовж 2 годин. Реакційну суміш завантажили безпосередньо у силікагелеву колонку та елюювали ДХМ:МеОН (98:2) для одержання (2)-ІЧ-(4хлорфенетил)-4-(2-бром-4-(2-(метилсульфініл)-2(метилтіо) вініл)фенокси)бензаміду (1,9 г, вихід 96%). Етап С: (2)-N-(4-хлорфенетил)-4-(2-бром-4-(2(метилсульфініл)-2-(метилтіо) вініл)фенокси)бензамід (2,0 г, 3,5 ммоль) обробили НСІ (8,9 мл, 18 ммоль) в етанолі. Реакційну суміш збовтували при температурі 70°С впродовж 2 годин. Реакційну суміш охолодили та завантажили безпосередньо у силікагелеву колонку з елююванням гексанами:етилацетатом (3:1) для одержання етил 2-(4-(4-((4-хлорфенетил)карбамоїл)фенокси)3-бромфеніл)ацетату. Етап D: Етил 2-(4-(4-((4хлорфенетил)карбамоїл)фенокси)-3-бромфеніл) ацетат (30 мг, 0,058 ммоль) розбавили діоксаном (500 мкл) із подальшим додаванням NaOH (0,093 мл, 0,46 ммоль) та 200 мкл води. Після збовтування впродовж 3 годин реакційну суміш розбавили етилацетатом і 2Н НСІ. Шари відокремили, і органічний шар висушили над MgSO4, відфільтрували та концентрували для одержання 2-(4-(4-((4хлорфенетил)карбамоїл)фенокси)-3бромфеніл)оцтової кислоти (24 мг, вихід 85%) у 1 вигляді твердої речовини. Н ЯМР (400 МГц, CD3CI3, CD3OD) 7,70 (d, 2Н), 7,60 (s, 1Н), 7,22-7,32 (m, 3Н), 7,19 (d, 2H), 7,05 (d, 1H), 6,90 (d, 2H), 3,62 (m, 4H), 2,90 (t, 2H). Приклад 47 2-(4-(4-(4-хлорфенетилкарбамоїл)фенокси)3,5диметилфеніл)оцтова кислота 57 Готували способом прикладу 46 із заміщенням 4-фтор-3,5-диметилбензальдегіду 3-бром-41 фторбензальдегідом на етапі А. Н ЯМР (400 МГц, CD3CI3, CD3OD) 7,60 (d, 2Н), 7,25 (d, 2H), 7,15 (d, 2H), 7,05 (s, 2H), 6,78 (d, 2Н), 3,65 (t, 2H), 3,58 (s, 2H), 2,90 (t, 2H), 2,15 (s, 6H). Приклад 48 2-(4-(4-(4-хлорфенетилкарбамоїл)фенокси)3метилфеніл)оцтова кислота Етап А: Етил 2-(4-(4-((4хлорфенетил)карбамоїл)фенокси)-3-бромфеніл) ацетат (Приклад 46, Етап С; 30 мг, 0,058 ммоль) розбавили ТГФ (1 мл) із подальшим додаванням біс(три-t-бутилфосфін) паладію (0) (3,0 мг, 0,0058 ммоль) та метилцинкхлориду (0,087 мл, 0,17 ммоль). Після збовтування впродовж 2 годин реакційну суміш завантажили безпосередньо у силікагелеву колонку з елююванням гексанами:етилацетатом (3:1) для одержання етил 2-(4-(4((4-хлорфенетил)карбамоїл)фенокси)-3метилфеніл)ацетату (20 мг, вихід 76%) у вигляді прозорої олії. Етап В: Етил 2-(4-(4-((4хлорфенетил)карбамоїл)фенокси)-3-метилфеніл) ацетат (20 мг, 0,0443 ммоль) розбавили діоксаном (500 мкл) із подальшим додаванням NaOH (0,0885 мл, 0,443 ммоль) та 200 мкл води. Після збовтування впродовж 3 годин реакційну суміш розбавили етилацетатом і 2Н НСІ. Шари відокремили, і органічний шар висушили над MgSO4, відфільтрували та концентрували для одержання 2-(4-(4-((4хлорфенетил)карбамоїл)фенокси)-3метилфеніл)оцтової кислоти (16,0 мг, вихід 85,3%). 1 Н ЯМР (400 МГц, CD3CI3, CD3OD) 7,62 (d, 2H), 7,30 (d, 2H), 7,10-7,22 (m, 4H), 6,92 (d, 1H), 6,85 (d, 2H), 3,65 (t, 2H), 3,60 (s, 2H), 2,90 (t, 2H), 2,15 (s, 3Н). Приклад 49 2-(4-(4-(4-хлорфенетилкарбамоїл)фенокси)3(тіофен-2-іл)феніл)оцтова кислота Етап А: Етил 2-(4-(4-((4хлорфенетил)карбамоїл)фенокси)-3-бромфеніл) 96459 58 ацетат (Приклад 46, Етап С; 24 мг, 0,046 ммоль) розбавили ТГФ (1 мл) із подальшим додаванням біс(три-t-бутилфосфін)паладію (0) (2,4 мг, 0,0046 ммоль) та 2-тієнілцинкброміду (0,23 мл, 0,12 ммоль). Після збовтування впродовж 2 годин реакційну суміш очистили силікагелевою хроматографією з елююванням гексанами:етилацетатом (3:1) для одержання етил 2-(4-(4-((4-хлорфенетил) карбамоїл)фенокси)-3-(тіофен-2-іл)феніл)ацетату (20 мг, вихід 83%) у вигляді прозорої олії. Етап В: Етил 2-(4-(4-((4хлорфенетил)карбамоїл)фенокси)-3-(тіофен-2-іл) феніл)ацетат (20 мг, 0,038 ммоль) розбавили діоксаном (500 мкл) із подальшим додаванням NaOH (0,052 мл, 0,26 ммоль) та 200 мкл води. Після збовтування впродовж 3 годин реакцію розбавили етилацетатом і 2Н НСІ. Шари відокремили, і органічний шар висушили над MgSO4, відфільтрували та концентрували для одержання 2-(4-(4-((4хлорфенетил)карбамоїл)фенокси)-3-(тіофен-2іл)феніл)оцтової кислоти (7 мг, вихід 37%) у вигля1 ді твердої речовини. Н ЯМР (400 МГц, CD3CI3, CD3OD) 7,69 (s, 1H), 7,64 (d, 2H), 7,45 (d, 1H), 7,30 (d, 2H), 7,22 (d, 1H), 7,15 (d, 2H), 6,98-7,05 (m, 2H), 6,90 (d, 2H), 3,65 (m, 4H), 2,90 (t, 2H). Приклад 50 2-(6-(4-(4хлорфенетилкарбамоїл)фенокси)біфеніл-3іл)оцтова кислота Етап А: Етил 2-(4-(4-((4хлорфенетил)карбамоїл)фенокси)-3-бромфеніл) ацетат (Приклад 46, Етап С; 24 мг, 0,046 ммоль) розбавили ТГФ (1 мл) із подальшим додаванням біс(три-t-бутилфосфін)паладію (0) (2,4 мг, 0,0046 ммоль) та фенілцинкйодиду (0,23 мл, 0,12 ммоль). Після збовтування впродовж 2 годин реакційну суміш завантажили безпосередньо у силікагелеву колонку та елюювали гексанами:етилацетатом (3:1) для одержання етил 2-(6-(4-(4-хлорфенетилкарбамоїл)фенокси)біфеніл-3-іл)ацетату (15 мг, вихід 63%) у вигляді прозорої олії. Етап В: Етил 2(6-(4-(4-хлорфенетилкарбамоїл)фенокси)біфеніл3-іл)ацетат (10 мг, 0,0195 ммоль) розбавили діоксаном (1 мл) із подальшим додаванням NaOH (0,0389 мл, 0,195 ммоль) та 200 мкл води. Після збовтування впродовж 2 годин реакційну суміш розбавили етилацетатом і 2Н НСІ. Шари відокремили, і органічний шар висушили над MgSO4, відфільтрували та концентрували для одержання 2(6-(4-(4-хлорфенетилкарбамоїл)фенокси)біфеніл3-іл)оцтової кислоти (1,6 мг, вихід 16,9%) у вигляді твердої речовини. MS ESI негативний М-Н = 485. 59 Приклад 51 2-(6-(4-(4-хлорфенетилкарбамоїл)фенокси)-3'(метилсульфоніл)біфеніл-3-іл)оцтова кислота Етап А: Етил 2-(4-(4-((4хлорфенетил)карбамоїл)фенокси)-3-бромфеніл) ацетат (Приклад 46, Етап С; 100 мг, 0,193 ммоль), 3-(метансульфоніл) фенілборну кислоту (58,1 мг, 0,290 ммоль), K2СО3 (80,2 мг, 0,580 ммоль) та Pd(PPh3)4 (22,4 мг, 0,0193 ммоль) розбавили діоксаном (2 мл) та водою (1 мл). Реакційну суміш тричі очистили азотом і збовтували при температурі 60°С впродовж ночі. Реакційну суміш охолодили та завантажили безпосередньо у силікагелеву колонку з елююванням гексанами:етилацетатом (2:1) для одержання етил 2-(6-(4-(4хлорфенетилкарбамоїл)фенокси)-3'(метилсульфоніл)біфеніл-3-іл)ацетату (80 мг, вихід 69,8%). Етап В: Етил 2-(6-(4-(4хлорфенетилкарбамоїл)фенокси)-3'-(метилсульфоніл)біфеніл-3-іл)ацетат (80 мг, 0,135 ммоль) розбавили діоксаном (1 мл) із подальшим додаванням NaOH (0,270 мл, 1,35 ммоль) та 300 мкл води. Після збовтування впродовж 2 годин реакцію розбавили етилацетатом і 2Н НСІ. Шари відокремили, і органічний шар висушили над MgSO4, відфільтрували та концентрували. Матеріал очистили із застосуванням картриджа Biotage 12i з елююванням 1-4%-ним метанолом/ДХМ для одержання 2-(6-(4-(4-хлорфенетилкарбамоїл)фенокси)-3'-(метилсульфоніл)біфеніл1 3-іл)оцтової кислоти (5 мг, вихід 6,56%). Н ЯМР (400 МГц, CD3CI3, CD3OD) 8,05 (s, 1H), 7,81 (d, 1H), 7,78 (d, 1H), 7,50-7,60 (m, 3Н), 7,42 (s, 1H), 7,38 (d, 1H), 7,25 (d, 2H), 7,19 (d, 2H), 7,05 (d, 1H), 6,85 (d, 1Н), 3,75 (s, 2Н), 3,62 (q, 2Н), 3,0 (s, 3Н), 2,90 (t, 2H). Приклад 52 2-(4-(4-(4-хлорфенетилкарбамоїл)фенокси)-3циклопропілфеніл)оцтова кислота Етап А: Колбу наповнили циклопропілбромідом магнію (29,6 мл, 14,8 ммоль) і поклали в азот. Додали хлорид цинку (14,8 мл, 14,8 ммоль), і реа 96459 60 кційну суміш збовтували впродовж 20 хвилин. 3Бром-4-фторбензальдегід (1,0 г, 4,93 ммоль) та біс(три-t-бутилфосфін)паладій (0) (0,126 г, 0,246 ммоль) розбавили у 600 мкл ТГФ і додали до реакційної суміші. Після збовтування впродовж 4 годин реакційну суміш нагріли до 50°С і збовтували впродовж ночі. Реакційну суміш охолодили і погасили насиченим NH4CI та екстрагували ДХМ. Органічний шар висушили над MgSO4, відфільтрували та концентрували. Матеріал очистили із застосуванням картриджа Biotage 40M з елююванням гексанами:етилацетатом (4:1) для одержання 3-циклопропіл-4-фторбензальдегіду (400 мг, вихід 49,5%). Етап В: ІМ-(4-Хлорфенетил)-4гідроксибензамід (504 мг, 1,83 ммоль) розбавили ДМСО (8 мл) і додали K2СО3 (379 мг, 2,74 ммоль) та 3-циклопропіл-4-фторбензальдегід (300 мг, 1,83 ммоль). Реакційну суміш збовтували при температурі 85°С впродовж ночі. Реакційну суміш охолодили до температури навколишнього середовища, розбавили етилацетатом і двічі промили 10%-ним карбонатом натрію, водою та соляним розчином і концентрували. Сирий матеріал очистили силікагелевою хроматографією з елююванням гексанами:етилацетатом (3:1) для одержання N-(4хлорфенетил)-4-(2-циклопропіл-4-формілфенокси) бензаміду (160 мг, вихід 20,9%). Етап С: N-(4-Хлорфенетил)-4-(2-циклопропіл4-формілфенокси)бензамід (160 мг, 0,381 ммоль) розбавили ТГФ (3 мл) із подальшим додаванням Ν,Ν,Ν-триметил(феніл)метанаміній гідроксиду (0,0866 мл, 0,191 ммоль) та метилсульфініл(метилтіо)метану (94,7 мг, 0,762 ммоль). Реакційну суміш нагріли до 70°С і збовтували впродовж 2 годин. Реакційну суміш охолодили та завантажили безпосередньо у силікагелеву колонку з елююванням етилацетатом для одержання (2)-N(4-хлорфенетил)-4-(2-циклопропіл-4-(2(метилсульфініл)-2(метилтіо)вініл)фенокси)бензаміду (100 мг, вихід 49,9%). Етап D: (Z)-N-(4-хлорфенетил)-4-(2циклопропіл-4-(2-(метилсульфініл)-2(метилтіо)вініл)фенокси)бензамід (100 мг, 0,190 ммоль) розбавили НСІ (0,950 мл, 1,90 ммоль), нагріли до 70°С і збовтували впродовж 4 годин. Реакційну суміш охолодили та завантажили безпосередньо у картридж Biotage 25 та елюювали гексанами:етилацетатом (3:1) для одержання етил 2-(4-(4-((4-хлорфенетил) карбамоїл)фенокси)-3циклопропілфеніл)ацетату (70 мг, вихід 77,0%) у вигляді твердої речовини. Етап Е: Етил 2-(4-(4-((4хлорфенетил)карбамоїл)фенокси)-3-циклопропілфеніл)ацетат (70 мг, 0,146 ммоль) розбавили діоксаном (1 мл) із подальшим додаванням NaOH (0,293 мл, 1,46 ммоль) та води (300 мкл). Після збовтування впродовж 3 годин реакційну суміш розбавили етилацетатом і 2N НСІ. Шари відокремили, і органічний шар висушили над MgSO4, відфільтрували та концентрували для одержання 2(4-(4-((4-хлорфенетил)карбамоїл)фенокси)-3циклопропілфеніл)оцтової кислоти (50 мг, вихід 1 75,9%) у вигляді твердої речовини. Н ЯМР (400
ДивитисяДодаткова інформація
Назва патенту англійською4-substituted phenoxyphenylacetic acid derivatives
Автори англійськоюDoherty, George, Cook, Adam
Назва патенту російською4-замещенные производные феноксифенилуксусной кислоты
Автори російськоюДогерти Джордж, Кук Адам
МПК / Мітки
МПК: A61K 31/18, A61K 31/381, A61K 31/10, C07D 213/81, C07D 213/82, C07D 333/16, C07C 255/57, C07C 233/87, A61K 31/77, C07C 307/00, C07C 317/14, C07C 311/19, A61K 31/165, A61K 31/435, C07C 311/06
Мітки: 4-заміщені, феноксифенілоцтової, похідні, кислоти
Код посилання
<a href="https://ua.patents.su/40-96459-4-zamishheni-pokhidni-fenoksifeniloctovo-kisloti.html" target="_blank" rel="follow" title="База патентів України">4-заміщені похідні феноксифенілоцтової кислоти</a>
Попередній патент: Тіазолпіразолопіримідинові сполуки як антагоністи рецептора crf1
Наступний патент: Фармацевтична композиція, що містить капецитабін
Випадковий патент: Спосіб підйому покриття на проектну відмітку за допомогою вантажопідйомного встановлювального модуля