Амідофеноксііндазоли, корисні як інгібітори c-met
Номер патенту: 101379
Опубліковано: 25.03.2013
Автори: Ян Вей Дженніфер, У Чжіпей, Поубенз Марк Ендрю, Лі Тешао, Чжон Боюй, Ші Чан
Формула / Реферат
1. Сполука формули:
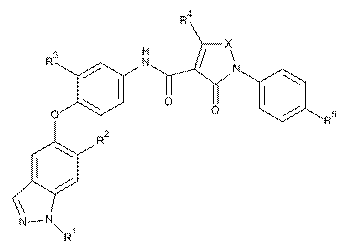 ,
,
де:
R1 - Н або метил;
R2 - аміногрупа, диметиламіногрупа, фтор, циклопропіл, піридил, факультативно заміщений амінозамісником або 1-2 метильними замісниками, піразоліл, факультативно заміщений двома метильними замісниками, 2-метоксипіримідин-5-іл, 4-метилсульфонілфеніл, тетрагідро-2Н-піран-4-іламіногрупа, (тетрагідро-2Н-піран-4-іл)амінокарбоніл або морфолін-4-ільний замісник:
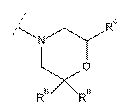 ,
,
де Ra, Rb та Rc незалежно один від одного вибрані з групи, яку складають Н та метил;
R3 - Н або F;
R4 - Н, метил, піперидин-1-ілметил, морфолін-4-ілметил або піразол-1-ілметил;
R5 - Н або F; та
X - CH=N, СН=СН, СН=С(СН3), С(СН3)=СН, C(CH3)=N, N(CH3) або С(морфолін-4-ілметил)=СН;
або фармацевтично прийнятна сіль цієї сполуки.
2. Сполука за п. 1 або фармацевтично прийнятна сіль цієї сполуки, де R2 - аміногрупа, диметиламіногрупа, циклопропіл, піридил, факультативно заміщений амінозамісником або 1-2 метильними замісниками, піразол-4-іл або морфолін-4-іл.
3. Сполука за п. 1 або фармацевтично прийнятна сіль цієї сполуки, де R2 - аміногрупа, диметиламіногрупа, піразол-4-іл або морфолін-4-іл.
4. Сполука за п. 1 або фармацевтично прийнятна сіль цієї сполуки, де R2 - піразол-4-іл.
5. Сполука за будь-яким із пп. 1-4 або фармацевтично прийнятна сіль цієї сполуки, де R4 - Н, метил або морфолін-4-ілметил.
6. Сполука за будь-яким із пп. 1-4 або фармацевтично прийнятна сіль цієї сполуки, де R4 - Н.
7. Сполука за будь-яким із пп. 1-6 або фармацевтично прийнятна сіль цієї сполуки, де X - СН=СН або СН=С(СН3).
8. Сполука за п. 1, яка являє собою N-(3-фтор-4-(1-метил-6-(1H-піразол-4-іл)-1H-індазол-5-ілокси)феніл)-1-(4-фторфеніл)-6-метил-2-оксо-1,2-дигідропіридин-3-карбоксамід, або фармацевтично прийнятна сіль цієї сполуки.
9. Сполука за п. 1, яка являє собою N-(3-фтор-4-(1-метил-6-(1H-піразол-4-іл)-1H-індазол-5-ілокси)феніл)-6-метил-2-оксо-1-феніл-1,2-дигідропіридин-3-карбоксамід, або фармацевтично прийнятна сіль цієї сполуки.
10. Сполука за будь-яким із пп. 1-9, де фармацевтично прийнятна сіль є метансульфонатом.
11. Сполука за будь-яким із пп. 1-10, де розмір частинок становить менше ніж 10 мкм.
12. Фармацевтична композиція, яка містить сполуку за пп. 1-11 або фармацевтично прийнятну сіль цієї сполуки та фармацевтично прийнятні носій, розріджувач або наповнювач.
13. Спосіб лікування раку, вибраного з групи, яку складають рак легенів, рак молочної залози, рак кишечнику, рак нирок, рак підшлункової залози, рак голови, рак шиї, спадковий папілярний нирковоклітинний рак, дитячий печінковоклітинний рак та рак шлунка, у ссавця, який включає введення в організм ссавця, що потребує такого лікування, ефективної кількості сполуки за будь-яким із пп. 1-11 або фармацевтично прийнятної солі цієї сполуки.
14. Сполука за будь-яким із пп. 1-11 або фармацевтично прийнятна сіль цієї сполуки для застосування як лікарського засобу.
15. Сполука або фармацевтично прийнятна сіль цієї сполуки за будь-яким із пп. 1-11 для застосування в лікуванні раку.
Текст
Реферат: Даний винахід стосується амідофеноксііндазольних сполук, корисних для лікування раку. c R N O R b a R UA 101379 C2 (12) UA 101379 C2 UA 101379 C2 5 10 15 c-Met належить до групи рецепторів фактора росту тирозинкінази. Експресія c-Met має місце у ендотеліальних, епітеліальних та мезенхімних клітинах. Зв'язування з c-Met ендогенного ліганду – фактора росту гепатоцитів (HGF) – сприяє міграції, проліферації та інвазії клітин. c-Met бере участь у розвитку певних пухлин. Надлишкову експресію c-Met виявлено у численних пухлинах, в тому числі у пухлинах товстої та ободової кишки, молочної залози, нирок, легенів, гемангіомах, при мієлоїдній лейкемії лускатих клітин, у меланомах, гліобластомах та астроцитомах. Активація рецепторів c-Met пухлинних клітин посилює проліферацію, інвазію та метастаз пухлинних клітин та стійкість до апоптозу та цитотоксичних способів терапії. Описані різноманітні амідофеноксигетероарильні сполуки – інгібітори c-Met. Дивись, наприклад, US2005/0288290, US2006/0211695, US2006/0004006 та WO 2007103308. Однак існує потреба у додаткових сполуках, які інгібують c-Met. Цей винахід пропонує нові сполуки – похідні амідофеноксііндазолу, які вважаються клінічно корисними для лікування раку шляхом інгібування c-Met. Вважається також, що сполуки за цим винаходом, яким віддається перевага, забезпечують підвищену ефективність у порівнянні з певними іншими інгібіторами cMet, відомими у галузі. Цей винахід пропонує сполуки формули I: 4 R X H 3 N R N O O 2 O 5 R R N N 20 25 1 R Формула I де: 1 R – H або метил; 2 R – аміногрупа, диметиламіногрупа, фтор, циклопропіл, піридил, факультативно заміщений амінозамісником або 1-2 метильними замісниками, піразоліл, факультативно заміщений двома метильними замісниками, 2-метоксипіримідин-5-іл, 4-метилсульфонілфеніл, тетрагідро-2Hпіран-4-іламіногрупа, (тетрагідро-2H-піран-4-іл)амінокарбоніл або морфолін-4-ільний замісник: c R N O b R 30 35 40 45 a R , a b c де R , R та R незалежно один від одного вибрані з групи, яку складають H та метил; 3 R – H або F; 4 R – H, метил, піперидин-1-ілметил, морфолін-4-ілметил або піразол-1-ілметил; 5 R – H або F; та X – CH=N, CH=CH, CH=C(CH3), C(CH3)=CH, C(CH3)=N, N(CH3) або C(морфолін-4ілметил)=CH; або фармацевтично прийнятні солі цих сполук. Цей винахід пропонує спосіб лікування у ссавця раку, вибраного з групи, яку складають рак легенів, рак молочної залози, рак кишечнику, рак нирок, рак підшлункової залози, рак голови, рак шиї, спадковий папілярний нирковоклітинний рак, дитячий печінковоклітинний рак та рак шлунка, який включає введення в організм ссавця, що потребує такого лікування, ефективної кількості сполуки формули I або фармацевтично прийнятної солі цієї сполуки. Цей винахід також пропонує фармацевтичну композицію, яка містить сполуку формули I або фармацевтично прийнятну сіль цієї сполуки та фармацевтично прийнятні носій, розріджувач або наповнювач. Цей винахід також пропонує сполуку формули I або фармацевтично прийнятну сіль цієї сполуки для застосування як лікарський засіб. Крім того, цей винахід пропонує застосування сполуки формули I або фармацевтично прийнятної солі цієї сполуки для виготовлення лікарського засобу для лікування раку. Зокрема, такі різновиди раку вибрані з групи, яку 1 UA 101379 C2 5 10 15 20 25 складають рак легенів, рак молочної залози, рак кишечнику, рак нирок, рак підшлункової залози, рак голови, рак шиї, спадковий папілярний нирковоклітинний рак, дитячий печінковоклітинний рак та рак шлунка. Крім того, цей винахід пропонує фармацевтичну композицію для лікування раку, вибраного з групи, яку складають рак легенів, рак молочної залози, рак кишечнику, рак нирок, рак підшлункової залози, рак голови, рак шиї, спадковий папілярний нирковоклітинний рак, дитячий печінковоклітинний рак та рак шлунка, яка містить сполуку формули I або фармацевтично прийнятну сіль цієї сполуки як активний інгредієнт. Для досвідченого читача зрозуміло, що більшість сполук за цим винаходом або всі такі сполуки здатні утворювати солі. Сполуки за цим винаходом є амінами і, відповідно, можуть вступати в реакції з будь-якою із численних неорганічних та органічних кислот з утворенням фармацевтично прийнятних солей з кислотами. Такі фармацевтично прийнятні солі з кислотами та загальна методологія їх виготовлення добре відомі в галузі. Дивись, наприклад, Шталь та ін., "Довідник з фармацевтичних солей: властивості, добір та застосування" (P. Stahl, et al., HANDBOOK OF PHARMACEUTICAL SALTS: PROPERTIES, SELECTION AND USE, (VCHA/WileyVCH, 2002); Біглі, Берж, Монкгауз у книзі "Енциклопедія фармацевтичної технології" (L.D. Bighley, S.M. Berge, D.C. Monkhouse, in "Encyclopedia of Pharmaceutical Technology". Eds. J. Swarbrick and J.C. Boylan, Vol. 13, Marcel Dekker, Inc., New York, Basel, Hong Kong 1995), стор. 453-499; Берж та ін., "Фармацевтичні солі" (S.M. Berge, et al., "Pharmaceutical Salts", Journal of Pharmaceutical Sciences, Vol 66, No. 1, January 1977). Перевага серед фармацевтично прийнятних солей сполук за цим винаходом віддається метансульфонатам. Перевага віддається сполукам формули I, де: 1 (a) R – H; 1 (b) R – метил; 2 (c) R – аміногрупа, диметиламіногрупа, циклопропіл, 6-метилпіридин-3-іл, піразол-4-іл або морфолін-4-іл формули: c R N O b R 30 35 40 45 50 55 a R ; 2 (d) R – аміногрупа, диметиламіногрупа, піразол-4-іл або морфолін-4-іл; 2 (e) R – піразол-4-іл; 1 2 (f) R – метил, та R – піразол-4-іл; 3 (g) R – F; 1 2 3 (h) R – метил, R – піразол-4-іл, та R – F; 4 (i) R – H, метил або морфолін-4-ілметил; 4 (j) R – H; 1 2 3 4 (k) R – метил, R – піразол-4-іл, R – F, та R – H; 5 (l) R – H; 5 (m) R – F; 1 2 3 4 5 (n) R – метил, R – піразол-4-іл, R – F, R – H, та R – H; 1 2 3 4 5 (o) R – метил, R – піразол-4-іл, R – F, R – H, та R – F; (p) X – CH=CH або CH=C(CH3); 1 2 3 4 5 (q) R – метил, R – піразол-4-іл, R – F, R – H, R – H, та X – CH=CH або CH=C(CH3); 1 2 3 4 5 (r) R – метил, R – піразол-4-іл, R – F, R – H, R – F, та X – CH=CH або CH=C(CH3); 1 2 3 4 5 (s) R – метил, R – піразол-4-іл, R – F, R – H, R – H або F, та X – CH=C(CH3); 1 2 3 4 5 (t) R – метил, R – піразол-4-іл, R – F, R – H, R – H, та X – CH=C(CH3); та 1 2 3 4 5 (u) R – метил, R – піразол-4-іл, R – F, R – H, R – F, та X – CH=C(CH3). Сполуки за цим винаходом можна одержати за поданими нижче схемами синтезу способами, добре відомими та поширеними у галузі. Прийнятні для виконання етапів цих схем умови реакцій добре відомі в галузі, а питання відповідних замін розчинників та вибір додаткових реагентів лежать у межах компетенції фахівця у галузі. Аналогічно, для фахівців у галузі зрозуміло, що проміжні продукти синтезів в разі необхідності або бажання можуть бути виділені та/або очищені різноманітними добре відомими способами та що часто можливо використовувати різноманітні проміжні продукти на подальших стадіях синтезів безпосередньо, після незначного очищення або без очищення. Крім того, для досвідченого фахівця зрозуміло, що в деяких випадках послідовність введення функціональних груп у молекулу не має істотного значення. Конкретна послідовність етапів, необхідних для одержання сполуки за цим винаходом, залежить від конкретної сполуки, яка синтезується, вихідної сполуки та відносної реакційної здатності заміщених груп, як зрозуміло для досвідченого хіміка. Усі замісники, якщо 2 UA 101379 C2 5 10 15 20 не зазначено інше, відповідають поданим вище визначенням, а всі реагенти добре відомі та поширені в галузі. Сполуки за цим винаходом можуть бути синтезовані, як показано на поданій нижче Схемі I, 3 4 5 1" 2" 1 2 де X, R , R та R відповідають поданим вище визначенням, а R та R є ідентичними R та R або є їх попередниками. Схема I Сполуки за цим винаходом можуть бути одержані у стандартних умовах пептидного сполучення, добре відомих досвідченому фахівцю. Відповідно заміщений індазоланілін формули (a) вводять в реакцію з похідним кислоти формули (b) у присутності реагента пептидного сполучення, такого як гідрохлорид 1-(3-диметиламінопропіл)-3-етилкарбодііміду (EDCI), гідрат 1-гідроксибензотриазолу (HOBt), та прийнятної кислоти, такої як Nметилморфолін, N, N-діізопропілетиламін (DIPEA), або триетиламін (TEA), у прийнятному розчиннику, такому як дихлорметан (DCM), N, N-диметилформамід (DMF) або тетрагідрофуран 1" (THF), для одержання цільового аміду за цим винаходом. Якщо R є прийнятною групою 2" захисту азоту, такою як тетрагідропіран (THP), або якщо R є функціональною групою, захищеною групою захисту азоту, то для одержання цільової сполуки за цим винаходом є необхідною стадія відщеплення групи захисту. Схема II 3 OH NO2 3 O O Br NO2 R NO2 R Br Br + 3 R N NH F N NH (g) (f) 3 3 NH2 2' 2' R R N N 1' 1' R R (a) (c) 1" 25 (d) O O N N 1' R R NO2 R N N (e) 2" 3 Сполуку формули (a) можна одержати як показано на Схемі II, де R , R та R відповідають поданим вище визначенням. Сполуку формули (f) можна ввести в реакцію з відповідно заміщеною сполукою формули (g) при підвищеній температурі у присутності прийнятної основи, такої як бікарбонат натрію, у прийнятному розчиннику, такому як DMF, з одержанням сполуки формули (e). Сполуку формули (e) можна метилювати прийнятним метилувальним реагентом, таким як метилйодид, у прийнятному розчиннику, такому як THF, з прийнятною основою, такою як трет-бутилат калію, 3 UA 101379 C2 1" 5 10 15 20 25 30 35 40 та одержати сполуку формули (d), де R – метил. Сполуку формули (e) можна також захистити із застосуванням прийнятного захисного реагенту, такого як 2,3-дигідропіран (DHP), у прийнятному розчиннику, такому як THF, у присутності кислоти, такої як CH 3SO3H, з 1" одержанням сполуки формули (d), де R – група захисту, така як 2-тетрагідропіраніл. [Способи введення та відщеплення груп захисту добре відомі в галузі; дивись, наприклад, Гріні та Вутс, "Групи захисту в органічному синтезі" – Greene and Wuts, Protective Groups in Organic Synthesis, rd 3 Ed., John Wiley та Sons, New York, (1999)]. Сполуку формули (d) можна ввести в реакцію в умовах сполучення із застосуванням різноманітних каталізаторів на основі перехідних металів, і одержати цільову сполуку 2" формули (c) з відповідно заміщеним R згідно з поданим вище визначенням. Більш конкретно, у випадку, коли згадане сполучення є сполученням вуглець-вуглець, то сполуку формули (c) можна одержати в умовах сполучення, такого як сполучення за Судзукі, із застосуванням прийнятної борної кислоти, прийнятного каталізатора, такого як хлорид 1,1’біс(дифенілфосфіно)фероценпаладію (II) (PdCl2(dppf)), та прийнятної основи, такої як CsF, у прийнятному розчиннику, такому як 1,4-діоксан, при підвищеній температурі. Якщо згадане сполучення є сполученням вуглець-азот, то сполуку формули (c) можна одержати в умовах сполучення, такого як сполучення за Бухвальдом-Гартвігом (Buchwald-Hartwig), із застосуванням прийнятного азотвмісного реагента, такого як морфолін, прийнятного ліганду, такого як 2-ди-трет-бутилфосфіно-2’-метилбіфеніл, основи, такої як KOH, та каталізатора, такого як трис(дибензиліденацетон)дипаладію (0) (Pd2(dba)3), у прийнятному розчиннику, такому як трет-бутанол, при підвищеній температурі. Реакцію сполучення можна виконувати при нагріванні звичайним способом або при мікрохвильовому опроміненні, в умовах, добре відомих фахівцям. Сполуку формули (c) можна відновити до аміносполуки в різноманітних відновлювальних умовах, добре відомих фахівцям. Більш конкретно, сполуку формули (c) можна ввести в реакцію із хлоридом олова (I) у прийнятному розчиннику, такому як суміш етилацетату (EtOAc) з етанолом (EtOH), при підвищеній температурі з одержанням цільової сполуки формули (a). У 1" випадку, коли R є групою захисту азоту, такою як 2-тетрагідропіраніл, цю групу захисту 1" відщеплюють. Після відновлення R буде являти собою протон. Сполуку формули (c) можна відновити також шляхом проведення реакції з N, Nдиметилгідразином та FeCl3 у прийнятному розчиннику, такому як метанол (MeOH), або з H 2 у присутності паладію на вугіллі (Pd/C) у прийнятному розчиннику, такому як EtOH. В обох варіантах відновлення відновлюється тільки нітрогрупа до аміногрупи, а група захисту азоту, 1" R , залишається незміненою. Для фахівця зрозуміло, що при реакціях за участю атома азоту деяких азотвмісних герероциклів, таких як індазол, сполуки можуть утворювати таутомери. Співвідношення таутомерів істотно залежить від способу проведення реакцій та різних умов. Проміжні продукти, описані в цій заявці, які містять групи захисту азоту, такі як THP, можуть існувати у формі 1 регіоізомерів. У сполуках за цим винаходом, якщо R – протон, згадані сполуки можуть існувати у формі пари швидкозмінних таутомерів, як показано на Схемі III. Схема III 4 R 4 R R O O 2 3 X N H N 3 O R O O 5 2 R X N H N O 5 R R R N N H N NH 45 50 Назви сполук, одержаних згідно з поданими нижче описами підготовчих синтезів та ® прикладами, утворені із застосуванням програмного забезпечення ChemDraw Ultra, версія 10.0. Підготовчий синтез 1 N-(4-метокси-2-метилфеніл)ацетамід До розчину 4-метокси-2-метиланіліну (120 г, 0,88 моль) у DCM (400 мл) краплями додають оцтовий ангідрид (120 мл, 1,2 моль). Одержану реакційну суміш перемішують при кімнатній температурі (RT) протягом 3 год. Додають петролейний ефір (PE) (1,6 л), після чого одержану 4 UA 101379 C2 5 10 15 20 25 30 35 40 45 50 55 60 суспензію перемішують ще 1 год. Утворений осад збирають шляхом фільтрування, та промивають петролейним ефіром, одержуючи бажаний продукт у вигляді рожевої твердої речовини (130 г, вихід 82 %). MS (m/z): 180,0 (M+H). Підготовчий синтез 2 N-(5-бром-4-метокси-2-метилфеніл)ацетамід До розчину N-(4-метокси-2-метилфеніл)ацетаміду (130 г, 0,73 моль) у оцтовій кислоті (800 мл) додають краплями бром (42 мл, 0,8 моль) при 0C. Після завершення додавання одержану суміш перемішують при кімнатній температурі протягом ночі. додають насичений водний розчин NaHSO3 до одержання прозорого розчину, після чого додають велику кількість води (2,0 л), при цьому утворюється осад. Осаджену тверду речовину збирають та промивають водою, одержуючи неочищений продукт (хроматографія в тонкому шарі (ХТШ), розчинник: DCM:EtOAc=10:1). Одержану тверду речовину розчиняють у мінімальній кількості DCM при нагріванні зі зворотним холодильником, після чого додають петролейний ефір (приблизно 1020 % об'єму використаного DCM). Одержаний розчин охолоджують до кімнатної температури. Через 2 год. осаджену тверду речовину збирають та промивають петролейним ефіром, одержуючи білий продукт (108 г, вихід 57 %). MS (m/z): 260,0 (M+H). Підготовчий синтез 3 5-бром-4-метокси-2-метиланілін До розчину N-(5-бром-4-метокси-2-метилфеніл)ацетаміду (108 г, 0,42 моль) у MeOH (400 мл) додають концентровану HCl (160 мл, 2 моль). Суміш нагрівають зі зворотним холодильником протягом ночі, після чого її нейтралізують водним розчином NaHCO 3, та екстрагують EtOAc (1200 мл). Органічну фазу сушать, та концентрують, одержуючи бажаний продукт (76 г, вихід 84 %). MS (m/z): 216,0 (M+H). Підготовчий синтез 4 Тетрафторборат 1-(5-бром-4-метокси-2-метилфеніл)діазонію До розчину 5-бром-4-метокси-2-метиланіліну (76 г, 0,35 моль) у HBF4 (48 % (мас.), 140 мл) та H2O (280 мл) додають розчин NaNO2 (27,6 г, 0,4 моль) у H2O (60 мл) при 0C. Після завершення додавання одержану реакційну суміш перемішують при 0C протягом 30 хвилин (хв). Утворений осад відфільтровують, промивають декілька разів невеликою кількістю охолодженої льодом води, та сушать, одержуючи бажаний продукт (110 г, вихід 99 %). MS (m/z): 229,0 (M+H). Підготовчий синтез 5 6-бром-5-метокси-1H-індазол Тетрафторборат 1-(5-бром-4-метокси-2-метилфеніл)діазонію (110 г, 0,35 моль) додають однією порцією при перемішуванні до суміші KOAc (140,5 г, 1,43 моль) та 18-краун-6-ефіру (9,3 г, 0,035 моль) у CHCl3 (800 мл), та перемішують при кімнатній температурі протягом ночі. Одержану суміш фільтрують, та одержану тверду речовину промивають DCM. Об'єднані фільтрати концентрують, та утворений залишок очищають хроматографією на колонці із силікагелем (DCM:MeOH, 50:1), одержуючи бажаний продукт (10 г). Цей продукт додають до THF (1600 мл), та одержану суміш перемішують при кімнатній температурі протягом 1 год. Суміш фільтрують, та фільтрат концентрують, одержуючи 10 г неочищеного продукту (загальний вихід 88 %). MS (m/z): 229,0 (M+H). Підготовчий синтез 6 6-бром-5-гідрокси-1H-індазол До розчину 6-бром-5-метокси-1H-індазолу (60 г, 0,265 моль) у DCM (1300 мл) додають розчин BBr3 (105 г, 0,42 моль) у DCM (200 мл) при 0C. Одержану реакційну суміш нагрівають до кімнатної температури, та перемішують протягом ночі. Потім реакційний розчин гасять MeOH при 0C. Розчинник видаляють у вакуумі, та утворений залишок нейтралізують твердим NaHCO3. Одержану суміш розподіляють між водою (1500 мл) та EtOAc (1500 мл). Водний шар двічі екстрагують EtOAc (1500 мл). Об'єднані органічні шари сушать, та концентрують, одержуючи неочищений продукт, який очищають хроматографією на колонці із силікагелем (PE:THF, 2:1), одержуючи бажаний продукт (42,5 г, вихід 75 %). MS (m/z): 215,0 (M+H). Підготовчий синтез 7 6-бром-5-(2-фтор-4-нітрофенокси)-1H-індазол Суміш 6-бром-5-гідрокси-1H-індазолу (7,0 г, 33,0 ммоль), 3,4-дифторнітробензолу (4,98 мг, 31,0 ммоль), NaHCO3 (2,5 г, 31,0 ммоль) у DMF (100 мл) перемішують при 80C протягом 4 год. Потім додають LiCl (10 % водний розчин), та одержаний розчин екстрагують EtOAc. Органічну фазу сушать безводним MgSO4, фільтрують, та концентрують. Утворений залишок очищають хроматографією на колонці із силікагелем, елююючи сумішшю петролейний простий ефір:DCM (1:1), та одержують бажаний продукт (5,5 г, вихід 46,6 %). MS (m/z): 354,0 (M+H). Вказану нижче сполуку одержують по суті за методикою Підготовчого синтезу 7: 5 UA 101379 C2 Підг. синт. Хімічна назва № 8 6-бром-5-(4-нітрофенокси)-1H-індазол 5 10 Підготовчий синтез 9 6-бром-5-(2-фтор-4-нітрофенокси)-1-(тетрагідро-2H-піран-2-іл)-1H-індазол До розчину 6-бром-5-(2-фтор-4-нітрофенокси)-1H-індазолу (5,0 г, 14,2 ммоль) у THF (50 мл) додають DHP (2,4 г, 28,5 ммоль) та CH3SO3H (1,0 г, 10,4 ммоль). Одержану суміш перемішують при кімнатній температурі протягом 1 год. Потім додають EtOAc та водний розчин NaHCO 3. Органічну фазу відділяють, сушать безводним MgSO 4, фільтрують, та концентрують. Утворений залишок очищають хроматографією на колонці із силікагелем, елююючи сумішшю петролейний ефір:EtOAc (5:1), та одержують бажаний продукт (5,5 г, вихід 89,0 %). MS (m/z): 436,0 (M+H). Вказану нижче сполуку одержують по суті за методикою Підготовчого синтезу 9: Підг. синт. № 10 15 20 Фізичні дані MS (m/z) (M+H) 336 Хімічна назва 6-бром-5-(4-нітрофенокси)-1-(тетрагідро-2H-піран-2-іл)-1Hіндазол Фізичні дані MS (m/z)(M+H) 418,0 Підготовчий синтез 11 6-бром-1-метил-5-(4-нітрофенокси)-1H-індазол До суміші 6-бром-5-(4-нітрофенокси)-1H-індазолу (2,68 г, 8,02 ммоль) та KOH (600 мг, 10,69 ммоль) у ацетоні (100 мл), охолодженому на льодо-водяній бані, додають краплями метилйодид (0,55 мл, 8,83 ммоль). Одержану реакційну суміш перемішують при 0C протягом 2 год., після чого її перемішують при кімнатній температурі протягом ночі. Розчинник видаляють, та утворений залишок очищають хроматографією на колонці із силікагелем, елююючи сумішшю петролейний ефір:EtOAc (3:1), одержуючи бажаний продукт (1,50 г, вихід 53,7 %). MS (m/z): 348,0 (M+H). Вказану нижче сполуку одержують по суті за методикою Підготовчого синтезу 11: Підг. синт. Хімічна назва № 12 6-бром-5-(2-фтор-4-нітрофенокси)-1-метил-1H-індазол Фізичні дані MS(m/z) (M+H) 365,9 25 30 35 40 45 Альтернативно 6-бром-5-(2-фтор-4-нітрофенокси)-1-метил-1H-індазол (Підготовчий синтез 12) можна також одержати за описаним нижче 3-стадійним способом: 2,4-дибром-5-гідрокси-бензальдегід (50 г, 178,6 ммоль), 1,2-дифтор-4-нітробензол (28,4 г, 178,6 ммоль) та карбонат калію (49,0 г, 357,2 ммоль) перемішують у DMF (500 мл) при 60C протягом 2 год. Реакційну суміш гасять водою (1000 мл), та екстрагують метил-трет-бутиловим ефіром (MTBE) (2500 мл). Органічний шар промивають насиченим водним розчином хлориду натрію (2500 мл), сушать безводним сульфатом натрію, та концентрують, одержуючи жовту тверду речовину. Неочищену тверду речовину перекристалізовують із суміші EtOAc/петролейний ефір (1:5), одержуючи 2,4-дибром-5-(2-фтор-4-нітрофенокси)бензальдегід у вигляді жовтої твердої речовини (52,8 г, вихід 70,6 %). 2,4-дибром-5-(2-фтор-4-нітрофенокси)бензальдегід (13,0 г, 31,0 ммоль) із метилгідразином (4,3 г, 93 ммоль) у THF (130 мл) нагрівають зі зворотним холодильником протягом 2 год. Реакційну суміш гасять водою (150 мл), та екстрагують MTBE (2150 мл). Органічний шар промивають насиченим водним розчином хлориду натрію (2150 мл), сушать безводним сульфатом натрію, та концентрують, одержуючи тверду речовину. Неочищену тверду речовину перекристалізовують із суміші EtOAc/гексан, одержуючи 1-(2,4-дибром-5-(2-фтор-4нітрофенокси)бензиліден)-2-метилгідразин у вигляді жовтої твердої речовини (10,6 г, вихід 76,7 %). MS (m/z): 447,9 (M+H). 1-(2,4-дибром-5-(2-фтор-4-нітрофенокси)бензиліден)-2-метилгідразин (1,0 г, 2,2 ммоль), хлорид міді (22 мг, 0,2 ммоль), карбонат калію (0,638 г, 7,2 ммоль), DMF (10 мл) та магнітну мішалку завантажують у флакон, придатний для роботи під тиском, у атмосфері азоту. Флакон закривають та вміщують у масляну баню при перемішуванні. Баню нагрівають до 100C протягом 30 хв, витримують при 100C протягом 6 год., після чого охолоджують до кімнатної температури. Одержану реакційну суміш виливають у ділильну лійку, яка вміщує MTBE (10 мл) 6 UA 101379 C2 5 10 15 20 25 30 35 40 та воду (10 мл). Шари розділяють, та водний шар екстрагують ще одною порцією MTBE (10 мл). Органічні шари об'єднують, та промивають водою, після чого насиченим водним розчином хлориду натрію. Органічний шар сушать сульфатом магнію, та концентрують, одержуючи 0,70 г неочищеного продукту. Неочищену тверду речовину розчиняють у DCM та гептані, після чого концентрують для видалення DCM, в результаті чого утворюється суспензія. Продукт збирають шляхом фільтрування, та сушать у вакуумі, одержуючи 6-бром-5-(2-фтор-4-нітрофенокси)-1метил-1H-індазол у вигляді твердої речовини (0,65 г, вихід 79 %). MS (m/z): 367,8 (M+H). Підготовчий синтез 13 6-бром-2-(тетрагідро-2H-піран-2-іл)-2H-індазол-5-ол До розчину 6-бром-5-гідрокси-1H-індазолу (725,0 г, 3,4 моль) у THF (10,2 л) додають при кімнатній температурі DHP (336,5 мл, 3,57 моль) та CH3SO3H (65,4 г, 0,68 моль). Одержану суміш перемішують при кімнатній температурі протягом 22 год. Реакційну суміш гасять дистильованою водою (6 л), та екстрагують EtOAc (6 л). Для доведення pH до 8 додають насичений водний розчин NaHCO3 (1100 мл). Фази розділяють, після чого органічну фазу промивають водою (4 л) та насиченим водним розчином хлориду натрію (3 л), сушать безводним Na2SO4, фільтрують, та концентрують, одержуючи бажаний продукт у вигляді твердої речовини (1,64 кг, вихід 99,3 %). MS (m/z): 299,0 (M+H). Підготовчий синтез 14 6-бром-5-(2-фтор-4-нітрофенокси)-2-(тетрагідро-2H-піран-2-іл)-2H-індазол До розчину 6-бром-2-(тетрагідро-2H-піран-2-іл)-2H-індазол-5-олу (1,475 кг, 4,96 моль) у DMF (5,3 л) додають при кімнатній температурі 3,4-дифторнітробензол (1,18 кг, 7,45 моль) та NaHCO3 (625,5 г, 7,45 моль). Одержану реакційну суміш нагрівають при 70C протягом 10 год., після чого охолоджують до температури менше ніж 20C. повільно додають до одержаного розчину деіонізовану (DI) воду (7,9 л), та одержану суспензію перемішують при 15C протягом 1 год. Тверду фазу збирають вакуумним фільтруванням, та твердий осад промивають водою (8 л), після чого його сушать на фільтрі повітрям під зниженим тиском, та розтирають із MTBE (18,6 л) при нагріванні зі зворотним холодильником протягом 2 год. Потім одержану суспензію охолоджують до кімнатної температури, та утворену тверду речовину збирають вакуумним фільтруванням. Твердий осад промивають MTBE (4 л, двічі), та сушать у вакуумній сушильній шафі при 35C, одержуючи бажаний продукт (1,405 кг, вихід 64,9 %). MS (m/z): 436,0 (M+H). Підготовчий синтез 15 5-(2-фтор-4-нітрофенокси)-6-(піридин-4-іл)-1-(тетрагідро-2H-піран-2-іл)-1H-індазол Суміш 6-бром-5-(2-фтор-4-нітрофенокси)-1-(тетрагідро-2H-піран-2-іл)-1H-індазолу (5,0 г, 11,5 ммоль), 4-піридинборної кислоти (3,0 г, 24,3 ммоль), PdCl2(dppf) (1,8 г, 2,25 ммоль) та CsF (5,0 г, 33,0 ммоль) у 1,4-діоксані (100 мл) перемішують при 110C протягом ночі. Потім додають водний розчин NH4Cl та EtOAc. Органічну фазу відділяють, сушать безводним MgSO 4, та концентрують.Утворений залишок очищають хроматографією на колонці із силікагелем, елююючи сумішшю петролейний ефір:EtOAc (3:1), та одержують бажаний продукт (2,8 г, вихід 56 %). MS (m/z): 435,1 (M+H). Вказані нижче сполуки одержують по суті за методикою Підготовчого синтезу 15: Підг. синт. № 16 17 18 19 20 21 22 * 23 Хімічна назва 5-(2-фтор-4-нітрофенокси)-6-(4-(метилсульфоніл)феніл)-1(тетрагідро-2H-піран-2-іл)-1H-індазол трет-бутил-4-(5-(2-фтор-4-нітрофенокси)-1-(тетрагідро-2Hпіран-2-іл)-1H-індазол-6-іл)-1H-піразол-1-карбоксилат 5-(2-фтор-4-нітрофенокси)-6-(1H-піразол-4-іл)-1-(тетрагідро-2Hпіран-2-іл)-1H-індазол 5-(2-фтор-4-нітрофенокси)-6-(піридин-3-іл)-1-(тетрагідро-2Hпіран-2-іл)-1H-індазол 6-(1,3-диметил-1H-піразол-5-іл)-5-(2-фтор-4-нітрофенокси)-1(тетрагідропіран-2-іл)-1H-індазол 5-(2-фтор-4-нітрофенокси)-6-(2-метоксипіримідин-5-іл)-1(тетрагідропіран-2-іл)-1H-індазол 5-(2-фтор-4-нітрофенокси)-6-(2-метилпіридин-4-іл)-1(тетрагідропіран-2-іл)-1H-індазол 6-циклопропіл-5-(2-фтор-4-нітрофенокси)-2-(тетрагідро-2Hпіран-2-іл)-2H-індазол трет-бутил-4-(1-метил-5-(4-нітрофенокси)-1H-індазол-6-іл)-1H 7 Фізичні дані MS (m/z) (M+H) 512,1 524,1 424,1 435,1 452,1 466,1 449,1 398 UA 101379 C2 Підг. синт. № Хімічна назва піразол-1-карбоксилат 1-метил-5-(4-нітрофенокси)-6-(1H-піразол-4-іл)-1H-індазол Фізичні дані MS (m/z) (M+H) 436,0 336,0 24 25 26 27 5-(2-фтор-4-нітрофенокси)-1-метил-6-(2-метилпіридин-4-іл)-1Hіндазол 5-(2-фтор-4-нітрофенокси)-1-метил-6-(піридин-3-іл)-1H-індазол трет-бутил-4-(5-(2-фтор-4-нітрофенокси)-1-метил-1H-індазол-6іл)-1H-піразол-1-карбоксилат трет-бутил-4-(5-(2-фтор-4-нітрофенокси)-1-метил-1H-індазол-6іл)-1H-піразол-1-карбоксилат 5-(2-фтор-4-нітрофенокси)-1-метил-6-(1H-піразол-4-іл)-1Hіндазол 379,1 365,1 454,0 454,1 354,1 *: Реакцію виконують при мікрохвильовому опроміненні при 95C протягом приблизно 90 хв. 5 10 15 20 25 Підготовчий синтез 28 6-(2,6-диметилпіридин-4-іл)-5-(2-фтор-4-нітрофенокси)-1-(тетрагідропіран-2-іл)-1H-індазол До розчину 6-бром-5-(2-фтор-4-нітрофенокси)-1-(тетрагідропіран-2-іл)-1H-індазолу (1,31 г, 3,0 ммоль) у 1,4-діоксані (20 мл) додають біс(пінаколато)дибор (0,91 г, 3,6 ммоль), Pd2(dba)3 (0,14 г, 0,2 ммоль), трициклогексилфосфін (0,1 г, 0,4 ммоль), ацетат калію (KOAc) (0,59 г, 6,0 ммоль) в атмосфері N2. Потім одержану реакційну суміш нагрівають зі зворотним холодильником протягом 3 год. в атмосфері N2, та охолоджують її до кімнатної температури. Додають гідробромід 4-бром-2,6-диметилпіридину (0,8 г, 3,0 ммоль), PdCl2(dppf) (0,16 г, 0,2 ммоль), CsF (1,38 г, 9,0 ммоль) в атмосфері N2. Одержану суміш нагрівають зі зворотним холодильником протягом ночі в атмосфері N2. тверду речовину відфільтровують, а одержаний фільтрат концентрують. Утворений залишок очищають хроматографією на колонці із силікагелем, елююючи сумішшю петролейний ефір:EtOAc (від 5:1 до 1:1), та одержують бажаний продукт (0,67 г, вихід 48,3 %). MS (m/z): 463,1 (M+H). Підготовчий синтез 29 4-(5-(2-фтор-4-нітрофенокси)-1-(тетрагідро-2H-піран-2-іл)-1H-індазол-6-іл)морфолін До розчину 6-бром-5-(2-фтор-4-нітро-фенокси)-1-(тетрагідропіран-2-іл)-1H-індазолу (8,0 г, 18 ммоль) у трет-бутанолі (150 мл) та H2O (3,2 мл) додають Pd2(dba)3 (320 мг, 0,35 ммоль), 2-дитрет-бутилфосфіно-2’-метилбіфеніл (480 мг, 1,54 ммоль), KOH (3,2 г, 57 ммоль) та морфолін (3,2 г, 36,7 ммоль) в атмосфері N2. Потім одержану суміш перемішують при 70C протягом 2 год. в атмосфері азоту, фільтрують її, та фільтрат концентрують. Утворений залишок розподіляють між EtOAc (100 мл) та насиченим водним розчином NH4Cl (30 мл). Органічний шар відділяють, сушать MgSO4, та концентрують. Утворений залишок очищають хроматографією на колонці із силікагелем, елююючи сумішшю петролейний ефір:EtOAc (3:1), та одержують бажаний продукт (4,5 г, вихід 56,5 %). MS (m/z): 443,1 (M+H). Перелічені нижче сполуки одержують по суті за методикою, описаною у Підготовчому синтезі 29: Підг. синт. № 30 31 30 35 Хімічна назва 5-(2-фтор-4-нітрофенокси)-N, N-диметил-1-(тетрагідро-2Hпіран-2-іл)-1H-індазол-6-амін N, N-диметил-5-(4-нітрофенокси)-1-(тетрагідро-2H-піран-2-іл)1H-індазол-6-амін Фізичні дані MS (m/z)(M+H) 401,2 383,1 Підготовчий синтез 32 4-(5-(2-фтор-4-нітрофенокси)-2-(тетрагідро-2H-піран-2-іл)-2H-індазол-6-іл)-2-метилморфолін (рацемічний) У флакон місткістю 25 мл, придатний для мікрохвильового нагрівання, завантажують 6бром-5-(2-фтор-4-нітрофенокси)-2-(тетрагідро-2H-піран-2-іл)-2H-індазол (0,8 г, 1,8 ммоль), 4,5біс(дифенілфосфіно)-9,9-диметилксантен (98 мг, 165 мкмоль) та Pd2(dba)3 (50 мг, 55 мкмоль). Одержану суміш суспендують у толуолі (12 мл, 113 ммоль), після чого додають гідрохлорид 2 8 UA 101379 C2 5 метилморфоліну (278 мг, 2,02 ммоль) та трет-бутилат натрію (454 мг, 4,58 ммоль). Одержану реакційну суміш витримують при 150C протягом 25 хв у мікрохвильовому реакторі. Потім реакційну суміш концентрують, та утворений залишок очищають на колонці із силікагелем, елююючи гексаном (A) та EtOAc (B), градієнт від 90 % (A):10 % (B) до 60 % (A):40 % (B) протягом 60 хв, а потім до 50 % (A):50 % (B) протягом 20 хв, одержуючи бажаний продукт у вигляді оранжевої твердої речовини (410 мг, вихід 39 %). MS (m/z): 457 (M+H). Вказані нижче сполуки одержують по суті за методикою, описаною у Підготовчому синтезі 32: Підг. синт. № 33 34 Хімічна назва (2R)-4-(5-(2-фтор-4-нітрофенокси)-2-(тетрагідро-2H-піран-2-іл)-2Hіндазол-6-іл)-2-метилморфолін (2S, 6R)-4-(5-(2-фтор-4-нітрофенокси)-2-(тетрагідро-2H-піран-2-іл)2H-індазол-6-іл)-2,6-диметилморфолін Фізичні дані MS (m/z)(M+H) 456,8 470,8 10 15 20 25 30 35 40 45 50 Підготовчий синтез 35 4-(5-(2-фтор-4-нітрофенокси)-2-(тетрагідро-2H-піран-2-іл)-2H-індазол-6-іл)-2,2диметилморфолін 6-бром-5-(2-фтор-4-нітрофенокси)-2-(тетрагідро-2H-піран-2-іл)-2H-індазол (1,5 г, 3,4 ммоль) ® завантажують у пробірку Genevac Carousel місткістю 50 мл, суспендують у аміленгідраті (10 мл, 91,4 ммоль), та через одержану суспензію барботують N2. До одержаної суміші додають 2-(ди-трет-бутилфосфіно)-2'-метилбіфеніл (97,7 мг, 309 мкмоль), Pd2(dba)3 (94,5 мг, 103 мкмоль) та деіонізовану воду (0,3 мл), та продовжують барботування N2 протягом 10 хв. До цієї суміші додають гідрохлорид 2,2-диметилморфоліну (1,04 г, 6,9 ммоль), та розчин KOH (617 мг, 11,0 ммоль) у 0,3 мл дистильованої води. Одержану реакційну суміш витримують при 80C протягом 2 год., після чого охолоджують до кімнатної температури. Потім одержану суміш виливають у EtOAc (300 мл), промивають дистильованою водою (1100 мл), після чого насиченим водним розчином хлориду натрію (100 мл). Об'єднані водні шари екстрагують EtOAc (100 мл). Об'єднаний органічний розчин сушать Na2SO4, фільтрують, та концентрують досуха, одержуючи яскраво-жовту тверду речовину. Одержану тверду речовину очищають на колонці із силікагелем, елююючи гексаном (A) та EtOAc (B), градієнт від 95 % (A):5 % (B) до 75 % (A):25 % (B) протягом 70 хв, та одержують бажаний продукт у вигляді світло-жовтої твердої речовини (410 мг, вихід 25 %). MS (m/z): 470,8 (M+H). Підготовчий синтез 36 5-(2-фтор-4-нітрофенокси)-6-(піридин-4-іл)-1H-індазол До розчину 5-(2-фтор-4-нітрофенокси)-6-(піридин-4-іл)-1-(тетрагідро-2H-піран-2-іл)-1Hіндазолу (2,8 г, 6,45 ммоль) у EtOH (30 мл) додають HCl (концентрована, 5,0 мл). Одержану суміш перемішують при 80C протягом 2 год. Потім додають водний розчин NaHCO 3 та EtOAc. Органічну фазу сушать безводним MgSO4, та концентрують. Утворений залишок очищають хроматографією на колонці із силікагелем, елююючи сумішшю петролейний простий ефір:EtOAc (3:1), одержуючи бажаний продукт (1,95 г, вихід 86,0 %). MS (m/z): 351,0 (M+H). Підготовчий синтез 37 3-фтор-4-(6-(піридин-4-іл)-1H-індазол-5-ілоксі)анілін Суміш 5-(2-фтор-4-нітрофенокси)-6-(піридин-4-іл)-1H-індазолу (1,95 г, 4,5 ммоль) та SnCl2·2H2O (10,2 г, 45,3 ммоль) у EtOAc/EtOH (200 мл/10 мл) перемішують при 80C протягом 2 год. Потім додають водний розчин NaHCO3 та EtOAc. Органічну фазу сушать безводним MgSO4, та концентрують. Утворений залишок очищають хроматографією на колонці із силікагелем, елююючи сумішшю петролейний ефір:EtOAc (2:1), та одержують бажаний продукт (1,10 г, вихід 61,0 %). MS (m/z): 321,0 (M+H). Підготовчий синтез 38 3-фтор-4-(6-(4-(метилсульфоніл)феніл)-1-(тетрагідро-2H-піран-2-іл)-1H-індазол-5ілоксі)анілін До розчину 5-(2-фтор-4-нітрофенокси)-6-(4-(метилсульфоніл)феніл)-1-(тетрагідро-2H-піран2-іл)-1H-індазолу (320 мг, 0,63 ммоль) у EtOAc (50 мл) додають Pd/C (10 %, 100 мг). Одержану суміш знегажують вакуумуванням, після чого тричі продувають H 2. Суміш перемішують в атмосфері H2 при кімнатній температурі протягом ночі. Тверду речовину видаляють шляхом фільтрування, та фільтрат концентрують. Утворений залишок очищають хроматографією на колонці із силікагелем, елююючи сумішшю DCM:MeOH (20:1), та одержують бажаний продукт (250 мг, вихід 83 %). MS (m/z): 482,1 (M+H). 9 UA 101379 C2 Вказані нижче сполуки одержують по суті за методикою, описаною у Підготовчому синтезі 38: Підг. синт. № 39 40 5 10 15 Хімічна назва 3-фтор-4-(1-метил-6-(2-метилпіридин-4-іл)-1H-індазол-5ілоксі)анілін трет-бутил-4-(5-(4-аміно-2-фторфенокси)-1-метил-1H-індазол-6-іл)1H-піразол-1-карбоксилат Фізичні дані MS (m/z)(M+H) 349,1 424 Підготовчий синтез 41 4-(6-(1H-піразол-4-іл)-1H-індазол-5-ілокси)-3-фторанілін До розчину 5-(2-фтор-4-нітрофенокси)-6-(1H-піразол-4-іл)-1-(тетрагідропіран-2-іл)-1Hіндазолу (900 мг, 2,13 ммоль) та трет-бутилового складного ефіру 4-[5-(2-фтор-4-нітрофенокси)1-(тетрагідропіран-2-іл)-1H-індазол-6-іл]піразол-1-карбонової кислоти (3,1 г, 5,92 ммоль) у EtOAc/EtOH (75 мл/75 мл) додають дигідрат дихлориду олова (2) (10 г, 52,74 ммоль). Одержану реакційну суміш перемішують при нагріванні зі зворотним холодильником протягом ночі. Потім її охолоджують, та підлуговують насиченим водним розчином NaHCO 3 до pH 8-9, і одержану суміш екстрагують EtOAc (100 мл). Органічну фазу відділяють, сушать MgSO 4, та концентрують. Утворений залишок очищають хроматографією на колонці із силікагелем, елююючи спочатку сумішшю петролейний ефір:EtOAc (1:1), після чого EtOAc, та одержують бажаний продукт (1,75 г, вихід 71,0 %). MS (m/z): 310,0 (M+H). Перелічені нижче сполуки одержують по суті за методикою, описаною у Підготовчому синтезі 41: Підг. Хімічна назва синт. № 42 3-фтор-4-(6-(піридин-3-іл)-1H-індазол-5-ілоксі)анілін 4-(6-(1,3-диметил-1H-піразол-5-іл)-1H-індазол-5-ілокси)-343 фторанілін 44 3-фтор-4-(6-морфоліно-1H-індазол-5-ілоксі)анілін 45 4-[6-(2,6-диметилпіридин-4-іл)-1H-індазол-5-ілокси]-3-фторанілін 46 3-фтор-4-[6-(2-метоксипіримідин-5-іл)-1H-індазол-5-ілокси]анілін 47 5-(4-аміно-2-фторфенокси)-N, N-диметил-1H-індазол-6-амін 48 3-фтор-4-(6-(2-метилпіридин-4-іл)-1H-індазол-5-ілоксі)анілін 49 5-(4-амінофенокси)-N, N-диметил-1H-індазол-6-амін 50 4-(1-метил-6-(1H-піразол-4-іл)-1H-індазол-5-ілоксі)анілін 51 3-фтор-4-(1-метил-6-(1H-піразол-4-іл)-1H-індазол-5-ілоксі)анілін 52 3-фтор-4-(1-метил-6-(піридин-3-іл)-1H-індазол-5-ілоксі)анілін Фізичні дані MS (m/z)(M+H) 321,1 338,1 329,1 349,1 352,1 287,1 335,1 269,1 306,0 324,1 335,1 20 25 30 Підготовчий синтез 53 4-(6-циклопропіл-2-(тетрагідро-2H-піран-2-іл)-2H-індазол-5-ілокси)-3-фторанілін У скляний флакон місткістю 25 мл завантажують 6-циклопропіл-5-(2-фтор-4-нітрофенокси)2-(тетрагідро-2H-піран-2-іл)-2H-індазол (395 мг, 994 мкмоль) та MeOH (20 мл, 494 ммоль). До одержаної суспензії додають N, N-диметилгідразин (756 мкл, 9,94 ммоль) та FeCl3 (163 мг, 994 мкмоль). Флакон закривають, нагрівають до 60C, та струшують протягом 2 год., після чого струшують при 50C протягом ночі. Одержану суміш фільтрують через фільтрувальну лійку Бюхнера, та одержану тверду речовину промивають MeOH (100 мл). Фільтрат збирають та концентрують, одержуючи коричнево-оранжеву тверду речовину. Утворений залишок очищають на колонці із силікагелем, елююючи DCM (A) та 10 % розчином MeOH у DCM (B), градієнт від 100 % (A) до 85 % (A):15 % (B) протягом 50 хв, та одержують вказану в заголовку сполуку у вигляді жовтої твердої речовини (358 мг, вихід 98 %). MS (m/z): 368 (M+H). Перелічені нижче сполуки одержують по суті за методикою, описаною у Підготовчому синтезі 53: 35 10 UA 101379 C2 Підг. синт. № 54 55 56 57 58 5 10 15 20 25 30 35 40 45 Хімічна назва 3-фтор-4-(6-(2-метилморфоліно)-2-(тетрагідро-2H-піран-2-іл)-2Hіндазол-5-ілоксі)анілін 4-(6-(2,2-диметилморфоліно)-2-(тетрагідро-2H-піран-2-іл)-2Hіндазол-5-ілокси)-3-фторанілін 3-фтор-4-(6-((R)-2-метилморфоліно)-2-(тетрагідро-2H-піран-2-іл)2H-індазол-5-ілоксі)анілін 4-(6-((2S, 6R)-2,6-диметилморфоліно)-2-(тетрагідро-2H-піран-2-іл)2H-індазол-5-ілокси)-3-фторанілін 3-фтор-4-(6-морфоліно-2-(тетрагідро-2H-піран-2-іл)-2H-індазол-5ілоксі)анілін Фізичні дані MS (m/z)(M+H) 427 441 427 441 413 Підготовчий синтез 59 N-(дифенілметилен)-5-(2-фтор-4-нітрофенокси)-1-метил-1H-індазол-6-амін У флакон місткістю 10 мл, придатний для мікрохвильового нагрівання, завантажують 6бром-5-(2-фтор-4-нітрофенокси)-1-метил-1H-індазол (500 мг, 1,37 ммоль), 4,5біс(дифенілфосфіно)-9,9-диметилксантен (73 мг, 123 мкмоль) та Pd2(dba)3 (38 мг, 41 мкмоль). Одержану суміш суспендують у толуолі (5 мл, 47 ммоль), та додають бензофенонімін (272 мг, 1,5 ммоль) та трет-бутилат натрію (203 мг, 2,05 ммоль). Одержану суміш витримують у мікрохвильовому реакторі при 150C протягом 20 хв. Після охолодження реакційний розчин концентрують, одержуючи коричневе масло, яке розчиняють у DCM (150 мл), та промивають насиченим водним розчином хлориду натрію (250 мл). Водні шари об'єднують, та екстрагують DCM (150 мл), сушать Na2SO4, фільтрують, та концентрують, одержуючи коричневий залишок. Утворений залишок очищають на колонці із силікагелем, елююючи гексаном (A) та EtOAc (B), градієнт від 85 % (A):15 % (B) до 50 % (A):50 % (B) протягом 50 хв, та одержують вказану в заголовку сполуку у вигляді жовтого твердого матеріалу (574 мг, вихід 90,1 %). MS (m/z): 467,2 (M+H). Підготовчий синтез 60 5-(4-аміно-2-фторфенокси)-N-бензгідрил-1-метил-1H-індазол-6-амін У круглодонну колбу місткістю 100 мл завантажують N-(дифенілметилен)-5-(2-фтор-4нітрофенокси)-1-метил-1H-індазол-6-амін (424 мг, 909 мкмоль) та EtOH (35 мл, 601 ммоль). До одержаної суміші додають форміат амонію (1000 мг, 15,9 ммоль), після чого додають 10 % Pd/C (300 мг, 141 мкмоль), перемішують реакційну суміш при кімнатній температурі протягом 1 год., нагрівають до 45C, і витримують протягом 15 хв. Розчинник видаляють, та утворений залишок розчиняють у DCM (150 мл) та дистильованій воді (100 мл). Органічний шар промивають дистильованою водою (1100 мл), та об'єднані водні шари екстрагують DCM (150 мл). Об'єднаний органічний розчинник сушать Na2SO4, фільтрують, та концентрують. Неочищений продукт очищають на колонці із силікагелем, елююючи гексаном (A) та EtOAc (B), градієнт від 90 % (A):10 % (B) до 40 % (A):60 % (B) протягом 90 хв, та одержують вказану в заголовку сполуку у вигляді злегка забарвленої твердої речовини (204 мг, вихід 51 %). MS (m/z): 438,8 (M+H). Підготовчий синтез 61 1-ацетил-6-бром-1H-індазол-5-ілацетат Суміш 6-бром-5-гідрокси-1H-індазолу (25 г, 117 ммоль) у ангідриді оцтової кислоти (75 мл) витримують при 110C при перемішуванні протягом 2 год. Потім її охолоджують, додають діетиловий ефір (100 мл). Утворений осад збирають шляхом фільтрування, промивають діетиловим ефіром (30 мл), та сушать у вакуумі, одержуючи бажаний продукт (34 г, вихід 98 %). MS (m/z): 297,0 (M+H). Підготовчий синтез 62 Етил-5-гідрокси-1H-індазол-6-карбоксилат У автоклав завантажують 1-ацетил-6-бром-1H-індазол-5-ілацетат (25 г, 84 ммоль), TEA (25 г, 252 ммоль), дихлорбіс(бензонітрил)паладій (Pd(PhCN) 2Cl2) (1,6 г, 4,2 ммоль), 1,1’біс(дифенілфосфіно)фероцен (dppf) (4,7 г, 8,4 ммоль) та EtOH (500 мл), та перемішують при 130C в атмосфері CO протягом 8 год. Одержану реакційну суміш концентрують, а залишок очищають хроматографією на колонці із силікагелем, одержуючи бажаний продукт (15,5 г, вихід 90 %). MS (m/z): 207,0 (M+H). Підготовчий синтез 63 Етил-5-гідрокси-1-(тетрагідро-2H-піран-2-іл)-1H-індазол-6-карбоксилат 11 UA 101379 C2 5 10 15 20 25 30 35 40 45 50 55 60 До розчину етил-5-гідрокси-1H-індазол-6-карбоксилату (15,5 г, 75 ммоль) у DCM (100 мл) та THF (100 мл), який містить метансульфонову кислоту (721 мг, 7,5 ммоль), додають краплями розчин 3,4-дигідро-2H-пірану (6,6 г, 79 ммоль) у DCM (20 мл) при кімнатній температурі. Одержаний розчин перемішують при кімнатній температурі протягом ночі. Потім розчинник видаляють, та додають EtOAc (500 мл), насичений водний розчин хлориду натрію (500 мл) та NaHCO3 (5 г). Органічний шар відділяють, сушать, та концентрують. Залишок очищають хроматографією на колонці із силікагелем, одержуючи бажаний продукт (16,8 г, вихід 77 %). MS (m/z): 291,1 (M+H). Підготовчий синтез 64 Етил-5-(2-фтор-4-нітрофенокси)-1-(тетрагідро-2H-піран-2-іл)-1H-індазол-6-карбоксилат Суміш етил-5-гідрокси-1-(тетрагідро-2H-піран-2-іл)-1H-індазол-6-карбоксилату (10,8 г, 37 ммоль), 1,2-дифтор-4-нітробензолу (7,1 г, 44 ммоль), NaHCO3 (7,4 г, 88 ммоль) та DMF (100 мл) перемішують при 80C протягом 2 год. Потім її охолоджують до кімнатної температури, додають воду (400 мл) та петролейний ефір (50 мл), та одержану суміш перемішують протягом 20 хв. Утворений осад збирають, та сушать у вакуумі при 50C, одержуючи бажаний продукт (15 г, вихід 95 %). MS (m/z): 430,1 (M+H). Підготовчий синтез 65 5-(2-фтор-4-нітрофенокси)-1-(тетрагідро-2H-піран-2-іл)-1H-індазол-6-карбонова кислота До розчину етил-5-(2-фтор-4-нітрофенокси)-1-(тетрагідро-2H-піран-2-іл)-1H-індазол-6карбоксилату (22 г, 51,2 ммоль) у THF (60 мл), MeOH (60 мл) та H2O (10 мл) додають LiOH (3 г, 125 ммоль). Одержаний розчин перемішують при кімнатній температурі протягом 1,5 год., та органічні розчинники видаляють. Водний залишок підкислюють холодним 6-н. розчином HCl до pH 2, та екстрагують EtOAc (150 мл). Органічну фазу відділяють, сушать, та концентрують. Залишок очищають хроматографією на колонці із силікагелем, елююючи сумішшю петролейний ефір:EtOAc:оцтова кислота (100:100:1), та одержують бажаний продукт (19,5 г, вихід 95 %). MS (m/z): 402,1 (M+H). Підготовчий синтез 66 Трет-бутил-5-(2-фтор-4-нітрофенокси)-1-(тетрагідро-2H-піран-2-іл)-1H-індазол-6-іл-карбамат Суміш 5-(2-фтор-4-нітрофенокси)-1-(тетрагідро-2H-піран-2-іл)-1H-індазол-6-карбонової кислоти (590 мг, 1,47 ммоль), дифенілфосфорилазиду (485 мг, 1,76 ммоль), TEA (179 мг, 1,76 ммоль), молекулярного сита 4 Å (3 г) у трет-бутанолі (40 мл) перемішують при 80C протягом ночі. Одержану суміш фільтрують, та фільтрат концентрують. Утворений залишок очищають хроматографією на колонці із силікагелем, елююючи сумішшю петролейний ефір/EtOAc (10:1), та одержують бажаний продукт (400 мг, вихід 65 %). MS (m/z): 473,1 (M+H). Підготовчий синтез 67 Трет-бутил-5-(4-аміно-2-фторфенокси)-1-(тетрагідро-2H-піран-2-іл)-1H-індазол-6-іл-карбамат До розчину трет-бутил-5-(2-фтор-4-нітрофенокси)-1-(тетрагідро-2H-піран-2-іл)-1H-індазол-6ілкарбамату (400 мг, 0,85 ммоль) у EtOAc (50 мл) додають Pd/C (10 %, 50 мг). Одержану суміш знегажують вакуумуванням, після чого тричі продувають H2. Суміш перемішують в атмосфері H2 при кімнатній температурі протягом ночі. Тверду речовину видаляють шляхом фільтрування, та фільтрат концентрують. Утворений залишок очищають хроматографією на колонці із силікагелем, елююючи сумішшю DCM:MeOH (10:1), та одержують бажаний продукт (300 мг, вихід 80 %). MS (m/z): 443,2 (M+H). Підготовчий синтез 68 5-(2-фтор-4-нітрофенокси)-1-(тетрагідро-2H-піран-2-іл)-N-(тетрагідро-2H-піран-4-іл)-1Hіндазол-6-карбоксамід Розчин 5-(2-фтор-4-нітрофенокси)-1-(тетрагідро-2H-піран-2-іл)-1H-індазол-6-карбонової кислоти (0,5 г, 1,25 ммоль), тетрагідропіран-4-іламіну (0,13 г, 1,25 ммоль), EDCI (0,24 г, 1,25 ммоль), HOBT (0,17 г, 1,25 ммоль), N-метилморфоліну (0,5 мл) у DMF (5 мл) перемішують при кімнатній температурі протягом ночі. Потім реакційну суміш розподіляють між насиченим водним розчином NH4Cl (20 мл) та EtOAc (50 мл). Органічну фазу відділяють, сушать MgSO 4, та концентрують. Утворений залишок очищають хроматографією на колонці із силікагелем, елююючи сумішшю петролейний ефір:EtOAc (1:1), та одержують бажаний продукт (0,49 г, вихід 81,2 %). MS (m/z): 485,1 (M+H). Підготовчий синтез 69 5-(4-аміно-2-фторфенокси)-1-(тетрагідро-2H-піран-2-іл)-N-(тетрагідро-2H-піран-4-іл)-1Hіндазол-6-карбоксамід До розчину 5-(2-фтор-4-нітрофенокси)-1-(тетрагідро-2H-піран-2-іл)-N-(тетрагідро-2H-піран-4іл)-1H-індазол-6-карбоксаміду (0,49 г, 1,0 ммоль) у MeOH (50 мл) додають Pd/C (100 мг, 10 % (мас.)) в атмосфері N2. Одержану суміш знегажують вакуумуванням, після чого 12 UA 101379 C2 5 10 15 20 25 30 35 40 45 50 55 60 продувають азотом. Потім одержану реакційну суміш перемішують при кімнатній температурі в атмосфері водню протягом ночі. Тверду речовину видаляють шляхом фільтрування, та фільтрат концентрують, одержуючи неочищений продукт (0,42 г, вихід 91,4 %). MS (m/z): 455,1 (M+H). Підготовчий синтез 70 5-(бензилокси)-6-бром-1H-індазол До розчину 6-бром-5-гідрокси-1H-індазолу (5 г, 23,5 ммоль) у THF (50 мл) додають бензиловий спирт (3,05 г, 28,2 ммоль), PPh3 (7,39 г, 28,2 ммоль) та діетилазодикарбоксилат (4,46 мл, 28,2 ммоль). Після перемішування одержаної реакційної суміші при кімнатній температурі протягом ночі додають EtOAc (50 мл) та насичений водний розчин NH4Cl (30 мл). Органічну фазу відділяють, сушать MgSO4, та концентрують. Утворений залишок очищають хроматографією на колонці із силікагелем, елююючи сумішшю петролейний ефір:EtOAc (4:1), та одержують продукт (5,0 г, вихід 70,2 %). MS (m/z): 303,0 (M+H). Підготовчий синтез 71 5-(бензилокси)-6-бром-1-(тетрагідро-2H-піран-2-іл)-1H-індазол До розчину 5-(бензилокси)-6-бром-1H-індазолу (5 г, 16,5 ммоль) у THF (30 мл) та DCM (30 мл) додають 3,4-дигідро-2H-піран (3 мл, 32,8 ммоль) та метансульфонову кислоту (1 мл, 15,3 ммоль). Після перемішування одержаної реакційної суміші при кімнатній температурі протягом 2 год. додають EtOAc (50 мл) та насичений водний розчин NaHCO3. Органічну фазу відділяють, сушать MgSO4, та концентрують. Утворений залишок очищають хроматографією на колонці із силікагелем, елююючи сумішшю петролейний ефір:EtOAc (4:1), та одержують бажаний продукт (2,7 г, вихід 42,2 %). MS (m/z): 387,0 (M+H). Підготовчий синтез 72 5-(бензилокси)-1-(тетрагідро-2H-піран-2-іл)-N-(тетрагідро-2H-піран-4-іл)-1H-індазол-6-амін До розчину 5-(бензилокси)-6-бром-1-(тетрагідро-2H-піран-2-іл)-1H-індазолу (2 г, 5,16 ммоль) у толуолі (30 мл) додають тетрагідропіран-4-іламін (800 мг, 7,91 ммоль), ацетат паладію (60 мг, 267 мкмоль), 2-дициклогексилфосфіно-2'-(N, N-диметиламіно)біфеніл (200 мг, 508 мкмоль) та трет-бутилат натрію (700 мг, 7,28 ммоль) в атмосфері N2. Після перемішування одержаної реакційної суміші при 100C в атмосфері N2 протягом 1 год., додають EtOAc (30 мл), та одержану реакційну суміш фільтрують. Одержаний фільтрат концентрують, та залишок очищають хроматографією на колонці із силікагелем, елююючи спочатку сумішшю EtOAc:петролейний ефір (1/1), а потім EtOAc, та одержують бажаний продукт (1,87 г, вихід 88,8 %). MS (m/z): 408,2 (M+H). Підготовчий синтез 73 N-(5-(бензилокси)-1-(тетрагідро-2H-піран-2-іл)-1H-індазол-6-іл)-N-(тетрагідро-2H-піран-4іл)ацетамід До розчину 5-(бензилокси)-1-(тетрагідро-2H-піран-2-іл)-N-(тетрагідро-2H-піран-4-іл)-1Hіндазол-6-аміну (1,87 г, 4,59 ммоль) у THF (30 мл) додають ацетилхлорид (0,39 мл, 5,48 ммоль) та K2CO3 (760 мг, 5,50 ммоль). Потім одержану реакційну суміш нагрівають зі зворотним холодильником протягом 30 хв, додають H2O (20 мл) та EtOAc (30 мл). Органічну фазу відділяють, промивають насиченим водним розчином NH 4Cl, сушать, та концентрують, одержуючи бажаний продукт (1,7 г, вихід 82,4 %). MS (m/z): 450,2 (M+H). Підготовчий синтез 74 N-(5-гідрокси-1-(тетрагідро-2H-піран-2-іл)-1H-індазол-6-іл)-N-(тетрагідро-2H-піран-4іл)ацетамід До розчину N-(5-(бензилокси)-1-(тетрагідро-2H-піран-2-іл)-1H-індазол-6-іл)-N-(тетрагідро-2Hпіран-4-іл)ацетаміду (1,7 г, 3,78 ммоль) у EtOH (100 мл) та EtOAc (100 мл) додають Pd/C (1 г, 10 % (мас.)). Потім одержану реакційну суміш перемішують при кімнатній температурі в атмосфері H2 протягом ночі, фільтрують її, та фільтрат концентрують. Утворений залишок очищають хроматографією на колонці із силікагелем, елююючи спочатку сумішшю петролейний ефір:EtOAc (1:1), а потім EtOAc, та одержують бажаний продукт (1,2 г, вихід 88,2 %). MS (m/z): 360,2 (M+H). Підготовчий синтез 75 N-(5-(2-фтор-4-нітрофенокси)-1-(тетрагідро-2H-піран-2-іл)-1H-індазол-6-іл)-N-(тетрагідро-2Hпіран-4-іл)ацетамід До розчину N-(5-гідрокси-1-(тетрагідро-2H-піран-2-іл)-1H-індазол-6-іл)-N-(тетрагідро-2Hпіран-4-іл)ацетаміду (1,2 г, 3,34 ммоль) у DMF (30 мл) додають 1,2-дифтор-4-нітробензол (0,64 г, 4,02 ммоль) та Cs2CO3 (1,63 г, 5,00 ммоль). Потім реакційну суміш перемішують при 100C протягом 2 год., додають EtOAc (60 мл) та насичений водний розчин NH4Cl. Органічну фазу відділяють, сушать MgSO4, та концентрують. Утворений залишок очищають 13 UA 101379 C2 5 10 15 20 25 30 35 40 45 50 55 60 хроматографією на колонці із силікагелем, елююючи спочатку сумішшю петролейний ефір:EtOAc (1:1), а потім EtOAc, та одержують бажаний продукт (1,44 г, вихід 86,5 %). MS (m/z): 499,2 (M+H). Підготовчий синтез 76 5-(4-аміно-2-фторфенокси)-N-(тетрагідро-2H-піран-4-іл)-1H-індазол-6-амін Вказану в заголовку сполуку одержують по суті за методикою, описаною у Підготовчому синтезі 41. MS (m/z): 343,1 (M+H). Підготовчий синтез 77 5-(бензилокси)-6-(6-метилпіридин-3-іл)-1-(тетрагідро-2H-піран-2-іл)-1H-індазол До розчину 5-(бензилокси)-6-бром-1-(тетрагідро-2H-піран-2-іл)-1H-індазолу (4 г, 10,3 ммоль) у 1,4-діоксані (25 мл) додають біс(пінаколато)дибор (3 г, 11,8 ммоль), dppf (0,3 г, 541 мкмоль), PdCl2(dppf) (0,42 г, 514 мкмоль) та KOAc (2 г, 20,4 ммоль) в атмосфері N2. Потім одержану реакційну суміш перемішують при нагріванні зі зворотним холодильником протягом 5 год., додають 5-бром-2-метилпіридин (2,1 г, 12,2 ммоль), тетракіс(трифенілфосфін)паладій (Pd(PPh3)4) (0,6 г, 519 мкмоль) та Cs2CO3 (4 г, 12,3 ммоль), та одержану суміш перемішують при нагріванні зі зворотним холодильником протягом ночі. Реакційну суміш охолоджують, та фільтрують, одержаний фільтрат концентрують. Утворений залишок очищають хроматографією на колонці із силікагелем, елююючи сумішшю петролейний ефір:EtOAc (2:1), та одержують бажаний продукт (1,9 г, вихід 46,0 %). MS (m/z): 400,1 (M+H). Підготовчий синтез 78 6-(6-метилпіридин-3-іл)-1-(тетрагідро-2H-піран-2-іл)-1H-індазол-5-ол До розчину 5-(бензилокси)-6-(6-метилпіридин-3-іл)-1-(тетрагідро-2H-піран-2-іл)-1H-індазолу (1,44 г, 3,60 ммоль) у EtOH (50 мл) та EtOAc (50 мл) додають Pd/C (500 мг, 10 % (мас.)) в атмосфері N2. Одержану суміш знегажують вакуумуванням, після чого продувають азотом. Потім реакційну суміш перемішують при кімнатній температурі в атмосфері водню протягом ночі. Реакційну суміш фільтрують. Фільтрат концентрують, одержуючи бажаний продукт (982 мг, вихід 88,0 %). MS (m/z): 310,1 (M+H). Підготовчий синтез 79 5-(2-фтор-4-нітрофенокси)-6-(6-метилпіридин-3-іл)-1-(тетрагідро-2H-піран-2-іл)-1H-індазол Вказану в заголовку сполуку одержують по суті за методикою, описаною у Підготовчому синтезі 75. MS (m/z): 449,2 (M+H). Підготовчий синтез 80 3-фтор-4-(6-(6-метилпіридин-3-іл)-1H-індазол-5-ілоксі)анілін Вказану в заголовку сполуку одержують по суті за методикою, описаною у Підготовчому синтезі 41. MS (m/z): 335,1 (M+H). Підготовчий синтез 81 1-(4-бром-2-фторфенокси)-2-фтор-5-метил-4-нітробензол Вказану в заголовку сполуку одержують по суті за методикою, описаною у Підготовчому синтезі 75. 1 H NMR (d6-диметилсульфоксид (DMSO)) 8,20 (d, 1H), 7,80 (d, 1H), 7,42 (d, 1H), 7,30 (d, 1H), 7,10 (d, 1H). Підготовчий синтез 82 4-(4-бром-2-фторфенокси)-5-фтор-2-метиланілін Вказану в заголовку сполуку одержують по суті за методикою, описаною у Підготовчому синтезі 53. MS (m/z): 315,8 (M+H). Підготовчий синтез 83 5-(4-бром-2-фторфенокси)-6-фтор-1H-індазол До суспензії 4-(4-бром-2-фторфенокси)-5-фтор-2-метиланіліну (5,2 г, 16,6 ммоль) у воді (100 мл) додають фторборну кислоту (6,06 г, 33,1 ммоль) при кімнатній температурі. Одержаний розчин охолоджують до 0C, та додають NaNO2 (1,71 г, 24,8 ммоль) у воді (2 мл). Реакційну суміш перемішують при 0C протягом 40 хв. Додають CHCl3 (200 мл). Органічну фазу відділяють, сушать Na2SO4, та фільтрують. До одержаного фільтрату додають KOAc (7,31 г, 74,5 ммоль) та 18-краун-6-ефір (0,218 г, 0,82 ммоль). Реакційну суміш перемішують при кімнатній температурі протягом 1 год. Потім реакційну суміш промивають насиченим водним розчином хлориду натрію, сушать Na2SO4, фільтрують, та випарюють. Утворений залишок промивають DCM, та фільтрують, одержуючи бажаний продукт у вигляді світло-жовтої твердої речовини. Фільтрат очищають хроматографією, елююючи DCM, а потім сумішшю EtOAc:гексан (1:1), та одержують ще певну кількість бажаного продукту. Обидві порції одержаної твердої речовини об'єднують, одержуючи бажаний продукт (3,2 г, вихід 59 %). MS (m/z): 324,8 (M+H). Підготовчий синтез 84 14 UA 101379 C2 5 10 15 20 25 30 35 40 45 50 55 60 5-(4-бром-2-фторфенокси)-6-фтор-1-(тетрагідро-2H-піран-2-іл)-1H-індазол Вказану в заголовку сполуку одержують по суті за методикою, описаною у Підготовчому синтезі 9. MS (m/z): 410,8 (M+H). Підготовчий синтез 85 N-(дифенілметилен)-3-фтор-4-(6-фтор-1-(тетрагідро-2H-піран-2-іл)-1H-індазол-5-ілоксі)анілін Суміш 5-(4-бром-2-фторфенокси)-6-фтор-1-(тетрагідро-2H-піран-2-іл)-1H-індазолу (0,97 г, 2,37 ммоль), бензофеноніміну (0,64 г, 3,56 ммоль), 4,5-біс(дифенілфосфіно)-9,9диметилксантену (0,10 г, 0,075 моль), Cs2CO3 (1,16 г, 3,56 ммоль), Pd2(dba)3 (0,11 г, 0,12 ммоль) у 1,4-діоксані (20 мл) продувають азотом, і перемішують при 100C протягом ночі. Одержану реакційну суміш охолоджують до кімнатної температури, екстрагують EtOAc, промивають насиченим водним розчином хлориду натрію, сушать Na 2SO4, фільтрують, та концентрують (1,45 г). MS (m/z): 510 (M+H). Підготовчий синтез 86 3-фтор-4-(6-фтор-1-(тетрагідро-2H-піран-2-іл)-1H-індазол-5-ілоксі)анілін До розчину N-(дифенілметилен)-3-фтор-4-(6-фтор-1-(тетрагідро-2H-піран-2-іл)-1H-індазол-5ілоксі)аніліну (1,45 г, 2,85 ммоль) у THF (30 мл) та воді (5 мл) додають 1-н. водний розчин HCl (5,69 мл, 5,69 ммоль). Реакційну суміш перемішують при кімнатній температурі протягом 2 год. Додають EtOAc, та одержану суміш промивають насиченим водним розчином NaHCO 3, насиченим водним розчином хлориду натрію, сушать Na2SO4, фільтрують, та випарюють. Утворений залишок очищають хроматографією, елююючи DCM, а потім сумішшю EtOAc:гексан (1:1), та одержують бажаний продукт у вигляді палевого гелю (0,53 г, вихід 54 %). MS (m/z): 346 (M+H). Підготовчий синтез 87 Етил-5-(2-фтор-4-нітрофенокси)-1-(тетрагідро-2H-піран-2-іл)-1H-індазол-6-карбоксилат Вказану в заголовку сполуку виготовляють по суті за методикою, описаною у Підготовчому синтезі 75. MS (m/z): 430,1 (M+H). Підготовчий синтез 88 Етил-5-(2-фтор-4-нітрофенокси)-1H-індазол-6-карбоксилат До розчину етил-5-(2-фтор-4-нітрофенокси)-1-(тетрагідро-2H-піран-2-іл)-1H-індазол-6карбоксилату (15 г, 35 ммоль) у DCM (300 мл) додають трифтороцтову кислоту (TFA) (30 мл), та перемішують при кімнатній температурі протягом ночі. DCM випарюють. Утворений залишок розподіляють між EtOAc (800 мл) та 5 % водним розчином NaHCO3 (400 мл). Органічний шар промивають насиченим водним розчином хлориду натрію, сушать MgSO 4, та концентрують. Утворений залишок очищають хроматографією на колонці із силікагелем, елююючи сумішшю петролейний простий ефір:ацетон (5:1), та одержують бажаний продукт (10,4 г, вихід 86 %). MS (m/z): 346,1 (M+H). Підготовчий синтез 89 Етил-5-(2-фтор-4-нітрофенокси)-1-метил-1H-індазол-6-карбоксилат Вказану в заголовку сполуку одержують по суті за методикою, описаною у Підготовчому синтезі 11. MS (m/z): 360,1 (M+H). Підготовчий синтез 90 5-(2-фтор-4-нітрофенокси)-1-метил-1H-індазол-6-карбонова кислота До розчину етил-5-(2-фтор-4-нітрофенокси)-1-метил-1H-індазол-6-карбоксилату (1,19 г, 3,5 ммоль) у THF/H2O (15 мл/5 мл) додають LiOH (0,2 г, 8,3 ммоль). Після перемішування реакційної суміші при кімнатній температурі протягом 2 год. розчинники видаляють. Утворений залишок підкислюють 2-н. розчином HCl до pH 5, та екстрагують EtOAc (50 мл). Органічну фазу промивають насиченим водним розчином хлориду натрію, сушать, та концентрують, одержуючи бажаний продукт (1,1 г, вихід 100 %). MS (m/z): 332,0 (M+H). Підготовчий синтез 91 Трет-бутил-5-(2-фтор-4-нітрофенокси)-1-метил-1H-індазол-6-ілкарбамат Суспензію 5-(2-фтор-4-нітрофенокси)-1-метил-1H-індазол-6-карбонової кислоти (1,1 г, 3,3 ммоль), дифенілфосфорилазиду (0,91 г, 3,3 ммоль), TEA (0,33 г, 3,3 ммоль) та молекулярного сита 4 Å (2,5 г) у трет-бутанолі (50 мл) нагрівають зі зворотним холодильником протягом ночі. Потім одержану тверду речовину відфільтровують, а фільтрат концентрують. Утворений залишок розподіляють між насиченим водним розчином хлориду натрію (40 мл) та EtOAc (100 мл). Органічну фазу відділяють, сушать, концентрують, та утворений залишок очищають хроматографією на колонці із силікагелем, елююючи сумішшю петролейний ефір:ацетон (4:1), та одержують бажаний продукт (0,64 г, вихід 47,9 %). MS (m/z): 403,1 (M+H). Підготовчий синтез 92 Трет-бутил-5-(4-аміно-2-фторфенокси)-1-метил-1H-індазол-6-ілкарбамат 15 UA 101379 C2 5 10 15 20 25 30 35 40 45 50 55 60 Вказану в заголовку сполуку одержують по суті за методикою, описаною у Підготовчому синтезі 38. MS (m/z): 373,1 (M+H). Підготовчий синтез 93 5-(5-(бензилокси)-1-(тетрагідро-2H-піран-2-іл)-1H-індазол-6-іл)піридин-2-амін До розчину 5-(бензилокси)-6-бром-1-(тетрагідро-2H-піран-2-іл)-1H-індазолу (1,5 г, 3,87 ммоль) у 1,4-діоксані (50 мл) додають 5-(4,4,5,5-тетраметил-1,3,2-діоксаборолан-2іл)піридин-2-амін (1 г, 4,54 ммоль), Pd(PPh3)4 (200 мг, 173 мкмоль) та Cs2CO3 (5 г, 10,6 ммоль). Потім одержану реакційну суміш перемішують при нагріванні зі зворотним холодильником протягом ночі, розподіляють її між EtOAc (100 мл) та насиченим водним розчином NH4Cl (50 мл). Органічну фазу відділяють, сушать, та концентрують. Утворений залишок очищають хроматографією на колонці із силікагелем, елююючи сумішшю DCM:MeOH (15:1), та одержують бажаний продукт (0,80 г, вихід 51,5 %). MS (m/z): 401,1 (M+H). Підготовчий синтез 94 Трет-бутил-5-(5-(бензилокси)-1-(тетрагідро-2H-піран-2-іл)-1H-індазол-6-іл)піридин-2-ілкарбамат До розчину 5-(5-(бензилокси)-1-(тетрагідро-2H-піран-2-іл)-1H-індазол-6-іл)піридин-2-аміну (310 мг, 774 мкмоль) у THF (20 мл) додають ди-трет-бутилдикарбонат (250 мг, 1,13 ммоль) та TEA (1 мл, 7,17 ммоль). Потім одержану реакційну суміш перемішують при кімнатній температурі протягом 3 год., розподіляють її між EtOAc (50 мл) та насиченим водним розчином NH4Cl (20 мл). Органічну фазу відділяють, сушать, та концентрують. Утворений залишок очищають хроматографією на колонці із силікагелем, елююючи сумішшю петролейний ефір:EtOAc (3:1), та одержують бажаний продукт (260 мг, вихід 67,1 %). MS (m/z): 501,2 (M+H). Підготовчий синтез 95 Трет-бутил-5-(5-гідрокси-1-(тетрагідро-2H-піран-2-іл)-1H-індазол-6-іл)піридин-2-ілкарбамат До розчину трет-бутил-5-(5-(бензилокси)-1-(тетрагідро-2H-піран-2-іл)-1H-індазол-6іл)піридин-2-ілкарбамату (260 мг, 519 мкмоль) у EtOH (25 мл) та EtOAc (25 мл) додають Pd/C (100 мг, 10 % (мас.)) в атмосфері N2. Одержану суміш знегажують вакуумуванням, після чого продувають азотом. Потім реакційну суміш перемішують при кімнатній температурі в атмосфері водню протягом 6 год. Реакційну суміш фільтрують. Фільтрат концентрують, одержуючи бажаний продукт (200 мг, вихід 93,8 %). MS (m/z): 411,1 (M+H). Підготовчий синтез 96 Трет-бутил-5-(5-(2-фтор-4-нітрофенокси)-1-(тетрагідро-2H-піран-2-іл)-1H-індазол-6іл)піридин-2-ілкарбамат Вказану в заголовку сполуку виготовляють по суті за методикою, описаною у Підготовчому синтезі 75. MS (m/z): 550,2 (M+H). Підготовчий синтез 97 Трет-бутил-5-(5-(4-аміно-2-фторфенокси)-1-(тетрагідро-2H-піран-2-іл)-1H-індазол-6іл)піридин-2-ілкарбамат Вказану в заголовку сполуку одержують по суті за методикою, описаною у Підготовчому синтезі 38. MS (m/z): 520,2 (M+H). Підготовчий синтез 98 Трет-бутил 4-(5-(2-фтор-4-нітрофенокси)-1-метил-1H-індазол-6-іл)-1H-піразол-1-карбоксилат 5-(2-фтор-4-нітрофенокси)-1-метил-6-(1H-піразол-4-іл)-1H-індазол (1,56 г, 4,42 ммоль) у DCM (15,6 мл) додають до ди-трет-бутилдикарбонату (1,09 мл, 4,83 ммоль). Одержану суміш перемішують протягом 30 хв. Рідинна хроматографія високої ефективності (РХВЕ) посвідчує завершення реакції. Розчинник видаляють під зниженим тиском. Потім додають MTBE (5 мл). Одержаний розчин охолоджують на льодо-водяній бані, та перемішують протягом 15 хв, після чого фільтрують, одержуючи вказану в заголовку сполуку у вигляді твердої речовини (0,764 г, 48,9 %). Підготовчий синтез 99 6-бром-5-(2-фтор-4-нітрофенокси)-1H-індазол У колбу місткістю 3000 мл завантажують 6-бром-5-(2-фтор-4-нітрофенокси)-2-(тетрагідро2H-піран-2-іл)-2H-індазол (250 г, 573,1 ммоль), після чого MeOH (1000 мл) та MeSO3H (112,71 мл, 1,72 моль), та витримують при 50C протягом 14 год. з розчину кристалізується тверда речовина. Потім суміш охолоджують до кімнатної температури. Одержану реакційну суміш концентрують у вакуумі при 45C досуха з утворенням твердої речовини. Одержану тверду речовину розчиняють у DCM (2000 мл), та обробляють водою (1000 мл) та 5-н. розчином NaOH (приблизно 350 мл) до досягнення pH 8-9. Органічний шар відділяють, розчинник видаляють, після чого обробляють продукт шляхом азеотропної дистиляції з толуолом, одержуючи 195,6 г жовтої твердої речовини. MS (m/z): 354,0 (M+H). 16 UA 101379 C2 5 10 15 20 25 30 35 40 45 50 55 60 Підготовчий синтез 100 6-бром-5-(2-фтор-4-нітрофенокси)-1-метил-1H-індазол У колбу місткістю 4000 мл завантажують 6-бром-5-(2-фтор-4-нітрофенокси)-1H-індазол (230 г, 653,2 ммоль), DMF (3000 мл) та K2CO3 (135,41 г, 979,78 ммоль). Одержану реакційну суміш охолоджують до 4,5C на льодяній бані. До цієї суміші додають метилйодид (92,71 г, 653,19 ммоль), та реакційну суміш витримують при перемішуванні протягом 20 хв при тій самій температурі. Реакційну суміш витримують для нагрівання до кімнатної температури, та й перемішують протягом 13 год. Хід реакції контролюють за допомогою рідинної хроматографії із мас-спектрометрією. Додають додаткову кількість метилйодиду (50 г) та NaHCO3 (33 г), та перемішують реакційну суміш при кімнатній температурі до завершення реакції. Реакційну суміш розділяють на дві порції, позначають їх (A) та (B), та кожну з них гасять водою (1 л), після чого екстрагують EtOAc (1 л), спричиняючи утворення певної кількості твердої речовини. Об'єднані тверді речовини з порцій (A) та (B) збирають вакуумним фільтруванням, одержуючи 70 г неочищеної речовини, яка містить приблизно 90 % 6-бром-5-(2-фтор-4-нітрофенокси)-1метил-1H-індазольного (який являє собою бажаний ізомер) та 8 % 6-бром-5-(2-фтор-4нітрофенокси)-2-метил-2H-індазольного ізомерів. Цю тверду речовину потім розтирають із 1000 мл DCM та 750 мл MeOH протягом ночі (приблизно 14 год.). Одержану тверду речовину збирають шляхом фільтрування, та ополіскують свіжим DCM (100 мл), одержуючи 55,5 г бажаної речовини, яку позначають (C). Маточний розчин концентрують, та позначають (D). Органічний шар з порцій (A) та (B) відділяють, та концентрують. Залишки порцій (A) та (B) об'єднують, одержуючи 185 г неочищеної оранжевої твердої речовини, та позначають її (E). Неочищену сполуку (E) розчиняють у MeOH та DCM, після чого одержаний розчин розділяють на три частини. змішують із кожною частиною розчину 600 г силікагелю, після чого суміш із силікагелем завантажують у сім порожніх картриджів місткістю по 270 г. Застосовують ® сім колонок ISCO місткістю 1,5 кг із системою розчинників, починаючи з 25 % EtOAc у гексані, потім змінюють її на 50 % EtOAc у гексані, та одержують 62 г бажаної сполуки у вигляді жовтого порошку, яку позначають (F). Після семи операцій одержують кілька змішаних фракцій 6-бром5-(2-фтор-4-нітрофенокси)-1-метил-1H-індазольного та 6-бром-5-(2-фтор-4-нітрофенокси)-2метил-2H-індазольного ізомерів. Фракції об'єднують, та змішують із маточним розчином (D) з описаної вище стадії, одержуючи 17 г суміші. Цю суміш розчиняють у MeOH та DCM, змішують із розчином 170 г діоксиду кремнію, та пропускають через колонку місткістю 1,5 кг, одержуючи 10 г бажаного продукту у вигляді жовтого порошку, який позначають (G). Загальний вихід (55,5 г (C), 62 г (F) та 10 г (G)) становить 127,5 г. Підготовчий синтез 101 Трет-бутил 4-(5-(2-фтор-4-нітрофенокси)-1-метил-1H-індазол-6-іл)-1H-піразол-1-карбоксилат У круглодонну колбу місткістю 12 л, споряджену введеною зверху мішалкою, термопарою, нагрівальним кожухом, холодильником та пристроєм для подавання азоту під поверхню, завантажують 1,4-діоксан (7,44 л) та воду (1,67 л). Одержаний розчин продувають N2 (через впускну трубку). Потім додають 6-бром-5-(2-фтор-4-нітрофенокси)-1-метил-1H-індазол (595 г, 1,63 моль), та одержаний розчин знову продувають N2. Додають трет-бутил-4-(4,4,5,5тетраметил-1,3,2-діоксаборолан-2-іл)-1H-піразол-1-карбоксилат (717,02 г, 2,44 моль), ’ триосновний N-гідрат фосфату калію (689,8 г, 3,25 моль) та 1,1 -біс (ди-третбутилфосфіно)фероцен (7,71 г, 16,25 ммоль). На закінчення додають Pd2(dba)3 (7,44 г, 8,13 ммоль). Одержаний розчин продувають протягом 15 хв, після чого нагрівають до 60C, і витримують протягом 12 год. Реакція не завершується, тому додають додаткову кількість Pd2(dba)3 (7,44 г, 8,13 ммоль). Одержаний розчин знову витримують при 60C протягом ще ® 3 год., і реакція завершується. Потім 1,4-діоксан видаляють (баня Buchi з температурою 60C), та утворений залишок знову розчиняють у 10 об'ємах (6 л) DCM. Додають воду (3 л), після чого шари розділяють. Органічний розчин сушать Na2SO4, фільтрують, та концентрують до одержання темного масла (835 г). Утворений матеріал є неочищеним та застосовується на наступній стадії. Цей матеріал містить приблизно 60 % бажаного продукту та приблизно 40 % 5(2-фтор-4-нітрофенокси)-1-метил-6-(1H-піразол-4-іл)-1H-індазолу. Неочищений матеріал знов обробляють для введення групи захисту на наступній стадії. Припускається, що 50 % неочищеного продукту становить 5-(2-фтор-4-нітрофенокси)-1-метил-6-(1H-піразол-4-іл)-1Hіндазол. У круглодонну колбу місткістю 22 л, оснащену введеною зверху мішалкою, термопарою, завантажувальною лійкою місткістю 1 л, пристроєм для барботування N 2, та охолоджувальною банею, завантажують розчин неочищеного 5-(2-фтор-4-нітрофенокси)-1-метил-6-(1H-піразол-4іл)-1H-індазолу (835 г, 1,18 моль) у DCM (6 л). У завантажувальну лійку завантажують ди-третбутилдикарбонат (283,69 г, 1,30 моль), розчинений у DCM (350 мл). Цей розчин додають 17 UA 101379 C2 5 10 15 20 25 30 35 40 45 50 55 60 краплями протягом 48 хв. Після завершення реакції DCM видаляють за допомогою роторного випарника, одержуючи темне масло. До цього темного масла додають MTBE (2,5 л), та одержаний маслянистий розчин охолоджують до приблизно 0-5C. В цей розчин вводять кристал-затравку з матеріалу, одержаного у Підготовчому синтезі 98. Після введення кристалзатравки відбувається кристалізація, і одержану суспензію перемішують протягом 30-40 хв. Блідо-жовту суспензію фільтрують через шар поліпропілену, та одержаний осад промивають холодним (0-5C) MTBE (1,5 л). Утворену тверду речовину сушать у вакуум-сушильній шафі при 40C протягом ночі, одержуючи бажаний продукт (443 г, вихід неочищеного продукту 60 %). MS (m/z): 354,0 (M+H). За даними РХВЕ продукт має чистоту приблизно 93-95 %, і тому є придатним для подальшої обробки. Підготовчий синтез 102 Трет-бутил-4-(5-(4-аміно-2-фторфенокси)-1-метил-1H-індазол-6-іл)-1H-піразол-1карбоксилат У бак місткістю 3 галони (11,35 л) завантажують трет-бутил-4-(5-(2-фтор-4-нітрофенокси)-1метил-1H-індазол-6-іл)-1H-піразол-1-карбоксилат (433,0 г, 952,8 ммоль), після чого THF (6,5 л) та Pd/C (21,65 г, 10 % Pd/C та 21,65 г, 5 % Pd/C). Одержану суміш витримують при 35C в атмосфері газоподібного водню протягом 2 год. Потім реакційну суміш охолоджують до кімнатної температури, та витримують при перемішуванні в атмосфері газоподібного водню протягом ночі, після чого витримують при 40C в атмосфері газоподібного водню протягом 7 год. Додають ще 2 г Pd/C (1 г 10 % Pd/C та 1 г 5 % Pd/C), перемішують в атмосфері газоподібного водню протягом ще 1 год., та охолоджують до кімнатної температури. Реакційну суміш знову перемішують в атмосфері газоподібного водню протягом ночі, при цьому реакція ® ® завершується. Суміш фільтрують через комбінацію фільтрувальних паперів GFF та Watman . Одержаний фільтрат концентрують, одержуючи злегка жовтувату тверду речовину (446 г, формальний вихід 110 %). Підготовчий синтез 103 Метил-2-оксо-1,2-дигідропіридин-3-карбоксилат У колбу завантажують 2-гідроксинікотинову кислоту (10 г, 72 ммоль), концентровану H2SO4 (2 мл) та MeOH (400 мл), а потім толуол (80 мл). Реакційну суміш нагрівають зі зворотним холодильником протягом ночі з уловлювачем Діна-Старка (Dean-Stark). Після охолодження до кімнатної температури суміш фільтрують, та фільтрат концентрують. Утворений залишок розчиняють у DCM (200 мл), нейтралізують насиченим водним розчином NaHCO3 до pH 7, та тричі екстрагують DCM (200 мл). Об'єднані органічні фази сушать, та концентрують, одержуючи бажаний продукт (8,2 г, вихід 74 %). MS (m/z): 153,9 (M+H). Підготовчий синтез 104 Метил-1-(4-фторфеніл)-2-оксо-1,2-дигідропіридин-3-карбоксилат До суміші метил-2-оксо-1,2-дигідропіридин-3-карбоксилату (6,0 г, 39 ммоль), 4фторфенілборної кислоти (16,3 г, 116 ммоль), ацетату міді (14 г, 78 ммоль) та піридину (12 г, 0,156 моль) у DCM (300 мл) додають молекулярне сито 4 Е (5 г). Реакційну суміш перемішують при кімнатній температурі протягом ночі на відкритому повітрі. Одержані тверді речовини відфільтровують та промивають водою, після чого фільтрат екстрагують DCM (100 мл). Органічний шар сушать MgSO4, та концентрують. Залишок очищають хроматографією на колонці із силікагелем, елююючи сумішшю петролейний ефір:DCM (градієнт від 2:1 до 0:1), одержуючи бажаний продукт (9,6 г, вихід 100 %). MS (m/z): 248,0 (M+H). Підготовчий синтез 105 Етил-2-(4-фторфеніл)гідразинкарбоксилат До розчину гідрохлориду 4-фторфенілгідразину (2 г, 12,05 ммоль) у THF (60 мл) додають DIPEA (6 мл, 34,40 ммоль), етилхлорформіат (1,2 мл, 12,55 ммоль) та 4-диметиламінопіридин (0,16 г, 1,31 ммоль). Одержану суміш перемішують при кімнатній температурі протягом 4 год. Реакційну суміш розводять водою, та екстрагують EtOAc, органічну фазу промивають насиченим водним розчином хлориду натрію, сушать Na2SO4, та концентрують. Утворений залишок очищають хроматографією на колонці із силікагелем, елююючи DCM, після чого сумішшю DCM:MeOH (80:1), та одержують вказану в заголовку сполуку (1,92 г, вихід 80,5 %). MS (m/z): 199 (M+H). Підготовчий синтез 106 1-(4-фторфеніл)-2-метилгідразин До суміші LiAlH4 (1,1 г) у THF (15 мл) додають краплями розчин етил-2-(4фторфеніл)гідразинкарбоксилату (1,9 г, 9,59 ммоль) у THF (10 мл) в атмосфері азоту на льодосольовій бані. Після завершення додавання льодяну баню видаляють, та одержану суміш витримують при 60C протягом ночі. Реакційну суміш охолоджують, та гасять водою. Утворений 18 UA 101379 C2 5 10 15 20 25 30 35 40 осад відфільтровують, та промивають EtOAc. Органічну фазу відділяють, сушать Na 2SO4, та концентрують. Утворений залишок очищають флеш-хроматографією, елююючи сумішшю петролейний ефір:EtOAc (градієнт від 80:1 до 60:1), та одержують вказану в заголовку сполуку (1 г, вихід 74 %). MS (m/z): 141 (M+H). Підготовчий синтез 107 Етил-2-(4-фторфеніл)-1,5-диметил-3-оксо-2,3-дигідро-1H-піразол-4-карбоксилат Суміш 1-(4-фторфеніл)-2-метилгідразину (0,6 г, 4,28 ммоль), діетил-2-ацетилмалонату (0,96 г, 4,75 ммоль) та оцтової кислоти (0,51 г, 8,49 ммоль) у воді (15 мл) витримують при 115C протягом 3 год. Реакційну суміш охолоджують, та двічі екстрагують EtOAc. Органічну фазу промивають насиченим водним розчином хлориду натрію, сушать Na 2SO4, та концентрують. Утворений залишок очищають хроматографією на колонці із силікагелем, елююючи сумішшю DCM:MeOH (градієнт від 150:1 до 60:1), та одержують вказану в заголовку сполуку (0,59 г, вихід 49,5 %). MS (m/z): 279 (M+H). Підготовчий синтез 108 (E)-2-(2-(4-фторфеніл)гідразоно)ацетальдегід Розчин гідрохлориду 4-фторфенілгідразину (1 г, 6 ммоль) у THF (20 мл) обробляють DIPEA (3 мл, 18 ммоль). Потім додають краплями гліоксаль (40 % у воді, 0,89 г, 6,0 ммоль) у THF (10 мл) на льодяній бані. Після завершення додавання суміш перемішують при кімнатній температурі протягом 30 хв, гасять водою, та екстрагують EtOAc. Органічну фазу промивають насиченим водним розчином хлориду натрію, сушать Na2SO4, концентрують, та одержують неочищену вказану в заголовку сполуку (0,97 г, вихід 97 %). MS (m/z): 167 (M+H). Підготовчий синтез 109 Етил-2-(4-фторфеніл)-3-оксо-2,3-дигідропіридазин-4-карбоксилат Неочищений (E)-2-(2-(4-фторфеніл)гідразоно)ацетальдегід (0,97 г, 5,8 ммоль) розчиняють у EtOH (50 мл), та додають діетилмалонат (0,93 г, 5,8 ммоль) та піперидин (0,2 мл, 2,0 ммоль). Одержану суміш нагрівають зі зворотним холодильником протягом ночі. Потім реакційну суміш охолоджують, та концентрують. Утворений залишок розчиняють водою, та двічі екстрагують EtOAc. Об'єднані органічні екстракти сушать Na2SO4, та концентрують. Утворений залишок очищають хроматографією на колонці із силікагелем, елююючи сумішшю петролейний ефір:EtOAc (градієнт від 3:1 до 1:1), та одержують вказану в заголовку сполуку (0,26 г, вихід 17 % за дві стадії) MS (m/z): 263 (M+H). Підготовчий синтез 110 Метил-3-(4-фторфеніламіно)-3-оксопропаноат До розчину 4-фтораніліну (4,4 мл, 45 ммоль) в ацетоні додають TEA (8,5 мл, 67 ммоль) та метилмалонілхлорид (7,2 мл, 67 ммоль). Одержану суміш перемішують при кімнатній температурі протягом 5 год., після чого концентрують. Додають воду (20 мл), після чого утворений залишок підкислюють концентрованою HCl до pH 3. Утворений осад збирають шляхом фільтрування, та промивають петролейним ефіром, одержуючи бажаний продукт (14,1 г, вихід 100 %). MS (m/z): 212,1 (M+H). Вказані нижче сполуки одержують по суті за методикою, описаною у Підготовчому синтезі 110: Підг. Хімічна назва синт. № 111 Етил-3-оксо-3-(феніламіно)пропаноат 112 Етил-3-(4-фторфеніламіно)-3-оксопропаноат 45 50 Фізичні дані MS (m/z) (M+H) 208 226,1 Підготовчий синтез 113 Етил-1-(4-фторфеніл)-6-метил-2-оксо-1,2-дигідропіридин-3-карбоксилат До розчину метил-3-(4-фторфеніламіно)-3-оксопропаноату (10,1 г, 48 ммоль) в EtOH (100 мл) додають транс-4-метокси-3-бутен-2-он (5,7 г, 57 ммоль) та CH3ONa (3,1 г, 57 ммоль). Одержану суміш нагрівають зі зворотним холодильником протягом ночі, після чого концентрують. Утворений залишок очищають хроматографією на колонці із силікагелем, елююючи сумішшю петролейний ефір:EtOAC (градієнт від 5:1 до 2:1), та одержують бажаний продукт (2,1 г, вихід 16 %). MS (m/z): 276,1 (M+H). Вказані нижче сполуки одержують по суті за методикою, описаною у Підготовчому синтезі 113: 19 UA 101379 C2 Підг. синт. № 114 115 5 10 15 20 25 30 35 40 45 50 Хімічна назва Етил-1-(4-фторфеніл)-5-метил-2-оксо-1,2-дигідропіридин-3карбоксилат Етил-5-метил-2-оксо-1-феніл-1,2-дигідропіридин-3-карбоксилат Фізичні дані MS(m/z) (M+H) 276,1 258,1 Підготовчий синтез 116 (Z)-4-амінопент-3-ен-2-он До розчину 2,4-пентандіону (20,0 г, 0,2 моль) у воді (20 мл) додають краплями 25 % водний розчин аміаку (13,2 мл, 0,2 моль) при кімнатній температурі. Одержану суміш перемішують при кімнатній температурі протягом 2 год. Потім розчинник видаляють, одержуючи бажаний продукт 1 (20,0 г, вихід 100 %) у вигляді твердої речовини. H ЯМР (ацетон-d6, 300 МГц): 1,88 (s, 3H), 1,88 (s, 3H), 2,8 (br s, 1H), 6,54 (br s, 1H), 9,7 (br s, 1H). Підготовчий синтез 117 Етил-4,6-диметил-2-оксо-1,2-дигідропіридин-3-карбоксилат Розчин (Z)-4-амінопент-3-ен-2-ону (20,0 г, 0,2 моль) у безводному THF (20 мл) додають до розчину етилціаноацетату (22,6 г, 0,2 моль) та TEA (20,2 г, 0,2 моль) у безводному THF (200 мл). Реакційну суміш нагрівають зі зворотним холодильником протягом 56 год., після чого концентрують. Утворений залишок витримують при кімнатній температурі протягом 5 год., та утворений осад відфільтровують, промивають EtOAc, та одержують вказану в заголовку сполуку (7,3 г, вихід 19,9 %). MS (m/z): 196,0 (M+H). Підготовчий синтез 118 Етил-1-(4-фторфеніл)-4,6-диметил-2-оксо-1,2-дигідропіридин-3-карбоксилат Суспензію етил-4,6-диметил-2-оксо-1,2-дигідропіридин-3-карбоксилату (5,0 г, 0,025 моль), 4фторфенілборної кислоти (10,7 г, 0,077 моль), ацетату міді (1,33 г, 0,007 моль), піридину (6,86 мл) та молекулярного сита 4 Е (5,0 г) у 1,4-діоксані (80 мл) витримують при 80C протягом 68 год. Одержані тверді речовини відфільтровують, та фільтрат концентрують. Утворений залишок розподіляють між EtOAc (50 мл) та 2-н. розчином HCl (70 мл). Осаджену тверду речовину збирають шляхом фільтрування, та промивають EtOAc, одержуючи вказаний у заголовку продукт (1,2 г). Відфільтрований розчин в EtOAc відділяють, сушать та концентрують. Залишок очищають хроматографією на колонці із силікагелем, елююючи сумішшю петролейний простий ефір:EtOAc:MeOH (40:20:1), та одержують ще одну порцію продукту (0,12 г), (загалом 1,32 г, вихід 17,8 %). MS (m/z): 290,1 (M+H). Підготовчий синтез 119 Етил-4,6-диметил-2-оксо-1-феніл-1,2-дигідропіридин-3-карбоксилат Суспензію етил-4,6-диметил-2-оксо-1,2-дигідропіридин-3-карбоксилату (7,5 г, 0,038 моль), фенілборної кислоти (14,1 г, 0,115 моль), ацетату міді (1,38 г, 0,008 моль), піридину (7,5 мл) у 1,4-діоксані (80 мл) витримують при 80C протягом 96 год. Одержану тверду речовину відфільтровують, а фільтрат концентрують. Утворений залишок розподіляють між EtOAc (50 мл) та 2-н. розчином HCl (70 мл), осад збирають шляхом фільтрування, та промивають EtOAc, одержуючи вказаний у заголовку продукт (2,95 г). розчин в EtOAc відділяють, сушать, та концентрують. Утворений залишок очищають хроматографією на колонці із силікагелем, елююючи сумішшю петролейний ефір:ацетон (2:1), та одержують ще одну порцію продукту (0,3 г). (3,25 г, вихід 31,2 %). MS (m/z): 272,0 (M+H). Підготовчий синтез 120 Етил-5-(бромметил)-2-(4-фторфеніл)-1-метил-3-оксо-2,3-дигідро-1H-піразол-4-карбоксилат До розчину етил-2-(4-фторфеніл)-1,5-диметил-3-оксо-2,3-дигідро-1H-піразол-4-карбоксилату (1,2 г, 4,3 ммоль) та азобісізобутиронітрилу (AIBN) (0,09 г, 0,06 ммоль) у DCM трьома порціями додають N-бромсукцинімід (NBS) (0,9 г, 4,3 ммоль) при кімнатній температурі. Одержану реакційну суміш перемішують при кімнатній температурі протягом ночі. Цю суміш концентрують, та утворений залишок очищають хроматографією на колонці із силікагелем, елююючи сумішшю петролейний ефір:EtOAc (4:1), та одержують бажаний продукт у вигляді білої твердої речовини (1,3 г, вихід 84 %). MS (m/z) 357,0 (M+H). Підготовчий синтез 121 Етил-5-((1H-піразол-1-іл)метил)-2-(4-фторфеніл)-1-метил-3-оксо-2,3-дигідро-1H-піразол-4карбоксилат До розчину етил-5-(бромметил)-2-(4-фторфеніл)-1-метил-3-оксо-2,3-дигідро-1H-піразол-4карбоксилату (1,3 г, 3,6 ммоль) та 1H-піразолу (0,25 г, 3,6 ммоль) у THF (50 мл) та H2O (1 мл), 20 UA 101379 C2 5 охолодженого на льодо-водяній бані, трьома порціями додають твердий KOH (0,2 г, 3,6 ммоль). Одержану реакційну суміш перемішують при кімнатній температурі протягом ночі, після чого розчинник видаляють. Утворений залишок очищають хроматографією на колонці із силікагелем, елююючи сумішшю петролейний ефір:EtOAc (4:1), та одержують бажаний продукт (0,87 г, вихід 70 %). MS (m/z): 345,1 (M+H). Вказані нижче сполуки одержують по суті за методикою, описаною у Підготовчому синтезі 121: Підг. синт. № 122 123 10 15 20 25 30 35 40 45 50 Хімічна назва Етил-2-(4-фторфеніл)-1-метил-5-(морфолінометил)-3-оксо-2,3дигідро-1H-піразол-4-карбоксилат Етил-2-(4-фторфеніл)-1-метил-3-оксо-5-(піперидин-1-ілметил)-2,3дигідро-1H-піразол-4-карбоксилат Фізичні дані MS(m/z) (M+H) 364,1 362,1 Підготовчий синтез 124 Етил-1-(4-фторфеніл)-5-(морфолінометил)-2-оксо-1,2-дигідропіридин-3-карбоксилат Суміш етил-1-(4-фторфеніл)-5-метил-2-оксо-1,2-дигідропіридин-3-карбоксилату (0,275 г, 1 ммоль), NBS (0,2 г, 1,1 ммоль), AIBN (40 мг, 0,2 ммоль) у CCl4 (20 мл) нагрівають зі зворотним холодильником протягом 3 год. Реакційну суміш охолоджують, після чого додають морфолін (0,088 мл, 1 ммоль) та K2CO3 (0,14 г, 1 ммоль). Реакційну суміш перемішують при кімнатній температурі протягом ще 2 год. Розчинник видаляють, утворений залишок розчиняють водою (10 мл), та двічі екстрагують EtOAc (20 мл). Об'єднані органічні фази промивають насиченим водним розчином хлориду натрію, сушать, та концентрують. Утворений залишок очищають хроматографією на колонці із силікагелем, елююючи сумішшю DCM:MeOH (градієнт від 100:1 до 50:1, із вмістом 0,5 % 2-н. NH3 у MeOH), та одержують вказану в заголовку сполуку (0,17 г, вихід 47 %). MS (m/z): 361,1 (M+H). Підготовчий синтез 125 Етил-2-(4-фторфенілкарбамоїл)-3-метилбут-2-еноат До розчину 4-фтораніліну (2 г, 18 ммоль) у діетилізопропіліденмалонаті (10 г, 50 ммоль) додають 1H-імідазол (0,25 г, 3,67 ммоль). Одержану реакційну суміш перемішують при 200C в атмосфері N2 протягом 3 год. Реакційну суміш охолоджують, після чого додають силікагель. Одержану суміш завантажують у колонку із силікагелем, та елююють спочатку петролейним ефіром, а потім сумішшю петролейний ефір:EtOAc (3:1), одержуючи бажаний продукт (1,85 г, вихід 39 %). MS (m/z): 266,1 (M+H). Підготовчий синтез 126 Етил-1-(4-фторфеніл)-4-метил-2-оксо-1,2-дигідропіридин-3-карбоксилат Суміш етил-2-(4-фторфенілкарбамоїл)-3-метилбут-2-еноату (1,85 г, 6,97 ммоль) та диметилацеталю N, N-диметилформаміду (5 мл, 37,45 ммоль) перемішують при 90C протягом 90 хв. Реакційну суміш охолоджують, після чого додають EtOAc (30 мл) та насичений розчин NH4Cl (20 мл). Органічну фазу відділяють, сушать, та концентрують. Утворений залишок очищають хроматографією на колонці із силікагелем, елююючи сумішшю DCM:MeOH (10:1). Фракції, які містять продукт, концентрують, та утворений залишок змішують із діетиловим ефіром, одержуючи 1,2 г жовтої твердої речовини, яку відділяють фільтруванням та викидають. Фільтрат концентрують, знову очищають хроматографією на колонці із силікагелем, елююючи сумішшю DCM:MeOH (20:1), та одержують бажаний продукт (500 мг, вихід 26 %). MS (m/z): 276,1 (M+H). Підготовчий синтез 127 Етил-2-(4-фторфеніл)-6-метил-3-оксо-2,3-дигідропіридазин-4-карбоксилат До суспензії 1-трифенілфосфораніліден-2-пропанону (3,18 г, 9,99 ммоль) у THF (50 мл) додають діетилкетомалонат (1,74 г, 9,99 ммоль). Одержану суміш перемішують при кімнатній температурі протягом 30 хв, одержуючи прозорий розчин. Потім цей розчин додають до розчину гідрохлориду 4-фторфенілгідразину (1,62 г, 9,96 ммоль) у суміші EtOH:H2O (30 мл:30 мл). Одержану суміш нагрівають зі зворотним холодильником протягом 1 год., після чого додають TEA (3 мл), та одержану суміш перемішують при нагріванні зі зворотним холодильником протягом ще 1 год. Потім її концентрують, та утворений залишок розподіляють між насиченим водним розчином NH4Cl (30 мл) та EtOAc (30 мл). Органічну фазу відділяють, сушать та концентрують. Утворений залишок очищають хроматографією на колонці із силікагелем, елююючи сумішшю петролейний ефір:EtOAc (3:1), та одержують бажаний продукт (1,20 г, вихід 43 %). MS (m/z): 277,1 (M+H). 21 UA 101379 C2 5 10 Підготовчий синтез 128 1-(4-фторфеніл)-2-оксо-1,2-дигідропіридин-3-карбонова кислота До розчину метил-1-(4-фторфеніл)-2-оксо-1,2-дигідропіридин-3-карбоксилату (10,0 г, 0,04 моль) у MeOH (150 мл) та воді (50 мл) додають LiOH (1,9 г, 0,08 моль). Одержану реакційну суміш перемішують при кімнатній температурі протягом 0,5 год. Більшу частину MeOH видаляють, після чого одержану суміш підкислюють концентрованим водним розчином HCl до утворення білого твердого осаду. Цю тверду речовину збирають шляхом фільтрування, та промивають водою (5 мл), одержуючи бажаний продукт (8,7 г, вихід 93 %). MS (m/z): 234,0 (M+H). Вказані нижче сполуки одержують по суті за методикою, описаною у Підготовчому синтезі 128: Підг. синт. № 129 130 131 132 133 134 * 135 ** 136 137 138 139 140 ** 141 Хімічна назва 2-(4-фторфеніл)-1,5-диметил-3-оксо-2,3-дигідро-1H-піразол-4карбонова кислота 2-(4-фторфеніл)-3-оксо-2,3-дигідропіридазин-4-карбонова кислота 1-(4-фторфеніл)-6-метил-2-оксо-1,2-дигідропіридин-3-карбонова кислота 1-(4-фторфеніл)-4,6-диметил-2-оксо-1,2-дигідро-піридин-3карбонова кислота 4,6-диметил-2-оксо-1-феніл-1,2-дигідропіридин-3-карбонова кислота 5-((1H-піразол-1-іл)метил)-2-(4-фторфеніл)-1-метил-3-оксо-2,3дигідро-1H-піразол-4-карбонова кислота 2-(4-фторфеніл)-1-метил-5-(морфолінометил)-3-оксо-2,3-дигідро1H-піразол-4-карбонова кислота 2-(4-фторфеніл)-1-метил-3-оксо-5-(піперидин-1-ілметил)-2,3дигідро-1H-піразол-4-карбонова кислота 1-(4-фторфеніл)-5-метил-2-оксо-1,2-дигідропіридин-3-карбонова кислота 5-метил-2-оксо-1-феніл-1,2-дигідропіридин-3-карбонова кислота 1-(4-фторфеніл)-5-(морфолінометил)-2-оксо-1,2-дигідропіридин-3карбонова кислота 1-(4-фторфеніл)-4-метил-2-оксо-1,2-дигідропіридин-3-карбонова кислота 2-(4-фторфеніл)-6-метил-3-оксо-2,3-дигідропіридазин-4-карбонова кислота Фізичні дані MS(m/z) (M+H) 251 235 248,1 244,0 336,1 334,1 248,0 230,1 333,1 248,1 249,0 *: як основу застосовують KOH. **: як основу застосовують NaOH. 15 20 25 30 Підготовчий синтез 142 6-метил-2-оксо-1-феніл-1,2-дигідропіридин-3-карбонова кислота До розчину етилату натрію у EtOH (одержаного з натрію (0,5 г, 21,75 ммоль), розчиненого у EtOH (40 мл)) додають етил-3-оксо-3-(феніламіно)пропаноат (4 г, 19,30 ммоль) та транс-4метокси-3-бутен-2-он (2 г, 19,98 ммоль). Реакційну суміш перемішують при нагріванні зі зворотним холодильником протягом ночі, після чого суміш концентрують. Утворений залишок розподіляють між H2O (50 мл) та EtOAc (50 мл). Водний шар підкислюють концентрованою HCl до pH 3~4, після чого його екстрагують EtOAc. Органічні екстракти сушать, та концентрують. Утворений залишок очищають хроматографією на колонці із силікагелем, елююючи сумішшю DCM:MeOH (25:1), та одержують бажаний продукт (1,20 г, вихід 27 %). MS (m/z): 230,0 (M+H). Підготовчий синтез 143 1,5-диметил-3-оксо-2-феніл-2,3-дигідро-1H-піразол-4-карбонова кислота До суміші 1,5-диметил-3-оксо-2-феніл-2,3-дигідро-1H-піразол-4-карбальдегіду (2 г, 9,25 ммоль) у воді (100 мл) при 75C повільно додають розчин KMnO4 (1,5 г, 9,49 ммоль) у воді (200 мл). Після завершення додавання реакційну суміш перемішують при 75C протягом ще 1 год. Додають твердий KOH для надання одержаному розчину лужного характеру, та одержану суміш фільтрують гарячою. До фільтрату додають EtOH (10 мл) та EtOAc (50 мл). Органічну 22 UA 101379 C2 5 10 15 20 25 30 фазу відділяють, та викидають. Водну фазу підкислюють концентрованою HCl до pH 5, та екстрагують EtOAc (60 мл) та DCM (60 мл). Органічні фази об'єднують, сушать, та концентрують, одержуючи вказаний у заголовку продукт (1,9 г, вихід 88,46 %). MS (m/z): 233,1 (M+H). Підготовчий синтез 144 Етил-3-(4-фторфеніламіно)-3-оксопропаноат У 4-горлу круглодонну колбу місткістю 10 л завантажують DCM (5000 мл), 4-фторанілін (111 г, 1,0 моль) та TEA (166 мл, 1,2 моль). Додають краплями етилмалонілхлорид (196 г, 1,3 моль) у DCM (500 мл) в атмосфері N2 при 0-5C (на льодяній бані) протягом 4 год. Після завершення додавання одержану суміш перемішують протягом 30 хв при тій самій температурі. До суміші при перемішуванні додають воду (2 л) при тій самій температурі. Органічну фазу промивають насиченим NaHCO3, насиченим водним розчином хлориду натрію, та сушать безводним Na2SO4. Водну фазу екстрагують EtOAc (21 л). Органічну фазу промивають насиченим водним розчином хлориду натрію, та сушать безводним Na 2SO4. Фільтрують, після чого об'єднаний органічний розчинник концентрують досуха під зниженим тиском. Залишок промивають петролейним простим ефіром (1 л), одержуючи етил-3-(4-фторфеніламіно)-3оксопропаноат (230 г, вихід неочищеного продукту 102 %) у вигляді жовтої твердої речовини. MS (m/z): 226,1 (M+H). Підготовчий синтез 145 1-(4-фторфеніл)-6-метил-2-оксо-1,2-дигідропіридин-3-карбонова кислота У 4-горлу круглодонну колбу місткістю 3 л завантажують EtOH (1500 мл), етил-3-(4фторфеніламіно)-3-оксопропаноат (139 г, 617 ммоль), етилат натрію (65,6 г, 925 ммоль) та 4метокси-3-бутен-2-он (103 г, 925 ммоль). Суміш нагрівають зі зворотним холодильником протягом 3 год. Одержаний розчин охолоджують до кімнатної температури, після чого реакційну суміш концентрують під зниженим тиском для видалення EtOH. Утворений залишок розчиняють у DCM (700 мл) та 1 M HCl (1500 мл). Водну фазу екстрагують DCM (3500 мл). Об'єднані органічні екстракти промивають насиченим водним розчином хлориду натрію (1000 мл), сушать безводним Na2SO4, та концентрують під зниженим тиском. Утворений залишок розтирають з EtOAc (150 мл) при кімнатній температурі (10-15C) протягом 1 год. Після фільтрування та промивання EtOAc (50 мл) одержують 1-(4-фторфеніл)-6-метил-2-оксо-1,2-дигідропіридин-3карбонову кислоту у вигляді жовтої твердої речовини (85,3 г, вихід 56 %). MS (m/z): 248 (M+H). Приклад 1 N-(3-фтор-4-(1-метил-6-(1H-піразол-4-іл)-1H-індазол-5-ілокси)феніл)-1-(4-фторфеніл)-6метил-2-оксо-1,2-дигідропіридин-3-карбоксамід F N O O N N N H 35 40 45 N H O N F У круглодонну колбу місткістю 100 мл завантажують трет-бутил-4-(5-(4-аміно-2фторфенокси)-1-метил-1H-індазол-6-іл)-1H-піразол-1-карбоксилат (1,43 г, 3,38 ммоль), 1-(4фторфеніл)-6-метил-2-оксо-1,2-дигідропіридин-3-карбонову кислоту (1,25 г, 5,07 ммоль), EDCI (1,48 г, 7,6 ммоль) та HOBt (776 мг, 5,07 ммоль), після чого DMF (15 мл, 193,99 ммоль) і потім DIPEA (1,47 мл, 8,44 ммоль). Одержану суміш витримують при перемішуванні при кімнатній температурі протягом ночі. Потім реакційну суміш розчиняють у EtOAc (300 мл), та промивають насиченим водним розчином хлориду натрію (5100 мл). Об'єднані водні розчини екстрагують EtOAc (1100 мл), після чого об'єднані органічні розчини сушать Na 2SO4, фільтрують, та концентрують досуха. Одержану тверду речовину очищають на колонці із силікагелем, елююючи DCM (A) та 10 % розчином MeOH у DCM (B), градієнт від 100 % (A) до 80 % (A):20 % (B) протягом 70 хв, та одержують трет-бутил-4-(5-(2-фтор-4-(1-(4-фторфеніл)-6-метил-2-оксо1,2-дигідропіридин-3-карбоксамідо)фенокси)-1-метил-1H-індазол-6-іл)-1H-піразол-1-карбоксилат у вигляді яскраво-жовтої твердої речовини (2,20 г, вихід 87 %). MS (m/z): 653. (M+H), 675 (M+Na). 23 UA 101379 C2 5 10 15 У круглодонну колбу завантажують трет-бутил-4-(5-(2-фтор-4-(1-(4-фторфеніл)-6-метил-2оксо-1,2-дигідропіридин-3-карбоксамідо)фенокси)-1-метил-1H-індазол-6-іл)-1H-піразол-1карбоксилат (1,92 г, 2,94 ммоль) та DCM (50 мл), після чого триетилсилан (1,88 мл, 11,77 ммоль) та TFA (17,8 мл, 235,35 ммоль). Одержану реакційну суміш витримують при перемішуванні при кімнатній температурі протягом 1,5 год. Розчинник видаляють, розводять залишок у DCM (150 мл), та промивають насиченим водним розчином NaHCO 3 (2100 мл). Органічний розчин сушать Na2SO4, та концентрують під зниженим тиском, одержуючи тверду речовину. Цю тверду речовину очищають на колонці із силікагелем, елююючи DCM (A) та 10 % розчином MeOH у DCM (B), градієнт від 100 % (A) до 75 %(A):25 %(B) протягом 70 хв, підтримуючи це співвідношення 75:25 протягом 15 хв, та одержують вказану в заголовку сполуку у вигляді злегка забарвленої твердої речовини. Цю тверду речовину розчиняють у гарячому EtOH (50 мл), після чого äîäàþòü порціями дистильовану воду (250 мл), спричиняючи осадження білої твердої речовини. Цю тверду речовину відфільтровують через фільтрувальну лійку Бюхнера, та промивають дистильованою водою (315 мл), сушать на повітрі та у вакуумі при 60C протягом 15 год., одержуючи вказану в заголовку сполуку у вигляді злегка забарвленої твердої речовини (1,27 г, вихід 78 %). MS (m/z): 552,8 (M+H). Приклад 2 N-(3-фтор-4-(1-метил-6-(1H-піразол-4-іл)-1H-індазол-5-ілокси)феніл)-1-(4-фторфеніл)-6метил-2-оксо-1,2-дигідропіридин-3-карбоксамід F N O O N N N H 20 25 30 35 40 45 N H O N F Круглодонну колбу місткістю 12 л споряджають введеною зверху мішалкою, термопарою, та пристроєм для барботування N2. Трет-бутил-4-(5-(4-аміно-2-фторфенокси)-1-метил-1H-індазол6-іл)-1H-піразол-1-карбоксилат (404 г, 954,08 ммоль) розчиняють у DMF (2 л), та завантажують у згадану колбу. Для промивання колби застосовують DMF (1 л). Додають 1-(4-фторфеніл)-6метил-2-оксо-1,2-дигідропіридин-3-карбонову кислоту (259,46 г, 1,05 моль) та EDCI (228,63 г, 1,19 моль), та промивають колбу DMF (500 мл). Потім додають HOBt (189,94 г, 1,24 моль), та знову промивають колбу DMF (500 мл). Нарешті, повільно додають DIPEA (184,97 г, 1,43 моль). Потім одержаний темний розчин перемішують при кімнатній температурі протягом уїкенду. У реактор із нижнім випуском місткістю 20 л завантажують деіонізовану воду (3 л) та DCM (5 л). Реакційну суміш виливають у реактор, та промивають DCM (1 л). Органічний шар відділяють, промивають деіонізованою водою (33 л), сушать Na2SO4, фільтрують, промивають твердий осад DCM, та концентрують фільтрат. До одержаного залишку додають EtOAc (2 л), та перемішують одержаний розчин протягом 1 год. Продукт кристалізується. Суміш концентрують. Додають ще одну порцію EtOAc (2 л), та концентрують для видалення всього DCM. До залишку додають EtOAc (650 мл) та MTBE (3 л), та одержаний розчин перемішують на льодяній бані протягом 1 год. Жовтувато-коричневу суспензію фільтрують, застосовуючи поліпропіленовий фільтр. Одержаний осад промивають MTBE (2500 мл). Світлу жовтувато-коричневу тверду речовину сушать протягом ночі у вакуум-сушильній шафі при 40C, одержуючи неочищений продукт (553 г). Неочищений продукт очищають хроматографією на колонці із силікагелем, елююючи сумішшю (50 % EtOAc (50 %):35 % DCM (35 %):н-гептан (15 %)), та одержують очищений бажаний продукт – трет-бутил-4-(5-(2-фтор-4-(1-(4-фторфеніл)-6-метил-2-оксо-1,2дигідропіридин-3-карбоксамідо)фенокси)-1-метил-1H-індазол-6-іл)-1H-піразол-1-карбоксилат (424 г, 68 %). MS (m/z): 651,0 (M-H). Трет-бутил-4-(5-(2-фтор-4-(1-(4-фторфеніл)-6-метил-2-оксо-1,2-дигідропіридин-3карбоксамідо)фенокси)-1-метил-1H-індазол-6-іл)-1H-піразол-1-карбоксилат (423,9 г, 649,50 ммоль) розчиняють у DCM (4,24 л). Додають розчин HCl у MeOH (5,74-н., 799,99 мл, 4,59 моль), та одержаний розчин витримують при 30C протягом 1 год. Потім реакційну суміш нагрівають до 45C, та додають DCM (1,5 л). Через 2 год. одержаний розчин нагрівають до 50C, та додають DCM (2 л). Через 3 год. додають DCM (2 л), після чого розчин HCl у MeOH 24 UA 101379 C2 5 10 15 20 25 30 35 40 45 50 55 60 (4,5-н., 721,67 мл, 3,25 моль). Через 45 хв додають DCM (1 л), розчин HCl у MeOH (4,5-н., 288,67 мл, 1,30 моль) та MeOH (1,5 л). Потім реакційний розчин нагрівають до 60C. Через 4 год. додають MeOH (2 л), та ще через 10 хв додають DCM (1 л), після чого – розчин HCl у MeOH (4,5-н., 200 мл). Через 5 год. реакція завершується. Одержану реакційну суміш концентрують до приблизно 1/3 об'єму. Додають MeOH (2 л), та одержаний розчин концентрують до утворення густої суспензії. Знову додають MeOH (2 л), та одержану суміш концентрують до густої суспензії. Цю суспензію охолоджують до приблизно 10-15C, після чого фільтрують. Одержану тверду речовину промивають MeOH. Потім цю тверду речовину вміщують у вакуум-сушильну шафу, та витримують при 55C протягом 2 діб, одержуючи бажаний продукт – гідрохлорид N-(3-фтор-4-(1-метил-6-(1H-піразол-4-іл)-1H-індазол-5ілокси)феніл)-1-(4-фторфеніл)-6-метил-2-оксо-1,2-дигідропіридин-3-карбоксаміду (377 г, 92,8 %). MS (m/z): 551,0 (M-H). У круглодонну колбу місткістю 22 л, споряджену механічною мішалкою, завантажують в атмосфері азоту гідрохлорид N-(3-фтор-4-(1-метил-6-(1H-піразол-4-іл)-1H-індазол-5ілокси)феніл)-1-(4-фторфеніл)-6-метил-2-оксо-1,2-дигідропіридин-3-карбоксаміду (367 г, 0,62 моль), після чого завантажують DCM (7,34 л) та воду (7,34 л). Додають Na2CO3 (181,6 г, 1,71 моль), та одержану суміш перемішують при кімнатній температурі протягом 30 хв. Вимірюють pH, та доводять його до приблизно 9,4. Суміш фільтрують через поліпропілен. Одержану тверду речовину збирають, та завантажують у круглодонну колбу місткістю 5 л. Додають 20 % розчин води в MeOH (2,6 л), та одержану суспензію перемішують протягом 30 хв. Суспензію фільтрують, та одержану тверду речовину промивають 20 % розчином води в MeOH (600 мл). Тверду речовину витримують у вакуум-сушильній шафі при 35C протягом ночі. Перше зважування дає результат 394 г (теоретичний вихід 324,8 г, реальний вихід приблизно 121 % (мас.)). TGA (термогравіметричний аналіз) та DSC (диференціальна сканувальна калориметрія) показують вміст приблизно 17 % (мас.) вільної води та втрату 10-11 % (мас.) летких речовин при плавленні. Цю тверду речовину сушать при 55C у вакуум-сушильній шафі з продуванням N2 протягом 3,5 год. (354,7 г, реальний вихід приблизно 109 % (мас.), ЯМР посвідчує присутність приблизно 9,3 % (мас.) DCM). За даними TGA/DSC вільна вода відсутня. Цей продукт передають на подрібнення. TM Струменевий млин (Aljet 0101) у рукавичному боксі змонтований всередині вхідного кожуха та підключений до лінії подачі азоту та збірника місткістю 100 фунтів (45 кг). У млин введене вхідне ежекторне сопло, відрегульоване на максимальну швидкість подавання та максимальний потік азоту. Показники тиску становлять 90 фунтів на кв. дюйм (620 кПа) на ежекторному соплі та 85 фунтів на кв. дюйм (586 кПа) на обох робочих соплах. Вихідний матеріал (353,4 г) повільно подають у млин, в разі необхідності припиняючи подавання для випорожнювання приймального патрубка. Загальна тривалість подрібнення становить 22 хв 25 с. Обчислена швидкість подавання становить 15,8 г/хв (353,4 г, поділені на 22,42 хв). Одержують подрібнений матеріал (335,7 г, 95 %), втрати становлять 17,7 г. Гранулометричний аналіз дає значення d90 подрібненого матеріалу 4,6 мкм. TGA/DSC показує присутність приблизно 11,4 % (мас.) летких речовин при плавленні, а ЯМР 1 (DMSO) показує присутність приблизно 9,3 % (мас.) DCM. H ЯМР (DMSO) 12,94 (br s, 1 H), 11,88 (s, 1H), 8,44 (d, J=7,47 Гц, 1H), 8,12 (br s, 1H), 8,00 (br s, 1 H), 7,96 (s, 1 H), 7,94 (d, J=2,2 Гц, 1H), 7,91 (d, J=2,6 Гц, 1H), 7,87 (s, 1H), 7,47-7,37 (m, 5 H), 6,82 (t, J=9,26 Гц, J=8,82 Гц, 1H), 6,65 (d, J=7,49 Гц, 1H), 4,04 (s, 3H), 2,03 (s, 3H). LC/MS: (M+H) 553,1. Одержання безводної кристалічної форми У флаконі місткістю 20 мл до 10 мл EtOH додають 120 мг вищезгаданої сполуки. Нагрівають пробу до 70C при перемішуванні. Спочатку тверда речовина починає розчинятися, а потім утворюється суспензія, а згодом білий осад. Охолоджують пробу до кімнатної температури при перемішуванні. Відбирають невелику кількість суспензії за допомогою піпетки та залишають для висушування на повітрі. Цей матеріал має високий ступінь кристалічності та ідентифікований методом TGA як етанольний сольват. До залишку суспензії додають 10 мл гептану, і нагрівають до кипіння. Температура суспензії за даними вимірювання дорівнює 70,8C доти, доки об'єм суспензії не зменшиться до 10 мл. Як тільки температура починає зростати, нагріванняприпиняють, і суспензію перемішують при кімнатній температурі протягом ночі. Тверду речовину відділяють фільтруванням під вакуумом, і сушать у вакуумній шафі при 45C протягом 3 год.; вихід продукту становить 77 %. Кристалічна форма характеризується втратою маси 0,17 % при TGA в діапазоні 25-238C. Початок плавлення форми при 247,8C. Приклад 3 Метансульфонат N-(3-фтор-4-(1-метил-6-(1H-піразол-4-іл)-1H-індазол-5-ілокси) феніл)-1-(4фторфеніл)-4, 6-диметил-2-оксо-1,2-дигідропіридин-3-карбоксаміду 25 UA 101379 C2 O F N H O N N 5 10 15 20 N O O S OH F O До розчину 3-фтор-4-(1-метил-6-(1H-піразол-4-іл)-1H-індазол-5-ілоксі)аніліну (300 мг, 927,8 мкмоль) та 1-(4-фторфеніл)-4,6-диметил-2-оксо-1,2-дигідропіридин-3-карбонової кислоти (300 мг, 1,15 ммоль) у DMF (5 мл) додають HOBt (130 мг, 0,962 ммоль), EDCI (180 мг, 0,939 ммоль) та N-метилморфолін (0,5 мл). Одержану реакційну суміш перемішують при 60C протягом ночі, після чого її розподіляють між EtOAc (50 мл) та насиченим водним розчином NH4Cl (30 мл). Органічну фазу відділяють, сушать, та концентрують. Залишок розтирають з EtOAc (5 мл), та утворену тверду речовину збирають шляхом фільтрування, одержуючи бажаний продукт – N-(3-фтор-4-(1-метил-6-(1H-піразол-4-іл)-1H-індазол-5-ілокси)феніл)-1-(4фторфеніл)-4,6-диметил-2-оксо-1,2-дигідропіридин-3-карбоксамід (230 мг, вихід 43,7 %). MS (m/z): 567,2 (M+H). До розчину N-(3-фтор-4-(1-метил-6-(1H-піразол-4-іл)-1H-індазол-5-ілокси)феніл)-1-(4фторфеніл)-4,6-диметил-2-оксо-1,2-дигідропіридин-3-карбоксаміду (230 мг, 0,406 ммоль) у ацетоні (10 мл) додають MeSO3H (39 мг, 0,406 ммоль). Реакційну суміш перемішують при кімнатній температурі протягом 0,5 год., після чого її концентрують. Залишок промивають діетиловим ефіром, та сушать, одержуючи метансульфонат N-(3-фтор-4-(1-метил-6-(1Hпіразол-4-іл)-1H-індазол-5-ілокси)феніл)-1-(4-фторфеніл)-4,6-диметил-2-оксо-1,2дигідропіридин-3-карбоксаміду (250 мг, вихід 92,9 %.) MS (m/z): 567,2 (M+H). Перелічені нижче сполуки одержують по суті за методикою Прикладу 3, за винятком того, що у окремих випадках утворюється вільна основа, а не сіль: N N H Прикл. № Хімічна назва 4 метансульфонат 1-(4-фторфеніл)-6метил-N-(4-(1-метил-6-(1H-піразол4-іл)-1H-індазол-5-ілокси)феніл)-2оксо-1,2-дигідропіридин-3карбоксаміду Фізичні дані MS(m/z) (M+H) 535,2 Структура H N N O O N N O F O S O O N N 535,1 5 метансульфонат N-(3-фтор-4-(1метил-6-(1H-піразол-4-іл)-1Hіндазол-5-ілокси)феніл)-6-метил-2оксо-1-феніл-1,2-дигідропіридин-3карбоксаміду H N F N O O O N N O S O O N N 549,1 6 метансульфонат N-(3-фтор-4-(1метил-6-(1H-піразол-4-іл)-1Hіндазол-5-ілокси)феніл)-4,6диметил-2-оксо-1-феніл-1,2дигідропіридин-3-карбоксаміду H N F N O O O N O S O O N N N 7 метансульфонат N-(3-фтор-4-(1метил-6-(1H-піразол-4-іл)-1Hіндазол-5-ілокси)феніл)-2-(4фторфеніл)-1,5-диметил-3-оксо-2,3дигідро-1H-піразол-4-карбоксаміду 26 556,2 N H N F O O N N N N N O O S O O F UA 101379 C2 Прикл. № 8 9 Хімічна назва Фізичні дані MS(m/z) (M+H) 540,2 Структура метансульфонат N-(3-фтор-4-(1метил-6-(1H-піразол-4-іл)-1Hіндазол-5-ілокси)феніл)-2-(4фторфеніл)-3-оксо-2,3дигідропіридазин-4-карбоксаміду N N H N F O O O N O S O O N N N метансульфонат N-(3-фтор-4-(1метил-6-(2-метилпіридин-4-іл)-1Hіндазол-5-ілокси)феніл)-1-(4фторфеніл)-6-метил-2-оксо-1,2дигідропіридин-3-карбоксаміду 578,1 H N F F N O O O N F O S O O N N 517,2 10 H N метансульфонат 6-метил-N-(4-(1метил-6-(1H-піразол-4-іл)-1Hіндазол-5-ілокси)феніл)-2-оксо-1феніл-1,2-дигідропіридин-3карбоксаміду N O O O N N O S O O N N F 627,2 N N 11 N 5-((1H-піразол-1-іл)метил)-N-(3фтор-4-(6-морфоліно-1H-індазол-5ілокси)феніл)-2-(4-фторфеніл)-1метил-3-оксо-2,3-дигідро-1Hпіразол-4-карбоксамід N H N O O F O N N O N H F 12 N-(3-фтор-4-(6-морфоліно-1Hіндазол-5-ілокси)феніл)-1-(4фторфеніл)-6-метил-2-оксо-1,2дигідропіридин-3-карбоксамід N O N N 558,1 H N O O O N H F 13 498,2 метансульфонат N-(4-(6(диметиламіно)-1H-індазол-5ілокси)-3-фторфеніл)-6-метил-2оксо-1-феніл-1,2-дигідропіридин-3карбоксаміду H N F N O O O N O S O O N NH 553,1 14 метансульфонат N-(3-фтор-4-(1метил-6-(1H-піразол-4-іл)-1Hіндазол-5-ілокси)феніл)-1-(4фторфеніл)-5-метил-2-оксо-1,2дигідропіридин-3-карбоксаміду H N F N O O O N F O S O O N N N F 15 N-(3-фтор-4-(6-(піридин-3-іл)-1Hіндазол-5-ілокси)феніл)-1-(4фторфеніл)-6-метил-2-оксо-1,2дигідропіридин-3-карбоксамід 550,2 H N O N O N O N H N F 27 UA 101379 C2 Прикл. № Хімічна назва N 16 метансульфонат 5-((1H-піразол-1іл)метил)-N-(4-(6-(диметиламіно)1H-індазол-5-ілокси)-3-фторфеніл)2-(4-фторфеніл)-1-метил-3-оксо-2,3дигідро-1H-піразол-4-карбоксаміду N N H N F N O O метансульфонат 1-(4-фторфеніл)4,6-диметил-N-(4-(1-метил-6-(1Hпіразол-4-іл)-1H-індазол-5ілокси)феніл)-2-оксо-1,2дигідропіридин-3-карбоксаміду N O S O O 549,2 H N N O O 19 20 O F N O S O O N N N F 18 F O N NH 17 Фізичні дані MS(m/z) (M+H) 585,1 Структура метансульфонат N-(3-фтор-4-(6морфоліно-1H-індазол-5ілокси)феніл)-1-(4-фторфеніл)-2оксо-1,2-дигідропіридин-3карбоксаміду O N H N N метансульфонат N-(3-фтор-4-(6(тетрагідро-2H-піран-4-іламіно)-1Hіндазол-5-ілокси)феніл)-1-(4фторфеніл)-4,6-диметил-2-оксо-1,2дигідропіридин-3-карбоксаміду 544,2 O N O O N H O S O O 586,1 H N F N O O O F F H N N NH O O O 503,1 N N H N F N-(4-(6-(диметиламіно)-1H-індазол5-ілокси)-3-фторфеніл)-2-(4фторфеніл)-3-оксо-2,3дигідропіридазин-4-карбоксамід O S O O O F N N NH 21 530,2 H N F N-(4-(6-(диметиламіно)-1H-індазол5-ілокси)-3-фторфеніл)-1-(4фторфеніл)-4,6-диметил-2-оксо-1,2дигідропіридин-3-карбоксамід N O O O F N N NH 480,2 22 H N метансульфонат N-(4-(6(диметиламіно)-1H-індазол-5ілокси)феніл)-6-метил-2-оксо-1феніл-1,2-дигідропіридин-3карбоксаміду N O O O N O S O O N NH F 23 N-(3-фтор-4-(6-(6-метилпіридин-3іл)-1H-індазол-5-ілокси)феніл)-1-(4фторфеніл)-6-метил-2-оксо-1,2дигідропіридин-3-карбоксамід 564,1 H N O N O N O N H N F 28
ДивитисяДодаткова інформація
Назва патенту англійськоюAmidophenoxyindazoles useful in the treatment of cancer
Автори англійськоюLi, Tiechao, Pobanz, Mark, Andrew, Shih, Chuan, Wu, Zhipei, Yang, Wei Jennifer, Zhong, Boyu
Назва патенту російськоюАмидофеноксииндазолы, полезные как ингибиторы c-мет
Автори російськоюЛи Тешао, Поубенз Марк Эндрю, Ши Чан, У Чжипей, Ян Вей Дженнифер, Чжон Боюй
МПК / Мітки
МПК: C07D 403/14, C07D 405/14, A61K 31/4412, C07D 403/12, C07D 401/14, A61P 35/00, C07D 401/12
Мітки: амідофеноксііндазоли, інгібітори, корисні, c-met
Код посилання
<a href="https://ua.patents.su/41-101379-amidofenoksiindazoli-korisni-yak-ingibitori-c-met.html" target="_blank" rel="follow" title="База патентів України">Амідофеноксііндазоли, корисні як інгібітори c-met</a>
Попередній патент: Вузол і система переміщення текучого середовища, ін’єкційний набір і спосіб збирання ін’єкційного пристрою
Наступний патент: Пристрій і спосіб управління співвідношенням палива і повітря при спалюванні меленого вугілля в топковій установці вугільної електростанції
Випадковий патент: Установка безперервного розливу металу












