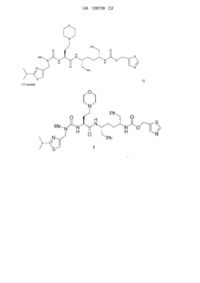
Спосіб одержання інгібітора цитохром р450 монооксигенази та залучені проміжні сполуки
Номер патенту: 108738
Опубліковано: 10.06.2015
Автори: Пфейффер Стівен, Йу Річард, Кент Кеннет, Польняшек Річард, Кордо Даг, Істон Леа, Жоу Жонгксін, Дауді Ерік, Каллен Аарон, Тран Дуонг
Формула / Реферат
1. Спосіб одержання сполуки формули І:
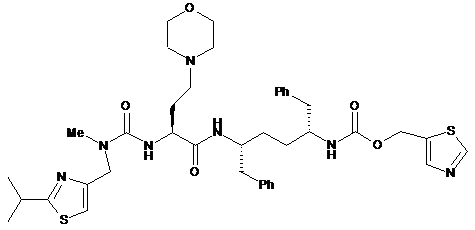 I
I
або її солі, в якому здійснюють:
а) димеризацію відповідної сполуки формули II:
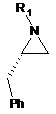 , II
, II
у якій R1 являє собою -S(=O)2NRaRb, причому кожний з Ra та Rb незалежно являє собою (С1-С8)алкіл; або Ra та Rb разом з азотом, до якого вони приєднані, утворюють 3- або 4-членне насичене кільце або 5-, 6- або 7-членне насичене або частково ненасичене кільце, що містить 1 або 2 гетероатоми, з одержанням відповідної сполуки формули V:
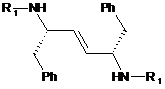 V
V
або її солі;
b) зняття захисних груп зі сполуки формули V або її солі з одержанням сполуки формули VI:
 VI
VI
або її солі;
с) відновлення сполуки формули VI або її солі до сполуки формули VII:
 VII;
VII;
d) перетворення сполуки формули VII у відповідну сіль шляхом обробки кислотою у органічному розчиннику;
e) перетворення відповідної солі зі стадії d) на сполуку формули IX:
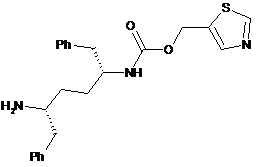 IX
IX
або її сіль; і
f) сполучення сполуки формули IX або її солі з кислотою формули Ха:
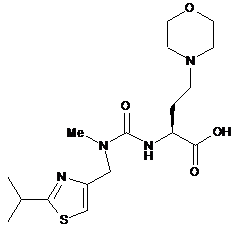 Xa
Xa
або її сіллю з одержанням сполуки формули І.
2. Спосіб за п. 1, у якому сполуку формули II одержують шляхом взаємодії (S)-2-бензилазиридину з відповідною сполукою R1-X, де X являє собою групу, що відходить, і R1 являє собою -S(=O)2NRaRb, де кожний з Ra та Rb незалежно являє собою (С1-С8)алкіл; або Ra та Rb разом з атомом азоту, до якого вони приєднані, утворюють 3- або 4-членне насичене кільце або 5-, 6- або 7-членне насичене або частково ненасичене кільце, що містить 1 або 2 гетероатоми, з одержанням сполуки формули II.
3. Спосіб за п. 1, у якому сполуку формули II одержують шляхом:
а) обробки сполуки формули III:
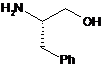 III
III
або її солі відповідною сполукою формули R1-X та R2-X, де X являє собою групу, що відходить, і R1 являє собою -S(=O)2NRaRb, де кожний з Ra та Rb незалежно являє собою (С1-С8)алкіл; або Ra та Rb разом з азотом, до якого вони приєднані, утворюють 3- або 4-членне насичене кільце або 5-, 6- або 7-членне насичене або частково ненасичене кільце, що містить 1 або 2 гетероатоми, і R2 являє собою придатну захисну групу, з одержанням відповідної сполуки формули IV:
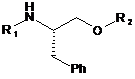 IV
IV
або її солі; і
b) обробки сполуки формули IV або її солі придатною основою для одержання сполуки формули II.
4. Спосіб за будь-яким з пп. 1-3, у якому кислоту формули Ха або її сіль одержують шляхом:
а) обробки сполуки формули XII:
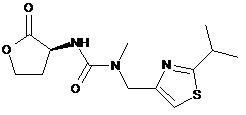 XII
XII
або її солі придатним джерелом йодиду з одержанням сполуки формули XIII:
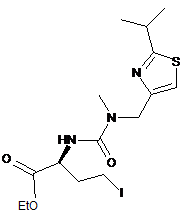 XIII
XIII
або її солі;
b) обробки сполуки формули XIII або її солі морфоліном з одержанням естеру формули XIV:
 XIV
XIV
або його солі; і
с) гідролізу естеру формули XIV з одержанням кислоти формули Ха або її солі.
5. Спосіб за п. 4, у якому сполуку формули XII або її сіль одержують шляхом:
а) обробки L-метіоніну алкілуючим агентом та необов'язково захищення аміну з одержанням аміну формули XI:
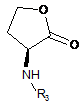 , XI
, XI
де R3 являє собою Н або захисну групу, або його солі; і
b) обробки аміну формули XI або його солі сполукою формули XIX:
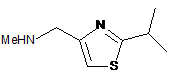 XIX
XIX
або її сіллю з одержанням сполуки формули XII або її солі.
6. Спосіб за п. 4, у якому сполуку формули XII або її сіль одержують шляхом:
а) обробки сполуки формули XV:
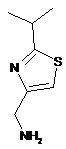 XV
XV
або її солі карбонілдіімідазолом у присутності основи з одержанням сполуки формули XVI:
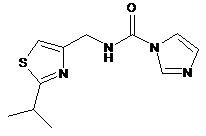 XVI
XVI
або її солі;
b) обробки сполуки формули XVI або її солі придатним метилюючим агентом в присутності основи з одержанням сполуки формули XVII:
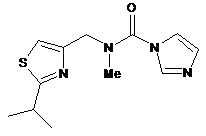 XVII
XVII
або її солі;
с) метилювання сполуки формули XVII або її солі з одержанням солі формули XVIII:
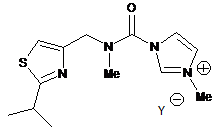 , XVIII
, XVIII
де Y- являє собою придатний протиіон; і
d) обробку солі формули XVIII аміном формули XI:
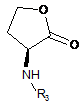 XI
XI
або його сіллю, де R3 являє собою Н або захисну групу, в присутності придатної основи та депротектування шляхом видалення R3, якщо він являє собою захисну групу, з одержанням сполуки формули XII або її солі.
7. Сполука формули XIV:
 XIV
XIV
або її сіль.
8. Сполука за п. 7, яка являє собою оксалатну сіль сполуки формули XIV.
9. Спосіб одержання сполуки формули І:
 I
I
або її солі, де сполуку формули V:
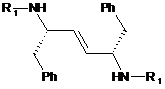 , V
, V
у якій R1 являє собою -S(=O)2NRaRb, де кожний з Ra та Rb незалежно являє собою (С1-С8)алкіл; або Ra та Rb разом з азотом, до якого вони приєднані, утворюють 3- або 4-членне насичене кільце або 5-, 6- або 7-членне насичене або частково ненасичене кільце, що містить 1 або 2 гетероатоми, або її сіль одержують і перетворюють на сполуку формули І, який відрізняється тим, що сполуку формули V одержують з відповідної сполуки формули II:
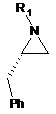 II
II
або її солі шляхом димеризації сполуки формули II.
10. Спосіб одержання сполуки формули І:
 I
I
або її солі, де сполуку формули IV:
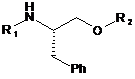 , IV
, IV
у якій R1 являє собою -S(=O)2NRaRb, де кожний з Ra та Rb незалежно являє собою (С1-С8)алкіл; або Ra та Rb разом з азотом, до якого вони приєднані, утворюють 3- або 4-членне насичене кільце або 5-, 6- або 7-членне насичене або частково ненасичене кільце, що містить 1 або 2 гетероатоми, і R2 являє собою придатну захисну групу, або її сіль одержують і перетворюють у сполуку формули І, який відрізняється тим, що сполуку формули IV одержують зі сполуки формули III:
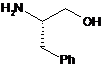 III
III
або її солі захищенням сполуки формули III.
11. Спосіб одержання сполуки формули І:
 I
I
або її солі, де сполуку формули XIV:
 XIV
XIV
або її сіль одержують і перетворюють у сполуку формули І, який відрізняється тим, що сполуку формули XIV або її сіль одержують з відповідної сполуки формули XIII:
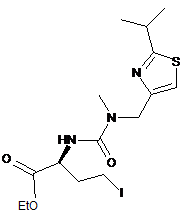 XIII
XIII
або її солі шляхом витіснення йодиду придатним морфоліновим реагентом.
12. Спосіб одержання сполуки формули І:
 I
I
або її солі, де сполуку формули XII:
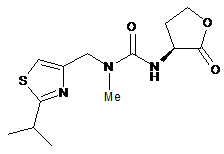 XII
XII
або її сіль одержують і перетворюють на сполуку формули І, який відрізняється тим, що сполуку формули XII одержують з відповідної сполуки формули XVIII:
 , XVIII
, XVIII
у якій Y- являє собою придатний протиіон, шляхом обробки сполуки формули XI:
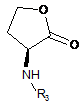 , XI
, XI
у якій R3 являє собою Н або захисну групу, в присутності основи та необов'язково шляхом видалення R3, якщо він являє собою захисну групу, з одержанням сполуки формули XII.
13. Спосіб одержання сполуки формули І:
 I
I
або її солі, де сіль формули XVIII:
 , XVIII
, XVIII
у якій Y- являє собою придатний протиіон,
одержують і перетворюють на сполуку формули І, який відрізняється тим, що сіль формули XVIII одержують з відповідної сполуки формули XVII:
 XVII
XVII
або її солі шляхом обробки метилюючим агентом з одержанням солі формули XVIII.
14. Спосіб одержання сполуки формули І:
 I
I
або її солі, де сполуку формули XVII:
 XVII
XVII
або її сіль одержують і перетворюють на сполуку формули І, який відрізняється тим, що сполуку формули XII одержують з відповідної сполуки формули XVI:
 XVI
XVI
або її солі шляхом обробки метилюючим агентом з одержанням сполуки формули XVII або її солі.
15. Спосіб одержання сполуки формули І:
 I
I
або її солі, де сполуку формули XVI:
 XVI
XVI
або її сіль одержують і перетворюють на сполуку формули І, який відрізняється тим, що сполуку формули XVI одержують з відповідної сполуки формули XV:
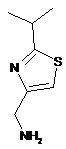 XV
XV
або її солі шляхом обробки карбонілдіімідазолом в присутності основи з одержанням сполуки формули XVI.
16. Спосіб одержання сполуки формули І:
 I
I
або її солі, в якому здійснюють сполучення сполуки формули IX:
 IX
IX
або її солі з сіллю сполуки формули X:
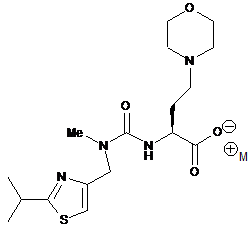 , X
, X
у якій М+ являє собою придатний протиіон;
з утворенням сполуки формули І.
17. Спосіб за п. 16, у якому М+ являє собою K+.
18. Спосіб за п. 16, у якому сполучення здійснюють у дихлорметані при температурі від приблизно -30 °C до приблизно 20 °C у присутності реагенту сполучення.
19. Спосіб за п. 16, у якому як реагент сполучення використовують EDC![]() HC1 та HOBt або циклічний ангідрид н-пропанфосфонової кислоти.
HC1 та HOBt або циклічний ангідрид н-пропанфосфонової кислоти.
20. Сіль формули X:
 X
X
у якій М+ являє собою K+.
21. Сполука формули XVI:
 XVI
XVI
або її сіль.
22. Сполука формули XVII:
 XVII
XVII
або її сіль.
23. Сполука формули XVIII:
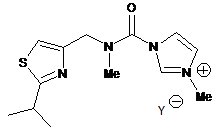 XVIII
XVIII
або її сіль, у якій Y- являє собою придатний протиіон.
24. Сполука формули IV:
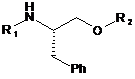 IV
IV
або її сіль, у якій R1 являє собою -S(=O)2NRaRb, причому кожен з Ra та Rb незалежно являє собою (С1-С8)алкіл; або Ra та Rb разом з азотом, до якого вони приєднані, утворюють 3- або 4-членне насичене кільце або 5-, 6- або 7-членне насичене або частково ненасичене кільце, що містить 1 або 2 гетероатоми; і R2 являє собою придатну захисну групу.
25. Сполука формули IVa:
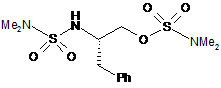 IVa
IVa
або її сіль.
26. Сполука формули V:
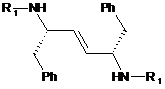 V
V
або її сіль, у якій R1 являє собою -S(=O)2NRaRb, причому кожен з Ra та Rb незалежно являє собою (C1-C8)алкіл; або Ra та Rb разом з атомом азоту, до якого вони приєднані, утворюють 3- або 4-членне насичене кільце або 5-, 6- або 7-членне насичене або частково ненасичене кільце, що містить 1 або 2 гетероатоми.
27. Сполука формули Va:
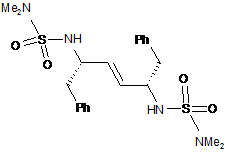 Va
Va
або її сіль.
Текст
Реферат: Даний винахід стосується способів та проміжних хімічних сполук, що придатні для отримання сполуки формули І: UA 108738 C2 (12) UA 108738 C2 O N Ph O O Me N S і її солей. H N N S N H N H O Ph O N (I) UA 108738 C2 Передумови винаходу 5 10 15 20 Міжнародна публікація патентної заявки номер WO 2008/010921 та міжнародна публікація патентної заявки номер WO 2008/103949 відносяться до сполук, які, як повідомлено, застосовні для модифікації фармакокінетики сумісно введеного лікарського засобу, наприклад, шляхом інгібування монооксигенази цитохрому P450. Однією конкретною сполукою, визначеною в даному винаході, є сполука наступної формули I: . На даний час існує потреба у покращених способах синтезу та проміжних хімічних сполуках, що можна використовувати для отримання сполуки формули I та її солей. Також існує потреба у покращених способах отримання проміжних хімічних сполук, що можуть використовуватися для отримання сполуки формули I та її солей. Покращені способи та проміжні хімічні сполуки можуть знижувати вартість, час та/або кількість відходів, пов’язаних з існуючими способами отримання сполуки формули I та її солей. Короткий опис даного винаходу Визначали покращений шлях синтезу для отримання сполуки формули I та її солей. Даний покращений шлях синтезу застосовує нові проміжні хімічні сполуки формул IV, V, XIV, XVI, XVII та XVIII, що визначені нижче у даному документі. Даний шлях знижує вартість, час та кількість відходів, пов’язаних з отриманням сполуки формули I та її солей. Відповідно до одного варіанта здійснення даний винахід відноситься до сполуки формули IV: H R2 N R1 O Ph IV 25 , де кожний з R1 та R2 незалежно являє собою придатну захисну групу; або її солі. В іншому варіанті здійснення даний винахід відноситься до сполуки формули V: Ph R1 NH Ph HN R1 V , де кожний R1 являє собою придатну захисну групу, окрім трет-бутилсульфонілу; або її солі. В іншому варіанті здійснення даний винахід відноситься до сполуки формули XIV: S N Me N HN O O RO XIV 30 N O , де R являє собою (C2-C8)алкіл, або її солі. В іншому варіанті здійснення даний винахід відноситься до способу отримання сполуки формули V: 1 UA 108738 C2 R1 NH Ph Ph HN R1 V , де кожний R1 являє собою придатну захисну групу, окрім трет-бутилсульфонілу, або її солі, що включає димеризацію відповідної сполуки формули II: R1 N Ph 5 II для забезпечення сполуки формули V або її солі. В іншому варіанті здійснення даний винахід відноситься до способу отримання сполуки формули I: або її солі, де сполуку формули V: Ph R1 NH Ph 10 HN R1 V , де R1 являє собою придатну захисну групу, або її сіль отримують і перетворюють у сполуку формули I, який відрізняється тим, що сполуку формули V отримують з відповідної сполуки формули II: R1 N Ph 15 II або її солі шляхом димеризації сполуки формули II. В іншому варіанті здійснення даний винахід відноситься до способу отримання сполуки формули I: або її солі, де сполуку формули IV: 2 UA 108738 C2 R1 H N R2 O Ph IV , де кожний з R1 та R2 незалежно являє собою придатну захисну групу, або її сіль отримують і перетворюють у сполуку формули I, який відрізняється тим, що сполуку формули IV отримують зі сполуки формули III: 5 10 або її солі прєднанням захисних груп до сполуки формули III. В іншому варіанті здійснення даний винахід відноситься до способу отримання сполуки формули I: або її солі, де сполуку формули XIV: S N Me N HN O O RO N XIV O , де R являє собою H або (C1-C8)алкіл, або її сіль отримують і перетворюють у сполуку формули I, який відрізняється тим, що сполуку формули XIV або її сіль отримують зі сполуки формули XIII: N S Me N HN O O RO 15 I XIII , де R являє собою H або (C1-C8)алкіл, або її солі шляхом витіснення йодиду придатним морфоліновим реагентом. У додатковому варіанті здійснення даного способу за даним винаходом R являє собою (C2-C8)алкіл у сполуці формули XIII та XIV. В іншому варіанті здійснення даний винахід відноситься до сполуки формули XVI або XVII: 3 UA 108738 C2 , або її солі. В іншому варіанті здійснення даний винахід відноситься до солі формули XVIII: O S N N N Me Y N Me XVIII 5 , де Y- являє собою придатний протийон. В іншому варіанті здійснення даний винахід відноситься до способу отримання сполуки формули I: або її солі, де сполуку формули XII: O O S 10 15 N N Me N H O XII або її сіль отримують і перетворюють у сполуку формули I, який відрізняється тим, що сполуку формули XII отримують з відповідної сполуки формули XVIII: де Y- являє собою придатний протийон, шляхом обробки сполуки формули XI: 4 UA 108738 C2 де R3 являє собою H або захисну групу, у присутності основи та необов’язково видалення R3, якщо він являє собою захисну групу, для забезпечення формули XII. В іншому варіанті здійснення даний винахід відноситься до способу отримання сполуки формули I: 5 або її солі, де сіль формули XVIII: 10 де Y- являє собою придатний протийон, отримують і перетворюють у сполуку формули I, який відрізняється тим, що сіль формули XVIII отримують зі сполуки формули XVII: або її солі шляхом обробки метилюючим засобом для забезпечення солі формули XVIII. В іншому варіанті здійснення даний винахід відноситься до способу отримання сполуки формули I: 15 або її солі, де сполуку формули XVII: або її сіль отримують і перетворюють у сполуку формули I, який відрізняється тим, що сполуку формули XVII отримують з відповідної сполуки формули XVI: 5 UA 108738 C2 5 або її солі шляхом обробки метилюючим засобом для забезпечення сполуки формули XVII або її солі. В іншому варіанті здійснення даний винахід відноситься до способу отримання сполуки формули I: або її солі, де сполуку формули XVI: 10 або її сіль отримують і перетворюють у сполуку формули I, який відрізняється тим, що сполуку формули XVI отримують з відповідної сполуки формули XV: 15 або її солі шляхом обробки карбонілдіімідазолом у присутності основи для забезпечення сполуки формули XVI. В іншому варіанті здійснення даний винахід відноситься до способу (Спосіб A) отримання сполуки формули I: або її солі, що включає: a) димеризацію відповідної сполуки формули II: 6 UA 108738 C2 R1 N Ph II , де R1 являє собою придатну захисну групу, для забезпечення відповідної сполуки формули V: R1 NH Ph Ph HN R1 V або її солі; b) зняття захисних груп зі сполуки формули V або її солі для забезпечення сполуки формули 5 VI: 10 15 або її солі; c) відновлення сполуки формули VI або її солі до сполуки формули VII: або її солі; d) перетворення сполуки формули VII у відповідну сіль шляхом обробки кислотою у органічному розчиннику; e) перетворення відповідної солі з d) на сполуку формули IX: або її сіль (наприклад, мінеральна кисла сіль, така як сіль HCl); та f) сполучення сполуки формули IX або її солі з сіллю формули X: 7 UA 108738 C2 O N O Me N O N H O N S 5 10 M X , де M+ являє собою придатний протийон, для забезпечення сполуки формули I. У одному конкретному варіанті здійснення даного винаходу сіль сполуки формули IX (наприклад, сіль HCl) можна сполучили з сіллю формули X для забезпечення сполуки формули I. В іншому варіанті здійснення Спосіб A може додатково включати отримання сполуки формули II шляхом взаємодії (S)-2-бензилазиридину з відповідною сполукою R1-X, де X являє собою групу, що відходить, (наприклад, Cl) для забезпечення сполуки формули II. В іншому варіанті здійснення Спосіб A може додатково включати отримання сполуки формули II шляхом: a) приєднання захисних груп до сполуки формули III: або її солі для забезпечення відповідної сполуки формули IV: H R2 N R1 O Ph IV 15 , де кожний з R1 та R2 незалежно являє собою придатну захисну групу, або її солі; та b) обробки сполуки формули IV або її солі придатною основою для забезпечення сполуки формули II. В іншому варіанті здійснення Спосіб A може додатково включати отримання солі формули X шляхом: a) обробки сполуки формули XII: O O N O 20 Me NH N S XII або її солі придатним джерелом йодиду у присутності спирту ROH для забезпечення сполуки формули XIII: 8 UA 108738 C2 N S Me N HN O O RO XIII I , де R являє собою (C1-C8)алкіл, або її солі; b) обробки сполуки формули XIII або її солі морфоліном для забезпечення складного ефіру формули XIV: N S Me N HN O RO 5 10 O N XIV O або його солі; та c) гідролізу складного ефіру формули XIV для забезпечення солі формули X. В іншому варіанті здійснення Спосіб A може додатково включати отримання сполуки формули XII або її солі шляхом: a) обробки L-метіоніну алкілуючим засобом та необов’язково захистом отриманого аміну для забезпечення аміну формули XI: де R3 являє собою H або захисну групу, або його солі; та b) обробки аміну формули XI або його солі сполукою формули XIX: MeHN N S 15 XIX або її сіллю для забезпечення сполуки формули XII або її солі. В іншому варіанті здійснення Спосіб A може додатково включати отримання сполуки формули XII або її солі шляхом: a) обробки сполуки формули XV: 9 UA 108738 C2 або її солі карбонілдіімідазолом у присутності основи для забезпечення сполуки формули XVI: 5 10 або її солі; b) обробки сполуки формули XVI або її солі придатним метилюючим засобом у присутності основи для забезпечення сполуки формули XVII: або її солі; c) метилювання сполуки формули XVII або її солі для забезпечення солі формули XVIII: де Y- являє собою придатний протийон; та d) обробки солі формули XVIII аміном формули XI: 15 де R3 являє собою H або захисну групу, або його сіллю з придатною основою та зняття захисних груп для видалення R3, якщо він являє собою захисну групу, для забезпечення сполуки формули XII або їїсолі. 10 UA 108738 C2 O O N O 5 10 15 20 25 30 35 Me NH N S XII Даний винахід також відноситься до нових синтетичних проміжних хімічних сполук, описаних в даному документі, а також до способів отримання таких проміжних хімічних сполук. Докладний опис Як застосовується у даному документі, алкіл, алкокси і подібне означають як нерозгалужені, так і розгалужені групи; але посилання на окремий радикал, такий як пропіл, охоплює радикал лише з нерозгалуженим ланцюгом, і є окремим посиланням на ізомер з розгалуженим ланцюгом, такий як ізопропіл. Галогеналкіл означає алкільну групу, яка заміщена однією або декількома (наприклад, 1, 2, 3, 4 тощо) галогеновими групами. Арил означає фенільний радикал або орто-конденсований біциклічний карбоциклічний радикал, що включає приблизно дев’ятьдесять атомів кільця, у якому, щонайменше, одне кільце ароматичне. Конкретні значення, що викладені нижче для радикалів, замісників та діапазонів, є лише для ілюстрації; вони не виключають інші визначені значення або інші значення у межах визначених діапазонів для радикалів та замісників. Зокрема, (C1-C8)алкілом може бути метил, етил, пропіл, ізопропіл, бутил, ізо-бутил, вторбутил, пентил, 3-пентил, гексил, гептил або октил; (C1-C8)алкокси може бути метокси, етокси, пропокси, ізопропокси, бутокси, ізо-бутокси, втор-бутокси, пентокси, гексилокси, гептилокси або октилокси; галоген(C1-C8)алкілом може бути фторметил, дифторметил та трифторметил; арил(C1-C8)алкокси може бути бензилокси; та арилом може бути феніл, інденіл або нафтил. Конкретним значенням R1 є N,N-двозаміщена аміносульфонільна група. Іншим конкретним значенням R1 є N,N-діалкіламіносульфонільна група. Іншим конкретним значенням R1 є -S(=O)2NRaRb, -S(=O)2Rc, -C(=O)Rc або -C(=O)NRaRb, де кожний з Ra та Rb незалежно являє собою (C1-C8)алкіл; або Ra та Rb разом з азотом, до якого вони приєднані, утворюють 3- або 4-членне насичене кільце або 5-, 6- або 7-членне насичене або частково ненасичене кільце, що містить 1 або 2 гетероатоми (наприклад, азиридин, азетидин, піперидин, морфолін, тіоморфолін, піролідин, гомопіперазин, гомопіперидин або піперазин); та Rc являє собою арил, (C1-C8)алкіл, галоген(C1-C8)алкіл (C1C8)алкокси або арил-(C1-C8)алкокси, де будь-який арил може необов’язково бути заміщений одним або декількома (C1-C8)алкілами. У одному варіанті здійснення даного винаходу R1 не є трет-бутилсульфонілом (наприклад, для сполуки формули V). Іншим конкретним значенням R1 є –S(=O)2NRaRb, де кожний з Ra та Rb незалежно являє собою (C1-C8)алкіл; або Ra та Rb разом з азотом, до якого вони приєднані, утворюють 3- або 4членне насичене кільце або 5-, 6- або 7-членне насичене або частково ненасичене кільце, що містить 1 або 2 гетероатоми (наприклад азиридин, азетидин, піперидин, морфолін, тіоморфолін, піролідин, гомопіперазин, гомопіперидин або піперазин.) Іншим конкретним значенням для R1 є: 11 UA 108738 C2 5 10 15 20 Іншим конкретним значенням R1 є -S(O)2N(CH3)2. Іншим конкретним значенням для R1 є бензилоксикарбоніл. Конкретним значенням для R2 є N,N-двозаміщена аміносульфонільна група. Іншим конкретним значенням для R2 є N,N-діалкіламіносульфонільна група. Іншим конкретним значенням для R2 є -S(=O)2NRaRb, -S(=O)2Rc, -C(=O)Rc або C(=O)NRaRb, де кожний з Ra та Rb незалежно являє собою (C1-C8)алкіл; або Ra та Rb разом з азотом, до якого вони приєднані, утворюють 3- або 4-членне насичене кільце або 5-, 6- або 7членне насичене або частково ненасичене кільце, що містить 1 або 2 гетероатоми (наприклад, азиридин, азетидин, піперидин, морфолін, тіоморфолін, піролідин, гомопіперазин, гомопіперидин або піперазин); та Rc являє собою арил, (C1-C8)алкіл, галоген(C1-C8)алкіл (C1C8)алкокси або арил-(C1-C8)алкокси, де будь-який арил може необов’язково бути заміщеним одним або декількома (C1-C8)алкілами. Іншим конкретним значенням для R2 є -S(=O)2NRdRe, де кожний з Rd та Re незалежно являє собою (C1-C8)алкіл; або Rd та Re разом з азотом, до якого вони приєднані, утворюють 3або 4-членне насичене кільце або 5-, 6- або 7-членне насичене або частково ненасичене кільце, що містить 1 або 2 гетероатоми (наприклад, азиридин, азетидин, піперидин, морфолін, тіоморфолін, піролідин, гомопіперазин, гомопіперидин або піперазин. Іншим конкретним значенням для R2 є група, що відходить, така як 4-метилфенілсульфоніл, метилсульфоніл, трифторметилсульфоніл. Іншим конкретним значенням для R2 є: 12 UA 108738 C2 5 Конкретним значенням для R3 є H. Сполука формули I або її сіль може бути приготована, як представлено на Схемах 1-4 нижче. 13 UA 108738 C2 5 14 UA 108738 C2 Отримання сполуки формули IV H2 N OH R1 H N O Ph Ph III 5 10 15 R2 IV Сполука формули III може бути захищена будь-якими придатними захисними групами (R1 та R2, які можуть бути однаковими або різними) за стандартних умов для забезпечення відповідної сполуки формули IV. Наприклад, реакцію(ї) можна виконувати у придатному розчиннику у присутності основи. Придатні розчинники включають апротонні розчинники, такі як дихлорметан, тетрагідрофуран та 2-метилтетрагідрофуран, а також інші апротонні органічні розчинники та їх суміші. Придатні основи включають триалкіламіни, такі як триетиламін, діізопропілетиламін та N-метилморфолін, а також гідридні основи, такі як гідрид натрію. Реакцію можна зручно виконувати при температурі від приблизно -20 °C до 40 °C. Придатні захисні групи включають трет-бутилсульфонільну (Bus) групу, N,Nдіалкілсульфамоїльні групи, такі як N,N-діізопропілсульфамоїльні, Н-азиридинілсульфамоїльні та інші сульфамоїльні групи, що містять N-гетероцикл (такий як піролідин або піперидин), а також N-етильні та N-метилсульфамоїльні групи та інші змішані N-алкілсульфамоїльні групи. Отримання сполуки формули II R1 R1 H N O R2 N Ph Ph II IV 20 25 30 Сполуку формули II можна отримати зі сполуки формули IV шляхом обробки основою у придатному розчиннику. Придатні основи включають гідриди металів, такі як гідрид натрію та гідрид калію; літію 2,2,6,6-тетраметилпіперидид; алкоксиди, такі як натрію трет-бутоксид або літію трет-бутоксид, гексаметилдисилазиди, такі як літію гексаметилдисилазид, та карбонатні основи, такі як карбонат калію або карбонат цезію. Придатні розчинники включають апротонні розчинники, такі як дихлорметан, тетрагідрофуран та 2-метилтетрагідрофуран, а також інші апротонні органічні розчинники та їх суміші. Реакцію можна зручно виконувати при температурі від приблизно 0 °C до 22 °C. Придатні R1 групи включають трет-бутилсульфонільну (Bus) групу, N,Nдіалкілсульфамоїльні групи, такі як N,N-діізопропілсульфамоїл, N-азиридинілсульфамоїл та інші сульфамоїльні групи, що містять N-гетероцикл (такий як піролідин або піперидин), а також Nетильні та N-метилсульфамоїльні групи та інші змішані N-алкілсульфамоїльні групи. Отриману в результаті сполуку формули II можна очистити шляхом перекристалізації з придатного розчинника або суміші розчинників. Наприклад, можна виконувати з комбінації ефірних та неполярних розчинників, таких як ізопропіловий ефір/гептан, а також викристалізовуванням з концентрованих розчинів виключно ефірних розчинників, таких як третбутилметиловий ефір. Альтернативне отримання сполуки формули II R1 HN N Ph 35 40 45 Ph II Початковий азиридин може бути захищений будь-якою придатною захисною групою (R1), наприклад, шляхом обробки сполукою R1-X, де X являє собою групу, що відходить, за стандартних умов для забезпечення відповідної сполуки формули II. Наприклад, реакцію можна виконувати у придатному розчиннику у присутності основи. Придатні розчинники включають апротонні розчинники, такі як дихлорметан, тетрагідрофуран, етиловий ефір, третбутилметиловий ефір, тетрагідропіран, 1,4-діоксан, 1,2-дихлоретан, та їх суміші. Придатні основи включають триалкіламіни, такі як триетиламін, N-метилморфолін, хінуклідин, Nметилпіперидин, N,N-діізопропілетиламін та N-метилпіролідин; а також інші слабкі, ненуклеофільні основи, такі як карбонат калію та бікарбонат натрію. Реакцію можна зручно виконувати при температурі від приблизно -10 °C до 40 °C. 15 UA 108738 C2 5 Отриману в результаті сполуку формули II можна очистити шляхом перекристалізації з придатного розчинника або суміші розчинників. Наприклад, можна використовувати комбінації ефірних та неполярних розчинників, таких як етиловий ефір, н-бутиловий ефір, тетрагідрофуран, тетрагідропіран, 1,2-диметоксіетан, гексани, трет-бутилметиловий ефір, гептан, пентан, циклогексан, толуол. Отримання сполуки формули V Ph R1 N R1 H N Ph N H Ph II 10 15 20 V Початковий азиридин можна димеризувати шляхом обробки ненуклеофільною амідною основою у придатному розчиннику. Придатні розчинники включають ефіри, такі як етиловий ефір, трет-бутилметиловий ефір, н-бутиловий ефір, тетрагідропіран та тетрагідрофуран, а також вуглеводні, такі як гексани та гептан, та їх суміші. Придатна ненуклеофільна амідна основа включає літію діізопропіламід, літію 2,2,6,6-тетраметилпіперидид, літію гексаметилдисилазид, натрію гексаметилдисилазид, калію гексаметилдисилазид, літію ди-тбутиламід та літію ізопропілциклогексиламід. Реакцію можна зручно виконувати при температурі від приблизно -78 °C до 22 °C. Отриману в результаті сполуку формули V можна очистити шляхом перекристалізації з придатного розчинника або суміші розчинників. Наприклад, можна використовувати комбінації ефірних та неполярних розчинників, таких як етиловий ефір, н-бутиловий ефір, тетрагідрофуран, тетрагідропіран, 1,2-диметоксіетан та трет-бутилметиловий ефір. Отримання сполуки формули VI Ph R1 H N Ph N H R1 H 2N NH2 Ph Ph V 25 30 VI З початкової сполуки формули V можна зняти захисні групи за стандартних умов для забезпечення відповідної сполуки формули VI. Реакцію можна виконувати у розчиннику, що містить амін; наприклад, моноамін, такий як етаноламін, діамін, такий як 1,3-діамінопропан, етилендіамін, 1,2-діаміноциклогексан, 1,2-фенілендіамін, гнильний розклад або кадаверин, або поліамін, такий як діетилентріамін, триетилентриамін або поліетиленімін. Розчинник може також містити толуол, анізол або подібне, або їх суміші. Реакцію можна зручно виконувати при температурі від приблизно 100ºC до приблизно 140ºC. Гідрогенізація для забезпечення сполуки формули VII Ph H2 N 40 45 Ph NH 2 Ph VI 35 R1 H2N NH 2 Ph VII Початковий алкен VI можна гідрогенізувати за стандартних умов. Наприклад, гідрогенізацію можна виконувати з застосуванням каталізатора, що містить метал, у спиртовому розчиннику. Придатні розчинники включають метанол, етанол, ізопропанол, н-пропанол, бутанол, етилацетат, толуол, діоксан, анізол та їх суміші. Придатні каталізатори включають паладій на вуглеці, платину на вуглеці, нікель Ренея, каталізатор Уілкінсона та гідроксид паладію. Реакцію можна зручно виконувати при тиску від приблизно тиску навколишнього середовища до приблизно 60 psi. Сполуку формули VII можна зручно виділити шляхом обробки кислотою у органічному розчиннику для забезпечення відповідної солі. Придатні кислоти включають хлористоводневу кислоту, бромистоводневу кислоту, йодистоводневу кислоту та сірчану кислоту. Придатні розчинники включають дихлорметан, етиловий ефір, тетрагідрофуран, трет-бутилметиловий ефір, 1,4-діоксан, 1,2-диметоксіетан, хлороформ, 1,2-дихлоретан, толуол, анізол та їх суміші. Перетворення на сіль можна зручно виконувати при температурі від приблизно -10ºC до приблизно 40ºC. 16 UA 108738 C2 Отримання сполуки формули VIII N O O O2N O S + HO O NO2 N O S O O2N VIII 5 10 Змішаний карбонат формули VIII можна отримати шляхом обробки 5-гідроксиметилтіазолу придатним карбонатом або еквівалентом карбонату, що включає групу, яка відходить, розташовану поряд з карбонільним вуглецем, таким як фосген, у присутності основи. Наприклад, придатні карбонати включають біс-(4-нітрофеніл)карбонат та дисукцинімідилкарбонат. Реакцію можна зручно виконувати у придатному апротонному органічному розчиннику, такому як дихлорметан, тетрагідрофуран, 1,2-дихлоретан або діетиловий ефір, або їх суміш. Придатні основи включають триалкіламінові основи, такі як діізопропілетиламін, N-метилморфолін та триетиламін. Отримання сполуки формули IX або її солі S O O 25 30 NH2 O N H2N Ph VIII O NH H2N N 20 Ph + O S 15 Ph NO2 VII Ph IX Сполуку формули IX або її сіль можна отримати зі сполуки формули VII або її солі шляхом обробки карбонатом формули VIII або її солі у присутності придатної основи у придатному розчиннику. Придатні основи включають карбонатні основи (наприклад, калію карбонат) та триалкіламіни (наприклад, діізопропілетиламін або N-метилморфолін). Придатні розчинники включають розчинники, такі як дихлорметан, тетрагідрофуран, 1,2-дихлоретан, ізопропілацетат, діетилефір та їх суміші. Отримання сполуки формули XI Сполуку формули XI, де R3 являє собою H, або її сіль можна отримати шляхом обробки Lметіонину алкілуючим засобом у присутності води та оцтової кислоти. Придатні алкілуючі засоби включають алкілброміди (бромоцтова кислота), алкілйодиди, алкілхлориди та диметилсульфат. Реакцію можна зручно виконувати у розчиннику, що містить спирт (наприклад, ізопропанол), воду та оцтову кислоту. Реакцію можна виконувати при температурі від приблизно 22ºC до приблизно 90ºC. Сполуку формули XI, де R3 є захисною групою (наприклад, карбаматна, амідна або бензильна захисна група), або її сіль можна отримати приєднанням захисних груп до відповідної сполуки формули XI, де R3 являє собою водень, для забезпечення сполуки формули XI, де R3 є захисною групою, або її солі. Отримання сполуки формули XII N MeHN O O HN R3 XI 35 O S XIX O NH O Me N N S XII Сполуку формули XII можна отримати шляхом обробки сполуки формули XI, де R3 є H або захисною групою (наприклад, карбаматну, амідну або бензильну захисну групу), або її солі сполукою формули XIX або її сіллю у апротонному розчиннику при температурі від приблизно 0ºC до приблизно 30ºC у присутності придатної основи та джерела карбонілу, такого як CDI. Якщо R3 є захисною групою, то її згодом можна видалити для забезпечення сполуки формули XII або її солі. Придатні основи включають гідриди металів (наприклад, гідрид натрію) та триалкіламіни (наприклад, діізопропілетиламін, триетиламін, N-метилморфолін або DBU). 17 UA 108738 C2 Придатні апротонні розчинники включають дихлорметан та їх суміші. Отримання сполуки формули XIII S N тетрагідрофуран, 2-метилтетрагідрофуран, S N Me Me N N HN HN O O O O O I RO XII XIII 5 10 Сполуку формули XIII можна отримати шляхом обробки сполуки формули XII або її солі придатним джерелом йодиду (наприклад, триметилсилілйодид, йодид водню, або йодид натрію та триметилсилілхлорид) у апротонному розчиннику у присутності спирту ROH для забезпечення сполуки формули XIII, де R являє собою (C1-C8)алкіл. Придатні апротонні розчинники включають тетрагідрофуран, 2-метилтетрагідрофуран, дихлорметан, ацетонітрил та їх суміші. Реакцію можна типово виконувати при температурі від приблизно 0 °C до приблизно 22 °C. Отримання сполуки формули XIV або її солі N Me N Me HN N HN O O O O RO XIV XIII 20 N I RO 15 S N S O Сполуку формули XIV або її сіль можна отримати шляхом обробки сполуки формули XIII, де R являє собою (C1-C8)алкіл, морфоліном для забезпечення сполуки формули XIV або її солі. Отриману в результаті сполуку формули XIV можна перетворити у відповідну сіль шляхом обробки кислотою (наприклад, органічною кислотою, такою як щавелева кислота, лимонна кислота або фумарова кислота, або мінеральною кислотою) у органічному розчиннику. Придатні розчинники включають трет-бутилметиловий ефір, метиленхлорид, тетрагідрофуран, ацетон, ацетонітрил, толуол, гептани, ізопропілацетат, етилацетат та спирти, та їх суміші. Утворення солі можна типово виконувати при температурі від приблизно 22 °C до приблизно 60 °C. Отримання сполуки формули X O N S N Me N O HN O RO Me O N N O XIV 25 30 N H N O O M S X Сполуку формули X, де M+ являє собою протийон, або її сіль можна отримати шляхом гідролізу складного ефіру формули XIV, де R являє собою (C1-C8)алкіл, або його солі за стандартних умов. Наприклад, гідроліз можна виконували у водному розчиннику (наприклад, вода та дихлорметан) у присутності основи (наприклад, гідроксид калію або гідроксид літію) при температурі від приблизно -10 °C до приблизно 28 °C. Отримання сполуки формули I 18 UA 108738 C2 O N Ph O O Me N H N N S 5 10 15 20 O O H2N + N H S O Ph M X I N IX Сполуку формули I або її сіль можна отримати сполученням кислої солі формули X, де M+ являє собою протийон, з аміном формули IX для утворення відповідного аміду. Дану реакцію утворення аміду можна виконувати за стандартних умов. Наприклад, її можна виконувати у придатному органічному розчиннику (наприклад, дихлорметані) у присутності придатного засобу сполучення (наприклад, EDC•HCl та HOBt). В даній галузі відомі інші придатні реагенти амідного сполучення та умови. Реакцію можна типово виконувати при температурі від приблизно -30 °C до приблизно 20 °C. Коли виконують у дихлорметані або толуолі або їх суміші, ці реакції сполучення неочікувано забезпечують покращені результати у порівнянні зі сполученням у тетрагідрофурані, що описано на стор. 254 міжнародної публікації патентної заявки номер WO 2008/103949. Відповідно, у одному варіанті здійснення даний винахід відноситься до способу отримання сполуки формули I, що містить сполучення кислої солі формули X з аміном формули IX або його сіллю у дихлорметані або толуолі, або їх суміші. Дану реакцію можна зручно виконувати у присутності засобу сполучення (наприклад, EDC•HCl та HOBt) при температурі від приблизно 30 °C до приблизно 20 °C. Отриману в результаті сполуку формули I можна виділити з застосуванням стандартних технік. Сполуку формули I можна виділили з застосуванням твердого матеріалу-підкладки, як описано у міжнародній публікації патентної заявки номер WO 2009/135179. Альтернативне отримання сполуки формули I O N Ph O O Me N N H N S 25 30 Xa OH O + H2 N N H S O I N Ph IX Сполуку формули I або її сіль можна отримати шляхом сполучення кислоти формули Xa або її солі з аміном формули IX або його сіллю для отримання відповідного аміду. Дану реакцію утворення аміду можна виконувати за стандартних умов. Наприклад, її можна виконувати у придатному органічному розчиннику (наприклад, дихлорметані) у присутності придатного засобу сполучення (наприклад, EDC•HCl та HOBt). В даній галузі відомі інші придатні реагенти амідного сполучення та умови. Реакцію можна типово виконувати при температурі від приблизно -30 °C до приблизно 20 °C. Альтернативне отримання сполуки формули XII Сполуку формули XII, показану на Схемі III вище, можна також отримати, як показано на Схемі V. 19 UA 108738 C2 5 10 15 20 25 30 Отримання сполуки формули XII Амін формули XV або його сіль можна обробити карбонілдіімідазолом у присутності придатної основи (наприклад,триалкіламіну, такого як триетиламін, N-метилморфолін, діізопропілетиламін, або DBU; гідридної основи, такої як гідрид натрію; або амідної основи, такої як LiHMDS) у апротонному розчиннику (наприклад, тетрагідрофурані або 2метилтетрагідрофурані) для забезпечення сечовини формули XVI. Алкілування сечовини формули XVI придатним метилюючим засобом (наприклад, метилйодидом) у присутності основи у апротонному розчиннику забезпечує сполуку формули XVII. Додаткове алкілування придатним метилюючим засобом (наприклад, метилйодидом) забезпечує сіль формули XVIII. Обробка солі формули XVIII N-незахищеним аміно γ-лактоном формули XI або відповідним Nзахищеним аміно γ-лактоном (наприклад, карбаматом, амідом або бензиламіном) у придатному апротонному розчиннику (наприклад, тетрагідрофурані або 2-метилтетрагідрофурані) у присутності придатної основи (наприклад, триалкіламіну, такого як триетиламін, Nметилморфолін, діізопропілетиламін, або DBU) забезпечує сполуку формули XII. Якщо застосовують N-захищений аміно -лактон на попередньо описаній стадії (тобто R3 є захисною групою), з отриманого в результаті захищеного продукту можна зняти захисні групи для забезпечення сполуки формули XII. Даний винахід зараз буде проілюстровано наступними необмежуючими прикладами. Приклад 1. Отримання захищеного (L)-фенілаланінолу IVa L-фенілаланінол III (5,0 г) розчиняли у дихлорметані (150 мл). Отриманий у результаті розчин охолоджували до 0 °C та завантажували діізопропілетиламін (21,4 г) у реакційну суміш, а потім N,N-диметилсульфамоїл хлорид (10 г). Реакцію нагрівали до кімнатної температури та перемішували. Через 20 годин реакцію загасили насиченим водним хлоридом амонію (100 мл) та водою (50 мл). Потім шари розділяли та органічну фазу промивали 1 M HCl (2 x 10 об’ємів) та водою (2 x 50 мл). Органічні речовини потім сушили над сульфатом натрію. Тверді речовини відфільтровували та рідини концентрували під вакуумом для отримання 97% сполуки IVa у вигляді жовто-помаранчевого масла. Сполуку IVa потім типово застосовували без додаткової очистки. 1H ЯМР (CDCl3) δ 7,26 (m, 5H), 4,94 (d, 1H, J = 8 Гц), 3,75 (m, 1H), 3,57 (m, 2H), 2,94 (s, 6H), 2,85 (m, 2H), 2,54 (s, 6H). Приклад 2. Отримання (S)-2-бензил-N,N-диметилазиридин-1-сульфонаміду IIa 20 UA 108738 C2 Me2 N S O H N O O O Me 2 N S O N O S O NMe 2 NaH 2-MeTHF Ph Ph IIa IVa 5 10 15 Захищений аміноспирт IVa (10 г) розчиняли у 2-MeTHF (300 мл). Отриманий в результаті розчин охолоджували до 0 °C. Гідрид натрію (2,0 г) потім завантажували порційно. Реакцію потім нагрівали до кімнатної температури та перемішували. Через 4,5 години реакцію охолоджували до 0 °C та загасили насиченим водним розчином хлориду амонію (150 мл) та водою (100 мл). Шари розділяли та органічний шар промивали 1M HCl (150 мл), а потім насиченим водним NaCl (150 мл). Органічні речовини сушили над сульфатом натрію. Тверді речовини відфільтровували та фільтрат концентрували. Додаткову очистку можна виконувати або за допомогою колонкової хроматографії, елююючи 100% дихлорметаном, або за допомогою перекристалізації з MTBE/гексанів, наприкінці призводячи до 64% сполуки IIa у вигляді білої твердої речовини. 1H ЯМР (CDCl3) δ 7,30 (m, 5H), 2,94 (dd, 1H, J = 14, 5 Гц), 2,83 (m, 1H), 2,71 (dd, 1H, J = 14, 7 Гц), 2,66 (s, 6H), 2,56 (d, 1H, J = 7Гц), 2,14 (d, 1H, J = 4 Гц); 13C ЯМР (CDCl3) δ 137,4, 129,3, 128,9, 127,2, 77,6, 77,3, 77,0, 40,6, 38,3, 38,1, 33,0. Приклад 3. Альтернативне отримання (S)-2-бензил-N,N-диметилазиридин-1-сульфонаміду IIa O Me HN Ph O S N Me Cl O Me2N O S N iPr2NEt, DCM -10 oC Ph IIa 20 25 30 До охолодженого (-10 °C) розчину (S)-2-бензилазиридину (100 г, 0,751 моль) та N,Nдиметилсульфамоїлхлориду (84,5 мл, 0,787 моль) у дихлорметані (100 мл) додавали N,Nдіізопропілетиламін (131 мл, 0,751 моль). Отриманий в результаті жовтий розчин перемішували при -10 °C мінімум 16 годин. Після цього періоду додали 0,5M розчин лимонної кислоти (500 мл) та фази розділили. Органічну фазу потім промивали 1,0 M розчином бікарбонату натрію (500 мл). Потім розчинник в органічній фазі замінили на трет-бутилметиловий ефір (500 мл). Розчин потім охолоджували до 0 °C та гептан (100 мл) додавали по краплях протягом 2 годин. Суміш потім додатково витримували 2 години при 0 °C, та потім охолоджували (-10 °C) для забезпечення виділення сполуки IIa у вигляді білої, кристалічної твердої речовини (27,8 г, 77%). Аналіз ТШХ: Rf: 0,53 (SiO2; 1:1 гептан:етилацетат, KMnO4). 1H ЯМР (400 MГц, CDCl3): δ 7,207,29 (m, 5H), 2,94 (dd, J = 14, 5 Гц, 1H), 2,80-2,88 (m, 1H), 2,70 (dd, J = 14, 7 Гц, 1H), 2,66 (s, 6H), 2,56 (d, J = 7 Гц, 1H), 2,14 (d, J = 4 Гц, 1H). 13C ЯМР (100 MГц, CDCl3): δ 137,4, 129,3, 128,9, 127,2, 40,6, 38,3, 38,1, 33,0. Приклад 4. Отримання захищеного діаміну Va 35 40 До охолодженого (0 °C) розчину 2,2,6,6-тетраметилпіперидину (5,5 мл) у тетрагідрофурані (14 мл) додавали н-бутиллітій (10M у гексанах, 3,1 мл). Отриманий в результаті мутний жовтий розчин нагрівали до 22 °C та перемішували при такій температурі протягом 20 хвилин. До охолодженого (-10 °C) мутного розчину IIa (5,0 г) у тетрагідрофурані (7 мл) додавали підготований літію тетраметилпіперидид (LTMP) по краплях за допомогою шприцевого насосу 21 UA 108738 C2 5 10 15 20 25 30 (швидкість додавання: 40 мл/год, температура LTMP: 22 °C). Під час додавання реакція поступово перетворювалась на темно-пурпуровий розчин. Реакцію потім повільно нагрівали до 0 °C протягом 45 хвилин. Потім до охолодженої реакції додавали 10% (маса/об’єм) розчин лимонної кислоти (15 мл) та отриманий в результаті світло-жовтий розчин інтенсивно перемішували при 0 °C декілька хвилин. Двофазну суміш потім розбавляли етилацетатом (75 мл) та фази розділяли. Органічну фазу промивали 10% (маса/об’єм) лимонною кислотою (1 x 15 мл), насиченим бікарбонатом натрію (2 x 15 мл) та розсолом (1 x 15 мл). Органічну фазу згодом сушили над сульфатом натрію, відфільтровували та концентрували під зниженим тиском для отримання світло-жовтої твердої речовини. Неочищену суміш суспендували у гарячому третбутилметиловому ефірі, охолоджували до -16 °C та відфільтровували для отримання Va у вигляді білого порошку (3,2 г, 64%). Аналіз ТШХ: Rf: 0,32 (SiO2, 1:1 гептан:етилацетат, KMnO4). 1H ЯМР (400 MГц, CDCl3): δ 7,10-7,35 (m, 10H), 5,59 (s, 2H), 3,95-4,10 (m, 4H), 2,80 (ddd, J = 22, 13, 6 Гц, 4H), 2,59 (s, 12H). 13C ЯМР (100 MГц, CDCl3): δ 136,7, 132,0, 129,9, 128,9, 127,2, 57,0, 42,4, 38,1. Приклад 5. Альтернативне отримання захищеного діаміну Va До охолодженої (-10 °C) зависі IIa (10,0 г) та 2,2,6,6-тетраметилпіперидину (2,1 мл) у 1:3 тетрагідрофурані:гептані (30 мл) повільно додавали н-бутиллітій (2,6M у гексанах, 19 мл) протягом 3 годин. Під час додавання реакція поступово перетворювалась на темно-пурпуровий розчин; після завершення отримане перемішували при такій температурі додатково 20 хвилин. Льодяну оцтову кислоту (4,0 мл) потім додавали до холодної реакції та отриману в результаті суспензію світло-жовтого кольору інтенсивно перемішували при 5 °C кілька хвилин. Суміш потім відфільтровували та твердий матеріал промивали 3:1 т-бутилметиловим ефіром : гептаном (2 x 30 мл), водою (3 x 30 мл) та знову 3:1 т-бутилметиловим ефіром : гептаном (2 x 30 мл). Потім вологий осад повністю висушили для отримання Va у вигляді білого порошку (7,22 г, 72%). Аналіз ТШХ: Rf: 0,32 (SiO2, 1:1 гептан:етилацетат, KMnO4). 1H ЯМР (400 MГц, CDCl3): δ 7,10-7,35 (m, 10H), 5,59 (s, 2H), 3,95-4,10 (m, 4H), 2,80 (ddd, J = 22, 13, 6 Гц, 4H), 2,59 (s, 12H). 13C ЯМР (100 MГц, CDCl3): δ 136,7, 132,0, 129,9, 128,9, 127,2, 57,0, 42,4, 38,1. Приклад 6. Отримання ненасиченого діаміну VI Me H N N Me S O O Ph Ph O N H Ph O S Me N Me H2N NH2 H2N Ph Va 35 40 45 NH2 110 oC VI Розчин захищеного діаміну Va (2,0 г) у 1,3-діамінопропані (4 мл) нагрівали до 110 °C та перемішували при такій температурі протягом 90 хвилин. Після охолодження розчину жовтого кольору до 22 °C додавали воду (16 мл), а потім дихлорметан (20 мл). Фази розділяли та водну фазу промивали додатковою частиною дихлорметану (1 x 10 мл). Об’єднані органічні фази сушили над сульфатом натрію, відфільтровували та концентрували під зниженим тиском для отримання VI у вигляді густого жовтого масла (1,1 г, 100%). Даний матеріал безпосередньо застосовували у наступній реакції без додаткового очищення. Аналіз ТШХ: Rf: 0,61 (SiO2, 4:1 CH2Cl2:CH3OH w/ 5% Et3N, KMnO4). 1H ЯМР (400 MГц, CDCl3): δ 7,10-7,35 (m, 10H), 5,60 (dd, J = 4, 2 Гц, 2H), 3,50-3,60 (br, 2H), 2,85 (dd, J = 13, 5 Гц, 2H), 2,60 (13, 8 Гц, 2H), 1,15 (br, 4H). 13C ЯМР (100 MГц, CDCl3): δ 139,0, 134,1, 129,7, 128,6, 126,5, 54,9, 44,9. Приклад 7. Отримання сполуки VII 22 UA 108738 C2 5 10 До розчину ненасиченого діаміну VI (1,1 г) у метанолі (8,2 мл) додавали 10% паладій на вуглеці (110 мг, 10 ваг. %). Отриману в результаті чорну суспензію очищали газом водню та утримували в атмосфері водню (балон) протягом 16 годин. Реакцію потім відфільтровували через целіт та концентрували під зниженим тиском для отримання VII у вигляді густого жовтого масла (1,11 г, 100%). Даний матеріал перенесли до наступної реакції без додаткової очистки. Аналіз ТШХ: Rf: 0,60 (SiO2, 4:1 CH2Cl2:CH3OH мас./ 5% Et3N, KMnO4). 1H ЯМР (400 MГц, CDCl3): δ 7,15-7,35 (m, 10H), 2,95-3,05 (m, 2H), 2,82 (dd, J = 13, 5 Гц, 2H), 2,50 (dd, J = 13, 9 Гц, 2H), 1,45-1,66 (m, 4H), 1,36 (br, 4H). 13C ЯМР (100 MГц, CDCl3): δ 139,7, 129,5, 128,7, 126,5, 53,2, 45,1, 34,6. Приклад 8. Отримання діамін-дигідрогенхлориду VIIa 15 20 До охолодженого (0 °C) розчину VII (1,11 г) у дихлорметані (14 мл) додавали розчин 4M хлористоводневої кислоти у діоксані (2,6 мл). Отриману в результаті блідо-рожеву суспензію нагрівали до 22 °C та перемішували при такій температурі протягом 90 хвилин. Суміш потім відфільтровували; осад промивали великими кількостями дихлорметану та сушили in vacuo для отримання VIIa у вигляді блідо-рожевого порошку (1,32 г, 94% з V). 1H ЯМР (400 MГц, D2O): δ 7,10-7,35 (m, 10H), 3,38-3,48 (m, 2H), 2,92 (dd, J = 14, 7 Гц, 2H), 2,76 (dd, J = 14, 8 Гц, 2H), 1,581,74 (m, 4H). Приклад 9. Отримання карбонату VIII O O O O O NO2 + HO S N TEA S O N DCM O2N VIII O2N 25 30 35 5-гідроксиметилтіазол (5 кг) розчиняли у дихлорметані (210 кг). До даного розчину додавали біс-(4-нітрофеніл)карбонат (15 кг) та триетиламін (7,5 кг). Реакційну суміш перемішували протягом ночі. Після завершення реакції реакційну суміш промивали 1,0 M водним розчином K2CO3 (50 кг) для повного видалення 4-нітрофенолу. Органічний шар потім промивали 1,0 M водною лимонною кислотою, доки pH органічного розчину не став менше 8. Органічний шар сушили над Na2SO4. Потім тверді речовини відфільтровували та розчинник в органічному шарі замінили на ізопропілацетат, та концентрували до об’єму приблизно 4 об’ємів. До даного розчину повільно додавали н-гептан (100 л) та витримували протягом 5 або більше годин. Даний процес передбачає VIII у вигляді білої речовини, яку можна згодом видалити за допомогою фільтрації. 1H ЯМР (CDCl3) δ 8,89 (s, 1H), 8,26 (d, 2H), 7,99 (s, 1H), 7,37 (d, 2H), 5,51 (s, 2H). Приклад 10a. Отримання монокарбамату гідрохлориду IXa 23 UA 108738 C2 5 10 15 Діамін-дигідрохлорид VIIa (2,37 кг), водний карбонат калію (1M, 27 кг) та дихлорметан (68 кг) струшували протягом 1 години при 20 °C. Шар дихлорметану відділили, висушили над сульфатом натрію (7,1 кг) та відфільтрували для отримання діамінової вільної основи. До даного розчину завантажили додатковий дихлорметан (66 кг) та змішаний карбонат VIII (1,95 кг). Як тільки всі тверді речовини розчинили, додавали діізопропілетиламін (1,1 кг, 8,3 мл) та за реакцією спостерігали за допомогою аналізу ТШХ (SiO2, 80% етилдихлорметан у метанолі у якості елюанту, продукт Rf = 0,73, спостереження за допомогою УФ). Вміст реакції промивали 0,25N водним NaOH, доки присутність залишкової VIII та 4-нітрофенолу не була визначена за допомогою аналізу ТШХ. Органічний шар промивали водою, сушили над сульфатом натрію (7 кг), відфільтровували, концентрували та розчиняли у ізопропілацетаті (приблизно 50 л) та розбавляли дихлорметаном (47 кг). До даного розчину завантажили HCl (1,88 кг 4N HCl у діоксані, приблизно 8,2 моль HCl), щоб викликати осадження. Продукт IXa відфільтровували та промивали ізопропілацетатом (21 кг) та сушили під вакуумом для отримання білого порошоку (2,57 кг, 83% вихід). 1H ЯМР (CD3OD) δ 9,0 (s, 1H), 7,8 (s, 1H), 7,4-7,14 (m, 10H), 5,2 (d, 1H), 4,8 (s, 5 H) 3,7 (m, 1H), 3,6 (m, 1H), 3,3 (s, 1H), 2,6-2,8 (m, 2H), 1,8-1,4 (m, 4H). 13C ЯМР (CD3OD) δ 154,4, 143,2, 129,6, 128,0, 126,0, 58,0, 52,4, 44,3, 41,6, 33,8, 30,5. Приклад 10b. Отримання монокарбамату гідрохлориду IXa 20 25 30 35 40 Діамін-дигідрохлорид VIIa (2,0 г), водний гідроксид натрію (3M, 4,1 г) та дихлорметан (13,3 г) струшували протягом 1 години при 20 °C. Шар дихлорметану відділяли та згодом промивали водою (10 г) для отримання діамінової вільної основи. До даного розчину завантажили додатковий дихлорметан (26,6 г) та змішаний карбонат VIII (1,72 г). Отриманий в результаті розчин нагрівали до 40 °C та утримували при такій температурі, доки реакцію не вважали закінченою за допомогою HPLC. Розчинник потім видаляли in vacuo, сумісно дистилювали тетрагідрофураном (17,8 г) та потім повторно розбавляли тетрагідрофураном (35,6 г). До даного розчину потім додавали концентровану хлористоводневу кислоту (12M, 0,588 г), щоб викликати осадження. Продукт IXa відфільтровували, промивали 1% H2O у 1:1 THF:CH2Cl2 (2 x 40 мл) та сушили під вакуумом для отримання білого порошку (2,15 г, 82% виходу). 1H ЯМР (CD3OD) δ 9,0 (s, 1H), 7,8 (s, 1H), 7,4-7,14 (m, 10H), 5,2 (d, 1H), 4,8 (s, 5 H) 3,7 (m, 1H), 3,6 (m, 1H), 3,3 (s, 1H), 2,6-2,8 (m, 2H), 1,8-1,4 (m, 4H). 13C ЯМР (CD3OD) δ 154,4, 143,2, 129,6, 128,0, 126,0, 58,0, 52,4, 44,3, 41,6, 33,8, 30,5. Приклад 11. Отримання амінолактону Xia До розчину L-метіоніну (46 кг) у воді (69 кг) при температурі навколишнього середовища завантажили бромоцтову кислоту (46,0 кг), 2-пропанол (69,0 кг) та оцтову кислоту (69,0 кг). 24 UA 108738 C2 5 10 Отриману в результаті суміш нагрівали зі зворотнім холодильником (85 °C - 95 °C) та струшували при даній температурі, доки не вирішили за допомогою 1H ЯМР, що реакція завершилась. Суміш концентрували під зниженим тиском та сумісно випарювали з 2пропанолом. 2-пропанол (161,0 кг) завантажували до концентрованої суміші з наступним повільним додаванням 10 ваг. % розчину HCl/діоксану (102 кг) при температурі навколишнього середовища. Отриману в результаті завись нагрівали до приблизно 60 °C та перемішували приблизно 4 годин. Температуру посудини відрегулювали до приблизно 22 °C та струшували приблизно 2 години. Продукт XIa відфільтровували, промивали двома частинами 2-пропанола (28 кг кожна частина) та сушили під вакуумом при 40 °C для отримання від білої до білуватої твердої речовини (39,3 кг, 70% вихід). 1H ЯМР (D2O) δ 4,79 (s, 2H), 4,61 (dd, 1H), 4,49-4,41 (m, 2H), 2,80 (m, 1H), 2,42 (m, 1H). Приклад 12. Отримання сечовини XII N MeHN O S O O NH2•HBr 1) iPr2NEt XIX O 2) CDI, DCM NH O Me N N S XII XIa 15 20 25 30 35 40 45 До зависі (L)-амінолактону XIa (31,5 кг) у дихлорметані (105 кг) завантажували діізопропілетиламін (28,8 кг). Реакційну суміш охолоджували до приблизно 10 °C та додавали карбонілдіімідазол (27,1 кг) порційно, тоді як температуру вмісту підтримували при менш ніж або рівній 25 °C. Отриману в результаті суміш струшували, доки реакцію не вважали закінченою. Метиламінометилтіазол XIX (21,0 кг) завантажували, підтримуючи температуру вмісту при менш ніж або рівній 25 °C, та струшували. При завершенні, реакційну суміш промивали водою (63,0 кг), потім двічі 20 ваг. % водним розчином лимонної кислоти (63,0 кг). Всі водні шари об’єднали та екстрагували дихлорметаном (63,0 кг). Органічні шари об’єднали та раз промивали 8 ваг. % водним розчином бікарбонату натрію (63,0 кг) та раз водою (63,0 кг). Органічний шар концентрували під зниженим тиском до 3 об’ємів та сумісно випарювали з дихлорметаном. Продукт XII вивантажували як маточний розчин у дихлорметані (33,4 кг, 91% вихід). 1H ЯМР (CDCl3) δ 7,02 (s, 1H), 4,55-4,41 (m, 4H), 4,27 (m, 1H), 3,29 (септети, 1H), 2,98 (s, 3H), 2,78 (m, 1H), 2,20 (m, 1H), 1,38 (d, 6H). Приклад 13. Отримання оксалатної солі L-тіазолморфолінового етилового складного ефіру XIVa До розчину (L)-тіазоламінолактону XII (33,4 кг) у дихлорметані (89,5 кг) завантажували дихлорметан (150 кг) та абсолютний етанол (33,4 кг). Температуру вмісту потім доводили до приблизно 10 °C з наступним повільним додаванням TMSI (78,8 кг), тоді як температуру вмісту підтримували при менш ніж або рівній 22 °C та перемішували, доки реакцію не вважали закінченою. Температуру вмісту регулювали до приблизно 10 °C з наступним повільним додаванням морфоліну (49,1 кг), тоді як температуру вмісту підтримували при менш ніж або рівній 22 °C. При завершенні реакційну суміш відфільтровували для видалення морфоліну•HI солі та осад на фільтрі промивали двома порціями дихлорметану (33,4 кг). Фільтрат промивали двічі водою (100 кг). Органічний шар концентрували під вакуумом досуха. Ацетон (100 кг) потім завантажували до концентрату та розчин концентрували під зниженим тиском досуха. Ацетон (233,8 кг) завантажували до концентрату з наступним повільним додаванням розчину щавелевої кислоти (10 кг) у ацетоні (100 кг). Отриману в результаті завись нагрівали зі зворотнім 25 UA 108738 C2 5 холодильником протягом приблизно 1 години перед охолодженням до приблизно 3 °C для виділення. Продукт XIVa відфільтровували та промивали ацетоном (66,8 кг) та сушили під вакуумом при 40 °C для отримання від білої до білуватої твердої речовини (40 кг, 71% вихід). 1H ЯМР (CDCl3) δ 7,00 (s, 1H), 6,35 (широкий s, 1H), 4,60-4,40 (m, 3H), 4,19 (квартети, 2H), 4,003,90 (m, 4H), 3,35-3,10 (m, 7H), 3,00 (s, 3H), 2,40-2,30 (m, 1H), 2,15-2,05 (m, 1H), 1,38 (d, 6H), 1,25 (триплети, 3H). Приклад 14. Отримання сполуки I O S N Me N HN O O OH O EtO N 1) KHCO3, H2O/DCM O • HO 2) KOH, H2O Me N N DCM -20 °C O N H O N XIVa HOBt EDC O K Xa O S O Ph O HCl • H2N Ph N H IXa O N S Me N S 10 15 20 25 30 35 40 Ph O N N N H H N O O S N H Ph O N I До розчину оксалатної солі L-тіазолморфолінового етилового складного ефіру XIVa (35,6 кг) у воді (66,0 кг) завантажували дихлорметан (264 кг) з наступним повільним додаванням 15 ваг. % розчину KHCO3 (184,8 кг). Отриману в результаті суміш струшували приблизно 1 годину. Шари розділили та органічний шар промивали водою (132 кг). Органічний шар концентрували під вакуумом досуха. Воду (26,5 кг) завантажували та температуру вмісту доволиди до приблизно 10 °C з наступним повільним додаванням 45% розчину KOH (9,8 кг), тоді як температуру вмісту підтримували при менш ніж або рівній 20 °C. Суміш струшували при менш ніж або рівній 20 °C, доки реакцію не вважали закінченою за допомогою HPLC. Реакційну суміш концентрували під вакуумом досуха та сумісно випарювали п’ять разів з дихлорметаном (132 кг кожного разу) під зниженим тиском досуха. Сумісне випарювання з дихлорметаном (132 кг) продовжували, доки вміст води не досяг
ДивитисяДодаткова інформація
Назва патенту англійськоюMethod of preparing an inhibitor of cytochrome p450 monooxygenase, and intermediates involved
Автори англійськоюPolniaszek, Richard, P., Pfeiffer, Steven, Yu, Richard, Cullen, Aaron, Dowdy, Eric, Tran, Duong, Kent, Kenneth, Zhou, Zhongxin, Cordeau, Doug, Easton, Leah
Автори російськоюПольняшек Ричард, Пфейффер Стивен, Йу Ричард, Каллен Аарон, Дауди Эрик, Тран Дуонг, Кент Кеннет, Жоу Жонгксин, Кордо Даг, Истон Леа
МПК / Мітки
МПК: C07D 417/12, C07C 307/00, C07C 307/06, C07C 307/08
Мітки: сполуки, р450, інгібітора, одержання, залучені, цитохром, проміжні, монооксигенази, спосіб
Код посилання
<a href="https://ua.patents.su/42-108738-sposib-oderzhannya-ingibitora-citokhrom-r450-monooksigenazi-ta-zalucheni-promizhni-spoluki.html" target="_blank" rel="follow" title="База патентів України">Спосіб одержання інгібітора цитохром р450 монооксигенази та залучені проміжні сполуки</a>
Попередній патент: Високовольтний вимикальний блок
Наступний патент: Заміщені похідні триазолу і імідазолу як модулятори гамма-секретази
Випадковий патент: Спосіб термообробки високовуглецевої сталі зі зменшеним вмістом марганцю