Інгібітори протеїнкіназ
Номер патенту: 104603
Опубліковано: 25.02.2014
Автори: де Діос Магана Альфонсо, Матео-Герранс Ана Ізабел, Санчес-Мартінес Консепсьон, Дель Прадо Каталіна Міріам Філадельфа, Мартін де ла Нава Ева Марія, Коутс Дейвід Ендрю, Гелберт Лоренс Марк, Перес Мартінес Карлос, Гарсіа Паредес Марія Крістіна, Мартінес Перес Хосе Антоніо, Нобелок Джон Монте, Мартін Ортега Фінгер Марія Долорес, де Прадо Гонсалес Ана
Формула / Реферат
1. Сполука формули:
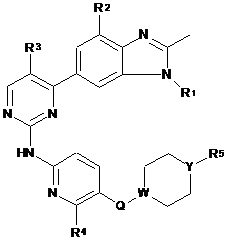 ,
,
де
R1 - Сз-С5-алкіл, С3-С5-циклоалкіл або циклопропілметил;
R2 та R3 - Н або фтор, де щонайменше один із R2 або R3 - фтор;
R4 - Н або СН3;
R5 - С1-С6-алкіл або -NR6R7, де R6 та R7 - С1-С3-алкіл;
Q - СН2, О, S або безпосередній зв'язок; та
W та Y - С або N, де щонайменше один із W або Y - N, та де якщо Q - О або S, то W - С;
або фармацевтично прийнятна сіль цієї сполуки.
2. Сполука за п. 1 або фармацевтично прийнятна сіль цієї сполуки, де R1 - ізопропіл, циклопропіл, циклопентил або циклопропілметил.
3. Сполука за будь-яким із попередніх пунктів або фармацевтично прийнятна сіль цієї сполуки, де кожен з R2 та R3 є фтором.
4. Сполука за будь-яким із попередніх пунктів або фармацевтично прийнятна сіль цієї сполуки, де R4 - Н.
5. Сполука за будь-яким із попередніх пунктів або фармацевтично прийнятна сіль цієї сполуки, де R5 - С1-С3-алкіл.
6. Сполука за будь-яким із попередніх пунктів або фармацевтично прийнятна сіль цієї сполуки, де Q - СН2.
7. Сполука за будь-яким із попередніх пунктів або фармацевтично прийнятна сіль цієї сполуки, де W - N.
8. Сполука за будь-яким із попередніх пунктів або фармацевтично прийнятна сіль цієї сполуки, вибрана з групи, яку складають:
 ,
,
 ,
,
 ,
,
 ,
,
 ,
,
 ,
,
 ,
,
 ,
,
 ,
,
 ,
,
 ,
,
 ,
,
 ,
,
 та
та
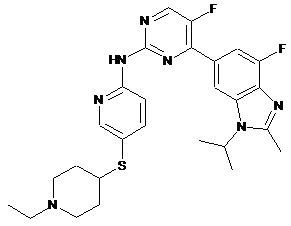 .
.
9. Сполука за будь-яким із попередніх пунктів, яка являє собою:
 ,
,
або фармацевтично прийнятна сіль цієї сполуки.
10. Сполука за будь-яким із попередніх пунктів, яка являє собою мезилатну сіль.
11. Кристалічна форма III [5-(4-етилпіперазин-1-ілметил)піридин-2-іл]-[5-фтор-4-(7-фтор-3-ізопропіл-2-метил-3Н-бензимідазол-5-іл)піримідин-2-іл]аміну, яка характеризується порошковою рентгенодифрактограмою (джерело випромінення СuКa, (l=1,54056 А), яка містить пік при 21,29 (20+0,1°) та факультативно один або декілька піків, вибраних з групи, яка включає в себе 11,54, 10,91 та 12,13 (26±0,1°).
12. Кристалічна форма III [5-(4-етилпіперазин-1-ілметил)піридин-2-іл]-[5-фтор-4-(7-фтор-3-ізопропіл-2-метил-3Н-бензимідазол-5-іл)піримідин-2-іл]аміну за п. 11, яка також характеризується спектром 13С ЯМР, який містить піки хімічних зсувів v(Fl) [млн-1] при 112,7, 127,3 та 129,4.
13. Фармацевтична композиція, яка містить сполуку за будь-яким із пп. 1-12 або фармацевтично прийнятну сіль цієї сполуки та фармацевтично прийнятні носій, розріджувач або допоміжну речовину.
14. Фармацевтична композиція, яка містить сполуку за будь-яким із пп. 1-12 або фармацевтично прийнятну сіль цієї сполуки, разом із фармацевтично прийнятним носієм та факультативно іншими терапевтичними інгредієнтами.
15. Сполука за будь-яким із пп. 1-12 або фармацевтично прийнятна сіль цієї сполуки для застосування у терапії.
16. Сполука за будь-яким із пп. 1-12 або фармацевтично прийнятна сіль цієї сполуки для застосування у лікуванні раку, вибраного з групи, яку складають рак ободової та прямої кишки, рак молочної залози, рак легенів, рак простати, гліобластома, лімфома з клітин мантії, хронічний мієлоїдний лейкоз та гострий мієлоїдний лейкоз.
Текст
Реферат: Цей винахід пропонує сполуку Формули (І): (72) Винахідник(и): Коутс Дейвід Ендрю (US), де Діос Магана Альфонсо (US), де Прадо Гонсалес Ана (ES), Дель Прадо Каталіна Міріам Філадельфа (ES), Гарсіа Паредес Марія Крістіна (ES), Гелберт Лоренс Марк (US), Нобелок Джон Монте (US), Мартін де ла Нава Ева Марія (ES), Мартін Ортега Фінгер Марія Долорес (ES), Мартінес Перес Хосе Антоніо (ES), Матео Герранс Ана Ізабел (ES), Перес Мартінес Карлос (ES), Санчес Мартінес Консепсьон (ES) (73) Власник(и): ЕЛІ ЛІЛЛІ ЕНД КОМПАНІ, Lilly Corporate Center, Indianapolis, IN 46285, United States of America (US) (74) Представник: Шляховецький Олександр Михайлович, реєстр. №21 (56) Перелік документів, взятих до уваги експертизою: WO 2005005426 (A1), 20.01.2005 WO 03062236 (A1), 31.07.2003 UA 104603 C2 (12) UA 104603 C2 R2 N R3 N R1 N N HN Y N Q R4 R5 W (I) або фармацевтично прийнятну сіль цієї сполуки, яка є корисною при лікуванні захворювань, що характеризуються аномальною проліферацією клітин. UA 104603 C2 5 10 15 20 25 30 35 40 45 Високогомологічні циклін-залежні кінази (Cdks) CDK4 та CDK6 у комбінації з цикліном D є ключовими регуляторами переходу через точку рестрикції R між G1- (ріст) та S- (реплікація ДНК) фазами клітинного циклу. CDK4/6 справляють свій вплив через фосфорилування ретинобластомного білка (pRb). Після завершення фосфорилування, pRb втрачає свій пригнічувальний вплив на транскрипцію генів, що стимулюють входження до S-фази. У протилежність до цього, наслідком специфічного пригнічення активності кіназ CDK4/6 INK4 ендогенним білковим модулятором p16 або дрібномолекулярними інгібіторами є одержання гіпофосфорилованого pRb та затримка клітин у точці рестрикції G1. Як основний механізм регуляції точки рестрикції G1, шлях, регульований цими кіназами, змінюється у широкому спектрі людських пухлин і, таким чином, пригнічення CDK4/CDK6 у цих пухлинах чинить терапевтично сприятливу дію, запобігаючи поділу клітин. Pim-1 являє собою серин/треонін-кіназу, яка регулює різноманітні біологічні функції, у тому числі розвиток клітинного циклу, шляхи транскрипції/трансдукції сигналів та апоптоз, експресія якої пов'язується з раками декількох типів, у тому числі, раком крові, раком передміхурової залози та раком ротової порожнини (M. Bachmann, and T. Moroy, Int. J. Biochem. Cell Biol., 2005. 37(4): p. 726-30). Інгібітори кіназ є відомими у цій галузі. У WO 98/11095 описаний ряд заміщених 2lck піримідинамінів, охарактеризованих як інгібітори кіназ, зокрема, кіназ p56 , ZAP-70 та протеїнкінази C. У WO 98/11095 не описано пригнічення Cdks. Ряд 2-(піридин-2-іламіно)-піридо-[2,3-d]-піримідин-7-онів, охарактеризованих як такі, що мають активність з пригнічення CDK4/6, описані в WO 03/062236. Ці сполуки охарактеризовані як такі, що є придатними для лікування клітинно-проліферативних розладів, наприклад, раку та рестенозу. Однак, згадані сполуки є недостатньо розчинні у водному розчині і не демонструють значної активності пригнічення інших (не-Cdk) кіназ-мішеней. Залишається потреба у інгібіторах CDK4/6, які можуть застосовуватись для лікування клітинно-проліферативних розладів, таких як рак. Цей винахід пропонує інгібітори CDK4/6. Деякі сполуки за цим винаходом є більш активними інгібіторами CDK4/6, ніж деякі сполуки, відомі у цій галузі. Крім того, існує потреба у інгібіторах CDK4/6, які є селективними відносно CDK4/6, порівняно з іншими Cdks, і, завдяки цьому, здатними до спричинення специфічної затримки G1 у разі присутності у фармакологічно відповідних концентраціях. Цей винахід пропонує інгібітори CDK4/6, що є здатними до спричинення специфічної затримки G 1 у разі присутності у фармакологічно прийнятних концентраціях. Залишається також потреба у інгібіторах CDK4/6 з поліпшеною розчинністю у водному розчині. Деякі сполуки за цим винаходом мають поліпшену розчинність у водному розчині, порівняно з певними сполуками, відомими у цій галузі. Крім того, залишається потреба у інгібіторах CDK4/6, які мають поліпшений розподіл у тканині головного мозку і можуть, завдяки цьому, застосовуватись для лікування розладів, які проявляються в головному мозку, наприклад, первинних та метастатичних пухлин головного мозку. Деякі сполуки за цим винаходом мають поліпшений розподіл у тканині головного мозку. Існує також потреба у інгібіторах CDK4/6 з добрими фармакокінетичними властивостями, такими як придатність для перорального введення. Деякі сполуки за цим винаходом мають поліпшену придатність для перорального введення, у порівнянні з певними сполуками, відомими у цій галузі. Також, існує потреба у інгібіторах кіназ, які мають вторинну пригнічувальну активність по відношенню до інших не-Cdk кіназ, наприклад, Pim-1-кінази. Певні сполуки за цим винаходом мають подвійну пригнічувальну активність як по відношенню до CDK4/6, так і по відношенню до Pim-1-кінази. Цей винахід пропонує сполуки формули I: (I), 50 1 UA 104603 C2 5 10 15 20 25 30 35 40 45 50 55 60 де R1 – C3-C5-алкіл, C3-C5-циклоалкіл або циклопропілметил; R2 та R3 – H або фтор, де щонайменше один із R2 або R3 – фтор; R4 – H або CH3; R5 – C1-C6 алкіл або -NR6R7, де R6 та R7 – C1-C3-алкіл; Q – CH2, O, S або безпосередній зв'язок; та W та Y – C або N, де щонайменше один із W або Y – N, та де якщо Q – O або S, то W – C; або фармацевтично прийнятні солі цих сполук. Цей винахід пропонує фармацевтичну композицію, яка містить сполуку за цим винаходом або фармацевтично прийнятну сіль цієї сполуки та фармацевтично прийнятні носій, розріджувач або допоміжну речовину. Цей винахід пропонує сполуку за цим винаходом або фармацевтично прийнятну сіль цієї сполуки для застосування у терапії. Цей винахід пропонує сполуку за цим винаходом або фармацевтично прийнятну сіль цієї сполуки для застосування при лікуванні раку. Зокрема, цей рак вибраний з групи, яку складають рак ободової та прямої кишки, рак молочної залози, рак легенів, особливо недрібноклітинний рак легенів (NSCLC), рак простати, гліобластома, лімфома клітин кори головного мозку (MCL), хронічний мієлоїдний лейкоз (CML) та гострий мієлоїдний лейкоз (AML). Цей винахід також пропонує спосіб лікування раку, вибраного з групи, яку складають рак ободової та прямої кишки, рак молочної залози, рак легенів, особливо недрібноклітинний рак легенів (NSCLC), рак простати, гліобластома, лімфома клітин кори головного мозку, хронічний мієлоїдний лейкоз та гострий мієлоїдний лейкоз у ссавця, який включає введення в організм ссавця, який потребує такого лікування, ефективної кількості сполуки за цим винаходом або фармацевтично прийнятної солі цієї сполуки. Крім того, цей винахід пропонує застосування сполуки за цим винаходом або фармацевтично прийнятної солі цієї сполуки для виготовлення лікарського засобу для лікування раку. Зокрема, цей рак вибраний з групи, яку складають рак ободової та прямої кишки, рак молочної залози, рак легенів, особливо недрібноклітинний рак легенів (NSCLC), рак простати, гліобластома, лімфома клітин кори головного мозку, хронічний мієлоїдний лейкоз та гострий мієлоїдний лейкоз. Крім того, цей винахід пропонує фармацевтичну композицію для застосування у терапії, яка містить сполуку за цим винаходом або фармацевтично прийнятну сіль цієї сполуки та фармацевтично прийнятні носій, розріджувач або допоміжну речовину. Цей винахід також пропонує фармацевтичну композицію для лікування раку ободової та прямої кишки, раку молочної залози, раку легенів, особливо недрібноклітинного раку легенів (NSCLC), раку простати, гліобластоми, лімфоми клітин кори головного мозку, хронічного мієлоїдного лейкозу та гострого мієлоїдного лейкозу, яка містить сполуку за цим винаходом або фармацевтично прийнятну сіль цієї сполуки та фармацевтично прийнятні носій, розріджувач або допоміжну речовину. Загальні хімічні терміни, вжиті вище у формулах, мають свої звичайні значення. Наприклад, термін "C3-C5-алкіл" означає нерозгалужений або розгалужений, одновалентний, насичений аліфатичний ланцюг з трьох-п'яти атомів вуглецю та охоплює, проте без обмеження, н-пропіл, ізопропіл, н-бутил, ізобутил, втор-бутил та трет-бутил. Термін "C3-C5-циклоалкіл" означає насичену вуглецеву циклічну систему, яка містить трип'ять атомів вуглецю. Фахівцю має бути зрозуміло, що більшість або всі сполуки за цим винаходом здатні утворювати солі. Сполуки за цим винаходом є амінами, та відповідно реагують з будь-якою з численних неорганічних та органічних кислот з утворенням фармацевтично прийнятних солей з кислотами. Такі фармацевтично прийнятні солі з кислотами та загальна методологія їх одержання є добре відомими в галузі. Дивись, наприклад, P. Stahl, et al., HANDBOOK OF PHARMACEUTICAL SALTS: PROPERTIES, SELECTION AND USE, (VCHA/Wiley-VCH, 2002); L.D. Bighley, S.M. Berge, D.C. Monkhouse, у "Encyclopedia of Pharmaceutical Technology". Eds. J. Swarbrick and J.C. Boylan, Vol. 13, Marcel Dekker, Inc., New York, Basel, Hong Kong 1995, стор. 453-499; S.M. Berge, et al., "Pharmaceutical Salts", Journal of Pharmaceutical Sciences, Vol. 66, No. 1, January 1977. Серед солей перевага віддається гідрохлоридам та мезилатам. Солями, яким віддається особлива перевага, є мезилати. За варіантом, якому віддається перевага, цей винахід охоплює сполуки Формули I, де R1 – ізопропіл, циклопропіл, циклопентил або циклопропілметил. За варіантом, якому віддається більша перевага, R1 – ізопропіл. 2 UA 104603 C2 5 10 15 За варіантом, якому віддається перевага, цей винахід охоплює сполуки Формули I, де R2 – фтор, та R3 – водень. За варіантом, якому віддається перевага, цей винахід охоплює сполуки Формули I, де R2 – водень, та R3 – фтор. За варіантом, якому віддається найбільша перевага, кожен з R2 та R3 є фтором. За варіантом, якому віддається перевага, цей винахід охоплює сполуки Формули I, де R4 – водень. Альтернативно R4 за варіантом, якому віддається перевага, – метил. За варіантом, якому віддається найбільша перевага, R4 – водень. За варіантом, якому віддається перевага, цей винахід охоплює сполуки Формули I, де R5 – C1-C3-алкіл або -NR6R7, де R6 та R7 – C1-C3-алкіл. За варіантом, якому віддається більша перевага, R6 та R7 – етил. За варіантом, якому віддається більша перевага, R5 – C1-C3-алкіл. За варіантом, якому віддається найбільша перевага, R5 – етил. За варіантом, якому віддається перевага, цей винахід охоплює сполуки Формули I, де Q – CH2 або безпосередній зв'язок. За варіантом, якому віддається найбільша перевага, Q – CH2. За варіантом, якому віддається перевага, цей винахід охоплює сполуки Формули I, де Y – N. За варіантом, якому віддається перевага, цей винахід охоплює сполуки Формули I, де W – N. За варіантом, якому віддається перевага, цей винахід охоплює сполуки Формули I, де обидва з W та Y – N. До сполук за цим винаходом, яким віддається перевага, належать сполуки формули: F N F N R1 N N HN N N Q R4 20 25 30 35 40 45 R5 W , Формула II де: R1 – ізопропіл, циклопропіл, циклопентил або циклопропілметил; R4 – H або CH3; R5 – C1-C3-алкіл; Q – CH2, O або безпосередній зв'язок; та W – C або N, де якщо Q – O, то W – C; або фармацевтично прийнятні солі цих сполук. Особлива перевага віддається сполукам, приклади яких наведені у цьому описі, або фармацевтично прийнятним солям цих сполук. Сполукою, якій віддається більш особлива перевага, є [5-(4-етилпіперазин-1-ілметил)піридин-2-іл]-[5-фтор-4-(7-фтор-3-ізопропіл-2-метил3H-бензимідазол-5-іл)піримідин-2-іл]амін або фармацевтично прийнятна сіль цієї сполуки. [5-(4етилпіперазин-1-ілметил)піридин-2-іл]-[5-фтор-4-(7-фтор-3-ізопропіл-2-метил-3H-бензимідазол5-іл)піримідин-2-іл]амін може мати альтернативну назву 2-піримідинамін-N-[5-[(4-етил-1піперазиніл)метил]-2-піридиніл]-5-фтор-4-[4-фтор-2-метил-1-(1-метилетил)-1H-бензимідазол-6іл]. Особлива перевага віддається кристалічній формі III [5-(4-етилпіперазин-1-ілметил)піридин2-іл]-[5-фтор-4-(7-фтор-3-ізопропіл-2-метил-3H-бензимідазол-5-іл)піримідин-2-іл]аміну, яка характеризується порошковою рентгенодифрактограмою (джерело випромінення CuKα, (λ=1,54056 A), яка містить пік при 21,29 (±0,1° 2θ), та факультативно одним або декількома піками, вибраними з групи, яка включає в себе 11,54, 10,91, та 12,13 (2θ±0,1°). Кристалічна форма III [5-(4-етилпіперазин-1-ілметил)піридин-2-іл]-[5-фтор-4-(7-фтор-3-ізопропіл-2-метил-3H13 бензимідазол-5-іл)піримідин-2-іл]аміну може також характеризуватися спектром C ЯМР, який -1 містить піки хімічних зсувів ν(F1) [млн ] при 112,7, 127,3 та 129,4. Сполуки за цим винаходом є специфічними інгібіторами CDK4 та CDK6, і тому є корисними при лікуванні захворювань або розладів, які характеризуються аномальною проліферацією клітин. Зокрема, сполуки за цим винаходом є корисними при лікуванні раку. 3 UA 104603 C2 5 10 15 20 25 30 35 40 CDK4 та CDK6 модулюють свій вплив на клітиннний цикл через фосфорилування pRb. Сполуки за цим винаходом, що є активними інгібіторами активності CDK4/6 і, отже, фосфорилування pRb, будуть пригнічувати проліферацію клітин (і, отже, ріст пухлин) у разі раку будь-якого типу, де клітини проліферують і містять функціональний, інтактний ген Rb1 (який + кодує pRb). Таким чином, сполуки за цим винаходом є корисними при лікуванні pRb раків, таких як рак ободової та прямої кишки, рак молочної залози, рак легенів, рак простати, хронічний мієлоїдний лейкоз, гострий мієлоїдний лейкоз (Fry D.W. et al. Mol. Cancer Ther. (2004), 3(11), 1427), лімфома клітин кори головного мозку (Marzec M. et al., Blood (2006), 108(5), 1744) рак яєчників (Kim T.M. et al., Cancer Research (1994), 54, 605), рак підшлункової залози (Schutte M. et al., Cancer Research (1997), 57, 3126) злоякісна меланома та метастатична злоякісна меланома (Maelandsmo G.M. et al., British Journal of Cancer (1996), 73, 909), у ссавців. Сполуки за цим винаходом також ймовірно є корисними при лікуванні рабдоміосаркоми (Saab R. et al., Mol. Cancer Ther. (2006), 5(5), 1299) та множинної мієломи (Baughn L.B. et al., Cancer Res. (2006), 66(15), 7661) у ссавців. Серед ссавців перевага при лікуванні віддається людині. Також сполуки за цим винаходом, яким віддається перевага, демонструють корисну властивість, яка полягає у тому, що вони мають поліпшений розподіл у тканині головного мозку. Наприклад, у разі застосування на пацючій моделі сполуки за Прикладом 16, коефіцієнт експозиції у головному мозку:плазмі (визначений із застосуванням площі під кривою (AUC) або максимальних концентрацій у плазмі та головному мозку (Cmax), дивись Таблицю 6c) дорівнює приблизно 1, що вказує на те, що сполука за Прикладом 16 добре розподіляється у головному мозку. У протилежність до цього, автори винаходу визначили, що сполука, якій віддається перевага у WO 03/062236 (6-ацетил-8-циклопентил-5-метил-2-(5-піперазин-1-іл-піридин-2іламіно)-8H-піридо[2,3-d]піримідин-7-он), демонструє коефіцієнти розподілу у головному мозку:плазмі 0,17 (AUC) та 0,1 (Cmax), що вказують на те, що згадана сполука на цій моделі у тканині головного мозку розподіляється відносно слабко. Отже, сполуки за цим винаходом, яким віддається перевага, здатні проникати в головний мозок, і тому є корисними при лікуванні первинних та метастатичних пухлин головного мозку, де клітини проліферують та містять + функціональний інтактний ген Rb1. До прикладів таких pRb пухлин головного мозку належать гліобластома, а також медулобластома та астроцитома (Lee W.-H. et al., Science (1987), 235, 1394). Темозоломід (temozolomide) є цитотоксичним ДНК-алкілувальним агентом, який застосовують для лікування пухлин головного мозку, в тому числі гліобластоми та астроцитоми (Friedman H.S. et al. (2000), Clin. Cancer Res. 6(7): 2585-2597), в тому числі метастазів меланоми, раку молочної залози та недрібноклітинного раку легенів (NSCLC) у головний мозок (Siena S. et al. (2009) Annals of Oncology, doi:10.1093/annonc/mdp343). Темозоломід взаємодіє з ДНК, спричинюючи хімічне модифікування/пошкодження (Marchesi F., et al. (2007), Pharmacol. Res. 56(4): 275-287). Сполуки за цим винаходом можна застосовувати в комбінації з + темозоломідом для лікування первинних та метастатичних pRb пухлин головного мозку, таких як гліобластома та астроцитома, наприклад, коли такі метастази походять з меланоми, раку молочної залози або недрібноклітинного раку легенів (NSCLC). Гідрохлорид гемцитабіну (Gemcitabine), аналог нуклеозиду, який виявляє протипухлинну активність, – моногідрохлорид 2’-дезокси-2’,2’-дифторцитидину (β-ізомер), також відомий як моногідрохлорид 2’,2’-дифтор-2’-дезоксицитидину або як 1-(4-аміно-2-оксо-1H-піримідин-1-іл)-2дезокси-2’,2’-дифторрибоза. Гідрохлорид гемцитабіну описаний у патенті США № 5,464,826. Структурна формула зображена нижче: NH2 HCI N HO H 45 50 O F N O F HO Гідрохлорид гемцитабіну є ефективним при лікуванні недрібноклітинного раку легенів (NSCLC) (Sandler A. та Ettinger D.S., (1999), The Oncologist, 4, 241), раку підшлункової залози (Pino S.M. et al., (2004), Current Gastroenterology Reports, 6, 119), раку яєчників (Pfisterer J. et al., (2006), Journal of Clinical Oncology, 24(29), 4699) та метастатичного раку молочної залози (Chan S., et al., (2009), Journal of Clinical Oncology, 27(11), 1753). Сполуки за цим винаходом можна застосовувати в комбінації з гідрохлоридом гемцитабіну для лікування недрібноклітинного раку 4 UA 104603 C2 5 10 15 20 25 30 35 40 45 50 55 60 легенів (NSCLC), раку підшлункової залози, раку яєчників та метастатичного раку молочної залози. Сполуки за цим винаходом можна застосовувати в способі лікування раку, зокрема, ракових захворювань, описаних вище, у ссавця, який включає введення в організм ссавця, який потребує такого лікування, ефективної кількості сполуки за цим винаходом. За варіантом здійснення цього винаходу, якому віддається перевага, сполуки за цим винаходом можна застосовувати в способі лікування раку, вибраного з групи, яку складають рак ободової та прямої кишки, лімфома клітин кори головного мозку, рак молочної залози, гліобластома, гострий мієлоїдний лейкоз та рак легенів, особливо недрібноклітинний рак легенів (NSCLC). За іншим варіантом здійснення цього винаходу, якому віддається перевага, сполуки за цим винаходом можна застосовувати в способі лікування раку, вибраного з групи, яку складають рак ободової та прямої кишки, гліобластома, гострий мієлоїдний лейкоз та рак легенів. За іншим варіантом здійснення цього винаходу, якому віддається перевага, сполуку за цим винаходом можна застосовувати в способі лікування гліобластоми або астроцитоми у ссавця, який включає введення в організм ссавця, який потребує такого лікування, терапевтично ефективної комбінації сполуки за цим винаходом та темозоломіду. За іншим варіантом здійснення цього винаходу, якому віддається перевага, сполуку за цим винаходом можна застосовувати в способі лікування недрібноклітинного раку легенів (NSCLC), раку підшлункової залози, раку яєчників або метастатичного раку молочної залози у ссавця, який включає введення в організм ссавця, який потребує такого лікування, терапевтично ефективної комбінації сполуки за цим винаходом та гідрохлориду гемцитабіну. Сполуки за цим винаходом можна застосовувати для лікування ракового захворювання, зокрема, ракових захворювань, описаних вище. За варіантом здійснення цього винаходу, якому віддається перевага, сполуки за цим винаходом можна застосовувати для лікування раку, вибраного з групи, яку складають рак ободової та прямої кишки,лімфома клітин кори головного мозку, рак молочної залози, гліобластома, гострий мієлоїдний лейкоз та рак легенів, особливо недрібноклітинний рак легенів (NSCLC). За іншим варіантом здійснення цього винаходу, якому віддається перевага, сполуки за цим винаходом можна застосовувати для лікування раку, вибраного з групи, яку складають рак ободової та прямої кишки, гліобластома, гострий мієлоїдний лейкоз та рак легенів. За іншим варіантом здійснення, якому віддається перевага, цей винахід пропонує сполуку за цим винаходом для одночасного, окремого або послідовного застосування в комбінації з темозоломідом при лікуванні гліобластоми або астроцитоми. За іншим варіантом здійснення, якому віддається перевага, цей винахід пропонує сполуку за цим винаходом для одночасного, окремого або послідовного застосування в комбінації з гідрохлоридом гемцитабіну при лікуванні недрібноклітинного раку легенів (NSCLC), раку підшлункової залози, раку яєчників або метастатичного раку молочної залози. Крім того, сполуки за цим винаходом можна застосовувати для виготовлення лікарського засобу для лікування раку, зокрема, ракових захворювань, описаних вище. За варіантом здійснення цього винаходу, якому віддається перевага, сполуки за цим винаходом можна застосовувати для виготовлення лікарського засобу для лікування раку, вибраного з групи, яку складають рак ободової та прямої кишки, лімфома клітин кори головного мозку, рак молочної залози, гліобластома, гострий мієлоїдний лейкоз та рак легенів, особливо недрібноклітинний рак легенів (NSCLC). За іншим варіантом здійснення цього винаходу, якому віддається перевага, сполуки за цим винаходом можна застосовувати для виготовлення лікарського засобу для лікування раку, вибраного з групи, яку складають рак ободової та прямої кишки, гліобластома, гострий мієлоїдний лейкоз та рак легенів. За іншим варіантом здійснення, якому віддається перевага, цей винахід пропонує застосування сполуки за цим винаходом для виготовлення лікарського засобу для лікування гліобластоми або астроцитоми, причому цей лікарський засіб також містить темозоломід або призначений для одночасного, окремого або послідовного введення з темозоломідом. За іншим варіантом здійснення, якому віддається перевага, цей винахід пропонує застосування сполуки за цим винаходом для виготовлення лікарського засобу для лікування недрібноклітинного раку легенів (NSCLC), раку підшлункової залози, раку яєчників або метастатичного раку молочної залози, причому цей лікарський засіб також містить гідрохлорид гемцитабіну або призначений для одночасного, окремого або послідовного введення з гідрохлоридом гемцитабіну. Цей винахід також пропонує фармацевтичну композицію для лікування раку, зокрема, ракових захворювань, описаних вище, яка містить сполуку за цим винаходом або фармацевтично прийнятну сіль цієї сполуки разом із фармацевтично прийнятним носієм. За варіантом здійснення, якому віддається перевага, цей винахід також пропонує фармацевтичну композицію для лікування раку, вибраного з групи, яку складають рак ободової та прямої кишки, 5 UA 104603 C2 5 10 15 20 25 30 35 40 45 50 55 60 лімфома клітин кори головного мозку, рак молочної залози, гліобластома, гострий мієлоїдний лейкоз та рак легенів, особливо недрібноклітинний рак легенів (NSCLC), яка містить сполуку за цим винаходом або фармацевтично прийнятну сіль цієї сполуки разом із фармацевтично прийнятним носієм. За варіантом здійснення, якому віддається перевага, цей винахід також пропонує фармацевтичну композицію для лікування раку, вибраного з групи, яку складають рак ободової та прямої кишки, гліобластома, гострий мієлоїдний лейкоз та рак легенів, яка містить сполуку за цим винаходом або фармацевтично прийнятну сіль цієї сполуки разом із фармацевтично прийнятним носієм. За іншим варіантом здійснення, якому віддається перевага, цей винахід пропонує фармацевтичну композицію для лікування гліобластоми або астроцитоми, яка містить сполуку за цим винаходом та темозоломід, разом із фармацевтично прийнятним носієм. За іншим варіантом здійснення, якому віддається перевага, цей винахід пропонує фармацевтичну композицію для лікування недрібноклітинного раку легенів (NSCLC), раку підшлункової залози, раку яєчників або метастатичного раку молочної залози, яка містить сполуку за цим винаходом та гідрохлорид гемцитабіну, разом із фармацевтично прийнятним носієм. Цей винахід також пропонує фармацевтичну композицію, яка містить сполуку за цим винаходом або фармацевтично прийнятну сіль цієї сполуки та темозоломід разом із фармацевтично прийнятним носієм, розріджувачем або допоміжною речовиною. Цей винахід також пропонує фармацевтичну композицію, яка містить сполуку за цим винаходом або фармацевтично прийнятну сіль цієї сполуки та гідрохлорид гемцитабіну разом із фармацевтично прийнятним носієм, розріджувачем або допоміжною речовиною. Цей винахід також пропонує фармацевтичну композицію, яка містить сполуку за цим винаходом або фармацевтично прийнятну сіль цієї сполуки разом із фармацевтично прийнятним носієм та факультативно іншими терапевтичними інгредієнтами. Крім того, наведені як приклад сполуки, яким віддається перевага, також є інгібіторами Pim1. Як вказувалось вище, Pim-1 являє собою серин/треонін-кіназу, яка є залученою до регуляції різноманітних біологічних функцій, у тому числі розвитку клітинного циклу, шляхів транскрипції/трансдукції сигналів та апоптозу, експресія якої пов'язується з раками декількох типів. Зокрема, було показано, що пригнічення Pim-1 дрібномолекулярним інгібітором K00135 порушує виживаність та клоногенний ріст панелі клітин людського гострого лейкозу (Pogacic, V., et al., Cancer Res. (2007). 67(14): p. 6916-24). Окрім того, було показано, що Pim-1 експресується у неоінтимі сонних артерій пацюків, пошкоджених балонним катетером, який вводиться до просвіту судин, та у грудних аортах і коронарних артеріях людей з потовщенням інтими. Крім того, специфічне пригнічення функції Pim-1 явно пригнічує як утворення неоінтими після пошкодження балонним катетером, який вводиться до просвіту судин, так і проліферацію культивованих гладеньком'язових клітин судин (VSMCs), що дозволяє припустити, що Pim-1 відіграє критичну роль у проліферації таких клітин. Проліферація VSMCs залучена до патогенезу оклюзивних судинних захворювань, наприклад, атеросклерозу і рестенозу, і тому очікується, що пригнічення Pim-1 буде пригнічувати проліферацію VSMC і, таким чином, буде корисним при лікуванні оклюзивних судинних захворювань (Katakami N., et al., JBC (2004), 279(52), 54742-54749). Відповідно, сполуки за цим винаходом, яким віддається перевага, або фармацевтично прийнятні солі цих сполук можна застосовувати в способі лікування оклюзивного судинного захворювання, такого як атеросклероз або рестеноз у ссавця, який включає введення в організм ссавця, який потребує такого лікування, ефективної кількості сполуки за цим винаходом. Сполуки за цим винаходом, яким віддається перевага, або фармацевтично прийнятні солі цих сполук можна застосовувати при лікуванні оклюзивного судинного захворювання, такого як атеросклероз або рестеноз. Крім того, сполуки за цим винаходом, яким віддається перевага, або фармацевтично прийнятні солі цих сполук можна застосовувати для виготовлення лікарського засобу для лікування оклюзивного судинного захворювання, такого як атеросклероз або рестеноз. Цей винахід також пропонує фармацевтичну композицію для лікування оклюзивного судинного захворювання, такого як атеросклероз або рестеноз, яка містить сполуку за цим винаходом, якій віддається перевага, або фармацевтично прийнятну сіль цієї сполуки. При вживанні у цьому описі, "год" означає годину або години, "хв" означає хвилину або хвилини, "Cdk" означає циклінзалежну кіназу, "pRb" означає білок ретинобластоми, "MCL" означає лімфому клітин кори головного мозку, "AML" означає гострий мієлоїдний лейкоз, "CML" означає хронічний мієлоїдний лейкоз, "Boc" означає N-трет-бутоксикарбоніл, "EA" означає етилацетат, "DCM" означає дихлорметан, "DMSO" означає диметилсульфоксид, "DMA" означає диметилацетамід, "THF" означає тетрагідрофуран, "MtBE" означає метил-трет-бутиловий ефір, 6 UA 104603 C2 5 10 15 20 "TEA" означає триетиламін, "FBS" означає сироватку плода корови, "PBS" означає забуферений фосфатом фізіологічний розчин, "BSA" означає бичачий сироватковий альбумін, "к.т." означає кімнатну температуру, "мг/кг" означає міліграми на кілограм, "po" означає per os (перорально), "qd" означає однодобову дозу, "HPLC" означає рідинну хроматографію високого розділення, "q2d" означає одну дозу кожні 2 доби, "q2d10" означає одну дозу кожні 2 доби 10 разів, "VSMC" означає клітини гладеньких м'язів судин та "XRD" означає рентгенівську дифракцію. Сполуки Формули I можуть бути одержані фахівцем у галузі із застосуванням загальновідомих обладнання та методик. Більш конкретно, сполуки Формули I можуть бути одержані за описаними нижче схемами, методами та прикладами. Фахівцю в галузі має бути зрозуміло, що для одержання сполуки Формули I окремі стадії в наведених нижче схемах можна змінювати. Реагенти та вихідні матеріали є легкодоступними для фахівця в галузі. Усі замісники, якщо конкретно на зазначено інше, відповідають наведеному вище визначенню. Назви сполук в наведених нижче підготовчих синтезах та прикладах утворені із застосуванням програми ChemDraw Ultra 5,0. Схеми Синтез сполук Формули I ілюстрований підготовчими синтезами, прикладами та схемами, де 1 2 3 4 5 R , R , R , R , R , Q, W та Y відповідають наведеним вище визначенням. Схема 1 Сполуки Формули I одержують із застосуванням каталізованих паладієм (0) реакцій сполучення, як показано на схемі 1: 5 25 Як показано на верхній реакції схеми 1, якщо Z – R , то піримідиніл-бензимідазолхлорид (A) вводять у взаємодію з піридиніламіном (B) за допомогою каталізованої паладієм реакції сполучення, з утворенням безпосередньо сполуки Формули I. Як показано на нижній реакції схеми 1, якщо Y-Z – N-трет-бутоксикарбоніл (Boc), то піримідинілгалогенід (A) також сполучають з піридиніламіном (B), а Boc-групу видаляють дією сильної кислоти з одержанням вільного аміну (C). На закінчення, амін (C) алкілують у 7 UA 104603 C2 відновлювальних умовах з одержанням сполуки Формули I. Схема 2 Підготовчий синтез піримідиніл-бензимідазолів (A) 3 2 R R Cl N N N O Cl 5 Pd(II) + (A) N B R1 O (E) (D) Піримідиніл-бензимідазоли (A) одержують із застосуванням каталізованих паладієм (II) реакцій сполучення наявних у продажу піримідиніл дихлоридів (D) та бензимідазолборатів (E). Схема 3 Підготовчий синтез бензимідазолборатів (E) F N HN Br F 2 R R1 (F) N (E) N Br NH2 H N Br (G) 10 15 20 25 30 R1 (H) R1 Бензимідазолборати (E) одержують шляхом каталізованого Pd(II) борилування броміду в бензимідазолах (H) біс(пінаколато)дибором. Бензимідазоли (H) в свою чергу одержують шляхом циклізування амідинів (F) трет-бутилатом калію або конденсування бензолдіамінів (G) з триетилортоацетатом/оцтовою кислотою. Амідини (F) одержують як відомо фахівцю у галузі органічного синтезу конденсуванням 4бром-2,6-дифторфеніламіну з моно-ацетамідним похідним амінів R1-NH2 у присутності фосфорилхлориду. Бензолдіаміни (G) одержують у дві стадії як відомо фахівцю у галузі органічного синтезу шляхом заміни брому в 2 положенні в 2,4-дибром-нітробензолі амінами R1NH2 з подальшим відновленням нітрогрупи до аміногрупи. Схема 4 Підготовчий синтез піридиніламінів (B), де Q – S або O, та W – C Синтез піридиніламінів (B), де Q – S або O та W – C, виконують шляхом заміни 5-галогеніду у піридині (I) наявним у продажу тіолом або спиртом (J). Якщо потрібен нітропіридин (I), замінений продукт у подальшому піддають стадії нітровідновлення з одержанням сполуки (B). Слід зазначити, що сполуки (I) є універсальними реактивами для усіх наведених схем, але тільки деякі з них наявні у продажу у вигляді піридиламінів та деякі у вигляді нітропіридинів. Однак наявні у продажу сполуки (I) можна перетворити із застосуванням реакцій аміноокиснювання або нітровідновлення, відомих у галузі, для технологічних послідовностей, опис яких наведено тут та нижче. Схема 5 8 UA 104603 C2 Підготовчий синтез піридиніламінів (B), де Q – CH2 5 10 15 20 Синтез піридиніламінів (B), де Q – CH2 виконують двома шляхами: 1) Наявні у продажу сполуки карбальдегіди (K) піддають відновлювальному амінуванню вільним аміном (L), після чого каталізованим Pd(0) амінуванням замінюють піридинбромід літій-1,1,1,3,3,3гексаметилдисилазаном або рідким аміаком та оксидом міді(I). 2) Наявний у продажу 1піперидинкарбонової кислоти, 4-метилен-, 1,1-диметилетиловий складний ефір (M) піддають гідроборуванню, з подальшим каталізованим Pd (II) сполученням з піридиламіном (I). Схема 6 Підготовчий синтез піридиніламінів (B), де Q –безпосередній зв'язок Синтез піридиніламінів (B), де Q – безпосередній зв'язок, виконують двома шляхами: 1) Наявний у продажу 1(2H)-піридинкарбонової кислоти, 3,6-дигідро-4-(4,4,5,5-тетраметил-1,3,2діоксаборолан-2-іл)-, 1,1-диметилетиловий складний ефір (N) піддають каталізованому паладієм (II) сполученню з нітропіридином (I) з подальшим відновленням як нітрогрупи, так і подвійного зв'язка. 2) Бромід у нітропіридині (I) замінюють вільним аміном (L), після чого відновлюють нітрогрупу. Підготовчий синтез 1 Трет-бутиловий складний ефір 4-(6-амінопіридин-3-ілсульфаніл)піперидин-1-карбонової кислоти 9 UA 104603 C2 5 10 15 20 Додають безводний толуол (6,06 мл) до суміші 2,9-диметил-1,10-фенантроліну (76,52 мг), йодид міді(I) (69,27 мг), трет-бутилат натрію (475,59 мг), трет-бутиловий складний ефір 4меркаптопіперидин-1-карбонової кислоти (583,5 мг), магній (49,10 мг) та 2-аміно-5-йодпіридин (550 мг). Барботують азот через суміш з обробкою ультразвуком, та струшують утворену суспензію при 110 °C в запаяній трубці протягом 24 год. Охолоджують, та фільтрують через целіт. Промивають толуолом, та видаляють розчинник у вакуумі. Додають суміш гексан/EA (1/1), фільтрують через шар целіту/силікагелю, та промивають двічі сумішшю гексан/EA (1/1), а потім – EA. Видаляють розчинник у вакуумі. Очищають хроматографією на колонці із силікагелем, елююючи сумішшю гексан/EA (50-75 %), та одержують 630 мг вказаної в заголовку сполуки. MS + + (ES ): m/z=310 (M+H) . Підготовчий синтез 2 5-фтор-2-нітропіридин До сірчаної кислоти (46 мл) при 0C додають 25 % розчин пероксиду водню (26,98 мл) на відкритому повітрі. Через 5 хв додають краплями холодний розчин 2-аміно-5-фторпіридину (9 г) у концентрованій сірчаній кислоті (46 мл) через краплинну лійку. Одержаний темний розчин, який мав температуру 0°C, витримують до досягнення кімнатної температури при перемішуванні на бані протягом ночі. Виливають у 200 мл охолодженої льодом води, та екстрагують DCM. Промивають об'єднані органічні шари 5 % водним розчином бісульфіту натрію, та сушать безводним сульфатом натрію. Видаляють розчинник у вакуумі, та очищають хроматографією на колонці із силікагелем, елююючи DCM, та одержують 7,5 г вказаної в + + заголовку сполуки. MS (ES ): m/z=143 (M+H) . Зазначену нижче сполуку одержують по суті за методикою, описаною для 5-фтор-2нітропіридину, із застосуванням відповідного аміну: Підготовчий синтез 3 Сполука MS (ES+): m/z (M+H)+ 3-бром-2-метил-6-нітропіридин 218 25 30 35 Підготовчий синтез 4 1-ізопропіл-4-(2-метил-6-нітропіридин-3-іл)піперазин Перемішують 3-бром-2-метил-6-нітропіридин (2,46 г), 1-ізопропілпіперазин (2,74 г), йодид тетра-н-бутиламонію (418,69 мг) та карбонат калію (1,72 г) у диметилсульфоксиді (DMSO, 20 мл) при 65°C протягом ночі. Додають EA та воду, розділяють одержані фази, сушать органічний шар сульфатом магнію, та видаляють розчинник у вакуумі. Очищають через картридж із сильною катіонообмінною смолою, елююючи метанолом, а потім сумішшю метанолу та 2 н + + розчину NH3, та одержують 2,58 г вказаної в заголовку сполуки. MS (ES ): m/z=265 (M+H) . Зазначені нижче проміжні сполуки одержують по суті за методикою, описаною для 1ізопропіл-4-(2-метил-6-нітропіридин-3-іл)піперазину, із застосуванням відповідної похідної брому: Підготовчий синтез 5 6 40 45 Сполука трет-бутиловий складний ефір (2'-метил-6'-нітро-3,4,5,6тетрагідро-2H-[1,3']біпіридиніл-4-іл)карбамінової кислоти трет-бутиловий складний ефір (6'-нітро-3,4,5,6-тетрагідро2H-[1,3']біпіридиніл-4-іл)карбамінової кислоти MS (ES+): m/z (M+H)+ 337 323 Підготовчий синтез 7 5-(4-ізопропілпіперазин-1-іл)-6-метилпіридин-2-іламін Перемішують 1-ізопропіл-4-(2-метил-6-нітропіридин-3-іл)піперазин (2,52 г) та 10 % розчин паладію на вугіллі (600 мг) у метанолі (38 мл) та EA (38 мл) у атмосфері H 2, створюваній еластичною камерою, протягом ночі. Фільтрують через шар целіту, та видаляють розчинник у вакуумі. Очищають хроматографією на колонці із силікагелем, елююючи сумішшю + DCM/метанол (0-10 %), та одержують 2,23 г вказаної в заголовку сполуки. MS (ES ): m/z=143 + (M+H) . Зазначені нижче проміжні сполуки одержують по суті за методикою, описаною для 5-(4ізопропілпіперазин-1-іл)-6-метилпіридин-2-іламіну, із застосуванням відповідної нітропохідної: 10 UA 104603 C2 Підготовчий синтез 8 9 5 10 15 20 трет-бутиловий складний ефір (6'-аміно-2'-метил-3,4,5,6тетрагідро-2H-[1,3']біпіридиніл-4-іл)карбамінової кислоти трет-бутиловий складний ефір (6'-аміно-3,4,5,6тетрагідро-2H-[1,3']біпіридиніл-4-іл)карбамінової кислоти 35 40 45 293 O N N 30 307 Підготовчий синтез 10 Трет-бутиловий складний ефір 4-(6-нітропіридин-3-ілокси)піперидин-1-карбонової кислоти Додають трет-бутилат калію (4,84 г) до розчину трет-бутил-4-гідрокси-1піперидинкарбоксилату (8,76 г) у диметилацетаміді (DMA, 39 мл) при 0 °C у атмосфері азоту. Перемішують протягом 1 год., та додають краплями розчин 5-фтор-2-нітропіридину (5 г) у DMA (78 мл). Перемішують реакційну суміш при кімнатній температурі протягом ночі. Додають воду, та витримують протягом 1 год. Фільтрують, промивають водою. Очищають хроматографією на колонці із силікагелем, елююючи сумішшю DCM/EA (0-15 %), та одержують 5,65 г вказаної в + + заголовку сполуки. MS (ES ): m/z=324 (M+H) . Підготовчий синтез 11 Трет-бутиловий складний ефір 4-(6-амінопіридин-3-ілокси)піперидин-1-карбонової кислоти Додають 10 % розчин паладію на вугіллі (0,6 г) до суспензії трет-бутилового складного ефіру 4-(6-нітропіридин-3-ілокси)піперидин-1-карбонової кислоти (5,65 г) у суміші тетрагідрофурану (THF) та метанолу (30/30 мл/мл). Гідрують у апараті Парра (Parr) при 2 атм (0,2 МПа) протягом ночі. Фільтрують через шар целіту, промивають DCM та метанолом. Очищають хроматографією на колонці із силікагелем, елююючи сумішшю DCM/метанол (10 %)/аміак (1 %), та одержують 5 г + + вказаної в заголовку сполуки. MS (ES ): m/z=294 (M+H) . Підготовчий синтез 12 Трет-бутиловий складний ефір 6-аміно-2-метил-3',6'-дигідро-2'H-[3,4']біпіридиніл-1'карбонової кислоти N 25 MS (ES+): m/z (M+H)+ Сполука O Барботують азот через суміш трет-бутилового складного ефіру 4-(4,4,5,5-тетраметил[1,3,2]діоксаборолан-2-іл)-3,6-дигідро-2H-піридин-1-карбонової кислоти (2,46 г) та 5-бром-6метилпіридин-2-іламіну (1,49 г) у 1,4-діоксані (31,82 мл) протягом 5 хв, після чого додають Nгідрат ортофосфату калію (5,07 г), ацетат паладію (35,72 мг), дициклогексил-(2',6'диметоксибіфеніл-2-іл)фосфан (134,69 мг), воду (7,96 мл), та перемішують при 90°C протягом 3 год. Розводять DCM, та промивають водою. Сушать сульфатом натрію, та видаляють розчинник у вакуумі. Очищають хроматографією на колонці із силікагелем, елююючи сумішшю DCM/етанол 5 %/NH3 0,1 %, після чого очищають через картридж із сильною іонообмінною смолою (SCX), елююючи метанолом, а потім сумішшю метанол-NH3 2 M, та одержують 2,12 г + + вказаної в заголовку сполуки. MS (ES ): m/z=292 (M+H) . Підготовчий синтез 13 Трет-бутиловий складний ефір 6-аміно-2-метил-3',4',5',6'-тетрагідро-2'H-[3,4']біпіридиніл-1'карбонової кислоти Перемішують суміш трет-бутилового складного ефіру 6-аміно-2-метил-3',6'-дигідро-2'H[3,4']біпіридиніл-1'-карбонової кислоти (2,12 г) та 10 % розчину паладію на вугіллі (330 мг) у метанолі (29,30 мл) (у вигляді вологої пасти) у атмосфері H 2 (45 фунт на кв. дюйм =310,05 МПа) протягом 48 год. Фільтрують через шар целіту, видаляють розчинник у вакуумі, та одержують + + 2,07 г вказаної в заголовку сполуки. MS (ES ): m/z=292 (M+H) . Підготовчий синтез 14 Трет-бутиловий складний ефір 6-нітро-3',6'-дигідро-2'H-[3,4']біпіридиніл-1'-карбонової кислоти Барботують азот через суміш трет-бутилового складного ефіру 4-(4,4,5,5-тетраметил[1,3,2]діоксаборолан-2-іл)-3,6-дигідро-2H-піридин-1-карбонової кислоти (19,6 г), 5-бром-2нітропіридину (12,87 г), 2M розчину карбонату натрію у воді (63,39 мл) та хлориду біс(трифенілфосфін)паладію(II) (4,45 г) у 1,4-діоксані (316,94 мл) протягом 5 хв, та перемішують суміш при 80C протягом 5 год. Розводять DCM, та промивають водою. Сушать сульфатом 11 UA 104603 C2 5 10 15 20 25 магнію, та видаляють розчинник у вакуумі. Очищають хроматографією на силікагелі, елююючи + сумішшю DCM/EA (0-40 %), та одержують 8,72 г вказаної в заголовку сполуки. MS (ES ): + m/z=306 (M+H) . Підготовчий синтез 15 Трет-бутиловий складний ефір 6-аміно-3',4',5',6'-тетрагідро-2'H-[3,4']біпіридиніл-1'карбонової кислоти Розчиняють трет-бутиловий складний ефір 6-нітро-3',6'-дигідро-2'H-[3,4']біпіридиніл-1'карбонової кислоти (1,89 г) у етанолі (123,80 мл). Гідрують у присутності паладію на вугіллі (протоковий гідрогенізаційний реактор H-Cube, 70 бар =7 МПа, 50C, 1 мл/хв), та одержують + + 1,72 г вказаної в заголовку сполуки. MS (ES ): m/z=278 (M+H) . Підготовчий синтез 16 Трет-бутиловий складний ефір 4-(6-амінопіридин-3-ілметил)піперидин-1-карбонової кислоти Перемішують протягом 5 хв трет-бутиловий складний ефір 4-метилен-піперидин-1карбонової кислоти (5,10 г) у атмосфері азоту, та додають 0,5 M розчин 9борабіцикло[3,3,1]нонану у THF (77,49 мл). Перемішують при 75 °C у атмосфері азоту протягом 1 год. Охолоджують, додають 2-аміно-5-бромпіридин (3,8 г), карбонат калію (3,87 г), хлорид 1,1'біс(дифенілфосфіно)фероцен)паладію(II) (538,10 мг) та знегажену суміш DMF (47,83 мл) та води (4,78 мл). Перемішують при 60 °C протягом 4 год., після чого при кімнатній температурі протягом уїк-енду. Додають воду та EA. Відділяють та екстрагують водний шар етилацетатом. Об'єднують одержані органічні шари, сушать сульфатом натрію, та видаляють розчинник у вакуумі. Очищають хроматографією на колонці із силікагелем, елююючи градієнтом від DCM/метанол (1 %)/аміак (0,1 %) до DCM/метанол (3 %)/аміак (0,3 %). Розтирають одержаний + залишок з етилацетатом, та одержують 1,85 г вказаної в заголовку сполуки. MS (ES ): m/z=292 + (M+H) . Зазначену нижче сполуку одержують по суті за методикою, описаною для трет-бутилового складного ефіру 4-(6-амінопіридин-3-ілметил)піперидин-1-карбонової кислоти, із застосуванням відповідного похідного брому: Підготовчий синтез 17 30 35 40 Сполука трет-бутиловий складний ефір 4-(6-аміно-2метилпіридин-3-ілметил)піперидин-1-карбонової кислоти MS (ES+): m/z (M+H)+ 306 Підготовчий синтез 18 1-(6-бромпіридин-3-ілметил)-4-етилпіперазин Додають нерозведений 1-етилпіперазин (221,44 мл) до суміші 6-бромпіридин-3карбальдегіду (300 г) та DCM (5000 мл). Потім порціями додають триацетоксиборгідрид натрію (372,09 г), та перемішують при кімнатній температурі протягом 12 год. Додають DCM (1000 мл) та 2 н водний розчин гідроксиду натрію (1500 мл). Відділяють одержані шари, та екстрагують двічі водний шар дихлорметаном (600 мл). Об'єднують одержані органічні шари, видаляють розчинник у вакуумі, додають EA, випарюють, та одержують 451,3 г вказаної в заголовку + + сполуки. MS (ES ): m/z=285 (M+H) . Зазначену нижче сполуку одержують по суті за методикою, описаною для 1-(6-бромпіридин3-ілметил)-4-етилпіперазину, із застосуванням відповідного аміну: Підготовчий синтез 50 MS (ES+): m/z (M+H)+ 19 45 Сполука трет-бутиловий складний ефір 4-(6бромпіридин-3-ілметил)піперазин-1-карбонової кислоти 357 Підготовчий синтез 20 5-(4-етилпіперазин-1-ілметил)піридин-2-іламін Повільно додають 1,1,1,3,3,3-гексаметилдисилазан літію (1055 мл) до знегаженої суміші 1(6-бромпіридин-3-ілметил)-4-етилпіперазину (250 г), дициклогексилфосфіно)біфенілу (18,50 г), трис(дибензиліденацетон)дипаладію (24,17 г) та THF (250 мл) при 50°C. Нагрівають одержану суміш до 65°C, і витримують при цій температурі протягом ночі. Охолоджують до 37°C, та додають воду (500 мл). Видаляють половину розчинника у вакуумі, та додають DCM (2,5 л). Фільтрують через шар целіту, та видаляють частину розчинника. Додають метанол (300 мл) та 12 UA 104603 C2 5 10 метил-трет-бутиловий ефір (MtBE, 600 мл) до одержаної суміші, та охолоджують на льодяній бані. Потім додають 2 M розчин хлористоводневої кислоти в етиловому ефірі (800 мл) та 32 % водний розчин хлористоводневої кислоти (100 мл). Видаляють органічний шар, та додають 2 M водний розчин гідроксиду натрію (2500 мл). Екстрагують водну фазу тричі дихлорметаном, та видаляють розчинник у вакуумі. Розчиняють у 90 мл толуолу при 50°C до завершення розчинення, після чого додають 80 мл MtBE. Перемішують протягом ночі при кімнатній температурі. Знову додають MtBE (100 мл) для завершення осадження. Відфільтровують одержану тверду речовину, сушать, та одержують 108,24 г вказаної в заголовку сполуки. MS + + (ES ): m/z=221 (M+H) . Зазначену нижче сполуку одержують по суті за методикою, описаною для 5-(4етилпіперазин-1-ілметил)піридин-2-іламіну, із застосуванням відповідного похідного 2бромпіридину: Підготовчий синтез 20 25 30 35 40 45 50 55 MS (ES+): m/z (M+H)+ 21 15 Сполука трет-бутиловий складний ефір 4-(6-амінопіридин-3ілметил)піперазин-1-карбонової кислоти 293 Підготовчий синтез 22 2,4-дибром-1-нітробензол Додають краплями димлячу азотну кислоту (101,40 мл) до розчину 1,3-дибромбензолу (102,51 мл) у концентрованій сірчаній кислоті (322,79 мл) та воді (62,39 мл) при 0°C. Нагрівають до кімнатної температури, та перемішують протягом 12 год. Виливають реакційну суміш у охолоджену льодом воду (1500 мл). Відфільтровують одержану жовту речовину у вакуумі, + + сушать, та одержують 178,46 г вказаної в заголовку сполуки. MS (ES ): m/z=281 (M+H) . Підготовчий синтез 23 (5-бром-2-нітрофеніл)циклопентиламін Додають циклопентанамін (32 мл) до розчину 2,4-дибром-1-нітробензолу (20 г) у 1-бутанолі (160 мл). Нагрівають одержану суміш до 100°C, та витримують протягом ночі. Видаляють розчинник у вакуумі, додають воду, та екстрагують етилацетатом. Промивають органічний шар послідовно водним насиченим розчином бікарбонату натрію та водою. Сушать сульфатом магнію, видаляють розчинник у вакуумі, та одержують 22 г вказаної в заголовку сполуки. MS + + (ES ): m/z=286 (M+H) . Підготовчий синтез 24 4-бром-N2-циклопентилбензол-1,2-діамін Додають дитіоніт натрію (107,47 г) до розчину 5-бром-2-нітро-феніл)циклопентиламіну (22 г), THF (150 мл), води (150 мл) та гідроксиду амонію (30 мл). Перемішують одержану суміш при кімнатній температурі протягом ночі. Екстрагують двічі етилацетатом, сушать сульфатом магнію, видаляють розчинник у вакуумі, та одержують 14,80 г вказаної в заголовку сполуки. MS + + (ES ): m/z=256 (M+H) . Підготовчий синтез 25 6-бром-1-циклопентил-2-метил-1H-бензимідазол Нагрівають суміш 4-бром-N2-циклопентилбензол-1,2-діаміну (10,6 г), триетилортоацетату (9,5 мл) та оцтової кислоти (6,3 мл) до 100°C, та витримують протягом 2,5 год. Розводять дихлорметаном, та виливають у водний насичений розчин бікарбонату натрію. Сушать сульфатом натрію, та видаляють розчинник у вакуумі. Очищають хроматографією на колонці із силікагелем, елююючи сумішшю DCM/етанол-10 % NH3 (0-3 %), та одержують 10,67 г вказаної в + + заголовку сполуки. MS (ES ): m/z=280 (M+H) . Підготовчий синтез 26 N-ізопропілацетамід Додають TEA (23,58 мл) до розчину 2-пропанаміну (10 г) у DCM (100 мл) при 0°C. Потім обережно додають краплями ангідрид оцтової кислоти (16,15 мл). Перемішують при кімнатній температурі протягом ночі. Видаляють розчинник у вакуумі, розводять етиловим ефіром, та відфільтровують одержану тверду речовину. Видаляють розчинник у вакуумі. Розводять одержане масло етиловим ефіром, додають карбонат калію, та перемішують протягом ночі при кімнатній температурі. Відфільтровують одержану тверду речовину, видаляють розчинник у вакуумі, та одержують 15,62 г вказаної в заголовку сполуки. ЯМР (CDCl3) 4,06 (m, 1H), 1,94 (s, 3H), 1,14 (d, 6H). Зазначені нижче аміди одержують по суті за методикою, описаною для Nізопропілацетаміду, із застосуванням відповідного аміну: 13 UA 104603 C2 Підготовчий синтез 27 28 29 5 10 Сполука N-циклопропілацетамід N-циклопропілметилацетамід N-циклопентил-ацетамід Підготовчий синтез 30 N-(4-бром-2,6-дифторфеніл)-N'-ізопропілацетамідин Додають TEA (10,05 мл) до суміші 4-бром-2,6-дифторфеніламіну (10,0 г), Nізопропілацетаміду (9,73 г), фосфорилхлориду (6,70 мл) у толуолі (150 мл). Нагрівають одержану суміш до кипіння та кип'ятять зі зворотним холодильником протягом 3 год. Охолоджують одержану суміш, та видаляють розчинник у вакуумі. Розчиняють неочищений залишок у DCM, промивають водним насиченим розчином бікарбонату натрію декілька разів до видалення всіх слідів кислоти. Сушать сульфатом натрію, видаляють розчинник у вакуумі, та + + одержують 14 г вказаної в заголовку сполуки. MS (ES ): m/z=292 (M+H) . Зазначені нижче проміжні сполуки одержують по суті за методикою, описаною для N-(4бром-2,6-дифторфеніл)-N'-ізопропілацетамідину, із застосуванням відповідного ацетаміду: Підготовчий Сполука синтез 31 N-(4-бром-2,6-дифторфеніл)-N'-циклопропілацетамідин N-(4-бром-2,6-дифторфеніл)-N'32 циклопропілметилацетамідин 33 N-(4-бром-2,6-дифторфеніл)-N'-циклопентилацетамідин MS (ES+): m/z (M+H)+ 290 304 318 15 20 25 Підготовчий синтез 34 6-бром-4-фтор-1-ізопропіл-2-метил-1H-бензимідазол Додають трет-бутилат калію (811,43 мг) до розчину N-(4-бром-2,6-дифторфеніл)-N'ізопропілацетамідину (2 г) у N-метилформаміді (20 мл). Нагрівають одержану суміш до 100°C, та витримують протягом 2 год. Охолоджують до кімнатної температури, додають DCM (150 мл), промивають тричі насиченим водним розчином хлориду натрію (розсіл, 300 мл), сушать сульфатом магнію, та видаляють розчинник у вакуумі. Додають гексан, та струшують під час обробки ультразвуком протягом декількох хвилин. Відфільтровують одержану тверду речовину, повторюють двічі додання гексану та фільтрування, й одержують 1,86 г вказаної в заголовку + + сполуки. MS (ES ): m/z=272 (M+H) . Зазначені нижче проміжні сполуки одержують по суті за методикою, описаною для 6-бром-4фтор-1-ізопропіл-2-метил-1H-бензимідазолу, із застосуванням відповідного ацетамідину: Підготовчий Сполука синтез 35 6-бром-1-циклопропіл-4-фтор-2-метил-1H-бензимідазол 6-бром-1-циклопропілметил-4-фтор-2-метил-1H36 бензимідазол 37 6-бром-1-циклопентил-4-фтор-2-метил-1H-бензимідазол 30 35 40 MS (ES+): m/z (M+H)+ 270 284 298 Підготовчий синтез 38 4-фтор-1-ізопропіл-2-метил-6-(4,4,5,5-тетраметил-[1,3,2]діоксаборолан-2-іл)-1Hбензимідазол Барботують азот через суміш 6-бром-4-фтор-1-ізопропіл-2-метил-1H-бензимідазолу (30,0 г), біс(пінаколато)дибору (42,15 г), трициклогексилфосфіну (5,43 г), ацетату калію (32,58 г) та DMSO (200 мл). Додають ацетат паладію (2,8 г), та нагрівають у заздалегідь нагрітій масляній бані до 90°C, та витримують протягом 1 год. Розводять етилацетатом (200 мл), та фільтрують через шар целіту. Промивають одержану суміш розсолом (100 мл), сушать сульфатом натрію, та видаляють розчинник у вакуумі. Розтирають з гексаном, відфільтровують одержану тверду + + речовину, та одержують 27 г вказаної в заголовку сполуки. MS (ES ): m/z=319 (M+H) . Зазначені нижче проміжні сполуки одержують по суті за методикою, описаною для 4-фтор-1ізопропіл-2-метил-6-(4,4,5,5-тетраметил-[1,3,2]діоксаборолан-2-іл)-1H-бензимідазолу, із застосуванням відповідних похідних 6-бромбензимідазолу: 14 UA 104603 C2 Підготовчий синтез 39 40 41 42 5 10 15 Сполука 1-циклопропіл-4-фтор-2-метил-6-(4,4,5,5-тетраметил[1,3,2]діоксаборолан-2-іл)-1H-бензимідазол 1-циклопентил-2-метил-6-(4,4,5,5-тетраметил[1,3,2]діоксаборолан-2-іл)-1H-бензимідазол 1-циклопропілметил-4-фтор-2-метил-6-(4,4,5,5-тетраметил[1,3,2]діоксаборолан-2-іл)-1H-бензимідазол 1-циклопентил-4-фтор-2-метил-6-(4,4,5,5-тетраметил[1,3,2]діоксаборолан-2-іл)-1H-бензимідазол 317 327 331 345 Підготовчий синтез 43 6-(2-хлор-5-фторпіримідин-4-іл)-4-фтор-1-ізопропіл-2-метил-1H-бензимідазол Барботують азот через суміш 2,4-дихлор-5-фторпіримідину (12,7 г), хлориду біс(трифенілфосфін)паладію(II) (4,9 г), 2 M розчину карбонату натрію у воді (103,7 мл) та 1,2диметоксіетан (120 мл). Нагрівають у заздалегідь нагрітій масляній бані до 80°C, та додають краплями розчин 4-фтор-1-ізопропіл-2-метил-6-(4,4,5,5-тетраметил-[1,3,2]діоксаборолан-2-іл)1H-бензимідазолу (22 г) у 1,2-диметоксіетані (200 мл). Перемішують одержану суміш до 84°C, та витримують протягом 1 год. Охолоджують до кімнатної температури, додають EA (800 мл), та промивають двічі розсолом (100 мл). Сушать сульфатом магнію, та видаляють розчинник у вакуумі. Розтирають з ацетонітрилом, та одержують 14,4 г вказаної в заголовку сполуки. MS + + (ES ): m/z=323 (M+H) . Зазначені нижче проміжні сполуки одержують по суті за методикою, описаною для 6-(2-хлор5-фторпіримідин-4-іл)-4-фтор-1-ізопропіл-2-метил-1H-бензимідазолу, із застосуванням відповідних похідних дихлорпіримідину та борату: Підготовчий синтез 44 45 46 47 48 20 MS (ES+): m/z (M+H)+ Сполука 6-(2-хлор-5-фторпіримідин-4-іл)-1-циклопропіл-4-фтор-2метил-1H-бензимідазол 6-(2-хлор-5-фторпіримідин-4-іл)-1-циклопентил-2-метил-1Hбензимідазол 6-(2-хлор-5-фторпіримідин-4-іл)-1-циклопропілметил-4-фтор2-метил-1H-бензимідазол 6-(2-хлор-піримідин-4-іл)-1-циклопентил-4-фтор-2-метил-1Hбензимідазол 6-(2-хлор-піримідин-4-іл)-4-фтор-1-ізопропіл-2-метил-1Hбензимідазол MS (ES+): m/z (M+H)+ 321 331 335 331 305 Зазначені нижче проміжні сполуки одержують по суті за методикою, описаною нижче для [5(4-етилпіперазин-1-ілметил)піридин-2-іл]-[5-фтор-4-(7-фтор-3-ізопропіл-2-метил-3Hбензимідазол-5-іл)піримідин-2-іл]аміну, із застосуванням відповідних похідних аміну та хлорпіримідину: Підготовчий синтез 49 50 51 52 Сполука трет-бутиловий складний ефір 4-{6-[5-фтор-4-(7-фтор-3ізопропіл-2-метил-3H-бензимідазол-5-іл)піримідин-2іламіно]піридин-3-ілметил}піперазин-1-карбонової кислоти трет-бутиловий складний ефір 4-{6-[4-(3-циклопропіл-7-фтор-2метил-3H-бензимідазол-5-іл)-5-фторпіримідин-2-іламіно]піридин3-ілметил}піперидин-1-карбонової кислоти трет-бутиловий складний ефір 4-{6-[5-фтор-4-(7-фтор-3ізопропіл-2-метил-3H-бензимідазол-5-іл)піримідин-2-іламіно]-2метилпіридин-3-ілметил}піперидин-1-карбонової кислоти трет-бутиловий складний ефір 6-[4-(3-циклопентил-2-метил-3Hбензимідазол-5-іл)-5-фторпіримідин-2-іламіно]-3',4',5',6'тетрагідро-2'H-[3,4']біпіридиніл-1'-карбонової кислоти 15 MS (ES+): m/z (M+H)+ 579 576 592 572 UA 104603 C2 Підготовчий синтез 53 54 55 56 57 MS (ES+): m/z (M+H)+ Сполука трет-бутиловий складний ефір 6-[5-фтор-4-(7-фтор-3-ізопропіл-2метил-3H-бензимідазол-5-іл)піримідин-2-іламіно]-2-метил3',4',5',6'-тетрагідро-2'H-[3,4']біпіридиніл-1'-карбонової кислоти трет-бутиловий складний ефір 4-{6-[5-фтор-4-(7-фтор-3ізопропіл-2-метил-3H-бензимідазол-5-іл)піримідин-2іламіно]піридин-3-ілокси}піперидин-1-карбонової кислоти трет-бутиловий складний ефір {6'-[5-фтор-4-(7-фтор-3-ізопропіл2-метил-3H-бензимідазол-5-іл)піримідин-2-іламіно]-2'-метил3,4,5,6-тетрагідро-2H-[1,3']біпіридиніл-4-іл}карбамінової кислоти трет-бутиловий складний ефір {6'-[4-(3-циклопентил-7-фтор-2метил-3H-бензимідазол-5-іл)піримідин-2-іламіно]-3,4,5,6тетрагідро-2H-[1,3']біпіридиніл-4-іл}карбамінової кислоти трет-бутиловий складний ефір 4-{6-[4-(7-фтор-3-ізопропіл-2метил-3H-бензимідазол-5-іл)піримідин-2-іламіно]піридин-3ілсульфаніл}піперидин-1-карбонової кислоти 578 580 593 587 578 Підготовчий синтез 58 [5-фтор-4-(7-фтор-3-ізопропіл-2-метил-3H-бензимідазол-5-іл)піримідин-2-іл]-(5-піперазин-1ілметилпіридин-2-іл)амін N H N F N N F HN 5 10 15 N N N До суміші трет-бутилового складного ефіру 4-{6-[5-фтор-4-(7-фтор-3-ізопропіл-2-метил-3Hбензимідазол-5-іл)піримідин-2-іламіно]піридин-3-ілметил}піперазин-1-карбонової кислоти (150 мг) у DCM (10 мл) та метанолі (10 мл) додають 4M розчин хлористого водню у діоксані (194 мкл). Перемішують 10 хв, та видаляють розчинник у вакуумі. Очищають через картридж із сильною катіонообмінною смолою (SCX), елююючи метанолом, потім сумішшю метанол-NH3 2M, після чого хроматографією на колонці із силікагелем, елююючи сумішшю DCM/метанол-NH3 + + 2M (3 %), та одержують 120 мг вказаної в заголовку сполуки. MS (ES ): m/z=479 (M+H) . Зазначені нижче проміжні сполуки одержують по суті за методикою, описаною для [5-фтор4-(7-фтор-3-ізопропіл-2-метил-3H-бензимідазол-5-іл)піримідин-2-іл]-(5-піперазин-1ілметилпіридин-2-іл)аміну: 16 UA 104603 C2 Підготовчий синтез Структура Назва сполуки MS (ES+): m/z (M+H)+ N H N F N N [4-(3-циклопропіл-7-фтор-2-метил3H-бензимідазол-5-іл)-5F фторпіримідин-2-іл]-(5-піперидин-4ілметилпіридин-2-іл)амін N 59 HN N 476 N H N F [5-фтор-4-(7-фтор-3-ізопропіл-2метил-3H-бензимідазол-5іл)піримідин-2-іл]-(6-метил-5піперидин-4-ілметилпіридин-2іл)амін 492 [4-(3-циклопентил-2-метил-3Hбензимідазол-5-іл)-5-фторпіримідин2-іл]-(1',2',3',4',5',6'-гексагідро[3,4']біпіридиніл-6-іл)амін 472 [5-фтор-4-(7-фтор-3-ізопропіл-2метил-3H-бензимідазол-5іл)піримідин-2-іл]-(2-метил1',2',3',4',5',6'-гексагідро[3,4']біпіридиніл-6-іл)амін 478 [5-фтор-4-(7-фтор-3-ізопропіл-2метил-3H-бензимідазол-5іл)піримідин-2-іл]-[5-(піперидин-4ілокси)піридин-2-іл]амін 480 F 493 N N6'-[5-фтор-4-(7-фтор-3-ізопропіл-2метил-3H-бензимідазол-5іл)піримідин-2-іл]-2'-метил-3,4,5,6тетрагідро-2H-[1,3']біпіридиніл-4,6'діамін F 487 N N6'-[4-(3-циклопентил-7-фтор-2метил-3H-бензимідазол-5іл)піримідин-2-іл]-3,4,5,6-тетрагідро2H-[1,3']біпіридиніл-4,6'-діамін N N 60 F HN N N N H N F N N 61 N N N H N H N F N N 62 F N N N H H N N F N N 63 F O HN N H N N 64 N N F N N N H2N H N N 65 N N N N H2N 17 UA 104603 C2 Підготовчий синтез Назва сполуки MS (ES+): m/z (M+H)+ [4-(7-фтор-3-ізопропіл-2-метил-3Hбензимідазол-5-іл)піримідин-2-іл]-[5(піперидин-4-ілсульфаніл)піридин-2іл]амін 478 Структура N H N N N 66 F S HN N N Приклад 1 [5-(4-етилпіперазин-1-ілметил)піридин-2-іл]-[5-фтор-4-(7-фтор-3-ізопропіл-2-метил-3Hбензимідазол-5-іл)піримідин-2-іл]амін N H F N N N F N N N 5 10 15 N Барботують азот через суміш 6-(2-хлор-5-фторпіримідин-4-іл)-4-фтор-1-ізопропіл-2-метил1H-бензимідазолу (15,9 г), 5-(4-етилпіперазин-1-ілметил)піридин-2-іламіну (10,85 г), карбонату цезію (32,10 г), трис(дибензиліденацетон)дипаладію (1,82 г), 4,5-біс(дифенілфосфіно)-9,9диметилксантену (2,35 г) у 1,4-діоксані (197,06 мл). Нагрівають одержану суміш у заздалегідь нагрітій масляній бані до 110°C, та витримують протягом 2 год. Охолоджують до кімнатної температури, розводять дихлорметаном, та фільтрують через шар целіту. Видаляють розчинник у вакуумі, очищають хроматографією на колонці із силікагелем, елююючи сумішшю DCM/метанол (2 %), а потім сумішшю DCM/метанол-NH3 2 M 2 %, та одержують 22,11 г вказаної + + в заголовку сполуки. MS (ES ): m/z=507 (M+H) . Сполуки наведених нижче прикладів одержують по суті за методикою, описаною для [5-(4етилпіперазин-1-ілметил)піридин-2-іл]-[5-фтор-4-(7-фтор-3-ізопропіл-2-метил-3H-бензимідазол5-іл)піримідин-2-іл]аміну, із застосуванням відповідних похідних аміну та хлорпіримідину: Приклад Назва сполуки MS (ES+): m/z (M+H)+ [5-фтор-4-(7-фтор-3ізопропіл-2-метил-3Hбензимідазол-5-іл)піримідин2-іл]-[5-(4-ізопропілпіперазин1-іл)-6-метилпіридин-2іл]амін 521 [4-(3-циклопропілметил-7фтор-2-метил-3Hбензимідазол-5-іл)-5фторпіримідин-2-іл]-[5-(4ізопропілпіперазин-1-іл)-6метилпіридин-2-іл]амін 533 Структура H N N N F N F 2 N N N N H N N N F N F 3 N N N N 18 UA 104603 C2 Приклад 4 [5-фтор-4-(7-фтор-3-ізопропіл-2-метил-3H-бензимідазол-5-іл)піримідин-2-іл]-[5-(4ізопропілпіперазин-1-ілметил)піридин-2-іл]амін N H F N N N F N N 5 10 15 N N Додають триацетоксиборгідрид натрію (299,9 мг) до суміші [5-фтор-4-(7-фтор-3-ізопропіл-2метил-3H-бензимідазол-5-іл)піримідин-2-іл]-(5-піперазин-1-ілметилпіридин-2-іл)аміну (130 мг), ацетону (31,6 мкл), 1,2-дихлоретану (9 мл) та оцтової кислоти (16,3 мкл). Нагрівають до 60C, та витримують протягом 1 год. Видаляють розчинник у вакуумі. Очищають через картридж із сильною катіонообмінною смолою (SCX), елююючи метанолом, а потім – сумішшю метанол-NH3 2 M, після чого очищають хроматографією на колонці із силікагелем, елююючи сумішшю + DCM/метанол-NH3 2 M (3 %), та одержують 115 мг вказаної в заголовку сполуки. MS (ES ): + m/z=521 (M+H) . Сполуки наведених нижче прикладів одержують по суті за методикою, описаною для [5фтор-4-(7-фтор-3-ізопропіл-2-метил-3H-бензимідазол-5-іл)піримідин-2-іл]-[5-(4ізопропілпіперазин-1-ілметил)піридин-2-іл]аміну, із застосуванням відповідних амінів: Приклад Структура Назва сполуки N H N F [5-фтор-4-(7-фтор-3-ізопропіл-2метил-3H-бензимідазол-5іл)піримідин-2-іл]-[6-метил-5-(1метилпіперидин-4ілметил)піридин-2-іл]амін N N 5 F N N N 6 F N N 534 N [4-(3-циклопентил-2-метил-3Hбензимідазол-5-іл)-5фторпіримідин-2-іл]-(1'-ізопропіл1',2',3',4',5',6'-гексагідро[3,4']біпіридиніл-6-іл)амін 514 N F N 7 N N [5-фтор-4-(7-фтор-3-ізопропіл-2метил-3H-бензимідазол-5іл)піримідин-2-іл]-[5-(1-ізопропілпіперидин-4-ілметил)-6метилпіридин-2-іл]амін F N N N 506 N H N H N MS (ES+): m/z (M+H)+ N 19 UA 104603 C2 Приклад Назва сполуки MS (ES+): m/z (M+H)+ [5-фтор-4-(7-фтор-3-ізопропіл-2метил-3H-бензимідазол-5іл)піримідин-2-іл]-[5-(1-ізопропілпіперидин-4-ілокси)піридин-2іл]амін 522 Структура H N N N N F 8 F O N N N Приклад 9 [4-(3-циклопропіл-7-фтор-2-метил-3H-бензимідазол-5-іл)-5-фторпіримідин-2-іл]-[5-(1етилпіперидин-4-ілметил)піридин-2-іл]амін N H F N N N F N N 5 10 15 N Додають триацетоксиборгідрид натрію (720 мг) до суміші [4-(3-циклопропіл-7-фтор-2-метил3H-бензимідазол-5-іл)-5-фторпіримідин-2-іл]-(5-піперидин-4-ілметилпіридин-2-іл)аміну (110 мг), 1,2-дихлоретану (1,14 мл) та оцтової кислоти (2709 мкл). Нагрівають до 60°C, та витримують протягом 1 год. Видаляють розчинник у вакуумі. Очищають через картридж із сильною катіонообмінною смолою (SCX), елююючи метанолом, а потім сумішшю метанол-NH3 2M, після чого очищають хроматографією на колонці із силікагелем, елююючи сумішшю DCM/метанол+ + NH3 2M (3 %), та одержують 80 мг вказаної в заголовку сполуки. MS (ES ): m/z=504 (M+H) . Сполуки наведених нижче прикладів одержують по суті за методикою, описаною для [4-(3циклопропіл-7-фтор-2-метил-3H-бензимідазол-5-іл)-5-фторпіримідин-2-іл]-[5-(1-етилпіперидин4-ілметил)піридин-2-іл]аміну, із застосуванням відповідних амінів: Приклад Назва сполуки MS (ES+): m/z (M+H)+ [5-(1-етилпіперидин-4-ілметил)-6метилпіридин-2-іл]-[5-фтор-4-(7-фтор3-ізопропіл-2-метил-3H-бензимідазол5-іл)піримідин-2-іл]амін 520 (1'-етил-2-метил-1',2',3',4',5',6'гексагідро-[3,4']біпіридиніл-6-іл)-[5фтор-4-(7-фтор-3-ізопропіл-2-метил3H-бензимідазол-5-іл)піримідин-2іл]амін 506 [5-(1-етилпіперидин-4-ілокси)піридин2-іл]-[5-фтор-4-(7-фтор-3-ізопропіл-2метил-3H-бензимідазол-5іл)піримідин-2-іл]амін 508 Структура N H N F N N 10 F N N H N N N N F N F 11 N N N H N N N F N 12 F N O N N 20 UA 104603 C2 Приклад Назва сполуки H N N ,N -діетил-N6'-[5-фтор-4-(7-фтор-3ізопропіл-2-метил-3H-бензимідазол-5іл)піримідин-2-іл]-2'-метил-3,4,5,6тетрагідро-2H-[1,3']біпіридиніл-4,6'діамін N6'-[4-(3-циклопентил-7-фтор-2метил-3H-бензимідазол-5іл)піримідин-2-іл]-N4,N4-diетил3,4,5,6-тетрагідро-2H-[1,3']біпіридиніл4,6'-діамін 543 [5-(1-етилпіперидин-4ілсульфаніл)піридин-2-іл]-[4-(7-фтор3-ізопропіл-2-метил-3H-бензимідазол5-іл)піримідин-2-іл]амін 506 F 4 F N 13 N N N H N N 14 N N N N N H N N N N 15 F N 4 N F S N 10 549 N N N 5 MS (ES+): m/z (M+H)+ Структура N Приклад 16 метансульфонат [5-(4-етилпіперазин-1-ілметил)піридин-2-іл]-[5-фтор-4-(7-фтор-3-ізопропіл2-метил-3H-бензимідазол-5-іл)піримідин-2-іл]аміну Додають метансульфонову кислоту (63,59 мл) до розчину [5-(4-етилпіперазин-1ілметил)піридин-2-іл]-[5-фтор-4-(7-фтор-3-ізопропіл-2-метил-3H-бензимідазол-5-іл)піримідин-2іл]аміну (17,3 г) у суміші DCM (100 мл) та метанолу (100 мл). Перемішують одержаний розчин протягом 1 год., та видаляють розчинник у вакуумі. Розтирають з MtBE, відфільтровують + одержану тверду речовину, та одержують 20,4 г вказаної в заголовку сполуки. MS (ES ): + m/z=507 (M+H) . Сполуки наведених нижче прикладів одержують по суті за методикою, описаною для метансульфонату [5-(4-етилпіперазин-1-ілметил)піридин-2-іл]-[5-фтор-4-(7-фтор-3-ізопропіл-2метил-3H-бензимідазол-5-іл)піримідин-2-іл]аміну: Приклад 17 18 19 20 21 Сполука метансульфонат [5-фтор-4-(7-фтор-3-ізопропіл-2-метил-3Hбензимідазол-5-іл)піримідин-2-іл]-[5-(4-ізопропілпіперазин-1-іл)-6метилпіридин-2-іл]аміну Метансульфонат [4-(3-циклопропілметил-7-фтор-2-метил-3Hбензимідазол-5-іл)-5-фторпіримідин-2-іл]-[5-(4-ізопропілпіперазин-1-іл)-6метилпіридин-2-іл]аміну метансульфонат [5-фтор-4-(7-фтор-3-ізопропіл-2-метил-3Hбензимідазол-5-іл)піримідин-2-іл]-[5-(4-ізопропілпіперазин-1ілметил)піридин-2-іл]аміну метансульфонат [5-фтор-4-(7-фтор-3-ізопропіл-2-метил-3Hбензимідазол-5-іл)піримідин-2-іл]-[6-метил-5-(1-метилпіперидин-4ілметил)піридин-2-іл]аміну метансульфонат [5-фтор-4-(7-фтор-3-ізопропіл-2-метил-3Hбензимідазол-5-іл)піримідин-2-іл]-[5-(1-ізопропіл-піперидин-4-ілметил)-6метилпіридин-2-іл]аміну 21 MS (ES+): m/z (M+H)+ 521 533 521 506 534 UA 104603 C2 Приклад 22 23 24 25 26 27 28 29 30 5 10 15 20 25 30 Сполука метансульфонат [4-(3-циклопентил-2-метил-3H-бензимідазол-5-іл)-5фторпіримідин-2-іл]-(1'-ізопропіл-1',2',3',4',5',6'-гексагідро-[3,4']біпіридиніл6-іл)аміну метансульфонат [5-фтор-4-(7-фтор-3-ізопропіл-2-метил-3Hбензимідазол-5-іл)піримідин-2-іл]-[5-(1-ізопропіл-піперидин-4ілокси)піридин-2-іл]аміну метансульфонат [4-(3-циклопропіл-7-фтор-2-метил-3H-бензимідазол-5іл)-5-фторпіримідин-2-іл]-[5-(1-етилпіперидин-4-ілметил)піридин-2іл]аміну метансульфонат [5-(1-етилпіперидин-4-ілметил)-6-метилпіридин-2-іл]-[5фтор-4-(7-фтор-3-ізопропіл-2-метил-3H-бензимідазол-5-іл)піримідин-2іл]аміну Метансульфонат (1'-етил-2-метил-1',2',3',4',5',6'-гексагідро[3,4']біпіридиніл-6-іл)-[5-фтор-4-(7-фтор-3-ізопропіл-2-метил-3Hбензимідазол-5-іл)піримідин-2-іл]аміну метансульфонат [5-(1-етилпіперидин-4-ілокси)піридин-2-іл]-[5-фтор-4-(7фтор-3-ізопропіл-2-метил-3H-бензимідазол-5-іл)піримідин-2-іл]аміну метансульфонат N4,N4-діетил-N6'-[5-фтор-4-(7-фтор-3-ізопропіл-2метил-3H-бензимідазол-5-іл)піримідин-2-іл]-2'-метил-3,4,5,6-тетрагідро2H-[1,3']біпіридиніл-4,6'-діаміну метансульфонат N6'-[4-(3-циклопентил-7-фтор-2-метил-3Hбензимідазол-5-іл)піримідин-2-іл]-N4,N4-diетил-3,4,5,6-тетрагідро-2H[1,3']біпіридиніл-4,6'-діаміну метансульфонат [5-(1-етилпіперидин-4-ілсульфаніл)піридин-2-іл]-[4-(7фтор-3-ізопропіл-2-метил-3H-бензимідазол-5-іл)піримідин-2-іл]аміну MS (ES+): m/z (M+H)+ 514 522 504 520 506 508 549 543 506 Приклад 31 [5-(4-етилпіперазин-1-ілметил)піридин-2-іл]-[5-фтор-4-(7-фтор-3-ізопропіл-2-метил-3Hбензимідазол-5-іл)піримідин-2-іл]амін Кристалічна форма I Змішують 102,1 мг аморфного [5-(4-етилпіперазин-1-ілметил)піридин-2-іл]-[5-фтор-4-(7фтор-3-ізопропіл-2-метил-3H-бензимідазол-5-іл)піримідин-2-іл]аміну з 2 мл ацетону. Виділяють осаджену тверду речовину шляхом вакуумного фільтрування, одержуючи світло-жовтий осад, та сушать безпосередньо у фільтрувальному пристрої протягом 30 хв, одержуючи 72,1 мг твердої речовини. Завантажують одержану тверду речовину у нагріту до 100°C вакуумну сушильну шафу та витримують протягом 3 год. Репрезентативні піки рентгенівської дифракції форми I наведені у Таблиці 1. Приклад 32 [5-(4-етилпіперазин-1-ілметил)піридин-2-іл]-[5-фтор-4-(7-фтор-3-ізопропіл-2-метил-3Hбензимідазол-5-іл)піримідин-2-іл]амін Кристалічна форма III Змішують 208 мг аморфного [5-(4-етилпіперазин-1-ілметил)піридин-2-іл]-[5-фтор-4-(7-фтор3-ізопропіл-2-метил-3H-бензимідазол-5-іл)піримідин-2-іл]аміну з 4 мл ацетону. Перемішують утворену суспензію протягом 2 год. при 60C при 1000 об/хв, після чого виділяють утворену тверду речовину шляхом вакуумного фільтрування, одержуючи світло-жовтий осад. Сушать осад на місці у фільтрувальному пристрої протягом 30 хв, одержуючи 112 мг твердої речовини (вихід 54 %). Завантажують у нагріту до 80°C вакуумну сушильну шафу та витримують протягом 3 год. Репрезентативні піки рентгенівської дифракції форми III наведені у Таблиці 2. Положення одержаних піків перевіряли із застосуванням зовнішнього стандарту. Порошкова рентгенографія Порошкові рентгенограми кристалів одержують за допомогою рентгенівського дифрактометру Bruker D8 Advance, спорядженого джереломвипромінювання CuKα (λ=1,54056 Å) та детектором Vantec (50 кВ, 40 мА). Кожен зразок сканують у межах 4-40° у напрямку 2θ з величиною кроку 2θ, 0,02°, швидкістю сканування 9,0 с/крок, 1 мм дифузорною та вхідною діафрагмами та 0,1 мм діафрагмою детектора. Сухий порошок завантажують до завантажуваного зверху тримача зразка з вирізом, і гладеньку поверхню забезпечують за допомогою предметного скла. Дифрактограми кристалічних форм одержують при температурі 22 UA 104603 C2 5 10 15 20 та відносній вологості навколишнього середовища. Фон для кристалів форми III перед визначенням піків видаляють, у той час як для кристалів форми I фон не видаляється. У галузі кристалографії добре відомо, що, для будь-якої даної кристалічної форми, відносна інтенсивність дифракційних піків може змінюватись унаслідок переважної орієнтації, що є наслідком таких факторів, як морфологія та форма кристалу. При наявності ефектів переважної орієнтації, інтенсивність піків змінюється, але положення характеристичних піків поліморфу залишаються незмінними. Дивись, наприклад, The United States Pharmacopeia #23, National Formulary #18, 1995, pр. 1843-1844. Окрім того, у галузі кристалографії також добре відомо, що кутове положення піків для будь-якої даної кристалічної форми може дещо різнитись. Наприклад, положення піків може зміщуватись унаслідок зміни температури або вологості, при якій аналізується зразок, зміщення зразка або присутності чи відсутності внутрішнього стандарту. У даному разі, змінність положення піків ±0,1 у напрямку 2θ буде враховувати ці потенційні зміни без перешкоджання безпомилковій ідентифікації вказаної кристалічної форми. Підтвердження кристалічної форми може робитись на основі будь-якої унікальної комбінації розрізнювальних піків (у градусах 2θ), як правило, найбільш визначних піків. Так, одержаний зразок [5-(4-етилпіперазин-1-ілметил)піридин-2-іл]-[5-фтор-4-(7-фтор-3-ізопропіл-2-метил-3Hбензимідазол-5-іл)піримідин-2-іл]аміну кристалічної форми I характеризується рентгенодифрактограмою із застосуванням джерела випромінення CuKα як такий, що має дифракційні піки (значення 2θ), вказані у наведеній нижче Таблиці 1, зокрема, що має піки при 4,51 у комбінації з одним або декількома піками, вибраними з групи, до складу якої входить 13,09, 16,31 та 18,82, з допуском у 0,1 градусу на кути дифракції. Таблиця 1 Дифракційні піки кристалічної форми I [5-(4-етилпіперазин-1-ілметил)піридин-2-іл]-[5-фтор-4(7-фтор-3-ізопропіл-2-метил-3H-бензимідазол-5-іл)піримідин-2-іл]аміну. Кут 2θ, градуси 4,51 5,89 8,98 11,20 12,57 13,09 15,93 16,31 17,01 18,58 18,82 20,86 21,90 23,12 23,53 26,71 26,85 25 Значення d, ангстреми 19,60 15,00 9,84 7,89 7,04 6,76 5,56 5,43 5,21 4,77 4,71 4,26 4,06 3,84 3,78 3,33 3,32 Ентенсивність, % 100 4 1,5 2,3 1,9 7 3 4,4 1,9 3,1 3,6 1,5 2,2 2,4 3,7 2,4 2 Одержаний зразок [5-(4-етилпіперазин-1-ілметил)піридин-2-іл]-[5-фтор-4-(7-фтор-3ізопропіл-2-метил-3H-бензимідазол-5-іл)піримідин-2-іл]аміну кристалічної форми III характеризується рентгенодифрактограмою із застосуванням джерела випромінення CuKα як такий, що має дифракційні піки (значення 2θ), вказані у наведеній нижче Таблиці 2, зокрема, що має піки при 21,29 у комбінації з одним або декількома піками при 11,54, 10,91, та 12,13, з допуском у 0,1 градусу на кути дифракції. 30 23 UA 104603 C2 Таблиця 2 Дифракційні піки кристалічної форми III [5-(4-етилпіперазин-1-ілметил)піридин-2-іл]-[5-фтор4-(7-фтор-3-ізопропіл-2-метил-3H-бензимідазол-5-іл)піримідин-2-іл]аміну. Кут °2θ, градуси 7,44 10,91 11,54 12,13 13,89 14,91 15,63 16,06 18,59 18,94 20,43 21,29 21,91 22,13 22,45 23,12 23,42 25,95 29,42 Значення d, ангстреми 11,87 8,11 7,66 7,29 6,37 5,94 5,67 5,52 4,77 4,68 4,34 4,17 4,05 4,01 3,96 3,84 3,80 3,43 3,03 13 5 10 15 20 25 Ентенсивність, % 8 19 38 18 25 20 27 11 21 26 21 100 37 12 8 6 9 17 9 Твердотільний C ЯМР Спектри ЯМР знімали методом кросполяризації/обертання під магічним кутом (CP/MAS) 1 (твердотільний ЯМР або SSNMR) на ЯМР-спектрометрі Avance III 400 компанії Bruker при H та 13 C частотах 400,131 та 100,623 МГц, відповідно, із застосуванням 4 мм подвійнорезонансного зонда компанії Bruker. Частоту обертання під магічним кутом (MAS) встановлюють на рівні 5 кГц або 10 кГц за допомогою контролера MAS-II компанії Bruker; частоту обертання підтримують у межах 2 Гц від встановленої. Для гетероциклічної розв'язки застосовують розв'язку SPINAL64 при частоті нутації протону 100 кГц. Бічні смуги обертання видаляють за допомогою п'ятиімпульсної послідовності повного пригнічення бічних смуг (TOSS). Тривалість контактування при кросполяризації для передачі намагніченості з протонів на атоми вуглецю 1 встановлюється на рівні 4 мс, а для підвищення ефективності кросполяризації на H каналі застосовують лінійну зміну потужності з 93,5 кГц до 46,9 кГц. Час збирання даних встановлюють на рівні 34 мс, і спектри знімають у 30 кГц спектральному діапазоні з 5 с затримкою повторного циклу. Температуру зразка підтримують на рівні 297±1 K для зведення до мінімуму фрикційного 13 нагрівання, що спричинюється обертанням зразка. Зовнішнім еталоном для C хімічних зсувів -1 13 (±0,05 млн ) є розв'язаний від протонів C пік нерозбавленого (рідкого) тетраметилсилану -1 через високорівневу резонансну частоту адамантину (δ=29,5 млн ). Список піків хімічних зсувів для [5-(4-етилпіперазин-1-ілметил)піридин-2-іл]-[5-фтор-4-(7фтор-3-ізопропіл-2-метил-3H-бензимідазол-5-іл)піримідин-2-іл]аміну кристалічної форми III виглядає таким чином: 13 -1 C-ЯМР: н(F1) (млн ) 11,7, 12,9, 20,5, 48,6, 52,5, 59,4, 108,9, 110,0, 112,7, 127,3, 129,4, 135,5, 136,4, 148,8, 150,1, 152,2, 154,5, 156,3. Приклад 33 [5-(4-етилпіперазин-1-ілметил)піридин-2-іл]-[5-фтор-4-(7-фтор-3-ізопропіл-2-метил-3Hбензимідазол-5-іл)піримідин-2-іл]амін Кристалічна форма III – Шлях B 24 UA 104603 C2 H N N F N N F N N N 5 10 15 20 25 30 35 40 45 50 N a. 1-(6-бромпіридин-3-ілметил)-4-етилпіперазин Додають нерозведений 1-етилпіперазин (5,6 кг) до суміші 6-бромпіридин-3-карбальдегіду (8,3 кг) та DCM (186 кг). Потім додають порціями триацетоксиборгідрид натрію (10,9 кг), та перемішують при 20-30°C протягом 12 год. Гасять реакційну суміш у суміші DCM (36 кг) та водного 2 н розчину гідроксиду натрію (46 кг). Розділяють одержані шари, та екстрагують двічі водний шар дихлорметаном (242 кг). Об'єднують одержані органічні шари, промивають розсолом (502 кг), видаляють розчинник у вакуумі, та одержують 11,5 кг вказаної в заголовку + + сполуки. MS (ES ): m/z=285 (M+H) . b. 5-(4-етилпіперазин-1-ілметил)піридин-2-іламін Додають рідкий амоній (50,0 кг) до знегаженої суміші 1-(6-бромпіридин-3-ілметил)-4етилпіперазину (14,2 кг), оксиду міді (200 г) та MeOH (57 кг) при температурі 40°C. Нагрівають одержану суміш та витримують при температурі 65-75°C протягом ночі. Охолоджують до 2030°C, та фільтрують через шар целіту (Celite ). Концентрують одержаний фільтрат, додають DCM (113 кг), доводять pH до 12-14 2 н розчином гідроксиду натрію (23 кг), розділяють одержані фази, промивають органічну фазу дихлорметаном (582 кг), та об'єднують одержані органічні шари. Фільтрують одержану суміш через целіт, та концентрують. Розчиняють одержаний залишок у толуолі (9,7 кг), кристалізують шляхом додання MtBE (8,3 кг), та одержують 6,0 кг вказаної в заголовку сполуки. Одержану сполуку очищають перекристалізацією з толуолу. MS + + (ES ): m/z=221 (M+H) . c. N-ізопропілацетамід Додають карбонат калію (28 кг) до розчину 2-пропанаміну (12 кг) у етилацетаті (108 кг) при температурі
ДивитисяДодаткова інформація
Назва патенту англійськоюProtein kinase inhibitors
Автори російськоюCoates, David, Andrew, de Dios Magana, Alfonso, de Prado Gonzales, Ana, Del Prado Catalina, Mirian Filadelfa, Garcia Paredes, Maria, Cristina, Gelbert, Lawrence, Mark, Knobeloch, John, Monte, Martin de la Nava, Eva, Maria, Martin Ortega Finger, Maria, Dolores, Martinez Perez, Jose, Antonio, Mateo Herranz, Ana, Isabel, Perez Martinez, Carlos, Sanchez Martinez, Concepcion
МПК / Мітки
МПК: A61K 31/517, A61P 35/00, C07D 401/14
Мітки: протеїнкіназ, інгібітори
Код посилання
<a href="https://ua.patents.su/44-104603-ingibitori-protenkinaz.html" target="_blank" rel="follow" title="База патентів України">Інгібітори протеїнкіназ</a>
Попередній патент: Спосіб одержання виробу з шоколаду з заповненим центром
Наступний патент: Спосіб вимірювання комплексного коефіцієнта відбиття двополюсника
Випадковий патент: Пристрій для вимірювання діагностичних моделей щелеп












