Сполуки для лікування раку
Номер патенту: 105005
Опубліковано: 10.04.2014
Автори: Лі Веі, Ванг Жао, Міллер Дуейн Д., Лі Чіен-Мінг, Чен Жіанйун, Далтон Джеймс Т., Лу Ян
Формула / Реферат
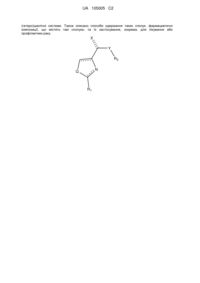
1. Сполука формули (І)
 (I)
(I)
де,
Q являє собою S, N, або О;
R1 та R2 кожен незалежно являє собою заміщені або незаміщені одинарні, конденсовані або множинні арильні або (гетеро)циклічні системи, включаючи насичені та ненасичені N-гетероцикли, насичені та ненасичені S-гетероцикли, та насичені та ненасичені О-гетероцикли, насичені або ненасичені циклічні вуглеводні, насичені або ненасичені змішані гетероцикли, аліфатичні або неаліфатичні нерозгалужені або розгалужені С1-С30 вуглеводні; або
її фармацевтично прийнятна сіль, гідрат або проліки.
2. Сполука за п. 1, де R1 та R2 кожен незалежно являє собою заміщені або незаміщені фураніл, індоліл, піридиніл, феніл, бифеніл, трифеніл, дифенілметан, адамантаніл, або флуореніл.
3. Сполука за п. 1, де R1 і R2 кожен являє собою заміщений або незаміщений феніл.
4. Сполука за п. 1, де Q являє собою S або N.
5. Сполука за п. 1, де R2 заміщений на R3 R4 R5 являє собою 3,4,5-триметоксіфеніл.
6. Сполука за п. 1, де R1 являє собою заміщений або незаміщений феніл, заміщений або незаміщений тіофеніл, або заміщений або незаміщений індоліл, що заміщені одним або більше замісниками, вибраними з групи, що складається з метилу, етилу, фторо, бромо, ціано, нітро, трифторо і аміно.
7. Сполука за п. 1, де сполуку вибирають з групи, що складається з:
(3,4,5-триметоксіфеніл)(2-фенілтіазол-4-іл)метанону;
(2-п-толілтіазол-4-іл)(3,4,5-триметоксіфеніл)метанону;
(2-(4-фторфеніл)-тіазол-4-іл)(3,4,5-триметоксіфеніл)метанону;
(2-(4-нітрофеніл)-тіазол-4-іл)(3,4,5-триметоксіфеніл)метанону;
(2-(4-ціанофеніл)-тіазол-4-іл)(3,4,5-триметоксіфеніл)метанону;
(2-(4-(трифторметил)-феніл)-тіазол-4-іл)(3,4,5-триметоксіфеніл)метанону;
(2-(4-бромфеніл)-тіазол-4-іл)-(3,4,5-триметоксіфеніл)метанону;
(2-(4-етилфеніл)-тіазол-4-іл)-(3,4,5-триметоксі-феніл)метанону;
(2-(4-амінофеніл)-тіазол-4-іл)-(3,4,5-триметоксі-феніл)метанону;
(2-(тіофен-2-іл)-тіазол-4-іл)-(3,4,5-триметоксіфеніл)метанону;
(2-(1H-індол-5-іл)тіазол-4-іл)(3,4,5-триметоксіфеніл)метанону;
(2-(1H-індол-2-іл)тіазол-4-іл)(3,4,5-триметоксіфеніл)метанону;
(2-(1H-індол-1-іл)тіазол-4-іл)(3,4,5-триметоксіфеніл)метанону;
(2-(1H-індол-3-іл)тіазол-4-іл)(3,4,5-триметоксіфеніл)метанону;
(2-(1H-індол-4-іл)тіазол-4-іл)(3,4,5-триметоксіфеніл)метанону;
(2-(1H-індол-6-іл)тіазол-4-іл)(3,4,5-триметоксіфеніл)метанону;
(2-(1H-індол-3-іл)імідазол-4-іл)(3,4,5-триметоксіфеніл)метанону та
(2-(1H-індол-7-іл)тіазол-4-іл)(3,4,5-триметоксіфеніл)метанону.
8. Фармацевтична композиція, що містить сполуку за п. 1 та фармацевтично прийнятний носій.
9. Спосіб лікування раку, що включає:
введення сполуки за п. 1 суб'єкту, хворому на рак, в умовах, ефективних для лікування раку, де рак вибирають з групи, що складається з раку простати, раку молочної залози, раку яєчників, раку шкіри, раку легенів, раку товстої кишки, лейкемії, раку нирок, раку ЦНС та їх комбінацій.
10. Спосіб за п. 9, де вказане введення проводять системно.
11. Спосіб за п. 9, де вказане введення проводять перорально, місцево, трансдермально, парентерально, підшкірно, внутрішньовенно, внутрішньом'язово, інтраперітонеально, шляхом інтраназальної інстиляції, шляхом внутрішньопорожнинної або внутрішньопухирчастої інстиляції, інтраокулярно, інтраартеріально, всередину уражених тканин, або шляхом аплікацій на слизові перегородки.
12. Спосіб за п. 9, де сполуку вводять в дозуванні, що становить від приблизно 0,01 до приблизно 100 мг/кг-масу тіла.
13. Спосіб за п. 9, де вказане введення повторяють періодично.
14. Спосіб за п. 9, де вказане введення проводять в комбінації з іншою протираковою терапією.
Текст
Реферат: Описано сполуки формули (І) Y R2 N Q R1 , (I) де Q являє собою S, N або О; X є необов'язковим і може бути О=, S=, =N-NH2, =N-OH або -ОН; Y є необов'язковим і може бути -N(H)-, О або С1-С20вуглеводнем; та R1 і R2, кожен незалежно, являють собою заміщені або незаміщені одинарні, конденсовані або множинні арильні або UA 105005 C2 (12) UA 105005 C2 (гетеро)циклічні системи. Також описано способи одержання таких сполук, фармацевтичні композиції, що містять такі сполуки, та їх застосування, зокрема, для лікування або профілактики раку. X Y R2 N Q R1 UA 105005 C2 5 10 15 20 25 30 35 40 45 50 У даній заявці заявлено пріоритет попередньої заявки на патент США серійний номер 61/061,875, поданої 16 червня 2008 р., що повністю включена у дану заявку шляхом посилання. Даний винахід був створений при фінансуванні, отриманому від Міністерства оборони США за грантом DAMD 01-1-0830, Служби охорони здоров'я США по гранту CA-125623, і Національного інституту здоров'я за основним грантом 21765. Уряд США має певні права на даний винахід. Галузь техніки Даний винахід стосується нових сполук, що мають протиракову активність, способів одержання таких сполук, і їх застосування для лікування різних форм раку. Рівень техніки Рак є другою найпоширенішою причиною смертей у Сполучених Штатах, його перевершують тільки серцеві захворювання. У Сполучених Штатах, 1 з кожних 4 смертей припадає на рак. Відносна п'ятирічна виживаність для всіх пацієнтів, хворих раком, що діагностували в 1996-2003 рр. становила 66%, до 50% в 1975-1977 рр. (Cancer Facts & Figuras American Cancer Society: Atlanta, GA (2008)). Зазначене збільшення виживаності відображає прогрес у діагностиці на ранній стадії та удосконалення лікування. Відкриття високоефективних засобів від раку, що мають низьку токсичність, є основною метою досліджень раку. Аміди 2-арил-тіазолідин-4-карбонові кислоти були описані як сильнодіючі цитотоксичні агенти як для раку простати, так і для меланоми (Li et al., “Synthesis and Antiproliferative Activity of Thiazolidine Analogs for Melanoma,” Bioorg. Med. Chem. Lett. 17: 4113-7 (2007); Li et al., “Structure-Activity Relationship Studies of Arylthiazolidine Amides as Selective Cytotoxic Agents for Melanoma,” Anticancer Res. 27: 883-888 (2007); Lu et al., “Synthesis and Biological Evaluation of 22- Arylthiazolidine-4-Carbоxylic Acid Amides for Melanoma and Prostate Cancer,” Abstracts of Papers, 234th ACS National Meeting, Boston, MA, United States, August 19-23, 2007, MEDI-304; Gududuru et al., “SAR Studies of Arylthiazolidine-4-Carboxylic Acid Amides: A Novel Class of Cytotoxic Agents for Prostate Cancer,” Bioorg. Med. Chem. Lett. 15: 4010-4013 (2005); Gududuru et al., “Discovery of Arylthiazolidine-4-Carbоxylic Acid Amides as a New Class of Cytotoxic Agents for Prostate Cancer,” J. Med. Chem. 48: 2584-2588 (2005)). Такі аміди 4-карбонових кислот були розроблені зі структури лізофосфатидинової кислоти (ЛФК) з ліпідним ланцюгом. Такий вибір розробок був спрямований на інгібування сигналів GPCR (рецептора, сполученого з G-білком), які задіяні в проліферації та виживанні раку простати (Raj et al., “Guanosine Phosphate Binding Protein Coupled Receptors in Prostate Cancer: A Review,” J. Urol. 167: 1458-1463 (2002); Kue et al., “Essential Role for G Proteins in Prostate Cancer Cell Growth and Signaling,” J. Urol. 164: 2162-7 (2000); Guo et al., “Expression and Function of Lysophosphatidic Acid LPA 1 Receptor in Prostate Cancer Cells,” Endocrinology 147: 4883-4892 (2006); Qi et al., “Lysophosphatidic Acid Stimulates Phospholipase D Activity and Cell Proliferation in PC-3 Human Prostate Cancer Cells,” J. Cell. Physiol. 174: 261-272 (1998)). Найбільш сильнодіючі з амідів 2-арил-тіазолідин-4-карбонової кислоти могли інгібувати ракові клітини простати із середнім значенням IC 50 у діапазоні від 0,7 до 1,0 мкМ, а середні значення IC50 відносно клітин меланоми становили1,8~2,6 мкМ (Li et al., “Synthesis and Antiproliferative Activity of Thiаzolidine Analogs for Melanoma,” Bioorg. Med. Chem. Lett. 17: 4113-7 (2007)). Одну переважну сполуку, гексадециламід (2RS, 4R)-2-феніл-тіазолідин-4-карбонової кислоти, було направлено до Національного інституту раку Сполучених Штатів Америки на скринінг лікарського засобу проти раку на 60 людських пухлинних клітинних лініях (NCI-60). Результати, отримані при аналізі NCI-60, показали, що дана сполука може інгібувати ріст всіх дев'яти типів ракових клітин зі значеннями IC50 у діапазоні від 0,124 мкМ (лейкемія, CCRF-CEM) до 3,81 мкМ (недрібноклітинний рак легенів, NCI-H522). Подальше збільшення протиракової активності даних сполук, у термінах їх IC50 значень, буде бажаним. Даний винахід спрямований на усунення цих і інших недоліків, відомих з рівня техніки. Сутність винаходу Перший аспект даного винаходу відноситься до сполук (I) 1 UA 105005 C2 X Y R2 N Q R1 5 10 15 20 (I) де Q являє собою S, N, або O; X є необов’язковим і може бути O=, S=, =N-NH2, =N-OH, або -OH; Y є необов’язковим і може бути -N(H)-, O, або C1-C20 вуглеводнем; R1 та R2 кожен незалежно являє собою заміщені або незаміщені одинарні, конденсовані або мультициклічні арильні або гетероциклічні системи, включаючи насичені та ненасичені Nгетероцикли, насичені та ненасичені S-гетероцикли, и насичені та ненасичені O-гетероцикли, насичені або ненасичені циклічні вуглеводні, насичені або ненасичені змішані гетероцикли, та аліфатичні нерозгалужені або розгалужені C1-C30 вуглеводні. Сполуки можуть бути представлені у вигляді їх фармацевтично прийнятних солей, гідратів або проліків. Другий аспект даного винаходу відноситься до фармацевтичної композиції, що містить фармацевтично прийнятний носій і сполуку за першого аспекту даного винаходу. Третій аспект даного винаходу відноситься до способу лікування раку, що включає вибір суб'єкта, що потребує лікування раку, та введення суб'єктові фармацевтичної композиції, що містить сполуку за першого аспекту даного винаходу в умовах, ефективних для лікування раку. Четвертий аспект даного винаходу відноситься до способу руйнування ракової клітини, що включає: забезпечення сполуки відповідно до даного винаходу з наступним контактуванням ракової клітини зі сполукою в умовах, ефективних для руйнування контактуючої ракової клітини. П'ятий аспект даного винаходу відноситься до способів одержання сполуки формули (I). Відповідно до одного варіанту виконання, спосіб відноситься до стадії CON O N Q' R1 2 25 30 2 реакції проміжної сполуки з реактивом Грін’яра, що містить R або Br-R в умовах, 1 ефективних для утворення сполуки формули (I), що містить метанонову лінкерну групу, де R и 2 R визначені як для формули (I) та Q’ аналогічний Q, за виключенням випадку, коли Q’ містить захисну групу, якщо Q являє собою N, та необов’язкового зняття захисної групи зі сполуки, якщо Q являє собою N. Перетворення метанонової лінкерної групи на гідразонову лінкерну групу, метаноноксімну лінкерну групу, і метиленовий лінкер також входять до обсягу даного винаходу. Відповідно до іншого переважного варіанту виконання, 2 UA 105005 C2 O CH N Q' R1 5 2 спосіб відноситься до стадії реакції проміжної сполуки з реактивом Грін’яра R в умовах, 1 2 ефективних для утворення сполуки формули (I), що містить -CH(OH)- лінкерну групу, де R и R визначені як у формулі (I) та Q’ аналогічний Q, за виключенням випадку, коли Q’ містить захисну групу, якщо Q являє собою N, та необов’язкового знятті захисної групи зі сполуки, якщо Q являє собою N. Також передбачено дегідрогенізацію з утворенням тіазольного, оксазольного, або імідазольного центрального циклу. Відповідно до іншого переважного варіанту виконання, спосіб включає COOH N Q' R1 10 15 20 25 30 35 40 2 реакцію проміжної сполуки с Br-R в умовах, ефективних для утворення сполуки формули (I), 1 2 що містить ефірну або амідну лінкерну групу, де R та R визначені як у формулі (I) та Q’ аналогічний Q, за виключенням випадку, коли Q’ містить захисну групу, якщо Q являє собою N, и необов’язкового зняття захисної групи зі сполуки, якщо Q являє собою N. Також передбачено дегідрогенізацію з утворенням тіазольного, оксазольного, або імідазольного центрального циклу. Даний винахід представляє новий клас сполук, що мають підвищену активність та селективність (у порівнянні з попередніми тіазолідинкарбоксамідами жирних кислот) під час досліджень in vitro по відношенню до декількох різних ліній ракових клітин, включаючи ракові клітини меланоми та простати. За допомогою першого переважного члена даного класу, також у прикладах, які наведені у даній заявці, показано, що дані сполуки є інгібіторами полімеризації тубуліну. Продемонстровано, що одна з даних сполук має значну протиракову активність під час in vivo досліджень ксенотрансплантатів меланоми мишей. Виходячи із цих даних та демонстрації їх механізму дії, вважають, що сполуки відповідно до даного винаходу мають значну активність по відношенню до ряду форм раку. Стислий опис фігур Фігура 1 являє собою зображення ORTEP сполуки 8f, де температурний еліпсоїд зображено при рівні ймовірності 50 %. Зображення було одержано в результаті рентгенографічних кристалографічних досліджень. Фігура 2 ілюструє дослідження ЯМР, де вимірювали авто-дегідрогенізацію тіазолінової та тіазольної сполуки 8f. У день 0, проба ЯМР містила суміші тіазоліну та тіазолів в CDCl3; співвідношення становило приблизно 3:2. На 9-й день, тіазолінова сполука майже повністю перетворилася на тіазольну сполуку 8f. Фігури 3 A-B ілюструють вплив сполук 8f на розподіл клітинного циклу ракових клітин простати LNCaР. Фігури 3A ілюструють ефект різних дозувань (10 нМ, 50 нМ, 200 нМ, та 500 нМ) сполуки 8f у порівнянні з контролем. Кількості, що перевищують значення IC 50, ілюструють значну зміну розподілу клітинного циклу. Фігура 3B графічно ілюструє зміну G2/M у порівнянні з розподілом клітинного циклу G1. Фігура 4 являє собою графічну ілюстрацію впливу сполуки 8f на тубулінову зборку. Фігури 5A-B являють собою графічні ілюстрації здатності сполук 8f та 8n значною мірою інгібувати утворення колоній меланоми A375 в аналізі in vitro. При 0,3 мкм або вище, утворення колоній інгібовано повністю. Фігура 6 являє собою графічну ілюстрацію здатності сполуки 8n (6 мг/кг, IP щоденна ін’єкція) 3 UA 105005 C2 інгібувати зростання пухлин меланоми B16 in vivo. Детальний опис винаходу Один аспект даного винаходу відноситься до сполук (I) X Y R2 N Q R1 5 10 15 20 25 30 35 (I) де Q являє собою S, N, або O; X є необов’язковим і може бути S=, O=, =N-NH2, =N-OH, або -OH; Y є необов’язковим і може бути -N(H)-, O, або C1-C20 вуглеводнем; і R1 и R2 кожен незалежно являє собою заміщені або незаміщені одинарні, конденсовані або множинні арильні або (гетеро)циклічні системи, включаючи насичені та ненасичені Nгетероцикли, насичені та ненасичені S-гетероцикли, и насичені та ненасичені O-гетероцикли, насичені або ненасичені циклічні вуглеводні, насичені або ненасичені змішані гетероцикли, аліфатичні нерозгалужені або розгалужені C1-C30 вуглеводні. Як вживають у даній заявці, “насичені або ненасичені циклічні вуглеводні” можуть являти собою будь-який такий циклічний вуглеводень, включаючи, але не обмежуючись наведеним, феніл, біфеніл, тріфеніл, нафтил, циклоалкіл, циклоалкеніл, циклодієніл, флуорен, адамантан, та інш.; “насичені або ненасичені N-гетероцикли” можуть являти собою будь-який такий Nвмісний гетероцикл, включаючи, але не обмежуючись наведеним, аза- і діаза-циклоалкіли, такі, як азиридиніл, азетидиніл, діазатидиніл, піролідиніл, піперидиніл, пієразиніл, та азоканіл, піроліл, піразоліл, імідазолил, піридиніл, піримідиніл, піразиніл, піридазиніл, тріазиніл, тетразиніл, піролізиніл, індоліл, хінолініл, ізохінолініл, бензимідазоліл, індазоліл, хінолізиніл, циннолініл, хіналолініл, фталазиніл, нафтиридиніл, хіноксалініл, та інш.; “насичені або ненасичені O-гетероцикли” можуть являти собою будь-який такий O-вмісний гетероцикл, включаючи, але не обмежуючись наведеним, оксіраніл, оксетаніл, тетрагидрофураніл, тетрагидропираніл, діоксаніл, фураніл, пірабой, бензoфураніл, бензoдіоксоліл, та інш.; “насичені або ненасичені S-гетероцикли” можуть являти собою будь-який такий S-вмісний гетероцикл, включаючи, але не обмежуючись наведеним, тираніл, тіетаніл, тетрагидротіофеніл, дитіоланіл, тетрагидротіопираніл, тіофеніл, тієпиніл, тіанафеніл, та інш.; “насичені або ненасичені змішані гетероцикли” можуть являти собою будь-який гетероцикл, що містить два або більше S-, N-, або O-гетероатоми, включаючи, але не обмежуючись наведеним, оксатіоланіл, морфолініл, тіоксаніл, тіазоліл, ізотіазоліл, ізадіазоліл, оксазоліл, ізоксазоліл, оксадіазоліл та інш. 1 2 Як відмічено вище, R і R групи можуть бути заміщеними або незаміщеними. Таким чином, незважаючи на те, що ілюстративні групи, зазначені в попередньому параграфі, є незаміщеними, фахівець у цій галузі повинен оцінити, що такі групи можуть бути заміщені одним або більше, двома або більше, трьома або більше й навіть п'ятьома або більше замісниками 1 2 (але не воднем). Переважні R і R групи можуть бути загалом представлені такими структурами: 4 UA 105005 C2 R3 R3 R4 R4 R5 Z1 , , 3 R Z2 5 Z1 або , 1 2 де Z та Z являють собою один чи більше S-, N-, або O-гетероатоми, що присутні в циклічній 1 2 структурі, а цикли є п’яти або шестичленними циклами. В одному варіанті виконання, R та R групи можуть мати структуру: R3 R4 R5 R7 R6 3 10 15 20 25 30 4 5 6 7 Замісники таких циклічних членів (наприклад, R , R , R , R , R ) незалежно вибирають із групи, що складається з водню (наприклад, відсутність заміщення в конкретному положенні), гідроксилу, аліфатичного нерозгалуженого або розгалуженого C 1-C10 вуглеводню, алкоксі, арилоксі, нітро, ціано, гало (наприклад, хлоро, фторо, бромо, або йодо), галоалкіло, дигалоалкіло, тригалоалкіло, аміно, алкіламіно, мезиламіно, діалкіламіно, ариламіно, амідо, карбаміду, алкіл-карбаміду, алкіламідо (наприклад, ацетаміду), галоалкіламіду, ариламідо, арилу, і C5-C7 циклоалкілу, арилалкілу, та їх комбінацій. Одинарні замісники можуть бути присутніми в орто, мета, або пара положеннях. Якщо присутні два або більше замісника, один з них переважно, хоча й необов'язково, знаходиться в пара положенні. Як вживають у цій заявці, “аліфатичний нерозгалужений або розгалужений вуглеводень” відноситься як до алкіленових груп, що містять від одного атома вуглеводню до певної верхньої межі, а також до алкенільних груп та алкінільних груп, що містять від двох атомів вуглеводня до певної верхньої межі, незалежно від того, чи присутні атоми вуглеводня в одному ланцюгу або в розгалуженому ланцюгу. Якщо не указано конкретно, вуглеводні можуть містити до приблизно 30 атомів вуглеводню, або до приблизно 20 атомів вуглеводню, або до приблизно 10 атомів вуглеводню. Алкенільні та алкінильні групи можуть бути мононенасиченими або поліненасиченими. Як вживають у цій заявці, термін “алкіл” може являти собою будь-яку нерозгалужену або розгалужену алкільну групу, що містить до приблизно 30 атомів вуглеводню, якщо не вказано інше. Алкільна група може бути єдиним замісником або може бути компонентом більшого замісника, наприклад, входити до складу алкоксі, галоалкілу, арилалкілу, алкіламіно, диалкіламіно, алкіламідо, алкілкарбаміду, та інш. Переважними алкільными групами є метил, етил, и пропіл, и таким чином галометил, дигалометил, тригалометил, галоетил, дигалоетил, тригалоетил, галопропіл, дигалопропіл, тригалопропіл, метоксі, етоксі, пропоксі, арилметил, арилетил, арилпропіл, метиламіно, етиламіно, пропіламіно, діметиламіно, діетиламіно, 5 UA 105005 C2 5 10 15 20 метиламідо, ацетамідо, пропіламідо, галометиламідо, галоетиламідо, галопропіламідо, метилкарбамід, етил-карбамід, пропіл-карбамід, та інш. Як вживають у цій заявці, термін “арил” відноситься до будь-якого замісника - ароматичного 1 2 циклу, що безпосередньо зв'язаний з R або R членом (членами) циклу. Арильна група може бути єдиним замісником, або арильна група може бути компонентом більшого замісника, наприклад, входити до складу арилалкілу, ариламіно, ариламідо, та інш. Ілюстративні арильні групи включають, без обмежень, феніл, толіл, ксабол, фураніл, нафтил, піридинил, піримідинил, піридазиніл, піразиніл, триазиніл, тіазоліл, оксазоліл, ізооксазоліл, піразоліл, імідазоліл, тіофеніл, піроліл, фенілметил, фенілетил, феніламіно, феніламідо, та інш. 1 2 3 7 Переважні R та R групи включають заміщені (R -R як визначено вище) та незаміщені фураніл, індоліл, піридинил, феніл, бифеніл, трифеніл, дифенілметан, адамантаніл, флуореніл, та інші гетероциклічні аналоги, такі, як визначені вище (наприклад, піроліл, піразоліл, імідазоліл, піридиніл, піримідиніл, піразиніл, піридазиніл, триазиніл, тетразиніл, піролізиніл, індоліл, хінолініл, ізохінолініл, бензімідазоліл, індазоліл, хінолізиніл, циннолініл, хіналолініл, фталазиніл, нафтиридиніл, хіноксалініл, оксіраніл, оксетаніл, тетрагідрофураніл, тетрагидропіраніл, диоксаніл, фураніл, пірабой, бензoфураніл, бензoдиоксоліл, тираніл, тіетаніл, тетрагідротіофеніл, дитіоланіл, тетрагідротіопіраніл, тіофеніл, тієпиніл, тіанафеніл, оксатіоланіл, морфолініл, тіоксаніл, тіазоліл, ізотіазоліл, ізадіазоліл, оксазоліл, ізоксазоліл, оксадіазоліл). 2 1 Найбільш переважною R групою є 3,4,5-триметоксіфеніл, а найбільш переважні R групи включають заміщені і незаміщені фенільні, заміщені і незаміщені тіофенільні, та заміщені і 1 незаміщені індолільні групи. Переважними замісниками цих переважних R груп є метил, етил, фторо, бромо, ціано, нітро, трифторо та аміно. В певних варіантах, сполука формули (I): (Ia), X X Y Y R2 R2 NH Q N Q R1 (Ia), R1 (Ib), X Y R2 Q 25 N R1 або (Ic). В залежності від визначення Q, тому, сполуки за даним винаходом включають тіазоли, дигідро-тіазоли, тіазолідини, оксазоли, дигідро-оксазоли, оксазолідини, імідазоли, дигідроімідазоли, та імідазолідини. За переважного варіанту виконання, клас сполук має структурну формулу (II): 6 UA 105005 C2 R3 R4 O R2 R5 N Q R3 R5 R1 R4 5 10 15 20 25 30 35 (II) 1 5 де X являє собою O=, Y опущено, и Q и R -R такі, як визначено вище для формули (I). Ілюстративні сполуки формули (II) включають, без обмежень: феніл(2-фенілтіазол-4іл)метанон (сполука 8a); феніл(2-фенілтіазолідин-4-іл)метанон; феніл(2-фенілоксазолідин-4іл)метанон; (4,5-дигідро-2-фенілоксазол-4-іл)(феніл)метанон; феніл(2-фенілоксазол-4іл)метанон; (4-метоксіфеніл)(2-фенілтіазол-4-іл)метанон (сполука 8b); (4-метоксіфеніл)(2фенілтіазолідин-4-іл)метанон; (4,5-дигідро-2-фенілтіазол-4-іл)(4-метоксіфеніл)метанон; (4метоксіфеніл)(2-фенілоксазол-4-іл)метанон; (4-метоксіфеніл)(2-фенілоксазолідин-4-іл)метанон; (4,5-дигідро-2-фенілоксазол-4-іл)(4-метоксіфеніл)метанон; (4-метоксіфеніл)(2-феніл-1Hімідазол-4-іл)метанон; (4-метоксіфеніл)(2-фенабомімідазолідин-4-іл)метанон; (4,5-дигідро-2феніл-1H-імідазол-4-іл)(4-метоксіфеніл)метанон; (3-метоксіфеніл)(2-фенілтіазол-4-іл)метанон (сполука 8c); (3-метоксіфеніл)(2-фенілтіазолідин-4-іл)метанон; (4,5-дигідро-2-фенілтіазол-4іл)(3-метоксіфеніл)метанон; (3-метоксіфеніл)(2-фенілоксазол-4-іл)метанон; (3-метоксіфеніл)(2фенілоксазолідин-4-іл)метанон; (4,5-дигідро-2-фенілоксазол-4-іл)(3-метоксіфеніл)метанон; (3метоксіфеніл)(2-феніл-1H-імідазол-4-іл)метанон; (3-метоксіфеніл)(2-фенабомімідазолідин-4іл)метанон; (4,5-дигідро-2-феніл-1H-імідазол-4-іл)(3-метоксіфеніл)метанон; (2-метоксіфеніл)(2фенілтіазол-4-іл)метанон (сполука 8d); (2-метоксіфеніл)(2-фенілтіазолідин-4-іл)метанон; (4,5дигідро-2-фенілтіазол-4-іл)(2-метоксіфеніл)метанон; (2-метоксіфеніл)(2-фенілоксазол-4іл)метанон; (2-метоксіфеніл)(2-фенілоксазолідин-4-іл)метанон; (4,5-дигідро-2-фенілоксазол-4іл)(2-метоксіфеніл)метанон; (2-метоксіфеніл)(2-феніл-1H-імідазол-4-іл)метанон; (2метоксіфеніл)(2-фенабомімідазолідин-4-іл)метанон; (4,5-дигідро-2-феніл-1H-імідазол-4-іл)(2метоксіфеніл)метанон; (3,4-діметоксіфеніл)(2-фенілтіазол-4-іл)метанон (сполука 8e); (3,4діметоксіфеніл)(2-фенілтіазолідин-4-іл)метанон; (4,5-дигідро-2-фенілтіазол-4-іл)(3,4діметоксіфеніл)метанон; (3,4-діметоксіфеніл)(2-фенілоксазол-4-іл)метанон; (3,4діметоксіфеніл)(2-фенілоксазолідин-4-іл)метанон; (4,5-дигідро-2-фенілоксазол-4-іл)(3,4діметоксіфеніл)метанон; (3,4-діметоксіфеніл)(2-феніл-1H-імідазол-4-іл)метанон; (3,4діметоксіфеніл)(2-фенабомімідазолідин-4-іл)метанон; (4,5-дигідро-2-феніл-1H-імідазол-4-іл)(3,4діметоксіфеніл)метанон; (3,4,5-триметоксіфеніл)(2-фенілтіазол-4-іл)метанон (сполука 8f); (3,4,5триметоксіфеніл)(2-фенілтіазолідин-4-іл)метанон; (4,5-дигідро-2-фенілтіазол-4-іл)(3,4,5триметоксіфеніл)метанон, що легко перетворюється на сполуку 8f; (3,4,5-триметоксіфеніл)(2фенілоксазолідин-4-іл)метанон; (4,5-дигідро-2-фенілоксазол-4-іл)(3,4,5триметоксіфеніл)метанон; (3,4,5-триметоксіфеніл)(2-фенілоксазол-4-іл)метанон; (4,5-дигідро-2феніл-1H-імідазол-4-іл)(3,4,5-триметоксіфеніл)метанон; (3,4,5-триметоксіфеніл)(2-феніл-1Hімідазол-4-іл)метанон; (3,4,5-триметоксіфеніл)(2-фенабомімідазолідин-4-іл)метанон; (3,5діметоксіфеніл)(2-фенілтіазол-4-іл)метанон (сполука 8g); (3,5-діметоксіфеніл)(2фенілтіазолідин-4-іл)метанон; (4,5-дигідро-2-фенілтіазол-4-іл)(3,5-діметоксіфеніл)метанон; (3,5діметоксіфеніл)(2-фенілоксазол-4-іл)метанон; (3,5-діметоксіфеніл)(2-фенілоксазолідин-4 7 UA 105005 C2 5 10 15 20 25 30 35 40 45 50 55 60 іл)метанон; (4,5-дигідро-2-фенілоксазол-4-іл)(3,5-діметоксіфеніл)метанон; (3,5діметоксіфеніл)(2-феніл-1H-імідазол-4-іл)метанон; (3,5-діметоксіфеніл)(2-фенабомімідазолідин4-іл)метанон; (4,5-дигідро-2-феніл-1H-імідазол-4-іл)(3,5-діметоксіфеніл)метанон; (2фторфеніл)(2-фенілтіазол-4-іл)метанон (сполука 8h); (2-фторфеніл)(2-фенілтіазолідин-4іл)метанон; (4,5-дигідро-2-фенілтіазол-4-іл)(2-фторфеніл)метанон; (2-фторфеніл)(2фенілоксазол-4-іл)метанон; (2-фторфеніл)(2-фенілоксазолідин-4-іл)метанон; (4,5-дигідро-2фенілоксазол-4-іл)(2-фторфеніл)метанон; (2-фторфеніл)(2-феніл-1H-імідазол-4-іл)метанон; (2фторфеніл)(2-фенабомімідазолідин-4-іл)метанон; (4,5-дигідро-2-феніл-1H-імідазол-4-іл)(2фторфеніл)метанон; (2-фенілтіазол-4-іл)(піридин-2-іл)метанон (сполука 8i); (4,5-дигідро-2фенілтіазол-4-іл)(піридин-2-іл)метанон; (2-фенілтіазолідин-4-іл)(піридин-2-іл)метанон; (2фенілоксазол-4-іл)(піридин-2-іл)метанон; (4,5-дигідро-2-фенілоксазол-4-іл)(піридин-2іл)метанон; (2-фенілоксазолідин-4-іл)(піридин-2-іл)метанон; (2-феніл-1H-імідазол-4-іл)(піридин2-іл)метанон; (4,5-дигідро-2-феніл-1H-імідазол-4-іл)(піридин-2-іл)метанон; (2фенабомімідазолідин-4-іл)(піридин-2-іл)метанон; (2-п-толілтіазол-4-іл)(3,4,5триметоксіфеніл)метанон (сполука 8k); (4,5-дигідро-2-п-толілтіазол-4-іл)(3,4,5триметоксіфеніл)метанон; (3,4,5-триметоксіфеніл)(2-п-толілтіазолідин-4-іл)метанон; (2-птолілоксазол-4-іл)(3,4,5-триметоксіфеніл)метанон; (4,5-дигідро-2-п-толілоксазол-4-іл)(3,4,5триметоксіфеніл)метанон; (3,4,5-триметоксіфеніл)(2-п-толілоксазолідин-4-іл)метанон; (2-птоліл-1H-імідазол-4-іл)(3,4,5-триметоксіфеніл)метанон; (4,5-дигідро-2-п-толіл-1H-імідазол-4іл)(3,4,5-триметоксіфеніл)метанон; (3,4,5-триметоксіфеніл)(2-п-толабомімідазолідин-4іл)метанон; (2-(2-фторфеніл)-тіазол-4-іл)-(3,4,5-триметоксіфеніл)метанон (сполука 8l); (4,5дигідро-2-(2-фторфеніл)тіазол-4-іл)(3,4,5-триметоксіфеніл)метанон; (3,4,5-триметоксіфеніл)(2(2-фторфеніл)тіазолідин-4-іл)метанон; (2-(2-фторфеніл)оксазол-4-іл)(3,4,5триметоксіфеніл)метанон; (4,5-дигідро-2-(2-фторфеніл)оксазол-4-іл)(3,4,5триметоксіфеніл)метанон; (3,4,5-триметоксіфеніл)(2-(2-фторфеніл)оксазолідин-4-іл)метанон; (2(2-фторфеніл)-1H-імідазол-4-іл)(3,4,5-триметоксіфеніл)метанон; (4,5-дигідро-2-(2-фторфеніл)1H-імідазол-4-іл)(3,4,5-триметоксіфеніл)метанон; (3,4,5-триметоксіфеніл)(2-(2фторфеніл)імідазолідин-4-іл)метанон; (2-(3-фторфеніл)-тіазол-4-іл)(3,4,5триметоксіфеніл)метанон (сполука 8m); (4,5-дигідро-2-(3-фторфеніл)тіазол-4-іл)(3,4,5триметоксіфеніл)метанон; (3,4,5-триметоксіфеніл)(2-(3-фторфеніл)тіазолідин-4-іл)метанон; (2(3-фторфеніл)оксазол-4-іл)(3,4,5-триметоксіфеніл)метанон; (4,5-дигідро-2-(3фторфеніл)оксазол-4-іл)(3,4,5-триметоксіфеніл)метанон; (3,4,5-триметоксіфеніл)(2-(3фторфеніл)оксазолідин-4-іл)метанон; (2-(3-фторфеніл)-1H-імідазол-4-іл)(3,4,5триметоксіфеніл)метанон; (4,5-дигідро-2-(3-фторфеніл)-1H-імідазол-4-іл)(3,4,5триметоксіфеніл)метанон; (3,4,5-триметоксіфеніл)(2-(3-фторфеніл)імідазолідин-4-іл)метанон; (2-(4-фторфеніл)-тіазол-4-іл)(3,4,5-триметоксіфеніл)метанон (сполука 8n); (4,5-дигідро-2-(4фторфеніл)тіазол-4-іл)(3,4,5-триметоксіфеніл)метанон; (3,4,5-триметоксіфеніл)(2-(4фторфеніл)тіазолідин-4-іл)метанон; (2-(4-фторфеніл)оксазол-4-іл)(3,4,5триметоксіфеніл)метанон; (4,5-дигідро-2-(4-фторфеніл)оксазол-4-іл)(3,4,5триметоксіфеніл)метанон; (3,4,5-триметоксіфеніл)(2-(4-фторфеніл)оксазолідин-4-іл)метанон; (2(4-фторфеніл)-1H-імідазол-4-іл)(3,4,5-триметоксіфеніл)метанон; (4,5-дигідро-2-(4-фторфеніл)1H-імідазол-4-іл)(3,4,5-триметоксіфеніл)метанон; (3,4,5-триметоксіфеніл)(2-(4фторфеніл)імідазолідин-4-іл)метанон; (2-(3,4-діметоксіфеніл)-тіазол-4-іл)(3,4,5триметоксіфеніл)метанон (сполука 8o); (4,5-дигідро-2-(3,4-діметоксіфеніл)тіазол-4-іл)(3,4,5триметоксіфеніл)метанон; (3,4,5-триметоксіфеніл)(2-(3,4-діметоксіфеніл)тіазолідин-4іл)метанон; (2-(3,4-діметоксіфеніл)оксазол-4-іл)(3,4,5-триметоксіфеніл)метанон; (4,5-дигідро-2(3,4-діметоксіфеніл)оксазол-4-іл)(3,4,5-триметоксіфеніл)метанон; (3,4,5-триметоксіфеніл)(2-(3,4діметоксіфеніл)оксазолідин-4-іл)метанон; (2-(3,4-діметоксіфеніл)-1H-імідазол-4-іл)(3,4,5триметоксіфеніл)метанон; (4,5-дигідро-2-(3,4-діметоксіфеніл)-1H-імідазол-4-іл)(3,4,5триметоксіфеніл)метанон; (3,4,5-триметоксіфеніл)(2-(3,4-діметоксіфеніл)імідазолідин-4іл)метанон; (2-(4-нітрофеніл)-тіазол-4-іл)(3,4,5-триметоксіфеніл)метанон (сполука 8p); (4,5дигідро-2-(4-нітрофеніл)тіазол-4-іл)(3,4,5-триметоксіфеніл)метанон; (3,4,5-триметоксіфеніл)(2(4-нітрофеніл)тіазолідин-4-іл)метанон; (2-(4-нітрофеніл)оксазол-4-іл)(3,4,5триметоксіфеніл)метанон; (4,5-дигідро-2-(4-нітрофеніл)оксазол-4-іл)(3,4,5триметоксіфеніл)метанон; (3,4,5-триметоксіфеніл)(2-(4-нітрофеніл)оксазолідин-4-іл)метанон; (2(4-нітрофеніл)-1H-імідазол-4-іл)(3,4,5-триметоксіфеніл)метанон; (4,5-дигідро-2-(4-нітрофеніл)1H-імідазол-4-іл)(3,4,5-триметоксіфеніл)метанон; (3,4,5-триметоксіфеніл)(2-(4нітрофеніл)імідазолідин-4-іл)метанон; (2-(4-ціанофеніл)-тіазол-4-іл)(3,4,5триметоксіфеніл)метанон (сполука 8q); (4,5-дигідро-2-(4-ціанофеніл)тіазол-4-іл)(3,4,5триметоксіфеніл)метанон; (3,4,5-триметоксіфеніл)(2-(4-ціанофеніл)тіазолідин-4-іл)метанон; (2 8 UA 105005 C2 5 10 15 20 25 30 35 40 45 50 55 60 (4-ціанофеніл)оксазол-4-іл)(3,4,5-триметоксіфеніл)метанон; (4,5-дигідро-2-(4ціанофеніл)оксазол-4-іл)(3,4,5-триметоксіфеніл)метанон; (3,4,5-триметоксіфеніл)(2-(4ціанофеніл)оксазолідин-4-іл)метанон; (2-(4-ціанофеніл)-1H-імідазол-4-іл)(3,4,5триметоксіфеніл)метанон; (4,5-дигідро-2-(4-ціанофеніл)-1H-імідазол-4-іл)(3,4,5триметоксіфеніл)метанон; (3,4,5-триметоксіфеніл)(2-(4-ціанофеніл)імідазолідин-4-іл)метанон; 4(4-(3,4,5-триметоксібензоїл)-тіазол-2-іл)-бензойну кислоту (сполука 8r); 4-(4-(3,4,5триметоксібензоїл)-(1,3-дигідро)тіазол-2-іл)-бензойну кислоту; 4-(4-(3,4,5-триметоксібензоїл)тіазолідин-2-іл)-бензойну кислоту; 4-(4-(3,4,5-триметоксібензоїл)-оксазол-2-іл)-бензойну кислоту; 4-(4-(3,4,5-триметоксібензоїл)-(1,3-дигідро)оксазол-2-іл)-бензойну кислоту; 4-(4-(3,4,5триметоксібензоїл)-оксазолідин-2-іл)-бензойну кислоту; 4-(4-(3,4,5-триметоксібензоїл)-1Hімідазол-2-іл)-бензойну кислоту; 4-(4-(3,4,5-триметоксібензоїл)-(1,3-дигідро)-1H-імідазол-2-іл)бензойну кислоту; 4-(4-(3,4,5-триметоксібензоїл)-імідазолідин-2-іл)-бензойну кислоту; метил-4(4-(3,4,5-триметоксібензоїл)-тіазол-2-іл)-бензоат (сполука 8s); метил-4-(4-(3,4,5триметоксібензоїл)-(1,3-дигідро)тіазол-2-іл)-бензоат; метил-4-(4-(3,4,5-триметоксібензоїл)тіазолідин-2-іл)-бензоат; метил-4-(4-(3,4,5-триметоксібензоїл)-оксазол-2-іл)-бензоат; метил-4-(4(3,4,5-триметоксібензоїл)-(1,3-дигідро)оксазол-2-іл)-бензоат; метил-4-(4-(3,4,5триметоксібензоїл)-оксазолідин-2-іл)-бензоат; метил-4-(4-(3,4,5-триметоксібензоїл)-1H-імідазол2-іл)-бензоат; метил-4-(4-(3,4,5-триметоксібензоїл)-(1,3-дигідро)-1H-імідазол-2-іл)-бензоат; метил-4-(4-(3,4,5-триметоксібензоїл)-імідазолідин-2-іл)-бензоат; (2-(4-(трифторметил)-феніл)тіазол-4-іл)(3,4,5-триметоксіфеніл)метанон (сполука 8t); (4,5-дигідро-2-(4-(трифторметил)феніл)тіазол-4-іл)(3,4,5-триметоксіфеніл)метанон; (3,4,5-триметоксіфеніл)(2-(4ціанофеніл)тіазолідин-4-іл)метанон; (2-(4-(трифторметил)-феніл)оксазол-4-іл)(3,4,5триметоксіфеніл)метанон; (4,5-дигідро-2-(4-(трифторметил)-феніл)оксазол-4-іл)(3,4,5триметоксіфеніл)метанон; (3,4,5-триметоксіфеніл)(2-(4-(трифторметил)-феніл)оксазолідин-4іл)метанон; (2-(4-(трифторметил)-феніл)-1H-імідазол-4-іл)(3,4,5-триметоксіфеніл)метанон; (4,5дигідро-2-(4-(трифторметил)-феніл)-1H-імідазол-4-іл)(3,4,5-триметоксіфеніл)метанон; (3,4,5триметоксіфеніл)(2-(4-(трифторметил)-феніл)імідазолідин-4-іл)метанон; (2-(4-бромфеніл)тіазол-4-іл)-(3,4,5-триметоксіфеніл)метанон (сполука 8u); (4,5-дигідро-2-(4-бромфеніл)тіазол-4іл)(3,4,5-триметоксіфеніл)метанон; (3,4,5-триметоксіфеніл)(2-(4-бромфеніл)тіазолідин-4іл)метанон; (2-(4-бромфеніл)оксазол-4-іл)(3,4,5-триметоксіфеніл)метанон; (4,5-дигідро-2-(4бромфеніл)оксазол-4-іл)(3,4,5-триметоксіфеніл)метанон; (3,4,5-триметоксіфеніл)(2-(4бромфеніл)оксазолідин-4-іл)метанон; (2-(4-бромфеніл)-1H-імідазол-4-іл)(3,4,5триметоксіфеніл)метанон; (4,5-дигідро-2-(4-бромфеніл)-1H-імідазол-4-іл)(3,4,5триметоксіфеніл)метанон; (3,4,5-триметоксіфеніл)(2-(4-бромфеніл)імідазолідин-4-іл)метанон; (2(4-етилфеніл)-тіазол-4-іл)-(3,4,5-триметоксі-феніл)метанон (сполука 8v); (4,5-дигідро-2-(4етилфеніл)тіазол-4-іл)(3,4,5-триметоксіфеніл)метанон; (3,4,5-триметоксіфеніл)(2-(4етилфеніл)тіазолідин-4-іл)метанон; (2-(4-етилфеніл)оксазол-4-іл)(3,4,5триметоксіфеніл)метанон; (4,5-дигідро-2-(4-етилфеніл)оксазол-4-іл)(3,4,5триметоксіфеніл)метанон; (3,4,5-триметоксіфеніл)(2-(4-етилфеніл)оксазолідин-4-іл)метанон; (2(4-етилфеніл)-1H-імідазол-4-іл)(3,4,5-триметоксіфеніл)метанон; (4,5-дигідро-2-(4-етилфеніл)-1Hімідазол-4-іл)(3,4,5-триметоксіфеніл)метанон; (3,4,5-триметоксіфеніл)(2-(4етилфеніл)імідазолідин-4-іл)метанон; (2-(4-амінофеніл)-тіазол-4-іл)-(3,4,5-триметоксіфеніл)метанон (сполука 8w); (2-(4-амінофеніл)тіазолідин-4-іл)(3,4,5-триметоксіфеніл)метанон; (2-(4-амінофеніл)-4,5-дигідротіазол-4-іл)(3,4,5-триметоксіфеніл)метанон; (2-(4-амінофеніл)оксазол-4-іл)-(3,4,5-триметоксі-феніл)метанон; (2-(4-амінофеніл)оксазолідин-4-іл)(3,4,5триметоксіфеніл)метанон; (2-(4-амінофеніл)-4,5-дигідрооксазол-4-іл)(3,4,5триметоксіфеніл)метанон; (2-(4-амінофеніл)-1H-імідазол-4-іл)-(3,4,5-триметоксі-феніл)метанон; (2-(4-амінофеніл)-1H-імідазолідин-4-іл)(3,4,5-триметоксіфеніл)метанон; (2-(4-амінофеніл)-4,5дигідроімідазол-4-іл)(3,4,5-триметоксіфеніл)метанон; (2-(4-ацетамідофеніл)тіазолідин-4іл)(3,4,5-триметоксіфеніл)метанон; (2-(4-ацетамідофеніл)-4,5-дигідротіазол-4-іл)(3,4,5триметоксіфеніл)метанон; (2-(4-ацетамідофеніл)-тіазол-4-іл)(3,4,5-триметоксіфеніл)метанон; (3,4,5-триметоксіфеніл)(2-(3,4,5-триметоксіфеніл)тіазол-4-іл)метанон; (4,5-дигідро-2-(3,4,5триметоксіфеніл)тіазол-4-іл)( 3,4,5-триметоксіфеніл)метанон; (3,4,5-триметоксіфеніл)(2-(3,4,5триметоксіфеніл)тіазолідин-4-іл)метанон; (3,4,5-триметоксіфеніл)(2-(3,4-діметоксіфеніл)тіазол4-іл)метанон; (4,5-дигідро-2-(3,4-діметоксіфеніл)тіазол-4-іл)( 3,4,5-триметоксіфеніл)метанон; (3,4,5-триметоксіфеніл)(2-(3,4-діметоксіфеніл)тіазолідин-4-іл)метанон; (2-(4fluornoфеніл)тіазолідин-4-іл)(3,4,5-триметоксіфеніл)метанон; (2-(4-фторфеніл)-4,5дигідротіазол-4-іл)(3,4,5-триметоксіфеніл)метанон; (2-(4-фторфеніл)-тіазол-4-іл)(3,4,5триметоксіфеніл)метанон; (3,4,5-триметоксіфеніл)(2-(2-метоксіфеніл)тіазол-4-іл)метанон; (4,5дигідро-2-(2-метоксіфеніл)тіазол-4-іл)( 3,4,5-триметоксіфеніл)метанон; (3,4,5 9 UA 105005 C2 5 10 15 20 25 30 35 40 45 50 55 60 триметоксіфеніл)(2-(2-метоксіфеніл)тіазолідин-4-іл)метанон; (2-(піридин-4-іл)-тіазол-4-іл)-(3,4,5триметоксіфеніл)метанон (сполука 8x); (4,5-дигідро-2-(піридин-4-іл)тіазол-4-іл)(3,4,5триметоксіфеніл)метанон; (3,4,5-триметоксіфеніл)(2-(піридин-4-іл)тіазолідин-4-іл)метанон; (2(піридин-4-іл)-оксазол-4-іл)-(3,4,5-триметоксіфеніл)метанон; (4,5-дигідро-2-(піридин-4іл)оксазол-4-іл)(3,4,5-триметоксіфеніл)метанон; (3,4,5-триметоксіфеніл)(2-(піридин-4іл)оксазолідин-4-іл)метанон; (2-(піридин-4-іл)-1H-імідазол-4-іл)-(3,4,5-триметоксіфеніл)метанон; (4,5-дигідро-2-(піридин-4-іл)-1H-імідазол-4-іл)(3,4,5-триметоксіфеніл)метанон; (3,4,5триметоксіфеніл)(2-(піридин-4-іл)імідазолідин-4-іл)метанон; (2-(піримідин-2-іл)-тіазол-4-іл)(3,4,5-триметоксіфеніл)метанон (сполука 8y); (4,5-дигідро-2-(піримідин-4-іл)тіазол-4-іл)(3,4,5триметоксіфеніл)метанон; (3,4,5-триметоксіфеніл)(2-(піримідин-4-іл)тіазолідин-4-іл)метанон; (2(піримідин-4-іл)-оксазол-4-іл)-(3,4,5-триметоксіфеніл)метанон; (4,5-дигідро-2-(піримідин-4іл)оксазол-4-іл)(3,4,5-триметоксіфеніл)метанон; (3,4,5-триметоксіфеніл)(2-(піримідин-4іл)оксазолідин-4-іл)метанон; (2-(піримідин-4-іл)-1H-імідазол-4-іл)-(3,4,5триметоксіфеніл)метанон; (4,5-дигідро-2-(піримідин-4-іл)-1H-імідазол-4-іл)(3,4,5триметоксіфеніл)метанон; (3,4,5-триметоксіфеніл)(2-(піримідин-4-іл)імідазолідин-4-іл)метанон; (2-(тіофен-2-іл)-тіазол-4-іл)-(3,4,5-триметоксіфеніл)метанон (сполука 8z); (4,5-дигідро-2-(тіофен2-іл)тіазол-4-іл)(3,4,5-триметоксіфеніл)метанон; (3,4,5-триметоксіфеніл)(2-(тіофен-2іл)тіазолідин-4-іл)метанон; (2-(тіофен-2-іл)-оксазол-4-іл)-(3,4,5-триметоксіфеніл)метанон; (4,5дигідро-2-(тіофен-2-іл)оксазол-4-іл)(3,4,5-триметоксіфеніл)метанон; (3,4,5-триметоксіфеніл)(2(тіофен-2-іл)оксазолідин-4-іл)метанон; (2-(тіофен-2-іл)-1H-імідазол-4-іл)-(3,4,5триметоксіфеніл)метанон; (4,5-дигідро-2-(тіофен-2-іл)-1H-імідазол-4-іл)(3,4,5триметоксіфеніл)метанон; (3,4,5-триметоксіфеніл)(2-(тіофен-2-іл)імідазолідин-4-іл)метанон; (2(1H-індол-5-іл)тіазол-4-іл)(3,4,5-триметоксіфеніл)метанон (сполука 31); (2-(1H-індол-5іл)тіазолідин-4-іл)(3,4,5-триметоксіфеніл)метанон; (4,5-дигідро-2-(1H-індол-5-іл)тіазол-4іл)(3,4,5-триметоксіфеніл)метанон; (2-(1H-індол-5-іл)оксазол-4-іл)(3,4,5триметоксіфеніл)метанон; (2-(1H-індол-5-іл)оксазолідин-4-іл)(3,4,5-триметоксіфеніл)метанон; (4,5-дигідро-2-(1H-індол-5-іл)оксазол-4-іл)(3,4,5-триметоксіфеніл)метанон; (2-(1H-індол-5іл)імідазол-4-іл)(3,4,5-триметоксіфеніл)метанон; (2-(1H-індол-5-іл)імідазолідин-4-іл)(3,4,5триметоксіфеніл)метанон; (4,5-дигідро-2-(1H-індол-5-іл)імідазол-4-іл)(3,4,5триметоксіфеніл)метанон; (2-(1H-індол-2-іл)тіазол-4-іл)(3,4,5-триметоксіфеніл)метанон (сполука 32); (4,5-дигідро-2-(1H-індол-2-іл)тіазол-4-іл)(3,4,5-триметоксіфеніл)метанон; (2-(1H-індол-2іл)тіазолідин-4-іл)(3,4,5-триметоксіфеніл)метанон; (2-(1H-індол-2-іл)оксазол-4-іл)(3,4,5триметоксіфеніл)метанон; (4,5-дигідро-2-(1H-індол-2-іл)оксазол-4-іл)(3,4,5триметоксіфеніл)метанон; (2-(1H-індол-2-іл)оксазолідин-4-іл)(3,4,5-триметоксіфеніл)метанон; (2(1H-індол-2-іл)імідазол-4-іл)(3,4,5-триметоксіфеніл)метанон; (4,5-дигідро-2-(1H-індол-2іл)імідазол-4-іл)(3,4,5-триметоксіфеніл)метанон; (2-(1H-індол-2-іл)імідазолідин-4-іл)(3,4,5триметоксіфеніл)метанон; (2-(1H-індол-1-іл)тіазол-4-іл)(3,4,5-триметоксіфеніл)метанон; (4,5дигідро-2-(1H-індол-1-іл)тіазол-4-іл)(3,4,5-триметоксіфеніл)метанон; (2-(1H-індол-1-іл)тіазолідин4-іл)(3,4,5-триметоксіфеніл)метанон; (2-(1H-індол-1-іл)оксазол-4-іл)(3,4,5триметоксіфеніл)метанон; (4,5-дигідро-2-(1H-індол-1-іл)оксазол-4-іл)(3,4,5триметоксіфеніл)метанон; (2-(1H-індол-1-іл)оксазолідин-4-іл)(3,4,5-триметоксіфеніл)метанон; (2(1H-індол-1-іл)імідазол-4-іл)(3,4,5-триметоксіфеніл)метанон; (4,5-дигідро-2-(1H-індол-1іл)імідазол-4-іл)(3,4,5-триметоксіфеніл)метанон; (2-(1H-індол-1-іл)імідазолідин-4-іл)(3,4,5триметоксіфеніл)метанон; (2-(1H-індол-3-іл)тіазол-4-іл)(3,4,5-триметоксіфеніл)метанон; (4,5дигідро-2-(1H-індол-3-іл)тіазол-4-іл)(3,4,5-триметоксіфеніл)метанон; (2-(1H-індол-3-іл)тіазолідин4-іл)(3,4,5-триметоксіфеніл)метанон; (2-(1H-індол-3-іл)оксазол-4-іл)(3,4,5триметоксіфеніл)метанон; (4,5-дигідро-2-(1H-індол-3-іл)оксазол-4-іл)(3,4,5триметоксіфеніл)метанон; (2-(1H-індол-3-іл)оксазолідин-4-іл)(3,4,5-триметоксіфеніл)метанон; (2(1H-індол-3-іл)імідазол-4-іл)(3,4,5-триметоксіфеніл)метанон; (4,5-дигідро-2-(1H-індол-3іл)імідазол-4-іл)(3,4,5-триметоксіфеніл)метанон; (2-(1H-індол-3-іл)імідазолідин-4-іл)(3,4,5триметоксіфеніл)метанон; (2-(1H-індол-4-іл)тіазол-4-іл)(3,4,5-триметоксіфеніл)метанон; (4,5дигідро-2-(1H-індол-4-іл)тіазол-4-іл)(3,4,5-триметоксіфеніл)метанон; (2-(1H-індол-4-іл)тіазолідин4-іл)(3,4,5-триметоксіфеніл)метанон; (2-(1H-індол-4-іл)оксазол-4-іл)(3,4,5триметоксіфеніл)метанон; (4,5-дигідро-2-(1H-індол-4-іл)оксазол-4-іл)(3,4,5триметоксіфеніл)метанон; (2-(1H-індол-4-іл)оксазолідин-4-іл)(3,4,5-триметоксіфеніл)метанон; (2(1H-індол-4-іл)імідазол-4-іл)(3,4,5-триметоксіфеніл)метанон; (4,5-дигідро-2-(1H-індол-4іл)імідазол-4-іл)(3,4,5-триметоксіфеніл)метанон; (2-(1H-індол-4-іл)імідазолідин-4-іл)(3,4,5триметоксіфеніл)метанон; (2-(1H-індол-6-іл)тіазол-4-іл)(3,4,5-триметоксіфеніл)метанон; (4,5дигідро-2-(1H-індол-6-іл)тіазол-4-іл)(3,4,5-триметоксіфеніл)метанон; (2-(1H-індол-6-іл)тіазолідин4-іл)(3,4,5-триметоксіфеніл)метанон; (2-(1H-індол-6-іл)оксазол-4-іл)(3,4,5 10 UA 105005 C2 5 10 15 20 25 30 триметоксіфеніл)метанон; (4,5-дигідро-2-(1H-індол-6-іл)оксазол-4-іл)(3,4,5триметоксіфеніл)метанон; (2-(1H-індол-6-іл)оксазолідин-4-іл)(3,4,5-триметоксіфеніл)метанон; (2(1H-індол-6-іл)імідазол-4-іл)(3,4,5-триметоксіфеніл)метанон; (4,5-дигідро-2-(1H-індол-6іл)імідазол-4-іл)(3,4,5-триметоксіфеніл)метанон; (2-(1H-індол-6-іл)імідазолідин-4-іл)(3,4,5триметоксіфеніл)метанон; (2-(1H-індол-7-іл)тіазол-4-іл)(3,4,5-триметоксіфеніл)метанон; (4,5дигідро-2-(1H-індол-7-іл)тіазол-4-іл)(3,4,5-триметоксіфеніл)метанон; (2-(1H-індол-7-іл)тіазолідин4-іл)(3,4,5-триметоксіфеніл)метанон; (2-(1H-індол-1-іл)оксазол-4-іл)(3,4,5триметоксіфеніл)метанон; (4,5-дигідро-2-(1H-індол-7-іл)оксазол-4-іл)(3,4,5триметоксіфеніл)метанон; (2-(1H-індол-7-іл)оксазолідин-4-іл)(3,4,5-триметоксіфеніл)метанон; (2(1H-індол-7-іл)імідазол-4-іл)(3,4,5-триметоксіфеніл)метанон; (4,5-дигідро-2-(1H-індол-7іл)імідазол-4-іл)(3,4,5-триметоксіфеніл)метанон; и (2-(1H-індол-7-іл)імідазолідин-4-іл)(3,4,5триметоксіфеніл)метанон. 1 Переважно, R група являє собою заміщений чи незаміщений феніл, заміщений чи 2 незаміщений тіофеніл, або заміщений чи незаміщений індоліл; та R група являє собою 3,4,5триметоксіфеніл. Таким чином, з наведених вище сполук, (3,4,5-триметоксіфеніл)(2фенілтіазол-4-іл)метанон (сполука 8f); (2-п-толілтіазол-4-іл)(3,4,5-триметоксіфеніл)метанон (сполука 8k); (2-(4-фторфеніл)-тіазол-4-іл)(3,4,5-триметоксіфеніл)метанон (сполука 8n); (2-(4нітрофеніл)-тіазол-4-іл)(3,4,5-триметоксіфеніл)метанон (сполука 8p); (2-(4-ціанофеніл)-тіазол-4іл)(3,4,5-триметоксіфеніл)метанон (сполука 8q); (2-(4-(трифторметил)-феніл)-тіазол-4-іл)(3,4,5триметоксіфеніл)метанон (сполука 8t); (2-(4-бромфеніл)-тіазол-4-іл)-(3,4,5триметоксіфеніл)метанон (сполука 8u); (2-(4-етилфеніл)-тіазол-4-іл)-(3,4,5-триметоксіфеніл)метанон (сполука 8v); (2-(4-амінофеніл)-тіазол-4-іл)-(3,4,5-триметоксі-феніл)метанон (сполука 8w); (2-(тіофен-2-іл)-тіазол-4-іл)-(3,4,5-триметоксіфеніл)метанон (сполука 8z); (2-(1Hіндол-5-іл)тіазол-4-іл)(3,4,5-триметоксіфеніл)метанон (сполука 31); (2-(1H-індол-2-іл)тіазол-4іл)(3,4,5-триметоксіфеніл)метанон (сполука 32); (2-(1H-індол-1-іл)тіазол-4-іл)(3,4,5триметоксіфеніл)метанон; (2-(1H-індол-3-іл)тіазол-4-іл)(3,4,5-триметоксіфеніл)метанон; (2-(1Hіндол-4-іл)тіазол-4-іл)(3,4,5-триметоксіфеніл)метанон; (2-(1H-індол-6-іл)тіазол-4-іл)(3,4,5триметоксіфеніл)метанон; и (2-(1H-індол-7-іл)тіазол-4-іл)(3,4,5-триметоксіфеніл)метанон, є переважними. Відповідно до другого варіанту виконання, клас сполук має структурну формулу (III): R3 O R4 O R2 R5 N Q R3 R5 R1 R4 35 (III) 1 5 де X являє собою O=, Y являє собою O, та Q і R -R визначені так, як наведено вище для формули (I). Ілюстративні сполуки формули (III) включають, без обмежень: 3,4,5-триметоксіфеніл 4,5дигідро-2-фенілтіазол-4-карбоксілат; 3,4,5-триметоксіфеніл 2-фенілтіазол-4-карбоксілат; 3,4,5триметоксіфеніл 2-фенілтіазолідин-4-карбоксілат; 3,4,5-триметоксіфеніл 2-фенілоксазолідин-4карбоксілат; 3,4,5-триметоксіфеніл 4,5-дигідро-2-фенілоксазол-4-карбоксілат; 3,4,5триметоксіфеніл 2-фенілоксазол-4-карбоксілат; 3,4,5-триметоксіфеніл 2-фенабомімідазолідин4-карбоксілат; 3,4,5-триметоксіфеніл 4,5-дигідро-2-феніл-1H-імідазол-4-карбоксілат; и 3,4,5 11 UA 105005 C2 триметоксіфеніл 2-феніл-1H-імідазол-4-карбоксілат. Відповідно до другого варіанту виконання, клас сполук має структурну формулу (IV): R3 O H N R4 2 R R5 N Q R3 R5 R1 R4 5 10 (IV) 1 5 де X являє собою O=, Y являє собою -NH-, та Q і R -R визначені так, як визначено вище для формули (I). Ілюстративні сполуки формули (IV) включають, без обмежень: N-(3,4,5-триметоксіфеніл)-2фенілоксазолідин-4-карбоксамід; 4,5-дигідро-N-(3,4,5-триметоксіфеніл)-2-фенілоксазол-4карбоксамід; N-(3,4,5-триметоксіфеніл)-2-фенілоксазол-4-карбоксамід; N-(3,4,5триметоксіфеніл)-2-феніл-1H-імідазол-4-карбоксамід; 4,5-дигідро-N-(3,4,5-триметоксіфеніл)-2феніл-1H-імідазол-4-карбоксамід; N-(3,4,5-триметоксіфеніл)-2-фенабомімідазолідин-4карбоксамід; 4,5-дигідро-N-(3,4,5-триметоксіфеніл)-2-фенілтіазол-4-карбоксамід; N-(3,4,5триметоксіфеніл)-2-фенілтіазол-4-карбоксамід; и N-(3,4,5-триметоксіфеніл)-2-фенілтіазолідин-4карбоксамід. Відповідно до другого варіанту виконання, клас сполук має структурну формулу (V): R3 R4 2 R R5 N Q R3 R5 15 R1 R4 (V) 1 5 де X та Y опущено, а Q та R -R визначено так, як визначено вище для формули (I). 12 UA 105005 C2 5 Ілюстративні сполуки формули (V) включають, без обмежень: 4-(3,4,5-триметоксібензил)-2фенілтіазолідин; 4-(3,4,5-триметоксібензил)-4,5-дигідро-2-фенілтіазол; 4-(3,4,5триметоксібензил)-2-фенілтіазол; 4-(3,4,5-триметоксібензил)-2-фенілоксазол; 4-(3,4,5триметоксібензил)-4,5-дигідро-2-фенілоксазол; 4-(3,4,5-триметоксібензил)-2-фенілоксазолідин; 4-(3,4,5-триметоксібензил)-2-фенабомімідазолідин; 4-(3,4,5-триметоксібензил)-4,5-дигідро-2феніл-1H-імідазол; и 4-(3,4,5-триметоксібензил)-2-феніл-1H-імідазол. Відповідно до другого варіанту виконання, клас сполук має структурну формулу (VI): R3 R4 S R2 R5 N Q R3 R5 R1 R4 10 15 (VI) 1 5 де X являє собою S=, Y опущено, а Q та R -R визначено так, як визначено вище для формули (I). Ілюстративні сполуки формули (VI) включають, без обмежень: феніл(2-фенілтіазолідин-4іл)метантіон; феніл(2-фенілоксазолідин-4-іл)метантіон; (4,5-дигідро-2-фенілоксазол-4іл)(феніл)метантіон; феніл(2-фенілоксазол-4-іл)метантіон; (3,4,5-триметоксіфеніл)(2фенілтіазол-4-іл)метантіон; (3,4,5-триметоксіфеніл)(2-фенілтіазолідин-4-іл)метантіон; (3,4,5триметоксіфеніл)(2-фенілоксазолідин-4-іл)метантіон; (4,5-дигідро-2-фенілоксазол-4-іл)(3,4,5триметоксіфеніл)метантіон; (3,4,5-триметоксіфеніл)(2-фенілоксазол-4-іл)метантіон; (4,5-дигідро2-феніл-1H-імідазол-4-іл)(3,4,5-триметоксіфеніл)метантіон; (3,4,5-триметоксіфеніл)(2-феніл-1Hімідазол-4-іл)метантіон; и (3,4,5-триметоксіфеніл)(2-фенілмідазолідин-4-іл)метантіон. Відповідно до другого варіанту виконання, клас сполук має структурну формулу (VII): 13 UA 105005 C2 R3 H2N R4 N R2 R5 N Q R3 R5 R1 R4 5 10 15 20 (VII) 1 5 де X являє собою =N-NH2, Y опущено, а Q та R -R визначено так, як визначено вище для формули (I). Ілюстративні сполуки формули (VII) включають, без обмежень, (Z)-1-((3,4,5триметоксіфеніл)(2-фенілтіазол-4-іл)метилен)гідразин (сполука 33); (E)-1-((3,4,5триметоксіфеніл)(2-фенілтіазол-4-іл)метилен)гідразин (сполука 34); (24Z)-1-((4,5-дигідро-2фенілтіазол-4-іл)(3,4,5-триметоксіфеніл)метилен) гідразин;(24E)-1-((4,5-дигідро-2-фенілтіазол-4іл)(3,4,5-триметоксіфеніл) метилен)гідразин; (Z)-1-((3,4,5-триметоксіфеніл)(2-фенілтіазолідин-4іл)метилен)гідразин; (E)-1-((3,4,5-триметоксіфеніл)(2-фенілтіазолідин-4-іл)метилен)гідразин; (Z)1-((3,4,5-триметоксіфеніл)(2-фенілоксазол-4-іл)метилен)гідразин; (E)-1-((3,4,5триметоксіфеніл)(2-фенілоксазол-4-іл)метилен)гідразин; (24Z)-1-((4,5-дигідро-2-фенілоксазол-4іл)(3,4,5-триметоксіфеніл)метилен)гідразин; (24E)-1-((4,5-дигідро-2-фенілоксазол-4-іл)(3,4,5триметоксіфеніл)метилен)гідразин; (Z)-1-((3,4,5-триметоксіфеніл)(2-фенілоксазолідин-4іл)метилен)гідразин; (E)-1-((3,4,5-триметоксіфеніл)(2-фенілоксазолідин-4-іл)метилен)гідразин; (Z)-1-((3,4,5-триметоксіфеніл)(2-феніл-1H-імідазол-4-іл)метилен)гідразин; (E)-1-((3,4,5триметоксіфеніл)(2-феніл-1H-імідазол-4-іл)метилен)гідразин; (24Z)-1-((4,5-дигідро-2-феніл-1Hімідазол-4-іл)(3,4,5-триметоксіфеніл)метилен) гідразин; (24E)-1-((4,5-дигідро-2-феніл-1Hімідазол-4-іл)(3,4,5-триметоксіфеніл)метилен)гідразин; (Z)-1-((3,4,5-триметоксіфеніл)(2фенабомімідазолідин-4-іл)метилен)гідразин; и (E)-1-((3,4,5-триметоксіфеніл)(2фенабомімідазолідин-4-іл)метилен)гідразин. Відповідно до другого переважного варіанту виконання, клас сполук має структурну формулу(VIII): 14 UA 105005 C2 R3 HO R4 N R2 R5 N Q R3 R5 R1 R4 5 10 15 20 25 30 35 (VIII) 1 5 де X являє собою =N-OH, Y опущено, а Q та R -R визначено так, як визначено вище для формули (I). Ілюстративні сполуки формули (VIII) включають, без обмежень, (Z)-(2-фенілтіазол-4іл)(3,4,5-триметоксіфеніл)метанон оксім (сполука 35); (E)-(2-фенілтіазол-4-іл)(3,4,5триметоксіфеніл)метанон оксім (сполука 36); (24Z)-1-(4,5-дигідро-2-фенілтіазол-4-іл)(3,4,5триметоксіфеніл)метанон оксім; (24E)-1-(4,5-дигідро-2-фенілтіазол-4-іл)(3,4,5триметоксіфеніл)метанон оксім; (Z)-1-(3,4,5-триметоксіфеніл)(2-фенілтіазолідин-4-іл)метанон оксім; (E)-1-(3,4,5-триметоксіфеніл)(2-фенілтіазолідин-4-іл)метанон оксім; (Z)-1-(3,4,5триметоксіфеніл)(2-фенілоксазол-4-іл)метанон оксім; (E)-1-(3,4,5-триметоксіфеніл)(2фенілоксазол-4-іл)метанон оксім; (24Z)-1-(4,5-дигідро-2-фенілоксазол-4-іл)(3,4,5триметоксіфеніл)метанон оксім; (24E)-1-(4,5-дигідро-2-фенілоксазол-4-іл)(3,4,5триметоксіфеніл)метанон оксім; (Z)-1-(3,4,5-триметоксіфеніл)(2-фенілоксазолідин-4-іл)метанон оксім; (E)-1-(3,4,5-триметоксіфеніл)(2-фенілоксазолідин-4-іл)метанон оксім; (Z)-1-(3,4,5триметоксіфеніл)(2-феніл-1H-імідазол-4-іл)метанон оксім; (E)-1-(3,4,5-триметоксіфеніл)(2-феніл1H-імідазол-4-іл)метанон оксім; (24Z)-1-(4,5-дигідро-2-феніл-1H-імідазол-4-іл)(3,4,5триметоксіфеніл)метанон оксім; (24E)-1-(4,5-дигідро-2-феніл-1H-імідазол-4-іл)(3,4,5триметоксіфеніл)метанон оксім; (Z)-1-(3,4,5-триметоксіфеніл)(2-фенабомімідазолідин-4іл)метанон оксім; та (E)-1-(3,4,5-триметоксіфеніл)(2-фенабомімідазолідин-4-іл)метанон оксім. Певні сполуки, особливо ті з них, які містять кислотні або основні групи, можуть також бути у формі солі, переважно фармацевтично прийнятної солі. Термін “фармацевтично прийнятна сіль” відноситься до таких солей, які зберігають біологічну ефективність і властивості вільних основ або вільних кислот, які не є біологічно або іншим чином небажаними. Такі солі утворюються з такими неорганічними кислотами, як соляна кислота, бромоводнева кислота, сірчана кислота, азотна кислота, фосфорна кислота та інш., і органічними кислотами, такими, як оцтова кислота, пропіонова кислота, гліколева кислота, піровиноградна кислота, щавлева кислота, малеїнова кислота, малонова кислота, бурштинова кислота, фумарова кислота, винна кислота, лимонна кислота бензойна кислота, корична кислота, мигдальна кислота, метансульфонова кислота, етансульфонова кислота, п-толуолсульфонова кислота, саліцилова кислота, N-ацетилцистеїн та інш. Інші солі відомі фахівцям у цій галузі та можуть бути легко адаптовані для застосування відповідно до даного винаходу. Сполуки відповідно до даного винаходу можуть бути також введені у вигляді проліків. Таким чином, певні похідні, що самі по собі можуть мати невелику фармакологічну активність або не мати її, можуть, при введенні в організм або на організм, бути перетворені в сполуки відповідно до даного винаходу, що мають бажану активність, наприклад, шляхом гідролітичного розщеплення. Додаткову інформацію відносно застосування проліків можна знайти в роботах Pro-drugs as Novel Delivery Systems, Vol. 14, ACS Symposium Series (Higuchi and Stella); і 15 UA 105005 C2 5 10 15 20 25 30 35 40 45 50 55 60 Bioreversible Carriers in Drug Design, Pergamon Press (ed. E B Roche, American Pharmaceutical Association) (1987), кожна з яких повністю включена в дану заявку шляхом посилання. Проліки можуть, наприклад, бути одержані шляхом заміщення відповідних функціональних груп, що присутні у сполуких за даним винаходом, де певні фрагменти відомі фахівцям у цій галузі як фрагменти. Приклади таких проліків включають, без обмежень, заміщення водню в спиртовій функціональній групі (-OH)C1-C6алкілом з утворенням етеру; і (ii) заміщення водню у вторинній аміно функціональній групі на C1-C10 алканоїл з утворенням аміду. Сполуки за даним винаходом можуть також бути у формі гідрату, що означає, що сполука додатково містить стехіометричну або нестехіометричну кількість води, зв'язаної нековалентними міжмолекулярними силами. Сполуки за даним винаходом можуть також бути присутніми у формі рацемічної суміші, що містить істотно еквівалентні кількості стереоізомерів. В іншому варіанті виконання, сполуки за даним винаходом можуть бути одержані або іншим чином виділені за допомогою відомих процедур, для одержання стереоізомеру, що в істотному ступені не містить його відповідний стереоізомер (тобто, істотно чистого). Під істотно чистим, мають на увазі, що сетероізомер є як мінімум приблизно 95% чистим, більш переважно як мінімум приблизно 98% чистим, найбільше переважно як мінімум приблизно 99% чистим. Додатковий аспект даного винаходу відноситься до способу одержання сполук формули (I). Додатково, даний винахід описує методології синтезу для одержання амідних, алкоксіамідних, кетонних, гідразинових та оксімних похідних тіазолідинів, тіазолінів, тіазолів, імідазолінів, імідазолів, оксазолідинів, оксазолінів та оксазолів. Для синтезу сполук тіазолінових та тіазольних серій, L- або D-цистеїн може реагувати з заміщениv або незаміщеним бензонітрилом в метанолі pH 6,4 фосфатному буферному розчині при температурі оточуючого середовища протягом декількох днів (див. роботи Bergeron et al., “Evaluation of Desferrithiocin and its Synthetic Analogs as Orally Effective Iron Chelators,” J. Med. Chem. 34:2072-8 (1991); Bergeron et al., “Desazadesmethyldesferrithiocin Analogues as Orally Effective Iron Chelators,” J. Med. Chem. 42:95-108 (1999); Zamri et al., “An Improved Stereocontrolled Synthesis Pyochelin, Siderophore of Pseudomonas aeruginosa and Burkholderia cepacia,” Tetrahedron 56:249-256 (2000), кожна з яких включена до цієї заявки шляхом посилання). Одержані в результаті проміжні сполуки карбонових кислот можуть бути легко перетворені на відповідні аміди Вейнреба (див. роботи Nahm et al., “N-Methoxy-N-methylamides as Effective Acylating Agents,” Tetrahedron Lett. 22:3815-18 (1981), що повністю включена до цієї заявки шляхом посилання), з використанням EDCI/HOBt (етил карбодиімід гідрохлорид) / 1гідроксібензотріазол) як реагентів сполучення. Тіазольні проміжні сполуки можуть бути одержані шляхом BrCCl3/ДБУ дегідрогенізації амідів Вайнреба. Тіазольні проміжні сполуки можуть реагувати з відповідними літієвими реактивами або реактивами Грін’яра (тобто, що мають відповідний “C” цикл, див. Схему 3 нижче) у безводному ТГФ з одержанням цільових тіазолів (Nahm et al., “N-Methoxy-N-methylamides as Effective Acylating Agents,” Tetrahedron Lett. 22:381518 (1981), що повністю включена до цієї заявки шляхом посилання). Альтернативно, тіазолінові аміди Вейнреба можуть реагувати безпосередньо з відповідними літієвими реактивами або реактивами Грін’яра, після гасіння насиченим розчином NH 4Cl, що призводить до одержання сумішей тіазолінових сполук та відповідних тіазольних сполук. Якщо тіазолін/тіазольні суміші помістити в розчинник і піддати впливу повітря в атмосфері навколишнього середовища протягом деякого часу (від однієї ночі до декількох днів), тіазоліновий цикл мимовільно дегідрогенізує до тіазолів. Як приклад, у розчині з дейтерованим хлороформом, суміші тіазолінових/тіазольних сполук можуть бути повільно перетворені в майже чисті тіазольні сполуки приблизно через 9 днів (див., наприклад, Фігуру 2). Утворення тіазолідинових сполук описано в патенті США № 7307093, виданому Miller et al., та патентній заявці США, номер публикації 2007/0155807, виданій Miller et al., кожна з яких включена до цієї заявки шляхом посилання. Оксазолінові похідні (карбонові кислоти, карбоксаміди, метанони) за даним винаходом одержують за допомогою перетворення імінових похідних (бензoнітрилу та 1-феніл-2-метоксіетаніміну) з енантіомерним (L або D) або рацемічним цистеїновим або серіновим естером, використовуючи триетиламін як основу (Meyer et al., Tetrahedron: Asymmetry 14: 2229-2238 (2003), що повністю включена до цієї заявки шляхом посилання). Імідазольні похідні одержують, використовуючи L-винну кислоту в реакції конденсації із заміщеним або незаміщеним арилальдегидом з утворенням імідазольної циклічної системи (Anderson et al., J. Med. Chem. 32(1),119-127 (1989), що повністю включена до цієї заявки шляхом посилання). Синтез тіазолу, оксазолу та імідазолу може бути проведений шляхом дегідрогенізації 16 UA 105005 C2 5 10 15 20 25 30 35 40 45 50 55 60 відповідних тіазоліну, оксазоліну та імідазоліну. Дегідрогенізація за даним винаходом може бути досягнута шляхом первісного галогенування таких основних циклічних систем (тіазоліну, імідазоліну та оксазоліну) з наступним елімінуванням з одержанням цільових тіазольних, оксазольних та імідазольних похідних. Утворення тіокарбонільної лінкерної групи (з карбонілу) може бути проведене з використанням реагенту Лоуссона (Jesberger et al., Synthesis 1929-1958 (2003), що повністю включена до цієї заявки шляхом посилання). Тіокетонова структура зі сполученими ароматичними циклами є стабільною у порівнянні з неутрудненими тіокетонами. Карбонільна лінкерна група може бути також відновлена в спирт за допомогою реакції Грін’яра проміжного альдегіду з відповідними реактивами Грін’яра. Альтернативно, карбонільна група може бути повністю вилучена шляхом відновлення за Клемменсеном з утворенням відповідного вуглеводню (наприклад, метиленової групи). При відновленні карбонілу в спирт або метилен, сильний акцептор водню C=O знову перетворюється в сильний донор водню O-H або вуглеводень, що повністю втрачає ефект зв'язування водню. Естерні та карбоксамідні зв'язки можуть бути одержані з таких самих проміжних кислот, які використовували для утворення кетонового зв'язку, за винятком того, що реагенти (кислоту й попередник “C” циклу) піддають впливу прийнятних умов для утворення відповідних естерних (DCC, NMM) або амідних (EDCl, HOBt, Et3N) зв'язків. Карбоксамідні зв'язки також описані в патенті США № 7,307,093, виданому Miller et al., і патентній заявці США номер публікації 2007/0155807, виданої Miller et al., кожна з яких включена до цієї заявки шляхом посилання. Також оцінено, що сполуки та синтетичні проміжні сполуки за даним винаходом можуть бути одержані за допомогою синтетичних процесів, відомих фахівцям у цій галузі. Функціональні групи проміжної сполуки та сполуки за даним винаходом можуть мати потребу в захисті за допомогою прийнятних захисних груп. Такі функціональні групи включають гідроксі, аміно, меркапто і карбонову кислоту. Прийнятні захисні групи для гідроксі-групи включають триалкілсабол або диарилалкілсабол (наприклад, t-бутилдіметилсабол, t-бутилдифенілсабол або триметилсабол), тетрагидропіраніл, бензил, та інш. Прийнятні захисні групи для аміно, амідінo та гуанідіно включають t-бутоксікарбоніл (t-Boc або Boc), бензилоксікарбоніл, та інш. Прийнятні захисні групи для меркапто-групи включають C(O)-R (де R являє собою алкіл, арил або аралкіл), п-метоксібензил, тритіл та інш. Прийнятні захисні групи для карбонової кислоти включають алкільні, арильні або аралкільні естери. Захисні групи можуть бути додані або вилучені за про стандартних методів, які добре відомі фахівцям у цій галузі та описані в даній заявці. Використання захисної групи докладно описано в Green et al., Protective Groups in Organic Synthesis, 2nd Ed., Wiley-Interscience (1991), що повністю включена до цієї заявки шляхом посилання. Інший аспект даного винаходу відноситься до фармацевтичної композиції, що містить фармацевтично прийнятний носій та сполуку відповідно до аспектів даного винаходу. Фармацевтична композиція може містити одну або більше ідентифікованих вище сполук за даним винаходом. Як правило, фармацевтична композиція за даним винаходом має містити сполуку за даним винаходом або її фармацевтично прийнятну сіль, а також фармацевтично прийнятний носій. Термін “фармацевтично прийнятний носій” відноситься до будь-яких прийнятних ад’ювантів, носіїв, ексципієнтів, або стабілізаторів і він може бути у твердій або рідкій формі, такій, як таблетки, капсули, порошки, розчини, суспензії або емульсії. Звичайно, композиція буде містити приблизно від 0,01 до 99 відсотків, переважно приблизно від 20 до 75 відсотків активної сполуки (активних сполук), разом із ад’ювантами, носіями й/або ексципієнтами. У той час як індивідуальні потреби можуть варіюватися, визначення оптимальних діапазонів ефективних кількостей кожного компонента можуть бути виконані фахівцем у цій галузі. Типові дозування містять приблизно від 0,01 до 100 мг/кг·масу тіла. Переважні дозування містять приблизно від 0,1 до 100 мг/кг·масу тіла. Найбільш переважні дозування містять приблизно від 1 до 100 мг/кг·масу тіла. Режим лікування для введення сполуки за даним винаходом може бути також легко визначений фахівцем у цій галузі. Тобто, частота введення й розмір дози можуть бути встановлені шляхом стандартної оптимізації, переважно при мінімізації будь-яких побічних ефектів. Тверді стандартні лікарські форми можуть бути традиційного типу. Тверда лікарська форма може бути капсулою й подібною формою, такою, як капсула звичайного желатинового типу, що містить сполуки за даним винаходом і носій, наприклад, речовини, що ковзають, та інертні наповнювачі, такі як лактоза, сахароза або кукурудзяний крохмаль. В іншому варіанті виконання, такі сполуки таблетовані з традиційними основами таблеток, такими, як лактоза, сахароза або кукурудзяний крохмаль у комбінації з такими зв'язувальними речовинами, як гуміарабік, кукурудзяний крохмаль, або желатин, агентами розпаду, такими, як кукурудзяний 17 UA 105005 C2 5 10 15 20 25 30 35 40 45 50 55 60 крохмаль, картопляний крохмаль або альгінова кислота, і речовиною, що ковзає, такою, як стеаринова кислота або стеарат магнію. Таблетки, капсули, та інш. можуть також містити зв'язувальну речовину, таку, як трагакантова камедь, гуміарабік, кукурудзяний крохмаль або желатин; ексципієнти, такі, як фосфат дикальцію; агент розпаду, такий, як кукурудзяний крохмаль, картопляний крохмаль, альгінова кислота; речовину, що ковзає, таку, як стеарат магнію; і підсолоджувач, такий, як лактоза, сахароза або сахарин. Якщо стандартна лікарська форма являє собою капсулу, то вона може містити, крім речовин зазначеного вище типу, рідкий носій, такий, якжирне масло. Різні інші матеріали можуть бути присутні як покриття або для модифікації фізичної форми стандартної лікарської форми. Наприклад, таблетки можуть бути покриті шелаком, цукром або ними обома. Сироп може містити, на додаток до активного інгредієнта, сахарозу як підсолоджувач, метил та пропілпарабени як консерванти, барвник і ароматизатор, такий, як вишневий або апельсиновий ароматизатор. Для перорального терапевтичного введення, такі активні сполуки можуть бути введені з ексципієнтами та застосовані у формі таблеток, капсул, еліксирів, суспензій, сиропів та інш. Такі композиції та препарати повинні містити як мінімум 0,1% активної сполуки. Процентний вміст сполуки в таких композиціях може, звичайно, варіюватися та може традиційно становити приблизно від 2% до 60% від одиниці маси. Кількість активної сполуки в таких терапевтично корисних композиціях є такою, що буде одержане прийнятне дозування. Переважні композиції за даним винаходом одержують таким чином, що лікарська форма для перорального застосування містить приблизно від 1 мг до 800 мг активної сполуки. Активні сполуки за даним винаходом можуть бути введені перорально наприклад, з інертним розріджувачем, або з їстівним носієм, що засвоюється, або вони можуть бути заключені в капсули із твердим або м'яким покриттям, або вони можуть бути спресовані в таблетки, або вони можуть бути включені безпосередньо в дієту з їжею. Фармацевтичні форми, прийнятні для застосування шляхом ін’єкцій, включають стерильні водні розчини або дисперсії, та стерильні порошки для препаратів для негайного приймання стерильних розчинів або дисперсій для ін’єкцій. В усіх випадках, форма має бути стерильною и має бути текучою тією мірою, в якій існує легкість введення шприцом. Вона має бути стабільною в умовах виробництва та зберігання, та має бути збережена від забруднюючої дії мікроорганізмів, таких, як бактерії та гриби. Носій може бути розчинником або дисперсійним середовищем, що містить, наприклад, воду, етанол, поліол (наприклад, гліцерин, пропіленгліколь та рідкий поліетиленгліколь), їх прийнятні суміші та рослинні олії. Сполуки або фармацевтичні композиції за даним винаходом можуть бути також введені в дозування для ін'єкцій за допомогою розчину або суспензії таких речовин у фізіологічно прийнятному розріджувачі з фармацевтичним ад’ювантом, носієм або ексципієнтом. Такі ад’юванти, носії та/або ексципієнти включають, не обмежуючись наведеним, стерильні рідини, такі, як вода та олії, з або без додавання поверхнево-активної речовини та інших фармацевтично і фізіологічно прийнятних компонентів. Ілюстративні олії є оліями нафтового, тваринного, рослинного або синтетичного походження, наприклад, арахісовою олією, соєвою олією, або мінеральною олією. Загалом, вода, сольовий розчин, водна декстроза й розчин родинних цукрів, і гліколі, такі, як пропіленгліколь або поліетиленгліколь, є переважними рідкими носіями, особливо для розчинів для ін'єкцій. Такі активні сполуки можуть бути також введені парентерально. Розчини або суспензії таких активних сполук можуть бути одержані в воді, прийнятним чином змішаній з такою поверхневоактивною речовиною, як гідроксіпропілцелюлоза. Дисперсії можуть бути також одержані в гліцерині, рідких поліетиленгліколях і їх сумішах в олії. Ілюстративні олії є оліями нафтового, тваринного, рослинного або синтетичного походження, наприклад, арахісовою олією, соєвою олією, або мінеральною олією. Загалом, вода, сольовий розчин, водна декстроза й розчин родинних цукрів, і гліколі, такі, як пропіленгліколь або поліетиленгліколь, є переважними рідкими носіями, особливо для розчинів для ін'єкцій. У звичайних умовах зберігання й застосування, такі препарати містять консервант для запобігання росту мікроорганізмів. Для застосування як аерозолі, сполуки за даним винаходом у розчині або суспензії можуть бути упаковані в герметизований аерозольний контейнер разом із прийнятними стислими рідинами, наприклад, вуглеводневими стислими рідинами, такими, як пропан, бутан або ізобутан із традиційними ад’ювантами. Речовини за даним винаходом також можуть бути введені у непресованій формі, наприклад, у небулайзері або аерозольному апараті. Ще один аспект даного винаходу відноситься до способу лікування раку, що включає вибір суб'єкта, що потребує лікування раку, і введення суб'єктові фармацевтичної композиції, що містить сполуку за першого аспекту даного винаходу й фармацевтично прийнятний носій в 18 UA 105005 C2 5 10 15 20 25 30 35 40 45 50 55 60 умовах, ефективних для лікування раку. При введенні сполук відповідно до даного винаходу, вони можуть бути введені системно або, альтернативно, вони можуть бути введені безпосередньо в конкретну ділянку, де присутні ракові клітини або передракові клітини. Тому введення може бути здійснено будь-яким чином, ефективним для доставки сполук або фармацевтичних композицій у ракові клітини або передракові клітини. Ілюстративні режими введення включають, без обмежень, введення сполук або композицій перорально, місцево, трансдермально, парентерально, підшкірно, внутрішньовенно, внутрішньом'язово, інтраперітонеально, шляхом інтраназальних інстиляцій, шляхом внутрішньопорожнинних або внутрішньопухирчастих інстиляцій, інтраокулярно, інтраартеріально, усередину уражених тканин, або шляхом аплікацій на слизуваті перегородки, наприклад, ніс, горло й бронхіоли. Сполуки за даним винаходом можна використовувати при лікуванні або профілактиці різних форм раку, зокрема, раку простати, раку молочної залози, яєчників, раку шкіри (наприклад, меланоми), раку легенів, раку товстої кишки, лейкемії, раку нирок, раку ЦНС (наприклад, гліоми, гліобластоми). Лікування багатьох таких видів раку підтримано наведеними в цій заявці Прикладами. Додатково, виходячи з їх передбачуваного режиму дії як інгібіторів тубуліну, вважають, що інші форми раку будуть аналогічно піддаватися лікуванню або профілактиці після введення пацієнтові сполук або композицій за даним винаходом. Переважні сполуки за даним винаходом є руйнівними для ракових клітин, призводячи до абляції ракових клітин, але переважно, не нормальних клітин. Дуже важливо, що пошкодження, що наносять нормальним клітинам, мінімізовано, оскільки ракові клітини є чутливими до руйнування при набагато більш низьких концентраціях сполук за даним винаходом. Таким чином, додатковий аспект даного винаходу відноситься до способу руйнування ракової клітини, що включає: забезпечення сполуки за даним винаходом з наступним її контактування з раковою клітиною в умовах, ефективних для руйнування контактуючої ракової клітини. Відповідно до різних варіантів виконання руйнування ракових клітин, клітини, які повинні бути зруйновані, можуть бути розташовані in vivo або ex vivo (тобто, у культурі). Ще один додатковий аспект даного винаходу відноситься до способу лікування або профілактики ракового стану, що включає: забезпечення сполуки за даним винаходом і наступне введення ефективної кількості сполуки пацієнтові способом, ефективним для лікування або профілактики ракового стану. Відповідно до одного варіанту виконання, пацієнт, що підлягає лікуванню, відрізняється присутністю передракового стану, і введення сполуки є ефективним для запобігання розвитку передракового стану в раковий. Це може відбуватися шляхом руйнування передраковой клітини до або одночасно з її подальшим розвитком у раковий стан. Відповідно до іншого варіанту виконання, пацієнт, що підлягає лікуванню, відрізняється наявністю в нього ракового стану, і введення сполуки є ефективним для викликання регресії ракового стану або для інгібування росту ракового стану, тобто, зупинки його росту взагалі або зменшення швидкості його росту. Це переважно відбувається шляхом руйнування ракових клітин, незалежно від їх розташування в організмі пацієнта. Тобто це має місце незалежно від того, чи розташовані ракові клітини в первинній ділянці пухлини, або мають вони метастази й створюють вторинні пухлини в організмі пацієнта. Як вживають у цій заявці, суб'єкт або пацієнт відноситься до будь-якого пацієнта-ссавця, включаючи, без обмежень, людей і інших приматів, собак, котів, коней, корів, овець, свиней, пацюків, мишей і інших гризунів. При введенні сполук або фармацевтичних композицій за даним винаходом для лікування або профілактики ракового стану, фармацевтична композиція може також містити, або може бути уведена в сполученні з іншими терапевтичними засобами або режимами лікування, які відомі на сьогодні або розроблені після для лікування різних типів раку. Приклади інших терапевтичних засобів або режимів лікування включають, без обмежень, радіаційну терапію, імунотерапію, хіміотерапію, хірургічне втручання і їх комбінації. Приклади Приклади, наведені нижче, призначені тільки для ілюстрації та не призначені для якогонебудь обмеження обсягу даного винаходу. Всі реагенти були придбані у Sigma-Aldrich Chemical Co., Fisher Scientific (Pittsburgh, PA), AK Scientific (Mountain View, CA), Oakwood Products (West Columbia, SC), та інш. і використані без додаткового очищення. Чутливі до наявності вологи реакції проводили в атмосфері аргону. Звичайну тонкошарову хроматографію (ТШХ) проводили на аркушах Uniplates з алюмінієвою основою. (Analtech, Newark, DE). Температури плавлення вимірювали на апараті ФішераДжонса для вимірювання температур плавлення (не коригували). ЯМР спектри отримували на 19 UA 105005 C2 5 10 спектрометрі Bruker ARX 300 (Billerica, MA) або спектрометрі Varian Inova-500. Про хімічні зсуви повідомляли як про мільйонні частки (ppm) відносно TМС в CDCl 3. Дані мас-спектрів збирали на приладі електроспрей/іонний уловлювач Bruker ESQUIRE у позитивному і негативному іонних режимах. Елементні аналізи проводили за допомогою Atlantic Microlab Inc., (Norcross, GA). Приклад 1 - Синтез тіазольних, тіазолінових та тіазолідінових карбоксамідів Синтез тіазольних та тіазолідінових карбоксамідів загалом описано в патенті США № 7,307,093, виданому Miller et al., та патентній заявці США, серійний номер публикації 2007/0155807, виданій Miller et al., кожна з яких включена до цієї заявки шляхом посилання. Синтез різних тіазольних, дигідротіазольних и тіазолідінових карбоксамідів за даним винаходом також проілюстрировано на Схемі 1 нижче. Схема 1 Заміщений бензальдегід 15 20 25 30 35 40 45 L-цистеїн 3,4,5-триметоксіл Реактиви та умови: (a) C2H5OH, H2O, кімнатна температура; (b) Boc2O, 1 N NaOH, 1, 4діоксан, H2O; (c) EDCI, HOBt, TЭA, 3,4,5-триметоксіанілін; (d) ТФК, CH2Cl2. Загальна процедура одержання (2RS, 4R)-2-арил-тіазолідин-4-карбонової кислоти 1: Суміш L-цистеїну ( 3,16 г, 26,11 ммоль) та відповідного альдегіду (26,15 ммоль) в етанолі (300 мл) та води (30 мл) перемішували при кімнатній температурі протягом 6-15 годин, а тверду речовину, що осаджувалася, збирали, промивали діетиловим етером з одержанням відповідної (2RS, 4R)2-арил-тіазолідин-4-карбонової кислоти 1 з виходами 70-99%. При 0 °C, 1 (5,95 ммоль) розчиняли в 1N NaOH (6 мл) та 1,4-діоксані (15 мл), потім ди-трет-бутилдикарбонат (2,80 г, 12,80 ммоль) повільно додавали та перемішували при кімнатній температурі протягом 1 год. Реакційну суміш концентрували в вакуумі та промивали етилацетатом (20 мл). Водну фазу доводили до pH=4 шляхом додавання 1N HCl або 5% KHSO 4, потім екстрагували етилацетатом, висушували над сульфатом магнію, фільтрували и концентрували у вакуумі з одержанням відповідних BOC-захіщених кислот у вигляді піноподібних твердих речовин, які використовували для наступної стадії без подальшої очистки. Загальна процедура одержання (2RS, 4R)-2-арил-N-(3,4,5-триметоксіфеніл)тіазолідин-4карбоксамідів 2a,2b: Суміш відповідних BOC-захищених карбонових кислот (0,3-0,5 г), EDCI (1,2 еквів.) та HOBT (1,05 еквів.) в CH2Cl2 (20 мл) перемішували при кімнатній температурі протягом 10 хв. До цього розчину додавали 3,4,5-триметоксіанілін (1,05 еквів.) та Et3N (1.2 еквів.) та продовжували перемішування при кімнатній температурі протягом 6-8 год. Реакційну суміш розводили CH2Cl2 (30 мл) та послідовно промивали водою, насич. NaHCO 3, сольовим розчином та висушували над MgSO4. Розчинник видаляли при зниженому тиску з одержанням неочищеної олії, яку перемішували з ТФК (0,6-1 мл) в 20 мл CH2Cl2 при кімнатній температурі протягом 1-8 годин для розщеплення BOC групи. Реакційну суміш концентрували, промивали насич. NaHCO 3 та висушували над MgSO4. Розчинник видаляли з одержанням неочищеної твердої речовини, а сполуки 2a-2b очищували за допомогою колонкової хроматографії. Вихід повідомляли як вихід 2 стадій. (2RS, 4R)-2-Феніл-N-(3,4,5-триметоксіфеніл)тіазолідин-4-карбоксамід (сполука 2a): Вихід: o 1 69,5 %. Т.пл. 158-159 C, H ЯМР (300МГц, CDCl3) 9,14 (s, 0,8 H), 8,61 (s, 0,2 H), 7,58-7,32 (m, 5 H), 6,90 (s, 1,6 H), 6,71 (s, 0,4H), 5,71 (dd, 0,2 H, J = 9,0 Гц), 5,42 (dd, 0,8 H, J = 11,7 Гц), 4,53 (dt, 0,8 H), 4,19 (m, 0,2 H), 3,87, 3,80 (s, s, 6 H), 3,82, 3,78 (s, s, 3 H), 3,80-3,78 (m, 0,4 H), 3,62-3,42 (m, + 1,6 H), 2,96 (t, 0,2 H, J = 9,0 Гц), 2,74 (dd, 0,8 H, J = 11,7 Гц), МС (ESI) m/z 375,1 [M + H] , 397,1 [M + + Na] . Анал. (C19H22N2O4S) C, H, N. (2RS, 4R)-N,2-бис(3,4,5-триметоксіфеніл)тіазолідин-4-карбоксамід (сполука 2b): Вихід: 34,5 o 1 %. Т.пл. 147-149 C. H ЯМР (300МГц, CDCl3) 9,10 (s, 0,7 H), 8,59 (s, 0,3 H), 6,90 (s, 1,4 H), 6,80 (s, 0,6 H), 6,74 (s, 1,4H), 6,71 (s, 0,6 H), 5,66 (br, 0,3 H), 5,35 (d, br, 0,7 H, J = 7,5 Гц), 4,52 (br, 0,7 H), 4,21 (br, 0,3 H), 3,90, 3,87, 3,86, 3,84, 3,82, 3,81, 3,79, 3,78 (все s, 18 H), 3,66-3,61, 3,54-3,38 20 UA 105005 C2 + 5 + (m, 1,6 H), 2,98, 2,72 (br, 1 H), МС (ESI) m/z 465,1 [M + H] , 487,1 [M + Na] . Анал. (C22H28N2O7S) C, H, N. Для підвищення активності та розробки більш селективних агентів, даний синтез було розширено та, як обговорено у наведених нижче прикладах, біологічні дослідження проводили для вивчення природи замісників, приєднаних до карбонілу в 4 положенні. Синтез таких додаткових сполук показано на Схемі 2 нижче. Схема 2 Бензонітрил L-або D-цистеїн 10 15 20 25 30 35 40 45 ізомер ізомер Реактиви та умови: (a) MeOH / pH=6,4 фосфатний буфер, кімнатна температура; (b) EDCI, HOBt, TЭA, 3, 4, 5-триметоксіанілін; (c) CBrCl3, ДБУ. Синтез 2-Феніл-N-(3,4,5-триметоксіфеніл)-4,5-дигідротіазол-4-карбоксамідів 4a-4b, 5: Заміщений бензoнітрил (40 ммоль) поєднували з L- або D-цистеїном (45ммоль)в 100 мл 1:1 o MeOH/pH 6,4 фосфатний буферний розчин. Реакцію перемішували при 40 C протягом 3 днів (Bergeron et al., “Evaluation of Desferrithiocin and its Synthetic Analogs as Orally Effective Iron Chelators,” J. Med. Chem. 34:2072-8 (1991), що повністю включена до цієї заявки шляхом посилання). Осадок видаляли шляхом фільтрації, а MeOH видаляли за допомогою роторного випаровування. До розчину, що залишився, додавали 1M HCl для доведення до pH=4 нижче 0 o C. Одержаний у результаті осад екстрагували у CH 2Cl2, висушували та концентрували (Схема 2). Карбонові кислоти 3a,3b реагували з 3,4,5-триметоксіаніліном з використанням тих самих процедур, що описані для одержання сполук 2a,2b, таким чином, з утворенням сполуки 4a,4b. Перетворення дигідротіазолів 4a,4b в тіазолідин 5 проводили шляхом окиснення BrCCl 3/ДБУ (робота Williams et al., “Studies of Mild Dehydrogenizations in Heterocyclic Systems,” Tetrahedron Lett. 38:331-334 (1997), що повністю включена до цієї заявки шляхом посилання). 1 (4R)-2-Феніл-4,5-дигідротіазол-4-карбонова кислота (сполука 3a): Вихід: 58,3 %. H ЯМР (300МГц, CDCl3) 9,31 (br, 1 H), 7,88-7,85 (m, 2 H), 7,55-7,41 (m, 3 H), 5,38 (t, 1 H, J = 9,6 Гц), 3,75 (dt, 2 H, J = 9,6 Гц, 2,7 Гц), МС (ESI) m/z 162,0 [M - COOH] . 1 (4S)-2-Феніл-4,5-дигідротіазол-4-карбонова кислота (сполука 3b): Вихід: 53,9 %. H ЯМР (300МГц, CDCl3) 7,89-7,85 (m, 2 H), 7,55-7,41 (m, 3 H), 5,38 (t, 1 H, J = 9,3 Гц), 3,75 (dt, 2 H, J = 9,3 Гц, 2,7 Гц), МС (ESI) m/z 162,0 [M - COOH] . (4R)-2-Феніл-N-(3,4,5-триметоксіфеніл)-4,5-дигідротіазол-4-карбоксамід (сполука 4a): Вихід: o 1 98,7 %. Т.пл. 121-122 C. H ЯМР (300МГц, CDCl3) 8,98 (s, 1 H), 8,02-7,94, 7,62-7,48 (m, 5 H), 6,93 (s, 2 H), 5,38 (t, 1 H, J = 9,6 Гц), 3,92-3,85 (m, 2 H), 3,87 (s, 6 H), 3,82 (s, 3 H), МС (ESI) m/z + 373,1 [M + H] , Анал. (C19H20N2O4S) C, H, N. (4R)-2-Феніл-N-(3,4,5-триметоксіфеніл)-4,5-дигідротіазол-4-карбоксамід (сполука 4b): Вихід: o 1 70,7 %. Т.пл. 122-123 C. H ЯМР (300МГц, CDCl3) 8.62 (s, 1 H), 7.93-7.90 (m, 2 H), 7.55-7.45 (m, 3 H), 6.88 (s, 2 H), 5.31 (t, 1 H, J = 9.6 Гц), 3.86 (s, 6 H), 3.79 (s, 3 H), 3.83-3.70 (m, 2 H). МС (ESI) + m/z 395.1 [M + Na] , 370.9 [M - 1] . Анал. (C19H20N2O4S) C, H, N. 2-Феніл-N-(3,4,5-триметоксіфеніл)тіазол-4-карбоксамід (сполука 5): Вихід: 89,7 %. Т.пл. 157o 1 158 C. H ЯМР (300МГц, CDCl3) 9,30 (s, 1 H), 8,20 (s, 1 H), 8,04-8,01 (m, 2 H), 7,53-7,51 (m, 3 + H), 7,08 (s, 2 H), 3,92 (s, 6 H), 3,86 (s, 3 H), МС (ESI) m/z 393,1 [M + Na] . Анал. (C19H18N2O4S) C, H, N. Приклад 2 - Синтез тіазольних та тіазолідінових похідних метанону Проміжні сполуки метоксіметиламіду 2-(заміщений-феніл)-4, 5-дигідротіазол-4-карбонової кислоти: Як показано на Схемі 3 нижче, 2-(заміщений-феніл)- та незаміщений 2-феніл-4,5дигідротіазол-4-карбонові кислоти 3 одержували з відповідних нітрилів (наприклад, бензoнітрилу, піридинил-нітрилу, піримідинил-нітрилу, тіофеніл-нітрилу) та L-цистеїну, як описано вище. Одержані карбонові кислоти використовували для синтезу метоксіметилaмідни проміжних сполук. Суміш відповідної карбонової кислоти 3 (5ммоль), EDCI (6 ммоль) та HOBt (5 ммоль) в CH2Cl2 (50мл) перемішували протягом 10 хв. До цього розчину, додавали NMM (5 21 UA 105005 C2 5 ммоль) та HNCH3OCH3 (5 ммоль) та продовжували перемішування при кімнатній температурі протягом 6-8 годин. Реакційну суміш розводили CH2Cl2 (100 мл) та послідовно промивали водою, насич. NaHCO3, сольовим розчином та висушували над MgSO 4. Розчинник видаляли при зниженому тиску з одержанням неочищеного продукту 2, який очищували за допомогою колонкової хроматографії. Схема 3 Для А-циклу Діметоксіл Заміщений L-цистеїн бензонітрил Суміш тіазолін/тіазол А-цикл=4-піридин А-цикл=2-піримідин А-цикл=2-тіофен Тіазол-4-карбонова кислота * Сполука 8J Містить ліпід в положенні „С” ** R=3,4,5- триметоксіфеніл 10 Реактиви та умови: (a) MeOH/pH=6,4 фосфатний буфер, кімнатна температура; (b) EDCI, HOBt, NMM, HNCH3OCH3; (c) CBrCl3, ДБУ; (d) ArBr/BuLi або ArMgBr, ТГФ; (e) HCl/HOAc; (f) MeOH/CH3COCl; (g) Fe/HOAc; (h) BBr3, CH2Cl2. 22 UA 105005 C2 (R)-N-Метоксі-N-метил-2-феніл-4,5-дигідротіазол-4-карбоксамід (сполука 6a). Вихід: 92,0 %. H ЯМР (300МГц, CDCl3) 7,85-7,83 (m, 2 H), 7,48-7,36 (m, 3 H), 5,66 (t, 1 H, J = 9,0 Гц), 3,90 (s, 3 H), 3,88-3,80 (br, 1 H), 3,55-3,47 (dd, 1 H, J = 10,8 Гц, 9,0 Гц), 3,30 (s, 3 H), МС (ESI) m/z 251,0 [M + + + H] , 273,0 [M + Na] . (R)-N-метоксі-N-метил-2-п-толіл-4,5-дигідротіазол-4-карбоксамід (сполука 6b). Вихід: 55,8 %. 1 H ЯМР (300МГц, CDCl3) 7,79 (d, 2 H, J = 7,8 Гц), 7,22 (d, 2 H, J = 7,8 Гц), 5,68 (t, 1 H, J = 8,7 Гц), 3,91 (s, 3 H), 3,80 (t, 1 H, J = 9,3 Гц), 3,55 (t, 1 H, J = 9,3 Гц), 3,30 (s, 3 H), 2,93 (s, 3 H), МС + + (ESI) m/z 265,0 [M + H] , 287,0 [M + Na] . (R)-2-(2-фторфеніл)-N-метоксі-N-метил-4,5-дигідротіазол-4-карбоксамід (сполука 6c). Вихід: 1 39,6 %. H ЯМР (300МГц, CDCl3) 7,91 (dt, 1 H, J = 7,5 Гц, 1,8 Гц), 7,43 (m, 1 H), 7,19-7,09 (m, 2 H), 5,63 (t, 1 H), 3,88 (s, 3 H), 3,83 (br, 1 H), 3,48 (dd, 1 H, J = 11,1 Гц, 9,6 Гц), 3,30 (s, 3 H), МС + (ESI) m/z 291,0 [M + Na] . (R)-2-(3-фторфеніл)-N-метоксі-N-метил-4,5-дигідротіазол-4-карбоксамід (сполука 6d). Вихід: 1 84,3 %. H ЯМР (300МГц, CDCl3) 7,60-7,56 (m, 2 H), 7,38 (dt, 1 H, J = 8,1 Гц, 6,0 Гц), 7,16 (dt, 1 H, J = 8,1 Гц, 2,4 Гц), 5,67 (t, 1 H), 3,90 (s, 3 H), 3,86-3,83 (br, 1 H), 3,52 (dd, 1 H, J = 10,8 Гц, 9,3 + Гц), 3,30 (s, 3 H), МС (ESI) m/z 291,0 [M + Na] . (R)-2-(4-фторфеніл)-N-метоксі-N-метил-4,5-дигідротіазол-4-карбоксамід (сполука 6e). Вихід: 1 66,0 %. H ЯМР (300МГц, CDCl3) 7,90 (d, 2 H), 7,13 (d, 2 H), 5,63 (t, 1 H), 3,88 (s, 3 H), 3,83 (br, 1 + H), 3,46 (dd, 1 H), 3,31 (s, 3 H), МС (ESI) m/z 269,0 [M + H] . (R)-2-(3,4-діметоксіфеніл)-N-метоксі-N-метил-4,5-дигідротіазол-4-карбоксамід (сполука 6f). 1 Вихід: 36,7 %, H ЯМР (300МГц, CDCl3) 8,11 (d, 1 H), 7,93 (s, 1 H), 7,19-7,09 (d, 1H), 5,41 (t, 1 H), + 3,97 (s, 6H), 3,89 (s, 3 H), 3,73 (br, 1 H), 3,39 (dd, 1 H), 3,31 (s, 3 H), МС (ESI) m/z 333,1 [M + Na] . (R)-N-метоксі-N-метил-2-(4-нітрофеніл)-4,5-дигідротіазол-4-карбоксамід (сполука 6g). Вихід: 1 53,7 %. H ЯМР (300МГц, CDCl3) 8,25(d, 2 H, J = 9,0 Гц), 8,01 (d, 2 H, J = 9,0 Гц), 5,73 (t, 1 H), 3,90 (s, 3 H), 3,87 (br, 1 H), 3,59 (dd, 1 H, J = 11,1 Гц, 9,3 Гц), 3,31 (s, 3 H), МС (ESI) m/z 318,1 [M + + Na] . (R)-2-(4-ціанофеніл)-N-метоксі-N-метил-4,5-дигідротіазол-4-карбоксамід (сполука 6h). Вихід: 1 26,7 %. H ЯМР (300МГц, CDCl3) 7,94(d, 2 H, J = 8,1 Гц), 7,69 (d, 2 H, J = 8,1 Гц), 5,71 (t, 1 H, J = 9,3 Гц), 3,89 (s, 3 H), 3,87 (br, 1 H), 3,56 (dd, 1 H, J = 10,8 Гц, 9,3 Гц), 3,30 (s, 3 H), МС (ESI) m/z + 298,0 [M + Na] . (R)-N-метоксі-N-метил-2-(4-трифторметилфеніл)-4,5-дигідротіазол-4-карбоксамід (сполука 1 6i). Вихід: 62,0 %. H ЯМР (300МГц, CDCl3) 7,95 (d, 2 H, J = 8,1 Гц), 7,65 (d, 2 H, J = 8,1 Гц), 5,70 (t, 1 H, J = 9,6 Гц), 3,89 (s, 3 H), 3,85 (br, 1 H), 3,55 (dd, 1 H, J = 10,8 Гц, 9,6 Гц), 3,30 (s, 3 H), МС + (ESI) m/z 341,0 [M + Na] . (R)-2-(4-бромфеніл)-N-метоксі-N-метил-4,5-дигідротіазол-4-карбоксамід (сполука 6j). Вихід: 1 20,0 %. H ЯМР (300МГц, CDCl3) 7,71, 7,53 (d, d, 4 H, J = 8,4 Гц), 5,63 (t, 1 H, J = 9,6 Гц), 3,88 (s, 3 H), 3,84 (t, 1 H, J = 9,6 Гц), 3,52 (dd, 1 H, J = 10,8 Гц, 9,6 Гц), 3,30 (s, 3 H), МС (ESI) m/z 351,0 [M + + Na] . (R)-N-метоксі-N-метил-2-(4-етил)-4,5-дигідротіазол-4-карбоксамід (сполука 6k). Вихід: 77,7 1 %. H ЯМР (300МГц, CDCl3) 7,75 (d, 2 H, J = 8,4 Гц), 7,21 (d, 2 H, J = 8,4 Гц), 5,64 (t, 1 H), 3,89 (s, 3 H), 3,81 (m, 1 H), 3,48 (dd, 1 H, J = 10,8 Гц, 9,3 Гц), 3,29 (s, 3 H), 2,67 (q, 2 H), 1,24 (t, 3 H), + МС (ESI) m/z 301,0 [M + Na] . (R)-N-метоксі-N-метил-2-(піридин-4-іл)-4,5-дигідротіазол-4-карбоксамід (сполука 6l). Вихід: 1 66,6 %. H ЯМР (300МГц, CDCl3) 8,70 (d, 2 H, J = 9,0 Гц), 7,67 (d, 2 H, J = 9,0 Гц), 5,71 (t, 1 H, J = 9,6 Гц), 3,90 (s, 3 H), 3,73 (t, 1 H), 3,55 (dd, 1 H, J = 10,8 Гц, 9,6 Гц), 3,30 (s, 3 H), МС (ESI) m/z + + 252,1 [M + H] , 274,0 [M + Na] . (R)-N-метоксі-N-метил-2-(піримідин-2-іл)-4,5-дигідротіазол-4-карбоксамід (сполука 6m). 1 Вихід: 32,5 %. H ЯМР (300МГц, CDCl3) 8,88 (d, 2 H, J = 4,8 Гц), 7,38 (t, 1 H, J = 4,8 Гц), 5,83 (t, 1 + H, J = 9,0 Гц), 3,87 (s, 3 H), 3,56 (dd, 2 H, J = 9,0 Гц), 3,30 (s, 3 H), МС (ESI) m/z 275,0 [M + Na] . (R)-N-метоксі-N-метил-2-(тіофен-2-іл)-4,5-дигідротіазол-4-карбоксамід (сполука 6p). Вихід: 1 58,5 %. H ЯМР (300МГц, CDCl3) 7,57 (br, 1 H), 7,49 (d, 1 H, J = 4,8 Гц), 7,09 (dd, 1 H, J = 3,6 Гц, 4,8 Гц), 5,64 (t, 1 H, J = 9,0 Гц), 3,90 (s, 3 H), 3,85 (br, 1 H), 3,57 (dd, 1 H, J = 9,9, 9,0Гц), 3,29 (s, 3 + H), МС (ESI) m/z 279,0 [M + Na] . 1 N-метоксі-N-метилтіазол-4-карбоксамід (сполука 9a): Вихід: 58,7 %. H ЯМР (300МГц, CDCl3) 8,82 (d, 1 H, J = 2,1 Гц), 8,10 (d, 1 H, J = 2,1 Гц), 3,79 (s, 3 H), 3,45 (s, 3 H), МС (ESI) m/z 194,9 + [M + Na] . Метоксіметиламіди 2-(заміщений-феніл)-тіазол-4-карбонової кислоти 7a-p: розчин одержаних у результаті метоксіметиламідів дигідротіазол-4-карбонової кислоти 6a-6p (1 еквів.) в o CH2Cl2 охолоджували до 0 C, та додавали дистильований ДБУ (2 еквів.). Бромтрихлорометан 1 5 10 15 20 25 30 35 40 45 50 55 23 UA 105005 C2 5 10 15 20 25 30 35 40 45 50 55 60 (1,7 еквів.) потім вводили по краплям через шприц протягом 10 хв. Реакційні суміші залишали нагріватися до кімнатної температури и перемішували усю ніч. Після промивання насиченим водним NH4Cl (2×50 мл), водну фазу екстрагували EtOAc (3×50 мл). Поєднані органічні шари висушували над MgSO4, фільтрували та концентрували in vacuo. Залишок очищували за допомогою флеш-хроматографії, що потребувалось для забезпечення сполук 7a-p. 1 Метоксіметиламід 2-феніл-тіазол-4-карбонової кислоти (сполука 7a): Вихід: 73,6 %. H ЯМР (300МГц, CDCl3) 8,01 (s, 1 H), 7,99-7,96 (m, 2 H), 7,47-7,44 (m, 3 H), 3,88 (s, 3 H), 3,49 (s, 3 H), + МС (ESI) m/z 271,0 [M + Na] . (2-(заміщений-феніл)-тіазол-4-іл)-(заміщений-феніл)-метанони: Як показано на Схемі 3 вище, три різних способи використовували для синтезу метанонів 8a-8z. Спосіб 1: До розчину n-BuLi (1.6M, 0,713 мл) в 8 мл ТГФ додавали розчин 3,4,5триметоксібромбензолу (1,09 ммоль) в 3 мл ТГФ при нижче -78°C. Суміш перемішували протягом 2 годин та завантажували розчин амідів 6 або 7 (1,14 ммоль) в 3 мл ТГФ. Суміш залишали нагріватися до кімнатної температури та перемішували усю ніч. Реакційну суміш гасили насиченим NH4Cl, екстрагували етиловим етером, висушували над MgSO 4, та залишали на повітрі на усю ніч. Розчинник видаляли при зниженому тиску з одержанням неочищеного продукту, який очищували за допомогою колонкової хроматографії з одержанням чистих сполук 8a-8z. Спосіб 2: До розчину відповідних реактивів Грін'яра (0,5M, 3 мл) в 2 мл ТГФ завантажували розчин амідів 6 або 7 (1 ммоль) в 3 мл ТГФ при 0°C. Суміші перемішували протягом від 30 хвилин до 2 годин до зникнення амідів на ТШХ пластинках. Реакційну суміш гасили насич. NH4Cl, екстрагували етиловим етером, висушували над MgSO 4 та залишали на повітрі на усю ніч з одержанням 6 як вихідної речовини. Розчинник видаляли при зниженому тиску з одержанням неочищеного продукту, який очищували за допомогою колонкової хроматографії з одержанням чистої сполуки 8a-8z. Також одержували гідрохлоридні солі сполук 8i, 8x, та 8w. При 0°C, до розчину 10 мл HCl в етиловому етері (2 M) додавали 8i, 8x або 8w (100 мг) в 5 мл CH2Cl2 (5 мл) та перемішували усю ніч. Гідрохлоридний осад фільтрували та промивали етиловим етером. Відкачування у високому вакуумі призводило до одержання відповідних солей. 1 Феніл (2-фенілтіазол-4-іл)-метанон (сполука 8a): Вихід: 76,3 %. Т.пл. 65-66°C. H ЯМР (300МГц, CDCl3) 8,32-8,29 (m, 2 H), 8,24 (s, 1 H), 8,04-8,00 (m, 2 H), 7,64-7,52 (m, 3 H), 7,50-7,46 + (m, 3 H), МС (ESI) m/z 288,0 [M + Na] . Анал. (C16H11NOS) C, H, N. (4-Метоксіфеніл)(2-фенілтіазол-4-іл)-метанон (сполука 8b): Вихід: 74,8 %. Т.пл. 105-106°C. 1 H ЯМР (300МГц, CDCl3) 8,41 (d, 2 H), 8,22 (s, 1 H), 8,02 (dd, 2 H), 7,47 (m, 3 H), 7,01 (d, 2 H), + 3,80 (s, 3 H), МС (ESI) m/z 318,1 [M + Na] . Анал. (C17H13NO2S) C, H, N. 1 (3-Метоксіфеніл)(2-фенілтіазол-4-іл)-метанон (сполука 8c): Вихід: 58,8 %. Т.пл. 43-44°C. H ЯМР (300МГц, CDCl3) 8,23 (s, 1 H), 8,05-8,01 (m, 2 H), 7,93 (d, 1 H), 7,84 (m, 1 H), 7,49-7,40 (m, 4 + H), 7,16-7,15 (m, 1 H), 3,89 (s, 3 H), МС (ESI) m/z 318,1 [M + Na] . Анал. (C17H13NO2S) C, H, N. 1 (2-Метоксіфеніл)(2-фенілтіазол-4-іл)-метанон (сполука 8d): Вихід: 57,4 %. Безбарвна олія. H ЯМР (300МГц, CDCl3) 8,03 (s, 1 H), 7,98-7,95 (m, 2 H), 7,57-7,47 (m, 2 H), 7,47-7,42 (m, 3 H), + 7,08-7,01 (m, 2 H), 3,78 (s, 3 H), МС (ESI) m/z 318,1 [M + Na] . Анал. (C17H13NO2S) C, H, N. (3, 4-Діметоксіфеніл)(2-фенілтіазол-4-іл)-метанон (сполука 8e): Вихід: 15,3 %. Т.пл. 89-91°C. 1 H ЯМР (500МГц, CDCl3) 8,24 (s, 1 H), 8,22 (dd, 1 H, J = 8,5 Гц, 2,0 Гц), 8,04-8,02 (m, 2 H), 7,99 (d, 1 H, J = 2,0 Гц), 7,49-7,47 (m, 3 H), 6,98 (d, 1 H, J = 8,5 Гц), 3,99 (s, 6 H), МС (ESI) m/z 348,0 [M + + Na] . Анал. (C18H15NO3S) C, H, N. (2-Феніл-тіазол-4-іл)-(3,4,5-триметоксі-феніл)-метанон (сполука 8f): Вихід: 27,3 %. Т.пл. 1331 135°C. H ЯМР (300МГц, CDCl3) 8,29 (s, 1 H), 8,03 (q, 2 H), 7,80 (s, 2 H), 7,49-7,47 (m, 3 H), 3,96 + (s, 6 H), 3,97 (s, 3 H), МС (ESI) m/z 378,1 [M + Na] . Анал. (C19H17NO4S) C, H, N. (3, 5-Діметоксіфеніл)(2-фенілтіазол-4-іл)-метанон (сполука 8g): Вихід: 41,5 %. Т.пл. 84-85°C. 1 H ЯМР (300МГц, CDCl3) 8,23 (s, 1 H), 8,04-8,01 (m, 2 H), 7,99 (d, 2 H, J = 2,4 Гц), 7,49-7,43 (m, 3 + H), 6,72 (t, 1 H, J = 2,4 Гц), 3,87 (s, 6 H), МС (ESI) m/z 348,3 [M + Na] . Анал. (C18H15NO3S) C, H, N. 1 (2-Фторфеніл)(2-фенілтіазол-4-іл)-метанон (сполука 8h): Вихід: 66,4 %. Т.пл. 77-79°C. H ЯМР (300МГц, CDCl3) 8,48-8,41 (m, 2 H), 8,28 (s, 2 H), 8,04-7,98 (m, 2 H), 7,50-7,46 (m, 3 H), + 7,26-7,16 (m, 2 H), МС (ESI) m/z 306,0 [M + Na] , 283,9 [M - H] . Анал. (C16H10FNOS) C, H, N. 1 (2-Фенілтіазол-4-іл)-(піридин-2-іл)-метанон (сполука 8i): Вихід: 20,7 %. Т.пл. 95-97°C. H ЯМР (300МГц, CDCl3) 9,01 (s, 1 H), 8,77 (d, 1 H, J = 4,8 Гц), 8,28 (d, 1 H, J = 7,8 Гц), 8,08-8,05 (m, 2 H), 7,92 (dt, 1 H, J = 7,8 Гц, 1,2 Гц), 7,52 (ddd, 1 H, J = 7,8 Гц, 4,8 Гц, 1,2 Гц), 7,48-7,46 (m, 3 H), 1 (сполука 8iHCl соль): Вихід: 70,6 %, Т.пл. 105-107°C, H ЯМР (300МГц, DМСO-d6) 9,03 (s, 1 H), 8,79 (d, 1 H, J = 4,8 Гц), 8,10 (br, 1 H), 8,08 (br, 1 H), 8,03-8,00 (m, 2 H), 7,73-7,69 (m, 1 H), 7,56+ 7,54 (m, 3 H), МС (ESI) m/z 267,0 [M + H] . Анал. (C15H10N2OS, C15H10N2OSHCl) C, H, N. 24 UA 105005 C2 1 5 10 15 20 25 30 35 40 45 50 55 1-(2-фенілтіазол-4-іл)-гептадекан-1-он (сполука 8j): Вихід: 66,4 %. Т.пл. 63-64°C. H ЯМР (300МГц, CDCl3) 8,12 (s, 1 H), 8,02-7,99 (m, 2 H), 7,49-7,47 (m, 3 H), 3,16 (t, 2 H, J = 7,5 Гц), 1,82+ 1,72 (m, 2 H), 1,26 (s, 26 H), 0,88 (t, 3 H, J = 6,9 Гц), МС (ESI) m/z 414,4 [M + H] . Анал. (C26H39NOS) C, H, N. (2-п-Толілтіазол-4-іл)-(3,4,5-триметоксіфеніл)-метанон (сполука 8k): Вихід: 53,2 %. Т.пл. 1161 119°C. H ЯМР (300МГц, CDCl3) 8,25 (s, 1 H), 7,91 (d, 2 H, J = 8,1 Гц), 7,80 (s, 2 H), 7,28 (d, 2 H, + J= 8,1 Гц), 3,96 (s, 3 H), 3,95 (s, 6 H), МС (ESI) m/z 392,1 [M + Na] . Анал. (C20H19NO4S) C, H, N. [2-(2-Фторфеніл)-тіазол-4-іл]-(3,4,5-триметоксіфеніл)-метанон (сполука 8l): Вихід: 39,6 %. 1 Т.пл. 90-102°C. H ЯМР (500МГц, CDCl3) 8,40 (s, 1 H), 8,33 (dt, 1 H, J = 1,5 Гц, 8,0 Гц), 7,78 (s, 2 + H), 7,49-7,44 (m, 1 H), 7,30-7,23 (m, 2 H), 3,97 (s, 3 H), 3,95 (s, 6 H), МС (ESI) m/z 396,1 [M + Na] . Анал. (C19H16FNO4S) C, H, N. [2-(3-Фторфеніл)-тіазол-4-іл](3,4,5-триметоксіфеніл)-метанон (сполука 8m): Вихід: 14,1 %. 1 Т.пл. 122-124°C. H ЯМР (300МГц, CDCl3) 8,31 (s, 1 H), 7,79 (s, 2 H), 7,76-7,74 (m, 2 H), 7,45 (dt, 1 H, J = 6,0 Гц, 8,4 Гц), 7,18 (dt, 1 H, J = 1,8 Гц, 8,4 Гц), 3,97 (s, 3 H), 3,96 (s, 6 H), МС (ESI) m/z + 396,1 [M + Na] . Анал. (C19H16FNO4S) C, H, N. [2-(4-Фторфеніл)-тіазол-4-іл]-(3,4,5-триметоксіфеніл)-метанон (сполука 8n): Вихід: 40,2 %. 1 Т.пл. 153-155°C. H ЯМР (300МГц, CDCl3) 8,27 (s, 1 H), 8,04-8,00 (dd, 2 H, J = 8,4 Гц, 5,7 Гц), + 7,75 (s, 2 H), 7,21-7,15 (t, 3 H, J = 8,4 Гц), 3,97 (s, 3 H), 3,95 (s, 6 H), МС (ESI) m/z 396,1 [M + Na] . Анал. (C19H16FNO4S) C, H, N. [2-(3,4-Діметоксіфеніл)-тіазол-4-іл]-(3,4,5-триметоксіфеніл)-метанон (сполука 8o): Вихід: 46,6 1 %. Т.пл. 145-147°C. H ЯМР (300МГц, CDCl3) 8,20 (s, 1 H), 7,76 (s, 2 H), 7,58-7,54 (m, 2 H), 6,94 + (d, 2 H, J = 8,1 Гц), 3,96 (s, 6 H), 3,95 (s, s, 9H), МС (ESI) m/z 438,1 [M + Na] . Анал. (C21H21NO6S1/4H2O ) C, H, N. [2-(4-Нітрофеніл)-тіазол-4-іл]-(3,4,5-триметоксіфеніл)-метанон (сполука 8p): Вихід: 46,4 %. 1 Т.пл. 199-200°C. H ЯМР (300МГц, CDCl3) 8,38 (d, 2 H, J = 8,7 Гц), 8,34 (s, 1 H), 8,20 (d, 2 H, J = + 8,7 Гц), 7,73 (s, 2 H), 3,98 (s, 3 H), 3,95 (s, 6 H), МС (ESI) m/z 423,1 [M + Na] . Анал. (C19H16N2O6S) C, H, N. 4-[4-(3,4,5-Триметоксібензоїл)-тіазол-2-іл]-бензoнітрил (сполука 8q): Вихід: 45,9 %. Т.пл. 1811 182°C. H ЯМР (300МГц, CDCl3) 8,37 (s, 1 H), 8,13 (d, 2 H, J = 8,4 Гц), 7,78 (d, 2 H, J = 8,4 Гц), + 7,72 (s, 2 H), 3,97 (s, 3 H), 3,94 (s, 6 H), МС (ESI) m/z 403,1 [M + Na] . Анал. (C20H16N2O4S) C, H, N. 4-[4-(3,4,5-Триметоксібензоїл)-тіазол-2-іл]-бензойну кислоту (сполука 8r): Вихід: 61,9 %. Т.пл. 1 >220°C (розкл.). H ЯМР (300МГц, CDCl3) 8,65 (s, 1 H), 8,00 (d, d, 4 H), 7,65 (s, 2 H), 3,88 (s, 6 H), 3,80 (s, 3 H), МС (ESI) m/z 397,9 [M - H] , 353,9 [M - COOH] . Анал. (C20H17NO6S) C, H, N. Метил-4-[4-(3,4,5-триметоксібензоїл)-тіазол-2-іл]-бензоат (сполука 8s): Вихід: 72,5 %. Т.пл. 1 172-174°C. H ЯМР (300МГц, CDCl3) 8,35 (s, 1 H), 8,12 (dd, 4 H, J = 8,4 Гц), 7,78 (s, 2 H), 3,97 (s, + 3 H), 3,96 (s, 3H), 3,95 (s, 6 H), МС (ESI) m/z 436,1 [M + Na] . Анал. (C21H19NO6S) C, H, N. (2-(4-(Трифторметил)-феніл)-тіазол-4-іл)(3,4,5-триметоксіфеніл)-метанон (сполука 8t): Вихід: 1 45,5 %. Т.пл. 144-145°C. H ЯМР (300МГц, CDCl3) 8,35 (s, 1 H), 8,14, 7,65 (d, d, 4 H, J = 8,1 Гц), + 7,76 (s, 2 H), 3,97 (s, 3 H), 3,95 (s, 6 H), МС (ESI) m/z 446,1 [M + Na] . Анал. (C20H16F3NO4S) C, H, N. [2-(4-Бромфеніл)-тіазол-4-іл]-(3,4,5-триметоксіфеніл)-метанон (сполука 8u): Вихід: 51,8 %. 1 Т.пл. 149-150°C. H ЯМР (300МГц, CDCl3) 8,28 (s, 1 H), 7,89, 7,62 (d, d, 4 H, J = 8,1 Гц), 7,75 (s, + 2 H), 3,97 (s, 3 H), 3,94 (s, 6 H), МС (ESI) m/z 456,0, 458,0 [M + Na] . Анал. (C19H16BrNO4S) C, H, N. [2-(4-Етил-феніл)-тіазол-4-іл]-(3,4,5-триметоксі-феніл)-метанон (сполука 8v): Вихід: 40,0 %. 1 Т.пл. 86-87°C. H ЯМР (300МГц, CDCl3) 8,25 (s, 1 H), 7,93, 7,31 (d, d, 4 H, J = 8,4 Гц), 7,81 (s, 2 + H), 3,97 (s, 3 H), 3,95 (s, 6 H), МС (ESI) m/z 406,1 [M + Na] . Анал. (C21H21NO4S) C, H, N. [2-(4-Аміно-феніл)-тіазол-4-іл]-(3,4,5-триметоксі-феніл)-метанон (сполука 8w): Вихід: 61,8 %. 1 Т.пл. 177-179°C. H ЯМР (300МГц, CDCl3) 8,14 (s, 1 H), 7,82, 7,65 (d, d, 4 H, J = 8,4 Гц), 7,78 (s, 1 2 H), 3,96 (s, 3 H), 3,94 (s, 6 H). (сполука 8wHCl соль): Вихід: 50.1 %. Т.пл. 166-169°C. H ЯМР (300МГц, DМСO-d6) 8,49 (s, 1 H), 7,84, 6,94 (d, d, 4 H, J = 8,4 Гц), 7,62 (s, 2 H), 3,86 (s, 3 H), 3,79 + (s, 6 H), МС (ESI) m/z 393,1 [M + Na] . Анал. (C19H18N2O4S, C19H18N2O4SHCl) C, H, N. [2-(Піридин-4-іл)-тіазол-4-іл]-(3,4,5-триметоксіфеніл)-метанон (сполука 8x): Вихід: 29,3 %. 1 Т.пл. 178-180°C. H ЯМР (300МГц, CDCl3) 8,77 (dd, 2 H, J = 6,0 Гц, 1,5 Гц), 8,40 (s, 1 H), 7,87 (dd, 2 H, J = 6,0 Гц, 1,8 Гц), 7,75 (s, 2 H), 3,98 (s, 3 H), 3,95 (s, 6 H). (сполука 8xHCl соль): Вихід: 1 92,7 %. Т.пл. 182-184°C. H ЯМР (300МГц, CDCl3) 8,85 (br, 2 H), 8,52 (s, 1 H), 8,22 (br, 2 H), 7,66 + (s, 2 H), 3,98 (s, 3 H), 3,94 (s, 6 H), МС (ESI) m/z 379,1 [M + Na] . Анал. (C18H16N2O4S, C18H16N2O4SHCl) C, H, N. [2-(Піримідин-2-іл)-тіазол-4-іл]-(3,4,5-триметоксіфеніл)-метанон (сполука 8y): Вихід: 51,9 %. 25 UA 105005 C2 Т.пл. 190-191°C. H ЯМР (300МГц, CDCl3) 8,88 (d, 2 H, J = 4,8 Гц), 8,44 (s, 1 H), 7,73 (s, 2 H), + 7,37 (t, 1 H, J = 4,8 Гц), 3,95 (s, 3 H), 3,94 (s, 6 H), МС (ESI) m/z 380,1 [M + Na] . Анал. (C17H15N3O4S) C, H, N. [2-(Тіофен-2-іл)-тіазол-4-іл]-(3,4,5-триметоксіфеніл)-метанон (сполука 8z): Вихід: 30,5 %. 1 Т.пл. 111-113°C. H ЯМР (300МГц, CDCl3) 8,25 (s, 1 H), 7,90 (s, 2 H), 7,58 (dd, 1 H, J = 3,6, 0,9 Гц), 7,46 (dd, 1 H, J = 5,4, 0,9 Гц), 7,12 (dd, 1 H, J = 5,4, 3,6 Гц), 3,98 (s, 6 H), 3,97 (s, 3 H), МС + (ESI) m/z 384,1 [M + Na] . Анал. (C17H15NO4S2) C, H, N. Тіазол-4-іл-(3,4,5-триметоксі-феніл)-метанон (сполука 10a): Вихід: 49,4 %. Т.пл. 106-108°C. 1 H ЯМР (300МГц, CDCl3) 8,92 (d, 1 H, J = 2,1 Гц), 8,34 (d, 1 H, J = 2,1 Гц), 7,61 (s, 2 H), 3,94 (s, 3 + H), 3,93 (s, 6 H), МС (ESI) m/z 302,0 [M + Na] . Анал. (C13H13NO4S) C, H, N. Спосіб 3: (2-Феніл-тіазол-4-іл)-(3,4,5-тригідроксі-феніл)-метанон (11f) синтезували, починаючи зі сполуки 8f. До розчину сполуки 8f (123 мг, 0,35 ммоль) в 5 мл безв. CH2Cl2 додавали BBr3 (1M розчин в CH2Cl2, 1,75 мл, 5 ммоль) при нижче -78°C. Суміш перемішували протягом 2 годин та завантажували розчин аміду 7 (1,14 ммоль) в 3 мл ТГФ. Суміш залишали повільно нагріватися до кімнатної температури и перемішували усю ніч. Реакційну суміш гасили насич. NH4Cl, екстрагували етилацетатом, висушували над MgSO 4. Розчинник видаляли при зниженому тиску з одержанням неочищеного продукту, який очищували за допомогою колонкової хроматографії з одержанням чистої сполуки у вигляді червоної кристалічної твердої 1 речовини. Вихід: 50,9 %. Т.пл. 175-176°C. H ЯМР (300МГц, DМСO-d6) 8,44 (d, 1 H), 8,07-8,04 + (m, 2 H), 7,57-7,55 (m, 3 H), 7,33 (s, 2 H), МС (ESI) m/z 336,1 [M + Na] . Анал. (C16H11NO4S) C, H, N. Приклад 3 - Рентгеноструктурне визначення кристалічної структури для сполуки 8f Сполуку 8f повторно кристалізували з гексану та етилацетату, та одержували одинарні безбарвні кристали, прийнятні для рентгенографічного дослідження. Рентгеноструктурні дані для 8f отримували для одинарного кристала, змонтованого з паратоновою олією на нейлоновій криопетлі. Дані збирали при 100K на двомірному детекторі Bruker Proteum CCD, контрольованому програмним забезпеченням Proteum2 (Proteum2, Bruker AXS Inc., Madisоn, Wisconsin, USA (2005)), з використанням генератора з обертовим анодом і дзеркалами Osmic для генерації Cu-випромінювання ( =1,54178A). Дані перетворювали за допомогою SAINT (SAINT, Bruker AXS Inc., Madisоn, Wisconsin, USA. (1998)), а корекцію поглинання застосовували за допомогою SADABS (SADABS, Bruker AXS Inc., Madisоn, Wisconsin, USA. (2000)), виходячи з надмірних відбитків; така корекція включала x4 сферичний компонент. Структуру вирішували за допомогою прямих способів (SHELXS ), які виявляли усі важкі атоми. Уточнення структури за допомогою SHELXL (SHELXL-97, G.M. Sheldrick, University of Göttingen, Germany (1997)) проводили за допомогою повноматричних 2 способів, виходячи з F , і плавно продовжували. Атоми водню додавали до структурної моделі, допускаючи ідеальні відстані C-H та ізотропні ADPs, обмежені тим, що вони аналогічні ADPs зв'язаного атома вуглеводню. У кінцевій моделі, анізотропні ADPs уточнювали для усіх важких металів, а ізотропні ADPs для хімічно аналогічних воднів (наприклад H метилу) були обмежені ідентичністю. Кінцеві параметри уточнення: wR2=0,084 для 228 параметрів та 3066 незалежних спостережень, R1=0.031, S (критерій погодженості)=1,057. Зображення ORTEP 8f зі схемою міток атомів показано на Фігурі 1. Рентгенівська структура показала, що молекула 8f містила кон'юговану систему, що складалася з трьох ароматичних циклів та лінкеру - карбонільної групи між “B” та “C” циклом, як очікували (“A” цикл = феніл; “B” цикл = тіазол; “C” цикл = 3, 4, 5-триметоксіфеніл). Як результат, два C-C зв’язки, прилеглі до C=O та C-C-зв'язку між “A” фенільним та “B” тіазольним циклом відображають (C1-C7 = 1,496(2) Å; C7-C8 = 1,492(2) Å; C10-C11 = 1,471(2) Å) більш короткі довжини зв’язків, ніж нормальний C-C одинарний зв’язок (1,54 Å), та більш довгі, ніж нормальний C=C подвійний зв’язок (1,34 Å) (див. Таблицю 1 нижче). Таким чином, кон'югація системи можлива для “A”, “B”, “C” циклів та карбонільної групи. Карбонільна група є практично копланарною з прилеглим “B” тіазольним циклом (O-C7-C1-C6 16.2(2), O-C7-C8-C9 9.7(2)). 1 5 10 15 20 25 30 35 40 45 50 26 UA 105005 C2 Таблиця 1 Вибіркові геометричні параметри сполуки 8f (Å, ) C1-C7 C7-O C7-C8 C8-C9 C8-N C9-S S-C10 C10-N C10-C11 C2-C1-C6 C2-C1-C7 C6-C1-C7 O-C7-C8 5 10 15 20 25 30 35 40 1,496(2) 1,224(2) 1,492(2) 1,371(2) 1,380(2) 1,711(2) 1,747(2) 1,303(2) 1,471(2) 121,2(2) 122,3(2) 116,4(2) 118,0(2) O-C7-C1 C8-C7-C1 C9-C8-N C9-C8-C7 N-C8-C7 C8-C9-S C9-S-C10 N-C10-C11 N-C10-S C11-C10-S C10-N-C8 C12-C11-C10 C16-C11-C10 120,1(2) 121,9(2) 115,1(2) 121,7(2) 123,0(2) 110,0(1) 89,6(1) 123,5(2) 113,9(1) 122,6(1) 111,4(2) 122,3(2) 118,5(2) Приклад 4 - Аналізи in vitro протиракової цитотоксічності In vitro аналізи були проведені на предмет тестування як меланомних клітинних ліній, так і клітинних ліній простати. У кожному випадку використовували стандартний аналіз із сульфородаміном B. Клітини висівали в планшети з 96 лунками при 1000-5000 клітин/лунка залежно від швидкостей росту. Через 12 годин, середовища замінювали та додавали серійні розведення сполук. Клітини інкубували для кожної зі сполук протягом 48 годин. Свіжі середовища, що містять тестову сполуку, замінювали кожні 24 години. Після цього, загальний клітинний білок, що відповідає кількостям клітин (як життєздатних, так і нежиттєздатних клітин) вимірювали шляхом аналізу з сульфородаміном B (SRB) за протоколу виробника (Sigma-Aldrich, Inc.) (Rubinstein et al., “Comparisоn of in vitro Anticancer Drug-screening Data Generated with a Tetrazolium Assay Versus a Protein Assay Against a Diverse Panel of Human Tumor Cell Lines,” J. Natl. Cancer Inst. 82: 1113-1118 (1990); Dothager et al., “Synthesis and Identification of Small Molecules that Potently Induce Apoptosis in Melanoma Cells Through G1 Cell Cycle Arrest,” J. Am. Chem. Soc. 127: 8686-8696 (2005), кожна з яких включена до цієї заявки шляхом посилання ). Для аналізів меланоми, використовували одну людську меланомну клітинну лінію (A375) і одну мишачу меланомну клітинну лінію (B16-F1). Клітини A375 та клітини B16-F1 придбавали у ATCC (Американська колекція типових культур, Manassas, VA, USA). Фібробластні клітини застосовували як контрольні для визначення селективності таких сполук по відношенню до меланоми. Людські дермальні фібробластні клітини придбавали в Cascade Biologics, Inc., Portland, OR, USA. Всі клітинні лінії культивували в модифікованому по способу Дульбекко середовищі Ігла (Cellgro Mediatech, Inc., Herndon, VA, USA), з додаванням 5% ембріональної бичачої сироватки (Cellgro Mediatech), суміші 1% антибіотик/антимікотик (Sigma-Aldrich, Inc., St. Louis, MO, USA) та бичачого інсуліну (5 мкг/мол; Sigma-Aldrich). Культури зберігали при 37°C у зволоженій атмосфері, що містить 5% CO2. Клітини піддавали впливу широкого діапазону концентрацій протягом 48 годин у круглодонних планшетах на 96 лунок. Клітини фіксували 10% трихлороцтовою кислотою та п'ятикратно промивали водою. Після висушування клітин на повітрі протягом ночі та забарвлення розчином сульфородаміну В, загальний вміст білку вимірювали при 560 нм за допомогою планшетного рідера. Значення IC50 (тобто, концентрація, що інгібує ріст клітин на 50% порівняно із контролем без лікування) одержували за допомогою аналізу нелінійної регресії з використанням GraphPad Prism (GraphPad Software, San Diego, CA). Для аналізів раку простати, відбирали чотири людські клітинні лінії раку простати (LNCaР, DU 145, PC-3, та PPC-1). Клітини LNCaР, PC-3 та DU 145 придбавали у ATCC (Американська колекція типових культур, Manassas, VA, USA). Доктор Мітчелл Штайнер (Mitchell Steiner), Університет Тенесі, Центр наук про здоров'я, люб'язно надав клітини PPC-1. Всі клітинні лінії раку простати культивували в RPMI 1640 (Cellgro Mediatech, Inc., Herndon, VA, USA), з додаванням 10% ембріональної бичачої сироватки (Cellgro Mediatech). Культури зберігали при 37°C у зволоженій атмосфері, що містить 5% CO 2. 1000-5000 кліток висівали на планшети в кожну лунку планшети на 96 лунок залежно від швидкості росту й піддавали впливу різних концентрацій тестової сполуки протягом 96 годин у трьох-п'яти репликатах. Кількості клітин наприкінці лікування лікарським засобом вимірювали за допомогою аналізу з сульфородаміном 27 UA 105005 C2 5 10 15 20 25 30 35 40 45 50 55 60 В. Стисло, клітини фіксували 10% трихлороцтової кислоти та забарвлювали 0,4% сульфородаміну В, та поглинання при 540 нм вимірювали за допомогою планшетного рідера (DYNEX Technologies, Chantilly, VA). Процентні вмісти виживання клітин залежно від концентрації лікарського засобу наносили на графік і значення IC 50 (концентрація, що інгібує ріст на 50% від необробленого контролю) одержували за допомогою аналізу нелінійної регресії за допомогою WinNonlin (Pharsight Corporation, Mountain View, CA). Результати даних аналізів представлені в Таблицях 2-4 нижче. Модифікації “B” циклу від тіазолідинової до тіазольної системи та лінкер від аміда до кетону. У попередніх сполуках ATCAA, було показано, що тіазолідиновий цикл, що містив вільну групу NH в 3-положенні, був важливим для цитотоксічності. Після заміщення “B” циклічного тіазолідинового фрагменту на тіазоліновий цикл, антипроліферативна активність різко зросла від 0,6 мкМ до більш, ніж 50 мкМ у клітинних лініях WM-164 (Li et al., “Synthesis and Antiproliferative Activity of Thiazolidine Analogs for Melanoma,” Bioorg. Med. Chem. Lett. 17: 4113-7 (2007), що повністю включена до цієї заявки шляхом посилання). Похідне ATCAA-1 жирного аміду було найбільш ефективним по відношенню до клітинних ліній меланоми та раку простати і було досліджено та показано, що воно мало значення IC50 0,4-2,2 мкМ (див. Таблицю 2). Заміщення довгого жирного ланцюга на певний ароматичний об'ємний замісник, такий, як флуорен ( ATCAA-2), проявляло інгібуючу активність на обидві ракові клітинні лінії (IC 50 = 1,6-3,9 мкМ). Флуоренова група в 4-карбоксілатному амідному положенні також була заміщена 3,4,5триметоксілфенільною групою (2a та 2b), але ефективність по відношенню до обох ракових ліній була втрачена. Наступна модифікація “B” циклу від насиченої тіазолідинової сполуки 2a у незаміщений тіазол 5 не виявила будь-якої цитотоксичності по відношенню до будь-якої досліджуваної ракової лінії. Але тіазолінові енантіомери 4a і 4b (R-ізомер та S-ізомер, з аналогічними антипроліферативними активностями) показали підвищену активність (IC 50 = 3,438,3 мкМ) у порівнянні з 2a, 2b та 5. При заміщенні амідного CONH зв'язку між “B” циклом та “C” циклом на карбонільний лінкер, були одержані суміші тіазолін/тіазольного кетону 8f замість цільового тіазолінового кетону, оскільки відбувалася ауто-дегідрогенізація між тіазоліном і тіазолом (перетворення показано на Фігурі 2). Несподівано, введення карбонільної лінкерної групи та тіазольного “B” циклу привело до значного підвищення інгібування росту досліджуваних ракових клітинних ліній з низьким наномолярним рівнем (8f, IC 50 = 0,021-0,071 мкМ), тобто порівняно із природним протираковим агентом колхіцином. Потім був розроблений та синтезований ряд родинних сполук з “B” як тіазольним циклом, виходячи з винаходу 8f. Також була оцінена їх протиракова активність по відношенню до меланоми та раку простати. Модифікації “C” циклу також мали значний ефект. Варіація фенільних замісників викликала значну зміну впливу на ефективність. Результати аналізу in vitro показані в Таблиці 3 і забезпечують цікаві результати, але тільки 3,4,5-триметоксілфенільний “C” цикл (8f) проявляв відмінне інгібування по відношенню до усіх ракових клітин (IC50= 21-71 нМ, середнє IC50= 41 нМ). Сполука 8g, з 3,5-діметоксіфенільною групою, виявила в 6 разів меншу середню цитотоксичність у порівнянні з 8f по відношенню до шести різних клітинних ліній (IC 50 = 170-424 нМ, розрахунк. середнє IC50= 261 нМ). Модифікації 8f шляхом видалення однієї метоксі-групи в пара-положенні (8e) або двох метоксі-груп (8b, 8c та 8d) від 8f призвело до різкого зменшення активності (IC50 >20 мкМ). Хоча орто-заміщена монометоксі-сполука 8d проявляла слабку активність по відношенню до певних клітинних ліній у порівнянні з мета-/пара-MeО-заміщеною 8c/8b та діметоксіфенільною сполукою 8e, жодні з них не проявляли значну активність при інгібуванні у порівнянні з 8f. Аналогічні тенденції також були показані для 8h та 8j з 2фторфенілом та гексадецилом у модифікаціях “C” циклу. Модифікації “A” циклу з використанням різних пара-заміщених електроноакцепторних груп (ЕАГ) та електронодонорних груп (ЕДГ) не проявляли чіткого впливу на антипроліферативну активність. Введення слабких ЕАГ (4-F в 8n, IC50 значення: 6 - 43 нM) або слабких ЕДГ (4-CH3 в 8k, IC50s: 5-21 нM), посилювало ефективність порівняно із 8f (див. Таблицю 4). Заміщення параположення на сильний ЕАГ, такий, як NO2 (8p), CN (8q), CF3 (8t) або введення сильного ЕДГ (3, 4-діметоксі) в “A” фенільний цикл (8o) проявляло порівняну антипроліферативну активність. Для порівняння ефектів орто-, мета- та пара-заміщень, атом фтору вводили в різні положення “A” фенільного циклу (8l, 8m, і 8n). Різні -о-, м-, п- замісники не проявляли однакової активності. п-Фтор заміщений 8n мав найбільшу активність для досліджуваних клітин раку простати (6-13 нМ), у той час як o-фтор заміщений 8l показував найбільш низькі значення IC 50 (27-30 нМ) по відношенню до кліток меланоми. 8n мало аналогічні середні значення IC50 (33-43 нМ) по відношенню до меланоми в порівнянні з 8l. Але o-фтор заміщене 8l мало найменшу ефективність (IC50 значення: 52-114 нМ) серед трьох заміщених сполук на клітки раку простати. Мета-заміщена сполука 8m показала найбільш низьку активність по відношенню до клітин 28
ДивитисяДодаткова інформація
Назва патенту англійськоюCompounds for the treatment of cancer
Автори англійськоюMiller, Duane, D., Li, Wei, Wang, Zhao, Lu, Yan, Chen, Jianjun, Dalton, James, T., Li, Chien-Ming
Автори російськоюМиллер Дуейн Д.
МПК / Мітки
МПК: C07D 263/34, A61K 31/421, A61K 31/415, A61K 31/425, C12N 5/02, C07D 233/22
Мітки: сполуки, раку, лікування
Код посилання
<a href="https://ua.patents.su/44-105005-spoluki-dlya-likuvannya-raku.html" target="_blank" rel="follow" title="База патентів України">Сполуки для лікування раку</a>
Попередній патент: Модульний процес для обробляння водотоків зі змінюваним і безперервним потоком
Наступний патент: Запобіжна муфта для передачі обертального руху
Випадковий патент: Сполука піридазинону і її застосування