Триазолопохідні, корисні для лікування хвороб
Номер патенту: 99524
Опубліковано: 27.08.2012
Автори: Джонс Лін Говард, Стренґ Росс Сінклер, Робертс Данніелль Френсіс
Формула / Реферат
1. Сполука загальної формули (1)
 ,
,
де
А є
 ,
,
де * - точка приєднання А до карбону, що несе гідроксил;
X є -(СН2)m-, де m - ціле число від 7 до 12 включно, або має формулу:
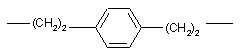 ,
,
Yє:
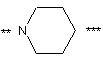 ,
,
де ** та *** - точки приєднання, ** є зв'язком з X;
n = 0 або 1;
R1 вибрано з групи: цикпогексил або феніл; та
R2 є феніл;
або її фармацевтично прийнятна сіль.
2. Сполука за п. 1 або її фармацевтично прийнятна сіль, де X - -(СН2)9- або має формулу:
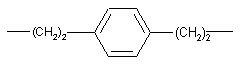 .
.
3. Сполука за п. 1 або п. 2, або її фармацевтично прийнятна сіль, де n = 1.
4. Сполука за п. 1, яку вибрано з групи:
5-[(1R)-2-({9-[4-({3-[(R)-циклогексил(гідрокси)фенілметил]-1Н-1,2,4-триазол-1-іл}метил)піперидин-1-іл]ноніл}аміно)-1-гідроксіетил]-8-гідроксихінолін-2(1Н)-он,
5-[(1R)-2-({9-[4-({3-[(R)-циклогексил(гідрокси)фенілметил]-1Н-1,2,4-триазол-1-іл}метил)піперидин-1-іл]ноніл}аміно)-1-гідроксіетил]-8-гідроксихінолін-2(1Н)-он нафталін-1,5-дисульфонат,
5-[(1R)-2-{[2-(4-{2-[4-({3-[(R)-циклогексил(гідрокси)фенілметил]-1Н-1,2,4-триазол-1-іл}метил)піперидин-1-іл]етил}феніл)етил]аміно}-1-гідроксіетил]-8-гідроксихінолін-2(1Н)-он,
5-[(1R)-2-{[2-(4-{2-[4-({3-[(R)-циклогексил(гідрокси)фенілметил]-1Н-1,2,4-триазол-1-іл}метил)піперидин-1-іл]етил}феніл)етил]аміно}-1-гідроксіетил]-8-гідроксихінолін-2(1Н)-он нафталін-1,5-дисульфонат,
5-[(1R)-2-{[2-(4-{2-[4-({3-[(R)-циклогексил(гідрокси)фенілметил]-1Н-1,2,4-триазол-1-іл}метил)піперидин-1-іл]етил}феніл)етил]аміно}-1-гідроксіетил]-8-гідроксихінолін-2(1Н)-он сукцинат,
5-[(1R)-2-{[2-(4-{2-[4-({3-[(R)-циклогексил(гідрокси)фенілметил]-1Н-1,2,4-триазол-1-іл}метил)піперидин-1-іл]етил}феніл)етил]аміно}-1-гідроксіетил]-8-гідроксихінолін-2(1Н)-он фумарат,
5-[(1R)-2-({9-[4-({3-[циклогексил(гідрокси)фенілметил]-1Н-1,2,4-триазол-1-іл}метил)піперидин-1-іл]ноніл}аміно)-1-гідроксіетил]-8-гідроксихінолін-2(1Н)-он,
8-гідрокси-5-[(1R)-1-гідрокси-2-({9-[4-({3-[гідрокси(дифеніл)метил]-1Н-1,2,4-триазол-1-іл}метил)піперидин-1-іл]ноніл}аміно)етил]хінолін-2(1Н)-он та
8-гідрокси-5-[(1R)-1-гідрокси-2-{[2-(4-{2-[4-({3-[гідрокси(дифеніл)метил]-1Н-1,2,4-триазол-1-іл}метил)піперидин-1-іл]етил}феніл)етил]аміно}етил]хінолін-2(1Н)-он.
5. Сполука за п. 1, якою є 5-[(1R)-2-{[2-(4-{2-[4-({3-[(R)-циклогексил(гідрокси)фенілметил]-1Н-1,2,4-триазол-1-іл}метил)піперидин-1-іл]етил}феніл)етил]аміно}-1-гідроксіетил]-8-гідроксихінолін2(1Н)-он нафталін-1,5-дисульфонат.
6. Фармацевтична композиція, що містить ефективну кількість сполуки формули (1), що вказана в будь-якому з пп. 1-5, або її фармацевтично прийнятної солі.
7. Сполука формули (1), вказана в будь-якому з пп. 1-5, або її фармацевтично прийнятна сіль, для застосування як медикаменту.
8. Сполука формули (1), вказана в будь-якому з пп. 1-5, або її фармацевтично прийнятна сіль, для застосування у лікуванні хвороб, розладів та станів, вибраних з групи:
астма будь-якого типу, етіології або патогенезу, зокрема астма, яка є вибраною з групи: атопічна астма, неатопічна астма, алергічна астма, атопічна бронхіальна ІgЕ-опосередкована астма, бронхіальна астма, есенціальна астма, істинна астма, інфекційно-алергічна астма, спричинена патофізіологічними порушеннями, екзогенна бронхіальна астма, спричинена факторами навколишнього середовища, есенціальна астма невідомої або неочевидної причини, неатопічна астма, бронхітна астма, емфізематозна астма, індукована фізичними вправами астма, індукована алергеном астма, індукована холодним повітрям астма, професійна астма, інфекційна астма, спричинена бактеріальною, грибковою, протозойною або вірусною інфекцією, неалергічна астма, початкова астма, астматичний дитячий синдром та бронхіоліт;
хронічна або гостра бронхоконстрикція, хронічний бронхіт, обструкція дрібних дихальних шляхів та емфізема;
обструктивні або запальні хвороби дихальних шляхів будь-якого типу, етіології або патогенезу, зокрема обструктивна або запальна хвороба дихальних шляхів, що є вибраною з групи: хронічна еозинофільна пневмонія, хронічна обструктивна хвороба легень (COPD), COPD, що охоплює хронічний бронхіт, емфізему легень або утруднене дихання, асоційоване або ні з COPD, COPD, що характеризується необоротною, прогресуючою обструкцією дихальних шляхів, респіраторний дистрес-синдром дорослих (ARDS), загострення гіперреактивності дихальних шляхів в результаті терапії іншими ліками та хвороба дихальних шляхів, що асоційована з гіпертензією легень;
бронхіт будь-якого типу, етіології або патогенезу, зокрема бронхіт, що є вибраним з групи: гострий бронхіт, гострий гортанно-трахеальний бронхіт, арахіновий бронхіт, катаральний бронхіт, крупозний бронхіт, сухий бронхіт, інфекційний астматичний бронхіт, продуктивний бронхіт, стафілококовий або стрептококовий бронхіт та везикулярний бронхіт;
гостре поранення легень; та
бронхоектаз будь-якого типу, етіології або патогенезу, зокрема бронхоектаз, що є вибраним з групи: циліндричний бронхоектаз, осумкований бронхоектаз, веретеноподібний бронхоектаз, капілярний бронхоектаз, кістозний бронхоектаз, сухий бронхоектаз та фолікулярний бронхоектаз.
9. Сполука формули:
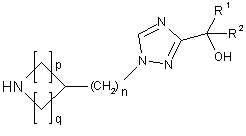 , (5)
, (5)
де р та q є незалежно вибраними з 1 або 2, а n = 0 або 1;
R1 вибрано з групи: циклогексил або феніл; та
R2 є феніл.
Текст
Реферат: Винахід стосується сполук формули (1) N OH H N A N X Y (CH2)n N R 1 R 2 OH (1) та способів їх отримання, проміжних сполук, застосовуваних в їх отриманні, композицій, що їх містять, та застосування таких похідних. UA 99524 C2 (12) UA 99524 C2 Сполуки згідно з заявленим винаходом є корисними у ряді хвороб, розладів та станів, зокрема запальних, алергічних та респіраторних хвороб, розладів та станів. UA 99524 C2 Заявлений винахід стосується сполук загальної формули (1): N OH A H N N N X 10 15 20 25 30 R2 OH (1) (CH2)n Y 1 5 R1 2 у котрій А, Х, Y, n, R та R описані нижче, та способів та проміжних сполук, отримання композицій, що їх містять, та застосування таких похідних. β2-адренергічні агоністи та холінергічні мускаринові антагоністи є добре встановленими терапевтичними агентами для лікування обструктивних респіраторних хвороб, як-то СОРD та астма. Зараз застосовувані інгаляційні β2 агоністи охоплюють короткодіючі агенти, як-то салбутамол (чотири рази на добу) та тербуталін (три рази на добу) та довше діючі агенти, як-то салметерол та формотерол (двічі на добу) та продукують бронходилатацію стимулюванням адренергічних рецепторів на гладеньких м'язах дихальних шляхів. Інгаляційні мускаринові антагоністи у клінічному застосуванні охоплюють короткодіючий іпратропіум бромід (чотири рази на добу), окситропіум бромід (чотири рази на добу) та довгодіючий тіотропіум (q.d.). Мускаринові антагоністи продукують бронходилатацію інгібуванням холінергічного тонусу дихальних шляхів головним чином антагонізувальною дією ацетилхоліну на мускаринові рецептори на гладеньких м'язах дихальних шляхів. Ряд опублікованих досліджень продемонстрували, що комбіноване призначення інгаляційних β 2 агоністів з інгаляційними мускариновими антагоністами (коротко або довгодіючими) пацієнтам з обструктивною хворобою легень має результатом пречудове поліпшення функції легень, симптомів та якості життя вимірює порівняно з пацієнтами, що отримували з будь-яким одиничним класом агенту поодинці. Дослідження зараз обмежені комбінацією досліджень із одиничними фармакологічними агентами, однак комбінація обох фармакологічних агентів в одиничній молекулі могло б бути бажаним, оскільки могло б збільшувати ефективність бронходилататору з терапевтичним індексом, подібним до одиничних агентів, або подібною ефективністю з кращим терапевтичним індексом. На додаток, комбінування обох фармакологічних агентів в одиничній молекулі могло б давати потенціал для комбінації із анти-запальними агентами, таким чином даючи потрійну терапію від одиничного інгалятору. Відповідно, є потреба у альтернативних сполуках, активних як агоністи бета 2 рецепторів та мускаринові антагоністи, придатних для лікування респіраторних хвороб, переважно інгаляцією. Такі сполуки могли б мати прийнятний фармакологічний профіль, наприклад, у термінах потужності, фармакокінетики або тривалості дії. На додаток, оскільки ці сполуки можна застосовувати для лікування хронічних хвороб, як-то астма або СОРD, вони могли б мати низький потенціал взаємодії зі співпризначеними сполуками. Винахід стосується сполук загальної формули (1): 35 N OH A H N N N X Y R1 R2 OH (1) (CH2)n де: А вибрано з групи: * HO * HO HN HO 40 * NHSO2CH3 , HO O , * * HO CH2OH , NHCOH та де * – точка приєднання А до карбону, що має гідрокси; Х – –(СН2)m–, де m– ціле число між 7 та 12 включно, або має формулу: 1 OH UA 99524 C2 (CH2)2 (CH2)2 ; Y вибрано з групи: 5 10 15 20 *** *** * * N , ** N ** N ** * та , де ** та *** – точки приєднання, ** є зв'язком з Х; n=0 або 1; 1 R вибрано з групи: циклопентил, циклогексил, феніл, фураніл та тіофеніл; та 2 R вибрано з групи: феніл, фураніл та тіофеніл; їх або фармацевтично прийнятних солей, або фармацевтично прийнятних сольватів вказаних сполук або солей. Сполуки формули (1) є агоністами β2 адренергічних рецепторів та агоністами мускаринових рецепторів, що є особливо корисними для лікування хвороб та/або станів що залучають вказані рецептори, виявляючи чудову потужність, зокрема, при призначенні інгаляцією. Сполуки формули (1) можна отримувати різними шляхами. Нижченаведені шляхи 1 2 ілюструють один такий шлях отримання сполук, у котрих А, Х, Y, n, R та R є визначеними вище для сполуки формули (1) якщо не визначене інше. Спеціалісту буде зрозуміло, що інші шляхи можуть бути також придатним. (1) Амінопохідне формули (1): R1 N OH A H N N N X Y R2 OH (CH2)n можна отримувати реакцією аміну формули (2): 25 N H2 N N N X Y R1 R2 (2) OH (CH2)n з бромідом формули (3): O 35 40 (3) Br 1 A 30 Si 1 де А – А, захищений придатною фенольною захисною групою, як-то бензил. У типовому способі, амін формули (2) реагує з бромідом формули (3) необов'язково у присутності розчиннику або суміші розчинників (наприклад, диметилсульфоксид, толуєн, N, Nдиметилформамід, пропіонітрил, ацетонітрил, бутиронітрил, дихлорметан), необов'язково у присутності придатної основи (як-то, триетиламін, діізопропілетиламін, калію карбонат, натрію гідрогенкарбонат), при температурі між 80 °C та 120С, протягом 12-72 годин. Захисні групи, якто трет-бутилдиметилсиліл та бензил, можна тоді видаляти, застосовуючи стандартну методологію відщеплювання оксиген-захисних груп, як-то наведених у Т. W. Grееnе, Рrоtесtіvе Grоuрs іn Оrgаnіс Sуnthеsіs (Wіlеу-Іntеrsсіеnсе Рublісаtіоn, 1981). 1 Сполуки формули (3), де А наведено нижче, можна отримувати способами, розкритими у нижченаведених посиланнях: 2 UA 99524 C2 * * * * O NHSO2CH3 US2005171147 HO O US2004224982 ЕР1460064 * NH O HN O O O O O WО2005/092840 US2005222128 Амін формули (2) можна отримувати з відповідно захищеного аміну формули (4): N a R N N N b X R 5 10 а Y R1 R2 OH (4) (CH2)n b де R та R – придатні захисні групи, як-то трет-бутоксикарбоніл, або разом є фталімідом. У типовому способі, амін формули (4) позбавляють захисту, застосовуючи стандартну методологію відщеплювання нітроген-захисних груп, як-то наведених у Т. W. Grееnе, Рrоtесtіvе Grоuрs іn Оrgаnіс Sуnthеsіs (Wіlеу-Іntеrsсіеnсе Рublісаtіоn, 1981). Амін формули (4) можна отримувати реакцією відповідного аміну формули (5): N N N p R1 R2 OH (5) (CH2)n HN q де р та q є незалежно вибраними з 1 або 2, зі сполукою формули (6): a R X LG R 15 20 25 30 35 (6) N b а b де R та R є визначеними вище, а LG – придатна відщеплювана група, як-то бромід або мезилат У типовому способі, амін формули (5) реагує зі сполукою формули (6) у придатному розчиннику (як-то, диметилсульфоксид, толуєн, N,N-диметилформамід, пропіонітрил, ацетонітрил, метилетилкетон), у присутності придатної основи (як-то, триетиламін, діізопропілетиламін) та необов'язково у присутності нуклеофільної добавки (наприклад, натрію йодид) при температурі між 50 °C та 90С, протягом 18-48 годин. На додаток до їх корисності для отримання сполук формули (1), сполуки формули (5) можна також застосовувати як мускаринові антагоністи. Зокрема вони можуть бути корисними для лікування хвороб, котрі можна полегшувати модулюванням активності мускаринового рецептору. Сполуки формули (6), де LG – бромід, можна отримувати реакцією відповідного аміноа b нуклеофілу R R NН із відповідним дибромідом формули (7): Вr – Х - Вr (7) а b У типовому способі, фталімід або ді-трет-бутил імінодикарбоксилат (R R NН) реагує з придатною основою, як-то натрію гідрид (60 % дисперсія в оливі), у придатному розчиннику, якто N,N-диметилформамід або тетрагідрофуран, при температурі між 0С та кімнатною температурою протягом до 1 години, а потім додають дибромід формули (7), при температурі між 0С та 150С, протягом 6-48 годин. а b Аміни формули R R NН є у продажу. Сполуки формули (7), де Х – –(СН2)m- є у продажу. 3 UA 99524 C2 Сполуки формули (7), де Х має формулу: (CH2)2 (CH2)2 5 можна отримувати, як описано у Jоurnаl оf Оrgаnіс Сhеmіstrу, 46(22), 4608-10; 1981. а b Альтернативно, сполуки формули (6), де R та R разом – фталімід, а Х має формулу: (CH2)2 (CH2)2 10 можна отримувати, як описано у схемі 1 нижче: Схема 1 N HO R (9) R a HO b (i) Br R N (8) (10) R a b (ii) LG HO N (6a) 15 20 25 30 35 а R R a (iii) N b (11) b R R a b де R та R разом – фталімід. Сполуки формули (8) та (9) є у продажу. Сполуки формули (10) можна отримувати від сполук формули (8) та (9) реакцією Хека (спосіб етап (і)). Типові умови полягають у реакції сполуки (8) зі сполукою (9), три-отолілфосфіном, паладій(ІІ)ацетатом та придатною основою, як-то діізопропілетиламін, у придатному розчиннику, як-то ацетонітрил, при 90С протягом 21 годин. Сполук формули (11) можна отримувати від сполук формули (10) гідруванням (спосіб етап (іі)). Типові умови полягають у реакції сполуки (10) з амонію форміатом та 30 % паладій гідроксидом на вугіллі, у придатних розчинниках, як-то етилацетат та етанол, при 80 °C протягом 18 годин. Альтернативні умови полягають у реакції сполуки (10) з воднем та родію трис(трифенілфосфін)хлоридом, у придатних розчинниках, як-то етилацетат та етанол, при 20 фунт/кв.дюйм та кімнатною температурою протягом 24 годин. Сполуку формули (6а), де LG – бромід, можна отримувати від сполук формули (11) бромуванням (спосіб етап (ііі)). Типові умови полягають у реакції сполуки (11) із фосфор трибромід, у придатному розчиннику, як-то толуєн, при кип'ятінні під зворотним холодильником протягом 4 годин. Сполук формули (6а), де LG – мезилат, можна отримувати від сполук формули (11) мезилуванням (спосіб етап (ііі)). Типові умови полягають у реакції сполуки (11) із метансульфонілхлоридом, у придатному розчиннику, як-то метилетилкетон, з придатною основою, як-то триетиламін, при 0 °C – кімнатній температурі протягом 1-4 годин. Аміни формули (5) можна отримувати з відповідно захищених амінів формули (12): 4 UA 99524 C2 N N N p c R R1 R2 OH (12) (CH2)n N q с 5 де R – придатна захисна група, як-то трет-бутоксикарбоніл або бензилоксикарбоніл. У типовому способі, амін формули (12) позбавляють захисту, застосовуючи стандартну методологію відщеплювання нітроген-захисної групи, як-то наведених у Т. W. Grееnе, Рrоtесtіvе Grоuрs іn Оrgаnіс Sуnthеsіs (Wіlеу-Іntеrsсіеnсе Рublісаtіоn, 1981). Аміни формули (12) можна отримувати реакцією відповідної сполуки формули (13): LG p c R (CH2)n N (13) q 10 де LG – придатна відщеплювана група, як-то бромід або мезилат, зі сполуками формули (14): R1 N R2 N N H 15 20 (14) OH У типовому способі, сполуки формули (13) реагують зі сполуками формули (14) у придатному розчиннику (як-то, N,N-диметилформамід, пропіонітрил, ацетонітрил, ацетон), у присутності придатної основи (як-то, калію карбонат, цезію карбонат, триетиламін, діізопропілетиламін) при температурі між 70 °C та 150 °C, протягом 5-48 годин. Сполуки формули (13) є у продажу або їх можна отримувати відомими способами. с Зокрема, сполуки формули (13), де R – трет-бутоксикарбоніл, р та q=1 або 2, n=0, а LG є с мезилатом, є у продажу. Сполуки формули (13), де R – трет-бутоксикарбоніл, р та q=1, n=1, а LG є мезилатом, можна отримувати, як описано у U.S. Раt. Аррl. Рubl., 2005101586. Сполуки с формули (13), де R – трет-бутоксикарбоніл, р = 1, q=2, n=1, а LG – бромід або мезилат є у с продажу. Зрештою, сполуки формули (13), де R – трет-бутоксикарбоніл або бензилоксикарбоніл, р та q=2, n=1 та LG – бромід, є у продажу Сполуки формули (14) можна отримувати з відповідних амідів формули (15): O 1 R 2 R (15) NH2 OH 25 30 У типовому способі, сполуки формули (15) реагують з N, N-диметилформаміду диметилацеталем при 90 °C протягом 2 годин. Надлишок N, N-диметилформаміду диметилацеталю видаляють під вакуумом та залишок переганяють з придатним розчинником, як-то толуєн. Гідразин гідрат додають, а потім льодяну оцтову кислоту, та нагрівають при 90 °C протягом 2 годин. Сполуки формули (15) можна отримувати з відповідних кислот формули (16): O 1 R 2 R (16) OH OH 5 UA 99524 C2 5 10 У типовому способі, сполуки формули (16) реагують з карбонілдіімідазолом у придатному розчиннику, як-то дихлорметан або тетрагідрофуран, при кімнатній температурі протягом 1 годин, а потім додають водний 0,880 розчин аміаку при кімнатній температурі протягом 18 годин. Сполуки формули (16) та їх відповідні одиничні енантіомери, як прийнятні, є у продажу, відомі у літературі, їх можна отримувати, як описано у літературі, або способами, аналогічними описаним у літературі. Приклади літератури охоплюють, але без обмеження: WО2002/053564, WО2006/048225, WО2001/04118, WО2003/057694, WО2004/052857, WО96/33973, Jоurnаl оf Оrgаnіс Сhеmіstrу, 46(14), 2885-9; 1981, Jоurnаl оf Оrgаnіс Сhеmіstrу (1961), 26, 1573-7, Сhіmіса Тhеrареutіса (1966), (4), 238-45 та Jоurnаl оf Меdісіnаl Сhеmіstrу, 44(20), 3244-3253; 2001. Наприклад, сполуку формули (16а): O OH (16а) OH 15 продають як (2R)-2-циклогексил-2-гідрокси-2-фенілоцтову кислоту. Альтернативно, сполуки формули (14) можна отримувати з відповідних сполук формули (17): N N N N 20 R1 R2 OH (17) У типовому способі, сполуки формули (17) реагують із натрію борогідридом у придатному розчиннику, як-то етанол, при кип'ятінні під зворотним холодильником, протягом 3 годин. Сполуки формули (17) можна отримувати реакцією сполук формули (18): N (18) N N N зі сполуками формули (19): 25 R1 R2 (19) O 30 35 У типовому способі, сполука формули (18) реагує з придатною основою, як-то n-бутиллітій, у придатному розчиннику, як-то тетрагідрофуран, при температурі між -78 °C та кімнатною температурою протягом 1 годин, а потім додають сполуки формули (19) у тетрагідрофурані при температурі між -78 °C та кімнатною температурою протягом 18 годин. Сполуки формули (18) можна отримувати, як описано у Теtrаhеdrоn: Аsуmmеtrу, 8(9), 14911500; 1997. Сполуки формули (19) є у продажу, їх можна отримувати, як описано у літературі, або способами, аналогічними описаним у літературі. Приклади літератури охоплюють, але без обмеження: Теtrаhеdrоn Lеttеrs, 49(11), 1884-1888; 2008; Теtrаhеdrоn Lеttеrs, 46(44), 7627-7630; 2005 Sуnthеsіs, (13), 1970-1978; 2007; Jоurnаl оf Оrgаnіс Сhеmіstrу, 55(4), 1286-91; 1990; U.S. 5969159; Теtrаhеdrоn Lеttеrs, 47(10), 1649-1651; 2006; Jоurnаl оf Сhеmісаl Rеsеаrсh, Sуnорsеs, (9), 280-1; 1984; Sуnthеsіs, (3), 242-3; 1991; Jоurnаl оf Сhеmісаl Sосіеtу, Реrkіn Тrаnsасtіоns 2: Рhуsісаl 6 UA 99524 C2 5 10 Оrgаnіс Сhеmіstrу (1972-1999), (11), 1741-51; 1989; та Sуnthеtіс Соmmunісаtіоns, 34(23), 42494256; 2004. Препарат сполуки формули (1) може потребувати захисту потенційно хімічно активної функціональної групи на додаток до вже описаних способів. У такому випадку, приклади сумісних захисних груп та певних способів захисту та зняття захисту є описаними у "Рrоtесtіng Grоuрs іn Оrgаnіс Sуnthеsіs" Т.W. Grееnе та Р. Wutz (Wіlеу-Іntеrsсіеnсе Рublісаtіоn, 1981) або "Рrоtесtіng Grоuрs" Р. J. Косіеnskі (Gеоrg Тhіеmе Vеrlаg, 1994). Сполуки формули (1), а також проміжні сполуки для їх отримання можна очищати та виділяти добре відомими способами, наприклад, кристалізацією або хроматографією. Підгрупи сполук формули (1), що містять нижченаведені замісники, або комбінації нижченаведених замісників, є кращими: Переважно, А має формулу: * HO HN O 15 де * – точка приєднання А до карбону, що має гідроксил. Переважно, Х – (СН2)9 або має формулу: (CH2)2 (CH2)2 . 20 У кращому втіленні, Х – (СН2)9. У ще одному кращому втіленні, Х має формулу: (CH2)2 (CH2)2 . 25 Переважно, Y має формулу: ** N 30 35 ** * де ** та *** – точки приєднання, ** є зв'язком з Х. 1 Переважно, R – феніл або циклогексил. 2 Переважно, R – феніл. Переважно, n=1. 1 2 Коли R та R є різними, атом карбону, що несе ці два замісники може бути у (R) або (S)1 2 1 2 конфігурації. Переважно, атом карбону, що несе R та R , є у (R)-конфігурації, коли R та R є різними. Сполуки формули (1) де: А має формулу: * HO HN O 40 де * – точка приєднання А до карбону, що має гідроксил; 7 UA 99524 C2 Х – -(СН2)9- або має формулу: (CH2)2 (CH2)2 ; 5 Y має формулу: ** N ** * , 10 15 20 25 30 35 40 45 50 55 де ** та *** – точки приєднання, ** є зв'язком з Х; n=1; 1 2 R – циклогексил або феніл та R – феніл; або їх фармацевтично прийнятні солі, або фармацевтично прийнятні сольвати вказаних сполук або солей, є ще кращими. Нижченаведені сполуки є більш кращими: 5-[(1R)-2-({9-[4-({3-[(R)-циклогексил(гідрокси)фенілметил]-1Н-1,2,4-триазол-1іл}метил)піперидин-1-іл]ноніл}аміно)-1-гідроксіетил]-8-гідроксихінолін2(1Н)-он, 5-[(1R)-2-({9-[4-({3-[(R)-циклогексил(гідрокси)фенілметил]-1Н-1,2,4-триазол-1іл}метил)піперидин-1-іл]ноніл}аміно)-1-гідроксіетил]-8-гідроксихінолін2(1Н)-он нафталін-1,5дисульфонат, 5-[(1R)-2-{[2-(4-{2-[4-({3-[(R)-циклогексил(гідрокси)фенілметил]-1Н-1,2,4-триазол-1іл}метил)піперидин-1-іл]етил}феніл)етил]аміно}-1-гідроксіетил]-8-гідроксихінолін2(1Н)-он, 5-[(1R)-2-{[2-(4-{2-[4-({3-[(R)-циклогексил(гідрокси)фенілметил]-1Н-1,2,4-триазол-1іл}метил)піперидин-1-іл]етил}феніл)етил]аміно}-1-гідроксіетил]-8-гідроксихінолін2(1Н)-он нафталін-1,5-дисульфонат, 5-[(1R)-2-{[2-(4-{2-[4-({3-[(R)-циклогексил(гідрокси)фенілметил]-1Н-1,2,4-триазол-1іл}метил)піперидин-1-іл]етил}феніл)етил]аміно}-1-гідроксіетил]-8-гідроксихінолін2(1Н)-он сукцинат, 5-[(1R)-2-{[2-(4-{2-[4-({3-[(R)-циклогексил(гідрокси)фенілметил]-1Н-1,2,4-триазол-1іл}метил)піперидин-1-іл]етил}феніл)етил]аміно}-1-гідроксіетил]-8-гідроксихінолін2(1Н)-он фумарат, 5-[(1R)-2-({9-[4-({3-[циклогексил(гідрокси)фенілметил]-1Н-1,2,4-триазол-1іл}метил)піперидин-1-іл]ноніл}аміно)-1-гідроксіетил]-8-гідроксихінолін2(1Н)-он, 8-гідрокси-5-[(1R)-1-гідрокси-2-({9-[4-({3-[гідрокси(дифеніл)метил]-1Н-1,2,4-триазол-1іл}метил)піперидин-1-іл]ноніл}аміно)етил]хінолін-2(1Н)-он, та 8-гідрокси-5-[(1R)-1-гідрокси-2-{[2-(4-{2-[4-({3-[гідрокси(дифеніл)метил]-1Н-1,2,4-триазол-1іл}метил)піперидин-1-іл]етил}феніл)етил]аміно}етил]хінолін2(1Н)-он. 5-[(1R)-2-{[2-(4-{2-[4-({3-[(R)-циклогексил(гідрокси)фенілметил]-1Н-1,2,4-триазол-1іл}метил)піперидин-1-іл]етил}феніл)етил]аміно}-1-гідроксіетил]-8-гідроксихінолін2(1Н)-он є ще більш кращим. 5-[(1R)-2-{[2-(4-{2-[4-({3-[(R)-циклогексил(гідрокси)фенілметил]-1Н-1,2,4-триазол-1іл}метил)піперидин-1-іл]етил}феніл)етил]аміно}-1-гідроксіетил]-8-гідроксихінолін2(1Н)-он нафталін-1,5-дисульфонат є найкращим. Фармацевтично прийнятні солі сполук формули (1) охоплюють кислотно-адитивні солі та солі їх основ. Придатну кислотно-адитивну сіль утворюють з кислотами, котрі утворюють нетоксичну сіль. Приклади охоплюють ацетат, аспартат, бензоат, безилат, гідрогенкарбонат/карбонат, бісульфат/сульфат, борат, камзилат, цитрат, едизилат, езилат, форміат, фумарат, глюцептат, глюконат, глюкуронат, гексафлуорфосфат, гібензат, гідрохлорид/хлорид, гідробромід/бромід, гідройодид/йодид, ізетіонат, лактат, малат, малеат, малонат, мезилат, метилсульфат, нафтилат, 1,5-нафталіндисульфонат, 2-напзилат, нікотинат, нітрат, оротат, оксалат, пальмітат, памоат, фосфат/гідрогенфосфат/дигідрогенфосфат, сахарат, стеарат, сукцинат, тартрат, тозилат та трифлуорацетат. Придатну сіль основи утворюють від основ, котрі утворюють нетоксичну сіль. Приклади охоплюють алюміній, аргінін, бензатин, кальцій, холін, діетиламін, діоламін, гліцин, лізин, магній, меглумін, оламін, калій, натрій, трометамін та цинк. Гемісолі кислот та основ можна утворювати також, наприклад, сіль 8 UA 99524 C2 5 10 15 20 25 30 35 40 45 50 55 60 гемісульфату та гемікальцію. Для огляду придатних солей, дивись "Наndbооk оf Рhаrmасеutісаl Sаlts: Рrореrtіеs, Sеlесtіоn, аnd Usе" Stаhl та Wеrmuth (Wіlеу-VСН, Wеіnhеіm, Gеrmаnу, 2002). Фармацевтично прийнятні солі сполук формули (1) можна отримувати одним або більше з трьох способів: (і) реакцією сполук формули (1) з потрібною кислотою або основою; (іі) видаленням кислотно- або основно-лабільної захисної групи від придатного попереднику сполуки формули (1) або відкриттям циклу придатного циклічного попереднику, наприклад, лактону або лактаму, застосовуючи потрібну кислот або основ; або (ііі) перетворенням одної солі сполуки формули (1) у ще одну реакцією з прийнятною кислотою або основою або за допомогою придатної іонообмінної колонки. Усі три реакції звичайно проводять у розчині. Утворену сіль можна осаджувати та збирати фільтруванням, або можна отримувати випарюванням розчиннику. Ступінь іонізації утвореної солі може варіювати від повністю іонізованого до майже неіонізованого. Сполуки винаходу можуть існувати у несольватованій та сольватованій формах. Термін "сольват" описує молекулярний комплекс, що містить сполуку винаходу або її сіль та стехіометричну кількість одної або більше молекул фармацевтично прийнятного розчиннику, наприклад, етанолу. Термін "гідрат" застосовують, коли вказаним розчинником є вода. Охопленими у рамках винаходу є комплекси, як-то клатрати, ліки-носій комплекси включення, де на відміну від вищезгаданих сольватів, ліки та носій є у стехіометричній або нестехіометричній кількості. Також охопленими є комплекси ліків, що містять два або більше органічних та/або неорганічних компонентів, що можуть бути у стехіометричній або нестехіометричній кількості. Утворені комплекси можуть бути іонізованими, частково іонізованими, або іонізованими. Для огляду таких комплексів, дивись J Рhаrm Sсі, 64 (8), 12691288 Наlеblіаn (Аugust 1975). Далі усі посилання на сполуки формули (1) охоплюють посилання на їх солі, сольвати та комплекси та сольвати та комплекси їх солей. Сполуки винаходу охоплюють сполуки формули (1), які визначені перед тим, охоплюючи усі їх поліморфи та кристалічні форми, їх проліки та ізомери (охоплюючи оптичні, геометричні та таутомерні ізомери), які далі визначено, та мічені ізотопами сполуки формули (1). Як позначено, так звані "про-ліки" сполук формули (1) є також у рамках винаходу. Таким чином певні похідні сполук формули (1), що можуть мати невелику фармакологічну активність або не мати її, можуть при призначенні перетворюватися в організмі у сполуки формули (1), що мають потрібну активність, наприклад, гідролітичним розщеплюванням. Такі похідні називають "проліки". Наступну інформацію про застосування проліків можна знайти у "Рrо-drugs аs Nоvеl Dеlіvеrу Sуstеms, Vоl. 14, АСS Sуmроsіum Sеrіеs (Т. Ніguсhі та W. Stеllа) та "Віоrеvеrsіblе Саrrіеrs іn Drug Dеsіgn", Реrgаmоn Рrеss, 1987 (еd. Е. В Rосhе, Аmеrісаn Рhаrmасеutісаl Аssосіаtіоn). Проліки згідно з винаходом можуть, наприклад, бути продукованими заміщенням прийнятних функціональних груп у сполуках формули (1) певними групами, відомими спеціалісту як "про-групи", як описано, наприклад, у "Dеsіgn оf Рrоdrugs" Н. Вundgааrd (Еlsеvіеr, 1985). Деякі приклади проліків згідно з винаходом охоплюють ті, (і) де сполука формули (1) містить спиртову функціональну групу (-ОН), її етер, наприклад, сполука, де гідроген спиртової функціональної групи сполуки формули (1) заміщено на (С 1С6)алканоїлоксиметил; та (іі) де сполука формули (1) містить первинну або вторинну аміно-функціональну групу (-NН2 або -NНR, де R ≠ Н), її амід, наприклад, сполука, де один або обидва гідрогени амінофункціональної групи сполуки формули (1) може бути заміщеним (С 1-С10)алканоїлом. Наступні приклади заміщення групи згідно з вищезгаданими прикладами та прикладами інших типів проліків можна знайти у вищезгаданих посиланнях. Більш того, певні сполуки формули (1) можуть самі діяти як проліки інших сполук формули (1). Також охопленими у рамках винаходу є метаболіти сполук формули (1), що є сполуками, утвореними іn vіvо після призначення ліків. Деякі приклади метаболітів згідно з винаходом охоплюють ті, (і) де сполука формули (1) містить метил, його гідроксиметильне похідне (-СН3 -СН2ОН): (іі) де сполука формули (1) містить алкоксигрупу, її гідроксипохідне (-ОR -ОН); 1 2 (ііі) де сполука формули (1) містить третинну аміногрупу, вторинне аміно похідне (-NR R 1 2 NНR або -NНR ); 1 (іv) де сполука формули (1) містить вторинну аміногрупу, її первинне похідне (-NНR NН2); 9 UA 99524 C2 5 10 15 20 25 30 35 40 45 50 55 (v) де сполука формули (1) містить феніл, його фенольне похідне (-Рh -РhОН); та (vі) де сполука формули (1) містить амідогрупу, її карбоново-кислотне похідне (-СОNН2 СООН). 1 2 Сполуки формули (1), де R та R є різними, можуть існувати як стереоізомери. Де структурні ізомери взаємоперетворюваними внаслідок низького енергетичного бар'єру, може відбуватися таутомерна ізомерія ("таутомерія"). Це може мати форму протонної таутомерії у сполуках формули (1), що містять, наприклад, іміно, кето, або оксимогрупу, або так званої валентної таутомерії у сполуках, що містять ароматичну груп. Це означає, що одинична сполука може виявляти більше, ніж один тип ізомерії. Зокрема, заявлений винахід стосується сполук формули (1), де триазол-група може бути як різні регіо-ізомери. Охопленими у рамках заявленого винаходу є усі стереоізомери та таутомери сполук формули (1), охоплюючи сполуки, що виявляють більше, ніж один тип ізомерії, та суміші одної або більше їх. Також охопленими є кислотно-адитивні солі або солі основ, де протиіон є оптично активним, наприклад, d-лактат або l-лізин, або рацемічними, наприклад, dl-тартрат або dlаргінін. Звичайні способи отримання/виділення індивідуальних енантіомерів охоплюють хіральний синтез з придатного оптично чистого попереднику або розділення рацемату (або його солі або похідного), застосовуючи, наприклад, хіральну високоефективну рідинну хроматографію (ВЕРХ). Альтернативно, рацемат (або рацемічний попередник) може реагувати з придатною оптично активною сполукою, як-то, спирт, або у випадку, де сполука формули (1) містить кислотну або основну групу, кислоти або основи, як-то винна кислота або 1-фенілетиламін. Утворену діастереомерну суміш можна відокремлювати хроматографією та/або фракційною кристалізацією та один або обидва діастереоізомери перетворювати у відповідні чисті енантіомери добре відомими способами. Хіральні сполуки винаходу (та їх хіральні попередники) можна отримувати у енантіомернозбагаченій формі, застосовуючи хроматографію, звичайно ВЕРХ, на асиметричній смолі з мобільною фазою, що складається з вуглеводню, звичайно гептану або гексану, що містить 0-50 об% ізопропанолу, звичайно 2-20 %, та 0-5 об% алкіламіну, звичайно 0,1 % діетиламіну. Концентрація елюату дає збагачену суміш. Стереоізомерні суміші можна відокремлювати звичайними відомими способами - дивись, наприклад, "Stеrеосhеmіstrу оf Оrgаnіс Соmроunds" Е. L. Еlіеl (Wіlеу, Nеw Yоrk, 1994). Заявлений винахід стосується усіх фармацевтично прийнятних мічених ізотопами сполук формули (1), де один або більше атомів заміщені атомами, що мають те ж атомне число, але атомну масу або масове число, відмінні від атомної маси або масового числа, що є переважними у природі. Приклади ізотопів, придатних для включення у сполуки винаходу, охоплюють ізотопи 2 3 11 13 14 13 15 гідрогену, як-то Н та Н, карбону, як-то С, С та С, нітрогену, як-то N та N, оксигену, як-то 15 17 18 35 О, О та О, та сульфуру, як-то S. Певні мічені ізотопами сполуки формули (1), наприклад, з уведеним радіоактивним ізотопом, є корисними у дослідженнях ліків та/або розподілу субстратів тканин. Радіоактивні ізотопи 3 14 тритій, тобто Н, та карбон-14, тобто С, є особливо корисними для цього. 2 Заміщення важчими ізотопами, як-то дейтерій, тобто Н, може дати певні терапевтичні переваги від більшої метаболічної стабільності, наприклад, збільшеного іn vіvо періоду напівперетворення або зменшеного дозування, та можуть бути кращими у деяких випадках. 11 15 13 Заміщення позитрон-емітувальними ізотопи, як-то С, О та N, можуть бути корисними у дослідженнях позитрон-емісійної томографії (РЕТ) для контролю заповненості рецептору субстрату. Мічені ізотопами сполуки формули (1) можна загалом отримувати звичайними відомими способами або способами, аналогічними описаним у прикладах та отриманнях, застосовуючи прийнятні мічені ізотопами реагенти замість немічених перед тим застосовуваних реагентів. Фармацевтично прийнятні сольвати згідно з винаходом охоплюють ті, де розчинник кристалізації може бути заміщеним ізотопами, наприклад, D2О, d6-ацетон, d6-ДМСО. Сполуки формули (1), їх фармацевтично прийнятні солі та/або фармацевтично прийнятні сольвати вказаних сполук або солей, є цінними фармацевтично активними сполуками, котрі є придатними для терапії та профілактики ряду розладів, у котрих є задіяними β2 рецептор та/або мускариновий рецептор. Зокрема, ці сполуки є корисними для терапії та профілактики ряду розладів, у котрих агонізм β2 рецептору та антагонізм мускаринового рецептору можуть індукувати користь, зокрема алергічних та неалергічних хвороб дихальних шляхів. 10 UA 99524 C2 5 10 15 20 25 30 35 40 45 50 55 60 Сполуки винаходу для фармацевтичного застосування можна призначати як кристалічні або аморфні продукти. Їх можна отримувати, наприклад, як тверді матеріали, порошки, або плівки способами, як-то осадження, кристалізація, сушіння сублімуванням, сушіння розпиленням, або сушіння випарюванням. Мікрохвильове або радіочастотне сушіння можна застосовувати для цього. Їх можна призначати поодинці або у комбінації з одною або більше іншими сполуками винаходу або у комбінації з одними або більше іншими ліками. Загалом, їх слід призначати як композицію в асоціації з одним або більше фармацевтично прийнятними наповнювачами. Термін "наповнювач" описує будь-який інгредієнт інший, ніж сполуки винаходу. Вибір наповнювачу залежатиме від факторів, як-то конкретний режим призначення, дія наповнювачу на розчинність та стабільність, та природа дозованої форми. Фармацевтичні композиції, придатні для доставляння сполук заявленого винаходу та способи їх отримання очевидні спеціалісту. Такі композиції та способи їх отримання можна знайти, наприклад, у "Rеmіngtоn's Рhаrmасеutісаl Sсіеnсеs", 19th Еdіtіоn (Масk Рublіshіng Соmраnу, 1995). Сполуки винаходу можна призначати перорально. Пероральне призначення може задіювати жування для входження у шлунково-кишковий тракт, або можна застосовувати букальне або лінгвальне призначення, коли сполука потрапляє у потік крові безпосередньо з рота. Композиції, придатні для перорального призначення, охоплюють тверді композиції, як-то таблетки, капсули, що містять частинки, рідини, або порошки, пастилки (охоплюючи заповнені рідиною), жуйки, багато- та нано-частинки, гелі, твердий розчин, ліпосоми, плівки, спреї та рідкі композиції. Рідкі композиції охоплюють суспензії, розчини, сиропи та еліксири. Такі композиції можна застосовувати як наповнювачі у м'яких або твердих капсулах та звичайно містять носій, як-то, вода, етанол, поліетиленгліколь, пропіленгліколь, метилцелюлоза або придатна олива, та один або більше емульгаторів та/або суспендувальних агентів. Рідкі композиції можна також отримувати відтворюванням твердого матеріалу, наприклад, з пакетику. Сполуки винаходу можна також застосовувати у швидкорозчинованих, швидкодезинтегровних дозованих формах, як-то описаних у Ехреrt Оріnіоn у Тhеrареutіс Раtеnts, 11 (6), 981-986, Lіаng та Сhеn (2001). Для дозованих форм таблеток, залежно від дози, ліки можуть складати від 1 мас% до 80 мас% дозованої форми, більш звичайно від 5 мас% до 60 мас% дозованої форми. На додаток до ліків, таблетки загалом містять дезинтегратор. Приклади дезинтеграторів охоплюють натрію крохмаль гліколят, натрію карбоксиметилцелюлозу, кальцію карбоксиметилцелюлозу, натрію кроскармелозу, кросповідон, полівінілпіролідон, метилцелюлозу, мікрокристалічну целюлозу, нижчу алкіл-заміщену гідроксипропілцелюлозу, крохмаль, пептизований крохмаль та натрію альгінат. Загалом, дезинтегратор міститиме від 1 мас% до 25 мас%, переважно від 5 мас% до 20 мас% дозованої форми. Зв'язуючі є загалом застосовуваними для надавання зчеплювальних властивостей композиції таблеток. Придатні зв'язуючі охоплюють мікрокристалічну целюлозу, желатин, цукри, поліетиленгліколь, природні та синтетичні камеді, полівінілпіролідон, пептизований крохмаль, гідроксипропілцелюлозу та гідроксипропілметилцелюлозу. Таблетки можуть також містити розріджувачі, як-то лактоза (моногідрат, висушений розпиленням моногідрат, безводну тощо), манітол, ксилітол, декстроза, цукроза, сорбітол, мікрокристалічна целюлоза, крохмаль та двоосновного кальцію фосфату дигідрат. Таблетки можуть також необов'язково містити поверхнево-активні агенти, як-то натрію лаурилсульфат та полісорбат 80, та гліданти, як-то силіцію діоксид та тальк. При наявності поверхнево-активні агенти можуть містити від 0,2 мас% до 5 мас% таблетки, та гліданти можуть містити від 0,2 мас% до 1 мас% таблетки. Таблетки також загалом містять лубриканти, як-то магнію стеарат, кальцію стеарат, цинк стеарат, натрію стеарил фумарат, та суміші магнію стеарату із натрію лаурилсульфатом. Лубриканти загалом містять від 0,25 мас% до 10 мас%, переважно від 0,5 мас% до 3 мас% таблетки. Інші можливі інгредієнти охоплюють анти-оксиданти, барвники, смакові агенти та консерванти. Зразкові таблетки містять до 80 % ліків, приблизно від 10 мас% до 90 мас% зв'язуючого, приблизно від 0 мас% до 85 мас% розріджувачу, приблизно від 2 мас% до 10 мас% дезинтегратору та приблизно від 0,25 мас% до 10 мас% лубриканту. Суміші для таблеток можна пресувати безпосередньо або валком у таблетки. Суміші для таблеток або частини суміші можуть альтернативно бути волого-, сухо- гранульованими, або 11 UA 99524 C2 5 10 15 20 25 30 35 40 45 50 55 60 гранульованими плавленням. Кінцева композиція може містити один або більше шарів та може бути покритою або непокритою; може навіть бути інкапсульованою. Композиції таблеток обговорено у Рhаrmасеutісаl Dоsаgе Fоrms: Таblеts, Vоl. 1, Н. Lіеbеrmаn та L. Lасhmаn (Маrсеl Dеkkеr, Nеw Yоrk, 1980). Витрачувані пероральні плівки для застосування для людини або для ветеринарного застосування є звичайно водорозчинними або водонабрякаючими тонкоплівковими дозованими формами, котрі можуть бути швидко розчинюваними або мукоадгезивними та звичайно містять сполуку формули (1), плівкотвірний полімер, зв'язуюче, розчинник, пластифікатор, стабілізатор або емульгатор, модифікатор в'язкості та розчинник. Сполука формули (1) може бути водорозчинною або нерозчинною. Водорозчинна сполука звичайно складає від 1 мас% до 80 мас%, більш звичайно від 20 мас% до 50 мас%, розчину. Менш розчинні сполуки можуть складати більшу пропорцію композиції, звичайно до 88 мас% розчиненої речовини. Альтернативно, сполука формули (1) може бути у формі кульок. Плівкотвірний полімер може бути вибраним з природних полісахаридів, білків, або синтетичних гідроколоїдів та є звичайно у межах 0,01-99 мас%, більш звичайно у межах 30-80 мас%. Інші можливі інгредієнти охоплюють анти-оксиданти, барвники та смакові агенти консерванти, агенти стимулювання слини, охолоджувачі, співрозчинники (охоплюючи олії), пом'якшувачі, антиспінювачі, та сурфактанти. Плівки згідно з винаходом звичайно отримують сушінням випарюванням покритих тонкою водною плівкою підкладки або паперу. Це можна робити у сушильній шафі, або сушінням сублімуванням або вакуумуванням. Тверді композиції для перорального призначення можна складати для негайного та/або модифікованого вивільнення. Композиції з модифікованим вивільненням охоплюють композиції з відстроченим, тривалим, імпульсним, контрольованим, цільовим та програмованим вивільненням. Придатні композиції з модифікованим вивільненням винаходу є описаними у US Раtеnt № 6,106,864. Деталі інших придатних режимів вивільнення, як-то високо-енергетичні дисперсії та осмотичні та покриті частинки можна знайти у Рhаrmасеutісаl Тесhnоlоgу Оn-lіnе, 25(2), 1-14, Vеrmа еt аl (2001). Застосування жувальної гумки для досягнення контрольованого вивільнення описано у WО 00/35298. Сполуки винаходу можна також призначати безпосередньо у кровотік, у м'язи, або у внутрішній орган. Придатні засоби для парентерального призначення охоплюють внутрішньовенні, інтраартеріальні, інтраперитонеальні, інтратекальні, інтравентрикулярні, інтрауретральні, інтрастернальні, інтракраніальні, внутрішньом'язові та підшкірні. Придатні пристрої для парентерального призначення охоплюють голки (охоплюючи мікроголки) ін'єктори, безголкові ін'єктори та способи вливання. Парентеральні композиції є звичайно водними розчинами, що можуть містити наповнювачі, як-то солі, вуглеводи та буферувальні агенти (переважно для рН від 3 до 9), але, для деяких застосовувань, їх можна більш належно складати як стерильні неводні розчини або як висушені форми для застосування разом з придатним носієм, як-то стерильна, піроген-вільна вода. Отримання парентеральних композицій у стерильних умовах, наприклад, ліофілізацією, можна легко досягти добре відомими стандартними фармацевтичними способами. Розчинність сполук формули (1), застосовуваних у отриманні парентеральних розчинів можна збільшувати застосуванням прийнятних способів композиції, як-то уведення агентів посилення розчинності. Композиції для парентерального призначення можна складати для негайного та/або модифікованого вивільнення. Композиції з модифікованим вивільненням охоплюють композиції з відстроченим, тривалим, імпульсним, контрольованим, цільовим та програмованим вивільненням. Таким чином сполуки винаходу можна складати як тверді, напівтверді, або тиксотропні рідини для призначення як імплантованого депо, що забезпечує модифіковане вивільнення активної сполуки. Приклади таких композицій охоплюють покриті ліками стенти та мікросфери полі(dl-молочно-гліколевої) кислоти (РGLА). Сполуки винаходу можна також призначати місцево до шкіри чи слизової, дермально або трансдермально. Типові композиції для цього охоплюють гелі, гідрогелі, лосьйони, розчини, креми, мазі, дрібні порошки, пінки, плівки, шкірні пластири, імплантати, губки, волокна, бандажі та мікроемулсії. Ліпосоми можна застосовувати також. Типові носії охоплюють спирт, воду, мінеральну оливу, рідкий вазелін, білий вазелін, гліцерин, поліетиленгліколь та пропіленгліколь. Посилювачі проникнення можна уводити - дивись, наприклад, J Рhаrm Sсі, 88 (10), 955-958 Fіnnіn та Моrgаn (Осtоbеr 1999). 12 UA 99524 C2 5 10 15 20 25 30 35 40 45 50 55 60 Інші засоби місцевого призначення охоплюють доставляння електропорацією, іонофорезом, фонофорезом, сонофорезом та мікроголковими або безголковими (наприклад, Роvdеrjесt™, Віоjесt™, тощо) ін'єкціями. Композиції для місцевого призначення можна складати для негайного та/або модифікованого вивільнення. Композиції з модифікованим вивільненням охоплюють композиції з відстроченим, тривалим, імпульсним, контрольованим, цільовим та програмованим вивільненням. Сполуки винаходу можна також призначати інтраназально або інгаляцією, звичайно у формі сухого порошку (поодинці, як суміш, наприклад, у сухій суміші із лактоза, або як змішані частинки компоненту, наприклад, змішані з фосфоліпідами, як-то фосфатидилхолін) з інгалятору сухого порошку або як аерозольний спрей з контейнера під тиском, насосу, спрею, пульверизатору (переважно електрогідродинамічного пульверизатору для продукування дрібного туману), або розпилювачу, із або без застосування придатного пропеленту, як-то 1,1,1,2-тетрагфлуоретан або 1,1,1,2,3,3,3-гептафлуорпропан. Для інтраназального застосування, порошок може містити біоадгезивний агент, наприклад, хітозан або циклодекстрин. Контейнер під тиском, насос, спрей, пульверизатор, або розпилювач містить розчин або суспензію сполуки винаходу, що містить, наприклад, етанол, водний етанол, або придатний альтернативний агент для диспергування, солюбілізування або подовження вивільнення активного компоненту, пропеленти як розчинник та необов'язково сурфактант, як-то сорбітан триолеат, олеїнова кислота або олігомолочна кислота. Перед застосуванням у композиції сухого порошку або суспензії ліки мікронізують до розміру, придатного для доставляння інгаляцією (звичайно менше, ніж 5 мікрон). Цього можна досягти будь-яким прийнятним способом подрібнення або сушінням розпиленням. Капсули (отримані, наприклад, з желатину або гідроксипропілметилцелюлози), блістери та ампули для застосування в інгаляторі або апараті для вдування можна складати з вмістом порошку сполуки винаходу, придатної порошкової основи, як-то лактоза або крохмаль, та модифікатору, як-то l-лейцин, манітол, або магнію стеарат. Лактоза може бути безводною або у формі моногідрату. Інші придатні наповнювачі охоплюють декстран, глюкозу, мальтозу, сорбітол, ксилітол, фруктозу, сахарозу та трегалозу. Придатні композиції розчину для застосування у розпилювачі, застосовуючи електрогідродинаміку для продукування дрібного туману можуть містити від 1 мкг до 20 мг сполуки винаходу на спрацьовування та об'єм спрацьовування може варіювати від 1 мкл до 100 мкл. Типова композиція може містити сполуку формули (1), пропіленгліколь, стерильну воду, етанол та натрію хлорид. Альтернативні розчинники, що можна застосовувати замість пропіленгліколю охоплюють гліцерин та поліетиленгліколь. Придатні смакові агенти, як-то ментол та левоментол, або підсолоджувачі, як-то сахарин або сахарин натрію, можна додавати до композиції винаходу для інгаляційного/інтраназального призначення. Композиції для інгаляційного/інтраназального призначення можна складати для негайного та/або модифікованого вивільнення, застосовуючи, наприклад, РGLА. Композиції з модифікованим вивільненням охоплюють композиції з відстроченим, тривалим, імпульсним, контрольованим, цільовим та програмованим вивільненням. У випадку інгаляторів сухого порошку та аерозолів, одиницю дозування визначають за допомогою попередньо заповненої капсули або блістеру. Одиниці згідно з винаходом є звичайно пристосованими для виміряної дози, що містить 1-5000 мкг сполуки, або її солі. Загальна добова доза повинна звичайно бути у межах 1 мкг – 20 мг, її можна призначати у одиничній дозі або, більш загально, як роздільні дози протягом доби. Сполуки формули (1) є особливо придатними для призначення інгаляцією, зокрема, застосовуючи інгалятор сухого порошку. Сполуки винаходу можна призначати ректально або вагінально, наприклад, у формі супозиторію, песарію або клізми. Масло какао є традиційною основою супозиторію, але можна застосовувати різні альтернативи. Композиції для ректального/вагінального призначення можна складати для негайного та/або модифікованого вивільнення. Композиції з модифікованим вивільненням охоплюють композиції з відстроченим, тривалим, імпульсним, контрольованим, цільовим та програмованим вивільненням. Сполуки винаходу можна також призначати безпосередньо до ока або вуха, звичайно у формі крапель мікронізованої суспензії або розчину в ізотонічному, рН-доведеному, стерильному фізіологічному розчині. Інші композиції, придатні для окулярного та вушного 13 UA 99524 C2 5 10 15 20 25 30 35 40 45 50 55 призначення охоплюють мазі, біодеградовувані та небіодеградовувані імплантати та частинки або везикулярні системи, як-то ніосоми або ліпосоми. Полімер, як-то перехресно-зв'язана поліакрилова кислота, полівініловий спирт, гіалуронова кислота, полімер целюлози, як-то, гідроксипропілметилцелюлоза, гідроксіетилцелюлоза, або метилцелюлоза, або полімер гетерополісахариду, як-то, геланова камедь, можна уводити разом з консервантом, як-то бензалконію хлорид. Такі композиції можна також доставляти іонофорезом. Композиції для окулярного/вушного призначення можна складати для негайного та/або модифікованого вивільнення. Композиції з модифікованим вивільненням охоплюють композиції з відстроченим, тривалим, імпульсним, контрольованим, цільовим та програмованим вивільненням. Сполуки винаходу можуть бути комбінованими із розчинними макромолекулярними компонентами, як-то циклодекстрин та його придатне похідне, або його поліетиленглікольвмісними полімерами, для поліпшення їх розчинності, швидкості розчинення, біозасвоюваності та/або стабільності для застосування будь-яким з вищезгаданих режимів призначення. Ліки-циклодекстрин-комплекси, наприклад, знаходять як загалом корисні для більшості дозованих форм та шляхів призначення. Можна застосовувати комплекси включення та невключення. Як альтернативу безпосередньому комплексуванню з ліками можна застосовувати циклодекстрин як носій, розріджувач, або солюбілізатор. Найбільш застосовуваними для цього є альфа-, бета- та гамма-циклодекстрини, приклади яких можна знайти у Іntеrnаtіоnаl Раtеnt Аррlісаtіоns № WО 91/11172, WО 94/02518 та WО 98/55148. Оскільки може бути бажаним призначення комбінації активних сполук, наприклад, для лікування конкретної хвороби або стану, у рамках заявленого винаходу є те, що дві або більше фармацевтичних композицій, принаймні одна з котрих містить сполуку згідно з винаходом, можуть зручно бути комбінованими у формі комплекту, придатного для співпризначення композицій. Таким чином комплект винаходу містить дві або більше окремих фармацевтичних композицій, принаймні одна з котрих містить сполуку формули (1) згідно з винаходом, та засоби для окремого зберігання вказаних композицій, як-то контейнер. Прикладом такого комплекту є звичайна блістерна упаковка для пакування таблеток, капсул тощо. Комплект винаходу є особливо придатним для призначення різних дозованих форм, наприклад, парентеральних, для призначення окремої композиції при різних інтервалах дозування, або для титрування певних композицій. Для зручності комплект звичайно містить інструкції для призначення та його можна застосовувати з так званою пам'яткою. Для призначення людям, загальна добова доза сполук винаходу є звичайно у межах 0,001 мг – 5000 мг залежно, безумовно, від режиму призначення. Наприклад, внутрішньовенна добова доза може потребувати тільки від 0,001 мг до 40 мг. Загальну добову дозу можна призначати одиничною або роздільними дозами. Ці дози є на основі середньої людини, що має масу приблизно 65-70 кг. Лікар легко здатний визначити дози для особи, чия маса є поза цими межами, як-то діти та літні особи. Для запобігання двозначності, посилання тут на "лікування" охоплюють посилання на нерадикальне та профілактичне лікування. У ще одному втіленні заявленого винаходу, сполуки формули (1), або їх фармацевтично прийнятні солі та/або фармацевтично прийнятні сольвати вказаних сполук або солей, можна також застосовувати як комбінації з одним або більше додатковими терапевтичними агентами для співпризначеня пацієнту для отримання певного особливо потрібного терапевтичного результату, як-то лікування процесів патофізіологічних хвороб, охоплюючи, але без обмеження (і) бронхоконстрикцію, (іі) запалення, (ііі) алергію, (іv) деструкцію тканин, (v) ознаки та симптоми, як-то порушення дихання, кашель. Другий та більші додаткові терапевтичні агенти можуть також бути сполуками формули (1), або їх фармацевтично прийнятними солями та/або фармацевтично прийнятними сольватами вказаних сполук або солей, або одним або більше відомими β2 агоністами. Більш звичайно, другий та більші терапевтичну агенти треба вибирати з різних класів терапевтичних агентів. Як застосовувано тут, терміни "співпризначення", "співпризначений" та "у комбінації з", що стосуються сполуки формули (1) та одного або більше інших терапевтичних агентів, охоплюють: - одночасне призначення такої комбінації сполуки формули (1) та терапевтичних агентів пацієнту при потребі лікування, коли такі компоненти складають разом у форму окремої дози, що вивільняє вказані компоненти по суті у той же час у вказаного пацієнта, - по суті одночасне застосування такої комбінації сполуки формули (1) та терапевтичних агентів пацієнту при потребі лікування, коли такі компоненти складають нарізно від кожного 14 UA 99524 C2 5 10 15 20 25 30 35 40 45 50 55 60 іншого у форми окремої дози, котрі приймає по суті у той же час вказаний пацієнт, після чого вказані компоненти вивільняються по суті у той же час у вказаного пацієнта, - послідовне призначення такої комбінації сполуки формули (1) та терапевтичних агентів пацієнту при потребі лікування, коли такі компоненти складають нарізно від кожного іншого у форми окремої дози, котрі приймає у наступний час вказаний пацієнт із значним інтервалом часу між кожним прийомом, після чого вказані компоненти вивільняються по суті у відмінний час у вказаного пацієнта; та - послідовне призначення такої комбінації сполуки формули (1) та терапевтичних агентів пацієнту при потребі лікування, коли такі компоненти складають разом у форму окремої дози, що вивільняє вказані компоненти у контрольованому режимі, після чого їх одночасно, послідовно, та/або перекривно приймає у той же час та/або відмінний час вказаний пацієнт, де кожну частину можна призначати будь-яким тим же або відмінним шляхами. Придатні приклади інших терапевтичних агентів, що можна застосовувати у комбінації зі сполуками формули (1), або їх фармацевтично прийнятними солями та/або фармацевтично прийнятними сольватами вказаних сполук або солей, охоплюють, але без обмеження: (a) інгібітори 5-ліпоксигенази (5-LО) або антагоністи білку активування 5-ліпоксигенази (FLАР); (b) антагоністи лейкотриєну (LТRА), охоплюючи антагоністи LТВ4, LТС4, LТD4, та LТЕ4; (c) антагоністи рецептору гістаміну, охоплюючи антагоністи Н1 та Н3; (d) симпатоміметики α1- та α2-адреномиметичних вазоконстрикторів для протизастійного застосування; (e) інгібітори РDЕ, наприклад, інгібітори РDЕ3, РDЕ4 та РDЕ5; (f) агоністи бета 2 рецептору; (g) антагоніст мускаринового рецептору М3 або антихолінергічні агенти; (h) теофілін; (i) натрію хромоглікат; (j) неселективні інгібітори СОХ та селективні інгібітори СОХ-1 або СОХ-2 (NSАІD); (k) антагоністи рецептору простагландину та інгібітори нейронної нітроген-оксид-синтази простагландину; (l) пероральні та інгаляційні глюкокортикостероїди; (m) дисоційовані агоністи кортикоідного рецептору (DАGR); (n) моноклональні антитіла, активні проти ендогенних запальних чинників; (o) агенти проти фактору некрозу пухлин (анти-ТNF-α); (p) інгібітори адгезійних молекул, охоплюючи антагоністи VLА-4; (q) антагоністи кінін-В1 - та В2 -рецепторів; (r) імунодепресивні агенти, охоплюючи інгібітори провідного шляху ІgЕ та циклоспорин; (s) інгібітори матриксних металопротеаз (ММР); (t) антагоністи рецепторів тахікініну NК1, NК2 та NК3; (u) інгібітор протеази, як-то інгібітори еластаз; (v) агоністи рецептору аденозину А2а та антагоністи А2b; (w) інгібітори урокінази; (x) сполуки, що діють на рецептори допаміну, як-то агоністи D2; (y) модулятори провідного шляху NFkβ, як-то інгібітори ІКК; (z) модулятори провідних шляхів передачі сигналів цитокінів, як-то р38 МАР-кіназа, РІ3кіназа, JАК-кіназа, sуk-кіназа, ЕGFR або МК-2; (aa) агенти, що можна класифікувати як муколітики або антикашльові; (bb) агенти, котрі посилюють відповіді на інгаляційні кортикостероїди; (cc) антибіотики та антивірусні агенти, ефективні проти мікроорганізмів, котрі можуть колонізувати респіраторний тракт; (dd) інгібітори НDАС; (ee) антагоністи СХСR2; (ff) антагоністи інтегрину; (gg) хемокіни; (hh) блокатори епітеліального каналу натрію (ЕNаС) або інгібітори епітеліального каналу натрію (ЕNаС); (ii) агоністи Р2Y2 та інші агоністи нуклеотидних рецепторів; (jj) інгібітори тромбоксану; (kk) інгібітори синтезу РGD2 та рецептори РGD2 (DР1 та DР2/СRТН2); (ll) ніацин; та (mm) фактори адгезії, охоплюючи VLАМ, ІСАМ, та ЕLАМ. 15 UA 99524 C2 5 10 15 20 25 30 35 40 45 50 55 60 Згідно з заявленим винаходом, комбінація сполуки формули (1) з нижченаведеним: - Н3-антагоністи; - антагоністи мускаринового рецептору М3; - інгібітори РDЕ4; - глюкокортикостероїди; - агоністи рецептору аденозину А2а; - модулятори провідних шляхів передачі сигналів цитокінів, як-то р38 МАР-кіназа або sуkкіназа; або - антагоністи лейкотриєну (LТRА), охоплюючи антагоністи = LТВ4, LТС4, LТD4, та LТЕ4 є ще кращою. Згідно з заявленим винаходом, комбінація сполуки формули (1) з нижченаведеним: - глюкокортикостероїди, зокрема інгаляційні глюкокортикостероїди зі зменшеною системною побічною дією, охоплюючи преднізон, преднізолон, флунізолід, триамцинолон ацетонід, беклометазон дипропіонат, будезонід, флутиказон пропіонат, циклезонід, та мометазон фуроат, або - антагоністи мускаринового рецептору М3 або антихолінергічні агенти, охоплюючи зокрема сіль іпратропіуму, а саме бромід, сіль тіотропіуму, а саме бромід, сіль окситропіуму, а саме бромід, перензепін, та телензепін є ще кращою. Зрозуміло, що усі посилання тут на лікування охоплюють цілюще, нерадикальне та профілактичне лікування. Сполуки формули (1) мають здатність взаємодіяти з β2 рецептором та холінергічними мускариновими рецепторами, та мають широкі межі терапевтичних застосовувань, як описано нижче, внаслідок суттєвої ролі, котру β2 рецептор та мускаринові рецептори грають у фізіології усіх ссавців. Тому, у наступному аспекті винахід стосується сполук формули (1), або їх фармацевтично прийнятних солей та/або фармацевтично прийнятних сольватів вказаних сполук або солей, для застосування у лікуванні хвороб, розладів та станів, у котрих є задіяними β2 рецептор та /або мускаринові рецептори. Більш конкретно, заявлений винахід також стосується сполук формули (1), або їх фармацевтично прийнятних солей та/або фармацевтично прийнятних сольватів вказаних сполук або солей, для застосування у лікуванні хвороб, розладів та станів вибраних з групи: - астма будь-якого типу, етіології або патогенезу, зокрема астма, яка є вибраною з групи: атопічна астма, неатопічна астма, алергічна астма, атопічна бронхіальна lgЕ-опосередкована астма, бронхіальна астма, есенціальна астма, істинна астма, інфекційно-алергічна астма, спричинена патофізіологічними порушеннями, екзогенна бронхіальна астма, спричинена факторами навколишнього середовища, есенціальна астма невідомої або неочевидної причини, неатопічна астма, бронхітна астма, емфізематозна астма, індукована фізичними вправами астма, індукована алергеном астма, індукована холодним повітрям астма, професійна астма, інфекційна астма, спричинена бактеріальною, грибковою, протозойною або вірусною інфекцією, неалергічна астма, початкова астма, астматичний дитячий синдром та бронхіоліт; - хронічна або гостра бронхоконстрикція, хронічний бронхіт, обструкція дрібних дихальних шляхів, та емфізема; - обструктивні або запальні хвороби дихальних шляхів будь-якого типу, етіології або патогенезу, зокрема обструктивна або запальна хвороба дихальних шляхів, що є вибраною з групи: хронічна еозинофільна пневмонія, хронічна обструктивна хвороба легень (СОРD), СОРD, що охоплює хронічний бронхіт, емфізему легень або утруднене дихання, асоційоване або ні з СОРD, СОРD, що характеризується необоротною, прогресувальною обструкцією дихальних шляхів, респіраторний дистрес-синдром дорослих (АRDS), загострення гіперреактивності дихальних шляхів в результаті терапії іншими ліками та хвороба дихальних шляхів, що асоційована з гіпертензією легень; - бронхіт будь-якого типу, етіології або патогенезу, зокрема бронхіт, що є вибраним з групи: гострий бронхіт, гострий гортано-трахеальний бронхіт, арахіновий бронхіт, катаральний бронхіт, крупозний бронхіт, сухий бронхіт, інфекційний астматичний бронхіт, продуктивний бронхіт, стафілококовий або стрептококовий бронхіт та везикулярний бронхіт; - гостре поранення легень; та - бронхоектаз будь-якого типу, етіології або патогенезу, зокрема бронхоектаз, що є вибраним з групи: циліндричний бронхоектаз, осумкований бронхоектаз, веретеноподібний бронхоектаз, капілярний бронхоектаз, кістозний бронхоектаз, сухий бронхоектаз та фолікулярний бронхоектаз. 16 UA 99524 C2 5 10 15 20 25 У наступному аспекті заявлений винахід також стосується застосування сполук формули (1), або їх фармацевтично прийнятних солей та/або фармацевтично прийнятних сольватів вказаних сполук або солей, для виробництва ліків, що мають активність β2 агоністу та активність М3 антагоністу. Зокрема, заявлений винахід стосується застосування сполук формули (1), або їх фармацевтично прийнятних солей та/або фармацевтично прийнятних сольватів вказаних сполук або солей, для виробництва ліків для лікування хвороб та/або станів що залучають бета 2 та мускаринов рецептори, зокрема хвороб та/або станів, перерахованих вище. Як наслідок, заявлений винахід особливо стосується способу лікування ссавців, охоплюючи людину, ефективною кількістю сполуки формули (1), або її фармацевтично прийнятної солі та/або фармацевтично прийнятного сольвату вказаної сполуки або солі. Більш конкретно, заявлений винахід стосується способу лікування β2-опосередкованих хвороб та/або станів що залучають бета 2 та мускаринові рецептори, у ссавців, охоплюючи людину, зокрема хвороб та/або станів, перерахованих вище, що полягає у призначенні вказаному ссавцю ефективної кількості сполуки формули (1), її фармацевтично прийнятної солі та/або сольватів вказаної сполуки або солі. Нижченаведені приклади ілюструють отримання сполук формули (1): Фіг. 1/1: Рентгенодифрактограма прикладу 2а Протоколи Для усіх прикладів нижче, були застосовуваними нижченаведені умови: Рентгенодифракція порошку (РДП) Рентгенодифрактограму визначали, застосовуючи порошковий рентгенодифрактометр Вrukеr-АХS Ltd. D4 з автоматичною зміною зразку, тета-тета-гоніометром та детектором РSD Vаntес-1. Зразок отримували для аналізу монтуванням на підкладці з силіцію. Отримані піки вирівнювали проти силіцію. Зразок обертали, опромінюючи рентгенопроменями купрум Кальфа1 (довжина хвилі = 1,5406 Å) з рентгенотрубкою = при 40 кВ/35 мА. Аналізи проводили з гоніометром у безперервному режимі протягом 0,2 с з кроком 0,018 у межах два тета 2 – 55 Отримання Отримання 1 (2R)-2-циклогексил-2-гідрокси-2-фенілацетамід 30 O NH2 OH 35 40 (2R)-2-Циклогексил-2-гідрокси-2-фенілоцтову кислоту (отримання 36, 4,87 г, 20,8 ммоль) розчиняли у дихлорметані (150 мл) та додавали одною частиною карбонілдіімідазол (3,37 г, 20,8 ммоль). Після перемішування протягом 1 годин при кімнатній температурі, додавали 0,880 аміак (21 мл) та перемішування продовжували при кімнатній температурі протягом 18 годин. Органічний шар відокремлювали, промивали розсолом (50 мл), сушили безводним магнію сульфатом, фільтрували та розчинник видаляли під вакуумом, отримуючи заголовну сполуку як білу пінку з 92 % виходу, 4,56 г. РХ-МС: ХІАТ ІЕР m/z 232 [М-Н] 1 Н ЯМР (400 МГц, ХЛОРОФОРМ-d) = 0,92 (m, 1Н), 1,15 (m, 5Н), 1,76 (m, 4Н), 2,40 (m, 1Н), –1 5,38 (br.s, 1Н), 6,52 (br.s, 1Н), 7,28 (m, 1Н), 7,37 (m, 2Н), 7,62 (m, 2Н) млн . Отримання 2 (R)-циклогексил(феніл)1Н-1,2,4-триазол-3-ілметанол 45 H N N N OH 17 UA 99524 C2 5 10 15 20 (2R)-2-циклогексил-2-гідрокси-2-фенілацетамід (Отримання 1, 4,497 г, 19,27 ммоль) розчиняли у диметилацеталі N, N-диметилформаміду (60 мл). Після перемішування при 90 °C протягом 2 годин розчинник видаляли під вакуумом та залишок переганяли з толуєном (100 мл), отримуючи жовту оливу. Гідразин гідрат (1,11 мл, 22,9 ммоль) додавали, а потім льодяну оцтову кислоту (90 мл). Після перемішування при 90 °C протягом 2 годин розчинник видаляли під вакуумом та залишок розподіляли між етилацетатом (250 мл) та насиченим водним розчином натрію гідрогенкарбонату (250 мл). Органічний шар відокремлювали, сушили безводним магнію сульфатом, фільтрували та розчинник видаляли під вакуумом. Залишок очищали хроматографією на колонці з силікагелем, елюючи етилацетатом, отримуючи заголовну сполуку як білий твердий матеріал з 100 % виходу, 4,9г. РХ-МС: ІЕР m/z 256 [М-Н] 1 Н ЯМР (400 МГц, ХЛОРОФОРМ-d) = 1,08 (m, 3Н), 1,36 (m, 2Н), 1,70 (m, 5Н), 2,46 (m, 1Н), –1 3,08 (br.s, 1Н), 7,23 (m, 1Н), 7,34 (m, 2Н), 7,65 (m, 2Н), 8,00(с, 1Н) млн . Енантіомерний надлишок: 99,3 %, розраховували, застосовуючи колонку Сhіrаlраk АS-Н (250 × 4,6 мм), елюючи 79 % гептану, 31 % ізопропілового спирту при швидкості потоку 1 мл/хвилин. Час утримування потрібного (R)-енантіомеру 13,61 хвилин, час утримування непотрібного (S)-енантіомеру 11,31 хвилин (ідентифіковано з рацемату). Отримання 3 трет-бутил 4-({3-[(R)-циклогексил(гідрокси)фенілметил]-1Н-1,2,4-триазол-1іл}метил)піперидин-1-карбоксилат O N O N N N HO 25 30 35 40 45 50 Трет-бутил 4-(бромметил)піперидин-1-карбоксилат (6,75 г, 24,2 ммоль) розчиняли у ДМФ (62 мл) та додавали (R)-циклогексил(феніл)1Н-1,2,4-триазол-3-ілметанол (Отримання 2, 5,2 г, 20 ммоль), а потім калію карбонат (5,58 г, 40,4 ммоль). Після перемішування при 70 °C протягом 18 годин розчинник видаляли під вакуумом, та залишок розподіляли між етилацетатом (150 мл) та водою (150 мл). Органічний шар відокремлювали, сушили безводним магнію сульфатом, фільтрували та розчинник видаляли під вакуумом. Залишок очищали хроматографією на колонці з силікагелем, елюючи етилацетатом:гептаном, (1:4-1:1, за об'ємом), отримуючи заголовну сполуку як білу пінку, у 51 % виходу, 4,7 г (містить 10 % іншого регіо-ізомеру триазолу). + РХ-МС: ХІАТ ІЕР m/z 487 [М+Н+МеОН] 1 Н ЯМР (400 МГц, МЕТАНОЛ-d4) = 1,05-1,36 (m, 9Н), 1,43 (с, 9Н), 1,47-1,75 (m, 5Н), 2,09 (m, 1Н), 2,38 (m, 1Н), 2,72 (m, 2Н), 4,08 (m, 4Н), 7,17 (m, 1Н), 7,26 (m, 2Н), 7,58 (d, 2Н), 8,30 (с, 1Н) –1 млн . Альтернативно, заголовну сполуку отримували нижченаведеним способом: (R)-циклогексил(феніл)1Н-1,2,4-триазол-3-ілметанол (Отримання 2, 3,0 г, 11,7 ммоль) розчиняли в ацетоні (60 мл) та додавали трет-бутил 4-(бромметил)піперидин-1-карбоксилат (3,24 г, 11,7 ммоль), а потім цезію карбонат (7,60 г, 23,3 ммоль). Після перемішування при 70 °C протягом 5 годин, реакційній суміші давали охолонути до кімнатної температури та перемішували ще 16 годин. Розчинник видаляли під вакуумом, та залишок розподіляли між етилацетатом (50 мл) та водою (50 мл). Органічний шар відокремлювали, сушили безводним магнію сульфатом, фільтрували та розчинник видаляли під вакуумом. 100 мг цього залишку розчиняли в ацетонітрилі (0,5 мл) та випарювали майже до сухого стану, коли утворена олива починала кристалізуватися. Залишки залишку розчиняли в ацетонітрилі (55 мл) та засівали отриманим вище кристалічним матеріалом. Кристалізації давали відбуватися протягом 18 годин та утворений твердий матеріал збирали фільтруванням, отримуючи заголовну сполуку як білий твердий матеріал з 64 % виходу, 3,4 г. + РХ-МС: ХІАТ ІЕР m/z 487 [М+Н+МеОН] 18 UA 99524 C2 Н ЯМР (400 МГц, МЕТАНОЛ-d4) = 1,05-1,36 (m, 9Н), 1,43 (с, 9Н), 1,47-1,75 (m, 5Н), 2,09 (m, 1Н), 2,38 (m, 1Н), 2,72 (m, 2Н), 4,08 (m, 4Н), 7,17 (m, 1Н), 7,26 (m, 2Н), 7,58 (d, 2Н), 8,30 (с, 1Н) –1 млн . Отримання 4 (R)-циклогексил(феніл)[1-(піперидин-4-ілметил)-1Н-1,2,4-триазол-3-іл]метанол 1 5 HN N N N HO 10 15 20 25 30 35 Трет-бутил 4-({3-[(R)-циклогексил(гідрокси)фенілметил]-1Н-1,2,4-триазол-1іл}метил)піперидин-1-карбоксилат (Отримання 3, 5,60 г, 12,3 ммоль) розчиняли у ДХМ (31 мл) та додавали 2М НСl в етері (31 мл, 60 ммоль). Після перемішування при кімнатній температурі протягом 5 годин розчинник видаляли під вакуумом, та залишок розподіляли між дихлорметаном (200 мл) та насиченим водним розчином натрію гідрогенкарбонату (200 мл). Органічний шар відокремлювали, сушили безводним магнію сульфатом, фільтрували та розчинник видаляли під вакуумом, отримуючи заголовну сполуку як білу пінку, у 92 % виходу, 4,03 г (містить 10 % іншого регіо-ізомеру триазолу). + РХ-МС: ХІАТ ІЕР m/z 377 [М+Nа] 1 Н ЯМР (400 МГц, МЕТАНОЛ-d4) = 1,04-1,36 (m, 9Н), 1,38-1,57 (m, 2Н), 1,58-1,81 (m, 3Н), 2,00 (m, 1Н), 2,38 (m, 1Н), 2,58 (m, 2Н), 3,06 (m, 2Н), 4,06 (d, 2Н), 7,17 (m, 1Н), 7,25 (m, 2Н), 7,58 –1 (d, 2Н), 8,31 (с, 1Н) млн . Альтернативно, заголовну сполуку отримували нижченаведеним способом: Трет-бутил 4-({3-[(R)-циклогексил(гідрокси)фенілметил]-1Н-1,2,4-триазол-1іл}метил)піперидин-1-карбоксилат (Отримання 3а, 2,00 г, 4,40 ммоль) розчиняли у діоксані (11 мл) та перемішували для досягнення солюбілізування і тоді додавали 4М НСl у діоксані (5,54 мл, 22,1 ммоль). Після перемішування при кімнатній температурі протягом 24 годин розчинник видаляли під вакуумом, та залишок розподіляли між дихлорметаном (50 мл) та насиченим водним розчином натрію гідрогенкарбонату (50 мл). Органічний шар відокремлювали, сушили безводним магнію сульфатом, фільтрували та розчинник видаляли під вакуумом, отримуючи заголовну сполуку як безбарвну оливу з 96 % виходу, 1,5 г. + РХ-МС: ХІАТ ІЕР m/z 377 [М+Nа] 1 Н ЯМР (400 МГц, МЕТАНОЛ-d4) = 1,04-1,36 (m, 9Н), 1,38-1,57 (m, 2Н), 1,58-1,81 (m, 3Н), 2,00 (m, 1Н), 2,38 (m, 1Н), 2,58 (m, 2Н), 3,06 (m, 2Н), 4,06 (d, 2Н), 7,17 (m, 1Н), 7,25 (m, 2Н), 7,58 –1 (d, 2Н), 8,31 (с, 1Н) млн . Отримання 5 Ді-трет-бутил {9-[4-({3-[(R)-циклогексил(гідрокси)фенілметил]-1Н-1,2,4-триазол-1іл}метил)піперидин-1-іл]ноніл}імідодикарбонат O O O N N N N O N HO 40 (R)-циклогексил(феніл)[1-(піперидин-4-ілметил)-1Н-1,2,4-триазол-3-іл]метанол (Отримання 4, 2,00 г, 5,64 ммоль) та ді-трет-бутил (9-бромноніл)імідодикарбонат (US04167167, 2,38 г, 5,64 19 UA 99524 C2 5 10 ммоль) розчиняли в ацетонітрилі (60 мл) та додавали триетиламін (2,35 мл, 16,9 ммоль). Після перемішування при 50 °C протягом 18 годин, розчинник видаляли під вакуумом, та залишок очищали хроматографією на колонці з силікагелем, елюючи сумішшю дихлорметан:метанол:880 аміак (98:2:0,2, за об'ємом), отримуючи заголовну сполуку як прозору оливу з 60 % виходу, 2,6 г (містить 10 % іншого регіо-ізомеру триазолу) + РХ-МС: ХІАТ ІЕР m/z 696 [М+Н] 1 Н ЯМР (400 МГц, МЕТАНОЛ-d4) = 1,14 (m, 4Н), 1,25-1,38 (m, 18Н) 1,41-1,51 (m, 18Н), 1,511,75 (m, 6Н), 1,99 (m, 2Н), 2,14 (m, 2Н), 2,42 (m, 2Н), 3,06 (m, 2Н), 3,55 (m, 2Н), 4,09 (m, 2Н), 7,16 –1 (m, 1Н), 7,26 (m, 2Н), 7,58 (m, 2Н), 8,32 (m, 1Н) млн . Отримання 6 (R)-(1-{[1-(9-амінононіл)піперидин-4-іл]метил}-1Н-1,2,4-триазол-3-іл)(циклогексил) фенілметанол H2N N N N N HO 15 20 25 30 Ді-трет-бутил {9-[4-({3-[(R)-циклогексил(гідрокси)фенілметил]-1Н-1,2,4-триазол-1іл}метил)піперидин-1-іл]ноніл}імідодикарбонат (Отримання 5, 2,6 г, 3,7 ммоль) розчиняли у дихлорметані (15 мл) та додавали гідрогенхлорид у діетил-етері (2М, 15 мл, 30 ммоль). Після перемішування при кімнатній температурі протягом 5 годин розчинник видаляли під вакуумом, залишок розподіляли між дихлорметаном (200 мл) та насиченим водним розчином натрію гідрогенкарбонату (200 мл). Органічний шар відокремлювали, сушили безводним магнію сульфатом, фільтрували та розчинник видаляли під вакуумом. Залишок очищали хроматографією на колонці з силікагелем, елюючи сумішшю дихлорметан:метанол:880 аміак (97,5:2,5:0,25, за об'ємом), отримуючи заголовну сполуку як прозору оливу з 70 % виходу, 1,29 г (містить 10 % іншого регіо-ізомеру триазолу). + РХ-МС: ХІАТ m/z 496 [М+Н] 1 Н ЯМР (400 МГц, МЕТАНОЛ-d4) = 1,12 (m, 4Н), 1,23-1,34 (m, 18Н), 1,49 (m, 6Н), 1,64 (m, 2Н), 1,94 (m, 2Н), 2,31 (m, 2Н), 2,63 (m, 2Н), 2,93 (m, 2Н), 4,07 (m, 2Н), 7,16 (m, 1Н), 7,25 (m, 2Н), –1 7,58 (m, 2Н), 8,31 (с, 1Н) млн . Отримання 7 8-(бензилокси)-5-[(1R)-1-{[трет-бутил(диметил)силіл]окси}-2-({9-[4-({3-[(R)циклогексил(гідрокси)-фенілметил]-1Н-1,2,4-триазол-1-іл}метил)піперидин-1іл]ноніл}аміно)етил]хінолін2(1Н)-он Si O H N N N N O N HN HO O 35 40 (R)-(1-{[1-(9-амінононіл)піперидин-4-іл]метил}-1Н-1,2,4-триазол-3-іл)(циклогексил) фенілметанол (Отримання 6, 350 мг, 0,706 мг), 8-(бензилокси)-5-[(1R)-2-бром-1-{[третбутил(диметил)силіл]окси}етил]хінолін2(1Н)-он (WО200509286, 345 мг, 0,706 ммоль) та натрію гідрогенкарбонат (88,9 мг, 1,06 ммоль) комбінували в ацетонітрилі (7 мл). Після перемішування при 90 °C протягом 72 годин розчинник видаляли під вакуумом та залишок розподіляли між дихлорметаном (50 мл) та насиченим водним розчином натрію гідрогенкарбонату (50 мл). 20 UA 99524 C2 5 10 Органічний шар відокремлювали, сушили безводним магнію сульфатом, фільтрували та розчинник видаляли під вакуумом. Залишок очищали хроматографією на колонці з силікагелем, елюючи сумішшю дихлорметан:метанол:880 аміак (99:1:0,1-95:5:0,5 за об'ємом), отримуючи заголовну сполуку як прозоре скло з 37 % виходу, 240 мг (містить 10 % іншого регіо-ізомеру триазолу). + РХ-МС: ХІАТ ІЕР m/z 904 [М+Н] 1 Н ЯМР (400 МГц, МЕТАНОЛ-d4) = 0,07 (с, 3Н), 0,37 (с, 3Н), 1,17 (с, 9Н), 1,37-1,49 (m, 4Н), 1,52-1,63 (m, 18Н), 1,76 (m, 6Н), 1,92 (m, 2Н), 2,20 (m, 2Н), 2,60 (m, 2Н), 2,88 (m, 2Н), 3,01 (m, 1Н), 3,18 (m, 3Н), 4,35 (m, 2Н), 5,50 (m, 1Н), 5,61 (с, 2Н), 6,95 (d, 1Н), 7,41-7,70 (m, 8Н), 7,79 (m, –1 2Н), 7,86 (m, 2Н), 8,59 (с, 1Н), 8,74 (d, 1Н) млн . Отримання 8 5-[(1R)-1-{[трет-бутил(диметил)силіл]окси}-2-({9-[4-({3-[(R)циклогексил(гідрокси)фенілметил]-1Н-1,2,4-триазол-1-іл}метил)піперидин-1іл]ноніл}аміно)етил]-8-гідроксихінолін2(1Н)-он 15 Si O H N N N N HO N HN HO O 20 25 30 8-(бензилокси)-5-[(1R)-1-{[трет-бутил(диметил)силіл]окси}-2-({9-[4-({3-[(R)циклогексил(гідрокси)-фенілметил]-1Н-1,2,4-триазол-1-іл}метил)піперидин-1іл]ноніл}аміно)етил]хінолін2(1Н)-он (Отримання 7, 230 мг, 0,255 ммоль) розчиняли в етанолі (10 мл) та додавали паладій гідроксид [20 мас% (суха основа) на вугіллі (вологому)] (5 мг), а потім амонію форміат (161 мг, 2,55 ммоль). Після перемішування при кип'ятінні під зворотним холодильником протягом 1 години реакційну суміш фільтрували через аrbосеl та розчинник видаляли під вакуумом. Залишок очищали хроматографією на колонці з силікагелем, елюючи сумішшю дихлорметан:метанол:880 аміак (97,5:2,5:0,25 до 90:10:1, за об'ємом), отримуючи заголовну сполуку як скло з 87 % виходу, 180 мг. + РХ-МС: ХІАТ ІЕР m/z 813 [М+Н] 1 Н ЯМР (400 МГц, МЕТАНОЛ-d4) = 0,00 (с, 3Н), 0,30 (с, 3Н), 1,10 (с, 9Н), 1,45-1,94 (m, 28Н), 2,21 (m, 3Н), 2,58 (m, 3Н), 2,85 (m, 2Н), 2,95 (m, 1Н), 3,17 (m, 3Н), 4,29 (m, 2Н), 5,42 (m, 1Н), 6,85 –1 (d, 1Н), 7,14 (d, 1Н), 7,32-7,48 (m, 4Н), 7,78 (m, 2Н), 8,52 (с, 1Н), 8,65 (d, 1Н) млн . Отримання 9 2-{2-[4-(2-Гідроксіетил)-феніл]-вініл}-ізоіндол-1,3-діон O N OH O 35 40 45 До розчину 2-(4-бромфеніл)етанолу (48,3 г) в ацетонітрилі (480 мл) додавали діізопропілетиламін (46,6 г), N-вінілфталімід (43,7 г) та три-о-толілфосфін (7,31 г) та суміш продували азотом три рази. Паладій ацетат (2,7 г) додавали та суміш перемішували при 90 °C протягом 21 год. під азотом. Реакційну суміш охолоджували та осаджений продукт збирали фільтруванням. Утворений твердий матеріал перерозчиняли у дихлорметані та етилацетаті та фільтрували через силікагель. Фільтрат концентрували під вакуумом, отримуючи заголовну сполуку, 24 г. 1 Н ЯМР (400 МГц, СDСl3) = 2,81-2,84 (t, 2Н), 3,82-3,90 (t, 2Н), 7,23-7,26 (d, 2Н) 7,32-7,36 (d, –1 1Н), 7,40-7,43 (d, 2Н), 7,61-7,64 (d, 1Н), 7,66-7,78 (d, 2Н), 7,86-7,88 (d, 2Н) млн . Отримання 10 21 UA 99524 C2 2-{2-[4-(2-Гідроксіетил)-феніл]-етил}-ізоіндол-1,3-діон O N OH O 5 10 15 20 25 При перемішуванні до розчину 2-{2-[4-(2-Гідроксіетил)-феніл]-вініл}-ізоіндол-1,3-діону (Отримання 9, 10 г) в етанолі та етилацетаті (350 мл кожного) додавали 30 % паладій гідроксиду на вугіллі (1,44 г), а потім амонію форміат (21,5 г). Реакційну суміш нагрівали до 80 °C протягом 4 годин. Додатково додавали паладій гідроксид на вугіллі (1,44 г) та амонію форміат (21,5 г) та реакційну суміш перемішували при 80 °C протягом 18 годин. Реакційну суміш ТМ охолоджували, фільтрували через шар Аrbосеl та промивали метанолом. Розчинник видаляли під зниженим тиском та утворений білий твердий матеріал розподіляли між дихлорметаном (200 мл) та водою (100 мл). Водний шар відокремлювали та екстрагували ще дихлорметаном (2 × 50 мл). Комбіновані органічні шари сушили (натрію сульфат) та розчинник видаляли під вакуумом, отримуючи заголовну сполуку як білуватий твердий матеріал, 9,11 г. 1 Н ЯМР (400 МГц, СDСl3) = 2,80-2,83 (t, 2Н), 2,92-3,00 (t, 2Н), 3,82-3,86 (t, 2Н), 3,87-3,96 (t, –1 2Н), 7,14-7,22 (2х d, 4Н), 7,70-7,72 (dd, 2Н), 7,82-7,84 (dd, 2Н) млн . Альтернативно, заголовну сполуку можна отримувати нижченаведеним способом: 2-{2-[4-(2-гідроксіетил)феніл]-вініл}-ізоіндол-1,3-діон (Отримання 9, 62,0 г, 211,37 ммоль) розчиняли в етилацетаті (1200 мл). До цього додавали родію трис(трифенілфосфін) хлорид, (12,7 г, 13,7 ммоль) та суміш гідрували при 20 фунт/кв.дюйм, при кімнатній температурі протягом 24 годин. Реакційну суміш фільтрували та концентрували під вакуумом. Залишок розчиняли в етилацетаті (1000 мл) та пропускали через шар силікагелю, промиваючи етилацетатом. Розчинник видаляли під вакуумом, отримуючи світло-коричневий твердий матеріал, що перекристалізовували з суміші етилацетат:гептан (4:1, за об'ємом), отримуючи заголовну сполуку як білуватий кристалічний твердий матеріал з 85 % виходу, 53 г, 1 Н ЯМР (400 МГц, СDСl3) = 2,80-2,83 (t, 2Н), 2,92-3,00 (t, 2Н), 3,82-3,86 (t, 2Н), 3,87-3,96 (t, –1 2Н), 7,14-7,22 (2х d, 4Н), 7,70-7,72 (dd, 2Н), 7,82-7,84 (dd, 2Н) млн . Отримання 11 2-{2-[4-(2-Бром-етил)-феніл]-етил}-ізоіндол-1,3-діон 30 O N Br O 35 40 45 Розчин 2-{2-[4-(2-Гідроксіетил)-феніл]-етил}-ізоіндол-1,3-діону (Отримання 10, 22,37 г) та фосфор триброміду (8,20 г) у толуєні (500 мл) кип'ятили під зворотним холодильником протягом 4 годин. Суміші давали охолонути до кімнатної температури, розбавляли етилацетатом (300 мл) та обережно гасили натрію бісульфітом/натрію гідрогенкарбонатом (1:1) у воді (100 мл). Органічний шар відокремлювали та промивали ще натрію бісульфітом/натрію гідрогенкарбонатом (1:1) у воді (100 мл), сушили безводним натрію сульфатом та концентрували під вакуумом. Утворений твердий матеріал (24,26 г) розтирали у порошок з сумішшю гептан:трет-бутилметил-етер (100 мл; 9:1, за об'ємом), отримуючи заголовну сполуку як блідо-зелений твердий матеріал, 17,94 г. 1 Н ЯМР (400 МГц, СDСl3) = 2,93-3,00 (t, 2Н), 3,07-3,18 (t, 2Н), 3,53-3,59 (t, 2Н), 3,88-3,94 (t, –1 2Н), 7,13-7,23 (2хd, 4Н), 7,70-7,73 (dd, 2Н), 7,83-7,85 (dd, 2Н) млн . Отримання 12 2-[2-(4-{2-[4-({3-[(R)-циклогексил(гідрокси)фенілметил]-1Н-1,2,4-триазол-1іл}метил)піперидин-1-іл]етил}феніл)етил]-1Н-ізоіндол-1,3(2Н)-діон 22 UA 99524 C2 O N N N N N HO O 5 10 15 20 25 30 35 40 45 Циклогексил-феніл-(1-піперидин-4-ілметил-1Н-[1,2,4]триазол-3-іл)-метанол (Отримання 4, 8,2 г, 2,98 ммоль), 2-{2-[4-(2-Бром-етил)-феніл]-етил}-ізоіндол-1,3-діон (Отримання 11, 7,56 г, 21,1 ммоль) та триетиламін (13,3 мл, 95,9 ммоль) розчиняли в ацетонітрилі (100 мл). Після перемішування при 90 °C протягом 48 годин розчинник видаляли під вакуумом, та залишок розподіляли між дихлорметаном (200 мл) та водою (200 мл). Органічний шар відокремлювали, сушили безводним магнію сульфатом, фільтрували та розчинник видаляли під вакуумом. Залишок очищали хроматографією на колонці з силікагелем, елюючи сумішшю дихлорметан:метанол:880 аміак (98:2:0,2, за об'ємом) та утворений матеріал тоді розтирали у порошок у трет-бутилметил-етері, отримуючи заголовну сполуку як прозорий твердий матеріал з 28 % виходу, 3,4 г. + РХ-МС: ХІАТ ІЕР m/z 632 [М+Н] 1 Н ЯМР (400 МГц, МЕТАНОЛ-d4) = 1,13 (m, 3Н), 1,22-1,37 (m, 5Н), 1,43 (m, 1Н), 1,50-1,74 (m, 5Н), 1,94 (m, 1Н), 2,03 (m, 2Н), 2,38 (m, 1Н), 2,52 (m, 2Н), 2,73 (m, 2Н), 2,90-3,02 (m, 4Н), 3,86 –1 (t, 2Н), 4,08 (d, 2Н), 7,06-7,17 (m, 5Н), 7,25 (m, 2Н), 7,58 (m, 2Н), 7,78 (m, 4Н), 8,32 (с, 1Н) млн . Альтернативно, заголовну сполуку можна отримувати нижченаведеним способом: Циклогексил-феніл-(1-піперидин-4-ілметил-1Н-[1,2,4]триазол-3-іл)-метанол (Отримання 4, 0,40 г, 1,13 ммоль) та 2-{2-[4-(2-Бром-етил)-феніл]-етил}-ізоіндол-1,3-діон (Отримання 11, 0,404 г, 1,13 ммоль) та діізопропілетиламін (0,59 мл, 3,38 ммоль) розчиняли у метилетилкетон (8 мл). Після перемішування при 90 °C протягом 24 годин реакційній суміші давали охолонути повільно до кімнатної температури. Кристалізація відбувалася та утворений твердий матеріал збирали фільтруванням та сушили під вакуумом, отримуючи заголовну сполуку як кремовий твердий матеріал з 74 % виходу, 0,532 г. + РХ-МС: ХІАТ ІЕР m/z 632 [М+Н] 1 Н ЯМР (400 МГц, МЕТАНОЛ-d4) = 1,13 (m, 3Н), 1,22-1,37 (m, 5Н), 1,43 (m, 1Н), 1,50-1,74 (m, 5Н), 1,94 (m, 1Н), 2,03 (m, 2Н), 2,38 (m, 1Н), 2,52 (m, 2Н), 2,73 (m, 2Н), 2,90-3,02 (m, 4Н), 3,86 –1 (t, 2Н), 4,08 (d, 2Н), 7,06-7,17 (m, 5Н), 7,25 (m, 2Н), 7,58 (m, 2Н), 7,78 (m, 4Н), 8,32 (с, 1Н) млн . Альтернативно, заголовну сполуку також отримували нижченаведеним способом: Метансульфонової кислоти 2-{4-[2-(1,3-діоксо-1,3-дигідро-ізоіндол-2-іл)-етил]-феніл}-етилестер (Отримання 35, 20,00 г, 53,56 ммоль) розчиняли в ацетонітрилі (80 мл) та перемішували при кімнатній температурі. Натрію йодид (16,06 г, 107,12 ммоль) додавали порціями та утворену суспензію нагрівали до 80 С протягом 18h. Реакційну суміш охолоджували до 50 С та ще ацетонітрил (80 мл) додавали. До цієї суміші додавали циклогексил-феніл-(1-піперидин-4ілметил-1Н-[1,2,4]триазол-3-іл)-метанол (Отримання 4, 15,87 г, 53,56 ммоль) та діізопропілетиламін (9,79 мл, 56,24 ммоль) та нагрівання продовжували протягом 6 годин, тоді давали охолонути до кімнатної температури. Воду(160 мл) додавали та утворену суспензію перемішували протягом ночі при кімнатній температурі. Твердий матеріал збирали фільтруванням та промивали ацетонітрилом (5 × 20 мл), тоді сушили під вакуумом при 45 С протягом 8 годин, отримуючи заголовну сполуку як коричневий твердий матеріал з 68 % виходу, 20,9 г, + РХ-МС: ХІАТ ІЕР m/z 632 [М+Н] 1 Н ЯМР (400 МГц, МЕТАНОЛ-d4) = 1,13 (m, 3Н), 1,22-1,37 (m, 5Н), 1,43 (m, 1Н), 1,50-1,74 (m, 5Н), 1,94 (m, 1Н), 2,03 (m, 2Н), 2,38 (m, 1Н), 2,52 (m, 2Н), 2,73 (m, 2Н), 2,90-3,02 (m, 4Н), 3,86 –1 (t, 2Н), 4,08 (d, 2Н), 7,06-7,17 (m, 5Н), 7,25 (m, 2Н), 7,58 (m, 2Н), 7,78 (m, 4Н), 8,32 (с, 1Н) млн . Отримання 13 (R)-{1-[(1-{2-[4-(2-аміноетил)феніл]етил}піперидин-4-іл)метил]-1Н-1,2,4-триазол-3іл}(циклогексил)фенілметанол 23 UA 99524 C2 N N N H2N N HO 5 10 15 2-[2-(4-{2-[4-({3-[(R)-циклогексил(гідрокси)фенілметил]-1Н-1,2,4-триазол-1іл}метил)піперидин-1-іл]етил}феніл)етил]-1Н-ізоіндол-1,3(2Н)-діон (Отримання 12, 3,4 г, 5,38 ммоль) суспендували в етанолі (20 мл) та додавали гідразин моногідрат (2,61 мл, 53,8 мл). Після перемішування при кип'ятінні під зворотним холодильником протягом 2 годин, реакційну суміш охолоджували до кімнатної температури та осад збирали фільтруванням та промивали етанолом (200 мл). Фільтрат концентрували під вакуумом, отримуючи заголовну сполуку як білий твердий матеріал з 81 % виходу, 2,57 г. + РХ-МС: ІЕР m/z 502 [М+Н] 1 Н ЯМР (400 МГц, МЕТАНОЛ-d4) = 1,04-1,75 (m, 14Н), 1,90-2,08 (m, 3Н), 2,38 (m, 1Н), 2,54 (m, 2Н), 2,68-2,78 (m, 4Н), 2,84 (m, 2Н), 2,99 (m, 2Н), 3,96 (d, 2Н), 7,09-7,17 (m, 4Н), 7,12 (m, 1Н), –1 7,25 (m, 2Н), 7,59 (m, 2Н), 8,31 (с, 1Н) млн . Отримання 14 8-(бензилокси)-5-[(1R)-1-{[трет-бутил(диметил)силіл]окси}-2-{[2-(4-{2-[4-({3-[(R)-циклогексил (гідрокси)фенілметил]-1Н-1,2,4-триазол-1-іл}метил)піперидин-1-іл]етил}феніл)етил] аміно}етил]хінолін2(1Н)-он N Si O N N H N N HO O HN O 20 25 30 Заголовну сполуку отримували з (R)-{1-[(1-{2-[4-(2-аміноетил)феніл]-етил}піперидин-4іл)метил]-1Н-1,2,4-триазол-3-іл}(циклогексил)фенілметанолу (Отримання 13, 2,57 г, 5,12 ммоль) та 8-(бензилокси)-5-[(1R)-2-бром-1-{[трет-бутил(диметил)силіл]окси}етил]хінолін2(1Н)-ону (WО2005/09286, 2,50 г, 5,12 ммоль), застосовуючи той же спосіб, як описано в отриманні 7, отримуючи білий твердий матеріал з 40 % виходу, 2,3 г. + РХ-МС: ІЕР m/z 909 [М+Н] 1 Н ЯМР (400 МГц, МЕТАНОЛ-d4) = -0,28 (с, 3Н),-0,04 (с, 3Н), 0,76 (с, 9Н), 1,04-1,76 (m, 14Н), 1,93 (m, 3Н), 2,39 (m, 1Н), 2,53 (m, 2Н), 2,64-2,79 (m, 5Н), 2,79-2,94 (m, 3Н), 2,99 (m, 2Н), 4,07 (d, 2Н), 5,15 (m, 1Н), 5,30 (с, 2Н), 6,65 (m, 1Н), 7,06 (m, 4Н), 7,15 (m, 3Н), 7,20-7,43 (m, 5Н), 7,49 (d, –1 2Н), 7,59 (d, 2Н), 8,32 (с, 1Н), 8,39 (d, 1Н) млн . Отримання 15 5-[(1R)-1-{[трет-бутил(диметил)силіл]окси}-2-{[2-(4-{2-[4-({3-[(R)-циклогексил(гідрокси)фенілметил]-1Н-1,2,4-триазол-1-іл}метил)піперидин-1-іл]етил}феніл)етил]аміно}етил]-8гідроксихінолін2(1Н)-он 35 24 UA 99524 C2 N Si O N N H N N HO HO HN O 5 10 Заголовну сполуку отримували з 8-(бензилокси)-5-[(1R)-1-{[трет-бутил(диметил)силіл]окси}2-{[2-(4-{2-[4-({3-[(R)-циклогексил(гідрокси)фенілметил]-1Н-1,2,4-триазол-1-іл}метил)піперидин1-іл]етил}феніл)етил]аміно}етил]хінолін2(1Н)-ону (Отримання 14, 2,30 г, 2,81 ммоль), застосовуючи той же спосіб, як описано в отриманні 8,, отримуючи жовтий твердий матеріал з 91 % виходу, 2,10 г. + РХ-МС: ІЕР m/z 819 [М+Н] 1 Н ЯМР (400 МГц, МЕТАНОЛ-d4) = -0,28 (с, 3Н),-0,04 (с, 3Н), 0,77 (с, 9Н), 1,02-1,22 (m, 3Н), 1,22-1,51 (m, 6Н), 1,51-1,76 (m, 5Н), 1,95 (m, 1Н), 2,08 (m, 2Н), 2,39 (m, 1Н), 2,57 (m, 2Н), 2,692,81 (m, 5Н), 2,84-2,94 (m, 3Н), 3,07 (m, 2Н), 4,08 (d, 2Н), 5,13 (m, 1Н), 6,62 (d, 1Н), 6,91 (d, 1Н), –1 6,99-7,11 (m, 5Н), 7,16 (m, 1Н), 7,25 (m, 2Н), 7,59 (d, 2Н), 8,32 (с, 1Н), 8,38 (d, 1Н) млн . Отримання 16 1-(піролідин-1-ілметил)-1Н-1,2,4-триазол 15 N N N N 20 25 Триазол (10 г, 144,8 ммоль) та піролідин (11,3 г, 159,0 ммоль) розчиняли в етанолі (60 мл) та додавали формальдегід (37 % водний розчин, 12,9 мл, 159,0 ммоль). Після перемішування при кип'ятінні під зворотним холодильником протягом 4 годин реакційну суміш тримали при кімнатній температурі протягом 18 годин. Розчинник видаляли під вакуумом, та залишок розподіляли між дихлорметаном (150 мл) та водою (80 мл). Водну фазу відокремлювали та екстрагували ще дихлорметаном (80 мл). Комбіновані органічні шари промивали розсолом (100 мл), сушили безводним магнію сульфатом, фільтрували та розчинник видаляли під вакуумом, отримуючи заголовну сполуку як жовту оливу з 55 % виходу, 12,2 г. 1 Н ЯМР (400 МГц, ХЛОРОФОРМ-d) = 1,75 (m, 4Н), 2,70 (m, 4Н), 5,13 (с, 2Н), 7,94 (с, 1Н), –1 8,13 (с, 1Н) млн . Отримання 17 Циклогексил(феніл)[1-(піролідин-1-ілметил)-1Н-1,2,4-триазол-5-іл]метанол 30 N N N OH N 35 40 1-(піролідин-1-ілметил)-1Н-1,2,4-триазол (Отримання 16, 12,0 г, 78,84 ммоль) розчиняли у тетрагідрофурані (120 мл) та розчин охолоджували до -78 °C. н-Бутил літій (2,5М у гексанах, 34,7 мл, 86,7 ммоль) тоді додавали краплями протягом 30 хв. Після нагрівання до кімнатної температури та перемішування протягом 1 години реакційну суміш охолоджували до -78 °C та розчин циклогексил(феніл)метанону (16,3 г, 86,7 ммоль) у тетрагідрофурані (30 мл) додавали краплями. Після нагрівання до кімнатної температури протягом 18 годин, додавали воду (100 мл) та розчинник видаляли під вакуумом. Залишок розподіляли етилацетатом (200 мл), водну фазу відокремлювали та знов екстрагували етилацетатом (2 × 200 мл). Комбіновані органічні 25 UA 99524 C2 5 шари сушили безводним магнію сульфатом, фільтрували та розчинник видаляли під вакуумом, отримуючи заголовну сполуку як жовту оливу з 100 % виходу, 27,28 г. 1 Н ЯМР (400 МГц, ХЛОРОФОРМ-d) = 1,00-1,94 (m, 14Н), 2,49 (m 1Н), 2,71 (m, 4Н), 5,08 (с, –1 2Н), 7,19 (m, 1Н), 7,30 (m, 2Н), 7,72 (m, 2Н), 8,00 (с, 1Н) млн . Отримання 18 Циклогексил(феніл)1Н-1,2,4-триазол-3-ілметанол N N N H 10 15 20 OH Циклогексил(феніл)[1-(піролідин-1-ілметил)-1Н-1,2,4-триазол-5-іл]метанол (Отримання 17, 27,28 г, 80,12 ммоль) розчиняли в етанолі (400 мл) та додавали порціями натрію борогідрид (3,03 г, 80,1 ммоль). Після перемішування при кип'ятінні під зворотним холодильником протягом 3 годин реакційну суміш залишали охолонути до кімнатної температури протягом 18 год. Розчинник видаляли під вакуумом та залишок очищали хроматографією на колонці з силікагелем, елюючи сумішшю пентан:етилацетат (3:1-0:1, за об'ємом), отримуючи заголовну сполуку як білу пінку з 79 % виходу, 16,4 г. РХ-МС: ХІАТ ІЕР m/z 256 [М-Н] 1 Н ЯМР (400 МГц, ХЛОРОФОРМ-d) = 0,90-1,80 (m, 10Н), 2,46 (m 1Н), 7,25 (m, 1Н), 7,33 (m, –1 2Н), 7,67 (m, 2Н), 8,00 (с, 1Н) млн . Отримання 19 Трет-бутил-4-({3-[циклогексил(гідрокси)фенілметил]-1Н-1,2,4-триазол-1-іл}метил)піперидин1-карбоксилат N OH N N N O O 25 30 35 Заголовну сполуку отримували з циклогексил(феніл)1Н-1,2,4-триазол-3-ілметанолу (Отримання 18, 500 мг, 1,94 ммоль) та трет-бутил 4-(бромметил)піперидин-1-карбоксилату (649 мг, 2,33 ммоль), застосовуючи той же спосіб, як описано в отриманні 3, отримуючи прозору оливу з 47 % виходу, 415 мг. + РХ-МС: ХІАТ ІЕР m/z 381 [М+Н] 1 Н ЯМР (400 МГц, МЕТАНОЛ-d4) = 1,05-1,45 (m, 9Н), 1,43 (с, 9Н), 1,52 (m, 2Н), 1,67 (m, 3Н), 2,09 (m, 1Н), 2,38 (m, 1Н), 2,72 (m, 2Н), 4,08 (m, 4Н), 7,17 (m, 1Н), 7,26 (m, 2Н), 7,58 (d, 2Н), 8,30 –1 (с, 1Н) млн . Отримання 20 Циклогексил(феніл)[1-(піперидин-4-ілметил)-1Н-1,2,4-триазол-3-іл]метанол N OH N N HN 26 UA 99524 C2 5 10 Заголовну сполуку отримували з трет-бутил 4-({3-[циклогексил(гідрокси)фенілметил]-1Н1,2,4-триазол-1-іл}метил)піперидин-1-карбоксилату (Отримання 19, 450 мг, 0,990 ммоль), застосовуючи той же спосіб, як описано в отриманні 4, отримуючи прозору оливу з 91 % виходу, 320 мг. + РХ-МС: ХІАТ ІЕР m/z 378 [М+Nа] 1 Н ЯМР (400 МГц, МЕТАНОЛ-d4) = 1,04-1,35 (m, 9Н), 1,39-1,55 (m, 2Н), 1,59-1,75 (m, 3Н), 2,03(m, 1Н), 2,38 (m, 1Н), 2,5 (m, 2Н), 3,01 (m, 2Н), 4,05 (d, 2Н), 7,15 (m, 1Н), 7,27 (m, 2Н), 7,58 (d, –1 2Н), 8,31 (с, 1Н) млн . Отримання 21 Ді-трет-бутил {9-[4-({3-[циклогексил(гідрокси)фенілметил]-1Н-1,2,4-триазол-1-іл}метил)піперидин-1-іл]ноніл}імідодикарбонат N O OH N O N O N N O 15 20 Заголовну сполуку отримували з циклогексил(феніл)[1-(піперидин-4-ілметил)-1Н-1,2,4триазол-3-іл]метанолу (Отримання 20, 300 мг, 0,846 ммоль) та ді-трет-бутил (9бромноніл)імідодикарбонату (US04167167, 357 мг, 0,846 ммоль), застосовуючи той же спосіб, як описано в отриманні 5, отримуючи білу пінку з 61 % виходу, 360 мг. + РХ-МС: ХІАТ ІЕР m/z 696 [М+Н] 1 Н ЯМР (400 МГц, МЕТАНОЛ-d4) = 1,14 (m, 4Н), 1,23-1,37 (m, 18Н) 1,46-1,60 (m, 24Н) 1,68 (m, 2Н) 1,96 (m, 2Н) 2,33 (m, 2Н) 2,95(m, 2Н) 3,55 (m, 2Н) 4,07 (m, 2Н) 7,16 (m, 1Н) 7,26 (m, 2Н) –1 7,58 (m, 2Н) 8,31 (с, 1Н) млн . Отримання 22 (1-{[1-(9-амінононіл)піперидин-4-іл]метил}-1Н-1,2,4-триазол-3-іл)(циклогексил)фенілметанол 25 N OH N N H2N 30 35 N Заголовну сполуку отримували з ді-трет-бутил {9-[4-({3-[циклогексил(гідрокси)фенілметил]1Н-1,2,4-триазол-1-іл}метил)піперидин-1-іл]ноніл}імідодикарбонату (Отримання 21, 360 мг, 0,57 ммоль), застосовуючи той же спосіб, як описано в отриманні 6, отримуючи прозору оливу з 90 % виходу, 230 мг. + РХ-МС: ХІАТ m/z 496 [М+Н] 1 Н ЯМР (400 МГц, МЕТАНОЛ-d4) = 1,12 (m, 4Н), 1,22-1,39 (m, 18Н), 1,39-1,58 (m, 6Н), 1,64 (m, 2Н), 1,94 (m, 2Н), 2,31 (m, 2Н), 2,65 (m, 2Н), 2,93 (m, 2Н), 4,06 (d, 2Н), 7,16 (m, 1Н), 7,25 (m, –1 2Н), 7,58 (d, 2Н), 8,31 (с, 1Н) млн . Отримання 23 8-(бензилокси)-5-[(1R)-1-{[трет-бутил(диметил)силіл]окси}-2-({9-[4-({3[циклогексил(гідрокси)фенілметил]-1Н-1,2,4-триазол-1-іл}метил)піперидин-1-іл]ноніл}аміно)етил]хінолін2(1Н)-он 40 27 UA 99524 C2 N O OH N Si N H N N O HN O 5 10 15 Заголовну сполуку отримували з (1-{[1-(9-амінононіл)піперидин-4-іл]метил}-1Н-1,2,4триазол-3-іл)(циклогексил)фенілметанолу (Отримання 22, 150 мг, 0,303 мг) та 8-(бензилокси)-5[(1R)-2-бром-1-{[трет-бутил(диметил)силіл]окси}етил]хінолін2(1Н)-ону (WО05/09286, 148 мг, 0,303 ммоль), застосовуючи той же спосіб, як описано в отриманні 7, отримуючи прозору оливу з 24 % виходу, 66 мг. + РХ-МС: ХІАТ m/z 904 [М+Н] 1 Н ЯМР (400 МГц, МЕТАНОЛ-d4) = 0,07 (с, 3Н), 0,37 (с, 3Н), 1,15 (с, 9Н), 1,32-1,65 (m, 22Н), 1,76 (m, 6Н), 1,92 (m, 2Н), 2,20 (m, 2Н), 2,58 (m, 2Н), 2,86 (m, 2Н), 3,01 (m, 1Н), 3,19 (m, 3Н), 4,35 (m, 2Н), 5,52 (m, 1Н), 5,61 (с, 2Н), 6,95 (d, 1Н), 7,4-7,69 (m, 8Н), 7,79 (m, 2Н), 7,86 (m, 2Н), 8,59 (с, –1 1Н), 8,74 (d, 1Н) млн . Отримання 24 5-[(1R)-1-{[трет-бутил(диметил)силіл]окси}-2-({9-[4-({3-[циклогексил(гідрокси)фенілметил]-1Н1,2,4-триазол-1-іл}метил)піперидин-1-іл]ноніл}аміно)етил]-8-гідроксихінолін2(1Н)-он N O OH N Si H N N N HO HN O 20 25 Заголовну сполуку отримували з 8-(бензилокси)-5-[(1R)-1-{[трет-бутил(диметил)силіл]окси}2-({9-[4-({3-[циклогексил(гідрокси)фенілметил]-1Н-1,2,4-триазол-1-іл}метил)піперидин-1іл]ноніл}аміно)етил]хінолін2(1Н)-ону (Отримання 23, 60 мг, 0,066 ммоль), застосовуючи той же спосіб, як описано в отриманні 8, отримуючи прозоре скло з 70 % виходу, 38 мг. + РХ-МС: ІЕР m/z 813 [М+Н] 1 Н ЯМР (400 МГц, МЕТАНОЛ-d4) = 0,05 (с, 3Н), 0,35 (с, 3Н), 1,16 (с, 9Н), 1,35-1,62 (m, 22Н), 1,68-1,85 (m, 6Н), 1,85-2,02 (m, 2Н), 2,22 (m, 2Н), 2,63 (m, 2Н), 2,90 (m, 2Н), 3,04 (m, 1Н), 3,23 (m, 3Н), 4,34 (m, 2Н), 5,47 (m, 1Н), 6,87 (d, 1Н), 7,19 (d, 1Н), 7,42 (m, 2Н), 7,53 (m, 2Н), 7,85 (m, 2Н), –1 8,58 (с, 1Н), 8,70 (d, 1Н) млн . Отримання 25 Бензил 4-({3-[гідрокси(дифеніл)метил]-1Н-1,2,4-триазол-1-іл}метил)піперидин-1-карбоксилат 30 28
ДивитисяДодаткова інформація
Назва патенту англійськоюTriazole derivatives useful for the treatment of diseases
Автори англійськоюJones, Lyn Howard, Roberts, Dannielle Frances, Strang, Ross Sinclair
Назва патенту російськоюТриазолопроизводные, полезные для лечения болезней
Автори російськоюДжонс Лин Говард, Робертс Данниелль Френсис, Стренг Росс Синклер
МПК / Мітки
МПК: C07D 401/04, A61K 31/4196, C07D 249/08, A61P 29/00, A61K 31/454, A61K 31/4709, A61P 11/00, C07D 401/06, C07D 401/14, C07D 401/12
Мітки: лікування, хвороб, корисні, триазолопохідні
Код посилання
<a href="https://ua.patents.su/44-99524-triazolopokhidni-korisni-dlya-likuvannya-khvorob.html" target="_blank" rel="follow" title="База патентів України">Триазолопохідні, корисні для лікування хвороб</a>
Попередній патент: Спосіб лазерного зварювання
Наступний патент: Спосіб контролю ступеня завантаження конвеєра
Випадковий патент: Спосіб синтезу 4-хлорфеноксіоцтової кислоти












