Йодовмісні дендримерні полімери, спосіб їх одержання та засіб для рентгенодіагностики
Номер патенту: 54370
Опубліковано: 17.03.2003
Автори: Бауер Міхель, Пресс Вольф-Рюдігер, Краузе Вернер, Майєр Франц-Карл, Шуманн-Жиамп'єрі Габріель
Формула / Реферат
1.Иодсодержащие дендримерные полимеры общей формулы (I):
А - (Х)б , (I)
где ядро А представляет собой атом азота, остаток ![]()
![]() ,
, ![]() или остаток общих формул (III) и (IV)
или остаток общих формул (III) и (IV)
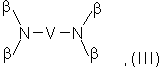
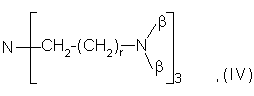
где R8 и R9 независимо друг от друга обозначают линейный или разветвленный алкильный, арильный или аралкильный остаток с количеством атомов углерода вплоть до 20, который, в случае необходимости, замещен 1-4 гидроксильными группами;
![]() обозначает место связи с остатком X, причем число
обозначает место связи с остатком X, причем число ![]() должно быть равно базисной мультиплетности б, причем б равно величине 1 - 8;
должно быть равно базисной мультиплетности б, причем б равно величине 1 - 8;
V обозначает линейный или разветвленный алкиленовый, ариленовый или аралкиленовый остаток с количеством атомов углерода вплоть до 20, который, в случае необходимости, прерывается 1 - 4 атомами кислорода и/или замещен 1-4 гидроксильными группами;
r равно 1, 2 или 3;
X обозначает состоящий из ![]() структурных единиц S и максимально 2n остатков Z, остаток, где n определяет число генераций и обозначает 1-10;
структурных единиц S и максимально 2n остатков Z, остаток, где n определяет число генераций и обозначает 1-10;
S обозначает остаток формулы (II):
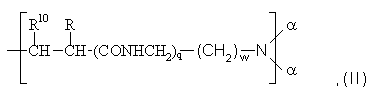
где R и R10 независимо друг от друга обозначают атом водорода или метильную группу;
w равно величине 1 или 2;
q равно величине 0 или 1,
положения ![]() для
для ![]() заняты другими структурными единицами S и для n-й генерации заняты остатками Z, причем, в случае необходимости, не занятые остатками Z положения
заняты другими структурными единицами S и для n-й генерации заняты остатками Z, причем, в случае необходимости, не занятые остатками Z положения ![]() заняты остатками -(CO)q-U-СООН, где q имеет указанное значение и U обозначает простую связь или алкиленовую цепь с количеством атомов углерода вплоть до 6, которая, в случае необходимости, прерывается 1-2 атомами кислорода и/или, в случае необходимости, замещена 1 - 4 гидроксильными группами и/или 1 - 2 карбоксильными группами, при условии, что максимально 20% положений
заняты остатками -(CO)q-U-СООН, где q имеет указанное значение и U обозначает простую связь или алкиленовую цепь с количеством атомов углерода вплоть до 6, которая, в случае необходимости, прерывается 1-2 атомами кислорода и/или, в случае необходимости, замещена 1 - 4 гидроксильными группами и/или 1 - 2 карбоксильными группами, при условии, что максимально 20% положений ![]() заняты этим остатком -(CO)q-U-СООН;
заняты этим остатком -(CO)q-U-СООН;
Z обозначает содержащий по меньшей мере одну алифатическую карбоксильную, сульфо- или фосфоновую группу и состоящий из соединительного звена Y и трииодзамещенной ароматической углеводородной группы В остаток Y - В, причем Y обозначает группу -СО-; -CONH-; -CSNH-;
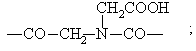
![]()
–CHR–CHR–CONH– или
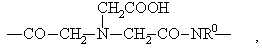
где R имеет указанное значение и R0 обозначает атом водорода; метильную или карбоксиметильную группу;
В обозначает бензольное кольцо
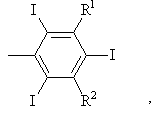
где R1 и R2 каждый независимо друг от друга, обозначают атом водорода, -CONR3R4 - или -NR6COR5 - группу, причем R3 и R4 независимо друг от друга обозначают атом водорода; замещенную, в случае необходимости, с помощью 1-5 гидроксильных групп, и/или 1-3 С1–С3-алкоксильных групп, и/или 1-3 карбоксильных, сульфо- или фосфоновых групп, линейную или разветвленную или циклическую алкильную группу с количеством атомов углерода вплоть до 12;
R3 и R4 вместе с атомом азота образуют 5- или 6-членное кольцо, содержащее, в случае необходимости, атом кислорода, SО2-группу или остаток (N-CO-R7), где R7 имеет значения карбоксильной группы или алкильной группы с количеством атомов углерода вплоть до 12, содержащий, в случае необходимости, 1-5 гидроксильных групп, 1-3 С1–С3-алкоксильных групп или 1-3 карбокси-, сульфо- или фосфоновых групп;
R5 обозначает карбоксильную группу или алкильную группу с количеством атомов углерода вплоть до 12, в случае необходимости, прерываемую атомом кислорода и/или, в случае необходимости, замещенную 1-3 карбоксильными, сульфо- или фосфоновыми группами и/или 1-5 гидроксильными группами и/или 1-3 С1-С3-алкоксильными группами;
R6 обозначает атом водорода или алкильную группу с количеством атомов углерода вплоть до 12, замещенную, в случае необходимости, 1-3 карбоксильными, сульфо- или фосфоновыми группами, и/или, в случае необходимости, 1-3 гидроксильными группами, и/или 1-3 С1-С3-алкоксильными группами;
причем структурные единицы S должны быть идентичны только для одной генерации;
с мол. м. от 5000 до 5000000, а также их соли с физиологически приемлемыми органическими и/или неорганическими основаниями, аминокислотами или амидами аминокислот.
2. Иодсодержащие дендримерные полимеры по п.1, отличающиеся тем, что ядро А обозначает группу ![]() .
.
3. Иодсодержащие дендримерные полимеры по п.1, отличающиеся тем, что S обозначает
-СН(СН3)СН(СН3)СОNH-СН2-СН2-N;
-СН(СН3)СН(СН3)СН2N;
-СН2СН2СН2N;
-СН2СН(СН3)СН2-N;
-CH2CH2-CONH-CH2CH2-N;
-СН(СН3)СН2СН2N;
-СН(СН3)СН2СОNН-СН2СН2-N;
-СН2СН(СН3)СОNН-СН2СН2-N.
4. Иодсодержащие дендримерные полимеры по п.1, отличающиеся тем, что n обозначает 2-6.
5. Иодсодержащие дендримерные полимеры по п.1, отличающиеся тем, что R1, соответственно, R2 обозначает группу CONH2; CONHCH2COOH; CON(CH2COOH)2; CONHCH2CH(OH)CH2ОH; СОN(СН3)СН2СООН; СОNНСН2РО3Н2; СОN(СН2РО3H2)2; СОN(СН2СООН)СН2РО3Н2; СОN(СН3)СН2СН(ОН)СН2OН; СОNНСН2СН2SO3Н; CON(CH2CH2SO3H).
6. Иодсодержащие дендримерные полимеры по п.1, отличающиеся тем, что R1, соответственно, R2 обозначает группу NHCO(CH2)2-COOH; NHCOCOOH; NHCOCH2OCH2COOH; NНСОСН2OСН3; N(СН2СООН)СОСH2OСН3; NНСОСН3; N(СН3)СОСН2OСН3.
7. Иодсодержащие дендримерные полимеры по п. 1, отличающиеся тем, что V обозначает группу:
-(СH2)4-; -СH2С6H4-СH2-; -(CH2)2-; -(СН2)2-O-(СH2)2-O-(СН2)2-; -СН2СНОНСН2-; -(СН2)2-O-(СН2)2-.
8. Иодсодержащие дендримерные полимеры по пп.1 и 2, отличающиеся тем, что -(CO)q-U-COOH обозначает группу: СО(СН2)2-СООН; -СОСООН; СО(СНОН)2-СООН; СОСН2OСН2СООН; СОСН2СООН; СОСН(ОСН3)СООН; СН2СН2СООН.
9. Иодсодержащий дендримерный полимер по п.1 для получения средств для рентгенодиагностики.
10. Иодсодержащий дендримерный полимер по п.1 для получения средств для рентгенодиагностики сосудистых заболеваний.
11. Способ получения иодсодержащих дендримерных полимеров, отличающийся тем, что дендримерные полимеры общей формулы (I'):
А-(Х')б , (I')
где А и б имеют указанные в п.1 значения, а
X' имеет указанное для Х в п.1 значение, причем в отличие от X, для n-й генерации положения ![]() заняты не остатками Z и, в случае необходимости, -(CO)q-U-COOH, a атомами водорода,
заняты не остатками Z и, в случае необходимости, -(CO)q-U-COOH, a атомами водорода,
вводят во взаимодействие с соединениями общей формулы (II):
Y'-B' , (II)
где
Y' обозначает остаток, содержащий карбонильную, тиокарбонильную, активированную карбонильную или CHR=CR- группу, где R имеет значение атома водорода или метильной группы, и превращаемый в Y;
В' имеет указанное для В значение трииодзамещенной ароматической углеводородной группы, причем содержащиеся в В карбоксильные и гидроксильные группы, однако, находятся в защищенной форме;
и затем, в случае необходимости, не занятые остатками Z положения ![]() , ацилируют или алкилируют с помощью вводящего остаток-(CO)q-U-COOH реагента.
, ацилируют или алкилируют с помощью вводящего остаток-(CO)q-U-COOH реагента.
12. Диагностическое средство для рентгенодиагностики, содержащее контрастное вещество в физиологически приемлемой среде, отличающееся тем, что оно в качестве контрастного вещества содержит иoдсодержащий дендримерный полимер по п.1.
Текст
1 Иодсодержащие дендримерные полимеры общей формулы (І) А - (Х)б , (І) где ядро А представляет собой атом азота, остаток p - N R * - p , p-NR R формул (III) и (IV) или остаток общих N-V-N .(IN) N -CH2-(CH2)rN .(IV) где R и R независимо друг от друга обозначают линейный или разветвленный алкильный, арильный или аралкильный остаток с количеством атомов углерода вплоть до 20, который, в случае необходимости, замещен 1-4 гидроксильными группами, р обозначает место связи с остатком X, причем число р должно быть равно базисной мультиплетности б, причем б равно величине 1 - 8, V обозначает линейный или разветвленный алкиленовый, ариленовый или аралкиленовый остаток с количеством атомов углерода вплоть до 20, ко торый, в случае необходимости, прерывается 1 - 4 атомами кислорода и/или замещен 1-4 гидроксильными группами, г равно 1, 2 или 3, п X обозначает состоящий из 1 У2 к=0 , структурных единиц S и максимально 2П остатков Z, остаток, где п определяет число генераций и обозначает 110, S обозначает остаток формулы (II) R1U R ,а •CH-CH-(CONHCH 2 ) q —(СН 2 )—N s (II) где R и R независимо друг от друга обозначают атом водорода или метильную группу, w равно величине 1 или 2, q равно величине 0 или 1, положения а для 0 < к < п — 1 заняты другими структурными единицами S и для n-й генерации заняты остатками Z, причем, в случае необходимости, не занятые остатками Z положения а заняты остатками -(CO)q-U-COOH, где q имеет указанное значение и U обозначает простую связь или алкиленовую цепь с количеством атомов углерода вплоть до 6, которая, в случае необходимости, прерывается 1-2 атомами кислорода и/или, в случае необходимости, замещена 1 - 4 гидроксильными группами и/или 1 - 2 карбоксильными группами, при условии, что максимально 20% положений а заняты этим остатком -(CO)q-U-COOH, Z обозначает содержащий по меньшей мере одну алифатическую карбоксильную, сульфо- или фосфоновую группу и состоящий из соединительного звена Y и трииодзамещенной ароматической углеводородной группы В остаток Y - В, причем Y обозначает группу -СО-, -CONH-, -CSNH-, сн 2 соон —CO-CTL-N—СО— О о го Ю 54370 сирпря —CO-CH-NH-CO— -CHR-CHR-CONH-или CH 2 COOH где R имеет указанное значение и R0 обозначает атом водорода, метильную или карбоксиметильную группу, В обозначает бензольное кольцо I R1 где R1 и R2 каждый независимо друг от друга, обозначают атом водорода, -CONR3R4 - или NR6COR5 - группу, причем R3 и R4 независимо друг от друга обозначают атом водорода, замещенную, в случае необходимости, с помощью 1-5 гидроксильных групп, и/или 1-3 Сі-Сз-алкоксильньїх групп, и/или 1-3 карбоксильных, сульфо- или фосфоновых групп, линейную или разветвленную или циклическую алкильную группу с количеством атомов углерода вплоть до 12, R3 и R4 вместе с атомом азота образуют 5- или 6членное кольцо, содержащее, в случае необходимости атом кислорода, SC^-rpynny или остаток (NCO-R), где R7 имеет значения карбоксильной группы или алкильной группы с количеством атомов углерода вплоть до 12, содержащий, в случае необходимости, 1-5 гидроксильных групп, 1-3 С-|Сз-алкоксильных групп или 1-3 карбокси-, сульфоили фосфоновых групп, R5 обозначает карбоксильную группу или алкильную группу с количеством атомов углерода вплоть до 12, в случае необходимости, прерываемую атомом кислорода и/или, в случае необходимости, замещенную 1-3 карбоксильными, сульфо- или фосфоновыми группами и/или 1-5 гидроксильными группами и/или 1-3 Ci-Сз-алкоксильными группами, R6 обозначает атом водорода или алкильную группу с количеством атомов углерода вплоть до 12, замещенную, в случае необходимости, 1 -3 карбоксильными, сульфо- или фосфоновыми группами, и/или, в случае необходимости, 1-3 гидроксильными группами, и/или 1 -3 С-і-Сзалкоксильными группами, причем структурные единицы S должны быть идентичны только для одной генерации, с мол м от 5000 до 5000000, а также их соли с физиологически приемлемыми органическими и/или неорганическими основаниями, аминокислотами или амидами аминокислот 2 Иодсодержащие дендримерные полимеры по п 1, отличающиеся тем, что ядро А обозначает группу p2N-(CH2)4-Np2,p2N(CH2)2Np2,pN(CH2CH2Np2)2,N(CH2CH2Np2)3 3 Иодсодержащие дендримерные полимеры по п 1, отличающиеся тем, что S обозначает -CH(CH3)CH(CH3)CONH-CH2-CH2-N, -CH(CH3)CH(CH3)CH2N, -CH2CH2CH2N, -CH2CH(CH3)CH2-N, -CH2CH2-CONH-CH2CH2-N, -CH(CH3)CH2CH2N, -CH(CH3)CH2CONH-CH2CH2-N, -CH2CH(CH3)CONH-CH2CH2-N 4 Иодсодержащие дендримерные полимеры по п 1, отличающиеся тем, что п обозначает 2-6 5 Иодсодержащие дендримерные полимеры по п 1, отличающиеся тем, что R1, соответственно, R2 обозначает группу CONH2, CONHCH2COOH, CON(CH2COOH)2, CONHCH2CH(OH)CH2OH, CON(CH3)CH2COOH, CONHCH2PO3H2, CON(CH2PO3H2)2, CON(CH2COOH)CH2PO3H2, CON(CH3)CH2CH(OH)CH2OH, CONHCH2CH2SO3H, CON(CH2CH2SO3H) 6 Иодсодержащие дендримерные полимеры по п 1, отличающиеся тем, что R1, соответственно, R2 обозначает группу NHCO(CH2)2-COOH, NHCOСООН, NHCOCH2OCH2COOH, NHCOCH2OCH3, N(CH2COOH)COCH2OCH3, NHCOCH3, N(CH3)COCH2OCH3 7 Иодсодержащие дендримерные полимеры по п 1, отличающиеся тем, что V обозначает группу -(СН2)4-, -СЬЬСбШ-СНг, -(СН2)2-, -(СН2)2-О-(СН2)2О-(СН2)2-, -СН2СНОНСН2-, -(СН2)2-О-(СН2)28 Иодсодержащие дендримерные полимеры по пп 1 и 2, отличающиеся тем, что -(CO)q-U-COOH обозначает группу СО(СН2)2-СООН, -СОСООН, СО(СНОН)2-СООН, СОСН2ОСН2СООН, СОСН2СООН, СОСН(ОСН3)СООН, СН2СН2СООН 9 Иодсодержащий дендримерный полимер по п 1 для получения средств для рентгенодиагностики 10 Иодсодержащий дендримерный полимер по п 1 для получения средств для рентгенодиагностики сосудистых заболеваний 11 Способ получения иодсодержащих дендримерных полимеров, отличающийся тем, что дендримерные полимеры общей формулы (Г) А-(Х')6 , (Iі) где А и б имеют указанные в п 1 значения, а X' имеет указанное для X в п 1 значение, причем в отличие от X, для п-й генерации положения а заняты не остатками Z и, в случае необходимости, -(CO)q-U-COOH, а атомами водорода, вводят во взаимодействие с соединениями общей формулы (II) V-B1 , (II) где Y' обозначает остаток, содержащий карбонильную, тиокарбонильную, активированную карбонильную или CHR=CR- группу, где R имеет значение атома водорода или метильной группы, и превращаемый в Y, В' имеет указанное для В значение трииодзамещенной ароматической углеводородной группы, причем содержащиеся в В карбоксильные и гидроксильные группы, однако, находятся в защищенной форме, и затем, в случае необходимости, не занятые остатками Z положения а , ацилируют или алкилируют с помощью вводящего остаток-(СО)д-11СООН реагента 5 54370 6 12 Диагностическое средство для рентгенодиагщееся тем, что оно в качестве контрастного веностики, содержащее контрастное вещество в щества содержит иодсодержащий дендримерный физиологически приемлемой среде, отличаюполимер по п 1 Изобретение относится к охарактеризованным в формуле изобретения объектам, т е к новым йодсодержащим дендримерным (с дендритовой структурой) полимерам, содержащим эти соединения средствам, применению полимерных соединений в качестве контрастных веществ, а также к способу получения этих соединений и средств Рентгеноконтрастные вещества являются необходимыми вспомогательными средствами при диагнозе многочисленных заболеваний, как, например, ате рос кле роти чес кие сосудистые процессы, опухоли, инфаркты, заболевания почек и мочевыводящих путей и нарушения перфузии, например, в случае сердца (ишемия, а также воспаления) Требования, которые предъявляются к такого рода контрастным веществам, касаются, прежде всего, следующего а) достаточно высокая концентрация йода в используемом растворе От нее - пока средство не разбавляют - зависит плотность для рентгеновских лучей контрастного вещества в качестве единственного параметра Это в особенности имеет место в ангиографии, когда контрастное вещество инъецируют с высокой скоростью через катетер в кровеносные сосуды и тем самым оно вытесняет кровь В ряде других исследований также желательны высококонцентрированные контрастные вещества, например, когда разбавление в организме становится обычно слишком сильным (инъекция в желудочки сердца, аорту или в случае внутривенной пальцевой субтракционной ангиографии) или в случае неблагоприятных условий записи (съемки) (так, прохождение лучей через организм более тяжелых пациентов может становиться очень длительным), б) хемотоксичность, неотъемлемое свойство растворов контрастных веществ, которое, между прочим, связано с липофильностью молекул, их сродством к протеинам и с электронной плотностью При клиническом применении оно выражается в появлении побочных действий, как тошнота, рвота, определенных реакций круга кровообращения, крапивницы, бронхоспазма и других симптомов вплоть до шока и смерти Фармакологически хемотоксичные эффекты измеряют, например, в виде ЛД50 после внутривенной инъекции, в) вязкость, величина, которая важна для процесса введения контрастных веществ, например, когда нужно быстро инъецировать большие объемы (30 - 100мл) высококонцентированных и таким образом более высоковязких растворов Кроме плохой инъецируемости более высоковязкие контрастные вещества также обладают недостатка ми, выражающимися в плохой смешиваемости с кровью (образование свилей вместо гомогенного заполнения полости сердца или кровеносных сосудов) и в воспрепятствовании прохождению через капилляры, например, легких, г) осмотичность растворов контрастных веществ В случае введения сильно гипертонических по отношению к крови и тканям растворов (физиологическая величина составляет 310м осм/кг) вода вытесняется из клеток, вследствие чего, между прочим, разрушаются оболочки клеток и нарушается "баланс" общего количества электролита Таким образом, возникает большое число отчасти серьезных побочных действий, как, например, падение кровяного давления, брадикардия вплоть до остановки сердца, нарушения гематоэнцефалического барьера, сосудистые боли и т д , д) растворимость, которая должна быть достаточно высокой в воде при физиологических значениях рН для практического применения контрастных веществ, однако, при этом слишком сильно не ухудшая одновременно переносимости и содержания йода в молекуле, е) химическая стабильность растворов контрастных веществ, которая позволяет осуществлять стерилизацию путем нагревания, а также придает способность к хранению, по меньшей мере, 24 месяца 54370 в диагнозе областей сосудов с пониженной или повышенной проницаемостью, которая, например, может быть вызвана воспалениями или опухолями, а также в лимфографии и в маммографии Поэтому существует потребность в рентгеноконтрастных веществах, которые могут маркировать сосудистое пространство Эти соединения должны отличаться хорошей переносимостью, также высокой эффективностью (сильное увеличение интенсивности сигнала, соответственно, снижение дозы) и тем, что молекулы остаются в сосудистом пространстве (никакого кровоизлияния), также как более длительным периодом полураспада, по сравнению с используемыми в ангиографии контрастными веществами Успех в попытках решить по меньшей мере часть этих проблем путем применения йодсодержащих макромолекулярных контрастных веществ до сих пор был только ограниченным Так, описанные в международной патентной заявке ВОИС-88/06162 производные декстрана обладают широким молекулярно-массовым распределением и связанным с этим неполным выделением, а также с недостаточной переносимостью Раскрытые в международной патентной заявке ВОИС-93/10824, йодсодержащие полиамины не очень хорошо растворимы в воде и к тому же относительно плохо приемлемы Поэтому существует задача нахождения новых рентгеноконтрастных веществ, прежде всего, для распознавания и локализации сосудистых заболеваний, которые не обладают указанными недостатками Эта задача решается благодаря настоящему изобретению Найдено, что йодсодержащие дендримерные (с дендритовой структурой) полимеры, которые включают азотсодержащее ядро и содержащие трииодзамещенные ароматические углеводородные группы, а также алифатические карбоксильные, сульфо- или фосфоновые группы, дающие изображение остатки, неожиданно превосходно пригодны для приготовления рентгенодиагностических средств, не обладающих указанными недостатками Предлагаемые в изобретении йодсодержащие дендримерные полимеры могут быть описаны общей формулой (1) (соннсн2) Г Д Є (П) ю R и R независимо друг от друга, обозначают атом водорода или метильную группу, "w" - равно величине 1 или 2, "q" - равно величине 0 или 1, и положения "а" для 0^1с£п-1 заняты другими структурными единицами S и для "п"-ной генерации заняты остатками Z, причем в случае необходимости не занятые остатками Z положения "а" заняты остатками -(CO)q-U-COOH, где "q" имеет вышеуказанное значение и U обозначает простую связь или алкиленовую цепь с количеством атомов углерода вплоть до 6, которая в случае необходимости прерывается 1-2 атомами кислорода и/или в случае необходимости замещена 1-4 гидроксильными группами и/или 1-2 карбоксильными группами, при условии, что максимально 20% положений "а" заняты этим остатком -(CO)q-U-COOH, Z обозначает содержащий по меньшей мере одну алифатическую карбоксильную, сульфо- или фосфоновую группу и состоящий из соединительного звена Y и трииодзамещенной ароматической углеводородной группы В, дающий изображение остаток Y-B, причем Y обозначает группу -СО-, CONH-, -CSNH-, і -СО~СН 2 -Н - CO-; І -СО-СН- Ш - С 0 - ; -CHR, - CHR. - СОЯН ияи -co-cs2- я - сн2 - со - шу - -, где R имеет вышеуказанное значение, a R0 обозначает атом водорода, метильную или карбоксиметильную группу, и В - обозначает бензольное кольцо А-Мб ( D где А - обозначает азотсодержащее ядро базисной (основной) мультиплетности "б", причем "б" равно величине 1-8, и X - обозначает состоящий из п-1 ^ 2 к=0 струк турных единиц (повторяющихся звеньев) S и максимально 2П дающих изображение остатков і остаток, где "п" - определяет число генераций и обозначает цифры 1-10, S - обозначает остаток формулы (II) Т 2 R и R , каждый независимо друг от друга, обозначают атом водорода, -CONR R4- или HR6COR5- группу, причем R и R4 независимо друг от друга, обозначают атом водорода, замещенную в случае необходимости с помощью 1-5 гидроксильных групп и/или 1-3 СгСз-алкоксильных групп и/или 1-3 карбоксильных, сульфо- или фосфоновых групп, линейную или разветвленную или циклическую алкильную группу с количеством атомов углерода вплоть до 12, 3 4 R и R вместе с атомом азота образуют 5-ти или 6-ти -членное кольцо, содержащее в случае необходимости атом кислорода, SC^-rpynny или 7 7 остаток (N-CO-R ), где R имеет значения карбоксильной группы или алкильной группы с количест 54370 вом атомов углерода до 12, содержащей в случае необходимости 1-5 гидроксильных групп, 1-3 ( d Сз)-алкоксильных групп или 1-3 карбоксильных, сульфо- или фосфо-новых групп, 5 R - обозначает карбоксильную группу, с количеством атомов углерода вплоть до 12, в случае необходимости прерываемую атомом кислорода и/или в случае необходимости замещенную 1-3 карбоксильными, сульфо- или фосфоновыми группами и/или 1-5 гидроксильными группами и/или 1-3 СгСз-алкоксильными группами, 6 R обозначает атом водорода, алькильную группу с количеством атомов углерода вплоть до 12, в случае необходимости замещенную 1-3 карбоксильными, сульфо- или фосфоновыми группами и/или в случае необходимости замещенную 1-3 гидроксильными группами и/или 1-3 С-і-Сзалкоксильными группами, причем структурные единицы S должны быть идентичны только для одной генерации, а также их соли с физиологически приемлемыми органическими и/или неорганическими основаниями, аминокислотами или амидами аминокислот Под дендримерами понимают разветвленные полимерные молекулы, которые описываются, например, BAngew Chem 104, 1609(1992) Предпочтительно "п" равно 2 - 6 В качестве каскадных ядер А пригодны атом азота, остатки p-NR -р, p-NR R9, остатки общих формул (III), (IV), (V) или (VI), X я-V - н -R - C - H, Hj C (ш) -, и c H 2 2'w л сн 2 Т (/1), - сн 2 - н 9 R и R , независимо друг от друга, обозначают линейный или разветвленный алкильный, арильный или аралкильный остаток с количеством атомов углерода вплоть до 20, который в случае необходимости замещен 1-4 гидроксильными группами, р обозначает место связи с остатком X, причем число "р" должно быть равно базисной мультиплетности "б", V обозначает линейный или разветвленный алкиленовый, ариленовый или аралкиленовый остаток с количеством атомов углерода вплоть до 20, который в случае необходимости прерывается 1-4 атомами кислорода и/или замещен 1-4 гидроксильными группами, "г" равно 1, 2 или 3, "w" равно 1 или 2, и "т" равно 0, 1, 2 или 3 10 Предлагаемые согласно изобретению полимеры имеют молекулярную массу 5000 - 5000000, предпочтительно 10000 - 500000, особенно предпочтительно 20000 -100000 Базисная мультиплетность представляет собой сумму свободных валентностей азотсодержащего ядра и равна 1 -8, предпочтительно 1 -6 Самый простейший случай каскадного ядра представляет собой атом азота, три связи которого (базисная мультиплетность "б"=3) в первом "внутреннем слое" (генерация 1) заняты тремя структурными единицами S, которые, каждая, содержат концевую Nbh-rpynny, (соответственно, три атома водорода аммиака, лежащего в основе каскадного "стартера", заменены тремя структурными единицами S) Второй, вводимый в самой ближайшей следующей реакционной последовательности, слой (генерация 2) структурных единиц S (которые в вышеуказанном примере с А=атом азота занимают 3x2 =6 связей) не должен быть идентичен со структурными единицами S 1-ой генерации Предпочтительно, структурные единицы S во всех генерациях полимера идентичны После максимально 10, предпочтительно 2 - 6, особенно предпочтительно 2 - 4 генераций, самый крайний слой имеет "б"х2п (в случае атома азота в качестве каскадного ядра Зх2п) положений "а" на концевых атомах азота последней генерации, которые на 80 - 100% заняты дающими изображение остатками Z и максимально на 20% остатками (CO)q-U-COOH В качестве других, предпочтительных каскадных "стартеров" А(Н)б следует, например, указать трис-(2-аминоэтил)амин (6=6), трис-(3аминопропил)амин (6=6), диэтилентриамин (6=5), триэтилентетраамин (6=6), тетраэтиленпентамин (6=7), тетраметилендиамин (6=4), 1,4,7триазациклонан (6=3), 1,4,7,10тетраазациклододекан (6=4), 1,4,7,10,13пентаазациклопентадекан (6=5), 1,4,8,11тетраазациклотетрадекан (6=4), 2-гидрокси-1,3,пропандиамин (6=4), ксилилендиамин (6=4), гидроксиэтиламин (6=2), 2,3-дигидроксипропиламин (6=2), метиламин (6=2), бензиламин (6=2), анилин (6=2), бис-(2,3-дигидроксилпропиламин) (6=1), 2,3дигидроксипропилметиламин (6=1), дибензиламин (6=1), 1,8-диамино-3,6-диоксаоктан (6=4), 1,5диамино-3-окса-пентан (6=4) X обозначает ветвь дендримерного полимера, которая получается из суммы структурных единиц S и относящихся к ним, дающих изображение остатков Z Так, например, "построенный" из "п"=3 генераций полимер содержит в целом 3-1 "б"х ^ 2 к (=2°+21+22)="б"х7 структурных единиц S и имеет "б"х23="б"х8 концевых положений "а", которые заняты максимально "б"х8 дающими изображение остатками Z Предпочтительными структурными единицами S являются -CH(CH3)CH(CH3)CONH-CH2-CH2-N, CH(CH3)CH(CH3)CH2N, -CH2CH2CH2-N, CH2CH(CH3)CH2-N, -CH2CH2-CONH-CH2CH2-N, CH(CH3)CH2CH2N, -CH(CH3)CH2CONH-CH2CH2-N, CH2CH(CH3)CONH-CH2CH2-N 12 11 54370 1 В качестве содержащихся в R -, соответстдержать вплоть до 6, предпочтительно вплоть до 2 венно, R - заместителях трииодзамещенной аро2, С-атомов и в случае необходимости может прематической углеводородной группы В алкильных рываться 1-2 атомами кислорода и/или в случае 3 4 7 групп R , R и R принимают во внимание линейнеобходимости может быть замещена 1-4, предные или разветвленные или циклические углевопочтительно 1-2 гидроксильными группами и/или дородные остатки с количеством атомов углерода 1-2 карбоксильными группами В качестве примевплоть до 12, предпочтительно вплоть до 10, осора остатков -(CO)q-U-COOH следует указать бенно предпочтительно вплоть до 6, которые заСО(СН2)2СООН, -СОСООН, -СО(СНОН)2СООН, мещены 1-5, предпочтительно 1-3 гидроксильныСОСН2ОСН2СООН, -СОСНэСООН, ми группами и/или 1-3 Ci-Сз-алкоксильными и/или СОСН(ОСН3)СООН, СН2СН2СООН, 1-3, предпочтительно одной, карбоксильными, СН(СН3)СН2СООН, СН2СН(СН3)СООН, сульфо- или фосфоновыми группами СН(СНз)СН(СНз)СООН, причем предпочтительны остатки -СО(СН2)2СООН, СОСНОСН2СООН, Особенно следует назвать, например, меСН2СН2СООН тил ьную, гидрокси-метильную, этил ьную, 2гидрокси-этильную, 2-гидрокси-1 Кислотные атомы водорода содержащихся в (гидроксиметил)этильную, 1полимере кислотных групп могут быть полностью или частично заменены катионами неорганических (гидроксиметил)этильную, пропильную, изопрои/или органических оснований, аминокислот или пильную, 2-гидроксипропильную, 3амидов аминокислот гидроксипропильную, 2,3-дигидроксипропильную, 1,2,3-тригидроксипропильную, бутил ьную, изобуПригодными катионами неорганических оснотильную, 2-гидрокси-бутильную, 3-гидроксиваний являются, например, ион лития, калия, бутильную, 4-гидрокси-бутильную, 2-, 3- и 4кальция, магния и в особенности натрия Пригодгидрокси-2-метилбутильную, 2- и 3-гидроксиными катионами органических оснований являютизобутильную, 2,3,4-тригидроксибутильную, 1,2,4ся, между прочим, таковые первичных, вторичных тригидроксибутильную, пентильную, циклопенили третичных аминов, как, например, этанолатильную, циклогексильную, 2,3,4,5,6мин, диэтаноламин, морфолин, глюкамин, N,Nдиметил-глюкамин, и в особенности N-метилпентагидрокси-гексильную, 2-метокси-этильную, глюкамин Пригодными катионами аминокислот карбоксиметильную, 2-сульфоэтильную, фосфоявляются, например, таковые лизина, аргинина и нометильную, 2-карбокси-этильную, 10-гидроксиорнитина, а также амидов других кислых или нейдецильную, карбоксильную, 3-сульфопропильную, тральных аминокислот 2-фосфоно-этильную группу Образованное заместителями R3 и R4 при Предлагаемые согласно изобретению соедивключении амидного азота гететроциклическое 5нения обладают указанными вначале желательили 6-членное кольцо в случае необходимости ными свойствами Они содержат необходимое для может содержать атом кислорода, SO2-rpynny или их применения в качестве рентгеноконстрастных 7 остаток (N-CO-R ) веществ число трииодзамещенных ароматических углеводородных групп Они распределяются тольВ качестве пригодных гетероциклов следует, ко в сосудистом пространстве и поэтому могут например, назвать пиперид ильное, пиразол имаркировать его с помощью рентгенодиагностики дильное, морфолинильное, N-замещенное пиперазинильное, З.З-диоксотиоморфолинильное Содержание йода в предлагаемых согласно кольцо изобретению соединениях составляет в среднем 40% по сравнению с другими, содержащими йоВ качестве остатков R5 и R6, содержащихся в 1 2 доароматические группы макромолекулами, как R - соответственно, R - заместителях трииодзаописанные в ВОИС-88/06162 производные декстмещенной ароматической углеводородной группы рана (примерно 2 - 35%), отчасти в несколько раз В, дополнительно к соответствующим, указанным выше Предлагаемые согласно изобретению содля R3, R4, и R7 остаткам, следует, например, наединения, в противоположность описанным в ВОзвать карбоксиметоксиметильную, 5-карбоксиИС-88/06162 производные декстрана, неожиданно 165-дигидрокси-З-оксапен-тильную, 2-карбокси-1 могут смешиваться с водой в любом соотношении, гидрокси-этильную, З-карбокси-2-оксапропильную что приводит к более высокой концентрации конгруппу трастного вещества в кровеносных сосудах вскоре Обозначающий R и R , соответственно, V , после инъекции и таким образом благоприятно алкильный, арильный или аралкильный остаток, воздействует на резкость изображения кровеноссоответственно, алкиленовый, ариленовый или ных сосудов Ответственное за побочные дейстаралкиленовый остаток, может быть линейным вия, как боли, повреждения кровеносных сосудов или разветвленным и может содержать вплоть до и нарушения кровообращения сердца, значение 20, предпочтительно вплоть до 12 С-атомов осмотичности отчетливо уменьшено и более не R8 и R9 - заместитель может быть замещен 1гиперосмотично, как, в противном случае, зачас4, предпочтительно 1-2 гидроксильными группами, тую наблюдается при использовании рентгеноконобозначенная как V цепь (в случае необходимости трастных веществ (Пример 1j) 220 [м осмол/кг] дополнительно) прерывается 1-4, предпочтительпри 37°С, 130мг йода/мл) Осмотичность предлано 1-2 атомами кислорода В качестве примера гаемых согласно изобретению соединений также следует назвать следующие группы этилен, бутиотчетливо меньше, чем у описанных в ВОИСлен, 1-метил-пропилен, пропилен, 3,688/06162 соединений декстрана (440 м осм/кг при диоксаоктилен, ксилиден, 2-гидрокси-пропилен, 390мг йода/мл) оксапентилен Обозначенная U алкиленовая цепь может соОтветственная за "острую" переносимость хео Q 14 13 54370 мотоксичность предлагаемых согласно изобрететолько в сосудистом пространстве, т е объем, в нию соединений (пример 6с) внутривенно ЛДбо котором они распределяются, составляет примермыши>5г йода/кг), как по сравнению с макромолено 0,05л/кг После внутривенного введения 300мг кулярными контрастными веществами на основе йода/кг в случае крысы предлагаемые согласно углеводоров (ВОИС-88/06162), так и также по изобретению соединения показывают полное высравнению с описанными в ВОИС-93/10824 приделение (удерживание < 1 % дозы, спустя 14 дней мерами на основе полиаминов, отчетливо улучпосле внутривенного введения) Таким образом шена впервые оказалось возможным получение макромолекулярных контрастных веществ с трииодзаПо сравнению с макромолекулами на основе мещенными ароматическими углеводородными декстрена также вязкость предлагаемых согласно группами изобретению соединений отчетливо меньше, что позволяет осуществлять введение болюса и таким Предлагаемые согласно изобретению каскадобразом отчетливо более резкое изображение ные полимеры служат в качестве контрастных кровеносных сосудов по сравнению с окружающей веществ для изображения сосудов посредством тканью (пример 6с) 4,02мПас при 37°С и 100мг рентгенодиагностики Таким образом, стало возйода/мл, пример 10 ВОИС-88/06162, 26мПас при можным отличать ишемическую ткань от нор37°С и 90мг йода/мл) мальной ткани Однако с помощью этих соединений можно также распознавать другие С помощью предлагаемых согласно изобретеповреждения барьера кровь-ткань В случае воснию соединений удается получать макромолекулы палений и опухолей в головном мозге, барьер с определенной молекулярной массой Такие, кровь-головной мозг повреждается так, что конточно определенные по величине своей молекутрастное вещество может инфильтрировать больлы, макромолекулярные контрастные вещества с ную ткань и таким образом больная ткань станойодсодержащими ароматическими углеводородвится распознаваемой с помощью ными группами до сих пор были недоступны рентгенодиагностики На основании непроницаеВ случае макромолекул на основе декстрана, мости интактного барьера кровь-головной мозг например, декстран 40000 (Rheomacrodex®), речь также для маленьких, однако, гидрофильных, моидет о смеси макромолекул различной величины, лекул можно распознавать воспаления и опухоли средняя молекулярная масса которых составляет, также уже с помощью низкомолекулярного Ultraнапример, 40000 дальтонов В этой смеси, однако, vist® Если в этих случаях, однако, применяют имеются также молекулы декстрана, которые по предлагаемые согласно изобретению каскадные величины более чем 50000, соответственно, полимеры, то их дозу можно снижать в 4 раза, так 60000 дальтонов Эта доля высокомолекулярных как макромолекулы распределяются в четырехдекстрановых соединений может составлять 5 кратно меньшем пространстве, а именно только в 10% от общего количества Как известно из литесосудистом пространстве, т е для того, чтобы ратуры (G Arturson и G Wallemus, The renal достичь одинаковых концентраций в крови, достаclearanse of dextran of different molecular sizes in точна четверть дозы normal humans, Scandmav J Clm and Lab Investigation, 1, 81 - 86 (1964)) молекулы декстрана этой Одновременно с помощью предлагаемых совеличины гломерулярно более не фильтруются, и гласно изобретению соединений можно осуществпочечный клиренс этих молекул поэтому равен лять измерения перфузии, например, в миокарде, почти нулю Также описанные в европейских пачто возможно только ограниченно с помощью низтентах ЕР-0206551, ЕР-0436316 и в примерах 1,2 комолекулярных соединений, как Ultravist®, так как и 3 ВОИС-93/10824 соединения на основании своэти молекулы быстро "выходят" в интерстициальих высокомолекулярных частей после внутривенное пространство "Выход" в интерстициальное ного введения не могут полностью выделяться От пространство в случае низкомолекулярных соедидиагностики, однако, ожидают, что после внутринений также часто приводит к нечеткости изобравенной инъекции рентгеноконтрастное вещество в жения, которого можно избегать за счет предлатечение короткого промежутка времени полностью гаемых согласно изобретению соединений удаляется из организма Другие, описанные в ВООдновременно время измерения может сильно ИС-93/10824, соединения, в противоположность удлиняться по сравнению с низкомолекулярными этому, выходят из внутрисосудистого пространстсоединениями ва слишком быстро и таким образом непригодны в Другое преимущество настоящего изобретекачестве перфузионных агентов С помощью ния заключается в том, что теперь стали доступны предлагаемых согласно изобретению соединений макромолекулы с различно липофильными или неожиданно впервые удалось получить йодсогидрофильными трииод-арильными остатками держащие полимеры, которые только медленно Благодаря этому создается возможность управпокидают сосудистое пространство, однако однолять переносимостью и фармакокинетикой этих временно еще проходят капилляры почек и таким каскадных полимеров за счет различно замещенобразом полностью выделяются На основании ных трииодарильных остатков молекулярной структуры, предлагаемые согласно Получение предлагаемых согласно изобретеизобретению соединения в первые 15 минут после нию йодсодержащих дендримерных полимеров внутривенного введения показывают концентраосуществляют тем, что дендримерные полимеры цию в крови, которая примерно в 4 раза больше, общей формулы (Г) А-(Х')б (Г), чем в случае внеклеточных рентгеноконтрастных где А и "б" указанные в п п 1-3 формулы изобревеществ, как, например, Ultravist® (рис с 58) При тения значения и X' имеет указанные для X в п 1 этом каскадные полимеры находятся в организме формулы изобретения значения, причем, однако, 15 54370 в отличие от X, для "п"-ной генерации положения "а" заняты не остатками Z и в случае необходимости -(CO)q-U-COOH, а атомами водорода, вводят во взаимодействие с соединениями общей формулы (II) 1 V-B (II), где Y' - обозначает остаток, содержащий карбонильную, тиокарбонильную, активированную карбонильную или (CHR=CR)-rpynny, где R имеет значение атома водорода или метильной группы, и превращаемый в Y, и В' имеет указанное для В значение трииодзамещенной ароматической углеводородной группы, причем содержащиеся в В карбоксильные и гидроксильные группы находятся в защищенной форме, и затем, в случае необходимости не занятые остатками Z положения "а" ацилируют, соответственно, алкилируют, с помощью вводящего остаток -(CO)q-U-COOH реагента В качестве примера активированной карбонильной группы в остатках Y' эдуктов общей формулы (II) следует назвать ангидрид, сложный пнитрофениловый эфир, лактон или хлорангидрид кислоты Например, для Y' следует назвать остатки СОСІ, НСО; ПС5 ; С О - я ' ^ і СОНН ( I ; HR 0 СОСН2 -Н я ЯНСО-CR = СНЙ,. р 16 18 17 54370 телей, при температурах 0 - 120°С, предпочтиных тельно при 20 - 75°С Реакционные времена соТак, например, в выложенных описаниях изоставляют, как правило, 1 - 48 часов, предпочтибретений к неакцептованным заявкам на патенты тельно 3 - 24 часа ФРГ №№2928417 и 2909439 описываются йодированные ароматические углеводороды, которые Взаимодействие содержащих лактоновые с помощью, например, тионилхлорида легко преструктуры трииодароматических углеводородных вращаются в соответствующие, содержащие групгрупп с соответствующими дендримерными полипы хлорангидридов кислот, ароматические углеаминами осуществляется, например, аналогично водороды описанному Т Sheradsky, Y Knobler u M F Frankel в І Org Chem , 26, 2710 (1961) способу для Изоцианат-, соответственно, изотиоцианатаминолиза 2-ациламино-4-бутиро-лактонов замещенные трииодсодержащие ароматические углеводороды можно получать путем взаимодейРеакции присоединения содержащих заместиствия соответствующих производных анилина с телей с олефиновой связью CHR=CR-CONH триифосгеном, соответственно, с тиофосгеном, в аподароматических углеводородных групп осущестротонных растворителях, как, например, 1,2вляют, например, согласно указанной в Org Synth дихлорэтан, дихлорметан, пиридин, диметилColl T V I , с 75 (1988) методике, по которой трииосульфоксид, тетрагидрофуран, диоксан, диэтилодированный акриламид в полярных растворитевый эфир, этилацетат (литература выложенное лях, как ДМФ, ДМА, пиридин, этанол, вводят во описание изобретения к неакцептованной заявке взаимодействие с желательным полиамином на патент ФРГ 2541491) Ацилирование концевых амино-групп полимеров общей формулы (Г) с помощью трииодсодерСодержащие лактоновый остаток трииодзажащих ароматичпских углеводородов, которые мещенные ароматические углеводороды получасодержат заместители в виде хлорангидрида киют, например, путем взаимодействия производнослоты, осуществляют по известным специалисту го трииодбензоилхлорида с 2-амино-4способам, например, аналогично методике, прибутиролактон-гидрохлоридом Превращение этого веденной в европейском патенте ЕР-0015867 рода описывается, например, I Brennan u PI Взаимодействие осуществляется, в общем, в поMurphy в Tetrahedron Lett 29 (17), 2063 (1988) лярных апротонных растворителях, как, например, Трииодированные ароматические углеводоДМФ, ДМА, соответственно, в смесях полярных роды с заместителями с олефиновой связью апротонных растворителей с водой, в присутствии CHR=CR-CONH можно получать аналогично данулавливателя кислоты, как, например, третичный ным ВОИС-85/01727 амин (например, триэтиламин, триметиламин, Другие ароматические остатки получают как N.N-диметиламинопиридин, 1,5описано М Sovak Radiocontrast Agents, Handbook of Experimental Pharmacology, т 73 (1984), Sprmgerдиазабицикло/4 3 0/нонен-5 (ДБУ), 1,5Verbag Berbm-Heidelberg-New York-Tokyo, или в диазабицикло/5 4 0/-ундецен-5 (ДБУ), карбонат, европейской патентной заявке ЕР-0015867 гидрокарбонат или гидроксид щелочного или щелочноземельного металла (например, карбонат Следующим объектом изобретения является калия, карбонат натрия, гидроксид лития, гидрофармацевтическое средство, которое содержит, ксид калия), при температурах 0 - 120°С, предпочпо меньшей мере, одно из предлагаемых согласно тительно 20 - 80°С, и при реакционных временах 1 изобретению соединений - 36 часов Изобретение относится, далее, к способу приготовления этих средств, который отличается тем, Последующее ацилирование, соответственно, что контрастное вещество с помощью обычных в алкилирование, в случае необходимости не свягаленовой промышленности добавок и стабилизазанных с дающими изображение остатками Y-B, торов доводится до пригодной для кишечного, концевых амино-групп осуществляют аналогично соответственно, парентерального, введения форизвестным из литературы методикам, см , напримы Фармацевтическую композицию в общем мер, Org Syn Coll, т 4, с 5 (1963) можно любым образом приспосабливать к специНейтрализацию кислотных групп можно осуфическим потребностям потребителя Концентраществлять с помощью неорганических оснований цию новых рентгеноконтрастных веществ в вод(например, гидроксидов, карбонатов или бикарбоной среде выбирают полностью в зависимости от натов), например, натрия, калия, лития, магния рентгенодиагностического метода Содержание или кальция и/или органических оснований, как, йода в растворах обычно находится в пределах 50 между прочим, первичные, вторичные и третич- 450мг/мл, предпочтительно 70 - 200мг/мл ные амины, как, например, этаноламин, морфолин, глюкамин, N-метил- и N.N-диметил-глюкамин, Полученные в результате средства затем в а также основные аминокислоты, как, например, желательном случае стерилизуют при нагревании лизин, аргинин и орнитин, или амиды первонаВ зависимости от содержания йода и применяемочально нейтральных или кислых аминокислот го рентгенодиагностического метода, соответственно, постановки вопроса, их вводят, как правиПрименяемые в качестве эдуктов дендримерло, в дозе 30 - 2000мг йода/кг ные полимеры формулы (Г) получают известными из литературы методами (например, европейская Введение водного раствора рентгеноконтраспатентная заявка ЕР-0430863, патент США тного вещества можно осуществлять кишечно или 4507466, международная заявка ВОИС-93/14147) парентерально, таким образом, орально, ректально, внутривенно, внутриартериально, внутрисосуИспользуемые в различных способах, йодиродисто, внутрикожно, подкожно (лимфография), ванные ароматические углеводороды известны субарахноидально (миелография) или соответственно, легко получаются из извест 19 54370 Пригодными добавками являются, например, физиологически приемлые буферы (как, например, трометамин, бикарбонат, фосфат, цитрат), стабилизаторы (как, например, ДТПК, эдетат натрия, динатриймедетат кальция) или - если необходимо - электролиты (как, например, хлорид натрия) или - если необходимо - антиоксиданты (как, например, аскорбиновая кислота) или также вещества для адаптации осмотичности (как, например, маннит, глюкоза) Если для кишечного введения или для других целей желательны суспензии или растворы предлагаемых согласно изобретению средств в воде или физиологическом солевом растворе, то их смешивают с одним или несколькими, обычными в галеновой промышленности вспомогательными веществами (например, как метилцеллюлоза, лактоза, маннит) и/или поверхностно-активными агентами (например, как лецитины, твины®, Myrj®) и/или ароматическими веществами для улучшения вкуса (например, как простые эфирные масла) Нижеследующие примеры служат для более подробного пояснения предметов изобретения, не ограничивая таким образом их объема охраны Пример 1 Получение 3-(3-карбоксипропиониламино)-5(2,3-дигидрокси-пропилкарбамоил)-2,4,6трииодбензил-производного 48-кратного первичного каскадного амина (см пример 1п) а) Трис-[г\1,1\1-бис-(метоксикарбонилэтил)-2аминоэтил]амин К 103,3г (1,20моля) метил а крилата, при перемешивании и при 20°С, прикапывают 14,69г (О.ЮОмоля) трис-(2-аминоэтил)амина, растворенных в 20мл метанола Смесь перемешивают в атмосфере аргона в течение 5 дней при комнатной температуре и в течение 2-х дней при 50°С Затем выпаривают в вакууме и избыточный метилакрилат удаляют путем азеотропной перегонки с толуолом Остаток обрабатывают 150мл метанола и 30мл диэтилового эфира, перемешивают со 150мл гексана и после отделения гексановой фазы выпаривают в вакууме Получают продукт в виде желтоватой жидкости, которую без очистки вводят во взаимодействие далее Выход 66,8г (100% от теории) Анализ (в расчете на не содержащее растворителя вещество) рассчитано, % С 54,37 Н 8,21 N 8,45 О 28,97 найдено,% С54.51 Н 8,13 N 8,26 б) Получение 6-кратного первичного каскадного амина К перемешиваемому в атмосфере аргона при комнатной температуре этилендиамину в количестве 1363мл (20,25моль) в течение 2-х часов прикапывают раствор из 67,5г (0,102моля) полученного в примере (1а), сложного гексаметилового эфира в 135мл метанола После перемешивания в течение 5 дней при комнатной температуре реакционную смесь выпаривают в вакууме Остаток обрабатывают метанолом и полученный раствор промывают 5 раз диэтиловым эфиром Метанольный раствор выпаривают в вакууме, и остаток высушивают в высоком вакууме Выход 72,6г (85,6% от теории), желтоватое 20 масло Анализ (в расчете на не содержащее растворителя вещество) рассчитано, % С 52,03 Н 9,46 N 26,96 О 11,55 найдено, % С 51,90 Н 9,62 N27,17 c) Получение 12-кратного дендримерного сложного метилового эфира К 559,5г (6,28моль) метил а крилата, при перемешивании и при 20°С, прикалывают раствор 43,73г (0,053моля) (полученного в примере 16) гексаамина в 120мл метанола После перемешивания в течение 5 дней при комнатной температуре реакционную смесь выпаривают и избыточный метилакрилат максимально удаляют путем азеотропной перегонки с толуолом при пониженном давлении Остаток обрабатывают небольшим количеством метанола и полученный раствор многократно промывают смесью диэтилового эфира с гексаном Полученный после выпаривания сырой продукт очищают путем хроматографии на силикагеле 60 (Merck) (элюирующее средство метиленхлорид/метанол) После выпаривания фракций продукта получают бесцветное масло Выход 95,6г (96,8% от теории) Анализ (в расчете на не содержащее растворителя вещество) рассчитано, % С 54,12 Н 8,11 N12,02 0 25,75 найдено, % С 53,93 Н 8,35 N 11,84 d) Получение 12-кратного первичного каскадного амина К перемешиваемым в атмосфере аргона при комнатной температуре 2,0л (ЗОмоль) этилендиамина в течение 4-х часов прикалывают раствор 40,2г (21,5ммоля) (полученного в примере 1с), сложного додекаметилового эфира в 250мл метанола Реакционную смесь перемешивают в течение 5 дней при комнатной температуре, затем выпаривают, обрабатывают небольшим количеством метанола и полученный раствор многократно промывают диэтиловым эфиром Метанольный раствор продукта выпаривают в вакууме и желтоватый, маслянистый остаток высушивают в высоком вакууме Выход 47,Зг (100% от теории) Анализ (в расчете на не содержащее растворителя вещество) рассчитано, % С 52,39 Н 9,07 N 25,46 О 13,09 найдено, % С 52,18 Н 9,25 N 25,63 e) Получение 24-кратного дендримерного сложного метилового эфира К 570мл (б.ЗОмоля) метил а крилата, при перемешивании и при комнатной температуре, прикалывают раствор из 40,9г (18,6ммоля) (полученного в примере 1d) додекаамина в 180мл метанола Реакционную смесь перемешивают в течение 6 дней при комнатной температуре, затем выпаривают в вакууме и избыточный метилакрилат максимально удаляют путем азеотропной перегонки с толуолом при пониженном давлении Остаток обрабатывают небольшим количеством метанола и полученный раствор многократно промывают диэтиловым эфиром Метанольный раствор выпаривают и остаток очищают на силикагеле 60 (Merck) (элюирующее средство метанол/пиридин) После выпаривания фракций продукта получают бесцветное масло 21 54370 Выход 73,4г (92,5% от теории) Анализ (в расчете на не содержащее растворителя вещество) рассчитано, % С 54,05 Н 8,08 Н 13,13 О 24,75 найдено, % С 54,27 Н 7,82 N 13,02 f) Получение 24-кратного первичного каскадного амина К перемешиваемым в атмосфере аргона при комнатной температуре 3,0л (45моль) этилендиамина в течение 4-х часов прикалывают раствор из 72,7г (17,0ммоль) (полученного в примере 1е), каскадного соединения в 300мл метанола Реакционную смесь перемешивают в течение 5 дней при комнатной температуре, затем выпаривают, обрабатывают небольшим количеством метанола и полученный раствор многократно промывают диэтиловым эфиром Метанольный раствор продукта выпаривают в вакууме и желтоватый маслянистый остаток высушивают в высоком вакууме Выход 82,6г (98% от теории) Анализ (в расчете на не содержащее растворителя вещество) рассчитано, % С 52,51 Н 8,94 N 24,95 О 13,60 найдено, % С 52,44 Н 9,12 N 22,21 22 23 54370 мер 1h) а) г\І,г\Г-бис-(Метоксикарбонилметил)-диамид 5-амино-2,4,6-трииодизофталевой кислоты (европейский патент 0129932) Раствор из 59,6г (ЮОммоль) дихлорангидрида 5-амино-2,4,6-трииодизофталевой кислоты в 300мл N.N-диметилформамида смешивают с 27,6г (220ммоль) гидрохлорида сложного метилового эфира глицина и 61,0мл (440ммоль) триэтиламина Образуется суспензия, которую перемешивают в течение ночи при комнатной температуре в атмосфере аргона После выпаривания суспензии в вакууме получающийся остаток перекристаллизуют из метанола Выход 66,3г (94,6% от теории) Анализ (в расчете на не содержащее растворителя вещество) рассчитано, % С 23,99 Н 2,01 I 54,31 N 5,99 О 13,69 найдено, % С 23,95 Н 2,14 I 54,28 N 6,09 б) г\І,г\Г-бис-(Метоксикарбонилметил)диамид5изоцианато-2,4,6-трииодизофталевой кислоты К перемешиваемой в атмосфере аргона при температуре масляной бани 60°С суспензии из 20,7г (29,5ммоля) полученного в примере 2а), анилинового производного в 200мл 1,2-дихлорэтана добавляют 147мл (73,8ммоля) 2н толуольного раствора фосгена и 2мл N,Nдиметилформамида После полного превращения анилинового производного реакционную смесь выпаривают в вакууме, остаток перемешивают с безводным этилацетатом, отсасывают в атмосфере азота и высушивают в вакууме масляного насоса Выход 21,5г (100% от теории) светлобежевого твердого вещества Анализ (в расчете на не содержащее растворителя вещество) рассчитано, % С 24,78 Н 1,66 I 52,37 N 5,78 О 15,40 найдено, % С 24,82 Н 1,73 I 52,35 N 5,70 с) Получение З-карбоксиметилкарбамоил-5натрийкарбоксил-атометил-карбамоил-2,4,6трииодфенилкарбамоильного производного 48кратного первичного каскадного амина (см пример 1п)) К перемешиваемому при комнатной температуре и в атмосфере аргона раствору из 18,7г (22,7ммоля) полученного в примере 26) изоцианата в 200мл безводного д и метил сульфоксид а медленно прикалывают раствор из 3,72г (О.Збммоля) полученного в примере 1п) каскадного амина в 37мл безводного диметилсульфоксида Реакционную смесь перемешивают в течение 2-х дней при комнатной температуре, затем смешивают с 30мл 2н раствора гидроксида натрия и перемешивают 2 часа при 50°С После охлаждения до комнатной температуры, раствор нейтрализуют с помощью 2н соляной кислоты и затем подвергают ультрафильтрации, причем отделяются низкомолекулярные составные части благодаря мембране из полых волокон (Н 1 Р 3 - 20, Amicon) Водный раствор продукта фильтруют через мембранный целлюлозный фильтр (размер пор 0,45мкм, Sartonus) и подвергают сушке вымораживанием Выход 13,23г (81,6% от теории) желтоватого 24 лиофилизата Анализ (в расчете на безводное вещество) рассчитано, % С 28,81 Н 2,81 I 40,59 N 10,20 Na 2,45 О 15,14 найдено, % С 29,10 Н 2,98 I 40,28 N 10,41 Na 2,77 Пример 3 Получение 3,5-бис-[(І\І-карбоксиметил)натрийкарбоксилатометил-карбамоил]-2,4,6трииодфенилкарбамоильного производного 48кратного первичного каскадного амина (см пример 1п) а) N,N,N',N'-TeTpaKHC (Метоксикарбонилметил)диамида5-амино-2,4,6трииодизофталевой кислоты Раствор из 47,2г (79,2ммоля) дихлорангидрида 5-амино-2,4,6-трииодизофталевой кислоты в 250мл N.N-диметилформамида смешивают с 34,4г (174ммоль) гидрохлорида диметилового сложного эфира иминодиуксусной кислоты (синтез по Dubsky, Graenacher, Chem Ber 50, 1693 (1917) и 48,2мл (348ммоль) триэтиламина Образуется суспензия, которую перемешивают в течение ночи при комнатной температуре и в атмосфере аргона После выпаривания суспензии в вакууме, образующийся остаток обрабатывают дихлорметаном и полученный раствор встряхивают с водным раствором гидрокарбоната натрия Органическую фазу сушат над безводным сульфатом магния, отфильтровывают и после концентрирования хроматографируют на силикагеле 60 (Merck, Дарштадт) (элюирующее средство дихлорметан/метанол) Фракции, содержащие продукт выпаривают в вакууме досуха Выход 57,1г (85,3% от теории) бесцветного твердого вещества Анализ (в расчете на не содержащее растворителя вещество) рассчитано, % С 28,42 Н 2,62 I 45,05 N 4,97 О 18,93 найдено, % С 28,61 Н 2,77 I 44,83 N 4,72 б) N,N,N',N'-TeTpaKHC (Метоксикарбонилметил)диамид5-изо-цианато2,4,6-трииодизофталевой кислоты К перемешиваемому в атмосфере аргона при температуре масляной бани 60°С раствору из 30,6 г (36,2ммоля) полученного в примере За) анилинового производного в 300мл 1,2-дихлор-этана добавляют 45,3мл (90,5ммоля) 2н толуольного раствора фосгена и Змл N.N-диметилформамида После полного превращения анилинового производного, реакционную смесь выпаривают в вакууме, остаток перемешивают с простым трет -бутилметиловым эфиром, отсасывают в атмосфере азота и высушивают в вакууме масляного насоса Выход 30,3г (96,2% от теории) красноватого твердого вещества Анализ (в расчете на не содержащее растворителя вещество) рассчитано, % С 28,95 Н 2,31 I 43,70 N 4,82 О 20,20 найдено, % С 29,14 Н 2,46 I 43,56 N 4,73 с) Получение 3,5-бис-[(І\І-карбоксиметил)натрийкарбоксил-атометилкарбамоил]-2,4,6трииодфенилкарбамоильного производного 48кратного первичного каскадного амина (см при 25 54370 мер 1h) К перемешиваемому при комнатной температуре и в атмосфере аргона раствору из 28,8г (33,1ммоль) полученного в примере 36) изоцианата в 250мл безводного д и метил сульфоксид а медленно прикалывают раствор из 4,79г (0,46ммоля) полученного в примере 1п) каскадного амина в 48мл безводного диметилсульфоксида Реакционную смесь перемешивают 2 дня при комнатной температуре, затем смешивают с 66мл 2н раствора гидроксида натрия и перемешивают 2 часа при 50°С Раствор, после охлаждения до комнатной температуры, нейтрализуют с помощью 2н соляной кислоты и затем подвергают ультрафильтрации, причем благодаря мембране из полых волокон (Н 1 Р 3-20, Amicon), отделяются низкомолекулярные составные части Водный раствор продукта фильтруют через мембранный целлюлозный фильтр (размер пор 0,45мкм, Sartonus) и подвергают сушке вымораживанием Выход 20,6г (86,7% от теории) желтоватого лиофилизата Анализ (в расчете на безводное вещество) рассчитано, % С 29,58 Н 2,73 I 35,38 N 8,90 Na 4,27 О 19,14 26 27 никакого эдукта, затем выпаривают остаток обрабатывают дихлорметаном и полученный раствор встряхивают с водным насыщенным раствором гидрокарбоната натрия После высушивания над безводным сульфатом магния, органическую фазу выпаривают и остаток перекристаллизуют из смеси этилацетата с простым трет -бутилметиловым эфиром Выход 73,9г (88,6% от теории) бесцветных кристаллов Анализ (в расчете на не содержащее растворителя вещество) рассчитано, % С 27,35 Н 2,17 CI 4,25 I 45,62 N 3,36 0 17,25 найдено, % С 27,33 Н 2,28 CI 4,17 I 45,49 N 3,42 б) Получение 3-карбоксиформиламино-5-(2,3дигидроксипро-пилкарбамоил)-2,4,6трииодбензоильного производного 48-кратного первичного каскадного амина (см пример 1п)) К механически перемешиваемому при комнатной температуре раствору из 62,6г (75,0ммоль) полученного в примере 5а) хлорангидрида кислоты в 350мл N.N-диметилформамида медленно прикалывают эмульсию, состоящую из 10,9г (1,04ммоля) полученного в примере 1п) каскадного амина, 15,6мл (0,112моля) триэтиламина и 80мл воды Реакционную смесь перемешивают 2 дня при комнатной температуре, затем смешивают со 150мл 2н раствора гидроксида натрия и перемешивают 2 часа при 50°С Раствор, после охлаждения до комнатной температуры, нейтрализуют с помощью 2н соляной кислоты и после этого подвергают ультрафильтрации, причем благодаря мембране из полых волокон (Н 1 Р 3-20, Amicon) отделяются низкомолекулярные составные части Водный раствор продукта фильтруют через мембранный целлюлозный фильтр (размер пор 0,45мкм, Sartonus) и подвергают сушке вымораживанием Выход 41,9г (93,0% от теории) бесцветного лиофилизата Анализ (в расчете на безводное вещество) рассчитано, % С 29,93 Н 3,14 I 42,16 N 9,05 О 15,73 найдено, % С 30,12 Н 3,42 141,83 N9,27 Пример 6 Получение 3-(4-карбокси-3оксабутириламино)-5-(2,3-дигидрокси-пропилкарбамоил)-2,4,6-трииодбензоильного производного 48-кратного первичного каскадного амина (см пример 1п)) а) Сложный моноизопропиловыи эфир хлорангидрида дигликолевой кислоты К 24,Ог (400ммоль) безводного изопропанола при исключении влаги добавляют 46,4г (400ммоль) ангидрида дигликолевой кислоты Температуру экзотермической реакции снижают с помощью водяной бани до 90 - 100°С Спустя 1 час, реакционную смесь оставляют охлаждаться и смешивают ее с 32,0мл (440ммоль) тионилхлорида и 0,1мл N.N-диметилформамида и перемешивают в течение 15 часов при комнатной температуре и в течение 1 часа при 50°С Целевое соединение получают путем перегонки при давлении 0,01торр и температуре кипения 100 -101 °С 54370 28 Выход 67,6г (86,8% от теории) бесцветной жидкости Газовая хроматография (100% - метод) содержание 96,4% Анализ (в расчете на не содержащее растворителя вещество) рассчитано, % С 43,20 Н 5,70 СІ 18,22 О 32,88 найдено, % С 43,34 Н 5,83 СІ 18,01 б) Хлорангидрид І\І-(2,3-диацетоксипропил)амида5-[4-(2-метилэтилокси-карбонил)-3оксабутириламино]-2,4,6-трииоди-зофталевой кислоты К перемешиваемой при исключении влаги суспензии из 73,4г (ЮОммоль) хлорангидрида N(2,3-диацетоксипропил)-амида-5-амино-2,4,6трииод-изофталевой кислоты (европейский патент 0308364) в 500мл безводного диоксана при комнатной температуре добавляют 29,2г (150ммоль) полученного в примере 6а), хлорангидрида кислоты Реакционную смесь кипятят с обратным холодильником в течение нескольких часов, до тех пор, пока согласно тонкослойной хроматографии более не будет обнаруживаться никакого эдукта, затем выпаривают, остаток обрабатывают дихлорметаном и полученный раствор встряхивают с водным насыщенным раствором гидрокарбоната натрия Органическую фазу, после высушивания над безводным сульфатом магния, выпаривают и остаток перекристаллизуют из смеси этилацетата с простым трет -бутилметиловым эфиром Выход 68,2г (76,4% от теории) бесцветных кристаллов Анализ (в расчете на не содержащее растворителя вещество) рассчитано, % С 29,60 Н 2,71 СІ 3,97 I 42,65 N 3,14 0 32,88 найдено, % С 29,7 Н 2,83 СІ 3,92 I 42,41 N 3,38 с) Получение 3-(4-карбокси-3оксабутириламино)-5-(2,3-дигидроксипропилкарбамоил)-2,4,6-трииодбензоильного производного 48-кратного первичного каскадного амина (см пример 1п)) К механически перемешиваемому при комнатной температуре раствору из 44,6г (50,0ммоль) полученного в примере 66) хлорангидрида кислоты в 200мл N.N-диметилформамида медленно прикалывают эмульсию, состоящую из 7,2г (0,69ммоля) полученного в примере 1п) каскадного амина, 10,4мл (75,0ммоль) триэтиламина и 50мл воды Реакционную смесь перемешивают 2 дня при комнатной температуре, затем смешивают со 100мл 2н раствора гидроксида натрия и перемешивают 2 часа при 50°С Раствор, после охлаждения до комнатной температуры, нейтрализуют с помощью 2н соляной кислоты и после этого подвергают ультрафильтрации, причем благодаря мембране из полых волокон (Н 1 Р 3-20, Amicon) отделяются низкомолекулярные составные части Водный раствор продукта фильтруют через мембранный целлюлозный фильтр (размер пор 0,45мкм, Sartonus) и подвергают сушке вымораживанием Выход 31,49г (83,7% от теории) бесцветного лиофилизата Анализ (в расчете на безводное вещество) рассчитано, % С 31,07 Н 3,42 I 40,20 N 8,63 О 29 16,68 найдено, % С 31,37 Н 3,65 I 39,94 N 8,62 Пример 7 Получение 3-[(ІЧ-карбоксиметил)натрийкарбоксилатометилкарбамоил]-5-метоксиацетиламино-2,4,6-триод-бензоильного поизводного 48-кратного первичного каскадного амина (см пример 1п)) а) Хлорангидрид N, N-бис(метоксикарбонилметил)амида5-метоксиацетиламино-2,4,6-трииод-изофталевой кислоты Раствор из 66,8г (ЮОммоль) дихлорангидрида5-метокси-ацетиламино-2,4,6-трииодизофталевой кислоты (европейский патент 0015867) в 300мл безводного N,Nдиметилформамида смешивают с 21,75г (ИОммоль) гидрохлорида сложного диметилового эфира иминодиуксусной кислоты (синтез по Dubsky, Graenacher, Chem Ber 50, 1693 (1917)) и 30,5мл (220моль) триэтиламина Образуется суспензия, которую перемешивают в течение 14 часов при комнатной температуре и в атмосфере аргона Реакционную смесь обрабатывают дихлорметаном, полученный раствор встряхивают один раз с водой, дважды с 2н водным раствором лимонной кислоты и один раз с водным раствором гидрокарбоната натрия Органическую фазу сушат над безводным сульфатом магния и концентрируют в вакууме За счет прикалывания ди-трет бутилового эфира в концентрированный раствор целевое соединение может осаждаться в виде кристаллического твердого вещества, которое отсасывают и высушивают в вакууме Выход 57,4г (72,4% от теории) Анализ (в расчете на не содержащее растворителя вещество) рассчитано, % С 25,76 Н 2,04 CI 4 47 I 48,04 N 3,54 0 16,15 найдено, % С 25,82 Н 2,11 CI 4,48 I 48,01 N 3,38 б) Получение 3-[(І\І-карбоксиметил)натрийкарбоксилатоме-тилкарбамоид]-5метоксиацетиламино-2,4,6-трииод-бензоильного производного 48-кратного первичного каскадного амина (см пример 1п)) К механически перемешиваемому при комнатной температуре раствору из 36,Зг (45,8ммоль) полученного в примере 7а) хлорангидрида кислоты в 200мл N.N-диметилформамида медленно прикалывают эмульсию, состоящую из 6,6г (0,64ммоля) полученного в примере 1п) каскадного амина, 9,30мл (68,7ммоль) триэтиламина и 50мл воды Реакционную смесь перемешивают 2 дня при комнатной температуре, затем смешивают со 100мл 2н раствора гидроксида натрия и перемешивают 2 часа при 50°С После охлаждения до комнатной температуры, раствор нейтрализуют с помощью 2н соляной кислоты и после этого подвергают ультрафильтрации, причем благодаря мембране из полых волокон (Н 1 Р 3-20, Amicon) отделяются низкомолекулярные составные части Водный раствор продукта фильтруют через мембранный целлюлозный фильтр (размер пор 0,45мкм, Sartonus) и подвергают сушке вымораживанием Выход 26,9г (90,5% от теории) бесцветного 54370 30 лиофилитазат Анализ (в расчете на безводное вещество) рассчитано, % С 30,43 Н 3,04 I 39,37 N 8,45 Na 2,38 О 16,34 найдено, % С 30,75 Н 3,27 I 39,04 N 8,58 Na 2,06 Пример 8 Получение І\І-[3,5-ди-(ацетиламино)-2,4,6трииодбензоил]-І\І-(карбокси-метил)-глицильного производного 48-кратного первичного каскадного амина (см пример 1п)) а) 3,5-Динитробензоил-г\І,І\І-бис(карбоксиметил)-амид 133,1г (1,00моль) иминодиуксусной кислоты растворяют в 1,50л 2н раствора гидроксида натрия и при механическом перемешивании смешивают с 230,6г (1,00моль) 3,5-динитробензоилхлорида Образуется окрашенный в темнокрасный цвет раствор, из которого путем подкисления с помощью полуконцентрированной соляной кислоты осаждается целевое соединение Осадок отсасывают, промывают водой и высушивают в вакууме Выход 260,5г (79,6% от теории) бесцветных кристаллов Анализ (в расчете на безводное вещество) рассчитано, % С 40,38 Н 2,77 N 12,84 О 44,01 найдено, % С 40,42 Н 2,85 N 12,63 б) 3,5-Диаминобензоил-г\І,І\І-бис(карбоксиметил)-амид 32,7г (ЮОммоль) описанного в примере 8а) динитросоединения вносят в 500мл метанола, смешивают с 1,6г каталлизатора на основе палладия (10% палладия-на-активном угле) и при встряхивании гидрируют с помощью водорода После поглощения теоретически рассчитанного количества водорода реакционную смесь отфильтровывают от катализатора и выпаривают досуха Остаток вводят во взаимодействие далее без очистки Выход 26,7г (100% от теории) бесцветного твердого вещества Анализ (в расчете на не содержащее растворителя вещество) рассчитано, % С 49,44 Н 4,90 N 15,72 О 29,93 найдено, % С 49,40 Н 4,98 N 15,68 с) 3,5-Диамино-2,4,6-трииодбензоил-г\І,І\І-бис(карбоксиметил)-амид 24,7г (92,4ммоль) Полученного в примере 86) соединения растворяют в 200мл воды и в течение 30 минут смешивают со 150мл 2н раствора монохлорида йода Смесь перемешивают в течение 12 часов при комнатной температуре и образовавшийся осадок отсасывают Твердое вещество суспендируют в воде, обрабатывают с помощью Юг гидросульфита натрия и снова выделяют Вещество растворяют в 300мл воды при рН=8 за счет добавления 30%-ного раствора гидроксида натрия, смешивают с 2г активного угля, перемешивают в течение 5 часов и отфильтровывают Путем подкисления фильтрата с помощью концентрированной соляной кислоты образуется осадок, который отсасывают и высушивают в вакууме Выход 40,1г (67,3% от теории) бесцветного твердого вещества 32 31 54370 Анализ (в расчете на безводное вещество) найдено, % С 31,98 Н 3,52 1 40,76 N 10,54 рассчитано, % С 20,49 Н 1,59 I 59,03 N 6,52 О Пример 9 12,40 Получение 3-[(І\І-карбоксиметил)найдено, % С 20,61 Н 1,63 I 58,86 N 6,68 метоксиацетиламино-5-(2,3-ди-гидроксипропилкарбамоил)-2,4,7-трииодбензоильного проd) 3,5-Бис-(ацетиламино)-2,4,6изводного 48-кратного первичного каскадного трииодбензоил-І\І,І\І-бис-(карбоксиметил)-амид амина (см пример 1п)) 38,6г (59,9ммоль) полученного в примере 8с), соединения вносят в смесь из 180мл уксусного а) Хлорангидрид N-(2,3ангидрида и 0,5мл концентрированной серной диацетоксипропил)амида-5-метокси-ацетиламинокислоты После перемешивания в течение ночи 2,4,6-трииод-изофталевой кислоты при комнатной температуре добавляют диэтилоК перемешиваемой при исключении влаги вый эфир и отфильтровывают образовавшееся суспензии из 73,4г (ЮОммоль) хлорангидрида Nтвердое вещество Твердое вещество растворяют (2,3-диацетоксипропил)амида5-амино-2,4,6в 300мл воды при рН=9 за счет добавления 30%трииод-изофталевой кислоты (европейский патент ного раствора гидроксида натрия и затем путем 0308364) в 500мл безводного диоксана при комподкисления с помощью концентрированной сонатной температуре добавляют 24,7г (150ммоль) ляной кислоты при рН=1 снова осаждают Осадок метоксиацетилхлорида Реакционную смесь кипяотсасывают и высушивают в вакууме тят с обратным холодильником в течение нескольких часов, до тех пор, пока согласно тонкосВыход 29,9г (68,6% от теории) бесцветного лойной хроматографии более не будет твердого вещества обнаруживаться никакого эдукта, после чего выАнализ (в расчете на безводное вещество) паривают, остаток обрабатывают дихлорметаном рассчитано, % С 24,71 Н 1,94 I 52,22 N 5,76 О и полученный раствор встряхивают с насыщен15,36 ным водным раствором гидрокабоната натрия найдено, % С 24,65 Н 2,03 I 52,31 N 5,65 После высушивания над безводным сульфатом є) І\І-[3,5-Бис-(ацетиламино)-2,4,6магния, органическую фазу выпаривают и остаток трииодбензоил]-2,6-ди-оксоморфолин перекристаллизуют из смеси этилацетата с про28,1г (38,5ммоль) Полученного в примере 8d) стым трет -бутилметиловым эфиром соединения растворяют в 56мл безводного пиридина, смешивают с 7,3мл (77ммоль) уксусного ангидрида и при исключении влаги перемешивают в течение 10 часов при комнатной температуре Путем прикалывания безводного диэтилового эфира осаждают образовавшийся ангидрид, отфильтровывают его и высушивают в вакууме Выход 27,4г (100% от теории) светлобежевого твердого вещества Анализ (в расчете на не содержащее растворителя вещество) рассчитано, % С 25,34 Н 1,70 I 53,55 N 5,91 О 13,50 найдено, % С 25,21 Н 1,83 I 53,58 N 5,86 О 13,73 f) Получение І\І-[3,5-ди-(ацетиламино)-2,4,6триииодбензоил]-І\І-(карбоксиметил)-глицильного производного 48-кратного первичного каскадного амина (см пример 1п)) К механически перемешиваемому при комнатной температуре раствору из 25,6г (Зб.Оммоль) полученного в примере 8е) ангидрида в 200мл N.N-диметилформамида медленно прикапывают)мульсию, состоящую из 5,2г (0,50ммоля) полученного в примере 1п) каскадного амина, 7,5мл (54,0ммоль) триэтиламина и 30мл воды Реакционную смесь перемешивают 2 дня при комнатной температуре, затем нейтрализуют с помощью 2н соляной кислоты и подвергают ультрафильтрации, причем благодаря мембране из полых волокон (Н 1 Р 3-20, Amicon) отделяются низкомолекулярные составные части Водный раствор продукта фильтруют через мембранный целлюлозный фильтр (размер пор 0,45мкм, и подвергают сушке вымораживанием Выход 19,5г (87,5% от теории) Анализ (в расчете на безводное вещество) рассчитано, % С 31,71 Н 3,38 I 41,02 N 10,31 0 13,58 Выход 73,2г (90,7% от теории) бесцветных кристаллов Анализ (в расчете на не содержащее растворителя вещество) рассчитано, % С 26,81 Н 2,25 СІ 4,40 I 47,21 N 3,47 0 15,87 найдено, % С 26,79 Н 2,32 СІ 4,48 I 47,13 N 3,44 б) І\І-(2,3-Дигидроксипропил)-моноамид5метоксиацетиламино-2,4,6-трииодизофталевой кислоты 60,6г (75,1ммоль) Полученного в примере 9а) хлорангидрида кислоты вносят в 376мл 1н раствора гидроксида натрия и интенсивно перемешивают примерно 45 минут в атмосфере азота Степень взаимодействия проверяют с помощью тонкослойной хроматографии, и раствор продукта без обработки используют в самой ближайшей стадии с) І\Г-(2,3-дигидроксипропил)-моноамидг\Ікарбоксиметил-5-метоксиацетил-амино-2,4,6трииод-изофталевой кислоты Полученный согласно примеру 96) раствор эдукта (75,1ммоль) в атмосфере азота смешивают с 17,5г (150,2ммоль) натриевой соли хлоруксусной кислоты и перемешивают примерно 18 часов при 90°С С помощью 2н соляной кислоты в растворе устанавливают рН=1 и его полностью выпаривают Остаток хроматографируют на силикагеле 60 (Merck) (элюирующее средство дихлорметан/м етанол/уксусная кислота=2 21)) Содержащие продукт фракции выпаривают в вакууме досуха и остаток перекристаллизуют из смеси метанола с изопропанолом Выход 47,7г (83,3% от теории) бесцветных кристаллов Анализ (в расчете на не содержащее растворителя вещество) 33 54370 рассчитано, % С 25,22 Н 2,25 I 49,96 N 3,68 О 18,90 найдено, % С 25,31 Н 2,51 I 49,82 N 3,72 d) І\Г-(2,3-дигидроксипропил)-моноамидІ\Іметоксикарбонил-метил-5-метоксиацетиламино2,4,6-трииод-изофталевой кислоты 45,8г (60,1ммоль) Полученного в примере 9с) соединения вносят в 150мл безводного метанола и перемешивают в атмосфере азота При перемешивании прикалывают 5,6мл (б.бммоль) диметилсульфита Реакционную смесь перемешивают в течение 4-х часов при комнатной температуре и в течение 1 часа кипятят с обратным холодильником Затем выпаривают, остаток перемешивают с изопропанолом, отфильтровывают и высушивают в вакууме Выход 41,2г (88,4% от теории) бесцветных кристаллов Анализ (в расчете на не содержащее растворителя вещество) рассчитано, % С 26,31 Н 2,47 I 49,06 N 3,61 О 18,55 найдено, % С 26,21 Н 2,35 I 49,13 N 3,53 є) г\Г-(2,3-Диацетоксипропил)-моноамидг\Іметоксикарбо-нилметил-5-метоксиацетиламино2,4,6-трииод-азофталевой кислоты 38,2г (49,2ммоль) Полученного в примере 9е) соединения вносят при перемешивании в смесь из 16,3мл (172ммоль) уксусного ангидрида и 150мл диоксана при исключении влаги Добавляют 0,60г (4,9ммоль) 4-г\І,І\І-диметиламинопиридина и перемешивают 2 часа при 50°С Затем реакционную смесь выпаривают, остаток перемешивают со смесью этилацетата с простым трет бутил метиловым эфиром, отфильтровывают и высушивают в вакууме Выход 37,Ог (87,4% от теории) бесцветного твердого вещества Анализ (в расчете на не содержащее растворителя вещество) рассчитано, % С 29,32 Н 2,70 I 44,26 N 3,26 О 20,46 найдено, % С 29,38 Н 2,77 I 44,17 N 3,30 f) Хлорангидрид І\Г-(2,3-диацетоксипропил)амида І\І-метоксикарбонил-метил-5метоксиацетиламино-2,4,6-трииод-изофтале-вой кислоты 35,6г (41,4ммоль) Описанного в примере 9е) соединения вносят в 150мл 1,2-дихлорэтана К перемешиваемой, при исключении влаги и при комнатной температуре, суспензии добавляют 0,1мл N.N-диметилформамида и 4,50мл (62,1ммоль) тионилхлорида Реакционную смесь кипятят с обратным холодильником до тех пор, пока более нельзя будет наблюдать никакого выделения газов Имеющийся теперь раствор выпаривают в вакууме, остаток обрабатывают дихлорметаном и полученный раствор встряхивают с насыщенным водным раствором гидрокарбоната натрия Органическую фазу сушат над безводным сульфатом магния и отфильтровывают Путем прикалывания трет -бутилметилового простого эфира к концентрированному фильтрату получают бесцветный осадок, который отсасывают и высушивают в вакууме Выход 30,6г (84,1% от теории) бесцветного 34 твердого вещества Анализ (в расчете на не содержащее растворителя вещество) рассчитано, % С 28,71 Н 2,52 CI 4,04 I 43,33 N 3,19 0 18,21 найдено, % С 28,81 Н 2,80 CI 4,28 I 43,17 N 3,31 д) Получение 3-[(І\І-карбоксиметил)метоксиацетиламино]-5-(2,3дигидроксипропилкарбамоил)-2,4,6трииодбензоильного производного 48-кратного первичного каскадного амина (см пример 1п)) К механически перемешиваемому при комнатной температуре раствору из 21,2г (24,1ммоль) полученного в примере 9f) хлорангидрида кислоты в 100мл N.N-диметилформамида медленно прикалывают эмульсию, состоящую из 3,49г (0,34ммоля) полученного в примере 1п) каскадного амина, 5,0мл (36,2ммоль) триэтиламина и 30мл воды Реакционную смесь перемешивают в течение 2-х дней при комнатной температуре, затем смешивают с 60мл 2н раствора гидроксида натрия и перемешивают 2 часа при 50°С После охлаждения до комнатной температуры, раствор нейтрализуют с помощью 2н соляной кислоты и подвергают ультрафильтрации, причем благодаря мембране из полых волокон (Н 1 Р 3-20, Amicon) отделяются низкомолекулярные составные части Водный содержащий продукт раствор фильтруют через мембранный целлюлозный фильтр (размер пор 0,45мкм, Sartonus) и подвергают сушке вымораживанием Выход 13,6г (86,8% от теории) бесцветного лиофилизата Анализ (в расчете на безводное вещество) рассчитано, % С 31,87 Н 3,58 I 39,61 N 8,50 О 16,44 найдено, % С 31,98 Н 3,68 I 39,43 N 8,62 Пример 10 Получение 3-(3-карбоксипропиониламино)-5(2,3-дигидроксипро-пилкарбамоил)-2,4,6трииодбензоильного производного 6-кратного первичного каскадного амина (см пример 10а)) а) Трис-{/7,7-бис-(4,7-диаза-3-оксогептил)/-4,7диаза-3-оксогептил}-амин (каскадный амин с 6 первичными амино-группами) 127,0г (121,6ммоль) этого каскадного амина получают согласно патенту США 4507466 путем взаимодействия триметилового сложного эфира нитрилотрипропионовой кислоты (Pfaltz и Bauer) с 1 этилендиамином, 2 метил а крил атом и 3 этилендиамином Анализ (в расчете на безводное вещество) рассчитано, % С 51,75 Н 8,98 N 25,48 О 13,79 найдено, % С 51,48 Н 9,04 N 25,70 б) Получение З-(З-карбоксипропиониламино)5-(2,3-дигид-роксипропил-карбамоил)-2,4,6трииодбензоильного производного 6-кратного первичного каскадного амина (см пример 10а)) К механически перемешиваемому при комнатной температуре раствору из 24,9г (28,9ммоль) полученного в примере 1і) хлорангидрида кислоты в 120мл N.N-диметилформамида медленно прикалывают эмульсию, состоящую из 3,35г (3,21ммоль) полученного в примере 16) каскадного амина, 6,01мл (43,3ммоль) триэтиламина и 35 36 рации, причем благодаря мембране из полых волокон (Н 1 Р 3-20, Amicon) отделяются низкомолекулярные составные части Водный, содержащий продукт раствор фильтруют через мембранный целлюлозный фильтр (размер пор 0,45мкм, Sartonus) и подвергают сушке вымораживанием Выход 12,1г (88,0% от теории) бесцветного лиолфилизата Анализ (в расчете на безводное вещество) рассчитано, % С 28,33 Н 2,76 I 39,91 N 10,03 Na2,41 0 13,21 S3.36 найдено, % С 28,45 Н 2,99 I 39,69 N 10,20 Na 2,19 S 3,21 Пример 12 Получение 3-карбоксиметилкарбамоил-5-['(І\Іметоксиацетил)метиламино]-2,4,6трииодбензоильного производного 32-кратного первичного каскадного амина (см пример 126) а) Хлорангидрид N'-этоксикарбонил метиламида М-метокси-ацетил-5-метиламино-2,4,6трииод-изофталевой кислоты Раствор 68,2г (ЮОммоль) дихлорангидрида Nметоксиацетил-5-метиламино-2,4,6-трииодизофталевой кислоты (европейский патент 0015867) в 500мл N.N-диметилформамида смешивают с 14,0г (ЮОммоль) гидрохлорида сложного этилового эфира глицина (получение по D, А Hoogwater, М Peereboom, Tetrahedron, 46, 5325 5332 (1990)) и 10,1г (ЮОммоль) триэтиламина Образуется суспензия, которую перемешивают в течение ночи в атмосфере аргона и при комнатной температуре Затем ее выпаривают и остаток хроматографируют на силикагеле 60 (Merck) с помощью смеси дихлорметана с этилацетатом После выпаривания содержащих продукт фракций получают бесцветное твердое вещество, которое высушивают в вакууме 54370 30мл воды Реакционную смесь перемешивают 2 дня при комнатной температуре, затем смешивают с 60мл 2н раствора гидроксида натрия и перемешивают 2 часа при 50°С После охлаждения до комнатной температуры раствор нейтрализуют с помощью 2н соляной кислоты и подвергают ультрафильтрации, причем благодаря мембране из полых волокон (Н 1 Р 3-20, Amicon) отделяются низкомолекулярные составные части Водный, содержащий продукт, раствор фильтруют через мембранный целлюлозный фильтр (размер пор 0,45 мкм, Sartonus) и подвергают сушке вымораживанием Выход 15,0г (76,2% от теории) бесцветного лиофилизата Анализ (В расчете на безводное вещество) рассчитано, % С 30,43 Н 3,24 I 42,87 N 8,15 О 15,31 найдено, % С 30,50 Н 3,24 I 42,69 N 8,16 Пример 11 Получение З-карбоксиметилкарбамоил-5натрийкарбоксилатометил-карбамоил-2,4,6трииодфенилтиокарбамоилыюго производного 48кратного первичного каскадного амина (см пример 1п)) а) г\1,г\Г-бис-(метоксикарбонилметил)-диамид5изотиоциана-то-2,4,б-трииод-изофталевой кислоты) К перемешиваемой при комнатной температуре суспензии из 17,3г (24,7ммоль) описанного в примере 2а) анилинового производного в 170мл 1,2-дихлорэтана добавляют 20мл поливинилпиридина (Reillex) 50мл воды и 3,66мл (49,4ммоль) тиофосгена в 30мл 1,2-дихлорэтана После перемешивания в течение 3-х часов при 50°С реакционную смесь обрабатывают дихлорметаном, органическую фазу отделяют, сушат над безводным сульфатом магния и отфильтровывают Фильтрат выпаривают в вакууме, остаток перемешивают с этилацетатом, отсасывают и высушивают в вакууме Выход 16,6г (90,7% от теории) светлобежевого твердого вещества Анализ (в расчете на не содержащее растворителя вещество) рассчитано, % С 24,25 Н 1,63 I 51,24 N 5,66 О 12,92 S 4,32 найдено, % С 24,33 Н 1,74 I 51,12 N 5,65 S 4,53 б) Получение З-карбоксиметилкарбамоил-5натрийкарбоксил-атометил-карбамоил-2,4,6трииодфенилтиокарбамоильного производного 48кратного первичного каскадного амина (см пример 1п)) К механически перемешиваемому при комнатной температуре раствору из 15,8г (21,3ммоль) полученного в примере 11а) изотиоцианата в 80мл диметилсульфоксида прикапывают раствор из 3,1 г (О.ЗОммоля) полученного в примере 1п) каскадного амина в 30мл диметилсульфоксида Реакционную смесь перемешивают в течение 2-х дней при комнатной температуре, затем смешивают с 30мл 2н раствора гидроксида натрия и перемешивают 2 часа при 50°С Раствор, после охлаждения до комнатной температуры, нейтрализуют с помощью 2н соляной кислоты и подвергают ультрафильт Выход 53,4г (71,49% от теории) Анализ (в расчете на не содержащее растворителя вещество) рассчитано, % С 25,68 Н 2,15 CI 4,74 I 50,87 N 3,74 0 12,83 найдено, % С 25,84 Н 2,31 CI 4,62 I 50,59 N 3,69 б) Получение З-карбоксиметилкарбамоил-5/(|\1-метоксиацетил)метиламино-2,4,6трииодбензоильного производного 32-кратного первичного каскадного амина (см пример 126)) К механически перемешиваемому при комнатной температуре и в атмосфере аргона раствору из 31,6г (42,2ммоль) полученного в примере 12а) хлорангидрида кислоты в 200мл N,Nдиметилформамида одновременно прикалывают раствор 3,12г (0,88ммоля) каскадного амина ДАВ (РА)4 (РА)8 (РА)іб (РА)з2 (ВОИС-93/14147, пример VIII) в 30мл воды и 6,41г (63,3ммоль) триэтиламина Реакционную смесь перемешивают 2 дня при комнатной температуре, затем смешивают с 50мл 2н раствора гидроксида натрия и перемешивают 1,5 часа при 50°С После охлаждения до комнатной температуры, раствор нейтрализуют с помощью 2н соляной кислоты и подвергают ультрафильтрации, причем благодаря мембране из полых волокон (Н 1 Р 3-20, Amicon) отделяются низкомолекулярные составные части Водный, содержащий продукт раствор фильтруют через 37 мембранный целлюлозный фильтр (размер пор 0,45мкм, Sartonus) и подвергают сушке вымораживанием Выход 18,7г (83,7% от теории) бесцветного лиофилизата Анализ (в расчете на безводное вещество) рассчитано, % С 29,88 Н 3,11 I 47,96 N 6,95 О 12,00 найдено, % С 30,04 Н 3,21 I 47,73 N 6,99 Пример 13 Получение 3-[(І\І-карбоксиметил)натрийкарбоксилатометилкарба-моил]-5-[(І\Іметоксиацетил)метиламино]-2,4,6трииодбензоильного производного 64-кратного первичного каскадного амина (см пример 136)) а) Хлорангидрид N,Nбис(этоксикарбонилметил)амида1\1-метоксиацетил-5-метиламино-2,4,6-трииодизофталевой кислоты Раствор из 68,2г (ЮОммоль) дихлорангидрида |\|-метокси-ацетил-5-метиламино-2,4,6-трииодизофталевой кислоты (европейский патент 0015867) в 500мл N.N-диметилформамида смешивают с 22,6г (ЮОммоль) гидрохлорида сложного диэтилового эфира иминодиуксусной кислоты (получение по Jongkees, Reel Trav Chimys-Bas, 27, 296 (1908)) и 10,1г (ЮОмоль) триэтиламина Образуется суспензия, которую перемешивают в течение ночи при комнатной температуре и в атмосфере аргона Затем ее выпаривают и остаток хроматографируют на силикагеле 60 (Merck) с помощью смеси дихлорэтана с этилацетатом После выпаривания содержащих продукт фракций получают бесцветное твердое вещество, которое высушивают в вакууме Выход 61,Зг (76,0% от теории) Анализ (в расчете на не содержащее растворителя вещество) рассчитано, % С 26,81 Н 2,25 CI 4,40 I 47,21 N 3,47 0 15,87 найдено, % С 26,79 Н 2,32 CI 4,43 I 47,15 N 3,52 б) Получение 3-[(І\І-карбоксиметил)натрийкарбоксилатометилкарбамоил]-5-[(І\Іметоксиацетил)метиламино]-2,4,6-трииодбензоильного производного 64-кратного первичного каскадного амина (см пример 136)) К механически перемешиваемому при комнатной температуре и в атмосфере аргона раствору из 59,8г (74,1ммоль) полученного в примере 13а), хлорангидрида кислоты в 200мл N,Nдиметилформамида одновременно прикалывают раствор 5,54г (0,77ммоля) каскадного амина ДАВ (РА)4 (РА)8 (РА)іб (РА)з2 (РА)64 (ВОИС-93/14147, пример X) в 50мл воды и 15,4мл (111ммоль) триэтиламина Реакционную смесь перемешивают 2 дня при комнатной температуре, затем смешивают со 100мл 2н раствора гидроксида натрия и перемешивают 2 часа при 50°С Раствор после охлаждения до комнатной температуры, нейтрализуют с помощью 2н соляной кислоты и подвергают ультрафильтрации, причем благодаря мембране из полых волокон (Н 1 Р 3-20, Amicon) отделяются низкомолекулярные составные части Водный, содержащий продукт раствор фильтруют через мембранный целлюлозный фильтр (размер 54370 38 пор 0,45мкм, Satrtonus) и подвергают сушке вымораживанием Выход 40,4г (93,2% от теории) бесцветного лиофилизата Анализ (в расчете на безводное вещество) рассчитано, % С 29,99 Н 2,96 I 43,46 N 6,35 О 14,61 Na2,62 найдено, % С 30,27 Н 3,19 I 43,18 N 6,48 Na 2,36 Пример 14 Получение 2-{3-[(І\І-карбоксиметил)метилкарбамоил]-5-[(І\Інатрийкарбоксилатометил)метилкарбамоил]-2,4,6трииодфенилкарбамоил}-этильного производного 24-кратного первичного каскадного амина (см пример 1f)) а) г\1,М'-бис-(Этоксикарбонил)-М,г\Г-диметилдиамид 5-акриламидо-2,4,6-трииод-изофталевой кислоты 8,7г Полученного в примере 4а) анилинового производного в 45мл N.N-диметилацетамида при 0°С смешивают с 3,12г (34,5ммоль) перегнанного хлорангидрида акриловой кислоты Реакционную смесь перемешивают в течение 18 часов при комнатной температуре и затем выливают в воду со льдом Образовавшийся осадок отсасывают и промывают водой до нейтральной реакции Сырой продукт сушат в вакууме при 50°С и очищают его с помощью ВЭЖХ (высокоэффективной жидкостной хроматографии) [стационарная фаза R P18, подвижная фаза вода/ацетонитрил] После выпаривания содержащих продукт фракций, остаток высушивают в высоком вакууме при вспенивании Выход 7,4г (79%) от теории) бесцветного твердого вещества Анализ (в расчете на безводное вещество) рассчитано, % С 31,09 Н 2,98 I 46,94 N 5,18 О 13,81 найдено, % С 30,96 Н 3,18 I 46,72 N5,04 б) Получение 2-{3-[(Nкарбоксиметил)метилкарбамоил]-5-[(І\І-натрийкарбоксилатометил)метилкарбамоил]-2,4,6трииод-фенилкарбамоил}-этильного производного 24-кратного первичного каскадного амина (см пример 1f)) К раствору из 7,05г (8,7ммоль) акриламида из примера 14а) в 25мл N.N-диметилформамида при комнатной температуре добавляют 0,895г (0,18ммоля) полиамина (пример 1f)) и реакционную смесь перемешивают в течение 5 часов при 75°С После прекращения взаимодействия, реакционную смесь выпаривают в вакууме досуха и в течение 2-х часов при 50°С смешивают с 2н раствором гидроксида натрия Когда омыление заканчивается, раствор нейтрализуют и для отделения низкомолекулярных составных частей подвергают ультрафильтрации через мембрану из полых волокон (Н 1 Р 3-20, Amicon) Водный, содержащий продукт раствор фильтруют через мембранный целлюлозный фильтр (размер пор 0,45мкм) и подвергают сушке вымораживанием Выход 6,85г (92% от теории) бесцветного лиофилизата Анализ (в расчете на безводное вещество) рассчитано, % С 30,03 Н 1,83 I 44,28 N 7,87 О 14,65 Na 1,34 54370 40 часа при 25°С Затем водный раствор подвергают ультрафильтрации, причем благодаря мембране из полых волокон (Н 1 Р 3-20, Amicon) отделяются низкомолекулярные составные части Водный, содержащий продукт раствор фильтруют через мембранный целлюлозный фильтр (размер пор 0,45мкм, Sartonus) и подвергают сушке вымораживанием Выход 31,2г (83,2% от теории) бесцветного лиофилизата Анализ (в расчете на безводное вещество) рассчитано, % С 29,66 Н 3,40 I 40,00 N 8,58 О 14,99 S 3,37 найдено, % С 29,73 Н 3,47 I 39,91 N 8,65 S 3,22 Пример 16 Получение 3,5-ди(натрийфосфонометилкарбамоил)-2,4,6-трииодарилкарбамоильного производного 12-кратного первичного каскадного амина (см пример 1d)) а) г\1,г\Г-Бис-(диэтилфосфонометил)-диамид5амино-2,4,6-трииодизофталевой кислоты Раствор из 59,6г (ЮОммоль) дихлорангидрида 5-амино-2,4,6-трииодизофталевой кислоты (выложенное описание изобретения к неакцептованной Выход 55,Зг (71,88% от теории) заявке на патент ФРГ 2926428) в 300мл N,NАнализ (в расчете на не содержащее растводиметилформамида смешивают с 36,8г рителя вещество) (220ммоль) сложного диэтилового эфира аминорассчитано, % С 21,86 Н 1,70 Вг 10,39 СІ 4,61 метанфосфоновой кислоты и 61,0мл (440ммоль) 149,49 N3,64 О 8,32 триэтиламина Образуется суспензия, которую найдено, % С 21,84 Н 1,81 Вг 10,48 СІ 4,62 I перемешивают в течение ночи в атмосфере арго49,59 N 3,69 на и при комнатной температуре После выпариб) Получение N-метоксиацетил-З-метиламинования суспензии в вакууме остаток перекристал5-(2-бромэтил-карбамоил)-2,4,6лизуют из метанола трииодбензоильного производного 48-кратного первичного каскадного амина (см пример 1п)) Выход 59,8г (69,8% от теории) К механически перемешиваемому при комнатАнализ (в расчете на не содержащее раствоной температуре и в атмосфере аргона раствору рителя вещество) из 53,8г (69,9ммоль) полученного в примере 15а) рассчитано, % С 25,22 Н 3,29 I 44,42 N 4,90 Р хлорангидрида кислоты в 200мл N,N7 23 0 14,93 диметилформамида одновременно прикалывают найдено, % С 25,16 Н 3,41 I 44,26 N 4,78 Р раствор из 10,1г (0,97ммоля) описанного в приме717 ре 1п) каскадного амина в 50мл воды и 12,6мл б) г\1,г\Г-Бис-(диэтилфосфонометил)-диамид5(90,9ммоль) триэтиламина Реакционную смесь изоцианато-2,4,6-трииодизофталевой кислоты перемешивают 2 дня при комнатной температуре, К перемешиваемой в атмосфере аргона и при затем нейтрализуют с помощью 2н соляной кислотемпературе масляной бани 65°С суспензии из ты и подвергают ультрафильтрации, причем бла25,7г (ЗОммоль) полученного в примере 16а), анигодаря мембране из полых волокон (Н 1 Р 3-20, линового производного в 200мл 1,2-дихлор-этана Amicon) отделяются низкомолекулярные составдобавляют 147мл (73,8ммоль) 2н толуольного ные части Водный, содержащий продукт раствор раствора фосгена и 2мл N.N-диметилформамида фильтруют через мембранный целлюлозный После полного превращения анилинового произфильтр (размер пор 0,45мкм, Sartonus) и подверводного реакционную смесь выпаривают в вакуугают сушке вымораживанием ме, остаток перемешивают с безводным этилацетатом, отсасывают в атмосфере азота и Выход 39,5г (89,2% от теории) бесцветного высушивают в вакууме масляного насоса лиофилизата Анализ (в расчете на безводное вещество) Выход 25,6г (96,7% от теории) светлорассчитано, % С 29,71 Н 3,30 Вг 8,41 I 40,08 N бежевого твердого вещества 8,60 О 9,90 Анализ (в расчете на не содержащее растворителя вещество) найдено, % С 29,83 Н 3,37 Вг 8,52 I 39,90 N 8,55 рассчитано, % С 25,84 Н 2,97 I 43,11 N 4,76 Р с) Получение N-метоксиацетил-З-метиламино7,02 0 16,31 5-(2-сульфо-этилкарбамоил)-2,4,6найдено, % С 25,72 Н 3,08 I 42,98 N 4,59 Р трииодбензоильного производного 48-кратного 6,91 первичного каскадного амина (см пример 1п)) с) Получение 3,5-ди37,4г (0,82ммоля) Описанного в примере 156) (натрийфосфонометилкарбамоил)-2,4,6соединения в 500мл воды смешивают с 49,6г трииоддарилкарбамоильного производного 12(ЗЭЗммоль) сульфита натрия и перемешивают 72 кратного первичного каскадного амина (см при 39 найдено, % С 29,87 Н 1,97 I 44,19 N 7,61 Na 1,16 Пример 15 Получение ІЧ-метоксиацетил-3-метиламино-5(2-сульфоэтилкарбамо-ил)-2,4,6трииодбензоильного производного 48-кратного первичного каскадного амина (см пример 1п)) а) Хлорангидрид 1\Г-(2-бромэтил)-амида Nметоксиацетил-5--метиламино-2,4,6-трииодизофталевой кислоты Раствор из 68,2г (ЮОммоль) дихлорангидрида |\1-метокси-ацетил-5-метиламино-2,4,6трииодизофталевой кислоты (европейский патент 0015867) в 500мл N.N-диметилформамида смешивают с 20,5г (ЮОммоль) гидробромида 2бромэтиламина и 20,2г (200ммоль) триэтиламина Образуется суспензия, которую перемешивают в течение ночи в атмосфере аргона и при комнатной температуре Затем ее выпаривают и остаток хроматогра-фируют на силикагеле 60 (Merck) с помощью смеси дихлорметана с етилацетатом После выпаривания содержащих продукт фракций получают бесцветное твердое вещество, которые высушивают в вакууме 42 41 54370 мер 166)) найдено, % С 30,14 Н 3,21 I 44,43 N 6,69 К перемешиваемому при комнатной темпераПример 18 туре в атмосфере аргона раствору из 22,5г Получение 3-(4-карбокси-3(25,5ммоль) полученного в примере 166) изоциаоксабутириламино)-5-(2,3,4,5,6-пентаната в 220мл безводного диметилсульфоксида гидросигексилкарбамоил)-2,4,6медленно прикалывают раствор 4,68г (2,12ммоль) трииодбензоильного производного 48-кратного полученного в примере 1d) каскадного амина в первичного каскадного амина (см пример 1п)) 47мл безводного диметилсульфоксида Реакциона) 3-Амино-5-(2,3,4,5,6ную смесь перемешивают в течение 3-х дней при пентаацетоксигексилкарбамоил)-2,4,6комнатной температуре, затем выпаривают в вытрииодбензойная кислота соком вакууме, смешивают с 14,11 мл 14,7г (20ммоль) 3-Амино-5-(2,3,4,5,6(110,5ммоль) бромтриметилсилана и перемешипентагидроксигексил-карбамоил)-2,4,6вают 26 часов при 45°С Сырой продукт по каплям трииодбензойной кислоты (выложенное описание смешивают со 150мл воды и перемешивают 4 изобретения к неакцептованной заявке на патент часа при комнатной температуре После нейтраФРГ 1928838) растворяют в 30мл N,Nлизации с помощью раствора гидроксида натрия диметилацетамида и при комнатной температуре содержащий продукт раствор подвергают ультрасмешивают с 25мг 4-(диметиламино)-пиридина фильтрации, причем благодаря мембране из поОхлаждают до 0°С и в течение 30 минут прикалылых волокон (Н 1 Р 3-20, Amicon) отделяются низвают 1163мл (120ммоль) ацетангидрида Спустя комолекулярные составные части Водный, следующие 30 минут выдерживания при этой темсодержащий продукт раствор фильтруют через пературе оставляют в течение ночи температуру мембранный целлюлозный фильтр (размер пор повышается до комнатной Избыточный ацетан0,45мкм, Sartonus) и подвергают сушке выморажигидрид вводят во взаимодействие с метанолом и ванием реакционную смесь выпаривают Остаток растворяют в 100мл бутилацетата и последовательно Выход 19,98г (78,7% от теории) желтоватого промывают раствором гидрокарбоната натрия и лиофилизата насыщенным раствором хлорида натрия После Анализ (в расчете на безводное вещество) высушивания органической фазы над сульфатом рассчитано, % С 22,86 Н 2,47 I 38,14 N 8,89 натрия раствор выпаривают досуха Сырой проNa4,61 P6.21 0 16,83 дукт без дальнейшей очистки можно использовать найдено, % С 22,69 Н 2,61 I 38,03 N 8,65 Na в ближайшей последующей стадии 4,49 Р 6,08 Пример 17 Выход 16,2г (85,6% от теории) желтоватой пены Получение триаконтакис-{3-(4-карбокси-3оксабутириламино)-5-(2,3б) Хлорангидрид 3-амино-5-(2,3,4,5,6пентаацетоксигексил-карбамоил)-2,4,6дигидроксипропилкарбамоил)-2,4-трииодбензоил}трииодбензойной кислоты бис-(4-карбокси-3-оксабутирил)-производного 32кратного первичного каскадного амина (см при15,5г (16,4ммоль) 3-Амино-5-(2,3,4,5,6мер 12) пентаацетокси-гексилкарбамоил)-2,4,6-трииодбензойной кислоты (пример 18а)) суспендируют в К механически перемешиваемому при комнат80мл этилацетата и вместе с 1,9мл (24,6ммоль) ной температуре и в атмосфере аргона раствору тионилхлорида кипятят с обратным холодильнииз 44,6г (50,0ммоль) полученного в примере 66) ком в течение 5 часов Реакционную смесь добавхлорангидрида кислоты в 250мл N,Nляют к ЗОг гидрокарбоната натрия в 300мл воды и диметилформамида одновременно прикалывают интенсивно перемешивают в течение 1,5 часов раствор 5,53г (1,56моль) каскадного амина ДАВ Затем фазы разделяют и органическую фазу су(РА)4 (РА)8 (РА)іе (РА)з2 [ВОИС-93/14147, пример шат над сульфатом натрия, отфильтровывают и VIII] в 40мл воды и 13,9мл (ЮОммоль) триэтилараствор выпаривают Маслянистый реакционный мина Реакционную смесь перемешивают 2 дня продукт сушат в высоком вакууме при вспенивапри комнатной температуре, затем смешивают с нии 1,16г (Ю.Оммоль) ангидрида дигликолевой кислоты и перемешивают следующие 24 часа После Выход 14 9г (94% от теории) светло-желтой этого добавляют 50мл 2н раствора гидроксида пены натрия и перемешивают 1,5 часа при 50°С После Анализ (в расчете на не содержащее раствоохлаждения до комнатной температуры раствор рителя вещество) нейтрализуют с помощью 2н соляной кислоты и рассчитано, % С 31,13 Н 2,93 CI 3,68 I 39,47 N подвергают ультрафильтрации, причем благодаря 2,90 0 19,90 мембране из полых волокон (Н 1 Р 3-20, Amicon) найдено, % С 31,15 Н 3,06 CI 3,52 I 39,28 N отделяются низкомолекулярные составные части 2,74 Водный, содержащий продукт, раствор фильтруют с) Хлорангидрид 5-[4-(2через мембранный целлюлозный фильтр (размер метилэтилоксикарбонил)-3-оксабутириламино]-5пор 0,45мкм, Sartonus) и подвергают сушке вымо(2,3,4,5,6-пентаацетоксигексилкарбамоил)-2,4,6раживанием трииодбензойной кислоты Выход 35,Ог (88,8% от теории) бесцветного К перемешиваемой при исключении влаги лиофилизата суспензии из 12,9г (13,3ммоль) хлорангидрида 3амино-5-(2,3,4,5,6Анализ (в расчете на безводное вещество) рассчитано, % С 30,03 Н 3,26 I 44,49 N 6,76 О пентаацетоксигексилкарбамоил)-2,4,615,45 трииодбензойной кислоты (пример 186)) в 50мл 43 54370 безводного диоксана при комнатной температуре добавляют 3,9г (20ммоль) полученного в примере 6а) хлорангидрида кислоты Реакционную смесь кипятят с обратным холодильником в течение 6 часов до тех пор, пока согласно тонкослойной хроматографии не будет обнаруживаться более никакого адукта, затем выпаривают, остаток обрабатывают дихлорметаном и полученный раствор встряхивают с насыщенным водным раствором гидрокарбоната натрия Органическую фазу, после высушивания над безводным сульфатом магния, выпаривают и остаток перекристаллизуют из смеси этилацетата с простым трет бутил метиловым эфиром Выход 11,Зг (75,7% от теории) бесцветных кристаллов Анализ (в расчете на не содержащее растворителя вещество) рассчитано, % С 34,23 Н 3,41 CI 3,16 I 33,91 N 2,50 О 22,80 найдено, % С 34,45 Н 3,53 CI 3,12 I 33,80 N 2,34 d) 3-(4-Карбокси-3-оксабутириламино)-5(2,3,4,5,6-пентагидроксигексилкарбамоил)-2,4,6трииодбензоильное производное 48-кратного первичного каскадного амина (см пример 1 п)) К механически перемешиваемому при комнатной температуре раствору из 10,8г (9,6ммоль) полученного в примере 18с) хлорангидрида кислоты в 40мл N.N-диметилформамида медленно прикалывают эмульсию, состоящую из 1,4г (0,13ммоля) полученного в примере 1п) каскадного амина, 2,0мл (15,0ммоль) триэтиламина и 10мл воды Реакционную смесь перемешивают 2 дня при комнатной температуре, затем смешивают с 20мл 2н раствора гидроксида натрия и перемешивают 2 часа при 50°С После охлаждения до комнатной температуры раствор нейтрализуют с помощью 2н соляной кислоты и затем подвергают ультрафильтрации, причем благодаря мембране из полых волокон (Н 1 Р 3-20, Amicon) отделяются низкомолекулярные составные части Водный раствор продукта фильтруют через мембранный целлюлозный фильтр (размер пор 0,45мкм, Sartonus) и подвергают сушке вымораживанием Выход 5,4г (82,3% от теории) бесцветного лиофилизата Анализ (в расчете на безводное вещество) рассчитано, % С 32,57 Н 3,85 I 36,22 N 7,77 О 19,60 найдено, % С 32,34 Н 3,97 I 36,13 N 7,52 Пример 19 Получение 3-(2,3-дигидрокси-3карбоксипропиониламино)-5-(2,3-дигидроксипропилкарбамоил)-2,4,6-трииодбензоильного производного 48-кратного первичного каскадного амина (см пример 1п)) а) Хлорангидрид І\І-(2,3-диацетоксипропил)амида 5-(2,3-диа-цетокси-3 44 метоксикарбонилпропиониламино)-2,4,6трииодизофта-левой кислоты К перемешиваемой при исключении влаги суспензии из 25,37г (35,43ммоль) N-(2,3диацетоксипропил)-амида 5-амино-2,4,6трииодизофталевой кислоты (европейский патент 0308364) в 150мл этилацетата при комнатной температуре добавляют 17,58г (70,87ммоль) монометилового сложного эфира 0,0диацетилвинной кислоты и 7,71мл (Юб.Зммоль) тионилхлорида Реакционную смесь кипятят с обратным холодильником в течение нескольких часов, до тех пор, пока согласно тонкослойной хроматографии превращение не закончится полностью, после этого выпаривают, остаток обрабатывают дихлорметаном и полученный раствор встряхивают с насыщенным водным раствором гидрокабоната натрия После высушивания над безводным сульфатом магния органическую фазу выпаривают и остаток хроматографируют на силикагеле с помощью смеси дихлорметана с этил ацетатом Выход 25,57г (74,81% от теории) Анализ (в расчете на не содержащее растворителя вещество) рассчитано, % С 29,88 Н 2,51 CI 3,68 I 39,47 N 2,90 0 21,56 найдено, % С 29,94 Н 2,63 CI 3,81 I 39,30 N 2,82 б) 3-(2,3-Дигидрокси-3карбоксипропиониламино)-5-((2,3-дигидроксипропилкарбамоил)-2,4,6трииодбензоильное производное 48-кратного первичного каскадного амина (см пример 1 п)) К механически перемешиваемому при комнатной температуре раствору из 25,6г (26,5ммоль) полученного в примере 19а) хлорангидрида кислоты в 100мл N.N-диметилформамида медленно прикалывают эмульсию, состоящую из 3,84г (0,37ммоль) полученного в примере 1п) каскадного амина, 5,51мл (39,8ммоль) триэ-тиламина и 30мл воды Реакционную смесь перемешивают 2 дня при комнатной температуре, затем смешивают с 50мл 2н раствора гидроксида натрия и перемешивают 2 часа при 50°С, после охлаждения до комнатной температуры раствор нейтрализуют с помощью 2н соляной кислоты и подвергают ультрафильтрации, причем благодаря мембране из полых волокон (Н I P 3-20, Amicon) отделяются низкомолекулярные составные части Водный раствор продукта фильтруют через мембранный целлюлозный фильтр (размер пор 0,45мкм, Sartonus) и подвергают сушке вымораживанием Выход 14,7г (86,3% от теории) бесцветного лиофилизата Анализ (в расчете на безводное вещество) рассчитано, % С 30,56 Н 3,36 I 39,53 N 8,48 О 18,07 найдено, % С 30,69 Н 3,42 I 39,40 N 8,55 центрация в крови Ультрависта® снижается намного быстрее, чем концентрация полимера согласно примеру 1j) Это может объясняться быстрым выходом Ультрависта® из содержащего кровь пространства в интерстициальное пространство, тогда как распределение полимера согласно примеру 1j) ограничено содержащим кровь пространством Как мономерное рентген о контрастное вещество Ультравист® (lopromid), так и также соединение примера 6с) (макромолекула) с дозой 200мг йода/кг в болюсе вводят внутривенно кроликам (весом 2кг белый новозеландский) (п=1 на вещество) Спустя 0 - 20 минут после введения измеряют усиление сигнала в единицах, Honusfield (HU) в паренхиме печени и в аорте Для этой цели применяют спираль-СТ (Somatium plus) фирмы Siemens Записи осуществляют при 120 KV Д Л Я обоих веществ измеряют кривую сигнал-время в аорте и в печени Рассчитывают площади под кривыми (А11Д)=площадь "под данными" /area under the data/) В качестве меры качества контраста веществ используют различие в сигнале между аортой и паренхимой печени через промежуток времени 0 - 20 минут (АІІД Aorta - АЦД Leber) Уровень в вгрови у крыс 70 Dosis -=* seispisl 1 J 5040 2010o4 1 0 1 5 20 Zsit p i [mm] p.і C 30 25 Уровень в крови в случае крысы после одноразовой внутривенной инъекции 300мг йода/кг веса тела Ультрависта® и соединения согласно примеру 1j) Данные представляют собой среднее значение из испытаний, каждый раз, на 4-х животных Несмотря на введение одинаковой дозы, конА„О Aorta AUO Из рисунка (см фиг) ясно видно, что различие в сигнале между кровеносным сосудом (аорта) и окружающей тканью печени для соединения примера 6с) (макромолекула) отчетливо больше, чем в случае мономерного рентгеноконтрастного вещества Ультравист ! 20 n r p ! 3G0 250 2СЭ Ees'p Si 6 С ФІГ. Підписано до друку 03 04 2003 р Тираж 39 прим ТОВ Міжнародний науковий комітет вул Артема 77 м Київ 04050 Україна (044)236-47-24 УКРАЇНА МІНІСТЕРСТВО ОСВІТИ І НАУКИ УКРАЇНИ (із) U А (11)54370 (із) С2 (51)7 C08G73/02,69/00,A61K49/04 ОПИС ДЕРЖАВНИЙ ДЕПАРТАМЕНТ ІНТЕЛЕКТУАЛЬНОЇ ВЛАСНОСТІ ДО ПАТЕНТУ НА ВИНАХІД (54) ИОДОВМІСНІ ДЕНДРИМЕРНІ ПОЛІМЕРИ, СПОСІБ IX ОДЕРЖАННЯ ТА ЗАСІБ ДЛЯ РЕНТГЕНОДІАГНОСТИКИ (21)96062448 (22)21 12 1994 (24)17 03 2003 (86) РСТ/ЕР94/04245, 21 12 1994 (31) Р 43 44 464 4 (32)22 12 1993 (33) DE (46) 17 03 2003, Бюл №3, 2003 р (72) Краузе Вернер , DE, Майєр Франц-Карл , DE, Бауер Міхель , DE, Шуманн-Жиамп'єрі Габріель , DE, Пресе Вольф-Рюдігер , DE (73)ШЕРІНГАГ, DE (56) WO, А, 93 10824, 10 061993, WO, А, 90 12050, 18 10 1990, ЕР, А, 0 430 863, 05 06 1991, WO, А, 93 14147, 22 07 1993, (57) 1 Иодсодержащие дендримерные полимеры общей формулы (І) А - (Х)б , (І) где ядро А представляет собой атом азота, остаток p - N R * - p , p-NR R формул (III) и (IV) или остаток общих N-V-N .(IN) N -CH2-(CH2)rN .(IV) где R и R независимо друг от друга обозначают линейный или разветвленный алкильный, арильный или аралкильный остаток с количеством атомов углерода вплоть до 20, который, в случае необходимости, замещен 1-4 гидроксильными группами, р обозначает место связи с остатком X, причем число р должно быть равно базисной мультиплетности б, причем б равно величине 1 - 8, V обозначает линейный или разветвленный алкиленовый, ариленовый или аралкиленовый остаток с количеством атомов углерода вплоть до 20, ко торый, в случае необходимости, прерывается 1 - 4 атомами кислорода и/или замещен 1-4 гидроксильными группами, г равно 1, 2 или 3, п X обозначает состоящий из 1 У2 к=0 , структурных единиц S и максимально 2П остатков Z, остаток, где п определяет число генераций и обозначает 110, S обозначает остаток формулы (II) R1U R ,а •CH-CH-(CONHCH 2 ) q —(СН 2 )—N s (II) где R и R независимо друг от друга обозначают атом водорода или метильную группу, w равно величине 1 или 2, q равно величине 0 или 1, положения а для 0 < к < п — 1 заняты другими структурными единицами S и для n-й генерации заняты остатками Z, причем, в случае необходимости, не занятые остатками Z положения а заняты остатками -(CO)q-U-COOH, где q имеет указанное значение и U обозначает простую связь или алкиленовую цепь с количеством атомов углерода вплоть до 6, которая, в случае необходимости, прерывается 1-2 атомами кислорода и/или, в случае необходимости, замещена 1 - 4 гидроксильными группами и/или 1 - 2 карбоксильными группами, при условии, что максимально 20% положений а заняты этим остатком -(CO)q-U-COOH, Z обозначает содержащий по меньшей мере одну алифатическую карбоксильную, сульфо- или фосфоновую группу и состоящий из соединительного звена Y и трииодзамещенной ароматической углеводородной группы В остаток Y - В, причем Y обозначает группу -СО-, -CONH-, -CSNH-, сн 2 соон —CO-CTL-N—СО— О о го Ю 54370 сирпря —CO-CH-NH-CO— -CHR-CHR-CONH-или CH 2 COOH где R имеет указанное значение и R0 обозначает атом водорода, метильную или карбоксиметильную группу, В обозначает бензольное кольцо I R1 где R1 и R2 каждый независимо друг от друга, обозначают атом водорода, -CONR3R4 - или NR6COR5 - группу, причем R3 и R4 независимо друг от друга обозначают атом водорода, замещенную, в случае необходимости, с помощью 1-5 гидроксильных групп, и/или 1-3 Сі-Сз-алкоксильньїх групп, и/или 1-3 карбоксильных, сульфо- или фосфоновых групп, линейную или разветвленную или циклическую алкильную группу с количеством атомов углерода вплоть до 12, R3 и R4 вместе с атомом азота образуют 5- или 6членное кольцо, содержащее, в случае необходимости атом кислорода, SC^-rpynny или остаток (NCO-R), где R7 имеет значения карбоксильной группы или алкильной группы с количеством атомов углерода вплоть до 12,содержащий, в случае необходимости, 1-5 гидроксильных групп, 1-3 С-|Сз-алкоксильных групп или 1-3 карбокси-, сульфоили фосфоновых групп, R5 обозначает карбоксильную группу или алкильную группу с количеством атомов углерода вплоть до 12, в случае необходимости, прерываемую атомом кислорода и/или, в случае необходимости, замещенную 1-3 карбоксильными, сульфо- или фосфоновыми группами и/или 1-5 гидроксильными группами и/или 1-3 Ci-Сз-алкоксильными группами, R6 обозначает атом водорода или алкильную группу с количеством атомов углерода вплоть до 12, замещенную, в случае необходимости, 1 -3 карбоксильными, сульфо- или фосфоновыми группами, и/или, в случае необходимости, 1-3 гидроксильными группами, и/или 1 -3 С-і-Сзалкоксильными группами, причем структурные единицы S должны быть идентичны только для одной генерации, с мол м от 5000 до 5000000, а также их соли с физиологически приемлемыми органическими и/или неорганическими основаниями, аминокислотами или амидами аминокислот 2 Иодсодержащие дендримерные полимеры по п 1, отличающиеся тем, что ядро А обозначает группу p2N-(CH2)4-Np2,p2N(CH2)2Np2,pN(CH2CH2Np2)2,N(CH2CH2Np2)3 3 Иодсодержащие дендримерные полимеры по п 1, отличающиеся тем, что S обозначает -CH(CH3)CH(CH3)CONH-CH2-CH2-N, -CH(CH3)CH(CH3)CH2N, -CH2CH2CH2N, -CH2CH(CH3)CH2-N, -CH2CH2-CONH-CH2CH2-N, -CH(CH3)CH2CH2N, -CH(CH3)CH2CONH-CH2CH2-N, -CH2CH(CH3)CONH-CH2CH2-N 4 Иодсодержащие дендримерные полимеры по п 1, отличающиеся тем, что п обозначает 2-6 5 Иодсодержащие дендримерные полимеры по п 1, отличающиеся тем, что R1, соответственно, R2 обозначает группу CONH2, CONHCH2COOH, CON(CH2COOH)2, CONHCH2CH(OH)CH2OH, CON(CH3)CH2COOH, CONHCH2PO3H2, CON(CH2PO3H2)2, CON(CH2COOH)CH2PO3H2, CON(CH3)CH2CH(OH)CH2OH, CONHCH2CH2SO3H, CON(CH2CH2SO3H) 6 Иодсодержащие дендримерные полимеры по п 1, отличающиеся тем, что R1, соответственно, R2 обозначает группу NHCO(CH2)2-COOH, NHCOСООН, NHCOCH2OCH2COOH, NHCOCH2OCH3, N(CH2COOH)COCH2OCH3, NHCOCH3, N(CH3)COCH2OCH3 7 Иодсодержащие дендримерные полимеры по п 1, отличающиеся тем, что V обозначает группу -(СН2)4-, -СЬЬСбШ-СНг, -(СН2)2-, -(СН2)2-О-(СН2)2О-(СН2)2-, -СН2СНОНСН2-, -(СН2)2-О-(СН2)28 Иодсодержащие дендримерные полимеры по пп 1 и 2, отличающиеся тем, что -(CO)q-U-COOH обозначает группу СО(СН2)2-СООН, -СОСООН, СО(СНОН)2-СООН, СОСН2ОСН2СООН, СОСН2СООН, СОСН(ОСН3)СООН, СН2СН2СООН 9 Иодсодержащий дендримерный полимер по п 1 для получения средств для рентгенодиагностики 10 Иодсодержащий дендримерный полимер по п 1 для получения средств для рентгенодиагностики сосудистых заболеваний 11 Способ получения иодсодержащих дендримерных полимеров, отличающийся тем, что дендримерные полимеры общей формулы (Г) А-(Х')6 , (Iі) где А и б имеют указанные в п 1 значения, а X' имеет указанное для X в п 1 значение, причем в отличие от X, для п-й генерации положения а заняты не остатками Z и, в случае необходимости, -(CO)q-U-COOH, а атомами водорода, вводят во взаимодействие с соединениями общей формулы (II) V-B1 , (II) где Y' обозначает остаток, содержащий карбонильную, тиокарбонильную, активированную карбонильную или CHR=CR- группу, где R имеет значение атома водорода или метильной группы, и превращаемый в Y, В' имеет указанное для В значение трииодзамещенной ароматической углеводородной группы, причем содержащиеся в В карбоксильные и гидроксильные группы, однако, находятся в защищенной форме, и затем, в случае необходимости, не занятые остатками Z положения а , ацилируют или алкилируют с помощью вводящего остаток-(СО)д-11СООН реагента 5 54370 6 12 Диагностическое средство для рентгенодиагщееся тем, что оно в качестве контрастного веностики, содержащее контрастное вещество в щества содержит иодсодержащий дендримерный физиологически приемлемой среде, отличаюполимер по п 1 Изобретение относится к охарактеризованным в формуле изобретения объектам, т е к новым йодсодержащим дендримерным (с дендритовой структурой) полимерам, содержащим эти соединения средствам, применению полимерных соединений в качестве контрастных веществ, а также к способу получения этих соединений и средств Рентгеноконтрастные вещества являются необходимыми вспомогательными средствами при диагнозе многочисленных заболеваний, как, например, ате рос кле роти чес кие сосудистые процессы, опухоли, инфаркты, заболевания почек и мочевыводящих путей и нарушения перфузии, например, в случае сердца (ишемия, а также воспаления) Требования, которые предъявляются к такого рода контрастным веществам, касаются, прежде всего, следующего а) достаточно высокая концентрация йода в используемом растворе От нее - пока средство не разбавляют - зависит плотность для рентгеновских лучей контрастного вещества в качестве единственного параметра Это в особенности имеет место в ангиографии, когда контрастное вещество инъецируют с высокой скоростью через катетер в кровеносные сосуды и тем самым оно вытесняет кровь В ряде других исследований также желательны высококонцентрированные контрастные вещества, например, когда разбавление в организме становится обычно слишком сильным (инъекция в желудочки сердца, аорту или в случае внутривенной пальцевой субтракционной ангиографии) или в случае неблагоприятных условий записи (съемки) (так, прохождение лучей через организм более тяжелых пациентов может становиться очень длительным), б) хемотоксичность, неотъемлемое свойство растворов контрастных веществ, которое, между прочим, связано с липофильностью молекул, их сродством к протеинам и с электронной плотностью При клиническом применении оно выражается в появлении побочных действий, как тошнота, рвота, определенных реакций круга кровообращения, крапивницы, бронхоспазма и других симптомов вплоть до шока и смерти Фармакологически хемотоксичные эффекты измеряют, например, в виде ЛД50 после внутривенной инъекции, в) вязкость, величина, которая важна для процесса введения контрастных веществ, например, когда нужно быстро инъецировать большие объемы (30 - 100мл) высококонцентированных и таким образом более высоковязких растворов Кроме плохой инъецируемости более высоковязкие контрастные вещества также обладают недостатка ми, выражающимися в плохой смешиваемости с кровью (образование свилей вместо гомогенного заполнения полости сердца или кровеносных сосудов) и в воспрепятствовании прохождению через капилляры, например, легких, г) осмотичность растворов контрастных веществ В случае введения сильно гипертонических по отношению к крови и тканям растворов (физиологическая величина составляет 310м осм/кг) вода вытесняется из клеток, вследствие чего, между прочим, разрушаются оболочки клеток и нарушается "баланс" общего количества электролита Таким образом, возникает большое число отчасти серьезных побочных действий, как, например, падение кровяного давления, брадикардия вплоть до остановки сердца, нарушения гематоэнцефалического барьера, сосудистые боли и т д , д) растворимость, которая должна быть достаточно высокой в воде при физиологических значениях рН для практического применения контрастных веществ, однако, при этом слишком сильно не ухудшая одновременно переносимости и содержания йода в молекуле, е) химическая стабильность растворов контрастных веществ, которая позволяет осуществлять стерилизацию путем нагревания, а также придает способность к хранению, по меньшей мере, 24 месяца 54370 в диагнозе областей сосудов с пониженной или повышенной проницаемостью, которая, например, может быть вызвана воспалениями или опухолями, а также в лимфографии и в маммографии Поэтому существует потребность в рентгеноконтрастных веществах, которые могут маркировать сосудистое пространство Эти соединения должны отличаться хорошей переносимостью, также высокой эффективностью (сильное увеличение интенсивности сигнала, соответственно, снижение дозы) и тем, что молекулы остаются в сосудистом пространстве (никакого кровоизлияния), также как более длительным периодом полураспада, по сравнению с используемыми в ангиографии контрастными веществами Успех в попытках решить по меньшей мере часть этих проблем путем применения йодсодержащих макромолекулярных контрастных веществ до сих пор был только ограниченным Так, описанные в международной патентной заявке ВОИС-88/06162 производные декстрана обладают широким молекулярно-массовым распределением и связанным с этим неполным выделением, а также с недостаточной переносимостью Раскрытые в международной патентной заявке ВОИС-93/10824, йодсодержащие полиамины не очень хорошо растворимы в воде и к тому же относительно плохо приемлемы Поэтому существует задача нахождения новых рентгеноконтрастных веществ, прежде всего, для распознавания и локализации сосудистых заболеваний, которые не обладают указанными недостатками Эта задача решается благодаря настоящему изобретению Найдено, что йодсодержащие дендримерные (с дендритовой структурой) полимеры, которые включают азотсодержащее ядро и содержащие трииодзамещенные ароматические углеводородные группы, а также алифатические карбоксильные, сульфо- или фосфоновые группы, дающие изображение остатки, неожиданно превосходно пригодны для приготовления рентгенодиагностических средств, не обладающих указанными недостатками Предлагаемые в изобретении йодсодержащие дендримерные полимеры могут быть описаны общей формулой (1) (соннсн2) Г Д Є (П) ю R и R независимо друг от друга, обозначают атом водорода или метильную группу, "w" - равно величине 1 или 2, "q" - равно величине 0 или 1, и положения "а" для 0^1с£п-1 заняты другими структурными единицами S и для "п"-ной генерации заняты остатками Z, причем в случае необходимости не занятые остатками Z положения "а" заняты остатками -(CO)q-U-COOH, где "q" имеет вышеуказанное значение и U обозначает простую связь или алкиленовую цепь с количеством атомов углерода вплоть до 6, которая в случае необходимости прерывается 1-2 атомами кислорода и/или в случае необходимости замещена 1-4 гидроксильными группами и/или 1-2 карбоксильными группами, при условии, что максимально 20% положений "а" заняты этим остатком -(CO)q-U-COOH, Z обозначает содержащий по меньшей мере одну алифатическую карбоксильную, сульфо- или фосфоновую группу и состоящий из соединительного звена Y и трииодзамещенной ароматической углеводородной группы В, дающий изображение остаток Y-B, причем Y обозначает группу -СО-, CONH-, -CSNH-, і -СО~СН 2 -Н - CO-; І -СО-СН- Ш - С 0 - ; -CHR, - CHR. - СОЯН ияи -co-cs2- я - сн2 - со - шу - -, где R имеет вышеуказанное значение, a R0 обозначает атом водорода, метильную или карбоксиметильную группу, и В - обозначает бензольное кольцо А-Мб ( D где А - обозначает азотсодержащее ядро базисной (основной) мультиплетности "б", причем "б" равно величине 1-8, и X - обозначает состоящий из п-1 ^ 2 к=0 струк турных единиц (повторяющихся звеньев) S и максимально 2П дающих изображение остатков і остаток, где "п" - определяет число генераций и обозначает цифры 1-10, S - обозначает остаток формулы (II) Т 2 R и R , каждый независимо друг от друга, обозначают атом водорода, -CONR R4- или HR6COR5- группу, причем R и R4 независимо друг от друга, обозначают атом водорода, замещенную в случае необходимости с помощью 1-5 гидроксильных групп и/или 1-3 СгСз-алкоксильных групп и/или 1-3 карбоксильных, сульфо- или фосфоновых групп, линейную или разветвленную или циклическую алкильную группу с количеством атомов углерода вплоть до 12, 3 4 R и R вместе с атомом азота образуют 5-ти или 6-ти -членное кольцо, содержащее в случае необходимости атом кислорода, SC^-rpynny или 7 7 остаток (N-CO-R ), где R имеет значения карбоксильной группы или алкильной группы с количест 54370 вом атомов углерода до 12, содержащей в случае необходимости 1-5 гидроксильных групп, 1-3 ( d Сз)-алкоксильных групп или 1-3 карбоксильных, сульфо- или фосфо-новых групп, 5 R - обозначает карбоксильную группу, с количеством атомов углерода вплоть до 12, в случае необходимости прерываемую атомом кислорода и/или в случае необходимости замещенную 1-3 карбоксильными, сульфо- или фосфоновыми группами и/или 1-5 гидроксильными группами и/или 1-3 СгСз-алкоксильными группами, 6 R обозначает атом водорода, алькильную группу с количеством атомов углерода вплоть до 12, в случае необходимости замещенную 1-3 карбоксильными, сульфо- или фосфоновыми группами и/или в случае необходимости замещенную 1-3 гидроксильными группами и/или 1-3 С-і-Сзалкоксильными группами, причем структурные единицы S должны быть идентичны только для одной генерации, а также их соли с физиологически приемлемыми органическими и/или неорганическими основаниями, аминокислотами или амидами аминокислот Под дендримерами понимают разветвленные полимерные молекулы, которые описываются, например, BAngew Chem 104, 1609(1992) Предпочтительно "п" равно 2 - 6 В качестве каскадных ядер А пригодны атом азота, остатки p-NR -р, p-NR R9, остатки общих формул (III), (IV), (V) или (VI), X я-V - н -R - C - H, Hj C (ш) -, и c H 2 2'w л сн 2 Т (/1), - сн 2 - н 9 R и R , независимо друг от друга, обозначают линейный или разветвленный алкильный, арильный или аралкильный остаток с количеством атомов углерода вплоть до 20, который в случае необходимости замещен 1-4 гидроксильными группами, р обозначает место связи с остатком X, причем число "р" должно быть равно базисной мультиплетности "б", V обозначает линейный или разветвленный алкиленовый, ариленовый или аралкиленовый остаток с количеством атомов углерода вплоть до 20, который в случае необходимости прерывается 1-4 атомами кислорода и/или замещен 1-4 гидроксильными группами, "г" равно 1, 2 или 3, "w" равно 1 или 2, и "т" равно 0, 1, 2 или 3 10 Предлагаемые согласно изобретению полимеры имеют молекулярную массу 5000 - 5000000, предпочтительно 10000 - 500000, особенно предпочтительно 20000 -100000 Базисная мультиплетность представляет собой сумму свободных валентностей азотсодержащего ядра и равна 1 -8, предпочтительно 1 -6 Самый простейший случай каскадного ядра представляет собой атом азота, три связи которого (базисная мультиплетность "б"=3) в первом "внутреннем слое" (генерация 1) заняты тремя структурными единицами S, которые, каждая, содержат концевую Nbh-rpynny, (соответственно, три атома водорода аммиака, лежащего в основе каскадного "стартера", заменены тремя структурными единицами S) Второй, вводимый в самой ближайшей следующей реакционной последовательности, слой (генерация 2) структурных единиц S (которые в вышеуказанном примере с А=атом азота занимают 3x2 =6 связей) не должен быть идентичен со структурными единицами S 1-ой генерации Предпочтительно, структурные единицы S во всех генерациях полимера идентичны После максимально 10, предпочтительно 2 - 6, особенно предпочтительно 2 - 4 генераций, самый крайний слой имеет "б"х2п (в случае атома азота в качестве каскадного ядра Зх2п) положений "а" на концевых атомах азота последней генерации, которые на 80 - 100% заняты дающими изображение остатками Z и максимально на 20% остатками (CO)q-U-COOH В качестве других, предпочтительных каскадных "стартеров" А(Н)б следует, например, указать трис-(2-аминоэтил)амин (6=6), трис-(3аминопропил)амин (6=6), диэтилентриамин (6=5), триэтилентетраамин (6=6), тетраэтиленпентамин (6=7), тетраметилендиамин (6=4), 1,4,7триазациклонан (6=3), 1,4,7,10тетраазациклододекан (6=4), 1,4,7,10,13пентаазациклопентадекан (6=5), 1,4,8,11тетраазациклотетрадекан (6=4), 2-гидрокси-1,3,пропандиамин (6=4), ксилилендиамин (6=4), гидроксиэтиламин (6=2), 2,3-дигидроксипропиламин (6=2), метиламин (6=2), бензиламин (6=2), анилин (6=2), бис-(2,3-дигидроксилпропиламин) (6=1), 2,3дигидроксипропилметиламин (6=1), дибензиламин (6=1), 1,8-диамино-3,6-диоксаоктан (6=4), 1,5диамино-3-окса-пентан (6=4) X обозначает ветвь дендримерного полимера, которая получается из суммы структурных единиц S и относящихся к ним, дающих изображение остатков Z Так, например, "построенный" из "п"=3 генераций полимер содержит в целом 3-1 "б"х ^ 2 к (=2°+21+22)="б"х7 структурных единиц S и имеет "б"х23="б"х8 концевых положений "а", которые заняты максимально "б"х8 дающими изображение остатками Z Предпочтительными структурными единицами S являются -CH(CH3)CH(CH3)CONH-CH2-CH2-N, CH(CH3)CH(CH3)CH2N, -CH2CH2CH2-N, CH2CH(CH3)CH2-N, -CH2CH2-CONH-CH2CH2-N, CH(CH3)CH2CH2N, -CH(CH3)CH2CONH-CH2CH2-N, CH2CH(CH3)CONH-CH2CH2-N 12 11 54370 1 В качестве содержащихся в R -, соответстдержать вплоть до 6, предпочтительно вплоть до 2 венно, R - заместителях трииодзамещенной аро2, С-атомов и в случае необходимости может прематической углеводородной группы В алкильных рываться 1-2 атомами кислорода и/или в случае 3 4 7 групп R , R и R принимают во внимание линейнеобходимости может быть замещена 1-4, предные или разветвленные или циклические углевопочтительно 1-2 гидроксильными группами и/или дородные остатки с количеством атомов углерода 1-2 карбоксильными группами В качестве примевплоть до 12, предпочтительно вплоть до 10, осора остатков -(CO)q-U-COOH следует указать бенно предпочтительно вплоть до 6, которые заСО(СН2)2СООН, -СОСООН, -СО(СНОН)2СООН, мещены 1-5, предпочтительно 1-3 гидроксильныСОСН2ОСН2СООН, -СОСНэСООН, ми группами и/или 1-3 Ci-Сз-алкоксильными и/или СОСН(ОСН3)СООН, СН2СН2СООН, 1-3, предпочтительно одной, карбоксильными, СН(СН3)СН2СООН, СН2СН(СН3)СООН, сульфо- или фосфоновыми группами СН(СНз)СН(СНз)СООН, причем предпочтительны остатки -СО(СН2)2СООН, СОСНОСН2СООН, Особенно следует назвать, например, меСН2СН2СООН тил ьную, гидрокси-метильную, этил ьную, 2гидрокси-этильную, 2-гидрокси-1 Кислотные атомы водорода содержащихся в (гидроксиметил)этильную, 1полимере кислотных групп могут быть полностью или частично заменены катионами неорганических (гидроксиметил)этильную, пропильную, изопрои/или органических оснований, аминокислот или пильную, 2-гидроксипропильную, 3амидов аминокислот гидроксипропильную, 2,3-дигидроксипропильную, 1,2,3-тригидроксипропильную, бутил ьную, изобуПригодными катионами неорганических оснотильную, 2-гидрокси-бутильную, 3-гидроксиваний являются, например, ион лития, калия, бутильную, 4-гидрокси-бутильную, 2-, 3- и 4кальция, магния и в особенности натрия Пригодгидрокси-2-метилбутильную, 2- и 3-гидроксиными катионами органических оснований являютизобутильную, 2,3,4-тригидроксибутильную, 1,2,4ся, между прочим, таковые первичных, вторичных тригидроксибутильную, пентильную, циклопенили третичных аминов, как, например, этанолатильную, циклогексильную, 2,3,4,5,6мин, диэтаноламин, морфолин, глюкамин, N,Nдиметил-глюкамин, и в особенности N-метилпентагидрокси-гексильную, 2-метокси-этильную, глюкамин Пригодными катионами аминокислот карбоксиметильную, 2-сульфоэтильную, фосфоявляются, например, таковые лизина, аргинина и нометильную, 2-карбокси-этильную, 10-гидроксиорнитина, а также амидов других кислых или нейдецильную, карбоксильную, 3-сульфопропильную, тральных аминокислот 2-фосфоно-этильную группу Образованное заместителями R3 и R4 при Предлагаемые согласно изобретению соедивключении амидного азота гететроциклическое 5нения обладают указанными вначале желательили 6-членное кольцо в случае необходимости ными свойствами Они содержат необходимое для может содержать атом кислорода, SO2-rpynny или их применения в качестве рентгеноконстрастных 7 остаток (N-CO-R ) веществ число трииодзамещенных ароматических углеводородных групп Они распределяются тольВ качестве пригодных гетероциклов следует, ко в сосудистом пространстве и поэтому могут например, назвать пиперид ильное, пиразол имаркировать его с помощью рентгенодиагностики дильное, морфолинильное, N-замещенное пиперазинильное, З.З-диоксотиоморфолинильное Содержание йода в предлагаемых согласно кольцо изобретению соединениях составляет в среднем 40% по сравнению с другими, содержащими йоВ качестве остатков R5 и R6, содержащихся в 1 2 доароматические группы макромолекулами, как R - соответственно, R - заместителях трииодзаописанные в ВОИС-88/06162 производные декстмещенной ароматической углеводородной группы рана (примерно 2 - 35%), отчасти в несколько раз В, дополнительно к соответствующим, указанным выше Предлагаемые согласно изобретению содля R3, R4, и R7 остаткам, следует, например, наединения, в противоположность описанным в ВОзвать карбоксиметоксиметильную, 5-карбоксиИС-88/06162 производные декстрана, неожиданно 165-дигидрокси-З-оксапен-тильную, 2-карбокси-1 могут смешиваться с водой в любом соотношении, гидрокси-этильную, З-карбокси-2-оксапропильную что приводит к более высокой концентрации конгруппу трастного вещества в кровеносных сосудах вскоре Обозначающий R и R , соответственно, V , после инъекции и таким образом благоприятно алкильный, арильный или аралкильный остаток, воздействует на резкость изображения кровеноссоответственно, алкиленовый, ариленовый или ных сосудов Ответственное за побочные дейстаралкиленовый остаток, может быть линейным вия, как боли, повреждения кровеносных сосудов или разветвленным и может содержать вплоть до и нарушения кровообращения сердца, значение 20, предпочтительно вплоть до 12 С-атомов осмотичности отчетливо уменьшено и более не R8 и R9 - заместитель может быть замещен 1гиперосмотично, как, в противном случае, зачас4, предпочтительно 1-2 гидроксильными группами, тую наблюдается при использовании рентгеноконобозначенная как V цепь (в случае необходимости трастных веществ (Пример 1j) 220 [м осмол/кг] дополнительно) прерывается 1-4, предпочтительпри 37°С, 130мг йода/мл) Осмотичность предлано 1-2 атомами кислорода В качестве примера гаемых согласно изобретению соединений также следует назвать следующие группы этилен, бутиотчетливо меньше, чем у описанных в ВОИСлен, 1-метил-пропилен, пропилен, 3,688/06162 соединений декстрана (440 м осм/кг при диоксаоктилен, ксилиден, 2-гидрокси-пропилен, 390мг йода/мл) оксапентилен Обозначенная U алкиленовая цепь может соОтветственная за "острую" переносимость хео Q 14 13 54370 мотоксичность предлагаемых согласно изобрететолько в сосудистом пространстве, т е объем, в нию соединений (пример 6с) внутривенно ЛДбо котором они распределяются, составляет примермыши>5г йода/кг), как по сравнению с макромолено 0,05л/кг После внутривенного введения 300мг кулярными контрастными веществами на основе йода/кг в случае крысы предлагаемые согласно углеводоров (ВОИС-88/06162), так и также по изобретению соединения показывают полное высравнению с описанными в ВОИС-93/10824 приделение (удерживание < 1 % дозы, спустя 14 дней мерами на основе полиаминов, отчетливо улучпосле внутривенного введения) Таким образом шена впервые оказалось возможным получение макромолекулярных контрастных веществ с трииодзаПо сравнению с макромолекулами на основе мещенными ароматическими углеводородными декстрена также вязкость предлагаемых согласно группами изобретению соединений отчетливо меньше, что позволяет осуществлять введение болюса и таким Предлагаемые согласно изобретению каскадобразом отчетливо более резкое изображение ные полимеры служат в качестве контрастных кровеносных сосудов по сравнению с окружающей веществ для изображения сосудов посредством тканью (пример 6с) 4,02мПас при 37°С и 100мг рентгенодиагностики Таким образом, стало возйода/мл, пример 10 ВОИС-88/06162, 26мПас при можным отличать ишемическую ткань от нор37°С и 90мг йода/мл) мальной ткани Однако с помощью этих соединений можно также распознавать другие С помощью предлагаемых согласно изобретеповреждения барьера кровь-ткань В случае воснию соединений удается получать макромолекулы палений и опухолей в головном мозге, барьер с определенной молекулярной массой Такие, кровь-головной мозг повреждается так, что конточно определенные по величине своей молекутрастное вещество может инфильтрировать больлы, макромолекулярные контрастные вещества с ную ткань и таким образом больная ткань станойодсодержащими ароматическими углеводородвится распознаваемой с помощью ными группами до сих пор были недоступны рентгенодиагностики На основании непроницаеВ случае макромолекул на основе декстрана, мости интактного барьера кровь-головной мозг например, декстран 40000 (Rheomacrodex®), речь также для маленьких, однако, гидрофильных, моидет о смеси макромолекул различной величины, лекул можно распознавать воспаления и опухоли средняя молекулярная масса которых составляет, также уже с помощью низкомолекулярного Ultraнапример, 40000 дальтонов В этой смеси, однако, vist® Если в этих случаях, однако, применяют имеются также молекулы декстрана, которые по предлагаемые согласно изобретению каскадные величины более чем 50000, соответственно, полимеры, то их дозу можно снижать в 4 раза, так 60000 дальтонов Эта доля высокомолекулярных как макромолекулы распределяются в четырехдекстрановых соединений может составлять 5 кратно меньшем пространстве, а именно только в 10% от общего количества Как известно из литесосудистом пространстве, т е для того, чтобы ратуры (G Arturson и G Wallemus, The renal достичь одинаковых концентраций в крови, достаclearanse of dextran of different molecular sizes in точна четверть дозы normal humans, Scandmav J Clm and Lab Investigation, 1, 81 - 86 (1964)) молекулы декстрана этой Одновременно с помощью предлагаемых совеличины гломерулярно более не фильтруются, и гласно изобретению соединений можно осуществпочечный клиренс этих молекул поэтому равен лять измерения перфузии, например, в миокарде, почти нулю Также описанные в европейских пачто возможно только ограниченно с помощью низтентах ЕР-0206551, ЕР-0436316 и в примерах 1,2 комолекулярных соединений, как Ultravist®, так как и 3 ВОИС-93/10824 соединения на основании своэти молекулы быстро "выходят" в интерстициальих высокомолекулярных частей после внутривенное пространство "Выход" в интерстициальное ного введения не могут полностью выделяться От пространство в случае низкомолекулярных соедидиагностики, однако, ожидают, что после внутринений также часто приводит к нечеткости изобравенной инъекции рентгеноконтрастное вещество в жения, которого можно избегать за счет предлатечение короткого промежутка времени полностью гаемых согласно изобретению соединений удаляется из организма Другие, описанные в ВООдновременно время измерения может сильно ИС-93/10824, соединения, в противоположность удлиняться по сравнению с низкомолекулярными этому, выходят из внутрисосудистого пространстсоединениями ва слишком быстро и таким образом непригодны в Другое преимущество настоящего изобретекачестве перфузионных агентов С помощью ния заключается в том, что теперь стали доступны предлагаемых согласно изобретению соединений макромолекулы с различно липофильными или неожиданно впервые удалось получить йодсогидрофильными трииод-арильными остатками держащие полимеры, которые только медленно Благодаря этому создается возможность управпокидают сосудистое пространство, однако однолять переносимостью и фармакокинетикой этих временно еще проходят капилляры почек и таким каскадных полимеров за счет различно замещенобразом полностью выделяются На основании ных трииодарильных остатков молекулярной структуры, предлагаемые согласно Получение предлагаемых согласно изобретеизобретению соединения в первые 15 минут после нию йодсодержащих дендримерных полимеров внутривенного введения показывают концентраосуществляют тем, что дендримерные полимеры цию в крови, которая примерно в 4 раза больше, общей формулы (Г) А-(Х')б (Г), чем в случае внеклеточных рентгеноконтрастных где А и "б" указанные в п п 1-3 формулы изобревеществ, как, например, Ultravist® (рис с 58) При тения значения и X' имеет указанные для X в п 1 этом каскадные полимеры находятся в организме формулы изобретения значения, причем, однако,
ДивитисяДодаткова інформація
Назва патенту англійськоюIodine-containing dendrimeric polymers, a process for preparation thereof and x-ray diagnostic agent
Назва патенту російськоюИодсодержащие дендримерные полимеры, способ их получения и средство для рентгенодиагностики
МПК / Мітки
МПК: C08G 18/60, A61K 49/04, C08G 69/04, C08G 85/00, C08G 69/00, C08G 83/00, C08G 73/00
Мітки: засіб, йодовмісні, рентгенодіагностики, дендримерні, спосіб, одержання, полімери
Код посилання
<a href="https://ua.patents.su/46-54370-jjodovmisni-dendrimerni-polimeri-sposib-kh-oderzhannya-ta-zasib-dlya-rentgenodiagnostiki.html" target="_blank" rel="follow" title="База патентів України">Йодовмісні дендримерні полімери, спосіб їх одержання та засіб для рентгенодіагностики</a>












