Виділений пептид, який стимулює протипухлинну імунну відповідь, фармацевтична композиція на його основі та її застосування
Формула / Реферат
1. Виділений пептид, який стимулює протипухлинну імунну відповідь, що має амінокислотну послідовність SEQ ID No: 16.
2. Пептид за п. 1, де вказана відповідь відбувається за рахунок модуляції імунної активності у пацієнта.
3. Пептид за п. 1, де вказана імунна відповідь модулює розвиток раку.
4. Пептид за п. 3, де вказаний рак являє собою рак печінки.
5. Пептид за п. 3, де вказаний рак являє собою меланому.
6. Фармацевтична композиція, яка складається з ефективної кількості пептиду за п. 1 і фармацевтично прийнятного носія.
7. Фармацевтична композиція за п. 6, яка стимулює протипухлинну імунну відповідь.
8. Фармацевтична композиція за п. 7, де вказана відповідь відбувається за рахунок модуляції імунної активності у пацієнта.
9. Фармацевтична композиція за п. 7, де вказана відповідь модулює розвиток раку.
10. Фармацевтична композиція за п. 9, де вказаний рак являє собою рак печінки.
11. Фармацевтична композиція за п. 9, де вказаний рак являє собою меланому.
12. Застосування фармацевтичної композиції за п. 6 у фармацевтично ефективній дозі для лікування захворювання ссавця, при якому необхідна стимуляція протипухлинної імунної відповіді.
13. Застосування за п. 12, де у вказаного ссавця діагностовано рак.
14. Застосування за п. 12, де вказаний рак являє собою рак печінки.
15. Застосування за п. 12, де вказаний рак являє собою меланому.
16. Застосування фармацевтичної композиції за п. 6 у фармацевтично ефективній дозі для модуляції імунної відповіді у пацієнта, який страждає на захворювання, при лікуванні якого необхідна стимуляція протипухлинної імунної відповіді.
17. Застосування за п. 16, де вказана імунна відповідь полягає у збільшенні цитотоксичної активності NK клітин.
18. Застосування за п. 16, де вказана імунна відповідь полягає в посиленні синтезу анти-SRBC антитіл при антигенній стимуляції.
19. Застосування за п. 16, де вказана імунна відповідь полягає в посиленні фагоцитарної активності моноядерних фагоцитів.
20. Застосування за п. 16, де вказана імунна відповідь полягає в збільшенні ваги вилочкової залози.
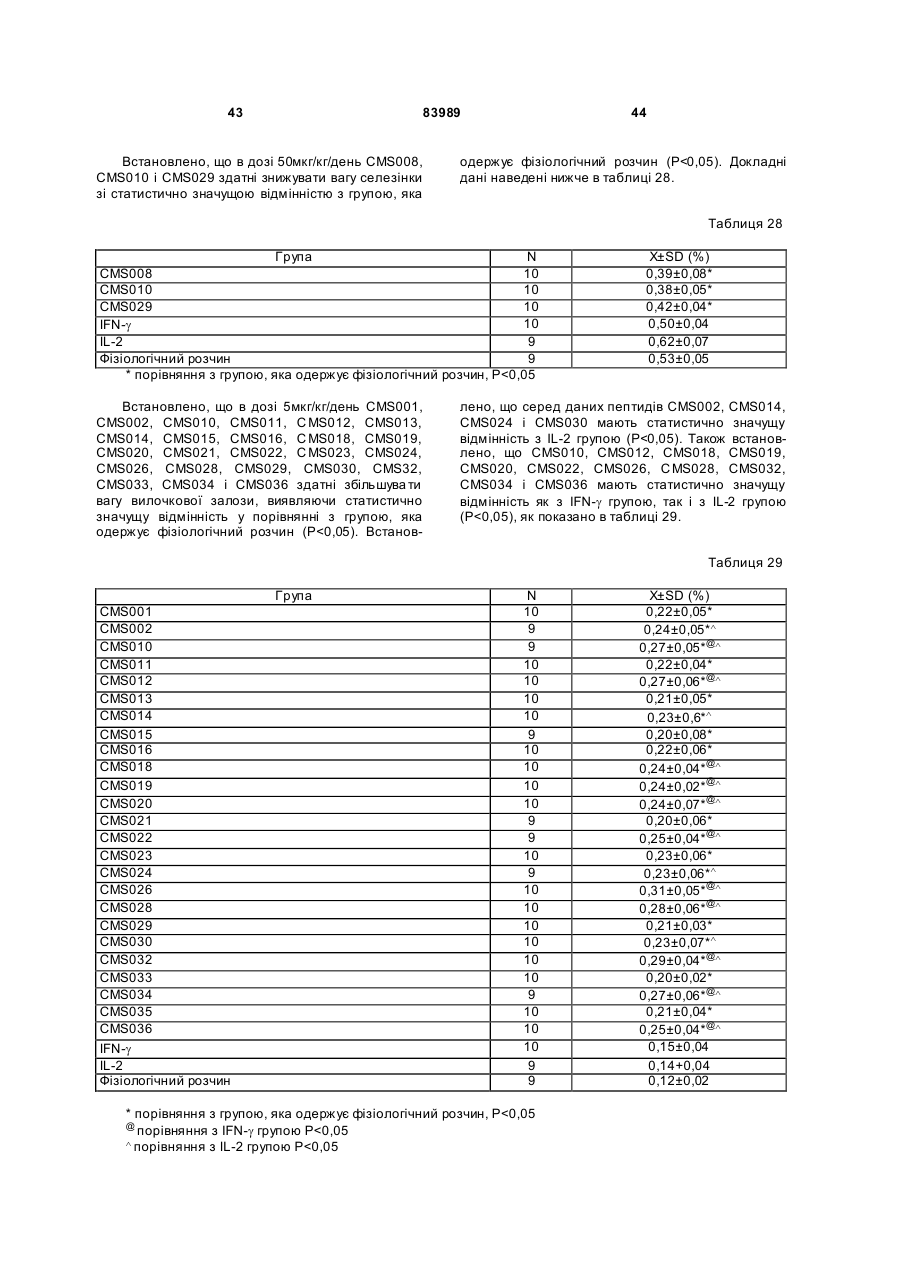
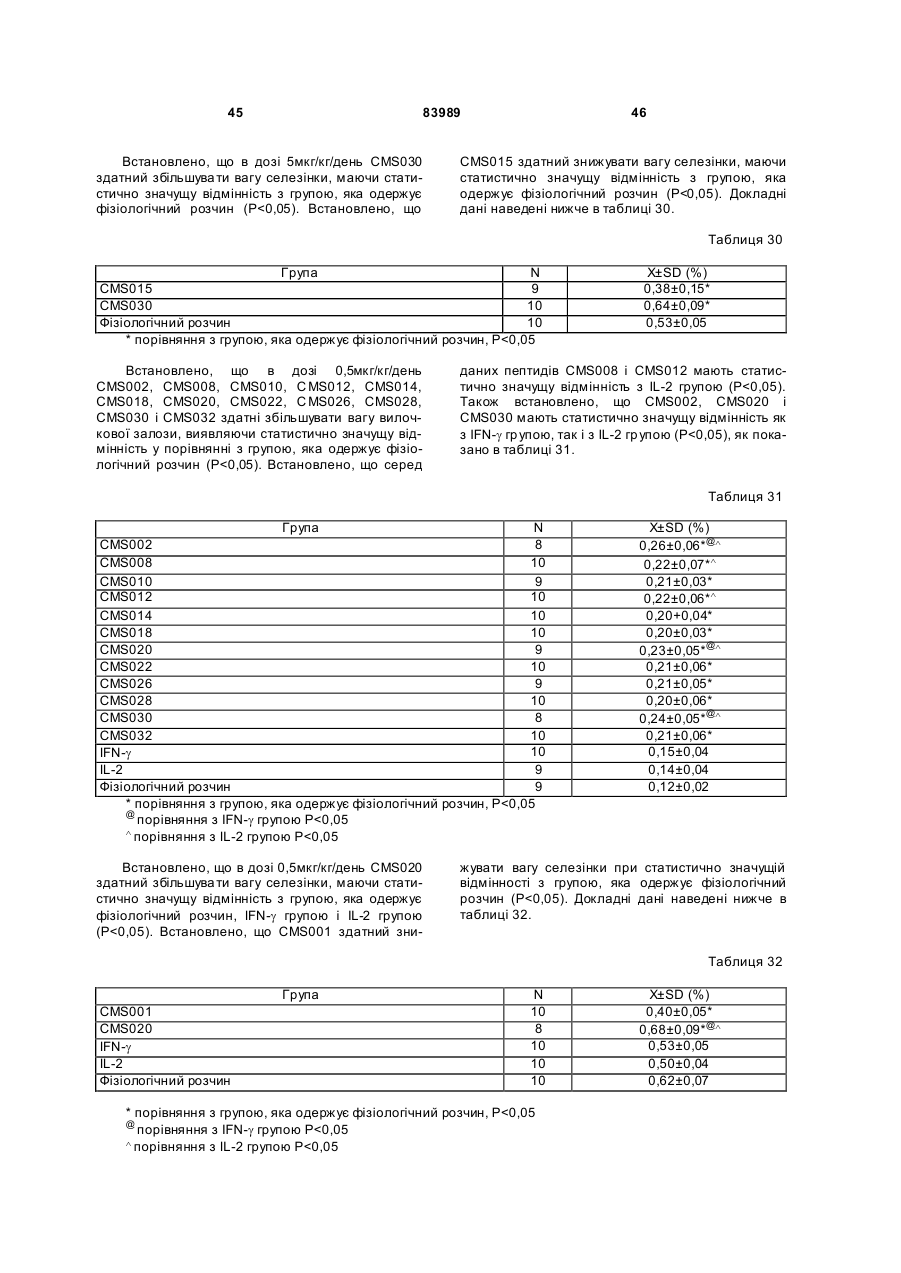
21. Застосування за п. 16, де вказана імунна відповідь полягає у зниженні ваги селезінки.
Текст
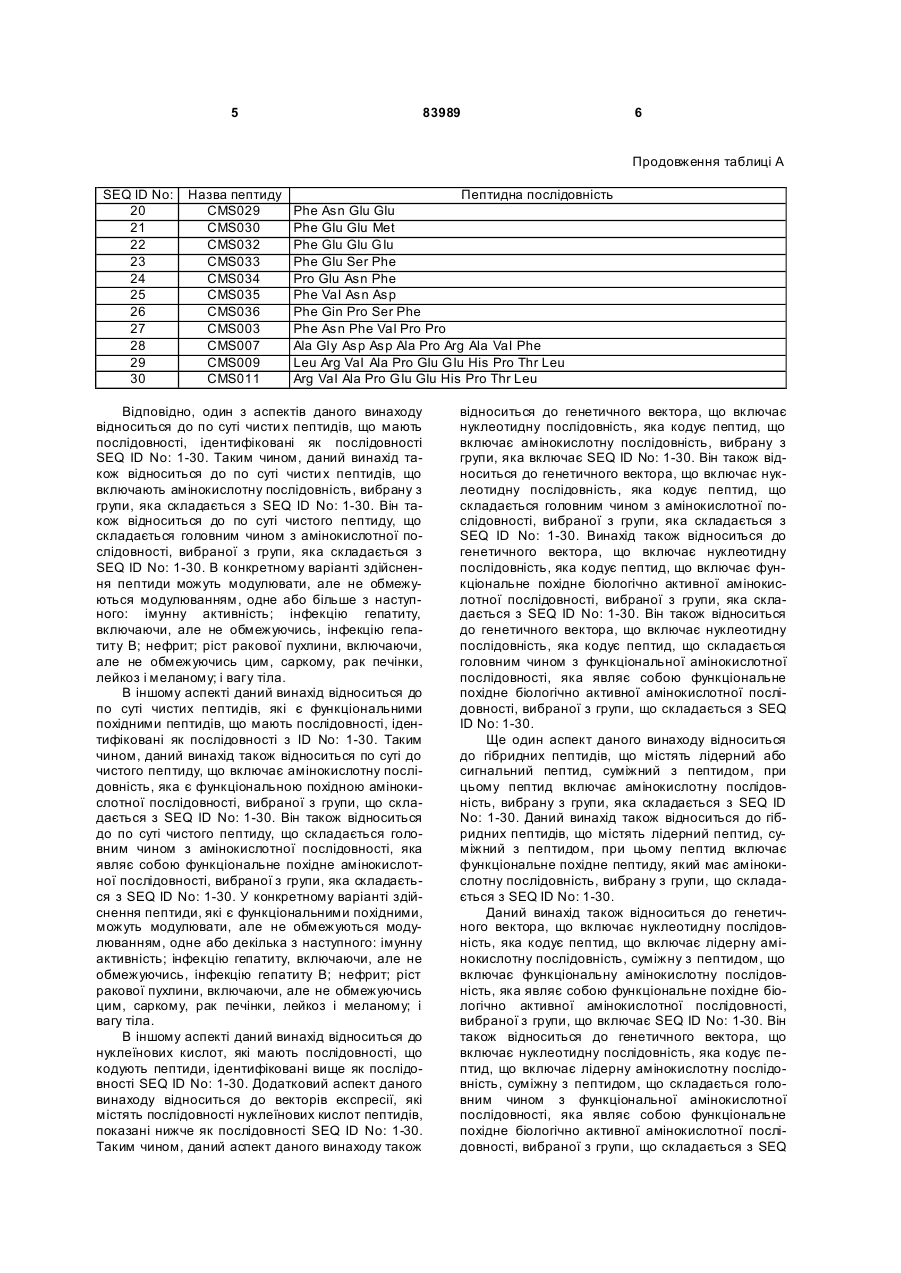
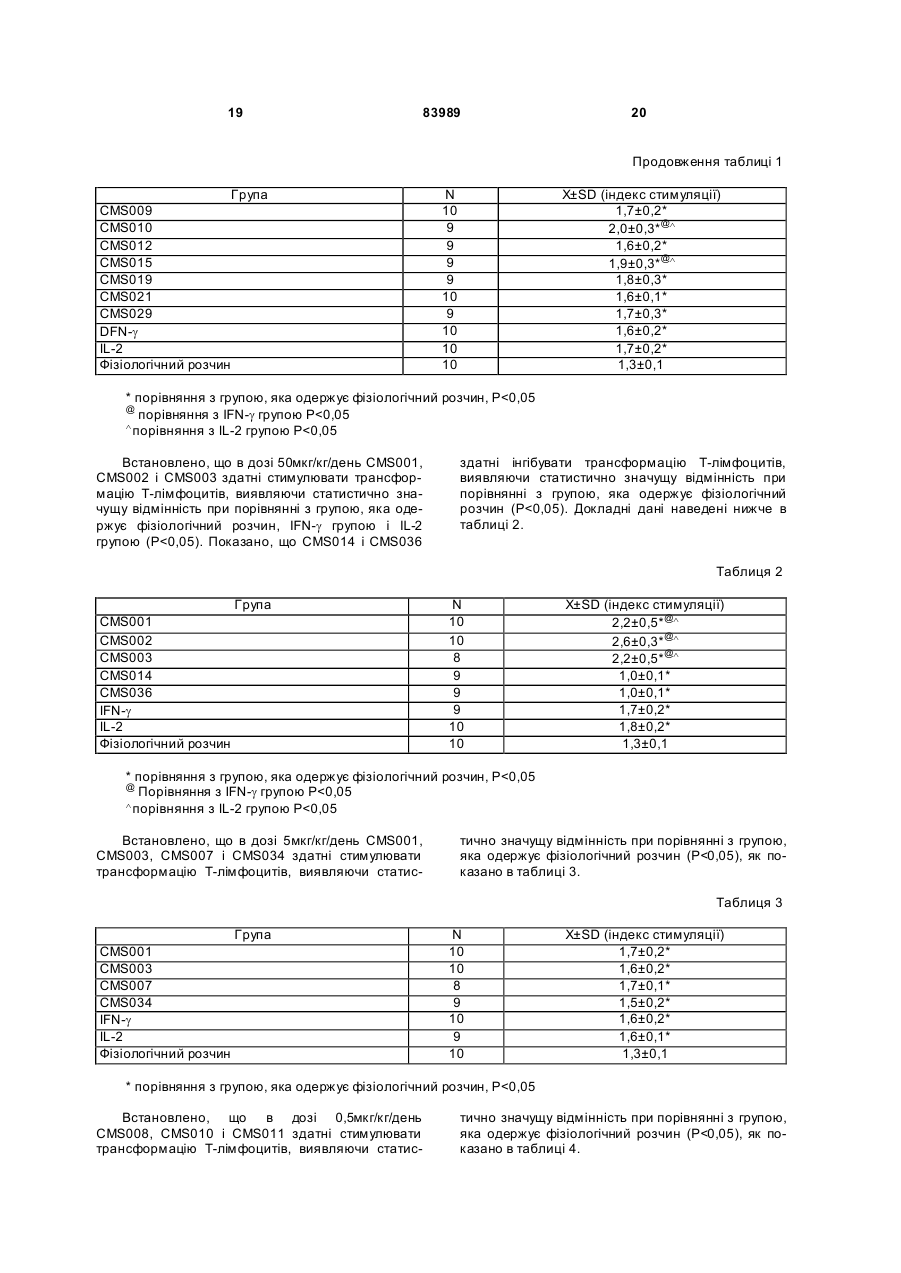
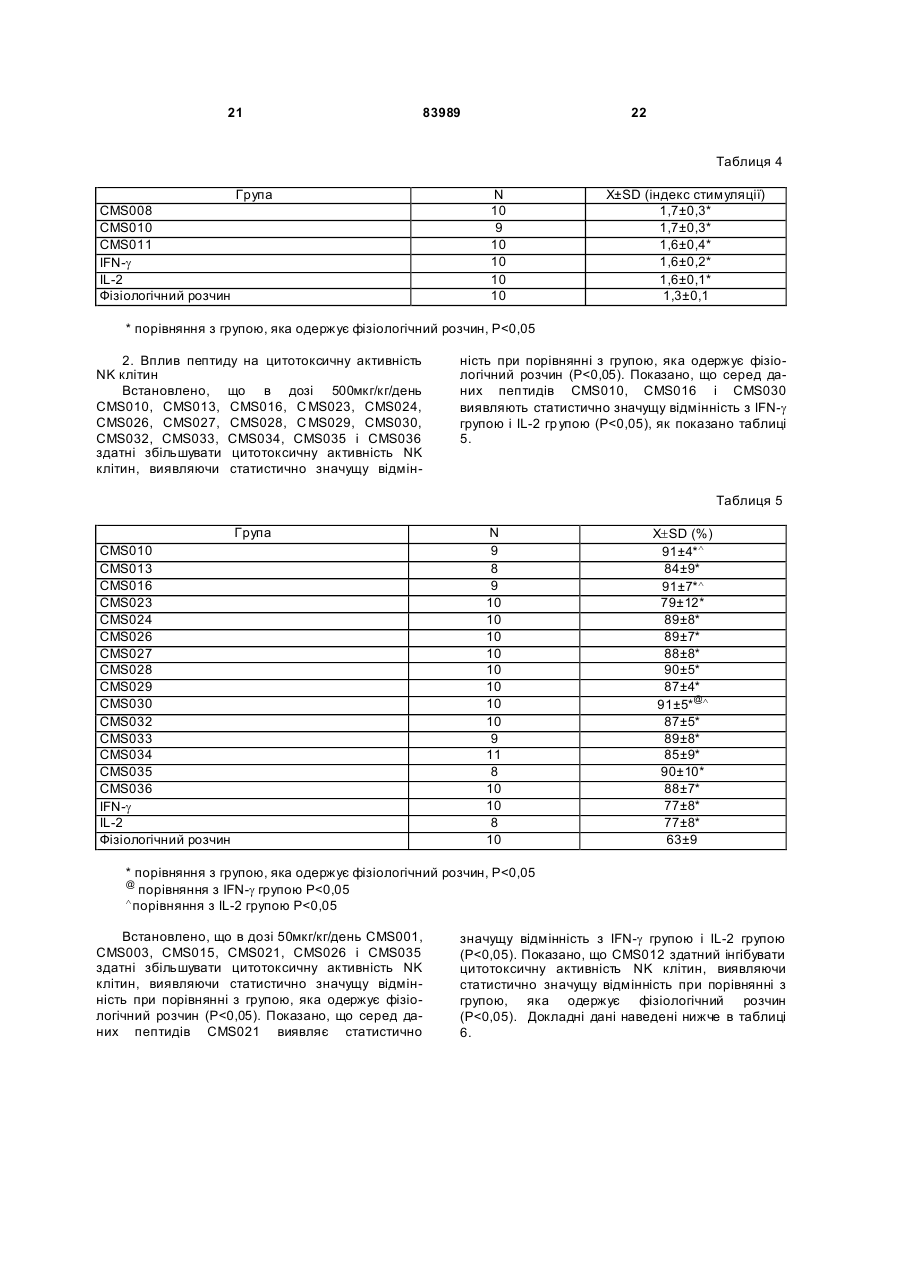
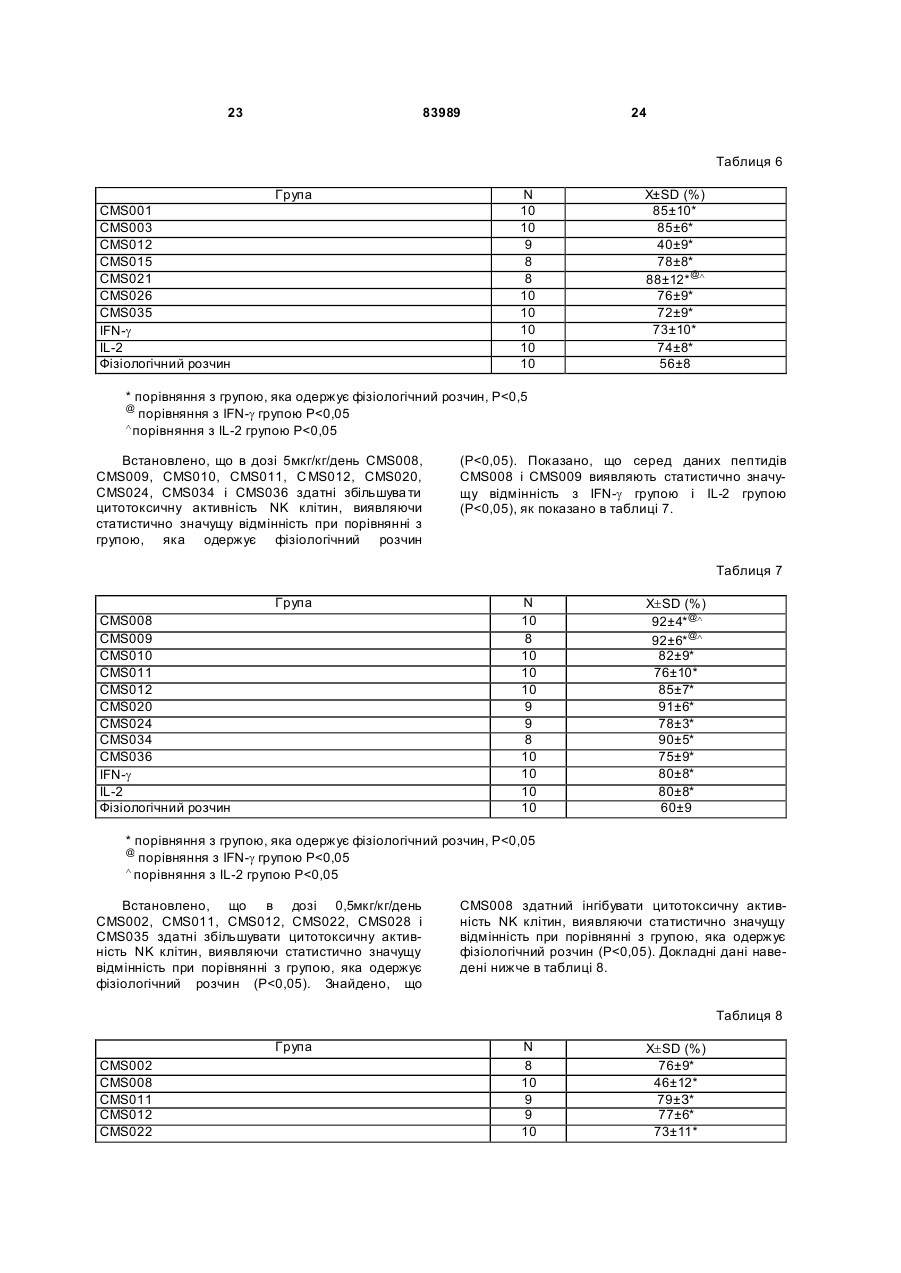
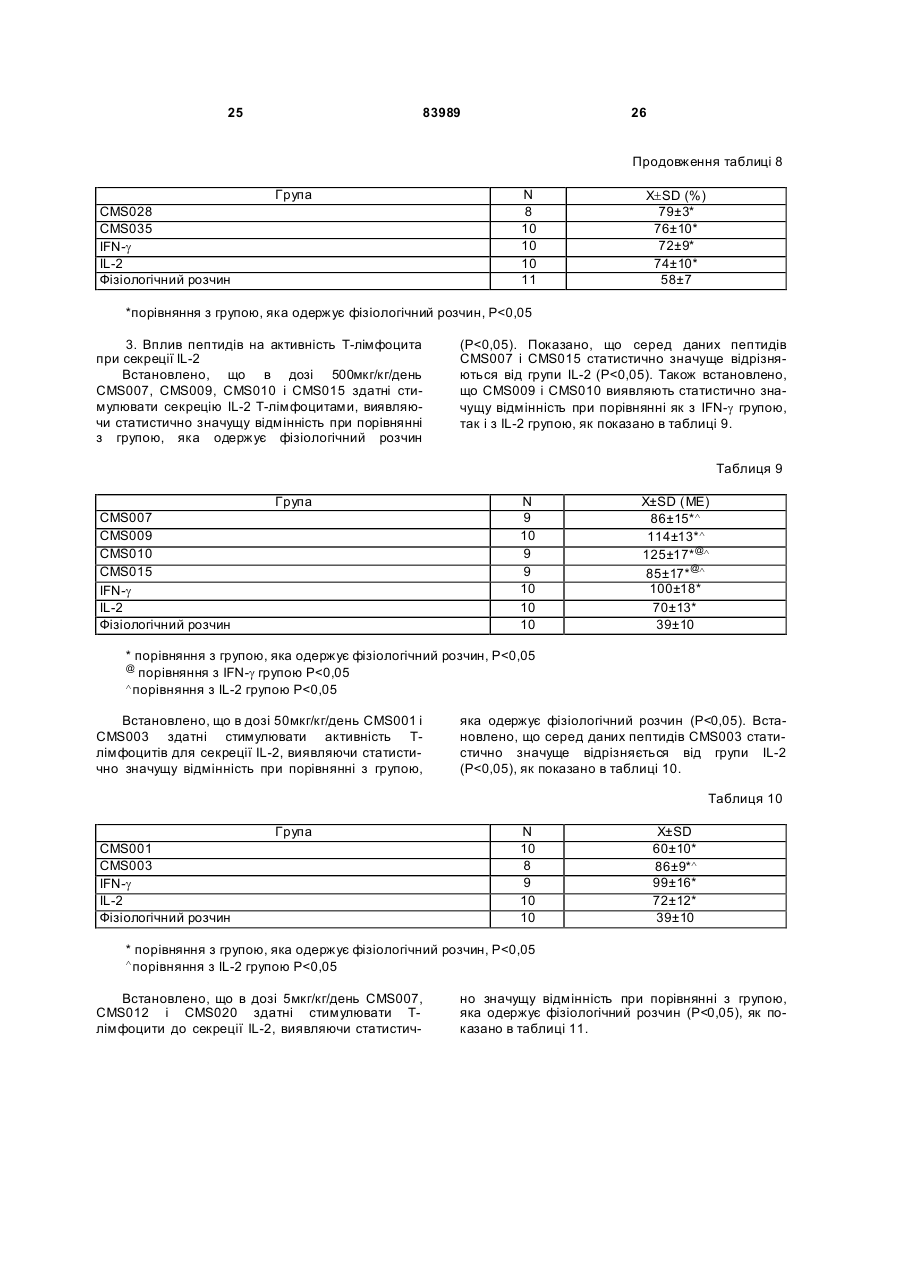
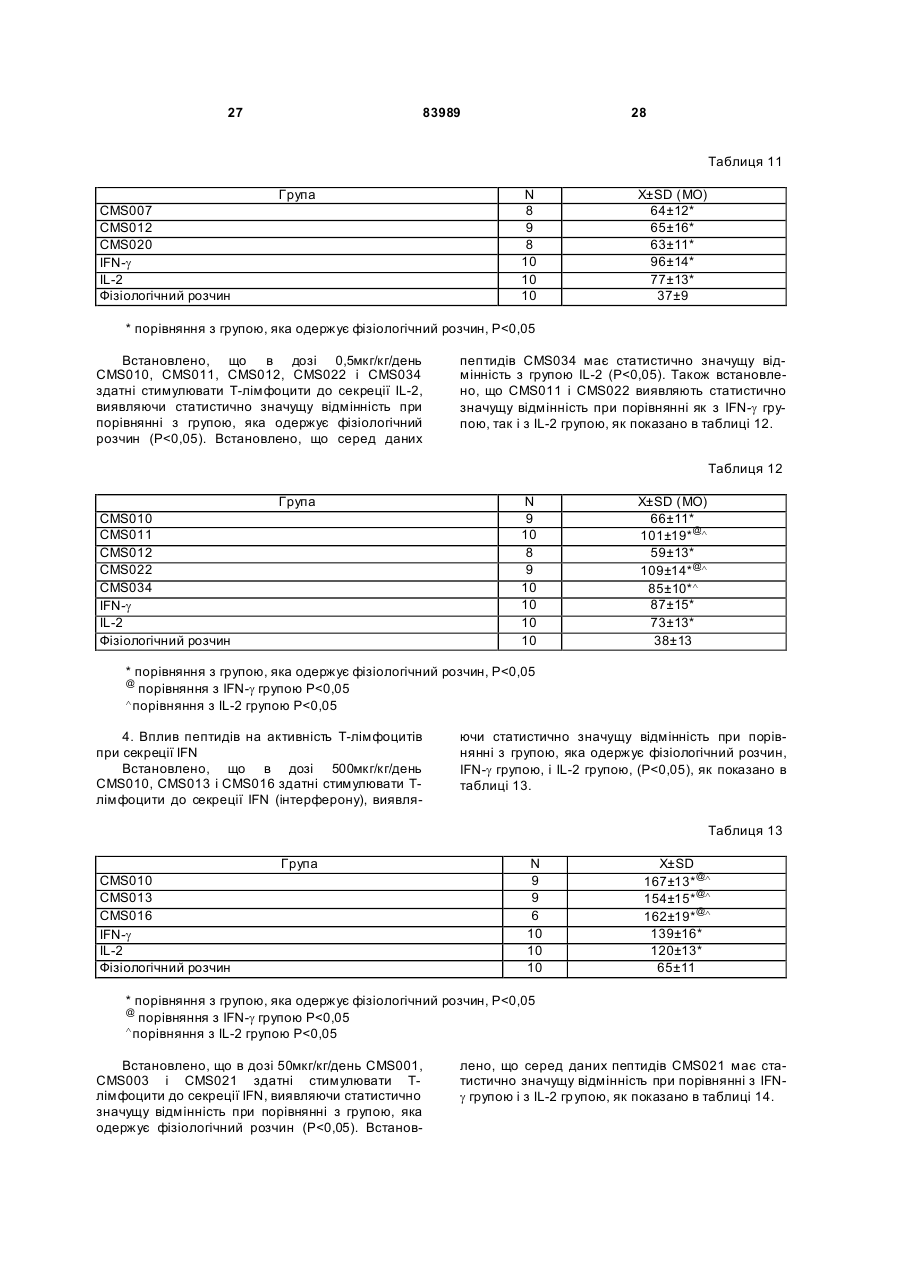
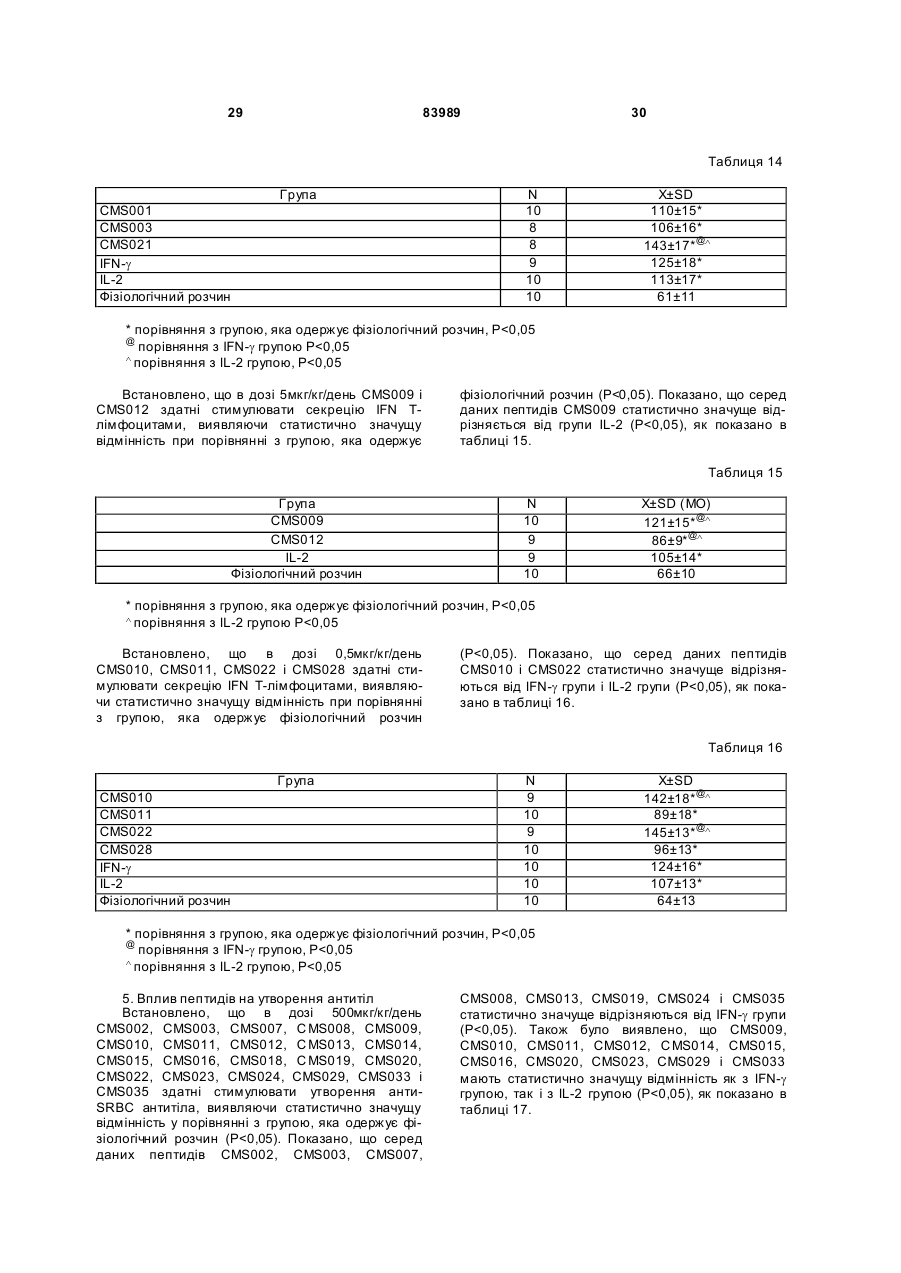
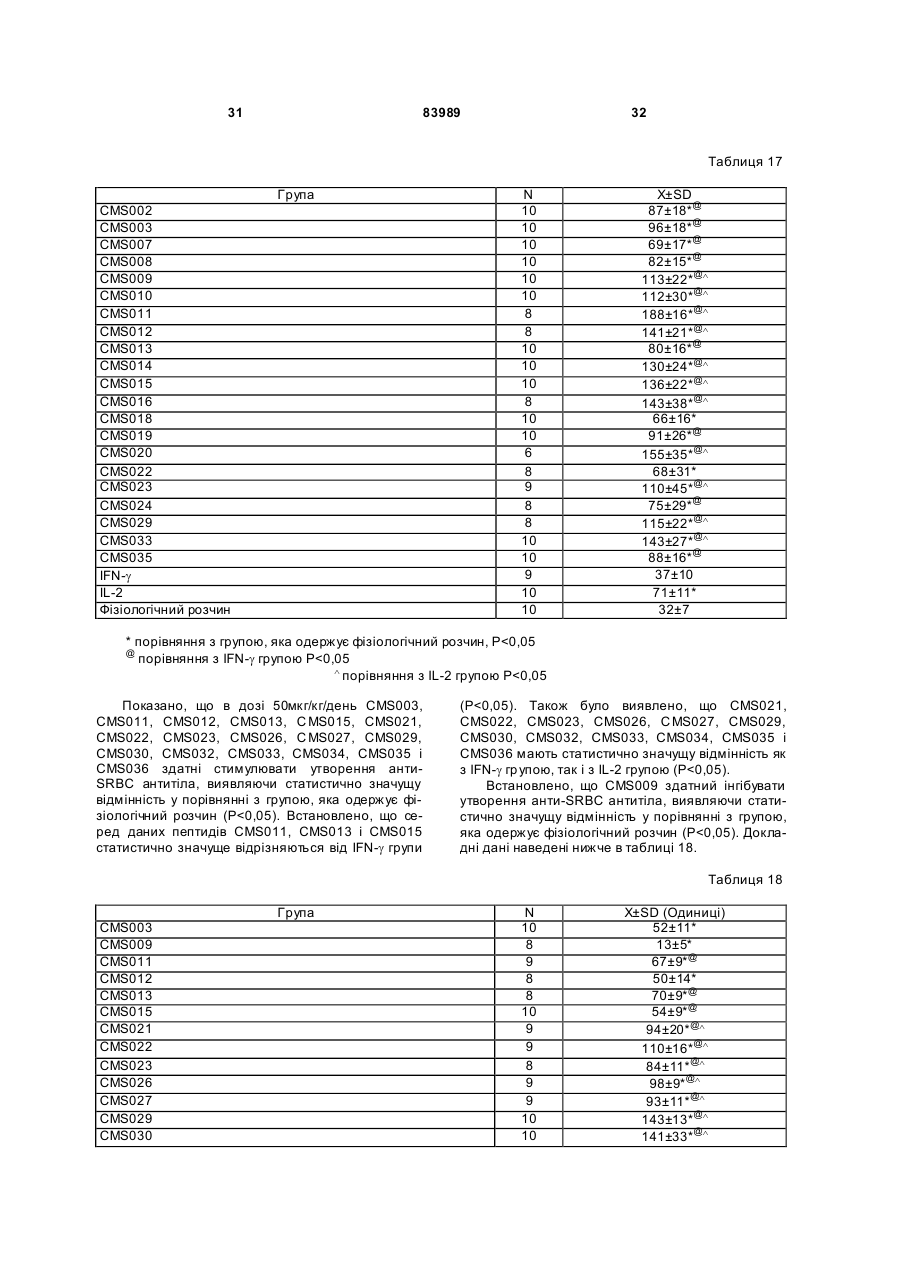
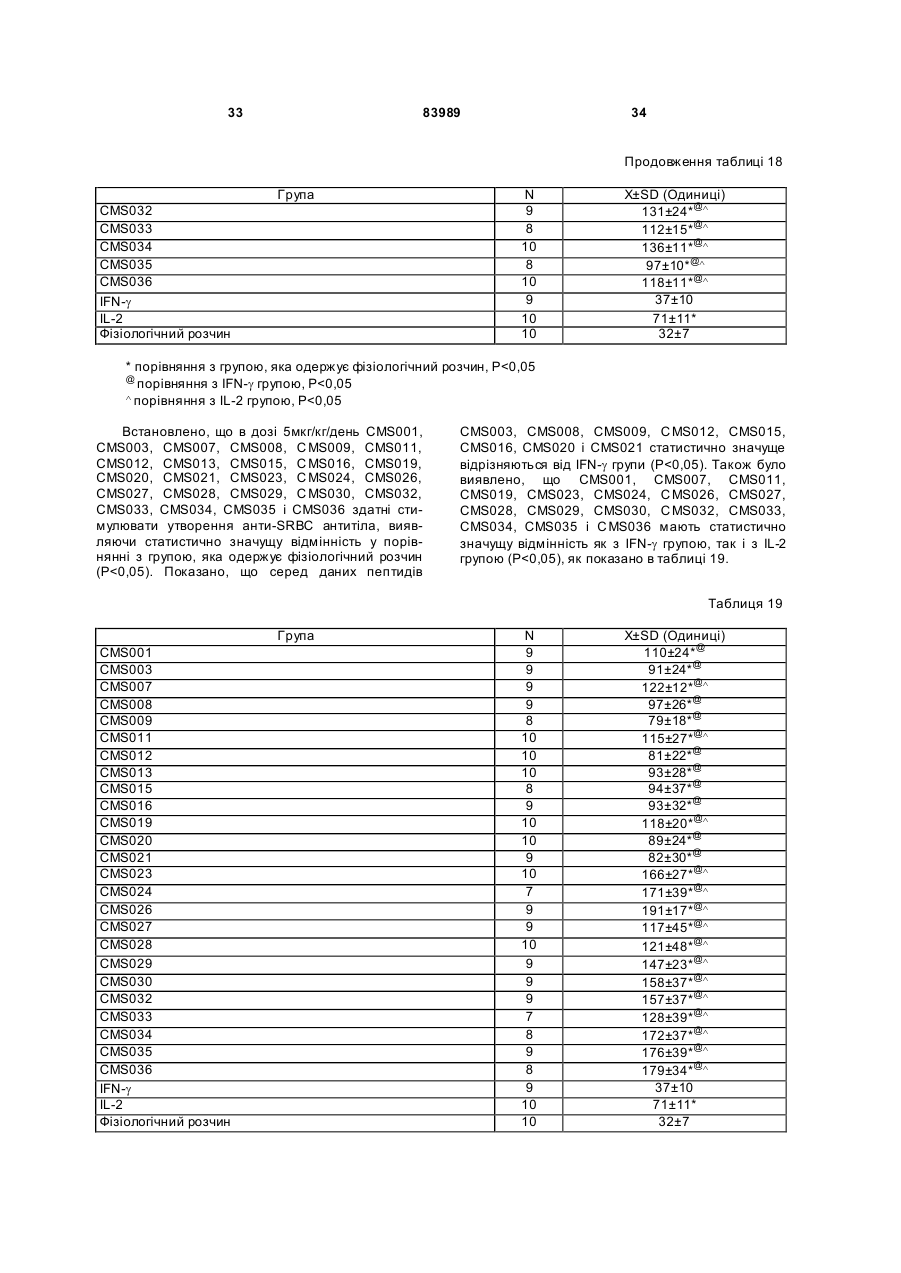
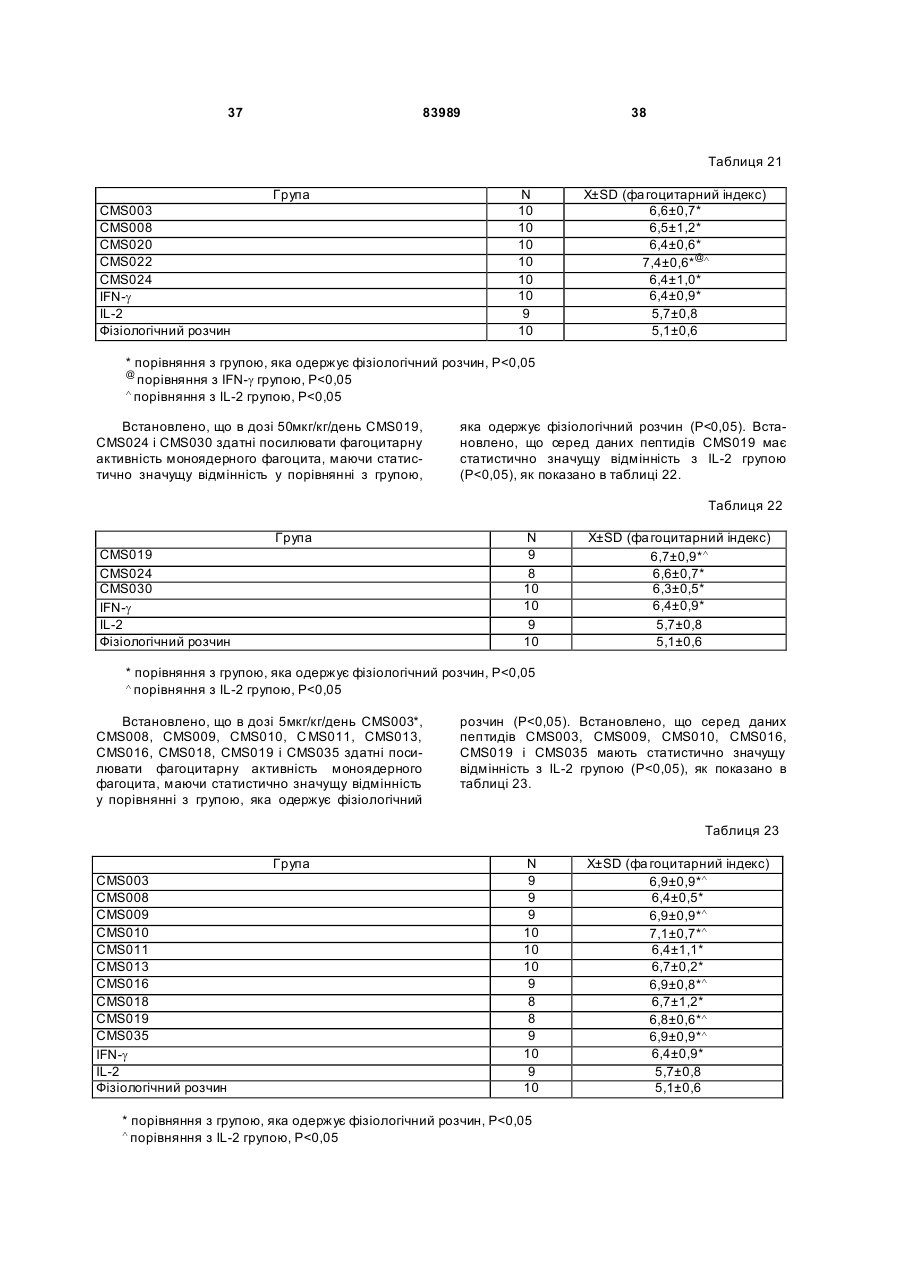
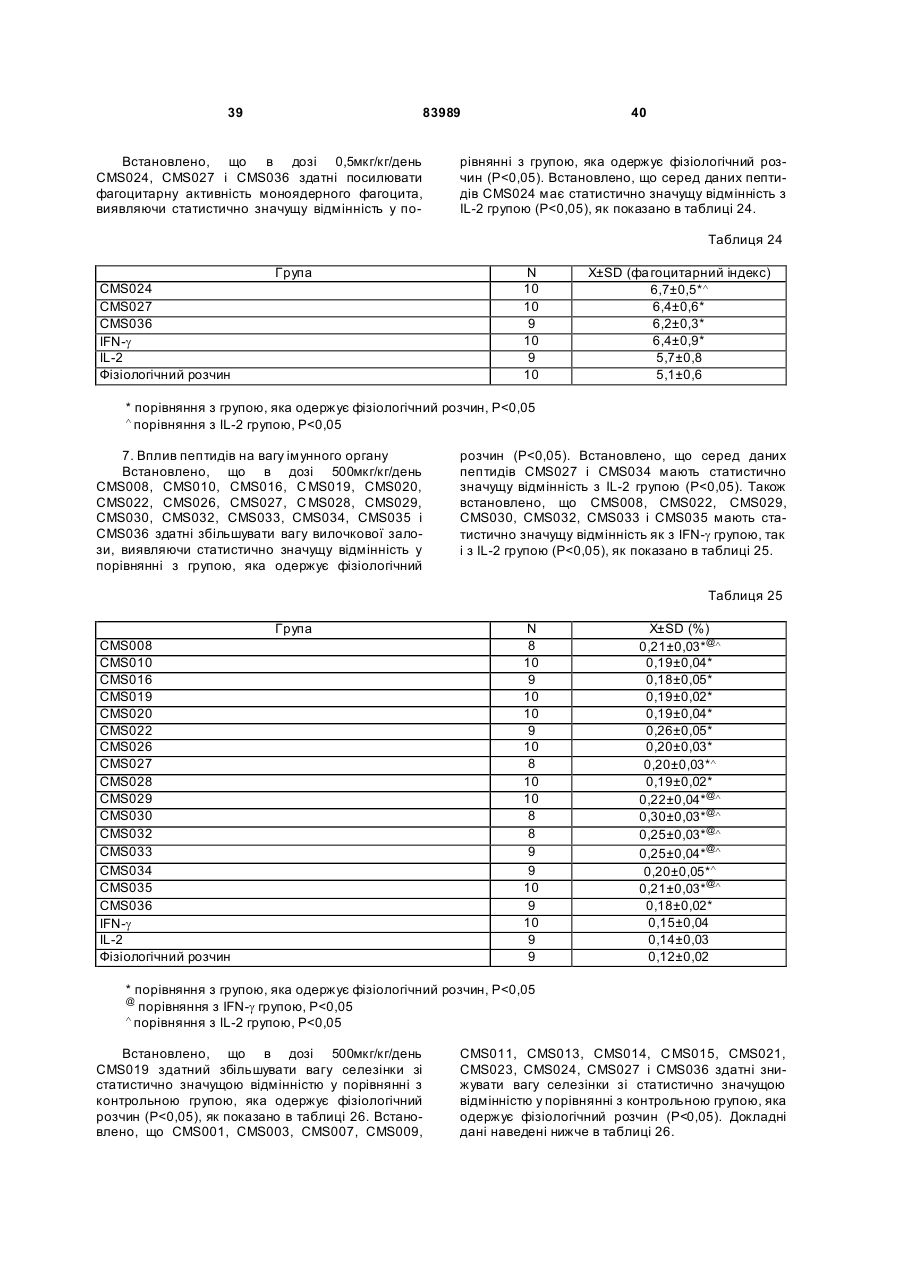
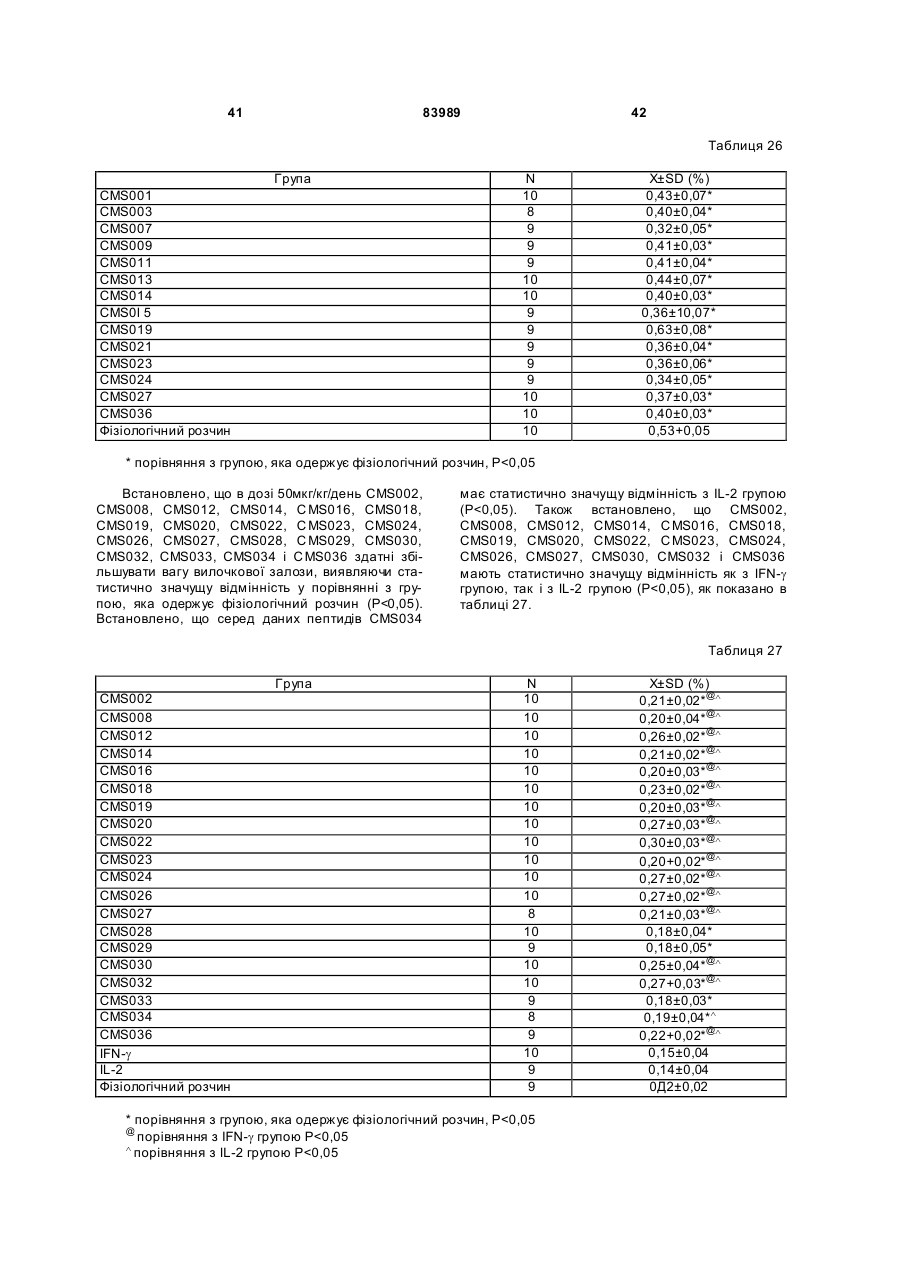
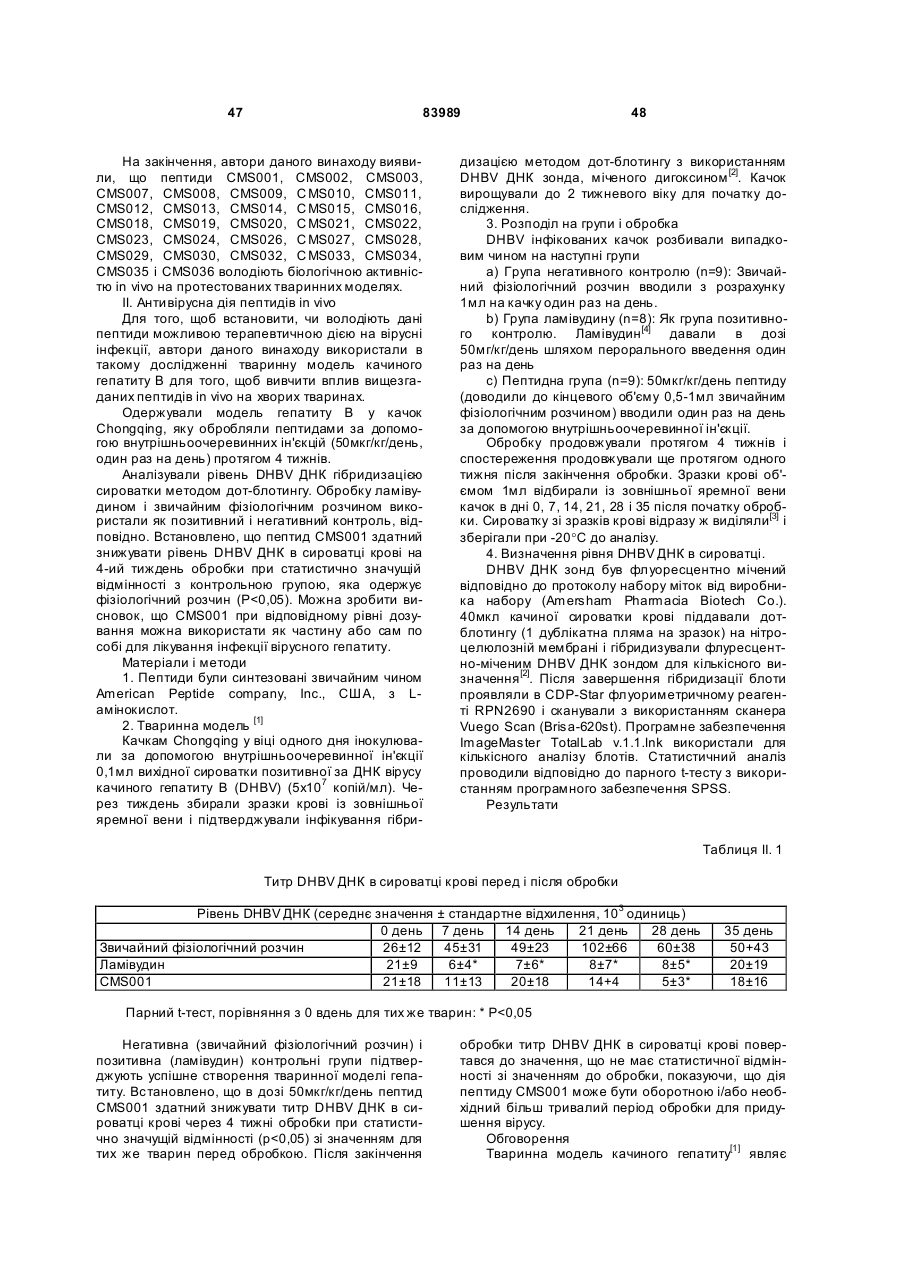
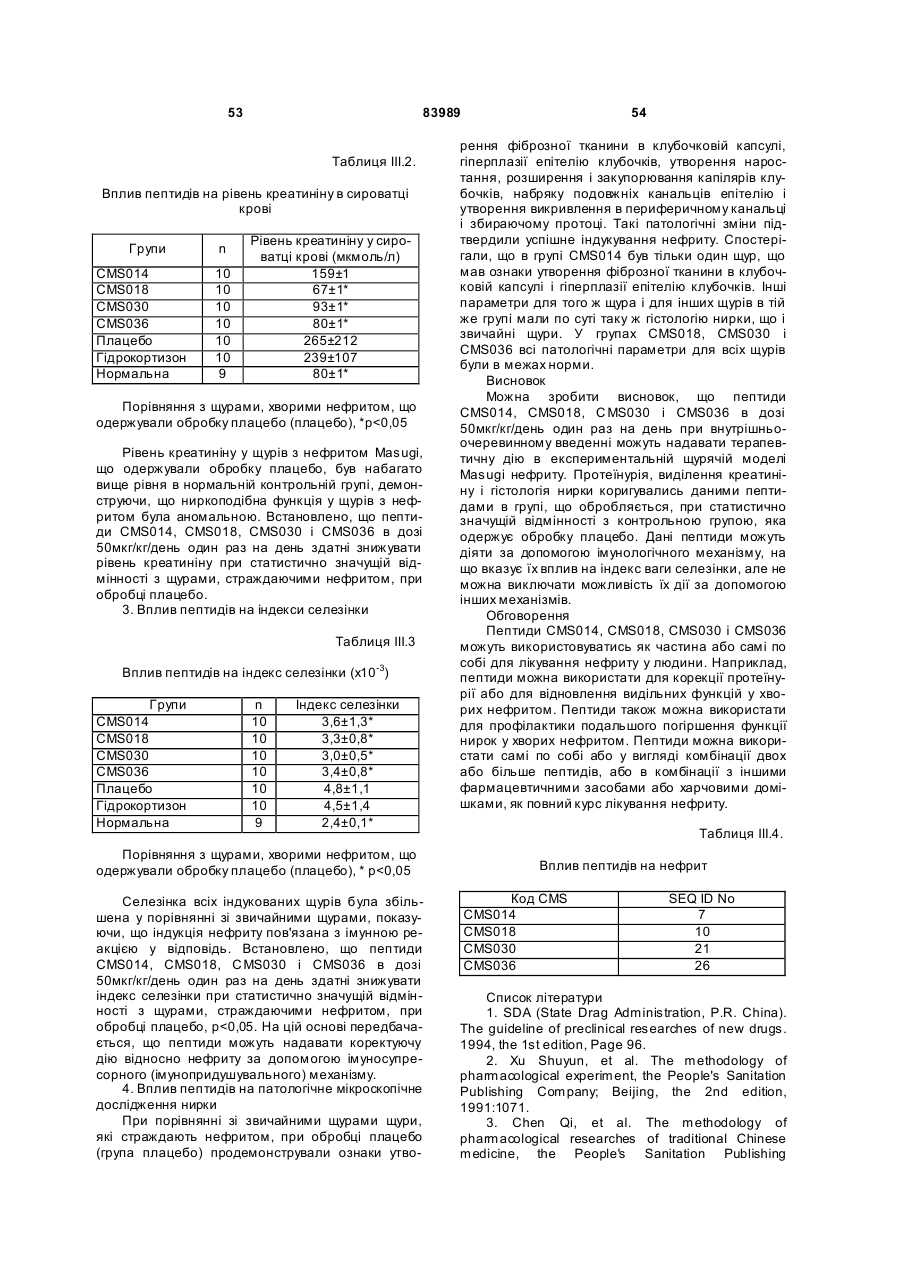
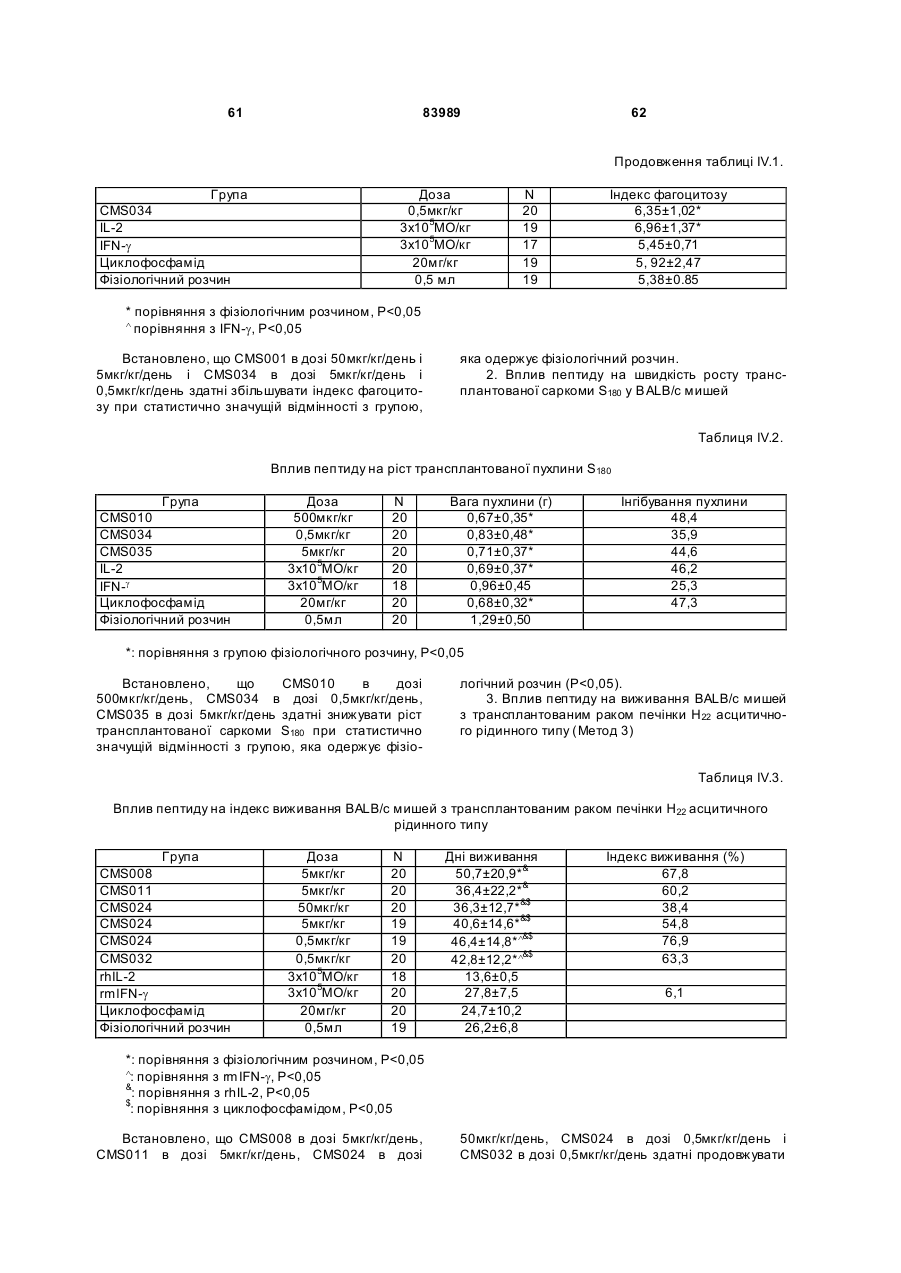
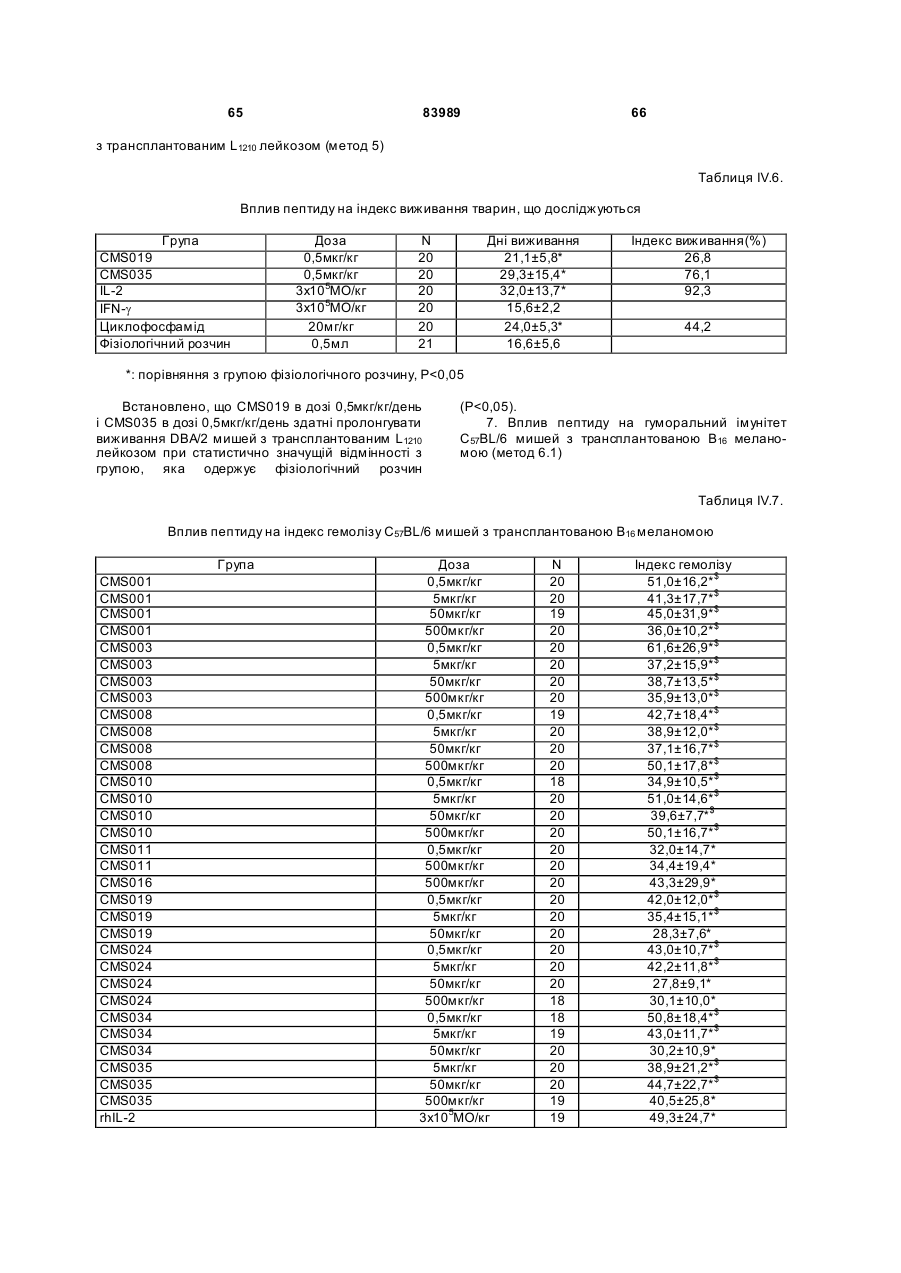
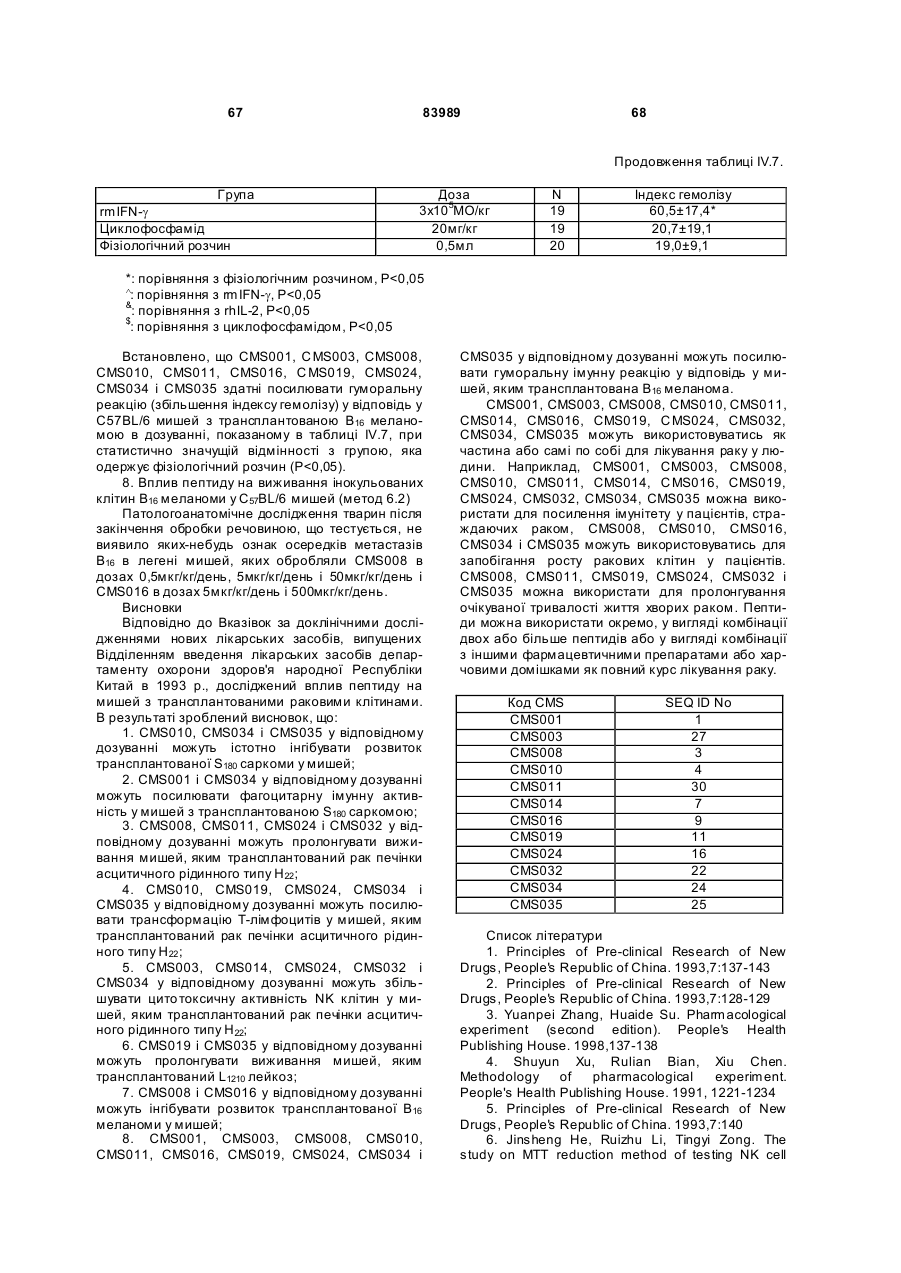
1. Виділений пептид, який стимулює протипухлинну імунну відповідь, що має амінокислотну послідовність SEQ ID No: 16. 2. Пептид за п. 1, де вказана відповідь відбувається за рахунок модуляції імунної активності у пацієнта. 3. Пептид за п. 1, де вказана імунна відповідь модулює розвиток раку. 4. Пептид за п. 3, де вказаний рак являє собою рак печінки. 5. Пептид за п. 3, де вказаний рак являє собою UA (21) 2004021049 (22) 11.07.2002 (24) 10.09.2008 (86) PCT/GB02/03203, 11.07.2002 (31) 09/904,492 (32) 13.07.2001 (33) US (46) 10.09.2008, Бюл.№ 17, 2008 р. (72) ВОНГ ВЕЙ МІНГ, ЛAM КОНГ (73) СІ-ЕМ-ЕС ПЕПТИДЕС ПАТЕНТ ХОЛДІНГ КОМП АНІ ЛІМІТЕД (56) WO A 9618646, 20.06.1996. US A 5556744, 17.09.1996. WO A 9109613, 11.07.1991. FR A1 2794370, 08.12.2000. FOGAC A E.A.: "Antimicrobial activity of bovine hemoglobin fragment in the tick Boophilus micrplus" JOURNAL OF BIOLOGIC AL CHEMISTR Y, vol. 274, no. 36, 1999, pages 25330-25334. KARELIN A A ET AL: "PROTEOL YTIC DEGRADATION OF HEMOGLOBIN IN ERYTHROCYTES LEADS TO BIOLOGIC ALLY ACTIVE PEPTIDES" PEPTIDES, ELMSFORD, US, vol. 16, no. 4, 1995, pages 693-697. SCHALLY E.A.: "Isolation, structural elucidation and synthesis of a tetradecapeptide with in vitro ACTHreleasing activity corresponding to residues 33-46of the alpha-chain of porcine hemoglobin" BIOCHEMIC AL AND BIOPHYSIC AL RESEARCH COMMUNICATIONS, vol. 82, no. 2, 1978, pages 582-588. CHANG R C C ET AL: "ISOLATION AND STRUCTURE OF SEVERAL PEPTIDES FROM PROCINE HYPOTHAL AMI" BIOCHIMICA ET BIOPHYSICA ACTA, AMSTERD AM, NL, vol. 625, 1980, pages 266-273. KARELIN A A ET AL: "[Proteolytic degradation of hemoglobin in erythrocytes results in formation of biologically active peptides]" BIOORGANICHESKAIA KHIMIIA. RUSSIA APR 1998, vol. 24, no. 4, April 1998 (1998-04), pages 271-281. PATI E.A.: ENDOCRINOLOGY, vol. 136, no. 1, 1995, pages 75-84. 2 (19) 1 3 83989 4 меланому. 6. Фармацевтична композиція, яка складається з ефективної кількості пептиду за п. 1 і фармацевтично прийнятного носія. 7. Фармацевтична композиція за п. 6, яка стимулює протипухлинну імунн у відповідь. 8. Фармацевтична композиція за п. 7, де вказана відповідь відбувається за рахунок модуляції імунної активності у пацієнта. 9. Фармацевтична композиція за п. 7, де вказана відповідь модулює розвиток раку. 10. Фармацевтична композиція за п. 9, де вказаний рак являє собою рак печінки. 11. Фармацевтична композиція за п. 9, де вказаний рак являє собою меланому. 12. Застосування фармацевтичної композиції за п. 6 у фармацевтично ефективній дозі для лікування захворювання ссавця, при якому необхідна стимуляція протипухлинної імунної відповіді. 13. Застосування за п. 12, де у вказаного ссавця діагностовано рак. 14. Застосування за п. 12, де вказаний рак являє собою рак печінки. 15. Застосування за п. 12, де вказаний рак являє собою меланому. 16. Застосування фармацевтичної композиції за п. 6 у фармацевтично ефективній дозі для модуляції імунної відповіді у пацієнта, який страждає на захворювання, при лікуванні якого необхідна стимуляція протипухлинної імунної відповіді. 17. Застосування за п. 16, де вказана імунна відповідь полягає у збільшенні цитотоксичної активності NK клітин. 18. Застосування за п. 16, де вказана імунна відповідь полягає в посиленні синтезу анти-SRBC антитіл при антигенній стимуляції. 19. Застосування за п. 16, де вказана імунна відповідь полягає в посиленні фагоцитарної активності моноядерних фагоцитів. 20. Застосування за п. 16, де вказана імунна відповідь полягає в збільшенні ваги вилочкової залози. 21. Застосування за п. 16, де вказана імунна відповідь полягає у зниженні ваги селезінки. Даний винахід відноситься до області імунології. Зокрема, даний винахід відноситься до пептидів і їх фармацевтичних композицій, здатних модулюва ти імунні відповіді. Відоме застосування пептидів для лікування захворювань і як фармацевтичні композиції. Наприклад, у патенті США 6191113 описаний пептид, який володіє інгібуючою активністю для росту клітин гладкої мускулатури і таким чином може використовуватись для профілактики і лікування патологічних станів, пов'язаних з ростом клітин гладкої мускулатури, таких як атеросклероз, рестеноз після ангіопластики, звуження просвіту після трансплантації кровоносних судин і саркома гладкої мускулатури. У патенті США 6184208 описаний інший пептид, який, як встановлено, модулює фізіологічні процеси, такі як активність приросту ваги зони епітеліального росту і росту волосся. Таким чином, об'єктом даного винаходу є ідентифікація біологічно активних поліпептидів. Стандартними хімічними методами була синтезована множина пептидів і проведений скринінг їх біологічної активності. Пептидам привласнені коди, що мають букви CMS з подальшим номером. Усього було виявлено 30 пептидів, що володіють біологічною активністю in vivo. Послідовності і відповідні ідентифікаційні номери (ID) таких біологічно активних пептидів наведені в таблиці А. Таблиця А SEQ ID No: 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 Назва пептиду CMS001 CMS002 CMS008 CMS010 CMS012 CMS013 CMS014 CMS015 CMS016 CMS018 CMS019 CMS020 CMS021 CMS022 CMS023 CMS024 CMS026 CMS027 CMS028 Пептидна послідовність Pro Thr Thr Lys Thr Туr Phe Pro His Phe VaI VaI Туr Pro Trp Thr GIn Arg Phe Lys Ala VaI GIy His Leu Asp Asp Leu Pro GIy Ala Leu VaIGIu Ala Pro GIu GIu His Pro Thr Leu Leu Thr Ala Pro Leu Asn Pro Lys Leu Tyr GIy Met GIu Ala Cys GIy He His GIu Thr Thr Leu Arg VaI Ala Pro GIu GIu His Pro VaI Leu Ala Ala His His Pro Asp Asp Phe Asn Pro Ser VaI Pro VaI Ser He VaI GIy Arg Pro Arg His Gin GIy Met He Thr GIy Met GIu Ser Ala GIy He His GIu Thr Tyr VaI GIy Met GIy GIu L ys Asp Ser Туr VaI GIy Met GIy Gin Lys Asp Ser Туr VaI GIy Met GIy Gin Lys Asp Ser Туr Va I Met Ala Thr Ala Ala Ser Ser Ser Ser Leu Tyr Ser Phe Ala Ala Phe Tyr Ser Leu Thr Thr Tyr Asn Ser He Met Phe GIu GIu Asn Met Phe GIu Pro Ser Phe 5 83989 6 Продовження таблиці А SEQ ID No: 20 21 22 23 24 25 26 27 28 29 30 Назва пептиду CMS029 CMS030 CMS032 CMS033 CMS034 CMS035 CMS036 CMS003 CMS007 CMS009 CMS011 Пептидна послідовність Phe Asn GIu GIu Phe GIu GIu Met Phe GIu GIu GIu Phe GIu Ser Phe Pro GIu Asn Phe Phe VaI Asn Asp Phe Gin Pro Ser Phe Phe Asn Phe VaI Pro Pro Ala GIy Asp Asp Ala Pro Arg Ala VaI Phe Leu Arg VaI Ala Pro GIu GIu His Pro Thr Leu Arg VaI Ala Pro GIu GIu His Pro Thr Leu Відповідно, один з аспектів даного винаходу відноситься до по суті чисти х пептидів, що мають послідовності, ідентифіковані як послідовності SEQ ID No: 1-30. Таким чином, даний винахід також відноситься до по суті чисти х пептидів, що включають амінокислотну послідовність, вибрану з групи, яка складається з SEQ ID No: 1-30. Він також відноситься до по суті чистого пептиду, що складається головним чином з амінокислотної послідовності, вибраної з групи, яка складається з SEQ ID No: 1-30. В конкретному варіанті здійснення пептиди можуть модулювати, але не обмежуються модулюванням, одне або більше з наступного: імунну активність; інфекцію гепатиту, включаючи, але не обмежуючись, інфекцію гепатиту В; нефрит; ріст ракової пухлини, включаючи, але не обмежуючись цим, саркому, рак печінки, лейкоз і меланому; і вагу тіла. В іншому аспекті даний винахід відноситься до по суті чистих пептидів, які є функціональними похідними пептидів, що мають послідовності, ідентифіковані як послідовності з ID No: 1-30. Таким чином, даний винахід також відноситься по суті до чистого пептиду, що включає амінокислотну послідовність, яка є функціональною похідною амінокислотної послідовності, вибраної з групи, що складається з SEQ ID No: 1-30. Він також відноситься до по суті чистого пептиду, що складається головним чином з амінокислотної послідовності, яка являє собою функціональне похідне амінокислотної послідовності, вибраної з групи, яка складається з SEQ ID No: 1-30. У конкретному варіанті здійснення пептиди, які є функціональними похідними, можуть модулювати, але не обмежуються модулюванням, одне або декілька з наступного: імунну активність; інфекцію гепатиту, включаючи, але не обмежуючись, інфекцію гепатиту В; нефрит; ріст ракової пухлини, включаючи, але не обмежуючись цим, саркому, рак печінки, лейкоз і меланому; і вагу тіла. В іншому аспекті даний винахід відноситься до нуклеїнових кислот, які мають послідовності, що кодують пептиди, ідентифіковані вище як послідовності SEQ ID No: 1-30. Додатковий аспект даного винаходу відноситься до векторів експресії, які містять послідовності нуклеїнових кислот пептидів, показані нижче як послідовності SEQ ID No: 1-30. Таким чином, даний аспект даного винаходу також відноситься до генетичного вектора, що включає нуклеотидну послідовність, яка кодує пептид, що включає амінокислотну послідовність, вибрану з групи, яка включає SEQ ID No: 1-30. Він також відноситься до генетичного вектора, що включає нуклеотидну послідовність, яка кодує пептид, що складається головним чином з амінокислотної послідовності, вибраної з групи, яка складається з SEQ ID No: 1-30. Винахід також відноситься до генетичного вектора, що включає нуклеотидну послідовність, яка кодує пептид, що включає функціональне похідне біологічно активної амінокислотної послідовності, вибраної з групи, яка складається з SEQ ID No: 1-30. Він також відноситься до генетичного вектора, що включає нуклеотидну послідовність, яка кодує пептид, що складається головним чином з функціональної амінокислотної послідовності, яка являє собою функціональне похідне біологічно активної амінокислотної послідовності, вибраної з групи, що складається з SEQ ID No: 1-30. Ще один аспект даного винаходу відноситься до гібридних пептидів, що містять лідерний або сигнальний пептид, суміжний з пептидом, при цьому пептид включає амінокислотну послідовність, вибрану з групи, яка складається з SEQ ID No: 1-30. Даний винахід також відноситься до гібридних пептидів, що містять лідерний пептид, суміжний з пептидом, при цьому пептид включає функціональне похідне пептиду, який має амінокислотну послідовність, вибрану з групи, що складається з SEQ ID No: 1-30. Даний винахід також відноситься до генетичного вектора, що включає нуклеотидну послідовність, яка кодує пептид, що включає лідерну амінокислотну послідовність, суміжну з пептидом, що включає функціональну амінокислотну послідовність, яка являє собою функціональне похідне біологічно активної амінокислотної послідовності, вибраної з групи, що включає SEQ ID No: 1-30. Він також відноситься до генетичного вектора, що включає нуклеотидну послідовність, яка кодує пептид, що включає лідерну амінокислотну послідовність, суміжну з пептидом, що складається головним чином з функціональної амінокислотної послідовності, яка являє собою функціональне похідне біологічно активної амінокислотної послідовності, вибраної з групи, що складається з SEQ 7 83989 ID No: 1-30. У конкретному варіанті здійснення пептиди, продуковані в будь-якому з вищезгаданих генетичних векторів, можуть модулювати, але не обмежуються модулюванням, одне або більше з наступного: імунну активність; інфекцію гепатиту, включаючи, але не обмежуючись, інфекцію гепатиту В; нефрит; ріст ракової пухлини, включаючи, але не обмежуючись цим, саркому, рак печінки, лейкоз і меланому; і вагу тіла. Ще в одному аспекті даний винахід відноситься до мікроорганізму, геном якого включає нуклеотидну послідовність, яка кодує пептид, що складається з амінокислотної послідовності, вибраної з групи, що складається з SEQ ID No: 1-30. Він також відноситься до мікроорганізму, геном якого включає нуклеотидну послідовність, що кодує пептид, який складається головним чином з амінокислотної послідовності, вибраної з групи, що складається з SEQ ID No: 1-30. Ще в одному аспекті даний винахід відноситься до мікроорганізму з генетичним матеріалом, який включає нуклеотидну послідовність, що кодує екзогенний пептид, який включає функціональну амінокислотну послідовність, яка являє собою функціональне похідне біологічно активної амінокислотної послідовності, вибраної з групи, що складається з SEQ ID No: 1-30. Він також відноситься до мікроорганізму з генетичним складом, що включає нуклеотидну послідовність, яка кодує екзогенний пептид, що складається головним чином з функціональної амінокислотної послідовності, яка являє собою функціональне похідне біологічно активної амінокислотної послідовності, вибраної з групи, що складається з SEQ ID No: 1-30. Термін «екзогенний пептид», як використано в даному описі, відноситься до пептиду, що має амінокислотну послідовність, яка відрізняється від будь-якого іншого пептиду, звичайно експресованого мікроорганізмом у своїй природній немодифікованій формі. Ще в одному аспекті даний винахід відноситься до мікроорганізму з генетичним складом, що включає нуклеотидну послідовність, яка кодує екзогенний гібридний пептид, що включає лідерну амінокислотну послідовність, суміжну з пептидом, пептид включає амінокислотну послідовність, вибрану з групи, яка складається з SEQ ID No: 1-30. Він також відноситься до мікроорганізму, геном якого включає нуклеотидну послідовність, що кодує гібридний пептид, який включає лідерну амінокислотну послідовність, суміжну з пептидом, що складається головним чином з амінокислотної послідовності, вибраної з групи, яка складається з SEQ ID No: 1-30. В іншому аспекті даний винахід відноситься до мікроорганізму з генетичним складом, що включає нуклеотидну послідовність, яка кодує екзогенний гібридний пептид, що включає лідерну амінокислотну послідовність, суміжну з пептидом, при цьому пептид включає функціональну амінокислотну послідовність, яка являє собою функціональне похідне біологічно активної амінокислотної послідовності, вибраної з групи, що складається з SEQ ID No: 1-30. Він також відноситься до мікроорганізму з генетичним складом, що включає нуклеотидну 8 послідовність, яка кодує екзогенний гібридний пептид, що включає лідерну амінокислотну послідовність, суміжну з пептидом, який складається головним чином з функціональної амінокислотної послідовності, яка являє собою функціональне похідне біологічно активної амінокислотної послідовності, вибраної з групи, що складається з SEQ ID No: 1-30. У конкретному варіанті здійснення пептиди, продуковані будь-яким з вищезгаданих мікроорганізмів, можуть модулювати, але не обмежуються модулюванням, одне або більше з наступного: імунну активність; інфекцію гепатиту, включаючи, але не обмежуючись, інфекцію гепатиту В; нефрит; ріст ракової пухлини, включаючи, але не обмежуючись цим, саркому, рак печінки, лейкоз і меланому; і вагу тіла. У наступному аспекті даний винахід відноситься до фармацевтичної композиції, що включає по суті чистий пептид, який включає амінокислотну послідовність, вибрану з групи, що складається з SEQ ID No: 1-30. Винахід також відноситься до фармацевтичної композиції, яка включає по суті чистий пептид, що складається головним чином з амінокислотної послідовності, вибраної з групи, яка складається з SEQ ID No: 1-30.Даний винахід також відноситься до фармацевтичної композиції, що включає по суті чистий пептид, який включає функціональне похідне амінокислотної послідовності, вибраної з групи, що складається з SEQ ID No: 1-30. Він також відноситься до фармацевтичної композиції, що включає по суті чистий пептид, який складається головним чином з функціонального похідного амінокислотної послідовності, вибраної з групи, що складається з SEQ ID No: 1-30. Крім того, винахід відноситься до фармацевтичної композиції, що складається з по суті чистого пептиду, який складається головним чином з функціонального похідного амінокислотної послідовності, вибраної з групи, що складається з SEQ ID No: 1-30. У конкретному варіанті здійснення пептиди у складі будь-якої з вищезгаданих фармацевтичних композицій можуть модулювати, але не обмежуються модулюванням, одне або більше з наступного: імунну активність; інфекцію гепатиту, включаючи, але не обмежуючись, інфекцію гепатиту В; нефрит; ріст ракової пухлини, включаючи, але не обмежуючись цим, саркому, рак печінки, лейкоз і меланому; і вагу тіла. У наступному аспекті даний винахід відноситься до способу одержання фармацевтичної композиції, що включає одержання по суті чистого пептиду, який включає амінокислотну послідовність, вибрану з групи, що складається з SEQ ID No: 130, і змішування вказаного по суті чистого пептиду з фармацевтично прийнятним носієм. Він також відноситься до способу одержання фармацевтичної композиції, що включає одержання по суті чистого пептиду, який складається головним чином з амінокислотної послідовності, вибраної з групи, що складається з SEQ ID No: 1-30. В іншому аспекті даний винахід відноситься до способу одержання фармацевтичної композиції, що включає одержання по суті чистого пептиду, 9 83989 який включає амінокислотну послідовність, яка є функціональним похідним амінокислотної послідовності, вибраної з групи, що складається з SEQ ID No: 1-30; і змішування вказаного по суті чистого пептиду з фармацевтично прийнятним носієм. Винахід далі відноситься до способу одержання фармацевтичної композиції, який включає одержання по суті чистого пептиду, що складається головним чином з амінокислотної послідовності, яка є функціональним похідним амінокислотної послідовності, вибраної з групи, що складається з SEQ ID No: 1-30. У зв'язку з будь-яким з вищезгаданих способів, пептид може модулювати, але не обмежується модулюванням, одне або більше з наступного: імунну активність; інфекцію гепатиту, включаючи, але не обмежуючись, інфекцію гепатиту В; нефрит; ріст ракової пухлини, включаючи, але не обмежуючись цим, саркому, рак печінки, лейкоз і меланому; і вагу тіла. Ще в одному аспекті даний винахід відноситься до способу лікування людини, який включає введення людині фармацевтично ефективної дози по суті чистого пептиду, що включає амінокислотну послідовність, вибрану з групи, яка складається з SEQ ID No: 1-30. Він також відноситься до способу лікування людини, який включає введення людині фармацевтично ефективної дози по суті чистого пептиду, що включає амінокислотну послідовність, яка являє собою функціональне похідне амінокислотної послідовності, вибраної з групи, що складається з SEQ ID No: 1-30. У конкретному варіанті здійснення описані вище пептиди, що використовуються для лікування людини, можуть використовуватись для модулювання, але не обмежуються модулюванням, одного або більше з наступних станів людини: імунної активності; інфекції гепатиту, включаючи, але не обмежуючись, інфекцію гепатиту В; нефриту; ріст ракової пухлини, включаючи, але не обмежуючись цим, саркому, рак печінки, лейкоз і меланому; і вагу тіла. У зв'язку з будь-якими вищеописаними послідовностями нуклеїнових кислот, пептиди і/або гібридні пептиди, експресовані з даних послідовностей нуклеїнових кислот, можуть модулювати, але не обмежуються модулюванням, наступне: імунну активність; інфекцію гепатиту, включаючи, але не обмежуючись, інфекцію гепатиту В; нефрит; ріст ракової пухлини, включаючи, але не обмежуючись цим, саркому, рак печінки, лейкоз і меланому; і вагу тіла. Інший аспект даного винаходу відноситься до способу лікування захворювань, що включає введення фармацевтично ефективної дози по суті чистого пептиду, з послідовністю SEQ ID No: 1 SEQ ID No: 30. У конкретному варіанті здійснення пептиди можуть модулювати, але не обмежуються модулюванням, наступне: імунну активність; інфекцію гепатиту, включаючи, але не обмежуючись, інфекцію гепатиту В; нефрит; ріст ракової пухлини, включаючи, але не обмежуючись цим, саркому, рак печінки, лейкоз і меланому; і вагу тіла. Як описано вище, інший варіант здійснення даного винаходу являє собою пептид або поліпеп 10 тид, що складається головним чином з пептидів за даним винаходом. Як використано в даному описі термін «що складається головним чином з» відноситься до пептиду або поліпептиду, який включає амінокислотну послідовність пептидів за даним винаходом нарівні з додатковими амінокислотами на карбоксильному і/або амінному кінцях, і який підтримує активність представлених тут пептидів за даним винаходом. Таким чином, як необмежувальний приклад, коли активність пептиду за даним винаходом полягає у модулюванні імунної активності, пептид або поліпептид, «що складається головним чином» з пептиду за даним винаходом, буде володіти активністю модулювання імунної активності, як представлено тут відносно пептиду, і не буде володіти якими-небудь характеристиками, які значно знижують здатність пептиду або поліпептиду модулювати імунну активність, або які вносять значущу зміну в основні і нові характеристики пептиду як модулятор імунної активності. Таким чином, в наведеному ви ще прикладі повнорозмірний природний поліпептид, який володіє первинною активністю, яка відрізняється від модулювання імунної активності, і який де-небудь в собі містить амінокислотну послідовність пептиду за даним винаходом, не буде являти собою пептид або поліпептид, «що складається головним чином» з пептиду за даним винаходом. Аналогічним чином у вищезгаданому прикладі генетично сконструйований пептид або поліпептид, який володіє первинною активністю, що відрізняється від модулювання імунної активності, але включає денебудь в собі амінокислотну послідовність пептиду за даним винаходом, не буде являти собою пептид або поліпептид, «що складається головним чином» з пептиду за даним винаходом. Крім використаного вище прикладу модулювання імунної активності, наведене вище визначення також відноситься до всіх пептидів даного винаходу відносно видів активності, якими володіють такі пептиди. Зокрема, наведене вище визначення відноситься до пептидів винаходу, що володіють активністю модулювання міри вірусного інфікування, модулювання міри інфекції гепатиту, модулювання міри нефриту, модулювання росту ракової пухлини або модулювання ваги тіла, як зазначено нижче в докладному описі. Фахівці в даній області легко зможуть визначити, складається або не складається пептид або поліпептид головним чином з пептиду за даним винаходом в рамках наведених вище визначень, за допомогою вимірювання активності пептиду або поліпептиду з використанням аналізів модулювання імунної активності, модулювання міри вірусного інфікування, модулювання міри інфекції гепатиту, модулювання міри нефриту, модулювання росту ракової пухлини або модулювання ваги тіла, які забезпечуються тут для конкретних пептидів за даним винаходом. У переважному варіанті здійснення термін «що складається головним чином з» відноситься до пептидів або поліпетидів, які мають менше 20 амінокислотних залишків в доповнення до пептиду згідно з даним винаходом. У більш переважному варіанті здійснення та ж термінологія відноситься 11 83989 до пептидів, що мають менше 15 амінокислотних залишків в доповнення до пептиду згідно з даним винаходом. У ще більш переважному варіанті здійснення та ж термінологія відноситься до пептидів, що мають менше 10 амінокислотних залишків в доповнення до пептиду згідно з даним винаходом. Ще в одному переважному варіанті здійснення та ж термінологія відноситься до пептидів або поліпептидів, що мають менше 6 амінокислотних залишків в доповнення до одного з пептидів згідно з даним винаходом. В іншому переважному варіанті здійснення та ж термінологія відноситься до пептидів або поліпептидів, що мають менше 4 амінокислотних залишків в доповнення до одного з пептидів згідно з даним винаходом. У найбільш переважному варіанті здійснення та ж термінологія відноситься до пептидів або поліпептидів, що мають менше 2 амінокислотних залишків в доповнення до одного з пептидів згідно з даним винаходом. Пептиди легко можуть бути синтезовані стандартними синтетичними способами з Lамінокислот, а також можуть бути синтезовані методами генної інженерії з використанням нуклеїнових кислот, що мають послідовності, які кодують конкретні пептиди. І. Біологічна активність Для дослідження можливої біологічної активності пептидів вивчали імунологічну дію пептидів на тваринній моделі за допомогою методик, відповідних «Принципам доклінічного дослідження нових лікарських засобів», випущених Міністерством охорони Здоров'я Народної республіки Китай [1]. Для виявлення якого-небудь можливого впливу пептидів на специфічну клітинну імунну функцію використали тест трансформації Т-лімфоцитів, тест цитотоксичної активності NK клітин і тест секреції Т-лімфоцитами IL-2 і IFN-g. Тест очи щення частинками вугілля використали для виявлення якого-небудь можливого впливу пептидів на неспецифічну клітинну імунну функцію. Гемоліз овечих еритроцитів (SRBC) використали для виявлення якого-небудь можливого впливу пептидів на гуморальну імунну функцію. Тест зі зважуванням імунного органу використали для виявлення якогонебудь можливого впливу пептидів на органному рівні. У такому дослідженні групу, що одержує фізіологічний розчин, використали як негативний контроль, тоді як групи, що одержують IL-2 і IFN-g, використали як позитивні контролі, оскільки IL-2 і IFN-g являють собою добре відомі імуностимулятори [10]. У такому дослідженні використали чотири довільних концентрації зразків пептидів для того, щоб перекрити 1000-кратний діапазон дозування. Через внутрішню складність імунологічної відповіді in vivo і відсутність попередніх даних про реакцію у відповідь в залежності від дозування, як позитивну біологічну активність розглядали будьяку статистично значущу відмінність відносно негативного контролю в будь-якій з груп дозування. Результати даного дослідження були наступними: 1. Встановлено, що пептиди CMS001, CMS002, CMS003, CMS007, C MS008, CMS009, 12 CMS010, CMS011, CMS012, C MS015, CMS019, CMS021, CMS029 і CMS034 здатні посилювати трансформацію Т-лімфоцитів, виявляючи статистично значущу відмінність при порівнянні з нормальною контрольною групою, яка одержує фізіологічний розчин. Також встановлено, що пептиди CMS014 і CMS036 здатні інгібувати трансформацію Т-лімфоцитів, виявляючи статистично значущу відмінність при порівнянні з нормальною контрольною групою, яка одержує фізіологічний розчин. 2. Встановлено, що пептиди CMS001, CMS002, CMS003, CMS008, C MS009, CMS010, CMS011, CMS012, CMS013, C MS015, CMS016, CMS020, CMS021, CMS022, C MS023, CMS024, CMS026, CMS027, CMS028, C MS029, CMS030, CMS032, CMS033, CMS034, CMS035 і CMS036 здатні збільшувати цитотоксичну активність NK клітин, виявляючи статистично значущу відмінність при порівнянні з нормальною контрольною групою, яка одержує фізіологічний розчин. Також встановлено, що пептиди CMS008 і CMS012 у відповідній концентрації здатні знижувати цитотоксичну активність NK клітин, виявляючи статистично значущу відмінність при порівнянні з нормальною контрольною групою, яка одержує фізіологічний розчин. 3. Встановлено, що пептиди CMS001, CMS003, CMS007, CMS009, C MS010, CMS011, CMS012, CMS015, CMS020, CMS022 і CMS034 здатні посилювати секрецію інтерлейкіну-2 (IL-2) Т-лімфоцитами, виявляючи статистично значущу відмінність при порівнянні з нормальною контрольною групою, яка одержує фізіологічний розчин. 4. Встановлено, що пептиди CMS001, CMS003, CMS009, CMS010, C MS011, CMS012, CMS013, CMS016, CMS021, CMS022 і CMS028 здатні посилювати секрецію IFN Т-лімфоцитами, виявляючи статистично значущу відмінність при порівнянні з нормальною контрольною групою, яка одержує фізіологічний розчин. 5. Встановлено, що пептиди CMS001, CMS002, CMS003, CMS007, C MS008, CMS009, CMS010, CMS011, CMS012, C MS013, CMS014, CMS015, CMS016, CMS018, C MS019, CMS020, CMS021, CMS022, CMS023, C MS024, CMS026, CMS027, CMS028, CMS029, C MS030, CMS032, CMS033, CMS034, CMS035 і CMS036 здатні посилювати синтез анти-SRBC антитіл при антигенній стимуляції, виявляючи статистично значущу відмінність при порівнянні з нормальною контрольною групою, яка одержує фізіологічний розчин. Також встановлено, що пептиди CMS002, CMS003, CMS009, CMS010, C MS011, CMS013, CMS014, CMS015, CMS018, C MS019, CMS020, CMS026, CMS028, CMS029, CMS030, CMS034 і CMS036 у відповідній концентрації здатні інгібувати синтез анти-SRBC антитіл при антигенній стимуляції, виявляючи статистично значущу відмінність при порівнянні з нормальною контрольною групою, яка одержує фізіологічний розчин. 6. Встановлено, що пептиди CMS003, CMS008, CMS009, CMS010, C MS011, CMS013, CMS016, CMS018, CMS019, C MS020, CMS022, CMS024, CMS027, CMS030, CMS035, CMS036 здатні посилювати фагоцитарну активність моно 13 83989 ядерних фа гоцитів, виявляючи ста тистично значущу відмінність при порівнянні з нормальною контрольною групою, яка одержує фізіологічний розчин. 7. Встановлено, що пептиди CMS001, CMS002, CMS008, CMS010, C MS012, CMS013, CMS014, CMS015, CMS016, C MS018, CMS019, CMS020, CMS021, CMS022, C MS023, CMS024, CMS026, CMS027, CMS028, C MS029, CMS030, CMS032, CMS033, CMS034, CMS035 і CMS036 здатні збільшувати вагу вилочкової залози, виявляючи статистично значущу відмінність при порівнянні з нормальною контрольною групою, яка одержує фізіологічний розчин. 8. Встановлено, що пептиди CMS019, CMS020 і CMS030 здатні збільшувати вагу селезінки, виявляючи статистично значущу відмінність при порівнянні з нормальною контрольною групою, яка одержує фізіологічний розчин. Також було встановлено, що пептиди CMS001, CMS003, CMS007, CMS008, CMS009, C MS010, CMS011, CMS013, CMS014, CMS015, C MS021, CMS023, CMS024, CMS027, CMS029 і CMS036 у відповідній концентрації здатні знижувати вагу селезінки, виявляючи статистично значущу відмінність при порівнянні з нормальною контрольною групою, яка одержує фізіологічний розчин. Нижче описані матеріали і методи, використані для аналізу впливу пептидів на мишах: Матеріали: 1. Експериментальна тварина Миші BALB/c, вага 18-22г, 50% самиць і 50% самців, надані Центром експериментальних тварин, Національний Інститут медичних наук (National Institute of Medical Science), КНР. 2. Введення Група рекомбінантного мишачого IFN-g (rmlFNg): 3x105 МО/кг/день Група рекомбінантного людського IL (rhIL)-2: 3x105МО/кг/день Група фізіологічного розчину: 0,5мл/кожний день дози пептиду в І гр упі: 500мкг/кг/день дози пептиду у II гр упі: 50мкг/кг/день дози пептиду в III гр упі: 5мкг/кг/день дози пептиду в IV гр упі: 0,5мкг/кг/день Всі вищезгадані речовини розчиняли в 0,5мл фізіологічного розчину і вводили внутрішньоочеревинно (і.р.) безперервно протягом 15 днів, один раз на день. 3. Основні реагенти Пептиди були вироблені звичайним чином American Peptide Company, Inc., США Фетальна теляча сироватка і клітинне культуральне середовище RPMI-1640 від Gibco, США MTT і ConA, Sigma, США rmlFN-g, Beijing Biotech Inc., Китай rhIL-2, Shanghai Huaxin Biotech Inc., Китай Розчин для відділення лімфоцитів, Науководослідний інститут Гематологічних захворювань, Національний інститут медичних наук, КНР. Вірус везикулярного стоматиту (VSV), IFN-g і IL-2 стандартні зразки, Національний Інститут контролю фармацевтичних і біологічних продуктів, КНР. 14 НТ-2 клітини і L929 клітини, дарунок Професора WF Chen, факультет імунологія Пекінського Університету Beijing, КНР. Метод 1. Вплив пептидів на клітинний імунітет 1.1. Одержання суспензії клітин селезінки [1, 2] Мишей BALB/c випадковим чином розподіляли на групи пептиду, IFN, IL-2 і фізіологічного розчину. Десять мишей на групу. Через день після останнього введення речовини мишей, що досліджуються, вбивали, зміщаючи шийні хребці. Селезінку видаляли в асептичних умовах і вручн у диспергували в холодному розчині D-Hank з використанням голки для ін'єкцій. Дисперговану клітинну суспензію додатково пропускали через сито 100 калібру з нержавіючої сталі діаметром 150мкм. Після центрифугування при 200g протягом 10 хвилин супернатант (надосадову рідину) відкидали. Осад клітин повторно суспендували в 10 об'ємах буфера Tris-NH4Cl і потім залишали на 10 хвилин при кімнатній температурі. Суспендовані клітини збирали центрифугуванням при 150g протягом 10 хвилин. Клітини промивали 2-4 рази холодним розчином D-Hank шляхом ресуспендування і центрифугування при описаних вище умовах. Промиті клітини потім розводили до бажаної щільності клітин з використанням культурального середовища RPMI-1640, що містить 10% фетальної телячої сироватки. 1.2. Вплив пептидів на трансформацію Тлімфоцитів Клітини селезінки щільністю 1x10 6мл вміщували в 96-ямкові планшети для клітинних культур, 100мкл/ямку, три паралельних ямки для кожного зразка, що аналізується, і контрольний зразок для кожної миші. У ямки, що аналізуються, додавали 100мкл/ямку СоnА розчину 100мкг/мл в RPMI-1640 і 100мкл/ямку просто RPMI-1640 використали для контролю. Клітини інкубували протягом 66 годин при 37°C, 5% CO2. Клітини потім осаджували центрифугуванням при 150g протягом 10 хвилин. Супернатант збирали і зберігали при -20°C для визначення цитокінів IL-2 і IFN. 50мкл/ямку MTT розчину 1мг/мл в RPMI-1640 додавали до осаду клітин і клітини повторно суспендували струшуванням протягом 2 хвилин. Інкубацію продовжували протягом 4 годин. Супернатант відкидали після центрифугування при 150g протягом 10 хвилин. 120мкл 40мм HCl в пропанолі-2 додавали до осаду клітин і струшували протягом 3 хвилин для одержання ОЩ570нм для кожної ямки, нормованої для 630нм. Використали рідер ELISA. Розрахунки: Для кожної миші формували три ямки, що аналізуються, і три контрольних ямки. Індекс стимуляції (SI) для кожної миші одержували, спочатку одержуючи середню ОЩ (оптичну щільність) для трьох паралельних ямок, а потім ділячи значення для ямок, що аналізуються, на значення для контрольних ямок. 1.3. Вплив пептидів на NK клітинну активність [3 ,4] Одержували мишачі клітини селезінки щільністю 4x106мл, як описано вище в розділі 1.1. Кліти 15 83989 ни-мішені YAC-1 брали в логарифмічній фазі і доводили до 1x105мл. З використанням 96-ямкових планшетів для культур клітин 100мкл клітин мишачої селезінки і 100мкл культурального середовища додавали в контрольну ямку, що містить тільки клітини селезінки; 100мкл клітин-мішеней і 100мкл культурального середовища додавали в контрольну ямку, що містить тільки клітини-мішені; 100мкл клітин мишачої селезінки і 100мкл клітинмішеней додавали в ямки для аналізу NK активності. Готували три паралельних серії вищезгаданих ямок на мишу. Зразки центрифугували при 150g протягом 10 хвилин для того, щоб зібрати клітини. Супернатант відкидали і додавали 50мкл/ямку MTT розчину 1мг/мл. Реакційну суміш потім струшували протягом 2 хвилин та інкубували при 37°C, 5% CO2 протягом 4 годин. Супернатант відкидали після центрифугування при 150g протягом 10 хвилин. Додавали 120мкл 40мм HCl в пропанолі-2 і струшували протягом 3 хвилин. Рідер ELISA використали для одержання ОЩ570нм для кожної ямки, нормованої для 630нм. Розрахунки: Для кожної миші було 9 ямок: три ямки з клітинами селезінки - тільки контроль, три з клітинамимішенями - тільки контроль і три ямки, що аналізуються, як з клітинами селезінки, так і з клітинами-мішенями. Індекс NK клітинної активності для кожної миші одержували, спочатку одержуючи середню ОЩ для трьох паралельних ямок кожної комбінації, потім використовуючи таку середню ОЩ в наступній формулі: Індекс активності NK клітин = [1 - (середня ОЩ ямки з клітинами селезінки і клітинами-мішенями середня ОЩ ямки тільки з клітинами селезінки) + (середня ОЩ ямки тільки з клітинами-мішенями)] х 100%. 1.4. Вплив пептидів на активність Т-лімфоцитів при секретуванні IL-2 [5]. НТ-2 клітини в логарифмічній фазі збирали центрифугуванням при 150g протягом 10 хвилин і промивали три рази холодним розчином Хенка за допомогою повторного суспендування і центрифугування. Зібрані НТ-2 клітини повторно суспендували в RPMI-1640 та інкубували при 37°С, 5% CO2 протягом 30 хвилин. Клітини додатково промивали двічі RPMI-1640 за допомогою повторного суспендування і центрифугування і ресуспендували до кінцевої концентрації 2х105/мл в середовищі RPMI1640. Одержаний в розділі 1.2 супернатант розводили середовищем RPMI-1640 до наступних процентних концентрацій: 100%, 50%, 25%, 12,5%, 6,25% і 3,125%. rIL-2 розводили середовищем RPMI-1640 до наступних концентрацій: 500МО/мл, 250МО/мл, 125МО/мл, 62,5МО/мл, 31,25МО/мл і 15,5МО/мл. У 96-ямковому планшеті для клітинних культур використали три паралельні ямки для комбінації: Негативний контроль: 100мкл RPMI-1640 + 100мкл суспензії НТ-2 клітин rIL-2 стандарт: 100мкл розчину rIL-2 + 100мкл суспензії НТ-2 клітин Ямки, що аналізуються: 100мкл розведеного 16 супернатанту + 100мкл суспензії НТ-2 клітин Планшет інкубували при 37°С, 5% CO2 протягом 68 годин, потім центрифугували при 150g протягом 15 хвилин і супернатант видаляли. В кожну ямку додавали 100мкл 0,5мг/мл MTT в RPMI-1640 без фенолсульфонафталіну. Після струшування протягом 3-4 хвилин для ресуспендування клітин продовжували інкубування додатково протягом 4 годин. Потім зразки центрифугували при 150g протягом 15 хвилин і супернатант видаляли. В кожну ямку додавали 120мкл 40мМ HCl в 2-пропанолі, перемішували протягом 3-4 хвилин і з використанням планшетного рідера ELISA аналізували ОЩ при 570нм, нормовану для 630нм. Розрахунок: Брали середнє значення ОЩ для трьох паралельних ямок для кожного розведення і будували графік відносно концентрації на напівлогарифмічній шкалі, відкладаючи концентрацію по осі X. Одержували значення концентрації при 50% насиченні ОЩ як для супернатанту, що тестується, так і для rIL-2. IL-2 активність зразка = (розведення зразка при 50% максимальній активності + стандартне розведення rIL-2 при 50% максимальній активностях активність rIL-2 стандарту при 50% максимальній активності (МО/мл). 1.5. Вплив пептидів на активність Т-лімфоцитів при секретуванні інтерферону (IFN) [6] Супернатант, одержаний в розділі 1.2, розводили культуральним середовищем RPMI-1640 до наступних процентних концентрацій: 100%, 50%, 25%, 12,5%, 6,25% і 3,125%. Стандарт рекомбінантного інтерферону (rIFN) розводили середовищем RPMI-1640 до наступних концентрацій: 500МО/мл, 250МО/мл, 125МО/мл, 62,5МО/мл, 31,25МО/мл і 15,5МО/мл. Клітини-мішені L929 у логарифмічній фазі доводили до концентрації 2х105/мл середовищем RPMI-1640 при такій же обробці, як описано в розділі 1.4 для клітин НТ-2. Вихідний VSV також доводили до 100 TCID50 середовищем RPMI-1640. У 96-ямковому планшеті для клітинних культур використали три паралельні ямки для комбінації: Негативний контроль: 150мкл RPMI-1640 + 100мкл L929 Ямка позитивного контролю: 100мкл розчину RPMI-1640 + 100мкл L929 + 50мкл VSV Ямка активності rIFN: 100мкл rIFN стандарту + 100мкл L929 + 50мкл VSV Ямка, що аналізується: 100мкл розведеного супернатанту + 100мкл L929 + 50мкл VSV Зразки інкубували при 37°С, 5% CO2 протягом 24 годин. Ямки позитивного контролю періодично спостерігали у зверненому мікроскопі для підтвердження лізису клітин, потім збирали, промивали і ОЩ всі х ямок зчитували, як описано в розділі 1.4. Розрахунок: Концентрації при 50% максимальній активності одержували таким же чином, як в розділі 1.4. Розраховували IFN активність зразка таким чином: IFN активність зразка = (розведення зразка при 50% максимальній активності + стандартне розведення rIFN при 50% максимальній активності) х активність rIFN стандарту при 50% максима 17 83989 18 тестується ¸ стандартизована ОЩ540нм )х500 3. Вплив пептидів на фагоцитарну функцію моноядерного фагоцита і вагу імунного органу [8, 9] На наступний день після останнього введення речовини (16 день), що досліджується, мишам робили ін'єкцію туші з розрахунку 0,1мл/кг ваги тіла (5 кратне розведення звичайним фізіологічним розчином) в хвостову вену. Через одну хвилину і п'ять хвилин після ін'єкції туші відбирали 20мкл крові з кута очної щілини за допомогою гепаринізованої трубки. Кров змішували з 2мл 0,1% ваг./об. розчину Na 2CO3 і потім одержували ОЩ680нм . Основний індекс виведення K розраховували за наступною формулою: K = (Ig A1 - Ig A2) + (t2 - t1) Ключ: A1: ОЩ680нм на першій хвилині А2: ОЩ680нм на п'ятій хвилині t2: 5 хвилин t1: 1 хвилина Через день після останнього введення речовини (16 день), що досліджується, печінку, селезінку і вилочкову залозу відділяли, промокали досуха фільтрувальним папером і зважували. Фагоцитарний індекс а розраховували, як показано нижче: льній активності (МО/мл). 2. Вплив пептидів на утворення антитіл [7] Одержували еритроцити овець (SRBC), збираючи кров з шийної вени і вміщуючи її у стерильну колбу зі скляними кульками. Колбу стр ушували протягом 3 хвилин і потім кров змішували з розчином Альзевера (Alsever) (глюкоза 2,05г, NaCl 0,4г, лемонад Na 0,8г, доводили до 100мл дистильованою водою) і зберігали при 4°С. Безпосередньо перед використанням зразки центрифугували при 130g протягом 5 хвилин, збираючи SRBC. Клітини двічі промивали ресуспендуванням і центрифугуванням в нормальному фізіологічному розчині. Потім осад клітин збирали центрифугуванням при 180g протягом 10 хвилин і повторно суспендували у фізіологічному розчині, одержуючи кінцеву робочу суспензію SRBC, 2% (об./об.). Комплемент одержували, додаючи 10 об'ємів свіжої сироватки крові морської свинки до одного об'єму ущільненого на центрифузі SRBC і потім обережно струшуючи протягом 30 хвилин при 4°С. SRBC видаляли центрифугуванням при 200g протягом 10 хвилин. Для одержання робочого комплементного розчину додавали 10 об'ємів звичайного фізіологічного розчину. Мишей BALB/c випадковим чином розподіляли на групу пептиду, IFN гр уп у, IL-2 гр упу і гр упу, яка одержує фізіологічний розчин, 10 мишей на групу. Речовини, що тестуються, вводили, як описано в розділі 1.1, плюс внутрішньоочеревинна ін'єкція 0,2мл SRBC на мишу на 12 день. Через день після останнього введення речовини (16 день), що тестується, збирали кров з кута очної щілини і залишали при кімнатній температурі на одну годину для виділення сироватки крові. Після центрифугування при 200g протягом 10 хвилин сироватку крові розводили в 500 разів з використанням звичайного фізіологічного розчину. До 1мл розведеної мишачої сироватки крові для кожної миші додавали 0,5мл суспензії SRBC. Охолоджували на льоду. Потім додавали 1мл робочого розчину комплементу та інкубували при 37°C на водяній бані протягом 10 хвилин. Реакцію зупиняли охолоджуванням льодом. Потім зразки центрифугували при 200g протягом 10 хвилин, одержуючи супернатант. До 1мл даного супернатанту додавали 3мл розчину Драбкіна (Drabkin) і залишали при кімнатній температурі на 10 хвилин. Одержували ОЩ540нм . Розрахунок: Стандартизовану ОЩ540нм одержували, змішуючи 0,25мл суспензії SRBC з розчином Драбкіна до 4мл і залишаючи суміш на 10 хвилин перед одержанням ОЩ540нм . Індекс сироватки зразка = (ОЩ540нм зразка, що ( ) a = 3 K ´ (W ¸ WLS ) Ключ: W: вага тіла WLS: вага печінки плюс селезінка Індекс вилочкової залози (%) = (вага вилочкової залози/вага тіла)х100% Індекс селезінки (%) = (вага селезінки/вага тіла)х100% Результати Через велику кількість включених «вихідних» даних, представлені тільки компільовані кінцеві результати. Групи, що не мали статистично значущої відмінності від негативного контролю з групою, яка одержує фізіологічний розчин, також опущені. 1. Вплив пептидів на трансформацію Тлімфоцитів Встановлено, що в дозі 500мкг/кг/день CMS002, CMS007, CMS008, C MS010, CMS012, CMS015, CMS019, CMS021 і CMS029 здатні посилювати трансформацію Т-лімфоцитів, виявляючи статистично значущу відмінність при порівнянні з групою, яка одержує фізіологічний розчин (Р
ДивитисяДодаткова інформація
Назва патенту англійськоюIsolated peptide for promoting anti-tumor immune response, pharmaceutical composition based thereon and use thereof
Автори англійськоюWong Wai Ming, Lam Kong
Назва патенту російськоюВыделенный пептид, который стимулирует противоопухолевый иммунный ответ, фармацевтическая композиция на его основе и ее применение
Автори російськоюВонг Вей Минг, ЛАМ Конг
МПК / Мітки
МПК: C07K 5/107, C07K 5/08, A61P 37/02, A61P 43/00
Мітки: протипухлинну, фармацевтична, відповідь, композиція, імунну, стимулює, пептид, виділений, застосування, основі
Код посилання
<a href="https://ua.patents.su/46-83989-vidilenijj-peptid-yakijj-stimulyueh-protipukhlinnu-imunnu-vidpovid-farmacevtichna-kompoziciya-na-jjogo-osnovi-ta-zastosuvannya.html" target="_blank" rel="follow" title="База патентів України">Виділений пептид, який стимулює протипухлинну імунну відповідь, фармацевтична композиція на його основі та її застосування</a>
Наступний патент: Спосіб видалення пилогазової фази з плавильного агрегату і пристрій для його здійснення
Випадковий патент: Шихта для виготовлення корундових вогнетривів