Похідні морфоліну як інгібітори повторного поглинання норепінефрину
Номер патенту: 85198
Опубліковано: 12.01.2009
Автори: Вальтер Магнус Вільгельм, Рудик Хелена Кетрін Ежені, Мастерз Джон Джозеф, Кейзес-Томас Мануель Хав'єр, Кампбелл Гордон Айан, Ман Тереза
Формула / Реферат
1. Сполука формули
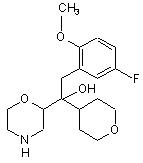
або фармацевтично прийнятна сіль цієї сполуки.
2. Сполука за п. 1 формули
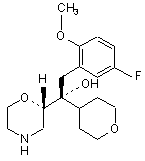
або фармацевтично прийнятна сіль цієї сполуки.
3. Сполука за п. 1 або п. 2, яка являє собою гідрохлорид відповідної сполуки.
4. Фармацевтична композиція, що містить сполуку за п. 1 або п. 2 або фармацевтично прийнятну сіль цієї сполуки разом із фармацевтично прийнятними розріджувачем, наповнювачем або носієм.
5. Сполука за п. 1 або п. 2 або фармацевтично прийнятна сіль цієї сполуки для застосування в терапії.
6. Застосування сполуки за п. 1 або п. 2 або фармацевтично прийнятної солі цієї сполуки для виготовлення лікарського засобу для лікування розладу дефіциту уваги з гіперактивністю (ADHD), розладу пізнавальної здатності, розладу поведінки, депресії, розладу агресивної суперечливості, припливів або вазомоторних симптомів у ссавця.
7. Сполука формули
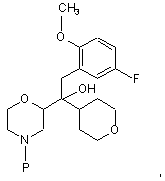
де Р - група захисту азоту.
8. Сполука за п. 7 або сіль цієї сполуки, де Р - бензильна група.
Текст
1. Сполука формули 2 O , де Р - гр упа захисту азоту. 8. Сполука за п. 7 або сіль цієї сполуки, де Р - бензильна група. 3 85198 Цей винахід стосується нових морфолінових сполук та їх застосування як селективних інгібіторів повторного поглинання норепінефрину. Селективне інгібування повторного поглинання норепінефрину є порівняно новим способом лікування афективних розладів. З'ясовано, що норепінефрин відіграє важливу роль при порушеннях функцій вегетативної нервової системи, пов'язаних з афективними розладами, станами неспокою, страху та тривоги та з розладами пізнавальної здатності. Селективним інгібітором повторного поглинання норепінефрину є гідрохлорид томоксетину, наявний на ринку як засіб для лікування розладу гшерактивності з дефіцитом уваги (ADHD). Селективним інгібітором повторного поглинання норепінефрину є також ребоксетин, наявний на ринку як засіб для лікування депресії. [WO 99/15177] розкриває застосування ребоксетину для лікування ADHD, a [WO 01/01973] розкриває застосування S,S-ребоксетину для лікування ADHD, а також інших розладів. [WO 2004/018441] розкриває конкретні похідні морфоліну як селективні інгібітори повторного поглинання норепінефрину. Відповідно до цього винаходу, запропоновано сполуку формули (І) (I) де X - ОН, С1-С4-алкоксигрупа, NH2 або NH(С1-С4алкіл); Rx - H або С 1-С4-алкіл; Ry - H або С 1-С4-алкіл; кожна з груп Rz незалежно одна від одної є H або С1-С4-алкіл, за умови, що не більше ніж 3 групи Rz можуть бути С 1-С4-алкілами; R1 - С1-С6-алкіл (факультативно заміщений 1, 2 або 3 атомами галогену та/або 1 замісником, вибраним із групи, яку складають С 1-С4алкілтіогрупа (факультативно заміщена 1 атомом, 2 атомами або 3 атомами фтору), С1-С4алкоксигрупа (факультативно заміщена 1 атомом, 2 атомами або 3 атомами фтору), С3-С6циклоалкоксигрупа, С1-С4-алкілсульфоніл, ціаногрупа, -СО-О(С1-С2-алкіл), -О-СО-(С1-С2-алкіл) та гідроксил); С2-С6-алкеніл (факультативно заміщений 1 атомом, 2 атомами або 3 атомами галогену); С3-С6-циклоалкіл (факультативно заміщений 1 атомом, 2 атомами або 3 атомами галогену та/або 1 замісником, вибраним із групи, яку складають С 1С4-алкоксигрупа та гідроксил), де один зв'язок C-C в циклоалкільній групі факультативно замінений зв'язком О-С, S-C або C=C; С4-С7-циклоалкілалкіл (факультативно заміщений 1 атомом, 2 атомами або 3 атомами галогену та/або 1 замісником, вибраним із групи, яку складають С1-С4-алкоксигрупа та гідроксил), де один зв'язок C-C в циклоалкільній 4 групі факультативно замінений зв'язком О-С, S-C або C=C; або СН 2Аr2; та кожний з Ar1 та Аr2 незалежно один від одного - фенільний цикл або 5- або 6-членний гетероарильний цикл, кожний з яких факультативно заміщений 1 замісником, 2 замісниками або 3 замісниками (залежно від кількості придатних для заміщення положень), незалежно один від одного вибраними з групи, яку складають С1-С4-алкіл (факультативно заміщений 1 атомом, 2 атомами або 3 атомами галогену), С1-С4-алкоксигрупа (факультативно заміщена 1 атомом, 2 атомами або 3 атомами галогену), С1-С4-алкілтіогрупа (факультативно заміщена 1 атомом, 2 атомами або 3 атомами галогену), -СО-О(С1-С4-алкіл), ціаногрупа, -NRE., CONRR, галоген та гідроксил та/або 1 замісником, вибраним із групи, яку складають піридил, тіофеніл, феніл, бензил та феноксигрупа, цикл кожного з яких факультативно заміщений 1 замісником, 2 замісниками або 3 замісниками, кожний з яких незалежно один від одного вибраний з групи, яку складають галоген, С1-С4-алкіл (факультативно заміщений 1 атомом, 2 атомами або 3 атомами галогену), С1-С4-алкоксигрупа (факультативно заміщена 1 атомом, 2 атомами або 3 атомами галогену), карбоксил, нітрогрупа, гідроксил, ціаногрупа, -NRR, -CONRR, SO2NRR та SO2R; та кожний з R незалежно один від одного - H або С1-С4-алкіл; або фармацевтично прийнятну сіль цієї сполуки. У цьому описі термін "С1-С4-алкіл" означає одновалентний незаміщений насичений вуглеводневий радикал із нерозгалуженим або розгалуженим ланцюгом, що містить від 1 атому до 4 атомів вуглецю. Таким чином, термін "С1-С4-алкіл" охоплює, наприклад, метил, етил, н-пропіл, ізопропіл, нбутил, ізобутил, втор-бутил та трет-бутил. У цьому описі термін "С1-С4-алкокси[група]" означає одновалентний незаміщений насичений вуглеводневий радикал із нерозгалуженим або розгалуженим ланцюгом, що містить від 1 атому до 4 атомів вуглецю, приєднаний до точки заміщення через двовалентний О-радикал. Таким чином, термін "С1-С4-алкокси[група]" охоплює, наприклад, метокси-, етокси-, н-пропокси-, ізопропокси-, н-бутокси-, ізобутокси-, втоp-бутоксита трет-бутоксигрупу. У цьому описі термін "С1-С4-алкілтіо[група]" означає одновалентний незаміщений насичений вуглеводневий радикал із нерозгалуженим або розгалуженим ланцюгом, що містить від 1 атому до 4 атомів вуглецю, приєднаний до точки заміщення через двовалентний S-радикал. Таким чином, термін "С1-С4-алкілтіо[група]" охоплює, наприклад, метилтіо-, етилтіо-, н-пропілтіо-, ізопропілтіо-, н-бутилтіо-, ізобутилтіо-, вторбутлтіо- та трет-бутилтіогруп у. У цьому описі термін "С3-С6-циклоалкіл" означає одновалентний незаміщений насичений циклічний вуглеводневий радикал, що містить від 3 атомів до 6 атомів вуглецю. Таким чином, термін 5 85198 "С3-С6-циклоалкіл" охоплює, наприклад, циклопропіл, циклобутил, циклопентил та циклогексил. У цьому описі термін "С4-С7-циклоалкілалкіл" означає одновалентний незаміщений насичений циклічний вуглеводневий радикал, що містить від 3 атомів до 6 атомів вуглецю, приєднаний до точки заміщення через двовалентний незаміщений насичений вуглеводневий радикал із нерозгалуженим або розгалуженим ланцюгом, що містить щонайменше 1 атом вуглецю. Таким чином, термін"C4-С7-циклоалкіл" охоплює, наприклад, циклопропілметил, циклопропілетил, циклобутилметил, циклопентилметил та циклогексилметил. У цьому описі вираз "де один зв'язок C-C в циклоалкільній групі факультативно замінений зв'язком О-С, S-C або C=C" означає, що будь-який (і) з двох суміжних атомів вуглецю в циклоалкільному циклі може бути зв'язаний через подвійний, а не через одинарний зв'язок (з відповідним зменшенням кількості замісників на кожному з атомів вуглецю), або що (іі) один з будь-яких двох суміжних атомів вуглецю в циклоалкільному циклі (та будьякий із замісників на ньому) може бути замінений атомом кисню або сірки. До прикладів груп, які охоплює цей вираз при вживанні в поєднанні з терміном "С3-С6-циклоалкіл", належать, зокрема: До прикладів груп, які охоплює цей вираз при вживанні в поєднанні з терміном "С4-С7циклоалкілалкіл", належать, зокрема: У цьому описі термін "С2-С6-алкеніл" означає одновалентний незаміщений ненасичений вуглеводневий радикал із нерозгалуженим або розгалуженим ланцюгом, що містить від 2 атомів до 6 атомів вуглецю та включає щонайменше один вуглець-вуглецевий подвійний зв'язок. Таким чином, термін "С2-С4-алкеніл" охоплює, наприклад, етеніл, пропеніл, 2-метил-2-пропеніл та бутеніл. У цьому описі термін "С3-С6циклоалкокси[група]" означає одновалентний незаміщений насичений циклічний вуглеводневий радикал, що містить від 3 атомів до 6 атомів вуглецю в циклі, приєднаний до точки заміщення через двовалентний О-радикал. Таким чином, термін "С3-С6-циклоалкокси-" охоплює, наприклад, циклопропоксигрупу. У цьому описі термін "С1-С4-алкілсульфоніл" означає одновалентний незаміщений насичений вуглеводневий радикал із нерозгалуженим або розгалуженим ланцюгом, що містить від 1 атому до 4 атомів вуглецю, приєднаний до точки заміщення через двовалентний SO2-радикал. Таким чином, термін "С1-С4-алкілсульфоніл" охоплює, наприклад, метилсульфоніл. У цьому описі терміни, аналогічні вищенаведеним визначенням, у яких вказано іншу кількість атомів вуглецю, мають аналогічні значення. Зокрема, "С1-С6-алкіл" означає одновалентний незаміщений насичений вуглеводневий радикал із нерозгалуженим або розгалуженим ланцюгом, що 6 містить від 1 атому до 6 атомів вуглецю. Таким чином, термін "С1-С6-алкіл" означає більшу гр упу сполук, котра охоплює підгрупу "С1-С4-алкіл", проте також охоплює, наприклад, н-пентил, 3метилбутил, 2-метилбутил, 1-метилбутил, 2,2диметил-пропіл, н-гексил, 4-метилпентил та 3метилпентил. Зокрема, "С1-С2-алкіл" означає одновалентний незаміщений насичений вуглеводневий радикал, що містить 1 атом або 2 атоми. Таким чином, термін "С1-С2-алкіл" означає підгрупу сполук, охоплених терміном "С1-С4-алкіл", та включає метил та етил. У цьому описі термін "гало" або "галоген" означає F, Cl, Br або І. У цьому описі термін "фенокси [група]" означає одновалентний незаміщений фенільний радикал, приєднаний до точки заміщення через двовалентний О-радикал. У цьому описі термін "5-членний гетероарильний цикл" означає 5-членний ароматичний цикл, що містить один або декілька гетероатомів, кожний з яких незалежно один від одного вибраний з N, O та S. Відповідно до варіанта, якому віддається перевага, цикл містить в загальній кількості не більш ніж три гетероатоми. Відповідно до варіанта, якому віддається більша перевага, цикл містить в загальній кількості не більш ніж два гетероатоми. Відповідно до варіанта, якому віддається більша перевага, цикл містить в загальній кількості не більш ніж один гетероатом. Цей термін охоплює, наприклад, такі радикали: тіазоліл, ізотіазоліл, оксазоліл, ізоксазоліл, тіофеніл, фураніл, піроліл, імідазоліл, триазоліл, оксадіазоліл та тіадіазоліл. Термін "тіазоліл", що вживається у цьому описі, охоплює 2-тіазоліл, 4-тіазоліл та 5-тіазоліл. Термін "ізотіазоліл", що вживається у цьому описі, охоплює 3-ізотіазоліл, 4-ізотіазоліл та 5ізотіазоліл. Термін "оксазоліл", що вживається у цьому описі, охоплює 2-оксазоліл, 4-оксазоліл та 5оксазоліл. Термін "ізоксазоліл", що вживається у цьому описі, охоплює 3-ізоксазоліл, 4-ізоксазоліл та 5ізоксазоліл. Термін "тіофеніл", що вживається у цьому описі, охоплює 2-тіофеніл та 3-тіофеніл. Термін "фураніл", що вживається у цьому описі, охоплює 2-фураніл та 3-фураніл. Термін "піроліл", що вживається у цьому описі, охоплює 2-піроліл та 3-піроліл. Термін "імідазоліл", що вживається у цьому описі, охоплює 2-імідазоліл та 4-імідазоліл. Термін "триазоліл", що вживається у цьому описі, охоплює 1-триазоліл, 4-триазоліл та 5триазоліл. Термін "оксадіазоліл", що вживається у цьому описі, охоплює 4- та 5-(1,2,3-оксадіазоліл), 3- та 5(1,2,4-оксадіазоліл), 3-(1,2,5-оксадіазоліл), 2-(1,3,4оксадіазоліл). Термін "тіадіазоліл", що вживається у цьому описі, охоплює 4- та 5-(1,2,3-тіадіазоліл), 3- та 5(1,2,4-тіадіазоліл), 3-(1,2,5-тіадіазоліл), 2-(1,3,4тіадіазоліл). 7 85198 У цьому описі термін "6-членний гетероарильний цикл" означає 6-членний ароматичний цикл, що містить один або декілька гетероатомів, кожний з яких незалежно один від одного вибраний з N, O та S. Відповідно до варіанта, якому віддається перевага, цикл містить в загальній кількості не більш ніж три гетероатоми. Відповідно до варіанта, якому віддається більша перевага, цикл містить в загальній кількості не більш ніж два гетероатоми. Відповідно до варіанта, якому віддається більша перевага, цикл містить в загальній кількості не більш ніж один гетероатом. Цей термін охоплює, наприклад, такі радикали: піридил, піримідил, піразиніл, піридазиніл та триазиніл. Термін "піридил", що вживається у цьому описі, охоплює 2-піридил, 3-піридил та 4-піридил. Термін "піримідил", що вживається у цьому описі, охоплює 2-піримідил, 4-піримідил та 5піримідил. Термін "піразиніл", що вживається у цьому описі, охоплює 2-піразиніл та 3-піразиніл. Термін "піридазиніл", що вживається у цьому описі, охоплює 3-піридазиніл та 4-піридазиніл. Термін "триазиніл", що вживається у цьому описі, охоплює 2-(1,3,5-триазиніл), 3-, 5- та 6(1,2,4-триазиніл) та 4- та 5-(1,2,3-триазиніл). У цьому описі термін "орто" стосується положення в ароматичному циклі, заміщеному Ar1, суміжного до положення, в якому замісник Ar1 приєднаний до решти сполуки формули (І). У цьому описі термін "група захисту азоту" означає функціональну гр упу, яка надає атому азоту, до якого вона приєднана, інертності в умовах реакцій, яким у подальшому будуть піддавати N-захищену сполуку, за винятком випадку, коли згаданий захищений атом азоту також приєднаний до атому водню та за винятком випадку, коли такі умови вибрані спеціально для відщеплення групи захисту азоту. Вибір придатних гр уп захисту азоту залежить від умов подальших реакційних стадій, а придатні групи захисту азоту для заданих випадків відомі пересічному фа хівцеві в цій галузі. Додаткова інформація про придатні групи захисту азоту, в тому числі методи їх введення та відщеплення, наведена в добре відомій монографії "Групи захисту в органічному синтезі" ["Protective Groups in Organic Synthesis", Theodora W. Greene and Peter G.M. Wuts, John Wiley & Sons, Inc., New York, 1999, cтop.494-653]. До прикладів груп захисту азоту належать карбаматні групи захисту -CO-ORA, де RA є, наприклад, метил, етил, 9-флуоренілметил (Fmoc), 2,2,2-трихлоретил (Тrос), 2триметилсилілетил (Теос), трет-бутил (Вос), аліл (Alloc), бензил (Cbz) або n-метоксибензил (Moz); амідні групи захисту -CO-RB, де RB є, наприклад, H, метил, бензил або феніл; алкіламінні групи захисту -RC, де RC є, наприклад, метил, трет-бутил, аліл, [2-(триметилсиліл)-етокси]метил, бензил, 4метоксибензил, 2,4-диметоксибензил, дифенілметил або трифенілметил (тритил); та сульфонамідні групи захисту -SO 2-RD, де RD є, наприклад, метил, бензил, феніл або феніл, заміщений 1-5 замісниками, кожний з яких незалежно один від одного вибраний з групи, яку складають метил, третбутил, метокси- та нітрогрупа. У окремих випадках 8 вираз "застосовані умови реакції" означають, що перевага віддається, як правило, групам захисту азоту, які є стабільними у сильно основних умовах та/або у присутності сильних нуклеофілів (наприклад, металоорганічних реагентів). До прикладів таких груп захисту азоту, яким віддається перевага, належать алкіламінні групи захисту -RC, де RC є, наприклад, метил, трет-бутил, аліл, [2(триметилсиліл))етокси]метил, бензил, 4метоксибензил, 2,4-диметокси-бензил, дифенілметил або трифенілметил (тритіл). Групою захисту азоту, якій віддається особлива перевага, є бензил. У варіанті здійснення цього винаходу, якому віддається особлива перевага, X - OH, С1-С4алкоксигрупа або NH2. Відповідно до варіанта, якому віддається більша перевага, X - OH або NH2. Відповідно до варіанта, якому віддається найбільша перевага, X - OH. У варіанті здійснення цього винаходу, якому віддається особлива перевага, Rx - H або метил. Відповідно до варіанта, якому віддається найбільша перевага, Rx - H. У варіанті здійснення цього винаходу, якому віддається особлива перевага, Ry - H або метил. Відповідно до варіанта, якому віддається найбільша перевага, Ry - H. У варіанті здійснення цього винаходу, якому віддається особлива перевага, кожна з груп Rz незалежно одна від одної є H або метил, за умови, що не більше ніж 3 групи Rz можуть бути метилами. Відповідно до варіанта, якому віддається найбільша перевага, кожний Rz - H. У варіанті здійснення цього винаходу, якому віддається особлива перевага, R1 - С1-С6-алкіл (факультативно заміщений 1 атомом, 2 атомами або 3 атомами галогену та/або 1 замісником, вибраним із групи, яку складають С1-С4-алкілтіогрупа (факультативно заміщена 1 атомом, 2 атомами або 3 атомами фтору), С1-С 4-алкоксигрупа (факультативно заміщена 1 атомом, 2 атомами або 3 атомами фтору), С3-С6-циклоалкоксигрупа, С1-С4алкілсульфоніл, ціаногрупа, -СO-O(С1-С2-алкіл), О-СО-(С1-С2-алкіл) та гідроксил). Відповідно до варіанта, якому віддається більша перевага, R1 С1-С6-алкіл (факультативно заміщений 1 атомом, 2 атомами або 3 атомами галогену та/або 1 замісником, вибраним із групи, яку складають С1-С4алкоксигрупа (факультативно заміщена 1 атомом, 2 атомами або 3 атомами фтору), ціаногрупа та гідроксил). Відповідно до варіанта, якому віддається більша перевага, R1 - С1-С6-алкіл (факультативно заміщений 1 атомом, 2 атомами або 3 атомами галогену). Відповідно до варіанта, якому віддається більша перевага, R1 - С1-С6-алкіл (факультативно заміщений 1 атомом, 2 атомами або 3 атомами фтору). Приклади конкретних значень для R1 в цьому варіанті здійснення охоплюють метил, етил, ізопропіл, ізобутил, н-бутил, 3,3,3трифторпропіл та 4,4,4-трифторбутил. У варіанті здійснення цього винаходу, якому віддається особлива перевага, R1 - С2-С6-алкеніл (факультативно заміщений 1 атомом, 2 атомами або 3 атомами галогену). 9 85198 У варіанті здійснення цього винаходу, якому віддається особлива перевага, R1 – С3-С6циклоалкіл (факультативно заміщений 1 атомом, 2 атомами або 3 атомами галогену та/або 1 замісником, вибраним із групи, яку складають С1-С4алкоксигрупа та гідроксил), де один зв'язок C-C в циклоалкільній групі факультативно замінений зв'язком О-С, S-C або C=C. Відповідно до варіанта, якому віддається більша перевага, R1 - С3-С6циклоалкіл (факультативно заміщений 1 атомом, 2 атомами або 3 атомами галогену та/або 1 замісником, вибраним із групи, яку складають C1-C4алкоксигрупа та гідроксил), де один зв'язок C-C в циклоалкільній групі факультативно замінений зв'язком О-С. Відповідно до варіанта, якому віддається більша перевага, R1 - С3-С6-циклоалкіл, де один зв'язок C-C в циклоалкільній групі факультативно замінений зв'язком О-С. Приклади конкретних значень для R1 в цьому варіанті здійснення охоплюють циклопропіл, циклопентил та тетрагідропіраніл (зокрема, тетрагідро-2Н-піран-4-іл). У варіанті здійснення цього винаходу, якому віддається особлива перевага, R1 - С3-С6циклоалкіл (факультативно заміщений 1 атомом, 2 атомами або 3 атомами галогену та/або 1 замісником, вибраним із групи, яку складають С1-С4алкоксигрупа та гідроксил). Відповідно до варіанта, якому віддається більша перевага, R1 - С3-С6циклоалкіл. Приклади конкретних значень для R1 в цьому варіанті здійснення охоплюють циклопропіл та циклопентил. У варіанті здійснення цього винаходу, якому віддається особлива перевага, R1 - С3-С6циклоалкіл (факультативно заміщений 1 атомом, 2 атомами або 3 атомами галогену та/або 1 замісником, вибраним із групи, яку складають С1-С4алкоксигрупа та гідроксил), де один зв'язок C-C в циклоалкільній групі замінений зв'язком О-С, S-C або C=C. Відповідно до варіанта, якому віддається більша перевага, R1 - С3-С6-циклоалкіл (факультативно заміщений 1 атомом, 2 атомами або 3 атомами галогену та/або 1 замісником, вибраним із групи, яку складають С 1-С4-алкоксигрупа та гідроксил), де один зв'язок C-C в циклоалкільній групі замінений зв'язком О-С. Відповідно до варіанта, якому віддається більша перевага, R1 - С3-С6циклоалкіл, де один зв'язок C-C в циклоалкільній групі замінений зв'язком О-С. Прикладом конкретного значення для R1 у цьому варіанті здійснення є тетрагідропіраніл (зокрема, тетрагідро-2Н-піран4-іл). У варіанті здійснення цього винаходу, якому віддається особлива перевага, R1 - С4-С7циклоалкілалкіл (факультативно заміщений 1 атомом, 2 атомами або 3 атомами галогену та/або 1 замісником, вибраним із групи, яку складають С1С4-алкоксигрупа та гідроксил), де один зв'язок C-C в циклоалкільній групі факультативно замінений зв'язком О-С, S-C або C=C. У варіанті здійснення цього винаходу, якому віддається особлива перевага, R1 - С4-С7циклоалкілалкіл (факультативно заміщений 1 атомом, 2 атомами або 3 атомами галогену та/або 1 замісником, вибраним із групи, яку складають С1С4-алкоксигрупа та гідроксил). 10 У варіанті здійснення цього винаходу, якому віддається особлива перевага, R1 - С4-С7циклоалкілалкіл (факультативно заміщений 1 атомом, 2 атомами або 3 атомами галогену та/або 1 замісником, вибраним із групи, яку складають С1С4-алкоксигрупа та гідроксил), де один зв'язок C-C в циклоалкільній групі замінений зв'язком О-С, S-C або C=C. У варіанті здійснення цього винаходу, якому віддається особлива перевага, R1 - СН2Аr2, де Аr2 відповідає вищенаведеному визначенню. Відповідно до варіанта, якому віддається більша перевага, R1 - СН2 Аr2, де Аr2 - фенільний цикл або (відповідно до варіанта, якому віддається перевага, 2піридильний) піридильний цикл, кожний з яких може бути заміщений 1 замісником, 2 замісниками або 3 замісниками, кожний з яких незалежно один від одного вибраний з групи, яку складають С 1-С4алкіл (факультативно заміщений 1 атомом, 2 атомами або 3 атомами галогену), С1-С4-алкоксигрупа (факультативно заміщена 1 атомом, 2 атомами або 3 атомами галогену), С1-С4-алкілтіогрупа (факультативно заміщена 1 атомом, 2 атомами або 3 атомами галогену), галоген та гідроксил. Відповідно до варіанта, якому віддається більша перевага, R1 – СН2Аr2, де Аr2 - фенільний цикл, факультативно заміщений у спосіб, описаний у попередньому реченні. Відповідно до варіанта, якому віддається більша перевага, R1 - СН2Аr2, де Аr2 фенільний цикл, факультативно заміщений 1 замісником або 2 замісниками, кожний з яких незалежно один від одного вибраний з групи, яку складають С1-С4-алкіл (факультативно заміщений 1 атомом, 2 атомами або 3 атомами галогену), С1С4-алкоксигрупа (факультативно заміщена 1 атомом, 2 атомами або 3 атомами галогену), галоген та гідроксил. Приклади конкретних значень для R1 в цьому варіанті здійснення охоплюють фенілметил та (2-метокси-феніл)метил. У варіанті здійснення цього винаходу, якому віддається особлива перевага, AR1 - фенільний цикл або 5- або 6-членний гетероарильний цикл, кожний з яких заміщений у o/wzo-положенні замісником, вибраним із групи, яку складають С1-С4алкіл (факультативно заміщений 1 атомом, 2 атомами або 3 атомами галогену), С1-С4-алкоксигрупа (факультативно заміщена 1 атомом, 2 атомами або 3 атомами галогену), С1-С4-алкілтіогрупа (факультативно заміщена 1 атомом, 2 атомами або 3 атомами галогену), -СО-О(С1-С4-алкіл), ціаногрупа, -NRR, -CONRR, галоген, гідроксил, піридил, тіофеніл, феніл, бензил та феноксигрупа, причому цикл кожного з орто-замісників факультативно заміщений (у разі наявності такого циклу) 1 замісником, 2 замісниками або 3 замісниками, кожний з яких незалежно один від одного вибраний з групи, яку складають галоген, С1-С4-алкіл (факультативно заміщений 1 атомом, 2 атомами або 3 атомами галогену), С1-С4-алкоксигрупа (факультативно заміщена 1 атомом, 2 атомами або 3 атомами галогену), карбоксил, нітрогрупа, гідроксил, ціаногрупа, -NRR, -CONRR, SO2NRR та SO2R; та кожний з яких (додатково до орто-заміщення) факультативно додатково заміщений 1 замісником або 2 замісниками, кожний з яких незалежно один від одного 11 85198 вибраний з групи, яку складають C1-C4-алкіл (факультативно заміщений 1 атомом, 2 атомами або 3 атомами галогену), С1-С4-алкоксигрупа (факультативно заміщена 1 атомом, 2 атомами або 3 атомами галогену), С1-С4-алкілтіогрупа (факультативно заміщена 1 атомом, 2 атомами або 3 атомами галогену), -СО-О(С1-С4-алкіл), ціаногрупа, -NRR, CONRR, галоген та гідроксил. Відповідно до варіанта, якому віддається більша перевага, AR1 - фенільний цикл або піридильний (відповідно до варіанта, якому віддається перевага, 2-піридильний) цикл, кожний з яких заміщений та факультативно додатково заміщений у спосіб, описаний у попередньому реченні. Відповідно до варіанта, якому віддається більша перевага, AR1 - гр упа формули (а): 12 метоксифеніл, 2-етокси-феніл, 2-трифторметоксифеніл, 2-феніл-феніл, 2-(3-фтор-феніл)-феніл, 2хлор-феніл, 2-метокси-5-фтор-феніл, 2-хлор-6фтор-феніл та 2-феніл-5-фтор-феніл. Мається на увазі, що сполука вищезазначеної формули (І) містить щонайменше два асиметричних атоми вуглецю. У цьому описі структурна формула, якщо в ній не вказано конкретну стереохімічну конфігурацію при одному або кількох хіральних центрах, охоплює всі можливі стереоізомери та всі можливі суміші стереоізомерів (в тому числі, але не тільки, рацемічні суміші), які можуть виникати внаслідок стереоізомерії при одному або кількох хіральних центрах. Таким чином, сполуки, визначені вищенаведеною формулою, включають кожний з індивідуальних стереоізомерів: (а) де A-N або CR6 (відповідно до варіанта, якому віддається перевага, CR6); R2 - С1-С4-алкіл (факультативно заміщений 1 атомом, 2 атомами або 3 атомами галогену), С1-С4-алкоксигрупа (факультативно заміщена 1 атомом, 2 атомами або 3 атомами галогену), С1-С4-алкілтіогрупа (факультативно заміщена 1 атомом, 2 атомами або 3 атомами галогену), галоген, гідроксил, піридил, тіофеніл, феніл (факультативно заміщений 1 замісником, 2 замісниками або 3 замісниками, кожний з яких незалежно один від одного вибраний з групи, яку складають галоген, С1-С4-алкіл (факультативно заміщений 1 атомом, 2 атомами або 3 атомами галогену), С1-С4-алкоксигрупа (факультативно заміщена 1 атомом, 2 атомами або 3 атомами галогену)) або феноксигрупа (факультативно заміщена 1 атомом, 2 атомами або 3 атомами галогену); R3 - H; R4 - H; R5 -H, С1-С4-алкіл (факультативно заміщений 1 атомом, 2 атомами або 3 атомами галогену), С1-С4-алкоксигрупа (факультативно заміщена 1 атомом, 2 атомами або 3 атомами галогену), C1-C4-алкілтіогрупа (факультативно заміщена 1 атомом, 2 атомами або 3 атомами галогену), галоген або гідроксил; та R6 (у разі наявності) - H або галоген (відповідно до варіанта, якому віддається перевага, H). Відповідно до варіанта, якому віддається більша перевага, AR1 - група формули (а), де А - CR6; R2 -С1-С4-алкіл (факультативно заміщений 1 атомом, 2 атомами або 3 атомами фтору), С1-С4-алкоксигрупа (факультативно заміщена 1 атомом, 2 атомами або 3 атомами фтору), галоген або феніл (факультативно заміщений 1 атомом, 2 атомами або 3 атомами фтор у); R3 - H; R4 H; R5 - H або F; та R6 - H або галоген. Відповідно до варіанта, якому віддається більша перевага, AR1 - група формули (а), де А - CR6; R2 - С1-С4алкіл (факультативно заміщений 1 атомом, 2 атомами або 3 атомами фтору), С1-С 4-алкоксигрупа (факультативно заміщена 1 атомом, 2 атомами або 3 атомами фтору) або феніл (факультативно заміщений 1 атомом, 2 атомами або 3 атомами фтор у); R3 - H; R4 - H; R5 - H або F; та R6 - H. До прикладів конкретних значень для Ar1 належать 2 та всі можливі суміші цих сполук. Незважаючи на те, що у цьому винаході розглядаються всі стереоізомери та їх суміші, до варіантів здійснення, яким віддається перевага, належать енантіомерно та діастереомерно чисті сполуки формули І. Термін "енантіомерно чистий" у значенні, вживаному у цьому описі, стосується енантіомерного надлишку, який перевищує 90%, відповідно до варіанта, якому віддається перевага, перевищує 95%, відповідно до варіанта, якому віддається більша перевага, перевищує 99%. У значенні, вживаному у цьому описі, термін "діастереомерно чистий" стосується діастереомерного надлишку, який перевищує 90%, відповідно до варіанта, якому віддається перевага, перевищує 95%, відповідно до варіанта, якому віддається більша перевага, перевищує 99%. У варіанті здійснення цього винаходу, якому віддається особлива перевага, запропонована сполука формули (II) (II) де X, Rx, R y, Rz, R1 та Ar1 відповідають вищенаведеним визначенням для формули (І); або фармацевтично прийнятна сіль цієї сполуки. Відповідно до варіанта, якому віддається перевага, згадана сполука формули (II) є як енантіомерно чистою, так і діастереомерно чистою. У варіанті здійснення цього винаходу, якому віддається особлива перевага, запропонована сполука формули (III) 13 85198 (III) де X, R1 та Ar1 відповідають вищенаведеним визначенням для формули (І); або фармацевтично прийнятна сіль цієї сполуки. У варіанті здійснення цього винаходу, якому віддається особлива перевага, запропонована сполука формули (III), де X-OH або NH2; R1 - С1-С6-алкіл (факультативно заміщений 1 атомом, 2 атомами або 3 атомами галогену та/або 1 замісником, вибраним із групи, яку складають C1C4-алкілтіогрупа (факультативно заміщена 1 атомом, 2 атомами або 3 атомами фтору), C1-C4алкоксигрупа (факультативно заміщена 1 атомом, 2 атомами або 3 атомами фтору), С3-С6циклоалкоксигрупа, C1-C4-алкілсульфоніл, ціаногрупа, -CO-O(C1-С2-алкіл), -О-СО-(С1-С2-алкіл) та гідроксил); С3-С6-циклоалкіл (факультативно заміщений 1 атомом, 2 атомами або 3 атомами галогену та/або 1 замісником, вибраним із групи, яку складають C1-C4-алкоксигрупа та гідроксил), де один зв'язок C-C в циклоалкільній групі факультативно замінений зв'язком О-С, S-C або C=C; або СН2Аr2, де Аr2 - фенільний цикл або піридильний (відповідно до варіанта, якому віддається перевага, 2-піридильний) цикл, кожний з яких може бути заміщений 1 замісником, 2 замісниками або 3 замісниками, кожний з яких незалежно один від одного вибраний з групи, яку складають C 1-C4-алкіл (факультативно заміщений 1 атомом, 2 атомами або 3 атомами галогену), С1-С4-алкоксигрупа (факультативно заміщена 1 атомом, 2 атомами або 3 атомами галогену), C1-C4-алкілтіогрупа (факультативно заміщена 1 атомом, 2 атомами або 3 атомами галогену), галоген та гідроксил; та AR1 - фенільний цикл або 5- або 6-членний гетероарильний цикл, кожний з яких заміщений у орто-положенні замісником, вибраним із групи, яку складають C1-C4-алкіл (факультативно заміщений 1 атомом, 2 атомами або 3 атомами галогену), C1C4-алкоксигрупа (факультативно заміщена 1 атомом, 2 атомами або 3 атомами галогену), C1-C4алкілтіогрупа (факультативно заміщена 1 атомом, 2 атомами або 3 атомами галогену), -CO-O(C1-C4алкіл), ціаногрупа, -NRR, -CONRR, галоген, гідроксил, піридил, тіофеніл, феніл, бензил та феноксигрупа, причому цикл кожного з орто-замісників факультативно заміщений (у разі наявності такого циклу) 1 замісником, 2 замісниками або 3 замісниками, кожний з яких незалежно один від одного вибраний з групи, яку складають галоген, С1-С4алкіл (факультативно заміщений 1 атомом, 2 атомами або 3 атомами галогену), С1-С4-алкоксигрупа (факультативно заміщена 1 атомом, 2 атомами або 3 атомами галогену), карбоксил, нітрогрупа, гідроксил, ціаногрупа, -NRR, -CONRR, SO2NRR та SO2R; та кожний з яких (додатково до орто заміщення) факультативно додатково заміщений 1 замісником або 2 замісниками, кожний з яких не 14 залежно один від одного вибраний з групи, яку складають С 1-С4-алкіл (факультативно заміщений 1 атомом, 2 атомами або 3 атомами галогену), C1C4-алкоксигрупа (факультативно заміщена 1 атомом, 2 атомами або 3 атомами галогену), C1-C4алкілтюгрупа (факультативно заміщена 1 атомом, 2 атомами або 3 атомами галогену), -СО-О(C1-C4алкіл), ціаногрупа, -NRR, -CONRR, галоген та гідроксил; або фармацевтично прийнятна сіль цієї сполуки. У варіанті здійснення цього винаходу, якому віддається особлива перевага, запропонована сполука формули (IV) (IV) де X-OH або NH2; R1 - С1-С6-алкіл (факультативно заміщений 1 атомом, 2 атомами або 3 атомами галогену та/або 1 замісником, вибраним із групи, яку складають C1C4-алкоксигрупа (факультативно заміщена 1 атомом, 2 атомами або 3 атомами фтору), ціаногрупа та гідроксил); С3-С6-циклоалкіл (факультативно заміщений 1 атомом, 2 атомами або 3 атомами галогену та/або 1 замісником, вибраним із групи, яку складають СрС^алкоксигрупа та гідроксил), де один зв'язок C-C в циклоалкільній групі факультативно замінений зв'язком О-С; або СН 2Аr2, де Аr2 фенільний цикл, факультативно заміщений 1 замісником, 2 замісниками або 3 замісниками, кожний з яких незалежно один від одного вибраний з групи, яку складають C1-C4-алкіл (факультативно заміщений 1 атомом, 2 атомами або 3 атомами галогену), C1-C4-алкоксигрупа (факультативно заміщена 1 атомом, 2 атомами або 3 атомами галогену), C1-C4-алкілтіогрупа (факультативно заміщена 1 атомом, 2 атомами або 3 атомами галогену), галоген та гідроксил; A-N або CR6 (відповідно до варіанта, якому віддається перевага, CR6); R2 - C 1-C4-алкіл (факультативно заміщений 1 атомом, 2 атомами або 3 атомами галогену), C1-C4-алкоксигрупа (факультативно заміщена 1 атомом, 2 атомами або 3 атомами галогену), C1-C4-алкілтіогрупа (факультативно заміщена 1 атомом, 2 атомами або 3 атомами галогену), галоген, гідроксил, піридил, тіофеніл, феніл (факультативно заміщений 1 замісником, 2 замісниками або 3 замісниками, кожний з яких незалежно один від одного вибраний з групи, яку складають галоген, C1-C4-алкіл (факультативно заміщений 1 атомом, 2 атомами або 3 атомами галогену), Сі-С4-алкоксигрупа (факультативно заміщена 1 атомом, 2 атомами або 3 атомами галогену)) або феноксигрупа (факультативно заміщена 1 атомом, 2 атомами або 3 атомами галогену); R3 - H; R4 - H; R5 - H, C1-C4-алкіл (факультативно заміщений 1 атомом, 2 атомами або 3 атомами 15 85198 галогену), С1-С4-алкоксигрупа (факультативно заміщена 1 атомом, 2 атомами або 3 атомами галогену), C1-C4-алкілтіогрупа (факультативно заміщена 1 атомом, 2 атомами або 3 атомами галогену), галоген або гідроксил; та R6 (у разі наявності) - H; або фармацевтично прийнятна сіль цієї сполуки. У варіанті здійснення цього винаходу, якому віддається особлива перевага, запропонована сполука формули (V) (V) де X - OH або NH2; R1 - С1-С6-алкіл (факультативно заміщений 1 атомом, 2 атомами або 3 атомами фтору), С3-С6циклоалкіл, де один зв'язок C-C в циклоалкільній групі факультативно замінений зв'язком O-С, або СН2Аr2, де Аr2 - фенільний цикл, факультативно заміщений 1 замісником або 2 замісниками, кожний з яких незалежно один від одного вибраний з групи, яку складають С 1-С4-алкіл (факультативно заміщений 1 атомом, 2 атомами або 3 атомами галогену), С1-С4-алкоксигрупа (факультативно заміщена 1 атомом, 2 атомами або 3 атомами галогену), галоген та гідроксил; R2 - С1-С4-алкіл (факультативно заміщений 1 атомом, 2 атомами або 3 атомами фтору), С1-С4алкоксигрупа (факультативно заміщена 1 атомом, 2 атомами або 3 атомами фтору) або феніл (факультативно заміщений 1 атомом, 2 атомами або 3 атомами фтору); та R5 - H або F; або фармацевтично прийнятна сіль цієї сполуки. У варіанті здійснення цього винаходу, якому віддається особлива перевага, запропонована сполука формули (VI) (VI) де R1 – С1-С6-алкіл (факультативно заміщений 1 атомом, 2 атомами або 3 атомами фтору) або С3С6-циклоалкіл, де один зв'язок C-C в циклоалкільній групі факультативно замінений зв'язком О-С; R2 - С1-С4-алкіл (факультативно заміщений 1 атомом, 2 атомами або 3 атомами фтору), С1-С4алкоксигрупа (факультативно заміщена 1 атомом, 2 атомами або 3 атомами фтору) або феніл (факультативно заміщений 1 атомом, 2 атомами або 3 атомами фтору); та R5 - H або F; або фармацевтично прийнятна сіль цієї сполуки. До конкретних варіантів здійснення цього винаходу належать сполуки: 1-[1,1'-біфеніл]-2-іл-2-морфолін-2-ілпропан-2ол, 16 1-[5-фтор-2-(метилокси)феніл]-2-морфолін-2ілбутан-2-ол, 2-морфолін-2-іл-1-{2[(трифторметил)окси]феніл}бутан-2-ол, 1-[1,1’-біфеніл]-2-іл-2-морфолін-2-ілбутан-2-ол, 1-[5-фтор-2-(метилокси)феніл]-3-метил-2морфолін-2-ілбутан-2-ол, 3-метил-1-[(2-метилокси)феніл]-2-морфолін-2ілбутан-2-ол, 1-[(2-етилокси)феніл]-3-метил-2-морфолін-2ілбутан-2-ол, 3-метил-2-морфолін-2-іл-1-{2[(трифторметил)окси]бутан-2-ол, 1-[1,1’-біфеніл]-2-іл-3-метил-2-морфолін-2ілбутан-2-ол, 1-(4-фтор[1,1’-біфеніл]-2-іл)-3-метил-2морфолін-2-ілбутан-2-ол, 1-[5-фтор-2-(метилокси)феніл]-4-метил-2морфолін-2-іл-пентан-2-ол, 1-[2-(етилокси)феніл]-4-метил-2-морфолін-2ілпентан-2-ол, 4-метил-2-морфолін-2-іл-1{2[трифторметил)окси]феніл}пентан-2-ол, 1-[1,1’-біфеніл]-2-іл-4-метил-2-морфолін-2ілпентан-2-ол, 1-(4-фтор[1,1’-біфеніл]-2-іл)-4-метил-2морфолін-2-ілпентан-2-ол, 1-циклопентил-2-[5-фтор-2-(метилокси)феніл]1-морфолін-2-ілетанол, 1-циклопентил-2-[2-(етилокси)феніл]-1морфолін-2-ілетанол, 1-циклопентил-1-морфолін-2-іл-2-{2[(трифторметил)окси]феніл}етанол, 2-[1,1'-біфеніл]-2-іл-1-циклопентил-1морфолін-2-ілетанол, 1-циклопентил-2-(4-фтор[1,1’-біфеніл]-2-іл)-1морфолін-2-ілетанол, 2-[5-фтор-2-(метилокси)феніл]-1-морфолін-2іл-1-тетрагідро-2Н-піран-4-ілетанол, 1-морфолін-2-іл-1-тетрагідро-2Н-піран-4-іл-2{2-[(трифторметил)окси]-феніл}етанол, 2-[1,1’-біфеніл]-2-іл-1-морфолін-2-іл-1тетрагідро-2Н-піран-4-ілетанол, 2-(3'-фтор-біфеніл-2-іл)-1-морфолін-2-іл-1(тетрагідро-піран-4-іл)-етанол, 5,5,5-трифтор-1-(5-фтор-2-метокси-феніл)-2морфолін-2-іл-пентан-2-ол, 5,5,5-трифтор-2-морфолін-2-іл-1-(2трифторметокси-феніл)-пентан-2-ол, 1-[1,1’-біфеніл]-2-іл-5,5,5-трифтор-2-морфолін2-ілпентан-2-ол, 6,6,6-трифтор-1-[5-фтор-2-(метилокси)феніл]2-морфол-2-ілгексан-2-ол, 1-[1,1’-біфеніл]-2-іл-6,6,6-трифтор-2-морфолін2-іл]гексан-2-ол, 1-циклопропіл-2-[-2-(метилокси)феніл]-1морфолін-2-ілетанол, 1-циклопропіл-2-[-2-(етилокси)феніл]-1морфолін-2-ілетанол, 2-[1,1’-біфеніл]-2-іл1-циклопропіл-1морфолін-2-ілетанол, 1,3-біс-(2-метокси-феніл)-2-морфолін-2-ілпропан-2-ол, 1-(2-метокси-бензил)-2-(2-метокси-феніл)-1морфолін-2-іл-етиламін, 17 85198 2-морфолін-2-іл-1,3-дифеніл-пропан-2-ол, 1-(2-метокси-феніл)-2-морфолін-2-іл-гексан-2ол, 2-морфолініл-1-біфеніл-2-іл-гексан-2-ол, 1-(2-хлор-6-фтор-феніл)-4-метил-2-морфолін2-іл-пентан-2-ол та 1-(2-хлор-феніл)-4-метил-2-морфолін-2-ілпентан-2-ол та фармацевтично прийнятні солі цих сполук. Сполуки за цим винаходом є інгібіторами повторного поглинання норепінефрину. Біогенні переносники амінів регулюють кількість біогенних амінних нейромедіаторів у синаптичних проміжках. Інгібування відповідного переносника спричиняє зростання концентрації вказаного нейромедіатора у синаптичному проміжку. Відповідно до варіанта, якому віддається перевага, сполуки формули (І) та їхні фармацевтично прийнятні солі при випробуванні на спорідненість зі сцинтиляційним детектуванням, описаному нижче стосовно до переносника норепінефрину виявляють значення Ki менше за 600нМ. Відповідно до варіанта, якому віддається більша перевага, сполуки формули (І) та їхні фармацевтично прийнятні солі виявляють стосовно до переносника норепінефрину значення Kі менше за 100нМ. Відповідно до варіанта, якому віддається ще більша перевага, сполуки формули (І) та їхні фармацевтично прийнятні солі виявляють стосовно до переносника норепінефрину значення Kі менше за 50нМ. Відповідно до варіанта, якому віддається особлива перевага, сполуки формули (І) та їхні фармацевтично прийнятні солі виявляють стосовно до переносника норепінефрину значення Kі менше за 20нМ. Відповідно до варіанта, якому віддається перевага, сполуки за цим винаходом виявляють при описаному нижче випробуванні на спорідненість зі сцинтиляційним детектуванням, коефіцієнт селективності інгібування переносника норепінефрину у порівнянні з переносниками серотоніну та допаміну щонайменше 5, краще щонайменше 10. Крім того, відповідно до варіанта, якому віддається перевага, сполуки за цим винаходом є стійкими у кислотному середовищі. Переважно вони виявляють послаблену взаємодію (як у ролі субстрату, так і інгібітора) з ферментом печінки цитохромом Р450 (CYP2D6). Інакше кажучи, відповідно до варіанта, якому віддається перевага, ці сполуки виявляють при описаному нижче випробуванні на субстрат C YP2D6, метаболізм шляхом, який включає CYP2D6, менше за 75%, а також виявляють при описаному випробуванні з інгібітором CYP2D6 значення IC50>6мкМ. Відповідно до своєї фармакологічної дії, сполуки за цим винаходом є корисними при лікуванні розладів центральної та/або периферичної нервової системи, зокрема, розладів, пов'язаних із норепінефриновою дисфункцією у ссавців, особливо у людей, в тому числі у дітей, підлітків та дорослих. Термін "норепінефринова дисфункція" у значенні, вживаному в цьому описі, означає зменшення кількості норепінефринового нейромедіатора у синаптичному проміжку до значення, нижчого за те, яке можна розглядати як нормальне або 18 бажане для певного виду або для індивідуальної особини цього виду. Таким чином, вираз "розлади, пов'язані з норепінефриновою дисфункцією у ссавців" означає розлади, пов'язані зі зменшенням кількості норепінефринового нейромедіатора у синаптичному проміжку до значення, нижчого за те, яке можна розглядати як нормальне або бажане для певного виду ссавців або для індивідуальної особини цього виду. До розладів, пов'язаних з норепінефриновою дисфункцією у ссавців, належать, наприклад, стани нервової системи, вибрані з групи, яку складають розлади наркологічного походження та синдроми абстиненції, розлади адекватності (в тому числі пригнічений настрій, стани неспокою, страху або тривоги, змішані стани пригніченого настрою та неспокою, страху або тривоги, порушення поведінки та змішані стани порушення поведінки та настрою), вікові розлади пізнавальної здатності та психічні розлади (в тому числі хвороба Альцгеймера), алкоголізм, алергічні розлади (зокрема, алергічний риніт), нервова анорексія, апатія, астма, розлад дефіциту уваги (ADD) як наслідок загального стану здоров'я, розлад дефіциту уваги з гіперактивністю (ADHD), в тому числі тип ADHD з переважанням дефіциту уваги та ADHD з переважанням гіперактивно-імпульсивних явищ (факультативно також шляхом комплексної терапії із застосуванням одного або кількох стимуляторів, наприклад, метилфенідату, амфетаміну та декстроамфетаміну), маніакально-депресивний розлад, нервова булімія, синдром хронічної втоми, хронічний або гострий стрес, розлади пізнавальної здатності (розглянуті більш детально нижче, але в тому числі маячіння, деменції, розлади типу амнезії, помірне порушення пізнавальної здатності (MCI), порушення пізнавальної здатності, пов'язані з шизофренією (CIAS) та порушення пізнавальної здатності, не ідентифіковані інакше), розлади комунікативної здатності (в тому числі заїкуватість, експресивний мовний розлад, змішаний спримально-експресивний мовний розлад, фонологічний розлад та розлади комунікативної здатності, не ідентифіковані інакше), розлади поведінки, циклотимічний розлад, деменція типу Альцгеймера (DAT), депресія (в тому числі підліткова депресія та легка депресія), дистимічний розлад, порушення емоційного регулювання (в тому числі порушення емоційного регулювання, пов'язане з ADHD, граничні розлади особистості, маніакальнодепресивний розлад, шизофренія, шизоафективний розлад та переміжний спалаховий розлад), фіброміалгія та інші соматоформні розлади (в тому числі соматизаційні розлади, конверсійні розлади, больові розлади, іпохондрія, дисморфний розлад організму, недиференційований соматоформний розлад та соматоформний розлад NOS), генералізований стан неспокою, страху або тривоги, припливи або вазомоторні симптоми, гіпотензивні стани, в тому числі ортостатична гіпотензія, розлади регуляції імпульсів (в тому числі переміжний спалаховий розлад, клептоманія, піроманія, патологічний азарт, три хотиломанія та розлади регуляції імпульсів, не ідентифіковані інакше), нетримання сечі (тобто нічний енурез, стресове нетримання сечі, природжене стресове нетримання 19 85198 сечі та нетримання змішаної природи), розлади дихання, інтоксикація, нездатність до навчання (в тому числі розлади розвитку мови та мовної здатності, наприклад, розлади розвитку артикуляції, розлад експресивного мовного розвитку та розлади розвитку сприймання мови), розлади здатності до навчання (в тому числі розлад здатності до читання, розлад здатності до вивчення математики, розлад здатності до вивчення письмової мови та розлади здатності до навчання, не ідентифіковані інакше) та розлади моторних навичок (наприклад, розлад розвитку координації), манії, головні болі при мігрені, болі невропатичного походження, нікотинізм, наркоманія, ожиріння (тобто для зменшення маси тіла пацієнтів із надлишком жирової тканини або з надлишковою масою тіла), обсесивно-компульсивні розлади та сукупність споріднених розладів, розлад агресивної суперечливості, болі, в тому числі хронічні болі, невропатичні болі та болі, пов'язані з чутливістю больових рецепторів, панічний розлад, хвороба Паркінсона (зокрема, для полегшення дискінезії, тремтіння, покращення відчуття рівноваги, координації, послаблення депресії та посилення мотивації), периферична невропатія, зміни особистості, пов'язані із загальним станом здоров'я (в тому числі лабільного типу, типу розгальмування, агресивного типу, апатичного типу, параноїдного типу, комбінованого типу та неідентифікованого типу), глибокі розлади розвитку (в тому числі аутизм, розлад Аспергера, розлад Ретта, дитячий дезінтеграційний розлад та глибокі розлади розвитку, не ідентифіковані інакше), посттравматичний стресовий синдром, передменструальний дисфоричний розлад (тобто передменструальний синдром та дисфоричний розлад пізньої фази жовтого тіла), псоріаз, розлади, пов'язані із застосуванням психотропних речовин, психотичні розлади (в тому числі шизофренія, шизоафективні та шизофреноподібні розлади), сезонні афективні розлади, розлади сну (наприклад, нарколепсія та енурез), соціальні фобії (в тому числі стан соціального неспокою, страху або тривоги), специфічні розлади розвитку, синдром "згасання" селективного інгібування повторного поглинання серотоніну (SSRI) (тобто випадки, коли пацієнт після початкового періоду задовільної реакції на терапію SSRI перестає задовільно реагувати на таку терапію), розлади TIC (наприклад, хвороба Туретта), нікотинізм та деменція судинного походження. Сполуки за цим винаходом особливо придатні для лікування розладу дефіциту уваги з гіперактивністю (ADHD). Сполуки за цим винаходом особливо придатні також для лікування шизофренії. Термін "розлади пізнавальної здатності" (а також різноманітні аналогічні терміни, наприклад, "руйнування пізнавальної здатності", "недостатність пізнавальної здатності", "дефіцит пізнавальної здатності", "порушення пізнавальної здатності", "пізнавальна дисфункція" тощо) означає порушення, послаблення або втрату однієї або кількох пізнавальних функцій, тобто процесів, які забезпечують сприйняття, утримання та застосування знань. До пізнавальної дисфункції належать зміни пізнавальної здатності, пов'язані зі старінням ("ві 20 кове порушення пам'яті"), а також зміни внаслідок інших причин. Порушення пізнавальної здатності найчастіше пов'язане з делірієм або деменцією, але може виникати також у зв'язку з численними іншими медичними або невропсихіатричними розладами. Більш точно порушення пізнавальної здатності діагностуються із застосуванням критеріїв, описаних у довіднику "Діагностичний та статистичний довідник із розумових розладів" (Diagnostic and Statistical Manual of Mental Disorders, Fourth Edition, Text Revision (DSM-IV-TR, 2000), American Psychiatric Association, Washington, D.C.), як або амнестичні розлади (що впливають на пам'ять), або розлади пізнавальної здатності, не ідентифіковані інакше (NOS), до яких належать дійова дисфункція, зорово-просторові та зоровоконструкційні порушення, дефіцит уваги, втрата орієнтації тощо. Ці більш конкретні розлади пізнавальної здатності також включають широке різноманіття випадків, в тому числі деякі випадки невідомої етіології. Делірій (маячіння) характеризується як порушення свідомості з послабленням здатності до концентрування, утримання або зміни напрямку уваги та зі зміною пізнавальної здатності, що розвивається протягом короткого періоду часу. Делірій є дуже поширеним патологічним станом і має місце приблизно у п'ятої частини загальної кількості пацієнтів, що надходять до лікувальних закладів, та є навіть більш звичайним у пацієнтів, що лікуються вдома, та у хворих на смертельні хвороби. Такі розлади, включені в розділ "Делірій" DSM-IV-TR, розрізняються за можливою етіологією: "Делірій, спричинений загальним станом хворого", "Делірій хімічного походження" (тобто спричинений наркотиками, лікарськими речовинами або токсинами), "Делірій комбінованої етіології" та "Делірій, не ідентифікований інакше" (якщо етіологія не визначена). Як виявлено Уайзом та ін. [Wise et al., (2002) "Делірій (стани сплутаності свідомості)", In Wise and Rundell, Eds., The American Psychiatric Publishing Textbook of ConsultationLiaison Psychiatry, Psychiatry in the Medically III, Second Edition, American Psychiatric Publishing, Inc., Washington, D.C., Chapter 15, pp.257-272, Table 15-4], до необмежувальних прикладів етіологічних основ делірію належать інфекція, алкогольна та наркотична абстиненція, гострі метаболічні порушення, травми різних типів, патології центральної нервової системи, гіпоксія, вітамінна недостатність, ендокринологічні розлади, гострі судинні розлади, токсини або наркотики та важкі метали. Деменція є хронічним станом, звичайно з більш поступовим погіршенням пам'яті та інших інтелектуальних функцій та інших пізнавальних навичок, досить тяжким, щоб заважати здатності виконувати дії, пов'язані зі щоденним життям. Хоча деменція може виникати в будь-якому віці, вона має місце, головним чином, у людей похилого віку, і нею вражено понад 15% осіб у віці понад 65 років і до 40% осіб у віці понад 80 років. Зокрема, звичайним явищем є деменція, пов'язана з хворобою Альцгеймера. До розладів пам'яті та/або деменцій, не пов'язаних із хворобою Альцгеймера, належать, наприклад, вказані явища, спричинені або пов'яза 21 85198 ні з такими захворюваннями: судинними захворюваннями; хворобою Паркінсона; захворюванням тіла Леві (дифузним тілом Леві); ВІЛ/СНІД; помірним погіршенням пізнавальної здатності; помірним погіршенням пізнавальної здатності неврологічного походження; віковими розладами пам'яті; неврологічними та/або психіатричними хворобливими станами, в тому числі епілепсією та лікуванням епілепсії; пухлинами, цистами та пошкодженнями мозку або іншими запальними захворюваннями мозку; розсіяним склерозом; синдромом Дауна; синдромом Ретта; прогресивним супрануклеарним паралічем; синдромами деменції, пов'язаними з ураженням лобових часток; шизофренією та спорідненими психічними розладами; антипсихотичною терапією; травматичними пошкодженнями мозку (закритими травмами голови), боксерською деменцією та іншими травмами голови; гідроцефалією з нормальним тиском; хірургічними втручаннями (в тому числі шунтуванням коронарних артерій) та анестезією, електрошоковою терапією, раком та терапією раку. Деменції також класифікуються у розділі "Деменція" DSM-IV-TR за можливою етіологією: "Деменція типу Альцгеймера", "Судинна деменція", "Деменція, спричинена іншими загальними патологічними станами" (наприклад, ВІЛзахворюванням, травмами голови, хворобою Паркінсона, хореєю Гантінгтона), "Стійка деменція хімічного походження" (тобто спричинена наркотиками, лікарськими речовинами або токсинами), "Деменція комбінованої етіології" та "Деменція, не ідентифікована інакше" (якщо етіологія не визначена). Як показано Греєм та Каммінгсом [Gray and Cummings (2002), "Деменція", In Wise and Rundell, Eds., The American Psychiatric Publishing Textbook of Consultation-Liaison Psychiatry, Psychiatry in the Medically III, Second Edition, American Psychiatric Publishing, Inc., Washington, D.C., Chapter 16, pp.273-306, Table 16-1], до необмежувальних прикладів етіологічних основ головних синдромів деменції належать дегенеративні розлади (кортикальні та субкортикальні), судинні розлади, розлади, пов'язані з демієлінізацією, травматичні стани, неоплазми, гідроцефалія, запальні стани, інфекції, токсикози, розлади метаболізму та психічні розлади. Амнезійний розлад характеризується погіршенням пам'яті за відсутності інших значних погіршень пізнавальної здатності. Розлади, включені до розділу "Амнезійні розлади" DSM-IV-TR також класифікуються за можливою етіологією: "Амнезійні розлади, спричинені загальним патологічним станом", "Стійкі амнезійні розлади хімічного походження" та "Амнезійні розлади, не ідентифіковані інакше." Розлади пізнавальної здатності, не ідентифіковані інакше, у DSM-IV-TR охоплюють явища, які характеризуються пізнавальною дисфункцією, спричинені, як вважається, або загальним патологічним станом, або вживанням хімічних речовин, та які не відповідають критеріям, що характеризують будь-який з розладів, перелічених в інших подрозділах розділу DSM-IV-TR, що має назву "Делірій, 22 деменція та амнезійні та інші розлади пізнавальної здатності". Деменція, амнезійні розлади та розлади пізнавальної здатності, не ідентифіковані інакше (NOS) виникають у пацієнтів, які страждають на різноманітні інші розлади, необмежувальними прикладами яких є: хвороба Гантінгтона (хорея); хвороба Піка; спіноцеребральні атаксії (типи 1-11); дегенерація кортикобазальних гангліїв; нейроакантоцитоз; дентаторубро-палідолюзійна атропія (DRPLA); системний червоний вовчак; інтоксикація важкими металами; алкогольна деменція (енцефалопатія Верніке); фетальний алкогольний синдром; одиничний інсульт або множинні інсульти, в тому числі ураження дрібних судин (деменція Бінсвангера: субкортикальна артеріосклеротична енцефалопатія) та крупних судин (мультиінфарктна деменція); гіпоксійна енцефалопатія; пухлини; пологова гіпоксія; передчасні пологи; вроджені розлади метаболізму; нейрофіброматоз (типу І); горбкуватий склероз; хвороба Галлерфордена-Шпатца; хвороба Вільсона; післяінфекційні ускладнення (наприклад, туберкульозу, вір усного гепатиту, бактеріального менінгіту); субдуральна гематома; субкортикальна деменція; хвороба КрейцфельдтаЯкоба; хвороба Герстманна-Штройслера-Шейнке; загальний парез та сифіліс. Як детально зазначено вище, порушення пізнавальної здатності може виникати у пацієнтів, що страждають на численні розлади, в тому числі на деменцію або делірій, або воно може бути викликане різноманітними іншими причинами. Сполуки за цим винаходом є корисними для лікування або профілактики порушень пізнавальної здатності, пов'язаними з розладами розглянутих ви ще етіологій, в тому числі з розладами, формально класифікованими у DSM-IV-TR, або спричиненими такими розладами. Для зручності читача нижче подано коди або описи розладів згідно з DSM-IVTR. Позначення "коди за ICD-9-CM" стосується кодів, наприклад, деяких загальних патологічних станів та індукованих лікарськими препаратами розладів, включених до довідника "Міжнародна класифікація захворювань" (International Classification of Diseases, 9 th Revision, Clinical Modification). Делірій, спричинений загальним патологічним станом 293.0 Делірій, індукований хімічними речовинами, в тому числі: Інтоксикаційний делірій: Код [конкретна речовина] інтоксикаційний делірій: (291.0 алкоголь; 292.81 амфетамін [або речовина, аналогічна амфетаміну]; 292.81 канабіс; 292.81 кокаїн; 292.81 галюциноген; 292.81 інгаляційний препарат; 292.81 опіоїд; 292.81 фенциклідин [або речовина, аналогічна фенциклідину]; 292.81 седативний, снотворний засіб або транквілізатор; 292.81 інша [або невідома] речовина [наприклад, циметидин, дигіталіс, бензтропін]) Делірій, спричинений абстиненцією: Код [конкретна речовина] абстиненційний делірій: (291.0 алкоголь; 292.81 седативний, снотворний засіб або транквілізатор; 292.81 інша [або невідома] речовина) Делірій комбінованої етіології: 23 85198 Застосовуються комбіновані коди, що відображають конкретний делірій та конкретні етіології, наприклад, 293.0 делірій, спричинений вірусним енцефалітом; 291.0 делірій, спричинений алкогольною абстиненцією Делірій, не ідентифікований інакше 780.09 Деменція типу Альцгеймера 294.ІХ* (*код ICD9-CM) Підтипи: з раннім початком (початок деменції у віці 65 років або раніше) з пізнім початком (початок деменції у віці понад 65 років) Без порушень поведінки 294.10 З порушеннями поведінки 294.11 Деменція судинного походження 290.4х Підтипи: з делірієм 290.41 з маячінням 290.42 з пригніченим настроєм 290.43 з порушеннями поведінки не кодована без ускладнень 290.40 Деменція, спричинена ВІЛ-захворюванням 294.Іx* (*кодІСО-9-СМ) Деменція, спричинена травмою голови 294.Іx* (*код ICD-9-CM) Деменція, спричинена хворобою Паркінсона 294. Ix* (*код ICD-9-CM) Деменція, спричинена хворобою Гантінгтона 294.ІХ* (*код ICD-9-CM) Деменція, спричинена хворобою Піка 290.Ix* (*код ICD-9-CM) Деменція, спричинена хворобою Крейцфельда-Якоба 290. Ix* (*код ICD-9-CM) Деменція, спричинена іншими загальними патологічними станами 294. Ix* (*код ICD-9-CM) Коди на основі присутності або відсутності клінічно значущи х порушень поведінки: Без порушень поведінки 294.10 З порушеннями поведінки 294.11 Стійка деменція, індукована хімічними речовинами Код Стійка деменція, індукована [конкретна речовина]: (291.2 алкоголь; 292.82 інгаляційний препарат; 292.82 седативний, снотворний засіб або транквілізатор; 292.82 інша [або невідома] речовина) Деменція комбінованої етіології Примітка для кодування: Застосовуються комбіновані коди, що відображають конкретні типи деменції та конкретні етіології, наприклад, 294.10 Деменція типу Альцгеймера з пізнім початком без порушень поведінки; 290.40 Деменція судинного походження без ускладнень. Деменція, не ідентифікована інакше 294.8 Амнезійний розлад, спричинений загальним патологічним станом 294.0 Перехідний або хронічний Стійкий амнезійний розлад, індукований хімічною речовиною Код Стійкий амнезійний розлад, індукований [конкретна речовина]: 291.1 алкоголь; 292.83 седативний, снотворний засіб або транквілізатор; 292.83 інша [або невідома] речовина 24 Амнезійний розлад, не ідентифікований інакше 294.8 Розлад пізнавальної здатності, не ідентифікований інакше 294.9 Вікове порушення пізнавальної здатності 780.9 До прикладів особливо перспективних можливостей профілактики або лікування розладів пізнавальної здатності різноманітної етіології (або пов'язаних із різноманітними розладами) із застосуванням сполук за цим винаходом належать: посилення пізнавальних функцій та функційної діяльності (здатності до планування, ініціювання, організації, виконання, контролю та коригування власної поведінки) у нормальних суб'єктів або у суб'єктів із пізнавальною дисфункцією; лікування дефіциту пізнавальної функції та уваги, пов'язаного з пренатальним впливом токсичних речовин, в тому числі (але не тільки) нікотину, алкоголю, метамфетаміну, кокаїну та героїну; лікування порушень пізнавальної здатності, спричинених хронічним зловживанням алкоголем та наркотиками (стійкої деменції, індукованої хімічними речовинами), побічними ефектами лікарських засобів, та лікування потягу до наркотиків та наркотичної абстиненції; лікування дефіциту пізнавальної здатності у хворих на синдром Дауна; лікування порушень нормальної діяльності пам'яті, пов'язаних із глибокою депресією та маніакальнодепресивним психозом; лікування порушень пізнавальної здатності, пов'язаних із депресією, розумовою відсталістю, маніакально-депресивним психозом або шизофренією; лікування синдромів деменції, пов'язаних із маніями, конверсійними розладами та симуляцією; лікування порушень уваги, префронтальної діяльної функції або пам'я ті, спричинених травмами голови або інсультами; лікування пізнавальної дисфункції у жінок в період менопаузи та у жінок, яких піддають гормонозаміщувальній терапії; лікування порушень пізнавальної здатності та втоми, спричинених раком або терапією раку або пов'язаних із раком або терапією раку (порушення пізнавальної здатності пов'язані з різними способами терапії раку, в тому числі з опроміненням голови, звичайною хіміотерапією при стандартному дозуванні, високодозовою хіміотерапією та з кровотвірною трансплантацією (трансплантацією кісткового мозку) та з біологічними агентами). Сполуки за цим винаходом корисні також у способі лікування пацієнта, що страждає від або схильний до психозу, який включає введення в організм згаданого пацієнта ефективної кількості першого компонента, який є антипсихотичним засобом, у комбінації з ефективною кількістю другого компонента, який є сполукою формули (І). Цей винахід пропонує також фармацевтичну композицію, яка включає перший компонент, який є антипсихотичним засобом, та другий компонент, який є сполукою формули (І). За загальним формулюванням цього аспекту винаходу, першим компонентом є сполука, що діє як антипсихотик. Цей антипсихотик може бути типовим антипсихотиком або атиповим антипсихотиком. Хоча для способів та лікарських засобів за цим винаходом корисними є як типові, так і атипові антипсихотики, відповідно 25 85198 до варіанта, якому віддається перевага, перший компонент є атиповим антипсихотиком. До необмежувальних прикладів типових антипсихотиків належать: хлорпромазин, 2-хлор-10-(3диметиламінпропіл)фенотіазин, описаний у [патенті США 2,645,640]. Огляд його фармакологічних властивостей подано в роботі Крісмона [Crismon, Psvchopharmacol. BuL. 4. 151 (October 1967)]: дроперидол, 1-(1-[3-(n-фторбензоїл)пропіл]-1,2,3,6тетрагідро-4-піридил)-2-бензимідазолінон, описаний у [патенті США №3,141,823]; галоперидол, 4[4-(4-хлорфеніл)-4-гідрокси-1-піперидиніл]-1-(4фтор феніл)-1-бутанон, описаний у патенті США №3,438,991]. Про його терапевтичну е фективність сповіщається у роботі Бересфорда та Уорда [Beresford and Ward, Drugs. 33, 31-49 (1987)]; тіоридазин, 1-гідрокси-10-[2-(1-метил-2піридиніл)етил]-2-(метилтіо)-фенотіазину гідрохлорид, описаний Буркеном та ін. [Bourquin, et al. (HeIv. CMm. Acta. 41, 1072 (1958)]. Його застосування як антипсихотика описано Аксельсоном та ін. [Axelsson, et al., Curr. Ther. Res.. 21, 587 (1977)]; та трифлуоперазин, 10-[3-(4-метил-1-піперазиніл)пропіл]-2-трифторметил-фенотіазину гідрохлорид, описаний у [патенті США №2,921,069]. До необмежувальних прикладів типових антипсихотиків належать: оланзапін, 2-метил-4-(4метил-1-піперазиніл)-10Н-тієно[2,3-b][1,5]бензодіазепін, який є відомою сполукою і описаний у [патенті США №5,229,382] як речовина, корисна для лікування шизофренії, шизофреноподібних розладів, гострих маній, помірних станів неспокою, страху або тривоги та психозів; клозапін, 8-хлор11-(4-метил-1-піперазиніл)-5Ндибензо[b,е][1,4]діазепін, описаний у [патенті США №3,539,573]. Його клінічна ефективність при лікуванні шизофренії описана Гейнсом та ін. [Hanes, et al., Psvchopharmacol. Bull.. 24, 62 (1988)]; рисперидон, 3-[2-[4-(6-фтор-1,2-бензізоксазол-3іл)піперидино]етил]-2-метил-6,7,8,9-тетрагідро-4Нпіридо [1,2-а] піримідин-4-он, та його застосування при лікуванні психотичних захворювань описано у [патенті США №4,804,663]; сертиндол, 1-[2-[4-[5хлор-1-(4-фторфеніл)-1Н-індол-3-іл]-1піперидиніл]етил]імідазолідин-2-он, описаний у [патенті США№4,710,500]. Його застосування при лікуванні шизофренії описано у [патентах США №5,112,838 та №5,238,945]; кветіапін, 5-[2-(4дибензо[b,f][1,4]тіазепін-11-іл-1-піперазиніл)етокси]етанол та його активність у випробуваннях, що демонструють корисність при лікуванні шизофренії, описано в [патенті США №4,879,288]. Кветіапін, як правило, застосовують у формі його (Е)-2бутендіоату (2:1); зипрасидон, 5-[2-[4-(1,2бензоізотіазол-3-іл)-1-піперазиніл]етил]-6-хлор-1,3дигідро-2Н-індол-2-он, як правило, застосовують у формі моногідрату гідрохлориду. Ця сполука описана у [патентах США №4,831,031 та №5,312,925]. Її активність у випробуваннях, що демонструють корисність при лікуванні шизофренії, описано в [патенті США№4,831,031]; та арипіпразол (Abilify), 7-[4-[4-(2,3-дихлорфеніл)-1-піперазиніл]бутокси]3,4-дигідрокарбостирил [патенти США№4,734,416 та №5,006,528], який є новим антипсихотиком, корисним для лікування шизофренії. 26 Слід мати на увазі, що хоча перевага віддається застосуванню одного антипсихотика як першого компонента, в разі необхідності або за бажанням можна застосовувати як перший компонент комбінації двох або більше антипсихотиків. Аналогічно, хоча перевага віддається застосуванню однієї сполуки формули (І) як другого компонента, в разі необхідності або за бажанням можна застосовувати як другий компонент комбінації двох або більше сполук формули (І). Хоча корисними та цінними є усі комбінації першого та другого компонентів, деякі комбінації мають особливу цінність, і їм віддається перевага, а саме такі комбінації: оланзапін/сполука формули (І) клозапін/сполука формули (І) рисперидон/сполука формули (І) сертіндол/сполука формули (І) кветіапін/сполука формули (І) зипрасидон/сполука формули (І) арипіпразол/сполука формули (І) Як правило, перевага віддається комбінаціям та способам лікування, де як перший компонент застосовується оланзапін. Якщо першим компонентом є оланзапін, то особлива перевага віддається оланзапіну Форми II, описаному в [патенті CШA 5,736,541]. Хоча перевага віддається оланзапіну Форми II, слід мати на увазі, що термін "оланзапін" в цьому описі охоплює усі сольвати та поліморфні форми, якщо не вказано інакше. До патологічних станів, які можна лікувати за аспектом цього винаходу, що стосується допоміжної терапії, належать шизофренія, шизофреноподібні захворювання, маніакально-депресивний розлад, гострі манії та шизоафективні розлади. Назви цих патологічних станів відповідають численним хворобливим станам. Поданий нижче перелік ілюструє деяку кількість хворобливих станів, причому багато з них класифіковано в DSM-IV-TR. Номери кодів DSM-IV-TR для цих хворобливих станів подано нижче для зручності читача. Шизофренія параноїдного типу 295.30 Шизофренія неорганізованого типу 295.10 Шизофренія кататонічного типу 295.20 Шизофренія недиференційованого типу 295.90 Шизофренія залишкового типу 295.60 Шизофреноподібний розлад 295.40 Шизоафективний розлад 295.70 Цей винахід охоплює також застосування однієї або кількох сполук формули (І) у комбінації з одним або кількома звичайними засобами Альцгеймера для профілактики або лікування пізнавальної дисфункції у хворих, що страждають на хворобу Альцгеймера. Цей винахід пропонує також фармацевтичну композицію, яка включає перший компонент, що є звичайним засобом Альцгеймера, та другий компонент, що є сполукою формули (І). До звичайних засобів Альцгеймера належать інгібітори розкладу ацетилхоліну (тобто інгібітори холінестерази або ацетилхолінестерази) у синапсах, наприклад, донепезил (Aricept®), ривастигмін (Exelon®), галантамін (Reminyl ®) та такрин (Cognex®); селективний інгібітор моноамінооксидази селегілін (Namenda®), новий дозволений Феде 27 85198 ральним управлінням із лікарських засобів (FDA) антагоніст рецептора NMDA для лікування помірної або тяжкої форми хвороби Альцгеймера. Для лікування хвороби Альцгеймера застосовують також модафініл (Provigil ®). Цей винахід охоплює також застосування однієї або кількох сполук формули (І) у комбінації з одним або кількома звичайними засобами Паркінсона для лікування пізнавальної дисфункції при хворобі Паркінсона. Цей винахід пропонує також фармацевтичну композицію, яка включає перший компонент, що є звичайним засобом Паркінсона, та другий компонент, що є сполукою формули (І). До звичайних засобів Паркінсона належать: леводопа; леводопа/карбідопа (Sinemet®); сталево (карбідопа/леводопа/ентакапон); агоністи допаміну, наприклад, бромокриптин; Мігарех® (праміпексол), Регаіах® (перголід) та Requip® (ропінірол); інгібітори COMT, наприклад, толкапон та ентакапон; селегілін (Deprenyl®; Eldepryl®); пропанолол; примідон; антихолінергічні засоби, наприклад, Cogentin®, Artane®, Akineton®, Disipal® та Kemadrin ®; а також амантадин. За кожним із вищезгаданих варіантів комплексної терапії, згадані перший та другий компоненти можна застосовувати спільно, окремо або послідовно. Аналогічно, згадані композиції охоплюють комбіновані лікарські форми для спільного, окремого або послідовного застосування. Термін "лікування" у значенні, вживаному в цьому описі, стосується як лікування, так і профілактики розладів, пов'язаних із норепінефриновою дисфункцією. Таким чином, термін "лікування" стосується усіх процесів, які можуть включати сповільнення, переривання, припинення, регулювання або зупинення розвитку описаних у цьому документі розладів, однак не обов'язково означає повне усунення усіх симптомів, а також охоплює профілактику та терапію таких розладів. Сполуки за цим винаходом є також корисними для лікування розладів, при яких стан хворого полегшується шляхом збільшення кількості норепінефринового нейромедіатора у синаптичному проміжку вищезгаданого ссавця, яку можна розглядати як нормальну або бажану для певного виду ссавця або для індивідуальної особини цього виду. За іншим варіантом здійснення цього винаходу, запропонована фармацевтична композиція, що містить сполуку формули (І) або фармацевтично прийнятну сіль цієї сполуки разом із фармацевтично прийнятними розріджувачем, наповнювачем або носієм. За іншим варіантом здійснення цього винаходу, запропонована сполука формули (І) або фармацевтично прийнятна сіль цієї сполуки для застосування в терапії. За іншим варіантом здійснення цього винаходу, запропонована сполука формули (І) або фармацевтично прийнятна сіль цієї сполуки для застосування як інгібітор повторного засвоєння норепінефрину. Відповідно до варіанта, якому віддається перевага, таке інгібування має місце всередині клітин організму ссавця (в тому числі у препаратах клітинних мембран ссавця), особливо в 28 клітинах, що знаходяться у складі центральної та/або периферичної нервової системи. Відповідно до варіанта, якому віддається більша перевага, таке інгібування має місце всередині клітин центральної нервової системи ссавця, особливо людини, що потребує такого інгібування. За іншим варіантом здійснення цього винаходу запропоноване застосування сполуки формули (І) або фармацевтично прийнятної солі цієї сполуки для лікування розладів, пов'язаних із дисфункцією норепінефрину у ссавців. За іншим варіантом здійснення цього винаходу, запропоноване застосування сполуки формули (І) або фармацевтично прийнятної солі цієї сполуки для виготовлення лікарського засобу для інгібування повторного поглинання норепінефрину. За іншим варіантом здійснення цього винаходу, запропоноване застосування сполуки формули (І) або фармацевтично прийнятної солі цієї сполуки для виготовлення лікарського засобу для лікування розладів, пов'язаних із норепінефриновою дисфункцією у ссавців. За іншим варіантом здійснення цього винаходу, запропонований спосіб інгібування повторного поглинання норепінефрину у ссавців, який включає введення в організм пацієнта, який цього потребує, ефективної кількості сполуки формули (І) або фармацевтично прийнятної солі цієї сполуки. За іншим варіантом здійснення цього винаходу, запропонований спосіб лікування розладів, пов'язаних із норепінефриновою дисфункцією у ссавців, який включає введення в організм пацієнта, який цього потребує, ефективної кількості сполуки формули (І) або фармацевтично прийнятної солі цієї сполуки. Цей винахід охоплює фармацевтично прийнятні солі сполуки формули (І). До придатних солей належать солі кислот, в тому числі солі неорганічних кислот, наприклад хлористоводневої, бромистоводневої, азотної, сірчаної або фосфорної кислот, або органічних кислот, наприклад, органічних карбонових кислот або органічних сульфонових кислот, наприклад, ацетоксибензойної, лимонної, гліколевої, 1-мигдалевої, d1-мигладевої, dмигдалевої, малеїнової, моногідрагаої мезовинної, гідроксималеїнової, фумарової, лактобіонової, яблучної, метансульфонової, нафталінсульфонової, нафталіндисульфонової, нафтойної, щавлевої, пальмітинової, фенілоцтової, пропіонової, пірвдилгідроксипіровиноградної, саліцилової, стеаринової, бурштинової, сульфанілової, 1винної, d1-винної, d-винної, 2гідроксіетансульфонової, толуол-и-суль фонової та ксинафоєвої кислот. Сполуки за цим винаходом можуть бути застосовані як лікарські засоби у медицині або у ветеринарії. Ці сполуки можна вводити в організм різноманітними шляхами, наприклад, пероральним, ректальним, місцевим або парентеральними шляхами, наприклад, шляхом ін'єкцій, і їх звичайно застосовують у формі фармацевтичних композицій. Такі композиції можна виготовляти способами, добре відомими у фармацевтичній галузі, і вони, як правило, включають щонайменше одну активну 29 85198 30 сполуку в поєднанні з фармацевтично прийнятним розріджувачем, наповнювачем або носієм. При виготовленні композицій за цим винаходом активний інгредієнт, як правило, змішують із носієм або розріджують носієм, та/або вміщують у носій, який може мати форму, наприклад, капсули, пакетасаше, паперового пакетика або іншого контейнера. Якщо носій виконує функцію розріджувача, він може являти собою твердий, напівтвердий або рідкий матеріал, який може виконувати функцію носія, наповнювача або середовища для активного інгредієнта. Таким чином, композиція може мати форму таблеток, пастилок, пакетів-саше, облаток, еліксирів, суспензій, розчинів, сиропів, аерозолів (у твердому або рідкому середовищі), мазей зі вмістом, наприклад, до 10% (мас.) активної сполуки, м'яких та твердих желатинових капсул, супозиторіїв, розчинів та суспензій для ін'єкцій та стерильних фасованих порошків. Деякими прикладами придатних носіїв є лактоза, декстроза, рослинні олії, бензилові спирти, алкіленгліколі, гліцеринтриацетат, желатин, вуглеводи, наприклад, крохмаль, вазелін, сахароза, сорбіт, маніт, різновиди крохмалю, акацієва камедь, фосфат кальцію, альгінати, трагант, желатин, сироп, метилцелюлоза, метил- та пропілгідроксибензоати, тальк, стеарат магнію та мінеральне масло. Сполуки формули (І) можна ліофілізувати і застосовувати одержані ліофілізати, наприклад, для виготовлення ін'єкційних препаратів. Вищезазначені препарати можуть бути стерилізовані та/або можуть містити допоміжні речовини, наприклад, змащувачі, консерванти, стабілізатори та/або змочувачі, емульгатори, солі для регулювання осмотичного тиску, буферні речовини, барвники, ароматизатори та/або один або кілька до даткових активних сполук, наприклад, один або кілька вітамінів. Композиції за цим винаходом можна виготовляти з розрахунком на забезпечення швидкого, сповільненого або затриманого вивільнення активного інгредієнта після введення в організм пацієнта, застосовуючи методики, добре відомі в галузі. Перевага віддається виготовленню композицій у формі дозованих одиниць, причому кожна дозована одиниця містить від приблизно 5мг до приблизно 500мг, більш звичайно від приблизно 25мг до приблизно 300мг, активного інгредієнта. Термін "дозована форма" означає фізично дискретні одиниці, придатні як одиничні дози для людей та інших ссавців, причому кожна одиниця містить заздалегідь визначену кількість активного матеріалу, розраховану на досягнення бажаного терапевтичного ефекту, у поєднанні з придатним фармацевтичним носієм. Сполуки за цим винаходом можуть бути одержані звичайними методами органічного синтезу. Нижче описано загальні схеми, що характеризують способи синтезу сполук за цим винаходом. Для ясності Rx, R y та Rz показані як H, однак мається на увазі, що аналогічні способи можна застосовувати для інших можливих значень Rx, Ry та R z. Проміжні продукти формули (X), формули (XI), формули (XII), формули (XV) та формули (XVI) можна одержати, як показано нижче (де P - група захисту N, і кожний із замісників R7 та R8, які можуть бути однаковими або різними, означає С1-С4алкіл (факультативно заміщений однією групою OMe) або обидва ці замісники спільно з атомом N, до якого вони приєднані, утворюють піролідиновий, піперидиновий або морфоліновий цикл): Захи щений по N етаноламін вводять в реакцію з 2-хлоракрилнітрилом і одержують адукт Міхаеля, який потім обробляють in situ основою, наприклад, трет-бутилатом натрію, і одержують сполуку формули (X). Сполуку формули (X) можна потім гідролізувати H2SO4 в етанолі, і одержати складний ефір формули (XI). Цю сполуку можна, у свою чергу, перетворити у вайнреб-амід формули (XII) шляхом додавання розчину сполуки (XI) до попередньо приготованої суміші розчину N,N’диметилгідроксиламіну та триметилалюмінію. За альтернативним варіантом, сполуку формули (X) можна гідролізувати в суміші Н 2О/НСІ, і одержати кислоту формули (XV). Цю кислоту можна, у свою чергу, перетворити в амід формули (XVI) шляхом проведення реакції розчину (XV) з оксалілхлоридом або SOCI2 з одержанням ацилхлориду, який потім вводять у реакцію з аміном формули R7R8NH, наприклад, із диметиламіном або морфоліном. Показані нижче енантіомери амідів (XII) та (XVI), яким віддається перевага, можна одержати хіральною хроматографією. 31 85198 32 Придатні групи захисту N відомі пересічному фа хівцеві в цій галузі. Додаткова інформація про придатні групи захисту азоту наведені у добре відомій монографії "Групи захисту в органічному синтезі" ["Protective Groups in Organic Synthesis", Theodora W. Greene and Peter G.M. Wuts, John Wiley & Sons, Inc., New York, 1999, стор.494-653]. Групою захисту азоту, якій віддається особлива перевага, є бензил. Захи щені по N сполуки формули (І), де X NH2, можуть бути одержані зі сполук формули (X), як показано нижче: До розчину (XII) або (XVI) додають розчин необхідного реагенту Гріньяра R1MgBr, і після обробки одержують сполуку формули (XIII). Якщо реакцію проводять із застосуванням енантіомерів (ХІІ)Ь або (XVI)b, яким віддається перевага, то вона протікає зі збереженням стереохімічної конфігурації, причому одержують сполуку (ХIII)b. (XIII)b За варіантом А, проміжну сполуку (X) обробляють надлишком реагенту Гріньяра Ar1CI2MgBr, і одержують захищену по N сполуку формули (І), де X є NH2 і R1 є СН2Аr2, де Аr2=Аr1. За варіантом В, проміжну сполуку (X) обробляють одним еквівалентом реагенту Гріньяра R1MgBr, а потім одним еквівалентом реагенту Гріньяра Ar1CH2MgBr захи щену по N сполуку формули (І), де X є NH2. За альтернативним варіантом, можна спочатку додавати реагент Гріньяра Ar1CH2MgBr, а потім R1MgBr. Відповідно до варіанта, якому віддається перевага, до реакційної суміші у проміжку між доданням реагентів Гріньяра додають кислоту Льюїса [дивись роботи Шаретта - Charette A.В.; GagnonA; Janes M; Mellon C; Tetrahedron Lett, 1998, 39(29), 5147-5150 та Charette A.B.; Gagnon A; Tetrahedron: Asymmetry, 1999, 10(10), 1961-1968]. Захи щені no N сполуки формули (I), де X - ОН та R1 - СН2Аr2, де Ar2=Ar1, можуть бути одержані зі сполук формули (XI), як показано нижче: Проміжну сполуку (XI) обробляють надлишком реактиву Гріньяра Ar1CH2MgBr для одержання Nзахищеної сполуки формули (І), де X - OH та R1 СН2Аr2, де Ar2=Ar1. Захи щені по N сполуки формули (І), де X - OH можуть бути одержані з вайнреб-аміду формули (XII) або аміду формули (XVI), як показано нижче: До розчину кетону формули (XIII) додають розчин реагенту Гріньяра Ar1CH2MgBr, і одержують захищену по N сполуку формули (І), де X є OH. Якщо реакцію проводять із застосуванням енантіомеру (ХIII)b, то вона протікає стереоселективно з одержанням захищеної по N сполуки формули (II), де X є OH. Кетони формули (XIII) можна також одержати іншим шляхом, як показано нижче: Розчин захищеного по N морфолінону обробляють сильною основою, наприклад, діізопропіламідом літію. До одержаного розчину додають альдегід R1CHO. Шляхом відновлення карбонільної групи морфоліну із застосуванням, наприклад, комплексу борану з THF, та подальшого окиснення спирту із застосуванням, наприклад, умов окиснення за Сверном одержують сполуку формули (XIII), яку потім можна ввести в реакцію, описану у попередній схемі, і одержати захищену по N сполуку формули (І), де X є OH. Захи щені по N сполуки за цим винаходом, де X - С1-С4-алкоксигрупа, можуть бути синтезовані стандартним шляхом алкілування захищених по N сполук формули (І), де X=OH, як показано нижче: 33 85198 34 чайних методик органічної хімії з етилового складного ефіру N-бензил-морфолін-2-карбонової кислоти 1 або N-бензилморфолінону, як показано на Схемах 1-4. Придатні сильні основи відомі пересічному фа хівцеві в цій галузі та включають, зокрема, гідрид натрію. Аналогічно, придатні алкілувальні агенти відомі пересічному фа хівцеві в цій галузі та включають, зокрема, галогеновані С1-С4-алкіли, наприклад, метилйодид. Захи щені по N сполуки відповідно до цього винаходу, де X - NH(C1-C4-алкіл), можуть бути синтезовані шляхом обробки сполуки формули (І), де X=NH2, в умовах відновлювального алкілування або з використанням придатних алкілувальних агентів, відомих пересічному фа хівцеві у цій галузі, в тому числі, наприклад, галогенованих С1-С4алкілів, наприклад, метилйодиду. Захи щені по N сполуки відповідно до цього винаходу можуть бути оброблені із використанням стандартних методик органічної хімії для одержання додаткових захищених по N сполук відповідно до цього винаходу. Наприклад, при реакціях сполучення металоорганічного типу між Ar1-Brпохідною та фенілборною кислотою, показаних нижче, можуть утворюватися Ar1-фенільні похідні. Сполуки формули (І) можуть бути одержані шляхом відщеплення груп захисту від захищених по N проміжних сполук, як показано нижче: Додаткова інформація про придатні методики відщеплення груп захисту наведена у вищезгаданій добре відомій монографії "Protective Groups in Organic Synthesis". Таким чином, інший варіант здійснення цього винаходу пропонує спосіб одержання сполуки формули (І), який включає стадію відщеплення захисної групи від сполуки формули (XIV) (XIV) де P означає групу захисту азоту, а всі інші змінні відповідають вищенаведеним визначенням для формули (І), для одержання сполуки формули (І), факультативно з наступною стадією утворення фармацевтично прийнятної солі. Приклади сполук відповідно до цього винаходу можуть бути одержані шляхом використання зви Шляхом перетворення 1 у вайнреб-амід 2 з подальшим обробленням відповідним реагентом Гріньяра одержують перелічені в Таблиці 1 кетони формули (XIII), де P - бензил. Таблиця 1 R1 метил етил ізопропіл ізобутил циклопентил тетрагідропіраніл 3,3,3-трифторпропіл 4,4,4-трифторбутил циклопропіл н-бутил Сполука №(кетон) 3 4 5 6 7 8 9 10 77 82 Заміщений циклопропілом кетон 77 можна одержати альтернативним способом з Nбензилморфолінону, як показано на Схемі 2. Шляхом оброблення N-бензилморфолінону сильною основою, наприклад, діізопропіламідом літію, з подальшим доданням циклопропілметилальдегіду одержують сполуку 75. Шляхом відновлення 75, наприклад, комплексом борану з THF, одержують 76. Шляхом додання розчину сполуки 76 до попередньо виготовленої суміші диметилсульфоксиду та оксалілхлориду одержують сполуку 77. Шляхом проведення реакцій кетонів, перелічених у Таблиці 1, з реагентами Гріньяра на основі відповідно заміщених бензилів одержують Nбензилзаміщені третинні спирти, перелічені в Таблиці 2 (де R2, R5 та R6 є H, якщо не вказано інакше), як показано на Схемі 3: 35 85198 36 Шляхом відщеплення бензильної групи та одержання солей, як показано на Схемі 4, одержують солі третинних спиртів, перелічених у Таблиці 2 (де R2, R5 та R6 є H, якщо не вказано інакше). Таблиця 2 Приклад 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 32 35 36 37 38 R1 метил етил етил етил ізопропіл ізопропіл ізопропіл ізопропіл ізопропіл ізопропіл ізобутил ізобутил ізобутил ізобутил ізобутил циклопентил циклопентил циклопентил циклопентил циклопентил тетрагідропіраніл тетрагідропіраніл тетрагідропіраніл тетрагідропіраніл 3,3,3-трифторпропіл 3,3,3-трифторпропіл 3,3,3-трифторпропіл 4,4,4-фифторбутил 4,4,4-трифторбутил циклопропіл циклопропіл циклопропіл н-бутил н-бутил ізобутил ізобутил R2, R5, R6 2-Ph 2-OMe, 5-F 2-OCF3 2-Ph 2-OMe, 5-F 2-OMe 2-ОEt 2-OCF3 2-Ph 2-Ph, 5-F 2-ОМе, 5-F 2-ОEt 2-OCF3 2-Ph 2-Ph, 5-F 2-ОМе, 5-F 2-ОEt 2-OCF3 2-Ph 2-Ph, 5-F 2-ОМе, 5-F 2-OCF3 2-Ph 2-(3-F-Ph) 2-ОМе, 5-F 2-OCF3 2-Ph 2-ОМе, 5-F 2-Ph 2-OMe 2-ОEt 2-Ph 2-ОМе 2-Ph 2-Сl, 6-F 2-Cl Сполуки за Прикладами 1-32 та 35-38 можна одержати описаним вище шляхом в енантіомерно чистій формі, застосовуючи хірально чистий складний ефір 1. Розділення 1 на його енантіомери можна виконати з використанням хіральної PXBE. Перетворення цього складного ефіру у вайнребамід не торкається хірального центра, отже, таким чином одержують хірально чистий амід 2. Перетворення цього вайнреб-аміду в кетон також не торкається хірального центра, отже, при цьому одержують хірально чисті кетони 3-10, 77 та 82. За альтернативним способом, можна виконати хіральне розділення аміду 2 методом хіральної PXBE, і одержати його енантіомери. За ще одним альтернативним способом, можна виконати хіральне Сполука № (N-бензильна проміжна) 11 13 15 17 19 21 23 25 27 29 31 33 35 37 39 41 43 45 47 49 51 53 55 57 59 61 63 65 67 69 71 73 83 85 87 89 Сполука № (гідрохлорид) 12 14 16 18 20 22 24 26 28 30 32 34 36 38 40 42 44 46 48 50 52 54 56 58 60 62 64 66 68 70 72 74 84 86 88 90 розділення кетонів 3-10, 77 та 82 методом хіральної PXBE, і одержати їхні енантіомери. Хіральне розділення згаданих складного ефіру, аміду або кетонів можна здійснити також іншими способами, відомими пересічному фахівцеві у цій галузі, наприклад, шляхом фракційної кристалізації діастереомерних солей згаданих сполук із хіральними кислотами. Приєднання бензилвмісного реагенту Гріньяра (Схема 3) є стереоселективним процесом, і при цьому утворюється переважно один діастереомер із домішкою незначних кількостей другого діастереомеру. При відщепленні бензильної групи епімеризація не спостерігається. За альтернативним варіантом, енантіомерно чисті продукти одержують шляхом перетворення на захищені по 37 85198 N аналоги, наприклад, у бутоксикарбоніл- або карбобензилоксипохідні, з подальшим розділенням хіральною PXBE. Після видалення групи захисту N одержують продукти з високим ступенем енантіомерного збагачення. В описах експериментальних методик, поданих нижче, застосовані такі абревіатури: PXBE (HPLC) - рідинна хроматографія високої ефективності THF - тетрагідрофуран 2-MeTHF - 2-метилтетрагідрофуран DIBALH - гідрид діізобутилалюмінію DCM - ди хлорметан FIA+ (або FIA-MS) - мас-спектрометрія з аналізом швидкою іонізацією LCMS - рідинна хроматографія з масспектроскопічним детектуванням ЯМР - ядерно-магнітний резонанс MW - молекулярна маса MeOH - метанол EtOAc або AcOEt - етилацетат PS-DIEA -діізопропілетиламін на полімерній основі DEA - діетиламін RT - час затримання cbz - карбобензилокси[група] год - година або години хв - хвилина або хвилини ее - енантіомерний надлишок de - діастереомерний надлишок екв. - еквівалент ACN - ацетонітрил DMF - диметилформамід DMEA - Ν,Ν-диметилетаноламін NH3aq - 25% (мас.) водний розчин аміаку Тmass=температура реакційної суміші Подані результати аналізу методом LCMS одержано за однією з двох таких методик: (і) тривалість циклу 6хв., аналіз на колонці (С18 50´3мм, зерно сорбенту 5мкм), елюювання градієнтом [90% H2O (+0,04% мурашиної кислоти) до 90% ACN (+0,04% мурашиної кислоти)] протягом 4хв. із подальшим елююванням постійним кінцевим складом елюенту протягом 2хв.; або (іі) тривалість циклу 12хв., аналіз на колонці (С18 100´3мм, зерно сорбенту 5мкм), елюювання градієнтом [90% Н2О (+0,04% мурашиної кислоти) до 90% ACN (+0,04% мурашиної кислоти)] протягом 9хв. із подальшим елююванням постійним кінцевим складом елюенту протягом 3хв. Загальні методики синтезів для одержання сполук за Прикладами 1-32 та Прикладами 35-38 Загальна методика 1: Одержання Nбензилморфоліналкілкетонів До розчину карбоксаміду 2 у безводному THF додавали при 0°C розчин необхідного реактиву Гріньяра (1,2-3екв. однією або двома аліквотами). Реакційній суміші давали нагрітися до кімнатної температури, і залишали при перемішуванні на час від 45хв. до 2год., після чого гасили або 1M хлористоводневою кислотою, або насиченим розчином хлориду амонію та екстрагували або DCM, або етилацетатом. Об'єднані органічні шари су 38 шили над сульфатом магнію, фільтрували, концентрували у вакуумі, і одержували відповідні алкілкетони 3-10, 77 та 82. Загальна методика 2: Одержання Nбензилових похідних третинних спиртів До розчину кетонів 3-10, 77 та 82 у безводному THF при 0°C додавали розчин необхідного бензилового реактиву Гріньяра (1,1-1,5екв.). Реакційній суміші давали нагрітися до кімнатної температури, і залишали при перемішуванні на 1-2год., після чого гасили доданням холодної води. Після екстрагування водних шарів DCM, об'єднані органічні шари промивали розсолом, сушили над сульфатом магнію, фільтрували, концентрували у вакуумі, і одержували вказані в заголовку N-бензилові похідні третинних спиртів. Очи щення докладно описано для окремих сполук. Загальна методика 3: Дебензилування Nбензилових похідних третинних спиртів До розчину необхідного N-бензилового похідного третинного спирту у безводному DCM додавали при кімнатній температурі у атмосфері азоту основу Х'юніга на твердому носії (Argonaut, 3,56ммоль/г, 2-4екв.) та α-хлоретилхлорформіат (3-10екв.). Реакційну суміш нагрівали до 40°C, реакцію контролювали за допомогою FIA+ та LCMS аналізу. Після завершення реакційну суміш фільтрували, і одержану смолу промивали DCM. Об'єднані органічні фази концентрували у вакуумі. Додавали метанол, одержаний розчин нагрівали при 60°C протягом 1,5-8год. Після повного вичерпання вихідного матеріалу метанольний розчин випарювали, і одержували продукт, який додатково очищали, як докладно описано для окремих сполук. Загальна методика 4: Перетворення амінів у гідрохлориди До розчину необхідного аміну у безводному діетиловому ефірі (5-10мл) додавали хлористоводневу кислоту (1,2екв., 1M розчин у діетиловому ефірі). Ефір видаляли шля хом продування струменем азоту або у вакуумі, а проби або сушили під високим вакуумом протягом декількох годин, або піддавали сублімаційному сушінню (ацетонітрил/вода 1/1 [у об'ємному відношенні]), і одержували гідрохлориди з майже кількісним виходом. Загальна методика 5: Одержання реактивів Гріньяра та бензилових реактивів Гріньяра Такі реактиви одержували з потрібного галогеніду або бензилгалогеніду, використовуючи методики, відомі пересічному фа хівцеві у цій галузі [дивись, наприклад, монографії Фізер - Fieser L.F. and Fieser M.F. "Reagents for Organic Synthesis", John Wiley and Sons, Inc., том 1, cтop.415-424, або Марч - March J. "Ad vanced Organic Chemistry", John Wiley and Sons Inc., 3rd Ed., cтop.558-561]. Необхідні галогеніди або бензилгалогеніди або є наявними на ринку, або їх одержували, використовуючи методики, описані в опублікованій раніше літературі. Одержання проміжних сполук для синтезів за Прикладами 1-32 4-бензил-морфолін-2карбонітрил 39 85198 40 ком (150мбар (15кПа)), підтримуючи Tmass£60°C, до видалення 351,8кг толуолу. Гідрохлорид 4-бензил-морфолін-2-карбонової кислоти (91) У реактор місткістю 1л із механічною мішалкою, охолоджений на льодяній бані, завантажували N-бензилетаноламін (172,2г; 1екв., продукт фірми Aldrich Chemical Company). Додавали краплями протягом 2хв. 2-хлоракрилонітрил (100г; 1екв., продукт фірми Aldrich Chemical Company). Температуру підтримували у межах від 23°С до 29°С за допомогою льодяної бані, а потім водяної бані з температурою 15°C. Після перемішування протягом ночі при кімнатній температурі (водяна баня) суміш розчиняли у тетрагідрофурані та переливали у реактор місткістю 2л, охолоджений до -5°С за допомогою бані із суміші льоду з NaCl. Загальний об'єм тетрагідрофурану становив 1,35л. Додавали частинами протягом 1год. трет-бутилат калію (148г; 1,1екв.), підтримуючи температуру реакційної суміші 0±2°С. Після подальшого перемішування протягом 1год. при 0°C, суміш гасили насиченим розчином NaHCO3 (500мл). Водний шар екстрагували діетиловим ефіром (500мл). Органічні шари сушили над MgSO4 та випарювали досуха. Вказану в заголовку сполук у (149,8г; 65%) одержували після пропускання 250г сухого залишку через 1кг SiO2 при градієнтному елююювані в такому режимі: 5% AcOEt - 95% н-гептан 2,5л 10% AcOEt - 90% н-гептан 2л 15% AcOEt - 85% н-гептан 2л 20% AcOEt - 80% н-гептан 5л В альтернативному варіанті цю проміжну сполуку можна одержати таким чином: У футерований склом реактор місткістю 1600л у атмосфері N2 послідовно завантажували 2хлоракрилонітрил (33,2кг, 379моль) та толуол (114л) при 21°С. Потім додавали Nбензилетаноламін (57кг, 377моль), і реакційну суміш перемішували при кімнатній температурі протягом приблизно 17год. Потім суміш розводили толуолом (336л), охолоджували до приблизно 12°С та додавали частинами (10) трет-бутилат калію (42,3кг, 377моль), підтримуючи температуру суміші в межах від приблизно -13°С до приблизно 2°С. Суміш перемішували приблизно при 0°C протягом 2,5год., потім гасили доданням води (142,5л), підтримуючи температур у суміші в межах від приблизно 2°C до приблизно 8°С. Після закінчення гасіння перемішували суміш протягом 35хв., даючи температурі досягти 15°С, потім толуольний шар промивали водою (142,5л), і водний шар відділяли. Органічний шар потім концентрували під зниженим тиском (150мбар (15кПа), підтримуючи Tmass£60°C, до видалення 162кг толуолу. Одержані фільтрати потім розводили толуолом (114л) та обробляли SiO2 (Merck silica gel 60, 0,0630,1мм, 74,1кг) при перемішуванні при кімнатній температурі протягом 1,25год. SiO2 відфільтровували та промивали толуолом (2´114л). Потім одержані фільтрати концентрували під зниженим тис У реактор місткістю 500мл у а тмосфері N2 послідовно завантажували при кімнатній температурі толуол (36,72мл) та 2-хлоракрилонітрил (10,7г, 122,23ммоль). Потім додавали Nбензилетаноламін (18,36г, 121,14ммоль) протягом 5хв., і реакційну суміш перемішували при кімнатній температурі протягом 16год. Після цього суміш розводили толуолом (110,16мл), охолоджували до -5°С, і повільно додавали розчин 2М трет-бутилату калію у THF (121,14ммоль) протягом 30хв., підтримуючи температуру від -5°С до 0°C. Суміш перемішували при температурі від приблизно -5°C до 0°С протягом 1год., потім гасили доданням води (45,9мл). Водний шар відділяли, толуольний шар промивали водою (45,9мл), після чого суміш залишали для нагрівання до кімнатної температури. Органічний шар потім концентрували під зниженим тиском при 40°C. Після цього суміш розводили толуолом (100мл) та екстрагували 6-н. водним розчином HCl (162мл). Цей водний шар нагрівали зі зворотним холодильником протягом 1год. 30хв., після чого суміш залишали при перемішуванні при кімнатній температурі протягом ночі. Після кристалізації сполуки 91, одержану тверду речовину відфільтровували, промивали 6-н. водним розчином HCl (40мл) та сушили під зниженим тиском при 40°C (19г, вихід=61%). Гідрохлорид N-бензил-2-(морфолін-4карбонм)-морфоліну (92) У реактор місткістю 250мл у а тмосфері N2 послідовно завантажували сполуку 91 (5г, 19,41ммоль), дихлоретан (50мл), DMF (0,014мл, 1% (мол.)) та оксалілхлорид (1,86мл, 21,35ммоль). Суміш нагрівали до 60-65°С протягом 2год., після чого охолоджували до 0°С. Потім додавали морфолін (6,93г, 79,60ммоль) у дихлоретані (20мл) протягом 15хв., підтримуючи температуру нижче 10°С. Одержаний гетерогенний розчин перемішували протягом 1год. 30хв. при кімнатній температурі та гасили водою (30мл). Цю двофазну суміш фільтрували через Hyflo Super Cel® (10г), потім, після розділення, органічний шар концентрували під зниженим тиском. До суміші додавали ізопропанол (80мл) та 12-н. водний розчин HCl (1,61мл, 19,41ммоль), перемішували протягом 10хв. та концентрували під зниженим тиском. До суміші додавали ізопропанол (13мл), нагрівали зі зворотним холодильником до утворення гомогенниого 41 85198 розчину, після чого його охолоджували до кімнатної температури. Одержаний осад відфільтровували, промивали ізопропанолом (10мл), сушили у вакуумі при 40°C протягом ночі, і одержували сполуку 92 у вигляді злегка забарвленого порошку (загальний вихід 79%). Етиловий складний ефір 4-бензил-морфолін2-карбонової кислоти (1) Розчин 4-бензил-морфолін-2-карбонітрилу (113,0г, 0,56моль) у етанолі (1030мл) обробляли концентрованою сірчаною кислотою (165мл), яку додавали частинами при перемішуванні, (екзотермічна реакція, температура суміші підвищувалась від кімнатної до 65°C). Потім суміш нагрівали зі зворотним холодильником протягом 66год. Розчин охолоджували, після чого концентрували у вакуумі до половини об'єму, підлуговували водним розчином карбонату калію (остерігатися спінювання), і одержаний продукт екстрагували діетиловим ефіром. Органічну фаз у сушили над сульфатом магнію, фільтрували та випарювали досуха у вакуумі до одержання масла. Цей матеріал витримували додатково у високому вакуумі. Вихід=121,3г (87%). В альтернативному варіанті, сполука 1 може бути синтезована таким чином: У реактор місткістю 100л, приєднаний до газоуловлювача, заповненого 1-н. NaOH (60л), завантажували у атмосфері азоту 4-бензил-морфолін-2карбонітрил (1867г, 9,23моль) та етанол (20л). При Tmass=15-20°C додавали до одержаного розчину концентровану сірчану кислоту (2,76л, 50моль) протягом 20хв. (сильно екзотермічна реакція). Розчин нагрівали зі зворотним холодильником протягом 2,5 діб. Після цього 10л розчинника випарювали у вакуумі, і реакційну суміш охолоджували до Tmass=20-25°C. Додавали воду (40л) протягом 25хв., потім розчин Na2СО3 (напівнасичений, 18л) та NaHCO3 (напівнасичений, 7л) до досягнення рН~7. Додавали етилацетат (15л), і одержані фази перемішували протягом 15хв. Органічну фазу відділяли, а водну фазу екстрагували етилацетатом (2´10л). Об'єднані органічні шари випарювали досуха у вакуумі, і одержували сполуку 1 у вигляді жовто-брунатного масла (1992г, 87%). Етиловий складний ефір 4-бензил-морфолін2-карбонової кислоти (1b) Сполуку 1 можна розділити на її енантіомери способом HPLC на хіральному сорбенті за такою методикою: колонка Daicel Chiralpak OJ 20мкм; 25см; 100% EtOH+0,3% DMEA; 0,4мл/хв.; детектування на довжині хвилі 260нм. Потрібний енантіомер 1b є піком з RT=20,25хв. Метокси-метил-амід карбонової кислоти (2) 42 4-бензил-морфолін-2 До суспензії N,N-диметилгідроксиламіну (6,6г, 67,6ммоль) у безводному DCM (200мл) у атмосфері азоту додавали краплями при 0°C при перемішуванні розчин триметилалюмінію (2M розчин у гексані, 34мл, 67,6ммоль) протягом 30хв. Реакційній суміші давали нагрітися до кімнатної температури та перемішували протягом 1год. Потім додавали краплями розчин складного ефіру 1 (6,74г, 27ммоль) у безводному DCM (100мл) протягом 30хв., і реакційну суміш перемішували протягом ночі, після чого гасили обережним додаванням розчину фосфатного буфера (динатрійфосфат, рН8). Одержаний осад видаляли фільтруванням через шар целіту, і залишок промивали хлороформом. Потім органічну фазу концентрували у вакуумі та промивали водою. Водний шар вдруге екстрагували хлорформом, органічні фази об'єднували, промивали розсолом, сушили над сульфатом магнію, розчинник випарювали у вакуумі, і одержували сполуку 2 у вигляді жовтого масла. В альтернативному варіанті, реакцію можна виконувати таким чином: перед додаванням розчину складного ефіру 1 (1екв.) реакційну суміш перемішували протягом 1год., після чого гасили доданням розчину фосфатного буфера (динатрійфосфат, рН8), після чого додавали воду. Водний шар вдруге екстрагували DCM, і органічні фази об'єднували і сушили над сульфатом магнію, DCM випарювали у вакуумі, і одержували сполуку 2 у ви гляді жовтого масла (3,36г, 47%). Молекулярна маса 264,33; C14H20N2O 3; 1H Я МР (CDCl3): 7,47-7,22 (5Н, m), 4,55 (1H, d, 1,5Гц), 4,00 (1H, dd, 11,5Гц, 1,7Гц), 3,75 (1H, dt, 11,5Гц, 2,2Гц), 3,65 (3Н, s), 3,56 (2Н, m), 3,17 (3Н, s), 2,93 (1H, d, 11,3Гц), 2,68 (1H, d, 11,3Гц), 2,30 (2Н, 11,3Гц); LCMS: (6хвилинна методика) m/z 265 [М+Н]+, RT=0,65хв. Метокси-метил-амід 4-бензил-морфолін-2карбонової кислоти (2b) Сполуку 2 можна розділити на її енантіомери методом HPLC на хіральному сорбенті за такою методикою: колонка Daicel Chiralpak OJ 20мкм; 25см; н-гептан/ізопропанол 80:20 у об'ємному відношенні; 0,4мл/хв; детектування на довжині хвилі 220нм. Потрібний енантіомер 2b є піком з RT=8,25хв. В альтернативному варіанті сполука 2b може бути синтезована, як описано вище для сполуки 2, з використанням сполуки 1b замість сполуки 1. 43 85198 44 2-феніл-5-фторбензилбромід Вказану в заголовку сполуку одержували у 5 стадій з наявної на ринку (Aldrich) 5фторсаліцилової кислоти за описаними в літературі методиками (JACS, 2000, 122, 4020-4028). Молекулярна маса 265,13; C13H10BrF; 1H ЯМР (CDCl3): 7,48-7,38 (5Н, m), 7,26-7,19 (1H, m), 7,05 (1H, td, 8,3Гц, 2,8Гц), 4,39 (2Н, s); 19F ЯМР (CDCl3): -114,72. (5-фтор-2-метокси-фенм)-метанол До розчину 2-метокси-5-фторбензальдегіду (11,093г, 1екв., продукт фірми Aldrich Chemical Company) у метанолі при -10°C у атмосфері азоту додавали частинами NaBH 4 (7,515г, 2,7екв.). Розчину давали нагрітися до кімнатної температури, і через 30хв. реакційний розчинник видаляли під зниженим тиском та заміняли дихлорметаном. Цей розчин виливали у крижану воду та додатково екстрагували дихлорметаном. Органічні фракції збирали та сушили (MgSO 4), розчинник видаляли під зниженим тиском, і одержували вказану в заголовку сполуку у вигляді масла (9,794г, 87%). Молекулярна маса 156,16; C8H9FO2; 1H ЯМР (CDCl3): 2,58 (m, 1H), 3,81 (s, 3H), 4,63 (d, 2Н, 6,3Гц), 6,78 (dd, 1H, 8,9Гц та 4,3Гц), 6,94 (td, 1H, 8,5Гц та 3,1Гц), 7,04 (dd, 1H, 8,7Гц та 3,1Гц). 5-фтор-2-метоксибензилхлорид Нерозбавлений (5-фтор-2-метокси-феніл)метанол (19,587г, 1екв.) додавали до нерозбавленого SOCl2 (42,2мл, 4,6екв.) при -78°C у атмосфері азоту, після чого розчину давали нагрітися до кімнатної температури і перемішували до припинення виділення газу. Додавали у колбу еквівалентний об'єм безводного толуолу, і одержаний розчин нагрівали до 60°C. Для охолодження реакційний розчин виливали у крижану воду. Толуольний шар відділяли та сушили (MgSO 4), а розчинник видаляли під зниженим тиском. Неочищений матеріал сублімували (60-80°С/0,05мбар (5Па)), і одержували вказану в заголовку сполуку у вигляді білої твердої речовини (13,40г, 61%). Молекулярна маса 174,60; C8H8ClFO; 1H ЯМР (CDCl3): 3,87 (s, 3H), 4,60 (s, 2Н), 6,79-7,20 (m, 3H). 2-метокси-5-фторбензилмагнійбромід Магнієву стружку (21,6г, 0,888моль, 2екв.) та діетиловий ефір (300мл) завантажували у реактор у атмосфері N2. Розчин 5-фтор-2метоксибензилхлориду (116г, 0,664моль, 1,5екв.) у діетиловому ефірі (200мл) завантажували у завантажувальну лійку. Додавали кристали йоду та невелику кількість розчину 5-фтор-2метоксибензилхлориду, і реакційну суміш перемішували для ініціювання реакції. Потім додавали краплями залишок розчину 5-фтор-2метоксибензилхлориду, підтримуючи температуру реакційної суміші нижче за 28°С. Суміш перемішували протягом додаткових 5хв. при 19°C, і після завершення додавання утворювалася біла суспензія. 1-[4-(фенілметил)морфолін-2-м]етан-1-он (3) Сполуку 3 одержували за Загальною методикою 1 зі сполуки 2 (0,730г, 2,8ммоль) та наявного на ринку (Aldrich) метилмагнійброміду (1M розчин у THF, 3мл, 3ммоль, 1,1екв.) у безводному THF (25мл), після чого очищали автоматизованою хроматографією на колонці (елюент EtOAc/н-гептан 14/86-100/0 [у об'ємному відношенні]) (0,3г, 49%). Молекулярна маса 235,33; C14H2INO2 . LCMS (6хвилинна методика) m/z 220,1 [М+Н]+, RT=1,55хв. 1-[4-(фенілметил)морфолін-2-и]пропан-1-он (4) Сполуку 4 одержували за Загальною методикою 1 зі сполуки 2 (0,70г, 2,65ммоль) та наявного на ринку (Aldrich) етилмагнійброміду (2,65мл, 7,94ммоль, 3екв.) у безводному THF (25мл) у вигляді жовтого масла (583мг, 89%). Молекулярна маса 249,36; C15H23NO2. LCMS (6-хвилинна методика) m/z 234,4 [М+Н]+, RT=1,78хв. 2-метил-1-[4-(фенілметил)морфолт-2іл]пропан-1-он (5) Сполуку 5 одержували за Загальною методикою 1 зі сполуки 2 (3,018г, 11,4ммоль) та наявного на ринку (Aldrich) ізопропілмагнійхлориду (2M розчин у THF, 17,1мл, 34,3ммоль, 3екв.) у THF (100мл), у вигляді жовтого масла (2,68г, 89%). Мо 45 85198 лекулярна маса 263,38; C16H25NO2; LCMS (6хвилинна методика): m/z 248,2 [М+Н]+, RT=2,41хв. 3-метил-1-[4-(фенілметил)морфолін-2іл]бутан-1-он (6) Сполуку 6 одержували за Загальною методикою 1 зі сполуки 2 (10г, 37ммоль) у безводному тетрагідрофурані (50мл) та наявного на ринку (Aldrich) ізобутилмагнійброміду (2М розчин у діетиловому ефірі, 56ммоль, 28мл, 1,5екв.). Після перемішування протягом 1год. реакцію гасили доданням водного розчину хлористоводневої кислоти (150мл). THF видаляли у вакуумі, і після коригування рН за допомогою насиченого розчину бікарбонату натрію додавали діетиловий ефір. Органічні фази об'єднували, сушили над сульфатом магнію, а розчинник видаляли у вакуумі. Сполуку 6 виділяли з чистотою 80% (8,7г, ви хід 67% по чистому продукту). Молекулярна маса 261,37; C16H23NO 2; LCMS: (6-хвилинна методика) m/z 262,2 [М+Н]+, RT=2,753хв. Циклопентил[4-(фенілметил)морфолін-2іл]метанон (7) Сполуку 7 одержували за Загальною методикою 1 зі сполуки 2 (3,36г, 12,7ммоль) у безводному тетрагідрофурані (120мл) та наявного на ринку (Aldrich) циклопентилмагнійброміду (2M розчин у діетиловому ефірі, 19,1мл, 38,2ммоль, 3екв.) із кількісним виходом у вигляді жовтого масла. Молекулярна маса 273,38; C17H23NO2; LCMS (6хвилинна методика) m/z 274 [М+Н]+, RT=2,24хв. [4-(фенілметил)морфолін-2-іл](тетрагідро-2Hпіран-4-іл)метанон (8) Сполуку 8 одержували за Загальною методикою 1 зі сполуки 2 (2,84г, 10,74ммоль) у безводному тетрагідрофурані (30мл) та 4-тетрагідропіранілмагнійхлориду (Chem. Вег. 98, 1965, 3757) (2M розчин у тетрагідрофурані, 6,5мл, 13ммоль, 1,2екв.). Через 30хв. додатково додавали 4тетрагідропіранілмагнійхлорид (2M розчин у діетиловому ефірі, 6,5мл, 13ммоль, 1екв.). Після перемішування протягом 2год. реакційну суміш гасили доданням розчину хлориду амонію (30мл) та етилацетату (30мл). Водний шар вдруге екстрагували етилацетатом (30мл), органічні фази об'єднували, сушили над сульфатом магнію, і розчинники видаляли у вакуумі. Одержаний залишок очищали іо 46 нообмінною хроматографією, і одержували сполуку 8 у ви гляді жовтого масла (2,98г, 96%). Молекулярна маса 289,38; C17H23NO3; LC MS (6хвилинна методика) m/z 290 [М+Н]+, RТ=2,20хв. В альтернативному варіанті сполуку 8 можна одержати таким чином: a) Нейтралізація сполуки 92 Сполуку 92 (97г) суспендували у толуолі (485мл) шляхом механічного перемішування, і додавали карбонат натрію (3,68-н., 97мл, 1,2екв.). Після цього суміш розводили водою (194мл) та перемішували протягом 45хв. при кімнатній температурі. Потім цю двофазну суміш фільтр ували через Hyflo Super Cel® та переливали у ділильну лійку. Водний шар відкидали, а органічний шар (594,3г) концентрували під зниженим тиском при 40°C до одержання маси 348г. Додавали толуол (150мл), і органічний шар концентрували за цих самих умов до одержання маси 347 г. Потім вільну основу сполуки 92 у вигляді розчину у толуолі розводили безводним THF (300г), і одержували розчин, готовий для додання до реактиву Гріньяра. b) Одержання реактиву Гріньяра У тригорлу колбу місткістю 3л в інертній атмосфері завантажували THF (50мл) та стружку магнію (9г, 0,370моль, 1,25екв.). Суміш нагрівали до Tmass=60°C, і додавали йод (0,150г) та 4хлортетрагідропіран (1мл). Початок реакції спостерігали через 5хв. Після цього суміш нагрівали до Tmass=63-68°C, і додавали решту 4хлортетрагідропірану (39,19мл, розведеного 188мл THF) протягом 1год., підтримуючи постійну температуру реакційної суміші приблизно 68°С. Після 40хв. перемішування реакційну суміш залишали для охолодження до кімнатної температури. c) Реакція Гріньяра Розчин нейтралізованої сполуки 92 у суміші толуол/THF додавали до реактиву Гріньяра при 20-25°C протягом 45хв. Суміш перемішували при кімнатній температурі протягом 1год. Потім реакційну суміш гасили шляхом додання при 0-5°С суміші оцтова кислота/Н 2О (44,3мл оцтової кислоти та 245мл H2O). Водний шар відділяли та відкидали, а органічний шар промивали Н 2О (60мл). Водний шар відділяли та відкидали, а органічний шар промивали 2-н. NaOH (100мл). Водний шар відділяли та відкидали, а органічний шар концентрували під зниженим тиском при 40°C до маси 230г. Залишок розчиняли в ізопропіловому спирті (1л) та концентрували, як описано вище, і одержували 230г сполуки 8 у формі вільної основи. [4-(фенілметил)морфолін-2-іл](тетрагідро-2Нпіран-4-іл)метанон (8b) У реактор місткістю 6л в інертній атмосфері завантажували THF (242,5мл), магній (54,47г, 2240ммоль) та 5% загальної кількості 4хлортетрагідропірану (12,28мл, 112ммоль). Потім додавали невелику кількість метилйодиду (0,5мл) та один кристал йоду. Реакційну суміш перемішу 47 85198 вали та нагрівали до 64-66°С. Після початку реакції повільно додавали протягом 135хв. решту 4хлортетрагідропірану (233,22мл, 2127ммоль), розчиненого у THF (890мл). Суміш нагрівали протягом додаткових 30хв., після чого охолоджували до 0°C. Після чого додавали протягом 180хв. вайнребамід 2b (370г, 1400ммоль), розчинений у THF (2777мл), при температурі 0-4°C, і перемішували суміш ще протягом 60хв. Потім до суміші додавали оцтову кислоту (48мл, 0,83ммоль), а потім суміш насиченого NH4Cl з H2O (55/45 у об'ємному співвідношенні, 2590мл), підтримуючи температуру нижче 9°С. Органічний шар промивали сумішшю насиченого NH4Cl з H2O (60/40 у об'ємному співвідношенні, 500мл), а після розділення до органічного розчину додавали толуол (1800мл) та воду (1800мл). Потім, після екстрагування, додавали воду (1100мл) до толуольної суміші, яку підлуговували 3,68 M водним розчином Na2CO3 (148мл). Органічний шар сушили над MgSO4, фільтрували та концентрували під зниженим тиском досуха, одержуючи сполуку 8b у формі вільної основи (400,8г, ви хід 98,6%). В альтернативному варіанті сполуку 8b можна одержати таким чином: До розчину сполуки 8 (3,15г, 10,8ммоль) у ізопропанолі (20мл) додавали R-(-)-мигдалеву кислоту (1,65г, 10,8ммоль). Після 2хв перемішування при кімнатній температурі одержували гомогенний розчин. Кристалізація починалася після 5хв. перемішування, причому утворювалася легко перемішувана суспензія. Цю суспензію перемішували протягом 21год. при кімнатній температурі. Одержану тверду речовину відфільтровували та промивали ізопропанолом (2мл). Білі кристали сушили у вакуумі при 40°C протягом 5год., і одержували 1,8г Rманделату сполуки 8b з виходом 37,5% та ее=99,2%. До суспензії R-манделату сполуки 8Ь (500мг, 1,13ммоль) у толуолі (5мл) додавали краплями при перемішуванні 0,5-н. розчин K2СО3 (2,4мл, 1,2ммоль). Одержували двофазний розчин. Вільна основа 8b повністю знаходилась у органічному шарі, який відділяли, концентрували у роторному випарнику та сушили у вакуумі при 40°C, одержуючи 8Ь у вигляді масла з виходом 98%. 5,5,5-трифтор-1-[4-(фенілметил)морфолін-2іл]бутан-1-он (9) Сполуку 9 одержували за Загальною методикою 1 зі сполуки 2 (1,38г, 5,23ммоль) та 3,3,3трифторпропілмагнійброміду (20,9мл, 10,50ммоль, 2екв.) у безводному THF (45мл). 3,3,3трифторпропілмагнійбромід одержували з наявного на ринку (Aldrich) 3,3,3-трифторпропілброміду за Загальною методикою 5. Після очищення іонообмінною хроматографією одержували сполуку 9 у вигляді масла (1,24г, 78,7%). Молекулярна маса 48 301,31; C15H18F3NO 2; LCMS (6-хвилинна методика): m/z 302,4 [M+H]+, RT=2,66хв. 5,5,5-трифтор-1-[4-(фенілметил)морфоліп-2іл]пентан-1-он (10) Сполуку 10 одержували з розчину сполуки 2 (0,717г, 2,71ммоль) у безводному тетрагідрофурані (20мл) та 4,4,4-трифторбутилмагнійброміду (0,5M розчин у діетиловому ефірі, 6,5мл, 3,25ммоль, 1,2екв.). 4,4,4трифторбутилмагнійбромід одержували з наявного на ринку (Aldrich) 4,4,4-трифторбутилброміду за Загальною методикою 5. Через 30хв. додавали ще 0,3екв. 4,4,4-трифторбутилмагнійброміду (0,5 M розчин у діетиловому ефірі, 2,5мл). Після перемішування протягом 2год. розчинники видаляли у вакуумі, і додавали до залишку воду (20мл) та етилацетат (30мл). Органічну фазу промивали розсолом, сушили над сульфатом магнію, розчинник видаляли у вакуумі, і одержували сполуку 10 у вигляді прозорого масла (0,985г). Сполуку 10 використовували на наступній стадії без додаткового очищення. Молекулярна маса 315,34; C16H20NO 2F3 ; LCMS: (6-хвилинна методика) m/z 316 [М+Н]+, RT=2,9хв. 4-бензилморфолін-3-он Розчин N-бензил-N-(2гідроксіетил)хлорацетаміду (627,7г, 2,76моль) у трет-бутанолі (0,9л) перемішували у атмосфері азоту при нагріванні до 25-30° C. Додавали протягом 2год. трет-бутилат калію (2,897л 1M розчину у трет-бутанолі, 2,90моль, 1,05екв.). Після цього реакційну суміш перемішували при кімнатній температурі протягом 90хв. Додавали льодяну воду (6л), і одержаний мутний розчин екстрагували етилацетатом. Об'єднані органічні шари промивали розсолом, сушили над сульфатом магнію та випарювали у вакуумі, і одержували світлокоричневе масло (441г, 84%), яке використовували на наступній стадії без додаткового очищення. Молекулярна маса 191,23; C11H13NO2; 1H ЯМР (CDCl3): 7,29-7,40 (5Н, m), 4,67 (2Н, s), 4,28 (2Н, s), 3,87 (2Н, t, 5Гц), 3,31 (2Н, t, 5Гц); LCMS: (12хвилинна методика) m/z 192 [М+Н]+ RT=1,00хв. 4-бензил-2-(циклопропи-гідроксиметил)морфолін-3-он (75) До розчину 4-бензил-морфолін-З-ону (9,5г, 50ммоль) у THF (200мл) додавали краплями про 49 85198 тягом 20хв. при -78°С діізопропіламід літію (2M розчин у THF, 27мл, 54ммоль, 1,1екв.), а потім повільно додавали циклопропілметилальдегід (3,85мл, 55ммоль, 1,1екв.). Після перемішування при -78°C протягом 1год. реакційній суміші давали нагрітися до кімнатної температури та перемішували ще протягом 6год. Реакцію гасили доданням EtOAc та розсолу. Водний шар екстрагували EtOAc, об'єднані органічні шари сушили над сульфатом магнію та випарювали у вакуумі. Після очищення автоматичною хроматографією на колонці (DCM/MeOH, 100/0-85/15 [у об'ємному співвідношенні]) одержували сполуку 75 (чистота 70%), основною домішкою був 4-бензил-морфолінЗ-он. Цей продукт безпосередньо використовували на наступній стадії. Молекулярна маса 261,32; C15H19NO 3; LC MS (6-хвилинна методика) m/z 261,32 [М+Н]+, RT=2,23. (4-бензил-морфолін-2-іл)-циклопропілметанол (76) До розчину сполуки 75 (1,9г, 7,3ммоль) у THF (100мл) повільно додавали комплекс боран-THF (1M розчин у THF, 30мл, 30ммоль, 4,1екв.). Реакційну суміш нагрівали при 60°C. Через 24год. додавали MeOH та хлористоводневу кислоту (2 M, надлишок), і одержану суміш нагрівали протягом 1год. при тій самій температурі. Обережно додавали насичений розчин NaHCO3 та EtOAc, після чого водний шар екстрагували EtOAc. Об'єднані органічні шари промивали розсолом, сушили над сульфатом магнію, і розчинник видаляли у вакуумі. Після очищення іонообмінною хроматографією одержували сполуку 76 (1,1г, 61%). Молекулярна маса 247,34; C15H21NO2; LCMS (6-хвилинна методика) m/z 248 [М+Н]+, RТ=2,48хв. Циклопропіл[4-(фенілметил)морфолін-2іл]метанон (77) До розчину оксалілхлориду (2,43мл, 4,85ммоль, 1,1екв.) у DCM (2,5мл) повільно додавали розчин диметилсульфоксиду (0,69мл, 9,7ммоль, 2,2екв.) у DCM (4,5мл), а потім розчин сполуки 76 (1,09г, 4,41ммоль) у DCM (0,7мл) у атмосфері азоту при -60°C. Після перемішування протягом 15хв. додавали триетиламін (3,14мл, 22,1ммоль, 5екв.) і перемішування продовжували протягом 15хв. Додавали воду, після чого одержані шари розділяли. Водний шар промивали DCM. Об'єднані органічні шари промивали розсолом, сушили над сульфатом магнію, і розчинник видаляли у вакуумі. Після очищення автоматичною хроматографією на колонці (EtOAc/н-гексан, 20/8050/50 [у об'ємному співвідношенні]) одержували сполуку 77 у вигляді жовтого масла (0,69г, 64%). 50 Молекулярна маса 245,32; C15H19NO2; LC MS (6хвилинна методика) m/z 246,3 [М+Н]+, RТ=1,095хв. 1-(4-бензил-морфолін-2-іл)-пентан-1-он (82) Сполуку 82 одержували за Загальною методикою 1 зі сполуки 2 (0,87г, 3,28ммоль) у безводному тетрагідрофурані (30мл) та наявного на ринку (Aldrich) н-бутилмагнійброміду (2М розчин у THF, 5ммоль, 2,5мл, 1,5екв.). Після перемішування протягом 1год. додатково додавали нбутилмагнійбромід (2M розчин у THF, 1,6ммоль, 0,8мл) і продовжували перемішування протягом 30хв. Реакцію гасили доданням розчину хлориду амонію (30мл), а потім EtOAc. Органічні фази об'єднували, сушили над сульфатом магнію, розчинник видаляли у вакуумі, і одержували сполуку 82 (0,82г, 96%). Молекулярна маса 261,37; С16H23NO2; LCMS (6-хвилинна методика): m/z 262,4 [М+Н]+, RТ=2,34хв. Приклад 1: Одержання гідрохлориду 1-[1,1’біфеніл]-2-іл-2-морфолін-2-ілпропан-2-олу (12) 1-1,1’-біфеніл]-2-іл-2-[4(фенілметил)морфолін-2-ілпропан-2-ол (11) Сполуку 11 одержували за Загальною методикою 2 з 2-феніл-бензилмагнійброміду (0,25M розчин у діетиловому ефірі, 5,5мл, 1,38ммоль) та сполуки 3 (275мг, 1,25ммоль) у безводному THF (7мл). 2-феніл-бензилмагнійбромід одержували з наявного на ринку (Aldrich) 2-феніл-бензилброміду за Загальною методикою 5. Додавали додаткові еквіваленти 2-фенілбензилмагнійброміду (10мл, 2,5ммоль), після чого гасили реакцію льодяною водою (7мл). Сполуку 11 одержували у вигляді масла 75% чистоти після іонообмінної (колонка 5г) хроматографії та автоматизованої хроматографії на колонці (EtOAc/н-гептан 0/100-50/50 [у об'ємному відношенні]) та використовували на наступній стадії без додаткового очищення (0,23г виділеного матеріалу). Молекулярна маса 387,53; C26H29NO2; LCMS (6-хвилинна методика): m/z 388,2 [М+Н]+, RT=3,37хв. Гідрохлорид 1-[1,1'-біфеніл]-2-іл-2-морфолін-2ілпропан-2-олу (12) Сполуку 12 одержували за Загальною методикою 3 зі сполуки 11 (204мг, 0,53ммоль), αхлоретилхлорформіату (0,23мл, 2,11ммоль) та 51 85198 основи Х'юніга на полімерному носії (296мг, 1,05ммоль) у DCM (5мл). Після очищення іонообмінною хроматографією, а потім препаративною LCMS та перетворення в гідрохлорид за Загальною методикою 4, одержували сполуку 12 у вигляді піни (102мг, 65%). Молекулярна маса 297,36; C19H23NO 2·HCl; 1H ЯМР (CD3OD) δ 7,15-7,39 (8H, m), 7,07-7,11 (1H, m), 3,97 (1H, dd, 3,0Гц, 13,0Гц), 3,56-3,65 (1H, m), 3,20-3,25 (1H, m), 3,08 (2Н, t, 12,5Гц), 2,82-2,99 (4Н, m), 0,60 (3Н, s); LCMS (12хвилинна методика): m/z 298,2 [М-НСІ+Н]+, RT=4,38хв. Приклад 2; Одержання гідрохлориду 1-[5фтор-2-(метилокси)феніл]-2-морфолін-2-ілбутан-2олу (14) 1-[5-фтор-2-(метилокси)феніл]-2-[4(фенілметил)морфолін-2-іл]бутан-2-ол (13) Сполуку 13 одержували за Загальною методикою 2 зі сполуки 4 (583мг, 2,5ммоль) та 2-метокси5-фторбензилмагнійброміду (5,5мл, 2,75ммоль, 1,1екв.) у безводному THF (15мл). Через 30хв. додавали додаткові еквіваленти 2-метокси-5фторбензилмагнійброміду (2M розчин у діетиловому ефірі, 10мл, 5,0ммоль), суміш нагрівали до кімнатної температури та перемішували протягом ночі. Після очищення іонообмінною хроматографією одержували сполуку 13 у вигляді жовтого масла 67% чистоти (702мг). Цю сполуку використовували протягом наступної стадії без додаткового очищення. Молекулярна маса 373,47; C22H28 FNO3; LCMS (6-хвилинна методика) m/z 374,2 [М+Н]+, RT=3,17хв. Гідрохлорид 1-[5-фтор-2-(метилокси)феніл]-2морфолін-2-ілбутан-2-олу (14) Сполуку 14 одержували за Загальною методикою 3 зі сполуки 13 (717мг, 1,92ммоль), αхлоретилхлорформіату (0,83мл, 3,84ммоль, 4екв.) та основи Х'юніга на полімерному носії (1,08г, 3,84ммоль, 2екв.) у DC M (17мл). Після очищення іонообмінною хроматографією, а потім препаративною LCMS та перетворення в гідрохлорид за Загальною методикою 4 одержували сполуку 14 у вигляді твердої речовини (185мг, 30%). Молекулярна маса 319,81; C15H22FNO3HCl; 1H Я МР (CD3OD) δ 6,94 (1H, dt, 1,5Гц, 9Гц), 6,81-6,84 (2Н, m), 4,07 (1H, dd, 3,5, 13Гц), 3,67-3,76 (4Н, m), 3,56 (1H, dd, 2,5Гц, 11Гц), 3,33 (1H, m), 3,14-3,25 (1H, m), 3,003,08 (2Н, m), 2,84 (2Н, , 14Гц), 1,37-1,51 (1H, m), 1,05-1,19 (1H, m), 0,82 (3Н, t, 7,5Гц); LC MS (12 52 хвилинна методика): m/z 284,1 [М-НСІ+Н]+, RT=3,76хв. Приклад 3: Одержання гідрохлориду 2морфолін-2-іл-1-{2[(трифторметил)окси]феніл}бутан-2-олу (16) 2-[4-(фенілметил)морфолін-2-іл]-1-{2[трифторметил)окси]феніл}бутан-2-ол (15) Сполуку 15 одержували за Загальною методикою 2 зі сполуки 4 (1,1г, 4,71ммоль) та наявного на ринку (Fluorochem) 2-трифторметоксибензилмагнійброміду (10,4мл, 5,19ммоль, 1,1екв.) у безводному THF (31мл). Через 30хв. додавали додаткові еквіваленти 2-трифторметоксибензилмагнійброміду (0,5М розчин у діетиловому ефірі, 4,71мл, 2,36ммоль). Після очищення іонообмінною хроматографією одержували сполуку 15 у вигляді масла (1,88г, 98%). Молекулярна маса 409,45; C22H26F3NO 3; LCMS (6-хвилинна методика): m/z 410,4 [М+Н]+, RT=3,28хв. Гідрохлорид 2-морфолін-2-іл-1-{2[(трифторметил)окси]феніл}бутан-2-олу (16) Сполуку 16 одержували за Загальною методикою 3 зі сполуки 15 (1,88г, 4,59ммоль), α-хлоретилхлорформіату (1,98мл, 18,4ммоль) та основи Х'юніга на полімерному носії (2,58г, 9,18ммоль) у DCM (40мл). Після очищення іонообмінною хроматографією, а потім автоматизованою хроматографією на колонці (елюент, MeOH/DCM від 0/100 до 20/80 [у об'ємному співвідношенні]) та перетворення на гідрохлорид за Загальною методикою 4 одержували сполуку 16 (258,5мг, 17%) у вигляді білої твердої речовини. Молекулярна маса 319,33; C15H20F 3NO3HCI; 1H ЯМР (CD3OD) - δ 7,53 (1H, dd, 2Гц, 7,5Гц), 7,27-7,38 (3Н, m), 4,20 (1H, dd, 3,5Гц, 13Гц), 3,85 (1H, td, 3Гц, 13Гц), 3,70 (1H, dd, 2Гц, 11Гц), 3,44 (1H, d, 13Гц), 3,27-3,34 (1H, m), 3,123,22 (2Н, m), 3,07 (1H, d, 14Гц), 2,96 (1H, d, 14Гц), 1,55 (1H, секстет, 7,5Гц), 1,26 (1H, секстет, 7,5Гц), 0,93 (3Н, t, 7,5Гц). LCMS (12-хвилинна методика): m/z 320,4 [М-НСІ+Н]+, RT=2,77хв. Приклад 4: Одержання гідрохлориду 1-[1,1’біфеніл]-2-іл-2-морфолін-2-ілбутан-2-олу (18) 1-[1,1’-біфеніл]-2-іл-2-[4(фенілметил)морфолін-2-ілбутан-2-ол (17) 53 85198 Сполуку 17 одержували за Загальною методикою 2 зі сполуки 3 (601мг, 2,58ммоль) та 2фенілбензилмагнійброміду (0,25M розчин у діетиловому ефірі, 11,5мл, 2,84ммоль) у безводному THF (15мл). 2-фенілбензил-магнійбромід одержували з наявного на ринку (Aldrich) 2фенілбензилброміду за Загальною методикою 5. Додатково додавали еквіваленти 2фенілбензилмагнійброміду (10,32мл, 2,58ммоль). Після очищення іонообмінною хроматографією, а потім автоматизованою хроматографією на колонці (елюент EtOAc/н-гептан 0/100-50/50 [у об'ємному співвідношенні) одержували сполуку 17 (705мг, 68%) у вигляді безбарвного масла 91% чистоти, яке безпосередньо використовували на наступній стадії. Молекулярна маса 401,55; C27H31NO2; LCMS (6-хвилинна методика): m/z 402,2 [М+Н]+, RT=3,56хв. Гідрохлорид 1-[1,1’-біфеніл]-2-іл-2-морфолін-2ілбутан-2-олу (18) Сполуку 18 одержували за Загальною методикою 3 зі сполуки 17 (705мг, 1,76ммоль), αхлоретилхлорформіату (0,76мл, 7,02ммоль) та основи Х'юніга на полімерному носії (988г, 3,52ммоль) у DCM (15мл). Після очищення іонообмінною хроматографією, а потім автоматизованою хроматографією на колонці (елюент MeOH/DCM 5/95-20/80 [у об'ємному співвідношенні]) та перетворення в гідрохлорид за Загальною методикою 4 одержували сполуку 18 (0,37г, 62%) у вигляді жовтої піни. Молекулярна маса 347,82; C20H25NO 2·HCІ; 1HH MP (CD3OD) δ 7,43-7,46 (1H, m), 7,29-7,34 (3Н, m), 7,14-7,25 (5Н, m), 7,06-7,11 (1H, m), 3,94 (1H, dd, 3,5Гц, 13Гц), 3,55-3,64 (1H, m), 3,37 (1H, dd, 1,5Гц, 11Гц), 3,09 (2Н, d, 12,5Гц), 2,80-2,99 (4Н, m), 1,11-1,23 (1H, m), 0,91 (1H, m), 0,38 (3Н, t, 7,5Гц). LCMS (12-хвилинна методика): m/z 312,1 [М-НСІ+Н]+, RT=4,67хв. Приклад 5: Одержання гідрохлориду 1-[5фтор-2-(метилокси)феніл]-3-метил-2-морфолін-2ілбутан-2-олу (20) 1-[5-фтор-2-(метилокси)феніл]-3-метил-2-[4(фенілметил)морфолін-2-іл]бутан-2-ол (19) 54 Сполуку 19 одержували за Загальною методикою 2 зі сполуки 5 (0,7г, 2,83ммоль) та 2-метокси5-фтор-бензилмагнійброміду (6,2мл, 3,11ммоль, 1,1екв.) у безводному THF (15мл). Додатково додавали еквіваленти 2-метокси-5-фторбензилмагнійброміду (8,49мл, 4,25ммоль), суміш нагрівали до кімнатної температури та перемішували протягом ночі. Після очищення автоматичною хроматографією на колонці (елюент нгептан/EtOAc 100/0-75/25 [у об'ємному співвідношенні]) одержували сполуку 19 (0,53г, 48%). Молекулярна маса 387,5; C23H30FNO3; LC MS (6хвилинна методика): m/z 388,2 [М+Н]+, RТ=3,21хв. Гідрохлорид 1-[5-фтор-2-(метилокси)феніл]-3метил-2-морфолін-2-мбутан-2-олу (20) Сполуку 20 одержували за Загальною методикою 4 зі сполуки 19 (523мг, 1,35ммоль), αхлоретилхлорформіату (0,58мл, 5,40ммоль, 4екв.) та PS-DIEA (0,76г, 2,70ммоль, 2екв.) у DCM (10мл). Після очищення іонообмінною хроматографією та перетворення в гідрохлорид за Загальною методикою 4 одержували сполуку 20 у вигляді злегка забарвленої твердої речовини (0,26г, 58%). Молекулярна маса 333,83; C16H24FNO3HCl; 1H ЯМР (CD3OD) δ 7,10 (1H, d, 9,5Гц), 6,94 (2Н, d, 6Гц), 4,07 (1H, dd, 3,5Гц, 13Гц), 3,71-3,88 (5Н, m), 3,21-3,47 (2Н, m), 2,99-3,11 (4Н, m), 1,8 (1H, септет, 7Гц), 1,04 (3Н, d, 7Гц), 0,94 (3Н, d, 7,0Гц); LCMS (12-хвилинна методика): m/z 298 [M-HCHH]+, RТ=4,29хв. Приклад 6: Одержання гідрохлориду 3-метил1-[2-метилокси)феніл]-2-морфолін-2-ілбутан-2-олу (22) 2-(4-бензилморфолін-2-іл)-1-(2-метоксифеніл)-3-метил-бутан-2-ол (21) Сполуку 21 одержували за Загальною методикою 1 зі сполуки 5 (1,5г, 6,06ммоль) та 2метоксибензилмагнійброміду (продукт фірми Rieke-Metals) (0,25М розчин у THF, 33,9мл, 8,49ммоль) у безводному THF (30мл). Після очищення хроматографією на колонці (елюент EtOAc/н-гептан 0/100-40/60 [у об'ємному співвідношенні]) одержували сполуку 21 у вигляді безбарвного масла (1,45г, 84%). Молекулярна маса 369,51; C23H31NO3·HCl; LCMS (6-хвилинна методика): m/z 370,2 [М-НСІ+Н]+, RТ=2,77хв. Гідрохлорид 3-метил-1-[2-метилокси)феніл]-2морфолін-2-ілбутан-2-олу (22) 55 85198 Сполуку 22 одержували за Загальною методикою 3 зі сполуки 21 (1,24г, 3,37ммоль), αхлоретилхлорформіату (3,63мл, 33,7ммоль) та основи Х'юніга на полімерному носії (4,72г, 16,8ммоль) у DCM (45мл) Після очищення іонообмінною хроматографією, а потім препаративною HPLC на хіральному сорбенті (градієнт н-гептан: EtOH:DEA 85:15:0,2, сорбент chiralcel-OD) одержували два енантіомери: енантіомер, що елююється першим (RТ=9,5хв.), та енантіомер, що елююється другим (RТ=11,41хв.). Ці два енантіомери перетворювали у відповідні гідрохлориди 22а (146мг) та 22b (138мг), які одержували у вигляді білих твердих речовин (загальний сукупний вихід 28%). Молекулярна маса 315,84; C16H25NO3HCl; 1H ЯМР (CD3OD) δ 7,22-7,34 (2Н, m), 6,85-6,95 (2Н, m), 4,08 (1H, dd, 3,6Гц, 12,8Гц), 3,86-3,9 (4Н, m), 3,77 (1H, td, 2,45Гц, 12,4Гц), 3,22-3,28 (1H, m), 3,24 (1H, d, 12,8Гц), 2,95-3,11 (4Н, m), 1,83 (1H, септет, 6,8Гц), 1,16 (3Н, d, 7,0Гц), 0,95 (3Н, d, 7,0Гц); LCMS (12хвилинна методика): m/z 280,2 [M-HCRH]+, RT=4,05хв. Приклад 7: Одержання гідрохлориду 1-[2етилокси)феніл]-3-метил-2-морфолін-2-ілбутан-2олу (24) 1-[2-етилокси)феніл]-3-метил-2-[4фенілметил)морфолін-2-мбутан-2-ол (23) Сполуку 23 одержували за Загальною методикою 2 зі сполуки 5 (1,5г, 6,06ммоль) та 2етоксибензилмагнійхлориду (продукт фірми RiekeMetals) (0,25M розчин у THF, 34мл, 8,49ммоль) у безводному THF (30мл). Після повторного очищення автоматизованою хроматографією на колонці (елюент MeOH/DCM 0/100-10/90 [у об'ємному співвідношенні], а потім EtOAc/DCM 0/100-50/50 [у об'ємному співвідношенні]) одержували сполуку 23 у ви гляді безбарвного масла (0,8г, 35%). Молекулярна маса 383,54, C24H33NO3; LCMS (6-хвилинна методика): m/z 384,4 [М+Н]+, RT=3,04хв. Гідрохлорид 1-[2-етилокси)феніл]-3-метил-2морфолін-2-ілбутан-2-олу (24) Сполуку 24 одержували за Загальною методикою 3 зі сполуки 23 (766мг, 2,0ммоль), αхлоретилхлорформіату (0,86мл, 8,0ммоль) та ос 56 нови Х'юніга на полімерному носії (1,12г, 4,0ммоль) у DCM (30мл). Після очищення іонообмінною хроматографією, а потім автоматизованою хроматографією на колонці (елюент MeOH/ DCM 0/100-20/80 [у об'ємному співвідношенні]) та препаративною хроматографією на хіральному сорбенті (градієнтне н-гептан:EtOH:DEA 95:5:0,2, сорбент chiracel AD) одержували енантіомер, що елююється першим (RТ=13,40хв.), та енантіомер, що елююється другим (RТ=15,63хв.). Після перетворення на відповідні гідрохлориди, сполуки 24а (85мг) та 24b (79мг) одержували у вигляді бр унатних твердих речовин (сукупний вихід 28%). Молекулярна маса 293,36; C17H27NO3·HCl; 1HHMP (CD3OD) δ 7,06-7,09 (1H, m), 6,95-7,01 (1H, m), 6,66-6,75 (2Н, m), 3,80-3,92 (3Н, m), 3,46-3,63 (2Н, m), 2,96-3,15 (2Н, m), 2,66-2,86 (4Н, m), 1,54-1,63 (1H, m), 1,22 (3Н, t, 7,0Гц), 0,82 (3Н, d, 7,0Гц), 0,71 (3Н, d, 7,0Гц); LCMS (12-хвилинна методика): m/z 294,2 [М-НСІ+Н]+, RT=4,60хв. Приклад 8: Гідрохлорид 3-метил-2-морФолін2-іл-1-(2-[(трифторметил)-окси]бутан-2-олу (26) 3-метил-2-[4-(фенілметил)морфолін-2-іл]-1-{2[(трифторметил)окси]феніл}бутан-2-ол (25) Сполуку 25 одержували за Загальною методикою 3 зі сполуки 5 (953мг, 3,85ммоль) та наявного на ринку (Fluorochem) 2-трифторметоксибензилмагнійброміду (8,48мл, 4,24ммоль, 1,1екв.) у безводному THF (25мл) із доданням додаткової кількості 2-трифторметоксибензилмагнійброміду (3,85мл, 1,93ммоль). Після очищення іонообмінною хроматографією одержували сполуку 25 у вигляді жовтого масла 86% чистоти, яку використовували на наступній стадії без додаткового очищення (1,53г виділеного матеріалу). Молекулярна маса 423,38; C23H28F3N O3; LCMS (6-хвилинна методика) m/z 424,1 [М+Н]+, RT=3,53хв. Гідрохлорид 3-метил-2-морфолін-2-іл-1-{2[(трифторметил)окси]бутан-2-олу (26) Сполуку 26 одержували за Загальною методикою 3 зі сполуки 25 (1,53г, 3,61ммоль), αхлоретилхлорформіату (1,55мл, 14,5ммоль, 4екв.) та основи Х'юніга на полімерному носії (2,03г, 7,23ммоль, 2екв.) у DC M (30мл). Після очищення іонообмінною хроматографією, а потім автомати 57 85198 зованою хроматографією на колонці (елюент MeOH/DCM 0/100-20/80 [у об'ємному співвідношенні]) та перетворення на відповідний гідрохлорид за Загальною методикою 4 одержували сполуку 26 у вигляді жовтої твердої речовини (0,4г, 29%). Молекулярна маса 379,82; C16H22F 3NO3HCl; 1 H ЯМР (CD3OD) δ 7,46 (1H, dd, 1,5Гц, 7,5Гц), 7,147,24 (3Н, m), 3,94 (1H, dd, 3,5Гц, 13Гц), 3,80 (1H, dd, 2,5Гц, 11,5Гц) 3,69 (1H, td, 2,5Гц, 13Гц), 3,27 (1H, d, 13Гц), 3,13 (1H, d, 12,5Гц), 2,72-3,02 (4Н, m), 1,70 (1H, септет, 7Гц), 0,94 (3Н, d, 7Гц), 0,84 (3Н, d, 7,0Гц). LCMS (12-хвилинна методика): m/z 334,4 [М-НСІ+Н]+, RТ=2,94хв. Приклад 9: Одержання гідрохлориду 1-[1,1’біфеніл]-2-іл-3-метил-2-морфолін-2-ілбутан-2-олу (28) 1-[1,1'-біфеніл]-2-іл-3-метил-2-[4(фенілметил)морфолін-2-ілбутан-2-ол (27) Сполуку 27 одержували за Загальною методикою 2 зі сполуки 5 (0,7г, 2,83ммоль) та 2фенілбензилмагнійброміду (12,5мл, 3,11ммоль) у безводному THF (15мл) із введенням в реакцію додаткових еквівалентів 2фенілбензилмагнійброміду (11,3мл, 5,66ммоль). 2фенілбензилмагнійбромід одержували з наявного на ринку (Aldrich) 2-фенілбензилброміду за Загальною методикою 5. Після очищення іонообмінною хроматографією, а потім автоматизованою хроматографією на колонці (елюент ЕtOАс/н-гептан 0/100-20/80 [у об'ємному співвідношенні]) одержували сполуку 27 у вигляді масла (0,46г, 40%). Молекулярна маса 415,58; C28H33NO2; LCMS (6хвилинна методика): m/z 416,2 [М+Н]+, RT=3,45хв. Гідрохлорид 1-[1,1'-біфеніл]-2-іл-3-метил-2морфолін-2-ілбутан-2-олу (28) Сполуку 28 одержували за Загальною методикою 3 зі сполуки 27 (405мг, 0,976ммоль), αхлоретилхлорформіату (0,42мл, 3,9ммоль) та основи Х'юніга на полімерному носії (0,55г, 1,95ммоль) у DCM (7мл). Одержаний неочищений продукт очищали іонообмінною хроматографією, а потім перетворювали у відповідний гідрохлорид за Загальною методикою 4 і одержували сполуку 28 у вигляді білої твердої речовини (0,23г, 71%). Молекулярна маса 361,91; C21H27NO2HCl; 1H ЯМР (CD3OD) δ 7,61-7,64 (1H, m), 7,19-7,47 (8Н, m), 3,95 (1H, dd, 4Гц, 13Гц), 3,61-3,71 (2Н, m), 3,04- 3,19 (4Н, m), 2,96 (1H, td, 4Гц, 12,6Гц), 2,70 (1H, dd, 13, 11,5Гц), 1,67 (1H, септет, 7Гц), 0,75 (3Н, d, 7Гц), 58 0,63 (3Н, d, 7Гц); LCMS (12-хвилинна методика): m/z 326,2 [М-НСІ+Н]+, RT=5,02хв. Приклад 10: Одержання гідрохлориду 1-(4фтор[1,1'-біфеніл]-2-іл)-3-метил-2-морфолін-2ілбутан-2-олу (30) Гідрохлорид 1-(4-фтор[1,1'-біфеніл]-2-іл)-3метил-2-[4-(фенілметил)-морфолін-2-ілбутан-2-олу (29) Сполуку 29 одержували за Загальною методикою 2 зі сполуки 5 (1,13г, 4,57ммоль) та 2-феніл-5фторбензилмагнійброміду (0,5М у THF, 10,5мл, 5,03ммоль) у безводному THF (30мл) (через 30хв. додатково додавали 2-феніл-5фторбензилмагнійбромід (0,33екв., 3мл, 1,51ммоль)). 2-феніл-5-фторбензилмагнійбромід одержували з 2-феніл-5-фторбензилброміду за Загальною методикою 5. Після очищення іонообмінною хроматографією, а потім автоматизованою хроматографією на колонці (елюент EtOAc/нгептан 0/100-20/80 [у об'ємному співвідношенні]) одержували сполуку 29 у вигляді жовтого масла 86% чистоти, яке безпосередньо використовували на наступній стадії (одержано 1,58г матеріалу). Молекулярна маса 415,58; C28H33NO2; LC MS (6хвилинна методика): m/z 434,5 [М+Н]+, RТ=3,71хв. Гідрохлорид 1-(4-фтор[1,1'-біфеніл]-2-іл)-3метил-2-морфолін-2-ілбутан-2-олу (30) Сполуку 30 одержували за Загальною методикою 3 зі сполуки 29 (1,58г, 3,63ммоль), αхлоретилхлорформіату (1,57мл, 3,63ммоль) та основи Х'юніга на полімерному носії (2,04г, 7,26ммоль) у DCM (30мл). Одержаний неочищений продукт очищали іонообмінною хроматографією, автоматизованою хроматографією на колонці (елюент MeOH/DCM 0/100-20/80 [у об'ємному відношенні]) та препаративною LCMS. Шляхом перетворення в гідрохлорид за Загальною методикою 4 одержували сполуку 30 у вигляді жовтої твердої речовини (0,3г, 22%). Молекулярна маса 379,91; C21H26FNO 2HCl; 1H Я МР (CD3OD) δ 7,20-7,35 (6Н, m), 7,07-7,14 (1H, m), 6,90 (1H, td, 2,5Гц, 8,5Гц), 3,83 (1H, d, br, 10Гц), 3,56 (2Н, t, 10Гц), 3,03-3,12 (2Н, m), 2,79-2,98 (3Н, m), 2,63 (1H, t, 11,5Гц), 1,55 (1H, квінтет, 7Гц), 0,64 (3Н, d, 7Гц), 0,51 (3Н, d, 7Гц); LCMS (12-хвилинна методика): m/z 344,1 [MHCH-H]+, RТ=5,14хв. Приклад 11: Одержання гідрохлориду 1-[5фтор-2-(метилокси)феніл]-4-метил-2-морфолін-2іл-пентан-2-олу (32) 59 85198 1-[5-фтор-2-(метилокси)феніл]-4-метил-2-[4(фенілметил)морфолін-2-іл]пентан-2-ол (31) Сполуку 31 одержували за Загальною методикою 2 зі сполуки 6 (465мг, 1,78ммоль) та 2метокси-5-фторбензилмагнійброміду (3,92мл, 1,96ммоль, 1,1екв.) у безводному THF (10мл). Після очищення іонообмінною хроматографією, а потім автоматизованою хроматографією на колонці (елюент ЕtOАс/н-гептан 0/100-40/60 [у об'ємному співвідношенні]) одержували сполуку 31 у вигляді масла (448мг, чистота 83%). Молекулярна маса 401,53; C24H32FNO3 ; LCMS (6-хвилинна методика): m/z 402,2 [М+Н]+, RT=3,40хв. Гідрохлорид 1-[5-фтор-2-(метилокси)феніл]-4метил-2-морфолін-2-ілпентан-2-олу (32) Сполуку 32 одержували за Загальною методикою 3 зі сполуки 31 (448мг, 1,12ммоль), αхлоретилхлорформіату (0,48мл, 4,47ммоль, 4екв.) та основи Х'юніга на полімерному носії (628г, 2,23ммоль, 2екв.) у DC M (10мл). Після очищення іонообмінною хроматографією, а потім препаративною LCMS та перетворення на відповідний гідрохлорид за Загальною методикою 4, одержували сполуку 32 у вигляді білої твердої речовини (0,11г, 32%). Молекулярна маса 347,72; C17H26FNO3 . HCl; 1 HHMP (CD3OD) δ 7,05-7,08 (1H, m), 6,95-6,98 (2Н, m), 4,16 (1H, dd, 3Гц, 12,5Гц), 3,75-3,86 (4Н, m), 3,67 (1H, d, 10,5Гц), 3,51 (1H, d, 12Гц), 3,25-3,29 (1H, m), 3,07-3,20 (2Н, m), 2,94 (2Н, , 14Гц), 1,861,9 (1H, m), 1,53 (1H, dd, 5,5Гц, 14,5Гц), 1,13 (1H, dd, 14,5Гц, 5,5Гц), 0,94 (3Н, d, 2,5Гц), 0,92 (3Н, d, 2,5Гц). LCMS (12-хвилинна методика): m/z 312,1 [М-НСІ+Н]+, RT=4,61хв. Приклад 12: Одержання 1-[2-(етилокси)феніл]4-метил-2-морфолін-2-ілпентан-2-олу (34) 1-[2-(етилокси)феніл]-4-метил-2-[4(фенілметил)морфолін-2-мпентан-2-ол (33) Сполуку 33 одержували за Загальною методикою 2 зі сполуки 6 (3,0г, 11,5ммоль) та 2етоксибензилмагнійхлориду (продукт фірми Rieke 60 Metals) (0,25M у діетиловому е фірі, 50,5мл, 12,6ммоль) у безводному THF (55мл). Через 30хв. додатково додавали два еквіваленти 2етоксибензилмагнійхлориду (92мл, 23ммоль). Після очищення автоматизованою хроматографією на колонці (елюент EtOAc/н-гептан 100-25/75 [у об'ємному співвідношенні]) одержували сполуку 33 (3,21г) у вигляді безбарвного масла 86% чистоти у вигляді суміші діастереомерів. Молекулярна маса 397,56; C25H35NO3. LCMS (6-хвилинна методика): m/z 398,3 [М+Н]+, RT=3,42 та 3,60хв. 1-[2-(Етилокси)феніл]-4-метил-2-морфолін-2мпентан-2-ол (34) Сполуку 34 одержували за Загальною методикою 3 зі сполуки 33 (3,20мг, 8,06ммоль), αхлоретилхлорформіату (3,48мл, 32,2ммоль) та основи Х'юніга на полімерному носії (4,53г, 16,1ммоль) у DCM (100мл). Після очищення іонообмінною хроматографією, а потім автоматизованою хроматографією на колонці (елюент MeOH/DCM 5/95-40/60 [у об'ємному співвідношенні]) та препаративною LCMS одержували сполуку 34. Препаративною хроматографією на хіральному сорбенті (градієнт н-гептан:ЕtOН:ОЕА 60:40:0,2, сорбент chiralcel-OD) одержували енантіомер 34а, що елюююється першим (13мг) (RT=8,25хв.), та енантіомер 34b, що елюююється другим (RT=10,17хв.), у вигляді безбарвних масел. Молекулярна маса 307,44; C18H29NO3 ; 1H ЯМР (CDCl3) δ 7,16-7,22 (2Н, m), 6,84-6,93 (2Н, m), 3,97-4,17 (2Н, m), 3,90 (1H, dd, 3Гц, 11Гц), 3,53 (1H, td, 3Гц, 11Гц), 3,37 (1H, dd, 2Гц, 10Гц), 3,18 (1H, d, 12Гц), 3,04 (1H, d, 14Гц), 2,74-2,91 (4Н, m), 1,89 (1H, септет, 6Гц), 1,52 (1H, dd, 5,5Гц, 14Гц), 1,44 (3Н, t, 7Гц), 1,11 (1H, dd, 6Гц, 14Гц), 0,93 (3Н, d, 7Гц), 0,90 (3Н, d, 7Гц); LCMS (12-хвилинна методика): m/z 308,2 [M-HCl+H]+, RT=4,92хв. Приклад 13: Одержання гідрохлориду 4-метил2-морфолін-2-іл-1{2[трифторметил)окси]феніл}пентан-2-олу (36) 4-метил-2-[4-(фенілметил)морфолін-2-іл]-12[трифторметил)окси]-феніл}пентан-2-ол (35) Сполуку 35 одержували за Загальною методикою 2 зі сполуки 6 (0,83г, 3,19ммоль) та наявного на ринку (Fluorochem) 2-трифторметоксибензилмагнійброміду (0,5M розчин у THF, 7,02мл, 3,51ммоль, 1,1екв.) у безводному THF (21мл). Через 30хв. додавали додаткові еквіваленти (3,19мл, 1,60ммоль) 2
ДивитисяДодаткова інформація
Назва патенту англійськоюMorpholin derivatives as inhibitors of norepinephrine reuptake
Автори англійськоюCampbell Gordon Iain, Cases-Thomas Manuel Javier, Man Theresa, Masters John Joseph, Rudyk Helene Catherine Eugenie, Walter Magnus Wilhelm
Назва патенту російськоюПроизводные морфолина как ингибиторы повторного поглощения норэпинефрина
Автори російськоюКэмпбелл Гордон Айан, Кейзес-Томас Мануэль Хавьер, Ман Тереза, Мастерз Джон Джозеф, Рудик Хелена Катрин Эжени, Вальтер Магнус Вильгельм
МПК / Мітки
МПК: C07D 265/30, A61P 25/22, A61K 31/5377, A61K 31/5375, C07D 413/06
Мітки: повторного, поглинання, інгібітори, морфоліну, похідні, норепінефрину
Код посилання
<a href="https://ua.patents.su/46-85198-pokhidni-morfolinu-yak-ingibitori-povtornogo-poglinannya-norepinefrinu.html" target="_blank" rel="follow" title="База патентів України">Похідні морфоліну як інгібітори повторного поглинання норепінефрину</a>
Попередній патент: Композиція, стабілізована відносно дії світла і/або тепла
Випадковий патент: Засіб для профілактики онкологічних захворювань