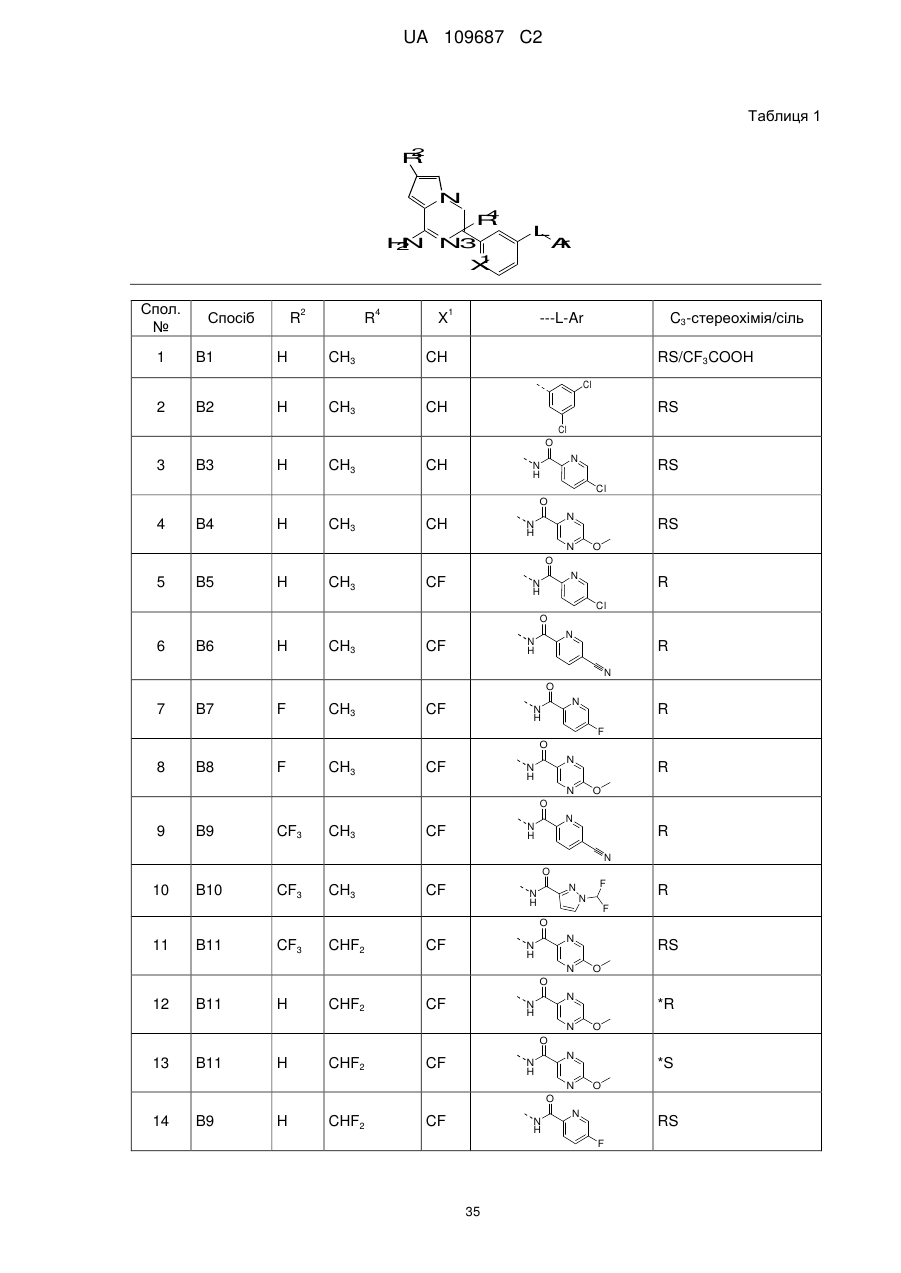
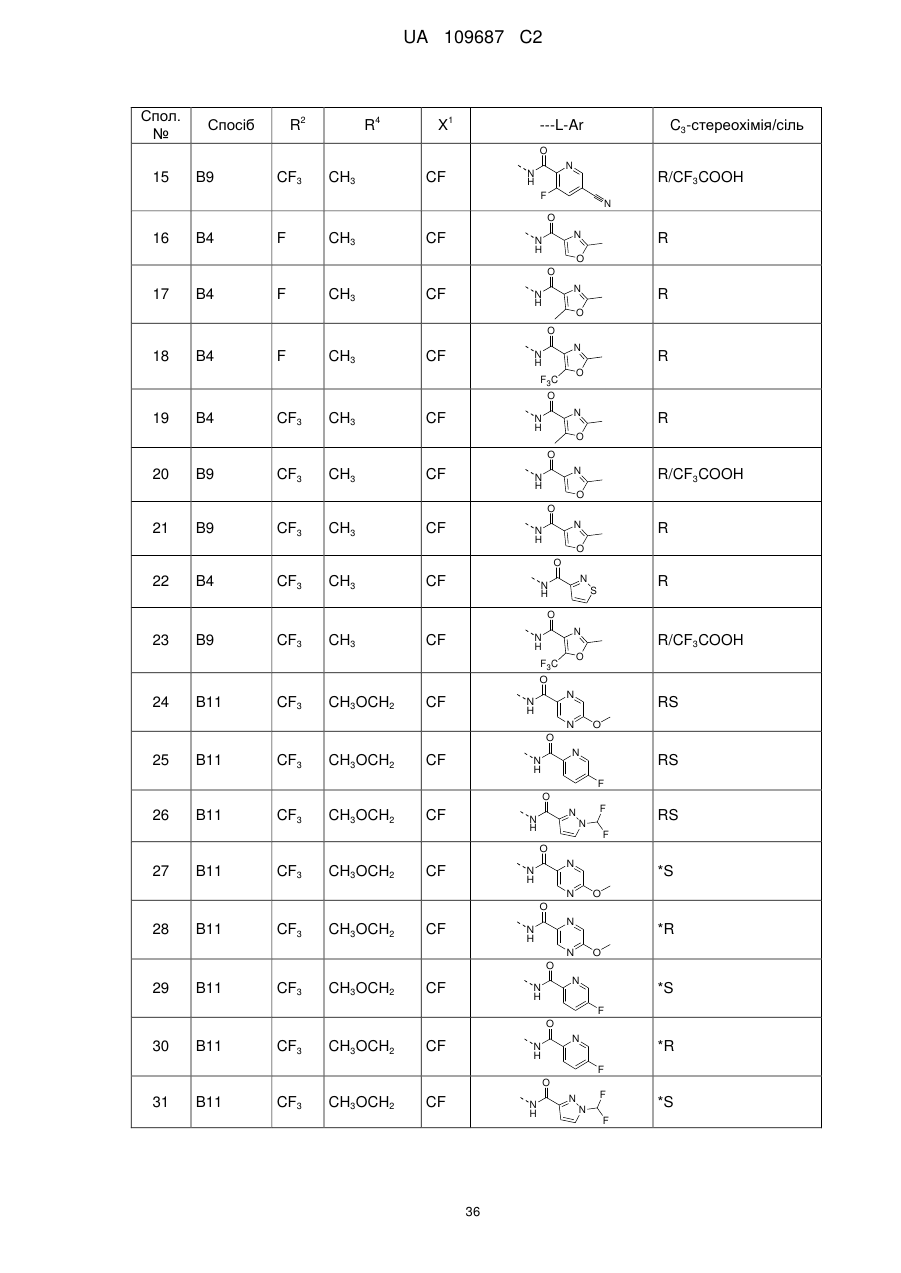
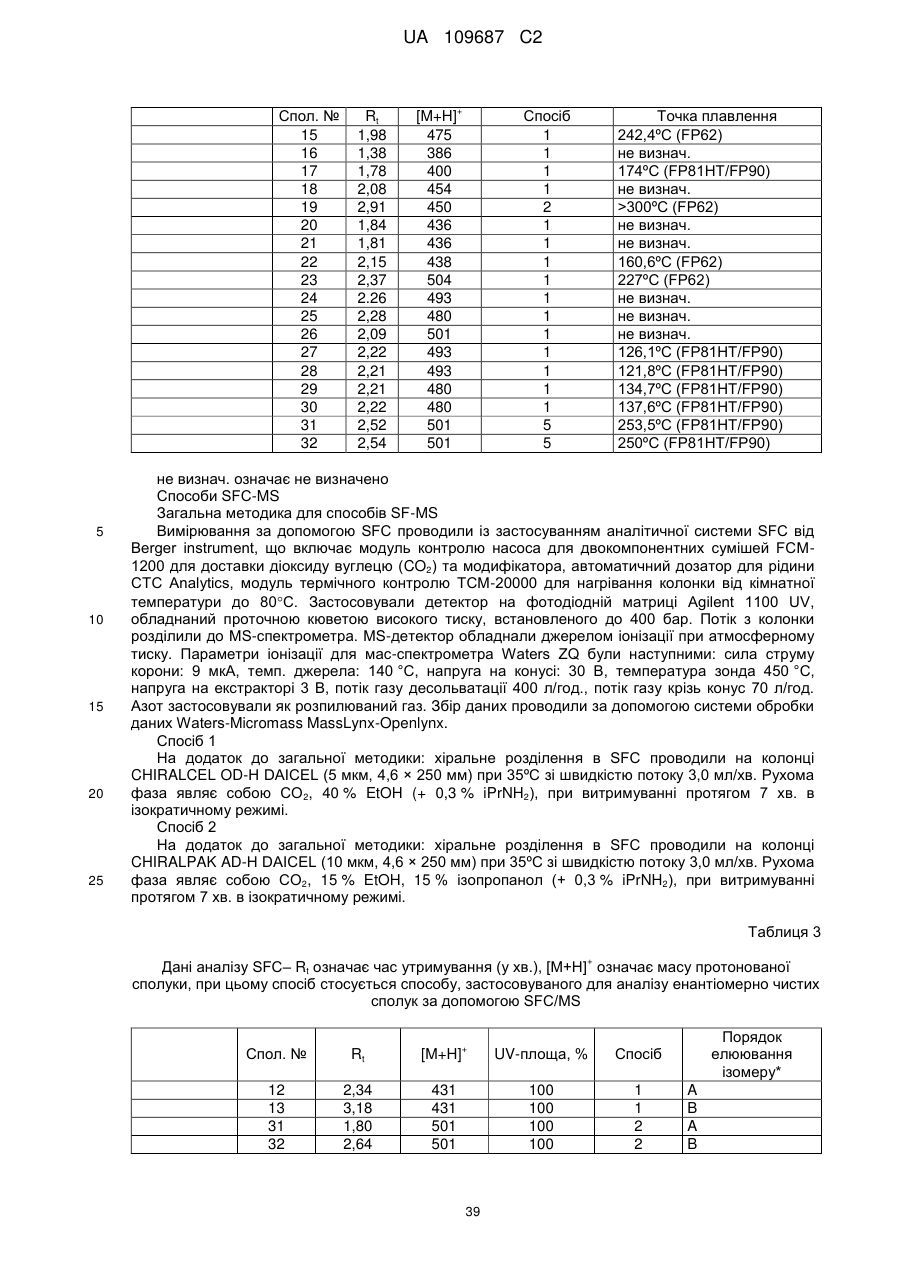
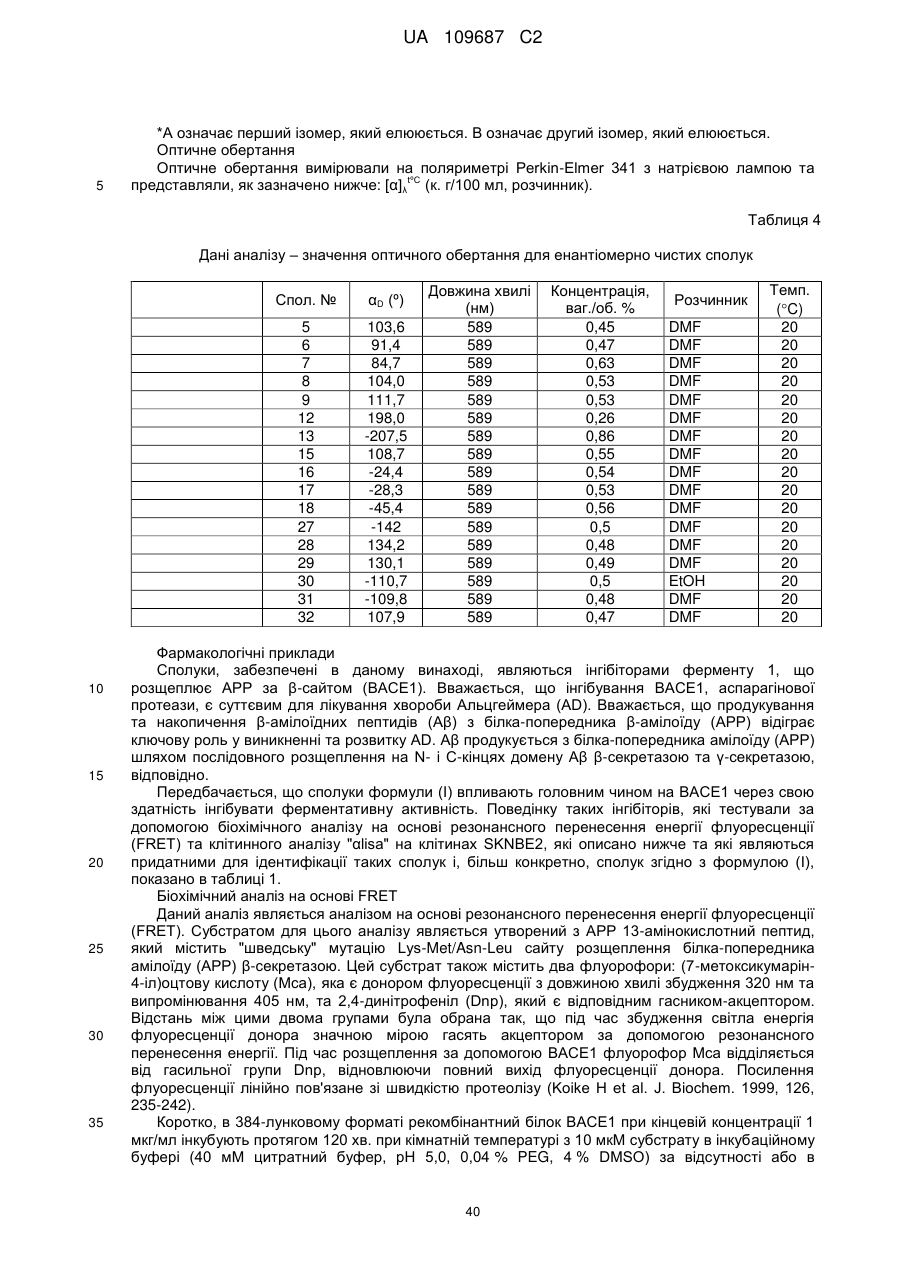
Похідні 3,4-дигідропіроло[1,2-a]піразин-1-іламіну, придатні як інгібітори бета-секретази (bace)
Номер патенту: 109687
Опубліковано: 25.09.2015
Автори: Трабанко-Суарес Андрес Авеліно, Дельгадо-Хіменес Франциска
Формула / Реферат
1. Сполука формули (І)
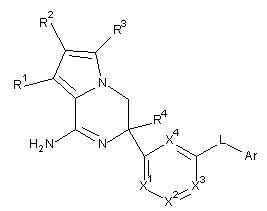
або її таутомерна або стереоізомерна форма, де
R1, R2, R3 незалежно вибрані з групи, що складається з водню, галогену, ціано, С1-3алкілу, моно- та полігалоген-С1-3алкілу та С3-6циклоалкілу;
R4 вибраний із групи, що складається з водню, С1-3алкілу, метоксиметилу, С3-6циклоалкілу, моно- та полігалоген-С1-3алкілу, арилу та гетероарилу;
X1, X2, X3, X4 незалежно являють собою C(R5) або N за умови, що не більше двох з них являють собою N; R5 вибраний із групи, що складається з водню, галогену, ціано, С1-3алкілу, моно- та полігалоген-С1-3алкілу та С3-6циклоалкілу;
L являє собою зв'язок або -NHCO-;
Аr являє собою арил або гетероарил;
де арил являє собою феніл або феніл, заміщений одним, двома або трьома замісниками, вибраними із групи, що складається з галогену, ціано, С1-3алкілу, С1-3алкілокси, моно- та полігалоген-С1-3алкілу, а також моно- та полігалоген-С1-3алкілoкси;
гетероарил вибраний із групи, що складається з піридилу, піримідилу, піразинілу, піридазилу, фуранілу, тієнілу, піролілу, піразолілу, імідазолілу, триазолілу, тіазолілу, тіадіазолілу, оксозолілу та оксадіазолілу, при цьому кожен необов'язково заміщений одним, двома або трьома замісниками, вибраними з групи, що складається з галогену, ціано, С1-3алкілу, С1-3алкілокси, моно- та полігалоген-С1-3алкілу, а також моно- та полігалоген-С1-3алкілокси; або її сіль приєднання або сольват.
2. Сполука за п. 1, де
R1, R2 та R3 незалежно вибрані з водню та С1-3алкілу;
X1, X2, X3, X4 незалежно являють собою C(R5), де кожен R5 вибраний з водню та галогену;
L являє собою зв'язок або -NHCO-;
Аr являє собою арил або гетероарил:
де арил являє собою феніл або феніл, заміщений одним або двома замісниками, вибраними з групи, що складається з галогену, ціано, С1-3алкілу, С1-3алкілокси та полігалоген-С1-3алкілокси;
гетероарил вибраний із групи, що складається з піридилу, піримідилу та піразинілу, при цьому кожен з них необов'язково заміщений одним або двома замісниками, вибраними з групи, що складається з галогену, ціано, С1-3алкілу, С1-3алкілокси та полігалоген-С1-3алкілокси; або
її сіль приєднання або сольват.
3. Сполука за п. 1, де
R1, R2 та R3 являють собою водень;
X1 являє собою CF:
X2, X3, X4 являють собою СН;
L являє собою зв'язок або -NHCO-;
Аr являє собою арил або гeтероарил;
де арил являє собою феніл, заміщений хлором;
гетероарил вибраний із групи, що складається з піридилу та піримідилу, при цьому кожен необов'язково заміщений одним або двома замісниками, вибраними з групи, що складається з хлору, фтору, ціано, метилу та метокси; або її сіль приєднання або сольват.
4. Сполука за п. 1, де атом вуглецю, заміщений R4, характеризується R-конфігурацією.
5. Сполука за п. 1, де R1 та R3 являють собою водень, R2 являє собою водень, фтор або трифторметил;
R4 являє собою метил або дифторметил;
X1 являє собою СН або CF;
X2, X3 та X4 являють собою СН;
L являє собою -NHCO-;
Аr являє собою 5-хлорпіридин-2-іл, 5-ціанопіридин-2-іл, 5-фторпіридин-2-іл, 5-ціано-3-фторпіридин-2-іл, 5-метоксипіразин-2-іл або 1-дифторметилпіразол-3-іл;
або її сіль приєднання або сольват.
6. Фармацевтична композиція, що містить терапевтично ефективну кількість сполуки за будь-яким з пп. 1-5 та фармацевтично прийнятний носій.
7. Спосіб одержання фармацевтичної композиції за п. 6, який відрізняється тим, що фармацевтично прийнятний носій рівномірно змішують з терапевтично ефективною кількістю сполуки за будь-яким з пп. 1-5.
8. Сполука за будь-яким з пп. 1-5 для застосування при лікуванні або попередженні хвороби Альцгеймера, помірного когнітивного порушення, згасання, деменції, деменції з тільцями Леві, синдрому Дауна, деменції, асоційованої з інсультом, деменції, асоційованої з хворобою Паркінсона, або деменції, асоційованої з бета-амілоїдом.
9. Спосіб лікування розладу, вибраного з групи, що складається з хвороби Альцгеймера, помірного когнітивного порушення, згасання, деменції, деменції з тільцями Леві, синдрому Дауна, деменції, асоційованої з інсультом, деменції, асоційованої з хворобою Паркінсона, та деменції, асоційованої з бета-амілоїдом, за яким суб'єкту, що потребує цього, вводять терапевтично ефективну кількість сполуки за будь-яким з пп. 1-5 або фармацевтичної композиції за п. 6.
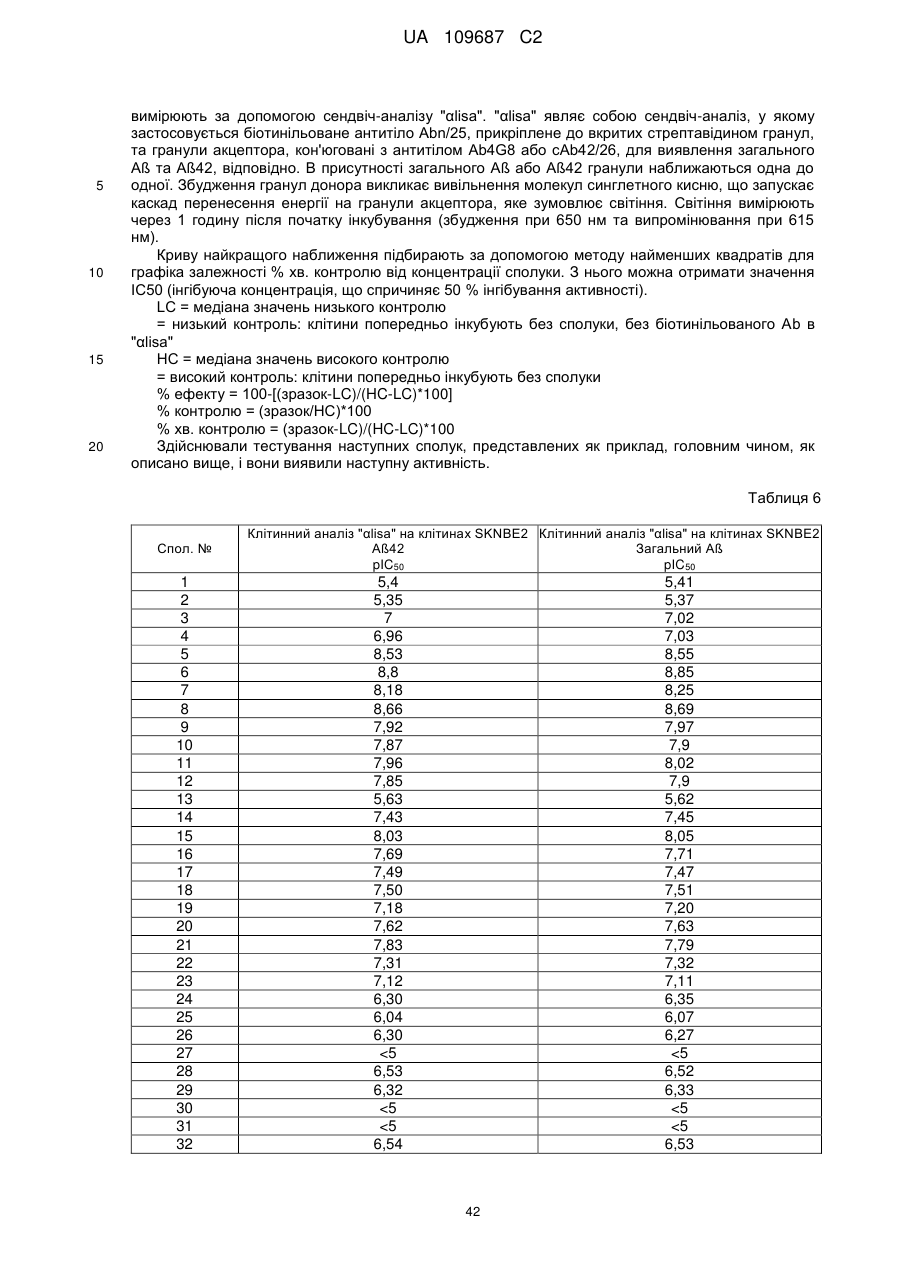
Текст
Реферат: Даний винахід стосується нових похідних 3,4-дигідропіроло[1,2-а]піразин-1-іламіну як інгібіторів бeта-секретази, також відомої як фермент, що розщеплює попередник амілоїду за бета-сайтом, ВАСЕ, ВАСЕ1, Asp2 або мемапсин 2. Даний винахід також спрямований на фармацевтичні композиції, які містять такі сполуки, на способи отримання таких сполук і композицій та на застосування таких сполук і композицій для попередження та лікування розладів, у які залучена бета-секретаза, таких як хвороба Альцгеймера (AD), помірне когнітивне порушення, згасання, деменція, деменція з тільцями Леві, синдром Дауна, деменція, асоційована з інсультом, деменція, асоційована з хворобою Паркінсона, або деменція, асоційована з бета-амілоїдом. UA 109687 C2 (12) UA 109687 C2 2 R R 1 R 3 N 4 R H 2 N 4 X N X 1 L X X 2 3 A r UA 109687 C2 5 10 15 20 25 30 35 ГАЛУЗЬ ВИНАХОДУ Даний винахід стосується нових похідних 3,4-дигідропіроло[1,2-a]піразин-1-іламіну в якості інгібіторів бета-секретази, також відомої як фермент, що розщеплює амілоїд за бета-сайтом, BACE, BACE1, Asp2 або мемапсин 2. Даний винахід також направлений на фармацевтичні композиції, які містять такі сполуки, на способи отримання таких сполук і композицій та на застосування таких сполук і композицій для попередження й лікування розладів, у які залучено бета-секретазу, таких як хвороба Альцгеймера (AD), помірне когнітивне порушення, згасання, деменція, деменція з тільцями Леві, синдром Дауна, деменція, асоційована з інсультом, деменція, асоційована з хворобою Паркінсона, або деменція, асоційована з бета-амілоїдом. ПЕРЕДУМОВИ ВИНАХОДУ Хвороба Альцгеймера (AD) являє собою нейродегенеративне захворювання, асоційоване зі старінням. Пацієнти з AD страждають дефіцитом когнітивних функцій та втратою пам'яті, а також поведінковими проблемами, такими як тривожність. Більше 90 % уражених AD мають спорадичну форму розладу, тоді як менше 10 % випадків є сімейними або спадковими. У Сполучених Штатах приблизно 1 з 10 людей у віці 65 років має AD, тоді як у віці 85 років 1 з кожних двох осіб страждає AD. Середня передбачувана тривалість життя від первинного діагнозу становить 7-10 років, і пацієнти з AD потребують всебічного догляду або в будинку пристарілих, що є дуже дорогим, або здійснюваного членами родини. За умов збільшуваної кількості людей похилого віку в популяції AD являє собою медичну проблему, що зростає. Доступні на даний час види терапії AD забезпечують лікування тільки симптомів захворювання та включають інгібітори ацетилхолінестерази для покращення когнітивних властивостей, а також анксіолітики та нейролептики для контролю поведінкових проблем, асоційованих із цією хворобою. Характерними патологічними ознаками в головному мозку пацієнтів з AD є нейрофібрилярні клубки, які виникають в результаті гіперфосфорилювання тау-білка, та амілоїдні бляшки, які утворюються в результаті агрегації пептиду бета-амілоїду 1-42 (Abeta 1-42). Abeta 1-42 утворює олігомери, а згодом фібрили та, врешті-решт, амілоїдні бляшки. Олігомери та фібрили вважаються особливо нейротоксичними та можуть спричиняти більшість неврологічних ушкоджень, асоційованих з AD. Засоби, які попереджають утворення Abeta 1-42, мають потенціал, щоб стати засобами, які модифікують перебіг захворювання, для лікування AD. Abeta 1-42 утворюється з білка-попередника амілоїду (APP), що складається з 770 амінокислот. Nкінець Abeta 1-42 відщеплюється бета-секретазою (BACE), а потім гамма-секретаза відщеплює C-кінцеву ділянку. На додаток до Abeta 1-42, гамма-секретаза також вивільняє Abeta 1-40, який є переважаючим продуктом розщеплення, так само як Abeta 1-38 та Abeta 1-43. Ці форми Abeta також можуть агрегуватися з утворенням олігомерів та фібрил. Таким чином, передбачається, що інгібітори BACE будуть попереджати утворення Abeta 1-42, а також Abeta 1-40, Abeta 1-38 та Abeta 1-43, і будуть потенційними терапевтичними засобами для лікування AD. КОРОТКИЙ ОПИС ВИНАХОДУ Даний винахід направлений на сполуку формули (I), R2 R3 R1 H2N N R4 X4 N 1 45 50 3 Ar X X2 , або її таутомерну або стереоізомерну форму, де 1 2 3 R , R , R незалежно вибрані з групи, що складається з водню, галогену, ціано, C1-3алкілу, моно- та полігалоген-C1-3алкілу й C3-6циклоалкілу; 4 R вибраний із групи, що складається з водню, C1-3алкілу, метоксиметилу, C3-6циклоалкілу, моно- та полігалоген-C1-3алкілу, арилу й гетероарилу; 1 2 3 4 5 X , X , X , X незалежно являють собою C(R ) або N за умови, що не більше двох з них 5 являють собою N; R вибраний із групи, що складається з водню, галогену, ціано, C 1-3алкілу, моно- та полігалоген-C1-3алкілу й C3-6циклоалкілу; L являє собою зв'язок або -NHCO-; Ar являє собою арил або гетероарил; де арил являє собою феніл або феніл, заміщений одним, двома або трьома замісниками, вибраними з групи, що складається з галогену, ціано, C1-3алкілу, X 40 L 1 UA 109687 C2 5 10 15 20 25 30 35 40 45 50 55 60 C1-3алкілоксі, моно- та полігалоген-C1-3алкілу й моно- та полігалоген-C1-3алкілоксі; гетероарил вибраний із групи, що складається з піридилу, піримідилу, піразинілу, піридазилу, фуранілу, тієнілу, піролілу, піразолілу, імідазолілу, триазолілу, тіазолілу, тіадіазолілу, оксазолілу та оксадіазолілу, при цьому кожен необов'язково заміщений одним, двома або трьома замісниками, вибраними з групи, що складається з галогену, ціано, C 1-3алкілу, C1-3алкілоксі, моно- та полігалоген-C1-3алкілу й моно- та полігалоген-C1-3алкілоксі; або її сіль приєднання або сольват. Ілюстративним прикладом даного винаходу є фармацевтична композиція, яка містить фармацевтично прийнятний носій та будь-яку зі сполук, описаних вище. Ілюстрацією даного винаходу є фармацевтична композиція, отримана шляхом змішування будь-якої зі сполук, описаних вище, та фармацевтично прийнятного носія. Ілюструванням даного винаходу є спосіб отримання фармацевтичної композиції, який включає змішування будь-якої зі сполук, описаних вище, та фармацевтично прийнятного носія. Прикладом даного винаходу служать способи лікування розладу, опосередкованого ферментом бета-секретазою, які включають уведення суб'єкту, що потребує цього, терапевтично ефективної кількості будь-якої зі сполук або фармацевтичних композицій, описаних вище. Додатковим прикладом даного винаходу служать способи інгібування ферменту бетасекретази, які включають уведення суб'єкту, що потребує цього, терапевтично ефективної кількості будь-якої зі сполук або фармацевтичних композицій, описаних вище. Прикладом даного винаходу є спосіб лікування розладу, вибраного з групи, що складається з хвороби Альцгеймера, помірного когнітивного порушення, згасання, деменції, деменції з тільцями Леві, синдрому Дауна, деменції, асоційованої з інсультом, деменції, асоційованої з хворобою Паркінсона, та деменції, асоційованої з бета-амілоїдом, переважно хвороби Альцгеймера, який включає введення суб'єкту, що потребує цього, терапевтично ефективної кількості будь-якої зі сполук або фармацевтичних композицій, описаних вище. Іншим прикладом даного винаходу є будь-яка зі сполук, описаних вище, для застосування при лікуванні: (a) хвороби Альцгеймера, (b) помірного когнітивного порушення, (c) згасання, (d) деменції, (e) деменції з тільцями Леві, (f) синдрому Дауна, (g) деменції, асоційованої з інсультом, (h) деменції, асоційованої з хворобою Паркінсона, та (i) деменції, асоційованої з бета-амілоїдом, у суб'єкта, що потребує цього. ДОКЛАДНИЙ ОПИС ВИНАХОДУ Даний винахід направлений на сполуки формули (I), визначені вище в даному документі, та їх фармацевтично прийнятні солі та сольвати. Сполуки формули (I) є інгібіторами ферменту бета-секретази (також відомої як фермент, що розщеплює за бета-сайтом, BACE, BACE1, Asp2 або мемапсин 2) та придатні для лікування хвороби Альцгеймера, помірного когнітивного порушення, згасання, деменції, деменції, асоційованої з інсультом, деменції з тільцями Леві, синдрому Дауна, деменції, асоційованої з хворобою Паркінсона, та деменції, асоційованої з бета-амілоїдом, переважно хвороби Альцгеймера, помірного когнітивного порушення або деменції, більш переважно хвороби Альцгеймера. 1 2 3 У варіанті здійснення даного винаходу R , R , R незалежно вибрані з групи, що складається з водню, галогену, ціано, C1-3алкілу, моно- та полігалоген-C1-3алкілу й C3-6циклоалкілу; 4 R вибраний із групи, що складається з водню, C1-3алкілу, C3-6циклоалкілу, моно- та полігалоген-C1-3алкілу, арилу та гетероарилу; 1 2 3 4 5 X , X , X , X незалежно являють собою C(R ) або N за умови, що не більше двох з них 5 являють собою N; R вибраний із групи, що складається з водню, галогену, ціано, C 1-3алкілу, моно- та полігалоген-C1-3алкілу й C3-6циклоалкілу; L являє собою зв'язок або -NHCO-; Ar являє собою арил або гетероарил; де арил являє собою феніл або феніл, заміщений одним, двома або трьома замісниками, вибраними з групи, що складається з галогену, ціано, C1-3алкілу, C1-3алкілоксі, моно- та полігалоген-C1-3алкілу й моно- та полігалоген-C1-3алкілоксі; гетероарил вибраний із групи, що складається з піридилу, піримідилу, піразинілу, піридазилу, фуранілу, тієнілу, піролілу, піразолілу, імідазолілу, триазолілу, тіазолілу, тіадіазолілу, оксазолілу та оксадіазолілу, при цьому кожен необов'язково заміщений одним, двома або трьома замісниками, вибраними з групи, що складається з галогену, ціано, C 1-3алкілу, C1-3алкілоксі, моно- та полігалоген-C1-3алкілу й моно- та полігалоген-C1-3алкілоксі; або її сіль приєднання або сольват. 1 2 3 У варіанті здійснення даного винаходу R , R та R незалежно вибрані з водню та C1-3алкілу; 1 2 3 4 5 5 X , X , X , X незалежно являють собою C(R ), де кожен R вибраний з водню та галогену; 2 UA 109687 C2 5 10 15 20 25 30 35 40 45 50 L являє собою зв'язок або -NHCO-; Ar являє собою арил або гетероарил; де арил являє собою феніл або феніл, заміщений одним або двома замісниками, вибраними з групи, що складається з галогену, ціано, C1-3алкілу, C1-3алкілоксі та полігалоген-C1-3алкілоксі; гетероарил вибраний із групи, що складається з піридилу, піримідилу й піразинілу, при цьому кожен необов'язково заміщений одним або двома замісниками, вибраними з групи, що складається з галогену, ціано, C1-3алкілу, C1-3алкілоксі та полігалоген-C1-3алкілоксі; або її сіль приєднання або сольват. 1 2 3 В іншому варіанті здійснення даного винаходу R , R та R являють собою водень; 1 X являє собою CF; 2 3 4 X , X , X являють собою CH; L являє собою зв'язок або -NHCO-; Ar являє собою арил або гетероарил; де арил являє собою феніл, заміщений хлором; гетероарил вибраний із групи, що складається з піридилу й піримідилу, при цьому кожен необов'язково заміщений одним або двома замісниками, вибраними з групи, що складається з хлору, фтору, ціано, метилу та метоксі; або її сіль приєднання або сольват. 4 В іншому варіанті здійснення атом вуглецю, заміщений R , характеризується Rконфігурацією. 1 3 2 У варіанті здійснення даного винаходу R і R являють собою водень, R являє собою водень, фтор або трифторметил; 4 R являє собою метил або дифторметил; 1 X являє собою СН або CF; 2 3 4 X , X та X являють собою CH; L являє собою -NHCO-; Ar являє собою 5-хлорпіридин-2-іл, 5-ціанопіридин-2-іл, 5-фторпіридин-2-іл, 5-ціано-3фторпіридин-2-іл, 5-метоксипіразин-2-іл або 1-дифторметилпіразол-3-іл; або її сіль приєднання або сольват. ВИЗНАЧЕННЯ "Галоген" буде позначати фтор, хлор та бром; "C 1-3алкіл" буде позначати насичену алкільну групу з прямим або розгалуженим ланцюгом з 1, 2 або 3 атомами вуглецю, наприклад, метил, етил, 1-пропіл та 2-пропіл; "C1-3алкілоксі" буде позначати ефірний радикал, де C 1-3алкіл визначений вище; "моно- та полігалоген-C1-3алкіл" будуть позначати C1-3алкіл, визначений вище, заміщений 1, 2, 3 або, за наявності можливості, більшою кількістю атомів галогенів, визначених вище; "моно- та полігалоген-C1-3алкілоксі" будуть позначати ефірний радикал, де моно- та полігалоген-C1-3алкіл визначені вище; "C3-6циклоалкіл" буде позначати циклопропіл, циклобутил, циклопентил та циклогексил; "C3-6циклоалкандіїл" буде позначати бівалентний радикал, такий як циклопропандіїл, циклобутандіїл, циклопентандіїл та циклогександіїл. Застосовуваний в даному документі вираз "суб'єкт" стосується тварини, переважно ссавця, найпереважніше людини, яка є або була об'єктом лікування, спостереження або експерименту. Застосовуваний в даному документі вираз "терапевтично ефективна кількість" означає таку кількість активної сполуки або фармацевтичного засобу, яка спричиняє біологічний або медичний ефект у тканинній системі, у тварини або людини, якого бажає дослідник, ветеринар, лікар або інший клініцист, що включає полегшення симптомів захворювання або розладу, лікування якого здійснюється. Застосовуваний в даному документі вираз "композиція", як передбачається, охоплює продукт, що містить певні інгредієнти в певних кількостях, а також будь-який продукт, який є результатом, безпосередньо або опосередковано, комбінацій певних інгредієнтів у певних кількостях. Вище та нижче в даному документі під виразом "сполука формули (I)" слід розуміти таку, що включає її солі приєднання, сольвати та стереоізомери. Вирази "стереоізомери" або "стереохімічно ізомерні форми" вище або нижче в даному документі застосовуються взаємозамінно. Сполуки формули (I) співіснують у динамічній рівновазі зі сполуками формули (I-1), 3 UA 109687 C2 R2 1 R R2 R3 R1 N R3 N R4 X4 4 H 2N R 4 X N 1 X L X HN Ar 3 X X2 (I-1) 10 15 20 25 30 35 40 45 50 L Ar X3 1 (I) 5 N H X2 . Даний винахід включає всі стереоізомери сполуки формули (I) або як чистий стереоізомер, або як суміш двох або більше стереоізомерів. Енантіомери є стереоізомерами, які являють собою дзеркальні відображення один одного, що не збігаються під час накладанні. Суміш пари енантіомерів за співвідношення 1:1 являє собою рацемат або рацемічну суміш. Діастереомери (або діастереоізомери) являють собою стереоізомери, які не є енантіомерами, тобто вони не співвідносяться як дзеркальні відображення. Якщо сполука містить подвійний зв'язок, замісники можуть перебувати в E- або Z-конфігурації. Якщо сполука містить двозаміщену циклоалкільну групу, замісники можуть перебувати в цис- або транс-конфігурації. Отже, даний винахід включає енантіомери, діастереомери, рацемати, E-ізомери, Z-ізомери, цис-ізомери, транс-ізомери та їхні суміші. Абсолютна конфігурація визначається згідно системи за Каном-Інгольдом-Прелогом. Конфігурація при асиметричному атомі визначається або як R, або як S. Розчинені сполуки, абсолютна конфігурація яких невідома, можна позначити (+) або (-) залежно від напрямку, у якому вони обертають плоскополяризоване світло. Якщо визначено конкретний стереоізомер, це означає, що зазначений стереоізомер, по суті, є відділеним, тобто асоційованим з менше 50 %, переважно менше 20 %, більш переважно менше 10 %, ще більш переважно менше 5 %, зокрема, менше 2 % та найбільш переважно менше 1 % інших ізомерів. Таким чином, якщо сполуку формули (I), наприклад, визначено як (R), це означає, що дана сполука, по суті, відділена від (S)-ізомеру; якщо сполуку формули (I), наприклад, визначено як E, це означає, що дана сполука, по суті, відділена від Z-ізомеру; якщо сполуку формули (I), наприклад, визначено як цис-, це означає, що дана сполука, по суті, відділена від транс-ізомеру. Крім того, деякі кристалічні форми сполук згідно з даним винаходом можуть існувати у формі поліморфів, і в якості таких передбачається їх включення у даний винахід. До того ж, деякі сполуки згідно з даним винаходом можуть утворювати сольвати з водою (тобто гідрати) або звичайними органічними розчинниками, і такі сольвати, як передбачається, також охоплені обсягом даного винаходу. Стосовно застосування в медицині, солі сполук згідно з даним винаходом належать до нетоксичних "фармацевтично прийнятних солей". Однак можуть бути придатними при отриманні сполук згідно з даним винаходом або їхніх фармацевтично прийнятних солей інші солі. Придатні фармацевтично прийнятні солі сполук включають солі приєднання кислоти, які, наприклад, можуть утворюватися при змішуванні розчину сполуки з розчином фармацевтично прийнятної кислоти, такої як соляна кислота, сірчана кислота, фумарова кислота, малеїнова кислота, бурштинова кислота, оцтова кислота, бензойна кислота, лимонна кислота, винна кислота, вугільна кислота або фосфорна кислота. Крім того, якщо сполуки згідно з даним винаходом несуть кислотний фрагмент, їхні придатні фармацевтично прийнятні солі можуть включати солі лужних металів, наприклад, солі натрію або калію; солі лужноземельних металів, наприклад, солі кальцію або магнію; і солі, утворені з придатними органічними лігандами, наприклад, солі четвертинного амонію. Типові кислоти, які можна застосовувати при отриманні фармацевтично прийнятних солей, без обмеження включають наступні: оцтову кислоту, 2,2-дихлороцтову кислоту, ациловані амінокислоти, адипінову кислоту, альгінову кислоту, аскорбінову кислоту, L-аспарагінову кислоту, бензолсульфонову кислоту, бензойну кислоту, 4-ацетамідобензойну кислоту, (+)камфорну кислоту, камфорсульфонову кислоту, капринову кислоту, капронову кислоту, каприлову кислоту, коричну кислоту, лимонну кислоту, цикламову кислоту, етан-1,2дисульфонову кислоту, етансульфонову кислоту, 2-гідроксіетансульфонову кислоту, мурашину кислоту, фумарову кислоту, галактарову кислоту, гентизинову кислоту, глюкогептонову кислоту, D-глюконову кислоту, D-глюкоронову кислоту, L-глутамінову кислоту, бета-оксоглутарову кислоту, гліколеву кислоту, гіпурову кислоту, бромистоводневу кислоту, соляну кислоту, (+)-Lмолочну кислоту, (±)-DL-молочну кислоту, лактобіонову кислоту, малеїнову кислоту, (-)-Lяблучну кислоту, малонову кислоту, (±)-DL-мигдалеву кислоту, метансульфонову кислоту, 4 UA 109687 C2 5 10 15 20 25 30 нафталін-2-сульфонову кислоту, нафталін-1,5-дисульфонову кислоту, 1-гідрокси-2-нафтойну кислоту, нікотинову кислоту, азотну кислоту, олеїнову кислоту, оротову кислоту, щавлеву кислоту, пальмітинову кислоту, памову кислоту, фосфорну кислоту, L-піроглутамінову кислоту, саліцилову кислоту, 4-аміносаліцилову кислоту, себацинову кислоту, стеаринову кислоту, бурштинову кислоту, сірчану кислоту, танінову кислоту, (+)-L-винну кислоту, тіоціанову кислоту, п-толуолсульфонову кислоту, трифторметилсульфонову кислоту та ундециленову кислоту. Типові основи, які можна застосовувати при отриманні фармацевтично прийнятних солей, без обмеження включають наступні: аміак, L-аргінін, бенетамін, бензатин, гідроксид кальцію, холін, диметилетаноламін, діетаноламін, діетиламін, 2-(діетиламіно)етанол, етаноламін, етилендіамін, N-метилглюкамін, гідрабамін, 1H-імідазол, L-лізин, гідроксид магнію, 4-(2-гідроксіетил)морфолін, піперазин, гідроксид калію, 1-(2-гідроксіетил)піролідин, вторинний амін, гідроксид натрію, триетаноламін, трометамін та гідроксид цинку. Хімічні назви сполук згідно з даним винаходом були утворені відповідно до правил номенклатури, ухвалених Хімічною реферативною службою. A. Отримання кінцевих сполук Експериментальна методика 1 Кінцеві сполуки згідно з формулою (I) можна отримати шляхом реакції проміжної сполуки формули (II) з відповідним джерелом аміаку, таким як, наприклад, хлорид амонію або водний аміак, згідно зі схемою реакції (1), при цьому реакція здійснюється в придатному реакційноінертному розчиннику, такому як, наприклад, вода або метанол, за температурних умов, таких як, наприклад, нагрівання реакційної суміші при 60-90ºC, наприклад, протягом 4-100 годин. На схемі реакції (1) усі змінні визначені як у формулі (I). Схема реакції 1 Експериментальна методика 2 Додатково, кінцеві сполуки згідно з формулою (I-a), де L являє собою -NHCO-, можна отримати шляхом реакції проміжної сполуки формули (III-а) з проміжним продуктом формули (IV) згідно зі схемою реакції (2), при цьому реакція здійснюється в придатному реакційноінертному розчиннику, такому як, наприклад, дихлорметан, в присутності конденсуючого засобу, такого як, наприклад, хлорид 4-(4,6-диметокси-1,3,5-триазин-2-іл)-4-метилморфолінію, за температурних умов, таких як, наприклад, нагрівання реакційної суміші при 25ºС, наприклад, протягом 2 годин. На схемі реакції (2) усі змінні визначені як у формулі (I). 2 3 R R 1 R 2 3 R R r H A O N 4 R 4 ( )O I V H 2 H N XN N 2 3 40 45 N 4 R H 4 r X NA H N N 2 3 1 X X2 (I ) IIa X 35 1 R 1 XO X2 ( ) I -a X Схема реакції 2 Експериментальна методика 3 Кінцеві сполуки згідно з формулою (I-b), де L являє собою зв'язок, можна отримати шляхом реакції проміжної сполуки формули (III-b) з проміжним продуктом формули (V) згідно зі схемою реакції (3), при цьому реакція здійснюється в придатному реакційно-інертному розчиннику або в суміші інертних розчинників, таких як, наприклад, 1,4-діоксан/етанол, в присутності придатної основи, такої як, наприклад, карбонат калію, каталізатора на основі комплексу Pd, такого як, наприклад, тетракіс(трифенілфосфін)паладій (0), за температурних умов, таких як, наприклад, нагрівання реакційної суміші при 80ºС, наприклад, протягом 20 годин або, наприклад, нагрівання реакційної суміші при 150ºC протягом від 10 хв. до 30 хв. під впливом мікрохвильового випромінювання. На схемі реакції (3) всі змінні визначені як у формулі (I), і W являє собою галоген. R6 та R7 можуть являти собою водень або алкіл або, взяті разом, можуть 5 UA 109687 C2 утворювати, наприклад, C(CH3)2C(CH3)2-. 2 R двовалентний радикал формули -СН2СН2-,-СН2СН2СН22 R 3 R або 3 R 6 1 R N H N N 2 4 R 4 X W O R A B r 7 R O () V 1 R N 4 R 4 X A r H N N 2 3 (I- ) IIb 5 10 15 20 25 30 35 3 1 X 2X X (-b I ) 1 X 2X X Схема реакції 3 Низка проміжних продуктів та вихідних матеріалів у наведених вище методиках отримання є відомими сполуками, які можна отримати згідно з відомими з рівня техніки методиками отримання зазначених або подібних сполук, і деякі проміжні продукти є новими. Низку таких способів отримання буде описано докладніше нижче в даному документі. B. Отримання проміжних сполук Експериментальна методика 4 Проміжні продукти згідно з формулою (III-а) можна отримати з відповідних проміжних сполук формули (III-b), дотримуючись відомих з рівня техніки методик сполучення за БухвальдомХартвігом, з наступним кислотним гідролізом згідно зі схемою реакції (4). Зазначене сполучення можна здійснювати шляхом обробки проміжних сполук формули (III-b) бензофеноніміном у придатному реакційно-інертному розчиннику, такому як, наприклад, толуол, в присутності придатної основи, такої як, наприклад, трет-бутоксид натрію, каталізатора на основі комплексу Pd, такого як трис(дибензиліденацетон)паладій (0), за температурних умов, таких як, наприклад, нагрівання реакційної суміші при 100 °C, наприклад, протягом 2 годин. Отриману проміжну сполуку формули (VI) згодом перетворюють на проміжну сполуку формули (III-а) за допомогою обробки сильною кислотою, такою як, наприклад, соляна кислота, у придатному реакційноінертному розчиннику, такому як, наприклад, ізопропіловий спирт, за температурних умов, таких як, наприклад, 25 °C, наприклад, протягом 1 години. В альтернативному випадку, проміжний продукт формули (III-а) можна отримати за один етап, починаючи з проміжного продукту формули (III-b), за допомогою каталізованого міддю сполучення в присутності азиду натрію, ліганду для міді, такого як N, N'-диметилетилендіамін, придатної основи, такої як карбонат натрію, у реакційно-інертному розчиннику, такому як DMSO, за температурних умов, таких як нагрівання реакційної суміші при 110ºC протягом 25 годин. На схемі реакції (4) усі змінні визначені як у формулі (I), і W являє собою галоген. Схема реакції 4 Експериментальна методика 5 Проміжні продукти згідно з формулою (VII) можна отримати з відповідних проміжних продуктів формули (VIII-c), дотримуючись відомих з рівня техніки методик відновлення нітрогрупи до аміногрупи, згідно зі схемою реакції (5). Наприклад, зазначене відновлення можна здійснювати за допомогою перемішування речовин, що беруть участь у реакції, або 6 UA 109687 C2 5 10 15 пропускання їх через проточний реактор в атмосфері водню та в присутності відповідного каталізатора, такого як, наприклад, паладій на вугіллі. Придатними розчинниками є, наприклад, вода, спирти, наприклад, метанол, етанол тощо, складні ефіри, наприклад, етилацетат тощо. Для підвищення швидкості зазначеної реакції відновлення може бути прийнятним підвищення температури та/або тиску в реакційній суміші. Небажаному додатковому гідруванню певних функціональних груп у речовинах, що беруть участь у реакції, та продуктах реакції можна запобігти шляхом додавання до реакційної суміші каталітичної отрути, такої як, наприклад, тіофен тощо. На схемі реакції (5) усі змінні визначені як у формулі (I). Схема реакції 5 Експериментальна методика 6 Проміжні сполуки формули (III-а) можна отримати з проміжних сполук формули (VII) згідно зі схемою реакції (6). Зазначене перетворення можна безперешкодно здійснювати за допомогою обробки зазначеного проміжного продукту джерелом аміаку, таким як, наприклад, хлорид амонію та етанольний аміак, за температурних умов, таких як, наприклад, нагрівання реакційної суміші при 80ºC, наприклад, протягом 72 годин. На схемі реакції (6) усі змінні визначені як у формулі (I). 2 R 1 R 2 R 3 R 1 R N 4 1 X N 4 R 4 H H N N X N 2 2 R 4 H S N X N 2 ( I) V I 3 R 3 X 2 X 1 X ( Ia I -) I 3 X 2 X Схема реакції 6 20 25 Експериментальна методика 7 Проміжний продукт формули (IX), де L являє собою -NHCO-, можна отримати шляхом реакції проміжної сполуки формули (VII) з проміжним продуктом формули (IV) згідно зі схемою реакції (7), при цьому реакція здійснюється в придатному реакційно-інертному розчиннику, такому як, наприклад, метанол, в присутності конденсуючого засобу, такого як, наприклад, хлорид 4-(4,6-диметокси-1,3,5-триазин-2-іл)-4-метилморфолінію, за температурних умов, таких як, наприклад, нагрівання реакційної суміші при 25ºС, наприклад, протягом 3 годин. На схемі реакції (7) усі змінні визначені як у формулі (I). 2 3 R R 1 R 2 3 R R r H A O N 4 R 4 ( )O I V H 2 SN XN 1 R N 4 R H 4 r X NA SN 3 (I V I ) 30 3 1 X X2 X () I X 1 XO X2 X Схема реакції 7 Експериментальна методика 8 Загалом, проміжні сполуки формул (III-b) та (III-C) можна отримати після етапів реакцій, показаних на схемах реакцій (8) та (9) нижче. 7 UA 109687 C2 5 10 15 20 Схема реакції 8 A: перетворення тіоаміду на амідин A’: перетворення метилтіогрупи на аміногрупу B: метилування за сіркою C: перетворення аміду на тіоамід (тіонування) D: циклізація E: вилучення будь-яких N-захисних груп Похідні амідину з вищевказаної схеми реакції (8) можна безперешкодно отримати з відповідних похідних тіоаміду, дотримуючись відомих з рівня техніки методик перетворення тіоаміду на амідин (етап реакції А). Зазначене перетворення можна безперешкодно здійснювати шляхом обробки зазначених тіоамідів джерелом аміаку, таким як, наприклад, хлорид амонію або водний аміак, у придатному реакційно-інертному розчиннику, такому як, наприклад, вода або метанол тощо, за температурних умов, таких як, наприклад, нагрівання реакційної суміші при 60-90ºC, наприклад, протягом 6-100 годин. За подібних умов метильовані проміжні продукти (VIII-b) та (VIII-c) також можна перетворювати на бажані амідини (етап реакції A"). Проміжні продукти (VIII-b) та (VIII-c) можна безперешкодно отримувати, починаючи з відповідних тіоамідів, розчинених у придатному розчиннику, такому як ацетон, в присутності основи, такої як карбонат калію, та метилюючого засобу, такого як метилйодид, за температурних умов, таких як кімнатна температура, протягом 3 годин (етап реакції В). Похідні тіоаміду з вищевказаної схеми реакції (8) можна отримати з похідних аміду, дотримуючись відомих з рівня техніки методик тіонування (етап реакції C). Зазначене 8 UA 109687 C2 5 10 15 20 25 перетворення можна безперешкодно здійснювати шляхом обробки зазначених амідів засобом для тіонування, таким як, наприклад, пентасульфід фосфору або 2,4-дисульфід 2,4-біс-(4метоксифеніл)-1,3-дитіа-2,4-дифосфетану [реагент Лавессона] в реакційно-інертному розчиннику, такому як, наприклад, тетрагідрофуран або 1,4-діоксан тощо, в присутності придатної основи, такої як піридин, за температурних умов, таких як, наприклад, нагрівання реакційної суміші при 50-100 °C, наприклад, протягом 24 годин. Похідні аміду формул (XI-b) та (XI-c) з вищевказаної схеми реакції (8) можна отримати з відповідних проміжних сполук формул (XII-b) та (XII-c), дотримуючись відомих з рівня техніки методик циклізації (етап реакції D). Зазначену циклізацію можна безперешкодно здійснювати шляхом обробки проміжних сполук формул (XII-b) та (XII-c) придатною основою, такою як ацетат калію або метоксид натрію, у придатному реакційному розчиннику, такому як, наприклад, етанол тощо, при від 55 °C до 100 °C протягом періоду часу, щоб забезпечити завершення реакції. Проміжні сполуки формул (XII-b) та (XII-c) з вищевказаної схеми реакції (8) можна отримати з відповідних проміжних сполук формул (XIII-b) та (XII-c) за допомогою вилучення захисної групи, здійснюваного згідно способів, відомих з рівня техніки. Експериментальна методика 9 Схема реакції 9 F: алкілування G: окиснення оксатіазолідину H: утворення оксатіазолідину Проміжні продукти згідно формул (XIII-b) та (XIII-c) у вищевказаній схемі реакції (9) можна 1 отримати з відповідних проміжних сполук формул (XV-b) та (XV-c), де Z являє собою захисну групу амінів, таку як, наприклад, трет-бутоксикарбонільна група, дотримуючись відомих з рівня 9 UA 109687 C2 5 10 15 20 25 30 35 40 45 50 техніки методик алкілування (етап реакції F). Зазначене алкілування можна безперешкодно здійснювати шляхом обробки (XV-b) та (XV-c), відповідно, відповідними проміжними сполуками формули (XIV) в присутності придатної основи, такої як, наприклад, карбонат натрію або карбонат цезію, у придатному інертному розчиннику, такому як, наприклад, N, Nдиметилформамід або диметоксисульфоксид, за низької температури, такої як, наприклад, 0 °C, протягом 30 хв., а згодом за помірно високої температури, такої як, наприклад, 100 °C, протягом від 24 годин до 100 годин або, наприклад, шляхом нагрівання реакційної суміші при 130 °C, наприклад, протягом від 30 хв. до 45 хв. під впливом мікрохвильового випромінювання. Проміжні продукти згідно з формулами (XV-b) та (XV-c) з вищевказаної схеми реакції (9) можна отримати шляхом реакції проміжних сполук формул (XVI-b) та (XVI-c), дотримуючись відомих з рівня техніки методик окиснення (етап реакції G). Зазначене окиснення можна безперешкодно здійснювати шляхом обробки відповідних проміжних сполук формул (XVI-b) та (XVI-c) окисником, таким як, наприклад, перйодат натрію, у придатному інертному розчиннику, такому як, наприклад, ацетонітрил/вода, в присутності хлориду рутенію (III) за помірно високої температури, такої як, наприклад, 25 °C, наприклад, протягом 2 годин. Проміжні продукти згідно з формулами (XVI-b) та (XVI-c) з наведеної вище схеми реакції (9) можна отримати шляхом реакції проміжних сполук формул (XVII-b) та (XVII-c), дотримуючись відомих з рівня техніки методик утворення сульфамідату (етап реакції H). Зазначене перетворення можна безперешкодно здійснювати шляхом обробки відповідних проміжних сполук формул (XVII-b) та (XVII-c) тіонілхлоридом в присутності основи, такої як, наприклад, піридин, у придатному реакційно-інертному розчиннику, такому як, наприклад, ацетонітрил, за низької температури, такої як, наприклад, -40 °C, наприклад, протягом 30 хв., а згодом за помірно високої температури, такої як, наприклад, 25 °C, наприклад, протягом 24-72 годин. 1 Проміжні сполуки формул (XVII-b) та (XVII-c), де Z являє собою захисну групу амінів, таку як, наприклад, трет-бутоксикарбонільна група, загалом можна отримати, дотримуючись відомих з рівня техніки методик за Штрекером, описаних у літературі. Експериментальна методика 10 Проміжні сполуки формули (XVIII), де Q являє собою галоген або нітро, можна отримати з проміжних сполук формул (XI-b) або (XI-c) згідно зі схемою реакції (14), при цьому реакція здійснюється в придатному реакційно-інертному розчиннику, такому як, наприклад, дихлорметан, в присутності метилюючого засобу, такого як, наприклад, тетрафторборат триметилоксонію, за температурних умов, таких як, наприклад, при 25ºC, наприклад, протягом 4 діб. Проміжний продукт (XVIII) можна перетворювати надалі на амідини (III-b) та (III-c) шляхом реакції з джерелом аміаку, таким як, наприклад, хлорид амонію та етанольний аміак, за температурних умов, таких як, наприклад, нагрівання реакційної суміші при 80 °C, наприклад, протягом 36 годин. У схемі реакції (10) всі змінні визначені як у формулі (I), і Q являє собою галоген або нітро. Схема реакції 10 ФАРМАКОЛОГІЯ Сполуки згідно з даним винаходом та їх фармацевтично прийнятні композиції інгібують BACE і у зв'язку з цим можуть бути придатними при лікуванні або попередженні хвороби Альцгеймера (AD), помірного когнітивного порушення (MCI), згасання, деменції, деменції з тільцями Леві, церебральної амілоїдної ангіопатії, мультиінфарктної деменції, синдрому Дауна, деменції, асоційованої з хворобою Паркінсона, та деменції, асоційованої з бета-амілоїдом. Даний винахід стосується сполуки згідно із загальною формулою (I), її стереоізомерної форми, або її фармацевтично прийнятної солі приєднання кислоти або основи, або сольвату для застосування в якості лікарського препарату. Даний винахід також стосується сполуки згідно із загальною формулою (I), її стереоізомерної форми, або її фармацевтично прийнятної солі приєднання кислоти або основи, або сольвату для застосування при лікуванні або попередженні захворювань або станів, 10 UA 109687 C2 5 10 15 20 25 30 35 40 45 50 55 60 вибраних з групи, що складається з AD, MCI, згасання, деменції, деменції з тільцями Леві, церебральної амілоїдної ангіопатії, мультиінфарктної деменції, синдрому Дауна, деменції, асоційованої з хворобою Паркінсона, та деменції, асоційованої з бета-амілоїдом. Даний винахід також стосується застосування сполуки згідно із загальною формулою (I), її стереоізомерної форми, або її фармацевтично прийнятної солі приєднання кислоти або основи, або сольвату для отримання лікарського препарату для лікування або попередження будь-яких хворобливих станів, згаданих вище в даному документі. Беручи до уваги корисність сполуки формули (I), передбачається спосіб лікування теплокровних тварин, у тому числі людей, які страждають будь-якими захворюваннями, згаданими вище в даному документі, або спосіб попередження таких у теплокровних тварин, у тому числі людей. Зазначені способи включають уведення, тобто системне або місцеве введення, переважно пероральне введення, ефективної кількості сполуки формули (I), її стереоізомерної форми, її фармацевтично прийнятної солі приєднання або сольвату теплокровній тварині, у тому числі людині. Спосіб лікування також може включати введення активного інгредієнта за схемою від одного до чотирьох прийомів на добу. У даних способах лікування сполуки згідно з даним винаходом зазвичай виготовляють до введення. Описані в даному документі нижче придатні фармацевтичні склади отримані за допомогою відомих методик із застосуванням добре відомих та легкодоступних інгредієнтів. Сполуки згідно з даним винаходом, які можуть бути придатними для лікування або попередження хвороби Альцгеймера або її симптомів, можна вводити окремо або в комбінації з одним або декількома додатковими терапевтичними засобами. Комбінована терапія включає введення одного фармацевтичного дозованого складу, який містить сполуку формули (I) та один або декілька додаткових терапевтичних засобів, а також введення сполуки формули (I) та кожного додаткового терапевтичного засобу в їх власному окремому фармацевтичному дозованому складі. Наприклад, сполуку формули (I) і терапевтичний засіб можна вводити пацієнтові разом в одній пероральній дозованій композиції, такій як таблетка або капсула, або кожний засіб можна вводити в окремих пероральних дозованих складах. ФАРМАЦЕВТИЧНІ КОМПОЗИЦІЇ Даний винахід також передбачає композиції для попередження або лікування захворювань, при яких є доцільним інгібування бета-секретази, таких як хвороба Альцгеймера (AD), помірне когнітивне порушення, згасання, деменція, деменція з тільцями Леві, синдром Дауна, деменція, асоційована з інсультом, деменція, асоційована з хворобою Паркінсона, та деменція, асоційована з бета-амілоїдом. Зазначені композиції містять терапевтично ефективну кількість сполуки згідно з формулою (I) та фармацевтично прийнятний носій або розріджувач. Незважаючи на те, що активний інгредієнт можна вводити окремо, краще надавати його у формі фармацевтичної композиції. Відповідно, даний винахід також передбачає фармацевтичну композицію, що містить сполуку згідно з даним винаходом разом з фармацевтично прийнятним носієм або розріджувачем. Носій або розріджувач повинен бути "прийнятним" у сенсі сумісності з іншими інгредієнтами композиції та нешкідливим для тих, хто його отримує. Фармацевтичні композиції згідно з даним винаходом можна отримати за допомогою будьяких способів, добре відомих в галузі фармації. Терапевтично ефективну кількість певної сполуки, у формі основи або у формі солі приєднання, в якості активного інгредієнту об'єднують в однорідну суміш з фармацевтично прийнятним носієм, що може набувати великої різноманітності форм залежно від форми препарату, необхідного для введення. Бажано, щоб ці фармацевтичні композиції перебували в одиничній лікарській формі, придатній, переважно, для системного введення, такого як пероральне введення, введення через шкіру або парентеральне введення; або місцевого введення, такого як за допомогою інгаляції, назального спрея, крапель для очей або за допомогою крему, гелю, шампуню тощо. Наприклад, при отриманні композицій у пероральній лікарській формі можна використовувати будь-яке зі звичайних фармацевтичних середовищ, таких як, наприклад, вода, гліколі, олії, спирти тощо у випадку пероральних рідких препаратів, таких як суспензії, сиропи, еліксири та розчини; або тверді носії, такі як крохмалі, цукри, каолін, змащувальні речовини, зв'язувальні речовини, речовини, які покращують розпадання тощо у випадку порошків, пігулок, капсул і таблеток. Зважаючи на простоту їх введення, таблетки та капсули являють собою найбільш придатну пероральну одиничну лікарську форму, при цьому, зрозуміло, використовуються тверді фармацевтичні носії. Що стосується парентеральних композицій, то носій, як правило, буде включати стерильну воду, щонайменше більшою мірою, хоча можна включити інші інгредієнти, наприклад для того, щоб сприяти розчинності. Наприклад, можна отримати розчини для ін'єкцій, 11 UA 109687 C2 5 10 15 20 25 30 35 40 45 50 55 60 у яких носій включає сольовий розчин, розчин глюкози або суміш сольового розчину та розчину глюкози. Також можна отримати суспензії для ін'єкцій, при цьому можна використовувати придатні рідкі носії, засоби, що суспендують, тощо. У композиціях, придатних для введення через шкіру, носій необов'язково включає засіб, який підсилює проникнення, та/або придатний змочувальний засіб, необов'язково в комбінації з придатними добавками будь-якої природи в незначних кількісних співвідношеннях, при цьому такі добавки не призводять до будь-яких значних шкідливих ефектів стосовно шкіри. Зазначені добавки можуть полегшувати нанесення на шкіру та/або можуть бути корисними для отримання необхідних композицій. Ці композиції можна наносити різними способами, наприклад, у формі трансдермального пластиру, шляхом точкового нанесення або у формі мазі. Особливо доцільно складати вищезгадані фармацевтичні композиції в одиничні лікарські форму для простоти введення та однорідності дозування. Одинична лікарська форма, як застосовується в описі та формулі винаходу даного документа, стосується цілком дискретних одиниць, придатних в якості одиничних дозувань, при цьому кожна одиниця містить попередньо визначену кількість активного інгредієнта, розраховану так, щоб отримати бажаний терапевтичний ефект, разом з необхідним фармацевтичним носієм. Прикладами таких одиничних лікарських форм є таблетки (у тому числі таблетки, які можна розділити, або покриті таблетки), капсули, пігулки, пакети з порошком, облатки, розчини для ін'єкцій або суспензії, чайні ложки, столові ложки тощо та їх окремі множини. Точне дозування та частота введення залежить від конкретної застосовуваної сполуки формули (I), конкретного стану, лікування якого здійснюється, тяжкості стану, лікування якого здійснюється, віку, ваги, статі, ступеня розладу та загального фізичного стану конкретного пацієнта, а також від інших лікарських препаратів, які може приймати особа, що є добре відомим фахівцям у даній галузі. Крім того, очевидно, що зазначену ефективну добову кількість можна зменшити або збільшити залежно від реакції суб'єкта, що зазнає лікування, та/або залежно від оцінки лікаря, який назначає сполуки згідно з даним винаходом. Залежно від способу введення фармацевтична композиція буде містити 0,05-99 % за вагою, переважно 0,1-70 % за вагою, більш переважно 0,1-50 % за вагою активного інгредієнта та 199,95 % за вагою, переважно 30-99,9 % за вагою, більш переважно 50-99,9 % за вагою фармацевтично прийнятного носія, при цьому всі відсотки основані на загальній вазі композиції. Дані сполуки можна застосовувати для системного введення, такого як пероральне введення, введення через шкіру або парентеральне введення; або місцевого введення, такого як за допомогою інгаляції, назального спрея, крапель для очей або за допомогою крему, гелю, шампуню тощо. Сполуки переважно вводять перорально. Точне дозування та частота введення залежать від конкретної застосовуваної сполуки згідно з формулою (I), конкретного стану, лікування якого здійснюється, тяжкості стану, лікування якого здійснюється, віку, ваги, статі, ступеня розладу та загального фізичного стану конкретного пацієнта, а також від інших лікарських препаратів, які може приймати особа, що є добре відомим фахівцям у даній галузі. Крім того, очевидно, що зазначену ефективну добову кількість можна зменшити або збільшити залежно від реакції суб'єкта, що зазнає лікування, та/або залежно від оцінки лікаря, який назначає сполуки згідно з даним винаходом. Кількість сполуки формули (I), яку можна об'єднати з матеріалом носія для отримання однієї лікарської форми, буде варіювати залежно від захворювання, лікування якого здійснюється, виду ссавців і конкретного способу введення. Однак, як загальна вказівка, придатні стандартні дози стосовно сполук згідно з даним винаходом можуть містити, наприклад, переважно від 0,1 мг до приблизно 1000 мг активної сполуки. Доцільна стандартна доза становить від 1 мг до приблизно 500 мг. Більш доцільна стандартна доза становить від 1 мг до приблизно 300 мг. Ще більш доцільна стандартна доза становить від 1 мг до приблизно 100 мг. Такі стандартні дози можна вводити частіше одного разу на добу, наприклад, 2, 3, 4, 5 або 6 разів на добу, але доцільно 1 або 2 рази на добу, щоб сумарне дозування для дорослої людини вагою 70 кг перебувало в діапазоні від 0,001 до приблизно 15 мг на кг ваги суб'єкта за прийом. Доцільне дозування становить від 0,01 до приблизно 1,5 мг на кг ваги суб'єкта за прийом, і така терапія може тривати протягом декількох тижнів або місяців і, у деяких випадках, може тривати роками. Однак буде зрозуміло, що певний рівень дози для будь-якого конкретного пацієнта буде залежати від різних чинників, у тому числі активності певної використаної сполуки, віку, ваги тіла, загального стану здоров'я, статі та харчування особи, що зазнає лікування; часу та шляху введення; швидкості екскреції; інших лікарських засобів, уведення яких здійснювалося раніше; та тяжкості конкретного захворювання, терапія якого здійснюється, що є добре зрозумілим для фахівців у даній галузі. Фахівцям у даній галузі буде очевидно, що в деяких випадках може бути необхідним 12 UA 109687 C2 5 10 15 20 25 30 35 застосовувати дозування поза цими діапазонами. Крім того, слід зазначити, що клініцист або лікар буде знати, як і коли починати, переривати, коригувати або завершувати терапію відповідно до індивідуальної реакції пацієнта. Наступні приклади призначені для ілюстрування, а не для обмеження обсягу даного винаходу. Експериментальна частина Нижче в даному документі вираз "AcOH" означає оцтову кислоту, "AcOEt" означає етилацетат, "DCM" означає дихлорметан, "DIPE" означає діізопропіловий ефір, "DMF" означає N, N-диметилформамід, "DMSO" означає диметилсульфоксид, "Et 2O" означає діетиловий ефір, "Et3N" означає триетиламін, "EtOH" означає етанол, "MeCN" означає ацетонітрил, "DCE" означає 1,2-дихлоретан, "MeOH" означає метанол, "т. п." означає точку плавлення, "рац" означає рацемічний, "Rt" означає час утримування, "THF" означає тетрагідрофуран, "K2CO3" означає карбонат калію, "NH3" означає аміак, "NH4Cl" означає хлорид амонію, "HCl" означає соляну кислоту, "Na2SO4" означає сульфат натрію, "NaHCO3" означає бікарбонат натрію, "KHSO4" означає гідросульфат калію, "MgSO 4" означає сульфат магнію, "H2O" означає воду, "TFA" означає трифтороцтову кислоту, "насич." означає насичений, "водн." означає водний, "хв." означає хвилини, "Pd2(dba)3" означає трис(дибензиліденацетон)дипаладій (0), "Pd(Pph 3)4" означає тетракіс(трифенілфосфін)паладій (0), "BINAP" означає 2,2'-біс(дифенілфосфін)-1,1'бінафтил, "TBAF" означає фторид тетрабутиламонію, "NaH" означає гідрид натрію, "DDQ" означає 2,3-дихлор-5,6-диціано-1,4-бензохінон, "DBU" означає 1,8-діазабіцикло[5.4.0]ундец-7ен. Реакції під впливом мікрохвильового випромінювання здійснювали в однорежимному TM реакторі: мікрохвильовому реакторі Emrys Optimizer (Personal Chemistry A.B., нині Biotage). Реакції гідрування здійснювали в гідрогенізаторі з безперервним потоком H-CUBE® від ThalesNano Nanotechnology Inc. Тонкошарову хроматографію (TLC) здійснювали на пластинах F254 із силікагелем 60 (Merck) із застосуванням чистих для аналізу розчинників. Хроматографію на відкритих колонках здійснювали на силікагелі, розмір частинок 60 Ǻ, меш = 230-400 (Merck), за допомогою стандартних методик. Колонкову флеш-хроматографію здійснювали із застосуванням легко приєднуваних картриджів від Merck на неоднорідному силікагелі, розмір частинок 15-40 мкм (одноразові флеш-колонки з нормальним шаром), на системі SPOT або LAFLASH від Armen Instrument. Оптичні обертання вимірювали на поляриметрі Perkin-Elmer 341 з натрієвою лампою та представляли, як зазначено нижче: [α]º (λ, к. г/100 мл, розчинник, TºC). A. Отримання проміжних продуктів Приклад A1 Отримання проміжного продукту A1 N NH 2 Br 40 45 50 Триметилсилілціанід (20 г, 200 ммоль) додали до перемішаного розчину 3бромацетофенону (20 г, 100 ммоль) та NH4Cl (11 г, 200 ммоль) в NH3/MeOH (400 мл). Суміш перемішували при кімнатній температурі протягом 4 діб. Згодом випарили розчинник in vacuo, а залишок поглинули AcOEt (100 мл). Тверду речовину відфільтрували та фільтрат випарили in vacuo з отриманням проміжного продукту A1 (20 г, вихід 86 %), який застосовували на наступному етапі без додаткового очищення. Приклад A2 Отримання проміжного продукту A2 O H O N 2 Br Проміжний продукт A1 (20 г, 88,9 ммоль) розчинили в HCl/MeOH (500 мл). Суміш нагрівали зі зворотним холодильником протягом 4 діб. Після охолодження до кімнатної температури додали AcOEt (100 мл) та H2O (100 мл) і суміш екстрагували за допомогою AcOEt (2 × 100 мл). Основність об'єднаних водн. шарів підвищили за допомогою водн. розчину NH 3 до pH=8 і ці 13 UA 109687 C2 5 10 шари екстрагували за допомогою AcOEt (5 × 100 мл). Об'єднані органічні шари висушили (Na2SO4), відфільтрували та випарили розчинники in vacuo з отриманням проміжного продукту A2 (10,6 г, вихід 46 %) у формі масла. Наступний проміжний продукт отримали згідно з методиками синтезу, описаними в прикладах А1-А2. Приклад A3 Отримання проміжного продукту A3 O OH N O 2 N+ -O Із рац-2-аміно-2-(3-нітрофеніл)пропіонітрилу. Колонкова флеш-хроматографія (силікагель; AcOEt у петролейному ефірі від 1/10 до 1/4) з отриманням проміжного продукту 3 (вихід 63 %). Приклад A4 Отримання проміжного продукту A4 H O H N 2 Br 15 20 25 30 Алюмогідрид літію (1 М в THF, 22 мл, 22 ммоль) краплинами додали до перемішаного розчину проміжного продукту A2 (7,5 г, 29,1 ммоль) в THF (200 мл) при -15ºC. Отриману суміш залишили повільно нагріватися до 0ºC протягом 1 години. Додали більше THF (150 мл) і насич. розчин Na2SO4 краплинами додавали до припинення утворення водню. Додали безводний Na2SO4 та забезпечили перемішування реакційної суміші протягом ночі при кімнатній температурі. Суміш відфільтрували через діатомову землю, промили THF і випарили розчинник in vacuo. Неочищений продукт очистили за допомогою колонкової флеш-хроматографії (силікагель; 7 М розчин NH3 в МеОН в DCM від 0/100 до 3/97). Зібрали необхідні фракції та випарили розчинники in vacuo з отриманням проміжного продукту А4 (5,70 г, вихід 85 %) у формі масла. Приклад A5 Отримання проміжного продукту A5 H O OH N 2 N + O Борогідрид натрію (16,3 г, 429,4 ммоль) порціями додали до перемішаного розчину проміжного продукту A3 (48,3 г, 214,7 ммоль) в MeOH (500 мл). Суміш перемішували при кімнатній температурі протягом 10 годин. Випарили розчинник in vacuo. Основність залишку підвищили за допомогою насич. водн. розчину NaHCO 3 до рН = 9 і цей залишок екстрагували за допомогою AcOEt (3 × 200 мл). Органічні шари висушили (Na 2SO4), відфільтрували та випарили розчинники in vacuo з отриманням проміжного продукту А5 (30,26 г, вихід 72 %). Приклад A6 Отримання проміжного продукту A6 O HN Br 35 40 O H O Хлористий бензоїл (4,66 мл, 32,6 ммоль) порціями додали до перемішаного розчину проміжного продукту A4 (5 г, 21,73 ммоль) у суміші насич. NaHCO 3 (10 мл) і THF (10 мл) при 0ºC. Суміш перемішували при 0ºC протягом 10 хв. та при кімнатній температурі протягом 15 годин. Суміш охолодили на крижаній/H2O бані та підвищили її кислотність при перемішуванні до pH=12 за допомогою KHSO4. Органічний шар відокремили та водн. шар згодом екстрагували за допомогою AcOEt. Об'єднані органічні шари відокремили, висушили (MgSO 4), відфільтрували та випарили розчинники in vacuo. Неочищений продукт очистили за допомогою колонкової флеш 14 UA 109687 C2 5 хроматографії (силікагель; AcOEt в DCM від 0/100 до 20/80). Зібрали необхідні фракції та концентрували in vacuo з отриманням проміжного продукту A6 (7,8 г, вихід 98 %) у формі безбарвного масла. Приклад A7 Отримання проміжного продукту A7 O S N O O 10 15 Br O Розчин проміжного продукту А6 (8 г, 21,9 ммоль) у сухому MeCN (20 мл) краплинами додали до перемішаного розчину тіонілхлориду (4,01 мл, 54,9 ммоль) у сухому MeCN (100 мл), охолодженому до -40С, та в атмосфері азоту. Реакційну суміш перемішували протягом 60 хв. при -40C перед додаванням піридину (8,84 мл, 109,8 ммоль). Забезпечили нагрівання реакційної суміші до кімнатної температури та перемішували протягом 14 годин. Випарили розчинник in vacuo. Залишок обробили Et2O, і відфільтрували тверді речовини, і фільтрат концентрували in vacuo з отриманням проміжного продукту A7 (8 г, вихід 89 %) у формі блідожовтого масла. Цей продукт застосовували в наступній реакції без додаткового очищення. Приклад A8 Отримання проміжного продукту A8 O O S O N O 20 25 Br O Хлорид рутенію (III) (41 мг, 0,195 ммоль) додали до суміші проміжного продукту A7 (8 г, 19,5 ммоль) в MeCN/H2O (1:1) (210 мл) при 0 °C з наступним додаванням перйодату натрію (6,26 г, 29,25 ммоль). Забезпечили нагрівання реакційної суміші до кімнатної температури та перемішували її протягом 2 годин. Суміш розвели AcOEt, відфільтрували через діатомову землю та промили AcOEt. До фільтрату додали H2O та AcOEt. Органічний шар відокремили, висушили (MgSO4), відфільтрували та випарили розчинники in vacuo. Продукт очистили за допомогою колонкової флеш-хроматографії (силікагель; DCM). Зібрали необхідні фракції та концентрували in vacuo з отриманням проміжного продукту A8 (8 г, вихід 96 %) у формі блідожовтого масла. Приклад A9 Отримання проміжного продукту A9 O -O N+ HN O O 30 35 40 H O Ди-трет-бутилдикарбонат (10 г, 45,87 ммоль) порціями додали до перемішаного розчину проміжного продукту A5 (3 г, 15,29 ммоль) у суміші насич. NaHCO 3 (50 мл) та THF (50 мл) при 0ºC. Суміш перемішували при 0ºC протягом 10 хв. та при кімнатній температурі протягом 15 годин. Суміш охолодили на крижаній/H2O бані та підвищили її кислотність при перемішуванні до pH=1-2 за допомогою KHSO4. Органічний шар відокремили, а водн. шар згодом екстрагували за допомогою AcOEt. Об'єднані органічні шари відокремили, висушили (MgSO 4), відфільтрували та випарили розчинники in vacuo. Неочищений продукт очистили за допомогою колонкової флешхроматографії (силікагель; AcOEt в DCM від 0/100 до 100/0). Зібрали необхідні фракції та концентрували in vacuo з отриманням проміжного продукту A6 (4,5 г, вихід 99 %) у формі блідожовтого масла, яка затвердла під час витримування. Приклад A10 Отримання проміжного продукту A10 15 UA 109687 C2 O S N O O 5 10 15 20 25 30 ON+ O O Розчин проміжного продукту A9 (4,5 г, 15,18 ммоль) у сухому MeCN (20 мл) краплинами додали до перемішаного розчину тіонілхлориду (2,771 мл, 37,96 ммоль) у сухому MeCN (80 мл), охолодженому до -40 °C, та в атмосфері азоту. Реакційну суміш перемішували протягом 30 хв. при -40ºC перед додаванням піридину (6,12 мл, 75,93 ммоль). Забезпечили нагрівання реакційної суміші до кімнатної температури та перемішували її протягом 18 годин. Випарили розчинник in vacuo. Залишок обробили Et2O. Тверді частинки відфільтрували та фільтрат концентрували in vacuo з отриманням проміжного продукту А10 (4,8 г, вихід 92 %) у формі масла. Цей продукт застосовували в наступній реакції без додаткового очищення. Приклад A11 Отримання проміжного продукту A11 O O S O N O O N+ O OХлорид рутенію (III) (29,5 мг, 0,14 ммоль) додали до суміші проміжного продукту А10 (4,8 г, 14,02 ммоль) в MeCN/H2O (1:1) (100 мл) при 0С з наступним додаванням перйодату натрію (4,5 г, 21,03 ммоль). Забезпечили нагрівання реакційної суміші до кімнатної температури та перемішували її протягом 2 годин. Суміш розвели AcOEt, відфільтрували через діатомову землю та промили AcOEt. До фільтрату додали H 2O та сольовий розчин. Органічний шар відокремили, висушили (MgSO4), відфільтрували та випарили розчинники in vacuo. Продукт очистили за допомогою колонкової флеш-хроматографії (силікагель; DCM). Зібрали необхідні фракції та концентрували in vacuo з отриманням проміжного продукту А11 (4,9 г, вихід 97 %) у формі блідо-жовтого масла. Проміжний продукт А12 отримали згідно з методиками синтезу, описаними у прикладах A9A11. Приклад A12 Отримання проміжного продукту A12: (R)-[3-(трет-бутилоксикарбоніл)-4-(5-бром-2фторфеніл)-4-метил-[1,1,3]оксатіазолідин-2,2-діоксиду Отримали з (R)-[3-(трет-бутилоксикарбоніл)-4-(5-бром-2-фторфеніл)-4-метил-[1,1,3]оксатіазолідин-2-оксиду (14,5 г, 36,79 ммоль). Колонкова флеш-хроматографія (силікагель; DCM) з отриманням проміжного продукту А12 у формі білої твердої речовини (11,6 г, вихід 77 %). Приклад A13 Отримання проміжного продукту A13 16 UA 109687 C2 Br N O 5 10 O NH O O Карбонат цезію (3,06 г, 9,83 ммоль) додали до суміші проміжного продукту А8 (2 г, 4,69 ммоль) та етилового ефіру 1H-пірол-2-карбонової кислоти (763 мг, 6,1 ммоль) в MeCN (16 мл) при кімнатній температурі. Суміш нагрівали при 130ºC протягом 30 хв. під впливом мікрохвильового випромінювання. Суміш розвели DCM та промили H 2O. Органічну фазу відокремили, обробили H2O (10 мл) та екстрагували за допомогою DCM (2 × 10 мл). Органічний шар відокремили, висушили (Na2SO4), відфільтрували та випарили розчинники in vacuo. Неочищений продукт очистили за допомогою колонкової флеш-хроматографії (силікагель; DCM). Зібрали необхідні фракції та випарили розчинники in vacuo з отриманням проміжного продукту А13 (1,7 г, вихід 77 %) у формі безбарвного масла. Приклад A14 Отримання проміжного продукту A14 Br N O O NH 2 15 20 Діетиловий ефірат трифтористого бору (4,53 мл, 36,1 ммоль) додали до проміжного продукту А13 (1,7 г, 3,61 ммоль) з наступним додаванням етантіолу (8,01 мл, 108,2 ммоль) при 0 °C у запаяній пробірці. Забезпечили нагрівання реакційної суміші до кімнатної температури та перемішували її при 60ºC протягом 3 годин. Випарили розчинники in vacuo, і залишок розчинили в DCM, і промили насич. NaHCO3. Органічний шар відокремили, висушили (Na2SO4), відфільтрували та випарили розчинники in vacuo. Неочищений продукт очистили за допомогою колонкової флеш-хроматографії (силікагель; AcOEt в DCM від 0/100 до 50/50). Зібрали необхідні фракції та випарили розчинники in vacuo з отриманням проміжного продукту A14 (950 мг, вихід 78 %) у формі безбарвного масла. Приклад A15 Отримання проміжного продукту A15 N N O H Br 25 30 Метоксид натрію 25 ваг. % в MeOH (1,284 мл, 5,36 ммоль) додали до розчину проміжного продукту А14 (950 мг, 2,82 ммоль) в MeOH (8 мл) при кімнатній температурі. Суміш перемішували при 55ºC протягом 18 годин. Випарили розчинник in vacuo. Залишок обробили водн. насич. розчином NH4Cl та екстрагували за допомогою DCM. Органічний шар відокремили, висушили (Na2SO4), відфільтрували та випарили розчинники in vacuo з отриманням проміжного продукту A15 (850 мг, вихід 99 %) у формі білої твердої речовини, який застосовували на наступному етапі без додаткового очищення. Приклад A16 Отримання проміжного продукту A16 N N S H Br 35 Пентасульфід фосфору (940 мг, 4,23 ммоль) додали до розчину проміжного продукту А15 17 UA 109687 C2 5 (860 мг, 2,82 ммоль) у піридині (7 мл) та суміш нагрівали при 110ºC протягом 38 годин. Випарили розчинник in vacuo та очистили неочищений продукт за допомогою хроматографії на коротких колонках (силікагель; AcOEt в DCM від 0/100 до 100/0). Зібрали необхідні фракції та випарили розчинники in vacuo з отриманням проміжного продукту A16 (830 мг, вихід 92 %) у формі жовтої твердої речовини. Приклад A17 Отримання проміжного продукту A17 N N S Br 10 15 Метилйодид (0,267 мл, 4,296 ммоль) та K 2CO3 (0,59 г, 4,296 ммоль) додали до розчину проміжного продукту А16 (690 мг, 2,15 ммоль) в ацетоні (10 мл) та суміш перемішували при кімнатній температурі протягом 3 годин. Випарили розчинник in vacuo та неочищений продукт поглинули DCM (25 мл) та H2O (25 мл). Органічний шар відокремили, висушили (MgSO4), відфільтрували та випарили розчинники in vacuo. Неочищений продукт очистили за допомогою колонкової флеш-хроматографії (силікагель; AcOEt в DCM від 0/100 до 50/50). Зібрали необхідні фракції та випарили розчинники in vacuo з отриманням проміжного продукту A17 (700 мг, вихід 97 %) у формі блідо-жовтої твердої речовини. Приклад A18 Отримання проміжного продукту A18 N Br N H N 2 20 25 30 NH4Cl (447 мг, 8,35 ммоль) додали до суспензії проміжного продукту А17 (700 мг, 2,09 ммоль) у 2 М розчині NH3 в EtOH (39,67 мл, 79,34 ммоль) та нагрівали суміш при 90ºC протягом 24 годин. Випарили розчинник in vacuo та суспендували залишок в 2 М розчині NH3 в EtOH (20 мл, 40 ммоль). Додали NH4Cl (447 мг, 8,35 ммоль) і суміш нагрівали при 90ºC протягом 2 діб. Випарили розчинник in vacuo та суспендували залишок в DCM і промили H2O. Органічний шар відокремили, висушили (MgSO4), відфільтрували та випарили розчинники in vacuo. Продукт очистили за допомогою колонкової флеш-хроматографії (силікагель; 7 М розчин NH3 в MeOH/DCM від 0/100 до 20/80). Зібрали необхідні фракції та випарили розчинники in vacuo з отриманням проміжного продукту A18 (550 мг, вихід 86 %) у формі блідо-жовтої твердої речовини. Приклад A19 Отримання проміжного продукту A19 O N O N+ O 35 40 O NH OO Карбонат цезію (2,73 г, 8,37 ммоль) додали до суміші проміжного продукту А11 (1,5 г, 4,186 ммоль) та етилового ефіру 1H-пірол-2-карбонової кислоти (681 мг, 5,441 ммоль) в MeCN (16 мл). Суміш перемішували при 130ºC протягом 30 хв. під впливом мікрохвильового випромінювання. Реакційну суміш розвели DCM та промили водн. HCl (1 н). Органічний шар відокремили, висушили (Na2SO4), відфільтрували та випарили розчинники in vacuo. Неочищений продукт очистили за допомогою колонкової флеш-хроматографії (силікагель; DCM). Зібрали необхідні фракції та випарили розчинники in vacuo з отриманням проміжного продукту A19 (1,5 г, вихід 89 %) у формі безбарвного масла. Приклад A20 Отримання проміжного продукту A20 18 UA 109687 C2 O N O N+ H2N 5 O O HCl (9,295 мл, 37,181 ммоль, 4 М в 1,4-діоксані) додали до проміжного продукту А19 (1,5 г, 3,718 ммоль) та суміш перемішували при кімнатній температурі протягом 1 години. Випарили розчинник in vacuo, і суспендували залишок в DCM, і промили водн. насич. розчином NaHCO3. Органічний шар відокремили, висушили (Na2SO4), відфільтрували та випарили розчинники in vacuo з отриманням проміжного продукту А20 (1,1 г, вихід 97 %), який застосовували на наступному етапі реакції без додаткового очищення. Приклад A21 Отримання проміжного продукту A21 N N H O N+ OМетоксид натрію 25 ваг. % в MeOH (0,909 мл, 3,99 ммоль) додали до розчину проміжного продукту А20 (1,1 г, 3,63 ммоль) в МеОН (10 мл) при кімнатній температурі. Суміш перемішували при 65ºC протягом 18 годин. Випарили розчинник in vacuo. Залишок обробили водн. насич. розчином NH4Cl та екстрагували за допомогою DCM. Органічний шар відокремили, висушили (Na2SO4), відфільтрували та випарили розчинники in vacuo. Неочищений продукт очистили за допомогою колонкової флеш-хроматографії (силікагель; AcOEt). Зібрали необхідні фракції, випарили розчинники in vacuo та отриманий залишок розтерли з DIPE з отриманням проміжного продукту A21 (650 г, вихід 66 %) у формі білої твердої речовини. Приклад A22 Отримання проміжного продукту A22 O 10 15 20 N 25 N O S H N + O Пентасульфід фосфору (799 мг, 3,59 ммоль) додали до розчину проміжного продукту А21 (650 мг, 2,4 ммоль) у піридині (10 мл) та суміш нагрівали при 100ºC протягом 18 годин. Випарили розчинник in vacuo та неочищений продукт очистили за допомогою хроматографії на коротких колонках (силікагель; AcOEt в DCM від 0/100 до 100/0). Зібрали необхідні фракції та випарили розчинники in vacuo з отриманням проміжного продукту A22 (535 мг, вихід 78 %) у формі жовтої твердої речовини. Приклад A23 Отримання проміжного продукту A23 N S N O N+ 30 35 O Метилйодид (0,232 мл, 3,724 ммоль) та K2CO3 (0,515 г, 3,724 ммоль) додали до розчину проміжного продукту А22 (535 мг, 1,86 ммоль) в ацетоні (10 мл) та суміш перемішували при кімнатній температурі протягом 3 годин. Випарили розчинник in vacuo та неочищений продукт поглинули DCM (25 мл) та H2O (25 мл). Органічний шар відокремили та водн. шар екстрагували за допомогою DCM (3 × 25 мл). Об'єднані органічні шари висушили (MgSO4), відфільтрували та випарили розчинники in vacuo. Неочищений продукт очистили за допомогою колонкової флеш 19 UA 109687 C2 5 хроматографії (силікагель; AcOEt в DCM від 0/100 до 50/50). Зібрали необхідні фракції та випарили розчинники in vacuo з отриманням проміжного продукту A23 (490 мг, 87 % вихід) у формі блідо-жовтої твердої речовини. Приклад A24 Отримання проміжного продукту A24 N N S NH 2 10 Розчин проміжного продукту А23 (490 мг, 1,626 ммоль) в EtOH (28 мл) гідрували в реакторі H-Cube (1 мл/хв., 30 мм картридж з 5 % Pd/C, режим з використанням усього H2, кімнатна температура, 2 цикли). Згодом випарили розчинники in vacuo. Неочищений продукт очистили за допомогою колонкової флеш-хроматографії (силікагель; 7 М NH 3 в MeOH в DCM від 0/100 до 10/90). Зібрали необхідні фракції та випарили розчинники in vacuo з отриманням проміжного продукту A24 (100 мг, вихід 23 %) у формі безбарвного масла. Приклад A25 Отримання проміжного продукту A25 N NH 2 N 15 20 25 H2N NH4Cl (78,8 мг, 1,474 ммоль) додали до розчину проміжного продукту А24 (100 мг, 0,368 ммоль) в 2 М розчині NH3 в EtOH (7 мл, 14 ммоль) і суміш нагрівали при 80ºC протягом 3 діб. Випарили розчинник in vacuo, суспендували залишок в DCM та промили за допомогою H2O. Органічний шар відокремили, висушили (MgSO 4), відфільтрували та випарили розчинники in vacuo. Продукт очистили за допомогою колонкової флеш-хроматографії (силікагель; 7 М розчин NH3 в MeOH/DCM від 0/100 до 20/80). Зібрали необхідні фракції та випарили розчинники in vacuo з отриманням проміжного продукту A25 (80 мг, вихід 90 %) у формі блідо-жовтої твердої речовини. Приклад A26 Отримання проміжного продукту A26 N S N NH 30 35 Cl O N 5-Хлорпіридин-2-карбонову кислоту (172 мг, 1,09 ммоль) додали до розчину хлориду 4-(4,6диметокси-1,3,5-триазин-2-іл)-4-метилморфолінію (330 мг; 1,19 ммоль) в MeOH (5 мл). Суміш перемішували при кімнатній температурі протягом 5 хв. Згодом суміш охолодили до 0 °C та додали розчин проміжного продукту А24 (270 мг, 0,995 ммоль) в MeOH (5 мл). Суміш нагріли до кімнатної температури та перемішували протягом 3 годин. Суміш обробили насич. розчином Na2CO3 та H2O й екстрагували за допомогою DCM. Органічний шар відокремили, висушили (MgSO4), відфільтрували та випарили розчинники in vacuo. Неочищений продукт очистили за допомогою колонкової флеш-хроматографії (силікагель; AcOEt у гептані 50/50). Зібрали необхідні фракції та випарили розчинники in vacuo з отриманням проміжного продукту A26 (200 мг, вихід 49 %) у формі білої твердої речовини. Приклад A27 Отримання проміжного продукту A27 20 UA 109687 C2 Br F N O 5 10 R NH O O O Карбонат цезію (18,27 г, 56,06 ммоль) додали до суміші проміжного продукту А12 (11,5 г, 28,01 ммоль) та етилового ефіру 1H-пірол-2-карбонової кислоти (4,56 г; 36,44 ммоль) в MeCN (40 мл) при кімнатній температурі. Суміш перемішували при кімнатній температурі протягом 20 хв. і згодом нагрівали при 130ºC протягом 30 хв. під впливом мікрохвильового випромінювання. Суміш розвели DCM і промили H2O. Органічну фазу висушили (Na2SO4), відфільтрували та випарили розчинники in vacuo. Неочищений продукт очистили за допомогою колонкової флешхроматографії (силікагель; DCM/гептан, 90/10). Зібрали необхідні фракції та випарили розчинники in vacuo з отриманням проміжного продукту A27 (10,7 г, вихід 83 %) у формі клейкої твердої речовини. Приклад A28 Отримання проміжного продукту A28 Br N O O F R NH 15 2 HCl (15 мл, 60 ммоль, 4 М в 1,4-діоксані) додали до проміжного продукту А27 (9,5 г, 20,864 ммоль) і суміш перемішували при кімнатній температурі протягом 90 хв. Випарили розчинник in vacuo з отриманням проміжного продукту A28 (10 г, неочищений, вихід 122 %), який застосовували на наступному етапі реакції без додаткового очищення. Приклад A29 Отримання проміжного продукту A29 N R O 20 25 30 F N H Br Метоксид натрію 25 ваг. % в MeOH (15,714 мл, 68,93 ммоль) додали до розчину проміжного продукту А28 (950 мг, 2,82 ммоль) в МеОН (30 мл) при кімнатній температурі. Суміш перемішували при 60ºC протягом 18 годин. Випарили розчинник in vacuo. Залишок обробили водн. насич. розчином NH4Cl та екстрагували за допомогою DCM. Органічний шар відокремили, висушили (Na2SO4), відфільтрували та випарили розчинники in vacuo. Неочищений продукт очистили за допомогою колонкової флеш-хроматографії (силікагель; AcOEt в DCM від 0/100 до 20/80). Зібрали необхідні фракції та випарили розчинники in vacuo з отриманням проміжного продукту А29 (1,5 г, вихід 18 %) у формі білої твердої речовини. Приклад A30 Отримання проміжного продукту A30 N R O F N Br Тетрафторборат триметилоксонію (2,56 г, 17,33 ммоль) додали до розчину проміжного продукту А29 (1,4 г, 4,33 ммоль) в DCM (5 мл) при кімнатній температурі. Суміш перемішували 21 UA 109687 C2 5 при кімнатній температурі протягом 4 діб. Реакційну суміш розвели та згодом обробили холодним водн. насич. розчином NaHCO3. Органічний шар відокремили, висушили (MgSO4), відфільтрували та випарили розчинники in vacuo з отриманням проміжного продукту A30 (910 мг, вихід 62 %) у формі брудно-білої твердої речовини, який застосовували на наступному етапі реакції без додаткового очищення. Приклад A31 Отримання проміжного продукту A31 N Br R N F H 2N 10 15 20 NH4Cl (577 мг, 10,79 ммоль) додали до розчину проміжного продукту А30 (910 мг, 2,7 ммоль) в 2 М розчині NH3 в EtOH (5 мл, 10 ммоль) та суміш нагрівали при 80ºC протягом 36 годин у запаяній пробірці. Суміш охолодили до кімнатної температури, і додали NH 4Cl (432 мг, 8,1 ммоль) і 2 М розчин NH3 в EtOH (5 мл, 10 ммоль), і суміш нагрівали при 80ºC протягом 36 годин у запаяній пробірці. Суміш охолодили до кімнатної температури, та додали NH 4Cl (432 мг, 8,1 ммоль) і 2 М розчин NH3 в EtOH (5 мл, 10 ммоль), і суміш нагрівали при 80ºC протягом 48 годин у запаяній пробірці. Випарили розчинник in vacuo та суспендували залишок в DCM, і промили H2O (4-5 мл). Органічний шар відокремили, висушили (MgSO 4), відфільтрували та випарили розчинники in vacuo. Отриманий у результаті неочищений продукт поглинули DCM, і осаджену тверду речовину відфільтрували з отриманням проміжного продукту A31 (458 мг, вихід 53 %) у формі білої твердої речовини. Приклад A32 Отримання проміжного продукту A32 N NH R N F H 2N 25 30 35 40 Трет-бутоксид натрію (0,329 г, 3,43 ммоль) додали до суміші проміжного продукту А31 (0,41 г, 1,143 ммоль) у толуолі (8,7 мл). Суміш перемішували протягом 5 хв. і згодом додали рацBINAP (0,213 г, 0,343 ммоль) та Pd2(dba)3 (105 мг, 0,114 ммоль) в атмосфері азоту при кімнатній температурі. Суміш продували азотом протягом декількох хвилин, і згодом додали бензофенонімін (0,383 мл, 2,286 ммоль), і суміш перемішували при 100ºC протягом 2 годин. Після охолодження до кімнатної температури суміш розвели H 2O та екстрагували за допомогою DCM. Органічний шар відокремили, висушили (MgSO 4), відфільтрували та випарили розчинники in vacuo. Неочищений продукт очистили за допомогою колонкової флеш-хроматографії (силікагель; 7 М розчин NH3 в MeOH в DCM від 0/100 до 50/50). Зібрали необхідні фракції та випарили розчинники in vacuo з отриманням неочищеного продукту, який розчинили в HCl (6 мл, 36 ммоль, 6 М в ізопропіловому спирті), і суміш перемішували при кімнатній температурі протягом 1 години. Випарили розчинники in vacuo. Згодом залишок поглинули DCM, і додали ізопропіловий спирт та твердий NaHCO3, і суміш перемішували при кімнатній температурі протягом 2 годин. Відфільтрували тверді речовини та випарили фільтрат in vacuo з отриманням проміжного продукту A32 (400 мг, вихід 136 %) у формі клейкого масла, який застосовували на наступному етапі реакції без додаткового очищення. Приклад A33 Отримання проміжного продукту A33 O O Me N F 45 2 R H 2N Br F До суміші проміжного продукту А12 (7,5 г, 18,281 ммоль) та метил-4-фтор-1H-пірол-2карбоксилату (2,9 г, 20,263 ммоль) в MeCN (150 мл) додали DBU (5,5 мл, 36,814 ммоль) при кімнатній температурі. Суміш перемішували при 90ºC протягом 16 годин. Після охолодження більшу частину розчинника випарили, і залишок розчинили в DCM, і промили 0,5 М HCl. Органічний шар відокремили, висушили (Na2SO4), відфільтрували та концентрували in vacuo. 22 UA 109687 C2 5 Залишок розчинили в DCM (100 мл) і додали TFA (15 мл). Суміш перемішували при кімнатній температурі протягом 2 годин. Випарили розчинники in vacuo. Основність суміші підвищили за допомогою насич. Na2CO3 і цю суміш екстрагували за допомогою DCM. Органічний шар відокремили, висушили (Na2SO4), відфільтрували та випарили розчинник in vacuo. Неочищений продукт очистили за допомогою колонкової флеш-хроматографії (силікагель; MeOH в DCM від 0/100 до 1/99). Зібрали необхідні фракції та концентрували in vacuo з отриманням проміжного продукту А33 (4,78 г, вихід 70 %) у формі брудно-білої твердої речовини. Приклад A34 Отримання проміжного продукту A34 F 10 15 N R NH Br F O Проміжний продукт 34 отримали з проміжного продукту А33 згідно з методикою синтезу, описаною в прикладі A15. Колонкова флеш-хроматографія (силікагель; MeOH в DCM від 0/100 до 1/99) з отриманням проміжного продукту А34 у формі брудно-білої твердої речовини (4,3 г, вихід 98 %). Приклад A35 Отримання проміжного продукту A35 F N S R N H Br F 20 25 Пентасульфід фосфору (14 г, 63,021 ммоль) додали до розчину проміжного продукту А34 (4,3 г, 12,604 ммоль) в THF (150 мл) і суміш нагрівали при 70ºC протягом 24 годин. Реакційну суміш відфільтрували через целіт і промили THF. Фільтрат концентрували in vacuo. Залишок очистили за допомогою колонкової флеш-хроматографії (силікагель; DCM). Зібрали необхідні фракції та концентрували in vacuo з отриманням проміжного продукту А35 (3,65 г, вихід 81 %) у формі блідо-жовтої твердої речовини. Приклад A36 Отримання проміжного продукту A36 F N H 2N R N F 30 35 Br Трет-бутилгідропероксид (70 %, 5,406 мл, 38 ммоль) додали до розчину проміжного продукту 35 (1,350 г, 3,779 ммоль) в 7 н NH3 в MeOH (40 мл). Суміш перемішували при кімнатній температурі протягом 40 годин. Розчинник частково випарили in vacuo, і залишок обробили DCM, і промили розведеним розчином Na2CO3. Органічний шар відокремили, висушили (Na2SO4), відфільтрували та випарили розчинники in vacuo. Неочищений продукт очистили за допомогою колонкової флеш-хроматографії (силікагель; 7 М розчин NH3 в MeOH в DCM від 0/100 до 2/98). Зібрали необхідні фракції та концентрували in vacuo з отриманням проміжного продукту А36 (990 мг, вихід 77 %) у формі жовтої твердої речовини. Приклад A37 Отримання проміжного продукту A37 23 UA 109687 C2 F N R N H 2N F 5 10 N Толуол (20 мл) додали до суміші проміжного продукту А36 (400 мг, 1,176 ммоль), Pd2(dba)3 (0,108 г, 0,118 ммоль), BINAP (0,22 г, 0,353 ммоль) та трет-бутоксиду натрію (0,203 г, 2,177 ммоль) в атмосфері азоту при кімнатній температурі. Суміш продували азотом протягом декількох хвилин, згодом додали бензофенонімін (0,359 мл, 2,352 ммоль), і суміш перемішували при 90ºC протягом 16 годин. Після охолодження суміш розвели H 2O та екстрагували за допомогою DCM. Органічний шар відокремили, висушили (Na 2SO4), відфільтрували та розчинники концентрували in vacuo. Неочищений продукт очистили за допомогою колонкової флеш-хроматографії (силікагель; 7 н NH3 в MeOH в DCM від 0/100 до 1/99, до 5/95). Зібрали необхідні фракції та концентрували in vacuo з отриманням проміжного продукту A37 (440 мг, вихід 85 %) у формі жовтої піни. Приклад A38 Отримання проміжного продукту A38 F N R N H 2N F 15 20 NH HCl (37 % в H2O, 500 мкл, 16,182 ммоль) додали до розчину проміжного продукту А37 (920 мг, 2,089 ммоль) в ізопропанолі (20 мл). Суміш перемішували при кімнатній температурі протягом 20 хв., згодом концентрували in vacuo та повторно розчинили в 25 мл ізопропанолу. Потім додали NaHCO3 і суміш перемішували протягом 1 години при кімнатній температурі. Суміш відфільтрували та фільтрат концентрували in vacuo. Продукт очистили за допомогою колонкової флеш-хроматографії (силікагель; 7 н NH3 в MeOH в DCM від 1/99 до 10/90). Зібрали необхідні фракції та концентрували in vacuo з отриманням проміжного продукту A38 (470 мг, вихід 81 %) у формі брудно-білої піни. Приклад A39 Отримання проміжного продукту A39 O O O S N O O 25 30 35 2 Оксалілхлорид (5,175 мл, 61,16 ммоль) краплинами додали до розчину DMSO (4,668 мл, 65,2 ммоль) в DCM (103 мл) при -78ºC в атмосфері азоту. Суміш перемішували протягом 15 хв. при -78 °C. Потім додали метиловий складний ефір N-boc-транс-4-гідрокси-L-проліну (10 г, 40,77 ммоль) та отриману в результаті суміш перемішували протягом 2 годин при -40С. Потім додали Et3N (17 мл, 122 ммоль), і забезпечили повільне нагрівання суміші до кімнатної температури та перемішували її протягом ночі. Потім суміш розвели 10 % розчином лимонної кислоти та екстрагували за допомогою DCM. Органічний шар висушили (Na 2SO4), відфільтрували та концентрували in vacuo з отриманням проміжного продукту A39 (10 г) у формі коричневого масла. Неочищений продукт застосовували на наступному етапі без додаткового очищення. Приклад A40 Отримання проміжного продукту A40 24 UA 109687 C2 O O O S N 5 10 OH O F F F (Трифторметил)триметилсилан (8,768 г, 61,663 ммоль) додали до розчину проміжного продукту А39 (10 г) в THF (114 мл) при 0 °C з наступним додаванням TBAF (1 М в THF, 2,47 мл, 247 ммоль). Реакційну суміш залишили нагріватися при кімнатній температурі та перемішували її протягом 18 годин. Суміш загасили насич. водн. NH 4Cl. Суміш перемішували протягом 15 хв., згодом додали TBAF (1 М в THF, 5 мл, 5 ммоль), і суміш перемішували протягом 30 хв. Органічний шар відокремили та водн. шар екстрагували за допомогою Et 2O. Об'єднані органічні фази промили H2O і сольовим розчином, потім висушили за допомогою Na 2SO4, відфільтрували та концентрували in vacuo. Неочищений продукт очистили за допомогою колонкової флеш-хроматографії (силікагель; гептан в AcOEt від 0/100 до 90/10). Зібрали необхідні фракції та концентрували in vacuo з отриманням проміжного продукту А40 (7,8 г, вихід 61 %). Приклад A41 Отримання проміжного продукту A41 O O O S N F 15 20 O F F Тіонілхлорид (14,352 мл, 196,633 ммоль) додали до проміжного продукту А40 (7,7 г, 24,579 ммоль) у піридині (188 мл). Суміш перемішували при 80ºC в атмосфері азоту протягом 1 години. Суміш загасили H2O, потім екстрагували за допомогою Et2O. Органічний шар промили 1 М HCl, насич. розчином NaHCO3, висушили за допомогою Na2SO4, відфільтрували та концентрували in vacuo. Неочищений продукт очистили за допомогою колонкової флеш-хроматографії (силікагель; гептан в AcOEt від 0/100 до 80/20). Зібрали необхідні фракції та концентрували in vacuo з отриманням проміжного продукту A41 (4,6 г, вихід 63 %) у формі жовтого масла. Приклад A42 Отримання проміжного продукту A42 O NH F 25 30 O F F DDQ (16,607 г, 73,16 ммоль) додали до проміжного продукту А41 (7,2 г, 24,385 ммоль) у діоксані (45 мл). Суміш перемішували при 85 °C протягом 104 годин. Суміш відфільтрували та фільтрат концентрували in vacuo. Залишок очистили за допомогою колонкової флешхроматографії (силікагель; DCM у гептані 40/60). Зібрали необхідні фракції та концентрували in vacuo з отриманням проміжного продукту A42 (4 г, вихід 85 %) у формі коричнюватої пасти. Приклад A43 Отримання проміжного продукту A43 25 UA 109687 C2 F F F O Br N R O HN O F O 5 10 DBU (2,85 мл, 19 ммоль) додали до суміші проміжного продукту А12 (6,07 г, 14,84 ммоль) і проміжного продукту A42 (2 г, 10,356 ммоль) в MeCN (40 мл). Згодом суміш нагрівали при 90ºC протягом 18 годин. Реакційну суміш розвели DCM і промили 1 н розчином HCl. Органічний шар відокремили, висушили (Na2SO4), відфільтрували та випарили розчинник in vacuo. Продукт очистили за допомогою колонкової флеш-хроматографії (силікагель; DCM). Зібрали необхідні фракції та концентрували in vacuo з отриманням проміжного продукту A43 у формі клейкої твердої речовини (4,6 г, вихід 59 %). Приклад A44 Отримання проміжного продукту A44 F3C N R N S Br F 15 Проміжний продукт А44 отримали з проміжного продукту А43 згідно з методиками синтезу, описаними в прикладах A20-A23. Цю сполуку застосовували як сировину для наступної реакції, при цьому передбачалося, що вихід буде кількісним. Приклад A45 Отримання проміжного продукту A45 F3C N H 2N R N Br F 20 25 Реакцію здійснювали трьома порціями. Представлена загальна кількість матеріалу. NH3 (2 М в EtOH, 47 мл, 94 ммоль) додали до проміжного продукту А44 (2,3 г, 5,46 ммоль) та NH4Cl (2,315 г, 43,7 ммоль). Суміш нагрівали під впливом мікрохвильового випромінювання при 170ºC протягом 45 хв., згодом концентрували in vacuo. Додали ще 45 мл NH 3 (2 М в EtOH) і суміш нагрівали під впливом мікрохвильового випромінювання при 170ºC протягом 45 хв. Суміш відфільтрували та концентрували in vacuo. Неочищений продукт очистили за допомогою колонкової флеш-хроматографії (силікагель; MeOH в DCM від 0/100 до 3/97). Зібрали необхідні фракції та концентрували in vacuo з отриманням проміжного продукту А45 (2,1 г, вихід 99 %). Проміжний продукт A46 отримали згідно з методиками синтезу, описаними в прикладах А37А38. Приклад A46 Отримання проміжного продукту A46 26 UA 109687 C2 F3C N R N H 2N NH 2 F 5 Отримали з проміжного продукту A45. Сполуку осадили з неочищеної реакційної суміші за допомогою DCM (вихід 89 %). Проміжний продукт A47 отримали згідно з методикою синтезу, описаною в прикладах A9A11. Приклад A47 Отримання проміжного продукту A47 O O S CHF2 O N F O 10 15 O Br Отримали з 1,1-диметилетилового ефіру N-[1-(5-бром-2-фторфеніл)-2,2-дифтор-1(гідроксиметил)етил]карбамінової кислоти. Неочищений продукт розтерли з гептаном та відфільтрували. Сіру тверду речовину розчинили в DCM та очистили за допомогою колонкової хроматографії (силікагель; DCM). Зібрали необхідні фракції та концентрували in vacuo з отриманням проміжного продукту A47 (вихід 78 %) у формі білої твердої речовини. Приклад A48 Отримання проміжного продукту A48 O O N HN O 20 25 CHF 2 F O Br NaH (60 % дисперсія в мінеральному маслі, 269 мг, 6,723 ммоль) додали до суміші метил-2піролкарбоксилату (841 мг, 6,723 ммоль) в DMF (20 мл) при 0ºC в атмосфері азоту. Потім суміш перемішували протягом 10 хв. при 0 °C, і згодом додали розчин проміжного продукту A47 (2 г, 4,482 ммоль) в DMF (10 мл), і суміш перемішували при кімнатній температурі протягом 20 годин. Реакційну суміш загасили насич. NH4Cl та екстрагували за допомогою AcOEt. Органічний шар відокремили, висушили (MgSO4), відфільтрували та випарили розчинник in vacuo з отриманням проміжного продукту А48 (2,2 г, вихід 100 %) у формі масла, який застосовували на наступному етапі без додаткового очищення. Проміжний продукт А49 отримали згідно з методикою синтезу, описаною в прикладі A20. Приклад A49 Отримання проміжного продукту A49 O O N CHF H 2N 2 F Br 27 UA 109687 C2 5 Отримали з проміжного продукту A48. Колонкова флеш-хроматографія (силікагель; AcOEt у гептані від 0/100 до 15/85) з отриманням проміжного продукту A49 (вихід 100 %). Приклад A50 Отримання проміжного продукту A50 N O 10 15 CHF 2 F N Br Триметилалюміній (2 М у толуолі, 4,47 мл, 8,9 ммоль) додали до перемішаної суміші проміжного продукту А49 (1,75 г, 4,47 ммоль) в THF (20 мл) при 0 °C у запаяній пробірці. Суміш перемішували при 100ºC протягом 2 годин. Суміш охолодили до кімнатної температури, перелили в колбу, охолодили до 0ºC та загасили декагідратом сульфату натрію. Суміш перемішували протягом 15 хв., згодом відфільтрували та фільтрати випарили in vacuo з отриманням проміжного продукту A49 (1,657 г, вихід 103 %) у формі твердої речовини, який застосовували на наступному етапі без додаткових очищень. Проміжний продукт A51 отримали згідно з методикою синтезу, описаною в прикладі A16. Приклад A51 Отримання проміжного продукту A51 N CHF S 20 2 F N Br Отримали з проміжного продукту А50. Колонкова флеш-хроматографія (силікагель; MeOH в DCM від 0/100 до 05/95) з отриманням проміжного продукту A51 (вихід 52 %) у формі блідожовтої твердої речовини. Приклад A52 Отримання проміжного продукту A52 N H2N 25 30 N CHF 2 F Br Водн. розчин NH3 (7 мл) додали до розчину проміжного продукту A51 (700 мг, 1,866 ммоль) в 7 н NH3 в МеОН (7 мл) і суміш нагрівали при 90C у запаяній пробірці протягом 21 години. Згодом випарили розчинник та знову додали водн. NH3 та 7 н NH3 в МеОН. Суміш перемішували при 90C протягом 24 годин. Випарили розчинник in vacuo. Неочищений продукт очистили за допомогою колонкової флеш-хроматографії (силікагель; MeOH в DCM від 0/100 до 03/97). Зібрали необхідні фракції та концентрували in vacuo з отриманням проміжного продукту A52 (464 мг, вихід 69 %). Проміжний продукт A53 отримали згідно з методикою синтезу, описаною в прикладах A37A38. Приклад A53 Отримання проміжного продукту A53 28
ДивитисяДодаткова інформація
Назва патенту англійською3,4-dihydro-pyrrolo[1,2-a]pyrazin-1-ylamine derivatives useful as inhibitors of beta-secretase (bace)
Автори англійськоюTrabanco-Suarez, Andres, Avelino, Delgado-Jimenez, Francisca
Автори російськоюТрабанко-Суарес Андрес Авелино, Дельгадо-Хименес Франциска
МПК / Мітки
МПК: C07D 487/04, A61P 25/28, A61K 31/4985, A61K 31/506
Мітки: бета-секретази, bace, придатні, інгібітори, похідні, 3,4-дигідропіроло[1,2-a]піразин-1-іламіну
Код посилання
<a href="https://ua.patents.su/47-109687-pokhidni-34-digidropirolo12-apirazin-1-ilaminu-pridatni-yak-ingibitori-beta-sekretazi-bace.html" target="_blank" rel="follow" title="База патентів України">Похідні 3,4-дигідропіроло[1,2-a]піразин-1-іламіну, придатні як інгібітори бета-секретази (bace)</a>
Попередній патент: Кран для стисненої текучої субстанції і резервуар, який має такий кран
Наступний патент: Трициклічні інгібітори pі3k та їх застосування
Випадковий патент: Пристрій для дугового зварювання