Похідні еритропоетин-міметичного пептиду та їх фармацевтичні солі, їх одержання і застосування
Номер патенту: 102236
Опубліковано: 25.06.2013
Автори: Ванг Ялі, Сун Чанган, Джянг Тао, Лю Айфенг, Ву Вентао
Формула / Реферат
1. Похідна еритропоетинміметичного пептиду (EPO) загальної формули (I) і її фармацевтично прийнятні солі,
R1-R2-(CH2)n1-R3-(CH2)n2-R4-R5
, (I)
де R1, R5 вибирають з циклічних пептидів, що мають наступні послідовності:
n1, n2 є цілі числа, що незалежно вибирають з 0-10;
R2, R4 вибирають з -CO або -CH2;
R3 вибирають з NCO(CH2)n4NHR6, CHOCONH(CH2)n5NHR6 або CHSCON(CH2)n5NHR6, де n4 є ціле число, що вибирають з 2-10, n5 є ціле число, що вибирають з 2-10, R6 вибирають з H або метоксиполіетиленгліколевих похідних.
2. Похідна міметичного пептиду ЕРО за пунктом 2 і її фармацевтично прийнятні солі, де амінокислотна послідовність R1, R5 може бути сумісною або несумісною.
3. Похідна міметичного пептиду ЕРО за будь-яким з пунктів 1-2 і її фармацевтично прийнятні солі, де N-кінцева група R1, R5 є ацетильованою.
4. Похідна міметичного пептиду ЕРО за будь-яким з пунктів1-3 і її фармацевтично прийнятні солі, де R1, R5 є циклічний пептид, циклізований дисульфідними зв'язками.
5. Похідна міметичного пептиду ЕРО за будь-яким з пунктів 1-4 і її фармацевтично прийнятні солі, де довжина амінокислотної послідовності R1, R5 складає 13-40 амінокислот, переважно 22 амінокислоти.
6. Похідна міметичного пептиду ЕРО за будь-яким з пунктів 1-5, де R1, R5 незалежно вибирають із циклічного пептиду, що має послідовності SEQ ID NО:5 – SEQ ID NО:8,
.
7. Похідна міметичного пептиду ЕРО за будь-яким з пунктів 1-6 і її фармацевтично прийнятні солі, де згадуваний міметичний пептид ЕРО вибирають з наступного пептиду, де
n1, n2 є 2, R2, R4 є -CO, R3 є CHOCONH(CH2)n5NHR6, n5 є 2;
n1, n2 є 1, R2, R4 є -CO, R3 є NCO(CH2)n4NHR6, n4 є 2;
n1, n2 є 2, R2, R4 є -CH2, R3 є CHOCONH(CH2)n5NHR6, n5 є 2; або
n1, n2 є 1, R2, R4 є -CH2, R3 є NCO(CH2)n4NHR6, n4 є 2.
8. Похідна міметичного пептиду ЕРО за будь-яким з пунктів 1-7 і її фармацевтично прийнятні солі, що характеризується тим, що R6 є H.
9. Похідна міметичного пептиду ЕРО за будь-яким з пунктів 1-8 і її фармацевтично прийнятні солі, де R6 - похідна метоксиполіетиленгліколю, де молекулярна маса похідних метоксиполіетиленгліколю переважно становить від 5000 до 100000 Дальтон.
10. Похідна міметичного пептиду ЕРО за пунктом 9 і її фармацевтично прийнятні солі, де структура похідних метоксиполіетиленгліколю вибрана з розгалуженого або лінійного типу, переважно похідні метоксиполіетиленгліколю мають лінійну структуру і молекулярну масу 20000 Дальтон або похідні метоксиполіетиленгліколю мають розгалужену структуру і молекулярну масу 40000 дальтон.
11. Похідна міметичного пептиду ЕРО за будь-яким з пунктів 1-10 і її фармацевтично прийнятні солі, де:
n1, n2 є 2, R1, R5 вибирають з SEQ ID NO:5 - SEQ ID NO:8, R2, R4 вибирають з -CO, -CH2, R3 є CHOCONH(CH2)n5NHR6, де n5 є ціле число, що вибирають з 2-10; R6 є похідні метоксиполіетиленгліколю лінійної структури з молекулярною масою 20000 Дальтон;
n1, n2 є 1, R1, R5 вибирають з SEQ ID NO:5 - SEQ ID NO:8, R2, R4 вибирають з -CO, -CH2, R3 вибирають з NCO(CH2)n4NHR6, де n4 є ціле число, що вибирають з 2-10; R6 є похідні метоксиполіетиленгліколю лінійної структури з молекулярною масою 20000 Дальтон;
n1, n2 є 2, R1, R5 вибирають з SEQ ID NO:5 - SEQ ID NO:8, R2, R4 вибирають з -CO, -CH2, R3 є CHOCONH(CH2)n5NHR6, де n5 є ціле число, що вибирають з 2-10; R6 є похідні метоксиполіетиленгліколю розгалуженої структури з молекулярной масою 40000 Дальтон; або
n1, n2 є 1, R1, R5 вибирають з SEQ ID NO:5 - SEQ ID NO:8, R2, R4 вибирають з -CO, -CH2, R3 є NCO(CH2)n4NHR6, де n4 є ціле число, що вибирають з 2-10; R6 є похідні метоксиполіетиленгліколю розгалуженої структури з молекулярною масою 40000 Дальтон.
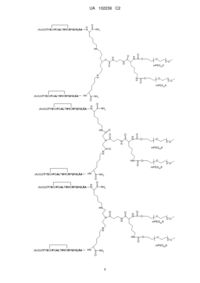
12. Похідна міметичного пептиду ЕРО за будь-яким з пунктів 1-11 і її фармацевтично прийнятні солі, де згадуваною похідною міметичного пептиду ЕРО і її фармацевтично прийнятними солями є:
.
13. Спосіб одержання похідної міметичного пептиду ЕРО за будь-яким з пунктів 1-12 і її фармацевтично прийнятних солей, який включає:
(1) одержання R1H, R5H, де R1, R5 вибирають з циклічних пептидів, що мають послідовності SEQ ID NO:5-8, SEQ ID NO:12-20, SEQ ID NO:23-26, SEQ ID NO:29-30;
(2) одержання функціональної малої молекули загальної формули (II)
R7-CO-(CH2)n1-Z2-(CH2)n2-CO-R8
, (II)
де n1, n2 є цілі числа, що незалежно вибирають з 0-10;
R7, R8 вибирають з OH або H;
Z2 вибирають з O, S, CH2, N(CH2)n6NHR9, NCO(CH2)n7NHR9, CHOCONH(CH2)n8NHR9, CHSCON(CH2)n8NHR9 або CHNHCON(CH2)n8NHR9, де n6 є ціле число, що вибирають з 1-10, n7 є ціле число, що вибирають з 2-10, n8 є ціле число, що вибирають з 2-10, R9 вибирають з Boc або Cbz,
(3) взаємодію R1, R5 з функціональною малою молекулою формули (II) через амідування або відновне амінування з одержанням сполуки формули (III),
R1-R2-(CH2)n1-Z2-(CH2)n2-R4-R5
, (III)
де R2, R4 незалежно вибирають з -CO або -CH2,
(4) видалення Boc або Cbz, здійснення реакції амідування використовуючи активний метоксиполіетиленгліколь.
14. Спосіб одержання за пунктом 13, який характеризується тим, що у згаданій загальній формулі (II)
n1, n2 є 1 або 2, R7, R8 є OH, Z2 вибирають з NCO(CH2)n7NHR9 або CHOCONH(CH2)n8NHR9, n7 є ціле число, що вибирають з 2-10, n8 ціле число, що вибирають з 2-10, R9 є Boc; або
n1, n2 є 1 або 2, R7, R8 є H, Z2 вибирають з NCO(CH2)n7NHR9 або CHOCONH(CH2)n8NHR9, n7 є ціле число, що вибирають з 2-10, n8 є ціле число, що вибирають з 2-10, R9 є Boc;
15. Фармацевтична композиція, що включає:
(1) терапевтично ефективну кількість похідної міметичного пептиду ЕРО за будь-яким з пунктів 1-12 або її фармацевтично прийнятної солі, і
(2) фармацевтично прийнятні носії.
16. Застосування похідної міметичного пептиду EPO за будь-яким з пунктів 1-12 або її фармацевтично прийнятних солей при виготовленні медикамента для лікування розладів, що характеризуються низьким рівнем EPO, недостатністю або дефектністю популяції еритроцитів.
17. Застосування фармацевтичної композиції за пунктом 15 у виготовленні медикамента для лікування розладів, які характеризуються низьким рівнем EPO, недостатністю або дефектністю популяції еритроцитів.
18. Застосування за пунктом 16 або 17, де згадуваними розладами, що характеризуються низьким рівнем EPO, недостатністю або дефектністю популяції еритроцитів є прогресуюча ниркова недостатність або діаліз; СНІД-асоційована анемія, аутоімунні захворювання, злоякісна пухлина; кістозний фіброз; рання анемія недоношених; хронічна анемія, пов'язана з хронічними запальними захворюваннями; ушкодження спинного мозку; гостра втрата крові; старіння та рак з патологічним продукуванням еритроцитів.
Текст
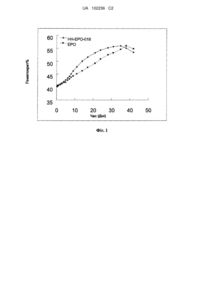
Реферат: Винахід належить до похідних ЕРО міметичного пептиду формули (І) R1-R2-(CH2)nl-R3-(CH2)n2-R4-R5, (I) де R1, R2, R3, R4, R5, n1, n2 є такими, як зазначено в описі винаходу, до їх фармацевтичних солей, одержання таких. Композиція включає похідні ЕРО міметичного пептиду формули (І) і їх фармацевтично прийнятні солі. Винахід також належить до застосування похідних і їх фармацевтично прийнятних солей, до застосування композиції для лікування захворювань, що характеризуються дефіцитом ЕРО, недостатньою або дефектною популяцією еритроцитів. UA 102236 C2 (12) UA 102236 C2 UA 102236 C2 5 10 15 20 25 30 35 40 45 50 55 60 ГАЛУЗЬ ВИНАХОДУ Даний винахід відноситься до похідних еритропоетин-міметичного пептиду (ЕРО, ЕПЕ) і їх фармацевтичних солей, які зв'язуються з рецептором EPO й активізують рецептор EPO, або мають EPO-агоністичний ефект. Зокрема, даний винахід відноситься до похідної еритропоетинміметичного пептиду, модифікованої активним метоксиполіетиленгліколем і способів її одержання; винахід також відноситься до лікування розладів, які характеризуються низьким рівнем EPO, або дефіцитом, або дефектною популяцією еритроцитів, застосовуючи згадувану похідну міметичного пептиду і її фармацевтичні солі. ПОПЕРЕДНІЙ РІВЕНЬ ТЕХНІКИ EPO - глікопротеїн, гормон з молекулярною масою приблизно 34 kD. EPO у плазмі складається з 165 амінокислот з високим ступенем глікозилування, де головний глікозиловий компонент - сіалова кислота. Виходячи з природних вуглеводів, EPO розділений на два типи, а саме, і -тип, де - тип містить 34% вуглеводів й -тип містить 26% вуглеводів. Ці два типи мають ті ж самі біологічні характеристики, антигенність і клінічний ефект. Людський ген EPO розташований у 22 подовженій зоні 7 хромосоми. В 1985 успішно клонували його кДНК, і людські рекомбінантні EPO (rHuEPO) були в значній мірі одержані, використовуючи генно-рекомбінантну технологію, й широко застосовувалися в клініці. EPO був біосинтезований, застосовуючи технологію рекомбінантної ДНК (Egrie, JC, Strickland, TW, Lane, J та ін. (986) Immunobiology (Immunobiol)72: 213-224), що є продуктом клонованого людського гена EPO, введеного в клітини яєчника китайського хом'яка (CHO клітини) і експресованого в них. Природний людський EPO, по-перше, трансльований на ланцюзі поліпептиду, що містить 166 амінокислот з аргініном в 166 положенні. У пост-трансляційній модифікації аргінін у 166 положенні піддають деградації, використовуючи гідроксил-пептидазу. Молекулярна маса людського EPO без глікозилу 18236Da. У інтактній молекулі EPO глікозил становить приблизно 40 % загальної молекулярної маси (J.Biol. Chem. 262: 12059). EPO - перший цитокін, застосований у клініці й безумовно найвідоміший препарат, що збільшує гемоглобін з єдиним і безпечним ефектом. Мається певний ефект при нирковій анемії, апластичній анемії, множинній мієломі, і пароксизмальній нічній гематурії; крім того, застосування EPO може зменшити кількість переливання крові в хірургії й певною мірою інгібувати анемію, викликану злоякісною пухлиною, хіміотерапією й ревматоїдним артритом. Оскільки EPO насамперед генерований нирковими тубулярними ендотеліальними клітинами, анемія, викликана нирковою хворобою, є першим показанням для EPO; клінічна ефективність EPO при нирковій анемії становить майже 100 %, але доза EPO не поліпшує ниркову функцію. Лікування з EPO є безпечним, ефективним й прийнятним для довготривалої терапії; крім того, воно спрямоване на проблеми недостачі кровопостачання. На ринку глобальних біотехнологічних перпаратів в 2006, EPO рекомбінантні препарати становили 11,9 мільярдів доларів США. Там існує величезна ринкова здатність. Ще в 1989 році рекомбінантний людський EPO (EPOGEN) був схвалений US FDA (USА, Food and Drug Administration - США, Управління з нагляду за якістю харчових продуктів та медикаментів) для лікування ниркової анемії, але тільки з 1992 EPOGEN вийшов на китайський ринок. Щорічна захворюваність на хронічний нефрит становить приблизно 0,25 % у Китаї, де у значної частини пацієнтів в остаточному підсумку розвивається ниркова недостатність. Число пацієнтів із нирковою анемією - приблизно 500-600 тисяч щороку. Відповідно до консервативних оцінок витрати разом з витратами при іншій, пов'язаній з раком, анемії на внутрішньому ринку становлять приблизно 1,2-1,6 мільярдів або навіть більше (обчислені за поточною ціною, яка складає 30-40 CNY/доза, з середньою вагою пацієнтів 50 кг). Починаючи з 1990-х, EPO був найбільш ходовим препаратом в найбільших містах Китаю. Кількість витрат становить 62,13 мільйонів юанів у типових лікарнях головних міст по всьому Китаю в 2003, класифікаційний номер 56. Витрати по EPO у типових лікарнях головних міст по всьому Китаю збільшився до 80,49 мільйонів CNY в 2004, із щорічним підвищенням на 30 %. Як ендогенний гормон, що діє на гематопоетичні клітини кісткового мозку, для підтримання проліферації, диференціації й дозрівання еритроїдних прогеніторних клітин, EPO відіграє важливу роль у регулюванні кисневого статусу організму. На ранній стадії ембріона EPO генерується печінкою й потім поступово переміщується до нирки. EPO головним чином секретується нирковими тубулярними інтерстиціальними клітинами після народження. Під час індукування диференціації еритроїдних прогеніторних клітин за допомогою EPO, утворюється глобулін, що дозволяє клітині набирати більше гемоглобіну із залізосинтезувальною функцією, який може об'єднатися з киснем у зрілих еритроцитах, тому еритроцит і гемоглобін відіграють важливу роль у постачанні кисню до організму. Таке протікання процесу викликане взаємодією між EPO і поверхневим рецептором еритроїдної 1 UA 102236 C2 5 10 15 20 25 30 35 40 45 50 55 60 прогеніторної клітини. Коли організм перебуває в здоровому стані, тканина може одержати достатню кількість кисню від еритроцитів. У цей час концентрація ЕРО в організмі дуже низька. Ця низька, але нормальна концентрація EPO є достатньою для стимулювання генерування еритроцитів, яке зазвичай під час старіння зменшується. Коли рівень кисневого транспорту еритроцитами в циркуляційній системі зменшений, і з'являється гіпоксія, кількість EPO у організмі збільшується. Гіпоксичний стан організму може бути індукований наступними причинами: надмірна радіація, зменшене поглинання кисню внаслідок високих широт або довготривалої коми, різних типів анемії й так далі. Як реакція на гіпоксичний стрес організму, більш високий рівень EPO може стимулювати диференціювання еритроїдної прогеніторної клітини, щоб підсилити її здатність продукувати еритроцити. Коли кількість еритроцитів у організмі перевищує потребу нормальної тканини, рівень EPO у циркуляційній системі зменшується. Оскільки EPO має вирішальну роль для утворення еритроцитів, у цих гормонів є дуже широка перспектива щодо лікування й діагностики захворювань крові, що характеризуються низькою генерацією й дефектом еритроцитів. Недавні дослідження забезпечують основу для прогнозування ефекту ЕРО терапії у безлічі захворювань, розладів і гематологічних патологій, включаючи: застосування EPO у лікуванні анемії у пацієнтів із хронічною нирковою недостатністю (CRF), і призначеня EPO пацієнтам зі СНІДом і пацієнтам, що одержують хіміотерапію (Danna, RP, Rudnick, SA, Abels, RI: під ред. MB, Garnick, EPO in Clinical Applications-An International Perspective. Marcel Dekker; 1990:p301-324). Частина біологічних ефектів EPO може бути відрегульована внутрішньою роллю поверхневих рецепторів на клітинній мембрані. Раніше, досліджуючи зв'язування ЕРО протеїну з клітинною поверхнеюз використанням незрілих еритроцитів, виділених із мишачої селезінки, було виявлено, що цей протеїн складається з двох поліпептидів, і його молекулярна маса приблизно 85000-100000KD (див. Sawyer, та ін. (1987) Proc. Natl. Acad. Sci. USA 84:3690-3694 для більш детального опису). Було також обчислено кількість сайтів з'вязування EPO. Кожна мембрана клітини містить приблизно 800-1000 сайтів. Серед цих сайтів з‟вязування приблизно 300 сайтів з‟вязування мають рівень Kd близько 90 пМ. З‟вязування залишкових сайтів з‟вязування є слабким, будучи приблизно 570 pМ. Деякі дослідження показали, що за реакцією EPO еритроцитів від селезінки мишей, інфікованих вірусною анемією, було ідентифіковано приблизно 400 сайтів з‟вязування, де деякі мають високий рівень Kd 100 пМ, і деякі мають низький рівень Kd 800 пМ. Наступна робота полягає в тому, що два типи ЕРО рецепторів транскрибуються єдиним геном. Згаданий ген клонували у теперішній час. Наприклад, послідовності ДНК і пептид, що кодує послідовності мишачого й людського ЕРО рецепторів, були описані в WO90/08822. Поточні моделі показують, що з‟вязування EPO з рецептором приводить до активації й димеризації двох ЕРО рецепторів. Ця димеризація надалі приводить до ініціювання передачі сигналів. Застосування клонованого гена EPO є корисним у виявленні агоністів й антагоністів цих важливих рецепторів. Був ідентифікований та описаний пептид, що може певною мірою діяти на ЕРО-рецептори. Зокрема, було ідентифіковано групу пептидів, що містять головний пептидний фрагмент, які можуть зв'язуватися з EPO рецептором і стимулювати диференціювання й проліферацію клітин EPO. Однак, EC50 пептиду, що може стимулювати диференціювання й проліферацію клітин EPO, є дуже низьким, у межах від 20 нМ до 250 нМ. Тому, клінічне застосування цих пептидів дуже обмежене. Для подолання дефіцитів існуючих технологій, даний винахід забезпечує похідну ЕРО міметичного пептиду з кращою біологічною активністю і більш високою біодоступністю, так само як її фармацевтичні солі і спосіб їх одержання. ОПИС ВИНАХОДУ Даний винахід стосується похідної ЕРО міметичного пептиду з кращою біологічною активністю і більш високою біодоступністю, так само як її фармацевтичних солей і способу їх одержання. Винахід також стосується фармацевтичної композиції, що включає вищезгадану похідну ЕРО міметичного пептиду та її фармацевтичні солі для лікування розладів, які характеризуються низьким рівнем EPO або недостатньою або дефектною популяцією еритроцитів. Винахід розкриває похідну ЕРО міметичного пептиду загальної формули (I) і її фармацевтичні солі з in vivo біологічною активністю, R1-R2-(CH2)n1-R3-(CH2)n2-R4-R5 (I) де R1, R5 вибрані з мономеру ЕРО міметичного пептиду і його аналогів з in vivo біологічною активністю; n1,n2 - цілі числа, незалежно вибрані з 0-10; R2, R4 вибрані з -CO або-CH2; R3 2 UA 102236 C2 5 10 15 20 25 вибраний з O, S, CH2, N(CH2)n3NHR6, NCO(CH2)n4NHR6, CHOCONH(CH2)n5NHR6, CHSCON(CH2)n5NHR6 або CHNHCON(CH2)n5NHR6; де n3 - ціле число, вибране з 1-10, n4 - ціле число, вибране з 2-10, n5 - ціле число, вибране з 2-10, R6 - вибраний з H або похідних метоксиполіетиленгліколя. У цьому аспекті переважним є втілення, коли: R 1, R5 - незалежно вибрані з мономера ЕРО міметичного пептиду і його аналогів загальної формули Y 1X1X2X3GX4X5TWX6X7Y2Y3, які мають in vivo біологічну активність, де кожна амінокислота позначається стандартною однією буквою, амінокислотна послідовність R1, R5 може бути сумісною або несумісною, і додаткові переважні амінокислотні послідовності R1, R5 є послідовними, і N-термінал R1, R5 ацетильований; X2, X3, X4, X5, X6, Y3 незалежно вибрані з будь-якої з 20 генетично кодованих L-амінокислот або ненатуральних амінокислот, Y1, Y2 незалежно вибрані з будь-якої з 20 генетично кодованих Lамінокислот або ненатуральних амінокислот або пептидів, які утворили ці амінокислоти; X1, X7 вибрані з C, K, D, E, Orn або Hoc. Далі, оптимізуючи вищезгадане переважне втілення, R1, R5 є циклічним пептидом, циклізованим амідними зв„язками або дисульфидними зв'язками; де, якщо R 1, R5 - циклічний пептид, циклізований дисульфидними зв'язками, X 1, X7 незалежно вибрані з C або Hoc подібним чином, якщо R1, R5 є циклічним пептидом, циклізованим амідними зв„язками, X 1, X7 незалежно вибрані з K, D, E або Orn. В аспекті, що охоплює вищезгадане переважне втілення, Y3 переважно вибраний з K, H або R, більш переважно Y3 - K. В аспекті, що охоплює вищезгадане переважне втілення, довжина амінокислотної послідовності R1, R5 додатково оптимізована, а саме, переважно вибрана з 13-40 амінокислот, більш переважно є 22 амінокислотами, усе ще більш переважно, але не обмежена наступною структурою із циклічним пептидом, найбільш переважно, але не обмежена циклічними пептидами NO:1-NO:8, а саме: 3 UA 102236 C2 Ac-GGLYADHYGPITWVKQPLRGGK-NH2(SEQ ID NO:1) Ac-GGLYADHYGPITWV-Orn-QPLRGGK-NH2(SEQ ID NO:2) Ac-GGLYAKHYGPITWVDQPLRGGK-NH2(SEQ ID NO:3) Ac-GGLYA-Orn-HYGPITWVDQPLRGGK-NH2(SEQ ID NO:4) Ac-GGTYSCHFGPLTWVCRPQRG-βAla- K-NH2(SEQ ID NO:5) Ac-GGTYSC-Nle-FGPLTWVCRPQRG-βAla-K-NH2(SEQ ID NO:6) Ac-GGTYSCHFGSLTWVCRPQRG-βAla-K-NH2(SEQ ID NO:7) Ac-GGTYSCHFGALTWVCRPQRG-βAla-K-NH2(SEQ ID NO:8) Ac-GGLYADHYGPMTWVKQPLRGGK-NH2(SEQ ID NO:9) Ac-GGLYADHYGPMTWV-Orn-QPLRGGK-NH2(SEQ ID NO:10) Ac-GGLYA-Orn-HYGPMTWVDQPLRGGK-NH2(SEQ ID NO:11) Ac-GGTYSKHFGPMTWVDRPQRG- βAla- K-NH2(SEQ ID NO:12) Ac-GGTYSCHFGPITWVCRPQRG-βAla- K-NH2(SEQ ID NO:13) Ac-GGTYSCHFGPMTWV-Hoc-RPQRG-βAla- K-NH2(SEQ ID NO:14) Ac-GGTYSCHFGPITWV-Hoc-RPQRG-βAla- K-NH2(SEQ ID NO:15) Ac-GGTYSC-Nle-FGPMTWV-Hoc-RPQRG-βAla-K-NH2(SEQ ID NO:16) Ac-GGTYSC-Nle-FGPITWVCRPQRG- βAla-K-NH2(SEQ ID NO:17) Ac-GGTYSCHFGPLTWVCRPQRG-βAla-K-NH2(SEQ ID NO:18) Ac-GGTYSCHFGSITWVCRPQRG-βAla-K-NH2(SEQ ID NO:19) Ac-GGTYSKHFGSMTWVERPQRG-βAla-K-NH2(SEQ ID NO:20) Ac-GGTYRCSMGPMTWVCLPMAGGK-NH2(SEQ ID NO:21) Ac-GGTYRCSMGPLTWVCLPMAGGK-NH2(SEQ ID NO:22) Ac-GGTYSCHFGAMTWVCRPQRG-βAla-K-NH2(SEQ ID NO:23) Ac-GGTYSCHFGAITWVCRPQRG- βAla-K-NH2(SEQ ID NO:24) Ac-GGTYSCHFGPITWVCRPQRG-βAla-K-NH2(SEQ ID NO:25) Ac-GGTYSCHFGPLTWVCRPQRG-βAla-K-NH2(SEQ ID NO:26) Ac-GGMYSCRMGPMTWVCGPSRGGK-NH2(SEQ ID NO:27) Ac-GGMYSCRMGPLTWVCGPSRGGK-NH2(SEQ ID NO:28) Ac-GGTYSCHFGPLTWV-Hoc-RPQRG-βAla- K-NH2(SEQ ID NO:29)或 Ac-GGTYS-Hoc-HFGPLTWVCRPQRG-βAla- K-NH2(SEQ ID NO:30)。 У цьому аспекті є чотири переважних втілення: 1 - n1,n2 є 2, R2,R4 є -CO, R3 є CHOCONH(CH2)n5NHR6, n5 є 2, R6 є H або похідною 4 UA 102236 C2 5 10 15 20 25 метоксиполіетиленгліколю. 2 - n1,n2 є 1, R2,R4 є -CO, R3 є NCO(CH2)n4NHR6, n4 є 2, R6 є H або похідною метоксиполіетиленгліколю. 3 - n1,n2 є 2, R2,R4 є -CH2, R3 є CHOCONH(CH2)n5NHR6, n5 є 2, R6 є H або похідною метоксиполіетиленгліколю. 4 - n1,n2 є 1, R2,R4 є -CH2, R3 є NCO(CH2)n4NHR6, n4 є 2, R6 є H або похідною метоксиполіетиленгліколю. Вищезгадані чотири переважних втілення існують паралельно, не є включаючими або в прогресивному взємозв„язку. Вищезгадані чотири переважних втілення можуть бути додатково оптимізованими, R 6 похідні метоксиполіетиленгліколя, найбільш переважно R 6 - похідні метоксиполіетиленгліколя, де молекулярна маса похідних метоксиполіетиленгліколя від 5 000 до 100 000 D, структура похідних метоксиполіетиленгліколя вибрана з розгалуженого або лінійного типу. У цьому аспекті, комплексна оптимізація може бути одержана наступними чотирма переважними пвтіленнями: 1 - n1, n2 є 2, R1, R5 вибрані з SEQ ID NO:1 - SEQ ID NO: 8, R2, R4 вибрані з -СО,-CH2, R3CHOCONH(CH2)n5NHR6, де n5 вибраний з 2-10, переважно 2; R6 - похідна метоксиполіетиленгліколя з лінійною структурою й молекулярною масою 20 000 дальтон. 2 - n1, n2 є 1, R1, R5 є SEQ ID NO: 1 - SEQ ID NO: 8, R2, R4 вибрані з -СО,-CH2, R3 -NCO (CH2)n4NHR6, де n4 вибраний з 2-10 і переважно 2; R6 - похідна метоксиполіетиленгліколя з лінійною структурою й молекулярною масою 20 000 дальтон. 3 - n1, n2 є 2, R1, R5 є SEQ ID NO: 1 - SEQ ID NO: 8, R2, R4 вибрані з -СО,-CH2, R3 -CHOCONH (CH2)n5NHR6, де n5 вибраний з 2-10 і переважно 2; R6 - похідна метоксиполіетиленгліколя з розгалуженою структурою й молекулярною масою 40 000 дальтон. 4 - n1, n2 є 1, R1, R5 є SEQ ID NO:1 - SEQ ID NO:8, R2, R4 вибрані з -СО,-CH2, R3 - NCO (CH2)n4NHR6, де n4 вибраний з 2-10 і переважно 2; R6 - похідна метоксиполіетиленгліколя з розгалуженою структурою й молекулярною масою 40 000 дальтон. Структура самих переважних похідних ЕРО міметичного пептиду й їхньої фармацевтичної солі вибрана з: (AcG)GTYSCHFGALTWVCRPQRG¦ÂA H N O NH2 HN O O H N O O N H (AcG)GTYSCHFGALTWVCRPQRG¦ÂA 30 HN O O H N O O n O mPEG20K N H N H O O n O mPEG20K NH2 O 5 O UA 102236 C2 (AcG)GTYSCHFGALTWVCRPQRG¦ÂA O H N NH2 HN O H N O H N O O O N H O O n mPEG20K N H N H O O n O O mPEG20K (AcG)GTYSCHFGALTWVCRPQRG¦ÂA HN NH2 O (AcG)GTYSCHFGALTWVCRPQRG¦ÂA H N O NH2 O HN O N O N H H N O O O n O n O n O mPEG20K O N H HN O O (AcG)GTYSCHFGALTWVCRPQRG¦ÂA (AcG)GTYSCHFGALTWVCRPQRG¦ÂA HN H N O mPEG20K NH2 O O NH2 HN O N O N H H N O O O mPEG20K N H HN O O n O mPEG20K (AcG)GTYSCHFGALTWVCRPQRG¦ÂA HN NH2 O 6 O UA 102236 C2 5 10 15 20 25 30 35 40 45 50 55 60 Похідні ЕРО міметичного пептиду, отримані тут, є амфіфільними сполуками, які можуть утворювати солі, реагуючи з кислими або лужними сполуками звичайним способом, відомим фахівцям. Звичайно використовувані кислоти вибрані із наступних: соляна кислота, бромводнева кислоти, йодводнева кислота, сірчана кислота, фосфорна кислота, птолуолсульфонова кислота, метансульфонова кислота, щавлева кислота, пбромфенілсульфокислота, вугільна кислота, бурштинова кислота, лимонна кислота, бензойна кислота, оцтова кислота; включаючи солі: сульфат, пірофосфат, трифлутат, сульфіт, бісульфіт, фосфат, біфосфат, дигідрофосфат, метафосфат, пірофосфат, хлорид, бромід, йодид, ацетат, пропіонат, каприлат, акрилат, форміат, ізобутират, капронат, енантат, пропіолат, оксалат, малонат, сукцинат, суберат, фумарат, малеат, бутен-1,4-діоат, гексин-1,6-діоат, бензоат, хлорбензоат, метилбензоат, динітробензоат, гідроксибензоат, метоксибензоат, фенілацетат, фенпропіонат, фенілбутират, цитрат, лактат, γ-гідроксибутират, гліколят, тартрат, метансульфонат, пропілсульфонат, нафталін-1-сульфонат, нафталін-2-сульфонат, манделат, переважно - трифлутат. Лужні речовини можуть також реагувати з похідними ЕРО міметичного пептиду, щоб одержувати солі. Ці лужні речовини вибрані з амонію, гідроксидів лужного або лужноземельного металу, так само як карбонат, бікарбонат, звичайно вибрані з гідроксиду натрію, гідроксиду калію, гідроксиду амонію, карбонату натрію, карбонату калію й так далі. Винахід також розкриває спосіб одержання вищезгаданих похідних ЕРО міметичного пептиду й їхніх фармацевтичних солей, включаючи наступні стадії: (1) одержання R1, R5 генною інженерією або хімічним синтезом. R1, R5 - мономер міметичного пептиду і його аналоги з біологічною функцією EPO; (2) одержання функціональної малої молекули загальної формули (II) R7-CO-(CH2)n1-Z2-(CH2)n2-CO-R8 (II) де n1, n2 - цілі числа, незалежно вибрані з 0-10; R7, R8 вибрані із ОН або H; Z2 вибраний з O, S, CH2, N(CH2)n6NHR9, NCO(CH2)n7NHR9, CHOCONH(CH2)n8NHR9, CHSCON (CH2)n8NHR9 або CHNHCON(CH2)n8NHR9, де n6 є цілим числом, вибраним з 1-10, n7 - ціле число, вибране з 2-10, n8 - ціле число, вибране з 2-10, R9 вибраний з Вос або Cbz, (3) виділення R1, R5 з функціональною малою молекулою формули (II) для одержання композиції формули (III); R1-R2-(CH2)n1-Z2-(CH2)n2-R4-R5 (III), де R2, R4 незалежно вибрані з -СО або -CH2, (4) зв„язування з активним метоксиполіетиленгліколем через ковалентні зв'язки після видалення Вос або Cbz . Винахід також відноситься до фармацевтичної композиції, що включає: (1) терапевтичну кількість вищезгаданих похідних ЕРО міметичного пептиду й їхніх фармацевтичних солей загальної формули (I); (2) фармацевтично прийнятний носій. Винахід також розкриває застосування препаратів, а саме, застосування будь-якої із згаданих похідних міметичного пептиду і її фармацевтичних солей у терапевтично ефективній кількості для лікування розладів, що характеризуються низьким рівнем EPO або недостатністю, або дефектністю еритроцитів, зокрема, для лікування наступних захворювань: прогресуюча ниркова недостатність або діаліз; СНІД-асоційована анемія, аутоімунні захворювання або злоякісні пухлини; кистозний фіброз; рання анемія недоношених; хронічна анемія, пов„язана з хронічними запальними захворюваннями; ушкодження спинного мозку; гостра втрата крові; старіння й рак з патологічним продукуванням еритроцитів. Похідні ЕРО міметичного пептиду й їхні фармацевтичні солі, заявлені в даному винаході, здатні до істотного збільшення ретикулоцитів у периферичній крові мишей, що вказує, що вони стимулюють еритропоез; у той же самий час вони також здатні до значного подовження періоду напіврозпаду кон„югатів в організмі. Похідні ЕРО міметичного пептиду і ЕРО протеїн не мають суттєвого впливу на зрілі еритроцити, гематокрит, кількість гемоглобіну, і також не мають ніякого істотного впливу на кількість периферичних лейкоцитів. Твердо-фазний синтез використовується, щоб синтезувати мономери EPO міметичного пептиду, основний принцип якого: спочатку зв„язують гідроксильну групу гідроксил-термінованої амінокислоти пептидного ланцюга, що необхідно синтезувати, з нерозчинною полімерною смолою через ковалентний зв'язок. Потім амінокислоти, приєднані до твердо-фазного носія, використовуються як амінокомпонент, щоб подовжити поліпептидний ланцюг через видалення 7 UA 102236 C2 5 10 15 20 25 30 35 40 45 захисної аміногрупи й взаємодію з надлишком активного карбоксильного компонента. Операцію (конденсація > промивання > зняття захисту > промивання > наступний етап конденсації) повторюють, щоб досягти бажаної довжини синтетичного пептидного ланцюга. Наприкінці пептидний ланцюг відділяють від смоли. Після очищення одержують бажаний пептид. При проміжному контролі стадій реакції конденсації й зняття захисту застосовували спосіб виявлення нінгідрином, а саме, коли полімерний пептидний ланцюг має вільну аміногрупу, синій колір з'явиться після фарбування нінгідриновим реактивом. Коли не буде вільних аміногруп, кольорова реакція не буде відбуватися (нінгідриновий реактив безпосередньо є жовтим). Тому, після здійснення реакції конденсації й виявлення нінгідріном, якщо присутній жовтий колір (колір нінгідринового реактиву), це означає, що стадія зв„язування завершена, і операція зняття захисту може бути виконана до зв„язування з наступною амінокислотою. Якщо присутній синій колір, це означає, що усе ще маються деякі вільні аміногрупи на пептидному ланцюзі. Необхідно повторювати зв„язування або змінювати поточний конденсаційний агент до жовтого забарвлення пептид-смола після виявлення нінгідріном. Спосіб циклізації мономерного пептиду відомий фахівцям у даній галузі. Циклізація дисульфидних зв'язків головним чином відбувається через окислювання сульфгідрильних груп в бічному ланцюзі амінокислот мономерного пептиду в дисульфідні зв„язки окислювачем. Зокрема, мономерний пептид поміщали в розчин диметилсульфоксиду або 5% розчин бікарбонату аміну для аутоокислювання, або додавали до розчину оцтової кислоти, що містить I2 для окислювання, переважно добавляли до розчину оцтової кислоти, що містить I 2 для окислювання. Циклізація амідних зв„язків відбувається головним чином через утворення амідних зв„язків між карбоксильною групою й аміногруппою бічного ланцюга мономерного пептиду в присутності конденсаційного агента. Доданий конденсаційний агент - відомий фахівцям у даній галузі, звичайно включає DIC, EDC, HATU, Pybop і т.д. Синтез димерного пептиду відбувається головним чином через утворення -NH-CH2-зв„язку або -NH-CO- зв„язку між аміногрупою бічного ланцюга амінокислотного залишку ЕРО міметичного пептидного мономера і функціональної малої молекули. Фахівець у даній галузі може легко синтезувати функціональну малу молекулу й з'єднати її з мономерним пептидом циклічного пептиду відомим способом. Одержували димерний пептид й активну похідну метоксиполіетиленгліколя. Реакційна система може бути вибрана з органічного розчинника або доступної буферної системи. Коли реакція ПЕГ-лування димерного пептиду виконана в органічному розчиннику, наступні луги можуть бути включені у прийнятній кількості, включаючи, але не обмежуючись, такими як: триетиламін, диізопропіл етиламін, піридин, 2,4,6-триметилпіридин. Коли реакція виділення поліетиленгліколю здійснюється в буферній системі, буферна система може бути вибрана з безлічі відомих доступних буферів, переважно pН 7,7 фосфатного буфера. Біологічна активність EPO або похідних ЕРО міметичного пептиду й їхніх фармацевтичних солей, наданих відповідно до цього винаходу, може бути визначена різними тестами, відомими у цій галузі. Тест in vivo активності виконували таким чином: мишам підшкірно вводили EPO і похідні ЕРО міметичного пептиду й їх фармацевтичні солі, надані відповідно до цього винаходу три наступних дні. Мишей потім умертвляли. Збирали цільну кров для підрахунку кількості клітин периферичної крові і ретикулоцитів. Визначення кількості форменних елементів крові виконанували на автоматичному лічильнику клітин крові. Фармакодинамічне дослідження виконували внутрішньовенним введенням Макакам у дозі 1,35 мг/кг. Доза ЕРО протеїну як препарату контролю становила 240 мкг/кг. Препарати вводили три рази на тиждень протягом шести тижнів. Зразки крові збирали, щоб виконати кількісний гематологічний аналіз. 8 UA 102236 C2 Опис абревіатур, що використовуються у винаході: Абревіатури Назва Структура NH 2 Orn L-Орнітин OH H 2N O SH Hoc L-Гомоцистеїн OH H 2N O CH 3 H 3C DIC N,N*-Діізопропіламінкарбодіімід EDC 1-Етил-3-(3диметиламінопропіл)карбодііміду гідрохлорид N C N H 3C CH 3 CH3 CH 3 H 3C N C N N PyBOP Бензотріазол-1-ілокситрипіролідинофосфонію гексафторфосфат N P N O N PF6 N N PF6 (H3 C) 2N HATU 2-(1H-7-Азабензотріазол-1-іл)-1,1,3,3тетраметил уроній гексафторфосфат Метаміній N(CH3 )2 N N N N O DMAP CH 3 4-Диметиламінопіри дин N N CH 3 Nle норлейцин H2N O N Розгалужений Метокси поліетиленгліколь mPEG2-OSU N-Гідроксисукцинімід (40k) (40k) O O H N O O n O O O 10 O O n O mPEG20K HN 5 COOH O mPEG20K Опис фігур Фіг.1 показує вплив похідних ЕРО міметичного пептиду (HH-EPO-018) на гематокрит у Макак. Фіг.2 показує вплив похідних ЕРО міметичного пептиду (HH-EPO-018) на гемоглобін у Макак. ПЕРЕВАЖНІ ВТІЛЕННЯ Для більш детального опису представленого винаходу наведені наступні приклади. Однак, об„єм представленого винаходу не обмежується ними. 9 UA 102236 C2 5 10 15 20 25 30 35 Приклад 1: Синтез мономера ЕРО міметичного пептиду Синтез мономера ЕРО міметичного пептиду виконаний способом твердо-фазного пептидного синтезу. Цей спосіб синтезу пептиду широко описаний в літературі, див. Stewart, J.M. та Young, J.D., Solid phase peptide synthesis, 2-е вид., Novabiochem peptide synthesis notes. Мономерний пептид похідної ЕРО міметичного пептиду у відповідності до цього винаходу одержують ручними способами синтезу. Смолою є амідна смола Рінка. -Аміно похідні амінокислоти захищають з використанням Fmoc (флуорен-формілкарбонілу). Тіольну групу бічного ланцюга цистеїну, аміногрупу бічного ланцюга глутаміну та імідазольну групу бічного ланцюга гістидину захищають Trt (тритилом). Гуанідинову групу бічного ланцюга аргініну захищають Pbf (2,2,4,6,7-пентаметилдигідробензофуран-5-сульфонілом). Індольну групу триптофанового ланцюга, аміногрупу бічного ланцюга лізину захищають Boc (третБутоксикарбонілом). Гідроксильну групу бічного ланцюга треоніну, фенольну групу бічного ланцюга тирозину, гідроксильну групу бічного ланцюга серину захищають tBu (трет-бутилом). Карбоксильну групу C-термінального пептидного ланцюга мономера пептиду похідної ЕРО міметичного пептиду, який повинно синтезуватися, з„єднують з нерозчинною смолою (амідною смолою Рінка) ковалентним зв'язком. Потім, амінокислоти, приєднані до твердофазного носія, використовуть як амінокомпонент для подовження поліпептидного ланцюга після видалення захисних аміногруп 20% розчином піперидин/ДМФ і піддають реакції з надлишком похідної амінокислоти. Повторюють операцію (конденсація > промивання > зняття захисту > промивання > наступний етап конденсації), щоб досягти бажаної довжини ланцюга синтетичного пептиду. Наприкінці, пептидний ланцюг видаляють із смоли, використовуючи змішаний розчин трифтороцтової кислоти, води, етиленмеркаптану, 3-ізопропілсилану (92,5:2,5:2,5:2,5). Після етерної седиментації одержуть сирий мономерний пептид похідної еритропоетин-міметичного пептиду. Сирий мономерний пептид відокремлюють й очищують С18 зворотно-фазовою препаративною хроматографією. Потім отримують мономерний пептид похідної ЕРО міметичного пептиду. У проміжному контролі стадій реакції конденсації й зняття захисту застосовують спосіб виявлення нінгідрином, а саме, коли полімерний пептидний ланцюг має вільну аміногрупу, синій колір буде з'являтися після фарбування нінгідриновим реактивом. Коли не буде вільних аміногруп, кольорова реакція не буде відбуватися (нінгідриновий реактив жовтого кольору). Тому, після здійснення реакції конденсації й виявлення нінгідріном, якщо присутній жовтий колір (колір нінгідринового реактиву), це означає, що стадія конденсації завершена, і операція зняття захисту може бути виконана перед конденсаццєю з наступною амінокислотою. Якщо присутній синій колір, це означає, що все ще маються деякі вільні аміногрупи на пептидному ланцюзі. Необхідно повторити конднсацію або змінити поточний конденсаційний агент, поки смола-пептид не дасть жовтого забарвлення після виявлення нінгідріном. Приклад 2: Одержання функціональних малих молекул (LG-1) 10 UA 102236 C2 O O O O H N O HO N H O O HO O O O O O N N H O O O NaOH N O N H O LG-1-A O LG-1-B HO O O N O O O O .HCl HN N N H O O LiAlH4 O LG-1-C N H O O O N N H O O LG-1 H 5 10 15 20 Стадія 1: Одержання LG-1-A Розчиняли діетиловий естер імінодіоцтової кислоти (10,0 г 52,8 ммоль), Boc--аланін (10,0 г 52,8 ммоль) у 100 мл дихлорметану, додавали DIC (8,0 мл 52,8 ммоль), перемішували при кімнатній температурі протягом ночі, реакційний розчин фільтрували, фільтрат промивали 100 мл насиченого NaHCO3, 50 мл розчину 0,5N HCl, 100 мл насиченого сольового розчину послідовно, відокремлювали органічний шар, сушили органічний шар з безводним MgSO 4, Фільтрували органічний шар, концентрували його, і одержували безбарвну масляну рідину субстанцію LG-1-A: 17 г. Стадія 2: Одержання LG-1-B Розчиняли 17 г LG-1-A в 100 мл суміші MeOH: ТГФ = 1:1 , і потім додавали 25 мл води, 5 г NaOH (125 ммоль). Доводили рН до 16N розчином HCl після 2 годин перемішування при кімнатній температурі. Екстрагували реакційний розчин етилацетатом чотири рази. Органічний шар промивали сольовим розчином, висушували безводним сульфатом магнію, концентрували при зниженому тиску до одержання напів-твердої білої речовини. Продукт розчиняли в 50 мл дихлорметану, і додавали 300 мл н-гексану. Отримували білий пастоподібний розчин. Після концентрування при зниженому тиску одержували 14 г твердої білої речовини LG-1-B (Вихід становить приблизно 90 %). Стадія 3: Одержання LG-1-C Розчиняли 7 г LG-1-B (23 ммоль) у 80 мл тетрагідрофурану, і при перемішуванні додавали 4,6 г гідрохлориду N,N-метоксиметиламіну (46 ммоль) і 5,1 г триетиламіну (51 ммоль), і потім додавали 4,4 г DIC (32 ммоль), 4,7 г HOBT (32 ммоль). Реакційну суміш перемішували протягом 11 UA 102236 C2 5 10 ночі при кімнатній температурі. Наступного дня реакційну суміш додавали у воду й екстрагували 350 мл етилацетату. Органічний шар послідовно промивали 200 мл 2N водного розчину HCl, 200 мл насиченого розчину бікарбонату натрію, 100 мл насиченого сольового розчину. Органічний шар відокремлювали і висушували з безводним сульфатом магнію протягом 2 годин і потім фільтрували. Фільтрат стає масляною речовиною після концентрування при зниженому тиску. Після колонкової хроматографії збирали цільовий продукт LG-1-C: 4,2 г, вихід: 70 %. Стадія 4: Одержання LG-1 Розчиняли 4,0 г LG-1-C (10,2 ммоль) у 60 мл тетрагідрофурану, охолоджували до 0 С у крижаній сольовій ванні. Додавали LiAl4 (340 мг, 8,9 ммоль). Після реакції при 0 С протягом 30 хвилин додавали послідовно 4 мл води та 4 мл 15% розчину NaOH. Реакційний розчин фільтрували. Фільтрат промивали тетрагідрофураном. Після концентрування до сухого стану й колонкової хроматографії на силікагелі одержували LG-1: 1,63 г (6 ммоль, Вихід: 58,8 %) Приклад 3: Одержання функціональних малих молекул (LG-2) O HO N O O HO N N H O O O O O O O N N H O O LG-1-B HO O O N O N O LG-2 O O 15 20 25 Розчиняли 4 г LG-1-B (13 ммоль) в 100 мл N,N-диметилформаміду, і додавали гідроксисукцинімід (3,1 г, 21 ммоль), DIC (4 мл, 26 ммоль) і DMAP (4-диметиламінопіридин) (12 мг, 0,08 ммоль). Після перемішування протягом ночі реакційний розчин концентрували при зниженому тиску. Розчиняли залишок в 80 мл етилацетату. Нерозчинні речовини відфільтровували. Органічну фазу промивали один раз послідовно насиченим розчином бікарбонату натрію (40 мл), 40 мл насиченого сольового розчину, 40 мл 0,5N HCl, 40 мл насиченого сольового розчину. Органічний шар відокремлювали і висушували безводним сульфатом магнію. Фільтрували органічний шар. Фільтрат концентрували при зниженому тиску. Одержували білу тверду речовину LG 2: 4,4 г (Вихід становив приблизно 68 %). Приклад 4: Одержання функціональних малих молекул (LG-3) 12 UA 102236 C2 5 10 15 20 Стадія 1: Одержання LG-3-A Розчиняли 7,0 г пентанон пімелінової кислоти (0,04 моль) у 100 мл метанолу. Додавали 5% метанольний розчин CsCO3 при перемішуванні і контролювали додавану кількість, щоб одержати рН реакційного розчину приблизно 8,5 (визначали рН тестувальною паперовою смугою). Перемішували протягом 30 хвилин після завершення додавання. Потім реакційний розчин фільтрували. Фільтрат ставав масляною речовиною після концентрування у вакуумі. Розчиняли масляну речовину в приблизно 100 мл диметилсульфоксиду і нагрівали до 60 С. Додавали 14 г (0,08 моль) бензилброміду. Після реакції протягом 8 годин реакційний розчин фільтрували, тверду речовину промивали малою кількістю етеру. Додавали 400 мл етеру у матковий розчин, промивали 200 мл насиченого сольового розчину. Відокремлювали органічний шар і висушували його безводним сульфатом магнію протягом 2 годин. Потім фільтрували. Після концентрування фільтрату при зниженому тиску до 1/5 його первинного об'єму, його поміщали в морозильну камеру при -20С на ніч для кристалізації. Наступного дня відфільтровували тверді частинки і одержували білу тверду речовину LG-3-A: 10,5 г (Вихід 74%). Стадія 2: Одержання LG-3-B Розчиняли 2 г LG-3-A (0,0056 моль) у 20 мл тетрагідрофурану. Підтримували внутрішню температуру розчину нижче -10 С, перемішували й додавали 626 мг NaBH4 (0,0168 моль). Після 1 год. взаємодії додавали 200 мл охолодженого етеру, потім додавали 150 мл насиченого розчину бікарбонату натрію, щоб завершити реакцію. Зерігали у спокійному стані, забезпечуючи 13 UA 102236 C2 5 10 15 20 25 30 розшарування. Органічний шар промивали однократно насиченим сольовим розчином, і потім висушували з безводним Na2SO4 протягом 2 годин і відфільтровували. Фільтрат концентрували при зниженому тиску з одержанням LG-3-B: 1,9 г (Вихід: 94,6 %). Стадія 3: Одержання LG-3-C Розчиняли 3,2 г LG-3-B (0,009 моль) у 50 мл дихлорметану. Додавали 4,34 г (0,043 моль) нижче 0 С при перемішуванні. Розчиняли 1,33 г (0,0045 моль) трифосгену у 25 мл дихлорметану. Потім додавали краплями отриманий розчин у вищезгаданий розчин LG-3-B. Через 1 годину додавали 2,8 г трет-бутоксикарбонілетилeндіаміну. Після взаємодії протягом 3 год. реакційну суміш доводили до нейтрального рН крижаною оцтовою кислотою, і в цей час одержували осад. Осад відфльтровували. Фільтрат концентрували при зниженому тиску й потім розчиняли в етері. Промивали з водою три рази, насиченим сольовим розчином один раз. Органічний шар відділяли і висушували з безводним сульфатом магнію протягом 2 годин і потім фільтрували. Фільтрат концентрували при зниженому тиску до маслянистості. Масляну субстанцію очищували колонковою хроматографією на силікагелі (мобільна фаза: петролат: етилацетат = 10:1). Цільовий продукт об„єднували та збирали, після чого концентрували з одержанням білої речовини LG-3-C: 1,5 г (Вихід 38,8%). Стадія 4: Одержання LG-3-D Розчиняли 13 г LG-3-C (0,031 моль) в 8 мл метанолу і додавали приблизно 200 мг 10% Pd-C при перемішуванні. Після взаємодії під H2 при атмосферному тиску протягом 4 год, фільтрували через активоване вугілля, і фільтрат концентрували до маслянистої речовини LG-3-D: 8,28 г (Вихід: 96,7%). Стадія 5: Одержання LG-3 Розчиняли 5 г LG-3-D (0,018 моль) у 10 мл тетрагідрофурану. Додавали 4,7 г п-нітрофенолу (0,043 моль), і додавали розчин DIC 4,2 г (0,043) при перемішуванні. Реакційну суміш перемішували протягом ночі. Наступного дня відфільтровували одержаний осад, промивали осад на фільтрі незначною кількістю етилацетату, висушували фільтрат концентруванням при зниженому тиску. Додавали 100 мл етилацетату в залишок і розчиняли. Промивали 50 мл насиченого сольового розчину один раз. Відокремлювали органічний шар і висушували його з безводним сульфатом магнію протягом 2 годин. Потім фільтрували. Фільтрат концентрували при зниженому тиску до одержання маслянистої речовини, яку очищували колонковою хроматографією на силікагелі (елюант: гексан/етилацетат 20:1 = 10:1). Цільовий продукт об„єднували та збирали, після чого концентрували при зниженому тиску до сухого стану, щоб одержати білу тверду речовину LG-3:3,5 г (Вихід: 32 %). Приклад 5: Одержання функціональної малої молекули (LG-4) O H N O O O NH HN H N O .HCl NH O O HO OH O LG-3-D O DIC HOBT O N N O O O LG-4-A O O O O LiAlH4 H N NH O O H 35 40 H LG-4 O O Стадія 1: Одержання LG-4-A Розчиняли 5 г LG-3-D (0,018 моль) у 60 мл тетрагідрофурану. Додавали при перемішуванні 3,51 г гідрохлориду N,N-метоксиметиламіну (0,036 моль) і 4,0 г триетиламіну (0,04 моль). Потім додавали 3,4 г DIC (0,02 7 моль) і 3,65 г HOBT (0,027 моль). Реакційну суміш перемішували протягом ночі при кімнатній температурі. Наступного дня додавали реакційний розчин у 200 мл води, і екстрагували двічі етилацетатом , щораз використовуючи 200 мл. Об„єднували органічні 14 UA 102236 C2 5 10 шари. Промивали один раз послідовно 50 мл 2N розчину HCl, 100 мл насиченого розчину NaHCO3, 100 мл насиченого сольового розчину. Відокремлювали органічний шар, висушували його протягом 2 годин з безводним сульфатом магнію. Потім фільтрували. Фільтрат концентрували при зниженому тиску з одержанням масляної речовини, яку очищували колонковою хроматографією (елюант: гексан/етилацетат 10:1). Цільовий компонент об„єднували з одержанням білої твердої речовини LG-4-A: 6,24 г (Вихід: 80 %). Стадія 2: Одержання LG-4 Розчиняли 4,0 г LG-4-A (9ммоль) в 50 мл тетрагідрофурану. Додавали LiAl4 300 мг (7,9 ммоль) при температурі нижче нуля у крижаній сольовій ванні. Реакцію витримували при 0 С протягом 30 хвилин. Потім додавали послідовно 0,3 мл води, 0,9 мл 15% розчину NaOH, 0,3 мл води, і в цей час утворювався осад. Осад на фільтрі промивали тетрагідрофураном однократно. Фільтрат об„єднували й концентрували при зниженому тиску до сухого стану. Залишок очищували колонковою хроматографієюз одержанням 1,65 г LG-4 (Вихід: 55,5 %). Приклад 6: Одержання HH-EPO-005 O NH 2 H Ac-GGTYS-C-HFGPLTWV-C-RPQRG-beta-A N S S HN O O O HN Ac-GGTYS-C-HFGPLTWV-C-RPQRG-beta-A N H S 15 20 25 30 35 40 S O N H NH 2 O NH 2 HH-EPO-005 Стадія 1: Одержання циклічних пептидів з SEQ ID NO: 5 Розчиняли 9 г мономерного пептиду похідної ЕРО міметичного пептиду SEQ ID NO: 5 (синтез відповідно способу, наданому у Прикладах) в 20% крижаній оцтовій кислоті (3000 мл), і потім повільно додавали 5% метанольний розчин йоду крапельно, поки не зникне жовтий колір. Реакційний розчин безпосередньо піддавали очищенню зворотно-фазовою хроматографією, використовуючи октадецилсилан, зв`язаний з силікагелем, як наповнювач колонки (Waters TM SymmetryShield RP18 3,5 мкм, 4,6 * 100 мм), де температура колонки - 60 С, і довжина хвилі виявлення 214 нм; воду (містила 0,05% трифтороцтової кислоти), і ацетонітрил (містив 0,05% трифтороцтової кислоти) у різних співвідношеннях використовували як мобільну фазу. Об„єднували й збирали цільові фракції. Потім більшу частину ацетонітрилу піддавали дистиляції при зниженому тиску, одержували ліофілізацією 3,0 г циклічного пептиду з SEQ ID NO: 5 (Вихід: 15,6 %). Стадія 2: Одержання HH-EPO-005 Розчиняли 3 г циклічного пептиду з SEQ ID NO: 5 (1,22ммоль) в 150 мл N,Nдиметилформаміду. Додавали триетиламін 147 мг (1,46 ммоль), функціональні малі молекули (368 мг, 0,61 ммоль, LG-3). Після перемішування реакційної суміші при кімнатній температурі протягом 6 годин, концентрували частину N,N-диметилформаміду. Додавали у залишок 200 мл етеру, поміщали у холодильник на 2 год. і потім центрифугували. Білу тверду речовину одержували вакуумною сушкою. Розчиняли цю білу тверду речовину в 50 мл розчину 20% трифтороцтова кислота/дихлорметан. Після перемішування при кімнатній температурі протягом 30 хвилин частину розчинника концентрували при зниженому тиску. Додавали 200 мл етеру у залишок, поміщали це у холодильник на 2 год. і потім центрифугували. Білу тверду речовину одержували вакуумною сушкою. Білу тверду речовину очищували зворотно-фазовою хроматографією, використовуючи октадецилсилан, зв‟язаний з силікагелем, як наповнювач TM колонки (Waters SymmetryShield RP18 3,5 мкм, 4,6 * 100 мм), де температура колонки - 60 С, і 15 UA 102236 C2 5 довжина хвилі виявлення становить 214 нм; воду (що містила 0,05% трифтороцтової кислоти) та ацетонітрил (що містив 0,05% трифтороцтової кислоти) у різних співвідношеннях використовували як мобільну фазу. Об„єднували й збирали цільові фракції. Потім більшу частину ацетонітрилу піддавали дистиляції при зниженому тиску, і одержували ліофілізацією HH-EPO-005: 1,0 г (Вихід становив приблизно 33 %). Приклад 7:Одержання HH-EPO-006 O Ac-GGTYS-C-Nle-FGPLTWV-C-RPQRG-betaA NH NH2 S S HN O O O N H NH2 HN O Ac-GGTYS-C-Nle-FGPLTWV-C-RPQRG-betaA N NH 2 H S O S HH-EPO-006 10 15 20 25 30 35 Стадія 1: Одержання циклічних пептидів з SEQ ID NO: 6 Розчиняли 9 г мономерного пептиду похідної ЕРО міметичного пептиду з SEQ ID NO: 6 (синтез відповідно до способу, поданого у Прикладах) в 20% крижаній оцтовій кислоті (3000 мл), і потім повільно крапельно додавали 5% метанольний розчин йоду, поки не зникне жовтий колір. Реакційний розчин безпосередньо піддавали препаративному очищенню зворотнофазовою хроматографією, використовуючи октадецилсилан, зв‟язаний з силікагелем, як ТМ наповнювач колонки (Waters SymmetryShield RP18 3,5 мкм, 4,6 * 100 мм), де температура колонки - 60 С, довжина хвилі виявлення становила 214 нм; воду (що містила 0,05 % трифтороцтової кислоти) і ацетонітрил (що містив 0,05% трифтороцтової кислоти) у різних співвідношеннях використовували як мобільну фазу. Об„єднували й збирали цільові фракції. Потім більшу частину ацетонітрилу піддавали дистиляції при зниженому тиску, одержували ліофілізацією 3,0 г циклічного пептиду з SEQ ID NO: 6 (Вихід: 15,3%). Стадія 2: Одержання HH-EPO-006 Розчиняли 3,0 г циклічного пептиду з SEQ ID NO: 6 (1,22 ммоль) в 150 мл N,Nдиметилформаміду. Додавали триетиламін 147 мг (1,46 ммоль), функціональні малі молекули LG-3 (368 мг, 0,61 ммоль). Після перемішування реакційної суміші при кімнатній температурі протягом 6 годин концентрували частину ДМФ. Додавали у залишок 200 мл етеру, поміщали це у холодильник на 2 год. і потім центрифугували. Білу тверду речовину одержували вакуумною сушкою. Розчиняли цю білу тверду речовину в 50 мл розчину 20% трифтороцтова кислота/дихлорметан. Після перемішування при кімнатній температурі протягом 30 хвилин частину розчинника концентрували при зниженому тиску. Додавали у залишок 200 мл етеру, поміщали це у холодильник на 2 год. і потім центрифугували. Білу тверду речовину одержували вакуумною сушкою. Білу тверду речовину піддавали препаративному очищенню зворотнофазовою хроматографією, використовуючи октадецилсилан, зв‟язаний з силікагелем, як TM наповнювач колонки (Waters SymmetryShield RP18 3,5 мкм, 4,6 * 100мм), де температура колонки - 60 С, і довжина хвилі виявлення становить 214 нм; воду (що містила 0,05 % трифтороцтової кислоти) і ацетонітрил (що містив 0,05% трифтороцтової кислоти) у різних співвідношеннях використовували як мобільну фазу. Об„єднували й збирали цільові фракції. Потім більшу частину ацетонітрилу піддавали дистиляції при зниженому тиску, одержували ліофілізацією HH-EPO-006: 3,98 (Вихід - приблизно 32,7%). Приклад 8: Одержання HH-EPO-007 16 UA 102236 C2 Ac-GGTYS-C-HFGSLTWV-C-RPQRG-betaA NH O NH 2 S S HN O O O N H NH2 HN O Ac-GGTYS-C-HFGSLTWV-C-RPQRG-betaA N NH 2 H O S S HH-EPO-007 5 10 15 20 25 30 Стадія 1: Одержання циклічних пептидів з SEQ ID NO:7 Розчиняли 9 г мономерного пептиду похідної ЕРО міметичного пептиду з SEQ ID NO: 7 (синтез відповідно до способів, наведених у Прикладах) в 3000 мл 20% крижаної оцтової кислоти, і потім повільно крапельно додавали 5% метанольний розчин йоду до зникнення жовтого кольору. Реакційний розчин безпосередньо піддають препаративному очищенню зворотно-фазовою хроматографією, використовуючи октадецилсилан, зв‟язаний з силікагелем, TM як наповнювач колонки (Waters SymmetryShield RP18 3,5м, 4,6*100 мм), де температура колонки - 60 С, і довжина хвилі виявлення становила 214 нм; воду (що містила 0,05% трифтороцтової кислоти) і ацетонітрил (що містив 0,05 % трифтороцтової кислоти) в різних пропорціях використовували як мобільну фазу. Об„єднували і збирали цільові фракції. Потім більшу частину ацетонітрилу піддавали дистиляції при зниженому тиску, одержували ліофілізацією 3,15 г циклічного пептиду з SEQ ID NO:7 (Вихід: 16,4%). Стадія 2: Одержання HH-EPO-007 Розчиняли циклічний пептид з SEQ ID NO: 7 3,0 г (1,22 ммоль) в 150 мл N,Nдиметилформаміду. Додавали триетиламін 147 мг (1,46 ммоль), функціональні малі молекули LG-3 (368 мг, 0,61 ммоль). Після перемішування реакційної суміші при кімнатній температурі протягом 6 годин, концентрували частину N, N-диметилформаміду. Додавали 200 мл етеру у залишок, поміщали у холодильник на 2 год. і потім центрифугували. Білу тверду речовину одержували вакуумною сушкою. Потім розчиняли цю білу тверду речовину в 50 мл розчину 20% трифтороцтова кислота/дихлорметан. Після перемішування при кімнатній температурі протягом 30 хвилин частину розчинника концентрували при зниженому тиску. Додавали у залишок 200 мл етеру, поміщали в рефрижератор на 2 години і потім центрифугували. Білу тверду речовину одержували вакуумною сушкою. Білу тверду речовину піддавали препаративному очищенню зворотно-фазовою хроматографією, використовуючи октадецилсилан, зв‟язаний з силікагелем, TM як наповнювач колонки (Waters SymmetryShield RP18 3,5м., 4,6*100 мм), де температура колонки - 60 С, і довжина хвилі виявлення становила 214 нм; воду (що містила 0,05% трифтороцтової кислоти) і ацетонітрил (що містив 0,05 % трифтороцтової кислоти) в різних пропорціях використовували як мобільну фазу. Об„єднували і збирали цільові фракції. Потім більшу частину ацетонітрилу піддавали дистиляції при зниженому тиску, HH-EPO-007: 1,0 г одержували ліофілізацією (Вихід складав приблизно 33%). Приклад 9: Одержання HH-EPO-008 17 UA 102236 C2 Ac-GGTYS-C-HFGALTWV-C-RPQRG-betaA NH S O NH 2 S HN O O O N H NH 2 HN O Ac-GGTYS-C-HFGALTWV-C-RPQRG-betaA N H S NH 2 O S HH-EPO-008 5 10 15 20 25 30 Стадія 1: Одержання циклічного пептиду зSEQ ID NO:8 Розчиняли 27 г мономерного пептиду похідної ЕРО міметичного пептиду з SEQ ID NO: 8 (синтез відповідно способу, наданого у Прикладах) в 3000 мл 20% крижаної оцтової кислоти, і потім повільно краплями додавали 5% метанольний розчин йоду до зникнення жовтого кольору. Реакційний розчин безпосередньо піддавали препаративному очищенню зворотно-фазовою хроматографією, використовуючи октадецилсилан, зв‟язаний з силікагелем, як наповнювач TM колонки (Waters SymmetryShield RP18 3,5 мкм, 4,6 * 100 мм), де температура колонки - 60 С, і довжина хвилі виявлення становила 214 нм; воду (що містила 0,05% трифтороцтової кислоти) і ацетонітрил (що містив 0,05 % трифтороцтової кислоти) в різних пропорціях використовували як мобільну фазу. Об„єднували і збирали цільові фракції. Потім більшу частину ацетонітрилу піддавали дистиляції при зниженому тиску, одержували ліофілізацією 9,3 г циклічного пептиду з SEQ ID NO: 8. (Вихід 15,7%) Стадія 2: Одержання HH-EPO-008 Розчиняли 3 г циклічного пептиду з SEQ ID NO: 8 (1,22 ммоль) в 150 мл N,Nдиметилформаміду. Додавали триетиламін 147 мг (1,4 6 ммоль), функціональні малі молекули LG-3 (368 мг, 0,61 ммоль). Після перемішування реакційної суміші при кімнатній температурі протягом 6 годин концентрували частину N,N-диметилформаміду. Додавали у залишок 200 мл етеру, поміщали у холодильник на 2 год. і потім центрифугували. Білу тверду речовину одержували вакуумною сушкою. Потім розчиняли цю білу тверду речовину в 50 мл розчину 20% трифтороцтова кислота/дихлорметан. Після перемішування при кімнатній температурі протягом 30 хвилин частину розчинника концентрували при зниженому тиску. Додавали у залишок 200 мл етеру, поміщали у холодильник на 2 год. і потім центрифугували. Білу тверду речовину одержували вакуумною сушкою. Білу тверду речовину піддавали препаративному очищенню зворотно-фазовою хроматографією, використовуючи октадецилсилан, зв‟язаний з силікагелем, TM як наповнювач колонки Waters SymmetryShield RP18 3,5 мкм, 4,6 * 100 мм), де температура колонки - 60 С, і довжина хвилі виявлення становила 214 нм; воду (що містила 0,05 % трифтороцтової кислоти) і ацетонітрил (що містив 0,05 % трифтороцтової кислоти) в різних пропорціях використовували як мобільну фазу. Об„єднували і збирали цільові фракції. Потім більшу частину ацетонітрилу піддавали дистиляції при зниженому тиску, одержували ліофілізацією 1,0 г HH-EPO-008: (Вихід складав приблизно 33%). Приклад 10: Одержання HH-EPO-008A 18 UA 102236 C2 Ac-GGTYS-C-HFGALTWV-C-RPQRG-betaA NH S O NH 2 S HN O O NH 2 N H HN Ac-GGTYS-C-HFGALTWV-C-RPQRG-betaA N H S NH 2 O S HH-EPO-008A 5 10 Розчиняли 3,0 г циклічного пептиду з SEQ ID NO: 8 (1,22 ммоль) в 150 мл 20 ммоль ацетатного буфера (pН 5,0), і потім додавали функціональні малі молекули 201 мг (LG-4) (0,61 ммоль) і ацетонітрил (10 мл). Після перемішування реакційної суміші при кімнатній температурі протягом 30 хвилин реакційний розчин піддають препаративному очищенню зворотно-фазовою хроматографією, використовуючи октадецилсилан, зв‟язаний з силікагелем як наповнювач TM колонки (Waters SymmetryShield RP18 3,5 мкм, 4,6*100 мм), де температура колонки - 60 С, і довжина хвилі виявлення становила 214 нм; воду (що містила 0,05% трифтороцтової кислоти) і ацетонітрил (що містив 0,05 % трифтороцтової кислоти) в різних пропорціях використовували як мобільну фазу. Об„єднували і збирали цільові фракції. Потім більшу частину ацетонітрилу піддавали дистиляції при зниженому тиску, одержували ліофілізацією HH-EPO-008: 0,75 г (Вихід 25%). Приклад 11: Одержання HH-EPO-008B O Ac-GGTYS-C-HFGALTWV-C-RPQRG-betaA NH NH 2 S S HN O NH 2 N O HN Ac-GGTYS-C-HFGALTWV-C-RPQRG-betaA N NH 2 H S 15 O O S HH-EPO-008B Розчиняли 3 г циклічного пептиду з SEQ ID NO: 8 (1,22 ммоль) в 150 мл N,Nдиметилформаміду. Додавали триетиламін 147 мг (1,46 ммоль), функціональні малі молекули (LG-2) (0,61 ммоль). Після перемішування реакційної суміші при кімнатній температурі протягом 6 годин концентрували частину N,N-диметилформаміду. Додавали у залишок 200 мл етеру, 19 UA 102236 C2 5 10 поміщали в холодильник на 2 години і потім центрифугували. Білу тверду речовину одержували вакуумною сушкою. Розчиняли цю білу тверду речовину в 50 мл розчину 20% трифтороцтова кислота/дихлорметан. Після перемішування при кімнатній температурі протягом 30 хвилин частину розчинника концентрували при зниженому тиску. Додавали у залишок 200 мл етеру, поміщали у холодильник на 2 год. і потім центрифугували. Білу тверду речовину одержували вакуумною сушкою. Білу тверду речовину піддавали препаративному очищенню зворотнофазовою хроматографією, використовуючи октадецилсилан, зв‟язаний з силікагелем, як TM наповнювач колонки (Waters SymmetryShield RP18 3,5 мкм, 4,6 * 100 мм), де температура колонки - 60 С, і довжина хвилі виявлення становила 214 нм; воду (що містила 0,05% трифтороцтової кислоти) і ацетонітрил (що містив 0,05% трифтороцтової кислоти) у різних співвідношеннях використовували як мобільну фазу. Об„єднували і збирали цільові фракції. Потім більшу частину ацетонітрилу піддавали дистиляції під зниженим тиском, одержували ліофілізацією 1,3 г HH-EPO-008 (Вихід приблизно 43%). Приклад 12: Одержання HH-EPO-008C O Ac-GGTYS-C-HFGALTWV-C-RPQRG-betaA NH NH 2 S S HN NH 2 N O HN Ac-GGTYS-C-HFGALTWV-C-RPQRG-betaA N NH 2 H S 15 20 25 O S HH-EPO-008C Розчиняли 3,0 г циклічного пептиду SEQ ID NO:8 (1,22 ммоль) в 150 мл 20 ммоль ацетатного буфера (pН 5,0), і потім додавали функціональні малі молекули (LG-1) (165 мг, 0,61 ммоль) і ацетонітрил (10 мл). Після перемішування реакційної суміші при кімнатній температурі протягом 30 хвилин, реакційний розчин піддавали препаративному очищенню зворотно-фазовою хроматографією, використовуючи октадецилсилан, зв‟язаний з силікагелем, як наповнювач TM колонки (Waters SymmetryShield RP18 3,5 мкм, 4,6 * 100 мм), де температура колонки - 60 С, і довжина хвилі виявлення становила 214 нм; воду (що містила 0,05% трифтороцтової кислоти) і ацетонітрил (що містив 0,05% трифтороцтової кислоти) у різних пропорціях використовували як мобільну фазу. Об„єднували і збирали цільові фракції. Потім більшу частину ацетонітрилу піддавали дистиляції при зниженому тиску, одержували ліофілізацією 0,8 г HH-EPO-008C (Вихід: 27%). Приклад 13: Одержання HH-EPO-018 20 UA 102236 C2 H N (AcG)GTYSCHFGALTWVCRPQRG¦ÂA O NH2 O HN O O H N O (AcG)GTYSCHFGALTWVCRPQRG¦ÂA HN O O n O mPEG20K N H O N H H N N H O O n O O O mPEG20K NH2 O 5 10 15 Розчиняли 0,5 г HH-EPO-008 (0,98 ммоль) в 100 мл N,N-диметилформаміду, додавали триетиламін 39,6 мг (0,196 ммоль), 3,8 г mPEG 2-OSU (40 К)(0,96 ммоль). Реакційну суміш перемішували при кімнатній температурі протягом 6 годин. Реакційний розчин поміщали безпосередньо у 600 мл охолодженого етеру. Одержували осад твердої речовини. Після витримки у холодильнику протягом 2 годин центрифугували, і сирий HH-EPO-018 одержували вакуумною сушкою. Сирий HH-EPO-018 очищали зворотно-фазовою хроматографією, використовуючи октадецилсилан, зв‟язаний з силікагелем, як наповнювач колонки (Waters TM SymmetryShield RP18 3,5 мкм, 4,6 * 100 мм), де температура колонки - 60 С, і довжина хвилі виявлення становила 214 нм; воду (що містила 0,05% трифтороцтової кислоти) і ацетонітрил (що містив 0,05% трифтороцтової кислоти) у різних пропорціях використовували як мобільну фазу. Об„єднували і збирали цільові фракції. Потім більшу частину ацетонітрилу піддавали дистиляції при зниженому тиску, одержували ліофілізацією 1,8 г HH-EPO-018 (Вихід приблизно 47%). Приклад 14: Одержання HH-EPO-018A (AcG)GTYSCHFGALTWVCRPQRG¦ÂA H N O NH2 HN H N O O N H O H N O O O N H n O mPEG20K N H O O n O O mPEG20K (AcG)GTYSCHFGALTWVCRPQRG¦ÂA HN NH2 O 20 Розчиняли 0,5 г HH-EPO-008 (0,98 ммоль) в 100 мл N,N-диметилформаміду, додавали триетиламін 39,6 мг (0,196 ммоль), 3,8 г mPEG2-OSU (40К)(0,96 ммоль). Реакційну суміш перемішували при кімнатній температурі протягом 6 годин. Поміщали реакційний розчин безпосередньо в 600 мл охолодженого етеру. Одержували осад твердої речовини. Після витримки у холодильнику протягом 2 годин, центрифугували, і сирий HH-EPO-018 одержували вакуумною сушкою. Сирий HH-EPO-018 очищували зворотно-фазовою хроматографією, використовуючи октадецилсилан, зв‟язаний з силікагелем, як наповнювач колонки (Waters 21 UA 102236 C2 SymmetryShield RP18 3,5 мкм, 4,6 * 100 мм), де температура колонки - 60 С, і довжина хвилі виявлення становила 214 нм; воду (що містила 0,05% трифтороцтової кислоти) і ацетонітрил (що містив 0,05% трифтороцтової кислоти) у різних пропорціях використовували як мобільну фазу. Об„єднували і збирали цільові фракції. Потім більшу частину ацетонітрилу піддавали дистиляції при зниженому тиску, одержували ліофілізацією 1,5 г HH-EPO-018A (Вихід приблизно 39%). Приклад 15: Одержання HH-EPO-018B TM 5 (AcG)GTYSCHFGALTWVCRPQRG¦ÂA H N O NH2 O HN O N O N H H N O O O n O n O mPEG20K O N H HN O O (AcG)GTYSCHFGALTWVCRPQRG¦ÂA HN O mPEG20K NH2 O 10 15 20 Розчиняли 0,5 г HH-EPO-008 (0,98 ммоль) в 100 мл N,N-диметилформаміду, додавали триетиламін 39,6 мг (0,196 ммоль), 3,8 г mPEG2-OSU (40 К)(0,96 ммоль). Реакційну суміш перемішували при кімнатній температурі протягом 6 годин. Реакційний розчин поміщали безпосередньо у 600 мл охолодженого етеру. Одержували осад твердої речовини. Після витримки у холодильнику протягом 2 годин центрифугували, і сирий HH-EPO-018 одержували вакуумною сушкою. Сирий HH-EPO-018 очищали зворотно-фазовою хроматографією, використовуючи октадецилсилан, зв‟язаний з силікагелем, як наповнювач колонки (Waters TM SymmetryShield RP18 3,5 мкм, 4,6 * 100 мм), де температура колонки - 60 С, і довжина хвилі виявлення становила 214 нм; воду (що містила 0,05% трифтороцтової кислоти) і ацетонітрил (що містив 0,05% трифтороцтової кислоти) у різних пропорціях використовували як мобільну фазу. Об„єднували і збирали цільові фракції. Потім більшу частину ацетонітрилу піддавали дистиляції при зниженому тиску, одержували ліофілізацією 1,7 г HH-EPO-018: (Вихід приблизно 45%). Приклад 16: Одержання HH-EPO-018C 22 UA 102236 C2 (AcG)GTYSCHFGALTWVCRPQRG¦ÂA H N O NH2 HN O N O N H H N O O O n O mPEG20K N H HN O O n O O mPEG20K (AcG)GTYSCHFGALTWVCRPQRG¦ÂA HN NH2 O 5 10 15 20 25 30 35 Розчиняли 0,5 г HH-EPO-008 (0,98 ммоль) в 100 мл N,N-диметилформаміду, додавали триетиламін 39,6 мг (0,196 ммоль), 3,8 г mPEG 2-OSU (40 К)(0,96 ммоль). Реакційну суміш перемішували при кімнатній температурі протягом 6 годин. Реакційний розчин поміщали безпосередньо у 600 мл охолодженого етеру. Одержували осад твердої речовини. Після витримки у холодильнику протягом 2 годин центрифугували, і сирий HH-EPO-018 держували вакуумною сушкою. Сирий HH-EPO-018 очищали зворотно-фазовою хроматографією, використовуючи октадецилсилан, зв‟язаний з силікагелем, як наповнювач колонки (Waters TM SymmetryShield RP18 3,5 мкм, 4,6 * 100 мм), де температура колонки - 60 С, і довжина хвилі виявлення становила 214 нм; воду (що містила 0,05% трифтороцтової кислоти) і ацетонітрил (що містив 0,05% трифтороцтової кислоти) у різних пропорціях використовували як мобільну фазу. Об„єднували і збирали цільові фракції. Потім більшу частину ацетонітрилу піддавали дистиляції при зниженому тиску, одержували ліофілізацією 1,4 г HH-EPO-018 (Вихід приблизно 37%). Приклад 17: Ефекти похідних ЕРО міметичного пептиду у мишей Ціль цього експерименту Оцінити й зрівняти ефекти похідних ЕРО міметичного пептиду і ЕРО протеїну на еритропоез у мишей. Матеріали й методи: Похідні EPO міметичних пептидів, включаючи HH-EPO-001, HH-EPO-002, HH-EPO-003, HHEPO-004, HH-EPO-005, HH-EPO-006, HH-EPO-007, HH-EPO-008, HH-EPO-015, HH-EPO-016, HHEPO-017 й HH-EPO-018, надані Jiangsu Hansoh Pharmaceutical co., LTD. EPO отриманий від Shenyang Sansheng Pharmaceutical Co., Ltd. Миші лінії Kunming отримані від Chinese Academy of Sciences Shanghai Experimental Animal Center, вагою 25-30 г, самці. Кількість тварин у кожній групі 10. Мишам підшкірно вводили похідні ЕРО міметичного пептиду і EPO протеїн протягом трьох послідовних днів. Потім мишей умертвляли, брали цільну кров для підрахунку клітин периферичної крові і ретикулоцитів, використовуючи автоматичний лічильник форменних елементів крові. Результати й обговорення Відповідно до поточного режиму дозування і похідні EPO міметичних пептидів, й ЕРО протеїн можуть суттєво сприяти збільшенню кількості ретикулоцитів периферичної крові, що вказує на стимулювання ними еритропоезу (Див. Таблицю 1). Похідні EPO міметичних пептидів й ЕРО протеїн не мають ніякого істотного впливу на зрілі еритроцити, гематокрит, кількість гемоглобіну (Див.Таблицю 2), і також не мають ніякого істотного впливу на кількість периферичних лейкоцитів (Див.Таблицю 3). 23 UA 102236 C2 Таблиця 1 Ефекти похідних ЕРО міметичного пептиду на еритропоез ретикулоцитів у мишей Група Кількість мишей Дози і програми 10 10 10 10 10 10 10 10 10 10 10 10 10 0,1 % BSA в NS * 4,5 мг/кг, пш , d1-3 4,5 мг/кг, пш, d1-3 4,5 мг/кг, пш, d1-3 4,5 мг/кг, пш, d1-3 4,5 мг/кг, пш, d1-3 4,5 мг/кг, пш, d1-3 4,5 мг/кг, пш, d1-3 4,5 мг/кг, пш, d1-3 4,5 мг/кг, пш, d1-3 4,5 мг/кг, пш, d1-3 4,5 мг/кг, пш, d1-3 5 мкг/кг, пш, d1-3 контроль HH-EPO-005 HH-EPO-006 HH-EPO-007 HH-EPO-008 HH-EPO-015 HH-EPO-016 HH-EPO-017 HH-EPO-018 HH-EPO-018A HH-EPO-018B HH-EPO-018C EPO * Кількість ретикулоцитів 9 (×10 /л,x±SD) 136,9±5,6 947,2±14,7 515,0±22,7 553,5±26,6 908,1±21,7 1146,9±176,6 1796,4±304,4 1208,9±178,5 2000,6±272,0 1889,3±252,0 1969,7±312,0 1879,3±162,0 483,9±146,5 - підшкірно Таблиця 2 Ефекти похідних ЕРО міметичного пептиду на еритропоез, гематокрит, кількість гемоглобіну у мишей Група Кількість мишей Контроль HH-EPO-005 HH-EPO-006 HH-EPO-007 HH-EPO-008 HH-EPO-015 HH-EPO-016 HH-EPO-017 HH-EPO-018 HH-EPO-018A HH-EPO-018B HH-EPO-018C EPO 10 10 10 10 10 10 10 10 10 10 10 10 10 Кількість еритроцитів 6 (×10 /мкл, x±SD) 9,6±0,5 10,1±0,6 9,6±0,5 9,1±3,1 9,6±0,2 10,0±0,40 9,88±0,42 9,70±0,30 9,69±0,33 9,44±0,65 9,77±0,51 9,59±0,53 9,0±0,6 Дози і програми 0,1 % BSA в NS 4,5 мг/кг, пш, d1-3 4,5 мг/кг, пш, d1-3 4,5 мг/кг, пш, d1-3 4,5 мг/кг, пш, d1-3 4,5 мг/кг, пш, d1-3 4,5 мг/кг, пш, d1-3 4,5 мг/кг, пш, d1-3 4,5 мг/кг, пш, d1-3 4,5 мг/кг, пш, d1-3 4,5 мг/кг, пш, d1-3 4,5 мг/кг, пш, d1-3 5 мкг/кг, пш, d1-3 5 24 Гематокрит ( %) Гемоглобін ( %) 48,2±3,0 54,4±3,2 50,5±2,8 49,4±17,1 54,0±1,7 54,57±2,50 56,50±2,95 55,84±2,33 56,97±3,13 54,47±2,61 55,71±3,31 54,98±2,83 46,2±2,7 14,8±0,7 16,3±0,9 15,3±0,9 14,8±4,8 16,1±0,5 15,01±0,57 13,24±4,2 14,93±0,55 13,22±2,66 14,35±1,35 13,72±2,35 13,86±2,47 14,3±0,7 UA 102236 C2 Таблиця 3 Ефекти похідних ЕРО міметичного пептиду на генерування тромбоцитів, лейкоцитів Група контроль HH-EPO-005 HH-EPO-006 HH-EPO-007 HH-EPO-008 HH-EPO-015 HH-EPO-016 HH-EPO-017 HH-EPO-018 HH-EPO-018A HH-EPO-018B HH-EPO-018C EPO 5 10 15 20 25 30 35 40 Кількість мишей 10 10 10 10 10 10 10 10 10 10 10 10 10 3 3 Дози і програми Тромбоцит(×10 /мкл) Лейкоцити(×10 /мкл) 0,1 % BSA в NS 4,5 мг/кг, пш, d1-3 4,5 мг/кг, пш, d1-3 4,5 мг/кг, пш, d1-3 4,5 мг/кг, пш, d1-3 4,5 мг/кг, пш, d1-3 4,5 мг/кг, пш, d1-3 4,5 мг/кг, пш, d1-3 4,5 мг/кг, пш, d1-3 4,5 мг/кг, пш, d1-3 4,5 мг/кг, пш, d1-3 4,5 мг/кг, пш, d1-3 5 мкг/кг, пш, d1-3 1078,0±151,2 1957,8±349,5 1087,8±118,5 2082,1±863,9 1685,5±351,3 1106,6±170,03 1275,88±239,90 1109,60±130,73 1317,50±461,06 1432,50±453,05 1337,70±363,06 1355,50±331,07 1306,8±170, 5,1±1,5 4,2±1,2 4,1±1,2 3,6±0,8 2,9±0,5 4,32±1,29 5,06±1,41 4,25±1,65 4,11±1,31 4,23±1,23 4,07±1,23 4,21±1,34 4,0±0,9 Приклад 18: Ефекти похідних ЕРО міметичного пептиду у Макак Ціль цього експерименту: Оцінити ефекти похідних ЕРО міметичного пептиду на еритропоез Макак. Матеріали й методи: Похідна EPO міметичного пептиду HH-EPO-018 надана Jiangsu Hansoh Pharmaceutical co., LTD. EPO отриманий від Shenyang Sansheng Pharmaceutical Co., Ltd. Перед використанням їх розбавляють в сольовому розчині, що містить 0,1 % BSA . Макаки, вагою 5,5~8,5 кг, самці або самки, отримані від Suzhou Xishan Zhongke Laboratory Animal Center. Макаки згруповані на основі кількості гемоглобіну, в кожній групі три макаки. HHEPO-018 1,35 мг/кг вводили внутрішньовенно однократно; EPO 240 мкг/кг, три рази на тиждень, безперервне введення протягом п'яти тижнів. Обчислювали гематологічні індекси 1-2 рази на тиждень. Результати й обговорення Однократна внутрішньовенна ін'єкція HH-EPO-018 макакам приводить до збільшення вмісту гемоглобіну, збільшення гематокриту, що вказує, що HH-EPO-018 стимулює еритропоез. Пік стимулювання - на 35 день, потім повільно зменшується. Стимулюючий ефект щодо гемоглобіну приблизно 33%. Як позитивний контроль, EPO також дають те ж саме збільшення у периферичній крові макак гемоглобіну і гематокриту, і ефект знижується повільно після відміни введення препарату. Відповідно до поточного режиму дозування, стимулювання НН-EPO-018 й EPO гемоглобину у макак є суттєвим (див. Фіг. 1, 2). Приклад 19: Оцінка й порівняння ефектів похідних ЕРО міметичного пептиду HH-EPO-015, HH-EPO-018, HH-EPO-018B і позитивного контролю AF37702 у мишей. Матеріали й методи: H-EPO-015, HH-EPO-018, HH-EPO-018B й AF37702 надані Jiangsu Hansoh Pharmaceutical co., LTD., де AF37702 є також похідною EPO міметичного пептиду, отриманою від Affymax (торговельна назва: Hematide). Одержували зразок у сольовому розчині, що містить 0,1% BSA перед використанням. Миші лінії Kunming отримані від Chinese Academy of Sciences Shanghai Experimental Animal Center, вагою 25-30 г, самці. Кількість тварин у кожній групі 10. Після адаптації тваринам підшкірно вводили HH-EPO-015, HH-EPO-018, HH-EPO-018B, AF37702. Мишей умертвляли на шостий день після першої дози, брали цільну кров для підрахунку форменних елементів периферичної крові і ретикулоцитів Підрахунок здійснювали, використовуючи ADVIA автоматичний лічильник форменних елементів крові. Результати й обговорення Однократна підшкірна ін‟єкція HH-EPO-015, HH-EPO-018, HH-EPO-018B, AF37702 значно збільшувала відсоток і кількість ретикулоцитів периферичної крові у мишей; де ефекти HH-EPO018B відносно сильні; ефекти HH-EPO-018, AF37702 - супутні; ефекти HH-EPO-015 були самими слабкими; еффекти HH-EPO-018 й AF37702 приблизно однакові (див. Таблицю 4). HH-EPO-015, HH-EPO-018, HH-EPO-018B й AF37702 збільшують вміст гемоглобіну, гематокрит у мишей. Їх 25 UA 102236 C2 ефекти приблизно однакові, але всі вони не мають ніякого істотного впливу на кількість еритроцитів (Див. Таблицю 5). Таблиця 4 Ефекти HH-EPO-015, HH-EPO-018, HH-EPO-018B й AF37702 на еритропоез ретикулоцитів периферичної крові мишей Група Дози і програми Контроль HH-EPO-015 HH-EPO-015 HH-EPO-018 HH-EPO-018 HH-EPO-018B HH-EPO-018B AF37702 AF37702 5 Кількість мишей 10 10 10 10 10 10 10 10 10 Еритропоез ретикулоцитів (x±SD) 2,8±1,0 6,9±2,1** 8,9±2,4** 16,2±3,5** 16,0±3,2** 19,0±8,9** 20,0±5,3** 13,5±4,1** 17,2±5,3** 0,1 % BSA в NS 2,5 мг/кг ,пш, d1 5,0 мг/кг, пш, d1 2,5 мг/кг, пш, d1 5,0 мг/кг, пш, d1 2,5 мг/кг, пш, d1 5,0 мг/кг, пш, d1 2,5 мг/кг, пш, d1 5,0 мг/кг, пш, d1 Індекс еритропоезу ретикулоцитів 9 (×10 /л,x±SD) 195,0±73,1 511,9±191,7** 558,9±230,5** 1137,3±240,2** 1113,2±210,7** 1336,5±629,0** 1440,3±416,5** 865,2±291,4** 1202,8±355,4** **P
ДивитисяДодаткова інформація
Назва патенту англійськоюErythropoietin mimetic peptide derivatives and its pharmaceutical salt, the preparation and use thereof
Автори англійськоюLu, Aifeng, Sun, Changan, Jiang, Tao, Wu, Wentao, Wang, Yali
Назва патенту російськоюПроизводные эритропоэтин-миметического пептида и их фармацевтические соли, их получение и применение
Автори російськоюЛю Айфенг, Сун Чанган, Джянг Тао, Ву Вентао, Ванг Яли
МПК / Мітки
МПК: C07K 17/00, A61P 7/06, C07K 14/505, A61K 47/48
Мітки: еритропоетин-міметичного, одержання, пептиду, застосування, солі, похідні, фармацевтичні
Код посилання
<a href="https://ua.patents.su/48-102236-pokhidni-eritropoetin-mimetichnogo-peptidu-ta-kh-farmacevtichni-soli-kh-oderzhannya-i-zastosuvannya.html" target="_blank" rel="follow" title="База патентів України">Похідні еритропоетин-міметичного пептиду та їх фармацевтичні солі, їх одержання і застосування</a>
Попередній патент: Розчинний напій
Наступний патент: Предмет одягу
Випадковий патент: Кутова секція одноланцюгового скребкового конвеєра