Похідні пептиду або їх солі, фармацевтична композиція
Формула / Реферат
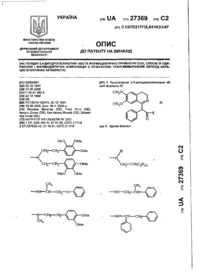
1. Производные пептида общей формулы I
где R1 - алкокси, низший алкил, циклоалкил, фторалкил, аминосульфонил, который может быть замещен алкилом; гидрокси или NRЗR4, где каждый R3 и R4 может быть либо водородом, либо алкилом;
R2 - водород, алкил, фторалкил, циклоалкил;
R1- N - R2 вместе могут обозначать 5-членный гетероцикл, который может быть незамещенным или замещенным одним или более заместителями, представляющими собой алкильные группы;
А - остаток валила, изолейцила, лейцила, аллоизолейцила, -аминоизобутаноила, 3-трет-бутилаланила, 2-трет-бутилглицила, 3-циклогексилаланила, 2-этилглицила, 2-циклогексилглицила, норлейцила, норвалила;
В - остаток N-алкил-валила, -норвалила, -лейцила, -изолейцила, -2-трет -бутилглицила, 3-трет -бутилаланила, 3-циклогексилаланила, -фенилаланила или -2-циклогексилглицила;
D, Е, F и G независимо выбирают из группы, состоящей из остатков пролила, гомопролила, гидроксипролила, тиазолидинил-4-карбонила, 1-аминопентил-1-карбонила, валила, 2-трет-бутилглицила, изолейцила, лейцила, 3-циклогексилаланила, фенилаланила, N-метилфенилаланила, тетрагидроизохинолил-2-карбонила, 3-тиазолилаланила, 3-тиенилаланила, гистидила, 1-аминоиндолил-1-карбонила, аргинила, 3-пиридилаланила, 3-трет-бутилаланила, 2-циклогексилглицила, норвалила, норлейцила и 3-нафтилаланила;
Х - водород, алкил, циклоалкил, -СН2-циклогексил или арилалкил;
E и F вместе могут обозначать
где Y - водород или низший алкил;
Z обозначает водород или низший алкил;
n = 1, 2 или 3;
V - кислород или сера;
М - водород, низший алкил, арилалкил,
циклогексил или -СН2- циклогексил;
Q - водород;
R - водород или низший алкил;
или R и Q могут вместе образовывать связь;
U - водород, низший алкил, фенил или циклоалкил;
W - водород, низший алкил или фенил;
u, v и w независимо равны 0 или 1;
К - гидрокси, алкокси, фенокси, бензилокси или замещенная или незамещенная аминогруппа,
и их соли с физиологически совместимыми кислотами.
2. Пептиды формулы I по п. 1, отличающиеся тем, что R1 - N - R2 обозначает 5-членный гетероцикл формулы
который может быть незамещенным или замещенным одним или более заместителями, представляющими собой алкильные группы.
3. Пептиды формулы I по п. 1, отличающиеся тем, что К - аминогруппа формулы
R5-N-R6,
в которой R5 - водород, низший алкил, низший алкокси, бензил;
R6 - водород, низший алкил, фенил,
С5 - циклоалкил, бензил, незамещенный или замещенный трижды низшей алкоксигруппой, бифенил, тиадиазолил, замещенный низшим алкилом или –CH2R7 -пятичленным гетероарилом, где R7 - водород, бензил, а гетероарил выбран из группы: тиазол, тиофен, оксазол.
4. Производные пептида общей формулы I по п. 1, представляющие собой пептиды формулы I, где u, v и w равны 0 и К не является гидрокси-, бензилокси-, фенокси- или алкоксигруппой.
5. Производные пептида общей формулы I по п. 1, представляющие собой пептиды формулы I, где u и v равны 0 и К не обозначает гидрокси- или алкоксигруппу.
6. Производные пептида общей формулы I по п. 1, представляющие собой пептиды формулы I, где u, v и w равны 1 и К обозначает гидрокси-, алкокси-, фенокси- или бензилоксигруппу.
7. Производные пептида общей формулы I по п. 1, представляющие собой пептиды формулы I, где u и v равны 1, w равно 0 и К обозначает гидрокси-, алкокси-, фенокси- или бензилоксигруппу.
8. Производные пептида общей формулы I по п. 1, представляющие собой пептиды формулы I, где u равно 1, v и w равны 0 и К обозначает гидрокси-, алкокси-, фенокси- или бензилоксигруппу.
9. Производные пептида общей формулы I по п. 1, обладающие опухоле-ингибирующей активностью.
10. Фармацевтическая композиция, обладающая опухолеингибирующей активностью, включающая активное вещество и носитель, отличающаяся тем, что в качестве активного вещества она содержит пептиды формулы І в эффективном количестве.
Текст
1 Производные пептида общей формулы I 5 сн СН Ї м °Т СО V X -СН-СО-А-В-ІМЕЗ гистидила, 1-аминоиндолил-1-карбонила, аргинила, 3-пиридилаланила, 3-трет-бутилаланила, 2циклогексилглицила, норвалила, норлейцила и 3нафтилаланила, X - водород, алкил, циклоалкил, -СЬЬ-циклогексил или арилалкил, Е и F вместе могут обозначать [FJ -CG] v \ j і г де R - алкокси, низший алкил, циклоалкил, фторалкил, аминосульфонил, который может быть замещен алкилом, гидрокси или NR3R4, где каждый R3 4 и R может быть либо водородом, либо алкилом, 2 R - водород, алкил, фторалкил, циклоалкил, R1- N - R2 вместе могут обозначать 5-членный гетероцикл, который может быть незамещенным или замещенным одним или более заместителями, представляющими собой алкильные группы, А - остаток валила, изолейцила, лейцила, аллоизолейцила, СС -аминоизобутаноила, 3-третбутилаланила, 2-трет-бутилглицила, 3циклогексилаланила, 2-этилглицила, 2циклогексилглицила, норлейцила, норвалила, В - остаток N-алкил-валила, -норвалила, -лейцила, -изолейцила, -2-трет -бутилглицила, 3-трет бутилаланила, 3-циклогексилаланила, фенилаланила или -2-циклогексилглицила, D, Е, F и G независимо выбирают из группы, состоящей из остатков пролила, гомопролила, гидроксипролила, тиазолидинил-4-карбонила, 1аминопентил-1-карбонила, валила, 2-третбутилглицила, изолейцила, лейцила, 3циклогексилаланила, фенилаланила, Nметилфенилаланила, тетрагидроизохинолил-2карбонила, 3-тиазолилаланила, 3-тиенилаланила, 1 \ / О со R2 R ' где Y - водород или низший алкил, Z обозначает водород или низший алкил, п = 1, 2 или 3, V - кислород или сера, М - водород, низший алкил, арилалкил, циклогексил или -СН2- циклогексил, Q- водород, R - водород или низший алкил, или R и Q могут вместе образовывать связь, U - водород, низший алкил, фенил или циклоалкил, W - водород, низший алкил или фенил, u, v и w независимо равны 0 или 1, К - гидрокси, алкокси, фенокси, бензилокси или замещенная или незамещенная аминогруппа, и их соли с физиологически совместимыми кислотами 2 Пептиды формулы І по п 1, отличающиеся тем, что R1 - N - R обозначает 5-членный гетероцикл """ ""Н ""И о го Ю 45304 v и w равны 0 и К не является гидрокси-, бензилокси-, фенокси- или алкоксигруппой 5 Производные пептида общей формулы І по п 1, представляющие собой пептиды формулы I, где и и v равны 0 и К не обозначает гидрокси- или алкоксигруппу 6 Производные пептида общей формулы І по п 1, представляющие собой пептиды формулы I, где и, v и w равны 1 и К обозначает гидрокси-, алкокси-, I N лы который мофенокси- или бензилоксигруппу жет быть незамещенным или замещенным одним 7 Производные пептида общей формулы І по п 1, или более заместителями, представляющими сопредставляющие собой пептиды формулы I, где и бой алкильные группы и v равны 1, w равно 0 и К обозначает гидрокси-, 3 Пептиды формулы І по п 1, отличающиеся алкокси-, фенокси- или бензилоксигруппу тем, что К - аминогруппа формулы 8 Производные пептида общей формулы І по п 1, R5-N-FT, представляющие собой пептиды формулы I, где и в которой R5 - водород, низший алкил, низший равно 1, v и w равны 0 и К обозначает гидрокси-, алкокси, бензил, алкокси-, фенокси- или бензилоксигруппу R6 - водород, низший алкил, фенил, 9 Производные пептида общей формулы І по п 1, С5 - циклоалкил, бензил, незамещенный или заобладающие опухоле-ингибирующей активностью мещенный трижды низшей алкоксигруппой, бифе10 Фармацевтическая композиция, обладающая нил, тиадиазолил, замещенный низшим алкилом 7 7 опухолеингибирующей активностью, включающая или -CH2R -пятичленным гетероарилом, где R активное вещество и носитель, отличающаяся водород, бензил, а гетероарил выбран из группы тем, что в качестве активного вещества она сотиазол, тиофен, оксазол держит пептиды формулы І в эффективном коли4 Производные пептида общей формулы І по п 1, честве представляющие собой пептиды формулы I, где и, -Л, Изобретение относится к медицине Изобретением предлагаются новые производные пептидов, проявляющие противоопухолевую активность, с потенциально улучшенным терапевтическим действием при лечении неопластических заболеваний по сравнению с доластатином-10 и 15 (патент США 4879278, 7 ноября 1989 года, патент США 4816444, 28 марта 1989 года) Кроме того, в отличие от доластатина-10 и -15, который должен быть выделен лабораторным путем из редких натуральных источников, соединения по настоящему изобретению могут быть синтезированы, как подробно описано ниже Помимо этого доластатин-10 неустойчив к кислотам Описано, что даже небольшие изменения в структуре могут вызвать полную потерю активности (Biochemical Pharmacology, том 40, № 8, 1859-1864, 1990) Изобретением также предлагается фармацевтическая композиция с использованием новых производных пептидов Соединения по изобретению включают новые пептиды формулы I >-CH-CO-A-B-D-f£] -IF] -IG] -К 2 R где R1 - алкокси, низший алкил, циклоалкил, фторалкил, аминосульфонил, который может быть замещен алкилом, гидрокси или NR3R4, где каждый R3 и R4 может быть либо водородом, либо алкилом, R - водород, алкил, фторалкил, циклоалкил, R1-N-R вместе могут обозначать 5-членный гетероцикл, который может быть незамещенным или замещенным одним или более заместителями, представляющими собой алкильные группы, А - остаток валила, изолейцила, лейцила, аллоизолейцила, а-аминоизобутаноила, 3-третбутилаланила, 2-трет-бутилглицила, 3циклогексилаланила, 2-этилглицила, 2циклогексилглицила, норлейцила, норвалила, В - остаток N-алкилвалила, -норвалила, лейцила, -изолейцила, -2-трет-бутилглицила, -3-третбутилаланила, -3-циклогексилаланила, фенилаланила или 2-циклогексилглицила, D, Е, F и G независимо выбирают из группы, состоящей из остатков пролила, гомопролила, гидроксипролила, тиазол ид инил-4-карбонила, 1аминопентил-1 -карбонила, валила, 2-третбутилглицила, изолейцила, лейцила, 3циклогексилаланила, фенилаланила, Nметилфенилаланила, тет-рагидроизохинолил-2карбонила, 3-тиазолилаланила, 3-тиенилаланила, гистидила, 1-аминоиндан-1-карбонила, аргинила, 3-пиридилаланила, 3-трет-бутилаланила, 2циклогексилглицила, норвалила, норлейцила и 3нафтилаланила, X - водород, алкил, циклоалкил, -СН2циклогексил или аралкил, Е и F вместе могут обозначать С Н СН 3 з \L_ -NH N. СО 45304 фенокси- или бензилоксигруппа Все предложенные производные пептида общей формулы I обладают опухоль-ингибирующей активностью Согласно изобретению предложена также фармацевтическая композиция, обладающая опухоль-ингибирующей активностью, включающая активное вещество и носитель, в которой в качестве активного вещества она содержит пептиды формулы І в эффективном количестве Один подкласс соединений изобретения включает соединения формулы І, в которых R1-NR2 - 5-членный гетероцикл формулы Ы где Y - водород или низший алкил, Z - водород или низший алкил, п = 1, 2 или 3, V - кислород или сера, М - водород, низший алкил, аралкил, циклогексил или -СН -циклогексил, Q - водород, R - водород или низший алкил, или R и Q могут вместе образовывать связь, U - водород, низший алкил, фенил или циклоалкил, W - водород, низший алкил или фенил, u, v и w независимо равны 0 или 1, и К - гидрокси, алкокси, фенокси, бензилокси или замещенная или незамещенная аминогруппа, или их соли с физиологически совместимыми кислотами Наиболее предпочтительны пептиды формулы I, где R1-N-R2-5-членный гетероцикл формулы который может быть незамещенным или замещенным одним или более заместителями, представляющими собой алкильные группы В частности, предпочтительны пептиды формулы I, где К - аминогруппа формулы R -N-R6, в которой R5 - водород, низший алкил, низший алкокси, бензил, R - водород, низший алкил, фенил, Сб-циклоалкил, бензил, незамещенный или замещенный трижды низшей алкоксигруппой, бифенил, тиадиазолил, замещенный низшим алкилом или -CH2R7-rmTH4neHHbm гетероарил, где R водород, бензил, а гетероарил выбран из группы тиазол, тиофен и оксазол Причем особенно предпочтительны пептиды формулы I, где u, v и w равны 0, а К не является гидрокси, бензилокси, фенокси или алкоксигруппой, или пептиды формулы I, где и и v равны 0 и К не обозначает гидрокси- или алкоксигруппу, либо пептиды формулы I, где u, v и w равны 1 и К гидрокси-, алкокси-, фенокси- или бензилоксигруппа, или пептиды формулы I, где и и v равны 1, w равно 0 и К - гидрокси-, алкокси-, фенокси- или бензилоксигруппа, либо пептиды формулы I, где и равно 1, v и w равны 0 и К - гидрокси-, алкокси-, ] I I N который может быть незамещен или замещен одним или более заместителями, независимо выбранными из алкила (предпочтительно С1-С4) Другой подкласс соединений изобретения включает соединения формулы I, где К - аминогруппа формулы R5-N-R6, в которой R7- водород или гидрокси, или Сі-Суалкокси, или бензилокси, или СгСуалкил, который может быть замещен одним или более атомами фтора, или С3-С7циклоалкил, или бензил, который может иметь до трех заместителей, независимо выбранных из CF3, нитро, СгСуалкилсульфонила, С1-С4алкокси, фенокси, бензокси, галогена или С1-С4алкила, R - водород, СгСуалкил, который может быть замещен одним или более атомами фтора, или Сз-Суциклоалкил, или фенил (который может иметь до трех заместителей, независимо выбранных из CF3, нитро, галогена, CONHBzl, CON(Bzl)2, Сі-С4-алкила, который может образовывать циклическую систему, СгС4-алкокси, фенокси, бензокси или СгСуалкилсульфонила), или бензил (который может иметь до трех заместителей, независимо выбранных из CF3, нитро, галогена, CONHBzl, CON(Bzl)2, Сі-С4-алкила, который может образовывать циклическую систему, С1-С4алкокси, фенокси, бензокси или С1-С7алкилсульфонила), или нафтил (который может иметь до двух заместителей, независимо выбранных из CF3, нитро, галогена, CONHBzl, CON(Bzl)2, Сі-С4-алкила, Сі-С4-алкокси, фенокси, бензокси или Сі-С7-алкилсульфонила), или бензгидрил (который может иметь до двух заместителей, независимо выбранных из CF3, нитро, галогена, CONHBzl, CON(Bzl)2, С г С 4 -алкила, С г С 4 -алкокси, фенокси, бензокси или Сі-С7-алкилсульфонила), или бифенил (который может иметь до двух заместителей, независимо выбранных из CF3, нитро, галогена, CONHBzl, CON(Bzl)2, С г С 4 -алкила, C r С4-алкокси, фенокси, бензокси или С1-С7алкилсульфонила), или трифенилметил (который может иметь до трех заместителей, независимо выбранных из CF3, нитро, галогена, CONHBzl, CON(Bzl)2, Сі-С4-алкила, Сі-С4-алкокси, фенокси, бензокси или Сі-С7-алкилсульфонила), или бензгидрилэтил (который может иметь до двух заместителей, независимо выбранных из CF3, нитро, галогена, CONHBzl, CON(Bzl)2, С г С 4 -алкила, C r 45304 С4-алкокси, бензокси, фенокси или С1-С7алкилсульфонила), или бензгид рил метил (который может иметь до двух заместителей, независимо выбранных из CF3, нитро, галогена, CONHBzl, CON(Bzl)2, С г С 4 -алкила, С г С 4 -алкокси, бензокси, фенокси или Сі-Суалкилсульфонила), или нафтилметил (который может иметь до двух заместителей, независимо выбранных из CF3, нитро, галогена, CONHBzl, CON(Bzl)2, С1-С4алкила, Сі-С4-алкокси, бензокси, фенокси или d С7-алкилсульфонила), или аценафтил (который может иметь до двух заместителей, независимо выбранных из CF3, нитро, галогена, CONHBzl, CON(Bzl)2, Сі-С4-алкила, Сі-С4-алкокси, бензокси, фенокси или Сі-Суалкилсульфонила), или аценафтилметил (который может иметь до двух заместителей, независимо выбранных из CF3, нитро, галогена, CONHBzl, CON(Bzl)2, С г С 4 -алкила, C r С4-алкокси, бензокси, фенокси или С1-С7алкилсульфонила), или пиридил (который может иметь до двух заместителей, независимо выбранных из CF3, нитро, галогена, CONHBzl, CON(Bzl)2, Сі-С4-алкила, Сі-С4-алкокси, бензокси, фенокси или Сі-С7-алкилсульфонила), или пиколил (который может иметь до двух заместителей, независимо выбранных из CF3, нитро, галогена, CONHBzl, CON(Bzl)2, С г С 4 -алкила, С г С 4 -алкокси, бензокси, фенокси или Сі-С7-алкилсульфонила), или бензотиазолил (который может иметь до двух заместителей, независимо выбранных из CF3, нитро, галогена, CONHBzl, CON(Bzl)2, С1-С4алкила, Сі-С4-алкокси, бензокси, фенокси или d С7-алкилсульфонила), или бензоизотиазолил (который может иметь до двух заместителей, независимо выбранных из CF3, нитро, галогена, CONHBzl, CON(Bzl)2, С г С 4 -алкила, С г С 4 -алкокси, бензокси, фенокси или Сі-С7-алкилсульфонила), или бензопиразолил (который может иметь до двух заместителей, независимо выбранных из CF3, нитро, галогена, CONHBzl, CON(Bzl)2, С1-С4алкила, Сі-С4-алкокси, бензокси, фенокси или d С7-алкилсульфонила), или бензоксазолил (который может иметь до двух заместителей, независимо выбранных из CF3, нитро, галогена, CONHBzl, CON(Bzl)2, С г С 4 -алкила, С г С 4 -алкокси, бензокси, фенокси или Сі-С7-алкилсульфонила), или флуоренил (который может иметь до двух заместителей, независимо выбранных из CF3, нитро, галогена, CONHBzl, CON(Bzl)2, С1-С4алкила, Сі-С4-алкокси, бензокси, фенокси или d С7-алкилсульфонила), или аминофлуоренил (который может иметь до двух заместителей, независимо выбранных из CF3, нитро, галогена, CONHBzl, CON(Bzl)2, С г С 4 -алкила, С г С 4 -алкокси, бензокси, фенокси или Сі-С7-алкилсульфонила), или пиримидил (который может иметь до двух заместителей, независимо выбранных из CF3, нитро, галогена, COOEt, CONHBzl, CON(Bzl)2, C r С4-алкила, который может образовывать циклическую систему, СгС4-алкокси, бензокси, фенокси или СгС7-алкилсульфонила), или 5-членный гетероарил [который может иметь до трех заместителей, независимо выбранных из CF3, нитро, галогена, циано, СООМе, COOEt, тиометила, тиоэтила, тио-фенила, пиколила, ацетила, -CH2COOEt, CONH2, CONHBzl, CON(Bzl)2, С г С 4 -алкила, С3-С6 8 циклоалкила, Сз-С4-алкилена, образующего бицикл ическую систему с гетеро-циклом, С1-С4алкокси, бензокси, фенокси, фенила (который может иметь до четырех заместителей, независимо выбранных из нитро, CF3, галогена или С1-С4алкила), бензила (который может иметь до четырех заместителей, независимо выбранных из нитро, CF3, галогена, Сі-С4-алкила, нафтила, С1-С7алкилсульфонила, фенилсульфонила или С1-С4диалкиламино) ], или -CHR -5-членный гетероарил (который может иметь до двух заместителей, независимо выбранных из CF3, нитро, галогена, CONHBzl, CON(Bzl)2, СООМе, COOEt, COОСН(СН3)2, CONH2, COOBzl, С г С 4 -алкила, С Г С 4 алкокси, бензокси, фенокси, фенила, бензила, нафтила или СгС7-алкилсульфонила [R7 - водород, линейный или ^разветвленный Ci-Cs-алкил, бензил, или R7 и R вместе образуют группу (СН2)3 или -(СН2)4-]) Этот подкласс включает соединения формулы I, где u, v и w независимо равны 0 или 1, R1, R2 и х - низший алкил, А и F - аминокислоты низшего алкила, В - N-низшая алкилированная аминокислота низшего алкила, D, Е, G и К имеют вышеприведенные значения С учетом вышесказанного, одна группа таких соединений может быть поэтому изображена формулой II R1R^N-CXH-CO-A-D-Pro-Pro-(F)v-(G)w-K, а другая - формулой III R1R^N-CXH-CO-A-D-Pro-Pro-(F)v-(G)w-K В другом подклассе соединений предлагаемого изобретения R5-N-R6 вместе могут образовывать структуры, выбранные из группы, состоящей из которые могут быть незамещенными или замещенными одним или более заместителями, независимо выбранными из группы, состоящей из CF3, нитро, галогена, оксо, циано, N,Nдиметиламино, CONHBzl, CON(Bzl)2, CrC6алкила, Сз-Сє-циклоалкила, Сз-С4-алкилена, образующего бициклическую систему с гетероциклом, Сі-С4-алкокси, фенокси, бензокси, нафтила, пиримидила, COOEt, COOBzl, Сз-Сє-циклоалкила, пиролидинила, пиперидинила, тиенила, пирролила, CH2-CO-NCH(CH3)2, -CH2-CO-N(CH2)4, -CH2-CON(CH2)4O, бензила (который может иметь до трех заместителей, независимо выбранных из нитро, галогена, CF3, тиометила или соответствующего сульфоксида или сульфона, тиоэтила или соответствующего сульфоксида или сульфона, С1-С4алкила и СгС4-алкокси) и фенила (который может иметь до трех заместителей, независимо выбранных из нитро, галогена, CF3, тиометила, тиоэтила, СгС4-алкила и СгС4-алкокси) 45304 10 дифторэтил, 2,2,2-трифторэтил, изопропил, пропил, бутил, циклопропил, формил, ацетил, пропионил, пивалоил, бензоил или бензил, 1 2 R -N-R вместе обозначают Предпочтительны соединения формулы I, в которых заместители имеют следующие значения R1 - этил, метил, 2-фторэтил, 2,2-дифторэтил, 2,2,2-трифторэтил, 2-фторизопропил, трифторизопропил, изопропил, пропил, бутил, пентил, циклопропил, циклопентил, морфолиносульфонил, трет-бутиламиносуль-фонил, метиламиносульфонил, NH2, N(CH3)2, N(CH2CH3)2, N[CH(CH3)2]2, R2 - водород, метил, этил, 2-фторэтил, 2,2дифторэтил, 2,2,2-трифторэтил, 2-фторизопропил, трифторизопропил, изопропил, пропил, бутил, циклопропил, или R1-N-R2 вместе обозначают один из остатков, приведенных на фиг 1, А, В, D, Е, F, G и X имеют вышеприведенные значения, u, v и w независимо равны 0 или 1, А и В вместе обозначают элементы по фиг 2 6, F и G вместе обозначают элементы по фиг 7 11, Е и F вместе обозначают элементы по фиг 12 -13, R1R2-CHX-CO и А вместе обозначают элементы по фиг 14-17, R5 - водород, метил, этил, 2-фторэтил, 2,2дифторэтил, трифторизопропил, пропил, изопропил или элементы по фиг 18, R6 - водород, метил, этил, 2-фторэтил, 2,2дифторэтил, трифторэтил, трифторизопропил, пропил, изопропил, трет-бутил или элементы по фиг 19-27, R5 -N-CHR7-5-4neHHbm гетероарил обозначает элементы по фиг 28, R5-N-R6 вместе обозначают элементы по фиг 29 - 33, К - гидрокси, алкокси (предпочтительно С г С4), фенокси или бензокси Более предпочтительны соединения, в которых заместители имеют следующие значения R1 - этил, метил, 2-фторэтил, 2,2-дифторэтил, 2,2,2-трифторэтил, 2-фторизопропил, трифторизопропил, изопропил, пропил, циклопропил, бензилоксикарбонил, метилоксикарбонил, лактил, метиламиносульфонил, тозил, уреил, мезил, г\І(СНз)2, амидино, метокси, бензил, 4феноксибензил, 4-бензилоксибензил или 3,4,5триметоксибензил, R2 - водород, метил, этил, 2-фторэтил, 2,2 сн А, В, D, Е, F, G и вышеприведенные значения; Е и F вместе обозначают X имеют R1R2N-CHX-CO и А вместе обозначают элементы по фиг 34, 35, К - гидрокси, СгС4-алкокси или бензилокси, R5 - водород, метил, этил, 2-фторэтил, 2,2дифторэтил, пропил, изопропил, циклопропил, циклопентил, циклогексил, бензил, 4феноксибензил, 4-бензилоксибензил или 3,4,5триметоксибензил, R6 - водород, метил, этил, 2-фторэтил, 2,2дифторэтил, пропил, изопропил, трет-бутил, циклопропил, циклопентил, циклогексил, бензил, 4феноксибензил, 4-бензилоксибензил, 3,4,5триметоксибензил, фенил, 4-феноксифенил, 4бензилоксифенил, 3,4,5-триметоксифенил или элементы по фиг 36 - 38, R5-N-CHR -5-членный гетероарил обозначает COOEt ! V І Я COOEt сн R -N-R вместе обозначают элементы по фиг 39-41 Эти примеры иллюстрируют, но не ограничивают объем настоящего изобретения Пептиды формулы I состоят предпочтительно из L-аминокислот, однако они могут содержать одну или более D-аминокислот Новые соединения могут присутствовать в виде солей с физиологически приемлемыми кислотами, такими как хлористоводородная кислота, лимонная кислота, винная кислота, молочная кислота, фосфорная кислота, метансульфокислота, 12 11 45304 ми группами, в химическом синтезе обратимая уксусная кислота, муравьиная кислота, малеинозащита реакционноспособных групп, не реагивая кислота, фумаровая кислота,яблочная кислорующих при образовании пептидной амидной свята, янтарная кислота, малоновая кислота, серная зи, необходима для обоих реагентов Для осущекислота, L-глутаминовая кислота, L-аспарагиновая ствления химического пептидного синтеза кислота, пировиноградная кислота, слизевая кипредпочтительны три традиционных метода ввеслота, бензойная кислота, глюкуроновая кислота, дения защитных групп бензилоксикарбонила (Z), щавелевая кислота, аскорбиновая кислота и ацетрет-бутоксикарбонила (Вое) и 9тил глицин фторенилметоксикарбонила (Fmoc) В каждом Новые соединения могут быть получены изслучае идентифицируют защитную группу на авестными методами в химии пептидов Так, пепаминогруппе звена, удлиняющего цепь Подробтиды могут быть синтезированы последовательный обзор аминокислотных защитных групп приным присоединением аминокислот либо путем веден в работе Muller, Methoden der orgamschen конденсации соответствующих пептидных фрагChemie, T XV/1, с 20 - 906, Thiemer Verlag, ментов При осуществлении последовательной Stuttgart, 1974 Звенья, используемые для образоконденсации, начиная с С-конца, пептидную цепь вания пептидной цепи, могут быть подвергнуты удлиняют постепенно с помощью одной аминовзаимодействию в растворе, в суспензии или с кислоты за один раз При соединении фрагментов применением метода, аналогичного описанному можно связывать фрагменты различной длины, и Mernfield в J AmerChem Soc 85 (1963) 2149 Ософрагменты в свою очередь могут быть получены бенно предпочтительными методами являются те, путем последовательной конденсации аминокисв которых пептиды собирают последовательно, лот или из самих себя посредством присоединелибо путем связывания фрагментов с использония фрагментов ванием метода защитных групп Z, Вое или Fmoc, Как при последовательном наращивании цепричем один реагент в указанном методе Mernfield пи, так и при конденсации фрагментов необходисвязан с нерастворимым полимерным носителем мо связать звенья путем образования амидной (далее называется также полимером) Это обычно связи Для этой цели пригодны ферментативные и приводит к тому, что пептид собирается последохимические способы вательно на полимерном носителе с использоваХимические способы получения амидной свянием метода защитных групп Вое или Fmoc, расзи описаны подробно в работах Muller, Methoden тущая пепти ная цепь ковалентно связывается у der orgamschen Chemie, т XV/2, с 1 - 364, Thieme С-окончания с нерастворимыми полимерными Verlag, Stuttgart 1974, Stewart, Young, SOhd Phase частицами Этот метод дает возможность отдеPeptide Synthesis, с 31 - 34, 71 - 82, Pierce лить реагенты и побочные продукты фильтрацией Chemical Company, Rockford, 1984, Bodanszky, и по этой причине отпадает необходимость в пеKlausner, Ondetti, Peptide Synthesis, с 85 - 128, рекристаллизации промежуточных продуктов John Wiley & Sons, New York, 1976, и других стандартных работах по химии пептидов Особое Защищенные аминокислоты могут быть сопредпочтение отдается азидному способу, спосоединены с любыми пригодными полимерами, кобу симметричных и смешанных ангидридов, акторые должны быть просто нерастворимыми в тивных сложных эфиров, полученных in situ или используемых растворителях и должны иметь предварительно, использованию уретанустойчивую физическую форму, которая облегчает проведение фильтрации Полимер должен созащищенных N-карбоксиангидридов аминокислот держать функциональную группу, к которой пери образованию амидной связи с использованием вая защищенная аминокислота может быть связующих агентов (активаторов), особенно диприсоединена надежно ковалентной связью Для циклогексилкарбодиимида (DCC), диизопропилэтой цели пригодно большое количество разнообкарбодиимида (DIC), 1-этоксикарбо-нил-2-этоксиразных полимеров, например целлюлоза, поливи1,2-дигидрохинолина (EEDQ), хлоргидрата 1 ниловый спирт, полиметакрилат, сульфонированэтил-3- (3-диметиламинопропил) карбодиимида ный полистирол, сополимер хлорметилированного (EDCI), н-пропанфосфонового ангидрида (РРА), стирола/дивинилбензола (смола Mernfield), смола М,г\1-бис(2-оксо-3-оксазолвдинил)4-метилбензгидриламина (МВНА-смола), фенилимидофосфорилхлорида (BOP-СІ), бромацетамидометил-смола (Pam-смола), птриспирролидинфосфония гекса-фторфосфата (РуВгор), дифенилфосфорилазида (DPPA), реабензилокси-бензил-спирт-смола, бензгидриламингента Кастро (ВОР, РуВор), О-бензотриазолилсмола (ВНА-смола), 4-(гидроксиметил) бензоилокМ,М,М',М'-тетраметилурониевых солей (HBTU), си-метил/ смола, смола Breipohl et al (Tetrahedron диэтилфосфорилцианида (DEPCN), 2,5-дифенилLetters 28 (1987) 565, поставляется фирмой ВАС2,3-дигидро-3-оксо-4-гидроксит иофендиоксида HEM), 4- (2,4-диметоксифениламинометил) (реагента Стеглиха, HOTDO) и 1,1'фенокси -смола (поставляется фирмой карбонилдиимидазола (CDI) Связующие реагенты Novabiochera) или о-хлортритил-смола (поставлямогут быть использованы в отдельности или в ется фирмой Biohellas) сочетании с такими присадками, как N.N-диметилДля пептидного синтеза в растворе пригодны 4-аминопиридин (DMAP), N-гидроксибензотриазол все растворителя, которые инертны в реакцион(HOBt), N-гидроксибензотриазин (HOOBt), Nных условиях, особенно вода, N,Nгидроксисукцинимид (HOSu) или 2-гидродиметилформамид (DMF), диметилсульфоксид ксипиридин (DMSO), ацетонитрил, дихлорметан (DCM), 1,4диоксан, тетрагидрофуран (THF), ІЧ-метил-2В то время, как в ферментативном пептидном пирролидон (NMP) и смеси указанных растворисинтезе обычно можно манипулировать защитны 13 45304 14 телей Пептидный синтез на полимерном носителимфом) путем введения соединения в организм ле может быть осуществлен во всех инертных млекопитающего Введение может быть осущесторганических растворителях, в которых не раствовлено любым способом, являющимся общеприняряются используемые аминокислотные производтым в фармацевтике, предпочтительно в онколоные, однако предпочтительны растворители, догии с помощью агентов, включая пероральные и полнительно приводящие к набуханию полимеров, парентеральные способы, такие как подкожный, такие как DMF, DCM, NMP, ацетонитрил и DMSO, внутривенный, внутримышечный и внутрибрюа также смеси этих растворителей После завершинный путь введения Соединения могут быть шения синтеза пептид отщепляют от полимерной введены по отдельности или в виде фармацевтисмолы Условия отщепления различных типов ческих композиций, содержащих соединение полимеров раскрыты в литературе Наиболее часформулы I вместе с фармацевтически приемлето используемыми реакциями отщепления являмым носителем, подходящим для желаемого пути ются реакции катализируемыми кислотой и палвведения Такие фармацевтические композиции ладием, особенно отщепление в жидком могут быть комбинированными продуктами, то безводном фтороводороде, в безводной трифесть могут также содержать другие терапевтичеторметансульфокислоте, в разбавленной или конски активные компоненты центрированной трифторуксусной кислоте, паллаДозировка, вводимая млекопитающему, содий-катализируемое отщепление в THF или держит эффективное опухоль-ингибирующее космесях THF-DCM в присутствии слабого основаличество активного компонента, которое зависит ния, такого как морфолин, или расщепление в от традиционных факторов, включая биологичесмесях уксусной кислоты, дихлорметана и трифскую активность конкретного используемого соторэтанола В зависимости от выбранных защитединения, способ введения, возраст, здоровье и ных групп они могут быть удержаны или аналогичмассу тела реципиента, природу и состояние симным образом отщеплены в условиях отщепления птомов, частоту лечения, введение других тераполимера Частичное освобождение от защитных певтических препаратов, а также искомый эффект групп пептида целесообразно, когда необходимо Обычная суточная доза составляет приблизиосуществить определенные реакции для получетельно 5 - 250мг на 1 кг массы тела при пероральния производных Пептиды, диалкилированные у ном введении и приблизительно 1 - 100мг на 1мг N-концевого азота, могут быть получены либо пумассы тела при парентеральном введении тем введения соответствующих N,NНовые соединения могут вводиться в традидиалкиламинокислот в растворе, либо на полиционных твердых или жидких формах, например мерном носителе, или же путем восстановительтаблетках без оболочки или с пленочным покрыного алкилирования пептида, связанного с политием, капсулах, порошках, гранулах, суппозиторимером, в смеси DMF/1% уксусной кислоты с ях или растворах Они изготавливаются традициNaCNBbb подходящими альдегидами Различные онным способом Для этой цели активные аминокислоты неприродного происхождения, а вещества могут быть переработаны с примененитакже различные неаминокислотные составляюем традиционных фармацевтических носителей, щие, раскрываемые в данном описании, могут таких как связующие таблеток, наполнители, конбыть получены из выпускаемых промышленносерванты, дезинтеграторы таблеток, регуляторы стью реагентов, либо синтезированы из промыштекучести, пластификаторы, смачивающие агенты, леннодоступных реагентов с использованием издиспергаторы, эмульгаторы, растворители, комповестных способов Например, аминокислоты, зиции пролонгированного действия, антиоксидансоставляющие фрагменты с остатками R1 и R2 , ты и/или газы-вытеснители (см Н Sucker et могут быть получены в соответствии с работой Е al Pharmazeutische Technology, Thieme-Verlag, Wunsch, Houben Weyl, Meth d Org Chemie, Stuttgart, 1978) Формы для введения, полученные BdXV, 1, p 306 following, Thieme Verlag Stuttgart таким путем, обычно содержат 1 - 90% по массе 1974, и литературными ссылками в ней Пептиды активного вещества с мостиками у- или 5-лактама могут быть получены путем включения соответствующих дипептидных Следующие примеры предназначены для илзвеньев, соединенных мостиковой связью с лаклюстрации изобретения Протеиногенные аминотамом (R Freidmger, J Org Chem Soc (1982)104кислоты даны в примерах в сокращении с исполь109) в пептидную цепь Пептиды с тиазол-, оксазованием известного трехбуквенного кода Другие зол-, тиазолин- или оксазолинсодержащими диобозначения следующие TFA - три фтору ксусная пептидными фрагментами могут быть получены кислота, Ас - уксусная кислота, Et - этил, Ви путем включения соответствующих дипептидных бутил, Me - метил, Bzl - бензил звеньев (Р Joum et al, Tetrahedron Letters (1992), А Общие методики 2807-2810, PWipf et al , Tetrahedron Letters (1992), I Пептиды, заявленные в п 1 формулы изо907-910, WRTully, J Med Chem (1991), 2065, бретения, либо синтезированы классическим споSynthesis (1987), 235) в пептидную цепь собом синтеза в растворе с использованием стандартного Z- и Вос-метода, описанного выше, либо получены стандартными методами твердофазного Соединения изобретения могут быть испольсинтеза на полностью автоматическом синтезатозованы для ингибирования или иного лечения ре модели 431 А, поставляемом фирмой APPILED твердых опухолей (например, опухолей легких, BIOSYSTEMS Аппарат использует различные молочной железы, ободочной кишки, простаты, синтетические циклы для методов защитных групп мочевого пузыря, прямой кишки или эндометриВое и Fmoc альных опухолей) или гематологических злокачественных образований (например, лейкемий, а) Синтетический цикл для метода защитной 15 45304 16 группы Вое со стадиями Ala и AI6, освобождают от N-концевой защиты (стадия 2-4 в AI6 или 1-6 в Ala) и затем 1 30% три фтору ксусная кислота в DCM - 1 х подвергают взаимодействию с 3-кратным молярЗмин ным избытком альдегида или кетона в DMF/1% 2 50% три фтору ксусная кислота в DCM - 1 х уксусной кислоте с добавлением 3 эквивалентов 1мин NaCNB-Нз По завершении реакции (негативный 3 Промывка DCM - 5 х 1мин тест Кайзера) полимер промывают несколько раз 4 5% диизопропилэтиламин в DCM - 1 х водой, изопропанолом, DMF и дихлорметаном 1мин 5 5% диизопропилэтиламин в NMP - 1 x 1 мин III Обработка пептид-полимеров, полученных в соответствии со стадиями la и II 6 Промывка NMP - 5 х 1мин 7 Добавление предварительно активированПептид-полимер сушат при пониженном давной защищенной аминокислоты (активация с полении и переносят в реакционный сосуд аппарата мощью 1 эквивалента DCC и 1 эквивалента HOBt TEFLON HF (поставляемого фирмой PENINSULA) в NMP/DCM), образование пептидной связи (1-ая После добавления акцептора, предпочтительно часть) - 1 х ЗОмин анизола (1мл/г полимера), а в случае тиольных триптофан-содержащих пептидов, с целью отще8 Добавление DMSO в реакционную смесь до пления индолформильной группы, предпочтитех пор, пока не останется 20% DMSO по объему тельно этандитиола (0,5мл/г полимера), осущест9 Образование пептидной связи (2-ая часть) вляют конденсирование во фтороводороде 1 х16мин (10мл/г полимера), охлаждая смесь жидким N2 10 Добавление 3,8 эквивалента диизопропиСмесь оставляют нагреваться до температуры лэтиламина в реакционную смесь 0°С и перемешивают при этой температуре в те11 Образование пептидной связи (3-я часть) чение 45мин Затем фтороводород упаривают при 1 х 7мин пониженном давлении и остаток промывают этил12 Промывка D C M - З х 1мин ацетатом для удаления оставшегося акцептора 13 Если превращение неполное, повторяют Пептид экстрагируют 30%-ной уксусной кислотой и стадию образования пептидной связи (возврат к фильтруют, после чего фильтрат лиофилизуют 5) IV Обработка пептид-полимеров, полученных 14 10% уксусный ангидрид, 5% диизопропина стадиях Ib и II лэтиламин в DCM - 1 х 2мин 15 10% уксусный ангидрид в DCM - 1 х 4мин Пептид-полимер сушат при пониженном давлении и затем подвергают одной из методик от16 Промывка D C M - 4 х 1мин щепления, приведенных в т а б л і , в зависимости 17 Возврат к 1 от аминокислотного состава (Wade, Tregear, BOP-СІ и РуВгор используют в качестве реаHoward Florey Fmoc Workshop Manual, Melbourne гентов взаимодействия аминокислоты вслед за N1985) метиламинокислотами Время реакции соответственно возрастает При синтезе в растворе испольСуспензию пептид-полимера в пригодной смезование либо Вос-защищенных аминокислотных си TFA перемешивают при комнатной температуNCA (г\І-трет-бутилоксикарбонил-аминокислота-г\Іре в течение указанного времени, после чего пока рбокси-ангидридов), либо Z-защищенных амилимер отфильтровывают и промывают TFA и нокислотных NCA (NDCM Фильтрат и промывные жидкости конценбензилоксикарбониламинокислота-ІЧ-карбокситрируют и пептид осаждают путем добавления ангидридов), соответственно, является наиболее диэтилового эфира После охлаждения в ледяной благоприятным для такого типа реакции бане осадок отфильтровывают, растворяют в 30%-ной уксусной кислоте и лиофилизуют б) Синтетический цикл для метода защитной группы Fmoc V Когда используют о-хлортритил-полимер (поставляемый фирмой Biohellas), суспензию пеп1 Промывка DMF - 1 x 1 мин тид-полимера в смеси уксусная кисло2 20% пиперидин в DMF - 1 х 4мин та^рифторэтанол/дихлорметан ( 1 1 3 ) переме3 20% пиперидин в D M F - 1 х 16мин шивают при комнатной температуре в течение 1ч 4 Промывка DMF - 5 х 1мин Затем полимер отфильтровывают отсасыванием и 5 Добавление предварительно активировантщательно промывают раствором для отщепленой аминокислоты (активирование 1 эквивалентом ния Объединенные фильтраты концентрируют в TBTU и 1,5 эквивалентами DIPEA в DMF), образовакууме и обрабатывают водой Осажденное вание пептидной связи - 1 х 61 мин твердое вещество удаляют фильтрацией или цен6 Промывка DMF - 3 х 1мин трифугированием, промывают диэтиловым эфи7 Если превращение не завершено, повторяром и сушат при пониженном давлении ют образование пептидной связи (возврат к 5) 8 10% уксусный ангидрид в DMF - 1 х 8мин VI Очистка и идентификация пептидов 9 Промывка DMF - 3 х 1мин Очистку осуществляют гель-хроматографией 10 Возврат к 2 (SEPHADEX G-10, 0 - 1 5 / 10% HOAc, SEPHADEX BOP-СІ и РуВгор используют в качестве реаLH20/MeOH) с использованием или без использогентов для взаимодействия аминокислот вслед за вания последующей хроматографии под средним N-метиламинокислотами Время реакции соответдавлением (стационарная фаза HD-SIL С-18, 2 ственно возрастает 1 Восстановительное алкилирование N1 45мкм, 100 А , подвижная фаза градиент с А = концевого азота 0,1% TFA/MeOH, В = 0,1% TFA/H2O) Пептид-полимер, полученный в соответствии Чистоту полученных продуктов определяют 18 17 45304 аналитической ЖХВД (стационарная фаза 100 температуре в течение 2 дней Реакционную смесь очищают гель-хроматографией 2,1мм VYDAC С-18, 5л, 300 А , подвижная фаза (SEPHADEX-LH-20, метанол) и фракции продукта CH3CN/H2O градиент, забуферено с помощью объединяют Получают 83мг продукта 0,1% TFA, 40°С) В соответствии с примерами 1 и 2 были получены и могут быть получены соединения, привеХарактеристики получают с помощью аминоденные втабл 2 кислотного анализа и масс-спектроскопией с бомбардировкой тяжелыми ядрами Примеры для получения характеристик с помощью масс-спектроскопии в отношении синтезиБ Конкретные примеры рованных новых соединений приведены втабл 3 Пример 1 (SEQIDNO 1) N, N-диметил- Val- Val-N-метил- Val-Pro-ProВ табл 4 указана последовательность соедиVal-Phe-NH2 нений, полученных в соответствии с примерами 1 и2 1,98г Fmoc-RINK-полимера (замещение 0,46ммоля/г), соответствующие порции Перечисление последовательностей 0,84ммоля, подвергают взаимодействию, как в (1) Общая информация стадии Alb, с использованием 1,26ммоля каждого (і) Заявитель из нижеприведенных соединений Fmoc-Phe-OH (A) BASF Aktiengesellschaft Pmoc-N-MeTHn-Val-OH (B) улица Carl-Bosch-Strasse 38 Fmoc-Val-OH Fmoc-Val-OH (C) город Ludwigshafen Fmoc-Pro-OH Fmoc-Val-OH (E) страна Германия Fmoc-Pro-OH (F) индекс W-6700 Аминокислоту вслед за N-метиламино(G) телефон 0621/6048526 кислотой связывают с РуВгор в качестве реагента (Н) телефакс 0621/6043123 связывания После завершения синтетических (1) телекс 1762175170 циклов пептид-полимер подвергают освобожде(II) Название изобретения новые пептиды, нию от N-концевой защиты (стадии 2 - 4 в Alb) и их получение и их применение далее подвергают взаимодействию с водным рас(III) Число последовательностей 57 твором формальдегида, как в АН, после чего су(IV) Машиночитаемый носитель шат при пониженном давлении Полученный по(A) т и п носителя дискета, 3,5 дюйма, 2 х лимер подвергают TFA-отщеплению, как в стадии двойная плотность AIV Неочищенный продукт (590мг) очищают гель(B) компьютер IBM АТ-совместимый, процесфильтрацией (SEPHADEX-LH-20) Выход составсор 80286 ляет 295 мг (C) оперативная система MS-DOS версия 5 0 Пример 2 (SEQIDNO 2) (D) программное обеспечение WordPerfect версия 5 1 (2) Информация о последовательности S E Q ID NO 1 (і) Характеристики последовательности (A) длина 9 аминокислот N,М-диыетил-Yal-Val-N-Me-Val-Pro-HU (B) тип аминокислотный (D)топология линейная 4,11 г полимера-Fmoc-Pro-n(II) Молекулярный тип пептид алкоксибензилового спирта (замещение (XI) Описание последовательности S E Q ID 0,73ммоля/г), соответствующие порции Зммоля, NO 1 подвергают взаимодействию, как в стадии Alb, с Хаа Val Val X a a Val Pro Pro Val Phe использованием 4,5ммоля каждого из нижеприве1 5 денных соединений (2) Информация о последовательности S EQ Fmoc-N-MeVal-OH ID NO 2 Fmoc-Val-OH (i) Характеристики последовательности Fmoc-Val-OH (A) длина 5 аминокислот Аминокислоту вслед за N-метиламино(B) тип аминокислотный кислотой в данном случае подвергают взаимодей(D)топология линейная ствию с применением двойной защиты с помощью (II) Молекулярный тип пептид РуВгор или Bop-CI при повышении времени реак(XI) Описание последовательности S E Q ID ции После завершения синтеза пептид-полимер NO 2 подвергают освобождению от N-концевой защиты Хаа Val X a a Pro X a a (стадии 2-4 в Alb) и далее взаимодействию с вод1 5 ным раствором формальдегида, как в стадии АН, (2) Информация о последовательности S E Q после чего сушат при пониженном давлении ПепID NO З тид-полимер, полученный таким путем, подверга(і) Характеристики последовательности ют TFA-расщеплению, как в стадии AIV Сырой (A) длина 7 аминокислот продукт (750мг) используют непосредственно для (B) тип аминокислотный дальнейшего взаимодействия 100мг этого соеди(D)топология линейная нения подвергают взаимодействию с 45мг (S)-2-[1(II) Молекулярный тип пептид амино-2-фенилэтил]тиазола и 230мг РуВор с до(XI) Описание последовательности S E Q ID бавлением 192мкл DIPEA в DMF при комнатной NO З ID ID ID ID ID ID 19 45304 Xaa Val Xaa Pro Pro Val Phe 1 5 (2) Информация о последовательности SEQ NO 4 ID (і) Хараісгеристики последовательности (A) длина 7 аминокислот (B) тип аминокислотный (D)топология линейная (II) Молекулярный тип пептид (XI) Описание последовательности SEQ ID N0 4 Xaa Val Xaa Pro Pro Val Xaa 1 5 (2) Информация о последовательности SEQ NO 5 ID (1) Х а р а к т е р и с т и к и последовательности (A) д л и н а 7 аминокислот (B) т и п а м и н о к и с л о т н ы й (D)топология линейная (II) М о л е к у л я р н ы й т и п пептид (XI) О п и с а н и е последовательности S E Q ID N0 5 Xaa Val Xaa Pro Pro Val His 1 5 (2) Информация о последовательности SEQ NO 6 ID (1) Х а р а к т е р и с т и к и последовательности (A) д л и н а 7 аминокислот (B) т и п а м и н о к и с л о т н ы й (D)топология линейная (II) М о л е к у л я р н ы й т и п пептид (XI) О п и с а н и е последовательности S E Q ID N0 6 Xaa Xaa Xaa Pro Pro Val Trp 1 5 (2) Информация о последовательности SEQ NO 7 ID (і) Характеристики последовательности (A) длина 7 аминокислот (B) тип аминокислотный (D)топология линейная (II) Молекулярный тип пептид (XI) Описание последовательности SEQ ID N0 7 Xaa Val Xaa Pro Pro Xaa Phe 1 5 (2) Информация о последовательности SEQ NO 8 ID (1) Х а р а к т е р и с т и к и последовательности (A) д л и н а 7 аминокислот (B) т и п а м и н о к и с л о т н ы й (D)топология линейная (II) М о л е к у л я р н ы й т и п пептид (XI) О п и с а н и е последовательности S E Q ID N0 8 Xaa Val Xaa Pro Pro He Phe 1 5 (2) Информация о последовательности SEQ NO 9 ID (i) Характеристики последовательности (A) длина 7 аминокислот (B) тип аминокислотный (D)топология линейная (II) Молекулярный тип пептид (XI) Описание последовательности SEQ ID N0 9 20 Xaa Val Xaa Pro Xaa Val Phe 1 5 (2) Информация о последовательности SEQ NO 10 (1) Х а р а к т е р и с т и к и последовательности (A) д л и н а 7 аминокислот (B) т и п а м и н о к и с л о т н ы й (D)топология линейная (II) М о л е к у л я р н ы й т и п пептид (XI) О п и с а н и е последовательности S E Q ID N0 10 Xaa Val Xaa Xaa Pro Val Phe 1 5 (2) Информация о последовательности SEQ NO 11 (1) Х а р а к т е р и с т и к и последовательности (A) д л и н а 7 аминокислот (B) т и п а м и н о к и с л о т н ы й (D)топология линейная (II) М о л е к у л я р н ы й т и п пептид (XI) О п и с а н и е последовательности S E Q ID N0 11 Xaa Val Xaa Pro Pro Val Phe 1 5 (2) Информация о последовательности SEQ NO 12 (1) Х а р а к т е р и с т и к и последовательности (A) д л и н а 6 аминокислот (B) т и п а м и н о к и с л о т н ы й (D)топология линейная (II) М о л е к у л я р н ы й т и п пептид (XI) О п и с а н и е последовательности S E Q ID N0 12 Xaa Xaa Pro Pro Val Phe 1 5 (2) Информация о последовательности SEQ NO 13 (і) Характеристики последовательности (A) длина 7 аминокислот (B) тип аминокислотный (D)топология линейная (II) Молекулярный тип пептид (XI) Описание последовательности SEQ ID N0 13 Xaa lie Xaa Pro Pro Val Phe 1 5 (2) Информация о последовательности SEQ NO 14 (і) Характеристики последовательности (A) длина 7 аминокислот (B) тип аминокислотный (D)топология линейная (II) Молекулярный тип пептид (XI) Описание последовательности SEQ ID N0 14 Xaa Xaa Xaa Pro Pro Val Phe 1 5 (2) Информация о последовательности SEQ NO 15 (і) Характеристики последовательности (A) длина 7 аминокислот (B) тип аминокислотный (D)топология линейная (II) Молекулярный тип пептид (XI) Описание последовательности SEQ ID N0 15 ID ID ID ID ID ID 45304 22 21 Xaa Val Xaa Xaa Pro Val Xaa Leu Xaa Pro Pro Val Phe 1 5 1 5 (2) Информация о последовательности SEQ (2) Информация о последовательности SEQ ID NO 22 NO 16 (і) Характеристики последовательности (і) Хараісгеристики последовательности (A) длина 6 аминокислот (A) длина 7 аминокислот (B) тип аминокислотный (B) тип аминокислотный (D)топология линейная (D)топология линейная (II) Молекулярный тип пептид (II) Молекулярный тип пептид (XI) Описание последовательности SEQ ID (XI) Описание последовательности SEQ ID N0 22 N0 16 Xaa Val Xaa Pro Xaa Val Xaa Val Xaa Pro Pro Phe Phe 1 5 1 5 (2) Информация о последовательности SEQ (2) Информация о последовательности SEQ ID NO 23 NO 17 (і) Характеристики последовательности (1) Х а р а к т е р и с т и к и последовательности (A) длина 4 аминокислоты (A) д л и н а 6 аминокислот (B) тип аминокислотный (B) т и п а м и н о к и с л о т н ы й (D)топология линейная (D)топология линейная (II) Молекулярный тип пептид (II) М о л е к у л я р н ы й т и п пептид (XI) Описание последовательности SEQ ID (XI) О п и с а н и е последовательности S E Q ID N0 23 N0 17 Xaa Val Xaa Pro Pro Val Xaa Val Xaa Xaa 1 5 1 (2) Информация о последовательности SEQ (2) Информация о последовательности SEQ ID NO 24 NO 18 (і) Характеристики последовательности (і) Характеристики последовательности (A) длина 5 аминокислот (A) длина 6 аминокислот (B) тип аминокислотный (B) тип аминокислотный (D)топология линейная (D)топология линейная (II) Молекулярный тип пептид (II) Молекулярный тип пептид (XI) Описание последовательности SEQ ID (XI) Описание последовательности SEQ ID N0 24 N0 18 Xaa Xaa Xaa Pro Pro Xaa Val Xaa Pro Pro Xaa 1 5 1 5 (2) Информация о последовательности SEQ (2) Информация о последовательности SEQ ID NO 25 NO 19 (і) Характеристики последовательности (і) Характеристики последовательности (A) длина 4 аминокислоты (A) длина 6 аминокислот (B) тип аминокислотный (B) тип аминокислотный (D)топология линейная (D)топология линейная (II) Молекулярный тип пептид (II) Молекулярный тип пептид (XI) Описание последовательности SEQ ID (XI) Описание последовательности SEQ ID N0 25 N0 19 Xaa Val Xaa Pro Pro Val Xaa Xaa Pro Pro 1 5 1 (2) Информация о последовательности SEQ (2) Информация о последовательности SEQ ID NO 26 NO 20 (і) Характеристики последовательности (і) Характеристики последовательности (A) длина 4 аминокислоты (A) длина 6 аминокислот (B) тип аминокислотный (B) тип аминокислотный (D)топология линейная (D)топология линейная (II) Молекулярный тип пептид (II) Молекулярный тип пептид (XI) Описание последовательности SEQ ID (XI) Описание последовательности SEQ ID N0 26 N0 20 Xaa Xaa Xaa Pro Pro Val Xaa Val Xaa Pro 1 5 1 (2) информация о последовательности SEQ ID (2) Информация о последовательности SEQ N0 27 NO 21 (і) Характеристики последовательности (і) Характеристики последовательности (A) длина 5 аминокислот (A) длина 6 аминокислот (B) тип аминокислотный (B) тип аминокислотный (D)топология линейная (D)топология линейная (II) Молекулярный тип пептид (II) Молекулярный тип пептид (XI) Описание последовательности SEQ ID (XI) Описание последовательности SEQ ID N0 21 N0 27 45304 24 23 Xaa Val Xaa Pro Xaa Phe Xaa Xaa Xaa Pro Xaa 1 5 1 5 (2) Информация о последовательности SEQ (2) Информация о последовательности SEQ ID NO 34 ID NO 28 (і) Характеристики последовательности (і) Хараісгеристики последовательности (A) длина 5 аминокислот (A) длина 7 аминокислот (B) тип аминокислотный (B) тип аминокислотный (D)топология линейная (D)топология линейная (II) Молекулярный тип пептид (II) Молекулярный тип пептид (XI) Описание последовательности SEQ ID (XI) Описание последовательности SEQ ID N0 34 N0 28 Xaa Xaa Pro Pro Xaa Xaa Val Xaa Pro Pro Val Xaa 1 5 1 5 (2) Информация о последовательности SEQ (2) Информация о последовательности SEQ ID NO 35 ID NO 29 (і) Характеристики последовательности (1) Х а р а к т е р и с т и к и последовательности (А) длина 5 аминокислот (A) длина 5 аминокислот (B) тип аминокислотный (В) т и п а м и н о к и с л о т н ы й (D)топология линейная (D)топология линейная (II) М о л е к у л я р н ы й т и п пептид (II) Молекулярный тип пептид (XI) О п и с а н и е последовательности S E Q ID (XI) Описание последовательности SEQ ID N0 29 N0 35 Xaa Xaa Pro Xaa Phe Xaa Xaa Pro Pro Val 1 5 1 5 (2) Информация о последовательности SEQ (2) Информация о последовательности SEQ ID NO 36 ID NO 30 (і) Характеристики последовательности (і) Характеристики последовательности (A) длина 7 аминокислот (A) длина 6 аминокислот (B) тип аминокислотный (B) тип аминокислотный (D)топология линейная (D)топология линейная (II) Молекулярный тип пептид (II) Молекулярный тип пептид (XI) Описание последовательности SEQ ID (XI) Описание последовательности SEQ ID N0 36 N0 30 Xaa Val Xaa Pro Pro Phe Phe Xaa Val Pro Pro Val Phe 1 5 1 5 (2) информация о последовательности SEQ ID (2) Информация о последовательности SEQ NO 37 ID NO 31 (1) Х а р а к т е р и с т и к и последовательности (і) Характеристики последовательности (A) д л и н а 7 аминокислот (A) длина 4 аминокислоты (B) т и п а м и н о к и с л о т н ы й (B) тип аминокислотный (D)топология линейная (D)топология линейная (II) М о л е к у л я р н ы й т и п пептид (II) Молекулярный тип пептид (XI) О п и с а н и е последовательности S E Q ID (XI) Описание последовательности SEQ ID N0 37 N0 31 Xaa Val Xaa Pro Pro Xaa Xaa Xaa Val Pro Pro 1 5 1 (2) Информация о последовательности SEQ (2) информация о последовательности SEQ ID ID NO 38 N0 32 (1) Х а р а к т е р и с т и к и последовательности (і) Характеристики последовательности (A) д л и н а 7 аминокислот (A) длина 4 аминокислоты (B) т и п а м и н о к и с л о т н ы й (B) тип аминокислотный (D)топология линейная (D)топология линейная (II) М о л е к у л я р н ы й т и п пептид (II) Молекулярный тип пептид (XI) О п и с а н и е последовательности S E Q ID (XI) Описание последовательности SEQ ID N0 38 N0 32 Xaa Val Xaa Pro Pro Leu Phe Xaa Xaa Pro Xaa 1 5 1 (2) Информация о последовательности SEQ (2) Информация о последовательности SEQ ID NO 39 ID NO 33 (i) Характеристики последовательности (і) Характеристики последовательности (A) длина 7 аминокислот (A) длина 6 аминокислот (B) тип аминокислотный (B) тип аминокислотный (D)топология линейная (D)топология линейная (II) Молекулярный тип пептид (II) Молекулярный тип пептид (XI) Описание последовательности SEQ ID (XI) Описание последовательности SEQ ID N0 33 N0 39 25 45304 26 Xaa NeXaa Pro Xaa Xaa Val Xaa Pro Pro lie Phe 1 5 1 5 (2) Информация о последовательности SEQ (2) Информация о последовательности SEQ ID NO 46 ID NO 40 (і) Характеристики последовательности (і) Хараісгеристики последовательности (A) длина 6 аминокислот (A) длина 7 аминокислот (B) тип аминокислотный (B) тип аминокислотный (D)топология линейная (D)топология линейная (II) Молекулярный тип пептид (II) Молекулярный тип пептид (XI) Описание последовательности SEQ ID (XI) Описание последовательности SEQ ID N0 46 N0 40 Xaa Val Xaa Pro Xaa Val Xaa Val Xaa Pro Pro Val Ala 1 5 1 5 (2) Информация о последовательности SEQ (2) Информация о последовательности SEQ ID NO 47 ID NO 41 (і) Характеристики последовательности (1) Характеристики последовательности (A) длина 7 аминокислот (A) д л и н а 7 аминокислот (B) тип аминокислотный (B) т и п а м и н о к и с л о т н ы й (D)топология линейная (D)топология линейная (II) Молекулярный тип пептид (II) М о л е к у л я р н ы й т и п пептид (XI) Описание последовательности SEQ ID (XI) О п и с а н и е последовательности S E Q ID N0 47 N0 41 Xaa Val Xaa Pro Xaa Leu Phe Xaa Xaa Xaa Pro Pro Val Phe 1 5 1 5 (2) Информация о последовательности SEQ (2) Информация о последовательности SEQ ID NO 48 ID NO 42 (1) Х а р а к т е р и с т и к и последовательности (і) Характеристики последовательности (A) д л и н а 6 аминокислот (A) длина 6 аминокислот (B) т и п а м и н о к и с л о т н ы й (B) тип аминокислотный (D)топология линейная (D)топология линейная (II) М о л е к у л я р н ы й т и п пептид (II) Молекулярный тип пептид (XI) О п и с а н и е последовательности S E Q ID (XI) Описание последовательности SEQ ID N0 48 N0 42 Xaa Val Xaa Pro Xaa Xaa Xaa Xaa Xaa Pro Pro Val 1 5 1 5 (2) Информация о последовательности SEQ (2) Информация о последовательности SEQ ID NO 49 ID NO 43 (і) Характеристики последовательности (і) Характеристики последовательности (A) длина 6 аминокислот (A) длина 7 аминокислот (B) тип аминокислотный (B) тип аминокислотный (D)топология линейная (D)топология линейная (II) Молекулярный тип пептид (II) Молекулярный тип пептид (XI) Описание последовательности SEQ ID (XI) Описание последовательности SEQ ID N0 49 N0 43 Xaa Leu Xaa Pro Pro Xaa Xaa Val Xaa Pro Pro Val Phe 1 5 1 5 (2) Информация о последовательности SEQ (2) Информация о последовательности SEQ ID NO 50 ID NO 44 (і) Характеристики последовательности (1) Характеристики последовательности (A) длина 6 аминокислот (A) д л и н а 6 аминокислот (B) тип аминокислотный (B) т и п а м и н о к и с л о т н ы й (D)топология линейная (D)топология линейная (II) Молекулярный тип пептид (II) М о л е к у л я р н ы й т и п пептид (XI) Описание последовательности SEQ ID (XI) О п и с а н и е последовательности S E Q ID N0 50 N0 44 Xaa Leu Xaa Pro Pro Xaa Xaa Val Xaa Pro Pro Val 1 5 1 5 (2) Информация о последовательности SEQ (2) Информация о последовательности SEQ ID NO 51 ID NO 45 (і) Характеристики последовательности (і) Характеристики последовательности (А) длина 5 аминокислот (A) длина 7 аминокислот (B) тип аминокислотный (В) тип аминокислотный (D)топология линейная (D)топология линейная (II) Молекулярный тип пептид (II) Молекулярный тип пептид (XI) Описание последовательности SEQ ID (XI) Описание последовательности SEQ ID N0 45 N0 51 ID ID ID ID ID ID 27 45304 28 Xaa Lys Xaa Pro Pro Val Phe Xaa Val Xaa Pro Pro Val Lys 1 5 1 5 (2) Информация о последовательности SEQ Сокращения имеют значения, приведенные на NO 52 фиг 42 - 71 (і) Хараісгеристики последовательности Окончание -NH2 означает что С-концевая аминокислота находится в ее амидной форме (A) длина 6 аминокислот (B) тип аминокислотный Соединения изобретения могут быть провере(D)топология линейная ны на противоопухолевую активность традиционными методиками, например, описанными ниже (II) Молекулярный тип пептид (XI) Описание последовательности SEQ ID А Методика in vitro N0 52 Цитотоксичность может быть измерена с исXaa Lys Xaa Pro Pro Val пользованием стандартной методики для линий 1 5 адгезивных клеток, такой как с использованием тетразолиевой пробы на микрокультуре (МТТ) (2) Информация о последовательности SEQ Детали данного анализа опубликованы (Alley, MC NO 53 et al , Cancer Research, 48 589-601, 1988) Экспо(і) Характеристики последовательности ненциально растущие культуры опухолевых кле(A) длина 5 аминокислот ток, таких как клетки НТ-29 карциномы ободочной (B) тип аминокислотный кишки или LX-1 опухоли легкого, используют с (D)топология линейная тем, чтобы получить культуры клеток в микропла(II) Молекулярный тип пептид тах Клетки высевают при концентрации 5000 (XI) Описание последовательности SEQ ID 20000 клеток на лунку в 96-луночных планшетах (в N0 53 150мкл среды) и выращивают в течение ночи при Xaa Lys Xaa Pro Pro температуре 37°С Добавляют испытуемые со1 5 единения при 10-кратных разбавлениях, варьи(2) Информация о последовательности SEQ рующихся от 10 4 М до 10 1 0 М Затем клетки инкуNO 54 бируют в течение 48ч Для определения (і) Характеристики последовательности количества жизнеспособных клеток в каждую лун(A) длина 5 аминокислот ку добавляют краситель МТТ (50мкл Змг/мл рас(B) тип аминокислотный твора 3-(4,5-ди-метилтиазол-2-ил)-2,5(D)топология линейная дифенилтетразолийбромида в солевом растворе) (II) Молекулярный тип пептид Эту смесь инкубируют при температуре 37°С в (XI) Описание последовательности SEQ ID течение 5ч, после чего в каждую лунку добавляют N0 54 50мкл 25%-ного додецилсульфата натрия (SDS), Xaa Lys Xaa Pro Xaa рН 2 После инкубации в течение ночи спектраль1 5 ную поглощательную способность каждой лунки (2) Информация о последовательности SEQ при 550нм регистрируют с использованием планNO 55 шет-ридера твердофазного иммуноферментного (і) Характеристики последовательности анализа Вычисляют значения для средних стан(A) длина 6 аминокислот дартных отклонений + / - от данных из реплика(B) тип аминокислотный тивных лунок, используя формулу % О/К (% отно(D)топология линейная шения обработанных клеток к контрольным) (II) Молекулярный тип пептид (XI) Описание последовательности SEQ ID OD обработанные клетки 1 Г 1 Г 1 _ 0 / т/г N0 55 OD контрольные клетки Xaa Xaa Xaa Pro Pro Val Концентрация испытуемого соединения, кото1 5 рая дает О/К, равную 50%-ному ингибированию (2) Информация о последовательности SEQ роста, обозначается как ICso (ингибирующая рост NO 56 на 50% концентрация) (і) Характеристики последовательности Б Методика in vivo (A) длина 7 аминокислот Соединения изобретения могут быть далее (B) тип аминокислотный испытаны в любом из различных доклинических (D)топология линейная анализов на активность in vivo, что является пока(II) Молекулярный тип пептид зателем клинической пригодности Такие анализы (XI) Описание последовательности SEQ ID осуществляют на бесшерстных мышах, которым N0 56 трансплантирована ("ксенотрансплантирована") Xaa Xaa Xaa Pro Pro Val Phe опухолевая ткань, предпочтительно человеческо1 5 го происхождения, что хорошо известно в данной (2) Информация о последовательности SEQ области техники Испытуемые соединения оцениNO 57 ваются на их противоопухолевую эффективность (і) Характеристики последовательности после введения ксенотрансплантатнесущим мы(A) длина 7 аминокислот шам Более конкретно, человеческие опухоли, (B) тип аминокислотный выращенные на бесшерстных мышах (бестимус(D)топология линейная ных мышах с мутацией по гену nude), трансплан(II) Молекулярный тип пептид тируют новых реципиентных животных с исполь(XI) Описание последовательности SEQ ID зованием опухолевых фрагментов, которые имеют N0 57 29 45304 30 размер около 50мг День трансплантации обознаТестируемые клетки (СХ-1, клон карциномы челочен как день 0 Через 6 - 1 0 дней мышей обрабавека) помещали в 96-ячеистую лунку микротитротывают испытуемым соединением, вводимым вальной пластинки при плотности 2 - 3 10 клевнутривенно или внутри-брюшинно в виде инъекток/лунку и культивировали при стандартных ции, в группах по 5 - 10 мышей на каждую дозу условиях культивирования (RPMI с 10%-ной феСоединения назначают ежедневно в течение 5 тальной сывороткой теленка и 1% необязательдней, 10 дней или 15 дней при дозировке 10 ных аминокислот) при 37°С и 5% СОг в течение 1 100мг/кг массы тела Диаметр опухолей и массы дня Затем клетки подвергали воздействию теститела измеряют дважды в неделю Объемы опухоруемыми соединениями в нескольких концентралей вычисляют с использованием диаметров, изциях Контроль инкубировали в среде отдельно меренных кронциркулем Верниера, и формулы После дальнейшей инкубации в течение 72ч куль(длина х ширина )/2 + мг массы опухоли туральную среду перемешивали путем встряхивания и добавляли 58мкл окрашенного кристалличеСредние массы опухолей вычисляют в отноского фиолетового в каждую лунку После шении каждой лечебной группы, а значения О/К окрашивания в течение 20мин окрашенный расопределяют в отношении каждой группы относитвор сливали и пластинки отмывали сильной тельно нелеченых контрольных опухолей струей воды до тех пор, пока весь несвязанный Новые соединения изобретения проявляют краситель удалится хорошую активность in vitro в вышеупомянутых системах анализов и противоопухолевую активОставшийся нерастворимый кристаллический ность в вышеупомянутой системе in vivo краситель растворяли, добавляя 100мкл раствора, содержащего 50% этанола и 0,1% уксусной кислоНиже приводятся данные по характеристике ты к каждой лунке Монослой каждой лунки опресвойств полученных соединений деляют с использованием микротитровальных В частности, приведены сведения о масспластинок ELISA счетчик при 540нм (Titertec спектроскопии пептидов (см табл 3) С помощью Multiscan, Flow Lab Mechenheim) Концентрация методики А, которая раскрыта в материалах заявтестируемого соединения, которая дает Т/С 50% ки, эти соединения были проанализированы на ингибирование роста, была обозначена как IDso противоопухолевую активность Результаты этого Результаты анализа цитотоксической активности анализа представлены в табл 5 Далее была изуописываемых соединений приведены в табл 6 чена цитотоксичность этих пептидов с помощью окрашивания кристаллическим фиолетовым (см Методика in vivo табл 6) Некоторые из соединений были протесДалее соединения согласно изобретению тестированы в доклиническом анализе для опредетировались в доклиническом анализе для определения противоопухолевой активности in vivo В ления активности in vivo, которая показывает их табл 8 даны соответствующие сведения клиническую пригодность Анализ проводили на бесшерстных мышах, которым были трансплантиСоли заявленных соединений можно получить рованы (ксенот-рансплантированы) опухолевые путем обработки пептидов эквивалентным колиткани, предпочтительно человеческой природы, чеством кислоты и концентрированием осадка В как это хорошо известно из данной области технитабл 8 приведены данные, полученные для укаки Тестируемые соединения оценивали на их занных солей противоопухолевую эффективность после введеТаким образом, материалы, содержащиеся в ния мышам, несущим ксенотрансплантат Более описании, показывают наличие противоопухолеконкретно, опухоли молочной железы человека вой активности у пептидов согласно изобретению (МХ-1), которые были выращены у бесшерстных Кроме того, они содержат достоверные данные, мышей (бестимусных мышей с мутацией в гене подтверждающие пригодность заявленного спосоnude) трансплантировали в новых мышей реципиба для лечения онкологических заболеваний у ентов День трансплантации обозначали как 0 млекопитающих Поскольку новые соединения в день Спустя 6 - 1 0 дней мышей обрабатывали испытаниях in vivo не проявили токсичности, их тестируемыми соединениями, которые вводили можно считать малотоксичными или слаботоксичвнутривенно, при каждой дозе использовали групными пы в 5 - 10 мышей Соединения давали каждый Соединения этого изобретения могут быть день, в течение 3 недель, при дозе 1 - 100мг/кг проанализированы на противоопухолевую активвеса тела Диаметр опухоли и вес тела измеряли ность с помощью обычных методик, например, дважды в неделю Размер опухоли определяли с приведенных ранее использованием диаметра, измеренного циркулем А Методика in vitro, приведенная выше РеВерниера, и формулы зультаты анализа противоопухолевой активности соединений приведены в табл 5 (длина х ширина2)/2 = мм 3 объем опухоли Далее соединения по изобретению анализи(фиг 72) ровались на противоопухолевую активность с поЗначение массы опухоли рассчитано для кажмощью количественного анализа кристаллическодой обработанной группы и Т/С значение опредего фиолетового на цитотоксичность лялось для каждых соответствующих необработанных контрольных опухолей Этот анализ проводили в соответствии с методом, описанным Flick Н and Gifford G E, J На фиг 72 дана противоопухолевая активImmunol Meth 68, 167-175 (1984) Протеины жизность на примере опухоли молочной железы (сонеспособного монослоя клеток окрашивались поединения примера 1) сле экспозиции в цитоток-сичном лекарстве и коВторой пример показывает мышей, которые лориметрически измерялось количество были обработаны соединением примера 234, 31 45304 25мг/кг три раза в неделю в течение трех недель Все опухоли в обработанной группе исчезли, в то время как в контроле опухоли выросли такими большими, что мыши погибли Невыросшие опухоли наблюдались у обработанных мышей Регресс опухоли наблюдали при дозах, которые не были токсичными для лошадей (фиг 73) На фиг 73 дана противоопухолевая активность на примере соединения 234 Сравнительное изучение соединения примера 234 и его гидрохлорида in vivo и in vitro Цитотоксичность in vitro приведена в табл 7 Активность in vivo против МХ-1, человеческих карцином молочной железы ксенотрансплантированных (s с ) бесшерстным мышам На фиг 74 дана противоопухолевая активность соединений по изобретению in vitro против МХ-1, человеческой карциномы молочной железы Свободные амиды и их гидрохлориды показали одинаковую биологическую активность Аналогичные соединения тестировались in vivo Другие соединения были также исследованы на модели МХ-1, как описано ниже Соединения были изучены і v Соединения, которые имели хорошую активность на МХ-1 модели, были также тестированы на дополнительных моделях in vivo Влияние на рост опухоли описываемых соединений, тестируемых in vivo, приведено в табл 8 Эти данные показывают, что новые соединения обладают свойствами хороших ингибиторов роста опухоли Таблица 1 Условия отщепления TFA 1 95% 2 95% Акцептор 5% Н20 5% этандитиол/анизол (13) Время реакции 1,5ч 1,5ч Таблица 2 3 Хаа Val Xan Pro Pro Val Phe 4 Xaa Val Xan Pro Pro Val Xac 5 Xaa Val Xan Pro Pro Val Xad 6 Xaa Val Xan Pro Pro Val Xae 7 Xaa Val Xan Pro Pro Val Xaf 8 Xaa Val Xan Pro Pro Val His-NH; 9 Xbo Val Xan Pro Pro Val Phe-NK? 10 Xaa Val Xan Pro Pro Val Xag-NH; 11 Xaa Val Xan Pro Pro Val Xah 12 XaaXbeXan Pro Pro Val Trp-NH2 13 Xaa Val Xan Pro Pro Xai Phe-NH2 14 Xae Val Xan Pro Pro lie Phe-NH2 15 Xaa Val Xan Pro Xal Val Phe-NH2 16 Xaa Val Xan Pro Xak Val Phe-NH2 17 Xaa Val Xan Xak Pro Val Phe-NH2 18 Xaa Val Xan Xal Pro Val Phe-NH2 Продолжение таблицы 2 19 Xaa Val Xao Pro Pro Val Phe-NH2 20 Xaa Val Xam Pro Pro Val Phe-NH2 21 22 23 24 25 25 27 23 29 30 31 32 33 34 35 36 37 38 39 40 41 42 43 44 45 46 47 43 49 50 51 52 53 54 55 56 57 58 59 6C 61 62 63 64 65 66 67 68 69 70 71 72 73 74 75 76 77 78 79 80 81 82 83 32 Xaa Xap>Pro Pro Val Phe-NH2 Xaa Xac Pro Pro Val Phe-NH2 Xaa lie Xan Pro Pro Val Phe-NH2 Xaa Xai Xan Pro Pro Val Phe-NH2 Xaa Leu Xan Pro Pro Val Phe-NH2 Xar Val Xan 3 roProValPhe-NH 2 Xas Val Xan Pro Pro Val Phe-NH2 Xat Val Kan 3 ro Pro Val Phe-NH2 Xau Val Xan ProXalValPhe-NH 2 Xav Val Xan Pro Pro Val Phe-NH2 Xan Val Xan Pro Pro Val Phe-NH2 Xaw Va Xan Pro Pro Val Phe-NH2 Xax Val Xan Pro Pro Val Phe-NH2 Xaa Val Xan Pro Pro Phe Phe-NH2 Xaz Val Xan Pro Pro Val Phe-NH2 Xba Val Xan Pro Pro Val Phe-NH2 Xaa Val Xan Pro Pro Val-NH2 Xaa Val Xan Pro Xbb Xaa Val Xan Pro Xbc Xaa Val Xan Pro Pro Xbc Xax Val Xan Pro Pro Val-NH2 Xaw Va Xan Pro Pro Val-NH2 Xat Val Kan 3 ro Pro Val-NH2 Xaa Xai Xan Pro Pro Val-NH2 Xaa Val Xan ProProXai-NH 2 Xaa Val XanXakProVal-NH 2 Xaa Val Xan ProXakVal-NH 2 Xaa Val Xan Pro Pro Val Xav Val Xan Pro Pro Val-NH2 Xaa Val Xan Pro Pro-NH2 Xaa Val Xan Pro Pro Xaa Val Xan Pro Xbf Xaa Val Xan Xbb Xaa Val Xan Xbc Xaa Val Xan Xbg Xaa Val Xan Xbh Xaa Val Xan Xbi Xaa Val Xan Xbk Xaa Val Xan Xbl XaaVa Xan Xbm Xaa Val Xan Xbn Xax Val Xan Pro Pro-NH2 Xaw Va Xan Pro Pro-NH2 Xbo Val Xan Pro Pro-NH2 Xac Val Xan Pro Pro-NH2 Xaa Xai Xan Pro Pro-NH2 Xat Xai Kan 3 ro Pro-NH2 Xaa Xap>Pro Pro-NH2 Xaa Xac Pro Pro-NH2 Xav Val Xan Pro Pro-NH2 Xaa Xap) Pro-NH2 Xaa Xac Pro-NH2 XaaVa Xan Pro Xaa Val Xbp Xaa Val Xbq Xaa Val Xbr Xaa Val Xbs Xaa Val Xan Xbf Xaa Val Xbt Xaa Val Xbu Xaa Val Xbv Xaa Val Xbw Xax Val Xan Pro-NH2 33 45304 84 Xbo Val Xan Pro-NH2 147 148 85 XavValXan Pro-NH2 149 86 Xaa Val Xan Pro Xbn 150 87 Xaa Val Xan Pro Xbg 151 88 Xaa Val Xan Pro Xbi 152 89 Xaa Val Xan Pro Xbl 153 90 Xbo Val Хал Pro Xbg 154 91 Xbo Val Xan Pro Xbl 155 92 Xbo Xbe Xan Pro Xbg 156 93 Xaa Val Xan Pro Xbx 157 94 Xaa Xbe Xan Pro Pro-NH2 158 95 Xby Val Xan Pro Pro Val Phe NH 2 159 96 Xad Val Xan Pro Pro Val Phe NH 2 160 97 Xee Val Xan Pro Pro Val Phe NH 2 161 98 Xef Val Xan Pro Pro Val Phe NH 2 162 99 Xbz Val Xan Pro Pro Val Phe NH 2 163 100 Xeg Val Xan Pro Pro Val Phe NH 2 164 101 Xca Val Xan Pro Pro Val Phe NH 2 165 102 Xcb Val Xan Pro Pro Val Phe NH 2 166 103 Xcb Val Xao Pro Pro Val Phe NH 2 167 104 XCC Val Xan Pro Pro Val Phe NH 2 168 105 Xce Val Xan Pro Pro Val Phe NH 2 169 107 Xcg Val Xan Pro Pro Val Phe NH 2 170 108 Xch Val Xan Pro Pro Val Phe NH 2 171 109 Xci Val Xan Pro Pro Val Phe NH 2 172 110 Xck Val Xan Pro Pro Val Phe NH 2 173 111 Xcl Val Xan Pro Pro Val Phe NH 2 174 112 Xcm Val Xan Pro Pro Val Phe NH 2 175 113 Xcn Val Xan Pro Pro Val Phe NH 2 176 114 Xhn Val Xan Pro Pro Val Phe NH 2 177 115 Xho Val Xan Pro Pro Val Phe NH 2 178 116 Xhp Val Xan Pro Pro Val Phe NH 2 179 117 Xhq Val Xan Pro Pro Val Phe NH 2 180 118 Xby Val Xan Pro Pro Val NH 2 181 119 Xed Val Xan Pro Pro Val NH 2 182 120 Xee Val Xan Pro Pro Val NH 2 183 121 Xef Val Xan Pro Pro Val NH 2 184 122 Xbz Val Xan Pro Pro Val NH 2 185 123 Xeg Val Xan Pro Pro Val NH 2 186 124 Xca Val Xan Pro Pro Val NH 2 187 125 Xcb Val Xan Pro Pro Val NH 2 188 126 Xcc Val Xan Pro Pro Val NH 2 189 127 Xce Val Xan Pro Pro Val NH 2 190 128 Xcg Val Xan Pro Pro Val NH 2 191 129 Xch Val Xan Pro Pro Val NH 2 192 130 Xci Val Xan Pro Pro Val NH 2 193 131 Xck Val Xan Pro Pro Val NH 2 194 132 Xcl Val Xan Pro Pro Val NH 2 195 133 Xcm Val Xan Pro Pro Val NH 2 196 134 Xcn Val Xan Pro Pro Val NH 2 197 135 Xhn Val Xan Pro Pro Val NH 2 198 136 Xho Val Xan Pro Pro Val NH 2 199 137 Xhp Val Xan Pro Pro Val NH 2 200 138 Xhq Val Xan Pro Pro Val NH 2 201 139 Xby Val Xan Pro Pro NH 2 202 140 Xed Val Xan Pro Pro NH 2 203 141 Xee Val Xan Pro Pro NH 2 204 142 Xef Val Xan Pro Pro NH 2 205 143 Xbz Val Xan Pro Pro NH 2 206 144 Xeg Val Xan Pro Pro NH 2 207 Продолжение таблицы 2 208 145 Xca Val Xan Pro Pro NH 2 209 146 Xcb Val Xan Pro Pro NH 2 34 Xcc Val Xan Pro Pro NH 2 Xce Val Xan Pro Pro NH 2 Xcg Val Xan Pro Pro NH 2 Xch Val Xan Pro Pro NH 2 Xci s/al XanF3 roF3 ro NH 2 Xck Val Xan Pro Pro NH 2 Xcl s/al XanF3 roF3 ro NH 2 Xcrr Val Xan Pro Pro NH 2 Xcn Val Xan Pro Pro NH 2 Xhn Val Xan Pro Pro NH 2 Xho Val Xan Pro Pro NH 2 Xhp Val Xan Pro Pro NH 2 Xhq Val Xan Pro Pro NH 2 Xaa Val Xan Pro Pro Val Xei Xaa Val Xan Pro Pro Val Xem Xaa Val Xan Pro Pro Val Xeo Xaa Val Xan Pro Pro Val Xep Xaa Val Xan Pro Pro Val Xeq Xaa Val Xan Pro Pro Val Xex Xaa Val Xan Pro Pro Val Xey Xaa Val Xan Pro Pro Val Xfb Xaa Val Xan Pro Pro Val Xfe Xaa Val Xan Pro Pro Val Xfh Xaa Val Xan Pro Pro Val Xfu Xaa Val Xan Pro Pro Val Xfv Xaa Val Xan Pro Pro Val Xft Xaa Val Xan Pro Pro Val Xfw Xaa Val Xan Pro Pro Val Xfx Xaa Val Xan Pro Pro Val Xga Xaa Val Xan Pro Pro Val Xgd Xaa Val Xan Pro Pro Val Xgg Xaa Val Xan Pro Pro Val Xgh Xaa Val Xan Pro Pro Val Xgi Xaa Val Xan Pro Pro Val Xgl Xaa Val Xan Pro Pro Val Xgs Xaa Val Xan Pro Pro Val Xgv Xaa Val Xan Pro Pro Val Xhe Xaa Val Xan Pro Pro Val Xgy Xaa Val Xan Pro Pro Val Xhd Xaa Val Xan Pro Pro Val Xhb Xaa Val Xan Pro Pro Val Xhc Xaa Val Xan Pro Pro Val Xhl Xaa Val Xan Pro Pro Xeh Xaa Val Xan Pro Pro Xen Xaa Val Xan Pro Pro Xeo Xaa Val Xan Pro Pro Xep Xaa Val Xan Pro Pro Xeq Xaa Val Xan Pro Pro Xer Xaa Val Xan Pro Pro Xet Xaa Val Xan Pro Pro Xeu Xaa Val Xan Pro Pro Xes Xaa Val Xan Pro Pro Xew Xaa Val Xan Pro Pro Xez Xaa Val Xan Pro Pro Xfc Xaa Val Xan Pro ProXff Xaa Val Xan Pro Pro Xfi Xaa Val Xan Pro ProXfs Xaa Val Xan Pro Pro Xfz Xaa Val Xan Pro Pro Xgc Xaa Val Xan Pro Pro Xgf Xaa Val Xan Pro Pro Xgm Xaa Val Xan Pro Pro Xgr Xaa Val Xan Pro Pro Xgu 35 45304 36 Val Xan Pro Pro Xgs 272 Xaa Xcw Pro Pro Val NH2 Val Xan Pro Pro Xgx 273 Xaa Xcv Pro Pro Val NH2 Val Xan Pro Pro Xha 274 Xaa Xcx Pro Pro Val NH2 Val Xan Pro Pro Xhk 275 Xaa Xcy Pro Pro Val NH2 Val Xan Pro Хек 276 Xaa Xcz Pro Pro Val NH2 Val Xan Pro Xen 277 xaa Xda Pro Pro Val NH2 Val Xan Pro Xer 278 Xaa Xdb Pro Pro Val NH2 Val Xan Pro Xep 279 Xaa Xdc Pro Pro Val NH2 Val Xan Pro Xeq 280 Xaa Xde Pro Pro Val NH2 Val Xan Pro Xer 281 Xaa Xdf Pro Pro Val NH2 Val Xan Pro Xet 282 Xaa Xdg Pro Pro Val NH2 Val Xan Pro Xeu 283 Xaa Xdh Pro Pro Val NH2 Val Xan Pro Xes 284 Xaa Xco Pro Pro NH2 Val Xan Pro Xfa 285 Xaa Xcp Pro Pro NH2 Val Xan Pro Xfd 286 XaaXcg Pro Pro NH2 Val Xan Pro Xfg 287 Xaa Xer Pro Pro NH2 Val Xan Pro Xfl 288 Xaa Xcs Pro Pro NH2 Val Xan Pro Xfk 289 Xaa Xct Pro Pro NH2 Val Xan Pro Xfm 290 Xaa Xcu Pro Pro NH2 Val Xan Pro Xfn 291 Xaa Xcw Pro Pro NH2 Val Xan Pro Xfo 292 Xaa Xcv Pro Pro NH2 Val Xan Pro Xfp 293 Xaa Xcx Pro Pro NH2 Val Xan Pro Xfq 294 Xaa Xcy Pro Pro NH2 Val Xan Pro Xfr 295 Xaa Xcz Pro Pro NH2 Val Xan Pro Xfy 296 Xaa Xda Pro Pro NH2 Val Xan Pro Xgb 297 xaa Xdb Pro Pro NH2 Val Xan Pro Xge 298 Xaa Xdc Pro Pro NH2 Val Xan Pro Xgk 299 Xaa Xdd Pro Pro NH2 Val Xan Pro Xgn 300 Xaa Xdf Pro Pro NH2 Val Xan Pro Xhi 301 Xaa Xdg Pro Pro NH2 Val Xan Pro Xgo 302 Xaa Xdh Pro Pro NH2 Val Xan Pro Xgp 303 Xds Xan Pro Pro Val Phe NH2 Val Xan Pro Xgq 304 XdtXan Pro Pro Val Phe NH2 Val Xan Pro Xgt 305 Xdu Хал Pro Pro Val Phe NH2 Val Xan Pro Xgw 306 XdvXan Pro Pro Val Phe NH2 Val Xan Pro Xgz 307 Xdw Xan Pro Pro Val Phe NH2 Val Xan Pro Xhra 308 XdxXan Pro Pro Val Phe NH2 Xco Pro Pro Val Phe NH2 309 Xdy Xan Pro Pro Val Phe NH2 Xcp Pro Pro Val Phe NH2 310 Xdz Xan Pro Pro Val Phe NH2 Xcq Pro Pro Val Phe NH2 311 XeaXan Pro Pro Val Phe NH2 Xer Pro Pro Val Phe NH2 312 Xeb Xan Pro Pro Val Phe NH2 Xcs Pro Pro Val Phe NH2 313 Xec Xan Pro Pro Val Phe NH2 Xct Pro Pro Val Phe NH2 314 Xds Xan Pro Pro Val NH2 Xcu Pro Pro Val Phe NH2 315 Xdt Xan Pro Pro Val NH2 Xcw Pro Pro Val Phe NH2 316 Xdu Xan Pro Pro Val NH2 Xcv Pro Pro Val Phe NH2 317 XdvXan Pro Pro Val NH2 Xcx Pro Pro Val Phe NH2 318 Xdw Xan Pro Pro Val NH2 Xcy Pro Pro Val Phe NH2 319 XdxXan Pro Pro Val NH2 Xda Pro Pro Val Phe NH2 320 Xdy Xan Pro Pro Val NH2 Xdb Pro Pro Val Phe NH2 321 Xdz Xan Pro Pro Val NH2 Xdc Pro Pro Val Phe NH2 322 Xea Xan Pro Pro Val NH2 Xdd Pro Pro Val Phe NH2 323 Xeb Xan Pro Pro Val NH2 Xdf Pro Pro Val Phe NH2 324 Xec Xan Pro Pro Val NH2 Xdg Pro Pro Val Phe NH2 325 Xds Xan Pro Pro NH2 Xdh Pro Pro Val Phe NH2 326 XdtXan Pro Pro NH2 Xco Pro Pro Val NH2 327 Xdu Xan Pro Pro NH2 Xcp Pro Pro Val NH2 328 XdvXan Pro Pro NH2 Xcq Pro Pro Val NH2 329 XdwXanProProNH 2 Xer Pro Pro Val NH2 330 XdxXan Pro Pro NH2 Xcs Pro Pro Val NH2 331 Xdy Xan ProProNH 2 232 XdzXarProProNH 2 Продолжение таблицы 2 270 Xaa Xct Pro Pro Val NH2 333 XeaXan Pro Pro NH2 271 Xaa Xcu Pro ProVa NH2 334 Xeb Xan Pro Pro NH2 210 211 212 213 214 215 216 217 218 219 220 221 222 223 224 225 226 227 228 229 230 231 232 233 234 235 236 237 238 239 240 241 242 243 244 245 246 247 248 249 250 251 252 253 254 255 256 257 258 259 260 261 262 263 264 265 266 267 268 269 Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa 37 45304 38 Xec Xan Pro Pro NH2 397 Xef Val Xan Pro Xbh Xds Val Pro Pro Val Phe NH2 398 Xef Val Xan Pro Xgn Xds Val Pro Pro NH2 399 Xca Xct Pro Xfy Xdv Val Pro Pro NH2 400 Xaa tLeu Xan Pro Pro Val Phe NH2 Xds Xan Pro Xfy 401 Xaa Leu Xan Pro Pro Val Phe NH2 Xdv Xan Pro Xfy 402 Xaa lie Xan Pro Pro Val Phe NH2 Xaa Val Xhf Pro Pro Val Phe NH2 403 Xaa Val Xan Pro Pro tLeu Phe NH2 Xaa Val Xhg Pro Pro Val Phe NH2 404 Xaa Val Xan Pro Pro Leu Phe NH2 Xaa Val Xhh Pro Pro Val Phe NH2 405 Xaa Val Xan Pro Pro lie Phe NH2 Xaa Val Xhf Pro Pro Val NH2 406 Xaa Val Xan Pro Pro Val Dab NH2 Xaa Val Xhg Pro Pro Val NH2 407 Xaa Val Xan Pro Pro Val Ala NH2 Xaa Val Xhh Pro Pro Val NH2 408 Xaa Dab Xan Pro Pro Val Phe NH2 Xaa Val Xhf Pro Pro NH2 409 Xaa Dab Xan Pro Pro Val NH2 Xaa Val Xhg Pro Pro NH2 410 Xaa Dab Xan Pro Pro NH2 Xaa Val Xhh Pro Pro NH2 411 Xhr Val Xan Pro Pro Val Phe NH2 Xaa Val Xhf Pro Xfy 412 Xhu Val Xan Pro Pro Val Phe NH2 Xaa Val Xhg Pro Xfy 413 Xht Val Xan Pro Pro Val NH2 Xaa Val Xhh Pro Xfy 413(a) Xhu Val Xan Pro Pro Val NH2 Xaa Val Xhf Pro Xgb 414 Xht Val Xan Pro Pro NH2 Xaa Val Xhg Pro Xgb 415 Xhu Val Xan Pro Pro NH2 Xaa Val Xhh Pro Xgb 416 Xaa Val Xhy Pro Pro Val Phe NH2 Xed Val Xan Pro Xfy 417 Xaa Val Xhz Pro Pro Val Phe NH2 Xby val Xan Pro Xfy 418 Xaa Val Xhy Pro Pro Val NH2 Xby Val Xan Pro Xhi 419 Xaa Val Xhz Pro Pro Val NH2 Xef Val Xan Pro Xfy 420 Xaa Val Xhy Pro Pro NH2 Xef Val Xan Pro Xhi 421 Xaa Leu Xhz Pro Pro NH2 Xea Val Xan Pro Xfy 422 Xaa Val Xhy Xfy Xca Val Xan Pro Xhi 423 Xa Val Xhz Xfy Xaa Val Xan ProXdpPheNH 2 424 Xhv Val Xan Pro Pro Val Phe NH2 Xaa Val Xan Pro Xdq Phe NH2 425 Xhw Val Xan Pro Pro Val Phe NH2 Xaa Val Xan ProXdrPheNH 2 426 Xhx Val Xan Pro Pro Val Phe NH2 Xaa Val Xan Pro Xdp NH2 427 Xhv Val Xan Pro Pro Val NH2 Xaa Val Xan Pro Xdq NH2 428 Xhw Val Xan Pro Pro Val NH2 Xaa Val Xan Pro Xdr NH2 429 Xhx Val Xan Pro Pro Val NH2 Xaa Val Xan ProProXdi NH2 430 Xhv Val Xan Pro Pro NH2 Xaa Val Xan Pro Pro Xcs NH2 431 Xhw Val Xan Pro Pro NH2 Xaa Val Xan Pro Pro Xct NH2 432 Xhx Val Xan Pro Pro NH2 Xaa Val Xan Pro ProXcu NH2 433 Xaa Val Xan Pro Xia Xaa Xcs Pro Pro Xdi NH2 434 Xaa Val Xan Pro Xib Xaa Xct Pro ProXdi NH2 435 Xaa Val Xan Pro Xic XaaXcsProXdpPheNH 2 436 Xaa Val Xan Pro Xid XaaXctProXdpPheNH 2 437 Xaa Val Xan Pro Xie XaaXcsProXdpNH 2 438 Xby Val Xan Pro Xia XaaXctProXdpNH 2 439 Xby Val Xan ProXib Xaa Xcs Pro Xdq NH2 440 Xby Val Xan Pro Xic Xaa Xct Pro Xdq NH2 441 Xby Val Xan Pro Xid XaaXcsProXdrNH 2 442 Xby Val Xan Pro Xie XaaXctProXdrNH 2 443 Xca Val Xan Pro Xia Xaa Val Xan ProProXdi NH2 444 Xca Val Xan ProXib Xaa Val Xan ProProXdkNH 2 445 Xca Val Xan Pro Xic Xaa Val Xan ProProXdi NH2 446 Xca Val Xan Pro Xid Xaa Val Xan ProProXdm NH2 447 Xca Val Xan Pro Xie Xaa Val Xan ProProXdn NH2 448 Xed Val Xan Pro Xic Xaa Val Xan ProProXdoNH 2 449 Xed ValXar ProXib Xca Val Xan Pro Pro Phe Phe NH2 450 Xed Val Xan Pro Xic Xby Val Xan Pro Pro Phe Phe NH2 451 Xed Val Xan Pro Xid Xca Val Xan Pro Pro Phe Phe NH2 452 Xed Val Xan Pro Xie Xef Val Xhf Pro Pro tLeu Phe NH2 453 Xby Leu Xan Pro Xia Xef Val Xhf Pro Pro tLeu Aic NH2 454 Xby Leu Xan ProXib Xef Val Xhf Pro Pro tLeu Tic NH2 455 Xby lie Xan Pro Xic Продолжение таблицы 2 456 Xby lie Xan Pro Xic 395 Xef Val Xan Pro Xfy 457 Xby Leu Xan Pro Xie 396 Xef Val Xan Pro Xbg 458 Xca Leu Xan Pro Xia 335 336 337 338 339 340 341 342 343 344 345 346 347 348 349 350 351 352 353 354 355 356 357 358 359 360 361 362 363 364 365 366 367 368 369 370 371 372 373 374 375 376 377 378 379 380 381 382 383 384 385 386 387 388 389 390 391 392 393 394 39 45304 40 459 XcaValXad ProXib 521 Xaa Lys Xan Pro Pro NH2 460 Xca Val Xao Pro Xic 522 Xaa Lys Xan Pro Xfy 461 Xat Val Xhf Pro Xak Leu Phe NH2 523 Xaa Chg Xan Pro Pro Val NH2 462 Xan Val Xhf Pro Xhr Leu Phe NH2 524 Xaa Chg Xan Pro Pro NH2 463 Xed Val Xhf Pro Xak Leu Phe NH2 525 Xaa Chg Xan Pro Pro Val Phe NH2 464 Xed Val Xhf Pro Xhr Leu Phe NH2 526 Xaa Val Хм Pro Pro Val Phe NH2 465 Xat Val Xhf Pro Xak Val NH2 527 Xaa Val Хм Pro Pro Val NH2 466 Xac Val Xhf Pro Xhr Val NH2 528 Xaa Val Хм Pro Pro NH2 467 Xed Val Xhf Pro Xak Val NH2 529 Xaa Val Xan Pro Pro Val Lys NH2 468 Xed Val Xhf Pro Xhr Val NH2 530 Xaa Val Xan Pro Xik 469 Xat Val Xhf Pro Xak NH2 531 Xaa Val Xan Pro Pro Хм NH2 470 Xat Val Xhf Pro Xhr NH2 532 Xaa Val Xbu 471 Xed Val Xhf Pro Xak NH2 533 XbyValXbu 472 Xat val Xhf Pro Xia 534 Xca Val Xbu 473 Xat Val Xhf Pro Xib 535 Xaa Val Xbv 474 Xed Val Xhf Pro Xic 536 XbyValXbv 475 Xed Val Xhf Pro Xid 537 Xca Val Xbv 476 Xat Val Xhf Pro Xie 538 Xaa Val Xan Pro Pro Xab 477 Xat Val Xhf Pro Xhs NH2 539 Xaa Val Xan Xab 478 Xed Val Xhf Pro Xhs NH2 540 Xira Val Xan Pro Pro Val Phe NH2 479 Xat Val Xhf Pro Xak Xfz 541 Xm Val Xan Pro Pro Val Phe NH2 480 Xat Val Xhf Pro Xhr Xfz 542 Xio Val Xan Pro Pro Val Phe NH2 481 Xed Val Xhf Pro Xak Xfz 543 Xip Val Xan Pro Pro Val Phe NH2 482 Xed Val Xhf Pro Xhr Xfz 544 Xiq Val Xar Pro Pro Val Phe NH2 483 Xat Val Xhf Pro Xak Xbw 545 Xkd Val Xar Pro Pro Val Phe NH2 484 Xat Val Xhf Pro Xhr Xbw 546 Xim Val Xan Pro Pro Val NH2 485 Xed Val Xhf Pro Xak Xbw 547 Xm Val Xan Pro Pro Val NH2 486 Xed Val Xhf Pro Xhr Xbw 548 Xio Val Xan Pro Pro Val NH2 487 Xat Val Xhf Pro Xak Xer 549 Xip Val Xan Pro Pro Val NH2 488 Xat Val Xhf Pro Xhr Xer 550 Xiq Val Xan Pro Pro Val NH2 489 Xed Val Xhf Pro Xak Xer 551 Xkd Val Xan Pro Pro Val NH2 490 Xed Val Xhf Pro Xhr Xer 552 Xim Val Xan Pro Pro NH2 491 Xat Val Xhf Pro Xak Xgi 553 Xm Val Xan Pro Pro NH2 492 Xat Val Xhf Pro Xhr Xgi 554 Xio Val Xan Pro Pro NH2 493 Xed Val Xhf Pro Xak Xgi 555 Xip Val Xan Pro Pro NH2 494 Xed Val Xhf Pro Xhr Xgi 556 Xiq Val Xan Pro Pro NH2 455 Xat Val Xhf Pro Xak Xif 557 Xkd Val Xan Pro Pro NH2 456 Xat Val Xhf Pro Xhr Xif 558 Xaa Val Xan Pro Pro Val Xir 457 Xed Val Xhf Pro Xak Xif 559 Xaa Val Xan Pro Pro Val Xis 498 Xed Val Xhf Pro Xhr Xif 560 Xaa Val Xan Pro Pro Val Xit 499 Xat Val Xhf Pro Xak Xig 561 Xaa Val Xan Pro Pro Val Xiu 500 Xat Val Xhf Pro Xhr Xig 562 Xaa Val Xan Pro Pro Xiv 501 Xed Val Xhf Pro Xak Xig 563 Xaa Val Xan Pro Pro Xiw 502 Xed Val Xhf Pro Xhr Xig 564 Xaa Val Xan Pro Pro Xiy 503 Xaa Val Xan Pro Pro Xif 565 Xaa Val Xan Pro Pro Xix 504 Xaa Val Xan Pro Xig 566 Xaa Val Xan Pro Xiz 505 Xca Val Xan Pro Pro Xif 567 Xaa Val Xan Pro Xxa 506 Xca Val Xan Pro Xig 568 Xaa Val Xan Pro Xkb 507 Xby Val Xan Pro Pro Xif 569 Xaa Val Xan Pro Xkc 508 Xby Val Xan Pro Xig 570 Xke Val Xan Pro Pro Val Phe NH2 509 Xed Val Xan Pro Pro Xif 571 Xkf Val Xan Pro Pro Val Phe NH2 510 Xed Val Xan Pro Xig 572 Xkg Val Xan Pro Pro Val Phe NH2 511 Xaa Leu Xan Pro Pro Xif 573 Xkh Val Xan Pro Pro Val Phe NH2 512 Xaa Leu Xan Pro Xig 574 Xke Val Xan Pro Pro Val NH2 513 Xca Leu Xan Pro Pro Xif 575 Xkf Val Xan Pro Pro Val NH2 514 Xca Leu Xan Pro Xig 576 Xkg Val Xan Pro Pro Val NH2 515 Xby Leu Xan Pro Pro Xif 577 Xkh Val Xan Pro Pro Val NH2 516 Xby Leu Xan Pro Xig 578 Xke Val Xan Pro Pro NH2 517 Xed Leu Xan Pro Pro Xif 579 Xkf Val Xan Pro Pro NH2 518 Xec Leu Xan Pro Xig 580 Xkg Val Xan Pro Pro NH2 581 Xkh Val Xan Pro Pro NH2 Продолжение таблицы 2 519 Xaa Lys Xan Pro Pro Val Phe NH2 582 Xaa Xcz Pro Pro Val Phe NH2 520 Xaa Lys Xan Pro Pro Val NH2 583 Xed Val Xhf Pro Xhr NH2 41 45304 Таблица 3 Примеры [М] 3 8 9 10 13 14 16 19 20 23 24 25 26 27 28 29 31 33 34 37 38 39 48 50 51 52 55 30 56 57 58 59 62 65 66 73 86 87 88 93 95 101 102 146 157 204 214 215 224 227 230 233 234 Масспектрометрический анализ быстрой бомбардировкой атомами [мол вес (измеренный) ] 798 787 825 809 811 812 812 812 812 812 812 812 812 812 811 825 783 881 845 649 737 648 651 550 551 731 537 825 550 534 545 545 635 566 566 454 655 635 630 704 825 853 809 576 616 740 619 845 648 649 691 717 641 Продолжение таблицы 3 238 667 239 579 42 241 246 347 115 139 349 350 351 352 357 361 401 403 404 405 407 411 417 538 566 567 568 569 544 671 595 566 845 579 566 655 669 656 669 697 811 811 812 812 721 869 869 837 642 565 579 608 869 Таблица 4 Номер (а) соединений 38, 39, 52, 8 6 - 9 1 , 93,214-246, 350 - 362, 366 - 368, 395 - 398, 433 - 452, 459, 460, 469 - 478, 504, 506, 508, 510, 530, 566 - 569, 583 3, 9, 26 - 28, 30 - 33, 35, 36, 95 117, 341 -343, 416, 417, 424-426, 526, 540 - 545, 570 - 573 4 - 7 , 10, И, 406, 558-561 8 12 13, 392, 403 14 15, 16, 29 17, 18 19, 20 21, 22, 247 - 264, 303 - 313, 582 23, 402 24, 400 25, 401 34 37, 118-138, 344-346 40, 45, 189 - 213, 369 - 372, 383 388, 503, 505, 507, 509, 531, 538, 562 - 565 41 - 43, 48, 49, 527 44 46, 50, 51, 62-65, 70, 139-159, 347 - 349, 414, 415, 420, 421, 430 432, 528, 552 - 557, 578 - 581 47 5 3 - 6 1 , 78, 422, 423,539 66, 67, 94, 410, 524 Номер последовательности Ю 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 43 68, 69, 284 - 302, 325 - 335 73, 83 - 85 92 160-188 265-283, 314-324 336 337, 338 339, 340, 377 - 382, 399 363 - 365 373, 374 375т 376 389 - 391 393, 394 404 405 407 408 409 411, 412, 418, 419, 427-429, 546551, 574-577 413, 413 (а), 453, 454, 457, 458, 512, 514, 516, 518 455, 456 465 - 468 461 - 464 479 - 502 515, 517 513 519 520 521 522 523 525 529 45304 25 26 27 28 29 30 31 32 33 34 35 36 37 38 39 40 41 42 43 44 45 46 47 48 49 50 51 52 53 54 55 56 57 Таблица 5 Соединение по примеру ID50 [M] 14 3x10"' 19 8x10"' 20 2x10"' 23 2x10"' 25 2хЮ" 4 26 6x10"" 27 5x10"' 29 >10" 4 52 5x10"' 55 2x10"' 56 4x10"' 57 4x10"' 58 10"' 62 3x10"' 65 4x10"' 66 2x10"' 73 2x10"' 86 10"' 87 4x10"" 88 2x10"' Продолжение таблицы 5 93 5x10"' 95 5x10"' 44 102 146 157 204 214 215 227 230 233 234 238 239 241 224 568 39 569 246 347 349 351 352 357 361 401 404 405 411 417 350 566 567 10" 4 2x10"' 2хЮ" 4 4x10"' 10"' 3x10"' 10"" 10"' 10"' Зх10" 1 и 6x10"' 6x10"" >10"' 4х10" 1 и 6 х10" 1и 2x10"" 1 хЮ"" 10"" 3x10"' 6x10"' 7x10"" 2x10"" 8x10"' >10"' 2хЮ" 4 4x10"' 3x10"' > 10"' 2x10"' 2x10"' 2х10" 1 и 2x10"' Таблица 6 Соединение по примеру 1 2 3 8 9 10 13 16 28 31 33 34 37 38 48 50 51 59 101 407 538 403 ID50 9x10"" 4x10"" 6x10"' 5x10"' 4x10"" 6x10"" 2x10"' 9x10"' ЗхЮ~" 10"' 2x10"' 4x10"" 4x10"' Зх10" 1 и 4x10"' 2x10"' 5x10"' 8x10"' 2хЮ" 4 9x10"' 10" ш 2x10"' Таблица 7 Клеточная Свободное основа HCL Ю50 (М) 45 линия НТ-29 45304 ниє Юбо (М) Среднее Среднее (пре(предел) дел) 2,7x10 |и(4,10 1 9 5,8х10 °(1,9х10 хЮ9-1,4х 1 , 0 x 1 0 10 ) 10 10) Таблица 8 Пример 2 37 Активность + ++ Комментарий задержка роста опухоли активно на других моде 46 излечивание, активно на других моделях излечивание, активно на +++ 50 других моделях ++ регрессия 230 + - задержка роста опухоли, + + - регрессия, + + + - излечивание, другие модели - Р388 лейкемия, OVCAR овариальная карцинома, LOX меланома человека +++ 38 N w • ^ CO • v -«VY001 CHj CPj П .^YV1 COCHj If о CHj CiCHjJj CO CK; Фиг 2 47 сні 45304 48 „., оь ~ со ь, Cr.j * СНз CFs CBj CKj CHj ск) СО V и Фиг 5 -г Спз -», СН; I ClCtUl *Г~ -^іґ СНз СКз Фиг 6 СНз Фиг 4 Chj 49 45304 50 оу" 1 » СНз CHj Оз СНз СНз f-r N т • \ h •" \ ІІ & f Г —' s-J сн3 CHj СНз СІСН^Із СР] •н и xj СН; со Фиг 9 Фйг7 •Vr"--4! =4 сн, 'сн3 CICHjh СНз СКз -а,- V // СКз Фиг 10 СНз IN 45304 51 CH, Фиг.-] 1 г CHj Фиг.12 s-J Фиг 15 СНз со СН; Фиг. 13 СВз Фиг. 14 53 54 45304 ФйГ. 18 - -о о < 'CHj со \ о _ R2 CF3 Фиг 19 Фиг. 17 45304 56 Х сн ( ч ,CCK(CHJ)J "Чнг CCCEt м ССШе CONHBzl СОВД; s. 1 W Щ •CCSKBil \sszl COOEt / Фиг 22 S ft// СООБе ц Я Фиг 23 Фиг 21 \ 45304 58 і uy* OCK3 Фиг 27 Фиг 25 59 60 45304 CQOBzl N і s N сн, ОСН 3 r< ФигЗО — N С Cri О — H 0 N О S — N У0 0 0 ^ 6 О 00 W СНССН,}, COOEt /~\ S К S (Д CHO — CH, / •С(СВ3)з Г л \ сн3 f \ 0 0 ОО 0 о0 Х Х Фиг 31
ДивитисяДодаткова інформація
Автори англійськоюDrescher Karla
Автори російськоюХаупт Андреас
МПК / Мітки
МПК: C07K 5/103, C07K 7/06, C07K 5/08, C07K 5/062, C07K 5/107, A61P 35/00, C07K 5/083, A61K 38/00, A61P 35/02, C07K 5/10, C07K 5/087
Мітки: фармацевтична, пептиду, похідні, композиція, солі
Код посилання
<a href="https://ua.patents.su/48-45304-pokhidni-peptidu-abo-kh-soli-farmacevtichna-kompoziciya.html" target="_blank" rel="follow" title="База патентів України">Похідні пептиду або їх солі, фармацевтична композиція</a>
Попередній патент: Похідні рапаміцину з стабілізованим кільцем с-22, спосіб індукування імуносупресії
Наступний патент: Спосіб кількісного визначення норфлоксацину в лікарських препаратах на його основі
Випадковий патент: Процес підготовки глибоких опіків до шкірної пластики