Композиція на основі кон’югату гідрокодону з бензойною кислотою, похідними бензойної кислоти або гетероарилкарбоновою кислотою, проліки, спосіб лікування від зловживань
Номер патенту: 102916
Опубліковано: 27.08.2013
Автори: Мікл Тревіс, Каньскі Ярослав, Мікл Крістел, Мартін Андреа К., Бера Бінду, Гюнтер Свен, Чі Гочень
Формула / Реферат
1. Композиція, яка містить щонайменше один кон'югат, при цьому кон'югат містить гідрокодон і щонайменше одну бензойну кислоту, її похідне, її сіль або їх комбінацію.
2. Композиція за п. 1, де щонайменше одна бензойна кислота або похідне бензойної кислоти має наступну формулу І:
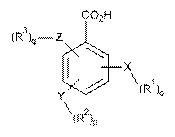 , (I)
, (I)
де
X, Y і Z незалежно вибрані з групи, що включає Н, О, S, NH і -(СН2)x-;
R1, R2 і R3 незалежно вибрані з групи, що включає Н, алкіл, алкокси, арил, алкеніл, алкініл, атом галогену, галогензаміщений алкіл, алкіларил, арилалкіл, гетероцикл, арилалкокси, циклоалкіл, циклоалкеніл і циклоалкініл;
о, р, q незалежно вибрані з 0 або 1; і
х означає ціле число в діапазоні від 1 до 10.
3. Композиція за п. 1, де щонайменше однією бензойною кислотою або похідним бензойної кислоти є амінобензоат, гідроксибензоат, аміногідроксибензоат, їх похідне або їх комбінація.
4. Композиція за п. 3, де амінобензоат вибраний із групи, що включає антранілову кислоту, 3-амінобензойну кислоту, 4,5-диметилантранілову кислоту, N-метилантранілову кислоту, N-ацетилантранілову кислоту, фенамові кислоти (наприклад, толфенамову кислоту, мефенамову кислоту, флуфенамову кислоту), 2,4-діамінобензойну кислоту (2,4-DABA), 2-ацетиламіно-4-амінобензойну кислоту, 4-ацетиламіно-2-амінобензойну кислоту, 2,4-діацетиламінобензойну кислоту, їх похідні і їх комбінації.
5. Композиція за п. 3, де гідроксибензоат вибраний із групи, що включає саліцилову кислоту, ацетилсаліцилову кислоту (аспірин), 3-гідроксибензойну кислоту, 4-гідроксибензойну кислоту, 6-метилсаліцилову кислоту, о,м,п-крезотинову кислоту, анакардинові кислоти, 4,5-диметилсаліцилову кислоту, о,м,п-оксипарацимолкарбонову кислоту, дифлузинал, о,м,п-анісову кислоту, 2,3-дигідробензойну кислоту (2,3-DHB), α,β,γ-резорцинову кислоту, протокатехову кислоту, гентизинову кислоту, піперонілову кислоту, 3-метоксисаліцилову кислоту, 4-метоксисаліцилову кислоту, 5-метоксисаліцилову кислоту, 6-метоксисаліцилову кислоту, 3-гідрокси-2-метоксибензойну кислоту, 4-гідрокси-2-метоксибензойну кислоту, 5-гідрокси-2-метоксибензойну кислоту, ванілінову кислоту, ізованілінову кислоту, 5-гідрокси-3-метоксибензойну кислоту, 2,3-диметоксибензойну кислоту, 2,4-диметоксибензойну кислоту, 2,5-диметоксибензойну кислоту, 2,6-диметоксибензойну кислоту, вератрову кислоту (3,4-диметоксибензойну кислоту), 3,5-диметоксибензойну кислоту, галову кислоту, 2,3,4-тригідроксибензойну кислоту, 2,3,6-тригідроксибензойну кислоту, 2,4,5-тригідроксибензойну кислоту, 3-О-метилгалову кислоту (3-ОMGA), 4-О-метилгалову кислоту (4-OMGA), 3,4-О-диметилгалову кислоту, бузкову кислоту, 3,4,5-триметоксибензойну кислоту, їх похідні і їх комбінації.
6. Композиція за п. 3, де аміногідроксибензоат вибраний із групи, що включає 4-аміносаліцилову кислоту, 3-гідроксіантранілову кислоту і 3-метоксіантранілову кислоту, їх похідні і їх комбінації.
7. Композиція за п. 1 або 2, де щонайменше один кон'югат застосовують для лікування від зловживання наркотиками або опіоїдами; для запобігання синдрому відміни наркотику або опіоїду; для купірування помірного або жорстокого болю; для зменшення або запобігання зловживанню лікарськими засобами, які призначають перорально, інтраназально або внутрішньовенно; або для надання стійкості до зловживання лікарськими засобами, які призначають перорально, інтраназально або парентерально.
8. Композиція за п. 1 або 2, де щонайменше один кон'югат дає поліпшене значення AUC і кращу швидкість вивільнення з плином часу у порівнянні з некон'югованим гідрокодоном за той же самий період часу; показує меншу мінливість перорального фармакокінетичного профілю в порівнянні з некон'югованим гідрокодоном; або дає менше побічних ефектів у порівнянні з некон'югованим гідрокодоном.
9. Композиція за п. 1 або 2, де щонайменше один кон'югат готують у вигляді лікарської форми, вибраної з групи, що включає: таблетку, капсулу, таблетку у формі капсули, супозиторій, пастилку, корж, призначуваний перорально порошок, розчин, тонкоплівкову пероральну форму, пластинку, суспензію і завись.
10. Композиція за п. 1 або 2, де щонайменше один кон'югат призначають у кількості, достатній для того, щоб одержати терапевтично біоеквівалентне значення AUC, у порівнянні з некон'югованим гідрокодоном.
11. Композиція за п. 1 або 2, де щонайменше один кон'югат призначають у кількості, достатній для того, щоб одержати терапевтично біоеквівалентне значення AUC і величину Сmах, у порівнянні з еквівалентною молярною кількістю некон'югованого гідрокодону.
12. Композиція за п. 1 або 2, де щонайменше один кон'югат призначають у кількості, достатній для того, щоб одержати терапевтично біоеквівалентне значення AUC і меншу величину Сmах, у порівнянні з еквівалентною молярною кількістю некон'югованого гідрокодону.
13. Спосіб лікування пацієнта, що має захворювання, розлад або стан, опосередковуваний зв'язуванням опіоїду з рецепторами опіоїду пацієнта, який включає пероральне введення зазначеному пацієнту фармацевтично ефективної кількості композиції за п. 1 або 2.
14. Спосіб за п. 13, де щонайменше один кон'югат оборотно зв'язується з рецепторами опіоїду зазначеного пацієнта.
15. Спосіб за п. 13, де щонайменше один кон'югат оборотно зв'язується з рецепторами опіоїду зазначеного пацієнта, не здійснюючи при цьому пригнічувального впливу на ЦНС.
16. Проліки, які містять щонайменше один кон'югат, де кон'югат містить гідрокодон і щонайменше одну гетероарилкарбонову кислоту, її похідне або їх комбінації.
17. Проліки за п. 16, де гетероарилкарбонова кислота вибрана з формули II, формули III і формули IV, де формула II, формула III або формула IV мають наступні структури:
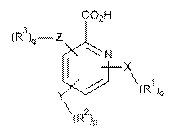 , (II)
, (II) 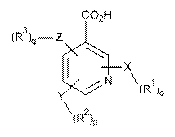 , (III)
, (III) 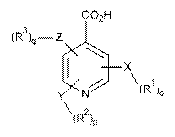 , (IV)
, (IV)
де
X, Y і Z незалежно вибрані з групи, що включає Н, О, S, NH і -(СН2)x-;
R1, R2 і R3 незалежно вибрані з групи, що включає Н, алкіл, алкокси, арил, алкеніл, алкініл, атом галогену, галогензаміщений алкіл, алкіларил, арилалкіл, гетероцикл, арилалкокси, циклоалкіл, циклоалкеніл і циклоалкініл;
о, р, q незалежно вибрані з 0 або 1; і
х означає ціле число в діапазоні від 1 до 10.
Текст
Реферат: У даному винаході пропонуються композиції, які містять арилкарбонові кислоти, хімічно зв'язані з гідрокодоном (морфінан-6-он, 4,5-альфа-епокси-3-метокси-17-метил) з одержанням нових проліків/композицій гідрокодону, включаючи бензоати або гетероарилкарбонові кислоти, що знижують можливість зловживання гідрокодоном. У даному винаході пропонуються також способи лікування пацієнтів, фармацевтичні набори реагентів і способи синтезу кон'югатів за даним винаходом. UA 102916 C2 (12) UA 102916 C2 UA 102916 C2 5 10 15 20 25 30 35 40 45 50 55 Споріднені заявки У даній заявці заявляється пріоритет попередньої заявки на патент США із серійним № 61/222718, поданої 2 липня 2009 р., яка у всій своїй повноті включена в дану заявку за допомогою посилання. Дослідження або розробки, субсидовані з федеральних джерел Дані відсутні. Передумови до створення винаходу Опіоїди є високоефективними аналгезуючими засобами і звичайно їх призначають при купіруванні гострого і хронічного болю. Їх звичайно також використовують як засоби проти кашлю. Однак опіоїди викликають ейфорію, а також легко викликають звикання. У результаті ними часто зловживають, що приводить до негативних соціальних наслідків і робить серйозний вплив на здоров'я. Через можливе зловживання бажано одержати фармацевтичну композицію, яка містить агоніст опіоїду, таким чином, щоб на практиці вона перешкоджала зловживанню або попереджувала зловживання лікарським засобом. Люди, що незаконно вживають наркотики, часто намагаються обійти властивості лікарських форм із пролонгованим вивільненням лікарського засобу шляхом ін'єкції або іншого неправильного використання подібних лікарських форм для того, щоб домогтися негайного вивільнення агоніста опіоїду. Незважаючи на їх здатність викликати залежність і можливе зловживання ними, морфіноподібні лікарські препарати, зокрема кодеїн, гідрокодон і оксикодон, в останні десятиріччя часто призначають для купірування жорстокого гострого і хронічного болю. Частково це викликано відсутністю альтернативи для ослаблення жорстокого болю, стійкого до дії інших менш потужних аналгезуючих засобів, таких як нестероїдні протизапальні препарати (NSAID). У зв'язку з цим зберігається потреба в зменшенні можливого зловживання ними. На жаль, розпочаті до даного часу спроби не вирішили дану проблему. Гідрокодон є опіоїдним аналгезуючим засобом, а також протикашльовим засобом і являє собою дрібні кристали білого кольору або кристалічний порошок. Гідрокодон є напівсинтетичним наркотичним аналгетиком, який одержують з кодеїну, і багато які його впливи якісно подібні дії кодеїну. Його головним чином використовують для полегшення помірного або помірно жорстокого болю. Крім того, у субаналгезуючих дозах (2,5-5 мг) його використовують як протикашльовий засіб у мікстурах і таблетках від кашлю. Пацієнти, що приймають опіоїдні аналгезуючі засоби, такі як гідрокодон, для ослаблення болю, мимоволі можуть стати залежними. В міру розвитку толерантності до опіоїдів, усе більша кількість ліків потрібна для полегшення болю і для гарного самопочуття, чого початково можна було досягти, приймаючи запропоновану дозу. Зазначена обставина приводить до ескалації дози, яка, якщо її не контролювати, може швидко привести до залежності. У деяких випадках пацієнти ставали сильно залежними усього через тридцять днів. Суть винаходу У даному винаході використовується утворення складних ковалентних сполук (кон'югатів) опіоїду гідрокодону з визначеними арилкарбоновими кислотами, з метою зниження його потенційної здатності викликати передозування або приводити до зловживань, за рахунок того, що для вивільнення активного гідрокодону потрібне in vivo руйнування кон'югатів під дією ферментів або обміну речовин. У даному винаході пропонуються також способи доставки гідрокодону у вигляді кон'югатів, які вивільняють гідрокодон після перорального введення і перешкоджають зловживанню ним обхідними шляхами, такими як внутрішньовенна ін'єкція ("введення наркотику внутрішньовенно") або інтраназальне введення ("прийом дози порошкоподібного наркотику"). Відповідно до щонайменше одного аспекту в даному винаході пропонується композиція для уповільненого/пролонгованого/керованого вивільнення гідрокодону у вигляді складної сполуки, яка дозволяє здійснити уповільнене/пролонговане/кероване вивільнення гідрокодону і/або його активного метаболіту, гідроморфону, у кровоносну систему людини або тварини в межах безпечного терапевтичного вікна шляхом, наприклад, перорального прийому. Щонайменше деякі композиції/сполуки за даним винаходом можуть знижувати можливість звикання/зловживання і/або зменшувати інші звичайні побічні ефекти, пов'язані з гідрокодоном і подібними йому сполуками. Відповідно до одного аспекту в даному винаході пропонується композиція, яка містить щонайменше один кон'югат гідрокодону і щонайменше однієї бензойної кислоти або її похідного, її солі або їх комбінації, при цьому бензойна кислота або її похідне має наступну формулу I: 1 UA 102916 C2 5 10 15 20 25 30 35 40 45 , 1 2 3 де X, Y і Z незалежно вибрані з групи, що включає H, O, S, NH і -(CH2)х-; R , R і R незалежно вибрані з групи, що включає Н, алкіл, алкокси, арил, алкеніл, алкініл, атом галогену, галогензаміщений алкіл, алкіларил, арилалкіл, гетероцикл, арилалкокси, циклоалкіл, циклоалкеніл і циклоалкініл; o, p, q незалежно вибрані з 0 або 1; а x означає ціле число в діапазоні від 1 до 10. Відповідно до деяких аспектів бензойна кислота або її похідне являє собою амінобензоат, гідроксибензоат, аміногідроксибензоат, його похідне або їх комбінацію. Відповідно до іншого аспекту в даному винаході пропонується композиція, яка містить щонайменше один кон'югат гідрокодону і щонайменше однієї бензойної кислоти, її похідного або їх комбінації. Відповідно до ще одного аспекту в даному винаході пропонуються кон'югати гідрокодону для використання з метою купірування болю, переважно помірного до жорстокого болю, або для використання з метою зменшення або запобігання зловживанню при пероральному, інтраназальному або парентеральному введенні лікарського засобу. Відповідно до деяких аспектів кон'югати надають стійкість до зловживання при пероральному, інтраназальному або парентеральному введенні лікарського засобу. Відповідно до іншого аспекту в даному винаході пропонується щонайменше один кон'югат гідрокодону, який забезпечує меншу швидкість вивільнення з плином часу і більшу або рівну величину площі під кривою (AUC) у порівнянні з еквівалентною молярною кількістю некон'югованого гідрокодону за той же самий інтервал часу. Відповідно до інших аспектів кон'югат гідрокодону показує меншу мінливість фармакокінетичного профілю при пероральному введенні в порівнянні з некон'югованим гідрокодоном. Відповідно до ще одного аспекту щонайменше один кон'югат дає менше побічних ефектів у порівнянні з некон'югованим гідрокодоном або запобігає зловмисному використанню лікарських засобів шляхом як фізичного, так і хімічного маніпулювання. Відповідно до іншого аспекту пропонується щонайменше один кон'югат у кількості, достатній для того, щоб забезпечити терапевтично біоеквівалентне значення AUC, у порівнянні з еквівалентною молярною кількістю некон'югованого гідрокодону. Відповідно до подальших аспектів пропонується щонайменше один кон'югат у кількості, достатній для того, щоб забезпечити терапевтично біоеквівалентне значення AUC, у порівнянні з еквівалентною молярною кількістю некон'югованого гідрокодону, і при цьому зазначена кількість не приводить до появи пікового значення Cmax або дає менше значення Cmax, ніж терапевтично еквівалентна кількість некон'югованого гідрокодону. Відповідно до інших аспектів пропонується щонайменше один кон'югат у кількості, достатній для того, щоб забезпечити терапевтично біоеквівалентне значення AUC, у порівнянні з еквівалентною молярною кількістю некон'югованого гідрокодону, і при цьому зазначена кількість не приводить до появи еквівалентного пікового значення C max. Відповідно до деяких аспектів щонайменше один кон'югат дає еквівалентне пікове значення Cmax при порівнянні з некон'югованим гідрокодоном. Відповідно до іншого аспекту в даному винаході пропонується спосіб лікування пацієнта, що має захворювання, розлад або стан, що вимагає зв'язування опіоїду або опосередковується зв'язуванням опіоїду з рецепторами опіоїду пацієнта, який включає пероральне введення зазначеному пацієнту фармацевтично ефективної кількості щонайменше одного кон'югата гідрокодону і щонайменше однієї бензойної кислоти або її похідного, її солі або їх комбінації, при цьому бензойна кислота або її похідне має формулу I: , де 1 2 3 X, Y і Z незалежно вибрані з групи, що включає H, O, S, NH і -(CH2)х-; R , R і R незалежно вибрані з групи, що включає Н, алкіл, алкокси, арил, алкеніл, алкініл, атом галогену, 2 UA 102916 C2 5 10 15 20 25 30 35 40 45 галогензаміщений алкіл, алкіларил, арилалкіл, гетероцикл, арилалкокси, циклоалкіл, циклоалкеніл і циклоалкініл; o, p, q незалежно вибрані з 0 або 1; а x означає ціле число в діапазоні від 1 до 10. Відповідно до іншого аспекту щонайменше один кон'югат необоротно зв'язується з рецепторами опіоїду пацієнта. Відповідно до ще одного аспекту щонайменше один кон'югат необоротно зв'язується з рецепторами опіоїду пацієнта, не роблячи при цьому пригнічувального впливу на ЦНС. Відповідно до іншого аспекту в даному винаході пропонується спосіб лікування пацієнта, що має захворювання, розлад або стан, що вимагає інгібування зв'язування опіоїду або опосередковується інгібуванням зв'язування опіоїду з рецепторами опіоїду пацієнта, який включає пероральне введення зазначеному пацієнту фармацевтично ефективної кількості щонайменше одного кон'югата гідрокодону і щонайменше однієї бензойної кислоти або її похідного, її солі або їх комбінації, при цьому бензойна кислота або її похідне має формулу I: , де 1 2 3 X, Y і Z незалежно вибрані з групи, що включає H, O, S, NH і -(CH2)х-; R , R і R незалежно вибрані з групи, що включає Н, алкіл, алкокси, арил, алкеніл, алкініл, атом галогену, галогензаміщений алкіл, алкіларил, арилалкіл, гетероцикл, арилалкокси, циклоалкіл, циклоалкеніл і циклоалкініл; o, p, q незалежно вибрані з 0 або 1; а x означає ціле число в діапазоні від 1 до 10. Відповідно до деяких аспектів у даному винаході пропонується щонайменше один кон'югат, який оборотно інгібує зв'язування опіоїду з рецепторами опіоїду пацієнта. Відповідно до інших аспектів щонайменше один кон'югат оборотно інгібує зв'язування опіоїду з рецепторами опіоїду пацієнта, не роблячи при цьому пригнічувального впливу на ЦНС. Відповідно до іншого аспекту в даному винаході пропонується спосіб лікування пацієнта, що має захворювання, розлад або стан (такий як біль), який можна лікувати шляхом зв'язування опіоїду з рецепторами опіоїду пацієнта, при цьому спосіб включає пероральне введення зазначеному пацієнту фармацевтично ефективної кількості щонайменше одного кон'югата гідрокодону і щонайменше однієї бензойної кислоти, її солі, її похідного або їх комбінації. Відповідно до іншого аспекту в даному винаході пропонується спосіб лікування пацієнта, що має захворювання, розлад або стан (такий як біль), який можна лікувати шляхом інгібування зв'язування опіоїду з рецепторами опіоїду пацієнта, при цьому спосіб включає пероральне введення зазначеному пацієнту фармацевтично ефективної кількості щонайменше одного кон'югата гідрокодону і щонайменше однієї бензойної кислоти, її солі, її похідного або їх комбінації. Відповідно до ще одного аспекту в даному винаході пропонується фармацевтичний набір реагентів, який включає визначену кількість індивідуальних дозувань в упаковці, що містять фармацевтично ефективну кількість щонайменше одного кон'югата гідрокодону і щонайменше одного бензоату, його солі, його похідного або їх комбінації, при цьому бензоат має формулу I: , 1 2 3 де X, Y і Z незалежно вибрані з групи, що включає H, O, S, NH і -(CH2)х-; R , R і R незалежно вибрані з групи, що включає Н, алкіл, алкокси, арил, алкеніл, алкініл, атом галогену, галогензаміщений алкіл, алкіларил, арилалкіл, гетероцикл, арилалкокси, циклоалкіл, циклоалкеніл і циклоалкініл; o, p, q незалежно вибрані з 0 або 1; а x означає ціле число в діапазоні від 1 до 10. Відповідно до деяких аспектів зазначений набір включає інструкції з використання зазначеного набору реагентів у способі лікування або запобігання симптомам відміни лікарського засобу або купірування болю у пацієнта-людини або пацієнта-тварини. Відповідно до іншого аспекту в даному винаході пропонується фармацевтичний набір реагентів, який включає визначену кількість індивідуальних дозувань в упаковці, що містять 3 UA 102916 C2 5 10 фармацевтично ефективну кількість щонайменше одного кон'югата гідрокодону і щонайменше однієї бензойної кислоти, її солі, її похідного або їх комбінації. Відповідно до деяких аспектів зазначений набір додатково включає інструкції з використання зазначеного набору в способі лікування або запобігання симптомам відміни лікарського засобу або купірування болю у пацієнта-людини або пацієнта-тварини. Відповідно до ще одного аспекту в даному винаході пропонується композиція, яка містить щонайменше один кон'югат гідрокодону і щонайменше однієї гетероарилкарбонової кислоти, її похідного або їх комбінації. Відповідно до ще одного аспекту в даному винаході пропонується щонайменше один кон'югат гідрокодону і щонайменше однієї гетероарилкарбонової кислоти, її похідного або їх комбінації, де щонайменше одна гетероарилкарбонова кислота вибрана з формули II, формули III і формули IV: 1 15 20 25 30 35 40 45 2 3 1 2 3 де X, Y і Z незалежно вибраніз групи, що включає H, O, S, NH і -(CH2)х-; R , R і R незалежно вибрані з групи, що включає Н, алкіл, алкокси, арил, алкеніл, алкініл, атом галогену, галогензаміщений алкіл, алкіларил, арилалкіл, гетероцикл, арилалкокси, циклоалкіл, циклоалкеніл і циклоалкініл; o, p, q незалежно вибрані з 0 або 1; а x означає ціле число в діапазоні від 1 до 10. Відповідно до деяких аспектів щонайменше одна гетероарилкарбонова кислота є похідним піридину. Відповідно до деяких аспектів у даному винаході пропонується щонайменше один кон'югат, який запобігає зловмисному використанню лікарських засобів шляхом як фізичного, так і хімічного маніпулювання. Відповідно до іншого аспекту в даному винаході пропонується спосіб лікування пацієнта, що має захворювання, розлад або стан, що вимагає зв'язування опіоїду або опосередковується зв'язуванням опіоїду з рецепторами опіоїду пацієнта, який включає пероральне введення зазначеному пацієнту фармацевтично ефективної кількості щонайменше одного кон'югата гідрокодону і щонайменше однієї гетероарилкарбонової кислоти. Відповідно до ще одного аспекту в даному винаході пропонується спосіб лікування пацієнта, що має захворювання, розлад або стан, що вимагає зв'язування опіоїду або опосередковується зв'язуванням опіоїду з рецепторами опіоїду пацієнта, який включає пероральне введення зазначеному пацієнту фармацевтично ефективної кількості щонайменше одного кон'югата гідрокодону і щонайменше однієї гетероарилкарбонової кислоти, де гетероарилкарбонова кислота вибрана з формули II, формули III і формули IV, де формула II, формула III і формула IV мають наступні структури: де X, Y і Z незалежно вибрані з групи, що включає H, O, S, NH і -(CH2)х-; R , R і R незалежно вибрані з групи, що включає Н, алкіл, алкокси, арил, алкеніл, алкініл, атом галогену, галогензаміщений алкіл, алкіларил, арилалкіл, гетероцикл, арилалкокси, циклоалкіл, циклоалкеніл і циклоалкініл; o, p, q незалежно вибрані з 0 або 1; а x означає ціле число в діапазоні від 1 до 10. Відповідно до іншого аспекту в даному винаході пропонується спосіб лікування пацієнта, що має захворювання, розлад або стан, що вимагає зв'язування опіоїду або опосередковується зв'язуванням опіоїду з рецепторами опіоїду пацієнта, який включає пероральне введення зазначеному пацієнту фармацевтично ефективної кількості щонайменше одного кон'югата гідрокодону і щонайменше однієї нікотинової кислоти, її похідного або їх комбінації. 4 UA 102916 C2 5 Відповідно до іншого аспекту в даному винаході пропонується спосіб лікування пацієнта, що має захворювання, розлад або стан, що вимагає інгібування зв'язування опіоїду або опосередковується інгібуванням зв'язування опіоїду з рецепторами опіоїду пацієнта, який включає пероральне введення зазначеному пацієнту фармацевтично ефективної кількості щонайменше одного кон'югата гідрокодону і щонайменше однієї гетероарилкарбонової кислоти. Відповідно до деяких аспектів гетероарилкарбонова кислота вибрана з формули II, формули III і формули IV, де формула II, формула III і формула IV мають наступні структури: 1 15 20 25 30 35 3 1 10 2 2 3 де X, Y і Z незалежно вибрані з групи, що включає H, O, S, NH і -(CH2)х-; R , R і R незалежно вибрані з групи, що включає Н, алкіл, алкокси, арил, алкеніл, алкініл, атом галогену, галогензаміщений алкіл, алкіларил, арилалкіл, гетероцикл, арилалкокси, циклоалкіл, циклоалкеніл і циклоалкініл; o, p, q незалежно вибрані з 0 або 1; а x означає ціле число в діапазоні від 1 до 10. Відповідно до іншого аспекту в даному винаході пропонується спосіб лікування пацієнта, що має захворювання, розлад або стан, що вимагає інгібування зв'язування опіоїду або опосередковується інгібуванням зв'язування опіоїду з рецепторами опіоїду пацієнта, який включає пероральне введення зазначеному пацієнту фармацевтично ефективної кількості щонайменше одного кон'югата гідрокодону і щонайменше однієї нікотинової кислоти, її похідного або їх комбінації. Відповідно до ще одного аспекту в даному винаході пропонується фармацевтичний набір реагентів, який включає визначену кількість індивідуальних дозувань в упаковці, що містять фармацевтично ефективну кількість щонайменше одного кон'югата гідрокодону і щонайменше однієї гетероарилкарбонової кислоти, її похідного або їх комбінації, де гетероарилкарбонова кислота вибрана з формули II, формули III і формули IV, де формула II, формула III і формула IV мають наступні структури: де X, Y і Z незалежно вибрані з групи, що включає H, O, S, NH і -(CH2)х-; R , R і R незалежно вибрані з групи, що включає Н, алкіл, алкокси, арил, алкеніл, алкініл, атом галогену, галогензаміщений алкіл, алкіларил, арилалкіл, гетероцикл, арилалкокси, циклоалкіл, циклоалкеніл і циклоалкініл; o, p, q незалежно вибрані з 0 або 1; а x означає ціле число в діапазоні від 1 до 10. Відповідно до деяких аспектів зазначений набір додатково включає інструкції з використанню зазначеного набору в способі лікування або запобігання симптомам відміни лікарського засобу або купірування болю у пацієнта-людини або пацієнта-тварини. Відповідно до ще одного аспекту в даному винаході пропонуються проліки, які включають щонайменше один кон'югат гідрокодону і щонайменше однієї бензойної кислоти або похідного бензойної кислоти, її солі або їх комбінації, при цьому бензойна кислота або похідне бензойної кислоти має наступну формулу I: , 5 UA 102916 C2 1 5 10 15 20 25 30 35 40 45 50 2 3 1 2 3 де X, Y і Z незалежно вибрані з групи, що включає H, O, S, NH і -(CH2)х-; R , R і R незалежно вибрані з групи, що включає Н, алкіл, алкокси, арил, алкеніл, алкініл, атом галогену, галогензаміщений алкіл, алкіларил, арилалкіл, гетероцикл, арилалкокси, циклоалкіл, циклоалкеніл і циклоалкініл; o, p, q незалежно вибрані з 0 або 1; а x означає ціле число в діапазоні від 1 до 10. Відповідно до іншого аспекту в даному винаході пропонуються проліки, які включають щонайменше один кон'югат гідрокодону і щонайменше однієї бензойної кислоти, похідного бензойної кислоти або їх комбінації. Відповідно до ще одного аспекту в даному винаході пропонуються проліки, які включають щонайменше один кон'югат гідрокодону і щонайменше однієї гетероарилкарбонової кислоти, її похідного або їх комбінації. Відповідно до деяких аспектів проліки включають щонайменше одну гетероарилкарбонову кислоту, вибрану з формули II, формули III і формули IV, де формула II, формула III і формула IV мають наступні структури: де X, Y і Z незалежно вибрані з групи, що включає H, O, S, NH і -(CH2)х-; R , R і R незалежно вибрані з групи, що включає Н, алкіл, алкокси, арил, алкеніл, алкініл, атом галогену, галогензаміщений алкіл, алкіларил, арилалкіл, гетероцикл, арилалкокси, циклоалкіл, циклоалкеніл і циклоалкініл; o, p, q незалежно вибрані з 0 або 1; а x означає ціле число в діапазоні від 1 до 10. Відповідно до ще одного аспекту в даному винаході пропонуються проліки, які включають щонайменше один кон'югат гідрокодону і щонайменше однієї нікотинової кислоти, її похідного або їх комбінації. Відповідно до деяких аспектів проліки включають амінобензоат, гідроксибензоат, аміногідроксибензоат, його похідне або їх комбінації. Відповідно до деяких аспектів щонайменше один кон'югат оборотно зв'язується з рецепторами опіоїду пацієнта. Відповідно до інших аспектів щонайменше один кон'югат оборотно зв'язується з рецепторами опіоїду пацієнта, не роблячи при цьому пригнічувального впливу на ЦНС. Відповідно до іншого аспекту щонайменше один кон'югат перешкоджає або зменшує щонайменше один викликаючий запор побічний ефект некон'югованого гідрокодону. Короткий опис декількох типів креслень Фігура 1. Хімічні структури гідроксибензойних кислот і похідних гідроксибензойних кислот, використовуваних з метою одержання кон'югатів за даним винаходом. Фігура 2. Хімічні структури амінобензойних кислот для використання з метою одержання кон'югатів за даним винаходом. Фігура 3. Хімічні структури аміногідроксибензойних кислот для використання з метою одержання кон'югатів за даним винаходом. Фігура 4. Фігура 4A являє собою таблицю типових лікарських форм гідрокодону і діапазонів доз, а фігура 4B являє собою таблицю типових лікарських форм гідрокодону, які використовують у сиропах від кашлю. Фігура 5. Графік фармакокінетичного профілю концентрацій у плазмі гідрокодону, що вивільнився з Bz-HC (бензоат-гідрокодон), YYFFI-HC (Tyr-Tyr-Phe-Phe-Ile-гідрокодон) і дигліколят-HC, з плином часу після перорального введення щурам. Фігура 6. Графік фармакокінетичного профілю концентрацій у плазмі активного метаболіту, гідроморфону, з плином часу після перорального введення Bz-HC, YYFFI-HC і дигліколят-HC щурам. Фігура 7. Графік фармакокінетичного профілю концентрацій у плазмі гідрокодону, що вивільнився з Bz-HC і адипат-HC, з плином часу після інтраназального введення щурам. Фігура 8. Графік фармакокінетичного профілю концентрацій у плазмі активного метаболіту, гідроморфону, з плином часу після інтраназального введення Bz-HC і адипат-HC щурам. Фігура 9. Графік фармакокінетичного профілю концентрацій у плазмі гідрокодону, що вивільнився з Bz-HC, нікотинат-HC і гідрокодон-BT, з плином часу після перорального введення щурам. 6 UA 102916 C2 5 10 15 20 25 30 35 40 45 50 55 60 Фігура 10. Графік фармакокінетичного профілю концентрацій у плазмі активного метаболіту, гідроморфону, з плином часу після перорального введення Bz-HC, нікотинат-HC і гідрокодон-BT щурам. Фігура 11. Графік фармакокінетичного профілю концентрацій у плазмі гідрокодону, що вивільнився з Bz-HC, 2-ABz-HC і гідрокодон-BT, з плином часу після перорального введення щурам. Фігура 12. Графік фармакокінетичного профілю концентрацій у плазмі активного метаболіту гідрокодону з плином часу після перорального введення Bz-HC, 2-ABz-HC і гідрокодон-BT щурам. Фігура 13. Діаграми синтезу кон'югатів гідрокодону. На фігурі 13A наведений синтез бензоату гідрокодону. На фігурі 13B наведений синтез нікотинату гідрокодону (нікотинова кислота). На фігурі 13C наведений синтез 2-амінобензоату гідрокодону. На фігурі 13D наведений синтез саліцилату гідрокодону. Фігура 14. Графік фармакокінетичного профілю концентрацій у плазмі вихідного Bz-HC, активного метаболіту гідроморфону і гідрокодону, що вивільнився з Bz-HC, з плином часу після перорального введення щурам. Фігура 15. Графік фармакокінетичного профілю концентрацій у плазмі гідрокодону, що вивільнився з Bz-HC і гідрокодон-BT, з плином часу після перорального введення собакам. Фігура 16. Графік фармакокінетичного профілю концентрацій у плазмі активного метаболіту, гідроморфону, з плином часу після перорального введення Bz-HC і гідрокодон-BT собакам. Фігура 17. Графік фармакокінетичного профілю концентрацій у плазмі вихідного Bz-HC і гідрокодону, що вивільнився з Bz-HC, з плином часу після перорального введення собакам. Фігура 18. Графік фармакокінетичного профілю концентрацій у плазмі вихідного Bz-HC, активного метаболіту, гідроморфону, і гідрокодону, що вивільнився з Bz-HC, з плином часу після внутрішньовенного введення щурам у кількості 0,30 мг/кг. Фігура 19. Графік фармакокінетичного профілю концентрацій у плазмі гідрокодону, що вивільнився з Bz-HC, з плином часу після перорального введення щурам для шести різних дозувань. Фігура 20. Графік фармакокінетичного профілю концентрацій у плазмі активного метаболіту, гідроморфону, з плином часу після перорального введення Bz-HC щурам для шести різних дозувань. Докладний опис винаходу У даному винаході пропонуються композиції, які містять арилкарбонові кислоти, хімічно зв'язані з гідрокодоном (морфінан-6-он, 4,5-альфа-епокси-3-метокси-17-метил), з одержанням нових проліків і композицій гідрокодону. У деяких варіантах здійснення даного винаходу хімічний зв'язок між зазначеними двома фрагментами може бути утворений шляхом взаємодії C-6 енольного таутомеру гідрокодону з активованою карбоксильною групою арилкарбонової кислоти з одержанням енолскладноефірного кон'югата. Варто розуміти, що використовуваний термін "опіоїд" включає будь-який лікарський засіб, який активує рецептори опіоїду, що знаходяться в мозку, спинному мозку і кишечнику. Існують чотири великих класи опіоїдів: алкалоїди опію, що зустрічаються в природі, такі як морфін (прототип опіоїду), кодеїн і тебаїн; ендогенні опіоїдні пептиди, такі як ендорфіни; напівсинтетичні опіоїди, такі як героїн, оксикодон і гідрокодон, які одержують шляхом модифікації природних алкалоїдів опію і які мають подібні хімічні структури; і чисто синтетичні речовини, такі як фентаніл і метадон, які одержують не з опію і які можуть мати хімічні структури, абсолютно відмінні від алкалоїдів опію. Додатковими прикладами опіоїдів є гідроморфон, оксиморфон, метадон, леворфанол, дигідрокодеїн, меперидин, дифеноксилат, суфентаніл, алфентаніл, пропоксифен, пентазоцин, налбуфін, буторфанол, бупренорфін, мептазинол, дезоцин і їх фармацевтично прийнятні солі. Варто розуміти, що використовуваний термін "гідрокодон" включає напівсинтетичний наркотичний аналгетик і протикашльовий засіб, який одержують з кодеїну і багато дій якого якісно аналогічні дії кодеїну. Його звичайно використовують для полегшення помірного і помірно жорстокого болю. Торгові назви включають Anexsia™, Hycodan™, Hycomine™, Lorcet™, Lortab™, Norco™, Tussionex™, Tylox™ і Vicodin™. Даний винахід охоплює інші сольові форми гідрокодону, такі як бітартрат гідрокодону, і полімерні суміші гідрокодону з пролонгованим вивільненням вмісту. У деяких варіантах здійснення даного винаходу пропонуються зв'язані з гідрокодоном карбонові кислоти, у яких карбоксильні групи безпосередньо з'єднані з арильним фрагментом. Карбонові кислоти, у яких карбоксильні групи безпосередньо з'єднані з арильним фрагментом, включають бензоати і гетероарилкарбонові кислоти. 7 UA 102916 C2 5 10 15 20 25 30 35 40 45 У деяких варіантах здійснення даного винаходу пропонується щонайменше один кон'югат гідрокодону і щонайменше однієї бензойної кислоти або похідного бензойної кислоти, її солі або їх комбінації. Бензоати поширені в природі і, наприклад, включають, однак цим не обмежуючись, амінобензоати (зокрема, аналоги антранілової кислоти, такі як фенамати), аміногідроксибензоати і гідроксибензоати (наприклад, аналоги саліцилової кислоти). Бензойна кислота і похідні бензойної кислоти за даним винаходом мають наступну загальну структуру: , 1 2 3 де X, Y і Z можуть бути незалежно будь-якою комбінацією H, O, S, NH і -(CH2)х-; R , R і R незалежно можуть бути будь-якими з наступних груп: Н, алкіл, алкокси, арил, алкеніл, алкініл, атом галогену, галогензаміщений алкіл, алкіларил, арилалкіл, гетероцикл, арилалкокси, циклоалкіл, циклоалкеніл і циклоалкініл; o, p, q можуть незалежно означати або 0, або 1. Придатні гідроксибензойні кислоти можна знайти на фігурі 1 і вони включають, однак цим не обмежуючись, бензойну кислоту, саліцилову кислоту, ацетилсаліцилову кислоту (аспірин), 3гідроксибензойну кислоту, 4-гідроксибензойну кислоту, 6-метилсаліцилову кислоту, o, м,пкрезотинову кислоту, анакардинові кислоти, 4,5-диметилсаліцилову кислоту, o, м,поксипарацимолкарбонову кислоту, дифлузинал, o, м,п-анісову кислоту, 2,3-дигідробензойну кислоту (2,3-DHB), α,β,γ-резорцинову кислоту, протокатехову кислоту, гентизинову кислоту, піперонілову кислоту, 3-метоксисаліцилову кислоту, 4-метоксисаліцилову кислоту, 5метоксисаліцилову кислоту, 6-метоксисаліцилову кислоту, 3-гідрокси-2-метоксибензойну кислоту, 4-гідрокси-2-метоксибензойну кислоту, 5-гідрокси-2-метоксибензойну кислоту, ванілінову кислоту, ізованілінову кислоту, 5-гідрокси-3-метоксибензойну кислоту, 2,3диметоксибензойну кислоту, 2,4-диметоксибензойну кислоту, 2,5-диметоксибензойну кислоту, 2,6-диметоксибензойну кислоту, вератрову кислоту (3,4-диметоксибензойну кислоту), 3,5диметоксибензойну кислоту, галову кислоту, 2,3,4-тригідроксибензойну кислоту, 2,3,6тригідроксибензойну кислоту, 2,4,5-тригідроксибензойну кислоту, 3-O-метилгалову кислоту (3OMGA), 4-O-метилгалову кислоту (4-OMGA), 3,4-O-диметилгалову кислоту, бузкову кислоту, 3,4,5-триметоксибензойну кислоту. Придатні амінобензойні кислоти наведені на фігурі 2 і вони включають, однак цим не обмежуючись, антранілову кислоту, 3-амінобензойну кислоту, 4,5-диметилантранілову кислоту, N-метилантранілову кислоту, N-ацетилантранілову кислоту, фенамові кислоти (наприклад, толфенамову кислоту, мефенамову кислоту, флуфенамову кислоту), 2,4-діамінобензойну кислоту (2,4-DABA), 2-ацетиламіно-4-амінобензойну кислоту, 4-ацетиламіно-2-амінобензойну кислоту, 2,4-діацетиламінобензойну кислоту. Придатні аміногідроксибензойні кислоти включають, однак цим не обмежуючись, 4аміносаліцилову кислоту, 3-гідроксіантранілову кислоту і 3-метоксіантранілову кислоту. У деяких варіантах здійснення даного винаходу композиція включає бензоатний кон'югат, що включає щонайменше один гідрокодон, зв'язаний щонайменше з однією бензойною кислотою або похідним бензойної кислоти, її сіллю або їх комбінацією. У деяких варіантах здійснення даного винаходу бензоати включають множину аналогів бензойної кислоти, бензоатні похідні, що мають гідроксильні групи або аміногрупи, або комбінації обох зазначених груп. Функціональні гідроксильні групи й аміногрупи можуть бути присутніми у їх вільній формі або ж вони можуть бути закриті іншим хімічним фрагментом, переважно, однак цим не обмежуючись, метильними або ацетильними групами. Фенільні групи можуть мати додаткові замісники, однак загальна кількість замісників може дорівнювати чотирьом або менше, трьом або менше або двом або менше. В іншому варіанті здійснення даного винаходу проліками або композицією кон'югата за даним винаходом є бензоат-гідрокодон, що має структуру: 8 UA 102916 C2 5 10 15 20 25 30 35 40 бензоат-гідрокодон (Bz-HC). У ще одному варіанті здійснення даного винаходу пропонуються проліки або композиція, що включає щонайменше один кон'югат гідрокодону і щонайменше однієї гетероарилкарбонової кислоти, її похідного або їх комбінації. Гетероарилкарбонова кислота може бути вибрана з формули II, формули III і формули IV, де формула II, формула III і формула IV мають наступні структури: У зазначених формулах X, Y і Z незалежно вибрані з групи, що включає H, O, S, NH і -(CH2)х1 2 3 ; R , R і R незалежно вибрані з групи, що включає Н, алкіл, алкокси, арил, алкеніл, алкініл, атом галогену, галогензаміщений алкіл, алкіларил, арилалкіл, гетероцикл, арилалкокси, циклоалкіл, циклоалкеніл і циклоалкініл; o, p, q незалежно вибрані з 0 або 1; а x означає ціле число в діапазоні від 1 до 10. У деяких варіантах здійснення даного винаходу карбоксильна група арилкарбонових кислот може бути приєднана безпосередньо до ароматичного ядра. Даний винахід включає як арильні групи, що містять лише атоми вуглецю, так і арильні групи з гетероатомами (гетероарильні групи). Арильна або гетероарильна група, яка безпосередньо приєднана до функціональної карбоксильної групи, може бути 6-членним циклом і не містить або ж містить один гетероатом. У деяких варіантах здійснення даного винаходу додаткові заміщені або незаміщені ароматичні або аліфатичні цикли можуть бути конденсовані з зазначеним 6-членним арильним або гетероарильним фрагментом. У деяких варіантах здійснення даного винаходу арилкарбонові кислоти можуть мати тільки одну вільну карбоксильну групу, а загальна кількість фенільних замісників у 6-членному циклі повинна бути чотири або менше, наприклад 4, 3, 2 або 1. У деяких варіантах здійснення даного винаходу, залежно від індивідуальної арилкарбонової кислоти, що зв'язана з гідрокодоном, кон'югат гідрокодону може мати нейтральну форму, форму вільної кислоти, форму вільної основи або різні фармацевтично прийнятні аніонні або катіонні сольові форми або суміші солей з будь-яким відношенням позитивно або негативно заряджених компонентів. Зазначені сольові форми включають, однак цим не обмежуючись: ацетат, Lаспартат, безилат, бікарбонат, карбонат, D-камсилат, L-камсилат, цитрат, едизилат, фумарат, глюконат, гідробромід/бромід, гідрохлорид/хлорид, D-лактат, L-лактат, D, L-лактат, D, L-малат, L-малат, мезилат, памоат, фосфат, сукцинат, сульфат, D-тартрат, L-тартрат, D, L-тартрат, мезотартрат, бензоат, глюцептат, D-глюкуронат, гібензат, ізетіонат, малонат, метилсульфат, 2напсилат, нікотинат, нітрат, оротат, стеарат, тозилат, ацефілінат, ацетурат, аміносаліцилат, аскорбат, борат, бутират, камфорат, камфокарбонат, деканоат, гексаноат, холат, ципіонат, дихлороацетат, едентат, етилсульфат, фурат, фузидат, галактарат (мукат), галактуронат, галат, гентизат, глутамат, глутарат, гліцерофосфат, гептаноат (енантат), гідроксибензоат, гіпурат, фенілпропіонат, йодид, ксинафоат, лактобіонат, лаурат, малеат, манделат, метансульфонат, міристат, нападизилат, олеат, оксалат, пальмітат, пікрат, півалат, пропіонат, пірофосфат, саліцилат, саліцилсульфат, сульфосаліцилат, танат, терефталат, тіосаліцилат, триброфенат, валерат, вальпроат, адипат, 4-ацетамінобензоат, камсилат, октаноат, естолат, езилат, гліколят, тіоціанат і ундециленат. У даному винаході придатний кон'югат гідрокодону включає нікотинат-гідрокодон, що має наступну структуру: 9 UA 102916 C2 5 10 15 20 25 30 35 40 45 50 нікотинат-гідрокодон (нікотинат-HC). У деяких варіантах здійснення даного винаходу пропонується кон'югат гідрокодону, який руйнується в умовах in vivo, або ферментативно, або іншим способом, вивільняючи активний гідрокодон і відповідну карбонову кислоту або їх метаболіти. Арилкарбонові кислоти, використовувані в кон'югатах за даним винаходом, нетоксичні при даних рівнях дозування і, переважно, являють собою відомі лікарські засоби, натуральні продукти, метаболіти або GRAS (загальновизнані безпечними) сполуки (зокрема, консерванти, барвники, ароматизатори і т. п.) або їх нетоксичні міметики. Сполуки, композиції і способи за даним винаходом знижують можливість передозування, знижують можливість зловживання або звикання і/або поліпшують характеристики гідрокодону, пов'язані з високою токсичністю або підоптимальними профілями вивільнення лікарського засобу. Не бажаючи обмежувати себе викладеною нижче теорією, автори даного винаходу вважають, що запобігання передозуванню може виникати внаслідок того, що при пероральному прийомі кон'югати піддаються впливу різних ферментів і/або метаболічних шляхів, при цьому вплив на кон'югат буде здійснений в кишечнику, і він піддається пресистемному метаболізму, на відміну від впливу ферментів у системі кровообігу і на мембранах слизових оболонок, що обмежує можливість гідрокодону бути вивільненим з кон'югата. Таким чином, стійкість до зловживання забезпечується за рахунок обмеження "початкового прояву приємних відчуттів" або "нервового підйому", що виникає під впливом активного гідрокодону, який вивільнився з проліків, і за рахунок обмеження ефективності альтернативних шляхів введення препарату. Композиції за даним винаходом переважно не мають фармакологічної активності або мають суттєво знижену фармакологічну активність, коли їх вводять шляхом ін'єкції або інтраназально. Однак вони залишаються перорально біодоступними. Знову, не бажаючи зв'язувати себе якоюнебудь конкретною теорією, автори даного винаходу вважають, що біодоступність може виявитися результатом гідролізу хімічного зв'язку (тобто ковалентного зв'язку) після перорального прийому. Щонайменше в одному варіанті здійснення даного винаходу вивільнення гідрокодону знижується, коли композицію за даним винаходом доставляють парентеральними шляхами. Наприклад, в одному варіанті здійснення даного винаходу композиція зберігає свою ефективність і стійкість до зловживання після дроблення таблетки, капсули або іншої пероральної лікарської форми. Навпаки, з некон'югованих (або "незв'язаних") парентеральних форм гідрокодону зазначений гідрокодон негайно вивільняється після дроблення і дозволяє використовувати вміст здрібненої таблетки шляхом ін'єкції або дозволяє прийняти дозу порошкоподібного наркотику, викликаючи ефект "початкового прояву приємних відчуттів", до якого прагнуть наркозалежні люди. У деяких варіантах здійснення даного винаходу кон'югати гідрокодону можна перорально вводити пацієнту-тварині або пацієнту-людині, а після введення вони вивільняють активний гідрокодон за рахунок гідролізу кон'югатів в організмі. Не бажаючи зв'язувати себе якою-небудь конкретною теорією, автори даного винаходу вважають, що, оскільки арилкарбонові кислоти являють собою метаболіти, що зустрічаються в природі, або їх міметики або ж є фармацевтично активними сполуками, то вони легко розпізнаються фізіологічними системами, що приводить до їх гідролізу і вивільнення гідрокодону. Самі кон'югати або не мають фармакологічної активності, або мають обмежену фармакологічну активність і, отже, можуть рухатися по метаболічних шляхах, відмінних від метаболічних шляхів вихідного лікарського засобу. У деяких варіантах здійснення даного винаходу вибір придатних арилкарбонових кислот ("лігандів") для кон'югування з гідрокодоном визначає процес вивільнення гідрокодону у велике коло кровообігу, і його можна контролювати навіть у тому випадку, коли кон'югат вводять способом, відмінним від перорального. У одному варіанті здійснення даного винаходу модифікований гідрокодон здатний вивільняти гідрокодон аналогічно вільному або немодифікованому гідрокодону. У іншому варіанті здійснення даного винаходу кон'югований гідрокодон вивільняє гідрокодон контрольовано або пролонговано. У деяких варіантах 10 UA 102916 C2 5 10 15 20 25 30 35 40 45 50 55 здійснення даного винаходу зазначене контрольоване вивільнення може полегшити визначені побічні ефекти і поліпшити профіль безпеки вихідного лікарського засобу. Зазначені побічні ефекти можуть включати, однак цим не обмежуючись, занепокоєння, кровотечі, запор, зниження апетиту, утруднене дихання, запаморочення, сонливість, садніння в роті, пронос, головний біль, нудоту, спазми шлунка, шлунковий біль, блювання. В іншому варіанті здійснення даного винаходу кон'югований гідрокодон дозволяє в процесі обміну речовин здійснити селективне перетворення гідрокодону в гідроморфон. В іншому варіанті здійснення даного винаходу зазначені кон'югати можуть застосовуватися для купірування болю, такого як помірний біль і жорстокий біль. Гідрокодон і інші опіоїди мають сильно виражену здатність викликати залежність і стимулюють зловживання ними. Неправильне застосування рекреаційних препаратів являє собою звичайну проблему і звичайно починається з пероральних доз, які приймають з метою випробувати ейфорію ("початковий прояв приємних відчуттів", "нервовий підйом"). З часом наркозалежна людина часто збільшує пероральні дозування, щоб домогтися більш сильних "нервових підйомів" або компенсувати підвищену толерантність до опіоїду. Зазначена поведінка загострюється і приводить до пошуку інших шляхів введення, таких як інтраназальний ("прийом дози порошкоподібного наркотику") і внутрішньовенний ("введення наркотику внутрішньовенно"). У деяких варіантах здійснення даного винаходу гідрокодон, який кон'югований із придатним лігандом у вигляді арилкарбонової кислоти, після перорального прийому не приводить до швидкого зростання його концентрації в плазмі, до чого прагне людина, що здатна зловживати лікарськими препаратами. У деяких варіантах здійснення даного винаходу гідрокодон, що вивільнився з зазначених кон'югатів, має відстрочену величину T max і, можливо, менше значення Cmax, ніж некон'югований гідрокодон. Не бажаючи зв'язувати себе якою-небудь конкретною теорією, автори даного винаходу вважають, що кон'югати за даним винаходом, коли їх приймають перорально або іншим відмінним від перорального шляхом, не створюють відчуття "початкового прояву приємних відчуттів" навіть у тому випадку, коли їх вводять у вищих дозах, але усе ще здатні послабляти біль. Крім того, у деяких варіантах здійснення даного винаходу гідрокодон, кон'югований із придатними лігандами за даним винаходом, не гідролізується ефективно в тому випадку, коли його вводять шляхом, відмінним від перорального. У результаті зазначені кон'югати, коли їх вводять у вигляді ін'єкції або у вигляді порошку, не створюють у плазмі або крові великих концентрацій вивільненого гідрокодону в порівнянні з вільним гідрокодоном, який вводять зазначеними шляхами. У деяких варіантах здійснення даного винаходу кон'югати, оскільки вони включають ковалентно зв'язаний гідрокодон, не здатні при фізичному маніпулюванні вивільняти опіоїд гідрокодон з кон'югованого гідрокодону такими способами, як, наприклад, здрібнювання або дроблення твердих лікарських форм. Крім того, кон'югати за даним винаходом стійкі до хімічного гідролізу в умовах, які людина, здатна зловживати лікарськими препаратами, може використовувати, щоб "витягти" активну частину молекули, наприклад шляхом кип'ятіння або шляхом кислотної або лужної обробки розчину кон'югата. Композиції і проліки за даним винаходом можуть бути приготовлені у вигляді пероральних лікарських форм. Зазначені лікарські форми включають, однак цим не обмежуючись, таблетку, капсулу, таблетку у формі капсули, пастилку, корж, порошок, суспензію, сироп, розчин або тонкоплівкову пероральну форму (OTF). Переважними пероральними формами є капсула, таблетка, розчин і OTF. Тверді лікарські форми можуть включати, однак цим не обмежуючись, наступні типи допоміжних сполук: антиадгезивні речовини, зв'язувальні речовини, покриття, розпушувачі, наповнювачі, ароматизатори і пігменти, гліданти, лубриканти, консерванти, сорбенти і підсолоджувачі. Пероральні композиції за даним винаходом можуть також бути включені в розчин або суспензію у водній рідині або неводній рідині. Склад може являти собою емульсію, таку як рідка емульсія олії у воді або рідка емульсія води в олії. Зазначені олії можна вводити, додаючи очищені і стерильні рідини до підготовленого ентерального складу, який потім поміщають у зонд для штучного годування пацієнта, що не може ковтати. Можуть бути приготовлені капсули з м'якого гелю або м'які желатинові капсули, наприклад, шляхом диспергування композиції в придатному носії (звичайно використовують рослинні олії) з утворенням високов'язкої суміші. Зазначену суміш потім інкапсулюють у плівку з желатину, використовуючи способи і технологічне устаткування, відомі фахівцям з галузі одержання м'яких 11 UA 102916 C2 5 10 15 20 25 30 35 40 45 50 55 60 гелів. Сформовані зазначеним чином індивідуальні препарати потім висушують до постійної ваги. Жувальні таблетки можна, наприклад, приготувати шляхом змішування композицій з інертними наповнювачами, придатними для формування відносно м'якої, ароматизованої лікарської форми у вигляді таблетки, яка призначена для розжовування, а не для ковтання. Можна використовувати звичайні таблетувальні машини і звичайні способи таблетування, наприклад пряме пресування або гранулювання, тобто агрегування зерен сипкого матеріалу перед пресуванням. Фахівці, що беруть участь у приготуванні твердих лікарських форм, мають досвід застосування зазначених способів і технологічного устаткування, оскільки призначені для жування лікарські форми є дуже поширеними лікарськими препаратами у фармацевтичній промисловості. Можна приготувати, наприклад, таблетку з плівковою оболонкою, формуючи на таблетці покриття за допомогою таких способів, як нанесення покриття методами, у яких використовують обертовий випарний апарат, або нанесення покриття повітряно-суспензійним методом, з метою формування на таблетці неперервного плівкового шару. Спресовані таблетки, наприклад, можна одержати, змішуючи склад з інертними наповнювачами, призначеними для того, щоб надати суміші зв'язувальних властивостей або розпушувальних властивостей. Суміш або безпосередньо спресовують, або гранулюють, а потім спресовують, використовуючи відомі в промисловості способи і технологічне устаткування. Одержані лікарські форми у вигляді таблеток потім упаковують, залежно від потреби ринку, наприклад, у вигляді стандартної разової лікарської форми, рулетів, балонів, прозорих упаковок і т. д. Даний винахід охоплює також використання біологічно прийнятних носіїв, які можна одержати із широкого кола речовин. Без обмежень, подібні речовини включають розчинники, зв'язувальні речовини і адгезиви, лубриканти, пластифікатори, розпушувачі, пігменти, наповнювачі, ароматизатори, підсолоджувачі і різноманітні інші речовини, такі як буферні добавки й адсорбенти, для того, щоб приготувати конкретну композицію лікарського засобу. Зв'язувальні сполуки можна вибрати із широкого кола речовин, таких як гідроксипропілметилцелюлоза, етилцелюлоза або інші придатні похідні целюлози, повідон, співполімери акрилової і метакрилової кислоти, фармацевтична глазур, смоли, продукти переробки молока, такі як сироватка, крохмалі і їх похідні, а також інші звичайні зв'язувальні речовини, відомі фахівцям з галузі техніки. Необмежуючими даний винахід прикладами розчинників є вода, етанол, ізопропіловий спирт, метиленхлорид або їх суміші і комбінації. Необмежуючими даний винахід прикладами наповнювачів є цукор, лактоза, желатин, крохмаль і діоксид кремнію. Варто розуміти, що крім тих інгредієнтів, які, зокрема, зазначені вище, композиції за даним винаходом можуть включати інші придатні агенти, такі як смакові добавки, консерванти й антиоксиданти. Подібні антиоксиданти повинні бути придатними в їжу і можуть включати вітамін E, каротин, BHT або інші антиоксиданти. Іншими сполуками, які можуть бути включені шляхом змішування, є, наприклад, інертні з медичної точки зору інгредієнти, зокрема тверді і рідкі розріджувачі, такі як лактоза, декстроза, сахароза, целюлоза, крохмаль або фосфат кальцію для таблеток або капсул, маслинова олія або етилолеат для м'яких капсул і вода або рослинна олія для суспензій або емульсій; лубриканти, такі як оксид кремнію, тальк, стеаринова кислота, стеарат магнію або кальцію і/або поліетиленгліколі; желатинізуючі засоби, такі як колоїдні глини; загусники, такі як трагакантова камедь або альгінат натрію, зв'язувальні речовини, такі як крохмалі, гуміарабіки, желатин, метилцелюлоза, карбоксиметилцелюлоза або полівінілпіролідон; розпушувачі, такі як крохмаль, альгінова кислота, альгінати або натрієвий гліколят крохмалю; шипучі суміші; барвники; підсолоджувачі; змочувальні агенти, такі як лецитин, полісорбати або лаурилсульфати; і інші терапевтично прийнятні допоміжні інгредієнти, такі як зволожувачі, консерванти, буферні добавки й антиоксиданти, що є відомими добавками для зазначених композицій. Для перорального прийому тонкоподрібнені порошки або гранули, що містять розріджувачі, диспергатори і/або поверхнево-активні речовини, можуть бути приготовлені у вигляді дози рідких ліків у воді або сиропі, у вигляді капсул або саше в сухому стані, у вигляді неводної суспензії, куди можуть додаватися суспендуючи засоби, або у вигляді суспензії у воді або сиропі. Якщо бажано, можна додати підсилювачі смаку, консерванти, суспендуючі засоби, загусники або емульгатори. Рідкі дисперсії для перорального прийому можуть являти собою сиропи, емульсії або суспензії. Сиропи як носій можуть містити, наприклад, сахарозу або сахарозу з гліцерином і/або манітом, і/або сорбітом. Зокрема, сироп для страждаючих діабетом пацієнтів може містити як 12 UA 102916 C2 5 10 15 20 25 30 35 40 45 50 55 носій лише ті речовини, наприклад сорбіт, які не перетворюються при обміні речовин у глюкозу або які при обміні речовин утворюють лише дуже малу кількість глюкози. Суспензії й емульсії можуть містити в складі носія, наприклад, природну камедь, агар, альгінат натрію, пектин, метилцелюлозу, карбоксиметилцелюлозу або полівініловий спирт. На даний час схвалені для використання композиції гідрокодону являють собою комбіновані лікарські засоби гідрокодону, залежно від передбачуваного призначення, що містять гідрокодон і один або декілька інших неактивних наркотичних інгредієнтів. Приклади зазначених активних фармацевтичних препаратів включають, однак цим не обмежуючись, ацетамінофен, фенілпропаноламін, гоматропін, ібупрофен, аспірин, фенірамін, хлорфенірамін, фенілефрин, псевдоефедрин, піриламін і гуайфенезин. Можна приготувати композицію кон'югованого гідрокодону за даним винаходом з однією із зазначених активних речовин або з комбінацією зазначених або інших активних речовин або ж приготувати композицію у вигляді окремого активного інгредієнта без додавання яких-небудь інших активних речовин. Композиції або проліки, що містять кон'югат, можуть використовуватися в способах лікування пацієнта, що має захворювання, розлад або стан, який вимагає або який опосередковується зв'язуванням або інгібуванням зв'язування опіоїду з рецепторами опіоїду пацієнта. Лікування включає пероральне введення пацієнту фармацевтично ефективної кількості щонайменше одного кон'югата гідрокодону, як зазначено в даному винаході. Кон'югат може демонструвати меншу швидкість вивільнення з плином часу і меншу величину AUC у порівнянні з еквівалентною молярною кількістю некон'югованого гідрокодону. В інших варіантах здійснення даного винаходу щонайменше один кон'югат може демонструвати меншу мінливість фармакокінетичного профілю при пероральному прийомі в порівнянні з некон'югованим гідрокодоном. В інших варіантах здійснення даного винаходу щонайменше один кон'югат пропонується в кількості, достатній для того, щоб забезпечити терапевтично біоеквівалентне значення AUC (площа під кривою), у порівнянні з еквівалентною молярною кількістю некон'югованого гідрокодону. В інших варіантах здійснення даного винаходу щонайменше один кон'югат пропонується в кількості, достатній для того, щоб забезпечити терапевтично біоеквівалентне значення AUC, у порівнянні з еквівалентною молярною кількістю некон'югованого гідрокодону, при цьому кон'югат має нижчу величину Cmax (пікова концентрація) в плазмі або не показує еквівалентну величину Cmax концентрації в плазмі. Відповідно до деяких аспектів кон'югат пропонується в кількості, достатній для одержання терапевтично біоеквівалентної величини Cmax, у порівнянні з некон'югованим гідрокодоном. Прикладами захворювань, розладів і станів, які можна лікувати за допомогою проліків або композицій за даним винаходом, є залежність від наркотиків або звикання до надмірного вживання лікарських засобів і/або гострий або хронічний біль. Дозування кон'югатів за даним винаходом залежать від їх молекулярної маси і відповідного масового відсотка гідрокодону як частини кон'югата загалом, і тому вони можуть бути вищими, ніж дозування вільного гідрокодону. Дози можна розрахувати на основі концентрації дозувань бітартрату гідрокодону, яка змінюється в діапазоні від 2,5 до 15 мг на дозу. Конверсію дози при переході від бітартрату гідрокодону до проліків гідрокодону можна здійснити, використовуючи наступну формулу: доза(HC проліки/кон'югат) = [доза(HC бітартрат) (молекулярна маса(HC проліки/кон'югат)/494,49)]/пропорція гідрокодону, що вивільнився з проліків/кон'югата, HC: гідрокодон. Придатні дозування кон'югованого гідрокодону за даним винаходом включають, однак цим не обмежуючись, композиції, що містять від приблизно 0,5 мг або більше або ж від приблизно 2,5 мг або більше, або ж від приблизно 5,0 мг або більше, або ж від приблизно 7,5 мг або більше, або ж від приблизно 10 мг або більше, або ж від приблизно 20 мг або більше, або ж від приблизно 30 мг або більше, або ж від приблизно 40 мг або більше, або ж від приблизно 50 мг або більше, або ж від приблизно 60 мг або більше, або ж від приблизно 70 мг або більше, або ж від приблизно 80 мг або більше, або ж від приблизно 90 мг або більше, або ж від приблизно 100 мг або більше, і включають будь-які його додаткові збільшення, наприклад 0,1; 0,2; 0,25; 0,3; 0,4; 0,5; 0,6; 0,7; 0,75; 0,8; 0,9 або 1,0 мг, і множники (наприклад, 1; 2; 2,5; 5; 10; 100 і т. д.). Даний винахід включає також склади дози, у тому числі схвалені на даний час до використання композиції гідрокодону (див. фігуру 4), де дозування можна розрахувати, використовуючи вищевказану формулу, що визначає кількість бітартрату гідрокодону. У даному винаході пропонуються лікарські форми, складені у вигляді монотерапевтичного засобу або лікарського засобу для комбінованої терапії з іншим активним фармакологічним інгредієнтом (фігура 4). 13 UA 102916 C2 5 10 15 20 25 30 35 40 45 50 55 60 Кон'югати гідрокодону з похідними бензойної кислоти або нікотинової кислоти за даним винаходом мають ряд переваг, включаючи, однак цим не обмежуючись, меншу мінливість концентрацій гідрокодону або гідроморфону в плазмі в порівнянні з вільним гідрокодоном, меншу потенційну небезпеку зловживання ліками, менший ризик хімічного або фізичного маніпулювання, що приводить до виділення всієї дози гідрокодону, поліпшені лікарські форми за рахунок утворення ковалентного зв'язку з карбоновою кислотою або її похідними, підвищений або знижений метаболізм гідрокодону в гідроморфон і/або знижені побічні ефекти, крім зловживання лікарським засобом. Гідрокодон являє собою наркотичний аналгезуючий засіб, що діє як слабкий агоніст рецептора опіоїду в центральній нервовій системі (ЦНС). Він, насамперед, впливає на μ (мю) рецептор (OP3), але також виявляє активність як агоніст δ (дельта) рецептора (OP1) і κ (каппа) рецептора (OP2). Крім того, гідрокодон має протикашльовівластивості, пригнічуючи кашльовий рефлекс у медулярному кашльовому центрі мозку. Побічні ефекти опіоїдних аналгезуючих засобів включають шлунково-кишковий розлад, що викликається зв'язуванням опіоїдів з мю (μ) рецепторами, наявними в шлунково-кишковому тракті. Побічні ефекти в шлунку включають зниження секреції хлористоводневої кислоти, зниження рухової функції шлунка, при цьому подовжується час спорожнювання шлунка, що може привести до гастроезофагеального рефлюксу. Час проходження вмісту шлунка через дванадцятипалу кишку може зрости на цілих 12 годин, і абсорбція перорально введених препаратів сповільнюється. У тонкому кишечнику опіоїдні аналгезуючі засоби зменшують секрецію жовчі, секрецію підшлункової залози і кишкові секреції і приводять до затримки перетравлювання їжі в тонкому кишечнику. Пропульсивні перистальтичні хвилі в товстій кишці знижуються або припиняються після призначення опіоїдів, а тонус зростає до рівня спазму. Виникаюча внаслідок цього затримка в просуванні вмісту кишечнику викликає значне висихання екскрементів, що, у свою чергу, сповільнює їх просування через товсту кишку. Зазначені дії в сполученні з ігноруванням нормальних подразників для рефлексу дефекації, викликаним центральною дією лікарського засобу, сприяють розвитку запору, що викликається опіоїдом. Гідрокодон застосовують для купірування гострого і помірно жорстокого болю і для пригнічення кашлю (зокрема сухого, непродуктивного кашлю). Проліки за даним винаходом можуть призначатися для ослаблення болю або для пригнічення кашлю, або для лікування будь-якого стану, який може потребувати блокування рецепторів опіоїду. Кон'югати за даним винаходом можуть знизити побічні ефекти опіоїдних аналгезуючих засобів, включаючи зниження або пригнічення ефектів, що викликають запори. У даному винаході пропонується також спосіб синтезу, з метою одержання кон'югатів гідрокодону за даним винаходом. В одному варіанті здійснення даного винаходу синтез включає наступні стадії: 1) захист ліганду, якщо необхідно; 2) активування карбоксильної групи ліганду, якщо він ще не знаходиться в активованій формі; 3) додавання активованого ліганду до гідрокодону або навпаки в присутності основи; і 4) видалення захисних груп ліганду, якщо вони використовувалися. Якщо арилкарбонова кислота містить які-небудь додаткові реакційноздатні функціональні групи, які можуть перешкодити протіканню реакції сполучення з гідрокодоном, то може виявитися необхідним спочатку приєднати одну або декілька захисних груп. Може використовуватися будь-яка придатна захисна група, залежно від типу функціональної групи й умов проведення реакції. Прикладами деяких захисних груп є: ацетил (Ac), βметоксіетоксиметиловий ефір (MEM), метоксиметиловий ефір (MOM), п-метоксибензиловий ефір (PMB), триметилсиліл (TMS), трет-бутилдиметилсиліл (TBDPS), триізопропілсиліл (TIPS), карбобензилокси (Cbz), п-метоксибензилкарбоніл (Moz), трет-бутилоксикарбоніл (Boc), 9флуоренілметоксикарбоніл (Fmoc), бензил (Bn), п-метоксибензил (MPM), тозил (Ts). Придатним є також тимчасове утворення ацеталів або кеталів з карбонільних груп. Карбоксильну групу лігандів необхідно активувати, щоб вона вступила у взаємодію з гідрокодоном і утворила помітні кількості кон'югата. Зазначену активацію можна здійснити множиною способів з використанням численних конденсуючих агентів, відомих фахівцю. Прикладами подібних конденсуючих агентів є: N, N'-дициклогексилкарбодіімід (DCC), N-(3диметиламінопропіл)-N'-етилкарбодіімід (EDCI), N, N'-діізопропілкарбодіімід (DBC), 1,1'карбонілдіімідазол (CDI) або інші карбодііміди; (бензотриазол-1ілокси)трис(диметиламіно)фосфонію гексафторфосфат (BOP), бромтрипіролідинофосфонію гексафторфосфат (PyBro), (бензотриазол-1-ілокси)трипіролідинофосфонію гексафторфосфат (PyBOP) або інші фосфонієві реагенти; O-(бензотриазол-1-іл)-N, N,N',N'-тетраметилуронію 14 UA 102916 C2 5 10 15 20 25 30 35 40 45 50 55 60 гексафторфосфат (HBTU), O-(бензотриазол-1-іл)-N, N,N',N'-тетраметилуронію тетрафторборат (TBTU), фтор-N, N,N',N'-тетраметилформамідинію гексафторфосфат (TFFH), N, N,N',N'тетраметил-О-(N-сукцинімідил)уронію тетрафторборат (TSTU) або інші амінієві реагенти. Арилкарбонову кислоту можна також перетворити у відповідний ацилгалогенід, ацилазид або змішаний ангідрид. На кожній зі стадій схеми синтезу кон'югата гідрокодону з арилкарбоновою кислотою може знадобитися основа. Придатні основи включають, однак цим не обмежуючись: 4метилморфолін (NMM), 4-(диметиламіно)піридин (DMAP), N, N-діізопропілетиламін, біс(триметилсиліл)амід літію, діізопропіламід літію (LDA), трет-бутоксид будь-якого лужного металу (наприклад, трет-бутоксид калію), гідрид будь-якого лужного металу (наприклад, гідрид натрію), алкоголят будь-якого лужного металу (наприклад, метоксид натрію), триетиламін або будь-який інший третинний амін. Придатні розчинники, які можуть використовуватися при проведенні будь-якої реакції схеми синтезу кон'югата гідрокодону з арилкарбоновою кислотою, включають, однак цим не обмежуючись: ацетон, ацетонітрил, бутанол, хлороформ, дихлорметан, диметилформамід (ДМФА), диметилсульфоксид (ДМСО), діоксан, етанол, етилацетат, діетиловий ефір, гептан, гексан, метанол, метил-трет-бутиловий ефір (MTBE), ізопропанол, ізопропілацетат, діізопропіловий ефір, тетрагідрофуран, толуол, ксилол або воду. У деяких варіантах здійснення даного винаходу проліки є гідрофобними і, таким чином, погано розчиняються у воді. Коли композицію змішують з водою, це приводить до утворення желеподібної консистенції або утворення грудкуватої суспензії. Приклади подібних проліків включають, однак цим не обмежуючись, піперонілат-HC, 3-OH-4-MeO-Bz-HC, 3-OH-Bz-HC і галат-HC. Зазначені проліки не можна вводити щурам у вигляді інтраназального дозування, оскільки вони не розчиняються у воді. Не бажаючи зв'язувати себе якою-небудь теорією, автори даного винаходу вважають, що зазначені сполуки затвердівають або утворюють грудочки, коли пацієнт-людина намагається вдихнути їх через ніс ("прийом дози порошкоподібного наркотику"). Зазначена властивість не тільки робить неприємною спробу зловживати лікарським засобом інтраназально, але, мабуть, також перешкоджає прониканню проліків через слизову оболонку носа. Як наслідок, зазначені сполуки стають неефективними для даного шляху введення. У даному винаході пропонуються фармацевтичні набори реагентів для лікування або запобігання симптомам відміни лікарського засобу або купірування болю у пацієнта. Пацієнт може бути людиною або твариною. Придатними пацієнтами-людьми є пацієнти-діти, літні пацієнти і звичайні пацієнти. Набір реагентів включає конкретну кількість індивідуальних доз в упаковці, що містять фармацевтично ефективну кількість щонайменше одного кон'югата гідрокодону за даним винаходом. Набір реагентів може також включати інструкції з використання зазначеного набору реагентів. Конкретна кількість індивідуальних доз може включати від приблизно 1 до приблизно 100 індивідуальних дозувань або ж від приблизно 1 до приблизно 60 індивідуальних дозувань, або ж від приблизно 10 до приблизно 30 індивідуальних дозувань, включаючи приблизно 1, приблизно 2, приблизно 5, приблизно 10, приблизно 15, приблизно 20, приблизно 25, приблизно 30, приблизно 35, приблизно 40, приблизно 45, приблизно 50, приблизно 55, приблизно 60, приблизно 70, приблизно 80, приблизно 100, і включати будь-які додаткові збільшення, наприклад 1, 2, 5, 10, і множники (наприклад, 1; 2; 2,5; 5; 10; 100 і т. д.). Описуваний винахід і його переваги стануть більш зрозумілі з посиланням на наведені нижче приклади. Зазначені приклади наведені для того, щоб описати конкретні варіанти здійснення даного винаходу. Варто розуміти, що наведені конкретні приклади не обмежують обсяг даного винаходу і не суперечать суті даного винаходу. Фахівцям повинно бути зрозуміло, що повний обсяг описуваного винаходу охоплює об'єкт винаходу, обумовлений наведеною в даному описі формулою винаходу, а також будь-які зміни, модифікації й еквіваленти формули винаходу. Приклади Приклад 1. Хімічна стабільність бензоатних і гетероарилкарбоксилатних кон'югатів гідрокодону Приклади кон'югатів гідрокодону за даним винаходом і контрольні тестові кон'югати не за даним винаходом випробовують на їх хімічну стабільність в умовах, аналогічних тим, які потенційний пацієнт, що зловживає ліками, може використовувати для "витягання" активної частини молекули, розчиненої у воді, хлористоводневій кислоті або бікарбонаті натрію при кімнатній температурі або при 100 °C. Кон'югати на одну годину поміщають у водний розчин або при температурі навколишнього середовища (приблизно 20 °C), або на масляну баню з температурою 100 °C, і визначають кількість кон'югата, яка піддалася гідролізу в зазначених 15 UA 102916 C2 умовах. Результати наведені в таблиці 1 і вони показують, що кон'югати не вивільняють гідрокодон при температурі навколишнього середовища або при нагріванні у воді аж до температури 100 °C протягом однієї години. Таблиця 1 Сполука 4-OH-Bz-HC 2-Abz-HC 4-MeO-Bz-HC вода температура навколишнього середовища 0% 0% 0% 100 °C 0% 0% 0% 5 10 Крім того, зразки кон'югатів гідрокодону за даним винаходом випробовують і порівнюють зі зразками інших кон'югатів гідрокодону не за даним винаходом (адипат-HC) на їх здатність гідролізуватися в гідрокодон після розведення в 1N розчині хлористоводневої кислоти (HCl) протягом 1 год. при температурі навколишнього середовища (~20 °C) або на масляній бані при 100 °C. Процент вказує, як багато вихідного кон'югата гідролізується у вказаних умовах. Результати наведені в таблиці 2. Таблиця 2 Сполука 4-OH-Bz-HC 2-Abz-HC 3-OH-4-MeO-Bz-HC 2-OH-Bz-HC адипат-HC 15 % вивільнення в 1N HCl температура навколишнього середовища 0% 0% 0% 3% 13 % 100 °C 30 % 16 % 35 % 27 % 100 % Зразки кожного кон'югата розчиняють в 5 %-ному розчині NaHCO3 протягом однієї години при температурі навколишнього середовища (~20 °C) або на масляній бані при 100 °C. Процент вказує, як багато вихідного кон'югата гідролізується у вказаних умовах, результати наведені в таблиці 3 для кон'югатів за даним винаходом і кон'югатів для порівняння не за даним винаходом (Tyr-Tyr-Phe-Phe-Ile-гідрокодон (YYFFI-HC) або адипат-HC). Таблиця 3 Сполука 4-OH-Bz-HC 3-OH-4-MeO-Bz-HC YYFFI-HC адипат-HC % вивільнення в 5 %-ному NaHCO3 температура навколишнього 100 °C середовища 1% 23 % 0% 36 % 0% 70 % 3% 100 % 20 25 30 Приклади 2: Пероральні фармакокінетичні профілі кон'югованого гідрокодону за даним винаходом Криві фармакокінетичного профілю при пероральному введенні визначають для бензоатгідрокодону (Bz-HC), проліків за даним винаходом, у порівнянні з двома кон'югатами не за даним винаходом: YYFFI-HC і дигліколят-HC. Щурам перорально вводять кількість кон'югата, еквівалентну 2 мг/кг гідрокодону у вигляді вільної основи, і концентрацію в плазмі вивільненого гідрокодону й активного метаболіту, гідроморфону, з плином часу визначають методом РХМС/МС. Як показано на фігурі 5, криві фармакокінетичного профілю при пероральному введенні для вивільненого гідрокодону певною мірою аналогічні для Bz-HC і YYFFI-HC, однак концентрації в плазмі гідрокодону, що виділяється з Bz-HC, в основному значно вище, ніж концентрації гідрокодону, що виділяється з дигліколят-HC (AUC і Cmax для Bz-HC, відповідно, приблизно на 40 і 50 % більше). Крім того, Bz-HC вивільняє вищі концентрації в плазмі більш 16 UA 102916 C2 5 10 15 20 25 30 35 40 45 50 55 діючого активного метаболіту, гідроморфону (фігура 6), ніж обидва YYFFI-HC (AUC і Cmax для гідроморфону, що утворився з Bz-HC, відповідно, на 60 і 80 % більше) і дигліколят-HC (AUC і Cmax для гідроморфону, що утворився з Bz-HC, відповідно, на 55 і 180 % більше). Зазначене спостереження змушує передбачити, що всі три сполуки вибирають різні шляхи обміну і що BzHC потенційно має вищу здатність купірувати біль, ніж будь-яка з наведених зразкових сполук. Приклади 3: Інтраназальні фармакокінетичні профілі кон'югатів гідрокодону Кон'югат гідрокодону за даним винаходом випробовують на здатність перешкоджати зловживанню, досліджуючи ефективність гідролізу при призначенні шляхами, відмінними від перорального. Щурам інтраназально вводять кон'югат у кількості, еквівалентній 2 мг/кг гідрокодону у вигляді вільної основи, і концентрацію в плазмі щурів вивільненого гідрокодону й активного метаболіту, гідроморфону, з плином часу визначають методом РХ-МС/МС. Концентрації гідрокодону в плазмі були значно нижче для Bz-HC (AUC і Cmax для гідроморфону, що виділився з адипат-HC, приблизно на 280 і 60 % більше, відповідно), як показано на фігурі 7. Крім того, Bz-HC дають дуже низьку концентрацію гідроморфону в плазмі в порівнянні з адипатHC (AUC і Cmax для гідроморфону, що виділився з адипат-HC, приблизно на 750 і 660 % більше, відповідно), як показано на фігурі 8. Проліки за даним винаходом дають концентрації гідрокодону і гідроморфону в плазмі, які значно нижче, ніж відповідні концентрації в плазмі для незв'язаного гідрокодон-BT або для інших класів проліків, коли введення проводять інтраназально. Приклади 4: Зразкові внутрішньовенні фармакокінетичні профілі кон'югатів за даним винаходом Кон'югати гідрокодону за даним винаходом є гідрофобними, наприклад Bz-HC, нікотинат-HC, 4-MeO-Bz-HC, піперонілат-HC, 4-OH-Bz-HC, саліцилат-HC, 3-OH-4-MeO-Bz-HC, 3-OH-Bz-HC і галат-HC. Тому зазначені сполуки не можна застосовувати внутрішньовенно в дозах, еквівалентних пероральному введенню, оскільки вони не розчиняються в прийнятній на практиці кількості води, оскільки сполуки для ін'єкції повинні повністю знаходитися в розчиненому стані, тому що будь-яка тверда частинка може викликати емболію. Кількість води, необхідна для розчинення необхідної кількості кон'югата, робить ін'єкцію неможливою, і, таким чином, композиції і проліки за даним винаходом потенційно здатні перешкодити зловживанню лікарськими засобами, на відміну від інших кон'югатів гідрокодону, які розчинні у воді, таких як адипат-HC і дигліколят-HC, і які можна вводити внутрішньовенно в дозах, еквівалентних пероральному введенню. Приклади 5: Порівняння пероральних фармакокінетичних профілів кон'югатів гідрокодону Концентрації в плазмі гідрокодону, вивільненого з Bz-HC і нікотинат-HC, порівнюють з концентраціями в плазмі гідрокодону, що утворюється з некон'югованого гідрокодон-BT після перорального введення щурам. Щурам вводять кон'югований або некон'югований лікарський засіб у кількості, еквівалентній 2 мг/кг гідрокодону у вигляді вільної основи, і концентрацію в плазмі гідрокодону і гідроморфону визначають методом РХ-МС/МС, як показано на фігурах 9 і 10, відповідно. Концентрація в плазмі гідрокодону, що вивільнився з Bz-HC, при пероральному введенні, збільшується аналогічно концентраціям гідрокодону в плазмі, спостережуваним для гідрокодон-BT, доти, поки вона не досягне значення Cmax (величина Cmax приблизно рівна для обох сполук). Після Tmax концентрація гідрокодону в плазмі для Bz-HC зменшується повільніше і більш керовано, ніж для некон'югованого гідрокодон-BT (фігура 9 і фігура 10). Bz-HC має більше значення AUC (AUC приблизно на 25 % більше, фігура 9) у порівнянні з гідрокодон-BT, і аналогічні результати спостерігалися для концентрацій у плазмі активного метаболіту, гідроморфону (фігура 10). Нікотинат-HC утворює концентрації гідрокодону і гідроморфону в плазмі, які нижче відповідних концентрацій, спостережуваних для кон'югованого гідрокодон-BT. Проте, відповідні величини AUC знаходяться в діапазоні біоеквівалентності для тієї ж дози (у перерахуванні на гідрокодон у вигляді вільної основи). 2-ABz-HC демонструє інший профіль вивільнення після перорального введення щурам, ніж Bz-HC або некон'югований гідрокодон-BT. Щурам вводять кількість, еквівалентну 2 мг/кг гідрокодону у вигляді вільної основи, і концентрацію в плазмі гідрокодону або гідроморфону з плином часу визначають методом РХ-МС/МС, як показано на фігурі 11 або фігурі 12, відповідно. 2-ABz-HC вивільняє гідрокодон дуже повільно, про що свідчить поступове підвищення концентрації в плазмі з наступним плавним зменшенням (фігура 11). Це приводить до згладжування фармакокінетичної кривої в порівнянні з кривою для гідрокодон-BT (Tmax для 2ABz-HC має приблизно в чотири рази більше значення, AUC і Cmax приблизно на 35 і 60 % менше, відповідно). Загалом, фармакокінетична крива для 2-ABz-HC теж більш плоска, ніж для 17 UA 102916 C2 5 10 гідрокодон-BT (фігура 12), однак показує невеликий початковий сплеск (AUC і C max для 2-ABzHC приблизно на 25 і 50 % менше, відповідно). Приклад 6: Визначення змін концентрацій у плазмі бензоат-гідрокодону Щоб визначити мінливість концентрації в плазмі для гідрокодону (HC) і гідроморфону (HM), розраховують коефіцієнт варіації (CV) для індивідуальних тварин, яким водять дози бензоатгідрокодону або некон'югованого бітартрату гідрокодону (BT) у кількості, еквівалентній 2 мг/кг гідрокодону у вигляді вільної основи, і концентрації в плазмі гідрокодону або гідроморфону з плином часу визначають методом РХ-МС/МС. Значення CV розраховують, розділивши величину середньоквадратичного відхилення концентрацій у плазмі для індивідуальних тварин на величини середніх концентрацій у плазмі для усіх тварин, яким вводили дози, для даної часової точки. "Середнє CV" означає середнє значення CV для всіх часових точок, як зазначено в таблиці 4. Таблиця 4 Сполука Bz-HC гідрокодон-BT 15 20 25 30 35 40 45 50 Середнє значення CV HC 46 75 HM 41 64 Менше середнє значення CV для Bz-HC показує, що зазначені проліки мають меншу відносну мінливість концентрації в плазмі для гідрокодону і гідроморфону по усіх тваринах, яким вводили дози, і по всіх часових точках, у порівнянні з некон'югованим лікарським засобом, бітартратом гідрокодону. Приклад 7: Синтез кон'югатів гідрокодону Синтез вільної основи бензоат-гідрокодону До розчину вільної основи гідрокодону (0,596 г, 1,99 ммол.) у тетрагідрофурані (25 мл) додають 1М розчин Li(SiMe3)2 у тетрагідрофурані (5,98 мл). Одержану оранжеву суспензію перемішують при температурі навколишнього середовища протягом 30 хв., після чого додають бензоат-янтарний ефір (1,25 г, 5,98 ммол.). Суміш, що утворилася, залишають перемішуватися на ніч при температурі навколишнього середовища, а через 18 год. реакцію переривають, додаючи 100 мл насиченого розчину хлориду амонію, і перемішують ще протягом 2 год. До суміші додають етилацетат (100 мл) і промивають насиченим розчином хлориду амонію (3100 мл) і водою (1100 мл). Органічні екстракти сушать над безводним MgSO 4, розчинник видаляють і залишок розчиняють у 2-ізопропанолі (50 мл). Додають воду до утворення твердої речовини. Одержану суміш охолоджують, фільтрують і сушать, одержуючи вільну основу бензоат-гідрокодону (0,333 г, 0,826 ммол., вихід 42 %) у вигляді твердої речовини темнокоричневого кольору. Наведений синтез зображений на фігурі 13A. Синтез сукцинату 2-Boc-амінобензойної кислоти 2-Boc-амінобензойну кислоту (2,56 г, 10,8 ммол.) і N-гідроксисукцинімід (1,37 г, 11,88 ммол.) розчиняють у 25 мл ТГФ. В один прийом додають DCC (2,45 г, 11,88 ммол.). Реакційну суміш залишають перемішуватися на ніч. Тверду речовину відфільтровують і промивають ацетоном (210 мл). Фільтрат упарюють досуха і залишок розчиняють у 100 мл ацетону. Осад (DCU), що утворився, відфільтровують, і фільтрат концентрують, одержуючи тверду речовину, яку збирають, промивають метанолом (34 мл) і одержують 3,26 г (90 %) продукту білого кольору. Синтез складного ефіру гідрокодону з 2-Boc-амінобензойною кислотою До гідрокодону у вигляді вільної основи (0,449 г, 1,5 ммол.), розчиненого в 20 мл безводного ТГФ, додають розчин LiHMDS у ТГФ (1М, 4,5 мл, 4,5 ммол.) протягом 20 хв. Суміш перемішують протягом 30 хв., і в один прийом додають сукцинат 2-Boc-амінобензойної кислоти (1,50 г, 4,5 ммол.). Реакційну суміш перемішують протягом 4 год., а потім переривають реакцію, додаючи 100 мл насиченого розчину NH4Cl. Суміш перемішують 1 год. й екстрагують 200 мл етилацетату. Шар етилацетату промивають насиченим розчином NaHCO 3 (280 мл) і 5 %-ним розчином солі (80 мл), сушать над безводним Na2SO4 і концентрують. Залишок очищають колонковою хроматографією на силікагелі (7 % MeOH/CH2Cl2) і одержують 449 мг (58 %) аморфної твердої речовини. Синтез хлористоводневої солі складного ефіру гідрокодону з 2-Boc-амінобензойною кислотою Складний ефір гідрокодону і 2-Boc-амінобензойної кислоти (259 мг, 0,5 ммол.) перемішують у 4 мл 4N розчину HCl/діоксан протягом 4 год. Розчинник упарюють досуха і до залишку 18 UA 102916 C2 5 10 15 20 25 30 35 40 45 50 55 60 додають 5 мл етилацетату. Тверду речовину збирають і промивають етилацетатом, одержуючи 207 мг (84 %) продукту. Синтез 2-МОМ-саліцилсукцинату 2-МОМ-саліцилову кислоту (3,2 г, 17,6 ммол.) і N-гідроксисукцинімід (2,23 г, 19,36 ммол.) розчиняють у 40 мл ТГФ. В один прийом додають DCC (3,99 г, 19,36 ммол.). Реакційну суміш залишають перемішуватися на ніч. Тверді речовини відфільтровують і промивають ацетоном (210 мл). Фільтрат концентрують, і залишок перекристалізовують з 10 мл метанолу, одержуючи 2,60 г (53 %) твердої речовини білого кольору. Синтез складного ефіру гідрокодону і 2-MOM-саліцилової кислоти До гідрокодону у вигляді вільної основи (0,449 г, 1,5 ммол.), розчиненого в 20 мл безводного ТГФ, додають розчин LiHMDS у ТГФ (1М, 4,5 мл, 4,5 ммол.) протягом 20 хв. Суміш перемішують протягом 30 хв., і в один прийом додають сукцинат 2-MOM-саліцилової кислоти (1,26 г, 4,5 ммол.). Реакційну суміш перемішують протягом 4 год., а потім переривають реакцію, додаючи 100 мл насиченого розчину NH4Cl. Суміш перемішують 1 год. й екстрагують 200 мл етилацетату. Шар етилацетату промивають насиченим розчином NaHCO 3 (280 мол) і 5 %-ним розчином солі (80 мл), сушать над безводним Na2SO4 і концентрують. Залишок очищають колонковою хроматографією на силікагелі (8 % MeOH/CH2Cl2) і одержують 381 мг (58 %) сиропоподібної речовини. Синтез хлористоводневої солі складного ефіру гідрокодону із саліциловою кислотою До складного ефіру гідрокодону і 2-MOM-саліцилової кислоти (380 мг, 0,82 ммол.) у 12 мл метанолу додають 0,5 мл концентрованої HCl (12N). Реакційну суміш перемішують протягом 6 год. Розчин концентрують, і залишкову воду видаляють спільним випарюванням з метанолом (55 мл). Одержану тверду речовину розчиняють у 1 мл метанолу, а потім додають 20 мл етилацетату. Одержану каламутну суміш концентрують до об'єму приблизно 4 мл. Тверду речовину, що утворилася, збирають і промивають етилацетатом, одержуючи 152 мг (41 %) продукту. Приклад 8: Пероральні фармакокінетичні профілі кон'югованого гідрокодону, гідрокодону і гідроморфону у щурів Після перорального введення бензоат-гідрокодону (Bz-HC) щурам одержують фармакокінетичні криві для вихідного Bz-HC, гідрокодону й активного метаболіту, гідроморфону. Щурам перорально вводять кількість кон'югата, еквівалентну 2 мг/кг гідрокодону у вигляді вільної основи, і концентрації в плазмі вихідного Bz-HC, вивільненого гідрокодону й активного метаболіту, гідроморфону, з плином часу визначають методом РХ-МС/МС. Як показано на фігурі 14, вплив вихідних проліків Bz-HC набагато менше, ніж вплив гідрокодону або гідроморфону (AUC для вихідного Bz-HC складає приблизно 10 і 3 % від значення AUC для гідрокодону і гідроморфону, відповідно). Приклад 9: Пероральні фармакокінетичні профілі кон'югованого гідрокодону, гідрокодону і гідроморфону у щурів Після перорального введення бензоат-гідрокодону (Bz-HC) або гідрокодон-BT собакам одержують фармакокінетичні криві для вихідного Bz-HC (лише гілка Bz-HC), гідрокодону й активного метаболіту, гідроморфону. Собакам перорально вводять кількість гідрокодон-BT або кон'югата, еквівалентну 2 мг/кг гідрокодону у вигляді вільної основи. Концентрації в плазмі вихідного Bz-HC, вивільненого гідрокодону й активного метаболіту, гідроморфону, з плином часу визначають методом РХ-МС/МС. Порівняння концентрацій у плазмі гідрокодону, вивільненого з Bz-HC і гідрокодон-BT, наведене на фігурі 15. Загалом, концентрації в плазмі гідрокодону, генеровані обома сполуками, дуже подібні. Системна дія гідрокодону трохи знижується для Bz-HC у порівнянні з гідрокодонBT (величина AUC гідрокодону для Bz-HC складає приблизно 72 % від значення AUC для гідрокодон-BT). Значення Cmax гідрокодону для Bz-HC складає приблизно 92 % від величини Cmax для гідрокодон-BT. Порівняння концентрацій у плазмі активного метаболіту, гідроморфону, після перорального введення Bz-HC або гідрокодон-BT наведені на фігурі 16. Системна дія і максимальні концентрації в плазмі гідроморфону аналогічні для обох сполук. AUC і значення C max гідрокодону для Bz-HC складають приблизно 103 і 109 % від відповідних значень для гідрокодон-BT. Порівняння концентрацій у плазмі вихідного Bz-HC і гідрокодону, вивільненого з Bz-HC, наведене на фігурі 17. Аналогічно результатам, спостережуваним для щурів, концентрації в плазмі вихідних проліків Bz-HC мають нижчі значення в порівнянні з концентрацією в плазмі гідрокодону (значення AUC для вихідного Bz-HC приблизно на 10 % менше, ніж значення AUC для гідрокодону). 19 UA 102916 C2 5 10 15 20 25 30 35 40 45 50 Приклад 10: Внутрішньовенні фармакокінетичні профілі кон'югованого гідрокодону, гідрокодону і гідроморфону у щурів Щурам вводять внутрішньовенно Bz-HC (0,30 мг/кг). Унаслідок його поганої розчинності у воді (або розчинності в забуференому фосфатом фізіологічному розчині), 0,30 мг/кг близько до максимальної дози, яку можна ввести щурам внутрішньовенно. Визначають фармакокінетичні криві для вихідного Bz-HC, гідрокодону й активного метаболіту, гідроморфону. Концентрації в плазмі вихідного Bz-HC, вивільненого гідрокодону й активного метаболіту, гідроморфону, з плином часу визначають методом РХ-МС/МС. Одержані фармакокінетичні криві наведені на фігурі 18. Приклад 11: Пероральні фармакокінетичні профілі гідрокодону і гідроморфону після різних дозувань Bz-HC у щурів Bz-HC перорально вводять щурам з дозами 0,25; 0,50; 1,00; 2,00; 3,00 або 4,00 мг/кг. Концентрації в плазмі гідрокодону або гідроморфону визначають методом РХ-МС/МС, як зазначено на фігурі 19 і 20, відповідно. Вплив (AUC) гідрокодону і гідроморфону для доз Bz-HC у діапазоні 0,25 і 4,00 мг/кг практично лінійний. Проте, відповідні значення Cmax більш мінливі, особливо для гідроморфону. Максимальні концентрації в плазмі гідроморфону не значно змінюються для доз Bz-HC вище 2,00 мг/кг. У даному описі застосування однини передбачає, якщо спеціально не зазначено, використання множини. Композиції, проліки і способи, наведені в даному описі, можуть бути проілюстровані наступними варіантами здійснення даного винаходу, що наведені нижче в пронумерованих параграфах. 1. Композиція, яка містить щонайменше один кон'югат гідрокодону і щонайменше однієї бензойної кислоти або похідного бензойної кислоти, її солі або їх комбінації, при цьому щонайменше одна бензойна кислота або похідне бензойної кислоти має наступну формулу I: , де X, Y і Z незалежно вибрані з групи, що включає H, O, S, NH і -(CH2)х-; 1 2 3 R , R і R незалежно вибрані з групи, що включає Н, алкіл, алкокси, арил, алкеніл, алкініл, атом галогену, галогензаміщений алкіл, алкіларил, арилалкіл, гетероцикл, арилалкокси, циклоалкіл, циклоалкеніл і циклоалкініл; o, p, q незалежно вибрані з 0 або 1; і x означає ціле число в діапазоні від 1 до 10. 2. Композиція, яка містить щонайменше один кон'югат гідрокодону і щонайменше однієї бензойної кислоти, її похідного або їх комбінації. 3. Композиція, яка містить бензоатний кон'югат, де бензоатний кон'югат включає щонайменше один гідрокодон, кон'югований щонайменше з однією бензойною кислотою або похідним бензойної кислоти. 4. Композиція за пунктом 1, де щонайменше однією бензойною кислотою або похідним бензойної кислоти є амінобензоат, гідроксибензоат, аміногідроксибензоат, їх похідне або їх комбінація. 5. Композиція за пунктом 4, де амінобензоат вибраний із групи, що включає антранілову кислоту, 3-амінобензойну кислоту, 4,5-диметилантранілову кислоту, N-метилантранілову кислоту, N-ацетилантранілову кислоту, фенамові кислоти (наприклад, толфенамову кислоту, мефенамову кислоту, флуфенамову кислоту), 2,4-діамінобензойну кислоту (2,4-DABA), 2ацетиламіно-4-амінобензойну кислоту, 4-ацетиламіно-2-амінобензойну кислоту, 2,4діацетиламінобензойну кислоту, їх похідні і їх комбінації. 6. Композиція за пунктом 4, де гідроксибензоат вибраний із групи, що включає саліцилову кислоту, ацетилсаліцилову кислоту (аспірин), 3-гідроксибензойну кислоту, 4-гідроксибензойну кислоту, 6-метилсаліцилову кислоту, o, м,п-крезотинову кислоту, анакардинові кислоти, 4,5диметилсаліцилову кислоту, o, м,п-оксипарацимолкарбонову кислоту, дифлузинал, o, м,панісову кислоту, 2,3-дигідробензойну кислоту (2,3-DHB), α,β,γ-резорцинову кислоту, протокатехову кислоту, гентизинову кислоту, піперонілову кислоту, 3-метоксисаліцилову кислоту, 4-метоксисаліцилову кислоту, 5-метоксисаліцилову кислоту, 6-метоксисаліцилову 20 UA 102916 C2 5 10 15 20 25 30 35 40 45 50 55 60 кислоту, 3-гідрокси-2-метоксибензойну кислоту, 4-гідрокси-2-метоксибензойну кислоту, 5гідрокси-2-метоксибензойну кислоту, ванілінову кислоту, ізованілінову кислоту, 5-гідрокси-3метоксибензойну кислоту, 2,3-диметоксибензойну кислоту, 2,4-диметоксибензойну кислоту, 2,5диметоксибензойну кислоту, 2,6-диметоксибензойну кислоту, вератрову кислоту (3,4диметоксибензойну кислоту), 3,5-диметоксибензойну кислоту, галову кислоту, 2,3,4тригідроксибензойну кислоту, 2,3,6-тригідроксибензойну кислоту, 2,4,5-тригідроксибензойну кислоту, 3-O-метилгалову кислоту (3-OMGA), 4-O-метилгалову кислоту (4-OMGA), 3,4-Oдиметилгалову кислоту, бузкову кислоту, 3,4,5-триметоксибензойну кислоту, їх похідні і їх комбінації. 7. Композиція за пунктом 4, де аміногідроксибензоат вибраний із групи, що включає 4аміносаліцилову кислоту, 3-гідроксіантранілову кислоту і 3-метоксіантранілову кислоту, їх похідні і їх комбінації. 8. Композиція за пунктом 1, 2, 3 або 4, де щонайменше один кон'югат являє собою композицію, призначену для лікування або запобігання захворюванню, яку застосовують для лікування зловживання наркотиками або опіоїдами або для попередження синдрому відміни лікарського засобу. 9. Композиція за пунктом 1, 2, 3 або 4, де щонайменше один кон'югат являє собою композицію, призначену для купірування болю. 10. Композиція за пунктом 1, 2, 3 або 4, де щонайменше один кон'югат являє собою композицію, призначену для купірування помірного і жорстокого болю. 11. Композиція за пунктом 1, 2, 3 або 4, де щонайменше один кон'югат зменшує або запобігає зловживанню ліками, які призначають перорально, інтраназально або внутрішньовенно. 12. Композиція за пунктом 1, 2, 3 або 4, де щонайменше один кон'югат забезпечує стійкість до зловживання пероральними, інтраназальними або парентеральними лікарськими засобами. 13. Композиція за пунктом 1, 2, 3 або 4, де щонайменше один кон'югат показує поліпшену швидкість вивільнення з плином часу і величину AUC у порівнянні з некон'югованим гідрокодоном за той же самий період часу. 14. Композиція за пунктом 1, 2, 3 або 4, де щонайменше один кон'югат показує меншу мінливість перорального фармакокінетичного профілю в порівнянні з некон'югованим гідрокодоном. 15. Композиція за пунктом 1, 2, 3 або 4, де щонайменше один кон'югат має менші побічні ефекти в порівнянні з некон'югованим гідрокодоном. 16. Композиція за пунктом 1, 2, 3 або 4, де щонайменше один кон'югат запобігає зловмисному використанню лікарських засобів шляхом як фізичного, так і хімічного маніпулювання. 17. Композиція за пунктом 1, 2, 3 або 4, де щонайменше один кон'югат готують у вигляді лікарської форми, вибраної з групи, що включає: таблетку, капсулу, таблетку у формі капсули, супозиторій, пастилку, корж, призначуваний перорально порошок, розчин, тонкоплівкову пероральну форму, пластинку, суспензію і завись. 18. Композиція за пунктом 1, 2, 3 або 4, де щонайменше один кон'югат призначають у кількості, достатній для того, щоб одержати терапевтично біоеквівалентне значення AUC, у порівнянні з некон'югованим гідрокодоном. 19. Композиція за пунктом 1, 2, 3 або 4, де щонайменше один кон'югат призначають у кількості, достатній для того, щоб одержати терапевтично біоеквівалентне значення AUC і величину Cmax, у порівнянні з еквівалентною молярною кількістю некон'югованого гідрокодону. 20. Композиція за пунктом 1, 2, 3 або 4, де щонайменше один кон'югат призначають у кількості, достатній для того, щоб одержати терапевтично біоеквівалентне значення AUC і меншу величину Cmax, у порівнянні з еквівалентною молярною кількістю некон'югованого гідрокодону. 21. Композиція за пунктом 1, 2, 3 або 4, де щонайменше один кон'югат присутній у кількості від приблизно 0,5 мг або більше. 22. Композиція за пунктом 1, 2, 3 або 4, де щонайменше один кон'югат присутній у кількості від приблизно 2,5мг або більше. 23. Композиція за пунктом 1, 2, 3 або 4, де щонайменше один кон'югат присутній у кількості від приблизно 5 мг або більше. 24. Композиція за пунктом 1, 2, 3 або 4, де щонайменше один кон'югат присутній у кількості від приблизно 10 мг або більше. 25. Композиція за пунктом 1, 2, 3 або 4, де щонайменше один кон'югат присутній у кількості від приблизно 20 мг або більше. 21 UA 102916 C2 5 10 15 20 25 30 35 40 45 50 26. Композиція за пунктом 1, 2, 3 або 4, де щонайменше один кон'югат присутній у кількості від приблизно 50 мг або більше. 27. Композиція за пунктом 1, 2, 3 або 4, де щонайменше один кон'югат присутній у кількості від приблизно 100 мг або більше. 28. Спосіб лікування пацієнта, що має захворювання, розлад або стан, що вимагає зв'язування опіоїду або опосередковується зв'язуванням опіоїду з рецепторами опіоїду пацієнта, який включає пероральне введення зазначеному пацієнту фармацевтично ефективної кількості щонайменше одного кон'югата гідрокодону і щонайменше однієї бензойної кислоти або похідного бензойної кислоти, її солі або їх комбінації, при цьому бензойна кислота або похідне бензойної кислоти має формулу I: , де X, Y і Z незалежно вибрані з групи, що включає H, O, S, NH і -(CH2)х-; 1 2 3 R , R і R незалежно вибрані з групи, що включає Н, алкіл, алкокси, арил, алкеніл, алкініл, атом галогену, галогензаміщений алкіл, алкіларил, арилалкіл, гетероцикл, арилалкокси, циклоалкіл, циклоалкеніл і циклоалкініл; o, p, q незалежно вибрані з 0 або 1; і x означає ціле число в діапазоні від 1 до 10. 29. Спосіб за пунктом 28, де щонайменше один кон'югат показує меншу швидкість вивільнення з плином часу і більше значення AUC у порівнянні з еквівалентною молярною кількістю некон'югованого гідрокодону за той же самий період часу. 30. Спосіб за пунктом 28, де щонайменше один кон'югат показує меншу мінливість перорального фармакокінетичного профілю в порівнянні з некон'югованим гідрокодоном. 31. Спосіб за пунктом 28, де щонайменше один кон'югат має менші побічні ефекти в порівнянні з некон'югованим гідрокодоном. 32. Спосіб за пунктом 28, де щонайменше один кон'югат готують у вигляді лікарської форми, вибраної з групи, що включає: таблетку, капсулу, таблетку у формі капсули, супозиторій, пастилку, корж, призначуваний перорально порошок, розчин, тонкоплівкову пероральну форму, пластинку, суспензію і завись. 33. Спосіб за пунктом 28, де щонайменше один кон'югат призначають у кількості, достатній для того, щоб одержати терапевтично біоеквівалентне значення AUC, у порівнянні з некон'югованим гідрокодоном. 34. Спосіб за пунктом 28, де щонайменше один кон'югат призначають у кількості, достатній для того, щоб одержати терапевтично біоеквівалентне значення AUC і величину C max, у порівнянні з еквівалентною молярною кількістю некон'югованого гідрокодону. 35. Спосіб за пунктом 28, де щонайменше один кон'югат призначають у кількості, достатній для того, щоб одержати терапевтично біоеквівалентне значення AUC і меншу величину C max, у порівнянні з еквівалентною молярною кількістю некон'югованого гідрокодону. 36. Спосіб за пунктом 28, де щонайменше один кон'югат присутній у кількості від приблизно 0,5 мг або більше. 37. Спосіб за пунктом 28, де щонайменше один кон'югат присутній у кількості від приблизно 2,5 мг або більше. 38. Спосіб за пунктом 28, де щонайменше один кон'югат присутній у кількості від приблизно 5 мг або більше. 39. Спосіб за пунктом 28, де щонайменше один кон'югат присутній у кількості від приблизно 10 мг або більше. 40. Спосіб за пунктом 28, де щонайменше один кон'югат присутній у кількості від приблизно 20 мг або більше. 41. Спосіб за пунктом 28, де щонайменше один кон'югат присутній у кількості від приблизно 50 мг або більше. 42. Спосіб за пунктом 28, де щонайменше один кон'югат присутній у кількості від приблизно 100 мг або більше. 43. Спосіб за пунктом 28, де щонайменше один кон'югат оборотно зв'язується з рецепторами опіоїду пацієнта. 22 UA 102916 C2 5 10 15 20 25 30 35 40 45 50 44. Спосіб за пунктом 28, де щонайменше один кон'югат оборотно зв'язується з рецепторами опіоїду пацієнта, не роблячи при цьому пригнічувального впливу на ЦНС. 45. Спосіб за пунктом 28, де щонайменше один кон'югат перешкоджає або знижує щонайменше один викликаючий запор побічний ефект некон'югованого гідро кодону. 46. Спосіб за пунктом 28, де щонайменше один кон'югат знижує або перешкоджає виникненню побічних ефектів, що викликають запор, у порівнянні з некон'югованим гідрокодоном. 47. Спосіб за пунктом 28, де щонайменше один кон'югат необоротно зв'язується з рецепторами опіоїду пацієнта. 48. Спосіб за пунктом 28, де щонайменше один кон'югат необоротно зв'язується з рецепторами опіоїду пацієнта, не роблячи при цьому пригнічувального впливу на ЦНС. 49. Спосіб лікування пацієнта, що має захворювання, розлад або стан, що вимагає інгібування зв'язування опіоїду або опосередковується інгібуванням зв'язування опіоїду з рецепторами опіоїду пацієнта, який включає пероральне введення зазначеному пацієнту фармацевтично ефективної кількості щонайменше одного кон'югата гідрокодону і щонайменше однієї бензойної кислоти або похідного бензойної кислоти, її солі або їх комбінації, при цьому бензойна кислота або похідне бензойної кислоти має формулу I: , де X, Y і Z незалежно вибрані з групи, що включає H, O, S, NH і -(CH2)х-; 1 2 3 R , R і R незалежно вибрані з групи, що включає Н, алкіл, алкокси, арил, алкеніл, алкініл, атом галогену, галогензаміщений алкіл, алкіларил, арилалкіл, гетероцикл, арилалкокси, циклоалкіл, циклоалкеніл і циклоалкініл; o, p, q незалежно вибрані з 0 або 1; і x означає ціле число в діапазоні від 1 до 10. 50. Спосіб за пунктом 49, де щонайменше один кон'югат оборотно інгібує зв'язування опіоїду з рецепторами опіоїду пацієнта. 51. Спосіб за пунктом 49, де щонайменше один кон'югат оборотно інгібує зв'язування опіоїду з рецепторами опіоїду пацієнта, не роблячи при цьому пригнічувального впливу на ЦНС. 52. Спосіб за пунктом 49, де щонайменше один кон'югат перешкоджає або знижує щонайменше один викликаючий запор побічний ефект самого гідрокодону. 53. Спосіб лікування пацієнта, що має захворювання, розлад або стан, що вимагає зв'язування опіоїду або опосередковується зв'язуванням опіоїду з рецепторами опіоїду пацієнта, який включає пероральне введення зазначеному пацієнту фармацевтично ефективної кількості щонайменше одного кон'югата гідрокодону і щонайменше однієї бензойної кислоти, її солі, її похідного або їх комбінації. 54. Спосіб за пунктом 53, де щонайменше один кон'югат показує меншу швидкість вивільнення з плином часу і більше значення AUC у порівнянні з еквівалентною молярною кількістю некон'югованого гідрокодону за той же самий період часу. 55. Спосіб за пунктом 53, де щонайменше один кон'югат показує меншу мінливість перорального фармакокінетичного профілю в порівнянні із самим гідрокодоном. 56. Спосіб за пунктом 53, де щонайменше один кон'югат має менші побічні ефекти в порівнянні із самим гідрокодоном. 57. Спосіб за пунктом 53, де щонайменше один кон'югат готують у вигляді лікарської форми, вибраної з групи, що включає: таблетку, капсулу, таблетку у формі капсули, супозиторій, пастилку, корж, призначуваний перорально порошок, розчин, тонкоплівкову пероральну форму, пластинку, суспензію і завись. 58. Спосіб за пунктом 53, де щонайменше один кон'югат призначають у кількості, достатній для того, щоб одержати терапевтично біоеквівалентне значення AUC, у порівнянні із самим гідрокодоном. 59. Спосіб за пунктом 53, де щонайменше один кон'югат призначають у кількості, достатній для того, щоб одержати терапевтично біоеквівалентне значення AUC і величину C max, у порівнянні із самим гідрокодоном. 23 UA 102916 C2 5 10 15 20 25 30 35 40 45 50 60. Спосіб за пунктом 53, де щонайменше один кон'югат призначають у кількості, достатній для того, щоб одержати терапевтично біоеквівалентне значення AUC, у порівнянні із самим гідрокодоном, з меншою величиною Cmax. 61. Спосіб за пунктом 53, де щонайменше один кон'югат призначають у кількості, достатній для того, щоб одержати терапевтично біоеквівалентне значення AUC, у порівнянні із самим гідрокодоном, але не еквівалентну величину C max. 62. Спосіб за пунктом 53, де щонайменше один кон'югат присутній у кількості від приблизно 0,5 мг або більше. 63. Спосіб за пунктом 53, де щонайменше один кон'югат присутній у кількості від приблизно 2,5 мг або більше. 64. Спосіб за пунктом 53, де щонайменше один кон'югат присутній у кількості від приблизно 5 мг або більше. 65. Спосіб за пунктом 53, де щонайменше один кон'югат присутній у кількості від приблизно 10 мг або більше. 66. Спосіб за пунктом 53, де щонайменше один кон'югат присутній у кількості від приблизно 20 мг або більше. 67. Спосіб за пунктом 53, де щонайменше один кон'югат присутній у кількості від приблизно 50 мг або більше. 68. Спосіб за пунктом 53, де щонайменше один кон'югат присутній у кількості від приблизно 100 мг або більше. 69. Спосіб за пунктом 53, де щонайменше один кон'югат оборотно зв'язується з рецепторами опіоїду пацієнта. 70. Спосіб за пунктом 53, де щонайменше один кон'югат оборотно зв'язується з рецепторами опіоїду пацієнта, не роблячи при цьому пригнічувального впливу на ЦНС. 71. Спосіб за пунктом 53, де щонайменше один кон'югат перешкоджає або знижує щонайменше один викликаючий запор побічний ефект самого гідрокодону. 72. Спосіб за пунктом 53, де щонайменше один кон'югат знижує або перешкоджає виникненню побічних ефектів, що викликають запор. 73. Спосіб за пунктом 53, де щонайменше один кон'югат довгочасно зв'язується з рецепторами опіоїду пацієнта. 74. Спосіб за пунктом 53, де щонайменше один кон'югат довгочасно зв'язується з рецепторами опіоїду пацієнта, не роблячи при цьому пригнічувального впливу на ЦНС. 75. Спосіб лікування пацієнта, що має захворювання, розлад або стан, що вимагає інгібування зв'язування опіоїду або опосередковується інгібуванням зв'язування опіоїду з рецепторами опіоїду пацієнта, який включає пероральне введення зазначеному пацієнту фармацевтично ефективної кількості щонайменше одного кон'югата гідрокодону і щонайменше однієї бензойної кислоти, її солі, її похідного або їх комбінації. 76. Спосіб за пунктом 75, де щонайменше один кон'югат оборотно інгібує зв'язування опіоїду з рецепторами опіоїду пацієнта. 77. Спосіб за пунктом 75, де щонайменше один кон'югат оборотно інгібує зв'язування опіоїду з рецепторами опіоїду пацієнта, не роблячи при цьому пригнічувального впливу на ЦНС. 78. Спосіб за пунктом 75, де щонайменше один кон'югат перешкоджає або знижує щонайменше один викликаючий запор побічний ефект самого гідрокодону. 79. Фармацевтичний набір реагентів, який включає: (і) визначену кількість індивідуальних дозувань в упаковці, що містять фармацевтично ефективну кількість щонайменше одного кон'югата гідрокодону і щонайменше однієї бензойної кислоти або похідного бензойної кислоти, її солі або їх комбінації, при цьому бензойна кислота або похідне бензойної кислоти має формулу I: , де X, Y і Z незалежно вибрані з групи, що включає H, O, S, NH і -(CH2)х-; 1 2 3 R , R і R незалежно вибрані з групи, що включає Н, алкіл, алкокси, арил, алкеніл, алкініл, атом галогену, галогензаміщений алкіл, алкіларил, арилалкіл, гетероцикл, арилалкокси, циклоалкіл, циклоалкеніл і циклоалкініл; 24 UA 102916 C2 5 10 15 20 25 30 35 40 o, p, q незалежно вибрані з 0 або 1; і x означає ціле число в діапазоні від 1 до 10. 80. Набір реагентів за пунктом 79, де зазначений набір додатково включає: (ii) інструкції з використання зазначеного набору реагентів у способі лікування або запобігання симптомам відміни лікарського засобу або купірування болю у пацієнта-людини або пацієнта-тварини. 81. Набір реагентів за пунктом 80, де зазначеним пацієнтом є пацієнт-дитина. 82. Набір реагентів за пунктом 80, де зазначеним пацієнтом є літній пацієнт. 83. Набір реагентів за пунктом 80, де зазначеним пацієнтом є звичайний пацієнт. 84. Фармацевтичний набір реагентів, який включає: (і) визначену кількість індивідуальних дозувань в упаковці, що містять фармацевтично ефективну кількість щонайменше одного кон'югата гідрокодону і щонайменше однієї бензойної кислоти, її солі, її похідного або їх комбінації. 85. Набір реагентів за пунктом 84, де зазначений набір додатково включає: (ii) інструкції з використання зазначеного набору реагентів у способі лікування або запобігання симптомам відміни лікарського засобу або купірування болю у пацієнта-людини або пацієнта-тварини. 86. Набір реагентів за пунктом 85, де зазначеним пацієнтом є пацієнт-дитина. 87. Набір реагентів за пунктом 85, де зазначеним пацієнтом є літній пацієнт. 88. Набір реагентів за пунктом 85, де зазначеним пацієнтом є звичайний пацієнт. 89. Набір реагентів за пунктом 79, 80, 84 або 85, де зазначені індивідуальні дозування містять щонайменше приблизно 0,5 мг або більше щонайменше одного кон'югата. 90. Набір реагентів за пунктом 79, 80, 84 або 85, де зазначені індивідуальні дозування містять щонайменше приблизно 2,5 мг або більше щонайменше одного кон'югата. 91. Набір реагентів за пунктом 79, 80, 84 або 85, де зазначені індивідуальні дозування містять щонайменше приблизно 5,0 мг або більше щонайменше одного кон'югата. 92. Набір реагентів за пунктом 79, 80, 84 або 85, де зазначені індивідуальні дозування містять щонайменше приблизно 10 мг або більше щонайменше одного кон'югата. 93. Набір реагентів за пунктом 79, 80, 84 або 85, де зазначені індивідуальні дозування містять щонайменше приблизно 20 мг або більше щонайменше одного кон'югата. 94. Набір реагентів за пунктом 79, 80, 84 або 85, де зазначені індивідуальні дозування містять щонайменше приблизно 50 мг або більше щонайменше одного кон'югата. 95. Набір реагентів за пунктом 79, 80, 84 або 85, де зазначені індивідуальні дозування містять щонайменше приблизно 100 мг або більше щонайменше одного кон'югата. 96. Набір реагентів за пунктом 79, 80, 84 або 85, де зазначений набір реагентів містить від приблизно 1 до приблизно 60 індивідуальних дозувань. 97. Набір реагентів за пунктом 79, 80, 84 або 85, де зазначений набір реагентів містить від приблизно 10 до приблизно 30 індивідуальних дозувань. 98. Композиція, яка містить щонайменше один кон'югат гідрокодону і щонайменше однієї гетероарилкарбонової кислоти, її похідного або їх комбінації. 99. Композиція за пунктом 98, де щонайменше одна гетероарилкарбонова кислота вибрана з формули II, формули III і формули IV, де формула II, формула III або формула IV мають наступні структури: , , 45 50 , де X, Y і Z незалежно вибрані з групи, що включає H, O, S, NH і -(CH2)х-; 1 2 3 R , R і R незалежно вибрані з групи, що включає Н, алкіл, алкокси, арил, алкеніл, алкініл, атом галогену, галогензаміщений алкіл, алкіларил, арилалкіл, гетероцикл, арилалкокси, циклоалкіл, циклоалкеніл і циклоалкініл; o, p, q незалежно вибрані з 0 або 1; і x означає ціле число в діапазоні від 1 до 10. 100. Композиція, яка містить щонайменше один кон'югат гідрокодону і щонайменше однієї нікотинової кислоти, її похідного або їх комбінації. 25 UA 102916 C2 5 10 15 20 25 30 35 40 45 50 55 60 101. Композиція за пунктом 98, де щонайменше однією гетероарилкарбоновою кислотою є похідне піридину. 102. Композиція за пунктом 98, де гетероарилкарбонова кислота вибрана з групи, що включає ізонікотинову кислоту, піколінову кислоту, 3-гідроксипіколінову кислоту, 6гідроксинікотинову кислоту, цитразинову кислоту, 2,6-дигідроксинікотинову кислоту, кінуренову кислоту, ксантуренову кислоту, 6-гідроксикінуренову кислоту, 8-метоксикінуренову кислоту, 7,8дигідроксикінуренову кислоту, 7,8-дигідро-7,8-дигідроксикінуренову кислоту їх похідні і їх комбінації. 103. Композиція за пунктом 98, 99 або 100, де щонайменше один кон'югат застосовують при лікуванні від зловживання лікарськими засобами, наркотиками або опіоїдами або для запобігання синдрому відміни лікарського засобу. 104. Композиція за пунктом 98, 99 або 100, де щонайменше один кон'югат застосовують для купірування болю. 105. Композиція за пунктом 98, 99 або 100, де щонайменше один кон'югат застосовують для купірування помірного або жорстокого болю. 106. Композиція за пунктом 98, 99 або 100, де щонайменше один кон'югат зменшує або запобігає зловживанню пероральними, інтраназальними або внутрішньовенними лікарськими засобами. 107. Композиція за пунктом 98, 99 або 100, де щонайменше один кон'югат надає стійкості до зловживання пероральними, інтраназальними або внутрішньовенними лікарськими засобами. 108. Композиція за пунктом 98, 99 або 100, де щонайменше один кон'югат запобігає зловмисному використанню лікарських засобів шляхом як фізичного, так і хімічного маніпулювання. 109. Композиція за пунктом 98, 99 або 100, де щонайменше один кон'югат показує поліпшену швидкість вивільнення з плином часу і величину AUC у порівнянні із самим гідрокодоном за той же самий період часу. 110. Композиція за пунктом 98, 99 або 100, де щонайменше один кон'югат показує меншу мінливість перорального фармакокінетичного профілю в порівнянні з еквівалентною молярною кількістю самого гідрокодону. 111. Композиція за пунктом 98, 99 або 100, де щонайменше один кон'югат має менші побічні ефекти в порівнянні із самим гідрокодоном. 112. Композиція за пунктом 98, 99 або 100, де зазначену композицію готують у вигляді лікарської форми, вибраної з групи, що включає: таблетку, капсулу, таблетку у формі капсули, супозиторій, пастилку, корж, призначуваний перорально порошок, розчин, тонкоплівкову пероральну форму, пластинку, суспензію і завись. 113. Композиція за пунктом 98, 99 або 100, де щонайменше один кон'югат призначають у кількості, достатній для того, щоб одержати терапевтично біоеквівалентне значення AUC, у порівнянні з еквівалентною молярною кількістю самого некон'югованого гідрокодону. 114. Композиція за пунктом 98, 99 або 100, де щонайменше один кон'югат призначають у кількості, достатній для того, щоб одержати терапевтично біоеквівалентне значення AUC і величину Cmax, у порівнянні із самим гідрокодоном. 115. Композиція за пунктом 98, 99 або 100, де щонайменше один кон'югат призначають у кількості, достатній для того, щоб одержати терапевтично біоеквівалентне значення AUC, у порівнянні із самим гідрокодоном, з меншою величиною Cmax. 116. Композиція за пунктом 98, 99 або 100, де щонайменше один кон'югат присутній у кількості від приблизно 0,5 мг або більше. 117. Композиція за пунктом 98, 99 або 100, де щонайменше один кон'югат присутній у кількості від приблизно 2,5 мг або більше. 118. Композиція за пунктом 98, 99 або 100, де щонайменше один кон'югат присутній у кількості від приблизно 5 мг або більше. 119. Композиція за пунктом 98, 99 або 100, де щонайменше один кон'югат присутній у кількості від приблизно 10 мг або більше. 120. Композиція за пунктом 98, 99 або 100, де щонайменше один кон'югат присутній у кількості від приблизно 20 мг або більше. 121. Композиція за пунктом 98, 99 або 100, де щонайменше один кон'югат присутній у кількості від приблизно 50 мг або більше. 122. Композиція за пунктом 98, 99 або 100, де щонайменше один кон'югат присутній у кількості від приблизно 100 мг або більше. 123. Спосіб лікування пацієнта, що має захворювання, розлад або стан, що вимагає зв'язування опіоїду або опосередковується зв'язуванням опіоїду з рецепторами опіоїду 26 UA 102916 C2 5 пацієнта, який включає пероральне введення зазначеному пацієнту фармацевтично ефективної кількості щонайменше одного кон'югата гідрокодону і щонайменше однієї гетероарилкарбонової кислоти. 124. Спосіб за пунктом 123, де щонайменше одна гетероарилкарбонова кислота вибрана з формули II, формули III і формули IV, де формула II, формула III або формула IV мають наступні структури: , , 10 15 20 25 30 35 40 45 50 , де X, Y і Z незалежно вибрані з групи, що включає H, O, S, NH і -(CH2)х-; 1 2 3 R , R і R незалежно вибрані з групи, що включає Н, алкіл, алкокси, арил, алкеніл, алкініл, атом галогену, галогензаміщений алкіл, алкіларил, арилалкіл, гетероцикл, арилалкокси, циклоалкіл, циклоалкеніл і циклоалкініл; o, p, q незалежно вибрані з 0 або 1; і x означає ціле число в діапазоні від 1 до 10. 125. Спосіб лікування пацієнта, що має захворювання, розлад або стан, що вимагає зв'язування опіоїду або опосередковується зв'язуванням опіоїду з рецепторами опіоїду пацієнта, який включає пероральне введення зазначеному пацієнту фармацевтично ефективної кількості щонайменше одного кон'югата гідрокодону і щонайменше однієї нікотинової кислоти, її похідного або їх комбінації. 126. Спосіб за пунктом 123, 124 або 125, де щонайменше один кон'югат показує поліпшену швидкість вивільнення з плином часу і величину AUC у порівнянні із самим гідрокодоном за той же самий період часу. 127. Спосіб за пунктом 123, 124 або 125, де щонайменше один кон'югат показує меншу мінливість перорального фармакокінетичного профілю в порівнянні із самим гідрокодоном. 128. Спосіб за пунктом 123, 124 або 125, де щонайменше один кон'югат має менші побічні ефекти в порівнянні із самим гідрокодоном. 129. Спосіб за пунктом 123, 124 або 125, де зазначену композицію готують у вигляді лікарської форми, вибраної з групи, що включає: таблетку, капсулу, таблетку у формі капсули, супозиторій, пастилку, корж, призначуваний перорально порошок, розчин, тонкоплівкову пероральну форму, пластинку, суспензію і завись. 130. Спосіб за пунктом 123, 124 або 125, де щонайменше один кон'югат призначають у кількості, достатній для того, щоб одержати терапевтично біоеквівалентне значення AUC, у порівнянні з еквівалентною молярною кількістю некон'югованого гідрокодону. 131. Спосіб за пунктом 123, 124 або 125, де щонайменше один кон'югат призначають у кількості, достатній для того, щоб одержати терапевтично біоеквівалентне значення AUC і величину Cmax, у порівнянні з еквівалентною молярною кількістю некон'югованого гідрокодону. 132. Спосіб за пунктом 123, 124 або 125, де щонайменше один кон'югат призначають у кількості, достатній для того, щоб одержати терапевтично біоеквівалентне значення AUC і меншу величину Cmax, у порівнянні з еквівалентною молярною кількістю некон'югованого гідрокодону. 133. Спосіб за пунктом 123, 124 або 125, де щонайменше один кон'югат призначають у кількості, достатній для того, щоб одержати терапевтично біоеквівалентне значення AUC, у порівнянні із самим гідрокодоном, але не еквівалентне значення Cmax. 134. Спосіб за пунктом 123, 124 або 125, де щонайменше один кон'югат присутній у кількості від приблизно 0,5 мг або більше. 135. Спосіб за пунктом 123, 124 або 125, де щонайменше один кон'югат присутній у кількості від приблизно 2,5 мг або більше. 136. Спосіб за пунктом 123, 124 або 125, де щонайменше один кон'югат присутній у кількості від приблизно 5 мг або більше. 137. Композиція за пунктом 123, 124 або 125, де щонайменше один кон'югат присутній у кількості від приблизно 10 мг або більше. 138. Спосіб за пунктом 123, 124 або 125, де щонайменше один кон'югат присутній у кількості від приблизно 20 мг або більше. 27 UA 102916 C2 5 10 15 20 25 139. Спосіб за пунктом 123, 124 або 125, де щонайменше один кон'югат присутній у кількості від приблизно 50 мг або більше. 140. Спосіб за пунктом 123, 124 або 125, де щонайменше один кон'югат присутній у кількості від приблизно 100 мг або більше. 141. Спосіб за пунктом 123, 124 або 125, де щонайменше один кон'югат оборотно зв'язується з рецепторами опіоїду пацієнта. 142. Спосіб за пунктом 123, 124 або 125, де щонайменше один кон'югат оборотно зв'язується з рецепторами опіоїду пацієнта, не роблячи при цьому пригнічувального впливу на ЦНС. 143. Спосіб за пунктом 123, 124 або 125, де щонайменше один кон'югат перешкоджає виникненню побічного ефекту або знижує щонайменше один викликаючий запор побічний ефект самого гідрокодону. 144. Спосіб за пунктом 123, 124 або 125, де щонайменше один кон'югат знижує або перешкоджає виникненню ефектів, що викликають запор. 145. Спосіб за пунктом 123, 124 або 125, де щонайменше один кон'югат довгочасно зв'язується з рецепторами опіоїду пацієнта. 146. Спосіб за пунктом 123, 124 або 125, де щонайменше один кон'югат довгочасно зв'язується з рецепторами опіоїду пацієнта, не роблячи при цьому пригнічувального впливу на ЦНС. 147. Спосіб лікування пацієнта, що має захворювання, розлад або стан, що вимагає інгібування зв'язування опіоїду або опосередковується інгібуванням зв'язування опіоїду з рецепторами опіоїду пацієнта, який включає пероральне введення зазначеному пацієнту фармацевтично ефективної кількості щонайменше одного кон'югата гідрокодону і щонайменше однієї гетероарилкарбонової кислоти. 148. Спосіб за пунктом 147, де щонайменше одна гетероарилкарбонова кислота вибрана з формули II, формули III і формули IV, де формула II, формула III або формула IV мають наступні структури: , , 30 35 40 45 50 , де X, Y і Z незалежно вибрані з групи, що включає H, O, S, NH і -(CH2)х-; 1 2 3 R , R і R незалежно вибрані з групи, що включає Н, алкіл, алкокси, арил, алкеніл, алкініл, атом галогену, галогензаміщений алкіл, алкіларил, арилалкіл, гетероцикл, арилалкокси, циклоалкіл, циклоалкеніл і циклоалкініл; o, p, q незалежно вибрані з 0 або 1; і x означає ціле число в діапазоні від 1 до 10. 149. Спосіб лікування пацієнта, що має захворювання, розлад або стан, що вимагає інгібування зв'язування опіоїду або опосередковується інгібуванням зв'язування опіоїду з рецепторами опіоїду пацієнта, який включає пероральне введення зазначеному пацієнту фармацевтично ефективної кількості щонайменше одного кон'югата гідрокодону і щонайменше однієї нікотинової кислоти, її похідного або їх комбінації. 150. Спосіб за пунктом 147, 148 або 149, де щонайменше один кон'югат оборотно інгібує зв'язування опіоїду з рецепторами опіоїду пацієнта. 151. Спосіб за пунктом 147, 148 або 149, де щонайменше один кон'югат оборотно інгібує зв'язування опіоїду з рецепторами опіоїду пацієнта, не роблячи при цьому пригнічувального впливу на ЦНС. 152. Спосіб за пунктом 147, 148 або 149, де щонайменше один кон'югат перешкоджає або знижує щонайменше один викликаючий запор побічний ефект самого гідрокодону. 153. Фармацевтичний набір реагентів, який включає: (і) визначену кількість індивідуальних дозувань в упаковці, що містять фармацевтично ефективну кількість щонайменше одного кон'югата гідрокодону і щонайменше однієї гетероарилкарбонової кислоти, її похідного або їх комбінації, де щонайменше одна гетероарилкарбонова кислота вибрана з формули II, формули III і формули IV, де формула II, формула III або формула IV мають наступні структури: 28
ДивитисяДодаткова інформація
Назва патенту англійськоюComposition based on conjugates of hydrocodone with benzoic acid, benzoic acid or heteroaryl carboxylic acid derivatives, prodrugs and method for treatment of abuses
Автори англійськоюMickle, Travis, Guenther, Sven, Mickle, Christal, Chi, Guochen, Kanski, Jaroslaw, Martin, Andrea K., Bera, Bindu
Назва патенту російськоюКомпозиция на основе коньюгата гидрокодона с бензольной кислотой, производными бензойной кислот или гетероарилкарбоновой кислотой, пролекарства, способ лечения от злоупотреблений
Автори російськоюМикл Тревис, Гюнтер Свен, Микл Кристел, Чи Гочень, Каньски Ярослав, Мартин Андреа К., Бера Бинду
МПК / Мітки
МПК: A61K 31/485, A61P 25/30, A61K 31/192
Мітки: гідрокодону, похідними, кислотою, лікування, кислоти, композиція, основі, гетероарилкарбоновою, бензойної, бензойною, кон'югату, проліки, зловживань, спосіб
Код посилання
<a href="https://ua.patents.su/48-102916-kompoziciya-na-osnovi-konyugatu-gidrokodonu-z-benzojjnoyu-kislotoyu-pokhidnimi-benzojjno-kisloti-abo-geteroarilkarbonovoyu-kislotoyu-proliki-sposib-likuvannya-vid-zlovzhivan.html" target="_blank" rel="follow" title="База патентів України">Композиція на основі кон’югату гідрокодону з бензойною кислотою, похідними бензойної кислоти або гетероарилкарбоновою кислотою, проліки, спосіб лікування від зловживань</a>
Попередній патент: Спосіб прокатки круглих профілів
Наступний патент: Пристрій для інтрамедулярного остеосинтезу поперекових, косих, багатоуламкових, невірно зрощених переломів та псевдоартрозів ключиці
Випадковий патент: Спосіб одержання ряжанкового продукту "пролісок" з пробіотичними властивостями












