Кон’югати димерів піроло[1,4]бензодіазепіну як протираковий засіб
Формула / Реферат
1. Сполука формули (І):
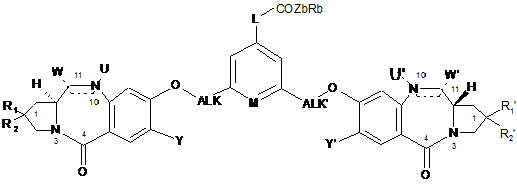 , (I)
, (I)
в якій:
![]() означає один простий зв'язок або один подвійний зв'язок, за умови, що, якщо
означає один простий зв'язок або один подвійний зв'язок, за умови, що, якщо ![]() означає простий зв'язок, тоді:
означає простий зв'язок, тоді:
![]() означає простий зв'язок;
означає простий зв'язок;
U і/або U', однакові або різні, означають, незалежно один від іншого, Н;
W і/або W', однакові або різні, означають, незалежно один від іншого: ОН, -OR, -OCOR, -COOR, -OCOOR, -OCONRR', циклічний карбамат, такий, в якому N10 і С11 включені в цикл, -NRCONRR', -OCSNHR, циклічний тіокарбамат, такий, в якому N10 і С11 включені в цикл, -SH, -SR, -SOR, -SOOR, -SO3-, -NRSOOR', -NRR', циклічний амін, такий, в якому N10 і С11 включені в цикл, -NROR', -NRCOR', -N3, -CN, Hal, групу триалкілфосфонію або триарилфосфонію;
R1, R2, R1', R2', однакові або різні, означають, незалежно один від іншого: Н, Hal або (С1-С6)алкіл, необов'язково заміщений одним або декількома замісниками, вибраними з Hal, CN, NRR', CF3, OR, арилу або гетероарилу, S(O)qR, де q=0, 1 або 2;
або
R1 і R2 і/або R1', R2' разом утворюють відповідно подвійний зв'язок =СН2 або =СН-СН3;
Y і Y', однакові або різні, означають, незалежно один від іншого, Н або OR;
М означає СН або N;
ALK і ALK', однакові або різні, означають, незалежно один від іншого, (С1-С6)алкіленову групу;
R і R', означають, незалежно один від іншого, Н або (С1-С6)алкіл- або арилгрупу, необов'язково заміщену одним або декількома замісниками, вибраними з Hal, CN, NRR', CF3, OR, арилу або гетероарилу,
L означає:
групу -L1-L2-, в якій L1 зв'язаний з ароматичним циклом, що містить М, через групу ALK або OALK і означає одну з наступних груп:
-ALK-S-,
 ,
,
![]() ,
,
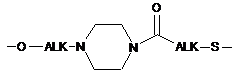 ,
,
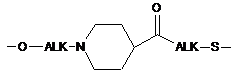 ,
,
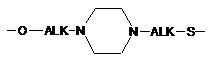 ,
,
і L2 означає групу -CH2C(=O)-NR3-(CH2CH2O)i-ALK-, зв'язану з L1 через -СН2С(=О)-,
або
групу -O-ALK-NR3-ALK-S-(CH2CH2O)i-ALK-, зв'язану з ароматичним циклом, що містить М, через групу OALK,
R3 означає Н або (С1-С6)алкіл;
і означає ціле число від 1 до 40, більш конкретно від 1 до 20, переважно від 1 до 10;
Zb означає простий зв'язок, -О- або -NH-, Rb означає Н або (С1-С6)алкіл, (С3-С7)циклоалкіл, арил, гетероарил або (С3-С7)гетероциклоалкіл, або Zb означає простий зв'язок і Rb означає Hal.
2. Сполука за п. 1 формули:
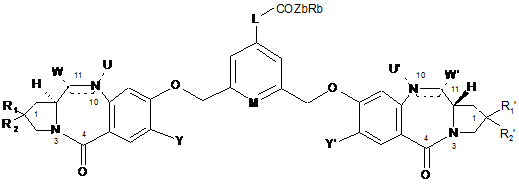 .
.
3. Сполука за п. 1 формули (ІА) або (IB):
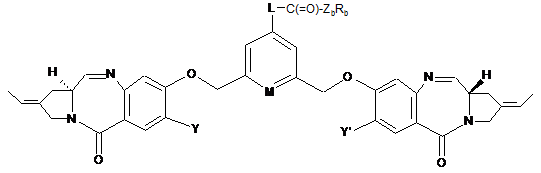 , (IA)
, (IA)
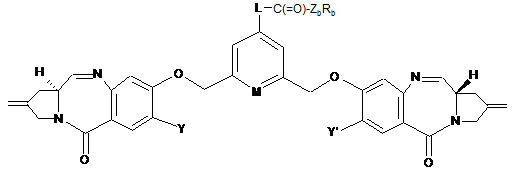 . (IB)
. (IB)
4. Сполука за будь-яким з пп. 1-3, в якій Y і Y' означають (С1-С4)алкокси, більш конкретно метоксигрупу.
5. Сполука за будь-яким з пп. 1-4, в якій L вибраний з:
-ALK-S-CH2C(=O)-NH-(CH2CH2O)i-CH2CH2-;
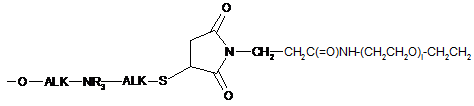 ;
;
-O-ALK-NR3-ALK-S-CH2C(=O)-NH-(CH2CH2O)i-CH2CH2-;
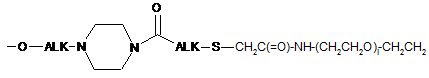 ;
;
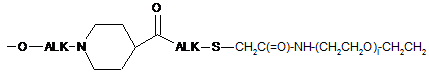 ;
;
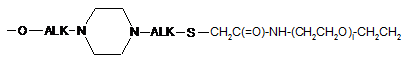 ;
;
-O-ALK-NR3-ALK-S-(CH2CH2O)i-CH2CH2-.
6. Сполука за п. 1 або 5, в якій L вибраний з:
 ;
;
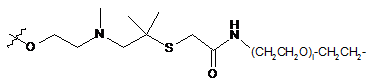 ;
;
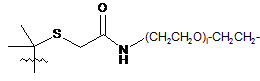 ;
;  ;
;
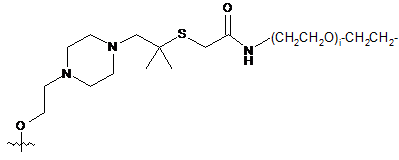 ;
;
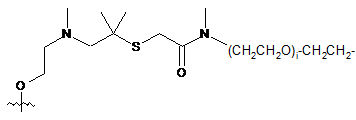 ;
;
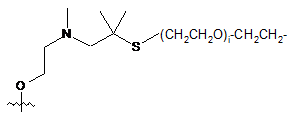 .
.
7. Сполука за п. 1 або 5, в якій L вибраний з:
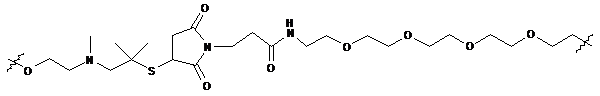 ,
,
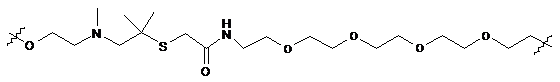 ,
,
 ,
,
 ,
,
 ,
,
 ,
,
 .
.
8. Сполука за будь-яким з пп. 1-7, в якій -COZbRb означає -СООН, -СОО(С1-С6)алкіл, -СООСН3, -СООСН2СН=СН2, 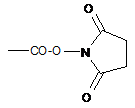 або
або 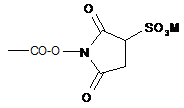 , М=Н або катіон,
, М=Н або катіон, 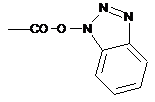 , або групу
, або групу 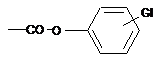 , в якій GI означає щонайменше одну електроноакцепторну групу, більш конкретно
, в якій GI означає щонайменше одну електроноакцепторну групу, більш конкретно 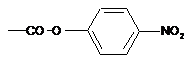 або
або  , або
, або 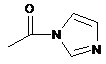 .
.
9. Сполука за п. 1, вибрана з групи наступних сполук:
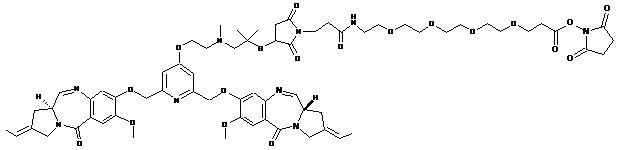 ,
,
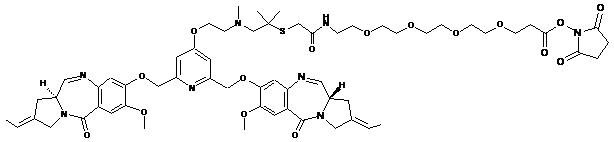 ,
,
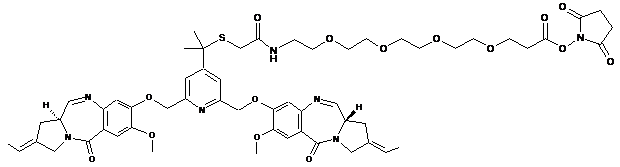 ,
,
 ,
,
 .
.
10. Спосіб одержання кон'югата, який полягає в тому, що:
(і) вводять в контакт і піддають взаємодії водний розчин агента клітинного зв'язування, необов'язково забуферений, і розчин сполуки за одним з пп. 1-9;
(іі) потім необов'язково відділяють кон'югат, утворений на стадії (і), від сполуки формули (І), що не прореагувала, і/або від агента клітинного зв'язування, що не прореагував, і/або від агрегатів, що можливо утворилися.
11. Спосіб за п. 10, в якому група -C(=O)ZbRb має реакційну здатність відносно хімічних груп, наявних в агенті клітинного зв'язування, зокрема аміногруп, в антитілі, яка забезпечує зв'язування сполуки формули (І) з агентом клітинного зв'язування за рахунок утворення ковалентного зв'язку.
12. Спосіб за п. 10 або 11, в якому стадія (іі) полягає в тому, що:
- відділяють кон'югат, утворений на стадії (і), від агента клітинного зв'язування, що не прореагував, і від агрегатів, що необов'язково знаходяться в розчині; або
- відділяють кон'югат, утворений на стадії (і), тільки від сполуки формули (І), що не прореагувала, і від агрегатів, що можливо сформувалися, і залишають в розчині агент клітинного зв'язування, що можливо не прореагував.
13. Спосіб за будь-яким з пп. 10-12, в якому агент клітинного зв'язування являє собою ліганд, білок, антитіло, більш конкретно моноклональне антитіло, фрагмент білка або антитіла, пептид, олігонуклеотид або олігосахарид.
14. Спосіб за пп. 10-13, в якому реакцію здійснюють при температурі між 20 і 40 °C і/або в якому тривалість реакції варіюється між 1 і 24 годинами.
15. Спосіб за будь-яким з пп. 10-14, в якому після стадії (і) або (іі) розчин кон'югата спрямовують на стадію (ііі) ультрафільтрації і/або діафільтрації.
16. Кон'югат, одержаний способом за будь-яким з пп. 10-15.
17. Кон'югат за п. 16, в якому агент клітинного зв'язування являє собою антитіло, переважно моноклональне, що відрізняється середнім значенням DAR між 1 і 10, переважно між 1,5 і 7;
причому DAR розрахований по рівнянню DAR=cD/cA, в якому:
cD=[(eА LO1×АLО2)-(eА LО2×АLО1)]/[(eD LO2×eА LO1)-(eA LO2×eD LO1)],
cА=[АLО1-(cD×eD LO1)]/eA LO1,
де АLО1 і АLО2 означають величини поглинання водного розчину кон'югата при довжинах хвиль LO1 і LO2, виміряні при відповідному піку спектра SEC;
eD LO1 і eD LO2 означають молярні коефіцієнти поглинання димеру піроло[1,4]бензодіазепіну перед кон'югуванням відповідно при двох довжинах хвиль LO1 і LO2;
eА LO1 і eА LО2 означають молярні коефіцієнти поглинання вільного антитіла відповідно при двох довжинах хвиль LO1 і LO2,
LO1=280 нм і LO2=320 нм.
18. Застосування сполуки за будь-яким з пп. 1-9 для одержання агента клітинного зв'язування, до якого ковалентно приєднаний в пара-положенні до М димер формули:
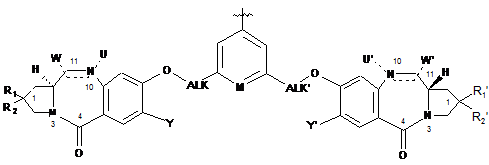 .
.
19. Застосування за п. 18, в якому агент клітинного зв'язування являє собою антитіло, переважно моноклональне.
20. Застосування за п. 18 або 19, в якому димер має формулу:
 ,
,
 .
.
21. Застосування за будь-яким з пп. 18-20, в якому Y і Y1 означають (С1-С4)алкоксигрупу, більш конкретно метоксигрупу.
22. Агент клітинного зв'язування, до якого ковалентно приєднаний в пара-положенні до М димер формули
 ,
,
після взаємодії сполуки за будь-яким з пп. 1-9 з агентом клітинного зв'язування.
23. Агент клітинного зв'язування за п. 22, в якому димер є таким, як він визначений в одному з пп. 20 або 21.
24. Агент клітинного зв'язування за п. 23, який має спорідненість до антигену або групи антигенів, локалізованих на ракових клітинах або стромальних клітинах, асоційованих з пухлиною.
25. Агент клітинного зв'язування за будь-яким з п. 22-24, який являє собою антитіло, переважно моноклональне.
26. Розчин кон'югата, одержаний згідно зі способом за одним з пп. 10-15.
27. Сполука за одним з пп. 1-9 для застосування як протиракового засобу.
28. Кон'югат за п. 16 або 17 для застосування як протиракового засобу.
29. Фармацевтична композиція, яка містить сполуку за будь-яким з пп. 1-9 або кон'югат за п. 16 або 17, а також щонайменше один ексципієнт.
30. Застосування сполуки формули Р2
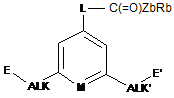
або сполуки формули
 ,
,
в якій L* вибраний з формул:
-ALK-SH;
-O-ALK-NR3-ALK-SH;
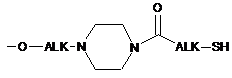 ,
,
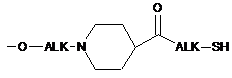 ,
,
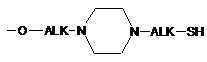 ,
,
в яких:
L, М, ALK, ALK', R3, Zb і Rb є такими, як визначено в одному з пп. 1-9;
Е і Е' означають незалежно один від іншого групу -ОН або відхідну групу;
як проміжної сполуки для одержання сполуки формули (І) за будь-яким з пп. 1-9.
31. Застосування за п. 30, в якому відхідна група вибрана з атома галогену, мезилатної, тозилатної, нозилатної групи або групи -OPPh3+.
32. Застосування сполуки, вибраної з групи наступних сполук:
 ,
,  ,
,  ,
,
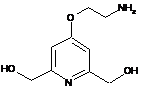 ,
, 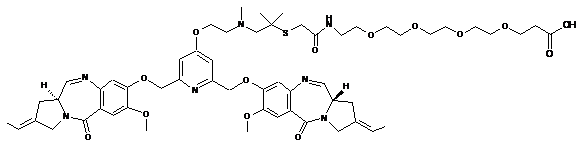 ,
,
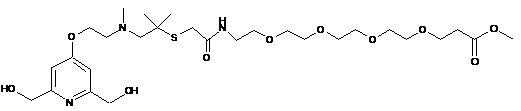 ,
, 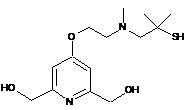 ,
,  ,
,
 ,
,
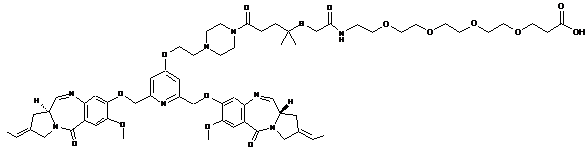 ,
,
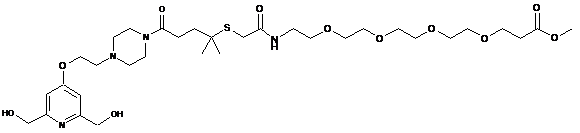 ,
,
 ,
,  ,
,  ,
,  ,
,
 ,
,
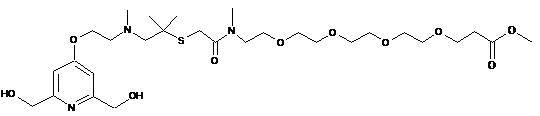 ,
,
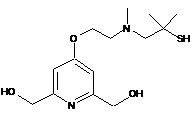 ,
,
за умови, що кінцева функціональна група -СООН може бути замінена на кінцеву функціональну групу -СОО(С1-С6)алкіл, зокрема -СООМе, а кінцева функціональна група -SH може бути замінена на кінцеву функціональну дисульфідну групу, зокрема -SSMe,
як проміжної сполуки для одержання сполуки формули (І) за будь-яким з пп. 1-9.
33. Застосування сполуки за будь-яким з пп. 1-9 для одержання протиракового засобу.
34. Застосування кон'югата за п. 16 або 17 для одержання протиракового засобу.
Текст
Реферат: Винахід стосується нових кон'югатів димерів піроло[1,4]бензодіазепіну (І), які можуть бути використані як протиракові засоби. L H R1 R2 W 11 COZbRb U N U' O ALK 10 1 O M 10 N W' 11 H ALK' 1 N 3 4 O Y Y' 4 O N 3 R1' R2' (I) UA 106507 C2 (12) UA 106507 C2 UA 106507 C2 5 10 15 20 25 30 35 40 45 Даний винахід стосується кон’югатів димерів піроло[1,4]бензодіазепіну (PBD), композицій на їх основі і їх терапевтичного застосування, зокрема як протиракового засобу. Винахід стосується також способу одержання кон’югатів, призначених для застосування як протиракового засобу, а також самих димерів. Галузь техніки Піроло[1,4]бензодіазепінові димери є протираковими агентами, які діють тоді, коли вони ковалентно зв'язуються з ДНК клітин. Ці похідні описані в міжнародних заявках WO 00/12508 і WO 2005/085260, а також в наступних публікаціях: Eur. J. Med. Chem. 2005, 40, 641-654; Tetrahedron Letters 1988, 29(40), 5105-5108. Хімія кон’югатів вивчається протягом декількох останніх років і була застосована для вивчення деяких сімейств цитотоксичних сполук, таких як, наприклад, майтансиноїди (WO 04103272), таксани (WO 06061258), лептоміцини (WO 07144709), СС-1065 і його аналоги (WO 2007102069); див. також про кон’юговані сполуки: Monneret С. et al., Bulletin du Cancer, 2000, 87(11), 829-38; Ricart A.D. et al., Nature Clinical Practice Oncology 2007, 4, 245-255; Singh R. et Rickson H.K., Therapeutic Antibodies: Methods and Protocls, 2009, 525, 445-467. Рівень техніки Кон’югати піроло[1,4]бензодіазепінових димерів були описані в міжнародних заявках WO 07085930 і WO 2009/016516. Більш конкретно, використовуваними димерами є димери формул: в яких Т може означати арил або гетероарил, заміщений групою -G-D-(Z)p-SZa або -G-D-(Z)pC(=O)ZbRb. G означає простий або подвійний зв'язок або -О-, -S- або -NR-. D означає простий зв'язок або одну з наступних груп: -E-, -E-NR-, -E-NR-F-, -E-O-, -E-O-F-, -E-NR-CO-, -E-NR-CO-F-, -E-CO-, -CO-E-, -E-CO-F-, -E-S-, -E-S-F-, -E-NR-CS-, -E-NR-CS-F-, в яких Е і F вибрані з (ОСН2СН2)iалкіл(ОСН2СН2)j-, -алкіл(ОСН2СН2)i-алкілу-, -(ОСН2СН2)i-, (ОСН2СН2)iциклоалкіл(ОСН2СН2)j-, -(ОСН2СН2)iгетероцикліл(ОСН2СН2)j-, -(ОСН2СН2)iарил(ОСН2СН2)j-, -(ОСН2СН2)iгетероарил(ОСН2СН2)j-, -алкіл(ОСН2СН2)iалкіл(ОСН2СН2)j-, -алкіл-(ОСН2СН2)i-, алкіл(ОСН2СН2)iциклоалкіл(ОСН2СН2)j-, -алкіл(ОСН2СН2)iгетероцикліл(ОСН2СН2)j-, алкіл(ОСН2СН2)iарил(ОСН2СН2)j-, -алкіл(ОСН2СН2)iгетероарил(ОСН2СН2)j-, -циклоалкілалкілу-, алкілциклоалкілу-, -гетероциклілалкілу-, -алкілгетероциклілу-, -алкіларилу-, -арилалкілу-, алкілгетероарилу-, -гетероарилалкілу-. Символи i і j означають цілі числа від 0 до 2000. Z означає алкіл і р означає ціле число 0 або 1. Група L2=-CH2C(=O)NR3-(CH2CH2O)i-ALK-, яка характеризує деякі сполуки даного винаходу, включає амідну ланку (-CONR3-) і в заявках WO 07085930 WO і 2009/016516 вона може відповідати тільки ланці -E-CONR-F-, де Е=алкіл і F=-(CH2CH2O)i-алкіл-. Однак група L1, яка зв'язувалася б з фенільним або піридинільним циклом, а також сполучалася б з L2, не описана і не передбачена в цих двох заявках. Дійсно, вона могла б відповідати тільки ланці G. Але ланка G може являти собою тільки зв'язок (простій, подвійний, потрійний) або означати -О-, -S - або NR-. Якщо говорити про інші сполуки даної заявки, які характеризуються лінкером -O-ALK-NR3ALK-S-(CH2CH2O)i-ALK-, то в заявках WO 07085930 або WO 2009/016516 жодне із значень D не передбачає комбінацію аміногрупи NR3 і -S-зв'язку. Так, в заявці 2009/016516 описані наступні димери: але жоден з цих димерів не містить лінкер, аналогічний лінкерам, описаним в даному винаході (зокрема, відсутня ланка -ALK-S-). Таким чином, обидві заявки WO 07085930 WO і 2009/016516 не описують і не передбачають одержання сполук згідно з даним винаходом. 1 UA 106507 C2 5 10 15 20 25 30 35 40 45 50 55 Технічна задача Технічна задача, яку пропонує вирішити даний винахід, полягає в розробці нових кон’югатів димерів піроло[1,4]бензодіазепіну. Визначення У рамках даної заявки використовують наступні визначення: - Кон’югат: агент клітинного зв’язування, з яким ковалентно сполучена щонайменше одна молекула цитотоксичної сполуки. - Агент клітинного зв’язування (або англійською "cell binding agent"): молекула, що має спорідненість до біологічної мішені, це може бути, наприклад, ліганд, білок, антитіло, більш конкретно моноклональне, фрагмент білка або антитіла, пептид, олігонуклеотид, олігосахарид. Функція агента клітинного зв’язування полягає в тому, щоб направляти біологічно активну сполуку, таку як цитотоксична сполука, до біологічної мішені. - Біологічна мішень: антиген (або група антигенів), локалізований переважно на поверхні ракових або стромальних клітин, асоційованих з цією пухлиною; цими антигенами можуть бути, наприклад, рецептор фактора росту, онкогенний продукт або мутований ген-"супрессор пухлини", молекула, зв'язана з ангіогенезом, адгезивна молекула. - Алкільна група: аліфатична насичена вуглеводнева група, одержувана видаленням атома водню з алкану. Алкільна група може бути лінійною або розгалуженою. Як приклад можна назвати групи: метил, етил, пропіл, ізопропіл, бутил, ізобутил, трет-бутил, пентил, 2,2диметилпропіл, гексил. - Циклоалкільна група: циклічна алкільна група, що містить 3-8 атомів вуглецю, вбудованих в циклічну структуру. Як приклади можна назвати групи: циклопропіл, циклобутил, циклопентил, циклогексил. - Арильна група: ароматична група, що не містить гетероатом, моно- або біциклічна. Більш конкретно, мова йде про феніл і нафтил. - Гетероарильна група: ароматична група, що містить щонайменше один гетероатом (О, S, N), в циклі і зв'язаний з атомами вуглецю, що утворюють моно- або біциклічну систему. Більш конкретно, мова йде про групи: піридиніл, піроліл, тієніл, фураніл, піримідиніл, триазоліл. - Гетероциклоалкільна група: циклоалкільна група, що містить щонайменше один гетероатом (О, S, N), в циклі і зв'язаний з атомами вуглецю, що утворюють цикл. - Алкоксигрупа: О-алкільна група, в якій алкільна група така, як визначена вище. - Алканоїлоксигрупа: група -О-СО-алкіл, в якій алкільна група така, як визначена вище. - Алкіленова група: двовалентна насичена група брутто-формули -CmH2m-, одержувана видаленням двох атомів водню з алкану. Алкан може бути лінійним або розгалуженим. Як приклад можна назвати групи: метилен (-СН2-), етилен (-СН2СН2-), пропілен (-СН2СН2СН2-), бутилен (-СН2СН2СН2СН2-), ізобутилен ( ), гексилен (-СН2СН2СН2СН2СН2СН2-). Більш конкретно, лінійна алкіленова група може мати формулу -(CH2)m-, де m означає ціле число. - В діапазон величин включені граничні значення (наприклад, в діапазон типу "i має значення від 1 до 6" включені граничні значення 1 і 6). Використовувані скорочення AcOEt: етилацетат; ALK: (С1-С12)алкілен, більш конкретно (С1-С6)алкілен; ССМ: тонкошарова хроматографія (англійською TLC); DAR: Drug-Antibody Ratio (відношення лікарського засобу до антитіла); DBU: 1,8-діазабіцикло[5.4.0]ундец-7-ен; DCC: N,N'дициклогексилкарбодіімід; DCM: дихлорметан; DEAD: діетилазодикарбоксилат; DIC: N,N'діізопропілкарбодіімід; DIPEA: N,N-діізопропілетиламін; DMA: диметилацетамід; DMAP: 4диметиламінопіридин; DME: диметоксіетан; DMF: диметилформамід; ДМСО: диметилсульфоксид; ε: коефіцієнт молярної екстинкції; EEDQ: 2-етоксі-1-етоксикарбоніл-1,2дигідрохінолін; EDCI: N-(3-диметиламінопропіл)-N'-етилкарбодіімід; EDTA: етилендіамінтетраоцтова кислота; Fmoc: флуоренілметоксикарбоніл; GР: захисна група; Hal: атом галогену; HOBt: 1-гідроксибензотриазол; HEPES: 4-(2-гідроксіетил)-1піперазинетансульфонова кислота; LG: відхідна група; NHS: N-гідроксисукцинімід; NMP: Nметилпіролідинон; ЗТ: знижений тиск; Rf: коефіцієнт утримування; SEC: ексклюзійна стерична хроматографія; КТ: кімнатна температура; TBDMS: трет-бутилдиметилсиліл; ТЕА: триетиламін; TFA: трифтороцтова кислота; TIPS: триізопропілсиліл; ТHF: тетрагідрофуран; tR: час утримування. Креслення Фіг. 1: мас-спектр високого розрізнення кон’югата прикладу 1 після деглікозилування; Фіг. 2: мас-спектр високого розрізнення кон’югата прикладу 2 після деглікозилування; Фіг. 3: мас-спектр високого розрізнення кон’югата прикладу 3 після деглікозилування; 2 UA 106507 C2 5 10 15 20 25 30 Фіг. 4: мас-спектр високого розрізнення кон’югата прикладу 4 після деглікозилування; Фіг. 5: мас-спектр високого розрізнення неглікозилованого кон’югата прикладу 6. Ці креслення показують для кожного кон’югата, після розгортки спектрів, розподіл фрагментів, що несуть 0-8 димерів томайміцину (D0: жодного димеру; Dx: х димерів). Опис винаходу Винахід стосується сполук формули: , в якій: - ---- означає один простий зв'язок або один подвійний зв'язок, за умови, що, якщо ---означає простий зв'язок, тоді: * --- означає простий зв'язок; * U і/або U', однакові або різні, означає(ють) незалежно один від іншого Н; * W і/або W', однакові або різні, означає(ють) незалежно один від іншого: ОН, -OR, -OCOR, COOR, -OCOOR, -OCONRR', циклічний карбамат, такий, в якому N10 і C11 включені в цикл, NRCONRR', -OCSNHR, циклічний тіокарбамат, такий, в якому N10 і C11 включені в цикл, -SH, SR, -SOR, -SOOR, -SO3 , -NRSOOR', -NRR', циклічний амін, такий, в якому N10 і C11 включені в цикл, -NROR', -NRCOR', -N3, -CN, Hal, групу триалкілфосфонію або триарилфосфонію; - R1, R2, R1', R2', однакові або різні, означають, незалежно один від іншого: Н, Hal або (С1С6)алкіл, необов'язково заміщений одним або декількома замісником(ами), вибраним(и) з Hal, CN, NRR', CF3, OR, арилу або гетероарилу, S(O)qR, де q= 0, 1 або 2; або - R1 і R2 і/або R1' і R2' разом утворюють відповідно подвійний зв'язок =СН2 або =СН-СН3; - Y і Y', однакові або різні, означають, незалежно один від іншого, Н або OR; - М означає СН або N; - ALK і ALK', однакові або різні, означають, незалежно один від іншого, (С1-С6)алкіленову групу; - R і R', означають, незалежно один від іншого, Н або (С1-С6)алкіл- або арилгрупу, необов'язково заміщену одним або декількома замісником(ами), вибраним(и) з Hal, CN, NRR', CF3, OR, арилу або гетероарилу, - L означає: * групу -L1-L2-, в якій L1 зв'язаний з ароматичним циклом, що містить М, через групу ALK або OALK і означає одну з наступних груп: і L2 означає групу -CH2C(=O)-NR3-(CH2CH2O)i-ALK-, зв'язану з L1 через групу -СН2С(О)-; 3 UA 106507 C2 5 10 або * групу -O-ALK-NR3-ALK-S-(CH2CH2O)i-ALK-, зв'язану з ароматичним циклом, що містить М, через групу OALK, - R3 означає Н або (С1-С6)алкіл; - i означає ціле число від 1 до 40, більш конкретно від 1 до 20, переважно від 1 до 10; - Zb означає простий зв'язок, -О- або -NH- і Rb означає Н або (С1-С6)алкіл, (С3-С7)циклоалкіл, арил, гетероарил або (С3-С7)гетероциклоалкіл, або Zb означає простий зв'язок і Rb означає Hal. Сполуки формули (I), в тому числі сполуки згідно з прикладами, можуть існувати у формі основ або адитивних солей з фармацевтично прийнятними кислотами або у формі гідратів або сольватів цих основ або цих кислот. Більш конкретно, дві групи ALK і ALK', зв'язані з фенільним або піридинільним кільцем, обидві означають метиленову групу: . Більш конкретно, серед сполук формули (I) виділяють сполуки формули (IA) або (IB): 15 20 , де Y і Y' означають, більш конкретно, (С1-С4)алкоксигрупу, зокрема метоксигрупу. Більш конкретно, R і R' можуть означати, незалежно один від іншого, Н або (С1-С6)алкіл. Згідно з конкретним варіантом, U=U' і/або W=W', і/або R1=R1', і/або R2=R2', і/або Y=Y', і/або дві групи ALK і ALK', зв'язані з фенільним або піридинільним кільцем, є однаковими. Більш конкретно, L може мати одне з наступних значень: , 25 . У перерахованих значеннях ALK означає, більш конкретно, (С1-С4)алкілен. Зокрема, ALK може мати одне з наступних значень: -СН2СН2-, -СН2СМе2-, -СН2СН2СМе2-. L може також мати одне із значень, описаних в представленій нижче Таблиці I або Таблиці II. i означає ціле число від 1 до 40, більш конкретно від 1 до 20, переважно від 1 до 10. i може приймати кожне із значень від 1 до 40, зокрема i може означати 3, 4, 5, 7, 8, 9 або 10. 4 UA 106507 C2 У Таблиці I надані приклади представницьких сполук формули (IA). Кожна сполука цієї таблиці може існувати у формі, при якій М=СН (бензол) або М=N (піридин). Сполуки, в яких M=N, більш розчинні у воді. 5 5 UA 106507 C2 5 10 Сполуки згідно з винаходом включають хімічну групу C(=O)ZbRb (GCR1), що має реакційну здатність відносно іншої реакційної хімічної групи (GCR2), що знаходиться в агенті клітинного зв’язування. Взаємодія між групами GCR1 і GCR2 забезпечує зв’язування сполуки з агентом клітинного зв’язування за рахунок утворення ковалентного зв'язку. Таким чином, сполука здатна утворювати кон’югат з агентом клітинного зв’язування. Більш конкретно, якщо Zb означає О, тоді GCR1 являє собою кислотну (Rb=Н) або складноефірну функціональну групу. Більш конкретно, -C(=O)ZbRb являє собою -СООН, -СОО(С1-С6)алкіл, зокрема -СООСН3 або СООСН2СН=СН2. Зі складноефірних функціональних груп переважними є складні ефіри, звані "активованими", які мають високу реакційну здатність відносно груп GCR2, зокрема аміногруп, що знаходяться на антитілах. Прикладами активованих складноефірних груп є наступні: , М=Н або катіон, або група , в якій GI означає щонайменше одну електроноакцепторну групу, таку як -NO2 або -Hal, зокрема -F. Мова 15 20 25 30 може йти, наприклад, про наступні групи: або . Іншим типом групи C(=O)ZbRb є наступна: . Як приклад GCR2 можна назвати ε-аміногрупи лізинів, що знаходяться на бічних ланцюгах лізинових залишків, які наявні на поверхні антитіла, сахаридні групи з'єднувальної ланки або тіольні групи цистеїнів, що утворюються відновленням дисульфідних міжланцюжкових зв'язків (Garnett M.C. et al., Advanced Drug Delivery Reviews 2001, 53, 171-216). Останнім часом розглянуті і інші підходи, такі як введення цистеїнів шляхом мутації (Junutula J.R. et al., Nature Biotechnology 2008, 26, 925-932; WO 09026274) або введення амінокислот неприродного походження, що дозволяють утворити інші типи хімічних зв'язків (Graaf A.J. et al., Bioconjugate Chem. 2009, лютий, 3, 2009 (Review); DOI: 10.1021/bc800294a; WO 2006/069246 і згідно з Chin J.W. et al., JACS 2002, 124, 9026-9027 (метод ReCode®)). Всі ці варіанти, використовувані для зв’язування з антитілами, можна застосовувати до всіх відомих агентів клітинного зв’язування залежно від їх структури. Таким чином, сполуки згідно з винаходом можуть бути використані для одержання агента клітинного зв’язування, до якого ковалентно приєднаний в пара-положенні до М димер формули: . Більш конкретно, агентом клітинного зв’язування є антитіло. Димер, більш конкретно, має формулу: 6 UA 106507 C2 , . Спосіб одержання сполук формули (I) Сполуки формули (I) можуть бути одержані згідно зі Схемою 1: 5 Схема 1 Групу сполук Р1, Р'1 і Р2 піддають взаємодії для одержання Р3. Групи LG і LG' означають відхідну групу. L3 може означати групу -L-C(=O)ZbRb, тоді в цьому випадку Р3 означає сполуку формули (I). У випадку, коли Р3 не є групою - L-C(=O)ZbRb, тоді необхідно перетворити L3 в групу -L-C(=O)ZbRb за допомогою однієї або декількох реакцій. 10 Наприклад, у випадку, коли , то можна ввести кінцеву групу L3 за допомогою групи -C(=O)ZbRb=-C(=O)O-(C1-C4)алкіл або -C(=О)О-аліл, яку потім перетворюють в групу -C(=О)ОН, яку, на закінчення, піддають взаємодії з N,N'-дисукцинімідилкарбонатом або з NHS. Перетворення -СООалкіл/аліл в -СООН може бути здійснене обробкою гідроксидом літію. Особливо доцільно використовувати, зокрема, метиловий ефір. Взаємодію з N,N'дисукцинімідилкарбонатом проводять в присутності основи, наприклад DIPEA; взаємодію з NHS проводять в присутності сполучного агента, наприклад DCC. Таким же чином, у випадку, коли 15 20 25 30 , можна ввести групу -C(=O)ZbRb=-СООН, яку потім піддати взаємодії з N,N'-карбонілдіімідазолом (JACS 1958, 80, 4423; JACS 1960, 82, 4596). Сполуки P1 і P'1 описуються в міжнародних заявках WO 00/12508, WO 00/12507, WO 2005/040170, WO 2005/085260, WO 07085930 або WO 2009/016516 або їх можна одержати шляхом загального синтезу (Mori M. et al., Tetrahedron, 1986, 42, 3793-3806). У випадку, коли P1 і/або P'1 означає(ють) томайміцин формули: , Томайміцин то цей томайміцин може бути одержаний за допомогою штаму Streptomyces croceus, згідно з інформацією, викладеною в патенті FR 1516743, або шляхом загального синтезу (див. J.Antibiotics 1983, ХХХVI(3), 276-282 Z.Tozuka "Studies on tomaymycin. Total syntheses of the antitumor antibiotics Е- and Z-tomaymycins"). Існують також комерційно доступні сполуки P1/P'1. Для введення груп W/W' потрібно використовувати імінофункцію (---- означає подвійний зв'язок), здатну приєднувати різні сполуки HW/HW' (наприклад, Н2О, спирт ROH). Про сполуки формули Р2 Ці сполуки мають формулу: 7 UA 106507 C2 5 , в якій: L, M, ALK, ALK’, Zb і Rb мають значення, вказані вище; Е і E' означають, незалежно один від іншого, групу -ОН або відхідну групу. Більш конкретно, L може мати одне із значень, описаних на Схемах 2, 2', 3, 3', 3", 4, 5, 5', 6, 6', 6", 7. Виділяють також проміжні сполуки формули: в якій L* вибирають з: -ALK-SH; -O-ALK-NR3-ALK-SH; 10 15 . У даному винаході під "відхідною групою" мають на увазі атом або групу атомів, що в гетеролітичній реакції між сполуками Р2 і Р1 або P'1 видаляють, яка несе електронну пару ковалентного зв'язку, що з'єднує ALK і LG або LG'. Більш конкретно, відхідну групу вибирають з атома галогену, зокрема з хлору або брому, мезилатної, тозилатної, нозилатної групи або + групи -OPPh3 . На інших представлених нижче Схемах використовують для спрощення наступні скорочення: , 20 Схема 2 Одержання Р2 Р2 одержують з відповідного галогенованого додержуючись вказівок прикладу 3 (Схема 2'): 8 діолу формули , UA 106507 C2 5 10 15 20 25 30 35 Схема 2' i) захист двох спиртових груп за допомогою захисної групи, такої як, наприклад, третбутилдиметилсилілокси (TBS); ii) одержання відповідної літійорганічної або магнійорганічної сполуки за допомогою, відповідно, н-BuLi або магнію; iii) нуклеофільне приєднання до кетону з одержанням спиртової групи; iv) одержання тіолу за допомогою утворення відповідного тіоацетату (див. приклади 3.7 і 3.8); v) зняття захисту; vi) введення груп LG і LG'. У випадку мезилатної групи використовують метансульфонілхлорид в присутності основи, такої як третинний амін (наприклад, ТЕА або DIPEA); див. приклад 1.4. Прикладом відповідного галогенованого діолу і захищеного діолу є діол, описаний на Схемі 1, стор. 48 заявки WO 2009/016516 (сполуки 2 і 3 Схеми 1). Двома прикладами захищених діолів служать діоли № CAS 181225-40-1 і 181225-41-2. Галогенований діол може бути одержаний відновленням сполуки, що являє собою відповідну дикислоту або відповідний складний діефір, наприклад сполуку № CAS 193010-40-1. У випадку піридину (М=N) див. також: Liebigs Annalen der Chemie 1991, 10, 987-988 Tetrahedron 2005, 61(7), 1755-1763 (сполука 3 Схеми 1). Одержання Р4 у випадку, коли ALK=СН2СН2 у випадку, коли R3=Н Стадія (i): утворення аміду і активація кислоти; два етапи здійснюють послідовно в полярному апротонному розчиннику, такому як DCM: реакція між амінофункцією і Nгідроксисукцинімідилгалогенацетатом з подальшим додаванням in situ сполучного агента, такого як DIC; у випадку, коли R3≠H Стадія (ii): захист карбонової кислоти у формі метилового ефіру і аміну у формі трифторацетаміду; реакцію здійснюють в два послідовних етапи в полярному апротонному розчиннику, такому як DCM: захист кислотної групи відбувається шляхом обробки триметилсилілдіазометаном в присутності метанолу, потім здійснюють захист аміну додаванням трифтороцтового ангідриду і основи, такої як TEA. Стадія (iii): алкілування аміну і омилювання складного ефіру; реакцію проводять в два послідовних етапи в полярному апротонному безводному розчиннику, такому як THF: алкілують амін обробкою основою, такою як NaH, в присутності реагенту, щонесе нуклеофугну групу, такого як алкілгалогенід R3Hal, потім додають гідроксид літію і воду. 9 UA 106507 C2 Стадія (i): продовження стадії (iii), повторюють реакції стадії (i) у випадку, коли R3=Н; у випадку, коли ALK≠СН2СН2 у випадку, коли R3=Н 5 10 15 20 25 , у випадку, коли R3≠H . Стадія (iv): елонгація ПЕГ-ланцюга; реакцію проводять в полярному апротонному безводному розчиннику, такому як THF або DMF, шляхом обробки галогенованого складного ефіру алкоголятом бензофенонімін-ПЕГ-спирту, що генерується під дією NaH або нафталеніду калію, як описано в заявці WO 2007/127440. Стадія (v): вибірне відщеплення іміну шляхом гідрування в присутності паладію на вугіллі, згідно Wessjohann L. et al., Synthesis 1989, 5, 359-63. Стадія (vi): захист аміну додаванням трифтороцтового ангідриду і основи, такої як ТЕА. Аміно-ПЕГ-спирти є комерційно доступними продуктами, для, наприклад, i=3,4,7,8, або можуть бути одержані з ПЕГ-діолів, комерційно доступних для i=3-12, відповідно до процедури, описаної в патенті US 7230101. Захист аміногрупи за допомогою бензофенону може бути здійснений шляхом азеотропного дегідратування в присутності кислоти Льюїса, такої як ефірат BF3. Схема 3 Одержання Р2 Схема 3' i) реакція нуклеофільного заміщення між однією з функціональних ОН-груп (дві інші захищені за допомогою GP і GP', які означають захисні групи) і бромаміновою кислотою, захищеною boc, формули Br-ALK-NHboc в присутності основи, такої як, наприклад, K2СО3, в полярному розчиннику, такому як DMF, THF або MeCN (див. наприклад, умови на с. 63 заявки WO 07085930). 10 UA 106507 C2 Відповідно до варіанта можна здійснити нуклеофільне заміщення в молекулі бромамінової 5 10 15 20 25 30 35 кислоти за допомогою гідроксидіефіру формули: , потім відновити складноефірну функціональну групу до -СН2ОН-групи, наприклад, за допомогою боргідриду натрію; для цього можна застосувати умови нуклеофільного заміщення і відновлення, описані на с. 62-63 заявки WO 2007/085930; ii) зняття захисних груп; iii) відновне амінування за допомогою альдегіду формули HC(=О)-ALK-SSMe в присутності ізопропоксиду титану; реакцію здійснюють при кімнатній температурі в полярному апротонному безводному розчиннику, такому як THF; iv) утворення проміжного комплексу, який відновлюють in situ відновним агентом, таким як, наприклад, ціанборгідрид натрію; v) введення груп LG і LG'. У випадку введення мезилатної групи використовують метансульфонілхлорид в присутності основи, такої як третинний амін (наприклад, ТЕА); див. приклад 1.4. Варіант, зображений на Схемі 3", полягає у введенні групи -ALK-SSMe в групу NHboc, основуючись, зокрема, на способі, описаному Kitagawa T. et al. JACS, 2006, 128(45), 1444814449, який був використаний для приєднання ацетилтіоалкільних ланцюгів до вторинного аміну: Схема 3" Згідно з цим варіантом проводять алкілування за допомогою проміжної сполуки Hal-ALKSCOMe (Hal=I, наприклад), а потім вивільняють тіол обробкою в лужному середовищі; vi) алкілування алкілгалогенідом, що несе тіоацетильну групу, в присутності карбонату цезію в полярному апротонному розчиннику, такому як DMF; vii) вибірне відщеплення ацетильної групи в слабколужному середовищі; viii) утворення груп -SSMe шляхом взаємодії проміжного тіолу з MeSSO2Me; ix) відщеплення захисних групу GP і GP'; х) перетворення гідроксильних груп в нуклеофугні групи LG/LG', переважно мезилатні групи. Схема 3''' Введення групи R3=(C1-C4)алкіл в групу NH можливе на різних стадіях синтезу (один приклад якого зображений на Схемі 3'''). Цю операцію здійснюють, наприклад, за допомогою реакції Валлаха, в якій використовується альдегід (див. приклад 1.5, в якому при алкілуванні NHNMe бере участь формальдегід). Про сполуку Р5 Компанії Thermo Fisher Scientific, Rockford, IL. 61105, США, Jenkem Technology USA Inc., 2033, W.McDermott Dr., Allen Tx 75013-4675, США і Quanta BioDesign, Ltd.195, West Olentangy Street, Suite O, Powll, Оhio 43065-8720, CША випускають на ринок сполуки загальної формули 11 UA 106507 C2 , називані NHS-ПЕГ-малеімідом. Більш конкретно, мова йде про сполуку № CAS 756525-99-2. Приєднання тіолу до малеімідної ланки описується на с. 721 "Bioconjugate Techniques", Greg Т. Hermanson, 2-е видання, Elsevier Inc. (isbn-13: 978-0-12-370501-3; isbn-10:0-12-370501-0). 5 10 15 Схема 4 Спосіб одержання близький до способу, описаного на Схемі 3, за умови заміни Р5 на Р4. Варіант, описаний на Схемі 4', відповідає способу одержання, який близький до способу одержання, описаного на Схемах 2 і 2': Схема 4' i) зняття захисту шляхом відновлення дисульфіду Схема 5 Приготування Р2 Використовують сполуку Р2 формули: Схемою 5', представленою нижче: , яку одержують згідно зі 12 UA 106507 C2 5 10 15 20 Схема 5' i) алкілування гідроксильної групи в ароматичному циклі за допомогою піперазину, який монозахищений в положенні 1 і несе в положенні 4 алкільний ланцюг, функціоналізований в кінцевому положенні нуклеофугною групою LG. Переважно, нуклефугною групою є мезилатна група, а реакція Вільямсона протікає в присутності гідриду в полярному апротонному безводному розчиннику, такому як THF або DMF; ii) зняття захисних груп boc, GP і GP', переважно, в кислому середовищі, наприклад в присутності соляної кислоти або TFA, якщо групи GP і GP' являють собою TBDMS. Згідно з одним з варіантів здійснення стадій i) і ii) можна здійснити нуклеофільне заміщення в молекулі бромамінової кислоти за допомогою гідроксидіефіру формули: , потім відновити складноефірну функцію до функції -СН2ОН, наприклад, боргідридом натрію; для цього можуть бути використані умови нуклеофільного заміщення і відновлення, описані на с. 62-63 заявки WO 2007/085930; iii) реакція сполучення, здійснювана після первинної активації кислоти у формі складного ефіру NHS; iv) введення відхідних груп LG і LG'. У випадку введення мезилатної групи використовують метансульфонілхлорид в присутності основи, такої як третинний амін (наприклад, ТЕА). Схема 6 Одержання Р2 Використовують сполуку Р2 формули: відновним амінуванням, додержуючись нижченаведеної Схеми 6': 13 , яку одержують UA 106507 C2 5 10 15 20 25 Схема 6' v) введення групи -ALK-SSMe шляхом відновного амінування, що проводиться, наприклад, в присутності ціанборгідриду або ізопропоксиду титану. Варіант схожий на варіант, який зображений на Схемі 3" і використовує спосіб алкілування, описаний Kitagawa T. et al. JACS, 2006, 128(45), 14448-14449, показаний на Схемі 6": Схема 6" i) алкілування монозахищеним піперазином (див. стадію i) Схеми 5'); vi) селективне зняття захисної групи Вос в кислому середовищі; vii) алкілування алкілгалогенідом, що несе тіоацетильну групу, в присутності карбонату цезію в полярному апротонному розчиннику, такому як DMF; viii) селективне відщеплення ацетильної групи в слабколужному середовищі і утворення групи -SSMe в результаті реакції проміжного тіолу з MeSSO2Me в присутності основи, такої як ТЕА; ix) відщеплення захисних груп GP і GP' і перетворення гідроксильних груп, переважно, в мезилатні групи, з використанням метансульфонілхлориду. Схема 7 Ця Схема складена на основі Схеми 3, представленої вище. Сполукою Р6 може бути, наприклад, сполука № CAS 564476-32-0, яку одержують згідно із заявкою WO 03068144 (див. сполуку 10а фігури 7), або сполука № CAS 309916-91-4. Можна одержати аналогічні сполуки з різною довжиною ланцюга i згідно з таким же принципом, зображеним на фігурі 7 заявки WO 03068144, з відповідної ПЕГ-сполуки. Про сполуку Р6 Сполука схемою: у випадку, коли ALK=CH2CH2 може бути одержана згідно з представленою нижче 14 UA 106507 C2 , у випадку, коли ALK≠CH2CH2 5 10 15 20 25 30 35 40 . Стадія (i): активація спиртової групи шляхом перетворення її в мезилатну: реакцію здійснюють в полярному апротонному безводному розчиннику, такому як DCM, обробкою мезилхлоридом в присутності основи, такої як ТЕА. Стадія (ii): обмін мезилат/галоген: реакцію здійснюють при нагріванні із зворотним холодильником в полярному апротонному розчиннику, такому як ацетон, при взаємодії з галогенідом натрію, таким як йодид натрію. Стадія (iii): зняття захисту проводять за допомогою розчину соляної кислоти (наприклад, розчину в діоксані) або трифтороцтової кислоти. Стадія (iv): активація кислоти: реакцію здійснюють при кімнатній температурі в полярному апротонному розчиннику, такому як DCM, обробкою за допомогою NHS в присутності сполучного агента, такого як DCC. Стадія (v): подовження ПЕГ-ланцюга: реакцію здійснюють в полярному апротонному безводному розчиннику, такому як THF або DMF, обробкою складного галогенованого ефіру алкоголятом ПЕГ-діолу, монозахищеного у формі простого ефіру тетрагідропірану (ТНР). Одержання цього монозахищеного ПЕГ-діолу описується в літературі, див., наприклад, Richard A. et al., Chem. Eur. J. 2005, 11, 7315-7321 Sakellariou E.G. et al., Tetrahedron 2003, 59, 90839090. Стадія (vi): зняття захисту за допомогою 0,1н. розчину соляної кислоти (наприклад, розчин в діоксані або етанолі). Фахівець може використовувати робочі умови здійснення прикладів, описаних нижче. Спосіб одержання кон’югата Кон’югат одержують способом, який полягає в тому, що: (i) вводять в контакт і піддають взаємодії водний розчин агента клітинного зв’язування, необов'язково забуферений, з розчином сполуки формули (I); (ii) потім необов'язково відділяють кон’югат, утворений на стадії (i), від сполуки формули (I), що не прореагувала, і/або від агента клітинного зв’язування, що не прореагував, і/або від агрегатів, що можливо утворилися. Відповідно до одного варіанта, відділяють на стадії (ii) кон’югат, який утворився на стадії (i), від агента клітинного зв’язування, що не прореагував, і від агрегатів, що необов'язково знаходяться в розчині. Відповідно до іншого варіанта, відділяють на стадії (ii) кон’югат, який утворився на стадії (i), тільки від сполуки формули (I), що не прореагувала, і від агрегатів, що можливо утворилися, і залишають в розчині агент клітинного зв’язування, що можливо не прореагував. Сполука формули (I) містить, переважно, одну активовану функціональну групу -C(=O)ZbRb, що має реакційну здатність до груп GCR2, зокрема до аміногруп, що знаходяться на антитілах. Мало реакційноздатна або недостатньо реакційноздатна хімічна група може бути легко перетворена в більш реакційноздатну групу за допомогою однією або декількох хімічних реакцій, відомих фахівцю; наприклад: -СООН + N-гідроксисукцинімід або СОО(С1-С6)алкіл -СООН -СООН + N-гідроксисукцинімід . Прикладом здійснення способу у випадку використання антитіла і сполуки формули (I) є спосіб, описаний в прикладі 1. 15 UA 106507 C2 5 10 15 20 25 30 35 40 45 50 55 Водний розчин агента клітинного зв’язування може бути забуферений за допомогою таких буферів, як, наприклад, фосфат калію або N-2-гідроксіетилпіперазин-N'-2-етансульфонова кислота (буфер HEPES). Буфер залежить від природи агента клітинного зв’язування. Сполуку формули (I) розчиняють в полярному органічному розчиннику, наприклад DMSO або DMA. Реакція звичайно протікає при температурі в діапазоні між 20 і 40°С. Тривалість реакції варіюється від 1 до 24 годин. Реакція між агентом клітинного зв’язування і сполукою формули (I) може контролюватися за допомогою ексклюзійної хроматографії (SEC), забезпеченої рефрактометричним і/або ультрафіолетовим детектором для спостереження за ходом реакції. Якщо міра зшивання недостатня, то можна продовжити час реакції і/або додати сполуку формули (I). Можна послатися на загальний спосіб, викладений в частині опису прикладів, де більш детально описані конкретні умови, використовувані для кон’югування. Фахівець має в своєму розпорядженні різні хроматографічні методи для розділення на стадії (ii): кон’югат може бути очищений, наприклад, ексклюзійною стеричною хроматографією (SEC), адсорбційною хроматографією (такою як іонообмінна хроматографія IEC), хроматографією гідрофобної взаємодії (HIC), афінною хроматографією, хроматографією на змішаних носіях, таких як керамічний гідроксіапатит, або ВЕРХ. Очищення можна також здійснити за допомогою діалізу або діафільтрації. Під "агрегатами" мають на увазі асоціати, які можуть формувати два або більше агентів клітинного зв’язування, при цьому агенти клітинного зв’язування піддають або ні модифікації шляхом кон’югування. Агрегати здатні формуватися під впливом великого числа параметрів, таких як висока концентрація в розчині агента клітинного зв’язування, рН розчину, високе значення зсувового зусилля, кількість прищеплених димерів і їх гідрофобний характер, температура (див. перераховані посилання в передмові в J. Membrane Sci. 2008, 318, 311-316), причому вплив деяких з них іноді точно не з'ясований. У випадку білків або антитіл можна послатися на AAPS Journal, "Protein Aggregation and Bioprocessing", 2006, 8(3), E572-E579. Вміст агрегатів може оцінюватися за допомогою відомих методів, таких як SEC (див. про це Analytical Biochemistry, 1993, 212(2), 469-480). Після проведення стадії (i) або (ii) розчин кон’югата може направлятися на стадію (iii) ультрафільтрації і/або діафільтрації. Отже, на виході з цих стадій одержують кон’югат у водному розчині. Антитіла Антитіло (див. про них Janeway et al. "Immunobiology", 5-е видання, 2001, Garland Publishing, Нью-Йорк) може бути вибране з антитіл, описаних, зокрема, в заявках WO 04043344, WO 08010101, WO 08047242, WO 05009369 (анти-CА6). Антитіло може бути, зокрема, моноклональним, поліклональним або мультиспецифічним. Це може бути також фрагмент антитіла. Це може бути також мишаче, людське, гуманізоване або химерне антитіло. Кон’югат Звичайно кон’югат містить порядку від 1 до 10 димерів піроло[1,4]бензодіазепіну, зв'язаних з агентом клітинного зв’язування (мова йде про міру зшивання або, англійською, про "drug-toantibody ratio" або "DAR"). Це число варіюється залежно від природи агента клітинного зв’язування і димеру, а також від робочих умов, використовуваних для кон’югування (наприклад, кількість еквівалентів димеру відносно агента клітинного зв’язування, час реакції, природа розчинника і, можливо, співрозчинника). Контактування агента клітинного зв’язування з димером приводить до суміші, що містить: декілька кон’югатів, відмінних індивідуально один від одного по різних величинах DAR; необов'язково агент клітинного зв’язування, що не прореагував (у випадку, якщо реакція пройшла не повністю); необов'язково агрегати. Отже, величина DAR, визначувана в кінцевому розчині, наприклад, шляхом УФ-спектроскопії, буде відповідати усередненій величині DAR. У випадку, коли агентом клітинного зв’язування є антитіло, може бути використаний метод УФ-спектроскопії для визначення DAR. Цей метод оснований на методі, викладеному в публікації Antony S. Dimitrov (ed), LLC, 2009, "Therapeutic Antibodies and Protocols", т. 525, 445, Springer Science. Він полягає у вимірюванні поглинання розчину кон’югата, одержаного після стадії розділення (ii), при двох довжинах хвиль, позначуваних LO1 і LO2. Використовують молярні коефіцієнти екстинкції, що залежать від вільного антитіла і димеру піроло[1,4]бензодіазепіну, які вимірюють перед кон’югуванням. Поглинання розчину кон’югата при LO1 і LO2 (АLO1) і (АLO2) вимірюють або при відповідному піку спектра SEC (це дозволяє розрахувати "DAR(SEC)"), або з використанням класичного УФспектрофотометра (це дозволяє розрахувати "DAR(UV)"). Величини поглинання можуть бути виражені в формі рівнянь: 16 UA 106507 C2 5 10 15 20 25 30 35 40 45 50 55 , в яких: - cD і cA означають, відповідно, концентрації в розчині частини кон’югата, що належить до димеру піроло[1,4]бензодіазепіну, і частини кон’югата, що належить до антитіла; - eDLO1 і eDLO2 означають молярні коефіцієнти поглинання димеру піроло[1,4]бензодіазепіну перед кон’югуванням при двох довжинах хвиль LO1 і LO2, відповідно; - eALO1 і eALO2 означають молярні коефіцієнти поглинання вільного антитіла при двох довжинах хвиль LO1 і LO2, відповідно. Під вільним антитілом розуміють антитіло, до якого не приєднаний жоден димер піроло[1,4]бензодіазепіну, тобто антитіло перед кон’югуванням. Рішення двох вказаних рівнянь приводить до значень: . Тоді середнє значення DAR буде відповідати відношенню сD/cA. У випадку димерів піроло[1,4]бензодіазепіну можна встановити дві довжини хвиль: LO1=280 нм і LO2=320 нм. Середнє значення DAR, вимірюване на спектрі SEC, переважно знаходиться між 1 і 10, більш переважно між 1,5 і 7. Кон’югат може бути використаний як протиракові агенти. Завдяки наявності агента клітинного зв’язування, кон’югат стає набагато більш вибірним відносно пухлинних клітин, ніж здорових клітин. Це дозволяє направляти сполуку формули (I), що має протиракову активність, в простір, близький до пухлинних клітин, або безпосередньо всередину цих клітин (див. про це наступні публікації, які описують використання кон’югатів з моноклональними антитілами в лікуванні ракових пухлин: "Antibody-drug conjugates for cancer therapy" Carter P.J. et al. Cancer J. 2008, 14, 154-169; "Targeted cancer therapy: conferring specificity to cytotoxic drugs" Chari R., Acc. Chem. Res. 2008, 41, 98-107). Це також дає можливість лікувати солідні або рідкі пухлини. Кон’югат входить в рецептури у формі забуференого водного розчину, в концентрації, як правило, між 1 і 10 мг/мл. Цей розчин може бути введений шляхом ін'єкції у вигляді перфузійної рідини як такої або розбавлений з одержанням перфузійного розчину. [Приклади] Хімічні зсуви (δ) виражені в м.ч. Метод А: рідинна хроматографія високого тиску - мас-спектрометрія (РХ/МС) Спектри одержують на апараті Waters UPLC-SQD методом іонізації електроспреєм в режимі позитивних і/або негативних іонів (ES+/-). Умови хроматографії: колонка ACQUITY BEH C18 1,7 мкм - 2,1×50 мм; розчинники: А: Н2О (0,1% мурашиної кислоти), і В: CH3CN (0,1% мурашиної кислоти); температура колонки: 50°С; швидкість потоку: 1 мл/хв.; градієнт (2 хв.): від 5 до 50% В за 0,8 хв.; 1,2 хв.: 100% В; 1,85 хв.: 100% В; 1,95 хв.: 5% В. Метод В: рідинна хроматографія високого тиску - мас-спектрометрія (РХ/МС) Спектри одержані на апараті Waters ZQ методом іонізації електроспреєм в режимі позитивних і/або негативних іонів (ES+/-). Умови хроматографії: колонка XBridge C18 2,5 мкм 3×50 мм; розчинники: А: Н2О (0,1% мурашиної кислоти), і В: CH3CN (0,1% мурашиної кислоти); температура колонки: 70°С; швидкість потоку: 0,9 мл/хв.; градієнт (7 хв.): від 5 до 100% В за 5,3 хв.; 5,5 хв.: 100% В; 6,3 хв.: 5% В. Метод С: мас-спектрометрія (МС) Спектри були одержані з використанням хімічної іонізації (реактивний газ: аміак) на апараті WATERS GCTof (пряме введення без РХ). Метод D: рідинна хроматографія високого тиску - мас-спектрометрія (РХ/МС) Спектри одержані на апараті Waters UPLC-SQD методом іонізації електроспреєм в режимі позитивних і/або негативних іонів (ES+/-). Умови хроматографії: колонка ACQUITY BEH C18 1,7 мкм - 2,1×50 мм; розчинники: А: Н2О (0,1% мурашиної кислоти), і В: CH3CN (0,1% мурашиної кислоти); температура колонки: 70°С; швидкість потоку: 1 мл/хв.; градієнт (2 хв.): від 5 до 50% В за 1 хв.; 1,3 хв.: 100% В; 1,45 хв.: 100% В; 1,75 хв.: 5% В. Метод Е: рідинна хроматографія високого тиску - мас-спектрометрія (РХ/МС) Спектри одержані на апараті Waters UPLC-SQD методом іонізації електроспреєм в режимі позитивних і/або негативних іонів (ES+/-). Умови хроматографії: колонка ACQUITY BEH C18 1,7 мкм - 2,1×50 мм; розчинники: А: Н2О (0,1% мурашиної кислоти), і В: CH3CN (0,1% мурашиної кислоти); температура колонки: 70°С; швидкість потоку: 1 мл/хв.; градієнт (4 хв.): від 5 до 100% В за 3,15 хв.; 3,75 хв.: 5% В. 17 UA 106507 C2 5 10 15 20 25 30 35 40 45 50 55 Метод F: рідинна хроматографія високого тиску - мас-спектрометрія (РХ/МС) Спектри одержані на апараті Waters UPLC-SQD методом іонізації електроспреєм в режимі позитивних і/або негативних іонів (ES+/-). Умови хроматографії: колонка ACQUITY BEH C18 1,7 мкм - 2,1×30 мм; розчинники: А: Н2О (0,1% мурашиної кислоти), і В: CH3CN (0,1% мурашиної кислоти); температура колонки: 45°С; швидкість потоку: 0,6 мл/хв.; градієнт (2 хв.): від 5 до 50% В за 1 хв.; 1,3 хв.: 100% В; 1,45 хв.: 100% В; 1,75 хв.: 5% В. Метод G: деглікозилування і мас-спектрометрія (HRMS) кон’югата Деглікозилуванням називається метод ферментативного перетравлювання за допомогою глікозидази. Для цього беруть 500 мкл кон’югата + 100 мкл буфера Tris·HCl 50 мМ + 10 мкл ферменту гліканази-F (100 одиниць ліофілізованого ферменту/100 мкл води). Суміш поміщають на вортекс і перемішують протягом ночі при 37°С. Після цього деглікозилований зразок готовий для аналізу по методу HRMS. За необхідності аналіз HRMS може бути проведений без попереднього деглікозилування. У обох випадках мас-спектри одержують на апараті Waters QTof-2 електроспреєм в режимі позитивних іонів (ES+). Умови хроматографії: колонка: 4 мкм BioSuite 250 URH SEC 4,6×300 мм (Waters); розчинники: А: форміат амонію 25 мМ + 1% мурашиної кислоти; В: CH3CN; температура колонки 30°С: швидкість потоку 0,4 мл/хв.; ізократичне елюювання 70%А+30%В (15 хв.). Всі проміжні сполуки, описані в даній заявці, входять в обсяг домагань в зв'язку з їх використанням для одержання сполуки формули (I). Більш конкретно, всі проміжні сполуки, описані в кожному прикладі, входять в обсяг домагань в зв'язку з їх використанням для одержання відповідної сполуки формули (I). Приклад 1 1.1. Одержання кон’югата Кон’югат одержують взаємодією hu2H11 (позначуваного також hu532H11 на с. 15 заявки WO 2008010101; мова йде про антитіло, яке містить Vh-домен, що має амінокислотну послідовність SED ID NO:24) і N-гідроксисукцинімідил-3-(2-{2-[2-(2-{3-[3-(2-{[2-(2,6-біс-[(S)-2-ет(Е)-иліден-7-диметокси-1,2,3,11а-тетрагідропіроло[2,1-c][1,4]бензодіазепін-5-он-8ілоксиметил]піридин-4-ілоксі)етил]метиламіно}-1,1-диметилетилсульфаніл)-2,5-діоксопіролідин1-іл]пропаноїламіно}етоксі)етоксі]етоксі}етокси)пропаноату. До 8,19 мг hu2H11 в 2,16 мл водного буфера з 0,05М концентрацією N-(2гідроксіетил)піперазин-N'-2-етансульфонової кислоти (HEPES), 0,05М NaCl і 2 мМ етилендіамінтетраоцтової кислоти (EDTA), рН=8, додають 516 мкг N-гідроксисукцинімідил-3-(2{2-[2-(2-{3-[3-(2-{[2-(2,6-біс-[(S)-2-ет-(Е)-иліден-7-диметокси-1,2,3,11а-тетрагідропіроло[2,1c][1,4]бензодіазепін-5-он-8-ілоксиметил]піридин-4-ілоксі)етил]метиламіно}-1,1диметилетилсульфаніл)-2,5-діоксопіролідин-1іл]пропаноїламіно}етоксі)етоксі]етоксі}етокси)пропаноату, розчиненого в 540 мкл DMA. Після 3 R годин перемішування при КТ суміш фільтрують на Millex -SV 0,45 мкM (PVDF Durapore Millipore) TM TM і очищають на колонці Superdex 200 prep grade (Колонка Hiload 26/60 GE), попередньо зрівноваженій фосфатносольовим буфером, доведеним до рН=6,5 додаванням HCl. Цільові фракції об'єднують і концентрують в Amicon Ultra-15 (Ultracel 50k Millipore), потім фільтрують на сорбенті Sephadex G-25 (колонки NAP-5 і NAP-10 GE), попередньо зрівноважені водним буфером з 10 мМ концентрацією гістидину, що містить 10% сахарози і 5% NMP. Одержаний кон’югат (2,5 мл) піддають кількісному аналізу методом спектрофотометрії, використовуючи коефіцієнт екстинкції 4-{2-[метил-(2-метил-2-меркаптопропіл)аміно]етокси}-2,6біс-[(S)-2-ет-(Е)-иліден-7-диметокси-1,2,3,11а-тетрагідропіроло[2,1-c][1,4]бензодіазепін-5-он-8-1 -1 -1 -1 -1 -1 ілоксиметил]піридину (ε319нм=8848 М см і ε280нм=8634 М см ) і hu2H11 (ε280нм=208380 М см ): було визначено в середньому 3,9 димерів томайміцину на молекулу антитіла в концентрації 1,52 мг/мл. 1.2. N-гідроксисукцинімідил-3-(2-{2-[2-(2-{3-[3-(2-{[2-(2,6-біс-[(S)-2-ет-(Е)-иліден-7-диметокси1,2,3,11а-тетрагідропіроло[2,1-c][1,4]бензодіазепін-5-он-8-ілоксиметил]піридин-4ілоксі)етил]метиламіно}-1,1-диметилетилсульфаніл)-2,5-діоксопіролідин-1іл]пропаноїламіно}етоксі)етоксі]етоксі}етокси)пропаноат До 3,3 мг діізопропілетиламіну, нанесеного на смолу (3,72 ммол/г), додають розчин 9,82 мг 4-{2-[метил-(2-метил-2-меркаптопропіл)аміно]етокси}-2,6-біс-[(S)-2-ет-(Е)-иліден-7-диметокси1,2,3,11а-тетрагідропіроло[2,1-c][1,4]бензодіазепін-5-он-8-ілоксиметил]піридину в 50 мкл DMA, а 18 UA 106507 C2 5 10 15 20 25 30 35 40 45 також розчин 6,8 мг N-гідроксисукцинімідил-3-{2-[2-(2-{2-[3-(2,5-діоксо-2,5-дигідропірол-1іл)пропаноїламіно]етоксі}етоксі)етоксі]етокси}пропаноату в 50 мкл DMA. Одержану суміш перемішують протягом 24 годин при КТ, потім фільтрують на діоксиді кремнію (Interchrom Puriflash Silice 15/35U 2G), застосовуючи градієнт метанолу від 0 до 10% в DCM. Фракції, що містять цільовий продукт, об'єднують, концентрують при ЗТ, потім очищають флешхроматографією на діоксиді кремнію (Interchrom Puriflash Silice 15/35U 2G) в градієнті метанолу від 0 до 10% в DCM. Фракції, що містять цільовий продукт, об'єднують, концентрують при ЗТ. Таким шляхом одержують 1,16 мг N-гідроксисукцинімідил-3-(2-{2-[2-(2-{3-[3-(2-{[2-(2,6-біс-[(S)-2ет-(Е)-иліден-7-диметокси-1,2,3,11а-тетрагідропіроло[2,1-c][1,4]бензодіазепін-5-он-8ілоксиметил]піридин-4-ілоксі)етил]метиламіно}-1,1-диметилетилсульфаніл)-2,5-діоксопіролідин1-іл]пропаноїламіно}етоксі)етоксі]етоксі}етокси)пропаноату. РХ/МС (Е): tR=1,38 хв.; [M+Н]+: m/z 1322. 1.3. 4-{2-[Метил-(2-метил-2-меркаптопропіл)аміно]етокси}-2,6-біс-[(S)-2-ет-(Е)-иліден-7диметокси-1,2,3,11а-тетрагідропіроло[2,1-c][1,4]бензодіазепін-5-он-8-ілоксиметил]піридин До 40 мг 4-{2-[метил-(2-метил-2-метилдисульфанілпропіл)аміно]етокси}-2,6-біс-[(S)-2-ет-(Е)иліден-7-диметокси-1,2,3,11а-тетрагідропіроло[2,1-c][1,4]бензодіазепін-5-он-8ілоксиметил]піридину, розчиненого в 2,1 мл метанолу і 930 мкл DMF, додають розчин 40 мг гідрохлориду трис(2-карбоксіетил)фосфіну і 36,6 мг NaHCO3 в 680 мкл води. Суміш перемішують 45 хвилин при КТ, потім концентрують при ЗТ і очищають флеш-хроматографією на діоксиді кремнію (колонка Merck SuperVarioFlash 15 г, Si60 15-40 мкм), застосовуючи градієнт МеОН від 0 до 10% в суміші DCM/ацетонітрил 9:1. Фракції, що містять цільовий продукт, об'єднують і концентрують при ЗТ. Одержують 21 мг 4-{2-[метил-(2-метил-2меркаптопропіл)аміно]етокси}-2,6-біс-[(S)-2-ет-(Е)-иліден-7-диметокси-1,2,3,11атетрагідропіроло[2,1-с][1,4]бензодіазепін-5-он-8-ілоксиметил]піридину. РХ/МС (Е): tR=1,28 хв.; [M+Н]+: m/z 809; [M+H2O+Н]+: m/z 827. 1.4. 4-{2-[Метил-(2-метил-2-метилдисульфанілпропіл)аміно]етокси}-2,6-біс-[(S)-2-ет-(Е)иліден-7-диметокси-1,2,3,11а-тетрагідропіроло[2,1-с][1,4]бензодіазепін-5-он-8ілоксиметил]піридин До розчину, охолодженого до -25°С, 22 мг 4-{2-[метил-(2-метил-2метилдисульфанілпропіл)аміно]етокси}-2,6-біс-(гідроксиметил)піридину і 53 мкл ТЕА в 0,5 мл DCM додають 19,6 мкл метансульфонілхлориду. Після перемішування протягом 30 хвилин суміш гідролізують, і органічний шар промивають водою, потім сушать над MgSO 4 і концентрують при ЗТ. Одержаний залишок (22 мг) додають до розчину 20 мг томайміцину в 0,7 мл DMF, а також 30 мг K2СО3 і 12 мг KI. Суміш перемішують 2 години при 30°С, потім гідролізують за допомогою 4 мл води. Утворений осад промивають водою, сушать у вакуумі, потім розчиняють в DCM, концентрують при ЗТ і очищають флеш-хроматографією на діоксиді кремнію (колонка Merck SuperVarioFlash 15 г, Si60 15-40 мкм) в градієнті МеОН від 0 до 5% в DCM. Фракції, що містять цільовий продукт, об'єднують і концентрують при ЗТ. Одержують 8 мг 4-{2-[метил-(2-метил-2-метилдисульфанілпропіл)аміно]етокси}-2,6-біс-[(S)-2-ет-(Е)-иліден-71 диметокси-1,2,3,11а-тетрагідропіроло[2,1-с][1,4]бензодіазепін-5-он-8-ілоксиметил]піридину. НЯМР (500 МГц, хлороформ-d): 1,28 (с, 6Н); 1,76 (д, J=6,4 Гц, 6Н); 2,39 (с, 3Н); 2,43 (с, 3Н); 2,60 (с, 2Н); 2,91 (с, 2Н); 2,97 (с, 4Н); 3,91 (д, J=4,2 Гц, 2Н); 4,00 (с, 6Н); 4,09 (с, 2Н); 4,27 (с, 4Н); 5,27 (с, 4Н); 5,61 (кв, J=6,4 Гц, 2Н); 6,85 (с, 2Н); 7,00 (с, 2Н); 7,56 (с, 2Н); 7,65 (д, J=4,2 Гц, 2Н). РХ/МС (А): tR=0,74 хв.; [M+Н]+: m/z 855; [M-H]-: m/z 853. 1.5. 4-{2-[Метил-(2-метил-2-метилдисульфанілпропіл)аміно]етокси}-2,6-біс(гідроксиметил)піридин 19 UA 106507 C2 5 10 15 20 25 30 35 40 45 50 До суспензії, охолодженої до 0°С, 322 мг 4-[2-(2-метил-2метилдисульфанілпропіламіно)етокси]-2,6-біс-(гідроксиметил)піридину в 262 мкл формальдегіду додають 365 мкл мурашиної кислоти. Суміш нагрівають 1 годину 15 хвилин при 100°С. Після повернення до кімнатної температури суміш гідролізують, потім додають 5н. водний розчин гідроокису натрію до досягнення рН=12. Водний шар екстрагують 3 рази за допомогою AcOEt і об'єднані органічні шари сушать над MgSO4 і концентрують при ЗТ. Одержують 310 мг 4-{2-[метил-(2-метил-2-метилдисульфанілпропіл)аміно]етокси}-2,6-біс1 (гідроксиметил)піридину. Н-ЯМР (300 МГц, ДМСО-d6): 1,26 (с, 6Н); 2,39 (с, 3Н); 2,40 (с, 3Н); 2,60 (с, 2H); 2,88 (т, J=5,7 Гц, 2Н); 4,13 (т, J=5,7 Гц, 2Н); 4,45 (д, J=6,0 Гц, 4Н); 5,31 (т, J=6,0 Гц, 2Н); 6,85 (с, 2Н). РХ/МС (А): tR=0,22 хв.; [M+Н]+: m/z 333; [M+HCO2H-H]-: m/z 377. 1.6. 4-[2-(2-Метил-2-метилдисульфанілпропіламіно)етокси]-2,6-біс-(гідроксиметил)піридин До суспензії 390 мг 4-[2-аміноетокси]-2,6-біс-(гідроксиметил)піридину (одержаного після видалення захисної групи boc з 4-(2-трет-бутоксикарбоніламіноетокси)-2,6-біс(гідроксиметил)піридину, описаного на с. 101 заявки WO 07085930) в 2 мл THF додають 270 мкл 2-(метилдитіо)ізобутиральдегіду і 730 мкл ізопропоксиду титану. Через 20 хвилин вводять додаткові 270 мкл 2-(метилдитіо)ізобутиральдегіду і 730 мкл ізопропоксиду титану і суміш перемішують при КТ протягом 2 годин. Потім до суміші додають 6 мл етанолу, перемішують протягом 20 хвилин при КТ, потім додають 124 мг ціанборгідриду натрію. Після перемішування протягом 45 хвилин додають знов 124 мг ціанборгідриду натрію і після перемішування протягом 1 години суміш концентрують при ЗТ, розбавляють в AcOEt і воді. Утворений осад відфільтровують, розчиняють в 1М водному розчині HCl. Утворений водний шар доводять до лужного значення рН за допомогою 5М водного розчину гідроокису натрію, екстрагують 3 рази за допомогою DCM і об'єднані органічні шари концентрують при ЗТ. Одержують 322 мг 4-[2-(21 метил-2-метилдисульфанілпропіламіно)етокси]-2,6-біс-(гідроксиметил)піридину. Н-ЯМР (400 МГц, ДМСО-d6): 1,26 (с, 6Н); 1,81 (шир.м, 1Н); 2,39 (с, 3Н); 2,67 (шир.с, 2Н); 2,94 (шир.т, J=5,7 Гц, 2Н); 4,11 (т, J=5,7 Гц, 2Н); 4,45 (д, J=5,5 Гц, 4Н); 5,32 (т, J=5,5 Гц, 2Н); 6,85 (с, 2Н). РХ/МС (А): tR=0,24 хв.; [M+Н]+: m/z 347. Приклад 2 2.1. Одержання кон’югата Для одержання кон’югата працюють згідно з прикладом 1 шляхом взаємодії hu2H11 і Nгідроксисукцинімідил-3-{2-[2-(2-{2-[2-(2-{[2-(2,6-біс-[(S)-2-ет-(Е)-иліден-7-диметокси-1,2,3,11атетрагідропіроло[2,1-c][1,4]бензодіазепін-5-он-8-ілоксиметил]піридин-4-ілоксі)етил]метиламіно}1,1-диметилетилсульфаніл)ацетиламіно]етоксі}етоксі)етоксі]етокси}пропаноату. Одержаний кон’югат піддають кількісному аналізу методом спектрофотометрії, використовуючи коефіцієнти екстинкції 4-{2-[метил-(2-метил-2-меркаптопропіл)аміно]етокси}-2,6-біс-[(S)-2-ет-(Е)-иліден-7диметокси-1,2,3,11а-тетрагідропіроло[2,1-c][1,4]бензодіазепін-5-он-8-ілоксиметил]піридину -1 -1 -1 -1 -1 -1 (ε319нм=8848 М см , ε280нм=8634 М см ) і hu2H11 (ε280нм=208380 М см ): було визначено в середньому 5,6 димерів томайміцину на молекулу антитіла. 2.2. N-гідроксисукцинімідил-3-{2-[2-(2-{2-[2-(2-{[2-(2,6-біс-[(S)-2-ет-(Е)-иліден-7-диметокси1,2,3,11а-тетрагідропіроло[2,1-c][1,4]бензодіазепін-5-он-8-ілоксиметил]піридин-4ілоксі)етил]метиламіно}-1,1-диметилетилсульфаніл)ацетиламіно]етоксі}етоксі)етоксі]етокси}пропаноат До 12 мг 3-{2-[2-(2-{2-[2-(2-{[2-(2,6-біс-[(S)-2-ет-(Е)-иліден-7-диметокси-1,2,3,11атетрагідропіроло[2,1-c][1,4]бензодіазепін-5-он-8-ілоксиметил]піридин-4-ілоксі)етил]метиламіно}1,1-диметилетилсульфаніл)ацетиламіно]етоксі}-етоксі)етоксі]етокси}пропанової кислоти, розчиненої в 1 мл THF і 1 мл DCM, додають 5,5 мг N,N'-дисукцинімідилкарбонату і 15 мкл DIPEA. Після 3 годин протікання реакції при КТ додають 4 мл DCM і утворений органічний шар 20 UA 106507 C2 5 10 15 20 25 промивають два рази водою, сушать над MgSO4, концентрують при ЗТ і очищають флешхроматографією на діоксиді кремнію (Interchrom Puriflash Silice 15/35U 2G) в градієнті метанолу від 3 до 8% в DCM. Одержують 8 мг N-гідроксисукцинімідил-3-{2-[2-(2-{2-[2-(2-{[2-(2,6-біс-[(S)-2ет-(Е)-иліден-7-диметокси-1,2,3,11а-тетрагідропіроло[2,1-c][1,4]бензодіазепін-5-он-8ілоксиметил]піридин-4-ілоксі)етил]метиламіно}-1,1-диметилетилсульфаніл)ацетиламіно]етоксі}етоксі)етоксі]етокси}пропаноату. РХ/МС (Е): tR=1,36 хв.; [M+2H2O+Na]+: m/z 1270; [M+H2O+Na]+: m/z 1252; [M+H2O+Н]+: m/z 1229; [M+Н]+: m/z 1211. 2.3. 3-{2-[2-(2-{2-[2-(2-{[2-(2,6-Біс-[(S)-2-ет-(Е)-иліден-7-диметокси-1,2,3,11атетрагідропіроло[2,1-c][1,4]бензодіазепін-5-он-8-ілоксиметил]піридин-4-ілоксі)етил]метиламіно}1,1-диметилетилсульфаніл)ацетиламіно]етоксі}-етоксі)етоксі]етокси}пропанова кислота До 18 мг метил-3-{2-[2-(2-{2-[2-(2-{[2-(2,6-біс-[(S)-2-ет-(Е)-иліден-7-диметокси-1,2,3,11атетрагідропіроло[2,1-c][1,4]бензодіазепін-5-он-8-ілоксиметил]піридин-4-ілоксі)етил]метиламіно}1,1-диметилетилсульфаніл)-ацетиламіно]етоксі}етоксі)етоксі]етокси}пропаноату, розчиненого в 270 мкл THF, додають 17,5 мкл ввідного розчину гідроксиду літію і 100 мкл води. Через 2 години суміш розбавляють в DCM і додають фосфатний буфер з рН=3. Утворений водний шар екстрагують 3 рази за допомогою DCM і об'єднані органічні шари сушать над MgSO4, концентрують при ЗТ і очищають флеш-хроматографією на діоксиді кремнію (Interchrom Puriflash Silice 15/35U 2G) в градієнті метанолу від 3 до 15% в DCM. Одержують 11,5 мг 3-{2-[2(2-{2-[2-(2-{[2-(2,6-біс-[(S)-2-ет-(Е)-иліден-7-диметокси-1,2,3,11а-тетрагідропіроло[2,1c][1,4]бензодіазепін-5-он-8-ілоксиметил]піридин-4-ілоксі)етил]метиламіно}-1,1диметилетилсульфаніл)ацетиламіно]етоксі}етоксі)етоксі]етокси}пропанової кислоти. РХ/МС (D): tR=0,88 хв.; [M+H2O+Na]+: m/z 1154; [M+H2O+Н]+: m/z 1133; [M+Н]+: m/z 1115. 2.4. Метил-3-{2-[2-(2-{2-[2-(2-{[2-(2,6-біс-[(S)-2-ет-(Е)-иліден-7-диметокси-1,2,3,11атетрагідропіроло[2,1-c][1,4]бензодіазепін-5-он-8-ілоксиметил]піридин-4-ілоксі)етил]метиламіно}1,1-диметилетилсульфаніл)-ацетиламіно]етоксі}етоксі)етоксі]етокси}пропаноат Працюють згідно з прикладом 1, виходячи з метил-3-{2-[2-(2-{2-[2-(2-{[2-(2,6-бісгідроксиметилпіридин-4-ілоксі)етил]метиламіно}-1,1диметилетилсульфаніл)ацетиламіно]етоксі}етоксі)етоксі]етокси}пропаноату: 30 . РХ/МС (D): tR=0,93 хв.; [M+H2O+Н]+: m/z 1146; [M+Н]+: m/z 1128. 2.5. Метил-3-{2-[2-(2-{2-[2-(2-{[2-(2,6-біс-гідроксиметилпіридин-4-ілоксі)етил]метиламіно}-1,1диметилетилсульфаніл)ацетиламіно]етоксі}етоксі)-етоксі]етокси}пропаноат 35 До 45 мг 4-{2-[(2-меркапто-2-метилпропіл)метиламіно]етокси}-2,6-біс(гідроксиметил)піридину, розчиненого в 1 мл DMF, додають 73,7 мг метил-3-[2-(2-{2-[2-(2йодацетиламіно)етоксі]етоксі}етоксі)етокси]пропаноату, розчиненого в 1 мл DMF і 39 мкл DIPEA. Після 24 годин проведення реакції при КТ суміш концентрують при ЗТ і очищають флеш-хроматографією на діоксиді кремнію (Analogix Super Flash SiO2 SF25-8g), застосовуючи градієнт від 0 до 10% метанолу в DCM. Одержують 53 мг метил-3-{2-[2-(2-{2-[2-(2-{[2-(2,6-бісгідроксиметилпіридин-4-ілоксі)етил]метиламіно}-1,1-диметилетилсульфаніл)1 ацетиламіно]етоксі}етоксі)етоксі]етокси}пропаноату. Н-ЯМР (400 МГц, ДМСО-d6): 1,21 (с, 6Н); 2,40 (с, 3Н); 2,50-2,56 (м, 4Н); 2,87 (т, J=5,8 Гц, 2Н); 3,15-3,23 (м, 4Н); 3,40 (т, J=5,8 Гц, 2Н); 3,473,52 (м, 12Н); 3,59 (с, 3Н); 3,62 (т, J=6,2 Гц, 2Н); 4,13 (т, J=5,8 Гц, 2Н); 4,45 (д, J=5,8 Гц, 4Н); 5,31 (т, J=5,8 Гц, 2Н); 6,85 (с, 2Н); 7,98 (т, J=5,8 Гц, 1Н). РХ/МС (А): tR=0,35 хв.; [M+Н]+: m/z 620; 2+ [M+2H] : m/z 310,5 (молекулярний пік); [M-H+HCO2H]-: m/z 664. 2.6. Метил-3-[2-(2-{2-[2-(2-йодацетиламіно)етоксі]етоксі}етоксі)етокси]-пропаноат 40 45 21 UA 106507 C2 5 10 15 20 25 30 35 40 45 До 100 мг 3-(2-{2-[2-(2-аміноетоксі)етоксі]етоксі}етокси)пропанової кислоти додають 117,4 мг N-гідроксисукцинімідилйодацетату, розчиненого в 3 мл DCM. Після 2 годин проведення реакції при КТ додають 330 мкл МеОН, потім суміш охолоджують до 0°С. Вводять 360 мкл 2М розчину триметилсилілдіазометану в гексані. Через 1 годину суміш нейтралізують додаванням 50 мкл оцтової кислоти, потім додають насичений водний розчин NaHCO 3 до досягнення рН=8. Органічний шар сушать над MgSO4, концентрують при ЗТ і очищають флеш-хроматографією на діоксиді кремнію (Interchrom Puriflash Silice 15/35U 10G), застосовуючи градієнт метанолу від 0 до 10% в DCM. Одержують 132 мг метил-3-[2-(2-{2-[2-(2-йодацетиламіно)етоксі]етоксі}1 етоксі)етокси]пропаноату. Н-ЯМР (400 МГц, ДМСО-d6): 2,54 (т, J=6,4 Гц, 2Н); 3,20 (кв, J=5,8 Гц, 2Н); 3,41 (т, J=5,8 Гц, 2Н); 3,48-3,53 (м, 12Н); 3,60 (с, 3Н); 3,63 (т, J=6,4 Гц, 2Н); 3,65 (с, 2Н); 8,27 (шир.т, J=5,8 Гц, 1Н). РХ/МС (А): tR=0,54 хв.; [M+Н]+: m/z 448; [M+HCO2H-H]-: m/z 492. 2.7. 4-{2-[(2-Меркапто-2-метилпропіл)метиламіно]етокси}-2,6-біс-(гідроксиметил)піридин До 80 г 4-{2-[метил-(2-метил-2-метилдисульфанілпропіл)аміно]етокси}-2,6-біс(гідроксиметил)піридину, розчиненого в 1,95 мл метанолу, додають розчин 198 мг гідрохлориду трис(2-карбоксіетил)фосфіну в 730 мкл води. Після 2 годин проведення реакції при КТ суміш концентрують при ЗТ і обробляють 10 мл води. Доводять водний шар до рН=8 додаванням водного розчину гідроокису натрію, потім екстрагують 2 рази AcOEt. Об'єднані органічні шари промивають насиченим водним розчином NaCl і концентрують при ЗТ. Одержують 68 мг 4-{21 [(2-меркапто-2-метилпропіл)метиламіно]етокси}-2,6-біс-(гідроксиметил)-піридину. Н-ЯМР (400 МГц, ДМСО-d6): 1,28 (с, 6Н); 2,43 (с, 3Н); 2,54 (с, 2Н); 2,62 (с, 1Н); 2,91 (т, J=5,7 Гц, 2Н); 4,15 (т, J=5,7 Гц, 2Н); 4,45 (д, J=5,8 Гц, 4Н); 5,30 (т, J=5,8 Гц, 2Н); 6,85 (с, 2Н). РХ/МС (А): tR=0,1 1 хв.; [M+Н]+: m/z 301. Приклад 3 3.1. Одержання кон’югата Кон’югат одержують згідно з прикладом 1, шляхом взаємодії hu2H11 і Nгідроксисукцинімідил-3-(2-{2-[2-(2-{2-[1-(3,5-біс-[(S)-2-ет-(Е)-иліден-7-диметокси-1,2,3,11атетрагідропіроло[2,1-c][1,4]бензодіазепін-5-он-8-ілоксиметил]-1метилетилсульфаніл]ацетиламіно}етоксі)етоксі]етоксі}етокси)-пропаноату. Одержаний кон’югат піддають кількісному аналізу методом спектрофотометрії, використовуючи коефіцієнти екстинкції 1-(1-метил-1-метилдисульфанілетил)-3,5-біс-[(S)-2-ет(Е)-иліден-7-диметокси-1,2,3,11а-тетрагідропіроло[2,1-c][1,4]бензодіазепін-5-он-8-1 -1 -1 -1 -1 -1 ілоксиметил]бензолу (ε319нм=8460 М см , ε280нм=10531 М см ) і hu2H11 (ε280нм=208380 М см ): було визначено в середньому 4,2 похідних томайміцину на молекулу антитіла. 3.2. N-гідроксисукцинімідил-3-(2-{2-[2-(2-{2-[1-(3,5-біс-[(S)-2-ет-(Е)-иліден-7-диметокси1,2,3,11а-тетрагідропіроло[2,1-с][1,4]бензодіазепін-5-он-8-ілоксиметил]-1метилетилсульфаніл]ацетиламіно}етоксі)етоксі]етоксі}етокси)-пропаноат Працюють згідно з прикладом 2, виходячи з 3-(2-{2-[2-(2-{2-[1-(3,5-біс-[(S)-2-ет-(Е)-иліден-7диметокси-1,2,3,11а-тетрагідропіроло[2,1-c][1,4]бензодіазепін-5-он-8-ілоксиметил]-1метилетилсульфаніл]ацетиламіно}-етоксі)етоксі]етоксі}етокси)пропанової кислоти: . РХ/МС (F): tR=1,27 хв.; [M+Н]+: m/z 1123. 3.3. 3-(2-{2-[2-(2-{2-[1-(3,5-Біс-[(S)-2-ет-(Е)-иліден-7-диметокси-1,2,3,11атетрагідропіроло[2,1-с][1,4]бензодіазепін-5-он-8-ілоксиметил]-1метилетилсульфаніл]ацетиламіно}етоксі)етоксі]етоксі}етокси)пропанова кислота Працюють згідно з прикладом 2, виходячи з метил-3-(2-{2-[2-(2-{2-[1-(3,5-біс-[(S)-2-ет-(Е)иліден-7-диметокси-1,2,3,11а-тетрагідропіроло[2,1-c][1,4]бензодіазепін-5-он-8-ілоксиметил]-1метилетилсульфаніл]ацетиламіно}-етоксі)етоксі]етоксі}етокси)пропаноату: 22 UA 106507 C2 5 10 15 20 25 30 35 40 . РХ/МС (F): tR=1,19 хв.; [M+Н]+: m/z 1026. 3.4. Метил-3-(2-{2-[2-(2-{2-[1-(3,5-біс-[(S)-2-ет-(Е)-иліден-7-диметокси-1,2,3,11атетрагідропіроло[2,1-с][1,4]бензодіазепін-5-он-8-ілоксиметил]-1метилетилсульфаніл]ацетиламіно}етоксі)етоксі]етоксі}етокси)пропаноат Працюють згідно з прикладом 2, виходячи з метил-3-(2-{2-[2-(2-{2-[1-(3,5-бісгідроксиметилфеніл)-1-метилетилсульфаніл]ацетиламіно}етоксі)етоксі]етоксі}етокси)пропаноату: . РХ/МС (F): tR=1,28 хв.; [M+Н]+: m/z 1040. 3.5. Метил-3-(2-{2-[2-(2-{2-[1-(3,5-біс-гідроксиметилфеніл)-1метилетилсульфаніл]ацетиламіно}етоксі)етоксі]етоксі}етокси)пропаноат Працюють згідно з прикладом 2, виходячи з 3,5-біс-гідроксиметил-1-(1-меркапто-1метилетил)бензолу: . Н-ЯМР (400 МГц, ДМСО-d6): 1,64 (с, 6Н); 2,53 (т, J=6,2 Гц, 2Н); 2,93 (с, 2Н); 3, 15 (кв, J=6,0 Гц, 2Н); 3,37 (т, J=6,0 Гц, 2Н); 3,49 (м, 12Н); 3,59 (с, 3Н); 3,62 (т, J=6,2 Гц, 2Н); 4,49 (д, J=5,6 Гц, 4Н); 5,13 (т, J=5,6 Гц, 2Н); 7,14 (с, 1Н); 7,32 (с, 2Н); 7,84 (т, J=6,0 Гц, 1Н). РХ/МС (В): tR=2,98 хв.; [M+Н]+: m/z 532; молекулярний пік: m/z 354; [M-H+HCO2H]-: m/z 576. 3.8. 3,5-Біс-гідроксиметил-1-(1-меркапто-1-метилетил)бензол 1 Розчин 43 мг 5-гідроксиметил-1-(1-меркапто-1-метилетил)-3-(третбутилдиметилсиланілоксиметил)бензолу в 1 мл суміші оцтової кислоти/THF/води (3/1/1) перемішують при КТ протягом 4,5 годин, концентрують при ЗТ, потім обробляють 3 мл води. Значення рН водного шару доводять до 7 додаванням 10%-го водного розчину Na2CO3, потім водний шар екстрагують за допомогою AcOEt. Органічний шар сушать над MgSO4 і концентрують при ЗТ. Одержують 18 мг 3,5-біс-гідроксиметил-1-(1-меркапто-11 метилетил)бензолу. Н-ЯМР (400 МГц, ДМСО-d6): 1,76 (с, 6Н); 3,19 (с, 1Н); 4,48 (д, J=5,9 Гц, 4Н); 5,14 (т, J=5,9 Гц, 2Н); 7,13 (с, 1Н); 7,36 (с, 2Н). MS (С): Cl: [M+NH4]+: m/z 230. 3.9. 5-Гідроксиметил-1-(1-меркапто-1-метилетил)-3-(третбутилдиметилсиланілоксиметил)бензол До 336 мг тіоацетату 1-[3-(трет-бутилдиметилсиланілоксиметил)-5-гідроксиметилфеніл]-1метилетилу, розчиненого в 3,7 мл ацетонітрилу, додають 114 мкл гідразингідрату. Після 3 годин ведення реакції при КТ суміш концентрують при ЗТ і очищають флеш-хроматографією на діоксиді кремнію (Biotage 25+M), застосовуючи градієнт від 0 до 55% AcOEt в гептані. Одержують 230 мг 5-гідроксиметил-1-(1-меркапто-1-метилетил)-3-(трет1 бутилдиметилсиланілоксиметил)бензолу. Н-ЯМР (400 МГц, ДМСО-d6): 0,08 (с, 6Н); 0,92 (с, 9Н); 1,76 (с, 6Н); 3,19 (с, 1Н); 4,48 (д, J=5,7 Гц, 2Н); 4,71 (с, 2Н); 5,14 (т, J=5,7 Гц, 1Н); 7,10 (с, 1Н); 7,33-7,42 (м, 2Н). MS (С): Cl: [M+NH4]+: m/z 344. 23 UA 106507 C2 3.10. Тіоацетат метилетилу 5 10 15 20 25 30 35 40 45 1-[3-(трет-бутилдиметилсиланілоксиметил)-5-гідроксиметилфеніл]-1 До 1 г 1-(1-гідрокси-1-метилетил)-3,5-біс-(трет-бутилдиметилсиланілоксиметил)бензолу, розчиненого в 4,7 мл 1,2-дихлоретану, додають 404 мкл тіооцтової кислоти і 376 мг йодиду цинку. Суміш нагрівають при 50°С протягом 40 хвилин. Після повернення до КТ солі видаляють фільтрацією і органічний шар концентрують при ЗТ і очищають флеш-хроматографією на діоксиді кремнію (Biotage 40+M), застосовуючи градієнт від 0 до 30% AcOEt в гептані. Одержують 248 мг тіоацетату 1-[3-(трет-бутилдиметилсиланілоксиметил)-51 гідроксиметилфеніл]-1-метилетилу. Н-ЯМР (400 МГц, ДМСО-d6): 0,08 (с, 6Н); 0,91 (с, 9H); 1,79 (с, 6Н); 2,17 (с, 3H); 4,48 (д, J=5,6 Гц, 2Н); 4,70 (с, 2Н); 5,16 (т, J=5,6 Гц, 1Н); 7,11 (с, 1Н); 7,33 (с, 1Н); 7,35 (с, 1Н). РХ/МС (А): tR=1,23 хв.; [M+Na]+: m/z 391. 3.11. 1-(1-Гідрокси-1-метилетил)-3,5-біс-(трет-бутилдиметилсиланілоксиметил)-бензол До 4,32 г 1-бром-3,5-біс-(трет-бутилдиметилсиланілоксиметил)бензолу (Crisp G.T., Turner P.D. Tetrahedron 2000, 56(42), 8335), розчиненого в 150 мл THF, охолодженого до -71°С, додають по краплях 10,5 мл 1,6М розчину н-BuLi в гексані. Через 1 годину 30 хвилин додають по краплях 4,27 мл ацетону. Температурі суміші дають піднятися до КТ, потім гідролізують насиченим водним розчином NH4Cl. Водний шар екстрагують 100 мл AcOEt і об'єднані органічні шари сушать над MgSO4, концентрують при ЗТ і очищають флеш-хроматографією на діоксиді кремнію (Biotage 65+M), застосовуючи градієнт від 0 до 20% AcOEt в гептані. Одержують 2,48 г 1 1-(1-гідрокси-1-метилетил)-3,5-біс-(трет-бутилдиметилсиланілоксиметил)бензолу. Н-ЯМР (400 МГц, хлороформ-d): 0,11 (с, 12Н); 0,96 (с, 18Н); 1,59 (с, 6H); 1,69 (с, 1Н); 4,76 (с, 4Н); 7,21 (с, 1Н); 7,33 (с, 2Н). РХ/МС (В): tR=6,43 хв.; [M+Na]+: m/z 447; молекулярний пік: m/z 407. Приклад 4 4.1. Одержання кон’югата Кон’югат одержують згідно з прикладом 1, шляхом взаємодії hu2H11 і Nгідроксисукцинімідил-3-{2-[2-(2-{2-[2-(4-{4-[2-(2,6-біс-[(S)-2-ет-(Е)-иліден-7-диметокси-1,2,3,11атетрагідропіроло[2,1-c][1,4]бензодіазепін-5-он-8-ілоксиметил]піридин-4-ілоксі)етил]піперазин-1іл}-1,1-диметил-4-оксобутилсульфаніл)ацетиламіно]етоксі}етоксі)етоксі]етокси}пропаноату. Одержаний кон’югат піддають кількісному аналізу методом спектрофотометрії, використовуючи -1 -1 -1 -1 коефіцієнти екстинкції ε320нм=7876 М см і ε280нм=4334 М см для димеру томайміцину і -1 -1 ε280нм=208380 М см для hu2H11, було визначено в середньому 3,13 димеру томайміцину на молекулу антитіла. 4.2. N-гідроксисукцинімідил-3-{2-[2-(2-{2-[2-(4-{4-[2-(2,6-біс-[(S)-2-ет-(Е)-иліден-7-диметокси1,2,3,11а-тетрагідропіроло[2,1-c][1,4]бензодіазепін-5-он-8-ілоксиметил]піридин-4ілоксі)етил]піперазин-1-іл}-1,1-диметил-4оксобутилсульфаніл)ацетиламіно]етоксі}етоксі)етоксі]етокси}пропаноат Працюють згідно з прикладом 2, виходячи з 3-{2-[2-(2-{2-[2-(4-{4-[2-(2,6-біс-[(S)-2-ет-(Е)иліден-7-диметокси-1,2,3,11а-тетрагідропіроло[2,1-c][1,4]бензодіазепін-5-он-8ілоксиметил]піридин-4-ілоксі)етил]піперазин-1-іл}-1,1-диметил-4оксобутилсульфаніл)ацетиламіно]етоксі}етоксі)етоксі]етокси}-пропанової кислоти: . 2+ РХ/МС (В): tR=3,27 хв.; [M+Н]+: m/z 1309; [M+2H] : m/z 655. 4.3. 3-{2-[2-(2-{2-[2-(4-{4-[2-(2,6-Біс-[(S)-2-ет-(Е)-иліден-7-диметокси-1,2,3,11атетрагідропіроло[2,1-c][1,4]бензодіазепін-5-он-8-ілоксиметил]піридин-4-ілоксі)етил]піперазин-1 24 UA 106507 C2 5 іл}-1,1-диметил-4-оксобутилсульфаніл)ацетиламіно]-етоксі}етоксі)етоксі]етокси}пропанова кислота Працюють згідно з прикладом 2, виходячи з метил-3-{2-[2-(2-{2-[2-(4-{4-[2-(2,6-біс-[(S)-2-ет(Е)-иліден-7-диметокси-1,2,3,11а-тетрагідропіроло[2,1-с][1,4]бензодіазепін-5-он-8ілоксиметил]піридин-4-ілоксі)етил]піперазин-1-іл}-1,1-диметил-4оксобутилсульфаніл)ацетиламіно]етоксі}етоксі)етоксі]етокси}-пропаноату: 2+ 10 15 20 25 РХ/МС (В): tR=3,16 хв.; [M+Н]+: m/z 1212; [M+2H] : m/z 606. 4.4. Метил-3-{2-[2-(2-{2-[2-(4-{4-[2-(2,6-біс-[(S)-2-ет-(Е)-иліден-7-диметокси-1,2,3,11атетрагідропіроло[2,1-c][1,4]бензодіазепін-5-он-8-ілоксиметил]піридин-4-ілоксі)етил]піперазин-1іл}-1,1-диметил-4-оксобутилсульфаніл)ацетиламіно]етоксі}етоксі)етоксі]етокси}пропаноат Працюють згідно з прикладом 2, виходячи з метил-3-{2-[2-(2-{2-[2-(4-{4-[2-(2,6-бісгідроксиметилпіридин-4-ілоксі)етил]піперазин-1-іл}-1,1-диметил-4оксобутилсульфаніл)ацетиламіно]етоксі}етоксі)етоксі]етокси}пропаноату: . Н-ЯМР (500 МГц, ДМСО-d6): 1,22 (с, 6Н); 1,69 (м, 8Н); 2,37 (м, 2Н); 2,40 (м, 2Н); 2,48 (м, 2Н); 2,53 (т, J=6,1 Гц, 2Н); 2,72 (м, 2Н); 2,92 (м, 2Н); 3,04 (м, 2Н); 3,11 (с, 2Н); 3,19 (кв, J=5,4 Гц, 2Н); 3,39 (т, J=5,4 Гц, 2Н); 3,42 (м, 4Н); 3,49 (м, 12Н); 3,59 (с, 3Н); 3,62 (т, J=6,1 Гц, 2Н); 3,86 (с, 6Н); 3,88 (м, 2Н); 4,10 (м, 4Н); 4,22 (м, 2Н); 5,17 (д, J=13,0 Гц, 2Н); 5,22 (д, J=13,0 Гц, 2Н); 5,55 (м, 2Н); 6,94 (с, 2Н); 7,09 (с, 2Н); 7,38 (с, 2Н); 7,77 (д, J=3,9 Гц, 2Н); 8,01 (т, J=5,4 Гц, 1Н). РХ/МС (В): 2+ tR=3,30 хв.; [M+Н]+: m/z 1225; [M+2H] : m/z 613 (молекулярний пік). 4.5. Метил-3-{2-[2-(2-{2-[2-(4-{4-[2-(2,6-біс-гідроксиметилпіридин-4-ілоксі)етил]піперазин-1іл}-1,1-диметил-4-оксобутилсульфаніл)ацетиламіно]-етоксі}етоксі)етоксі]етокси}пропаноат Працюють згідно з прикладом 2, виходячи з 4-(2-[4-(4-меркапто-4метилпентаноїл)піперазин-1-іл]етокси)-2,6-біс-(гідроксиметил)піридину: 1 . Н-ЯМР (500 МГц, ДМСО-d6): всі сигнали широкі: 1,22 (с, 6Н); 1,71 (м, 2Н); 2,20-2,58 (м частково екранований, 8Н); 2,75 (м, 2Н); 3,12 (м, 2Н); 3,19 (м, 2Н); 3,47-3,53 (м, 18Н); 3,60 (м, 5Н); 4,18 (м, 2Н); 4,46 (м, 4Н); 5,31 (м, 2Н); 6,86 (с, 2Н); 8,00 (м, 1Н). РХ/МС (В): tR=2,20 хв.; [M+Н]+: m/z 717; [M-H+HCО2H]-: m/z 761. 4.6. 4-(2-[4-(4-Меркапто-4-метилпентаноїл)піперазин-1-іл]етокси)-2,6-біс(гідроксиметил)піридин Працюють згідно з прикладом 2, виходячи з 4-(2-[4-(4-метил-4метилдисульфанілпентаноїл)піперазин-1-іл]етокси)-2,6-біс-(гідроксиметил)-піридину: 1 30 35 40 . Н-ЯМР (400 МГц, ДМСО-d6): 1,32 (с, 6Н); 1,76 (м, 2Н); 2,36-2,53 (м частково екранований, 6Н); 2,66 (с, 1Н); 2,75 (т, J=5,5 Гц, 2Н); 3,40-3,52 (м, 4Н); 4,18 (т, J=5,5 Гц, 2Н); 4,46 (с, 4Н); 5,30 (дуже шир.м, 2Н); 6,86 (с, 2Н). РХ/МС (В): tR=0,76 хв.; [M+Н]+: m/z 398; [M-H]-: m/z 396. 4.7. 4-(2-[4-(4-Метил-4-метилдисульфанілпентаноїл)піперазин-1-іл]етокси)-2,6-біс(гідроксиметил)піридин 1 25 UA 106507 C2 5 10 15 20 25 30 35 До 600 мг 4-(2-піперазин-1-ілетокси)-2,6-біс-(гідроксиметил)піридину, розчиненого в 12 мл DMF, додають 344 мкл ТЕА, потім, після 10-хвилинного перемішування, 748 мг 4-метил-4метилдисульфанілпентанової кислоти, 417 мкл діізопропілкарбодііміду і 69 мг 1гідроксибензотриазолгідрату. Після 15 годин протікання реакції при КТ суміш концентрують при ЗТ, додають 15 мл води і екстрагують 2 рази AcOEt. Об'єднані органічні шари сушать над MgSO4, концентрують при ЗТ і очищають флеш-хроматографією на діоксиді кремнію (Analogix Super Flash SiO2 SF25-80g), застосовуючи градієнт від 2 до 10% МеОН в DCM. Одержують 390 мг 4-(2-[4-(4-метил-4-метилдисульфанілпентаноїл)піперазин-1-іл]етокси)-2,6-біс1 (гідроксиметил)-піридину. Н-ЯМР (400 МГц, ДМСО-d6): 1,26 (с, 6Н); 1,79 (м, 2Н); 2,36 (м, 2Н); 2,39 (с, 3Н); 2,40-2,53 (м частково екранований, 4Н); 2,75 (т, J=5,6 Гц, 2Н); 3,45 (м, 4Н); 4,18 (т, J=5,6 Гц, 2Н); 4,46 (д, J=5,9 Гц, 4Н); 5,30 (т, J=5,9 Гц, 2Н); 6,86 (с, 2Н). РХ/МС (А): tR=0,42 хв.; [M+Н]+: m/z 444; [M-H+HCO2H]-: m/z 488. 4.8. 4-(2-Піперазин-1-ілетокси)-2,6-біс-(гідроксиметил)піридин До 2,3 г 4-(2-(4-трет-бутоксикарбонілпіперазин-1-іл)етокси)-2,6-біс-(гідроксиметил)піридину, розчиненого в 33 мл діоксану, додають 19 мл 4М розчину HCl в діоксані. Після 12 годин проведення реакції при КТ утворений осад збирають фільтрацією через фритоване скло, обробляють за допомогою МеОН, потім концентрують при ЗТ і розбавляють в 40 мл суміші МеОН/вода 1/1. Одержаний розчин переносять на колонку Mega BE-SCХ, 25GM 150ML (Varian). Після промивання шару за допомогою МеОН цільовий продукт елююють 2н. розчином аміаку в метанолі. Шар МеОН/NH3 концентрують при ЗТ. Одержують 1,6 г 4-(2-піперазин-1-ілетокси)-2,61 біс-(гідроксиметил)піридину. Н-ЯМР (400 МГц, ДМСО-d6): 2,40 (м, 4Н); 2,68 (м, 6Н); 4,15 (т, J=5,7 Гц, 2H); 4,44 (м, 4Н); 5,29 (м, 2Н); 6,85 (с, 2Н). РХ/МС (А): tR=0,10 хв.; [M+Н]+: m/z 268; 2+ [M+2H] : m/z 134,5; молекулярний пік: m/z 113. 4.9. 4-(2-(4-Трет-бутоксикарбонілпіперазин-1-іл)етокси)-2,6-біс-(гідроксиметил)піридин До 3,1 г діетил-4-[2-(4-трет-бутоксикарбонілпіперазин-1-іл)етокси]-піридин-2,6дикарбоксилату, розчиненого в 105 мл EtOH, додають 779 мг боргідриду натрію і 2,29 г CaCl2. Через 3 години проведення реакції при КТ суміш гідролізують і концентрують при ЗТ. До одержаного залишку додають воду і утворений водний шар екстрагують 4 рази за допомогою AcOEt. Об'єднані органічні шари промивають насиченим водним розчином NaCl, потім концентрують при ЗТ. Одержують 2,4 г 4-(2-(4-трет-бутоксикарбонілпіперазин-1-іл)етокси)-2,61 біс-(гідроксиметил)піридину. Н-ЯМР (400 МГц, ДМСО-d6): 1,39 (с, 9Н); 2,43 (м, 4Н); 2,73 (т, J=5,6 Гц, 2Н); 3,30 (м частково екранований, 4Н); 4,17 (т, J=5,6 Гц, 2Н); 4,45 (д, J=5,9 Гц, 4Н); 5,30 (т, J=5,9 Гц, 2H); 6,86 (с, 2Н). РХ/МС (А): tR=0,24 хв.; [M+Н]+: m/z 368. 4.10. Діетил-4-[2-(4-трет-бутоксикарбонілпіперазин-1-іл)етокси]піридин-2,6-дикарбоксилат 26 UA 106507 C2 5 10 15 20 До розчину 5 г 1-трет-бутоксикарбоніл-4-(2-гідроксіетил)піперазину в 102 мл DCM, охолодженого до 0°С, додають 4,5 мл ТЕА, потім 2 мл метансульфонілхлориду. Після витримування реакції протягом 1 години суміш доводять до КТ. Після перемішування протягом ще 1 години суміш гідролізують і органічний шар промивають 2 рази водою, потім сушать над MgSO4 і концентрують при ЗТ. До одержаного залишку (6,7 г) додають 140 мл DMF і нагрівають до 60°С. Потім додають 190 мг діетилового ефіру хелідамової кислоти (Scrimin Р.; Tecilla Р.; Tonellato U.; Vendrame T.J. Org. Chem. 1989, 54, 5988) і 549 мг K2СО3 і суміш нагрівають при 80°С протягом 20 годин. Після концентрування при ЗТ суміш гідролізують, екстрагують 3 рази AcOEt і об'єднані органічні шари промивають насиченим розчином NaCl, концентрують при ЗТ і очищають флеш-хроматографією на діоксиді кремнію (Analogix Super Flash SiO2 SF25-150g), застосовуючи градієнт від 60 до 85% AcOEt в гептані. Одержують 3,1 г діетил-4-[2-(4-трет1 бутоксикарбонілпіперазин-1-іл)етокси]-піридин-2,6-дикарбоксилату. Н-ЯМР (400 МГц, ДМСОd6): 1,34 (т, J=7,2 Гц, 6Н); 1,39 (с, 9Н); 2,44 (м, 4Н); 2,76 (т, J=5,7 Гц, 2Н); 3,30 (м частково екранований, 4Н); 4,34 (т, J=5,7 Гц, 2Н); 4,38 (кв, J=7,1 Гц, 4Н); 7,74 (с, 2Н). РХ/МС (В): tR=2,81 хв.; [M+Н]+: m/z 452; [MH+HCO2H]-: m/z 496. Приклад 5 5.1. 4-{2-[4-(2-Метил-2-метилдисульфанілпропіл)піперазин-1-іл]етокси}-2,6-біс(гідроксиметил)піридин Одержують згідно з прикладом 1, виходячи з 4-(2-піперазин-1-ілетокси)-2,6-біс(гідроксиметил)піридину: . Н-ЯМР (400 МГц, ДМСО-d6): 1,25 (с, 6Н); 2,39 (с, 3Н); 2,40 (с, 2Н); 2,44-2,57 (м частково екранований, 8Н); 2,69 (т, J=5,7 Гц, 2Н); 4,14 (т, J=5,7 Гц, 2Н); 4,45 (д, J=5,7 Гц, 4Н); 5,29 (т, J=5,7 Гц, 2Н); 6,85 (с, 2Н). РХ/МС (В): tR=0,51 хв.; [M+Н]+: m/z 402. Приклад 6 6.1. Одержання кон’югата Кон’югат одержують згідно з прикладом 1, шляхом взаємодії hu2H11 і Nгідроксисукцинімідил-3-{2-[2-(2-{2-[2-(2-{[2-(2,6-біс-[(S)-2-ет-(Е)-иліден-7-диметокси-1,2,3,11атетрагідропіроло[2,1-c][1,4]бензодіазепін-5-он-8-ілоксиметил]піридин-4-ілоксі)етил]метиламіно}1,1-диметилетилсульфаніл)-ацетилметиламіно]етоксі}етоксі)етоксі]етокси}пропаноату. Одержаний кон’югат піддають кількісному аналізу методом спектрофотометрії, використовуючи -1 -1 -1 -1 коефіцієнти екстинкції ε319нм=7789 М см і ε280нм=4362 М см для димеру томайміцину і -1 -1 ε280нм=208380 М см для hu2H11, було визначено в середньому 2,90 димеру томайміцину на молекулу антитіла. 6.2. N-гідроксисукцинімідил-3-{2-[2-(2-{2-[2-(2-{[2-(2,6-біс-[(S)-2-ет-(E)-иліден-7-диметокси1,2,3,11а-тетрагідропіроло[2,1-c][1,4]бензодіазепін-5-он-8-ілоксиметил]піридин-4ілоксі)етил]метиламіно}-1,1-диметилетилсульфаніл)ацетилметиламіно]етоксі}етоксі)етоксі]етокси}пропаноат Працюють згідно з прикладом 2, виходячи з 3-{2-[2-(2-{2-[2-(2-{[2-(2,6-біс-[(S)-2-ет-(E)-иліден7-диметокси-1,2,3,11а-тетрагідропіроло[2,1-c][1,4]бензодіазепін-5-он-8-ілоксиметил]піридин-4ілоксі)етил]метиламіно}-1,1диметилетилсульфаніл)ацетилметиламіно]етоксі}етоксі)етоксі]етокси}пропанової кислоти: 1 25 30 35 40 45 50 . РХ/МС (F): tR=1,02 хв.; [M+Н]+: m/z 1225; [M+H2O+Н]+: m/z 1243. 6.3. 3-{2-[2-(2-{2-[2-(2-{[2-(2,6-Біс-[(S)-2-ет-(E)-иліден-7-диметокси-1,2,3,11атетрагідропіроло[2,1-c][1,4]бензодіазепін-5-он-8-ілоксиметил]піридин-4-ілоксі)етил]метиламіно}1,1-диметилетилсульфаніл)ацетилметиламіно]етоксі}-етоксі)етоксі]етокси}пропанова кислота Працюють згідно з прикладом 2, виходячи з метил-3-{2-[2-(2-{2-[2-(2-{[2-(2,6-біс-[(S)-2-ет-(E)иліден-7-диметокси-1,2,3,11а-тетрагідропіроло[2,1-c][1,4]бензодіазепін-5-он-8-ілоксиметил]піридин4-ілоксі)етил]метиламіно}-1,1диметилетилсульфаніл)ацетилметиламіно]етоксі}етоксі)етоксі]етокси}пропаноату: 27 UA 106507 C2 5 10 15 . РХ/МС (F): tR=0,97 хв.; [M+Н]+: m/z 1129. 6.4. Метил-3-{2-[2-(2-{2-[2-(2-{[2-(2,6-біс-[(S)-2-ет-(E)-иліден-7-диметокси-1,2,3,11атетрагідропіроло[2,1-c][1,4]бензодіазепін-5-он-8-ілоксиметил]піридин-4-ілоксі)етил]метиламіно}1,1-диметилетилсульфаніл)-ацетилметиламіно]етоксі}етоксі)етоксі]етокси}пропаноат Працюють згідно з прикладом 2, виходячи з метил-3-{2-[2-(2-{2-[2-(2-{[2-(2,6-бісгідроксиметилпіридин-4-ілоксі)етил]метиламіно}-1,1диметилетилсульфаніл)ацетилметиламіно]етоксі}етоксі)етоксі]етокси}пропаноату: . Н-ЯМР (500 МГц, ДМСО-d6): широкі смуги поглинання при: 1,20 (с, 6H); 1,58-1,73 (м, 6H); 2,38 (с, 3Н); 2,52-3,07 (м, 13Н); 3,36-3,63 (м, 23Н); 3,67-3,91 (м, 8Н); 4,06-4,26 (м, 6Н); 5,02-5,26 (м, 4Н); 5,33-5,60 (м, 2Н); 6,39-7,42 (м, 6Н); 7,76 (м, 2Н). РХ/МС (А): tR=0,77 хв.; [M+Н]+: m/z 1 2+ 142; [M+2H] : m/z 571,5 (молекулярний пік). 6.5. Метил-3-{2-[2-(2-{2-[2-(2-{[2-(2,6-біс-гідроксиметилпіридин-4-ілоксі)етил]метиламіно}-1,1диметилетилсульфаніл)ацетилметиламіно]етоксі}-етоксі)етоксі]етокси}пропаноат Працюють згідно з прикладом 2, виходячи з метил-3-{2-[2-(2-{2-[(2йодацетил)метиламіно]етоксі}етоксі)етоксі]етокси}пропаноату: 1 . Н-ЯМР (400 МГц, ДМСО-d6): розділення ротамерів 50-50 при: 1,22 (с, 3H); 1,24 (с, 3Н); 2,41 (с, 3Н); 2,53 (т, J=6,2 Гц, 2Н); 2,56 (м, 2Н); 2,80 (с, 1Н); 2,88 (т, J=5,9 Гц, 2Н); 3,05 (с, 2Н); 3,353,58 (м, 18Н); 3,59 (с, 3Н); 3,62 (т, J=6,2 Гц, 2Н); 4,13 (т, J=5,9 Гц, 2Н); 4,45 (д, J=5,9 Гц, 4Н); 5,29 (т, J=5,9 Гц, 2Н); 6,85 (с, 2Н). РХ/МС (В): tR=2, 18 хв.; [M+Н]+: m/z 634; [M-H+HCO2H]-: m/z 678. 6.6. Метил-3-{2-[2-(2-{2-[(2-йодацетил)метиламіно]етоксі}етоксі)етоксі]-етокси}пропаноат 1 20 25 30 35 40 До 215 мг метил-3-(2-{2-[2-(2-метиламіноетоксі)етоксі]етоксі}-етокси)пропаноату додають 117,4 мг N-гідроксисукцинімідилйодацетату, розчиненого в 6,5 мл DCM. Після 2 годин реакції при КТ суміш концентрують при ЗТ і очищають флеш-хроматографією на діоксиді кремнію (Analogix Super Flash SiO2 SF25-24g), застосовуючи градієнт від 0 до 6% МеОН в DCM. Одержують 210 мг метил-3-{2-[2-(2-{2-[(2-йодацетил)метиламіно]етоксі}1 етоксі)етоксі]етокси}пропаноату. Н-ЯМР (400 МГц, ДМСО-d6): розділення ротамерів 55-45 при: 2,54 (т, J=6,2 Гц, 2H), 2,83 (с, 1,35Н) 3,02 (с, 1,65Н); 3,36-3,55 (м, 16Н), 3,60 (с, 3Н), 3,63 (т, J=6,2 Гц, 2H), 3,83 (с, 1,1Н), 3,88 (с, 0,9Н). РХ/MС (А): tR=0,62 хв.; [M+Н]+: m/z 462. 6.7. Метил-3-(2-{2-[2-(2-метиламіноетоксі)етоксі]етоксі}етокси)пропаноат До 390 мг метил-3-[2-(2-{2-[2-(трет-бутоксикарбонілметиламіно)етоксі]етоксі}етоксі)етокси]пропаноату, розчиненого в 5,3 мл діоксану, додають 3 мл 4М розчину HCl в діоксані. Після проведення реакції протягом 12 годин при КТ суміш концентрують при ЗТ, розчиняють в мінімальній кількості метанолу і переносять на колонку Mega BE-SCX, 10GM 60ML (Varian). Після промивання шару за допомогою МЕОН цільовий продукт елююють 2н. розчином аміаку в метанолі. Шар метанол/NH3 концентрують при ЗТ. Одержують 270 мг метил-3-(2-{2-[21 (2-метиламіноетоксі)етоксі]етоксі}етокси)пропаноату. Н-ЯМР (400 МГц, ДМСО-d6): 2,28 (с, 3Н); 2,54 (т, J=6,2 Гц, 2Н); 2,59 (т, J=5,9 Гц, 2Н); 3,44 (т, J=5,9 Гц, 2Н); 3,47-3,54 (м, 12Н); 3,60 (с, 3Н); 3,63 (т, J=6,2 Гц, 2Н). РХ/МС (А) (ELSD): tR=0,30 хв.; [M+Н]+: m/z 294. 28
ДивитисяДодаткова інформація
Назва патенту англійськоюConjugates of pyrrolo[1,4]benzodiazepine dimers as anticancer agents
Автори англійськоюCommercon, Alain, Gauzy-Lazo, Laurence
Автори російськоюКоммерсон Ален, Гози-Лазо Лоранс
МПК / Мітки
МПК: A61K 31/551, A61P 35/00, C07D 519/00
Мітки: піроло[1,4]бензодіазепіну, засіб, протираковій, димерів, кон'югати
Код посилання
<a href="https://ua.patents.su/48-106507-konyugati-dimeriv-pirolo14benzodiazepinu-yak-protirakovijj-zasib.html" target="_blank" rel="follow" title="База патентів України">Кон’югати димерів піроло[1,4]бензодіазепіну як протираковий засіб</a>
Попередній патент: Інсулінвмісний фармацевтичний препарат для перорального застосування
Наступний патент: Спосіб та пристрій для завантаження плавильного агрегату
Випадковий патент: Спосіб портової перевалки вугілля із залізничного потяга на судна












