Селективні модулятори рецепторів естрогену для лікування вазомоторних симптомів
Номер патенту: 85862
Опубліковано: 10.03.2009
Автори: Хінклін Рональд Джей, Уолліс Оуен Брендан, Франк Скотт Алан, Даллі Роберт Дін, Шеперд Тімоті Алан, Додж Джеффрі Алан
Формула / Реферат
1. Сполуки формули І:
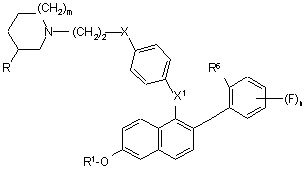 , (I)
, (I)
де:
m - 0, 1 або 2;
n - 1, 2, 3 або 4;
R - Н або метил, за умови, що коли m - 1 або 2, то R має бути Н, і якщо m=0, то R має бути метилом;
R1 - Н, SO2(н-С4-С6-алкіл) або COR2;
Х - О або NR3;
X1 - О, СН2 або С=О;
R6 - Н або F, або R6 спільно з X1 утворює групу формули:
 ,
,
де Y - О, S, SO aбo NR4;
R2 - С1-С6-алкіл; С1-С6-алкоксигрупа; NR5R5a; феноксигрупа; або феніл, факультативно заміщений галогеном;
R3 та R4 незалежно один від одного - Н або С1-С6-алкіл; і
R5 та R5a незалежно один від одного - Н, С1-С6-алкіл або феніл; або фармацевтична сіль такої сполуки з кислотою;
причому згадана сполука формули І не є
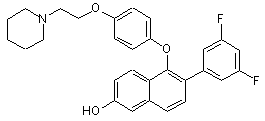 .
.
2. Сполука за п. 1, де m - 1 або 2, R1 - Н або COR2 і R2 - С1-С4-алкіл, NHCH3 або феніл, Х - О, Х1 - О або СН2 і Y - О або S.
3. Сполука за п. 1 або п. 2, де R1 - Н.
4. Сполука за будь-яким із пп. 1-3, де m=1, R6 - Н або F; і X1 - О.
5. Сполука за будь-яким із пп. 1-3, де m=1, R6 поєднаний з Х1 і Y - О.
6. Сполука за будь-яким із пп. 1-3, де m=1, R6 поєднаний з Х1 і Y - S.
7. Сполука за будь-яким із пп. 1-4, де загальна кількість атомів фтору при n та R6 є 1, 2 або 3.
8. Сполука за будь-яким із пп. 1-4, де загальна кількість атомів фтору при n та R6 є 1 або 2.
9. Сполука за будь-яким із пп. 1-3, п. 5 або п. 6, де R6 поєднаний з X1, n=2 і відповідні атоми фтору стоять у положеннях 3 та 5.
10. Сполука за будь-яким із пп. 1-3, п. 5 або п. 6, де R6 поєднаний з X1, n=1 і відповідний атом фтору стоїть у положенні 4.
11. Сполука за будь-яким із пп. 1-4, п. 7 або п. 8, де R6 - Н, n=2 і відповідні атоми фтору стоять у положеннях 3 та 5.
12. Сполука за будь-яким із пп. 1-4, п. 7 або п. 8, де R6 - Н, n=1 і відповідний атом фтору стоїть у положенні 4.
13. Сполука формули
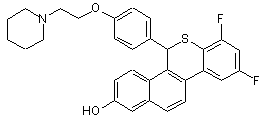
або фармацевтична сіль такої сполуки з кислотою.
14. Сполука за будь-яким із пп. 1-13 для застосування при лікуванні одного або кількох вазомоторних симптомів.
15. Сполука за п. 14, де лікуванню підлягає один симптом, і цей симптом є припливом.
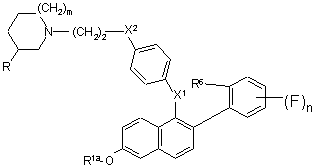
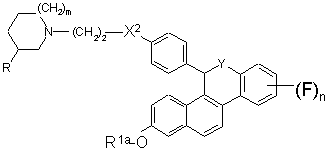
16. Сполука формули II:
 , II
, II
де:
m - 0, 1 або 2;
n - 1, 2, 3 або 4;
R - В або метил, за умови, що коли m - 1 або 2, то R має бути Н, і якщо m=0, то R має бути метилом;
R1a - Н, SO2СН3, SO2(н-С4-С6-алкіл), COR2, С1-С6-алкіл або бензил;
X1 - О, СН2 або С=О;
X2 - О або NR7;
R6 - Н або F, або R6 спільно з Х1 утворює групу формули:
 ,
,
де Y - О, S, SO aбo NR4;
R2 - С1-С6-алкіл; С1-С6-алкоксигрупа; NR5R5a; феноксигрупа; або феніл, факультативно заміщений галогеном;
R4 - Н або С1-С6-алкіл;
R5 та R5a незалежно один від одного - Н, С1-С6-алкіл або феніл;
R7 - Н, С1-С6-алкіл або СO2(С1-С6-алкіл); за умови, що коли R1a - Н, SO2(н-С4-С6-алкіл) або COR2, то X2 - NR7 і R7 - СO2(С1-С6-алкіл); або сіль цієї сполуки з кислотою; причому згадана сполука формули II не є
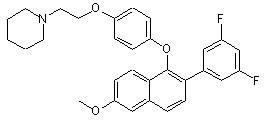 .
.
17. Сполука за п. 16, де m=1, R1a є SO2CH3, бензил або метил, R6 поєднаний з X1, Y - О або S, та X2 - О.
18. Сполука за будь-яким із п. 16 або п. 17, де n=2 і відповідні атоми фтору стоять у положеннях 3 та 5.
19. Сполука за п. 16, яка являє собою
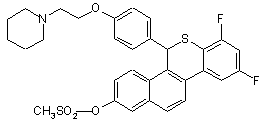 ,
,
або фармацевтична сіль такої сполуки з кислотою.
20. Сполука формули III:
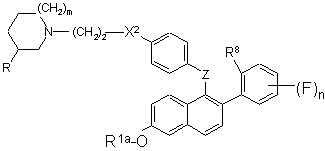 , III
, III
де:
m - 0, 1 або 2;
n - 1, 2, 3 або 4;
R - Н або метил, за умови, що коли m - 1 або 2, то R має бути Н, і якщо m=0, то R має бути метилом;
R1a - Н, SO2СН3, SO2(н-С4-С6-алкіл), COR2, С1-С6-алкіл або бензил;
R8 - ОН, O(С1-С6-алкіл), S(С1-С6-алкіл) або NR4(CO2(C1-C6-алкіл);
X2 - О або NR7;
Z - С=O або СНОН;
R2 - С1-С6-алкіл; С1-С6-алкоксигрупа; NR5R5a; феноксигрупа; або феніл, факультативно заміщений галогеном;
R4 - Н або С1-С6-алкіл;
R5 та R5a незалежно один від одного - Н, С1-С6-алкіл або феніл; і
R7 - Н, С1-С6-алкіл або СO2(С1-С6-алкіл); або сіль цієї сполуки з кислотою.
21. Сполука за п. 20, де m=2, n - 1 або 2, R1a - Н, SО2СН3, бензил або метил та X2 - О.
22. Сполука за п. 20 або п. 21, де n=2 і відповідні атоми фтору стоять у положеннях 3 та 5.
23. Сполука за будь-яким із пп. 20-22, де R8 - ОН, О(СН3), ОСН(СН3)2, S(СН3) або NR4(CO2(трет-бутил)) і R4 - Н або метил.
24. Сполука за п. 20, вибрана з групи, яку складають
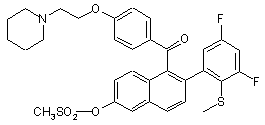 та
та 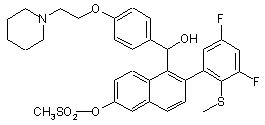 ,
,
або фармацевтична сіль такої сполуки з кислотою.
Текст
1. Сполуки формули І: 3 85862 4 5. Сполука за будь-яким із пп. 1-3, де m=1, R6 поR2 - С1-С6-алкіл; С1-С6-алкоксигрупа; NR5R5a; феєднаний з Х1 і Y - О. ноксигрупа; або феніл, факультативно заміщений 6. Сполука за будь-яким із пп. 1-3, де m=1, R6 погалогеном; єднаний з Х1 і Y - S. R4 - Н або С 1-С6-алкіл; 7. Сполука за будь-яким із пп. 1-4, де загальна R5 та R5a незалежно один від одного - Н, С1-С66 кількість атомів фтору при n та R є 1, 2 або 3. алкіл або феніл; 8. Сполука за будь-яким із пп. 1-4, де загальна R7 - Н, С1-С6-алкіл або СO2(С1-С6-алкіл); за умови, кількість атомів фтору при n та R6 є 1 або 2. що коли R1a - Н, SO2(н-С4-С6-алкіл) або COR2, то 9. Сполука за будь-яким із пп. 1-3, п. 5 або п. 6, де X2 - NR7 і R7 - СO2(С1-С6-алкіл); або сіль цієї сполуR6 поєднаний з X1, n=2 і відповідні атоми фтору ки з кислотою; причому згадана сполука формули стоять у положеннях 3 та 5. II не є O 10. Сполука за будь-яким із пп. 1-3, п. 5 або п. 6, N F де R6 поєднаний з X1, n=1 і відповідний атом фтору стоїть у положенні 4. O 11. Сполука за будь-яким із пп. 1-4, п. 7 або п. 8, 6 де R - Н, n=2 і відповідні атоми фтору стоять у F положеннях 3 та 5. 12. Сполука за будь-яким із пп. 1-4, п. 7 або п. 8, O . де R6 - Н, n=1 і відповідний атом фтору стоїть у 17. Сполука за п. 16, де m=1, R 1a є SO2CH3, бензил положенні 4. або метил, R6 поєднаний з X1, Y - О або S, та X2 13. Сполука формули О. O 18. Сполука за будь-яким із п. 16 або п. 17, де n=2 N F і відповідні атоми фтору стоять у положеннях 3 та S 5. 19. Сполука за п. 16, яка являє собою F O N F HO S або фармацевтична сіль такої сполуки з кислотою. 14. Сполука за будь-яким із пп. 1-13 для застосування при лікуванні одного або кількох вазомоторних симптомів. 15. Сполука за п. 14, де лікуванню підлягає один симптом, і цей симптом є припливом. 16. Сполука формули II: F CH3SO2 , або фармацевтична сіль такої сполуки з кислотою. 20. Сполука формули III: (CH 2) m (CH2) m (CH2 )2 N O N X2 (CH 2)2 X2 R8 R R X1 R6 (F)n Z (II) R1a-O R1a -O , де: m - 0, 1 або 2; n - 1, 2, 3 або 4; R - В або метил, за умови, що коли m - 1 або 2, то R має бути Н, і якщо m=0, то R має бути метилом; R1a - Н, SO2СН3, SO2(н-С4-С6-алкіл), COR2, С1-С6алкіл або бензил; X1 - О, СН2 або С=О; X2 - О або NR7; R6 - Н або F, або R6 спільно з Х1 утворює групу формули: (CH2 )m N (CH 2) 2 X2 Y R (F)n R 1a-O де Y - О, S, SO aбo NR 4; , (F) n (III) , де: m - 0, 1 або 2; n - 1, 2, 3 або 4; R - Н або метил, за умови, що коли m - 1 або 2, то R має бути Н, і якщо m=0, то R має бути метилом; R1a - Н, SO2СН3, SO2(н-С4-С6-алкіл), COR2, С1-С6алкіл або бензил; R8 - ОН, O(С1-С6-алкіл), S(С1-С6-алкіл) або NR4(CO2(C1-C6-алкіл); X2 - О або NR7; Z - С=O або СНОН; R2 - С1-С6-алкіл; С1-С6-алкоксигрупа; NR5R5a; феноксигрупа; або феніл, факультативно заміщений галогеном; R4 - Н або С 1-С6-алкіл; R5 та R5a незалежно один від одного - Н, С1-С6алкіл або феніл; і R7 - Н, С1-С6-алкіл або СO2(С1-С6-алкіл); або сіль цієї сполуки з кислотою. 21. Сполука за п. 20, де m=2, n - 1 або 2, R1a - Н, SО2СН3, бензил або метил та X2 - О. 5 85862 22. Сполука за п. 20 або п. 21, де n=2 і відповідні атоми фтору стоять у положеннях 3 та 5. 23. Сполука за будь-яким із пп. 20-22, де R8 - ОН, О(СН3), ОСН(СН3)2, S(СН3) або NR4(CO2(третбутил)) і R 4 - Н або метил. 24. Сполука за п. 20, вибрана з групи, яку складають N O 6 N O F OH F CH3SO2 O S , або фармацевтична сіль такої сполуки з кислотою. F O F CH3SO2 O S та "Вазомоторні симптоми", тобто напади відчуття жару ("припливи"), нічне потіння, вагінальна сухість, порушення сну, нудота та різкі зміни настрою, звичайно виникають у жінок при наближенні менопаузи. Дійсно, більшість жінок у постклімактеричному періоді відчуває вазомоторні симптоми, і значна частка таких жінок продовжують страждати від цих симптомів протягом більше п'яти років [Psychosom. Med. 1965, 27, 266; Med. gynecol. Soc. 1969, 4, 268]. До припливів особливо схильні жінки, які перенесли двосторонню оваріектомію, радіотерапію або лікування агоністами gnRH (гормону вивільнення гонадотропіну) [Br. J. Obstet. gynaecol. 1977, 84, 769]. Сповіщається, що чоловіки також відчувають вазомоторні симптоми після лікування агоністом gnRH [N. Engl. J. Med. 1981, 305, 663] або після орхідектомії [Urology 1980, 16, 620]. Хоча ще сотні років назад вазомоторні симптоми були ідентифіковані як захворювання, пов'язане з менопаузою, механізм, який спричиняє їх виникнення, точно не з'ясовано. Проте широко визнано зв'язок таких симптомів із відхиленням від норми рівня естрогену (внаслідок природної менопаузи або з інших причин). Цікаво, що жінки з низькими рівнями естрогену, спричиненим дисгенезією яєчників, як правило, не страждають на вазомоторні симптоми, за винятком випадків, коли до них попередньо була застосована гормонозаміщувальна терапія (HRT), яка потім була припинена [Clin. Endocrinol. (Oxf) 1985, 22, 293]; це дозволяє припустити, що причиною вазомоторної нестабільності може бути естрогенна абстиненція. На даний час HRT віддається перевага як стандартному способу лікування вазомоторних симптомів, і вона є ефективною у більш ніж 80% жінок, які починають лікування; цей факт також свідчить про певну роль естрогену в етіології вазомоторних симптомів. Припливи характеризуються відчуттям теплоти, яке починається у грудя х і поширюється на шию та голову, і часто супроводжуються потінням, прискоренням серцевих скорочень та почервонінням шкіри. Напади тривають від 30с до 10хв. Вважається, що приплив сам по собі опосередковується центральною нервовою системою і спричиняється тимчасовим зниженням встановленого рівня терморегуляції у гіпоталамусі [огляд з проблеми дивись Can. J. Physiol. Pharmacol. 1987, 65, 1312]. У регуляції терморегуляторного процесу можуть брати участь, поряд з іншими чинниками, катехоламіни, естроген, тестостерон, опіоїди та серотонін [огляд з проблеми дивись Мауо. Clin. Proc. 2002, 77, 1207]. Дійсно, сполуки, які модулюють сигнальний шлях для кожного з цих гормонів та нейротрансмітерів мають певне значення при лікуванні припливів. [Дивись, наприклад, Ann. Intern. Med. 2000, 132, 788; Вr. Med. J. 1974, і, 409; Maturitas, 1978, 1, 21; Med. J. Aust. 1986, 144, 369; Fertil. Steril. 1985, 43, 401; Br. J. Obstet. Gynaecol. 1981, 88, 919; J. Clin. Endocrinol. Metab. 1984, 58, 578; Clin. Endocrinol. 1985, 22, 293; Maturitas 2000, 36, 155; J. Clin. Oncol 2002, 20, 1583; JAMA 2003, 289, 2827; Lancet 2000, 356, 2059; N. Engl. J. Med. 1994, 331, 347; Obstet. Gynecol. 1984, 63, 1; Obstet. Gynecol. 1999, 94, 225; Br. J. Obstet. Gynecol. 1998, 105, 904; Neurology 2000, 54, 2161; Obstet. Gynecol. 1998, 72, 688; J. Clin. Oncol. 1998, 16, 495; J. Clin. Oncol. 2001, 19, 2739; та J. Nutr. 2001, 131 (11, supl), 3095s]. Незважаючи на значну кількість способів лікування припливів, усі сучасні способи терапії мають недостатню ефективність, пов'язану з неприйнятними побічними ефектами, або протипоказані для деяких груп пацієнтів. Наприклад, HRT не рекомендується для жінок, які у минулому хворіли на рак молочної залози, рак матки, рак яєчників або венозну тромбоемболію. Згідно з сучасними даними, HRT може бути непридатною для жінок з ішемічною хворобою серця. Негормональні способи терапії, як правило, є не досить ефективними (наприклад, клонідин) та/або спричиняють негативні ефекти (наприклад, венлафаксин, габапентин). За останні десять років з'явилися численні публікації, де описано селективні модулятори рецепторів естрогену (SERM), наприклад, [патенти США №5,484,795, №5,484,798, №5,510,358, №5,998,401 та WO 96/09040]. Взагалі кажучи, з'ясовано, що багато таких SERM виявляють сприятливу активність як агоністи естрогену у кістковій та серцевосудинній системах та одночасну сприятливу акти 7 85862 8 вність як антагоністи естрогену у молочній залозі. Цей винахід стосується також фармацевтичної Виявлено також, що невелика особливо корисна композиції, яка містить сполуку формули І або фагрупа таких сполук є антагоністами естрогену або рмацевтичну сіль такої сполуки з кислотою та фавиявляє неестрогенний ефект у матці. Проте реармацевтичний носій. За іншим варіантом здійсненльному застосуванню SERM при лікуванні вазомоня, фармацевтична композиція за цим винаходом торних симптомів також заважають ускладнення, може бути адаптована для лікування одного або пов'язані з проблемами ефективності. Наприклад, кількох вазомоторних симптомів. на протязі третьої фази клінічних досліджень раЦей винахід стосується також способів лікулоксифену як засобу для лікування або профілаквання одного або кількох вазомоторних симптомів тики постклімактеричного остеопорозу дія ралокіз застосуванням сполуки формули І або фармасифену пов'язується з незначним збільшенням цевтичної солі такої сполуки. частоти припливів у порівнянні з плацебо, а тамокКрім того, цей винахід стосується сполуки фосифен, як відомо, викликає припливи у більш ніж рмули І або фармацевтичної солі такої сполуки 50% пацієнтів [Arch. Intern. Med. 1991, 151, 1842]. для застосування при лікуванні одного або кількох Таким чином, продовжує існувати незадоволевазомоторних симптомів. Далі, цей винахід стосуна медична потреба у способах лікування вазомоється застосування сполуки формули І або фарторних симптомів, які забезпечують уникнення мацевтичної солі такої сполуки для виготовлення вад, притаманних існуючим способам терапії. Зоклікарського засобу для лікування одного або кільрема, існує потреба у лікарських засобах, які макох вазомоторних симптомів. ють позитивні характеристики описаних раніше Цей винахід стосується також сполуки формуSERM, наприклад, ралоксифену (тобто позитивний ли II: вплив на кісткову систему, матку, молочні залози та серцево-судинну систему), але також полегшують вазомоторні симптоми. Цей винахід стосується сполуки формули І: де: m - 0, 1 або 2; n - 1, 2, 3 або 4 ; R - Η або метил, за умови, що коли m - 1 або 2, то R має бути Н, і якщо m=0, то R має бути метилом; R1 - Н, SО 2(н-С4-С6-алкіл) або COR2; X - О або NR3; X1 - О, СН2 або С=О; R6 - Η або F, або R6 спільно з X1 утворює груп у формули: де Υ - О, S, SO або NR4; R2 - С1-С6-алкіл; С1-С6-алкоксигрупа; NR5R5a; феноксигрупа; або феніл, факультативно заміщений галогеном; R3 та R4 незалежно один від одного - Η або С1С6 алкіл; і R5 та R5a незалежно один від одного - Н, С1С6-алкіл або феніл; або фармацевтична сіль такої сполуки з кислотою. або солі цієї сполуки з кислотою, де m, n, R, та X1 відповідають поданим вище визначенням для сполуки формули І і: R1a - Η, SO2CH3, SО 2(н-С4-С6-алкіл), COR2, С1С6-алкіл або бензил; R6 - Η або F, або R6 спільно з X1 утворює груп у формули: де Υ відповідає поданому вище визначенню для сполуки формули І; X2 - О або NR7; і R7 - Н, С1-С6-алкіл або СО2(С1-С6-алкіл); за умови, що коли R1a - Η, SО2(н-С4-С6-алкіл) або COR2, то X2 - NR 7 і R7 - СО 2(С1-С6-алкіл); корисної як проміжний продукт для одержання сполуки формули І. Цей винахід стосується також сполуки формули III: 9 85862 або солі цієї сполуки з кислотою, де m, n, R та R1a відповідають поданим вище визначенням для сполуки формули II і де: X2 - О або NR7; R8 - ОН, О(С1-С6-алкіл), S(С1-С6-алкіл) або 4 NR (СО2(С1-С6-алкіл)); Ζ - С=О або СНОН; і R7 - Н, С1-С6-алкіл або СО2(С1-С6-алкіл); корисної як проміжний продукт для одержання сполуки формули І, де R6 поєднаний з X1. Якщо не вказано інакше, у поданому нижче описі посилання на "сполуку формули І" о хоплює фармацевтичні солі цієї сполуки з кислотами. Сполуки за цим винаходом містять один або кілька хіральних центрів і можуть існувати у різноманітних стереоізомерних конфігураціях. Внаслідок присутності цих хіральних центрів сполуки за цим винаходом можуть мати форму рацематів, сумішей енантіомерів та індивідуальних енантіомерів, а також діастереомерів та сумішей діастереомерів. Усі такі рацемати, енантіомери та діастереомери охоплюються обсягом цього винаходу. Нижче подано визначення термінів, що вживаються в описі та в формулі винаходу для цілей цього винаходу. Термін "галоген" охоплює фтор, хлор, бром та йод. Термін "С1-С6-алкіл" означає вуглеводневу груп у прямої, розгалуженої або циклічної будови, які містить від одного до шести атомів вуглецю, наприклад, метил, етил, н-пропіл, ізопропіл, циклопропіл, н-бутил, ізобутил, втор-бутил, третбутил, циклобутан, пентил, циклопентан, гексил, циклогексил тощо. Такі групи, як циклобутилметиленіл та циклопропілметиленеїл, також охоплюються поняттям "С1-С6-алкіл". Термін "С1-С4-алкіл" стосується конкретно таких груп: метил, етил, нпропіл, ізопропіл, циклопропіл, н-бутил, ізобутил, втор-бутил, трет-бутил, циклопропілметил та циклобутан. Термін "н-С4-С6-алкіл" стосується конкретно таких груп: н-бутил, н-пентил та н-гексил. Термін "С1-С6-алкокси(група)" означає С1-С6-алкіл, приєднаний до решти молекули через кисневий місток. Термін "фармацевтичний", що вживається в цьому описі як прикметник, означає практичну нешкідливість. Фармацевтична "сіль з кислотою" є сіль, що утворюється при реакції сполуки формули І у формі вільної основи з фармацевтичною кислотою згідно з описом у ["Енциклопедії фармацевтичної технології" під редакцією Суорбріка та Бойлена (Encyclopedia of Pharmaceutical Technology, editors James Swarbrick and James С Boylan, Vol 13, 1996, "Preservation of Pharmaceutical Products to Salt Forms of Drugs and Absorption")]. Необмежувальними прикладами конкретних сольових форм є: ацетат, бензоат, бензолсульфонат, 4хлорбензолсульфонат, цитрат, етансуль фонат, фумарат, d-глюконат, d-глюкуронат, глуратат, гіпурат, гідрохлорид, 2-гідроксіетансульфонат, dlлактат, малеат, d-малат; l-малат, малонат, dманделат, l-манделат, метансульфонат, 1,5нафталіндисульфонат, 2-нафталінсульфонат, фосфат, саліцилат, сукцинат, сульфат, d-тартрат, lтартрат та n-толуолсульфонат. 10 Терміни "лікування" та "лікувати" у значенні, вживаному в цьому описі, означають полегшення, покращення, профілактику, запобігання, обмеження, уповільнення, припинення або зміну напрямку розвитку або тяжкості патологічного стану або його ускладнень, описаних у цьому документі. Термін "профілактика" означає зниження ймовірності виникнення, подальшого виникнення або розвитку будь-якого з патологічних станів або їх ускладнень, описаних у цьому документі, у пацієнта, в організм якого вводять сполуку формули І. Термін "вазомоторний симптом" означає стан, вибраний з групи, яку складають: напади відчуття жару, нічне потіння, вагінальна сухість, порушення сну, н удота та різкі зміни настрою, причому цей стан є наслідком зниження рівня циркулюючого ендогенного естрогену, яке виникає в організмі жінки після припинення або зниження частоти менструацій внаслідок природних причин, хірургічного втр учання або інших процесів. Термін "жінка, яка цього потребує" означає або жінку, яка страждає на згаданий патологічний стан, або жінку з відомим ризиком виникнення такого стану, визначеним шляхом медичної діагностики, тобто визначеним лікарем-куратором. Термін "ефективна кількість" у значенні, вживаному в цьому описі, означає кількість сполуки формули І, здатн у лікувати патологічні стани, описані в цьому документі. Сполуки та варіанти здійснення винаходу, яким віддається перевага Деякі сполуки за цим винаходом становлять особливий інтерес, і їм віддається перевага. У поданих нижче переліках охарактеризовано кілька груп сполук, яким віддається перевага. Мається на увазі, що кожний з цих переліків можна комбінувати з іншими переліками та утворювати таким чином додаткові групи сполук, яким віддається перевага. Для опису положень фторного замісника, яким віддається перевага, буде застосовано подану нижче систему нумерації. a) m - 1; b) R 6 - Η або F та n - 1, 2 або 3; c) n - 1, 2 або 3; d) n - 1 або 2; e) n - 1; f) n - 2; g) R6 - Η або поєднаний з X1, n - 1, та відповідний фторний замісник стоїть у положенні 4; h) R6 - Η або поєднаний з X1, n - 2, та відповідні фторні замісники стоять у положеннях 3,5; і) R1 - Н; j) R1 - Η або COR2 та R 2 - С1-С 6-алкіл або феніл; k) R1 - Η або COR2 та R2 - С1-С4-алкіл, NHCH3 або феніл; l) R 3 - Н, метил або етил; m) R3 - Н; 11 n) Χ - О; о) X - NR 3 та R3 - Η або метил; р) X1 - О; q) R 6 - Η або F; r) R6 поєднаний з X1; s) форма гідрохлоридної солі. Щодо позначеного нижче хірального центра: 85862 перевага віддається енантіомерному надлишку (ее) понад 90%, більша перевага віддається ее понад 95%, а найбільша перевага віддається ее понад 99%. Пересічному фахівцю в галузі легко визначити ступінь енантіомерного збагачення, застосувавши стандартні способи, наприклад, газову або високоефективну рідинну хроматографію на хіральному сорбенті [дивись, наприклад, монографії Жака та ін. "Енантіомери, рацемати та їх розділення" - J. Jacques, et al., "Enantiomers, Racemates. and Resolutions". John Wiley and Sons, Inc., 1981; Ельєля та Уайлена "Стереохімія органічних сполук" - E.L. Eliel and S.H. Wilen," Stereochemistry of Organic Compounds", (WileyInterscience 1994), та заявку на європейський патент ЕР-А-838448, опубліковану 29 квітня 1998p.]. Очевидно, що перевага віддається енантіомеру, який виявляє сприятливу активність у біологічних випробуваннях, описаних у цьому документі. При застосуванні хроматографічних способів, вказаних у цьому описі, енантіомер, якому віддається перевага (енантіомер зі сприятливою активністю), як правило, має більший час затримання, тобто виходить із колонки другим. Для підтвердження ідентифікації енантіомера, якому віддається перевага, у будь-якій конкретній рацемічній суміші активність індивідуальних ізомерів має бути перевірена у біологічних випробуваннях, описаних у цьому документі. Перевага віддається застосуванню сполуки формули І при лікуванні припливів. Відповідно до варіантів, яким віддається перевага, сполуку формули І перед введенням в організм пацієнтки вводять до складу одиничної дозованої форми, тобто індивідуальної одиниці носія для постачання лікарської речовини, наприклад, таблетки або капсули. Відповідно до варіантів, яким віддається перевага, сполуку формули І застосовують перорально. Синтез Сполуку формули І можна одержати, як описано нижче у схемі (де R8a є R8, Η або F), підготовчих синтезах та у прикладах. 12 За Схемою 1 сполуку формули V вводять у реакцію зі сполукою формули IV у звичайних умовах реакцій Сузукі або Стілле, тобто одним із замісників "А" або "D" є гр упа борної кислоти або її складного ефіру, або алкілстанату, а др угий є відщеплюваною групою, наприклад, хлором, бромом або йодом, або сульфонатною групою, наприклад, трифторметилсульфонатом, і одержують сполуку формули VI (якщо R8a - R8, то одержують сполуку формули III). Якщо у сполуці формули VI X1 є СО, то кетогрупу можна відновити у стандартних умовах, наприклад, застосовуючи бороводень, і одержати відповідний бензиловий спирт. Цей відновлений продукт можна піддати циклізації у стандартних умовах, наприклад, якщо R8a - F, шляхом основного каталізу з трет-бутилатом натрію, або, якщо R8a не є F, шляхом кислотного каталізу з HCl, і одержати відповідну сполуку формули І або формули II. За альтернативним варіантом, кетогрупу можна відновити в умовах, які сприяють реакції замикання циклу, таким чином, виконують обидві стадії "в одній посудині" (дивись, наприклад, Приклад 96 та Приклад 108). Якщо R1a - SO2CH3 , С1-С6-алкіл або бензил (переважно метил, бензил або SO2CH3), то згадані групи захисту гідроксилу можна відщепити у стандартних умовах [дивись, наприклад, подані нижче методики або останнє видання монографії Гріні "Захисні групи в органічному синтезі" - Greene, Protective groups in Organic Synthesis, John Wiley & Sons, New York, N.Y.], і одержати сполуку формули І, де R1 - Н. Аналогічно, якщо X2 є NR7 і R7 є СО2(С1-С6-алкіл), то згадані групи захисту аміну також можна відщепити способами, описаними у монографії Гріні. Сполуку формули І, де R1 - Н, можна дериватизувати, застосовуючи стандартні методики ацилювання або сульфонілування, і 13 85862 14 одержати сполуку формули І, де R1 - COR2 або N-бромсукцинимід (NBS, 21,5г, 120ммоль) протяSО2(н-С4-С6-алкіл). гом 30хв. Через 45хв розбавляють суміш водою Сполуки формули IV можна одержати, як по(800мл), збирають та сушать осад, одержуючи казано нижче, або за методиками, аналогічними 25,5г (87%) 1-бром-6-метоксинафталін-2-олу. відомим. Сполуки формули V, як правило, є наявДо DMF (800мл) додають 1-бром-6ними на ринку або можуть бути одержані за метометоксинафталін-2-ол (66,7г, 264ммоль), карбонат диками, легко доступними для пересічного фахівкалію (K2СО3, 40,0г, 290ммоль) та бензилбромід ця в галузі синтетичної органічної хімії або (49,6г, 290ммоль). Перемішують суміш при кімнатописаними нижче. ній температурі протягом 1год. Додають воду Підготовчі синтези та Приклади (400мл) для осадження продукту. Збирають осад і Умови хірального розділення: промивають на фільтрі гептаном (3´125мл), після Для всіх препаративних хіральних розділень чого сушать і одержують 83,7г 2-бензилокси-1застосовують колонки Chiralpak AD. бром-6-метоксинафталіну (86,2%). Умови А: 3:2 гептан/ізопропіловий спирт (ІРА) Змішують толуол (200мл), 2-бензилокси-1/0,2% (мас.) диметилетиламіну (DMEA), 8´30см, бром-6-метоксинафталін (30г, 87,4ммоль), 4-(2365нм, 350мл/хв. піперидин-1-іл-етокси)фенол (23,2г, 105ммоль) та Умови В: 3:2 гептан/ІРА/0,2% (мас.) DMEA, карбонат цезію (34,4г, 105ммоль), і нагрівають суміш зі зворотним холодильником. Видаляють 8´30см, 365нм, 350мл/хв. частину толуолу (100мл), додають до реакційної Умови С: 80/10/10 гептан/етанол сорту суміші етилацетат (390мг, 4,37ммоль) та комплекс 3А/МеОН /0,2% (мас.) DMEA, 8´34см, 260нм, трифлату міді з бензолом (2,20г, 4,37ммоль) і пе375мл/хв. ремішують протягом 5хв. Видаляють розчинник Умови D: 75/15/10 гептан/ІРА/МеОН /0,2% дистиляцією, і нагрівають одержаний залишок при (мас.) DMEA, 8´34см, 260нм, 375мл/хв. 174°С протягом 1,5год. Розчиняють залишок у суУмови Е: 70/30 гептан/ІРА/0,2% (мас.) DMEA, міші етилацетату (200мл) та водного розчину HCl 8´34см, 260нм, 375мл/хв. (1-н., 90мл). Розділяють шари, і концентрують орУмови F: 4:1 гептан/ІРА /0,2% (мас.) DMEA, ганічний шар, одержуючи залишок. Хроматогра8´30см, 350нм, 350мл/хв. фують залишок на колонці, і одержують 12,4г 1-{2Умови G: 3:1 гептан/ІРА /0,2% (мас.) DMEA, [4-(2-бензилокси-6-метокси-нафталін-1-ілокси)8´33см, 340нм, 375мл/хв. фенокси]-етил}-піперидину (30%). Умови Н: 3:1 гептан/ІРА /0,2% (мас.) DMEA, Додають 1-{2-[4-(2-бензилокси-6-метокси8´33см, 340нм, 375мл/хв. нафталін-1-ілокси)-фенокси]-етил}-піперидин Умови І: 3:1 гептан/ІРА /0,2% (мас.) DMEA, (12,4г, 25,5ммоль) до суміші метанол/етилацетат 8´33см, 360нм, 375мл/хв. (1:1, 490мл) і нагрівають до розчинення. ВідстороУмови J: 4:1 гептан/ІРА /0,2% (мас.) DMEA, няють джерело тепла, і додають форміат амонію 8´30см, 260нм, 350мл/хв. (4,83г, 76,6ммоль) та Pd(OH)2 на вугіллі (20% Умови K: 70/30 гептан/ІРА /0,2% (мас.) DMEA, (мас), 1,58г, 1,12ммоль). Нагрівають зі зворотним 8´34см, 320нм, 350мл/хв. холодильником протягом 50хв, після чого фільтУмови L: 100% 3А /0,2% (мас.) DMEA, 8 ´30см, рують суміш. Концентрують фільтрат, і одержують 260нм, 300мл/хв. 9,9г 6-метокси-1-[4-(2-піперидин-1-іл-етокси)Умови М: 70/30 гептан/ІРА /0,2% (мас.) DMEA, фенокси]-нафталін-2-олу (98,5%). 8´30см, 260нм, 350мл/хв. Охолоджують суміш ди хлорметану (290мл), Умови N: 70/30 гептан/ІРА /0,2% (мас.) DMEA, триетиламіну (3,08г, 30,4ммоль) та 6-метокси-1-[48´30см, 260нм, 350мл/хв. (2-піперидин-1-іл-етокси)-фенокси]-нафталін-2-олу Умови О: 65/35 3А/гептан /0,2% (мас.) DMEA, (9,2г, 23,4г) до -50°С, і додають ангідрид трифтор8´30см, 260нм, 350мл/хв. метансульфонової кислоти (7,26г, 25,7ммоль). Умови Р: 100% 3А /0,2% (мас.) DMEA, 8´30см, Перемішують одержану суміш при -50°С протягом 260нм, 350мл/хв. 2год, потім дають суміші нагрітися до температури Умови Q: 70/30 гептан/ІРА /0,2% (мас.) DMEA, навколишнього середовища, після чого перемішують ще протягом 1год. Додають розсіл (150мл), і 8´30см, 260нм, 350мл/хв. Підготовчий синтез 1 відділяють органічну фазу. Промивають органічну 6-метокси-1-[4-(2-піперидин-1-іл-етокси)фазу розчином NaHCO3, потім сушать і концентрують, одержуючи залишок. Після кристалізації фенокси]-нафталін-2-іловий складний ефір тризалишку із суміші етиловий ефір-гексан одержують фторметансульфонової кислоти 11,2г вказаної в заголовку сполуки (90,9%). Приклад 1 1-(2-{4-[2-(2,6-дифторфеніл)-6-метоксинафталін-1-ілокси]-фенокси}-етил)-піперидин До диметилформаміду (DMF, 250мл) додають при температурі навколишнього середовища 6метоксинафталін-2-ол (20г, 114,8ммоль), а потім 15 85862 16 матографією, і одержують 295мг (110%) вільної Розчиняють 6-метокси-1-[4-(2-піперидин-1-ілоснови вказаної в заголовку сполуки. Розчиняють етокси)-фенокси]-нафталін-2-іловий складний ефір вільну основу у 3мл ефіру, і додають 0,8мл 1-н. трифторметансульфонової кислоти (1,0г, HCl. Одразу ж сушать, і одержують 305мг вказаної 1,9ммоль) у 20мл DMF. До цього розчину додають в заголовку сполуки. Мас-спектр (іонне розпилен2,6-дифторфенілборну кислоту (0,6г, 3,8ммоль), ня) m/z=472 (М-СІ). фосфа т калію (2,42г, 11,4ммоль) та тетракісПриклад 4 (трифенілфосфін)паладій (0) (0,44г, 0,38ммоль) і Гідрохлорид 6-(2-фтор-феніл)-5-[4-(2нагрівають при 100°С протягом 18год. Охолоджупіперидин-1-іл-етокси)-фенокси]-нафталін-2-олу ють та фільтр ують суміш, і очищають продукт на У круглодонну колбу місткістю 100мл завантаколонці SCX з елююванням домішок метанолом, а жують гідрохлорид 1-(2-{4-[2-(2-фтор-феніл)-6потім продукту 2-н. розчином аміаку в метанолі. метокси-нафталін-1-ілокси]-фенокси}-етил)Додатково очищають продукт на колонці із силікапіперидину (290мг, 0,57ммоль) у 5мл безводного гелем при градієнтному елююванні 50-100% дихСН2СІ2 і охолоджують до 0°С в атмосфері азоту. лорметану в гексані з домішкою 1% ізопропіламіну, Додають 2,90мл (2,90ммоль) 1Μ розчину ВВr3 у і одержують 300мг (32%) вказаної в заголовку споСН2СІ2, і контролюють проходження реакції маслуки. спектроскопією з іонізацією електронним ударом Приклад 2 (ES-MS). Після перемішування протягом 1год, реаГідрохлорид 6-(2,6-дифтор-феніл)-5-[4-(2кційну суміш виливають в охолоджений насичений піперидин-1-іл-етокси)-фенокси]-нафталін-2-олу водний розчин бікарбонату натрію та дихлорметан Розчиняють 1-(2-{4-[2-(2,6-дифтор-феніл)-6(150мл). Суша ть органічний шар над сульфатом метокси-нафталін-1-ілокси]-фенокси}-етил)натрію і концентрують у вакуумі. Очи щають непіперидин (300мг, 0,61ммоль) в 20мл дихлорметаочищений продукт радіальною хроматографією з ну і охолоджують льодом. Додають до суміші при елююванням 8% МеОН/СН2СІ2, і одержують 137мг збовтуванні 2,0мл триброміду бору і дають нагрі(52%) вільної основи вказаної в заголовку сполуки. тися до кімнатної температури. Виливають реакОдержують гідрохлорид шляхом додання 0,8мл 1ційну суміш у дво фазну суміш, яка складається з н. розчину HCl в Еt 2О. Мас-спектр (іонне розпинасиченого розчину бікарбонату натрію та суміші лення) m/z=458 (M-Cl). хлороформ/ізопропанол (3/1). Промивають органіПриклад 5 чний шар розсолом і сушать над молекулярним Гідрохлорид 1-(2-{4-[2-(2,4-дифтор-феніл)-6ситом 3Å. Додатково очищають продукт хроматогметокси-нафталін-1-ілокси]-фенокси}-етил)рафією з оберненою фазою, і одержують 138мг піперидину вказаної в заголовку сполуки(48%). Перетворюють у гідрохлорид і ліофілізують. 1H-Я МР (CDCI3, 300МГц) d 7,92 (d, J=9,0Гц, 1Н); 7,59 (d, J=8,4Гц, 1Н); 7,35 (d, J=8,4Гц, 1H); 7,20-7,17 (m, 2H); 7,03 (dd, J=9,0Гц, 2,1Гц, 1Н); 6,85-6,80 (m, 2H); 6,52 (s, 4H); 3,95 (t, J=5,7Гц, 2H); 2,73 (t, J=6,0Гц, 2H); 2,522,52 (m, 4H); 1,64-1,59 (m, 4H); 1,46-1,44 (m, 2H). Приклад 3 Гідрохлорид 1-(2-{4-[2-(2-фтор-феніл)-6Змішують 6-метокси-1-[4-(2-піперидин-1-ілметокси-нафталін-1-ілокси]-фенокси}-етил)етокси)-фенокси]-нафталін-2-іловий складний ефір піперидину трифторметансульфонової кислоти (2,99г, 5,70ммоль), 2,4-дифторфенілборну кислоту (2,70г, 17,09ммоль), ацетат паладію (II) (0,13г, 0,57ммоль), трициклогексилфосфін (240мг, 0,85ммоль), фторид цезію (7,79г, 51,25ммоль) та ацетонітрил (70мл) і нагрівають до 90°С. Через 10хв охолоджують до температури навколишнього середовища, фільтрують і видаляють розчинник у вакуумі. Розчиняють залишок у дихлорметані і промивають 1-н. водним розчином хлористоводУ висушену в ша фі круглодонну колбу місткісневої кислоти, насиченим водним розчином хлотю 100мл завантажують 6-метокси-1-[4-(2риду натрію, сушать над сульфатом магнію, фільпіперидин-1-іл-етокси)-фенокси]-нафталін-2-іловий трують і видаляють розчинник у вакуумі. складний ефір трифторметансульфонової кислоти Хроматографують на силікагелі з елююванням (300мг, 0,57ммоль) і створюють у колбі атмосферу сумішами дихлорметан/метанол, додають 1Μ розазоту. Розчиняють тверду речовину в ацетонітрилі чин хлороводню в ефірі (10мл), і одержують 3,0г (10мл) і додають 2-фторфенілборну кислоту (100%) вказаної в заголовку сполуки. Мас-спектр (240мг, 1,71ммоль), трициклогексилфосфін (48мг, (іонне розпилення) m/z=488 (M-Cl). 0,17ммоль), ацетат паладію (38мг, 0,17ммоль), та Приклад 6 фторид цезію (780мг, 5,14ммоль). Нагрівають розГідрохлорид 6-(2,4-дифтор-феніл)-5-[4-(2чин до 85°С і перемішують протягом 1год. Фільтпіперидин-1-іл-етокси)-фенокси]-нафталін-2-олу рують розчин через шар целіту, промивають Розчиняють гідрохлорид 1-(2-{4-[2-(3,4фільтр ацетонітрилом, і концентрують у вакуумі. дифтор-феніл)-6-метокси-нафталін-1-ілокси]Очищають неочищений продукт радіальною хрофенокси}-етил)-піперидину (3,00г, 5,70ммоль) у 17 85862 18 дихлорметані (90мл) і охолоджують на льодяній ржуючи 108мг (83%) вказаної в заголовку сполуки. бані. Додають трибромід бору (1Μ у дихлорметані, Мас-спектр (іонне розпилення) m/z=476 (Μ-СІ). 18,0мл, 18,0ммоль) і перемішують протягом Приклад 9 2,5год. Додають метанол (20мл), нагрівають до 1-(2-{4-[6-метокси-2-(3,4,5-трифтор-феніл)кімнатної температури і видаляють розчинник у нафталін-1-ілокси]-фенокси}-етил)-піперидин вакуумі. Розчиняють залишок у дихлорметані з доданням мінімальної кількості метанолу, промивають насиченим водним розчином бікарбонату натрію, і видаляють розчинник у вакуумі. Кристалізують із суміші етилацетат/дихлорметан, відфільтровують тверду речовину, і одержують вільну основу вказаної в заголовку сполуки. Розчиняють вільну основу у суміші дихлорметан/метанол, додають 1Μ розчин хлороводню в ефірі (10мл), і виЗавантажують у колбу 6-метокси-1-[4-(2даляють розчинник у вакуумі, одержуючи 2,68г піперидин-1-іл-етокси)-фенокси]-нафталін-2-іловий (92%) вказаної в заголовку сполуки. Мас-спектр складний ефір трифторметансульфонової кислоти (іонне розпилення) m/z=476 (M-Cl). (800мг, 1,52ммоль), 3,4,5-трифторфенілборну кисПриклад 7 лоту (804мг, 4,57ммоль) та фторид цезію (1,1г, Гідрохлорид 1-(2-{4-[2-(2,5-дифтор-феніл)-67,6ммоль), і продувають колбу азотом. В іншу колметокси-нафталін-1-ілокси]-фенокси}-етил)бу завантажують ацетат паладію (II) (34мг, піперидину 0,15ммоль) та трициклогексилфосфін (64мг, Змішують 6-метокси-1-[4-(2-піперидин-1-ілетокси)-фенокси]-нафталін-2-іловий складний ефір трифторметансульфонової кислоти (154мг, 0,29ммоль), 2,5-дифторфенілборну кислоту (139мг, 0,88ммоль), комплекс [1,1'біс(дифенілфосфіно)-фероцен)дихлорпаладію (II) з дихлорметаном (1:1) (239мг, 0,29ммоль), фторид цезію (400мг, 2,63ммоль) та ацетонітрил (6мл), перемішують і нагрівають при 90°С. Через 4год охолоджують суміш до температури навколишнього середовища, і видаляють розчинник у вакуумі. Суспендують залишок у діетиловому ефірі, обробляють його ультразвуком, фільтрують і видаляють розчинник у вакуумі. Хроматографують неочищений продукт на силікагелі з елююванням сумішами дихлорметан/метанол, об'єднують фракції, які містять продукт, додають 1Μ розчин хлороводню в ефірі (1мл), і видаляють розчинник у вакуумі, одержуючи 140мг вказаної в заголовку сполуки. Масспектр (іонне розпилення) m/z=490 (M-Cl). Приклад 8 Гідрохлорид 6-(2,5-дифтор-феніл)-5-[4-(2піперидин-1-іл-етокси)-фенокси]-нафталін-2-олу Розчиняють гідрохлорид 1-(2-{4-[2-(2,5дифтор-феніл)-6-метокси-нафталін-1-ілокси]фенокси}-етил)-піперидину (133мг, 0,25ммоль) у дихлорметані (5мл), охолоджують на льодяній бані і додають трибромід бору (1Μ у дихлорметані, 0,76мл, 0,76ммоль). Дають суміші повільно нагрітися до кімнатної температури протягом 18год, гасять реакцію насиченим водним розчином бікарбонату натрію, суша ть органічний шар над сульфатом магнію, фільтрують і хроматографують продукт на силікагелі з елююванням сумішами дихлорметан/метанол. Об'єднують фракції, які містять продукт, додають 1Μ розчин хлороводню в ефірі (1мл), і видаляють розчинник у вакуумі, оде 0,23ммоль), і продувають колбу азотом. Додають знегажений ацетонітрил, і обробляють суміш ультразвуком в атмосфері азоту протягом 10хв. Додають до твердої речовини розчин каталізатора, і вміщують суміш у масляну баню з температурою 80°С на 10хв. Охолоджують до кімнатної температури і фільтрують через шар целіту. Концентрують фільтрат, і знову розчиняють залишок у дихлорметані. Промивають розчин насиченим водним розчином бікарбонату натрію, розділяють шари, органічний шар сушать, фільтрують і концентрують. Очищають залишок хроматографією на силікагелі з градієнтним елююванням 0-5% метанолу в дихлорметані, і одержують 720мг (93%) вказаної в заголовку сполуки. Мас-спектр (іонне розпилення) 508,3 (М+Н). Приклад 10 Гідрохлорид 6-(3,4,5-трифтор-феніл)-5-[4-(2піперидин-1-іл-етокси)-фенокси]-нафталін-2-олу Розчиняють 1-(2-{4-[6-метокси-2-(3,4,5трифтор-феніл)-нафталін-1-ілокси]-фенокси}етил)-піперидин (720мг, 1,4ммоль) у ди хлорметані (15мл). Додають 2Μ HCl у діетиловому ефірі (1,4мл, 2,8ммоль) і концентрують у вакуумі. Розчиняють залишок у дихлорметані (15мл), і додають краплями трибромід бору (0,53мл, 5,6ммоль) при 0°С в атмосфері азоту. Через 45хв виливають суміш у охолоджений насичений водний розчин бікарбонату натрію і екстрагують дихлорметаном. Концентрують органічний шар, і очищають залишок на силікагелі з градієнтним елююванням 012% метанолу в дихлорметані, одержуючи 554мг (80%) вільної основи вказаної в заголовку сполуки. Розчиняють вільну основу (554мг, 1,1ммоль) в етилацетаті (мл) та діетиловому ефірі (12мл). Додають 2Μ HCl у діетиловому ефірі (1,1мл, 2,2ммоль) і збирають осад. Сушать у вакуумній шафі протягом ночі при 50°С, і одержують 467мг (79%) вказаної в заголовку сполуки. Мас-спектр (іонне розпилення) m/z=494,3 (M-Cl). Приклад 11 1-(2-{4-[2-(2,3-дифтор-феніл)-6-метоксинафталін-1-ілокси]-фенокси}-етил)-піперидин 19 85862 За методикою, описаною у Прикладі 9, проводять реакцію 6-метокси-1-[4-(2-піперидин-1-ілетокси)-фенокси]-нафталін-2-ілового складного ефіру три фтор-метансульфонової кислоти (800мг, 1,52ммоль), 2,3-дифторфенілборної кислоти (720мг, 4,57ммоль), фториду цезію (2,1г, 13,7ммоль), ацетату паладію (II) (34мг, 0,15ммоль) та трициклогексилфосфіну (64мг, 0,23ммоль), і одержують 622мг (84%) вказаної в заголовку сполуки. Мас-спектр (іонне розпилення) 490,4 (М+Н). Приклад 12 Гідрохлорид 6-(2,3-дифтор-феніл)-5-[4-(2піперидин-1-іл-етокси)-фенокси]-нафталін-2-олу За методикою, описаною у Прикладі 10, проводять реакцію 1-(2-{4-[2-(2,3-дифтор-феніл)-6метокси-нафталін-1-ілокси]-фенокси}-етил)піперидину (622мг, 1,27ммоль), 2Μ HCl у діетиловому ефірі (1,3мл, 2,6ммоль) та триброміду бору (0,60мл, 6,4ммоль), і одержують 309мг (48%) вказаної в заголовку сполуки. Мас-спектр (іонне розпилення) 476,4 (М-Сl). Приклад 13 1-(2-{4-[2-(3,5-дифтор-феніл)-6-метоксинафталін-1-ілокси]-фенокси}-етил)-піперидин За методикою, описаною у Прикладі 9, проводять реакцію 6-метокси-1-[4-(2-піперидин-1-ілетокси)-фенокси]-нафталін-2-ілового складного ефіру трифтор-метансульфонової кислоти (3,5г, 6,67ммоль), 3,5-дифторфенілборної кислоти (3,1г, 19,6ммоль), фториду цезію (9,2г, 60,4ммоль), ацетату паладію (II) (145мг, 0,64ммоль) та трициклогексилфосфіну (290мг, 1,03ммоль), і одержують 3,3г (100%) вказаної в заголовку сполуки. Масспектр (іонне розпилення) 490,3 (М+Н). Приклад 14 Гідрохлорид 6-(3,5-дифтор-феніл)-5-[4-(2піперидин-1-іл-етокси)-фенокси]-нафталін-2-олу За методикою, описаною для одержання гідрохлориду 6-(3,4,5-трифтор-феніл)-5-[4-(2піперидин-1-іл-етокси)-фенокси]-нафталін-2-олу проводять реакцію 1-(2-{4-[2-(3,5-дифтор-феніл)-6метокси-нафталін-1-ілокси]-феноксі}-етил)піперидину (3,8г, 7,9ммоль), 2Μ HCl у діетиловому ефірі (7,9мл, 15,8ммоль) та триброміду бору (3,7мл, 39,2ммоль), і після хроматографування на силікагелі одержують 2,6г (64%) вказаної в заголовку сполуки. Мас-спектр (іонне розпилення) 476,3 (М-Сl). Приклад 15 20 Гідрохлорид 6-(3,4-дифтор-феніл)-5-[4-(2піперидин-1-іл-етокси)-фенокси]-нафталін-2-олу Гідрохлорид 6-(3,4-дифтор-феніл)-5-[4-(2піперидин-1-іл-етокси)-фенокси]-нафталін-2-олу одержують за методикою, аналогічною описаній у Прикладах 7 та 8, і одержують 1,79г вказаної в заголовку сполуки. Мас-спектр (іонне розпилення): m/z=476 (M-Cl). Підготовчий синтез 2 4-[2-(3-фтор-феніл)-6-метокси-нафталін-1ілокси]-фенол У висушену в ша фі круглодонну колбу місткістю 250мл завантажують 6-метокси-1-тетралон (3,0г, 17,0ммоль), і створюють у колбі атмосферу азоту. Розчиняють тверду речовину у толуолі (30мл) і додають 1-бром-3-фторбензол (4,7мл, 42,6ммоль), трет-бутлат натрію (6,5г, 68,1ммоль), ацетат паладію (76мг, 0,34ммоль) та рацемічний BINAP (2,2'-біс(дифенілфосфіно)-1,1'-динафтил) (212мг, 0,34ммоль). Нагрівають розчин до 115°С і перемішують протягом 18год. Розбавляють розчин охолодженою 5-н. HCl (50мл) та етилацетатом (200мл). Відділяють органічний шар і сушать над сульфатом натрію, фільтрують через шар целіту і концентрують у вакуумі. Очи щають неочищений продукт радіальною хроматографією, і одержують 3,4г (74%) вказаної в заголовку сполуки. Цей матеріал використовують без додаткового очищення. Мас-спектр (іонне розпилення) m/z=267 (M-H). Розчиняють 2-(3-фтор-феніл)-6-метоксинафталін-1-ол (3,36г, 12,5ммоль) у N-метил-2піролідиноні (NMP) (10мл) і додають гідрид натрію (500мг, 60% дисперсія в маслі, 12,5ммоль) при кімнатній температурі. Після перемішування протягом 1год цей розчин додають до нагрітого до 185°С розчину 4-фторбензальдегіду (2,4мл, 22,5ммоль) у NMP (10мл). Продовжують перемішування протягом 2,5год. Охолоджують реакційну суміш до кімнатної температури, додають буфер рН 7 (50мл) і екстрагують етилацетатом (2x100мл). Органічні екстракти промивають водою і фільтрують через шар силікагелю. Очищають неочищений продукт радіальною хроматографією, і одержують 2,50г (54%) вказаної в заголовку сполуки, яку використовують без додаткового очищення. Масспектр (іонне розпилення) m/z=371 (M-H). У круглодонну колбу місткістю 100мл завантажують 4-[2-(3-фтор-феніл)-6-метокси-нафталін-1ілокси]-бензальдегід (2,5г, 6,71ммоль) та етилаце 21 85862 22 тат (5мл). При кімнатній температурі додають 2мл 4-[6-бензилокси-2-(4-фтор-феніл)-нафталін-135% пероксиду водню. До одержаного розчину ілокси]-фенол повільно додають 2мл концентрованої сірчаної кислоти. Суміш нагрівається приблизно до 40°С, і її перемішують протягом 2год, при цьому температура знижується до кімнатної. Розбавляють реакційну суміш водою та етилацетатом (100мл), органічний шар сушать над сульфатом натрію, фільтрують і концентрують у вакуумі. Очи щають неочищений продукт радіальною хроматографією при елююванні СН 2СІ2, і одержують 540мг (22%) До розчину 6-бензилокси-3,4-дигідро-2Нвказаної в заголовку сполуки. Мас-спектр(іонне нафталін-1-ону (250г, 0,99моль) у хлороформі (2л) розпилення) m/z=359 (M-H). додають бром (107мл, 2,08моль) при 5°С на проПриклад 16 тязі 1,5год. Додають розчин тіосульфату натрію Гідрохлорид 1-(2-{4-[2-(3-фтор-феніл)-6(250мл) для погашення реакції при 0°С. Додають метокси-нафталін-1-ілокси]-фенокси}-етил)етилацетат (1л), і розділяють шари. Водний шар піперидину екстрагують СН 2СІ2 (500мл), органічні шари об'єд До розчину 4-[2-(3-фтор-феніл)-6-метоксинафталін-1-ілокси]-фенолу (180мг, 0,50ммоль) у 10мл безводного DMF додають гідрид натрію (60мг, 60% дисперсія у маслі, 1,50ммоль), і перемішують розчин протягом 30хв при кімнатній температурі. Додають гідрохлорид 1-(2хлоретил)піперидину (138мг, 0,75ммоль), і перемішують реакційну масу протягом 3 днів. Розбавляють реакційну масу дихлорметаном, промивають насиченим водним розчином бікарбонату натрію (1´), розсолом (1´), відділяють органічну фазу і сушать над сульфатом натрію. Очищають неочищений продукт радіальною хроматографією з елююванням 4% МeОН/СН2СІ2, і одержують 234мг (99%) вільної основи вказаної в заголовку сполуки. Одержують гідрохлорид шляхом додання 0,8мл 1-н. розчину HCl в Et2O. Мас-спектр (іонне розпилення) m/z=472 (M-Cl). Приклад 17 Гідрохлорид 6-(3-фтор-феніл)-5-[4-(2піперидин-1-іл-етокси)-фенокси]-нафталін-2-олу У круглодонну колбу місткістю 100мл завантажують гідрохлорид 1-(2-{4-[2-(3-фтор-феніл)-6метокси-нафталін-1-ілокси]-фенокси}-етил)піперидину (245мг, 0,48ммоль) і охолоджують до 0°С в атмосфері азоту. Додають 1,45мл 1Μ розчину ВВr3 у СН2СІ2 , і контролюють проходження реакції методом ES-MS. Після перемішування протягом 1год реакційну суміш виливають у суміш охолодженого насиченого водного розчину бікарбонату натрію та дихлорметану (150мл). Сушать органічний шар над сульфатом натрію і концентрують у вакуумі. Очи щають неочищений продукт радіальною хроматографією з елююванням 4% МеОН/СН2СІ2 , і одержують 139мг (63%) вільної основи вказаної в заголовку сполуки. Одержують гідрохлорид шляхом додання 0,8мл 1-н. розчину HCl в Et2O. Мас-спектр (іонне розпилення) m/z=458(М-Сl). Підготовчий синтез 3 нують, промивають водним розчином бікарбонату натрію та розсолом. Сушать над сульфа том натрію і концентрують у вакуумі. Розтирають залишок, додаючи суміш 10% етилацетату з гексаном (600мл), і одержують твердий продукт. Цей продукт фільтрують і сушать, одержуючи 405г (100%) 6-бензилокси-2,2-дибром-3,4-дигідро-2Н-нафталін1-ону. До розчину 6-бензилокси-2,2-дибром-3,4дигідро-2Н-нафталін-1-ону (205г, 0,5моль) у метанолі (1,3л) додають 1Μ розчин метилату натрію (215мл, 0,99моль). Нагрівають суспензію до розчинення твердих речовин. Охолоджують реакційну суміш до 0°С і додають 1-н. HCl (540мл). Додають Н2О (3л) і охолоджують до 3°С, одержуючи тверду речовину. Цей продукт відділяють фільтруванням і сушать, одержуючи 152г (92%) 6-бензилокси-2бром-нафталін-1-олу. До розчину 6-бензилокси-2-бром-нафталін-1олу (179г, 0,54моль) у THF (3,0л) додають частинами гідрид натрію (24г, 0,6ммоль) при 0°С. Додають метансульфонілхлорид (47мл, 0,61моль) на протязі 45хв, і перемішують реакційну суміш протягом 1,5год при 10°С. Додають розчин бікарбонату натрію (500мл) та воду (500мл). Розділяють шари, і екстрагують водний шар етилацетатом (2´500мл). Органічні шари об'єднують і промивають розсолом (200мл). Сушать над сульфатом магнію, фільтрують і концентрують у вакуумі. Розтирають залишок, додаючи суміш 20% етилацетату в гексані (1л), і одержують твердий продукт. Цей продукт фільтрують, промивають толуолом (2´200мл) і сушать, одержуючи 176г (80%) 6бензилокси-2-бром-нафталін-1-ілового складного ефіру метансульфонової кислоти. Змішують 6-бензилокси-2-бром-нафталін-1іловий складний ефір метансульфонової кислоти (10,0г, 24,4ммоль), 4-фторфенілборну кислоту (10,2г, 72,9ммоль), карбонат натрію (7,8г, 73,6ммоль) та тетракіс-(трифенілфосфін)-паладій (2,8г, 2,4ммоль) у суміші толуолу (300мл), етанолу (60мл) та води (40мл). Нагрівають суміш при 100°С протягом 12год. Охолоджують і фільтрують суспензію через шар целіту. Випарюють розчинник у вакуумі. Залишок промивають розчином бікарбонату натрію та розсолом. Сушать над сульфатом магнію і концентрують у вакуумі. Залишок очищають хроматографією на силікагелі при елююванні 23 85862 24 продукту ступінчастим градієнтом метанці (силікагель, 0-4% MeOH-NH4OH (10/1, нол/дихлорметан (0-10%), і одержують 10,1г (98%) об/об)/СН2Сl2), одержуючи 6,5г (99%) вказаної в 6-бензилокси-2-(4-фтор-феніл)-нафталін-1-ілового заголовку сполуки. Мас-спектр (іонне розпилення) складного ефіру метансульфонової кислоти. m/z=548,3 (M+H). Розчиняють 6-бензилокси-2-(4-фтор-феніл)Приклад 19 нафталін-1-іловий складний ефір метансульфоноГідрохлорид 6-(4-фтор-феніл)-5-[4-(2вої кислоти (5,2г, 12,3ммоль) у 5Μ розчині гідропіперидин-1-іл-етокси)-фенокси]-нафталін-2-олу ксиду натрію (12мл, 60ммоль), THF (86мл) та МеРозчиняють 1-(2-{4-[6-бензилокси-2-(4-фторОН (86мл). Нагрівають при 50°С протягом 1год. феніл)-нафталін-1-ілокси]-феноксі}-етил)Охолоджують і додають етилацетат (100мл). Орпіперидин (6,5г, 11,87ммоль) у суміші MeOH/THF ганічний шар промивають 1-н. HCl, насиченим во(200мл, об'ємне відношення 1/1) в атмосфері N2. дним розчином бікарбонату натрію та розсолом. Додають Pd/C (0,65г, 10%) і тричі замінюють N2 на Сушать над сульфатом магнію і концентрують у Н2. Перемішують реакційну суміш протягом 2год, вакуумі, одержуючи 3,4г (89%) 6-бензилокси-2-(4після чого відфільтровують Pd/C. Видаляють розфтор-феніл)-нафталін-1-олу. чинник, і очищають залишок хроматографією на До розчину 6-бензилокси-2-(4-фтор-феніл)колонці (силікагель, 2-8% MeOH-NH4OH (10/1, нафталін-1-олу в Ν ΜΡ (40мл) додають гідрид наоб/об)/ СН2СІ2), одержуючи 2,93г (54%) вільної трію (400мг, 10ммоль). Додають вищезгадану суоснови вказаної в заголовку сполуки. Розчиняють спензію алкоголяту до розчину 4цю вільну основу (2,93г, 6,41ммоль) у СН2СІ2 фторбензальдегіду (2мл, 19ммоль) в ΝΜΡ (30мл) (100мл) і охолоджують до -78°С. Додають HCl при 165°С. Нагрівають при 165°С протягом 1год. (10мл, 2,0Μ у Еt 2О), і перемішують розчин протяОхолоджують і додають буферний розчин (рН=7, гом 10хв. Видаляють розчинник під зниженим тис10мл). Додають діетиловий ефір (1л). Розділяють ком та при 40°С протягом ночі у вакуумі, і одержушари, і екстрагують водний шар діетиловим ефіють 3,17г (100%) вказаної в заголовку сполуки. Мас-спектр (іонне розпилення) m/z=458,2 (M-Cl). ром (2´200мл). Органічні шари об'єднують, сушать Підготовчий синтез 4 над сульфатом магнію і концентрують у вакуумі. 1-[4-(2-азепан-1-іл-етокси)-фенокси]-6Залишок хроматографують на колонці Biotage при елююванні продукту ступінчастим градієнтом меметокси-нафталін-2-іловий складний ефір трифторметансульфонової кислоти танол/дихлорметан (0-10%), і одержують 2,9г (70%) 4-[6-бензилокси-2-(4-фтор-феніл)-нафталін1-ілокси]-бензальдегіду. До розчину Н2О 2 (1мл, 9,7ммоль) та 4-[6бензилокси-2-(4-фтор-феніл)-нафталін-1-ілокси]бензальдегіду додають краплями при 0°С 18Μ H2SO4 (1мл, 16,8ммоль), і перемішують суміш при кімнатній температурі протягом 12год. Додають Н2О (20мл) та СН2Сl2 (100мл). Розділяють шари, і екстрагують водний шар СН 2Сl2 (2´50мл). ОрганіДо розчину 4-бензилоксифенолу (41г, чні шари об'єднують, сушать над сульфатом маг0,20моль) та гідрохлориду 2нію і концентрують у вакуумі, одержуючи 1,88г (гексаметиленіміно)етилхлориду (44г, 0,22ммоль) (73%) вказаної в заголовку сполуки. Мас-спектр у THF (600мл) та DMF (100мл) додають при кімна(іонне розпилення) m/z=435,1 (М-Н). тній температурі гідрид натрію (18г, 0,45моль). Приклад 18 Нагрівають при 60°С протягом 30хв. Виливають 1-(2-{4-[6-бензилокси-2-(4-фтор-феніл)розчин у суміш води з льодом. Розбавляють етинафталін-1-ілокси]-феноксі}-етил)-піперидин лацетатом (500мл), і розділяють шари. Органічний шар сушать над сульфатом магнію, фільтрують і концентрують під зниженим тиском, одержуючи коричневе масло. Розчиняють це масло в етилацетаті (500мл) та метанолі (500мл). Додають форміат амонію (100г, 1,59моль) та паладій на вугіллі (10г, 9,4ммоль). Нагрівають суміш зі зворотним холодильником протягом 30хв. Додають форміат амонію (100г, 1,59моль) та паладій на вугіллі (10г, 9,4ммоль). Нагрівають реакційну суміш протягом Розчиняють 4[6-бензилокси-2-(4-фтор30хв. Відфільтровують суспензію через шар целіту феніл)-нафталін-1-ілокси]-фенол (5,20г, і елююють етилацетатом (500мл). Випарюють роз11,91ммоль) у D MF (60мл) в атмосфері N2 і додачинник під зниженим тиском, і додають воду ють NaH (1,43г, 35,74ммоль, 60% мас). Перемішу(100мл). Розбавляють суміш етилацетатом ють розчин протягом 0,5год при кімнатній темпе(500мл), і розділяють шари. Органічний шар проратурі, після чого додають гідрохлорид 1-(2мивають насиченим розчином бікарбонату натрію хлоретил)-піперидину (3,29г, 17,87ммоль). Продо(2´200мл), сушать над сульфатом магнію, фільтвжують перемішувати розчин, після чого додають рують і випарюють розчинник під зниженим тисводу (300мл). Екстрагують водний шар СН 2Сl2 ком, одержуючи 31г (64 %) 4-(2-азепан-1-іл(3´300мл), і об'єднують органічні шари. Сушать етокси)-фенолу. органічний розчин Na2SO4, фільтрують, концентЗмішують 2-бензилокси-1-бром-6-метоксирують і очи щають фле ш-хроматографією на колонафталін (31г, 90ммоль), 4-(2-азепан-1-іл-етокси) 25 85862 26 фенол (31г, 132ммоль), мідну бронзу (12г, ефір трифторметансульфонової кислоти (435мг, 189ммоль), карбонат калію (25г, 181ммоль) та пі0,80ммоль), фторид цезію (864мг, 5,7ммоль) та ридин (400мл). Нагрівають суміш зі зворотним хо1,3-дифторфенілборну кислоту (383мг, 2,4ммоль) лодильником протягом 85год. Охолоджують, фільу безводному ацетонітрилі (5мл) і перемішують трують залишок через шар целіту і елююють протягом 10хв. В окремій колбі суспендують ацеметанолом та дихлорметаном (500мл, об'ємне тат паладію (18мг, 0,08ммоль) та трициклогексилвідношення 1:5). Випарюють розчинник під знижефосфін (33мг, 0,12ммоль) у безводному ацетонітним тиском, і хроматографують залишок на колонрилі (15мл), і обробляють ультразвуком в ці із силікагелем, елююючи продукт ступінчастим атмосфері азоту протягом 10хв. Поєднують вміст градієнтом метанол/дихлорметан (0-10%), і одеробох колб, і нагрівають реакційну суміш при 60°С жують 19г (43%) 1 -{2- [4-(2-бензилокси-6-метоксипротягом 15хв. Охолоджують реакційну суміш, нафталін-1-ілокси)-фенокси]-етил}-азепану. фільтрують через шар целіту і концентрують у Розчиняють 1-{2-[4-(2-бензилокси-6-метоксивакуумі. Неочищений продукт очищають хроматонафталін-1-ілокси)-фенокси]-етил}-азепан (19г, графією на силікагелі при елююванні продукту 38ммоль) в етилацетаті (500мл) та метанолі градієнтом 1-3% метанолу в дихлорметані, і одер(600мл). Нагрівають суміш до одержання прозорожують 400мг (98%) вказаної в заголовку сполуки. го розчину. Охолоджують до кімнатної температуМас-спектр (іонне розпилення) m/z=504,2 (M+H). ри. Додають форміат амонію (30г, 476ммоль) та Приклад 21 паладій на вугіллі (2г, 1,9ммоль). Нагрівають суміш Гідрохлорид 5-[4-(2-азепан-1-іл-етокси)зі зворотним холодильником протягом 30хв. Дофенокси]-6-(3,5-дифтор-феніл)-нафталін-2-олу дають форміат амонію (7г, 111ммоль) та паладій Розчиняють 1-(2-{4-[2-(3,5-дифтор-феніл)-6на вугіллі (0,7г, 0,7ммоль). Нагрівають суміш зі метокси-нафталін-1-ілокси]-феноксі}-етил)-азепан зворотним холодильником протягом 30хв. Відфі(583мг, 1,2ммоль) у дихлорметані (10мл). Охолольтровують суспензію через шар целіту і елююють джують до 0°С, додають 2Μ HCl (1,2мл, 2,3ммоль) етилацетатом (500мл). Випарюють розчинник під і перемішують при кімнатній температурі протягом зниженим тиском і додають воду (100мл). Розбав15хв. Концентрують у вакуумі. Розчиняють одерляють суміш етилацетатом (500мл), і розділяють жану сіль у дихлорметані (10мл) і охолоджують до шари. Органічний шар промивають насиченим 0°С. Додають краплями трибромід бору (972мг, 3,5ммоль), і доводять суміш до кімнатної темперарозчином бікарбонату натрію (2´200мл), сушать тури. Перемішують реакційну суміш протягом над сульфатом магнію, фільтрують і випарюють 1,5год і виливають у суміш льоду, насиченого розрозчинник під зниженим тиском, одержуючи 15,1г чину бікарбонату натрію (10мл) та метанолу (97%) 1-[4-(2-азепан-1-іл-етокси)-фенокси]-6метокси-нафталін-2-олу. (10мл). Екстрагують суміш ди хлорметаном, об'єднують екстракти і промивають водою та насичеДо суміші 1-[4-(2-азепан-1-іл-етокси)-фенокси]ним розчином бікарбонату натрію. С ушать над 6-метокси-нафталін-2-олу (15г, 37ммоль), триетисульфатом натрію, фільтрують і концентрують у ламіну (20мл) та дихлорметану (500мл) додають вакуумі. Очищають продукт хроматографією на при -50°С трифторметансульфоновий ангідрид (7мл, 42ммоль). Підігрівають реакційну суміш до силікагелі при елююванні продукту градієнтом 14% метанолу в дихлорметані, і одержують 366мг кімнатної температури і перемішують при цій тем(65%) вільної основи вказаної в заголовку сполуки. пературі протягом 1год. Охолоджують реакційну Розчиняють вільну основу у 10мл дихлорметану і суміш до -78°С, і додають розсіл (20мл). Підігрівадодають 2Μ HCl (0,8мл), перемішують протягом ють реакційну суміш до кімнатної температури. Розділяють шари, і промивають органічний шар 10хв і концентрують у вакуумі, одержуючи 343мг (88%) вказаної в заголовку сполуки. Мас-спектр насиченим розчином бікарбонату натрію (100мл) (іонне розпилення) m/z=490,3 (M-Cl). та розсолом. Сушать органічний шар над сульфаПриклад 22 том магнію, фільтрують і випарюють розчинник під 1-(2-{4-[2-(3,4-дифтор-феніл)-6-метоксизниженим тиском. Хроматографують залишок на колонці із силікагелем при елююванні ступінчастим нафталін-1-ілокси]-феноксі}-етил)-азепан градієнтом метанол/дихлорметан (0-10%), і одержують 20г (99%) 1-[4-(2-азепан-1-іл-етокси)фенокси]-6-метокси-нафталін-2-ілового складного ефіру трифторметан-сульфонової кислоти. Приклад 20 1-(2-{4-[2-(3,5-дифтор-феніл)-6-метоксинафталін-1-ілокси]-феноксі}-етил)-азепан Розчиняють 1-[4-(2-азепан-1-іл-етокси)фенокси]-6-метокси-нафталін-2-іловий складний Змішують ацетат паладію (33мг, 0,15ммоль), трициклогексилфосфін (61мг, 0,22ммоль) та ацетонітрил (6мл). Обробляють суміш ультразвуком протягом 5хв. Змішують 1-[4-(2-азепан-1-ілетокси)-фенокси]-6-метокси-нафталін-2-іловий складний ефір трифторметансульфонової кислоти (787мг, 1,46ммоль), фторид цезію (2,00г, 13,2ммоль), 3,4-дифторфенілборну кислоту (692мг, 4,38ммоль) та ацетонітрил (16мл). Додають у реакційну посудину оброблену ультразвуком 27 85862 28 суспензію Pd/Рсу3, і нагрівають суміш при 90°С Гідрохлорид 5-[4-(2-азепан-1-іл-етокси)протягом 30хв. Охолоджують до кімнатної темпефенокси]-6-(3-фтор-феніл)-нафталін-2-олу ратури, фільтрують через шар целіту і випарюють Цю сполуку одержують за методикою, описарозчинник. Розчиняють залишок в етилацетаті ною вище для одержання гідрохлориду 6-(3-фтор(40мл) і промивають насиченим розчином NaHCO3 феніл)-5-[4-(2-піперидин-1-іл-етокси)-фенокси](10мл). Розділяють шари, промивають органічний нафталін-2-олу, застосовуючи як вихідний матерішар розсолом (10мл), сушать над MgSO4, фільтал гідрохлорид 1-(2-{4-[2-(3-фтор-феніл)-6рують і концентрують у вакуумі. Хроматографують метокси-нафталін-1-ілокси]-фенокси}-етил)залишок на колонці з SiO2 при елююванні продукту азепану, після радіальної хроматографії одержуметанолом у дихлорметані (0-5%), і одержують ють вільну основу вказаної в заголовку сполуки з 630мг (86%) вказаної в заголовку сполуки. Масвиходом 52%. Одержують гідрохлорид шляхом спектр (іонне розпилення) m/z=504,2 (М+Н). додання 0,8мл 1М розчину HCl в Et2O. Мас-спектр Приклад 23 (іонне розпилення) m/z=472 (М-Сl). Гідрохлорид 5-[4-(2-азепан-1-іл-етокси)Приклад 26 фенокси]-6-(3,4-дифтор-феніл)-нафталін-2-олу 1-(2-{4-[6-бензилолкси-2-(4-фтор-феніл)Розчиняють 1-(2-{4-[2-(3,4-дифтор-феніл)-6нафталін-1-ілокси]-феноксі}-етил)-азепан метокси-нафталін-1-ілокси]-феноксі}-етил)-азепан (630мг, 1,25ммоль) у дихлорметані (20мл). Додають 2Μ HCl у діетиловому ефірі (1мл, 2,0ммоль). Перемішують протягом 5хв. Концентрують суспензію і суша ть у вакуумі. Розбавляють залишок дихлорметаном (20мл), і створюють у колбі атмосферу азоту. Охолоджують розчин до 0°С за допомогою льодяної бані. Додають ВВr3 (0,4мл, 4,3ммоль). Перемішують реакційну суміш при кімДо розчину 4-[6-бензилокси-2-(4-фтор-феніл)натній температурі протягом 30хв і виливають у нафталін-1-ілокси]-фенолу (1,18г, 2,7ммоль) у суміш насиченого водного розчину NaHCO3 DMF (10мл) додають гідрид натрію (324мг, (20мл), льоду (5г) та метанолу (5мл). Розбавляють 8,0ммоль) і перемішують протягом 20хв при кімнасуміш дихлорметаном (20мл), розділяють шари, тній температурі. Додають гідрохлорид 2промивають органічний шар розсолом (10мл), су(гексаметиленіміно)-етилхлориду (1,07г, 5,4ммоль) шать над MgSO4, фільтрують і концентрують у і перемішують при кімнатній температурі протягом вакуумі. Хроматографують залишок на колонці з 12год. Додають Н 2О (10мл) та діетиловий ефір SiO2 при елююванні продукту ступінчастим градіє(100мл). Розділяють шари і промивають водний нтом метанол/дихлорметан (0-5%), і одержують шар діетиловим ефіром (2´50мл). Об'єднують орвільну основу вказаної в заголовку сполуки. Розганічні шари, сушать над сульфатом магнію і кончиняють вільну основу в діетиловому ефірі центрують у вакуумі. Очи щають залишок хромато(5,0мл), етилацетаті (6,0мл) та метанолі (1,0мл) і графією на силікагелі при елююванні продукту додають 2Μ HCl в діетиловому е фірі (1мл, ступінчастим градієнтом метанол/дихлорметан (02,0ммоль). Збирають осад на фільтрувальному 10%), і одержують 1,0г вказаної в заголовку сполупапері, промивають діетиловим ефіром і суша ть у ки (66%). Мас-спектр (іонне розпилення) m/z=562,3 вакуумі (99%. Маточний щають реакційну суміш на колонці із SCX, і одеррозчин очищають на силікагелі (елюювання 1-6% жують 674мг (93%) вказаної в заголовку сполуки. метанолу в дихлорметані), і одержують 2,0г (загаМас-спектр (іонне розпилення): m/z=520,2 (M+H). льний вихід 75%) вказаної в заголовку сполуки з За альтернативним варіантом, змішують 6ее 91%. Мас-спектр (іонне розпилення): m/z=508,3 метокси-1-[4-(2-піперидин-1-іл-етокси)-бензоїл](M+H). нафталін-2-іловий складний ефір трифторметанПриклад 80 сульфонової кислоти (1,93г, 3,60ммоль), фторид 7,9-дифтор-5-[4-(2-піперидин-1-іл-етокси)цезію (5,0г, 33ммоль), біс(неопентилфеніл]-5Н-6-окса-хризен-2-ол гліколято)дибор (1,0г, 4,4ммоль), Розчиняють 5-{гідрокси-[4-(2-піперидин-1-ілетокси)-феніл]-метил}-6-(2,3,5-трифтор-феніл)нафталін-2-ол (4,3г, 3,0ммоль) у безводному THF (85мл). Додають трет-бутилал калію (2,4г, 21,3ммоль), і перемішують при кімнатній температурі протягом 3год. Виливають реакційну суміш у насичений водний розчин хлориду амонію, і двічі екстрагують дихлорметаном. Сушать органічний шар над сульфатом натрію, фільтрують і концентрують у вакуумі, одержуючи 3,7г (90%) вказаної в заголовку сполуки. Мас-спектр (іонне розпилення) біс(трициклогексилфосфін)-паладій (0,50г, 0,75ммоль) та ацетонітрил (50мл). Нагрівають суміш при 90°С протягом 20хв, і одержують темнозабарвлений розчин. Додають 2-бром-1,3,5трифтор-бензол (5г, 23,7ммоль) і нагрівають при 90°С протягом 2год. Додають біс(трициклогексилфосфін)паладій (0,50г, 0,75ммоль) та 2-бром-1,3,5-трифтор-бензол (5,0г, 23ммоль), і нагрівають суміш при 90°С протягом 4год. Охолоджують до кімнатної температури, фільтрують через шар целіту, і випарюють розчинник. Залишок очищають на силікагелі при елююванні метанолом у дихлорметані (0-5%), і одержують 1,30г (67%) вказаної в заголовку сполуки. Мас-спектр (іонне розпилення) m/z=520,2 (M+H). Приклад 83 [6-гідрокси-2-(2,4,6-трифтор-феніл)-нафталін1-іл]-[4-(2-піперидин-1-іл-етокси)-феніл]-метанон 57 85862 58 Розчиняють [6-метокси-2-(2,4,6-трифтор254нм)=2,41 (100%). Мас-спектр (іонне розпиленфеніл)-нафталін-1-іл]-[4-(2-піперидин-1-іл-етокси)ня): m/z=508,3 (M+H). феніл]-метанон (670мг, 1,3ммоль) у дихлорметані За альтернативним варіантом, додають (R)(10мл). Охолоджують до 0°С, додають 2Μ HCl (+)-a,a-дифенілпролінол (83мг, 0,33ммоль) до су(1,3мл, 2,6ммоль), і перемішують суміш при кімнаміші 1Μ розчину борану у THF (8мл, 8ммоль) та тній температурі протягом 15хв. Концентрують у THF (8мл) при 45°С. Розчиняють [6-гідрокси-2вакуумі. Розчиняють одержану сіль у ди хлорметані (2,4,6-трифтор-феніл)-нафталін-1-іл]-[4-(2(10мл) і охолоджують до 0°С. Додають краплями піперидин-1-іл-етокси)-феніл]-метанон (0,83г, трибромід бору (1,1г, 3,9ммоль), і доводять темпе1,6ммоль) у THF (5мл), і додають цей розчин до ратур у до кімнатної. Перемішують реакційну суміш реакційної суміші протягом 3год за допомогою протягом 1,5год і виливають її у суміш льоду, нашприца при 45°С. Охолоджують до 0°С і додають сиченого розчину бікарбонату натрію (10мл) та краплями 2-аміноетанол (1,0мл, 16ммоль). Нагріметанолу (10мл). Екстрагують суміш ди хлорметавають при 45°С протягом 30хв. Промивають суміш ном, об'єднують екстракти, і промивають водою та водою (10мл), і екстрагують водну фазу етилаценасиченим розчином бікарбонату натрію. Сушать татом (20мл). Органічні шари об'єднують і промиорганічний шар над сульфатом натрію, фільтрувають розсолом. Сушать над суль фатом магнію і ють і концентрують у вакуумі. Очи щають продукт концентрують у вакуумі. Очи щають залишок на хроматографією на силікагелі, елююючи градієнсилікагелі при елююванні продукту ступінчастим том метанолу в дихлорметані (1-3%), і одержують градієнтом метанолу в ди хлорметані (0-10%), і 454мг (70%) вказаної в заголовку сполуки. Масодержують 804мг (97%) енантіомерно збагаченої спектр (іонне розпилення): m/z=506,3 (M+H). сполуки, вказаної в заголовку. Мас-спектр (іонне За альтернативним варіантом, розчиняють [6розпилення) m/z=508,2 (M+H). метокси-2-(2,4,6-трифтор-феніл)-нафталін-1-іл]-[4Приклад 85 (2-піперидин-1-іл-етокси)-феніл]-метанон (1,90г, 8,10-дифтор-5-[4-(2-піперидин-1-іл-етокси)3,67ммоль) у дихлорметані (10мл). Додають 2Μ феніл]-5Н-6-окса-хризен-2-ол HCl у діетиловому ефірі (4,0мл, 80ммоль). Концентрують суспензію і сушать у вакуумі. Розчиняють залишок у дихлорметані (30мл), і вміщують розчин в атмосферу азоту. Охолоджують розчин до 0°С на льодяній бані. Додають трибромід бору (1мл, 11ммоль). Через 60хв виливають реакційну суміш у суміш льоду (20г), метанолу (10мл) та насиченого розчину бікарбонату натрію (20мл). Екстрагують суміш дихлорметаном (100мл). Розділяють шари, Розчиняють гідрохлорид 5-{гідрокси-[4-(2промивають органічний шар розсолом (20мл), супіперидин-1-іл-етокси)-феніл]-метил}-6-(2,4,6шать над сульфатом магнію, фільтрують і концентрифтор-феніл)-нафталін-2-олу (730мг, 1,4ммоль) трують у вакуумі. Очищають залишок на силікагелі та трет-бутилат калію (5,36мг, 4,8ммоль) у безвопри елююванні продукту ступінчастим градієнтом дному DMF (25мл) і нагрівають при 50°С протягом метанолу в ди хлорметані (0-10%), і одержують 10хв. Охолоджують реакційну масу і виливають її у 1,6г (87%) вказаної в заголовку сполуки. Массуміш льоду з етилацетатом. Відділяють органічспектр (іонне розпилення) m/z=506,2 (M+H). ний шар і промивають його 10% водним розчином Приклад 84 хлориду літію. С ушать, фільтрують і концентрують Гідрохлорид 5-{гідрокси-[4-(2-піперидин-1-ілу вакуумі. Очи щають залишок хроматографією на етокси)-феніл]-метил}-6-(2,4,6-трифтор-феніл)силікагелі при елююванні градієнтом метанолу в нафталін-2-олу дихлорметані (0-6%), і одержують 532мг (76%) Розчиняють [6-гідрокси-2-(2,4,6-трифторвказаної в заголовку сполуки. феніл)-нафталін-1-іл]-[4-(2-піперидин-1-іл-етокси)За альтернативним варіантом, розчиняють феніл]-метанон (728мг, 1,4ммоль) у THF (85мл) і енантіомерно збагачений 5-{гідрокси-[4-(2охолоджують до 0°С. Додають 1Μ розчин алюмопіперидин-1-іл-етокси)-феніл]-метил}-6-(2,4,6гідриду літію у THF (5,8мл, 5,8ммоль), і доводять трифтор-феніл)-нафталін-2-ол (804мг, 1,59ммоль) температуру до кімнатної. Нагрівають реакційну у DMF (10мл). Додають трет-бутилат калію (532мг, суміш зі зворотним холодильником протягом 30хв. 4,75ммоль). Нагрівають при 50°С протягом 2хв. Охолоджують реакційну суміш і виливають її у Виливають реакційну суміш на лід (5г). Екстрагусуміш льоду з хлороформом, одержуючи суспенють етилацетатом (100мл). Розділяють шари, і зію. Додають краплями 6-н. HCl до рН 1. Екстрагупромивають органічний шар 10% водним розчиють сумішшю 20% ізопропілового спирту у хлороном хлориду літію (2´20мл). Сушать над сульфаформі. Промивають органічний шар розсолом, том магнію і концентрують у вакуумі. Очи щають сушать, фільтрують і концентрують у вакуумі, одезалишок на силікагелі при елююванні продукту ржуючи 730мг (100%) вказаної в заголовку сполуступінчастим градієнтом метанолу в ди хлорметані ки. РХВЕ: Rt (рухома фаза А - 0,01% гептафторма(0-10%), і одержують енантіомерно збагачену спосляної кислоти: 1,0% ізопропілового спирту у воді; луку, вказану в заголовку. рухома фаза В - 0,01% гептафтормасляної кислоПриклад 86 ти: 1,0% ізопропілового спирту у ацетонітрилі; граГідрохлорид 8,10-дифтор-5-[4-(2-піперидин-1дієнт 5-95% рухомої фази В, детектування для іл-етокси)-феніл]-5Н-6-окса-хризен-2-олу визначення ступеня чистоти на довжині хвилі 59 85862 60 Розчиняють 8,10-дифтор-5-[4-(2-піперидин-1іл-етокси)-феніл]-5Н-6-окса-хризен-2-ол (532мг, Розчиняють [4-(2-азепан-1-іл-етокси)-феніл]1,1ммоль) у дихлорметані (10мл), додають 2Μ HCl [6-гідрокси-2-(2,3,6-трифтор-феніл)-нафталін-1-іл](1,1мл, 2,2ммоль) і перемішують протягом 10хв. метанон (529мг, 1,02ммоль) у діоксані (205мл). Концентрують суміш у вакуумі, і одержують 536мг Продувають колбу N2, потім додають LiBHEt3 (100%) вказаної в заголовку сполуки. Мас-спектр (4,1мл, 4,1ммоль, 1,0Μ у THF). Перемішують реак(іонне розпилення): m/z=488 (М+Н-HCl). Розділяційну масу при кімнатній температурі протягом ють рацемічну суміш на її енантіомерні компонен1год, після чого нагрівають реакційну масу до ти хіральною хроматографією. Умови: колонка 100°С. Продовжують нагрівання реакційної маси протягом 4год, після чого охолоджують її до кімнаChiralcel OD, 4,6´150мм; елюент: 0,2% DMEA, 5% тної температури. Додають насичений розчин МеОН, 10% етанолу 3 А у гептані. NH4CI (200мл), і екстрагують водний шар СН 2СI2 За альтернативним варіантом, розчиняють енантіомерно збагачену вільну основу у діетило(3´200мл). Об'єднують органічні шари, сушать над вому ефірі (4мл), етилацетаті (1мл) та метанолі Na2SO4, фільтрують, концентрують і очищають (0,5мл) і охолоджують до 0°С. Додають 2Μ HCl у залишок флеш-хроматографією на колонці (силідіетиловому ефірі (2мл, 20ммоль). Концентрують кагель, 2-8% метанол (MeOH)-NH4OH (10/1 за об'одержану суспензію і сушать у вакуумі, одержуючи ємом)/СН2СІ2), одержуючи 401мг (79%) продукту. енантіомерно збагачену сполуку, вказану в загоРозчиняють цей продукт (401мг, 0,80ммоль) у ловку (480мг, вихід 58%). Мас-спектр (іонне розпиСН2СІ2 (8мл), і охолоджують розчин до -78°С. Долення) m/z=488,3 (M-CI). дають HCl (0,8мл, 2,0Μ у Еt2 О), і перемішують розПриклад 87 чин протягом 10хв. Видаляють розчинник під зни[4-(2-азепан-1-іл-етокси)-феніл]-[6-метокси-2женим тиском. Одержану тверду речовину сушать (2,3,6-трифтор-феніл)-нафталін-1-іл]-метанон у вакуумі при 40°С протягом ночі, і одержують 432мг (100%) вказаної в заголовку сполуки. Масспектр (іонне розпилення): m/z=502,3 (M+H-HCl). Приклад 90 [6-метокси-2-(2,3,6-трифтор-феніл)-нафталін1-іл]-[4-(2-піперидин-1-іл-етокси)-феніл]-метанон Проводять реакцію сполучення 1-[4-(2-азепан1-іл-етокси)-бензоїл]-6-метоксинафталін-2-ілового складного ефіру трифторметансульфонової кислоти (1,48г, 2,67ммоль) із 2-бром-1,3,4трифторбензолом (1,13г, 5,35ммоль) за методикою, аналогічною описаній для Підготовчого синтезу [6-гідрокси-2-(2,3,5-трифтор-феніл)-нафталін1-іл]-[4-(2-піперидин-1-іл-етокси)-феніл]-метанону, і одержують 660мг (46%) вказаної в заголовку сполуки. Мас-спектр (іонне розпилення): m/z=534,4 (M+H). Приклад 88 [4-(2-азепан-1-іл-етокси)-феніл]-[6-гідрокси-2(2,3,6-трифтор-феніл)-нафталін-1-іл]-метанон Деметилюють [4-(2-азепан-1-іл-етокси)-феніл][6-метокси-2-(2,3,6-трифтор-феніл)-нафталін-1-іл]метанон (0,66г, 1,24ммоль) із застосуванням ВВr3 з за методикою, аналогічною описаній для Підготовчого синтезу [6-гідрокси-2-(2,4,6-трифторфеніл)-нафталін-1-іл]-[4-(2-піперидин-1-іл-етокси)феніл]-метанону, і одержують 530мг (82%) вказаної в заголовку сполуки. Мас-спектр (іонне розпилення): m/z=520,3 (M+H-HCI). Приклад 89 Гідрохлорид 5-[4-(2-ізепан-1-іл-етокси)-феніл]7,10-дифтор-5Н-6-окса-хризен-2-олу Проводять реакцію сполучення 6-метокси-1-[4(2-піперидин-1-іл-етокси)-бензоїл]-нафталін-2ілового складного ефіру три фторметансульфонової кислоти (1,81г, 3,37ммоль) з 2-бром1,3,4-трифторбензолом (1,42г, 6,75ммоль) за методикою, аналогічною описаній для Підготовчого синтезу [6-гідрокси-2-(2,3,5-трифтор-феніл)нафталін-1-іл]-[4-(2-піперидин-1-іл-етокси)-феніл]метанону, і одержують 0,79г (45%) вказаної в заголовку сполуки. Мас-спектр (іонне розпилення): m/z=520,3 (M+1). Приклад 91 [6-гідрокси-2-(2,3,6-трифтор-феніл)-нафталін1-іл]-[4-(2-піперидин-1-іл-етокси)-феніл]-метанон Деметилюють [6-метокси-2-(2,3,6-трифторфеніл)-нафталін-1-іл]-[4-(2-піперидин-1-іл-етокси)феніл]-метанон (0,79г, 1,52ммоль) із застосуванням ВВr3 за методикою, аналогічною описаній для Підготовчого синтезу [6-гідрокси-2-(2,4,6-трифторфеніл)-нафталін-1-іл]-[4-(2-піперидин-1-іл-етокси)феніл]-метанону, і одержують 0,67г (88%) вказаної в заголовку сполуки. Мас-спектр (іонне розпилення): m/z=506,3 (M+H). Приклад 92 5-{гідрокси-[4-(2-піперидин-1-іл-етокси)-феніл]метил}-6-(2,3,5-трифтор-феніл)-нафталін-2-ол Додають (R)-(+)-a,a-дифеніл-2піролідинметанол (0,06г, 0,24ммоль) до розчину BH3·THF (6,0мл, 6,0ммоль, 1,0Μ у THF) у THF
ДивитисяДодаткова інформація
Назва патенту англійськоюSelective estrogen receptor modulators for the treatment of vasomotor symptoms
Автори англійськоюDally Robert Dean, Dodge Jeffrey Alan, Frank Scott Alan, Hinklin Ronald Jay, Shepherd Timothy Alan, Wallace Owen Brendan
Назва патенту російськоюСелективные модуляторы рецепторов эстрогена для лечения фазомоторных симптомов
Автори російськоюДалли Роберт Дин, Додж Джеффри Алан, Франк Скотт Алан, Хинклин Рональд Джей, Шеперд Тимоти Алан, Уоллис Оуэн Брендан
МПК / Мітки
МПК: C07D 335/00, C07D 311/78, A61K 31/4523, A61K 31/55, A61P 15/12, C07D 221/18, C07D 295/08, A61K 31/4453
Мітки: вазомоторних, селективні, лікування, модулятори, естрогену, рецепторів, симптомів
Код посилання
<a href="https://ua.patents.su/48-85862-selektivni-modulyatori-receptoriv-estrogenu-dlya-likuvannya-vazomotornikh-simptomiv.html" target="_blank" rel="follow" title="База патентів України">Селективні модулятори рецепторів естрогену для лікування вазомоторних симптомів</a>
Попередній патент: Стабільна до ультрафіолетових променів рідка або напівтверда форма для трансдермального введення, що включає фоточутливий активний інгредієнт
Наступний патент: Спосіб одержання матеріалів на основі гідроксидів або оксидів полівалентних металів
Випадковий патент: Спосіб випробувань обмоткових проводів на механічну стійкість ізоляції












