Інгібітори протеїнкінази
Номер патенту: 115176
Опубліковано: 25.09.2017
Автори: Аппукуттан Прасад, Раджагопалан Срінівасан, Уджінаматада Раві Котрабасаіах, Джордж Шила, Нарасінгапурам Арумугам Картхікейан, Ліннанен Теро
Формула / Реферат
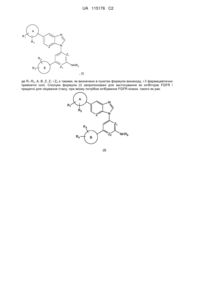
1. Сполука формули (І):
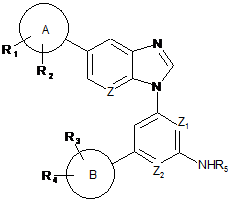 , (I)
, (I)
де
Ζ1 являє собою N, і Z2 являє собою СН, або
Ζ1 являє собою СН, і Z2 являє собою N, або
Ζ1 і Ζ2 являють собою Ν;
Ζ являє собою СН або Ν;
А являє собою фенільне кільце або 5-12-членне гетероциклічне кільце;
R1 являє собою Н, С1-7алкіл, С3-7циклоалкіл, С3-7циклоалкілС1-7алкіл, С1-7алкокси, С1-7алкілкарбоніл, аміно, гідрокси, гідроксіС1-7алкіл, галогенС1-7алкіл, С1-7алкіламіноС1-7алкіл, -R16-C(O)-R17 або -E-R6;
R2 являє собою Н, галоген або С1-7алкіл;
В являє собою 5-12-членне карбоциклічне або гетероциклічне кільце;
R3 являє собою Н, галоген, С1-7алкіл, С1-7алкокси, галогенС1-7алкіл або галогенС1-7алкокси;
R4 являє собою Н, галоген, С1-7алкіл або оксо;
R5 являє собою Н, -C(O)R7, -SO2R8 або необов'язково заміщене 5-6-членне гетероциклічне кільце;
R6 являє собою необов'язково заміщене 5-6-членне гетероциклічне кільце;
R7 являє собою С1-7алкіл, С2-7алкеніл, С1-7алкокси, С1-7алкоксіС1-7алкіл, карбоксіС1-7алкіл, С1-7алкоксикарборнілС1-7алкіл, С1-7алкіламіноС1-7алкіл, -NH-R10 або -NH-X1-R11;
R8 являє собою С1-7алкіл, С2-7алкеніл, С3-7циклоалкіл, гідроксіС1-7алкіл, -NR13R14, -NH-X2-R15, феніл або необов'язково заміщене 5-6-членне гетероциклічне кільце;
R10 являє собою С1-7алкіл або С3-7циклоалкіл;
R11 являє собою феніл або необов'язково заміщене 5-6-членне гетероциклічне кільце;
R12 являє собою Η або С1-7алкіл;
R13 і R14 незалежно являють собою Н, С1-7алкіл або С3-7циклоалкіл;
R15 являє собою феніл або необов'язково заміщене 5-6-членне гетероциклічне кільце;
R16 являє собою зв'язок або С1-7алкіл;
R17 являє собою С1-7алкіл, С1-7алкокси, С1-7алкіламіно, аміно або гідрокси;
Ε являє собою зв'язок або С1-7алкіл;
Х1 і Х2 незалежно являють собою зв'язок або С1-7алкіл;
або її фармацевтично прийнятні солі.
2. Сполука за п. 1, де Ζ являє собою СН.
3. Сполука за п. 1 або 2, де Z1 являє собою Ν, і Ζ2 являє собою СН.
4. Сполука за п. 1 або 2, де Z1 являє собою СН, і Z2 являє собою N.
5. Сполука за п. 1 або 2, де Ζ1 і Ζ2 являють собою N.
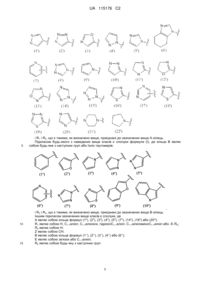
6. Сполука за будь-яким із пп. 1-5, де кільце А являє собою будь-яку з наступних груп або їх таутомерів:
 ,
,
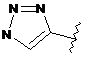 ,
,
 ,
,
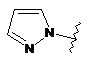 ,
,
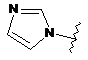 ,
,
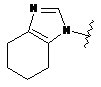 ,
,
(1’)
(2’)
(3’)
(4’)
(5’)
(6’)
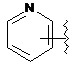 ,
,
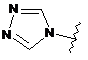 ,
,
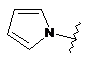 ,
,
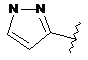 ,
,
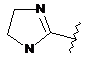 ,
,
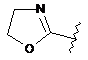 ,
,
(7’)
(8’)
(9’)
(10’)
(11’)
(12’)
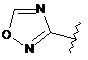 ,
,
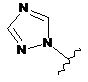 ,
,
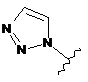 ,
,
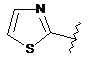 ,
,
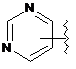 ,
,
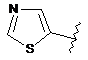 ,
,
(13’)
(14’)
(15’)
(16’)
(17’)
(18’)
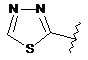 ,
,
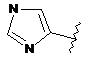 ,
,
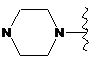 ,
,
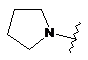 .
.
(19’)
(20’)
(21’)
(22’)
7. Сполука за будь-яким із пп. 1-6, де кільце В являє собою будь-яку з наступних груп або їх таутомерів:
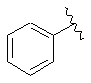 ,
,
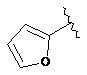 ,
,
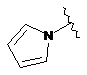 ,
,
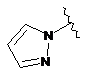 ,
,
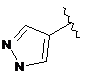 ,
,
(1”)
(2”)
(3”)
(4”)
(5”)
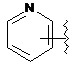 ,
,
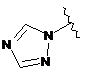 ,
,
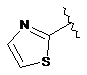 ,
,
 ,
,
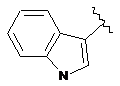 .
.
(6”)
(7”)
(8”)
(9”)
(10”)
8. Сполука за будь-яким із пп. 1-7, де
А являє собою кільце формул (1’), (2’), (3’), (4’), (5’), (7’), (14’), (16’) або (20’);
R1 являє собою Н, С1-7алкіл, С1-7алкокси, гідроксіС1-7алкіл, С1-7алкіламіноС1-7алкіл або -E-R6;
R2 являє собою Н;
Ζ являє собою СН;
В являє собою кільце формул (1”), (2”), (3”), (4”) або (6”);
Ε являє собою зв'язок або С1-7алкіл;
R6 являє собою будь-яку з наступних груп:
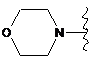 ,
,
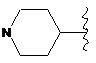 ,
,
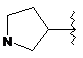 ,
,
 ,
,
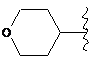 ,
,
(a)
(b)
(c)
(d)
(e)
R3 являє собою Н, галоген, С1-7алкіл, С1-7алкокси; R4 являє собою Η або галоген;
R5 являє собою -C(O)R7 або -SO2R8 або будь-яку з наступних груп:
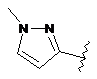 ,
,
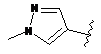 ,
,
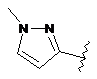 ,
,
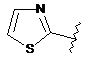 ,
,
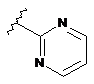 ,
,
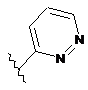 ,
,
(a”)
(b”)
(c”)
(d”)
(e”)
(f”)
R7 являє собою С1-7алкіл, С2-7алкеніл або -NH-R10;
R8 являє собою С1-7алкіл, С2-7алкеніл, С3-7циклоалкіл, гідроксіС1-7алкіл або -NR13R14; і
R10 являє собою С1-7алкіл або С3-7циклоалкіл.
9. Сполука за будь-яким із пп. 1-8, де В являє собою кільце формул (1”), (3”) або (6”).
10. Сполука за будь-яким із пп. 1-9, де А являє собою кільце формул (1’), (2’), (4’), (5’) або (20’).
11. Сполука за будь-яким із пп. 1-10, де R5 являє собою -SO2R8.
12. Сполука за будь-яким із пп. 1-11, де Ζ являє собою СН, Z1 являє собою Ν, і Ζ2 являє собою СН, А являє собою кільце формули (1’), В являє собою кільце формули (1”), R1 являє собою С1-7алкіл, R2 являє собою Н, R3 являє собою галоген, R4 являє собою Η або галоген, R5 являє собою -SO2R8, і R8 являє собою С1-7алкіл або С3-7циклоалкіл.
13. Сполука за будь-яким із пп. 1-12, яка являє собою:
4-(2,4-дифторфеніл)-N-(1-метил-1Н-піразол-3-іл)-6-(5-(1-метил-1Н-піразол-4-іл)-1Н-бензо[d]імідазол-1-іл)піридин-2-амін;
N-(4-(2,4-дифторфеніл)-6-(5-(1-метил-1Н-піразол-4-іл)-1Н-бензо[d]імідазол-1-іл)піридин-2-іл)циклопропансульфонамід;
натрієву сіль імідоформи N-(4-(2,4-дифторфеніл)-6-(5-(1-метил-1Н-піразол-4-іл)-1Н-бензо[d]імідазол-1-іл)піридин-2-іл)циклопропансульфонаміду;
N-(4-(2,4-дифторфеніл)-6-(5-(1-метил-1Н-піразол-4-іл)-1Н-бензо[d]імідазол-1-іл)піридин-2-іл)метансульфонамід;
N-(4-(2,4-дифторфеніл)-6-(5-(1-метил-1Н-піразол-4-іл)-1H-бензо[d]імідазол-1-іл)піридин-2-іл)етансульфонамід;
натрієву сіль імідоформи N-(4-(2,4-дифторфеніл)-6-(5-(1-метил-1Н-піразол-4-іл)-1Н-бензо[d]імідазол-1-іл)піридин-2-іл)етансульфонаміду;
N-(4-(2,4-дифторфеніл)-6-(5-(1-метил-1Н-піразол-4-іл)-1Н-бензо[d]імідазол-1-іл)піридин-2-іл)пропан-2-сульфонамід;
імідоформу N-(4-(2,4-дифторфеніл)-6-(5-(1-метил-1Н-піразол-4-іл)-1Н-бензо[d]імідазол-1-іл)піридин-2-іл)пропан-2-сульфонаміду;
N-(4-(2-фторфеніл)-6-(5-(1-метил-1Н-піразол-4-іл)-1H-бензо[d]імідазол-1-іл)піридин-2-іл)циклопропансульфонамід;
натрієву сіль імідоформи Ν-(4-(2-фторфеніл)-6-(5-(1-метил-1Н-піразол-4-іл)-1Н-бензо[d]імідазол-1-іл)піридин-2-іл)циклопропансульфонаміду;
N-(4-(2-фторфеніл)-6-(5-(1-метил-1Н-піразол-4-іл)-1H-бензо[d]імідазол-1-іл)піридин-2-іл)метансульфонамід;
N-(4-(2-фторфеніл)-6-(5-(1-метил-1Н-піразол-4-іл)-1Н-бензо[d]імідазол-1-іл)піридин-2-іл)етансульфонамід;
натрієву сіль імідоформи N-(4-(2-фторфеніл)-6-(5-(1-метил-1Н-піразол-4-іл)-1Н-бензо[d]імідазол-1-іл)піридин-2-іл)етансульфонаміду;
N-(4-(2-фторфеніл)-6-(5-(1-метил-1Н-піразол-4-іл)-1Н-бензо[d]імідазол-1-іл)піридин-2-іл)пропан-2-сульфонамід;
натрієву сіль імідоформи N-(4-(2-фторфеніл)-6-(5-(1-метил-1Н-піразол-4-іл)-1Н-бензо[d]імідазол-1-іл)піридин-2-іл)пропан-2-сульфонаміду;
N-(4-(4-фторфеніл)-6-(5-(1-метил-1Н-піразол-4-іл)-1Н-бензо[d]імідазол-1-іл)піридин-2-іл)циклопропансульфонамід;
N-(4-(4-фторфеніл)-6-(5-(1-метил-1Н-піразол-4-іл)-1Н-бензо[d]імідазол-1-іл)піридин-2-іл)метансульфонамід;
N-(4-(4-фторфеніл)-6-(5-(1-метил-1Н-піразол-4-іл)-1H-бензо[d]імідазол-1-іл)піридин-2-іл)пропан-2-сульфонамід;
натрієву сіль імідоформи N-(4-(4-фторфеніл)-6-(5-(1-метил-1Н-піразол-4-іл)-1H-бeнзo[d]iмiдaзoл-1-iл)пipидин-2-iл)пpoпaн-2-cyльфoнaмiдy;
Ν-(3-фтор-6’-(5-(1-метил-1Н-піразол-4-іл)-1Н-бензо[d]імідазол-1-іл)-[2,4’-біпіридин]-2’-іл)циклопропансульфонамід;
Ν-(3-фтор-6’-(5-(1-метил-1Н-піразол-4-іл)-1Н-бензо[d]імідазол-1-іл)-[2,4’-біпіридин]-2’-іл)ацетамід;
N-(4-(2,4-дифторфеніл)-6-(5-(1-(2-(диметиламіно)етил)-1Н-піразол-4-іл)-1Н-бeнзo[d]iмiдaзoл-1-iл)пipидин-2-iл)циклoпpoпaнcyльфoнaмiд;
N-(4-(2-фторфеніл)-6-(5-(1-метил-1Н-піразол-4-іл)-1Н-бензо[d]імідазол-1-іл)піримідин-2-іл)циклопропансульфонамід;
N-(6-(5-(1Н-піразол-1-іл)-1Н-бензо[d]імідазол-1-іл)-4-(2,4-дифторфеніл)піридин-2-іл)циклопропансульфонамід;
Ν-(3,5-дифтор-6’-(5-(1-метил-1Н-піразол-4-іл)-1Н-бензо[d]імідазол-1-іл)-[2,4’-біпіридин]-2'-іл)циклопропансульфонамід;
N-(3,5-дифтор-6’-(5-(1-метил-1Н-піразол-4-іл)-1Н-бензо[d]імідазол-1-іл)-[2,4’-біпіридин]-2’-іл)ацетамід;
N-(4-(2-хлорфеніл)-6-(5-(1-метил-1Н-піразол-4-іл)-1Н-бензо[d]імідазол-1-іл)піридин-2-іл)циклопропансульфонамід;
N-(3-хлор-6’-(5-(1-метил-1Н-піразол-4-іл)-1Н-бензо[d]імідазол-1-іл)-[2,4’-біпіридин]-2’-іл)циклопропансульфонамід;
N-(5-фтор-6’-(5-(1-метил-1Н-піразол-4-іл)-1Н-бензо[d]імідазол-1-іл)-[2,4’-біпіридин]-2’-іл)циклопропансульфонамід;
Ν-(6-(5-(1Н-імідазол-1-іл)-1Н-бензо[d]імідазол-1-іл)-4-(2,4-дифторфеніл)піридин-2-іл)циклопропансульфонамід;
N-(4-(2,4-дифторфеніл)-6-(5-(1-(2-морфоліноетил)-1Н-піразол-4-іл)-1Н-бензо[d]імідазол-1-іл)піридин-2-іл)циклопропансульфонамід;
N-(4-(2,4-дифторфеніл)-6-(5-(1-(піролідин-3-іл)-1Н-піразол-4-іл)-1Н-бензо[d]імідазол-1-іл)піридин-2-іл)циклопропансульфонамід;
N-(4-(2,4-дифторфеніл)-6-(5-(1-етил-1Н-1,2,3-триазол-4-іл)-1Н-бензо[d]імідазол-1-іл)піридин-2-іл)циклопропансульфонамід;
N-(4-(2,4-дифторфеніл)-6-(5-(1-метил-1Н-1,2,3-триазол-4-іл)-1Н-бензо[d]імідазол-1-іл)піридин-2-іл)циклопропансульфонамід;
N-(4-(2,4-дифторфеніл)-6-(5-(1-метил-1Н-імідазол-4-іл)-1Н-бензо[d]імідазол-1-іл)піридин-2-іл)циклопропансульфонамід;
N-(4-(2,4-дифторфеніл)-6-(5-(1-метил-1Н-піразол-4-іл)-1Н-бензо[d]імідазол-1-іл)піримідин-2-іл)ацетамід;
етил-1-(1-(6-(циклопропансульфонамідо)-4-(2,4-дифторфеніл)піридин-2-іл)-1Н-бензо[d]імідазол-5-іл)-1Н-1,2,3-триазол-4-карбоксилат;
N-(4-(2-(дифторметокси)-4-фторфеніл)-6-(5-(1-метил-1Н-піразол-4-іл)-1Н-бензо[d]імідазол-1-іл)піридин-2-іл)циклопропансульфонамід;
N-(4-(2,4-дифторфеніл)-6-(5-(1-метил-1Н-піразол-4-іл)-1Н-бензо[d]імідазол-1-іл)піримідин-2-іл)циклопропансульфонамід;
N-(6-(2,4-дифторфеніл)-4-(5-(1-метил-1Н-піразол-4-іл)-1Н-бензо[d]імідазол-1-іл)піридин-2-іл)циклопропансульфонамід
або її фармацевтично прийнятна сіль або таутомер.
14. Фармацевтична композиція, яка містить сполуку формули (І) або її фармацевтично прийнятну сіль разом із фармацевтично прийнятним носієм.
15. Застосування сполуки формули (І) або її фармацевтично прийнятної солі для виготовлення лікарського засобу для лікування стану, при якому потрібне інгібування FGFR-кінази.
16. Застосування сполуки формули (І) або її фармацевтично прийнятної солі для виготовлення лікарського засобу для лікування раку.
Текст
Реферат: Описано сполуку формули (І): (72) Винахідник(и): Раджагопалан Срінівасан (IN), Аппукуттан Прасад (IN), Нарасінгапурам Арумугам Картхікейан (IN), Уджінаматада Раві Котрабасаіах (IN), Джордж Шила (IN), Ліннанен Теро (FI) (73) Власник(и): ОРІОН КОРПОРЕЙШН, Orionintie 1, FI-02200 Espoo, Finland (FI) (74) Представник: Мошинська Ніна Миколаївна, реєстр. №115 (56) Перелік документів, взятих до уваги експертизою: WO 2013/053983 A1 (ORION CORP [FI]), 18.04.2013 WO 2008/078100 A2 (ASTEX THERAPEUTICS LTD [GB]; BERDINI VALERIO [GB]; BESONG GILBERT EBAI), 03.07.2008 WO 2010/119284 A1 (ASTEX THERAPEUTICS LTD [GB]; BERDINI VALERIO [GB]; SAXTY GORDON [GB]), 21.10.2010 WO 2011/038579 A1 (ZHEJIANG BETA PHARMA INC [CN]; KANG XINSHAN [CN]; FINE RICHARD [CN]), 07.04.2011 WO 2005/021531 A1 (OSI PHARM INC [US]; BOLGER JOSHUA [US]; CASTELHANO ARLINDO L [US]), 10.03.2005 UA 115176 C2 (12) UA 115176 C2 A N R1 R2 Z N Z1 R3 R4 B Z2 NHR5 , (I) де R1-R5, А, В, Ζ, Ζ1 і Z2 є такими, як визначено в пунктах формули винаходу, і її фармацевтично прийнятні солі. Сполуки формули (І) запропоновані для застосування як інгібіторів FGFR і придатні для лікування стану, при якому потрібне інгібування FGFR-кінази, такого як рак. UA 115176 C2 5 10 15 20 25 30 35 40 45 Галузь техніки Даний винахід стосується терапевтично активних сполук і їх фармацевтично прийнятних солей, які придатні, наприклад, при лікуванні раку. Передумови створення винаходу Протеїнкінази являють собою клас білків (ферментів), що регулюють різні клітинні функції. Це досягається шляхом фосфорилування конкретних амінокислот на білкових субстратах з одержанням у результаті конформаційних змін білка субстрату. Конформаційні зміни модулюють активність субстрату або його здатність вступати у взаємодію з іншими партнерами зв'язування. Тирозинкінази являють собою множину протеїнкіназ, що каталізують передачу термінального фосфату аденозинтрифосфату (АТФ) залишкам тирозину білкових субстратів. Геном людини містить близько 90 тирозинкіназ і 43 тирозинкінази, подібних до генів, продукції яких регулюють клітинну проліферацію, виживання, диференціація, функції і рухомість. Тирозинкінази представляють два різновиди, тобто рецепторні і нерецепторні тирозинкінази. Рецепторні тирозинкінази (наприклад, FGFR) є трансмембранними білками позаклітинного ліганд-зв'язувального домену і каталітичного внутрішньоклітинного домену кінази, у той час як у нерецепторних тирозинкіназ (наприклад, c-ABL) відсутні трансмембранні домени і виявляються в цитозолі, ядрах і на внутрішній поверхні клітинної мембрани. Кіназні домени всіх тирозинкіназ мають двочасткову структуру, з N-термінальним сегментом, що зв'язує АТФ і магній, Cтермінальним сегментом, що містить петлю активації, і щілинами між сегментами, з якими субстрати поліпептидів зв'язуються. Рецептори тирозинкіназ активуються, коли ліганд зв'язується з позаклітинним доменом у результаті рецепторної олігомеризації й аутофосфорилування регулювання тирозину в петлі активації кіназного домену. Ці явища переорієнтування важливі для залишків амінокислот, зміцнюючи, тим самим, каталітичну активність ферменту. Фактор росту фібробластів (FGF) визнаний важливим медіатором багатьох фізіологічних процесів, таких як клітинна міграція, проліферація, виживання і диференціація в ході розвитку й ангіогенезу. В даний час відомо більше 25 членів сімейства FGF. Рецептор сімейства фактора росту фібробластів (FGFR) складається з чотирьох членів, який кожен складається з додаткового ліганд-зв'язувального клітинного домену, єдиного трансмембранного домену і внутрішньоклітинного цитоплазматичного домену білка тирозинкінази. Після стимуляції з FGF, FGFR проходять димеризацію і трансфосфорилування. Після димеризації, FGFR активують ряд наступних шляхів передачі сигналів, наприклад MAPK і PKB/Akt шляхи (Zhou, W. et. al. Chemistry & Biology, 2010, 17, 285). Повідомлялося про аномальну передачу сигналів FGFR у багатьох типах пухлин, включаючи множинну мієлому шлунка, ендометрії, простати і молочної залози (Squires M. et. al. Mol. Cancer Ther., September 2011, 10:1542-1552). FGF також відіграють роль в ангіогенезі пухлини і сприяють резистентності відносно інгібіторів рецепторів 2 васкулярного ендотеліального фактора росту (VEGFR2) (Casanovas, O. et. al., Cancer Cell, 2005, 8, 299). Тому FGF і FGFR мають потенціал для ініціювання і/або сприяють утворенню пухлин. Завдяки цьому система передачі сигналів FGF виявляється привабливою як терапевтична мішень, головним чином тому, що терапія, спрямована проти передачі сигналів FGFR і/або FGF, може впливати як на пухлинні клітини, а також і на ангіогенез пухлини (Foote, K. M. et. al., WO 2009/019518 A1). Тому FGF і FGFR мають потенціал в ініціюванні і/або сприянні утворенню пухлин. Суть винаходу Було виявлено, що сполуки формули (I) інгібують або модулюють активність деяких протеїнкіназ, більш конкретно — протеїнтирозинкіназ. Зокрема, було виявлено, що сполуки формули (I) є могутніми і селективними інгібіторами кіназ FGFR. Сполуки даного винаходу мають антипроліферативну активність й особливо корисні в лікуванні раку. Сполуки даного винаходу мають структуру, представлену формулою (I): 1 UA 115176 C2 5 10 15 20 25 30 35 , де Z1 являє собою N, і Z2 являє собою CH, або Z1 являє собою CH, і Z2 являє собою N, або Z1 і Z2 являють собою N; Z являє собою CH або N; A являє собою фенільне кільце або 5-12-членне гетероциклічне кільце; R1 являє собою H, C1-7алкіл, C3-7циклоалкіл, C3-7циклоалкілC1-7алкіл, C1-7алкокси, C17алкілкарборніл, аміно, гідрокси, гідроксіC 1-7алкіл, галогенC1-7алкіл, C1-7алкіламіноC1-7алкіл, -R16C(O)-R17 або -E-R6; R2 являє собою H, галоген або C1-7алкіл; B являє собою 5-12-членне карбоциклічне або гетероциклічне кільце; R3 являє собою H, галоген, C1-7алкіл, C1-7алкокси, галогенC1-7алкіл або галогенC1-7алкокси; R4 являє собою H, галоген, C1-7алкіл або оксо; R5 являє собою H, -C(O)R7, -SO2R8 або необов'язково заміщене 5-6-членне гетероциклічне кільце; R6 являє собою необов'язково заміщене 5-6-членне гетероциклічне кільце; R7 являє собою C1-7алкіл, C2-7алкеніл, C1-7алкокси, C1-7алкоксіC1-7алкіл, карбоксіC1-7алкіл, C17алкоксикарборнілC1-7алкіл, C1-7алкіламіноC1-7алкіл, -NH-R10 або -NH-X1-R11; R8 являє собою C1-7алкіл, C2-7алкеніл, C3-7циклоалкіл, гідроксіC1-7алкіл, -NR13R14, -NH-X2-R15, феніл або необов'язково заміщене 5-6-членне гетероциклічне кільце; R10 являє собою C1-7алкіл або C3-7циклоалкіл; R11 являє собою феніл або необов'язково заміщене 5-6-членне гетероциклічне кільце; R12 являє собою H або C1-7алкіл; R13 і R14 незалежно являють собою H, C1-7алкіл або C3-7циклоалкіл; R15 являє собою феніл або необов'язково заміщене 5-6-членне гетероциклічне кільце; R16 являє собою зв'язок або C1-7алкіл; R17 являє собою C1-7алкіл, C1-7алкокси, C1-7алкіламіно, аміно або гідрокси; E являє собою зв'язок або C1-7алкіл; X1 і X2 незалежно являють собою зв'язок або C1-7алкіл; і її фармацевтично прийнятні солі. Одним класом сполук є сполуки формули (I), де Z являє собою CH. Іншим класом сполук є сполуки формули (I), де Z1 являє собою N, і Z2 являє собою CH. Іншим класом сполук є сполуки формули (I), де Z1 являє собою CH, і Z2 являє собою N. Іншим класом сполук є сполуки формули (I), де Z1 і Z2 являють собою N. Підкласом будь-якого з наведених вище класів є сполуки формули (I), де кільце A являє собою будь-яке з наступних груп або їхніх таутомерів: 2 UA 115176 C2 5 10 15 і R1 і R2, що є такими, як визначено вище, приєднані до зазначених вище A-кілець. Підкласом будь-якого з наведених вище класів є сполуки формули (I), де кільце B являє собою будь-яке з наступних груп або їхніх таутомерів: , і R3 і R4, що є такими, як визначено вище, приєднані до зазначених вище B-кілець. Іншим підкласом зазначених вище класів є сполуки, де A являє собою кільце формул (1"), (2"), (3"), (4"), (5"), (7"), (14"), (16") або (20"); R1 являє собою H, C1-7алкіл, C1-7алкокси, гідроксіC1-7алкіл, C1-7алкіламіноC1-7алкіл або -E-R6; R2 являє собою H; Z являє собою CH; B являє собою кільце формул (1’’), (2’’), (3’’), (4’’) або (6’’); E являє собою зв'язок або C1-7алкіл; R6 являє собою будь-яку з наступних груп: 3 UA 115176 C2 ; R3 являє собою H, галоген, C1-7алкіл, C1-7алкокси; R4 являє собою H або галоген; R5 являє собою -C(O)R7 або -SO2R8 або будь-яку з наступних груп: 5 10 ; R7 являє собою C1-7алкіл, C2-7алкеніл або -NH-R10; R8 являє собою C1-7алкіл, C2-7алкеніл, C3-7циклоалкіл, гідроксіC1-7алкіл або -NR13R14; і R10 являє собою C1-7алкіл або C3-7циклоалкіл. Одним із класів сполук є сполуки формули (I), де R 5 являє собою -C(O)R7 або -SO2R8 або будь-яку з наступних груп: Одним із класів сполук є сполуки формули (I), де R5 являє собою -SO2R8. Одним із класів сполук є сполуки формули (I), де R6 являє собою будь-яку з наступних груп: 15 20 25 30 Даний винахід також забезпечує фармацевтичну композицію, яка містить сполуку формули (I) або її фармацевтично прийнятну сіль разом із фармацевтично прийнятним носієм. Даний винахід додатково забезпечує застосування сполуки формули (I) або її фармацевтично прийнятної солі при виробництві лікарського засобу для лікування стану, при якому потрібно інгібування FGFR кінази. Даний винахід додатково забезпечує застосування сполуки формули (I) або її фармацевтично прийнятної солі при виробництві лікарського засобу для лікування раку. Даний винахід забезпечує сполуку формули (I) або її фармацевтично прийнятну сіль для застосування в лікуванні стану, при якому потрібно інгібування FGFR кінази. Даний винахід забезпечує сполуку формули (I) або її фармацевтично прийнятну сіль для застосування при лікуванні раку. Даний винахід додатково забезпечує спосіб лікування стану, при якому потрібно інгібування FGFR кінази, що включає введення суб'єкту, що потребує цього, терапевтично ефективної кількості сполуки формули (I). Даний винахід додатково забезпечує спосіб лікування раку, що включає введення суб'єкту, що потребує цього, терапевтично ефективної кількості сполуки формули (I). Докладний опис винаходу Сполуки даного винаходу можуть бути отримані різними синтетичними шляхами, аналогічно способам, відомим у літературі, з використанням придатних вихідних речовин. Сполуки, що відповідають формулі (I), можуть бути отримані, наприклад, аналогічно або відповідно до 4 UA 115176 C2 5 10 15 20 наступних реакційних схем. Деякі сполуки, включені у формулу (I), можуть бути отримані перетворенням функціональних груп в інші сполуки формули (I), отриманої відповідно до наступних схем, шляхом відомих реакційних стадій, таких як окислювання, відновлення, гідроліз, ацилювання, алкілування, амідування, амінування, сульфонування й інші. Потрібно зазначити, що будь-які відповідні групи, що видаляються, наприклад N-захисні групи, такі як трет-бутоксикарборнільна (t-BOC) група або фенілсульфонільна група, можуть бути використані добре відомим способом у ході синтезу для підвищення вибірковості стадій реакції. Сполуки формули (I), де R5 являє собою -C(O)CH3, може бути отримано, наприклад, відповідно до схеми 1, де R1, R2, R3, R4, кільце A, кільце B і Z, Z1 і Z2 є такими, як визначено вище, і R являє собою водень або алкіл. У способі за схемою 1 N-(3-бром-5нітрофеніл)ацетамід [1] піддають сполученню в придатному розчиннику, такому як 1,2диметоксіетан, з похідним боронової кислоти [2] або її придатним ефіром у присутності Pd(dppf)Cl2 і водного карбонату натрію при підвищеній температурі. Нітрогрупу отриманої сполуки [3] відновлюють, наприклад воднем і Pd/C каталізатором, порошком заліза і водним хлоридом кальцію або цинком і водним амонійхлоридом, і отриманий у результаті амін [4] піддають взаємодії зі сполукою [5] у придатному розчиннику, такому як ДМФА, у присутності фториду калію при підвищеній температурі, з одержанням сполуки [6]. У випадку, коли Z являє собою CH у сполуці [5], X’’ являє собою відповідно фтор, і коли Z являє собою N, X’’ являє собою відповідно хлор. Нітрогрупу в сполуці [6] відновлюють, наприклад використанням цинку і водного амонійхлориду або порошку заліза і водного хлориду кальцію, і отриманий у результаті амін [7] нагрівають із мурашиною кислотою з одержанням сполуки [8] у реакції замикання кільця. Нарешті, сполуку [10] одержують реакцією сполучення Судзукі між сполукою [8] і похідним боронової кислоти [9] або її придатним ефіром у придатному розчиннику, такому як 1,2диметоксіетан у присутності Pd(dppf)Cl2 і водного карбонату натрію при підвищеній температурі. 25 5 UA 115176 C2 Схема 1 5 Альтернативно, сполука формули [3] може бути отримана відповідно до схеми 2, де R 3, R4, Z1 і Z2, кільце B і R є такими, як визначено вище, з використанням похідного боронової кислоти [11] або її придатного ефіру в присутності Pd(dppf)Cl2 і водного карбонату натрію. Сполука [11] може бути отримана, наприклад обробкою N-(3-бром-5-нітрофеніл)ацетаміду біс(пінаколато)дибороном у присутності Pd(dppf)Cl2 і ацетату калію. 10 Схема 2 15 У випадку, коли B-кільце в сполуці [3] являє собою гетероцикл, зв'язаний з фенілом через гетероатом азоту, сполука [3] також може бути отримана з використанням каталізованого міддю амінування Бухвальда в присутності основи, такої як карбонат цезію або карбонат калію, відповідно до схеми 3, де Z1, Z2, R3 і R4 є такими, як визначено вище. 20 6 UA 115176 C2 Схема 3 5 У випадку, коли B-кільце в сполуці [3] являє собою пірольне кільце, зв'язане з фенілом через атом азоту, сполука [3] також може бути отримана з 3,5-динітроаніліну [15] і 2,5диметокситетрагідрофурану відповідно до схеми 4, де Z 1 і Z2 є такими, як визначено вище. Утворене похідне піролу [16] відновлюють із використанням сульфіду амонію, з одержанням сполуки [17], яку згодом піддають взаємодії з оцтовим ангідридом з одержанням сполуки [18]. 10 Схема 4 15 20 У випадку, коли кільце A у сполуці [10] являє собою оксазол-5-ільне кільце, сполука [10] також може бути отримана відповідно до схеми 5, де кільце B, R 3, R4, Z1 і Z2 є такими, як визначено вище. У даному способі сполуку [4] обробляють 4-фтор-3-нітробензальдегідом, і отриману в результаті сполуку [20] потім піддають взаємодії з толуолсульфонілметилізоціанідом з одержанням оксазол-5-ільної сполуки [21] по реакції замикання кільця. Нітрогрупа сполуки [21] може бути далі відновлена, наприклад гідруванням, з одержанням відповідного аміну, що потім може бути оброблений мурашиною кислотою відповідно до схеми 1, з одержанням кінцевого продукту в реакції замикання кільця. Схема 5 25 У випадку, коли кільце A у сполуці [10] являє собою гетероцикл, зв'язаний з атомом вуглецю біциклічного кільця через гетероатом азоту, сполука [10] також може бути отримана з 7 UA 115176 C2 використанням сполучення Бухвальда відповідно до схеми 6, де X", кільце B, R 1, R2, R3, R4, Z1 і Z2 є такими, як визначено вище. Схема 6 5 10 У випадку, коли кільце A у сполуці [10] являє собою 1H-1,2,3-триазол-4-ільне кільце, і R2 являє собою водень, сполука [10] також може бути отримана відповідно до схеми 7, де X", Z, R 1, R3, R4, Z1, Z2 і кільце B є такими, як визначено вище. Вихідну сполуку [8] піддають силілуванню шляхом взаємодії з етинілтриметилсиланом у присутності тетракис(трифенілфосфін)паладію(0) (Pd(PPh3)4) і Йодиду міді(I), з одержанням сполуки [32]. Обробка TBAF дає етинільну сполуку [33], що може бути піддана взаємодії з азидосполукою R1-N3 у придатному розчиннику, такому як суміш ДМСО:ТГФ:вода (1:1:1) або ДМСО:DCM:вода (1:1:1), з одержанням сполуки [34]. 15 Схема 7 20 25 У випадку, коли кільце A у сполуці [10] являє собою 1-метил-1H-піразол-3-ільне кільце, сполука [10] також може бути отримана відповідно до схеми 8, де R 3, R4, Z1, Z2 і кільце B є такими, як визначено вище. У даному способі сполуку [4] обробляють 1-(4-фтор-3нітрофеніл)етаноном, і отриману в результаті сполуку [36] потім піддають взаємодії з ДМФАдиметилацеталем, з одержанням оксазол-5-ільної сполуки [37]. Наступна обробка метилгідразином приводить до одержання сполуки [38] у реакції замикання кільця. Нітрогрупа сполуки [38] може бути далі відновлена, наприклад водним аміаком і цинком, з одержанням відповідного аміну, що потім може бути оброблений мурашиною кислотою відповідно до схеми 1, з одержанням кінцевого продукту в реакції замикання кільця. 30 8 UA 115176 C2 Схема 8 5 10 У випадку, коли кільце A у сполуці [10] являє собою 1H-імідазол-2-ільне кільце, сполука [10] також може бути отримана відповідно до схеми 9, де R 3, R4, Z1, Z2 і кільце B є такими, як визначено вище. У даному способі сполуку [20] схеми 5 обробляють етилендіаміном і Nбромсукцинімідом, з одержанням сполуки [39] у реакції замикання кільця. Нітрогрупа сполуки [39] може бути далі відновлена, наприклад водним аміаком і цинком, з одержанням відповідного аміну, що потім може бути оброблений мурашиною кислотою відповідно до схеми 1, з одержанням кінцевого продукту в реакції замикання кільця. Схема 9 15 20 25 Різні сполуки формули (I), де R5 є іншим, ніж -C(O)CH3, можуть бути отримані, наприклад, відповідно до схеми 10, де R1, R2, R3, R4, R7, R8, Z, Z1, Z2, кільце A і кільце B є такими, як визначено вище. Ацетамідна сполука [10] може бути перетворена в її відповідний амін [24], наприклад, нагріванням у етанолі в присутності основи, такої як водного гідроксид натрію або гідроксид калію, або кислоти, такої як водна HCl. Отриманий амін [24] може бути використаний як вихідна речовина для наступних реакційних стадій. Сполуки формули (I), де R5 являє собою SO2R8, можуть бути отримані, наприклад, обробкою аміну [24] Cl-SO2R8 у придатному розчиннику, такому як DCM, у присутності піридину. Сполуки формули (I), де R 5 являє собою C(O)R7, і R7 являє собою C1-7алкіл або C1-7алкіламіноC1-7алкіл, можуть бути отримані, наприклад, шляхом взаємодії аміну [24] з HOOC-R7 у придатному розчиннику, такому як ДМФА, у присутності гексафторфосфату метанаміній 2-(1H-7-азабензотриазол-1-іл)-1,1,3,3тетраметилуронію (HATU) і DIPEA. 30 9 UA 115176 C2 Схема 10 5 10 Сполуки формули (I), де R7 являє собою -NH-R10 або -NH-X-R11, можуть бути отримані, наприклад, відповідно до схеми 11 шляхом взаємодії аміну [24] у придатному розчиннику, такому як н-бутанол, з похідними ізоціанату O=C=N-R10 або O=C=N-X-R11 у присутності придатної основи, такої як триетиламін (TEA). Альтернативно, сполуки, де R 7 являє собою -NHX-R11, можуть бути отримані обробкою аміну [24] у придатному розчиннику, такому як DCM, фосгеном і потім H2N-X-R11, див. схему 11. Схема 11 10 UA 115176 C2 5 Сполуки, де R5 являє собою -C(O)R7, -SO2R8 або необов'язково заміщене 5-6-членне гетероциклічне кільце, також можуть бути отримані відповідно до схеми 12, виходячи зі сполуки [40], де X являє собою галоген, такий як Br або Cl, і R 1, R2, R3, R4, Z, Z1, Z2 і кільце B є такими, як визначено вище, з використанням паладію (наприклад, Pd2(dba)3), каталізуючого C-N сполучення, у присутності металевого хелатуючого ліганду, такого як ксантфос. Схема 12 10 15 Сполуки формули (I) також можуть бути отримані відповідно до схеми 13 шляхом взаємодії сполуки [42] зі сполукою [43], з одержанням сполуки [44], де X являє собою галоген, такий як Cl або Br, і R1, R2, R3, R4, Z, Z1, Z2 і кільце B є такими, як визначено вище, з наступним замиканням біциклічного кільця, як на схемі 1, і додаванням -NHR5 групи відповідно до схеми 12. Схема 13 20 Сполуки формули (I) також можуть бути отримані відповідно до схеми 14 шляхом взаємодії сполуки [45] зі сполукою [46], де X являє собою галоген, такий як Cl або Br, і R 1, R2, R3, R4, R5, Z, Z1, Z2 і кільця A і B є такими, як визначено вище. 25 11 UA 115176 C2 Схема 14 5 Сполуки формули (I) також можуть бути отримані відповідно до схеми 15 шляхом взаємодії сполуки [48] зі сполукою [49], де X являє собою галоген, такий як Cl або Br, і R 1, R2, R5, Z, Z1, Z2 і кільця A і B є такими, як визначено вище. Утворена сполука [50] може бути піддана замиканню біциклічного кільця і додаванню B-кільця сполученням Судзукі, як представлено на схемі 1, з одержанням сполуки формули (I). 10 Схема 15 15 20 25 30 35 Фармацевтично прийнятні солі відомі в даній галузі фармацевтики. Необмежуючі приклади придатних солей включають солі металів, сіль амонію, солі з органічною основою, солі з неорганічною кислотою, солі з органічною кислотою і солі з основною або кислотною амінокислотою. Необмежуючі приклади солей металів включають солі лужних металів, такі як сіль натрію і сіль калію; солі лужноземельних металів, такі як сіль кальцію і сіль магнію. Необмежуючі приклади солей з неорганічними або органічними кислотами включають хлориди, броміди, сульфати, нітрати, фосфати, сульфонати, формати, тартрати, малеати, цитрати, бензоати, саліцилати й аскорбати. Фармацевтично прийнятні складні ефіри, коли це застосовно, можуть бути отримані відомими способами з використанням фармацевтично прийнятних кислот, що є загальноприйнятими в галузі фармацевтичних препаратів і зберігають фармакологічні властивості у вільній формі. Необмежуючі приклади таких ефірів включають складні ефіри аліфатичних або ароматичних спиртів, наприклад метилові, етилові, пропілові, ізопропілові, бутилові, ізобутилові, втор-бутилові, трет-бутилові ефіри. Складні фосфатні ефіри і карбонатні ефіри також входять в обсяг даного винаходу. Терміни, використовувані в даному описі, мають наступні значення. Термін "гало" або "галоген", як використано в даному описі, як такий або як частина іншої групи, стосується хлору, брому, фтору або йоду. Термін "C1-7алкіл", як використано в даному описі, як такий або як частина іншої групи, стосується насиченої вуглеводневої групи з прямим або розгалуженим ланцюгом, що має 1, 2, 3, 4, 5, 6 або 7 атомів вуглецю. Репрезентативні приклади C 1-7алкілу включають, але, не обмежуючись ними, метил, етил, н-пропіл, ізопропіл, н-бутил, ізобутил, втор-бутил, трет-бутил, н-пентил, ізопентил і н-гексил. Термін "C1-3алкіл" стосується переважного варіанта здійснення "C1-7алкілу", що має 1, 2 або 3 атоми вуглецю. 12 UA 115176 C2 5 10 15 20 25 30 35 40 45 50 55 60 Термін "C3-7циклоалкіл", як використано в даному описі, як такий або як частина іншої групи, стосується насиченої циклічної вуглеводневої групи, що містить 3, 4, 5, 6 або 7 атомів вуглецю. Репрезентативні приклади циклоалкілу включають, але, не обмежуючись ними, циклопропіл, циклобутил, циклопентил і циклогексил. Термін "C3-7циклоалкілC1-7алкіл", як використано в даному описі, стосується C 37циклоалкільної групи, як визначено в даному описі, доданої до основного залишку молекули за посередництвом C1-7алкільної групи, як визначено в даному описі. Термін "C2-7алкеніл", як використано в даному описі, як такий або як частина іншої групи, стосується аліфатичної вуглеводневої групи, що має 2-7 атомів вуглецю і містить одну або кілька подвійних зв'язків. Репрезентативні приклади включають, але, не обмежуючись ними, етеніл, пропеніл і циклогексеніл. Термін "гідрокси", як використано в даному описі, як такий або як частина іншої групи, стосується -OH групи. Термін "ціано", як використано в даному описі, як такий або як частина іншої групи, стосується -CN групи. Термін "карбокси", як використано в даному описі, як такий або як частина іншої групи, стосується -COOH групи. Термін "карборніл", як використано в даному описі, як такий або як частина іншої групи, стосується атома вуглецю, зв'язаного з атомом кисню подвійним зв'язком (C=O). Термін "оксо", як використано в даному описі, як такий або як частина іншої групи, стосується атома кисню, зв'язаного з іншим атомом подвійним зв'язком (=O). Термін "C1-7алкокси", як використано в даному описі, як такий або як частина іншої групи, стосується C1-7алкілу, як визначено в даному описі, доданого до основного залишку молекули за посередництвом атома кисню. Репрезентативні приклади C1-7алкокси включають, але, не обмежуючись ними, метокси, етокси, пропокси, бутокси, ізобутоки, втор-бутокси і трет-бутокси. Термін "гідроксилC1-7алкіл", як використано в даному описі, стосується щонайменше однієї гідроксигрупи, як визначено в даному описі, доданої до основного залишку молекули за посередництвом C1-7алкільної групи, як визначено в даному описі. Репрезентативні приклади гідроксилC1-7алкілу включають, але, не обмежуючись ними, гідроксиметил, 2,2-дигідроксіетил, 1гідроксіетил, 3-гідроксипропіл, 1-гідроксипропіл, 1-метил-1-гідроксіетил і 1-метил-1гідроксипропіл. Термін "галогенC1-7алкіл", як використано в даному описі, стосується щонайменше одного галогену, як визначено в даному описі, доданого до основного залишку молекули за посередництвом C1-7алкільної групи, як визначено в даному описі. Репрезентативні приклади галогенC1-7алкілу включають, але, не обмежуючись ними, фторметил, дифторметил, трифторметил, 2-хлоретил і 3-бромпропіл. Термін "ціаноC1-7алкіл", як використано в даному описі, стосується ціаногрупи, як визначено в даному описі, доданої до основного залишку молекули за посередництвом C 1-7алкільної групи, як визначено в даному описі. Репрезентативні приклади ціаноC1-7алкілу включають, але, не обмежуючись ними, ціанометил, 1-ціаноетил, 1-ціанопропіл і 2-ціанопропіл. Термін "карбоксіC1-7алкіл", як використано в даному описі, як такий або як частина іншої групи, стосується карбоксигрупи, як визначено в даному описі, доданої до основного залишку молекули за посередництвом C1-7алкільної групи, як визначено в даному описі. Термін "галогенC1-7алкокси", як використано в даному описі, стосується щонайменше до одного галогену, як визначено в даному описі, доданого до основного залишку молекули за посередництвом C1-7алкоксигрупи, як визначено в даному описі. Термін "фенілC1-7алкокси", як використано в даному описі, стосується щонайменше однієї фенільної групи, доданої до основного залишку молекули за посередництвом C 1-7алкоксигрупи, як визначено в даному описі. Термін "C1-7алкілкарборніл", як використано в даному описі, як такий або як частина іншої групи, стосується C1-7алкільної групи, як визначено в даному описі, доданої до основного залишку молекули за посередництвом карборнільної групи, як визначено в даному описі. Термін "C1-7алкоксикарборніл", як використано в даному описі, як такий або як частина іншої групи, стосується C1-7алкоксигрупи, як визначено в даному описі, доданої до основного залишку молекули за посередництвом карборнільної групи, як визначено в даному описі. Термін "C1-7алкоксикарборнілC1-7алкіл", як використано в даному описі, як такий або як частина іншої групи, стосується C1-7алкоксикарборнільної групи, як визначено в даному описі, доданої до основного залишку молекули за посередництвом C 1-7алкільної групи, як визначено в даному описі. Термін "амінокарборніл", як використано в даному описі, як такий або як частина іншої групи, стосується аміногрупи, доданої до основного залишку молекули за посередництвом карборнільної групи, як визначено в даному описі. 13 UA 115176 C2 5 10 15 20 25 30 35 40 45 50 55 60 Термін "аміноC1-7алкіл", як використано в даному описі, стосується щонайменше однієї аміногрупи, доданої до основного залишку молекули за посередництвом C 1-7алкільної групи, як визначено в даному описі. Репрезентативні приклади аміноC1-7алкілу включають, але, не обмежуючись ними, амінометил, 2-аміноетил, 1-аміноетил, 2,2-діаміноетил, 3-амінопропіл, 2амінопропіл, 4-амінобутил і 1-метил-1-аміноетил. Термін "C1-7алкіламіно", як використано в даному описі, як такий або як частина іншої групи, стосується щонайменше однієї C1-7алкільної групи, як визначено в даному описі, доданої до основного залишку молекули за посередництвом аміногрупи. Репрезентативні приклади C 17алкіламіно включають, але, не обмежуючись ними, метиламіно, етиламіно, пропіламіно, бутиламіно, диметиламіно, діетиламіно і N-етил-N-метиламіно. Термін "C1-7алкіламіноC1-7алкіл", як використано в даному описі, як такий або як частина іншої групи, стосується щонайменше однієї C1-7алкіламіногрупи, як визначено в даному описі, доданої до основного залишку молекули за посередництвом C1-7алкільної групи, як визначено в даному описі. Термін "карбоксіC1-7алкіламіно", як використано в даному описі, як такий або як частина іншої групи, стосується щонайменше однієї карбоксигрупи, як визначено в даному описі, доданої до основного залишку молекули за посередництвом C1-7алкіламіногрупи, як визначено в даному описі. Термін "C1-7алкоксіC1-7алкіл", як використано в даному описі, стосується щонайменше однієї C1-7алкоксигрупи, як визначено в даному описі, доданої до основного залишку молекули за посередництвом C1-7алкільної групи, як визначено в даному описі. Термін "C1-7алкоксикарборнілC1-7алкіл", як використано в даному описі, стосується щонайменше однієї C1-7алкоксикарборнільної групи, як визначено в даному описі, доданої до основного залишку молекули за посередництвом C1-7алкільноїгрупи, як визначено в даному описі. Термін "заміщений", як використано в даному описі, у зв'язку з різними залишками, стосується галогенових замісників, таких як фтор, хлор, бром, йод, або C 1-7алкільних, C37циклоалкільних, галогенC1-7алкільних, гідрокси, аміно, C1-7алкокси, C1-7ацилC1-7алкіламіно, аміноC1-7алкільних, нітро, ціано, тіольних або метилсульфонільних замісників. Переважними є галогенові, C1-7алкільні, галогенC1-7алкільні, гідрокси, аміно, C1-7алкокси і метилсульфонільні замісники. Найбільш переважними є 1-3 C1-3алкільні замісники. "Заміщені" групи можуть містити 1-3, переважно 1 або 2 наведених вище замісники. Термін "5-6-членне гетероциклічне кільце", як використано в даному описі, стосується насиченого, частково насиченого або ароматичного кільця з 5 або 6 атомами кільця, з яких 1-4 атоми є гетероатомами, вибраними з групи, що складається з N, O і S. Репрезентативні приклади 5-6-членного гетероциклічного кільця включають, але, не обмежуючись ними, піразолільне, 1,2,4-триазол-1-ільне, 1,2,3-триазол-1-ільне, піримідинільне, піридинільне, тетразолільне, піперазинільне, фуранільне, морфолінільне, піперидинільне, піролідинільне, тіазолільне, ізоксазолільне, піразинільне, тетрагідропіранільне, 1,2,4-оксадіазолільне, оксазолільне, імідазолільне, індолільне і 4,5-дигідроімідазолільне кільця. Термін "5-12-членне гетероциклічне кільце", як використано в даному описі, стосується моноциклічного або біциклічного насиченого, частково насиченого або ароматичного кільця з 512 атомами кільця, з яких 1-5 атомів є гетероатомами, вибраними з групи, що складається з N, O і S. Репрезентативні приклади 5-12-членного гетероциклічного кільця включають приклади, наведені вище, і додатково, але, не обмежуючись ними, індазолільне, піразолo[1,5a]піримідинільне, бензо[d]імідазолільне, імідазо[4,5-b]піридинільне, 4,5,6,7тетрагідробензо[d]імідазолільне і бензофуранільне кільця. Термін "5-12-членне карбоциклічне кільце", як використано в даному описі, стосується насиченого, частково насиченого або ароматичного кільця з 5-12 атомами кільця, що складаються тільки з атомів вуглецю. Репрезентативні приклади 5-12-членного карбоциклічного включають, але, не обмежуючись ними, фенільне, нафтильне і циклогексильне кільця. Визначення формули (I) вище включає всі можливі ізотопи й ізомери, такі як стереоізомери сполук, включаючи геометричні ізомери, наприклад, Z і E ізомери (цис і транс-ізомери), і оптичні ізомери, такі як діастереомери і енантіомери, і складні ефіри проліків, наприклад, складні фосфатні і карбонатні ефіри. Фахівцю в даній галузі буде очевидно, що дані сполуки можуть містити щонайменше один хіральний центр. Відповідно, сполуки можуть існувати в оптично активній або рацемічній формах. Потрібно розуміти, що формула (I) включає будь-яку рацемічну або оптично активну форму, або їх суміші. В одному з варіантів здійснення дані сполуки є чистими (R)-ізомерами. В іншому варіанті здійснення дані сполуки є чистими (S)-ізомерами. В іншому варіанті здійснення 14 UA 115176 C2 5 10 15 20 25 30 35 40 45 дані сполуки являють собою суміш (R) і (S) ізомерів. В іншому варіанті здійснення дані сполуки являють собою рацемічну суміш, що складається з однакової кількості (R) і (S) ізомерів. Сполуки можуть містити два хіральні центри. У такому випадку, відповідно до одного з варіантів здійснення, сполуки даного винаходу являють собою чисті діастереомери. Відповідно до іншого варіанта здійснення, сполуки являють собою суміш різних діастереомерів. Індивідуальні ізомери можуть бути отримані з використанням відповідних ізомерних форм вихідних речовин або вони можуть бути виділені після одержання кінцевої сполуки відповідно до загальноприйнятих методів поділу. Для поділу оптичних ізомерів, наприклад, енантіомерів або діастереомерів з їхньої суміші, можуть бути використані загальноприйняті методи поділу, такі як фракційна кристалізація. Дані сполуки також можуть існувати у вигляді таутомерів або їхніх рівноважних сумішей, де протон сполуки змінює один атом іншим атомом. Приклади таутомерів включають, але, не обмежуючись ними, аміно-імідо, кето-енол, фенол-кето, оксим-нітрозо, нітро-аци, імін-енамін тощо. Таутомерні форми сполуки формули (I) призначені, щоб бути охопленими сполуками формули (I), навіть якщо тільки вона може бути зображена через одну таутомерну форму. Наприклад, сполуки формули (Ib"): , де R1, R2, R3, R4, R5, Z, Z2 і кільця A і B є такими, як визначено вище, являють собою імідо таутомери амідо сполуки формули (Ib) і тому входять в обсяг формули (I), як визначено в даному описі. Приклади переважних сполук формули (I) включають:4-(2,4-дифторфеніл)-N-(1-метил-1H-піразол-3-іл)-6-(5-(1-метил-1H-піразол-4-іл)-1Hбензо[d]імідазол-1-іл)піридин-2-амін; N-(4-(2,4-дифторфеніл)-6-(5-(1-метил-1H-піразол-4-іл)-1H-бензо[d]імідазол-1-іл)піридин-2іл)циклопропансульфонамід; натрієву сіль імідо форми N-(4-(2,4-дифторфеніл)-6-(5-(1-метил-1H-піразол-4-іл)-1Hбензо[d]імідазол-1-іл)піридин-2-іл)циклопропансульфонаміду; N-(4-(2,4-дифторфеніл)-6-(5-(1-метил-1H-піразол-4-іл)-1H-бензо[d]імідазол-1-іл)піридин-2іл)метансульфонамід; N-(4-(2,4-дифторфеніл)-6-(5-(1-метил-1H-піразол-4-іл)-1H-бензо[d]імідазол-1-іл)піридин-2іл)етансульфонамід; натрієву сіль імідо форми N-(4-(2,4-дифторфеніл)-6-(5-(1-метил-1H-піразол-4-іл)-1Hбензо[d]імідазол-1-іл)піридин-2-іл)етансульфонаміду; N-(4-(2,4-дифторфеніл)-6-(5-(1-метил-1H-піразол-4-іл)-1H-бензо[d]імідазол-1-іл)піридин-2іл)пропан-2-сульфонамід; імідо форму N-(4-(2,4-дифторфеніл)-6-(5-(1-метил-1H-піразол-4-іл)-1H-бензо[d]імідазол-1іл)піридин-2-іл)пропан-2-сульфонаміду; N-(4-(2-фторфеніл)-6-(5-(1-метил-1H-піразол-4-іл)-1H-бензо[d]імідазол-1-іл)піридин-2іл)циклопропансульфонамід; натрієву сіль імідо форми N-(4-(2-фторфеніл)-6-(5-(1-метил-1H-піразол-4-іл)-1Hбензо[d]імідазол-1-іл)піридин-2-іл)циклопропансульфонаміду; N-(4-(2-фторфеніл)-6-(5-(1-метил-1H-піразол-4-іл)-1H-бензо[d]імідазол-1-іл)піридин-2іл)метансульфонамід; N-(4-(2-фторфеніл)-6-(5-(1-метил-1H-піразол-4-іл)-1H-бензо[d]імідазол-1-іл)піридин-2іл)етансульфонамід; натрієву сіль імідо форми N-(4-(2-фторфеніл)-6-(5-(1-метил-1H-піразол-4-іл)-1Hбензо[d]імідазол-1-іл)піридин-2-іл)етансульфонаміду; 15 UA 115176 C2 5 10 15 20 25 30 35 40 45 50 55 60 N-(4-(2-фторфеніл)-6-(5-(1-метил-1H-піразол-4-іл)-1H-бензо[d]імідазол-1-іл)піридин-2іл)пропан-2-сульфонамід; натрієву сіль імідо форми N-(4-(2-фторфеніл)-6-(5-(1-метил-1H-піразол-4-іл)-1Hбензо[d]імідазол-1-іл)піридин-2-іл)пропан-2-сульфонаміду; N-(4-(4-фторфеніл)-6-(5-(1-метил-1H-піразол-4-іл)-1H-бензо[d]імідазол-1-іл)піридин-2іл)циклопропансульфонамід; N-(4-(4-фторфеніл)-6-(5-(1-метил-1H-піразол-4-іл)-1H-бензо[d]імідазол-1-іл)піридин-2іл)метансульфонамід; N-(4-(4-фторфеніл)-6-(5-(1-метил-1H-піразол-4-іл)-1H-бензо[d]імідазол-1-іл)піридин-2іл)пропан-2-сульфонамід; натрієву сіль імідо форми N-(4-(4-фторфеніл)-6-(5-(1-метил-1H-піразол-4-іл)-1Hбензо[d]імідазол-1-іл)піридин-2-іл)пропан-2-сульфонаміду; N-(3-фтор-6'-(5-(1-метил-1H-піразол-4-іл)-1H-бензо[d]імідазол-1-іл)-[2,4'-біпіридин]-2’іл)циклопропансульфонамід; N-(3-фтор-6'-(5-(1-метил-1H-піразол-4-іл)-1H-бензо[d]імідазол-1-іл)-[2,4'-біпіридин]-2’іл)ацетамід; N-(4-(2,4-дифторфеніл)-6-(5-(1-(2-(диметиламіно)етил)-1H-піразол-4-іл)-1H-бензо[d]імідазол1-іл)піридин-2-іл)циклопропансульфонамід; N-(4-(2-фторфеніл)-6-(5-(1-метил-1H-піразол-4-іл)-1H-бензо[d]імідазол-1-іл)піримідин-2іл)циклопропансульфонамід; N-(6-(5-(1H-піразол-1-іл)-1H-бензо[d]імідазол-1-іл)-4-(2,4-дифторфеніл)піридин-2іл)циклопропансульфонамід; N-(3,5-дифтор-6'-(5-(1-метил-1H-піразол-4-іл)-1H-бензо[d]імідазол-1-іл)-[2,4'-біпіридин]-2’іл)циклопропансульфонамід; N-(3,5-дифтор-6'-(5-(1-метил-1H-піразол-4-іл)-1H-бензо[d]імідазол-1-іл)-[2,4'-біпіридин]-2’іл)ацетамід; N-(4-(2-хлорфеніл)-6-(5-(1-метил-1H-піразол-4-іл)-1H-бензо[d]імідазол-1-іл)піридин-2іл)циклопропансульфонамід; N-(3-хлор-6'-(5-(1-метил-1H-піразол-4-іл)-1H-бензо[d]імідазол-1-іл)-[2,4'-біпіридин]-2’іл)циклопропансульфонамід; N-(5-фтор-6'-(5-(1-метил-1H-піразол-4-іл)-1H-бензо[d]імідазол-1-іл)-[2,4'-біпіридин]-2’іл)циклопропансульфонамід; N-(6-(5-(1H-імідазол-1-іл)-1H-бензо[d]імідазол-1-іл)-4-(2,4-дифторфеніл)піридин-2іл)циклопропансульфонамід; N-(4-(2,4-дифторфеніл)-6-(5-(1-(2-морфоліноетил)-1H-піразол-4-іл)-1H-бензо[d]імідазол-1іл)піридин-2-іл)циклопропансульфонамід; N-(4-(2,4-дифторфеніл)-6-(5-(1-(піролідин-3-іл)-1H-піразол-4-іл)-1H-бензо[d]імідазол-1іл)піридин-2-іл)циклопропансульфонамід; N-(4-(2,4-дифторфеніл)-6-(5-(1-етил-1H-1,2,3-триазол-4-іл)-1H-бензо[d]імідазол-1-іл)піридин2-іл)циклопропансульфонамід; N-(4-(2,4-дифторфеніл)-6-(5-(1-метил-1H-1,2,3-триазол-4-іл)-1H-бензо[d]імідазол-1іл)піридин-2-іл)циклопропансульфонамід; N-(4-(2,4-дифторфеніл)-6-(5-(1-метил-1H-імідазол-4-іл)-1H-бензо[d]імідазол-1-іл)піридин-2іл)циклопропансульфонамід; N-(4-(2,4-дифторфеніл)-6-(5-(1-метил-1H-піразол-4-іл)-1H-бензо[d]імідазол-1-іл)піримідин-2іл)ацетамід; етил 1-(1-(6-(циклопропансульфонамідо)-4-(2,4-дифторфеніл)піридин-2-іл)-1Hбензо[d]імідазол-5-іл)-1H-1,2,3-триазол-4-карбоксилат; N-(4-(2-(дифторметокси)-4-фторфеніл)-6-(5-(1-метил-1H-піразол-4-іл)-1H-бензо[d]імідазол-1іл)піридин-2-іл)циклопропансульфонамід; N-(4-(2,4-дифторфеніл)-6-(5-(1-метил-1H-піразол-4-іл)-1H-бензо[d]імідазол-1-іл)піримідин-2іл)циклопропансульфонамід; N-(6-(2,4-дифторфеніл)-4-(5-(1-метил-1H-піразол-4-іл)-1H-бензо[d]імідазол-1-іл)піридин-2іл)циклопропансульфонамід; або їх фармацевтично прийнятну сіль або таутомер. Сполуки даного винаходу можуть бути введені пацієнту в терапевтично ефективній кількості, що звичайно становить інтервал приблизно від 0,1 до приблизно 5000 мг, переважно приблизно від 1 до приблизно 2000 мг у день залежно від віку, маси, етнічної групи, стану здоров'я пацієнта, стану, що піддається лікуванню, шляху введення і використовуваного активного інгредієнта. Сполуки даного винаходу можуть бути сформульовані в дозовані форми з 16 UA 115176 C2 5 10 15 20 25 30 35 використанням принципових знань у даній галузі. Сполука може призначатися пацієнту як така або в комбінації з придатними фармацевтично прийнятними ексципієнтами у формі таблеток, гранул, капсул, супозиторіїв, емульсій, суспензій або розчинів. Вибір придатних інгредієнтів для композиції є звичайним для фахівця в даній галузі. Також можуть бути використані придатні носії, розчинники, гелеутворюючі інгредієнти, інгредієнти, що утворюють суспензії, антиоксиданти, забарвлювальні агенти, підсолоджувачі, змочувальні сполуки й інші інгредієнти, звичайно використовувані в даній галузі техніки. Композиції, що містять активну сполуку, можуть вводитися ентерально або парентерально, причому пероральний шлях є переважним способом. Вміст активної сполуки в композиції становить приблизно від 0,5 до 100 %, переважно приблизно від 0,5 до приблизно 20 % від загальної маси композиції. Сполуки даного винаходу можуть призначатися суб'єкту у вигляді єдиного активного інгредієнта або в комбінації з одним або більше іншими активними інгредієнтами для лікування конкретного захворювання, наприклад раку. Даний винахід більш докладно буде пояснено наступними експериментами і прикладами. Експерименти і приклади призначені тільки для ілюстративних цілей і не обмежують обсягу винаходу, визначеного у формулі винаходу. Експерименти 1. Інгібування FGFR1 кінази FGFR1 аналіз Сполуки скринували в TR-FRET аналізі з FGFR1 кіназою. Для аналізу використовували 5 нг FGFR1 [Upstate, USA] кінази. Сполука інкубували з кіназою протягом 30 хвилин при кімнатній температурі. Після інкубації додавали суміш субстрату [40 нм ультра легкого полі GT (Perkin Elmer, USA) і 13 мкМ ATP (Sigma)]. Зазначену вище реакцію зупиняли додаванням 40 мМ EDTA через 30 хв кіназної реакції. Додавали Eu-мічене антифосфо-тирозин антитіло [Perkin Elmer, USA] при 0,5 нМ і вимірювали емісію флюоресценції при 615 нм/665 нм [збудження при 340 нм]. Сполуки спочатку скринували при концентрації 100 нМ і 1 мкМ. Сполуки з >50 % інгібуванням при 100 нМ FGFR1 брали для дослідження повної відповідної реакції на дозу. Кінцева концентрація ДМСО в аналізі становила 1 %. Для визначення IC50 проводили серійне розбавлення на 1/3 стокового розчину 20 мМ ДМСО. 2 мкл отриманого розбавлення поміщали в тестові ямки, що містять 20 мкл реакційної суміші [загальний реакційний об'єм — 20 мкл]. Флюоресценцію вимірювали на лічильнику Perkin Elmer Wallac 1420 Multilabel Victor 3. IC 50 визначали шляхом коректування даних відповідь-доза-відповідь для сигмоїдальної кривої за допомогою програмного забезпечення GraphPad Prism V5. Результати Ферментативна активність і селективність вибраної сполуки даного винаходу відносно різних кіназ представлені в таблиці 1. Сполуки даного винаходу знайшли інгібуючу здатність і селективність відносно FGFR кінази. Таблиця 1 Інгібування FGFR1 кінази Сполука Приклад 1 Приклад 2 Приклад 2 (імідо) Приклад 4 Приклад 5 Приклад 5 (імідо) Приклад 6 Приклад 6 (імідо) Приклад 8 Приклад 8 (імідо) Приклад 10 Приклад 11 Приклад 11 (імідо) Приклад 12 Приклад 12 (імідо) Приклад 14 (%) Інгібування FGFR1 при 1000 нМ 97 99 97 98 99 98 99 98 99 97 97 98 98 97 99 98 17 IC50 інгібування FGFR1 (нМ) 16,5 3,9 3,3 4,3 1,1 4,4 1,7 1,7 5,42 3,3 5,8 2,8 3,2 1,5 5,2 14,4 UA 115176 C2 Продовження таблиці 1 Сполука Приклад 16 Приклад 17 Приклад 17 (імідо) Приклад 18 Приклад 19 Приклад 21 Приклад 22 Приклад 23 Приклад 25 Приклад 26 Приклад 28 Приклад 29 Приклад 30 Приклад 32 Приклад 33 Приклад 34 Приклад 35 Приклад 36 Приклад 37 Приклад 38 Приклад 39 Приклад 40 Приклад 41 Приклад 43 5 10 15 20 25 30 (%) Інгібування FGFR1 при 1000 нМ 97 96 97 97 96 99 97 97 97 94 97 97 96 99 99 99 99 99 99 87 81 76 93 94 IC50 інгібування FGFR1 (нМ) 3,4 4,6 5,2 5 28,5 3,7 9,2 10 3,1 21,9 7,2 9,7 24 21,7 2 1,6 2 4,7 1,3 12 294,2 293,5 32,7 43,4 Одержання сполук даного винаходу проілюстровано наступними прикладами. Приклади РХМС були записані в +ve режимі, якщо не зазначене інше. Приклад одержання проміжної сполуки 1 4-(1-Метил-1H-піразол-4-іл)-2-нітроанілін Розчин 4-бром-2-нітроаніліну (6 г, 27,6 ммоль) у 1,2-диметоксіетані (15 мл) дегазували барботуванням N2 протягом 5 хвилин. Додавали 1-метил-4-(4,4,5,5-тетраметил-1,3,2діоксаборолан-2-іл)-1H-піразол (6,90 г, 33,1 ммоль, 1,2 екв.) і суміш дегазували протягом ще 5 хвилин. Pd(dppf)Cl2 (2,25 г, 27,6 ммоль, 0,1 екв.) і водний карбонат натрію (8,79 г, 82,9 ммоль, 3,0 екв.) додавали послідовно, і суміш додатково дегазували протягом 5 хвилин і потім нагрівали при 90C протягом 2 годин. Реакційну суміш гасили водою й екстрагували етилацетатом (350 мл). Об'єднаний органічний шар промивали водою, насиченим розчином солі і сушили над сульфатом натрію. Розчинник відганяли при зниженому тиску з одержанням неочищеного залишку, який очищували колонковою хроматографією (60-120 силікагель, 40 % етилацетат у гексані), з одержанням зазначеного в заголовку продукту з виходом 75 % (4,5 г). РХ-МС (ESI): обчислена маса: 218,21; знайдена маса: 218,9 [M+H]+(rt: 0,390 хв). Приклад одержання проміжної сполуки 2 трет-Бутил 3-(4-(1H-бензо[d]імідазол-5-іл)-1H-піразол-1-іл)піролідин-1-карбоксилат a) трет-Бутил 3-(метилсульфоніл)піролідин-1-карбоксилат До розчину трет-бутил 3-гідроксипіролідин-1-карбоксилату (0,5 г, 2,67 ммоль, 1,0 екв.) у DCM (10 мл) додавали TEA (0,8 мл, 5,35 ммоль, 2,0 екв.). Суміш перемішували при КТ протягом 15 хвилин. Потім додавали метансульфонілхлорид (0,23 мл, 2,94 ммоль 1,1 екв.) і суміш перемішували протягом 3 годин. Суміш потім гасили водою й екстрагували CH 2Cl2 (350 мл). Розчинник відганяли з одержанням зазначеного в заголовку продукту з виходом 86 % (0,6 г). b) трет-бутил 3-(4-(4,4,5,5-тетраметил-1,3,2-діоксаборолан-2-іл)-1H-піразол-1-іл)піролідин-1карбоксилат До розчину 4-(4,4,5,5-тетраметил-1,3,2-діоксаборолан-2-іл)-1H-піразолу (0,6 г, 2,26 ммоль) у ДМФА додавали гідрид натрію при 0C (0,108 г, 4,53 ммоль, 2 екв.) і сполуку прикладу одержання проміжної сполуки 2(a) (0,44 г, 2,26 ммоль, 1,0 екв.). Суміш перемішували при КТ 18 UA 115176 C2 5 10 15 20 25 30 35 40 45 50 55 60 протягом 1 години і нагрівали при 90C протягом 4 годин, гасили льодом і екстрагували, як у прикладі одержання проміжної сполуки 1. Розчинник відганяли з одержанням неочищеного залишку з виходом 50 % (0,4 г). c) трет-Бутил 3-(4-(1H-бензо[d]імідазол-5-іл)-1H-піразол-1-іл)піролідин-1-карбоксилат До дегазованого (барботування N2) розчину 5-бром-1H-бензо[d]імідазолу (0,050 г, 0,15 ммоль) у 1,4-діоксані (10 мл) додавали сполуку прикладу одержання проміжної сполуки 2(b) (0,052 г, 0,15 ммоль, 1 екв.), Pd(PPh3)4 (16 мг, 0,015 ммоль, 0,1 екв.) і карбонат цезію (0,118 г, 0,36 ммоль, 2,5 екв.) з використанням методики прикладу одержання проміжної сполуки 1. Отриману суміш нагрівали при 90C протягом 16 годин. Реакційну суміш гасили й екстрагували, як у прикладі одержання проміжної сполуки 1. Розчинник відганяли з одержанням продукту з + виходом 40 % (20 мг). РХ-МС (ESI): обчислена маса: 353,2; знайдена маса: 354,4 [M+H] (rt: 0,11 хв). Приклад одержання проміжної сполуки 3 4-(1-(2-(Диметиламіно)етил)-1H-піразол-4-іл)-2-нітроанілін a) 2-(4-йод-1H-піразол-1-іл)-N, N-диметилетанамін До розчину 4-йод-1H-піразолу (2,8 г, 10 ммоль) в ацетонітрилі (50 мл) додавали карбонат цезію (5,04 г, 15 ммоль, 1,5 екв.) і гідрохлорид 2-хлор-N, N-диметилетанаміну (2,96 г, 20 ммоль, 2 екв.), і отриману суміш перемішували при КТ протягом 8 годин. Суміш гасили водою й екстрагували EtOAc (3(150 мл). Об'єднаний органічний шар промивали водою, насиченим розчином солі і сушили над сульфатом натрію. Розчинник відганяли з одержанням неочищеного продукту з виходом 38 % (1 г). b) 4-(1-(2-(диметиламіно)етил)-1H-піразол-4-іл)-2-нітроанілін Розчин сполуки прикладу 3(a) (0,5 г, 1,9 ммоль) у 1,2-диметоксіетані (15 мл) дегазували барботуванням N2 протягом 5 хвилин. Додавали 2-нітро-4-(4,4,5,5-тетраметил-1,3,2діоксаборолан-2-іл)анілін (0,74 г, 2,8 ммоль, 1,5 екв.) і суміш дегазували протягом ще 5 хвилин. Pd(dppf)Cl2 (0,16 г, 0,2 ммоль, 0,1 екв.) і водний карбонат натрію (0,5 г, 4,7 ммоль, 2,5 екв.) додавали послідовно з використанням методики прикладу одержання проміжної сполуки 1, і отриману суміш нагрівали при 90C протягом 16 годин. Реакційну суміш гасили й екстрагували, як у прикладі одержання проміжної сполуки 1. Розчинник відганяли з одержанням неочищеного залишку, який очищували колонковою хроматографією (60-120 силікагель, 70 % етилацетат у гексані), з одержанням зазначеного в заголовку продукту з виходом 65 % (0,3 г). РХ-МС (ESI): + обчислена маса: 275,14; знайдена маса: 276,15 [M+H] (rt: 0,18 хв). Приклад одержання проміжної сполуки 4 5-(1H-Піразол-1-іл)-1H-бензо[d]імідазол a) 2-нітро-4-(1H-піразол-1-іл)анілін До розчину 4-бром-2-нітроаніліну (3 г, 13,8 ммоль) у ДМФА (12 мл) додавали піразол (1,12 г, 16,4 ммоль, 1,2 екв.), оксид міді(I) (0,1 г, 0,69 ммоль, 0,05 екв.) і карбонат цезію (8 г, 24,6 ммоль, 1,8 екв.), і отриману суміш нагрівали при 100C протягом ночі. Суміш гасили й екстрагували, як у прикладі одержання проміжної сполуки 1. Розчинник відганяли, і неочищений залишок очищували колонковою хроматографією (60-120 силікагель, 20 % етилацетат у гексані), з одержанням зазначеного в заголовку продукту з виходом 53,5 % (1,5 г). b) 5-(1H-піразол-1-іл)-1H-бензо[d]імідазол Суміш сполуки прикладу 4(a) (0,5 г, 2,5 ммоль) і порошку заліза (1,39 г, 25 ммоль, 10 екв.) кип'ятили зі зворотним холодильником у мурашиній кислоті (20 мл) протягом ночі. Мурашину кислоту відганяли, і неочищений продукт розчиняли в етилацетаті і фільтрували. Етилацетатний шар промивали водою, насиченим розчином солі і сушили над сульфатом натрію. Розчинник відганяли зодержанням зазначеного в заголовку продукту з виходом 87 % + (0,4 г). РХ-МС (ESI): обчислена маса: 184,07; знайдена маса: 185,3 [M+H] (rt: 0,097 хв). Приклад одержання проміжної сполуки 5 N-(6-хлор-4-(2,4-дифторфеніл)піридин-2-іл)циклопропансульфонамід a) 2,6-дихлор-4-(2,4-дифторфеніл)піридин Розчин 2,6-дихлор-4-йодпіридину (1,5 г, 5,49 ммоль) у 1,2-диметоксіетані (15 мл) дегазували барботуванням N2 протягом 5 хвилин. Додавали 2,4-дифторфенілборонову кислоту (0,86 г, 5,49 ммоль, 1 екв.), і отриману суміш дегазували протягом ще 5 хвилин. Pd(dppf)Cl 2 (0,358 г, 0,43 ммоль, 0,08 екв.) і водний карбонат натрію (1,45 г, 13,7 ммоль, 2,5 екв.) додавали послідовно з використанням методики прикладу одержання проміжної сполуки 1, і отриману суміш нагрівали при 90C протягом 16 годин. Реакційну суміш гасили й екстрагували, як у прикладі одержання проміжної сполуки 1. Розчинник відганяли з одержанням неочищеного залишку, який очищували колонковою хроматографією (60-120 силікагель, 3 % етилацетат у гексані), з одержанням зазначеного в заголовку продукту з виходом 98,5 % (1,4 г). 19 UA 115176 C2 5 10 15 20 25 30 35 40 45 50 55 60 b) N-(6-хлор-4-(2,4-дифторфеніл)піридин-2-іл)циклопропансульфонамід Розчин сполуки прикладу одержання проміжної сполуки 5(a) (0,9 г, 3,46 ммоль) у діоксані (20 мл) дегазували барботуванням N2 протягом 5 хвилин. Додавали циклопропансульфонамід (0,36 г, 2,94 ммоль, 1 екв.), і отриману суміш дегазували протягом ще 5 хвилин. Додавали ацетат паладію (39 мг, 0,173 ммоль, 0,05 екв.), ксантфос (200 мг, 0,35 ммоль, 0,1 екв.) і Cs 2CO3 (3,37 г, 10,4 ммоль, 3,0 екв.), і отриману суміш додатково дегазували протягом 5 хвилин і потім нагрівали при 100C протягом 16 годин. Отриману суміш фільтрували через целіт і екстрагували етилацетатом (350 мл). Об'єднаний органічний шар промивали водою, насиченим розчином солі і сушили над сульфатом натрію. Розчинник відганяли з одержанням неочищеного залишку, який очищували колонковою хроматографією (60-120 силікагель, 30 % етилацетат у гексані), з одержанням зазначеного в заголовку продукту з виходом 50 % (0,6 г). 1 H ЯМР (300 МГц, ДМСО-d6): δ 11,05 (с, 1H), 7,76-7,68 (м, 1H), 7,51-7,43 (м, 1H), 7,35 (с, 1H), 7,30-7,24 (м, 1H), 7,16 (с, 1H), 3,09-3,01 (м, 1H), 1,22-1,09 (м, 2H), 1,08-1,03 (м, 2H). Приклад одержання проміжної сполуки 6 5-(1-Метил-1H-піразол-4-іл)-1H-бензо[d]імідазол Суміш сполуки прикладу одержання проміжної сполуки 1 (3 г, 13,7 ммоль) і порошку заліза (7,68 г, 137 ммоль, 10 екв.) кип'ятили зі зворотним холодильником у мурашиній кислоті (50 мл) протягом ночі. Мурашину кислоту відганяли, і неочищений продукт розчиняли в етилацетаті і фільтрували. Етилацетатний шар промивали водою, насиченим розчином солі і сушили над сульфатом натрію. Розчинник відганяли з одержанням зазначеного в заголовку продукту з + виходом 55,5 % (1,5 г). РХ-МС (ESI): обчислена маса: 198,09; знайдена маса: 199,2 [M+H] (rt: 0,097 хв). Приклад одержання проміжної сполуки 7 5-(1-Метил-1H-піразол-4-іл)-3-нітропіридин-2-амін Розчин 5-бром-3-нітропіридин-2-аміну (5 г, 23 ммоль) у 1,2-диметоксіетані (50 мл) дегазували барботуванням N2 протягом 5 хвилин. Додавали 1-метил-4-(4,4,5,5-тетраметил1,3,2-діоксаборолан-2-іл)-1H-піразол (7,2 г, 37 ммоль, 1,5 екв.), і отриману суміш дегазували протягом ще 5 хвилин. Pd(dppf)Cl2 (1,88 г, 2,3 ммоль, 0,1 екв.) і водний карбонат натрію (6,1 г, 52 ммоль, 2,5 екв.) додавали послідовно з використанням методики прикладу одержання проміжної сполуки 1, і отриману суміш нагрівали при 90C протягом 16 годин. Реакційну суміш гасили й екстрагували, як у прикладі одержання проміжної сполуки 1. Розчинник відганяли з одержанням неочищеного залишку, який очищували колонковою хроматографією (60-120 силікагель, 70 % етилацетат у гексані), з одержанням зазначеного в заголовку продукту з виходом 50 % (2,5 г). РХ-МС (ESI): обчислена маса: 219,08; знайдена маса: 220,1 [M+H]+(rt: 0,22 хв). Приклад одержання проміжної сполуки 8 4-(1-(2-Морфоліноетил)-1H-піразол-4-іл)-2-нітроанілін a) 4-(2-(4-бром-1H-піразол-1-іл)етил)морфолін До розчину 4-(2-хлоретил)морфоліну (2,55 г, 13,6 ммоль) і 4-бром-1H-піразолу (2 г, 13,6 ммоль, 1 екв.) у ДМФА (50 мл) додавали K2CO3 (0,16 г, 6,72 ммоль, 1,5 екв.), і отриману суміш перемішували при КТ протягом 24 годин. Суміш потім гасили водою й екстрагували етилацетатом (3100 мл). Об'єднаний органічний шар промивали водою, насиченим розчином солі і сушили над сульфатом натрію. Розчинник відганяли з одержанням неочищеного продукту з виходом 57 % (2 г). b) 4-(2-(4-(4,4,5,5-тетраметил-1,3,2-діоксаборолан-2-іл)-1H-піразол-1-іл)етил)морфолін Розчин сполуки прикладу одержання проміжної сполуки 8(a) (1 г, 3,8 ммоль) у DME (15 мл) дегазували барботуванням N2 протягом 5 хвилин. Додавали біспінаколатодиборан (1,46 г, 5,7 ммоль, 1,5 екв.), і отриману суміш дегазували протягом ще 5 хвилин. Pd(dppf)Cl 2 (0,313 г, 0,38 ммоль, 0,1 екв.) і ацетат калію (1,32 г, 13,4 ммоль, 3,5 екв.) додавали послідовно з використанням методики прикладу одержання проміжної сполуки 1, і отриману суміш потім нагрівали при 100C протягом 4 годин. Реакційну суміш потім гасили й екстрагували, як у прикладі одержання проміжної сполуки 1. Розчинник відганяли з одержанням неочищеного залишку, який очищували колонковою хроматографією (60-120 силікагель, 50 % етилацетат у гексані), з одержанням зазначеного в заголовку продукту з виходом 87 % (1 г). РХ-МС (ESI): + обчислена маса: 307,2; знайдена маса: 308,5 [M+H] (rt: 0,10 хв). c) 4-(1-(2-морфоліноетил)-1H-піразол-4-іл)-2-нітроанілін Розчин сполуки прикладу одержання проміжної сполуки 8(b) (1 г, 4,6 ммоль) у 1,2диметоксіетані (15 мл) дегазували барботуванням N2 протягом 5 хвилин. Додавали 4-бром-2нітроанілін (1,41 г, 4,6 ммоль, 1 екв.), і отриману суміш дегазували протягом ще 5 хвилин. Pd(dppf)Cl2 (0,38 г, 0,46 ммоль, 0,1 екв.) і водний карбонат натрію (1,41 г, 13,8 ммоль, 3 екв.) 20 UA 115176 C2 5 10 15 20 25 30 35 40 45 50 55 60 додавали послідовно з використанням методики прикладу одержання проміжної сполуки 1, і отриману суміш потім нагрівали при 100C протягом 4 годин. Реакційну суміш потім гасили й екстрагували, як у прикладі одержання проміжної сполуки 1. Розчинник відганяли з одержанням неочищеного залишку, який очищували колонковою хроматографією (60-120 силікагель, 50 % етилацетат у гексані), з одержанням зазначеного в заголовку продукту з виходом 42 % (0,6 г). + РХ-МС (ESI): обчислена маса: 317,15; знайдена маса: 318,05 [M+H] (rt: 0,20 хв). Приклад одержання проміжної сполуки 9 4-(1H-Імідазол-1-іл)-2-нітроанілін До розчину 4-бром-2-нітроаніліну (3 г, 13,8 ммоль) у ДМФА (12 мл) додавали імідазол (2,71 г, 27,6 ммоль, 2 екв.), оксид міді(I) (0,1 г, 0,69 ммоль, 0,05 екв.) і карбонат цезію (13,4 г, 41,4 ммоль, 3 екв.), і отриману суміш нагрівали при 100C протягом ночі. Суміш гасили й екстрагували, як у прикладі одержання проміжної сполуки 1. Розчинник відганяли, і неочищений залишок очищували колонковою хроматографією (60-120 силікагель, 50 % етилацетат у гексані), з одержанням зазначеного в заголовку продукту з виходом 40 % (1,1 г). 1 H ЯМР (300 МГц, ДМСО-d6): δ 8,17 (ушир.с, 1H), 8,12 (д, 1H), 7,73-7,68 (м, 2H), 7,59 (с, 2H), 7,15 (д, 1H), 7,08 (с, 1H). Приклад одержання проміжної сполуки 10 5-(1-Етил-1H-1,2,3-триазол-4-іл)-1H-бензо[d]імідазол a) 2-Нітро-4-((триметилсиліл)етиніл)анілін Розчин сполуки 4-йод-2-нітроаніліну (1 г, 3,8 ммоль) у суміші ДМФА-Et3N (1:1; 20 мл) дегазували барботуванням N2 протягом 15 хвилин. Pd(PPh3)4 (0,22 г, 0,19 ммоль, 0,05 екв.), йодид міді(I) (0,073 г, 0,386 ммоль, 0,1 екв.) і етинілтриметилсилан (0,45 мл, 4,63 ммоль, 1,2 екв.) додавали послідовно, і отриману суміш перемішували протягом 12 годин при КТ. Суміш гасили й екстрагували, як у прикладі одержання проміжної сполуки 1. Розчинник відганяли, і неочищений залишок очищували колонковою хроматографією (60-120 силікагель, 10 % етилацетат у гексані), з одержанням зазначеного в заголовку продукту з виходом 67 % (0,6 г). b) 4-Етиніл-2-нітроанілін До розчину сполуки прикладу одержання проміжної сполуки 10(a) (0,5 г, 2,15 ммоль) у ТГФ (10 мл) при 0C додавали TBAF (0,5 г, 2,17 ммоль, 1,2 екв.), і отриману суміш перемішували протягом 0,5 години. Суміш фільтрували через шар діоксиду кремнію і переганяли, з одержанням зазначеного в заголовку продукту з виходом 86 % (0,3 г). c) 4-(1-Етил-1H-1,2,3-триазол-4-іл)-2-нітроанілін Суміш сполуки прикладу одержання проміжної сполуки 10(b) (0,3 г, 1,85 ммоль), азиду натрію (0,24 г, 3,7 ммоль, 1,0 екв.), метилйодиду (0,23 г, 1,85 ммоль, 1,0 екв.), аскорбату натрію (0,36 г, 1,85 ммоль, 1,0 екв.) і пентагідрату сульфату натрію (0,23 г, 0,92 ммоль, 0,5 екв.) у ДМСО, ТГФ і воді (1:1:0,5, 5 мл) перемішували протягом 12 годин при КТ. Суміш гасили водою, і осад, що утворився, відфільтровували і сушили. Неочищений продукт очищували колонковою хроматографією (60-120 силікагель, 30 % етилацетат у гексані), з одержанням зазначеного в заголовку продукту з виходом 25 % (100 мг). d) 5-(1-Етил-1H-1,2,3-триазол-4-іл)-1H-бензо[d]імідазол До розчину сполуки прикладу одержання проміжної сполуки 10(c) (0,1 г, 0,42 ммоль) у мурашиній кислоті (2 мл) додавали залізо (0,23 г, 4,2 ммоль) і нагрівали при 100C протягом 16 годин. Мурашину кислоту відганяли при зниженому тиску, і неочищений продукт розчиняли в етилацетаті. Етилацетатний шар промивали водою, насиченим розчином солі і сушили над сульфатом натрію. Розчинник відганяли з одержанням зазначеного в заголовку продукту з виходом 33 % (30 мг). РХ-МС (ESI): обчислена маса: 213,1; знайдена маса: 214,1 [M+H]+(rt: 0,14 хв). Приклад одержання проміжної сполуки 11 5-(1-Метил-1H-імідазол-4-іл)-1H-бензо[d]імідазол a) 4-(1-Метил-1H-імідазол-4-іл)-2-нітроанілін Розчин 2-нітро-4-(4,4,5,5-тетраметил-1,3,2-діоксаборолан-2-іл)аніліну (1,45 г, 5,55 ммоль, 1,1 екв.) у 1,2-диметоксіетані (15 мл) дегазували барботуванням N 2 протягом 5 хвилин. Додавали 4бром-1-метил-1H-імідазол (0,81 г, 5 ммоль, 1 екв.), і отриману суміш дегазували протягом ще 5 хвилин. Pd(dppf)Cl2 (0,4 г, 0,5 ммоль, 0,1 екв.) і водний карбонат натрію (1,59 г, 15 ммоль, 3 екв.) додавали послідовно з використанням методики прикладу одержання проміжної сполуки 1 і потім нагрівали при 100C протягом 4 годин. Реакційну суміш потім гасили й екстрагували, як у прикладі одержання проміжної сполуки 1. Розчинник відганяли з одержанням неочищеного залишку, який очищували колонковою хроматографією (60-120 силікагель, 50 % етилацетат у гексані), з одержанням зазначеного в заголовку продукту з виходом 60 % (0,6 г). РХ-МС (ESI): + обчислена маса: 218,08; знайдена маса: 219,2 [M+H] (rt: 0,09 хв). 21 UA 115176 C2 5 10 15 20 25 30 35 40 45 50 55 60 b) 5-(1-метил-1H-імідазол-4-іл)-1H-бензо[d]імідазол До розчину сполуки прикладу одержання проміжної сполуки 11(a) (0,3 г, 1,376 ммоль) у мурашиній кислоті (5 мл) додавали залізо (0,77 г, 13,76 ммоль), і отриману суміш нагрівали при 90C протягом 12 годин. Мурашину кислоту відганяли, і неочищений продукт розчиняли в етилацетаті. Етилацетатний шар промивали водою, насиченим розчином солі і сушили над сульфатом натрію. Розчинник відганяли з одержанням зазначеного в заголовку продукту з + виходом 26 % (0,07 г). РХ-МС (ESI): обчислена маса: 198,09; знайдена маса: 199,2 [M+H] (rt: 0,10 хв). Приклад одержання проміжної сполуки 12 5-((Триметилсиліл)етиніл)-1H-бензо[d]імідазол a) 5-Йод-1H-бензо[d]імідазол До розчину 4-йод-2-нітроаніліну (1 г, 3,7 ммоль) у мурашиній кислоті (10 мл) додавали залізо (2,1 г, 37 ммоль) і нагрівали при 90C протягом 12 годин. Мурашину кислоту відганяли, і неочищену речовину розчиняли в етилацетаті. Етилацетатний шар промивали водою, насиченим розчином солі і сушили над сульфатом натрію. Розчинник відганяли з одержанням зазначеного в заголовку продукту з виходом 68 % (0,85 г). РХ-МС (ESI): обчислена маса: 243,95; + знайдена маса: 244,8 [M+H] (rt: 0,173 хв). b) 5-((Триметилсиліл)етиніл)-1H-бензо[d]імідазол Розчин сполуки прикладу одержання проміжної сполуки 12(a) (0,7 г, 2,56 ммоль) у суміші ДМФА-Et3N (1:1; 10 мл) дегазували барботуванням N2 протягом 15 хвилин. Pd(dppf)Cl2 (0,11 г, 0,14 ммоль, 0,05 екв.), йодид міді(I) (0,054 г, 0,25 ммоль, 0,1 екв.) і етинілтриметилсилан (0,3 г, 3,15 ммоль, 1,1 екв.) додавали послідовно, і отриману суміш перемішували протягом 12 годин при RT. Суміш гасили й екстрагували, як у прикладі одержання проміжної сполуки 1. Розчинник відганяли, і неочищений залишок перекристалізовували з гексану, з одержанням зазначеного в заголовку продукту з виходом 57 % (0,35 г). РХ-МС (ESI): обчислена маса: 214,09; знайдена + маса: 215,5 [M+H] (rt: 0,22 хв). Приклад одержання проміжної сполуки 13 4-(1-Метил-1H-піразол-4-іл)бензол-1,2-діамін До розчину сполуки прикладу одержання проміжної сполуки 1 (1 г, 4,58 ммоль) у ТГФ (10 мл) додавали розчин амонійхлориду (1,486 г, 27,5 ммоль, 6 екв.) у воді (5 мл) і цинк (1,78 г, 27,5 ммоль, 6 екв.). Реакційну суміш перемішували при КТ протягом 6 годин і фільтрували. Фільтрат розбавляли водою й екстрагували етилацетатом (3100 мл). Об'єднаний органічний шар промивали водою, насиченим розчином солі і сушили над сульфатом натрію. Розчинник відганяли з одержанням неочищеного залишку, який очищували колонковою хроматографією (60-120 силікагель, 3 % метанол у DCM), з одержанням зазначеного в заголовку продукту з + виходом 58 % (0,5 г). РХ-МС (ESI): обчислена маса: 188,11; знайдена маса: 189,0 [M+H] (rt: 0,113 хв). Приклад одержання проміжної сполуки 14 Етил 1-(1H-бензо[d]імідазол-5-іл)-1H-1,2,3-триазол-4-карбоксилат a) 1H-бензо[d]імідазол-5-амін До розчину 5-нітро-1H-бензо[d]імідазолу (5 г, 44,2 ммоль) у метанолі (100 мл) додавали Pd/C, і реакційну суміш перемішували при КТ протягом 16 годин і фільтрували. Фільтрат розбавляли водою й екстрагували етилацетатом (3100 мл). Об'єднаний органічний шар промивали водою, насиченим розчином солі і сушили над сульфатом натрію. Розчинник відганяли з одержанням неочищеного залишку, який очищували промиванням простим діетиловим ефіром, з одержанням зазначеного в заголовку продукту з виходом 85 % (2,5 г). РХ+ МС (ESI): обчислена маса: 133,06; знайдена маса: 134,2 [M+H] (rt: 0,175 хв). b) 5-Азидо-1H-бензо[d]імідазол До розчину сполуки прикладу одержання проміжної сполуки 14(a) (2 г, 15 ммоль) у концентрованій HCl (8 мл) при 0C по краплях додавали водний розчин NaNO 2 (1,3 г, 18,7 ммоль, 1,25 екв.), і отриману суміш перемішували при 0C протягом 30 хв. Потім додавали NaN3 (1,13 г, 18,7 ммоль, 1,25 екв.) при 0C, і отриману суміш перемішували протягом 15 хвилин. Суміш гасили й екстрагували, як у прикладі одержання проміжної сполуки 1(a). Розчинник відганяли з одержанням продукту з виходом 75 % (1,8 г). РХ-МС (ESI): обчислена маса: 159,05; + знайдена маса: 160,0 [M+H] (rt: 0,136 хв). c) Етил 1-(1H-бензо[d]імідазол-5-іл)-1H-1,2,3-триазол-4-карбоксилат Суміш сполуки прикладу одержання проміжної сполуки 14(b) (1,75 г, 10,99 ммоль), етилпропіолату (1,08 г, 10,99 ммоль, 1,0 екв.), аскорбату натрію (0,22 г, 1,09 ммоль, 0,1 екв.) і пентагідрату сульфату натрію (30 мг, 0,1 ммоль, 0,01 екв.) у трет-бутанолі і воді (1:0,5, 20 мл) перемішували протягом 48 годин при КТ. Леткі речовини випарювали і реакційну суміш 22 UA 115176 C2 5 10 15 20 25 30 35 40 45 50 55 60 екстрагували 10 % метанолом у CH2Cl2 (3100 мл). Об'єднаний органічний шар промивали водою, насиченим розчином солі, сушили над сульфатом натрію і концентрували. Отриману ясно-коричневу тверду речовину (1,6 г, 56,6 % вихід) безпосередньо переносили на наступну стадію без додаткового очищення. РХ-МС (ESI): обчислена маса: 257,09; знайдена маса: 258,05 + [M+H] (rt: 0,193 хв). Приклад одержання проміжної сполуки 15 N-(6-хлор-4-(2-(дифторметокси)-4-фторфеніл)піридин-2-іл)циклопропансульфонамід a) 1-Бром-2-(дифторметокси)-4-фторбензол До розчину 2-бром-5-фторфенолу (3 г, 15,7 ммоль) у ДМФА (5 мл) додавали карбонат цезію (7,7 г, 23,56 ммоль, 1,5 екв.) і хлордифторацетат натрію (6 г, 39,26 ммоль, 2,5 екв.), і отриману суміш нагрівали при 100C протягом 5 годин. Реакційну суміш потім екстрагували водою і етилацетатом (350 мл). Об'єднаний органічний шар промивали водою, насиченим розчином солі і сушили над сульфатом натрію. Розчинник відганяли з одержанням неочищеного залишку, який очищували колонковою хроматографією (60-120 силікагель, 10 % етилацетат у гексані) з виходом 58 % (2,2 г). b) 2,6-Дихлор-4-(2-(дифторметокси)-4-фторфеніл)піридин Розчин сполуки прикладу одержання проміжної сполуки 15(a) (2,2 г, 9,13 ммоль) у 1,2диметоксіетані (50 мл) дегазували барботуванням N 2 протягом 5 хвилин. Додавали 2,6-дихлор4-(4,4,5,5-тетраметил-1,3,2-діоксаборолан-2-іл)піридин (2,75 г, 10,04 ммоль, 1,1 екв.), і отриману суміш дегазували протягом ще 5 хвилин. Pd(dppf)Cl2 (0,74 г, 0,9 ммоль, 0,1 екв.) і водний карбонат натрію (2,9 г, 27,3 ммоль, 2,5 екв.) додавали послідовно з використанням методики прикладу одержання проміжної сполуки 1 і потім нагрівали при 110C протягом 4 годин. Реакційну суміш потім гасили й екстрагували, як у прикладі одержання проміжної сполуки 1. Розчинник відганяли з одержанням неочищеного залишку, який очищували колонковою хроматографією (60-120 силікагель, 10 % етилацетат у гексані), з одержанням зазначеного в заголовку продукту з виходом 43 % (1,2 г). РХ-МС (ESI): обчислена маса: 306,98; знайдена + маса: 307,85 [M+H] (rt: 2,0 хв). c) N-(6-хлор-4-(2-(дифторметокси)-4-фторфеніл)піридин-2-іл)циклопропансульфонамід Розчин сполуки прикладу одержання проміжної сполуки 15(b) (0,5 г, 1,62 ммоль) у діоксані (10 мл) дегазували барботуванням N 2 протягом 5 хвилин. Додавали циклопропансульфонамід (0,19 г, 1,62 ммоль, 1 екв.), і отриману суміш дегазували протягом ще 5 хвилин. Ацетат паладію (18 мг, 0,08 ммоль, 0,05 екв.), ксантфос (46 мг, 0,08 ммоль, 0,05 екв.) і карбонат цезію (1,56 г, 4,8 ммоль, 3,0 екв.) додавали послідовно, і отриману реакційну суміш додатково дегазували протягом 5 хвилин і потім нагрівали при 100C протягом 5 годин. Реакційну суміш фільтрували через пухкий шар целіту й екстрагували етилацетатом (350 мл). Об'єднаний органічний шар промивали водою, насиченим розчином солі і сушили над сульфатом натрію. Розчинник відганяли з одержанням неочищеного залишку, який очищували колонковою хроматографією (60-120 силікагель, 30 % етилацетат у гексані) з виходом 47 % (0,3 г). РХ-МС (ESI): обчислена + маса: 392,02; знайдена маса: 392,85 [M+H] (rt: 1,82 хв). Приклад одержання проміжної сполуки 16 N-(6-хлор-4-(2,4-дифторфеніл)піридин-2-іл)ацетамід Розчин сполуки прикладу одержання проміжної сполуки 5(a) (0,5 г, 1,92 ммоль) у діоксані (20 мл) дегазували барботуванням N2 протягом 5 хвилин. Додавали ацетамід (0,11 г, 1,92 ммоль, 1 екв.), і отриману суміш дегазували протягом ще 5 хвилин. Додавали ацетат паладію (43 мг, 0,19 ммоль, 0,1 екв.), потім ксантфос (222 мг, 0,38 ммоль, 0,2 екв.) і Cs 2CO3 (1,88 г, 5,76 ммоль, 3,0 екв.), і отриману реакційну суміш додатково дегазували протягом 5 хвилин і потім нагрівали при 100C протягом 16 годин. Реакційну суміш фільтрували через целіт і екстрагували етилацетатом (350 мл). Об'єднаний органічний шар промивали водою, насиченим розчином солі і сушили над сульфатом натрію. Розчинник відганяли з одержанням неочищеного залишку, який очищували колонковою хроматографією (60-120 силікагель, 30 % етилацетат у гексані), з одержанням зазначеного в заголовку продукту з виходом 64,5 % (0,35 г). РХ-МС (ESI): + обчислена маса: 282,04; знайдена маса: 283,0 [M+H] (rt: 1,60 хв). Приклад 1 4-(2,4-Дифторфеніл)-N-(1-метил-1H-піразол-3-іл)-6-(5-(1-метил-1H-піразол-4-іл)-1Hбензо[d]імідазол-1-іл)піридин-2-амін a) 6-Хлор-4-(2,4-дифторфеніл)-N-(4-(1-метил-1H-піразол-4-іл)-2-нітрофеніл)піридин-2-амін Розчин сполуки прикладу одержання проміжної сполуки 5(a) (0,8 г, 3,07 ммоль) у толуолі (5 мл) дегазували барботуванням N2 протягом 5 хвилин. Додавали сполуку прикладу одержання проміжної сполуки 1 (0,8 г, 3,69 ммоль, 1,2 екв.), і отриману суміш дегазували протягом ще 5 хвилин. Ацетат паладію (0,027 г, 0,123 ммоль, 0,04 екв.), BINAP (0,076 г, 0,123 ммоль, 0,04 екв.) 23 UA 115176 C2 5 10 15 20 25 30 35 40 45 50 55 і трет-бутоксид калію (0,69 г, 6,15 ммоль, 2,0 екв.) додавали послідовно, і отриману суміш додатково дегазували протягом 5 хвилин і потім нагрівали при 100C протягом 5 годин. Отриману суміш фільтрували через пухкий шар целіту й екстрагували етилацетатом (350 мл). Об'єднаний органічний шар промивали водою, насиченим розчином солі і сушили над сульфатом натрію. Розчинник відганяли з одержанням неочищеного залишку, який очищували колонковою хроматографією (60-120 силікагель, 30 % етилацетат у гексані) з виходом 29,5 % + (0,4 г). РХ-МС (ESI): обчислена маса: 441,2; знайдена маса: 442,0 [M+H] (rt: 1,84 хв). b) 1-(6-Хлор-4-(2,4-дифторфеніл)піридин-2-іл)-5-(1-метил-1H-піразол-4-іл)-1Hбензо[d]імідазол До розчину сполуки прикладу 1(a) (0,4 г, 0,907 ммоль) у мурашиній кислоті (5 мл) додавали залізо (0,5 г, 9,07 ммоль), і отриману суміш нагрівали при 100C протягом 16 годин. Мурашину кислоту відганяли, і неочищений продукт розчиняли в етилацетаті. Етилацетатний шар промивали водою, насиченим розчином солі і сушили над сульфатом натрію. Розчинник відганяли з одержанням зазначеного в заголовку продукту з виходом 47 % (0,18 г). РХ-МС (ESI): + обчислена маса: 421,2; знайдена маса: 422,5 [M+H] (rt: 1,83 хв). c) 4-(2,4-Дифторфеніл)-N-(1-метил-1H-піразол-3-іл)-6-(5-(1-метил-1H-піразол-4-іл)-1Hбензо[d]імідазол-1-іл)піридин-2-амін Розчин сполуки прикладу 1(b) (0,07 г, 0,166 ммоль) у толуолі (5 мл) дегазували барботуванням N2 протягом 5 хвилин. Додавали 1-метил-1H-піразол-3-амін (0,024 г, 0,199 ммоль, 1,2 екв.), і отриману суміш дегазували протягом ще 5 хвилин. Pd 2(dba)3 (0,007 г, 0,0083 ммоль, 0,05 екв.), ксантфос (0,005 г, 0,0083 ммоль, 0,05 екв.) і Cs2CO3 (0,162 г, 0,4988 ммоль, 3,0 екв.) додавали послідовно з використанням методики прикладу 1(a), і отриману суміш нагрівали при 100C протягом 16 годин. Отриману суміш фільтрували й екстрагували з використанням методики прикладу 1(a). Розчинник відганяли з одержанням неочищеного залишку, який очищували препаративною ВЕРХ, з одержанням зазначеного в заголовку продукту з виходом 15 % (12 мг). 1 H ЯМР (400 МГц, CD3OD): δ 8,83 (с, 1H), 8,24-8,22 (д, 1H), 8,03 (с, 1H), 7,90-7,89 (д, 2H), 7,77-7,71 (м, 1H), 7,62-7,60 (м, 1H), 7,51 (д, 1H), 7,30-7,25 (д, 2H), 7,20-7,13 (м, 2H), 6,43-6,42 (д, 1H), 3,97 (с, 3H), 3,86 (с, 3H); РХ-МС (ESI): обчислена маса: 482,18; знайдена маса: 483,55 + [M+H] (rt: 1,57 хв). Приклад 2 N-(4-(2,4-дифторфеніл)-6-(5-(1-метил-1H-піразол-4-іл)-1H-бензо[d]імідазол-1-іл)піридин-2іл)циклопропансульфонамід Розчин сполуки прикладу 1(b) (42 мг, 0,1 ммоль) у діоксані (1 мл) дегазували барботуванням N2 протягом 5 хвилин. Додавали циклопропансульфонамід (0,11 г, 0,1 ммоль, 1 екв.), і отриману суміш дегазували протягом ще 5 хвилин. Додавали ацетат паладію (2 мг, 0,008 ммоль, 0,08 екв.), потім ксантфос (5 мг, 0,008 ммоль, 0,08 екв.) і Cs 2CO3 (100 мг, 0,3 ммоль, 3,0 екв.), і отриману суміш додатково дегазували протягом 5 хвилин і потім нагрівали при 100C протягом 16 годин. Отриману суміш фільтрували через целіт і екстрагували етилацетатом (350 мл). Об'єднаний органічний шар промивали водою, насиченим розчином солі і сушили над сульфатом натрію. Розчинник відганяли з одержанням неочищеного залишку, який очищували препаративною ВЕРХ, з одержанням зазначеного в заголовку продукту з виходом 20 % (10 мг). 1 H ЯМР (300 МГц, CD3OD): δ 9,33 (с, 1H), 8,68 (д, 1H), 8,08 (с, 1H), 7,94-7,92 (м, 2H), 7,817,73 (м, 2H), 7,70 (с, 1H), 7,24-7,16 (м, 3H), 3,96 (с, 3H), 3,16-3,09 (м, 1H), 1,28-1,24 (м, 2H), 1,05+ 1,01 (м, 2H); РХ-МС (ESI): обчислена маса: 506,1; знайдена маса: 507,1 [M+H] (rt: 1,52 хв). Приклад 2 (імідо) Натрієва сіль імідо форми N-(4-(2,4-дифторфеніл)-6-(5-(1-метил-1H-піразол-4-іл)-1Hбензо[d]імідазол-1-іл)піридин-2-іл)циклопропансульфонаміду Дану сполуку (34 мг) одержували з використанням методики, описаної в прикладі 17 (імідо), виходячи з зазначеної в заголовку сполуки прикладу 2. Необхідну сполуку перекристалізовували з етанолу. 1 H ЯМР (300 МГц, ДМСО-d6): δ 8,83 (с, 1H), 8,81-8,78 (д, 1H), 8,19 (с, 1H), 7,93 (с, 1H), 7,88 (д, 1H), 7,76-7,68 (м, 1H), 7,53-7,5 (д, 1H), 7,45-7,37 (дт, 1H), 7,27-7,20 (дт, 1H), 6,93 (с, 1H), 6,5 (с, 1H), 3,87 (с, 3H), 2,9 (м, 1H), 0,81-0,8 (м, 2H), 0,6-0,58 (м, 2H); РХ-МС (ESI): обчислена маса: + 506,1; знайдена маса: 506,8 [M+H] (rt: 1,54 хв). Приклад 3 N-(4-(2,4-дифторфеніл)-6-(5-(1-метил-1H-піразол-4-іл)-1H-бензо[d]імідазол-1-іл)піридин-2іл)ацетамід Дану сполуку одержували зі сполуки прикладу 1(b) з використанням методики прикладу 2. 24 UA 115176 C2 1 5 10 15 20 25 30 35 40 45 50 55 60 H ЯМР (400 МГц, ДМСО-d6): δ 10,81 (с, 1H), 9,07 (с, 1H), 8,58 (д, 1H), 8,32-8,22 (м, 2H), 7,967,95 (м, 2H), 7,85-7,81 (м, 2H), 7,59 (д, 1H), 7,61-7,49 (м, 1H), 7,36-7,31 (м, 1H), 3,89 (с, 3H), 2,21 + (с, 3H); РХ-МС (ESI): обчислена маса: 444,15; знайдена маса: 445,3 [M+H] (rt: 1,43 хв). Приклад 4 N-(4-(2,4-дифторфеніл)-6-(5-(1-метил-1H-піразол-4-іл)-1H-бензо[d]імідазол-1-іл)піридин-2іл)метансульфонамід Дану сполуку одержували зі сполуки прикладу 1(b) з використанням методики прикладу 2. 1 H ЯМР (400 МГц, ДМСО-d6): δ 11,2 (с, 1H), 9,03 (с, 1H), 8,60 (д, 1H), 8,21 (с, 1H), 7,95 (с, 2H), 7,89-7,82 (м, 1H), 7,74 (с, 1H), 7,59-7,48 (м, 2H), 7,34-7,31 (м, 1H), 7,05 (с, 1H), 3,87 (с, 3H), 3,38 + (с, 3H); РХ-МС (ESI): обчислена маса: 480,12; знайдена маса: 481,05 [M+H] (rt: 1,39 хв). Приклад 5 N-(4-(2,4-дифторфеніл)-6-(5-(1-метил-1H-піразол-4-іл)-1H-бензо[d]імідазол-1-іл)піридин-2іл)етансульфонамід Дану сполуку одержували зі сполуки прикладу 1(b) з використанням методики прикладу 2. 1 H ЯМР (400 МГц, ДМСО-d6): δ 11,1 (с, 1H), 9,02 (с, 1H), 8,61 (д, 1H), 8,22 (с, 1H), 7,95-7,94 (м, 2H), 7,89-7,83 (м, 1H), 7,74 (с, 1H), 7,60-7,56 (м, 1H), 7,54-7,48 (м, 1H), 7,36-7,31 (м, 1H), 7,06 (с, 1H), 3,87 (с, 3H), 3,54 (квартет, 2H), 1,26 (т, 3H); РХ-МС (ESI): обчислена маса: 494,13; + знайдена маса: 494,8 [M+H] (rt: 1,5 хв). Приклад 5 (імідо) Натрієва сіль імідо форми N-(4-(2,4-дифторфеніл)-6-(5-(1-метил-1H-піразол-4-іл)-1Hбензо[d]імідазол-1-іл)піридин-2-іл)етансульфонаміду Дану сполуку (30 мг) одержували з використанням методики, описаної в прикладі 17 (імідо), виходячи з зазначеної в заголовку сполуки прикладу 5. Необхідну сполуку промивали діетиловим ефіром і сушили. 1 H ЯМР (300 МГц, ДМСО-d6): δ 8,83 (с, 1H), 8,8-8,7 (д, 1H), 8,19 (с, 1H), 7,93 (с, 1H), 7,88 (с, 1H), 7,73-7,69 (м, 1H), 7,52-7,49 (дд, 1H), 7,27-7,21 (т, 1H), 6,94 (с, 1H), 6,48 (с, 1H), 3,87 (с, 3H), 3,11-3,04 (кв, 2H), 1,14-1,07 (т, 3H); РХ-МС (ESI): обчислена маса: 494,13; знайдена маса: 495,1 + [M+H] (rt: 1,42 хв). Приклад 6 N-(4-(2,4-дифторфеніл)-6-(5-(1-метил-1H-піразол-4-іл)-1H-бензо[d]імідазол-1-іл)піридин-2іл)пропан-2-сульфонамід Дану сполуку одержували зі сполуки прикладу 1(b) з використанням методики прикладу 2. 1 H ЯМР (400 МГц, ДМСО-d6): δ 11,1 (с, 1H), 9,04 (с, 1H), 8,67 (д, 1H), 8,22 (с, 1H), 7,96-7,94 (м, 2H), 7,87-7,85 (м, 1H), 7,73 (с, 1H), 7,61-7,52 (м, 2H), 7,34 (м, 1H), 7,06 (с, 1H), 3,95 (м, 1H), + 3,87 (с, 3H), 1,33 (д, 6H); РХ-МС (ESI): обчислена маса: 508,15; знайдена маса: 509,05 [M+H] (rt: 1,65 хв). Приклад 6 (імідо) Імідо форма N-(4-(2,4-дифторфеніл)-6-(5-(1-метил-1H-піразол-4-іл)-1H-бензо[d]імідазол-1іл)піридин-2-іл)пропан-2-сульфонамід Суспензію неочищеного залишку сполуки прикладу 6 (12 г) перемішували при 65C із ТГФ (166 мл) і фільтрували в гарячому стані. Тверду речовину сушили у вакуумі з одержанням 3,5 г зазначеної в заголовку сполуки. 1 H ЯМР(400 МГц, ДМСО-d6) δ 8,83-8,81 (м, 2H), 8,18 (с, 1H), 7,92 (с, 1H), 7,87 (с, 1H), 7,737,69 (м, 1H), 7,5-7,48 (д, 1H), 7,43-7,37 (дт, 1H), 7,25-7,21 (дт, 1H), 6,93 (с, 1H), 6,49 (с, 1H), 3,87 (с, 3H), 3,75-3,65 (сеп, 1H), 1,16-1,14 (д, 6H); РХ-МС (ESI): обчислена маса: 508,15 (вільна + основа); знайдена маса: 508,8 [M+H] (вільна основа) (rt: 1,51 хв). Приклад 7 N-(4-(2,4-дифторфеніл)-6-(5-(1-метил-1H-піразол-4-іл)-1H-бензо[d]імідазол-1-іл)піридин-2іл)піридазин-3-амін Дану сполуку одержували зі сполуки прикладу 1(b) з використанням методики прикладу 2. 1 H ЯМР (400 МГц, ДМСО-d6): δ 10,29 (с, 1H), 8,93 (с, 1H), 8,90-8,87 (м, 1H), 8,43-8,42 (м, 1H), 8,24-8,18 (м, 2H), 8,15-8,10 (м, 2H), 7,99 (с, 1H), 7,96 (с, 1H), 7,65-7,62 (м, 2H), 7,5-7,44 (м, 1H), 7,36-7,28 (м, 2H), 3,87 (с, 3H); РХ-МС (ESI): обчислена маса: 480,16; знайдена маса: 481,1 + [M+H] (rt: 1,39 хв). Приклад 8 N-(4-(2-фторфеніл)-6-(5-(1-метил-1H-піразол-4-іл)-1H-бензо[d]імідазол-1-іл)піридин-2іл)циклопропансульфонамід a) 2,6-Дихлор-4-(2-фторфеніл)піридин Розчин 2,6-дихлор-4-йодпіридину (1,09 г, 4 ммоль) у 1,2-диметоксіетані (15 мл) дегазували барботуванням N2 протягом 5 хвилин. Додавали 2-Фторфенілборонову кислоту (0,67 г, 4,8 25 UA 115176 C2 5 10 15 20 25 30 35 40 45 50 55 60 ммоль, 1,2 екв.), і отриману суміш дегазували протягом ще 5 хвилин. Pd(dppf)Cl 2 (0,33 г, 0,4 ммоль, 0,1 екв.) і водний карбонат натрію (1,27 г, 12 ммоль, 3 екв.) додавали послідовно з використанням методики прикладу одержання проміжної сполуки 1, і отриману суміш потім нагрівали при 90C протягом 2 годин. Реакційну суміш потім гасили й екстрагували, як у прикладі одержання проміжної сполуки 1. Розчинник відганяли з одержанням неочищеного залишку, який очищували колонковою хроматографією (60-120 силікагель, 1 % етилацетат у гексані), з одержанням зазначеного в заголовку продукту з виходом 100 % (0,97 г). b) 6-Хлор-4-(2-фторфеніл)-N-(4-(1-метил-1H-піразол-4-іл)-2-нітрофеніл)піридин-2-амін Розчин сполуки прикладу 8(a) (0,97 г, 4 ммоль) у толуолі (5 мл) дегазували барботуванням N2 протягом 5 хвилин. Додавали сполуку прикладу одержання проміжної сполуки 1 (0,96 г, 4,4 ммоль, 1,1 екв.), і отриману суміш дегазували протягом ще 5 хвилин. Ацетат паладію (36 мг, 0,16 ммоль, 0,04 екв.), BINAP (99 мг, 0,16 ммоль, 0,04 екв.) і трет-бутоксид калію (0,67 г, 6 ммоль, 1,5 екв.) додавали послідовно, слідуючи методиці прикладу 1(a). Неочищений залишок продукту очищували колонковою хроматографією (60-120 силікагель, 50 % етилацетат у гексані) + з виходом 36 % (0,6 г). РХ-МС (ESI): обчислена маса: 423,09; знайдена маса: 424,05 [M+H] (rt: 2,04 хв). c) 1-(6-хлор-4-(2-фторфеніл)піридин-2-іл)-5-(1-метил-1H-піразол-4-іл)-1H-бензо[d]імідазол До розчину сполуки прикладу 8(b) (0,59 г, 1,4 ммоль) у мурашиній кислоті (5 мл) додавали залізо (0,78 г, 14 ммоль) і нагрівали при 100C протягом 16 годин. Мурашину кислоту відганяли, і неочищений продукт розчиняли в етилацетаті. Етилацетатний шар промивали водою, насиченим розчином солі і сушили над сульфатом натрію. Розчинник відганяли з одержанням зазначеного в заголовку продукту з виходом 53 % (0,3 г). РХ-МС (ESI): обчислена маса: 403,1; знайдена маса: 404,1 [M+H]+(rt: 1,66 хв). d) N-(4-(2-фторфеніл)-6-(5-(1-метил-1H-піразол-4-іл)-1H-бензо[d]імідазол-1-іл)піридин-2іл)циклопропансульфонамід Розчин сполуки прикладу 8(c) (0,1 г, 0,25 ммоль) у діоксані (1 мл) дегазували барботуванням N2 протягом 5 хвилин. Додавали циклопропансульфонамід (30 мг, 0,25 ммоль, 1 екв.), і отриману суміш дегазували протягом ще 5 хвилин. Додавали ацетат паладію (5 мг, 0,02 ммоль, 0,08 екв.), потім ксантфос (12 мг, 0,02 ммоль, 0,08 екв.) і Cs 2CO3 (0,24 г, 0,75 ммоль, 3,0 екв.), і отриману суміш додатково дегазували протягом 5 хвилин і потім нагрівали при 100C протягом 16 годин. Отриману суміш фільтрували через целіт і екстрагували, як у прикладі 1. Розчинник відганяли з одержанням неочищеного залишку, який очищували препаративною ВЕРХ, з одержанням зазначеного в заголовку продукту з виходом 8 % (10 мг). 1 H ЯМР (400 МГц, CD3OD): δ 8,91 (с, 1H), 8,62 (д, 1H), 8,05 (с, 1H), 7,91 (м, 2H), 7,73-7,67 (м, 3H), 7,58-7,52 (м, 1H), 7,41-7,33 (м, 2H), 7,21 (с, 1H), 3,97 (с, 3H), 3,17-3,15 (м, 1H), 1,30-1,26 (м, + 2H), 1,06-1,04 (м, 2H); РХ-МС (ESI): обчислена маса: 488,14; знайдена маса: 489,2 [M+H] (rt: 1,46 хв). Приклад 8 (імідо) Натрієва сіль імідо форми N-(4-(2-фторфеніл)-6-(5-(1-метил-1H-піразол-4-іл)-1Hбензо[d]імідазол-1-іл)піридин-2-іл)циклопропансульфонаміду Дану сполуку (45 мг) одержували з використанням методики, описаної в прикладі 17 (імідо), виходячи з зазначеної в заголовку сполуки прикладу 8. 1 H ЯМР (300 МГц, ДМСО-d6): δ 8,82 (с, 1H), 8,79-8,76 (д, 1H), 8,18 (с, 1H), 7,91 (с, 1H), 7,87 (д, 1H), 7,67-7,62 (м, 1H), 7,52-7,42 (м, 2H), 7,37-7,31 (м, 2H), 6,93 (с, 1H), 6,53 (с, 1H), 3,86 (с, 3H), 2,89 (м, 1H), 0,82-0,79 (м, 2H), 0,61-0,57 (м, 2H); РХ-МС (ESI): обчислена маса: 488,14; + знайдена маса: 489,4 [M+H] (rt: 1,49 хв). Приклад 9 N-(4-(2-фторфеніл)-6-(5-(1-метил-1H-піразол-4-іл)-1H-бензо[d]імідазол-1-іл)піридин-2іл)ацетамід Дану сполуку одержували зі сполуки прикладу 8(c) з використанням методики прикладу 8. 1 H ЯМР (300 МГц, CD3OD): δ 8,88 (с, 1H), 8,37-8,35 (м, 2H), 8,01 (с, 1H), 7,87 (м, 2H), 7,697,61 (м, 3H), 7,59-7,49 (м, 1H), 7,36-7,34 (м, 2H), 3,95 (с, 3H), 2,26 (м, 3H); РХ-МС (ESI): + обчислена маса: 426,16; знайдена маса: 427,25 [M+H] (rt: 1,4 хв). Приклад 10 N-(4-(2-фторфеніл)-6-(5-(1-метил-1H-піразол-4-іл)-1H-бензо[d]імідазол-1-іл)піридин-2іл)метансульфонамід Дану сполуку одержували зі сполуки прикладу 8(c) з використанням методики прикладу 8. 1 H ЯМР (300 МГц, ДМСО-d6): δ 11,2 (с, 1H), 9,02 (с, 1H), 8,60 (д, 1H), 8,20 (с, 1H), 7,94 (с, 2H), 7,74 (м, 2H), 7,56 (м, 2H), 7,41 (м, 2H), 7,07 (с, 1H), 3,86 (с, 3H), 3,38 (с, 3H); РХ-МС (ESI): + обчислена маса: 462,13; знайдена маса: 463,1 [M+H] (rt: 1,31 хв). 26 UA 115176 C2 5 10 15 20 25 30 35 40 45 50 55 60 Приклад 11 N-(4-(2-фторфеніл)-6-(5-(1-метил-1H-піразол-4-іл)-1H-бензо[d]імідазол-1-іл)піридин-2іл)етансульфонамід Дану сполуку одержували зі сполуки прикладу 8(c) з використанням методики прикладу 8(d). 1 H ЯМР (400 МГц, ДМСО-d6): δ 11,1 (с, 1H), 9,03 (с, 1H), 8,61 (д, 1H), 8,22 (с, 1H), 7,95-7,94 (м, 2H), 7,79-7,76 (м, 2H), 7,60-7,57 (м, 2H), 7,46-7,40 (м, 2H), 7,09 (с, 1H), 3,87 (с, 3H), 3,55 + (квартет, 2H), 1,26 (т, 3H); РХ-МС (ESI): обчислена маса: 476,14; знайдена маса: 477,0 [M+H] (rt: 1,41 хв). Приклад 11 (імідо) Натрієва сіль імідо форми N-(4-(2-фторфеніл)-6-(5-(1-метил-1H-піразол-4-іл)-1Hбензо[d]імідазол-1-іл)піридин-2-іл)етансульфонаміду Дану сполуку (34 мг) одержували з використанням методики, описаної в прикладі 17 (імідо), виходячи з зазначеної в заголовку сполуки прикладу 11. Необхідну сполуку промивали діетиловим ефіром і сушили. 1 H ЯМР (400 МГц, ДМСО-d6): δ 8,83 (с, 1H), 8,8-8,78 (д, 1H), 8,2 (с, 1H), 7,93 (с, 1H), 7,89-7,88 (д, 1H), 7,68-7,65 (дт, 1H), 7,52-7,46 (м, 1H), 7,38-7,33 (м, 2H), 6,96 (с, 1H), 6,51 (с, 1H), 3,22 (с, 3H), 3,11-3,06 (кв, 2H), 1,14-1,08 (т, 3H); РХ-МС (ESI): обчислена маса: 476,14; знайдена маса: + + 477,0 [M+H] (rt: 1,41 хв). Знайдена маса: 476,8 [M+H] (rt: 1,37 хв). Приклад 12 N-(4-(2-фторфеніл)-6-(5-(1-метил-1H-піразол-4-іл)-1H-бензо[d]імідазол-1-іл)піридин-2іл)пропан-2-сульфонамід Дану сполуку одержували зі сполуки прикладу 8(c) з використанням методики прикладу 8. 1 H ЯМР (300 МГц, ДМСО-d6): δ 11,03 (с, 1H), 9,03 (с, 1H), 8,67 (д, 1H), 8,22 (с, 1H), 7,96-7,94 (м, 2H), 7,79-7,73 (м, 2H), 7,61-7,55 (м, 2H), 7,42-7,39 (м, 2H), 7,08 (с, 1H), 3,96-3,93 (м, 1H), 3,87 + (с, 3H), 1,33 (д, 6H); РХ-МС (ESI): обчислена маса: 490,16; знайдена маса: 491,1 [M+H] (rt: 1,48 хв). Приклад 12 (імідо) Натрієва сіль імідо форми N-(4-(2-фторфеніл)-6-(5-(1-метил-1H-піразол-4-іл)-1Hбензо[d]імідазол-1-іл)піридин-2-іл)пропан-2-сульфонаміду Зазначену в заголовку сполуку (24 мг) одержували з використанням методики, описаної в прикладі 17 (імідо), виходячи з зазначеної в заголовку сполуки прикладу 12. 1 H ЯМР (400 МГц, ДМСО-d6): δ 8,83-8,81 (м, 2H), 8,19 (с, 1H), 7,92 (с, 1H), 7,87 (д, 1H), 7,677,63 (дт, 1H), 7,51-7,46 (м, 2H), 7,37-7,32 (м, 2H), 6,94 (с, 1H), 6,51 (с, 1H), 3,87 (с, 3H), 3,75-3,65 + (м, 1H), 1,16-1,14 (д, 6H); РХ-МС (ESI): обчислена маса: 490,16; знайдена маса: 491,4 [M+H] (rt: 1,5 хв). Приклад 13 N-(4-(2-фторфеніл)-6-(5-(1-метил-1H-піразол-4-іл)-1H-бензо[d]імідазол-1-іл)піридин-2іл)піридазин-3-амін Дану сполуку одержували зі сполуки прикладу 8(c) з використанням методики прикладу 8. 1 H ЯМР (400 МГц, ДМСО-d6): δ 10,49 (с, 1H), 9,01 (с, 1H), 8,85-8,83 (м, 1H), 8,32-8,29 (м, 1H), 8,20 (с, 1H), 8,05 (с, 1H), 7,99-7,94 (м, 3H), 7,79-7,78 (м, 1H), 7,63-7,58 (м, 4H), 7,47-7,41 (м, 2H), + 3,87 (с, 3H); РХ-МС (ESI): обчислена маса: 462,17; знайдена маса: 463,2 [M+H] (rt: 0,95 хв). Приклад 14 N-(4-(4-фторфеніл)-6-(5-(1-метил-1H-піразол-4-іл)-1H-бензо[d]імідазол-1-іл)піридин-2іл)циклопропансульфонамід a) 2,6-Дихлор-4-(4-фторфеніл)піридин Розчин 2,6-дихлор-4-йодпіридину (2,18 г, 8 ммоль) у 1,2-диметоксіетані (15 мл) дегазували барботуванням N2 протягом 5 хвилин. Додавали 4-фторфенілборонову кислоту (1,34 г, 9,6 ммоль, 1,2 екв.), і отриману суміш дегазували протягом ще 5 хвилин. Pd(dppf)Cl 2 (1,3 г, 1,6 ммоль, 0,2 екв.) і водний карбонат натрію (2,54 г, 24 ммоль, 3 екв.) додавали послідовно з використанням методики прикладу одержання проміжної сполуки 1, і отриману суміш потім нагрівали при 90C протягом 2 годин. Реакційну суміш гасили й екстрагували, як у прикладі одержання проміжної сполуки 1. Розчинник відганяли з одержанням неочищеного залишку, який очищували колонковою хроматографією (60-120 силікагель, 1 % етилацетат у гексані), з одержанням зазначеного в заголовку продукту з виходом 77 % (1,5 г). РХ-МС (ESI): обчислена + маса: 240,99; знайдена маса: 242,0 [M+H] (rt: 1,95 хв). b) 6-Хлор-4-(4-фторфеніл)-N-(4-(1-метил-1H-піразол-4-іл)-2-нітрофеніл)піридин-2-амін Розчин сполуки прикладу 14(a) (0,97 г, 4 ммоль) у толуолі (5 мл) дегазували барботуванням N2 протягом 5 хвилин. Додавали сполуку прикладу одержання проміжної сполуки 1 (0,96 г, 4,4 ммоль, 1,1 екв.), і отриману суміш дегазували протягом ще 5 хвилин. Ацетат паладію (36 мг, 27 UA 115176 C2 5 10 15 20 25 30 35 40 45 50 55 0,16 ммоль, 0,04 екв.), BINAP (99 мг, 0,16 ммоль, 0,04 екв.) і трет-бутоксид калію (0,67 г, 6 ммоль, 1,5 екв.) додавали послідовно, слідуючи методиці прикладу 1(a). Неочищений залишок продукту очищували колонковою хроматографією (60-120 силікагель, 50 % етилацетат у гексані) з виходом 15 % (0,25 г). c) N1-(6-хлор-4-(4-фторфеніл)піридин-2-іл)-4-(1-метил-1H-піразол-4-іл)бензол-1,2-діамін До розчину сполуки прикладу 14(b) (0,25 г, 0,6 ммоль) у ТГФ (10 мл) додавали розчин амонійхлориду (0,26 г, 4,8 ммоль, 8 екв.) у воді (2 мл) і цинк (0,31 г, 4,8 ммоль, 8 екв.). Суміш перемішували при КТ протягом 6 годин і фільтрували. Фільтрат розбавляли водою й екстрагували, як у прикладі одержання проміжної сполуки 1. Розчинник відганяли з одержанням зазначеного в заголовку продукту з виходом 100 % (0,24 г). РХ-МС (ESI): обчислена маса: + 393,12; знайдена маса: 394,5 [M+H] (rt: 1,59 хв). d) 1-(6-хлор-4-(4-фторфеніл)піридин-2-іл)-5-(1-метил-1H-піразол-4-іл)-1H-бензо[d]імідазол Розчин сполуки прикладу 14(c) (0,24 г, 0,6 ммоль) і мурашиної кислоти (5 мл) нагрівали при 100C протягом 16 годин. Мурашину кислоту відганяли, і неочищений продукт екстрагували, як у прикладі 8(c). Розчинник відганяли з одержанням зазначеного в заголовку продукту з виходом + 38 % (90 мг). РХ-МС (ESI): обчислена маса: 403,1; знайдена маса: 404,2 [M+H] (rt: 1,68 хв). e) N-(4-(4-фторфеніл)-6-(5-(1-метил-1H-піразол-4-іл)-1H-бензо[d]імідазол-1-іл)піридин-2іл)циклопропансульфонамід Розчин сполуки прикладу 14(d) (40 мг, 01 ммоль) у діоксані (1 мл) дегазували барботуванням N2 протягом 5 хвилин. Додавали циклопропансульфонамід (12 мг, 0,1 ммоль, 1 екв.), і отриману суміш дегазували протягом ще 5 хвилин. Додавали ацетат паладію (2 мг, 0,008 ммоль, 0,08 екв.), потім ксантфос (5 мг, 0,008 ммоль, 0,08 екв.) і Cs 2CO3 (0,1 г, 0,3 ммоль, 3,0 екв.), і отриману суміш додатково дегазували протягом 5 хвилин і потім нагрівали при 100C протягом 16 годин. Отриману суміш фільтрували через целіт і екстрагували, як у прикладі 1. Розчинник відганяли з одержанням неочищеного залишку, який очищували препаративною ВЕРХ, з одержанням зазначеного в заголовку продукту з виходом 20 % (10 мг). 1 H ЯМР (400 МГц, CD3OD): δ 8,97 (с, 1H), 8,68 (д, 1H), 8,06 (с, 1H), 7,92-7,89 (м, 4H), 7,73 (м, 1H), 7,69-7,67 (м, 1H), 7,34-7,29 (м, 2H), 7,21 (м, 1H), 3,97 (с, 3H), 3,16-3,09 (м, 1H), 1,30-1,26 (м, + 2H), 1,05-1,03 (м, 2H); РХ-МС (ESI): обчислена маса: 488,14; знайдена маса: 489,1 [M+H] (rt: 1,5 хв). Приклад 15 N-(4-(4-фторфеніл)-6-(5-(1-метил-1H-піразол-4-іл)-1H-бензо[d]імідазол-1-іл)піридин-2іл)ацетамід Дану сполуку одержували зі сполуки прикладу 14(d) з використанням методики прикладу 14. 1 H ЯМР (400 МГц, ДМСО-d6): δ 10,75 (с, 1H), 9,13 (с, 1H), 8,59 (д, 1H), 8,29 (д, 1H), 7,93-7,89 (м, 5H), 7,56 (д, 2H), 7,43-7,4 (м, 2H), 3,86 (с, 3H), 2,19 (м, 3H); РХ-МС (ESI): обчислена маса: + 426,16; знайдена маса: 427,5 [M+H] (rt: 1,47 хв). Приклад 16 N-(4-(4-фторфеніл)-6-(5-(1-метил-1H-піразол-4-іл)-1H-бензо[d]імідазол-1-іл)піридин-2іл)метансульфонамід Дану сполуку одержували зі сполуки прикладу 14(d) з використанням методики прикладу 14. 1 H ЯМР (400 МГц, ДМСО-d6): δ 11,2 (с, 1H), 9,12 (с, 1H), 8,63 (д, 1H), 8,22 (с, 1H), 7,96-7,92 (м, 4H), 7,86 (с, 1H), 7,59-7,57 (м, 1H), 7,46-7,42 (м, 2H), 7,11 (с, 1H), 3,88 (с, 3H), 3,38 (с, 3H); РХ+ МС (ESI): обчислена маса: 462,13; знайдена маса: 462,8 [M+H] (rt: 1,43 мін). Приклад 17 N-(4-(4-фторфеніл)-6-(5-(1-метил-1H-піразол-4-іл)-1H-бензо[d]імідазол-1-іл)піридин-2іл)пропан-2-сульфонамід Дану сполуку одержували зі сполуки прикладу 14(d) з використанням методики прикладу 14(e). 1 H ЯМР (300 МГц, ДМСО-d6): δ 11,0 (с, 1H), 9,13 (с, 1H), 8,68 (д, 1H), 8,22 (с, 1H), 7,96-7,87 (м, 5H), 7,62-7,58 (м, 1H), 7,47-7,41 (м, 2H), 7,12 (с, 1H), 3,99-3,93 (м, 1H), 3,87 (с, 3H), 1,34 (д, + 6H); РХ-МС (ESI): обчислена маса: 490,16; знайдена маса: 491,05 [M+H] (rt: 1,58 хв). Приклад 17 (імідо) Натрієва сіль імідо форми N-(4-(4-фторфеніл)-6-(5-(1-метил-1H-піразол-4-іл)-1Hбензо[d]імідазол-1-іл)піридин-2-іл)пропан-2-сульфонаміду До сполуки прикладу 17 (37 мг) додавали ізопропіловий спирт (1 мл) і трет-бутоксид натрію (7 мг) і, після кип'ятіння зі зворотним холодильником протягом ночі, отриману суміш упарювали, з одержанням 32 мг зазначеної в заголовку сполуки. 28
ДивитисяДодаткова інформація
Назва патенту англійськоюProtein kinase inhibitors
Автори англійськоюRajagopalan, Srinivasan, Appukuttan, Prasad, Narasingapuram Arumugam, Karthikeyan, Ujjinamatada, Ravi Kotrabasaiah, George, Shyla, Linnanen, Tero
Автори російськоюРаджагопалан Сринивасан, Аппукуттан Прасад, Нарасингапурам Арумугам Картхикейан, Уджинаматада Рави Котрабасаиах, Джордж Шила, Линнанен Тэро
МПК / Мітки
МПК: A61K 31/4439, C07D 401/14, C07D 471/04
Мітки: протеїнкінази, інгібітори
Код посилання
<a href="https://ua.patents.su/49-115176-ingibitori-protenkinazi.html" target="_blank" rel="follow" title="База патентів України">Інгібітори протеїнкінази</a>
Попередній патент: Друковане зображення у вигляді водної розмальовки та спосіб отримання цього зображення (варіанти)
Наступний патент: Полімерна композиція
Випадковий патент: Спосіб захисту нержавіючої сталі від корозії в сірчаній кислоті