Інгібітори протеїнкінази
Номер патенту: 111382
Опубліковано: 25.04.2016
Автори: Вольфарт Герд, Раджагопалан Срінівасан, Уджинаматада Раві, Ліннанен Теро, Нандурі Срінівас, Мукхерджи Субхенду
Формула / Реферат
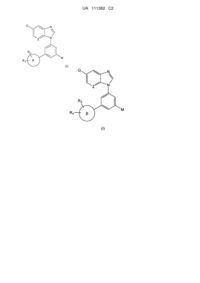
1. Сполука формули (І)
 , (I)
, (I)
де
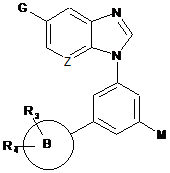
Z є СН або N;
G є ціано, -C(O)NR15R16, -C(O)OR17, -C(O)R21, -C(CH3)=NOR22 або групою формули
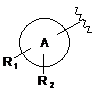 ,
,
де А є фенільним кільцем або 5-12-членним гетероциклічним кільцем, і
R1 є Н, С1-7алкілом, С3-7циклоалкілом, С3-7циклоалкілС1-7алкілом, С1-7алкокси, С1-7алкілкарбонілом, аміно, гідрокси, гідроксіС1-7алкілом, С1-7алкіламіноС1-7алкілом, фенілС1-7алкокси, -NHC(O)-R21, -R12-C(O)-R13, -SO2-R14 або -E-R6, і
R2 є Н, галогеном, С1-7алкілом або оксо;
В є 5-12-членним карбоциклічним або гетероциклічним кільцем;
R3 є Н, галогеном, С1-7алкілом, С1-7алкокси, ціано або необов'язково заміщеним 5-6-членним гетероциклічним кільцем;
R4 є Н, галогеном, С1-7алкілом або оксо;
М є гідроксилом, С1-7алкілом або -NHR5;
R5 є Н, -С(O)R7, -SO2R8, -C(O)-D-R9 або необов'язково заміщеним 5-6-членним гетероциклічним кільцем;
R6 є необов'язково заміщеним 5-6-членним гетероциклічним кільцем;
R7 є С1-7алкілом, С2-7алкенілом, С3-7циклоалкілом, С1-7алкокси, С1-7алкоксіС1-7алкілом, карбоксіС1-7алкілом, С1-7алкоксикарбонілС1-7алкілом, С1-7алкіламіноС1-7алкілом, -NH-R10 або -NH-X1-R11;
R8 є С1-7алкілом, С2-7алкенілом, С3-7циклоалкілом, гідроксіС1-7алкілом, -NR18R19, -NH-X2-R20, фенілом або необов'язково заміщеним 5-6-членним гетероциклічним кільцем;
R9 є фенілом або необов'язково заміщеним 5-6-членним гетероциклічним кільцем;
R10 є С1-7алкілом або С3-7циклоалкілом;
R11 є фенілом або необов'язково заміщеним 5-6-членним гетероциклічним кільцем;
R12 і R21 є С1-7алкілом;
R13 є С1-7алкокси, аміно або гідрокси;
R14 є С1-7алкілом або С3-7циклоалкілом;
R15, R16, R17, R18, і R19 є, незалежно, Н, С1-7алкілом або С3-7циклоалкілом;
R20 є фенілом або необов'язково заміщеним 5-6-членним гетероциклічним кільцем;
R21 є необов'язково заміщеним 5-6-членним гетероциклічним кільцем;
R22 є Н або С1-7алкілом;
Е є зв'язком або С1-7алкілом;
D є зв'язком або С1-7алкілом;
Х1 і Х2 незалежно є зв'язком або С1-7алкілом;
або її фармацевтично прийнятні солі.
2. Сполука за п. 1, де G є групою формули
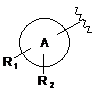 .
.
3. Сполука за п. 1 або 2, де М є -NHR5.
4. Сполука за будь-яким з пунктів 1-3, де кільцем А є одна з наступних груп або їх таутомерів:
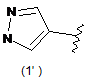 ,
, 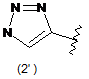 ,
, 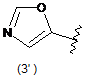 ,
, 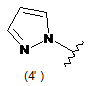 ,
, 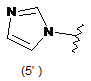 ,
,  ,
,
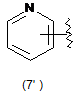 ,
, 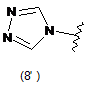 ,
, 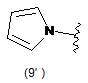 ,
, 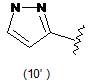 ,
, 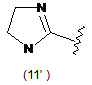 ,
,  ,
,
 ,
, 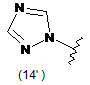 ,
, 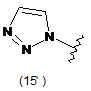 ,
,  ,
,  ,
,  ,
,
 ,
, 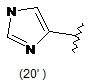 ,
, 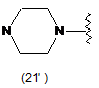 ,
, 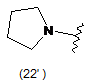 ,
, 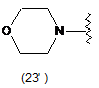 .
.
5. Сполука за будь-яким з пп. 1-4, де кільцем В є будь-яка з наступних груп або їх таутомерів:
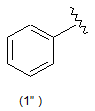 ,
,  ,
,  ,
, 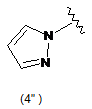 ,
, 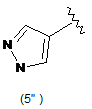 ,
,
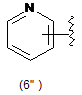 ,
, 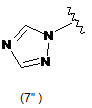 ,
, 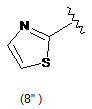 ,
,  ,
,  .
.
6. Сполука за будь-яким з пп. 1-5, де Z є СН.
7. Сполука за будь-яким з пп. 1-5, де Z є N.
8. Сполука за будь-яким з пп. 1-7, де G є групою формули
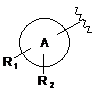 ,
,
де А є кільцем формули (1'), (2') (3'), (4'), (5'), (7'), (10'), (12'), (14'), (16') або (20');
R1 є Н, С1-7алкілом, С1-7алкокси, гідроксіС1-7алкілом, С1-7алкіламіноС1-7алкілом або -E-R6;
R2 є H;
В є кільцем формули (1"), (2"), (3"), (4") або (6");
Е є зв'язком або С1-7алкілом;
R6 є однією з наступних груп
 ,
, 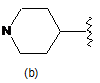 ,
, 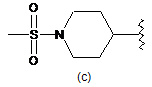 ,
, 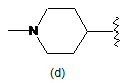 ,
, 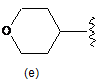 ;
;
R3 є Н, галогеном, С1-7алкілом, С1-7алкокси або ціано;
R4 є Н або галогеном;
М є -NHR5;
R5 є -C(O)R7, -SO2R8 або -C(O)-D-R9 або будь-якою з наступних формул
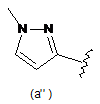 ,
, 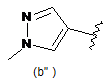 ,
, 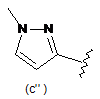 ,
, 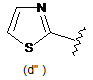 ,
, 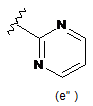 ,
, 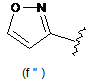 ;
;
R7 є С1-7алкілом, С2-7алкенілом, -NH-R10 або -NH-X1-R11;
R8 є С1-7алкілом, С2-7алкенілом, С3-7циклоалкілом, гідроксіС1-7алкілом, -NR18R19, -NH-X2-R20, фенілом або групою
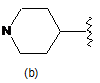 ;
;
R9 є фенілом або є однією з наступних груп
 ,
, 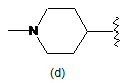 ,
,  ,
, 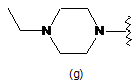 ,
,
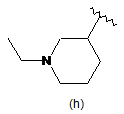 ,
, 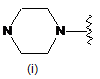 ,
,  ,
, 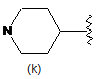 ,
,  ,
,
 ,
, 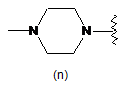 ,
, 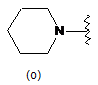 ,
,  ;
;
R10 є С1-7алкілом або С3-7циклоалкілом;
R11 є фенілом, 4-фторфенілом або однією з наступних груп
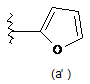 ,
, 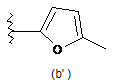 ,
, 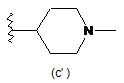 ;
;
R18 і R19 незалежно є Н, С1-7алкілом або С3-7циклоалкілом;
R20 є групою
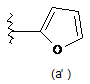 ;
;
Х1 і Х2 незалежно є зв'язком або С1-7алкілом, і
D є зв'язком або С1-7алкілом.
9. Сполука за будь-яким з пп. 1-8, де В є кільцем формули (1") або (6").
10. Сполука за будь-яким з пп. 1-9, де А є кільцем формули (1'), (2'), (4'), (7'), (10'), (14'), (16') або (20').
11. Сполука за будь-яким з пп. 1-10, де В є фенілом, R3 є галогеном і R4 є Н або галогеном.
12. Сполука за будь-яким з пп. 1-11, де М є -NHC(O)R7, де R7 є С1-7алкілом, С2-7алкенілом, С3-7циклоалкілом, -NH-R10 або -NH-X1-R11, де R11 є С1-7алкілом або С3-7циклоалкілом, X1 є зв'язком або С1-7алкілом і R11 є 5-6-членним гетероциклічним кільцем, необов'язково заміщеним однією або двома С1-7алкільними групами.
13. Сполука за будь-яким з пп. 1-11, де М є -NHSO2R8, де R8 є С1-7алкілом, С2-7алкенілом, С3-7циклоалкілом, фенілом або NR18R19, де R18 і R19 незалежно є Н, С1-7алкілом або С3-7циклоалкілом.
14. Сполука за будь-яким з пп. 1-11, де М є -NHC(O)-D-R9, де D є зв'язком або С1-7алкілом, і R9 є 5-6-членним гетероциклічним кільцем, необов'язково заміщеним однією або двома С1-7алкільними групами.
15. Сполука за будь-яким з пп. 1-11, де R5 є 5-6-членним гетероциклічним кільцем, необов'язково заміщеним однією або двома С1-7алкільними групами.
16. Фармацевтична композиція, що містить сполуку формули (І) або її фармацевтично прийнятну сіль разом з фармацевтично прийнятним носієм.
17. Застосування сполуки формули (І) або її фармацевтично прийнятної солі у виробництві лікарського засобу для лікування стану, у якому бажано інгібування РФРФ кінази.
18. Застосування сполуки формули (І) або її фармацевтично прийнятної солі у виробництві лікарського засобу для лікування раку.
Текст
Реферат: Описано сполуку формули (І), де R3, R4, G, В, М і Z такі, як визначені у формулі винаходу, і її фармацевтично прийнятна сіль. Сполуки формули (І) діють як інгібітори РФРФ і можуть застосовуватися в лікуванні стану, у якому бажане інгібування РФРФ кінази, такого як рак. UA 111382 C2 (12) UA 111382 C2 G N Z N R3 R4 B M (I) UA 111382 C2 5 10 15 20 25 30 35 40 45 Галузь техніки Даний винахід стосується терапевтично активних сполук і їх фармацевтично прийнятних солей, які застосовують, наприклад, при лікуванні раку. Рівень техніки Протеїнкінази являють собою клас білків (ферментів), які регулюють множину клітинних функцій. Це супроводжується фосфорилуванням певних амінокислот на субстратах білка, що приводить до конформаційного переходу субстрату білка. Конформаційний перехід модулює активність субстрату або його здатність взаємодіяти з іншими зв'язувальними партнерами. Тирозинкінази являють собою підвид протеїнкіназ, який каталізує перенесення кінцевого фосфату аденозинтрифосфату (АТФ) на тирозинові залишки на білкових субстратах. Людський геном містить близько 90 тирозинкіназ і 43 тирозинкінази, таких як гени, продукти яких регулюють проліферацію, виживання, диференціацію, функцію і рухливість клітин. Тирозинкінази мають два різновиди, тобто рецепторні і нерецепторні тирозинкінази. Рецепторні тирозинкінази (наприклад, FGFR) являють собою трансмембранні білки з лігандзв'язувальним позаклітинним доменом і каталітичним внутрішньоклітинної кіназним доменом, а нерецепторні тирозинкінази (наприклад, c-ABL) не мають трансмембранних доменів і знаходяться в цитозолі, ядрі і на внутрішній поверхні клітинної мембрани. Кіназні домени всіх тирозинкіназ мають двочасткову архітектуру, з N-кінцевою часткою, що зв'язує АТФ і магній, а C-кінцева частка містить петлю активації і щілину між частками, з яким зв'язуються поліпептидні субстрати. Тирозинкінази рецептора активуються, коли ліганд зв'язується з позаклітинним доменом, що викликає олігомеризацію й аутофосфорилування рецептора регулюючого тирозину в петлі активації кіназного домену. Це явище переорієнтує важливі амінокислотні залишки, тим самим поліпшуючи каталітичну активність ферменту. Фактор росту фібробласта (ФРФ) був визнаний важливим медіатором багатьох фізіологічних процесів, таких як міграція, проліферація, виживання і диференціація клітин під час розвитку й ангіогенезу. В даний час існує більше 25 відомих членів сімейства ФРФ. Сімейство рецепторів фактора росту фібробласта (РФРФ) включає чотири члени, кожний з який складається з позаклітинного домену зв'язування ліганду, одного трансмембранного домену і внутрішньоклітинного домену цитоплазматичної протеїнтирозинкінази. При стимулюванні ФРФ, РФРФ піддаються димеризації і трансфосфорилуванню. При димеризації РФРФ активує ряд спадних сигнальних шляхів, таких як шляхи MAPK і PKB/Akt (Zhou, W. et. al. Chemistry & Biology, 2010, 17, 285). Аномальна подача сигналів РФРФ була описана в багатьох типах пухлин, включаючи множинну мієлому, рак шлунка, ендометрію, простати і молочної залози (Squires M. et. al. Mol. Cancer Ther., September 2011, 10: 1542-1552). ФРФ також відіграють роль в ангіогенезі пухлини і медіюють резистентність до інгібіторів рецептора фактора росту ендотелію судин 2 (VEGFR2) (Casanovas, O. et. al., Cancer Cell, 2005, 8, 299). Отже, ФРФ і РФРФ мають потенціал ініціювати і/або сприяти онкогенезу. Через цього сигнальна система ФРФ виявляється привабливою терапевтичною метою, в основному через те, що терапії, спрямовані на подачу сигналів РФРФ і/або ФРФ, можуть впливати і на клітини пухлини, і на ангіогенез пухлини (Foote, K. M. et. al., WO 2009/019518 A1). Отже, ФРФ і РФРФ мають потенціал до ініціювання і/або сприяння онкогенезу. Суть винаходу Було виявлено, що сполуки формули (I) інгібують або модулюють активність визначених протеїнкіназ, більш конкретно, протеїнтирозинкіназ. зокрема, було виявлено, що сполуки формули (I) є потужними і селективними інгібіторами РФРФ кіназ. Сполуки відповідно до даного винаходу мають антипроліферативну дією й особливо корисні при лікуванні раку. Сполуки відповідно до даного винаходу мають структуру, представлену формулою (I) 1 UA 111382 C2 , де Z є CH або N; G є ціано, -C(O)NR15R16, -C(O)OR17, -C(O)R21, -C(CH3)=NOR22 або групою формули 5 10 15 20 25 30 35 , де A є фенільним кільцем або 5-12-членним гетероциклічним кільцем, і R1 є H, C1-7 алкілом, C3-7 циклоалкілом, C3-7 циклоалкіл C1-7 алкілом, C1-7 алкокси, C1-7 алкілкарбонілом, аміно, гідрокси, гідроксі C1-7 алкілом, C1-7 алкіламіно C1-7 алкілом, феніл C1-7 алкокси, -NHC(O)-R21, -R12-C(O)-R13, -SO2-R14 або -E-R6, і R2 є H, галогеном, C1-7 алкілом або оксо; В є 5-12-членним карбоциклічним або гетероциклічним кільцем; R3 є H, галогеном, C1-7 алкілом, C1-7 алкокси, ціано або необов'язково заміщеним 5-6членним гетероциклічним кільцем; R4 є H, галогеном, C1-7 алкілом або оксо; М є гідроксилом, C1-7 алкілом або -NHR5; R5 є H, -C(O)R7, -SO2R8, -C(O)-D-R9 або необов'язково заміщеним 5-6-членним гетероциклічним кільцем; R6 є необов'язково заміщеним 5-6-членним гетероциклічним кільцем; R7 є C1-7 алкілом, C2-7 алкенілом, C3-7 циклоалкілом, C1-7 алкокси, C1-7 алкоксі C1-7 алкілом, карбоксі C1-7 алкілом, C1-7 алкоксикарбоніл C1-7 алкілом, C1-7 алкіламіно C1-7 алкілом, -NH-R10 або -NH-X1-R11; R8 є C1-7 алкілом, C2-7 алкенілом, C3-7 циклоалкілом, гідроксі C1-7 алкілом, -NR18R19, -NH-X2R20, фенілом або необов'язково заміщеним 5-6-членним гетероциклічним кільцем; R9 є фенілом або необов'язково заміщеним 5-6-членним гетероциклічним кільцем; R10 є C1-7 алкілом або C3-7 циклоалкілом; R11 є фенілом або необов'язково заміщеним 5-6-членним гетероциклічним кільцем; R12 і R21 є C1-7 алкілом; R13 є C1-7 алкокси, аміно або гідрокси; R14 є C1-7 алкілом або C3-7 циклоалкілом; R15, R16, R17, R18 і R19 є, незалежно, H, C1-7 алкілом або C3-7 циклоалкілом; R20 є фенілом або необов'язково заміщеним 5-6-членним гетероциклічним кільцем; R21 є необов'язково заміщеним 5-6-членним гетероциклічним кільцем; R22 є H або C1-7 алкілом; E є зв'язком або C1-7 алкілом; D є зв'язком або C1-7 алкілом; X1 і X2 незалежно є зв'язком або C1-7 алкілом; і їх фармацевтично прийнятна сіль. Один клас переважних сполук включає сполуки формули (I), де кільцем A є одна з наступних груп або їх таутомерів: 2 UA 111382 C2 5 10 15 і R1 і R2, такі, як визначені вище, приєднані до вказаних вище кілець А. Інший клас переважних сполук включає сполуки формули (I), де кільцем В є будь-яка з наступних груп або їх таутомерів: і R3 і R4, такі, як визначені вище, приєднані до вказаних вище кілець B. Інший клас переважних сполук включає сполуки формули (I), де Z є CH. Інший клас переважних сполук включає сполуки формули (I), де Z є N. Підклас вказаних вище переважних класів включає сполуки, де G є групою формули , де A є кільцем формули (1'), (2'), (3'), (4'), (5'), (7'), (10'), (12'), (14'), (16') або (20'); R1 є H, C1-7 алкілом, C1-7 алкокси, гідроксі C1-7 алкілом, C1-7 алкіламіно C1-7 алкілом або -E-R6; R2 є H; В є кільцем формули (1"), (2"), (3"), (4") або (6"); E є зв'язком або C1-7 алкілом; R6 є однією з наступних груп 3 UA 111382 C2 ; 5 R3 є H, галогеном, C1-7 алкілом, C1-7 алкокси; R4 є H або галогеном; М є -NHR5; R5 є -C(O)R7, -SO2R8 або -C(O)-D-R9 або будь-якою з наступних формул ; R7 є C1-7 алкілом, C2-7 алкенілом, -NH-R10 або -NH-X1-R11; R8 є C1-7 алкілом, C2-7 алкенілом, C3-7 циклоалкілом, гідроксі C1-7 алкілом, -NR18R19, -NH-X2R20, фенілом або групою 10 , R9 є фенілом або є однією з наступних груп ; R10 є C1-7 алкілом або C3-7 циклоалкілом; R11 є фенілом, 4-фторфенілом або однією з наступних груп 15 20 ; R18 і R19 незалежно є H, C1-7 алкілом або C3-7 циклоалкілом; R20 є групою ; X1 і X2 незалежно є зв'язком або C1-7 алкілом, і D є зв'язком або C1-7 алкілом. Один клас включає сполуки формули (I), де М є -NHC(O)R7, де R7 є C1-7 алкілом, C2-7 алкенілом, C3-7 циклоалкілом, -NH-R10 або -ΝΗ-X1-R11, де R10 є C1-7 алкілом або C3-7 циклоалкілом, X1 є зв'язком або C1-7 алкілом, і R11 є 5-6-членним гетероциклічним кільцем, необов'язково заміщеним однією або двома C1-7 алкільними групами. 4 UA 111382 C2 5 10 15 20 25 30 35 40 45 50 Інший клас включає сполуки формули (I), де М є -NHSO2R8, де R8 є C1-7 алкілом, C2-7 алкенілом, C3-7 циклоалкілом, фенілом або NR18R19, де R18 і R19 незалежно є H, C1-7 алкілом або C3-7 циклоалкілом. Інший клас включає сполуки формули (I), де М є -NHC(O)-D-R9, де D є зв'язком або C1-7 алкілом, і R9 є 5-6-членним гетероциклічним кільцем, необов'язково заміщеним однією або двома C1-7 алкільними групами. У даному винаході також представлена фармацевтична композиція, що містить сполуку формули (I) або її фармацевтично прийнятну сіль разом з фармацевтично прийнятним носієм. У даному винаході також представлене застосування сполуки формули (I) або її фармацевтично прийнятної солі у виробництві лікарського засобу для лікування стану, при якому бажано інгібування РФРФ кінази. У даному винаході також представлене застосування сполуки формули (I) або її фармацевтично прийнятної солі у виробництві лікарського засобу для лікування раку. У даному винаході представлена сполука формули (I) або її фармацевтично прийнятна сіль для застосування в лікуванні стану, при якому бажане інгібування РФРФ кінази. У даному винаході представлена сполука формули (I) або її фармацевтично прийнятна сіль для застосування в лікуванні раку. У даному винаході також представлений спосіб лікування стану, при якому бажане інгібування РФРФ кінази, що включає введення пацієнту, який потребує її, терапевтично ефективної кількості сполуки формули (I). У даному винаході також представлений спосіб лікування раку, що включає введення пацієнту, який потребує її, терапевтично ефективної кількості сполуки формули (I). Детальний опис винаходу Сполуки відповідно до даного винаходу можуть бути отримані множиною методів синтезу аналогічно методам, відомим у літературі, із застосуванням придатних вихідних матеріалів. Сполуки формули (I) можуть бути отримані, наприклад, аналогічно або відповідно до наступних схем реакцій. Деякі сполуки, включені у формулу (I), можуть бути отримані перетворенням функціональних груп інших сполук формули (I), отриманих відповідно до наступних схем, із застосуванням добре відомих реакцій, таких як окислювання, відновлення, гідроліз, ацилування, алкілування, амідування, сульфонування й інші. Необхідно відзначити, що будь-які придатні відхідні групи, наприклад N-захисні групи, такі трет-бутоксикарбонільна (t-BOC) група або фенілсульфонільна група, можуть застосовуватися відомим чином під час синтезу для поліпшення селективності стадій реакції. Сполуки формули (I), де G є необов'язково заміщеним кільцем A і R 5 є -C(O)CH3, можуть бути отримані, наприклад, відповідно до схеми 1, де R 1, R2, R3, R4, кільце A, кільце B і Z такі, як визначені вище, і R є воднем або алкілом. У способі зі схеми 1, N-(3-бром-5нітрофеніл)ацетамід [1] сполучають із придатним розчинником, таким як 1,2-диметоксіетан, з похідним боронової кислоти [2] або її придатним складним ефіром у присутності Pd(dppf)Cl 2 і водним карбонатом натрію при підвищеній температурі. Нітрогрупу отриманої сполуки [3] відновлюють, наприклад, воднем і Pd/C каталізатором, порошком заліза і водним хлоридом кальцію або цинку і водним хлоридом амонію, і отриманий амін [4] піддають взаємодії зі сполукою [5] у придатному розчиннику, такому як ДМФ, у присутності фториду калію при підвищеній температурі з одержанням сполуки [6]. Якщо Z є CH у сполуці [5], X" придатним чином є фтором, і якщо Z є N, X" придатним чином є хлором. Нітрогрупу в сполуці [6] відновлюють, наприклад, із застосуванням цинку і водного хлориду амонію або порошку заліза і водного хлориду кальцію, і отриманий амін [7] нагрівають з мурашиною кислотою з одержанням сполуки [8] у реакції замикання кільця. Нарешті, сполуку [10] одержують сполученням Сузукі сполуки [8] і похідного боронової кислоти [9] або її придатного складного ефіру в придатному розчиннику, такому як 1,2-диметоксіетан, у присутності Pd(dppf)Cl2 і водного карбонату натрію при підвищеній температурі. 5 UA 111382 C2 Схема 1 5 Альтернативно, сполука формули [3] може бути отримана відповідно до схеми 2, де R 3, R4, кільце B і R такі, як визначені вище, із застосуванням похідного боронової кислоти [11] або її придатного складного ефіру в присутності Pd(dppf)Cl2 і водного карбонату натрію. Сполука [11] може бути отримана, наприклад, обробкою N-(3-бром-5-нітрофеніл)ацетаміду з біс(пінаколато)диборону в присутності Pd(dppf)Cl2 і ацетату калію. 10 6 UA 111382 C2 Схема 2 5 Якщо кільце B у сполуці [3] є гетероциклом, зв'язаним з фенілом через гетероатом азоту, сполука [3] також може бути отримана з застосуванням каталізованого міддю амінування Бухвальда в присутності основи, такої як карбонат цезію або карбонат калію, відповідно до схеми 3, де R3 і R4 такі, як визначені вище. Схема 3 10 15 Якщо кільце B у сполуці [3] є пірольним кільцем, зв'язаним з фенілом через атом азоту, сполука [3] також може бути отримана з 3,5-динітроаніліну [15] і 2,5-диметокситетрагідрофуран відповідно до схеми 4. Отримане похідне піролу [16] відновлюють із застосуванням сульфіду амонію з одержанням сполуки [17], яку потім піддають взаємодії з оцтовим ангідридом з одержанням сполуки [18]. Схема 4 20 25 Якщо кільцем A у сполуці [10] є оксазол-5-ільне кільце, сполука [10] також може бути отримана відповідно до схеми 5, де кільце B, R3 і R такі, як визначені вище. У цьому способі сполуку [4] обробляють 4-фтор-3-нітробензальдегідом і отриману сполуку [20] потім піддають взаємодії з ізоціанідом толуолсульфонілметилу з одержанням сполуки оксазол-5-ілу [21] у реакції замикання кільця. Нітрогрупа сполуки [21] може бути далі відновлена, наприклад, гідруванням, з одержанням відповідного аміну, який потім обробляють мурашиною кислотою відповідно до схеми 1 з одержанням кінцевого продукту в реакції замикання кільця. 7 UA 111382 C2 Схема 5 5 Якщо кільце A у сполуці [10] є гетероциклом, зв'язаним з атомом вуглецю біциклічного кільця через гетероатом азоту, сполука [10] також може бути отримана з застосуванням сполучення Бухвальда відповідно до схеми 6, де X', кільце B, R 1, R2, R3 і R4 такі, як визначені вище. Схема 6 10 15 Якщо кільце A у сполуці [10] є 1Н-1,2,3-триазол-4-ільним кільцем і R2 є воднем, сполука [10] також може бути отримана відповідно до схеми 7, де X', Z, R1, R3, R4 і кільце B такі, як визначені вище. Вихідну сполуку [8] силілують взаємодією з етинілтриметилсиланом у присутності тетракіс(трифенілфосфін)паладію(0) (Pd(PPh3)4) і йодиду Cu(I) з одержанням сполуки [32]. Обробка TBAF дає етинільну сполуку [33], яка може бути підданою реакції зі сполукою азидо R1-N3 у придатному розчиннику, такому як ДМСО:ТГФ:вода (1:1:1) або ДМСО:ДХМ:вода (1:1:1) з одержанням сполуки [34]. 20 8 UA 111382 C2 Схема 7 5 10 Якщо кільце A у сполуці [10] є 1-метил-1Н-піразол-3-ільним кільцем, сполука [10] також може бути отримана відповідно до схеми 8, де R3, R4 і кільце B такі, як визначені вище. У цьому способі сполуку [4] обробляють 1-(4-фтор-3-нітрофеніл)етаноном, і отриману сполуку [36] потім піддають взаємодії з ДМФ диметилацеталем з одержанням сполуки оксазол-5-ілу [37]. Подальша обробка гідразином метилу дає сполуку [38] у реакції замикання кільця. Нітрогрупа сполуки [38] потім може бути відновлена, наприклад, водним амонієм і цинком, з одержанням відповідного аміну, який потім може бути оброблений мурашиною кислотою відповідно до схеми 1 з одержанням кінцевого продукту в реакції замикання кільця. Схема 8 15 9 UA 111382 C2 5 Якщо кільце A у сполуці [10] є 1Н-імідазол-2-ільним кільцем, сполука [10] також може бути отримана відповідно до схеми 9, де R3, R4 і кільце B такі, як визначені вище. У цьому способі сполуку [20] зі схеми 5 обробляють етилендіаміном і N-бромсукцинімідом з одержанням сполуки [39] у реакції замикання кільця. Нітрогрупа сполуки [39] далі може бути відновлена, наприклад, водним аміаком і цинком, з одержанням відповідного аміну, який потім може бути оброблений мурашиною кислотою відповідно до схеми 1 з одержанням кінцевого продукту в реакції замикання кільця. Схема 9 10 15 20 25 Різні сполуки формули (I), де R5 відмінний від -C(O)CH3, можуть бути отримані, наприклад, відповідно до схеми 10, де R1, R2, R3, R4, R7, R8, R9, Z, D, кільце A і кільце B такі, як визначені вище. Сполука ацетаміду [10] може бути перетворена у відповідний амін [24], наприклад, нагріванням у етанолі в присутності основи, такої як водний гідроксид натрію або гідроксид калію, або кислоти, такої як водна HCl. Отриманий амін [24] може застосовуватися як вихідний матеріал на наступних стадіях реакції. Сполуки формули (I), де R 5 є -SO2R8, можуть бути отримані, наприклад, обробкою аміну [24] Cl-SO2R8 у придатному розчиннику, такому як ДХМ, у присутності піридину. Сполуки формули (I), де R5 є -C(O)R7 і R7 є C1-7 алкілом або C1-7 алкіламіно C1-7 алкілом, може бути отримано, наприклад, взаємодією аміну [24] з HOOC-R7 у придатному розчиннику, такому як ДМФ, у присутності метанамінію гексафторфосфату 2-(1Н-7аза-бензотриазол-1-іл)-1,1,3,3-тетраметилуронію (ГАТУ) і ДІПЕА. Сполуки формули (I), де R 5 є C(O)-D-R9, можуть бути отримані, наприклад, взаємодією аміну [24] з HOOC-D-R9 у придатному розчиннику, такому як ДМФ, у присутності EDC, HOBt і ДІПЕА. Сполуки формули (I), де R 5 є C(O)-D-R9, D є зв'язком і R9 є гетероциклічним кільцем, зв'язаним з атомом вуглецю карбонілу через гетероатом азоту, можуть бути отримані взаємодією аміну [24] з фосгеном і потім зі сполукою [29], як показано на схемі 10. 10 UA 111382 C2 Схема 10 5 10 Сполуки формули (I), де R7 є -NH-R10 або -NH-X-R11, можуть бути отримані, наприклад, відповідно до схеми 11 взаємодією аміну [24] у придатному розчиннику, такому як н-бутанол з похідними ізоціанато O=C=N-R10 або O=C=N-X-R11 у присутності придатної основи, такої як триетиламін (ТЕА). Альтернативно, сполуки, де R7 є -NH-X-R11, можуть бути отримані обробкою аміну [24] у придатному розчиннику, такому як ДХМ, фосгеном і потім H 2N-X-R11, див. схему 11. 11 UA 111382 C2 Схема 11 5 10 15 Сполуки, де G не є необов'язково заміщеним кільцем A, можуть бути отримані аналогічно, із застосуванням методів зі схеми 1, де X' заміщений G. Сполуки формули (I), де G є -C(O)NH2, також можуть бути отримані нагріванням сполуки [8], де X' є ціано, у водному гідроксиді калію. Сполуки, де М є гідроксигрупою, можуть бути придатним чином отримані зі сполуки формули [42], потім замиканням біциклічного кільця як на схемі 1, і додаванням B-кільця в, наприклад, сполученні Сузукі як на схемі 1. Алкоксигрупа отриманої сполуки може бути перетворена в гідроксигрупу, наприклад, нагріванням сполуки алкокси в присутності пари реагентів тіосечовина/AlCl3. . Нарешті, сполуки, де R5 є необов'язково заміщеним 5-6-членним гетероциклічним кільцем, можуть бути отримані відповідно до схеми 12 або 13, починаючи зі сполуки [40] або [42], де R 3, R4, Z, кільце B і G такі, як визначені вище, із застосуванням паладію (наприклад, Pd 2(dba)3) каталізованим C-N сполученням у присутності металевого хелатуючого ліганду, такого як Ксантфос. 20 12 UA 111382 C2 Схема 12 . Схема 13 5 10 15 20 25 30 35 40 . Фармацевтично прийнятні солі, наприклад, кислотно-адитивні солі як з органічними, так і неорганічними кислотами, добре відомі в галузі фармацевтики. Необмежені приклади цих солей включають хлориди, броміди, сульфати, нітрати, фосфати, сульфонати, форміати, тартрати, малеати, цитрати, бензоати, саліцилати й аскорбати. Фармацевтично прийнятні складні ефіри, якщо застосовуються, можуть бути отримані відомими методами з застосуванням фармацевтично прийнятних кислот, які є звичайними в галузі фармацевтичних засобів і які зберігають фармакологічні властивості вільної форми. Необмежувальні приклади таких складних ефірів включають складні ефіри аліфатичних або ароматичних спиртів, наприклад, складні ефіри метилу, етилу, пропілу, ізопропілу, бутилу, ізобутилу, втор-бутилу, трет-бутилу. Складні ефіри фосфату і складні ефіри карбонату також включені в обсяг даного винаходу. Застосовувані тут терміни мають наступні значення. Термін "гало" або "галоген", застосовуваний тут окремо або як частина іншої групи, стосується хлору, брому, фтору і йоду. Фтор є переважним галогеном. Термін "C1-7 алкіл", застосовуваний тут окремо або як частина іншої групи, стосується прямої або розгалуженої насиченої вуглеводневої групи, що має 1, 2, 3, 4, 5, 6 або 7 атомів вуглецю. Типові приклади C1-7 алкілу включають, але не обмежені ними, метил, етил, н-пропіл, ізопропіл, н-бутил, ізобутил, втор-бутил, трет-бутил, н-пентил, ізопентил і н-гексил. Одним із переважних елементів "C1-7 алкілу" є C1-3 алкіл. Термін "C1-3 алкіл" стосується переважного варіанта "C1-7 алкілу", що має 1, 2 або 3 атоми вуглецю. Термін "C3-7 циклоалкіл", застосовуваний тут окремо або як частина іншої групи, стосується насиченої циклічної вуглеводневої групи, що містить 3, 4, 5, 6 або 7 атомів вуглецю. Типові приклади циклоалкілу включають, але не обмежені ними, циклопропіл, циклобутил, циклопентил і циклогексил. Термін "C3-7 циклоалкіл C1-7 алкіл", застосовуваний тут, стосується C3-7 циклоалкільної групи, такої як визначена тут, приєднаної до основної молекулярної групи через C1-7 алкільну групу, таку як визначена тут. Термін "C2-7 алкеніл", застосовуваний тут окремо або як частина іншої групи, стосується аліфатичної вуглеводневої групи, що має від 2 до 7 атомів вуглецю, і містить один або декілька подвійних зв'язків. Типові приклади включають, але не обмежені ними, етеніл, пропеніл і циклогексеніл. Термін "гідрокси", застосовуваний тут окремо або як частина іншої групи, стосується -OH групи. Термін "ціано", застосовуваний тут окремо або як частина іншої групи, стосується -CN групи. Термін "аміно", застосовуваний тут окремо або як частина іншої групи, стосується -NH2 групі. Термін "карбокси", застосовуваний тут окремо або як частина іншої групи, стосується COOH групи. Термін "карбоніл", застосовуваний тут окремо або як частина іншої групи, стосується атома вуглецю, з'єднаному подвійним зв'язком з атомом кисню (C=O). Термін "оксо", застосовуваний тут окремо або як частина іншої групи, стосується атома кисню, зв'язаному з іншим атомом подвійним зв'язком (=O). 13 UA 111382 C2 5 10 15 20 25 30 35 40 45 50 55 Термін "C1-7 алкокси", застосовуваний тут окремо або як частина іншої групи, стосується C 1-7 алкілу, такого, як визначений тут, приєднаного до основної молекулярної групи через атом кисню. Типові приклади C1-7 алкокси включають, але не обмежені ними, метокси, етокси, пропокси, бутокси, ізобутокси, втор-бутокси і трет-бутокси. Термін "гідроксил C1-7 алкіл", застосовуваний тут, стосується принаймні однієї гідроксигрупи, такої, як визначена тут, приєднаної до основної молекули через C 1-7 алкільну групу, таку, як визначена тут. Типові приклади гідроксил C1-7 алкілу включають, але не обмежені ними, гідроксиметил, 2,2-дигідроксіетил, 1-гідроксіетил, 3-гідроксипропіл, 1-гідроксипропіл, 1-метил-1гідроксіетил і 1-метил-1-гідроксипропіл. Термін "галоген C1-7 алкіл", застосовуваний тут, стосується принаймні одного галогену, такому, як визначений тут, приєднаному до основної молекули через C 1-7 алкільну групу, таку, як визначена тут. Типові приклади галоген C1-7 алкілу включають, але не обмежені ними, фторметил, дифторметил, трифторметил, 2-хлоретил і 3-бромпропіл. Термін "ціано C1-7 алкіл", застосовуваний тут, стосується ціаногрупи, такої, як визначена тут, приєднаної до основної молекули через C1-7 алкільну групу, таку, як визначена тут. Типові приклади ціано C1-7 алкілу включають, але не обмежені ними, ціанометил, 1-ціаноетил, 1ціанопропіл і 2-ціанопропіл. Термін "карбоксі C1-7 алкіл", застосовуваний тут окремо або як частина іншої групи, стосується карбоксигрупи, такої, як визначена тут, приєднаної до основної молекули через C1-7 алкільну групу, таку, як визначена тут. Термін "галоген C1-7 алкокси", застосовуваний тут, стосується принаймні одного галогену, такого, як визначений тут, приєднаного до основної молекули через C 1-7 алкоксигрупу, таку, як визначена тут. Термін "феніл C1-7 алкокси", застосовуваний тут, стосується принаймні однієї фенільної групи, приєднаної до основної молекули через C1-7 алкоксигрупу, таку, як визначена тут. Термін "C1-7 алкілкарбоніл", застосовуваний тут окремо або як частина іншої групи, стосується C1-7 алкільної групи, такої, як визначена тут, приєднаної до основної молекули через карбонільну групу, таку, як визначена тут. Термін "C1-7 алкоксикарбоніл", застосовуваний тут окремо або як частина іншої групи, стосується C1-7 алкоксигрупи, такої, як визначена тут, приєднаної до основної молекули через карбонільну групу, таку, як визначена тут. Термін "C1-7 алкоксикарбоніл C1-7 алкіл", застосовуваний тут окремо або як частина іншої групи, стосується C1-7 алкоксикарбонільної групи, такої, як визначена тут, приєднаної до основної молекули через C1-7 алкільну групу, таку, як визначена тут. Термін "амінокарбоніл", застосовуваний тут окремо або як частина іншої групи, стосується аміногрупи, такої, як визначена тут, приєднаної до основної молекули через карбонільну групу, таку, як визначена тут. Термін "аміно C1-7 алкіл", застосовуваний тут, стосується принаймні однієї аміногрупи, такої, як визначена тут, приєднаної до основної молекули через C 1-7 алкільну групу, таку, як визначена тут. Типові приклади аміно C1-7 алкілу включають, але не обмежені ними, амінометил, 2аміноетил, 1-аміноетил, 2,2-діаміноетил, 3-амінопропіл, 2-амінопропіл, 4-амінобутил і 1-метил-1аміноетил. Термін "C1-7 алкіламіно", застосовуваний тут окремо або як частина іншої групи, стосується принаймні однієї C1-7 алкільної групи, такої, як визначена тут, приєднаної до основної молекули через аміногрупу, таку, як визначена тут. Типові приклади C1-7 алкіламіно включають, але не обмежені ними, метиламіно, етиламіно, пропіламіно, бутиламіно, диметиламіно, діетиламіно і N-етил-N-метиламіно. Термін "C1-7 алкіламіно C1-7 алкіл", застосовуваний тут окремо або як частина іншої групи, стосується принаймні однієї C1-7 алкіламіногрупи, такої, як визначена тут, приєднаної до основної молекули через C1-7 алкільну групу, таку, як визначена тут. Термін "карбоксі C1-7 алкіламіно", застосовуваний тут окремо або як частина іншої групи, стосується принаймні однієї карбоксигрупи, такої, як визначена тут, приєднаної до основної молекули через C1-7 алкіламіногрупу, таку, як визначена тут. Термін "C1-7 алкоксі C1-7 алкіл", застосовуваний тут, стосується принаймні однієї C 1-7 алкоксигрупи, такої, як визначена тут, приєднаної до основної молекули через C 1-7 алкільну групу, таку, як визначена тут. Термін "C1-7 алкоксикарбоніл C1-7 алкіл", застосовуваний тут, стосується принаймні однієї C1-7 алкоксикарбонільної групи, такої, як визначена тут, приєднаної до основної молекули через C1-7 алкільну групу, таку, як визначена тут. 14 UA 111382 C2 5 10 15 20 25 30 35 40 45 50 55 60 Термін "заміщений" у даному описі, у сполученні з різними залишками, стосується галогенових замісників, таких як фтор, хлор, бром, йод або C 1-7 алкіл, C3-7 циклоалкіл, галоген C1-7 алкіл, гідрокси, аміно, C1-7 алкокси, C1-7 ацил, C1-7 алкіламіно, аміно C1-7 алкіл, нітро, ціано, тіол або метилсульфоніл. Переважними є галоген, C1-7 алкіл, галоген C1-7 алкіл, гідрокси, аміно, C1-7 алкокси і метилсульфоніл. Одна група переважних замісників включає один або два C 1-7 алкільні замісники, особливо один або два C1-3 алкільні замісники, зокрема, які вибрані з метилу і етилу. "Заміщені" групи можуть містити від 1 до 3, переважно, 1 або 2, із зазначених вище замісників. Термін "5-6-членне гетероциклічне кільце", застосовуваний тут, стосується насиченого, частково насиченого або ароматичного кільця з 5 або 6 атомами в кільці, з яких 1-4 атома є гетероатомами, вибраними з групи, що включає N, O і S. Типові приклади 5-6-членного гетероциклічного кільця включають, але не обмежені ними, піразолільне, 1,2,4-триазол-1-ільне, 1,2,3-триазол-1-ільне, піримідинільне, піридинільне, тетразолільне, піперазинільне, фуранільне, морфолінільне, піперидинільне, піролідинільне, тіазолільне, ізоксазолільне, піразинільне, тетрагідропіранільне, 1,2,4-оксадіазолільне, оксазолільне, імідазолільне, індолільне і 4,5дигідроімідазолільне кільця. Термін "5-12-членне гетероциклічне кільце", застосовуваний тут, стосується моноциклічного або біциклічного, насиченого, частково насиченого або ароматичного кільця з 5-12 атомами в кільці, з яких 1-5 атома включають гетероатоми, вибрані з групи, що включає N, O і S. Типові приклади 5-12-членного гетероциклічного кільця включають приклади, дані вище, і, додатково, але не обмежені ними, яндазолільне, піразоло[1,5-a]піримідинільне, бензо[d]імідазолільне, імідазо[4,5-b]піридинільне, 4,5,6,7-тетрагідробензо[d]імідазолільне і бензофуранільне кільця. Термін "5-12-членне карбоциклічне кільце", застосовуваний тут, стосується насиченого, частково насиченого або ароматичного кільця з 5-12 атомами в кільці, що включають тільки атоми вуглецю. Типові приклади 5-12-членного карбоциклічного кільця включають, але не обмежені ними, фенільне, нафтильне і циклогексильне кільця. Визначення формули (I) вище включає всі можливі стереоізомери сполук, включаючи геометричні ізомери, наприклад Z і E ізомери (цис- і транс-ізомери) і оптичні ізомери, наприклад, діастереомери і енантіомери, і всі складні ефіри проліків, наприклад, складні ефіри фосфату і складні ефіри карбонату, і ізотопи. Більше того, даний винахід включає як окремі ізомери, так і будь-якої їхні суміші, наприклад, рацемічні суміші. Окремі ізомери можуть бути отримані з застосуванням відповідних ізомерних форм вихідного матеріалу, або вони можуть бути розділені після одержання кінцевої сполуки звичайними методами поділу. Для відділення оптичних ізомерів, наприклад, енантіомерів, з їхньої суміші можуть застосовуватися звичайні методи розділення, наприклад, фракційна кристалізація. Сполуки відповідно до даного винаходу можуть уводитися пацієнту в терапевтично ефективних кількостях, що варіюються звичайно від близько 0,1 до близько 2000 мг на добу залежно від віку, маси тіла, етнічної групи, стану пацієнта, лікованого стану, способу введення і застосовуваного активного інгредієнта. Сполуки відповідно до даного винаходу можуть бути складені в лікарські форми з застосуванням принципів, відомих у даній галузі техніки. Сполука може вводитися пацієнту як така або в сполученні з придатними фармацевтичними ексципієнтами у формі таблеток, гранул, капсул, супозиторіїв, емульсій, суспензій або розчинів. Вибір придатних інгредієнтів для композиції є рутинною операцією для фахівця в даній галузі техніки. Також застосовують придатні носії, розчинники, гелеутворювальні інгредієнти, диспергуючі інгредієнти, антиоксиданти, барвники, підсолоджувачі, змочувальні сполуки й інші інгредієнти, звичайно застосовувані в даній галузі техніки. Композиції, що містять активну сполуку, можуть уводитися ентерально або парентерально, де переважним є пероральний спосіб. Вміст активної сполуки в композиції становить від близько 0,5 до 100 %, переважно від близько 0,5 до близько 20 % від загальної маси композиції. Сполуки відповідно до даного винаходу можуть бути дані пацієнту у вигляді окремого активного інгредієнта або в сполученні з одним або більше іншими активними інгредієнтами для лікування конкретного захворювання, наприклад, раку. Даний винахід більш докладно викладається в наступних експериментах і прикладах. Експерименти і приклади представлені тільки в ілюстративних цілях і не обмежують обсяг винаходу, визначений у формулі винаходу. Експерименти 1. Інгібування РФРФ1 і інших кіназ Методи Аналіз РФРФ1 15 UA 111382 C2 5 10 15 20 25 30 Сполуки піддають скринінгу в аналізі РПЕФ-ВР із РФРФ1 кіназою. 5 нг РФРФ1 [Upstate, USA] кіназу застосовують для аналізу. Сполуку інкубують з кіназою протягом 30 хвилин при КТ. Після інкубування додають субстратну суміш [40 нМ Ultra light poly GT (Perkin Elmer, USA) і 13 мкМ АТФ (Sigma)]. Вказану вище реакцію зупиняють додаванням 40 мМ ЕДТК через 30 хв. реакції кінази. Eu-мічене антифосфотирозинове антитіло [Perkin Elmer, USA] додають у кількості 0,5 нМ, і вимірюють емісію флуоресценції при 615 нм/665 нм [збудження при 340 нм]. Сполуки початково піддають скринінгу при концентраціях 100 нМ і 1 мкМ. Сполуки з >50 % інкубуванням при 100 нМ РФРФ1 беруть для проведення повного дослідження впливу величини дози на rd ефективність. Кінцева концентрація ДМСО в аналізі складає 1 %. Для визначення IC50, 1/3 серійне розведення одержують з маточного розчину 20 мМ ДМСО. 2 мкл цього розчину переносять у тестові ямки, що містять 20 мкл реакційної суміші [загальний об'єм реакції 20 мкм]. Флуоресценцію вимірюють на Perkin Elmer Wallac 1420 Multilabel Counter Victor 3. IC 50 визначають підстановкою даних реакції на дозу в рівняння підбору сигмоїдальної кривої з застосуванням програмного забезпечення GraphPad Prism V5. Аналіз c-Met Сполуки піддають скринінгу в аналізі РПЕФ-ВР із c-Met кіназою. Для аналізу застосовують 0,1 нг c-Met кіназу [отриману в лабораторії]. Сполуку інкубують з кіназою протягом 60 хв. при КТ. Після інкубування додають субстратну суміш [40 нМ Ultra light poly GT (Perkin Elmer, USA) і 10 мкМ АТФ (Sigma)]. Вказану вище реакцію зупиняють додаванням 40 мМ ЕДТК через 30 хв. реакції кінази. Eu-мічене антифосфотирозинове антитіло [Perkin Elmer, USA] додають у кількості 0,5 нМ, і вимірюють емісію флуоресценції при 615 нм/665 нм [збудження при 340 нм]. Сполуки початково піддають скринінгу при концентраціях 100 нМ і 1 мкМ. Сполуки з >50 % інкубуванням при 100 нМ РФРФ1 беруть для проведення повного дослідження впливу величини дози на rd ефективність. Кінцева концентрація ДМСО в аналізі складає 1 %. Для визначення IC50, 1/3 серійне розведення одержують з маточного розчину 20 мМ ДМСО. 2 мкл цього розчину переносять у тестові ямки, що містять 20 мкл реакційної суміші [загальний об'єм реакції 20 мкм]. Флуоресценцію вимірюють на Perkin Elmer Wallac 1420 Multilabel Counter Victor 3. IC 50 визначають підстановкою даних реакції на дозу в рівняння підбору сигмоїдальної кривої з застосуванням програмного забезпечення GraphPad Prism V5. Результати Ферментна активність і селективність вибраних сполук відповідно до даного винаходу для різних кіназ представлені в таблиці 1. Сполуки відповідно до даного винаходу є потужними і селективними інгібіторами РФРФ кінази. Таблиця 1 Інгібування РФРФ1 і c-Met кінази Сполука Приклад 5 Приклад 22 Приклад 25 Приклад 26 Приклад 30 Приклад 38 Приклад 47 Приклад 49 Приклад 69 Приклад 70 Приклад 72 Приклад 82 Приклад 83 Приклад 112 Приклад 119 Приклад 123 Приклад 127 Приклад 131 Приклад 133 Інгібування (%) РФРФ1 IC50 інгібування РФРФ1 при 1000 нМ (нМ) 95 12 99 3,8 93 34 93 21 94 16 88 33 99 7 98 3,4 87 22 99 10 98 32 96 16 95 37 97 1,8 94 83 94 61 91 62 99 1,3 97 14 35 16 Інгібування (%) c-Met при 1000 нМ 7 5 12 2 1 0 10 9 -2 0 11 15 5 0 23 0 10 15 0 UA 111382 C2 Продовження таблиці 1 Сполука Приклад 134 Приклад 142 Приклад 152 Приклад 155 Приклад 158 Приклад 169 Приклад 170 Приклад 178 Приклад 190 Приклад 204 Приклад 217 Приклад 241 Приклад 244 Приклад 280 Приклад 281 Приклад 220 Приклад 289 Приклад 294 Приклад 319 Приклад 322 Приклад 259 Інгібування (%) РФРФ1 IC50 інгібування РФРФ1 при 1000 нМ (нМ) 92 98 91 48 79 7,3 89 62 95 22 89 94 92 59 86 14,9 96 4,3 98 20 91 10,4 97 2,9 98 14 80 90 96 9 97 3,4 94 32 99 9,3 97 18 92 65,8 92 45 Інгібування (%) c-Met при 1000 нМ 0 0 0 1 12 н.в. н.в. н.в. н.в. н.в. н.в. н.в. н.в. н.в. н.в. н.в. н.в. н.в. н.в. н.в. н.в. н.в. = не визначено 5 10 15 20 25 30 Одержання сполук відповідно до даного винаходу проілюстровано в наступних прикладах. Приклади РХМС дані записують на +позитивному методі, якщо не вказано інакше. Проміжний приклад 1 N, N-диметил-2-(4-(4,4,5,5-тетраметил-1,3,2-діоксаборолан-2-іл)-1Н-піразол-1-іл)етанамін a) 2-(4-бром-1H-піразол-1-іл)-N, N-диметилетанамін До розчину 4-бром-1Н-піразолу (5 г, 34 ммоль) у ДМФ додають K2CO3 (11,75 г, 85,03 ммоль, 2,5 екв.) і 2-хлор-N, N-диметилетанамін HCl (7,35 г, 51 ммоль, 1,5 екв.), і суміш перемішують при КТ протягом 12 год. Суміш гасять водою й екстрагують ДХМ (3150 мл). Об'єднаний органічний шар промивають водою, насиченим розчином солі і сушать над сульфатом натрію. Розчинник відганяють з одержанням неочищеного залишку, який очищають хроматографією на колонці 1 (60-120 силікагель, 1 % метанол у ДХМ) з одержанням продукту з 86 % виходом (6,4 г). H ЯМР (300 МГц, ДМСО-d6): δ 7,95 (с, 1H), 7,25 (с, 1H), 4,18 (т, 2H), 2,61 (т, 2H), 2,15 (с, 6H); РХ-МС + (ІЕР): розрахована маса: 218,09; знайдена маса: 219,8 [M+H] (час утрим.: 0,439 хв.). b) N, N-диметил-2-(4-(4,4,5,5-тетраметил-1,3,2-діоксаборолан-2-іл)-1Н-піразол-1-іл)етанамін У дегазований (барботування N2) розчин сполуки з проміжного приклада 1(a) (10 г, 45,85 ммоль) у 1,4-діоксані (50 мл) додають 4,4,4',4',5,5,5',5'-октаметил-2,2’-бі(1,3,2-діоксаборолан) (17,47 г, 68,78 ммоль, 1,5 екв.), Pd(dppf)Cl2 (1,87 г, 2,29 ммоль, 0,05 екв.) і ацетат калію (11,23 г, 114,6 ммоль, 2,5 екв.). Суміш нагрівають при 100C у герметично закритій колбі протягом 12 год. Суміш розводять етилацетатом і фільтрують над шаром целіту. Розчинник відганяють з одержанням продукту (7,0 г). РХ-МС (ІЕР): розрахована маса: 265,16; знайдена маса: 266,2 + [M+H] (час утрим.: 0,09 хв.). Проміжний приклад 2 4-(2-(4-(4,4,5,5-тетраметил-1,3,2-діоксаборолан-2-іл)-1H-піразол-1-іл)етил)морфолін Сполуку синтезують із застосуванням методики, описаної в прикладі 1. РХ-МС (ІЕР): + розрахована маса: 307,2; знайдена маса: 308,1 [M+H] (час утрим.: 0,11 хв.). Проміжний приклад 3 1-фтор-4-йод-2-нітробензол До розчину 1-фтору-2-нітробензолу (5 г, 35,43 ммоль) у трифторметансульфокислоті (15,6 мл, 177,15 ммоль, 5 екв.) при 0 °C додають N-йодсукцинімід (9,57 г, 42,5 ммоль, 1,2 екв.) 17 UA 111382 C2 5 10 15 20 25 30 35 40 45 50 55 порціями, і суміш перемішують при КТ протягом 1 год. Суміш гасять додаванням води й екстрагують діетиловим ефіром (3150 мл). Об'єднаний органічний шар промивають водою, водним тіосульфатом натрію, насиченим розчином солі і сушать над сульфатом натрію. Розчинник відганяють, і неочищений залишок очищають хроматографією на колонці (60-120 1 силікагель, 5 % етилацетат у гексані) з одержанням сполуки з 66 % виходом (6,2 г). H ЯМР (300 МГц, ДМСО-d6): δ 8,42 (дд, 1H), 8,18-8,13 (м, 1H), 7,46-7,39 (м, 1H). Проміжний приклад 4 4-фтор-3-нітробензальдегід Нітруючу суміш (сірчана кислота 40 мл + азотна кислота 5,5 мл) додають по краплях до 4фторбензальдегіду (10 г, 80,57 ммоль) при 0C, і суміш перемішують при 5C протягом 20 хв. і при КТ протягом 1 год. Суміш гасять додаванням подрібненого льоду. Осад, що випав, фільтрують і промивають декілька разів водою з одержанням твердої речовини білого кольору. 1 Тверду речовину сушать у вакуумі з одержанням продукту з 77 % виходом (10,5 г). H ЯМР (300 МГц, CDCl3): δ 10,04 (с, 1H), 8,58 (дд, 1Н), 8,22-8,18 (м, 1H), 7,5 (т, 1H). Проміжний приклад 5 трет-бутил 4-(4-(4,4,5,5-тетраметил-1,3,2-діоксаборолан-2-іл)-1Н-піразол-1-іл)піперидин-1карбоксилат a) трет-бутил 4-гідроксипіперидин-1-карбоксилат До розчину піперидин-4-олу (3,5 г, 34,6 ммоль) у CH2Cl2 (50 мл) при 0C додають Boc2O (11,3 г, 51,9 ммоль, 1,5 екв.) і Et3N (7,2 мл, 51,9 ммоль, 1,5 екв.). Суміш перемішують при КТ протягом 1 год. і гасять і екстрагують як у проміжному прикладі 1(a). Розчинник відганяють з одержанням неочищеного продукту (7,0 г). b) трет-бутил 4-(метилсульфонілокси)піперидин-1-карбоксилат Сполуку з проміжного приклада 5(a) (7 г, 34,7 ммоль) розчиняють у CH 2Cl2 (70 мл) при 0C і додають Et3N (10 мл, 69,4 ммоль, 2 екв.) і хлорид метансульфонілу (2,7 мл, 34,7 ммоль, 1 екв.). Суміш перемішують при КТ протягом 3 год. і гасять і екстрагують як у попередньому прикладі. Розчинник відганяють з одержанням неочищеного продукту (6,7 г). c) трет-бутил 4-(4-бром-1H-піразол-1-іл)піперидин-1-карбоксилат До охолодженого розчину сполуки з проміжного приклада 5(b) (6,7 г, 23,9 ммоль) у ДМФ (50 мл) додають NaH (2,8 г, 119 ммоль, 5 екв.) і 4-бром-1Н-піразол (2,8 г, 19,1 ммоль, 0,8 екв.) і перемішують при 80 °C протягом 12 год. Суміш гасять і екстрагують етилацетатом (3×100 мл). Об'єднаний органічний шар промивають водою, насиченим розчином солі і сушать над сульфатом натрію. Розчинник відганяють з одержанням неочищеного продукту (8,0 г). d) трет-бутил 4-(4-(4,4,5,5-тетраметил-1,3,2-діоксаборолан-2-іл)-1Н-піразол-1-іл)піперидин-1карбоксилат До (N2 барботованого) розчину сполуки з проміжного приклада 5(с) (8 г, 24,2 ммоль) у 1,4діоксані (100 мл) додають 4,4,4',4',5,5,5',5'-октаметил-2,2'-бі-(1,3,2-діоксаборолан) (7,36 г, 29 ммоль, 1,2 екв.), Pd(dppf)Cl2 (2 г, 2,42 ммоль, 0,1 екв.) і ацетат калію (8 г, 82,4 ммоль, 3,4 екв.) за методикою з проміжного приклада 1(b). Розчинник відганяють і залишок очищають хроматографією на колонці (60-120 силікагель, 10 % етилацетат у гексані) з одержанням продукту з 59 % виходом (5,4 г). РХ-МС (ІЕР): розрахована маса: 377,29; знайдена маса: 378,3 + [(м+H] (час утрим.: 1,83 хв.). Проміжний приклад 6 4-азидо-2-метилбутан-2-ол a) 4-бром-2-метилбутан-2-ол До охолодженого розчину етил 3-бромпропаноату (0,5 г, 2,8 ммоль) у діетиловому ефірі (50 мл) при 0 °C додають бромід метилмагнію (0,98 г, 8,3 ммоль, 3 екв.) по краплях протягом 5 хв., і суміш перемішують доти, поки ТШХ не покаже відсутності вихідного матеріалу. Суміш гасять і екстрагують як у проміжному прикладі 5(с). Розчинник відганяють з одержанням неочищеного продукту (0,4 г). b) 4-азидо-2-метилбутан-2-ол До суміші 4-бром-2-метилбутан-2-олу (0,4 г, 2,4 ммоль) і триетиламіну (1 мл, 7 ммоль, 3 екв.) у CH2Cl2 (15 мл) додають азид натрію (0,47 г, 7 ммоль, 3 екв.) у H 2O (5 мл), і суміш перемішують протягом ночі. Суміш гасять водою й екстрагують CH 2Cl2 (350 мл). Об'єднаний органічний шар промивають водою, насиченим розчином солі і сушать над сульфатом натрію. Розчинник 1 відганяють з одержанням продукту з 65 % виходом (0,2 г). H ЯМР (300 МГц, ДМСО-d6): δ 4,39 (ушир. с, 1H), 3,40-3,32 (м, 2H), 1,15 (т, 2H), 1,23-1,04 (м, 6H). 18 UA 111382 C2 5 10 15 20 25 30 35 40 45 50 55 60 Проміжний приклад 7 Азидоциклопентан До розчину йодциклопентану (0,5 г, 2,55 ммоль) у ДМФ (2 мл) додають водний азид натрію (0,33 г, 5,1 ммоль). Суміш перемішують при КТ протягом 10 хв. і потім перемішують при 80C протягом ночі. Суміш екстрагують діетиловим ефіром (350 мл) і об'єднаний органічний шар промивають водою, насиченим розчином солі і сушать над сульфатом натрію. Розчинник відганяють з одержанням продукту з 64 % виходом (0,18 г), що застосовують відразу на -1 наступній стадії. ІЧПФ (чистий): ν 3448, 2471, 2100, 1671, 1498, 1438, 1383, 1256, 1094, 865 см . Проміжний приклад 8 (Азидометил)циклобутан До розчину (бромметил)циклобутану (0,5 г, 3,35 ммоль) у ДМФ (2 мл) додають водний азид натрію (0,43 г, 6,7 ммоль). Суміш перемішують при КТ протягом 10 хв., потім перемішують при 80C протягом ночі. Суміш екстрагують як у попередньому прикладі. Розчинник відганяють з 1 одержанням продукту з 54 % виходом (0,2 г). Н ЯМР (300 МГц, ДМСО-d6): δ 3,66-3,53 (м, 2H), 2,66-2,21 (м, 1H), 2,06-2,00 (м, 2H), 1,84-1,66 (м, 4H). Проміжний приклад 9 1-(Циклопропілметил)-4-(4,4,5,5-тетраметил-1,3,2-діоксаборолан-2-іл)-1H-піразол a) 4-бром-1-(циклопропілметил)-1H-піразол До розчину 4-бром-1H-піразолу (0,1 г, 0,68 ммоль) у ДМФ (20 мл) додають K2CO3 (0,19 г, 1,36 ммоль, 2 екв.) і (бромметил)циклопропан (92 мг, 0,68 ммоль, 1 екв.). Суміш перемішують при КТ протягом 4 год. Суміш гасять і екстрагують як у проміжному прикладі 5(с). Розчинник відганяють з одержанням неочищеного продукту (0,15 г). b) 1-(Циклопропілметил)-4-(4,4,5,5-тетраметил-1,3,2-діоксаборолан-2-іл)-1H-піразол У дегазований (N2 барботований) розчин сполуки з проміжного приклада 9(a) (0,15 г, 0,75 ммоль) у 1,4-діоксані (10 мл) додають 4,4,4',4',5,5,5',5'-октаметил-2,2'-бі(1,3,2-діоксаборолан) (0,23 г, 0,9 ммоль, 1,2 екв.), Pd(dppf)Cl2 (0,12 г, 0,15 ммоль, 0,2 екв.) і ацетат калію (0,25 г, 2,55 ммоль, 3,4 екв.) за методикою з проміжного приклада 1(b). Розчинник відганяють з одержанням неочищеного залишку, який очищають хроматографією на колонці (60-120 силікагель, 30 % етилацетат у гексані) з одержанням продукту з 81 % виходом (0,15 г). РХ-МС (ІЕР): розрахована + маса: 248,13; знайдена маса: 249,2 [(м+H] (час утрим.: 1,58 хв.). Проміжний приклад 10 2-Морфолінооцтова кислота a) Етил 2-морфоліноацетат До розчину етил 2-хлорацетату (0,5 г, 5,74 ммоль) у ДМФ (70 мл) при 10C додають K2CO3 (1,98 г, 14,34 ммоль, 2,5 екв.) і 1-метилпіперазин (1,05 г, 8,6 ммоль, 1,5 екв.), і суміш перемішують при КТ протягом 2 год. Суміш гасять і екстрагують як у проміжному прикладі 5(с). Розчинник відганяють, і неочищений залишок очищають хроматографією на колонці (60-120 силікагель, 40 % етилацетат у гексані) з одержанням продукту з 74 % виходом (0,74 г). РХ-МС + (ІЕР): розрахована маса: 173,2, знайдена маса: 174,0 [M+H] (час утрим.: 0,20 хв.). b) 2-Морфолінооцтова кислота Розчин етил 2-морфоліноацетату (1,8 г, 11,44 ммоль) у 8н HCl (5 мл) нагрівають при 90C протягом 12 год. Суміш концентрують з одержанням продукту з 64 % виходом (0,9 г). РХ-МС + (ІЕР): розрахована маса: 145,16; знайдена маса: 146,3 [M+H] (час утрим.: 0,21 хв.). Проміжний приклад 11 4-Азидо-1-метилпіперидин a) Метансульфонат 1-метилпіперидин-4-ілу 1-метилпіперидин-4-ол (4 г, 34,7 ммоль) розчиняють у CH2Cl2 (70 мл) при 0C з наступним додаванням Et3N (10 мл, 69,4 ммоль, 2 екв.) і хлориду метансульфонілу (2,7 мл, 34,7 ммоль, 1 екв.). Суміш перемішують при КТ протягом 3 год. і гасять, і екстрагують як у проміжному прикладі 5(a). Розчинник відганяють з одержанням неочищеного продукту (6,7 г). b) 4-азидо-1-метилпіперидин До розчину сполуки з проміжного приклада 11(a) (2,1 г, 10,9 ммоль) у ДМФ (30 мл) додають азид натрію (1 г, 16,32 ммоль, 1,5 екв.) Суміш перемішують при 60C протягом 12 год. Суміш потім гасять водою й екстрагують діетиловим ефіром (3100 мл). Об'єднаний органічний шар промивають водою, насиченим розчином солі і сушать над сульфатом натрію. Розчинник 1 відганяють з одержанням продукту (1,3 г). Н ЯМР (300 МГц, CDCl3): δ 3,49-3,37 (м, 1H), 2,712,67 (м, 2H) 2,24 (с, 3H) 2,18-2,09 (м, 2H) 1,93-1,85 (м, 2H) 1,72-1,60 (м, 2H); РХ-МС (ІЕР): + розрахована маса: 140,1: знайдена маса: 141,1 [M+H] (час утрим.: 0,13 хв.). Проміжний приклад 12 1-ізопропіл-4-(4,4,5,5-тетраметил-1,3,2-діоксаборолан-2-іл)-1Н-піразол 19 UA 111382 C2 5 10 15 20 25 30 35 40 45 50 55 a) 4-бром-1-ізопропіл-1H-піразол До розчину 4-бром-1H-піразол (5 г, 34 ммоль) у ДМФ (70 мл) додають K2CO3 (11,83 г, 85,6 ммоль, 2,5 екв.) і 2-бромпропан (6,3 г, 51,36 ммоль, 1,5 екв.), і суміш перемішують при КТ протягом 12 год. Суміш гасять і екстрагують як у проміжному прикладі 5(a). Розчинник відганяють, і неочищений залишок очищають хроматографією на колонці (60-120 силікагель, 1 20 % етилацетат у гексані) з одержанням продукту з 89 % виходом (5,8 г). H ЯМР (300 МГц, ДМСО-d6): δ 8,01 (с, 1H), 7,50 (с, 1H), 4,49-4,43 (м, 1H), 1,38 (д, 6H). b) 1-ізопропіл-4-(4,4,5,5-тетраметил-1,3,2-діоксаборолан-2-іл)-1Н-піразол У дегазований (N2 барботований) розчин сполуки з проміжного приклада 12(a) 4-бром-1ізопропіл-1Н-піразол (1,5 г, 7,9 ммоль) у 1,4-діоксані (30 мл) додають 4,4,4',4',5,5,5',5'-октаметил2,2'-бі(1,3,2-діоксаборолан) (3 г, 11,84 ммоль, 1,5 екв.), Pd(dppf)Cl2 (0,64 г, 0,79 ммоль, 0,1 екв.) і ацетат калію (1,93 г, 19,74 ммоль, 2,5 екв.) за методикою з проміжного приклада 1(b). Розчинник відганяють з одержанням продукту з 67 % виходом (1,2 г). РХ-МС (ІЕР): розрахована маса: + 236,12; знайдена маса: 237,1 [M+H] (час утрим.: 1,41 хв.). Проміжний приклад 13 1-етил-4-(4,4,5,5-тетраметил-1,3,2-діоксаборолан-2-іл)-1Н-піразол a) 4-бром-1-етил-1H-піразол До розчину 4-бром-1H-піразолу (5 г, 34 ммоль) у ДМФ додають K2CO3 (11,75 г, 85,03 ммоль, 2,5 екв.) і йодетан (8 г, 51 ммоль, 1,5 екв.), і суміш перемішують при КТ протягом 12 год. Суміш гасять і екстрагують як у проміжному прикладі 5(с). Розчинник відганяють, і неочищений залишок очищають хроматографією на колонці (60-120 силікагель, 40 % етилацетат у гексані) з 1 одержанням продукту з 84 % виходом (5 г). H ЯМР (300 МГц, ДМСО-d6): δ 8,02 (с, 1H), 7,55 (с, 1Н), 4,15 (кв, 2H), 1,37 (т, 3H); РХ-МС (ІЕР): розрахована маса: 175,03; знайдена маса: 177,0 + [M+H] (час утрим.: 0,56 хв.). b) 1-етил-4-(4,4,5,5-тетраметил-1,3,2-діоксаборолан-2-іл)-1Н-піразол У дегазований (N2 барботований) розчин 4-бром-1-етил-1H-піразол (2 г, 11,42 ммоль) у 1,4діоксані (30 мл) додають 4,4,4',4',5,5,5',5'-октаметил-2,2'-бі-(1,3,2-діоксаборолан) (4,35 г, 17,14 ммоль, 1,5 екв.), Pd(dppf)Cl2 (0,93 г, 1,14 ммоль, 0,1 екв.) і ацетат калію (2,79 г, 28,55 ммоль, 2,5 екв.) за методикою з проміжного приклада 1(b). Розчинник відганяють з одержанням продукту з + 88 % виходом (2,2 г). РХ-МС (ІЕР): розрахована маса: 222,09; знайдена маса: 223,3 [M+H] (час утрим.: 0,83 хв.). Проміжний приклад 14 2-хлор-5-йод-3-нітропіридин a) 5-йод-3-нітропіридин-2-амін До розчину 3-нітропіридин-2-аміну (1,2 г, 8,63 ммоль) в оцтовій кислоті (5 мл), воді (1 мл) і сірчаній кислоті (0,2 мл) додають перйодну кислоту (0,4 г, 1,72 ммоль, 0,2 екв.), і суміш перемішують при 90 °C протягом 15 хв. Йод (0,87 г, 3,45 ммоль, 0,4 екв.) додають порціями, і суміш нагрівають при 90 °C протягом 1 год. Суміш гасять додаванням води й екстрагують етилацетатом (3150 мл). Об'єднаний органічний шар промивають водою, водним тіосульфатом натрію, насиченим розчином солі і сушать над сульфатом натрію. Розчинник 1 відганяють з одержанням продукту з 57 % виходом (1,3 г). Н ЯМР (300 МГц, ДМСО-d6): δ 8,58 (д, 1H), 8,54 (д, 1H) 8,04 (ушир. с, 2H); РХ-МС (ІЕР); розрахована маса: 265,01: знайдена маса: + 265,9 [M+H] (час утрим.: 1,36 хв.). b) 2-хлор-5-йод-3-нітропіридин До розчину 5-йод-3-нітропіридин-2-аміну (1,3 г, 4,9 ммоль) у концентрованої HCl при 0 °C додають нітрит натрію (6,73 г, 97,13 ммоль, 20 екв.) порціями з наступним додаванням хлориду міді(I) (0,5 г, 4,9 ммоль, 1 екв.), і суміш перемішують при КТ протягом 12 год. Суміш потім виливають у суміш гідроксиду амонію і води (1:1) і екстрагують етилацетатом (3150 мл). Об'єднаний органічний шар промивають водою, водним тіосульфатом натрію, насиченим розчином солі і сушать над сульфатом натрію. Розчинник відганяють з одержанням продукту з 43 % виходом (0,6 г). Проміжний приклад 15 2-(4-етилпіперазин-1-іл)оцтова кислота a) Етил 2-(4-метилпіперазин-1-іл)ацетат До розчину 1-метилпіперазину (1 г, 8,771 ммоль, 1,0 екв.) у ДМФ додають K 2CO3 (265 мг, 21,927 ммоль, 2,5 екв.) і етил 2-бромацетат (167 мг, 13,15 ммоль, 1,5 екв.). Суміш перемішують при КТ протягом 16 год. і гасять і екстрагують як у проміжному прикладі 5(a). Розчинник відганяють з одержанням продукту з 76,4 % виходом (1,3 г). b) 2-(4-етилпіперазин-1-іл)оцтова кислота 20 UA 111382 C2 5 10 15 20 25 30 35 40 45 50 55 60 Розчин метил 2-(4-етилпіперазин-1-іл)ацетату (1,3 г, 6,50 ммоль, 1,0 екв.) у 8н HCl перемішують при 95C протягом 16 год. і концентрують у вакуумному насосі. Суміш гасять розчином бікарбонату натрію й екстрагують етилацетатом (3150 мл). Об'єднаний органічний шар промивають водою, насиченим розчином солі і сушать над сульфатом натрію. Розчинник відганяють з одержанням продукту з 54,5 % виходом (0,6 г). РХ-МС (ІЕР): розрахована маса: + 158,0; знайдена маса: 159,1 [M+H] (час утрим.: 0,102 хв.). Проміжний приклад 16 N-циклопропіл-2-оксооксазолідин-3-сульфонамід До розчину брометанолу (1 г, 8,06 ммоль) у ДХМ додають ізоціанат хлорсульфонілу (1,13 г, 8,06 ммоль) у ДХМ, і цей розчин додають протягом 2 хв., по краплях, до циклопропіламіну (0,552 г, 0,009 ммоль) і триетиламіну (1 мл, 0,007 ммоль) у ДХМ і перемішують при КТ протягом 1 год. Суміш гасять 0,2M розчином HCl і екстрагують ДХМ (3150 мл). Об'єднаний органічний шар промивають водою, насиченим розчином солі і сушать над сульфатом натрію. Розчинник 1 відганяють з одержанням продукту з 48 % виходом (0,8 г). H ЯМР (400 МГц, ДМСО-d6): δ 8,158,14 (д, 1H), 4,42 (т, 2H), 3,70 (т, 2H), 2,35 (м, 1H), 0,58-0,53 (м, 4H). Проміжний приклад 17 N-(1H-піразол-4-іл)ацетамід Оцтовий ангідрид (0,7 мл, 8,433 ммоль) додають по краплях при 0C до 1H-піразол-4-аміну (0,7 г, 8,433 ммоль). Суміш перемішують протягом 30 хв. при КТ і гасять додаванням подрібненого льоду. Суміш екстрагують етилацетатом. Об'єднаний органічний шар промивають водою, насиченим розчином солі і сушать над сульфатом натрію. Розчинник відганяють з одержанням продукту з 54 % виходом (0,6 г). РХ-МС (ІЕР): розрахована маса: 125,0; знайдена + маса: 126,1 [M+H] (час утрим.: 0,115 хв.). Проміжний приклад 18 2-(1H-1,2,4-триазол-1-іл)оцтова кислота a) Етил 2-(1Н-1,2,4-триазол-1-іл)ацетат До розчину 1Н-1,2,4-триазолу (2 г, 29,9 ммоль, 1,0 екв.) у ДМФ додають K2CO3 (12,3 г, 88,9 ммоль, 3 екв.) і етил 2-бромацетат (4,8 г, 29,9 ммоль, 1 екв.). Суміш перемішують при КТ протягом 16 год. Суміш гасять і екстрагують як у проміжному прикладі 5(a). Розчинник відганяють з одержанням продукту з 65 % виходом (3 г). РХ-МС (ІЕР): розрахована маса: 155,0; + знайдена маса: 156,1 [M+H] (час утрим.: 0,113 хв.). b) 2-(1Н-1,2,4-триазол-1-іл)оцтова кислота Розчин сполуки з проміжного приклада 18(a) (3 г, 19,35 ммоль, 1,0 екв.) у 8н HCl перемішують при 95C протягом 16 год. і концентрують у вакуумному насосі. Суміш гасять і екстрагують як у проміжному прикладі 15(b). Розчинник відганяють з одержанням бажаного продукту з 62 % виходом (1,5 г). РХ-МС (ІЕР): розрахована маса: 127,0; знайдена маса: 128,0 + [M+H] (час утрим.: 0,24 хв.). Проміжний приклад 19 a) Етил 2-(піролідин-1-іл)ацетат До розчину піролідина (1,2 г, 16,3 ммоль, 1,0 екв.) у ДМФ додають K 2CO3 (5,63 г, 40,7 ммоль, 2,5 екв.) і етил 2-бромацетат (1,73 г, 24,4 ммоль, 1,5 екв.). Суміш перемішують при КТ протягом 16 год. і гасять і екстрагують як у проміжному приклад 5(a). Розчинник відганяють з одержанням продукту з 80 % виходом (2 г). РХ-МС (ІЕР): розрахована маса: 157,2; знайдена маса 158,1 + [M+H] (час утрим.: 0,2 хв.). b) 2-(Піролідин-1-іл)оцтова кислота Розчин етил 2-(піролідин-1-іл)ацетату (2 г, 12,7 ммоль, 1,0 екв.) у 8н HCl перемішують при 95C протягом 16 год. Суміш концентрують і гасять і екстрагують як у проміжному прикладі 15(b). Розчинник відганяють з одержанням продукту з 91 % виходом (1,5 г). РХ-МС (ІЕР): + розрахована маса: 129,1; знайдена маса 130,1 [M+H] (час утрим.: 0,26 хв.). Проміжний приклад 20 2-Морфолінооцтова кислота a) Етил 2-морфоліноацетат До розчину морфоліну (1,4 г, 16,3 ммоль, 1,0 екв.) у ДМФ додають K2CO3 (5,63 г, 40,7 ммоль, 2,5 екв.) і етил 2-бромацетат (4,07 г, 24,4 ммоль, 1,5 екв.). Суміш перемішують при КТ протягом 16 год. і гасять і екстрагують як у проміжному прикладі 5(a). Розчинник відганяють з одержанням продукту з 71,4 % виходом (2 г). РХ-МС (ІЕР): розрахована маса: 173,2; знайдена маса: 174,0 + [M+H] (час утрим.: 0,20 хв.). b) 2-морфолінооцтова кислота Розчин етил 2-морфоліноацетату (1 г, 57,8 ммоль, 1,0 екв.) у 8н HCl перемішують при 95C протягом 16 год. Суміш концентрують і гасять і екстрагують як у проміжному прикладі 15(b). 21 UA 111382 C2 5 10 15 20 25 30 35 40 45 50 55 60 Розчинник відганяють з одержанням продукту з 96,3 % виходом (0,8 г). РХ-МС (ІЕР): + розрахована маса: 145,16; знайдена маса: 146,3 [M+H] (час утрим.: 0,21 хв.). Проміжний приклад 21 2-(Піперидин-1-іл)оцтова кислота a) Етил 2-(піперидин-1-іл)ацетат До розчину піперидину (3,4 г, 40,7 ммоль, 1,0 екв.) у ДМФ додають K 2CO3 (14 г, 101,0 ммоль, 2,5 екв.) і етил 2-хлорацетат (4,83 мл, 48,9 ммоль, 1,2 екв.). Суміш перемішують при КТ протягом 16 год. Суміш гасять і екстрагують як у проміжному прикладі 5(a). Розчинник відганяють з одержанням продукту з 72 % виходом (5 г). РХ-МС (ІЕР): розрахована маса: 171,1; + знайдена маса 172,3 [M+H] (час утрим.: 0,1 хв.). b) 2-(Піперидин-1-іл)оцтова кислота Розчин етил 2-(піперидин-1-іл)ацетату (1 г, 5,84 ммоль, 1,0 екв.) у 8н HCl перемішують при 95C протягом 16 год. Суміш концентрують і гасять і екстрагують як у проміжному прикладі 15(b). Розчинник відганяють з одержанням продукту з 95 % виходом (0,8 г). РХ-МС (ІЕР): + розрахована маса: 143,1; знайдена маса 144,4 [M+H] (час утрим.: 0,21 хв.). Проміжний приклад 22 2-(3,5-диметилпіперазин-1-іл)оцтова кислота a) Етил 2-(3,5-диметилпіперазин-1-іл)ацетат До розчину 2,6-диметилпіперазину (500 мг, 4,378 ммоль, 1,0 екв.) у ТГФ додають K 2CO3 (1,2 г, 8,75 ммоль, 2,2 екв.) і етил 2-бромацетат (731 мг, 4,378 ммоль, 1 екв.). Суміш перемішують при КТ протягом 4 год. і потім гасять і екстрагують як у проміжному прикладі 5(a). Розчинник відганяють з одержанням продукту з 34 % виходом (0,3 г). РХ-МС (ІЕР): розрахована маса: + 200,0; знайдена маса: 201,0 [M+H] (час утрим.: 0,102 хв.). b) 2-(3,5-диметилпіперазин-1-іл)оцтова кислота Розчин сполуки з проміжного приклада 22(a) (300 мг, 1,5 ммоль, 1,0 екв.) у 8н HCl перемішують при 95C протягом 16 год. Суміш концентрують і гасять і екстрагують як у проміжному прикладі 15(b). Розчинник відганяють з одержанням продукту з 96 % виходом (250 + мг). РХ-МС (ІЕР): розрахована маса: 172,0; знайдена маса: 173,1 [M+H] (час утрим.: 0,094 хв.). Проміжний приклад 23 2-(4-(трет-бутоксикарбоніл)піперазин-1-іл)оцтова кислота a) трет-бутил 4-(2-етокси-2-оксоетил)піперазин-1-карбоксилат До розчину трет-бутил піперазин-1-карбоксилату (2,9 г, 10,7 ммоль, 1,0 екв.) у ТГФ додають карбонат калію (2,96 г, 21,0 ммоль, 2 екв.) і етил 2-бромацетат (1,58 г, 10,7 ммоль, 1 екв.). Суміш перемішують при КТ протягом 16 год. Суміш гасять і екстрагують як у проміжному прикладі 5(a). Розчинник відганяють з одержанням продукту з 51 % виходом (1,5 г). b) 2-(4-(трет-бутоксикарбоніл)піперазин-1-іл)оцтова кислота До розчину сполуки з проміжного приклада 23(a) (1,5 г, 5,51 ммоль) у метанолі (10 мл) додають водний розчин NaOH (0,8 г, 22,0 ммоль, 4 екв.). Суміш перемішують при КТ протягом 2 год. Суміш концентрують і екстрагують як у проміжному прикладі 5(с). Розчинник відганяють з одержанням продукту з 76 % виходом (1 г). РХ-МС (ІЕР): розрахована маса: 244,29; знайдена + маса: 145,1 [M-Boc+H] (час утрим.: 0,102 хв.). Проміжний приклад 24 a) Етил 2-(4-етилпіперазин-1-іл)ацетат До розчину 1-етилпіперазину (1 г, 8,771 ммоль, 1,0 екв.) у ДМФ додають K2CO3 (3 г, 21,927 ммоль, 2,5 екв.) і етил 2-бромацетат (2,19 г, 13,156 ммоль, 1,5 екв.). Суміш перемішують при КТ протягом 16 год. Суміш гасять і екстрагують як у проміжному прикладі 5(a). Розчинник відганяють з одержанням продукту з 76,4 % виходом (1,3 г). b) 2-(4-етилпіперазин-1-іл)оцтова кислота Розчин етил 2-(4-етилпіперазин-1-іл)ацетату (1,3 г, 6,50 ммоль, 1,0 екв.) у 8н HCl перемішують при 95C протягом 16 год. Суміш концентрують у вакуумному насосі, і гасять і екстрагують як у проміжному прикладі 15(b). Розчинник відганяють з одержанням продукту з 54,5 % виходом (0,6 г). Проміжний приклад 25 1-ізопропіл-4-(4,4,5,5-тетраметил-1,3,2-діоксаборолан-2-іл)-1Н-піразол a) 4-бром-1-ізопропіл-1H-піразол До розчину 4-бром-1Н-піразолу (5 г, 34,24 ммоль, 1,0 екв.) у ДМФ додають K2CO3 (11,83 г, 85,60 ммоль, 2,5 екв.) і 2-бромпропан (6,31 г, 51,36 ммоль, 1,5 екв.). Суміш перемішують при КТ протягом 12 год. Суміш гасять і екстрагують як у проміжному прикладі 5(a). Розчинник відганяють з одержанням продукту з 76,9 % виходом (5,0 г). b) 1-ізопропіл-4-(4,4,5,5-тетраметил-1,3,2-діоксаборолан-2-іл)-1Н-піразол 22 UA 111382 C2 5 10 15 20 25 30 35 40 45 50 55 ДО (N2 барботованому) розчину 4-бром-1-ізопропіл-1H-піразолу (1,5 г, 7,894 ммоль) у 1,4діоксані (15 мл) додають 4,4,4',4',5,5,5',5'-октаметил-2,2'-бі(1,3,2-діоксаборолан) (3,0 г, 11,84 ммоль, 1,5 екв.), Pd(dppf)Cl2 (0,644 г, 0,784 ммоль, 0,1 екв.) і ацетат калію (1,93 г, 19,73 ммоль, 2,5 екв.) за методикою з проміжного приклада 1(b). Розчинник відганяють, і залишок очищають хроматографією на колонці (60-120 силікагель, 15 % етилацетат у гексані) з одержанням продукту з 66,6 % виходом (1,2 г). РХ-МС (ІЕР): розрахована маса: 236,17; знайдена маса: 237,1 + [M+H] (час утрим.: 1,4 хв.). Проміжний приклад 26 2-(Піперидин-1-іл)оцтова кислота a) Етил 2-(піперидин-1-іл)ацетат До розчину піперидину (1,5 г, 17,61 ммоль, 1,0 екв.) у ДМФ додають K 2CO3 (6,08 г, 44,02 ммоль, 2,5 екв.) і етил 2-хлорацетат (3,23 г, 26,42 ммоль, 1,5 екв.). Суміш перемішують при КТ протягом 12 год. і гасять і екстрагують як у проміжному прикладі 5(a). Розчинник відганяють з одержанням продукту з 80 % виходом (2,4 г). РХ-МС (ІЕР): розрахована маса: 171,1; знайдена + маса 172,3 [M+H] (час утрим.: 0,1-0,2 хв.). b) 2-(Піперидин-1-іл)оцтова кислота Розчин етил 2-(піперидин-1-іл)ацетату (2,4 г, 14,0 ммоль, 1,0 екв.) у 8н HCl перемішують при 95C протягом 16 год. Суміш концентрують у вакуумному насосі і гасять і екстрагують як у проміжному прикладі 15(b). Розчинник відганяють з одержанням продукту з 60 % виходом (1,2 + г). РХ-МС (ІЕР): розрахована маса: 143,1; знайдена маса 144,4 [M+H] (час утрим.: 0,21 хв.). Проміжний приклад 27 2-Морфолінооцтова кислота a) Етил 2-морфоліноацетат До розчину морфоліну (0,5 г, 5,739 ммоль, 1,0 екв.) у ДМФ додають K 2CO3 (1,98 г, 14,34 ммоль, 2,5 екв.) і етил 2-хлорацетат (1,05 г, 8,60 ммоль, 1,5 екв.). Суміш перемішують при КТ протягом 12 год. Суміш гасять і екстрагують як у проміжному прикладі 5(a). Розчинник відганяють з одержанням продукту з 73,9 % виходом (0,735 г). РХ-МС (ІЕР): розрахована маса: + 173,21; знайдена маса 174,0 [M+H] (час утрим.: 0,1-0,4 хв.). b) 2-морфолінооцтова кислота Розчин етил 2-морфоліноацетату (0,73 г, 4,24 ммоль, 1,0 екв.) у 8н HCl перемішують при 95C протягом 16 год. Суміш концентрують у вакуумному насосі і гасять і екстрагують як у проміжному прикладі 15(b). Розчинник відганяють з одержанням продукту з 60 % виходом (0,37 + г). РХ-МС (ІЕР): розрахована маса: 145,1; знайдена маса 146,3 [M+H] (час утрим.: 0,28 хв.). Проміжний приклад 28 2-(Піролідин-1-іл)оцтова кислота a) Етил 2-(піролідин-1-іл)ацетат До розчину піролідина (0,9 г, 12,65 ммоль, 1,0 екв.) у ДМФ додають K 2CO3 (4,37 г, 31,62 ммоль, 2,5 екв.) і етил 2-хлорацетат (2,32 г, 18,98 ммоль, 1,5 екв.). Суміш перемішують при КТ протягом 12 год. Суміш гасять і екстрагують як у проміжному прикладі 5(a). Розчинник відганяють з одержанням продукту з 94,7 % виходом (1,8 г). РХ-МС (ІЕР): розрахована маса: + 157,2; знайдена маса 158,1 [M+H] (час утрим.: 0,2-0,3 хв.). b) 2-(Піролідин-1-іл)оцтова кислота Розчин етил 2-(піролідин-1-іл)ацетату (1,8 г, 11,95 ммоль, 1,0 екв.) у 8н HCl перемішують при 95C протягом 16 год. Суміш концентрують у вакуумному насосі і гасять і екстрагують як у проміжному прикладі 15(b). Розчинник відганяють з одержанням продукту з 54 % виходом (1,4 + г). РХ-МС (ІЕР): розрахована маса: 129,1; знайдена маса 130,1 [M+H] (час утрим.: 0,26 хв.). Проміжний приклад 29 2-метил-4-(4-(4,4,5,5-тетраметил-1,3,2-діоксаборолан-2-іл)-1Н-піразол-1-іл)бутан-2-ол a) 4-бром-2-метилбутан-2-ол До розчину метил 3-бромпропаноату (5,0 г, 29,94 ммоль, і 1,0 екв.) у сухому ТГФ додають бромід метилмагнію при 0C. Суміш перемішують при КТ протягом 16 год. і гасять і екстрагують як у проміжному прикладі 5(с). Розчинник відганяють з одержанням неочищеного залишку, який очищають хроматографією на колонці (60-120 силікагель, 50 % етилацетат у гексані). Вихід + 48,9 % (2,4 г). РХ-МС (ІЕР): розрахована маса: 167,0; знайдена маса 167,1 [M+H] (час утрим.: 0,8-1,0 хв.). b) 4-(4-бром-1H-піразол-1-іл)-2-метилбутан-2-ол До розчину 4-бром-1Н-піразолу (1 г, 6,84 ммоль, 1,0 екв.) у ДМФ додають K2CO3 (2,3 г, 17,1 ммоль, 2,5 екв.) і 4-бром-2-метилбутан-2-ол (1,7 г, 10,27 ммоль, 1,5 екв.). Суміш перемішують при КТ протягом 16 год. Суміш гасять і екстрагують як у проміжному прикладі 5(a). Розчинник 23 UA 111382 C2 5 10 15 20 25 30 35 40 45 50 55 60 відганяють з одержанням продукту з 60 % виходом (0,9 г). РХ-МС (ІЕР): розрахована маса + 233,0; знайдена маса 235,0 [M+H] (час утрим.: 0,64 хв.). c) 2-метил-4-(4-(4,4,5,5-тетраметил-1,3,2-діоксаборолан-2-іл)-1Н-піразол-1-іл)бутан-2-ол У дегазований (N2 барботований) розчин сполуки з проміжного приклада 29(b) (0,5 г, 2,16 ммоль) у 1,4-діоксані (5 мл) додають 4,4,4',4',5,5,5',5'-октаметил-2,2'-бі(1,3,2-діоксаборолан) (0,824 г, 3,24 ммоль, 1,5 екв.), Pd(dppf)Cl2 (0,1766 г, 0,216 ммоль, 0,1 екв.) і ацетат калію (0,529 г, 5,40 ммоль, 2,5 екв.) за методикою з проміжного приклада 1(b). Розчинник відганяють, суміш очищають хроматографією на колонці (60-120 силікагель, 15 % етилацетат у гексані) з одержанням продукту з 49,6 % виходом (0,3 г). РХ-МС (ІЕР): розрахована маса: 280,1; знайдена + маса: 281,2 [M+H] (час утрим.: 0,8 хв.). Проміжний приклад 30 трет-бутил 3-(4-(4,4,5,5-тетраметил-1,3,2-діоксаборолан-2-іл)-1Н-піразол-1-іл)піролідин-1карбоксилат a) трет-бутил 3-(метилсульфоніл)піролідин-1-карбоксилат До розчину трет-бутил 3-гідроксипіролідин-1-карбоксилату (1,0 г, 5,34 ммоль, 1,0 екв.) у ДХМ (10 мл) додають ТЕА (1,08 г, 10,68 ммоль, 2,0 екв.) і ДМАП (65 мг, 0,53 ммоль). Суміш перемішують при КТ протягом 15 хв. Потім додають хлорид метансульфонілу (0,730 г, 6,41 ммоль, 1,2 екв.), і суміш перемішують протягом ночі. Суміш гасять і екстрагують як у проміжному прикладі 5(a). Розчинник відганяють з одержанням продукту з 71,4 % виходом (1,0 г). b) трет-бутил 3-(4-бром-1Н-піразол-1-іл)піролідин-1-карбоксилат До розчину 4-бром-1Н-піразолу (0,65 г, 4,42 ммоль) у ДМФ додають гідрид натрію при 0 °C (0,159 г, 6,6 ммоль, 1,5 екв.) і сполука з проміжного приклада 30(a) (1,1 г, 4,42 ммоль, 1,0 екв.). Суміш перемішують при КТ протягом 16 год. і гасять і екстрагують як у проміжному прикладі 5(a). Розчинник відганяють з одержанням неочищеного залишку, який очищають хроматографією на колонці (60-120 силікагель, 1 % метанол у ДХМ) з одержанням продукту з 61,5 % виходом (0,85 г). c) трет-бутил 3-(4-(4,4,5,5-тетраметил-1,3,2-діоксаборолан-2-іл)-1Н-піразол-1-іл)піролідин-1карбоксилат У дегазований (N2 барботований) розчин сполуки з проміжного приклада 30(b) (0,850 г, 2,68 ммоль) у 1,4-діоксані (10 мл) додають 4,4,4',4',5,5,5',5'-октаметил-2,2'-бі(1,3,2-діоксаборолан) (0,819 г, 3,22 ммоль, 1,2 екв.), Pd(dppf)Cl2 (0,218 г, 0,268 ммоль, 0,1 екв.) і ацетат калію (0,788 г, 8,04 ммоль, 3,0 екв.) за методикою з проміжного приклада 1(b). Розчинник відганяють з одержанням продукту з 84,5 % виходом (0,82 г). РХ-МС (ІЕР): розрахована маса: 363,2; + знайдена маса: 364,2 [M+H] (час утрим.: 1,73 хв.). Проміжний приклад 31 4-(4-Фтор-3-нітрофеніл)-1-метил-1Н-піразол Розчин 4-брому-1-фтору-2-нітробензолу (2 г, 9,095 ммоль) у 1,4-діоксані (20 мл) дегазують барботуванням N2 протягом 5 хв. Додають 1-метил-4-(4,4,5,5-тетраметил-1,3,2-діоксаборолан-2іл)-1Н-піразол (2,27 г, 10,91 ммоль, 1,2 екв.) і водний карбонат натрію (2,89 г, 27,27 ммоль, 3,0 екв.), і суміш дегазують протягом ще 15 хв. Потім додають Pd(PPh3)2Cl2 (0,638 г, 0,909 ммоль, 0,1 екв.), і суміш далі дегазують протягом 15 хв. і потім нагрівають при 90C протягом 2 год. Суміш гасять і екстрагують як у проміжному прикладі 5(с). Розчинник відганяють з одержанням неочищеного залишку, який очищають хроматографією на колонці (60-120 силікагель, 40-50 % 1 етилацетат у гексані) з одержанням продукту з 79 % виходом (1,6 г). H ЯМР (300 МГц, ДМСОd6): δ 8,32-8,26 (м, 2H), 8,0-7,97 (м, 2H), 7,62-7,55 (м, 1H). Проміжний приклад 32 1-циклопентил-4-(4,4,5,5-тетраметил-1,3,2-діоксаборолан-2-іл)-1Н-піразол a) 1-циклопентил-4-йод-1Н-піразол До розчину 4-йод-1Н-піразолу (5 г, 25,78 ммоль, 1,0 екв.) у ДМФ (25 мл) додають K 2CO3 (8,908 г, 64,45 ммоль, 2,5 екв.) і бромциклопентан (4,96 г, 33,51 ммоль, 1,3 екв.). Суміш перемішують при КТ протягом 12 год. Суміш гасять і екстрагують як у проміжному прикладі 5(a). 1 Розчинник відганяють з одержанням продукту з 89,5 % виходом. H ЯМР (300 МГц, CDCl3): δ 7,49 (с, 1H), 7,45 (с, 1H), 4,66-4,62 (м, 1H), 2,17-2,02 (м, 1H), 2,00-1,96 (м, 2H), 1,93-1,78 (м, 2H), + 1,73-1,67 (м, 2H); РХ-МС (ІЕР): розрахована маса: 262; знайдена маса: 263 [M+H] (час утрим.: 1,57 хв.). b) 1-циклопентил-4-(4,4,5,5-тетраметил-1,3,2-діоксаборолан-2-іл)-1Н-піразол У дегазований (N2 барботований) розчин 1-циклопентил-4-йод-1Н-піразолу (6,0 г, 22,90 ммоль) у ДМСО (60 мл) додають 4,4,4',4',5,5,5',5'-октаметил-2,2'-бі(1,3,2-діоксаборолан) (8,312 г, 34,35 ммоль, 1,5 екв.), Pd(dppf)Cl2 (0,529 г, 0,45 ммоль, 0,02 екв.) і ацетат калію (4,494 г, 45,80 24 UA 111382 C2 5 10 15 20 25 30 35 40 45 50 55 60 ммоль, 2,0 екв.) за методикою з проміжного приклада 1(b). Розчинник відганяють, результат очищають хроматографією на колонці (60-120 силікагель, 15 % етилацетат у гексані) з 1 одержанням продукту з 48 % виходом (2,89 г). H ЯМР (300 МГц, CDCl3): δ 7,77 (с, 1H), 7,72 (с, 1H), 4,65 (м, 1H), 2,17-2,02 (м, 1H), 2,00-1,96 (м, 2H), 1,93-1,78 (м, 2H), 1,73-1,67 (м, 2H), 1,30+ 1,24 (м, 12H); РХ-МС (ІЕР): розрахована маса: 262; знайдена маса: 262,92 [M+H] (час утрим.: 1,54 хв.). Проміжний приклад 33 трет-бутил (5-(4,4,5,5-тетраметил-1,3,2-діоксаборолан-2-іл)піридин-2-іл)карбамат До розчину 5-(4,4,5,5-тетраметил-1,3,2-діоксаборолан-2-іл)піридини-2-аміну (0,33 г, 1,5 ммоль) у CH2Cl2 (5 мл) при 0C додають Boc2O (0,33 г, 1,5 ммоль, 1 екв.) і Et3N (0,62 мл, 4,5 ммоль, 3 екв.). Суміш перемішують при КТ протягом 1 год. і потім гасять і екстрагують як у проміжному прикладі 5(a). Розчинник відганяють з одержанням неочищеного продукту (0,48 г). Приклад 1 N-(2',4'-дифтор-5-(5-(1-метил-1Н-піразол-4-іл)-1Н-бензо[d]імідазол-1-іл)-біфеніл-3іл)ацетамід a) 1-бром-3,5-динітробензол До розчину 1,3-динітробензолу (25 г, 0,149 моль) у концентрованій сірчаній кислоті (100 мл) при 0 °C додають 1,3-дибром-5,5-диметилгидантоин (31,75 г, 0,111 моль, 0,75 екв.) порціями протягом більш 30 хв. Суміш перемішують протягом 12 при КТ і гасять додаванням подрібненого льоду. Осад, що випав, фільтрують і промивають кілька разів водою з одержанням твердої речовини білого кольору. Тверду речовину сушать у вакуумі з одержанням продукту з 87 % виходом (32 г). b) 3-бром-5-нітроанілін До розчину 1-бром-3,5-динітробензолу (20 г, 80,97 ммоль) в оцтовій кислоті (120 мл) при 90C додають порошок заліза (11,3 г, 202,4 ммоль, 2,5 екв.) повільно, порціями протягом більш 30 хв. (обережно: сильно екзотермічна реакція). Після завершення додавання суміш гасять додаванням подрібненого льоду. Осад, що випав, фільтрують і промивають холодною водою з одержанням твердої речовини жовтогарячого кольору. Тверду речовину сушать у вакуумі з 1 одержанням продукту з 80 % виходом (14 г). H ЯМР (300 МГц, CDCl3): δ 10,55 (ушир. с, 2H), 8,46 (с, 1H), 8,19 (с, 1H), 8,02 (с, 1H). c) N-(3-бром-5-нітрофеніл)ацетамід Оцтовий ангідрид (14 мл) додають по краплях при 0C до 3-бром-5-нітроаніліну (14 г, 64,5 ммоль). Суміш перемішують протягом 30 хв. при КТ і потім гасять додаванням подрібненого льоду. Осад, що випав, фільтрують і промивають холодною водою з одержанням білуватої твердої речовини. Тверду речовину сушать у вакуумі з одержанням продукту з 78 % виходом 1 (13 г). H ЯМР (300 МГц, ДМСО-d6): δ 10,54 (ушир. с, 1H), 8,45 (с, 1H), 8,2 (с, 1H), 8,03 (с, 1H), 2,11 (с, 3H). d) N-(2',4'-дифтор-5-нітробіфеніл-3-іл)ацетамід Розчин N-(3-бром-5-нітрофеніл)ацетаміду (1 г, 3,86 ммоль) у 1,2-диметоксіетані (15 мл) дегазують барботуванням N2 протягом 5 хв. Додають 2,4-дифторфенілборонову кислоту (0,727 г, 4,63 ммоль, 1,2 екв.), і суміш дегазують протягом ще 5 хв. Додають послідовно Pd(dppf)Cl2 (0,627 г, 0,769 ммоль, 0,2 екв.) і водний карбонат натрію (1,22 г, 11,5 ммоль, 3,0 екв.), і суміш далі дегазують протягом 5 хв. і потім нагрівають при 90C протягом 2 год. Суміш гасять водою й екстрагують етилацетатом (350 мл). Об'єднаний органічний шар промивають водою, насиченим розчином солі і сушать над сульфатом натрію. Розчинник відганяють при зниженому тиску, і неочищений залишок очищають хроматографією на колонці (60-120 силікагель, 30 % 1 етилацетат у гексані) з одержанням продукту з 80 % виходом (0,9 г). H ЯМР (300 МГц, ДМСОd6): δ 10,63 (с, 1H), 8,7-8,69 (м, 1H), 8,16 (д, 1H), 8,04 (с, 1H), 7,8-7,67 (м, 1H), 7,53 (м, 1H), 7,34 (м, 1H), 2,19 (с, 3H). e) N-(5-аміно-2',4'-дифторбіфеніл-3-іл)ацетамід До розчину N-(2',4'-дифтор-5-нітробіфеніл-3-іл)ацетаміду (4 г, 13,7 ммоль) у метанолі (30 мл) і етилацетаті (15 мл) додають 10 % Pd/C (400 мг, 0,1 екв.) і реакційну посудину продувають азотом протягом 5 хв. Суміш потім гідрують із застосуванням H 2 з балона протягом 12 год. Суміш фільтрують через шар целіту і фільтрат концентрують при зниженому тиску з 1 одержанням сполуки з 89 % виходом (3,2 г). H ЯМР (300 МГц, ДМСО-d6): δ 9,77 (ушир. с, 1H), 7,46-7,42 (м, 1H), 7,35-7,28 (м, 1H), 7,2-7,15 (м, 1H), 6,99 (ушир. с, 1H), 8,86 (д, 1H), 6,39 (д, 1H), 5,45 (ушир. с, 2H), 2,02 (с, 3H). f) N-(5-(4-бром-2-нітрофеніламіно)-2',4'-дифторбіфеніл-3-іл)ацетамід Розчин N-(5-аміно-2',4'-дифторбіфеніл-3-іл)ацетаміду (3,0 г, 11,44 ммоль), 4-брому-1-фтору2-нітробензолу (2,52 г, 11,44 ммоль, 1,0 екв.) і фториду калію (0,663 г, 11,44 ммоль, 1,0 екв.) у 25 UA 111382 C2 5 10 15 20 25 30 35 40 45 50 55 ДМФ нагрівають при 130 °C протягом 5 год. Суміш гасять і екстрагують як у прикладі 1(d). Розчинник відганяють при зниженому тиску, і неочищений залишок очищають хроматографією на колонці (60-120 силікагель, 40 % етилацетат у гексані) з одержанням продукту з 45 % виходом (2,4 г). g) N-(5-(2-аміно-4-бромфеніламіно)-2',4'-дифторбіфеніл-3-іл)ацетамід До розчину N-(5-(4-бром-2-нітрофеніламіно)-2',4'-дифторбіфеніл-3-іл)ацетамід (3,2 г, 6,92 ммоль) у ТГФ (30 мл) додають розчин хлориду амонію (3,7 г, 69,22 ммоль, 10 екв.) у воді (15 мл) і цинку (4,53 г, 69,22 ммоль, 10 екв.). Суміш перемішують при КТ протягом 6 год. і фільтрують. Фільтрат розбавляють водою й екстрагують як у прикладі 1(d). Розчинник відганяють при зниженому тиску з одержанням продукту з 87 % виходом (2,6 г). h) N-(5-(5-бром-1H-бензо[d]імідазол-1-іл)-2',4'-дифторбіфеніл-3-іл)ацетамід Суміш сполуки з приклада 1(g) (2,6 г, 6,01 ммоль) і мурашиної кислоти (10 мл) нагрівають при 100C протягом 30 хв. Мурашину кислоту відганяють при зниженому тиску і неочищеному залишку розчиняють у етилацетаті. Шар етилацетату промивають водою, насиченим розчином солі і сушать над сульфатом натрію. Розчинник відганяють при зниженому тиску з одержанням 1 продукту з 60 % виходом (1,6 г). H ЯМР (300 МГц, ДМСО-d6): δ 10,41 (с, 1H), 8,72 (с, 1H), 8,02 (д, 2H), 7,82 (с, 1H), 7,75-7,66 (м, 2H), 7,53-7,41 (м, 3H), 7,27 (м, 1H), 2,11 (с, 3H). i) N-(2',4'-дифтор-5-(5-(1-метил-1Н-піразол-4-іл)-1Н-бензо[d]імідазол-1-іл)-біфеніл-3іл)ацетамід Розчин сполуки з приклада 1(h) (1,5 г, 3,39 ммоль) у 1,2-диметоксіетані (15 мл) дегазують барботуванням N2 протягом 5 хв. Додають 1-метил-4-(4,4,5,5-тетраметил-1,3,2-діоксаборолан-2іл)-1Н-піразол (0,847 г, 4,07 ммоль, 1,2 екв.), і суміш дегазують протягом ще 5 хв. Додають Pd(dppf)Cl2 (0,553 г, 0,678 ммоль, 0,2 екв.) і водний карбонат натрію (1,08 г, 10,18 ммоль, 3,0 екв.), потім обробляють за методикою, описаної в прикладі 1(d). Неочищений залишок продукту очищають хроматографією на колонці (60-120 силікагель, 80 % етилацетат у гексані) з 1 одержанням продукту з 67 % виходом (1,0 г). H ЯМР (300 МГц, ДМСО-d6): δ 10,4 (с, 1H), 8,64 (с, 1H), 8,2 (1H, с), 8,07 (с, 1H), 7,99 (с, 1H), 7,94 (с, 1H), 7,8-7,68 (м, 2H), 7,6-7,45 (м, 4H), 7,27 (т, 1H), 3,88 (с, 3H), 2,12 (с, 3H); РХ-МС (ІЕР): розрахована маса: 443,45; знайдена маса: 444,1 + [M+H] (час утрим.: 1,2 хв.). Приклад 2 N-(2',4'-дифтор-5-(5-(1-метил-1H-піразол-4-іл)-1H-бензо[d]імідазол-1-іл)біфеніл-3іл)метансульфонамід a) 2',4'-дифтор-5-(5-(1-метил-1H-піразол-4-іл)-1H-бензо[d]імідазол-1-іл)біфеніл-3-амін До розчину N-(2',4'-дифтор-5-(5-(1-метил-1Н-піразол-4-іл)-1Н-бензо-[d]імідазол-1-іл)біфеніл3-іл)ацетаміду з приклада 1 (1,0 г, 2,26 ммоль) у етанолі (10 мл) додають водний розчин NaOH (800 мг, 20 ммоль, 8,9 екв.) і суміш нагрівають при 85C протягом 5 год. Суміш гасять і екстрагують, як у прикладі 1(d). Розчинник відганяють при зниженому тиску з одержанням продукту з 66 % виходом (0,6 г). РХ-МС (ІЕР): розрахована маса: 401,41; знайдена маса: 402,1 + [M+H] (час утрим.: 1,198 хв.). b) N-(2',4'-дифтор-5-(5-(1-метил-1H-піразол-4-іл)-1Н-бензо[d]імідазол-1-іл)біфеніл-3іл)метансульфонамід До розчину сполуки з приклада 2(a) (50 мг, 0,125 ммоль) у ДХМ додають піридин (20 мг, 0,249 ммоль, 2,0 екв.), потім хлорид метансульфонілу (17 мг, 0,15 ммоль, 1,2 екв.). Суміш перемішують протягом 1 год., гасять водою й екстрагують ДХМ (350 мл). Об'єднаний органічний шар промивають водою, насиченим розчином солі і сушать над сульфатом натрію. Розчинник відганяють при зниженому тиску, і неочищений залишок очищають препаративною 1 ВЕРХ з одержанням продукту з 33 % виходом (20 мг). H ЯМР (300 МГц, ДМСО-d6): δ 10,26 (с, 1H), 8,66 (с, 1H), 8,2 (с, 1H), 7,98 (с, 1H), 7,94 (с, 1H), 7,75-7,67 (м, 2H), 7,57 (т, 3H), 7,45-7,43 (м, 2H), 7,29-7,25 (м, 1H), 3,87 (с, 3H), 3,17 (с, 3H); РХ-МС (ІЕР): розрахована маса: 479,5; знайдена + маса: 480,2 [M+H] (час утрим.: 1,34 хв.). Приклад 3 N-(2',4'-дифтор-5-(5-(1-метил-1Н-піразол-4-іл)-1Н-бензо[d]імідазол-1-іл)біфеніл-3іл)етансульфонамід 1 Сполуку одержують зі сполуки з приклада 1 із застосуванням методик із приклада 2. H ЯМР(300 МГц, ДМСО-d6): δ 10,29 (с, 1H), 8,84 (с, 1H), 8,22 (с, 1H), 7,99 (с, 1H), 7,96 (с, 1H), 7,787,62 (м, 3H), 7,57 (ушир. с, 2H), 7,48-7,43 (м, 2H), 7,29-7,25 (м, 1H), 3,88 (с, 3H), 3,29 (квартет, + 2H), 1,25 (т, 3H); РХ-МС (ІЕР): розрахована маса: 493,53; знайдена маса: 494,2 [M+H] (час утрим.: 1,41 хв.). 26 UA 111382 C2 5 10 15 20 25 30 35 40 45 50 55 60 Приклад 4 N-(2',4'-дифтор-5-(5-(1-метил-1H-піразол-4-іл)-1H-бензо[d]імідазол-1-іл)біфеніл-3-іл)пропан2-сульфонамід 1 Сполуку одержують зі сполуки з приклада 1 із застосуванням методик із приклада 2. H ЯМР(300 МГц, ДМСО-d6): δ 10,29 (с, 1H), 8,81 (с, 1H), 8,22 (с, 1H), 7,99 (с, 1H), 7,95 (с, 1H), 7,757,56 (м, 5H), 7,48-7,43 (м, 2H), 7,27 (м, 1H), 3,88 (с, 3H), 3,48-3,44 (м, 1H), 1,3 (д, 6H); РХ-МС + (ІЕР): розрахована маса: 507,55; знайдена маса: 508,2 [M+H] (час утрим.: 1,47 хв.). Приклад 5 , N-(2 ,4'-дифтор-5-(5-(1-метил-1H-піразол-4-іл)-1H-бензо[d]імідазол-1-іл)біфеніл-3іл)циклопропансульфонамід Сполуку одержують зі сполуки з приклада 1 із застосуванням методик із приклада 2 і 1 хлориду циклопропансульфонілу. H ЯМР (300 МГц, ДМСО-d6): δ 10,29 (с, 1H), 8,88 (с, 1H), 8,23 (с, 1H), 8,0 (с, 1H), 7,96 (с, 1H), 7,76-7,64 (м, 3H), 7,6 (с, 2H), 7,5-7,46 (м, 2H), 7,3-7,25 (м, 1H), 3,88 (с, 3H), 2,88-2,85 (м, 1H), 1,02-1,0 (м, 4H); РХ-МС (ІЕР): розрахована маса: 505,54; знайдена + маса: 506,1 [M+H] (час утрим.: 1,517 хв.). Приклад 6 N-(2',4'-дифтор-5-(5-(1-метил-1H-піразол-4-іл)-1H-бензо[d]імідазол-1-іл)біфеніл-3іл)циклопентансульфонамід 1 Сполуку одержують зі сполуки з приклада 1 із застосуванням методик із приклада 2. H ЯМР (300 МГц, ДМСО-d6): δ 10,25 (с, 1H), 8,96 (с, 1H), 8,24 (с, 1H), 8,0 (с, 1Н), 7,97 (с, 1H), 7,77-7,66 (м, 3H), 7,6-7,59 (м, 2H), 7,49 (м, 1H), 7,46-7,43 (м, 1H), 7,3-7,25 (м, 1H), 3,88 (с, 3H), 3,83-3,78 (м, 1H), 1,99-1,93 (м, 4H), 1,69-1,64 (м, 2H), 1,63-1,52 (м, 2H); РХ-МС (ІЕР): розрахована маса: + 533,59; знайдена маса: 534,3 [M+H] (час утрим.: 1,57 хв.). Приклад 7 N-(2',4'-дифтор-5-(5-(1-метил-1H-піразол-4-іл)-1H-бензо[d]імідазол-1-іл)біфеніл-3іл)бензолсульфонамід 1 Сполуку одержують зі сполуки з приклада 1 із застосуванням методик із приклада 2. H ЯМР(300 МГц, ДМСО-d6): δ 8,57 (с, 1H), 8,21 (с, 1Н), 7,96-7,95 (м, 2H), 7,88-7,86 (м, 2H), 7,727,61 (м, 4H), 7,57-7,55 (м, 2H), 7,5 (ушир. с, 1H), 7,45-7,32 (м, 4H), 7,26-7,22 (м, 1H), 3,88 (с, 3H); + РХ-МС (ІЕР): розрахована маса: 541,57; знайдена маса: 542,1 [M+H] (час утрим.: 1,642 хв.). Приклад 8 N-(5-(5-(1-(2-(диметиламіно)етил)-1H-піразол-4-іл)-1H-бензо[d]імідазол-1-іл)-2',4'дифторбіфеніл-3-іл)ацетамід Розчин сполуки з приклада 1(h) (7 г, 15,83 ммоль) у 1,2-диметоксіетані (200 мл) дегазують барботуванням N2 протягом 5 хв. Додають N, N-диметил-2-(4-(4,4,5,5-тетраметил-1,3,2діоксаборолан-2-іл)-1H-піразол-1-іл)етанамін із проміжного приклада 1 (6,3 г, 23,74 ммоль, 1,5 екв.), і суміш дегазують протягом ще 5 хв. Додають Pd(PPh3)4 (1,83 г, 1,583 ммоль, 0,1 екв.) і водний карбонат натрію (5,03 г, 47,5 ммоль, 3,0 екв.), потім обробляють за методикою з приклада 1(d). Неочищений залишок продукту очищають хроматографією на колонці (нейтральний окис алюмінію, 80 % етилацетат у гексані) з одержанням продукту з 19 % виходом 1 (1,5 г). H ЯМР (300 МГц, ДМСО-d6): δ 10,45 (с, 1H), 8,8 (с, 1H), 8,35 (с, 1H), 8,15 (с, 2H), 8,05 (с, 1H), 7,6-7,7 (м, 4H), 7,4-7,55 (м, 2H), 7,2-7,3 (м, 1H), 4,56 (т, 2H), 3,65-3,63 (м, 2H), 2,85 (с, 6H), + 2,12 (с, 3H); РХ-МС (ІЕР): розрахована маса: 500,54; знайдена маса: 501,2 [M+H] (час утрим.: 0,277 хв.). Приклад 9 N-(5-(5-(1-(2-(диметиламіно)етил)-1H-піразол-4-іл)-1H-бензо[d]імідазол-1-іл)-2',4'дифторбіфеніл-3-іл)метансульфонамід a) 5-(5-(1-(2-(диметиламіно)етил)-1H-піразол-4-іл)-1H-бензо[d]імідазол-1-іл)-2',4'дифторбіфеніл-3-амін До розчину сполуки з приклада 8 (1,5 г, 3,0 ммоль) у етанолі (30 мл) додають водний розчин NaOH (1,5 г, 37,5 ммоль, 12,5 екв.) і суміш нагрівають при 100 °C протягом 4 год. Суміш гасять і екстрагують як у прикладі 1(d). Розчинник відганяють з одержанням продукту з 58 % виходом (0,8 г). b) N-(5-(5-(1-(2-(диметиламіно)етил)-1H-піразол-4-іл)-1H-бензо[d]імідазол-1-іл)-2',4'дифторбіфеніл-3-іл)метансульфонамід До розчину сполуки з приклада 9(a) (200 мг, 0,436 ммоль) у ДХМ додають піридин (69 мг, 0,872 ммоль, 2,0 екв.), потім хлорид метансульфонілу (75 мг, 0,654 ммоль, 1,5 екв.). Суміш перемішують протягом 1 год. і гасять і екстрагують як у прикладі 2(b). Розчинник відганяють і неочищений залишок очищають препаративною ВЕРХ з одержанням продукту з 13 % виходом 1 (30 мг). H ЯМР (300 МГц, ДМСО-d6): δ 8,66 (с, 1H), 8,26 (с, 1H), 7,99 (д, 1H), 7,96 (с, 1H), 7,81-7,7 27 UA 111382 C2 5 10 15 20 25 30 35 40 45 50 55 60 (м, 2H), 7,68 (с, 1H), 7,62-7,57 (м, 3H), 7,5-7,44 (м, 2H), 7,3-7,25 (м, 1H), 4,23 (т, 2H), 3,18 (с, 3H), 2,75-2,73 (м, 2H), 2,12 (с, 6H); РХ-МС (ІЕР): розрахована маса: 536,6; знайдена маса: 537,3 + [M+H] (час утрим.: 0,26 хв.). Приклад 10 N-(5-(5-(1-(2-(диметиламіно)етил)-1H-піразол-4-іл)-1H-бензо[d]імідазол-1-іл)-2',4'дифторбіфеніл-3-іл)етансульфонамід 1 Сполуку одержують зі сполуки з приклада 8 із застосуванням методик із приклада 9. H ЯМР (300 МГц, ДМСО-d6): δ 10,35 (с, 1H), 9,2-9,4 (ушир. с, 1H), 8,8 (с, 1H), 8,4 (с, 1H), 8,15 (с, 1H), 8,0 (с, 1H), 7,6-7,8 (м, 2H), 7,6 (с, 2H), 7,4-7,5 (м, 2H), 7,2-7,3 (м, 1H), 4,55 (т, 2H), 3,65-3,63 (м, 2H), 3,3 (квартет, 2H), 2,85 (с, 6H), 1,26 (т, 3H); РХ-МС (ІЕР): розрахована маса: 550,62; знайдена + маса: 551,2 [M+H] (час утрим.: 0,365 хв.). Приклад 11 N-(5-(5-(1-(2-(диметиламіно)етил)-1H-піразол-4-іл)-1H-бензо[d]імідазол-1-іл)-2',4'дифторбіфеніл-3-іл)пропан-2-сульфонамід 1 Сполуку одержують зі сполуки з приклада 8 із застосуванням методик із приклада 9. H ЯМР (300 МГц, CD3OD): δ 8,5 (с, 1H), 8,1 (с, 1H), 7,9-7,95 (д, 2H), 7,55-7,7 (м, 5H), 7,45-7,5 (м, 2H), 7,05-7,1 (м, 2H), 4,32 (т, 2H), 3,44-3,39 (м, 1H), 2,85 (т, 2H), 2,3 (с, 6H), 1,4 (д, 6H); РХ-МС (ІЕР): + розрахована маса: 564,65; знайдена маса: 565,2 [M+H] (час утрим.: 0,507 хв.). Приклад 12 N-(2',4'-дифтор-5-(5-(1-(2-морфоліноетил)-1H-піразол-4-іл)-1H-бензо[d]імідазол-1-іл)біфеніл3-іл)ацетамід Сполуку одержують із застосуванням методик із приклада 8 із застосуванням сполуки з 1 проміжного приклада 2. H ЯМР(300 МГц, ДМСО-d6): δ 10,43 (с, 1H), 8,82 (с, 1H), 8,35 (с, 1H), 8,13 (с, 2H), 8,05 (с, 1H), 7,79-7,73 (м, 3H), 7,67-7,63 (м, 1H), 7,51-7,44 (м, 2H), 7,31-7,27 (м, 1H), 4,6 (т, 2H), 3,93-3,88 (м, 4H), 3,67-3,63 (м, 4H), 3,82-3,78 (м, 2H), 2,1 (с, 3H); РХ-МС (ІЕР): + розрахована маса: 542,58; знайдена маса: 543,2 [M+H] (час утрим.: 0,24 хв.). Приклад 13 N-(2',4'-дифтор-5-(5-(1-(2-морфоліноетил)-1Н-піразол-4-іл)-1Н-бензо[d]імідазол-1-іл)біфеніл3-іл)метансульфонамід 1 Сполуку одержують зі сполуки з приклада 12 із застосуванням методик із приклада 9. H ЯМР (300 МГц, ДМСО-d6): δ 10,3 (с, 1H), 8,8 (с, 1H), 8,35 (с, 1H), 8,15 (с, 1H), 8,05 (с, 1H), 7,7-7,8 (м, 2H), 7,6-7,7 (м, 1H), 7,55-7,6 (м, 2H), 7,4-7,5 (м, 2H), 7,25-7,35 (м, 1H), 4,59 (т, 2H), 4,0 (м, 4H), 3,82-3,78 (м, 2H), 3,5 (м, 4H), 3,18 (с, 3H); РХ-МС (ІЕР): розрахована маса: 578,63; знайдена + маса: 579,2 [M+H] (час утрим.: 0,383 хв.). Приклад 14 N-(2',4'-дифтор-5-(5-(1-(2-морфоліноетил)-1Н-піразол-4-іл)-1Н-бензо[d]імідазол-1-іл)біфеніл3-іл)етансульфонамід 1 Сполуку одержують зі сполуки з приклада 12 із застосуванням методик із приклада 9. H ЯМР (300 МГц, ДМСО-d6): δ 10,35 (с, 1H), 8,85 (с, 1H), 8,35 (с, 1H), 8,15 (с, 1H), 8,05 (с, 1H), 7,777,68 (м, 3H), 7,58 (с, 2H), 7,48-7,45 (м, 2H), 7,31-7,27 (м, 1H), 4,59 (т, 2H), 4,0-3,92 (м, 4H), 3,823,78 (м, 2H), 3,5-3,41 (м, 4H), 3,29 (квартет, 2H), 1,25 (т, 3H); РХ-МС (ІЕР): розрахована маса: + 592,66; знайдена маса: 593,2 [M+H] (час утрим.: 0,419 хв.). Приклад 15 N-(2',4'-дифтор-5-(5-(1-(2-морфоліноетил)-1Н-піразол-4-іл)-1Н-бензо[d]імідазол-1-іл)біфеніл3-іл)пропан-2-сульфонамід 1 Сполуку одержують зі сполуки з приклада 12 із застосуванням методик із приклада 9. H ЯМР (300 МГц, CD3OD): δ 8,5 (с, 1Н), 8,1 (с, 1H), 7,93 (с, 1H), 7,9 (с, 1H), 7,6-7,7 (м, 4H), 7,5 (с, 2H), 7,1-7,15 (м, 2H), 4,33 (т, 2H), 3,67 (т, 4H), 3,46-3,39 (м, 1H), 2,85 (т, 2H), 2,52 (т, 4H), 1,4 (д, + 6H); РХ-МС (ІЕР): розрахована маса: 606,69; знайдена маса: 607,3 [M+H] (час утрим.: 0,62 хв.). Приклад 16 N-(2',4'-дифтор-5-(5-(1-(2-морфоліноетил)-1Н-піразол-4-іл)-1Н-бензо[d]імідазол-1-іл)біфеніл3-іл)циклопропансульфонамід Сполуку одержують зі сполуки з приклада 12 із застосуванням методик із приклада 9 і 1 хлориду циклопропансульфонілу. H ЯМР (300 МГц, ДМСО-d6): δ 8,6 (с, 1H), 8,25 (с, 1H), 7,98 (с, 1H), 7,95 (с, 1H), 7,74-7,65 (м, 2H), 7,59-7,55 (м, 1H), 7,45-7,38 (м, 2H), 7,28-7,24 (м, 4H), 4,24 (т, 2H), 3,56 (т, 4H), 2,75 (т, 2H), 2,67-2,64 (м, 1H), 2,42 (т, 4H), 0,91-0,88 (м, 4H); РХ-МС (ІЕР):+ розрахована маса: 604,67; знайдена маса: 605,4 [M+H] (час утрим.: 0,68 хв.). Приклад 17 N-(2',4'-дифтор-5-(5-(1-метил-1H-1,2,3-триазол-4-іл)-1H-бензо[d]імідазол-1-іл)біфеніл-3іл)ацетамід 28
ДивитисяДодаткова інформація
Назва патенту англійськоюProtein kinase inhibitors
Автори англійськоюLinnanen, Tero, Wohlfahrt, Gerd, Nanduri, Srinivas, Ujjinamatada, Ravi, Rajagopalan, Srinivasan, Mukherjee, Subhendu
Назва патенту російськоюИнгибиторы протеинкиназы
Автори російськоюЛиннанен Тэро, Вольфарт Герд, Нандури Сринивас, Уджинаматада Рави, Раджагопалан Сринивасан, Мукхерджи Субхенду
МПК / Мітки
МПК: A61K 31/4184, C07D 403/04, C07D 401/14, A61P 35/00, A61K 31/4188, C07D 471/04, C07D 413/04
Мітки: протеїнкінази, інгібітори
Код посилання
<a href="https://ua.patents.su/121-111382-ingibitori-protenkinazi.html" target="_blank" rel="follow" title="База патентів України">Інгібітори протеїнкінази</a>
Попередній патент: Верстат паралельної кінематики з мехатронною системою активного контролю
Наступний патент: Тверда дисперсія
Випадковий патент: Спосіб лікування акне у жінок з склерополікістозом яєчників