Карбапенемовий антибіотик, композиція та спосіб одержання
Номер патенту: 62920
Опубліковано: 15.01.2004
Автори: Ціммерман Джеффрі Е., Дюбост Девід К., Бергквіст Пол Е., Сідлер Деніел Р., Дімішель Ліза М., Уільямс Джон М., Кауфман Майкл Дж., Ханке Уільям Е.
Формула / Реферат
1. Фармацевтична композиція, яка містить сполуку, представлену формулою I:
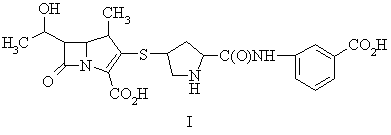
або її фармацевтично прийнятну сіль, стабілізовану форму, проліки або гідрат у комбінації з джерелом діоксиду вуглецю.
2. Фармацевтична композиція, яка містить сполуку, представлену формулою І:

або її фармацевтично прийнятну сіль, стабілізовану форму, проліки або гідрат у комбінації з карбонатом натрію або бікарбонатом натрію.
3. Фармацевтична композиція за п. 2, що містить близько 3-6 масових частин сполуки І або її фармацевтично прийнятної солі, стабілізованої форми, проліків або гідрату і близько 1 масової частини бікарбонату натрію.
4. Фармацевтична композиція за п. 3, що містить близько 4,5 частин сполуки І або її фармацевтично прийнятної солі, стабілізованої форми, проліків або гідрату.
5. Фармацевтична композиція за п. 2, що містить близько 3-6 масових частин сполуки І або її фармацевтично прийнятної солі, стабілізованої форми, проліків або гідрату і близько 1 масової частини карбонату натрію.
6. Фармацевтична композиція за п. 5, що містить близько 4,5 частин сполуки І або її фармацевтично прийнятної солі, стабілізованої форми, проліків або гідрату.
7. Фармацевтична композиція за п. 2, що містить близько 4-10 масових частин сполуки І або її фармацевтично прийнятної солі, стабілізованої форми, проліків або гідрату і 1 масову частину карбонату натрію.
8. Фармацевтична композиція за п. 7, де близько 6,7 масових частин сполуки І або її фармацевтично прийнятної солі, стабілізованої форми, проліків або гідрату комбінують із 1 масовою частиною карбонату натрію.
9. Фармацевтична композиція за п. 1, що містить близько 4-10 масових частин сполуки формули І або її фармацевтично прийнятної солі, стабілізованої форми, проліків або гідрату і 1 масову частину бікарбонату натрію.
10. Фармацевтична композиція за п. 8, де близько 6,7 масових частин сполуки формули І або її фармацевтично прийнятної солі, стабілізованої форми, проліків або гідрату, комбінують із 1 масовою частиною бікарбонату натрію.
11. Фармацевтична композиція за п. 2, що додатково містить інгібітор дегідропептидази.
12. Фармацевтична композиція за п. 11, де інгібітором дегідропептидази є циластатин.
13. Сполука, представлена формулою II:
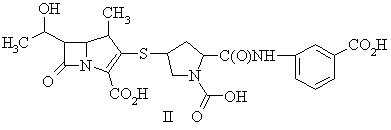
або її фармацевтично прийнятна сіль, проліки або гідрат.
14. Фармацевтична композиція, що містить сполуку, представлену формулою II:

або її фармацевтично прийнятну сіль, проліки або гідрат у комбінації з фармацевтично прийнятним носієм.
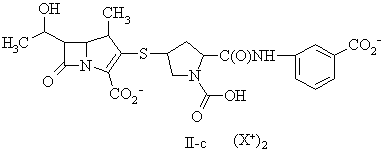
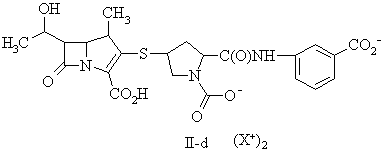
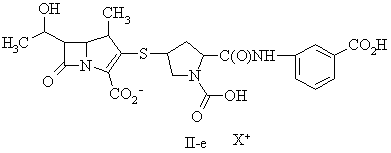
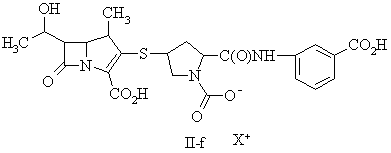
15. Сполука за п. 13, де фармацевтично прийнятну сіль вибирають із групи, до складу якої входять:
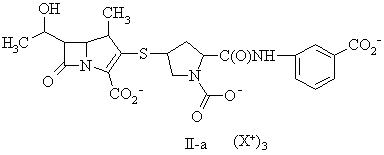 ,
,
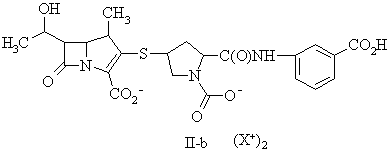 ,
,
 ,
,
 ,
,
 ,
,
 ,
,
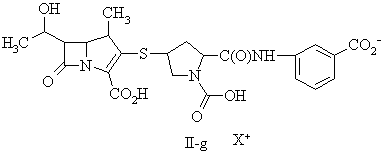 ,
,
де X+ являє собою фармацевтично прийнятну катіонну групу.
16. Фармацевтична композиція, яку одержують комбінуванням сполуки формули І:

або її фармацевтично прийнятної солі, проліків або гідрату, з джерелом діоксиду вуглецю.
17. Фармацевтична композиція за п. 16, де джерело діоксиду вуглецю вибирають із діоксиду вуглецю, карбонату натрію і бікарбонату натрію.
18. Фармацевтична композиція за п. 17, де джерелом діоксиду вуглецю є карбонат натрію або бікарбонат натрію.
19. Спосіб стабілізації карбапенему формули І:

або його фармацевтично прийнятної солі, проліків або гідрату, що полягає в додаванні до даної сполуки достатньої кількості джерела діоксиду вуглецю для утворення сполуки формули II:

або її фармацевтично прийнятної солі, проліків або гідрату.
20. Спосіб за п. 19, де джерело діоксиду вуглецю вибирають із діоксиду вуглецю, карбонату натрію і бікарбонату натрію.
21. Спосіб за п. 20, де джерело діоксиду вуглецю вибирають із карбонату натрію і бікарбонату натрію.
Текст
Цей винахід стосується композиції карбапенемового антибіотика, стабілізованої форми антибіотика і способів його одержання. Композицію можна використовувати при лікуванні інфекційних хвороб, включно викликані грампозитивними і - негативними, аеробними й анаеробними бактеріями. Композиція забезпечує хорошу стабільність проти бета-лактамаз і відповідну тривалість дії. Сутність винаходу: описана фармацевтична композиція, яка містить сполуку формули 1: або його фармацевтично прийнятну сіль, стабілізовану форму, проліки або гідрат у комбінації з джерелом діоксиду вуглецю. Докладний опис винаходу Використовуваний тут термін «стабілізована форма» стосується сполук, які мають карбаматну груп у, утворену біля атому азоту піролідину, як показано на сполуках формули II. Цей карбамат одержують змішуванням сполук формули І або його солі, проліків або гідрату з джерелом діоксиду вуглецю, таким як карбонат натрію або бікарбонат натрію. Приклади показані на сполуках формули II і формул від ІІ-а до ll-g. Термін «проліки» стосується сполук з групою, яка видаляється, приєднаною до гідроксилу гідроксиетильного бокового ланцюга (положення 6 кільця карбапенему), карбоновою кислотою в положенні 3 кільця карбапенему або групою мета-карбонової кислоти на кільці фенілу бокового ланцюга. Групи, які придатні для утворення проліків, повинні бути очевидні фахівцю з медичної хімії з наведених тут даних. Серед прикладів - аліл, ацетил, бензилоксикарбоніл, метоксиметил, трет-бутоксикарбоніл, триметилсиліл тощо. Термін «гідрат» використовують в загальноприйнятному сенсі для включення сполук формул І і II в фізичній асоціації з водою. Цей винахід стосується фармацевтичних композицій, які містять карбапенемові антибіотичні сполуки: а також його солі, стабілізовані форми, проліки і гідрати. Сполука формули І є карбапенемовим антибіотиком, що є особливо придатним для внутрішньовенного або внутрішньом'язового введення. В одному аспекті винаходу фармацевтичну композицію виготовляють із будь-яким фармацевтично прийнятним буфером, який при розчиненні забезпечить рН від приблизно 6,0 до приблизно 9,0. Наприклад, кращим фармацевтично прийнятним буфером є бікарбонат натрію. Кращим значенням рН композиції при розчиненні від приблизно 6,2 до приблизно 8,5. В іншому аспекті винаходу є стабілізована форма сполуки, показана нижче як формула II. Звичайно, для утворення сполуки формули II із сполукою формули І можна використовувати будь-яку сполуку, яка при розчиненні дає діоксид вуглецю. Композиції цього винаходу звичайно виготовляють із використанням джерела діоксиду вуглецю. Кращими джерелами діоксиду вуглецю є діоксид вуглецю (газоподібний, рідкий або твердий), карбонати і бікарбонати, а ще кращими - карбонат натрію і бікарбонат натрію, які можна вводити до складу готової препаративної форми, так, щоб при розчиненні одержувати відповідне значення рН, наприклад біля 6,2-8,5. Природне значення рН мононатрієвої солі сполуки І приблизно 5,4. Сполуки формули І можна синтезувати відповідно до патенту США №5478820, виданим Betts et al. 26 грудня, 1995, зміст якого наводиться тут у якості посилання. Сполука формули І у ліофілізованій або неліофілізованій формі, змішана з сполукою, яка утворює діоксид вуглецю, такою, як карбонат натрію або бікарбонат натрію, перетворюється в сполуку формули II. Звичайно сполуки формули II можна синтезувати змішуванням сполуки формули І із джерелом діоксиду вуглецю і потім розчиненням суміші в відповідному розчиннику. Сполуку формули 1 можна змішати з джерелом діоксиду вуглецю і суміш розчинити, що звичайно призводить до утворення сполуки формули II. В багатьох випадках слід надати перевагу розчиненню сполуки формули І із сполукою, яка утворює діоксид вуглецю, у водяному розчиннику з наступною ліофілізацією утвореної композиції, що забезпечує утворення суміші, яка містить сполуки формули II. При розчиненні сполука формули II (II і від На до llg) після певного часу перетворюється в сполуки формули І (I, I-а, І-b і I-c). Порошок сполуки формули І може бути змішаний із сполукою, що утворює діоксид вуглецю, так, щоб при розчиненні або відновленні утворювалась сполука формули II або її сіль, проліки або гідрат. Відповідно до іншого варіанта, сполуку формули І і сполуку, яка утворює діоксид вуглецю, можна змішати в розчині для утворення сполуки II, після чого композицію ліофілізують, щоб забезпечити утворення композиції, яка містить сполуку формули II або її сіль, проліки або гідрат. Кількість карбонату натрію або бікарбонату натрію, яка використовується в композиції, може змінюватися в широких межах. Наприклад, кількість карбонату натрію в готовій препаративній формі може змінюватися від такого низького значення, як біля 0,025г карбонату натрію/грам лікарського засобу, до такого високого значення, як біля 0,25г карбонату натрію/грам лікарського засобу. Таким же чином кількість бікарбонату натрію в го товій препаративній формі може змінюватися від такого низького значення, як біля 0,025 г/грам лікарського засобу, до такого високого значення, як біля 0,7г/грам лікарського засобу. Для регулювання рН композиції при розчиненні або перетворенні можна включити інші сполуки. їх прикладами є гідроксид калію, гідроксид натрію, N-метилглюкамін тощо. Одна готова препаративна форма, що викликає особливий інтерес, містить біля 3-6 масових частин, переважно біля 4,5 масових частин, сполуки І або її фармацевтично прийнятної солі, стабілізованої форми, проліків або гідрату і 1 масову частину бікарбонату натрію. Перевагу слід надавати карбапенему у формі мононатрієвої солі. Значення рН, яке одержують при розчиненні цієї готової препаративної форми, приблизно 6,5. Виготовлення даного лікарського засобу за цим способом може підвищити стабільність продукту в розчині. Інша готова препаративна форма, яка викликає особливий інтерес, містить біля 4-10 масових частин, переважно біля 6,7 масових частин, сполуки І або його фармацевтично прийнятної солі, стабілізованої форми, проліків або гідрату і 1 масову частину карбонату натрію. Перевагу слід надати карбапенему у формі мононатрієвої солі. Значення рН, які одержують при розчиненні цієї готової препаративної форми, приблизно 7,5. Виготовлення даного лікарського засобу за цим способом може підвищити стабільність продукту в розчині. Як згадувалося вище, сполуку формули І або II можна використовувати в ліофілізованій або неліофілізованій формі. Ліофілізовану форму одержують із використанням стандартних способів ліофілізації. В композицію згідно з цим винаходом, крім того, можна включити додаткові компоненти. Оскільки композицію переважно вводять ін'єкцією, то в її склад можна ввести різні розріджувачі, буфери, консерванти, місцево-анестезуючі засоби, засоби, що регулюють тонічність, та інші компоненти. Репрезентативними прикладами розріджувачів є стерильна вода для ін'єкції, ізотонічний розчин, 5% розчин декстрози (D5W), лактатований розчин Рінгера тощо. Кращим розріджувачем є ізотонічний розчин або стерильна вода для ін'єкції. Репрезентативними прикладами буферів є фосфатний буфер, такий як однозаміщений фосфат натрію, цитратний буфер, такий, як цитрат натрію, меглумін і три(гідроксиметил)-амінометан. Репрезентативними прикладами консервантів є бутилгідроксиацетон (ВНА), бутилгідрокситолуол (ВНТ) і хлорид бензалконію. Репрезентативними прикладами місцево-анестезуючих засобів є бензокаїн, лідокаїн, новокаїн, понтокаїн тощо. Репрезентативними прикладами агентів, що модифікують тонічність, є хлорид натрію, маніт, декстроза, глюкоза, лактоза і сахароза. Репрезентативними прикладами фармацевтичних наповнювачів є вода, маніт, сорбіт, декстроза, лактоза, глюкоза, лекстран, сахароза, мальтоза, желатини, альбумін бичачої сироватки iBSA), гліцин, маноза, рибоза, полівінілпіролідон (PVP), похідні целюлози, глутамін, інозит, глутамат калію, еритрит, серин й інші амінокислоти. Якщо сполуку формули І готують у вигляді фармацевтичної композиції з відповідною кількістю карбонату натрію або бікарбонату натрію, будь-який або усі з різновидів компонентів, описаних тут, можуть міститись в готовій препаративній формі при розведенні або відновленні. Сполука І представляє нестабілізовану форму вільної кислоти. Тому в неї введено різноманітні сольові форми сполуки формули І, такі, як солі від формули І-а до І-е. Значення X' представляє катіон, який врівноважує заряд і є присутнім в асоціації з сполукою, якщо необхідно підтримувати нейтральність загального заряду. Типово зарядженим різновидом може бути утворюючий фармацевтично прийнятну сіль іон, такий як іон натрію, калію, магнію тощо. У випадках, коли в сполуці присутні два карбоксилатні аніони, як у формулі 1-а, або коли є присутньою напівмолярна кількість відносно сполуки, така, як у формулі І-b або 1-c, може також бути присутнім двовалентний різновид, такий як Са2+. Коли протиіон має біскатіонний різновид, наприклад Са2+, то він звичайно є присутнім у відповідній кількості відносно залишку карбапенему, щоб забезпечити нейтральність загального заряду. Таким чином, для підтримки загальної нейтральності заряду з монокарбоксилатом може бути включена напівмолярна кількість Са 2+. Всі такі приклади здійснення включені в цей винахід. Чисельні іони, які утворюють солі, перераховуються в статті Berge, S. Μ. , et al. J. Pharm. Sci. 66(1): 1-16 (1977), зміст якої вводиться тут у якості посилання. Кращою групою катіонів, які утворюють солі, представлених X’, є іон, вибраний із групи, до складу якої входять натрій, калій, кальцій і магній. Ще кращим X’ є іон, вибраний із групи, в склад якої входять Na+, Са+2 і К+. Шляхом введення відповідної кількості сполуки, що утворює діоксид вуглецю, переважно бікарбонату натрію або карбонату натрію, утворюють одну або кілька таких стабілізованих структур. Сполуку II, наведену ви ще, називають формою вільної кислоти стабілізованої сполуки. Сполуки від ІІ-а до ll-g є прикладами сольових форм стабілізованої сполуки, Кількість сполуки, що утворює діоксид вуглецю, наприклад, бікарбонату натрію або карбонату натрію, яку вводять в композицію, таку, яка є достатньою для утворення сполук від формули II до формули llg і яка необов'язково забезпечує бажане рН композиції при розчиненні або переутворенні. Для забезпечення електронного балансу і нейтральності загального заряду є присутніми від нуля до трьох позитивно заряджених протиіонов. В композицію можна внести різні протиіони. Отже, в фармацевтичну композицію для забезпечення загальної нейтральності заряду, можуть бути введені разом, наприклад, кальцій і натрій. Протиіони можна, таким чином, варіювати в широких межах. Звичайно протиіон або протиіони є фармацевтично прийнятними катіонними різновидами. Карбапенемова сполука згідно з цим винаходом є придатною для лікування бактеріальних інфекцій у тварин і людей. Термін «фармацевтично прийнятна сіль» стосується ти х сольових форм, які будуть очевидними фахівцеві з фармацевтичної хімії, тобто тих форм, які фактично нетоксичні і які забезпечують бажані фармакокінетичні властивості, приємний смак, абсорбцію, розподіл, метаболізм або екскрецію. Іншими чинниками, більш практичними за природою, які також є важливими при виборі, є ціна вихідних матеріалів, легкість кристалізації, вихід, стабільність, гігроскопічність і сипкість одержуваної маси лікарського засобу. Фармацевтичні композиції можна зручно одержати з активних інгредієнтів у комбінації з фармацевтично прийнятними носіями. Таким чином, цей винахід стосується фармацевтичних композицій і способів лікування бактеріальних інфекцій, що використовують карбапенемові сполуки. Карбапенем можна використовувати в різноманітних фармацевтичних препаратах. Композиції для ін'єкції, кращого шляху доставки, можна одержати в уніфікованій лікарській формі або в контейнері з багатьма дозами. Композиції можуть мати такі форми, як суспензії, розчини або емульсії, олійні або водяні за природою, і можуть містити різноманітні утворюючі форми агенти, такі як розріджувачі, буфери, консерванти тощо. Отже, сполука є присутньою у комбінації з цими фармацевтично прийнятними носіями. Альтернативно активний інгредієнт може бути у формі порошку, який можна переутворити рідиною, такою, як стерильна вода, ізотонічний розчин тощо, під час введення. Порошок може бути в ліофілізованій або неліофілізованій формі. Репрезентативні пероральні композиції типово бувають у формі таблеток, капсул, розчинів або суспензій. Такі композиції можуть також бути упакованими в контейнери з уніфікованою дозою або великою кількістю доз. В цих пероральних композиціях фармацевтично прийнятні носії можуть містити розріджувачі, таблетуючі і гранулюючі додатки, змазувальні засоби, дезінтегруючі агенти, буфери, речовинипідсолоджувачі, консерванти тощо. Композиції для місцевого застосування можуть бути виготовлені з фармацевтично прийнятними носіями у формі гідрофобних або гідрофильних мазей, кремів, лосьйонів, розчинів, фарб або порошків . Доза, яка підлягає введенню, значною мірою залежить від стану і розміру ссавця-пацієнта, якого лікують, а також шляху доставки і частоти введення. Слід надавати перевагу парентеральному шляху (ін'єкціям). Композиції для доставки людині, незалежно від того, рідкі вони або тверді, на уніфіковану дозу можуть містити від біля 0,01% до біля 99% активного матеріалу, причому діапазон, якому слід надати перевагу, становить біля 10-60%. Композиція звичайно буде містити від біля 10мг до біля 3000мг активного інгредієнта, проте в загальному випадку слід надати перевагу використанню дозованої кількості в діапазоні від біля 100 мг до біля 1000мг. При парентеральному введенні уніфікована доза звичайно є сполукою в стерильній воді або фізіологічному розчині або сполукою, що перебуває в формі порошку, призначеного для розчинення або переутворення. Кращий спосіб введення сполуки формули І парентеральним шляхом внутрішньовенної (в. в.) інфузії. Альтернативно, сполуки можна ввести внутрішньом'язовою (в.м.) ін'єкцією. Для дорослого пацієнта дозу від біля 5 до біля 50мг антибактеріальної сполуки формули І на кг маси тіла вводять від 1 до 6 разів на день. Краща доза складає від біля 100мг до біля 1000мг сполуки, яку дають від одного до чотирьох разів на день, переважно 1-2 рази на день, найбільшу перевагу слід надати одному разу щоденно. Конкретніше, для слабких інфекцій краща доза - від біля 100мг до біля 1000мг для введення від одного до чотирьох разів щоденно, найбільшу перевагу слід надати одному разу щоденно. Для середніх інфекцій краща доза від біля 500мг до біля 1000мг для введення від одного до чотирьох разів щоденно. Для сильних, небезпечних для життя інфекцій краща доза становить приблизно 1000-2000мг для уведення від одного до шести разів щодня. Для дітей краща доза 5-25мг/кг маси тіла, яка вводиться від 1 до 4 разів на день; найбільшу перевагу слід надати дозу 10мг/кг, яка вводиться від одного до чотирьох разів щодня. Сполука формули І ставиться до широкого класу сполук, відомих як карбапенеми. Карбапенеми , які зустрічаються в природі, сприйнятливі до впливу ниркового ферменту, відомого як дегідропептилаза (DHP). Цей вплив або деградація може знизити ефективність карбапенемового антибактеріального агента. Сполука, яка використовується в цьому винаході, значно менше піддається такому впливу і, отже, використання інгібітору DHP може бути непотрібним. Проте використання інгібітору DHP необов'язкове, і розглядається як введене в цей винахід. Інгібітори DHP і їх використання з карбапенемовими антибактеріальними агентами описується в заявках на Європейські патенти №79102616. 4, поданої 24 липня 1979 (патент № 0 007 614) і №82107174.3, поданої 9 серпня 1982 (публікація №0072014). Сполуку згідно з цим винаходом, коли інгібування DHP є бажаним або необхідним, можна комбінувати або використовува ти з підхожим інгібітором DHP, як описано в показаних вище патентах і опублікованій заявці. Цитована заявка на Європейський патент встановлює спосіб визначення сприйнятливості цих карбапенемів до DHP і описує відповідні інгібітори, комбіновані композиції і способи лікування. Краще масове відношення сполуки формули І: інгібітор DHP у комбінованих композиціях складає біля 1:1. Кращим інгібітором DHP є 7-(L-2-аміно-2-карбоксиетилтіо)-2-(2,2-диметилциклопропанкарбоксамід)-2гептенова кислота або її сіль, відома як циластатин. Карбапенем активний проти різних грампозитивних і в меншому ступені -грамнегативних бактерій, і тому знаходить застосування в медицині і ветеринарії. Фармакокінетичний профіль композиції, описаної тут, несподівано є кращим, ніж такі профілі родинних сполук. Репрезентативні приклади фармацевтичних композицій, що містять описані тут сполуки, наводяться нижче. Композиція 1 Сполука І 4,5г Бікарбонат натрію 1,0г Порошок включає суміш вказаних вище інгредієнтів. Сполука І перебуває в формі мононатрієвої солі. Одержуване значення рН водяного розчину (225мл) приблизно 6,5. Композиція 2 Сполука І 6,7г Карбонат натрію 1,0г В склад порошку входить суміш вказаних вище інгредієнтів. Сполука І перебуває у формі мононатрієвої солі. Одержуване значення рН водяного розчину (335мл) приблизно 7,5. ПРИКЛАД 45,4мг/мл (еквівалентно Сполука І 36мг безводної вільної кислоти) Бікарбонат натрію, USP 8,0мг/л Хлорид натрію, USP 4,0мг/л В склад порошку входить суміш інгредієнтів, вказаних вище в композиції 1, і змішується з водою (скільки знадобиться, до 1,0 мл). Кінцеві значення рН розчину наводяться нижче. Стабільність розчину цієї готової препаративної форми для внутрішньовенного введення визначали при 25°С і одержали такі результати. % сполуки, що залишилося в розчині при; Кон-цен. (мг/мл) Початкове рН Кінцеве РН 36мг/мл 6,7 7,3 *12мг/мл 7,0 7,4 1год 96,7 98,6 2год 95,7 98,0 4год 94,1 97,2 6год 91,8 96,5 8год 89,9 95,0 к(год-1) 0,010438 0,004994 t90% 7.3 21,0 Незважаючи на те, що деякі кращі приклади здійснення винаходу описані тут докладно, численні альтернативні приклади здійснення розглядаються як такі, що знаходяться в межах долученої формули винаходу. Отже, винахід цим не обмежується.
ДивитисяДодаткова інформація
Назва патенту англійськоюCarbapeneme antibiotic, a composition and a method for the preparation
Назва патенту російськоюКарбапенемовый антибиотик, композиция и способ получения
Автори російськоюKaufman, Michael, J.
МПК / Мітки
МПК: A61K 31/00, A61K 31/40, A61P 31/04, A61K 31/397, A61K 31/407, A61P 31/00, C07D 477/00
Мітки: композиція, карбапенемовий, антибіотик, одержання, спосіб
Код посилання
<a href="https://ua.patents.su/5-62920-karbapenemovijj-antibiotik-kompoziciya-ta-sposib-oderzhannya.html" target="_blank" rel="follow" title="База патентів України">Карбапенемовий антибіотик, композиція та спосіб одержання</a>
Попередній патент: Спосіб (варіанти) та композиція для лікування астми
Наступний патент: Свердловинний заряд вибухової речовини (варіанти)
Випадковий патент: Консервування та контрольована доставка/вивільнення сперматозоїдів









