Спосіб тривалого зберігання мікроводоростей
Формула / Реферат
1. Спосіб тривалого зберігання мікроводоростей, який складається з культивування клітин з використанням середовищ культивування, переведення клітин в анабіотичний стан шляхом дегідратації та реактивації, що включає зволоження клітин, який відрізняється тим, що дегідратацію мікроводоростей проводять на стадії стаціонарного росту при температурі 30-60 °С до залишкової вологості клітин 8-14 %, а реактивацію сухих одноклітинних водоростей проводять при освітленості 2 кЛк шляхом зволожування живильним середовищем, розведеним в співвідношенні 1:1 дистильованою водою, температура якої 30 °С.
2. Спосіб за п. 1, який відрізняється тим, що збезводнені культури утримують у герметичному впакуванні, без доступу світла і при температурі навколишнього середовища 15-20 °С.
Текст
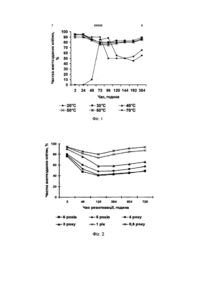
1. Спосіб тривалого зберігання мікроводоростей, який складається з культивування клітин з використанням середовищ культивування, переведення клітин в анабіотичний стан шляхом дегідратації та реактивації, що включає зволоження клітин, який відрізняється тим, що дегідратацію мікроводоростей проводять на стадії стаціонарного росту при температурі 30-60 °С до залишкової вологості клітин 8-14 %, а реактивацію сухих одноклітинних водоростей проводять при освітленості 2 кЛк шляхом зволожування живильним середовищем, розведеним в співвідношенні 1:1 дистильованою водою, температура якої 30 °С. 2. Спосіб за п. 1, який відрізняється тим, що збезводнені культури утримують у герметичному впакуванні, без доступу світла і при температурі навколишнього середовища 15-20 °С. Передбачуваний винахід відноситься до прикладної гідробіології і альгології та призначений для тривалого зберігання мікроводоростей в наукових і навчальних установах, а також може бути використаний в біотехнологічній промисловості для зберігання штамів музейних культур. Надійне збереження культур мікроводоростей і створення банків штамів є однією з важливих задач сучасної біології. Практичне значення винаходу пов'язане зі зростаючою потребою науки й біотехнології постійно мати у своєму розпорядженні життєздатні та стабільні культури, а також із проблемою збереження біорізноманіття флори України. В альгологічної практиці використовують широкий спектр методів, які дозволяють зберігати мікроводорості в життєздатному стані. Це тримання мікроводоростей на рідких середовищах тривалого зберігання [Marsalek В., Rojickova, 1988], агарі, альгінаті [Chen Х. С, 2003], за допомогою ліофілізації та криосбереження з використанням захисних середовищ і криопротекторів [Айздайчер H.A., Силкин В.А., 1983]. Однак при використанні цих методів відбувається зміна морфологічних і функціональних властивостей, а також здрібніння клітин культур, які зберігають. Крім того, підтримка культур у життєздатному стані є трудомістким процесом і вимагає дорогого устаткування. Для збереження мікроорганізмів протягом тривалого часу застосовують висушування (зневоднювання) - переведення клітин у стан ангідробіозу. Ангідробіоз -глибоке та тривале гальмування метаболізму, оборотне при сприятливих умовах і досить розповсюджене явище в природі. Способи тривалого збереження культур, що застосовують, повинні відповідати двом основним вимогам: поперше, процес збезводнення не повинен шкідливо впливати на клітини; по-друге, збезводнені клітини повинні тривалий час зберігати свої біохімічні властивості [Колесов С.Г., 1952, 1959]. Клітини різних видів мікроорганізмів можуть бути висушені на повітрі при кімнатній або злегка підвищеній температурі в стерильному ґрунті, у кварцовому піску, на гранульованій пемзі, на тальку, на активованому (19) UA (11) 86908 (13) C2 (21) a200803311 (22) 17.03.2008 (24) 25.05.2009 (46) 25.05.2009, Бюл.№ 10, 2009 р. (72) ХАРЧУК ІРИНА ОЛЕКСІЇВНА, UA (73) ІНСТИТУТ БІОЛОГІЇ ПІВДЕННИХ МОРІВ ІМ. О.О. КОВАЛЕВСЬКОГО НАЦІОНАЛЬНОЇ АКАДЕМІЇ НАУК УКРАЇНИ, UA (56) RU C 2108382, 10.04.1998 EP A 0145197, 19.06.1985 FR A 2676454, 20.11.1992 WO A 9302210, 04.02.1993 Вопросы управления биосинтезом низших растений. - Новосибирск: Наука, 1982. - С. 139-143 Методы хранения коллекционных культур микроорганизмов. - М.: Наука, 1967. - С. 119-135 Беккер М.Е. Обезвоживание микробной биомассы и экстра-целлюлярных метаболитов. - Рига: Зинатне, 1967. - С. 74-77 Microbiological Reviews. - 1994. - Vol.58, №4. P.755-805 3 86908 4 вугіллі, на зернах злаків, на дисках агару, на папеність клітин мікроводоростей; Фіг. 2 - Вплив строку рі, на вовняних нитках і багатьох інших «носіях» і зберігання на життєздатність мікроводоростей в зберігатися протягом багатьох років у життєздатстані ангідробіозу; Фіг. 3 - Вплив умов реактивації ному стані [Бекер М.Е. Обезвоживание микробной на життєздатність культури, що реактивується (1 биомассы и экстрацеллюлярных метаболитов. хлорид натрію, 2 -розведене середовище Заррук Рига: Зинатне, 1967. - С. 74-77.; Бекер М.Е., Куд(1:1), 3 - середовище Заррук). рявцев В.И. Лиофилизация бактерий // Методы У способі збезводнюють клітини мікроводорохранения коллекций культур. - М: Наука, 1967. - С. стей, що досягли необхідних якісних характерис119 - 135.; Potts M. Desiccation tolerance of proтик у процесі культивування. Відомо [Далакян Т.А., karyotes // Microbiol Rev. - 1994. - Vol. 58, №4. - P. Волкова Е.Р., Недосекин А.Г., 1984], що кожна з 755-805]. Недоліком цих методів є те, що вони фаз росту мікроводоростей характеризується яскрозроблені для бактерій і дріжджів. Досліджень по раво вираженою спрямованістю потоку вуглецю в ангідробіозу мікроводоростей у літературі зустріодин з основних блоків метаболізму клітин. У лочається вкрай мало. Дослідження ангідробіозу гарифмічній фазі синтезується білок, у фазі вповімікроводоростей представлені [див. Нестеренко льнення швидкості росту - вуглеводи, у стаціонарТ.В. Реактивация микроводорослей из состояния ній фазі, особливо наприкінці фази, накопичуються сухого анабиоза. // Вопросы управления биосинтеліпіди. Для максимального збереження життєздатзом низших растений. - Новосибирск: Наука, 1982. ності клітини необхідно збезводнювати на стаціо- 139 с], де розглядається процес реактивації клінарній стадії росту, тому що накопичені вуглеводи тин. Недолік методу полягає в тому, що при звоі ліпіди - найефективніші джерела збереження ложенні клітин хлоридом натрію, з урахуванням енергії та грають життєво важливу роль у стабільконцентрації розчинів, яка залежить від ступеня ності до різних фізіологічних стресів. У пропоновависушування мікроводоростей, відбувається втраному способі культивування мікроводоростей прота клітинного вмісту. водять у накопичувальному режимі, при цьому В основу винаходу «Спосіб тривалого зберіклітини перебувають у стаціонарній фазі росту. гання мікроводоростей» поставлена задача шляЕкспериментальні дослідження впливу умов хом вибору умов де- і регідратації, забезпечити збезводнення клітин на їх життєздатність, які прооптимальне збереження життєздатності клітин ведені автором, дозволили зробити вибір оптимамікроводоростей тривалий час. льної температури зневоднювання (див. Фіг. 1 і Поставлена задача досягається тим, що в Табл. 1). пропонованому способі, якій складається з переАвтором експериментально визначений оптиводу мікроводоростей у стан ангідробіозу, зберемальний діапазон залишкової вологості (8-14%). ження мікроводоростей у збезводненому стані, Зміна залишкової вологості всього на 2% виявлявиведенні з ангідробіозу, дегідратацію мікроводолася критичною для збереження життєздатності ростей проводять на стадії стаціонарного росту клітин у висушеному стані. при температурі 30-60°С до залишкової вологості Розведення середовища водою і нагрівання клітин 8-14%. Реактивацію сухі одноклітинних воперешкоджають розвитку осмотичного шоку в реадоростей проводять при освітленості 2 кЛк шляктивуємих клітинах. Стабілізуючу дію на мембрани хом зволожування живильним середовищем, розпри осмотичному шоку роблять іони кальцію, які веденим дистильованою водою в співвідношенні присутні в поживних розчинах. Визначення опти1:1 температура якої 30°С. Через 2ч водорості, що мального режиму регідратації здійснили в експереактивують, розводять культуральним середорименті на прикладі водорості Spirulina platensis, вищем тієї ж концентрації та температури. Збезвирощеної на середовищі Зарук. Використали три воднені культури зберігають у герметичному впарозчини: 1) хлорид натрію 0,25 М, 2) середовище куванні, без доступу світла й при температурі Заррук, розведене дистильованою водою в співнавколишнього середовища 15-20°С. відношенні 1:1, 3) повне середовище Заррук (не Спосіб пояснюється ілюстраціями. На Фіг.1 розведене). Результати представлені в Табл. 2 Вплив температури зневоднювання на життєздатТаблиця 1 Життєздатність клітин мікроводорості при різних температурах дегідратації № п/п Типи життєздатності клітин (по Мейсель, 1961) 1 Повноцінні, неушкоджені 2 Злегка ушкоджені, що швидко відновлюють свої функції 3 Сильно ушкоджені, що повільно відновлюються Необратимо ушкоджені, що продовжують здійснювати порушений 4 обмін речовин 5 Мертві Частка реактивованих клітин, % Температура дегідратації, °3 20 30 40 50 60 70 50 80 80 78 75 45 40 15 15 16 15 40 10 5 5 6 10 15 5 86908 6 Таблиця 2 Залежність життєздатності реактивуємої культури Spirulina platensis від виду і температури розчинів, використаних для регидратації Часовий інтервал, ч 1 1,5 2 24 Хлорид натрію 20 30,0 40,0 60,0 65,0 30 50,0 60,0 80,0 80,0 Кількість життєздатних клітин, % Середовище Заррук (1:1) Повне середовище Заррук Температура розчинів, °З 20 30 20 30 50,0 80,0 35,0 70,0 55,0 85,0 40,0 75,0 60,0 95,0 50,0 90,0 65,0 95,0 55,0 90,0 Найбільший відсоток життєздатних клітин відзначено при зволоженні середовищем Заррук (1:1), при t=30°C. Результати дослідження впливу умов реактивації на життєздатність реактивуємої культури (див. Фіг.3) підтверджують необхідність її витримування при освітленості 2 кЛк. Спосіб реалізується таким чином. Мікроводорості, що культивували, збезводнюють на стаціонарній стадії росту в температурному діапазоні 30-60°С до залишкової вологості клітин 8-14%. Дегідровані культури поміщають у герметичний поліетиленовий пакет, а потім у пластиковий ємність. Зберігають у спеціальному приміщенні (боксі) без доступу світла і температурі навколишнього середовища 15-20°С. Для реактивації збезводнені клітини мікроводоростей зволожують середовищем для культивування розведеним дистильованою водою в співвідношенні 1:1 і підігрітим до 30°С. Приклад. Про- і еукариотичні мікроводорості, які культивували на різних середовищах (Spirulina platensis - середовище Заррук; Synechococcus sp, Phaeodactylum tricornutum, Porphyridium cruentum - середовище Тренкеншу), збезводнювали на стаціонарній стадії росту в термостаті при температурі 30-60°С до залишкової вологості клітин Spirulina platensis 9-11%, Synechococcus sp. - 811%, Phaeodactylum tricornutum - 12-14%, Porphyridium cruentum - 10-11%. Дегідратовані клітини упаковували в герметичні поліетиленові пакети, а потім у пластикові бокси. Зберігали в спеціальному приміщенні без доступу світла й температурі навколишнього середовища 15-20°С. За необ хідністю зі сховища вилучали зразки мікроводоростей. Навіски мікроводоростей поміщали в чашки Петри й зволожували середовищем культивування (Spirulina platensis - середовищем Заррук; Synechococcus sp, Phaeodactylum tricornutum, Porphyridium cruentum - середовищем Тренкешпу), розведеним дистильованою водою в співвідношенні 1:1 і підігрітим до 30°С. Чашки Петри зі зволоженими клітинами мікроводоростей виставляли на люміностат з освітленістю 2 клк. Через 2 години додавали культуральне середовище тієї ж концентрації та температури. Прокариотичні мікроводорості більш стійкі до зневоднювання в порівнянні з еукариотичними. Вихідні розміри клітин Synechococcus sp. відновлювалися через 30 хв. послу початку реактивації, a Spirulina platensis - через 24 години. В еукариотичній мікроводорості Porphyridium cruentum вихідні розміри відновлювалися через 10 днів, а Phaeodactylum tricornutum - протягом 1 місяця. Процес розподілу після реактивації починається: в Synechococcus sp. - через 24 години, в Spirulina platensis - через 2 тижні, в Phaeodactylum tricornutum й Porphyridium cruentum - через 1 місяць. Зберігання мікроводоростей в стані ангідробіозу не приводило до втрати життєздатності клітин (див. Фіг.2). Основна перевага способу тривалого зберігання мікроводоростей, якій заявляється, є простота й надійність. Перевагою є те, що пропонований метод оптимально наближений до природних умов, економічно вигідний і дає можливість рекомендувати його для використання в біотехнологічних, наукових і навчальних цілях. 7 86908 8 9 Комп’ютерна верстка В. Мацело 86908 Підписне 10 Тираж 28 прим. Міністерство освіти і науки України Державний департамент інтелектуальної власності, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюMethod for long-term storage of microalgae
Автори англійськоюKharchuk Iryna Oleksiivna
Назва патенту російськоюСпособ продолжительного хранения микроводорослей
Автори російськоюХарчук Ирина Алексеевна
МПК / Мітки
МПК: C12N 1/04
Мітки: тривалого, мікроводоростей, зберігання, спосіб
Код посилання
<a href="https://ua.patents.su/5-86908-sposib-trivalogo-zberigannya-mikrovodorostejj.html" target="_blank" rel="follow" title="База патентів України">Спосіб тривалого зберігання мікроводоростей</a>