Індолсульфонамідні модулятори рецепторів прогестерону
Номер патенту: 94600
Опубліковано: 25.05.2011
Автори: Люгар Третій Чарлз Уілліс, Річардсон Тімоті Айво, Йє Ін Квон, Мехл Брайан Стефан, Блейш Томас Джон, Ю Куо-лон, Джоунз Скотт Алан, Додж Джеффрі Алан, Кларк Крістьян Александер, Лопес Хосе Едуардо
Формула / Реферат
1. Сполука формули І:
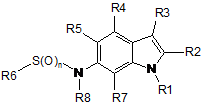 , І
, І
де n - 1 або 2;
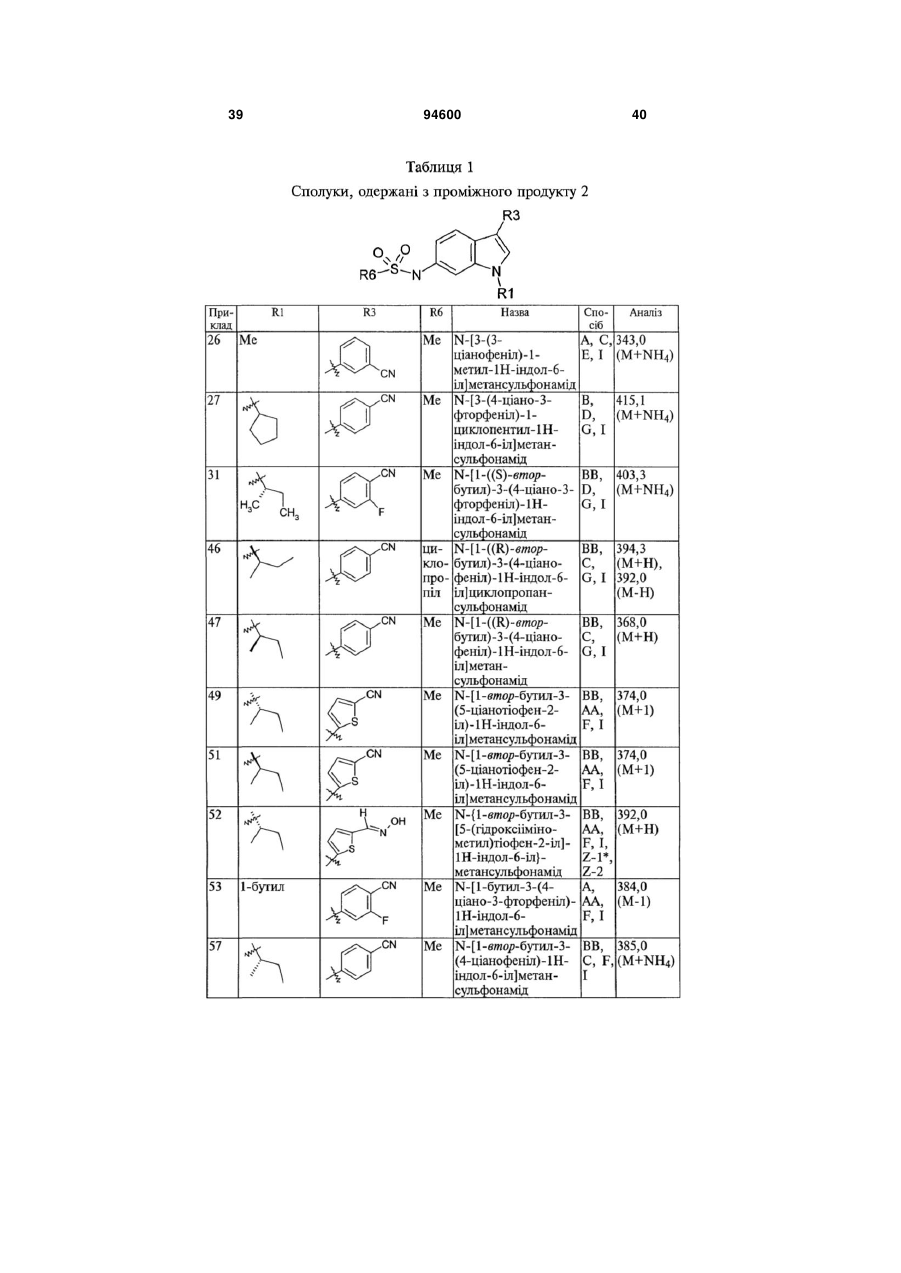
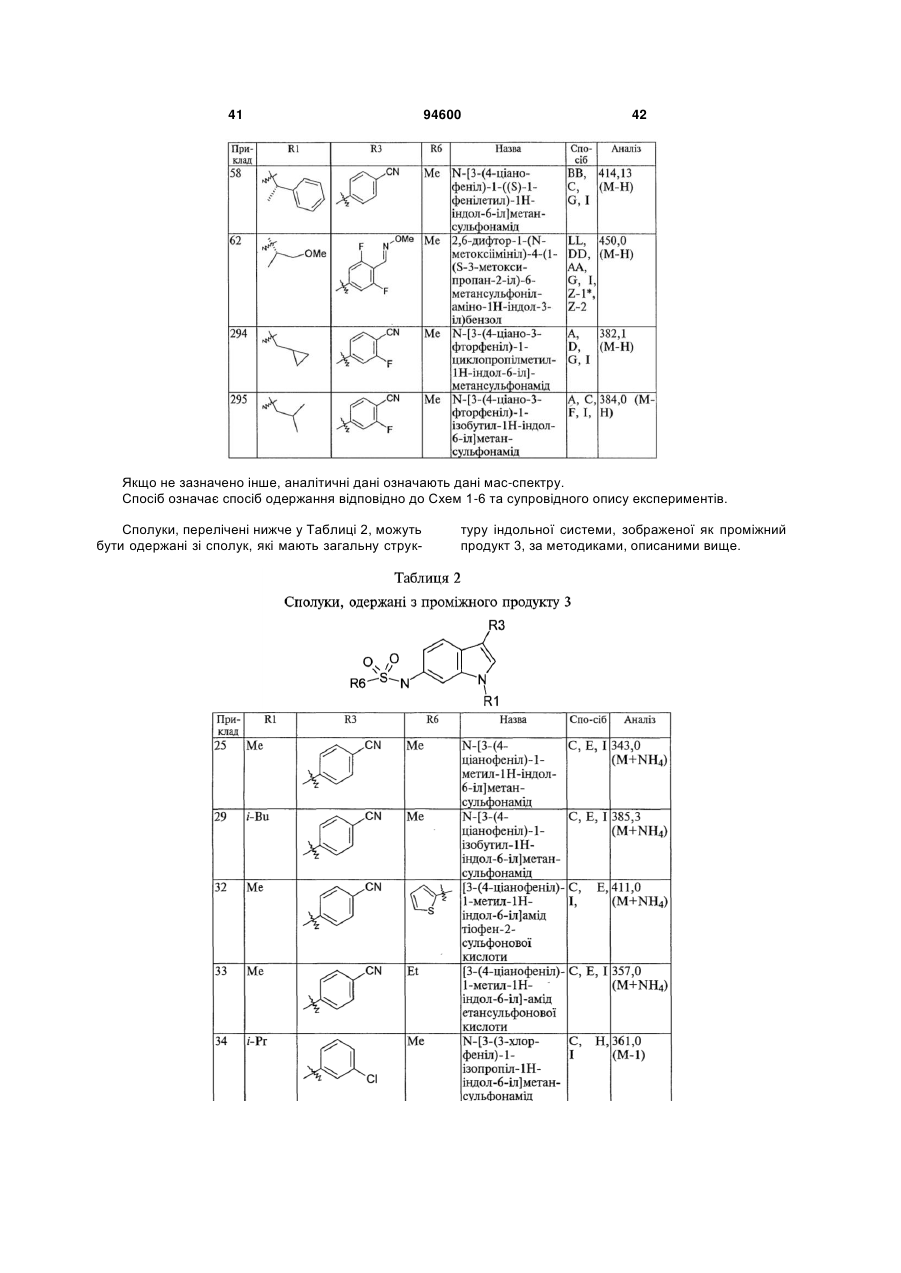
R1 вибраний з групи, яку складають: С1-С8-алкіл, С1-С6-алкіл-О-С1-С6-алкіл, С3-С8-циклоалкіл, С1-С6-алкілциклоалкіл, С0-С3-алкіл-С(О)ОR12, С1-С6-алкіларил, арил, С1-С6-алкілпіридиніл, піридиніл, тетрагідрофураніл, тетрагідропіраніл, -SОnС1-С6-алкіл, -SОnС0-С6-алкілциклоалкіл та -SОn-піридиніл, де кожен зі згаданих арилу та піридинілу, згаданих окремо або у комбінації з алкільною групою, факультативно заміщений 1-3 замісниками, індивідуально вибраними з групи, яку складають -CN та -ОСН3, за умови, що арил не є заміщеним виключно двома або трьома алкоксизамісниками;
R2 вибраний з групи, яку складають Н, галоген та С1-С6-алкіл;
R3 вибраний з групи, яку складають: бензо[1,3]діоксол, бензотіофеніл, хромен-2-іл, 2,3-дигідробензо[1,4]діоксиніл, 2,3-дигідробензофураніл, 2,3-дигідро-1H-індоліл, 1,3-дигідробензоімідазол-2-іл, 1,3,-дигідроіндол-2-іл, фураніл, індан-1-іл, індазоліл, ізоксазоліл, феніл, піразоліл, піридиніл, 1,2,3,4-тетрагідрохінолініл, тіофеніл та тіазоліл, кожен з яких факультативно заміщений 1-3 замісниками, індивідуально вибраними з групи, яку складають: галоген, -CN, -NO2, -NH2, С1-С3-алкіл, С2-С3-алкініл, С1-С3-галогеналкіл, С1-С3-гідроксіалкіл, -ОС1-С3-алкіл, -ОС1-С3-галогеналкіл, -SCH3, -(C(S)NH2), -C=N-OH, -С=N-ОС1-С6-алкіл, -С(О)ОСН3, C(O)NH2, 1-метилтетразол-5-іл, C(O)R12 та (С(О)NНС3-циклоалкіл);
кожен з R4, R5 та R7 є Н;
R6 вибраний з групи, яку складають: С1-С6-алкіл та тіофеніл;
R8 вибраний з групи, яку складають: Н, С1-С4-алкіл;
R12 вибраний з групи, яку складають: Н, С1-С6-алкіл, С1-С6-алкілциклоалкіл та NH2;
або фармацевтично прийнятна сіль цієї сполуки.
2. Сполука за п. 1, де R6 - СН3.
3. Сполука формули І за п. 1, де:
R1 вибраний з групи, яку складають: С1-С6-алкіл, С3-С8-циклоалкіл,
С1-С6-алкілциклоалкіл, С1-С4-алкіл-О-С1-С4-алкіл;
R2 - H;
R3 вибраний з групи, яку складають: феніл, тіофеніл, піридиніл, піразоліл, фураніл, тіазоліл та бензотіофеніл, кожен з яких факультативно заміщений 1-3 замісниками, індивідуально вибраними з групи, яку складають: галоген, -CN, С1-С3-алкіл, С1-С3-галогеналкіл, -NO2, -ОС1-С3-алкіл, -C(O)R12, -С=N-ОС1-С5-алкіл та -C=N-OH;
R6 - С1-С3-алкіл;
R8 - H;
R12 вибраний з групи, яку складають: Н, С1-С6-алкіл та С1-С6-алкілциклоалкіл;
або фармацевтично прийнятна сіль цієї сполуки.
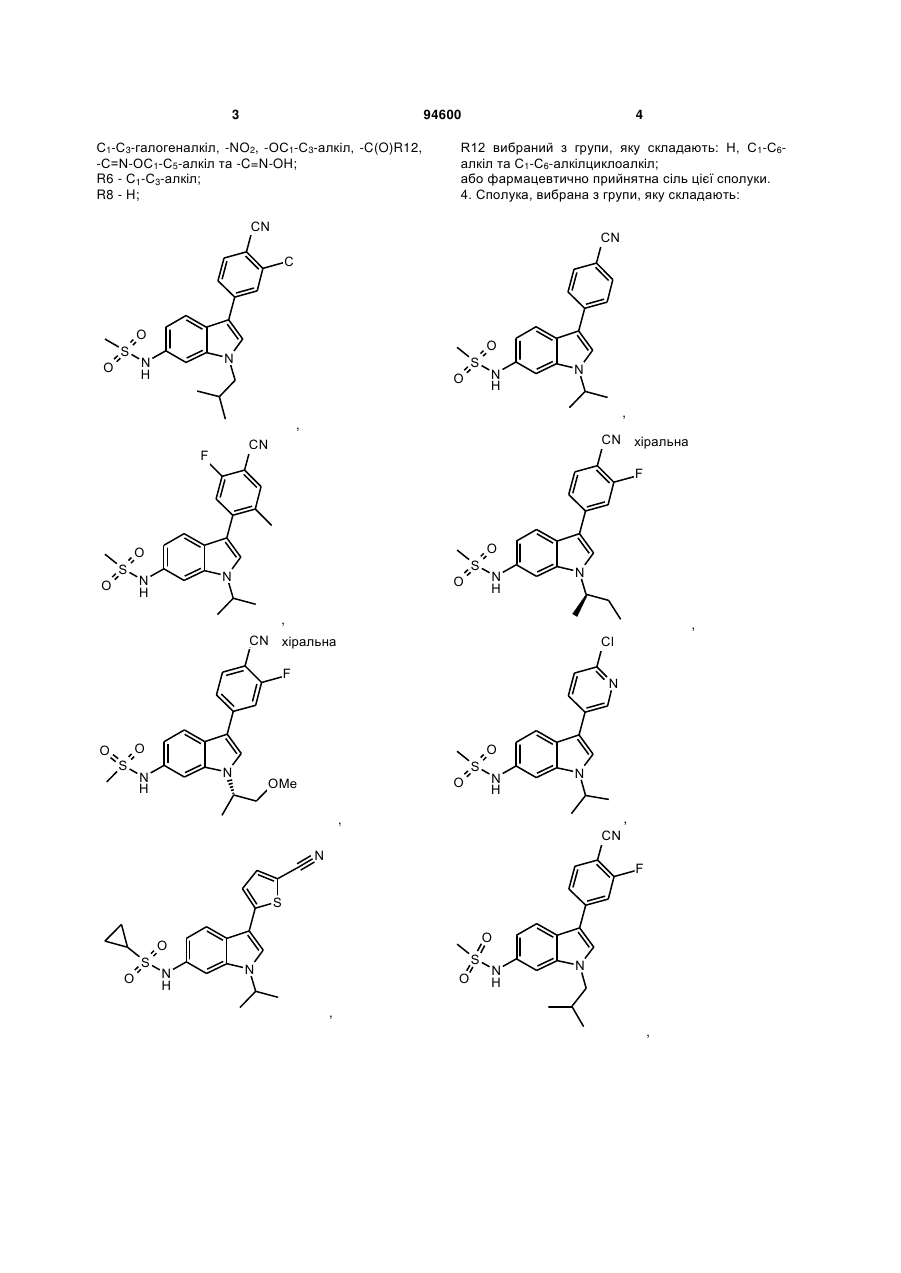
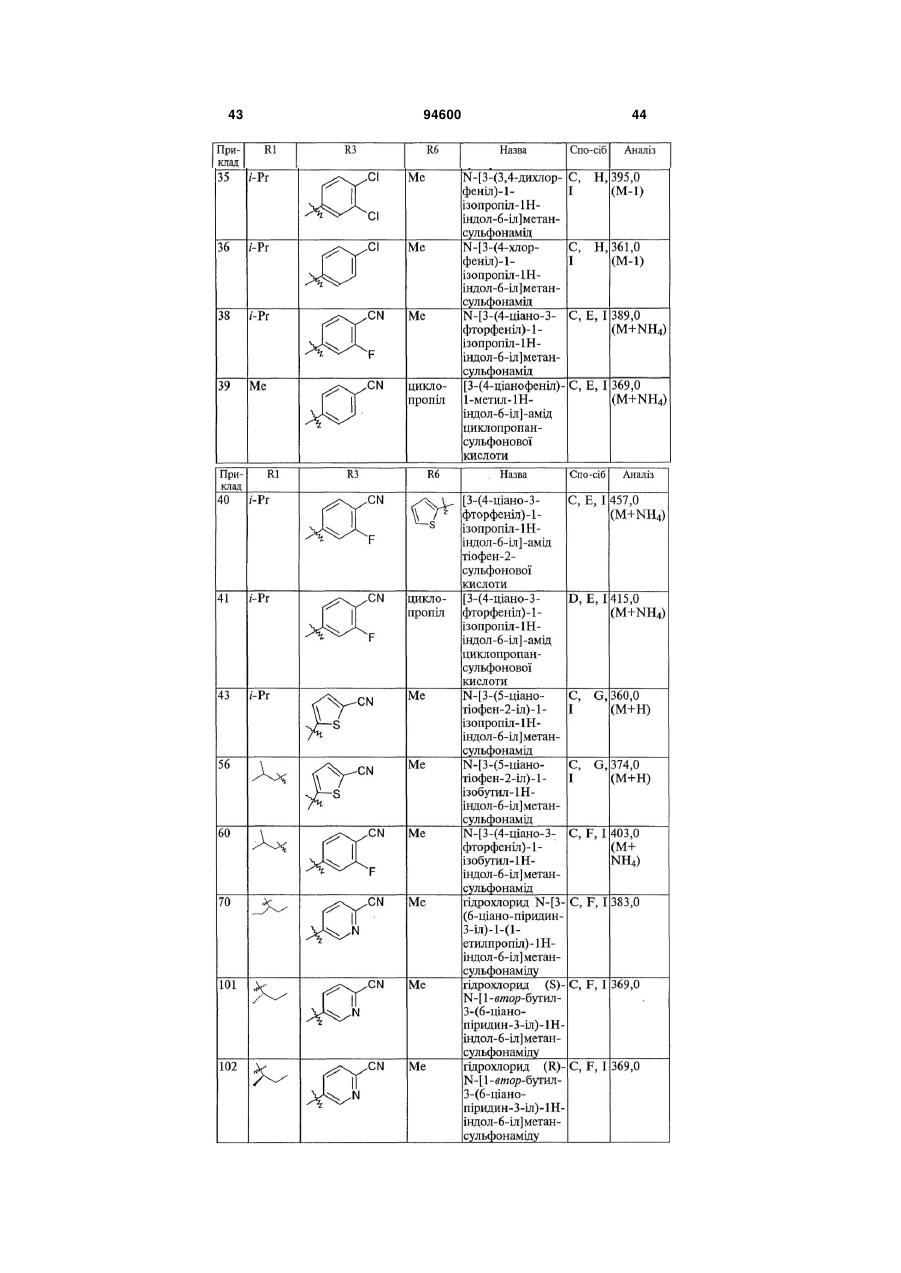
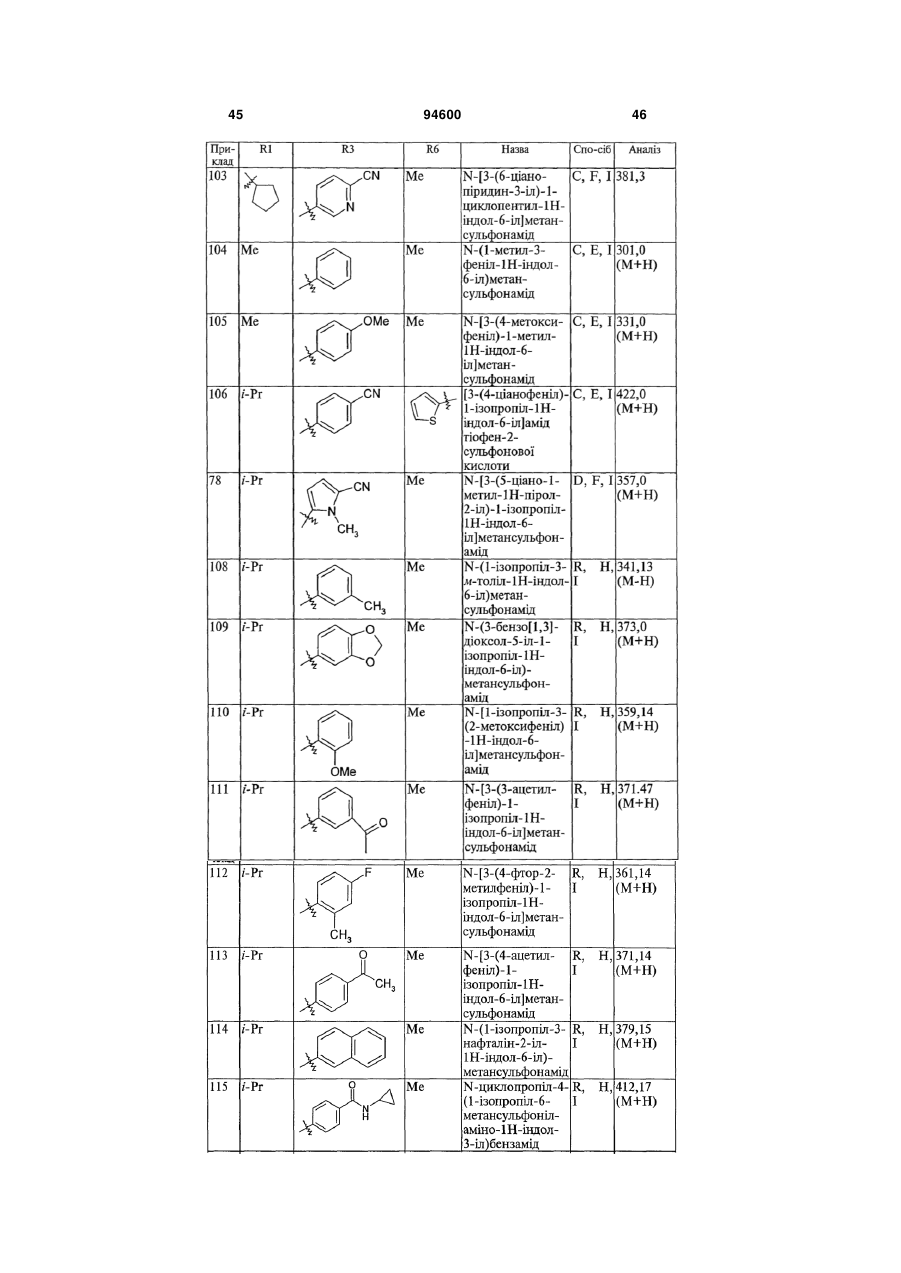
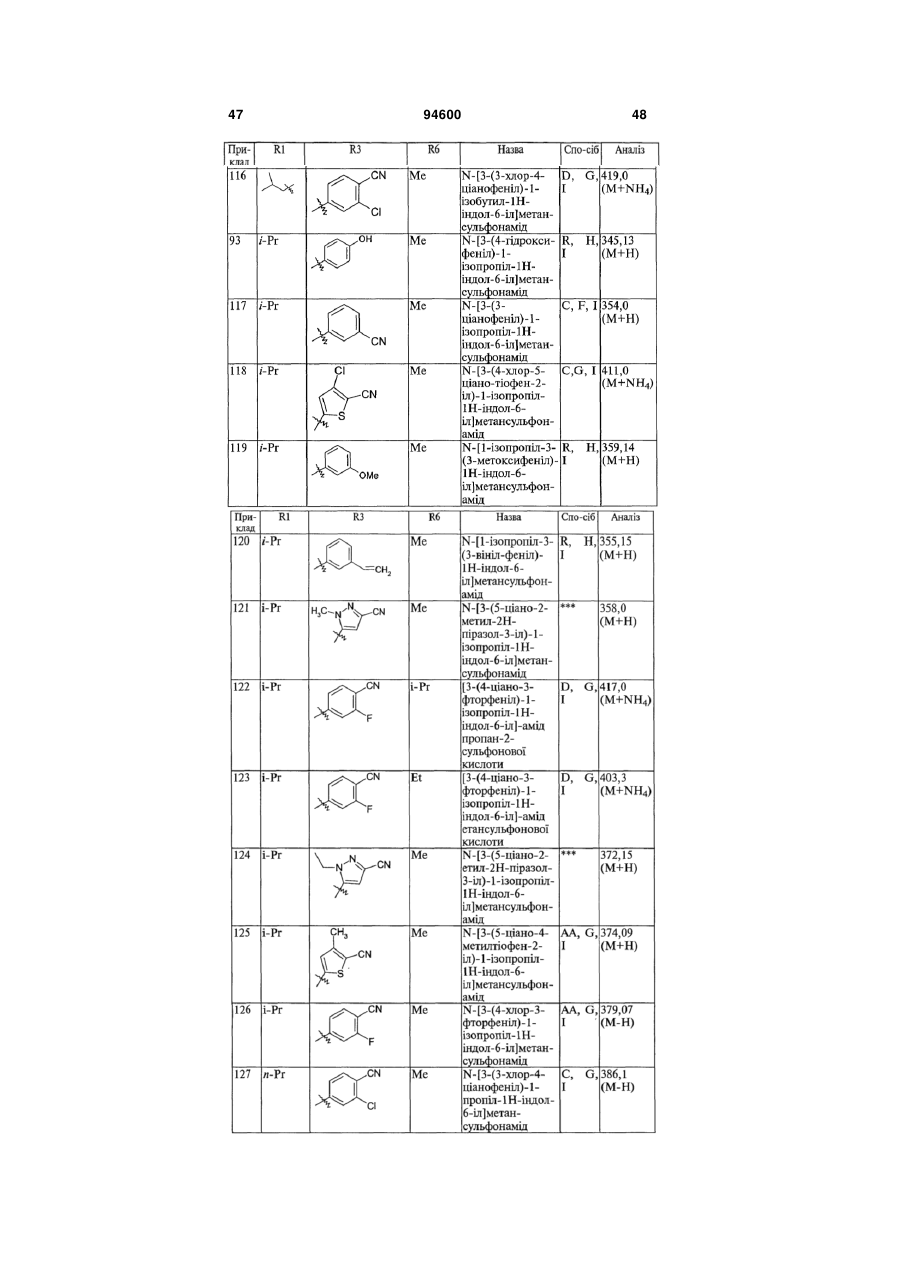
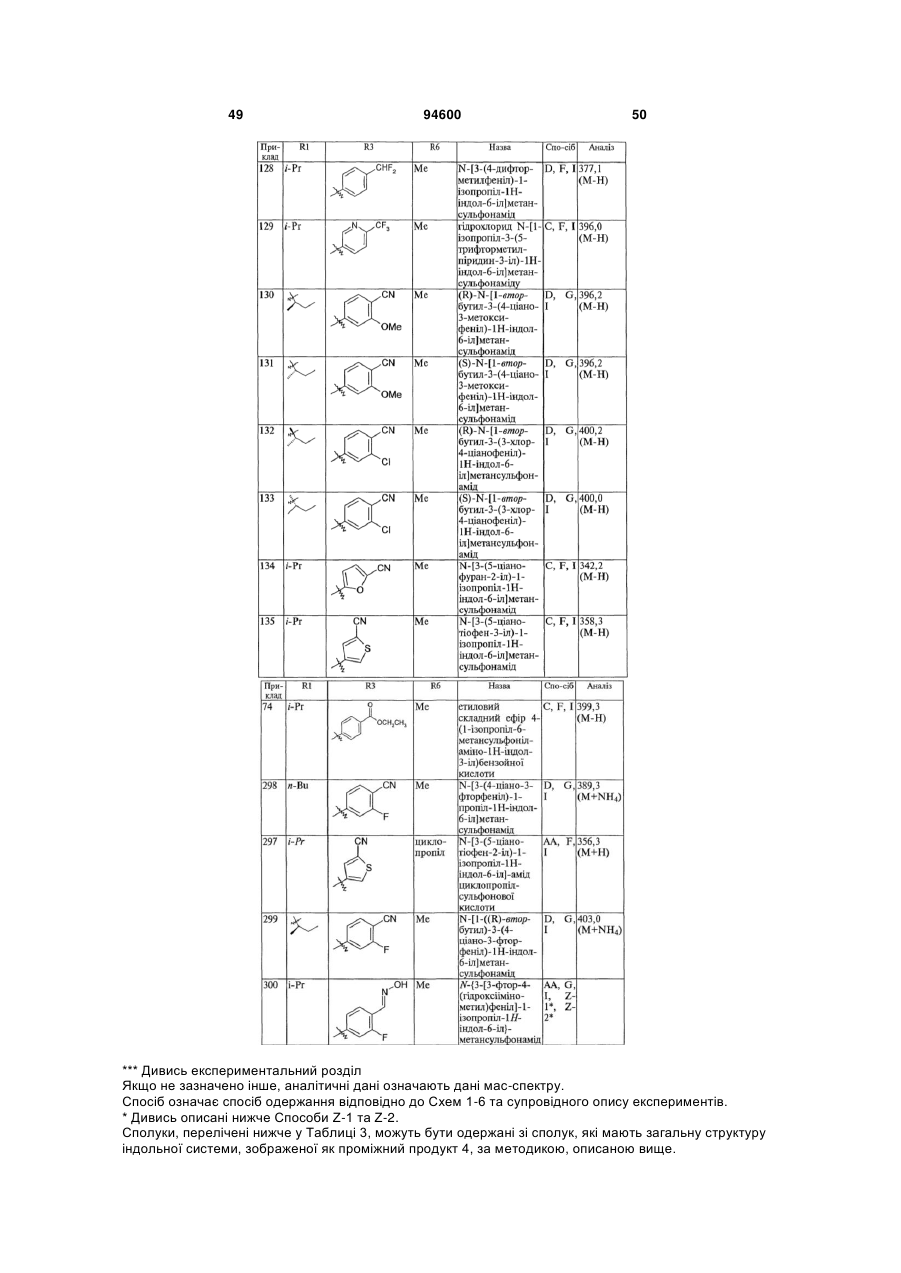
4. Сполука, вибрана з групи, яку складають:
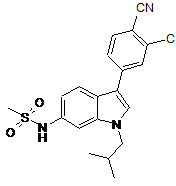 ,
,
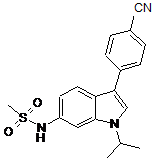 ,
,
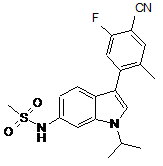 ,
,
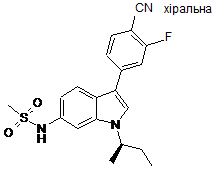 ,
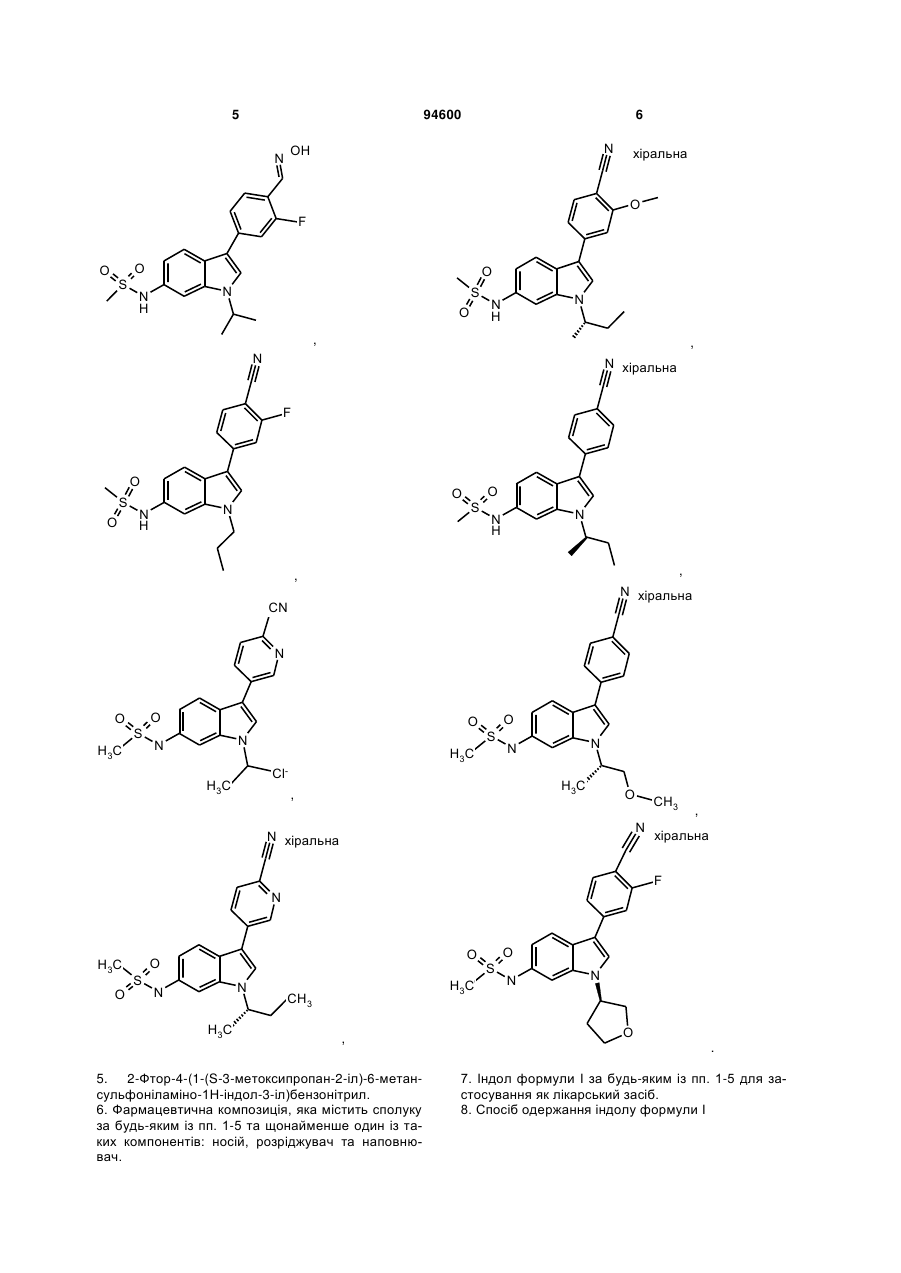
,
 ,
,
 ,
,
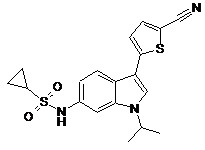 ,
,
 ,
,
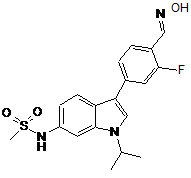 ,
,
 ,
,
 ,
,
 ,
,
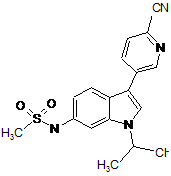 ,
,
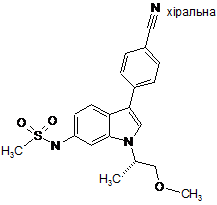 ,
,
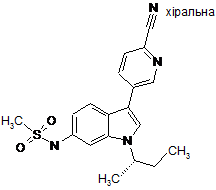 ,
,
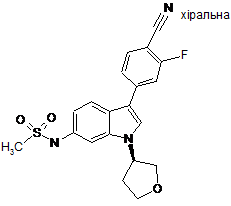 .
.
5. 2-Фтор-4-(1-(S-3-метоксипропан-2-іл)-6-метансульфоніламіно-1Н-індол-3-іл)бензонітрил.
6. Фармацевтична композиція, яка містить сполуку за будь-яким із пп. 1-5 та щонайменше один із таких компонентів: носій, розріджувач та наповнювач.
7. Індол формули І за будь-яким із пп. 1-5 для застосування як лікарський засіб.
8. Спосіб одержання індолу Формули І
 І
І
або фармацевтично прийнятної солі цієї сполуки,
де
n - 1 або 2;
R1 вибраний з групи, яку складають: С1-С8-алкіл, С1-С6-алкіл-О-С1-С6-алкіл, С3-С8-циклоалкіл, С1-С6-алкілциклоалкіл, С0-С3-алкіл-С(O)OR12, С1-С6-алкіларил, арил, С1-С6-алкілпіридиніл, піридиніл, тетрагідрофураніл, тетрагідропіраніл, -SОnС1-С6-алкіл, -SОnС0-С6-алкілциклоалкіл та -SОnпіридиніл, де кожен зі згаданих арилу та піридинілу, вказаних окремо або у комбінації з алкільною групою, факультативно заміщений 1-3 замісниками, індивідуально вибраними з групи, яку складають -CN та -ОСН3; за умови, що арил не є заміщеним виключно двома або трьома алкоксизамісниками;
R2 вибраний з групи, яку складають Н, галоген, С1-С6-алкіл;
R3 вибраний з групи, яку складають бензо[1,3]діоксол, бензотіофеніл, хромен-2-іл, 2,3-дигідробензо[1,4]діоксиніл, 2,3-дигідробензофураніл, 2,3-дигідро-1H-індоліл, 1,3-дигідробензоімідазол-2-іл, 1,3,-дигідроіндол-2-іл, фураніл, індан-1-іл, індазоліл, ізоксазоліл, феніл, піразоліл, піридиніл, 1,2,3,4-тетрагідрохінолініл, тіофеніл та тіазоліл, кожен з яких факультативно заміщений 1-3 замісниками, індивідуально вибраними з групи, яку складають: галоген, -CN, -NO2, -NH2, С1-С3-алкіл, С2-С3-алкініл, С1-С3-галогеналкіл, С1-С3-гідроксіалкіл, -О-С1-С3-алкіл, -О-С1-С3-галогеналкіл, -SCH3, -(C(S)NH2), -C=N-OH, -С=N-ОС1-С6-алкіл, -С(О)ОСН3, C(O)NH2, 1-метилтетразол-5-іл, C(O)R12 та (С(О)NНС3-циклоалкіл);
кожен з R4, R5 та R7 є Н;
R8 вибраний з групи, яку складають: Н, С1-С4-алкіл;
R12 вибраний з групи, яку складають: Н, С1-С6-алкіл, С1-С6-алкілциклоалкіл та NH2;
або фармацевтично прийнятна сіль цієї сполуки;
причому у згаданому способі здійснюють сполучення сполуки формули II
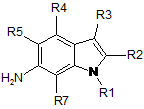 II
II
з основою та R6SO2Cl,
де R6 вибраний з групи, яку складають: С1-С6-алкіл та тіофеніл.
9. Застосування сполуки формули І для виготовлення лікарського засобу для лікування та/або попередження лейоміоми у ссавців, яке включає введення в організм згаданого ссавця терапевтично ефективної дози сполуки формули І за будь-яким із пп. 1-5 або фармацевтично прийнятної солі цієї сполуки.
10. Застосування сполуки формули І для виготовлення лікарського засобу для лікування або попередження ендометріозу, яке включає введення в організм пацієнта, який цього потребує, ефективної кількості сполуки формули І за будь-яким із пп. 1-5 або фармацевтично прийнятної солі цієї сполуки.
11. Фармацевтична композиція, яка містить сполуку формули І за будь-яким із пп. 1-5, для лікування лейоміоми або ендометріозу.
Текст
1. Сполука формули І: R4 R3 C2 2 (19) 1 3 94600 С1-С3-галогеналкіл, -NO2, -ОС1-С3-алкіл, -C(O)R12, -С=N-ОС1-С5-алкіл та -C=N-OH; R6 - С1-С3-алкіл; R8 - H; 4 R12 вибраний з групи, яку складають: Н, С1-С6алкіл та С1-С6-алкілциклоалкіл; або фармацевтично прийнятна сіль цієї сполуки. 4. Сполука, вибрана з групи, яку складають: CN CN C O S O O N N H S O N H N , , CN хіральна CN F F O O S N N H O S O N H N , CN хіральна , Cl F O N O S O S N N H O OMe N H N , , CN N F S O O S O N H S N O N H N , , 5 94600 6 N OH N хіральна O F O O S O N N H S O N N H , , N N хіральна F O S O O N N H O S N N H , , N хіральна CN N O O S H3C O N N O S H3 C Cl H3C N N H3 C , O CH3 N N хіральна , хіральна F N H3C O O O S N N H3 C H3C CH3 , 5. 2-Фтор-4-(1-(S-3-метоксипропан-2-іл)-6-метансульфоніламіно-1Н-індол-3-іл)бензонітрил. 6. Фармацевтична композиція, яка містить сполуку за будь-яким із пп. 1-5 та щонайменше один із таких компонентів: носій, розріджувач та наповнювач. O S N N O . 7. Індол формули І за будь-яким із пп. 1-5 для застосування як лікарський засіб. 8. Спосіб одержання індолу формули І 7 R4 94600 R3 R5 R6 S(O)n R2 N N R8 R7 R1 І або фармацевтично прийнятної солі цієї сполуки, де n - 1 або 2; R1 вибраний з групи, яку складають: С1-С8-алкіл, С1-С6-алкіл-О-С1-С6-алкіл, С3-С8-циклоалкіл, С1-С6алкілциклоалкіл, С0-С3-алкіл-С(O)OR12, С1-С6алкіларил, арил, С1-С6-алкілпіридиніл, піридиніл, тетрагідрофураніл, тетрагідропіраніл, -SОnС1-С6алкіл, -SОnС0-С6-алкілциклоалкіл та -SОnпіридиніл, де кожен зі згаданих арилу та піридинілу, вказаних окремо або у комбінації з алкільною групою, факультативно заміщений 1-3 замісниками, індивідуально вибраними з групи, яку складають -CN та ОСН3; за умови, що арил не є заміщеним виключно двома або трьома алкоксизамісниками; R2 вибраний з групи, яку складають Н, галоген, С1С6-алкіл; R3 вибраний з групи, яку складають бензо[1,3]діоксол, бензотіофеніл, хромен-2-іл, 2,3дигідробензо[1,4]діоксиніл, 2,3дигідробензофураніл, 2,3-дигідро-1H-індоліл, 1,3дигідробензоімідазол-2-іл, 1,3,-дигідроіндол-2-іл, фураніл, індан-1-іл, індазоліл, ізоксазоліл, феніл, піразоліл, піридиніл, 1,2,3,4-тетрагідрохінолініл, тіофеніл та тіазоліл, кожен з яких факультативно заміщений 1-3 замісниками, індивідуально вибраними з групи, яку складають: галоген, -CN, -NO2, NH2, С1-С3-алкіл, С2-С3-алкініл, С1-С3-галогеналкіл, С1-С3-гідроксіалкіл, -О-С1-С3-алкіл, -О-С1-С3галогеналкіл, -SCH3, -(C(S)NH2), -C=N-OH, -С=NОС1-С6-алкіл, -С(О)ОСН3, C(O)NH2, 1 Галузь винаходу Цей винахід стосується галузей медичної органічної хімії, фармакології та медицини. Крім того, цей винахід стосується нових сполук та способів, корисних для лікування пухлин, гінекологічних розладів та пов'язаних із ними симптомів та ускладнень. Передумови створення винаходу Найпоширенішими нераковими пухлинами у жінок дітородного віку є лейоміоми. Лейоміоми (або фіброми) матки вважаються доброякісними пухлинами м'язової та сполучної тканин, які розвиваються у стінці матки або приєднані до неї. За даними ультразвукових досліджень, на момент досягнення менопаузи фіброми розвиваються більш ніж у 70% жінок (Берд та ін. - Baird et al., Am. J. Obstet. Gvnecol. 2005; 188: 100-107; Креймер та ін. - Cramer et al. Am. J. Clin. Pathol. 1990; 90: 435438). Симптоми, які вимагають обов'язкового лікування, розвиваються не у всіх жінок, однак у значної кількості жінок спостерігаються симптоми від помірної до сильної інтенсивності, до яких належать анормальні маткові кровотечі, відчуття тиску 8 метилтетразол-5-іл, C(O)R12 та (С(О)NНС3циклоалкіл); кожен з R4, R5 та R7 є Н; R8 вибраний з групи, яку складають: Н, С1-С4алкіл; R12 вибраний з групи, яку складають: Н, С1-С6алкіл, С1-С6-алкілциклоалкіл та NH2; або фармацевтично прийнятна сіль цієї сполуки; причому у згаданому способі здійснюють сполучення сполуки формули II R4 R3 R5 R2 N H2 N R7 R1 II з основою та R6SO2Cl, де R6 вибраний з групи, яку складають: С1-С6алкіл та тіофеніл. 9. Застосування сполуки формули І для виготовлення лікарського засобу для лікування та/або попередження лейоміоми у ссавців, яке включає введення в організм згаданого ссавця терапевтично ефективної дози сполуки формули І за будьяким із пп. 1-5 або фармацевтично прийнятної солі цієї сполуки. 10. Застосування сполуки формули І для виготовлення лікарського засобу для лікування або попередження ендометріозу, яке включає введення в організм пацієнта, який цього потребує, ефективної кількості сполуки формули І за будь-яким із пп. 1-5 або фармацевтично прийнятної солі цієї сполуки. 11. Фармацевтична композиція, яка містить сполуку формули І за будь-яким із пп. 1-5, для лікування лейоміоми або ендометріозу. та болі в тазовій ділянці та репродуктивна дисфункція. Сучасні способи лікування включають хірургічні втручання, наприклад, гістеректомію та міомектомію. До менш радикальних процедур належать емболізація маткової артерії та термоаблятивна коагуляція. До терапевтичних способів лікування належить гормональна терапія. На даний час єдиним способом гормональної терапії, затвердженим Федеральним управлінням з контролю лікарських засобів США (FDA), є застосування агоніста GnRH (гонадотропного гормону) у передопераційний період (Уокер та Стюарт - Walker and Stewart, Science, 2005; 308; 1589-1592.) Тривалість лікування агоністом GnRH часто обмежується 1-3 місяцями, оскільки при його довготривалому застосуванні спостерігається помітна рарефікація кісток, яка призводить до остеопорозу. Крім того, міоми після лікування агоністом GnRH часто знов розростаються до початкового розміру протягом кількох тижнів після припинення лікування. Тому таке лікування часто застосовується з метою зменшення розміру міоми та підготовки жінки до видалення 9 94600 пухлини хірургічним шляхом (Стюарт - Stewart, Lancet, 2001; 357; 293-298). Ці способи спричиняють небажані наслідки для жінок, які мають намір завагітніти в подальшому. Очевидно, що гістеректомія виключає можливість подальшої вагітності, а інші хірургічні втручання також пов'язані з певними ризиками, в тому числі з розривами матки та рецидивами фібром. Терапевтичне лікування також може викликати значні побічні ефекти. Наприклад, агоністи GnRH викликають розвиток в організмі стану, дуже подібного до клімактеричного, з відповідними побічними ефектами, наприклад, з припливами, сухістю вапни та, як згадано вище, втратою щільності кісток. Ці та інші проблеми пояснюють постійну потребу у лікуванні та полегшення гінекологічних розладів, наприклад, міом взагалі, та, зокрема (але не виключно), лейоміом, а також ендометріозу та їх супутніх симптомів. У нижчезазначених літературних джерелах описані як додаткові передумови створення цього винаходу індольні та індолінові сполуки та їх терапевтичне застосування. Мере та ін. (Merce et al.) у WO 2005/013976 описують похідні індол-6-сульфонаміду поданої нижче формули, заміщені, як описано у вказаному документі: , які, за твердженням авторів, є корисними як модулятори 5-НТ-6. Цзі та ін. (Hsieh et al.) у патенті США № 6,933,316 розкривають похідні індолу поданої нижче формули, заміщені, як описано у вказаному документі, 10 та, зокрема, неефективність або низьку ефективність лікування міом, лейоміом та ендометріозу. Таким чином, існує постійна значна потреба в ефективних сполуках та способах лікування пухлин, гінекологічних розладів та пов'язаних із ними симптомів та ускладнень. Цей винахід спрямований на задоволення цієї потреби. Суть винаходу Якщо не вказано інше, у цій заявці буде застосовуватися подана нижче система числових позначень атомів у структурі індолу: Цей винахід пропонує сполуку формули І: , де n - 1 або 2 та R1-R8 відповідають визначенням, наведеним у цьому документі. Для обраних застосувань сполуки за даним винаходом, яким віддається перевага, є селективними модуляторами рецептора прогестерону (SPRM). За іншим аспектом, цей винахід також пропонує фармацевтичну композицію, яка містить сполуку за формулою І, яка відповідає вищенаведеному визначенню, та один або декілька з перелічених складників: носій, розріджувач та наповнювач. Цей винахід також пропонує спосіб виготовлення вищезгаданої сполуки формули І. За одним з аспектів, спосіб включає сполучення сполуки формули II , які, за твердженням авторів, виявляють протиракову дію, зумовлену втручанням у процеси полімеризації/деполімеризації у мікроканальцях. У вищезазначених джерелах немає вказівок на ефективне лікування ненормального розростання тканин або на корисність сполук як лігандів рецепторів прогестерону. Крім того, описані сполуки мають одну або декілька небажаних характеристик, в тому числі низьку біодоступність, низьку спорідненість до зв'язування прогестерону, неспецифічне зв'язування з рецепторами гормонів взагалі, тобто відсутність специфічного зв'язування рецепторів прогестерону (PR), та неефективність або низьку ефективність лікування пухлин взагалі з основою та R6SO2CI. Цей спосіб також включає відновлення нітрогрупи нижченаведеної сполуки формули ІІА до аміну. 11 За іншим аспектом, згаданий спосіб включає заміну галогену (X) у положенні 3 індолу нижченаведеної формули III факультативно заміщеним арилом, факультативно заміщеним гетероарилом або факультативно заміщеним біциклічним арилом або біциклічним гетероарилом. Цей спосіб може включати як першу стадію заміну галогену більш реакційноздатною групою, такою як, наприклад, діоксаборолан, утворений з біс(пінаконато)дибору. За іншим аспектом, цей винахід пропонує спосіб модулювання активності рецептора прогестерону та/або лікування захворювань, опосередкованих модулюванням активності рецептора прогестерону у ссавців, в тому числі тварин та людей (більш конкретно, жінок). Спосіб включає введення в організм пацієнта терапевтично ефективної композиції, яка містить сполуку формули І або фармацевтично прийнятну сіль, сольват, енантіомер, рацемат, діастереомер або суміш діастереомерів відповідної сполуки. За варіантом здійснення, якому віддається перевага, спосіб включає введення сполуки формули І або фармацевтично прийнятної солі, сольвату, енантіомеру, рацемату, діастереомеру або суміші діастереомерів відповідної сполуки, які виявляють високий ступінь селективності зв'язування рецептора прогестерону (PR). За варіантом здійснення, якому віддається більша перевага, сполуки, які вводяться, виявляють у приблизно 5 або більше разів вищу селективність зв'язування рецептора прогестерону, ніж рецептора андрогену (AR), рецептора глюкокортикоїду (GR) та рецептора мінералокортикоїду (MR), що 50 виявлено шляхом порівняння індивідуальних ІС або значень Ki, одержаних при відповідному дослідженні зв'язування. За іншим варіантом здійснення, якому віддається перевага, спосіб включає введення сполуки формули І або фармацевтично прийнятної солі, сольвату, енантіомеру, рацемату, діастереомеру або суміші діастереомерів відповідної сполуки, здатних виявляти ефект агоніста PR, ефект антагоніста PR, частковий ефект агоніста PR, частковий ефект антагоніста PR або комбінацію таких ефектів, або вибраних із розрахунком на досягнення таких ефектів або їх комбінації. За ще одним аспектом, цей винахід пропонує спосіб лікування або полегшення симптомів одного або декількох із таких розладів/синдромів: пухлини; новоутворення; міоми (myomata); лейоміоми (фіброми матки); ендометріоз (аденоміоз); післяопераційні очеревинні рубцеві зрощення; ендометріальна гіперплазія; синдром полікістозного яєчника; карциноми та аденокарциноми матки, яєчника, молочної залози, ободової кишки та передміхурової залози; неплідність; регулювання плідності; жіноча статева дисфункція; інші гінекологічні або 94600 12 менструальні синдроми, наприклад, анормальна або дисфункціональна кровотеча, аменорея, менорагія, гіперменорея та дисменорея; або патологічні наслідки, спричинені вищезгаданими розладами/синдромами у ссавців, у тому числі тварин та людей (більш конкретно, жінок). За ще одним аспектом, цей винахід пропонує спосіб лікування ендометріозу або симптомів та патологічних ускладнень ендометріозу. За іншим аспектом, цей винахід пропонує спосіб лікування або полегшення наслідків гінекологічних або менструальних розладів у ссавців шляхом введення в організм згаданого ссавця терапевтично ефективної дози сполуки формули І або фармацевтично прийнятної солі, сольвату, енантіомеру, рацемату, діастереомеру або суміші діастереомерів. За ще одним аспектом, цей винахід пропонує застосування сполуки для виготовлення лікарського засобу для лікування або покращення симптомів одного або декількох із таких захворювань: лейоміоми, ендометріоз та дисфункціональна кровотеча. Цей винахід також пропонує комплексну терапію, яка застосовується у паралельному, послідовному або періодичному режимі, яка включає застосування сполуки формули І та одного або декількох із таких засобів: селективні модулятори рецептора естрогену (SERM), естроген, агоністи рецептора естрогену, антагоністи рецептора естрогену, селективні модулятори рецептора андрогену (SARM), агоністи та антагоністи гонадотропного гормону (GnRH), прогестерон (Р4), прогестини та інші модулятори та агоністи рецептора прогестерону. Детальний опис винаходу За одним з аспектів, цей винахід пропонує нові сполуки формули І , де: n - 1 або 2; R1 вибраний з групи, яку складають: C1-C8алкіл, С2-С6-алкеніл, С2-С6-алкініл, С1-С6гідроксіалкіл, С1-С6-галогеналкіл, С1-С6-ціаноалкіл, С1-С6-алкіларил, С1-С6-алкілгетероарил, С3-С8циклоалкіл, С1-С6-алкілциклоалкіл, С1-С6алкілдициклоалкіл, С1-С6-алкілгетероцикліл, гетероцикліл, арил, гетероарил, С1-С6-алкіл-О-К9, C0C6-алкіл-C(S)R9, С0-С6-алкіл-СО2R9, -SOnR11, де кожен зі згаданих циклоалкілу, гетероциклілу, арилу та гетероарилу, вказаних окремо або у комбінації з алкільною групою, факультативно заміщений 1-3 замісниками, індивідуально вибраними з групи, яку складають: галоген, -CN, -ОН, оксогрупа, C1-C3-алкіл, C1-C3-галогеналкіл, C1-C3ціаноалкіл, С2-С5-алкеніл, С0-С3-алкіл-NO2, -ОC1 13 C3-алкіл, C1-C3-гідроксіалкіл, C0-C3-aлкiл-NR12R13, C0-C3-aлкiл-C(O)R12, C0-C3-алкіл-C(O)OR12, C(O)NR12R13, C(S)NR12R13, CH2OR12, -SR12, S(O)nR12, -S(O)nNR12R13, -N(R9)C(O)NR12R13, N(R12)C(O)OR13, -N(R12)S(O)nR13, N(R12)S(O)nNR12R13, -C=N-OR10 та -iциклоCN4R9; за умови, що арил та гетероарил не є заміщеними виключно двома або трьома алкоксизамісниками; R2 вибраний з групи, яку складають Н, галоген, -CN, С1-С6-алкіл, С1-С6-галогеналкіл, C3-С6циклоалкіл, С2-С4-алкеніл, С2-С4-алкініл; R3 вибраний з групи, яку складають факультативно заміщений арил, факультативно заміщений гетероарил та факультативно заміщений біциклічний гетероарил; де згадані заміщений арил, заміщений гетероарил та біциклічний гетероарил заміщені 1-3 замісниками, індивідуально вибраними з групи, яку складають: галоген, -CN, -ОН, оксогрупа, C1-C3-алкіл, C1-C3-галогеналкіл, C1-C3ціаноалкіл, С2-С5-алкеніл, С2-С6-алкініл, C0-C3алкіл-NO2, -OC1-C3-алкіл, -ОC1-C3-галогеналкіл, C1C3-гідроксіалкіл, C0-C3-алкіл-NR12R13, C0-C3-алкілC(O)R12, C0-C3-aлкiл-C(O)OR12, -C(O)NR12R13, C(S)NR12R13, -CH2OR12, -SR12, -S(O)nR12, S(O)nNR12R13, -N(R9)C(O)NR12R13, N(R12)C(O)OR13, -N(R12)S(O)nR13, N(R12)S(O)nNR12R13, -C=N-OR10 та -циклоСN4R9; кожен з R4, R5 та R7 незалежно від інших вибраний з групи, яку складають: Н, галоген, -ОН, CN, С1-С6-алкіл, С2-С4-галогеналкіл, С2-С4-алкеніл, С2-С4-алкініл, -ОС1-С4-алкіл, -ОС1-С4-галогеналкіл; R6 вибраний з групи, яку складають: С1-С6алкіл, С1-С6-галогеналкіл, С2-С6-алкеніл, C3-С8циклоалкіл, С1-С6-алкілциклоалкіл, гетероцикліл, C1-C3-алкілгетероцикліл, феніл, C1-C3алкілгетероарил, C0-C3-aлкiл-NR9R10 та N(H)C(O)R9, де кожен зі згаданих циклоалкілу, гетероциклілу, фенілу та гетероарилу, вказаних окремо або у комбінації з алкільною групою, факультативно заміщений 1-3 замісниками, індивідуально вибраними з групи, яку складають галоген, CN, -ОН, оксогрупа, C1-C3-алкіл, C1-C3галогеналкіл, C1-C3-ціаноалкіл, С2-С5-алкеніл, C0C3-алкілNО2, -OC1-C3-алкіл та C1-C3-гідроксіалкіл; R8 вибраний з групи, яку складають: Н, C1-C4алкіл; R9 індивідуально вибраний з групи, яку складають: Н, С1-С6-алкіл, С1-С6-галогеналкіл, C0-C6алкілгетероцикліл, С1-С6-алкілциклоалкіл; С1-С6алкіларил, C0-C6-алкілгетероарил, С1-С6гідроксіалкіл, С2-С6-алкеніл, C3-С8-циклоалкіл; R10 вибраний з групи, яку складають Н, С1-С6алкіл та C3-С8-циклоалкіл; R11 вибраний з групи, яку складають: С1-С6алкіл, -NR9R9, C0-C6-алкілциклоалкіл, арил, гетероарил, де згадані арил та гетероарил факультативно заміщені 1-3 замісниками, індивідуально вибраними з групи, яку складають галоген, -CN та -OC1-C3-алкіл; R12 та R13 індивідуально вибрані з групи, яку складають: Н, С1-С6-алкіл, С1-С6-галогеналкіл, С1С6-алкілциклоалкіл; С1-С6-алкіларил, C0-C6 94600 14 алкілгетероарил, С1-С6-гідроксіалкіл, С2-С6-алкеніл та С3-С8-циклоалкіл; або фармацевтично прийнятні солі цих сполук. За одним з аспектів, до значень R1, яким віддається перевага, належать: С1-С6-алкіл, С1-С6алкеніл, С1-С6-алкініл, С1-С6-галогеналкіл, С3-С8циклоалкіл, С1-С6-алкілциклоалкіл, арил, С1-С6алкіларил, гетероарил, С1-С6-алкілгетероарил, С1С6-алкілгетероцикліл, -SOnR11 та С1-С6-aлкiл-SR9, де кожен зі згаданих циклоалкілу, гетероциклілу, арилу та гетероарилу, вказаних окремо або у комбінації з алкільною групою, факультативно заміщений 1-3 замісниками, індивідуально вибраними з групи, яку складають галоген, -CN, -ОН, -NO2, C1-C3-алкіл, C1-C3-галогеналкіл та C1-C3гідроксіалкіл. За іншим аспектом, до значень R1, яким віддається перевага, належать: гетероцикліл, С1-С6алкілгетероцикліл, арил, С1-С6-алкіларил, гетероарил та С1-С6-алкілгетероарил, кожен з яких факультативно заміщений 1-3 замісниками, індивідуально вибраними з групи, яку складають галоген, CN, -OH, -NO2, C1-C3-алкіл, C1-C3-галогеналкіл та C1-C3-гідроксіалкіл. До значень R3, яким віддається більша перевага, належать: бензо[1,3]діоксол, бензофураніл, бензо[1,2,5]тіадіазоліл, бензотіофеніл, хромен-2оніл, 2,3-дигідробензо[1,4]діоксиніл, 2,3дигідробензофураніл, 2,3-дигідро-1Н-індоліл, 1,3дигідробензоімідазол-2-оніл, 1,3-дигідроіндол-2оніл, фураніл, індан-1-оніл, індазоліл, ізобензофуран-1-оніл, ізоксазоліл, нафталеніл, феніл, піразоліл, піридиніл, піримідил, піроліл, хінолініл, 1,2,3,4тетрагідрохінолініл, тіофеніл, тіазоліл, тетрагідрофураніл та тетрагідропіраніл, кожен з яких факультативно заміщений 1-3 замісниками, індивідуально вибраними з групи, яку складають: галоген, CN, -OH, -NO2, C1-C3-алкіл, C1-C3-галогеналкіл, C1C3-гідроксіалкіл, -O-C1-C3-алкіл, -C(S)NR9R9, C=N-OH, -C=N-OR11 та C(O)R11. До значень R6, яким віддається більша перевага, належать: С1-С6-алкіл, С1-С6-галогеналкіл, С1-С6-алкілгетероцикліл, С3-С8-циклоалкіл, С1-С6алкілциклоалкіл, С2-С6-алкеніл, гетероцикліл та C0C6-aлкiл-NR9R10. До значень R6, яким віддається ще більша перевага, належать С1-С6-алкіл, С1-С6алкілциклоалкіл та гетероцикліл. Обсяг цього винаходу також охоплює лікування та поліпшення незлоякісних паталогічних станів, таких як, наприклад, міоми, лейоміоми (фіброми матки), ендометріоз (аденоміоз), післяопераційні очеревинні рубцеві зрощення та ендометріальна гіперплазія, або патологічних наслідків, спричинених переліченими вище станами. Цей винахід охоплює також регулювання плідності; лікування та/або послаблення неплідності; жіночої статевої дисфункції; та гінекологічних або менструальних розладів або синдромів, наприклад, анормальної або дисфункціональної кровотечі, аменореї, менорагії, гіперменореї та дисменореї, або патологічних наслідків, спричинених переліченими вище захворюваннями, розладами та/або синдромами. Цей винахід охоплює також лікування та/або полегшення злоякісних патологічних станів, напри 15 клад, карциноми та аденокарциноми матки, яєчника, молочної залози, ободової кишки та передміхурової залози, або патологічних наслідків, спричинених переліченими вище захворюваннями, розладами та/або синдромами. Термін «модулювання» охоплює підсилення, послаблення, інгібування, сприяння (агонізм), протидію (антагонізм) впливу рецептора, спрямовані на досягнення експресії гена, та біологічні наслідки такого втручання, але не обмежений вищезгаданими значеннями. Вислів «захворювання, пов'язані з модулюванням рецептора» або «захворювання, опосередковані дією рецептора» означає будь-який фізіологічний розлад будь-якого походження, реакцію на введення в організм модулятора рецептора, тобто агоніста, антагоніста, часткового агоніста або часткового антагоніста та їх сумішей. У структурах, ілюстрованих у цьому описі, подане нижче позначення вказує атом або місце приєднання ілюстрованої групи до решти молекули: Загальні хімічні терміни, вживані при описуванні сполук у цьому документі, мають свої звичайні значення. Наприклад, термін "С1-6-алкіл," або "(С1-С6)-алкіл" або "С1-С6-алкіл" означає нерозгалужений або розгалужений аліфатичний ланцюг з 1-6 атомів вуглецю. Якщо не зазначено інше, термін "алкіл" означає С1-С6-алкіл. Якщо конкретно не зазначено протилежне, атоми вуглецю алкільних груп приєднані до решти згаданої молекули. При вживанні в поєднанні із замісником, згадана алкільна група може бути алкіленовою групою, яка приєднує замісник до решти згаданої молекули. Термін "С0-С6-алкіл" охоплює вищезгадану алкільну групу, однак якщо вживається позначення С0, то алкільна група відсутня. У цьому варіанті здійснення решта групи (груп) приєднана безпосередньо до решти згаданої молекули без проміжного містка, утвореного алкіленовою групою. Терміни алкеніл та алкініл, наприклад, С2-С6алкеніл (або С2-С6-алкініл) у значенні, вживаному у цьому описі, означають, що відповідні групи можуть містити 1, 2 або 3 подвійні зв'язки (або потрійні зв'язки). Якщо група містить більше ніж один подвійний або потрійний зв'язок, то ці подвійні та потрійні зв'язки можуть бути спряженими або неспряженими. У винаході також мається на увазі, що терміни "С1-С6-алкіл", "С2-С6-алкеніл" та подібні терміни також охоплюють згадані алкіл або алкеніл, або подібні групи, які можуть бути хіральними, регіоабо стереоізомерними. Такі хіральні або регіо- чи стереоізомерні групи у ролі замісників також охоплюються цим винаходом. Термін "циклоалкіл" у значенні, вживаному у цьому описі, означає циклічну групу С3-С8, яка містить як члени циклу тільки атоми вуглецю, причому кожний член циклу, який містить атом вуглецю, також містить відповідну кількість атомів водню або факультативно заміщений одним або декіль 94600 16 кома замісниками, які відповідають наведеному у цьому документі опису. Мається на увазі, що термін також передбачає, що цикл може містити один або декілька вуглець-вуглецевих подвійних зв'язків. Термін "гетероцикл", "гетероцикліл" або "гетероциклічна [група]" означає 5-10-членний моноциклічну або конденсовану біциклічну систему, яка може бути насиченою або частково ненасиченою, та може містити 1-5 гетероатомів. Термін "гетероатом" у значенні, вживаному у цьому описі, означає атом, вибраний з-посеред N, S та О. Якщо не зазначено інше, згадані гетероцикл, гетероцикліл або гетероциклічна група можуть факультативно бути заміщені при атомі(ах) вуглецю, азоту або сірки, які входять до складу циклу, одним або декількома замісниками, переліченими нижче. Ця гетероциклічна група приєднана до згаданої сполуки або субструктури. За одним з аспектів, перевага віддається моноциклічним гетероциклам. За іншим аспектом, до гетероциклічних груп, яким віддається перевага, належать бензотіофен, діоксаран, гексаметиленіміногрупа, індоліл, ізохіноліл, морфоліногрупа, піперидиніл, піридиніл, піролідиніл, хіноліл, тетразоліл та тіоморфоліногрупа. Як наслідок, мається на увазі, що термін "алкілгетероциклічна група" або "алкілгетероцикл означає, що до гетероциклу приєднана алкільна група та точкою приєднання до решти згаданої молекули або підструктури є алкільна група (або алкіленова група). Термін "галогеналкіл" у значенні, вживаному у цьому описі, означає алкільну групу (згадану вище), заміщену одним або декількома атомами галогенів, вибраними з-посеред F, Br, СІ та І. У обраних варіантах здійснення даного винаходу, перевага віддається дифторалкілам, наприклад, дифторметильним групам, -CHF2. Термін "гідроксіалкіл" у значенні, вживаному у цьому описі, означає алкільну групу, заміщену одною або декількома гідроксильними групами, де атом вуглецю алкільної групи приєднаний до відповідної молекули або її частини. Термін "алкокси[група]" або "-ОС1-С6-алкіл" у значенні, вживаному у цьому описі, означає алкільну групу, приєднану до відповідної молекули або її частини через атом кисню. Термін "арил" або "факультативно заміщений арил" означає циклічну ароматичну групу. До прикладів арильних груп належать моноциклічні або біциклічні конденсовані системи, наприклад (але без обмеження ними): феніл, нафтилен, фенантрен, антрацен тощо. У разі заміщення, арильна група може бути заміщена одним або декількома замісниками, переліченими нижче. Термін "феніл" або "факультативно заміщений феніл" означає ароматичну групу, яка містить у циклі 6 атомів вуглецю з відповідною кількістю атомів водню. Факультативно заміщена фенільна група може мати один або декілька перелічених нижче замісників, приєднаних до вуглецевих атомів циклу. Термін алкіларил означає алкільну групу, заміщену арильною групою (як описано вище). Наприклад, С1-С6-алкіларил означає, що арильна 17 група приєднана до С1-С6-алкільної групи (або алкіленової групи) та що утворений С1-С6алкіларил приєднаний до решти згаданої молекули через алкільну групу (або алкіленову групу). Алкіларильною групою, якій віддається перевага, є бензил. Термін "гетероарил" або "гетероароматична група" означає заміщену або незаміщену 5-10членну циклічну систему, яка вважається такою, що виявляє ароматичний характер та містить як члени циклу від 1 гетероатому до 4 гетероатомів. Терміни «гетероарил» або «гетероароматичні цикли» у значенні, вживаному в цьому описі, охоплює моноциклічні або конденсовані біциклічні системи. У значенні, вживаному в цьому описі, у біциклічному гетероарилі або гетероароматичній конденсованій системі обидва цикли не обов'язково є ароматичними. Наприклад, термін «конденсовані з бензолом біциклічні системи» охоплюється терміном «гетероарили та гетероароматичні цикли». Якщо не зазначено інше, ароматичний цикл безпосередньо приєднаний до згаданої індольної сполуки або підструктури. Приклади гетероатомів охоплюють: О, S та N. До ілюстративних прикладів гетероарилів належать, але без обмеження ними: бензодіоксоліл, бензимідазоліл, бензофурил, бензотієніл, фурил, імідазоліл, імідазолідиноніл, імідазолоніл, імідазопіридиніл, індазоліл, індоліл, ізотіазоліл, ізобензофураніл, ізоксазоліл, морфолініл, оксадіазоліл, оксазоліл, хініл, піраніл, піразиніл, піразоліл, піридазиніл, піридил, піримідиніл, піролідиніл, піроліл, тетрагідрофураніл, тетрагідрохіноліл, тетразоліл, тіадіазоліл, тіазоліл, триазиніл, 1,2,3-триазоліл, 1,2,4-триазоліл, триазолоніл, тієніл та їхні ізомери. Якщо не зазначено інше, гетероарильна або гетероароматична група, яка містить гетероатоми, може бути заміщена одним або декількома замісниками, переліченими нижче. Якщо конкретно не зазначено інше, термін "факультативно заміщений" або "заміщений" при вживанні стосовно до груп, наприклад, до арилів, гетероарилів, циклоалкілів та/або гетероциклілів, стосується відповідних груп, які розглядаються окремо або у поєднанні з іншими групами або сполуками, та означає, що група заміщена одним або декількома замісниками, переліченими у цьому документі, у типових випадках, але виключно, шляхом заміни одного або кількох атомів водню. До замісників належать: галоген, -CN, -ОН, оксогрупа (=O), C1-C3-алкіл, C1-C3-галогеналкіл, C1-C3ціаноалкіл, С2-С5-алкеніл, C0-C3-алкілNO2, -OC1-C3алкіл (або C1-C3-алкоксигрупа), C1-C3-гідроксіалкілC0-C3-алкіл-NR12R13, C0-C3-алкіл-С(O)R12, С0-С3алкіл-C(O)OR12, -C(O)NR12R13, -C(S)NR12R13, CH2OR12, -SR12, -S(O)nR12, -S(O)nNR12R13, N(R9)C(O)NR12R13, -N(R12)C(O)OR13, N(R12)S(O)nR13, -N(R12)S(O)nNR12R13, -C=NOR12, -цикло-СN4R12 (факультативно заміщений тетразол), де n=1 або 2 та де R12 та R13 індивідуально вибрані з групи, яку складають: Н, С1-С6алкіл, С1-С6-галогеналкіл, С1-С6-алкілциклоалкіл; С1-С6-алкіларил, C0-C6-алкілгетероарил, С1-С6гідроксіалкіл, С2-С6-алкеніл та С3-С8-циклоалкіл. Замісники, яким віддається перевага, вибрані з групи, яку складають: F, СІ, -CN, -NO2, СН3, C1-C3 94600 18алкіл, -CF3, -CHF2, -CH2CN, С2-С4-алкеніл, C(O)R12, -C(O)OR12, -C(O)NR12R13, -C(O)H, CH2OR12, -OR12, -SR12, -NR12R13 та -C=N-OR12. Термін "проліки" означає похідні сполук за цим винаходом, які містять хімічно або метаболічно відщеплювані групи та внаслідок сольволізу або у фізіологічних умовах перетворюються in vivo у фармацевтично активні сполуки за цим винаходом. Похідні сполук за цим винаходом виявляють активність як у формі похідних кислот, так і у формі похідних основ, але форма похідних кислот часто забезпечує переваги з точки зору розчинності, сумісності з тканинами або модифікованого вивільнення в організмі ссавців (дивись Бундгард, «Дизайн проліків» - Bundgard Η., Design of Prodrugs. pp. 7-9, 21-24, Elsevier, Amsterdam 1985). До проліків належать похідні кислот, наприклад, складні ефіри, одержані шляхом проведення реакції вихідної сполуки кислотного характеру з відповідним спиртом, або аміди, одержані шляхом проведення реакції вихідної сполуки кислотного характеру з відповідним аміном. Серед проліків перевага віддається складним ефірам нижчих аліфатичних спиртів (наприклад., метиловому, етиловому, пропіловому, ізопропіловому, бутиловому, втор-бутиловому, трет-бутиловому) або ароматичним складним ефірам - похідним кислотних груп, які входять до складу сполук за цим винаходом. До інших складних ефірів, яким віддається перевага, належать морфоліноетилокси-, діетиламід та діетиламінокарбонілметокси-похідні. У деяких випадках бажано одержувати проліки типу подвійних складних ефірів, наприклад, (ацилокси)алкілові складні ефіри або ((алкоксикарбоніл)окси)алкілові складні ефіри. У значенні, вживаному в цьому описі, термін "група захисту" означає групу, корисну для екранування реакційноздатних місць у молекулі з метою підвищення реакційної здатності іншої групи або забезпечення протікання реакції у іншому бажаному місці або місцях, після чого група захисту може бути видалена. Групи захисту застосовуються для захисту або екранування функціональних груп, до яких належать (але без обмеження ними) -ОН, -NH, та -СООН. Відповідні групи захисту відомі фахівцям у галузі та описані у монографії Гріні та Вутса «Групи захисту в органічному синтеrd зі» (Protecting groups in Organic Synthesis, 3 edition, Greene T.W.; Wuts P.G.M. Eds., John Wiley and Sons, New York, 1999). У значенні, вживаному в цьому описі, термін "сольват" означає кристал (або кристали) сполуки за цим винаходом, утворені із включенням стехіометричної або нестехіометричної кількості сполуки Формули І та молекули розчинника. До типових сольвативних розчинників належать, наприклад, вода, метанол, діетиловий ефір, етанол, етилацетат, ацетон, ацетонітрил та диметилформамід. Якщо розчинником є вода, то для позначення форми, яка містить сполуку та воду у стехіометричному або нестехіометричному співвідношенні, факультативно вживається термін «гідрат» (або гемігідрат, якщо вода присутня у кількості, яка відповідає половині стехіометричної кількості). 19 У випадках, коли сполука за цим винаходом містить кислотні або основні функціональні групи, можуть бути одержані різноманітні солі, які характеризуються підвищеною водорозчинністю та/або покращеною фізіологічною придатністю у порівнянні з вихідною сполукою. Солі зручно одержувати відомими в галузі способами, наприклад, шляхом проведення реакції сполуки кислотного характеру з основою або оброблення сполуки кислотного характеру іонообмінною смолою. Визначення «фармацевтично прийнятні солі» охоплює порівняно нетоксичні солі сполук за цим винаходом з неорганічними та органічними основами або кислотами (наприклад, солі, описані у публікації Бержа та ін. «Фармацевтичні солі» - S.M. Berge, et al., "Pharmaceutical Salts," J. Phar. Sci.. 66: 1-19 (1977) та «Довіднику з властивостей, вибору та застосування фармацевтичних солей» - "A Handbook of Pharmaceutical Salts Properties, Selection, and Use", Wermuth C.G. та Stahl P.H. (eds.) Verlag Helvtica Chimica Acta, 2002, які включені до цього опису шляхом посилання). До звичайних солей з основами належать, наприклад, солі з такими речовинами: аргінін, бенетамін, бензатин, діетаноламін, діетиламін, етилендіамін, меглумін, лізин, магній, піперазин, кальцій, калій, натрій, трометамін та цинк, а також з катіонами амонію, четвертинного амонію та амінів, похідні азотвмісних основ достатньої основності для утворення солей зі сполуками за цим винаходом. Крім того, основні групи сполук за цим винаходом можуть реагувати з відповідними органічними та неорганічними кислотами з утворенням солей. До звичайних солей з кислотами належать, наприклад: ацетат, адипат, бензолсульфонат, бензоат, цитрат, етансульфонат, фумарат, D-глюконат, бромід, хлорид, лактат, лактобіонат, малеат, метансульфонат, нафталін-2-сульфонат, фосфат, сукцинат, сульфат, тартрат та n-толуолсульфонат. Сполуки Формули І можуть існувати у формі будь-якого з їхніх стереохімічних ізомерів, позиційних ізомерів або регіоізомерів, причому усі ці форми охоплюються обсягом цього винаходу. Деякі сполуки за цим винаходом можуть містити один або кілька хіральних центрів і, отже, можуть існувати в оптично активних формах. Додаткова кількість асиметричних атомів вуглецю може бути присутня в замісниках, наприклад, в алкільних групах. Мається на увазі, що цей винахід охоплює R- та S-ізомери та їх суміші, в тому числі рацемічні суміші, а також суміші енантіомерів або цис- та транс-ізомерів. Аналогічно, якщо сполуки містять алкенільні, алкеніленові, оксимні та О-алкіловані оксимні групи, то можливим є існування цис- та транс-ізомерних форм сполук. Мається на увазі, що всі такі ізомери, а також їх суміші охоплюються обсягом винаходу. Якщо бажаним є конкретний ізомер, то його можна одержати добре відомими в галузі способами, застосовуючи стереоспецифічні реакції з використанням вихідних матеріалів, які містять асиметричні центри та вже розділені. За альтернативними способами, бажані стереоізомери можна одержати способами, які забезпечують одержання сумішей стереоізомерів, із подальшим їх розділенням відомими способами. Наприклад, 94600 20 рацемічну суміш можна ввести в реакцію з окремим енантіомером певної іншої сполуки, тобто з реагентом, який забезпечує хіральне розділення. Нижче розглянуто сполуки за даним винаходом, яким віддається перевага, котрі ілюструються формулою І , дe n - 1 або 2 та R1-R8 відповідають визначенням, наведеним у цьому описі, а також фармацевтично прийнятні солі сполук формули І. Сполуки за цим винаходом, конкретно подані як приклади та/або описані в цьому документі, мають назви та нумерацію, утворені із застосуванням програми "AUTONOM" для версії 2.5 SP1 програмного продукту ISIS/Draw або версій 7.0.1 CHEMDRAW ULTRA AUTONOM. Сполуки за цим винаходом, яким віддається перевага, перелічені у поданих нижче таблицях, включених до цього опису, причому в переліку маються на увазі фармацевтично прийнятні солі, сольвати, енантіомери, рацемати, діастеомери та суміші діастереомерів згаданих сполук. Мається на увазі, що обсяг цього винаходу охоплює також геометричні ізомери сполук формули І, пов'язані з наявністю подвійних зв'язків, та оптичні ізомери, пов'язані з наявністю асиметричних атомів вуглецю, як речовини, корисні для лікування захворювань, пов'язаних із модулюванням рецепторів PR. Загальна схема синтезу індольних проміжних сполук для застосування у даному винаході Сполуки за цим винаходом можуть бути синтезовані за способами, представленими на поданих нижче схемах, у прикладах та загальних методиках. Однак подані нижче описи не призначені для будь-якого обмеження обсягу цього винаходу, оскільки фахівець у галузі може без зайвого експериментування перейти від схем та прикладів, поданих у цьому описі, до інших конкретних сполук, які охоплюються цим винаходом. Численні реагенти та вихідні матеріали можуть бути без утруднень одержані з ринкових джерел або синтезовані пересічним фахівцем у галузі. Інші необхідні реагенти та вихідні матеріали можуть бути виготовлені за методиками, вибраними з-посеред стандартних способів хімії органічних та гетероциклічних сполук, за методиками, аналогічними синтезам відомих подібних реагентів та вихідних матеріалів та за методиками, поданими нижче в описах підготовчих синтезів та прикладах, в тому числі за будь-якими новими методиками. Значення символів R, R1, R2, R3, R4, R5, R6 і т.д., застосовуваних у наступному розділі, призначені для ілюстрування різних способів синтезу сполук за цим винаходом та/або для ілюстрування змінності замісників у відповідних положеннях та не обов'язково є за 21 обсягом та значенням синонімами аналогічних груп, застосовуваних у загальній структурі сполук формули І. Однак групи у кінцевих сполуках на схемах, які займають аналогічні положення, за обсягом та значенням відповідають групам, які займають аналогічні положення у загальній структурі сполук формули І. Описано конкретні приклади кожного зі способів, представлених на Схемах 1-5. Мається на увазі, що умови, тобто конкретні значення (діапазони) температури, розчинники, тривалості реакцій тощо, можуть бути скориговані фахівцем у галузі для забезпечення одержання усіх конкретних сполук, описаних у цьому документі. Таким чином, способи та приклади ілюструють загальні методики, які можна застосувати для одержання сполук за цим винаходом. В описі застосовуються такі терміни та абревіатури: DAST трифторид діетиламіносірки DEAD діетилазодикарбоксилат DIAD діізопропілазодикарбоксилат DPDB (дифенкфосфіно)-2'-(N,Nдиметиламіно)біфеніл DMF Ν,Ν-диметилформамід DMSO диметилсульфоксид DMAP Ν',Ν'-диметиламінопіридин Pd2(dba)3 Трис(дибензиліденацетон)дипаладій PdCl2(dppf)2 біс(дифенілфосфінофероцен)хлорид паладію EtOAc етилацетат Et2O діетиловий ефір 94600 22 смола FC-1032 прищеплений до полістиролу (PPh2)Pd[P(t-Bu)3]Cl2 - Pd каталізатор, продукт фірми Johnson Mathey Catalysis and Chrial Technologies Η ЯМР означає, що ілюстрованій структурі відповідає одержаний спектр Н-ЯМР HMDS гексаметиддисилазан KОАс ацетат калію LRMS мас-спектроскопія низького розрізнення LiHMDS гексаметиддисилазид літію NaHMDS гексаметиддисилазид натрію NBS N-бромсукцинамід к.т. кімнатна температура THF тетрагідрофуран ТВАF фторид тетрабутиламонію РСу3 трициклогексилфосфін Ts тозилат (n-толуолсульфоніл) TsCl n-толуолсульфонілхлорид X у застосовуваному значенні означає галоген, тобто І, Br, СІ або F Подана нижче Схема 1 ілюструє загальний шлях синтезу деяких індольних проміжних сполук, які можна використати для синтезу 6 сульфонамідних сполук за цим винаходом. Приклади одержання конкретних сполук подано нижче як в описах прикладів, так і в таблицях. "Способи", перелічені на схемах жирним шрифтом (разом із вказаними реагентами), описані більш детально у прикладах. Методики, описані для цих "Способів", можна застововувати як загальні методики одержання сполук, поданих у цьому описі як приклади. 23 3-бром-6-нітро-1H-індол (2) Додають N-бромсукцинамід (NBS) до 6нітроіндолу 1 (22,72 г, 140,12 ммоль), розчиненому в тетрагідрофурані (600 мл), та перемішують одержану суміш протягом 18 год. Гасять реакційну суміш насиченим водним розчином тіосульфату натрію (600 мл), розводять етилацетатом (EtOAc) (600 мл), та розділяють шари. Послідовно промивають органічний шар насиченим водним розчином бісульфату натрію (100 мл), насиченим водним розчином бікарбонату натрію (100 мл), водою (100 мл) та розсолом (100 мл). Сушать одержаний органічний шар над Na2SO4 та фільтрують. Концентрують фільтрат до одержання жовтої твердої речовини. Перекристалізовують цю тверду речовину з дихлорметану та гексану, одержуючи 29,21 г вказаної в заголовку сполуки (86%). LRMS (API ES+)=263,0 (M+Na). 3-бром-1-метил-6-нітро-1H-індол (3, R1=Me) Спосіб А. Додають 1M розчин гексаметиддисилазиду літію у тетрагідрофурані (31,2 мл, 31,17 ммоль) та метилйодид (2,6 мл, 41,56 ммоль) до розчину 3-бром-6-нітро-1H-індолу 2 (5,01 г, 20,78 ммоль) у N,N-диметилформаміді (100 мл) при 0°С. Нагрівають реакційну суміш до кімнатної температури та залишають при перемішуванні протягом 5 год. Гасять насиченим водним розчином хлориду амонію (100 мл), розводять етилацетатом (200 мл), та розділяють шари. Послідовно промивають органічний шар 10% водним розчином хлориду літію (75 мл), насиченим водним розчином бікарбонату натрію (75 мл), водою (75 мл2) та розсолом (75 мл). Сушать одержаний органічний шар над Na2SO4 та фільтрують. Концентрують фільтрат, одержуючи залишок. Адсорбують цей залишок з неочищеним продуктом на силікагель. Хроматографують залишок на колонці із силікагелем, елююючи дихлорметаном у гексані (об'ємна частка 5-50%), одержуючи 4,13 г вказаної в заголовку сполуки (78%). LRMS (API ES+)=255,0 (М+Н). 3-бром-1-ізопропіл-6-нітро-1H-індол (3', R1=iPr) Застосовують описану вище методику (Спосіб А) для 3-бром-1-метил-6-нітро-1H-індолу 3 з такими змінами: застосовують ізопропілйодид замість метилйодиду та залишають реакційну суміш при перемішуванні при кімнатній температурі протягом 18 год. Після чого додають 1M розчин гексаметиддисилазиду літію у тетрагідрофурані (15,5 мл, 15,5 ммоль) та ізопропілйодид (2,1 мл, 20,74 ммоль). Нагрівають одержану суміш до 40°С та залишають при перемішуванні протягом 6 год. Охолоджують суміш до кімнатної температури, та очищають одержаний продукт, як описано вище, одержуючи 4,37 г вказаної в заголовку сполуки (74%). LRMS (API ES+)=285,0 (М+Н). 3-бром-1-ізобутил-6-нітро-1H-індол (3'', R1=iBu) Спосіб В. Додають NaH (1,2 екв.) до розчину 3бром-6-нітроіндолу 2 (15 г, 62 ммоль) у 250 мл DMF. Залишають реакційну суміш при перемішуванні протягом 1 год, та потім додають ізобутилйодид (17,2 мл, 149 ммоль, 2,4 екв.). Залишають цей розчин при перемішуванні при кімнатній тем 94600 24 пературі. Коли червоний колір, пов'язаний з аніоном, змінюється на коричневий, додають ще NaH та ізобутилйодид до витрачення більшої частини вихідного матеріалу. Додають 600 мл 5 Μ розчину NaOH та екстрагують діетиловим ефіром (Et2O, 2200 мл). При цьому утворюється тришаровий розчин із продуктом у шарі Et2O та вихідним матеріалом у середньому шарі суміші води з Ν,Νдиметилформамідом. Об'єднують ефірні екстракти та промивають 5 Μ розчином NaOH, водою (2) та розсолом. Сушать органічні шари над Na2SO4, фільтрують, та концентрують. Перекристалізовують із суміші СН2Сl2/гексан, та одержують 15,73 г, 1 52,9 ммоль, 85% вказаної в заголовку сполуки. H ЯМР (CDCl3) 8,28 (d, 1Н, J=2,2 Гц), 8,04 (dd, 1Н, J=1,8 Гц, 8,8 Гц), 7,59 (d, 1Н, J=8,8 Гц), 7,35 (s, 1H), 3,96 (d, 2 H, J=8,8 Гц), 2,18 (m, 1H), 0,93 (d, 6H, J=6,6 Гц). Альтернативно замісник R1 може бути приєднаний у положенні N1 індолу з використанням Способу L, описаного нижче стосовно до 4-[1-(3метилбутил)-6-нітро-1H-індол-3-іл]бензонітрилу (11, R1=i-Pr). Два нижченаведені способи ілюструють інші альтернативні методики синтезу проміжного індолу 3. 3-бром-1-[(S)-втор-бутил]-6-нітро-1Н-індол (3''', R1=(S)-втор-Bu) Спосіб ВВ. Додають трифенілфосфін (19,04 г, 72,60 ммоль) та (R)-2-бутанол (6,14 мл, 66,38 ммоль) до дихлорметанового (400 мл) розчину, який містить 3-бром-6-нітро-1Н-індол (10,00 г, 41,49 ммоль). Охолоджують цю суміш до 0°С, та додають при перемішуванні діізопропілазодикарбоксилат (13,98 мл, 70,53 ммоль) у вигляді розчину у дихлорметані (50 мл) протягом 45 хв. Після завершення додавання відстороняють льодяну баню, та перемішують реакційну суміш протягом 3,5-4 год при температурі навколишнього середовища. Концентрують неочищену реакційну суміш у вакуумі, та очищають одержане масло флешхроматографією (силікагель, завантаження у суміші 30% СН2СІ2/гексан; елюювання градієнтом 15%-35% СН2Сl2 у гексані). Одержують 8,83 г (72%) продукту у вигляді жовтої твердої речовини. 1 Н ЯМР (CDCl3) δ 8,34 (d, 1Н, J=2,0 Гц), 8,04 (dd, 1H, J=8,8 Гц, 2,0 Гц), 7,59 (d, 1H, J=8,8 Гц), 7,45 (s, 1H), 4,47 (секстет, 1Н, J=6,9 Гц), 1,89 (квінтет, 2H, J=6,9 Гц), 1,53 (d, 3H, J=6,9 Гц), 0,84 (t, 3H, J=7,5 79 Гц); MS (API ES+) m/e 297 (M+1, Br), 299 (M+1, 81 Br). iν 3-бром-1-[(R)-втор-бутил]-6-нітро-1Н-індол (3 , R1=(R)-втор-Bu) 25 Спосіб ВВ. Додають трифенілфосфін (20,64 г, 78,69 ммоль) та (S)-2-бутанол (6,11 мл, 66,52 ммоль) до дихлорметанового (400 мл) розчину, який містить 3-бром-6-нітро-1Н-індол (10,02 г, 41,57 ммоль). Охолоджують цю суміш до 0°С, та додають при перемішуванні діізопропілазодикарбоксилат (10,71 мл, 54,02 ммоль) у вигляді розчину у дихлорметані (20 мл) протягом 15 хв. Після завершення додавання відстороняють льодяну баню, та перемішують реакційну суміш протягом 3,5-4 год при температурі навколишнього середовища. Концентрують неочищену реакційну суміш у вакуумі, а потім очищають одержане масло флешхроматографією (силікагель, завантаження у суміші 30% H2Сl2/гексан; елюювання градієнтом 15%-35% СН2Сl2 у гексані), одержуючи 8,46 г (68%) продукту у вигляді жовтої твердої речовини. 1 H ЯМР (CDCl3) 8,34 (d, 1Н, J=2,0 Гц), 8,04 (dd, 1Н, J=8,8 Гц, 2,0 Гц), 7,59 (d, 1Н, J=8,8 Гц), 7,45 (s, 1Н), 4,47 (секстет, 1Н, J=6,9 Гц), 1,89 (квінтет, 2Н, J=6,9 Гц), 1,53 (d, ЗН, J=6,9 Гц), 0,84 (t, ЗН, J=7,5 7 Гц); MS (API ES+) m/e 297 (M+1, 9Br), 299 (М+1, 81 Br). 1-ізопропіл-6-нітро-3-(4,4,5,5-тетраметил[1,3,2]діоксаборолан-2-іл)-1Н-індол (4, R1=i Pr) Спосіб DD. Завантажують у колбу місткістю 500 мл висушений у вакуумі ацетат калію (37,50 г, 382,00 ммоль), 3-бром-1-ізопропіл-6-нітро-1Hіндол, 3' (32,40 г, 114,50 ммоль), біс(пінаколято)дибор (40,71г, 160,00 ммоль), PdCL2(dppf)2·СН2Сl2 (12,75 г, 15,64 ммоль) та безводний диметилсульфоксид (430 мл). Нагрівають цю суміш на масляній бані до 85°С та перемішують її протягом ночі. Охолоджують забарвлену у чорний колір реакційну суміш до температури навколишнього середовища, гасять великою кількістю води, та екстрагують одержану водну суміш дихлорметаном. Промивають об'єднані екстракти водою та розсолом. Сушать одержаний органічний шар над сульфатом натрію, фільтрують, та концентрують фільтрат у вакуумі. Одержане забруднене масло очищають флеш-хроматографією (силікагель; завантаження у суміші 30% СН2Сl2/гексан; елюювання градієнтом 2,5%-20% етилацетату у гексані). Матеріал із цієї колонки можна вдруге очистити флеш-хроматографією (силікагель, градієнт 30%-60% СН2Сl2 у гексані), одержуючи продукт (22,7 г, 60%) у вигляді жовтої твердої речови1 ни. H ЯМР (CDCl3) 8,32 (app. s, 1Н), 8,03-8,04 (m, 2Н), 7,90 (s, 1Н), 4,69-4,79 (m, 1Н), 1,56 (d, 6H, J=6,7 Гц), 1,35 (br s, 12H); MS (API ES+) m/e 331 (M+1). 5-(1-ізопропіл-6-нітро-1H-індол-3-іл)піридин-2карбонітрил (5, R1=i-Pr, R3=2-ціанопіридин) Цю сполуку одержали з 1-ізопропіл-6-нітро-3(4,4,5,5-тетраметил-[1,3,2]діоксаборолан-2-іл)-1Hіндолу (4, R1=i-Pr) та 5-бром-2-ціанопіридину, за 94600 26 стосовуючи Спосіб D, описаний нижче. LRMS (API ES+)=307,0 (M+H). Альтернативно, нітрогрупа може бути перетворена у сульфонамідну групу при індольній структурі для одержання проміжних сполук, які мають структуру сполуки 100 на вищенаведеній Схемі 1, застосовуючи описані нижче Способи Н та І для одержання відповідно 6-аміно-1-ізопропіл-3-(3,4,5трифторфеніл)-1H-індолу та N-[1-ізопропіл-3(3,4,5-трифторфеніл)-1Н-індол-6іл]метансульфонаміду (6, R1=I-Pr, R3=3,4,5трифторфеніл, R6=Me). 4-(1-ізопропіл-6-нітро-1H-індол-3іл)бензонітрил (5, R1=i-Pr, R3=4-бензонітрил) Спосіб С. 3авантажують 3-бром-1-ізопропіл-6нітро-1Н-індол, 3', (350 мг, 1,24 ммоль), трис(дибензиліденацетон)дипаладій (0) - (110 мг, 0,12 ммоль), тетрафторборат три-трет-бутилфосфонію (70 мг, 0,24), 4-ціанофенілборну кислоту (364 мг, 2,48 ммоль), фторид калію (216 мг, 3,72 ммоль) та тетрагідрофуран (6 мл) у атмосфері азоту у колбу місткістю 50 мл. Нагрівають реакційну суміш до 40°С протягом 18 год. Охолоджують реакційну суміш до кімнатної температури та фільтрують через шар целіту. Промивають шар целіту етилацетатом (200 мл). Далі збирають та концентрують фільтрати. Очищають осаджуванням або кристалізуванням з етилацетату, одержуючи 260,2 мг вказаної в заголовку сполуки (69%). LRMS (АРІ ES+)=306,0 (M+H). Спосіб R. Додають Рd(РРh3)4 (58 мг, 0,05 ммоль) до суспензії 3-бром-1-ізопропіл-6-нітро-1Hіндолу (3', R1=i-Pr) (194,5 мг, 0,5 ммоль), арилборної кислоти (0,75 ммоль) та KF·2H2O (141 мг, 1,5 ммоль) у 5 мл [1,4]діоксану у атмосфері азоту. Нагрівають реакційну суміш до 80°С та перемішують її при цій температурі протягом ночі. Випарюють розчинник у вакуумі. Розчиняють залишок у етилацетаті (10 мл), після чого промивають водою (5 мл). Концентрують органічний шар та очищають, застосовуючи хроматографію на колонці, та одержують бажані сполуки (50-80%). 2-фтор-4-(6-нітро-1Н-індол-3-іл)бензонітрил (9F) А. Розчиняють 2-фтор-4-бромбензонітрил (200 г, 990 ммоль, 1,00 екв.) та триізопропілборат (228 г, 1188 ммоль, 1,2 екв.) у 700 мл THF та 1400 мл толуолу. Охолоджують суміш на бані із суміші сухого льоду з ацетоном до внутрішньої температури -75°С. Повільно додають n-BuLi (396 мл 2,5 Μ розчину у гексані) протягом 2 год. Після завершення додавання утворюється світло-червона суспензія. Перемішують розчин при -74°С протягом 15 хв, дозволяючи розчину нагрітися до -20°С, а потім гасять, застосовуючи 1500 мл 2,5 Μ розчину HCl. Нагрівають розчин до кімнатної температури. Розділяють шари, екстрагують водний шар EtOAc, сушать об'єднані органічні фази Na2SO4, фільтрують та концентрують у вакуумі, та одержують світло-коричневу тверду речовину. Розтирають цю тверду речовину з гексаном та переносять у лійку зі скляним фільтром. Ополіскують гексаном до одержання блідо-жовтого фільтрату. Перемішують світло-коричневу тверду речовину з холодним СН2Сl2 та фільтрують. Ополіскують не 27 великою кількістю СН2Сl2, та одержують злегка забарвлену тверду речовину та коричневий фільтрат. Сушать одержану тверду речовину у вакуумсушильній шафі при 40°С, та одержують 112 г (679 ммоль, 69%) 3-фтор-4-ціанофенілборонової кислоти у вигляді злегка забарвленої твердої речовини. В. 4-(1-бензолсульфоніл-6-нітро-1Н-індол-3іл)-2-фторбензонітрил одержують із 1бензолсульфоніл-3-бром-6-нітро-1H-індолу, 7, та 3-фтор-4-ціанофенілборної кислоти, застосовуючи Спосіб АА: Pd2(dba)3, [(t-Bu3)PH]BF4, K2СО3, THF, Н2О. Очищають осаджуванням із суміші EtOAc/гексан. Видаляють групу захисту бензолсульфонілу, застосовуючи ТВАF та THF, як описано нижче для 4-(6-нітро-1Н-індол-3-іл)бензонітрилу (9). LRMS (API ES-)=280,0 (M-1). 1-ізопропіл-3-(4,4,5,5-тетраметил[1,3,2]діоксаборолан-2-іл)-1Н-індол-6-іламін Спосіб Р. Додають розчин 1-ізопропіл-6-нітро3-(4,4,5,5-тетраметил-[1,3,2]діоксаборолан-2-іл)1Н-індолу (4, R1=i-Pr) (14,48 г, 43,88 ммоль) в етанолі до суспензії 5% паладію на вугіллі (1,44 г) та етанолу у реакторі Парра. Створюють у реакторі атмосферу водню (60 фунтів на кв. дюйм (0,41 МПа)) та перемішують у струшувальному пристрої Парра при кімнатній температурі протягом 18 год. Через 18 год фільтрують вміст реактора через шар целіту, та концентрують одержаний фільтрат у вакуумі. Одержаний неочищений світло-рожевий кристалічний матеріал (11,84 г, 90%) може бути 1 використаний без додаткового очищення. H ЯМР (DSMO-d6) 7,39 (s, 1Н), 7,39 (d, 1H, J=8,3 Гц), 6,54 (d, 1H, J=1,8 Гц), 6,41 (dd, 1H, J=8,3 Гц, 1,8 Гц), 4,73 (br s, 2H), 4,37 (септет, 1H, J=6,8 Гц), 1,37 (d, 6H, J=6,8 Гц), 1,23 (br s, 12H); MS (API ES+) m/e 301 (M+1). N-[1-ізопропіл-3-(4,4,5,5-тетраметил[1,3,2]діоксаборолан-2-іл)-1Н-індол-6іл]метансульфонамід (4-А, R1=і Pr, R6=Me) Спосіб І. 3авантажують у круглодонну колбу 1ізопропіл-3-(4,4,5,5-тетраметил[1,3,2]діоксаборолан-2-іл)-1Н-індол-6-іламін (11,83 г, 39,43 ммоль), дихлорметан (400 мл) та піридин (6,40 мл, 78,87 ммоль). Охолоджують одержаний розчин до 0°С; при перемішуванні повільно додають метансульфонілхлорид (12,20 мл, 157,73 ммоль). 3алишають реакційну суміш при перемішуванні протягом ночі до досягнення температури навколишнього середовища. Гасять реакційну суміш насиченим водним розчином бікарбонату натрію. Екстрагують одержаний водний шар дихлорметаном. Об'єднують екстракти та промивають їх насиченим водним розчином бікарбонату натрію, водою та розсолом, сушать над сульфатом натрію та концентрують у вакуумі. Очищають одержану тверду речовину флеш-хроматографією (силікагель; градієнт 65%-100% дихлорметану у гексані, після чого градієнт до 2,5% етилацетату у дихлорметані), одержуючи 12,0 г (80%) продукту у вигляді 1 світло-рожевої твердої піни. H ЯМР (CDCl3) 7,96 (d, 1Н, J=8,4 Гц), 7,69 (s, 1H), 7,39 (d, 1H, J=1,9 Гц), 6,88 (dd, 1H, J=8,4 Гц, 1,9 Гц), 6,38 (br s, 1Н), 4,56 (септет, 1H, J=6,8 Гц), 2,91 (s, 3H), 1,49 (d, 6H, J=6,8 Гц), 1,34 (s, 12H); MS (IS-) m/e 377 (M-1). 94600 28 1-ізопропіл-6-нітро-3-(3,4,5-трифторфеніл)-1Hіндол (5, R1=i-Pr, R3=3,4,5-трифторфеніл) Спосіб D. 3авантажують 1-ізопропіл-6-нітро-3(4,4,5,5-тетраметил-[1,3,2]діоксаборолан-2-іл)-1Ніндол (4, R1=i-Pr) (328 мг, 0,98 ммоль), хлорид літію (125 мг, 2,94 ммоль), 3,4,5-трифторбромбензол (240 мкл, 1,96 ммоль), толуол (4 мл), етанол (4 мл) та 2М водний розчин карбонату натрію (1,7 мл, 3,43 ммоль) у колбу місткістю 50 мл, обладнану зворотним холодильником. Створюють у колбі атмосферу азоту та додають тетракіс(трифенілфосфін)-паладій (0) (58 мг, 0,05 ммоль). Нагрівають реакційну суміш зі зворотним холодильником протягом 4 год, після чого охолоджують до кімнатної температури. Фільтрують розчин через шар целіту, та промивають цей шар етилацетатом (50 мл). Промивають об'єднані фільтрати насиченим водним розчином бікарбонату натрію (20 мл), водою (20 мл), розсолом (20 мл). Сушать одержаний органічний розчин над Na2SO4 та фільтрують. Концентрують фільтрат, та адсорбують одержаний залишок на силікагель. Хроматографують залишок на колонці із силікагелем, елююючи дихлорметаном у гексані (об'ємна частка 2-50%), та одержують 140,7 мг вказаної в заголовку сполуки (43%). LRMS (API ES+)=335,0 (M+H). 4-(1-ізопропіл-6-нітро-1Н-індол-3-іл)фталонітрил (5, R1=i-Pr, R3=фталонітрил) Спосіб О. 3авантажують 1-ізопропіл-6-нітро-3(4,4,5,5-тетраметил-[1,3,2]діоксаборолан-2-іл)-1Hіндол 4 (107 мг, 0,324 ммоль), 4-йодфталонітрил (246 мг, 0,968 ммоль), Pd(OAc)2 (11 мг, 0,049 ммоль) та трициклогексилфосфін (22 мг, 0,078 ммоль) у колбу місткістю 50 мл у атмосфері азоту. Додають ацетонітрил (4 мл), та барботують через розчин азот протягом 15 хв. Додають фторид цезію (446 мг, 2,936 ммоль), вміщують реакційну посудину у масляну баню, заздалегідь нагріту до 90°С, та перемішують протягом 30 хв. Охолоджують реакційну суміш до кімнатної температури, виливають у воду (15 мл), та екстрагують водний шар СН2Сl2 (215 мл). Сушать одержаний органічний розчин над Na2SO4, фільтрують та концентрують у вакуумі. Розтирають одержаний залишок із СН2Сl2 та гексаном, одержуючи 102 мг вказаної в заголовку сполуки (95%) у вигляді жовтої твердої 1 речовини. H ЯМР (DMSO-d6) 8,705 (s, 1Н), 8,640 (d, 1H, J=2,1 Гц), 8,506 (d, 1H, J=1,8 Гц), 8,280 (dd, 1H, J=1,8 Гц, 8,5 Гц), 8,191 (d, 1H, J=9,1 Гц), 8,137 (d, 1H, J=8,5 Гц), 8,015 (dd, 1H, J=2,1 Гц, 9,1 Гц), 5,072 (квінтет, 1Н, J=6,7 Гц), 1,511 (d, 6H, J=6,7 Гц). 4-(1-ізопропіл-6-нітро-1H-індол-3-іл)-3-метил-5карбонітрилтіофен-2-іл (5, R1=i-Pr, R3=3-метил-5карбонітрилтіофен-2-іл) Спосіб АА. Об'єднують 1-ізопропіл-6-нітро-3(4,4,5,5-тетраметил-[1,3,2]діоксаборолан-2-іл)-1Ніндол (4, R1=i-Pr) (1,1 г, 1,00 екв.; 3,5 ммоль), 5бром-4-метил-2-тіофенкарбонітрил (0,7 г; 1,00 екв.; 3,5 ммоль) та карбонат калію (1,0 г, 2,2 екв.; 7,6 ммоль) у THF (10 мл) та воді (5 мл). Барботують суміш N2 протягом 20 хв із постійним подаванням струменя N2 під поверхню. Потім додають трис(дибензиліденацетон)дипаладій(0) (158 мг, 0,05 екв.; 170 мкмоль) та тетрафторборат три 29 94600 30 трет-бутилфосфонію (101 мг, 0,1 екв., 350 мкмоль), та нагрівають суміш до 40°С у герметично закритій посудині в атмосфері азоту. Спостерігають за ходом реакції, застосовуючи TLC (30%EtOAc/гексан); після вичерпання вихідного матеріалу охолоджують суміш до кімнатної температури, та додають 10 мл етилацетату. Промивають суміш водою, після чого розсолом та сушать над MgSO4. Видаляють MgSO4 фільтруванням, концентрують фільтрат у вакуумі, та одержують тверду речовину. Перекристалізовують цю тверду речовину із суміші дихлорметан/гексан. Вихід 0,789 г (70%). LRMS (API ES+)=326,0 (M+H). 1-ізопропіл-3-[5-(1-метил-1Н-тетразол-5іл)тіофен-2-іл]-6-нітро-1Н-індол Спосіб СС. У колбу місткістю 50 мл, обладнану зворотним холодильником, завантажують 1ізопропіл-6-нітро-3-(4,4,5,5-тетраметил[1,3,2]діоксаборолан-2-іл)-1Н-індол (4, R1=i-Pr) (700 мг, 2,1 ммоль), 5-(5-бромтіофен-2-іл)-1-метил1Н-тетразол (466 мг, 1,9 ммоль), трис(дибензиліденацетон)дипаладій(0) (17 мг, 0,019 ммоль) та трициклогексил-фосфін (13 мг, 0,0047 ммоль) у діоксані (5,5 мл). 3некиснюють у атмосфері азоту тричі у колбі місткістю 50 мл, обладна ній зворотним холодильником; після чого додають 1,3 Μ водний розчин фосфату калію (2,5 мл, 3,2 ммоль). Нагрівають реакційну суміш до 100°С протягом 4 год. Охолоджують реакційну суміш до кімнатної температури та розводять водою (20 мл) та етилацетатом (20 мл); після чого розділяють шари. Екстрагують водний шар тричі етилацетатом (10 мл). Об'єднують органічні шари; сушать над MgSO4; видаляють тверді речовини фільтруванням; та концентрують фільтрат у вакуумі. Очищають хроматографією на колонці із силікагелем, елююючи етилацетатом у гексані, та одержують 1 0,3 г (39%) вказаного в заголовку матеріалу. H ЯМР (CDCl3) 8,39 (s, 1Н), 8,09 (d, 1H, J=9,1 Гц), 8,02 (d, 1H, J=9,1 Гц), 7,78 (d, 1H, J=3,9 Гц), 7,75 (s, 1H), 7,28 (d, 1H, J=3,9 Гц), 4,79 (квінтет,1Н, J=6,5 Гц), 4,37 (s, 3Н), 1,62 (d, 6H, J=6,5 Гц). 3агальний метод синтезу індолів для застосування у даному винаході Нижченаведена Схема 2 ілюструє додаткові стратегії синтезу для одержання індолів 6 із проміжних індолів, одержаних вище. Деякі зі способів, позначених на схемі жирним шрифтом, описані вище; інші способи описані нижче після схеми. 4-(6-аміно-1-ізопропіл-1H-індол-3іл)бензонітрил Спосіб Ε. 3авантажують 4-(1-ізопропіл-6-нітро1Н-індол-3-іл)бензонітрил (4, R1=i-Pr, R3=4бензонітрил) 250 мг, 0,82 ммоль) у колбу місткістю 50 мл та додають суспензію оксиду платини (II) (16 мг) у тетрагідрофурані (9 мл). Вміщують реакційну суміш у атмосферу водню та перемішують до витрачання вихідного матеріалу. Фільтрують через шар целіту, та промивають цей шар етилацетатом (50 мл). Концентрують об'єднані фільтрати, одержуючи 225,0 мг вказаної в заголовку сполуки (99%). LRMS (API ES+)=276,0 (M+H). 5-(6-аміно-1-ізопропіл-1H-індол-3-іл)піридин-2карбонітрил Спосіб F. Цю сполуку можна одержати з 5-(1ізопропіл-6-нітро-1Н-індол-3-іл)піридин-2карбонітрилу (4, R1=i-Pr, R3=5-(2-ціанопіридин)) за методикою, практично аналогічною описаній безпосередньо вище для 4-(6-аміно-1-ізопропіл-1Ніндол-3-іл)бензонітрилу, за виключенням того, що замість оксиду платини (II) у Способі Ε може бути застосований 10% паладій на активованому вугіллі (Degussa, тип Е101 NE/W). LRMS (API ES+)=277,0 (М+Н). 5-(6-аміно-1-ізопропіл-1Н-індол-3-іл)тіофен-2карбонітрил 31 Спосіб G. Додають N,N-диметилформамід (2 мл) та дигідрат дихлориду олова (II) (992 мг, 4,40 ммоль) у колбу місткістю 50 мл, яка містить 5-(1ізопропіл-6-нітро-1H-індол-3-іл)тіофен-2карбонітрил (4, R1=i-Pr, R3=2-ціанотіофен), (136,3 мг, 0,44 ммоль) у атмосфері азоту. Нагрівають до 60°С та перемішують протягом 45 хв. Охолоджують до кімнатної температури та гасять насиченим водним розчином бікарбонату натрію (15 мл). Фільтрують через шар целіту, та промивають цей шар етилацетатом (100 мл). Промивають об'єднані фільтрати насиченим водним розчином бікарбонату натрію (20 мл), водою (20 мл), розсолом (20 мл), сушать (Na2SO4) та фільтрують. Концентрують фільтрат до одержання 107,9 мг вказаної в заголовку сполуки (87%). LRMS (API ES+)=282,0 (M+H). 6-аміно-1-ізопропіл-3-(3,4,5-трифторфеніл)-1Ніндол Спосіб Н. 3авантажують 1-ізопропіл-6-нітро-3(3,4,5-трифторфеніл)-1Н-індол (4, R1=i-Pr, R3=3,4,5-трифторбензол) (136,1 мг, 0,41 ммоль), тетрагідрат ацетату нікелю (II) (204 мг, 0,82 ммоль), тетрагідрофуран (2,5 мл) та метанол (2,5 мл) у колбу місткістю 50 мл. Додають невеликими порціями боргідрид натрію (62 мг, 1,64 ммоль). Одразу ж після завершення виділення газу гасять реакційну суміш насиченим водним розчином хлориду амонію (5 мл), розводять етилацетатом (10 мл), та розділяють шари. Промивають органічний шар насиченим водним розчином бікарбонату натрію (5 мл), водою (5 мл), розсолом (5 мл), сушать (Na2SO4), фільтрують та концентрують. Цей матеріал можна використовувати без додаткового очищення на наступній стадії. N-[1-iзoпpoпiл-3-(3,4,5-тpифтopфeнiл)-1Hiндoл-6-iл]мeтaнcyльфoнaмiд (6, R1=i-Pr, R3=3,4,5трифторфеніл, R6=Me) Спосіб І. 3авантажують 6-аміно-1-ізопропіл-3(3,4,5-трифторфеніл)-1Н-індол (116,6 мг, 0,38 ммоль), одержаний, як описано безпосередньо вище, дихлорметан (3,0 мл) та піридин (62 мкл, 0,76 ммоль) у колбу місткістю 25 мл у атмосфері азоту. Охолоджують реакційну суміш до 0°С, та додають метансульфонілхлорид (33 мкл, 0,42 ммоль). Дозволяють реакційній суміші нагрітися до кімнатної температури при перемішуванні протягом 3 год. Гасять реакційну суміш насиченим водним розчином бікарбонату натрію (5 мл), розводять етилацетатом (10 мл), та розділяють шари. Промивають органічний шар водою (5 мл), розсолом (5 мл), сушать (Na2SO4) та фільтрують. Концентрують фільтрат, та адсорбують неочищений продукт на силікагелі. Очищають хроматографією на силікагелі, елююючи етилацетатом у дихлорметані (об'ємна частка 0-5%), та одержують 95,1 мг вказаної в заголовку сполуки (61%). LRMS (API ES+)=383,0 (M+H). N-[3-(5-хлортіофен-2-іл)-1-ізопропіл-1H-індол6-іл]метансульфонамід (6, R1=i-Pr, R3=5хлортіофен-2-іл, та R6=метил) Спосіб J. 3авантажують у запаювану трубку у атмосфері азоту N-[1-ізопропіл-3-(4,4,5,5тетраметил-[1,3,2]-діоксаборолан-2-іл)-1Н-індол-6іл]-метансульфонамід (266 мг, 0,70 ммоль), карбо 94600 32 нат калію (242 мг, 1,75 ммоль), 2-бром-5хлортіофен (207 мг, 1,05 ммоль), діоксан (6 мл) та воду (1 мл), після чого додають тетракіс(трифенілфосфін)паладій (0) (20 мг, 0,018 ммоль). Нагрівають реакційну суміш при 100°С протягом ночі, після чого охолоджують до кімнатної температури. Розводять реакційну суміш етилацетатом, та послідовно промивають одержану суміш водою та розсолом. Сушать органічний шар над MgSO4. Неочищений залишок піддають хроматографії на колонці із силікагелем, елююючи гексаном та етилацетатом (градієнт), та одержу1 ють 89 мг (34%) вказаної в заголовку сполуки. H ЯМР (CDCl3) 7,79 (d, 1Н, J=8,8 Гц), 7,42 (d, 1Н, J=1,8 Гц), 7,35 (s, 1 Η), 6,97 (dd, 1Н, J=2,0 Гц, 8,6 Гц), 6,93 (d, 1Н, J=4,0 Гц), 6,88 (d, 1H, J=4,0 Гц), 4,50-4,67 (m, 1H), 2,97 (s, 3H), 1,52 (d, 6H, J=6,6 Гц). Альтернативно замісник R3 може бути приєднаний у положенні 3 індолу, із застосуванням Способу Q, описаного нижче стосовно до N-[3-(2ціанофеніл)-1-ізопропіл-1Н-індол-6іл]метансульфонаміду (6, R1=i Pr, R3=2ціанофеніл, R6=Me). N-[3-(2-ціанофеніл)-1-ізопропіл-1Н-індол-6іл]метансульфонамід (6, R1=i Pr, R3=2-ціанофеніл, R6=Me) Спосіб Q. 3авантажують N-[1-ізопропіл-3(4,4,5,5-тетраметил-[1,3,2]діоксаборолан-2-іл)-1Ніндол-6-іл]метансульфонамід (50,0 мг, 0,132 ммоль), 4-бром-3-метилбензонітрил (51,8 мг, 0,264 ммоль), Pd(OAc)2 (4,25 мг, 0,018 ммоль; 4,25 мг), 2(дифенілфосфіно)-2'-(N,N-диметиламіно)біфеніл (11,5 мг, 0,030 ммоль), фосфат калію (84,2 мг, 0,396 ммоль) та 1,4-діоксан (1,00 мл) у посудину для мікрохвильової обробки місткістю 10 мл, обладнану мішалкою. Продувають реакційну суміш азотом, а потім закривають посудину кришкою. Вміщують посудину у мікрохвильовий реактор і нагрівають при 150°С протягом 15 хв при потужності 250 Вт. Спостерігають за ходом реакції, застосовуючи LC/MS. Охолоджують реакційну суміш до температури навколишнього середовища та гасять насиченим водним розчином хлориду амонію. Екстрагують одержану суміш етилацетатом. Промивають об'єднані екстракти насиченим водним розчином хлориду амонію, водою та розсолом. Сушать одержаний розчин над сульфатом натрію (гранульованим) та концентрують у вакуумі. Розчиняють одержану тверду речовину у дихлорметані та очищають на хроматотроні (пластина із силікагелем 1ММ), елююючи градієнтом 0-2% етилацетату у дихлорметані. Може бути необхідне повторне очищення. В такому разі матеріал очищають градієнтом 30-40% етилацетату у гексані, і одержують N-[3-(4-ціано-2-метилфеніл)-1ізопропіл-1Н-індол-6-іл]метансульфонамід (35 мг, 75%) у-вигляді злегка забарвленої твердої речо1 вини. H ЯМР (CDCl3) 7,58 (s, 1Н), 7,45-7,52 (m, 3H), 7,41 (d, 1H, J=8,4 Гц), 7,25 (s, 1H), 6,9 (dd, 1H, J=8,4 Гц, 1,7 Гц), 6,52 (s, 1H), 4,65 (септет, 1H, J=6,7 Гц), 2,98 (s, 3H), 2,34 (s, 3H), 1,55 (d, 6H, J=6,7 Гц); MS (IS-) m/e 377 (M-1). 33 N-[3-(2-тіоамідофеніл)-1-ізопропіл-1Н-індол-6іл]метансульфонамід (6, R1=i Pr, R3=2-тіоамід, R6=Me) Ціано- (або нітрильний) замісник N-[3-(2ціанофеніл)-1-ізопропіл-1Н-індол-6іл]метансульфонаміду може бути перетворений у тіоамідну групу, застосовуючи реагент Лавессона (Lawesson) відповідно до модифікованої методики, описаної Томсеном та ін. (Thomsen et al. Ore. Synth. 1984, 62, 158); Клаузеном та ін. (K. Clausen et al. J. Chem. Soc. Perkin Trans. I. 1984, 785); та Шабана та ін. (Shabana R.; Meyer H.J.; and Lawesson R.-O. Phosphorus and Sulfur, 1985, 25, 297). Приклад 178. N-[3-(6-ціано-5-фторпіридин-3іл)-1-ізопропіл-1H-індол-6-іл]метансульфонамід Спосіб X. Барботують азот через суміш N-[1ізопропіл-3-(4,4,5,5-тетраметил[1,3,2]діоксаборолан-2-іл)-1Н-індо-6іл]метансульфонаміду (0,186 г, 0,493 ммоль), 5бром-2-ціано-3-фторпіридину (0,090 г, 0,448 ммоль), K3РО4 (1,3 М) (0,60 мл) та діоксану (1,2 мл) протягом 5 хв. Додають трициклогексилфосфін (3,0 мг, 0,011 ммоль) та Pd2(dba)3 (4,1 мг, 0,0045 ммоль). 3апаюють трубку та перемішують при 100°С протягом 18 год. Після охолодження до кімнатної температури, екстрагують EtOAc та промивають NaHCO3. Сушать органічну фазу MgSO4. Очищають неочищений залишок, застосовуючи хроматографію на силікагелі, та одержують 0,112 г (вихід 67%) вказаної в заголовку сполуки, MS: 373,0 (М+Н). N-[3-(3,5-дифтор-4-гідроксиметилфеніл)-1iзопропіл-1H-індол-6-іл]метансульфонамід Спосіб S. 3авантажують N-(3-бром-1-ізопропіл1Н-індол-6-іл)-метансульфонамід (100 мг, 0,302 ммоль) та 2-фторпіридин-4-боронову кислоту (42,5 мг, 0,302 ммоль) у пробірку місткістю 10 мл для мікрохвильової обробки. Додають етанол (4 мл) та 1-н. розчин карбонату калію (847,4 мг, 0,362 мл, 0,362 ммоль). Додають смолу FC-1032 (19,3 мг, 9,1 мкмоль, 0,47 ммоль/г), після чого закривають пробірку. Обробляють мікрохвилями при 110°С протягом 15 хв. Фільтрують реакційну суміш, та концентрують у вакуумі. Очищають способом Isco на силікагелі (0-50% EtOAc/гексан). Концентрують, одержуючи вказану в заголовку сполуку (127 мг, 1 55%). Н ЯМР (DMSO) відповідає продукту. Синтези різних замісників, які можуть бути приєднані у положенні 3 або у положенні N-1 індолу, описано нижче. Амід 3-аміно-5-бром-піридин-2-карбонової кислоти: Додають невеликими порціями NaBH4 (0,663 г, 17,5 ммоль) до метанольного розчину (50 мл) 5-бром-2-ціано-3-нітропіридину (2,00 г, 8,77 ммоль) та тетрагідрату ацетату нікелю (II) (4,37 г, 17,5 ммоль) при 0°С. Після струшування при кімнатній температурі протягом 20 хв додають воду та EtOAc. Пропускають суміш через шар целіту. Екстрагують EtOAc. Сушать об'єднані екстракти EtOAc над MgSO4. Очищають неочищений продукт, застосовуючи хроматографію на силікагелі, та одержують 0,75 г (40% вихід) аміду 3-аміно-5бром-піридин-2-карбонової кислоти. MS 216,0/218,0 (М+Н). 94600 34 Амід 5-бром-3-фторпіридин-2-карбонової кислоти: Перемішують розчин аміду 3-аміно-5-бромпіридин-2-карбонової кислоти (0,75 г, 3,47 ммоль) та тетрафторборату нітрозонію (0,487 г, 4,16 ммоль) у дихлорметані (50 мл) при 23°С протягом 18 год. Випарюють розчинник. Видаляють розчинник азеотропною дистиляцією з толуолом, і одержують залишок. Суспендують залишок у толуолі (20 мл) та нагрівають зі зворотним холодильником протягом 2 год. Концентрують суміш, та очищають неочищений продукт хроматографією на силікагелі (10-100% EtOAc/гексан), одержуючи амід 5-бром3-фторпіридин-2-карбонової кислоти (0,378 г, 50%). MS: М+Н=221,0. 5-бром-2-ціано-3-фторпіридин: Перемішують суміш аміду 5-бром-3-фторпіридин-2-карбонової кислоти (0,375 мг, 1,71 ммоль) та NaCl (0,120 г, 2,05 ммоль) у СН2Сl2 (20 мл). Через 15 хв додають РОСl3 (0,795 мл, 8,55 ммоль), та нагрівають зі зворотним холодильником суміш протягом ночі. Охолоджують суміш до кімнатної температури та розводять СН2Сl2; промивають насиченим розчином NaHCO3, сушать над MgSO4. Очищають неочищений продукт, застосовуючи хроматографію на силікагелі (0-50% EtOAc/гексан), та одержують 0,25 г (вихід 73%) 5-бром-2-ціано-3-фторпіридину. 5-бром-2-ціано-3-метоксипіридин: 3мішують метилат натрію (141 мг, 2,61 ммоль) та 5-бром-2ціано-3-фторпіридин (105 мг, 0,52 ммоль) у THF (5 мл) та нагрівають зі зворотним холодильником протягом 18 год. Додають фосфатний буферний розчин, який має рН 7, та екстрагують EtOAc. Сушать екстракти над MgSO4. Видаляють осушувальний реагент, та випарюють фільтрат. Очищають неочищений продукт, застосовуючи хроматографію на силікагелі та елюючи сумішшю EtOAc/гексан (0-30%), та одержують 77 мг (вихід 69%) 5-бром-2-ціано-3-метоксипіридину. 5-бром-2-ціано-3-хлорпіридин: Додають NaNO2 (83,0 мг, 1,20 ммоль) до суспензії 3-аміно-5-бром2-ціанопіридину (198 мг, 1,00 ммоль) у 37% HCl (2,00 мл) та Н2О (0,5 мл) при 0°С та перемішують протягом 1 год. Додають порошок міді (15 мг), та нагрівають суміш зі зворотним холодильником протягом 30 хв. Охолоджують суміш та гасять льодом, підлуговують 5-н. розчином NaOH. Екстрагують EtOAc, та промивають органічні екстракти розсолом, сушать над MgSO4. Очищають неочищений продукт, застосовуючи хроматографію на силікагелі та елюючи сумішшю (0-30% EtOAc/гексан), та одержують 110 мг (вихід 50%) 5бром-2-ціано-3-хлорпіридину. 4-бром-нафталін-1-карбонітрил: Обробляють ультразвуком суспензію 4-бромнафталін-1-іламіну (0,974 г, 4,386 ммоль) у воді (6 мл) та концентрованій HCl (2 мл) протягом 10 хв. Охолоджують одержану суспензію до 0°С. Повільно додають нітрит натрію (0,336 г, 4,869 ммоль) у воді (2 мл) зі швидкістю, яка забезпечує підтримування температури нижче 5°С. Перемішують одержану суміш протягом 30 хв, а потім нейтралізують твердим бікарбонатом натрію. Додають частинами одержаний розчин до розчину ціаніду калію (0,717 г, 11,010 ммоль) та ціаніду міді (0,464 г, 5,181 ммоль) у воді (10 мл). Утворюється осад. Нагріва 35 ють реакційну суміш при 70° С протягом 30 хв, після чого екстрагують водну реакційну суміш етилацетатом (320 мл). Об'єднують органічні шари та промивають послідовно водою (30 мл), насиченим розчином хлориду амонію (30 мл) та бікарбонатом натрію (30 мл). Сушать одержані органічні шари (Na2SO4); видаляють тверді речовини фільтруванням; та концентрують фільтрат у вакуумі. Очищають одержаний залишок флешхроматографією з елююванням градієнтом від гексану до 20% етилацетату у гексані, одержуючи 0,864 г (85%) 4-бром-нафталін-1-карбонітрилу у 1 вигляді світло-коричневої твердої речовини. H ЯМР (CDCl3) 8,314 (dd, 1Н, J=2,4 Гц, 7,0 Гц), 8,235 (dd, 1Н, J=2,4 Гц, 7,0 Гц), 7,836 (d, 1Н, J=7,6 Гц), 7,728 (m, 3Н). 4-бром-2-фторбензамід: 3авантажують у колбу кислий оксид алюмінію (АІ2О3) (3,03 г, 29,718 ммоль) та метансульфонову кислоту (10 мл). Нагрівають одержаний розчин до 120°С, та додають однією порцією 4-бром-2-фторбензонітрил (2,00 г, 9,999 ммоль). Перемішують одержану суміш протягом 30 хв, після чого охолоджують реакційну суміш до кімнатної температури та виливають її у воду (50 мл). Екстрагують одержану водну суміш дихлорметаном (330 мл). Об'єднують органічні екстракти; сушать над Na2SO4; видаляють тверді речовини фільтруванням; та концентрують фільтрат у вакуумі, одержуючи 2,14 г (98%) 4-бром-2фторбензаміду у вигляді білої твердої речовини. 1 H ЯМР (DMSO-d6) 7,706 (d, 2Н, J=21,1 Гц), 7,598 (dd, 1Н, J=1,9 Гц, 10,1 Гц), 7,557 (dd, 1H, J=8,0 Гц, 8,0 Гц), 7,446 (ddd, 1Н, J=0,4 Гц, 1,9 Гц, 8,1 Гц). 5-(4-бром-2-фторфеніл)-1Н-тетразол: 3авантажують у колбу 4-бром-2-фторбензонітрил (3,0 г, 15,0 ммоль) та азидотрибутилолово (10 г, 30,0 ммоль). Нагрівають суміш при 80°С протягом 24 год, після чого охолоджують реакційну суміш та розводять її 15 мл діетилового ефіру. Виливають одержаний розчин у 15 мл діетилового ефіру, насиченого газоподібним хлористим воднем. Видаляють одержану тверду речовину фільтруванням, та промивають тверді речовини гексаном, одержуючи 3,1 г (85%) вказаного в заголовку матеріалу. LRMS (API ES+)=243,0 (M+H). 5-(4-бром-2-фторфеніл)-1-метил-1Н-тетразол: Додають безводний DMF до гідриду натрію (0,2 г, 4,8 ммоль), який заздалегідь промивають тричі гексаном, охолоджують одержану суспензію до 0°С, та додають порціями 5-(4-бром-2-фторфеніл)1Н-тетразол (1,0 г, 4,4 ммоль). Перемішують суміш протягом 30 хв, після чого додають метилйодид (0,68 г, 4,8 ммоль), та продовжують перемішувати реакційну суміш при кімнатній температурі; спостерігають за ходом реакції за допомогою хроматографії у тонкому шарі (ХТШ). Після завершення гасять реакційну суміш 10% розчином NaHSO4 (50 мл); розводять етилацетатом (50 мл); та розділяють шари. Екстрагують водний шар тричі етилацетатом (25 мл). Об'єднують органічні шари; та сушать над MgSO4. Видаляють тверді речовини фільтруванням, та концентрують фільтрат у вакуумі. Хроматографують залишок на колонці із силікагелем, елююючи 20% розчином етилацетату у 94600 36 гексані, одержуючи 0,68 г (65%) вказаного в заголовку матеріалу. LRMS (API ES+)=239,0 (M+H). 5-бром-4-метил-2-тіофенкарбоксамід: 3авантажують метил-5-бром-4-метил-2тіофенкарбоксилат (5,0 г, 1,0 екв., 21,2 ммоль) та 7-н. розчин NH3 у МеОН (50 мл) у колбу. Нагрівають суміш у запаяній трубці при 100°С протягом 18 год. Очищають залишок хроматографією на силікагелі, елююючи градієнтом (ступінчастим) від 30%EtOAc/гексан до 80% EtOAc/гексан. Виділяють 0,7 г (64%). LRMS (API ES+)=221,8 (M+H). 5-бром-4-метил-2-тіофенкарбонітрил: 3авантажують 5-бром-4-метил-2тіофенкарбоксамід (1,2 г, 1,0 екв., 5,4 ммоль) та РОСІ3 (30 мл) у колбу. Перемішують суміш при кімнатній температурі протягом 18 год. Очищають залишок хроматографією на силікагелі, елююючи сумішшю 30%EtOAc/гексан, та одержують вказану 1 в заголовку сполуку (0,7 г, 64%). H ЯМР (CDCl3) 7,27 (s, 1Н), 2,17 (s, 3Н). 4-бром-3-метил-2-тіофенкарбоксамід: 3авантажують 4-бром-3-метил-2-тіофенкарбонову кислоту (2,0 г, 1,0 екв., 9,0 ммоль) та тіонілхлорид (30 мл) у колбу. Перемішують суміш при кімнатній температурі протягом 18 год. Концентрують одержану суміш у вакуумі, а потім суспендують залишок у 7-н. розчині ΝΗ3 у МеОН (50 мл). Перемішують протягом 1 год. Концентрують у вакуумі, одержуючи 1,9 г (100%) вказаної в заголовку сполуки. LRMS (API ES+)=221,8 (M+H). 4-бром-3-метил-2-тіофенкарбонітрил: Розчиняють 4-бром-3-метил-2-тіофенкарбоксамід у 30 мл РОСl3, та залишають суміш при перемішуванні при кімнатній температурі протягом 18 год. Потім концентрують реакційну суміш у вакуумі; та очищають залишок хроматографією (силікагель, 5% етилацетат/гексан), одержуючи вказану в заголов1 ку сполуку (0,9 г, 49%). Н-ЯМР (CDCl3) 9,44 (s, 1Н), 4,40 (s, 3Н). 4-бром-2-фтор-6-метоксибензонітрил: Спосіб DF1. Розчиняють 4-бром-2,5дифторбензонітрил (1,5 г, 6,9 ммоль) у THF (10 мл). Додають NaOMe (1,9 г, 25% (мас.) розчин у МеОН, 8,3 ммоль). Перемішують реакційну суміш протягом ночі при кімнатній температурі. Концентрують у вакуумі та очищають хроматографією на силікагелі (градієнт 0-50% EtOAc/гексан/30 хв). Концентрують вибрані фракції у вакуумі, одержуючи вказану в заголовку сполуку (1,5 г, 94%) у ви1 гляді білої твердої речовини. H ЯМР відповідає структурі. TLC (20% EtOAc/гексан) Rf=0,28. 4-бром-2-фтор-6-метоксибензальдегід: Спосіб DF2. Розчиняють 4-бром-2-фтор-6метоксибензонітрил (1,15 г, 5,0 ммоль) у дихлорметані (50 мл) та охолоджують до 0°С. Додають DIBAL (6,0 мл, 1,0-н. розчин у дихлорметані 1,2 ммоль). Перемішують реакційну суміш протягом приблизно 1 год при 0°С. Додають 5-н розчин HCl (20 мл), та перемішують одержаний розчин протягом приблизно 10 хв. Екстрагують дихлорметаном, промивають розсолом, сушать над Na2SO4, фільтрують та концентрують у вакуумі. Очищають хроматографією на силікагелі (градієнт 0-50% EtOAc/гексан/30 хв). Концентрують вибрані фракції у вакуумі без нагрівання, одержуючи вказану в 37 заголовку сполуку (485 мг, 44%) у вигляді білої 1 твердої речовини. H ЯМР відповідає структурі. 5-бром-2-дифторметил-1-фтор-3метоксибензол: Спосіб DF3. Розчиняють 4-бром-2-фтор-6метоксибензальдегід (485 мг, 2,0 ммоль) у дихлорметані (5 мл); додають DAST (0,3 мл, 2,2 ммоль) та нагрівають зі зворотним холодильником протягом ночі у запаяній трубці. Охолоджують до кімнатної температури та переносять безпосередньо у завантажувальний картридж для хроматографії на силікагелі. Очищають хроматографією на силікагелі (градієнт 0-50% EtOAc/гексан/30 хв) та концентрують у вакуумі, одержуючи вказану в заголовку сполуку (353 мг, вихід 70%) у вигляді безбарвного 1 масла. TLC (20% EtOAc/гексан) Rf=0,50. H ЯМР відповідає структурі. 2-бром-5-етилтриметилсиланпіридин: Нагрівають при кипінні суміш 2-бром-5-йод-піридину (1 г, 3,5 ммоль), етилтриметил-силану (360 мг, 3,67 ммоль), йодиду міді (І) (20 мг, 0,1 ммоль) та тетракіс-(трифенілфосфін)паладію (0) (121 мг, 0,01 ммоль) у триетиламіні (10 мл) у атмосфері азоту у запаяній трубці протягом 3 діб. Випарюють розчинник. Очищають неочищений залишок, застосовуючи хроматографію на силікагелі, та одержують 800 мг (90%) бажаного продукту. 4-бром-2-тюфенкарбонітрил: Нагрівають зі зворотним холодильником 4-бром-2тіофенкарбонову кислоту (960 мг, 4,63 ммоль) у SOCI2 (5 мл) протягом 1 год. Випарюють надлишок SOCl2. Додають до залишку THF (5 мл). Повільно додають краплями одержаний розчин до концентрованого розчину NH4OH (15 мл) у льодяній бані. Перемішують суміш протягом ночі. Концентрують суміш, після чого додають EtOAc, промивають розсолом; та сушать над MgSO4; фільтрують та концентрують у вакуумі. Додають до залишку NaCl (307 мг, 5.26 ммоль) та дихлорметан (10 мл) та нагрівають зі зворотним холодильником протягом 30 хв. Додають РОСІ3 (3,36 г, 21,9 ммоль), після чого суміш нагрівають зі зворотним холодильником протягом 1 год. Розводять суміш дихлорметаном та промивають водним розчином NaHCO3, розсолом, та сушать над MgSO4; фільтрують та концентрують у вакуумі, одержуючи 753 мг бажаного продукту. 4-бром-2,6-диметилбензонітрил: 3авантажують 4-бром-2,6-диметилфеніламін (4,49 94600 38 г, 22,4 ммоль), воду (25 мл) та концентровану хлористоводневу кислоту (8,0 мл) у тригорлу колбу та обробляють ультразвуком до утворення тонкодисперсної суспензії. Охолоджують цю суспензію до 0°С, та додають краплями розчин нітриту натрію (1,67 г, 24,2 ммоль) у воді (5 мл), підтримуючи температуру реакційної суміші нижче 5°С. Перемішують реакційну суміш при 0°С протягом 30 хв після завершення додавання. Обережно нейтралізують реакційну суміш твердим бікарбонатом натрію. Додають нейтралізовану реакційну суміш порціями у круглодонну колбу, яка містить ціанід міді (І) (2,42 г, 27,0 ммоль), ціанід калію (3,65 г, 56,1 ммоль) та воду (25 мл) при 70°С. Перемішують одержаний розчин протягом 30 хв при 70°С. Охолоджують реакційну суміш до температури навколишнього середовища та екстрагують толуолом (75 мл3). Об'єднують органічні шари та промивають водою та розсолом. Сушать над сульфатом натрію та концентрують у вакуумі. Очищають флеш-хроматографією (градієнт 2-20% етилацету у гексані), одержуючи 4-бром-2,61 диметилбензонітрил (3,36 г, 15,99 ммоль, 71%). H ЯМР (CDCl3) 7,50 (s, 1Н), 2,46 (s, 6H). 4-бром-2-хлор-6-метилбензонітрил: Одержують за способом, практично таким самим, як описано для 4-бром-2,6-диметилбензонітрилу, з 41 бром-2-хлор--6-метилфеніламіну. Н ЯМР (DMSOd6) 7,52 (s, 1Н), 7,38 (s, 1Н) 2,53 (s, 3H). 4-бром-2,6-дихлорбензонітрил: Одержують за способом, практично таким самим, як описано для 1 4-бром-2,6-диметилбензонітрилу, із феніламіну. Н ЯМР (CDCl3) 7,59 (s, 2H). 4-бром-3-метоксибензонітрил: Одержують за способом, практично таким самим, як описано для 1 4-бром-2,6-диметилбензонітрилу, з феніламіну. H ЯМР (CDCl3) 7,62 (d, 1Н, J=7,9 Гц), 7,09 (dd, 1H, J=7,9 Гц, 1,8 Гц), 7,07 (d, 1H, J=1,8 Гц), 3,91 (s, 3H). 4-бром-2-фтор-5-метилбензонітрил: Одержують за способом, практично таким самим, як опи1 сано для 4-бром-2,6-диметилбензонітрилу. H ЯМР (CDCl3) 7,46 (m, 2Н), 2,40 (s, 3Н). Сполуки, перелічені нижче у Таблиці 1, можуть бути одержані зі сполук, які мають загальну структуру індольної системи, зображеної як проміжний продукт 2, за методиками, описаними вище. 39 94600 40 41 94600 42 Якщо не зазначено інше, аналітичні дані означають дані мас-спектру. Спосіб означає спосіб одержання відповідно до Схем 1-6 та супровідного опису експериментів. Сполуки, перелічені нижче у Таблиці 2, можуть бути одержані зі сполук, які мають загальну струк туру індольної системи, зображеної як проміжний продукт 3, за методиками, описаними вище. 43 94600 44 45 94600 46 47 94600 48 49 94600 50 *** Дивись експериментальний розділ Якщо не зазначено інше, аналітичні дані означають дані мас-спектру. Спосіб означає спосіб одержання відповідно до Схем 1-6 та супровідного опису експериментів. * Дивись описані нижче Способи Z-1 та Z-2. Сполуки, перелічені нижче у Таблиці 3, можуть бути одержані зі сполук, які мають загальну структуру індольної системи, зображеної як проміжний продукт 4, за методикою, описаною вище. 51 94600 52 53 94600 54 55 94600 56 Якщо не зазначено інше, аналітичні дані означають дані мас-спектру. Спосіб означає спосіб одержання відповідно до Схем 1-6 та супровідного опису експериментів. 57 Сполуки, перелічені нижче у Таблиці 4, можуть бути одержані зі сполук, які мають загальну струк 94600 58 туру індольної системи, зображеної як проміжний продукт 4-А, за методиками, описаними вище. 59 94600 60
ДивитисяДодаткова інформація
Назва патенту англійськоюIndole sulfonamide modulators of progesterone receptors
Автори англійськоюBleisch Thomas John, Clarke Christian Alexander, Dodge Jeffrey Alan, Jones Scott Alan, Lopez Jose Eduardo, Lugar III, Charles Willis, Muehl Brian Stephen, Richardson Timothy Ivo, Yee Ying Kwong, Yu Kuo-Long
Назва патенту російськоюИндолсульфонамидные модуляторы рецепторов прогестерона
Автори російськоюБлейш Томас Джон, Кларк Кристьян Александер, Додж Джеффри Алан, Джоунз Скотт Алан, Лопес Хосе Эдуардо, Люгар Третий, Чарлз Уиллис, Мехл Брайан Стефан, Ричардсон Тимоти Айво, Йе Ин Квон, Ю Куо-лон
МПК / Мітки
МПК: C07D 209/24, C07D 403/04, C07D 209/10, C07D 209/18, C07D 209/12, C07D 209/14, C07D 401/04
Мітки: рецепторів, модулятори, індолсульфонамідні, прогестерону
Код посилання
<a href="https://ua.patents.su/51-94600-indolsulfonamidni-modulyatori-receptoriv-progesteronu.html" target="_blank" rel="follow" title="База патентів України">Індолсульфонамідні модулятори рецепторів прогестерону</a>
Попередній патент: Пристрій для подачі відкривальних пристроїв, які приклеюються до упаковок, які містять розливні харчові продукти
Наступний патент: Похідні триазолоанілінопіримідину для застосування як противірусні засоби
Випадковий патент: Сонячний колектор