Дифенілові етери, фармацевтична композиція, що їх містить, їх застосування, спосіб лікування (варіанти), спосіб їх одержання і спосіб одержання проміжних сполук
Номер патенту: 75067
Опубліковано: 15.03.2006
Автори: Стобі Алан, Ендрюс Марк Девід, Гепуорт Девід, Мідлтон Дональд Стюарт
Формула / Реферат
1. Дифеніловий етер загальної формули (І) або його фармацевтично прийнятні солі, сольвати або поліморфи;
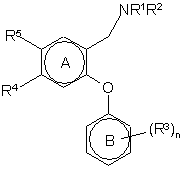 , (І)
, (І)
де
R1 і R2, які можуть бути однаковими або різними, є воднем, С1-С6алкілом, (СН2)m(С3-С6циклоалкіл), де m = 0, 1, 2 або 3, або R1 і R2 разом з атомом азоту, до якого вони приєднані, утворюють азетидинове кільце;
кожний R3 є незалежно СF3, OCF3, С1-4алкілтіо або С1-4алкокси;
n є 1, 2 або 3; і
R4 і R5, які можуть бути однаковими або різними, є:
А-Х, де А=-СН=СН- або -(CH2)p- де р є 0, 1 або 2; Х є воднем, F, Сl, Br, I, CONR6R7, SO2NR6R7, SO2NHC(=O)R6, ОН, С1-4алкокси, NR8SO2R9, NO2, NR6R11, CN, CO2R10, CHO, SR10, S(O)R9 або SO2R10; R6, R7, R8 і R10, які можуть бути однаковими або різними, є воднем або С1-С6алкілом, необов'язково заміщеним незалежно одним або більшою кількістю R12; R9 є С1-С6алкілом, необов'язково, заміщеним незалежно одним або більшою кількістю R12; R11 є воднем, С1-С6алкілом, необов'язково заміщеним незалежно одним або більшою кількістю R12, C(O)R6, CO2R9, C(O)NHR6 або SO2NR6R7; R12 є F, OH, CO2H, С3-6циклоалкілом, NH2, CONH2, С1-С6алкокси, С1-С6алкоксикарбонілом або 5- або 6-членним героциклічним кільцем, яке містить 1, 2 або 3 гетероатоми, вибрані з N, S і О, необов'язково заміщеним незалежно одним або більшою кількістю R13; або R6 і R7, разом з атомом азоту до якого вони приєднані, утворюють 4-, 5- або 6-членне гетероциклічне кільце, необов'язково заміщене незалежно одним або більшою кількістю R13; або 5- або 6-членне гетероциклічне кільце, яке містить 1, 2 або 3 гетероатоми, вибрані з N, S і О, необов'язково заміщене незалежно одним або більшою кількістю R13; де R13 є гідрокси, С1-С4алкокси, F, С1-С6алкілом, галоалкілом, галоалкокси, -NН2, -NН(С1-С6алкіл) або -N(С1-С6алкіл)2; де якщо R1 і R2 є метилом, R4 і R5 є воднем, і n є 1, R3 не є -SMe групою, що знаходиться в пара положенні до зв'язку, що з'єднує кільця А і В.
2. Сполука за пунктом 1 або її фармацевтично прийнятні солі, сольвати або поліморфи, де R1 і R2, які можуть бути однаковими або різними, є воднем або С1-С6алкілом.
3. Сполука за пунктами 1 або 2 або її фармацевтично прийнятні солі, сольвати або поліморфи, де кожний R3 є незалежно -CF3, -OCF3, метилтіо, етилтіо або метокси.
4. Сполука за будь-яким з попередніх пунктів або її фармацевтично прийнятні солі, сольвати або поліморфи, де принаймні один R3 є групою, що знаходиться в параположенні до зв'язку, що з'єднує кільця А і В.
5. Сполука за будь-яким з попередніх пунктів або її фармацевтично прийнятні солі, сольвати або поліморфи, де принаймні один R3 є метилтіо.
6. Сполука за будь-яким з попередніх пунктів або її фармацевтично прийнятні солі, сольвати або поліморфи, де R6 і R7, які можуть бути однаковими або різними, є воднем, С1-С3алкілом, необов'язково, заміщеним гідрокси, -CONH2 або С1-С3алкокси.
7. Сполука за будь-яким з попередніх пунктів або її фармацевтично прийнятні солі, сольвати або поліморфи, де R8 є воднем, гідроксіетилом або метилом.
8. Сполука за будь-яким з попередніх пунктів або її фармацевтично прийнятні солі, сольвати або поліморфи, де R9 є метилом, етилом, ізопропілом, трифторметилом або метоксіетилом.
9. Сполука за будь-яким з попередніх пунктів, або її фармацевтично прийнятні солі, сольвати або поліморфи, де р є 1 або 0.
10. Сполука за будь-яким з попередніх пунктів або її фармацевтично прийнятні солі, сольвати або поліморфи, де R4 і R5, які можуть бути однаковими або різними, є -(СН2)р-Х, де р є 0, 1 або 2; Х є воднем, гідрокси, CONR6R7, SO2R6R7, NR8SOR9, SR10, SOR9 або SO2R10; або 5- або 6-членним гетероциклічним кільцем, яке містить 1, 2 або 3 гетероатоми, вибрані з N, S і О.
11. Сполука за будь-яким з пунктів 1-5 або її фармацевтично прийнятні солі, сольвати або поліморфи, де R4 і R5, які можуть бути однаковими або різними, є -(СН2)р-Х, де р є 0 або 1; Х є воднем, гідрокси, CONR6R7, SO2NR6R7 або NR8SO2R9; де R6 і R7, які можуть бути однаковими або різними, є воднем або С1-С3алкілом, необов'язково заміщеним гідрокси, -CONH2 або С1-С3алкокси; R8 є воднем, гідроксіетилом або метилом;
або R9 є метилом, етилом, ізопропілом, трифторметилом або метоксіетилом; або триазолілом, імідазолілом або піразолілом.
12. Сполука за будь-яким з попередніх пунктів або її фармацевтично прийнятні солі, сольвати або поліморфи, де R4 і R5 не є обидва воднем.
13. Сполука за будь-яким з попередніх пунктів або її фармацевтично прийнятні солі, сольвати або поліморфи, де R4 є воднем.
14. Сполука за пунктом 1 або її фармацевтично прийнятні солі, сольвати або
поліморфи, вибрані з групи, яка складається з:
3-[(диметиламіно)метил]-4-[4-(метилсульфаніл)фенокси]бензолсульфонаміду;
3-[(диметиламіно)метил]-N-метил-4-[4-(трифторметил)фенокси]бензолсульфонаміду;
3-[(диметиламіно)метил]-4-[4-(трифторметокси)фенокси]бензолсульфонаміду;
3-[(диметиламіно)метил]-N-[(2R)-2-гідроксипропіл]-4-[4-(метилсульфаніл)-
фенокси]бензолсульфонаміду;
3-[(диметиламіно)метил]-N-[(1S)-2-гідрокси-1-метилетил]-4-[4-
(метилсульфаніл)фенокси]бензолсульфонаміду;
3-[(диметиламіно)метил]-N-(2-гідроксіетил)-4-[4-(метилсульфаніл)-
фенокси]бензолсульфонаміду;
3-[(диметиламіно)метил]-4-[4-(метилсульфаніл)фенокси]бензонітрилу;
3-[(диметиламіно)метил]-4-[4-(метилсульфаніл)фенокси]бензаміду;
3-[(диметиламіно)метил]-4-[4-(трифторметокси)фенокси]бензаміду;
3-[(метиламіно)метил]-4-[4-(метилсульфаніл)фенокси]бензаміду;
N-{3-[(диметиламіно)метил]-4-[4-(трифторметил)фенокси]феніл}метансульфонаміду;
4-[3-метокси-4-(метилсульфаніл)фенокси]-3-[(метиламіно)метил]бензаміду;
N-метил-3-[(метиламіно)метил]-4-[4-(метилсульфаніл)фенокси]бензаміду;
3-[(диметиламіно)метил]-4-[3-метокси-4-(метилсульфаніл)фенокси]бензаміду;
N-метил-N-[2-[4-(метилсульфаніл)фенокси]-5-(1Н-1,2,3-триазол-1-іл)бензил]аміну;
N-метил-N-[2-[4-(метилсульфаніл)фенокси]-5-(1Н-1,2,4-триазол-1-іл)бензил]аміну;
N,N-диметил-N-[2-[4-(метилсульфаніл)фенокси]-5-(1Н-1,2,4-триазол-1-іл)бензил]аміну;
N-[2-[4-(метилсульфаніл)фенокси]-5-(4Н-1,2,4-триазол-4-іл)бензил]-N,N-диметиламіну і
N-{5-(3-аміно-1Н-піразол-1-іл)-2-[4-(метилсульфаніл)фенокси]бензил}-N-метиламіну.
15. 3-[(диметиламіно)метил]-4-[4-(метилсульфаніл)фенокси]бензолсульфонамід або його (L)- або (D)-тартратна сіль.
16. Сполука за будь-яким з попередніх пунктів або її фармацевтично прийнятні солі, сольвати або поліморфи, для використання як фармацевтичного засобу.
17. Фармацевтична композиція, яка містись сполуку за будь-яким з пунктів 1-15 або її фармацевтично прийнятні солі, сольвати або поліморфи, і фармацевтично прийнятний ад'ювант, розріджувач або носій.
18. Застосування сполуки за будь-яким з пунктів 1-15 або її фармацевтично прийнятних солей, сольватів або поліморфів, у виробництві ліків для лікування або профілактики розладу, при якому задіяна функція регуляції транспорту моноаміну.
19. Застосування за пунктом 18, де розладом є депресія, дефіцит уваги внаслідок гіперактивності, обсесивно-компульсивний розлад, посттравматичний стрессиндром, залежність від речовин або сексуальна дисфункція.
20. Застосування за пунктом 18 у виробництві ліків для лікування або профілактики передчасної еякуляції.
21. Спосіб лікування або профілактики розладу, при якому задіяна функція регуляції транспорту моноаміну, який включає призначення ефективної кількості сполуки за будь-яким з пунктів 1-15 або її фармацевтично прийнятних солей, сольватів або поліморфів, пацієнту, якому необхідне таке лікування або профілактика.
22. Спосіб лікування або профілактики передчасної еякуляції, який включає призначення ефективної кількості сполуки за будь-яким з пунктів 1-15 або її фармацевтично прийнятних солей, сольватів або поліморфів, пацієнту, якому необхідне таке лікування або профілактика.
23. Спосіб збільшення затримки еякуляції, який включає призначення ефективної кількості сполуки за будь-яким з пунктів 1-15 або її фармацевтично прийнятних солей, сольватів або поліморфів, чоловіку, який бажає збільшити затримку еякуляції.
24. Спосіб одержання дифенілового етеру загальної формули (І)
 , (І)
, (І)
де R1, R2, R3, R4 і R5 і n мають визначені в пункті 1 значення, який включає реакцію сполуки загальної формули II
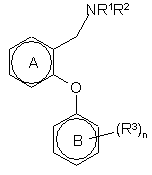 (ІІ)
(ІІ)
у придатних умовах для проходження реакції з утворенням сполуки формули І, де придатними умовами для проходження реакції є:
і) якщо R4/R5 є галогеном, шляхом взаємодії (II) з придатним галогенуючим агентом в інертному розчиннику, який не перешкоджає проходженню реакції;
іі) якщо R4/R5 є -NO2, шляхом взаємодії (II) з придатним нітруючим агентом в інертному розчиннику, який не перешкоджає проходженню реакції, при кімнатній температурі або нижче; або
ііі) якщо R4/R5 є -SO2NR6R7 шляхом взаємодії проміжного сульфонілхлориду з необхідним аміном формули HNR6R7 у придатному розчиннику.
25. Спосіб за пунктом 24 одержання сполуки формули Іа, тобто сполуки формули І, в якій R5 є -SO2NR6R7;
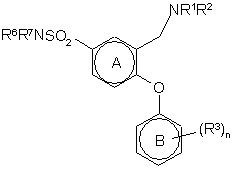 , (Іа)
, (Іа)
який включає
а) реакцію сполуки формули II, необов'язково, у придатному розчиннику з хлорсульфоновою кислотою з одержанням сполук формули (XII)
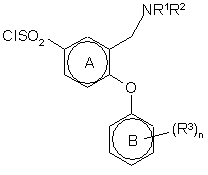 (ХІІ)
(ХІІ)
з наступною b) реакцією з HNR6R7 з одержанням сполук формули (Іа).
26. Спосіб за пунктом 25, де сполуки формули (XII) одержують in situ і піддають реакції з HNR6R7 без виділення.
27. Спосіб одержання сполуки формули (II), в якому сполуку формули (III)
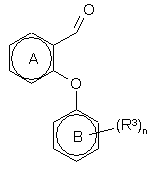 (ІІІ)
(ІІІ)
піддають взаємодії зі сполукою формули HNR1R2, або з її придатною сіллю, разом із гідридним відновлюючим агентом у придатному розчиннику з утворенням сполуки формули (II).
28. Дифеніловий етер загальної формули (І)
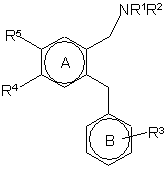 (І)
(І)
і його фармацевтично прийнятні солі або сольвати де:
R1 і R2 незалежно представляють Н, С1-С6 алкіл, (СH2)m(С3-С6циклоалкіл), де m = 0, 1, 2 або 3, або де NR1R2 разом представляють 4-членне кільце, де R1 і R2 разом представляють С3 алкіл;
R3 представляють одну або більшу кількість груп, вибраних з групи, яка включає: CF3, OCF3, SR12 і С1-С4алкокси, де R12 представляє С1-С6алкіл; і
R4 і R5 незалежно представляють А-Х, де А = -(СH2)n-, де n представляє 0, 1 або 2, і де Х представляє: Н, F, Сl, Br, I, CONR6R7 або SO2NR6R7, OH, NR8SO2R9, NO2, NR6R11, CN, CO2R10, CHO, S(O)mR10, де m = 0, 1 або 2, і де R6, R7, R8 і R10 незалежно представляють Н або С1-С6алкіл, де R9 представляє С1-С6 алкіл, R11 представляє Н, С1-С6алкіл, C(O)R6, CO2R9, C(O)NHR6 або SO2NR6R6, і де зазначена С1-С6алкільна група є необов'язково, заміщеною одним або більшою кількістю груп, вибраних з ОН, СO2Н, С3-6циклоалкілу, NH2, CONH2, С1-6алкокси, С1-С6алкоксикарбонілу і 5- або 6-членного гетероциклічного кільця, яке містить 1, 2 або 3 гетероатоми, вибрані з N, S і О;
або R4 і/або R5 можуть бути 5- або 6-членним гетероциклічним кільцем, яке містить 1, 2 або 3 гетероатоми, вибрані з N, S і О; і, крім того, R6 і R7 можуть, разом з атомом N, до якого вони приєднані, представляти піролідинове і піперидинове кільце (які є необов'язково заміщеними ОН або СОNН2) або морфолінове кільце (яке є необов'язково заміщеним CONH2) за умови, що обидва R4 і R5 не є Н.
Текст
1. Дифеніловий етер загальної формули (І) або його фармацевтично прийнятні солі, сольвати або поліморфи; (13) 75067 (21) 2002097628 (22) 19.03.2001 (24) 15.03.2006 (86) PCT/IB01/00428, 19.03.2001 (31) 0007884.0 (32) 31.03.2000 (33) GB (46) 15.03.2006, Бюл. № 3, 2006 р. (72) Ендрюс Марк Девід, GB, Гепуорт Девід, GB, Мідлтон Дональд Стюарт, GB, Стобі Алан, GB (73) ПФАЙЗЕР ІНК., US (56) US 5334748 A, 02.08.1994 R. H.F. MANSKE, ET AL.:"Synthesis and reactions of some dibenzoxepins", JOURNAL OF THE AMERICAN CHEMICAL SOCIETY, 16.10.1950, Vol: 72, Nr. 10, Page(s): 4797-4799, XP002170116, 2 (11) 1 UA (54) ДИФЕНІЛОВІ ЕТЕРИ, ФАРМАЦЕВТИЧНА КОМПОЗИЦІЯ, ЩО ЇХ МІСТИТЬ, ЇХ ЗАСТОСУВАННЯ, СПОСІБ ЛІКУВАННЯ (ВАРІАНТИ), СПОСІБ ЇХ ОДЕРЖАННЯ І СПОСІБ ОДЕРЖАННЯ ПРОМІЖНИХ СПОЛУК C2 ДО ПАТЕНТУ НА ВИНАХІД (19) ДЕРЖАВНИЙ ДЕПАРТАМЕНТ ІНТЕЛЕКТУАЛЬНОЇ ВЛАСНОСТІ 3 75067 4 6. Сполука за будь-яким з попередніх пунктів або її фармацевтично прийнятні солі, сольвати або поR5 ліморфи, де R6 і R7, які можуть бути однаковими A або різними, є воднем, С1-С3алкілом, необов'язкоO R4 (І) во, заміщеним гідрокси, -CONH2 або С1-С3алкокси. 7. Сполука за будь-яким з попередніх пунктів або її (R3)n фармацевтично прийнятні солі, сольвати або поB ліморфи, де R8 є воднем, гідроксіетилом або ме, тилом. де 8. Сполука за будь-яким з попередніх пунктів або її 1 2 R і R , які можуть бути однаковими або різними, є фармацевтично прийнятні солі, сольвати або поводнем, С1-С6алкілом, (СН2)m(С3-С6циклоалкіл), де ліморфи, де R9 є метилом, етилом, ізопропілом, 1 2 m = 0, 1, 2 або 3, або R і R разом з атомом азоту, трифторметилом або метоксіетилом. до якого вони приєднані, утворюють азетидинове 9. Сполука за будь-яким з попередніх пунктів, або кільце; її фармацевтично прийнятні солі, сольвати або 3 кожний R є незалежно СF3, OCF3, С1-4алкілтіо або поліморфи, де р є 1 або 0. С1-4алкокси; 10. Сполука за будь-яким з попередніх пунктів або n є 1, 2 або 3; і її фармацевтично прийнятні солі, сольвати або 4 5 R і R , які можуть бути однаковими або різними, є: поліморфи, де R4 і R5, які можуть бути однаковими А-Х, де А=-СН=СН- або -(CH2)p- де р є 0, 1 або 2; Х або різними, є -(СН2)р-Х, де р є 0, 1 або 2; Х є водє воднем, F, Сl, Br, I, CONR6R7, SO2NR6R7, нем, гідрокси, CONR6R7, SO2R6R7, NR8SOR9, SR10, 6 8 9 SO2NHC(=O)R , ОН, С1-4алкокси, NR SO2R , NO2, SOR9 або SO2R10; або 5- або 6-членним гетероциNR6R11, CN, CO2R10, CHO, SR10, S(O)R9 або клічним кільцем, яке містить 1, 2 або 3 гетероатоSO2R10; R6, R7, R8 і R10, які можуть бути однаковими, вибрані з N, S і О. ми або різними, є воднем або С1-С6алкілом, не11. Сполука за будь-яким з пунктів 1-5 або її фаробов'язково заміщеним незалежно одним або бімацевтично прийнятні солі, сольвати або полільшою кількістю R12; R9 є С1-С6алкілом, морфи, де R4 і R5, які можуть бути однаковими або необов'язково, заміщеним незалежно одним або різними, є -(СН2)р-Х, де р є 0 або 1; Х є воднем, більшою кількістю R12; R11 є воднем, С1-С6алкілом, гідрокси, CONR6R7, SO2NR6R7 або NR8SO2R9; де необов'язково заміщеним незалежно одним або R6 і R7, які можуть бути однаковими або різними, є більшою кількістю R12, C(O)R6, CO2R9, C(O)NHR6 воднем або С1-С3алкілом, необов'язково заміщеабо SO2NR6R7; R12 є F, OH, CO2H, С3ним гідрокси, -CONH2 або С1-С3алкокси; R8 є водциклоалкілом, NH2, CONH2, С1-С6алкокси, С16 нем, гідроксіетилом або метилом; С6алкоксикарбонілом або 5- або 6-членним героабо R9 є метилом, етилом, ізопропілом, трифторциклічним кільцем, яке містить 1, 2 або 3 гетероаметилом або метоксіетилом; або триазолілом, томи, вибрані з N, S і О, необов'язково заміщеним імідазолілом або піразолілом. незалежно одним або більшою кількістю R13; або 12. Сполука за будь-яким з попередніх пунктів або 6 7 R і R , разом з атомом азоту до якого вони приєдїї фармацевтично прийнятні солі, сольвати або нані, утворюють 4-, 5- або 6-членне гетероциклічне поліморфи, де R4 і R5 не є обидва воднем. кільце, необов'язково заміщене незалежно одним 13. Сполука за будь-яким з попередніх пунктів або або більшою кількістю R13; або 5- або 6-членне її фармацевтично прийнятні солі, сольвати або гетероциклічне кільце, яке містить 1, 2 або 3 гетеполіморфи, де R4 є воднем. роатоми, вибрані з N, S і О, необов'язково заміще14. Сполука за пунктом 1 або її фармацевтично не незалежно одним або більшою кількістю R13; де прийнятні солі, сольвати або 13 R є гідрокси, С1-С4алкокси, F, С1-С6алкілом, гаполіморфи, вибрані з групи, яка складається з: лоалкілом, галоалкокси, -NН2, -NН(С1-С6алкіл) або 3-[(диметиламіно)метил]-4-[41 2 4 5 -N(С1-С6алкіл)2; де якщо R і R є метилом, R і R (метилсульфаніл)фенокси]бензолсульфонаміду; 3 є воднем, і n є 1, R не є -SMe групою, що знахо3-[(диметиламіно)метил]-N-метил-4-[4диться в пара положенні до зв'язку, що з'єднує (трифторметил)фенокси]бензолсульфонаміду; кільця А і В. 3-[(диметиламіно)метил]-4-[42. Сполука за пунктом 1 або її фармацевтично (трифторметокси)фенокси]бензолсульфонаміду; 1 прийнятні солі, сольвати або поліморфи, де R і 3-[(диметиламіно)метил]-N-[(2R)-2-гідроксипропіл]2 R , які можуть бути однаковими або різними, є во4-[4-(метилсульфаніл)днем або С1-С6алкілом. фенокси]бензолсульфонаміду; 3. Сполука за пунктами 1 або 2 або її фармацев3-[(диметиламіно)метил]-N-[(1S)-2-гідрокси-1тично прийнятні солі, сольвати або поліморфи, де метилетил]-4-[43 кожний R є незалежно -CF3, -OCF3, метилтіо, ети(метилсульфаніл)фенокси]бензолсульфонаміду; лтіо або метокси. 3-[(диметиламіно)метил]-N-(2-гідроксіетил)-4-[44. Сполука за будь-яким з попередніх пунктів або її (метилсульфаніл)фармацевтично прийнятні солі, сольвати або пофенокси]бензолсульфонаміду; ліморфи, де принаймні один R3 є групою, що зна3-[(диметиламіно)метил]-4-[4ходиться в параположенні до зв'язку, що з'єднує (метилсульфаніл)фенокси]бензонітрилу; кільця А і В. 3-[(диметиламіно)метил]-4-[45. Сполука за будь-яким з попередніх пунктів або її (метилсульфаніл)фенокси]бензаміду; фармацевтично прийнятні солі, сольвати або по3-[(диметиламіно)метил]-4-[4ліморфи, де принаймні один R3 є метилтіо. (трифторметокси)фенокси]бензаміду; NR1R2 5 75067 6 3-[(метиламіно)метил]-4-[4NR1R2 (метилсульфаніл)фенокси]бензаміду; R5 N-{3-[(диметиламіно)метил]-4-[4(трифтормеA тил)фенокси]феніл}метансульфонаміду; 4 O (І) R 4-[3-метокси-4-(метилсульфаніл)фенокси]-3[(метиламіно)метил]бензаміду; (R3)n N-метил-3-[(метиламіно)метил]-4-[4B (метилсульфаніл)фенокси]бензаміду; 3-[(диметиламіно)метил]-4-[3-метокси-4, (метилсульфаніл)фенокси]бензаміду; де R1, R2, R3, R4 і R5 і n мають визначені в пункті 1 N-метил-N-[2-[4-(метилсульфаніл)фенокси]-5-(1Нзначення, який включає реакцію сполуки загальної 1,2,3-триазол-1-іл)бензил]аміну; формули II N-метил-N-[2-[4-(метилсульфаніл)фенокси]-5-(1НNR1R2 1,2,4-триазол-1-іл)бензил]аміну; N,N-диметил-N-[2-[4-(метилсульфаніл)фенокси]-5(1Н-1,2,4-триазол-1-іл)бензил]аміну; A N-[2-[4-(метилсульфаніл)фенокси]-5-(4Н-1,2,4(ІІ) O триазол-4-іл)бензил]-N,N-диметиламіну і N-{5-(3-аміно-1Н-піразол-1-іл)-2-[4(метилсульфаніл)фенокси]бензил}-N-метиламіну. (R3)n B 15. 3-[(диметиламіно)метил]-4-[4(метилсульфаніл)фенокси]бензолсульфонамід або його (L)- або (D)-тартратна сіль. у придатних умовах для проходження реакції з 16. Сполука за будь-яким з попередніх пунктів або утворенням сполуки формули І, де придатними її фармацевтично прийнятні солі, сольвати або умовами для проходження реакції є: поліморфи, для використання як фармацевтичного і) якщо R4/R5 є галогеном, шляхом взаємодії (II) з засобу. придатним галогенуючим агентом в інертному ро17. Фармацевтична композиція, яка містись сполузчиннику, який не перешкоджає проходженню реаку за будь-яким з пунктів 1-15 або її фармацевтичкції; но прийнятні солі, сольвати або поліморфи, і фаріі) якщо R4/R5 є -NO2, шляхом взаємодії (II) з примацевтично прийнятний ад'ювант, розріджувач датним нітруючим агентом в інертному розчинниабо носій. ку, який не перешкоджає проходженню реакції, при 18. Застосування сполуки за будь-яким з пунктів 1кімнатній температурі або нижче; або 15 або її фармацевтично прийнятних солей, сольііі) якщо R4/R5 є -SO2NR6R7 шляхом взаємодії проватів або поліморфів, у виробництві ліків для лікуміжного сульфонілхлориду з необхідним аміном вання або профілактики розладу, при якому задіяформули HNR6R7 у придатному розчиннику. на функція регуляції транспорту моноаміну. 25. Спосіб за пунктом 24 одержання сполуки фор19. Застосування за пунктом 18, де розладом є мули Іа, тобто сполуки формули І, в якій R5 є депресія, дефіцит уваги внаслідок гіперактивності, SO2NR6R7; обсесивно-компульсивний розлад, посттравматичNR1R2 ний стрессиндром, залежність від речовин або R6R7NSO2 сексуальна дисфункція. A 20. Застосування за пунктом 18 у виробництві ліків для лікування або профілактики передчасної еякуO (Іа) ляції. 21. Спосіб лікування або профілактики розладу, (R3)n B при якому задіяна функція регуляції транспорту моноаміну, який включає призначення ефективної , кількості сполуки за будь-яким з пунктів 1-15 або її який включає фармацевтично прийнятних солей, сольватів або а) реакцію сполуки формули II, необов'язково, у поліморфів, пацієнту, якому необхідне таке лікупридатному розчиннику з хлорсульфоновою кисвання або профілактика. лотою з одержанням сполук формули (XII) 22. Спосіб лікування або профілактики передчасNR1R2 ної еякуляції, який включає призначення ефективCISO2 ної кількості сполуки за будь-яким з пунктів 1-15 A або її фармацевтично прийнятних солей, сольваO (ХІІ) тів або поліморфів, пацієнту, якому необхідне таке лікування або профілактика. (R3)n 23. Спосіб збільшення затримки еякуляції, який B включає призначення ефективної кількості сполуки за будь-яким з пунктів 1-15 або її фармацевтично з наступною b) реакцією з HNR6R7 з одержанням прийнятних солей, сольватів або поліморфів, чосполук формули (Іа). ловіку, який бажає збільшити затримку еякуляції. 24. Спосіб одержання дифенілового етеру загальної формули (І) 7 75067 8 26. Спосіб за пунктом 25, де сполуки формули (XII) R1 і R2 незалежно представляють Н, С1-С6 алкіл, одержують in situ і піддають реакції з HNR6R7 без (СH2)m(С3-С6циклоалкіл), де m = 0, 1, 2 або 3, або виділення. де NR1R2 разом представляють 4-членне кільце, 27. Спосіб одержання сполуки формули (II), в якоде R1 і R2 разом представляють С3 алкіл; му сполуку формули (III) R3 представляють одну або більшу кількість груп, 12 вибраних з групи, яка включає: CF3, OCF3, SR і O 12 С1-С4алкокси, де R представляє С1-С6алкіл; і R4 і R5 незалежно представляють А-Х, де А = A (СH2)n-, де n представляє 0, 1 або 2, і де Х представляє: Н, F, Сl, Br, I, CONR6R7 або SO2NR6R7, O (ІІІ) OH, NR8SO2R9, NO2, NR6R11, CN, CO2R10, CHO, S(O)mR10, де m = 0, 1 або 2, і де R6, R7, R8 і R10 не(R3)n залежно представляють Н або С1-С6алкіл, де R9 B представляє С1-С6 алкіл, R11 представляє Н, С1С6алкіл, C(O)R6, CO2R9, C(O)NHR6 або SO2NR6R6, і 1 2 піддають взаємодії зі сполукою формули HNR R , де зазначена С1-С6алкільна група є необов'язково, або з її придатною сіллю, разом із гідридним відзаміщеною одним або більшою кількістю груп, виновлюючим агентом у придатному розчиннику з браних з ОН, СO2Н, С3-6циклоалкілу, NH2, CONH2, утворенням сполуки формули (II). С1-6алкокси, С1-С6алкоксикарбонілу і 5- або 628. Дифеніловий етер загальної формули (І) членного гетероциклічного кільця, яке містить 1, 2 NR1R2 або 3 гетероатоми, вибрані з N, S і О; або R4 і/або R5 можуть бути 5- або 6-членним ге5 R тероциклічним кільцем, яке містить 1, 2 або 3 гетероатоми, вибрані з N, S і О; і, крім того, R6 і R7 A можуть, разом з атомом N, до якого вони приєдна(І) R4 ні, представляти піролідинове і піперидинове кільце (які є необов'язково заміщеними ОН або СОNН2) або морфолінове кільце (яке є необов'язR3 B ково заміщеним CONH2) за умови, що обидва R4 і R5 не є Н. і його фармацевтично прийнятні солі або сольвати де: Даний винахід стосується ряду нових дифенілових етерів, які інгібують зворотне захоплення моноаміну. Зокрема сполуки згідно з даним винаходом проявляють активність у якості селективних інгібіторів зворотного захоплення серотоніну (СІЗЗС (SSRIs)) і тому використовуються у різноманітних терапевтичних сферах. Крім того, сполуки згідно з даним винаходом корисні у лікуванні та профілактиці різноманітних розладів, включно з тими, в яких залучена функція регуляції транспорту моноаміну, таких як депресія, дефіцит уваги внаслідок гіперактивності, обесивнокомпульсивний розлад, пост-травматичний стрессиндром, залежність від речовин та сексуальні дисфункції, включно з передчасною еяколяцією, а також винахід стосується фармацевтичних композицій, які містять такі сполуки. Відповідно до першого втілення винахід стосується сполуки загальної формули (І), або її фармацевтично прийнятних солей, сольватів або поліморфів; де; R1 і R2, які можуть бути однаковими або різними, є воднем, С1-С6 алкілом, (СН2)m(С3С6циклоалкіл), де m = 0, 1,2 або 3, або R1 і R2 разом з атомом азоту, до якого вони приєднані, утворюють азетидинове кільце; кожний R3 є, незалежно, CF3 OCF3, С1С4алкілтіо або С1-С4алкокси; n є 1, 2 або 3; та R4 і R5, які можуть бути однаковими або різними, є: А-Х, де А = -СН=СН- або -(СН2)p-, де p є 0, 1 або 2; X є воднем, F, СІ, Br, I, CONR6R7, SO2NR6R7, SO2NHC(=O)R6, ОН, С1-4алкокси, NR8SO2R8, NO2, NP6R11, CN, CO2R10, CHO, SR10, S(O)R9 або SO2R10; R6, R7, R8 і R10, які можуть бути однаковими або різними, є воднем або С1-6алкілом, необов'язково, заміщеним, незалежно, одним або біль' 9 75067 10 шою кількістю R12; R9 є С1-6 алкілом, необов'язкоцем, яке містить 1, 2 або 3 гетероатоми, вибрані з во, заміщеним незалежно одним або більшою кіN, S і О (переважно оксадіазоліл, триазоліл, імідалькістю R12; R11 є воднем, С1-6 алкілом, необов'яззоліл, оксазоліл, піразоліл, піридиніл або піримідиково, заміщеним незалежно одним або більшою ніл). кількістю R12, C(O)R6, CO2R9, C(O)NHR6 або Більш переважно R4 і R5, які можуть бути од6 7 12 SO2NR R ; R є F (переважно до 3), ОН, СО2Н, С3наковими або різними, є: МН2, CONH2, С1-6алкокси, С1-(СН2)p-Х, де p є 0 або 1; X є воднем, гідрокси, 6циклоалкілом, CONR6R7, SO2NR6R7 або NR8SO2R9; де R6 і R7, які 6алкоксикарбонілом або 5- або 6-членним гетероциклічним кільцем, яке містить 1, 2 або 3 гетероаможуть бути однаковими або різними, є воднем томи, вибрані з N, S і О, необов'язково, заміщеним або С1-С3алкілом, необов'язково, заміщеним гідронезалежно одним або більшою кількістю R13; або кси, -CONH2 або С1-С3алкокси (переважно метокR8 і R7, разом з атомом азоту до якого вони приєдси); R8 є воднем, гідроксиетилом або метилом; або нані, утворюють 4-, 5- або 6-членне гетероциклічне R9 є метилом, етилом, ізопропілом, трифторметикільце, необов'язково, заміщене незалежно одним лом або метоксиетилом; або триазолілом, імідаабо більшою кількістю R13; або 5- або 6- членним золілом або піразолілом. гетероциклічним кільцем, яке містить 1, 2 або 3 Ще більш переважно R4 і R5 не є обидва водгетероатоми, вибрані з N, S і О, необов'язково, нем. Ще більш переважно R4 є воднем. Переважзаміщеним незалежно одним або більшою кількісно, R6 і R7, які можуть бути однаковими або різни13 13 тю R ; де R є гідрокси, С1-С4алкокси, F, С1ми, є воднем, С1-С3алкілом, необов'язково, С6алкілом, галоалкілом, галоалкокси, -NH2, заміщеним гідрокси, -CONH2 або С1-С3алкокси NН(С1-С6алкіл) або -N(C1-С6алкіл)2; і де, якщо R1 і (переважно метокси). Більш переважно, R6 і R7, які 2 4 5 3 R є метилом, R і R є воднем і n є 1, R не є -SMe можуть бути однаковими або різними, є воднем групою, що знаходиться в пара положенні до зв'яабо метилом, ще більш переважно воднем. зку, що з'єднує кільця А і В. Якщо присутній, R12 є переважно оксадіазоліЯкщо не вказано інше, будь-яка алкільна група лом, триазолілом, імідазолілом, оксазолілом, піраможе бути нерозгалуженою або розгалуженою та золілом, піридинілом або піримідинілом. Більш складатися з від 1 до 6 атомів вуглецю, переважно переважно, триазолілом, імідазолілом або піразовід 1 до 4, і переважно від 1 до 3 атомів вуглецю. лілом. Якщо не вказано інше, будь-яка гетроциклічна У випадку, якщо R6 і R7, разом з атомом азоту група містить від 5 до 7 атомів кільця, не більше до якого вони приєднані, утворюють гетероциклічніж 4 з яких можуть бути гетероатомами, такими як не кільце, переважними кільцями є піролідинове азот, кисень та сірка, та може бути насиченою, або піперидинове кільця, кожне з яких може бути ненасиченою та ароматичною. Прикладами гетезаміщеним ОН або CONH2, або морфоліновим роциклічних груп є фурил, тієніл, піроліл, піролініл, кільцем, яке може бути заміщеним CONH2. піролідиніл, диоксоланіл, оксазоліл, тіазоліл, імідаПереважно R11 є воднем або С1-6 алкілом. Пезоліл, імідазолініл, імідазолідиніл, піразоліл, пірареважно R8 є воднем, гідроксиетилом або метизолініл, піразолідиніл, ізоксазоліл, ізотіазоліл, оклом. Більш переважно воднем. садіазоліл, триазоліл, триадіазоліл, піраніл, Переважно R9 є метилом, етилом, ізопропіпіридиніл, піперидиніл, діоксаніл, морфоліно, дитілом, трифторметилом або метоксиетилом. Більш аніл, тіоморфоліно, піридазиніл, піримідиніл, пірапереважно, метилом або етилом (переважно мезиніл, піперазиніл, сульфоланіл, тетразоліл, триатилом). зиніл, азепініл, оксазепініл, тіазепініл, діазепініл і Переважно R10 є метилом або етилом. тіазолініл. Крім того, термін гетероцикліл включає Переважно p є 1 або 0, більш переважно 0. приконденсовані гетроциклічні групи, наприклад Переважно R1 і R2, які можуть бути однаковибензімідазоліл, бензоксазоліл, імідазопіридиніл, ми або різними, є воднем або метилом; принаймні бензоксазиніл, бензотіазиніл, оксазолопіридиніл, один R3 є групою, що знаходиться в пара полохінолініл, хіназолініл, хіноксалініл, дигідрохіназоліженні до зв'язку, і є CF3, OCF3, метилтіо, етилтіо ніл, бензотіазоліл, фталімідо, бензофураніл, бенабо метокси; і зодіазепініл, індоліл і ізоіндоліл. Термін гетроцикR4 і R5, які можуть бути однаковими або різнилічне кільце має ті ж значення. ми, є Переважно R1 і R2, які можуть бути однакови(СН2)p-Х, де ρ є 0 або 1; X є воднем, гідрокси, ми або різними, є воднем або С1-С6алкілом. Більш CONR6R7, SO2NR6R7, NR8SO2R9, SR10, SOR9 або переважно воднем або метилом. SO2R10, де R6 і R7, які можуть бути однаковими або 3 Переважно кожний R є, незалежно, -CF3, різними, є воднем, C1-С3алкілом, необов'язково, OCF3, метилтіо, етилтіо або метокси. заміщеним гідрокси, -CONH; або С1-С3алкокси Переважно принаймні один R3 є групою, що (переважно метокси); або R6 і R7, разом з атомом знаходиться в пара положенні до зв'язку, що з'єдазоту до якого вони приєднані, можуть утворювати нує кільця А і В. Переважно принаймні один R3 є морфолінове, піролідинове або піперидинове кільметилтіо. це, кожне з яких може бути заміщеним ОН або 4 5 8 Переважно R і R , які можуть бути однаковиCONH2; R є воднем, гідроксиетилом або метилом ми або різними, є (переважно воднем); R9 є метилом, етилом, ізоп-(СН2)p-Х, де p є 0, 1 або 2 (переважно 0 або ропілом, трифторметилом або метоксиетилом; і 1); X є воднем, гідрокси, CONR6R7, SO2NR6R7, R10 є метилом або етилом; або оксадіазолілом, NR8SO2R9, SR10, SOR9 або SO2R10, де R6, R7, R8, триазолілом, імідазолілом, оксазолілом, піразоліR9 і R10 мають значення, визначені в першому втілом, піридинілом або піримідинілом. ленні, або 5- або 6-членним гетероциклічним кільБільш переважно R1 і R2, які можуть бути од 11 75067 12 наковими або різними, є воднем або метилом; (трифторметил)фенокси]феніл}принаймні один R3 є групою, що знаходиться в метансульфонамід; пара положенні до зв'язку, і є CF3, OCF3, метилтіо, 4-[3-метокси-4-(метилсульфаніл)фенокси]-3етилтіо або метокси, і принаймні один R3 є метил[(метиламіно)метил]бензамід; тіо або етилтіо; і N-метил-3-[(метиламіно)метил]-4-[44 5 R і R , які можуть бути однаковими або різни(метилсульфаніл)фенокси]бензамід; ми, є -(СН2)p-Х, де p є 0 або 1; X є воднем, гідрок3-[(диметиламіно)метил]-4-[3-метокси-4си, CONR6R7, SO2NR6R7 або NR8SO2R9; де R6 і R7, (метилсульфаніл)фенокси]-бензамід; які можуть бути однаковими або різними, є водN-метил-N-[2-[4-(метилсульфаніл)фенокси]-5нем, С1-С3алкілом, необов'язково, заміщеним гід(1Н-1,2,3-триазол-1-іл)бензил]амін; рокси, -CONH2 або С1-С3алкокси (переважно метоN-метил-N-[2-[4-(метилсульфант)фенокси]-5кси); R8 є воднем, гідроксиетилом або метилом; R9 (1Н-1,2,4-триазол-1-іл)бензил]амін; є метилом, етилом, ізопропілом, трифторметилом N,N-диметил-N-[2-[4або метоксиетилом; або триазолілом, імідазолілом (метилсульфант)фенокси]-5-(1Н-1,2,4-триазол-1або піразолілом. іл)бензил]-амін; Ще більш переважно R1 і R2, які можуть бути N-[2-[4-(метилсульфант)фенокси]-5-(4Н-1,2,4однаковими або різними, є воднем або метилом; триазол-4-т)бензил]-N,N-диметиламін; і принаймні один R3 є групою, що знаходиться в N-{5-(3-аміно-1Н-піразол-1-іл)-2-[4пара положенні до зв'язку, і є CF3, OCF3, метилтіо (метилсульфаніл)фенокси]бензил}-N-метиламін. або метокси, і принаймні один R3 є метилтіо; Перевагою сполук згідно з даним винаходом є R4 є воднем, і те, що вони є селективними інгібіторами зворотноR5 є -(СН2)p-Х, де p є 0 або 1; X є воднем, гідго захоплення серотоніну (SRIs) (і тому ймовірно рокси, CONR8R7, SO2NR6R7 або NR8SO2R9; де R6 і мають меншу кількість побічних ефектів), вони R7, які можуть бути однаковими або різними, є вомають швидкий початок дії (що робить їх придатднем, С1-С3алкілом, необов'язково, заміщеним ними для призначення незадовго до одержання гідрокси, -CONH2 або С1-С3алкокси (переважно необхідного результату дії), вони мають бажану метокси); R8 є воднем, гідроксиетилом або метиефективність та асоційовані властивості. Є перелом; R9 є метилом, етилом, ізопропілом, трифторважними сполуки, які селективно інгібують зворотметилом або метоксиетилом; або триазолілом, не захоплення серотоніну, а не норадреналіну або імідазолілом або піразолілом. допаміну. Ще більш переважно R4 і R5 не є обидва водВиявили, що сполуки формули І, які мають ці нем. властивості, мають відносно полярну групу в R4R5. Для уникнення невизначеності, якщо не вказаТому, відповідно до наступного втілення, вино інше, термін "заміщений" означає "заміщений нахід стосується сполуки загальної формули І і її одною або більшою кількістю вказаних груп". У фармацевтично прийнятних солей, в якій R1, R2, випадку, якщо групи можуть вибиратись з ряду R3 і n мають значення, визначені в першому втіальтернативних груп, вибрані групи можуть бути ленні; і R4 і R5, які можуть бути однаковими або однаковими або різними. різними, є -(СН2)p-А', де p є 0, 1 або 2, і А' є полярДля уникнення невизначеності, термін "незаною групою. У цьому втіленні полярні групи молежно" означає, що якщо з ряду можливих замісжуть визначатись як ті, що мають від'ємне πників вибирається один замісник, ці замісники мозначеня [див. С Hansch i A Leo, 'Substituent жуть бути однаковими або різними. Constants for Correlation Analysis in Chemistry and Переважними сполуками формули (І) є: Biology', Wiley, New York, 1979]. У цій системі, Η 3-[(диметиламіно)метил]-4-[4має -значення 0.00, -ОСН3 має -значення -0.02, і (метилсульфаніл)фенокси]бензолсульфонамід; -SO2NH2 має -значення -1.82, неприклад [див. 3-[(диметиламіно)метил]-N-метил-4-[4Таблиця Vl-I, 'Well-Characterized Aromatic (трифторметил)фенокси]бензолсульфонамід; Substituents', p 49, там же]. Більш переважні поля3-[(диметиламіно)метил]-4-[4рні групи мають -значення із більшим від'ємним (трифторметокси)фенокси]бензолсульфонамід; числом: таким чином, переважні групи мають 3-[(диметиламіно)метил]-N-[(2R)-2значенням із більшим від'ємним числом ніж -0.1, гідроксипропіл]-4-[4-(метилсульфаніл)більш переважно значення із більшим від'ємним фенокси]бензолсульфонамід; числом ніж -0.5, і найбільш переважно значення із 3-[(диметиламіно)метил]-N-[(1S)-2-гідрокси-1більшим від'ємним числом ніж -1.0. Навіть якщо p метилетил]-4-[4-(метилсульфаніл)не є нулем у вищенаведеному визначені, визнафенокси]бензолсульфонамід; чення А' грунтується на вищенаведеному поси3-[(диметиламіно)метил]-N-(2-гідроксиетил)-4ланні припускаючи ніби р є нулем. [4-(метилсульфаніл)фенокси]-бензолсульфонамід; Фармацевтично або ветеринарно прийнятни3-[(диметиламіно)метил]-4-[4ми солями сполук згідно з даним винаходом, які (метилсульфаніл)фенокси]бензонітрил; містять основні центри, є, наприклад, нетоксичні 3-[(диметиламіно)метил]-4-[4кислотно-адитивні солі, одержані з неорганічних (метилсульфаніл)фенокси]бензамід; кислот, таких як соляна, бромводнева, йодистово3-[(диметиламіно)метил]-4-[4днева, сірчана та фосфорна кислота, з карбонових (трифторметокси)фенокси]бензамід; кислот або з органо-сульфонових кислот. Прикла3-[(метиламіно)метил]-4-[4дами є НСІ, НВr, НІ, сульфатні або бісульфатні, (метилсульфаніл)фенокси]бензамід; нітратні, фосфатні або гідрофосфатні, ацетатні, N-{3-[(диметиламіно)метил]-4-[4бензоатні, сукцинатні, сахаратні, фумаратні, мале 13 75067 14 атні, лактатні, цитратні, тартратні, глюконатні, кам19, Number 9,1983, pp 499-538 і в Topics in зилатні, метансульфонатні, етансульфонатні, бенChemistry, Chapter 31, pp 306-316, в "Design of золсульфонатні, п-толуолсульфонатні і памоатні Prodrugs" by H. Bundgaard, Elsevier, 1985, Chapter солі. Сполуки згідно зданим винаходом також 1 (ці публікації включені тут у якості посилань). включають фармацевтично або ветринарно приСпеціалістам в цій галузі також очевидно, що датні солі металів, зокрема солі нетоксичних луждеякі замісники, відомі фахівцям у цій галузі як них та лужно-земельних металів. Прикладами є "прозамісники", наприклад описані Н. Bundgaard в солі натрію, калію, алюмінію, кальцію, магнію, цин"Design of Prodrugs" (ця публікація включена тут у ку та диетаноламіну. Для перегляду придатних якості посилання) можуть розміщувати на придатфармацевтичних солей див. Berge et al. J. Pharm, них функціональних групах, якщо такі функціонаSci., 66,1-19,1977; Bighley et al. International Journal льні групи присутні у сполуках згідно з даним виof Pharmaceutics, 33 (1986), 201-217; і Ρ L Gould, находом. Encyclopedia of Pharmaceutical Technology, Marcel Перважними проліками сполук згідно з даним Debker Inc. New York 1996, Volume 13, стор. 453винаходом є: естери, естери карбонатів, гемі497. естери, естери фосфатів, нітроестери, естери суФармацевтично прийнятними сольватами льфатів, сульфоксиди, аміди, карбамати, азосполук згідно з даним винаходом є їх гідрати. сполуки, фосфаміди, глікозиди, етери, ацетали та Також до сполук та різних солей згідно з дакетали. ним винаходом включені їх поліморфи. Сполуки згідно з даним винаходом можуть буПереважними солями є тартратні солі, зокрети одержані відомим способом за допомогою різма L-тартратна і D-тартрана солі (і також рацемічноманітних методик. на D/L-тартратна сіль); фосфатна сіль; сіль соляУ наступних схемах реакцій і далі, якщо не ної кислоти; цитратна сіль; і сульфатна сіль. Також вказано інше, R1 - R13, n, m і p мають значення, переважною сіллю є сіль натрію (див. Приклад 28). визначені в першому втіленні. Ці способи є настуВказані нижче сполуки, їх фармацевтично пним втіленням даного винаходу. прийнятні солі, їх сольвати або поліморфи, визнаУ всьому описі загальні формули позначені чені у будь-якому втіленні даного винаходу (окрім римськими цифрами І, II, III, IV і т.д. Підгрупи загаприміжних сполук в хімічних реакціях), відносять льних формул позначені як la, Ib, Іс і т.д.,... IVa, до "сполук згідно з даним винаходом". IVb, IVc і т.д. Сполуки згідно з даним винаходом можуть маСполуки загальної формули (І) можуть бути ти один або більше хіральних центрів, тому моодержані із сполук загальної формули (II) різними жуть існувати у різних стереоізомерних формах. методиками (див. Схему 1), де L є придатною груВсі стереоізомери та їх суміші включені до об'єму пою, що відходить, такою як галоген (F, СІ, Вr або даного винаходу. Рацемічні сполуки можуть бути І), або сульфонатним естером, таким як трифторабо виділені шляхом препаративної ВЕРХ із викометансульфонат або метансульфонат, переважно ристанням колонки з хіральною нерухомою фазою, L є F або СІ. або шляхом розділення з одержанням окремих енантіомерів за допомогою методів, відомих фахівцям у цій галузі. Крім того, хіральні проміжні сполуки можуть піддаватись розділенню та застосоовуватись для одержання хіральних сполук згідно з даним винаходом. Сполуки згідно з даним винаходом можуть існувати в одній або більшій кількості таутомерних форм. Усі таутомери та їх суміші також включені Наприклад: до об'єму даного винаходу. Наприклад, пункт, в і) Якщо R4/R5 є галогеном, шляхом взаємодії якому заявляється 2-гідроксипіридиніл, буде також (II) з придатним галогенуючим агентом в інертному включати його таутомерну форму, -піридоніл. розчиннику, який не перешкоджає проходженню Винахід також включає мічені ізотопами спореакції. Придатними галогенуючими агентами є луки. трифторметансульфонова кислота і NСпеціалістам в цій галузі очевидно, що деякі йодсукцинімід, і придатні інертні розчинники вклюзахищені похідні сполук згідно з даним винаходом, чають дихлорметан як наведено у Прикладі 16 які можуть одержуватись до останньої стадії знятнижче; тя захисту, можуть не мати фармакологічної дії як іі) Якщо R4/R5 є -NO2, шляхом взаємодії (II) з такої, але можуть у деяких випадках призначатись придатним нітруючим агентом, таким як нітрат перорально або парентерально і потім метаболілужного металу, в інертному розчиннику, який не зуватись у тілі з одержанням сполук згідно з даним перешкоджає проходженню реакції, при або нижче винаходом, які є фармакологічно активними. Такі кімнатної температури. Придатними нітруючими похідні можуть тому бути описані як "проліки". Крім агентами є суміш трифторметансульфонова кистого, деякі сполуки згідно з даним винаходом молота/нітрат калію, і придатні інертні розчинники жуть діяти як проліки інших сполук згідно з даним включають трифтороцтову кислоту як наведено у винаходом. Прикладі 21 нижче; або Всі захищені похідні та проліки сполук згідно з ііі) Перетворення у сполуки формули І, де даним винаходом включені до об'єму даного винаR4/R5 є -SO2NR6R7, шляхом взаємодії проміжного ходу. Приклади придатних проліків сполук згідно з сульфонілхлориду з відповідним аміном формули даним винаходом описані в Drugs of Today, Volume 15 75067 16 HNR6R7 у придатному розчиннику. Придатними (VII) (див. Схему 2) аналогічно одержанню (II) (див. розчинниками є етанол, і реакції загалом провоСхему 1). дять при або нижче кімнатної температури. Наприклад, сполуки формули (Іа), де R5 є -SO2NR6R7, можуть одержувати шляхом реакції проміжних сульфонілхлоридів (XII), одержаних зі сполук формули (II) шляхом взаємодії (II) з хлорсульфоновою кислотою, з HNR6R7. Умови для проходження реакції звичайно включають її проходження при низькій температурі. Реакція може проходити або без розчинника, або у присутності інертного розчинника, який не перешкоджає проходженню реакції. Придатними інертними розчинниками є дихСполуки загальної формули (VII) можуть оделорметан, і типовою температурою для ржувати з (VI) і (IV) аналогічно одержанню (III) проходження реакції є 0°С, як наведено у Прикладі (див. Схему 1). 28 нижче. Проміжний сульфонілхлорид (XII) моАльтернативно, сполуки загальної формули жуть виділяти, очищати і потім піддавати реакції з (І), які мають особливий R4/R5 замісник, можуть HNR6R7, альтернативно його можуть одержувати бути перетворені у інші сполуки формули (І) за in situ, без виділення, і піддавати реакції з HNR6R7. допомогою відомих методик. Наприклад: і) Якщо R4/R5 є воднем, таким як хлор, бром або йод, він може бути перетворений у ціано шляхом взаємодії з ціанідом у присутності Pd(0) або (II) каталізатора у висококиплячому розчиннику при підвищеній температурі. Придатним Pd каталізатором є тетракіс(трифенілфосфін)паладію, прийнятні цианіди включають Zn(CN)2, і придатні висококиплячі розчинники, які не перешкоджають проходженню реакції, включають диметилформаОтже, відповідно до наступного втілення, вимід, як наведено у Прикладі 81 нижче; нахід стосується способу одержання сполук загаіі) Якщо R4/R5 є галогеном, таким як хлор, льної формули (І) із сполук загальної формули (II). бром або йод, він може бути перетворений у У переважному втіленні передбачено спосіб одерCH2CN через проміжний ціаноестер. Проміжні ціажання сполук формули (Іа) шляхом взаємодії споноестери одержували шляхом взаємодії з лук формули (II) у придатному розчиннику з хлорціаноацетатом у присутності солі міді(І) і основи в сульфоновою кислотою з одержанням сполук висококиплячому розчиннику при підвищеній темформули (XII) з наступною реакцією з HNR6R7 з пературі. Придатними α-ціаноацетатами є етил одержанням сполук формули (Іа). Переважно споціаноацетат, придатними солями міді(І) є бромід луки формули (XII) одержували in situ і піддавали 6 7 міді(І), придатними основами є карбонат калію, і реакції з HNR R без виділення. придатні висококиплячі розчинники включають Сполуки загальної формули (II) можуть, в свою диметилсульфоксид. Проміжні ціаноестери можуть чергу, одержуватись зі сполук формули (III) шляпотім піддавати гідролізу та декарбоксилуванню в хом взаємодії з аміном загальної формули одній стадії шляхом обробки гідроксидом в високоHNR1R2, або з його придатною сіллю разом із гідкиплячому розчиннику при підвищеній температуридним відновлюючим агентом у придатному розрі. Придатні гідроксиди включають гідроксид начиннику. Якщо або R1 або R2 є воднем, придатнитрію, і придатні висококиплячі розчинники ми розчинниками є протонні розчинники, такі як включають водний розчин діоксану, як наведено в етанол, і боргідрид натрію є придатними відновПрикладі 89 нижче; люючим агентом. Якщо ні R1, ні R2 не є воднем, 4 5 ііі) Якщо R /R є галогеном, таким як хлор, суміш тетрагідрофуран/дихлорметан є придатним бром або йод, його можна перетворити у відповідрозчинником, і три(ацетокси)боргідрид натрію є ний сульфід -SR шляхом обробки з алкілтіолатом і придатним відновлюючим агентом. У такій реакції 1 2 a Pd(O) або (II) каталізатором, в інертному високопереважним є використання солі HNR R , такої як киплячому розчиннику, який не перешкоджає прогідрохлорид, і, для покращення розчинності солі 1 2 ходженню реакції, при підвищеній температурі. HNR R , можуть, необов'язково, додавати допоміПридатні солі алкілтіолату включають метантіолат жну основу, таку як триетиламін. натрію, придатні Pd каталізатори включають тетСполуки формули (III) можуть одержувати у ракіс(трифенілфосфін)паладію, і придатні інертні свою чергу шляхом конденсування сполук загальвисококиплячі розчинники включають диметилсуної формули (IV) з альдегідами загальної формули льфоксид, як наведено в Прикладі 141 нижче; (V). Такі ракції конденсування можуть проводитись 4 5 iv) Якщо R /R є галогеном, таким як хлор, відомими у цій галузі методиками, такими як шлябром або йод, його можна перетворити у відповідхом взаємодії з карбонатом калію у придатному ний естер -CO2R шляхом обробки монооксидом розчиннику, такому як диметилформамід, у придавуглецю при високому тиску з Pd(0) або (II) каталітних умовах для проходження реакції, таких як затором, в спиртовому розчиннику (ROH, де R є підвищена температура і в інертній атмосфері. С1-С4алкілом) у присутності основи при підвищеній Альтернативно, сполуки загальної формули (І) температурі. Наприклад реакцію можуть проводиможуть одержувати із сполук загальної формули 17 75067 18 ти при тиску приблизно в районі 100 псі, причому тозилгідразид при підвищеній температурі, і приPd каталізатори включають тетрадатні інертні розчинники включають толуол, як кіс(трифенілфосфін)паладію, придатні основи наведено в Прикладі 71 нижче; включають триетиламін, і придатні спиртові розхі) Якщо R4/R5 є нітро, він може бути відновлечинники включають метанол, як наведено в Прикний у відповідну -NН2 групу шляхом обробки відладі 151 нижче; новлюючим агентом в протонному розчиннику при ν) Якщо R4/R5 є галогеном, таким як йод, його кімнатній температурі, або вище. Придатні відновможна перетворити у відповідний амід -CONR6R7, люючі агенти включають суміш залізний порошок / де R6 і R7 мають визначені вище значення, шляхлорид кальцію, придатні протонні розчинники хом обробки монооксидом вуглецю, відповідним включають водний розчин етанолу, і звичайна теаміном формули HNR6R7 і Pd(0) каталізаторм в мпература для проходження реакції є від 70°С до інертному розчиннику, який не перешкоджає проприблизно 100°С, переважно приблизно 90°С, як ходженню реакції. Придатні каталізатори включанаведено в Прикладі 107 нижче; ють тетракіс(трифенілфосфін)паладію, і придатні хіі) Якщо R4/R5 є -NH2, його можна перетворирозчинники включають диметилформамід. Реакти у відповідну -NHSO2R9 групу шляхом взаємодії цію переважно проводять при підвищеній темпез сульфонілюючим агентом у присутності основи в ратурі і тиску, як наведено в Прикладі 100 нижче; інертному розчиннику, який не перешкоджає проvi) Якщо R4/R5 є галогеном, таким як хлор, ходженню реакції, при кімнатній температурі, або бром або йод, його можна перетворити у -CH2CN нижче. Придатні сульфонілюючї агенти включають шляхом взаємодії з трибуангідрид метансульфонової кислоти, придатні остил(ціанометил)стананом [відповідно до М. Kosugi, нови включають триетиламін, і придатні інертні Μ. Ishiguro, Y. Negishi, Η. Sano, Τ. Migita, Chem. розчинники включають тетрагідрофуран, як навеLett., 1984, 1511-1512] і Pd-каталізатором у придадено в Прикладі 114 нижче; тному розчиннику при підвищеній температурі. хііі) Якщо R4/R5 є -NH2, його можна перетвориПридатні каталізатори включають ти у триазол шляхом обробки Nбіс(ацетонітрил)дихлорпаладій(ІІ), і придатні роз[(диметиламіно)метиліден]-N,Nчинники включають м-ксилен, як наведено в Прикдиметилгідразоноформамідом і придатною кислоладі 88 нижче; тою в інертному розчиннику, який не перешкоджає vii) Якщо R4/R5 є галогеном, таким як бром, йопроходженню реакції, при підвищеній температурі. го можна перетворити у гетероциклічну групу шляПридатні кислоти включають п-толуолсульфонову хом обробки порошком міді і бажаною гетероциккислоту, і придатні розчинники включають толуол, лічною сполукою разом із основою. Придатні як наведено в Прикладі 189 нижче; 4 5 9 гетероциклічні групи мають вказані вище значення xiv) Якщо R /R є -NHSO2R групою, його можі включають 1,2,3-триазоли, придатні основи на перетворити у відповідну -NR8SO2R9 групу шлявключають карбонат калію, і реакцію переважно хом обробки алкілюючим агентом і основою в припроводять при підвищеній температурі, як наведедатному інертному розчиннику. Приклади но в Прикладі 181 нижче; придатних алкілюючих агентів включають 2viii) Якщо R4/R5 є галогеном, таким як бром, брометанол, придатні основи включають карбонат калію, і придатні інертні розчинники включають його можна перетворити у ,β-ненасичений сульацетонітрил, як наведено в Прикладі 122 нижче; фонамід шляхом обробки вінілсульфонамідом, xv) Якщо R4/R5 є сульфонамідом, його можна Pd(0) або (II) каталізатором і придатною основою в перетворити у ацилсульфонамід шляхом обробки інертному розчиннику, який не перешкоджає ацилюючим агентом і основою у розчиннику, який 15 не перешкоджає проходженню реакції. Придатні проходженню реакції при підвищеній темпераацилюючі агенти включають ангідрид оцтової кистурі. Придатні Pd каталізатори включають ацетат лоти, придатні основи включають триетиламін, і паладію(ІІ) у присутності три(о-толіл)фосфіну, придатні розчинники включають дихлорметан, як придатні основи включають триетиламін, і придатнаведено в Прикладі 66 нижче; ні інертні розчинники включають ацетонітрил, як xvi) Якщо R4/R5 є -CN, його можна перетворити наведено в Прикладі 67 нижче; 4 5 у відповідний альдегід шляхом обробки гідридним іх) Якщо R /R є галогеном, таким як бром, йовідновлюючим агентом в інертному розчиннику, го можна перетворити у α, -ненасичений амід, який не перешкоджає проходженню реакції. Прикшляхом обробки акриламідом, Pd(0) або (II) каталади придатних відновлюючих агентів включають лізатором і придатною основою в інертному розлітійалюмгідрид, і придатні інертні розчинники чиннику, який не перешкоджає проходженню реаквключають тетрагідрофуран. Такі реакції переважції, при підвищеній температурі. Придатні Pd но проводять при низькій температурі і в інертній каталізатори включають ацетат паладію(ІІ) у приатмосфері, як наведено в Прикладі 157 нижче; сутності три(о-толіл)фосфіну, придатні основи xvii) Якщо R4/R5 є нітрил -CN, його можна певключають триетиламін, і придатні інертні розчинретворити у відповідну -C(O)NH2 групу шляхом ники включають ацетонітрил, як наведено в Прикгідролізу в основних, окислюючих або кислотних ладі 68 нижче; умовах. Основний гідроліз переважно проводять х) Якщо R4/R5 є α, -ненасиченим сульфонамігідроксидом, таким як гідроксид калію, в протондом, його можна перетворити у -CH2CH2SO2NH2 ному розчиннику, такому як m-бутанол при підвишляхом обробки придатним відновлюючим агенщеній температурі як наведено у Прикладі 91 нижтом при придатній температурі, в інертному розче. Окисний гідроліз переважно проводять чиннику, який не перешкоджає проходженню реакпероксидом водню у полярному розчиннику, такоції. Придатні відновлюючі агенти включають 19 75067 20 му як диметилсульфоксид, у присутності придатної хлорметан, при або нижче кімнатної температури, основи, такої як карбонат калію, при кімнатній теяк наведено в Прикладі 183 нижче; і мпературі, або нижче, як наведено в Прикладі 90 іі) сполуки формули (І), де R1 є воднем, можуть нижче. Кислотний гідроліз переважно проводять бути перетворені в інші сполуки формули (І), де R1 сильною кислотою, такою як поліфосфорна кислоє метилом, шляхом взаємодії сполуки формули (І) та, при підвищеній температурі, як наведено в з формілюючим агентом у придатному розчиннику Прикладі 92 нижче; з наступним відновленням проміжного N-формілу xviii) Якщо R4/R5 є -CN, він може бути відновгідридним відновлюючим агентом в інертному розлений у відповідний амін -CH2NH2 шляхом обробки чиннику переважно при підвищеній температурі. гідридним відновлюючим агентом, таким як літійаПридатні формілюючі агенти включають пентафлюмгідрид, як наведено в Прикладі 110 нижче; торфенілформат (утворений з мурашиної кислоти, хіх) Якщо R4/R5 є -СНО, він може бути відновпентафторфенолу і дициклогексилкарбодііміду), і лений у відповідний спирт -СН2ОН шляхом обробпридатні розчинники для формілювання включаки відновлюючим агентом у придатному розчинниють дихлорметан. Придатні відновлюючі агенти ку. Приклади придатних відновлюючих агентів включають комплекс боран-тетрагідрофуран, і включають боргідрид натрію, і придатні розчиннипридатні інертні розчинники для відновлення ки включають етанол, як наведено в Прикладі 157 включають тетрагідрофуран, як наведено в Прикнижче; ладі 128 нижче. хх) Якщо R4/R5 є, його можна перетворити у Альтернативно, сполуки загальної формули (І) відповідний сульфоксид -S(O)R9 шляхом обробки можуть одержувати зі сполук формули (VIII) (див. окислюючим агентом, таким як оксон (RTM), при Схему 3), де L має значення, визначене для Схенизькій температурі, або пероксидом водню в проми 1, і Τ є групуою, яка може бути перетворена в тонному розчиннику, як наведено в Прикладах 145 CH2NR1R2. Приклади придатних Τ замісників або 149 нижче; включають: карбокси, алкоксикарбоніл, -CN і ххі) Якщо R4/R5 є -SR10, його можна перетвоC(O)NR1R2. 10 рити у відповідний сульфон -SO2R шляхом оброСхема 3 бки окислюючим агентом, таким як оксон (RTM), при низькій температурі, або пероксидом водню в протонному розчиннику, як наведено в Прикладах 146 і 150 нижче; ххіі) Якщо R4/R5 є естером, він може бути відновлений у відповідну спиртову групу -СН2ОН шляхом обробки гідридним відновлюючим агентом, таким як літійалюмгідрид, як наведено в ПриМетодики для перетворення сполук формули кладі 154 нижче; (VIII) у (І), включають: ххііі) Якщо R4/R5 є естром, його можна переті) якщо Τ є карбокси або алкоксикарбонілом, ворити у відповідну кислоту -СО2Н шляхом обробшляхом взаємодії з аміном загальної формули ки придатним гідроксидом у присутності води і NHR1R2 з утворенням аміду з наступним відновпридатного співрозчинника. Придатні гідроксиди ленням аміду з одержанням сполуки формули (І). включають гідроксид літію, і придатні співрозчинТакі сполуки загальної формули (І) можуть далі ники включають тетрагідрофуран, як наведено в реагувати з придатним альдегідом і гідридним відПрикладі 158 нижче; і новлюючим агентом, або формілюючим агентом з xxiv) Якщо R4/R5 є карбоновою кислотою, його наступною реакцією з гідридним відновлюючим можна перетворити у відповідний амід -CONR6R7 агентом з одержанням сполуки формули (і); шляхом обробки конденсуючим агентом, основою і іі) якщо Τ є -CN, шляхом відновлення у його аміном HNR6R7 в придатному інертному розчиннивідповідний амін формули -CH2NH2. Для одержанку, який не перешкоджає проходженню реакції. ня інших сполук загальної формули (І), де або Придатні конденсуючі агенти включають гідрохлоодин або обидва R1 або R2 не є воднем, амін може рид 1-(3-диметиламінопропіл)-3-етилкарбодііміду у далі вступати в реакцію з придатним альдегідом і присутності 1-гідроксибензотриазолу, придатні гідридним відновлюючим агентом, або формілююоснови включають триетиламін, і придатні розчинчим агентом з наступною взаємодією з гідридним ники включають дихлорметан, як наведено в Привідновлюючим агентом з одержанням сполуки фокладі 159 нижче. рмули (І); і Альтернативно, сполуки загальної формули ііі) якщо Τ є -C(O)NR1R2, шляхом відновлення (І), які мають особливу NR1R2 групу, можуть бути одержували амін з наступним, необов'язково, приперетворені у сполуки загальної формули (І), які датним перетворенням R1 і/або R2, якщо один з мають іншу NR1R2 групу. Наприклад: них є воднем, у альтернативні R1 і/або R2 групи 1 2 і) сполуки формули (І), де або R або R є водшляхом обробки альдегіду з наступним відновленнем, можуть бути перетворені в інші сполуки форням, або шляхом обробки формілюючим агентом з 1 2 мули (І), де ні R , ні R не є воднем, шляхом взаєнаступною обробкою гідридним відновлюючим модії сполуки формули (І) з альдегідом і гідридним агентом. відновлюючим агентом. Придатні альдегіди вклюСполуки загальної формули (VIII) можуть одечають формальдегід, придатні відновлюючі агенти ржувати у свою чергу шляхом конденсування сповключають три(ацетокси)боргідрид натрію, і реаклук загальної формули (IX) і сполук загальної фоцію переважно проводять у розчиннику, який не рмули (IV). Реагенти та умови для проведення цієї перешкоджає проходженню реакції, такому як диреакції конденсування є такими ж як для конден 21 75067 22 сування сполук загальних формул (IV) і (V) на мули (II), якщо R1 і R2 є метилом і n є 1, R3 не є Схемі 1. SMe групою, що знаходиться в пара положенні до Сполуки загальної формули (IX) можуть одерзв'язку, що з'єднує кільця А і В. жувати в свою чергу із сполук загальної формули Сполуки формул (IV), (V), (VI) або (IX) є або ві(X) (див. Схему 4). домими, або доступними з комерційних джерел, або можуть бути одержані з комерційно доступних матеріалів шляхом відомих методик. Для фахівців у цій галузі зрозуміло, що чутливі функціональні групи, можливо, буде необхідно піддавати захисту і знімати захист під час синтезу сполуки формули І, що може бути виконано відомими методиками, наприклад описаними в 'Protective Groups in Organic Synthesis', 3rd edition, by Τ W Greene and PGM Wuts, John Wiley and Sons Сполуки формули (IX) можуть одержувати Inc, 1999. Приклад 121 ілюструє методику захисту шляхом ароматичного електрофільного заміщення груп, яка застосовується під час синтезу сполуки сполук формули (X) з безпосереднім одержанням згідно з даним винаходом. сполук формули IX. Альтернативно, сполуки форДосвідченому хіміку очевидно, що діарилові мули (IX) можуть одержувати у дві або більшу кіетери можна одержувати шляхом різних методик лькість стадій; ароматичним електрофільним засинтезу. Для перегляду методик див. публікацію J міщенням сполук формули (X) одержували S Sawyer, Tetrahedron, 56 (2000) 5045-5065, яка проміжні сполуки, які потім піддавали наступній включена тут у якості посилання. реакції з одержанням сполук формули (IX). ПроміСполуки згідно з даним винаходом є кориснижні сполуки можуть бути виділені, або одержані in ми через те, що вони мають фармакологічну актиsitu без виділення. Переважний шлях наведений вність у ссавців, включно з людиною. Зокрема, на Схемі 5. вони корисні у лікуванні та профілактиці розладів, при яких задіяна функція регуляції транспорту моноаміну. Захворюваннями, які слід зазначити, є гіпертензія, депресія (наприклад, депресія у хворих на рак, депресія у хворих на хворобу Паркінсона, депресія після інфаркту міокарда, субсиндромально симптоматична депресія, депресія у безплідних жінок, депресія педіатрії, майоральна Сполуки формули (X) вступали в реакцію з судепресія, одиничні епізоди депресії, рекурентна льфонілхлоридом з одержанням сполук формули депресія, депресія у дитини, індукована жорстоким (XI) з наступною реакцією з NHR6R7 з одержанням ставленням, післяпологова депресія та синдром сполук формули (ІХа). роздратування у старих чоловіків), стан загального Переважний шлях одержання сполук формули неспокою, фобії (наприклад агорафобія, соціальна (Іа) наведений на Схемі 6. Переважними умовами фобія і прості фобії), посттравматичний стресдля проходження реакції на кінцевій стадії, яка синдром, аутизм, передчасна еяколяція, розлади включає відновлення сполук формули (Vllla) у харчування (наприклад анорексія нервова та булісполуки формули (Іа), є обробка комплексом бомія нервова), ожиріння, хімічні залежності (наприран-тетрагідрофуран (див. Приклад 61). клад залежності від алкоголю, кокаїну, героїну, Схема 6 фенобарбіталу, нікотину та бензодіазепінів), "гістаміновий" головний біль, мігрень, біль, хвороба Альцгеймера, обесивно-компульсивного розлад, панічний розлад, розлади пам'яті (наприклад, деменція, амнезія та вікові зміни когнітивних функцій (ВЗКФ)), хвороба Паркінсона (наприклад деменція при хворобі Паркінсона, паркінсонізм індукований нейролептиками та пізня діскінезія), ендокринні розлади (наприклад гіперпролактинемія), вазоспазм (особливо в церебральних судинах), мозочкова атаксія, розлади шлунково-кишкового тракту (перистальтики та секреції), негативні симптоми шизофренії, передменструальний синдром, синдром фіброміалгії, нетримання при стресі, хвороба Туретта, тріхокриптоманія, клептоманія, чоловіча імпотенція, дефіцит уваги внаслідок гіперактивності (ДУНГ (ADHD)), хронічна пароксизмальна гемікранія, головний біль (пов'язаний з судинними розладами), емоційна лобільність, патологічний плач, розлади сну (катаплексія) і шок. Відповідно до наступного втілення, винахід Розладами, які є предметом собливого зацікастосується сполук вказаних вище формул (II), (III), влення, є депресія, дефіцит уваги внаслідок гіпе(VII), (VIII), (Vllla) і (XII). У сполуках загальної форрактивності, пост травматичний стрес-синдром, 23 75067 24 залежність від речовин і сексуальні дисфункції ної терапії. Якщо призначається комбінація активвключно (зокрема) із передчасною еяколяцією. Під них агентів, тоді вони можуть призначатись однопередчасною еяколяцією розуміють постійну або часно, окремо або послідовно. Зокрема, сполуки повторювану еяколяцію до, під час або незадовго згідно з даним винаходом можуть бути об'єднані з після введення члена у сексуального партнера. наступними речовинами для лікування передчасВона може також визначатись як еяколяція, яка ної еяколяції: стається до бажаного особою моменту [див. The -блокаторами (наприклад фентоламіном, доMerck Manual , 16th edition, p 1576, опубліковано ксазазимом, танзулозином, теразазинои, празазиMerck Research Laboratories, 1992]. нои і Прикладом 19 з публікації WO 9830560); Отже, відповідно до наступного аспекту, винаапоморфіном - методика застосування апомохід стосується: рфіну у якості фармацевтичного засобу викладена і) сполуки формули (І), визначеній у першому у US-A-5945117; аспекті, або її фармацевтично прийнятних солей, агоністами допаміну D2 (наприклад Преміпріксольватів або поліморфів, для використання у салом, номер сполуки компанії Фармація Апджон якості фармацевтичного засобу; PNU95666); іі) використання сполуки формули (І), визначеагоністами рецептора меланокортину (наприної у першому аспекті, або її фармацевтично приклад Меланотан II); йнятних солей, сольватів або поліморфів, у вироагоністами рецептора PGE1 (наприклад алпбництві ліків для лікування або профілактики ростадилом); розладу, при якому задіяна функція регуляції траінгібіторами транспорту моноаміну, зокрема іннспорту моноаміну, наприклад депресія, дефіцит гібіторами зворотного захоплення норадреналіну уваги внаслідок гіперактивності, обесивно(NRIs (IЗЗH)) (наприклад Ребоксетином), іншими компульсивний розлад, посттравматичний стресінгібіторами зворотного захоплення серотоніну синдром, залежність від речовин, або сексуальні (SRIs (IЗЗC)) (наприклад пароксетином) або інгібідисфункції включно з передчасною еяколяцією; торами зворотного захоплення допаміну (DRIs ііі) використання сполуки загальної формули (ІЗЗД)); (І), визначеної у першому аспекті, або її фармацеантагоністами 5-НТ3 (наприклад онданстеровтично прийнятних солей, сольватів або поліморном і гранізетроном); і фів, у виробництві ліків для лікування або профіінгібіторами PDE, такими як PDE2 (наприклад лактики передчасної еяколяції, і також включає еритро-9-(2-гідроксил-3-ноніл)-аденіном) і Прикласпосіб лікування або профілактики передчасної дом 100 ЕР 0771799, включеного тут у якості поеяколяції, який включає призначення цієї сполуки силання), і зокрема інігібітором PDE5 (наприклад пацієнту, якому необхідне таке лікування або прозілденафілом, 1-{[3-(3,4-дигідро-5-метил-4-оксо-7філактика; пропілімідазо[5,1-f]-аз-тразин-2-іл)-4iν) спосіб лікування або профілактики депресії, етоксифеніл]сульфоніл}-4-етилпіперазином, тобто гіперактивного розладу відсутності уваги, обесивварденафілом / Bayer ΒΑ 38-9456) і ІС351 (див. но-компульсивний розладу, посттравматичного структуру нижче, Icos Lilly). стрес-синдрому, залежність від речовин або сексуальних дисфункцій включно з передчасною еяколяцією, який включає призначення терапевтично ефективної кількості сполуки формули (І), визначеної у першому аспекті, або її фармацевтично прийнятних солей, сольватів або поліморфів, пацієнту, якому необхідне таке лікування або профілактика; ν) спосіб збільшення затримки еяколяції, який включає призначення ефективної кількості сполуки формули (І), визначеної у першому аспекті, або її фармацевтично прийнятних солей, сольватів або Для вживання людиною сполуки згідно з даполіморфів, чоловіку, який бажає збільшення заним винаходом можуть призначатись окремо, але тримки еяколяції; i при лікуванні людини вони звичайно призначаютьvi) сполука формули (І), визначена у першому ся у сумішах з фармацевтично прийнятними екциаспекті, або її фармацевтично прийнятні солі, сопієнтами, розріджувачами або носіями, вибраними львати або поліморфи, для лікування або профізважаючи на бажаний шлях введення та звичайну лактики розладу, при якому задіяна функція регуфармацевтичну практику. ляції транспорту моноаміну, наприклад депресії, Наприклад, сполуки згідно з даним винаходом гіперактивного розладу відсутності уваги, обесивможуть вводитись перорально, букально або під но-компульсивного розладу, посттравматичного язик у формі таблеток, капсул (включно з м'якими стрес-синдрому, залежність від речовин або секжелатиновими капсулами), овулів, еліксирів, розсуальних дисфункцій включно з передчасною еячинів або суспензій, які можуть містити ароматизаколяцією. тори або барвники, для безпосереднього, уповільВисоко оціниться той факт, що усі посилання неного, модифікованого, затриманого, на лікування включатимуть терапію з лікувальною, комбінованого, контрольованого або пульсуючого пом'якшуючою та профілактичною метою. вивільнення. Сполуки згідно з даним винаходом Сполуки згідно з даним винаходом можуть можуть бути введені шляхом ін'єкції в печеристе призначатись окремо, або як складові комбінова 25 75067 26 тіло. Сполуки згідно з даним винаходом можуть лікарська речовина є нерозчинною, може бути бути введені у вигляді дозованих форм, які швидко приготована дозована форма, яка швидко диспердиспергуються або розчиняються. гується, а якщо лікарська речовина розчинна, моТакі таблетки можуть містити такі екципієнти же бути приготована дозована форма, яка швидко як мікрокристалічна целюлоза, лактоза, цитрат розчиняється. натрію, карбонат кальцію, двоосновний фосфат Сполуки згідно з даним винаходом можуть такальцію, гліцин та крохмаль (переважно кукурукож бути введені парентерально, наприклад, внутдзяний, картопляний або тапіоки), дизінтегратори, рішньовенно, в артерію, внутрішньочеревинно, такі як гліколят крохмалю натрію, кроскармелоза інтратекально, інтравентрикулярно, інтрауретранатрію та деякі складні силікати, а також зв'язуючі льно, інтрастернально, інтракраніально, внутрішагенти, такі як полівініл пірол ідон, гідроксипропілньом'язово або підшкірно, або можуть бути введеметилцелюлоза (ГПМЦ), гідроксипропілцелюлоза ні вливанням. Для парентерального призначення (ГПЦ), сахароза, желатин і гуміарабік. Додатково їх краще використовувати у формі стерильних воможуть бути включені лубриканти, такі як стеарат дних розчинів, які можуть містити інші речовини, магнію, стеаринова кислота, гліцерилбегенат і наприклад, достатню кількість солей або глюкози, тальк. що робить розчин ізотонічним з кров'ю. Водні розТверді композиції подібного типу можуть бути чини повинні бути прийнятно забуферовані (перетакож застосовані у якості наповнювачів в желативажно до рівня рН 3-9), якщо це необхідно. Пригонових капсулах. Переважними екципієнтами є лактування придатних парентеральних рецептур в тоза, крохмаль, целюлоза, молочний цукор, або стерильних умовах легко проводиться шляхом поліетиленгліколі з високою молекулярною масою. стандартних фармацевтичних методик, відомих Для водних суспензій та/або еліксирів сполуки фахівцям у цій галузі. згідно з даним винаходом та їх фармацевтично Для перорального і парентерального введення прийнятні солі можуть бути об'єднані з різними пацієнтам, які є людьми, денний рівень дозування підсолоджувачами або ароматизаторами, барвнисполук згідно з даним винаходом або їх солей або ками, емульгаторами та/або суспендуючими агенсольватів звичайно знаходиться у межах від 10 до тами, а також з розріджувачами, таким як вода, 500мг (в одній або розподіленій дозі). етанол, пропіленгліколь та гліцерин, та їх комбінаОтже, наприклад таблетки або капсули сполук ціями. згідно з даним винаходом або їх солей або сольДозовані форми з модифікованим або пульсуватів можуть містити від 2.5мг до 250мг активної ючим вивільненням можуть містити екципієнти, сполуки для одноразового введення, або двічі, або такі як наведені для дозованих форм безпосередбільше разів, як придатно. Лікар у будь-якому винього вивільнення, разом з додатковими екципієнпадку визначить ту дозу, яка буде найбільш притами, які виступають у якості модифікаторів рівня йнятною для кожного окремого пацієнта, яка буде вивільнення, які покривають та/або включені в варіюватися в залежності від віку, ваги та реакції дозовану форму. Модифікатори швидкості вивільокремого пацієнта. Вищенаведені дози є прикланення включають, але не обмежуються ними, гіддами середнього випадку. Можуть мати місце інроксипропілметилцелюлозу, метилцелюлозу, кардивідуальні випадки, коли вищий або нижчий рібоксиметилцелюлозу натрію, етилцелюлозу, вень доз є більш прийнятним і такі знаходяться в ацетат целюлози, оксид поліетилену, Xanthan межах цього винаходу. Фахівцю повинно бути зроgum, Carbomer, співполімер метакрилату амонію, зуміло, що при лікуванні деяких станів (включаючи гідроване касторове масло, карнаубський віск, РЕ) сполуки згідно з даним винаходом можуть випарафіновий віск, фталат ацетату целюлози, фтакористовуватись в одиничній дозі на основі "яка лат гідроксипропілметилцелюлози, співполімер потрібна" (тобто, як потрібно або бажано). метакрилової кислоти та їх суміші. Дозовані форми Приклад рецептури таблетки з модифікованим або пульсуючим вивільненням Звичайно рецептура таблетки може типово міможуть містити один або комбінацію екципієнтів, стити між приблизно 0.1мг та 500мг сполуки згідно які модифікують рівень вивільнення. Екципієнти, з даним винаходом (або її солі), в той час як вага які модифікують рівень вивільнення, можуть знанаповнення таблетки може знаходитись у межах ходитись у дозованих формах, тобто у матриці, від 50мг до 1000мг. Далі наведено приклад рецепта/або на дозованих формах, тобто на поверхні тури для таблетки 10мг: або покритті. % ваІнгредієнти Дозовані рецептури, які швидко диспергують га/вага або розчиняються (ДРШДР) можуть містити настуВільна кислота, вільна основа або пні інгредієнти: аспартам, ацесульфам калію, лисіль 10.000* монну кислоту, кроскармелозу натрію, кросповісполуки дон, диаскорбінову кислоту, етилакрилат, Лактоза 64.125 етилцелюлозу, желатин, гідроксипропілметилцеКрохмаль 21.375 люлозу, стеарат магнію, манітол, метилметакриКроскармелоза натрію 3.000 лат, м'ятний ароматизатор, поліетиленгліколь, Стеарат магнію 1.500 силікагель, що димить, диоксид силікону, гліколят крохмалю натрію, фумарат стеарилу натрію, сор* кількість встановлюється згідно з активністю бітол, ксилітол. Вживання термінів "диспергуютьлікарського засобу ся" або "розчиняються", як вони вживається тут Сполуки згідно з даним винаходом можуть для опису ДРШДР, залежить від розчинності ліпризначатись інтраназально або шляхом інгаляції і карської речовини, яка застосовується, тобто якщо зручно вводяться із інгалятора, що містить сухий 27 75067 28 порошок, або аерозольного спрею з герметичного ну, емульгуючого воску і води. Альтернативно, контейнера, насосу, пульверизатора або розпилювони можуть бути виготовлені у формі придатного вача із використанням придатного пропеланту, лосьйону або крему, суспендовані або розчинені у, наприклад дихлордифторметану, трихлорфторменаприклад, суміші однієї або більше наступних тану, дихлортетрафторетану, гідрофторалкану, речовин: мінерального масла, сорбітмоностеаратакого як 1,1,1,2-терафторетан (HFA 134A [товарту, поліетиленгліколя, рідкого парафіну, полісорний знак]) або 1,1,1,2,3,3,3-гептафторпропан (HFA бату 60, цетилових естерів, воску, цетеарилового 227EA [товарний знак]), диоксид вуглецю або інші спирту, 2-октилдодеканолу, бензилового спирту і придатні гази. У випадку аерозолю, який знаховоди. диться під тиском, дозована одиниця може бути Сполуки згідно з даним винаходом можуть тавизначена шляхом забезпечення його клапаном, кож бути застосовані у комбінації з циклодекстрищо вивільнює визначену кількість. Герметичний ном. Циклодекстрини відомі утворенням комплекконтейнер, насос, пульверизатор або розпилювач сів включення та сполук невключения із може містити розчин або суспензію активної спомолекулами лікарського засобу. Утворення комлуки, наприклад застосовуючи суміш етанолу та плексу лікарський засіб - циклодекстрин може мопропеланту у якості розчинника, яка може додатдифікувати розчинність, швидкість розчинення, ково містити лубрикант, наприклад триолеат сорбіодоступність і/або стійкість молекули лікарського біту. Капсули і картриджі (виготовлені, наприклад, засобу. Комплекси лікарський засіб - циклодекстз желатину) для використання в інгаляторі або рин є, загалом, придатними для майже всіх дозоінсульфлаторі можуть містити порошкоподібну ваних форм і шляхів призначення. Як альтернатисуміш сполуки згідно з даним винаходом і придатва утворенню комплексу з лікарським засобом, ну порошкоподібну основу, таку як лактоза або циклодекстрин може бути застосований у якості крохмаль. допоміжної домішки, наприклад, у якості носія, Аерозольні або сухі порошкові рецептури вирозріджувача або розчинника. У більшості випадготовлюють таким чином, щоб кожна доза, яка ків застосовують альфа-, бета-і гаммавимірюється, або "пшик" містив від 1 до 50мг споциклодекстрини, прийнятні приклади описані в луки згідно з даним винаходом для введення паціWO-A-91/11172, WO-A-94/02518 і WO-A-98/55148. єнтові. Повна денна доза аерозолю буде знаходиДля перорального або парентерального вветися в інтервалі від 1 до 50мг, і може призначатися дення пацієнтам денний рівень дозування сполук одною дозою, або, як правило, розділена на декіформули (І) та їх фармацевтично прийнятних солька прийомів протягом дня. лей знаходиться у межах від 0.01 до 30мг/кг (в Сполуки згідно з даним винаходом можуть буодній або розподіленій дозах) і переважно знахоти також виготовлені для введення за допомогою диться у межах від 0.01 до 5мг/кг. Таким чином розмелювача. Рецептури для розмелювачів мотаблетки будуть містити від 1мг до 0.4г сполуки жуть містити наступні інгредієнти у якості розчиндля введення одноразово, або двічі або більше ників, емульгаторів або суспендуючих агентів: воразів, як є придатним. У кожному випадку лікар да, етанол, гліцерин, пропіленгліколь, визначить дійсну дозу, яка буде найбільш придатполіетиленгліколі з низькою молекулярною масою, ною для кожного окремого пацієнта, і вона буде хлорид натрію, фторвуглеці, етери поліетиленглірізнитись в залежності від віку, ваги та відповіді кою, триолеат сорбіту, олеїнова кислота. окремого пацієнта. Вищенаведені дози є, звичайАльтернативно, сполуки згідно з даним винано, лише усередненими прикладами, і можуть маходом можуть призначатись у формі супозиторію ти місце випадки коли більші або менші дози буабо песарію, або вони можуть призначатись місдуть переважними, і такі випадки також включені цево у формі гелю, гідрогелю, лосьйону, розчину, до даного винаходу. крему, мазі або присипки. Сполуки згідно з даним Пероральне введення є переважним. Перевавинаходом можуть призначатись дермально або жно введення має місце незадовго до моменту трансдермально, наприклад, у вигляді пластиру. одержання бажаного результату. Вони можуть також призначатись окулярним, Для застосування у ветеринарії сполука згідно пульмонарним або ректальним шляхами. з даним винаходом, або її ветеринарно прийнятна Для офтальмологічного застосування, сполуки сіль, або її ветеринарно прийнятний сольват або можуть бути виготовлені у формі тонкозмелених пролікарська форма, призначається у відповідній суспензій в ізотонічному, заданого рівня рН, степрийнятній рецептурі відповідно до звичайної верильному соляному розчині, або, переважно, у теринарної практики, і ветеринар визначить дозурозчинах ізотонічному, заданого рівня рН, стеривання та шлях введення, який буде найбільш прильному соляному, необов'язково, у комбінації з йнятним для окремої тварини. консервантами, такими як бензилалконійхлорид. Отже, відповідного до наступного аспекту, виАльтернативно, вони можуть бути виготовлені на нахід стосується фармацевтичної композиції, яка основі мазі, такої як вазелін. містить сполуку формули (І), визначену у першому Для місцевого призначення на шкірі, сполуки аспекті, або її фармацевтично прийнятну сіль і згідно з даним винаходом можуть бути виготовлені фармацевтично прийнятний ад'ювант, розріджувач у формі мазі, яка містить активну сполуку, суспенабо носій. довану або розчинену в, наприклад, суміші однієї Винахід ілюстрований наступними Прикладаабо більше наступних речовин: мінерального масми, які його не обмежують, в яких вжиті наступні ла, рідкого вазеліну, медичного вазеліну, пропілеабревіації та визначення: нгліколя, сполук поліоксиетилену поліоксипропіле 29 ДМАП ДМФ ш Celite® δ д ДХМ DMPU ДМСО ES+ ESгод. m/z ВЕРХ хв. MS ЯМР Охоnе® к с т Tf ТФО ТФОА ТГФ ТШХ TS+ WSCDI 75067 30 4-(диметиламіно)піридин Ν,Ν-диметилформамід широкий фільтр, з Aldrich Chemical Company хімічний зсув дуплет дихлорметан 1,3-диметил-3,4,5,6-тетрагідро-2(1Н)-піримідинон диметилсульфоксид електроіонізація з позитивним скануванням електроіонізація з негативним скануванням години піки масспектру високоефективна рідкісна хроматографія хвилини масспектроскопія ядерно-магнітний резонанс пероксимоносульфат калію, з Aldrich Chemical Company квартет Синглет триплет трифторметансульфоніл трифтороцтова кислота трифтороцтовий ангідрид тетрагідрофуран тонкошарова хроматографія електроіонізація з позитивним скануванням гідрохлориду 1-(3-диметиламінопропіл)-3-етилкарбодіімід нагрівання Де зазначено, сполуки описувались як їх гідрохлоридні солі. Типова методика утворення гідрохлоридних солей наведена в Приготуванні 21. Ця методика може проводитись і з іншими розчинниками, наприклад діетиловим етером або ДХМ. Порошкову рентгенограму (ПРГ) визначали застосовуючи Siemens D5000 порошковий рентгенний дифрактометр, обладнаний тета-тета гоніометром, щілинами, які автоматично змінюють розходження пучка, вторинним монохроматором та сцинтиляційним витратоміром. Зразок піддавали ротації доти, поки він не був опромінений рентгенівськими променями міді K-alpha1 (дов жина хвилі = 1.5046 Ангстрем), фільтрували графітним монохроматором ( = 0.15405нм) рентгенівською трубкою, яка діяла при 40кВ/мА. Головні піки (в градусах 2 ) ПРГ наведені нижче. Температури плавлення визначали використовуючи Perkin Elmer DSC7 при швидкості нагрівання 20°С/хв. Приклади 1-15 Приклади 1-15 одержували відповідно до методики, описаної у приготуванні 21 нижче з вказаного альдегіду і придатного аміну. 31 Приклад 16 N-(5-Йод-2-[4(трифторметокси)фенокси]бензил}-N,Nдиметиламін До перемішаного розчину аміну приготування 23 (4.0г, 12.9ммоль) в ДХМ (30мл) при 0°С додавали трифторметансульфонову кислоту (5.7мл, 64.5ммоль) з наступним додаванням порціями Nйодсукциніміду (2.89г, 12.9ммоль) протягом 15хв. Після завершення додавання суміш залишали перемішуватись при 0°С протягом 30хв. і потім при 10°С протягом 1 години. Реакційну суміш гасили шляхом додавання водного розчину гідроксиду натрію (2М) і екстрагували тричі етилацетатом. 75067 32 Об'єднані органічні екстракти промивали розчином тіосульфату натрію, сушили (MgSO4) і випарювали до одержання червоного масла, яке очищували флеш хроматографією [SiO2; ДХМ/ МеОН/ 880 NH3 (95:5:0.5)] з одержанням бажаного йодиду у вигляді червоного масла (4.16г, 74%); δН (CDCL3, 400МГц) 2.24 (6Н, с), 3.40 (2Н, с), 6.64 (1Н, д), 6.92 (2Н, м), 7.16 (2Н, м), 7.53 (1Н, дд), 7.83 (1Н, д); MS m/z (TS+) 438 (МН+). Приклади 17-18 Наступні йодиди були одержані аналогічно реакції, описаної для одержання Прикладу 16. 33 75067 Приклад Початковий матеріал R R 17 Приг. 26 Η -OCF3 18 Приг. 22 Me CF3 1 3 34 Показники δΗ (CDCI3) 300МГц) 1.88 (1H, ш), 2.43 (3Н, с), 3.73 (2Н, с), 6.62 (1Н, д), 6.95 (2Н, м), + + 7.17 (2Н, м), 7.53(1Н, дд), 7.77 (1Н, д); MS m/z (TS ) 423 (М ) δH(CDCI3, 400МГц) 2.23 (6Н, с), 3.37 (2Н, с), 6.70 (1Н, д), 6.95 (2Н, д), 7.55 (2Н, д), + + 7.57 (1Н, дд), 7.88 (1Н, д); MS m/z (TS ) 422 (МН ). Приклад 19 N,N-Диметил-N-(2-[4(метилсульфаніл)фенокси]-5-нітробензил}амін Вказану в заголовку сполуку одержували з альдегіду Приготування 19 відповідно до методики, застосованої для приготування 21. Оцтова кислота (1екв. відносно третиламіну) була додатковим компонентом реакційної суміші. δΗ (CDCI3, 400МГц) 2.33 (6Н, с), 2.50 (3Н, с), 3.60 (2Н, с), 6.79 (1Н, д), 6.98 (2Н, д), 7.29 (2Н, д), 8.03 (1Н, дд), 8.39 (1Н, д); MS m/z (TS+) 319 (МН+). Приклад 20 N-Метил-N-{5-нітро-2-[4(трифторметил)фенокси]бензил}амін Альдегід приготування 20 (5.0г, 16.07ммоль) розчиняли в розчині монометиламіну в етанолі (прибл. 8М) (20мл, 160ммоль), і суміш перемішували протягом 30хв. при кімнатній температурі з утворенням оранжевого розчину. Боргідрид натрію (3.0г, 80ммоль) додавали порціями протягом 10хв. і перемішування продовжувалось протягом 30хв., протягом цього часу розчин став темно-червоним. Реакційну суміш гасили шляхом обережного вливання реакційної суміші в соляну кислоту (2М, 100мл). Суміш робили основною шляхом вливання розчину в великий надлишок карбонату калію з одержанням суміші з приблизним рівнем рН 10, яку екстрагували етилацетатом (3 70мл). Об'єднані органічні фракції сушили (MgSO4) і випарювали до одержання оранжевого масла, яке фільтрували через тонкий шар силікагелю, елююючи сумішшю ДХМ/ метанол/ 880 аміак (93:7:1). Після випарювання залишок далі очищували флеш хроматографією [SiO2; пентан/етилацетат (2:1) до елюювання неосновних матеріалів ДХМ/ метанол/ 880 аміак (93:7:1)] з одержанням бажаного аміну у вигляді жовтого масла (3.08г, 59%); δΗ (CDCI3) 400МГц) 2.49 (3Н, с), 3.89 (2Н, с), 6.89 (1Н, д), 7.12 (2Н, д), 7.67 (2Н, д), 8.10 (1Н, дд), 8.40 (1Н, д); MS m/z (TS+) 327 (МН+). Приклад 21 N,N-Диметил-N-(5-нітро-2-[4(трифторметил)фенокси]бензил}амін По краплям додавали трифторметансульфонову кислоту (500мкл) до розчину аміну приготування 22 (504мг, 1.71ммоль) в ТФО (4.5мл) при 0°С в атмосфері азоту з наступним додаванням нітрату калію (173мг, 1.71ммоль). Суміш перемішували при 0°С протягом 75хв., потім вливали на лід і робили основною кульками гідроксиду натрію. Водну суміш екстрагували етилацетатом і органічний екстракт промивали розчином солі, сушили (MgSO4) і концентрували in vacuo. Залишок очищували флеш хроматографією [SiO2; ДХМ/ метанол/ 880 аміак (99:1:0.5)] з одержанням бажаної нітросполуки (400мг, 69%) у вигляді жовтого масла; δΗ (CDCI3, 300МГц) 2.30 (6Н, с), 3.55 (2Н, с), 6.92 (1Н, д), 7.08 (2Н, д), 7.65 (2Н, д), 8.10 (1Н, дд), 8.45 (1Н, д); MS m/z (TS+) 341 (МН+). Приклад 22 N,N-Диметил-N-{5-нiтро-2-[4(трифторметокси)фенокси]бензил}амiн Реакцію прикладу 21 повторювали за тих же умов із використанням аміну приготування 23 з одержанням вказаної в заголовку нітросполуки. δΗ (CDCI3, 400МГц) 2.33 (6Н, с), 3.58 (2Н, С), 6.83 (1Н, д), 7.05 (2Н, м), 7.25 (2Н, м), 8.06 (1Н, д), 8.41 (1Н, с); MS m/z (TS+) 357 (МН+). Приклад 23 N-(5-Бром-2-[4(метилсульфаніл)фенокси]бензил}-N-метиламін Бромальдегід приготування 9 (39.0г, 120ммоль), розчиняли в монометиламіні (7.37мл, 33% в етанолі) і розчин перемішували протягом 10хв. перед додаванням боргідриду натрію (6.8г, 180ммоль). Реакційну суміш перемішували протягом 3 годин при кімнатній температурі перед обережним додаванням до 3М НСІ. Після завершення 35 75067 36 додавання суміш залишали на 10хв. перед дове7.30 (1Н, дд), 7.54 (1Н, д); MS m/z (TS+) 338/ 340 денням рівня рН до 14 гідроксидом натрію (3М). (МН+). Водну фазу екстрагували етилацетатом і органічПриклади 24-27 ний шар промивали розчином солі, сушили Ряд вторинних амінів одержували з придатно(MgSO4) і випарювали. Одержане масло переного альдегіду використовуючи методику, описану сили в діетиловий етер і оброблювали надлишком для прикладу 23. соляної кислоти (1M в диетиловому етері). Сіль збирали шляхом фільтрації і промивали ДХМ. Промиту тверду речовину розділяли між етилацетатом і гідроксидом натрію (3М), органічний шар відділяли, промивали розчином солі, сушили і випарювали до одержання безбарвного масла (24.6г, 61%); δН (CDCI3, 300МГц) 2.43 (3Н, с), 2.47 (3Н, с), 3.76 (2Н, с), 6.72 (1 Η, д), 6.87 (2Н, д), 7.24 (2Н, д), Приклад Початковий матеріал R4 24 Приг. 8 Вr 25 Приг. 13 Η 26 Приг. 16 Η 27 Приг. 17 Η R6 (R3)n Показники НСІ сіль: δH(CDCI3, 400МГц) 2.59 (3Н, с), 4.16 (2Н, с), 6.88 (1Н, Η 4-OCF3 с), 7.18-7.29 (5Н, м), 7.59 (1Н, д), 9.82 (2Н, шс); MS m/z (TS+) 376, 378 (МН+) НСІ сіль: δH(CD3OD, 300МГц) 2.47 (3Н, с), 2.75 (3Н, с), 3.82 ОМе 4-SMe (3Н, с), 4.20 (2Н, с), 6.95 (4Н, м), 7.10 (1Н, дд), 7.30 (2Н, д); MS/m/z (TS+) 304 (MH+) Вільна основа: δH(CDCI3, 400МГц) 2.43 (3Н, с), 2.46 (3Н, с), 3-OMe 3.77 (2Н, с), 3.87 (3Н, с), 6.48 (1Н, дд), 6.56 (1Н, с) 6.78 (1Н, д), Br 4-SMe 7.15 (1Н, д), 7.33 (1Н, дд), 7.57 (1Н, д); MS m/z (TS+) 368/370 (МН+) 3-CF3 Вільна основа: δΗ (CDCI3, 300МГц) 2.44 (3Н, с), 2.51 (3Н, с), Br 4-SMe 3.75 (2Н, с), 6.78 (1Н, д), 7.03 (1Н, дд), 7.39 (2Н, т), 7.61 (1Н, с) Приклад 28 3-[Диметиламіно)метил]-4-[4(метилсульфаніл)фенокси]бензолсульфонамід Хлорсульфонову кислоту (48.1мл, 724ммоль) обережно додавали до розчину сполуки приготування 21 (19.8г, 72.4ммоль) в ДХМ (290мл), охолоджували до 0°С і суміш перемішували протягом 4год. перед вливанням у суміш лід-вода (1000мл) і екстрагували ДХМ (300мл). Неочищений розчин сульфонілхлориду оброблювали насиченим аміаком етанолом (1160мл) і перемішували при кімнатній температурі протягом ночі перед концентруванням in vacuo. Реакцію повторювали ще двічі в однакових умовах і матеріал з цих трьох реакцій об'єднували. Очищенням об'єднаних залишків флеш хроматографією [SiO2; (МеОН/ 880 NH3) (9:1)} (0 5%) в ДХМ] одержували чистий зразок бажаного сульфонаміду (3.96г, 5%), а також трохи забруднений сульфонамід (19.73г, 26%). Для чистої вільної основи; δΗ (CDCI3, 300МГц) 2.24 (6Н, с), 2.48 (3Н, с), 3.56 (2Н, с), 5.25 (2Н, ш), 6.81 (1Н, д), 6.92 (2Н, д), 7.27 (2Н, д), 7.70 (1Н, дд), 8.04 (1Н, д); MS m/z (TS+) 353 (МН+). Кожний зразок перетворювали в гідрохлорид шляхом перемішування суспензії в діетиловому етері з надлишком етерної соляної кислоти протягом 30хв., осад збирали і сушили, потім перекристалізовували з суміші гаря чий етанол/етилацетат (1:1) (темп, плавлення 193194°С) з одержанням 2.69г і 15.63г гідрохлориду бажаного сульфонаміду з кожної серії відповідно; δΗ (d6-ДМСО, 400МГц) 2.48 (3Н, с), 2.78 (6Н, с), 4.43 (2Н, с), 6.86 (1Н, д), 7.19 (2Н, д), 7.31-7.38 (4Н, м), 7.82 (1Н, дд), 8.11 (1Н, дд), 10.44 (1Н, шс); MS m/z (TS+) 353 (МН+). Альтернативно, вказана в заголовку сполука може бути одержана із вторинного аміну Прикладу 42, який можна одержати шляхом боранового відновлення аміду з приготування 31, використовуючи метод, описаний для Прикладу 61. Альтернативно, вказана в заголовку сполука можуть одержувати наступним чином: Розчин гідрохлоридної солі вказаного в заголовку продукту з приготування 21 (113г) в дихлорметані (1130мл) повільно додавали до розчину хлорсульфонової кислоти (428г) в дихлорметані (230мл) підтримуючи температуру між 0 і 5°С. Через 1год. при 0-5°С, реакційну суміш повільно гасили в 5% розчині трифтороцтової кислоти у воді (1200мл), підтримуючи температуру між 0-10°С. Дві фази розділяли і дихлорметановий шар концентрували in vacuoz одержанням масла. Додавали ацетонітрил (1360мл), і до цього розчину повільно додавали РОСІ3 (140г). Одержану суспензію нагрівали із зворотним холодильником, після чого вона ставала розчином. Через 1год. реакційну суміш охолоджували до кімнатної температури і гасили у 37 75067 38 суміші лід/вода (1200мл) підтримуючи температуТверду речовину фільтрували, промивали вору нижче 20°С. Суміш екстрагували дихлорметадою (107мл) і вологу тверду речовину знову суном (1х1400мл і 1х400мл) і об'єднані екстракти спендували у суміші 9:1, вода:ацетон перемішували при кімнатній температурі додаючи (289мл:32мл) протягом 1год. нижче 10°С. Цю суводний розчин аміаку (250мл). Через 1год. шари спензію фільтрували і сушили у вакуумній печі при розділяли і водний шар потім екстрагували дихло50°С протягом ночі. Розчин вищевказаної твердої рметаном (400мл). Об'єднані дихлорметанові шаречовини в ацетоні (565мл) суспендували з вугілри концентрували in vacuo. Додавали воду (539мл) лям (Norit SX plus, 50% вага/вага), фільтрували і і до цієї суміші додавали водний розчин гідроксиду оброблювали ще однією порцією вугілля (Norit SX натрію (108мл; 46-48% вага/вага) і суспензію пеplus, 50% вага/вага). Розчин знову фільтрували і ремішували протягом 1год. при кімнатній темпераконцентрували, заміщуючи водою (1130мл). Сутурі і наступну 1год. при 0°С. Тверду речовину спензію гранулювали, фільтрували і сушили у вафільтрували і знову суспендували у воді (500мл), куумі протягом ночі з одержанням продукту у видоводили рівень рН до 6-6.5 шляхом додавання гляді білої твердої речовини (78.6г, 61%), темп, суміші 1:1, вода:концентрована соляна кислота. плавлення 119°С. Одержану суспензію перемішували протягом 1год. Головні піки (в градусах 2 ) ПРГ є наступними: при 10°С або нижче. Кут 2-тета° 4.891 8.221 10.305 10.416 11.476 14.720 16.301 16.581 18.011 19.373 19.668 20.568 20.943 21.235 21.509 Інтенсивність % 9.6 2.3 7.8 20.3 46.3 36.6 11.6 43.1 43.8 44.3 51.3 18.3 19.7 77.6 100.0 Кут 2-тета° 22.267 23.305 23.964 24.686 25.192 25.593 26.177 26.650 27.744 28.098 29.737 30.262 30.814 31.141 31.493 Альтернативно, вказану в заголовку сполуку може бути одержана наступним чином: Хлорсульфонову кислоту (706мл) дуже повільно додавали до холодного (від -5°С до 0°С) розчину вказаного в заголовку продукту приготування 21 (290г, 1.06моль) в дихлорметані (2.9л). Реакційну суміш перемішували при 0°С протягом ночі. Суміш повільно додавали у 3М НСІ (2.9л) підтримуючи температуру між -5 і 0°С. Додавали дихорметан (2.9л) і шари розділяли. Додавали водний розчин аміаку (580мл) до дихлорметанового шару при 0°С, і перемішували протягом ночі. Додавали воду (2л) і шари розділяли. Водний шар промиваКут 2-тета° 1 8.807 9.088 11.580 11.887 14.068 14.489 14.978 15.918 16.558 17.021 18.254 18.787 Інтенсивність % 2 4.7 20.6 4.4 2.5 8.5 1.9 8.5 2.2 2.3 8.3 100.0 8.0 Кут 2-тета° 3 23.265 23.876 24.416 24.640 25.318 25.622 26.077 26.746 26.974 27.259 27.948 29.197 Інтенсивність % 89.7 14.4 49.6 7.6 13.2 16.5 10.5 26.0 7.6 37.9 6.1 12.9 9.9 7.8 15.5 Кут 2-тета° 31.964 32.738 33.161 35.203 35.316 35.534 35.858 36.427 36.820 38.360 39.471 39.996 40.984 41.907 43.787 Інтенсивність % 9.2 10.2 17.6 11.0 11.4 11.7 11.5 12.2 8.0 11.1 8.4 9.6 9.9 9.7 10.2 ли дихлорметаном. Дихлорметанові шари об'єднували і концентрували у вакуумі з одержанням коричневого масла, яке ставало твердим при стоянні. Залишок очищували флеш хроматографією [SiO2; ДХМ:0-6% (МеОН NН3, 9:1)] з одержанням блідо-жовтої твердої речовини, яку далі очищували шляхом перемішування в суміші 9:1, вода:ацетон (1.3). Суспензію фільтрували, промивали і сушили протягом ночі у вакуумній печі при 55°С з одержанням продукту у вигляді білої твердої речовини (57г, 15%), темп, плавлення 129°С. Головні піки (в градусах 2 ) ПРГ є наступними: Інтенсивність % 4 17.5 4.3 4.6 8.4 10.2 3.4 6.6 20.8 6.8 13.4 13.6 4.1 Кут 2-тета° 5 34.425 35.326 35.750 36.189 36.715 36.946 37.500 38.534 39.065 39.468 39.695 40.850 Інтенсивність % 6 4.3 3.3 6.0 2.8 4.1 7.0 4.2 3.1 4.4 5.3 4.3 5.1 39 75067 40 Продовження таблиці 1 19.388 19.759 20.079 20.476 20.743 21.323 22.005 2 4.2 4.2 5.2 72.1 5.2 76.2 8.8 3 29.530 30.284 30.952 31.779 32.224 32.690 33.708 Проміжний сульфонілхлорид 3-[(Диметиламіно)метил]-4-[4(метилсульфаніл)фенокси]бензолсульфонілхлорид У методиці приготування Прикладу 28, проміжний сульфонілхлорид не виділяли, а одержували in situ. Це є переважною методикою приготування Прикладу 28. Однак, у ході повторення експерименту, порцію проміжного сульфонілхлориду виділяли; 1Н ЯМР δΗ (d6-ДМСО, 300МГц) 3.6 (3Н, шс), 4.3 (6Н, ш с), 8.3 (1Н, шс), 8.6 (2Н, шс), 8.9 (2Н, шс), 9.2 (1Н, шс), 9.4 (1Н, шс). 1Н ЯМР δΗ (d6ДМСО + D2O, 300МГц) 2.4 (3Н, с), 2.8 (6Н, с), 6.8 (1Н, д), 7.1 (2H, д), 7.4 (2Н, д), 7.7 (1Н, дд), 7.9 (1Н, с). Солі Кут тета° 4.330 12.165 12.425 12.543 13.218 14.368 14.463 16.849 17.149 17.469 17.623 18.498 19.403 20.422 20.733 20.923 21.914 23.542 23.776 24.958 2 Інтенсивність % 21.9 5.6 10.1 5.4 12.7 6.3 6.3 7.3 57.2 49.5 66.1 9.5 47.2 12.4 15.7 28.2 100.0 19.0 20.0 30.8 Кут тета° 25.156 25.787 26.057 26.114 26.408 26.642 26.830 27.130 27.540 28.001 29.122 29.772 30.394 30.983 31.259 32.085 32.258 32.818 33.433 34.085 2 ii) D-тартратна сіль Розчин D-винної кислоти (2.81г, 18.7ммоль) у воді (6мл) додавали до гарячого (40°С) розчину вказаної в заголовку сполуки (6.0, 17.0ммоль) в ацетоні (54мл). Суспензію потім нагрівали при 60°С протягом 30хв. і залишали охолоджуватись до кімнатної температури. Після перемішування при кімнатній температурі протягом 1-2 год. суміш охолоджували до 0°С. Через наступні 3год. 4 11.1 6.7 11.5 3.4 6.0 5.4 2.6 5 41.596 42.460 43.120 43.506 44.103 44.530 6 6.5 6.9 7.2 4.5 5.1 3.9 і) L-тартратна сіль Розчин L-винної кислоти (2.81, 18.7ммоль) у воді (6мл) додавали до гарячого (40°С) розчину вказаного в заголовку продукту (6.0, 17.0ммоль) в ацетоні (54мл). Суспензію потім нагрівали при 60°С протягом 30хв. і залишали охолоджуватись до кімнатної температури. Після перемішування при кімнатній температурі протягом 1-2год. суміш охолоджували до 0°С. Через наступні 3год. суміш фільтрували, промивали ацетоном (2x10мл) і сушили у вакуумній печі при 55°С протягом ночі з одержанням бажаної солі у вигляді білої кристалічної твердої речовини (8.4г, 98%), темп, плавлення 179°С. Головні піки (в градусах 2 ) ПРГ є наступними: Інтенсивність % 12.0 6.1 12.4 14.5 11.6 25.5 25.4 26.7 12.6 20.7 17.7 28.7 13.5 12.8 32.9 14.6 9.5 5.2 6.5 20.3 Кут тета° 34.663 35.071 35.674 35.788 36.228 36.517 36.975 37.618 37.799 38.242 38.882 39.432 39.577 40.198 41.451 42.109 42.816 43.969 44.213 44.812 2 Інтенсивність % 6.7 5.6 15.2 14.7 10.7 8.6 13.3 17.4 19.7 16.2 15.5 8.1 9.0 18.4 8.2 14.6 8.7 11.5 14.2 11.9 суміш фільтрували, промивали ацетоном (2x10мл), сушили у вакуумній печі при 55°С протягом ночі з одержанням бажаної солі у вигляді білої кристалічної твердої речовини (8.4г, 98%), темп, плавлення 182°С. Головні піки (в градусах 2 ) ПРГ є наступними: 41 Кут тета° 4.320 12.147 12.414 12.539 13.219 14.368 14.480 16.854 17.161 17.452 17.631 18.516 19.407 20.425 20.733 20.9Ί2 21.919 23.566 23.787 24.974 2 Інтенсивність % 23.3 5.0 11.1 4.8 11.9 5.8 6.0 7.0 58.2 52.8 68.8 8.5 50.3 12.3 17.0 26.5 100.0 20.2 17.5 32.1 75067 Кут тета° 25.153 25.776 26.058 26.135 26.405 26.635 26.825 27.133 27.547 28.005 29.125 29.788 30.408 30.984 31.273 32.093 32.268 32.821 33.461 34.084 2 2 Інтенсивність % 10.4 22.3 19.0 10.0 20.5 14.2 10.6 18.7 9.7 23.7 36.5 22.3 16.4 Кут тета° 18.749 19.031 19.374 20.096 20.904 21.408 21.710 22.012 22.157 22.485 22.614 23.967 24.503 2 b) Форма з вищою температурою плавлення Розчин соляна кислота /ізопропанол (7.02М, 0.41мл, 2.86ммоль) додавали до розчину вказаної в заголовку сполуки (1.0г, 2.84ммоль) в метилетилкетоні (10мл). Після перемішування при кімнатній температурі протягом 7год. суміш фільКут 2-тета° 1 6.511 10.198 11.969 12.081 12.500 12.948 14.111 Інтенсивність % 2 1.5 2.6 2.9 6.0 2.1 17.7 2.6 Інтенсивність % 11.8 5.4 7.2 11.8 10.1 25.4 24.3 27.8 13.3 19.1 18.2 26.8 12.2 10.2 26.4 12.5 7.5 4.8 5.4 17.3 ііі) Гідрохлоридні солі а) Форма з нижчою температурою плавлення Розчин соляна кислота/ізопропанол (7.02М, 0.41мл, 2.86ммоль) додавали до розчину вказаної в заголовку сполуки (1.0г, 2.84ммоль) в етилметилкетоні (10мл). Після перемішування при кімнатній температурі протягом 3 год. суміш фіКут тета° 4.365 8.758 11.591 13.184 14.438 14.522 14.948 15.512 15.886 16.716 16.975 17.568 18.506 42 Кут 2-тета° 3 23.777 24.218 24.288 25.086 25.973 26.342 26.825 Кут тета° 34.701 35.066 35.693 35.794 36.241 36.525 37.044 37.632 37.806 38.264 38.880 39.454 39.542 40.193 41.530 42.108 42.854 43.930 44.243 2 Інтенсивність % 5.1 4.9 13.8 11.5 11.5 8.5 8.8 15.2 18.8 15.3 14.1 9.1 8.4 17.2 5.8. 12.1 5.2 7.9 11.7 льтрували, промивали і сушили у вакуумній печі при 55°С протягом ночі з одержанням бажаної солі, темп, плавлення 176°С. Головні піки (в градусах 2 ) ПРГ є наступними: Інтенсивність % 23.5 42.1 20.8 47.2 15.0 20.4 74.1 100.0 42.7 27.9 31.6 11.9 19.6 Кут тета° 25.485 26.443 26.634 27.345 27.846 29.280 30.117 31.281 33.336 34.024 35.172 37.237 38.993 2 Інтенсивність % 37.9 40.8 36.1 13.4 34.0 17.9 13.9 21.4 16.5 11.0 16.2 14.6 11.4 трували, промивали і сушили у вакуумній печі при 55°С протягом ночі з одержанням бажаної солі, темп, плавлення 192°С. Головні піки (в градусах 2 ) ПРГ є наступними: Інтенсивність % 4 8.7 19.1 24.1 20.8 6.2 13.0 13.8 Кут 2-тета° 5 33.939 34.326 35.190 36.183 36.674 37.061 37.365 Інтенсивність % 6 10.0 6.5 6.6 6.9 5.9 4.8 4.3 43 4.9 15.313 75067 27.357 8.2 44 37.918 3.9 Продовження таблиці 1 16.477 16.587 17.261 18.009 19.104 20.174 21.435 21.961 22.554 22.860 23.059 23.126 23.425 2 13.2 15.0 3.8 22.0 15.6 100.0 11.7 26.1 4.7 21.3 11.2 13.5 17.0 3 27.600 27.942 28.322 28.895 30.097 30.192 30.567 31.493 31.776 32.417 32.931 33.516 4 5.7 5.2 20.0 13.7 9.2 10.2 11.1 7.3 4.8 17.4 5.5 7.5 iv) Цитратна сіль Лимонну кислоту (0.30г, 1.56ммоль) додавали до розчину вказаної в заголовку сполуки (0.50г, 1.42ммоль) в ацетоні (5мл). Після перемішування при кімнатній температурі протягом 3год. суміш фільтрували, промивали і сушили у Кут тета° 5.516 5.731 7.279 9.057 10.733 11.522 11.957 13.115 13.429 14.311 14.702 16.515 16.813 2 Інтенсивність % 11.7 25.7 7.7 8.2 25.1 15.3 13.8 11.2 12.2 13.3 23.6 17.8 17.6 Кут тета° 17.246 17.307 17.587 18.186 19.089 19.596 19.815 20.286 20.553 20.713 21.342 21.666 21.830 2 ν) Сульфатна сіль Концентровану сірчану кислоту (0.04мл) додавали до розчину вказаної в заголовку сполуки (0.50г, 1.42ммоль) в ацетоні (5мл). Після перемішування при кімнатній температурі протягом 2год. суміш перемішували при 0°С протягом наступних 3год. Суміш потім фільтрували, промиКут 2-тета° 4.770 9.354 9.906 12.435 14.406 16.040 16.563 17.145 17.322 17.945 18.292 18.794 19.234 Інтенсивність % 7.1 10.5 8.0 6.2 12.9 8.2 3.4 26.5 48.9 7.3 35.2 100.0 7.1 Кут 2-тета° 21.291 21.610 22.019 22.611 23.168 23.567 23.855 24.096 24.521 24.951 25.341 25.790 26.276 5 38.491 38.680 39.283 39.915 40.271 40.686 41.448 42.435 43.170 43.612 43.682 44.077 6 7.4 5.6 2.9 3.9 6.8 7.4 4.9 5.3 4.3 11.1 12.1 5.8 вакуумній печі при 55°С протягом ночі з одержанням бажаної солі, темп. плавлення 110°С. Головні піки (в градусах 2 ) ПРГ є наступними: Інтенсивність % 39.6 44.3 52.4 44.3 100.0 51.9 68.6 56.9 81.1 63.0 34.4 42.6 51.1 Кут тета° 23.513 24.114 24.737 25.403 25.986 26.182 27.333 30.030 30.250 30.396 31.830 34.066 37.320 2 Інтенсивність % 48.2 39.9 50.0 38.8 37.5 42.2 23.8 31.2 40.4 39.5 24.5 27.4 23.2 вали і сушили протягом ночі у вакуумній печі при 55°С з одержанням бажаної солі у вигляді білої твердої речовини (0.31г, 48%), темп, плавлення 233°С. Головні піки (в градусах 2 ) ПРГ є наступними: Інтенсивність % 9.5 45.1 11.0 52.2 12.2 39.0 16.6 12.7 33.7 53.7 9.7 13.6 13.5 Кут 2-тета° 29.923 31.761 32.221 32.690 33.983 34.610 35.098 35.420 36.212 36.942 37.618 38.349 38.856 Інтенсивність % 15.5 10.5 8.3 9.0 9.3 10.2 11.2 16.7 9.4 14.4 9.6 9.9 11.6 19.780 20.026 20.365 45 46.3 50.0 20.513 26.815 28.030 11.6 vi) Фосфатна сіль Фосфорну кислоту (4.63мл, 67.7ммоль) по краплях додавали до суспензії вказаної в заголовку сполуки (21.7г, 61.6ммоль) у воді (149мл). Суспензію потім нагрівали на водяній бані до одержання прозорого розчину. Цей розчин потім залишали охолоджуватись до кімнатної температури і перемішували протягом 2год. Суміш потім охолоджували до 0°С, і перемішували протягом Кут 2-тета° 4.336 11.698 13.047 13.479 14.330 15.217 15.440 16.205 17.440 17.899 18.300 18.750 19.120 19.740 19.930 20.291 20.581 21.617 21.832 Інтенсивність % 18.7 8.5 14.5 9.4 13.5 69.4 10.6 12.4 70.9 5.4 30.6 22.5 12.6 100.0 30.8 15.6 58.2 39.9 10.4 Кут 2-тета° 22.157 22.729 23.034 23.219 23.506 23.915 25.456 25.691 26.317 26.508 26.838 26.976 27.115 27.971 28.902 29.351 29.987 31.022 31.368 Приклади 29-60 Наступні сульфонаміди одержували аналогічно описаному у Прикладі 28 способу, заміщуючи аміак необхідним аміном, де необхідно. 75067 12.8 22.5 29.274 46 39.126 40.321 8.8 8.3 10.0 43.839 наступних 3год. Осад фільтрували, промивали водою (2х50мл) і сушили у вакуумній печі при 55°С протягом ночі з одержанням бажаної солі у вигляді білої кристалічної твердої речовини (23.1г, 83%), темп, плавлення 196°С. Головні піки (в градусах 2 ) ПРГ є наступними: Інтенсивність % 13.9 22.5 16.2 17.3 79.0 11.9 17.3 27.0 12.5 21.9 14.9 25.5 22.6 32.6 12.5 8.6 22.1 8.0 11.6 Кут 2-тета° 31.877 32.521 32.702 33.213 33.960 34.334 34.717 35.586 36.184 36.722 37.819 38.412 38.773 39.078 39.848 40.076 41.269 43.921 44.699 Інтенсивність % 5.7 13.0 6.9 7.2 8.9 10.5 22.6 10.7 16.7 6.8 6.4 8.7 13.3 9.5 11.5 10.7 9.9 12.8 9.8 47 75067 48 49 75067 50 Приклад 61 4-[4-Метокси-3-(метилсульфаніл)фенікси]-3[(метиламіно)метил]-бeнзолсульфонамід Комплекс боран-тетрагідрофуран (1M в ТГФ, 10мл, 10ммоль) додавали по краплях до аміду з приготування 32 (450мг, 1.18ммоль). Суміш потім перемішували при кипінні протягом 4 годин. Після охолодження до кімнатної температури реакцію гасили шляхом додавання метанолу (10мл) і суміш випарювали до одержання білої піни. Залишок оброблювали соляною кислотою (6М, 10мл) і суміш ще раз нагрівали до кипіння протягом 1 години. Після охолодження до кімнатної температури суміш нейтралізували до рівня рН приблизно 7 шляхом обробки надлишком гідроксиду натрію (2М) і потім насиченим водним розчином хлориду амонію. Суміш потім екстрагували етилацетатом (3 50мл), ДХМ (2 50мл), об'єднані органічні шари сушили (MgSO4) і випарювали до одержання безбарвного масла. Масло потім знову розчиняли в етилацетаті (20мл) і оброблювали 1Μ соляною кислотою в діетиловому етері (2мл, 2ммоль) з утворенням гідрохлоридної солі, яку збирали шляхом фільтрації і сушили (346мг, 73%); δΗ (CD3OD, 400МГц) 2.34 (3Н, с), 2.78 (3Н, с), 3.86 (3Н, с), 4.39 (2Н, с), 6.83 (1Н, д), 6.90 (1Н, м), 6.98 (2Н, м), 7.84 (1Н, дд), 8.01 (1Н, д); MS m/z (ES+) 369 (МН+). Приклади 62-63 Наступні сульфонаміди одержували аналогічно методиці Прикладу 61, починаючи з придатного аміду. Сульфонамід Прикладу 42 можуть також одержувати шляхом цієї методики, починаючи з аміду приготування 31. Приклади 64-65 Наступні третинні аміносульфонаміди одержували шляхом відновного метилювання відповідно до методики, описаної для Прикладу 178, і використовуючи придатний вторинний амін як початковий матеріал. Цією методикою можуть також одержувати продукт прикладу 28 із вторинного аміну Прикладу 42. Приклад 66 N-Ацетил-3-[(диметиламіно)метил]-4-[4(метилсульфаніл)фенікси]-бензолсульфонамід Триетиламін (399мкл, 2.86ммоль) додавали до розчину сульфонаміду з прикладу 28 (500мг, 1.3ммоль) в ДХМ (5мл) з наступним додаванням ацетилхлориду (102мкл, 1.43ммоль). Суміш перемішували при кімнатній температурі протягом 16год. і потім розчинник видаляли in vacuo. Залишок очищували колонковою хроматографією [SiO2; ДХМ 100% збільшуючи полярність до 15% (1:7 NH4OH:MeOH) в ДХМ] з одержанням кристалічної твердої речовини (438мг, 86%); δΗ (ДMCO-D6, 400МГц) 1.83 (3Н, с), 2.31 (6Н, с), 2.46 (3Н, с), 3.68 (2Н, с), 6.83 (1Н, д), 7.03 (2Н, д), 7.32 (2Н, д), 7.71 (1Н, д), 7.99 (1Н, с); MS m/z (ES+) 395 (МН+). Приклад 67 (Е)-2-{3-[(Диметиламіно)метил]-4-[4(метилсульфаніл)фенікси]феніл}-етенсульфонамід Бромід з Прикладу 9 (2.0г, 5.68ммоль), вінілсульфонамід (1.22г, 11,35ммоль), ацетат паладію (64мг, 0.28ммоль, 5моль%), три(о-толіл)фосфін (173мг, 0.57ммоль, 10моль%) і триетиламін (1.98мл, 14.19ммоль) об'єднували в ацетонітрилі (50мл) і нагрівали із зворотнім холодильником в атмосфері азоту протягом 20 годин. Після охолодження до кімнатної температури реакційну суміш вливали на силікагель і потім хроматографували [SiO2; (EtOAc/ MeOH/ 880 NH3; 100:5:0.5)/ пентан; 3:1 1:0] з одержанням бажаної вказаної в заголовку сполуки у вигляді жовтого порошку (1.26г, 59%) Вільна основа: H (CDCI3, 300МГц) 2.28 (6Н, с), 2.49 (3Н, с), 3.52 (2Н, с). 6.80-6.95 (4Н, м), 7.257.31 (3Н, м), 7.48 (1Н, д), 7.68 (1Н, с); MS m/z (TS+) 51 75067 52 379 (МН+). льфонаміду Прикладу 70. Вільна основа: H Приклади 68-70 (CDCI3, 300МГц) 2.25 (6Н, с), 2.48 (3Н, с), 3.08 (2Н, Реакцію, описану у Прикладі 67, повторювали м), 3.33 (2Н, м), 3.44 (2Н, м), 4.57 (2Н, шс), 6.73 застосовуючи придатні алкен та арилбромід як (1Н, с), 6.86 (2Н, д), 6.98 (1Н, дд), 7.25 (2Н, д), 7.41 компоненти для одержання наступних алкенів. (1Н, д); MS m/z (TS+) 381 (МН+). Приклад 73 3-[(Диметиламіно)метил]-4-[4(метилсульфаніл)фенокси]фенол Приклад 71 2-{3-[(Диметиламіно)метил]-4-[4(метилсульфаніл)фенокси]феніл)етансульфонамід Вінілсульфонамід з прикладу 67 (1.26г, 3.33ммоль) нагрівали разом з тозилгідразином (6,20г, 33.3ммоль) в толуолі із зворотнім холодильником протягом 5 годин. Після охолодження до кімнатної температури розчинник випарювали і залишок розділяли між ЕtOАс (50мл) і насич. NaHCO3 (50мл). Органічний шар відділяли, промивали водою (20мл), розчином солі (20мл), потім сушили (MgSO4) і випарювали. Залишок очищували флеш хроматографією [SiO2; (ЕtOАс/ МеОН/ 880 NH3; 100:5:0.5)/ пентан; 3:1 1:0] з одержанням бажаного продукту у вигляді порошку кремового кольору (1.055г, 83%); Вільна основа: H (CD3OD, 400МГц) 2.27 (6Н, с), 2.47 (3Н, с), 3.093.13 (2Н, м), 3.30-3.36 (2Н, м), 3.50 (2Н, м), 6.83 (1Н, д), 6.87 (2Н, д), 7.19 (1Н, д), 7.27 (2Н, д), 7.35 (1Н, с); MS m/z (TS+) 381 (МН+). Приклад 72 2-{4-[(Диметиламіно)метил]-3-[4(метилсульфаніл)фенокси]феніл}етансульфонамід Вказаний в заголовку сульфонамід одержували аналогічно описаному в Прикладі 71 з вінілсу Метиловий етер з прикладу 14 (500мг, 1.65ммоль) перемішували з бромоводнем в оцтовій кислоті (30%, 3мл) і водному розчині бромоводню (48%, 200 мікролітрів), суміш нагрівали із зворотнім холодильником протягом ночі в атмосфері азоту. Після охолодження до кімнатної температури суміш випарювали при зниженому тиску і залишок розділяли між насиченим водним розчином бікарбонату натрію (20мл) і ДХМ (30мл). Органічний шар відділяли, водний шар знову екстрагували ДХМ (4 30мл). Об'єднані органічні фракції промивали розчином солі, сушили (MgSO4) і випарювали до одержання темного масла. Очищенням флеш хроматографією, яку проводили декілька разів, спочатку [силікагель; ДХМ/ метанол 880 аміак (95:5:0.5)] і потім [SiO2; ДХМ/ метанол/ 880 аміак (97:3:0.3)] одержували частково очищений продукт. Цей продукт розчиняли в соляній кислоті (2М) і промивали діетиловим етером (3x5мл). Водний шар робили основним насич. NаНСО3(водний) (10мл) і знову екстрагували ДХМ (4 10мл). Органічні фракції об'єднували і випарювали до одержання залишку, який далі очищували флеш хроматографією [SiO2; ДХМ/ метанол/ 880 аміак (95:5:0.5)]. Таким чином одержували бажаний фенол у вигляді білої твердої речовини (141мг, 30%); H (CDCI3, 400МГц) 2.25 (6Н, с), 2.42 (3Н, с), 3.40 (2Н, с), 6.71 (1Н, м), 6.79 (3Н, д), 6.89 (1Н, с), 7.25 (2Н, д); MS m/z (TS+) 290 (МН+). Приклад 74 3-[(Метиламіно)метил]-4-[4(метилсульфаніл)фенокси]фенол Вказану в заголовку сполуку одержували з метилового етеру Прикладу 25 методикою, описаною для Прикладу 73. δΗ (CDCI3, 400МГц) 2.35 (3Н, с), 2.43 (3Н, с), 3.59 (2Н, с), 6.70 (1Н, с), 6.80 (2Н, м), 6.83 (2Н, д), 7.25 (2Н, д); MS m/z (TS+) 276 (МН+). Приклад 75 3-{3-[(Диметиламіно)метил]-4-[4(метилсульфаніл)фенокси]феніл)пропанамід 53 75067 54 заголовку сполуки, яке затверділо після висушування у вакуумі (264мг, 52%); Вільна основа: H (CDCI3, 400МГц) 2.25 (6Н, с), 2.48 (3Н, с), 2.54 (2Н, т), 2.95 (2Н, т), 3.42 (2Н, с), 5.39 (2Н, шс), 6.81 (1Н, д), 6.85 (2Н, д), 7.07 (1Н, д), 7,25 (2Н, д), 7.33 (1Н, + + с); MS m/z (TS ) 345 (МН ). Приклад 76 ТГФ (20мл) насичували NH3 і охолоджували до 3-{4-[(Диметиламіно)метил]-3-[4-60°С. Додавали гідразид з приготування 68 (метилсульфаніл)фенокси]феніл)пропанамід Вка(756мг, 1.47ммоль) з наступним додаванням по заний в заголовку амід одержували з гідразиду краплях тетраацетату свинцю (1.30г, 2.94ммоль) в Приготування 69 методикою, описаною у Прикладі ДХМ (15мл). Реакційну суміш перемішували при 75. 60°С в атмосфері азоту протягом 3 годин, потім залишали нагрітись до кімнатної температури протягом ночі. Розчинник видаляли випарюванням з одержанням оранжевого залишку, який розводили водним розчином гідроксиду натрію (2М) (50мл) і екстрагували етилацетатом (2 50мл). Об'єднані органічні шари промивали водою (20мл), розчином Вільна основа: H (CDCI3, 400МГц) 2.23 (6Н, с), солі (30мл), сушили (MgSO4) і випарювали до оде2.48 (5Н, м), 2.90 (2Н, т), 3.40 (2Н, с), 5.35 (2Н, шс), ржання оранжевого масла. Очищенням за допомо6.75 (1Н, с), 6.85 (2Н, д), 6.98 (1Н, д), 7.25 (2Н, д), гою ВЕРХ [феномонекс Luna С18 150 21.2мм, 7,38 (1Н, д); MS m/z (TS+) 345 (МН+). 5мкМ; 0.1% водний розчин суміші діетилаПриклад 77 мін/метанол (градієнт)] одержували масло, яке 2-Бром-5-[(метиламіно)метил]-4-[4розділяли між гідроксидом натрію (1М) і діетило(трифторметокси)фенікси]-бензолсульфонамід вим етером (10мл). Органічний шар відділяли, промивали водою (10мл), сушили (MgSO4) і випарювали до одержання прозорого масла вказаної в (i) Утворення трифторацетаміду: N-{4-бром-2[4-(трифторметокси)фенокси]бензил}-2,2,2трифтор-N-метилацетамід Похідну броміду з прикладу 24 (1.31г, 3.2ммоль) розчиняли в ДХМ (12мл), оброблювали триетиламіном (1.77мл, 13.9моль), розчин охолоджували до 0°С. Трифтороцтовий ангідрид (897мкл, 6.3ммоль) по краплях додавали протягом 5 хвилин і перемішування продовжували протягом наступних 30 хвилин. Реакційну суміш гасили шляхом додавання води (20мл) і органічний шар відділяли. Водний шар знову екстрагували ДХМ (20мл) і об'єднані органічні фракції сушили (MgSO4) і випарювали до одержання прозорого масла: H (CDCI3, 400МГц, 2 видимі ротомери) 3.00 [3Н, с (менший ротомер)], 3.17 (3Н, с), 4.66 (2Н, с), 4.69 [2Н, с (менший ротомер)]. 6.97-7.02 (3Н, м), 7.22-7.27 (4Н, м); MS m/z (TS+) 489,491 (MNH4+). (iі) Синтез сульфонаміду: N-{5(аміносульфоніл)-4-бром-2-[4(трифторметокси)фенокси]бензил}-2,2,2трифтор-N-метилацетамід Трифторацетамід із стадії (і) (використаний без наступного очищення) розчиняли в ТФО (6мл) і додавали хлорсульфонову кислоту (2.1мл, 31.7ммоль). Суміш перемішували протягом ночі при кімнатній температурі і потім гасили обережно вливаючи на суміш лід - вода. В осад випадала біла тверда речовина, яку збирали шляхом 55 75067 56 фільтрації і потім розчиняли в ДХМ, сушили (CDCI3, 400МГц, 2 видимі ротомери) 3.04 (3Н, с, (MgSO4), фільтрували і випарювали до одержанменший ротомер), 3.10 (3Н, с), 4.72 (2Н, с), 4.75 ня жовтого масла. Масло оброблювали насиче(2Н, с, менший ротомер), 5.15 (2Н, шс), 7.04-7.09 ним NH3 етанолом (30мл), через 30 хвилин роз(3Н, м), 7.24-7.35 (2Н, м), 8.00 (1Н, с, менший чинники випарювали. Очищенням залишку флеш ротомер), 8.09 (1Н, с); MS m/z (TS+) 568, 570 + хроматографією [SiC2; ДХМ, МеОН, 880 NH3 (MNH4 ). (93:7:1)] одержували бажаний сульфонамід у ви(ііі) Гідроліз трифторацетамідної групи: 2бром-5-[(метиламіно)метил]-4-[4гляді білої твердої речовини (825мг, 47%); H (трифторметок5-[(диметиламіно)метил]-2-(метилсульфаніл)си)фенокси[бензолсульфонамід 4-[4-(трифторметокси)фенікси]Сульфонамід зі стадії (іі) розчиняли в етанолі бензолсульфонамід (Приклад 80) (10мл) і оброблювали 1М LiOH(водний) (20мл). Суміш перемішували протягом 10 хвилин перед випарюванням для видалення основної кількості етанолу. Одержану водну суміш екстрагували діетиловим етером (2 50мл) і об'єднані екстракти промивали розчином солі (100мл), сушили Суміш бром- і метилсульфаніл- сульфонамі(MgSO4) і випарювали до одержання білої твердів, одержаних із реакції Прикладу 78 до очищендої речовини (550мг, 81%); H (CDCI3) 400МГц) ня за допомогою ВЕРХ (136мг, прибл. 0.3ммоль), 2.46 (ЗН, с), 3.84 (ЗН, с), 7.05 (2Н, д), 7.06 (1Н, с), розчиняли в ДХМ (2мл) і оброблювали формаль7.27 (2Н, д), 8.20 (1Н, с); MS m/z (TS+) 455,457 дегідом (37% водний) (80мкл, 3екв.). Реакційну (МН+). суміш перемішували протягом 30 хвилин перед Приклад 78 додаванням три(ацетокси)боргідриду натрію 5-[(Метиламіно)метил]-2-(метилсульфаніл)-4(273мг, 1.3ммоль). Після перемішування протя[4-(трифторметокси)фенокси]гом наступної 1 години суміш випарювали, гасили бензолсульфонамід шляхом додавання соляної кислоти (2М) і рівень рН доводили до слабо основного шляхом додавання водного розчину гідроксиду натрію (2М). Суміш екстрагували етером (2 30мл), об'єднані органічні фракції сушили (MgSO4) і випарювали до одержання безбарвного масла. Очищенням флеш хроматографією [силікагель; 97:3:0.3 (ДХМ/ метанол/ 880 аміак)] одержали білу піну, з якої після розчинення в діетиловому етері і розведення пентаном утворився білий порошок. Цей маСульфонамід з прикладу 77 (510мг, теріал відповідно до показників 1Н ЯМР був 50:50 1.1ммоль) розчиняли в ДМСО (3мл) і оброблюсумішшю Прикладу 79 і 80. Цей зразок далі очивали тетракіс(трифенілфосфін)паладієм (129мг, щували за допомогою ВЕРХ [Magellen C18 0.11ммоль) і метантіолатом натрію (157мг, 15*21.12см колонка, 0.2% діетиламін(водний)/ аце2.2ммоль). Суміш потім нагрівали при 100°С в тонітрил (50:50), швидкість потоку 20мл/хв.] з атмосфері азоту протягом 18 годин. Після охолоодержанням Прикладу 79 (час утримання: дження до кімнатної температури суміш розділя12.02хв., 15мг], і Прикладу 80 (час утримання: ли між водою і діетиловим етером (50мл кожно12.56хв., 25.6мг): го). Етерний шар відділяли і органічний шар Приклад 79: 15мг, вільна основа: H (CDCI3, знову екстрагували діетиловим етером (2 25мл). 400МГц) 2.26 (6Н, с), 3.56 (2Н, с), 7.08 (1Н, с), Об'єднані органічні фракції сушили (MgSO4) і ви7.13 (1.Н, д), 7.33 (1Н, д), 8.16 (1Н, с); MS m/z парювали до одержання оранжевого масла. (TS+) 469,471 (МН+). Очищенням флеш хроматографією [SiO2; ДХМ/ Приклад 80: 25.6мг, гідрохлоридна сіль: H МеОН/ 880 NH3 (93:7:1)] одержували білу тверду (CD3OD, 400МГц) 2.30 (3Н, с), 2.8 (6Н, с), 4.40 речовину (286 мг, прибл. 60%), яка згідно з пока(2Н, шс), 6.80 (ТН, с), 7.28 (2Н, д), 7.40 (2Н, д), зниками 1Н-ЯМР була 60:40 сумішшю бажаний 8.14 (1Н, д); MS m/z (TS+) 437 (МН+). продукгпочатковий бромід. Частину цього зразка Приклад 81 далі очищували за допомогою ВЕРХ [Magellen 3-[(Метиламіно)метил]-4-[4C18 15*21.12см колонка, 0.2% діетиламін(водний)/ (трифторметокси)фенокси]бензонітрил ацетонітрил (50:50), швидкість потоку 20мл/хв.] з одержанням бажаної вказаної в заголовку сполуки (час утримання 8.2хв.) у вигляді білої твердої речовини. (22.1мг); H (CDCI3, 400МГц) 2.32 (3Н, с), 2.37 (3Н, с), 3.75 (2Н, с), 6.83 (1Н, с), 7.12 (2Н, д), 7.32 (2Н, д), 8.00 (1Н, с); MS m/z (TS+) 423 (МН+). Приклади 79-80 2-бром-5-[(диметиламіно)метил]-4-[4(трифторметокси)фенокси]-бензолсульфонамід Матеріал Прикладу 17 (2.46г, 5.8ммоль) роз(Приклад 79) і чиняли в ДМФ (30мл) разом із тетра 57 75067 58 кіс(трифенілфосфін)паладієм (0.538г, 0.47ммоль) і цианідом цинку(ІІ) (478мг, 4.1ммоль). Реакційну суміш перемішували і нагрівали при 100°С протягом 12 годин. Після охолодження до кімнатної температури реакційну суміш вливали у воду і екстрагували тричі етилацетатом. Об'єднані органічні екстракти сушили (MgSO4) і випарювали до одержання коричневого масла. Залишок очищували флеш хроматографією [SiO2; ДХМ/ метаСуміш броміду Прикладу 9 (1.5г, 4.26ммоль), нол/ 880 аміак (95:5:0.5 90:10:1)]. Одержаний трибутил(ціанометил)станату [одержаного відпоматеріал знову очищали на колонці [SiO2; етилавідно до М. Kosugi, Μ. Ishiguro, Y. Negishi, Η. цетат/ метанол/ 880 аміак (95:5:0.5)], після чого Sano, T. Migita, Chem. Lett., 1984,1511-1512] (2.1г, залишилась не зовсім біла тверда речовина. Ма6.36ммоль), трі-о-толілфосфіну (78мг, теріал далі очищували шляхом розтирання з су0.26ммоль), біс(ацетонітрил)дихлорпаладію(ІІ) мішшю етилацетат/діетиловий етер з наступним (33мг, 0.13ммоль) і м-ксилену (20мл) перемішувисушуванням у вакуумі з одержанням бажаного вали при 120°С в атмосфері азоту протягом нітрилу у вигляді не зовсім білої твердої речови16год. Після охолодження до кімнатної темперани (1.2г, 64%); δΗ (CDCI3, 400МГц) 2.67 (3Н, с), тури розчинник видаляли in vacuo і залишок очи4.24 (2Н, с), 6.77 (1Н, д), 7.32 (4Н, м), 7.58 (1Н, д), щували флеш хроматографією [SiO2; ДХМ/ Ме8.02 (1H, с); MS m/z (TS+) 323 (MH+). ОН/ 880 N 143 (97:3:0.5)] з одержанням бажаної Приклади 82-86 сполуки (895мг, 67%) у вигляді жовтого масла; δΗ Ряд нітрилів одержували з придатних арил(CDCI3, 400МГц) 2.27 (6Н, с), 2.47 (3Н, с), 3.46 галідів (йодидів або бромідів) методикою, описа(2Н, с), 3.74 (2Н, с), 6.87 (3Н, м), 7.18 (1 Η, д), ною для приготування Прикладу 81. 7.25 (2Η, д), 7.45 (1Н, с); MS m/z (TS+) 313. Приклад 89 {3-[(Диметиламіно)метил]-4-[4(трифторметокси)фенокси]феніл}ацетонітрил Стадія 1. Приготування проміжного ціаноестеру Приклад 87 3-[(Метиламіно)метил]-4-[4(метилсульфаніл)фенокси]бензонітрил Вказаний в заголовку нітрит одержували з броміду прикладу 23 відповідно до методики, описаної для прикладу 81; H ДMCO-D6, 300МГц) 2.47 (3Н, с), 2.62 (3Н, с), 4.25 (2Н, с), 6.81 (1Н, д), 7.18 (2Н, д), 7.40 (2Н, д), 7.81 (1Н, дд), 8.06 (1Н, д), 9.03 (2Н, ш); MS m/z(TS+)285(MH+). Приклад 88 {3-[(Диметиламіно)метил]-4-[4(метилсульфаніл)фенокси]феніл}ацетонітрил Суміш йодиду прикладу 16 (1.03г, 2.37ммоль), CuBr (1.70г, 11.8ммоль), αціаноетилацетату (1.337г, 11.83ммоль) і карбонату калію (3.29г, 23.7ммоль) в ДМСО (30мл) нагрівали при 120°С в атмосфері азоту протягом 2год. Після охолодження до кімнатної температури суміш розділяли між етером і насиченим водним розчином хлориду амонію. Органічний шар промивали розчином солі, сушили (MgSO4) (концентрували in vacuo. Залишок очищували флеш хроматографією [SiO2; ДХМ/ МеОН (98:2)] з одержанням бажаного проміжного ціаноестеру (410мг, 41%); δΗ (CDCI3 400МГц) 1.27 (3Н, т), 2.22 (6Н, с), 3.46 (2Н, с), 4.23 (2Н, к), 4.64 (1Н, ш), 6.89 (1Н, д), 6.92 (2Н, д), 7.18 (2Н, д), 7.33 (1Н, д), 7.60 (1Н, с); MS m/z (TS+) 423 (МН+). Стадія 2. Гідроліз естеру/ декарбоксилювання для одержання бажаного нітрилу {3[(диметиламіно)метил]-4-[4(трифторметокси)фенокси]феніл}ацетонітрил Гідроксид натрію (39мг, 0.97ммоль) додавали до розчину проміжного ціаноестеру (410мг, 0.97ммоль) в діоксані (40мл), суміш нагрівали із зворотним холодильником протягом 2 годин. Після охолодження до кімнатної температури реакційну суміш розділяли між етром і водою. Органічний шар промивали розчином солі, сушили (MgSO4) і концентрували in vacuo. Залишок очищували флеш хроматографією [SiO2; ДХМ/ МеОН (97:3)] з одержанням бажаного нітрилу (141мг, 41%); Н (CDCI3, 400МГц) 2.25 (6Н, с), 3.43 (2Н, с), 59 75067 3.75 (2Н, с), 6.85-6.97 (3Н, м), 7.13-7.24 (3Н, м), 7.46 (1Н, с); MS m/z (TS+) 351 (МН+). Приклад 90 4-[(Диметиламіно)метил]-3-[4(трифторметил)фенокси]бензамід Нітрил Прикладу 82 (300мг, 0.94ммоль) розчиняли в ДМСО (2мл) і додавали карбонат калію (43мг, 0.3ммоль) з наступним додаванням Н2О2 (30%, 0.2мл). Реакційну суміш перемішували при кімнатній температурі протягом 30хв. до розведення водою (5мл) і екстрагування діетиловим етером (2 10мл). Об'єднані етерні шари сушили MgSO4 і випарювали до одержання масла. Залишок очищували флеш хроматографією [SiO2; ДХМ/ МеОН/ 880 NH3 (93:7:1)] з одержанням бажаного аміду у вигляді безбарвної твердої речовини (258мг, 78%); H (CDCI3, 300МГц) 2.24 (6Н, с), 3.45 (2Н, с), 5.60-6.00 (2Н, 2 х шс), 6.98 (2Н, д), 7.44 (1Н, с), 7.54-7.64 (4Н, м); MS m/z. (TS+) 339 (МН+). Приклад 91 3-[(Диметиламіно)метил]-4-[4(метилсульфаніл)фенокси]бензамід 60 Суміш нітрилу Прикладу 88 (100мг, 0.32ммоль) і поліфосфорної кислоти (750мг) нагрівали при 110°С в атмосфері азоту протягом 75 хвилин. Після охолодження до кімнатної температури додавали гідроксид натрію (2М) і одержану суміш екстрагували етилацетатом (тричі). Об'єднані органічні екстракти сушили (MgSO4) і концентрували in vacuo. Залишок очищували флеш хроматографією [ДХМ/ МеОН/ 880 NH3 (93:7:1 90:10:1)] з одержанням бажаного первинного аміду (58мг, 55%); δΗ (CDCI3, 400МГц) 2.25 (6Н, с), 2.45 (3Н, с), 3.45 (2Н, с), 3.55 (2Н, с), 5.63 (1Н, ш), 5.76 (1Н, ш), 6.87 (3Н, м), 7.15 (1Н, д), 7.25 (2Н, д), 7.40 (1Н, с); MS m/z (TS+) 331 (МН+). Приклади 93-97 Ряд первинних амідів одержували в придатних для гідролізу умовах з необхідних нітрилів шляхом реакцій, описаних у Прикладах 90, 91 або 92. Нітрил Прикладу 85 (60мг, 0.2ммоль) розчиняли в трет-бутанолі, додавали гідроксид калію (45мг, 0.8ммоль) і суміш кип'ятили в атмосфері азоту протягом 1 години. Суміш охолоджували, розводили водою і ЕtOАс. Органічний шар відділяли, промивали розчином солі, сушили (MgSO4) і випарювали до одержання блідо-жовтої гумоподібної речовини. Очищенням флеш хроматографією [SiO2; ДХМ/ МеОН/ 880 NH3 (95:5:1)] одержували бажаний амід у вигляді білого порошку (39мг, 61%); Н (CDCI3, 400МГц) 2.30 (6Н, с), 2.50 (3Н, с), 3.57 (2Н, с), 5.60 (1Н, ш), 6.00 (1Н, ш), 6.86 (1Н, д), 6.92 (2Н, д), 7.27 (2Н, д), 7.73 (1Н, дд), 7.93 (1Н, с); MS m/z (TS+) 317 (МН+). ПРИКЛАД 92 2-{3-[{Диметиламіно)метил]-4-[4(метилсульфаніл)фенокси]феніл}ацетамід Приклад 98 4-[(Диметиламіно)метил]-3-[4(трифторметокси)фенокси]бензамід
ДивитисяДодаткова інформація
Назва патенту англійськоюDiphenyl ethers, pharmaceutical composition containing them, use thereof, a method for treatment (variants), a method for obtaining thereof and method for producing intermediary compounds
Назва патенту російськоюДифениловые этеры, фармацевтическая композиция, которая их содержит, их применение, способ лечения (варианты), способ их получения и способ получения промежуточных соединений
МПК / Мітки
МПК: A61K 31/4164, C07C 323/67, C07D 295/192, C07C 311/37, A61K 31/24, C07C 237/30, C07C 205/00, A61P 25/30, A61K 31/4196, A61K 31/165, C07D 249/06, A61P 25/24, C07C 229/38, C07D 205/00, A61K 31/5375, A61K 31/397, A61K 31/18, C07C 217/90, C07C 303/00, C07C 323/20, A61K 31/277, C07D 521/00, C07C 319/00, C07D 295/096, A61P 15/10, C07D 295/18, C07D 233/61, C07D 207/12, A61K 31/4192, C07C 213/00, A61P 25/00, C07C 217/58, C07C 45/71, C07D 249/08, A61K 31/415, C07D 231/38, C07C 255/43, A61K 31/137, C07C 323/32, A61P 25/14, A61P 43/00, C07C 47/52, A61K 31/40, A61K 31/195, C07C 255/59, C07C 311/08, C07C 317/32, C07C 311/05, A61K 31/145, A61P 15/00, C07C 237/28
Мітки: композиція, спосіб, застосування, одержання, містить, дифенілові, етери, лікування, проміжних, варіанти, фармацевтична, сполук
Код посилання
<a href="https://ua.patents.su/54-75067-difenilovi-eteri-farmacevtichna-kompoziciya-shho-kh-mistit-kh-zastosuvannya-sposib-likuvannya-varianti-sposib-kh-oderzhannya-i-sposib-oderzhannya-promizhnikh-spoluk.html" target="_blank" rel="follow" title="База патентів України">Дифенілові етери, фармацевтична композиція, що їх містить, їх застосування, спосіб лікування (варіанти), спосіб їх одержання і спосіб одержання проміжних сполук</a>
Попередній патент: Катодна фольга для електролітичних конденсаторів
Наступний патент: Ліпополісахариди з escherichia coli
Випадковий патент: Пристрій для кріплення півпетлі












