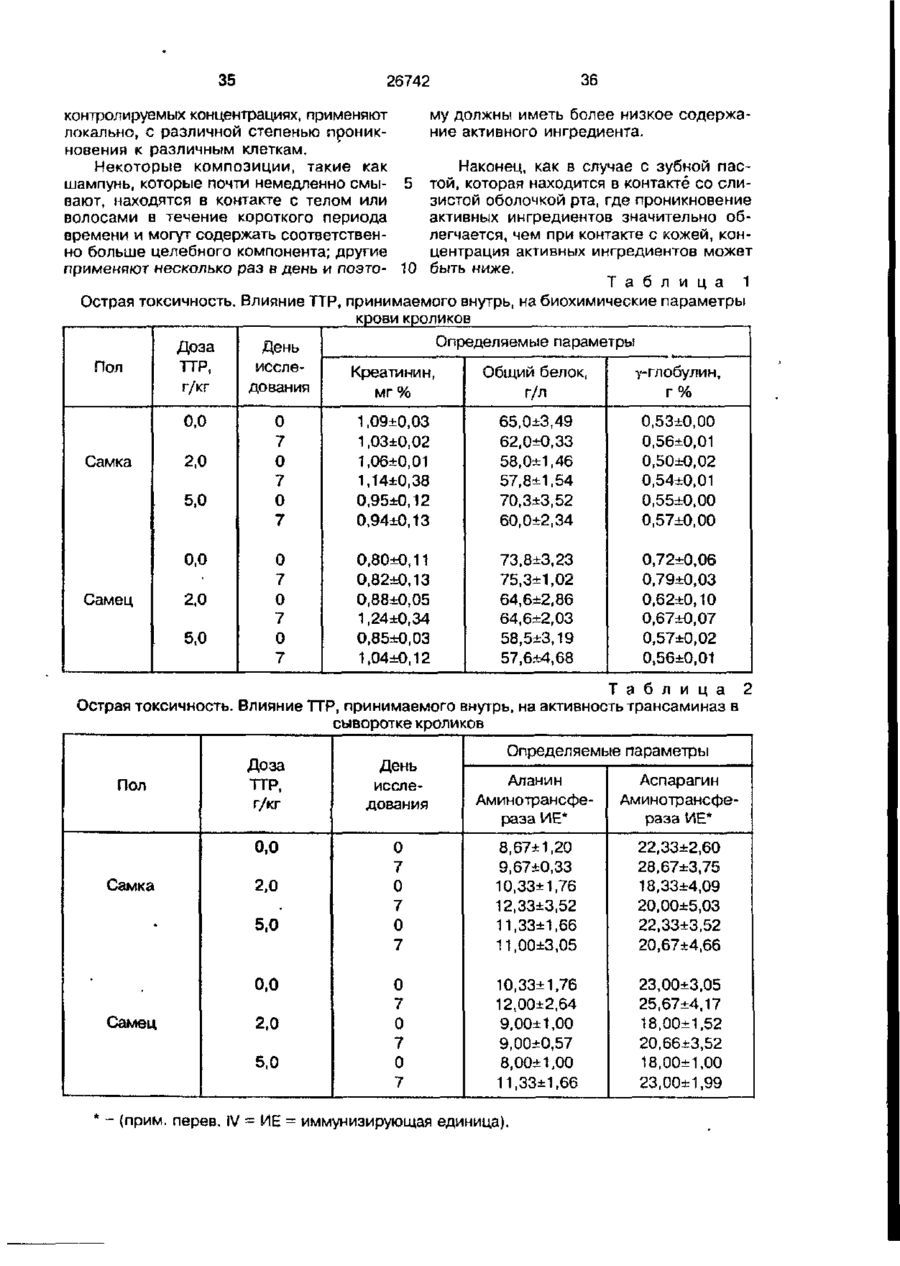
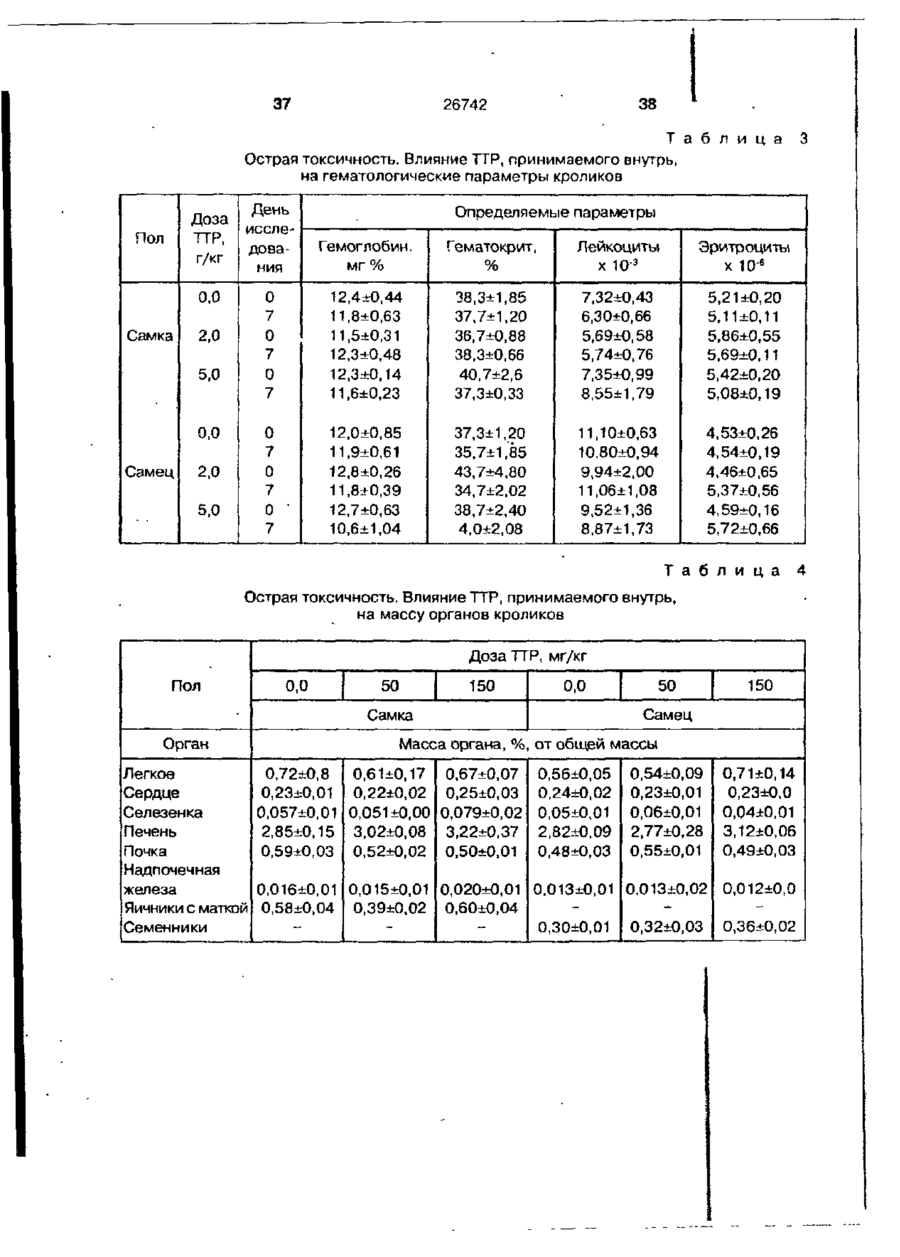
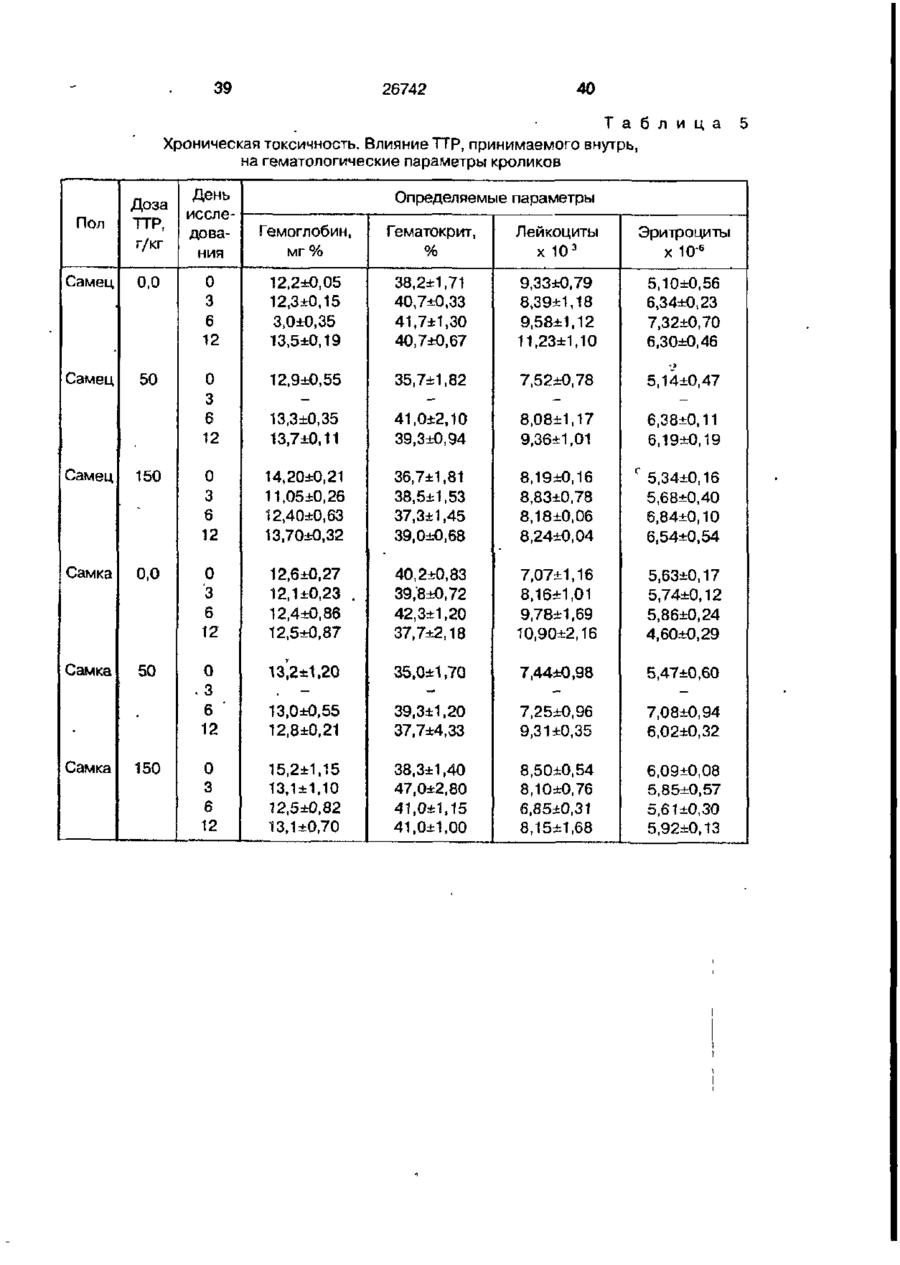
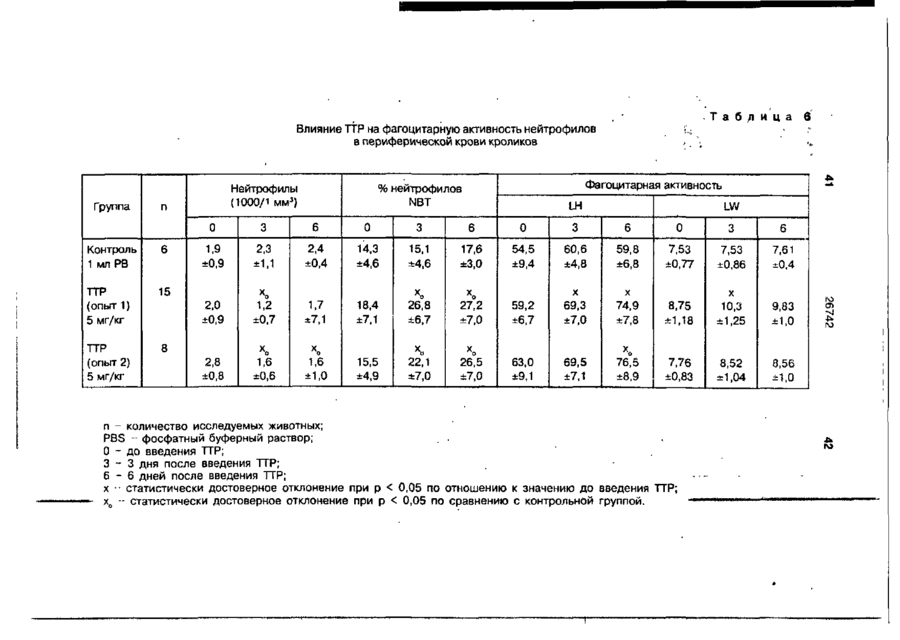
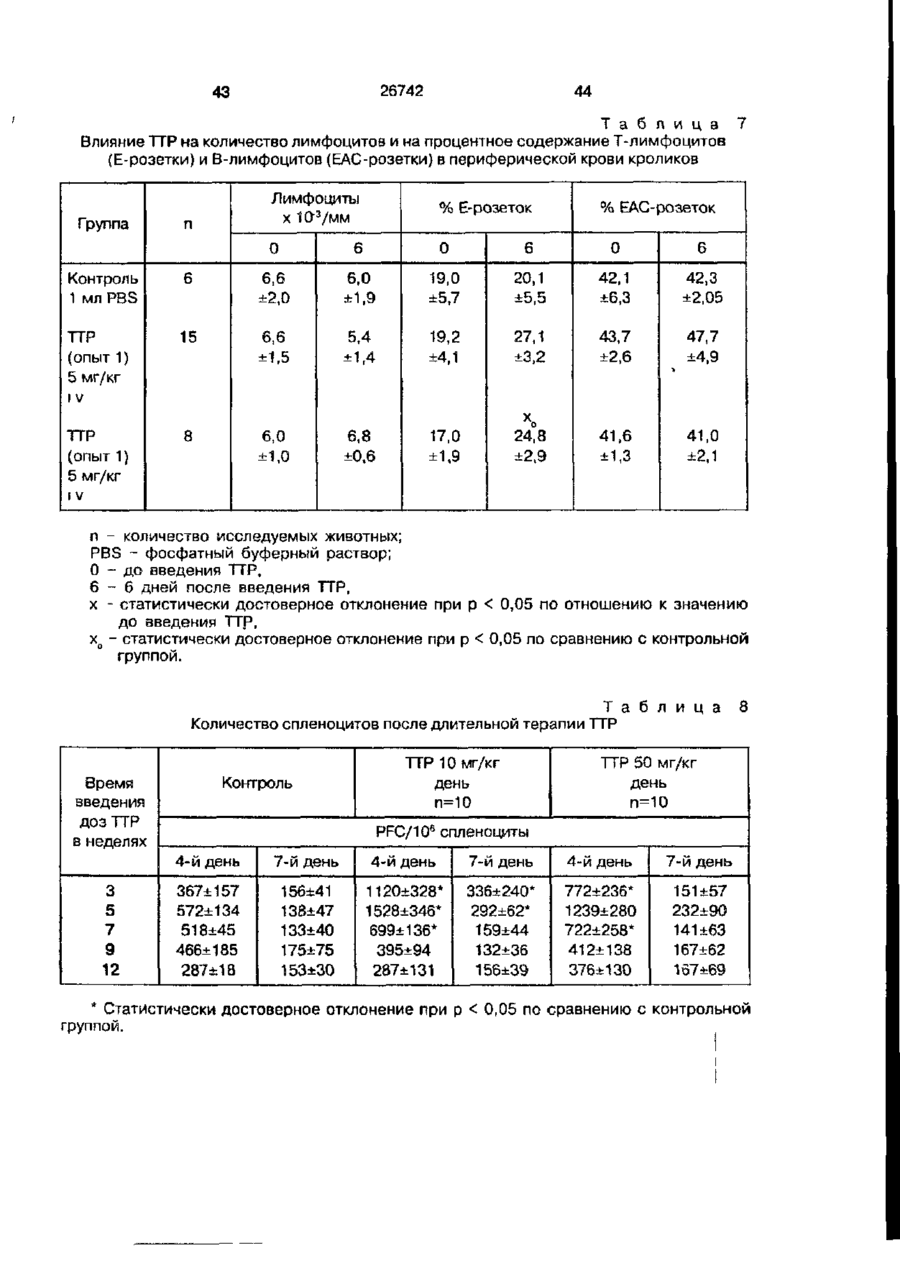
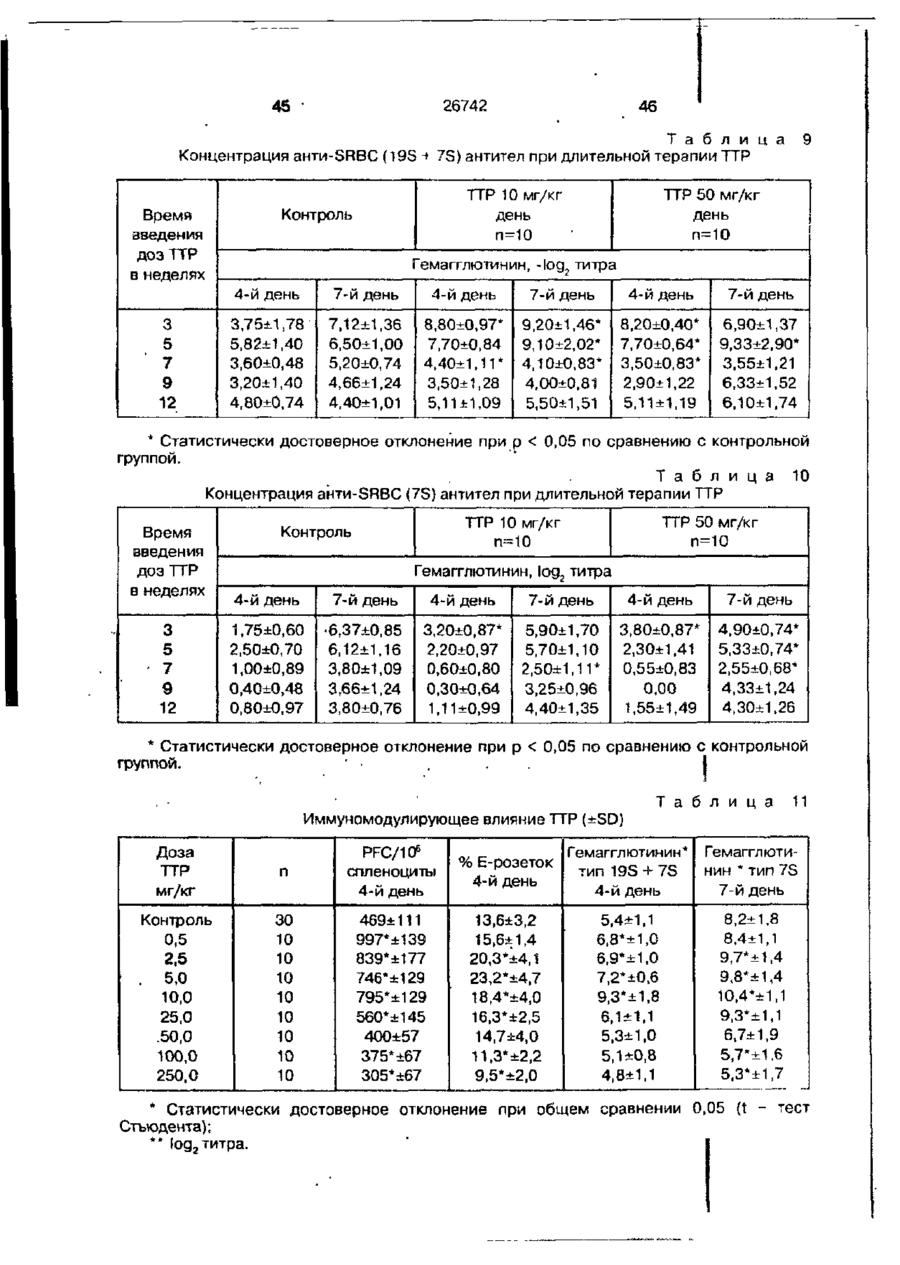
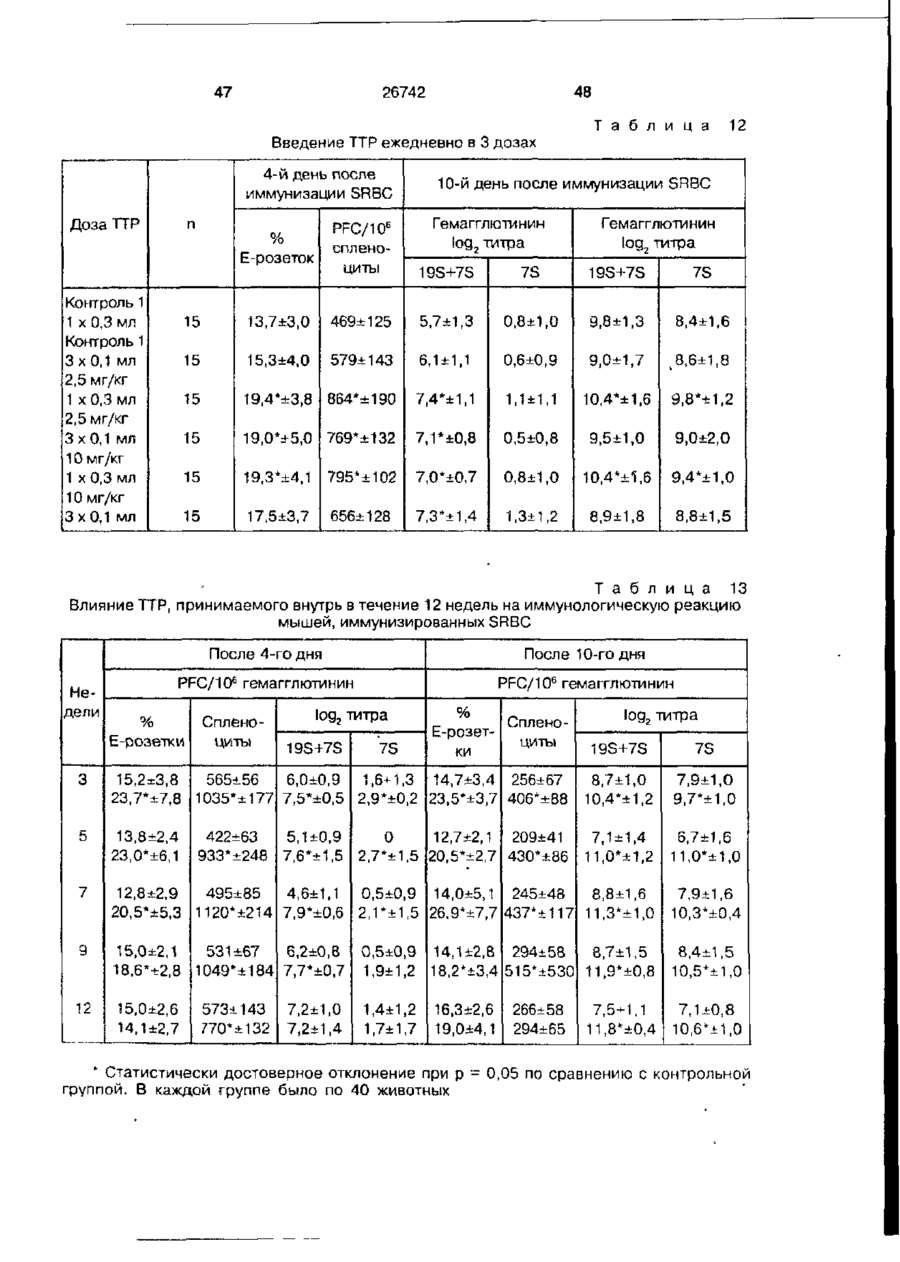
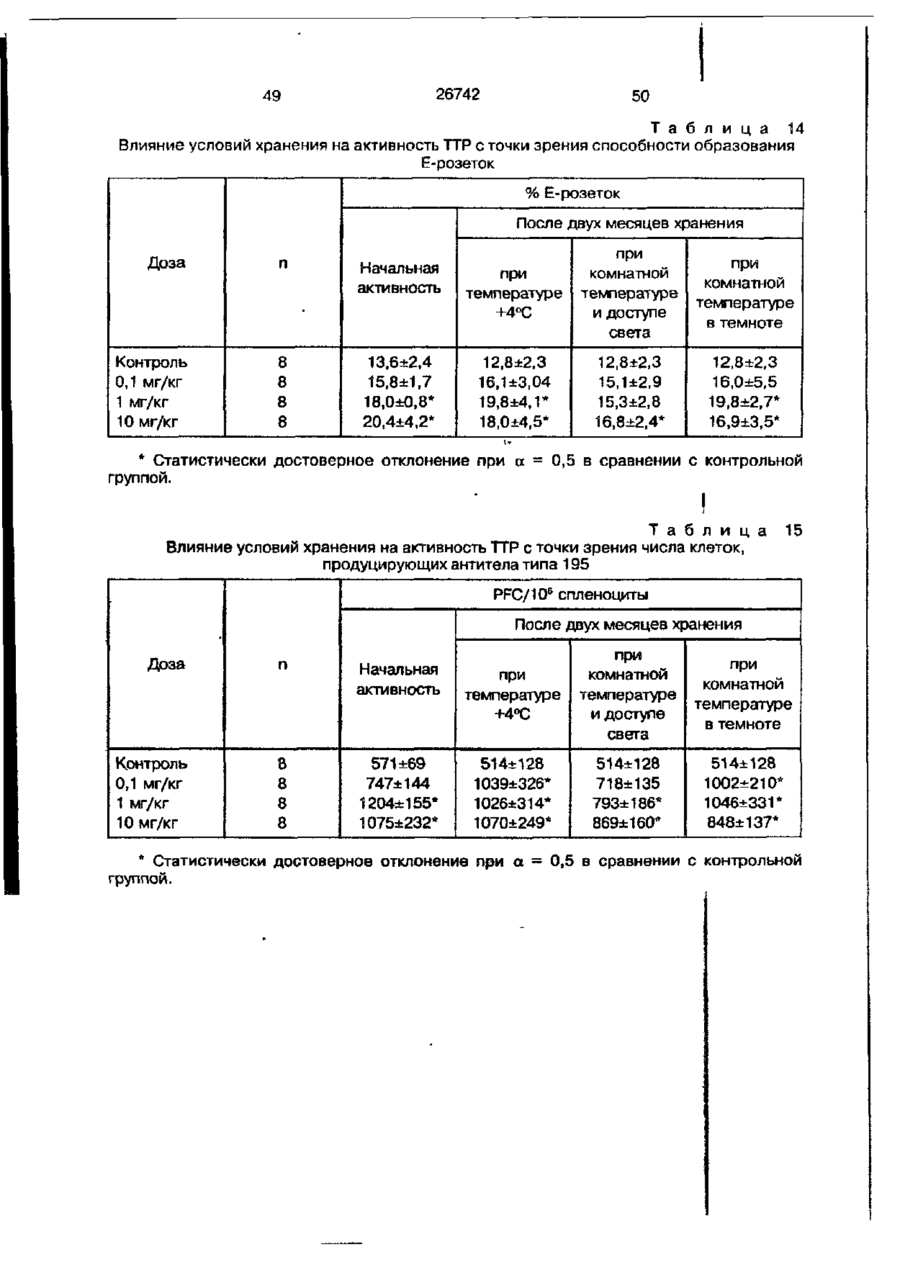
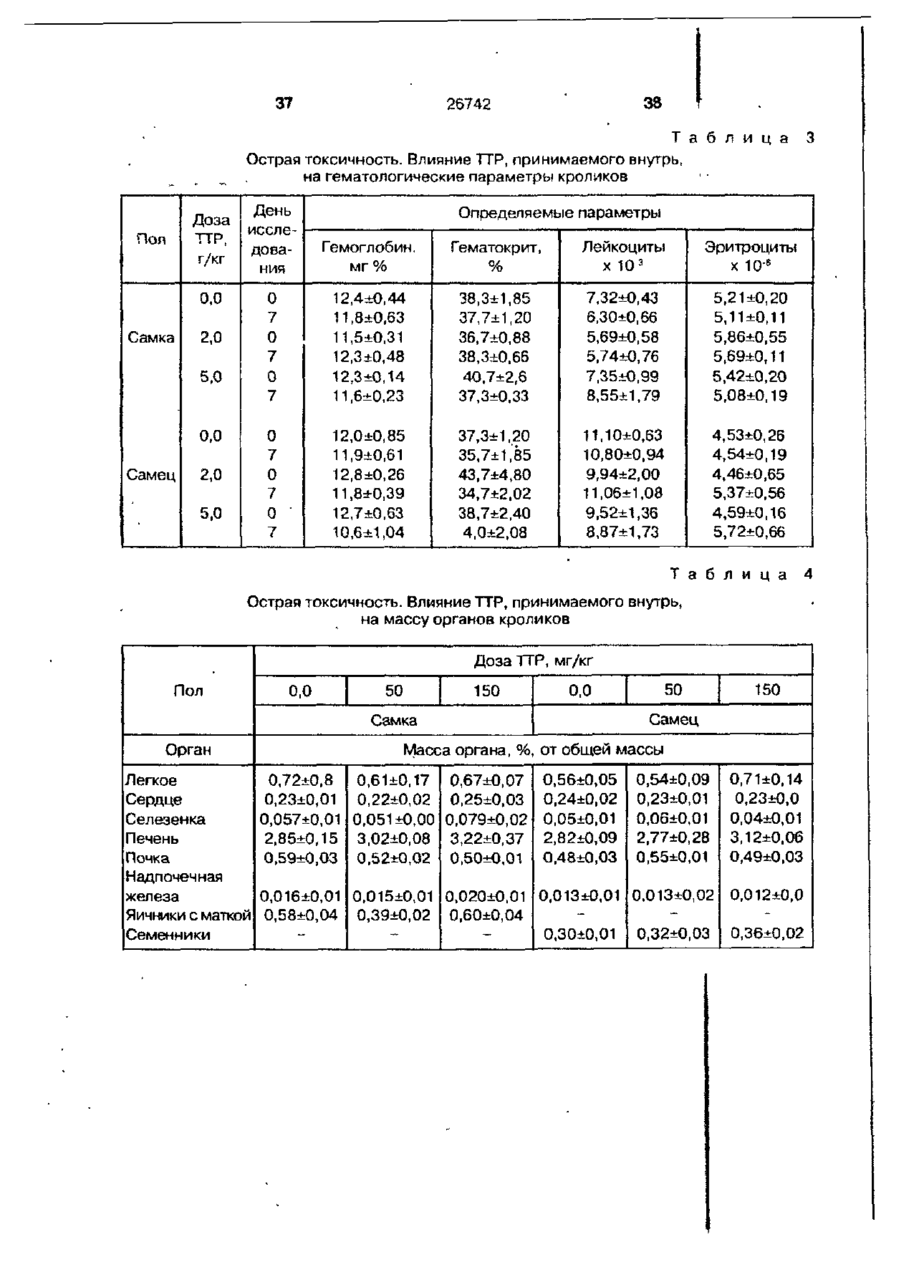
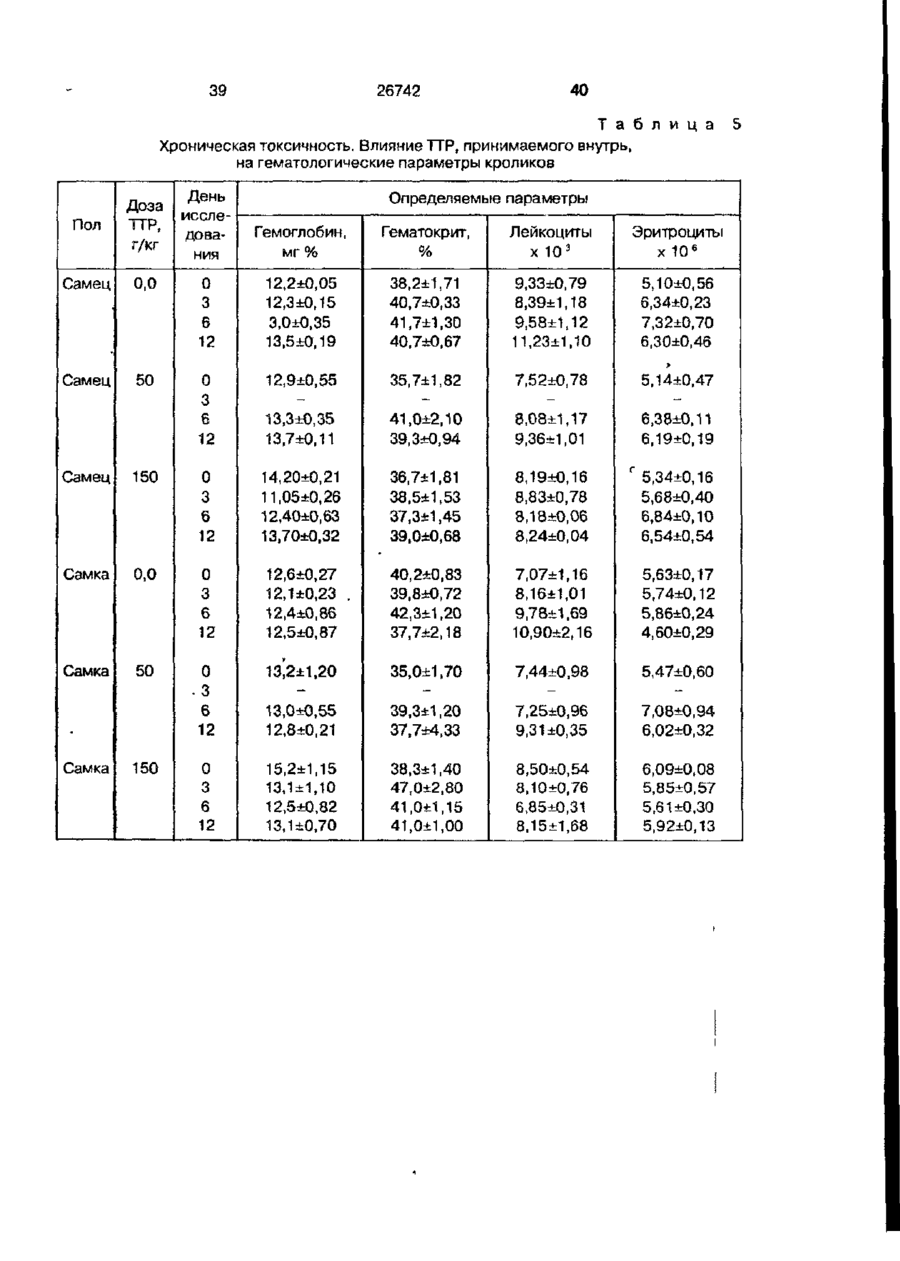
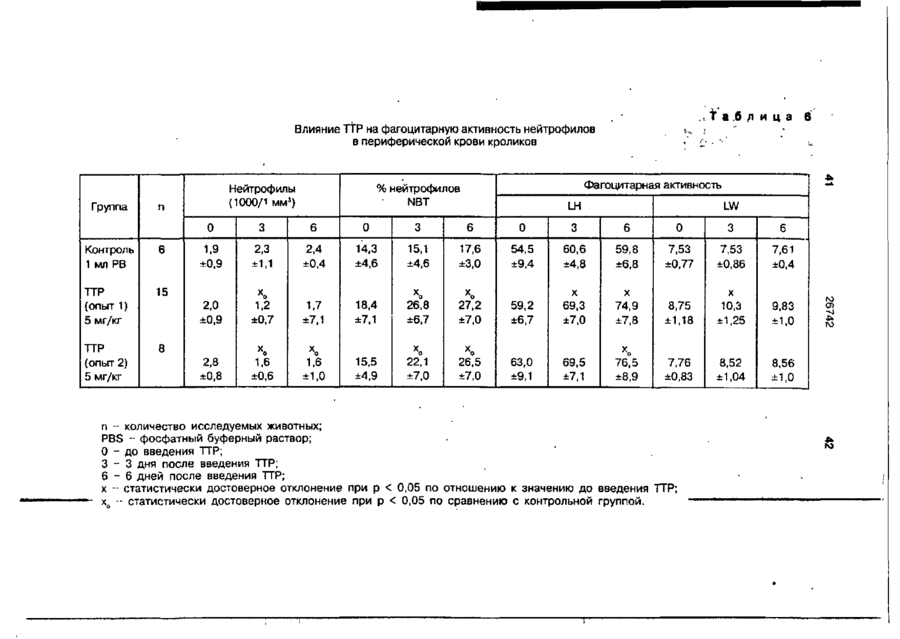
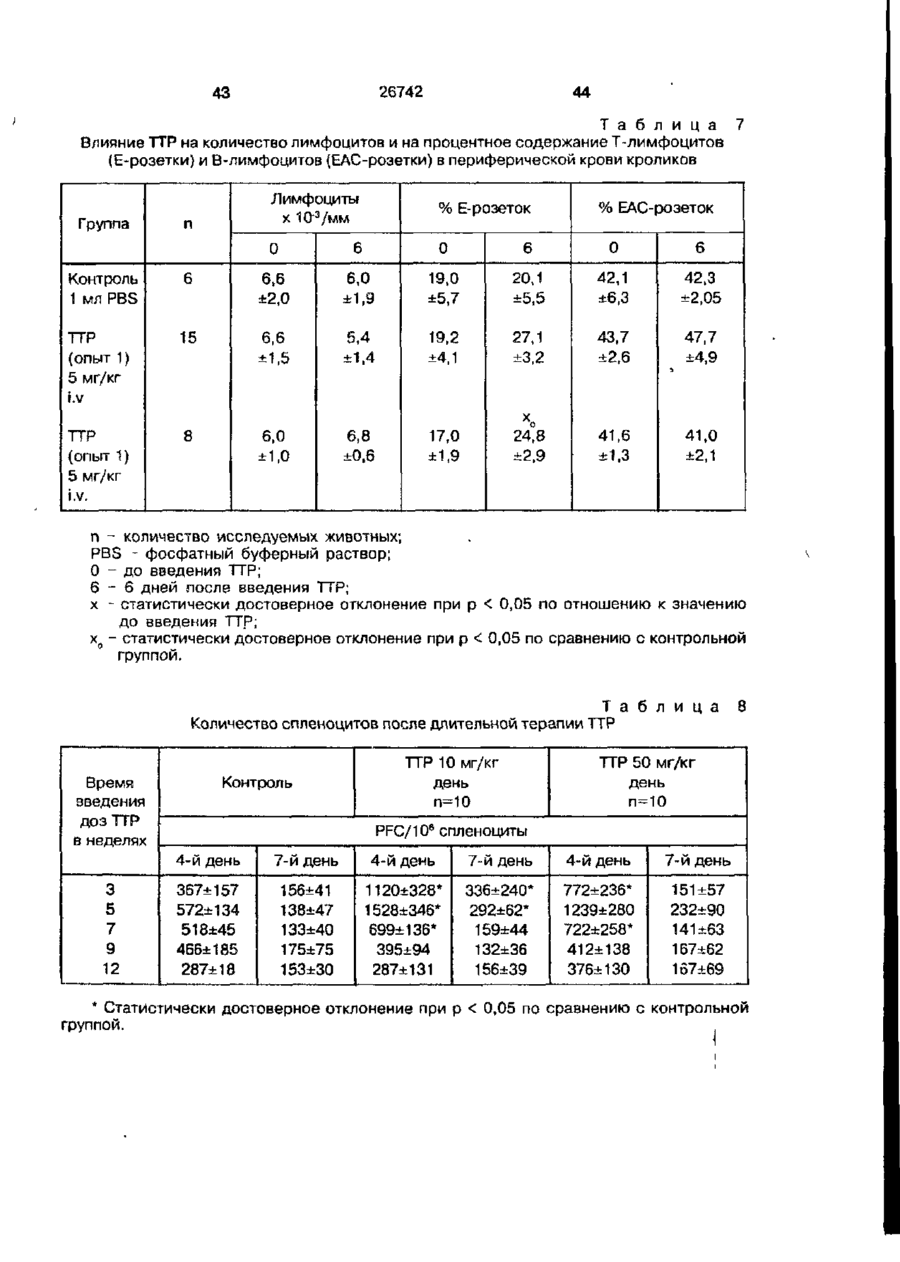
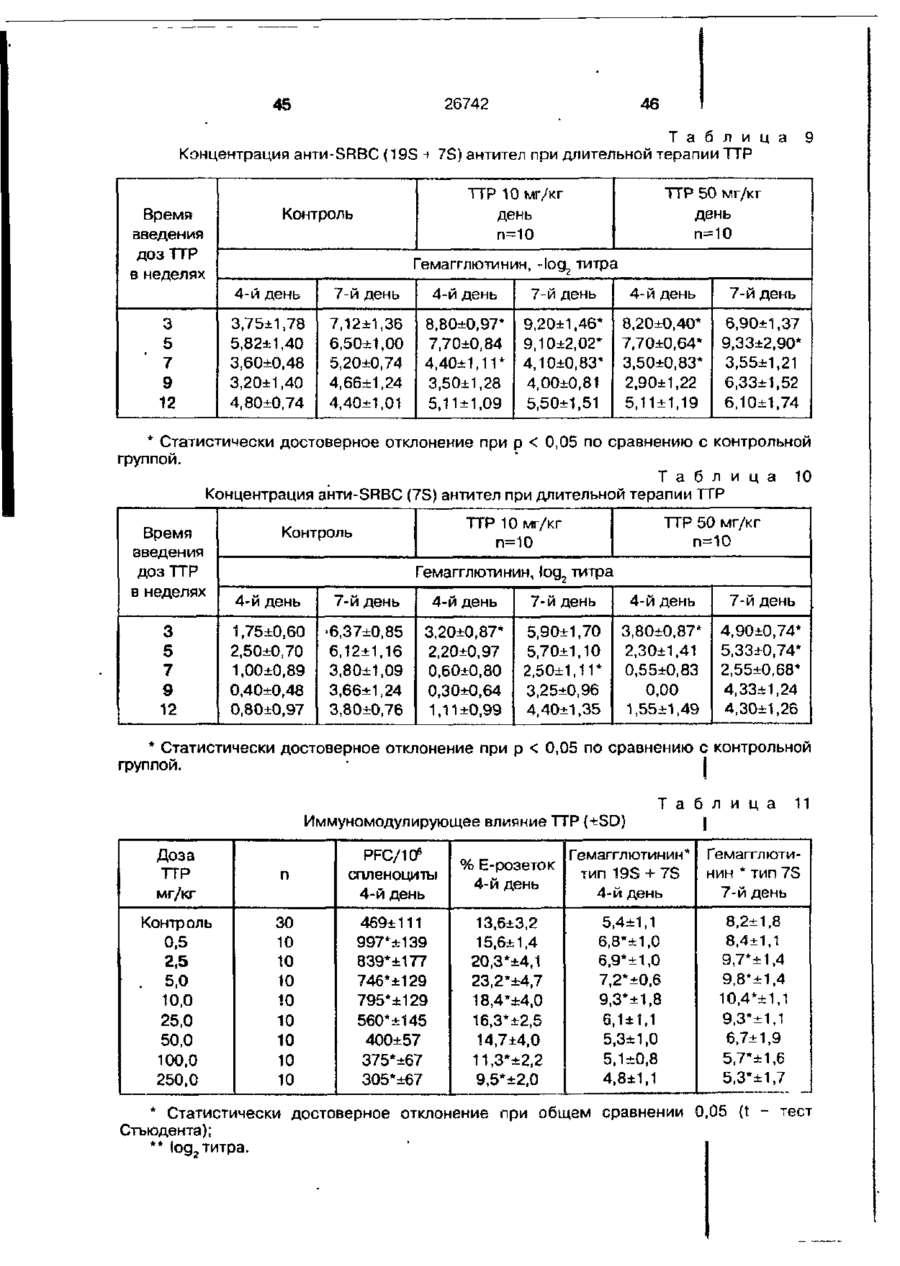
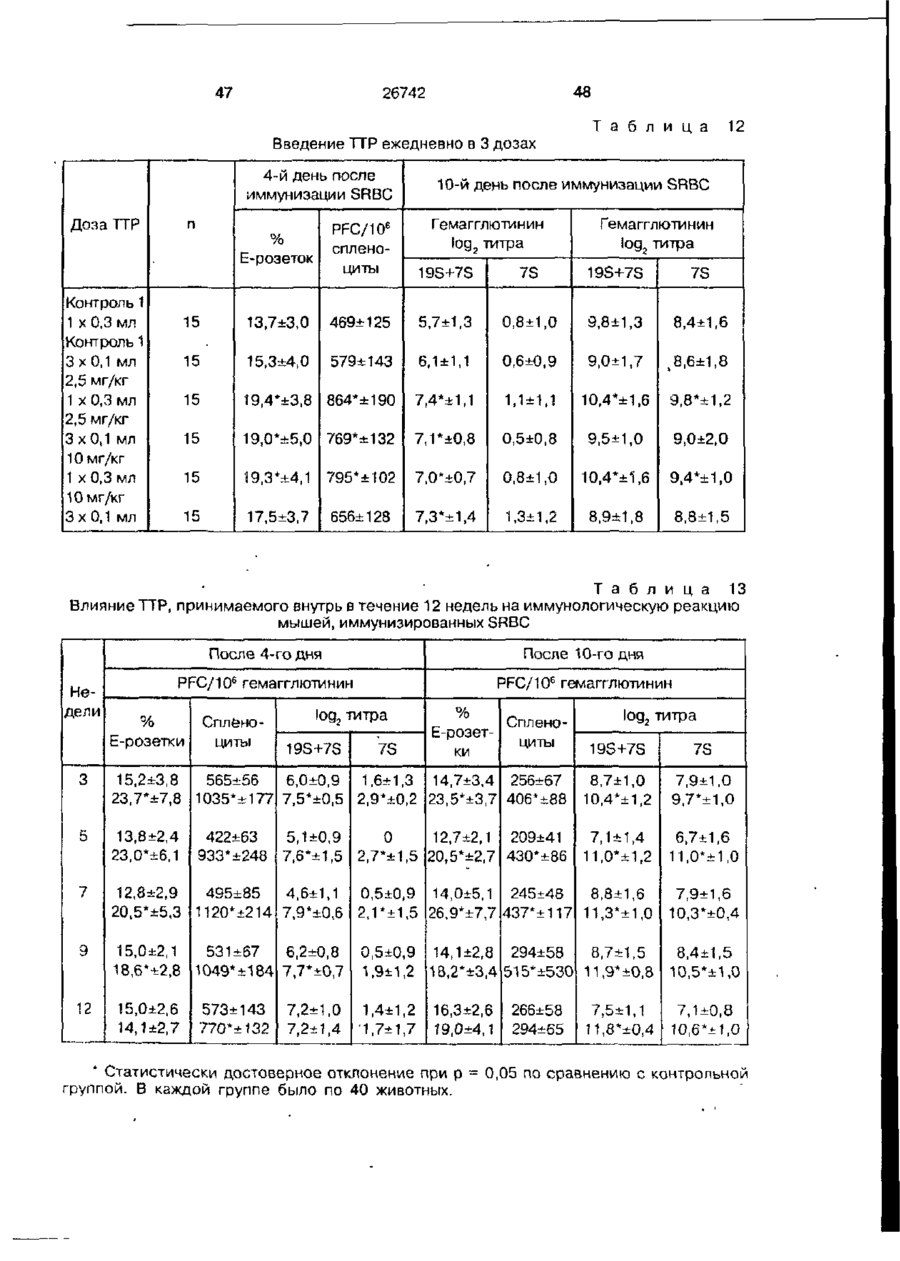
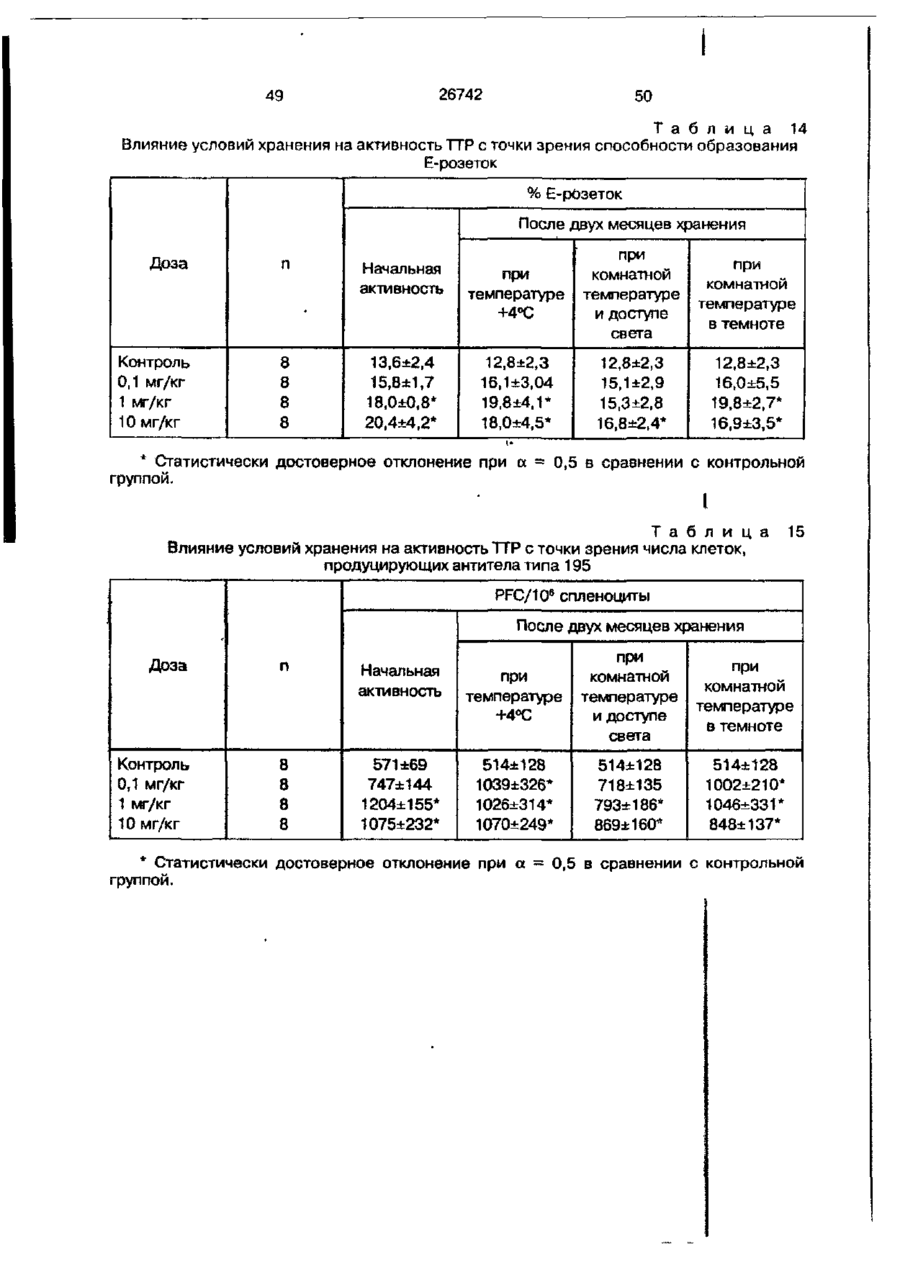
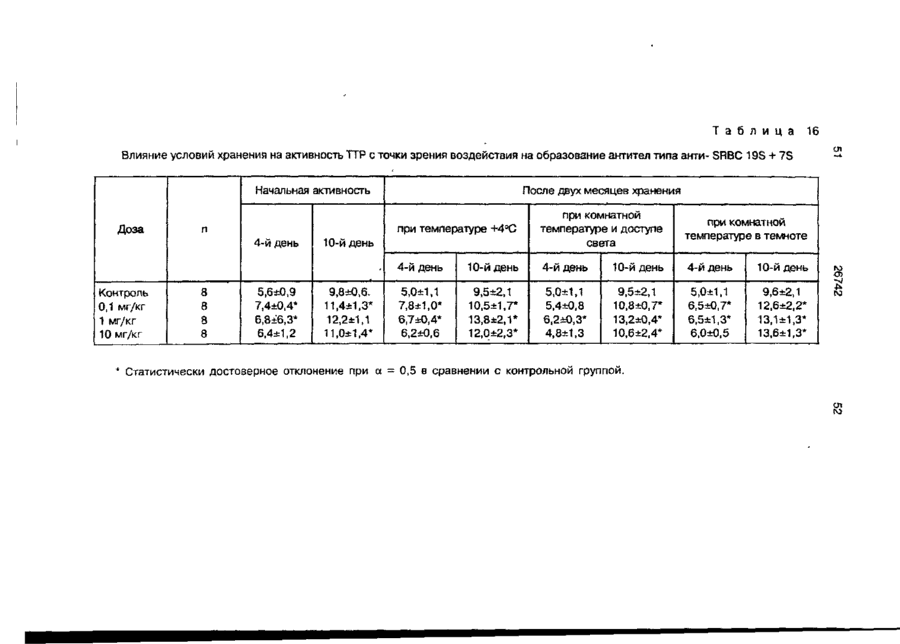
Біоактивний продукт, що одержують з торфу, спосіб його одержання, спосіб одержання фармацевтичної композиції, що здатна індукувати цитокіни, та композиція, що здатна визивати неспецифічну імуностимуляцію
Номер патенту: 26742
Опубліковано: 12.11.1999
Автори: Томков Станіслав, Ріттер Станіслава, Джерш Тадеуш, Скрзижевська Малгоржата, Толпа Станіслав, Кукла Рішард
Формула / Реферат
1. Биоактивный продукт, полученный из торфа, используемый для неспецифической иммуностимуляции, представляющий собой смесь активных торфяных ингредиентов и неорганических солей, полученную способом, предусматривающим первичный щелочной гидролиз сырьевого торфяного материала, подкисление гидролизата, отделение нерастворимой части с последующим вторичным подщелачиванием, а затем подкислением чистой жидкой фазы, удаление балластных веществ с использованием экстракции органическим растворителем, и последующую обработку оставшейся жидкой фазы, содержащей неорганические соли и извлеченные из торфа биоактивные ингредиенты, отличающийся тем, что он содержит не более 70вес.% неорганических солей, особенно хлорида натрия, из расчета по сухому веществу, причем это содержание солей обеспечено посредством разбавления указанной жидкой фазы деминерализованной водой с последующим обратным осмосом для снижения содержания солей в продукте.
2. Продукт по п.1, отличающийся тем, что он находится в виде водного раствора или высушенного порошка.
3. Продукт по п.1 или 2, отличающийся тем, что содержание в нем органических солей не превышает 60%.
4. Продукт по любому из пп.1 - 3, отличающийся тем, что в случае, когда продукт находится в виде 1% - ного водного раствора, он имеет pH от 5,0 до 6,5 предпочтительно около 6.
5. Продукт по любому из пп.1 - 4, отличающийся тем, что в случае, когда продукт находится в виде концентрированного раствора, этот раствор представляет собой темно-коричневую жидкость с удельной плотностью от 1,02 до 1,09г/мл, а содержание в нем сухих веществ составляет не менее 5вес.%.
6. Способ получения биоактивного продукта из торфа, предусматривающий первичный щелочной гидролиз сырьевого торфяного продукта, последующее подкисление гидролизата, отделение нерастворимых твердых частей с последующим вторичным подщелачиванием, а затем подкисленном чистой жидкой фазы, удаление инертных веществ с использованием экстракции органическим растворителем, и последующую обработку оставшейся жидкой фазы, содержащей неорганические соли и извлеченные из торфа биоактивные ингредиенты, отличающийся тем, что предусматривает следующие дополнительные стадии: стадию разбавления, в которой упомянутый раствор разбавляют деминерализованной водой; стадию последующего обессоливания, в которой разбавленный раствор подвергают обратному осмосу для обессоливания раствора, причем неорганические соли удаляют до концентрации не более 70вес.%, из расчета по сухому веществу; стадию концентрирования и очистки.
7. Способ по п.6, отличающийся тем, что разбавление деминерализованной водой проводят при соотношении от 1 : 5 до 1 : 8, а разбавленный раствор обессоливают до предпочтительного содержания неорганических солей не более 60вес.%, из расчета по сухому веществу.
8. Способ по п.6 или 7, отличающийся тем, что дополнительно содержит стадии стерилизации и/или сушки, где концентрированный и очищенный раствор стерилизуют и/или подвергают распылительной сушке.
9. Способ по любому из пп.6 - 8, отличающийся тем, что после экстракции органическим растворителем, остаточные количества растворителя удаляют из водной фазы, которую для этого пропускают через спеченный керамический фильтр под действием пониженного давления, получая чистый фильтрат упомянутой жидкой фазы, содержащей неорганические соли и биоактивные ингредиенты.
10. Способ по п.9, отличающийся тем, что стерилизацию проводят посредством мембранного фильтра.
11. Способ по п.9 или 10, отличающийся тем, что раствор подвергают распылительной сушке при температуре на входе около 180°C и на выходе около 90°C.
12. Способ получения фармацевтической композиции, способной индуцировать цитокины и полезной для улучшенного терапевтического лечения наружных ран или варикозных язв, особенно варикозных язв нижних частей ног, предусматривающий соединение индуцирующего цитокины биоактивного материала с травяным экстрактом или травяными экстрактами, гелеобразующим агентом, и другими ингредиентами, отличающийся тем, что стерильный водный раствор биоактивного продукта, полученного из торфа, содержащий не более 70% неорганических солей, особенно хлорида натрия, из расчета по сухому веществу, соединяют со стерильным спиртовым травяным экстрактом, после чего жидкую смесь переводят в гелеобразную форму путем добавления. гелеобразующего агента.
13. Способ по п.12 получения фармацевтической композиции в виде геля, отличающийся тем, что добавляют гелеобразующий агент, предпочтительно коллоидный кремнезем, причем весовое соотношение жидкой смеси к гелеобразующему агенту составляет 90 - 94 : 10 - 6.
14. Способ по п.12 получения фармацевтической композиции в виде мази, отличающийся тем, что добавляют гелеобразующий агент, предпочтительно коллоидный кремнезем, причем весовое соотношение жидкой смеси к гелеобразующему агенту составляет около 30 : 2, и полученный таким образом гель растирают с предварительно стерилизованной основой мази, содержащей смесь жировых компонентов, таких как эуцирин и вазелин, в весовом соотношении гель к жидкому компоненту 32 - 34 : 68 : 66.
15. Способ по любому из пп.12 - 14, отличающийся тем, что травяной экстракт выбирают из группы, состоящей из экстракта конского каштана, экстракта календулы, экстракта ромашки, экстракта ноготков, экстракта листа шалфея, экстракта мыльнянки лекарственной, экстракта хвоща, экстракта листьев жгучей крапивы, экстракта зародышей пшеницы, экстракта алоэ, экстракта тимьяна, травяного экстракта Фуллера.
16. Способ по любому из пп.12 - 15, отличающийся тем, что содержит глицерин и/или стерильный раствор ароматизирующего соединения, предпочтительно отобранной из группы, состоящей из ментола, тимола, мяты, лимона и эвкалипта, которые добавляют к жидкой смеси.
17. Способ по любому из пп.12 - 16, отличающийся тем, что биоактивный продукт, полученный из торфа, представляет собой экстракт торфа в виде концентрированного водного раствора или высушенного порошка, который предпочтительно, содержит не более 60вес.% неорганических солей, из расчета по сухому веществу.
18. Композиция, способная вызвать неспецифичную иммуностимуляцию, содержащая фармацевтически активный ингредиент и физиологически приемлемый носитель, наполнитель и/или добавку, отличающаяся тем, что активным ингредиентом является биоактивный продукт из торфа, содержащий не более 70вес.% неорганических солей, особенно хлорида натрия, из расчета по сухому веществу, причем биоактивный продукт способен индуцировать цитокины и присутствует в композиции в количестве 0,01 - 10вес.%, что соответствует количеству 90 - 99,99вес.% носителей, наполнителей и/или добавок.
19. Композиция по п.18, отличающаяся тем, что носитель является смесью лактозы и смазывающих веществ, а весовое соотношение активного ингредиента к носителю составляет 1 : 9 - 1 : 19.
20. Композиция по п.18 или п.19, отличающаяся тем, что выполнена в виде таблеток или капсул.
21. Композиция по п.18, отличающаяся тем, что она содержит носители и/или другие добавки, обычные для косметичеких препаратов, а упомянутый биоактивный продукт из торфа присутствует в композиции в количестве 0,01 - 1вес.%, в частности 0,05 - 0,1вес.%, причем композиция предназначена для ухода за телом, а именно для кожи, волос или зубов.
22. Композиция по п.21, отличающаяся тем, что она содержит указанный биоактивный продукт из торфа в концентрации 0,05 - 1вес.%, а носители и/или добавки выбраны из группы, состоящей из водных растворов спиртов, всех типов эмульсий, гелей, пенящихся композиций и жировых носителей.
23. Композиция по п.21 или п.22, отличающаяся тем, что дополнительно содержит, по меньшей мере, один травяной экстракт и/или, по меньшей мере, одно ароматизирующее вещество.
24. Композиция по п.18, отличающаяся тем, что включает в себя стерильный спиртовой травяной экстракт и стерильный раствор ароматизирующего соединения, а носитель содержит гелеобразующий агент, причем весовое соотношение жидкой смеси к гелеобразующему агенту составляет от 90 : 94 до 94 : 6.
1. Приоритет от 15.07.91. по пунктам 1 - 24.
2. Приоритет от 16.03.91 по пунктам 15, 16, 21 - 23.
3. Приоритет от 17.05.91 по пунктам 15, 16, 21 - 23.
4. Приоритет от 03.06.91 по пунктам 15, 16, 21 - 23.
5. Приоритет от 16.03.91 по пунктам 21 - 23.
6. Приоритет от 16.03.91 по пунктам 21 - 23.
7. Приоритет от 10.06.91 по пунктам 21 - 23.
8. Приоритет от 10.06.91 по пунктам 21 - 23.
9. Приоритет от 10.06.91 по пунктам 21 - 23.
10. Приоритет от 17.06.91 по пунктам 21 - 23.
11. Приоритет от 17.06.91 по пунктам 21 - 23.
12. Приоритет от 17.06.91 по пунктам 21 - 23.
Текст
1. Биоактивный продукт, полученный из торфа, используемый для неспецифической иммуностимуляции, представляющий собой смесь активных торфяных ингредиентов и неорганических солей, полученную способом, предусматривающим первичный щелочной гидролиз сырьевого торфяного материала, подкисление гидролизата, отделение нерастворимой части с последующим вторичным подщелачиванием, а затем подкислением чистой жидкой фазы, удаление балластных веществ с использованием экстракции ор ганическим растворителем, и последующую обработку оставшейся жидкой фазы,, содержащей неорганические соли и извлеченные из торфа биоактивные ингредиенты, о т л и ч а ю щ и й с я тем, что он содержит не более 70 вес.% неорганических солей, особенно хлорида натрия, из расчета по сухому веществу, причем это содержание солей обеспечено посредством разбавления указанной жидкой фазы деминерализованной водой с последующим обратным осмосом для снижения содержания солей в продукте. 2. Продукт по п. 1 , о т л и ч а ю щ и й с я тем, что он находится в виде водного раствора или высушенного порошка. 3. Продукт по п. 1 или 2, о т л и ч а ю щ и й с я тем, что содержание в нем органических солей не превышает 60%. 4. Продукт по любому из пп. 1-3, о тл и ч а ю щ и й с я тем, что в случае, когда продукт находится в виде 1%-ного водного раствора, он имеет рН от 5,0 до 6,5 предпочтительно около 6. 5. Продукт по любому из пп. 1-4, о тл и ч а ю щ и й с я тем, что в случае, когда продукт находится в виде концентрированного раствора, этот раствор представляет собой темно-коричневую жидкость с удельной плотностью от 1,02 до 1,09 г/мл, а содержание в нем сухих веществ составляет не менее 5 вес.%. 6. Способ получения биоактивного продукта из торфа, предусматривающий первичный щелочной гидролиз сырьевого торфяного продукта, последующее подкисление гидролизата, отделение нерастворимых твердых частей с последующим вторичным подщелачиванием, а затем ю О 26742 подкислением чистой жидкой фазы, удаление инертных веществ с использованием экстракции органическим растворителем, и последующую обработку оставшейся жидкой фазы, содержащей неорганические соли и извлеченные из торфа биоактивные ингредиенты, о т л и ч а ю щ и й с я тем, что предусматривает следующие дополнительные стадии: стадию разбавления, в которой упомянутый раствор разбавляют деминерализованной водой; стадию последующего обессоливания, в которой разбавленный раствор подвергают обратному осмосу для обессоливания раствора, причем неорганические соли удаляют до концентрации не более 70 вес.%, из расчета по сухому веществу; стадию концентрирования и очистки. 7. Способ по п. 6, о т л и ч а ю щ и й с я тем, что разбавление деминерализованной водой проводят при соотношении от 1:5 до 1:8, а разбавленный раствор обессоливают до предпочтительного содержания неорганических солей не более 60 вес.%, из расчета по сухому веществу. 8. Способ по п. 6 или 7, о т л и ч аю щ и й с я тем, что дополнительно содержит стадии стерилизации и/или сушки, где концентрированный и очищенный раствор стерилизуют и/или подвергают распылительной сушке. 9. Способ по любому из пп. 6-8, о тл и ч а ю щ и й с я тем, что после экстракции органическим растворителем, остаточные количества растворителя удаляют из водной фазы, которую для этого пропускают через спеченный керамический фильтр под действием пониженного давления, получая чистый фильтрат упомянутой жидкой фазы, содержащей неорганические соли и биоактивные ингредиенты. 10. Способ по п. 9, о т л и ч а ю щ и й с я тем, что стерилизацию проводят посредством мембранного фильтра. 11. Способ по п. 9 или 10, о т л и ч а ю щ и й с я тем, что раствор подвергают распылительной сушке при температуре на входе около 180'С и на выходе около 90*С. 12. Способ получения фармацевтической композиции, способной индуцировать цитокины и полезной для улучшенного терапевтического лечения наружных ран или варикозных язв, особенно варикозных язв нижних частей ног, предусматривающий соединение индуцирующего цитокины биоактивного материала с травяным экст рактом или травяными экстрактами, гелеобразующим агентом, и другими ингредиентами, о т л и ч а ю щ и й с я тем, что стерильный водный раствор биоактивного продукта, полученного из торфа, содержащий не более 70% неорганических солей, особенно хлорида натрия, из рас„ чета по сухому веществу, соединяют со стерильным спиртовым травяным экстрактом, после чего жидкую смесь переводят в гелеобразную форму путем добавления гелеобразующего агента. 13. Способ по п. 12 получения фармацевтической композиции в виде геля, о т л и ч а ю щ и й с я тем, что добавляют гелеобразующий агент, предпочтительно коллоидный кремнезем, причем весовое соотношение жидкой смеси к гелеобразующему агенту составляет 90-94:10-6. 14. Способ по п. 12 получения фармацевтической композиции в виде мази, о т л и ч а ю щ и й с я тем, что добавляют гелеобразующий агент, предпочтительно коллоидный кремнезем, причем весовое соотношение жидкой смеси к гелеобразующему агенту составляет около 30:2, и полученный таким образом гель растирают с предварительно стерилизованной основой мази, содержащей смесь жировых компонентов, таких как эуцирин и вазелин, в весовом соотношении гель к жидкому компоненту 32-34:68:66. 15. Способ по любому из пп. 12-14, о т л и ч а ю щ и й с я тем, что травяной экстракт выбирают из группы, состоящей из экстракта конского каштана, экстракта календулы, экстракта ромашки, экстракта ноготков, экстракта листа шалфея, экстракта мыльнянки лекарственной, экстракта хвоща, экстракта листьев жгучей крапивы, экстракта зародышей пшеницы, экстракта алоэ, экстракта тимьяна, травяного экстракта Фуллера. 16. Способ по любому из пп. 12-15, о т л и ч а ю щ и й с я тем, что содержит глицерин и/или стерильный раствор ароматизирующего соединения, предпочтительно отобранной из группы, состоящей из ментола, тимола, мяты, лимона и эвкалипта, которые добавляют к жидкой смеси. 17. Способ по любому из пп. 12-16, о т л и ч а ю щ и й с я тем, что биоактивный продукт, полученный из торфа, представляет собой экстракт торфа в виде концентрированного водного раствора или высушенного порошка, который предпочтительно, содержит не более, 60 вес.% неорганических солей, из расчета по сухому веществу. 26742 18. Композиция, способная вызвать неспецифичную иммуностимуляцию, содержащая фармацевтически активный ингредиент и физиологически приемлемый носитель, наполнитель и/или добавку, о тли ч а ю щ а я с я тем, что активным ингредиентом является биоактивный продукт из торфа, содержащий не более 70 вес.% неорганических солей, особенно хлорида натрия, из расчета по сухому веществу, причем биоактивный продукт способен индуцировать цитокины и присутствует в композиции в количестве 0,0110 вес.%, что соответствует количеству 90-99,99 вес.% носителей, наполнителей и/или добавок. 19. Композиция по п. 18, о т л и ч аю щ а я с я тем, что носитель является смесью лактозы и смазывающих веществ, а весовое соотношение активного ингредиента к носителю составляет 1:9-1:19. 20. Композиция по п. 18 или п. 19, о т л и ч а ю щ а я с я тем, что выполнена в виде таблеток ил'и капсул. 21. Композиция по п. 18, о т л и ч аю щ а я с я тем, что она содержит носители и/или другие добавки, обычные для косметичеких препаратов, а упомянутый биоактивный продукт из торфа присутствует в композиции в количестве 0,011 вес.%, в частности 0,05-0,1 вес.%, причем композиция предназначена для ухода за телом, а именно для кожи, волос или зубов. 22. Композиция по п. 21, о т л и ч аю щ а я с я тем, что она содержит указанный биоактивный продукт из торфа в концентрации 0,05-1 вес.%, а носители и/или добавки выбраны из группы, состоящей из водных растворов спиртов, всех типов эмульсии, гелей, пенящихся композиций и жировых носителей. 23. Композиция по п. 21 или п. 22, о т л и ч а ю щ а я с я тем, что дополнительно содержит, по меньшей мере, один травяной экстракт и/или, по меньшей мере» одно ароматизирующее вещество. 24. Композиция по п. 18, о т л и ч аю щ а я с я тем, что включает в себя стерильный спиртовой травяной экстракт и стерильный раствор ароматизирующего соединения, а носитель содержит гелеобразующий агент, причем весовое соотношение жидкой смеси к гелеобразующему агенту составляет от 90:94 до 94:6. 1. П р и о р и т е т от 15.07.91. п о п у н к т а м 1-24. 2. П р и о р и т е т от 16.03.91 п о п у н к т а м 15,16, 21-23. 3. П р и о р и т е т от 17.05.91 п о п у н к т а м 15,16, 21-23. 4. П р и о р и т е т от 03.06.91 п о п у н к т а м 15,16, 21-23. 5. П р и о р и т е т от 16.03.91 п о п у н к т а м 21-23. 6. П р и о р и т е т от 16.03.91 п о п у н к т а м 21-23. 7. П р и о р и т е т от 10.06,91 п о п у н к т а м 21-23. 8. П р и о р и т е т от 10.06.91 п о п у н к т а м 21-23. 9. П р и о р и т е т от 10.06.91 п о п у н к т а м 21-23. 10: П р и о р и т е т от 17.06.91 п о п у н к т а м 21-23. 11. П р и о р и т е т от 17.06.91 п о п у н к т а м 21-23. 12. П р и о р и т е т от 17.06.91 п о п у н к т а м 21-23. Изобретение относится к химической и фармацевтической промышленности, прежде всего, к новым биоактивным продуктам, получаемым из торфа, и к способам получения таких продуктов. 5 Изобретение также относится к фармацевтическим и косметическим композициям, содержащим эти продукты, и к способам получения фармацевтических и/ /или косметических композиций, содер- 10 жащих вышеуказанные биоактивные продукты,полученные из торфа. Известны различные способы экстрагирования торфа с использованием различных экстракционных сред, а также использование таких экстрактов, содержащих полученные из торфа биоактивные ингредиенты, для фармацевтических и косметических целей. * Один из таких известных способов охарактеризован в польском описании изобретения к патенту № 124110 (Chemical Abstract 101(10), 78854е). В соответствии с этим известным способом биоактивные 26742 продукты получают из торфа с помощью первичного и вторичного щелочного гидролиза воздушно-сухого неочищенного торфяного материала, затем проводят подкисление полученного таким образом гидролизата и сепарацию нерастворимой твердой части с последующим вторым подщелачиванием, подкислением чистой (прозрачной) жидкой фазы и удалением балластных веществ с помощью спиртовой или эфирной экстракции. В указанном способе водная фаза органической экстракции является жидким биоактивным продуктом, полученным из торфа. Известный жидкий продукт, который является раствором полученных из торфа активных ингредиентов в сильно концентрированном, почти насыщенном растворе хлорида натрия, полученный в соответствии с вышеуказанной ссылкой на польское описание изобретения к патенту, является нестабильным при хранении в течение длительного времени и, кроме того, содержит - что касается биологической активности композиции - большой избыток неорганических нейтральных веществ. Будучи объемным продуктом, он не удобен в обращении-, его трудно хранить и производить. Известен также биоактивный продукт, получаемый из торфа, способ его получения, способ получения фармацевтической композииии, способной индуцировать цитокины, и композиция, способная вызывать неспецифическую иммуностимуляцию. Машковский М.Д., Лекарственные средства, М.,. Медицина, 1989, ч. II, с. 33-76 (прототип). Известный биоактивный продукт, полученный из торфа и используемый для неспецифической иммуностимуляции, представляет собой смесь активных торфяных ингредиентов и неорганических солей. Смесь получают способом, предусматривающим первичный щелочной гидролиз сырьевого торфяного материала, подкисление гидролизата, отделение нерастворимой части с последующим вторичным подщелачиванием, а затем подкислением чистой жидкой фазы, удаление балластных веществ с использованием экстракции органическим растворителем, и последующую обработку оставшейся жидкой фазы, содержащей неорганические соли и извлеченные из торфа биоактивные ингредиенты. Известный способ получения биоактивного продукта из торфа предусматривает первичный щелочной гидролиз сырьевого торфяного продукта, последующее 5 10 15 20 25 30 35 " 4Q 45 50 55 8 подкисление гидролизата, отделение нерастворимых твердых частей с последующим вторичным подщелачиванием, а затем подкислением чистой жидкой фазы, удаление инертных веществ с использованием экстракции органическим растворителем, и последующую обработку оставшейся жидкой фазы, содержащей неорганические соли и извлеченные из торфа биоактивные ингредиенты. Известный способ получения фармацевтической композиции, способной индуцировать цитокины и полезной для улучшенного терапевтического лечения наружных ран или варикозных язв, особенно варикозных язв нижних частей ног, предусматривает соединение индуцирующего цитокины биоактивного материала с травяным экстрактом или травяными экстрактами; гелеобразующим агентом, и другими ингредиентами. Известная композиция, способная вызывать неспецифичную иммуностимуляцию, содержит фармацевтически активный ингредиент и физиологически приемлемый носитель, наполнитель и/или добавку. Главной задачей настоящего изобретения является разработка продукта, который является стабильным и может быть легко введен в фармацевтические или ветеринарные продукты, а также в косметические препараты как в твердом виде, так и в виде любого удобного раствора. В частности, что касается Использования полученного из торфа биоактивного продукта для фармацевтических целей, т.е. для получения фармацевтических композиций, то была настоятельная необходимость в разработке твердой формы, которая хорошо подходила бы для этих целей. Так как предварительные попытки, связанные с концентрацией известного водного раствора полученных из торфа биоактивных веществ и его обессоливания, не дали положительных результатов в связи с окклюзией активных ингредиентов в кристаллизующуюся твердую фазу, вызывающей уменьшение биологической активности композиции, то было очень трудно найти подходящий способ для превращения жидкой композиции в порошок. Неожиданно было обнаружено, что положительного результата можно достигнуть, если до концентрирования жидкую композицию сначала развести в несколько раз, т.е. разбавить один объем композиции несколькими объемами воды. Указанная задача решается благодаря тому, что биоактивный продукт, полученный из торфа, используемый для нес 26742 пецифической иммуностимуляции, представляющий собой смесь активных торфяных ингредиентов и неорганических солей, полученную способом, предусматривающим первичный щелочной гидролиз сырьевого торфяного материала, подкисление гидролизата, отделение нерастворимой части с последующим вторичным подщелачиванием, а затем подкислением чистой жидкой фазы, удаление балластных веществ с использованием экстракции органическим растворителем, и последующую обработку оставшейся жидкой фазы, содержащей неорганические соли и извлеченные из торфа биоактивные ингредиенты, согласно изобретению содержит не более 70 вес.% неорганических солей, особенно хлорида натрия, из расчета по сухому веществу, причем это содержание солей обеспечено посредством разбавления указанной жидкой фазы деминерализованной водой с последующим обратным осмосом для снижения содержания солей в продукте. Продукт находится в виде водного раствора или высушенного порошка. Содержание в продукте неорганических солей не превышает 60%. Кроме того, когда продукт находится в виде 1%-ного «одного раствора, он имеет рН от 5,0 до 6,5* предпочтительно около 6. Когда продукт находится в виде концентрированного раствора, этот раствор представляет собой темно-коричневую жидкость с удельной плотностью от 1,02 до 1,09 г/мл, а содержание в нем сухих веществ составляет не менее 5 вес.%. Указанная задача решается также и тем, что способ получения биоактивного продукта из торфа, предусматривающий первичный щелочной гидролиз сырьевого торфяного продукта, последующее подкисление гидролизата, отделение нерастворимых твердых частей с последующим вторичным подщелачивэчием, а затем подкислением чистой жидкой фазы, удаление инертных веществ с использованием экстракции органическим растворителем, и последующую обработку оставшейся жидкой фазы, содержащей неорганические соли и извлеченные из торфа биоактивные ингредиенты, согласно изобретению предусматривает следующие дополнительные стадии, стадию разбавления, в которой упомянутый раствор разбавляют деминерализованной водой; стадию последующего обессоливания, в которой разбавленный раствор подвергают обратному осмосу для обессоливания раствора, причем неорганические соли удаляют до 5 Ю 15 20 25 30 35 40 45 50 55 10 концентрации не более 70 вес %, из расчета по сухому веществу; стадию концентрирования и очистки. Разбавление деминерализованной водой проводят при соотношении от 1:5 до 1*8, а разбавленный раствор обессоливают до предпочтительного содержания неорганических солей не более 60 вес.% из расчета по сухому веществу. Кроме того, способ дополнительно содержит стадии стерилизации и/или сушки, где концентрированный и очищенный раствор стерилизуют и/или подвергают распылительной сушке. После экстракции органическим растворителем, остаточные количества растворителя удаляют из водной фазы, которую для этого пропускают через спеченный керамический фильтр под действием пониженного давления, получая чистый фильтрат упомянутой жидкой фазы, содержащей неорганические соли и биоактивные ингредиенты. Стерилизацию проводят посредством мембранного фильтра. Кроме того, раствор подвергают распылительной сушке при температуре на входе около 180'С и на выходе около. 90*С. Указанная задача решается также благодаря тому, что в способе получения фармацевтической композиции, способной индуцировать цитокины и полезной для улуч-шейного терапевтического лечения наружных ран или варикозных язв, особенно варикозных язв нижних частей ног, предусматривающий соединение индуцирующего цитокины биоактивного материала с травяным экстрактом или травяными экстрактами, гелеобразующим агентом, и другими ингредиентами, согласно изобретению, стерильный водный раствор биоактивного продукта, полученного из торфа, содержащий не более 70% неорганических солей, особенно хлорида натрия, из расчета по сухому веществу, соединяют со стерильным спиртовым травяным экстрактом, после чего жидкую смесь переводят в гелеобразную форму путем добавления гелеобразующего агента. В качестве гелеобразующего агента добавляют, предпочтительно коллоидный кремнезем, причем весовое соотношение жидкой смеси к гелеобразующему агенту составляет 90-94:10-6. Для получения фармацевтической композиции в виде мази добавляют гелеобразующий агент, предпочтительно коллоидный кремнезем, причем весовое соотношение жидкой смеси к гелеобразующему 11 26742 агенту составляет около 30:2, и полученный таким образом гель растирают с предварительно стерилизованной основой мази, содержащей смесь жировых компонентов, таких как эуцирин и вазелин, в весовом соотношении гель к жидкому компоненту 32-34:68:66. Травяной экстракт выбирают из группы, состоящей из экстракта конского каштана, экстракта календулы, экстракта ромашки, экстракта ноготков, экстракта листа шалфея, экстракта мыльнянки лекарственной, экстракта хвоща, экстракта листьев жгучей крапивы, экстракта зародышей пшеницы, экстракта алоэ, экстракта тимьяна, травяного экстракта Фуллера. Глицерин и/или стерильный раствор ароматизирующего соединения, предпочтительно отобранный из группы, состоящей из ментола, тимола, мяты, лимона и эквалипта добавляют к жидкой смеси. Биоактивный продукт, полученный из торфа, представляет собой экстракт торфа в виде концентрированного водного раствора или высушенного порошка, который предпочтительно содержит не более 60 вес.% неорганических солей по сухому веществу. . Указанная задача решается также благодаря тому, что в композиции, способной вызвать неспецифичную иммуностимуляцию, содержащей фармацевтически активный ингредиент и физиологически приемлемый носитель, наполнитель и/или добавку, согласно изобретению активным ингредиентом является биоактивный продукт из торфа, содержащий не более 70 вес.% неорганических солей, особенно хлорида натрия, из расчета по сухому веществу, причем биоактивный продукт способен индуцировать цитокины и присутствует в композиции в количестве 0,0110 вес.%, что соответствует количеству 90-99,99 вес.% носителей, наполнителей и/или добавок. В качестве носителя композиция содержит смесь лактозы и смазывающих веществ, а весовое соотношение активного ингредиента к носителю составляет 1:9-1:19. Композиция выполнена в виде таблеток или капсул. Кроме того, композиция содержит носители и/или другие добавки, обычные для косметических препаратов, а упомянутый биоактивный продукт из торфа присутствует в композиции в количестве 0,01 1 вес.%, в частности 0,05-0,1 вес.%, причем композиция предназначена для ухода за телом, а именно для кожи, волос или зубов. 5 10 15 20 25 30 35 40 45 50 55 12 Указанный биоактивный продукт из торфа композиция содержит в концентрации 0,05-1 вес.%, а носители и/или добавки выбраны из группы, состоящей из водных растворов спиртов, всех типов эмульсий, гелей, пенящихся композиций и жировых носителей. Композиция дополнительно содержит, по меньшей мере, один травяной экстракт и/или, по меньшей мере, одно ароматизирующее вещество. Кроме того, композиция включает стерильный спиртовой травяной экстракт и стерильный раствор ароматизирующего соединения, а носитель содержит гелеобразующий агент, причем весовое соотношение жидкой смеси к гелеобразующему агенту составляет от 90:94 до 94:6. Соответственно, настоящее изобретение разрабатывает способ, с помощью которого возможно получение выделенного из торфа биоактивного продукта, отличающегося вышеуказанными преимущественными характеристиками. Из высококонцентрированного водного раствора неорганической соли - главным образом хлорида натрия, содержащего полученные из торфа биоактивные ингредиенты с помощью разбавления упомянутого раствора деминерализованной водой, т.е. дистиллированной водой, с последующим обратным осмосом, концентрированием и очисткой. Полученный таким образом раствор может быть легко превращен в стерильный и твердый продукт, подходящий для необходимых целей, посредством стерилизации и распылительной сушки. Разбавление количествами воды предпочтительно осуществляют в несколько раз, предпочтительно от 5 до В раз, от количества концентрированного раствора, который необходимо развести. Данный способ, применяемый для обработки продукта, полученного в соответствии с описанием изобретения к патенту Польши № 124110, заключается в удалении остаточных органических растворителей из постэкстракционной водной фазы, сепарировании нерастворимых частей с помощью фильтрации при пониженном давлении через спекшийся керамический материал, разбавлении растворенного вещества в несколько раз объемом дистиллированной воды и обработке его посредством обессоливания с помощью обратного осмоса для отделения избыточных минеральных солей, в основном хлорида натрия, в виде пермеата. Затем обессоленный раствор концентрируют, очищают с помощью центрифугирования 13 26742 14 и стерилизуют фильтрацией через мембго известного продукта как по химическоранный фильтр, например, фильтр "милму составу, так и по более широкому липор" диапазону противораковой активности. Полученный микробиологический чисПример получения продукта по патентый раствор в необязательном порядке 5 ту Польши № 124110. может быть подвергнут распылительной Один килограмм воздушно-сухого торсушке. Из стерильного продукта, жидкого фа измельчают и экстрагируют с примеили твердого, может быть составлена коснением 8 л 0,1-8,0%-ного водного растметическая, фармацевтическая или ветевора NaOH в течение 36 часов при комринарная композиция. 10 натной температуре и при постоянном пеНеобязательно, концентрированный и ремешивании. Затем щелочной экстракт очищенный раствор может быть испольцентрифугируют для отделения твердых зован: без стерилизации и распылитель, частей, после чего его подкисляют соляной сушки; в любом подходящем разбавной кислотой до значения рН примерно 2 лении в качестве компонента во многих 15 и оставляют на 12 часов. Образующийся косметических композициях. при этом осадок отделяют, а прозрачный раствор обрабатывают гидроксидом натрия до достижения значения рН 9, после Предпочтительно, на стадии распыличего снова фильтруют. Далее фильтрат тельной сушки температуру на входе устанавливают около 180'С, а температуру 20 опять подкисляют соляной кислотой и конна выходе - около 90°С. центрируют при пониженном давлении до В соответствии с патентом Польши № достижения 1/5 от первоначального объе124110 подкисленный гидролизат, полума. Концентрированный раствор нейтрачаемый из торфа, характеризующийся солизуют гидроксидом натрия и выпаривают держанием зольных веществ в количестве 25 досуха. Проводят экстракцию сухой мас8-30%, степенью распада до 30-70% и сы водным этанолом. Экстракт отделяют значением рН, равным 3,5-7,0, подверот жирового остатка и неорганических согают вторичному гидролизу в водном растлей. Затем экстракт концентрируют до то-, воре щелочных веществ при значениях го момента, когда соли начинают выпарН от 9,0 до 14,0 и температуры 16-60*С. 30 дать в осадок. Осадок отделяют, а полуПосле отделения осадка фильтрат сноченный таким образом фильтрат экстрава подкисляют до значения рН, равного гируют смесью в пропорции 1:1 этанола 3,0-1,0, после чего его концентрируют, и эфира, хлороформа, бензола или этинейтрализуют и снова концентрируют долацетата. Выпавший во второй раз осадок суха. Полученную таким образом сухую 35 неорганических солей вновь отфильтромассу экстрагируют затем 40-80% водвывают, а водный фильтрат концентриным этанолом при температуре 30-60'С. руют до половинного объема относительПосле отделения от экстракта балластно его исходного значения, центрифугиных веществ его концентрируют до полуруют и фильтруют, Прозрачный фильтрат чения половинного объема от исходного 40 подвергают хроматографии на колонке с значения. Остаток экстрагируют этанолом, Биогелем Р-2 минус 400 меш (сырой) с смешанным с другим органическим растиспользованием в качестве элюента воды ворителем, таким как эфир, хлороформ, или 10% водного этанола, а фракции, оббензол, этилацетат, в соотношении от 1:1 ладающие антираковой активностью, содо 1:3. Затем водный слой концентрируют 45 бирают. до половины от исходного объема, центПолученный препарат представляет сорифугируют и разделяют на колонках с бой гигроскопичное, аморфное вещество целлюлозой, или биогелем, используя в коричневатого цвета, содержащее примеркачестве разделяющей системы воду или но 10% воды. Оно водорастворимо и не5-10%-ный водный этанол, метанол или 50 растворимо в органических растворитеацетон. лях. После проведения кислотного гидролиза оно дает положительную реакцию Селективное удаление избытка солей при взаимодействии с группой реагентов, или кислот проводят с помощью ионообприменяемых для определения наличия саменной техники. 55 харов - глюкозы, галактозы, арабинозы, Полученный в соответствии с указанглюкуроновой кислоты, рамнозы, ксилоным патентом продукт содержит, помимо зы, б-дезоксиглюкози и 2-де-зоксиглюкополисахаридов, определенные минеральзы. ИК-слектр типичен для полисахариные соли дов. После прокаливания при 700°С полуКонечный продукт, полученный таким чают золы, составляющие до 6-10% от способом, отличается от соответствующе 15 26742 исходной массы и содержащие окислы металлов, среди которых найдены такие, -как окислы Mo, Cd, Co, N, Mn, Мд, С, V, а также неметаллические окислы, среди которых следует отметить окислы Si и Р. Хотя способ по изобретению описывается в комбинации со способом согласно описанию изобретения к патенту Польши № 124110, его использование не ограничено такой комбинацией, но обычно применимо а контексте способа получения выделенного из торфа биоактивного продукта из высококонцентрированного жидкого раствора неорганических солей, главным образом хлорида натрия, содержащего выделенные из торфа биоактивные ингредиенты. Полученные из торфа биоактивные продукты, о которых идет речь в данном изобретении, не содержат более 70 вес.%, предпочтительно не более 60 вес.%, неорганических солей, главным образом хлорида натрия. Так как в оптимальном продукте является желательной концентрация хлорида натрия как можно более низкая, главным образом для фармацевтического применения и такого косметического применения, где необходимы более высокие концентрации, т.е. для ухода за лицом, то наиболее предпочтительными являются более низкие концентрации хлорида натрия, такие как 55% и даже ниже, особенно при возможности получения посредством стадий разбавления и обратного осмоса. Если способ ограничивается стадиями концентрирования и очистки, то продукт является концентрированным или сгущенным раствором. "Концентрированный торфяной экстракт", на который ссылаются в этом описании изобретения, является темно-коричневой жидкостью с плотностью 1,02-1,09 г/мл и содержит не менее 5 зес.% сухих твердых веществ. Содержание иона хлорида в сухих твердых веществах, рассчитанное как NaCI, составляет не выше 70%, предпочтительно не выше 60%, и значение рН 1% водного раствора равно 5,0-6,5, обычно 6,0. Отсутствие следующей стадии стерилизации а некоторых случаях не наносит вреда, например, для определенного косметического использования упомянутого концентрированного торфяного экстракта. 5 10 15 20 25 30 35 40 45 50 С другой стороны, стадия стерилизации может быть обязательной, в частнос- 55 ти, асли продукт предназначается для приготовления фармацевтических композиций. В этом случае особенно предпочтительной является дополнительная стадия распылительной сушки, если не обязатель 16 ной. Продукт, полученный после такой стадии распылительной сушки, находится в форме порошка и поэтому особенно годится для приготовления некоторых фармацевтических композиций. Наиболее предпочтительным продуктом такого типа является продукт, выпускаемый под названием "ToLPA®. Torf Preparation" ToLPA® является зарегистрированной торговой маркой Torf Corporation, Mydlana 2, Wroclaw, Poland. В этом описании к изобретению будет использоваться аббревиатура ТТР для обозначения вышеупомянутого продукта. Настоящее изобретение также относится к фармацевтическим композициям, содержащим в качестве активного ингредиента полученный из торфа биоактивный продукт, описанный выше, в частности продукт, содержащий не более 70 вес.%, предпочтительно не более 60 вес.%, неорганических солей, главным образом хлорида натрия, по сухим твердым веществам, вместе с фармацевтически приемлемым носителем. Полученный из торфа биоактивный продукт, содержащийся в таких фармацевтических композициях, предпочтительно является ТТР, указанным выше. Фармацевтические препараты содержат полученный из торфа биоактивный продукт и фармацевтически приемлемый носитель, предпочтительно в весовом соотношении от около 1:5 до 1:25, и наиболее предпочтительно между 1:9 и 1:19. Кроме того, настоящее изобретение относится к способу приготовления фармацевтической композиции, содержащей полученный из торфа биоактивный продукт в форме геля. Этот способ отличается тем, что стерильный спиртовой травяной экстракт соединяют со стерильным глицерином, стерильным водным - предпочтительно концентрированным раствором предварительно измельченного в порошок полученного из торфа биоактивного продукта и стерильным ментоловым раствором, и полученную смесь постепенно соединяют с коллоидным кремнеземом для превращения жидкой композиции в форму геля, при этом весовое соотношение жидкой смеси к кремнезему составляет от 90:10 до 94:6. Предпочтительным является использование в качестве порошкообразного или концентрированного полученного из торфа биоактивного продукта ТТР. Настоящее изобретение также относится к способу приготовления фармацевтической композиции, содержащей полученный из торфа биоактивный продукт, 17 26742 в виде мази. Этот способ отличается тем, что стерильный травяной экстракт постепенно соединяют со стерильным раствором порошкообразного полученного из торфа биоактивного продукта, полученную смесь превращают в гель с помощью добавления коллоидного кремнезема, и полученный таким образом гель растирают в порошок с предварительно стерилизованной смесью жирных компонентов, таких как эуцерин (eucerine) и вазелин, предпочтительно с весовым соотношением жидких компонентов к кремнезему около 30:20 и геля к жирным компонентам от 32:68 до 34:66. Здесь также является предпочтительным использование в качестве порошкообразного или концентрированного полученного из тофра биоактивного продукта ТТР. Косметические препараты, которые могут включать травяные экстракты, а также другие добавочные и обогащенные компоненты, ароматизирующие компоненты и носители, приемлемые для косметических целей, содержат полученный из торфа биоактивный продукт в соответствии с настоящим изобретением в количестве 0,01-10 вес.%, предпочтительно 0,05-1,00 вес.%, и наиболее предпочтительно 0,050,10 вес.%. Носители могут быть водными растворами спиртов, всеми типами эмульсий, гелями, пенообразующими композициями и жирными носителями. Использование одного определенного носителя, выбранного из группы упомянутых выше веществ, позволяет составлять различные типы косметических препаратов в соответствии с изобретением, таких как тонизирующие средства, кремы, бальзамы, молочко для очищения кожи и т.д., для повседневного ухода за телом, а также шампуни, бальзамы для волос, пеномоющие средства для ванн, все с добавками полученных из торфа биоактивных продуктов. Выделенные из торфа биоактивные продукты (сокращенно торфяные экстракты), полученные из исходного неочищенного торфяного материала, такие как (среди других) лечебные грязи, содержат хорошо сбалансированные количества минеральных или органических соединений, таких как минеральные соли следующих элементов: В, Si, Ab, Fe, Mg, Mr», Cu, Si, Ni, Ca, Ag и Na; органические соединения, такие как аминокислоты в свободной форме и в виде солей; полисахариды, частично разложившиеся/реагирующие в случае гидролиза - до дезоксисахаридов и/или аминосахаридов. Торф, в част 5 10 15 20 25 30 35 40 45 50 55 18 ности лечебная грязь, известен и изучается как материал биологического растительного и микробиологического происхождения; благодаря содержанию в нем питательных и стимулирующих компонентов он обладает целебным воздействием на организм человека и млекопитающего; следовательно, полученные из торфа биоактивные композиции содержат вышеупомянутые вещества в пропорциях, харак-. терных для живых организмов; это можно рассматривать как объяснение полезного воздействия косметических и фармацевтических препаратов, содержащих полученные из торфа активные продукты и композиции. Особенно хороший эффект при применении новых косметических композиций наблюдают в том случае, когда в композиции также присутствуют травяные экстракты. Выбор подходящего травяного экстракта основан на известном обычном использовании таких экстрактов в косметике с изменением активности препаратов и позволяя тем самым приспособить содержание косметических препаратов к требованиям и нуждам больных. Настоящее изобретение более подробно характеризуется и объясняется ни-, жеследующими примерами. П р и м е р 1. Исходя из 1000 кг воздушно-сухого неочищенного торфяного материала, обработанного затем, например, по технологии согласно польскому патенту № 124110, получают раствор выделенных из торфа биоактивных ингредиентов в насыщенном водном растворе хлорида натрия в количестве около 10 л. Раствор фильтруют через спеченный керамический материал при пониженном давлении для того, чтобы очистить его перед обессоливанием. Полученный таким образом чистый раствор содержит около 95% NaCl сухой массы. Сухая масса составляет около 32 вес.% раствора. Объем чистого раствора равен приблизительно 7 л. Чистый раствор разбавляют в 5-6 раз дистиллированной водой, и в разведенной форме подвергают обессоливанию, которое проводят, используя метод обратного осмоса и пользуясь прибором DDS. Обессоливание осуществляют в течение 3-4 часов, посредством чего избыток минеральных солей - в основном NaCl отделяют в виде пермеата. Обессоленная композиция содержит примерно 65-70% хлорида натрия в твердом виде. Полученный таким образом раствор объемом 67 л концентрируют в 4-5 раз в роторном испарителе Bucchi до получения концент 19 26742 рированного раствора, содержащего примерно 20% сухих веществ. Полученный в результате концентрированный раствор очищают, используя центрифугу BiotugaHerabus {сепаратор потоков), и затем стерилизуют фильтрацией через фильтр 5Miliipore®. Полученный микробиологически чистый раствор высушивают распылительной сушкой в сушилке Anhydro при темпера- 10 туре на выходе 90"С и температуре, устанавливаемой на входе, 180'С. Выход сухого порошка равен примерно 200 г. П р и м е р 2. Продукт, полученный в примере 1, используют для приготовле- 15 ния фармацевтических композиций в виде геля и мази, содержащих также травяные экстракты, которые синергетически усиливают эффект лечения некоторых заболеваний. Например, гель и мазь от варикоз- 20 ной язвы ног получают следующим образом: 20 г экстракта каштана конского (hippocastanaceous), 10 г экстракта календулы, 60 г глицерина, 0,01 г ТТР в виде порошка, полученного как описано выше з 25 примере 1, 0,1 г салициловой кислоты, 1,0 г дистиллированной воды и 8,8 г Aerosil® коллоидного кремнезема используют для получения препарата в виде геля. Жидкие (нелетучие) ингредиенты сте- 30 рилизуют перед использованием с помощью нагревания с обратным холодильником в течение двух часов. Травяные экстракты соединяют с глицерином и водным раствором ТТР, а также с ментолом, и к получен- 35 ной смеси постепенно добавляют кремнезем при постоянном перемешивании. Подобным образом, для получения композиции в форме мази используют следующие ингредиенты: 20 г экстракта каш- 40 тана конского (hippocastanaceous), 10 г экстракта календулы, 0,1 г салициловой кислоты, 0,1 ТТР в виде порошка, полученного как описано выше в примере 1, и 2,0 г Aerosil® (коллоидного кремнезема). 45 В качестве жирных компонентов используют смесь следующих веществ: 22 г эуцерина (eucerine) и 45,8 г вазелина. Травяные экстракты стерилизуют при помощи нагревания с обратным холодиль- 50 ником в течение примерно 2 часов. Жидкие ингредиенты осторожно соединяют с кремнеземом для получения геля, который, в свою очередь, растирают со стерильными жидкими компонентами, охлаж- 55 денными до комнатной температуры. Получают стабильную мазь, которая не разделяется при хранении. Гель и мазь, полученные как указано выше, одновременно применяют для ле 20 чения варикозной язвы ног. Язвы обрабатывают гелевым препаратом, тогда как непораженную кожу вокруг них обрабатывают мазью. Полагают, что добавка коллоидного кремнезема способствует быстрому подсушиванию, в то время как травяные и выделенные из торфа ингредиенты являются ответственными за лечебный эффект препарата. Жирные компоненты помогают сохранять эластичность корки на ране (струпа) и кожи. Полученные результаты сравнивают с результатами, полученными на контрольной группе пациентов, которых лечат новым методом, выбирали из группы пациентов, страдающих заболеванием в течение многих месяцев (иногда лет) без заметного улучшения. Пациенты, подвергшиеся лечению композициями в соответствии с изобретением. показывают лучшие результаты уже в течение первых нескольких недель по сравнению с контрольной группой пациентов. П р и м е р 3. Продукты, полученные в примере 1, используют для приготовления фармацевтических композиций в виде таблеток или гранул, которые помещают в капсулы. Стерильную полученную из торфа биоактивную композицию в виде порошка соединяют с носителем в весовом соотношении 1:9. В качестве носителя используют MYVATEX® (торговое название продукта фирмы Истмен-Кодак), смесь лактозы и смазывающих веществ в весовом соотношении 44:1. Лактозу с размерами частиц 50 меш и MYVATEX® TL мелко измельчают таким образом, что примерно 70% от их веса проходит через сито 100 меш. Из части полученной смеси активной композиции и носителя образуют таблетки, содержащие 5 мг активных ингредиентов. Общая масса каждой таблетки составляет 50 мг. Другую часть этой смеси активной композиции и носителя гранулируют, используя d.s. этанола (40 об.%). Гранулы просеивают сквозь сито и, если это необходимо, размалывают, и затем помещают в капсулы в таком количестве, чтобы каждая капсула содержала 5 мг активных ингредиентов посредством использования ТТР в смеси с носителем в соотношении 1:19. Таблетки, полученные как указано выше, испытывают с целью измерения времени их дезинтеграции в искусственном желудочном соке при температуре 37±2'С, используя оборудование ErweKa. Искусственный желудочный сок готовят следующим образом: 2,0 г хлорида натрия, 3,2 г пепсина растворяют в 7 мл соляной кис 26742 22 собой чистые (прозрачные) жидкости без каких-либо твердых веществ. Они имеют желтый цвет. Значение рН равно 4,28, и содержание этанола - 45,92 об.%. Общая кислотность, которую считают по содержанию салициловой кислоты, составляет не менее 0,1 вес.%, а именно 0,23 вес.%. При хранении в течение" 12 месяцев препарат не изменил ни одной из своих вышеуказанных характеристик. П р и м е р 5. Повторяют процедуру, описанную выше в примере 4, с тем только отличием, что вместо экстракта ромашки и ароматизирующей композиции TOLIANA H4308 используют экстракт цветков ноготков и композицию FINUS H4625 (также продукт Fabryka Syntetykow Zapachowych Pollena-Aroma) таким же образом и в таких же молярных и объемных соотношениях. Полученный тонизирующий препарат подходит для сухой и нежной кожи. Он также является чистой жидкостью без каких-либо твердых частиц. Значение рН составляет 4,30, общее содержание этанола 45,82 об.% и общая кислотность 0,27 об.%. При хранении в течение 12 месяцев препарат не изменяет своих свойств, так же как препарат, полученный согласно примеру 4. П р и м е р 6. Повторяют процедуру из примера 4, за исключением того, что вместо экстракта ромашки выбирают экстракт листьев шалфея, а вместо TILIANA Н430В выбирают ароматизирующую композицию LELIA 90368 (Pollena-Aroraa, Warsaw). Экстракт листьев шалфея получают экстракцией сухих листьев шалфея этанолом при 50*С, и он имеет коричневый цвет, характерный запах шалфея и плотность 0,9160-0,9503, он содержит 5256% этанола. Полученный агент для ухода за кожей особенно подходит для жирной кожи. Он является чистой и гомогенной жидкостью, имеющей темно-желтый цвет, значение рН, содержание этанола и кислотность являются аналогичными значениями агента для ухода за кожей согласно примеру 4. Использованный концентрированный П р и м е р 7. Следующая композиторфяной экстракт является темно-коричневой жидкостью с плотностью 1,020- 50 ция является особенно эффективным гелем для предотвращения или лечения па1,090 г/мл, и содержание сухих твердых родонтоза, г: веществ составляет не менее 5%, значение рН 1%-ного водного раствора равно Экстракт ромашки , 34,0 5,0-6,5. Экстракт ромашки является красЭкстракт листьев шалфея 3,0 но-коричневой жидкостью с плотностью 55 Салициловая кислота 0,3 0,9160-0,9503 г/мл и содержанием этаМентол , 0,2 нола 52-56 об.%. ТТР 0,1 Общая масса промышТонизирующие препараты, полученные ленного геля в качестве как описано выше, являются пригодными основы 100,0 для всех типов кожи. Они представляют лоты и доводят дистиллированной водой до общего объема 1000 мл. Значение рН полученного раствора составляет примерно 1,2. Время дезинтеграции таблетки, имеющей диаметр 5,1 мм и общую массу 5 0,0498 г, составляет 6 минут. Следующие примеры относятся к многочисленным косметическим препаратам согласно настоящему изобретению, имеющим различные композиционные формы 10 и созданным для различного применения, содержащим целебные добавки биоактивных ингредиентов, полученных из торфа. Среди других описаны такие препараты, как тонизирующие средства, бальзамы, 15 кремы, молочко, шампуни, пеномоющие средства для ванн и др. П р и м е р 4. В реакционный сосуд, оборудованный мешалкой, помещают 150 г экстракта ромашки, полученного экст- 20 ракцией соцветия ромашки раствором этанол:вода 1:1, а также 1 г ТТР, как описано выше. К полученной смеси добавляют 50 г глицерина. Три вещества перемешивают для получения однородной смеси. Затем в 25 этот же сосуд вливают вторую предварительно приготовленную смесь. Она включает 340 г раствора этанол:вода 95:5, 1 г салициловой кислоты и 0,5 г ментола. Две смеси перемешивают для образования од- 30 нородного раствора. После этого добав- ляют 3 г ароматизирующей композиции TIL1ANA H4308. TiLIANA H4308 является продуктом Fabryka Syntetykow Zapachowych Poilena-Aroma (фабрика синтетических аро- 35 матизирующих веществ Pollena-Arema, Варшава, Польша). Раствор затем доводят до общего объема 1000 мл, добавляя 454,5 г дистиллированной воды, перемешивание продолжают до тех пор, пока не образует- 40 ся гомогенная смесь. В вышеуказанной методике используют 86%-ный глицерин, ментол и воду в соответствии с требованиями польской Pharmacopea FPIV и этанол в концентрации 95% в соответствии с 45 польскими промышленными стандартами BN-75/6193-01. 23 26742 П р и м е р 8. В реакционный сосуд объемом 2000 мл, оснащенный механической мешалкой, вносят тщательно взвешенные компоненты: 270 г экстракта ромашки, полученного экстракцией цветков ромашки 50%-ным этанолом; экстракт является красно-коричневой жидкостью, имеющей плотность 0,9160-0,9503 г/мл, и содержание этанола составляет примерно 55 об.%.; 50 г глицерина, 86%, согласно требованиям Polish Pharmacopea FPIV; 30 г экстракта мыльнянки лекарственной, полученной экстракцией корней мыльнянки лекарственной 70%-ным этанолом, экстракт является красно-коричневой жидкостью, плотность составляет 0,9630-0,9810 г/мл, а содержание этанола - примерно 75 об.%; 1,0 г изобретенного концентрированного торфяного экстракта, который является темно-коричневой жидкостью с плотностью 1,02-1,09 г/мл, содержит не более 2% ионов хлорида, которые рассчитывают по хлориду натрия, содержание сухих твердых веществ составляет не менее 5%, значение рН 1%-ного водного раствора экстракта равно 6,0. Названные выше ингредиенты тщательно смешмвают. Туда же добавляют предварительно приготовленный раствор 1 г салициловой кислоты в 260 г 95%-ного этанола, 1 смешанному раствору добавС ляют 383 г дистиллированной воды и 5 г ароматизирующей композиции TILIANA Н4308 и перемешивают до получения однородного раствора. Препарат подвергают анализу и хранят в бутылках для розничной торговли объемом 200 мл. Полученный препарат является пригодным для ухода за волосами. Он является прозрачной, слегка опалесцирующей жидкостью, содержащей примерно 45 об.% этанола; значение рН равно 4,5; общая кислотность, которую рассчитывают по салициловой кислоте, составляет не менее 0,1 вес.%. Препарат пригоден для светлых волос. Качество препарата на протяжении 12 месяцев хранения остается неизменным. П р и м е р 9. Повторяют процедуру, описанную в примере 8, за исключением того, что вместо экстракта ромашки и композиции TILIANA H4308 используют в такой же последовательности соотношении: травяной экстракт хвоща и ароматизирующую композицию PINUS H4625. Травяной экстракт хвоща является зелено-коричневой жидкостью с плотностью 5 10 15 20 25 30 35 40 45 50 55 24 0,9160-0,9503 г/мл и содержанием этанола 55 об.%. Полученный препарат пригоден для всех типов волос. Он является чистой и прозрачной жидкостью без каких-либо твердых частей желто-коричневого цвета, значение рН, содержание этанола, общая кислотность, а также стабильность после хранения в течение 12 месяцев остаются неизменными и имеют такие же величины, как у препарата, описанного в примере 6. П р и м е р 10. Процедуру, описанную в примере 8, повторяют с аналогичными результатами. Единственным отличием является то, что вместо экстракта ромашки и композиции TILIANA H4308 используют экстракт листьев жгучей крапивы и ароматизирующую композицию, LELTA 90368 (продукт этой же Fabryka Syntetykow Zapachowych Pollena-Aroma) в такой же последовательности и в том же соотношении. Используемый травяной экстракт имеет оливково-зеленый цвет, плотность 0,9160-0,9503 г/мл и содержание этанола примерно 55 об.%. Препарат подходит для всех типов волос. П р и м е р 11. Обычно косметическое-молочко является дисперсией жирных веществ, воздействующих как химически, так и механически на кожу. Фактически, благодаря удобному способу применения и лучшему взаимодействию жидкости и кожи целесообразно использовать жидкость, в частности эмульсионные кремы. Они легко проникают в глубокие слои кожи и таким образом предотвращают изменения кожи в связи с возрастом. Косметическое молочко в основном используют для очищения сухой и нежной кожи. Соответственно, оно не должно содержать агрессивных летучих масел, и в то же время оно часто содержит подходящие травяные экстракты, такие как экстракт ромашки или экстракт зародышей пшеницы. Добавление полученных из торфа биоактивных продуктов в такое косметическое молочко еще более уксиливают его положительный эффект. В частности, состав нового средства является следующим, г: ТТР • 0,05 Экстракт алоэ 20,00 Глицерин • 3,00 Эуцерин 2,00 Белое парафиновое масло 1,00 Триэтиламин 1,00 Aerosil® (коллоидный кремнезем) 4,00 25 26742 П р и м е р 12 Улучшенные результаты по восстановлению наблюдают при использовании ТТР, и тщательно отобранных жирных носителей в составе классических питательных и восстанавливающих кремов ТТР используют в количестве 0,011,00 вес % в комбинации с травяным экстрактом (выбор зависит от типа кожи, для которой предназначается крем) в количестве по крайней мере 0,05-1,00 вес.%, антибактериальным препаратом в количестве 0,05-1,00 вес %, синтетической ароматизирующей композицией в количестве 0,01 -0,05 вес % и жирным носителем в виде водной эмульсии, составляющей 97,00-99,50 вес % всей композиции Необходимо, чтобы жирная композиция была хорошим носителем для активных ингредиентов и чтобы она являлась приемлемой для кожи. Предпочтительно, она является эмульсией (все количества даны в вес.%) 35-45 эуцерина, 8-14 вазелина, 2,5-4 оливкового масла, 6-10 глицерина и 35-40 воды. Предпочтительными травяными экстрактами являются экстракт цветков ноготков, экстракт ромашки, экстракт тимьяна и т.п. Предпочтительными рецептами являются следующие, вес.ч.: 1 рецепт Эуцерин 39,00 Вазелин 11,50 Оливковое масло 3,13 Глицерин 7,80 Вода 38,00 NIPAGINA (антибактериальный препарат) 0,40 ТТР 0,05 Экстракт ноготков 0,10 Синтетическое ароматизирующее вещество 0,02 Всего • 100,00 2 рецепт Эуцерин 42,00 Вазелин 8,50 Оливковое масло 3,08 Глицерин 7,90 Вода 38,00 NIPAGINA (антибактериальный препарат) 0,40 ТТР 0,05 Экстракт ромашки 0,02 Синтетическое ароматизирующее вещество 0,05 Всего 100,00 П р и м е р 13 Препарат для применения после бритья содержит ТТР в качестве торфяного экстракта в количестве 0,01-1 вес.%, травяные экстракты в количестве 1-30 вес.%, глицерин в коли 5 10 15 20 25 30 35 40 45 50 55 26 честве 1-8 вес %, салициловую кислоту и ментол в водно-спиртовом растворе Предпочтительными травяными экстрактами являются экстракты ромашки, ноготков, тимьяна, алоэ и аналогичные экстракты лекарственных растений Добавка глицерина также является полезной в связи с его воздействием на эластичность кожи Он ускоряет нанесение препарата на лицо, а также его проникновение в более глубокие слои кожи, усиливая таким образом целебный эффект активных торфяной композиции и травяных экстрактов Предпочтительным рецептом является следующий, вес.ч.. ТТР 0,10 Экстракт ромашки 15,00 Глицерин 5,00 Ментол 0,10 Салициловая кислота 0,10 Этанол (конц. 95%) 10,00 Ароматизирующая композиция 0,30 Дистиллирования вода, добавление до 100,00 П р и м е р 14. Композицию шампуня готовят в соответствии со следующим рецептом, г (вес.%) Травяной экстракт ' Фуллера 15,0 (7,5) Экстракт листьев жгучей крапивы 20,0 (10,0) GAMAL SBS-11 (детергент) 30,0 (15,0) GAMAL NO-3 (детергент) 20,0 (10,0) Aseptina (асептина) 0,4 (0,2) Этанол 1,6 (0,8) BRONOPOL (консервант) 0,04 (0,02) Хлорид натрия 6,0 (3,0) Вода 106,96(53,48) Всего 200,0 (100,0) К 92 весовым частям вышеуказанной композиции шампуня добавляют 8 весовых частей ТТР для получения 100 весовых частей шампуня согласно изобретению Вместо экстракта листьев жгучей крапивы могут быть использованы другие травяные экстракты. П р и м е р 15. Готовят следующую композицию шампуня, г: Экстракт конского каштана 13,00 Экстракт ноготков 22,00 GAMAL SBS-11 30,00 GAMAL NO-3 20,00 Aseptina (асептина) 0,40 Этанол 1.60 BPONOPOL 0,04 27 26742 Хлорид натрия 6,00 Вода . 106,96 Всего: 200,00 П р и м е р 16. Зубная паста содержит ТТР в качестве концентрированного торфяного экстракта в количестве 0,010,10 вес.%, эфирные масла или их композиции или другие фруктовые эссенции в количестве 1-10 вес.%, глицерин в количестве 5-10 вес.%, травяные экстракты в количестве 0,10-10 вес.% и чистящие вещества в количестве 20-35 вес.%, красители и отбеливающие вещества в количестве 1-2 вес.%. Двуокись титана может быть использована в качестве отбеливающего компонента; ТТР сам по себе может служить антибактериальной добавкой; экстракты листьев шалфея, ромашки или цветков ноготков используют в качестве полезных предпочтительных травяных экстрактов. Предпочтительным рецептом является следующий, г: Осажденный карбонат кальция ' 150,00 Карбонат магния 60,00 Глицерин 70,00 Травяной экстракт 5,00 ТТР 0,50 Двуокись титана 10,00 Эфирные масла (или мятная, лимонная и т.п. эссенция) 5,00 Вода 400,00 Краситель Следовые количества П р и м е р 17. Приготовление соли для ванн. В способе получения выделенного из торфа биоактивного продукта согласно настоящему изобретению, в частности при превращении жидкой формы в порошок, присутствует стадия обессоливания, на которой хлорид натрия отделяют как побочный продукт. В вышеупомянутом побочном продукте 95% составляет хлорид натрия; другими минеральными солями, которые отделяют, являются соли кальция, соли магния, в основном хлориды и сульфаты; эти солевые продукты также содержат некоторые органические полученные из торфа низкомолекулярные соединения, откклюдированные внутри кристаллической структуры этих неорганических солей. Эти органические соединения являются компонентами ТТР и являются - среди других - полисахаридами, аминокислотами, фульвокислотами (fulvic acids) и т.п. Наличие этих компонентов в солевых по 5 10 15 20 25 30 35 40 45 50 55 28 бочных продуктах является полезным при использовании соли в качестве соли для ванн, так как они могут давать дополнительный полезный эффект к стандартной активности соли для ванн. Этот побочный продукт тестируют соответствующим образом по его химическим и физическим свойствам в Бальнеологическом Институте в Познани, в Польше, для выяснения возможности использования его в косметических ваннах. Так как этими исследованиями не было обнаружено никаких нежелательных свойств этого продукта, то было разрешено использовать его для косметических целей. Предпочтительным является следующий рецепт, г: Соль (Nad), содержащая окклюдированный ТТР 97,00 Хвойное эфирное масло или композиция эфирных масел 3,00 П р и м е р 18. Новый бальзам для волос содержит ТТР в количестве 0,01-1 вес.%, травяной экстракт в количестве 0,01-10 вес.%, антиэлектростатические компоненты в количестве 3-4 вес.%, компоненты, предотвращающие чрезмерное высушивание волос и кожи в количестве до 2вес.%, глицерин в количестве 1-5 вес.%, консервант и стабилизаторы в количестве 0,05-0,50 вес.% и воду - до общих 100 вес.%. В качестве антиэлектростатического компонента данный бальзам содержит спиртовой раствор триметиламина и соль хлорид аммония, полученную из жирных аминов животного происхождения; в качестве загустителя, играющего роль также и стабилизирующего агента, - косметический спирт; в качестве агента, предотвращающего чрезмерное высушивание волос и кожи - растительные масла, которые одновременно являются коэмульгирующим агентом; и глицерин - для облегчения нанесения и впитывания бальзама, особенно его активных ингредиентов, т.е. ТТР и травяных экстрактов. Так как кислая среда препятствует размножению бактерий, то бальзам в соответствии с изобретением содержит лимонную или фумаровую кислоту в количестве 0,1%, а также консервант, известный под названием BRONOPOL и ароматизирующую композицию. Предпочтительным является следующий рецепт, вес.%: Спиртовой раствор триметиламина и солей хлорида аммония 3-4 29 26742 Косметические спирты 3-4 ТТР 0,01-10 Сгущенные травяные экстракты 0,01-10 Глицерин 1,5 Растительные масла До 2 Лимонная или фумаровая кислота , 0,1 BRONOPOL 0,1 Ароматизирующая композиция 0,3 Дистиллированная вода До 100 П р и м е р 19. Косметические маски являются известными косметическими препаратами, служащими для многих целей. В связи с тем, что лечебные грязи оказывают благотворное воздействие на кожу и тело, то также возможно и применение оставшегося после экстракции тофра, который получают с помощью способа сепарирования биоактивных выделенных из торфа композиций, для косметических целей. Оставшийся после экстракции торф содержит раствор активных тел, которые высвобождаются в процессе щелочного гидролиза, благодаря необычайно высокой сорбционной способности торфа после нейтрализации. Поэтому его можно использовать в качестве полезного компонента косметических масок. С целью обогащения оставшегося после экстракции торфа большим количеством ценных компонентов добавляют природные лечебные грязи и фракции гумминовой кислоты, которые присутствуют в природном торфе, а их отделяют в процессе получения выделенных из торфа биоактивных композиций из щелочного гидролизата. Эти композиции проверяют в вышеуказанном Бальнеологическом Институте и находят ее пригодной для косметического использования. 5 10 15 20 25 30 35 40 Предпочтительным является следующий состав, г: Полученный после 45 экстракции торф 100,00 Природная лечебная грязь или торф 20,00 Фракция гуминовой кислоты 10,00 50 Карбонат магния 10,00 Окись цинка 5,00 Лимонная кислота или подобная ей 0,1 Травяной экстракт 55 или растительный 5,0 Материал в виде порошка Дистиллированная вода Следующие положения и объяснения относятся к биологическому аспекту про ЗО дуктов настоящего изобретения, т е. к их биоактивным характеристикам и к совместимости этих продуктов, в частности, с точки зрения их использования в качестве фармацевтических препаратов. Далее будут использоваться следующие сокращения: ТТР TOLPA® - торфяной препарат (торговая марка Торф Корпорейшн, Вроцлав, улица Mydlana 2, Польша). IFN - интерферон, существует в виде повсеместного цитокина (гормон ткани). Гены IFN присутствуют во всех клетках. IFN в основном индуцируется протеинами или гликопротеинами. Вещества, стимулирующие гены IFN к продуцированию IFN, называются индукторами. Процесс индуцирования IFN является регулируемым с высокой точностью сложным биохимическим процессом; обнаружены негативные и позитивные регуляторные гены, контролирующие продукцию 1FN. (Небольшие количества IFN могут продуцироваться спонтанноц без какого-либо обнаруживаемого индуктора. Такие IFN иногда называют "физиологическими IFN". IFN существует в природе в трех молекулярных формах: IFN-a (или лейкоцитный), IFN-p (фибропластовый) и IFN-y (иммунный). IFN-a и IFN-p относятся к типу I-IFN, а IFN-y - к типу II-IFN. Основными биологическими действиями IFN являются антивирусная, антипролиферационная (противораковая) и иммуномодулирующая активность. В продаже имеются различные формы IFN в виде естественных и рекомбинантных препаратов, и их используют в качестве лекарства для лечения опухолевых, вирусных и некоторых других заболеваний. CTL. = цитолитический Т-лимфоцит. NK-клетки = естественные клетки-киллеры. IK-1, IL-2 - хорошо известные интерлейкины, стимулирующие пролиферацию Т-клеток и других лимфоидных клеток, включая В-клетки. RPMI 1640 - культура ткани (среда) для выращивания лейкоцитов человека и др. (аббревиатура Roswell Park Memorial Institute, Buffalo). PCS - фетальная телячья сыворотка (для анализас лейкоцитами ее необходимо предварительно проверить, так как она может содержать митогенные вещества, имитирующие действие интерлейкинов). EMCY = вирус энцефаломиокардита, вирус мыши (Mouse picorna virus), непа 31 26742 тогенныи для человека, его часто используют в качестве вируса при контрольном заражении в биологических анализах. А-549 = клеточная линия аденокарциномы человека - используют в биологических анализах IPN из-за ее высокой чувствительности к IFN а, р и у. Линия рекомендуется для такого использования экспертами WHO (Всемирная организация здравоохранения, Женева), по 1FNстандартизации. МТТ = бромид 3-[4,5-диметилтиазол2-ил]-2,5-дифенил-тетразолия. Реагент используют для измерения лизиса клеток или роста клеток в некоторых биологических анализах, при помощи сканирующего устройства ELISA (Hansen и др., Immunol, Meth, 1980, 119, 203-210). L 929 = клеточная линия мыши, используемая обычно для анализа мышиного !FN и TNF человека или мыши. TNF = фактор некроза опухолей, цитокин (относительно небольшой белок, очень чувствительный к протеолитическим ферментам), продуцируемый моноцитами и макрофагами (TNF- также известен как фактор некроза опухолей кахектин, вызывающий кахексию (истощение) у людей и животных), продуцируется после стимуляции LPS (липополисахаридами) вирусами, бактериями и многими другими агентами, очень токсичен для многих зараженных вирусами клеток и клеток новообразований; также может играть роль фактора роста для фибропластов, связан с воспалительными реакциями. Родственная форма TNF- (лимфотоксин) продуцируется Тклетками и некоторыми другими клетками. PBL = лейкоциты периферической крови, выделенной из светлого слоя кровяного сгустка (мед. - лейкоцитарная пленка) (промежуточная фаза между красными (кровяными) клетками и плазмой). Реактивность PBL отдельных доноров на различные цитокиновые индукторы производит впечатление зависимой от генетической системы доноров. Были идентифицированы высокоотвечающие респондеры и низкоотвечающие респондеры. Это также относится к чувствительности PBL на ТТР. Вариации отдельных ответов на индукторы IFN или TNF являются более очевидными при использовании слабых индукторов, и не очень сильных индукторов, таких как вирусы. Это происходит благодаря тому, что реакции на слабые индукторы является типом "все или ничего", тогда как вирусы почти всегда индуци 5 10 15 20 25 30 35 40 45 50 55 32 руют определяемые количества цитокииов. Толерантность к индуктору - называется также гипореактивным состоянием. Происходит после введения одной дозы индуктора, например, после 20 часов воздействия PBL на индуктор (например, вирус); клетки прекращают дальнейшее продуцирование IFN. Гипореактивное состояние длится обычно около 7 дней. Оно может быть полное или частичное. Такая реактивность затрудняет терапевтическое применение сильных индукторов и/или делает его неэффективным. Слабые IFNиндукторы либо не индуцируют гипореактивное состояние, либо толерантность является незначительной. Некоторые натуральные лекарства, выделенные из лекарственных растений, обладают иммуномодулирующими свойствами. ТТР производит впечатление одного из них. ТТР изменяет многие различные иммунные функции in vitro и in vivo. Он инициирует сбалансированную иммуностимуляцию посредством способности неспецифической активации всех эффекторных путей (С04-хелпера, слабо CDS-cyn-рессора, CTL, NK-клеткии активирован-, ного макрофага) без цитотоксичности для нормальных тканей. ТТР оказывает тонизирующее воздействие на заживление обычных ран. Низкие дозы ТТР слабо стимулируют продуцирование IL-1 и IL-2. Высокие дозы могут ингибировать синтез цитокина, С ТТР проводят соответствующие опыты посредством следующих методов: PBL из крови здоровых доноров очищают с помощью обработки хлоридом аммония. Культурной средой является RPM1 1640 плюс 10% FCS. Культивируют примерно 8- 106 клеток/мл в течение 20 часов при 37*С, 5% СО2. Антивирусную активность интерферона анализируют по цитопатическому эффекту ингибирования EMCY в клетках А549 человека. Также используют метод МТТ для измерения лизиса клеток. Активность TNF измеряют в клетках 1 _ 929. Для определения типа IFN отдельные образцы IFN обрабатывают различными сыворотками анти-IFN в течение 1 часа. Их антивирусную активность сравнивают с необработанными препаратами. Опыты показывают, что ТТР стимулирует продуцирование эндогенных интерферонов (IFN) и фактор некроза опухолей (TNF). Ответ является соответствующим дозе. Семь исследуемых производных упаковок (партий) ТТР имеют сопоставимую 33 26742 биологическую активность как иммуностимулирующие и цитокииовые индукторы. Наблюдают значительные отклонения в ответе на ТТР лейкоцитов каждого донора крови. PBL нескольких доноров оказалось иммунологически толерантными. Это может являться отражением генетического фона. Используют сильнодействующие поликлональные* антисыворотки, такие как анти-IFN-a (Cantell), анти-IFN-a Ly (Hamaiwa) от K.Fantes и анти-IFN-y (Cantell) для нейтрализации антивирусной активности в супернатантах PBL, обработанных в течение 20 часов ТТР. Результаты анализов нейтрализации оказываются сходными с отпечатками пальцев каждого отдельного донора крови. Другими словами, пропорции типов IFN, индуцируемых каждым индивидуумом, значительно отличаются. Разделение PBL на вязкие (adherent) и невязкие (nonadherent) фракции может усилить индуцированный цитокиновый синтез. Гипореактивность (толерантность) к индуцированию IFN посредством NDY, наблюдается в течение 20 часов после начального стимулирования PBL с помощью ТТР, является либо минимальной, либо отсутствует. Все семь упаковок партий ТТР, испытываемой в PBL человека в качестве IFN и TNF индукторов, оказались активными в отношении индукции IFN и/ /или TNF. Оптимальной концентрацией ТТР для индукции IFN является 30-100 [іг/мп и для индукции TNF ~ 100-200 цг/мл. Доза 200 ^іг/мл может быть субтоксической для pBL, однако синтез TNF происходит гораздо быстрее, чем синтез IFN, и быстрее, чем рост небольшой цитотоксичности. Из вышеизложеного можно сделать вывод о том, что активным началом фармацевтических препаратов на основе ТТР является иммуноактивчая фракция экстракта торфа, содержащая органику главным образом связанные сахара, аминокислоты, уроновые кислоты, вещества гуминовой кислоты, и минеральные соли, включая микроэлементы, ЛД50 для животных составляет > 2400 мг/кг per OS. Не было обнаружено ни мутагенной, ни генотоксической, ни эмбриотоксической, ни тератогенной или канцерогенной активности ТТР. ТТР не показывает никаких аллергенных свойств, а также не имеет никаких вызывающих местное раздражение свойств. Терапевтические показания включают хронические и рецидивные воспаления 5 10 15 20 25 30 35 40 45 50 55 34 респираторного тракта и варикозные язвы нижней части ног, добавочное лечение влагалищных эрозий и пародонтозные заболевания. Из клинических наблюдений следует, что ТТР может быть использован в качестве иммуномодулятора в поддерживающей терапии некоторых опухолевых заболеваний. ТТР принимают внутрь (таблетки 5 мг) или локально. Особенно уместным и важным является тот факт, что PBL, обработанный ТТР' в течение 20 часов при 37'С, не дает гипореактивного состояния, так как они сохраняют способность продуцировать IFN после индукции посредством NDV (Newcastle Desease Virus - Ньюкаслский болезнетворный вирус), очень сильного индуктора IFN. Прилагаемые табл. 1-23 относятся к различным биологическим, например токсикологическим, гематологическим и иммунологическим опытам. Эти таблицы являются вполне ясными и могут служить для биолога источником информации, относящейся к совместимости и биологической активности ТТР. Необходимо отметить, что концентрация активных ингредиентов в фармацевтических препаратах, как указано в пункте 12 формулы изобретения, может быть выше, чем в косметических композициях (как указано в пункте 13) в связи со следующими причинами. Фармацевтические препараты готовят в единичных дозировках, где содержание активных ингредиентов находится под строгим контролем, например, в таблетках, где концентрацию подбирают соответственно размеру таблетки, содержащей эффективную дневную дозу (или ее часть) активного ингредиента. Концентрация активного ингредиента, например, ТТР, в гранулах, которыми заполнены капсулы, предпочтительно составляет только 5 вес.% для того, чтобы получить достаточный размер таблетки и для удобства - соответствующих операций на аппарате, который делает капсулы. Другой причиной является то, что большинство фармацевтических препаратов принимают вовнутрь, и активный ингредиент распространяется по всему телу. Хотя он достигает клеток кожи в очень низких концентрациях, терапевтический эффект является значительным. Кроме того, косметические композиции - в противоположность фармацевтическим препаратам - используют в не 35 36 26742 контролируемых концентрациях, применяют локально, с различной степенью проникновения к различным клеткам. Некоторые композиции, такие как шампунь, которые почти немедленно смывают, находятся в контакте с телом или волосами в течение короткого периода времени и могут содержать соответственно больше целебного компонента; другие применяют несколько раз в день и поэто- 10 му должны иметь более низкое содержание активного ингредиента. Наконец, как в случае с зубной пастой, которая находится в контакте со слизистой оболочкой рта, где проникновение активных ингредиентов значительно облегчается, чем при контакте с кожей, концентрация активных ингредиентов может быть ниже. Т а б л и ц а 1 Острая токсичность. Влияние ТТР, принимаемого внутрь, на биохимические параметры крови кроликов Определяемые параметры Доза День ТГР, Пол исслеОбщий белок, у-глобулин, Креатини н, г/кг дования г/л г% мг% 7 0,0 Самка 2,0 1,09±0,03 1,03±0,02 1,06+0,01 1,14+0,38 0,95+0,12 0,94±0,13 65,0+3,49 62,0+0,33 58,0±1,46 57,8+1,54 70,3+3,52 60,0+2,34 0,53+0,00 0,56+0,01 0,50+0,02 0,54+0,01 0,55+0,00 0,57+0,00 0 7 0 7 0 7 0,80±0,11 0,82+0,13 0,88+0,05 1,24±0,34 0,85+0,03 1,04±0,12 73,8+3,23 75,3+1,02 64,6+2,86 64,6+2,03 58,5+3,19 57,6+4,68 0,72+0,06 0,79+0,03 0,62+0,10 0,67±0,07 0,57+0,02 0,56+0,01 0 7 0 7 5,0 0,0 Самец 2,0 5,0 0 Т а б л и ц а 2 Острая токсичность. Влияние ТТР, принимаемого внутрь, на активность трансаминаз в сыворотке кроликов Доза ТГР, г/кг 0,0 Пол Самка * День исследования 2,0 5,0 0,0 Самец 2,0 Алании Аминотрансфераза ИЕ* Аспарагин Аминотрансфераза ИЕ* 0 7 0 7 0 7 8,67+1,20 9,67+0,33 10,33+1,76 12,33+3,52 11,33+1,66 11,00+3,05 22,33+2,60 28,67+3,75 18,33+4,09 20,00+5,03 22,33+3,52 20,67+4,66 0 7 0 10,33±1,76 12,00+2,64 9,00±1,00 9,00+0,57 8,00+1,00 11,33+1,66 23,00+3,05 25,67±4,17 18,00+1,52 20,66±3,52 18,00+1,00 23,00+1,99 7 5,0 Определяемые параметры 0 7 (прим. перев. IV = ИЕ = иммунизирующая единица). 37 38 26742 Т а б л и ц а Острая токсичность. Влияние ТТР, принимаемого внутрь, на гематологические параметры кроликов Доза ТТР, г/кг Пол День исследования Гемоглобин. мг% Гематокрит, % Лейкоциты х 10 э Эритроциты х 10 е 0 7 0 7 0 7 12,4+0,44 11,8+0,63 11,5+0,31 12,3+0,48 12,3+0,14 11,6+0,23 38,3+1,85 37,7+1,20 36,7+0,88 38,3+0,66 40,7+2,6 37,3+0,33 7,32+0,43 6,30+0,66 5,69+0,58 5,74+0,76 7,35+0,99 8,55+1,79 5,21+0,20 5,11+0,11 5,86+0,55 5.69+0,11 5,42+0,20 5,08+0,19 0 7 0 7 12,0+0,85 11,9+0,61 12,8+0,26 11,8+0,39 12,7+0,63 10,6+1,04 37,3+1,20 35,7+1,85 43,7+4,80 34,7+2,02 38,7+2,40 4,0+2,08 11,10+0,63 10.80±0,94 9,94+2,00 11,06+1,08 9,52+1,36 8,87±1,73 4,53+0,26 4,54+0,19 4,46+0,65 5,37+0,56 4,59+0,16 5,72+0,66 0,0 Самка 2.0 5.0 0,0 Самец 2,0 5,0 о • 7 Определяемые параметры Т а б л и ц а Острая токсичность. Влияние ТТР, принимаемого внутрь, на массу органов кроликов Доза ТТР, мг/кг Пол 0,0 150 50 0,0 Легкое Сердце Селезенка Печень Почка Надпочечная железа Яичники с маткой Семенники Масса органа, % 0,72+0 ,8 0,23+0, 01 0,057+0 .01 2,85+0, 15 0,59+0, 03 150 Самец Самка Орган 50 01г общей 0 ,61±0,17 0,67+0,07 0 56+0,05 0 ,22+0,02 0,25+0,03 0 .24+0,02 0,051+0,00 0,079+0,02 0 05±0,01 3 ,02+0,08 3,22±0.37 2 .82+0.09 0 ,52+0,02 0,50+0.01 0 48+0,03 массы 0 ,54+0 09 0 ,23+0 01 0 ,06±0 01 2 ,77±0 28 0 .55+0 01 0 71+0, 14 1,23+0.0 с 0 04+0. 01 3 12+0,06 0 49+0. 03 0,016+0 ,01 0,015±0,01 0,020+0,01 0, 013±0,01 0, 013+а ,02 0 012+0,0 0,58±0, 04 0 ,39+0,02 0,60+0,04 0 30±0,01 0 ,32±0 03 0 36+0, 02 4 39 26742 40 Т а б л и ц а Хроническая токсичность. Влияние ТТР, принимаемого внутрь, на гематологические параметры кроликов День исследования Гемоглобин, мг% Гематокрит, % Лейкоциты х 10 э Эритроциты х 10-в Определяемые параметры Пол Доза ТТР, г/кг Самец 0,0 0 3 6 12 12,2+0,05 12,3+0,15 3,0+0,35 13,5+0,19 38,2±1,71 40,7+ДЗЗ 41,7±1,30 40,7±0,67 9,33+0,79 8,39+1,18 9,58+1,12 11,23+1,10 5,10+0,56 6,34+0,23 7,32+0,70 6,30+0,46 Самец 50 0 12,9+0,55 35,7+1,82 7,52+0,78 * > 5,14+0,47 6 12 13,3±0,35 13,7+0,11 41,0±2,10 39,3+0,94 8,08+1,17 9,36+1,01 6,38±0,11 6,19+0,19 Самец 150 0 3 6 12 14,20*0,21 11,05+0,26 12,40±0,63 13,70±0,32 36,7±1,81 38,5±1,53 37,3+1,45 39,0±0,68 8,19+0,16 8,83+0,78 8,18+0,06 8,24+0,04 Самка 0,0 0 3 6 12 12,6+0,27 12,1+0,23 . 12,4±0,86 12,5±0,87 40,2±0,83 39/8+0,72 42,3±1,20 37,7±2,18 7,07+1,16 8,16+1,01 9,78+1,69 10,90+2,16 5,63+0,17 5,74+0,12 5,86±0,24 4,60+0,29 Самка 50 0 13£±1,20 35.0+-1J0 7,44+0,98 5,47+0,60 6 12 13,0+0,55 12,8+0,21 39,3±1,20 37,7±4,33 7,25+0,96 9,31+0,35 7,08+0,94 6,02+0,32 0 3 6 12 15,2+1,15 13,1 + 1,10 12,5+0,82 13,1+0,70 38,3+1,40 47,0±2,80 41,0±1,15 41,0+1,00 8,50+0,54 8,10±0,76 6,85+0,31 8,15+1,68 6,09+0,08 5,85±0,57 5,61+0,30 5,92±0,t3 Самка 150 г 5,34+0,16 5,68+0,40 6,84±0,10 6,54±0,54 Т а б л и ц а Влияние ТТР на фагоцитарную активность нейтрофилов в периферической крови кроликов Группа Нейтрофилы (1000/1 м м з ) п Фагоцитарная активность %\ нейтрофилов NBT LH LW 0 Контроль 1 мл РВ 6 ТТР (опыт 1) 5 мг/кг 6 0 3 6 0 3 6 0 3 6 1.9 ±0.9 2,3 ±1,1 2,4 ±0,4 14.3 ±4,6 15,1 ±4,6 17,6 ±3.0 54,5 ±9,4 60,6 ±4,8 59,8 ±6.8 7,53 ±0,77 7,53 ±0,86 7,61 X X 1,7 18,4 ±7,1 26\8 ±6.7 59,2 ±6,7 69,3 ±7.0 74,9 ±7,8 8,75 ±1,18 10,3 ±1,25 9,83 ±1,0 63,0 ±9.1 69.5 ±7.1 76^5 ±8,9 7,76 ±0,83 8,52 ±1,04 8,56 ±1,0 15 ТТР (опыт 2) 5 мг/кг 3 8 Х 2,0 ±0,9 1.2 ±0.7 Х 2,8 ±0,8 о о 1,6 ±0,6 Х Х о 1.6 ±1,0 Х 15,5 ±4.9 о 22,1 ±7,0 о 27,2 ±7.0 Х о 26.5 ±7,0 X п - количество исследуемых животных; PBS -- фосфатный буферный раствор; . . 0 - до введения ТТР; 3 - 3 дня после введения ТТР; 6 - 6 дней после введения ТТР; х • статистически достоверное отклонение при р < 0,05 по отношению к значению до введения ТТР; хо - статистически достоверное отклонение при р < 0,05 по сравнению с контрольной группой. го О) ГЭ Ч го 26742 43 44 Т а б л и ц а 7 Влияние ТТР на количество лимфоцитов и на процентное содержание Т-лимфоцитов (Е-розетки) и В-лимфоцитов (ЕАС-розетки) в периферической крови кроликов Лимфоциты Группа % Е-розеток X 1U /мм п % ЕАС-розеток 6 0 6 0 6 66 , 6,0 +1,9 19,0 ±5,7 20,1 ±2,0 42,1 ±6.3 42,3 ±2,05 19,2 ±4,1 27,1 ±3,2 43,7 +2,6 47,7 +4,9 X о 24,8 ±2,9 41,6 ±1,3 41,0 ±2,1 0 Контроль 1 мл PBS 6 ТТР 15 6,6 54 , ±1,5 (опыт 1) 5 мг/кг ±1,4 ±5,5 1 V ТТР 8 6,0 6,8 ±1,0 (опыт 1) 5 мг/кг ±0,6 17,0 ±1,9 1 V п - количество исследуемых животных; PBS - фосфатный буферный раствор; 0 - до введения ТТР, 6 - 6 дней после введения ТТР, х - статистически достоверное отклонение при р < 0,05 по отношению к значению до введения ТТР, хо - статистически достоверное отклонение при р < 0,05 по сравнению с контрольной группой. Т а б л и ц а Количество спленоцитов после длительной терапии ТТР Время введения доз ТТР в неделях Контроль ТТР 10 мг/кг день п=10 ТТР 50 мг/кг день п=10 PFC/106 спленоциты 4-й день 3 5 7 9 12 8 7-й день 4-й день 7-й день 4-й день 7-й день 367±157 572+134 518±45 466±185 287±18 156+41 138+47 133±40 175+75 153+30 1120±328* 1528±346* 699+136* 395±94 287±131 336±240* 292±62* 159±44 132+36 156+39 772±236* 1239±280 722±258* 412+138 376+130 151±57 232+90 141±63 167+62 167+69 * Статистически достоверное отклонение при р < 0,05 по сравнению с контрольной группой. 45 26742 46 Т а б л и ц а Концентрация анти-SRBC (19S -* 7S) антител при длительной терапии ТТР ТТР Время введения доз ТТР в неделях Контроль ТТР 50 мг/кг день п=10 10 МГ/КГ день п=10 Гемагглютинин, -log2 титра 4-й день 3 5 7 9 12 9 7-й день і 3,75+1,78 5,82+1,40 3,60+0,48 3,20+1,40 4,80+0,74 4-й день 7-й день 4-й день 7-й день 7,12+1,36 6,50+1,00 5,20+0,74 4,66±1,24 4,40+1,01 8,80+0,97* 7,70+0,84 4,40+1,11* 3,50+1,28 5,11 ±1,09 9,20+1,46* 9,10+2,02* 4,10+0,83* 4,00+0,81 5,50+1,51 8.20+0,40* 7,70+0,64* 3,50+0,83* 2,90+1,22 5,11 + 1,19 6,90+1,37 9,33+2,90* 3,55+1,21 6,33+1,52 6,10+1,74 * Статистически достоверное отклонение при р < 0,05 по сравнению с контрольной группой. Т а б л и ц а 10 Концентрация анти-SRBC
ДивитисяДодаткова інформація
Автори англійськоюTolpa Stanislaw, Ritter Stanislawa, Kukla Ryszard, Skrzyszewska Malgorzata, Tomkow Stanislaw, Gersz Tadeusz
Автори російськоюТолпа Станислав, Риттер Станіслава, Кукла Ришард, Скрзижевська Малгоржата, Томков Станіслав, Джерш Тадеуш
МПК / Мітки
МПК: A61K 35/10
Мітки: фармацевтично, продукт, одержання, одержують, торфу, визивати, спосіб, цитокіни, біоактивний, композиція, композиції, індукувати, неспецифічну, здатна, імуностимуляцію
Код посилання
<a href="https://ua.patents.su/58-26742-bioaktivnijj-produkt-shho-oderzhuyut-z-torfu-sposib-jjogo-oderzhannya-sposib-oderzhannya-farmacevtichno-kompozici-shho-zdatna-indukuvati-citokini-ta-kompoziciya-shho-zdatna-vizivat.html" target="_blank" rel="follow" title="База патентів України">Біоактивний продукт, що одержують з торфу, спосіб його одержання, спосіб одержання фармацевтичної композиції, що здатна індукувати цитокіни, та композиція, що здатна визивати неспецифічну імуностимуляцію</a>
Попередній патент: Мікродисперсія типу “вода-в-маслі” та спосіб її одержання
Наступний патент: Трансфекційна композиція для вищих еукаріотичних клітин
Випадковий патент: Система для організації вагонопотоків з місць навантаження